Модуляторы р-селектин гликопротеин лиганда 1 - RU2407539C2
Код документа: RU2407539C2
Чертежи












Описание
Область техники
Изобретение относится к композициям и способам для контролирования иммунных реакций.
Уровень техники
Контроль нежелательных иммунных реакций является важным моментом при лечении заболеваний, например воспалительных заболеваний, аутоиммунных заболеваний, отторжений пересаженного органа, аллергических заболеваний и опухолей, происхождение которых связано с Т-клетками. Активность чрезмерно агрессивных Т-клеток можно регулировать иммуносупресией или индуцированием иммунологической толерантности. Толерантность определяют как состояние, когда иммунную систему делают нечувствительной к антигену, в то время как иммуносупресия, которая снижает иммунный ответ на антигены, как правило, требует продолжительного применения лечебных средств. При трансплантации органов Т-клетки играют исключительную роль в формировании иммунного ответа на аллоантигены. Современные иммуносупрессивные методики обычно включают использование кортикостероидов, циклоспорина или рапамицина, которые блокируют транскрипцию IL-2, ключевого фактора роста для Т-клеток, или ингибируют IL-2 зависимую пролиферацию. Тем не менее, некоторые моноклональные антитела, которые действуют или как средства, истощающие Т-клетки (например, CD3, CD4, CD8), или как ингибиторы подачи сигнала цитокинами или костимулирующего пути обмена Т-клеток (например, CD25, В7-1, В7-2, CD 152, CTLA4), проявили себя эффективными в снижении числа случаев отторжения с ограниченными побочными эффектами или токсичностью. Показано, что некоторые такие средства с успехом применяются при лечении аутоиммунных заболеваний или при пролонгировании выживаемости в трансплантологии.
Широко распространено мнение, что апоптоз жизненно важен для поддержания надлежащей функции иммунной системы и является основным механизмом удаления нежелательных клеток (Kabelitz et al. Immunol. Today 14: 338-340. (1993); Raff, Nature: 356: 397-399 (1992)). Различные сигналы, исходящие снаружи или изнутри клетки, оказывают влияние на жизнь и гибель (отмирание) этой клетки. Антитела, специфичные к веществам клеточной поверхности Т-клеток, такие как Fas (или CD95, М.м.=43 кДа), TNFR2 (М.м.=75 кДа), CD2 (М.м.=45 кДА) и CTLA-4 (М.м.=33 кДа) индуцируют апоптоз Т-клеток (Osbome, Curr. Opin. Immunol. 8: 245-248 (1996); Lin et al. J. Immunol. 158: 598-603 (1997); Zhang et al. Nature: 377: 348-350 (1995); Lai et al. Eur. J. Immunol. 25: 3243-3248 (1995); Mollereau et al. J. Immunol. 156: 3184-3190 (1996); Gribben et al. Proc. Natl. Acad. Sci. USA 92: 811-815 (1995)).
Попытки использовать Fas и TNFR2 для контроля за нежелательными Т-клетками были затруднены из-за того, что эти два вещества экспрессируются не только иммунными клетками, но также и другими важными системами органов, например печенью. Такой пример экспрессии существенно ограничивает терапевтическое применение этих двух антител (Ogasawara et al. Nature 364: 806-809 (1993); Pfeffer et al. Cell: 73: 457-467 (1993); Engelmann et al. J. Biological Chemistry 265: 14497-14504 (1990)).
Селектины, интегрины и члены суперсемейства (Ig) иммуноглобулинов представляют собой три основных класса адгезивных веществ, которые важны для взаимодействия лейкоцитов и тромбоцитов или друг с другом или с внеклеточным матриксом и васкулярным эндотелием (Springer, Nature 346:425 (1990); Osborn, Cell 62:3 (1990); Hynes, Cell 69:11 (1992)).
Адгезионное вещество одного типа клеток часто связывается с другим адгезионным веществом, экспрессируемым другим типом клеток, образуя пару «лиганд-рецептор».
Семейство селектинов состоит из Р-селектина (известного также как CD62, CD62P, GMP140 и PADGEM), Е-селектина (известного также как ELAM-1 и CD62E) и L-селектина (известного также как LEGAM-1, Mel-14, LAM-1 и CD62L). Эти селектины высокогомологичны, в их состав входят N-концевой лектиновый домен, состоящий из 120 аминокислотных остатков, EGF-подобный домен, непостоянное (изменяющееся) количество доменов, состоящих из многочисленных коротких консенсусных последовательностей (SCR) и гомологичных обнаруженным в комплемент-регуляторных белках, за которыми следуют трансмембранный домен и короткий цитоплазматический «хвост» (Siegelman et al., Science 243: 1165-1172 (1989); Lasky et al., Cell 56: 1045-1055 (1989); Tedder et al., J. Exp. Med. 170:123-133 (1989); Johnson et al., Cell 56: 1033-1044 (1989); Bevilacqua et al., Proc. Natl. Acad. Sci. USA 84: 9238-9242 (1987), Bevilacqua et al., Science 243: 1160-1165 (1989); Bevilacqua et al., J. Clin. Invest. 91: 379-387 (1993), Camerini et al. Nature 280: 496-498 (1989)).
Последовательности селектинов частично перекрываются, но отличаются специфичностью по отношению к рецепторам клеточной поверхности (Bevilacqua et al., J. Clin. Invest. 91: 379-387 (1993); Feize, Current Opinion in Struct Biol. 3: 701-710 (1993); Berg et al., Biochem Biophys. Res. Comm. 184:1048-1055 (1992); Foxall et al., J. Cell Biol. 117: 895-902 (1992); Larsen et al., J. Biol. Chem. 267: 11104-11110 (1992); Polley et al., Proc. Natl. Acad. Sci. USA 88: 6224-6228 (1991)).
Р-селектин, Е-селектин и L-селектин содействуют адгезивным взаимодействиям клеток: первый лейкоцит-эндотелиальная клетка и тромбоцит-лейкоцит во время воспаления (Bevilacqua et al., 1993, там же). Было показано, что все три селектина участвуют в развертывающемся первоначальном взаимодействии лейкоцитов с активированным эндотелием (von Andrian et al., Proc. Natl. Acad. Sci. USA 88: 7538-7542 (1991); Ley et al., Blood 77: 2553-2555 (1991); Abassi et al., J. Cin. Invest. 92: 2719-2730 (1993); Dore et al., Blood 82: 1308-1316 (1993); Jones et al., Biophys. J. 65: 1560-1569 (1993); Mayadas et al., Cell 74: 541-554 (1993)).
Р-селектин, экспрессированный активированными тромбоцитами и эндотелиальными клетками, связывается с белками клеточной поверхности большей части лейкоцитов (McEver et al., J. Biol. Chem. 250:9799-9804 (1984); Hsu-Lin et al., J. Biol. Chem. 264:8121-9126 (1984)).
Е-селектин, экспрессированный цитоксин-активированными клетками эндотелия (например, после 6-8 часовой TNF-альфа или IL-1 стимуляции) связывается с белками клеточной поверхности большинства лейкоцитов (McEver et al, J. Clin. Invest. 100: 485-492 (1997); Bevilacqua et al., 1987, supra; Bevilacqua et al., 1989, там же).
L-селектин, экспрессируемый большей частью лейкоцитов, связывается с белками клеточной поверхности части эндотелиальных клеток и других лейкоцитов (Gallatin et al., Nature 304: 30-34 (1983); Berg et al., Immunol. rev. 108: 5-18 (1989); Berg et al., J. Cell. Biol. 114: 343-349 (1991), Hallman et al., Biochem. Biophys. Res. Comm. 174: 236-243 (1991); Smith et al., J. Clin. Invest. 87: 609-618 (1991); Spetrini et al., J. Immunol. 147: 2565-2573 (1991)).
Показано, что все три селектина связываются с белком клеточной поверхности, PSGL-1, экспрессия которого ограничивается главным образом лейкоцитами, особенно Т-клетками и NK-клетками. Для того чтобы осуществлялось связывание с Р-селектином, Е-селектином и L-селектином, необходимы посттрансляционные модификации PSGL-1 (McEver et al., J. Clin. Invest, 1997, там же).
Сущность изобретения
Изобретение основывается на обнаружении того факта, что Т-клетки могут быть истощены и/или могут быть вынуждены претерпевать апоптоз, если в этом задействован Т-клеточный поверхностный антиген-гликопротеиновый лиганд-1 Р-селектина (PSGL-1). Истощение Т-клеток может быть, в частности, использовано при лечении состояний, связанных с повышенным или нежелательным опосредованным Т-клетками иммунным ответом или повышенной или нежелательной пролиферацией Т-клеток. Например, истощение Т-клеток может вызывать понижение или устранение нежелательной активности Т-клеток или пролиферации, связанных с воспалительными заболеваниями, аутоиммунными заболеваниями, отторжением пересаженных органов и/или опухолями, происхождение которых связано с Т-клетками. Изобретение включает также способы применения модуляторов PSGL-1 функции для предотвращения или снижения уровня опосредованного Т-клетками иммунного ответа, а также способы скринирования модуляторов PSGL-1 функции.
В одном аспекте данное изобретение отражает способ предотвращения или снижения опосредованного Т-клетками иммунного ответа у субъекта. Этот способ включает следующие стадии: выбор индивидуума, в отношении которого установлено наличие или риск достижения состояния, характеризующегося чрезмерным или нежелательным опосредованным Т-клетками иммунным ответом; введение индивидууму соединения, которое связывается с PSGL-1 на поверхности Т-клетки, причем связывание этого соединения с PSGL-1 на поверхности Т-клетки индуцирует особый путь трансдукции сигнала, который приводит к гибели Т-клетки, тем самым предотвращая опосредованный Т-клетками иммунный ответ или снижая его уровень у индивидуума.
Соединение, используемое в этом способе, может включать антитело или его антигенсвязывающий фрагмент, который специфически связывает PSGL-1. В одном примере это соединение представляет собой моноклональное антитело, которое специфически связывается с PSGL-1. В одном варианте способ включает дополнительную стадию введения средства, которое связывается с моноклональным антителом и способствует поперечному сшиванию ряда PSGL-1 антигенов на поверхности Т-клетки.
В некоторых вариантах способ включает индуцирование поперечного сшивания ряда PSGL-1 антигенов на поверхности Т-клетки, причем это поперечное сшивание индуцирует особый путь трансдукции сигнала, который приводит к гибели Т-клетки.
В некоторых вариантах способ включает следующие стадии: (i) выбор индивидуума, в отношении которого установлено наличие или риск достижения состояния, характеризующегося чрезмерным или нежелательным опосредованным Т-клетками иммунным ответом; и (ii) введение индивидууму мультимерного соединения, которое связывается с, по меньшей мере, двумя PSGL-1 белками на поверхности Т-клетки, причем мультимерное соединение содержит две полипептидные цепи, каждая полипептидная цепь включает (а) связывающий домен, который связывается с PSGL-1, и (b) гетерологичную аминокислотную последовательность, причем полипептидные цепи соединены гетерологичной аминокислотной последовательностью с образованием мультимерного соединения, а связывание мультимерного соединения с, по меньшей мере, двумя PSGL-1 белками на поверхности Т-клетки индуцирует особый путь трансдукции сигнала, который приводит к гибели Т-клетки, тем самым предотвращая опосредованный Т-клетками иммунный ответ или снижая его уровень у индивидуума.
Мультимерное соединение может быть гомомультимерным соединением или гетеромультимерным соединением. Связывающий домен может необязательно содержать экстрацеллюлярный домен Р-селектина или его PSGL-1-связывающий фрагмент, экстрацеллюлярный домен Е-селектина или его PSGL-1-связывающий фрагмент, экстрацеллюлярный домен L-селектина или его PSGL-1-связывающий фрагмент, специфичное к PSGL-1 антитело или его PSGL-1-связывающий фрагмент, PSGL-1-связывающий полипептид, выбранный из библиотеки фагового дисплея, или их сочетание.
В некоторых вариантах мультимерное соединение не включает антитело, специфичное к PSGL-1, или фрагмент антитела, который связывается с PSGL-1.
Гетерологическая аминокислотная последовательность может необязательно содержать область, связывающую рецептор клеточной поверхности, например константную область тяжелой цепи иммуноглобулина. В некоторых вариантах полипептидные цепи ковалентно связаны, например, дисульфидными связями через гетерологичную аминокислотную последовательность с образованием мультимерного соединения.
В некоторых вариантах способ может включать дополнительную стадию введения индивидууму средства, которое связывается с мультимерным соединением с помощью гетерологичной аминокислотной последовательности и способствует поперечному сшиванию ряда PSGL-1 антигенов на поверхности Т-клетки.
В некоторых вариантах описываемый выше способ включает стадию выбора (отбора) индивидуума, в отношении которого установлено наличие аутоиммунного заболевания. В другом примерном варианте способ включает стадию подбора (отбора) индивидуума, которому пересажен или будет пересажен аллогенный или ксеногенный трансплантат. В другом случае способ включает стадию подбора индивидуума, у которого диагностировано аллергическое заболевание. В другом случае способ включает стадию подбора пациента, у которого диагностирован Т-клеточный рак.
В некоторых вариантах Т-клетка представляет собой активированную Т-клетку. В одном случае Т-клетка представляет собой СВ4+Т-клетку. В другом случае Т-клетка представляет собой CD8+T-клетку.
В некоторых вариантах способ включает стадию определения количества Т-клеток в первой биологической пробе, взятой у индивидуума перед введением соединения (например, мультимерного соединения), и сравнения результатов с количеством Т-клеток во второй биологической пробе, взятой у индивидуума после введения соединения (например, мультимерного соединения).
В некоторых вариантах способ включает стадию определения биологической активности Т-клеток в первой биологической пробе, взятой у индивидуума перед введением соединения (например, мультимерного соединения), и сравнения результатов с биологической активностью Т-клеток во второй биологической пробе, взятой у индивидуума после введения соединения (например, мультимерного соединения).
В некоторых вариантах такое введение приводит к истощению, по меньшей мере, 10% активированных Т-клеток у индивидуума. В некоторых вариантах это введение приводит к истощению, по меньшей мере, 10%, 20%, 30%, 40%, 50% или более активированных Т-клеток у индивидуума.
В некоторых вариантах антитело или его антигенсвязывающий фрагмент или мультимерное соединение вызывают гибель, по меньшей мере, 10% активированных Т-клеток у индивидуума после воздействия указанными антителом или его антигенсвязывающим фрагментом или мультимерным соединением. В некоторых вариантах введение указанных средств вызывает гибель, по меньшей мере, 10%, 20%, 30%, 40%, 50% или более активированных Т-клеток у индивидуума. Количество погибших клеток может быть измерено в любой момент времени, например спустя один, два, три, четыре, пять, шесть, семь или более дней, после воздействия антителом или его антигенсвязывающим фрагментом или мультимерным соединением.
В другом аспекте изобретение включает способ индуцирования гибели Т-клеток или естественной (природной) клетки-киллера (NK-клетки). Способ включает стадии: обеспечение Т-клетки или NK-клетки, экспрессирующей PSGL-1 на своей поверхности; контактирование Т-клетки или NK-клетки с соединением, которое связывается с PSGL-1 на поверхности Т-клетки или NK-клетки, причем связывание соединения с PSGL-1 на поверхности Т-клетки или NK-клетки индуцирует особый путь трансдукции сигнала, который приводит к гибели Т-клетки или NK-клетки.
Соединение, используемое в таком способе, может включать антитело или его антигенсвязывающий фрагмент, который специфически связывается с PSGL-1. В одном случае это соединение может представлять собой моноклональное антитело, которое специфически связывается с PSGL-1. В одном варианте способ включает стадию контактирования моноклонального антитела со средством, которое связывается с моноклональным антителом и способствует поперечному сшиванию ряда PSGL-1 антигенов на поверхности Т-клетки или NK-клетки.
В одном варианте способ включает следующие стадии: (i) обеспечение Т-клетки или NK-клетки, экспрессирующей PSGL-1 на своей поверхности; и (ii) контактирование Т-клетки или NK-клетки с мультимерным соединением, которое связывается с PSGL-1 белками на поверхности Т-клетки или NK-клетки, причем мультимерное соединение содержит две полипептидные цепи, каждая полипептидная цепь включает (а) связывающий домен, который связывается с PSGL-1, и (b) гетерологичную аминокислотную последовательность, причем полипептидные цепи соединены гетерологичной аминокислотной последовательностью с образованием мультимерного соединения, а связывание мультимерного соединения с, по меньшей мере, двумя PSGL-1 белками на поверхности Т-клетки или NK-клетки индуцирует особый путь трансдукции сигнала, который приводит к гибели Т-клетки или NK-клетки.
Мультимерное соединение может быть гомомультимерным соединением или гетеромультимерным соединением. Связывающий домен может необязательно содержать экстрацеллюлярный домен Р-селектина или его PSGL-1-связывающий фрагмент, экстрацеллюлярный домен Е-селектина или его PSGL-1-связывающий фрагмент, экстрацеллюлярный домен L-селектина или его PSGL-1-связывающий фрагмент, специфичное к PSGL-1 антитело или его PSGL-1-связывающий фрагмент, пептид, выбранный из библиотеки фагового дисплея, или их сочетание.
Гетерологическая аминокислотная последовательность может необязательно содержать область, связывающую рецептор клеточной поверхности, например константную область тяжелой цепи иммуноглобулина. В некоторых вариантах полипептидные цепи ковалентно связаны, например, дисульфидными связями через гетерологичную аминокислотную последовательность с образованием мультимерного соединения.
В некоторых вариантах способ включает дополнительную стадию контактирования мультимерного соединения со средством, которое связывается с мультимерным соединением с помощью гетерологичной аминокислотной последовательности и способствует поперечному сшиванию ряда PSGL-1 антигенов на поверхности Т-клетки.
В некоторых вариантах способ включает стадию индуцирования поперечного сшивания ряда PSGL-1 антигенов на поверхности Т-клетки или NK-клетки, причем это поперечное сшивание индуцирует особый путь трансдукции сигнала, который приводит к гибели Т-клетки или NK-клетки.
В некоторых вариантах Т-клетка представляет собой активированную Т-клетку. В одном случае Т-клетка представляет собой CD4+Т-клетку. В другом случае Т-клетка представляет собой CD8+T-клетку.
В некоторых вариантах описанных здесь способов способ включает оценку жизнеспособности Т-клетки или NK-клетки после контактирования с соединением (например, мультимерным соединением).
В некоторых вариантах описанных здесь способов способ включает оценку биологической активности Т-клетки или NK-клетки после контактирования с соединением (например, мультимерным соединением).
В некоторых вариантах способ включает индуцирование гибели активированной Т-клетки.
В другом аспекте изобретение включает способ скринирования модулятора функционирования PSGL-1. Способ включает стадии: обеспечение экспрессирования PSGL-1 клетками на клеточной поверхности; контактирование клетки с исследуемым веществом и измерение жизнеспособности (выживаемости) клетки после контактирования с исследуемым веществом, в соответствии с которым определяют, является ли исследуемое вещество модулятором действия PSGL-1.
В одном варианте способ включает стадию детектирования гибели клетки, вызванной исследуемым веществом, в соответствии с которым устанавливают, что исследуемое вещество является модулятором действия PSGL-1.
В одном варианте исследуемое вещество представляет собой антитело, его антигенсвязывающий фрагмент, который специфически связывается с PSGL-1. В одном случае исследуемое вещество является моноклональным антителом, которое специфически связывается с PSGL-1. В одном варианте способ включает стадию контактирования моноклонального антитела со средством, которое связывается с моноклональным антителом и способствует поперечному сшиванию ряда PSGL-1 антигенов на поверхности клетки.
В некоторых вариантах способ включает стадию индуцирования поперечного сшивания ряда PSGL-1 антигенов на поверхности клетки, причем это поперечное сшивание индуцирует особый путь трансдукции сигнала, который приводит к гибели клетки.
В некоторых вариантах Т-клетка представляет собой активированную Т-клетку. В одном случае Т-клетка представляет собой CD4+Т-клетку. В другом случае Т-клетка представляет собой CD8+T-клетку.
В одном варианте способ включает стадию производства больших количеств исследуемого вещества и сочетания исследуемого вещества с фармацевтически приемлемым носителем.
В другом аспекте изобретение касается набора, содержащего соединение, которое связывается с PSGL-1 на поверхности Т-клетки, причем связывание соединения с PSGL-1 на поверхности Т-клетки индуцирует особый путь трансдукции сигнала, который приведет к гибели Т-клетки, и инструкции по применению соединения для лечения состояния, связанного с чрезмерным или нежелательным опосредованным Т-клетками иммунным ответом или чрезмерной или нежелательной пролиферацией Т-клеток, например воспаления, аутоиммунитета, отторжения трансплантата, аллергического состояния или Т-клеточного рака.
В одном варианте набор содержит: (i) мультимерное соединение, которое связывается с, по меньшей мере, двумя PSGL-1 белками на поверхности Т-клетки, причем мультимерное соединение содержит две полипептидные цепи, каждая полипептидная цепь включает: а) связывающий домен, который связывается с PSGL-1, и b) гетерологичную аминокислотную последовательность, причем полипептидные цепи соединены гетерологичной аминокислотной последовательностью с образованием мультимерного соединения, а связывание мультимерного соединения с, по меньшей мере, двумя PSGL-1 белками на поверхности Т-клетки индуцирует особый путь трансдукции сигнала, который приводит к гибели Т-клетки; и (ii) инструкции по применению соединения для лечения состояния, связанного с чрезмерным или нежелательным опосредованным Т-клетками иммунным ответом или чрезмерной или нежелательной пролиферацией Т-клеток, например воспаления, аутоиммунитета, отторжения трансплантата, аллергического состояния или Т-клеточного рака.
Преимуществом изобретения является то, что оно индуцирует истощение Т-клеток и/или запускание процесса апоптоза в Т-клетках без вызывания связанных с этим нежелательного или пагубного иммунного ответа. Например, в некоторых вариантах введение индивидууму специфичного к PSGL-1 антитела или мультимерного соединения, описанного здесь, не приводит к нежелательному повышению уровней воспалительных цитокинов, таких как IL-2 или TNF-α.
Еще одним преимуществом данного изобретения является то, что оно вызывает истощение Т-клеток за счет применения агонистических композиций, которые вызывают апоптоз Т-клеток. Соответственно изобретением предусматриваются активные иммуносупрессивные способы, а не пассивная иммуносупрессия, которая обусловлена использованием композиций антагонистического действия (например, антагонистических анти-PSGL-1-антител или антагонистических растворимых фрагментов селектина), которые действуют, связывая иммунные рецепторы и предотвращая активацию иммунной системы, в которой задействованы эти рецепторы.
Еще одним преимуществом данного изобретения является возможность целенаправленного выбора белка клеточной поверхности, PSGL-1, экспрессия которого лимитируется, в основном, лейкоцитами и, в частности, Т-клетками и NK-клетками. Следовательно, описанные здесь соединения в целом не вызывают значительных уровней апоптоза клеток других систем, например клеток печени. Выбор Т-клеток и NK-клеток (важный тип CD3- клеток, участвующих в процессах отторжения или трансплантации) для избирательного истощения без значительного повышения опасного для жизни уровня реакции цитокинов и опасности для других систем организма является привлекательным свойством иммуносупрессивного средства.
Если иное не оговорено, все технические и научные термины, используемые здесь, имеют одно и то же определенное значение, которое в общем понятно специалисту в данной области, к которой относится изобретение. Несмотря на то, что при осуществлении и испытании изобретения могут использоваться способы и материалы, подобные или эквивалентные описанным здесь, ниже описываются подходящие способы и материалы. Все публикации, патентные заявки, патенты и другие ссылки на источники информации указываются здесь и приводятся как ссылки во всей полноте. В случае конфликта, связанного с терминологией, настоящее описание будет подлежать проверке. Кроме этого, описываемые материалы и способы носят не ограничивающий характер, а скорее иллюстративный.
Другие признаки и преимущества изобретения будут очевидны из нижеследующего детального описания и формулы изобретения.
Краткое описание чертежей
На Фиг.1 изображены результаты продолжительного эксперимента, в котором исследовалось, когда активированные клетки приобретают чувствительность к опосредованным ТАВ4 (специфичное к PSGL-1 моноклональное антитело) сигналам апоптоза.
На Фиг.2 показаны результаты биотинилирования клеточной поверхности и иммунопреципитации антигена, узнаваемого ТАВ4 антителом.
На Фиг.3 показана экспрессия PSGL-1 антигена CD4+ Т-клетками, CD8+ Т-клетками селезенки и NK-клетками.
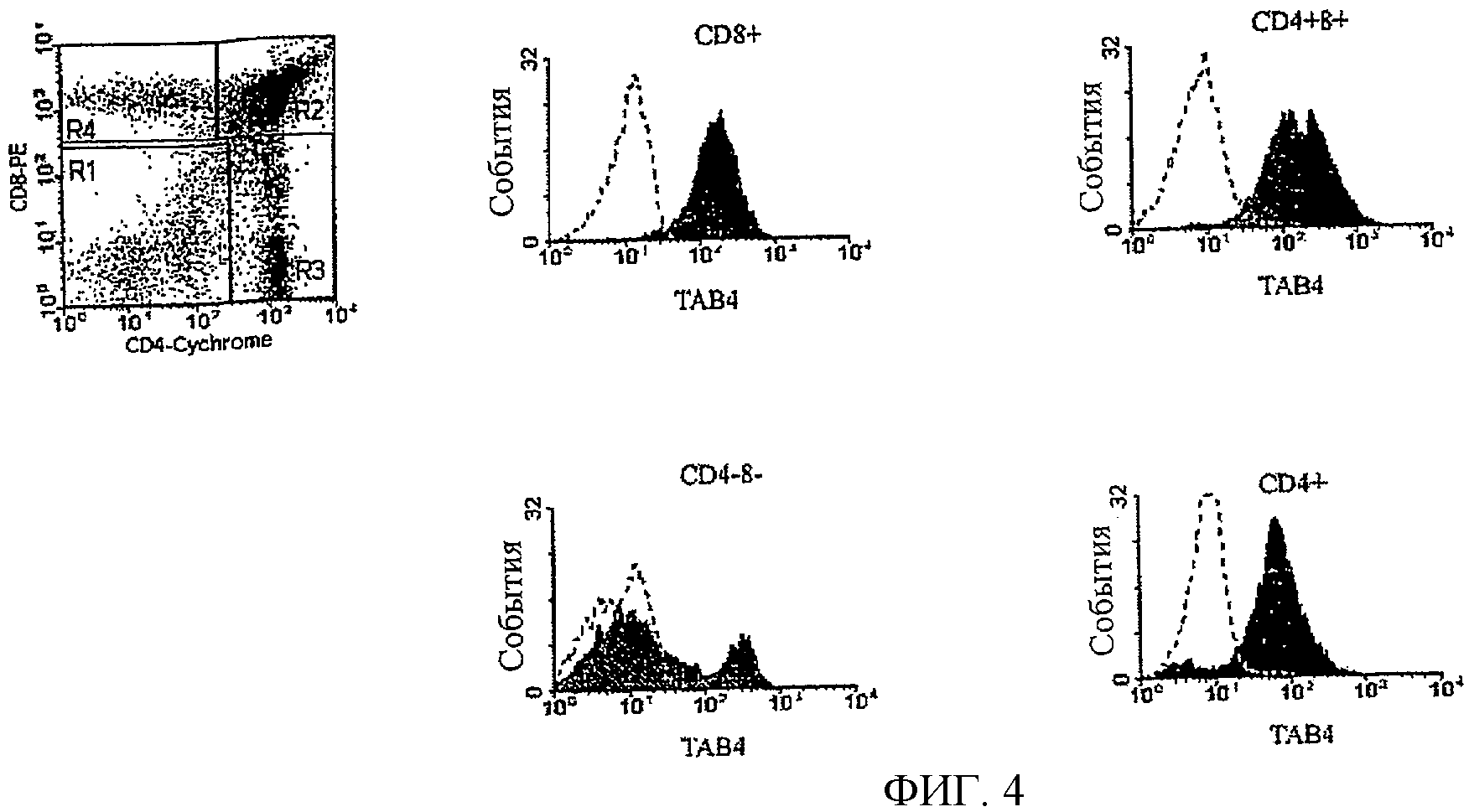
На Фиг.4 показана экспрессия PSGL-1 антигена CD4+, CD8+, CD4+8+ и CD4-8- тимоцитами.
На Фиг.5 показаны уровни IL-2, продуцированнного в смешанной культуре лимфоцитов с использованием клеток селезенки, полученных от Balb/с мышей, получивших ТАВ4 (или Ig хомяка) в качестве респондеров и Н2-мисматчированных С3Н клеток селезенки в качестве стимулятора.
На Фиг.6 показаны результаты вестерн-блот-анализа, демонстрирующие, что (А) белки, иммунопреципитированные ТАВ4-антителом, могут распознаваться коммерчески доступным специфичным к PSGL-1 антителом, и (В) предварительная очистка (клиренс) Т-клеточного лизата с помощью анти-PSGL-1-антитела может истощать белки, узнаваемые ТАВ4.
На Фиг.7 показана процентная доля трансплантатов, прижившихся у C57BL/c мышей, получивших кожные трансплантаты от BALB/c мышей и которым были введены антитела, специфичные к PSGL-1 (обозначено как линия с заштрихованными ромбами), или контрольные антитела (линия с незаштрихованными квадратами).
На Фиг.8 показана зависимость процентной доли апоптозных Т-клеток от времени, полученных в результате обработки активированных периферических мононуклеарных клеток крови человека антителом человека, специфичным PSGL-1.
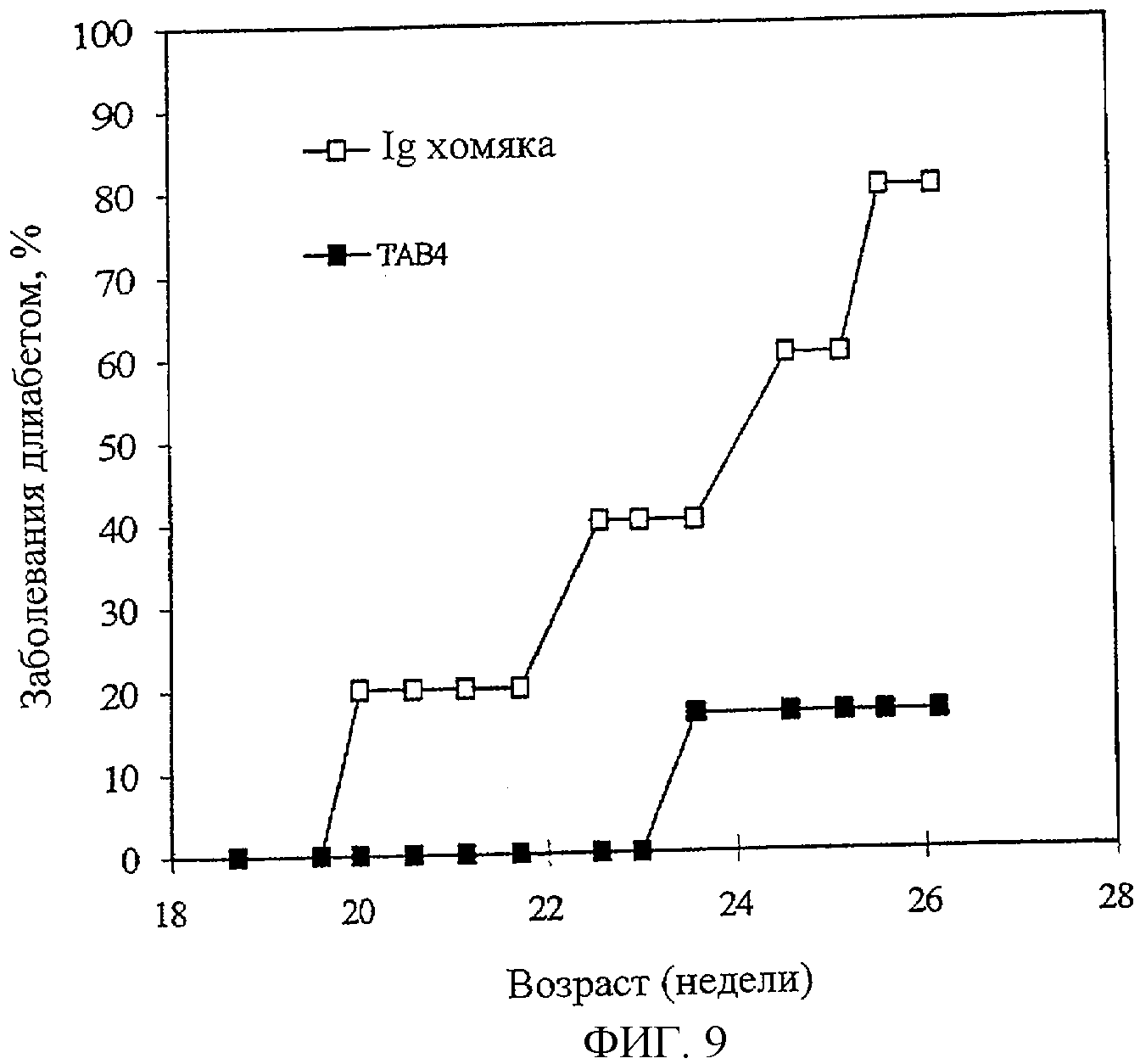
На Фиг.9 показано распространение диабета у самцов (NOD) мышей с аутоиммунным не характеризующимся тучностью диабетом, которые получали анти-PSGL-1-1-антитело (линия с заштрихованными квадратами) или контрольное антитело (линия с незаштрихованными квадратами).
На Фиг.10 показано связывание мышиных Р-селектина, Е-селектина и L-селектина с активированными Т-клетками мыши.
На Фиг.11А-11С показана индукция апоптоза активированных Т-клеток мыши мультимерными формами Е-селектина (Фиг.11А), Р-селектина (Фиг.11В) и L-селектина (Фиг.11С).
На Фиг.12 показана индукция апоптоза активированных Т-клеток мыши in vitro поперечным сшиванием растворимого Р-селектин-Fc-слитого белка.
Подробное описание изобретения
Данное изобретение относится к способам модулирования активности Т-клеток путем воздействия на функцию PSGL-1 молекул, находящихся на поверхности Т-клеток. Соединение PSGL-1 с агонистическими композициями, описанными здесь, может вызывать истощение Т-клеток и/или индуцировать апоптоз Т-клеток. Поэтому эти агонистические композиции могут применяться как терапевтические агенты для регулирования иммунозависимых состояний, таких как воспалительные заболевания, аутоиммунные заболевания, отторжение трансплантата, аллергические заболевания и/или Т-клеточный рак. Композиции на основе агонистов также могут применяться для того, чтобы вызвать истощение Т-клеток в какой-либо биологической пробе, где присутствие или активность Т-клеток нежелательны.
PSGL-1 белок
PSGL-1 представляет собой адгезивное вещество клеточной поверхности, которое экспрессируется нейтрофилами, Т-, В-лимфоцитами, NK-клетками, моноцитами, дендритными клетками и первобытными человеческими CD34 кроветворными клетками-предшественниками. Благодаря способности взаимодействовать с селектинами PSGL-1 участвует в проходе лейкоцитов в эндотелии и экстравазатизации лейкоцитов в воспаленных тканях. PSGL-1-опосредованное связывание Т-клеток с Е- и Р-селектином, или миграция, регулируется по-разному.
Например, считается, что появление CLA (антиген-лимфоцита кожи) эпитопа индуцируется Т-клетками, претерпевающими переход от первичного состояния к памяти (на антиген). Только «хелпер» 1-, но не «Хелпер» 2- Т-клетки экспрессируют функциональный PSGL-1, способный мигрировать в зону воспаления кожи.
PSGL-1 представляет собой сиаломуцин, который нуждается в специфическом сиалилировании, фукозилировании и сульфатировании, чтобы обладать свойством связывать Р-селектин. PSGL-1 существует в виде изоформ, характеризующихся различным положением сайтов гликозилирования и сульфатирования на их N-концах. Покоящиеся Т- и В-клетки периферической крови, линии лимфоидных клеток и in vitro активированные периферические кровяные Т-клетки экспрессируют примерно одинаковый уровень PSGL-1. Однако только активированные Т-клетки дают функциональную форму PSGL-1 и стремительно связываются с Р-селектином. По-видимому такая зависящая от активации способность к связыванию является результатом пост-трансляционной модификации, что можно предположить исходя из повышенной активности альфа (1, 3)-фукозилтрансфераз в активированных Т-клетках.
Изоформы PSGL-1 показывают также различную аффинность по отношению к L-селектину и Е-селектину. Например, человеческие Т-клетки, у которых обнаруживается CLA-позитивная изоформа, могут связывать и взаимодействовать и с Е- и с Р-селектином, тогда как Т-клетки, экспрессирующие PSGL-1 без CLA-эпитопа, связывают только Р-селектин. Более того, связывание PSGL-1 с Р-селектином возможно при наличии терминального декапептида, который содержит три тирозиновых остатка для сульфатирования и один треониновый остаток для гликозилирования.
PSGL-1 белок может быть получен с помощью рекомбинантной технологии и/или выделением нативного PSGL-1 белка из биологического материала. Рекомбинантный PSGL-1 белок может быть получен в прокариотических и эукариотических клетках либо in vitro, либо in vivo. Нуклеиновые кислоты, кодирующие PSGL-1, могут использоваться для рекомбинантного получения белка (см., например, GenBank™ Accession NM 003006 для примера нуклеиновой кислоты, кодирующей PSGL-1 полипептид). Антитела к PSGL-1 также хорошо известны и могут использоваться для очистки антигена (см., например, Herron et al. (2000) Science Jun 2; 288 (5471): 1653-56; WO 00/25808) и/или использоваться в описанных здесь способах. Кроме того, PSGL-1 описан, например, в источниках, включающих Sako et al. (1993) Cell 75:1179; Vachino et al. (1995) J. Biol. Chem. 270:21966; Veldman et al. (1995) J. Biol. Chem. 270:16470.
При рекомбинантном получении PSGL-1 для функциональной экспрессии PSGL-1 может потребоваться одновременная экспрессия и PSGL-1, и модифицирующей его альфа (1, 3)-фукозилтрансферазы, Fuc-TVII. В дополнение к этому или взамен этого рекомбинантное получение PSGL-1 может сопровождаться котрансфекцией нуклеиновой кислоты, кодирующей РАСЕ, для удаления пропептида и/или нуклеиновой кислоты, кодирующей тирозинсульфотрансферазу.
Антитело к PSGL-1 может использоваться для выделения PSGL-1 антигена из биологического материала и его очистки. Любой тип клеток, экспрессирующих PSGL-1 белок, например Т-клетки, полученные от любого индивидуума, или линия Т-клеток, могут использоваться как источник этого белка. В очищенном виде этот белок может использоваться в различных описываемых здесь способах. Например, очищенный PSGL-1 белок может использоваться при in vitro-скрининге модуляторов PSGL-1 функции Т-клеток или как иммуноген при получении антител, специфичных к этому белку.
Антитела, специфичные к PSGL-1
PSGL-1 полипептиды (или их иммуногенные фрагменты или аналоги) могут использоваться для получения антител, пригодных для использования в способах настоящего изобретения. Как описано выше, PSGL-1 полипептиды или их пептидные фрагменты могут быть получены методами рекомбинантной технологии или синтезированы методами твердофазного синтеза. PSGL-1 полипептиды или их пептидный фрагмент могут использоваться как иммуноген для получения антител, специфичных к PSGL-1. Кроме того, антитела к PSGL-1, например ТАВ4 моноклональное антитело, могут использоваться для очистки PSGL-1 полипептида, например PSGL-1 полипептида в его природной конформации, который может потом использоваться как иммуноген для получения последующих анти-PSGL-1-антител.
Согласно изобретению антитело может быть моноклональным, поликлональным или сконструированным антителом, все из которых специфически связываются с PSGL-1 полипептидом. Антитело, которое «специфически связывается» с определенным антигеном, например PSGL-1 полипептидом, не должно в существенной степени распознавать или связывать другие вещества в пробе. Так что изобретение включает также и способы идентификации исследуемого вещества (например, антитела), которое связывает полипептид данного изобретения, путем контактирования полипептида с исследуемым веществом и определением, связывается ли этот полипептид с исследуемым веществом (например, прямым определением связывания, определением вещества-конкурента, которое разрушает связывание исследуемого вещества с полипептидом, и/или определением связывания по исследованию апоптоз-индуцирующей активности).
В общем PSGL-1 полипептиды могут быть связаны с белком-носителем, таким как KLH, смешанный с адъювантом, и введены млекопитающему-реципиенту. Антитела, получаемые из этого животного, могут быть потом выделены аффинной хроматографией с пептидным антигеном.
В частности, самые разные животные-реципиенты могут быть иммунизированы введением PSGL-1 полипептида или его антигенного фрагмента. Обычно в таком качестве используются кролики, мыши, морские свинки, крысы. Различные адъюванты, которые могут использоваться для усиления иммунного ответа, зависят от вида животного-хозяина и включают адъювант Фрейнда (полный и неполный), минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, например лизолецитин, плуроновые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин, выделенный из reynell limpet, и динитрофенол. Потенциально используемыми для человека могут быть адъюванты, включающие BCG (бациллы Calmette-Guerin) и Corynebacterium parvum. Поликлональные антитела являются гетерогенными популяциями молекул антител, которые содержатся в сыворотке иммунизированных животных.
Таким образом, в объеме изобретения антитела включают поликлональные антитела и, помимо них, моноклональные антитела, гуманизированные или химерные антитела, одноцепочечные антитела, Fab фрагменты, F(ab')2 фрагменты и вещества, полученные из библиотеки экспрессирования Fab.
Моноклональные антитела, которые являются гомогенными популяциями антител к определенному антигену, могут быть получены с помощью PSGL-1 полипептидов, описанных здесь, и стандартной гибридомной технологии (см., например, Kohler et al., Nature 256:495 [1975]; Kohler et al., Eur J Immunol 6:511 [1976]; Kohler et al., Eur J Immunol 6,292 [1976]; Hammerling et al., Monoclonal Antibodies and Т Cell Hybridomas, Elsevier, N.Y. [1981]).
В частности, моноклональные антитела могут быть получены любым способом, который обеспечивает производство антител с помощью клеточных линий в непрерывной культуре, как, например, описанные у Kohler et al., Nature 256:495 (1975) и в патенте США 4376110; гибридомной технологией с помощью В-клеток человека (Kosbor et al., Immunology Today 4:72 [1983]; Cole et al., Proc Natl Acad Sci USA 80:2026 [1983]) и EBV-гибридомной технологией (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., pp. 77-96 [1983]). Такие антитела могут относиться к любому классу иммуноглобулинов, включая IgG, IgM, IgE, IgA, IgD, и любому их подклассу. Гибридома, продуцирующая mAb данного изобретения, может культивироваться in vitro или in vivo. Способность продуцировать высокие титры mAb in vivo делает этот метод особенно приемлемым способом получения.
Полученные поликлональные или моноклональные антитела проверяются на специфичность узнавания PSGL-1 вестерн-блот-анализом или иммунопреципитационным анализом с помощью известных методов, таких, например, которые описаны Ausubel et al. выше. Антитела, которые распознают и связываются с PSGL-1, используются в настоящем изобретении. Анти-PSGL-1-антитела, которые связываются с PSGL-1-антигеном на поверхности Т-клеток, например CD3+ клеток, и индуцируют истощение и/или апоптоз Т-клеток у индивидуума, особенно полезны.
Эти антитела могут использоваться, например, как составная часть курса терапии (например, для уменьшения или устранения нежелательной иммунной реакции, такой как опосредованная Т-клетками иммунная реакция, связанная с такими состояниями, как воспалительные заболевания, аутоиммунные заболевания, отторжение трансплантата, аллергические заболевания и Т-клеточный рак). Антитела могут также использоваться при скринировании для определения способности вещества-кандидата связывать PSGL-1.
Кроме того, методы, разработанные для получения «химерных антител» (Morrison et al., Proc Natl Acad Sci USA 81:6851 [1984]; Neuberger et al., Nature 312:604 [1984]; Takeda et al., Nature 314:452 [1984]) путем сплайсинга генов мышиного антитела с соответствующей антигенной специфичностью вместе с генами антитела человека с соответствующей биологической активностью, могут быть использованы. Химерное антитело представляет собой молекулу (вещество), в которое различные части имеют происхождение от различных видов животных, например, такое, у которого имеется вариабельная область от мышиного моноклонального антитела и константная область иммуноглобулина человека.
В другом случае способы, описанные для получения одноцепочечных антител (US патент №4946778, 4946778 и 470469) могут быть адаптированы для производства одноцепочечных антител к PSGL-1 полипептиду или его фрагменту. Одноцепочечные антитела получают связыванием фрагментов тяжелой и легкой цепи Fu региона с помощью аминокислотного мостика, что приводит в результате к одноцепочечному полипептиду.
Фрагменты антитела, которые распознают и связываются со специфическими эпитопами, могут быть созданы с помощью известных способов. Например, такие фрагменты включают (но без ограничения) F(ab')2 фрагменты, которые могут быть получены перевариванием пепсином молекулы антитела, a Fab фрагменты могут быть получены восстановлением дисульфидных мостиков F(ab')2 фрагментов. Или же могут быть сконструированы библиотеки Fab экспрессии (Huse et al., Science 246,1275 [1989]) для быстрой и легкой идентификации моноклональных Fab фрагментов с желаемой специфичностью.
Антитела могут быть гуманизированы известными в данной области методами. Например, моноклональные антитела с желаемой специфичностью связывания могут быть гуманизированными и коммерчески доступными (Scotgene, Scotland; Oxford Molecular, Palo Alto, Calif). Полные антитела человека, такие как те, что экспрессируются трансгенными животными, также используются в данном изобретении (Green et al., Nature Genetics 7:13 [1994]; US патенты №5545806, 5569825).
Мультимерные соединения
Мультимерные соединения, которые связываются с рядом PSGL-1 белков на поверхности Т-клетки или NK-клетки, могут использоваться для индуцирования апоптоза в клетке. Мультимерное соединение содержит, по меньшей мере, две полипептидные цепи. Каждая из полипептидных цепей содержит (i) связывающий домен, который связывается с PSGL-1, и (ii) гетерологичную аминокислотную последовательность.
В целом мультимерное соединение связывается с, по меньшей мере, двумя различными PSGL-1 белками на поверхности данной клетки. Однако мультимерное соединение может включать 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 и более отличающихся PSGL-1 связывающих доменов, что обуславливает связывание мультимерным соединением 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 и более различных PSGL-1 белков на поверхности данной клетки.
Связывающий домен может содержать любую аминокислотную последовательность (или любую аминокислотную последовательность с модификацией, такой как, например, гликозилирование и/или сульфатирование), которая связывается с PSGL-1. Связывающий домен может соответствовать аминокислотной последовательности как природного происхождения, так и неприродного происхождения. Например, связывающий домен может содержать PSGL-1-связывающий домен селектина (например, Р-селектина, Е-селектина или L-селектина). Полипептид, содержащий PSGL-1 связывающий домен селектина, может необязательно включать: (i) экстрацеллюлярный домен селектина (например, Р-селектина, Е-селектина или L-селектина); (ii) кальций-зависимый лектиновый домен селектина (например, Р-селектина, Е-селектина или L-селектина) или (iii) фрагмент экстрацеллюлярного домена селектина (например, Р-селектина, Е-селектина или L-селектина), который участвует в связывании PSGL-1. Помимо этих встречающихся в природе аминокислотных последовательностей, одна или несколько аминокислотных замен могут быть включены в PSGL-1 связывающий домен природного происхождения, приведя к получению последовательности неприродного характера, но при сохранении PSGL-1 связывающей функции. Например, полипептид может содержать аминокислотную последовательность, которая связывается с PSGL-1 и, по меньшей мере, на 80%, 85%, 90%, 95% или 98% идентична любой из следующих последовательностей: (i) экстрацеллюлярный домен селектина (например, Р-селектина, Е-селектина или L-селектина); (ii) кальций-зависимый лектиновый домен селектина (например, Р-селектина, Е-селектина или L-селектина) или (iii) фрагмент экстрацеллюлярного домена селектина (например, Р-селектина, Е-селектина или L-селектина), который участвует в связывании PSGL-1. Стандартные молекулярно-биологические способы мутагенеза могут использоваться для внесения изменений (замен) в последовательность нуклеиновой кислоты, кодирующую PSGL-1 связывающий домен. Модифицированные связывающие домены могут быть потом протестированы на способность связывать PSGL-1, например, иммобилизованный PSGL-1 или PSGL-1 на поверхности клетки. Связывающий домен может также содержать PSGL-1 связывающий домен антитела, специфичного к PSGL-1, или полипептида, отобранного из библиотеки фагового дисплея, или аминокислотную последовательность, которая связывается с PSGL-1 и, по меньшей мере, на 80%, 85%, 90%, 95% или 98% идентична PSGL-1 связывающему домену анти-PSGL-1-антитела или полипептида, выбранного из библиотеки фагового дисплея.
PSGL-1 связывающий домен может содержать аминокислотную последовательность, которая соответствует PSGL-1-связывающему фрагменту Р-селектина. Пример полипептидной цепи (мультимерного соединения, описываемого здесь), содержащей такую аминокислотную последовательность, представляет собой рекомбинантное химерное соединение мышиного Р-селектина и Fc (поставляется на рынок R&D Systems, Minneapolis, MN), содержащее следующие компоненты: (i) CD33 сигнальный пептид (Met 1-Ala 16); (ii) мышиный Р-селектин (Trp 42-Ala 709 экстрацеллюлярного домена); (ii) IEGRMD (SEQ ID NO:l) и (iv) человеческий IgG1 (Pro 100-Lys 330). Второй пример полипептидной цепи, содержащей такую аминокислотную последовательность, представляет собой рекомбинантное химерное соединение Р-селектина человека и Fc (поставляется R&D Systems, Minneapolis, NM), содержащее следующие компоненты: (i) Р-селектин человека (Met 1 -Ala 771, экстрацеллюлярный домен); (ii) IEGRMD (SEQ ID NO: 1) и (iii) IgG1 человека (Pro 100-Lys 330).
PSGL-1 связывающий домен может содержать аминокислотную последовательность, которая соответствует PSGL-1-связывающему фрагменту Е-селектина. Пример полипептидной цепи (мультимерного соединения, описываемого здесь), содержащей такую аминокислотную последовательность, представляет собой рекомбинантное химерное соединение мышиного Е-селектина и Fc (поставляется R&D Systems, Minneapolis, MN), содержащее следующие компоненты: (i) Е-селектин мыши (Met 1 -Pro 557, экстрацеллюлярный домен); (ii) IEGRMD (SEQ ID NO: 1); (iii) IgG1 человека (Pro 100 - Lys 330) и (iv) HHHHHH (SEQ ID NO: 2). Второй пример полипептидной цепи, содержащей такую аминокислотную последовательность, представляет собой рекомбинантное химерное соединение Е-селектина человека и Fc (поставляется R&D Systems, Minneapolis, MN), содержащее следующие компоненты: (i) Е-селектин человека (Met 1 - Pro 556, экстрацеллюлярный домен); (ii) IEGRMD (SEQ ID NO:2); IgG1 человека (Pro 100 - Lys 330) и (iv) HHHHHH (SEQ ID NO:2).
PSGL-1 связывающий домен может содержать аминокислотную последовательность, которая соответствует PSGL-1-связывающему фрагменту L-селектина. Пример полипептидной цепи (мультимерного соединения, описываемого здесь), содержащей такую аминокислотную последовательность, представляет собой рекомбинантное химерное соединение мышиного L-селектина и Fc (поставляется R&D Systems, Minneapolis, MN), содержащее следующие компоненты: (i) L-селектин мыши (Met 1 - Pro 557, экстрацеллюлярный домен); (ii) IEGRMD (SEQ ID NO: 1); (iii) IgG1 человека (Pro 100 - Lys 330) и (iv) HHHHHH (SEQ ID NO: 2). Второй пример полипептидной цепи, содержащей такую аминокислотную последовательность, представляет собой рекомбинантное химерное соединение L-селектина человека и Fc (поставляется R&D Systems, Minneapolis, MN), содержащее следующие компоненты: (i) L-селектин человека (Met 1 - Pro 556, экстрацеллюлярный домен); (ii) IEGRMD (SEQ ID NO: 2); IgG1 человека (Pro 100 - Lys 330) и (iv) HHHHHH (SEQ ID NO: 2).
Мультимерное соединение может быть гомомультимерным соединением или гетеромультимерным соединением. Гомомультимерное соединение содержит только полипептидные цепи, которые имеют идентичные PSGL-1 связывающие домены. Например, гомомультимерное соединение может содержать полипептидные цепи, содержащие идентичные PSGL-1 связывающие фрагменты Р-селектина. Гетеромультимерное соединение содержит полипептидные цепи, которые имеют различные PSGL-1 связывающие домены. Например, гетеромультимерное соединение может содержать первую полипептидную цепь, которая содержит PSGL-1 связывающий фрагмент Р-селектина, и вторую полипептидную цепь, которая содержит PSGL-1 связывающий фрагмент Е-селектина.
Гетерологичная аминокислотная последовательность может быть аминокислотной последовательностью. Однако аминокислотная последовательность полипептидных цепей, описанная здесь, не соответствует последовательности природного белка. Гетерологичная аминокислотная последовательность содержит одну или более аминокислот, которые дают возможность связывания полипептидным цепям. Например, одна или несколько аминокислот могут ковалентно связывать, например, с помощью дисульфидных связей полипептидные цепи. Один пример гетерологичной последовательности - это константная область тяжелой цепи иммуноглобулина. Дисульфидное связывание между Fc областями двух полипептидных цепей может приводить к образованию димерного соединения.
Помимо участия в образовании связи полипептидных цепей, гетерологичная аминокислотная последовательность может также содержать область, связывающуюся с «поперечным сшивателем», например область, связывающую рецептор клеточной поверхности. При связывании агента с такой связывающей областью в результате может происходить поперечное связывание (сшивание) полипептидных цепей и PSGL-1 белков клеточной поверхности, с которыми они взаимодействуют. Константная область тяжелой цепи иммуноглобулина содержит область, связывающую Fc рецептор. Поперечным сшивателем может быть, к примеру, антитело, которое специфически связывается с областью, гетерологичной аминокислотной последовательности, связывающейся с поперечным сшивателем.
Испытания по скринированию соединений, которые способны модулировать действие PSGL-1
Изобретение также включает способы выявления соединений, которые вступают во взаимодействие с PSGL-1 (или с доменом PSGL-1), включая (но не только) соединения, которые способствуют истощению Т-клеток и/или апоптозу Т-клеток при связывании с PSGL-1. Сюда включаются также и вещества, которые модулируют взаимодействие PSGL-1 с трансмембранными, экстрацеллюлярными или интрацеллюлярными белками, оказывающими влияние на PSGL-1 активность, или вещества, которые модулируют активность.
Вещества, которые могут быть подвергнуты скринированию в соответствии с изобретением, включают (но не только): пептиды, антитела и их фрагменты и другие органические соединения, которые связываются с PSGL-1 и модулируют биологическое действие, производимое PSGL-1, согласно описанному выше.
Такие соединения могут включать (но не только): пептиды, например растворимые пептиды, включающие (но без ограничения) представители из произвольных библиотек пептидов (Lam et al., Nature 354:82 [1991]; Houghten et al., Nature 354:84 [1991]), комбинаторные полученные химическими способами молекулярные библиотеки, состоящие из аминокислот D-и/или L-конфигурации, фосфопептиды (включающие, но без ограничения, представители библиотек произвольных или частично вырожденных полных фосфопептидов; Songyang et al., Cell 72:767 [1993]), антитела (включая, но не только), поликлональные, моноклональные, гуманизированные, антиидиотипические, химерные или одноцепочечные антитела, и Fab, F(ab')2 и FAb фрагменты из библиотек и их эпитопсвязывающие фрагменты), а также небольшие органические и неорганические вещества.
Другие вещества, которые могут быть скринированы в соответствии с изобретением, включают (но не только) небольшие органические вещества, которые влияют на активность PSGL-1 белка согласно описанному выше.
Компьютерное моделирование и поисковые технологии позволяют выявлять вещества или усовершенствовать уже выявленные вещества, которые могут моделировать PSGL-1 экспрессию или активность. Располагая таким выявленным веществом или композицией, можно выявить его активные центры или области. Такие активные центры, как правило, являются связывающим сайтом природного модулятора активности. Такой активный центр может быть выявлен с помощью известных в данной области способов исходя из аминокислотных последовательностей пептидов, нуклеотидных последовательностей нуклеиновых кислот или при изучении комплексов соответствующего вещества или композиции с его природным лигандом. В последнем случае химические или рентгенокристаллографические методы могут использоваться для нахождения активного центра путем установления, при каком условии обнаруживается модулятор (лиганд).
Несмотря на описанное выше в отношении разработки и получения веществ, могущих изменять связывание, можно проверять библиотеку уже известных веществ, включая природные и синтетические химические вещества и материалы, в том числе белки, для поиска соединений, которые связываются с PSGL-1 белком и вызывают истощение Т-клеток и/или индуцируют апоптоз Т-клеток.
Могут быть разработаны in vitro системы для поиска веществ, способных взаимодействовать с PSGL-1 (или доменом PSGL-1). Выявленные вещества могут использоваться, например, при модулировании активности Т-клеток, как описано выше, и в результате могут использоваться для лечения состояний, связанных с чрезмерным или нежелательным опосредованным Т-клетками иммунным ответом или чрезмерной или нежелательной пролиферацией Т-клеток, например воспаления, аутоиммунитета, отторжения трансплантата, аллергии или Т-клеточного рака.
Основная идея исследований, проводимых для выявления веществ, которые связываются с PSGL-1, предусматривает приготовление реакционной смеси PSGL-1 (или домена PSGL-1) и испытуемого вещества при условиях и в течение времени, достаточных для взаимодействия и связывания этих двух компонентов с образованием комплекса, который может быть отделен и/или определен в реакционной смеси. Используемые виды PSGL-1 могут быть различными в зависимости от цели скрининга. В некоторых случаях предпочтительно использовать пептид, соответствующий домену PSGL-1, слитый с гетерологичным белком или полипептидом, что дает преимущества при исследовании (например, при введении метки, выделении получившегося комплекса и т.д.).
Такие исследования по выявлению могут проводиться разными путями. Например, один способ осуществления такого исследования включает закрепление PSGL-1 белка, полипептида, пептида или слитого белка или исследуемого вещества на твердой фазе и определение комплексов на основе PSGL-1/исследуемое вещество на этой твердой фазе по завершении реакции. В одном варианте такого способа PSGL-1 реагент может быть закреплен на твердой поверхности, а исследуемое вещество, которое не закреплено, может быть меченым, косвенно или непосредственно.
На практике в качестве твердой фазы используют планшеты для микротитрования. Закрепляемый компонент может быть иммобилизован ковалентным или нековалентным связыванием. Нековалентное связывание может достигаться нанесением на твердую поверхность раствора белка и высушиванием. Или же иммобилизованное антитело, предпочтительно моноклональное антитело, специфичное к белку, который надо иммобилизовать, может использоваться для закрепления белка на твердой поверхности. Такие твердофазные поверхности можно готовить заранее и хранить.
Для этого, чтобы проводить это исследование, неиммобилизованный компонент добавляют на поверхность с нанесенным покрытием, содержащую закрепленный компонент. После того как реакция завершится, непрореагировавшие компоненты удаляют (например, промыванием) при условиях, когда образовавшиеся комплексы останутся на поверхности твердой фазы в иммобилизованном состоянии. Определение комплексов, закрепленных на твердой поверхности, может проводиться разными способами. Если не иммобилизуемый предварительно компонент является предварительно меченым, определение метки, иммобилизованной на поверхности, показывает, что комплексы были получены. Если неиммобилизуемый предварительно компонент не метят предварительно, то для определения комплексов, закрепленных на поверхности, может использоваться непосредственное мечение, например, с использованием меченого антитела, специфичного к предварительно неиммобилизуемому компоненту (антитело, в свою очередь, может быть непосредственно меченым или косвенно меченым с помощью меченого анти-IgG антитела).
Альтернативно реакция может проводиться в жидкой фазе, продукты реакции отделяют от непрореагировавших компонентов и определяют комплексы; например, используя иммобилизованное антитело, специфичное к PSGL-1 белку, полипептиду, пептиду или слитому белку или исследуемому веществу, чтобы закрепить (на поверхности) любые комплексы, образовавшиеся в растворе, и меченое антитело, специфичное к другому компоненту возможного комплекса, чтобы определить закрепленные комплексы.
Альтернативно основанные на использовании клеток исследования могут использоваться для выявления соединений, которые взаимодействуют с PSGL-1. С этой целью могут использоваться клеточные линии, которые экспрессируют PSGL-1, или клеточные линии, которые созданы генетическими методами для экспрессии PSGL-1. Исследования, основанные на использовании клеток, используются, в частности, при оценке функционального действия вещества, выявленного при поиске, описанном выше. Например, вещество проверяют на его способность связываться с PSGL-1 белком, затем тестируют способность этого вещества, например, индуцировать Т-клеточный апоптоз in vitro или in vivo или истощать Т-клетки in vitro или in vivo.
Фармацевтические композиции
При условии, что цель данного изобретения состоит в изменении иммунного ответа у индивидуума, фармацевтическая композиция, содержащая, например, антитела, мультимерные соединения, небольшие молекулы или другие вещества, которые специфически связываются с PSGL-1 полипептидами, также характеризует данное изобретение. В предпочтительном примере такое вещество проявляет себя как агонист PSGL-1.
Фармацевтические композиции для использования в настоящем изобретении могут быть составлены обычным путем с использованием одного или нескольких физиологически приемлемых носителей или наполнителей. Таким образом, на основе соединений и их физиологически приемлемых солей и сольватов могут быть созданы композиции для введения самими различными путями.
Композиции могут быть составлены для парентерального введения путем инъекций, например инъекций болюсов или непрерывной инфузией. Составы для инъекций могут быть в виде единичных доз, например в ампулах или в мультидозных контейнерах, с добавлением консервантов. Композиции могут быть в виде суспензий, растворов или эмульсий в масляных или водных средах и могут содержать составообразующие средства, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно активный ингредиент может быть в виде порошка для сочетания с подходящим средством, например стерильной апирогенной водой перед использованием.
Способы регулирования опосредованного Т-клетками иммунного ответа и истощения Т-клеточных популяций
Вещества, например, раскрытые в опытах по скринированию, описанных здесь, могут быть использованы, например, при модулировании биологической функции, опосредованной PSGL-1 полипептидом, и/или для лечения заболеваний, связанных с чрезмерным или нежелательным иммунным ответом, например опосредованным Т-клетками иммунным ответом. Эти вещества включают (но без ограничения) пептиды, антитела и их фрагменты, а также другие органические соединения, которые связываются с PSGL-1 на поверхности Т-клеток и индуцируют особый путь трансдукции, что приводит к гибели Т-клетки. Способы по изобретению необязательно включают добавление поперечно-сшивающего агента, который индуцирует поперечное сшивание PSGL-1 на поверхности клетки. Вещества, описываемые здесь, могут использоваться в любом случае, когда истощение или элиминирование активности Т-клеток является желательным. Конкретные состояния, на которые можно воздействовать веществами данного изобретения, включают воспалительные заболевания, аутоиммунные заболевания, отторжение трансплантата, аллергические заболевания и Т-клеточный рак.
Примеры состояний, которые можно лечить с помощью описанных здесь веществ, специфичных к PSGL-1, включают (без ограничения) сахарный диабет, артриты (включая ревматоидный артрит, юношеский ревматоидный артрит, остеоартрит, псориазный артрит), рассеянный склероз, энцефаломиелит, миастению gravis, системную красную волчанку, аутоиммунный тиреоидит, дерматиты (включая атонический дерматит, экзематозный дерматит), псориаз, синдром Шегрена, болезнь Крона, афтозную язву, ирит, конъюктивит, кератоконъюктивит, диабет I типа, воспалительные кишечные заболевания, язвенный колит, астму, аллергическую астму, красную волчанку кожи, склеродермию, вагинит, проктит, лекарственный дерматит, лепрозные обратные реакции, лепрозную узелковую эритему, аутоиммунный увеит, аллергический энцефаломиелит, острую некротизирующую геморрагическую энцефалопатию, идиопатическую билатеральную прогрессирующую сенсорневральную потерю слуха, апластическую анемию, полноэритроцитную анемию, идиопатическую тромбоцитопению, полихондрит, Wegener's грануломатоз, хронический активный гепатит, синдром Стивенса-Джонсона, идиопатические спру, красный плоский лишай, болезнь Грейвса, саркоидоз, первичный биллиарный цирроз, увентное воспаление сосудистой оболочки задней части глазного яблока, интерстициальный фиброз легкого, состояние «трансплантат-против-хозяина», случаи трансплантации (включая трансплантацию тканей аллогенного или ксеногенного типа), в том числе трансплантацию костного мозга, пересадку печени или пересадку любого органа или ткани, аллергии, такие как атоническая аллергия, СПИД и Т-клеточные новообразования, такие как лейкемии и/или лимфомы.
Способы данного изобретения могут использоваться для истощения Т-клеток в клеточных популяциях либо in vitro, или in vivo. Например, в биологической пробе, взятой у индивидуума, Т-клетки могут быть истощены in vitro при контактировании пробы с анти-PSGL-1 веществом, описанным здесь, необязательно вместе с поперечно-сшивающим агентом. Этот метод пригоден, например, если допускается снижение числа Т-клеток в клеточной популяции, а также снижение или элиминирование активности Т-клеток в клеточной популяции.
Далее приводятся примеры осуществления изобретения. Они не предназначаются для ограничения объема изобретения тем или иным образом.
Примеры
Пример 1: Получение моноклонального антитела, специфичного к белку («TAIP»), индуцирующего апоптоз Т-клеток
TAIP-специфичное моноклональное антитело получали с помощью известных методов слияния клеток, разработанных Kohler и Mistein ((1976) European Journal of Immunology 6:511-519) для получения нужных антител, секретируемых гибридомами.
Продуцирующие антитела клетки хомяка, которому предварительно были введены Balb/c Т-клетки селезенки, активированные конканавалином A (Con A), сливали с линией клеток миеломы, чтобы получить гибридому, секретирующую антитела. Две популяции клеток сливали с полиэтиленгликолем, получившиеся клетки, продуцирующие антитела, клонировали и размножали обычными методами культивирования. Одна гибридома, полученная таким способом, секретировала моноклональное антитело, обозначенное ТАВ4, которое обладало способностью индуцировать апоптоз Т-клеток in vitro и истощать Т-клетки in vivo. Протеин, распознаваемый ТАВ4, был обозначен как белок (протеин), индуцирующий апоптоз Т-клеток (TAIP).
С57 BL/6J (В6) и BALB/c мыши были закуплены в Jackson лаборатории (Bar Harbor, ME). Сирийские хомяки были приобретены в Animal Core Facilitu, National Taiwan University Medical College.
Концентрированный культуральный супернатант от ТАВ4 гибридомы подвергали центрифугированию при 20000 xg в течение 10 минут, затем супернатант разбавляли в соотношении 1:1 связывающим буфером (0,1 М ацетат натрия, рН 5,0). Колонку с G-белком (приблизительно со слоем 1 мл по объему) промывали три раза 3-5 мл связывающего буфера. Очищенный культуральный супернатант наносили на G-белок-колонку, проточные фракции собирали и вновь загружали в колонку. Колонку промывали 6-10 мл связывающего буфера, и связанное антитело элюировали с колонки 5 мл элюирующего буфера (0,1 М глицин - HCl, рН 2,8). Каждая фракция содержала 1 мл элюированного антитела и в элюированной фракции рН доводился до нейтрального значения смешиванием каждой 1 мл фракции с 50 микролитрами 1М Трис-HCl, рН 7,5. Фракции, содержащие антитело, были собраны, объединены и подвергнуты диализу против 2 л PBS, рН 7,4, трижды в течение 3 часов на каждую операцию диализа. Определяли концентрацию белка в пробах антител согласно методу, описанному Bradford с применением Bio-Rad Protein Assay (BIO-RAD, Hercules, CA).
Пример 2: Приготовление суспензии клеток селезенки мыши и активация и обогащение Т-клеток
Селезенку мыши погружали в 8 мл сбалансированного солевого раствора Хенкса (HBSS), осторожно измельчали с помощью стерильного покровного стекла и переносили в 15 мл-ю центрифужную пробирку (Costar), центрифугировали при 200 xg в течение 5 минут. Супернатант отделяли и осадок клеток ресуспендировали в оставшемся буфере, мягко покачивая. Контаминирующие красные кровяные клетки (RBS) лизировали добавлением 1 мл RBC лизирующего буфера (0,6 М NH4Cl, 0,17 М Трис-основание, рН 7,65) с последующей 2-х минутной инкубацией при комнатной температуре и быстрым добавлением 9 мм HBSS. Клетки осаждали при 200 xg в течение 5 минут, дважды промывали и ресуспендировали в RPMI среде. Концентрацию и жизнеспособность клеток в смеси определяли с помощью гемоцитометра (Cambridge Scientific Inc) с исключением Trypan blue.
Содержание клеток селезенки доводили до конечной концентрации 3×106/мл добавлением RPMI среды, добавляли Конканавалин А до конечной концентрации 2 микроорганизма, чтобы активировать Т-клетки. Клеточную суспензию переносили в 6-луночный культуральный планшет (5 мл/на лунку) или на 10-см культуральную чашку (10 мл/ чашка) и инкубировали при 37°С в атмосфере 5% СО2 в течение 48 часов перед съемом. Активированные клетки селезенки, включая активированные Т-клетки, ресуспендировали в 5 мл HBSS и осторожно наслаивали на поверхность 5 мл верхнего слоя 55% Percall раствора в центрифужной пробирке. Нужно проявлять осторожность, чтобы не перемещать слои. Клетки подвергают центрифугированию при 1900 xg в течение 13 минут при 25°С без перемешивания (слоев). Сконцентрировавшиеся Т-клетки собирали с поверхности двух слоев, после трех промывок HBSS они были готовы для использования в опытах.
Пример 3: Апоптоз активированных Т-клеток
Активированные Т-клетки (см. пример 2) ресуспендировали до конечной концентрации 5×105 клеток/мл в RPMI среде, содержащей 5 нг/мл IL-2, и обрабатывали контрольным Ig, TAB4 или анти-CD3 в соответствии с условиями, обозначенными в таблице 1.
После инкубации в течение 18-24 часов определяли избыточный апоптоз в каждой культуре с помощью 7-AAD исследования апоптоза. Обработанные клетки переносили в FACS пробирки (Falcon), дважды промывали ледяным FACS раствором (1% сыворотки теленка, 0,05% азида натрия в PBS), центрифугировали при 200 xg при 4°С. Клетки ресуспендировали в ледяном FACS растворе до конечной концентрации 1-2×107 клеток/мл. Для окрашивания 0,1 мл ресуспендированных клеток смешивали с 7-AAD до конечной концентрации 2 мкг/мл и затем инкубировали при 4°С в темноте в течение 20 минут. Наконец, окрашенные клетки дважды промывали ледяным раствором FACS, ресуспендировали в 0,5 мл FACS раствора и анализировали с помощью BD LSR проточного цитометра (Beckton Dickinson).
На Фиг.1 показаны результаты репрезентативного продолжающегося в течение определенного времени эксперимента, в котором выявляли, когда активированные Т-клетки приобретают чувствительность к опосредованным TAB4 (анти-ТАIР) сигналам апоптоза. Спленоциты мыши были активированы Con-А и поддерживались в IL-2-содержащей среде. Активированные Т-клетки собирали, ресуспендировали и подвергали воздействию с TAB4 моноклональным антителом или контрольным IgG хомяка в присутствии «поперечного сшивателя» - антитела, специфичного к IgG хомяка. Возможность поперечного сшивания с помощью TAIP влияло на индуцирование довольно низкого уровня (6,5%) гибели апоптотических клеток, что было очевидно в первый день. Однако степень ТАВ4-индуцированного апоптоза повысилась до 17% на 2-й день, достигла пика в 52% в 4-й день и снизилась до 44% на 6-й день. Контрольный IgG хомяка не вызывал специфической гибели Т-клеток в результате апоптоза по сравнению с культурами, которые получали только IL-2. Анти-CD3 (как позитивный контроль) вызывал апопотоз у 38% Т-клеток спустя 48 часов после активации (данные не приведены).
Пример 4: Экспрессия TAIP антигена в различных тканях
Клетки дважды промывали ледяным FACS раствором (1% фетальной сыворотки теленка, 0,05% азида натрия в PBS) и центрифугировали при 200xg при 4°С в FACS пробирке (Falcon). Клетки ресуспендировали в ледяном FACS растворе до конечной концентрации 1×107 клеток/мл и аликвоту в 0,1 мл от всех клеток, ресуспендированных в FACS пробирке (Falcon) использовали для каждого анализа. Для поверхностного окрашивания ТАВ4 моноклональные антитела или контрольный IgG хомяка при конечной концентрации 2 мкг/мл добавили к клеткам и смеси инкубировали при 4°С в течение 30 минут в темноте. Клетки были промыты ледяным FACS раствором и затем подвергнуты окрашиванию: (1) для клеток селезенки, цихром-конъюгированное анти-CD3 антитело (2 мкг/мл), FITC-конъюгированный анти-Ig хомяка и РЕ-конъюгированное анти-CD8/CD4/CD19/CD11 b/pan -NK/I-A/I-Е/Мас-3 антитело (2 мкг/мл) в 100 мкл ледяного FACS раствора; и (2) для тимоцитов, FITC-конъюгированный анти-Ig хомяка, РЕ-конъюгированное анти-CD 8 и цихром-конъюгированные анти-CD4 антитела (2 мкг/мл) в 100 мкл ледяного FACS раствора. Реакцию проводили при 4°С в течение 30 минут в темноте. В заключение окрашенные клетки промывали два раза FACS раствором, ресуспендировали в 1 мл FACS раствора и анализировали на BD LSR проточном цитометре (Beckton Dickison).
На Фиг.3 и 4 показаны результаты FACS анализа распределения TAIP антигена в различных субпопуляциях спленоцитов и тимоцитов. Как показано на Фиг.3, CD19+В клетки экспрессировали низкие, но детектируемые количества TAIP белков на своей поверхности. Значительно более высокие количества TAIP белков были детектированы для CD3+Т-клеток и фракции NK-клеток. Большинство CD4+, CD8+ и CD4+8+ тимусных Т-клеток экспрессировали значительные количества TAIP белков. При этом TAIP белки экспрессировались только небольшой популяцией CD4-8- тимусных Т-клеток (Фиг.4).
Ткани от В6 и BALB/c мышей, включая головной мозг, тимус, сердце, легкое, печень, желудок, почку, селезенку и кожу, собирали, закрепляли 10% формальдегидом в течение ночи при комнатной температуре и погружали в парафиновые блоки. Срезы тканей толщиной 4 мкм готовили из парафиновых блоков с помощью Leica RM2135 микротома, расправляли в воде 45°С и помещали на покровное стекло (слайд). Эти слайды высушивали при 37°С и хранили готовыми для последующих опытов.
Слайды, содержащие срезы ткани в парафине, очищали от парафина и высушивали, пропуская через ксилены и 100% этанол согласно стандартной методике и в заключение выдерживали в 100% этаноле. Срезы обезвоживали, многократно инкубируя их в 100% этаноле - 90% этаноле - 85% этаноле - 70% этаноле - PBS согласно стандартной методике до конечного этапа в PBS. Следующие реакции выполняли в увлажняющем боксе. Неспецифическое связывание блокировали инкубированием тканевых срезов в блокирующем буфере (1% стандартной козьей сыворотки) в течение 1 часа при комнатной температуре (или 4°С в течение ночи). Блокирующий буфер удаляли, к срезам добавляли ТАВ4 или стандартный Ig хомяка (разведение 1:200) и инкубировали еще один час при комнатной температуре (или при 4°С в течение ночи). Срезы дважды промывали PBS, каждый раз в течение 5 минут, чтобы удалить первичное антитело, подвергали взаимодействию с разведенным в 250 раз конъюгатом щелочной фосфатазы и антител козы к иммуноглобулину хомяка, затем инкубировали при комнатной температуре в течение 1 часа. Срезы затем вновь промывали два раза PBS, по 5 минут каждый раз, чтобы удалить конъюгат антитела и фермента, после чего произошло окрашивание реакционной смеси при использовании раствора субстрата BCIP/NBT при комнатной температуре и в темноте в течение 30 минут. Срезы промывали снова PBS для удаления избытка субстрата фермента, дегидратировали, применяя PBS-этанолксилены, и готовили для микроскопирования.
Результаты показали, что экспрессия TAIP белков детектировалась только в тканях костного мозга, а в остальных не была обнаружена.
Пример 5: Биотинилирование клеточной поверхности и иммунопреципитация TAIP антигена
5×107 RL ♂ 1 или NIH-3T3 клеток были поверхностно-биотинилированы в 1 мл PBS, содержащем 0,5 мг/мл Sulfo-NHS-биотина (Pierce) в течение 30 минут на льду. Реакцию прекращали инкубированием клеток с 0,5 мл среды Дюльбекке, модифицированной Иглом (Life Technologies, Inc.) в течение 10 минут на льду. Клетки промывали один раз 1 мл среды Дюльбекко, модифицированной Иглом, и 2 раза 1 мл фосфатно-солевого буфера.
Меченые клетки лизировали при плотности 5,0×107 клеток/мл в холодном лизирующем буфере (1% Тритон Х-100, 20 мМ Трис-HCl, рН 8.0, 160 мМ NaCl, 1 мМ CaCl2), содержащем полную смесь протеазных ингибиторов (cocktail) (Roche), в течение 15 минут, нерастворимый материал осаждали при 10000 xg в течение 10 минут; эти и последующие этапы проводили при 4°С. Для иммунопреципитации лизат проинкубировали в течение 30 мин с 50 µл сефарозы с присоединенным G-белком (Amersham Pharmacia Biotech) для удаления белков с неспецифическим связыванием. Зерна (сефарозы) отделяли, аликвоты супернатанта (как правило, соответствующие 5,0×107 клеток) инкубировали с 20 µл протеин G-сефарозой, предварительно загруженной 10 мкг mAb TAB4 или IgG стандартной сыворотки хомяка. После инкубации при 4°С в течение 4 часов смолу промывали 4 раза промывочным буфером (0,05% Тритон Х-100, 50 мМ Трис-HCl, рН 8,5, 400 мМ NaCl, 1 мМ CaCl2, 1 мг/мл овальбумина), дважды - сходным по составу промывочным буфером, содержащим 250 мМ вместо 400 мМ NaCl. Белки, специфически связавшиеся с TAB4, элюировали 50 µл буфера 1×SDS пробы. Элюированные белки выделяли 8% SDS-PAGE и переносили на нитроцеллюлозную мембрану (Millipore). Фильтры затем анализировали на биотинилированные белки с помощью пероксидаза-авидинового конъюгата (PharMingen) и обрабатывали Chemilumenescense реагентом (NENTM Life Science Products).
Как показано на Фиг.2, биотинилированный поверхностный белок с молекулярной массой приблизительно 120-кДа был идентифицирован TAB4 в RL.1 клетках (TAIP+Т-клетки), но не в 3Т3 клетках (TAIP-клетки). Напротив, с протеин FG-сефарозы с нанесенной стандартной сывороткой хомяка не элюировался этот 120-кДа белок. Эти результаты дают основание полагать, что этот 120-кДа белок является антигеном, распознаваемым моноклональным антителом TAB4 на поверхности Т-клеток.
Пример 6: Истощение Т-клеток in vivo
Для того чтобы выявить действие TAB4 на популяции Т-клеток и другие клетки in vivo, мышам вводили 300 мкг TAB4 или контрольного Ig хомяка внутрибрюшинной инъекцией и на 4-й день отбирали спленоциты, тимоциты, мононуклеарные периферические кровяные клетки для общего подсчета клеток и для анализов с помощью FACS маркеров клеточной поверхности.
Для FACS испытаний клетки закрепляли 2% параформальдегидом при 4°С в течение 20 минут, дважды промывали и ресуспендировали в ледяном FACS растворе до конечной концентрации 1×107 клеток/мл. 100 мкг аликвоту ресуспендированных клеток в FACS пробирке (Falcon) использовали для каждого анализа. ТАВ4 или контрольный Ig хомяка при конечной концентрации 2 мкг/мл добавляли к клеткам и инкубировали смеси при 4°С в течение 30 мин в темноте. Клетки промывали один раз ледяным FACS раствором и подвергали взаимодействию с: (1) для клеток селезенки: конъюгированное с цихромом антитело, специфичное к CD3 (2 мкг/мл), конъюгированное с FITC специфичное к Ig хомяка и РЕ-конъюгированное специфичное к CD8/CD4/CD 19/CD 11b/pan - NK/I-A/I-Е/Мас-3 антитело (2 мкг/мл) в 100 мкг ледяного FACS раствора; и (2) для тимусных клеток: конъюгированное с FITC специфичное к Ig хомяка антитело, конъюгированное с РЕ специфичное к CD8 антитело и цихром-конъюгированное специфичное к CD4 антитело (2 мкг/мл) в 100 мкгл ледяного FACS раствора. Реакцию проводили при 4°С в течение 30 минут в темноте. В заключение окрашенные клетки дважды промывали ледяным FACS раствором, ресуспендировали в 1000 мкл FACS раствора и анализировали с помощью BD LSR цитометра (Beckton Dickison).
Спустя четыре дня после инъекции доля CD3+ Т-клеток в лейкоцитах периферической крови (PBL) уменьшилась с 36,7% для контрольных мышей до 4,1% для ТАВ4-леченных мышей (Табл.2). ТАВ4 обработка вызывала небольшое снижение общего числа спленоцитов. Однако у ТАВ4-леченных мышей наблюдалось 62% снижение числа CD3+ Т-клеток, 50% снижение количества NK-клеток и слабое повышение общего числа CD19+ В-клеток. Общее число тимоцитов, полученных вновь от ТАВ4-леченных мышей, составило только 48% от уровня, полученного в контроле (менее 52%). Кроме того, за исключением CD4+ Т-клеток количества всех других CD8+, CD4+CD8+ и CD4-CD8-Т-клеток были меньше, а особенно в CD4+CD8+ субпопуляции, что отчетливо видно (64,7% уменьшение).
Пример 7: Специфичное к TAIP антитело не индуцирует секретирование IL-2 или TNF-альфа
Balb/с мышам инъецировали внутрибрюшинно 300 мкг ТАВ4 или стандартного Ig хомяка. Спленоциты выделяли спустя 7 дней после инъекции и использовали в качестве респондеров в культуре с обработанными митомицином С С3Н (H-2k) спленоцитами (в качестве стимуляторов). Через три дня собирали супернатанты культур и определяли содержание IL-2 с помощью набора ELISA (PharMingen). Как показано на Фиг.5, продуцирование IL-2 подавляется в респондерных клетках, полученных от ТАВ4-обработанных мышей по сравнению с контрольными мышами. Проверяли также уровни IL-2 и TNF-альфа и существенной разницы в содержании IL-2 (или TNF-альфа) в сыворотке контрольных и ТАВ4-обработанных мышей не было отмечено. Так как воспроизводство IL-2 является основопологающим в плане активности Т-клеток, результаты показывают, что TAIP-спепифичное антитело, такое как ТАВ4, может использоваться in vivo для манипулирования Т-клетками и регулирования нежелательных опосредованных Т-клетками иммунных реакций, таких которые связаны с аутоиммунными заболеваниями и отторжением трансплантатов.
Пример 8: Применение специфичных к TAIP антител для предотвращения отторжения трансплантата
Мышей (полученных из Jackson Laboratory) возрастом 8-12 недель анестезировали малеатом Ацепромазина (Fermenta Animal Health Co., Kansas City, МО).
До пересадки кожи реципиентные C57BL/6 мыши (Н-2b) (которым не удаляли тимус) получали внутрибрюшинные инъекции 500 мкг ТАВ4 или изотипических контрольных антител за семь дней до проведения операции по пересадке кожи. Спустя семь дней кожа с боковой области от полностью аллогенных мисматчированных Balb/cj мышей (Н-2d) была пересажена в боковую область предварительно получившим антитела C57BL/6 мышам. Спустя семь дней после трансплантации мышам снова инъецировали 500 мкг ТАВ4 или изотипических контрольных антител. Мышей обследовали ежедневно после трансплантации. Заключение об отторжении трансплантатов делали, если состояние 50% донорской кожи было некротическим. Доля прижившихся трансплантатов показана на Фиг.7 (n=8). Эти данные показывают, что лечение ТАВ4 антителом пролонгирует жизнеспособность аллогенных кожных трансплантатов.
Пример 9: Идентификация TAIP в качестве PSGL-1
Гликопротеиновый лиганд-1 Р-селектина (PSGL-1), называемый также CD 162, является главным лигандом Р-селектина, экспрессируемым лейкоцитами, включая Т-клетки (Sako et al. (1993) Cell 75:1179; Vachino et al. (1995) J. Biol. Chem. 270:21966; Veldman et al. (1995) J. Biol. Chem. 270:16470). Биохимические свойства TAIP, например его молекулярная масса и его тенденция к димеризации, позволяют предположить, что ТАВ4 может быть схож с PSGL-1. Чтобы исследовать взаимосвязь между этими двумя антигенами, исследовали следующее: 1) мог ли антиген, преципитированный с помощью ТАВ4, распознаваться пригодным коммерческим антителом, специфичным к PSGL-1; и 2) может ли специфичное к PSGL-1 антитело истощать ТАВ4 из клеточного лизата.
RL ♂ Т-клетки лизировали при плотности 1,0×10 клеток/мл в лизирующем буфере (1% Тритон Х-100, 20 мМ Трис-HCl, рН 8,0, 160 мМ NaCl, 1 мМ CaCl2), содержащем полный «коктейль» протеазных ингибиторов, в течение 1 часа, нерастворимый материал осаждали при 10000 xg в течение 10 минут. Эту и последующие стадии выполняли при 4°С. Лизат с 54,0×107 клеток инкубировали с 20 мкл протеин G-Сефарозы, предварительно загруженной 10 мкг анти-PSGL-1 mAb (клон 2НР1, PharMingen, San Diego, CA), анти-TAIP mAb, ТАВ4 или IgG стандартной сыворотки хомяка. После 4-х часов инкубации при 4°С зерна промывали пять раз промывочным буфером (0,05% Тритон Х-100, 50 мМ Трис-HCl, рН 8,5, 400 мМ NaCl, 1 мМ CaCl2, 1 мг/мл овальбумина) и дважды сходным промывочным буфером, содержащим 200 мМ вместо 400 мМ NaCl. Связанные белки элюировали 40 мл 1×SDS буфером пробы. Элюированные белки отделяли 6% SDS-PAGE и переносили на нитроцеллюлозную мембрану. Эти мембраны подвергали иммуноблоттингу с mAb, специфичным к PSGL-1, и выявляли конъюгатом пероксидазы с козьим антикрысиным IgG (H+L) с последующей хемилюминесценцией (Renaissance, NEN).
Поверхностно-биотинилированные RL ♂ Т-клетки были лизированы при плотности 1,0×108 клеток/мл в лизирующем буфере. Клеточный экстракт инкубировали с 20 мкг антитела, связанного с 40 мкл протеин G-Сефарозы при 4°С, в течение ночи. Истощение достигалось с анти-PSGL-1 mAb (2HP1) или контрольным IgG крысы, с ТАВ4 или контрольной стандартной сывороткой хомяка. Истощенные лизаты далее подвергали иммунопреципитации с ТАВ4 или mAb, специфичными к PSGL-1, соответственно. Иммунопреципитаты выделяли на 6% SDS-полиакриламидном геле и детектировали флюорографией. Как показано на Фиг.6, антитела, специфичные к PSGL-1, могут истощать TAIP белок из лизатов Т-клеток. Кроме того, белки, иммунопреципитированные с помощью анти-TAIP антитела (ТАВ4), распознаются антителами, специфичными к PSGL-1, при Вестерн-анализе.
Пример 10: Индукция апотоза Т-клеток человека антителом, специфичным к PSGL-1
Для выявления роли, которую играет PSGL-1 в апоптозе Т-клеток человека, проводили опыты в течение определенных периодов времени, чтобы определить, когда активированные Т-клетки человека приобретают чувствительность по отношению PSGL-1-опосредованным сигналам апоптоза. Т-клетки человека стимулировали митогеном фитогемагглютинина (РНА) и далее выдерживали в IL-2-содержащей среде. Активированные Т-клетки собирали и распускали в анти-PSGL-1 в присутствии IL-2 и поперечно-сшивающих антител.
У здоровых взрослых людей делали забор периферической крови, гепаринизировали ее и обогащали (концентрировали) мононуклеарные клетки периферической крови (РВМС) на основе разности плотностей с помощью Ficoll-Pague Plus (Pharmacia Biotech). PBMC активировали 1% РНА (Life Technologies, GibcoBRL) в течение 48 часов и последовательно культивировали в рекомбинантном человеческом IL-2 (5 нг/мл) в течение всего периода исследования. Для того чтобы оценить апоптозиндуцирующую способность антитела, специфичного к PSGL-1 человека, активированные клетки обрабатывали: (1) 1 мкг/мл специфичным к PSGL-1 антителом, клон KPL (BD PharMingen) плюс поперечно-сшивающим антимышиным Ig кролика (0,5 мкг/мл) (Jackson ImmunoResearch Laboratories); (2) изотипическим контрольным очищенным Ig мыши плюс поперечно-сшивающий антимышиный Ig кролика или (3) одним поперечно-сшивающим антимышиным Ig кролика. После шести часов обработки с помощью FACS определяли долю клеток начальной стадии апоптоза, окрашивая анти-Annexin V (BD PharMingen) и PI (Sigma).
Как показано на Фиг.8, подача сигнала, запускаемая PSGL-1 с помощью специфичного к PSGL-1 антитела, плюс запускаемая поперечно-сшивателем, приводила к значительному уровню апоптоза РНА-активированных РВМС человека (главным образом, Т-клеток). Процентная доля апоптотических клеток увеличивалась от 8,5% на 3-й день до 24% к 8-му дню в культурах, обработанных специфичным к PSGL-1 антителом. Ни изотипически сходный контроль, ни поперечно-сшивающие антитела сами по себе не давали никакого результата на указанных выше клетках.
Пример 11: Применение агонистического антитела, специфичного к PSGL-1, для лечения аутоиммунных заболеваний
Разводили мышей с «тощим» диабетом (NOD), животных с хорошо известным аутоиммунным диабетом. Спонтанный диабет развивался у NOD мышей в возрасте около 20 недель. В опытной группе мыши получали три дозы анти-PSGL-1 антитела (ТАВ4) внутрибрюшинно по 300 µг на мышь в возрасте 14, 15 и 17 недель. Еще две дополнительные инъекции тех же доз делали в возрасте 24 и 26 недель. Контрольная группа получала иммуноглобулин хомяка в тех же дозах. У мышей регулярно определяли глюкозу в моче с помощью полосок Medi-Test Glucose (Macherey-Nagel, Germany) каждую неделю по два раза по достижении возраста 15 недель. Не снижающийся уровень глюкозы в моче сверх 300 мг/дл во время следующих подряд двух определений позволял сделать вывод о наличии диабета.
Как показано на Фиг.9, лечение ТАВ4 антителом (специфичным к PSGL-1) приводило к существенной защите по сравнению с лечением антителами в контроле. Таким образом, лечением специфичным к PSGL-1 антителом можно добиться угнетения активности аутоиммунных Т-клеток и приостановить наступление диабета I типа.
Пример 12: Связывание Р-селектина, Е-селектина и L-селектина с активированными Т-клетками
Для определения способности селектинов (Р-селектина, Е-селектина и L-селектина) связываться с активированными Т-клетками, свежеполученные спленоциты от C57BL/6 мышей активировали и собирали на 2, 4 и 6 день. Неактивированные Т-клетки (т.е. свежеприготовленные спленоциты в день 0) также анализировали. На 2-й день пробу, содержащую спленоциты в количестве 3×106 клеток/мл, активировали 2 мкг/мл Конканавалина A (Con А) в DMEM+10% FBS в течение 2 дней. Живые клетки выделяли с помощью отделения с использованием градиента Ficoll. На 4-й день получили пробу из клеток, которые были активированы с помощью Con А в течение 3 дней и выращивались в среде, содержащей 5 нг/мл IL-2 еще один день. На 6-й день получали пробу из клеток, активированных с помощью Con А в течение 3 дней и культивируемых при 5 нг/мл IL-2 в течение 3 дней.
Для проведения FACS анализа проб от культур возрастом 0, 2, 4 и 6 дней отбирали по 2×105 клеток на лунку, инкубировали при 4°С в течение 30 минут с 40 мкг/мл мышиного Р-селектина, Е-селектина или L-селектина, конъюгированного с Fс-областью человеческого IgG1 (R&D Systems, Minneapolis, MN) при концентрациях, превышающих 20 мкг/мл, с двукратным серийным разведением до 0,156 мкг/мл. После инкубации клетки промывали 1×FACScan буфером (1×PBS без ионов кальция и магния от Biochrom AG, Berlin и 2% FBS). Далее пробы инкубировали при 4°С в течение 30 минут с 95 мкл/ячейку анти-Thy 1.2 и вторым реагентом (FITC-анти-IgG человека, который специфичен к Fc-фрагменту, получен от Jackson Immuno Research Laboratories, Inc., West Grove, PA) при 3,25 мкг/мл, а затем промывали 1×FACSsan буфером.
Результаты FACSCalibur анализа показаны на Фиг.10. При 20 мкг/мл связывание Р-селектина с активированными Т-клетками мыши резко повышалось, достигло пика к 4-му дню и слабо снижалось на 6-й день. Связывание Е-селектина существенно повышалось, начиная с 2-го дня по 4-й день, и затем оставалось на высоком уровне на 6-й день. Связывание L-селектина с активированными мышиными Т-клетками не было явным и не изменялось после периода активации, т.е. от дня 0 к дню 6. Результаты, наблюдаемые с L-селектином, могли быть такими из-за очевидной низкой аффинности связывания L-селектина с его лигандом. Подобные результаты были также получены, когда в опытах использовались более низкие концентрации всех трех селектинов.
Пример 13: Мультимерные формы Е-селектина и Р-селектина индуцируют апоптоз активированных Т-клеток.
В 96-луночный планшет (NUNC) наносили 50 мкл IgG, специфичного к Fc человека, по 20 мкг/мл в 1×PBS при 4°С в течение ночи, закрепляли 1% BSA при 37°С в течение 2 часов и инкубировали с 50 мкл со слитым селектин-Fc человека (от 0,063 до 5 мкг/мл) при комнатной температуре в течение 2 часов. На всех экспериментальных стадиях каждую лунку тщательно пять раз промывали 1×PBS. Затем 2×105 Т-клеток, активированных предварительно с помощью Con А в течение четырех дней, добавляли в каждую лунку и инкубировали при 37°С в течение 5 часов до центрифугирования планшета при 200xg в течение 5 минут при 4°С. Получившийся осадок, содержащий активированные Т-клетки, инкубировали с Annexin-V-биотиновым конъюгатом при комнатной температуре в течение 15 минут и затем с авидиновым конъюгатом (SA-бета-гал при разведении 1:5000) еще 30 минут при 37°С. В каждой реакции связывания каждую лунку промывали трижды Annexin V-связывающим буфером. Цветное окрашивание происходило при инкубировании и 110 мкл, Z-буферной смеси (54 мкл 2-меркаптоэтанола в 20 мл Z-буфера) и 30 мкл ONPG (0,04 г/10 мл) при 4°С. Значения оптической плотности при 420 нм регистрировались.
Уровень селектин-индуцируемого апоптоза активированных Con-А Т-клеток повышался с повышением концентраций (от 0,063 мкг/мл до 5 мкг/мл) Р-селектина (Фиг.11А) или Е-селектина (Фиг.11В), слитых с Fc человеческого IgG1. Антитело хомяка, ТАВ4, индуцирует апоптоз активированных Т-клеток (см. пример 1) и использовался как позитивный контроль во всех опытах. Как негативный контроль, античеловеческий Fc, человеческий Ig (HIg) и BSA не вызывали апоптоза. Никакого значительного уровня апоптоза не определялось в присутствии слитого белка L-селектина и Fc человека (Фиг.11С), что соответствует неспособности L-селектина успешно связываться с активированными Т-клетками (Пример 12).
В заключение следует отметить, что стереотипно-связанный слитый белок, содержащий PSGL-1 связывающий фрагмент Р-селектина или Е-селектина и Fc-фрагмента человека, индуцировал апоптоз активированных Т-клеток.
Пример 14: Поперечное сшивание растворимого Р-селектин-Fc слитого белка индуцирует апоптоз активированных Т-клеток
Селектины мыши (Р-селектин, Е-селектин и L-селектин) сливали с Fc-областью человеческого IgG1, что детально описано выше, с образованием растворимых димерных слитых белков. Чтобы оценить, могут ли растворимые селектины индуцировать апоптоз активированных Т-клеток, осуществляли эксперимент, который детально описан в примере 13, за исключением того, что не использовался стереотипно-связанный Ig, специфичный к Fc человека. Ничтожно малые или низкие уровни апоптоза активированных Т-клеток фиксировались исключительно в присутствии растворимой формы слитого белка Р-селектина (димера) (Фиг.12). Однако при добавлении поперечно-сшивающего средства (анти-Fc человека) активность апоптоза существенно возрастала, приблизительно до уровней апоптоза, индуцированного в присутствии стереотипно-связанного антитела. Ни анти-Fc человека, Ig человека (HIg), ни BSA не индуцировали апоптоза.
Подобные результаты были получены для Е-селектин-Fc слитого белка, а также для Р-селектин-Fc слитого белка. Кроме того, согласно результатам, полученным для связанного (мультимерная форма) L-селектина, растворимая форма слитого белка L-селектина не индуцирует апоптоза активированных Т-клеток.
Реферат
Изобретение относится к области иммунологии и касается модуляторов гликопротеинового лиганда 1 Р-селектина. Сущность изобретения включает мультимерное соединение, которое связывается, по меньшей мере, с двумя (PSGL-1) белками на поверхности Т-клетки, причем мультимерное соединение содержит две полипептидные цепи, каждая из которых включает связывающий домен, который связывается с PSGL-1 и который содержит экстрацеллюлярный домен Р-селектина или его связывающий фрагмент, или экстрацеллюлярный домен Е-селектина или его связывающий фрагмент, а также гетерологичную аминокислотную последовательность, причем две полипептидные цепи соединены гетерологичной аминокислотной последовательностью с образованием мультимерного соединения. Преимущество изобретения заключается в создании средства, которое может использоваться для индуцирования Т-клеточного истощения и/или индуцирования апоптоза Т-клеток. 3 н. и 27 з.п. ф-лы, 12 ил., 2 табл.
Формула
выбор индивидуума, в отношении которого установлено наличие или риск достижения состояния, характеризующегося чрезмерным или нежелательным опосредованным Т-клетками иммунным ответом; и
введение индивидууму мультимерного соединения, которое связывается с, по меньшей мере, двумя PSGL-1 белками на поверхности Т-клетки, причем мультимерное соединение содержит две полипептидные цепи, каждая полипептидная цепь включает (i) связывающий домен, который связывается с PSGL-1, который включает экстрацеллюлярный домен Р-селектина или его PSGL-1 - связывающий фрагмент или экстрацеллюлярный домен Е-селектина или его PSGL-1 - связывающий фрагмент, и (ii) гетерологичную аминокислотную последовательность, причем полипептидные цепи соединены гетерологичной аминокислотной последовательностью с образованием мультимерного соединения, и
связывание мультимерного соединения с, по меньшей мере, двумя PSGL-1 белками на поверхности Т-клетки индуцирует особый путь трансдукции сигнала, который приводит к гибели Т-клетки, тем самым предотвращая опосредованный Т-клетками иммунный ответ или снижая его уровень у индивидуума.
использование Т-клетки или NK-клетки, экспрессирующей PSGL-1 на своей поверхности;
контактирование Т-клетки или NK-клетки с мультимерным соединением, которое связывается с, по меньшей мере, двумя PSGL-1 белками на поверхности Т-клетки или NK-клетки, причем мультимерное соединение содержит две полипептидные цепи, каждая полипептидная цепь включает (i) связывающий домен, который связывается с PSGL-1, который включает экстрацеллюлярный домен Р-селектина или его PSGL-1 - связывающий фрагмент или экстрацеллюлярный домен Е-селектина или его PSGL-1 - связывающий фрагмент, и (ii) гетерологичную аминокислотную последовательность, причем полипептидные цепи соединены гетерологичной аминокислотной последовательностью с образованием мультимерного соединения; и
связывание мультимерного соединения с, по меньшей мере, двумя PSGL-1 белками на поверхности Т-клетки или NK-клетки индуцирует особый путь трансдукции сигнала, который приводит к гибели Т-клетки или NK-клетки.
мультимерное соединение, которое связывается с, по меньшей мере, двумя PSGL-1 белками на поверхности Т-клетки, причем мультимерное соединение включает две полипептидных цепи, каждая полипептидная цепь включает (i) связывающий домен, который связывается с PSGL-1, который включает экстрацеллюлярный домен Р-селектина или его PSGL-1 - связывающий фрагмент или экстрацеллюлярный домен Е-селектина или его PSGL-1 - связывающий фрагмент, и ii) гетерологичную аминокислотную последовательность, причем полипептидные цепи соединены гетерологичной аминокислотной последовательностью с образованием мультимерного соединения, а связывание мультимерного соединения с, по меньшей мере, двумя PSGL-1 белками на поверхности Т-клетки индуцирует особый путь трансдукции сигнала, который приводит к гибели Т-клетки; и инструкции по применению соединения.

Комментарии