Способ лечения, антитела, гибридома - RU2139731C1
Код документа: RU2139731C1
Чертежи


























Описание
Уведомление об авторском
праве 37 C.F.R. 1.74 (d) / (e)
Часть заявленного в этом патентном документе содержит материал, который является предметом защиты авторского права. Автор не возражает против воспроизведения
кем бы то ни было этого патентного документа или материала, заявленного в нем, в том виде, в каком он появляется в картотеках патентов или регистрационных протоколах Patent and Trademark office, но во
всех других случаях оговаривает все авторские права.
Заявки, касающиеся предмета данной заявки
Эта заявка является частичным продолжением заявки United States Serial N
07/978891, представленной 13 ноября 1992, ожидающей решения. Этот патентный документ близок к United States Serial N 07/977691 с заголовком "ПОВРЕЖДЕННАЯ ДОМИНАНТНАЯ СЕЛЕКТИРУЕМАЯ МАРКЕРНАЯ
ПОСЛЕДОВАТЕЛЬНОСТЬ ДЛЯ УСИЛЕНИЯ ЭКСПРЕССИИ ПРОДУКТА СОЕДИНЕННОГО С НЕЙ ГЕНА И СОДЕРЖАЩИЕ ЕЕ ЭКСПРЕССИРУЮЩИЕ ВЕКТОРНЫЕ СИСТЕМЫ" (ожидающей решения, представленной 13 ноября 1992) и "ПОВРЕЖДЕННАЯ
ДОМИНАНТНАЯ СЕЛЕКТИРУЕМАЯ МАРКЕРНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ И СТРАТЕГИИ ИНТРОННЫХ ВСТАВОК ДЛЯ УСИЛЕНИЯ ЭКСПЕРССИИ ГЕННОГО ПРОДУКТА И СОДЕРЖАЩИЕ ИХ ЭКСПРЕССИРУЮЩИЕ ВЕКТОРНЫЕ СИСТЕМЫ"
U. S. Serial N
(представленной одновременно с данной заявкой). Эти близкие по теме патентные документы включены здесь в виде ссылки.
Содержание
A. Область изобретения
B. Предпосылки
изобретения
C. Краткое изложение сущности изобретения
D. Краткое описание рисунков
E. Детальное описание предпочтительных вариантов
F. Примеры
I.
РАДИОАКТИВНО МЕЧЕННОЕ АНТИ-CD 20 АНТИТЕЛО 2B8
A. Получение анти-CD20 моноклональных (мышиных) антител ("288")
B. Получение конъюгата 2B8-MX-DPTA
i. MX - DTPA
ii.
Получение 2B8
iii. Конъюгировании 2B8 с MX-DTPA
iv Определение включения MX-DTPA
v Иммунореактивность 2B8-MX-DTPA
vi Получение меченного индием-[III] 2B8-MX-DTPA
("12B8")
vii Получение меченного иттрием-[90]-2B8-MX-DTPA ("Y2B8")
C. Исследования на животных (не человеке)
i Распределение радиоактивного меченного 2B8-MX-DTPA
ii
Локализация 12B8 в опухоли
iii Исследования биораспределения и локализации опухоли с применением 2B8-MX-DTPA D Исследования на человеке
i 2B8 и 2B8-MX-DTPA: иммуногистологические
исследования с тканями человека
ii Клинический анализ 12B8 (томография) и Y2B8 (терапия)
a. Клиническое исследование фазы I/II:
Исследование терапии с применением
однократной дозы.
Клиническое исследование фазы I/II:
исследование терапии с применением многократных доз
II. ПОЛУЧЕНИЕ ХИМЕРНЫХ АНТИ-CD20 АНТИТЕЛ ("C2B8")
A.
Конструирование химерных экспрессирующих анти-CD20 иммуноглобулин векторов ДНК
B. Создание химерных продуцирующих анти-CD20 CHOB и SP 2/0 трансфектом
C. Определение иммунологической
активности химерных анти-CD20 антител
i Анализ с человеческим C1q
ii Комплемент - зависимый клеточный лизис
iii Эффекторный анализ зависимой от антител клеточной
цитотоксичности
III. ИСТОЩЕНИЕ B-КЛЕТОК IN VIVO ПРИ ПОМОЩИ ХИМЕРНЫХ И АНТИ-CD20 АНТИТЕЛ
A. Исследование на приматах
B. Клинический анализ C2B8
i Клиническое
испытание фазы I/II C2B8: исследование терапии с применением однократной дозы
ii Клиническое испытание фазы I/II C2B8: исследование терапии с применением многократных доз
IV.
КОМБИНИРОВАННАЯ ТЕРАПИЯ: C2B8 и Y2B8
A. Получение Y2B8
B. Получение C2B8
C. Результаты
V. АЛЬТЕРНАТИВНЫЕ СТРАТЕГИЙ ТЕРАПИИ
VI. ИНФОРМАЦИЯ О
ДЕПОНИРОВАНИИ
G. ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
H. ФОРМУЛА ИЗОБРЕТЕНИЯ
A. Область изобретения
Ссылки, обсуждаемые в тексте данного документа, изложены лишь для
информации, описанной до даты представления этого документа, и ничто здесь не должно быть истолковано как допущение, выраженное определенно или в виде намека, что эти ссылки являются "предшествующими
работами" или что эти заявители не имеют права датировать задним числом такие описания посредством прежних изобретений или приоритета, основанного на раньше представленных заявках.
Данное изобретение касается лечения B-клеточной лимфомы при помощи химерных и радиоактивно меченных антител к антигену Bp 35 ("CD20") поверхности B-клеток.
B. Предпосылки изобретения
Иммунная система позвоночник (например, приматов, включающих в себя человека, обезьян, мартышек и т.д.) состоит из ряда типов органов и клеток, которые развиваются, чтобы: точно и специфически
узнавать чужеродные микроорганизмы ("антиген"), которые заселяют позвоночное - хозяина; специфически связываться с такими чужеродными микроорганизмами, элюминировать/разрушать такие чужеродные
микроорганизмы.
Лимфоциты, среди других, являются решающими для иммунной системы. Лимфоциты продуцируются в тимусе (вилочковой железе), селезенке и костном мозгу (взрослых особей) и составляют приблизительно 30% общего числа лейкоцитов, присутствующих в сердечно-сосудистой системе человека (взрослого). Существуют две основные субпопуляции лимфоцитов: T-клетки и B-клетки. T-клетки ответственны за клеточно-опосредованный иммунитет, тогда как B-клетки ответственны за продуцирование антител (гуморальный иммунитет). Однако T-клетки и B-клетки могут рассматриваться как зависимые в типичном иммунном ответе, поскольку T-клетки активируются при связывании рецептора T-клеток с фрагментами антигена, связанными с гликопротеинами главного комплекса гистосовместимости ("MHC") на поверхности несущих антиген клеток; такая активация вызывает выделение биологических посредников (медиаторов), "интерлейкинов"), которые, при их накоплении, стимулируют дифференциацию B-клеток и образование антител ("иммуноглобулинов") против этого антигена.
Каждая B-клетка внутри хозяина экспрессирует отличающиеся антитела на ее поверхности: так, одна B-клетка будет экспрессировать антитела, специфические против одного антигена, тогда как другая B-клетка будет экспрессировать антитела, специфические для другого антигена. Таким образом, B-клетки очень разные, и это разнообразие является критическим для иммунной системы. У человека каждая B-клеток может продуцировать огромное количество молекул антител (приблизительно 107 - 108). В наиболее типичных случаях такое продуцирование антител прекращается (или существенно уменьшается) при нейтрализации чужеродного антигена. Однако иногда пролифтерация определенной B-клетки не ослабляется; такая пролиферация может привести к раку, называемому "B-клеточной лимфомой".
T-клетки и B-клетки содержат поверхностные клеточные белки, которые могут использованы в качестве "маркеров" для дифференциации и идентификации. Одним из таких маркеров человеческих B-клеток является консервативный (эволюционно стабильный) дифференцировочный антиген Bp 35 B-лимфоцитов человека, называемый "C20". CD20 экспрессируется во время раннего развития предшественников B-клеток и остается до дифференциации клеток плазмы. В частности, молекула CD20 может регулировать стадию в процессе активации, которая необходима для инициации клеточного цикла и дифференциации, и обычно экспрессируется на очень высоких уровнях на неопластических ("опухолевых") B-клетках. CD20, по определению, присутствует как на "нормальных" B-клетках, так и на "злокачественных" - клетках, т.е. тех B-клетках, неослабленная пролиферация которых может приводить к B-клеточной лимфоме. Таким образом, поверхностный антиген CD20 может потенциально быть кандидатом для "нацеливания" на B-клеточную лимфону.
В сжатом виде такое нацеливание можно обобщить следующим образом: антитела, специфические для поверхностного антигена CD20 B-клеток, инъецируют в больного. Эти антитела CD20 специфически связываются с поверхностным антигеном CD20 как нормальных, так и злокачественных B-клеток, анти-CD20 антитела, связанные с поверхностным антигеном CD20, могут приводить к разрушению и истощению неопластических B-клеток. Дополнительно с анти-CD20 антителами могут быть конъюгированы химические агенты или радиоактивные метки, потенциально разрушающие опухоль, так что такой агент специфически "доставляется", например, к неопластическим (опухолевым) B-клеткам. Независимо от подхода первичной задачей является разрушение опухоли: особый подход может определяться определенными анти-CD20 антителами, которые применяют. Таким образом, подходящие подходы для нацеливания на антиген C20, могут значительно отличаться один от другого.
Например, сообщалось о попытках такого нацеливания на поверхностный антиген CD20. Сообщалось, что мышиные моноклональные антитела IF5 (анти-CD20 антитела) вводили непрерывным внутривенным вливанием больным с B-клеточной лимфомой. Сообщалось, что чрезвычайно высокие уровни (более 2 граммов) IF5 требовались для истощения циркулирующих опухолевых клеток, и результаты были описаны как "временные". Press et al., Monoclonal Antibody IF5 (Anti-CD20) Serotherapy of Human B-Cell Lymphoma". Blood 69/2: 584 - 591 (1987).
Потенциальной проблемой при этом подходе является то, что нечеловеческие моноклональные антитела (например, мышиные моноклональные антитела) не имеют функциональности человеческого эффектора, т.е. они не способны медиировать зависимый от комплемента лизис или лизировать человеческие клетки мишени через зависимую от антител клеточную токсичность или опосредованный с - рецептором фагоцитоз. Кроме того, нечеловеческие моноклональные антитела могут узнаваться человеком - хозяином как чужеродный белок; поэтому повторные инъекции таких чужеродных антител могут приводить к индукции иммунных ответных реакций, ведущих к опасным реакциям гиперчувствительности. В случае мышиных антител это часто называют человеческой ответной реакцией на анти- мышиные антитела, или "НАМА". Дополнительно, эти "чужеродные" антитела могут быть атакованы иммунной системой хозяина таким образом, что они фактически нейтрализуются до того, как они достигнут их целевого сайта.
Лимфоцита и лимфомные клетки всегда чувствительны к радиотерапии по нескольким причинам: локальная эмиссия ионизирующей радиации радиоактивно меченных антител может убивать клетки с целевым антигеном или без него (например, с CD20 или без CD20) вблизи антитела, связанного с антигеном, проникающая радиация может устранять проблему лимитированного доступа к антителам в объемных или слабо васкуляризованных опухолях; общее количество требуемых антител может быть уменьшено. Радионуклиды испускают радиоактивные частицы, которые могут разрушать клеточную ДНК до такой степени, когда клеточные механизмы репарации не способны обеспечить продолжение жизни клетки; поэтому, если целевые клетки - мишени являются опухолевыми, радиоактивная метка убивает опухолевые клетки. Радиоактивно меченные антитела, по определению, включают применение радиоактивного вещества, что может требовать соблюдения мер предосторожности как для больного (то-есть возможной трансплантации костного мозга), так и для человека, обеспечивающего медико-санитарную помощь (т. е. необходимости соблюдения высокой степени осторожности при работе с радиоактивностью).
Поэтому подход для улучшения
способности мышиных моноклональных антител быть эффективными в лечении B-клеточных нарушений состоял в том, чтобы конъюгировать радиоактивную метку или токсин с этими антителами таким образом, чтобы
метка или токсин локализовались в месте опухоли. Например, упомянутое выше антитело IF5 "метили" иодом - 131 ("1311") и оценивали биораспределение метки в двух больных. См. Eary J.F.et.al
"Imaging and Treatment of B-Cell Lymphoma" J. Nuc.Med. 31/8: 1257 - 1268 (1990); см. также, Press.O.W.et. al. "Treatment of Refractory Non-Hodgkin's Lymphoma with Radiolabeled MB-1 (Rufi-CD37)
Antibocly" J.Clin.Onc.7/8 1027 - 1038 (1989) (показано, что один больной, получивший1311 - меченый IF - 5, давал частичную ответную реакцию"); Goldenberg. D.M. et.al. "Targeting, Dosimetry
and Radioimmunotherapy of B-Cell Lymphomas with Iodine-131-Labeled LL2 Monoclonal Antibody" J.Clin. Onc. 9/4: 548 - 564 (1991) (сообщено, что 3 из 8 больных, получающих многократные инъекции, развили
НАМА - ответную реакцию); Appelbaum, F.R. "Radiolabeled Monoclonal
Antibodies in the Treatment of Non-Hodgkin's Lymphoma "Hem.Onc.Clinics of N. A. 5/5: 1013-1025 (1991) (обзорная статья):
Press, O.W. et al. "Radiolabeled-Antibody Therapy of B-Cell Lymphoma with Antologous Bone Marrow Support" New England Journal of Medicine 329/17: 1219-1223 (1993) (меченные иодом-131 анти-CD20
антитела 175 и B1) и Kaminiski, M.G.et.al. "Radioimmunotherapy of B-Cell Lymphoma with [1311]Anti-B1 (Aati-CD20) Antibody", NEYM 329/7 (1993) (меченные иодом - 131 анти-CD20 антитела B1,
далее называемые "Kaminski")
Токсины (т.е. химиотерапевтические агенты, такие как доксорубцин или митомицин C) также коньюгировали с антителами. См. например PCT (опубликованная заявка) WO
92/07466 (опубликована 14 мая 1992)
"Химерные антитела, т. е. антитела, которые содержат части из двух или более различных видов (например, мыши и человека), были разработаны как альтернатива
"конъюгированным" антителом. Например, Lin, A.Y.et.al. "Production of a Mouse - Human Chimerice Monoclonal Antibody to CD20 с сильной Fc-зависимой биологической активностью". J. Immun. 139/10:
3521-3526 (1987), описывает химерные антитела мышь/человек, направленные против антигена CD20. См. также PCT Publication 0/88/04936. Однако нет информации о правомочности, эффективности или
практичности применения таких химерных антител для лечения B-клеточных нарушений в этой ссылке. Отмечается, что функциональные тесты in vitro (например, комплемент - зависимый лизис ("CDC"); зависимая
от антител клеточная цитотоксичность ("ADCC") и т.д.) необязательно могут предсказать способность in vivo химерного антитела разрушать или истощать клетки-мишени, экспрессирующие специфический
антиген. См., например, Robinson, R.D. et al. "Chimeric mouse-human anti-cavcinoma antibodies that mediate different anti-tumor cell biological actirities" Hum. Antibol. Hybridomas 2: 84 - 93 (1991)
(химерные антитела мышь-человек, имеющие недетектируемую ADCC активность). Таким образом, потенциальную терапевтическую эффективность химерных антител можно оценить правильно только в экспериментах in
vivo.
Что необходимо и что было бы большим успехом в этой области, это терапевтические подходы к нацеливанию на антиген CD20 для лечения B-клеточных лимфом в приматах, в том числе (но не только) в человеке.
C. Краткое изложение сущности изобретения
Здесь описаны терапевтические способы, предназначенные для лечения B-клеточных нарушений и, в частности,
B-клеточных лимфом. Эти протоколы основаны на введении иммунологически активных химерных анти-CD20 антител для истощения периферических B-клеток крови, в том числе B-клеток, ассоциированных с лимфомой;
введении радиоактивно меченных анти-CD20 антител для направления на локализованные и связанные с периферическими B-клетками опухоли; введении химерных анти-CD20 антител и радиоактивно меченных
анти-CD20 антител в кооперативной терапевтической стратегии.
D. Краткое описание рисунков
Фиг. 1 представляет схему тандемного экспрессирующего химерное антитело вектора,
применимого в получении иммунологически активных химерных анти-CD20 антител ("TCAE 8");
Фиг. 2A - 2E представляют последовательность нуклеиновой кислоты вектора фиг. 1;
Фиг. 3A - 3F
представляют последовательность нуклеиновой кислоты вектора 1, содержащую дополнительно мышиные вариабельные области легкой и тяжелой цепей ("анти-CD20 в TCAE 8")
Фиг. 4 представляет
последовательность нуклеиновой кислоты и аминокислотную последовательность (в том числе CDR и каркасный районы) мышиной вариабельной области легкой цепи, происходящей из мышиного анти-CD20
моноклонального антитела 2B8;
Фиг. 5 представляет последовательность нуклеиновой кислоты и аминокислотную последовательность (в том числе CDR и каркасный районы) мышиной вариабельной области
тяжелой цепи, происходящей из мышиного анти-CD20 моноклонального антитела 2B8;
Фиг. 6 представляет результаты проточной цитометрии, свидетельствующие о связывании флуоресцентно меченого
человеческого CIq с химерным анти-CD20 антителом, причем в качестве контролей использованы меченый CIq; меченый CIq и мышиное анти-CD20 моноклональное антитело 2B8; и меченый CIq и человеческий IgG1,
: к :
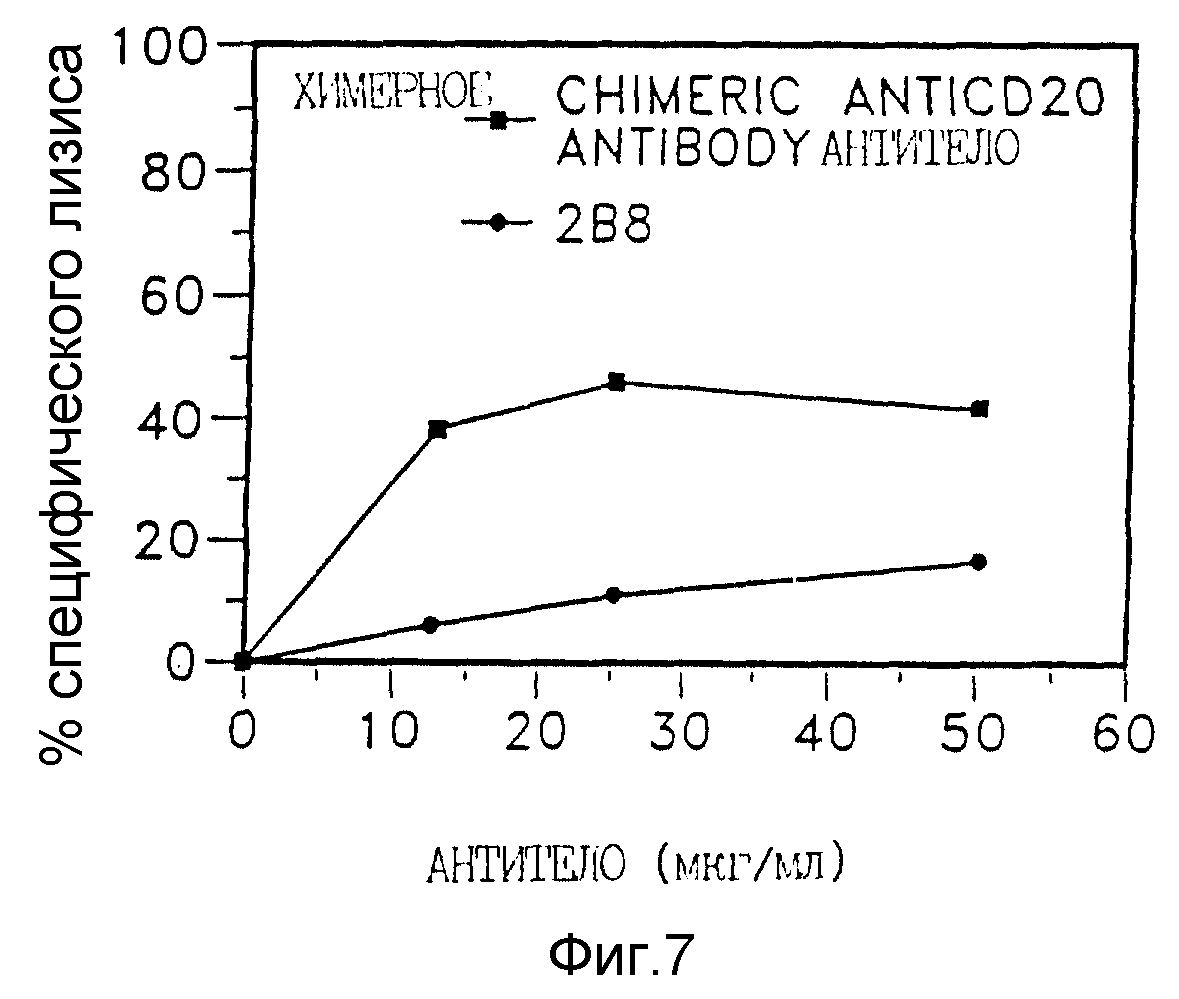
Фиг. 7 представляет результаты связанного с комплементом лизиса, сравнивающие химерное анти-CD20 антитело и мышиное анти-CD20 моноклональное антитело 2B8;
Фиг. 8 представляет
результаты опосредованной антителами клеточной цитотоксичности с человеческими эффекторными клетками in vivo, сравнивающие химерное анти-CD20 антитело и 2B8;
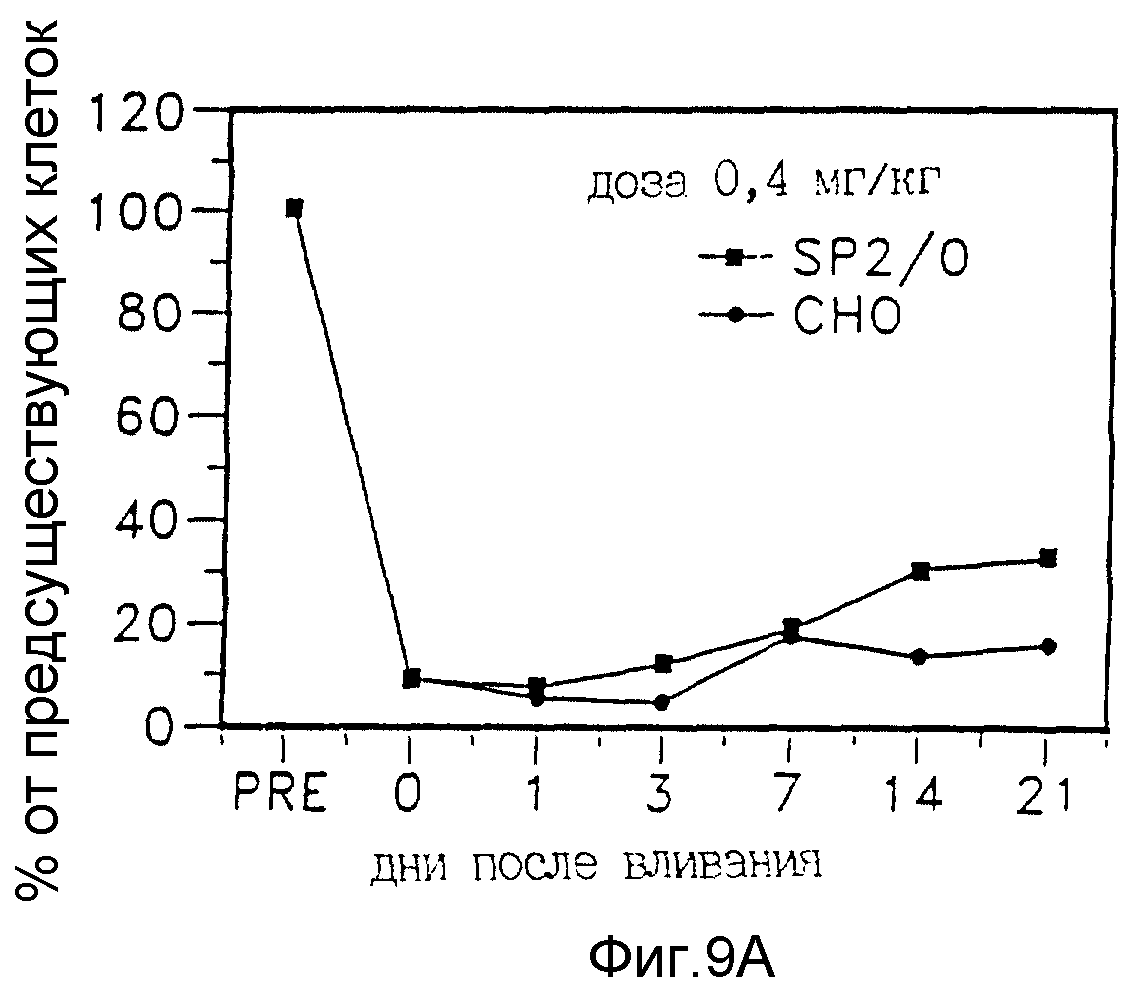
Фиг. 9A, 9B и 9C представляют
результаты истощения B - лимфоцитов периферической крови примата (не человека) после инфузии 0,4 мг/кг (A); 1,6 мг/кг (B) и 6,4 мг/кг (C) иммунологически активного химерного анти-CD20 антитела;
Фиг. 10 демонстрирует результаты, inter alia, истощения B - лимфоцитов периферической крови примата (не человека) после инфузии 0,01 мг/кг иммунологически активного химерного анти-CD20 антитела;
Фиг. 11 показывает результаты уничтожающего опухолевые клетки действия У2В8 в мышиной модели ксенотрансплантата, использующей B-клеточную лимфобластную опухоль;
Фиг. 12 показывает
результаты уничтожающего опухолевые клетки действия C2B8 в мышиной модели ксенотрансплантата, использующей B-клеточную лимфобластную опухоль;
Фиг. 13 показывает результаты уничтожающего
опухолевые клетки действия комбинации У2В8 и C2B8 в мышиной модели ксенотрансплантата, использующей B-клеточную лимфобластную опухоль;
Фиг. 14A и 14B показывают результаты клинического
анализа фазы 1/11 C2B8, свидетельствующие об истощении B-клеточной популяции с течением времени у больных, что свидетельствует о частичной ремиссии заболевания (14A) и небольшой ремиссии заболевания
(14B).
E. Детальное описание предпочтительных вариантов
Обычно антитела состоят из двух легких и двух тяжелых цепей; эти цепи образуют общую "Y" форму, в которой как легкая,
так и тяжелая цепи образуют плечи Y, а тяжелые цепи образуют основание Y. Легкие и тяжелые цепи разделены на домены структурной и функциональной гомологии. Вариабельные домены легкой ("U2")
и тяжелой ("Uн") цепей определяют узнавание и специфичность. Домены константной области легкой ("CL") и тяжелой ("CH") цепей ответственны за важные биологические свойства,
например, за ассоциацию цепей антител, секрецию, трансплацентарную мобильность, связывание Fc рецептора, связывание комплемента и т.д. Ряд событий, ведущих к экспрессии гена иммуноглобулина
в продуцирующих антитела клетках, является комплексным. Генные последовательности района вариабельного домена локализованы в отдельной линии генных сегментов, называемых "Uн", "D" и "YH" или "UL" и "YL". Эти генные сегменты соединены путем реаранжировок ДНК с образованием полных районов U, экспрессируемых, соответственно, в тяжелых и легких цепях.
Реаранжированные соединенные U сегменты (UL-YL и UH-D-YH) затем кодируют полные вариабельные области или антиген-связывающие домены легких и тяжелых цепей,
соответственно.
Серотерапия B-клеточных лимфом человека при помощи анти-CD20 мышиных моноклональных антител (IF5) описана Press et al. (69 Blood 584, 1987, Supra); сообщенные терапевтические ответы, к сожалению, были временными. Кроме того, 25% обследованных больных развили ответную реакцию человека против мышиных антител (HAMA) в ответ на серотерапию. Press et. al., предполагают, что эти антитела, конъюгированные с токсинами или радиоактивными изотопами, могут бать более длительную клиническую пользу, чем неконъюгированные антитела.
Благодаря истощающим действием B-клеточной лимфомы и реальной необходимости обеспечения действенных подходов лечения для этого заболевания мы предприняли различные подходы с применением определенного антитела, 2B8, в качестве общего звена между этими подходами. Один из таких подходов выгодно использует способность систем млекопитающих легко и эффективно восстанавливать B-клетки периферической крови, при помощи такого подхода мы пытаемся избавиться от B-клеток или истощить B/ клетки в периферической крови и лимфатической ткани как средство устранения также и B/ клеточных лимфом. Мы выполняем это путем применения, inter alia иммунологически активных, химерных анти-CD20 антител. В другом подходе мы пытаемся разрушать опухолевые клетки, направляя в них радиоактивные метки.
В применении здесь, термин "анти-CD20 антитела" обозначает антитела, которые специфически узнают негликозилированный фосфопротеин 35000 дальтон клеточной поверхности, обычно обозначаемый как консервативный (эволюционно стабильный) дифференцировочный антиген Bp 35 B-лимфоцитов человека, обычно называемый CD 20. В применении здесь, термин "химерный" при использовании его относительно анти-CD20 антител охватывает антитела, которые наиболее предпочтительно произведены при помощи технологии рекомбинантных ДНК и которые содержат компоненты как человека (в том числе иммунологически "близких" видов, например, шимпанзе), так и не человека : константная область химерного антитела наиболее предпочтительно по существу идентична константной области природного антитела человека; вариабельная область химерного антитела наиболее предпочтительно произведена из источника, не являющегося человеком и имеет желаемую антигенную специфичность в отношении CD20 антигена клеточной поверхности. Источником иным, чем человек, может быть любое позвоночное животное, которое можно использовать для генерирования антител к CD20 поверхностному антигену человека, или материал, содержащий поверхностный антиген CD20 клеток человека. Таким источником могут быть (но не только) грызуны (например, кролик, крыса, мышь и т.д.) и приматы (не человек) (например, низшие узконосые обезьяны (мартышки), человекообразные обезьяны и т. д.). Наиболее предпочтительно, нечеловеческий компонент (вариабельную область) получают из мышиного источника. В применении здесь, фраза "иммунологически активны" при применении к химерным анти-CD20 антителам обозначает химерные антитела, которые связывают человеческий C1q, медиируют комплемент - зависимый лизис ("CDC") линий B - лимфоидных клеток человека и лизируют клетки - мишени человека вследствие зависимой от антител клеточной цитотоксичности ("ADCC"). В применении здесь, фразы "непрямое мечение", "подход непрямого мечения" означают, что к антителу ковалентно присоединен хелатирующий агент и по меньшей мере один радионуклид встроен в этот желатирующий агент. Предпочтительные хелатирующие агенты и радионуклиды описаны в Srivagtara, S.C. and. Mease, R.C. "Progress in Research on Ligands, Nuclides and Technigues for Labeling Monoclonal Antibodies", Nucl. Med. Bio. 18/6: 589-603/1991) ("Srivagtava") - включено здесь в виде ссылки. Особенно предпочтительным хелатирующим агентом является 1-изотиоцианатобензил-3-метилдиэтилен- триаминопентауксусная кислота ("MX-DTPA"); особенно предпочтительными радионуклидами для непрямого мечения являются индий [111] и иттрий [90] . В применении здесь, фразы "прямое мечение" и "подход прямого мечения" обозначают, что радионуклид непосредственно ковалентно присоединен к антителу (обычно через остаток аминокислоты). Предпочтительные радионуклиды описаны Srivagtara, особенно предпочтительным радионуклидом для прямого мечения является иод [131], ковалентно соединенный через остатки тирозина. Особенно предпочтительным является подход непрямого мечения.
Описанные здесь терапевтические подходы основаны на способности иммунной системы приматов быстро восстанавливать или омолаживать B-клетки периферической крови. Кроме того, поскольку основной иммунный ответ приматов осуществляется T-клетками, то в том случае, когда иммунная система имеет недостаток B-клеток периферической крови, необходимость "чрезвычайных" мер предосторожности (т.е. изоляции больного и т.д.) не является обязательной. Вследствие этих и других нюансов иммунных систем приматов наш терапевтический подход к B-клеточным нарушениям позволяет удалять B-клетки периферической крови при помощи иммунологически активных химерных анти-CD20 антител.
Поскольку нарушения B-клеток периферической крови, по определению, могут свидетельствовать о необходимости доступа к крови для ее обработки, путь введения иммунологически активных химерных анти-CD20 антител и радиоактивно меченных анти-CD20 антител предпочтительно является парентеральным, в применении здесь термин "парентеральный" включает в себя внутривенное, внутримышечное, подкожное, ректальное, вагинальное или внутрибрюшинное введение. Из них наиболее предпочтительно внутривенное введение.
Иммунологически активные химерные анти-CD20 антитела и радиоактивно меченные анти-CD20 антитела обычно получают стандартными способами в фармацевтически приемлемом буфере, например, стерильном солевом растворе, стерильной забуференной воде, пропиленгликоле или их комбинации и т.д. Способы получения парентерально вводимых агентов описаны в Pharmaceutical Carriers and Formulations, Martin, Remington's Pharmaceutical Sciences, 15 th Ed (Mack. Pub. Co. Easton, PA. 1975), включено здесь в виде ссылки.
Специфическое терапевтически эффективное количество иммунологически активных химерных анти-CD20 антител, применимое для получения уникального терапевтического эффекта в любом больном, можно определить стандартными способами, хорошо известными специалистам, с обычной квалификацией в данной области.
Эффективные дозы (т.е. терапевтически эффективные количества) иммунологически активных химерных анти-CD20 антител находятся в диапазоне приблизительно от 0,001 до 30 мг/кг веса тела, более предпочтительно приблизительно от 0,01 до 25 мг/кг веса тела и наиболее предпочтительно приблизительно от 0,4 до 20,0 мг/кг веса тела. Другие дозы возможны; факторы, влияющие на дозу, включают в себя (но не лимитируются ими) серьезность, тяжесть заболевания, предшествующие подходы лечения; общее здоровье больного, другие присутствующие заболевания и т. д. Квалифицированный специалист легко оценит конкретного больного и определит подходящую дозу, находящуюся внутри указанных диапазонов, и, если необходимо, вне этих диапазонов.
Введение иммунологически активных химерных анти-CD20 антител в этих диапазонах доз можно проводить в виде единственного введения или в виде серии введений. В случае химерных антител предпочтительно, чтобы такое введение проводили в виде ряда введений, этот предпочтительный подход прогнозирован методологией лечения этого заболевания. Не желая быть связанными с какой бы то ни было конкретной теорией, отметим, что поскольку иммунологически активные анти-CD20 антитела иммунологически активны и связываются с CD20, при исходном введении иммунологически активных химерных анти-CD20 антител индивидууму начинается истощение B-клеток периферической крови, и мы наблюдали почти полное удаление в пределах приблизительно 24 часов после инфузии. Поэтому последующее введение (введение иммунологически активных химерных анти-CD20 антител) (или радиоактивно меченных анти-CD20 антител) больному предположительно: a) удаляет оставшиеся B-клетки периферической крови; b) начинает удалять B-клетки из лимфатических узлов; c) начинает удалять B/ клетки из других источников ткани, например, из костного мозга, опухоли и т. д. В результате повторных введений иммунологически активных химерных анти-CD20 антител ряд событий имеет место, каждое из которых рассматривается нами как важное для эффективного лечения этого заболевания. Первое "событие" может рассматриваться как направленное главным образом на истощение B-клеток в периферической крови больного; последующие события могут рассматриваться как направленные в основном на одновременное или последовательное удаление оставшихся B-клеток из системы, путем выведения B/-клеток из лимфатических узлов или из других тканей.
В сущности, в то время как одиночные дозы обеспечивают пользу и могут эффективно применяться для лечения/ ведения заболевания, предпочтительный протокол лечения осуществляется в виде нескольких стадий, наиболее предпочтительно между 0,4 и 20 мг/кг веса тела иммунологически активного химерного анти-CD20 антитела вводят больному один раз в неделю в течение периода приблизительно 2 - 10 недель, наиболее предпочтительно приблизительно 4 недель.
В случае применения радиоактивно меченных анти-CD20 антител предпочтительно, чтобы антитела не были химерными; это прогнозировано значительно большим периодом полувыведения химерных антител по сравнению с мышиными антителами (т.е. с более длительным периодом полувыведения из крови радионуклид присутствуют в больном в течение длительных периодов). Однако радиоактивно меченные химерные антитела можно с пользой использовать с более низкими дозами милли-Кюри ("мКи") и в сочетании с химерным антителом, связанным с мышиным антителом. Этот сценарий позволяет уменьшить токсичность для костного мозга до приемлемых уровней с сохранением терапевтического действия.
Многие радионуклиды применимы для данного изобретения, и специалисты в данной области способны легко определить, какой радионуклеид наиболее пригоден при множестве обстоятельств. Например, иод [131] является хорошо известным радионуклидом, применяемым для нацеленной иммунотерапии. Однако клиническая применимость иода [131] может быть лимитирована несколькими факторами, в том числе: восьмидневным физическим периодом полувыведения; дегалогенированием иодинированных антител как в крови, так и в месте опухоли; характеристикой излучения (например, большой компонент γ-излучения), которые могут быть субоптимальными для локализованного депонирования дозы в опухоли. С появлением превосходных хелатирующих агентов возможность присоединения хелатирующих металл групп к белкам повысила возможности использования других радионуклидов, таких как индий [111] и иттрий [90]. Иттрий [90] обеспечивает несколько преимуществ для использования в радиоиммунотерапевтических приложениях: период полураспада 64 часа иттрия [90] достаточно длинен для накопления антител в опухоли и в противоположность иоду [131] иттрий [90] излучает меньше бета-лучей высокой энергии без сопутствующих гамма-лучей при его распаде, с диапазоном в ткани 200 - 1000 диаметров клетки. Кроме того, минимальное количество проникающей радиации делает возможным введение меченных иттрием [90] антител амбулаторным больным. Кроме того, интернализация меченых антител не требуется для убивания клеток, и локальная эмиссия ионизирующей радиации должна быть летальной для соседних опухолевых клеток, не содержащих антигена-мишени.
Одно из нетерапевтических ограничений для иттрия 90 основано на отсутствии значительной γ- радиации, что делает затруднительным получение изображения. Чтобы
избежать этой проблемы, можно использовать диагностический "дающий изображение" радионуклид, такой как индий [111], для определения локализации и относительного размера опухоли перед введением
терапевтических доз меченных иттрием [90] анти-CD20 антител. Индий [111] особенно предпочтителен в качестве диагностического радионуклида, поскольку: можно вводить без детектируемой токсичности
приблизительно 1 - 10 мКи; данные томографии обычно предсказывают последующее распределение меченных иттрием [90] антител. Большинство исследований по получению изображения используют меченые 5 мКи
индия [111] антитела, поскольку эта доза безопасна и имеет увеличенную эффективность в получении изображения по сравнению с более низкими дозами, причем оптимальное изображение получают при 3 - 6 днях
после введения антител. См., например, Murray J.L. 26 Y. Nuc. Med. 3326 (1985) и Carraguillo, J. A. et.al. 26 Y. Nuc. Med. 67 (1985)
Эффективные дозы единственной обработки (т.е.
терапевтически эффективные количества) меченных иттрием [90] анти- CD20 антител лежат в диапазоне между приблизительно 5 и 75 мКи, более предпочтительно между приблизительно 10 и 40 мКи. Эффективные
однократные не разрушающие костный мозг дозы меченных иодом [131] анти- CD20 антител лежат в диапазоне между приблизительно 5-70 мКи, более предпочтительно между приблизительно 5 и 40 мКи. Эффективные
разрушающие костный мозг дозы для одного введения (т.е. которые могут требовать трансплантации аутологичного костного мозга) меченных иодом [131] анти- CD20 антител лежат в диапазоне между
приблизительно 30 и 600 мКи, более предпочтительно между приблизительно 50 и менее 500 мКи. В соединении с химерными анти -CD20 антителами, вследствие более длительного периода полувыведения на крови
по сравнению с мышиными антителами, эффективные однократные дозы, не разрушающие костный мозг, меченных иодом [131] химерных анти- CD20 антител лежит в диапазоне между приблизительно 5 и 40 мКи, более
предпочтительно менее 30 мКи. Критерии для томографии, например, для индия [III] обычно менее приблизительно 5 мКи.
В случае радиоактивно меченных анти- CD20 атител терапия с их применением может также осуществляться с использованием однократных обработок или с использованием многократных обработок. Вследствие присутствия радионуклидного компонента предпочтительно брать перед обработкой периферические стволовые клетки ("PSC") или костный мозг ("ВМ") для больных, испытывающих потенциально губительную токсичность для костного мозга, происходящую в результате облучения. ВМ и (или) PSC берут при помощи стандартных способов, затем очищают и замораживают при возможной реинфузии. Кроме того, наиболее предпочтительно проведение перед обработкой диагностической дозиметрии с применением диагностических меченых антител (например, с применением индия [III] на больном. Цель этой проверки состоит в обеспечении гарантии того, что терапевтически меченое антитело (например, меченное иттрием [90] не будет "концентрироваться" в каком-либо нормальном органе или ткани.
Описаны химерные мышь/человек антитела. См., например, Morrison. S.L.et. al. PNAS 11: 6851-6854 (November 1984) European Patent Publication N 172404, Boulianne, C.L.et.al.Nature 312:642 (December 1984); Neubeiger M.S.et.al.Nature 314:268 (March 1985); European Patent Publication N=125023, Tan et.al. J. Immunol.135:8564 (November 1985); Sun L.K.et.al.Hybridoma 5/1:517 (1986); Sanagan et. al, J. Immunol. 137: 1066-1074 (1986). Cm.Muron.Nature 312:597 (December 1984), Diekson, Genetic Ehgineering News 5/3 (Marck 1985), Marx, Science 229: 455 (August 1985) и Morrison Science 229:1202-1207 (September 1985). Robinson et.al, в PCT Publation N WO88/04936 описывают химерное антитело с человеческой константной областью и мышиной вариабельной областью, специфические для эпитопа CD20; мышиная часть этого химерного антитела произведена из мышиного моноклонального антитела 2H7 (гамма 2, каппа). Хотя автор отмечает, что описанное химерное антитело является "превосходным кандидатом" для лечения B-клеточных нарушений, это утверждение можно рассматривать не более, чем предложение, и специалисты в данной области должны определить, является ли это предположение верным для этого конкретного антитела, особенно потому, что в этой ссылке отсутствуют какие-либо данные, подтверждающие заявление о терапевтической эффективности и, что важно, отсутствуют данные с использованием млекопитающих высшего порядка, таких как приматы или человек.
Методологии для получения химерных антител доступны для специалистов в данной области. Например, легкую и тяжелую цепи можно экспрессировать раздельно при помощи, например, легкой цепи иммуноглобулина и тяжелых цепей иммуноглобулина в отдельных пламидах. Они могут быть очищены и собраны in vitro в полные антитела, способы выполнения подобной сборки были описаны. См. например.Scharff M.Harveg Lectures 69: 125 (1974). Параметры реакции in vitro для образования IgG антител из изолированных легкой и тяжелой цепей также были описаны. См. , например Beychok, S. Cells of Immunoglobulin Synthesis, Academic Press, New York p.69,1979. Совместная экспрессия легких и тяжелых цепей в одних и тех же клетках для достижения внутриклеточной сборки и соединения тяжелых и легких цепей в полные H2L2 IgG антитела также возможна. Такая ко-экспрессия может быть выполнена с применением либо одной и той же плазмиды, либо различных плазмид в одной и той же клетке хозяина.
Другой подход, который является нашим наиболее предпочтительным подходом для поучения химерного не- человек/человек, анти- CD20 антитела, основан на использовании экспрессирующего вектора, который содержит, ab initio ДНК, кодирующую константные области тяжелой и легкой цепи из человеческого источника. Такой вектор позволяет введение ДНК, кодирующей нечеловеческую вариабельную область, таким образом, что можно получить множество не- человеческих анти CD20 антител, которые могут быть подвергнуты скринингу, анализированы на различные характеристики (например, на тип связующей специфичности, связующие эпитоп районы и т.п.); после этого в вектор может быть включена кДНК, кодирующая вариабельные районы легких и тяжелых цепей из предпочтительных или желательных анти CD20 антител. Мы называем эти типы векторов тандемными экспрессирующими химерные антитела векторами ("TCAE"). Наиболее предпочтительным TCAE вектором, который применяли для генерирования иммунологически антивных химерных анти- CD20 антител для терапевтической обработки лимфом, является TCAE 8. TCAE 8 является производным вектора, который принадлежит представителю данного патентного документа и называется TCAE 5.2. Различие состоит в том, что в TCAE 5.2 стартовый сайт инициации трансляции доминантного селектирующего маркера (неомицинфосфотрансферазы, "NEO") представляет собой консенсусную последовательность Козака, тогда как для TCAE 8 этот район представляет собой поврежденную консенсусную последовательность Козака. Детали, касающиеся действия стартового сайта инициации трансляции доминантного селектируемого маркера векторов TCAE (также называемых "ANEX векторами") на экспрессию белка обсуждаются детально в одновременно поданной заявке, представленной вместе с этой заявкой.
TCAE 8 содержит четыре
транскрипционные кассеты, находящиеся в тандемном порядке, т.е. легкая цепь человеческого иммуноглобулина с отсутствием вариабельной области; человеческая тяжелая цепь иммуноглобулина с отсутствием
вариабельной области, DHER; NEO. Каждая транскрипционная кассета содержит ее собственный эукариотический промотор и район полиаденилирования (ссылка сделана на фиг. 1, который представляет собой
схематическое изображение вектора TCAE 8). Конкретно:
1) CMV промотор/энхансер впереди тяжелой цепи иммуноглобулина представляет собой укореченную версию промотора/энхансера впереди легкой
цепи, от Nhe 1 сайта при -350 до SstI, сайта при -16 (см. 41 Cell 521, 1985).
2) константная область легкой цепи человеческого иммуноглобулина получена через амплификацию кДНК при
помощи полимеразной цепной реакции (PCR), в TCAE 8 это была константная область легкой каппа человеческого иммуноглобулина (нумеразная Kabat, аминокислоты 108-214, аллотип Km3, (см.Rabat E.A.
"Seguences of proteins of immunological interest" NIH Publication, Fifth Ed. N 91-3242, 1991) и константная область тяжелой цепи гамма 1 человеческого иммуноглобулина (Kabat нумерация, аминокислоты
114 - 478, аллотип Gmba, Gmlz). Легкая цепь была выделена из нормальной человеческой крови (IDEC Pharmaccuticals Corporation, La Jolla, CA) РНК из нее использовали для синтеза кДНК, которую затем
амплифицировали с применением техники PCR (праймеры были получены против консенсуса из Kabat). Тяжелую цепь выделяли (с применением способа PCR) из кДНК, полученной из РНК, которую в свою очередь
получали из клеток, трансфицированных человеческим вектором (см. 3 Prot. Eng 531, 1990; вектор pN γ1 62). Две аминокислоты были изменены в выделенном человеческом IgGI, чтобы
подходить к консенсусу аминокислотной последовательности из Kabat, а именно: аминокислоту 225 изменяли от валина до аланина (G TT заменяли на GGA), а аминокислоту 287, метионин, заменяли на лизин (АТС
заменяли на AAG);
3) Кассеты легкой и тяжелой цепи человеческого иммуноглобулина содержат синтетические сигнальные последовательности для секреции этих цепей иммуноглобулина;
4)
Кассеты легкой и тяжелой цепей человеческого иммуноглобулина содержат специфические сайты рестрикции ДНК, которые делают возможным встраивание вариабельных областей легкой и тяжелой цепей
иммуноглобулина, которые сохраняют переходную рамку считывания и не изменяют аминокислоты, нормально обнаруживаемые в цепях иммуноглобулинов;
5) Кассета DHER содержала ее собственный
эукариотический промотор (мышиный основной промотор бета-глобулина, "ВЕТА") и район полиаденилирования (район полиаденилирования бычьего гормона роста, "BGH"); и
6) Кассета NEO содержала ее
собственный эукариотический промотор (ВЕТА) и район полиаденилирования (район раннего полиаденилирования Sr50, "SV").
В случае вектора TCAE 8 и кассеты NEO район Козака был частично
поврежденной консенсусной последовательностью Козака (которая включала в себя в направлении 3' - 5; сайт Cla I):
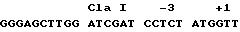
(В векторе TCAE 5.2 есть изменение между районами Cla I и ATG, а именно: CCACC).
Полная последовательность TCAE 8 (в том числе специфические компоненты четырех транскрипционных кассет) представлена в фиг. 2 (SEQ ID N 1).
Как будет понятно специалистам в этой области, векторы TCAE позволяют существенно уменьшить время получения иммунологически активных химерных анти- CD20 антител. Генерирование и выделение не - человеческих вариабельных областей легкой и тяжелой цепей с последующим включением их в транскрипционную кассету константной области легкой цепи человеческого иммуноглобулина и транскрипционную кассету константной области тяжелой цепи иммуноглобулина человека позволяют получать иммунологически активные химерные анти- CD20 антитела.
Мы получили наиболее предпочтительный не - человеческий вариабельный район со специфичностью в отношении антигена CD20 с применением мышиного источника и
гибридомной технологии. С применением способа полимеразной цепной реакции ("PCR")
вариабельные области мышиных легких и тяжелых цепей были клонированы непосредственно в вектор TCAE 8. Это
наиболее предпочтительный путь включения не- человеческой вариабельной области в вектор TCAE. Эта предпочтительность принципиально предсказана по эффективности реакции PCR и точности инсерции
(встраивания). Однако пригодны и другие эквивалентные процедуры для выполнения этой задачи. Например, при помощи TCAE 8 (или при помощи эквивалентного вектора) можно получить последовательность
вариабельной области не-человеческого анти-CD20 антитела, затем провести олигонуклеотидный синтез частей этой последовательности или, если нужно, всей этой последовательности; после этого части или
вся синтетическая последовательность могут быть встроены в подходящие места внутри этого вектора. Специалисты в данной области способны выполнить эту задачу.
Наши наиболее предпочтительные иммунологически активные химерные анти- CD20 антитела были получены путем использования вектора TCAE 8, который содержал мышиные вариабельные области, полученные из моноклональных антител к CD20; эти антитела (которые будут обсуждены детально infra называют 2B8.
Полная последовательность вариабельных областей, полученных из 2B8 в TCAE ("анти-C 20 в TCAE 8") представлена в фиг. 3 (SEQ ID N 2).
Линия клеток хозяина, примененная для экспрессии белка, наиболее предпочтительно является линией клеток млекопитающих, специалисты в данной области способны определить предпочтительные линии клеток хозяина, которые являются наиболее подходящими для экспрессии в них целевого генного продукта. Приводимые в качестве примера клеточные линии хозяина включают в себя (но не ограничены ими) линии DG44 и DUB11 (линия клеток яичников китайского хомячка, DH7R минус), HELA (человеческая карцинома шейки матки), CVI (линия почек мартышек) COS (производное CVI с T антигеном SV40), R 1610 (фибробласты китайского хомячка), BAL BC/ЗТЗ (мышиные фибробласты), НАК (почечная линия хомячка), SP 2/0 (мышиная миелома), P3 х 63 - Ag 3,653 (мышиная миелома), BFA - 1cIBPT (бычьи эндотелиальные клетки), RAJI (человеческие лимфоциты) и 293 (почки человека). Линии клеток хозяина обычно доступны из коммерческих служб, АТСС или из опубликованной литературы.
Предпочтительной клеточной линией хозяина является DG44 ("CHO") или SP2/0. См. Urland.G.et.al. "Effect of gamma vays and the dihydrofolate veductase locus: deletions and inversions". Som.
Cell.and Mol. Gen. 12/6: 555-566/1986), и Shulman, M.et.al." A.better cell line for making hybridomas secreting specific antibodies". Nature
276 : 269 (1978), соответственно. Наиболее
предпочтительно, клеточная линия хозяина представляет собой DG44. Трансфекция этой плазмиды в клетку хозяина может быть выполнена любым способом, доступным специалистам в этой области. Эти способы
включают в себя (но не ограничены ими) трансфекцию (в том числе электрофорез и электропорацию), слияние клеток с покрытой оболочкой ДНК, микроинъекцию и инфекцию интактным вирусом. См. Ridgway, A.
A.G. "Mammalian Expverssion Vectors".
Chapter 24.2.pp. 470-472 Vectors, Rodriguez and Denhardt, Eds. (Butterworths, Boston, MA 1988). Наиболее предпочтительно введение плазмиды в хозяина через электропорацию.
Г. Примеры
Следующие далее примеры не предназначены для ограничения данного изобретения. Эти примеры предназначены для того, чтобы показать:
дозовую томографию с применением радиоактивно меченного анти- CD20 антитела (12B8"); радиоактивное меченое анти- CD20 антитело ("Y2B8"); и иммунологически активное, химерное анти- CD20 антитело
("C2B8"), полученное с использованием специфического вектора ("TCAE8") и вариабельных областей, произведенных из мышиного анти- CD20 моноклонального антитела ("2B8").
1. Радиоактивно
меченное анти-CD20 антитело 2B8
A. Получение анти- CD20 моноклонального антитела (мышиного) ("2B")
BALB/C мышей многократно иммунизировали лимфобластоидной клеточной линией человека
(B(см. Adams, R.A. et.al. "Direct implantation and serial transplantation of human acute lymploblastic leukemia in hamsters, SB-2". Can. Res. 28: 1121- 1125 (1968); эта клеточная линия доступна из
American Tissue Culture Collection, Rockville, M.D. nog ATCC accession N=ATCC CCL 120), с еженедельными инъекциями в течение периода 3-4 месяцев. Были идентифицированы мыши, обнаруживающие высокие
сывороточные титры анти-CD20 антител, как было определено ингибированием известных специфических для CD20 антител (применяли антитела Beckton Dickinson, San. Jose, CA, Cat. N 7670, и B1, Conlter Corp.
Hiallah. FL. Cat. N 6602201); после этого удаляли селезенки из этих мышей. Клетки селезенки сливали с мышиной миеломой SP2/0 в соответствии с протоколом, описанным в Einfeld. D.A. et. al. (1988) EMBO
7:711 (SP 2/0 имеет ATCC accession N ATCC CRL 8006).
Испытания на C 20 специфичность выполняли при помощи радиоиммуноанализа. Вкратце, очищенные анти-CD20 B1 радиоактивно метили I125 по способу иодных бусин (iodobead), как описано в Valentine. M.A. et. al. (1989), J. Biol. Chem. 264: 11282. (I125 Sodium Iodide (иодид натрия), ICN Irvine, CA. Cat N 28665H).
Гибридомы подвергали скринингу путем ко-инкубации 0,05 мл среды из каждой лунки для слияния вместе с 0,05 мл меченого I125 анти-CD20 B1 (10 нг) в 1% BSA (бычьем сывороточном альбумине), PBS
(pH 7,4) и 0,5 мл того же буфера, содержащих 100000 SB клеток. После инкубации в течение 1 часа при комнатной температуре клетки собирали путем переноса на 96-луночные титрационные планшеты (V P
Scientific, San Diego, CA) и тщательно промывали. Лунки в двух повторностях, содержащие немеченые анти-CD20 B1, и лунки, не содержащие ингибирующих антител, использовали в качестве положительных и
отрицательных контролей, соответственно. Лунки, показавшие более 50% ингибирования, увеличивали в объеме и клонировали. Антитела, обнаруживающие наиболее высокое ингибирование, были получены из
клонированной клеточной линии, называемой здесь "2B8",
B. Получение конъюгата 2B8 - MX - DTPA i MX - DTPA
Меченую14C 1-изотиоцианатобензил
- 3-метилдиэтилен-три-аминопентауксусную кислоту ("14C меченую MX-DTPA") применяли в качестве хелатирующего агента для конъюгирования радиоактивной метки с 2B8. Манипуляции с MX-DTPA
проводили с сохранением не содержащих металла условий, т.е. применяли не содержащие металлов реагенты и, если возможно, полипропиленовые пластиковые контейнеры (колбы, химические стаканы,
градуированные цилиндры, наконечники пипеток), промытые Alconox и ополоснутые Milli-Q водой. MX-DTPA получали в виде сухого твердого вещества от Д-ра Otto-Gansow (National Institute of Health,
Bethesda, MD) и хранили в эксикаторе при 4oC (с защитой от света), исходные растворы готовили на Milli-Q воде при концентрации 2-5 мМ и хранили при -70oC. MX-DTPA получали также
из Coulter Immunology (Hialeah, Florida) в виде двунатриевой соли в воде и хранили при -70oC.
ii Получение 2B8
Очищенные 2B8 получали для конъюгирования с MX-DTPA
путем переноса этих антител в не содержащий металлов 50 мМ бицин - NAOff, pH 8,6 содержащий 150 мМ NaCl, с применением повторяемой смены буфера с CENTRICON 30TM spin-фильтрами (30000 MWCO;
Amicon) Обычно 50-200 мкл белка (10 мг/нл) добавляли к одному фильтру, а затем 2 мл бицин-буфера. Фильтр центрифугировали при 4oC в роторе Sorval SS-34 (6000 об/мин, 45 мин). Объем
ретентата был приблизительно 50 - 100 мкл, этот процесс повторяли дважды с использованием того же самого фильтра. Ретентат переносили в полипропиленовую пробирку на 1,5 мл с завинчивающейся крышкой,
определяли белок, разводили до 10,0 мг/мл и хранили при 4oC до применения; белок подобным образом переносили в 50 мМ цитрат натрия, pH 5,5, содержащий 150 мМ NaCl и 0,05% азид натрия, с
применением предшествующего протокола.
iii Конъюгирование 2B8 с MX-DTPA
Конъюгирование 2B8 с MX-DTPA выполняли в полипропиленовых пробирках при температуре окружающей среды.
Замороженные исходные растворы MX-DTPA оттаивали непосредственно перед использованием. 50 - 200 мл белка при 10 мг/мл реагировали с MX-DTPA при молярном отношении MX-DTPA к 2B8 4:1. Реакции
инициировали добавлением исходного раствора MX-DTPA и осторожным перемешиванием; конъюгирование происходило в течение ночи (14 - 20 ч) при температуре окружающей среды. Непрореагировавшую MX-DTPA
удаляли из конъюгата диализом или повторяющейся ультрафильтрацией, как описано выше в Примере I.B.ii и в не содержащий металлов обычный солевой раствор (0,9% вес/объем), содержащий 0,05% азид натрия.
Концентрацию белка доводили до 10 мг/мл и раствор хранили при 4oC в полипропиленовой пробирке до радиоактивного мечения.
in Определение включения MX-DTPA
MX-DTPA
включение определяли при помощи сцинтилляционного счета и сравнения величины, полученной с очищенным конъюгатом, с удельной активностью меченой14C MX-DTPA. Для определенных исследований, в
которых применяли нерадиоактивную MX-DTPA (Coulter Immunology) включение MX-DTPA оценивали путем инкубирования конъюгата с избытком радиоактивного раствора - носителя иттрия - [90] известной
концентрации и удельной активности.
Исходный раствор хлорида иттрия известной концентрации готовили в не содержащей металлов 0,05 N HCl, к которой добавляли не содержащий носителя иттрий - [90] (соль соляной кислоты). Аликвоту этого раствора анализировали при помощи жидкостного сцинтилляционного счета для определения точной удельной активности для этого реагента. Объем этого реагента хлорида иттрия, содержащий в 3 раза большее число молей хелата, чем число молей, которое должно быть присоединено к антителам, (обычно 2 моля/моль антител), добавляли в полипропиленовую пробирку и pH доводили до 4,0 - 4,5 2 М ацетатом натрия. Затем добавляли конъюгированные антитела и смесь инкубировали 15 - 30 мин при температуре окружающей среды. Реакцию останавливали путем добавления 20 мМ ЭДТА до конечной концентрации 1 мМ и pH доводили приблизительно до 6 2 М ацетатом натрия.
После 5 мин инкубации весь объем очищали при помощи гель-фильтрационной хроматографии высокого разрешения (описанной infra). Элюированные содержащие белок фракции объединяли, определяли концентрацию белка и в аликвоте определяли радиоактивность. Включение хелата рассчитывали по удельной активности препарата хлорида иттрия - [90] и концентрации белка.
v. Иммунореактивность 2B8 - MX-DTPA
Иммунореактивность конъюгированного 2B8 оценивали
при помощи ELISA для целых клеток. SB клетки в середине логарифмической фазы роста собирали из культуры при помощи центрифугирования и промывали два раза 1 х HBSS Клетки разводили до 1-2 •
106 клеток/мл в HBSS и брали аликвоты в 96-луночные полистироловые микротитрационные планшеты при 50000 - 100000 клеток/лунку. Планшеты высушивали под вакуумом в течение 2 ч при 40 - 45oC для фиксации клеток на пластике; планшеты хранили в сухом виде при -20oC до использования. Для анализа планшеты нагревали до температуры окружающей среды непосредственно перед
использованием, затем блокировали 1 • PBS, pH 7,2 - 7,4, содержащим 1% BSA (2 ч). Пробы для анализа разводили в 1 • PBS/1% BSA, наносили на планшеты и последовательно разбавляли
(серийное разведение) (1:2) в том же самом буфере. После инкубирования планшетов в течение 1 часа при окружающей температуре планшеты промывали три раза 1 х PBS. К лункам добавляли вторичные антитела
(козьи анти-мышиные IgG 1, конъюгированные со специфическим HRP, 50 мкл) (1: 1500 разведение в 1 х PBS 1% BSA) и инкубировали 1 час при температуре окружающей среды. Планшеты промывали 4 раза 1 х PBS,
после чего добавляли субстратный раствор ABTS (50 мМ цитрата натрия, pH 4,5, содержащий 0,01% ATBS и 0,001% H2O2). Планшеты считывали при 405 нм после 15 - 30 мин инкубации.
Антиген-отрицательные HSB клетки включали в анализы для определения неспецифического связывания. Иммунореактивность конъюгата рассчитывали нанесением величин поглощения на график против
соответствующего фактора разведения и сравнения их с величинами, полученными с применением нативных антител (представляющих 100% иммунореактивность), тестируемых на том же самом планшете; некоторые
величины на линейной части титрационного профиля сравнивали и определяли среднюю величину (данные не приведены).
vi Получение меченного индием-[III]2B8 - MX-DTPA ("12B8")
Конъюгаты метили радиоактивно не содержащим носителя индием-[III]. Аликвоту изотопа (0,1 - 2 мКи/мг атител) в 0,05 М HCl переносили в полипропиленовую пробирку и добавляли приблизительно 1/10 объема
не содержащей металлов 2 М HCl. После инкубирования в течение 5 мин добавляли не содержащий металлов 2 М ацетат натрия для доведения pH раствора до 4,0 - 4,4. Затем добавляли приблизительно 0,5 мг 2B8
- MX-DTPA из исходного раствора 10,0 мг/мл DTPA в нормальном солевом растворе или 50 мМ цитрате натрия /150 мМ NaCl, содержащем 0,05% азид натрия, и раствор сразу же осторожно перемешивали. Проверяли
pH раствора бумажкой для определения pH, чтобы удостовериться, что pH равен 4,0 - 4,5, и смесь инкубировали при температуре окружающей среды в течение 15 - 30 мин. Затем реакцию останавливали
добавлением 20 мМ ЭДТА до конечной концентрации 1 мМ и реакционную смесь доводили приблизительно до pH 6,0 при помощи 2 М ацетата натрия.
После 5-10 мин инкубации некомплексированный изотоп удаляли гель-фильтрационной хроматографией. Узел HPLC состоял из Waters Model 6000 или TosoHaas TSK - 6110 системы подачи растворителя, снабженной, соответственно, инъекционным клапаном Waters U6K или Rheodyne 700. Хроматографические разделения проводили с применением гель-проникающей колонки (BioRad SEC-250; 7,5 x 300 мм или сравнимой Toso Haas колонки) и предохранительной колонки SEC-250 (7,5 x 100 мм). Система была снабжена коллектором фракций (Pharmacia Frac 200) и УФ-монитор был снабжен фильтром 280 нм (Pharmacia Model UV 1). Пробы наносили и элюировали изократически с применением 1 х PBS, pH 7,4, при скорости тока 1,0 мл/мин. Собирали фракции по 0,5 мл в стеклянные пробирки и аликвоты из этих пробирок считали в гамма-счетчике. Верхнее и нижнее окошки устанавливали на 500 и 100 кэВ, соответственно.
Включение радиоактивности рассчитывали суммированием радиоактивности, связанной с элюированным пиком белка и делением этого числа на общую радиоактивность, элюированную из колонки; эту величину выражали затем в процентах (данные не приведены). В некоторых случаях включение радиоактивности определяли немедленной тонкослойной хроматографией ("ITLC"). Радиоактивно меченный конъюгат разводили 1:10 или 1:20 в 1 x PBS, содержащем 1 x PBS/1 мМ DTPA, затем 1 мкл наносили на расстоянии 1,5 см от одного конца полоски 1 х 5 см бумаги ITLC SG. Бумагу проявляли при помощи восходящей хроматографии с применением 10% ацетата аммония в смеси метанол : вода (1 : 1, об/об). Полоску высушивали, разрезали крест-на-крест пополам и радиоактивность, связанную с каждой секцией, определяли по гамма-счету. Радиоактивность, связанную с нижней половиной полоски (связанную с белком радиоактивностью) выражали в процентах от общей радиоактивности, определенной суммированием величин для верхней и нижней половин (данные не показаны).
Удельные активности определяли измерением радиоактивности подходящей аликвоты радиоактивно меченного конъюгата. Эту величину корректировали на эффективность счетчика (обычно 75%) и относили к концентрации белка конъюгата, определенную предварительно по поглощению при 280 нм. Результаты выражали как мКи/мг белка.
Для некоторых экспериментов 2B8 - MX-DTPA метили индием [III] согласно описанному выше протоколу, но без очистки при помощи HPLC; этот протокол назван "mix-and-shoot" протоколом.
vii Получение меченного иттрием - [90] 2B8 - MX-DTPA ("Y2B8")
Тот же самый протокол, описанный для получения 12B8, был применен для получения меченного иттрием
- [90] 2В8 - MX-DTPA (Y2B8") конъюгата, за исключением того, что не использовали 2 нг HCl; все препараты меченных иттрием конъюгатов очищали гель-фильтрационной хроматографией, как описано выше.
C. Исследования на животных (не на человеке)
i Биораспределение радиоактивно меченного 2B8 - MX-DTPA
Оценивали распределение 12В8 в тканях в 6 - 8 недельных BALB/c мышах.
Радиоактивно меченный конъгат готовили с применением клинического 2В8 - MX-DTPA после описанного выше протокола "mix-and-shoot". Удельная активность конъюгата была 2,3 мКи/мг и конъюгат готовили в PBS,
pH 7,4, содержащем 50 мг/мл HSA (человеческого сывороточного альбумина). Мышей инъецировали внутривенно 100 мкл 12В8 (приблизительно 21 мкКи) и группы из трех мышей убивали путем шейного смещения при
0, 24, 48 и 72 часах. После убивания удаляли хвост, сердце, легкие, почки, селезенку, мышцы и бедро, промывали и взвешивали; пробу крови также брали для анализа. Радиоактивность, связанную с каждым
образом, определяли при помощи счета гамма-излучения и затем определяли процент инъецированной дозы на грамм ткани. Поправки на вклад радиоактивности за счет крови, связанной с отдельными органами, не
делались.
В отдельном протоколе аликвоты 2В8 - MX-DTPA, инкубированные при 4oC и 30oC в течение 10 недель, радиоактивно метили индием [III] до удельной активности 2,1 мКи/мг для обоих препаратов. Эти конъюгаты использовали затем в исследованиях по биораспределению, как описано выше.
Для дозиметрических определений 2В8 - MX-DTPA радиоактивно метили индием - [III] до удельной активности 2,3 мКи/мг и приблизительно 1,1 мкКи инъецировали в каждую из 20 BaLB/c мышей. Затем группы из 5 мышей убивали при 1, 24, 48 и 72 часах и их органы удаляли и препарировали для анализа. Кроме того, части кожи, мышц и костей удаляли и обрабатывали для анализа, мочу и фекалии также собирали и анализировали для точек 24 - 72 ч.
При помощи подобного подхода 2В8 - MX-DTPA также радиоактивно метили иттрием -[90] и его биологическое распределением оценивали в BALB/c мышах в течение 72-часового периода. После очистки при помощи гель-фильтрационно хроматографии HPLC четыре группы из 5 мышей инъецировали внутривенно приблизительно 1 мкКи клинически приготовленного конъюгата (удельная активность: 12,2 мКи/мг); эти группы затем убивали при 1, 24, 48 и 72 часах и их органы и ткани анализировали, как описано выше. Радиоактивность, связанную с каждым образцом ткани, определяли путем измерения излучаемой энергии в гамма-сцинтилляицонном счетчике. Величины активности выражали в процентах инъецированной дозы на грамм ткани или в процентах инъецированной дозы на орган. В то время как органы и другие ткани многократно споласкивались для удаления поверхностной крови, органы внутри не промывались. Таким образом не вводили поправки на вклад радиоактивности за счет содержащейся внутри органа крови.
ii Локализация 12В8 в опухоли
Локализацию радиоактивного меченого 2В8 - MX-DTPA определяли в лишенных тимуса мышах, несущих Ramos опухоли B-клеток. 6 - 8 недельным лишенным тимуса
мышам инъецировали подкожно (в левую заднюю сторону) 0,1 мл RPMI-1640, содержащую 1,2 • 107 Ramos опухолевых клеток, которые были предварительно адаптированы к росту в лишенных
тимуса мышах. Опухоли возникали в пределах двух недель и имели вес от 0,07 до 1,1 г. Мышей инъецировали внутривенно 100 мкл меченного индием - [III] 2В8 - MX-DTPA (16,7 мкКи) и группы из трех мышей
убивали шейным смещением при 0, 24, 48 и 72 часах. После убивания удаляли хвост, сердце, легкие, печень, почки, селезенку, мышцы, бедро и опухоль, промывали, взвешивали, также брали для анализа пробы
крови. Радиоактивность, связанную с каждым образцом, определяли при помощи гамма-счета и определяли процент инъецированной дозы на грамм ткани.
iii Исследования биораспределения и
локализации в опухоли с применением радиоактивного меченого 2В8 - MX-DTPA
После описанного выше предварительного эксперимента по изучению биораспределения (Пример I.B.viii, a) конъюгированный
2В8 радиоактивно метили индием - [III] до удельной активности 2,3 мКи/мг и примерно 1,1 мкКи инъецировали в каждую из двадцати BALB/c мышей для определения биораспределения радиоактивно меченного
материала. Затем группы из пяти мышей убивали при 1, 24, 48 и 72 часах и их органы и части кожи, мышц и костей удаляли и обрабатывали для анализа. Кроме того, собирали мочу и фекалии и анализировали в
точках 24 - 72 часа. Уровень радиоактивности в крови падал от 40,3% инъецированной дозы на грамм в первой точке (1 час) до 18,9% в точке 72 часа (данные не приведены). Величины для сердца, почек, мышц
и селезенки оставались в диапазоне 0,7 - 9,8% в течение всего эксперимента. Уровни радиоактивности, обнаруженные в легких, снижались от 14,2% в первой точке (1 час) до 7,6% при 72 часах: подобным
образом соответствующие величины инъецированной дозы на грамм легких были 10,3% и 9,9%. Эти данные использовали для определения оценок поглощенной дозы радиации 12В8, описанного ниже.
Для определения локализации в опухоли готовили 2В8 - MX-DTPA и радиоактивно метили индием - [III] до удельной активности 2,7 мКи/мг 100 мкл меченого конъюгата (приблизительно 24 мкКи) инъецировали затем в каждую из 12 лишенных тимуса мышей, несущих Ramos B-клеточные опухоли. Опухоли весили от 0,1 до 1,0 граммов. В точках времени 0, 24, 48 и 72 часа после инъекции 50 мкл крови брали заглазничной пункцией, мышей убивали шейным смещением и удаляли хвост, сердце, легкие, печень, почки, селезенку, мышцы, бедро и опухоль. После обработки и взвешивания тканей определили радиоактивность, связанную с каждым тканевым образом, при помощи гамма-счетчика и величины выражали в виде процента инъецированной дозы на грамм.
Результаты (не показаны) показали, что концентрации в опухоли111In-2B8 - MX-DTPA увеличивались стабильно в ходе эксперимента. 13% инъецированной дозы накапливалось в опухоли после 72 часов. Уровни в крови, напротив, падали в ходе эксперимента от более 30% при 0 точке до 13% при 72 часах. Все другие ткани (кроме мышцы) содержали между 1,3 и 6% инъецированной дозы на грамм ткани в конце эксперимента; мышечная ткань содержала приблизительно 13% инъецированной дозы на грамм.
D. Исследования на человеке
i. 2B8 и 2В8 - MX-DTPA: иммуногистологические исследования с тканями человека.
Способность реагировать с разными тканями мышиных моноклональных антител 2В8 оценивали при помощи панели 32 различных тканей человека, фиксированных ацетоном. Антитела 2В8 реагируют с антигеном CD20, имеющим очень ограниченное распределение в ткани: он наблюдается только в посерии клеток в лимфоидных тканях, в том числе лимфоидных тканях гемопоэтического происхождения.
В лимфатическом узле иммунореактивность наблюдали в популяции зрелых кортикальных B-лимфоцитов, а также в пролиферирующих клетках в эмбриональных центрах. Положительная реактивность наблюдалась также в периферической крови, B-клеточных зонах миндалин, белой пульпу селезенки и с 40 - 70% медуллярных лимфоцитов, обнаруженных в тимусе (вилочковой железе). Положительную реактивность наблюдали также в фолликулах lamina propria (пейеровых бляшек) толстой кишки. Наконец, агрегаты или рассеянные лимфоидные клетки в строме различных органов, в том числе мочевого пузыря, грудной железы, шейки матки, пищевода, легкого, околоушной железы, предстательной железы, тонкого кишечника и желудка, были также положительными с антителом 2В8 (данные не приведены).
Все клетки однослойного эпителия, а также многослойный эпителий и эпителий различных органов не реагировал с 2В8. Подобным образом не было реактивности с нейроэктодермальными клетками, в том числе в мозгу, спинном мозгу и периферических нервах. Мезенхимные элементы, такие как клетки скелетных и гладких мышц, фибробласт, эндотелиальные клетки и полиморфноядерные воспалительные клетки были также отрицательными (данные не приведены).
Тканевую реактивность конъюгата 2В8 - MX-DTPA оценивали с применением набора (панели) 16 тканей человека, фиксированных ацетоном. Как было показано предварительно с нативным антителом (данные не показаны), конъюгат 2В8 - MX-DTPA узнавал антиген CD20, который обнаруживал очень ограниченный патерн распределения: он был обнаружен только на подсерии клеток лимфоидного происхождения. В лимфатическом узле иммунореактивность наблюдали в популяции B-клеток. Сильную реактивность наблюдали в белой пульпу селезенки и в медуллярных лимфоцитах тимуса. Иммунореактивность также наблюдали в рассеянных лимфоцитах в мочевом пузыре, сердце, толстых кишках, печени, легком и матке, а также в воспалительных клетках, присутствующих в этих тканях. Как и в случае нативного антитела, реактивности не наблюдали с клетками нейроэктодермы или с мезенхимными элементами (данные не приведены).
ii Клинический анализ 12B8 (томография) и Y2B8 (терапия)
a. Клинический анализ фазы
I-II 12B8 с применением терапии с однократной дозой
Клиническое исследование фазы I-II 12B8 (томографию) с последующей обработкой одной терапевтической дозой Y2B8 проводят в настоящее время.
Для исследования терапии с применением однократной дозы выполняют следующую схему:
1. Сбор с очисткой периферических стволовых клеток (PSG) или костного мозга (BM);
2. 12B8
- томография;
3. Y2B8 - терапия (три дозовых уровня); и
4. Трансплантация PSC или аутологического BM (если необходимо на основе абсолютного счета нейтрофилов ниже 500 на нм3 для трех последовательных дней или тромбоцитов ниже 20000 на мм3 при отсутствии восстановления костного мозга при испытании костного мозга).
Уровня доз Y2B8
следующие:
Уровень дозы - Доза (мКи)
1 - 20
2 - 30
3 - 40
Для определения максимальной переносимой в дозы (MTD) следует обработать трех больных при каждом
уровне дозы.
Томографические (дозиметрия) исследования проводят следующим образом: каждый больной участвует в двух исследованиях in vivo распределения с применением 12B8. В первом исследовании 2 мг 12B8 (5 мКи) вводят в виде внутривенного вливания (i.v.) в течение 1 ч; спустя одну неделю 2B8 (т.е. неконъюгированное антитело) вводят путем i.v. при скорости не более 250 мг/ч с последующим немедленным введением 2 мг 12B8 (5 мКи) i.v. в течение 1 ч. В обоих исследованиях сразу же после вливания 12B8 каждого больного подвергают томографии и томографию повторяют при времени t=14-18 ч (если указано), t = 24 ч; = 96 ч (если указано). Определяют среднее время удерживания целым телом для индия - ([III];, такие определения также делают для узнаваемых органов или опухолевых поражений ("интересующие районы").
Эти представляющие интерес районы сравнивают с концентрациями метки целого тела; на основе этого сравнения можно оценить локализацию и определить концентрацию Y2B8 при помощи стандартных протоколов. Если оцененная кумулятивная доза Y2B8, чем в 8 раз, превышает дозу целого тела, или если определенная кумулятивная доза для печени превышает 1500 cGy, не должно осуществляться лечение Y2B8.
Если исследования томографии дают приемлемые результаты, либо 0, либо 1,0 мг/кг веса тела больного 2B8 вводят внутривенным вливанием при скорости, не превышающей 250 мг/ч. Затем вводят Y2B8 (10, 20 или 40 мКи) при скорости i.v. вливания 20 мКи/ч.
b. Клиническое исследование фазы I/II: исследование терапии с применением
многократных доз
Проводят клинический анализ фазы I/II Y2B8. Для исследования с многократными дозами выполняют следующую схему:
1. Сбор PSC или BM;
2. 12B8 - томография;
3. Y2B8 - терапия (три уровня доз) для четырех доз или общей кумулятивной дозы 80 (мКи):
4. Трансплантация PSC или аутологичного BM (на основании решения медицинского работника).
Уровни дозы Y2B8 следующие:
Уровень дозы - Доза (мКи)
1 - 10
2 - 15
3 - 20
Для определения MTD следует обработать трех больных при каждом уровне
дозы.
Томографические (дозиметрические) исследования проводили следующим образом: предпочтительную дозу для томографии для немеченого антитела (т.е. 2B8) определяют с первыми двумя больными. Первые двое больных получают 100 мг немеченого 2B8 в 250 мл нормального солевого раствора в течение 4 ч, а затем 0,5 мКи 12B8. Пробы крови берут для данных по биораспределению при t=0, t=10 мин, t = 120 мин, t = 24 ч, t = 48 ч. Больных сканируют при помощи гамма-камеры для получения множества местных изображений при временных точках 2 ч, 24 ч, и 48 ч. После сканирования при 48 ч больные получают 250 мг 2B8, как описано, затем 4,5 мКи 12B8. Взятие проб крови и сканирование следует затем, как описано. Если 100 мг 2B8 дают превосходное изображение, то следующие двое больных получают 50 мг 2B8, как описано, затем 0,5 мКи 12B8 и спустя 48 ч 100 мг 2B8, затем 4,5 мКи 12B8. Если 250 мг 2B8 дают превосходное изображение, то следующие двое больных получают 250 мг 2B8, как описано, затем 0, 5 мКи 12B8, спустя 48 ч : 500 мг 2B8 и затем 4,5 мКи 12B8. Последующих больных обрабатывают наименьшим количеством 2B8, которое обеспечивает оптимальное изображение. Оптимальное изображение характеризуется: (1) наиболее эффективным изображением с самым медленным исчезновением антител; (2) наилучшим распределением, уменьшающим компартментализацию в одном органе; (3) наилучшим субъективным разрешением повреждения (сравнение опухоль/фон).
Для первых четырех больных первую терапевтическую дозу Y2B8 начинают давать спустя 14 дней после последней дозы 12B8; для последующих больных первую терапевтическую дозу Y2B8 начинают давать между 2 и 7 днями после 12B8.
Перед получением Y2B8 для больных, кроме первых четырех, 2B8 вводят, как описано, с последующим i.v. вливанием Y2B8 в течение 5-10 мин. Пробы крови для биораспределения берут при 0, 10 мин, 120 мин, 24 ч, и 48 ч. Больным дают повторные дозы Y2B8 (вводят такую же дозу, что и при первом введении) приблизительно каждые 6-8 недель для максимума четырех доз или общую кумулятивную дозу 80 мКи. Наиболее предпочтительно, чтобы больные не получали последующую дозу Y2B8, пока WBC больных больше 3000 или равен 3000, а AGC больше или равен 100000.
После завершения исследования трех уровней доз определяют MTD. Затем в исследование вводят дополнительных больных, которые получают
MTD
II. Получение Анти-CD20 Aнтител ("C2B8")
A. Конструирование химерного экспрессирующего анти-CD20-иммуноглобулин вектора ДНК
РНК выделяли из 2B8 мышиной гибридомной
клетки (как описано в Chomczynki P. et. al. "Single stepmethod of RNA isolation by acid guanidimum thiocyanate - phenolchloroform extraction". Anal. Biochem. 162: 156-159 (1987) Из этой РНК получали
кДНК. ДНК вариабельной области легкой цепи мышиного иммуноглобулина выделяли из кДНК при помощи полимеразной цепной реакции с использованием набора ДНК праймеров, имеющих гомологию с мышиными
сиганальными последовательностями легкой цепи на 5'-конце и y районом мышиной легкой цепи на 3'-конце.
Праймерные последовательности были следующими:
1. UL
смысловая (SEQ ID N 3)
5' ATC AC

(Подчеркнутая часть является сайтом BglII: отмеченная выше часть является стратовым кодоном)
2. UL Антисмысловая (SEQ ID N 4)
5' TGC AGC ATC

(Подчеркнутая часть является сайтом BsiWI) См. фиг. 1 и 2 для соответствующих сайтов BglII и BsiWII в TCAE 8 и фиг. 3 для соответствующих сайтов в анти-CD20 в TCAE 8.
Эти полученные фрагменты ДНК клонировали непосредственно в вектор TCAE 8 впереди константного домена легкой цепи каппа человека и секвенировали. Определенная последовательность ДНК для вариабельной области мышиной легкой цепи представлена в фиг. 4. (SEQ ID N 5), см. также фиг. 3, нуклеотиды 978-1362. Фиг. 4, кроме того, дает аминокислотную последовательность этого мышиного вариабельного района в район CDR и каркасный район. Вариабельная область мышиной легкой цепи из 2B8 относится к мышиному семейству каппа VI См. Kabat, Supra.
Вариабельная область мышиной тяжелой цепи была подобным образом выделена и клонирована впереди константных доменов человеческого IgGI. Праймеры были следующими:
1. UH Смысловая (SEQ ID N 6)
5' GCG GCT CCC

(Подчеркнутая часть является сайтом MluI)
2. UH Антисмысловая (SEQ ID N 7)
5' GG (G/C) TGT TGT

(Подчеркнутая часть является сайтом Nhe I)
См. фиг. 1 и 2 для соответствующих сайтов MluI и Nhe I в TCAE 8 и фиг. 3 для соответствующих сайтов в анти-CD20 в TCAE8.
Последовательность для мышиной тяжелой цепи представлена в фиг. 5 (SEQ ID N 8); см. также фиг. 3; нуклеотиды 2401-2820. фиг. 5 дает также аминокислотную
последовательность из этой мышиной вариабельной области и районы CDR и каркасный. Мышиная вариабельная область тяжелой цепи из 2B8 относится к мышиному семейcтву VH 2B. См. Kabatm, supra
B.
Получение химерных продуцирующих анти-CD20 антитела CHO и SP2/O трансфектом
Клетки DG44 яичника китайского хомячка (CHO) выращивали в среде SSFM II, не содержащей гипоксантин и тимидин (Gibco,
Grand Island, NY, Form N 91-0456PK); клетки мышиной миеломы SP2/0 выращивали в модифицированной Игла среде Дульбенко ("DMEM") (Irvine Scientific, Santa Ana, Ca, Cat. N 9024) с 5% плодной бычьей
сыворотки и 20 мл/л глутамина, добавленными к среде. Четыре миллиона клеток электропорировали либо с 25 мкг CHO, либо с 50 мкг плазмидной ДНК SP 2/0, которая была рестриктирована при помощи NotI с
применением системы электропорации BTX 600 (BTX, San Diego, CA), в одноразовых кюветах на 0,4 мл. Условия были либо 210 вольт для CHO, либо 180 вольт для P2/0, 400 микрофарад, 13 Ом. Каждую
электропорацию высевали в шесть 96-луночных планшетов (приблизительно 7000 клеток на лунку). В планшеты подавали среду, содержащую G418 (GENETICIN, Gibco, Cat. N 860-1811) при 400 мкг/мл активного
соединения для CHO (среда, кроме того, содержала 50 мкМ гипоксантина и 8 мкМ тимидина), либо 800 мкг/мл для SP2/0 два дня после электропорации и после этого 2 или 3 дня, пока не возникали колонии.
Супернатант из колоний тестировали на присутствие химерного иммуноглобулина при помощи E LISA, специфического для антитела человека. Колонии, продуцирующие наибольшее количество иммуноглобулина,
увеличивали в объеме и высевали в 96-луночные планшеты, содержащие среду плюс метотрексат (25 нМ для SP 2/0 и 5 нМ для CHO), и среду подавали каждые два или три дня. Супернатанты тестировали, как
указано выше, и исследовали колонии, продуцирующие наибольшее количество иммуноглобулина. Химерные анти- CD20 антитела очищали из супернатанта с применением протеин А-аффинной хроматографии.
Очищенные химерные анти- CD20 анализировали электрофорезом в полиакриламидных гелях и оценили, что они имели чистоту приблизительно 95%. Химерные анти- CD20 антитела, испытанные в прямом и конкурентном анализе связывания при сравнении с мышиными анти- CD20 моноклональными антителами 2B8, обнаружили сравнимую аффинность и специфичность на ряде CD20 положительных B- клеточных линиях (данные не представлены). Среднюю афинную константу ("Кар") химерного антитела определяли путем прямого связывания125I радиоактивного меченого химерного анти - CD20 и сравнивали с радиоактивно меченным 2B8 при помощи кривой Скетчарда, оцененная Кар для продуцирующих химерное анти- CD20 антитело CHO была 5,2 • 109 М и для антитела, продуцируемого SP 2/0, 7,4 • 10-9 М. Кар для 2B8 была 3,5 • 10-9.
Прямую конкуренцию с применением радиоиммуноанализа использовали для подтверждения как специфичности, так и удерживания иммунореактивности химерного антитела путем сравнения его способности к эффективной конкуренции с 2B8. Требовались практически эквивалентные количества химерного анти- CD20 и 2B8 антител для получения 50% ингибирования связывания с антигенами CD20 на B-клетках (данные не представлены), т. е. по-видимому, наблюдалась минимальная потеря ингибирующей активности анти- CD20 антител, обусловленная химеризацией.
Результаты Примера 11. В показывают inter alia что химерные анти- CD20 антитела были получены из CHO и SP 2/0 трансфектом при помощи векторов TCAE 8 и что эти химерные антитела имели в основном ту же самую специфичность и связывающую способность, то и мышиное анти- CD20 моноклональное антитело 2B8.
C. Определение иммунологической
активности химерных анти CD20 антител
i Анализ с человеческим C1q
Химерные анти- CD20 антитела, продуцируемые как CHO, так и SP2/0 клеточными линиями, оценивали на связывание
человеческого C1q в тесте проточной цитометрии с применением меченного флуоресцеином C1q/(C1q получали из Quidel, Mira, Mesa CA, Prod N A 400 и FITC label (метку) из Sigma, St. Louis MO. Prod.
N=7-7250, FITC).
Мечение C1q выполняли в соответствии с протоколом, описанным в Selected Methods In Cellular Immunology, Michel and Shiigi, Ed.(W.H.Freeman and Co, San Francisko, CA, 1980, p. 292). Аналитические результаты получали при помощи проточного цитометра Becton Dickinson FACScanТМ (флуоресцеин измеряли в диапазоне 515 - 545 нм). Эквивалентные количества химерного анти- CD20 антитела, человеческого Ig GI, K миеломного белка (Binding Site, San Diego, CA, Prod. N ВРО 78) и 2B8 инкубировали с эквивалентным количеством CD20 положительных SB клеток, затем промывали FACS буфером ( 0,2% B S A в PB S, pH 7,4, 0,02% азид натрия) для удаления неприсоединенных антител, с последующим инкубированием с меченым FITC C1q. После 30-60 мин инкубации клетки опять промывали. Анализировали три условия, в том числе меченый FITC C1q в качестве контроля, на FACScaTM согласно инструкциям изготовителя. Результаты представлены на фиг. 6.
Как показывают результаты фиг. 6, значительное увеличение флуоресценции наблюдали только для варианта с химерным анти- CD20 антителом, т.е. только B клетки с прикрепленными химерными анти- CD20 антителами были C1q положительными, тогда как другие варианты давали тот же самый результат, который был получен в контроле.
ii Комплемент - зависимый клеточный лизис
Химерные анти- CD20
антитела анализировали на их способность лизировать лимфомные клеточные линии в присутствии сыворотки человека (источника комплекта). CD20 - положительные SB клетки метили51Cr путем
смешивания 100 мк Ки51Cr с 1•106 SB клеток в течение 1 ч при 37oC; затем меченые SB клетки инкубировали в присутствии эквивалентных количеств (0-50 мкг/мл)
либо химерных анти- CD20 антител, либо 2B8 в течение 4 ч при 37oC (см. Brunner, K.T. et. al. "Quantiatire assay of the lytic action of immune lymphoid cells of51Cr-labeled
allogeneic target cells in vitro" . Immunology 14: 181 - 189 (1968). Результаты представлены на фиг. 7
Результаты фиг. 7 показывают, что inter alia химерные анти-CD20 антитела вызывали
значительный лизис (49%) при этих условиях.
iii Эффекторный анализ зависимой от антител клеточной цитотоксичности
Для этого исследования использовали CD20 положительные клетки
(SB) и CD20 отрицательные клетки (линия Т-клеточного лейкоза HSB; см. Adams, Richard, "Formal Discussion" Can. Res. 27: 2479 - 2482 (1967); АТСС депозит N ATCC CCL 120.1); их метили51Cr.
Анализ проводили согласно протоколу, описанному в Brunner K.T.et. al "Quantitative assay of the lytic action of immune lymphoid cells on51Cr-labeled allogeneic target cells in vitro,
inhibition by isoantibody and druds " Immunology 14: 181 - 189 (1968); существенный опосредованный зависимыми от химерных анти-CD20 антител клетками лизис CD20 - положительных B клеток - мишеней (51Cr -меченых) наблюдали в конце 4 ч при инкубации при 37oC. Этот эффект наблюдали как для антител, продуцируемых CHO, так и для антител, продуцируемых SP 2/0 (эффекторными клетками
были человеческие периферические лимфоциты; отношение эффекторных клеток к клеткам - мишеням было 100:1). Эффективный лизис клеток - мишеней получали при 3,9 мкг/мл. В противоположность этому, при тех
же самых условиях мышиное анти-CD20 моноклональное антитело 2B8 обнаруживало статистически незначительный эффект, а CD20 - отрицательные. В клетки не были лизированы. Результаты представлены на фиг.
8.
Результаты Примера 11 показывают, inter alia что химерные анти-CD20 антитела Примера 1 были иммунологическими активными.
III Истощение B/Клеток in vivo при помощи
химерных анти- CD20 Антител
A. Исследования на приматах (не на человеке)
Проводили три отдельных исследования на приматах (не на человеке). Для удобства их называют здесь: "Химерные
анти-D20 : CHO и SP 2/0"; Химерные анти-CD20 : CHO"; и "Высокие дозы химерных анти-CD20 ". Условия были следующими:
Химерные анти-CD20 : CHO и SP2/0
Шесть обезьян cynomolgus весом в
диапазоне от 4,5 до 7 кг (White Sands Research Center, Alamogordo, NM) разделяли на три группы по две обезьяны в каждой. Оба животных каждой группы получали одинаковую дозу иммунологически активного
химерного анти-CD20 антитела. Одно животное в каждой группе получало очищенное антитело, продуцируемое CHO трансфектомой; другое получало антитело, продуцируемое SP2/0 трансфектомой. Три группы
получали дозы антител, соответствующие 0,1 мг/кг, 0,4 мг/кг и 1,6 мг/кг каждый день в течение 4 последовательных дней. Химерное иммунологически активное анти-CD20 антитело, смешанное со стерильным
солевым раствором, вводили внутривенным влиянием; перед каждым вливанием брали пробы крови. Дополнительные пробы крови брали, начиная с 24 ч после последней инъекции (T = 0) и после этого в дни 1-ый,
3-ий, 7-ой, 14-ый и 28-ой; пробы крови также брали после этого с интервалами в две недели до завершения исследования на 90-ый день.
Приблизительно 5 мл цельной крови из каждого
животного центрифугировали при 2000 об/мин в течение 5 мин. Плазму удаляли для анализа уровней растворимых химерных анти-CD20 антител. Осадок (содержащий лейкоциты периферической крови и эритроциты)
ресуспендировали в плодной сыворотке теленка для анализа меченных флуоресцеином антител (см. "Fluorescent Antilogy Labeling of Lymphoid Cell Population" infra" Химерные анти-CD20: CHO
Шесть
обезьян cynomolgus весом от 4 до 6 кг. (White Sands) делили на три группы по две обезьяны в каждой. Всем животным вводили иммунологически активные химерные анти-CD20 антитела, полученные из CHO
трансфектомы (в стерильном солевом растворе). Три группы различались следующим образом: подгруппа 1 получала ежедневное внутривенные инъекции 0,01 мг/кг антитела в течение 4 дней; подгруппа 2
получала ежедневные внутривенные инъекции 0,4 мг/кг антитела в течение 4 дней; подгруппа 3 получала одну внутривенную инъекцию 6,4 мг/кг антитела.
У всех трех подгрупп брали пробу крови перед началом обработки; дополнительно пробы крови брали при T = 0; 1, 3, 7, 14 и 28 днях после последней инъекции, как описано выше, и эти пробы обрабатывали для анализа флуоресцентно меченых антител (см. "Fluorescent Antibody Labeling, infra). Кроме количественного анализа B-клеток крови, брали биопсии лимфатических узлов на 7-ой, 14-ый и 28-ой дни после последней инъекции и один клеточный препарат окрашивали для определения количества популяций лимфоцитов при помощи проточной цитометрии.
Высокие дозы химерных анти-CD0 антител
Двум обезьянам
cynomolgus (White Sands) вливали 16,8 мг/кг иммунологически активных химерных анти-CD20 антител из CHO трансфектом (в стерильном солевом растворе) еженедельно в течение периода из четырех
последовательных недель. В конце эксперимента обоих животных анестезировали для удаления костного мозга; брали также биопсии лимфатических узлов. Оба набора ткани окрашивали на присутствие
B-лимфоцитов при помощи Leu 16 проточной цитометрией согласно протоколу, описанному в Ling, N.R. et. al. "B-cell and plasma cell antigens" Leucocyte Typing III White Cell Diffeventiation Antigens, A.
J. Mc Michael, Ed. (Oxford University Press, Oxford UK, 1987, p. 302). Мечение флуоресцентными антителами популяции лимфоидных клеток
После удаления плазмы лейкоциты промывали дважды Hanks
Balanced Salt Solution ("BHSS") и ресуспендировали в эквивалентном плазме объеме плодной сыворотки теленка (инактивированной теплом при 56oC в течение 30 минут). Объем 0,1 мл клеточного
препарата распределяли в каждую из шести конических центрифужных пробирок на 15 мл. Меченные флуоресцеином моноклональные антитела, специфические для поверхностных маркеров CD20 лимфоцитов человека
(AMAC, Westbrook ME), CD20 (Becton Dickinson) и человеческий IgM (Binding Site, San Diego CA) добавляли к трем из пробирок для идентификации популяций T- B- лимфоцитов. Все реагенты были тестированы
предварительно как положительные по отношению к соответствующим антигенам лимфоцитов обезьян. Химерное анти-CD20 антитело, связанное с CD20 поверхности B- клеток обезьян, измеряли в четвертой пробирке
с применением поликлонального козьего античеловеческого IgG, соединенного с фикоэритрином (AMAC). Этот реагент предварительно адсорбировали на сефарозной колонке с иммуноглобулином обезьян для
предотвращения кросс-реактивности с иммуноглобулином обезьян, что делало возможными специфическое детектирование и определение количества химерного анти-CD20 антитела, связанного с клетками. Пятая
пробирка содержала как анти-IgM, так и анти-IgG человека для дважды окрашенной популяции B-клеток. Шестая проба была включена без реагентов для определения аутофлуоресценции. Клетки инкубировали с
флуоресцентными антителами в течение 30 минут, промывали и фиксировали 0,5 мл буфера для фиксации (0,15 М NaCl, 1% параформальдегида, pH 7,4) и анализировали на приборе Becton Duckinson FAC ScanТМ. Популяции лимфоцитов исходно идентифицировали по рассеиванию света (вперед versus прямого угла) в дот-плотдвоичных изображениях с немечеными лейкоцитами. Затем выделяли общую популяцию
лимфоцитов, отбрасывая все другие события. Последующие измерения флуоресценции отражали только специфические для лимфоцитов события.
Истощение B-лимфоцитов периферической крови
Не обнаружено наблюдаемое различие между эффективностью CHO и SP 2/0 продуцируемыми антителами в истощении B-клеток in vivo, хотя слабое увеличение в восстановлении B-клеток, начинающееся после
7-ого дня у обезьян, инъецированных химерными анти-CD20 антителами, полученными из CHO трансфектом, при уровнях дозы 1,6 мг/кг и 6,4 мг/кг наблюдали, а также для обезьян, инъецированных продуцируемыми
SP 2/0 антителами при уровне дозы 0,4 мг/кг. Фиг. 9A, B и C дают результаты, полученные из исследования "химерные анти-CD20: CHO и SP 2/0": фиг. 9A изображает уровень дозы 0,4 мг/кг; фиг. 9B
изображает уровень дозы 1,6 мг/кг и фиг. 9C уровень дозы 6,4 мг/кг.
Как видно из фиг. 9, наблюдали сильное уменьшение (более 95%) в уровнях B-клеток в периферической крови после терапевтической обработки во всех испытанных диапазонах доз, и эти уровни сохранялись вплоть до 7 дней после вливания, после этого периода начиналось восстановление B-клеток и время начала восстановления не зависело от уровня дозы.
В исследовании "химерные анти-CD20: CHO: использовали в 10 раз более низкую дозовую концентрацию (0,01 мг/кг) в течение четырехдневного периода ежедневных инъекций (0,04 мг/кг всего). Фиг. 10 дает результаты этого исследования. Эта доза истощала популяцию B-клеток периферической крови приблизительно до уровня 50% от нормальных уровней, что оценивали либо с IqM против поверхности клеток, либо с Leu 16 антителами. Результаты также показывают, что насыщение антигена CD20 на популяции B-лимфоцитов не достигается с иммунологически активным анти-CD20 антителом при этой дозовой концентрации в течение этого периода времени у приматов; B-лимфоциты, покрытые этими антителами, детектировали в пробах крови во время начальных трех дней после терапевтической обработки. Однако на 7-ой день покрытые антителами клетки не были детектированы.
Таблица I суммирует результаты действия однократной и многократных доз иммунологически активного анти-CD20 антитела на популяции периферической крови; вариант однократной дозы был 6,4 мг/кг; многократные дозы были 0,4 кг/кг в течение четырех последовательных дней (эти результаты были получены на описанных выше обезьянах).
Данные, суммированные в таблице I, показывают, что истощение B-клеток в периферической крови при условиях избытка антител происходит быстро и эффективно, независимо от однократной или многократных доз. Кроме того, истощение наблюдали в течение по меньшей мере семи дней после последней инъекции, с частичным восстановлением B-клеток, наблюдаемым на 21 день.
Таблица II суммирует действие иммунологически активных химерных анти- CD20 антител на клеточные популяции лимфатических узлов с применением режима лечения таблицы I (4 ежедневных дозы по 0,4 мг/кг; I доза 6,4 мг/кг); также даны сравнительные величины для нормальных лимфатических узлов (контрольные обезьяны, подмышечные и паховые лимфатические узлы) и для нормального костного мозга (две обезьяны).
Результаты таблицы II показывают эффективное истощение B-лимфоцитов для обеих режимов лечения. Далее, таблица II свидетельствует о том, что для приматов, не являющихся человеком, полное насыщение B-клеток в лимфатической ткани иммунологически активным химерным анти- CD20 антителом не достигается; кроме того, покрытые антителами клетки наблюдались через 7 дней после обработки, с последующим заметным с истощением B-клеток в лимфатических узлах, наблюдаемым на 14-ый день.
На основании этих данных проводили упомянутое выше исследование высоких доз химерного анти- CD20, направленное на определение фармакологии/токсикологии т.е. это исследование проводили для оценки какой-либо токсичности, связанной с введением химерного антитела, а также эффективности истощения B-клеток в лимфатических узлах, периферической крови и костном мозгу. Кроме того, поскольку данные таблицы II показывают, что для этого исследования большая часть III-клеток лимфатических узлов истощается между 7 и 14 днями после обработки, режим с недельным дозированием может дать более эффективные результаты. Таблица III суммирует результаты исследования высоких доз химерного анти-CD20 антитела.
Оба животных, обследованных при 22 днях после прекращения обработки, содержали менее 5% B-клеток по сравнению с 40% в контрольных лимфатических узлах (см. Таблицу II, Supra). Подобным образом, в костном мозгу животных, обработанных химерным анти-CD20 антителом, уровни CD20- положительных клеток были ниже 3% по сравнению с 11 - 15% в нормальных животных (см. таблицу II, Supra). В животных, обследованных при 36 днях после прекращения обработки, одно их животных (H) имело приблизительно 12% B-клеток в лимфатическом узле и 4,4% B-клеток в костном мозгу, тогда как другое животное (C) имело приблизительно 5% B-клеток в лимфатическом узле и 0,8% в костном мозгу. Эти данные свидетельствуют о значительном истощении B-клеток.
Результаты Примера III указывают, inter alia, что низкие дозы иммунологически активного химерного анти-CD20 приводят к долгосрочному истощению B-клеток в периферической крови у приматов. Эти данные также показывают, что значительное истощение популяции B-клеток было достигнуто в периферических лимфатических узлах и костном мозгу при введении повторяемых высоких доз антитела. Продолжительное обследование тест-животных показало, что даже такое сильное истощение периферических B-лимфоцитов во время первой недели лечения не привело к неблагоприятному воздействию на здоровье. Кроме того, когда наблюдали восстановление популяции B-клеток, был сделан вывод о том, что плюрипотентные стволовые клетки этих приматов не были пагубно повреждены этой обработкой.
B. Клинический анализ C2B8
i Клиническое испытание фазы I/II C2B8: исследование терапии с применением однократной дозы
Пятнадцать больных, имеющих гистологически документированную рецидивирующую B-клеточную лимфому, обрабатывали C2B8 в клиническом испытании фазы I-II. Каждый больной получал одну дозу C2B8 в
исследовании с увеличивающимися дозами; испытывали трех больных для доз: 10 мг/м2; 50 мг/м2; 100 кг/м2; 250 мг/м2 и 500 мг/м2. Введение проводили
путем внутривенной инфузии через 0,22 микронный фильтр, причем C2B8 разводили в конечном объеме 250 мл или при максимальной концентрации 1 мг/мл в нормальном солевом растворе. Исходная скорость была
50 мл/ч в течение первого часа; если не наблюдали токсичности, скорость дозирования увеличивали максимально до 200 мл/ч.
Токсичность (как показано клиницистом) находилась в диапазоне от "нет" до "жар", до "умеренная" (двое больных), до "серьезная" (один больной); все больные прошли полную терапевтическую обработку. Для определения: inter alia действия C2B8 на T-клетки и B-клетки анализировали лимфоциты периферической крови. У всех больных лимфоциты периферической крови истощались после инфузии C2B8 и это истощение сохранялось в течение более двух недель.
Один больной (получающий 100 мг/м2 C2B8, обнаружил частичную ответную реакцию на обработку C2B8 (снижение более чем на 50%, суммы перпендикулярных диаметров всех измеряемых индикаторных повреждений, длящееся более четырех недель, во время которых не могут появиться новые повреждения и не могут увеличиться прежние повреждения); по меньшей мере еще один больной (получающий 500 мг/м2) обнаружил слабую ответную реакцию на обработку C2B8 (снижение менее чем на 50%, но не менее 25% в сумме измерений двух самых длинных перпендикулярных диаметров из всех измеряемых индикаторных повреждений). Для представления эффективности результаты PB изображены на фиг. 14A; для больного, обнаруживающего малую ответную реакцию (MR), данные представлены на фиг. 14B. На фиг. 14 приведены обозначения.
Как показано, B- клеточные маркеры CD20 и CD19, Каппа и Лямбда истощались в течение более двух недель, тогда как было слабое исходное снижение числа T-клеток, которые возвращались к фоновому уровню в относительно коротком промежутке времени.
ii Клиническое испытание фазы I/II C2B8; исследование терапии с применением многократных доз
Больные, имеющие гистологически подтвержденную B-клеточную лимфому с измеримо прогрессирующим заболеванием желательны для этого исследования, которое делилось на две фазы; в фазе I, состоящей из
дозовой эскалации (нарастание дозы), для характеристики лимитирующих токсичностей и определения биологически активной переносимой дозы, группы из трех больных получают еженедельно внутривенные
вливания C2B8, всего четыре отдельных инфузии. Кумулятивная доза при каждом из трех уровней будет: 500 мг/м2 (125 мг/м2 на 1 вливание); 1000 мг/м2 (250 мг/м2
на 1 вливание); 1500 мг/м2 (375 мг/м2 на 1 вливание. Биологически активную переносимую дозу определяют как самую низкую дозу с переносимой токсичностью и адекватной активностью);
в фазе 11 дополнительные больные получают биологически активную переносимую дозу, причем большое значение придают определению активности четырех доз C2B8.
IV. Комбинированная
терапия: C2B8 и Y2B8
Комбинированный терапевтический подход с применением C2B8 и Y2B8 был исследован в модели с ксенотрансплантацией мыши (пи/пи мышь, самка, приблизительно 10-недельного
возраста), с использованием B-клеточной лимфобластной опухоли (Ramos опухолевые клетки). Для сравнительных целей дополнительные мыши были обработаны C2B8 и Y2B8.
Ramos опухолевые клетки (АТСС, CRL 1596) поддерживали в культуре с применением RPMI - 1640 с добавлением 10% плодной сыворотки теленка и глутамина при 37oC и 5% CO2. Опухоли инициировали в 9 самках "голых" мышей приблизительно 7 - 10-недельного возраста при помощи подкожной инъекции 1,7 • 106 Ramos клеток в объеме 0,10 мл (HBSS) с применением шприца на 1 мл с иглой 25 г. Со всеми животными манипулировали в ламинарном боксе и все клетки, подстилки, корм и вода автоклавировались. Опухолевые клетки получали вырезанием опухолей и проведением их через сито 40 меш; клетки промывали дважды 1xHBSS (50 мл) при помощи центрифугирования (1300 об/мин), ресуспендировали в 1 x HBSS до 10 • 106 клеток/мл и замораживали при -70oC до использования.
Для экспериментальных условий клетки из нескольких партий оттаивали, осаждали центрифугированием (1300 об/мин) и промывали дважды 1 x HBSS. Затем клетки ресуспендировали приблизительно до 2,0 • 106 клеток/мл. Приблизительно 9 - 12 мышей инъецировали 0,10 мл этой клеточной суспензии подкожно (S • C) при помощи шприца на 1 мл, снабженного иглой 25 г; инъекции выполняли в левый бок животного, примерно в среднюю часть. Опухоли развивались приблизительно за две недели. Опухоли вырезали и обрабатывали, как описано выше. Мышей, предназначенных для исследования, инъецировали, как описано выше, с использованием 1,67 • 106 клеток в 0,10 мл HBSS.
На основании предварительных экспериментов по дозированию было определено, что для этого исследования следует использовать 200 мкг C2B8 и 100 мкКи Y2B8. 90 самок пи/пи мышей ("голая" мышь, т.е. бестимусная мышь с мутацией по гену nude) (приблизительно в 10-недельном возрасте) инъецировали опухолевыми клетками.
Спустя приблизительно 10 дней, 24 мыши были определены для четырех исследуемых групп (шесть мышей на группу) причем старались сохранить сравнимое
распределение размеров опухолей в каждой группе (средний размер опухоли, выраженный как произведение длины на ширину опухоли, был приблизительно 80 мм2). Следующие группы обрабатывали, как
указано, через инъекцию в хвостовую вену с применением микрошприца Hamilton с иглой 25 г:
A. Нормальный солевой раствор
B. Y2B8 (100 мкКи)
C. C2B8 (200 мг)
D. Y2B8
(100 мкКи) + C2B8 (200 мг)
Группам, тестируемым с C2B8, давали вторую инъекцию C2B8 (200 мг/мышь) через 7 дней после исходной инъекции. Измерения опухоли проводили каждые два или три дня при
помощи циркуля.
Приготовление материалов для обработки проводили в соответствии со следующими протоколами:
A. Приготовление Y2B8
Хлорид иттрия - [90] (6 мКи) вносили
в полипропиленовую пробирку и pH доводили до 4,1 - 4,4 при помощи не содержащего металлов 2 М ацетата натрия. Добавляли 3B8 - MX-DTPA (0,3 мг в нормальном солевом (физиологическом) растворе, см. выше
приготовление 2B8-MX-DTPA) и осторожно перемешивали при помощи вортекса. После 15 мин инкубирования реакцию останавливали добавлением 0,05 x объема 20 мМ ЭДТА и 0,05 x объема 2 М ацетата натрия.
Концентрацию радиоактивности определяли разбавлением 5,0 мкл реакционной смеси в 2,5 мл 1 x PBS, содержащего 75 мг/мл HSA и 1 мМDTPA ("композиционный буфер"); радиоактивность считали путем добавления
10,0 мкл к 20 мл сцинтилляционной смеси EcolumeTM. Остаток реакционной смеси добавляли к 3,0 мл композиционного буфера, стерильно фильтровали и хранили при 2 - 8oC до
использования. Удельную радиоактивность (14 мКи/мг в момент инъекции) рассчитывали на основе концентрации радиоактивности и рассчитанной концентрации белка (на основе количества добавленных к
реакционной смеси антител). Связанную с белком радиоактивность определяли при помощи быстрой тонкослойной хроматографии. Включение радиоактивности было 95%. Y2B8 разбавляли в композиционном буфере
непосредственно перед использованием и стерильно фильтровали (конечная концентрация радиоактивности была 1,0 мКи мл).
B. Приготовление C2B8
C2B8 готовили, как описано выше.
Его получали в виде стерильного реагента в нормальном солевом растворе при 5,0 мг/мл. Перед инъекцией C2B8 разводили в нормальном солевом растворе до 2,0 мг/мл и стерильно фильтровали.
C. Результаты
После обработки размер опухоли выражали как произведение длины на ширину и измерения производили в дни, указанные на фиг. 11 (Y2B8 vs. солевого раствора); фиг. 12 (C2B8 по
сравнению с солевым раствором) и фиг. 13 (Y2B8 + C2B8 по сравнению с солевым раствором). Также определяли стандартную ошибку.
Как показано на фиг. 13, комбинирование Y2B8 и C2B8 давали уничтожающие опухоль эффекты, сравнимые с эффектами, полученными отдельно с Y2B8 или C2B8.
V. Альтернативные стратегии терапии
Альтернативные стратегии терапии
очевидны, если принять во внимание предшествующие примеры. Одна из таких стратегий предусматривает использование терапевтической дозы C2B8 с последующим (приблизительно в пределах одной недели)
комбинированием либо 2B8 и радиоактивно меченного 2B8 (например, Y2B8) либо 2B8, C2B8 и, например, Y2B8; или С2В8 и, например, У2В8. Дополнительной стратегией является использование радиоактивно
меченного С2В8: такая стратегия позволяет использовать выгоды иммунологически активной части С2В8 плюс выгоды, связанные с радиоактивной меткой. Предпочтительные радиоактивные метки включают в себя
иттрий - 90 вследствие большего периода полувыведения С2В8 по сравнению с мышиными антителами 2В8. Благодаря способности С2В8 истощать B-клетки и преимуществам, получаемым вследствие использования
радиоактивной метки, предпочтительна альтернативная стратегия, предусматривающая лечение больного при помощи С2В8 (с применением одной дозы или многократных доз), так что большая часть B-клеток, если
не все B-клетки, удаляются. Это могло бы сопровождаться применением радиоактивного 2В8; вследствие удаления периферических B-клеток радиоактивно меченный 2В8 имеет увеличенную возможность попадания в
опухолевые клетки. Предпочтительно применяют меченный иодом - [131] 2В8, на основании характера результатов, сообщенных в литературе для этой метки (см. Kaminski). Альтернативно предпочтение отдается
применению радиоактивно меченного 2В8 (или С2В8) первично в попытке увеличения проницаемости опухоли, с последующими однократной или многократными обработками С2В8; эта стратегия предназначена для
увеличения шансов попадания С2В8 как к наружной части опухли, так и внутрь опухоли. Дальнейшая стратегия предусматривает применение химиотерапевтических агентов в комбинации с С2В8. Эти стратегии
включают в себя так называемые "колебательные" обработки, т.е. обработку химиотерапевтическим агентом, затем обработку С2В8, затем повторение этого протокола. Альтернативно, пригодна исходная
обработка одной или несколькими дозами С2В8, после чего следует химиотерапевтическая обработка. Предпочтительные химиотерапевтические агенты включают в себя (но не ограничены ими) циклофисфамид,
доксорубицин; винеристин; преднизон, см. Armitage, Y.O. et. al. Cancer 50 : 1595 (1982), включено здесь в виде ссылки.
Предшествующие альтернативно стратегии терапии не предназначены для ограничения изобретения, а скорее представлены как репрезентативные стратегии.
VI. Информация о депонировании
Анти-CD20 в TCAE 8 (трансформированный в E. coli для целей
депонирования) был депонирован в American Type Culture Collection (ATCC), 12301 Parklawn Drive, Rockville, Maryland 20852 по положениям договора Budapest Treaty для International Recognition of the
Deposit of Microorganisms для целей Патентной процедуры ("Budapest Treaty"). Этот микроорганизм испытывали в АТСС 9 ноября 1992 г. и определили, что в момент испытания он был жизнеспособен. АТСС
определили этот микроорганизм для АТСС депозитного номера: АТСС 60119 (анти-CD20 в TCAE 8). Гибридома 2В8 была помещена в АТСС 22 июня 1993 г. по положениям Жизнеспособность этой культуры определяли
25 июня 1993 г. и АТСС определил для этой гибридомы депозитной АТСС номер НВ 11388.
Реферат
Изобретение относится к медицине, в частности к онкологии и иммунологии, и касается лечения В-клеточной лимфомы. Предложено новое иммунологически активное химерное антитело - анти- СД 20, в том числе радиоактивное меченое, а также гибридома, секретирующая специфическое в отношении СД 20-антигена антитело. Способ лечения заключается во введении препаратов указанного антитела, в том числе поэтапно в три стадии при использовании различных терапевтически эффективных количеств этих антител. Изобретение приводит к повышению специфичности воздействия на злокачественные клетки. 8 с. и 7 з.п. ф-лы, 27 ил., 3 табл.

Формула
13.11.92 по пп.1-9;
03.11.93 по пп.10-15.

Комментарии