Иммуноконъюгат, способ доставки полинуклеотидов в специфический тип клеток, способ доставки цитотоксического гелонина в клетку - RU2164943C2
Код документа: RU2164943C2
Чертежи









Описание
Настоящее изобретение относится к молекулярной биологии и терапии. Более конкретно, настоящее изобретение относится к новому невирусному вектору, предназначенному для переноса генетической информации к клеткам.
В настоящее время наиболее распространенным способом переноса генетического материала, способного изменять молекулярные свойства клеток млекопитающих, являются вирусные, главным образом ретровирусные, векторы. Однако этот тип генетической терапии или переноса имеет ряд недостатков и является опасным. При наиболее широком применении ретровирусных векторов в настоящее время исследуются аденовирусные векторы, которые также обладают некоторым потенциалом. К сожалению, вирусный вектор имеет множество недостатков. Во-первых, мишеневые клетки, то есть клетки человека, должны взаимодействовать с вирусами за счет экспрессии специфического элемента клеточной поверхности, который вовсе не обязательно может экспрессироваться на клетках или тканях, представляющих интерес для доставки генетической информации. Во-вторых, генетический материал должен быть реализован и экспрессирован в мишеневой, то есть человеческой, клетке, что требует активного деления мишеневых клеток - условиe, которое препятствует эффективности и гомогенности такой системы переноса. Даже будучи успешно интегрированным, ген может оказаться транскрипционно молчащим в системе клеточного механизма хозяина. В-третьих, размер генетической информации, который доступен при такой системе, ограничен и должен быть сконструирован с высокой точностью, чтобы была обеспечена биологическая активность. В-четвертых, для применений в генной терапии должны использоваться репликационно дефективные вирусы, чтобы снизить риск рекомбинации с эндогенными вирусами, которые могут образовывать новые инфекционные агенты. Репликационно дефективные вирусы могут уменьшить такую опасность, но не могут исключить ее. В-пятых, репликационно дефективные вирусы из-за их конструкции не являются самоудаляющимися, что требует повторного инфицирования для обеспечения полного переноса генной последовательности во все клетки.
Известные до настоящего времени системы не содержали невирусные векторы. Настоящее изобретение направлено на решение этой проблемы.
В настоящем изобретении предложена, наряду с остальным, новая невирусная система переноса генетического материала, способного модифицировать вредные или нежелательные фенотипические характеристики.
Таким образом, в одном варианте настоящего изобретения предложен невирусный вектор, включающий связывающийся с клеткой компонент, содержащий биотин-связующий элемент, конъюгированный с биотинилированным фрагментом.
В другом варианте настоящего изобретения предложен способ введения генетического материала в специфические клетки, включающий введение невирусного вектора человеку, причем указанный невирусный вектор содержит связывающийся с клеткой компонент, имеющий биотин-связующий элемент, конъюгированный с биотинилированным фрагментом.
В еще одном варианте настоящего изобретения предложен способ переноса цитотоксического фрагмента в клетку, включающий введение человеку невирусного вектора.
Другие или последующие аспекты, особенности и преимущества настоящего изобретения будут очевидны из следующего описания представленных предпочтительных вариантов изобретения, приведенных с целью раскрытия изобретения.
Нижеследующие чертежи представлены для иллюстрации различных аспектов настоящего изобретения. Для этой цели некоторые из чертежей представлены в схематической форме и не обязательно с соблюдением масштабов.
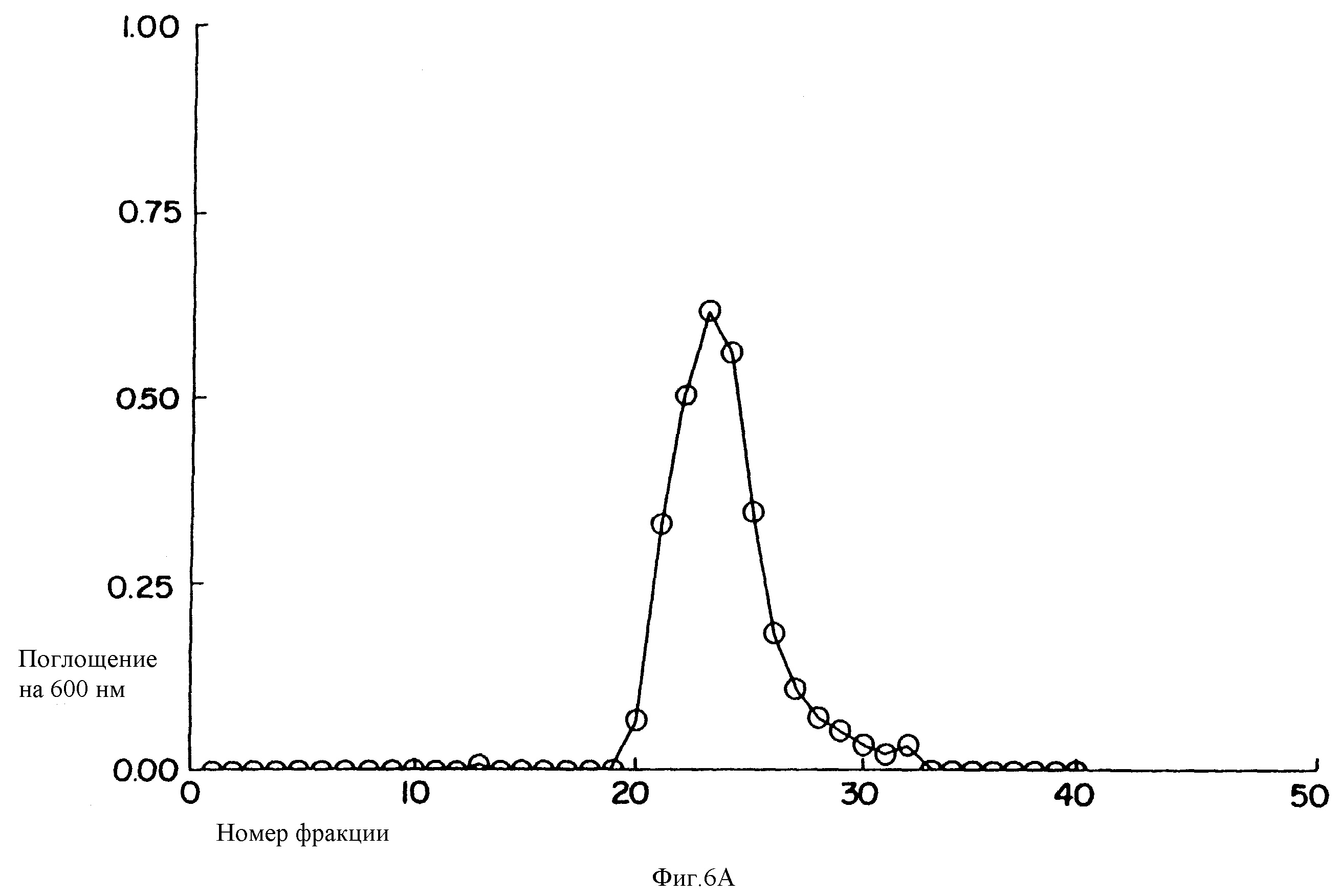
Фиг. 1 представляет выделение свободного SPDP из A108/SPDP на G25 колонке.
Фиг. 2 представляет выделение свободного 2-YT из авидин/2-YT на G25 колонке.
Фиг. 3 представляет выделение свободного авидина из A108-авидин конъюгата на S-200 колонке (FPLC - жидкостная хроматография быстрого разрешения).
Фиг. 4 представляет выделение свободного антитела из А108-авидин конъюгата на Coh-A колонке.
Фиг. 5 представляет 7,5% ПААГ-ДСН минигель, на котором показаны стадии очистки A108-авидин конъюгата.
Фиг. 6 представляет связывающую активность для анализа биотинилированного гелонина.
Фиг. 7 представляет профиль G-75 (FPLC) для A108-авидин гелонин/биотин конъюгата и выделение свободного авидин/гелонина и некоторых субфрагментов авидина.
На фиг. 8 показана связывающая активность биотинилированного гелонина и конъюгата A108-авидин/биотинилированный гелонин при твердофазном иммуноферментном анализе (ЭЛАЙЗА).
Фиг. 9 представляет цитотоксичность конъюгата A108-гелонин по сравнению с конъюгатом A108-авидин/биотинилированный гелонин на A431 клетках.
На фиг. 10 показано влияние инкубирования клеток с последовательностями нуклеиновых кислот, направленными против промоторной последовательности гена рецептора эпидермального фактора роста (обозначаемого антисмысловой EGFp).
В настоящем изобретении предложен невирусный вектор, включающий связывающийся с клеткой компонент, который содержит связывающий биотин элемент, конъюгированный с биотинилированным фрагментом.
В общих чертах связывающий биотин элемент настоящего изобретения может быть любым химическим веществом, которое связывает биотин и которое хорошо известно специалистам в данной области. Предпочтительно, чтобы связывающий биотин элемент был выбран из группы, состоящей из авидина, стрептавидина или аналогов авидина или стрептавидина.
Связывающийся с клеткой элемент настоящего изобретения может иметь один из несколько различных вариантов. Так, например, связывающийся с клеткой элемент может быть моноклональным антителом. Моноклональные антитела, которые могут быть использованы в композициях и в способах настоящего изобретения, являются моноклональными антителами, которые специфически связывают антиген. Антигены, с которыми могут связаться такие антитела, представляют собой эпидермальные рецепторы факторов роста (EGFp), c-erbB2 антиген, антиген Льюиса У (Lewis J), рецептор трансферрина, MDR1, MDR3, рецептор инсулина, CD45, CD33, GP240, CD2, CD3, рецептор фактора роста фибробласта, рецептор фактора роста, полученный из тромбоцита.
В другом варианте связывающийся с клеткой элемент представляет собой лиганд, который специфически связывает рецептор клеточной поверхности. Примерами лигандов, которые связывают рецепторы клеточной поверхности, является трансформирующий фактор роста-альфа, херегулин, фактор роста фибробласта, рецептор фактора роста, полученный из тромбоцита.
Вообще биотинилированный фрагмент может быть любым соединением, которое можно соответствующим образом биотинилировать и которое является химическим веществом, которое необходимо специфически ввести в клетку, для того чтобы получить конкретный биологический или фармакологический эффект. Так, биотинилированным фрагментом может быть белок или нуклеиновая кислота.
Белки, которые можно использовать в композициях и в способах настоящего изобретения, представляют собой гелонин, рицин, сапорин, абрин, дифтерийный токсин, псевдомонас экзотоксин, райалаза, супероксиддисмутаза, протеинтирозинфосфатаза, протеинфосфатаза (PP-1 или PP-2), протеинкиназа A и протеинкиназа C.
Нуклеиновые кислоты представляют собой спиральные олигонуклеотиды, например, триплексные олигонуклеотиды EGF рецептора, антисмысловые олигонуклеотиды, например, для EGF или myc, частичные генные последовательности, например, последовательности, кодирующие отдельный домен протеина с несколькими доменами, такими, как c-src рецептор или EGF рецептор, и полные гены, т.е. взятые из встречающегося фрагмента ретровирусного генома.
В настоящем изобретении предложен также способ переноса генетического материала в специфическую клетку, включающий введение невирусного вектора человеку, причем указанный невирусный вектор включает связывающийся с клеткой компонент, содержащий связывающий биотин элемент, конъюгированный с биотинилированным фрагментом.
В настоящем изобретении предложен также способ переноса цитотоксического фрагмента в клетку, включающий введение человеку невирусного вектора.
Настоящее изобретение включает композиции и способы, позволяющие осуществлять введение нуклеиновых кислот в специфическую группу клеток без использования компонента вирусной инфекции или трансфекции. Моноклональные антитела, направленные против компонента клеточной поверхности, модифицируют и используют для переноса во внутриклеточное отделение нуклеиновых кислот, способных модифицировать экспрессию гена, специфически повысить или понизить уровень белка, экспрессированного внутри мишеневых клеток. Настоящее изобретение применимо также в технологии антисмысловых нуклеиновых кислот у людей.
Моноклональные антитела, направленные против компонента клеточной поверхности, модифицируют биотин-связующим фрагментом и последовательностями нуклеиновых кислот, которые связывают последовательности геномной ДНК или мРНК, так, чтобы изменить экспрессию гена, и связывают за счет взаимодействия авидин: биотин, используя биотинилированные производные последовательностей нуклеиновых кислот. За счет интернализации комплексов антитело: биотин происходит соинтернализация последовательностей активных нуклеиновых кислот, что увеличивает внутриклеточное содержание этих последовательностей. Применение настоящего изобретения: (1) повышает внутриклеточное содержание последовательностей нуклеиновых кислот, регулирующих экспрессию гена с помощью механизмов, отличных от механизмов, связанных с вирусными векторами, или за счет простой или облегченной диффузии сквозь мембрану плазмы; (2) позволяет обойти ограничения маленького размера молекул, т.е. последовательностей нуклеиновых кислот (-20 меров) за счет исключения необходимости простой диффузии через плазменную мембрану в качестве механизма ввода этих последовательностей в клетку; и (3) позволяет обеспечить перенос этих последовательностей, представляющих интерес, к клеткам специфически или селективно за счет взаимодействия антитело:антиген, а не за счет глобальной доставки или вирусной инфекции для повышения клеточного содержания последовательностей нуклеиновых кислот.
В одном из вариантов настоящего изобретения синтезируют антисмысловую ДНК против онкогенного белка, который включает нуклеотиды (10) в прямом и в обратном направлении от кодона начала трансляции мРНК. Затем синтезируют ДНК, комплементарную первым 5 нуклеотидам синтезированной ранее антисмысловой ДНК. Затем встраивают в последовательность биотин/нуклеотидного фрагмента. Затем две цепи гибридизуют. Затем осуществляют перенос к опухоли посредством введения в опухоль MAb авидин/трептавидина.
Нижеследующие примеры иллюстрируют отдельные варианты настоящего изобретения, не ограничивая его объема.
Пример 1
Модификация Антитела A108
A108 распознает человеческий рецептор для эпидермального фактора роста. 10 мг A108 в 2,2 мл буферированного фосфатам
физиологического раствора (PBS) добавляют к 12·75 мл стеклянную ампулу. В ампулу при вращении осторожно добавляют аликвоту 9,35 мкл антител и 2,5-кратный молярный избыток SPDP
(N-сукцинимидил-3-(2-пиридилдитио)пропионат из исходного р-ра 3 мг/мл диметилформамида. Полученную смесь вращают каждые 5 мин в течение 30 мин инкубирования при комнатной температуре.
Избыток непрореагировавшего SPDP удаляют из образца с помощью гель-фильтрационной хроматографии на колонке (1,5·37 мл) Sephadex, предварительно уравновешенной 100 мл натрийфосфатного буфера (pH 7,0), содержащего 0,5 мм EДTA. Фракции объемом 1 мл собирают в фракционный сборник Гильсона (Gilson) во время элюирования буфера. Фракции анализируют на содержание протеина в 96-луночном микротитрационном планшете (Falcon), используя анализ связывания красителя Бредфорда (Bradford). Каждая лунка содержит 120 мкл PBS, 40 мкл концентрата красителя и 40 мкл образца. Поглощение считывают с помощью BioTek Microplate Autoreader на длине волны 540 нм. Фракции 30-38 объединяют и хранят при 4oC.
Фиг. 1 изображает присоединение SPDP к анти-EGFr антителу (A108) за счет ковалентного связывания. A108 модифицируют за счет лизиса и N-терминальной аминокислотной модификации, используя SPDP. Непрореагировавший материал отделяют от высокомолекулярного A108 с помощью гельфильтрации. Профиль элюирования SPDP-модифицированного A108 представлен на фиг. 1. Фиг. 1 демонстрирует, что модифицированное A108 восстанавливается после SPDP конъюгации.
Пример
2
Модификация авидин-белок
10 мг авидина в 2,5 мл дважды дистиллированной воды (ddH2O) разбавляют до содержания 60 мМ TEA/HCl (триэтаноламин, pH 8,0) и 1 мМ ЕДТА за счет
добавления 300 мкл 0,5 мМ TEA/HCl и 28 мкл 0,1 мМ исходного раствора ЕДТА. Конечный объем составляет 2,8 мл. Затем добавляют 17 мкл 2-имино-тиолана (2-УТ) TEA/HCl (pH 8,0) до конечной концентрации 3
мМ. Образец инкубируют в течение 90 мин при 4oC в струе газообразного азота. Избыток непрореагировавшего 2-IT отделяют с помощью гель-фильтрационной хроматографии, используя колонку G25
Sephader (1,5·38 см) (Pharmacia), предварительно уравновешенную 5 мМ бистрис/ацетатным буфером (pH 5,8), содержащим 50 мМ NaHCl и 1 мМ ЕДТА. Содержание белка в элюированных фракциях определяют
в анализе связывания красителя Бредфорда. Поглощение определяют с помощью BioTek Microplate Autoreader при длине волны 540 нм. Собирают фракции (по 1 мл каждая) 27-38 и объединяют. Методом
гель-фитрации выделяют авидин, модифицированный 2-иминотиоланом, как представлено на фиг 2.
Пример 3
Конъюгирование антитела A108 и авидина
Модифицированное антитело
и фракции модифицированного авидина инкубируют при 4oC в потоке газообразного азота в течение 20 ч (15,5 мл полный объем). Добавляют раствор 0,1М иодоацетамида (0,310 мл) до конечной
концентрации 2 мМ для блокирования любых оставшихся сульфгидрильных групп, и инкубирование продолжают в течение 1 ч при комнатной температуре. SPDP-модифицированные A108 и 2-иминотиоланом
модифицированный авидин совместно инкубируют, так что A108 оказывается ковалентно связанным с авидином за счет сульфгидрильной связи, обеспечиваемой за счет SPDP : 2-иминотиоланового химического
взаимодействия.
Иммуноконъюгат, состоящий из A108-авидина (помеченный как конъюгат на фиг. 3), отделяют от непрореагировавшего авидина с помощью гель-фильтрации. Пик белка, элюирующегося с фракциями 7-9, представляет немодифицированное A108, и A108-авидин, который выделяют и подвергают дальнейшей очистке.
Пример 4
Очистка конъюгата
Неконъюгированный авидин удаляют из реакционной смеси с помощью гель-фильтрации на колонке Pharmacia FPLC Superdex S-200 (2,6·60 см), предварительно уравновешенной 20 мМ Tris и 150 мМ NaCl (pH
7,4) (фиг. 3).
Фракции конъюгата антитело-авидин и свободного антитела (6-10) объединяют и диализуют, (Spectra)Par молекулярная пористая мембрана, трубка N 2, MWCO 12000-14000) в течение ночи против PBS при 4oC. Свободное антитело удаляют из смеси, используя сродство конкавалина-A (вектор) и агарозы. Колонка (1,5 · 7 см), предварительно уравновешенная PBS (20 мМ Na-K-фосфат, 150 мМ NaCl, pH 7,0). После введения образца колонку один раз промывают 40 мл PBS, содержащим 1М NaCl (pH 7,0), и конъюгат элюируют PBS, содержащим 200 мМ метил-Д-маннозы (pH 7,0) (фракции 34-38) (по 2 мл каждая). Содержание протеина в элюированных фракциях определяют на спектрофотометре Varian при длине волны 280 нм.
За счет связывания углеводного фрагмента на авидине A108-авидин отделяют от A108 с помощью его удержания на иммобилизованном носителе конкавалина A растительного пектина (ConA), который связывает альфа-метилманнозил (который присутствует на авидине). Свободное антитело не содержит альфа-метилманнозида и промывается из ConA колонки (показан как свободный Ab на фиг. 4). A108-авидин (помеченный как конъюгат) вытесняют из ConA-Sepharose. колонки, используя элюирование альфа-метилманнозидом в растворе. Конъюгат, полученный таким способом, не содержит немодифицированного A108.
За чистотой конъюгата A108-авидин следят с помощью гель-электрофореза в натрийдодецилсульфатном полиакриламидном геле (SDS-PAGE), который разделяет белки по молекулярным размерам. Используют 7,5% акриламидный SDS-PAGE минигель для проверки стадий очистки конъюгации. Как представлено на фиг. 5, белки, представляющие A108, авидин или конъюгаты A108-авидина, разделяют с помощью их окрашивания красителем Кумасси синим в полиакриламидном геле, отсутствие окрашивания определяет фон. Образец, нанесенный на полосу 7 (элюат из ConA колонки), представляет очищенный иммуноконъюгат (A108-авидин), который используют на последующих стадиях.
Способность A108-авидина связывать биотин и интернализоваться в эукариотических клетках, можно продемонстрировать, используя биотинилированный белок, обладающий токсичной активностью только, если он интернализован в клетках (например, белок растительного происхождения, гелонин). Очищенный гелониновый белок химически модифицируют биотином (за счет ковалентного связывания через лизиновые остатки на гелонине с NHS-биотином) и отделяют от несвязанного биотина с помощью гель-фильтрации.
Пример 5
Биотинилирование гелонина
Используют биотин в
форме N-гидроксисукцинимидного сложного эфира с длинными цепями (NHS-LC) биотина (Pierce Chemical Co.). Используют пятикратный молярный избыток биотина по отношению к гелонину (0,1 мг биотина к 1 мг
гелонина). Исходный раствор гелонина представляет 2 мг гелонина в 2 мл 50 мМ бикарбонатного буфера (pH 8,5). 5 мг биотина растворяют в 500 мкл сухого диметилформамида (DMF), и немедленно 20 мкл (0,2
мг) этого раствора биотина добавляют к гелонину в чистую, сухую 13 · 100 мм стеклянную ампулу. Образец инкубируют в течение 2 ч на льду при перемешивании. Спустя 2 ч свободный биотин выделяют с
помощью гель-фильтрационной хроматографии на колонке 1,5 · 37 см G-25, уравновешенной PBS (pH 7,0). Собирают фракции по 1 мл в сборник фракций Гилсона, и анализируют на содержание белка в
анализе связывания красителя Бредфорда. Фракции 21-27 объединяют.
Для демонстрации того, что биотин включен в гелонин, биотинилированный гелонин иммобилизуют на полистирольной подложке с антителом, направленным против гелонинового протеина. Определенные количества немодифицированного гелонина или биотинилированного гелонина инкубируют в ячейках, содержащих антигелониновое антитело. То, что биотин с гелонином удерживается, определяют, промывая ячейки и добавляя стрептавидин, который химически конъюгирован с пероксидазой хрена и который при инкубировании с бесцветным субстратом пероксидазы (ABTS) становится зеленым, и таким образом его можно определить с помощью спектрометра при длине волны 405 нм. Степень поглощения при длине волны 405 нм прямо пропорциональна количеству биотина, включенного в молекулу гелонина. Как видно на фиг. 6, гелонин, подверженный биотимилизации, удерживает биотин, о чем свидетельствует наличие более насыщенного зеленого цвета, при увеличении количества биотинилированного гелонина, вводимого в анализ. Эти результаты показывают, что биотин можно вводить в молекулу гелонина и распознавать с помощью белков, имеющих сродство к биотину.
Пример 6
Активность биотинилированного гелонина
Исходный раствор 0,583 мг/мл мышиных моноклональных антигелониновых антител (10 Кюри) (10 мкл) разбавляют в 12 мл буфера (50
мМ NHCO3) бикарбонат натрия, pH 9,6 (1 мкг/мл раствор). Используя многоканальную пипетку, в каждую ячейку микротитрационной пластины Falcon, с 96-ячейками наносят 50 мкл (50 нг/ячейку).
Образцы закрывают и охлаждают в холодильнике в течение ночи. Примерно спустя 12 ч, образцы трижды промывают PBS-0,05% Твина-20 и фиксируют в течение 1,5 ч при комнатной температуре 5% альбумином
бычьей сыворотки (BSA) в PBS. Затем образцы трижды промывают PBS и 0,05% Твин-20.
Раствор гелонина в PBS готовят в концентрации 2 мг/мл. Затем приготавливают раствор биотинилированного гелонина в PBS также в концентрации 2 мг/мл. На пластину наносят 100 мкл 1 мг/мл раствор BSA в PBS, оставляя первый ряд пустым. В первую половину этого ряда добавляют 200 мкл/ячейку исходного раствора гелонина, а во вторую половину ряда 200 мкл/ячейку биотинилированного исходного раствора. Используя многоканальную пипетку 100 мкл, отбирают из этого первого ряда и смешивают с 100 мкл BSA-PBS во втором ряду. Эту процедуру повторяют слева направо по всей пластине, получая сериальное разбавление белка. Пластину закрывают и инкубируют в течение 1,5 ч при комнатной температуре. Ячейки на пластине трижды промывают PBS-0,05% Твин-20. Затем добавляют 100 мкл авидин-пероксидазы (Boehringer-Mannheim), разбавленной 1: 6000 в 1 мг/мл BSA-PBS. Затем пластины инкубируют в течение 1,5 ч при комнатной температуре, а затем трижды промывают PBS-0,05% Твин-20. И, наконец, добавляют 100 мкл ABTS (2,2'-аминобис(3-этилбензтиазолин-6-сульфоновой кислоты)) перекиси водорода. Пластину считывают на автоматическом BioTek Laboratories Microplate Autoreader на длине волны 405 нм (фиг. 6B).
Пример 7
Конъюгирование биотинилированного гелонина с A108-авидином
Используют 5-молярный избыток биотинилированного гелонина по отношению к A108-авидину. 1 мл (250 мкг) A108-авидина объединяют со 175 мкл (175 мкг) биотинилированного гелонина. Образец инкубируют в
течение 1 ч при комнатной температуре при перемешивании.
Для удаления из смеси неконъюгированного гелонина полученную смесь помещают на гель-фильтрационную колонку Pharmacia FPLC G75 (1,6·60 см), предварительно уравновешенную 20 мМ Tris, содержащим 0,5 М NaCl (pH 7,4). Собирают фракции по 1 мл, и значения получают спектрофотометрическим методом (Varian) при длине волны 280 нм. Пики, соответствующие меченому конъюгату A108-авидин биотинилированный гелонин, представлены на фиг. 8, и они не содержат несвязанного гелонина или свободного авидина.
Конъюгацию A108-авидина с биотинилированным гелонином проверяют, используя тот же ELISA анализ, что и описанный ранее для биотинилированного гелонина. Как видно из фиг. 8, содержание биотина можно определять по образованию зеленой окраски при тестировании в этом анализе либо биотинилированного гелонина, либо конъюгата биотинилированный гелонин/авидин-A108. Так, конъюгат действительно содержит биотинилированный гелонин.
Пример 8
Цитотоксичность A108-авидин/биотинилированный гелонин на клетках A431
Клетки A431 разбавляют 3·104 клеток/мл в
среде для выращивания (MEM - минимальная необходимая среда) с несущественной аминокислотой, 100 мМ глютамина и 50 мкл гентамицина (TriBio Laboratories) с 5% сывороткой плода теленка и 5% сывороткой
теленка. 100 мкл этого раствора добавляют в каждую ячейку 96-луночной микротитрационной пластины (Falcon) и инкубируют в течение ночи при 37oC в 5% CO2 инкубаторе. На следующий
день готовят 2 мкг/мл раствора A108-гелонин конъюгата (прямой конъюгат A108-гелонин, используя SPDP, модифицированный A108 и 2-УТ модифицированный гелонин, ковалентно связывают друг с другом за счет
той же химической связи, которую используют для получения A108-авидина) в среде для роста, стерилизуют на фильтре, используя 0,22-микронный Acrodisc (Gilman) шприцевой фильтр и сериально разбавляют в
10-15 мл центрифужных ампул (Corning). Аналогичным образом получают A108-авидин:биотинилированный гелонин, и 100 мкл каждого из разбавлений наносят (в трех экземплярах) на пластину. Так как уже 100
мкл среды присутствует на пластине, конечная концентрация составляет 1 мкг/мл для каждого конъюгата. Для контроля конъюгаты готовят таким же образом, но в каждый добавляют 100-кратный молярный избыток
(100 мкг/мл) антител A108. Клетки инкубируют 3 дня, а затем окрашивают 0,5% кристаллическим фиолетовым в 20% метаноле и промывают в дистиллированной воде, и добавляют 150 мкл буфера Соренсона для
экстрагирования красителя из клеток. Затем пластины считывают на длине волны 540 нм Microplate Autoreader.
Фиг. 9 представляет способность конъюгата переносить гелонин внутрь клетки, где он может вызвать цитотоксичность. Этот конъюгат инкубируют с клетками, которые экспрессируют EGF рецептор на своей клеточной поверхности (A431).
Интернализация конъюгата обеспечивает внутриклеточный эффект гелонина, то есть наблюдается цитотоксичность. Как видно из фиг. 9, при инкубировании конъюгата с клетками A431, наномолярная концентрация (нМ) (1·10-6 молярной) приводит их к гибели, свидетельствуя о том, что A108-авидин может обеспечить проникновение биотинилированного гелонина в клетки A431 (незаштрихованные кружки). При инкубировании клеток со свободным A108 антителом в большом избытке (если сравнивать с концентрацией иммуноконъюгата), способность A108-авидин: биотинилированный гелонин проникать в клетки A431 уменьшается. Свободный A108 связывает все доступные EGF рецепторы на клеточной поверхности, тем самым ингибируя связывание иммуноконъюгата с EGF рецептором и внедрение гелонина внутрь A431 клеток. Как видно из фиг. 9, при содержании A108 в 100-кратном избытке по сравнению с концентрацией иммуноконъюгата (заштрихованные кружки) клетки A431 способны выживать, что свидетельствует о том, что иммуноконъюгат может проникать в клетки и вызывать интоксикацию только за счет своей способности связываться и интернализоваться с EGF рецептором. Прямой ковалентный конъюгат A108-гелонин также активно убивает А431 клетки путем введения гелонина во внутриклеточное пространство A431 клеток (незаштрихованные треугольники). Включение 100-кратного молярного избытка свободных A108 с этим прямым конъюгатом также защищает клетки от интоксикации гелонином, показывая, что A108-гелонин был введен во внутриклеточное пространство, по его способности взаимодействовать и интернализоваться с EGF рецептором. Таким образом, использование авидин/биотин взаимодействия позволяет вводить молекулу во внутриклеточное пространство клетки, если этот конъюгант направлен и доставлен в это пространство с помощью антитела, способного распознавать антиген на клетке, которое интернализуется после соединения с антигеном (в этом случае EGF рецептором).
Пример 9
Влияние образования тройной спирали
последовательностей нуклеиновых кислот на экспрессию белка EGF рецептора
Показана способность образования триплексов олигонуклеотидов или последовательностей нуклеиновых кислот для подавления
экспрессии белка EGF рецептора в интактных клетках. Клетки A431 инкубируют в течение 72 ч с 40 мкМ последовательности нуклеиновых кислот гена EGF рецептора (N 5 EGFr), способной связываться с
промоторным участком гена EGF рецептора или нонсенс-контрольной последовательностью (которая содержит те же самые нуклеиновые кислоты, но в случайной последовательности).
N 5 EGF и последовательности контрольных нуклеиновых кислот получают в среде, нагревая до 95oC в течение 2-5 мин и стерилизуя на фильтре. Среду для роста удаляют из чашек с культурами клеток, содержащими 2·105 клеток A431. В одну чашку добавляют N 5 EGFr, разбавленный в среде до конечной концентрации 40 мкм. Контрольные последовательности нуклеиновых кислот разбавляют в 2 мл среды до конечной концентрации 40 мкМ, и этот раствор добавляют во вторую чашку с A431 клетками. В третью чашку добавляют только 2 мл среды. Инкубируют 72 ч. Клетки собирают, промывая каждую чашку трижды ледяным PBS. К солюбилизированным клеткам и экстракту белка добавляют 1 мл буфера PIPA, и клетки собирают клеточным скребком и переносят в центрифужную ампулу. Каждую ампулу обрабатывают ультразвуком с помощью клеточного измельчителя Kontes, и центрифугируют в центрифуге Sorval Ultra в течение 1 ч при 4oC со скоростью 100000 х. После центрифугирования удаляют надосадочную жидкость, и содержание белка определяют в анализе на протеин GBCA (Pierce).
EGF рецептор в этих экстрактах иммуноосаждают антителом A108 и нерастворимым антителo-связывающим реагентом пансорбином (pansorbin). Надосадочную жидкость, содержащую 200 мкг белка, инкубируют в течение 2 ч при 4oC с 2,5 мкг антитела A108. К каждому образу добавляют 50 мкл пансорбина и инкубируют в течение 30 мин при 4oC при перемешивании. EGF рецептор, связанный с A108-пансорбином, промывают для удаления других белков. После центрифугирования в течение 1 мин (4oC) на микроцентрифуге Sorvall при скорости 12000 об/мин, надосадочную жидкость декантируют. Осадок промывают, ресуспендируя трижды в PBS, содержащем 0,1% Тритон с последующим центрифугированием и осаждением центрифугированием после каждого ресуспендирования. После окончательной промывки и центрифугирования, надосадочную жидкость сливают.
Количество EGF рецептора, присутствующего в каждом иммуноосадке, определяют, инкубируя его с радиоактивным (32P)-меченым АТФ. Осадок снова суспендируют в 25 мл 0,4 мМ Na-ванадата в мМ Hepes буфера (pH 7,4). Затем добавляют 25 мкл 20 мМ Hepes буфера, содержащего32P-меченый АТФ (10 мкКюри) и 12 мМ MCl2. Образцы инкубируют в течение 5 мин при комнатной температуре. Так как EGF рецептор обладает ферментной активностью, благодаря которой переносит32P из АТФ в сам рецептор EGF. Количеством32P, перенесенного в EGF рецептор, измеряют количество EGF рецептора в иммуноосадке из каждого лизата. Количество радиоактивности на EGF рецепторе можно сравнить, отделив EGF рецептор от свободного32P ATP в DCH-ПААГ и определяя радиоактивность EGF рецептора авторадиографически в полиакриламидном геле, используя коммерческую рентгеновскую пленку.
15 мкл 5х - Лаемли образцового буфера добавляют к образцу, образец нагревают до 95oC в течение 5 мин, а затем помещают в 7,5% полиакриламидный гель. Белки подвергают электрофорезу в течение ночи при 14 мА. Гель удаляют из электрофоретической ячейки и фиксируют в 40% метаноле, 10% уксусной кислоте, 50% ddH2O в течение 1 ч. Гель сушат в сушилке для геля Bio Rad 583 в течение 2 ч при 80oC.
Как видно на фиг. 10, инкубирование клеток с последовательностями нуклеиновых кислот, направленных против промоторной последовательности гена рецептора EGF (помеченной как антисмысловая EGFr), снижает уровень EGF рецептора в A431 клетках в пять раз по сравнению со случайными последовательностями нуклеиновых кислот (помеченными как нонсенс EGFr) или с одним буфером (помечено как контроль). Таким образом, инкубирование клеток с высокими концентрациями последовательностей нуклеиновых кислот, образующих тройные спирали, которые взаимодействуют с промоторным участком гена рецептора EGF, подавляет экспрессию EGF рецептора в интактных A431 клетках.
Пример 10
A108: последовательности нуклеиновых кислот вводят в A431 клетки за счет связи авидин: биотин. Для демонстрации того, что последовательности нуклеиновых кислот
направлены против EGF рецептора, промоторную последовательность гена включают в A431 клетки, используя A108-антитело, A108-авидин химически связанный конъюгат конструируют и очищают.
Последовательности нуклеиновых кислот синтезируют, но с замещением нормального нуклеотида на биотинилированный нуклеотид в одном положении в последовательности (предпочтительно в конце или начале
последовательности). Эти последовательности инкубируют с A108-авидин для обеспечения комплекса, содержащего A108-авидин:биотин-последовательности нуклеиновых кислот. Эти гибридные молекулы очищают для
удаления последовательностей свободных нуклеиновых кислот и определяют количество нуклеиновой кислоты, связанной с A108-авидином, а затем инкубируют с A431 клетками. Если последовательности
нуклеиновых кислот, подавляющие экспрессию гена включены в нужный внутриклеточный участок A431 клеток, это можно определить биохимическими методами. Специфичность последовательностей нуклеиновых
кислот в отношении прерывания экспрессии EGF рецептора определяют, тестируя иммуноконъюгаты, образующиеся между антисмысловыми EGFr или нонсенс EGFr, с A108-авидином, и измеряя фосфорилирование EGF
рецептора, как было указано в примере 9. Кроме того, способность последовательностей нуклеиновых кислот проникать в клетку за счет образования комплексов A108:EGF рецептор тестируют, включая большой
молярный избыток свободного A108 в инкубируемую смесь с A431 клетками. Супрессивные эффекты гибридных молекул, состоящих из антитело: последовательности нуклеиновых кислот, ингибируются в присутствии
свободного A108, и это подтверждает тот факт, что нуклеиновые кислоты попадают в клетку за счет их интернализации с антителами в результате соединения с интернализуемым антигеном клеточной поверхности,
например, EGF рецептором.
Пример 11
Более крупные биотинилированные нуклеиновые кислоты используют для определения их возможности проникать в клетки за счет A108-авидин
механизма. Концентрацию последовательностей нуклеиновых кислот, присутствующих в клетках за счет A108-авидин механизма, которое необходимо для повышения уровней EGF рецепторов, сравнивают с
нормальными последовательностями нуклеиновых кислот в свободном состоянии в растворе. Способность A108-авидина направлять активные последовательности нуклеиновых кислот к специфическим
антиген-экспрессирующим клеткам (например, EGF рецепторам) исследуют, используя клетки, которые не экспрессируют антиген. Исследуют перенос этих нуклеиновых кислот к специфическим клеткам в организме
животных, в которых находятся клетки, которые экспрессируют этот антиген. Определяют супрессию EGF рецепторов. Используют как антисмысловые, так и нонсенсные последовательности нуклеиновых кислот,
закомплексованных с A108-авидином (в дополнение к клеткам, которые не экспрессируют специфический антиген) как меру специфичности такой системы переноса, и ее внутриклеточной биохимической
специфичности.
Пример 12
Моноклональное антитело против карциномы груди, экспрессирующее антиген HER2/Neu (например, TAb-250) химически конъюгируют с авидином по способу
примеров 1-4 для A108 антител. Синтезируют антисмысловые последовательности нуклеиновых кислот против антигена c-myc (5'-AACGTTGAGGGGCAT-3') с биотинилированным аденином инкубируют с Tab-250-авидином
и выделяют комплексы, состоящие из TAb-250: антисмысловой c-myc. Эти комплексы инкубируют с клетками опухоли груди, экспрессирующими HER2/Neu, например, клетками BT-474 или клетками, негативными для
этого антигена, например, клетками BT-20. Супрессию c-myc антисмысловых нуклеиновых кислот определяют с помощью Вестерн-блоттинга для c-myc белка из неочищенного клеточного лизата. C-myc экспрессия
изменяется в HER2/Neu позитивных клетках, но не в антиген-негативных клетках. Кроме того, под специфичностью подразумевается вариант, если большой избыток (100-кратный) немодифицированных TAb-250
способен ингибировать супрессивные эффекты комплексов антитело-нуклеиновая кислота на c-myc в антиген-позитивных клетках. Последовательность биотинилированных нуклеиновых кислот изменяют, заменяя
положение биотинилированного нуклеотида внутри последовательности или увеличивая размер последовательности, комплементарной и простирающейся на сайты начала трансляции или первую границу сплайсинга на
c-myc мРНК. Полученные модификации тестируют для получения наиболее специфичной и чувствительной антисмысловой последовательности, доставляемой к клеткам карциномы груди, экспрессирующие НER2/Neu
антиген, который подавляет c-myc экспрессию.
Пример 13
Моноклональное антитело A108 конъюгируют химически с авидином, как показано в примерах 1-4. Антисмысловые
олигонуклеотиды, представляющие комплементарную последовательность для сайта старта трансляции мРНК фактора роста фибробласта (bFGF) (5'-GGCTGCCATGGTCC-3') химически синтезируют с биотинилированным
гуанозином вместо немодифицированного нуклеотида в 5'-терминальном положении. Эти последовательности инкубируют с A108-авидином для получения комплексов антитело: нуклеиновая кислота и выделяют из
незакомплексованных нуклеиновых кислот. Эти комплексы инкубируют с глиомными клетками человека (SNB-19), которые экспрессируют EGF рецептор, и критически зависят от собственного клеточного синтеза
bFGF для промотирования их собственного роста. После инкубирования с этим конъюгатом, подсчитывая количество SNB клеток, определяют степень подавления роста за счет предотвращения экспрессии bFGF в
этих мишеневых клетках, как уже обсуждалось ранее, избыток A108 совместно инкубируют с комплексами A108:нуклеиновая кислота для того, чтобы обеспечить специфичность и контролировать механизм включения
антисмысловых последовательностей за счет интернализации антигена.
Пример 14
Моноклональное антитело, которое специфически связывается с антигеном Льюис У на нескольких
карциномах человека, химически конъюгируют с авидином, как указано ранее. Химически синтезируют антисмысловые олигонуклеотиды, комплементарные с c-Ha-ras 5' фланкирующей мРНК последовательностью
(5'-CAGCTGCAACCCAGC-3') с биотинилированным цитозиновым нуклеотидом вместо немодифицированного цитозина в 5'-положении. BR96-антисмысловые ras олигонуклеотиды получают в результате инкубирования с
клетками карценомы мочевого пузыря T24, которые экспрессируют антиген Льюиса У и которые также содержат c-Ha-онкоген. После инкубирования комплекса иммун: нуклеиновая кислота с клетками T24, продукт
ras онкогена, p21, проверяют Вестерн-блоттингом. Контролируют рост клеток. Демонстрируют нейтрализацию эффектов ras онкогена за счет внутриклеточного включения антисмысловых молекул в результате
интернализации антигена Льюиса У.
Пример 15
Как указано ранее, химически синтезируют конъюгат A108-авидин и используют его для интернализации синтетических двухцепочечных ДНК
молекул, которые цитотоксичны по отношению к специфическим клеткам карциномы. Химически синтезируют полимер инозин (РУ) (40-мер) и гибридизуют его с полицитозином (PC) (39-мером), у которого концевой
цитозин обработан биотином. Эту двухцепочечную молекулу РНК инкубируют с A208-авидином и A108-авидин: биотин-РС:РУ комплексами, очищают и вносят в среду для роста клеток МЕ-180 цервикальной карциномы,
которая экспрессирует EGF рецептор, и которые цитотоксически чувствительны к РУ:РС (ds РНК). Степень внутриклеточной доставки ds PHK за счет интернализации EGF рецептора определяют с помощью оценки
жизнеспособности клеток после инкубирования с этой конструкцией. Цитотоксичность, вызванная за счет инкубирования с этим конъюгатом, показывает, что нуклеиновые кислоты можно доставлять к
специфическим типам клеток за счет невирусного вектора.
Все патенты и публикации, упомянутые в этом описании, являются показателями известных уровней знаний в областях, к которым относится изобретение. Все патенты и публикации включены сюда для ссылки в такой же степени, как если бы были включены отдельные публикации.
Специалистам должно быть ясно, что настоящее изобретение прекрасно адаптировано для осуществления указанных целей и реализации преимуществ, ему присущих. Представленные примеры наряду со способами, процедурами, обработками, молекулами и конкретными соединениями, раскрытыми здесь, являются примерами предпочтительных вариантов, и никоим образом не ограничивают объем изобретения. Специалистам должны быть очевидны изменения и другие применения, которые охватываются сутью изобретения, как оно определено в объеме представленной формулы изобретения.
Реферат
Настоящее изобретение относится к молекулярной биологии и терапии. Предложен иммуноконъюгат, содержащий связывающийся с биотином элемент, конъюгированный с биотинилированным фрагментом. Кроме того, предложен способ введения генетического материала внутрь специфической клетки, включающий введение человеку иммуноконъюгата, причем указанный невирусный вектор включает связывающийся с клеткой компонент, содержащий связывающийся с биотином элемент, конъюгированный с биотинилированным фрагментом. Далее предложен способ переноса цитотоксического гелонина к клетке, включающий введение человеку иммуноконъюгата. Новая система переноса генетического материала позволяет модифицировать вредные или нежелательные фенотипические характеристики. 3 с. и 8 з.п. ф-лы, 10 ил.


Комментарии