Белки специфического связывания и их применения - RU2673724C2
Код документа: RU2673724C2
Чертежи






























































































































































































































Описание
ДАННЫЕ О РОДСТВЕННЫХ ЗАЯВКАХ
Настоящая международная заявка PCT на патент притязает на приоритет заявки на патент США № 12/388504, поданной 18 февраля 2009 года, описание которой в его полном объеме тем самым включено посредством ссылки. Настоящая международная заявка PCT на патент также включает посредством ссылки описание в его полном объеме каждой из следующих заявок: заявки на патент США № 10/145598, поданной 13 мая 2002 года (ныне патента США № 7589180, выданного 15 сентября 2009 года); предварительной заявки на патент США № 60/290410, поданной 11 мая 2001 года; предварительной заявки на патент США № 60/326019, поданной 28 сентября 2001 года; предварительной заявки на патент США № 60/342258, поданной 21 сентября 2001 года; международной заявки PCT на патент № PCT/US02/15185, поданной 13 мая 2002 года (опубликованной как WO 02/092771 21 ноября 2002 года); международной заявки PCT на патент № PCT/US2008/009771, поданной 14 августа 2008 года (опубликованной как WO 2009/023265 19 февраля 2009 года); и предварительной заявки на патент США № 60/964715, поданной 14 августа 2007 года.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к членам специфического связывания, в частности, антителам и их фрагментам, которые связываются с амплифицированным рецептором эпидермального фактора роста (EGFR) и с EGFR с делецией внутри рамки считывания экзонов 2-7 EGFR, приводящей к усеченному рецептору EGFR, в котором пропущены 267 аминокислот экстраклеточного домена (de2-7 EGFR). В частности, эпитоп, распознаваемый членами специфического связывания, в частности, антителами и их фрагментами, является усиленным или выраженным в результате аберрантной посттрансляционной модификации. Эти члены специфического связывания полезны при диагностировании и лечении рака. Связывающие члены настоящего изобретения могут также использоваться при терапии в комбинации с химиотерапевтическими или противораковыми средствами и/или с другими антителами или их фрагментами.
КРАТКАЯ ИНФОРМАЦИЯ О РОДСТВЕННОЙ ТЕХНОЛОГИИ
Лечение пролиферативного заболевания, в частности рака, химиотерапевтическими средствами часто основывается на использовании различий в пролиферирующих клетках-мишенях и других нормальных клетках в организме человека или животного. Например, разработано множество химических агентов, которые включаются в быстро реплицируемую ДНК, вследствие чего процесс репликации ДНК и деления клеток нарушается. Другим подходом является идентификация антигенов на поверхности опухолевых клеток или других анормальных клетках, которые не экспрессируются при нормальных условиях в сформировавшейся ткани человека, таких как опухолевые антигены или эмбриональные антигены. Такие антигены могут стать мишенями связывающих белков, таких как антитела, которые могут блокировать или нейтрализовать антиген. Кроме того, связывающие белки, в том числе антитела и их фрагменты, могут доставлять токсичное вещество или другое вещество, которое способно непосредственно или опосредованно активировать токсическое вещество в месте опухоли.
EGFR является привлекательной мишенью в случае терапии с использованием направленных на опухоли антител, поскольку он сверхэкспрессирован во многих типах эпителиальных опухолей (Voldborg et al. (1997). Epidermal growth factor receptor (EGFR) and EGFR mutations, function and possible role in clinical trials. Ann Oncol. 8, 1197-1206; den Eynde, B. and Scott, A.M. Tumor Antigens. In: P.J. Delves and I.M. Roitt (eds.), Encyclopedia of Immunology, Second Edition, pp. 2424-2431. London: Academic Press (1998)). Кроме того, экспрессия EGFR соотносима с плохим прогнозом в ряде типов опухолей, в том числе желудка, ободочной кишки, мочевого пузыря, молочной железы, предстательной железы, эндометрия, почки и головного мозга (например, глиомы). Следовательно, в литературе было описано множество антител против EGFR с проводимой индивидуальной клинической оценкой (Baselga et al. (2000) Phase I Studies of Anti-Epidermal Growth Factor Receptor Chimeric Antibody C225 Alone and in Combination With Cisplatin. J. Clin. Oncol. 18, 904; Faillot et al. (1996): A phase I study of an anti-epidermal growth factor receptor monoclonal antibody for the treatment of malignant gliomas. Neurosurgery. 39, 478-483; Seymour, L. (1999) Novel anti-cancer agents in development: exciting prospects and new challenges. Cancer Treat. Rev. 25, 301-312)).
Результаты исследований с использованием мАт против EGFR на пациентах с раком головы и шеи, плоскоклеточным раком легкого, глиомами головного мозга и злокачественными астроцитомами вселили надежды. Противоопухолевая активность большей части антител против EGFR усиливается их способностью блокировать связывание лиганда (Sturgis et al. (1994) Effects of antiepidermal growth factor receptor antibody 528 on the proliferation and differentiation of head and neck cancer. Otolaryngol. Head Neck. Surg. 111, 633-643; Goldstein et al. (1995) Biological efficacy of a chimeric antibody to the epidermal growth factor receptor in a human tumor xenograft model. Clin. Cancer Res. 1, 1311-1318). Эффективность таких антител может достигаться как через модуляцию клеточной пролиферации, так и через антителозависимые иммунные функции (например, активацию комплемента). Однако использование этих антител может быть ограничено абсорбцией в органах, которые имеют высокие эндогенные уровни EGFR, таких как печень и кожа (Baselga et al, 2000; Faillot et al., 1996).
Значительная часть опухолей, имеющих амплификации гена EGFR (т.е. множество копий гена EGFR), также коэкспрессируют усеченный вариант рецептора (Wikstrand et al. (1998) The class III variant of the epidermal growth factor receptor (EGFR): characterization and utilization as an immunotherapeutic target. J. Neurovirol. 4, 148-158), известный как de2-7 EGFR, ΔEGFR или Δ2-7 (термины, используемые здесь взаимозаменяемы) (Olapade-Olaopa et al. (2000) Evidence for the differential expression of a variant EGF receptor protein in human prostate cancer. Br. J. Cancer. 82, 186-194). Реаранжировка, наблюдаемая в de2-7 EGFR, приводит к зрелой мРНК в рамке считывания, в которой отсутствуют 801 нуклеотид, заполняющий экзоны 2-7 (Wong et al. (1992) Structural alterations of the epidermal growth factor receptor gene in human gliomas. Proc. Natl. Acad. Sci. U.S.A. 89, 2965-2969; Yamazaki et al. (1990) A deletion mutation within the ligand binding domain is responsible for activation of epidermal growth factor receptor gene in human brain tumors. Jpn. J. Cancer Res. 81, 773-779; Yamazaki et al. (1988) Amplification of the structurally and functionally altered epidermal growth factor receptor gene (c-erbB) in human brain tumors. Mol. Cell Biol. 8, 1816-1820; Sugawa et al. (1990) Identical splicing of aberrant epidermal growth factor receptor transcripts from amplified rearranged genes in human glioblastomas. Proc. Natl. Acad. Sci. U.S.A. 87, 8602-8606). Соответствующий белок EGFR характеризуется делецией 267 аминокислот, включающей остатки 6-273 экстраклеточного домена, и имеет новый остаток глицина в точке соединения (Sugawa et al., 1990). Эта делеция вместе со вставкой остатка глицина порождает уникальный соединительный пептид на стыке делеции (Sugawa et al., 1990).
de2-7 EGFR был описан в ряде типов опухолей, в том числе глиоме, опухолях молочной железы, легкого, яичника и предстательной железы (Wikstrand et al. (1997) Cell surface localization and density of the tumor-associated variant of the epidermal growth factor receptor, EGFRvIII. Cancer Res. 57, 4130-4140; Olapade-Olaopa et al. (2000) Evidence for the differential expression of a variant EGF receptor protein in human prostate cancer. Br. J. Cancer. 82, 186-194; Wikstrand, et al. (1995) Monoclonal antibodies against EGFRvIII in are tumor specific and react with breast and lung carcinomas and malignant gliomas. Cancer Res. 55, 3140-3148; Garcia de Palazzo et al. (1993) Expression of mutated epidermal growth factor receptor by non-small cell lung carcinomas. Cancer Res. 53, 3217-20). Хотя этот усеченный рецептор не связывает лиганд, он обладает низкой нерегулируемой активностью и дает значительное преимущество роста клеткам глиомы, развиваемым в виде опухолевых ксенотрансплантатов в бестимусных мышах (Nishikawa et al. (1994) A mutant epidermal growth factor receptor common in human glioma confers enhanced tumorigenicity. Proc. Natl. Acad. Sci. U.S.A. 91, 7727-7731), и способен к трансформации клеток NIH3T3 (Batra et al. (1995) Epidermal growth factor ligand independent, unregulated, cell-transforming potential of a naturally occurring human mutant EGFRvIII gene. Cell Growth Differ. 6, 1251-1259) и клеток MCF-7. Клеточные механизмы, используемые de2-7 EGFR в клетках глиомы, не полностью установлены, но, как сообщалось, они включают уменьшение апоптоза (Nagane et al. (1996) A common mutant epidermal growth factor receptor confers enhanced tumorigenicity on human glioblastoma cells by increasing proliferation and reducing apoptosis. Cancer Res. 56, 5079-5086) и небольшое усиление пролиферации (Nagane et al., 1996).
Поскольку экспрессия этого усеченного рецептора ограничена опухолевыми клетками, он представляет в высокой степени специфическую мишень в случае терапии с использованием антител. Соответственно, ряд лабораторий сообщили о создании как поликлональных (Humphrey et al. (1990) Anti-synthetic peptide antibody reacting at the fusion junction of deletion mutant epidermal growth factor receptors in human glioblastoma. Proc. Natl. Acad. Sci. U.S.A. 87, 4207-4211), так и моноклональных (Wikstrand et al. (1995) Monoclonal antibodies against EGFRvIII are tumor specific and react with breast and lung carcinomas and malignant gliomas; Okamoto et al. (1996) Monoclonal antibody against the fusion junction of a deletion-mutant epidermal growth factor receptor. Br. J. Cancer. 73, 1366-1372; Hills et al. (1995) Specific targeting of a mutant, activated EGF receptor found in glioblastoma using a monoclonal antibody. Int. J. Cancer. 63, 537-543) антител, специфичных в отношении уникального пептида de2-7 EGFR. Все из ряда мышиных мАт, выделенных после иммунизации уникальным пептидом de2-7, продемонстрировали селективность и специфичность в отношении усеченного рецептора и целевых, положительных по de2-7 EGFR ксенотрансплантатов, развиваемых в бестимусных мышах (Wikstrand et al. (1995); Reist et al. (1997) Improved targeting of an anti-epidermal growth factor receptor variant III monoclonal antibody in tumor xenografts after labeling using N-succinimidyl 5-iodo-3-pyridinecarboxylate. Cancer Res. 57, 1510-1515; Reist et al. (1995) Tumor-specific anti-epidermal growth factor receptor variant III monoclonal antibodies: use of the tyramine-cellobiose radioiodination method enhances cellular retention and uptake in tumor xenografts. Cancer Res. 55, 4375-4382).
Однако одним потенциальным недостатком антител против de2-7 EGFR является то, что лишь часть опухолей, демонстрирующих амплификации гена EGFR, также экспрессирует de2-7EGFR (Ekstrand et al. (1992) Amplified and rearranged epidermal growth factor receptor genes in human glioblastomas reveal deletions of sequences encoding portions of the N- and/or C-terminal tails. Proc. Natl. Acad. Sci. U.S.A. 89, 4309-4313). Точный процент опухолей, содержащих de2-7 EGFR, не полностью установлен, поскольку использование различных методов (т.е. ПЦР в сравнении с иммуногистохимическим анализом) и различных антител породило широкий ряд значений, определенных для частоты его присутствия. Опубликованные данные указывают на то, что приблизительно 25-30% глиом экспрессируют de2-7 EGFR, при этом экспрессия является самой низкой в анапластических астроцитомах и самой высокой в мультиформной глиобластоме (Wong et al. (1992); Wikstrand et al. (1998) The class III variant of the epidermal growth factor receptor (EGFR): characterization and utilization as an immunotherapeutic target. J. Neurovirol. 4, 148-158; Moscatello et al. (1995) Frequent expression of a mutant epidermal growth factor receptor in multiple human tumors. Cancer Res. 55, 5536-5539). Сообщалось, что доля положительных клеток в экспрессирующих de2-7 EGFR глиомах колеблется от 37 до 86% (Wikstrand et al. (1997)). Установлено, что 27% раков молочной железы и 17% раков легкого являются положительными по de2-7 EGFR (Wikstrand et al. (1997); Wikstrand et al. (1995); Wikstrand et al. (1998); и Hills et al., 1995). Таким образом, можно было бы ожидать, что специфичные в отношении de2-7 EGFR антитела будут полезны лишь в части положительных по EGFR опухолей.
Таким образом, несмотря на то, что существующие данные об активности антител против EGFR вселяют надежду, остаются замеченные ограничения в отношении области применимости и эффективности, отраженные выше. Соответственно, была бы желательной разработка антител и подобных агентов, которые демонстрируют эффективность в отношении широкого диапазона опухолей, и именно на достижение этой цели направлено настоящее изобретение.
Приведение здесь ссылок не должно рассматривается как признание того, что они являются уровнем техники для настоящего изобретения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящим изобретением предоставляются выделенные члены специфического связывания, в частности, антитела или их фрагменты, которые распознают эпитоп EGFR, в котором не обнаружены какие-либо изменения или замены в аминокислотной последовательности по сравнению с таковой EGFR дикого типа, и который обнаруживается в образующих опухоль, гиперпролиферативных или анормальных клетках и обычно не является обнаруживаемым в нормальных клетках или клетках дикого типа. (Используемый здесь термин ʺклетка дикого типаʺ предполагает клетку, которая экспрессирует эндогенный EGFR, но не de2-7EGFR, и термин исключает, в частности, клетку, которая сверхэкспрессирует ген EGFR; термин ʺдикий типʺ относится к генотипу или фенотипу или другой характеристике, который имеется в нормальной клетке, а не в анормальной или образующей опухоль клетке). В дальнейшем аспекте настоящим изобретением предоставляются члены специфического связывания, в частности, антитела или их фрагменты, которые распознают эпитоп EGFR, который обнаруживается в образующих опухоль, гиперпролиферативных или анормальных клетках и обычно не является обнаруживаемым в нормальных клетках или клетках дикого типа, причем этот эпитоп является усиленным или выраженным в результате аберрантной посттрансляционной модификации или аберрантной экспрессии. В конкретном не ограничивающем примере, предоставленном здесь, эпитоп EGFR является усиленным или выраженным там, где посттрансляционная модификация не является полной или полной в той степени, которая наблюдается при нормальной экспрессии EGFR в клетках дикого типа. В одном аспекте эпитоп EGFR является усиленным или выраженным в результате начальной модификации или модификации в результате присоединения простых углеводов, или раннего гликозилирования, в частности модификации в результате присоединения большого числа остатков маннозы, и является ослабленным или не выраженным в присутствии модификации в результате присоединения сложных углеводов.
Члены специфического связывания, которые могут быть антителами или их фрагментами, такими как их иммуногенные фрагменты, по существу не связываются с нормальными клетками или клетками дикого типа, содержащими нормальный эпитоп EGFR или эпитоп EGFR дикого типа, или не распознают их в отсутствие аберрантной экспрессии и в присутствии нормальной посттрансляционной модификации EGFR.
Конкретнее, члены специфического связывания настоящего изобретения могут быть антителами или их фрагментами, распознающими эпитоп EGFR, который присутствует в клетках, сверхэкспрессирующих EGFR (например, ген EGFR амплифицирован) или экспрессирующих de2-7 EGFR, особенно в присутствии аберрантной посттрансляционной модификации, и который является обычно не обнаруживаемым в клетках, экспрессирующих EGFR в нормальных состояниях, особенно в присутствии нормальной посттрансляционной модификации.
Авторы настоящего изобретения обнаружили новые моноклональные антитела, примерами которых здесь являются антитела, обозначенные как мАт806, ch806, hu806, мАт175, мАт124 и мАт1133, которые специфически распознают аберрантно экспрессированный EGFR. В частности, антитела настоящего изобретения распознают эпитоп EGFR, который обнаруживается в образующих опухоль, гиперпролиферативных или анормальных клетках и обычно не является обнаруживаемым в нормальных клетках или клетках дикого типа, причем этот эпитоп является усиленным или выраженным в результате аберрантной посттрансляционной модификации. Новые антитела настоящего изобретения также распознают амплифицированные EGFR дикого типа и de2-7 EGFR, хотя связываются с эпитопом, отличным от уникального соединительного пептида мутированного de2-7 EGFR. Антитела настоящего изобретения специфически распознают абберантно экспрессированный EGFR, в том числе амплифицированные EGFR и мутантный EGFR (примером которого здесь является мутация de2-7), в частности, в результате аберрантной посттрансляционной модификации. Кроме того, несмотря на то, что эти антитела не распознают EGFR при его представлении на клеточной поверхности линии глиомных клеток, экспрессирующих нормальные количества EGFR, они действительно связываются с экстраклеточным доменом EGFR (sEGFR), иммобилизованным на поверхности планшетов для ELISA, что указывает на распознавание конформационного эпитопа. Эти антитела связываются с поверхностью клеток A431, которые имеют амплификацию гена EGFR, но не экспрессируют de2-7 EGFR. Важно, что эти антитела не связываются в значительной степени с нормальными тканями, такими как печень и кожа, которые экспрессируют эндогенный EGFR дикого типа (wt) на уровнях, которые превышают таковые в большей части других нормальных тканей, но в которых EGFR не является аберрантно экспрессированным или амплифицированным.
Антитела настоящего изобретения могут специфическим образом опередить природу положительных по EGFR опухолей или образующих опухоль клеток, посредством окрашивания или иного распознавания этих опухолей или клеток, в которых имеется аберрантная экспрессия EGFR, в том числе амплификация EGFR и/или мутация EGFR, в частности de2-7EGFR. Кроме того, антитела настоящего изобретения демонстрируют значительную in vivo противоопухолевую активность против опухолей, содержащих амплифицированный EGFR, и против положительных по de2-7 EGFR ксенотрансплантатов.
Уникальная специфичность связывания этих антител с de2-7 EGFR и амплифицированным EGFR, но не с нормальным EGFR дикого типа, обеспечивает диагностические и терапевтические применения для идентификации, определения характеристик и воздействия на ряд типов опухолей, например, опухоли головы и шеи, молочной железы или предстательной железы и глиомы, без проблем, связанных с абсорбцией нормальными тканями, которую можно наблюдать при использовании ранее известных антител против EGFR.
Соответственно, настоящим изобретением предоставляются белки специфического связывания, такие как антитела, которые связываются с de2-7 EGFR в эпитопе, который отличен от соединительного пептида, но которые по существу не связываются с EGFR на поверхности нормальных клеток в отсутствие амплификации гена EGFR. Термин ʺамплификацияʺ, как подразумевается, заключает в себе то, что клетка имеет множество копий гена EGFR.
Предпочтительно эпитоп, распознаваемый антителами настоящего изобретения, располагается в области, включающей остатки 273-501 последовательности зрелого нормального EGFR или EGFR дикого типа, и предпочтительно включает остатки 287-302 (SEQ ID NO: 14) последовательности зрелого нормального EGFR или EGFR дикого типа. Следовательно, также предоставляются белки специфического связывания, такие как антитела, которые связываются с de2-7 EGFR в эпитопе, который располагается в области, включающей остатки 273-501 и/или 287-302 (SEQ ID NO: 14) последовательности EGFR. Эпитоп можно определить с помощью любых общепринятых методов картирования эпитопов, известных квалифицированному в данной области техники специалисту. Альтернативно, можно было бы расщепить последовательность ДНК, кодирующую остатки 273-501 и/или 287-302 (SEQ ID NO: 14), и результирующие фрагменты экспрессировать в подходящем хозяине. Связывание антител можно было бы определить, как указано выше.
В предпочтительном аспекте антителами являются антитела, которые имеют характеристики антител, которые были идентифицированы и охарактеризованы авторами настоящего изобретения, в частности, распознающие аберрантно экспрессированный EGFR, как установлено в случае амплифицированных EGFR и de2-7EGFR.
В другом аспекте настоящим изобретением предоставляются антитела, способные конкурировать с антителами настоящего изобретения в условиях, в которых связывание по меньшей мере 10% антитела, имеющего последовательности VH и VL антител настоящего изобретения, с de2-7EGFR блокировано в результате конкуренции с таким антителом в анализе ELISA. Предусматриваются, в частности, антиидиотипические антитела, и их примеры приводятся здесь. Здесь предоставляются антиидиотипические антитела LMH-11, LMH-12 и LMH-13.
Связывание антитела со своей мишенью-антигеном опосредуется через определяющие комплементарность участки (CDR) его тяжелой и легкой цепей, при этом CDR3 играет особенно важную роль. Соответственно, члены специфического связывания на основе участков CDR3 тяжелой или легкой цепи, а предпочтительно обеих цепей, антител настоящего изобретения будут полезными членами специфического связывания для in vivo терапии.
Соответственно, члены специфического связывания, такие как антитела, которые основаны на CDR идентифицированных антител настоящего изобретения, особенно участках CDR3, будут применимы для воздействия на опухоли с амплифицированным EGFR независимо от их de2-7 EGFR-статуса. Поскольку антитела настоящего изобретения не связываются в значительной степени с нормальным рецептором дикого типа, не будет значительной абсорбции нормальной тканью, ограничения антител против EGFR, которые разработаны в настоящее время.
В другом аспекте предоставляется способное к связыванию с EGFR на поверхности клеток опухолей, имеющих амплификации гена EGFR, при этом клетки опухолей имеют множество копий гена EGFR, и на поверхности клеток опухолей, экспрессирующих усеченный вариант рецептора de2-7 EGFR, выделенное антитело, которое не связывается с соединительным пептидом de2-7 EGFR, состоящим из аминокислотной последовательности SEQ ID NO: 13, которое связывается с эпитопом внутри последовательности из остатков 287-302 (SEQ ID NO: 14) EGFR дикого типа человека, и которое не включает последовательность вариабельной области тяжелой цепи, соответствующую аминокислотной последовательности, представленной в SEQ ID NO: 2, и не включает последовательность вариабельной области легкой цепи, соответствующую аминокислотной последовательности, представленной в SEQ ID NO: 4.
В другом аспекте предоставляется выделенное антитело, которое включает тяжелую цепь и легкую цепь, при этом тяжелая цепь имеет аминокислотную последовательность, представленную в SEQ ID NO: 42, а легкая цепь имеет аминокислотную последовательность, представленную в SEQ ID NO: 47.
В другом аспекте предоставляется выделенное антитело, которое включает тяжелую цепь и легкую цепь, при этом тяжелая цепь имеет аминокислотную последовательность, представленную в SEQ ID NO: 129, а легкая цепь имеет аминокислотную последовательность, представленную в SEQ ID NO: 134.
В другом аспекте предоставляется выделенное антитело, которое включает тяжелую цепь и легкую цепь, при этом тяжелая цепь имеет аминокислотную последовательность, представленную в SEQ ID NO: 22, а легкая цепь имеет аминокислотную последовательность, представленную в SEQ ID NO: 27.
В другом аспекте предоставляется выделенное антитело, которое включает тяжелую цепь и легкую цепь, при этом тяжелая цепь имеет аминокислотную последовательность, представленную в SEQ ID NO: 32, а легкая цепь имеет аминокислотную последовательность, представленную в SEQ ID NO: 37.
В другом аспекте предоставляется выделенное антитело, которое включает легкую цепь и тяжелую цепь, где вариабельная область тяжелой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 44, 45 и 46.
В другом аспекте предоставляется выделенное антитело, которое включает тяжелую цепь и легкую цепь, где вариабельная область легкой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 49, 50 и 51.
В другом аспекте предоставляется выделенное антитело, которое включает тяжелую цепь и легкую цепь, где вариабельная область тяжелой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 130, 131 и 132.
В другом аспекте предоставляется выделенное антитело, которое включает тяжелую цепь и легкую цепь, где вариабельная область легкой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 135, 136 и 137.
В другом аспекте предоставляется выделенное антитело, которое включает тяжелую цепь и легкую цепь, где вариабельная область тяжелой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 23, 24 и 25.
В другом аспекте предоставляется выделенное антитело, которое включает тяжелую цепь и легкую цепь, где вариабельная область легкой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 28, 29 и 30.
В другом аспекте предоставляется выделенное антитело, которое включает тяжелую цепь и легкую цепь, где вариабельная область тяжелой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 33, 34 и 35.
В другом аспекте предоставляется выделенное антитело, которое включает тяжелую цепь и легкую цепь, где вариабельная область легкой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 38, 39 и 40.
В другом аспекте предоставляется выделенное антитело, которое является формой антитела F(ab')2, scFv-фрагментом, диателом, триателом или тетрателом.
В другом аспекте предоставляется выделенное антитело, дополнительно включающее обнаруживаемую или функциональную метку.
В другом аспекте обнаруживаемой или функциональной меткой является ковалентно присоединенное лекарственное средство.
В другом аспекте меткой является радиоактивная метка.
В другом аспекте предоставляется выделенное антитело, которое является ПЭГилированным.
В другом аспекте предоставляется выделенная нуклеиновая кислота, которая включает последовательность, кодирующую выделенное антитело, описанное здесь.
В другом аспекте предоставляется способ приготовления выделенного антитела, включающий экспрессию нуклеиновой кислоты, описанной выше и здесь, в условиях, которые приводят к экспрессии антитела, и извлечение антитела.
В другом аспекте предоставляется способ лечения опухоли у являющегося человеком пациента, который включает введение пациенту эффективного количества выделенного антитела, описанного здесь.
В другом аспекте предоставляется набор для диагностирования опухоли, в которой EGFR аберрантно экспрессирован или в которой EGFR экспрессирован в форме усеченного белка, включающий выделенное антитело, описанное здесь.
В другом аспекте набор, кроме того, включает реагенты и/или инструкции в отношении использования.
В другом аспекте предоставляется фармацевтическая композиция, включающая выделенное антитело, описанное здесь.
В другом аспекте фармацевтическая композиция, кроме того, включает, фармацевтически приемлемый наполнитель, носитель или разбавитель.
В другом аспекте фармацевтическая композиция, кроме того, включает противоопухолевое средство, выбираемое из группы, состоящей из химиотерапевтических средств, антител против EGFR, радиоиммунотерапевтических средств и их комбинаций.
В другом аспекте химиотерапевтические средства выбирают из группы, состоящей из ингибиторов тирозинкиназы, ингибиторов каскада реакций фосфорилирования, модуляторов посттрансляционной модификации, ингибиторов роста или деления клеток (например, антимитотических средств), ингибиторов передачи сигналов и их комбинаций.
В другом аспекте ингибиторы тирозинкиназы выбирают из группы, состоящей из AG1478, ZD1839, STI571, OSI-774, SU-6668 и их комбинаций.
В другом аспекте антитела против EGFR выбирают из группы, состоящей из антител против EGFR 528, 225, SC-03, DR8.3, L8A4, Y10, ICR62, ABX-EGF и их комбинаций.
В другом аспекте предоставляется способ предотвращения и/или лечения рака у млекопитающих, включающий введение млекопитающему терапевтически эффективного количества фармацевтической композиции, описанной здесь.
В другом аспекте предоставляется способ лечения присущих головному мозгу раков, которые продуцируют аберрантно экспрессированный EGFR, у млекопитающих, включающий введение млекопитающему терапевтически эффективного количества фармацевтической композиции, описанной здесь.
В другом аспекте присущий головному мозгу рак выбирают из группы, состоящей из глиобластом, медуллобластом, менингиом, неопластических астроцитом и неопластических артериовенозных мальформаций.
В другом аспекте предоставляется одноклеточный хозяин, трансформированный рекомбинантной молекулой ДНК, которая кодирует выделенное антитело, описанное здесь.
В другом аспекте одноклеточный хозяин выбирают из группы, состоящей из E. coli, Pseudomonas, Bacillus, Streptomyces, дрожжей, клеток CHO, YB/20, NSO, SP2/0, Rl.1, B-W, L-M, COS 1, COS 7, BSC1, BSC40 и BMT10, клеток растений, клеток насекомых и клеток человека в культуре ткани.
В другом аспекте предоставляется способ обнаружения присутствия амплифицированного EGFR, de2-7EGFR или EGFR, гликозированного в результате присоединения большого числа остатков маннозы, в котором EGFR измеряют посредством (a) приведения биологического образца от млекопитающего, в котором предполагается присутствие амплифицированного EGFR, de2-7EGFR или EGFR, гликозированного в результате присоединения большого числа остатков маннозы, в контакт с выделенным антителом по пункту 1 в условиях, допускающих возникновение связывания EGFR с выделенным антителом; и (b) обнаружения, произошло ли связывание между EGFR из образца и выделенным антителом; причем обнаружение связывания служит признаком присутствия или активности EGFR в образце.
В другом аспекте способа обнаружения присутствия амплифицированного EGFR, de2-7EGFR или EGFR, гликозированного в результате присоединения большого числа остатков маннозы, обнаружение присутствия EGFR служит признаком наличия опухоли или рака у млекопитающего.
В другом аспекте предоставляется способное к связыванию с EGFR на поверхности клеток опухолей, имеющих амплификации гена EGFR, при этом клетки опухолей имеют множество копий гена EGFR, и на поверхности клеток опухолей, экспрессирующих усеченный вариант рецептора de2-7 EGFR, выделенное антитело, которое включает тяжелую цепь и легкую цепь, при этом тяжелая цепь имеет аминокислотную последовательность, которая в значительной степени гомологична аминокислотной последовательности, представленной в SEQ ID NO: 42, а легкая цепь имеет аминокислотную последовательность, которая в значительной степени гомологична аминокислотной последовательности, представленной в SEQ ID NO: 47.
В другом аспекте тяжелая цепь антитела включает аминокислотную последовательность, представленную в SEQ ID NO: 42, а легкая цепь антитела включает аминокислотную последовательность, представленную в SEQ ID NO: 47.
В другом аспекте предоставляется способное к связыванию с EGFR на поверхности клеток опухолей, имеющих амплификации гена EGFR, при этом клетки опухолей имеют множество копий гена EGFR, и на поверхности клеток опухолей, экспрессирующих усеченный вариант рецептора de2-7 EGFR, выделенное антитело, которое включает тяжелую цепь и легкую цепь, причем вариабельная область тяжелой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 44, 45 и 46, а вариабельная область легкой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 49, 50 и 51.
В другом аспекте предоставляется способное к связыванию с EGFR на поверхности опухолей, имеющих амплификации гена EGFR, при этом клетки опухолей имеют множество копий гена EGFR, и на поверхности опухолей, экспрессирующих усеченный вариант рецептора de2-7 EGFR, выделенное антитело, которое включает тяжелую цепь и легкую цепь, при этом тяжелая цепь имеет аминокислотную последовательность, которая в значительной степени гомологична аминокислотной последовательности, представленной в SEQ ID NO: 129, а легкая цепь имеет аминокислотную последовательность, которая в значительной степени гомологична аминокислотной последовательности, представленной в SEQ ID NO: 134.
В другом аспекте тяжелая цепь антитела включает аминокислотную последовательность, представленную в SEQ ID NO: 129, а легкая цепь антитела включает аминокислотную последовательность, представленную в SEQ ID NO: 134.
В другом аспекте предоставляется способное к связыванию с EGFR на поверхности опухолей, имеющих амплификации гена EGFR, при этом клетки опухолей имеют множество копий гена EGFR, и на поверхности опухолей, экспрессирующих усеченный вариант рецептора de2-7 EGFR, выделенное антитело, которое включает тяжелую цепь и легкую цепь, причем вариабельная область тяжелой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 130, 131 и 132, а вариабельная область легкой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 135, 136 и 137.
В другом аспекте предоставляется способное к связыванию с EGFR на поверхности опухолей, имеющих амплификации гена EGFR, при этом клетки опухолей имеют множество копий гена EGFR, и на поверхности опухолей, экспрессирующих усеченный вариант рецептора de2-7 EGFR, выделенное антитело, которое включает тяжелую цепь и легкую цепь, при этом тяжелая цепь имеет аминокислотную последовательность, которая в значительной степени гомологична аминокислотной последовательности, представленной в SEQ ID NO: 22, а легкая цепь имеет аминокислотную последовательность, которая в значительной степени гомологична аминокислотной последовательности, представленной в SEQ ID NO: 27.
В другом аспекте тяжелая цепь антитела включает аминокислотную последовательность, представленную в SEQ ID NO: 22, а легкая цепь антитела включает аминокислотную последовательность, представленную в SEQ ID NO: 27.
В другом аспекте предоставляется способное к связыванию с EGFR на поверхности опухолей, имеющих амплификации гена EGFR, при этом клетки опухолей имеют множество копий гена EGFR, и на поверхности опухолей, экспрессирующих усеченный вариант рецептора de2-7 EGFR, выделенное антитело, которое включает тяжелую цепь и легкую цепь, причем вариабельная область тяжелой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 23, 24 и 25, а вариабельная область легкой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 28, 29 и 30.
В другом аспекте предоставляется способное к связыванию с EGFR на поверхности опухолей, имеющих амплификации гена EGFR, при этом клетки опухолей имеют множество копий гена EGFR, и на поверхности опухолей, экспрессирующих усеченный вариант рецептора de2-7 EGFR, выделенное антитело, которое включает тяжелую цепь и легкую цепь, при этом тяжелая цепь имеет аминокислотную последовательность, которая в значительной степени гомологична аминокислотной последовательности, представленной в SEQ ID NO: 32, а легкая цепь имеет аминокислотную последовательность, которая в значительной степени гомологична аминокислотной последовательности, представленной в SEQ ID NO: 37.
В другом аспекте тяжелая цепь антитела включает аминокислотную последовательность, представленную в SEQ ID NO: 32, а легкая цепь антитела включает аминокислотную последовательность, представленную в SEQ ID NO: 37.
В другом аспекте предоставляется способное к связыванию с EGFR на поверхности опухолей, имеющих амплификации гена EGFR, при этом клетки опухолей имеют множество копий гена EGFR, и на поверхности опухолей, экспрессирующих усеченный вариант рецептора de2-7 EGFR, выделенное антитело, которое включает тяжелую цепь и легкую цепь, причем вариабельная область тяжелой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 33, 34 и 35, а вариабельная область легкой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 38, 39 и 40.
В другом аспекте предоставляется способное к связыванию с EGFR на поверхности опухолей, имеющих амплификации гена EGFR, при этом клетки опухолей имеют множество копий гена EGFR, и на поверхности опухолей, экспрессирующих усеченный вариант рецептора de2-7 EGFR, выделенное антитело, которое не связывается с соединительным пептидом de2-7 EGFR, состоящим из аминокислотной последовательности SEQ ID NO: 13, которое связывается с эпитопом внутри последовательности из остатков 287-302 EGFR человека дикого типа,
при этом антитело включает тяжелую цепь и легкую цепь, причем вариабельная область легкой цепи включает первый участок связывающего полипептид домена, имеющий аминокислотную последовательность, соответствующую аминокислотной последовательности, представленной формулой I:
HSSQDIXaa1SNIG (I),
где Xaa1 является остатком аминокислоты, имеющей незаряженную полярную группу R (SEQ ID NO: 151);
второй участок связывающего полипептид домена, имеющий аминокислотную последовательность, соответствующую аминокислотной последовательности, представленной формулой II:
HGTNLXaa2D (II),
где Xaa2 является остатком аминокислоты, имеющей заряженную полярную группу R (SEQ ID NO: 152);
и третий участок связывающего полипептид домена, имеющий аминокислотную последовательность, соответствующую аминокислотной последовательности, представленной формулой III:
VQYXaa3QFPWT (III),
где Xaa3 выбирают из группы, состоящей из A, G и аминокислотного остатка, являющегося консервативной заменой A или G (SEQ ID NO: 153); а
вариабельная область тяжелой цепи включает первый участок связывающего полипептид домена, имеющий аминокислотную последовательность, соответствующую аминокислотной последовательности, представленной формулой IV:
SDXaa4AWN (IV),
где Xaa4 выбирают из группы, состоящей из F, Y и аминокислотного остатка, являющегося консервативной заменой F или Y (SEQ ID NO: 154);
второй участок связывающего полипептид домена, имеющий аминокислотную последовательность, соответствующую аминокислотной последовательности, представленной формулой V, формулой VI или формулой VII:
YISYSGNTRYXaa5PSLKS (V),
где Xaa5 является остатком аминокислоты, имеющей незаряженную полярную группу R (SEQ ID NO:155),
YISYSXaa6NTRYNPSLKS (VI),
где Xaa6 выбирают из группы, состоящей из G, A и аминокислотного остатка, являющегося консервативной заменой G или A (SEQ ID NO: 156),
YISYSGNTRYNPSLXaa7S (VII),
где Xaa7 является остатком основной аминокислоты (SEQ ID NO: 157); и
третий участок связывающего полипептид домена, имеющий аминокислотную последовательность, соответствующую аминокислотной последовательности, представленной формулой VIII:
Xaa8TAGRGFPY (VIII),
где Xaa8 выбирают из группы, состоящей из V, A и аминокислотного остатка, являющегося консервативной заменой V или A (SEQ ID NO: 158),
и причем антитело не включает последовательность вариабельной области тяжелой цепи, соответствующую аминокислотной последовательности, представленной в SEQ ID NO: 2, и не включает последовательность вариабельной области легкой цепи, соответствующую аминокислотной последовательности, представленной в SEQ ID NO: 4.
В другом аспекте Xaa1 является N; Xaa2 является D; Xaa3 является A; Xaa4 является F; Xaa5 является остатком аминокислоты, имеющей незаряженную полярную группу R; Xaa6 является G; Xaa7 является K; и Xaa8 является V.
В другом аспекте Xaa5 является N или Q.
В другом аспекте Xaa1 является N или S.
В другом аспекте Xaa2 является D или E.
В другом аспекте Xaa3 является A или G.
В другом аспекте Xaa4 является F или Y.
В другом аспекте Xaa5 является N или Q.
В другом аспекте Xaa6 является G или A, а Xaa7 независимо представляет собой K или R.
В другом аспекте Xaa8 является V или A.
В другом аспекте предоставляется способное к связыванию с EGFR на поверхности опухолей, имеющих амплификации гена EGFR, при этом клетки опухолей имеют множество копий гена EGFR, и на поверхности опухолей, экспрессирующих усеченный вариант рецептора de2-7 EGFR, выделенное антитело, которое не связывается с соединительным пептидом de2-7 EGFR, состоящим из аминокислотной последовательности SEQ ID NO: 13, которое связывается с эпитопом внутри последовательности из остатков 273-501 EGFR человека дикого типа,
при этом антитело включает тяжелую цепь и легкую цепь, причем вариабельная область легкой цепи включает первый участок связывающего полипептид домена, имеющий аминокислотную последовательность HSSQDINSNIG (SEQ ID NO: 18); второй участок связывающего полипептид домена, имеющий аминокислотную последовательность HGTNLDD (SEQ ID NO: 19); и третий участок связывающего полипептид домена, имеющий аминокислотную последовательность VQYAQFPWT (SEQ ID NO:20), а
вариабельная область тяжелой цепи включает первый участок связывающего полипептид домена, имеющий аминокислотную последовательность SDFAWN (SEQ ID NO: 15); второй участок связывающего полипептид домена, имеющий аминокислотную последовательность, соответствующую аминокислотной последовательности, представленной формулой IX:
YISYSGNTRYXaa9PSLKS (IX),
где Xaa9 является остатком аминокислоты, имеющей незаряженную полярную группу R (SEQ ID NO: 159); и
третий участок связывающего полипептид домена, имеющий аминокислотную последовательность VTAGRGFPY (SEQ ID NO: 17).
В другом аспекте антитело связывается с эпитопом внутри последовательности из остатков 287-302 (SEQ ID NO: 14) EGFR человека дикого типа.
В другом аспекте Xaa9 является N или Q.
В другом аспекте участки связывающего домена поддерживаются каркасом антитела человека.
В другом аспекте каркасом антитела человека является каркас антитела человека IgG1.
В другом аспекте предоставляется способное к связыванию с EGFR на поверхности опухолей, имеющих амплификации гена EGFR, при этом клетки опухолей имеют множество копий гена EGFR, и на поверхности опухолей, экспрессирующих усеченный вариант рецептора de2-7 EGFR, выделенное антитело, которое включает тяжелую цепь и легкую цепь, при этом тяжелая цепь имеет аминокислотную последовательность, которая в значительной степени гомологична аминокислотной последовательности, представленной в SEQ ID NO: 2, а легкая цепь имеет аминокислотную последовательность, которая в значительной степени гомологична аминокислотной последовательности, представленной в SEQ ID NO: 4.
В другом аспекте тяжелая цепь антитела включает аминокислотную последовательность, представленную в SEQ ID NO: 2, а легкая цепь антитела включает аминокислотную последовательность, представленную в SEQ ID NO: 4.
В другом аспекте предоставляется способное к связыванию с EGFR на поверхности опухолей, имеющих амплификации гена EGFR, при этом клетки опухолей имеют множество копий гена EGFR, и на поверхности опухолей, экспрессирующих усеченный вариант рецептора de2-7 EGFR, выделенное антитело, которое включает тяжелую цепь и легкую цепь, причем вариабельная область тяжелой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 15, 16 и 17, а вариабельная область легкой цепи включает участки связывающего полипептид домена, имеющие аминокислотные последовательности, в высокой степени гомологичные аминокислотным последовательностям, представленным в SEQ ID NO: 18, 19 и 20.
Другие объекты и преимущества станут очевидными квалифицированным в данной области техники специалистам в результате рассмотрения следующего подробного описания изобретения, которое осуществляется со ссылкой на следующие иллюстративные фигуры, и сопровождающей формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг. 1 представлены результаты проточно-цитометрического анализа линий глиомных клеток. Клетки U87MG (светло-серые гистограммы) и U87MG.Δ2-7 (темно-серые гистограммы) окрашивали нерелевантным антителом IgG2b (не закрашенные гистограммы) и тем или другим антителом, выбираемым из DH8.3 (специфического для de2-7 EGFR), мАт806 или 528 (связывается как с EGFR дикого типа, так и с de2-7 EGFR), как указано.
На фиг. 2A-D представлены результаты ELISA мАт806, мАтDH8.3 и мАт528. (A) Связывание увеличивающихся концентраций мАт806 (▲), антитела DH8.3 (●) или 528 (■) с покрытыми sEGFR планшетами для ELISA. (B) Ингибирование связывания мАт806 и мАт528 с покрытыми sEGFR планшетами для ELISA при увеличении концентраций растворимого EGFR (sEGFR) в растворе. (C) Связывание увеличивающихся концентраций DH8.3 с соединительным пептидом de2-7. (D) Иллюстрируются кривые связывания мАт806 и мАт528 с иммобилизованным sEGFR дикого типа.
На фиг. 2E и 2F графически представлены результаты исследований связывания BIAcore, в которых используется С-концевой биотинилированный пептид и в которые включено моноклональное антитело настоящего изобретения, наряду с другими известными антителами, среди них антитело L8A4, которое распознает соединительный пептид мутанта de2-7 EGFR, и контролями.
На фиг. 3 отображена интернализация мАт806 и антитела DH8.3. Клетки U87MG.Δ2-7 предварительно инкубировали с мАт806 (▲) или DH8.3 (●) при 4ºC, переносили на 37ºC, и интернализацию определяли с помощью FACS. Данные представляют среднюю интернализацию в каждый момент времени ± стандартная ошибка в случае 3 (DH8.3) или 4 (мАт806) отдельных экспериментов.
На фиг. 4A и 4B иллюстрируется биораспределение (% Инъецированной дозы (ID)/г опухолевой ткани) меченных радиоактивными изотопами антител: (a)125I-мАт806 и (b)131I-DH8.3 у бестимусных мышей, имеющих ксенотрансплантаты U87MG и U87MG.Δ2-7. Каждая точка представляет среднее значение для 5 мышей ± стандартная ошибка, за исключение 1 ч, когда n=4.
На фиг. 5A и 5B иллюстрируется биораспределение меченных радиоактивными изотопами антител:125I-мАт806 (не закрашенный столбик) и131I-DH8.3 (закрашенный столбик), представленное в виде отношений локализаций (а) опухоль: кровь или (b) опухоль: печень, у бестимусных мышей, имеющих ксенотрансплантаты U87MG.Δ2-7. Каждый столбик представляет среднее значение для 5 мышей ± стандартная ошибка, за исключение 1 ч, когда n=4.
На фиг. 6A-C иллюстрируется проточно-цитометрический анализ линий клеток, имеющихся амплификацию гена EGFR. Клетки A431 окрашивали тем или другим антителом, выбираемым из мАт806, DH8.3 и 528, (черные гистограммы) и сравнивали с окрашиванием нерелевантным антителом IgG2b (незакрашенные гистограммы).
На фиг. 7A и 7B иллюстрируется биораспределение (% ID/г опухолевой ткани) меченных радиоактивными изотопами антител: (a)125I-мАт806 и (b)131I-528 у бестимусных мышей, имеющих ксенотрансплантаты U87MG.Δ2-7 и A431.
На фиг. 8A-D иллюстрируется биораспределение меченных радиоактивными изотопами антител:125I-мАт806 (незакрашенный столбик) и131I-528 (закрашенный столбик), представленное в виде отношений локализаций (A, B) опухоль: кровь или (C, D) опухоль: печень у бестимусных мышей, имеющих ксенотрансплантаты (A, C) U87MG.Δ2-7 и (B, D) A431.
На фиг. 9A и 9B иллюстрируется противоопухолевый эффект мАт806 на скорости роста ксенотрансплантатов (A) U87MG и (B) U87MG.Δ2-7 в превентивной модели. 3×106 клеток U87MG или U87MG.Δ2-7 инъецировали подкожно в оба бока бестимусных мышей BALB/c возрастом 4-6 недель (n=5) в день 0. Мышам внутрибрюшинно инъецировали либо составляющие 1 мг дозы мАт806 (●), составляющие 0,1 мг дозы мАт806 (▲), либо носитель (○), начиная с дня, предшествующего дню инокуляции опухолевых клеток. Инъекции осуществляли три раза в неделю в течение двух недель, как указано стрелками. Данные представлены как средний объем опухолей ± стандартная ошибка.
На фиг. 10A, 10B и 10C иллюстрируется противоопухолевый эффект мАт806 на ксенотрансплантаты (A) U87MG, (B) U87MG.Δ2-7 и (C) U87MG.wtEGFR в модели укоренившейся опухоли. 3×106 клеток U87MG, U87MG.Δ2-7 или U87MG.wtEGFR инъецировали подкожно в оба бока бестимусных мышей BALB/c возрастом 4-6 недель (n=5). Мышам внутрибрюшинно инъецировали либо составляющие 1 мг дозы мАт806 (●); составляющие 0,1 мг дозы мАт806 (▲); либо носитель (○), начиная с того дня, когда средний объем опухолей достигал 65-80 мм3. Инъекции осуществляли три раза в неделю в течение двух недель, как указано стрелками. Данные представлены как средний объем опухолей ± стандартная ошибка.
На фиг. 11A и 11B иллюстрируется противоопухолевый эффект мАт806 на ксенотрансплантаты A431 в (A) превентивной модели и (B) модели укоренившейся опухоли. 3×106 клеток A431 инъецировали подкожно в оба бока бестимусных мышей BALB/c возрастом 4-6 недель (n=5). Мышам внутрибрюшинно инъецировали либо составляющие 1 мг дозы мАт806 (●); либо носитель (○), начиная с дня, предшествующего дню инокуляции опухолевых клеток, в превентивной модели, или когда средний объем опухолей достигал 200 мм3. Инъекции осуществляли три раза в неделю в течение двух недель, как указано стрелками. Данные представлены как средний объем опухолей ± стандартная ошибка.
На фиг. 12 иллюстрируется противоопухолевый эффект лечения мАт806 в комбинации с лечением AG1478 на ксенотрансплантаты A431 в превентивной модели. Данные представлены как средний объем опухолей ± стандартная ошибка.
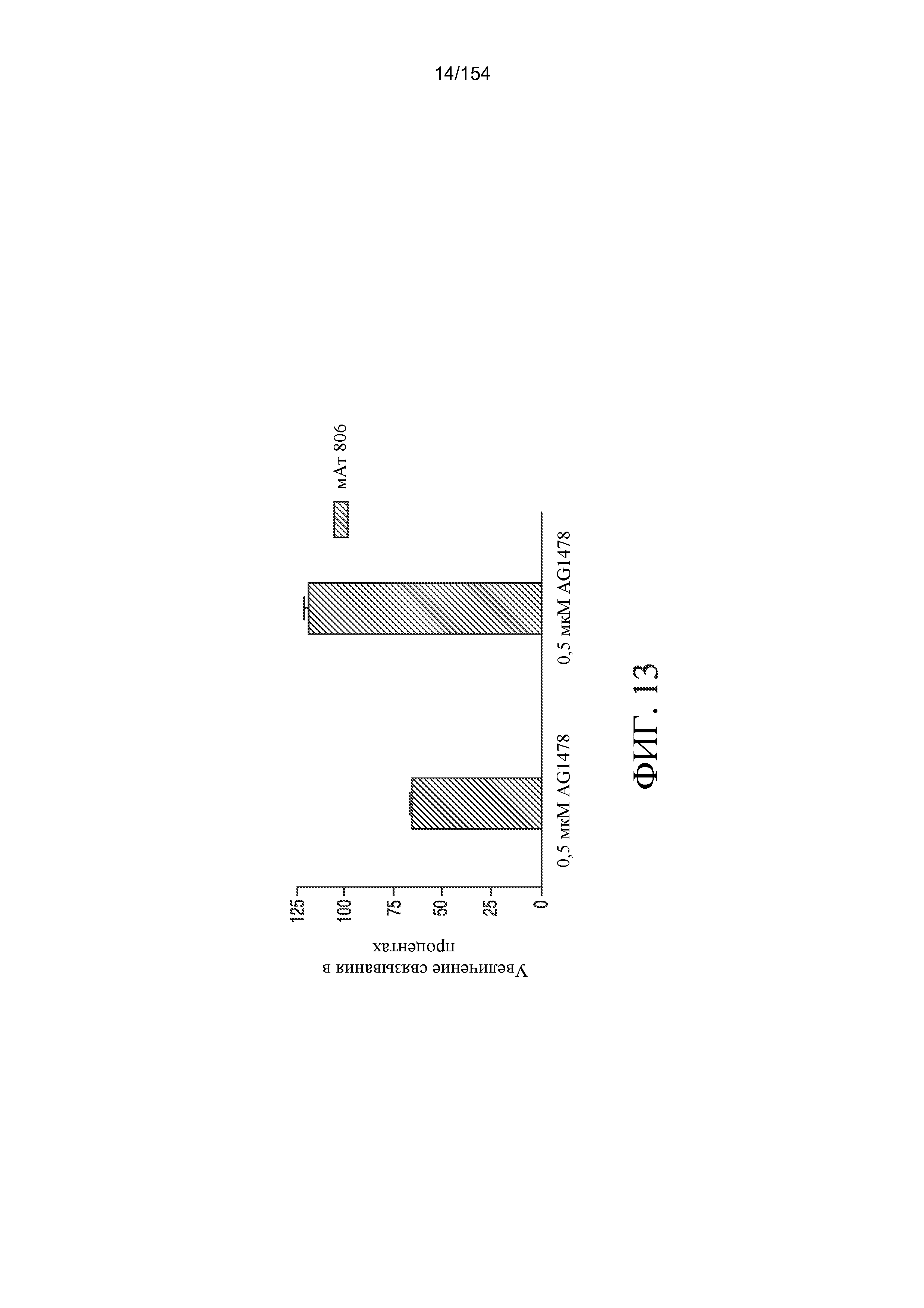
На фиг. 13 отображено связывание мАт806 с клетками A431 в присутствии увеличивающихся концентраций AG1478 (0,5 мкМ и 5 мкМ).
На фиг. 14A и 14B иллюстрируется (A) последовательность нуклеиновой кислоты и (B) являющаяся результатом ее трансляции аминокислотная последовательность гена VH 806 (SEQ ID NO: 1 и SEQ ID NO: 2, соответственно).
На фиг. 15A и 15B иллюстрируется (A) последовательность нуклеиновой кислоты и (B) являющаяся результатом ее трансляции аминокислотная последовательность гена VL 806 (SEQ ID NO: 3 и SEQ ID NO: 4, соответственно).
На фиг. 16 представлена последовательность VH (SEQ ID NO: 2), пронумерованная в соответствии с Kabat, с подчеркнутыми CDR (SEQ ID NO: 15, 16 и 17). Важными остатками последовательности VH (SEQ ID NO: 2) являются 24, 37, 48, 67 и 78.
На фиг. 17 представлена последовательность VL (SEQ ID NO: 4), пронумерованная в соответствии с Kabat, с подчеркнутыми CDR (SEQ ID NO: 18, 19 и 20). Важными остатками последовательности VL (SEQ ID NO: 4) являются 36, 46, 57 и 71.
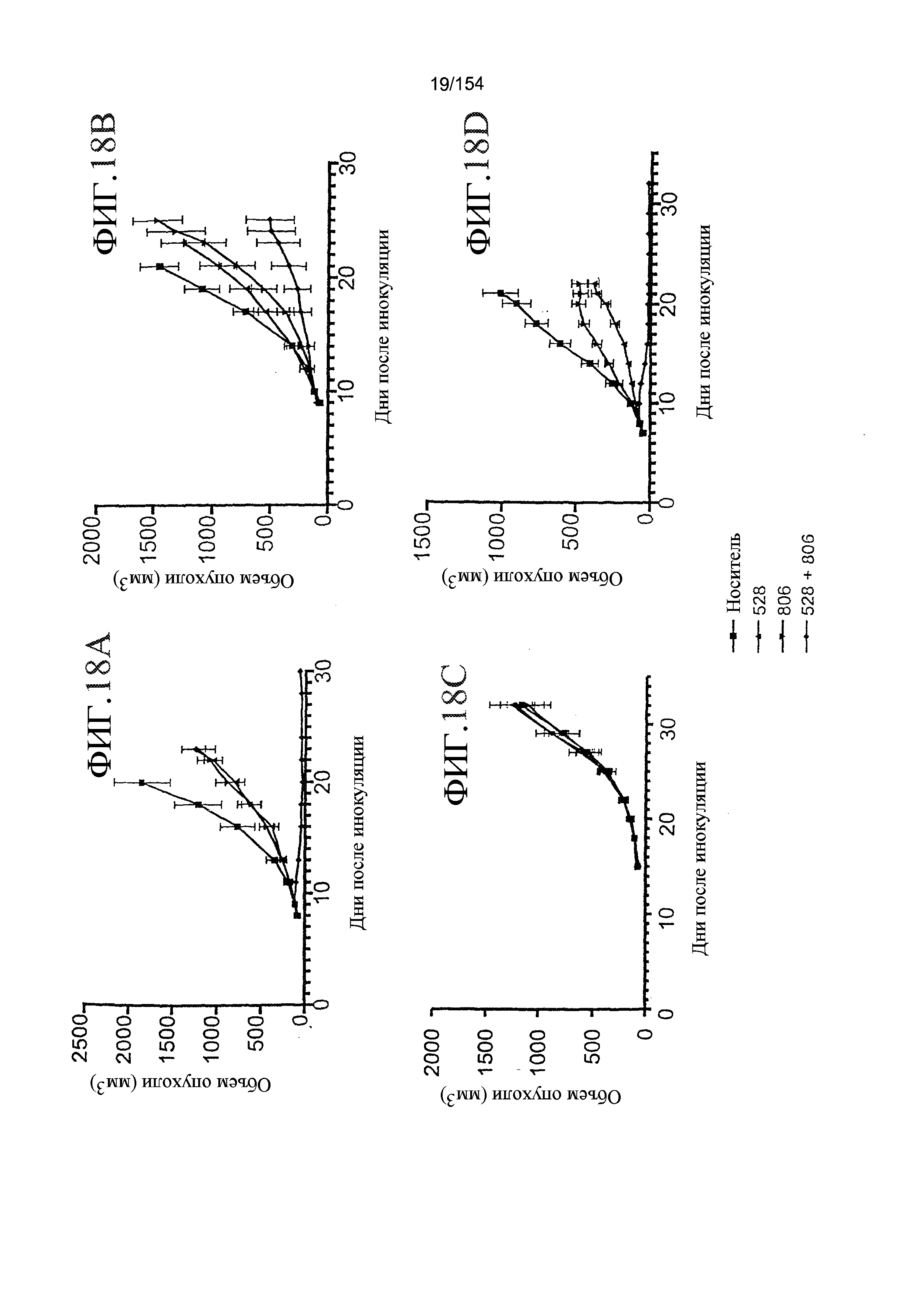
На фиг. 18A-18D представлены результаты in vivo исследований, спланированных для определения терапевтического эффекта комбинированной терапии с использованием антител, конкретно, мАт806 и антитела 528. Мышам инокулировали клетки U87MG.D2-7 (A и B), U87MG.DK (C) или A431 (D).
На фиг. 19 A-D показан анализ интернализации с помощью электронной микроскопии. Клетки U87MG.Δ2-7 предварительно инкубировали с мАт806 или DH8.3, а затем с конъюгированным с золотом антителом против IgG мыши при 4ºC, переносили на 37ºC, и интернализацию проверяли в различные моменты времени с помощью электронной микроскопии: (А) локализация антитела DH8.3 в окаймленной ямке (стрелка) через 5 мин; (В) интернализация мАт806 с помощью макропиноцитоза (стрелка) через 2 мин; (С) локализация DH8.3 в лизосомах (стрелка) через 20 мин; (D) локализация мАт806 в лизосомах (стрелка) через 30 мин. Исходное увеличение в случае всех изображений - X30000.
На фиг. 20 показана радиоавтография среза ксенотрансплантата U87MG.Δ2-7, полученного через 8 ч после инъекции125I-меченного мАт806.
На фиг. 21 показан проточно-цитометрический анализ линий клеток, имеющий амплификацию гена EGFR. Клетки HN5 и MDA-468 окрашивали нерелевантным антителом IgG2b (незакрашенная гистограмма с пунктирными линиями), мАт806 (закрашенная гистограмма) или 528 (незакрашенная гистограмма с замкнутыми линиями). Обе линии клеток были полностью отрицательными по реактивности с антителом DH8.3 (не представленные данные).
На фиг. 22 показана иммунопреципитация EGFR из клеточных линий. Иммунопреципитации подвергали EGFR из35S-меченных клеток U87MG.Δ2-7 или A431 с помощью мАт806, антитела sc-03 или совпадающего по изотипу контроля IgG2b. Стрелки сбоку указывают положение de2-7 и EGFR дикого типа. Идентичные картины полос были получены в трех независимых экспериментах.
На фиг. 23 показана ауторадиография среза ксенотрансплантата A431, полученного через 24 ч после инъекции125I-меченного мАт806, области локализации жизнеспособной ткани показаны стрелками.
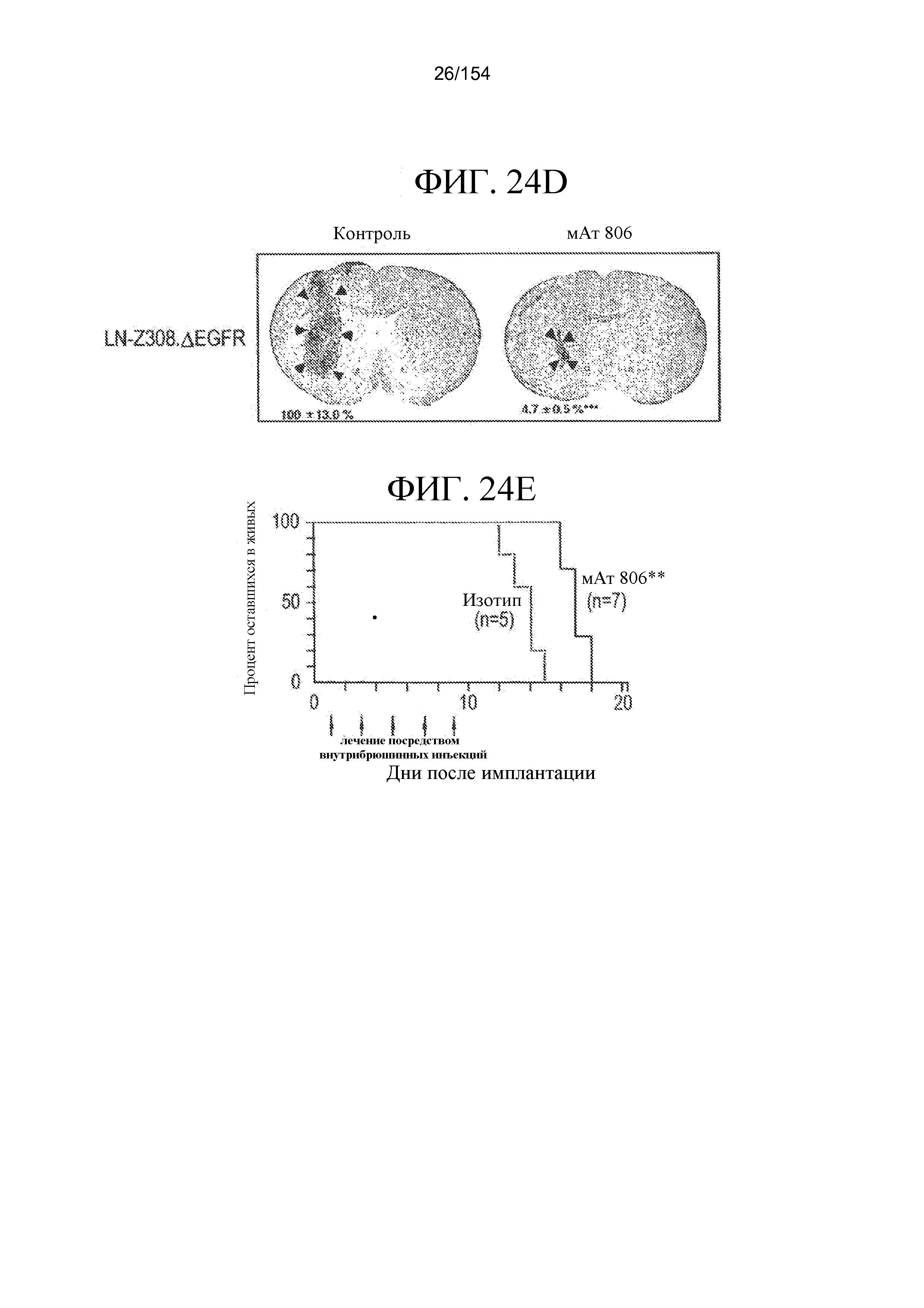
На фиг. 24A и 24B показано увеличение выживаемости бестимусных мышей, имеющих внутричерепные ксенотрансплантаты U87MG.ΔEGFR (A) и LN-Z308.ΔEGFR (B), с помощью системного лечения мАт806. Клетки U87MG.EGFR (1×105) или клетки LN-Z308.ΔEGFR (5×105) имплантировали в головной мозг бестимусных мышей и животных подвергали лечению либо мАт806, PBS, либо совпадающим по изотипу IgG с дня 0 по день 14 после имплантации.
На фиг. 24C и 24D показано подавление роста внутричерепных опухолей с помощью лечения мАт806. Бестимусных мышей (пять в каждой группе), подвергнутых лечению либо мАт806, либо совпадающим по изотипу IgG в качестве контроля, подвергали эвтаназии в день 9 в случае U87MG.EGFR (C) и в день 15 в случае LN-Z308.ΔEGFR (D) и головной мозг извлекали, фиксировали и делали срезы. Данные рассчитывали при принятии объема опухоли контроля за 100%. Значения представляют собой среднее значение ± стандартная ошибка. ***, P<0,001; контроль в сравнении с мАт806. Стрелки, опухолевая ткань.
На фиг. 24E показано увеличение выживаемости бестимусных мышей, имеющих внутричерепные ксенотрансплантаты U87MG.ΔEGFR, с помощью лечения посредством инъекций внутрь опухолей мАт806. Клетки U87MG.ΔEGFR имплантировали, как описано. 10 мг мАт806 или совпадающего по изотипу IgG в качестве контроля в объеме 5 мкл инъецировали в место инъекции опухолевых клеток через день, начиная с дня 1, пять раз.
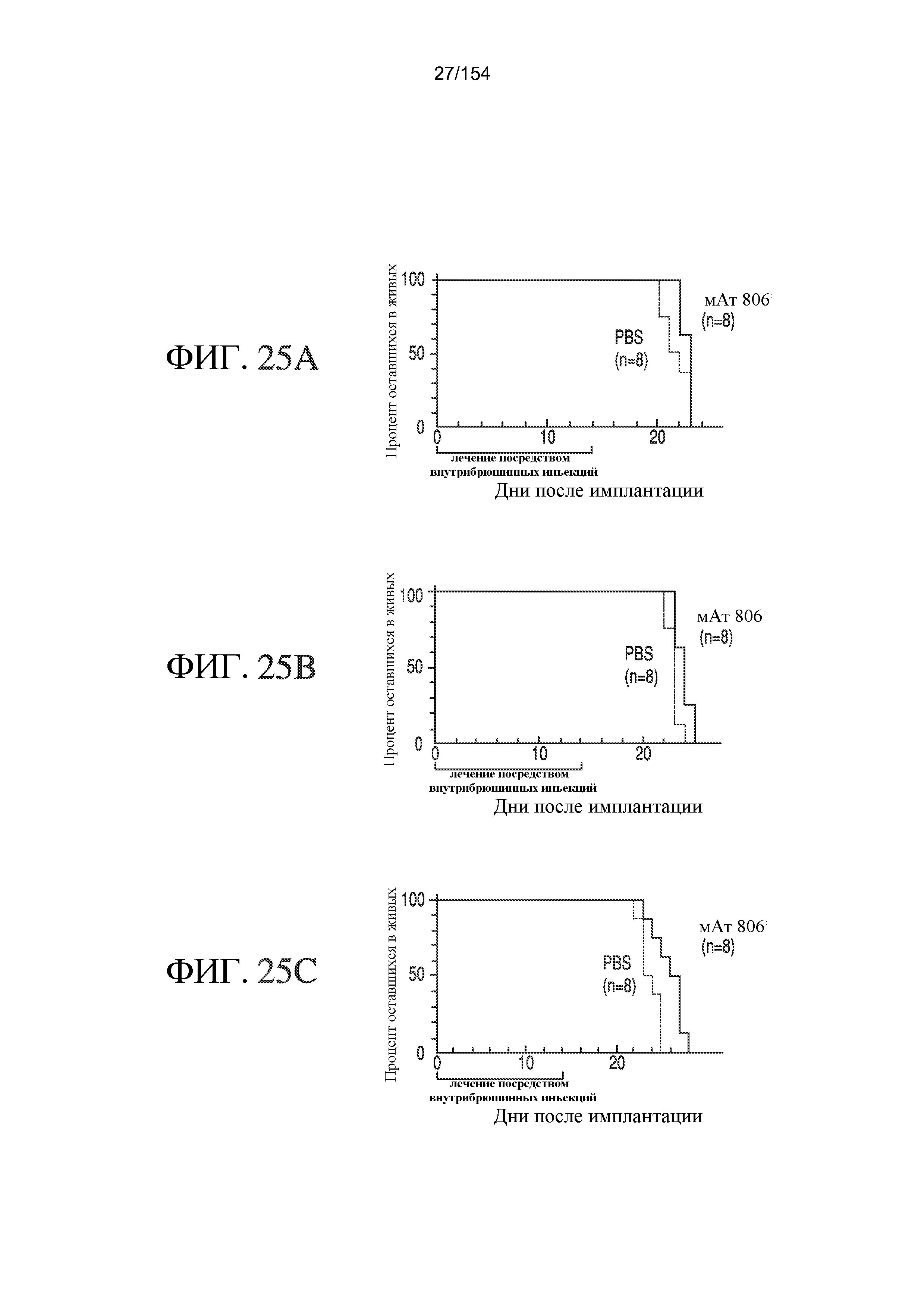
На фиг. 25A, 25B и 25C показано, что мАт806 увеличивает выживаемость мышей с опухолями головного мозга U87MG.EGFR дикого типа, но не с опухолями головного мозга U87MG.DK или U87MG. Клетки U87MG (A), U87MG.DK (B) или U87MG.EGFR дикого типа (C) (5×105) имплантировали в головной мозг бестимусных мышей и животных подвергали лечению мАт806 с дня 0 по день 14 после имплантации с последующим наблюдением после прекращения терапии.
На фиг. 26A представлен анализ с помощью FACS реактивности мАт806 с линиями клеток U87MG. Клетки U87MG, U87MG.ΔEGFR, U87MG.DK и U87MG.wtEGFR окрашивали моноклональными антителами против EGFR 528, EGFR.1, и антителом против ΔEGFR, мАт806. Моноклональное антитело EGFR.1 распознавало только EGFR дикого типа, а моноклональное антитело 528 реагировало как с EGFR дикого типа, так и с ΔEGFR. мАт806 реагировало сильно с U87MG.ΔEGFR и U87MG.DK и слабо с U87MG.wtEGFR. Столбики на абсциссе, максимальное окрашивание клеток в отсутствие первого антитела. Результаты воспроизводились в трех независимых экспериментах.
На фиг. 26B показана иммунопреципитация с помощью мАт806 форм EGFR. Мутантный EGFR и EGFR дикого типа выделяли с помощью антител против EGFR, 528, EGFR.1, или антитела против ΔEGFR, мАт806, из клеток (дорожка 1) U87MG, (дорожка 2) U87Δ.EGFR, (дорожка 3) U87MG.DK и (дорожка 4) U87MG.wtEGFR, а затем выявляли с помощью Вестерн-блоттинга с использованием антитела против всех EGFR, C13.
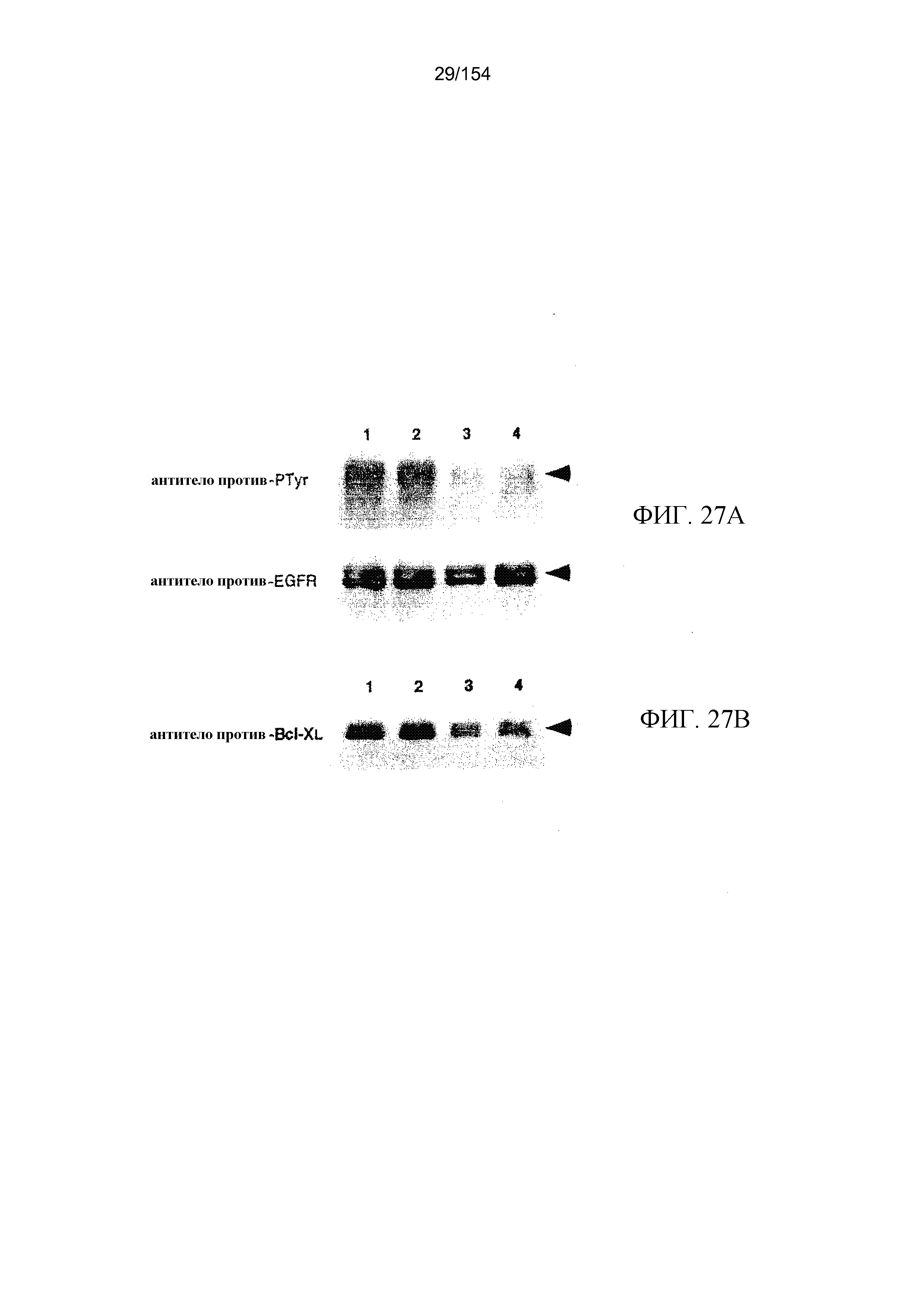
На фиг. 27A и 27B показано, что системное лечение мАт806 уменьшает фосфорилирование ΔEGFR и экспрессию Bcl-XL в опухолях головного мозга U87MG.ΔEGFR. Опухоли U87MG.ΔEGFR иссекали в день 9 лечения мАт806, сразу же замораживали в жидком азоте и хранили при -80ºC до приготовления опухолевых лизатов.
(A) Анализ с помощью Вестерн-блоттинга экспрессии и степени аутофосфорилирования ΔEGFR. Тридцать мкг опухолевых лизатов подвергали электрофорезу в SDS-полиакриламидных гелях, переносили на нитроцеллюлозные мембраны и зондировали с использованием мАт против фосфотирозина, затем это антитело десорбировали, и мембраны повторно зондировали, но с использованием антитела против EGFR, C13.
(B) Вестерн-блоттинг Bcl-XL при использовании тех же опухолевых лизатов, которые использовались в (A). Мембраны зондировали с использованием поликлонального антитела против Bcl-X человека. Дорожки 1 и 2, опухоли головного мозга U87MG.ΔEGFR, подвергнутые лечению совпадающим по изотипу контролем; дорожки 3 и 4, опухоли головного мозга U87MG.ΔEGFR, подвергнутые лечению мАт806.
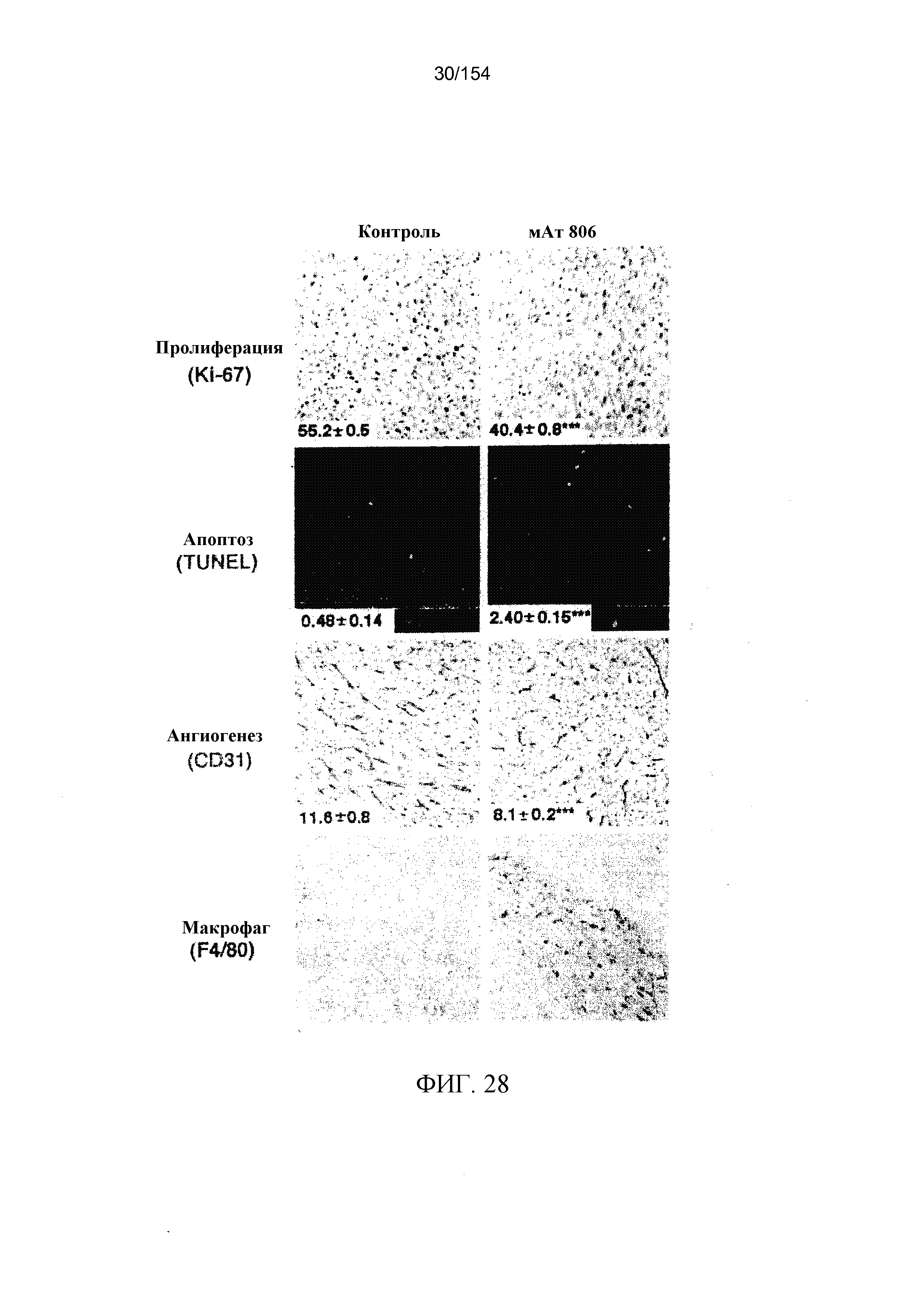
На фиг. 28 показано, что лечение мАт806 приводит к уменьшению роста и васкулогенеза и к увеличению апоптоза и накоплению макрофагов в опухолях U87MG.ΔEGFR. Срезы опухолей окрашивали на антиген Ki-67. Индекс пролиферации клеток определяли с помощью определения процента всех клеток, которые были Ki-67-положительными, из четырех случайно выбранных полей зрения под большим увеличением (X400) во внутричерепных опухолях от четырех мышей каждой группы. Данные представляют собой среднее значение ± стандартная ошибка. Апоптозные клетки выявляли с помощью анализа с использованием TUNEL (терминального дезоксиуридиного мечения концов). Индекс апоптоза определяли с помощью определения отношения числа TUNEL-положительных клеток к общему числу клеток из четырех случайно выбранных полей зрения под большим увеличением (X400) во внутричерепных опухолях от четырех мышей каждой группы. Данные представляют собой среднее значение ± стандартная ошибка. Срезы опухолей подвергали иммуноокрашиванию антителом против CD31. MVA (площади микроваскуляризации) анализировали с помощью выполняемого с помощью вычислительной машины анализа изображений из четырех случайно выбранных полей зрения (X200) внутричерепных опухолей от четырех мышей каждой группы. Инфильтраты макрофагов вокруг опухолей в подвергнутых лечению мАт806 опухолях U87MG.ΔEGFR. Срезы опухолей окрашивали антителом против F4/80.
На фиг. 29 показан проточно-цитометрический анализ линий родительских и трансфицированных глиомных клеток U87MG. Клетки окрашивали либо нерелевантным антителом IgG2b (незакрашенные гистограммы), либо антителом 528 или мАт806 (закрашенные гистограммы), как указано.
На фиг. 30 показана иммунопреципитация EGFR из клеточных линий. Иммунопреципитации подвергали EGFR из35S-меченных клеток U87MG.wtEGFR, U87MG.Δ2-7 и A431 с помощью мАт806 (806), антитела sc-03 (c-term) или совпадающего по изотипу контроля IgG2b (con). Стрелки, положение de2-7 и EGFR дикого типа.
На фиг. 31 представлены репрезентативные, окрашенные H&E, залитые парафином срезы ксенотрансплантатов U87MG.Δ2-7 и U87MG.wtEGFR. Ксенотрансплантаты U87MG.Δ2-7 (извлеченные спустя 24 дня после инокуляции опухолевых клеток) и U87MG.wtEGFR (извлеченные спустя 42 дня после инокуляции опухолевых клеток) извлекали из мышей, подвергнутых лечению, как описано выше в разъяснении к фиг. 10, и окрашивали H&E. Подвергнутые лечению носителем ксенотрансплантаты U87MG.Δ (извлеченные спустя 18 дней после инокуляции опухолевых клеток) и U87MG.wtEGFR (извлеченные спустя 37 дней после инокуляции опухолевых клеток) продемонстрировали очень маленькие зоны некроза (левая панель), тогда как обширный некроз (стрелки) наблюдали в подвергнутых лечению мАт806 ксенотрансплантатах как клеток U87MG.Δ2-7, так и клеток U87MG.wtEGFR (правая панель).
На фиг. 32 показан иммуногистохимический анализ экспрессии EGFR в замороженных срезах, полученных из ксенотрансплантатов U87MG, U87MG.Δ2-7 и U87MG.wtEGFR. Срезы делали в моменты времени, описанные выше в разъяснении к фиг. 31. Срезы ксенотрансплантатов подвергали иммуноокрашиванию антителом 528 (левая панель) и мАт806 (правая панель). Уменьшение иммунореактивности либо с EGFR дикого типа, амплифицированным EGFR, либо с de2-7 EGFR не наблюдалось в ксенотрансплантатах, подвергнутых лечению мАт806. В соответствии с in vitro данными ксенотрансплантаты родительских клеток U87MG были положительными по реактивности с антителом 528, но были отрицательными в отношении окрашивания мАт806.
Фиг. 33 является схематическим представлением созданных бицистронных экспрессионных конструкций. Транскрипция цепей химерного антитела инициируется промотором фактора-1 элонгации и терминируется сильной искусственной последовательностью терминации. Последовательности IRES введены между кодирующими областями легкой цепи и NeoR и между кодирующими областями тяжелой цепи и гена dhfr.
На фиг. 34A и 34B показан анализ биораспределения ch806, меченного либо (A)125I, либо (B)111In, который был выполнен на бестимусных мышах BALB/c, имеющих ксенотрансплантаты опухолевых клеток U87MG-de2-7. Мышам инъецировали 5 мкг меченного радиоактивным изотопом антитела, и их умерщвляли группами по четыре мыши в каждый момент времени - через 8, 24, 48 или 74 часа. Органы извлекали, взвешивали и радиоактивность измеряли в счетчике гамма-излучения.
На фиг. 35A и 35B отображены (A) % ID/грамм опухолевой ткани и (B) отношение опухоль:кровь. В случае111In-меченного антитела обнаруживается приблизительно 30% ID/грамм ткани и составляющее 4,0 отношение опухоль:кровь.
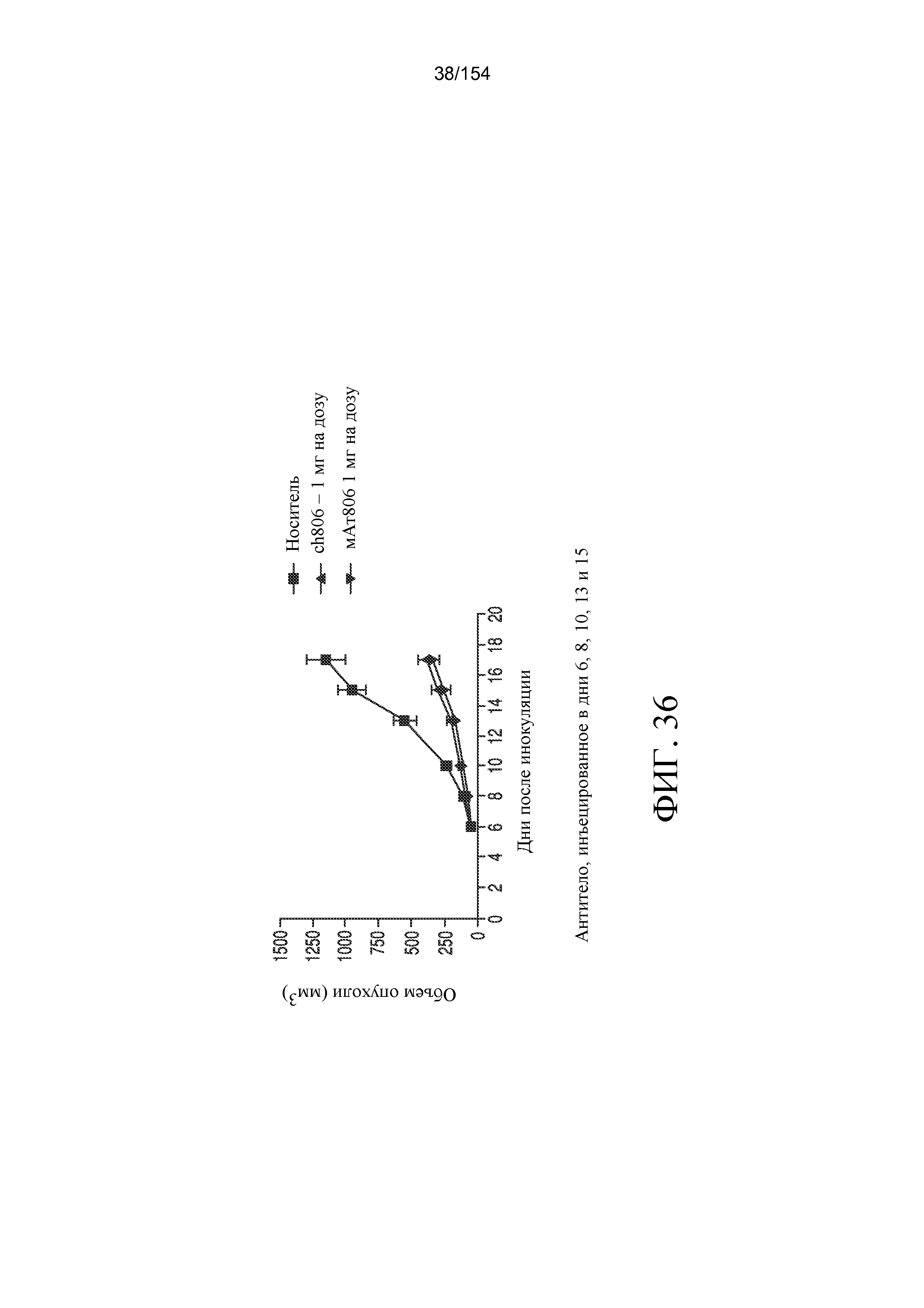
На фиг. 36 отображена терапевтическая эффективность химерного антитела ch806 в модели укоренившейся опухоли. 3×106 клеток U87MG.Δ2-7 в l00 мкл PBS инокулировали подкожно в оба бока самок бестимусных мышей возрастом 4-6 недель. В качестве положительного контроля включали мАт806. Лечение начинали, когда средний объем опухолей достигал 50 мм3, и оно состояло из всего 5 внутрибрюшинных инъекций по 1 мг ch806 или мАт806 при каждой инъекции, осуществляемых в указанные дни. Данные представляли как средний объем опухолей ± стандартная ошибка для каждой подвергаемой лечению группы.
На фиг. 37 представлена активность в виде CDC в отношении клеток-мишеней (A) U87MG.de2-7 и (B) A431 в случае химерных антител против EGFR в виде IgG1 - ch806 и контрольного cG250. Представлены средние значения (ʺящикиʺ; ± стандартная ошибка) цитотоксичности в процентах при определениях в трех повторах.
На фиг. 38 показана ADCC в отношении клеток-мишеней (A) U87MG.de2-7 и (B) A431 при соотношении эффекторы:клетки-мишени, составляющем 50:1, достигаемая при помощи ch806 и совпадающего по изотипу контрольного антитела cG250 (0-10 мкг/мл). Результаты представлены как средние значения (ʺящикиʺ; ± стандартная ошибка) цитотоксичности в процентах при определениях в трех повторах.
На фиг. 39 показана ADCC, достигаемая при помощи 1 мкг/мл исходного мАт806 и ch806, в отношении клеток-мишеней U87MG.de2-7 в диапазоне соотношений эффекторы:мишени. Представлены средние значения (ʺящикиʺ; ± стандартная ошибка) при определениях в трех повторах.
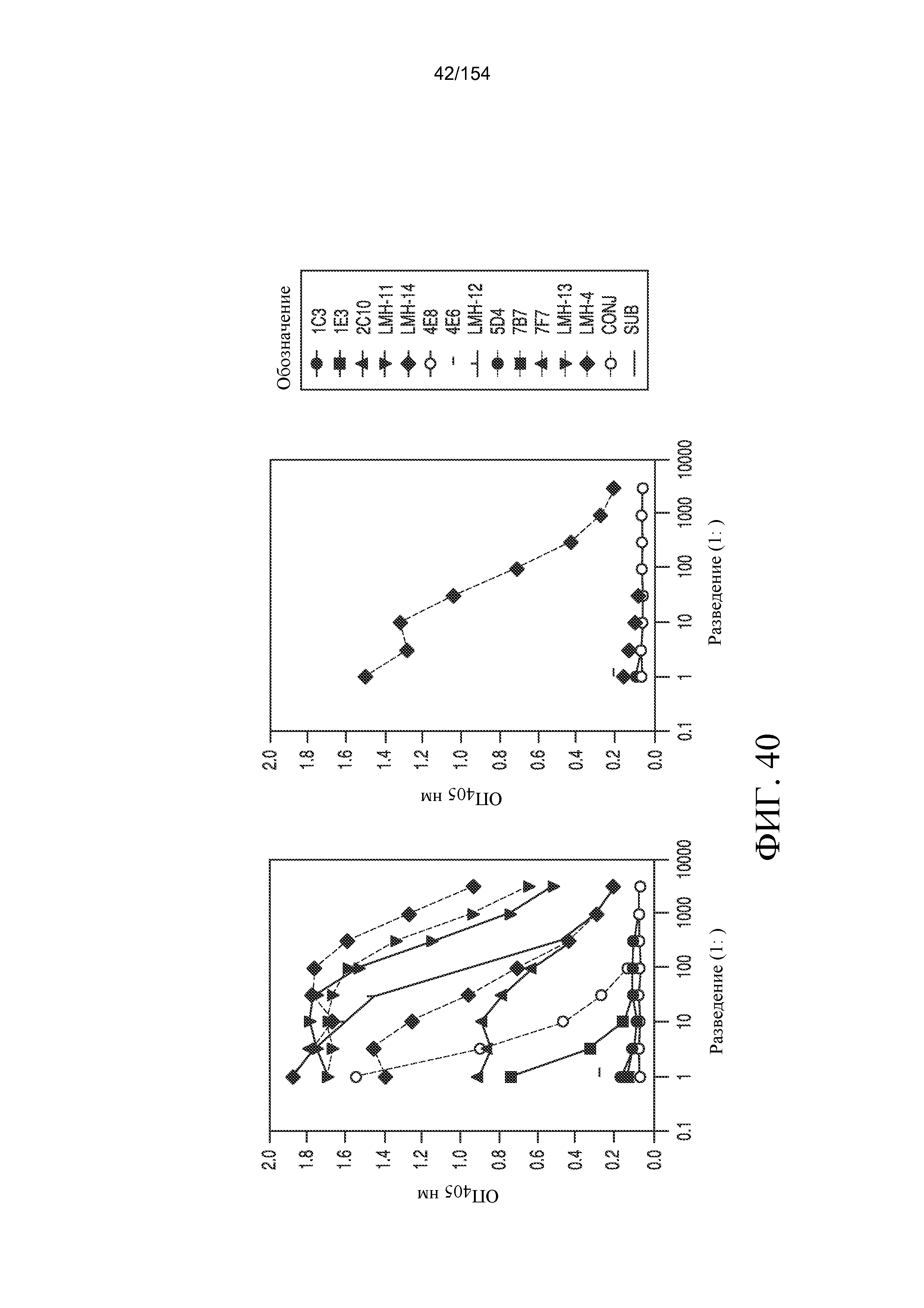
На фиг. 40 показано, что первоначально было отобрано двадцать пять гибридом, продуцирующих антитела, которые связывались с ch806, но не с huIgG. В отношении четырех из этих гибридом, продуцирующих антитела против ch806 с высокой аффинностью связывания (клонов 3E3, 5B8, 9D6 и 4D8), впоследствии выполняли клональную экспансию из одиночных клеток посредством предельного разведения, и они были названы Ludwig Institute for Cancer Research Melbourne Hybridoma (LMH)-11, -12, -13 и - 14, соответственно. Кроме того, были также клонированы и в дальнейшем охарактеризованы две гибридомы, которые продуцировали мАт, специфичные в отношении huIgG: клоны 2C10 (LMH-15) и 2B8 (LMH-16).
На фиг. 41A, 41B и 41C показано, что после клональной экспансии супернатанты культур гибридомных клеток проверяли в трех повторах с помощью ELISA на способность к нейтрализации активности связывания ch806 или мАт806 с антигеном - sEGFR621. Результаты в виде среднего значения (± стандартная ошибка) свидетельствовали об антагонистической активности антиидиотипических мАт LMH-11, -12, -13 и -14 с блокированием в растворе связывания как ch806, так и мышиного мАт806 с планшетами, покрытыми sEGFR (LMH-14 не показан).
На фиг. 42A, 42B и 42C демонстрируются титрационные микропланшеты, которые были покрыты 10 мкг/мл очищенного (A) LMH-11, (B) LMH-12 и (C) LMH-13. Три очищенных клона были сравнены по их способности к улавливанию ch806 или мАт806 в сыворотке или 1% FCS/средах, а затем обнаружению связанного ch806 или мАт806. Совпадающие по изотипу контрольные антитела hu3S193 и m3S193 в сыворотке и 1% FCS/средах были включены в дополнение к контролям на второй конъюгат авидин-HRP и субстрат ABTS. Результаты представлены как среднее значение (± стандартная ошибка) образцов при измерении в трех повторах, используя биотинилированое LMH-12 (10 мкг/мл) для обнаружения, и показывают, что LMH-12, использованный для улавливания и обнаружения, обеспечивал наибольшую чувствительность к ch806 в сыворотке (3 нг/мл) с незначительным фоновым связыванием.
На фиг. 43 продемонстрирована валидация оптимальных условий для фармакокинетических анализов с помощью ELISA, используя 1 мкг/мл антиидиотипического LMH-12 и 1 мкг/мл биотинилированного LMH-12 для улавливания и обнаружения, соответственно. Три отдельных ELISA были выполнены в четырех повторах для измерения ch806 в сыворотке трех здоровых доноров (●) или 1% BSA/средах (■) с совпадающим по изотипу контрольным hu3S193 в сыворотке (▲) или 1% BSA/средах (▼). При использовании каждого ELISA были также включены контроли на второй конъюгат авидин-HRP (◆) и субстрат ABTS (шестиугольник) сам по себе. Результаты в виде среднего значения (± стандартная ошибка) демонстрируют высоко воспроизводимые кривые связывания для определения ch806 (2 мкг/мл - 1,6 нг/мл) в сыворотках с составляющим 3 нг/мл пределом выявления (n=12; 1-100 нг/мл, коэффициент вариации <25%; 100 нг/мл - 5 мкг/мл, коэффициент вариации <15%). Не было заметным фоновое связывание с любой из трех проверенных сывороток, и наблюдалось незначительное связывание с совпадающим по изотипу контрольным hu3S193.
На фиг. 44 изображен иммуноблот рекомбинантного sEGFR, экспрессированного в клетках CHO, зондированный с использованием мАт806. Рекомбинантный sEGFR подвергали обработке PNGaseF (пептид-N-гликаназой F) для устранения N-связанного гликозилирования (дегликозилирования) или не подвергали такой обработке, белок подвергали электрофорезу в SDS-ПААГ, переносили на мембрану и подвергали гибридизации с мАт806.
На фиг. 45 отображена иммунопреципитация EGFR из линий35S-меченных клеток (U87MG.Δ2-7, U87MG-wtEGFR и A431) с помощью различных антител (антител SC-03, 806 и 528).
На фиг. 46 отображена иммунопреципитация EGFR из различных клеток (A431 и U87MG.Δ2-7) в различные моменты времени (от момента времени = 0 до 240 минут) после импульсного мечения с помощью35S метионина/цистеина. Для иммунопреципитации использованы антитела 528 и 806.
На фиг. 47 отображена иммунопреципитация EGFR из различных линий клеток (U87MG.Δ2-7, U87MG-wtEGFR и A431) с помощью различных антител (SC-03, 806 и 528) в отсутствие расщепления Endo H (-) и после расщепления Endo H (+) для удаления типа углеводов с высоким содержанием маннозы.
На фиг. 48 отображено йодирование структур поверхностей линий клеток A431 и U87MG.Δ2-7 с последующей иммунопреципитацией с помощью антитела 806, и с расщеплением Endo H или без него, которое служит подтверждением того, что EGFR, связываемый 806, на поверхности клеток A431 является чувствительной к EndoH формой.
На фиг. 49 представлен вектор pREN ch806 LC Neo (SEQ ID NO: 7).
На фиг. 50 представлен вектор pREN ch806 HC DHFR Vector (SEQ ID NO: 8).
На фиг. 51A-D представлены последовательности нуклеиновых кислот VH- и VL-областей мАт124 (SEQ ID NO: 21 и 26, соответственно) и их аминокислотные последовательности (SEQ ID NO: 22 и 27, соответственно).
На фиг. 52A-D представлены последовательности нуклеиновых кислот VH- и VL-областей мАт1133 (SEQ ID NO: 31 и 36, соответственно) и их аминокислотные последовательности (SEQ ID NO: 32 и 37, соответственно).
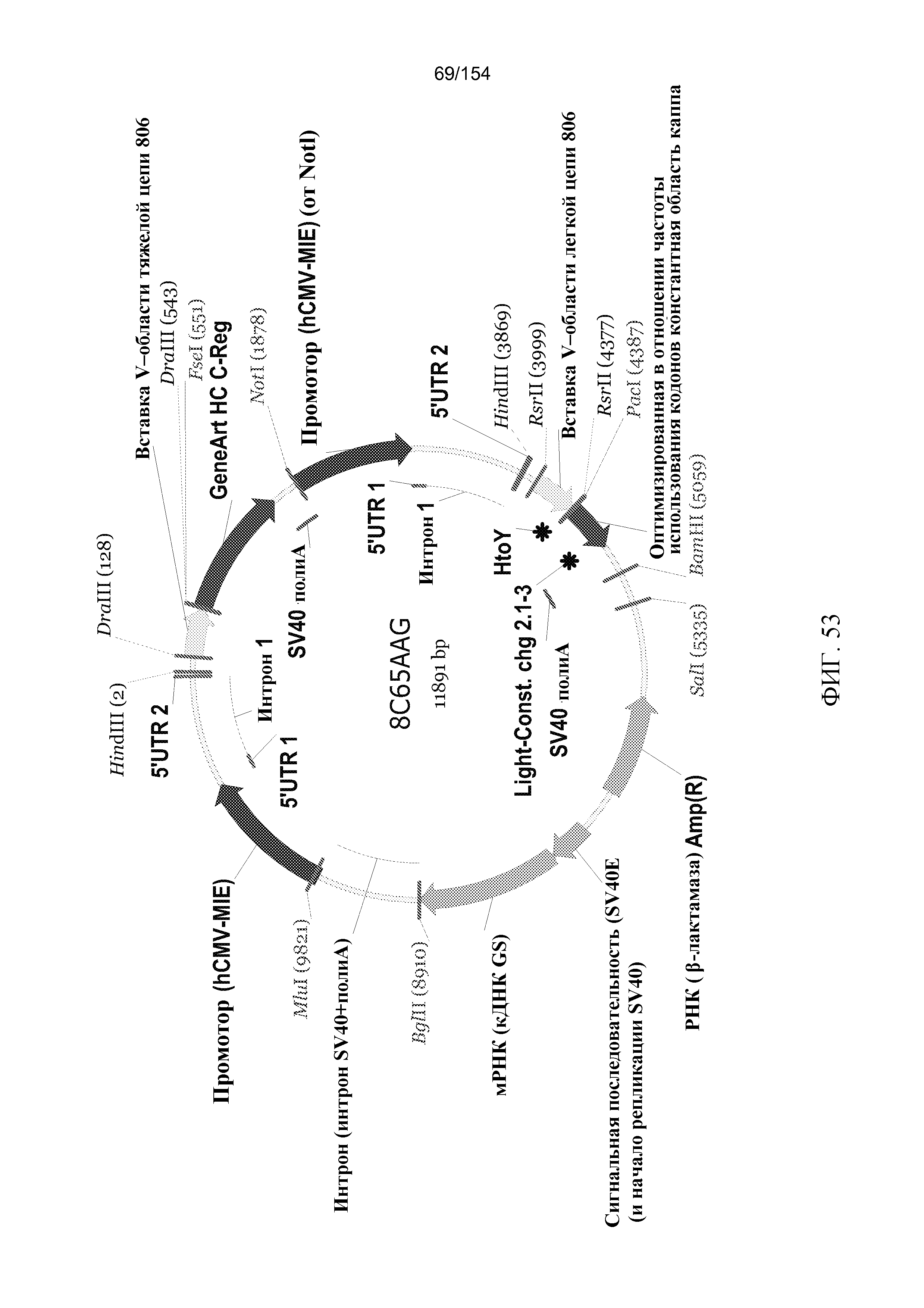
На фиг. 53 графически представлена ДНК-плазмида - объединенная плазмида Lonza с двумя генами, включающая pEE12.4, содержащую кассету для экспрессии (VH+CH) hu806H, и pEE6.4, содержащую кассету для экспрессии (VL+CL) hu806L.
На фиг. 54 представлена последовательность ДНК (SEQ ID NO: 41; комплементарная последовательность SEQ ID NO: 162) объединенной плазмиды Lonza, представленной на фиг. 53. На этой фигуре также показаны все являющиеся результатом трансляций аминокислотные последовательности (SEQ ID NO: 42-51 и 163-166), относящиеся к антителу hu806. Последовательность плазмиды была подвергнута верификации, и были проверены кодирующая последовательность и являющаяся результатом трансляции аминокислотная последовательность. Для идентификации представляющих интерес районов участки последовательности были заштрихованы; заштрихованные участки соответствуют действительным местам соединений при сплайсинге. Используется следующая цветная маркировка:
(серая): сигнальный участок, начальные кодирующие последовательности, обнаруживаемые в вариабельных областях как тяжелой, так и легкой цепей;
(бледно-лиловая): VH-область hu806, венированная вариабельная область тяжелой цепи;
(розовая): CH-область hu806, оптимизированная в отношении частоты использования кодонов константная область тяжелой цепи.
(зеленая): VL-область hu806, венированная вариабельная область легкой цепи; и
(желтая): CL-область hu806, оптимизированная в отношении частоты использования кодонов константная область легкой цепи.
На фиг. 55A и 55B представлены транслированные аминокислотные последовательности hu806 (VH- и VL-области SEQ ID NO: 164 и 166 и связанные с ними сигнальные пептиды SEQ ID NO: 163 и 165; CH- и CL-области SEQ ID NO: 43 и 48), и представлена нумерация по Kabat для VH- и VL-областей (SEQ ID NO: 164 и 165, соответственно), при этом CDR (SEQ ID NO: 44-46 и 49-51) подчеркнуты.
На фиг. 56A, 56B, 56C, 57A, 57B и 57C показан начальный этап в плане венирования, оценка аминокислотных остатков в последовательности мАт806 (VH-области SEQ ID NO: 167 и VL-области SEQ ID NO: 12) в отношении экспонирования на поверхности. Оценки равняются числу звездочек (*) над каждым остатком, при этом наиболее экспонированные остатки имеют три звездочки. Три фигуры включают карту, на которой указано, как перекрывались первоначальные олигонуклеотиды (для VH-области: фиг. 56C и SEQ ID NO: 52 и 169-177; для VL-области: фиг. 57C и SEQ ID NO: 62, 66, 68 и 181-187) с образованием первого венированного продукта (VH-области SEQ ID NO: 168 и VL-области SEQ ID NO: 180).
На фиг. 58 представлена карта оптимизированной в отношении частоты использования кодонов последовательности ДНК тяжелой цепи huIgG1 (SEQ ID NO: 80; комплементарная последовательность SEQ ID NO: 178) и являющейся результатом ее трансляции аминокислотной последовательности (SEQ ID NO: 43).
На фиг. 59 представлено совмещение белков для сравнения аминокислотной последовательности VH+CH hu806 (VH+CH 8C65AAG hu806; SEQ ID NO: 81) с исходным ссылочным файлом для VH-области мАт806 (SEQ ID NO: 167). Выделенные районы означают консервативные аминокислотные последовательности в VH. CDR подчеркнуты. Звездочки отражают изменения, которые планировались и были осуществлены в первоначальном процессе венирования. Пронумерованные сайты относятся к последующим модификациям.
На фиг. 60 представлено соответствующее совмещение аминокислотной последовательности VL+CL hu806 (сигнальная последовательность + VL + CL 8C65AAG hu806; SEQ ID NO: 83) с исходным ссылочным файлом для VL-области мАт806 (SEQ ID NO: 179). Она содержит дополнительный файл (сигнальная последовательность + VL + CL r2vkl hu806; SEQ ID NO: 82), конструкцию-предшественник, который был включен для иллюстрации изменения, внесенного при модификации #7.
На фиг. 61 представлено совмещение нуклеотидной и аминокислотной последовательностей сигнальная последовательность +VL и CL hu806 (VL+CL 8C65AAG hu806; SEQ ID NO: 190 и 188) с соответствующими последовательностями ch806 (pREN ch806 LC Neo; LICR; SEQ ID NO: 189). Были осуществлены модификации, и примечания к ним даны в разъяснении к фиг. 62.
На фиг. 62 представлено совмещение нуклеотидной последовательности сигнальная последовательность + VH hu806 (VH-области 8C65AAG hu806; SEQ ID NO: 192) с соответствующей последовательностью мАт806 [VH-области мАт806 до изменения кодонов (cc) и венирования (ven); SEQ ID NO: 191]. Проиллюстрированы замены нуклеотидов, лежащие в основе изменений аминокислот на фиг. 59 и 60, а также показаны консервативные замены в последовательности нуклеиновой кислоты, которые не приводят к изменению аминокислоты. Интрон между сигнальной последовательностью и VH-областью в hu806 был удален для облегчения просмотра. Сигнальная последовательность и CDR подчеркнуты. Соответствующая аминокислотная последовательность (SEQ ID NO: 42) была добавлена к совмещению.
На фиг. 63 показано связывание очищенного антитела hu806, полученного из транзиторно трансфицированных клеток 293, с рекомбинантным EGFR-ECD, определяемое с помощью Biacore. Связывание с EGFR-ECD не наблюдалось при использовании очищенного контрольного антитела в виде IgG1 человека.
На фиг. 64 представлен отформатированный для GenBank текстовый документ, касающийся последовательности (SEQ ID NO: 41) плазмиды 8C65AAG, кодирующий hu806 в виде IgG1, и аннотаций к ней.
На фиг. 65 представлено совмещение аминокислотных последовательностей CDR из мАт806 (SEQ ID NO: 15-18, 20 и l93) и мАт175 (SEQ ID NO: 130-132, 135 и 194-195). Различия в последовательностях двух антител выделены жирным шрифтом.
На фиг. 66A и 66B продемонстрировано иммуногистохимическое окрашивание линий клеток и нормальной печени человека антителом мАт175. (A) Биотинилированное мАт175 было использовано для окрашивания срезов, приготовленных из массивов, содержащих клетки A431 (которые сверхэкспрессируют EGFR дикого типа), клетки U87MG.Δ2-7 (которые экспрессируют Δ2-7EGFR) и клетки U87MG (которые экспрессируют EGFR дикого типа на средних уровнях). (B) Окрашивание нормальной печени человека (400x) антителом мАт175 (левая панель), совпадающим по изотипу контрольным антителом (центральная панель) и контролем на второе антитело (правая панель). Не наблюдалось специфическое окрашивание синусоидных капилляров или гепатоцитов.
На фиг. 67A, 67B и 67C продемонстрирована реактивность мАт806 и мАТ175 с фрагментами EGFR, представленными на поверхности дрожжей. (A) Репрезентативные, полученные в результате проточно-цитометрического анализа гистограммы, на которых представлен средний флуоресцентный сигнал мечения антителами мАт175 и мАт806 фрагментов EGFR, представленных на поверхности дрожжей. При использовании представления на поверхности дрожжей процент клеток не отражает белок на их поверхности, что имеет следствием 2 пика на гистограмме. Антитело 9E10 использовано в качестве положительного контроля, поскольку все фрагменты содержат линейную C-концевую c-myc-метку. (B) Итоговая сводка связывания антител с различными фрагментами EGFR. (C) Фрагменты EGFR подвергали денатурации посредством нагревания осадков дрожжевых клеток до 800ºC в течение 30 мин. Во всех случаях антитело против c-myc 9Е10 все еще распознавало с-myc-метку, демонстрируя, что тепловая обработка не подвергает опасности белок, представленный на поверхности дрожжей. Чувствительное к конформации антитело против EGFR - мАт225 было использовано для подтверждения денатурации.
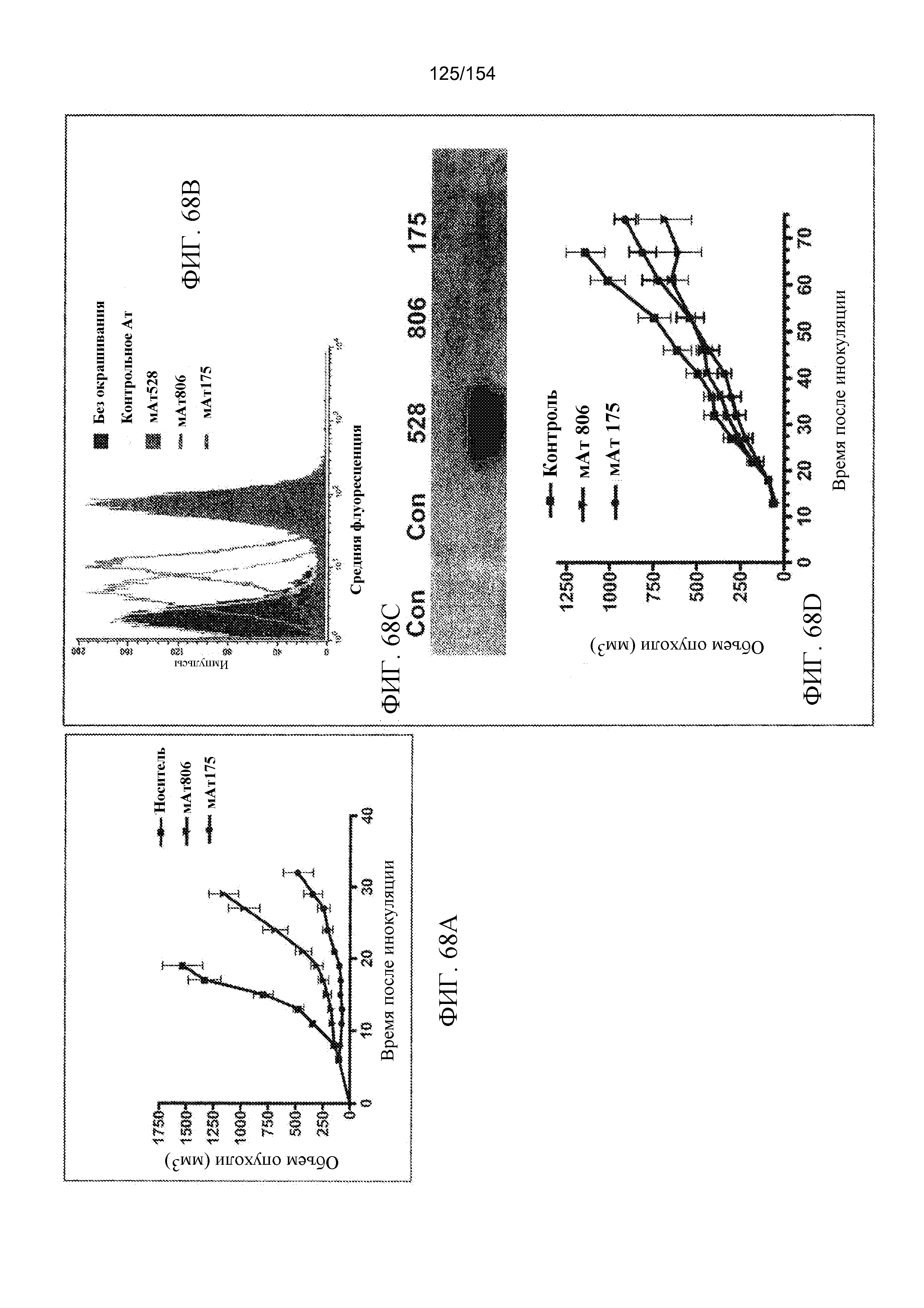
На фиг. 68A, 68B, 68C и 68D показаны противоопухолевые эффекты мАт175 на ксенотрансплантаты клеток рака головного мозга и предстательной железы. (A) Мышам (n=5), имеющим ксенотрансплантаты U87MG.Δ2-7, внутрибрюшинно инъецировали PBS, 1 мг мАт175 или мАт806 (положительный контроль), трижды в неделю в течение двух недель в дни 6, 8, 10, 13, 15 и 17 от дня, когда начальный объем опухоли составлял 100 мм3. Данные представлены как средний объем опухолей ± стандартная ошибка. (B) Клетки окрашивали двумя нерелевантными антителами (голубая маркировка, не полая, и зеленая маркировка, полая), мАт528 на EGFR в целом (розовая маркировка, не полая), мАт806 (бледно-голубая маркировка, полая) и мАт175 (оранжевая маркировка, полая), а затем анализировали с помощью FACS. (C) Клетки DU145 подвергали лизису, иммунопреципитации с помощью мАт528, мАт806, мАт175 или двух независимых нерелевантных антител, а затем иммуноблоттингу для выявления EGFR. (D) Мышам (n=5), имеющим ксенотрансплантаты DU145, внутрибрюшинно инъецировали PBS, 1 мг мАт175 или мАт806, ежедневно в дни 18-22, 25-29 и 39-43 от дня, когда начальный объем опухоли составлял 85 мм3. Данные представлены как средний объем опухолей ± стандартная ошибка.
На фиг. 69A, 69B, 69C, 69D, 69E и 69F представлены кристаллические структуры пептида 287-302 EGFR, связанного с Fab-фрагментами: (A) Рисунок Fab 806, при этом маркировка легкой цепи является красной; тяжелой цепи - голубой; связанного пептида - желтой; а наложенного EGFR287-302 из EGFR - пурпурной. (B) Рисунок Fab 175, при этом маркировка легкой цепи является желтой; тяжелой цепи - зеленой; связанного пептида - сиреневой; а EGFR287-302 из EGFR(DI-3) - пурпурной. (C) Деталь рисунка (B), демонстрирующая схожесть EGFR287-302 в рецепторе с пептидом, связанным с Fab 175. Основы пептидов показаны в виде полос Cα, а взаимодействующие боковые цепи - в виде веточек. Атомы O имеют красную окраску; N - голубую; S - оранжевую, а C, как и основная цепь. (D) Наложение EGFR c образованием комплекса Fab175:пептид, демонстрирующее пространственное перекрытие. Окраска, как в (C), при этом поверхность EGFR187-286 имеет бирюзовую окраску. (E) Перпендикулярный (D) вид, при этом EFR187-286 показан непрозрачной голубой краской, а поверхность легкой цепи и тяжелой цепей - прозрачными оранжевой и зеленой красками, соответственно. (F) Детальное пространственное представление комплекса с 175 Fab для исследования антигенсвязывающего сайта. Окраска, как в (C), а водородные связи, образуемые боковыми цепями, отмечены черными точками. Молекулы воды, погруженные внутрь после образования комплекса, представлены в виде красных сфер.
На фиг. 70A, 70B, 70C и 70D демонстрируется влияние связи между цистеинами 271 и 283 на связывание мАт806 с EGFR. (A) Клетки, трансфицированные EGFR дикого типа, мутантом EGFR-C271A, EGFR-C283A или C271A/C283A, подвергали окрашиванию мАт528 (сплошная розовая гистограмма), мАт806 (голубая линия) или только вторым антителом (пурпурная), а затем анализировали с помощью FACS. Увеличение устанавливали, используя совпадающее по классу нерелевантное антитело. (B) Клетки BaF3, экспрессирующие EGFR-C271A или C271/283A EGFR, исследовали в отношении их ответной реакции на EGF в анализе на основе MTT, как описано. EC50S выводили, используя выравнивание по Больцману частных значений наблюдений. Данные представляют среднее значение и стандартное отклонение определений в трех повторах. (C) Клетки BaF3, экспрессирующие EGFR дикого типа или EGFR-C271A/C283A, лишали IL-3 и сыворотки, а затем подвергали воздействию EGF или носителя в качестве контроля. Полноклеточные лизаты разделяли с помощью электрофореза в SDS-ПААГ и подвергали гибридизации с антителом против фосфотирозина (верхняя панель) или антителом против EGFR (нижняя панель). (D) Клетки BaF3, экспрессирующие EGFR дикого типа (левая панель) или C271A/C283A EGFR (правая панель), подвергали стимуляции увеличивающими концентрациями EGF в отсутствие антитела (незакрашенные символы), в присутствии мАт528 (серые кружки) или мАт806 (черные треугольники), оба в концентрации 10 мкг/мл. Данные представлены как среднее значение и стандартное отклонение определений в трех повторах.
На фиг. 71A, 71B и 71C демонстрируются: (A) полученное в гамме-камере изображение биораспределения111In-ch806 по всему телу пациента с метастатическим плоскоклеточным раком голосовой связки, демонстрирующее высокую в количественном отношении степень абсорбции опухолью в правой части шеи (стрелка). Также видна активность в пуле крови и незначительный катаболизм свободного111In в печени. (B) Полученное при однофотонной эмиссионной компьютерной томографии (SPECT) изображение шеи этого пациента, демонстрирующее абсорбцию111In-ch806 жизнеспособной опухолью (стрелка), при этом уменьшенная абсорбция в центре служит признаком некроза. (C) Соответствующее изображение шеи, полученное при КТ (компьютерной томографии), демонстрирующее большую опухолевую массу в правой части шеи (стрелка) с некрозом в центре.
На фиг. 72A и 72B представлена пространственная модель структуры неаутоингибированного EGFR1-621. Остов рецептора имеет голубую маркировку, а лиганд TGF-α красную. Эпитоп для мАт806/175 имеет бирюзовую маркировку, а дисульфидные связи - желтую. Атомы дисульфидной связи, которая затягивает эпитоп снова в рецептор, представлены в заполняющем пространство формате. Модель была сконструирована посредством состыковки домена CR2 EGFR-ECD из аутоингибированной конформации со структурой неаутоингибированного мономера EGFR в присутствии его лиганда.
На фиг. 73 демонстрируется реактивность мАт806 с фрагментами EGFR. Лизаты клеток 293T, трансфицированных векторами, экспрессирующими растворимый фрагмент 1-501 EGFR или слитые белки GH/фрагмент EGFR (GH-274-501, GH-282-501, GH-290-501 и GH-298-501) разделяли с помощью электрофореза в SDS-ПААГ, переносили на мембрану и подвергали гибридизации с мАт806 (левая панель) или антителом против myc 9B11 (правая панель).
На фиг. 74A и 74B представлены последовательность нуклеиновой кислоты (SEQ ID NO: 128) и аминокислотная последовательность(и) (SEQ ID NO: 129), соответственно, VH-области мАт175.
На фиг. 75A и 75B представлены последовательность нуклеиновой кислоты (SEQ ID NO: 133) и аминокислотная последовательность(и) (SEQ ID NO: 134), соответственно, VL-области мАт175.
На фиг. 76A, 76B и 76C представлены (A) приведенная к объему концентрация продукта и (B) концентрация жизнеспособных клеток в случае hu806-трансфектантов GS-CHO (14D8, 15B2 и 40A10) и GS-NS0 (36) при мелкомасштабном культивировании во встряхиваемых колбах (100 мл). Концентрацию продукта определяли с помощью ELISA, используя антиидиотипическое (анти-806) антитело в качестве антитела для покрытия и ch806 (клиническая серия: J06024) в качестве стандарта; (C) рост клеток-трансфектантов GS-CHO 40A10 и объемная продукция в биореакторе - смесительном чане на 15 л. Концентрация жизнеспособных клеток (◆×105 клеток/мл), жизнеспособность клеток (■) и продукция (▲ мг/л).
На фиг. 77A, 77B, 77C, 77D и 77E показан анализ с помощью хроматографии с исключением по размеру (Biosep SEC-S3000) подвергнутых очистке с использованием белка A конструкций антитела hu806, полученных в результате мелкомасштабного культивирования, и контрольных ch806 и мАт 806. В верхних и нижних панелях каждой фигуры представлены хроматограммы при ОП214 нм и ОП280 нм, соответственно.
На фиг. 78 показан анализ с помощью хроматографии с исключением по размеру (Biosep SEC-S3000) подвергнутой очистке с использованием белка A конструкции антитела hu806 из 40A10 после высокомасштабной продукции и очистке с использованием белка А. Представлена хроматограмма при ОП214 нм, указывающая на составляющую 98,8% чистоту с 1,2% присутствующего агрегата.
На фиг. 79 показано, что готовые 4-20% гели в Трис/глициновом буфере от Novex, США использовались в стандартных условиях для электрофореза в SDS-ПААГ для анализа очищенных из трансфектантов GS-CHO (14D8, 15B2 и 40A10) и GS-NS0 (36) препаратов hu806 (5 мкг) в восстанавливающих условиях. Белки выявляли с помощью окрашивания Кумасси синим.
На фиг. 80 показано, что готовые 4-20% гели в Трис/глициновом буфере использовались в стандартных условиях для электрофореза в SDS-ПААГ для анализа препаратов очищенного hu806 (5 мкг) из трансфектантов GS CHO (14D8, 15B2 и 40A10) и GS-NS0 (36) в невосстанавливающих условиях. Белки выявляли с помощью окрашивания Кумасси синим.
На фиг. 81 показано, что готовые 4-20% гели в Трис/глициновом буфере использовались в стандартных условиях для электрофореза в SDS-ПААГ для анализа очищенного из трансфектанта GS-CHO hu806 40A10 продукта (5 мкг) после высокомасштабной продукции. Белки выявляли с помощью окрашивания Кумасси синим.
На фиг. 82 показан анализ с помощью изоэлектрофокусировки в гелевой пластинке очищенного из трансфектанта GS-CHO hu806 40A10 продукта (5 мкг) после 15 л продукции. Белки выявляли с помощью окрашивания Кумасси синим. Дорожка 1, pI-маркеры; дорожка 2, hu806 (три изоформы, pI от 8,66 до 8,82); дорожка 3, pI-маркеры.
На фиг. 83 показано связывание с клетками A431: проточно-цитометрический анализ очищенных с использованием белка А препаратов антитела hu806 (20 мкг/мл) и совпадающего по изотипу контроля huA33 (20 мкг/мл). Контроли включают лишь второе антитело (зеленая маркировка) и ch806 (красная маркировка). Конструкции Hu806 были продуцированы в результате мелкомасштабного культивирования.
На фиг. 84 показано связывание с клетками A431: проточно- цитометрический анализ очищенных препаратов мАт806, ch806 и антитела hu806 40A10 (20 мкг/мл), которые связывают ~10% EGFR дикого типа на клеточной поверхности, 528 (которое связывается как с EGFR дикого типа, так и с de2-7 EGFR) и нерелевантного контрольного антитела (20 мкг/мл), как указано.
На фиг. 85 показано связывание с глиомными клетками U87MG.de2-7: проточно-цитометрический анализ очищенных препаратов мАт806, ch806 и антитела hu806 40A10 (20 мкг/мл), антитела против EGFR 528 и нерелевантного контрольного антитела (20 мкг/мл).
На фиг. 86 показано специфическое связывание меченных радиоактивным изотопом125I конструкций антитела 806 с (A) глиомными клетками U87MG.de2-7 и (B) клетками карциномы A431.
На фиг. 87 показан анализ Скетчарда: связывание меченных радиоактивным изотопом125I конструкций антитела ch806 (А) и hu806 (В) с клетками U87MG.de2-7.
На фиг. 88 показан анализ Скетчарда: связывание меченных радиоактивным изотопом125I конструкций антитела ch806 (А) и hu806 (В) с клетками A431.
На фиг. 89А и 89В продемонстрирован анализ BIAcore связывания эпитопа в виде пептида из аминокислот 287-302 EGFR для 806 антителом (A) hu806 и (B) ch806, пропускаемым над иммобилизованным пептидом в увеличивающихся концентрациях, составляющих 50 нМ, 100 нМ, 150 нМ, 200 нМ, 250 нМ и 300 нМ.
На фиг. 90А и 90В продемонстрирована достигаемая при помощи ch806 и hu806 антителозависимая клеточноопосредованная цитотоксичность в отношении являющихся мишенями клеток А431, определенная (А) при концентрации 1 мкг/мл каждого антитела в диапазоне отношений клетки-эффекторы/клетки-мишени (E:T=0,78:1 - 100:1); (В) при E:T=50:1 в диапазоне концентраций каждого антитела (3,15 нг/мл - 10 мкг/мл).
На фиг. 91 продемонстрировано лечение укоренившихся ксенотрансплантатов А431 у бестимусных мышей BALB/c. Группы из 5 мышей получили 6×1 мг доз в течение 2-недельного лечения антителами, как указано (стрелками). Представлен объем опухолей в виде среднего значения ± стандартное отклонение до завершения исследования.
На фиг. 92 продемонстрировано лечение укоренившихся ксенотрансплантатов U87MG.de2-7 у бестимусных мышей BALB/c. Группы из 5 мышей получили 6×1 мг доз в течение 2-недельного лечения антителами, как указано (стрелками). Представлен объем опухолей в виде среднего значения ± стандартное отклонение до завершения исследования.
На фиг. 93 представлены отклонения от значений химического сдвига в случайной спирали для мАт806-пептида: (A) N, (B) HN и (C) HA. Пептид был приготовлен в водном растворе, содержащем 5%2H2O, 70 мМ NaCl и 50 мМ NaPO4 при pH 6,8. Все спектры, использованные для последующих отнесений, были получены при 298K в спектрометре Bruker Avance500.
На фиг. 94A, 94B, 94C, 94D, 94E и 94F продемонстрированы полученные в гамме-камере снимки всего тела пациента 7, A) спереди и B) сзади, через 5 дней после инфузии111In-ch806. Налицо высокая степень абсорбции111In-ch806 метастатическими очагами поражениями в легких (стрелки). C) и D) демонстрируют метастатические очаги поражения (стрелки) на изображении, полученном при КТ. E) Трехмерные, полученные при однофотонной эмиссионной компьютерной томографии (SPECT) изображения грудной клетки и F) совмещенные трансаксиальные изображения, полученные при SPECT и КТ, демонстрирующие специфическую абсорбцию111In-ch806 метастатическими очагами поражения.
На фиг. 95A, 95B, 95C, 95D, 95E и 95F продемонстрированы лежащие в одной плоскости изображения головы и шеи пациента 8, полученные в A) день 0, B) день 3 и C) день 7 после инфузии111In-ch806. Исходная активность в пуле крови наблюдается в день 0, а абсорбция111In-ch806 анапластической астроцитомой в правой лобной доле налицо к дню 3 (стрелка) и увеличивается к дню 7. Специфическая абсорбция111In-ch806 подтверждается на D) полученном при SPECT изображении головного мозга (стрелка), налицо в месте опухоли (стрелка), при E)18F-FDG позитронно-эмиссионной томографии и F) ЯМР-томографии.
На фиг. 96A, 96B, 96C и 96D показано, что налицо схожая абсорбция111In-ch806 опухолью у пациента 3 по сравнению с пациентом 4, несмотря на различия в экспрессии антигена для 806 в подвергнутых скринингу образцах опухолей. A) Локализация111In-ch806 в метастазе в легкое (стрелка) на полученном при SPECT, трансаксиальном изображении у пациента 4, с явной активностью в сердечном пуле крови (B). B) Соответствующее изображение, полученное при КТ. Установлено, что заархивированная опухоль имела составляющую <10% положительность в отношении экспрессии антигена для 806. C) Локализация111In-ch806 в метастазе в легкое (стрелка) у пациента 3, с явной активностью в сердечном пуле крови. D) Соответствующее изображение, полученное при КТ. Установлено, что заархивированная опухоль имела составляющую 50-75% положительность в отношении экспрессии антигена для 806.
На фиг. 97 показана фармакокинетика белка ch806, определяемого с помощью ELISA, для объединенной популяции. Наблюдаемые и прогнозируемые % ID/л в случае ch806 в зависимости от времени после инфузии (ч).
На фиг. 98A и 98B представлены относящиеся к отдельным пациентам результаты для A) приведенного выведения из организма и B) выведения печенью111In-ch806 при уровнях доз, составляющих 5 мг/м2 (■), 10 мг/м2 (Δ), 20 мг/м2 (∇) и 40 мг/м2 (◆). Линейная регрессия для совокупности данных, указанных в каждой панели [A) r2=0,9595; B) r2=0,9415].
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением могут использоваться общепринятые методы молекулярной биологии, микробиологии и рекомбинантных ДНК в пределах знаний в данной области техники. Такие методы полностью объяснены в литературе. См., например, Sambrook et al., ʺMolecular Cloning: A Laboratory Manualʺ (1989); ʺCurrent Protocols in Molecular Biologyʺ Volumes I-E [Ausubel, R.M., ed. (1994)]; ʺCell Biology: A Laboratory Handbookʺ Volumes I-III [J.E. Celis, ed. (1994))]; ʺCurrent Protocols in Immunologyʺ Volumes I-III [Coligan, J.E., ed. (1994)]; ʺOligonucleotide Synthesisʺ (M.J. Gait ed. 1984); ʺNucleic Acid Hybridizationʺ [B.D. Hames & S.J. Higgins eds. (1985)]; ʺTranscription And Translationʺ [B.D. Hames & S.J. Higgins, eds. (1984)]; ʺAnimal Cell Cultureʺ [R.I. Freshney, ed. (1986)]; ʺImmobilized Cells And Enzymesʺ [IRL Press, (1986)]; B. Perbal, ʺA Practical Guide To Molecular Cloningʺ (1984).
Считается, что используемые здесь следующие термины имеют, без ограничения, представленные определения.
Термин ʺчлен специфического связыванияʺ описывает член пары молекул, обладающих специфичностью связывания друг с другом. Члены специфически связывающейся пары могут быть получены из природного источника или быть полностью или частично синтетически полученными. Один член пары молекул имеет участок на своей поверхности, или углубление, который специфически связывается с особой пространственной и полярной структурой другого члена пары молекул и, следовательно, комплементарен этой структуре. Таким образом, члены пары обладают свойством связываться специфически друг с другом. Примерами типов специфически связывающихся пар являются антиген-антитело, биотин-авидин, гормон-рецептор гормона, рецептор-лиганд, фермент-субстрат. Эта заявка имеет отношение к реакциям типа антиген-антитело.
Термин ʺаберрантная экспрессияʺ в его различных грамматических формах может означать и включать любую увеличенную или измененную экспрессию или сверхэкспрессию белка в ткани, например, увеличение количества белка, вызванное любым способом, в том числе в результате увеличенной экспрессии или трансляции, модуляции промотора или регулятора белка, амплификации гена белка, или увеличения полупериода существования или стабильности, так что в любой момент времени существует или может быть обнаружено больше белка, чем в состоянии без сверхэкспрессии. Аберрантная экспрессия включает и предполагает любой сценарий или изменение, в котором механизм экспрессии или посттрансляционной модификации белка в клетке чрезмерно напряжен или иначе нарушен вследствие увеличенной экспрессии или увеличенных уровней или количеств белка, в том числе, в котором экспрессируется измененный белок, как например, мутированный белок или вариант вследствие изменения последовательности, делеции из нее или вставки в нее или измененной укладки.
Важно понимать, что термин ʺаберрантная экспрессияʺ был специально выбран здесь для охвата состояния, при котором присутствуют анормальные (обычно увеличенные) количества/уровни белка, независимо от действующей причины этого анормального количества или уровня. Таким образом, анормальные количества белка могут быть следствием сверхэкспрессии белка в отсутствие амплификации гена, которая является случаем, например, во многих образцах клеток/тканей, взятых из головы и шеи субъектов с раком, в то время как другие образцы демонстрируют анормальные уровни белка, связанные с амплификацией гена.
В связи с последним из двух названных случаев некоторая часть работы авторов настоящего изобретения, которая здесь представлена для иллюстрации настоящего изобретения, включает анализ образцов, некоторые из которых демонстрируют анормальные уровни белка, являющиеся следствием амплификации гена EFGR. Поэтому это является причиной представления здесь экспериментальных данных, в которых упоминается амплификация, и использования терминов ʺамплификация/амплифицированныйʺ и т.п. при описании анормальных уровней EFGR. Однако именно измерение анормальных количеств или уровней белка определяет условие или случай, при котором предусматривается клиническое вмешательство, например, посредством обращения к связывающим членам настоящего изобретения, и по этой причине авторы настоящего изобретения считают, что термин ʺаберрантная экспрессияʺ шире отражает причинные факторы, которые порождают соответствующую анормальность в уровнях EFGR.
Соответственно, несмотря на то, что термины ʺсверхэкспрессияʺ и ʺамплификацияʺ в их различных грамматических формах, как подразумевается, имеют отличные технические значения, они должны считаться эквивалентными друг другу, поскольку они отражают состояние, в котором присутствуют анормальные уровни белка EFGR, в связи с настоящим изобретением. Соответственно, термин ʺаберрантная экспрессияʺ был выбран, поскольку он, как полагают, включает термины ʺсверхэкспрессияʺ и ʺамплификацияʺ в свой объем с целью настоящего изобретения, вследствие чего все термины, как здесь используются, могут считаться эквивалентными друг другу.
Термин ʺантителоʺ описывает иммуноглобулин, либо природный, либо частично или полностью синтетически полученный. Термин также охватывает любой полипептид или белок, имеющий связывающий домен, который является связывающим доменом антитела или гомологичным такому домену. Под этим термином также предполагаются антитела с пересаженными CDR.
Поскольку антитела можно модифицировать рядом способов, термин ʺантителоʺ должен рассматривается как термин, охватывающий любой член или вещество специфического связывания, имеющий(ее) связывающий домен с требуемой специфичностью. Таким образом, этот термин охватывает фрагменты антител, производные, функциональные эквиваленты и гомологи антител, включающие любой полипептид, включающий связывающий домен иммуноглобулина, либо природный, либо полностью или частично синтетический. Следовательно, включены химерные молекулы, включающие связывающий домен иммуноглобулина, или эквивалент, слитый с другим полипептидом. Клонирование и экспрессия химерных антител описаны в EP-A-0120694 и EP-A-0125023, и в патентах США № 4816397 и 4816567.
Было установлено, что фрагменты целостного антитела могут выполнять функцию связывания антигенов. Примерами связывающих фрагментов являются (i) Fab-фрагмент, состоящий из VL-, VH-, CL- и CH1-доменов; (ii) Fd-фрагмент, состоящий из VH- и CH1-доменов; (iii) Fv-фрагмент, состоящий из VL- и VH-доменов одного антитела; (iv) dAb-фрагмент (Ward, E.S. et al. (1989) Nature 341, 544-546), который состоит из VH-домена; (v) выделенные CDR-участки; (vi) F(ab')2-фрагмент, двухвалентный фрагмент, включающий два связанных Fab-фрагмента, (vii) одноцепочечные Fv молекулы (scFv), в которых VH-домен и VL-домен связаны пептидным линкером, который позволяет двум доменам объединяться с образованием антигенсвязывающего сайта (Bird et al. (1988) Science. 242, 423-426; Huston et al. (1988) PNAS USA. 85, 5879-5883); (viii) поливалентные фрагменты антител (димеры, тримеры и/или тетрамеры scFv (Power and Hudson (2000) J. Immunol. Methods 242, 193-204); (ix) биспецифические димеры одноцепочечных Fv молекул (PCT/US92/09965) и (x) ʺдиателаʺ, поливалентные или полиспецифические фрагменты, созданные посредством слияния генов (W094/13804; P. Holliger et al. (1993) Proc. Natl. Acad. Sci. USA 90, 6444-6448).
ʺСайт соединения антителаʺ представляет собой такую структурную часть молекулы антитела, состоящую из легкой цепи или вариабельных областей и гипервариабельных участков тяжелой и легкой цепи, которая специфически связывает антиген.
Выражение ʺмолекула антителаʺ в его различных грамматических формах, как здесь используется, предполагает как интактную молекулу иммуноглобулина, так и иммунологически активную часть молекулы иммуноглобулина.
Приводимыми в качестве примеров молекулами антител являются интактные молекулы иммуноглобулинов, по существу интактные молекулы иммуноглобулинов и такие части молекулы иммуноглобулина, которые содержат паратоп (антигенсвязывающий центр), в том числе те части, которые известны в данной области техники как Fab, Fab', F(ab')2 и F (v), которые являются предпочтительными частями для использования в терапевтических способах, описанных здесь.
Антитела могут также быть биспецифическими, при этом один связывающий домен антитела является членом специфического связывания настоящего изобретения, а другой связывающий домен обладает отличной специфичностью, например, для укрепления эффекторной функции или т.п. Биспецифические антитела настоящего изобретения включают те, в которых один связывающий домен антитела является членом специфического связывания настоящего изобретения, в том числе его фрагментом, а другой связывающий домен является отличным антителом или его фрагментом, в том числе фрагментом отличного антитела против EGFR, например, антитела 528 (патент США № 4943533), химерного и гуманизированного антитела 225 (патент США № 4943533 и WO/9640210), антитела против de2-7, такого как DH8.3 (Hills, D. et al. (1995) Int. J. Cancer. 63(4), 537-543), антитела L8A4 и Y10 (Reist, C.J. et al. (1995) Cancer Res. 55 (19): 4375-4382; Foulon C.F. et al. (2000) Cancer Res. 60 (16): 4453-4460), ICR62 (Modjtahedi H. et al. (1993) Cell Biophys. Jan-Jun; 22 (1-3): 129-46; Modjtahedi et al. (2002) P.A.A.C.R. 55 (14): 3140-3148) или антитела, описанного Wikstrand и др. (Wikstrand C. et al. (1995) Cancer Res. 55 (14): 3140-3148). Другим связывающим доменом может быть антитело, которое распознает или направлено против конкретного типа клеток, как например, специфичное в отношении нервных или глиальных клеток антитело. В биспецифических антителах настоящего изобретения один связывающий домен антитела настоящего изобретения может быть объединен с другими связывающими доменами или молекулами, которые распознают рецепторы конкретных клеток и/или модулируют клетки особым образом, например, иммуномодулятором (например, интерлейкином(ами)), модулятором роста или цитокином (например, фактором некроза опухолей (TNF), и, в частности, TNF с биспецифической модальностью, продемонстрированной в заявке на патент США № 60/355838, поданной 13 февраля 2002 года, которая включена сюда в полном объеме) или токсином (например, рицином), или антимитотическим средством или апоптозным агентом или фактором.
Fab- и F(ab')2-части молекул антител можно приготовить с помощью протеолитической реакции папаина и пепсина, соответственно, на по существу интактные молекулы антител с использованием способов, которые хорошо известны. См., например, патент США № 4342566, выданный Theofilopolous и др. Fab'-части молекул антител также хорошо известны и получают из F(ab')2-частей с последующим восстановлением дисульфидных связей, связывающих две части тяжелых цепей, например, с помощью меркаптоэтанола, и с последующим алкилированием результирующего белка меркаптана с использованием такого реагента, как йодацетамид. Здесь предпочтительным является антитело, содержащее интактные молекулы антител.
Выражение ʺмоноклональное антителоʺ в его различных грамматических формах относится к антителу, имеющему лишь один вид сайта соединения антитела, способный к вступлению в иммунореакцию с конкретным антигеном. Таким образом, моноклональное антитело обычно проявляет одну аффинность связывания с каким-либо антигеном, с которым оно вступает в иммунореакцию. Моноклональное антитело может также содержать молекулу антитела, имеющую множество сайтов соединения антитела, каждый из которых является иммуноспецифическим в отношении отличного антигена; например, биспецифическое (химерное) моноклональное антитело.
Термин ʺантигенсвязывающий доменʺ описывает часть антитела, которая включает участок, который специфически связывается с частью антигена или всем антигеном и комплементарен указанной части или всему антигену. Если антиген является большим, антитело может связываться лишь с особой частью антигена, которую называют эпитопом. Антигенсвязывающий домен может обеспечиваться одним или несколькими вариабельными доменами антитела. Предпочтительно, когда антигенсвязывающий домен включает вариабельную область легкой цепи антитела (VL) и вариабельную область тяжелой цепи антитела (VH).
ʺПосттрансляционная модификацияʺ может включать любую одну из модификаций или комбинацию модификаций, включающих ковалентную модификацию, которой белок подвергается после завершения трансляции и после отсоединения от рибосомы или в момент образования полипептида котрансляционно. Посттрансляционная модификация включает, но без ограничения, фосфорилирование, миристилирование, убиквитинирование, гликозилирование, присоединение коэнзима, метилирование и ацетилирование. Посттрансляционная модификация может модулировать или оказывать воздействие на активность белка, его внутриклеточное или экстраклеточное целевое положение, его стабильность или полупериод существования, и/или его распознавание лигандами, рецепторами или другими белками. Посттрансляционная модификация может происходить в клеточных органеллах, в ядре или цитоплазме, или экстраклеточно.
Термин ʺспецифическийʺ может использоваться для обращения к ситуации, в которой один член специфически связывающейся пары не будет демонстрировать какое-либо значительное связывание с молекулами, отличными от его партнера(ов) по специфическому связыванию. Термин также применим, когда, например, антигенсвязывающий домен является специфичным в отношении конкретного эпитопа, которым обладает ряд антигенов, в этом случае член специфического связывания, обладающий антигенсвязывающим доменом, будет способен к связыванию с различными антигенами, обладающими эпитопом.
Термин ʺвключает(ют)ʺ обычно используется в смысле включает, иначе говоря, допуская присутствие одного или более признаков или компонентов.
Термин ʺпо существу состоящий изʺ относится к продукту, в частности последовательности пептида, из определенного числа остатков, который не присоединен ковалентно к большему продукту. В случае пептида настоящего изобретения, упоминаемого выше, квалифицированные в данной области техники специалисты признают, что можно, однако, ожидать минорные модификации на N- или C-конце пептида, такие как химическая модификация конца для добавления защитной группы или т.п., например, амидирование C-конца.
Термин ʺвыделенныйʺ относится к состоянию, в котором будут находиться, в соответствии с настоящим изобретением, члены специфического связывания настоящего изобретения или нуклеиновая кислота, кодирующая члены с таким связыванием. Члены и нуклеиновая кислота не будут содержать или по существу не будут содержать материал, с которым они объединены в природном состоянии, такой как другие полипептиды или нуклеиновые кислоты, с которыми они обнаруживаются в своем природном окружении, или среду, в которой они приготовлены (например, культуру клеток), когда такое приготовление осуществляют с помощью технологии рекомбинантных ДНК, осуществляемой in vitro или in vivo. Члены и нуклеиновая кислота могут быть составлены в смесь с разбавителями или вспомогательными веществами и, тем не менее, для практических результатов быть выделенными - например, члены обычно будут смешаны с желатином или другими носителями в случае использования для покрытия титрационных микропланшетов для использования в иммуноанализах или будут смешаны с фармацевтически приемлемыми носителями или разбавителями при использовании для диагностики или терапии. Члены специфического связывания могут быть гликозилированными, либо по природе, или с помощью систем гетерологичных эукариотических клеток, или они могут быть (например, в случае продукции посредством экспрессии в прокариотической клетке) негликозилированными.
Также, как здесь используются, термины ʺгликозилированиеʺ и ʺгликозилированныйʺ включают и охватывают посттрансляционную модификацию белков, называемых гликопротеинами, посредством присоединения олигосахаридов. Присоединение олигосахаридов, в частности, включающих N-связывающиеся олигосахариды и О-связывающиеся олигосахариды, осуществляется в сайтах гликозилирования в гликопротеинах. N-связывающиеся олигосахариды присоединятся к остатку Asn, особенно, когда остаток Asn находится в последовательности N-X-S/T, где X не может быть Pro или Asp, и являются олигосахаридами, чаще всего обнаруживаемыми в гликопротеинах. При биосинтезе N-связанных гликопротеинов сначала в эндоплазматическом ретикулуме (ER) образуется гликопротеин, включающий тип олигосахарида с высоким содержанием маннозы (обычно состоящий из долихола, N-ацетилглюкозамина, маннозы и глюкозы). Гликопротеины, включающие тип олигосахаридов с высоким содержанием маннозы, затем перемещаются из эндоплазматического ретикулума в аппарат Гольджи, где происходит дальнейшее процессирование и модификация олигосахаридов. О-связывающиеся олигосахариды присоединяются к гидроксильной группе остатка Ser или Thr. В случае О-связанных гликопротеинов N-ацетилглюкозамин сначала переносится на остаток Ser или Thr с помощью N-ацетилглюкозаминилтрансферазы в эндоплазматическом ретикулуме. Затем белок перемещается в аппарат Гольджи, где происходит дальнейшая модификация и удлинение цепи. О-связанные модификации могут происходить с помощью простого присоединения лишь моносахарида OGlcNAc в тех местах Ser или Thr, которые могут также, в отличных условиях, подвергаться фосфорилированию, а не гликозилированию.
Как здесь используется, ʺпгʺ означает пикограмм, ʺнгʺ означает нанограмм, ʺмкгʺ означает микрограмм, ʺмгʺ означает миллиграмм, ʺмклʺ означает микролитр, ʺмлʺ означает миллилитр, ʺлʺ означает литр.
Термины ʺантитело 806ʺ, ʺмАт806ʺ, ʺch806ʺ и любые варианты, не перечисленные при этом, могут использоваться здесь взаимозаменяемо и, как используются на всем протяжении настоящей заявки и в формуле изобретения, относятся к белковоподобному веществу, включающему один или множество белков, и распространяются на те белки, которые имеют характеристики - аминокислотные последовательности, описанные здесь и представленные в SEQ ID NO: 2 и SEQ ID NO: 4, и параметры активности, изложенные здесь и в формуле изобретения, и химерное антитело ch806, которое включено в SEQ ID NO: 7 и 8 и образует часть SEQ ID NO: 7 и 8. Соответственно, белки, проявляющие по существу эквивалентную или измененную активность, также предусматриваются. Эти модификации могут быть преднамеренными, например, в случае модификаций, осуществляемых благодаря сайт-направленному мутагенезу, или могут быть случайными в случае модификаций, происходящих благодаря мутациям у хозяев, которые являются продуцентами комплекса или его упомянутых субъединиц. Предполагается, что термины ʺантитело 806ʺ, ʺмАт806ʺ и ʺch806ʺ также включают в свой объем белки, упомянутые, в частности, здесь, а также все в значительной степени гомологичные аналоги и аллельные варианты.
Термины ʺгуманизированное антитело 806ʺ, ʺhu806ʺ и ʺвенированное антитело 806ʺ и любые варианты, не перечисленные при этом, могут использоваться здесь взаимозаменяемо и, как используются на всем протяжении настоящей заявки и в формуле изобретения, относятся к белковоподобному веществу, включающему один или множество белков, и распространяются на те белки, которые имеют характеристики - аминокислотные последовательности, описанные здесь и представленные в SEQ ID NO: 42 и SEQ ID NO: 47, и параметры активности, изложенные здесь и в формуле изобретения. Соответственно, белки, проявляющие по существу эквивалентную или измененную активность, также предусматриваются. Эти модификации могут быть преднамеренными, например, в случае модификаций, осуществляемых благодаря сайт-направленному мутагенезу, или могут быть случайными в случае модификаций, происходящих благодаря мутациям у хозяев, которые являются продуцентами комплекса или его упомянутых субъединиц. Предполагается, что термины ʺгуманизированное антитело 806ʺ, ʺhu806ʺ и ʺвенированное антитело 806ʺ также включают в свой объем белки, упомянутые, в частности, здесь, а также все в значительной степени гомологичные аналоги и аллельные варианты.
Термины ʺантитело 175ʺ и ʺмАт175ʺ и любые варианты, не перечисленные при этом, могут использоваться здесь взаимозаменяемо и, как используются на всем протяжении настоящей заявки и в формуле изобретения, относятся к белковоподобному веществу, включающему один или множество белков, и распространяются на те белки, которые имеют характеристики - аминокислотные последовательности, описанные здесь и представленные в SEQ ID NO: 129 и SEQ ID NO: 134, и параметры активности, изложенные здесь и в формуле изобретения. Соответственно, белки, проявляющие по существу эквивалентную или измененную активность, также предусматриваются. Эти модификации могут быть преднамеренными, например, в случае модификаций, осуществляемых благодаря сайт-направленному мутагенезу, или могут быть случайными в случае модификаций, происходящих благодаря мутациям у хозяев, которые являются продуцентами комплекса или его упомянутых субъединиц. Предполагается, что термины ʺантитело 175ʺ и ʺмАт175ʺ также включают в свой объем белки, упомянутые, в частности, здесь, а также все в значительной степени гомологичные аналоги и аллельные варианты.
Термины ʺантитело 124ʺ и ʺмАт124ʺ и любые варианты, не перечисленные при этом, могут использоваться здесь взаимозаменяемо и, как используются на всем протяжении настоящей заявки и в формуле изобретения, относятся к белковоподобному веществу, включающему один или множество белков, и распространяются на те белки, которые имеют характеристики - аминокислотные последовательности, описанные здесь и представленные в SEQ ID NO: 22 и SEQ ID NO: 27, и параметры активности, изложенные здесь и в формуле изобретения. Соответственно, белки, проявляющие по существу эквивалентную или измененную активность, также предусматриваются. Эти модификации могут быть преднамеренными, например, в случае модификаций, осуществляемых благодаря сайт-направленному мутагенезу, или могут быть случайными в случае модификаций, происходящих благодаря мутациям у хозяев, которые являются продуцентами комплекса или его упомянутых субъединиц. Предполагается, что термины ʺантитело 124ʺ и ʺмАт124ʺ также включают в свой объем белки, упомянутые, в частности, здесь, а также все в значительной степени гомологичные аналоги и аллельные варианты.
Термины ʺантитело 1133ʺ и ʺмАт1133ʺ и любые варианты, не перечисленные при этом, могут использоваться здесь взаимозаменяемо и, как используются на всем протяжении настоящей заявки и в формуле изобретения, относятся к белковоподобному веществу, включающему один или множество белков, и распространяются на те белки, которые имеют характеристики - аминокислотные последовательности, описанные здесь и представленные в SEQ ID NO: 32 и SEQ ID NO: 37, и параметры активности, изложенные здесь и в формуле изобретения. Соответственно, белки, проявляющие по существу эквивалентную или измененную активность, также предусматриваются. Эти модификации могут быть преднамеренными, например, в случае модификаций, осуществляемых благодаря сайт-направленному мутагенезу, или могут быть случайными в случае модификаций, происходящих благодаря мутациям у хозяев, которые являются продуцентами комплекса или его упомянутых субъединиц. Предполагается, что термины ʺантитело 1133ʺ и ʺмАт1133ʺ также включают в свой объем белки, упомянутые, в частности, здесь, а также все в значительной степени гомологичные аналоги и аллельные варианты.
Предпочтительно, когда описываемые здесь аминокислотные остатки находятся в изомерной ʺLʺ-форме. Однако остатками в изомерной ʺDʺ-форме можно заменить любой L-аминокислотный остаток, если у полипептида сохраняется желаемое функциональное свойство связывания иммуноглобулина. NH2 относится к свободной аминогруппе, присутствующей на аминоконце полипептида. COOH относится к свободной карбоксильной группе, присутствующей на карбоксильном конце полипептида. В соответствии со стандартной номенклатурой полипептидов, J. Biol. Chem., 243: 3552-3559 (1969), сокращения для аминокислотных остатков представлены в следующей таблице соответствия:
Таблица соответствия

Следует обратить внимание, что все последовательности аминокислотных остатков представлены здесь формулами, ориентация которых слева направо соответствует общепринятому направлению от аминоконца к карбоксильному концу. Кроме того, следует обратить внимание, что тире в начале или конце последовательности из аминокислотных остатков означает пептидную связь с дополнительной последовательностью из одного или более аминокислотных остатков. Таблица выше представлена для увязки трехбуквенных и однобуквенных изображений, которые могут альтернативно фигурировать здесь.
ʺРепликонʺ представляет собой любой генетический элемент (например, плазмиду, хромосому, вирус), который функционирует как автономная единица репликации ДНК in vivo; т.е. способен к репликации под своим собственным контролем.
ʺВекторʺ представляет собой репликон, такой как плазмида, фаг или космида, к которому может быть присоединен другой фрагмент ДНК для того, чтобы вызвать репликацию присоединенного сегмента.
ʺМолекула ДНКʺ относится к полимерной форме дезоксирибонуклеотидов (аденина, гуанина, тимина или цитозина) в своей либо одноцепочечной форме, либо форме двухцепочечной спирали. Этот термин относится лишь к первичной и вторичной структуре молекуле, и он не ограничивается какими-либо конкретными третичными формами. Таким образом, этот термин включает двухцепочечную ДНК, обнаруживаемую, в частности, в линейных молекулах ДНК (например, рестрикционных фрагментах), вирусах, плазмидах и хромосомах. При обсуждении структуры конкретных двухцепочечных молекул ДНК последовательности могут здесь описываться в соответствии с обычным правилом предоставления лишь последовательности в направлении от 5' к 3' вдоль нетранскрибируемой цепи ДНК (т.е. цепи, имеющей последовательность, гомологичную мРНК).
ʺНачало репликацииʺ относится к таким последовательностям ДНК, которые принимают участие в синтезе ДНК.
ʺКодирующей последовательностьюʺ ДНК является последовательность двухцепочечной ДНК, которая подвергается транскрипции и трансляции в полипептид in vivo после помещения под контроль соответствующих регуляторных последовательностей. Границы кодирующей последовательности определяются инициирующим кодоном на 5' (амино)конце и кодоном терминации трансляции на 3' (карбоксильном) конце. Кодирующая последовательность может включать, но без ограничения, прокариотические последовательности, кДНК на основе эукариотической мРНК, последовательности геномной ДНК из эукариотической ДНК (например, ДНК млекопитающего) и даже синтетические последовательности ДНК. Сигнал полиаденилирования и последовательность терминации транскрипции будут обычно располагаться 3' от кодирующей последовательности.
Контролирующими транскрипцию и трансляцию последовательностями являются регуляторные последовательности ДНК, такие как промоторы, энхансеры, сигналы полиаденилирования, терминаторы и т.п., которые обеспечивают экспрессию кодирующей последовательности в клетке-хозяине.
ʺПромоторной последовательностьюʺ является регуляторный район ДНК, способный связываться с РНК-полимеразой в клетке и инициировать транскрипцию в направлении экспрессии гена (3'-направлении) кодирующей последовательности. С целью определения настоящего изобретения, промоторная последовательность ограничивается на своем 3'-конце сайтом инициации транскрипции и простирается в направлении, противоположном направлению экспрессии (5'-направлении), с включением минимального числа оснований или элементов, необходимых для инициации транскрипции на выявляемых уровнях, превышающих фон. Внутри промоторной последовательности будет встречаться сайт инициации транскрипции (обычно определяемый с помощью картирования с использованием нуклеазы S1), а также связывающие белки домены (консенсусные последовательности), ответственные за связывание РНК-полимеразы. Эукариотические промоторы будут часто, но не всегда, содержать ʺTATAʺ-боксы и ʺCATʺ-боксы. Прокариотические промоторы содержат последовательности Шайна-Дальгарно помимо -10 и -35 консенсусных последовательностей.
ʺКонтролирующей экспрессию последовательностьюʺ является последовательность ДНК, которая контролирует и регулирует транскрипцию и трансляцию другой последовательности ДНК. Кодирующая последовательность находится ʺпод контролемʺ контролирующих транскрипцию и трансляцию последовательностей в клетке, когда РНК-полимераза транскрибирует кодирующую последовательность в мРНК, которая затем транслируется в белок, кодируемый кодирующей последовательностью.
Перед кодирующей последовательностью может быть включена ʺсигнальная последовательностьʺ. Эта последовательность кодирует сигнальный пептид, являющийся N-концевым относительно полипептида, который посылает клетке-хозяину сообщение о направлении полипептида на клеточную поверхность или о секреции полипептида в среды, и этот сигнальный пептид отрезается клеткой-хозяином прежде, чем белок покидает клетку. Сигнальные последовательности можно обнаружить связанными с рядом белков, присущих прокариотам и эукариотам.
Термин ʺолигонуклеотидʺ, как здесь используется при упоминании зонда настоящего изобретения, определяется как молекула, состоящая из двух или более рибонуклеотидов, предпочтительно более трех. Его точный размер будет зависеть от множества факторов, которые, в свою очередь, зависят от конечной функции и применения олигонуклеотида.
Используемый здесь термин ʺпраймерʺ относится к олигонуклеотиду, или встречающемуся в природе, как например, очищенный продукт расщепления рестриктазами, или созданному синтетически, который способен действовать в качестве точки инициации синтеза после помещения в условия, в которых индуцируется синтез продукта удлинения праймера, который комплементарен цепи нуклеиновой кислоты, т.е. в присутствии нуклеотидов и индуцирующего агента, такого как ДНК-полимераза, и при подходящей температуре и pH. Праймер может быть либо одноцепочечным, либо двухцепочечным и должен быть достаточно длинным, чтобы служить затравкой для синтеза желаемого продукта удлинения в присутствии индуцирующего агента. Точная длина праймера будет зависеть от множества факторов, включающих температуру, источник праймера и применения способа. Например, для диагностических применений, в зависимости от сложности последовательности-мишени, праймер в виде одигонуклеотида обычно содержит 15-25 или более нуклеотидов, хотя он может содержать меньшее число нуклеотидов.
Праймеры здесь выбирают так, чтобы они были ʺв значительной степениʺ комплементарны различным цепям конкретной, являющейся мишенью последовательности ДНК. Это означает, что праймеры должны быть достаточно комплементарными, чтобы гибридизоваться с соответствующими им цепями. Следовательно, не требуется, чтобы последовательность праймера отражала точную последовательность матрицы. Например, к 5'-концу праймера может быть присоединен некомплементарный нуклеотидный фрагмент, при этом оставшаяся часть последовательности праймера является комплементарной цепи. Альтернативно, в праймере могут быть расположены с интервалами некомплементарные основания или более длинные последовательности при условии, что последовательность праймера достаточно комплементарна последовательности цепи, чтобы гибридизоваться с ней и, тем самым, формировать матрицу для синтеза продукта удлинения.
Используемые здесь термины ʺрестрикционные эндонуклеазыʺ и ʺрестрикционные ферменты (рестриктазы)ʺ относятся к бактериальным ферментам, каждый из которых разрезает двухцепочечную ДНК в специфической нуклеотидной последовательности или вблизи нее.
Клетка является ʺтрансформированнойʺ экзогенной или гетерологичной ДНК, когда такая ДНК введена внутрь клетки. Трансформирующая ДНК может интегрироваться или может не интегрироваться (ковалентно связываться) в хромосомную ДНК, составляющую геном клетки. В прокариотах, дрожжах и клетках млекопитающих, например, трансформирующая ДНК может сохраняться в эписомном элементе, таком как плазмида. Что касается эукариотических клеток, стабильно трансформированной клеткой является клетка, в которой трансформирующая ДНК стала интегрированной в хромосому, вследствие чего она наследуется дочерними клетками благодаря репликации хромосом. Эта стабильность проявляется в способности эукариотической клетки к установлению линий клеток или клонов, состоящих из популяции дочерних клеток, содержащих трансформирующую ДНК. ʺКлонʺ представляет собой популяцию клеток, происходящих из одной клетки или общего предшественника в результате митоза. ʺЛиния клетокʺ представляет собой клон первичной клетки, который способен к стабильному росту in vitro в течение многих поколений.
Две последовательности ДНК являются ʺв значительной степени гомологичнымиʺ, когда по меньшей мере приблизительно 75% (предпочтительно по меньшей мере приблизительно 80% и наиболее предпочтительно по меньшей мере приблизительно 90 или 95%) нуклеотидов совпадают по всей заданной длине последовательностей ДНК. Последовательности, которые являются в значительной степени гомологичными, можно идентифицировать посредством сравнения последовательностей, имеющихся в банках данных о последовательностях, с использованием стандартного программного обеспечения или посредством сравнения последовательностей в эксперименте с использованием гибридизации по Саузерну, например, в жестких условиях, определенных для этой конкретной системы. Определение подходящих условий гибридизации находится в пределах знаний в данной области техники. См., например, Maniatis et al., выше; DNA Cloning, Vols. I & II, выше; Nucleic Acid Hybridization, выше.
Следует принимать во внимание, что внутри объема настоящего изобретения находятся последовательности ДНК, кодирующие члены специфического связывания (антитела) настоящего изобретения, которые кодируют антитела, имеющие представленные здесь последовательности, но которые являются вырожденными относительно таких последовательностей. Под ʺвырожденными относительноʺ подразумевается, что используется отличный трехбуквенный кодон для определения конкретной аминокислоты. В данной области техники хорошо известно, что следующие кодоны могут использоваться взаимозаменяемо для кодирования каждой конкретной аминокислоты:


Следует понимать, что определенные выше кодоны присутствуют в случае последовательностей РНК. Соответствующие кодоны в случае ДНК имеют T вместо U.
Например, в описанных последовательностях антител настоящего изобретения могут быть осуществлены мутации из условия, чтобы конкретный кодон был заменен на кодон, который кодирует отличную аминокислоту. Такую мутацию обычно осуществляют посредством осуществления наименьшего числа возможных изменений нуклеотидов. Мутацию с заменой этого типа можно осуществить для замены аминокислоты в результирующем белке неконсервативным образом (т.е. посредством замены кодона с заменой аминокислоты, относящейся к группе аминокислот, обладающих конкретным размером или свойством, на аминокислоту, относящуюся к другой группе) или консервативным образом (т.е. посредством замены кодона с заменой аминокислоты, относящейся к группе аминокислот, обладающих конкретным размером или свойством, на аминокислоту, относящуюся к этой же группе). Такая консервативная замена обычно приводит к меньшему изменению структуры и функции результирующего белка. По всей вероятности, неконсервативная замена изменит структуру, активность или функцию результирующего белка. Следует принимать во внимание, что настоящее изобретение включает последовательности, содержащие консервативные замены, которые не изменяют значительно активность или свойства связываться результирующего белка.
Одним из примеров различных групп аминокислот является следующий пример:
Аминокислоты с неполярными группами R:
аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан, метионин;
Аминокислоты с незаряженными полярными группами R:
глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин;
Аминокислоты с заряженными полярными группами R (отрицательно заряженными при рН 6,0):
аспарагиновая кислота, глутаминовая кислота;
Основные аминокислоты (положительно заряженные при рН 6,0):
лизин, аргинин, гистидин (при pH 6,0).
Другой группой могут быть те аминокислоты, которые обладают фенильными группами:
фенилаланин, триптофан, тирозин.
Другая группировка может быть осуществлена в соответствии с молекулярной массой (т.е. размером групп R):
Особенно предпочтительными заменами являются
- Lys вместо Arg и наоборот, так что положительный заряд может сохраняться;
- Glu вместо Asp и наоборот, так что отрицательный заряд может сохраняться;
- Ser вместо Thr, так что свободная -OH может сохраняться; и
- Gln вместо Asn, так что свободная NH2 может сохраняться.
Замены аминокислот могут также привести к подстановке аминокислоты с особенно предпочтительным свойством. Например, введение Cys может привести к потенциальному сайту для образования дисульфидных мостиков с другим Cys. His может быть введен в качестве особого ʺкаталитическогоʺ сайта (т.е. His может действовать в качестве кислоты или основания и является самой распространенной аминокислотой в биохимическом катализе). Pro может быть введен из-за его особенно плоской структуры, которая порождает троечные повороты в структуре белка.
Две аминокислотные последовательности являются ʺв значительной степени гомологичнымиʺ, когда по меньшей мере приблизительно 70% (предпочтительно по меньшей мере приблизительно 80% и наиболее предпочтительно по меньшей мере приблизительно 90 или 95%) аминокислотных остатков являются идентичными или представляют консервативные замены.
ʺГетерологичнымʺ районом ДНК-конструкции является идентифицируемый сегмент ДНК внутри большей молекулы ДНК, который не обнаруживается в соединении с большей молекулой в природе. Таким образом, когда гетерологичный район кодирует ген млекопитающего, ген будет обычно фланкирован ДНК, которая не фланкирует геномную ДНК млекопитающего в геноме организма - его источника. Другим примером гетерологичной кодирующей последовательности является конструкция, в которой сама кодирующая последовательность не обнаруживается в природе (например, кДНК, если геномная кодирующая последовательность содержит интроны, или синтетические последовательности, имеющие кодоны, отличные от таковых природного гена). Аллельные вариации или встречающиеся в природе мутационные явления не порождают гетерологичный район ДНК, описанный здесь.
Выражение ʺфармацевтически приемлемыеʺ относится к молекулярным объектам и композициям, которые являются физиологически переносимыми и обычно не вызывают аллергическую или схожую нежелательную реакцию, такую как желудочное расстройство, головокружение и т.п., после введения человеку.
Выражение ʺтерапевтически эффективное количествоʺ, как здесь используется, означает количество, достаточное для предотвращения, а предпочтительно уменьшения на по меньшей мере приблизительно 30 процентов, предпочтительно на по меньшей мере 50 процентов, предпочтительно на по меньшей мере 70 процентов, предпочтительно на по меньшей мере 80 процентов, предпочтительно на по меньшей мере 90% клинически значимого изменения роста или прогрессирования или митотической активности целевой клеточной массы, группы раковых клеток или опухоли, или другой патологической особенности. Может быть уменьшена, например, степень активации или активности EGFR или количество или число EGFR-положительных клеток, в частности, вступающих во взаимодействие с антителами или связывающими членами или положительных по ним клеток.
Последовательность ДНК является ʺфункционально связаннойʺ с контролирующей экспрессию последовательностью, когда контролирующая экспрессию последовательность контролирует и регулирует транскрипцию и трансляцию этой последовательности ДНК. Термин ʺфункционально связаннаяʺ включает обладание подходящим сигналом инициации (например, ATG) перед последовательностью ДНК, подвергаемой экспрессии, и сохранение правильной рамки считывания, чтобы сделать возможной экспрессию последовательности ДНК под контролем контролирующей экспрессию последовательности и продукцию желаемого продукта, кодируемого последовательностью ДНК. Если ген, который хотят встроить в рекомбинантную молекулу ДНК, не содержит подходящий сигнал инициации, такой сигнал инициации можно встроить перед геном.
Термин ʺстандартные условия гибридизацииʺ относится к связанным с солью и температурным условиям, по существу эквивалентным 5×SSC и 65ºC и для гибридизации, и для отмывки. Однако квалифицированному в данной области техники специалисту будет понятно, что такие ʺстандартные условия гибридизацииʺ зависят от конкретных условий, включающих концентрацию натрия и магния в буфере, длину и концентрацию нуклеотидной последовательности, процента несоответствий, процента формамида и т.п. При определении ʺстандартных условий гибридизацииʺ также важно, являются ли две гибридизуемые последовательности РНК-РНК, ДНК-ДНК или РНК-ДНК. Квалифицированный в данной области техники специалист может легко определить такие стандартные условия гибридизации в соответствии с широко известной формулой, причем гибридизацию проводят на температуре, которая обычно на 10-20ºC ниже предсказанной или определенной Tm, с использованием более жестких отмывок, при желании.
Настоящим изобретением предоставляется новый член специфического связывания, в частности, антитело или его фрагмент, в том числе иммуногенные фрагменты, который распознает эпитоп EGFR, который обнаруживается в образующих опухоль, гиперпролиферативных или анормальных клетках, в которых этот эпитоп является усиленным или выраженным в результате аберрантной посттрансляционной модификации и не является обнаруживаемым в нормальных клетках или клетках дикого типа. В конкретном, не ограничивающем варианте осуществления связывающий член, такой как антитело, распознает эпитоп EGFR, который является усиленным или выраженным в результате модификации с присоединением простых углеводов или раннего гликозилирования и является ослабленным или не выраженным в присутствии модификации или гликозилирования в результате присоединения сложных углеводов. Член специфического связывания, такой как антитело или его фрагмент, не связывается с нормальными клетками или клетками дикого типа, содержащими нормальный эпитоп EGFR или эпитоп EGFR дикого типа, или не распознает их в отсутствие сверхэкспрессии и в присутствии нормальной посттрансляционной модификации EGFR.
Настоящим изобретением, кроме того, предоставляются новые антитела 806, 175, 124, 1133, ch806 и hu806 и их фрагменты, в том числе иммуногенные фрагменты, которые распознают эпитоп EGFR, в частности, пептид EGFR (287CGADSYEMEEDGVRKC302 (SEQ ID NO: 14)), который обнаруживается в образующих опухоль, гиперпролиферативных или анормальных клетках, в которых этот эпитоп является усиленным, выявляемым или выраженным, и не является обнаруживаемым в нормальных клетках или клетках дикого типа. В конкретном, но не ограничивающем варианте осуществления антитело распознает эпитоп EGFR, который является усиленным или выраженным в результате модификации с присоединением простых углеводов или раннего гликозилирования и является ослабленным или не выраженным в присутствии модификации или гликозилирования в результате присоединения сложных углеводов. Антитело или его фрагмент не связывается с нормальными клетками или клетками дикого типа, содержащими нормальный эпитоп EGFR или эпитоп EGFR дикого типа, или не распознает их в отсутствие сверхэкспрессии, амплификации или канцерогенеза.
В конкретном аспекте настоящего изобретения, и как указано выше, авторы настоящего изобретения обнаружили новые моноклональные антитела 806, 175, 124, 1133, ch806 и hu806, которые специфически распознают амплифицированным EGFR дикого типа и de2-7 EGFR, хотя связываются с эпитопом, отличным от уникального соединительного пептида мутированного de2-7 EGFRn. Кроме того, несмотря на то, что мАт806, мАт175, мАт124, мАт1133 и hu806 не распознают нормальный EGFR дикого типа, представленный на клеточной поверхности глиомных клеток, они действительно связываются с экстраклеточным доменом EGFR, иммобилизованным на поверхности планшетов для ELISA, что служит признаком конформационного эпитопа в ракурсе полипептида.
Важно, что мАт806, мАт175, мАт124, мАт1133, ch806 и hu806 не связываются в значительной степени с нормальными тканями, такими как печень и кожа, которые экспрессируют эндогенный EGFR дикого типа на уровнях, которые превышают таковые в большей части других нормальных тканей, но в которых EGFR не является сверхэкспрессированным или амплифицированным. Таким образом, мАт806, мАт175, мАт124, мАт1133 и hu806 демонстрируют новую и полезную специфичность, распознавая de2-7 EGFR и амплифицированный EGFR, в то же время не распознавая нормальный EGFR дикого типа или уникальный соединительный пептид, который является характерной особенностью de2-7 EGFR. В предпочтительном аспекте мАт806, мАт175, мАт124, мАт11133 и hu806 настоящего изобретения включают аминокислотные последовательности CDR VH- и VL-доменов, показанные на фиг. 14B и 15B; 74B и 75B; 51B и 51D; 52B и 52D; и 55A и 55B, соответственно (SEQ ID NO: 2 и 4; 129 и 134; 22 и 27; 32 и 37; и 42 и 47, соответственно; SEQ ID NO: 42, включающую сигнальный пептид VH hu806, и последовательности VH SEQ ID NO: 163 и 164, соответственно, и SEQ ID NO: 47, включающую сигнальный пептид VL hu806, и последовательности VL SEQ ID NO: 165 и 166, соответственно).
В другом аспекте настоящим изобретением предоставляется антитело, способное конкурировать с антителом 175 в условиях, в которых связывание по меньшей мере 10% антитела, имеющего последовательности VH и VL антитела 175 (SEQ ID NO: 129 и 134, соответственно), с de2-7EGFR блокировано в результате конкуренции с таким антителом в анализе ELISA. Как изложено выше, здесь предусматриваются антиидиотипические антитела.
Настоящее изобретение относится к членам специфического связывания, в частности антителам или их фрагментам, которые распознают эпитоп EGFR, который присутствует в клетках, экспрессирующих амплифицированный ген EGFR или экспрессирующих de2-7 EGFR, и является не обнаруживаемым в клетках, экспрессирующих нормальный EGFR или EGFR дикого типа, особенно в присутствии нормальной посттрансляционной модификации.
Кроме того, обращается внимание и здесь демонстрируется, что дополнительным неограничивающим результатом наблюдения или характеристикой антител настоящего изобретения является распознавание ими своего эпитопа в присутствии большого числа остатков маннозы, которое является характерной особенностью раннего гликозилирования или модификации в результате присоединения простых углеводов. Таким образом, измененное или аберрантное гликозилирование обеспечивает присутствие и/или распознавание эпитопа антителом или включает часть распознаваемого антителом эпитопа.
Гликозилирование включает и охватывает посттрансляционную модификацию белков, называемых гликопротеинами, посредством присоединения олигосахаридов. Присоединение олигосахаридов, в частности, включающих N-связывающиеся олигосахариды и О-связывающиеся олигосахариды, осуществляется в сайтах гликозилирования в гликопротеинах. N-связывающиеся олигосахариды присоединятся к остатку Asn, особенно, когда остаток Asn находится в последовательности N-X-S/T, где X не может быть Pro или Asp, и являются олигосахаридами, чаще всего обнаруживаемыми в гликопротеинах. При биосинтезе N-связанных гликопротеинов сначала в эндоплазматическом ретикулуме образуется гликопротеин, включающий тип олигосахарида с высоким содержанием маннозы (обычно состоящий из долихола, N-ацетилглюкозамина, маннозы и глюкозы). Гликопротеины, включающие тип олигосахаридов с высоким содержанием маннозы, затем перемещаются из эндоплазматического ретикулума в аппарат Гольджи, где обычно происходит дальнейшее процессирование и модификация олигосахаридов. О-связывающиеся олигосахариды присоединяются к гидроксильной группе остатка Ser или Thr. В случае О-связанных гликопротеинов N-ацетилглюкозамин сначала переносится на остаток Ser или Thr с помощью N-ацетилглюкозаминилтрансферазы в эндоплазматическом ретикулуме. Затем белок перемещается в аппарат Гольджи, где происходит дальнейшая модификация и удлинение цепи.
В конкретном аспекте настоящего изобретения, и как указано выше, авторы настоящего изобретения обнаружили новые моноклональные антитела, примерами которых здесь являются антитела, названные мАт806 (и его химерная форма ch806), мАт175, мАт124, мАт1133 и hu806, которые специфически распознают амплифицированный EGFR дикого типа и de2-7 EGFR, хотя связываются с эпитопом, отличным от уникального соединительного пептида мутированного de2-7 EGFR. Антитела настоящего изобретения специфически распознают сверхэкспрессированный EGFR, в том числе амплифицированный EGFR, и мутантный EGFR (примером которого здесь является мутация de2-7), в частности, в результате аберрантной посттрансляционной модификации. Кроме того, несмотря на то, что эти антитела не распознают нормальный EGFR дикого типа, представленный на клеточной поверхности глиомных клеток, они действительно связываются с экстраклеточным доменом EGFR, иммобилизованным на поверхности планшетов для ELISA, что служит признаком конформационного эпитопа в ракурсе полипептида. Важно, что эти антитела не связываются в значительной степени с нормальными тканями, такими как печень и кожа, которые экспрессируют эндогенный EGFR дикого типа на уровнях, которые превышают таковые в большей части других нормальных тканей, но в которых EGFR не является сверхэкспрессированным или амплифицированным. Таким образом, эти антитела демонстрируют новую и полезную специфичность, распознавая de2-7 EGFR и амплифицированный EGFR, в то же время не распознавая нормальный EGFR дикого типа или уникальный соединительный пептид, который является характерной особенностью de2-7 EGFR.
В предпочтительном аспекте антителами являются антитела, которые имеют характеристики антител, которые были идентифицированы и охарактеризованы авторами настоящего изобретения, в частности, распознающие амплифицированный EGFR и de2-7EGFR. В особенно предпочтительных аспектах антителами являются мАт806, мАт175, мАт124, мАт1133 и hu806 или их активные фрагменты. В дальнейшем предпочтительном аспекте антитело настоящего изобретения включает аминокислотные последовательности VH и VL, показанные на фиг. 16 и 17; 74B и 75B; 51B и 51D; 52B и 52D; и 55A и 55B, соответственно.
Предпочтительно эпитоп, распознаваемый членом специфического связывания или антителом, располагается в области, включающей остатки 273-501 последовательности зрелого нормального EGFR или EGFR дикого типа, и предпочтительно эпитоп включает остатки 287-302 (SEQ ID NO: 14) последовательности зрелого нормального EGFR или EGFR дикого типа. Следовательно, также предоставляются белки специфического связывания, такие как антитела, которые связываются с de2-7 EGFR в эпитопе, который располагается в области, включающей остатки 273-501 последовательности EGFR и включающей остатки 287-302 последовательности EGFR (SEQ ID NO: 14). Эпитоп можно определить с помощью любых общепринятых методов картирования эпитопов, известных квалифицированному в данной области техники специалисту. Альтернативно, можно было бы расщепить последовательности ДНК, кодирующие остатки 273-501 и 287-302 (SEQ ID NO: 14), и результирующие фрагменты экспрессировать в подходящем хозяине. Связывание антител можно было бы определить, как указано выше.
В частности, член будет связываться с эпитопом, включающим остатки 273-501, а конкретнее, включающим остатки 287-302 (SEQ ID NO: 14) зрелого нормального EGFR или EGFR дикого типа. Однако аспект настоящего изобретения также составляют другие антитела, которые демонстрируют такую же или в значительной степени аналогичную картину реактивности. Их можно определить посредством сравнения таких членов с антителом, включающим VH- и VL-домены, представленные в SEQ ID NO: 2 и 4; 129 и 134; 22 и 27; 32 и 37; и 42 и 47, соответственно. Сравнение будет обычно проводиться, используя Вестерн-блоттинг, в котором связывающие члены подвергают связыванию с блотами в двух повторах, приготовленными из ядерного препарата клеток, вследствие чего можно непосредственно сравнивать картины связывания.
В другом аспекте настоящим изобретением предоставляется антитело, способное конкурировать с мАт806 в условиях, в которых связывание по меньшей мере 10% антитела, имеющего последовательности VH и VL одного из таких антител, с de2-7EGFR блокировано в результате конкуренции с таким антителом в анализе ELISA. Как изложено выше, здесь предусматриваются и проиллюстрированы антиидиотипические антитела.
В другом аспекте настоящим изобретением предоставляется антитело, способное конкурировать с мАт175, мАт124 и/или мАт1133 в условиях, в которых связывание по меньшей мере 10% антитела, имеющего последовательности VH и VL одного из таких антител, с de2-7EGFR блокировано в результате конкуренции с таким антителом в анализе ELISA. Как изложено выше, здесь предусматриваются и проиллюстрированы антиидиотипические антитела.
В другом аспекте настоящим изобретением предоставляется антитело, способное конкурировать с мАт806, мАт175, мАт124, мАт1133 и/или hu806 в условиях, в которых связывание по меньшей мере 10% антитела, имеющего последовательности VH и VL одного из таких антител, с de2-7EGFR блокировано в результате конкуренции с таким антителом в анализе ELISA. Как изложено выше, здесь предусматриваются и проиллюстрированы антиидиотипические антитела.
Выделенный полипептид, по существу состоящий из эпитопа, включающего остатки 273-501, а конкретнее, включающего остатки 287-302 (SEQ ID NO: 14) зрелого EGFR дикого типа, составляет другой аспект настоящего изобретения. Пептид настоящего изобретения, в частности, применим в диагностических исследованиях или наборах и терапевтически или профилактически, в том числе в качестве противоопухолевой или противораковой вакцины. Таким образом, композиции пептида настоящего изобретения включают фармацевтические композиции и иммуногенные композиции.
Диагностические и терапевтические применения
Уникальная специфичность членов специфического связывания, в частности антител или их фрагментов, настоящего изобретения, в силу чего связывающие члены(член) распознают эпитоп EGFR, который обнаруживается в образующих опухоль, гиперпролиферативных или анормальных клетках и обычно не является обнаруживаемым в нормальных клетках или клетках дикого типа, причем этот эпитоп является усиленным или выраженным в результате аберрантной посттрансляционной модификации, и причем члены(член) связываются с de2-7 EGFR и амплифицированным EGFR, но не с EGFR дикого типа, обеспечивает диагностические и терапевтические применения для идентификации, определения характеристик и превращения в мишени и лечения, сокращения или ликвидации ряда типов образующих опухоль клеток и типов опухолей, например, опухолей головы и шеи, молочной железы, легкого, мочевого пузыря или предстательной железы и глиомы, без проблем, связанных с абсорбцией нормальными тканями, которую можно наблюдать при использовании ранее известных антител против EGFR. Таким образом, клетки, сверхэкспрессирующие EGFR (например, в результате амплификации или экспрессии мутанта или варианта EGFR), особенно те, которые демонстрируют аберрантную посттрансляционную модификацию, могут быть распознаны, выделены, охарактеризованы, превращены в мишень и подвергнуты лечению или ликвидации, используя связывающий член(ы), в частности, антитело(а) или их фрагменты, настоящего изобретения.
В дальнейшем аспекте настоящего изобретения предоставляется способ лечения опухоли, ракового состояния, предракового состояния и любого состояния, связанного с ростом гиперпролиферативных клеток или являющего следствием такого роста, включающий введение мАт806, мАт175, мАт124, мАт1133 и/или hu806.
Антитела настоящего изобретения могут, таким образом, специфическим образом определить природу положительных по EGFR опухолей или образующих опухоль клеток посредством окрашивания или иного распознавания этих опухолей или клеток, в которых налицо сверхэкспрессия EGFR, в том числе амплификация и/или мутация EGFR, в частности de2-7EGFR. Кроме того, антитела настоящего изобретения, примерами которых являются мАт806 (и химерное антитело ch806), мАт175, мАт124, мАт1133 и hu806, демонстрируют значительную in vivo противоопухолевую активность против опухолей, содержащих амплифицированный EGFR, и против положительных по de2-7 EGFR ксенотрансплантатов.
Как изложено выше, авторы настоящего изобретения обнаружили, что член специфического связывания настоящего изобретения распознает связанные с опухолями формы EGFR (de2-7 EGFR и амплифицированный EGFR), но не нормальный рецептор дикого типа, экспрессируемый в нормальных клетках. Полагают, что распознавание антителом зависит от аберрантной посттрансляционной модификации (например, уникального варианта гликозилирования, ацетилирования или фосфорилирования) EGFR, представленного в клетках, демонстрирующих сверхэкспрессию гена EGFR.
Как описывается ниже, антитела настоящего изобретения были использованы в терапевтических исследованиях и, как установлено, ингибируют рост сверхэкспрессирующих (например, в результате амплификации) EGFR ксенотрансплантатов и экспрессирующих de2-7 EGFR человека ксенотрансплантатов опухолей человека и вызывают значительный некроз в таких опухолях.
Кроме того, антитела настоящего изобретения ингибируют рост внутричерепных опухолей в превентивной модели. Эта модель предполагает инъекцию глиомных клеток, экспрессирующих de2-7 EGFR, бестимусным мышам, а затем внутричерепную инъекцию антитела либо в тот же день, либо в пределах 1-3 дней, необязательно с использованием многократных доз. Подходяще, когда дозы составляют приблизительно 10 мкг. Мышей, которым инъецировали антитело, сравнивают с контролями, и было установлено, что выживаемость подвергнутых лечению мышей значительно увеличивается.
Следовательно, в дальнейшем аспекте настоящего изобретения предоставляется способ лечения опухоли, ракового состояния, предракового состояния и любого состояния, связанного с ростом гиперпролиферативных клеток или являющегося следствием такого роста, включающий введение члена специфического связывания настоящего изобретения.
Антитела настоящего изобретения предназначены для использования в способах диагностирования и лечения опухолей у являющихся людьми или животными субъектов, в частности, эпителиальных опухолей. Эти опухоли могут быть первичными или вторичными солидными опухолями любого типа, включающими, но без ограничения, глиому, опухоли молочной железы, легкого, предстательной железы, головы или шеи.
Создание связывающих членов и антител
Общая методология для приготовления моноклональных антител с помощью гибридом хорошо известна. Линии иммортализованных, продуцирующих антитела клеток можно также создать с помощью методов, отличных от слияния, таких как непосредственная трансформация B-лимфоцитов онкогенной ДНК или трансфекция вирусом Эпштейна-Барр. См., например, M. Schreier et al., ʺHybridoma Techniquesʺ (1980); Hammering et al., ʺMonoclonal Antibodies And T cell Hybridomasʺ (1981); Kennett et al., ʺMonoclonal Antibodiesʺ (1980); см. также патенты США № 4341761, 4399121, 4427783, 4444887, 4451570, 4466917, 4472500, 4491632 и 4493890.
Панели моноклональных антител, созданных против EFGR, можно подвергнуть скринингу на различные свойства; т.е. изотип, эпитоп, аффинность и т.д. Особый интерес представляют моноклональные антитела, которые имитируют активность EFGR или его субъединиц. Такие моноклональные антитела можно без труда идентифицировать в анализах активности членов специфического связывания. Также применимы антитела с высокой аффинностью, когда возможна иммуноаффинная очистка природного или рекомбинантного члена специфического связывания.
Способы получения поликлональных антител против EFGR хорошо известны в данной области техники. См. патент США № 4493795, выданный Nestor и др. Моноклональное антитело, обычно содержащее Fab- и/или F(ab')2-части эффективных молекул антител, можно приготовить, используя гибридомную технологию, описанную в Antibodies-A Laboratory Manual, Harlow and Lane, eds., Cold Spring Harbor Laboratory, New York (1988), который включен сюда посредством ссылки. Вкратце, для создания гибридомы, из которой получают структуру в виде моноклонального антитела, линию клеток миеломы или других могущих сохраняться бесконечно клеток сливают с лимфоцитами, полученными из селезенки млекопитающего, гипериммунизированного соответствующим EGFR.
Спленоциты обычно сливают с миеломными клетками, используя полиэтиленгликоль (ПЭГ) 6000. Полученные в результате слияния гибриды отбирают в соответствии с их чувствительностью к HAT. Гибридомы, продуцирующие моноклональное антитело, применимое при осуществлении этого изобретения, идентифицируют по их способности к вступлению в иммунореакцию с антителом или связывающим членом настоящего изобретения и по их способности к ингибированию определенной онкогенной или гиперпролиферативной активности в клетках-мишенях.
Моноклональное антитело, применимое при осуществлении настоящего изобретения, можно продуцировать посредством инициации культуры продуцирующей моноклональное антитело гибридомы, включающей питательную среду, содержащую гибридому, которая секретирует молекулы антитела со специфичностью к соответствующему антигену. Культуру поддерживают в условиях и в течение периода времени, достаточных для секреции гибридомой молекул антител в среду. Содержащую антитела среду затем собирают. Затем молекулы антитела можно выделить далее с помощью широко известных методов.
Среды, применимые для приготовления этих структур, являются и широко известными в данной области техники, и имеющимися в продаже и включают синтетические культуральные среды, инбредных мышей и т.п. Приводимой в качестве примера синтетической средой является минимальная поддерживающая среда Дульбекко (DMEM; Dulbecco et al., Virol. 8: 396 (1959)), дополненная 4,5 г/л глюкозы, 20 мМ глутамином и 20% фетальной телячьей сыворотки. Приводимой в качестве примера линией инбредных мышей является Balb/c.
В данной области техники также широко известны способы продуцирования моноклональных антител против EGFR. См. Niman et al., Proc. Natl. Acad. Sci. USA, 80: 4949-4953 (1983). В качестве иммуногена обычно используют EGFR или пептидный аналог либо сам по себе, либо в соединении с иммуногенным носителем в ранее описанной процедуре для продуцирования моноклональных антител против EGFR. Гибридомы подвергают скринингу на способность к продукции антитела, которое вступает в иммунореакцию с EGFR, присутствующим в образующих опухоль, анормальных или гиперпролиферативных клетках. Другие антитела против EGFR включают, но без ограничения, антитело HuMAX-EGFr от Genmab/Medarex, антитело 108 (ATCC HB9764 и патент США № 6217866) и антитело 14E1 от Schering AG (патент США № 5942602).
Рекомбинантные связывающие члены, химерные молекулы, биспецифические молекулы и фрагменты
Обычно CDR1-участки, включающие аминокислотные последовательности, по существу представленные как CDR1-участки с SEQ ID NO: 2 и 4; 129 и 134; 22 и 27; 32 и 37; и 42 и 47, соответственно, будут содержаться в структуре, которая позволяет CDR1-участкам связываться с опухолевым антигеном. В случае CDR1-участка с SEQ ID NO: 4, например, его предпочтительно содержит участок VL с SEQ ID NO: 4 (и аналогично в случае других перечисленных последовательностей).
Обычно CDR2-участки, включающие аминокислотные последовательности, по существу представленные как CDR2-участки с SEQ ID NO: 2 и 4; 129 и 134; 22 и 27; 32 и 37; и 42 и 47, соответственно, будут содержаться в структуре, которая позволяет CDR2-участкам связываться с опухолевым антигеном. В случае CDR2-участка с SEQ ID NO: 4, например, его предпочтительно содержит участок VL с SEQ ID NO: 4 (и аналогично в случае других перечисленных последовательностей).
Обычно CDR3-участки, включающие аминокислотные последовательности, по существу представленные как CDR3-участки с SEQ ID NO: 2 и 4; 129 и 134; 22 и 27; 32 и 37; и 42 и 47, соответственно, будут содержаться в структуре, которая позволяет CDR3-участкам связываться с опухолевым антигеном. В случае CDR3-участка SEQ ID NO: 4, например, его предпочтительно содержит участок VL с SEQ ID NO: 4 (и аналогично в случае других перечисленных последовательностей).
Под ʺпо существу представленныеʺ подразумевается, что CDR-участки, например CDR3-участки, настоящего изобретения будут либо идентичны, либо в высокой степени гомологичны определенным участкам с SEQ ID NO: 2 и 4; 129 и 134; 22 и 27; 32 и 37; и 42 и 47, соответственно. Под термином ʺв высокой степени гомологичныеʺ имеется в виду, что в одном или нескольких CDR может быть осуществлено лишь небольшое число замен, предпочтительно от 1 до 8, предпочтительно от 1 до 5, предпочтительно от 1 до 4, или от 1 до 3, или 1, или 2 замены. Также предполагается, что такие термины включают усечения CDR при условии, что результирующее антитело проявляет уникальные свойства класса антител, обсуждаемых здесь, например, проявляемые мАт806, мАт175, мАт124, мАт1133 и hu806.
Обычно структурой, содержащей CDR настоящего изобретения, в частности CDR3, будет структура с последовательностью тяжелой или легкой цепи антитела или ее существенная часть, в которой CDR-участки располагаются в местах, соответствующих местам CDR-участков встречающихся в природе вариабельных доменов тяжелой и легкой цепей антитела - VH- и VL-доменов, кодируемых подвергнутыми реаранжировке генами иммуноглобулинов. Структуры и местонахождения вариабельных доменов иммуноглобулинов можно определить, основываясь на Kabat, E.A. et al., Sequences of Proteins of Immunological Interest. 4th Edition. US Department of Health and Human Services. 1987, и его обновления, в настоящее время имеющиеся в Интернете (http://immuno.bme.nwu.edu)). Кроме того, как это известно квалифицированным в данной области техники специалистам, определения CDR можно осуществить различными путями. Можно использовать, например, анализы для определения доменов по Kabat, Chothia и комбинированные анализы. В связи с этим см., например, http://www.bioinf.org.uk/abs/#cdrid.
Предпочтительно, аминокислотные последовательности, по существу представленные как остатки CDR VH в антителах настоящего изобретения, находятся в вариабельном домене тяжелой цепи антитела человека или его существенной части, а аминокислотные последовательности, по существу представленные как остатки CDR VL в антителах настоящего изобретения, находятся в вариабельном домене легкой цепи антитела человека или его существенной части.
Вариабельные домены могут происходить из вариабельного домена зародышевой линии или подвергшегося реаранжировке вариабельного домена человека или могут быть синтетическим вариабельным доменом, основанным на консенсусных последовательностях известных вариабельных доменов человека. Происходящие из CDR3 последовательности настоящего изобретения, например описанные в предшествующем параграфе, могут быть встроены в набор вариабельных доменов, в которых отсутствуют CDR3-участки, с использованием технологии рекомбинантных ДНК.
Например, Marks и др. (Bio/Technology, 1992, 10: 779-783) описывают способы создания наборов вариабельных доменов антител, в которых используются консенсусные праймеры, ориентированные на 5'-конец вариабельного домена или примыкающую к нему область, в соединении с консенсусными праймерами к третьей каркасной области генов VH человека для обеспечения набора вариабельных доменов VH, в которых отсутствует CDR3. Marks и др., кроме того, описывают, каким образом этот набор можно объединить с CDR3 конкретного антитела. Используя аналогичные методы, происходящие из CDR3 последовательности настоящего изобретения могут быть перетасованы с наборами VH- или VL-доменов, в которых отсутствует CDR3, и перетасованные полные VH- или VL-домены могут быть объединены с родственным VL- или VH-доменом для обеспечения членов специфического связывания настоящего изобретения. Затем набор можно представить в подходящей системе хозяина, такой как система фагового дисплея W092/01047, вследствие чего могут быть отобраны подходящие члены специфического связывания. Набор может состоять из чего-нибудь, начиная с 104 индивидуальных членов, например, от 106 до 108или 1010 членов.
Аналогичные способы перетасовки или комбинаторные методы также описаны Stemmer (Nature, 1994, 370: 389-391), который описывает метод по отношению к гену β-лактамазы, но высказывается, что этот подход может использоваться для создания антител.
Дополнительной альтернативой является создание новых VH- или VL-областей, содержащих происходящие из CDR3 последовательности настоящего изобретения, используя неспецифический мутагенез, например, генов VH или VL мАт806 для порождения мутаций внутри целого вариабельного домена. Такой метод описан Gram и др. (1992, Proc. Natl. Acad. Sci., USA, 89: 3576-3580), которые использовали допускающую ошибки ПЦР.
Другим способом, который может использоваться, является мутагенез, направленный на CDR-участки генов VH или VL. Такие методы описаны Barbas и др. (1994, Proc. Natl. Acad. Sci. USA, 91: 3809-3813) и Schier и др. (1996, J. Mol. Biol. 263: 551-567).
Все описанные выше методы известны как таковые в данной области техники и сами по себе не образуют часть настоящего изобретения. Квалифицированный специалист сможет использовать такие методы для обеспечения членов специфического связывания настоящего изобретения, используя обычную в данной области техники методологию.
Существенная часть вариабельного домена иммуноглобулина будет включать по меньшей мере три CDR-участка вместе с находящимися между ними каркасными областями. Предпочтительно эта часть будет также включать по меньшей мере приблизительно 50% либо одной из двух, либо обеих следующих областей: первой и четвертой каркасных областей, при этом этими 50% являются C-концевые 50% первой каркасной области и N-концевые 50% четвертой каркасной области. Дополнительные остатки на N-конце или C-конце существенной части вариабельного домена могут быть такими, которые обычно не присоединены к встречающимся к природе вариабельным доменам. Например, конструирование членов специфического связывания настоящего изобретения, осуществляемое с помощью методов рекомбинантных ДНК, может привести к введению N- или C-концевых остатков, кодируемых линкерами, встроенными для облегчения клонирования или других стадий манипулирования. Другие стадии манипулирования включают встраивания линкеров для соединения вариабельных доменов настоящего изобретения с дополнительными последовательностями белков, в том числе тяжелыми цепями иммуноглобулинов, другими вариабельными доменами (например, при создании диател) или являющимися белками метками, обсуждаемыми подробнее ниже.
Хотя в предпочтительном аспекте настоящего изобретения члены специфического связывания, включающие пару связывающих доменов на основе последовательностей, по существу представленных в SEQ ID NO: 2 и 4; 129 и 134; 22 и 27; 32 и 37; и 42 и 47, соответственно, являются предпочтительными, одноцепочечные связывающие домены на основе этих последовательностей составляют дополнительные аспекты настоящего изобретения. В случае связывающих доменов на основе последовательности, по существу представленной в VH-доменах, такие связывающие домены могут использоваться в качестве агентов, мишенями которых являются опухолевые антигены, поскольку известно, что VH-домены иммуноглобулинов способны связываться с антигенами-мишенями специфическим образом.
В случае любого из одноцепочечных специфически связывающих доменов эти домены могут использоваться для скрининга на комплементарные домены, способные к образованию двухдоменного специфически связывающегося члена, который имеет in vivo характеристики, все равно что таковые или равные таковым антител мАт806, ch806, мАт175, мАт124, мАт1133 и hu806, описанных здесь.
Это можно с успехом выполнить с помощью способов скрининга молекул фагового дисплея, используя так называемый иерархический двойной комбинаторный подход, описанный в патенте США № 5969108, при котором индивидуальный клон, содержащий либо H-, либо L-цепь, используют для инфицирования полной библиотеки клонов, кодирующих другую цепь (L или H), и результирующий двухцепочечный специфически связывающийся член отбирают в соответствии с методами фагового дисплея, такими как те, которые описаны в этой ссылке. Этот метод также описан Marks и др., там же.
Члены специфического связывания настоящего изобретения могут, кроме того, включать константные области антитела или их части. Например, члены специфического связывания на основе последовательностей VL-доменов могут быть присоединены у своего C-конца к константным доменам легкой цепи антитела, в том числе Cκ или Cλ человека, предпочтительно Cλ. Также члены специфического связывания на основе последовательностей VH-доменов могут быть присоединены у своего C-конца ко всей или части тяжелой цепи иммуноглобулина, происходящей из любого изотипа антитела, например, IgG, IgA, IgE, IgD и IgM и любого из подклассов изотипов, в частности, IgG1, IgG2b и IgG4. IgG1 является предпочтительным.
Создание технологии моноклональных антител (мАт) 25 лет назад обеспечило громадный набор применимых в исследованиях реагентов и создало возможность использования антител в качестве разрешенных фармацевтических веществ для лечения рака, аутоиммунных заболеваний, отторжений трансплантатов, противовирусной профилактики и в качестве антитромботических средств (Glennie and Johnson, 2000). Использование молекулярной инженерии для превращения мАт мыши в химерные мАт (мышиная V-область, человеческая C-область) и гуманизированные вещества, в которых лишь определяющие комплементарность районы (CDR) мАт имеют мышиное происхождение, было решающим в клиническом успехе лечения мАт. Созданные мАт имели заметно уменьшенную иммуногенность или не имели ее, имели увеличенный полупериод существования в сыворотке, а Fc-часть человека в мАт увеличивает возможность привлечения к участию иммуноэффекторов комплемента и цитотоксических клеток (Clark 2000). Для исследований биораспределения, фармакокинетики и любой индукции иммунного ответа на клинически вводимые мАт необходима разработка анализов, позволяющих отличить фармацевтические белки от эндогенных белков.
Антитела или любые их фрагменты могут также быть конъюгированы или рекомбинантно слиты с любым клеточным токсином, бактериальным или другим, например, экзотоксином Pseudomonas, рицином или дифтерийным токсином. Используемой частью токсина может быть весь токсин или любой конкретный домен токсина. Такие молекулы антитело-токсин были с успехом использованы для направленной доставки и лечения различных типов раков, см., например, Pastan, Biochim. Biophys. Acta. 1997 Oct. 24; 1333 (2): C1-6; Kreitman et al., N. Engl. J. Med. 2001 Jul. 26; 345 (4): 241-247; Schnell et al., Leukemia. 2000 Jan.; 14 (1): 129-135; Ghetie et al., Mol. Biotechnol. 2001 Jul.; 18 (3): 251-268.
Би- и триспецифические мультимеры можно создать посредством соединения различных молекул scFv, и они были разработаны в качестве перекрестно-сшиващих реагентов для рекрутмента T-клеток в опухоли (иммунотерапии), вирусной переориентации (генной терапии) и в качестве реагентов для агглютинации эритроцитов (иммунодиагностики), см., например, Todorovska et al., J. Immunol. Methods. 2001 Feb. 1; 248 (l-2): 47-66; Tomlinson et al., Methods Enzymol. 2000; 326: 461-479; McCall et al., J. Immunol. 2001 May 15; 166 (10): 6112-6117.
Полностью человеческие антитела можно приготовить посредством иммунизации трансгенных мышей, содержащих большие части тяжелой и легкой цепей иммуноглобулинов человека. Эти мыши, примерами которых являются XenomouseTM (Abgenix, Inc.) (патенты США № 6075181 и 6150584), HuMAb-MouseTM (Medarex, Inc./GenPharm) (патенты США № 5545806 и 5569825), TransChromo Mouse (Kirin) и KM Mouse (Medarex/Kirin), широко известны в данной области техники.
Антитела можно к тому же приготовить, например, с помощью стандартной гибридобной технологии или с помощью фагового дисплея. Эти антитела будут в этом случае содержать только полностью человеческие аминокислотные последовательности.
Полностью человеческие антитела можно также создать с использованием фагового дисплея человеческих библиотек. Фаговый дисплей можно выполнить, используя способы, хорошо известные квалифицированному специалисту, как например, способы Hoogenboom и др. и Marks и др. (Hoogenboom H.R. and Winter G. (1992) J. Mol. Biol. 227 (2): 381-388; Marks J.D. et al. (1991) J. Mol. Biol. 222 (3): 581-597; а также патенты США № 5885793 и 5969108).
Терапевтические антитела и применения
In vivo характеристики, в частности, что касается отношения локализаций опухоль:кровь и скорости выведения, членов специфического связывания настоящего изобретения будут по меньшей мере сравнимыми с таковыми мАт806. После введения являющемуся человеком или животным субъекту такой член специфического связывания будет демонстрировать максимальное отношение опухоль:кровь, составляющее >1:1. Предпочтительно при таком отношении член специфического связывания будет также демонстрировать отношение локализаций опухоль:орган, превышающее 1:1, предпочтительно превышающее 2:1, более предпочтительно превышающее 5:1. Предпочтительно при таком отношении член специфического связывания будет также демонстрировать отношение локализаций орган:кровь, составляющее <1:1 в органах вдали от места опухоли. Эти отношения исключают органы катаболизма и выделения введенного члена специфического связывания. Таким образом, в случае scFv и Fab (как показано в сопутствующих примерах), связывающие члены выделяются через почки, и здесь их присутствие больше, чем в других органах. В случае цельных IgG выведение будет, по меньшей мере отчасти, происходить через печень. Максимальное отношение локализаций интактного антитела будет обычно достигаться через 10-200 часов после введения члена специфического связывания. Конкретнее, отношение можно определить в опухолевом ксенотрансплантате весом приблизительно 0,2-1,0 г, созданном подкожно в одном боку бестимусной голой мыши.
Антитела настоящего изобретения можно пометить обнаруживаемой или функциональной меткой. Обнаруживаемые метки включают, но без ограничения, радиоактивные метки, такие как изотопы3H,14C,32P,35S,36Cl,51Cr,57Co,58Co,59Fe,90Y,121I,124I,125I,131I,111In,211At,198Au,67Cu,225Ac,213Bi,99Tc и186Re, которые можно присоединить к антителам настоящего изобретения, используя общепринятую химическую технологию, известную в области визуализации антител. Метки могут включать флуоресцентные метки и метки, обычно используемые в данной области техники для получения изображения с помощью ЯМР компьютерной томографии. Они также включают ферментные метки, такие как пероксидаза хрена. Метки, кроме того, включают химические составляющие, такие как биотин, который можно обнаружить через связывание со специфической родственной обнаруживаемой составляющей, например, меченым авидином.
Функциональные метки включают вещества, которые предназначены для направленной доставки в место опухоли для вызова разрушения опухолевой ткани. Такие функциональные метки включают цитотоксические лекарственные средства, такие как 5-фторурацил или рицин, и ферменты, такие как бактериальная карбоксипептидаза или нитроредуктаза, которые способны к превращению пролекарств в активные лекарственные средства в месте опухоли.
Также антитела, включающие как поликлональные, так и моноклональные антитела, и лекарственные средства, которые модулируют продукцию или активность членов специфического связывания, антитела и/или их субъединицы могут иметь определенные диагностические применения и могут, например, использоваться с целью обнаружения и/или определения таких состояний, как рак, предраковые патологические изменения, состояния, связанные с ростом гиперпролиферативных клеток или являющиеся следствием такого роста, или т.п. Например, члены специфического связывания, антитела или их субъедицы могут использоваться для продукции как поликлональных, так и моноклональных антител против них самих в ряде клеточных сред, с помощью известных методов, таких как гибридомная технология, в которой используются, например, слитые с миеломными клетками лимфоциты из селезенки мыши. Также небольшие молекулы, которые имитируют или вызывают противодействие активности(ям) членов специфического связывания настоящего изобретения, можно обнаружить или синтезировать, и они могут использоваться в диагностических и/или профилактических протоколах.
Меченные радиоактивными изотопами члены специфического связывания, в частности антитела и их фрагменты, применимы в методах in vitro диагностирования и в методах in vivo визуализации на основе радиоактивных изотопов, и в радиоиммунотерапии. В случае in vivo визуализации члены специфического связывания настоящего изобретения могут быть конъюгированы с визуализирующим средством, а не с радиоактивным изотопом(ами), включающим, но без ограничения, агент для усиления магнитно-резонансного изображения, при этом, например, в молекулу антитела вводят большое число парамагнитных ионов через хелатные группы. Примеры хелатных групп включают EDTA, порфирины, полиамины, краун-эфиры и полиоксимы. Примеры парамагнитных ионов включают гадолиний, железо, марганец, рений, европий, лантанид, гольмий и эрбий. В дальнейшем аспекте настоящего изобретения меченные радиоактивными изотопами члены специфического связывания, в частности антитела и их фрагменты, в частности радиоиммуноконъюгаты, применимы в радиоиммунотерапии, в частности в виде меченных радиоактивными метками антител для лечения рака. Опять же, в дальнейшем аспекте меченные радиоактивными изотопами члены специфического связывания, в частности антитела и их фрагменты, применимы в методах радиоиммуно-направленнной хирургии, в которых они могут идентифицировать и указывать на присутствие и/или местонахождение раковых клеток, предраковых клеток, опухолевых клеток и гиперпролиферативных клеток до, во время или после хирургического вмешательства для удаления этих клеток.
Иммуноконъюгаты или слитые с антителами белки настоящего изобретения, в которых члены специфического связывания, в частности антитела и их фрагменты, настоящего изобретения конъюгированы или соединены с другими молекулами или агентами, кроме того, включают, но без ограничения, связывающие члены, конъюгированные с химическим агентом для разрушения, токсином, иммномодулятором, цитокином, цитотоксическим агентом, химиотерапевтическим агентом или лекарственным средством.
Радиоиммунотерапия (RAIT) проникла в клинику и продемонстрировала эффективность при использовании иммуноконъюгатов на основе различных антител. Оценка меченного131I гуманизированного антитела hMN-14 против карциноэмбрионального антигена (CEA) была проведена на колоректальном раке (Behr T.M. et al. (2002) Cancer 94 (4 Suppl): 1373-1381), а оценка того же антитела с меткой в виде90Y была проведена на медуллярной карциноме щитовидной железы (Stein R. et al. (2002) Cancer 94 (1): 51-61). Радиоиммунотерапия с использованием моноклональных антител была также подвергнута оценке на неходжкинской лимфоме и раке поджелудочной железы, и отчет о ней был представлен (Goldenberg D.M. (2001) Crit. Rev. Oncol. Hematol. 39 (l-2): 195-201; Gold D.V. et al. (2001) Crit. Rev. Oncol. Hematol. 39 (1-2) 147-154). Радиоиммунотерапевтические способы с использованием конкретных антител также описаны в патентах США № 6306393 и 6331175. Радиоиммуно-направленнная хирургия (RIGS) также проникла в клинику и продемонстрировала эффективность и полезность, в том числе при использовании антител против CEA и антител, направленных против связанных с опухолями антигенов (Kim J.C. et al. (2002) Jut. J. Cancer 97(4): 542-547; Schneebaum, S. et al. (2001) World J. Surg. 25(12): 1495-1498; Avital, S. et al. (2000) Cancer 89(8): 1692-1698; McIntosh D.G. et al. (1997) Cancer Biother. Radiopharm. 12 (4): 287-294).
Антитела настоящего изобретения могут вводиться нуждающемуся в лечении пациенту любым подходящим путем, обычно с помощью инъекции в кровяное русло или цереброспинальную жидкость, или непосредственно в место опухоли. Точная доза будет зависеть от ряда факторов, включающих то, предназначено ли антитело для диагностирования или для лечения, размер и местонахождение опухоли, определенную природу антитела (то, является ли оно целым антителом, фрагментом, диателом и т.д.) и природу обнаруживаемой или функциональной метки, присоединяемой к антителу. В случае использования радионуклида подходящая максимальная однократная доза составляет от приблизительно 45 мКи/м2 до максимум приблизительно 250 мКи/м2. Предпочтительная доза находится в диапазоне, составляющем от 15 до 40 мКи, при этом также предпочтительным диапазоном доз является диапазон от 20 до 30 мКи или от 10 до 30 мКи. В случае такой терапии может потребоваться замещение костного мозга или стволовых клеток. Типичная доза для либо визуализации опухоли, либо лечения опухоли будет находиться в диапазоне от 0,5 до 40 мг, предпочтительно от 1 до 4 мг антитела в форме F(ab')2. Предпочтительно ʺголыеʺ антитела вводят в дозах, составляющих от 20 до 1000 мг белка в каждой дозе, или от 20 до 500 мг белка в каждой дозе, или от 20 до 100 мг белка в каждой дозе. Эта доза является дозой для однократного лечения взрослого пациента, которая может быть пропорционально установлена для детей и младенцев, и также установлена для других антительных форм пропорционально молекулярной массе. Лечения могут быть многократными с суточными, полунедельными, недельными или месячными интервалами, по усмотрению врача.
Эти препараты могут включать второй связывающий белок, такой как связывающие EGPR белки, описанные выше. В особенно предпочтительной форме этот второй связывающий белок представляет собой моноклональное антитело, такое как 528 или 225, обсуждаемое ниже.
Фармацевтические и терапевтические композиции
Члены специфического связывания настоящего изобретения будут обычно вводиться в форме фармацевтической композиции, которая может включать по меньшей мере один компонент помимо члена специфического связывания.
Таким образом, фармацевтические композиции в соответствии с настоящим изобретением и для применения в соответствии с настоящим изобретением могут включать, помимо активного ингредиента, фармацевтически приемлемый эксципиент, носитель, буфер, стабилизатор или другие вещества, хорошо известные квалифицированным в данной области техники специалистам. Такие вещества должны быть нетоксичными и не должны затрагивать эффективность активного ингредиента. Точная природа носителя или другого вещества будет зависеть от пути введения, который может быть оральным или с помощью инъекции, например, внутривенным.
Фармацевтические композиции для орального введения могут быть в форме таблетки, капсулы, порошка и жидкой форме. Таблетка может включать твердый носитель, такой как желатин или вспомогательное средство. Жидкие фармацевтические композиции обычно включают жидкий носитель, такой как вода, сульфированные, животные или растительные масла, минеральное масло или синтетическое масло. Могут быть также включены физиологический солевой раствор, раствор декстрозы или другого сахарида или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленликоль.
Для внутривенной инъекции, или инъекции в место, подверженное болезни, активный ингредиент будет находиться в форме парентерально приемлемого водного раствора, который является апирогенным и имеет соответствующие pH, изотоничность и стабильность. Специалисты с релевантными знаниями в данной области техники вполне способны приготовить подходящие растворы, используя, например, изотонические носители, такие как инъекционный раствор натрия хлорида, инъекционный раствор Рингера, инъекционный раствор Рингера с добавлением лактата. Могут быть также включены, в случае необходимости, консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки.
Композиция может назначаться отдельно или в комбинации с другими лечениями, терапевтическими средствами или агентами, либо одновременно, либо последовательно в зависимости от подвергаемого лечению состояния. Кроме того, настоящее изобретение предусматривает и включает композиции, включающие связывающий член, в частности антитело или его фрагмент, описанный здесь, и другие агенты или терапевтические средства, такие как противораковые средства или терапевтические средства, гормоны, агенты или антитела против EGFR, или иммуномодуляторы. В общем, этими противораковыми средствами могут быть ингибиторы тирозинкиназы, ингибиторы каскада реакций фосфорилирования, модуляторы посттрансляционной модификации, ингибиторы роста или деления клеток (например, антимитотические средства) или ингибиторы передачи сигналов. Другие лечения или терапевтические средства могут включать введение подходящих доз лекарственных средств для купирования боли, таких как нестероидные противовоспалительные лекарственные средства (например, аспирин, парацетамол, ибупрофен или кетопрофен), или опиатов, таких как морфин, или противорвотных средств. Композиция может назначаться в комбинации (либо последовательно (т.е. до или после), либо одновременно) с ингибиторами тирозинкиназы (включающими, но без ограничения, AG1478 и ZD1839, STI571, OSI-774, SU-6668), доксорубицином, темозоломидом, цисплатином, карбоплатином, нитрозомочевинами, прокарбазином, винкристином, гидроксимочевиной, 5-фторурацилом, цитозинарабинозидом, циклофосфамидом, эпиподофиллотоксином, кармустином, ломустином и/или другими химиотерапевтическими средствами. Таким образом, эти агенты могут быть специфическими агентами против EGFR или ингибиторами тирозинкиназы, такими как AG1478, ZD1839, STI571, OSI-774 или SU-6668, или, в общем, могут быть противораковыми и антинеопластическими средствами, такими как доксорубицин, цисплатин, темозоломид, нитрозомочевины, прокарбазин, винкристин, гидроксимочевина, 5-фторурацил, цитозинарабинозид, циклофосфамид, эпиподофиллотоксин, кармустин или ломустин. Кроме того, композиция может вводиться вместе с гормонами, такими как дексаметазон, иммуномодуляторами, такими как интерлейкины, фактор некроза опухолей (TNF) или другие факторы роста или цитокины, которые стимулируют иммунный ответ и сокращают или устраняют раковые клетки или опухоли.
Иммуномодулятор, такой как TNF, может быть скомбинирован с членом настоящего изобретения в форме биспецифического антитела, распознающего эпитоп EGFR, распознаваемый антителами настоящего изобретения, а также связывающегося с рецепторами TNF. Композиция может также назначаться вместе с, или может включать комбинации вместе с, другими антителами против EGFR, включающими, но без ограничения, антитела против EGFR 528, 225, SC-03, DR8.3, L8A4, Y10, ICR62 и ABX-EGF.
Ранее использование таких агентов, как доксорубицин и цисплатин, в соединении с антителами против EGFR порождало усиленную противоопухолевую активность (Fan et al., 1993; Baselga et al., 1993). Комбинация доксорубицина и мАт 528 приводила к полной ликвидации укоренившихся ксенотрансплантатов A431, тогда как лечение любым из двух агентов по отдельности вызывало лишь временное подавление in vivo роста (Baselga et al., 1993). Подобным образом, комбинация цисплатина и любого из мАт528 или 225 также приводила к ликвидации вполне укоренившихся ксенотрансплантатов A431, которое не наблюдалось, когда использовалось лечение любым одним из двух агентов (Fan et al., 1993).
Стандартная радиотерапия
Кроме того, настоящее изобретение предусматривает и включает терапевтические композиции в случае применения связывающего члена в комбинации со стандартной радиотерапией. Было показано, что лечение антителами, направленными против рецепторов EGF, может усилить эффекты стандартной радиотерапии (Milas et al., Clin. Cancer Res. 2000 Feb.: 6(2): 701, Huang et al., Clin. Cancer Res. 2000 Jun.: 6(6): 2166).
Как здесь показано, комбинации связывающего члена настоящего изобретения, в частности, антитела или его фрагмента, предпочтительно мАт806, ch806, мАт175, мАт124, мАт1133 или hu806 или его фрагмента, и противораковых средств, в частности, терапевтических средств против EGFR, включающих другие антитела против EGFR, является иллюстрацией эффективной терапии, и, в частности, синергизма, против ксенотрансплантированных опухолей. В примерах, например, показано, что комбинация AG1478 и мАт806 приводит к значительно большему сокращению объема ксенотрансплантата опухолевых клеток A431 по сравнению с лечением любым из двух агентов по отдельности. AG1478 (4-(3-хлоранилино)-6,7-диметоксихиназолин) является сильным и селективным ингибитором киназы рецептора EGF и, в частности, описан в патенте США с № 5457105, включенном сюда посредством ссылки в его полном объеме (см. также Liu, W. et al. (1999) J. Cell Sci. 112: 2409; Eguchi, S. et al. (1998) J. Biol. Chem. 273: 8890; Levitsky, A. and Gazit, A. (1995) Science 267: 1782). В примерах описания настоящего изобретения, кроме того, показан терапевтический синергизм антител настоящего изобретения с другими антителами против EGFR, в частности, с антителом против EGFR 528.
Настоящее изобретение, кроме того, предусматривает терапевтические композиции, применимые при осуществлении терапевтических способов этого изобретения. Являющаяся объектом настоящего изобретения терапевтическая композиция включает, в смеси, фармацевтически приемлемый эксципиент (носитель) и один или несколько членов специфического связывания, их полипептидных аналогов или их фрагментов, описанных здесь, в качестве активного ингредиента. В предпочтительном варианте осуществления композиция включает антиген, способный модулировать специфическое связывание связывающего члена/антитела настоящего изобретения с клеткой-мишенью.
Приготовление терапевтических композиций, которые содержат полипептиды, аналоги или активные фрагменты в качестве активных ингредиентов, вполне установлено в данной области техники. Как правило, такие композиции готовят в виде инъецируемых препаратов, в виде либо жидких растворов, либо суспензий. Однако можно также приготовить твердые формы, подходящие для растворения или суспендирования в жидкости перед инъекцией. Препарат может также быть эмульгированным. Активный терапевтический ингредиент часто смешивают с эксципиентами, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом. Подходящими эксципиентами являются, например, вода, солевой раствор, декстроза, глицерин, этанол или т.п. и их комбинации. Кроме того, если желательно, композиция может содержать небольшие количества вспомогательных веществ, таких как смачивающие реагенты или эмульгаторы, pH буферные агенты, которые увеличивают эффективность активного ингредиента.
Полипептид, аналог или активный фрагмент можно составить в терапевтическую композицию в виде форм нейтральных фармацевтически приемлемых солей. Фармацевтически приемлемые соли включают кислотно-аддитивные соли (образованные в результате реакций по свободным аминогруппам полипептида или молекулы антитела), и которые образуются при присоединении неорганических кислот, таких как, например, соляная или фосфорная кислота, или таких органических кислот, как уксусная, щавелевая, винная, миндальная кислота и т.п. Соли, образованные в результате реакций по свободным карбоксильным группам, можно также получить из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа, и таких органических оснований, как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и т.п.
Терапевтические композиции, содержащие полипептид, аналог или активный фрагмент, обычно вводят внутривенно, например, с помощью инъекции единичной дозы, например. Термин ʺединичная дозаʺ при использовании в связи с терапевтической композицией настоящего изобретения относится к физически дискретным единицам, подходящим в качестве однократной дозы для людей, при этом каждая единица содержит заранее заданное количество активного вещества, рассчитанное для вызова желаемого терапевтического эффекта, совместно с требуемым разбавителем; т.е. носителем или наполнителем.
Композиции вводят способом, совместимым с составлением дозы, и в терапевтически эффективном количестве. Вводимое количество зависит от подвергаемого лечению субъекта, способности иммунной системы субъекта к использованию активного ингредиента и желаемой степени способности к связыванию EFGR. Точные количества активного ингредиента, которые необходимо вводить, зависят от оценки практикующего специалиста и являются специфическими для каждого индивидуума. Однако подходящие дозы могут колебаться в пределах от приблизительно 0,1 до 20, предпочтительно от приблизительно 0,5 до приблизительно 10 и более предпочтительно от одного до нескольких миллиграммов активного ингредиента на килограмм веса тела индивидуума в день и зависят от пути введения. Подходящие схемы первоначального введения и бустер-дозы являются также регулируемыми, но их типичным примером служит первоначальное введение с последующими повторными дозами с составляющими один или более часов интервалами, вводимыми с помощью последующей инъекции или иного введения. Альтернативно предусматривается непрерывная внутривенная инфузия, достаточная для сохранения десяти наномолярных - десяти микромолярных концентраций в крови.
Фармацевтические композиции для перорального введения могут быть в форме таблетки, капсулы, порошка и жидкой форме. Таблетка может включать твердый носитель, такой как желатин или вспомогательное средство. Жидкие фармацевтические композиции обычно включают жидкий носитель, такой как вода, сульфированные, животные или растительные масла, минеральное масло или синтетическое масло. Могут быть также включены физиологический солевой раствор, раствор декстрозы или другого сахарида или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленликоль.
Для внутривенной инъекции, или инъекции в место, подверженное болезни, активный ингредиент будет находиться в форме парентерально приемлемого водного раствора, который является апирогенным и имеет соответствующие pH, изотоничность и стабильность. Специалисты с релевантными знаниями в данной области техники вполне способны приготовить подходящие растворы, используя, например, изотонические носители, такие как инъекционный раствор натрия хлорида, инъекционный раствор Рингера, инъекционный раствор Рингера с добавлением лактата. Могут быть также включены, в случае необходимости, консерванты, стабилизаторы, буферы, антиоксиданты и/или другие добавки.
Диагностические исследования
Настоящее изобретение также относится к ряду диагностических применений, в том числе методам обнаружения наличия стимулов, таких как аберрантно экспрессированный EGFR, на основе их способности быть распознанными членом специфического связывания настоящего изобретения. Как отмечалось ранее, EGFR можно использовать для получения антител к нему самому с помощью ряда известных методов, и такие антитела можно было бы выделить и использовать, например, в исследованиях на наличие особой активности EGFR в сомнительных клетках-мишенях.
Диагностические применения членов специфического связывания настоящего изобретения, в частности, антител и их фрагментов, включают in vitro и in vivo применения, которые являются хорошо известными и обычными для квалифицированного специалиста и основываются на описании настоящего изобретения. Диагностические исследования и наборы для in vitro определения и оценки состояния EGFR, в частности в отношении аберрантной экспрессии EGFR, могут использоваться для диагностирования, оценки и контроля выборочных совокупностей пациентов, в том числе тех, которые, как известно, имеют или у которых подозревается наличие рака, предракового состояния, состояния, связанного с ростом гиперпролиферативных клеток, или на основе образца опухоли. Определение и оценка состояния EGFR также полезна для определения возможности использования пациента для клинического испытания лекарственного средства и для введения конкретного химиотерапевтического средства или члена специфического связывания, в частности антитела, настоящего изобретения, в том числе их комбинаций, в сравнении с отличающимся агентом или связывающим членом. В случае рака молочной железы уже используются на практике антитела против белка HER2 (Hercep Test, Dako Corporation) при этом типе диагностического контроля и определения, при котором исследование также используется для оценки пациентов в отношении терапии с использованием антитела Герцептина. In vivo применения включают визуализацию опухолей или определение ракового состояния индивидуумов, в том числе визуализацию на основе радиоактивных изотопов.
Как предложено выше, диагностический способ настоящего изобретения включает исследование клеточного образца или среды посредством анализа, включающего эффективное количество антагониста EFGR/белка, такого как антитело против EFGR, предпочтительно подвергнутое аффинной очистке поликлональное антитело и более предпочтительно мАт. Кроме того, предпочтительно, когда используемые здесь молекулы антител против EFGR находятся в форме частей Fab, Fab', F(ab')2 или F(v) или целых молекул антител. Как обсуждалось ранее, пациенты, которым может принести пользу этот способ, включают пациентов, страдающих раком, предраковыми патологическими изменениями, вирусной инфекцией, патологиями, в которые вовлечен рост гиперпролиферативных клеток или которые являются следствием такого роста, или другими подобными патологическими нарушениями. Все способы, включающие способы выделения EFGR и индукции продукции антител против EFGR, и определения и оптимизации способности антител против EFGR к содействию в исследовании клеток-мишеней, хорошо известны в данной области техники.
Предпочтительно, когда антитело против EFGR, используемое в диагностических способах этого изобретения, является подвергнутым аффинной очистке поликлональным антителом. Более предпочтительно, когда антителом является моноклональное антитело (мАт). Кроме того, используемые здесь молекулы антител против EFGR могут находиться в форме частей Fab, Fab', F(ab')2 или F(v) молекул целых антител.
Как подробно описано выше, антитело(а) против EGFR можно продуцировать и выделить с помощью стандартных способов, включающих хорошо известные гибридомные технологии. Для удобства, антитело(а) против EGFR, индуцированное в одном виде, будет упоминаться здесь как Ат1, а антитело(а), индуцированное в другом виде, как Ат2.
Наличие EGFR в клетках можно определить с помощью обычных in vitro или in vivo иммунологических способов, применимых для таких определений. Известен ряд применимых способов. В трех из таких способов, являющихся особенно применимыми, используется либо EGFR, меченный обнаруживаемой меткой, антитело Ат, меченное обнаруживаемой меткой, либо Ат2, меченное обнаруживаемой меткой. Способы можно свести к следующим уравнениям, в которых звездочка указывает на то, что частица является меченой, а ʺRʺ означает EGFR:
А. R*+Ат1=R*Ат1
B. R+Ат*=RAт1*
C. R+Ат1+Ат2*=RАт1Ат2*
И способы, и их применения известны квалифицированным в данной области техники специалистам и, соответственно, могут использоваться в пределах объема настоящего изобретения. ʺКонкурентныйʺ способ, способ A, описан в патентах США № 3654090 и 3850752. Способ C, ʺсэндвичʺ-способ, описан в патентах США № RE 31006 и 4016043. Известны, однако, другие способы, такие как способ с использованием ʺсдвоенных антителʺ или методика проведения радиоиммуноанализа с использованием твердой фазы с двумя антителами (ʺDASPʺ).
В каждом вышеприведенном случае EGFR образует комплексы с одним или более антителом(ами) или партнерами по связыванию, и один член комплекса является меченным обнаруживаемой меткой. Событие образования комплекса, а, при желании, его количество, можно определить с помощью известных способов, применимых для обнаружения меток.
На основе изложенного выше будет понятно, что характеристическим свойством Ат2 является то, что оно будет взаимодействовать с Ат1. Это обусловлено тем, что Ат1, индуцированное в одном виде млекопитающего, было использовано в другом виде в качестве антигена для индукции антитела Ат2. Например, Ат2 можно индуцировать у коз, используя кроличьи антитела в качестве антигенов. Следовательно, Ат2будет антикроличьим антителом, индуцированным у коз. Для целей этого описания и формулы изобретения Ат1 будет называться первым антителом или антителом против EGFR, а Ат2 будет называться вторым антителом или антителом против Ат1.
Метками, чаще всего используемыми для этих исследований, являются радиоактивные элементы, ферменты, химически вещества, которые флуоресцируют после подвергания воздействию ультрафиолетового свет , и другие.
Множество флуоресцентных веществ известно и может использоваться в качестве меток. Они включают, например, флуоресцеин, родамин, аурамин, техасский красный, AMCA синий и люцифериновый желтый. Конкретным веществом для обнаружения является антикроличье антитело, полученное в козах и конъюгированное с флуоресцеином через посредство изотиоцианата.
EGFR или его партнер(ы) по связыванию, такой как член специфического связывания настоящего изобретения, можно также пометить радиоактивным элементом или ферментом. Радиоактивную метку можно обнаружить с помощью любого из имеющихся в настоящее время методов подсчета. Предпочтительный изотоп можно выбрать из3H,14C,32P,35S,36Cl,51Cr,57Co,58Co,59Fe,90Y,121I,124I,125I,131I,111In,211At,198Au,67Cu,225Ac,213Bi,99Tc и186Re.
Так же применимы ферментные метки, и их можно обнаружить с помощью любого из используемых в настоящее время колориметрических, спектрофотометрических, флуороспектрофотометрических, амперометрических или газометрических методов. Фермент конъюгируют с выбранной частицей с помощью реакции сшивания таких молекул, как карбодиимиды, диизоцианаты, глутаральдегид и т.п. Множество ферментов, которые могут использоваться в этих методах, известно и может использоваться. Предпочтительными являются пероксидаза, β-глюкуронидаза, β-D-глюкозидаза, β-D-галактозидаза, уреаза, глюкозооксидаза плюс пероксидаза и щелочная фосфатаза. Патенты США № 3654090, 3850752 и 4016043 указываются в качестве примеров в отношении описания в них альтернативных веществ и способов для мечения.
Конкретная система исследования, которая может преимущественно применяться в соответствии с настоящим изобретением, известна как рецепторный анализ. В рецепторном анализе вещество, подвергаемое анализу, такое как член специфического связывания, соответствующим образом метят, и затем в некоторые клеточные исследуемые колонии вносят количество как меченого, так и немеченого вещества, после чего проводят исследования связывания для определения степени, в которой меченое вещество связывается с клеточными рецепторами. Этим способом можно установить различия в аффинности между веществами.
Соответственно, количество подвергнутого очистке члена специфического связывания можно пометить радиоактивным изотопом и объединить, например, с антителами или другими его ингибиторами, после чего будут проводиться исследования связывания. Затем будут приготовлены растворы, которые содержат различные количества меченого и немеченого, не объединенного члена специфического связывания, и затем их будут вносить в образцы клеток, и впоследствии будет осуществляться инкубация. Результирующие клеточные монослои затем промывают, солюбилизируют и затем подсчитывают в счетчике гамма-излучения в течение отрезка времени, достаточного для получения стандартной ошибки, составляющей <5%. Эти данные затем подвергают анализу Скетчарда, после чего могут быть сделаны наблюдения и выводы в отношении активности вещества. Хотя вышеизложенное приводится в качестве примера, оно иллюстрирует способ, которым рецепторный анализ может быть выполнен и использован в том случае, когда способность исследуемого вещества к связыванию с клетками может служить отличительной чертой.
Анализ, который является применимым и предусмотренным в соответствии с настоящим изобретением, известен как ʺцис/трансʺ-анализ. Вкратце, в этом анализе используются две генетические конструкции, первая из которых является обычно плазмидой, которая непрерывно экспрессирует конкретный рецептор, представляющий интерес, после трансфекции в соответствующую линию клеток, а вторая из которых является плазмидой, которая экспрессирует репортер, такой как люцифераза, под контролем комплекса рецептор/лиганд. Таким образом, например, если желательной является оценка соединения в качестве лиганда для конкретного рецептора, первой из плазмил могла бы быть конструкция, которая приводит к экспрессии рецептора в выбранной клеточной линии, в то время как вторая плазмида могла бы обладать промотором, связанным с геном люциферазы, в который встроен чувствительный к конкретному рецептору элемент. Если исследуемое соединение является агонистом рецептора, лиганд будет образовывать комплекс с рецептором, и результирующий комплекс будет связываться с чувствительным элементом и инициировать транскрипцию гена люциферазы. Затем фотометрически измеряют результирующую хемилюминесценцию, и графики зависимости ответа от дозы строят и сравнивают с таковыми известных лигандов. Вышеприведенный протокол подробно описан в патенте США № 4981784 и международной заявке PCT № WO 88/03168, к которым отсылается специалист.
В дальнейшем варианте осуществления этого изобретения могут быть приготовлены промышленные тест-наборы, подходящие для использования специалистом в медицине, для определения присутствия или отсутствия аберрантной экспрессии EGFR, в том числе, но без ограничения, амплификации гена EGFR и/или мутации EGFR, в потенциальных клетках-мишенях. В соответствии с обсуждаемыми выше методами тестирования один класс таких наборов будет содержать по меньшей мере меченый EGFR или его партнер по связыванию, например, антитело, специфичное в отношении него, и инструкции, конечно, зависящие от выбранного способа, например, ʺконкурентногоʺ, ʺсэндвичʺ, ʺDASPʺ и т.п. Наборы могут также содержать дополнительные реагенты, такие как буферы, стабилизаторы и т.д.
Соответственно, тест-набор может быть приготовлен для обнаружения присутствия аберрантной экспрессии или посттрансляционной модификации EGFR или способности к ним клеток и включает
(a) заданное количество по меньшей мере одного меченого иммунохимически активного компонента, полученного в результате непосредственного или опосредованного присоединения члена специфического связывания настоящего изобретения или его партера по специфическому связыванию к обнаруживаемой метке;
(b) другие реагенты; и
(c) инструкции в отношении использования указанного набора.
Конкретнее, диагностический тест-набор может включать
(a) известное количество описанного выше члена специфического связывания (или партнера по связыванию), обычно связанного с твердой фазой с образованием иммуносорбента или, в альтернативном случае, связанного с подходящей меткой, или многочисленные такие конечные продукты и т.п. (или их партнеры по связыванию), по одному каждого типа;
(b) в случае необходимости, другие реагенты; и
(c) инструкции в отношении использования указанного тест-набора.
В дальнейшем варианте тест-набор может быть приготовлен и использоваться с указанной выше целью, при этом набор эксплуатируется в соответствии с заранее определенным протоколом (например, ʺконкурентнымʺ, ʺсэндвичʺ, ʺсдвоенное антителоʺ и т.д.) и включает
(a) меченый компонент, который был получен посредством соединения члена специфического связывания с обнаруживаемой меткой;
(b) один или более дополнительных иммунохимических реагентов, из которых по меньшей мере один реагент является лигандом или иммобилизованным лигандом, который выбирают из группы, состоящей из
(i) лиганда, способного к связыванию с меченым компонентом (a);
(ii) лиганда, способного к связыванию с партнером по связыванию меченого компонента (a);
(iii) лиганда, способного к связыванию с по меньшей мере одним из определяемых компонентов; и
(iv) лиганда, способного к связыванию с по меньшей мере одним из партнеров по связыванию по меньшей мере одного из определяемых компонентов; и
(c) инструкции в отношении выполнения протокола для обнаружения и/или определения одного или более компонентов иммунохимической реакции между EFGR, членом специфического связывания и его партером по специфическому связыванию.
В соответствии с вышеизложенным могут быть приготовлены аналитические системы для скрининга потенциальных лекарственных средств, эффективных в модулировании активности EFGR, аберрантной экспрессии или посттрансляционной модификации EGFR и/или активности или связывания члена специфического связывания. Рецептор или связывающий член могут быть введены в тест-систему, и в результирующую клеточную культуру может быть также введено предполагаемое лекарственное средство, и впоследствии культуру исследуют для фиксации любых изменений в активности клеток в S-фазе, либо вследствие лишь добавления предполагаемого лекарственного средства, либо вследствие эффекта добавленных количеств известного агента(ов).
Нуклеиновые кислоты
Настоящим изобретением, кроме того, предоставляется выделенная нуклеиновая кислота, кодирующая член специфического связывания настоящего изобретения. Нуклеиновая кислота включает ДНК или РНК. В предпочтительном аспекте настоящим изобретением предоставляется нуклеиновая кислота, которая кодирует полипептид настоящего изобретения, определенный выше, в том числе полипептид, представленный как остатки CDR VH- и VL-доменов антител настоящего изобретения.
Настоящим изобретением также предоставляются конструкции в форме плазмид, векторов, транскрипционных или экспрессионных кассет, которые включают по меньшей мере один полинуклеотид, указанный выше.
Настоящим изобретением также предоставляется рекомбинантная клетка-хозяин, которая включает одну или более конструкций, указанных выше. Аспект настоящего изобретения составляет нуклеиновая кислота, кодирующая любой член специфического связывания, предоставленная сама по себе, как и способ продуцирования члена специфического связывания, который включает экспрессию с кодирующей его нуклеиновой кислотой. Экспрессии можно подходящим образом достичь посредством культивирования в соответствующих условиях рекомбинантных клеток-хозяев, содержащих нуклеиновую кислоту. После продукции посредством экспрессии член специфического связывания можно выделить и/или очистить, используя любой подходящий метод, а затем использовать сообразно обстоятельствам.
Члены специфического связывания и кодирующие молекулы нуклеиновых кислот и векторы в соответствии с настоящим изобретением могут быть предоставлены выделенными и/или очищенными, например от их природного окружения, в по существу чистой или гомогенной форме, или, в случае нуклеиновой кислоты, не содержащими или по существу не содержащими нуклеиновую кислоту или гены, отличные по происхождению от последовательности, кодирующей полипептид с требуемой функцией. Нуклеиновая кислота в соответствии с настоящим изобретением может включать ДНК или РНК и может быть полностью или частично синтетической.
Системы для клонирования и экспрессии полипептида в ряде различных клеток-хозяев хорошо известны. Подходящие клетки-хозяева включают бактерии, клетки млекопитающих, дрожжи и бакуловирусные системы. Линии клеток млекопитающих, применимые в данной области техники для экспрессии гетерологичного полипептида, включают клетки яичника китайского хомячка, клетки HeLa, клетки почки новорожденного хомячка, клетки миеломы мыши NSO и многие другие. Ходовым, предпочтительным бактериальным хозяином является E. coli.
Экспрессия антител и фрагментов антител в прокариотических клетках, таких как E. coli, широко известна в данной области техники. Для обзора см., например, Pluckthun, A. Bio/Technology 9: 545-551 (1991). В распоряжение квалифицированных в данной области техники специалистов также находится экспрессия в эукариотических клетках в качестве варианта продукции члена специфического связывания, см. недавние обзоры, например, Raff, M.E. (1993) Curr. Opinion Biotech. 4: 573-576; Trill J.J. et al. (1995) Curr. Opinion Biotech 6: 553-560.
Можно выбрать или сконструировать подходящие векторы, содержащие соответствующие регуляторные последовательности, включающие последовательности промоторов, последовательности терминаторов, последовательности полиаденилирования, энхансерные последовательности, гены-маркеры и другие последовательности сообразно обстоятельствам. Векторы могут быть плазмидами, вирусными векторами, например, фагом или фагемидой, сообразно обстоятельствам. Дополнительные детали см., например, в Molecular Cloning: a Laboratory Manual: 2nd edition, Sambrook et al., 1989, Cold Spring Harbor Laboratory Press. Множество известных методов и протоколов для манипулирования нуклеиновой кислотой, например для приготовления конструкций нуклеиновых кислот, мутагенеза, секвенирования, введения ДНК в клетки и экспрессии генов, и анализа белков подробно описано в Short Protocols in Molecular Biology, Second Edition, Ausubel et al. eds., John Wiley & Sons, 1992. Описания Sambrook et al. и Ausubel et al. включены сюда посредством ссылки.
Таким образом, в дальнейшем аспекте настоящего изобретения предоставляется клетка-хозяин, содержащая нуклеиновую кислоту, описываемую здесь. Опять же в дальнейшем аспекте предоставляется способ, включающий введение такой нуклеиновой кислоты в клетку-хозяина. Для введения может использоваться любой имеющийся в распоряжении метод. В случае эукариотических клеток подходящие методы могут включать трансфекцию с использованием фосфата кальция, DEAE-декстрана, электропорацию, трансфекцию с помощью липосом и трансдукцию с использованием ретровируса или другого вируса, например, вируса коровьей оспы или, в случае клеток насекомых, бакуловируса. В случае бактериальных клеток подходящие методы могут включать трансформацию с использованием хлорида кальция, электропорацию и трансфекцию с использованием бактериофага.
За введением может последовать вызов или создание возможности экспрессии нуклеиновой кислоты, например, в результате культивирования клеток-хозяев в условиях, подходящих для экспрессии гена.
В одном варианте осуществления нуклеиновая кислота настоящего изобретения интегрирована в геном (например, хромосому) клетки-хозяина. Интеграции может содействовать включение последовательностей, которые активируют рекомбинацию с геномом, в соответствии со стандартными методами.
Настоящим изобретением также предоставляется способ, который включает использование конструкции, указанной выше, в экспрессионной системе, чтобы экспрессировать член специфического связывания или полипептид, указанный выше.
Как указано выше, настоящее изобретение также относится к рекомбинантной молекуле ДНК или клонированному гену, или его вырожденному варианту, которая(ый) кодирует член специфического связывания, в частности, антитело или его фрагмент, который имеет аминокислотную последовательность, представленную в SEQ ID NO: 2 и 4; 129 и 134; 22 и 27; 32 и 37; и/или 42 и 47, предпочтительно, молекула нуклеиновой кислоты, в частности рекомбинантная молекула ДНК или клонированный ген, кодирующие связывающий член или антитело, имеет нуклеотидную последовательность, кодирующую одну из таких последовательностей, или является комплементарной последовательности ДНК, кодирующей одну из таких последовательностей.
Другим признаком этого изобретения является экспрессия последовательностей ДНК, раскрытых здесь. Как хорошо известно в данной области техники, последовательности ДНК можно экспрессировать посредством их функционального связывания с контролирующей экспрессию последовательностью в подходящем экспрессионном векторе и использования этого экспрессионного вектора для трансформации соответствующего одноклеточного хозяина.
Такое функциональное связывание последовательности ДНК этого изобретения с контролирующей экспрессию последовательностью, конечно, включает, в случае, если он еще не является частью последовательности ДНК, обеспечение инициирующего кодона, ATG, в правильной рамке считывания 5' от последовательности ДНК.
Широкий спектр комбинаций хозяин/экспрессионный вектор может использоваться для экспрессии последовательностей ДНК этого изобретения. Применимые экспрессионные векторы, например, могут состоять из сегментов хромосомных, нехромосомных и синтетических последовательностей ДНК. Подходящие векторы включают производные SV40 и известные бактериальные плазмиды, например, плазмиды col E1 E. coli, pCR1, pBR322, pMB9 и их производные, такие плазмиды, как RP4; фаговые ДНК, например, многочисленные производные фага X, например, NM989, и другую фаговую ДНК, например, M13 и одноцепочечную ДНК нитчатого фага; плазмиды дрожжей, такие как плазмида 2u или ее производные; векторы, применимые для эукариотических клеток, такие как векторы, применимые для клеток насекомых или млекопитающих; векторы, полученные в результате объединений плазмид и фаговых ДНК, такие как плазмиды, которые были модифицированы, чтобы задействовать фаговую ДНК или другие контролирующие экспрессию последовательности; и т.п.
Любую из широкого спектра контролирующих экспрессию последовательностей - последовательностей, которые контролируют экспрессию последовательности ДНК, функционально связанных с ней - можно использовать в этих векторах для экспрессии последовательности ДНК настоящего изобретения. Такие применимые контролирующие экспрессию последовательности включают, например, ранний или поздний промоторы SV40, CMV, вируса коровьей оспы, полиомавируса или аденовируса, lac-систему, trc-систему, TAC-систему, TRC-систему, LTR-систему, основной оператор и промоторные районы фага λ, контролирующие районы гена покровного белка fd, промотор гена 3-фосфоглицераткиназы или промоторы генов других ферментов гликолиза, промоторы гена кислотной фосфатазы (например, Pho5), промоторы генов факторов спаривания дрожжей и другие последовательности, которые, как известно, контролируют экспрессию генов прокариотических или эукариотических клеток или их вирусов, и их различные комбинации.
Широкий спектр одноклеточных клеток-хозяев также применим для экспрессии последовательностей ДНК этого изобретения. Эти хозяева могут включать широко известные эукариотические и прокариотические клетки-хозяева, такие как штаммы E. coli, Pseudomonas, Bacillus, Streptomyces, грибы, такие как дрожжи, и клетки животных, такие как клетки CHO, YB/20, NSO, SP2/0, Rl.1, B-W и L-M, клетки почки африканской зеленой мартышки (например, COS 1, COS 7, BSCl, BSC40 и BMT10), клетки насекомых (например, Sf9), и клетки человека и клетки растений в культуре тканей.
Будет понятно, что не все векторы, контролирующие экспрессию последовательности и хозяева будут функционировать с одинаковым успехом в экспрессии последовательностей ДНК этого изобретения. Также не все хозяева будут функционировать с одинаковым успехом с одной и той же экспрессионной системой. Однако квалифицированный в данной области техники специалист будет способен выбрать должные векторы, контролирующие экспрессию последовательности и хозяев без чрезмерного экспериментирования для выполнения желаемой экспрессии без отклонения от объема этого изобретения. Например, при выборе вектора должен приниматься во внимание хозяин, поскольку вектор должен функционировать в нем. Также будут приниматься во внимание число копий вектора, способность к контролированию этого числа копий и экспрессия любых других белков, кодируемых вектором, таких как являющиеся антибиотиками маркеры.
При выборе контролирующей экспрессию последовательности во внимание обычно будет приниматься ряд факторов. Они включают, например, относительную силу системы, ее регулируемость и ее совместимость с конкретной последовательностью ДНК или геном, подвергаемой(ым) экспрессии, в частности, в отношении потенциальных вторичных структур. Подходящие одноклеточные хозяева будут выбираться с учетом, например, их совместимости с выбранным вектором, их свойства секреции, их способности к правильной укладке белков и необходимых для них условий ферментации, а также токсичности для хозяина продукта, кодируемого последовательностями ДНК, подвергаемыми экспрессии, и легкости очистки продуктов экспрессии.
Учитывая эти и другие факторы, квалифицированный в данной области техники специалист будет способен создать ряд комбинаций вектор/контролирующая экспрессию последовательность/хозяин, которые будут экспрессировать последовательности ДНК этого изобретения при ферментации или в высокомасштабной животной культуре.
Кроме того, предполагается, что могут быть приготовлены аналоги членов специфического связывания на основе нуклеотидных последовательностей белкового комплекса/субъединицы, полученных в пределах объема настоящего изобретения. Аналоги, такие как фрагменты, можно получить, например, с помощью расщепления пепсином вещества члена специфического связывания. Другие аналоги, такие как мутеины, можно создать с помощью стандартного сайт-направленного мутагенеза кодирующего члены специфического связывания последовательностей. Аналоги, демонстрирующие ʺактивность члена специфического связыванияʺ, такие как небольшие молекулы, функционирующие либо как активаторы, либо как ингибиторы, можно идентифицировать с помощью известных in vivo и/или in vitro анализов.
Как указано выше, последовательность ДНК, кодирующую член специфического связывания, можно приготовить синтетически, а не клонировать. Последовательность ДНК можно сконструировать с подходящими кодонами для аминокислотной последовательности члена специфического связывания. В общем, будут выбираться предпочтительные для предполагаемого хозяина кодоны, если последовательность будет использоваться для экспрессии. Полную последовательность составляют из перекрывающихся олигонуклеотидов, приготовленных с помощью стандартных способов и составляемых в полную кодирующую последовательность. См., например, Edge, Nature, 292: 756 (1981); Nambair et al., Science, 223: 1299 (1984); Jay et al., J. Biol. Chem., 259: 6311 (1984).
Синтетические последовательности ДНК позволяют удобным образом конструировать гены, которые будут экспрессировать аналоги членов специфического связывания или ʺмутеиныʺ. Альтернативно, ДНК, кодирующую мутеины, можно приготовить с помощью сайт-направленного мутагенеза природных генов членов специфического связывания или их кДНК, и мутеины можно приготовить непосредственно, используя обычный синтез полипептидов.
Общий способ сайт-специфического включения неприродных аминокислот в белки описан в Christopher J. Noren, Spencer J. Anthony-Cahill, Michael C. Griffith, Peter G. Schultz, Science, 244: 182-188 (April 1989). Этот способ может использоваться для создания аналогов с неприродными аминокислотами.
Настоящее изобретение распространяется на приготовление антисмысловых олигонуклеотидов и рибозимов, которые могут использоваться для препятствования экспрессии EGFR на трансляционном уровне. При этом подходе используется антисмысловая нуклеиновая кислота и рибозимы для блокирования трансляции конкретной мРНК, посредством либо маскировки этой мРНК антисмысловой нуклеиновой кислотой, либо ее расщепления рибозимом.
Антисмысловыми нуклеиновыми кислотами являются молекулы ДНК или РНК, которые комплементарны по меньшей мере части конкретной молекулы мРНК (см. Weintraub, 1990; Marcus-Sekura, 1988.). В клетке они гибридизуются с этой мРНК, образуя двухцепочечную молекулу. Клетка не транслирует мРНК в этой двухцепочечной форме. Следовательно, антисмысловые нуклеиновые кислоты препятствуют экспрессии мРНК в белок. Олигомеры из приблизительно пятнадцати нуклеотидов и молекулы, которые гибридизуются с инициирующим кодоном AUG, будут особенно эффективными, поскольку их легко синтезировать, и они, вероятно, вызывают меньше проблем, чем более большие молекулы при их введении в продуцирующие клетки. Способы с использованием антисмысловых молекул были использованы для ингибирования экспрессии множества генов in vitro (Marcus-Sekura, 1988; Hambor et al., 1988).
Рибозимы представляют собой молекулы РНК, обладающие способностью специфически расщеплять другие одноцепочечные молекулы РНК способом, до некоторой степени аналогичным таковому в случае эндонуклеаз ДНК-рестрикции. Рибозимы были обнаружены на основании наблюдения, что определенные мРНК обладают способностью к делетированию своих собственных интронов. Посредством модифицирования нуклеотидной последовательности этих РНК исследователи смогли сконструировать молекулы, которые узнают специфические нуклеотидные последовательности в молекуле РНК и расщепляют ее (Cech, 1988.). Поскольку они являются специфическими в отношении последовательности, инактивируются лишь мРНК с особыми последовательностями.
Исследователи идентифицировали два типа рибозимов, типа Tetrahymena и типа ʺголовки молоткаʺ (Hasselhoff and Gerlach, 1988). Рибозимы типа Tetrahymena распознают последовательности четырех оснований, в то время как рибозимы типа ʺголовки молоткаʺ распознают последовательности одиннадцати - восемнадцати оснований. Чем длиннее распознаваемая последовательность, тем вероятнее то, что она встречается только в разновидностях мРНК-мишеней. Следовательно, рибозимы типа ʺголовки молоткаʺ предпочтительнее рибозимов Tetrahymena-типа для инактивации специфических разновидностей мРНК, а распознаваемые последовательности восемнадцати оснований предпочтительнее более коротких распознаваемых последовательностей.
Описываемые здесь последовательности ДНК могут, таким образом, использоваться для приготовления антисмысловых молекул против мРНК для EFGR и их лигандов и рибозимов, которые расщепляют такие мРНК.
Настоящее изобретение можно лучше понять на основе следующих неограничивающих примеров, которые предоставлены в качестве иллюстрации настоящего изобретения. Следующие примеры представлены для более полной иллюстрации предпочтительных вариантов осуществления и не должны никоим образом рассматриваться, однако, как ограничение широкого объема настоящего изобретения.
Пример 1
Создание и выделение антител
Линии клеток
Для иммунизации и исследований специфичности было использовано несколько линий клеток, природных или трансфицированных либо геном нормального EGFR дикого типа, либо геном ΔEGFR, имеющим делеционную мутацию Δ2-7: линия мышиных фибробластов NR6, NR6ΔEGFR (трансфицированная ΔEGFR) и NR6wtEGFR(трансфицированная EGFR дикого типа), линия клеток глиобластомы человека U87MG (экспрессирующая на низких уровнях эндогенный EGFR дикого типа), U87MGwtEGFR(трансфицированнная EGFR дикого типа), U87MGΔEGFR(трансфицированная ΔEGFR) и линия клеток плоскоклеточного рака человека A431 (экспрессирующая на высоких уровнях EGFR дикого типа).
Для иммунизации и исследований специфичности было использовано несколько линий клеток, природных или трансфицированных либо геном нормального EGFR дикого типа, или ʺwtEGFRʺ либо геном ΔEGFR, имеющим делеционную мутацию de2-7 или Δ2-7: линия мышиных фибробластов NR6, NR6ΔEGFR (трансфицированная ΔEGFR) и NR6wtEGFR(трансфицированная EGFR дикого типа), линия клеток глиобластомы человека U87MG (экспрессирующая на низких уровнях эндогенный EGFR дикого типа), U87MGwtEGFRили ʺU87MG.wtEGFRʺ (трансфицированная EGFR дикого типа), U87MGΔEGFRили ʺU87MG.Δ2-7ʺ (трансфицированная ΔEGFR) и линия клеток плоскоклеточного рака человека A431 (экспрессирующая на высоких уровнях EGFR дикого типа). Линии клеток NR6, NR6ΔEGFR и NR6wtEGFRбыли описаны ранее (Batra et al. (1995) Epidermal Growth Factor Ligand-independent, Unregulated, Cell-Transforming Potential of a Naturally Occurring Human Mutant EGFRvIII Gene. Cell Growth Differ. 6(10): 1251-1259). В линии клеток NR6 отсутствует нормальный эндогенный EGFR (Batra et al., 1995). Линии клеток U87MG и их трансфицирования были описаны ранее (Nishikawa et al. (1994) A mutant epidermal growth factor receptor common in human glioma confers enhanced tumorigenicity. Proc. Natl. Acad. Sci. U.S.A. 91, 7727-7731).
Линия клеток астроцитомы U87MG (Ponten, J. and Macintyre, E.H. (1968) Long term culture of normal and neoplastic human glia. Acta. Pathol. Microbiol. Scand. 74, 465-486), которая эндогенно экспрессирует низкие уровни EGFR дикого типа, была инфицирована ретровирусом, содержащим de2-7 EGFR, с созданием линии клеток U87MG.Δ2-7 (Nishikawa et al., 1994). Линия трансфицированнных клеток U87MG.EGFR дикого типа была создана, как описано в Nagane et al. (1996) Cancer Res. 56, 5079-5086. Тогда как клетки U87MG экспрессируют приблизительно 1×105 EGFR, клетки U87MG.wtEGFR экспрессируют приблизительно 1×106EGFR, и, следовательно, имитируют ситуацию, наблюдаемую при амплификации гена. Линия про-B-лимфоцитов мыши BaF/3, которая не экспрессирует какие-либо известные, родственные EGFR молекулы, также была трансфицирована de2-7 EGFR, что привело к созданию линии клеток BaF/3.Δ2-7 (Luwor et al. (2004). Опухолевоспецифический de2-7 рецептор эпидермального фактора роста (EGFR) содействует выживанию клеток и гетеродимеризуется с EGFR дикого типа, Oncogene 23: 6095-6104). Клетки плоскоклеточного рака человека A431 были получены из ATCC (Rockville, MD). Линия клеток эпидермоидного рака A431 была описана ранее (Sato et al. (1987) Derivation and assay of biological effects of monoclonal antibodies to epidermal growth factor receptors. Methods Enzymol. 146, 63-81).
Все линии клеток культивировали в среде DMEM/F-12 с GlutaMAXTM (Life Technologies, Inc., Melbourne, Австралия и Grand Island, NY), дополненной 10% FCS (фетальная телячья сыворотка) (CSL, Melbourne, Австралия); 2 мМ глутамина (Sigma Chemical Co., St. Louis, MO) и пенициллином/стрептомицином (Life Technologies, Inc., Grand Island, NY). К тому же линии клеток U87MG.Δ2-7 и U87MG.EGFR дикого типа поддерживали в присутствии 400 мг/мл генетицина (Life Technologies, Inc., Melbourne, Victoria, Австралия). Линии клеток выращивали при 37ºC в неизменяемой атмосфере 5% CO2.
Реагенты
Уникальный соединительный пептид de2-7 EGFR имеет аминокислотную последовательность: LEEKKGNYVVTDH (SEQ ID NO: 13). Биотинилированные уникальные соединительные пептиды (биотин-LEEKKGNYVVTDH (SEQ ID NO: 5) и LEEKKGNYVVTDH-биотин (SEQ ID NO: 6)) на основе de2-7 EGFR были синтезированы с помощью стандартной химической технологии с использованием Fmoc, и чистоту (>96%) определяли с помощью HPLC с обращенной фазой и масс-спектрального анализа (Auspep, Melbourne, Australia).
Антитела, используемые в исследованиях
Для сравнения находок авторов настоящего изобретения с другими реагентами в исследования были включены дополнительные мАт. Этими реагентами были мАт528 против EGFR дикого типа (Sato et al. (1983) Mol. Biol. Med. 1(5), 511-529) и DH8.3, которое было создано против синтетического пептида, охватывающего соединительную последовательность делеционной мутации Δ2-7 EGFR. Антитело DH8.3 (IgG1), которое является специфичным в отношении de2-7 EGFR, было описано ранее (Hills et al. (1995) Specific targeting of a mutant, activated EGF receptor found in glioblastoma using a monoclonal antibody. Int. J. Cancer. 63, 537-543, 1995) и было получено после иммунизации мышей уникальным соединительным пептидом, обнаруженным в de2-7 EGFR (Hills et al., 1995).
Антитело 528, которое распознает и de2-7, и EGFR дикого типа, было описано ранее (Masui et al. (1984) Growth inhibition of human tumor cells in athymic mice by antiepidermal growth factor receptor monoclonal antibodies. Cancer Res. 44, 1002-1007) и было получено в Biological Production Facility, Ludwig Institute for Cancer Research (Melbourne, Австралия) с использованием гибридомы (ATCC HB-8509), полученной из Американской коллекции типовых культур (Rockville, MD). Поликлональное антитело SC-03 является подвергнутым аффинной очистке кроличьим поликлональным антителом, индуцированным против С-концевого пептида EGFR (Santa Cruz Biotechnology Inc.).
Образование антител
В качестве иммуногена была использована линия фибробластов мыши NR6ΔEGFR. Мышиные гибридомы были созданы посредством пятикратной, подкожной иммунизации мышей BALB/c с составляющими 2-3 недели интервалами с использованием 5×l05 - 2×106клеток в адъюванте. Для первой инъекции был использован полный адъювант Фрейнда. Впоследствии использовался неполный адъювант Фрейнда (DifcoTM, Voigt Global Distribution, Lawrence, KS). Клетки селезенок иммунизированных мышей сливали с линией клеток миеломы мыши SP2/0 (Shulman et al. (1978) Nature 276: 269-270). Супернатанты вновь созданных клонов подвергали скринингу в анализах гемадсорбции на реактивность с линиями клеток NR6, NR6wtEGFRи NR6ΔEGFR, а затем анализировали с помощью анализов гемадсорбции с использованием линий клеток глиобластомы человека U87MG, U87MGwtEGFRи U87ΔEGFR. Отобранные супернатанты гибридом впоследствии исследовали с помощью Вестерн-блоттинга и, кроме того, подвергали иммуногистохимическому анализу. Вновь созданные мАт, демонстрирующие ожидаемую картину реактивности, очищали.
Было создано пять гибридом, и для получения дальнейших характеристик первоначально были отобраны три клона: 124 (IgG2a), 806 (IgG2b) и 1133 (IgG2a) - на основе высокого титра антител (1:2500) при использовании NR6ΔEGFR и низкого фона в реакции гемагглютинации для подсчета розеткообразующих клеток NR6 и NR6wtEGFR. Четвертый клон, 175 (IgG2a), был впоследствии охарактеризован дополнительно и обсуждается отдельно в примере 23, ниже. В последующих реакциях гемагглютинации эти антитела (не разведенный супернатант ≤10%) не продемонстрировали реактивность с линией природных клеток глиобластомы человека U87MG и U87MGwtEGFR, но давали сильную реакцию с U87MGΔEGFR; меньшая реактивность наблюдалась с A431. Напротив, в анализе с использованием FACS (клеточного сортера с возбуждением флуоресценции), 806 не давал реакцию с линией природных клеток U87MG, а интенсивно окрашивал U87MGΔEGFR и в меньшей степени U87MGwtEGFR, что указывает на связывание 806 и с ΔEGFR, и с EGFR дикого типа (см. ниже).
Затем мАтl24, мАт806 и мАт1133 были проанализированы в анализах с использованием Вестерн-блоттинга на реактивность с EGFR дикого типа и ΔEGFR. Были извлечены лизаты, полученные в результате детергентной обработки клеток NR6ΔEGFR, U87MGΔEGFR, а также A431. Все три мАт продемонстрировали схожие картины реактивности с клеточными лизатами, окрашивая как EGFR дикого типа (170 кДа), так и белок ΔEGFR (140 кДа). В качестве контрольного реагента было использовано мАтR.I., которое, как известно, дает реакцию с EGFR дикого типа (Waterfield et al. (1982) J. Cell Biochem. 20(2), 149-161), вместо мАт528, которое, как известно, не дает реакцию в анализах с использованием Вестерн-блоттинга. мАтR.I. продемонстрировало реактивность с EGFR дикого типа и ΔEGFR. Все три вновь созданных клона продемонстрировали реактивность с ΔEGFR и менее сильную реактивность с EGFR дикого типа. DH8.3 давал положительную реакцию лишь в случае лизатов U87MGΔEGFR и NR6ΔEGFR.
В таблице 1 представлены результаты иммунохимического исследования клонов 124, 806 и 1133, а также мАт528 и мАтDH8.3 на ксенотрансплантатах опухолевых клеток U87MG, U87MGΔEGFR и A431. Все мАт продемонстрировали сильное окрашивание ксенотрансплантата клеток U87MGΔEGFR. Лишь мАтAb528 продемонстрировало слабую реактивность с ксенотрансплантатом природных клеток U87MG. В ксенотрансплантатах A431 мАт528 продемонстрировало сильную однородную реактивность. мАт124, мАт806 и мАт1133 показали реактивность, главным образом, с базально расположенными клетками плоскоклеточного рака A431 и не реагировали с верхними клеточными слоями или ороговевающим компонентом. DH8.3 давало отрицательную реакцию в случае ксенотрансплантатов A431.
Небольшое окрашивание стромы вследствие выявления эндогенных мышиных антител.
Секвенирование
Были секвенированы вариабельные области тяжелой (VH) и легкой (VL) цепей мАт806, мАт124 и мАт1133, и идентифицированы их определяющие комплементарность участки (CDR), как указано далее.
мАт806
VH мАт806: последовательность нуклеиновой кислоты (SEQ ID NO: 1) и аминокислотная последовательность с сигнальным пептидом (SEQ ID NO: 2) представлены на фиг. 14A и 14B, соответственно (сигнальный пептид подчеркнут на фиг. 14B). Определяющие комплементарность участки CDR1, CDR2 и CDR3 (SEQ ID NO: 15, 16 и 17, соответственно) показаны подчеркиванием на фиг. 16. Аминокислотная последовательность VH мАт806 без своего сигнального пептида (SEQ ID NO: 11) представлена на фиг. 16.
VL мАт806: последовательность нуклеиновой кислоты (SEQ ID NO: 3) и аминокислотная последовательность с сигнальным пептидом (SEQ ID NO: 4) представлены на фиг. 15A и 15B, соответственно (сигнальный пептид подчеркнут на фиг. 15B). Определяющие комплементарность участки CDR1, CDR2 и CDR3 (SEQ ID NO: 18, 19, и 20, соответственно) показаны подчеркиванием на фиг. 17. Аминокислотная последовательность VL мАт806 без своего сигнального пептида (SEQ ID NO: 12) представлена на фиг. 17.
мАт124
VH мАт124: нуклеотидная (SEQ ID NO: 21) и аминокислотная (SEQ ID NO: 22) последовательности представлены на фиг. 51A и 51B, соответственно. Определяющие комплементарность участки CDR1, CDR2 и CDR3 (SEQ ID NO: 23, 24 и 25, соответственно) показаны подчеркиванием.
VL мАт124: нуклеотидная (SEQ ID NO: 26) и аминокислотная (SEQ ID NO: 27) последовательности представлены на фиг. 51C и 51, соответственно. Определяющие комплементарность участки CDR1, CDR2 и CDR3 (SEQ ID NO: 28, 29 и 30, соответственно) показаны подчеркиванием.
мАт1133
VH мАт1133: нуклеотидная (SEQ ID NO: 31) и аминокислотная (SEQ ID NO: 32) последовательности представлены на фиг. 52A и 52B, соответственно. Определяющие комплементарность участки CDR1, CDR2 и CDR3 (SEQ ID NO: 33, 34 и 35, соответственно) показаны подчеркиванием.
VL мАт1133: нуклеотидная (SEQ ID NO: 36) и аминокислотная (SEQ ID NO: 37) последовательности представлены на фиг. 52C и 52D, соответственно. Определяющие комплементарность участки CDR1, CDR2 и CDR3 (SEQ ID NO: 38, 39 и 40, соответственно) показаны подчеркиванием.
Пример 2
Анализ связывание антител с линиями клеток с помощью FACS
Для получения дальнейших характеристик, изложенных здесь и в последующих примерах, вначале было выбрано мАт806. мАт124 и мАт1133 были также выбраны для получения дальнейших характеристик, обсуждаемых в примере 26 ниже, и, как установлено, обладают свойствами, соответствующими уникальным свойствам мАт806, обсуждаемым здесь.
Для определения специфичности мАт806 его связывание с клетками U87MG, U87MG.Δ2-7 и U87MG.wtEGFR было проанализировано с помощью клеточного сортера с возбуждением флуоресценции (FACS). Вкратце, клетки метили релевантным антителом (10 мкг/мл), а затем конъюгированным с флуоресцеином козьим антителом против IgG мыши (в разведении 1:100; Calbiochem San Diego, CA, США; Becton-Dickinson PharMingen, San Diego, CA, США), как описано ранее (Nishikawa et al., 1994). Данные FACS были получены на Coulter Epics Elite ESP посредством фиксации как минимум 5000 событий и проанализированы, используя EXPO (версию 2) для Windows. Нерелевантный IgG2b был включен в качестве совпадающего по изотипу контроля для мАт806, и было включено антитело 528, поскольку оно распознает и de2-7 и EGFR дикого типа.
Лишь антитело 528 было способно окрашивать родительскую линию клеток U87MG (фиг. 1), что согласуется с предшествующими сообщениями о том, что эти клетки экспрессируют EGFR дикого типа (Nishikawa et al., 1994). мАт806 и DH8.3 продемонстрировали уровни связывания, схожие с таковыми контрольного антитела, что ясно свидетельствует о том, что они неспособны к связыванию рецептора дикого типа (фиг. 1). Связывание совпадающего по изотипу контрольного антитела с клетками U87MG.Δ2-7 и U87MG.wtEGFR было таким же, как связывание, наблюдаемое в случае клеток U87MG.
мАт806 окрашивало клетки U87MG.Δ2-7 и U87MG.wtEGFR, что указывает на то, что мАт806 специфически распознает de2-7 EGFR и амплифицированный EGFR (фиг. 1). Антитело DH8.3 окрашивало клетки U87MG.Δ2-7, подтверждая, что антитело DH8.3 специфически распознает de2-7 EGFR (фиг. 1). Как и ожидалось, антитело 528 окрашивало линии как клеток U87MG.Δ2-7, так и клеток U87MG.wtEGFR (фиг. 1). Как и ожидалось, антитело 528 окрашивало клетки U87MG.Δ2-7 более интенсивно, чем родительскую линию клеток, поскольку оно связывается и с рецепторами de2-7, и с рецепторами дикого типа, которые коэкспрессируются в этих клетках (фиг. 1). Сходные результаты были получены, используя комбинированную гемадсорбцию с использованием белка А, при которой связанный с поверхностью IgG обнаруживают по появлению белка А, покрытого эритроцитами человека (группы O), на клетках-мишенях. Моноклональное антитело 806 давало реакцию с клетками U87MG.Δ2-7, но не продемонстрировало значительной реактивности (не разведенный супернатант менее 10%) с клетками U87MG, экспрессирующими EGFR дикого типа. Важно, что мАт806 также связывалось с линией клеток BaF/3.Δ2-7, что свидетельствует о том, что для реактивности мАт806 коэкспрессия EGFR дикого типа не требуется (фиг. 1).
Пример 3
Связывание антител в анализах
Для дальнейшего определения специфичности мАт806 и антитела DH8.3 их связывание исследовали с помощью ELISA. Для определения специфичности антител использовали два типа ELISA. В первом анализе планшеты покрывали sEGFR (10 мкг/мл в 0,1 M карбонатном буфере pH 9,2) в течение 2 ч, а затем блокировали с помощью 2% сывороточного альбумина человека (HSA) в PBS. sEGFR представляет собой рекомбинантный экстраклеточный домен (аминокислоты 1-621) EGFR дикого типа и был продуцирован, как описано ранее (Domagala et al. (2000) Stoichiometry, kinetic and binding analysis of the interaction between Epidermal Growth Factor (EGF) and the Extracellular Domain of the EGF receptor. Growth Factors. 18, 11-29). В лунки в трех повторах добавляли антитела в увеличивающейся концентрации в 2% HSA в забуференном фосфатом солевом растворе (PBS). Связанное антитело выявляли с помощью конъюгированного с пероксидазой хрена овечьего антитела против IgG мыши (Silenus, Melbourne, Австралия), используя ABTS (Sigma, Sydney, Австралия) в качестве субстрата, и оптическую плотность измеряли при 405 нм.
Как мАт806, так и антитело 528 продемонстрировали кривые дозозависимого связывания с насыщением с иммобилизованным sEGFR дикого типа (фиг. 2A). Поскольку уникальный соединительный пептид, обнаруженный в de2-7 EGFR, не содержится в sEGFR, мАт806 должно связываться с эпитопом, расположенным в последовательности EGFR дикого типа. Связывание антитела 528 было меньшим такового, наблюдаемого в случае мАт806, вероятно, потому, что оно распознает конформационный эпитоп. Как и ожидалось, антитело DH8.3 не связывалось с sEGFR дикого типа даже при концентрации вплоть до 10 мкг/мл (фиг. 2A). Хотя sEGFR в растворе ингибировал связывание антитела 528 с иммобилизованным sEGFR дозозависимым образом, он был неспособен ингибировать связывание мАт806 (фиг. 2B). Это наводит на мысль, что мАт806 может связываться лишь с EGFR дикого типа после иммобилизации на планшетах для ELISA, процесса, который может вызывать конформационные изменения. Сходные результаты наблюдали, используя BIAcore, тем самым мАт806 связывалось с иммобилизованным sEGFR, но иммобилизованное мАт806 было неспособно к связыванию sEGFR в растворе (фиг. 2C).
После денатурации посредством нагревания в течение 10 мин при 95ºC sEGFR в растворе был способен к ингибированию связывания мАт806 с иммобилизованным sEGFR (фиг. 2C), подтверждая, что мАт806 может связываться с EGFR дикого типа в определенных условиях. Интересно, что денатурированный sEGFR был неспособен к ингибированию связывания антитела 528 (фиг. 2C), что свидетельствует о том, что это антитело распознает конформационный эпитоп. Антитело DH8.3 продемонстрировало дозозависимое связывание с насыщением с уникальным пептидом de2-7 EFR (фиг. 2D). Ни мАт806, ни антитело 528 не связывалось с пептидом, даже в концентрациях, превышающих те, которые использовались для достижения насыщения связывания DH8.3, что служит дополнительным свидетельством того, что мАт806 не распознает антигенную детерминанту в этом пептиде.
Во втором анализе биотинилированный специфичный для de2-7 пептид (биотин-LEEKKGNYVVTDH (SEQ ID NO: 5)) связывали с планшетами для ELISA, предварительно покрытыми стрептавидином (Pierce, Rockford, Illinois). Антитела связывали и обнаруживали, как и в первом анализе. Ни мАт806, ни антитело 528 не связывалось с пептидом, даже в концентрациях, превышающих те, которые использовались для достижения насыщения связывания DH8.3, что служит дополнительным свидетельством того, что мАт806 не распознает антигенную детерминанту в этом пептиде.
Для дальнейшей демонстрации того, что мАт806 распознает эпитоп, отличный от соединительного пептида, были проведены дополнительные эксперименты. C-концевой биотинилированный пептид de2-7 (LEEKKGNYVVTDH-биотин (SEQ ID NO: 6)) был использован в исследованиях с использованием мАт806 и мАтL8A4, созданных против пептида de2-7 (Reist et al. (1995) Cancer Res. 55(19), 4375-4382; Foulon et al. (2000) Cancer Res. 60(16), 4453-4460).
Реагенты, используемые в исследованиях с использованием пептидов
Соединительный пептид: LEEKKGNYVVTDH-OH (Biosource, Camarillo, CA);
пептид C: LEEKKGNYVVTDH(K-биотин)-OH (Biosource, Camarillo, CA);
sEGFR: происходящий из клеток CHO рекомбинантный растворимый экстраклеточный домен (аминокислоты 1-621) EGFR дикого типа (LICR Melbourne);
мАт806: мышиное моноклональное антитело, IgG2b (LICR NYB);
мАтL8A4: мышиное моноклональное антитело, IgG1(Duke University);
IgG1 совпадающее по изотипу контрольное мАт;
IgG2bсовпадающее по изотипу контрольное мАт.
Пептид C был иммобилизован на микросенсорном чипе со стрептавидином на его поверхности с плотностью, составляющей 350 РЕ (±30 РЕ). Серийные разведения мАт проверяли на реактивность с пептидом. Для оценки специфичности проводили эксперименты с использованием блокирования с помощью небиотинилированного пептида.
мАтL8A4 продемонстрировало сильную реактивность с пептидом
C даже при низких концентрациях антитела (6,25 нМ) (фиг. 2E). мАт806 не демонстрировало обнаруживаемую специфическую реактивность с пептидом C вплоть до концентраций антитела, составляющих 100 нМ (наибольшей из проверенных концентраций) (фиг. 2E и 2F). Ожидалось, что мАтL8A4 будет реагировать с пептидом C, поскольку этот пептид был использован в качестве иммуногена для образования мАтL8A4. Добавление соединительного пептида (небиотинилированного, 50 мкг/мл) полностью блокирует реактивность мАтL8A4 с пептидом C, подтверждая специфичность этого антитела в отношении эпитопа соединительного пептида.
Во второй совокупности экспериментов с использованием BIAcore sEGFR был иммобилизован на микросенсорном чипе с CM на его поверхности с плотностью, составляющей ~4000 РЕ. Серийные разведения мАт проверяли на реактивность с sEGFR.
мАт806 давало сильную реакцию с денатурированным sEGFR, в то время как мАтL8A4 не реагировало с денатурированным sEGFR. Реактивность мАт806 с денатурированным sEGFR уменьшается с уменьшением концентраций антитела. Ожидалось, что мАтL8A4 не будет реагировать с sEGFR, поскольку мАтL8A4 было образовано с использованием соединительного пептида в качестве иммуногена, а sEGFR не содержит соединительный пептид.
Были также проведены эксперименты с использованием имммуноокрашивания дот-блотов. Серийные разведения пептида в объеме 0,5 мкл наносили в виде пятен на PVDF или нитроцеллюлозные мембраны. Мембраны блокировали с помощью 2% BSA в PBS, и затем зондировали с использованием антител 806, L8A4, DH8.3 и контрольных антител. Антитела L8A4 и DH8.3 связывались с пептидом на мембранах (не представленные данные). мАт806 не связывало пептид в концентрациях, в которых L8A4 четко демонстрировало связывание (не представленные данные). Контрольные антитела также были отрицательными в отношении связывания пептида.
мАт806 связывалось с EGFR дикого типа в клеточных лизатах после иммуноблоттинга (не представленные результаты). Этот результат отличается от результатов, полученных с антителом DH8.3, которое реагировало с de2-7 EGFR, но не с EGFR дикого типа. Таким образом, мАт806 может распознавать EGFR дикого типа после денатурации, но не тогда, когда рецептор находится в своем природном состоянии на поверхности клетки.
Пример 4
Анализ Скетчарда
Анализ Скетчарда, используя клетки U87MG.Δ2-7, был выполнен после внесения поправок в иммунореактивность для определения относительной аффинности каждого антитела. Антитела метили125I (Amrad, Melbourne, Австралия) с помощью способа с использованием хлорамина T, и иммунореактивность определяли с помощью анализа Lindmo (Lindmo et al. (1984) Determination of the immunoreactive fraction of radiolabeled monoclonal antibodies by linear extrapolation to binding at infinite antigen excess. J. Immunol. Methods. 72, 77-89).
Все анализы связывания проводили в 1% HSA/PBS на 1-2×106 живых клеток U87MG.Δ2-7 или A431 в течение 90 мин при 4ºC со слабым вращением. Постоянную концентрацию 10 нг/мл125I-меченного антитела использовали в присутствии увеличивающихся концентраций соответствующего немеченого антитела. Неспецифическое связывание определяли в присутствии 10000-кратного избытка немеченого антитела. Ни125I-меченное мАт806, ни антитело DH8.3 не связывалось с родительскими клетками U87MG. После завершения инкубации клетки отмывали и подсчитывали в отношении связанного125I-меченного антитела, используя счетчик гамма-излучения COBRA II (Packard Instrument Company, Meriden, CT, США).
Как мАт806, так и антитело DH8.3 сохраняли высокую иммунореактивность после йодирования, которая обычно составляла более 90% в случае мАт806 и 45-50% в случае антитела DH8.3. мАт806 обладало аффинностью к рецептору de2-7 EGFR, составляющей 1,1×109 M-1, тогда как аффинность DH8.3 была примерно в 10 раз меньше, составляя 1,0×108 M-1. Так же йодированное антитело не связывалось с родительскими клетками U87MG. мАт806 распознавало в среднем 2,4×105 сайтов связывания в каждой клетке, при этом антитело DH8.3 связывалось в среднем с 5,2×105 сайтами. Таким образом, хорошее соответствие существовало не только в отношении числа рецепторов между антителами, но также с предшествующим сообщением об установлении 2,5×105 рецепторов de2-7 в каждой клетке, определенных с помощью отличного, специфичного в отношении de2-7 EGFR антитела в той же линии клеток (Reist et al. (1997) Improved targeting of an anti-epidermal growth factor receptor variant III monoclonal antibody in tumor xenografts after labeling using N-succinimidyl 5-iodo-3-pyridinecarboxylate. Cancer Res. 57, 1510-1515).
Пример 5
Интернализация антител клетками U87MG.Δ2-7
Скорость интернализации антитела после связывания с клеткой-мишенью оказывает влияние как на характеристики его воздействия на опухоли, так и на его терапевтические возможности. Поэтому авторы настоящего изобретения исследовали интернализацию мАт806 и антитела DH8.3 после связывания с клетками U87MG.Δ2-7 с помощью FACS. Клетки U87MG.Δ2-7 инкубировали либо с мАт806, либо с антителом DH8.3 (10 мкг/мл) в течение 1 ч в DMEM при 4ºC. После промывки клетки переносили в DMEM, предварительно нагретую до 37ºC, и аликвоты отбирали в различные моменты времени после инкубации при 37ºC. Интернализацию останавливали посредством безотлагательной промывки аликвот холодным, как лед, буфером для промывки (1% HSA/PBS). По завершении периода инкубации клетки окрашивали и исследовали с помощью FACS, как описано выше. Интернализацию в процентах рассчитывали посредством сравнения окрашивания антителами поверхности в различные моменты времени с таковым в момент времени = 0, используя формулу: процент интернализованного антитела = (средняя флуоресценция в момент времени x - фоновая флуоресценция)/(средняя флуоресценция в момент времени 0 - фоновая флуоресценция) × 100. Это способ был валидизирован в одном анализе с использованием йодированного антитела (мАт806) для определения интернализации, как описано ранее (Huang et al. (1997) The enhanced tumorigenic activity of a mutant epidermal growth factor receptor common in human cancers is mediated by threshold levels of constitutive tyrosine phosphorylation and unattenuated signaling. J. Biol. Chem. 272, 2927-2935). Различия в степени интернализации в различные моменты времени сравнивали, используя критерий Стьюдента. На всем протяжении этого исследования значимость данных анализировали с помощью критерия Стьюдента, за исключением анализов in vivo выживаемости, данные которых анализировали с помощью критерия Вилкоксона.
Оба антитела продемонстрировали относительно быструю интернализацию, достигающую неизменяющихся уровней через 10 мин в случае мАт806 и через 30 мин в случае DH8.3 (фиг. 3). Интернализация DH8.3 была значительно выше как по показателю скорости (80,5% DH8.3, интернализованного через 10 мин, по сравнению с 36,8% в случае мАт806, p<0,01), так и по показателю общего количества, интернализованного через 60 мин (93,5% в сравнении с 30,4%, p<0,001). мАт806 продемонстрировало немного более низкие уровни интернализации через 30 и 60 мин по сравнению с 20 мин во всех 4 проведенных анализах (фиг. 3). Этот результат был также подтвержден, используя анализ интернализации на основе йодированного мАт806 (не представленные данные).
Пример 6
Электронно-микроскопический анализ интернализации антител
Принимая во внимание отмеченные выше различия в скоростях интернализации между антителами, детальный анализ направленного перемещения антител внутрь клеток был проведен с использованием электронной микроскопии.
Клетки U87MG.Δ2-7 выращивали в планшетах, разделенных на лунки, покрытые желатином, (Nunc, Naperville, IL) до 80% конфлюэнтности, а затем промывали холодным как лед DMEM. Затем клетки инкубировали с мАт806 или антителом DH8.3 в DMEM в течение 45 мин при 4ºC. После промывки клетки инкубировали в течение еще 30 мин с конъюгированным с золотом (20 нм частицами) антителом против IgG мыши (BBlnternational, Cardiff, Объединенное Королевство) при 4ºC. После дополнительной промывки предварительно нагретую DMEM/10% PCS добавляли к клеткам, которые инкубировали при 37ºC в течение различных периодов времени от 1 до 60 мин. Интернализацию антитела останавливали с помощью холодных как лед сред, и клетки фиксировали с помощью 2,5% глутаральдегида в PBS/0,1% HSA, а затем подвергали дополнительной фиксации в 2,5% тетроксиде осмия. После дегидратации с помощью ступенчато изменяющихся рядов ацетона образцы заливали смолой Эпон/Аралдит, делали ультратонкие срезы с помощью микротома Reichert Ultracut-S (Leica) и помещали на никелевые гриды. Срезы окрашивали уранилацетатом и лимоннокислым свинцом перед наблюдением под трансмиссионным электронным микроскопом Philips CM 12 при 80 кВ. Статистический анализ золотых зерен, содержащихся в окаймленных ямках, выполняли, используя критерий хи-квадрат.
В то время как антитело DH8.3 подвергалось интернализации преимущественно через посредство окаймленных ямок, мАт806, как представляется, подвергалось интернализации с помощью макропиноцитоза (фиг. 19). Действительно, детальный анализ 32 окаймленных ямок, образованных в клетках, подвергнутых инкубации с мАт806, показал, что ни одна из них не содержала антитело. Напротив, приблизительно 20% от всех окаймленных ямок в клетках, подвергнутых инкубации с DH8.3, были положительными в отношении антитела, при этом ряд из них содержал множество золотых зерен. С помощью статистического анализа общего числа золотых зерен, содержащихся в окаймленных ямках, установлено, что различие было высоко значимым (p<0,01). Через 20-30 мин оба антитела можно было видеть в структурах, которые морфологически напоминают липосомы (фиг. 19C). Наличие клеточного дебриса внутри этих структур также согласуется с их лисосомальной природой.
Пример 7
Биораспределение антител у имеющих опухоли бестимусных мышей
Биораспределение мАт806 и антитела DH8.3 сравнивали у бестимусных мышей, имеющих ксенотрансплантаты U87MG в одном боку и ксенотрансплантаты U87MG.Δ2-7 в другом боку. Для этого исследования был выбран относительно короткий период времени, поскольку в предшествующем сообщении указывалось на то, что антитело DH8.3 демонстрирует максимальные уровни воздействия на опухоли между 4-24 ч (Hills et al. (1995) Specific targeting of a mutant, activated EGF receptor found in glioblastoma using a monoclonal antibody. Int. J. Cancer. 63, 537-543).
Опухолевые ксенотрансплантаты создавали у бестимусных мышей BALB/c посредством подкожной инъекции 3×106 клеток U87MG, U87MG.Δ2-7 или A431. Экспрессия de2-7 EGFR в ксенотрансплантатах U87MG.Δ2-7 оставалась стабильной на всем протяжении периода исследования биораспределения, что определено с помощью иммуногистохимического анализа в различные моменты времени (не представленные данные). Клетки A431 сохраняли свою реактивность с мАт806 после развития в опухолевых ксенотрансплантатах, что определено с помощью иммуногистохимического анализа. Клетки U87MG или A431 инъецировали в один бок за 7-10 дней перед инъекцией клеток U87MG.Δ2-7 в другой бок из-за большей скорости роста, наблюдаемой в случае экспрессирующих de2-7 EGFR ксенотрансплантатов. Антитела метили радиоактивным изотопом и оценивали на иммунореактивность, как описано выше, и инъецировали мышам ретроорбитальным путем, когда вес опухолей составлял 100-200 мг. Каждая мышь получала два различных антитела (2 мкг каждого антитела): 2 мкКи125I-меченного мАт806 и 2 мкКи131I-меченного DH8.3 или 528. Если не указано, группы из 5 мышей умерщвляли в различные моменты времени после инъекции, и кровь получали с помощью пункции сердца. Посредством вскрытия получали опухоли, печень, селезенку, почки и легкие. Все ткани взвешивали и анализировали на активность125I и131I, используя окно для подсчета с использованием двух каналов. Для каждого антитела данные представляли как % ID/г опухоли, определяемый посредством сравнения со стандартами инъецированных доз (ID) и превращаемый в отношения локализаций опухоль: кровь/печень (т.е. % ID/г опухоли, разделенный на % ID/г крови или печени). Различия между группами анализировали с помощью критерия Стьюдента. После инъекции меченного радиоактивным изотопом мАт806 некоторые опухоли фиксировали в формалине, заливали парафином, делали среды толщиной 5 мкм, а затем осуществляли экспонирование рентгеновской пленке (AGFA, Mortsel, Belgium) излучением от них для определения локализации антител с помощью радиоавтографии.
Касательно % ID/г опухоли, мАт806 достигало в ксенотрансплантатах U87MG.Δ2-7 своего максимального уровня, составляющего 18,6% ID/г опухоли, через 8 ч (фиг. 4A), который является значительно выше, чем в любой другой ткани, за исключением крови. Хотя DH8.3 также продемонстрировало максимальные уровни в опухоли через 8 ч, уровень был статистически (p<0,001) ниже, составляя 8,8% ID/г опухоли, чем в случае мАт806 (фиг. 4B). Уровни обоих антител медленно снижались через 24 и 48 ч. Радиоаутография срезов тканей ксенотрансплантатов U87MG.Δ2-7, полученных через 8 ч после инъекции только125I-меченного мАт806, ясно показывает локализацию антитела в жизнеспособной опухоли (фиг. 20). Также антитело не продемонстрировало специфическую направленность на ксенотрансплантаты родительских клеток U87MG (фиг. 4A и 4B). Что касается отношений опухоль:кровь/печень, мАт806 продемонстрировало наибольшее отношение через 24 ч как в случае крови (отношение, составляющее 1,3), так и в случае печени (отношение, составляющее 6,1) (фиг. 5A и 5B). Антитело DH8.3 имело наибольшее отношение в случае крови через 8 ч (отношение, составляющее 0,38) и через 24 ч в случае печени (отношение, составляющее 1,5) (фиг. 5A и 5B), оба из которых значительно ниже значений, полученных для мАт806.
Как описано выше, уровни мАт806 в опухоли достигали максимума через 8 часов. Хотя этот максимум является относительно ранним по сравнению со многими направленными против опухоли антителами, он полностью согласуется с другими исследованиями с использованием специфичных в отношении de2-7 EGFR антител, все из которых демонстрируют максимумы через 4-24 часа после инъекции при использовании схожей дозы антитела (Hills et al., 1995; Reist et al., 1997; Reist et al. (1996) Radioiodination of internalizing monoclonal antibodies using N-succinimidyl 5-iodo-3-pyridinecarboxylate. Cancer Res. 56, 4970-4977). Действительно, в отличие от предыдущих сообщений, составляющий 8 ч момент времени был включен, исходя из того, что максимальная направленная доставка антитела будет достигаться быстро. % ID/г опухоли, наблюдаемый в случае мАт806, был схож с таковым, сообщенным для других специфичных в отношении de2-7 EGFR антител при использовании стандартных методов йодирования (Hills et al., 1995; Huang et al., 1997; Reist et al. (1995) Tumor-specific anti-epidermal growth factor receptor variant III monoclonal antibodies: use of the tyramine-cellobiose radioiodination method enhances cellular retention and uptake in tumor xenografts. Cancer Res. 55, 4375-4382).
Причина раннего максимума является, вероятно, двоякой. Во-первых, опухоли, экспресссирующие de2-7 EGFR, в том числе трансфицированные клетки U87MG, растут очень быстро в виде опухолевых ксенотрансплантатов. Поэтому даже во время относительно короткого периода времени, который использовался в этих исследованиях биораспределения, размер опухоли увеличивается до такой степени (5-10-кратное увеличение массы в течение 4 дней), что % ID/г опухоли уменьшен по сравнению с медленно растущими опухолями. Во-вторых, хотя интернализация мАт806 была относительно медленной по сравнению с DH8.3, она тем не менее является быстрой относительно многих других систем антитело/опухолевый антиген. Подвергшиеся интернализации антитела подвергаются быстрому протеолизу, при этом продукты деградации выводятся из клетки (Press et al. (1990) Inhibition of catabolism of radiolabeled antibodies by tumor cells using lysosomotropic amines and carboxylic ionophores. Cancer Res. 50, 1243-1250). Этот процесс интернализации, деградации и выведения уменьшает количество йодированного антитела, остающегося внутри клетки. Поэтому подвергаемые интернализации антитела демонстрируют более низкие уровни воздействия, чем их не подвергаемые интернализации эквиваленты. Сообщенные здесь данные электронной микроскопии свидетельствуют о том, что подвергнутое интернализации мАт806 быстро перемещается в лизосомы, где происходит предположительно быстрая деградация. Эти данные согласуются с быстрым удалением йода из клетки.
Ранее описанное моноклональное антитело L8A4, направленное против уникального соединительного пептида, обнаруженного в de2-7 EGFR, ведет себя схожим с мАт806 образом (Reist et al. (1997) In vitro and in vivo behavior of radiolabeled chimeric anti-EGFRvIII monoclonal antibody: comparison with its murine parent. Nucl. Med. Biol. 24, 639-647). При использовании клеток U87MG, трансфицированных de2-7 EGFR, это антитело продемонстрировало сходную скорость интернализации (35% через 1 час по сравнению с 30% через 1 час в случае мАт806) и продемонстрировало сравнимую in vivo направленность при использовании фибробластов 3T3, трансфицированных de2-7 EGFR (максимум, составляющий 24% ID/г опухоли через 24 часа, по сравнению с 18% ID/г опухоли через 8 часов в случае мАт806) (Reist et al. (1997) Improved targeting of an anti-epidermal growth factor receptor variant III monoclonal antibody in tumor xenografts after labeling using N-succinimidyl 5-iodo-3-pyridinecarboxylate. Cancer Res. 57, 1510-1515).
Интересно, что in vivo удержание этого антитела в опухолевых ксенотрансплантатах улучшалось в случае мечения N-сукцинимидил-5-йод-3-пиридинкарбоксилатом (Reist et al., 1997). Эта меченая простетическая группа является положительно заряженной при лизосомальном pH и, таким образом, улучшает удержание в клетке (Reist et al. (1996) Radioiodination of internalizing monoclonal antibodies using N-succinimidyl 5-iodo-3-pyridinecarboxylate. Cancer Res. 56, 4970-4977). Улучшенное удержание потенциально полезно с учетом применения антитела для радиоиммунотерапии, и этот способ мог бы использоваться для улучшения удержания йодированного мАт806 или его фрагментов.
Пример 8
Связывание мАт806 с клетками, имеющими амплифицированный ген EGFR
Для проверки того, может ли мАт806 распознавать EGFR, экспрессированный в клетках, имеющих амплифицированный ген рецептора, было проанализировано его связывание с клетками A431. Как описано ранее, клетки A431 являются клетками плоскоклеточного рака человека и экспрессируют на высоких уровнях EGFR дикого типа. Наблюдалось низкое, но высоко воспроизводимое, связывание мАт806 с клетками A431 при анализе с использованием FACS (фиг. 6). Антитело DH8.3 не связывалось с клетками A431, что указывает на то, что связывание мАт806 не было результатом экспрессии de2-7 EGFR на низких уровнях (фиг. 6). Как и ожидалось, направленное против EGFR антитело 528 продемонстрировало сильное окрашивание клеток A431 (фиг. 6). Принимая во внимание этот результат, связывание мАт806 с клетками A431 оценили с помощью анализа Скетчарда. Несмотря на то, что связывание йодированного мАт806 было относительно низким, было возможно получение непротиворечивых данных для анализа Скетчарда. В среднем в трех таких экспериментах определено значение для аффинности, составляющее 9,5×107 M-1, при определении 2,4×105 рецепторов в каждой клетке. Таким образом, аффинность к этому рецептору была приблизительно в 10 раз ниже аффинности к de2-7 EGFR. Кроме того, мАт806, как представляется, распознает лишь небольшую часть EGFR, обнаруживаемого на поверхности клеток A431. Антитело 528 определило приблизительно 2×106 рецепторов в каждой клетке, что согласуется с многочисленными другими исследованиями (Santon et al. (1986) Effects of epidermal growth factor receptor concentration on tumorigenicity of A431 cells in nude mice. Cancer Res. 46, 4701-4705).
Чтобы убедиться в том, что эти результаты не ограниваются лишь линией клеток A431, реактивность мАт806 была исследована в 2 других линиях клеток, демонстрирующих амплификацию гена EGFR. Как сообщалось, как линия клеток опухоли головы и шеи HN5 (Kwok T.T. and Sutherland R.M. (1991) Differences in EGF related radiosensitisation of human squamous carcinoma cells with high and low numbers of EGF receptors. Br. J. Cancer. 64, 251-254), так и линия клеток рака молочной железы MDA-468 (Filmus et al. (1985) MDA-468, a human breast cancer cell line with a high number of epidermal growth factor (EGF) receptors, has an amplified EGF receptor gene and is growth inhibited by EGF. Biochem. Biophys. Res. Commun. 128, 898-905) содержат множество копий гена EGFR. В соответствии с этими сообщениями антитело 528 продемонстрировало интенсивное окрашивание обеих линий клеток (фиг. 21). Как и в случае линии клеток A431, мАт806, несомненно, окрашивало обе линии клеток, но на более низком уровне, чем уровень, наблюдаемый в случае антитела 528 (фиг. 21). Таким образом, связывание мАт806 не ограничивается лишь клетками A431, но, как представляется, является общим результатом для клеток, имеющих амплификацию гена EGFR.
Для распознавания sEGFR дикого типа моноклональным антителом 806, явно требуется некоторая денатурация рецептора для экспонирования эпитопа. Степень требуемой денатурации является всего-навсего небольшой, поскольку даже абсорбция sEGFR дикого типа к пластмассовой поверхности индуцировала сильное связывание мАт806 в анализах ELISA. Поскольку мАт806 связывалось лишь с приблизительно 10% EGFR на поверхности клеток A431, заманчиво предположить, что это подмножество рецепторов, возможно, имеет измененную конформацию, сходную с таковой, индуцируемой усечением в de2-7 EGFR. Действительно, очень высокая экспрессия EGFR, опосредованная амплификацией гена, в клетках A431 может быть причиной неправильного процессирования некоторых рецепторов, приводящего к измененной конформации. Интересно, что полуколичественный иммуноблоттинг лизатов клеток A431 с использованием мАт806 показал, что оно может распознавать большую часть рецепторов EGF в А431 после электрофореза в SDS-ПААГ и Вестерн-переноса. Этот результат дополнительно поддерживает тезис, что мАт806 связывается с подмножеством рецепторов на поверхности клеток A431, которое имеет измененную конформацию. Эти данные наблюдений в клетках A431 согласуются с данными иммуногистохимического анализа, показывающими, что мАт806 связывается с глиомами, имеющими амплификацию гена EGFR. Поскольку связывание мАт806 было полностью отрицательным в случае родительских клеток U87MG, создается впечатление, что это явление может ограничиваться клетками, имеющими амплифицированный EGFR, хотя уровень ʺденатурированногоʺ рецептора на поверхности клеток U87MG может быть ниже уровня обнаружения. Однако последнее представляется невероятным, поскольку йодированное мАт806 не связывалось с осадками клеток U87MG, содержащими вплоть до 1×107 клеток.
Пример 9
In vivo направленность мАт806 против клеток A431
Было выполнено второе исследование биораспределения с использованием мАт806 для определения, могут ли быть его мишенями ксенотрансплантаты опухолевых клеток A431. Исследование проводили в течение большего периода времени для получения большего количества информации по вопросу направленности мАт806 против ксенотрансплантатов U87MG.Δ2-7, которые были включены в случае всех мышей в качестве положительного контроля. Кроме того, направленное против EGFR антитело 528 было включено в качестве положительного контроля в случае ксенотрансплантатов A431, поскольку предшествующее исследование показало низкую, но значимую направленность этого антитела против клеток A431, развиваемых в бестимусных мышах (Masui et al. (1984) Growth inhibition of human tumor cells in athymic mice by anti-epidermal growth factor receptor monoclonal antibodies. Cancer Res. 44, 1002-1007).
Во время первых 48 ч мАт806 проявило свойства направленности, почти идентичные тем, которые наблюдались в начальных экспериментах (фиг. 7A по сравнению с фиг. 4A). По показателю % ID/г опухоли уровни мАт806 в ксенотрансплантатах U87MG.Δ2-7 медленно снижались спустя 24 ч, но всегда оставались выше уровней, определяемых в нормальной ткани. Абсорбция в ксенотрансплантатах A431 была относительно низкой, однако наблюдалось небольшое увеличение % ID/г опухоли во время первых 24 ч, не наблюдаемое в нормальных тканях, таких как печень, селезенка, почка и легкое (фиг. 7A). Абсорбция антитела 528 была очень небольшой в случае обоих ксенотрансплантатов при представлении в виде % ID/г опухоли (фиг. 7B) отчасти вследствие более быстрого удаления этого антитела из крови. Радиоаутография срезов тканей ксенотрансплантатов A431, полученных через 24 ч после инъекции только125I-меченного мАт806, ясно показывает локализацию антитела в жизнеспособной опухоли по периферии, а не в центральных зонах некроза (фиг. 23). Что касается отношения опухоль:кровь, мАт806 достигало максимума через 72 ч в случае ксенотрансплантатов U87MG.Δ2-7 и через 100 ч в случае ксенотрансплантатов A431 (фиг. 8A, B). Что касается опухоли A431, хотя отношение опухоль:кровь для мАт806 никогда не превышало 1,0, оно действительно увеличивалось на протяжении всего периода наблюдения (фиг. 8B) и было выше, чем в случае других проверенных тканей (не представленные данные), что указывает на низкие уровни направленности.
Отношение опухоль:кровь для антитела 528 продемонстрировало профиль, сходный с таковым для мАт806, хотя более высокие уровни отмечались в ксенотрансплантатах A431 (фиг. 8A, B). В случае ксенотрансплантатов U87MG.Δ2-7 мАт806 продемонстрировало максимальное отношение опухоль:печень, составляющее 7,6 через 72 ч, ясно показывая предпочтительную абсорбцию в этих опухолях по сравнению с нормальной тканью (фиг. 8C). Другие отношения опухоль:орган для мАт806 были схожи с таковыми, зарегистрированными в печени (не представленные данные). Максимальное отношение опухоль:печень для мАт806 в ксенотрансплантатах A431 составляло 2,0 через 100 ч, снова указывая на небольшую предпочтительную абсорбцию в опухоли по сравнению с нормальной тканью (фиг. 8D).
Пример 10
Терапевтические исследования
Эффекты мАт806 определяли в двух моделях с использованием ксенотрансплантатов: превентивной модели заболевания и модели укоренившейся опухоли.
Модели с использованием ксенотрансплантатов
В соответствии с предшествующими сообщениями (Nishikawa et al., Proc. Natl. Acad. Sci. U.S.A., 91(16), 7727-7731) клетки U87MG, трансфицированные de2-7 EGFR, росли быстрее родительских клеток и клеток U87MG, трансфицированных EGFR дикого типа. Поэтому было невозможным развитие обоих типов клеток в одних и тех же мышах.
Опухолевые клетки (3×106) в 100 мл PBS инокулировали подкожно в оба бока самок бестимусных мышей возрастом 4-6 недель (Animal Research Centre, Western Australia, Австралия). Терапевтическую эффективность мАт806 исследовали как в превентивной модели, так и в модели укоренившейся опухоли. В случае превентивной модели 5 мышей с двумя ксенотрансплантатами у каждой подвергали лечению посредством внутрибрюшинного введения либо 1 или 0,1 мг мАт806, либо носителя (PBS), начиная с предшествующего инокуляции опухолевых клеток дня. Лечение продолжали в течение введения всего 6 доз, 3 раза в неделю в течение 2 недель. В модели укоренившейся опухоли лечение начинали, когда средний объем опухолей достигал 65±6,42 мм3 (U87MG.Δ2-7), 84±9,07 мм3 (U87MG), 73±7,5 мм3 (U87MG.EGFR дикого типа) или 201±19,09 мм3 (опухоли A431). Объем опухоли в мм3 определяли, используя формулу (длина × ширина2)/2, где длина представляла собой самую длинную ось, а ширина - измерение под прямыми углами относительно длины (Clark et al. (2000) Therapeutic efficacy of anti-Lewis (y) humanized 3S 193 radioimmunotherapy in a breast cancer model: enhanced activity when combined with Taxol chemotherapy. Clin. Cancer Res. 6, 3621-3628). Данные представляли как средний объем опухолей ± стандартная ошибка для каждой подвергаемой лечению группы. Статистический анализ выполняли в заданные моменты времени, используя критерий Стьюдента. Животных подвергали эвтаназии, когда приблизительный объем ксенотрансплантатов достигал 1,5 см3, и опухоли иссекали для гистологического анализа. Этот исследовательский проект был разрешен Комиссией по проблеме этики отношения к животным Austin and Repatriation Medical Centre.
Гистологический анализ опухолевых ксенотрансплантатов
Ксенотрансплантаты иссекали и делили пополам. Одну половину фиксировали в 10% формалине/PBS до заливки парафином. Затем делали срезы толщиной четыре микрона, и их окрашивали гематоксилином и эозином (H&E) для обычного гистологического анализа. Другую половину заливали соединением Tissue Tek® OCT (Sakura Finetek, Torrance, CA), замораживали в жидком азоте и хранили при -80ºC. Делали тонкие (5 микрон) криостатные срезы, и их фиксировали в холодном как лед ацетоне в течение 10 мин с последующей сушкой на воздухе в течение дополнительных 10 мин. Срезы блокировали в блокирующем белки реагенте (Lipshaw Immunon, Pittsburgh, США) в течение 10 мин, а затем инкубировали с биотинилированным первым антителом (1 мг/мл) в течение 30 мин при комнатной температуре. Все антитела были биотинилированы с использованием компонента для биотинилирования белков ECL (Amersham, Baulkham Hills, Австралия), в соответствии с инструкциями производителя. После промывки PBS срезы инкубировали с комплексом стрептавидин-пероксидаза хрена в течение еще 30 мин (Silenus, Melbourne, Австралия). После конечной промывки PBS срезы подвергали воздействию субстрата 3-амино-9-этилкарбозола (AEC) (0,1 M уксусной кислоты, 0,1 M натрия ацетата, 0,02 M AEC (Sigma Chemical Co., St Louis, MO)) в присутствии перекиси водорода в течение 30 мин. Срезы промывали водой и подвергали контрастному окрашиванию гематоксилином в течение 5 мин и монтировали на предметных стеклах.
Эффективность мАт806 в превентивной модели
мАт806 проверяли на эффективность против опухолей U87MG и U87MG.Δ2-7 в превентивной модели с использованием ксенотрансплантатов. Антитело или носитель вводили внутрибрюшинно за день до инокуляции опухолевых клеток, и введение осуществляли 3 раза в неделю в течение 2 недель. мАт806 не оказывало эффект на рост ксенотрансплантатов родительских клеток U87MG, которые экспрессируют EGFR дикого типа, в дозе, составляющей 1 мг при каждой инъекции (фиг. 9A). Напротив, мАт806 значительно подавляло рост ксенотрансплантатов U87MG.Δ2-7 дозозависимым образом (фиг. 9B). В день 20, когда умерщвляли контрольных животных, средний объем опухолей составлял 1637±178,98 мм3 в случае контрольной группы, статистически меньше 526±94,74 мм3 в случае группы, которой вводили 0,1 мг при каждой инъекции (p<0,0001), и 197±42,06 мм3 в случае группы, которой вводили 1 мг при каждой инъекции (p<0,0001). Подвергнутые лечению группы умерщвляли в день 24, когда средний объем опухолей составлял 1287±243,03 мм3 в случае группы, подвергнутой лечению 0,1 мг, и 492±100,8 мм3 в случае группы, подвергнутой лечению 1 мг.
Эффективность мАт806 в модели укоренившегося ксенотрансплантата
Принимая во внимание эффективность мАт806 в превентивной модели с использованием ксенотрансплантатов, затем была проверена его способность к подавлению роста укоренившихся опухолевых ксенотрансплантатов. Лечение антителом было таким, которое описано для превентивной модели, за исключением того, что его начинали, когда средний объем опухолей достигал 65±6,42 мм3 в случае ксенотрансплантатов U87MG.Δ2-7 и 84±9,07 мм3в случае ксенотрансплантатов родительских клеток U87MG. И опять мАт806 не оказывало эффект на рост ксенотрансплантатов родительских клеток U87MG в дозе, составляющей 1 мг при каждой инъекции (фиг. 10A). Напротив, мАт806 значительно подавляло рост ксенотрансплантатов U87MG.Δ2-7 дозозависимым образом (фиг. 10B). В день 17, за день до умерщвления контрольных животных, средний объем опухолей составлял 935±215,04 мм3 в случае контрольной группы, 386±57,51 мм3в случае группы, которой вводили 0,1 мг при каждой инъекции (p<0,01), и 217±58,17 мм3в случае группы, которой вводили 1 мг при каждой инъекции (p<0,002).
Для исследования, ограничено ли подавление роста, наблюдаемое при использовании мАт806, клетками, экспрессирующими de2-7 EGFR, его эффективность против ксенотрансплантатов опухолевых клеток U87MG.wtEGFR была проверена в модели укоренившейся опухоли. Эти клетки служат в качестве модели для опухолей, имеющих амплификацию гена EGFR без экспрессии de2-7 EGFR. Лечение мАт806 начинали, когда средний объем опухолей достигал 73±7,5 мм3. мАт806 значительно подавляло рост укоренившихся ксенотрансплантатов U87MG.wtEGFR по сравнению с контрольными опухолями, подвергнутыми лечению носителем (фиг. 10C). В день умерщвления контрольных животных средний объем опухолей составлял 960±268,9 мм3 в случае контрольной группы и 468±78,38 мм3в случае группы, подвергнутой лечению посредством инъекций 1 мг (p<0,04).
Гистологический и иммуногистохимический анализ укоренившихся опухолей
Для определения возможных гистологических различий между подвергнутыми лечению мАт806 и контрольными ксенотрансплантатами U87MG.Δ2-7 и U87MG.wtEGFR (полученными в дни 24 и 42, соответственно), фиксированные с помощью формалина, залитые парафином срезы окрашивали H&E. Зоны некроза наблюдали в срезах как ксенотрансплантатов U87MG.Δ2-7 (полученных через 3 дня после окончания лечения), так и ксенотрансплантатов U87MG.wtEGFR (полученных через 9 дней после окончания лечения), подвергнутых лечению мАт806. Этот результат наблюдали раз за разом в ряде опухолевых ксенотрансплантатов (n=4). Однако, при анализе срезов ксенотрансплантатов, подвергнутых лечению контролем, не обнаружены те же зоны некроза, которые наблюдались при лечении мАт806. Срезы ксенотрансплантатов U87MG, подвергнутых лечению мАт806 или контролем, также окрашивали H&E, и не было выявлено различий в жизнеспособности клеток между двумя группами, что служит дополнительным подтверждение гипотезы, что связывание мАт806 индуцирует уменьшенную жизнеспособность клеток/некроз в опухолевых ксенотрансплантатах.
Иммуногистохимический анализ срезов ксенотрансплантатов U87MG, U87MG.Δ2-7 и U87MG.wtEGFR был проведен для определения уровней экспрессии de2-7 и EGFR дикого типа после лечения мАт806. Срезы получали в дни 24 и 42, как указано выше, и подвергали иммуноокрашиванию антителами 528 и 806. Как и ожидалось, антитело 528 окрашивало все срезы ксенотрансплантатов без явного уменьшения интенсивности между подвергнутыми лечению и контрольными опухолями. При использовании мАт806 окрашивание срезов U87MG было необнаруживаемым, однако было зарегистрировано положительное окрашивание срезов ксенотрансплантатов U87MG.Δ2-7 и U87MG.wtEGFR. Не было различия в интенсивности окрашивания мАт806 между контрольными и подвергнутыми лечению ксенотрансплантатами U87MG.Δ2-7 и U87MG.wtEGFR, что говорит о том, что лечение антителом не ингибирует экспрессию de2-7 или EGFR дикого типа.
Лечение ксенотрансплантатов A431 с помощью мАт806
Для демонстрации того, что противоопухолевые эффекты мАт806 не ограничиваются клетками U87MG, антитело вводили мышам с ксенотрансплантатами A431. Эти клетки имеют амплифицированный ген EGFR и экспрессируют приблизительно 2×106 рецепторов на клетку. Как обсуждалось выше, мАт806 связывается с приблизительно 10% этих EGFR и воздействует на ксенотрансплантаты A431. мАт806 значительно подавляло рост ксенотрансплантатов A431 при проверке в ранее описанной превентивной модели с использованием ксенотрансплантата (фиг. 11A). В день 13, когда умерщвляли контрольных животных, средний объем опухолей составлял 1385±147,54 мм3 в случае контрольной группы и 260±60,33 мм3 случае группы, подвергнутой лечению посредством инъекций 1 мг (p<0,0001).
В отдельном эксперименте составляющая 0,1 мг доза мАт также значительно подавляла рост ксенотрансплантатов A431 в превентивной модели.
Принимая во внимание эффективность мАт806 в превентивной модели с использованием ксенотрансплантатов A431, затем была проверена его способность к подавлению роста укоренившихся опухолевых ксенотрансплантатов. Лечение антителом было таким, которое описано для превентивной модели, за исключением того, что его не начинали до тех пор, пока средний объем опухолей не достигал 201±19,09 мм3. мАт806 значительно подавляло рост укоренившихся опухолевых ксенотрансплантатов (фиг. 11B). В день 13, когда умерщвляли контрольных животных, средний объем опухолей составлял 1142±120,06 мм3 в случае контрольной группы и 451±65,58 мм3в случае группы, которой вводили 1 мг при каждой инъекции (p<0,0001).
Итак, описанные здесь исследования терапии с использованием мАт806 явно свидетельствовали о дозозависимом подавлении роста ксенотрансплантатов U87MG.Δ2-7. Напротив, подавления роста ксенотрансплантатов родительских клеток U87MG не наблюдалось, несмотря на тот факт, что они продолжают экспрессировать EGFR дикого типа in vivo. мАт806 не только значительно уменьшало объем ксенотрансплантатов, оно также индуцировало значительный некроз внутри опухоли. Это является первым сообщением об успешном терапевтическом применении in vivo такого антитела против ксенотрансплантатов глиомных клеток человека, экспрессирующих de2-7 EGFR.
Сообщалось об амплификации гена EGFR в ряде различных опухолей, и она наблюдалась в приблизительно 50% глиом (Voldberg et al., 1997). Было выдвинуто предположение, что последующая сверхэкспрессия EGFR, опосредованная амплификацией гена рецептора, может дать преимущество роста посредством увеличения внутриклеточной передачи сигналов и клеточного роста (Filmus et al., 1987). Линия клеток U87MG была трансфицирована EGFR дикого типа для создания глиомной клетки, которая имитирует процесс амплификации гена EGFR. Лечение укоренившихся ксенотрансплантатов U87MG.wtEGFR моноклональным антителом 806 приводило к значительному подавлению роста. Таким образом, мАт806 также опосредует in vivo противоопухолевую активность против клеток, имеющих амплификацию гена EGFR. Интересно, что подавление с помощью мАт806 ксенотрансплантатов U87MG.wtEGFR, как представляется, является менее эффективным, чем таковое, наблюдаемое в случае опухолей U87MG.Δ2-7. Это, вероятно, служит отражением того факта, что мАт806 имеет низкую аффинность к увеличенному в числе в результате амплификации гена EGFR и связывается лишь с небольшой частью рецепторов, представленных на клеточной поверхности. Однако, следует отметить, что несмотря на небольшой эффект на объемы ксенотрансплантатов U87MG.wtEGFR лечение мАт806 порождало большие зоны некроза внутри этих ксенотрансплантатов.
Для исключения возможности того, что мАт806 опосредует подавление лишь происходящих из U87MG линий клеток, была проверена его эффективность против ксенотрансплантатов A431. Эта происходящая из плоскоклеточного рака линия клеток имеет значительную амплификацию гена EGFR, которая сохраняется как in vitro, так и in vivo. Лечение ксенотрансплантатов A431 моноклональным антителом 806 порождало значительное подавление роста и в превентивной модели, и в модели укоренившейся опухоли, что означает, что противоопухолевые эффекты мАт806 не ограничиваются линиями трансфицированных клеток U87MG.
Пример 11
Комбинированное терапевтическое лечение ксенотрансплантатов A431 с помощью мАт806 и AG1478
Противоопухолевые эффекты мАт806 в комбинации с AG1478 проверяли на мышах с ксенотрансплантатами A431. AG1478 (4-(3-хлоранилино)-6,7-диметоксихиназолин) является сильным и селективным ингибитором киназы EGFR в сравнении с HER2-neu и рецептором тромбоцитарного фактора роста (Calbiochem кат. № 658552). Были включены три контроля: лечение только носителем, только носителем + мАт806 и только носителем + AG1478. Результаты проиллюстрированы на фиг. 12. 0,1 мг мАт806 вводили за 1 день до создания ксенотрансплантата и через 1, 3, 6, 8 и 10 дней после создания ксенотрансплантата. 400 мкг AG1478 вводили в дни 0, 2, 4, 7, 9 и 11 после создания ксенотрансплантата.
Как AG1478, так и мАт806, после введения по отдельности, вызывали значительное уменьшение объема опухолей. Однако в комбинации уменьшение объема было значительно больше.
Кроме того, оценивали связывание мАт806 с EGFR клеток A431 в отсутствие и в присутствии AG1478. Клетки помещали в бессывороточные среды на ночь, затем обрабатывали AG1478 в течение 10 мин при 37ºC, дважды промывали PBS, затем лизировали в 1% Тритона, и лизаты готовили посредством центрифугирования в течение 10 мин при 12000×g. Затем лизаты оценивали на реактивность с 806 с помощью ELISA в модифицированном варианте анализа, описанного Schooler и Wiley в Analytical Biochemistry 277, 135-142 (2000). Планшеты покрывали 10 мкг/мл мАт806 в PBS/EDTA в течение ночи при комнатной температуре, а затем дважды промывали. Затем планшеты блокировали с помощью 10% сывороточного альбумина/PBS в течение 2 часов при 37ºC и дважды промывали. Добавляли клеточный лизат в разведении 1:20 в 10% сывороточного альбумина/PBS на 1 час при 37ºC, затем планшет промывали четыре раза. Вызывали реакцию с антителом против EGFR (SC-03; Santa Cruz Biotechnology Inc.) в 10% сывороточного альбумина/PBS в течение 90 мин при комнатной температуре, планшет промывали четыре раза, и добавляли конъюгированное с HRP антикроличье антитело (1:2000, если оно от Silenus) в 10% сывороточного альбумина/PBS на 90 мин при комнатной температуре, планшет промывали четыре раза, и цветовое проявление осуществляли с использованием ABTS в качестве субстрата. Было установлено, что связывание мАт806 значительно увеличивается в присутствии увеличивающихся количеств AG1478 (фиг. 13).
Пример 12
Иммунореактивность в глиобластомах человека, состояние EGFR в которых заранее типировано
Принимая во внимание высокую частоту экспрессии, амплификации и мутации EGFR в глиобластомах, было проведено детальное иммуногистохимическое исследование для определения специфичности 806 в опухолях, отличных от ксенотрансплантатов. С помощью иммуногистохимического исследования была проанализирована панель из 16 глиобластом. В этой панели из 16 глиобластом было заранее определено с помощью ОТ-ПЦР присутствие увеличенного в числе в результате амплификации гена EGFR дикого типа и экспрессии de2-7 EGFR. Шесть из этих опухолей экспрессировали лишь транскрипт для EGFR дикого типа, 10 имели амплификацию EGFR дикого типа, при этом 5 из них продемонстрировали лишь транскрипты для EGFR дикого типа, а другие 5 - как транскрипт для EGFR дикого типа, так и транскрипт гена de2-7.
Иммуногистохимический анализ был выполнен с использованием срезов толщиной 5 мм свежей замороженной ткани, помещенных на предметные стекла для гистологического исследования и фиксированных в течение 10 минут в холодном ацетоне. Связанное первое антитело обнаруживали с помощью биотинилированного антимышиного антитела с последующей реакцией с образованием комплекса авидин-биотин. Диаминобензидинтетрагидрохлорид (DAB) использовали в качестве хромогена. Степень иммуногистохимической реактивности в тканях устанавливали с помощью световой микроскопии, и расположение по степеням осуществляли в соответствии с числом иммунореактивных клеток, последовательно его увеличивая на 25%, как указано ниже:
Фокальное = менее чем 5%
+ = 5-25%
++ = 25-50%
+++ = 50-75%
++++ = >75%
Антитело 528 продемонстрировало сильную реактивность во всех опухолях, в то время как иммуноокрашивание антителом DH8.3 ограничивалось теми опухолями, которые экспрессируют de2-7 EGFR (таблица 2). В соответствии с предшествующими данными анализов с использованием FACS и анализов розеткообразующих клеток мАт806 не реагировало с глиобластомами, экспрессирующими транскрипт для EGFR дикого типа из не амплифицированных генов EGFR (таблица 2). Такая картина реактивности в случае мАт806 сходна с таковой, наблюдаемой в исследованиях с использованием ксенотрансплантатов, и снова наводит на мысль о том, что это антитело распознает de2-7 и амплифицированный EGFR, но не EGFR дикого типа, после представления на клеточной поверхности.
Пример 13
Иммунореактивность с EGFR в нормальной ткани
Для определения того, экспрессируется ли de2-7 EGFR в нормальной ткани, был проведен иммуногистохимический анализ с помощью мА806 и DH8.3 с использованием панели из 25 тканей. Ни в одной из исследованных тканей не наблюдалась сильная реактивность ни с мАт806, ни с DH8.3, что говорит о том, что de2-7 EGFR отсутствует в нормальных тканях (таблица 3). При использовании мАт806 наблюдалось некоторое непостоянное окрашивание, обнаруживаемое в миндалинах, которое было ограничено базальным клеточным слоем эпидермиса и секретирующими слизь сквамозными клетками эпителия. В плаценте наблюдалось нерегулярное иммуноокрашивание трофэктодермы. Интересно, что две ткани, которые экспрессируют высокие эндогенные уровни EGFR дикого типа, печень и кожа, не продемонстрировали какой-либо значительной реактивности с мАт806. Реактивность совсем не наблюдалась с образцами печени, и лишь слабая и нестабильная фокальная реактивность наблюдалась время от времени (в не более чем 10% от всех исследованных образцов) в базальных кератиноцитах в образцах кожи и в сквамозном эпителии слизистой оболочки миндалин, что служит дополнительным свидетельством того, что это антитело не связывается с EGFR дикого типа, представленным на поверхности клеток в какой-либо значительной степени (таблица 3). Все ткани были положительными в отношении EGFR дикого типа, о чем свидетельствует всеобщее окрашивание, наблюдаемое при использовании антитела 528 (таблица 3).
Пример 14
Иммунореактивность с EGFR в различных опухолях
Распространенность de2-7 EGFR в других типах опухолей исследовали с использованием панели из 12 различных раков. Антитело 528 часто демонстрировало однородное окрашивание во множестве проанализированных опухолей, за исключением меланомы и семиномы. При наличии иммунореактивности с DH8.3 она ограничивалась редкой фокальной опухолевой клеткой, указывая на то, что существует незначительная, если вообще существует, экспрессия de2-7 EGFR в опухолях вне головного мозга при использовании этой системы обнаружения (таблица 4). При использовании антитела DH8.3 также наблюдалось фокальное окрашивание кровеносных сосудов и меняющееся диффузное окрашивание соединительной ткани в некоторых опухолях (таблица 4). Это окрашивание сильно зависело от используемой концентрации антитела и считалось неспецифической фоновой реактивностью. мАт806 продемонстрировало положительное окрашивание 64% опухолей головы и шеи и 50% карцином легких (таблица 4). Была отмечена незначительная реактивность мАт806 в других опухолях помимо опухолей мочевого пузыря, которые были положительными в 30% случаев.
Поскольку раки головы и шеи и легких были отрицательными в отношении окрашивания антителом DH8.3, реактивность, наблюдаемая с этим мАт в этих опухолях, может иметь отношение к амплификации гена EGFR.

Пример 15
Иммунореактивность в глиобластомах человека с нетипированным состоянием EGFR
Для подтверждения уникальной специфичности и определения реактивности мАт806 его сравнивали с антителами 528 и DH8.3 с использованием панели из 46 глиобластом с нетипированным заранее состоянием EGFR. Антитело 528 продемонстрировало сильное и однородное окрашивание всех образцов, кроме двух (№ 27 и 29) (44/46, 95,7%). Эти два случая были также отрицательными по реактивности с мАт806 и мАтDH8.3. мАт806 было положительным в 27/46 (58,7%) случаев, в 22 из которых продемонстрирована однородная иммунореактивность в более чем 50% опухолей. Антитело DH8.3 было положительным в 15/46 (32,6%) глиобластом, в 9 из которых продемонстрирована однородная иммунореактивность. Результаты иммунохимического окрашивания этих опухолей с нетипированным состоянием EGFR сведены в таблицу 5.
Между мАт806 и DH8.3 было соответствие в каждом случае, кроме одного (№ 35). Молекулярный анализ наличия амплификации гена EGFR был выполнен в 44 случаях (таблица 5). Из них типирование 30 случаев совпадало с ранее установленной картиной иммунореактивности с мАт806: например, в 16 мАт806-отрицательных случаях не выявлена амплификация EGFR, а 14 случаев с амплификацией EGFR были также мАт806-иммуноположительными. Однако 13 случаев, которые продемонстрировали иммунореактивность с 806, были отрицательными по амплификации гена EGFR, в то время как один случай с амплификацией гена EGFR был мАт806-отрицательным. Дополнительный анализ мутационного состояния этих случаев, отрицательных по амплификации и положительных по реактивности с 806, описан ниже и дает объяснение большинству из 13 случаев, которые были отрицательными по амплификации гена EGFR и распознавались антителом 806.
Впоследствии был выполнен молекулярный анализ делеционной мутации с помощью ОТ-ПЦР с использованием 41/46 случаев (таблица 5). Из них типирование 34 случаев совпадало с картиной иммунореактивности с антителом DH8.3, специфичным в отношении делеционной мутации: 12 случаев были положительными как в ОТ-ПЦР, так и при иммуногистохимическом анализе, и 22 случая были отрицательными/отрицательными. Три случая (#2, #34 и #40) были DH8.3-положительными/отрицательными по делеционной мутации в ОТ-ПЦР, и три случая (#12, #18 и #39) были DH8.3-отрицательными/положительными в ОТ-ПЦР. Как и ожидалось на основе предшествующих анализов специфичности авторов настоящего изобретения, иммунореактивность с мАт806 наблюдалась во всех DH8.3-положительных тканей, кроме одного случая (#35).
В случае #3 также выявлена мутация (обозначенная A2 в таблице 5), которая включала последовательности мутации de2-7, но, как представляется, не была классической делецией de2-7 с утратой 801 основания (не представленные данные). Этот случай был отрицательным по реактивности с DH8.3, но продемонстрировал реактивность с 806, что означает, что 806 может распознавать допонительную и, возможно, уникальную мутацию EGFR.

Положительный тип реактивности антитела 806 соответствовал амплифициронному или de2-7 мутантному EGFR в 19/27 или в свыше 70% случаев. Примечательно, что 2 из этих 8 случаев также реагировали с DH8.3.
Пример 16
Системная терапия и анализ внутричерепных опухолей - глиом
Для проверки эффективности моноклонального антитела против ΔEGFR, мАт806, бестимусных мышей с внутричерепными ксенотрансплантатами экспрессирующих ΔEGFR глиом подвергали лечению с помощью внутрибрюшинных инъекций мАт806, совпадающего по изотипу IgG в качестве контроля или PBS.
Поскольку в первичных эксплантах глиобластом человека быстро утрачивается экспрессия рецепторов, являющихся следствием амплификации, реаранжировки их гена, в культуре, существующие линии клеток глиобластом не демонстрируют такую экспрессию. Для принуждения к сохранению уровней экспрессии, сравнимых с таковыми, наблюдаемыми в опухолях человека, клетки U87MG, LN-Z308 и A1207 (подарок от Dr. S. Aaronson, Mount Sinai Medical Center, New York, NY) инфицировали вирусами, кодирующими ΔEGFR, ΔEGFR с недостатком киназной активности (DK) или EGFR дикого типа (wtEGFR), которые также придают резистентность к G418, как описано ранее (Nishikawa et al. (1994) A mutant epidermal growth factor receptor common in human glioma confers enhanced tumorigenicity. Proc. Natl. Acad. Sci. U.S.A., 91, 7727-7731).
Популяции, экспрессирующие сходные уровни различных аллелей EGFR (эти уровни экспрессии приблизительно соответствуют уровню амплификации, составляющему 25 копий гена; глиобластомы человека обычно имеют уровни амплификации, составляющие от 10 до 50 копий гена усеченного рецептора) были отобраны с помощью FACS, как описано ранее (Nishikawa et al., 1994), и названы U87MG.ΔEGFR, U87MG.DK, U87MG.wtEGFR, LN-Z308.ΔEGFR, LN-Z308.DK, LN-Z308.wtEGFR, A1207.ΔEGFR, A1207.DK и A1207.wtEGFR, соответственно. Каждую из них сохраняли в среде, содержащей G418 (в случае линий клеток U87MG - 400 мкг/мл; в случае линий клеток LN-Z308 и A1207 - 800 мкг/мл).
Клетки U87MG.ΔEGFR (1×105) или 5×105клеток LN-Z308.ΔEGFR, A1207.ΔEGFR, U87MG, U87MG.DK и U87MG.wtEGFR в 5 мкл PBS имплантировали в правое полосатое тело головного мозга бестимусных мышей, как описано ранее (Mishima et al. (2000) A peptide derived from the non-receptor binding region of urokinase plasminogen activator inhibits glioblastoma growth and angiogenesis in vivo in combination with cisplatin. Proc. Natl. Acad. Sci. U.S.A. 97, 8484-8489). Системную терапию с использованием мАт806, или IgG2b в качестве совпадающего по изотипу контроля, осуществляли посредством внутрибрюшинной инъекции 1 мкг мАт в объеме 100 мкл через день с дня 0 по 14 после трансплантации. Для прямого лечения внутричерепных опухолей U87MG.ΔEGFR 10 мкг мАт806, или IgG2b в качестве совпадающего по изотипу контроля, в объеме 5 мкл инъецировали в место инъекции опухолевых клеток через день, начиная с дня 1, в течение 5 дней.
Животные, подвергнутые лечению PBS или совпадающим по изотипу IgG в качестве контроля, имели медиану выживаемости, составляющую 13 дней, тогда как подвергнутые лечению мАт806 мыши имели составляющее 61,5% увеличение медианы выживаемости вплоть до 21 дня (P<0,001; фиг. 24A).
Лечение мышей спустя 3 дня после имплантации, после укоренения опухоли, также увеличивало медиану выживаемости подвергнутых лечению мАт806 животных на 46,1% (с 13 дней до 19 дней; P<0,01) по сравнению с таковой контрольной группы (не представленные данные).
Для определения того, выходят ли эти противоопухолевые эффекты мАт806 за рамки ксенотрансплантатов U87MG.ΔEGFR, сходные лечения назначали животным с ксенотрансплантатами других глиомных клеток: LN-Z308.ΔEGFR и A1207.ΔGFR. Медиана выживаемости подвергнутых лечению мАт806 мышей с ксенотрансплантатами LN-Z308.ΔEGFR увеличивалась с 19 дней в случае контролей до 58 дней (P<0,001; фиг. 24B). Поразительно, что четыре из восьми подвергнутых лечению мАт806 животных оставались живыми больше 60 дней (фиг. 24B). Медиана выживаемости животных с ксенотрансплантатами A1207.ΔEGFR также увеличивалась с 24 дней в случае контролей до 29 дней (P<0,01; не представленные данные).
Лечение мАт806 подавляет рост сверхэкспрессирующих ΔEGFR опухолей головного мозга
Мышей с ксенотрансплантатами U87MG.ΔEGFR и LN-Z308.ΔEGFR подвергали эвтаназии в день 9 и день 15, соответственно. Срезы опухолей подвергали гистопатологическому анализу и определяли объемы опухолей. В соответствии с результатами, полученными в отношении выживаемости животных, лечение мАт806 значительно уменьшало объемы на приблизительно 90% в случае ксенотрансплантатов U87MG.ΔEGFR. (P<0,001; фиг. 24C) и на более чем 95% в случае ксенотрансплантатов LN-Z308.ΔEGFR (P<0,001; фиг. 24D) по сравнению с таковыми контрольных групп. Сходные результаты были получены в случае животных с опухолями A1207.ΔEGFR (уменьшение объема на 65%, P<0,01; не представленные данные).
Лечение посредством инъекции мАт806 внутрь опухолей увеличивает выживаемость мышей с опухолями головного мозга U87MG.ΔEGFR
Также была определена эффективность прямой инъекции мАт806 внутрь опухолей для лечения ксенотрансплантатов U87MG.ΔEGFR. Животным инъецировали внутрь опухолей мАт806 или совпадающий по изотипу IgG в качестве контроля спустя день после имплантации. Контрольные животные оставались живыми в течение 15 дней, тогда как подвергнутые лечению мАт806 мыши оставались живыми в течение 18 дней (P<0,01; фиг. 24E). Хотя лечение посредством инъекции мАт806 внутрь опухолей было до некоторой степени эффективным, оно включало трудности многократных внутричерепных инъекций и увеличивало риск инфицирования. Поэтому авторы настоящего изобретения сосредоточились на системных терапиях для дальнейших исследований.
Лечение мАт806 слегка увеличивает выживаемость мышей с внутричерепными ксенотрансплантатами U87MG.wtEGFR, но не U87MG или U87MG.DK
Для определения того, является ли подавление роста с помощью мАт806 селективным для опухолей, экспрессирующих ΔEGFR, лечению подвергали животных с ксенотрансплантатами опухолей головного мозга: U87MG, U87MG.DK (ΔEGFR с недостатком киназной активности) и U87MG.wtEGFR. Лечение мАт806 не увеличивало выживаемость мышей, которым были имплантированы опухоли U87MG (фиг. 25A), которые экспрессировали на низком уровне эндогенный EGFR дикого типа (wtEGFR) (Huang et al. (1997) The enhanced tumorigenic activity of a mutant epidermal growth factor receptor common in human cancers is mediated by threshold levels of constitutive tyrosine phosphorylation and unattenuated signaling. J. Biol. Chem., 272, 2927-2935) или животных с ксенотрансплантатами U87MG.DK, которые сверхэкспрессировали ΔEGFR с недостатком киназной активности помимо низкого уровня эндогенного EGFR дикого типа (фиг. 25B). Лечение мАт806 слегка увеличивало выживаемость мышей, имеющих опухоли U87MG.wtEGFR (P<0, 05, медиана выживаемости - 23 дня в сравнении с 26 днями для контрольных групп), которые сверхэкспрессировали EGFR дикого типа (фиг. 25C).
Реактивность мАт806 коррелирует с in vivo противоопухолевой эффективностью
Для понимания дифференциального эффекта мАт806 на опухоли, экспрессирующие различные уровни или различные типы EGFR, авторы настоящего изобретения определили реактивность мАт806 с различными опухолевыми клетками посредством анализа с использованием FACS. Окрашенные клетки анализировали с помощью FACS Calibur, используя программное обеспечение Cell Quest (Becton-Dickinson PharMingen). В качестве первого антитела использовались следующие мАт: мАт806, клон 528 мАт против EGFR и клон EGFR.1. В качестве совпадающего по изотипу контроля использовали мышиный IgG2a или IgG2b.
В соответствии с предшествующими сообщениями (Nishikawa et al. (1994) A mutant epidermal growth factor receptor common in human glioma confers enhanced tumorigenicity. Proc. Natl. Acad. Sci. U.S.A., 91, 7727-7731), мАт528 против EGFR распознавало как ΔEGFR, так и EGFR дикого типа и продемонстрировало более интенсивное окрашивание клеток U87MG.ΔEGFR, чем клеток U87MG (фиг.26A, 528).
Напротив, антитело клона EGFR.1 реагировало с EGFR дикого типа, но не с ΔEGFR (Nishikawara et al., 1994), поскольку с клетками U87MG.ΔEGFR реакция была настолько же слабой, как и с клетками U87MG (фиг.26A, панель EGFR.1).
Это антитело клона EGFR.1 реагировало с U87MG.wtEGFR более сильно, чем с клетками U87MG, поскольку клетки U87MG.wtEGFR сверхэкспрессировали EGFR дикого типа (фиг. 26A, панель EGFR.1). Хотя мАт806 реагировало сильно с клетками U87MG.ΔEGFR и U87MG.DK, но не с клетками U87MG, оно реагировало слабо с U87MG.wtEGFR, что означает, что мАт806 является селективным для ΔEGFR, при этом существует слабая перекрестная реакция со сверхэспрессированным EGFR дикого типа (фиг. 26A, панель мАт806).
Этот уровень реактивности с U87MG.wtEGFR соответствовал в количественном и качественном отношении увеличению выживаемости, опосредуемому лечением антителом (фиг. 25C).
В дальнейшем авторы настоящего изобретения определили специфичность мАт806 с помощью иммунопреципитации. EGFR в различных клеточных линиях подвергали иммунопреципитации с помощью антител мАт806, клона 528 мАт против EGFR (Oncogene Research Products, Boston, MA) или клона EGFR.1 (Oncogene Research Products).
Вкратце, клетки лизировали с помощью буфера для лизиса, содержащего 50 мМ HEPES (pH 7,5), 150 мМ NaCl, 10% глицерина, 1% Тритона X-100, 2 мМ EDTA, 0,1% SDS, 0,5% натрия дезоксихолата, 10 мМ натрия PPi, 1 мМ фенилметилсульфонилфторид, 2 мМ Na3VO4, 5 мкг/мл лейпептина и 5 мкг/мл апротинина. Антитела инкубировали с лизатами клеток при 4ºC в течение 1 ч перед добавлением сефарозы с белком A и G. Иммунопреципитаты промывали дважды буфером для лизиса и один раз буфером HNTG [50 мМ HEPES (pH 7,5), 150 мМ NaCl, 0,1% Тритона X-100 и 10% глицерина], подвергали электрофорезу и переносили на нитроцеллюлозные мембраны.
Блоты с электрофоретически разделенными белками зондировали с использованием антител против EGFR, C13 (предоставленного Dr. G.N. Gill, University of California, San Diego, CA), используемого для обнаружения как EGFR дикого типа, так и ΔEGFR на иммуноблотах (Huang et al., 1997), и белки визуализировали, используя хемилюминесцентную систему обнаружения ECL (Amersham Pharmacia Biotech.). Антитела против Bcl-X (кроличье поликлональное антитело; Transduction Laboratories, Lexington, KY) и фосфотирозина (4G10, Upstate Biotechnology, Lake Placid, NY) использовали для анализа с использованием Вестерн-блоттинга, как описано ранее (Nagane et al. (1998) Drug resistance of human glioblastoma cells conferred by a tumor-specific mutant epidermal growth factor receptor through modulation of Bcl-XL and caspase-3-like proteases. Proc. Natl. Acad. Sci. U.S.A. 95, 5724-5729).
В соответствии с анализом с использованием FACS антитело 528 распознавало EGFR дикого типа и мутантные рецепторы (фиг. 26B-панель IP: 528), тогда как антитело EGFR.1 реагировало с EGFR дикого типа, но не с мутантными разновидностями (фиг. 26B, панель IP:EGFR.1). Кроме того, уровни мутантных рецепторов в клетках U87MG.ΔEGFR и U87MG.DK сравнимы с уровнями EGFR дикого типа в клетках U87MG.wtEGFR (фиг. 26B, панель IP: 528).
Однако антитело мАт806 было способно к преципитации лишь небольшого количества EGFR дикого типа из лизатов клеток U87MG.EGFR дикого типа по сравнению с большим количеством подвергающего преципитации мутантного рецептора из клеток U87MG.ΔEGFR и U87MG.DK и не обнаруживаемым количеством из клеток U87MG (фиг. 26B, панель IP: мАт806). В совокупности эти данные говорят о том, что мАт806 распознает эпитоп в ΔEGFR, который также существует в небольшой части EGFR дикого типа только в случае его сверхпредставленности на клеточной поверхности (см. ниже дальнейшее обсуждение и упоминания эпитопа для мАт806).
Лечение мАт806 уменьшает аутофосфорилирование ΔEGFR и подавляет экспрессию Bcl-XL в опухолях головного мозга U87MG.ΔEGFR
Затем были исследованы механизмы, лежащие в основе подавления роста антителом мАт806. Поскольку активность конститутивно активной киназы и аутофосфорилирование карбоксильного конца ΔEGFR важны для его биологических функций (Nishikawa et al. (1994) A mutant epidermal growth factor receptor common in human glioma confers enhanced tumorigenicity. Proc. Natl. Acad. Sci. U.S.A. 91, 7727-7731; Huang et al., 1997; Nagane et al. (1996) A common mutant epidermal growth factor receptor confers enhanced tumorigenicity on human glioblastoma cells by increasing proliferation and reducing apoptosis. Cancer Res., 56, 5079-5086; Nagane et al. (2001) Aberrant receptor signaling in human malignant gliomas: mechanisms and therapeutic implications. Cancer Lett. 162 (Suppl.l), S17-S21), было определено состояние фосфорилирования ΔEGFR в опухолях подвергнутых лечению и контрольных животных. Как показано на фиг. 27A, лечение мАт806 значительно снижает аутофосфорилирование ΔEGFR, хотя уровни рецептора были лишь слегка снижены в подвергнутых лечению мАт806 ксенотрансплантатах. Авторы настоящего изобретения ранее установили, что аутофосфорилирование рецептора является причиной увеличения экспрессии антиапоптозного гена, Bcl-XL, который играет ключевую роль в снижении апоптоза сверхэкспрессирующих ΔEGFR опухолевых клеток (Nagane et al., 1996; Nagane et al., 2001). Поэтому затем был определен эффект лечения мАт806 на экспрессию Bcl-XL. В опухолях ΔEGFR от подвергнутых лечению мАт806 животных, в действительности, не выявлены уменьшенные уровни Bcl-XL (фиг. 27A).
Лечение мАт806 уменьшает рост и ангиогенез и увеличивает апоптоз в опухолях U87MG.ΔEGFR
Ввиду in vivo подавления, вызванного лечением мАт806, и его биохимическими эффектами на передачу сигнала рецептором, авторы настоящего изобретения определили скорость пролиферации опухолевых клеток у контрольных и подвергнутых лечению мышей. Индекс пролиферации, определенный с помощью окрашивания на антиген Ki-67 подвергнутых лечению мАт806 опухолей, был значительно ниже, чем индекс для контрольных опухолей (P<0,001; фиг. 28).
Вкратце, для оценки ангиогенеза в опухолях их фиксировали в растворе, содержащем хлорид цинка, заливали парафином, делали срезы и подвергали иммуноокрашиванию, используя моноклональное крысиное антитело против CD31 мыши (Becton-Dickinson PharMingen; 1:200). Оценку пролиферации опухолевых клеток осуществляли с помощью иммуногистохимического анализа Ki-67 на фиксированных формалином залитых парафином опухолевых тканях. После депарафинизации и регидратации срезы тканей инкубировали с 3% перекиси водорода в метаноле для подавления эндогенной пероксидазы. Срезы блокировали в течение 30 мин с помощью козьей сыворотки и инкубировали в течение ночи с первым антителом при 4ºC. Затем срезы промывали PBS и инкубировали с биотинилированным вторым антителом в течение 30 мин. После нескольких промывок PBS продукты визуализировали, используя конъюгированную со стрептавидином пероксидазу хрена, с использованием диаминобензидина в качестве хромогена и гематоксилина в качестве вещества для контрастного окрашивания. В качестве показателя пролиферации определяли индекс мечения по Ki-67 как отношение меченых ядер ко всем ядрам в полях зрения под большим увеличением (3400).
Подсчитывали приблизительно 2000 ядер в каждом случае при систематически случайном отборе образцов. В случае окрашивания макрофагов и NK-клеток замороженные срезы, фиксированные с помощью забуференного 4% раствора параформальдегида, подвергали иммуноокрашиванию, используя биотинилированное мАтF4/80 (Serotec, Raleigh, NC) и поликлональное кроличье антитело против асиало-GM1 (Dako Chemicals, Richmond, VA), соответственно. Используя выполняемый с помощью вычисленной машины анализ, осуществляли количественный анализ ангиогенеза в виде площади васкуляризации. С этой целью срезы подвергали иммуноокрашиванию, используя антитело против CD31, и анализировали, используя систему для выполняемого с помощью вычисленной машины анализа изображений, без контрастного окрашивания. MVA (площадь микроваскуляризации) определяли посредством фиксации преобразуемых в цифровую форму изображений срезов при увеличении 3200, используя аппарат для цветной съемки CCD, как описано ранее (Mishima et al., 2000). Затем изображения анализировали, используя программное обеспечение Image Pro Plus, версию 4.0 (Media Cybernetics, Silver Spring, MD), и MVA определяли посредством определения общего окрашивания в каждом срезе. В случае каждого препарата оценивали четыре поля. Это значение затем представляли как процент от всей площади в каждом поле. В каждом эксперименте результаты подтверждали по меньшей мере два наблюдателя (K. M., H-J. S. H.).
Кроме того, в опухолевой ткани выявляли апоптозные клетки посредством использования способа с использованием TUNEL (терминального дезоксиуридиного мечения концов), как описано ранее (Mishima et al., 2000). TUNEL-положительные клетки подчитывали при увеличении 400. Индекс апоптоза рассчитывали как отношение числа апоптозных клеток к общему числу клеток в каждом поле. Анализ индекса апоптоза благодаря TUNEL-мечению показал значительное увеличение числа апоптозных клеток в подвергнутых лечению мАт806 опухолях по сравнению с контрольными опухолями (P<0,001; фиг. 28).
Степень васкуляризации опухолей также анализировали с помощью иммуноокрашивания опухолей от подвергнутых лечению и контрольных субъектов на CD31. Для количественного анализа васкуляризации опухолей определяли площади микроваскуляризации (MVA), используя выполняемый с помощью вычисленной машины анализ изображений. Подвергнутые лечению мАт806 опухоли продемонстрировали меньшую на 30% MVA, чем контрольные опухоли (P<0,001; фиг. 28).
Для уяснения, может ли взаимодействие между рецептором и антителом индуцировать воспалительную реакцию, срезы опухолей окрашивали на маркер макрофагов, F4/80, и маркер NK-клеток, асиало-GM1. Макрофаги были идентифицированы по всему опухолевому матриксу и были особенно скоплены по периферии подвергнутых лечению мАт806 опухолей U87MG.ΔEGFR (фиг. 28). Авторы настоящего изобретения наблюдали небольшое число NK-клеток, инфильтрованных в опухоли, и вокруг них и не наблюдали значительного различия между подвергнутыми лечению мАт806 и совпадающим по изотипу контролем опухолями (не представленные данные).
Пример 17
Комбинированная иммунотерапия с использованием мАт806 и мАт528
Изложенные здесь эксперименты являются видом in vivo исследования, спланированного для определения эффективности антител в соответствии с этим изобретением.
Самки бестимусных мышей возрастом 4-6 недель использовались в качестве экспериментальных животных. Мышам подкожно инокулировали 3×106 опухолевых клеток в каждый из их боков.
Животным инокулировали клетки либо U87MG.D2-7, U87MG.DK, либо A431, все из которых описаны выше. Лечение начинали, когда опухоли вырастали до достаточного размера.
Затем мышам инъецировали одно из следующего: (i) забуференный фосфатом солевой раствор, (ii) мАт806 (0,5 мг/инъекцию), (iii) мАт528 (0,5 мг/инъекцию) или (iv) комбинацию обоих мАт. Что касается ʺ(iv)ʺ, различные группы мышей получали либо 0,5 мг/инъекцию каждого мАт, либо 0,25 мг/инъекцию каждого мАт.
Первой исследуемой группой мышей были мыши, которым инъецировали клетки U87MG.D2-7. Протокол лечения начинался спустя 9 дней после инокуляции и продолжался 3 раза в неделю в течение 2 недель (т.е. инъекции животным осуществляли в дни 9, 11, 13, 16, 18 и 20 после того, как им инокулироали клетки). В начале протокола лечения средний диаметр опухолей составлял 115 мм3. Каждая группа содержала 50 мышей, каждая с двумя опухолями.
В группе мышей, которые получали комбинацию антител (0,5 мг/инъекцию каждого), были три полные регрессии. Регрессией не было в какой-либо из других групп. На фиг. 18A графически представлены результаты.
В случае второй группы мышей инъецируемые материалы были такими же, кроме того, что комбинированная терапия содержала 0,25 мг каждого антитела на инъекцию. Инъекции осуществляли в дни 10, 12, 14, 17, 19 и 21 после инокуляции клеток. В начале терапии средний диаметр опухолей составлял 114 мм3. Результаты представлены на фиг. 18B.
Третьей группе мышей инокулировали клетки U87MG.DK. Инъекции терапевтических средств начинали спустя 18 дней после инокуляции клеток и продолжали в дни 20, 22, 25, 27 и 29. Средний размер опухолей в начале лечения составлял 107 мм3. Результаты суммированы на фиг. 18C. Инъекции терапевтических средств были такими же, как и в случае первой группы.
Наконец, инъекции четвертой группе мышей, которой инокулировали клетки A431, осуществляли, как и случае групп I и III, в дни 8, 10, 12 и 14 после инокуляции. Вначале средний размер опухолей составлял 71 мм3. Результаты представлены на фиг. 18D.
Результаты указывают на то, что комбинированная терапия с использованием антител продемонстрировала синергетический эффект в уменьшении опухолей. См. фиг. 18A. Схожий эффект наблюдался при более низкой дозе, в соответствии с фиг. 18B, что означает, что эффект не обусловлен лишь уровнями введения доз.
Комбинированная терапия не подавляла рост U87MG.DK (фиг. 18C), что означает, что иммунная функция антитела не была причиной уменьшения, наблюдаемого на фиг. 18A и 18B.
Отмечено, что, как показано на фиг. 18D, комбинированная терапия также проявляла синергетический эффект на опухоли A431, при этом 4 дозы приводили к степени, составляющей 60% от полного ответа. Эти данные говорят о том, что молекула EGFR, распознаваемая мАт806, является функционально отличной от молекулы, инкубируемой 528.
Пример 18
Подавление с помощью мАт806 роста опухолевых ксенотрансплантатов
Как здесь обсуждалось и далее демонстрируется и обсуждается в этом примере, было неожиданно обнаружено, что мАт806 подавляет рост ксенотрансплантатов опухолей, экспрессирующих либо de2-7 или амплифицированный EGFR, но не EGFR дикого типа.
Линии клеток и антитела были приготовлены, как описано в примере 1. Для определения специфичности мАт806 анализировали его связывание с клетками U87MG, U87MG.Δ2-7 и U87MG.wtEGFR с помощью FACS. Вкратце, подвергнутые культивированию линии родительских и трансфицированных клеток U87MG анализировали на экспрессию EGFR дикого типа и de2-7EGFR, используя антитела 528, 806 и DH8.3. Клетки (1×106) инкубировали с 5 мкг/мл соответствующего антитела или совпадающего по изотипу антитела в качестве отрицательного контроля в PBS, содержащем 1% HSA, в течение 30 мин при 4ºC. После трех промывок PBS/1% HSA клетки инкубировали еще 30 мин при 4ºC со связанным с FTTC козьим антимышиным антителом (в разведении 1:100; Calbiochem, San Diego, CA). После трех последующих промывок клетки анализировали в Epics Elite ESP (Beckman Coulter, Hialeah, FL) посредством фиксации как минимум 20000 событий и анализировали, используя EXPO (версию 2) для Windows. Нерелевантный IgG2b (мАт 100-310, направленное против антигена A33 человека) был включен в качестве совпадающего по изотипу контроля для мАт806, и было включено антитело 528, поскольку оно распознает и de2-7, и EGFR дикого типа.
Лишь антитело 528 было способно окрашивать родительскую линию клеток U87MG (фиг. 29), что согласуется с предшествующими сообщениями о том, что эти клетки экспрессируют EGFR дикого типа (Nishikawa et al. (1994) A mutant epidermal growth factor receptor common in human glioma confers enhanced tumorigenicity. Proc. Natl. Acad. Sci. U.S.A. 91, 7727-7731). мАт806 демонстрировало уровни связывания, схожие с таковыми контрольного антитела, что ясно свидетельствует о том, что оно не способно к связыванию рецептора EGFR дикого типа (фиг. 29). Связывание совпадающего по изотипу контрольного антитела с клетками U87MG.Δ2-7 и U87MG.wtEGFR было таким же, как связывание, наблюдаемое в случае клеток U87MG. мАт806 окрашивало клетки U87MG.Δ2-7 и U87MG.wtEGFR, что указывает на то, что мАт806 специфически распознает de2-7 EGFR и подмножество сверхэкспрессированного EGFR (фиг. 29). Как и ожидалось, антитело 528 окрашивало линии как клеток U87MG.Δ2-7, так и клеток U87MG.wtEGFR (фиг. 29). Интенсивность окрашивания антителом 528 клеток U87MG.wtEGFR была намного больше интенсивности окрашивания мАт806, что наводит на мысль, что мАт806 распознает лишь часть сверхэкспрессированного EGFR. Реактивность мАт806, наблюдаемая с клетками U87MG.wtEGFR, является схожей с таковой, полученной с клетками A431, другой линией клеток, которая сверхэкспрессирует EGFR.3 дикого типа.
Анализ Скетчарда был выполнен, используя клетки U87MG.Δ2-7 и A431, для определения относительной аффинности и сайтов связывания мАт806 в каждой линии клеток. мАт806 обладало аффинностью к рецептору de2-7 EGFR, составляющей 1,1×109 M-1, и распознавало в среднем (три отдельных эксперимента) 2,4×105 сайтов связывания в каждой клетке, как отмечено в примере 4. В отличие от этого, аффинность мАт806 к EGFR дикого типа на клетках A431 составляла лишь 9,5×107 M-1, как отмечено в примере 8. Интересно, что мАт806 распознавало 2,3×105 сайтов связывания на поверхности A431, что приблизительно в 10 раз меньше представленного в сообщении числа EGFR, установленного в этих клетках. Для подтверждения числа EGFR на поверхности клеток A431, используемых авторами настоящего изобретения, они выполнили анализ Скетчарда, используя125I-меченное антитело 528. Как и ожидалось, это антитело связывалось с приблизительно 2×106 сайтов на поверхности клеток A431. Таким образом, мАт806, как представляется, связывается лишь с частью рецепторов EGFR на поверхности клеток A431. Важно, что125I-меченное мАт806 вообще не связывалось с родительскими клетками U87MG, даже когда число клеток увеличивали до 1×107.
В дальнейшем реактивность мАт806 в различных линиях клеток определяли с помощью иммунопреципитации после35S-мечения, используя мАт806, sc-03 (имеющееся в продаже поликлональное антитело, специфичное в отношении COOH-концевого домена EGFR) и IgG2b в качестве совпадающего по изотипу контроля. Вкратце, клетки подвергали мечению в течение 16 ч 100 мКи/мл транс35S-меткой (ICN Biomedicals, Irvine, CA) в среде DMEM без метионина/цистеина, дополненной 5% подвергнутой диализу FCS. После промывки PBS клетки помещали в буфер для лизиса (1% Тритона X-100, 30 мМ HEPES, 150 мМ NaCl, 500 мкМ 4-(2-аминоэтил)бензолсульфонилфторид (AEBSF), 150 нМ апротинин, 1 мкМ ингибитор протеаз E-64, 0,5 мМ EDTA и 1 мкМ лейпептин, рН 7,4) на 1 ч при 4ºC. Лизаты осветляли центрифугированием в течение 10 мин при 12000×g, а затем инкубировали с 5 мкг соответствующего антитела в течение 30 мин при 4ºC перед добавлением сефарозы с белком A. Иммунопреципитаты промывали трижды буфером для лизиса, смешивали с буфером для образцов с SDS, разделяли с помощью гель-электрофореза, используя 4-20% ПААГ в Трис/глицине, который затем подвергали сушке, и осуществляли экспонирование рентгеновской пленки излучением от него.
Антитело sc-03 иммунопреципитировало дающие три полосы молекулы из клеток U87MG.Δ2-7: дублет, соответствующий 2 полосам de2-7 EGFR, наблюдаемого в этих клетках, и полосу молекул большей молекулярной массы, соответствующих EGFR дикого типа (фиг. 22 и 30). В отличие от этого, хотя мАт806 иммунопреципитировало дающие две полосы молекулы de2-7 EGFR, EGFR дикого типа полностью отсутствовал. Картины, наблюдаемые в клетках U87MG.wtEGFR и A431, были по существу идентичными. Антитело sc-03 иммунопреципитировало дающие одну полосу молекулы, соответствующие EGFR дикого типа, из клеток A431 (фиг. 22 и 30). мАт806 также иммунопреципитировало дающие одну полосу молекулы, соответствующие EGFR дикого типа, и из клеток U87MG.wtEGFR, и из клеток A431 (фиг. 22 и 30). В соответствии с данными анализа с использованием FACS и анализа Скетчарда количество EGFR, иммунопреципитированное мАт806, было существенно меньше общего количества EGFR, присутствующего на клеточной поверхности. Принимая во внимание, что мАт806 и sc-03 иммунопреципитировали схожие количества de2-7 EGFR, этот результат поддерживает идею, что антитело мАт806 распознает лишь часть EGFR в клетках, сверхэкспрессирующих рецептор. Сравнения между мАт806 и антителом 528 обнаружило идентичные картины реактивности (не представленные данные). Нерелевантный IgG2b (совпадающий по изотипу контроль для мАт806) не иммунопреципитировал EGFR из какой-либо линии клеток (фиг. 22 и 30). При использовании идентичных условий мАт806 не иммунопреципитировало EGFR из родительских клеток U87MG (не представленные данные).
мАт806 также проверяли на эффективность против опухолей U87MG и U87MG.Δ2-7 в превентивной модели с использованием ксенотрансплантатов. Антитело или носитель вводили внутрибрюшинно за день до инокуляции опухолевых клеток, и введение осуществляли 3 раза в неделю в течение 2 недель. В дозе, составляющей 1 мг/инъекцию, мАт806 не оказывало эффект на рост ксенотрансплантатов родительских клеток U87MG, которые экспрессируют EGFR дикого типа (фиг. 9A). Напротив, мАт806 значительно подавляло рост ксенотрансплантатов U87MG.Δ2-7 дозозависимым образом (фиг. 9B). Спустя двадцать дней после инокуляции опухолевых клеток, когда умерщвляли контрольных животных, средний объем опухолей составлял 1600±180 мм3 в случае контрольной группы, значимо меньше 500±95 мм3 в случае группы, которой вводили 0,1 мг при каждой инъекции (p<0,0001), и 200±42 мм3 в случае группы, которой вводили 1 мг при каждой инъекции, (p<0,0001). Подвергнутые лечению группы умерщвляли в день 24, когда средние объемы опухолей составляли 1300±240 мм3 в случае группы, подвергнутой лечению 0,1 мг, и 500±100 мм3 в случае группы, подвергнутой лечению 1 мг (p<0,0005).
Принимая во внимание эффективность мАт806 в превентивной модели с использованием ксенотрансплантатов, была проверена его способность к подавлению роста укоренившихся опухолевых ксенотрансплантатов. Лечение антителом было таким, которое описано для превентивной модели, за исключением того, что его начинали, когда средний объем опухолей достигал 65 мм3 (спустя 10 дней после имплантации) в случае ксенотрансплантатов U87MG.Δ2-7 и 84 мм3(спустя 19 дней после имплантации) в случае ксенотрансплантатов родительских клеток U87MG (см. пример 10). И опять мАт806 не оказывало эффект на рост ксенотрансплантатов родительских клеток U87MG даже в дозе, составляющей 1 мг/инъекция (фиг. 10A). Напротив, мАт806 значительно подавляло рост ксенотрансплантатов U87MG.Δ2-7 дозозависимым образом (фиг. 10B). В день 17, за день до умерщвления контрольных животных, средний объем опухолей составлял 900±200 мм3 в случае контрольной группы, 400±60 мм3в случае группы, которой вводили 0,1 мг при каждой инъекции (p<0,01), и 220±60 мм3в случае группы, которой вводили 1 мг при каждой инъекции (p<0,002). Лечение ксенотрансплантатов U87MG.Δ2-7 совпадающим по изотипу контрольным антителом IgG2b не оказывало эффект на рост опухолей (не представленные данные).
Для исследования, ограничено ли подавление роста, наблюдаемое при использовании мАт806, клетками, экспрессирующими de2-7 EGFR, его эффективность против ксенотрансплантатов клеток U87MG.wtEGFR была проверена в модели укоренившейся опухоли. Эти клетки служат в качестве модели для опухолей, имеющих амплификацию гена EGFR без экспрессии de2-7 EGFR. Лечение мАт806 начинали, когда средний объем опухолей достигал 73 мм3(спустя 22 дня после имплантации). мАт806 значительно подавляло рост укоренившихся ксенотрансплантатов U87MG.wtEGFR по сравнению с контрольными опухолями, подвергнутыми лечению носителем (фиг. 10C). В день умерщвления контрольных животных средний объем опухолей составлял 1000±300 мм3 в случае контрольной группы и 500±80 мм3в случае группы, подвергнутой лечению посредством инъекций 1 мг (p<0,04).
Для определения возможных гистологических различий между подвергнутыми лечению мАт806 и контрольными ксенотрансплантатами U87MG.Δ2-7 и U87MG.wtEGFR фиксированные с помощью формалина залитые парафином срезы окрашивали H&E (фиг. 31). Зоны некроза наблюдали в срезах подвергнутых лечению мАт806 ксенотрансплантатов U87MG.Δ2-7 (подвергнутые лечению мАт806 ксенотрансплантаты извлекали спустя 24 дня после инокуляции опухолевых клеток, а подвергнутые лечению носителем ксенотрансплантаты - спустя 18 дней) и ксенотрансплантатов U87MG.wtEGFR (подвергнутые лечению мАт806 ксенотрансплантаты извлекали спустя 42 дня после инокуляции опухолевых клеток, а подвергнутые лечению носителем ксенотрансплантаты - спустя 37 дней, фиг. 31). Этот результат наблюдали раз за разом в ряде опухолевых ксенотрансплантатов (n=4 для каждой линии клеток). Однако, при анализе срезов ксенотрансплантатов U87MG.Δ2-7 и U87MG.wtEGFR, подвергнутых лечению контролем (n=5), не обнаружены те же зоны некроза, которые наблюдались при лечении мАт806 (фиг. 31). Подвергнутые лечению носителем и мАт806 ксенотрансплантаты, извлекаемые в одни и те же моменты времени, также продемонстрировали эти различия в некрозе внутри опухолей (не представленные данные). Таким образом, наблюдаемое увеличение некроза не было вызвано более длинными периодами роста, используемыми для подвергаемых лечению мАт806 ксенотрансплантатов. Кроме того, срезы ксенотрансплантатов U87MG, подвергнутых лечению мАт806, также окрашивали H&E, и не были выявлены какие-либо зоны некроза (не представленные данные), что служит дополнительным подтверждение гипотезы, что связывание мАт806 индуцирует уменьшенную жизнеспособность клеток, приводя к увеличению некроза в опухолевых ксенотрансплантатах.
Иммуногистохимический анализ срезов ксенотрансплантатов U87MG, U87MG.Δ2-7 и U87MG.wtEGFR был проведен для определения уровней экспрессии de2-7 и EGFR дикого типа после лечения мАт806 (фиг. 32). Как и ожидалось, антитело 528 окрашивало все срезы ксенотрансплантатов без явного уменьшения интенсивности между подвергнутыми лечению и контрольными опухолями (фиг. 32). При использовании мАт806 окрашивание срезов U87MG было не обнаруживаемым, однако было зарегистрировано положительное окрашивание срезов ксенотрансплантатов U87MG.Δ2-7 и U87MG.wtEGFR (фиг. 32). Не было различия в интенсивности окрашивания мАт806 между контрольными и подвергнутыми лечению ксенотрансплантатами U87MG.Δ2-7 и U87MG.wtEGFR, что говорит о том, что лечение антителом не приводит к отбору клональных вариантов с отсутствием реактивности с мАт806.
Для демонстрации того, что противоопухолевые эффекты мАт806 не ограничиваются клетками U87MG, антитело вводили мышам, имеющим ксенотрансплантаты A431. Эти клетки имеют амплифицированный ген EGFR и экспрессируют приблизительно 2×106 рецепторов на клетку. Как показано выше, мАт806 связывается с ~10% этих EGFR и воздействует на ксенотрансплантаты A431 (Garcia et al. (1993) Expression of mutated epidermal growth factor receptor by non-small cell along carcinomas. Cancer Res. 53, 3217-3220). мАт806 значительно подавляло рост ксенотрансплантатов A431 при проверке в ранее описанной превентивной модели с использованием ксенотрансплантата (фиг. 11A). В день 13, когда умерщвляли контрольных животных, средний объем опухолей составлял 1400±150 мм3 в случае подвергнутой лечению носителем группы и 260±60 мм3 случае группы, подвергнутой лечению посредством введения 1 мг при каждой инъекции (p<0,0001). В отдельном эксперименте составляющая 0,1 мг доза мАт также значимо (p<0,05) подавляла рост ксенотрансплантатов A431 в превентивной модели (не представленные данные) (см. пример 10).
Принимая во внимание эффективность мАт806 в превентивной модели с использованием ксенотрансплантатов A431, была проверена его способность к подавлению роста укоренившихся опухолевых ксенотрансплантатов. Лечение антителом было таким, которое описано для превентивной модели, за исключением того, что его не начинали до тех пор, пока средний объем опухолей не достигал 200±20 мм3. мАт806 значительно подавляло рост укоренившихся опухолевых ксенотрансплантатов (фиг. 11B). В день 13, когда умерщвляли контрольных животных, средний объем опухолей составлял 1100±100 мм3 в случае контрольной группы и 450±70 мм3в случае группы, которой вводили 1 мг при каждой инъекции (p<0,0001).
Пример 19
Конструирование, экспрессия и анализ химерного антитела 806
Химерные антитела представляют собой класс молекул, в которых вариабельные области тяжелой и легкой цепей, например, мыши, крысы или другого вида присоединены к областям тяжелой и легкой цепей человека. Химерные антитела продуцируют рекомбинантным способом. Одним преимуществом химерных антител является то, что они могут уменьшить эффекты против ксеноантигенов, присущую иммуногенность нечеловеческих антител (например, мыши, крысы или другого вида). Кроме того, рекомбинантно полученные химерные антитела часто можно продуцировать в больших количествах, в частности, при использовании векторов для экспрессии на высоком уровне.
Для продукции на высоком уровне наиболее широко используемой системой для экспрессии в клетках млекопитающих является система, в которой используется процесс амплификации гена, обеспечиваемый клетками яичника китайского хомячка с недостатком дегидрофолатредуктазы (ʺdhfr-ʺ). Эта система хорошо известна квалифицированному специалисту. Система основана на гене дегидрофолатредуктазы ʺdhfrʺ, который кодирует фермент DHFR, катализирующий превращение дегидрофолата в тетрагидрофолат. Для достижения высокой продукции клетки dhfr-CHO трансфицируют экспрессионным вектором, содержащим функциональный ген DHFR, вместе с геном, который кодирует желаемый белок. В этом случае желаемым белком является тяжелая цепь и/или легкая цепь рекомбинантного антитела.
При увеличении количества конкурентного ингибитора DHFR - метотрексата (MTX) у рекомбинантных клеток развивается резистентность в результате амплификации гена dhfr. В стандартных случаях используемая амплификационная единица намного больше размера гена dhfr, и в результате коамплифицируется тяжелая цепь антитела.
Когда желательна высокомасштабная продукция белка, такого как цепь антитела, решающими являются как уровень экспрессии, так и стабильность используемых клеток. При культивировании в течение длительного срока популяции рекомбинантных клеток CHO теряют гомогенность в отношении своей продуктивности специфического антитела во время амплификации, даже если они происходят из одного, родительского клона.
Бицистронные экспрессионные векторы были приготовлены для применения при рекомбинантной экспрессии химерных антител. В этих бицистронных экспрессионных векторах используется ʺучасток внутренней посадки рибосомыʺ или ʺIRESʺ. В случае этих конструкций для продукции химерного антитела против EGFR кДНК для цепей иммуноглобулина и селектируемых маркеров соединяют через IRES. IRES являются действующими в цис-положении элементами, которые привлекают небольшие рибосомные субъединицы к внутреннему инициирующему кодону в мРНК с помощью клеточных, действующих в транс-положении факторов. IRES способствуют экспрессии двух или более белков с полицистронной транскрипционной единицы в эукариотических клетках. Бицистронные экспрессионные векторы, в которых селектируемый маркер транслируется кэп-зависимым образом, а представляющий интерес ген - IRES-зависимым образом, использовались в ряде экспериментальных способов. IRES-элементы были успешно включены в векторы для трансформации клеток, создания трансгенных животных, продукции рекомбинантных белков, генной терапии, остановки генов и воздействия на гены.
Резюме конструирования химерного антитела 806
Химерное антитело 806 было создано посредством клонирования VH- и VL-областей антитела 806 исходной мышиной гибридомы, используя стандартные методы молекулярной биологии. VH- и VL-области затем клонировали в векторы для экспрессии в клетках млекопитающих pREN, конструкции которых представлены в SEQ ID NO: 7 и SEQ ID NO: 8, и трансфицировали в клетки CHO (DHFR-/-ve) для амплификации и экспрессии. Вкратце, после трипсинизации 4×106 клеток CHO котрансфицировали 10 мкг каждого из векторов для экспрессии LC и HC, используя электропорацию в стандартных условиях. После 10-минутного периода покоя при комнатной температуре клетки добавляли к 15 мл среды (10% фетальной телячьей сыворотке, гипоксантин/тимидин - дополнение дополнительными компонентами) и переносили на 15×10 см культуральные чашки Петри. Затем чашки помещали в термостат в обычных условиях на 2 дня.
В этот момент добавлением гентамицина, 5 нМ метотрексата, заменой фетальной телячьей сыворотки подвергнутой диализу фетальной телячьей сывороткой и удалением гипоксантина/тимидина инициировали селекцию клонов, которые были трансфицированы как LC, так и HC, из среды. Через 17 дней после трансфекции индивидуальные клоны, растущие в селективных условиях, отбирали и скринировали на экспрессию химерного антитела 806. Для скрининга использовали ELISA, и он состоял из покрытия планшета для ELISA денатурированным растворимым рецептором EGF (денатурированный EGFR, как известно, делает возможным связывание 806). Этот анализ позволяет скринировать уровни продукции индивидуальными клонами, а также на функциональность скринируемого антитела. Было установлено, что все клоны продуцируют функциональное ch806, и наилучший продуцент был выбран и подвергнут экспансии в результате амплификации. Для увеличения уровня продуцируемого ch806 клон с наилучшей продукцией подвергали повторной селекции при более высокой концентрации метотрексата (100 нМ в сравнении с 5 нМ). Это выполняли, используя вышеотмеченные процедуры.
Клоны, растущие при 100 нМ, передавали в Biological Production Facility, Ludwig Institute, Melbourne, Австралия для определения уровней продукции, избавляясь от сыворотки, банкируя клетки. Установлено, что клеточная линия устойчиво продуцирует ~10 мг/литр во вращающихся флаконах.
Последовательность нуклеиновой кислоты вектора pREN ch806 LC neo предоставлена в SEQ ID NO: 7. Последовательность нуклеиновой кислоты вектора pREN ch806 HC DHFR предоставлена в SEQ ID NO: 8.
На фиг. 33 изображены векторы pREN-HC и pREN-LC, в которых используется IRES. Система с бицистронными векторами pREN описана и раскрыта в находящейся одновременно на рассмотрении патентного ведомства заявке на патент США № 60/355838, поданной 13 февраля 2002 года, которая включена сюда посредством ссылки в полном объеме.
Оценку ch806 осуществляли с помощью анализа с использованием FACS для демонстрации того, что химерное 806 проявляет специфичность связывания, идентичную таковой мышиного исходного антитела. Анализ выполняли с использованием клеток дикого типа (родительских клеток U87MG), клеток, сверхэкспрессирующих рецептор EGFR (клеток A431 и клеток U87MG.wtEGFR) и клеток UA87.Δ2-7 cells (не представленные данные). Схожая специфичность связывания мАт806 и ch806 была установлена, используя клетки, сверхэкспрессирующие EGFR, и клетки, экспрессирующие de2-7 EGFR. В случае клеток дикого типа связывание не наблюдали. С помощью анализа Скетчарда установлена аффинность связывания с меченным радиоактивным изотопом ch806, составляющая 6,4×109 M-1, используя клетки U87MG-de2-7 (не представленные данные).
Анализ биораспределения антитела ch806 был проведен на бестимусных мышах BALB/c, имеющих ксенотрансплантаты опухолевых клеток U87MG-de2-7, и результаты представлены на фиг. 34. Мышам инъецировали 5 мкг меченного радиоактивным изотопом антитела, и их умерщвляли группами по четыре мыши в каждый момент времени - через 8, 24, 48 и 74 часа. Органы извлекали, взвешивали и радиоактивность измеряли в счетчике гамма-излучения.125I-меченное ch806 демонстрирует уменьшенную направленность на опухоль по сравнению с111In-меченным ch806, которое характеризуется высокой адсорбцией опухолью и кумулятивным удержанием в опухоли в течение 74-часового периода времени. В момент времени - 74 часа в случае111In-меченного антитела обнаруживается приблизительно 30% ID/грамм ткани и составляющее 4,0 отношение опухоль:кровь (фиг. 35).111In-меченное антитело ch806 демонстрирует некоторое неспецифическое удержание в печени, селезенке и почках. Это является обычным в случае использования этого изотопа и уменьшается со временем, подтверждая, что это связывание является неспецифическим для ch806 и обусловлено связыванием111In.
Химерное антитело ch806 оценивали на терапевтическую эффективность в модели укоренившейся опухоли. 3×106 клеток U87MG.Δ2-7 в 100 мкл PBS инокулировали подкожно в оба бока самок бестимусных мышей возрастом 4-6 недель (Animal Research Center, Western Australia, Австралия). В качестве положительного контроля включали мАт806. Результаты представлены на фиг. 36. Лечение начинали, когда средний объем опухолей достигал 50 мм3, и состояло из всего 5 внутрибрюшинных инъекций по 1 мг ch806 или мАт806 при каждой инъекции, осуществляемых в указанные дни. Объем опухоли в мм3 определяли, используя формулу (длина × ширина2)/2, где длина представляла собой самую длинную ось, а ширина - измерение под прямыми углами относительно длины. Данные представляли как средний объем опухолей ± стандартная ошибка для каждой подвергаемой лечению группы. ch806 и mAb806 продемонстрировали почти идентичную противоопухолевую активность против ксенотрансплантатов U87MG.Δ2-7.
Анализ иммуноэффекторной функции Ch806
Материалы и методы
Антитела и линии клеток
Мышиное моноклональное антитело против de2-7 EGFR-мАт806, химерное антитело ch806 (IgG1) и контрольное, совпадающее по изотипу химерное моноклональное антитело против G250-cG250 были приготовлены Biological Production Facility, Ludwig Institute for Cancer Research, Melbourne, Австралия. Как в анализе комплементзависимой цитотоксичности (CDC), так и в анализе антителозависимой клеточноопосредованной цитотоксичности (ADCC) использовали клетки U87MG.de2-7 и A431 в качестве клеток-мишеней. Ранее описанная линия клеток U87MG.de2-7 является линией клеток астроцитомы человека, инфицированной ретровирусом, содержащим de2-7EGFR (Nishikawa et al. (1994) Proc. Natl. Acad. Sci. U.S.A. 91, 7727-7731). Клетки плоскоклеточного рака человека A431 были приобретены из Американской коллекции типовых культур (Manassas, VA). Все линии клеток культивировали в среде DMEM/F-12 с GlutaMAX (Life Technologies, Inc., Melbourne, Австралия), дополненной 10% инактивированной нагреванием FCS (CSL, Melbourne, Австралия); 100 единиц/мл пенициллина и 100 мкг/мл стрептомицина. Для поддержания селекции в отношении трансфицированных ретровирусом клеток U87MG.de2-7 в среды включали 400 мкг/мл G418.
Приготовление мононуклеарных клеток периферической крови (PBMC) человека - клеток-эффекторов
PBMC выделяли из крови здоровых доноров-добровольцев. Гепаринизированную цельную кровь подвергали фракционированию посредством центрифугирования в градиенте плотности фиколла-гипака (ICN Biomedical Inc., Ohio, США). Фракции PBMC собирали и трижды промывали RPMI+ 1640, дополненной 100 Е/мл пенициллина и 100 мкг/мл стрептомицина, 2 мМ L-глутамином, содержащей 5% инактивированной нагреванием FCS.
Приготовление клеток-мишеней
Анализы CDC и ADCC выполняли посредством модификации ранее опубликованного способа (Nelson, D.L. et al. (1991) In: J.E. Colignan, A.M. Kruisbeek, D.D. Margulies, E.M. Shevach, and W. Strober (eds.), Current Protocols in Immunology, pp. 7.27.1 New York: Greene Publishing Wiley Interscience). Вкратце, 5×106 клеток-мишеней U87MG.de2-7 и A431 метили с использованием 50 мкКи51Cr (Geneworks, Adelaide, Австралия) на 1×106 клеток и инкубировали в течение 2 ч при 37ºC. Затем клетки промывали три раза PBS (0,05M, pH 7,4), а четвертый раз средой для культивирования. Аликвоты (1×104 клеток/50 мкл) меченых клеток добавляли в каждую лунку 96-луночных титрационных микропланшетов (NUNC, Roskilde, Дания).
Анализ CDC
К 50 мкл меченых клеток-мишеней добавляли в трех повторах 50 мкл ch806 или совпадающего по изотипу контрольного антитела cG250 во всем диапазоне концентраций - 0,00315-10 мкг/мл и инкубировали на льду в течение 5 мин. Затем добавляли 50 мкл свежеприготовленного комплемента здорового донора (сыворотки) для получения конечного разведения сыворотки 1:3. Титрационные микропланшеты инкубировали в течение 4 ч при 37ºC. После центрифугирования осуществляли счет высвободившегося51Cr в супернатанте (в автоматизированном счетчике гамма-излучения Cobra II, Canberra Packard, Melbourne, Австралия). Процент специфического лизиса рассчитывали на основе экспериментального высвобождения51Cr, общего (50 мкл клеток-мишеней + 100 мкл 10% Tween 20) и самопроизвольного (50 мкл клеток-мишеней + 100 мкл среды) высвобождения.
Анализ ADCC
ch806-зависимую ADCC, опосредованную PBMC здорового донора, определяли с помощью 4-часовых анализов высвобождения51Cr. В первом анализе меченые клетки-мишени помещали вместе с клетками-эффекторами в 96-луночные микропланшеты с U-образным дном (NUNC, Roskilde, Дания) в составляющем 50:1 соотношении клетки-эффекторы/клетки-мишени (E:T). Для определения активности - ADCC в каждую лунку в трех повторах добавляли 0,00315-10 мкг/мл (конечная концентрация) исследуемого и контрольного антител. Во втором анализе ADCC активность - ADCC ch806 сравнивали с таковой исходного мышиного мАт806 в диапазоне отношений клетки-эффекторы/клетки-мишени при использовании постоянной, составляющей 1 мкг/мл концентрации исследуемого антитела. В обоих анализах титрационные микропланшеты инкубировали при 37ºC в течение 4 часов, затем из каждой лунки отбирали 50 мкл супернатанта и высвободившийся51Cr определяли подсчетом гамма-излучения (в автоматизированном счетчике гамма-излучения Cobra II, Canberra Packard, Melbourne, Австралия). Включенные в анализы контроли вносили поправки на самопроизвольное высвобождение (только среда) и на общее высвобождение (10% Tween20/PBS). Параллельно выполнялись соответствующие контроли с использованием антитела того же подкласса.
Процент лизиса клеток (цитотоксичности) рассчитывали в соответствии с формулой:

Строили график зависимости цитотоксичности в процентах (%) от концентрации антитела (мкг/мл).
Результаты
Результаты анализов CDC представлены на фиг. 37. Минимальная активность - CDC наблюдалась в присутствии вплоть до 10 мкг/мл ch806, при этом CDC была сравнимой с таковой, наблюдаемой в случае совпадающего по изотипу контрольного cG250.
ch806-зависимая ADCC в отношении клеток-мишеней U87MG.de2-7 и A431 при соотношении E:T, составляющем 50:1, представлена на фиг. 38. Результативная, ch806-специфическая цитотоксичность была продемонстрирована в отношении клеток-мишеней U87MG.de2-7, но наблюдалась минимальная ADCC в отношении клеток A431 при помощи ch806. Достигнутые уровни цитотоксичности отражают количество сайтов связывания ch806 в двух популяциях клеток. Клетки-мишени U87MG.de2-7 экспрессируют ~1×106 de2-7EGFR, которые специфически распознаются ch806, в то время как лишь подмножество 1×106 молекул EGFR дикого типа, представленных на клетках A431, распознается ch806 (см. примеры выше).
Кроме того, были выполнены анализы ADCC для сравнения ADCC в отношении клеток-мишеней U87MG.de2-7 при помощи 1 мкг/мл ch806 с таковой, осуществляемой при помощи 1 мкг/мл исходного мышиного мАт806. Результаты представлены на фиг. 39. Последствием химеризации мАт806 явилось очевидное увеличение ADCC, достигаемой при помощи исходного мышиного мАт, при этом превышающая 30% цитотоксичность достигалась при соотношениях E:T, составляющих 25:1 и 50:1.
Отсутствующая иммуноэффекторная функция у исходного мышиного мАт806 была значительно увеличена после химеризации. При помощи ch806 достигается значительная ADCC, но минимальная активность CDC.
Пример 20
Создание антиидиотипических антител против химерного антитела ch806
Для содействия клинической оценки мАт806 или ch806 требуются лабораторные анализы для слежения за фармакокинетикой антител в сыворотке и для количественного анализа любых иммунных ответов против химерного мышиного-человеческого антитела. Были созданы мышиные моноклональные антиидиотипические антитела, и определена их пригодность в качестве реагентов для ELISA для измерения ch806 в образцах сывороток пациентов и возможность использования в качестве положительных контролей в анализах иммунных ответов против химерного антитела у человека. Эти антиидиотипические антитела также применимы в качестве терапевтических или профилактических вакцин, создающих природный ответ в виде продукции антител против EGFR у пациентов.
Способы продуцирования антиидиотипических антител хорошо известны в данной области техники (Chatterjee et al., 2001; Uemura et al., 1994; Steffens et al., 1997; Safa and Foon, 2001; Brown and Ling, 1988).
Вкратце, мышиные моноклональные антиидиотипические антитела создавали следующим образом. Спленоциты мышей, подвергнутых иммунизации ch806, сливали с клетками плазмацитомы SP2/0-AG14, и продуцирующие антитела гибридомы отбирали через посредство ELISA по специфическому связыванию с ch806 и конкурентному связыванию в случае использования антигена (фиг. 40). Первоначально было отобрано двадцать пять гибридом, и четыре, названные LMH-11, -12, -13 и -14, секретировали антитела, которые демонстрировали специфическое связывание с ch806, мАт806 и были способны нейтрализовать активность связывания ch806 или мАт806 с антигеном (фиг. 41). Доказательством распознавания идиотопа или CDR-участка ch806/мАт806 было отсутствие перекрестной реактивности с очищенным поликлональным IgG человека.
В отсутствие легко доступного рекомбинантного антигена de2-7 EGFR для помощи в определении ch806 в образцах сыворотки была использована способность новых антиидиотипических антител против ch806 к параллельному связыванию вариабельных областей 806 при разработке чувствительного, специфического ELISA для определения ch806 в клинических образцах (фиг. 42). При использовании LMH-12 для улавливания и биотинилированного LMH-12 для обнаружения подвергнутый валидации ELISA продемонстрировал высоко воспроизводимые кривые связывания для определения ch806 (2 мкг/мл - 1,6 нг/мл) в сыворотке с составляющим 3 нг/мл пределом выявления (n=12; 1-100 нг/мл, коэффициент вариации <25%; 100 нг/мл - 5 мкг/мл, коэффициент вариации <15%). Не было заметным фоновое связывание с тремя проверенными сыворотками от здоровых доноров, и наблюдалось незначительное связывание с совпадающим по изотипу контрольным hu3S193. Гибридома продуцирует антитело LMH-12 на высоких уровнях, и планируется более высокомасштабная продукция для того, чтобы сделать возможным определение ch806 и количественный анализ любых иммунных ответов в клинических образцах (Brown and Ling, 1988).
Результаты
Иммунизация мышей и отбор гибридомных клонов
Иммунореактивность образцов сыворотки до и после иммунизации указывала на создание мышиных мАт против ch806 и против huIgG с высокими титрами. Первоначально было отобрано двадцать пять гибридом, продуцирующих антитела, которые связывались с ch806, но не с huIgG. Характеристики связывания некоторых из этих гибридом представлены на фиг. 42A и 42B. В отношении четырех из этих гибридом, продуцирующих антитела против ch806 с высокой аффинностью связывания (клоны 3E3, SB8, 9D6 и 4D8), впоследствии выполняли клональную экспансию из одиночных клеток посредством предельного разведения, и они были названы Ludwig Institute for Cancer Research Melbourne Hybridoma (LMH)-11, -12, -13 и - 14, соответственно (фиг. 42).
Активности связывания и блокирования отобранных антиидиотипических антител
Способность антител против ch806 параллельно связываться с двумя антителами ch806 является желаемой особенностью в случае их применения в качестве реагентов в ELISA для определения уровней ch806 в сыворотке. Клональные гибридомы LMH-11, -12, -13 и -14 продемонстрировали параллельное связывание (не представленные данные).
После клональной экспансии супернатанты культур гибридомных клеток проверяли с помощью ELISA на способность к нейтрализации активности связывания ch806 или mAb806 с антигеном - sEGFR621. Результаты свидетельствовали об антагонистической активности антиидиотипических мАт LMH-11, -12, -13 и -14 с блокированием в растворе связывания как ch806, так и мышиного мАт806 с планшетами, покрытыми sEGFR (фиг. 41 в случае LMH-11, -12, -13).
После более высокомасштабного культивирования во вращающихся флаконах проверяли специфичность связывания стабильных клональных гибридом LMH-11, -12, -13 и -14 с помощью ELISA. Антитела с LMH-11 по -14 были идентифицированы как изотип IgG1κ с помощью набора для определения изотипов мышиных моноклональных антител.
ch806 для разработки фармакокинетических анализов с помощью ELISA клинических образцов сыворотки
Для помощи в определении ch806 в образцах сыворотки была использована способность антиидиотипических антител против ch806 к параллельному связыванию вариабельной области 806 при разработке чувствительного и специфического ELISA для определения ch806 в клинических образцах. Три очищенных клона LMH-11, -12 и -13 (фиг. 49B и 49C, соответственно) были сравнены по их способности к улавливанию, а затем обнаружению связанного ch806 в сыворотках. Результаты показали, что использование LMH-12 (10 мкг/мл) для улавливания и биотинилированого LMH-12 для обнаружения обеспечивает наибольшую чувствительность к ch806 в сыворотке (3 нг/мл) с незначительным фоновым связыванием.
После установления оптимальных условий для фармакокинетических анализов с помощью ELISA, используя 1 мкг/мл антиидиотипического LMH-12 и 1 мкг/мл биотинилированного LMH-12 для улавливания и обнаружения, соответственно, была проведена валидация способа. Три отдельных ELISA были выполнены в четырех повторах для измерения ch806 в сыворотке трех здоровых доноров или 1% BSA/средах с совпадающим по изотипу контрольным hu3S193. Результаты валидации представлены на фиг. 43 и демонстрируют высоковоспроизводимые кривые связывания для определения ch806 (2 мкг/мл - 1,6 нг/мл) в сыворотках с составляющим 3 нг/мл пределом выявления (n=12; 1-100 нг/мл, коэффициент вариации <25%; 100 нг/мл - 5 мкг/мл, коэффициент вариации <15%). Не было заметным фоновое связывание с любой из трех проверенных сывороток, и наблюдалось незначительное связывание с совпадающим по изотипу контрольным hu3S193.
Пример 21
Оценка углеводных структур и распознавание антителом
Были выполнены эксперименты для дальнейшего определения роли углеводных структур в связывании и распознавании EGFR, как увеличенного в числе в результате амплификации гена EGFR, так и de2-7 EGFR, антителом мАт806.
Для определения, включены ли непосредственно углеводные структуры в эпитоп для мАт806, рекомбинантный sEGFR, экспрессированный в клетках CHO, подвергали обработке PNGase F (пептид-N-гликаназой F) для устранения N-связанного гликозилирования. После обработки белок подвергали электрофорезу в SDS-ПААГ, переносили на мембрану и подвергали гибридизации с мАт806 (фиг. 44). Как и ожидалось, дегликозилированный sEGFR перемещался быстрее при электрофорезе в SDS-ПААГ, что означало, что углеводы были успешно удалены. Антитело мАт806 явно связывалось с дегликозилированным материалом, что свидетельствует о том, что эпитопом для антитела является пептид по природе, а не только гликозилированная форма эпитопа.
Лизаты, приготовленные на основе линий клеток, метаболически меченных35S, подвергали иммунопреципитации с использованием различных антител, направленных против EGFR (фиг. 45). Как и ожидалось, антитело 528 иммунопреципитировало соответствующие трем полосам молекулы из клеток U87MG.Δ2-7, при этом верхняя полоса соответствовала EGFR дикого типа, а две нижние полосы соответствовали de2-7 EGFR. Эти две соответствующие de2-7 EGFR полосы, как сообщалось ранее и предполагается, отражают дифференциальное гликозилирование (Chu et al. (1997) Biochem. J. Jun 15; 324 (Pt 3): 885-861). В отличие от этого, мАт806 иммунопреципитировало лишь соответствующие двум полосам de2-7 EGFR, при этом рецептор дикого типа полностью отсутствовал даже после передержки (не представленные данные). Интересно, что мАт806 продемонстрировало увеличенную относительную реактивность с соответствующим нижней полосе de2-7 EGFR, но уменьшенную реактивность с верхней полосой по сравнению с антителом 528. Антитело SC-03, коммерческое кроличье поликлональное антитело, направленное против C-концевого домена EGFR, иммунопреципитировало соответствующие трем полосам EGFR, наблюдаемые при использовании антитела 528, хотя общее количество рецептора, иммунопреципитированного этим антителом, было значительно меньше. Полосы не наблюдались при использовании нерелевантного антитела IgG2b в качестве контроля для мАт806 (см. пример 18).
Антитело 528 давало одну полосу, соответствующую рецептору дикого типа, в результате иммунопреципитации из клеток U87MG.wtEGFR (фиг. 45). мАт806 также давало одну полосу в результате иммунопреципитации из этих клеток, однако эта полоса EGFR явно перемещалась быстрее полосы, соответствующей реагирующему с 528 рецептору. Антитело SC-03 иммунопреципитировало реагирующие EGFR обеих полос из клеток U87MG.wtEGFR, что служит дополнительным подтверждением того, что мАт806 и 528 распознают отличные формы EGFR в цельноклеточных лизатах этих клеток.
Как наблюдалось с клетками U87MG.wtEGFR, антитело 528 давало одну полосу EGFR в результате иммунопреципитации из клеток A431 (фиг. 45). Полоса реагирующего с 528 EGFR является очень широкой в этих низкопроцентных гелях (6%) и, вероятно, служит отражением разнообразия гликозилирования рецептора. Одна полоса EGFR также наблюдалась после иммунопреципитации с помощью мАт806. Несмотря на то, что эта полоса EGFR не перемещалась значительно быстрее широкой полосы в целом реагирующего с 528 EGFR, она располагалась во фронте широкой полосы, полученной с 528, раз за разом. В отличие от лизатов клеток U87MG.Δ2-7, общее количество EGFR, иммунопреципитированного с помощью мАт806 из лизатов A431, было значительно меньше такового в случае использовании антитела 528, результат, находящийся в соответствии с полученными авторами настоящего изобретения данными анализа Скетчарда, показывающими, что мАт806 распознает лишь часть EGFR на поверхности этих клеток (см. пример 4). Следствием иммунопреципитации с помощью SC-03 была одна широкая полоса EGFR, как и в случае с антителом 528. Схожие результаты были получены с клетками HN5 (не представленные данные). Взятые вместе, эти данные означают, что мАт806 предпочтительно реагирует с более быстро перемещающимися разновидностями EGFR, которые могут представлять дифференциально гликозилированные формы рецептора.
Для определения, на какой стадии процессирования рецептора появляется реактивность с мАт806, был проведен опыт ʺимпульсное мечение/отслеживаниеʺ. Клетки A431 и U87MG.Δ2-7 подвергали импульсному мечению в течение 5 мин с помощью35S метионина/цистеина, а затем их инкубировали при 37ºC в течение различных периодов времени до иммунопреципитации с помощью мАт806 или 528 (фиг. 46). Картина иммунопреципитации с помощью антитела 528 в клетках A431 была типичной для антитела, специфичного в отношении конформационного эпитопа EGFR. Небольшое количество рецептора иммунопреципитировалось в t=0 мин (т.е. после импульсного мечения в течение 5 мин), при этом количество меченого EGFR увеличивалось в каждый момент времени. По мере того, как шло время, также параллельно увеличивалась молекулярная масса рецептора. Напротив, реагирующий с мАт806 материал EGFR присутствовал на высоких уровнях в t=0 мин, достигал максимума через 20 мин, а затем уменьшался в каждый дальнейший момент времени. Таким образом, мАт806, как представляется, предпочтительно распознает форму EGFR, обнаруживаемую на ранней стадии процессирования.
Реактивность с антителом, наблюдаемая в подвергнутых импульсному мечению клетках U87MG.Δ2-7, была более сложной. В результате иммунопреципитации с помощью антитела 528 в t=0 мин обнаружено, что было помечено небольшое количество de2-7 EGFR, соответствующего нижней полосе (фиг. 46). По мере того, как шло время, количество реагирующего с 528 de2-7 EGFR, соответствующего нижней полосе, увеличивалось, достигая максимума через 60 мин и медленно снижаясь к 2 и 4 ч. Значительное количество меченого de2-7 EGFR, соответствующего верхней полосе, не обнаруживалось до 60 мин, после чего уровень продолжал увеличиваться до конца периода отслеживания. Это явно свидетельствует о том, что de2-7 EGFR верхней полосы является более зрелой формой рецептора. Реактивность мАт806 также менялась во время периода отслеживания, однако мАт806 предпочтительно преципитировало de2-7 EGFR нижней полосы. Действительно, значительные уровни реагирующего с мАт806 рецептора верхней полосы не наблюдались до 4 ч после мечения.
Вышеприведенные эксперименты говорят о том, что мАт806 предпочтительно реагирует с формой de2-7 и EGFR дикого типа более раннего гликозилирования. Эта возможность была проверена с помощью иммунопреципитации EGFR из различных линий клеток, помеченных в течение ночи35S метионином/цистеином, а затем подвергания получающихся в результате продуктов преципитации расщеплению эндогликозидазой H (Endo H). Этот фермент предпочтительно удаляет тип углеводов с высоким содержанием маннозы (т.е. раннего гликозилирования) с белков, оставляя интактными сложные углеводы (т.е. позднее гликозилирование). Иммунопреципитация с помощью 528, мАт806 и SC-03 и расщепление Endo H лизатов меченых клеток U87MG.Δ2-7 дали схожие результаты (фиг. 47).
Как и ожидалось, de2-7 EGFR нижней полосы был совершенно чувствителен к расщеплению Endo H, перемещаясь быстрее при электрофорезе в SDS-ПААГ после расщепления Endo H, что свидетельствует о том, что эта полоса представляет форму de2-7 EGFR с высоким содержанием маннозы. de2-7 EGFR верхней полосы был по существу устойчивым к расщеплению Endo H, демонстрируя лишь очень незначительное различие в перемещении после расщепления Endo H, что свидетельствует о том, что большая часть углеводных структур является структурами сложного типа. Небольшое, но воспроизводимое уменьшение молекулярной массы рецептора верхней полосы после расщепления ферментом говорит о том, что хотя углеводы de2-7 EGFR верхней полосы являются преимущественно структурами сложного типа, он обладает некоторым количеством структур с высоким содержанием маннозы. Интересно, что эти клетки также экспрессируют низкие количества эндогенного EGFR дикого типа, который ясно виден после иммунопреципитации 528. Наблюдалось также небольшое, но заметное уменьшение молекулярной массы рецептора дикого типа после расщепления Endo H, указывая на то, что он также содержит структуры с высоким содержанием маннозы.
Чувствительность подвергнутого иммунопреципитации EGFR дикого типа к расщеплению Endo H была сходной в обеих линиях клеток U87MG.wtEGFR и A431 (фиг. 47). Большое количество материала, преципитированного антителом 528, было устойчиво к ферменту Endo H, хотя небольшое количество материала было материалом формы с высоким содержанием маннозы. И в этот раз наблюдалось небольшое уменьшение молекулярной массы EGFR дикого типа после расщепления Endo H, что говорит о том, он действительно имеет некоторое количество структур с высоким содержанием маннозы. Результаты при использовании антитела SC-03 были схожи с результатами при использовании антитела 528. Напротив, большая часть EGFR, преципитированного мАт806, была чувствительна к Endo H в обеих линиях клеток U87MG.wtEGFR и A431, подтверждая, что мАт806 предпочтительно распознает форму EGFR с высоким содержанием маннозы. При использовании клеток HN-5 были получены схожие результаты, в которых большая часть материала, преципитированного мАт806, была чувствительна к расщеплению Endo H, в то время как большая часть материала, преципитированного мАт528 и SC-03, была устойчива к расщеплению Endo H (не представленные данные).
Йодирование структур поверхности линии клеток A431 выполняли с использованием125I с последующей иммунопреципитацией с помощью антитела 806. Протокол йодирования поверхностных структур был следующим. Лизис клеток, иммунопреципитация, расщепление Endo H, электрофорез в SDS-ПААГ и радиоаутография являются процедурами, описанными здесь выше. Для мечения клетки выращивали в средах с 10% FCS, отсоединяли с помощью EDTA, промывали дважды PBS, затем ресуспедировали в 400 мкл PBS (приблизительно 2-3×106 клеток). К ним добавляли 15 мкл125I (100 мКи/мл маточного раствора), 100 мкл маточного раствора бычьей лактопероксидазы (1 мг/мл), 10 мкл H2O2 (0,1% маточный раствор), и смесь инкубировали в течение 5 мин. Затем добавляли еще 10 мкл H2O2, и инкубацию продолжали в течение еще 3 мин. Затем клетки снова промывали 3 раза PBS и лизировали в 1% Тритона. Йодирование структур поверхности линии клеток A431 с помощью лактопероксидазы с последующей иммунопреципитацией с помощью антитела 806 показало, что, как и в случае цельноклеточных лизатов, описанных выше, преобладающая форма EGFR, распознаваемая антителом 806, находящаяся на поверхности клеток A431, является чувствительной к расщеплению EndoH (фиг. 48). Это служит подтверждением того, что форма EGFR, связываемая 806, на поверхности клеток A431 является чувствительной к EndoH формой и, следовательно, является типом с высоким содержанием маннозы.
Пример 22
Гуманизированное (венированное) антитело 806
A. Конструирование hu806
Был сконструирован вектор для экспрессии гуманизированного антитела 806 (hu806). Вектор, названный 8C65AAG (11891 п.о.; SEQ ID NO: 41), был сконструирован так, что он содержит оба гена для полноразмерного hu806 в управляемой одним промотором GS генно-экспрессионной кассете (фиг. 53 и 54).
Вариабельная область тяжелой цепи (VH) и ее константная область (CH) (SEQ ID NO: 42 и 43, соответственно) представлены на фиг. 55A, при этом CDR1, CDR2 и CDR3 (SEQ ID NO: 44, 45 и 46, соответственно) VH-области показаны подчеркиванием.
Вариабельная область легкой цепи (VH) и ее константная область (CH) (SEQ ID NO: 47 и 48, соответственно) представлены на фиг. 55В, при этом CDR1, CDR2 и CDR3 (SEQ ID NO: 49, 50 и 51, соответственно) VL-области показаны подчеркиванием.
Для получения конструкции для гуманизированного антитела 806 использовали технологию венирования (Daugherty et al. (1991) Polymerase chain reaction facilitates the cloning, CDR-grafting, and rapid expression of a murine monoclonal antibody directed against the CD18 component of leukocyte integrins. Nucleic Acids Res. 19(9), 2471-2476; патент США № 6797492, выданный Daugherty; Padlan, E.A. (1991) A possible procedure for reducing the immunogenicity of antibody variable domains while preserving their ligand-binding properties. Mol. Immunol. 28(4-5), 489-498; европейский патент № 519596, выданный Padlan и др.). Для минимизации иммуногенности вариабельных доменов антитела 806, при сохранении лигандсвязывающих свойств, была выполнена замена экспонированных на поверхности остатков в каркасных областях, которые отличаются от остатков, обычно встречающихся в антителах человека. Для выполнения этого VL- и VH-области мышиного моноклонального антитела (мАт) 806 были перестроены с помощью технологии синтеза генов с использованием перекрывающихся праймеров для ПЦР. CL (каппа)-область составляли таким же образом. Для доказательства сохранения интактными сайтов связывания vVL и vVH также экспрессировали в форме scFv, которая продемонстрировала достаточное связывание с синтетическим пептидом, который включает антигенную детерминанту для 806, с помощью ELISA и с рекомбинантным экстраклеточным доменом (ECD) рецептора EGF (EGFR), что определено с помощью анализа с использованием поверхностного плазмонного резонанса (SPR).
v806VL и v806VH подстроили в фон полноразмерного IgG1 человека, используя оптимизированную в отношении частоты использования кодонов каппа-LC и вновь созданную, оптимизированную в отношении частоты использования кодонов и сайтов сплайсинга константную область тяжелой цепи IgG1 человека, для достижении стабильной экспрессии гена в системах с использованием клеток NSO и CHO. Экспрессионная система основана на экспрессионной системе LONZA GS, в которой используются векторы для экспрессии тяжелой и легкой цепей pEE12.4 и pEE6.4, предоставляемые LONZA Biologies.
Продукт в виде антитела hu806 (фиг. 55), полученный с помощью транзиторной экспрессии вектора 8C65AAG, реагировал с рекомбинантным EGFR-ECD, что определено с помощью SPR, и с эпитопом синтетического пептида EGFR для 806, что определено с помощью ELISA. Вектор 8C65AAG передали LICR Affiliate Christoph Renner (University of Zurich), для создания стабильных линий клеток GS-NSO hu806, и LICR, Melbourne Centre, для создания линий клеток GS-CHO hu806.
Стратегия конструирования, амплификации и клонирования генов антитела hu806
Венирование и оптимизация в отношении частоты использования кодонов
Венирование антител является стратегией гуманизации, направленной на противодействие ответам в виде продукции HAMA (человеческих антител против антител мыши). Иммунная система пациента рассматривает мышиные мАт в качестве ʺчужеродныхʺ антигенов, и индуцируется иммунный ответ, даже после однократного введения, что мешает дальнейшему применению реагента для этих пациентов. На первом этапе процесса венирования мАт806 анализировали аминокислотные последовательности VL- и VH-областей в мАт806, и каждый аминокислотный остаток в последовательности белка мАт806 оценивали в отношении экспонирования на поверхности (фиг. 56 и фиг. 57). Для возможной модификацию рассматривались лишь те аминокислоты, которые располагались на внешней поверхности молекулы антитела, поскольку эти аминокислоты являются единственными аминокислотами, которые могли бы быть распознаны антителом. Используя BLAST, последовательность белка мАт806 сравнивали с последовательностями трех антител человека (VH36germ, CAD26810 и AAA37941). Повсюду, где поверхностный остаток мАт806 не совпадал с консенсусной последовательностью, выведенной из последовательностей антител человека, этот остаток идентифицировали как остаток, который должен быть заменен остатком консенсусной последовательности. Сначала 12 аминокислот в VL были подвергнуты венированию, и 14 - в VH ch806 (фиг. 56 и фиг. 57).
Оптимизация в отношении частоты использования кодонов является способом улучшения гетерологичной экспрессии антител или других белков на основе отдания предпочтения кодонам системы, используемой для экспрессии этих антител. Одной из целей при создании hu806 было использование оптимизации в отношении частоты использования кодонов для увеличения уровней экспрессии этого антитела. Экспрессионная система основана на экспрессионной системе LONZA GS, в которой используются векторы для экспрессии HC и LC pEE12.4 и pEE6.4, предоставляемые LONZA Biologies, и клетки NSO и/или CHO в качестве клеток-продуцентов. Поэтому решения в отношении того, какой кодон использовать для конкретной аминокислоты, принимались с учетом того, будет ли этот кодон предпочтительным в экспрессионной системе с использованием NS0/CHO.
Конструирование и амплификация последовательностей ДНК 806 с помощью ПЦР
Последовательности для венированных, оптимизированных в отношении частоты использования кодонов вариантов вариабельных областей тяжелой (VH) и легкой (VL) цепей антитела hu806 синтезировали следующим образом. Для каждой области (VH или VL) было сконструировано 8-10 олигонуклеотидов в виде перекрывающихся смысловых и антисмысловых праймеров. Эти олигонуклеотиды непременно перекрывались друг с другом так, что охватывали всю последовательность VH или VL hu806, включающую сигнальную последовательность, кодирующие последовательности, интроны, и включали сайт для HindIII на 5'-конце и сайт для BamHI на 3'-конце. Картирования олигонуклеотидов представлены на фиг. 56B и 57B, а подробности в отношении праймеров представлены ниже.
Вкратце, VH или VL hu806 составляли с помощью ПЦР следующим образом. Сначала в трех отдельных реакциях объединяли v806hc- или v8061c-олигонуклеотиды 1, 2, 3 и 4, олигонуклеотиды 5 и 6 и олигонуклеотиды 7, 8, 9 и 10. Аликвоты (50 пмоль) каждого фланкирующего олигонуклеотида и 5 пмоль каждого внутреннего олигонуклеотида добавляли к 50 мкл реакционной смеси для ПЦР, содержащей 25 мкл 2× смеси HotStar Taq Master Mix (Qiagen) и 48 мкл не содержащей нуклеазы воды. Программировали следующие термоциклы: 95ºC; 15ʺ, [94ºC; 30ʺ, 58ºC; 30ʺ, 72ºC; 30ʺ]× 20 циклов, 72ºC; 10ʺ, 4ºC. Продукты этих трех реакций вырезали после разделения с помощью гель-электрофореза. Затем их очищали, используя колонку для обессоливания (Qiagen-Qiaspin Minipreps), и объединяли. Эти продукты далее подвергали амплификации с помощью ПЦР, используя праймеры 1 и 10. Продукт этой второй реакции включал сайты для рестрикционных ферментов HindIII и BamHI, что обеспечивало возможность встраивания в экспрессионные плазмиды.
Олигонуклеотиды, использованные для синтеза с помощью ПЦР V-областей hu806:


CL hu806:
Оптимизированный в отношении частоты использования кодонов вариант константной области легкой цепи каппа (CL) был приготовлен способом, схожим со способом, использованным для вариабельных областей. Однако первоначальный этап ПЦР включал создание только двух предварительных продуктов, используя олигонуклеотиды VK1cons-1, 2, 3 и 4, и 5, 6, 7 и 8. Кроме того, в случае этого продукта фланкирующими рестрикционными сайтами были BamHI и Notl до встраивания в плазмиду.
Олигонуклеотиды, использованные для синтеза с помощью ПЦР CL-областей hu806:


CH hu806:
Синтетический, гуманизированный вариант гена константной области тяжелой цепи (CH) IgG1 (SEQ ID NO: 80) был приобретен у GeneArt, Regensburg, Германия. Ген оптимизировали в отношении частоты использования кодонов для экспрессии в клетках CHO/NS0. Детали в отношении последовательности гена, рестрикционных сайтов и т.д. представлены на фиг. 58.
Конструирование экспрессионных плазмид
Для транзиторной трансфекции и предварительной проверки последовательности VH и VL hu806, приготовленные описанным выше образом, лигировали в экспрессионные векторы, содержащие родовые константные области. Эти векторы, обеспечиваемые LICR Affiliate Christoph Renner (University of Zurich, Швейцария), были известны как pEAK8 HC (который содержал родовую CH) и a33-xm-lc (который содержал родовую CL). Векторы расщепляли, используя BamHI и HindIII, в присутствии CIP, а затем VH и VL hu806 лигировали в соответствующие векторы. Результирующие плазмиды использовали для трансформации химически компетентных E. coli Top10 (Invitrogen) в соответствии с инструкциями от производителя. Трансформированные E. coli помещали на чашки с LB + ампициллин, и устойчивые клоны отбирали c помощью расщепления рестриктазами и ПЦР. В общем, восемь положительных клонов, выявленных таким образом, выделяли и далее амплифицировали. Очищенные из этих колоний ДНК анализировали с помощью автоматизированного секвенирования ДНК.
Оптимизированные в отношении частоты использования кодонов варианты константных областей добавляли в эти конструкции посредством расщепления рестрикционными ферментами, используя BamHI и NotI, и лигирования. Эти трансформанты подвергали отбору, секвенированию и анализу, как указано выше. Перед лигированием полноразмерных цепей антитела в систему Lonza GS ликвидировали сайт для BamHI между последовательностями вариабельной и константной областей, в одном случае, посредством расщепления BamHI, заполнения с использованием ДНК-полимеразы и лигирования по тупым концам.
Рестрикционные фрагменты, содержащие hu806 (VH+CH) или hu806 (VL+CL), затем расщепляли NotI, а затем HindIII. Эти расщепления предназначены для создания тупого конца в сайте для NotI и поэтому проводились последовательно следующим образом. Сначала плазмиду расщепляли NotI. Полностью расщепленную (в одном сайте) плазмиду отделяли с помощью электрофореза, используя 1% агарозный гель. Этот продукт затем вырезали и очищали на колонке для обессоливания, а концы заполняли с использованием ДНК-полимеразы. Продукт этой реакции очищали на колонке для обессоливания, а затем расщепляли HindIII. Этот продукт (~1,3 т.п.о. в случае hu806 (VH+CH) и ~0,8 т.п.о. в случае hu806 (VL+CL)) затем отделяли с помощью электрофореза, вырезали и очищали.
Каждый из векторов pEE12.4 и pEE6.4 (Lonza Biologies plc, Slough, Соединенное Королевство) расщепляли HindIII и PmlII. hu806 (VH+CH) лигировали с pEE12.4 с созданием pEE12.4-hu806H, а hu806 (VL+CL) лигировали с pEE6.4 с созданием pEE6.4-hu806L.
После отбора создавали объединенную плазмиду Lonza с двумя генами, содержащую обе последовательности тяжелой и легкой цепей hu806. Вкратце, векторы pEE12.4-hu806H и pEE6.4-hu806L расщепляли рестрикционными ферментами NotI и SalI. Результирующие фрагменты, содержащие транскрипционную единицу GS и промотор hCMV-MIE, с последующими кассетами для экспрессии тяжелой или легкой цепей hu806, выделяли и лигировали вместе. Результирующую ʺобъединеннуюʺ плазмиду Lonza (названную 8C65AAG) использовали для транзиторных трансфекций одной плазмидой системы HEK 293 и стабильных трансфекций систем NS0 и CHO. Карта плазмиды представлена на фиг. 53.
Модификации конструкций
Полные верифицированные аминокислотные последовательности венированных hu806Hc и hu806Lc представлены в сравнении с HC и LC мАт806 на фиг. 59 и фиг. 60, соответственно. Примыкающими к последовательности hu806 в примечаниях являются звездочки (*), указывающие на первоначальные изменения при венировании, а числа (1-8) относятся к пронумерованным модификациям №1-№8, описываемым здесь.
Что касается фиг. 60, ссылочный файл (LC мАт806) неправильно указывает на гистидин (H), а не на правильный тирозин (Y) в положении 91; причина модификации #1. Исходная последовательность неисправленного файла включена в фиг. 60 для иллюстрации необходимой модификации, внесенной в hu806 в положении 91.
Ряд модификаций был внесен в последовательности кДНК hu806 после первоначальной фазы конструирования и секвенирования. Причины внесения этих модификаций включали введение 4 сайтов для рестрикционных ферментов с целью модификации последовательностей, исправление 2 аминокислотных ошибок в последовательности, введенных во время ПЦР, исправление одной аминокислотной ошибки, проистекающей из исходной документации, касающейся мАт806, и внесение 4 дополнительных аминокислотных замен для обеспечения дополнительных вариантов венирования. Были выполнены следующие 8 стадий модификаций:
1. VL hu806: CDR3 H91Y
Документ, на основе которого создавались первоначальные олигонуклеотиды, неправильно указывал на то, что CAC (гистидин, H) находится в положении 91 в последовательности CDR3 VL мАт806. Для создания правильной последовательности TAC (тирозин, Y; заявка на патент WO02/092771) использовали сайт-направленный мутагенез. Являющимся следствием изменением в аминокислотной последовательности в этом положении было изменение с CVQHAQF (SEQ ID NO: 84) на CVQYAQF (SEQ ID NO: 85). Окончательные последовательности ДНК и транслируемого белка в сравнении с ch806 представлены на фиг. 61.
Смысловой праймер для модификации с заменой гистидина на тирозин VL-области hu806 (PDV1; 40-мер):
5'-CCACATACTACTGCGTCCAGTACGCTCAGTTCCCCTGGAC-3' (SEQ ID NO: 86)
Антисмысловой праймер для модификации с заменой гистидина на тирозин VL-области hu806 (PDV2; 20-мер):
5'-CTGGACGCAGTAGTATGTGG-3' (SEQ ID NO: 87)
2. Тяжелая цепь hu806: добавление сайтов для рестриктаз DraIII и Fsel
В интроны, окружающие VH- и VL-области hu806, были добавлены сайты для рестрикционных ферментов. Эти рестрикционные сайты (уникальные в системе векторов pREN, LICR) были предназначены для облегчения процесса внесения модификаций в экспрессионные кассеты. Последовательность VH-области hu806, без начального участка сигнальной последовательности, можно было удалить или встроить с помощью расщепления лишь DraIII. Кроме того, можно было использовать FseI вместе с NotI (в системе pREN) или EcoRI (в системе Lonza) для вырезания константной области, реализуя функцию сайта BamHI на основе первоначальной последовательности.
Эти модификации с успехом выполняли с использованием двухэтапного процесса ПЦР. Затем продукты расщепляли HindIII и BglII. Затем их лигировали в векторы pREN, содержащие оптимизированные в отношении частоты использования кодонов константные области, которые были расщеплены HindIII и BamHI. Это процесс повторного лигирования ликвидировал сайт для BamHI.
Смысловой праймер для вариабельной области 5' от первого сайта для DraIII (5' от сайта для DraIII в последовательности тяжелой цепи 806; 26-мер):
5'-GAGAAGCTTGCCGCCACCATGGATTG-3' (SEQ ID NO: 88)
Антисмысловой праймер, включающий сайт I для DraIII (3' от сайта для DraIII в последовательности тяжелой цепи 806; 28-мер): 5'-CACTGGGTGACTGGCTTCGATGGTGACC-3' (SEQ ID NO: 89)
Смысловой праймер для вариабельной области HC между двумя сайтами для DraIII (5' от сайтов для DraIII-FseI в последовательности тяжелой цепи 806; 49-мер):
5'-GGTCACCATCGAAGCCAGTCACCCAGTGAAGGGGGCTTCCATCCACTCC-3' (SEQ ID NO: 90)
Антисмысловой праймер, включающий сайт II для DraIII и сайт для FseI (3' от сайтов для DraIII-FseI в последовательности тяжелой цепи 806; 44-мер):
5'-CCAAGATCTGGCCGGCCACGGTGTGCCATCTTACCGCTGCTCAC-3' (SEQ ID NO: 91)
3. Легкая цепь hu806: добавление сайтов для рестриктаз RsrII и PacI
В случае легкой цепи hu806 добавленными рестрикционными сайтами были сайт для RsrII, имеющий такую же функцию, как и сайт для DraIII в тяжелой цепи, и сайт для PacI, функция которого совпадала с таковой сайта для FseI.
Смысловой праймер для вариабельной области 5' от первого сайта для RsrII (5' от сайта для RsrII в последовательности легкой цепи 806; 22-мер):
5'-GAGAAGCTTGCCGCCACCATGG-3' (SEQ ID NO: 92)
Антисмысловой праймер, включающий сайт I для RsrII (3' от сайта для RsrII в последовательности легкой цепи 806; 25-мер): 5'-CGGTCCGCCCCCTTGACTGGCTTCG-3' (SEQ ID NO: 93)
Смысловой праймер для вариабельной области LC между двумя сайтами для RsrII (5' от сайтов RsrII-PacI в последовательности легкой цепи 806; 45-мер):
5'-CGAAGCCAGTCAAGGGGGCGGACCGCTTCCATCCACTCCTGTGTC-3' (SEQ ID NO: 94)
Антисмысловой праймер, включающий сайт II для RsrII и сайт для PacI (3' от сайтов для RsrII-PacI в последовательности легкой цепи 806; 50-мер):
5'-CCAAGATCTTTAATTAACGGACCGCTACTCACGTTTGATTTCCAGTTTTG-3' (SEQ ID NO:95)
4. VH hu806: повторное венирование P85A
В случае исходного мАт806 белковой последовательности в диапазоне положений аминокислот 81-87 VH является SVTIEDT (SEQ ID NO: 96). В качестве части процесса венирования изолейцин и глутаминовая кислота в положениях 84 и 85 были заменены на алалин-пролин, чтобы читаться SVTAPDT (SEQ ID NO: 97; фиг. 56). После дополнительного анализа было принято решение, что лучшим выбором мог бы быть аланин, а не пролин в этом случае. Для осуществления этого вторичного изменения (SVTAADT, SEQ ID NO: 98) был использован сайт-направленнный мутагенез с использованием праймеров, перечисленных ниже. Конечные последовательности ДНК и транслируемого белка представлены на фиг. 62.
Смысловой праймер (Fx3; 49-мер):
5'-CTGCAGCTGAACTCCGTTACAGCCGCAGACACAGCAACATATTACTGCG-3' (SEQ ID NO: 99)
Антисмысловой праймер (Fx4; 49-мер):
5'-CGCAGTAATATGTTGCTGTGTCTGCGGCTGTAACGGAGTTCAGCTGCAG-3' (SEQ ID NO: 100)
5. VH hu806: дополнительное венирование
Последовательность вариабельной области тяжелой цепи hu806 подверглась трем дополнительным мутациям после первоначального венирования: T70S, S76N и Q81K. Замена в положении 76 серина на аспарагин представляла изменение обратно к исходной последовательности молекулы мАт806. Дополнительные замены в каркасной области были включены, поскольку они представляют остатки, не обнаруженные в антителах мыши, но обнаруженные в антителах человека. Соответственно, было осуществлено венирование белковой последовательности TRDTSKSQFFLQ (SEQ ID NO: 101) в SRDTSKNQFFLK (SEQ ID NO: 102). Конечные последовательности ДНК и транслируемого белка в сравнении с мАт806 представлены на фиг. 62.
Смысловой праймер для 5' ПЦР-фрагмента вариабельной области HC (hu806HCfx2-5p-U; 49-мер):
5'-GGTCACCATCGAAGCCAGTCACCCAGTGAAGGGGGCTTCCATCCACTCC-3' (SEQ ID NO: 103)
Антисмысловой праймер для 5' ПЦР-фрагмента включает первые две замены (hu806HCfx2-5p-D; 45-мер):
5'-GATTCTTCGACGTGTCCCTTGAGATTGTGATCCGGCTTTTCAGAG-3' (SEQ ID NO: 104)
Смысловой праймер для 3' ПЦР-фрагмента включает все замены (hu806HCfx2-3p-U; 55-мер):
5'-CAAGGGACACGTCGAAGAATCAGTTCTTCCTGAAACTGAACTCCGTTACAGCCGC-3' (SEQ ID NO: 105)
Антисмысловой праймер для 3' ПЦР-фрагмента вариабельной области HC (hu806HCfx2-3p-D; 44-мер):
5'-CCAAGATCTGGCCGGCCACGGTGTGCCATCTTACCGCTGCTCAC-3' (SEQ ID NO: 106)
6. VL hu806: венирование E79Q
Это было единственной модификацией в процессе венирования VL, выполненной после конструирования. При модификации в положении 79 использовался сайт-направленный мутагенез для изменения последовательности SSLEPE (SEQ ID NO: 107) на SSLQPE (SEQ ID NO: 108). Конечные последовательности ДНК и транслируемого белка в сравнении с ch806 представлены на фиг. 61.
Смысловой праймер для 5' ПЦР-фрагмента вариабельной области LC (hu806LC-5p-U; 45-мер):
5'-CGAAGCCAGTCAAGGGGGCGGACCGCTTCCATCCACTCCTGTGTC-3' (SEQ ID NO: 109)
Антисмысловой праймер для 5' ПЦР-фрагмента включает намеченную мутацию (hu806LC-5p-D; 34-мер):
5'-CTCTGGTTGTAAGCTAGAGATGGTCAGTGTATAG -3' (SEQ ID NO: 110)
Смысловой праймер для 3' ПЦР-фрагмента вариабельной области LC включает намеченную мутацию (hu806LC-3p-U; 45-мер):
5'-CCATCTCTAGCTTACAACCAGAGGACTTTGCCACATACTACTGCG-3' (SEQ ID NO: 111)
Антисмысловой праймер для 3' ПЦР-фрагмента вариабельной области LC (hu806LC-3p-D; 50-мер):
5'-CCAAGATCTTTAATTAACGGACCGCTACTCACGTTTGATTTCCAGTTTTG-3' (SEQ ID NO: 112)
7. Легкая цепь hu806: модификация в месте соединения в процессе сплайсинга константной области каппа
Эта точечная мутация была необходима для исправления ошибки в сплайсинге оптимизированного в отношении частоты использования кодонов варианта константной области каппа. До этого изменения часть аминокислотной цепи, начинающуюся с VYACEVTH (SEQ ID NO: 113) и продолжающуюся до конца молекулы, не включали в конечное антитело (фиг. 60).
Смысловой праймер для 5' ПЦР-фрагмента константной области каппа LC (F1; 21-мер):
5'-GGCGGCACAAAACTGGAAATC-3' (SEQ ID NO: 114)
Антисмысловой праймер для 5' ПЦР-фрагмента константной области каппа LC включает изменение (F2; 59-мер):
5'-GATGAGTTACTTCACAGGCATATACTTTGTGCTTTTCATAATCAGCTTTTGACAGTGTC-3' (SEQ ID NO: 115)
Смысловой праймер для 3' ПЦР-фрагмента константной области каппа LC включает изменение (F3; 26-мер):
5'-AGTATATGCCTGTGAAGTAACTCATC-3' (SEQ ID NO: 116)
Антисмысловой праймер для 3' ПЦР-фрагмента константной области каппа LC (F4; 17-мер):
5'-GCCACGATGCGTCCGGC-3' (SEQ ID NO: 117)
8. VH hu806: N600
Помимо изменений в процессе венирования, внесенных в антитело 806 на начальных стадиях конструирования, в это время аспарагин в положении 60 в CDR2 VH был заменен на глутамин. N-гликозилирование сосредоточено на структуре: NXS/T, где X является любой аминокислотой. Аминокислотной последовательностью с положения 60 была NPS, которая вытекает из этой структуры. Однако случай, когда в положении Х в сайте N-гликозилирования обнаруживается пролин (как в этом примере) или цистеин, является нечастым. Беспокоились, что неустойчивое гликозилирование могло привести к колебаниям в реактивности антитела. Поэтому аспарагин был удален и заменен наиболее близкородственной аминокислотой, глутамином, что приводило к исключению любой возможности гликозилирования в этом сайте (фиг. 59 и фиг. 62).
Связывание венированного антитела hu806 конструкции 8C65AAG
Была выполнена транзиторная трансфекция клеток 293FT конечной плазмидой 8C65AAG для обеспечения возможности приготовления небольших количеств hu806 для первоначальной верификации связывания с антигеном. Супернатанты культур, полученных в результате нескольких мелкомасштабных параллельных транзиторных трансфекций, объединяли, концентрировали, и антитело 806 получали, используя хроматографическую стадию с использованием белка A. Было получено приблизительно 1-2 мкг антитела hu806, что определено с помощью количественного ELISA для huIgG1, и антитело анализировали с помощью Biacore на связывание с рекомбинатным EGFR-ECD (фиг. 63). Бычий иммуноглобулин из среды для культивирования клеток был очищен вместе с hu806 и представлял основную фракцию общего IgG, ограничивая количественное определение связывания hu806.
Использованные для секвенирования праймеры
RenVecUPSTREAM: смысловой праймер, делающий возможным начало секвенирования 5' от вариабельной области в векторах peak8 и a33xm.
5'-GCACTTGATGTAATTCTCCTTGG-3' (SEQ ID NO: 118)
RenVecDwnstrmHC: антисмысловой праймер, делающий возможным начало секвенирования 3' от вариабельной области в плазмиде для тяжелой цепи peak8. Его отжиг происходит с районом внутри не оптимизированной в отношении частоты использования кодонов константной областью HC.
5'-GAAGTAGTCCTTGACCAGG-3' (SEQ ID NO: 119)
RenVecDwnstrmLC: антисмысловой праймер, делающий возможным начало секвенирования 3' от вариабельной области в плазмиде для легкой цепи a33-xm-lc. Его отжиг происходит с районом внутри не оптимизированной в отношении частоты использования кодонов константной областью LC.
5'-GAAGATGAAGACAGATGGTGCAG-3' (SEQ ID NO: 120)
Upstrm Lonza: смысловой праймер, делающий возможным начало секвенирования 5' от вариабельной области в векторах Lonza pEE 12.4 и pEE 6.4. Его нельзя использовать с объединенной плазмидой Lonza, поскольку в ней существует район-дубликат.
5'-CGGTGGAGGGCAGTGTAGTC-3' (SEQ ID NO: 121)
Dnstrm 6-4: антисмысловой праймер, делающий возможным начало секвенирования 3' от константной области в векторе Lonza pEE 6.4
5'-GTGATGCTATTGCTTTATTTG-3' (SEQ ID NO: 122)
Dnstrm 12-4: антисмысловой праймер, делающий возможным начало секвенирования 3' от константной области в векторе Lonza pEE 12.4
5'-CATACCTACCAGTTCTGCGCC-3' (SEQ ID NO: 123)
Cod-Opt LC const E: смысловой праймер, внутренний относительно оптимизированной в отношении частоты использования кодонов константной области v-каппа легкой цепи
5'-CCATCCTGTTTGCTTCTTTCC-3' (SEQ ID NO: 124)
Cod-Opt LC const F: антисмысловой праймер, внутренний относительно оптимизированной в отношении частоты использования кодонов константной области v-каппа легкой цепи (vκ).
5'-GACAGGGCTGCTGAGTC-3' (SEQ ID NO: 125)
806HCspec: смысловой праймер, внутренний и уникальный для венированного варианта вариабельной области HC 806.
5'-GTGCAGCTCCAAGAGAGTGGAC-3' (SEQ ID NO: 126)
806LCspec: смысловой праймер, внутренний и уникальный для венированного варианта вариабельной области LC 806.
5'-CAGAGTCCATCCAGCATGTC-3' (SEQ ID NO: 127)
Отформатированный для GenBank текстовый документ, касающийся последовательности плазмиды 8C65AAG, кодирующей hu806 в виде IgG1, и аннотаций к ней, представлен на фиг. 64.
Фиг. 53 была создана с использованием вектора NTI (Invitrogen).
Фиг. 59-62 были созданы с использованием вектора NTI AlignX.
Обсуждение
Венирование антитела 806 против рецептора EGF включало мутирование 14 аминокислот в VH (фиг. 59 и фиг. 62) и 12 изменений в VL-области (фиг. 60 и фиг. 61) с оптимизацией в отношении частоты использования кодонов, как указано, для экспрессии в клетках млекопитающих CHO или NS0. Последовательность конечного вектора с двумя генами, названного 8C65AAG, была верифицирована, и были проверены кодирующая последовательность и являющаяся результатом ее трансляции последовательность. Связывание с рекомбинантным экстраклеточным доменом EGFR было подтверждено с помощью анализов Biacore с использованием транзиторно экспрессированного продукта hu806.
Стабильные одиночные клоны, продуцирующие на высоких уровнях интактное антитело hu806, отбирали в среде без глутамина, как рекомендовано LONZA. Стабильные клоны постепенно отучали от сыворотки для получения бессывороточных культур.
B. In vitro и in vivo характеристика hu806
В дальнейшем были созданы более высоко продуцирующие, стабильные GS-CHO hu806-трансфектанты 14D8, 15B2 и 40A10 и GS-NSO hu806-трансфектант 36, и были инициированы мелкомасштабные культуры для обеспечения возможности предварительной очистки и характеристики продукта в виде hu806. Результаты указывали на схожие физико-химические свойства. Поэтому было выполнено высокомасштабное культивирование в смесительном чане (15 л) трансфектанта с самой высокой продукцией (GS-CHO hu806 40A10), а подвергнутый очистке продукт был подвергнут дополнительной in vitro характеристике и in vivo терапевтических исследованиям в моделях с использованием ксенотрансплантатов U87MG.de2-7 и A431.
Методика и результаты
Продукция и дальнейшая обработка
Мелкомасштабная продукция
Были выполнены эксперименты с использованием встряхиваемых колб E500 с составляющим 100 мл объемом клеточной культуры. На фиг. 76 представлена жизнеспособность клеток и графики выработки антител для четырех трансфектантов во время культивирования. Концентрацию продукта определяли с помощью ELISA, используя антиидиотипическое (анти-806) антитело LMH-12 (Liu et al. (2003) Generation of anti-idiotype antibodies for application in clinical immunotherapy laboratory analyses. Hybrid Hybridomics. 22(4), 219-228) в качестве антитела для покрытия и ch806 (клиническая серия: J06024) в качестве стандарта. Материал в момент сбора подвергали центрифугированию, и супернатант подвергали фильтрованию через фильтр с размером пор 0,2 мкм, а затем антитела подвергали аффинной очистке с помощью хроматографии с использованием белка A.
Высокомасштабная продукция
Линию клеток-трансфектантов CHO-K1SV, экспрессирующих hu806, - клон-кандидат 40A10 культивировали в биореакторе-смесительном чане на 15 л с дозовой подачей глюкозы в течение 16 дней, используя CD-CHO (Invitrogen)/25 мкМ L-метионина сульфоксимин (MSX; Sigma)/GS-добавки (Sigma) в качестве основных сред. На фиг. 76C представлены рост клеток и объемная продукция в биореакторе-смесительном чане на 15 л. Конечный выход составлял 14,7 л в концентрации 58 мг/л, определенной с помощью ELISA.
Материал в момент сбора подвергали центрифугированию, и супернатант подвергали фильтрованию через фильтр с размером пор 0,2 мкм, а затем концентрировали до 2 л, используя 2 мембраны с номинальным отсечением по молекулярной массе - 30 кДа в концентраторе Pall Centrimate. Впоследствии аликвоты (4×500 мл) вносили в 250 мл колонку с белком А, и элюирование осуществляли с помощью 50 мМ цитратного буфера, pH 4,5, содержащего 200 мМ NaCl. Подвергнутое элюированию на основе выполнения 4 хроматографий антитело затем объединяли, концентрировали и подвергали диализу против PBS, pH 7,4.
Количество продуктов в виде hu806, полученных в результате мелко- и высокомасштабных культивирований, определяли по ОП280 нм. Образцы антитела, элюированного с рекомбинантного белка А, подвергали оценке с помощью гель-фильтрации (SEC) (мелкомасштабной, фиг. 77; крупномасштабной, фиг. 78), электрофореза в 4-20% ПААГ в Трис-глициновом буфере с SDS в восстанавливающих и невосстанавливающих условиях (фиг. 79-81), и была выполнена изоэлектрофокусировка с помощью системы Amersham Multiphor II Electrophoresis в пластинке Ampholine PAG (pH 3,5-9,5) в соответствии с инструкциями изготовителя (фиг. 82).
Подвергнутые аффинной очистке с использованием белка А антитела hu806 демонстрировали симметричные белковые пики и профили элюирования при SEC, идентичные таковым клинического контрольного вещества ch806. Картины гелей после электрофореза в SDS-ПААГ находились в соответствии с таковыми иммуноглобулина. Картина после IEF указывала на три изоформы с pI, колеблющейся от 8,66 до 8,82, что соответствовало рассчитанной для белковой последовательности pI, составляющей 8,4.
Анализы связывания
Анализ с помощью FACS
Оценки концентрации антитела, определенные для каждого образца по ОП280 нм, использовали для анализов с помощью FACS с использованием линии клеток аденокарциномы A431 (имеющих амплификацию гена EGFR). Авторы настоящего изобретения ранее установили, что мАт806 связывается с приблизительно 10% от ~2×106EGFR дикого типа, представленных на поверхности опухолевых клеток A431, по сравнению со специфическим для EGFR дикого типа мАт528 (Johns et al. (2002) Novel monoclonal antibody specific for the de2-7 epidermal growth factor receptor (EGFR) that also recognizes the EGFR expressed in cells containing amplification of the EGFR gene. Int. J. Cancer. 98(3), 398-408). Клетки подвергали окрашиванию либо одним из четырех образцов hu806, нерелевантным антителом IgG2b, либо ch806 в качестве положительного контроля; каждое в соответствии с оценкой в концентрации, составляющей 20 мкг/мл. Также был включен контроль на лишь второе антитело [конъюгированное с FITC козье антитело против IgG человека (специфичное для Fc)]. Суммарные кривые связывания при анализе с помощью FACS представлены на фиг. 83 и демонстрируют эквивалентное окрашивание в случае всех конструкций.
С помощью FACS были также определены характеристики связывания клеток образца hu806 40A10, полученного при высокомасштабном культивировании, с клетками A431, а также клетками глиомы U87MG.de2-7, экспрессирующими вариант рецептора EGFRvIII (Johns et al., 2002). Репрезентативные результаты анализов в двух повторах представлены на фиг. 84 и фиг. 85, соответственно. Контроли включали нерелевантное антитело IgG2b (закрашенные гистограммы), ch806 или 528 (связывается как с EGFR дикого типа, так и с de2-7 EGFR), как указано.
ch806 и антитело hu806 продемонстрировали схожие окрашивания линий клеток A431 и U87MG.de2-7, подтверждая предшествующие данные наблюдений авторов настоящего изобретения, состоящие в том, что мАтb806 специфически распознает de2-7 EGFR и подмножество сверхэкспрессированного EGFR (Luwor et al. (2001) Monoclonal antibody 806 inhibits the growth of tumor xenografts expressing either the de2-7 or amplified epidermal growth factor receptor (EGFR) but not wild-type EGFR. Cancer Res. 61(14), 5355-5361). Как и ожидалось, антитело 528 окрашивало обе линии клеток U87MG.de2-7 и A431 (фиг. 84 и 85).
Анализы связывания с клетками
Способности радиоиммуноконъюгатов к связыванию антигена оценивали с помощью анализов клеточной абсорбции (Lindmo et al. (1984) Determination of the immunoreactive fraction of radiolabeled monoclonal antibodies by linear extrapolation to binding at infinite antigen excess. J. Immunol. Methods. 72(1), 77-89) с использованием линии глиомных клеток U87MG.de2-7 и клеток эпидермоидного рака A431, экспрессирующих амплифицированный ген EGFR.
Иммунореактивные фракции радиоиммуноконъюгатов на основе hu806 и ch806 определяли по связыванию с экспрессирующими антиген клетками в присутствии избытка антигена. На фиг. 86А представлены результаты связывания125I-hu806 и125I-ch806 с клетками U87MG.de2-7 в диапазоне концентраций клеток от 20×106 до 0,03×106 клеток/образец. На фиг. 86B представлены результаты связывания125I-hu806 и125I-ch806 с клетками A431 в диапазоне концентраций клеток от 200×106 до 0,39×106 клеток/образец.
Анализы Скетчарда использовались для расчета константы ассоциации (Ka) (Lindmo et al., 1984). Связывание низких уровней (20 нг) меченого антитела самого по себе сравнивали с его связыванием в присутствии избытка немеченого антитела. Иммунореактивная фракция учитывалась при расчете количества свободного, реактивного антитела, как описано ранее (Clarke et al. (2000) In vivo biodistribution of a humanized anti-Lewis Y monoclonal antibody (hu3S193) in MCF-7 xenografted BALB/c nude mice. Cancer Res. 60(17), 4804-4811), и строили график зависимости от концентрации специфически связанного мАт (нМ; общая концентрация антитела × % связанной фракции) отношения специфически связанное мАт/реактивное свободное мАт (фиг. 87 и 88). Константу ассоциации определяли на основе отрицательного наклона линии.
Аффинность связывания в случае связывания125I-hu806 с EGFRvIII на клетках U87MG.de2-7, как определено, составляет 1,18×109 M-1. Ka для125I-ch806 составляла 1,06×109 M-1. Эти данные согласуются с опубликованными результатами, касающимися значений Ka для111In- и125I-ch806, составляющих 1,36×109 M-1 и 1,90×109 M-1, соответственно, которые в высокой степени соразмерны со значением Ka для исходного мышиного мАт806, составляющим 1,1×109 M-1 (Panousis et al. (2005) Engineering and characterization of chimeric monoclonal antibody 806 (ch806) for targeted immunotherapy of tumours expressing de2-7 EGFR or amplified EGFR. Br. J. Cancer. 92(6), 1069-77).
Анализ Скетчарда на клетках A431 показал связывание с высокой аффинностью обеих конструкций 806 с небольшим количеством EGFR на этих клетках. Ka для125I-ch806 составила 0,61×109 M-1, а для125I-hu806 Ka=0,28×109 M-1.
Анализ с использованием биосенсора
Анализы с использованием биосенсора были выполнены в биосенсоре BIAcore 2000, используя покрытый карбоксиметилдекстраном сенсорный чип (CM5). Канал 3 чипа был подвергнут дериватизации с использованием содержащего эпитоп пептида 806 (аминокислоты 287-302 EGFR; SEQ ID NO: 14; см. заявку на патент США № 11/060646, поданную 17 февраля 2005 года; предварительную заявку на патент США № 60/546602, поданную 20 февраля 2004 года; и предварительную заявку на патент США № 60/584623, поданную 1 июля 2004 года, описания всех из которых включены, тем самым, в их полном объеме), используя стандартную химию сочетания с аминами. Канал 2 был подвергнут дериватизации с использованием контрольного антигена, используемого для определения пригодности системы. Канал 1 был подвергнут дериватизации с использованием этаноламина и использовался в качестве пустого контрольного канала для внесения поправки в эффекты на показатель рефракции. Образцы hu806 разбавляли в буфере HBS (10 мМ HEPES, pH 7,4; 150 мМ NaCl; 3,4 мМ ди-Na-EDTA; 0,005% Tween-20), и аликвоты (120 мкл), содержащие 50 нМ, 100 нМ, 150 нМ, 200 нМ, 250 нМ и 300 нМ, инъецировали с пропусканием по поверхности сенсорного чипа со скоростью потока, составляющей 30 мкл/мин. После фазы инъекции следили за диссоциацией под действием текущего по поверхности чипа буфера HBS в течение 600 сек. Связанное антитело подвергалось элюированию, и поверхность чипа регенерировали между инъекциями образцов посредством инъекции 20 мкл 10 мМ раствора гидроксида натрия. Был включен положительный контроль, ch806. Параметры связывания определяли с использованием модели равновесного связывания программного обеспечения BIAevaluation. На фиг. 89 представлены полученные сенсограммы.
Дозозависимое связывание наблюдали при использовании как hu806, так и положительного контроля, ch806, в канале 3. Пригодность системы была подтверждалась дозозависимым связыванием соответствующего моноклонального антитела с контрольным каналом 2. Перекрестная реактивность не наблюдалась между hu806 (или ch806) и контрольным антителом. В этих анализах было установлено, что кажущаяся KD (1/Ka) составляет 37 нМ для hu806 и 94 нМ в случае ch806.
Анализы антителозависимой клеточноопосредованной цитотоксичности
Анализы ADCC были выполнены, используя очищенный препарат антитела hu806 40A10 вместе с мишенями-клетками аденокарциномы A431 и эффекторными клетками в виде свежевыделенных мононуклеарных клеток периферической крови здоровых доноров. Вкратце, все анализы были выполнены в трех повторах 1) с использованием 1 мкг/мл каждого антитела в диапазоне отношений клетки-эффекторы/клетки-мишени (E:T=0,78:1 - 100:1), а также 2) при E:T=50:1 в диапазоне концентраций каждого антитела (3,15 нг/мл - 10 мкг/мл). В трех повторах были включены контроли на изотип антитела, самопроизвольную и общую цитотоксичность, и расчеты специфической цитотоксичности проводились, как описано ранее (Panousis et al., 2005). Результаты представлены на фиг. 90.
hu806 раз за разом демонстрировало активность в виде ADCC, которая была лучше таковой в случае химерного ch806 IgG1. В репрезентативном эксперименте установлено, что с помощью hu806 в концентрации 1 мкг/ил достигалась ADCC, составляющая 30% цитотоксичности, в отличие от достигаемой с помощью ch806 5% цитотоксичности.
In vivo терапевтическое исследование 806
Терапевтическую эффективность hu806 исследовали, используя укоренившиеся ксенотрансплантаты клеток аденокарциномы A431 или глиомных клеток U87MG-de2-7 у бестимусных мышей BALB/c. Для создания ксенотрансплантатов мышам инъецировали подкожно в правую и левую мамилярные линии паховой области 1×106 клеток аденокарциномы A431 или 1×106 глиомных клеток U87MG.de2-7 в 100 мкл PBS. Объем опухоли (TV) рассчитывали по формуле [(длина×ширина2)/2], где длина представляла собой самую длинную ось, а ширина - измерение под прямыми углами относительно длины. В первоначальном эксперименте группы из пяти бестимусных мышей BALB/c (n=10 опухолей/группа) с укоренившимися ксенотрансплантатами A431 или U87MG.de2-7 получили лечение 1 мг hu806, или 1 мг антитела ch806, или носителем PBS в качестве контроля посредством внутрибрюшинной инъекции. Лечение назначали в дни 6, 8, 11, 13, 15 и 18 в случае линии клеток A431 и дни 4, 6, 8, 11, 13 и 15 в случае линии клеток U87MG.de2-7, соответственно. Объемы опухолей в виде средних значений ± стандартное отклонение до завершения экспериментов по этическим соображениям в отношении опухолевой массы представлены на фиг. 91 для ксенотрансплантата A431 до дня 25 и на фиг. 92 для ксенотрансплантата U87MG.de2-7 до дня 31.
Оценки in vivo терапии с использованием hu806 показали очевидное уменьшение роста ксенотрансплантата A431 по сравнению с лечением носителем PBS в качестве контроля. Кривая роста ксенотрансплантата A431, установленная в случае hu806, была сопоставима в высокой степени с таковой для группы лечения ch806. Подвергнутая лечению контролем в виде PBS группа мышей с укоренившимися ксенотрансплантатами U87MG.de2-7 была подвергнута эвтаназии в день 20. Лечение hu806 продемонстрировало значительное уменьшение роста опухолей к дню 20 по сравнению с контрольными лечениями PBS (P<0,001) и продолженное замедление роста опухолей после дня 20, так и в группе, подвергнутой лечению ch806.
Обсуждение
Подвергнутые аффинной очистке с использованием белка А антитела hu806 продемонстрировали профили элюирования при SEC, идентичные таковым клинического контрольного вещества ch806, и картины гелей после электрофореза в SDS-ПААГ в соответствии с таковыми иммуноглобулина. Картина после IEF находится в соответствии с ожидаемой pI, составляющей 8,4.
В продолжение анализов Скетчарда клеточного связывания и анализов эпитопного связывания с помощью биосенсора антитело hu806 продемонстрировало кривые связывания и параметры аффинности, в высокой степени сопоставимые с таковыми антитела ch806. Аффинности связывания hu806 и ch806 с EGFRvIII и сверхэкспрессированным EGFR дикого типа были схожими и находились в низком наномолярном диапазоне. Связывание с клетками, определяемое благодаря анализам с помощью FACS, подтвердило эти данные наблюдений.
Кроме того, hu806 продемонстрировало заметно увеличенную ADCC по сравнению с конструкцией ch806 в отношении антиген-положительных клеток A431 - мишеней.
Оценки in vivo терапии с использованием hu806 показали очевидное уменьшение роста ксенотрансплантата A431, которое было соизмеримо в высокой степени с таковым в группе, подвергнутой лечению ch806. В моделях с использованиях укоренившихся ксенотрансплантатов U87MG.de2-7 лечение hu806 продемонстрировало значительное уменьшение роста опухолей к дню 20 по сравнению с контрольными лечениями PBS и продолженное замедление роста опухолей после дня 20, как и в группе, подвергнутой лечению ch806.
Пример 23
Моноклональное антитело 175
Как обсуждалось в примере 1, клон 175 (IgG2a) был выбран для определения дополнительных характеристик.
Материалы и методы
Линии клеток
Трансфицированные Δ2-7EGFR линии клеток U87MG.Δ2-7 (Huang et al. (1997) J. Biol. Chem. 272, 2927-2935) и A431 (Ullrich et al. (1984) Nature. 309, 418-425) были описаны ранее. Линия клеток гормононезависимой карциномы предстательной железы DU145 (Mickey et al. (1977) Cancer Res. 37, 4049-4058) была получена из ATCC (atcc.org).
Все линии клеток поддерживали в среде DMEM (Life Technologies, Grand Island, NY), дополненной 10% FCS (CSL, Melbourne); 2 мМ глутамином (Sigma Chemical Co., St. Louis) и пенициллином/стрептомицином (Life Technologies, Grand Island). К тому же линию клеток U87MG.Δ2-7 поддерживали в присутствии 400 мг/мл генетицина (Life Technologies, Inc., Grand Island). Линии клеток BaF/3 (Palacios et al. (1984) Nature. 309, 126-131) и BaF/3, экспрессирующих отличные рецепторы EGF (Walker et al. (2004) J. Biol. Chem. 2(79), 22387-22398), поддерживали обычно в среде RPMI 1640 (GIBCO BRL), дополненной 10% фетальной телячьей сыворотки (GIBCO BRL) и 10% кондиционированной среды WEHI-3B (Ymer et al. (1985) Nature. 19-25; 317, 255-258) в качестве источника IL-3. Все линии клеток выращивали при 37ºC в атмосфере воздух/CO2(95%-5%).
Антитела и пептиды
мАт806 и mAb175 были созданы в Ludwig Institute for Cancer Research (LICR) New York Branch и были продуцированы и очищены в Biological Production Facility (Ludwig Institute for Cancer Research, Melbourne). В качестве иммуногена была использована линия фибробластов мыши NR6ΔEGFR. Мышиные гибридомы были созданы посредством пятикратной подкожной иммунизации мышей BALB/c с составляющими 2-3 недели интервалами с использованием 5×105 - 2×106клеток в адъюванте. Для первой инъекции был использован полный адъювант Фрейнда. Впоследствии использовался неполный адъювант Фрейнда (Difco). Клетки селезенок иммунизированных мышей сливали с линией клеток миеломы мыши SP2/0. Супернатанты вновь созданных клонов подвергали скринингу в анализах гемадсорбции на реактивность с линией клеток NR6, NR6wtEGFRи NR6ΔEGFR, а затем анализировали с помощью анализов гемадсорбции с использованием линий клеток глиобластомы человека U87MG, U87MGwtEGFR и U87ΔEGFR.
Интактные мАт (50 мг) подвергали расщеплению в PBS активированным папаином в течение 2-3 часов при 37ºC в соотношении 1:20, и папаин инактивировали йодацетамидом. Продукт расщепления затем пропускали через колонку с сефарозой с белком А (Amersham) в 20 мМ натрийфосфатном буфере pH 8,0, при этом в дальнейшем не связавшийся материал подвергали очистке с помощью катионообменной хроматографии на колонке Mono-S (Amersham). Затем белок концентрировали, используя центробежный концентратор с номинальным отсечением по молекулярной массе - 10000 Да (Millipore). Для образования комплексов Fab-пептид непосредственно к Fab добавляли молярный избыток лиофилизированного пептида и инкубировали в течение 2 часов при 4ºC, прежде чем приступить к кристаллизационным исследованиям.
Картирование эпитопов для мАт175 с использованием фрагментов EGFR, экспрессированных в клетках млекопитающих
За день до трансфекции этими фрагментами фибробласты почки новорожденного человека 293T засевали с плотностью 8×105 на лунку в 6-луночные планшеты для культивирования тканей, содержащие 2 мл среды. Клетки трансфицировали 3-4 мкг плазмидной ДНК, образовавшей комплекс с липофектамином 2000 (Invitrogen), в соответствии с инструкциями производителя. Через 24-48 ч после трансфекции культуры клеток аспирировали, а клеточные монослои лизировали в 250 мкл буфера для лизиса (1% Тритона X-100, 10% глицерина, 150 мМ NaCl, 50 мМ HEPES pH 7,4, 1 мМ EGTA и смесь ингибиторов всех протеаз (Roche)). Аликвоты клеточного лизата (10-15 мкл) смешивали с содержащим SDS буфером для образцов, содержащим 1,5% β-меркаптоэтанола, подвергали денатурации нагреванием в течение 5 мин при 100ºC и подвергали электрофорезу в 10% полиакриламидных гелях в бис-Трис-буфере NuPAGE (Invitrogen). Затем образцы подвергали электропереносу на нитроцеллюлозные мембраны, которые промывали в буфере TBST (10 мМ Трис-HCl, pH 8,0, 100 мМ NaCl и 0,1% Tween-20) и блокировали в TBST, содержащем 2,5% снятого молока, в течение 30 мин при комнатной температуре. Мембраны инкубировали в течение ночи при 4ºC с 0,5 мкг/мл мАт175 в буфере для блокирования. Параллельные мембраны зондировали в течение ночи с использованием мАт 9B11 (1:5000, Cell Signaling Technology, Danvers, Massachusetts) для обнаружения эпитопа c-myc. Мембраны промывали в TBST и инкубировали в буфере для блокирования, содержащем конъюгированное с пероксидазой хрена кроличье антитело против мышиного IgG (Biorad) в разведении 1:5000, в течение 2 ч при комнатной температуре. Затем блоты промывали в TBST, и проявляли, используя пленку для дефектоскопии, после инкубации с хемилюминесцентным субстратом Western Pico (Pierce, Rockford, Illinois).
Картирование эпитопов для мАт175 с использованием фрагментов EGFR, экспрессированных в клетках млекопитающих и дрожжах
Ряд перекрывающихся, меченных c-myc фрагментов эктодомена EGFR, начинающихся с остатков 274, 282, 290 и 298 и заканчивающихся во всех случаях аминокислотой 501 и слитых с гормоном роста, был описан ранее (Johns et al. (2004) J. Biol. Chem. 279, 30375-30384). Экспрессия белков EGFR на поверхности дрожжевых клеток была выполнена, как описано ранее (Johns et al., 2004).
Вкратце, трансформированные колонии выращивали при 30ºC в минимальных средах, содержащих основу азотного агара для дрожжей, гидролизат казеина, декстрозу и фосфатный буфер pH 7,4, на качающейся платформе в течение приблизительно одного дня до достижения ОП600=5-6. Затем осуществляли индукцию представления белков дрожжевыми клетками посредством переноса в минимальные среды, содержащие галактозу, и инкубировали с покачиванием при 30ºC в течение 24 ч. Затем культуры хранили при 4ºC до анализа. Неочищенная асцитическая жидкость, содержащая моноклональное антитело против c-myc 9E10, была получена от Covance (Richmond, CA). 1×106 дрожжевых клеток промывали холодным как лед буфером FACS (PBS, содержащим 1 мг/мл BSA) и инкубировали либо с асцитами, содержащими антитело против c-myc (в разведении 1:50), либо с моноклональным антителом против EGFR человека (10 мкг/мл) в конечном объеме 50 мкл в течение 1 ч при 4ºC. Затем клетки промывали холодным как лед буфером FACS и инкубировали с меченным фикоэритрином антителом против IgG мыши (в разведении 1:25) в конечном объеме 50 мкл в течение 1 ч при 4ºC, с защитой от света. После промывки дрожжевых клеток холодным, как лед, буфером FACS касающиеся флуоресценции данные получали с помощью проточного цитометра Coulter Epics XL (Beckman-Coulter) и анализировали с помощью программного обеспечения для цитометрических данных WinMDI (J. Trotter, Scripps University).Для определения линейных эпитопов в сравнении с конформационными эпитопами дрожжевые клетки нагревали при 80ºC в течение 30 мин, затем охлаждали на льду в течение 20 мин до мечения антителами. Ряд мутантов EGFR, перечисленных в таблице 7, были описаны ранее (Johns et al., 2004).
Поверхностный плазмонный резонанс (BIAcore)
Во всех экспериментах был использован BIAcore 3000. Пептиды, содержащие предполагаемый эпитоп для мАт806, иммобилизовали на сенсорном чипе CM5, используя сочетание с аминами, тиолами или Pms, при скорости потока 5 мкл/мин (Wade et al. (2006) Anal. Biochem. 348, 315-317). мАт806 и мАт175 пропускали по поверхности сенсора со скоростью потока 5 мкл/мин при 25ºC. Поверхности регенерировали между инъекциями антител посредством инъекции 10 мМ HCl со скоростью потока, составляющей 10 мкл/мин.
Иммунопреципитация и Вестерн-блоттинг
Клетки лизировали с помощью буфера для лизиса (1% Тритона Х-100, 30 мМ HEPES, 150 мМ NaCl, 500 мМ 4-(2-аминоэтил)бензолсульфонилфторид, 150 нМ апротинин, 1 мМ ингибитор протеазы Е-64, 0,5 мМ EDTA и 1 мМ лейпептин) в течение 20 минут, осветляли посредством центрифугирования при 14000×g в течение 30 минут, подвергали иммунопреципитации релевантными антителами в конечной концентрации, составляющей 5 мкг/мл, в течение 60 минут и улавливанию гранулами сефарозы-А в течение ночи. Затем образцы элюировали 2X буфером для образцов с SDS NuPAGE (Invitrogen), разделяли в гелях NuPAGE (или 3-8%, или 4-12%), подвергали электропереносу на мембраны для переноса Immobilon-P (Millipore), а затем зондировали с использованием релевантных антител до выявления с помощью хемилюминесцентной дефектоскопии.
Иммуногистохимический анализ
Замороженные срезы подвергали окрашиванию 5 мкг/мл мАт175 или нерелевантного, совпадающего по изотипу контрольного антитела в течение 60 мин при комнатной температуре. Связанное антитело выявляли с использованием системы для выявления Dako Envision+ HRP в соответствии с инструкциями производителя. Наконец, срезы промывали водой, и подвергали контрастному окрашиванию гематоксилином и монтировали.
Модели с использованием ксенотрансплантатов
Клетки U87MG.Δ2-7 (3×106) в 100 мл PBS инокулировали подкожно в оба бока самок бестимусных мышей возрастом 4-6 недель (Animal Research Centre, Perth, Австралия). Все исследования были проведены с использованием моделей укоренившихся опухолей, как сообщалось ранее (Perera et al. (2005) Clin. Cancer Res. 11, 6390-6399). Лечение начинали, когда средний объем опухолей достигал значения, указанного в подписи к соответствующей фигуре. Объем опухоли в мм3 определяли, используя формулу (длина × ширина2)/2, где длина представляла собой самую длинную ось, а ширина - измерение под прямыми углами относительно длины. Данные представляли как средний объем опухолей ± стандартная ошибка для каждой подвергаемой лечению группы. Все данные анализировали на значимость с помощью одностороннего критерия Стьюдента, где p<0,05 считалось статистически значимым. Этот исследовательский проект был разрешен Комиссией по проблеме этики отношения к животным Austin Hospital.
Создание и характеристика стабильных линий клеток, экспрессирующих конструкции мутантных EGFR
Мутации EGFR дикого типа были созданы с использованием набора для сайт-направленного мутагенеза (Stratagene, La Jolla, CA). В случае каждого мутагенеза матрицей служила кДНК для EGFR человека (входящий номер x00588) (Ullrich et al. (1984) Nature. 309, 418-425). Выполняли автоматизированное нуклеотидное секвенирование каждой конструкции для подтверждения сохранности мутаций EGFR. EGFR дикого типа и мутантный (C173A/C281A) EGFR трансфицировали в клетки BaF/3 с помощью электропорации.
Стабильные линии клеток, экспрессирующих мутантный EGFR, получали посредством отбора в содержащей неомицин среде. После окончательного отбора мРНК выделяли из каждой клеточной линии, подвергали обратной транскрипции, и последовательность для EGFR амплифицировали с помощью ПЦР. Все мутации в экспрессируемых EGFR подтверждали посредством секвенирования продуктов ПЦР. Уровень экспрессии EGFR определяли с помощью анализа с использованием FACS в FACStar (Becton and Dickinson, Franklin Lakes, NJ), используя антитело против EGFR - мАт528 (Masui et al. (1984) Cancer Res. 44, 1002-1007; Gill et al. (1984) J. Biol. Chem. 259, 7755-7760) в концентрации 10 мкг/мл в PBS, 5% FCS, 5 мМ EDTA, а затем меченное Alexa 488 антитело против Ig мыши (в конечном разведении 1:400). Фоновую флуоресценцию определяли посредством инкубации клеток с нерелевантным, совпадающим по классу первым антителом. Все клетки обычно пассировали в RPMI, 10% FCS, 10% кондиционированной среды WEHI3B и 1,5 мг/мл G418.
EGF-зависимая активация мутантного EGFR
Клетки, экспрессирующие EGFR дикого типа или C271A/C283A-EGFR, отмывали и инкубировали в течение 3 ч в среде без сыворотки или IL-3. Клетки собирали посредством центрифугирования и ресуспендировали в среде, содержащей EGF (100 нг/мл) или равный объем PBS. Клетки собирали через 15 мин, осаждали и подвергали лизису непосредственно в буфере для образцов, подвергаемых электрофорезу в SDS-ПААГ, содержащем β-меркаптоэтанол. Образцы разделяли в 4-12% градиентных гелях NuPAGE, переносили на PVDF-мембрану Immobilon и зондировали с использованием антитела против фосфотирозина (4G10, Upstate Biotechnologies) или антитела против EGFR (мАт806, продуцированного в LICR). Реактивные полосы выявляли с использованием хемилюминесценции.
Эффект EGF и антител на пролиферацию клеток
Клетки в логарифмической фазе роста собирали и дважды промывали PBS для удаления остаточного IL-3. Клетки ресуспендировали в RPMI 1640 плюс 10% FCS и засевали в 96-луночные планшеты с плотностью 105 клеток/лунка только с носителем или с увеличивающимися концентрациями EGF. Сообразно обстоятельствам, к культурам также добавляли постоянную концентрацию мАт528 или мАт806 (2 мкг/лунка). Пролиферацию определяли, используя анализ на основе MTT (van de Loosdrecht et al. (1994) J. Immunol Methods. 174, 311-320).
Реактивность с антителами, специфичными в отношении конформационных эпитопов
Клетки собирали посредством центрифугирования и подвергали окрашиванию контрольным и исследуемым антителами (во всех случаях в концентрации 10 мкг/мл в буфере для FACS в течение 40 мин на льду, промывали буфером для FACS), а затем меченным Alexa 488 антителом против Ig мыши (в конечном разведении 1:400, в течение 20 мин на льду). Клетки промывали холодным как лед буфером для FACS, собирали посредством центрифугирования и анализировали в FACScan; для каждого образца определяли канал максимальной флуоресценции и медиану флуоресценции, используя статистический способ программы Cell Quest (Becton and Dickinson). Из всех определений вычитали фоновую флуоресценцию (отрицательного контроля). Значения медианы флуоресценции были выбраны как создающие наилучшее представление о форме пика и интенсивности флуоресценции и использовались для получения отношения связывание мАт806:связывание мАт528.
Определения кристаллических структур Fab175 и Fab806, комплексов Fab-пептид и определенная в растворе с помощью ЯМР структура эпитопа на основе пептида для 806
Структуры определяли посредством молекулярного замещения и уточнения до R-фактора=0,225/Rfree=0,289 для Fab806 и R-фактора=0,226/Rfree=0,279 для Fab806:пептид; R-фактора=0,210/Rfree=0,305 для Fab806 и R-фактора=0,203/Rfree=0,257 для Fab806:пептид.
Кристаллы Fab природного 806 выращивали с помощью удерживания диффузии из пара в каплю, используя 10 мг/мл Fab и резервуар, содержащий 0,1 М натрийацетатный буфер pH 4,6, 6-8% ПЭГ 6000 и 15-20% изопропанола. Для сбора данных кристаллы
переносили в криопротекторный раствор, содержащий 0,1 М натрийацетатный буфер pH 4,6, 10% ПЭГ 6000, 15-20% изопропанола и 10% глицерина. Кристаллы вставляли в рамку из нейлона и быстро замораживали непосредственно в жидком азоте.
Кристаллы комплекса 806 Fab-пептид выращивали с помощью удерживания диффузии из пара в каплю, используя 10 мг/мл комплекса Fab-пептид и резервуар, содержащий 0,2 M ацетат аммония, 16-18% ПЭГ 5000 монометилэфир, качество кристаллов затем улучшали через посредство методов внесения затравки. Для сбора данных кристаллы переносили в криопротекторный раствор, состоящий из раствора резервуара, дополненного 25% глицерина. Кристаллы вставляли в рамку из нейлона и быстро замораживали непосредственно в жидком азоте.
Кристаллы комплекса 175 Fab-пептид сначала выращивали с использованием свободной диффузии между фазами, используя систему для кристаллизации Topaz (Fluidigm, San Francisco). Микрокристаллы выращивали с помощью удерживания диффузии из пара в каплю, используя 7 мг/мл Fab, с использованием схожих условий: 0,1 М Бис-Трис пропановый буфер, 0,2 М ацетат аммония и 18% ПЭГ 10000. Затем осуществляли улучшение микрокристаллов посредством внесения затравки в виде полоски в 0,15 М формат натрия и 15% ПЭГ 1500 для получения небольших кристаллов пластинчатой формы. Для сбора данных кристаллы переносили в криопротекторный раствор, состоящий из раствора резервуара, дополненного 25% глицерина. Кристаллы вставляли в рамку из нейлона и быстро замораживали непосредственно в жидком азоте.
Данные по дифракции в кристаллах 806 Fab и комплекса 175 Fab-пептид были собраны собственными силами, используя детектор R-AXIS IV в генераторе Rigaku Micromax-007, оснащенном оптическими системами AXCO, эти данные затем обрабатывали, используя CrystalClear. Данные по дифракции в кристаллах комплекса 806 Fab-пептид были собраны в детекторе ADSC quantum315 CCD через канал синхронного излучения X29, Brookhaven National Laboratory, эти данные затем обрабатывали, используя HKL2000 (Otwinowski, Z. and Minor, W. (1997) Processing of X-ray diffraction data collected in oscillation mode. Academic Press (New York)) (статистика сбора данных представлена в таблице 9). Разрешение структуры Fab природного 806 осуществляли посредством молекулярного замещения с использованием программы MOLREP (Vagin, A. and Teplyakov, A. (1997) J. Appl. Cryst. 30, 1022-1025), используя координаты структуры Fab - 2E8, уточнение структуры выполняли в REFMAC5 (Murshudov et al. (1997) Acta crystallographica 53, 240-255), а построение модели - в COOT (Emsley, P. and Cowtan, K. (2004) Acta crystallographica 60, 2126-2132).
Разрешение структур как комплекса 806 Fab-пептид, так и комплекса 175 Fab-пептид осуществляли посредством молекулярного замещения с использованием программы MOLREP, используя координаты структуры 806 Fab, уточнение и реконструкцию снова выполняли в REFMAC5, и COOT и валидацию конечных структур осуществляли с помощью PROCHECK (Laskowski et al. (1993) J. Appl. Cryst. 26, 283-291) и WHATCHECK (Hooft et al. (1996) Nature 381, 272).
Исследования с помощью ЯМР
Для исследований с помощью ЯМР меченный15N пептид был получен рекомбинатно в виде слияния с SH2-доменом SHP2, используя способ, ранее описанный Fairlie и др. (Fairlie et al. (2002) Protein expression and purification 26, 171-178), за исключением того, что E. coli выращивали а минимальной среде Neidhardt, дополненной15NH4Cl (Neidhardt et al. (1974) Journal of bacteriology 119, 736-747). Пептид отщепляли от партера по связыванию, используя CNBr, очищали с помощью HPLC с обращенной фазой, и его идентичность подтверждали с помощью MALDI-TOF масс-спектрометрии и N-концевого секвенирования. Остаток метионина в связывающейся с антителом 806 последовательности подвергали мутации с заменой на лейцин, чтобы создать возможность отщепления от партнера по связыванию, но не внутри самого пептида.
Используемые для исследований с помощью ЯМР образцы готовили в водном растворе, содержащем 5%2H2O, 70 мМ NaCl и 50 мМ NaPO4 при pH 6,8. Все спектры были получены при 298K в спектрометре Bruker Avance500, используя криозонд. Последующие отнесения к пептиду в отсутствие Fab мАт806 осуществляли, используя стандартные 2D TOCSY и NOES спектры, а также скорректированные с учетом15N TOCSY and NOESY спектры. Взаимодействие между пептидом и Fab806 исследовали посредством отслеживания15N HSQC спектров пептида в отсутствие и в присутствии Fab806. Отклонение15N HSQC спектров пептида в присутствии Fab806 служит явным признаком того, что пептид был способен к связыванию с Fab806 в условиях раствора. Детальная структура пептида в форме комплекса не определена. Отклонения от значений химического сдвига в случайной спирали для мАт806-пептида представлены на фиг. 93.
Биораспределение chAb806 у пациентов
Для демонстрации специфичности для опухолей мАт806 in vivo химерный вариант (ch806) был сконструирован и продуцирован в условиях использования cGMP (Panousis et al. (2005) Br. J. Cancer. 92, 1069-1077). Проводимое впервые на людях испытание фазы I было предпринято для определения безопасности, биораспределения и иммунного ответа на ch806 у пациентов с положительными по реактивности с 806 опухолями, и результаты определения безопасности, биораспределения и фармакокинетики сообщались ранее (Scott et al. (2007) Proc. Natl. Acad. Sci. U.S.A. 104, 4071-4076). Для определения специфичности ch806 для опухоли по сравнению с нормальной тканью (например, печенью) у пациентов был выполнен количественный анализ абсорбции ch806 опухолью и печенью посредством расчета % инъецированной дозы (ID)111In-ch806 на основе снимков всего тела, полученных в гамма-камере в течение одной недели после инъекции 5-7 мКи (200-280 МБк)111In-ch806. Дозиметрические подсчеты в печени и опухоли осуществляли на основе представляющих интерес областей у каждого отдельного пациента. Набор данных в виде снимков после инфузии111In-ch806, скорректированный на фон и ослабление, позволил рассчитать кумулятивную активность. Дозиметрический подсчет был выполнен для выведения концентрации111In-ch806 в опухоли и печени в течение однонедельного периода после инъекции.
b. Секвенирование
Были секвенированы вариабельная область тяжелой цепи (VH) и вариабельная область легкой цепи (VL) мАт175, и в них идентифицированы определяющие комплементарность участки (CDR), как указано ниже:
VH-область мАт175: последовательность нуклеиновой кислоты (SEQ ID NO: 128) и аминокислотная последовательность (SEQ ID NO: 129) представлены на фиг. 74A и 74B, соответственно. Определяющие комплементарность участки CDR1, CDR2 и CDR3 (SEQ ID NO: 130, 131 и 132, соответственно) показаны подчеркиванием на фиг. 74B.
VL-область мАт175: последовательность нуклеиновой кислоты (SEQ ID NO: 133) и аминокислотная последовательность (SEQ ID NO: 134) представлены на фиг. 75A и 75B, соответственно. Определяющие комплементарность участки CDR1, CDR2 и CDR3 (SEQ ID NO: 135, 136 и 137, соответственно) показаны подчеркиванием на фиг. 75В.
Данные, касающиеся последовательности мАт175, основаны как на данных определения последовательности, так и на данных определения кристаллической структуры, поскольку линия клеток не является клональной, и поэтому множество последовательностей было получено из этой линии клеток. Последовательности мАт175, представленные выше, были подтверждены кристаллической структурой и отличаются одной аминокислотой в каждом из CDR1 и CDR2 VL-области от прежних последовательностей, основанных лишь на данных, касающихся стандартных последовательностей. Был также получен отличный изотип мАт175 (необычный изотип IgG2a), на основе окончательных данных, касающихся последовательностей и кристаллической структуры.
Специфичность мАт175
Предварительные исследования связывания дали возможность предположить, что мАт175 проявляет специфичность в отношении EGFR, схожую с таковой мАт806. Аминокислотные последовательности CDR-участков мАт806 (IgG2b) и мАт175 (IgG2a) являются почти идентичными, с отличием лишь в одной аминокислоте в каждом из трех CDR (фиг. 65; см. пример 26, ниже). При всех трех отличиях сохраняется заряд и размер боковых цепей. Очевидно, что эти антитела возникли независимо.
c. Эксперименты
Ряд экспериментов с использованием иммуногистохимического анализа был проведен для анализа специфичности связывания мАт175. мАт175 окрашивает срезы ксенотрансплантатов A431, которые сверхэкспрессируют EGFR (фиг. 66A) и срезы ксенотрансплантатов глиомных клеток U87MG.Δ2-7, которые экспрессируют Δ2-7EGFR (фиг. 66A). В отличие от этого мАт175 не окрашивает срезы ксенотрансплантатов U87MG. Линия клеток U87MG экспрессирует лишь на средних уровнях EGFR дикого типа (фиг. 66A) и не имеет обнаруживаемой аутокринной петли, в которую вовлечен EGFR. Самое важное, что мАт175 не связывается со срезами нормальной печени человека (фиг. 66B). Таким образом, мАт175, как представляется, демонстрирует такую же специфичность, как и мАт806, т.е. оно обнаруживает сверхэкспрессированный и усеченный EGFR человека, но не EGFR дикого типа, экспрессируемый на средних уровнях.
Идентификация эпитопа для мАт175
Поскольку мАт175 также связывается с Δ2-7EGFR, из которого делетированы аминокислоты 6-273, и EGFR1-501, эпитоп для мАт175 должен содержаться в пределах остатков 274-501. При определении эпитопа для мАт806 авторы настоящего изобретения экспрессировали ряд меченных c-myc фрагментов EGFR, слитых с карбоксильным концом GH (гормона роста), заканчивающихся во всех случаях аминокислотой 501 (Chao et al. (2004) J. Mol. Biol. 342, 539-550; Johns et al. (2004) J. Biol. Chem. 279, 30375-30384).
мАт175 также реагировало с обоими фрагментами 274-501 и 282-501 EGFR при Вестерн-блоттинге, но не выявляло фрагменты, начинающиеся с аминокислоты 290 или 298 (фиг. 73). Присутствие всех слитых белков GH-EGFR подтверждали, используя антитело против c-myc, 9EI0 (фиг. 73). Следовательно, важный определитель эпитопа для мАт175 располагается около аминокислоты 290. Наконец, фрагмент 274-501 EGF с делецией эпитопа для мАт806 (Δ287-302) был также отрицательным в отношении связывания с мАт175 (фиг. 73), давая возможность предположить, что эта область точно также определяла, главным образом, связывание с мАт175.
Для дальнейшей характеристики эпитопа для мАт175 был использован второй подход. Фрагменты, охватывающие экстраклеточные домены EGFR, были экспрессированы на поверхности дрожжей и проверены на связывание с мАт175 с использованием прямой иммунофлуоресценции, используя проточную цитометрию. мАт175 распознавало дрожжевой фрагмент 273-621, которыйсоответствует экстраклеточному домену Δ2-7 EGFR, но не фрагменты 1-176, 1-294, 294-543 или 475-621 (фиг. 67A и фиг. 67B). Таким образом, по меньшей мере часть эпитопа для мАт175 должна содержаться внутри области между аминокислотами 274-294, что находится в соответствии с данными иммуноблоттинга при использовании фрагментов EGFR. Поскольку мАт175 связывается с денатурированным фрагментом 273-621 (фиг. 67C), эпитоп должен быть линейным по природе (фиг. 73). Очевидно, что мАт806 и мАт175 распознают схожую область и конформацию EGFR.
Используя поверхностный плазмонный резонанс (BIAcore) исследовали связывание мАт175 с пептидом EGFR (287CGADSYEMEEDGVRKC302; SEQ ID NO: 138)). EGFR287-302 был иммобилизован на поверхности биосенсора, используя химию сочетания с аминами, тиол-дисульфидного обмена или сочетания Pms-Ser. В последнем способе иммобилизация пептида происходит исключительно через N-концевой цистеин (Wade et al. (2006) Anal. Biochem. 348, 315-317).
мАт175 связывалось с EGFR287-302 во всех ориентациях (таблица 6). Аффиннность мАт175 к EGFR287-302 колебалась от 35 нМ в случае сочетания Pms-серин до 154 нМ в случае сочетания с аминами. Во всех случаях аффинность связывания мАт175 с EGFR287-302 была ниже таковой, установленной для мАт806 (таблица 6). Авторы настоящего изобретения также определили аффинность мАт175 к двум отличным экстраклеточным фрагментам EGFR. мАт175 связывалось с фрагментом 1-501 с аффинностью, схожей с таковой, установленной при использовании пептида (16 нМ в сравнении с 35 нМ) (таблица 6). Как и ожидалось, аффинность мАт175 к 1-621 полноразмерному экстраклеточному домену, который может образовывать аутоингибированную конформацию, была намного ниже (188 нМ). Хотя мАт806 и мАт175 имеют схожие аффинности к EGFR287-302, мАт175, как представляется, проявляет большую аффинность к экстраклеточному домену EGFR (таблица 6). Очевидно, что эпитоп для мАт175 содержится в EGFR287-302, и, подобно мАт806, аффинность связывания с экстраклеточным доменом EGFR зависит от конформации.
Для определения ультраструктуры эпитопа для мАт175 был использован набор мутантов фрагмента 273-621 EGFR, экспрессированных на поверхности дрожжей (Chao et al. (2004) J. Mol. Biol. 342, 539-550; Johns et al. (2004) J. Biol. Chem. 279, 30375-30384). мАт175 и мАт806 продемонстрировали почти идентичную картину реактивности с мутантами (таблица 7). Разрушение дисульфидной связи 287-302 оказывало лишь умеренный эффект на реактивность эпитопа, поскольку антитело связывалось со всеми мутантами в C287 и с некоторыми, но не всеми, мутантами в C302 (таблица 7). Важные для связывания с мАт175 аминокислоты включают E293, G298, V299, R300 и C302 (таблица 7). мАт175 представлялось относительно более чувствительным к мутациям V299 и D297, но мАт806 также продемонстрировало уменьшенное связывание с некоторыми мутациями в этих сайтах (таблица 7). И опять, эпитопом для мАт175, как представляется, является по существу тот же эпитоп, что и эпитоп, распознаваемый мАт806.

Эффективность мАт175 против опухолевых ксенотрансплантатов, стимулированных Δ2-7EGFR или аутокринной петлей, в которую вовлечен EGFR
Была исследована in vivo противоопухолевая активность мАт806 и мАт175 против ксенотрансплантатов глиомных клеток U87MG.Δ2-7. Ксенотрансплантатам позволяли укорениться в течение 6 дней до начала лечения антителами (3 раза в неделю в течение 2 недель в указанные дни). В это время средний объем опухолей составлял 100 мм3 (фиг. 68A). Лечение мАт175 приводило к уменьшению скорости общего роста опухолей по сравнению с лечением носителем или мАт806 и было в высокой степени значимым в день 19 после инокуляции (P<0,0001 в сравнении с контролем и P<0,002 в сравнении с мАт806), когда контрольную группу умерщвляли по этическим причинам. Средний объем опухолей в этот момент времени составлял 1530, 300 и 100 мм3 для групп, подвергнутых лечению носителем, мАт806 и мАт175, соответственно (фиг. 68A), что подтверждает противоопухолевую активность мАт175 против ксенотрансплантатов, экспрессирующих Δ2-7EGFR.
Но хотя клетки U87MG экспрессируют приблизительно 1×105 EGFR на клетку, мАт806 не способно распознавать какой-либо поверхностный EGFR и, неудивительно, не ингибирует in vivo рост U87MG. Кроме того, эти клетки не коэкспрессируют какой-либо лиганд EGFR. Было проведено исследование в отношении того, экспонируется ли транзиторно эпитоп EGFR, а, следовательно, может ли он распознаваться мАт806 и мАт175 в клетках, имеющих аутокринную петлю, в которую вовлечен EGFR. Клетки предстательной железы DU145 экспрессируют EGFR дикого типа на уровнях, схожих с таковыми, установленными в клетках U87MG, однако в отличие от клеток U87MG клетки DU145 имеют амплификацию гена TGF-α и поэтому демонстрируют аутокринную петлю, в которую вовлечен EGFR/TGF-α. Как мАт175, так и 806 связываются с клетками DU145, как определено с помощью анализа с использованием FACS (фиг. 68B), и оба антитела способны иммунопреципитировать небольшую часть EGFR, экстрагированного из этих клеток (фиг. 68C). Оба метода показали большее связывание мАт175, однако, по сравнению с мАт528, которое связывается с L2-доменом, мАт175 и мАт806 связывают лишь подмножество EGFR на поверхности этих клеток (фиг. 68B и фиг. 68C). Схожие данные наблюдений были получены со второй линией клеток предстательной железы (LnCap); (не представленные данные) или с линий клеток ободочной кишки (LIM1215), обе их которых также имеют аутокринные петли, в которые вовлечен EGFR (Sizeland, A.M. and Burgess, A.W. (1992) Mol. Cell Biol. 3, 1235-1243; Sizeland, A.M. and Burgess, A.W. (1991) Mol. Cell Biol. 11, 4005-4014). Очевидно, что мАт806 и мАт175 могут распознавать лишь небольшую часть EGFR на клетках при наличии аутокринной петли стимуляции.
Поскольку мАт175 и мАт806 связываются эффективнее с EGFR, экспрессированным в клетках DU145, чем в клетках U87MG, было проведено исследование для анализа противоопухолевой активности этих антител в ксенотрансплантатах DU145, развитие которых происходит в бестимусных мышах. Ксенотрансплантатам позволяли укорениться в течение 18 дней до начала лечения (3 раза в неделю в течение 3 недель в указанные дни). В это время средний объем опухолей составлял 90 мм3 (фиг. 68D). Как мАт175, так и мАт806 ингибировали рост ксенотрансплантатов DU145. Контрольную группу умерщвляли в день 67, и она имела средний объем опухолей, составляющий 1145 мм3 по сравнению с 605 и 815 мм3 для групп, подвергнутых лечению мАт806 и мАт175, соответственно (p<0,007 и 0,02, соответственно) (фиг. 68D).
Пространственная структура EGFR287-302 при контакте с Fab-фрагментами мАт806 и мАт175
Для понимания молекулярных тонкостей того, каким образом мАт806 и мАт175 могло распознавать EGFR в некоторых, но не во всех конформациях, были определены кристаллические структуры Fab-фрагментов обоих антител в комплексе с оксидированным эпитопом EGFR287-302 (при разрешении 2,0 и 1,59 Å, соответственно, фиг. 69A и 69B) и самих по себе (при разрешении 2,3 Å и 2,8 Å, соответственно). В обоих случаях структуры Fab в свободной форме и в комплексе были по существу одинаковыми, и хорошо определялись конформации пептида и петлевых участков CDR антител (фиг. 69). Эпитоп принимает β-складчатую структуру, при этом одна грань складчатого листа направлена на Fab, и V299 залегает в центре антигенсвязывающего сайта (фиг. 69C-E). Оба конца эпитопа подвергаются воздействию растворителя, что находится в соответствии с тем, что эти антитела связывают более длинные полипептиды.
Из 20 остатков антител, находящихся в контакте с эпитопом, между мАт806 и мАт175 существуют лишь две замены (фиг. 65). Находящимися в контакте с эпитопом остатками мАт175 являются S30, S31, N32, Y49, H50, Y91, F94, W96 легкой цепи и D32, Y33, A34, Y51, S53, Y54, S55, N57, R59, A99, G100, R101 тяжелой цепи; находящимися в контакте с эпитопом остатками мАт806 являются те же остатки за исключением одного различия в последовательности легкой цепи, N30, и одного различия в последовательности тяжелой цепи, F33. EGFR287-302 связывается с Fab благодаря тесным контактам между остатками пептида 293-302, при этом большая часть контактов - между остатками 297 и 302. Единственные водородные связи между атомами основной цепи EGFR287-302 и Fab обеспечиваются остатками 300 и 302 (фиг. 69F). Распознавание последовательности эпитопа происходит через образование водородных связей между остатком E293 и боковыми цепями (H50 и R101 Fab), между D297 и боковыми цепями (Y51 и N57), R300 и боковыми цепями (D32) и K301 и боковыми цепями (Y51 и W96 через посредство молекул воды). Гидрофобные контакты осуществляются в G298, V299 и C302.
В кристаллах Fab806 и Fab175 конформации остова эпитопа между 293 и 302 были по существу идентичными (стандартное отклонение = 0,4 Å, для атомов Cα в этих остатках). Хотя и скованный дисульфидной связью, N-конец пептида (287-292) не контактирует в значительной степени ни с той, ни с другой структурой антитела, и конформации в этом районе отличаются. Однако этот сегмент в комплексе с Fab806 представляется довольно разупорядоченным. Более интересно, что конформация пептида EGFR287-302 в контакте с антителами является весьма близкородственной конформации EGFR287-302, наблюдаемой в остове аутоингибированных или неаутоингибированных структур EGFR (Li et al., 2005; Garrett et al., 2002). В случае EGFR287-302 из комплекса с Fab175 стандартные отклонения в положениях Cα равняются 0,66 и 0,75 Å, соответственно (фиг. 69).
Для получения дальнейших сведений о распознавании EGFR антителами мАт806 и мАт175 конформацию15N-меченного, оксидированного пептида EGFR287-302, свободного и в присутствии 806 Fab, изучали с помощью ЯМР спектроскопии в растворе (см. ʺМатериалы и методыʺ). В случае свободного пептида резонансы определяли и сравнивали с таковыми для случайной спирали. По существу свободный пептид принимал структуру случайной спирали, а не бета-складчатого листа, наблюдаемую в природном EGFR (Garrett et al. (2002) Cell 20; 110, 763-773).
После добавления Fab наблюдали сдвиг резонансных частот. Однако вследствие слабого сигнала, являющегося результатом значительного линейного расширения после добавления Fab и успешной кристаллизации комплексов, изучение структуры комплекса Fab806-эпитоп в растворе не было продолжено в дальнейшем. Несмотря на это, ясно, что в случае связывания пептида с Fab-фрагментом мАт806 (или мАт175) Fab, как представляется, выбирает или индуцирует конформацию пептида, которая соответствует конформации пептида в природном рецепторе.
Для исследования, почему мАт806 и мАт175 распознают лишь некоторые конформации EGFR, Fab-фрагмент мАт175 был состыкован с экстраклеточным доменом EGFR (аутоингибированными и неаутоингибированными мономерами) посредством наложения EGFR287-302. В случае Δ2-7-подобного фрагмента не было значительных стерических конфликтов с рецептором. В случае неаутоингибированной формы значительно большая площадь открытой поверхности Fab подвергалась закрытию (920 Å2 по сравнению с 550 Å2 в аутоингибированной форме). Следовательно, этот антиген может дополнительно контактировать с не являющимися CDR участками антитела, на что указывают экпрессируемые в дрожжах мутанты (Chao et al. (2004) J. Mol. Biol. 342, 539-550). Напротив, при состыковке целого эктодомена EGFR с Fab наблюдается значительное пространственное перекрытие с частью домена CR1 перед эпитопом (остатками 187-286) и с проходом через центр Fab (фиг. 69D и 69E). Следовательно, поскольку домен CR1 имеет по существу одинаковую структуру в аутоингибированных или неаутоингибированных конформациях, мАт806 или мАт175 будет не способно к связыванию с любой формой EGFR. Очевидно, что должно быть различие между ориентацией эпитопа относительно домена CR1 в любой известной конформации EGFR дикого типа и ориентацией, делающей возможной связывание эпитопа. Обследование домена CR1 показало, что дисульфидная связь (271-283) перед EGFR287-302сковывает полипептид, что блокирует доступ к эпитопу; можно было бы ожидать, что разрушение этой дисульфной связи, хотя она и не вовлечена в непосредственное связывание с антителами, сделает возможным частичное развертывание домена CR1, вследствие чего мАт175 или мАт806 могли бы получить доступ к эпитопу.
Разрушение дисульфидной связи 271-283 EGFR увеличивает связывание с мАт806
Дисульфидные связи в белках обеспечивают повышенную структурную жесткость, но в случае некоторых рецепторов на клеточной поверхности, в частности, рецепторов для цитокинов и факторов роста, кратковременное разрушение дисульфидных связей и дисульфидный обмен могут контролировать функцию рецепторов (Hogg, P.J. (2003) Trends in biochemical sciences 28, 210-214). Поскольку это один из механизмов, с помощью которого мАт806 и мАт175 могли получить доступ к их сайту связывания, была предпринята попытка увеличить доступность эпитопа посредством мутирования одного из двух или обоих остатков цистеина в положениях 271 и 283 на остатки аланина (C271A/C283A). Векторы, способные к экспрессии полноразмерного мутанта C271A-, C283A- или C271A/C283A-EGFR, трансфицировали в IL-3-зависимую линию клеток Ba/F3. Были отобраны стабильные клоны Ba/F3, которые экспрессировали мутант C271A- и C271A/C283A-EGFR на уровнях, равных таковым для EGFR дикого типа (фиг. 70A). Клетки Ba/F3, экспрессирующие на высоких уровнях мутант C283A-EGFR, не были обнаружены. Как ранее описывалось, EGFR дикого типа слабо реагирует с мАт806; однако мутантные рецепторы реагировали в равной степени сильно с мАт528, мАт806 и антителом против FLAG, что говорит о том, что рецептор представлен на клеточной поверхности, правильно свернут, и что эпитоп для мАт806 является полностью доступным в таких случаях. Для подтверждения того, что мАт806 распознает эффективнее мутант C271A/C283A, чем EGFR дикого типа, определяли отношение связывания мАт806 к связыванию мАт528. Поскольку и EGFR дикого типа, и C271A/C283A EGFR были помечены на N-концах FLAG, можно было легко определить отношение связываний мАт806/мАт528 с использованием антитела M2. Как сообщалось ранее, мАт806 распознавал лишь небольшую часть всех EGFR дикого типа, представленных на поверхности клеток Ba/F3 (отношение связываний мАТ806/528 составляет 0,08) (таблица 8). В отличие от этого, мАт806 распознавало фактически все мутантные C271A/C283A EGFR, представленные на клеточной поверхности (отношение связываний мАт806/528-1,01) (фиг. 70A и таблица 8).
Мутация двух цистеинов не вносила помехи в связывание EGF или функцию рецептора. Клетки BaF3, экспрессирующие мутант C271A/C283A EGFR, пролиферируются в присутствии EGF (фиг. 70B). Наблюдали сдвиг влево кривой зависимости ответной реакции от дозы EGF в клетках, экспрессирующих мутации C271A/C283A, с воспроизводимым результатом, что говорит либо о более высокой аффинности к лиганду, либо об увеличенной способности мутантного рецептора к передаче сигнала. Анализ с помощью Вестерн-блоттинга подтвердил, что мутант C271A/C283A экспрессируется на уровнях, схожих с таковыми для EGFR дикого типа, и подвергается фосфорилированию по тирозину в ответ на стимуляцию EGF (фиг. 70C). В соответствии с предшествующими исследованиями на других линиях клеток мАт806 не оказывает эффект на in vitro EGF-индуцируемую пролиферацию клеток Ba/F3, экспрессирующих EGFR дикого типа, тогда как блокирование лиганда с помощью мАт528 полностью ингибирует EGF-индуцируемую пролиферацию этих клеток (FIG.70D, левая панель). Напротив, мАт806 полностью ингибирует EGF-индуцируемую пролиферацию клеток BaF3, экспрессирующих мутант C271A/C283A (фиг. 70D, правая панель). В случае разрушения цистеиновой петли 271-283 мАт806 не только связывается более эффективно, но, связавшись, оно предотвращает индуцируемую лигандом пролиферацию.
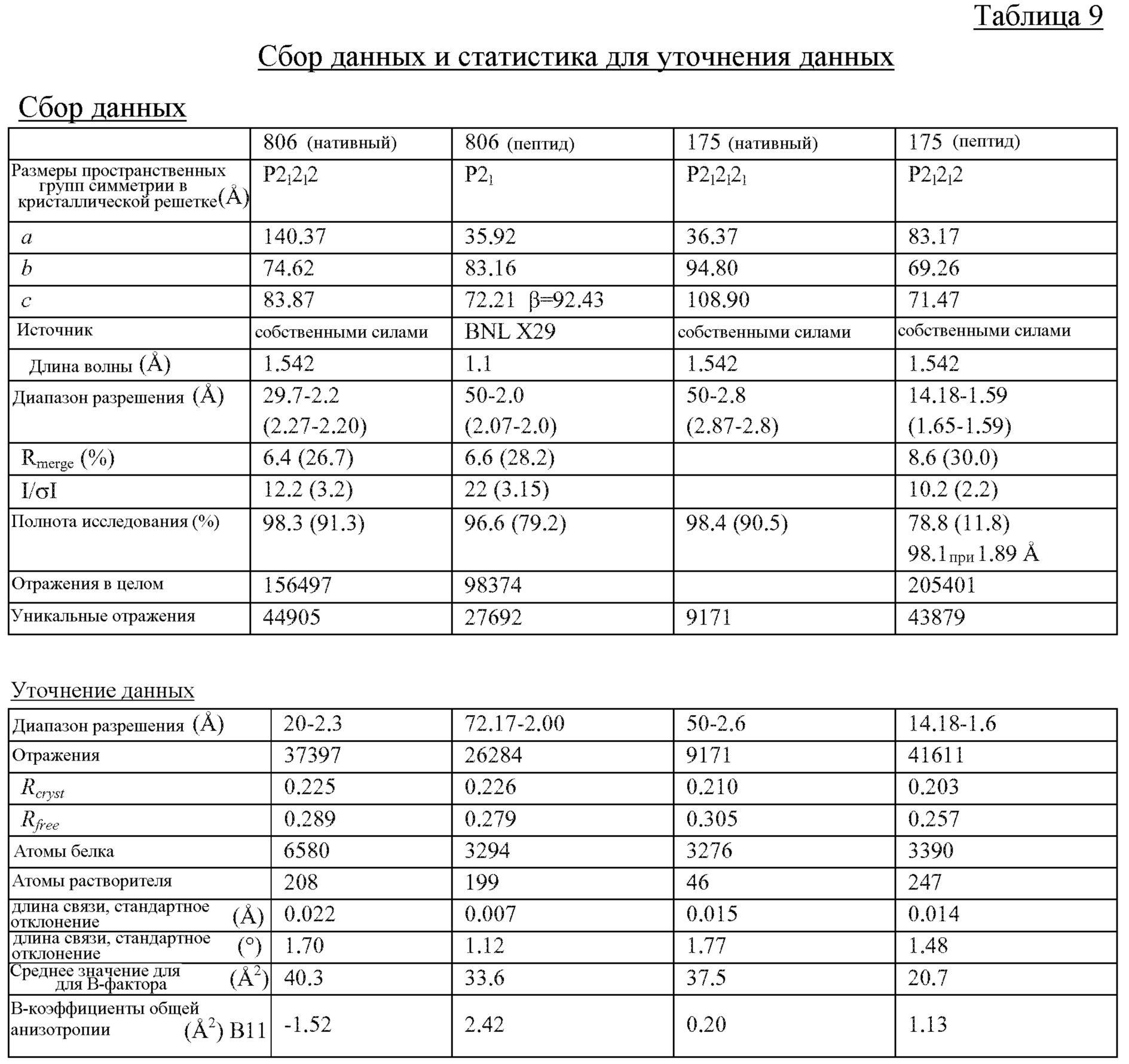
Обсуждение
Структурные исследования эпитопа EGFR287-302 показывают, что как мАт806, так и мАт175 распознавали один и тот же пространственный мотив в структурах EGFR дикого типа, что указывает на то, что эта основная конформация также встречается в Δ2-7EGFR и экпонирована в нем. Немаловажно, однако, что ориентация эпитопа в этих структурах будет предотвращать доступ антител к релевантным аминокислотам. Это согласуется с экспериментальными данными наблюдений, что мАт806 не связывается с EGFR дикого типа, представленным на клеточной поверхности на физиологических уровнях.
Результаты с мутантом EGFRC271A/C283A указывают на то, что домен CR1 может открыть возможность связывания мАт806 и мАт175 стехиометрически с этим мутантным рецептором. Этот мутантный рецептор все еще может принимать природную конформацию, поскольку он являются совершенно чувствительным к стимуляции EGF, но, в отличие от EGFR дикого типа, полностью ингибируется мАт806. Данные ясно показывают, что если бы неправильно свернутая форма EGFR с этой разрушенной дисульфидной связью была представлена на поверхности раковых клеток, она была бы способна к инициации передачи сигнала в клетке и должна была бы ингибироваться либо мАт806, либо мАт175.
Другим объяснением этих данных является то, что во время активации лигандом структурная перестройка рецептора могла индуцировать локальное развертывание около эпитопа, что создавало бы возможность для принятия рецептором конформации, допускающей связывание. В кристаллических структурах эпитоп расположен вблизи физического центра эктодомена EGFR, и доступ к эпитопу блокирован как свернутым доменом CR1, так и четвертичной структурой эктодомена EGFR. В аутоингибированных и неаутоингибированных конформациях неизменность домена CR1 поддерживается дополнительными взаимодействиями либо с L1:лиганд:L2 доменами (в случае неаутоингибированной конформации), либо с L2:CR2 доменами (в случае аутоингибированной конформации). Однако область эпитопа имеет некоторые из самых высоких термических показателей, установленных в эктодомене: эпитоп для мАт806/175 является структурно лабильным. Во время активации рецептора, когда рецептор подвергается переходу от аутоингибированной к неаутоингибированной конформации, мАт806 и мАт175 могут иметь доступ к эпитопу. Таким образом, на молекулярном уровне эти механизмы могли бы вносить вклад в пренебрежимо малое связывание мАт806 и мАт175 с нормальными клетками и существенно более высокие уровни связывания с опухолевыми клетками, которые имеют сверхэкспрессированный и/или активированный EGFR.
Пример 24
Моноклональные антитела 124 и 1133
Как обсуждалось в примере 1 выше, мАт124 и мАт1133 были созданы в то же время, что и мАт806, и, как установлено, проявляют схожие свойства, в частности, от специфичности в отношении сверхэкспрессированного EGFR дикого типа до уникальных свойств мАт806, обсуждаемых здесь.
Первоначальные скрининги проводились в Нью-Йорке (Jungbluth et al. (2003) A Monoclonal Antibody Recognizing Human Cancers with Amplification/Over-Expression of the Human Epidermal Growth Factor Receptor PNAS. 100, 639-644). Были проведены оценки с использованием конкурентного ELISA и анализы Biacore для определения того, распознают ли мАт124 и/или мАт1133 эпитоп, идентичный эпитопу для мАт806, и альтернативную детерминанту EGFR.
Анализ с помощью FACS
Связывание антител с клетками U87MG.Δ2-7, A431 и HN5 определяли с помощью FACS. Все антитела продемонстрировали специфичность, схожую с таковой мАт806, с сильным связыванием с de2-7 EGFR и слабым связыванием со сверхэкспрессированным EGFR дикого типа.
Конкурентный ELISA
Был проведен ряд конкурентных ELISA для определения, конкурируют ли антитела 124 и 1133 с мАт806 за эпитоп. Вкратце, денатурированным растворимым доменом EGFR (sEGFR) покрывали планшеты для ELISA. Затем в поперечном направлении планшета в увеличивающихся концентрациях добавляли немеченые антитела 124 или 1133. После промывки в каждую лунку добавляли биотинилированное мАт806 для определения того, может ли оно все еще связываться с sEGFR. Обнаружение связанного мАт806 успешно выполняли с использованием конъюгированной со стрептавидином HRP. Если антитело связывается с тем же (или перекрывающимся) эпитопом, что и мАт806, то связывание мАт806 не ожидается.
Результаты суммированы в таблице 10. Наблюдали зависимый от концентрации ингибиторный эффект связывания мАт124 и мАт1133: связывание мАт806 увеличивалось по мере того, как уменьшалась концентрация немеченого антитела, что говорит о том, что антитела 124 и 1133 распознают эпитоп, идентичный таковому для мАт806, или эпитоп, находящийся вблизи от него.
Анализ с помощью FACS: конкуренция за связывание с клетками
Клетки U87MG.Δ2-7 предварительно инкубировали с немеченым антителом 124, 1133. В анализ были также включены положительный контроль 806 и совпадающее по изотипу контрольное антитело. Клетки отмывали, а затем окрашивали конъюгированным с Alexa488 мАт806, и уровень связывания 806 определяли с помощью FACS.
Результаты суммированы в таблице 11. Антитела 124 и 1133 блокировали связывание мАт806 с клеточной поверхностью, что указывает на распознавание эпитопа, идентичного таковому для мАт806, или эпитопа, находящегося вблизи от него.
Анализ BIAcore: связывание с пептидным эпитопом для мАт806
Аминокислотную последовательность EGFR287CGADSYEMEEDGVRKC302(SEQ ID NO: 14), содержащую эпитоп для мАт806, синтезировали в виде пептида и иммобилизовали на сенсорном чипе. Определяли связывание антител 124, 1133 и 806 (200 нМ) с этим пептидом. Полученные при максимальном связывании резонансные единицы (РЕ) суммированы в таблице 12. Антитела 124 и 1133 продемонстрировали явное связывание с пептидом, подтверждая распознавание пептидного эпитопа для 806.
Обсуждение
Как показано в этом примере, мАт124 и мАт1133 связываются с пептидом EGFR, распознаваемым мАт806, и блокируют связывание мАт806 с экстраклеточным доменом EGFR и клетками, экспрессирующими de2-7 EGFR. Таким образом, эти три антитела распознают одну и ту же детерминанту в EGFR.
Пример 25
Клиническое испытание ch806
Клиническое испытание предназначалось для исследования in vivo специфичности ch806 в анализе направленности на опухоль/анализе биораспределения/фармакокинетическом анализе на пациентах с разнообразными типами опухолей.
1. Материалы и методы
План испытания
Это впервые проводимое на людях испытание было открытым исследованием фазы I с использованием увеличения дозы. Главной целью была оценка безопасности однократной инфузии ch806 пациентам с запущенными опухолями, экспрессирующими антиген для 806. Вторичными целями исследования были определение биораспределения, фармакокинетики и абсорбции опухолью111In-ch806; определение у пациента иммунного ответа против ch806 и оценка предварительных данных, касающихся клинической активности ch806. Для этого исследования была выбрана однократная доза для оптимальной оценки in vivo специфичности ch806 в отношении EGFR, представленного на опухолевых клетках. Протокол был одобрен Комитетом по вопросам исследования на людях и этики Austin Hospital до начала исследования. Испытание проводилось по схеме исключений из клинического испытания (СТХ), разработанной Австралийским министерством по терапевтическим товарам. Все пациенты дали письменное информированное согласие.
Критерии отбора для вхождения в исследования включали запущенные или метастатические опухоли, положительные по экспрессии антигена для 806 на основе хромогенной in situ гибридизации или иммуногистохимического анализа заархивированных образцов опухолей (опухоли получали определение 806-положительные, если в результате иммуногистохимической оценки заархивированных образцов опухолей определялись любые клетки, положительные по экспрессии антигена для 806, см. ниже); гистологически или цитологически доказанный рак; заболевание, обнаруживаемое на изображении, полученном при КТ (компьютерной томографии), с по меньшей мере одним поражением ≥2 см; предполагаемое время жизни в течение по меньшей мере 3 месяцев; оценку по шкале функционирования Карновского (KPS) ≥70; отвечающую требованиям гематологическую характеристику, функцию печени и почек; возраст >18 лет и способность дать информированное согласие. Критерии исключения включали активные метастазирования в центральную нервную систему (помимо подвергнутых соответствующему лечению и стабильных); химиотерапию, иммунотерапию, биологическую терапию или радиотерапию в пределах четырех недель до вхождения в исследование; предшествующее подвергание воздействию антителами [кроме случаев, когда нет доказательства наличия человеческих антител против химерных антител (HACA)]; неспособность к полному восстановлению от эффектов предшествующей противораковой терапии; сопутствующее применение системных кортикостероидов или иммуносупрессантов; неконтролируемую инфекцию или другое серьезное заболевание; беременность или период грудного кормления; женщин с репродуктивным потенциалом, не использующих приемлемые в медицине средства контрацепции.
Пациенты получали однократную инфузию ch806, меченного ничтожным количеством индия-111 (111In, 200-280 МБк; 5-7 мКи), посредством внутривенной инфузии в физиологическом растворе/5% сывороточного альбумина человека в течение 60 минут. Запланированное увеличение дозы означает, что пациентов зачисляли в одну из четырех групп уровня дозы: 5, 10, 20 и 40 мг/м2. Эти дозы были выбраны, чтобы сделать возможной оценку специфичности ch806 в отношении EGFR, экспрессируемого в опухолях, и определение, связывается ли какой-либо компартмент нормальной ткани с ch806 (и оказывает ли влияние на фармакокинетику или биораспределение) in vivo. Биораспределение, фармакокинетику и иммунный ответ определяли у всех пациентов.
Получаемые в гамма-камере снимки всего тела для оценки биораспределения и абсорбции опухолью делали в день 0, день 1, день 2 или 3, день 4 или 5 и день 6 или 7 после инфузии111In-ch806. Образцы крови для фармакокинетических анализов получали в эти моменты времени и дополнительно в день 14 (±2 дня) и день 21 (±2 дня). Образцы крови для оценки уровней HACA получали на этапе включения и еженедельно до дня 30. Оценку токсичности осуществляли при каждом посещении для исследования. Физическое обследование и обычные определения гематологических и биохимических показателей выполняли еженедельно до конца исследования (день 30). Перевод на новую стадию осуществляли в день 30.
Критерии увеличения дозы
Первого пациента при каждом уровне дозы наблюдали в течение четырех недель до зачисления каких-либо дополнительных пациентов. Если ограничивающая дозу токсичность (DLT) не наблюдалась у любых первых 2 пациентов в пределах 4 недель от инфузии ch8063, то 4 пациента должны были зачисляться в группу следующего более высокого уровня дозы. Если у одного пациента в любой группе из 2 пациентов наблюдалась DLT в пределах 4 недель от введения первой дозы, дополнительных 4 пациентов (максимум 6) зачисляли в группу этого уровня дозы. Если у не более чем одного пациента из 6 при любом уровне дозы наблюдалась токсичность ≥ степени 3, последующие пациенты зачислялись в группу следующего уровня дозы.
DLT определяли как негематологическую токсичность степени 3 или гематологическую токсичность степени 4, определяемую с помощью разработанной NCI общей терминологии критериев побочных эффектов (CTCAE v3.0). Максимальную переносимую дозу (MTD) определяли как дозу ch806, ниже которой у 2 или более пациентов из 6 наблюдалась DLT.
Мечение ch806 радиоактивным изотопом
ch806 качества, отвечающего требованиям к клиническому применению, было продуцировано в Biological Production Facility of the Ludwig Institute for Cancer Research, Melbourne, Австралия. Антитело ch806 метили111In (MDS Nordion, Kanata, Канада) через посредство бифункционального хелата йонов металла CHX-Aʺ-DTPA в соответствии со способами, описанными ранее (Scott et al. (2000) Cancer Res 60, 3254-3261; Scott et al. (2001) J. Clin. Oncol. 19(19), 3976-3987).
Получаемые в гамма-камере снимки
Снимки всего тела для оценки биораспределения111In-ch806 получали для всех пациентов в день 0 после инфузии111In-ch806 и по меньшей мере 3 дополнительных раза вплоть до дня 7 после инфузии. Получаемые с помощью однофотонной эмиссионной компьютерной томографии (SPECT) снимки области тела с известной опухолью также получали по меньшей мере один раз во время этого периода. Все полученные в гамме-камере снимки были получены в гамме-камере с двойной головкой (Picker International, Cleveland, OH).
Фармакокинетика
Кровь для фармакокинетического анализа получали в день 0 перед инфузией111In-ch806; затем через 5 минут, 60 минут, 2 ч и 4 ч после инфузии111In-ch806, в день 1, день 2 или 3, день 4 или 5 и день 6 и 7. Кроме того, кровь для фармакокинетических анализов белка ch806 также получали в день 14 (±2 дня), день 21 (±2 дня) и день 30 (±2 дня).
Образцы сыворотки делили на две аликвоты и подчитывали в сцинтилляционном гамма-счетчике (Packard Instruments, Melbourne, Australia), вместе с соответствующими стандартами111In. Результаты, относящиеся к сыворотке, представляли как % инъецированной дозы на литр (% ID/л). Определение уровней белка ch806 в сыворотке пациента после каждой инфузии выполняли, используя признанный действительным протокол для иммунологического измерения белка ch806 в сыворотке человека40. Нижний предел количественного определения ch806 в образцах сывороток составлял 70 нг/мл. Все образцы исследовали в трех повторах и разводили в соотношении, составляющем по меньшей мере 1:2. Определенные уровни ch806 в сыворотке представляли как мкг/мл.
Фармакокинетические расчеты осуществляли на основе измерений111In-ch806 в сыворотке после инфузии и определенных с помощью ELISA уровней белка ch806 в сыворотках пациентов, используя программу аппроксимации кривой по точкам (WinNonlin Pro Node 5.0.1, Pharsight Co., Mountain View, CA). Были проведены оценки следующих параметров: T1/2α и T1/2β (полупериоды существования начальной и конечной фаз элиминации); V1, объем центрального компартмента; Cmax (максимальная концентрация в сыворотке); AUC (площадь под кривой зависимости концентрации в сыворотке от времени с экстраполяцией до бесконечности); и CL (общий сывороточный клиренс).
Выведение из организма и дозиметрический подсчет в опухоли и органах111In-ch806
Дозиметрические подсчеты во всем организме и нормальных органах (печени, легких, почке и селезенке) осуществляли на основе представляющих интерес областей в наборе данных в виде снимков после инфузии111In-ch806 каждого отдельного пациента, что позволяло осуществить расчет кумулятивной активности и анализ, используя OLINDA, окончательных дозиметрических результатов (Stabin et al. (2005) J. Nucl. Med. 46(6), 1023-1027). Представляющие интерес области также определяли для соответствующих опухолей в каждый момент времени в наборах данных в виде снимков после инфузии111In-ch806, с коррекцией на фон и ослабление, и дозиметрический подсчет был выполнен для выведения концентрации111In-ch806 в опухоли/г (Scott et al. (2005) Clin. Cancer Res. 11(13), 4810-4817). Ее превращали в мкг ch806/г опухолевой ткани на основе инъецированной дозы в мг белка ch806.
Анализы на наличие HACA
Образцы крови для оценки HACA отбирали до инфузии ch806, затем еженедельно до 30 дней после инфузии ch806. Образцы анализировали с помощью ELISA и с помощью технологии поверхностного плазмонного резонанса, используя прибор BIAcore2000, как описано ранее (Scott et al., 2005; Liu et al. (2003) Hybrid Hybridomics 22(4), 219-228; Ritter et al. (2001) Cancer Res. 61(18), 685-6859).
Иммуногистохимический способ
Фиксированную формалином залитую парафином опухолевую ткань от каждого испытуемого пациента подвергали иммуноокрашиванию следующим образом. Вкратце, срезы толщиной 4 мкм залитой парафином ткани монтировали на предметных стеклах SuperFrost® Plus (Menzel-Glaser, Германия), подвергали депарафинизации и регидратации до извлечения антигена в микроволновой печи в растворе для извлечения мишени, рН 6,0 (10 мин; Dako, Glostrup, Дания). Затем срезы обрабатывали 3% перекиси водорода в течение 10 мин для устранения эндогенной пероксидазы и инкубировали при комнатной температуре в течение 60 мин с мАт806 (4 мкг/мл) или с совпадающим по изотипу контрольным антителом (IgG2b; Chemicon, Temecula, CA) в соответствующей концентрации. Связывание антител обнаруживали с использованием набора PowerVision Kit (Immuno Vision Technologies, Brisbane, CA). Чтобы сделать возможной визуализацию иммуноокрашивания, срезы инкубировали с хромогеном 3-амино-9-этилкарбазолом (0,4%, Sigma Chemical Co. MO, США) в течение 10 мин и подвергали контрастному окрашиванию гематоксилином Майера. Отрицательные контроли для процедуры иммуноокрашивания были приготовлены посредством пропуска первого антитела. Результаты представляли как процент положительного окрашивания опухолевых клеток.
Способ хромогенной in situ гибридизации
Делали срезы фиксированной формалином залитой парафином опухолевой ткани от каждого испытуемого пациента и их монтировали на предметных стеклах SuperFrost® Plus, подвергали депарафинизации и регидратации до предварительной обработки набором Spotlight® Tissue Pre-treatment Kit (Zymed Laboratories Inc. South San Francisco, CA). Срезы затем покрывали зондом для ДНК EGFR Spotlight®, подвергали денатурации при 95ºC в течение 10 мин и инкубировали в течение ночи при 37ºC. После гибридизации предметные стекла промывали в 0,5×SSC. Выявление зонда осуществляли, используя набор для выявления полимеров Spotlight® CISHTM. Считали, что срезы, которые продемонстрировали кластеры сигналов или ≥5 отдельных сигналов в >25% раковых клеток, имеют амплификацию гена EGFR, которая коррелировала с реактивностью с мАт806.
2. Результаты
Пациенты
Восемь пациентов [1 женщина и 7 мужчин; средний возраст 61 год (диапазон 44-75)] прошли полное испытание (таблица 16). В таблице 13 также представлены первоначальные места опухолей, до лечения в прошлом, и места, пораженные заболеванием, в момент вхождения в исследование. Все 8 пациентов имели положительность по антигену для 806 в заархивированных опухолях (таблица 13).
Все пациенты удовлетворяли критериям отбора, за исключением пациента 8 (который имел первичную опухоль головного мозга), все страдали метастатическим заболеванием в момент вхождения в исследование. Пораженные заболеванием места, определенные как являющиеся мишенями очаги поражения, включали легкое (5 пациентов), головной мозг (1 пациент), лимфатические узлы (1 пациент), надъязычную область (1 пациент). Другие места метастатического заболевания (не являющиеся мишенями очаги поражения) включали массу над почкой, кость и лимфатические узлы (таблица 13). Медиана состояния функционирования по Карновскому составляла 90 (диапазон 80-100).

Побочные эффекты и HACA
Побочные эффекты, связанные с ch806, перечислены в таблицах 14 и 18. Связанные с инфузией побочные эффекты не наблюдались. Не было DLT, а, следовательно, MTD не была достигнута. Основными токсичностями, которые, по мнению исследователей, были, возможно, связанными с ch806, были преходящий зуд, небольшая тошнота, усталость/вялость и возможные эффекты на уровни ALP (щелочной фосфатазы) и GGT (гамма-глутамилтрансферазы) в сыворотке. Наблюдался подъем степени 2 по СТС (оценочной шкале общих критериев токсичности) уровня GGT у пациента 5, однако он был на фоне подъема степени 1 базовой линии и был преходящим по природе. Было зарегистрировано три серьезных побочных эффекта (SAE), но ни один из них не был связан с ch806. В общем, ch806 было безопасным и хорошо переносилось в случае всех уровней доз, при этом наблюдались обычно прогнозируемые и поддающиеся контролю незначительные токсичности. Дальнейшее увеличение дозы не осуществлялось из-за ограниченного количества cGMP ch806, имеющегося в распоряжении для этого испытания.
Положительный иммунный ответ против ch806 (в соответствии с методиками как ELISA, так и BIAcore) наблюдался лишь у одного из восьми пациентов (пациента 1).
Мечение ch806 радиоактивным изотопом
Во время испытания было осуществлено всего 8 инфузий111In-ch806. Средняя (± стандартное отклонение) радиохимическая чистота и иммунореактивность111In-ch806, как определено, составляла 99,3±0,1% и 77,4±7,0%, соответственно.
Биораспределение ch806
Первоначальная картина биораспределения111In-ch806 у пациентов при всех уровнях доз находилась в соответствии с активностью в пуле крови, которая постепенно гасилась по мере того, как шло время. В течение одной недели после инъекции абсорбция111In-ch806 печенью и селезенкой находилась в соответствии с обычным выведением метаболитов111In-хелата через ретикулоэндотелиальную систему. Специфическая локализация111In-ch806 наблюдалась в являющихся мишенями очагах поражения (≥2 см) всех пациентов при всех уровнях доз (фиг. 94), в том числе являющихся мишенями очагах поражения, находящихся в легких (у пациентов 1, 3, 4, 5 и 7), животе (у пациентов 1 и 2) и в надъязычной области с правой стороны шеи (у пациента 6). Выявлена также высокая степень абсорбции111In-ch806 опухолью головного мозга (у пациента 8) (фиг. 95). Важно, что абсорбция111In-ch806 опухолью не зависела от уровня экспрессии антигена для 806. Например, у пациента 4 выявлена высокая степень абсорбции являющимися мишенями очагами поражения, находящими в обоих легких, несмотря на составляющую <10% положительность в соответствии с IHC в отношении реактивности с 806 в заархивированной опухоли (фиг. 96). Эта степень абсорбции111In-ch806 являющимися мишенями очагами поражения у пациента 4 была сравнима с таковой, наблюдаемой у пациента 3, у которого 50-75% опухолевых клеток были положительными по окрашиванию на антиген для 806 при иммуногистохимическом анализе заархивированных образцов (фиг. 96).
Фармакокинетика
Фармакокинетические параметры у отдельных пациентов T1/2α и T1/2β, V1, Cmax, AUC и CL в случае однократной инфузии111In-ch806 представлены в таблице 16. Критерий суммы рангов Крускала-Уоллиса был применен к полупериодам существования альфа- и бета-фаз, V1 и клиренсу. Значимых различий между уровнями доз не наблюдали (P>0,05).
Фармакокинетическая кривая, соответствующая полученным с помощью ELISA данным для объединенной популяции, представлена на фиг. 97. Фармакокинетическими параметрами, представленными в виде среднего значения ± стандартное отклонение, были T1/2α 29,16±21,12 ч, T1/2β 172,40±90,85 ч, V1 2984,59±91,91 мл и CL 19,44±4,05 мл/ч. Данные, касающиеся определенных максимальных и минимальных концентраций ch806 в сыворотке (Cmaxи Cmin), представлены в таблице 17 для каждого пациента. Как и ожидалось, наблюдались линейные зависимости Cmaxи Cmin при каждом уровне доз. Значения в виде среднего значения ± стандартное отклонение, определенные для фармакокинетических параметров при использовании ELISA ch806, хорошо согласовались со значениями, полученными для фармакокинетических параметров при использовании111In-ch806 (таблица 16).


Дозиметрический подсчет111In-ch806
Выведение из организма было схожим у всех пациентов при всех уровнях доз, при этом биологический T1/2 (среднее значение ± стандартное отклонение) составлял 948,6±378,6 ч. Вследствие относительно короткого полупериода физического существования расчет полупериода биологического существования очень зависел от небольших изменений полупериода эффективного существования. Не было статистически значимого различия в выведении из организма между уровнями доз [критерий суммы рангов Крускала-Уоллиса: P-значение = 0,54] (фиг. 98).
Не выявлено различие в клиренсе111In-ch806 из нормальных органов (печени, легких, почек и селезенки) между уровнями доз, и среднее значение для эффективного T1/2, как рассчитано, составляло 78,3, 48,6, 69,7 и 66,2 ч, соответственно. Не было статистически значимого различия в клиренсе между этими нормальными органами. В частности, не выявлено различие в выведении печенью между уровнями доз (фиг. 98), что указывает на отсутствие насыщаемого ch806 компартмента антигена в печени.
Дозиметрический анализ опухолей был завершен в случае 6 пациентов. Пациенты 1 и 2 имели являющиеся мишенями очаги поражения близко от сердечного пула крови и сделали движение во время получения некоторых изображений, что помешало точному анализу. Определенная максимальная абсорбция111In-ch806 имела место спустя 5-7 дней после инфузии и колебалась от 5,2 до 13,7×10-3% инъецированной дозы/г опухолевой ткани.
Оценка клинической активности
По окончании периода времени этого исследования, составляющего один месяц, было установлено, что 5 пациентов имеют стабильное заболевание, а 3 пациента - прогрессирующее заболевание (таблица 13). Интересно, что в случае одного пациента (пациента 7, уровень дозы = 40 мг/м2) клинические данные говорили о временном сокращении пальпируемого под ушной раковиной лимфатического узла (который, как было доказано при аспирационной диагностической пункции, является метастатическим SCC) во время периода исследования, что наводит на мысль о возможной биологической активности ch806. Однако этот пациент имел подтвержденное с помощью RECIST (критерия оценки ответа при солидных опухолях) по окончании исследования прогрессирующее заболевание.
Дополнительные данные
Восемь пациентов [1 женщина и 7 мужчин; средний возраст 61 год (диапазон 44-75)] прошли полное испытание фазы I, как сообщалось (Scott et al. (2007) Proc. Natl. Acad. Sci. U.S.A. 104, 4071-4076). Все пациенты удовлетворяли критериям отбора, за исключением пациента 8 (который имел первичную опухоль головного мозга), все страдали метастатическим заболеванием при входе в исследование. Абсорбция Ат опухолью наблюдалась у всех пациентов, и111In-ch806, подвергнутый химеризации вариант мАт806, продемонстрировало быструю и на высоком уровне абсорбцию опухолью (фиг. 71). Не выявлено различие в клиренсе111In-ch806 из нормальных органов (печени, легких, почек и селезенки) между уровнями доз (Scott et al., 2007). В частности, не выявлено различие в выведении печенью между уровнями доз, что указывает на отсутствие насыщаемого ch806 компартмента антигена в печени. Общая абсорбция печенью имела максимальное значение 14,45±2,43% ID сразу же после инфузии и снизилась до 8,45±1,63% ID к 72 часам и до 3,18±0,87% ID не позднее одной недели после инфузии. Это явно противоположно абсорбции антител против EGFR дикого типа (например, антитела 225), которые, как было установлено, достигают более 30% ID в печени (в случае составляющей 40 мг дозы) в течение 3 дней после инфузии (Divgi et al. (1991) J. Natl. Cancer Inst. 83, 97-104). Определенная максимальная абсорбция печенью111In-ch806 имела место спустя 5-7 дней после инфузии. Количественный расчет абсорбции печенью у пациентов 1 и 3 нельзя было точно выполнить вследствие близости являющегося мишенью очага поражения к сердечному пулу крови и телодвижения пациента. Максимальная абсорбция ch806 опухолью колебалась от 5,21 до 13,73×10-3% ID/г опухолевой ткани. Расчет фактической концентрации ch806 в опухоли показал максимальные значения (среднее значение ± стандартное отклонение), составляющие 0,85±0 мкг/г (5 мг/м2), 0,92±0 мкг/г (10 мг/м2), 3,80±1,10 мкг/мл (20 мг/м2) и 7,05±1,40 мкг/г (40 мг/м2).
Обсуждение
Как изложено в этом примере, это исследование представляет впервые сообщаемую демонстрацию биораспределения и направленности на опухоль химерного антитела против эпитопа, представленного лишь в сверхэкспрессированной, мутантной или активированной лигандом формах EGFR. Ch806 продемонстрировало превосходную направленную доставку к местам опухолей у всех пациентов, при этом не выявлены данные об абсорбции нормальными тканями и значительная токсичность. Эти in vitro и in vivo характеристики ch806 выделяют его из всех других антител, направленных против EGFR.
В дозах вплоть до 40 мг/м2 ch806 хорошо переносилось, не выявлена DLT, и MTD не была достигнута. Основными токсичностями, которые были, возможно, связанными с ch806, были преходящий зуд, небольшая тошнота, усталость/вялость и возможные эффекты на уровни ALP и GGT в сыворотке. Запущенный характер рака у пациентов подразумевал, что их заболевания также могли быть факторами, вносящими вклад в эти побочные эффекты. Все побочные эффекты, которые, возможно, были связаны с исследуемым лекарственным средством, были легкими, многие из них самоограничивающимися, и ни один не требовал активного лечения. Важно, что ни у одного пациента не наблюдались кожная сыпь или расстройства желудочно-кишечного тракта, даже при самом высоком уровне дозы. Превосходная переносимость ch806 в этом исследовании с использованием однократной дозы оправдывает следующую стадию проверки в испытаниях с использованием многократных доз.
Анализ биораспределения ch806 у всех пациентов показал постепенное гашение активности в пуле крови и отсутствие несомненной абсорбции111In-ch806 нормальными тканями. У всех пациентов также налицо была отличная абсорбция ch806 опухолями, в том числе метастазами в легкие, лимфатические узлы и надпочечник, и мезотелиомой и глиомой. Это наблюдалось при всех уровнях доз, в том числе 5 мг/м2 (самой низкой из исследованных доз), которая составляет от одной десятой до одной двадцатой от дозы, необходимой для визуализации абсорбции опухолью других антител против EGFR дикого типа33. Это отличие в абсорбции ch806 по сравнению с антителами против EGFR дикого типа может быть связано с существенной абсорбцией их нормальными тканями (печенью и кожей) вследствие действия EGFR дикого типа в качестве места поглощения материала - антигена33. Помимо этого, локализация111In-ch806 была даже выше у пациентов с низкой экспрессией антигена для 806, определенной с помощью иммуногистохимического анализа заархивированных образцов опухолей (фиг. 96). Абсорбция111In-ch806 глиомой была особенно впечатляющей (фиг. 97) и сравнимой с таковой в любых опубликованных данных по направленной доставке антител к опухоли головного мозга после системной или даже местно-регионарной инфузии. Эти данные подтверждают уникальную селективность ch806 в отношении EGFR, экспрессируемого широким рядом опухолей, и подтверждают отсутствие абсорбции этого антитела нормальными тканями человека.
Фармакокинетические анализы показали, что ch806 характеризуется конечным периодом полувыведения, составляющим более недели, и нет зависимости от дозы выведения111In-ch806 из сыворотки. Также установлены линейные зависимости для AUC, Cmaxи Cmin, при этом при уровнях доз, превышающих 10 мг/м2, достигаются минимальные концентрации в сыворотке выше 1 мкг/мл. Значения V1, C1, T1/2α и T1/2β были единообразными между уровнями доз и находились в соответствии с типичными антителами человека изотипа IgG1 (Scott et al., 2005; Steffens et al. (1997) J. Clin. Oncol 15, 1529-1537; Scott et al. (2001) J. Clin. Oncol. 19(19), 3976-3987). Также установлено, что клиренс ch806 был ниже, когда расчеты ch806, определенного с помощью ELISA, были сравнены с измерениями111In-ch806. Хотя это различие может быть объяснено небольшим числом исследованных пациентов, более многочисленные моменты времени отбора образцов для ELISA ch806 могли бы поддержать это значение в качестве создающего лучшее представление о подлинном клиренсе ch806. Фармакокинетические значения для ch806 сравнимы с таковыми для других химерных антител, опубликованными на данное число (Steffens et al., 1997; Scott et al., 2001), и поддерживают схему введения доз ch806 на еженедельной основе.
Результаты количественных дозиметрического и фармакокинетического анализов указывают на отсутствие насыщаемого ch806 компартмента антигена в нормальных тканях при уровнях доз, оцененных в этом испытании. Важно, что данные об отсутствии зависимости от дозы фармакокинетики и выведения из организма и печенью явно противоположны данным всех опубликованных исследований антител против EGFR дикого типа (Baselga J. and Artega C.L. (2005) J. Clin. Oncol. 23, 2445-2449; Divgi et al. J. Natl. Cancer Inst. 83(2), 97-104; Baselga J (2001) Eur. J. Cancer 37 Suppl. 4, S16-22; Gibson et al. (2006) Clin. Colorectal Cancer 6(1), 29-31; Rowinsky et al. (2004) J. Clin. Oncol. 22, 3003-3015; Tan et al. (2006) Clin. Cancer Res. 12(21), 6517-6522), подтверждая специфичность в отношении опухолей и отсутствие связывания ch806 с нормальными тканями человека. Эти данные наблюдений обеспечивают неопровержимое доказательство способности ch806 (или гуманизированных форм) к селективному связыванию с мишенью - EGFR в опухоли, избеганию обычной токсичности других антител против EGFR и ингибиторов киназ (в частности, в отношении кожи) (Lacouture AE (2006) Nature Rev. Cancer 6, 803-812; Adams G.P. and Weiner L.M. (2005) Nat. Biotechnol. 23(9), 1147-1157) и, возможно, достижению большего терапевтического эффекта. Кроме того, данные этого испытания являются сильной поддержкой возможности доставки полезной нагрузки (вследствие быстрой интернализации мАт806 в опухолевые клетки), и комбинированного лечения с использованием других биологических агентов, таких как антитела против EGFR и ингибиторы тирозинкиназы, в случае которого токсичность при совместном введении, по-видимому, минимизируется. Это исследование обеспечивает явное доказательство способности к связыванию с мишенью - эпитопом в EGFR, который является специфичным для опухоли, и в настоящее время проводится дальнейшая клиническая разработка этого уникального подхода к раковой терапии.
Пример 26
Сравнение последовательностей
Здесь представляются и сравниваются CDR VH- и VL-областей каждого из мАт806, мАт175, мАт124, мАт1133 и hu806.


CDR, приведенные выше для соответствующих изотипов антител, основаны на анализе по Kabat. Как это будет очевидно квалифицированным в данной области техники специалистам, CDR можно также определить на основе других анализов, например, на основе объединения определений по Kabat и Chothia. Например, при применении комбинированного анализа по Kabat и Chothia к вышеприведенным изотипам последовательности CDR VL-области и CDR VH-области для соответствующих изотипов представлены в таблице 14.



Как показано выше, последовательности CDR изотипов мАт806, мАт175, мАт124 и мАт1133 являются идентичными за исключением высококонсервативных аминокислотных замен, которые, вероятно, порождают гомологичное свертывание белков для распознавания эпитопа. Эти данные, в совокупности с данными по связыванию и другими данными, предоставленными в примерах выше, показывают, что эти изотипы и hu806 являются вариантами - близкородственными членами семейства, проявляющими одинаковые уникальные свойства, обсуждавшиеся выше в отношении мАт806 (например, связывание с эпитопом в EGFR, который доступен для связывания лишь в сверхэкспрессированных, мутированных или активированных лигандом формах EGFR, что приводит к уникальной специфичности в отношении экспрессированного в опухолях EGFR, но не в отношении EGFR дикого типа в нормальной ткани), и показывают, что антитела с отличными последовательностями вариабельных областей, в частности, с варьирующими последовательностями CDR, имеют одинаковые свойства и способности к связыванию.
Список цитированной литературы























Это изобретение может быть воплощено в других формах или выполнено другими способами без отступа от его сущности или существенных характеристик. Поэтому описание настоящего изобретения должно считаться во всех аспектах иллюстративным, а не ограничивающим, при этом объем настоящего изобретения определяется прилагаемой формулой изобретения, и в него включены, как предполагается, все изменения, которые подпадают под значение и область эквивалентности.
Различные ссылки приводятся на всем протяжении описания настоящего изобретения и представлены в вышеприведенном списке цитированной литературы, каждая из которых включена сюда посредством ссылки в ее полном объеме.
Реферат
Настоящее изобретение относится к иммунологии. Предложен иммуноконъюгат, включающий рекомбинантное антитело IgG1 к эпидермальному фактору роста человека (hEGFR), ковалентно присоединенное к цитотоксическому средству. Также описана фармацевтическая композиция, содержащая указанный иммуноконъюгат, и способ лечения рака. Данное изобретение может найти применение в лечении различных видов рака, в том числе таких солидных опухолей, как глиома, эпителиальная опухоль, опухоль молочной железы, опухоль легких, опухоль предстательной железы, опухоль мочевого пузыря, опухоль головы, опухоль ободочной кишки, опухоль поджелудочной железы и опухоль шеи. 3 н. и 11 з.п. ф-лы, 98 ил., 20 табл., 26 пр.

Комментарии