Способ лечения опухоли у субъекта - RU2404193C2
Код документа: RU2404193C2
Чертежи










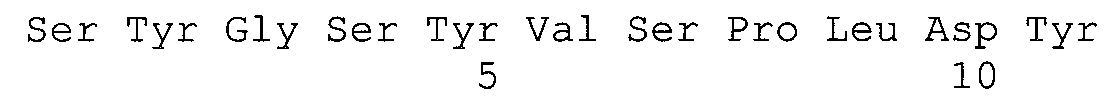













Описание
СВЯЗАННЫЕ ЗАЯВКИ
Данная заявка представляет собой предварительную заявку, поданную по 37 CFR 1,53(b)(1), по которой испрашивается приоритет согласно 35 USC 119(e) по предварительной заявке номер 60/665482, поданной 25 марта 2005 года, содержание которой включено в настоящее описание в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится, главным образом, к области молекулярной биологии и регуляции посредством факторов роста. Более конкретно, это изобретение относится к модуляторам каскада передачи сигнала HGF/c-met и к применению указанных модуляторов.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
HGF представляет собой плейотропный фактор мезенхимального происхождения с митогенной, мотогенной и морфогенной активностями в отношении ряда клеток различных типов. Посредником для эффектов HGF является определенная тирозинкиназа, c-met, и нарушенную экспрессию HGF и c-met часто наблюдают в различных опухолях. См., например, Maulik et al., Cytokine & Growth Factor Reviews (2002), 13:41-59; Danilkovitch-Miagkova & Zbar, J. Clin. Invest. (2002), 109(7):863-867. Регуляция каскада передачи сигнала HGF/c-Met вовлечена в прогрессирование и метастазирование опухоли. См., например, Trusolino & Comoglio, Nature Rev. (2002), 2:289-300).
HGF связывает внеклеточный домен тирозинкиназы рецептора Met (RTK) и регулирует различные биологические процессы, такие как распространение, пролиферация и выживание клеток. Передача сигнала HGF-Met является необходимой для нормального развития эмбриона, особенно при миграции мышечных клеток-предшественников и развитии печени и нервной системы (Bladt et al., Nature (1995), 376, 768-771.; Hamanoue et al., Faseb J (2000), 14, 399-406; Maina et al., Cell (1996), 87, 531-542; Schmidt et al., Nature (1995), 373, 699-702; Uehara et al., Nature (1995), 373, 702-705). Связанные с развитием фенотипы мышей с нокаутом Met и HGF являются очень сходными, что позволяет предположить, что HGF является лигандом, узнаваемым рецептором Met (Schmidt et al., 1995, выше; Uehara et al., 1995, выше). Также HGF-Met участвует в регенерации печени, ангиогенезе и заживлении ран (Bussolino et al., J Cell Biol (1992), 119, 629-641; Matsumoto and Nakamura, Exs (1993), 65, 225-249; Nusrat et al., J Clin Invest (1994) 93, 2056-2065). Предшественник рецептора Met подвергается протеолитическому расщеплению на внеклеточную α-субъединицу и трансмембранную β-субъединицу, связанные дисульфидными связями (Tempest et al., Br J Cancer (1988), 58, 3-7). β-субъединица содержит цитоплазматический киназный домен и обладает мультисубстратным участком для связывания на C-конце, с которым связываются адапторные белки и запускают передачу сигнала (Bardelli et al., Oncogene (1997), 15, 3103-3111; Nguyen et al., J Biol Chem (1997), 272, 20811-20819; Pelicci et al., Oncogene (1995), 10, 1631-1638; Ponzetto et al., Cell (1994), 77, 261-271; Weidner et al., Nature (1996), 384, 173-176). При связывании HGF, активация Met приводит к фосфорилированию тирозина и последующей передаче сигнала через опосредуемую Gabl и Grb2/Sos активацию PI3-киназы и Ras/MAPK соответственно, которая запускает двигательную активность и пролиферацию клетки (Furge et al., Oncogene (2000), 19, 5582-5589; Hartmann et al., J Biol Chem (1994), 269, 21936-21939; Ponzetto et al., J Biol Chem (1996), 271, 14119-14123; Royal and Park, J Biol Chem (1995), 270, 27780-27787).
Была показана трансформация Met в обработанной карциногеном клеточной линии остеосаркомы (Cooper et al., Nature (1984), 311, 29-33; Park et al., Cell (1986), 45, 895-904). Сверхэкспрессию или амплификацию гена Met наблюдали во множестве злокачественных опухолей. Например, при злокачественных опухолях ободочной и прямой кишки происходит по меньшей мере 5-кратная сверхэкспрессия Met, и описано, что в метастазах в печени происходит амплификация его гена (Di Renzo et al., Clin Cancer Res (1995), 1, 147-154; Liu et al., Oncogene (1992), 7, 181-185). Также описана сверхэкспрессия белка Met при плоскоклеточной карциноме полости рта, печеночно-клеточной карциноме, почечно-клеточном раке, карциноме молочной железы и карциноме легкого (Jin et al., Cancer (1997), 79, 749-760; Morello et al., J Cell Physiol (2001), 189, 285-290; Natali et al., Int J Cancer (1996), 69, 212-217; Olivero et al., Br J Cancer (1996), 74, 1862-1868; Suzuki et al., Br J Cancer (1996), 74, 1862-1868). Кроме того, сверхэкспрессию мРНК выявили при печеночно-клеточной карциноме, карциноме желудка и карциноме ободочной и прямой кишки (Boix et al., Hepatology (1994), 19, 88-91; Kuniyasu et al., Int J Cancer (1993), 55, 72-75; Liu et al., Oncogene (1992), 7, 181-185).
При папиллярной карциноме почки в киназном домене Met выявлен ряд мутаций, которые приводят к постоянной активации рецептора (Olivero et al., Int J Cancer (1999), 82, 640-643; Schmidt et al., Nat Genet (1997), 16, 68-73; Schmidt et al., Oncogene (1999), 18, 2343-2350). Эти активирующие мутации обеспечивают конститутивное фосфорилирование тирозина Met и приводят к активации MAPK, формированию очага и образованию опухоли (Jeffers et al., Proc Natl Acad Sci U S A (1997), 94, 11445-11450). Кроме того, эти мутации усиливают подвижность и инвазию клеток (Giordano et al., Faseb J (2000), 14, 399-406; Lorenzato et al., Cancer Res (2002), 62, 7025-7030). HGF-зависимая активация Met в трансформированных клетках опосредует повышенную подвижность, распространение и миграцию, что в итоге приводит к инвазивному росту опухоли и метастазированию (Jeffers et al., Mol Cell Biol (1996), 16, 1115-1125; Meiners et al., Oncogene (1998), 16, 9-20).
Было показано, что Met взаимодействует с другими белками, которые запускают активацию рецептора, трансформацию и инвазию. Описано, что в клетках новообразования Met взаимодействует с α6β4-интегрином, рецептором для компонентов внеклеточного матрикса (ECM), таких как ламинины, и способствует HGF-зависимому инвазивному росту (Trusolino et al, Cell (2001), 107, 643-654). Кроме того, было показано, что внеклеточный домен Met взаимодействует с членом семейства семафорина, плексином B1, и усиливает инвазивный рост (Giordano et al., Nat Cell Biol (2002), 4, 720-724). Более того, также описано, что CD44v6, который вовлечен в образование опухоли и метастазирование, образует комплекс с Met и HGF и приводит к активации рецептора Met (Orian-Rousseau et al., Genes Dev (2002), 16, 3074-3086).
Met является членом подсемейства рецепторных тирозинкиназ (RTK), которое включает в себя Ron и Sea (Maulik et al., Cytokine Growth Factor Rev (2002), 13, 41-59). Предсказание структуры внеклеточного домена Met позволяет предположить наличие общей гомологии с семафоринами и плексинами. N-конец Met содержит домен Sema приблизительно из 500 аминокислот, который является консервативным для всех семафоринов и плексинов. Семафорины и плексины принадлежат большому семейству секретируемых и мембраносвязанных белков, впервые описанному с точки зрения их участия в развитии нервов (Van Vactor and Lorenz, Curr Bio (1999),1 9, R201-204). Однако позднее была показана корреляция сверхэкспрессии семафорина с инвазией и метастазированием опухоли. Богатый цистеином домен PSI (также обозначаемый как домен связанной с Met последовательности), обнаруженный в плексинах, семафоринах и интегринах, примыкает к домену Sema, за которым следуют четыре повтора IPT, которые представляют собой подобные иммуноглобулину участки, обнаруженные в плексинах и факторах транскрипции. Последние исследования показывают, что домен Sema в Met является достаточным для связывания HGF и гепарина (Gherardi et al., Proc Natl Acad Sci USA (2003), 100(21): 12039-44).
Как указано выше, рецепторную тирозинкиназу Met активирует узнаваемый ею лиганд HGF и фосфорилирование рецептора активирует последующие каскады MAPK, киназы PI-3 и PLC-γ (1, 2). Фосфорилирование Y1234/Y1235 в киназном домене является важным для активации киназы Met, в то время как Y1349 и Y1356 в мультисубстратном участке для связывания являются важными для связывания белков с src-гомологичным доменом 2 (SH2), связывающим фосфотирозин доменом (PTB) и связывающим Met доменом (MBD) (3-5), для обеспечения активации последующих каскадов передачи сигнала. Дополнительный околомембранный участок фосфорилирования Y1003 хорошо охарактеризован вследствие его связывания со связывающим тирозинкиназу (TKB) доменом Cb1 E3-лигазы (6, 7). Описано, что связывание Cb1 запускает опосредуемый эндофилином эндоцитоз рецептора, убиквитинилирование и последующую деградацию рецептора (8). Этот механизм отрицательной регуляции рецептора был описан ранее для семейства EGFR, который также содержит аналогичный участок для связывания Cb1 (9-11).
Нарушение регуляции Met и HGF описано для многих опухолей. Запускаемая лигандом активация Met была выявлена при нескольких злокачественных опухолях. Повышение уровня HGF в сыворотке и внутри опухоли выявлено при раке легкого, раке молочной железы и множественной миеломе (12-15). Сверхэкспрессия Met и/или HGF, амплификация или мутация Met были описаны при различных злокачественных опухолях, таких как рак ободочной и прямой кишки, рак легкого, рак желудка и рак почки, и полагают, что они запускают независимую от лиганда активацию рецептора (2, 16). Кроме того, индуцибельная сверхэкспрессия Met в печени в модели на мышах приводит к развитию почечно-клеточной карциномы, демонстрируя, что сверхэкспрессия рецептора запускает независимое от лиганда образование опухоли (17). Наиболее убедительное доказательство участия Met в злокачественной опухоли описано для пациентов с наследственной и спорадической почечной папиллярной карциномой (RPC). При RPC выявлены мутации в киназном домене Met, в виде зародышевых и соматических мутаций, которые приводят к конститутивной активации рецептора (18). Внесение этих мутаций в моделях на трансгенных мышах приводит к образованию опухоли и метастазированию (19).
Несмотря на то что роль киназного домена Met подробно исследована и было предположено, что повышенные уровни экспрессии HGF/c-met, вероятно, лежат в основе развития некоторых злокачественных опухолей, отсутствуют прямые доказательства биологической роли некиназных доменов c-met. Действительно, несмотря на участие в этиологии многих онкологических состояний каскад HGF/-c-met является сложным каскадом для терапевтического воздействия. В связи с этим работе в значительной степени препятствует отсутствие понимания механизмов действия, посредством которых нарушение регуляции HGF/c-met приводит к образованию опухоли. Таким образом, очевидна высокая необходимость в большем понимании связанных с c-met онкогенных механизмов действия. Это изобретение, представленное в настоящем описании, удовлетворяет эту потребность и обеспечивает другие преимущества.
Все приведенные в настоящем описании ссылки, включая патентные заявки и публикации, включены в настоящее описание в качестве ссылок в полном объеме.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В основе этого изобретения по меньшей мере частично лежит новое открытие, что определенные опухоли человека экспрессируют мутантный белок c-met, который демонстрирует сниженные уровни внутриклеточной отрицательной регуляции, но, тем не менее, способен к передаче сигнала в клетке. Было обнаружено, что эти "гиперстабилизированные" белки c-met обладают повышенной онкогенной активностью по сравнению с c-met дикого типа. Как показано в настоящем описании, эти опухоли можно ингибировать ингибиторами, направленными против c-met. Ингибирование активности гиперстабилизированных c-met обеспечивает ряд терапевтических преимуществ. Например, поскольку эти мутантные формы c-met являются особенно онкогенными, можно ожидать, что направленное на них ингибирование снизит образование опухолей, запускаемых этими мутантами. Более того, поскольку c-met обнаруживается во многих типах клеток, включая нормальные клетки, способность специфично направлять воздействие на опухолеспецифичные мутантные формы c-met может быть особенно предпочтительной, например, в отношении снижения побочных эффектов терапии с ингибированием c-met. Это изобретение относится к способам и композициям, в основе которых лежат описанные в настоящем описании открытия и которые являются пригодными для воздействия на опухоли и/или лечения опухолей, обладающих гиперстабилизированным c-met.
В одном аспекте это изобретение относится к веществу, способному специфично связываться с гиперстабилизированным c-met. В одном варианте осуществления вещество обладает ингибиторной активностью в отношении биологической активности, связанной с гиперстабилизированным c-met. В другом варианте осуществления вещество обладает способностью специфично связывать гиперстабилизированный c-met. В одном варианте осуществления вещество связывается с гиперстабилизированным c-met и ингибирует активность c-met. В одном варианте осуществления вещество связывается с гиперстабилизированным c-met без существенного ингибирования активности c-met. Эти вещества найдут множество применений, например, в качестве молекул для нацеливания лекарственных средств на клетку, экспрессирующую гиперстабилизированный c-met. Лекарственные средства включают в себя любое вещество, описанное в настоящем описании, например токсины. Вещества могут находиться в любой пригодной форме, включая форму конъюгатов антитело-лекарственное средство и слитых полипептидов.
В одном аспекте это изобретение относится к антагонистам c-met, которые нарушают передачу сигнала HGF/c-met, обусловленную гиперстабилизированным белком c-met. В одном варианте осуществления это изобретение относится к антагонисту, который ингибирует активность гиперстабилизированного полипептида c-met человека в отношении передачи сигнала c-met, где гиперстабилизированный полипептид c-met содержит такую делецию по меньшей мере части 14 экзона, при которой скорость деградации в клетке уменьшается по сравнению с c-met дикого типа, и где гиперстабилизированный полипептид c-met обладает активностью в отношении передачи сигнала c-met.
Антагонист по этому изобретению может находиться в любой форме, способной специфично ингибировать активность гиперстабилизированной молекулы c-met, как описано в настоящем описании. В одном варианте осуществления антагонист по этому изобретению включает в себя антитело. В одном варианте осуществления антитело по этому изобретению специфично связывается с эпитопом, образованным посредством сплайсинга в рамке считывания экзона 13 и экзона 15 c-met. В одном варианте осуществления по меньшей мере часть экзона 14 удалена в результате указанного сплайсинга в рамке считывания. В другом аспекте антагонист по этому изобретению включает в себя аптамер. В одном варианте осуществления аптамер по этому изобретению специфично связывается с эпитопом, образованным посредством сплайсинга в рамке считывания экзона 13 и экзона 15 c-met. В одном варианте осуществления по меньшей мере часть экзона 14 удалена в результате указанного сплайсинга в рамке считывания. В одном аспекте антагонист по этому изобретению содержит ингибиторную РНК, которая предпочтительно/селективно ингибирует экспрессию молекулы нуклеиновой кислоты, кодирующей вариант по сплайсингу (сплайсированный вариант) c-met, где экзон 13 сплайсирован с экзоном 15. В одном варианте осуществления нуклеиновая кислота кодирует гиперстабилизированный c-met, в котором по меньшей мере часть экзона 14 удалена в результате измененного сплайсинга. В одном аспекте это изобретение относится к антагонисту, содержащему антисмысловой олигонуклеотид, который предпочтительно/селективно ингибирует молекулу нуклеиновой кислоты, кодирующую вариант по сплайсингу c-met, где экзон 13 сплайсирован с экзоном 15. В одном варианте осуществления молекула нуклеиновой кислоты кодирует гиперстабилизированный c-met, в котором по меньшей мере часть экзона 14 удалена в результате измененного сплайсинга.
Ингибирование активности c-met можно обеспечивать любым из ряда способов, известных в данной области, при условии снижения биологической активности гиперстабилизированного c-met в клетке. Например, в одном варианте осуществления ингибирование активности c-met антагонистом по этому изобретению включает в себя усиление клеточной деградации гиперстабилизированного белка c-met. В другом варианте осуществления ингибирование активности c-met антагонистом по этому изобретению включает в себя ингибирование фосфорилирования гиперстабилизированного белка c-met. В другом варианте осуществления ингибирование активности c-met антагонистом по этому изобретению включает в себя ингибирование фосфорилирования члена каскада передачи сигнала HGF/c-met посредством гиперстабилизированного c-met. Ингибирование активности c-met антагонистом по этому изобретению также можно обеспечивать посредством снижения уровней гиперстабилизированного полипептида c-met в клетке. Таким образом, например, в одном варианте осуществления ингибирование активности c-met антагонистом по этому изобретению включает в себя ингибирование экспрессии гиперстабилизированного белка c-met, например транскрипции и/или трансляции с полинуклеотида, кодирующего гиперстабилизированный полипептид c-met. В другом варианте осуществления ингибирование активности c-met антагонистом по этому изобретению включает в себя гибель клетки, обусловленную цитотоксином, связанным с молекулой (например, конъюгат антитело-лекарственное средство), которая специфично связывается с гиперстабилизированным c-met в клетке.
В одном варианте осуществления антагонист по этому изобретению представляет собой моноклональное антитело, фрагмент антитела, химерное антитело, гуманизированное антитело, антитело человека, полиспецифичное антитело или одноцепочечное антитело. Антагонисты, используемые в способах по этому изобретению, необязательно могут быть конъюгированными с ингибирующим рост веществом или цитотоксическим веществом, таким как токсин, в том числе, например, с майтанзиноидом или калихеамицином, с антибиотиком, с радиоактивным изотопом, ферментом нуклеолизиса или со сходными с ними. В некоторых вариантах осуществления способов по этому изобретению субъекту также вводят химиотерапевтическое средство.
Как правило, эффективные антагонисты c-met включают в себя ингибиторы c-met, которые препятствуют связыванию лиганда, такого как HGF, с гиперстабилизированным c-met. Например, ингибитор c-met может связываться с гиперстабилизированным c-met, так что происходит ингибирование связывания HGF с c-met. В одном варианте осуществления антитело-антагонист представляет собой химерное антитело, например антитело, содержащее антигенсвязывающие последовательности из не относящегося к человеку донора, пересаженные в гетерологичную не являющуюся человеческой, человеческую или гуманизированную последовательность (например, последовательности каркасной области и/или константного домена). В одном варианте осуществления не относящийся к человеку донор представляет собой мышь. В одном варианте осуществления антигенсвязывающая последовательность является синтетической, например полученной посредством мутагенеза (например, скрининга посредством фагового дисплея и т.д.). В одном варианте осуществления химерное антитело по этому изобретению обладает V-участками мыши и C-участком человека. В одном варианте осуществления V-участок легкой цепи мыши является слитым с легкой цепью каппа человека. В одном варианте осуществления V-участок тяжелой цепи мыши является слитым с C-участком IgG1 человека. В одном варианте осуществления антигенсвязывающие последовательности содержат по меньшей мере одну, по меньшей мере две или все три CDR легкой и/или тяжелой цепи. В одном варианте осуществления антигенсвязывающие последовательности содержат CDR3 тяжелой цепи. В одном варианте осуществления антигенсвязывающие последовательности содержат часть из последовательностей или все последовательности CDR и/или вариабельного домена моноклонального антитела, продуцируемого гибридомной клеточной линией, доступной под регистрационным номером Американской коллекции типовых культур ATCC HB-11894 (гибридома 1A3.3.13) или HB-11895 (гибридома 5D5.11.6). В одном варианте осуществления антигенсвязывающие последовательности содержат по меньшей мере CDR3 тяжелой цепи моноклонального антитела, продуцируемого гибридомной клеточной линией 1A3.3.13 или 5D5.11.6. Гуманизированные антитела по этому изобретению включают в себя антитела, которые обладают аминокислотными заменами в FR, и варианты, полученные посредством созревания аффинности, с изменениями в пересаженных CDR. Замещенные аминокислоты в CDR или FR не ограничиваются аминокислотами, представленными в донорном или реципиентном антителе. В других вариантах осуществления антитела по этому изобретению дополнительно включают в себя изменения аминокислотных остатков в Fc-участке, которые приводят к улучшению эффекторной функции, включая усиление функции в отношении CDC и/или ADCC и уничтожения посредством B-клеток. Другие антитела по этому изобретению включают в себя антитела, обладающие определенными изменениями, которые повышают стабильность. Антитела по этому изобретению также включают в себя в дефицитные по фукозе варианты, обладающие усиленной функцией в отношении ADCC in vivo.
В одном варианте осуществления фрагмент антитела по этому изобретению содержит антигенсвязывающую часть, содержащую тяжелую цепь, содержащую меньшей мере одну, по меньшей мере две или все три последовательности CDR, выбранные из группы, состоящей из SYWLH (SEQ ID NO:1), MIDPSNSDTRFNPNFKD (SEQ ID NO:2) и YGSYVSPLDY (SEQ ID NO:3). В одном варианте осуществления антигенсвязывающая часть содержит CDR-H1 тяжелой цепи, обладающий аминокислотной последовательностью SYWLH. В одном варианте осуществления антигенсвязывающая часть содержит CDR-H2 тяжелой цепи, обладающий аминокислотной последовательностью MIDPSNSDTRFNPNFKD. В одном варианте осуществления антигенсвязывающая часть содержит CDR-H3 тяжелой цепи, обладающий аминокислотной последовательностью YGSYVSPLDY. В одном варианте осуществления фрагмент антитела по этому изобретению содержит антигенсвязывающую часть, содержащую легкую цепь, содержащую по меньшей мере одну, по меньшей мере две или все три последовательности CDR, выбранные из группы, состоящей из KSSQSLLYTSSQKNYLA (SEQ ID NO:4), WASTRES (SEQ ID NO:5) и QQYYAYPWT (SEQ ID NO:6). В одном варианте осуществления антигенсвязывающая часть содержит CDR-L1 тяжелой цепи, обладающий аминокислотной последовательностью KSSQSLLYTSSQKNYLA. В одном варианте осуществления антигенсвязывающая часть содержит CDR-L2 тяжелой цепи, обладающий аминокислотной последовательностью WASTRES. В одном варианте осуществления антигенсвязывающая часть содержит CDR-L3 тяжелой цепи, обладающий аминокислотной последовательностью QQYYAYPWT. В одном варианте осуществления фрагмент антитела по этому изобретению содержит антигенсвязывающую часть, содержащую тяжелую цепь, содержащую по меньшей мере одну, по меньшей мере две или все три последовательности CDR, выбранные из группы, состоящей из SYWLH (SEQ ID NO:1), MIDPSNSDTRFNPNFKD (SEQ ID NO:2) и YGSYVSPLDY (SEQ ID NO:3), и легкую цепь, содержащую по меньшей мере одну, по меньшей мере две или все три последовательности CDR, выбранные из группы, состоящей из KSSQSLLYTSSQKNYLA (SEQ ID NO:4), WASTRES (SEQ ID NO:5) и QQYYAYPWT (SEQ ID NO:6).
Это изобретение относится к гуманизированному антителу-антагонисту, которое связывает гиперстабилизированный c-met человека, или к его антигенсвязывающему фрагменту, где антитело является эффективным в отношении ингибирования активности гиперстабилизированного HGF/c-met человека in vivo, и антитело содержит в вариабельном участке H-цепи (VH) по меньшей мере последовательность CDR3 моноклонального антитела, продуцируемого гибридомной клеточной линией, доступной под регистрационным номером Американской коллекции типовых культур ATCC HB-11894 (гибридома 1A3.3.13) или HB-11895 (гибридома 5D5.11.6), и по существу человеческую консенсусную последовательность (например, остатки по существу человеческого каркасного участка (FR) тяжелой цепи человека подгруппы III (VHIII)). В одном варианте осуществления антитело дополнительно содержит последовательность CDR1 и/или последовательность CDR2 H-цепи моноклонального антитела, продуцируемого гибридомной клеточной линией, доступной под регистрационным номером Американской коллекции типовых культур ATCC HB-11894 (гибридома 1A3.3.13) или HB-11895 (гибридома 5D5.11.6). В другом варианте осуществления указанное выше антитело содержит последовательность CDR1, последовательность CDR2 и/или последовательность CDR3 L-цепи моноклонального антитела, продуцируемого гибридомной клеточной линией, доступной под регистрационным номером Американской коллекции типовых культур ATCC HB-11894 (гибридома 1A3.3.13) или HB-11895 (гибридома 5D5.11.6) с по существу человеческим остатками консенсусного каркасного участка (FR) легкой цепи человека κ подгруппы I (VκI).
В одном варианте осуществления фрагмент антитела по этому изобретению содержит антигенсвязывающую часть, содержащую вариабельный домен тяжелой цепи, обладающий последовательностью:
QVQLQQSGPELVRPGASVKMSCRASGYTFTSYWLHWVKQRPGQGLEWIGMIDPSNSDTRFNPNFKDKATLNVDRSSNTAYMLLSSLTSADSAVYYCATYGSYVSPLDYWGQGTSVTVSS (SEQ ID NO:7)
В одном варианте осуществления фрагмент антитела по этому изобретению содержит антигенсвязывающую часть, содержащую вариабельный домен легкой цепи, обладающий последовательностью:
DIMMSQSPSSLTVSVGEKVTVSCKSSQSLLYTSSQKNYLAWYQQKPGQSPKLLIYWASTRESGVPDRFTGSGSGTDFTLTITSVKADDLAVYYCQQYYAYPWTFGGGTKLEIK (SEQ ID NO:8)
В других примерах может быть преимущественным антагонист c-met, который не препятствует связыванию лиганда (такого как HGF) с c-met. Таким образом, в некоторых вариантах осуществления антагонист по этому изобретению не связывает связывающий лиганд (такой как HGF) участок на c-met. В другом варианте осуществления антагонист по этому изобретению по существу не ингибирует связывание лиганда (например, HGF) с c-met. В одном варианте осуществления антагонист по этому изобретению по существу не конкурирует с лигандом (например, HGF) за связывание с c-met. В одном примере антагонист по этому изобретению можно использовать совместно с одним или несколькими другими антагонистами, где антагонисты нацелены на различные процессы и/или функции в системе HGF/c-met. Таким образом, в одном варианте осуществления антагонист c-met по этому изобретению связывается с эпитопом на c-met, отличным от эпитопа, с которым связывается другой антагонист c-met, такой как Fab-фрагмент моноклонального антитела, продуцируемого гибридомной клеточной линией, доступной под регистрационным номером Американской коллекции типовых культур ATCC HB-11894 (гибридома 1A3.3.13) или HB-11895 (гибридома 5D5.11.6). В другом варианте осуществления антагонист c-met по этому изобретению отличается от (т.е. не представляет собой) Fab-фрагмента моноклонального антитела, продуцируемого гибридомной клеточной линией, доступной под регистрационным номером Американской коллекции типовых культур ATCC HB-11894 (гибридома 1A3.3.13) или HB-11895 (гибридома 5D5.11.6). В одном варианте осуществления антагонист c-met по этому изобретению не содержит связывающей c-met последовательности антитела, продуцируемого гибридомной клеточной линией, доступной под регистрационным номером Американской коллекции типовых культур ATCC HB-11894 (гибридома 1A3.3.13) или HB-11895 (гибридома 5D5.11.6). В одном варианте осуществления антагонист по этому изобретению ингибирует активность c-met, но не связывается с околомембранным доменом c-met дикого типа.
В одном варианте осуществления антагониста c-met по этому изобретению связывание антагониста с c-met ингибирует активацию c-met посредством HGF. В одном варианте осуществления антагониста c-met по этому изобретению связывание антагониста с c-met в клетке ингибирует пролиферацию, распространение, морфогенез и/или подвижность клетки. В одном варианте осуществления антагонист c-met по этому изобретению связывается с гиперстабилизированным c-met в клетке, вызывая гибель клетки. Например, в одном варианте осуществления антагонист связан с токсином, как описано в настоящем описании.
В некоторых вариантах осуществления антагонист c-met по этому изобретению представляет собой или содержит пептид (например, олигопептид), антитело, фрагмент антитела, аптамер, олигонуклеотид (например, антисмысловой олигонуклеотид), ингибиторную РНК или их сочетание.
В некоторых вариантах осуществления антагонист c-met по этому изобретению получают посредством способа скрининга или идентификации по этому изобретению, описанному в настоящем описании.
В другом аспекте это изобретение относится к способам скрининга или идентификации антагониста c-met. В одном примере указанные способы включают в себя контактирование вещества-кандидата с молекулой-мишенью, содержащей по меньшей мере часть гиперстабилизированного c-met, посредством чего отбирают вещество, которое специфично связывает указанную молекулу-мишень (в качестве антагониста c-met). В одном варианте осуществления способы дополнительно включают в себя определение наличия специфичного связывания отобранного вещества-кандидата с мутантным участком гиперстабилизированного c-met. Например, если молекула-мишень содержит полипептид, то выбранное вещество-кандидат должно специфично связываться с эпитопом, содержащим мутировавшее положение (или участок) гиперстабилизированного c-met. В другом примере, если молекула-мишень содержит нуклеиновую кислоту, кодирующую по меньшей мере часть гиперстабилизированного c-met, выбранное вещество-кандидат должно специфично ингибировать экспрессию гиперстабилизированного белка c-met с нуклеиновой кислоты, кодирующей гиперстабилизированный c-met. В некоторых вариантах осуществления способы скрининга по этому изобретению дополнительно включают в себя контактирование выбранного вещества с клеткой, экспрессирующей гиперстабилизированный c-met, где оценивают ингибирование активности c-met в клетке (например, где выявляют или количественно определяют уровень последующей передачи сигнала c-met (например, фосфорилирование MAPK)). Ингибирование активности в отношении передачи сигнала c-met можно оценивать множеством способов, известных в данной области и исходя из любого из множества критериев, известных в данной области, некоторые из которых описаны в настоящем описании более подробно. Например, ингибирование активности в отношении передачи сигнала c-met можно показать по снижению уровня активации c-met, которое в свою очередь можно показать, например, по уровню обусловленной c-met передачи сигнала в клетке. Передачу сигнала клетке можно оценивать множеством способов и исходя из различных критериев, которые известны в данной области, некоторые из которых описаны в настоящем описании. Например, частоту передачи сигнала в клетке посредством каскада HGF/c-met можно определить биологически по изменению фосфорилирования молекул-мишеней в каскаде передачи сигнала. Таким образом, например, можно измерять уровень фосфорилирования белка, обусловленного одной или несколькими известными мишенями для фосфорилирования в каскаде HGF/c-met. Примеры таких мишеней для фосфорилирования включают в себя сам c-met и активируемую митогеном протеинкиназу (MAPK).
В одном аспекте это изобретение относится к композиции, содержащий один или несколько антагонистов по этому изобретению и носитель. В одном варианте осуществления носитель является фармацевтически приемлемым.
В одном аспекте это изобретение относится к нуклеиновым кислотам, кодирующим антагонист c-met по этому изобретению. В одном варианте осуществления нуклеиновая кислота по этому изобретению кодирует антагонист c-met, который представляет собой или содержит полипептид (например, олигопептид). В одном варианте осуществления нуклеиновая кислота по этому изобретению кодирует антагонист c-met, который представляет собой или содержит антитело или его фрагмент. В одном варианте осуществления нуклеиновая кислота по этому изобретению представляет собой аптамер. В одном варианте осуществления нуклеиновая кислота по этому изобретению представляет собой антисмысловой олигонуклеотид. В одном варианте осуществления нуклеиновая кислота по этому изобретению представляет собой ингибиторную РНК (например, малую интерферирующую РНК).
В одном аспекте это изобретение относится к векторам, содержащим нуклеиновую кислоту по этому изобретению.
В одном аспекте это изобретение относится к клеткам-хозяевам, содержащим нуклеиновую кислоту или вектор по этому изобретению. Вектор может представлять собой вектор любого типа, например, рекомбинантный вектор, такой как экспрессирующий вектор. Можно использовать любую из множества клеток-хозяев. В одном варианте осуществления клетка-хозяин представляет собой прокариотическую клетку, например E. coli. В одном варианте осуществления клетка-хозяин представляет собой эукариотическую клетку, например клетку млекопитающего, такую как клетка яичника китайского хомяка (CHO).
В одном аспекте это изобретение относится к способам получения антагониста по этому изобретению. Например, это изобретение относится к способу получения антагониста c-met, который представляет собой или содержит антитело (или его фрагмент), где указанный способ включает в себя экспрессию в пригодной клетке-хозяине рекомбинантного вектора по этому изобретению, кодирующего указанное антитело (или его фрагмент), и выделение указанного антитела. В другом примере это изобретение относится к способу получения антагониста c-met, который представляет собой или содержит полипептид (такой как олигопептид), где указанный способ включает в себя экспрессию в пригодной клетке-хозяине рекомбинантного вектора по этому изобретению, кодирующего указанный полипептид (такой как олигопептид), и выделение указанного полипептида (такого как олигопептид).
В одном аспекте это изобретение относится к изделию, содержащему контейнер, и композиции, содержащейся в контейнере, где композиция содержит один или несколько антагонистов c-met по этому изобретению. В одном варианте осуществления композиция содержит нуклеиновую кислоту по этому изобретению. В одном варианте осуществления композиция, содержащая антагонист, дополнительно содержит носитель, который в некоторых вариантах осуществления является фармацевтически приемлемым. В одном варианте осуществления изделие по этому изобретению дополнительно содержит инструкции по введению композиции (например, антагониста) субъекту.
В одном аспекте это изобретение относится к набору, содержащему первый контейнер, содержащий композицию, содержащую один или несколько антагонистов c-met по этому изобретению; и второй контейнер, содержащий буфер. В одном варианте осуществления буфер является фармацевтически приемлемым. В одном варианте осуществления композиция, содержащая антагонист, дополнительно содержит носитель, который в некоторых вариантах осуществления является фармацевтически приемлемым. В одном варианте осуществления набор дополнительно содержит инструкции по введению композиции (например, антагониста) субъекту.
В одном аспекте это изобретение относится к применению антагониста c-met по этому изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как злокачественная опухоль, новообразование, клеточно-пролиферативное нарушение, иммунное (такое как аутоиммунное) нарушение и/или связанное с ангиогенезом нарушение. Антагонист c-met может находиться в любой форме, описанной в настоящем описании, включая антитело, фрагмент антитела, полипептид (например, олигопептид), нуклеиновую кислоту (например, олигонуклеотид, такой как антисмысловой олигонуклеотид, ингибиторная РНК), аптамер или их сочетание.
В одном аспекте это изобретение относится к применению нуклеиновой кислоты по этому изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как злокачественная опухоль, новообразование, клеточно-пролиферативное нарушение, иммунное (такое как аутоиммунное) нарушение и/или связанное с ангиогенезом нарушение.
В одном аспекте это изобретение относится к применению экспрессирующего вектора по этому изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как злокачественная опухоль, новообразование, клеточно-пролиферативное нарушение, иммунное (такое как аутоиммунное) нарушение и/или связанное с ангиогенезом нарушение.
В одном аспекте это изобретение относится к применению клетки-хозяина по этому изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как злокачественная опухоль, новообразование, клеточно-пролиферативное нарушение, иммунное (такое как аутоиммунное) нарушение и/или связанное с ангиогенезом нарушение.
В одном аспекте это изобретение относится к применению изделия по этому изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как злокачественная опухоль, новообразование, клеточно-пролиферативное нарушение, иммунное (такое как аутоиммунное) нарушение и/или связанное с ангиогенезом нарушение.
В одном аспекте это изобретение относится к применению набора по этому изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как злокачественная опухоль, новообразование, клеточно-пролиферативное нарушение, иммунное (такое как аутоиммунное) нарушение и/или связанное с ангиогенезом нарушение.
Изобретение относится к способам и композициям, пригодным для модулирования болезненных состояний, обусловленных нарушением регуляции системы передачи сигнала HGF/c-met, связанным с замедленной отрицательной регуляцией c-met. Каскад передачи сигнала HGF/c-met вовлечен во множество биологических и физиологических функций, включая, например, пролиферацию клеток и ангиогенез. Таким образом, в одном аспекте это изобретение относится к способу, включающему в себя введение субъекту антагониста, который нацелен на гиперстабилизированный c-met, с модулированием посредством этого передачи сигнала HGF/c-met.
В одном аспекте это изобретение относится к способу лечения опухоли у субъекта, включающему в себя введение антагониста по этому изобретению субъекту, где посредством этого лечат субъекта. В одном варианте осуществления выявлено, что опухоль содержит гиперстабилизированный c-met. В одном варианте осуществления выявлено, что опухоль содержит мутантный c-met, содержащий делецию по меньшей мере части экзона 14.
В одном варианте осуществления способов по этому изобретению ингибитор c-met по этому изобретению вводят совместно с веществом, которое индуцирует и/или усиливает деградацию рецепторного белка.
В одном аспекте это изобретение относится к способу ингибирования пролиферации активированных посредством c-met клеток, включающему в себя контактирование клетки или ткани с эффективным количеством антагониста c-met по этому изобретению, где посредством этого ингибируют пролиферацию, обусловленную активацией c-met.
В одном аспекте это изобретение относится к способу лечения патологического состояния, обусловленного нарушением регуляции активации c-met, у субъекта, включающему в себя введение субъекту эффективного количества антагониста c-met по этому изобретению, где посредством этого лечат указанное состояние.
В одном аспекте это изобретение относится к способу ингибирования роста клетки, которая экспрессирует c-met, или фактор роста гепатоцитов, или оба из них, где указанный способ включает в себя контактирование указанной клетки с антагонистом c-met по этому изобретению, вызывая, таким образом, ингибирование роста указанной клетки. В одном варианте осуществления клетку приводят в контакт с HGF, экспрессированным другой клеткой (например, посредством паракринного эффекта).
В одном аспекте это изобретение относится к способу терапевтического лечения млекопитающего со злокачественной опухолью, содержащей клетку, которая экспрессирует c-met, или фактор роста гепатоцитов, или обоих из них, где указанный способ включает в себя введение указанному млекопитающему эффективного количества антагониста c-met по этому изобретению, где посредством этого эффективно лечат указанное млекопитающее. В одном варианте осуществления клетку приводят в контакт с HGF, экспрессируемым другой клеткой (например, посредством паракринного эффекта).
В одном аспекте это изобретение относится к способу лечения или профилактики клеточно-пролиферативного нарушения, обусловленного повышенной экспрессией или активностью c-met, или фактора роста гепатоцитов, или обоих из них, где указанный способ включает в себя введение субъекту эффективного количества антагониста c-met по этому изобретению, где посредством этого эффективно лечат или проводят профилактику указанного пролиферативного нарушения. В одном варианте осуществления указанное пролиферативное нарушение представляет собой злокачественную опухоль.
В одном аспекте это изобретение относится к способу ингибирования роста клетки, где рост указанной клетки по меньшей мере частично зависит от эффекта усиления роста посредством c-met, или фактора роста гепатоцитов, или обоих из них, где указанный способ включает в себя контактирование указанной клетки с эффективным количеством антагониста c-met по этому изобретению, где посредством этого ингибируют рост указанной клетки. В одном варианте осуществления клетку приводят в контакт с HGF, экспрессированным другой клеткой (например, посредством паракринного эффекта).
В одном аспекте это изобретение относится к способу терапевтического лечения опухоли у млекопитающего, где рост указанной опухоли по меньшей мере частично зависит от эффекта усиления роста посредством c-met, или фактора роста гепатоцитов, или обоих из них, где указанный способ включает в себя контактирование указанной клетки с эффективным количеством антагониста c-met по этому изобретению, где посредством этого эффективно лечат указанную опухоль. В одном варианте осуществления клетку приводят в контакт с HGF, экспрессированным другой клеткой (например, посредством паракринного эффекта).
Способы по этому изобретению можно использовать для воздействия на любое подходящее патологическое состояние, например на клетки и/или ткани, связанные с нарушением регуляции каскада передачи сигнала HGF/c-met. В одном варианте осуществления клетка, на которую направляют воздействие в способе по этому изобретению, представляет собой злокачественную клетку. Например, злокачественная клетка может представлять собой клетку, выбранную из группы, состоящей из клетки рака молочной железы, клетки рака ободочной и прямой кишки, клетки рака легкого, клетки папиллярной карциномы (например, щитовидной железы), клетки рака толстого кишечника, клетки рака поджелудочной железы, клетки рака яичника, клетки рака шейки матки, клетки злокачественной опухоли центральной нервной системы, клетки остеогенной саркомы, клетки карциномы почки, клетки печеночно-клеточной карциномы, клетки рака мочевого пузыря, клетки рака предстательной железы, клетки карциномы желудка, клетки плоскоклеточной карциномы головы и шеи, клетки лимфомы, клетки меланомы и лейкозной клетки. В одном варианте осуществления клетка, на которую направлено воздействие в способе по этому изобретению, представляет собой гиперпролиферативную и/или гиперпластическую клетку. В одном варианте осуществления клетка, на которую направлено воздействие в способе по этому изобретению, представляет собой диспластическую клетку. В другом варианте осуществления клетка, на которую направлено воздействие в способе по этому изобретению, представляет собой клетку метастаза.
Способы по этому изобретению могут дополнительно включать в себя дополнительные стадии лечения. Например, в одном варианте осуществления способ дополнительно включает в себя стадию, где клетку-мишень и/или ткань-мишень (например, злокачественную клетку) подвергают обработке облучением и/или химиотерапевтическим средством.
Как описано в настоящем описании, активация c-met является важным биологическим процессом, нарушение регуляции которого приводит к ряду патологических состояний. Таким образом, в одном варианте осуществления способов по этому изобретению клетка, на которую направлено воздействие (например, злокачественная клетка), представляет собой клетку, в которой активация c-met является повышенной по сравнению с нормальной клеткой из той же ткани. В одном варианте осуществления способ по этому изобретению вызывает гибель клетки-мишени. Например, контактирование с антагонистом по этому изобретению может приводить к неспособности клеток к передаче сигнала посредством каскада c-met, что приводит к гибели клетки или ингибированию роста клетки. В другом примере антагонист по этому изобретению направляет связанный с ним токсин в клетку, экспрессирующую гиперстабилизированный c-met.
Нарушение регуляции активации c-met (и, таким образом, передачи сигнала) может происходить вследствие ряда изменений в клетке, включающих в себя, например, сверхэкспрессию HGF (узнаваемого c-met лиганда) и/или самого c-met (вследствие замедления отрицательной регуляции/деградации, повышения уровней экспрессии и т.д.). Таким образом, в некоторых вариантах осуществления способ по этому изобретению включает в себя направление воздействия на клетку, где c-met, или фактор роста гепатоцитов, или оба из них в большем количестве экспрессируются клеткой (например, злокачественной клеткой) по сравнению с нормальной клеткой из той же ткани. Экспрессирующую c-met клетку можно регулировать посредством HGF из различных источников, т.е. аутокринным или паракринным образом. Например, в одном варианте осуществления способов по этому изобретению клетку-мишень приводят в контакт/связывают посредством фактора роста гепатоцитов, экспрессированного в/посредством другой клетки (например, посредством паракринного эффекта). Источником указанной другой клетки может быть та же ткань, что и для клетки-мишени, или другая ткань. В одном варианте осуществления клетку-мишень приводят в контакт/связывают посредством HGF, экспрессированным самой клеткой-мишенью (например, посредством аутокринного эффекта/цикла). Активация c-met и/или передача сигнала также может происходить независимо от лиганда. Таким образом, в одном варианте осуществления способов по этому изобретению активация c-met в клетке-мишени происходит независимо от лиганда.
В одном варианте осуществления способов по этому изобретению способы дополнительно включают в себя стадию определения наличия в опухолевой клетке гиперстабилизированного c-met (например, посредством выявления мутации полинуклеотида или полипептида, как описано в настоящем описании).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГ. 1 изображены иллюстративные мутации в интроне, фланкирующие экзон 14 Met. На схематическом изображении экзона Met 14 показаны соответствующие делеции и/или точковые мутации (светло-серый текст) нуклеиновой кислоты (NM_000245) относительно структуры интрон/экзон. (A) H596, клеточная линия рака легкого. (B) pat. 14, образец опухоли легкого пациента 14. (C) pat. 16, образец опухоли легкого пациента 16. Для сравнения, в опухоли H596 существует точковая мутация с G на T в положении, обозначенном +1 на (A). В опухоли pat 14 существует делеция последовательности из положения, обозначенного от -27 до -6 на (B). В опухоли pat 16 существует делеция последовательности из положения, отмеченного от 3195 до +7 на (C).
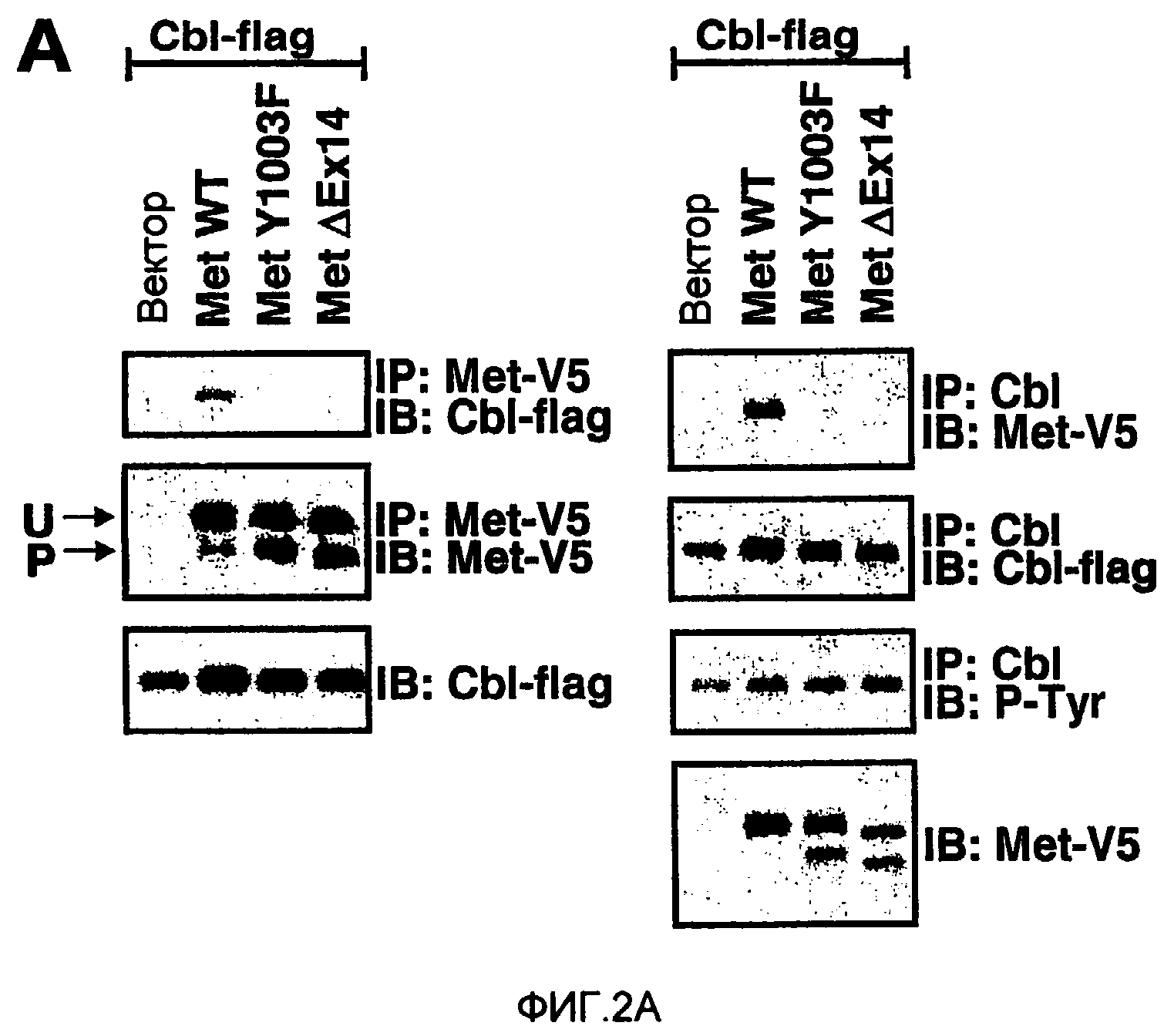
ФИГ. 2. Замедленная отрицательная регуляция гиперстабилизированного c-met ассоциирована с активацией Met и MAPK. (A) Проводили иммунопреципитацию клеток 293, котрансфицированных посредством конструкций Met и Cb1-flag, с антителами против V5 или Cb1 с последующим иммуноблоттингом (IB) с антителами против V5, flag или P-Tyr. Лизаты метили посредством антител против flag или Cb1. (B) Клетки 293 трансфицировали посредством конструкций Met с последующей IP эндогенного Cb1. Иммуноблоттинг с антителом против V5 показывает, что Met WT, но не MetΔEx14, копреципитирует с эндогенным Cb1. Мембрану промывали и проводили повторное мечение посредством фосфоспецифичных антител против Y1003, YY1234/1235, Y1349 или Y1365. (C) Лизаты временно трансфицированных клеток 293 подвергали иммунопреципитации с антителом против V5 и проводили иммуноблоттинг с антителом против убиквитина для выявления убиквитинилированного Met. Мембрану промывали и проводили повторное мечение посредством антитела против V5 для выявления наличия Met. Лизаты метили посредством антител против flag или актина для детекции эквивалентной экспрессии Cb1-flag или актина. (D) Клетки 293 трансфицировали посредством указанных конструкций и обрабатывали циклогексимидом в концентрации 10 мкг/мл. Лизаты метили антителом против V5 или актина. (E) Клеточные линии рака легкого, культивированные без сыворотки, стимулировали в течение 10 минут посредством rhuHGF в концентрации 50 нг/мл, затем промывали и возвращали в бессывороточную среду. Через указанные промежутки времени собирали лизаты и проводили иммуноблоттинг для P-Met (Y1230/Y1234/Y1235), Met, P-MAPK, MAPK, P-Akt или Akt. (F) Стабильные клоны Rat 1A культивировали без сыворотки и обрабатывали в течение 10 минут моноклональным антителом 3D6, агонистом Met (5 мкг/мл), промывали посредством PBS и возвращали в бессывороточную среду. Через указанные промежутки времени получали лизаты и проводили иммуноблоттинг для P-MAPK, MAPK, P-Akt или Akt.
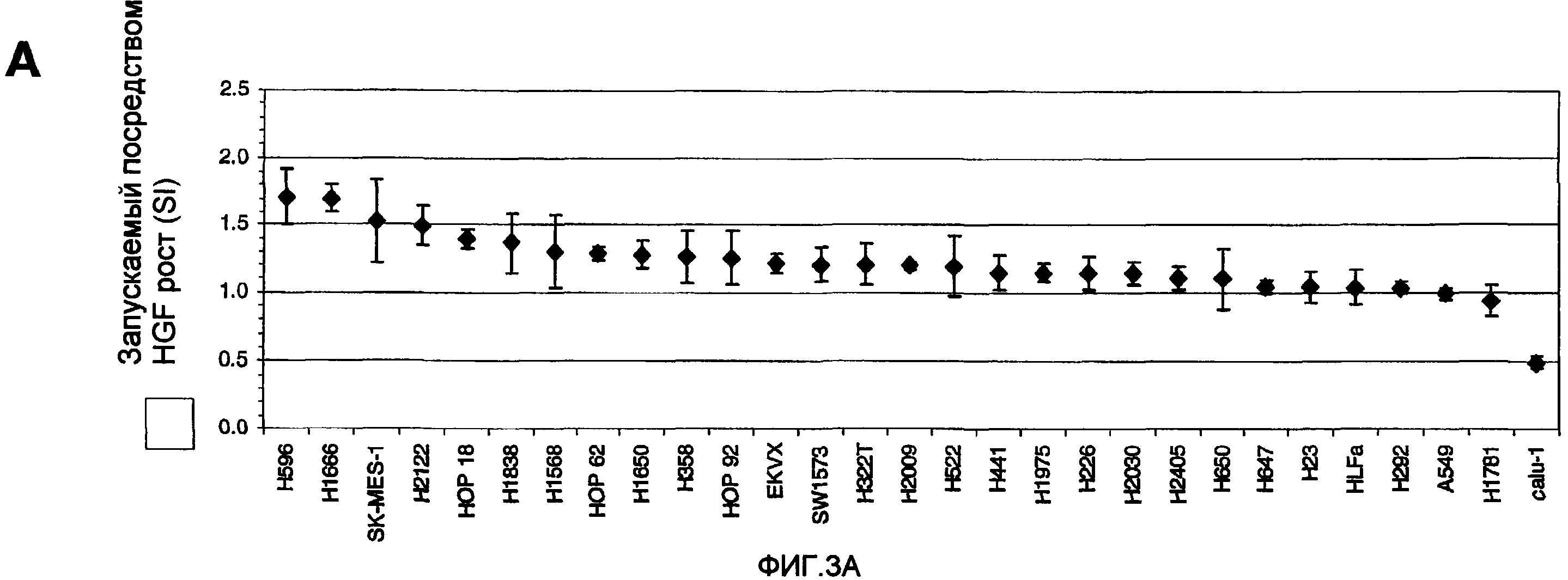
ФИГ. 3. Повышенный зависимый от лиганда пролиферативный потенциал в клеточных линиях, обладающих околомембранной делецией Met. (A) Стимулированный посредством HGF рост на панели клеточных линий NSCLC определяли после 72 часов культивирования в присутствии и в отсутствие rhuHGF в концентрации 50 нг/мл. Результаты представлены в качестве индекса стимуляции (SI), определенного исходя из минимального значения среди трех отдельных экспериментов. (B) Кривые роста для подкожно инокулированных мышам nude стабильных клеточных линий Rat 1A, экспрессирующих вектор, Met WT, MetΔEx14, в каждом случае в присутствии или в отсутствие антитела-агониста HGF (3D6).
ФИГ. 4. Ингибирование зависимой от лиганда передачи сигнала Met и роста клеток H596 посредством mAb против Met OA-5D5. (A) Культивированные без сыворотки клетки H226 или H596 инкубировали с OA-5D5 в течение 30 минут в указанных концентрациях, а затем стимулировали посредством rhuHGF в концентрации 100 нг/мл в течение 15 минут. Получали лизаты и проводили иммуноблоттинг для P-Met (Y1234/Y1235), Met, P-Akt, Akt, P-MAPK или MAPK. (B) Клетки обрабатывали посредством OA-5D5 или контрольного Ig в указанных концентрациях в присутствии или в отсутствие rhuHGF в концентрации 50 нг/мл и через 72 часа определяли жизнеспособность.
ФИГ. 5. Количественное определение соотношений фосфо-киназы к киназе в стабильных клеточных линиях Rat1A с Met. Соотношение P-MAPK:MAPK (слева) и P-Akt:Akt (справа) количественно определяли с использованием инфракрасного сканера Odyssey, который выявляет конъюгированные с AlexaFluor680 и IR Dye800 вторичные антитела.
ФИГ. 6. Количественное определение соотношений фосфо-киназы к киназе в клетках H596 и H226, обработанных посредством OA-5D5. Соотношение P-Met:Met, P-Akt:Akt или P-MAPK:MAPK для каждой клеточной линии количественно определяли с использованием инфракрасного сканера Odyssey, который выявляет конъюгированные с AlexaFluor680 и IRDye800 вторичные антитела.
На ФИГ. 7 представлены иллюстративные цис-регуляторные элементы для сплайсинга, которые, как полагают, регулируют сплайсинг 14 экзона c-met человека. Ожидают, что мутация в одном или нескольких положениях в этих элементах может оказать отрицательное воздействие на сплайсинг экзона 14 дикого типа.
На фиг. 8 представлена белковая последовательность c-met человека дикого типа, исходя из RefSeq. NM_000245.
На ФИГ. 9 представлены последовательности вариабельных доменов легкой и тяжелой цепи антитела OA-5D5, которые описаны в примерах.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ЭТОГО ИЗОБРЕТЕНИЯ
Это изобретение относится к способам, композициям, наборам и изделиям для идентификации ингибиторов каскада передачи сигнала HGF/c-met (в частности, ингибиторов гиперстабилизированного c-met) и к способам применения таких ингибиторов.
Подробное описание этих способов, композиций, наборов и изделий представлено в настоящем описании.
Основные способы
Для практики этого изобретения используют, если нет иных указаний, общепринятые способы молекулярной биологии (включая рекомбинантные способы), микробиологии, клеточной биологии, биохимии и иммунологии, которые лежат в пределах квалификации специалиста в данной области. Такие способы полностью описаны в литературе, такой как "Molecular Cloning: A Laboratory Manual", второе издание (Sambrook et al., 1989); "Oligonucleotide Synthesis" (M. J. Gait, ed., 1984); "Animal Cell Culture" (R.I. Freshney, ed., 1987); "Methods in Enzymology" (Academic Press, Inc.); "Current Protocols in Molecular Biology" (F.M. Ausubel et al., eds., 1987, и периодические дополнения); "PCR: The Polymerase Chain Reaction", (Mullis et al., ed., 1994); "A Practical Guide to Molecular Cloning" (Perbal Bernard V., 1988).
Определения
Как используют в настоящем описании, термин "гиперстабилизированный c-met" и его варианты относится к природному мутантному c-met человека, уровень деградации/отрицательной регуляции которого заметно ниже уровня для c-met дикого типа. Способы сравнения уровней деградации/отрицательной регуляции между c-met дикого типа и гиперстабилизированным c-met очевидны специалисту в данной области, в том числе, например, как описано в примерах ниже. В одном примере замедленную деградацию/отрицательную регуляцию оценивают, исходя из количественного определения уровней рецепторных белков в клетке. В другом примере замедленную деградацию/отрицательную регуляцию определяют, исходя из определения мутации в участке c-met, который ассоциирован со связыванием Cb1 с c-met. В одном примере мутация расположена в участке c-met, который ассоциирован с убиквитинилированием c-met (например, в экзоне 14 c-met) и деградацией/отрицательной регуляцией рецепторного белка. Эти мутации могут происходить в любой форме, которая приводит к экспрессии мутантного белка c-met, уровень деградации/отрицательной регуляции которого ниже, чем уровень для c-met дикого типа, где мутантный белок c-met способен проявлять обусловленную c-met дикого типа активность (например, последующее фосфорилирование молекул, таких как MAPK, стимуляция пролиферации клеток и/или индуцирование образования опухоли). Например, эти мутации включают в себя мутации, которые связаны с экспрессией функционального находящегося в рамке считывания варианта по сплайсингу c-met, лишенного по меньшей мере части экзона 14, который связан с деградацией/отрицательной регуляцией рецепторного белка. Иллюстративные примеры мутаций включают в себя мутации в элементе сплайсинга, как представлено на фиг.1 и 7. В одном варианте осуществления наличие гиперстабилизированного белка c-met по этому изобретению в клетке ассоциировано с пролонгированным и/или повышенным фосфорилированием последующих молекул в каскаде HGF/c-met по сравнению с аналогичным количеством белка c-met дикого типа в клетке.
Подразумевают, что термин "вектор", как используют в настоящем описании, относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она связана. Один тип вектора представляет собой "плазмиду", которая относится к кольцевой двухцепочечной петле ДНК, в которую можно лигировать дополнительные сегменты ДНК. Другой тип вектора представляет собой фаговый вектор. Другой тип вектора представляет собой вирусный вектор, где дополнительные сегменты ДНК могут быть лигированы в геном вируса. Определенные векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, обладающие бактериальным ориджином (началом) репликации и эписомные векторы млекопитающих). Другие векторы (например, не эписомные векторы млекопитающих) могут встраиваться в геном клетки-хозяина при введении в клетку-хозяина и, таким образом, реплицируются совместно с геномом хозяина. Более того, определенные векторы способны обеспечивать экспрессию генов, с которыми они функционально связаны. Такие векторы обозначают в настоящем описании как "рекомбинантные экспрессирующие векторы" (или просто "рекомбинантные векторы"). Как правило, экспрессирующие векторы для применения в способах рекомбинантных ДНК часто находятся в форме плазмид. В настоящем описании "плазмида" и "вектор" могут использоваться взаимозаменяемо, поскольку плазмида представляет собой наиболее широко применяемую форму вектора.
"Полинуклеотид" или "нуклеиновая кислота", как используют в настоящем описании взаимозаменяемо, относятся к полимерам нуклеотидов любой длины и включают в себя ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды, или основания и/или их аналоги, или любой субстрат, который может быть встроен в полимер ДНК-полимеразой или РНК-полимеразой или посредством реакции синтеза. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Модификацию, при ее наличии, нуклеотидной структуры можно проводить до или после сборки полимера. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. После синтеза полинуклеотид можно дополнительно модифицировать, например, посредством конъюгации с меткой. Другие типы модификаций включают в себя, например, "кэпы", замену одного или нескольких природных нуклеотидов аналогом, межнуклеотидные модификации, например модификации посредством образования связей с незаряженными веществами (например, метилфосфонатами, фосфотриэфирами, фосфоамидатами, карбаматами и т.д.) и посредством образования связей с заряженными веществами (например, с фосфоротиоатами, фосфородитиоатами и т.д.), модификацию посредством выступающих групп, например, таких как белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации посредством интеркалирующих веществ (например, акридина, псоралена и т.д.), модификации посредством хелатирующих агентов (например, металлов, радиоактивных металлов, бора, окислительных металлов и т.д.), модификации посредством алкилирующих веществ, модификации посредством модифицированных связей (например, посредством альфа-аномерных нуклеиновых кислот, и т.д.), а также немодифицированных форм полинуклеотида(ов). Кроме того, любую гидроксильную группу, представленную в сахарах, можно замещать, например, фосфонатными группами, фосфатными группами, защищенными стандартными защитными группами, или ее можно активировать для получения дополнительных связей с дополнительными нуклеотидами, или ее можно конъюгировать с твердой или полутвердой подложкой. 5'- и 3'-концевой OH может быть фосфорилированным или замещенным группами замещенных аминов или органической образующей кэп группой из от 1 до 20 атомов углерода. Другие гидроксилы также можно преобразовывать в стандартные защитные группы. Полинуклеотиды также могут содержать формы аналогов сахаров рибозы или дезоксирибозы, которые широко известны в данной области, включая, например, 2'-O-метил-, 2'-O-аллил-, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги сахаров, альфа-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилоза или ликсоза, сахара на основе пиранозы, сахара на основе фуранозы, седогептулозу, ациклические аналоги и аналоги нуклеозидов без основания, такие как метилрибозид. Одна или несколько фосфодиэфирных связей могут быть замещены альтернативными связывающими группами. Эти альтернативные связывающие группы включают в себя, но не ограничиваются ими, варианты осуществления, где фосфат замещен P(O)S ("тиоатом"), P(S)S ("дитиоатом"), (O)NR.sub.2 ("амидатом"), P(O)R, P(O)OR'; CO или CH.sub.2 ("формацеталь"), в которых каждый R или R' независимо представляет собой H или замещенный или незамещенный алкил (1-20 C.), необязательно содержащий либо связь (-O-), либо арил, алкенил, циклоалкил, циклоалкенил или аралдил. Не все связи в полинуклеотиде должны быть идентичными. Представленное выше описание относится ко всем полинуклеотидам, указанным в настоящем описании, включая РНК и ДНК.
Как используют в настоящем описании, "олигонуклеотид", главным образом, относится к коротким, главным образом, одноцепочечным, главным образом, синтетическим, полинуклеотидам, длина которых, как правило, но не обязательно, составляет менее чем приблизительно 200 нуклеотидов. Термины "олигонуклеотид" и "полинуклеотид" не являются взаимоисключающими. Представленное выше описание полинуклеотидов является в равной степени и полностью применимым для олигонуклеотидов.
Термин "фактор роста гепатоцитов" или "HGF", как используют в настоящем описании, относится, если нет иных указаний, к любому природному полипептиду HGF или его варианту (как к природному, так и к синтетическому), который способен активировать каскад передачи сигнала HGF/c-met в условиях, которые позволяют осуществление этого процесса. Термин "HGF дикого типа", главным образом, относится к полипептиду, содержащему аминокислотную последовательность природного белка HGF. Термин "последовательность HGF дикого типа", главным образом, относится к аминокислотной последовательности природного HGF. C-met (или Met) представляет собой известный рецептор для HGF, посредством которого биологически осуществляется внутриклеточная передача сигнала HGF. Белковая последовательность c-met человека дикого типа, исходя из RefSeq NM_000245, представлена на фиг. 8.
Как используют в настоящем описании, термины "участок сплайсинга", "точка сплайсинга", "точка ветвления", "полипиримидиновый тракт" обладают значениями, известными в данной области в отношении сплайсинга РНК у млекопитающих, в частности человека. См., например, Pagani & Baralle, Nature Reviews: Genetics (2004), 5:389-396, и приведенные в ней ссылки. В качестве пригодной ссылки, один вариант осуществления последовательностей для элементов сплайсинга РНК c-met иллюстративно представлен на фиг.7.
Подразумевают, что термин "клетка-хозяин" (или "рекомбинантная клетка-хозяин"), как используют в настоящем описании, относится к клетке, которая генетически изменена или является способной к генетическому изменению посредством введения экзогенного полинуклеотида, такого как рекомбинантная плазмида или вектор. Следует понимать, что такие термины предназначены для указания не только на данную конкретную клетку, но и на потомство такой клетки. Вследствие того что в последующих поколениях могут возникать определенные модификации вследствие либо мутации, либо влияния окружающих условий, такой потомок, в действительности, может быть не идентичным родительской клетке, однако, тем не менее, он относится к объему термина "клетка-хозяин", как используют в настоящем описании.
"Антитела" (Ab) и "иммуноглобулины" (Ig) представляют собой гликопротеины, обладающие одинаковыми структурными характеристиками. В то время как антитела проявляют специфичность в отношении связывания со специфичным антигеном, иммуноглобулины включают в себя как антитела, так и другие подобные антителам молекулы, которые, как правило, лишены специфичности в отношении антигена. Полипептиды последнего типа, например, продуцируются на низких уровнях лимфатической системой и на повышенных уровнях миеломами.
Термины "антитело" и "иммуноглобулин" используют взаимозаменяемо в наиболее широком значении и включают в себя моноклональные антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, моновалентные антитела, поливалентные антитела, полиспецифичные антитела (например, биспецифичные антитела, при условии, что они проявляют требуемую биологическую активность), а также могут включать в себя определенные фрагменты антител (как описано в настоящем описании более подробно). Антитело может представлять собой химерное антитело, антитело человека, гуманизированное антитело и/или полученное посредством созревания аффинности.
"Фрагменты антител" содержат только часть интактного антитела, где часть предпочтительно сохраняет по меньшей мере одну, предпочтительно большую часть или все функции, в норме ассоциированные с этой частью, когда она находится в интактном антителе. В одном варианте осуществления фрагмент антитела содержит антигенсвязывающий участок интактного антитела и, таким образом, сохраняет способность связывать антиген. В другом варианте осуществления фрагмент антитела, например фрагмент, который содержит Fc-участок, сохраняет по меньшей мере одну биологическую функцию, в норме ассоциированную с Fc-участком, когда он находится в интактном антителе, такую как связывание FcRn, модулирование времени полужизни антитела, функция ADCC и связывание комплемента. В одном варианте осуществления фрагмент антитела представляет собой моновалентное антитело, которое обладает временем полужизни in vivo, по существу аналогичным времени полужизни интактного антитела. Например, такие фрагменты антител могут содержать антигенсвязывающую часть, связанную с последовательностью Fc, способной обеспечивать стабильность фрагмента in vivo.
Как используют в настоящем описании, термин "гипервариабельный участок", "HVR" или "HV" относится к участкам вариабельного домена антитела, последовательность которых является гипервариабельной и/или которые формируют определенные по своей структуре петли. Буквы "HC" и "LC" перед термином "HVR" или "HV" относятся соответственно к HVR или HV тяжелой цепи и легкой цепи. Как правило, антитела содержат шесть гипервариабельных участков; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). Применяют ряд обозначений гипервариабельного участка и они включены в настоящее описание. Определяющие комплементарность участки (CDR) по Kabat используют, исходя из вариабельности последовательностей, и их применяют наиболее широко (Kabat et al, Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Вместо этого в отношении расположения структурных петель ссылаются на Chothia (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). Гипервариабельные участки AbM представляют собой компромисс между CDR Kabat и структурными петлями Chothia, и они используются в программном обеспечении для модулирования антител Oxford Molecular's AbM. В основе "контактных" гипервариабельных участков лежит анализ доступных комплексных кристаллических структур. Остатки из каждого из этих гипервариабельных участков указаны ниже.
Остатки "каркасной области" или "FR" представляют собой остатки вариабельного домена, отличные от остатков гипервариабельного участка, как определено в настоящем описании.
"Вариабельный участок" или "вариабельный домен" антитела относится к амино-концевым доменам тяжелой или легкой цепи антитела. Эти домены, главным образом, представляют собой наиболее вариабельные части антитела и содержат антигенсвязывающие участки.
Как используют в настоящем описании, термин "моноклональное антитело" относится к антителу, полученному из совокупности по существу гомогенных антител, т.е. отдельные антитела, составляющие совокупность, являются идентичными, за исключением возможных природных мутаций, которые могут быть представлены в небольших количествах. Моноклональные антитела являются высоко специфичными и направлены против одного антигена. Более того, в противоположность препаратам поликлонального антитела, которые, как правило, включают в себя различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене.
В рамках настоящего описания конкретно моноклональные антитела включают в себя "химерные" антитела, в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям в антителах из конкретных видов или относится к конкретному классу или подклассу антител, в то время как оставшаяся часть цепи(ей) является идентичной или гомологичной соответствующим последовательностям в антителах из другого вида или относится к другому классу или подклассу антитела, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (патент США No. 4816567; и Morrison et al., Proc. Natl. Acad. Sci USA 81:6851-6855 (1984)).
"Гуманизированные" формы не являющихся человеческими (например, мышиных) антител представляют собой химерные антитела, которые содержат минимальную последовательность, источником которой является не являющийся человеческим иммуноглобулин. В большинстве случаев гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельного участка реципиентного антитела замещены остатками из гипервариабельного участка не относящихся к человеку видов (донорное антитело), таких как мышь, крыса, кролик или не относящийся к человеку примат, обладающими требуемой специфичностью, аффинностью и емкостью. В некоторых примерах остатки каркасной области (FR) иммуноглобулина человека замещены соответствующими не являющимися человеческими остатками. Более того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются в реципиентном антителе или в донорном антителе. Эти модификации проводят для дальнейшего проведения очистки антитела. Как правило, гуманизированное антитело содержит по существу все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют петлям не являющегося человеческим иммуноглобулина, и все или по существу все из FR представляют собой FR последовательности иммуноглобулина человека. Гуманизированное антитело также необязательно содержит по меньшей мере часть константного участка иммуноглобулина (Fc), как правило, константного участка иммуноглобулина человека. Для более подробного описания, см. Jones et al, Nature 321:522-525 (1986); Riechmann et al, Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). См. также следующие обзорные статьи и ссылки, приведенные в них: Vaswani and Hamilton, Ann. Allergy, Astma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994).
"Антитело человека" представляет собой антитело, которое обладает аминокислотной последовательностью, которая соответствует последовательности антитела, продуцируемого в организме человека и/или полученного с использованием любого из способов получения антител человека, как описано в настоящем описании. Это определение антитела человека, в частности, не включает в себя гуманизированное антитело, содержащее не являющиеся человеческими антигенсвязывающие остатки.
Антитело, "полученное посредством созревания аффинности" представляет собой антитело с одним или несколькими изменениями в одном или нескольких их CDR/HVR, которые приводят к повышению аффинности антитела в отношении антигена по сравнению с исходным антителом, которое не обладает этим изменением(ями). Предпочтительные полученные посредством созревания аффинности антитела обладают наномолярной или даже пикомолярной аффинностью к антигену-мишени. Антитела, полученные посредством созревания аффинности, получают способами, известными в данной области. В Marks et al. Bio/Technology 10:779-783 (1992) описано созревание аффинности посредством перестановки доменов VH и VL. Случайный мутагенез остатков CDR/HVR и/или каркасного участка описан: Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al, J. Immunol. 154(7):3310-9 (1995); и Hawkins et al, J. Mol. Biol. 226:889-896 (1992).
Термин "Fc-участок" используют для определения C-концевого участка тяжелой цепи иммуноглобулина, который можно получать посредством расщепления папаином интактного антитела. Fc-участок может представлять собой Fc-участок с природной последовательностью или вариант Fc-участка. Несмотря на то что границы Fc-участка тяжелой цепи иммуноглобулина могут варьировать, Fc-участок тяжелой цепи IgG человека, как правило, определяется как участок от аминокислотного остатка в положении приблизительно Cys226 или от приблизительно положения Pro230 до C-конца Fc-участка. Fc-участок иммуноглобулина обычно содержит два константных домена, домен CH2 и домен CH3, и необязательно содержит домен CH4. В рамках настоящего описания под "цепью Fc-участка" подразумевают одну из двух полипептидных цепей Fc-участка.
Как используют в настоящем описании, термин "цитотоксическое вещество" относится к веществу, которое ингибирует или препятствует функционированию клеток и/или вызывает разрушение клеток. Подразумевают, что термин включает в себя радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu), химиотерапевтические средства и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины, источником которых являются бактерии, грибы, растения или животные, включая их фрагменты и/или варианты.
"Химиотерапевтическое средство" представляет собой химическое соединение, пригодное для лечения злокачественной опухоли. Примеры химиотерапевтических средств включают в себя алкилирующие средства, такие как тиотепа и циклофосфамид ЦИТОКСАН®; алкилсульфонаты, такие как бисульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогинины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, МАРИНОЛ®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (ГИКАМТИН®), CPT-11 (иринотекан, КАМПТОСАР®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамина оксида гидрохлорид, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урацила иприт; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма1I и калихеамицин омегаI1 (см., например, Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также хромофор неокарциностатин и сходные с ним хромофоры хромопротеиновых энедииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая АДРИАМИЦИН®, морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин, липосомальную инъекцию доксорубицин HCl (ДОКСИЛ®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (ГЕМЗАР®), тегафур (УФТОРАЛ®), капецитабин (КСЕЛОДА®), эпотилон, и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; антиадреналовые вещества, такие как аминоглутетимид, митотан, трилостан; наполнитель на основе фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; эльфорнитин; эллиптиния ацетат; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (особенно токсин T-2, верракурин A, роридин A и ангвидин); уретан; виндезин (ЭЛДИЗИН®, ФИЛДЕЗИН®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); тиотепа; таксоиды, например, паклитаксел (ТАКСОЛ®), сконструированный на основе альбумина состав паклитаксела (АБРАКСАН™), и доксетаксела, (ТАКСОТЕР®); хлоранбуцил; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (ВЕЛБАН®); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ОНКОВИН®); оксалиплатин; лейкововин; винорелбин (НАВЕЛБИН®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; фармацевтически приемлемые соли, кислоты или производные любого из указанных выше; а также сочетания двух или более из указанных выше, такие как CHOP, сокращение для сочетанной терапии из циклофосфамида, доксорубицина, винкристина и преднизолона, и FOLFOX, сокращение для схемы лечения оксалиплатином (ЭЛОКСАТИН™), в сочетании с 5-FU и лейкововином.
Также к этому определению относятся антигормональные средства, которые действуют посредством регуляции, снижения, блокирования или ингибирования эффектов гормонов, которые могут обеспечивать рост злокачественной опухоли, и часто представляют собой системное лечение, или лечение во всем организме. Они сами по себе могут представлять собой гормоны. Примеры включают в себя анти-эстрогены и селективные модуляторы рецептора для эстрогена (SERM), включая, например, тамоксифен (включая НОЛВАДЕКС® тамоксифен), ралоксифен (ЭВИСТА®), дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (ФАРЕСТОН®); антипрогестероны; отрицательные регуляторы рецептора для эстрогена (ERD); антагонисты рецептора для эстрогена, такие как фулвестрант (ФАСЛОДЕКС®); вещества, которые выполняют функцию подавления или прекращения работы яичников, например агонисты рилизинг-фактора лютеинизирующего (LHRH), такие как леупролида ацетат (ЛУПРОН® и ЭЛИГАРД®), гозерелина ацетат, бузерелина ацетат и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует продукцию эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, мегестрола ацетат (МЕГЕЙС®), экземестан (АРОМАСИН®), форместан, фадрозол, ворозол (РИВИЗОР®), лектрозол (ФЕМАРА®) и анастрозол (АРИМИДЕКС®). Кроме того, к такому определению химиотерапевтических средств относятся бифосфонаты, такие как клодронат (например, БОНЕФОС® или ОСТАК®), этидронат (ДИДРОКАЛ®), NE-58095, золедроновая кислота/золедронат (ЗОМЕТА®), алендронат (ФОСАМАКС®), памидронат (АРЕДИЯ®), тилудронат (СКЕЛИД®) или ризедронат (АКТОНЕЛ®); а также троксацитабин (1,3-диоксолановый аналог нуклеозида цитозина); антисмысловые олигонуклеотиды, в частности олигонуклеотиды, которые ингибируют экспрессию генов каскадов передачи сигнала, вовлеченных в нарушенную пролиферацию клеток, например, таких как PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина ТЕРАТОП® и вакцины для генной терапии, например вакцина АЛЛОВЕКТИН®, вакцина ЛЕУВЕКТИН® и вакцина ВАКСИД®; ингибитор топоизомеразы 1 (например, ЛУРТОТЕКАН®); rmRH (например, АБАРЕЛИКС®); лапатиниба дитозилат (двойной низкомолекулярный ингибитор тирозинкиназы ErbB-2 и EGFR, также известный как GW572016); ингибиторы COX-2, такие как целекоксиб (ЦЕЛЕБРЕКС®); 4-(5-(4-метилфенил)-3-(трифторметил)-1H-пиразол-1-ил)бензолсульфонамид; и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше.
"Блокирующее" антитело или антитело-"антагонист" представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, который оно связывает. Такое блокирование может происходить любыми способами, например посредством препятствования белок-белковому взаимодействию, такому как связывание лиганда с рецептором. В одном варианте осуществления блокирующие антитела или антитела-антагонисты по существу или полностью ингибируют биологическую активность антигена.
Термины "злокачественная опухоль" и "злокачественный" относятся к физиологическому состоянию или описывают физиологическое состояние у млекопитающих, которое, как правило, характеризуется нерегулируемым клеточным ростом/пролиферацией. Примеры злокачественной опухоли включают в себя, но не ограничиваются ими, карциному, лимфому (например, лимфому Ходжкина и неходжкинскую лимфому), бластому, саркому и лейкоз. Более конкретные примеры таких злокачественных опухолей включают в себя плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточный рак легкого, злокачественную опухоль брюшины, печеночно-клеточный рак, злокачественную опухоль желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстого кишечника, рак ободочной и прямой кишки, карциному эндометрия или матки, карциному слюнной железы, рак почки, рак печени, рак предстательной железы, рак женских наружных половых органов, рак щитовидной железы, карциному печени и различные типы рака головы и шеи.
Как используют в настоящем описании "лечение" относится к клиническому вмешательству в попытках изменения естественного течения жизни индивидуума или клетки, подвергаемой лечению, и его можно проводить либо для профилактики, либо при клинической патологии. Требуемые эффекты лечения включают в себя профилактику возникновения или рецидива заболевания, смягчение симптомов, уменьшение любого прямого или непрямого патологического следствия заболевания, предотвращение метастазирования, снижение скорости прогрессирования заболевания, смягчение или временное облегчение болезненного состояния и ремиссию или улучшение прогноза. В некоторых вариантах осуществления модулирующие молекулы и способы по этому изобретению используют для замедления развития заболевания или нарушения.
"Эффективное количество" относится к количеству, эффективному в отношении достижения требуемого терапевтического или профилактического результата, в необходимых дозах и в течение необходимых периодов времени. "Терапевтически эффективное количество" лекарственного средства может варьировать в зависимости от факторов, таких как болезненное состояние, возраст, пол и масса тела индивидуума и способности антитела вызывать требуемый ответ у индивидуума. Терапевтически эффективное количество также представляет собой количество, в котором благоприятные эффекты преобладают над любыми токсическими или неблагоприятными эффектами лекарственного средства. "Профилактически эффективное количество" относится к количеству, эффективному в отношении достижения требуемого профилактического результата, в необходимых и дозах и в течение необходимого периода времени. Как правило, но не обязательно, вследствие того, что профилактическую дозу используют у субъектов до заболевания или на ранней стадии заболевания, профилактически эффективное количество меньше, чем терапевтически эффективное количество.
Композиции и способы по этому изобретению
A. Антитела-антагонисты c-met
В одном варианте осуществления это изобретение относится к антителам-антагонистам c-met, которые могут быть применимыми здесь в качестве терапевтических и/или диагностических средств. Иллюстративные антитела включают в себя поликлональные, моноклональные, гуманизированные, биспецифичные и гетероконъюгированные антитела. Аспекты получения, идентификации, охарактеризации, модификации и получения антител являются общепринятыми в данной области, например, как описано в патентной заявке США No. 2005/0042216 в абзацах с 522 по 563, с 604 по 608, и с 617 по 688.
Антитела-антагонисты c-met, описанные в настоящем описании, можно составлять в пригодной форме для доставки в клетки-мишени/ткани-мишени. Например, антитела можно составлять в качестве иммунолипосом. "Липосома" представляет собой небольшую везикулу, состоящую из различных типов липидов, фосфолипидов и/или поверхностно-активных веществ, которые пригодны для доставки лекарственного средства млекопитающему. Компоненты липосомы обычно организованы в виде двухслойного образования, сходного с липидной организацией мембран. Липосомы, содержащие антитело, получают способами, известными в данной области, такими как описано в Epstein et al., Proc. Natl. Acad. Sci. USA 82:3688 (1985); Hwang et al., Proc. Natl Acad. Sci. USA 77:4030 (1980); патенте США No. 4485045 и 4544545; и WO97/38731, опубликованной 23 октября 1997 года. Липосомы с повышенным временем циркуляции описаны в патенте США No. 5013556.
Особенно пригодные липосомы можно получать посредством способа обращенно-фазового выпаривания с липидной композицией, содержащей фосфатидилхолин, холестерин и образованное посредством PEG производное фосфатидилэтаноламина (PEG-PE). Липосомы пропускают через фильтры с определенным размером пор с получением липосом с требуемым диаметром. Fab'-фрагменты антитела по настоящему изобретению можно конъюгировать с липосомами, как описано в Martin et al., J. Biol. Chem. 257:286-288 (1982), посредством реакции дисульфидного обмена. Липосома необязательно содержит химиотерапевтическое средство. См. Gabizon et al., J. National Cancer Inst. 81(19):1484 (1989).
B. Полипептиды-антагонисты c-met
В одном аспекте антагонист c-met по этому изобретению содержит полипептид. В одном варианте осуществления полипептид-антагонист связывается гиперстабилизированным белком c-met в клетке и/или оказывает антагонистическое воздействие на него. В одном варианте осуществления полипептиды связываются, предпочтительно специфично, с гиперстабилизированным c-met. Полипептиды можно химически синтезировать с использованием известных способов синтеза пептидов или их можно получать и очищать с использованием рекомбинантной технологии. В одном варианте осуществления длина полипептида-антагониста c-met составляет по меньшей мере приблизительно 5 аминокислот, альтернативно длина составляет по меньшей мере приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислот или более, где такие полипептиды способны ингибировать активность гиперстабилизированного c-met. Эти полипептиды можно идентифицировать без излишнего экспериментирования с использованием хорошо известных способов. При этом следует отметить, что способы скрининга олигопептидных библиотек для олигопептидов, которые способны специфично связываться с полипептидной мишенью, хорошо известны в данной области (см., например, патенты США No. 5556762, 5750373, 4708871, 4833092, 5223409, 5403484, 5571689, 5663143; публикации PCT No. WO 84/03506 и WO84/03564; Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 81:3998-4002 (1984); Geysen et al., Proc. Natl. Acad. Sci. U.S.A., 82:178-182 (1985); Geysen et al., в Sinthetic Peptides as Antigens, 130-149 (1986); Geysen et al., J. Immunol. Meth., 102:259-274 (1987); Schoofs et al., J. Immunol., 140:611-616 (1988), Cwirla, S. E. et al. (1990) Proc. Natl. Acad. Sci. USA. 87:6378; Lowman, H.B. et al. (1991) Biochemistry. 30:10832; Clackson, T. et al. (1991) Nature. 352: 624; Marks, J. D. et al. (1991), J. Mol. Biol. 222:581; Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA. 88:8363, и Smith, G. P. (1991) Current Opin. Biotechnol., 2:668).
Бактериофаговый (фаговый) дисплей представляет собой один хорошо известный способ, который позволяет проводить скрининг крупных олигопептидных библиотек с целью выявления члена(ов) этих библиотек, которые способны специфично связываться с полипептидной мишенью. Фаговый дисплей представляет собой способ, в котором варианты полипептидов воспроизводятся в качестве слитых белков в белок оболочки на поверхности частиц бактериофага (Scott, J.K. and Smith, G. P. (1990) Science, 249: 386). В основе полезности фагового дисплея лежит тот факт, что в крупных библиотеках селективно рандомизированных вариантов белков (или случайным образом клонированных кДНК) можно быстро и эффективно отсортировать последовательности, которые связываются с молекулой-мишенью с высокой аффинностью. Дисплей пептидных (Cwirla, S.E. et al. (1990) Proc. Natl. Acad. Sci. USA. 87:6378) или белковых (Lowman, H.B. et al. (1991) Biochemistry. 30:10832; Clackson, T. et al. (1991) Nature. 352: 624; Marks, J. D. et al. (1991), J. Mol Biol, 222:581; Kang, A.S. et al. (1991) Proc. Natl. Acad. Sci. USA. 88:8363) библиотек в фаге использовали для скрининга миллионов полипептидов или олигопептидов на полипептиды или олигопептиды со свойствами в отношении специфичного связывания (Smith, G. P. (1991) Current Opin. Biotechnol., 2:668). Сортировка фаговых библиотек случайных мутантных форм требует стратегии для конструирования и воспроизведения большого количества вариантов, способа аффинной очистки с использованием рецептора-мишени и способов для оценки результатов в виде повышения связывания. Патенты США No. 5223409, 5403484, 5571689 и 5663143.
Несмотря на то что для большинства способов фагового дисплея используют нитчатые фаги, также известны системы для дисплея в лямбдоидных фагах (WO 95/34683; U.S. 5627024), системы для дисплея фага T4 (Ren et al., Gene. 215: 439 (1998); Zhu et al., Cancer Research. 58(15): 3209-3214 (1998); Jiang et al., Infection & Immunity. 65(11): 4770-4777 (1997); Ren et al., Gene, 195(2):303-311 (1997); Ren, Protein Sci., 5: 1833 (1996); Efimov et al., Virus Genes. 10: 173 (1995)) и системы для дисплея в фаге T7 (Smith and Scott, Methods in Enzymology, 217: 228-257 (1993); U.S. 5766905).
К настоящему времени разработано множество других усовершенствований и вариантов основной концепции фагового дисплея. Эти усовершенствования повышают возможность проведения скрининга пептидных библиотек посредством систем для дисплея на связывание определенных молекул-мишеней и воспроизведения функциональных белков с возможным скринингом этих белков на требуемые свойства.
Разработаны комбинаторные устройства для реакции для проведения реакций фагового дисплея (WO 98/14277), и библиотеки для фагового дисплея использовали для анализа и контроля бимолекулярных взаимодействий (WO 98/20169; WO 98/20159) и свойств ограниченных пептидов в форме спирали (WO 98/20036). В WO 97/35196 описан способ выделения аффинного лиганда, в котором библиотеку для фагового дисплея контактируют с первым раствором, в котором лиганд связывается с молекулой-мишенью, и вторым раствором, в котором аффинный лиганд не связывается с молекулой-мишенью, с селекивным выделением связывающихся лигандов. В WO 97/46251 описан способ биологического пэннинга случайной библиотеки для фагового дисплея посредством очищенного аффинным способом антитела с последующим выделением связанного фага, с последующим процессом микропэннинга с использованием лунок микропланшета с выделением связавшегося с высокой аффинностью фага. Также описано применение белка A Staphylococcus aureus в качестве аффинной метки (Li et al. (1998) Mol Biotech., 9: 187). В WO 97/47314 описано применение библиотек с удалением субстрата для определения специфичности фермента с использованием комбинаторной библиотеки, которая может представлять собой библиотеку для фагового дисплея. Способ для отбора ферментов, пригодных для применения в детергентах с использованием фагового дисплея, описан в WO 97/09446. Дополнительные способы отбора специфичных белков для связывания описаны в патентах США No. 5498538, 5432018 и WO 98/15833.
Способы получения пептидных библиотек и скрининга этих библиотек также описаны в патентах США No. 5723286, 5432018, 5580717, 5427908, 5498530, 5770434, 5734018, 5698426, 5763192 и 5723323.
Способы получения, идентификации, охарактеризации, модификации и получения полипептидов-антагонистов являются общепринятыми в данной области, например, как описано в публикации патентной заявки США No. 2005/0042216 в абзацах с 606 по 608, с 614 по 688.
В одном варианте осуществления полипептиды для антагонистического воздействия на активность гиперстабилизированного c-met можно сконструировать, исходя из структуры гиперстабилизированного белка c-met, например, посредством скрининга на основе антигена-мишени, содержащего мутантную околомембранную последовательность c-met, содержащую делецию по меньшей мере части экзона 14, как описано в настоящем описании. Например, антиген-мишень может содержать полипептид, содержащий последовательность, полученную в результате сплайсинга в рамке считывания экзонов 13 и 15 c-met.
C. Иммуноконъюгаты
В другом аспекте это изобретение относится к иммуноконъюгатам или конъюгатам антитело-лекарственное средство (ADC), содержащим антитело, конъюгированное с цитотоксическим веществом, таким как химиотерапевтическое средство, лекарственное средство, ингибирующее рост вещество, токсин (например, ферментативно активный токсин, источником которого являются бактерии, грибы, растения или животные, или его фрагменты) или радиоактивный изотоп (т.е. радиоконъюгат).
Применение конъюгатов антитело-лекарственное средство для местной доставки цитотоксических или цитостатических веществ, т.е. лекарственных средств для уничтожения или ингибирования опухолевых клеток, для лечения злокачественной опухоли (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26: 151-172; патент США 4975278) обеспечивает направленную доставку лекарственного вещества в опухоли и внутриклеточное накопление в ней, где системное введение этих неконъюгированных лекарственных средств может приводить к неприемлемым уровням токсичности в отношении нормальных клеток, а также клеток опухоли, которые стремятся элиминировать (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986):603-05; Thorpe, (1985) "Antibody Carriers Of Cytotoxic agents In Cancer Therapy: A Review", в Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al. (ed.s), pp. 475-506). Таким образом, стремятся достичь максимальной эффективности при минимальной токсичности. Как поликлональные антитела, так и моноклональные антитела были описаны как пригодные для этих стратегий (Rowland et al., (1986) Cancer Immunol. Immunother., 21:183-87). Лекарственные средства, используемые в этих способах, включают в себя дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., (1986) выше). Токсины, используемые в конъюгатах антитело-токсин, включают в себя бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Mandler et al (2000) Jour. of the Nat. Cancer Inst. 92(19):1573-1581 ; Mandler et al (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al (2002) Bioconjugate Chem. 13:786-791), майтанзиноиды (EP 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) и калихеамицин (Lode et al (1998) Cancer Res. 58:2928; Hinman et al (1993) Cancer Res. 53:3336-3342). Токсины могут оказывать их цитотоксические и цитостатические эффекты посредством механизмов, включающих в себя связывание тубулина, связывание ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства могут становиться неактивными или менее активными при конъюгации с крупными антителами или лигандами белковых рецепторов.
ЗЕВАЛИН® (ибритумомаб тиуксетан, Biogen/Idec) представляет собой конъюгат антитело-радиоактивный изотоп, состоящий из моноклонального антитела IgG1 каппа мыши, направленного против антигена CD20, находящегося на поверхности нормальных и злокачественных B-лимфоцитов, и радиоизотопа111In или90Y, присоединенного посредством линкера-хелатора тиомочевины (Wiseman et al (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al (2002) Blood 99(12):4336-42; Witzig et al (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al (2002) J. Clin. Oncol. 20(15):3262-69). Несмотря на то что ЗЕВАЛИН обладает активностью против B-клеточной неходжскинской лимфомы (NHL), его введение приводит к тяжелым и длительным цитопениям у большинства пациентов. МИЛОТАРГ™ (гемтузумаб озогамицин, Wyeth Pharmaceuticals), конъюгат антитело-лекарственное средство, состоящий из антитела hu CD33, связанного с калихеамицином, был одобрен в 2000 году для лечения острого миелоидного лейкоза посредством инъекции (Drugs of the Future (2000) 25(7):686; патенты США No. 4970198; 5079233; 5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Кантузумаб мертанзин (Immunogen, Inc.), конъюгат антитело-лекарственное средство, состоящий из антитела huC242, связанного посредством дисульфидного линкера SPP с лекарственным веществом на основе майтанзиноида, DM1, тестируют для лечения злокачественных опухолей, которые экспрессируют CanAg, таких как опухоли толстого кишечника, поджелудочной железы, желудка и другие. MLN-2704 (Millennium Pharm., BZL Biologics, Immunogen Inc.), конъюгат антитело-лекарственное средство, состоящий из моноклонального антитела против простатспецифического мембранного антигена (PSMA), связанного с лекарственным веществом на основе майтанзиноида, DM1, тестируют для возможного лечения опухолей простаты. Пептиды ауристатина, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина, конъюгировали с химерными моноклональными антителами cBR96 (специфичными в отношении Lewis Y в карциномах) и cAC10 (специфичными в отношении CD30 в гематологических опухолях) (Doronina et al (2003) Nature Biotechnology 21(7):778-784), и они находятся в терапевтической разработке.
Химиотерапевтеческие средства, пригодные для получения иммуноконъюгатов, описаны в настоящем описании (выше). Ферментативно активные токсины и их фрагменты, которые можно использовать, включают в себя A-цепь дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, A-цепь экзотоксина (из Pseudomonas aeruginosa), A-цепь рицина, A-цепь абрина, A-цепь модецина, альфа-сарцин, белки тунга Форда, белки диантина, белки американского лаконоса (PAPI, PAPII и PAP-S), ингибитор момордики харантии, курцин, кротин, ингибитор мыльнянки лекарственной, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены. См., например, WO 93/21232, опубликованную 28 октября 1993 года. Для получения радиоконъюгированных антител доступно множество радионуклидов. Примеры включают в себя212Bi,131I,131In,90Y и186Re. Конъюгаты антитела и цитотоксического вещества получают с использованием множества бифункциональных веществ для присоединения белков, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как 2,6-диизоцианат толуола) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин можно получать, как описано в Vitetta et al., Science, 238: 1098 (1987). Меченная углеродом 14 1-изотиоцианатбензил-3-метилдиэтилентриаминопентауксусная кислота (MX-DTPA) представляет собой иллюстративный хелатирующий агент для конъюгации радионуклида с антителом. См. WO94/11026.
Также в настоящем описании предусмотрены конъюгаты антитела и одного или нескольких низкомолекулярных токсинов, таких как калихеамицин, майтанзиноиды, долостатины, ауростатины, трихотецен и CC1065, и производные этих токсинов, которые обладают активностью токсинов.
Майтанзин и майтанзиноиды
В некоторых вариантах осуществления иммуноконъюгат содержит антитело по этому изобретению, конъюгированное с одним или несколькими молекулами майтанзиноида.
Майтанзиноиды представляют собой ингибиторы митоза, которые действуют посредством ингибирования полимеризации тубулина. Впервые майтанзин был выделен из восточно-африканского кустарника Maytenus serrata (патент США No. 3896111). Затем было обнаружено, что определенные микроорганизмы также продуцируют майтанзиноиды, такие как майтанзинол и C-3 сложные эфиры майтанзинола (патент США No. 4151042). Синтетический майтанзинол и его производные и аналоги описаны, например, в патентах США No. 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533.
Лекарственные вещества на основе майтанзиноида представляют собой привлекательные лекарственные вещества в конъюгатах антитело-лекарственное средство вследствие того, что они: (i) являются относительно поддающимися получению ферментацией или химической модификацией, образованием производных продуктов ферментации, (ii) являются поддающимися преобразованию в производное посредством функциональных групп, пригодных для конъюгации с антителами посредством не-дисульфидных линкеров, (iii) стабильны в плазме и (iv) эффективны против различных опухолевых клеточных линий.
Иллюстративные варианты осуществления молекул лекарственных веществ на основе майтанзиноидов включают в себя: DM1; DM3 и DM4. Иммуноконъюгаты, содержащие майтанзиноиды, способы их получения и их терапевтическое применение описано, например, в патентах США No. 5208020, 5416064 и европейском патенте EP 0425235 B1, описания которых прямо включены в настоящее описание в качестве ссылок. В Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996) описаны иммуноконъюгаты, содержащие майтанзиноид, обозначаемый как DM1, связанный с моноклональным антителом C242, направленным против рака ободочной и прямой кишки человека. Было обнаружено, что конъюгат является высоко цитотоксичным в отношении культивируемых клеток рака толстого кишечника, и для него была показана противоопухолевая активность в анализе роста опухоли in vivo. В Chari et al., Cancer Research 52:127-131 (1992) описаны иммуноконъюгаты, в которых майтанзиноид конъюгировали посредством дисульфидного линкера с антителом A7 мыши, связывающимся с антигеном в клеточных линиях рака толстого кишечника человека, или с другим моноклональным антителом мыши TA.1, которое связывает онкоген HER-2/neu. Цитотоксичность конъюгата TA.1-майтанзиноид тестировали in vitro на клеточной линии рака молочной железы человека SK-BR-3, которая экспрессирует 3×105 поверхностных антигенов HER-2 на клетку. Конъюгат лекарственного средства достигал уровня цитотоксичности, аналогичного свободному лекарственному средству на основе майтанзиноида, который можно было повышать посредством повышения количества молекул майтанзиноида на молекулу антитела. Конъюгат A7-майтанзиноид показал низкую системную цитотоксичность у мышей.
Конъюгаты антитело-майтанзиноид можно получать посредством химического присоединения антитела к молекуле майтанзиноида без существенного снижения биологической активности либо антитела, либо молекулы майтанзиноида. См., например, патент США No. 5208020 (описание которого прямо включено в настоящее описание в качестве ссылки). Было показано, что в среднем 3-4 молекулы майтанзиноида, конъюгированные с одной молекулой антитела, являются эффективными в отношении повышения цитотоксичности клеток-мишеней без отрицательного воздействия на функцию или растворимость антитела, хотя можно было ожидать, что даже одна молекула токсин/антитело повысит цитотоксичность по сравнению с применением антитела отдельно. Майтанзиноиды хорошо известны в данной области, и их можно синтезировать известными способами или выделять из природных источников. Пригодные майтанзиноиды описаны, например, в патенте США No. 5208020 и в других патентах и непатентных публикациях, на которые ссылаются в настоящем описании выше. Предпочтительные майтанзиноиды представляют собой майтанзинол и аналоги майтанзинола, модифицированные в ароматическом кольце или в других положениях молекулы майтанзинола, такие как различные сложные эфиры майтанзинола.
Существует множество известных в данной области линкерных групп для получения конъюгатов антитело-майтанзиноид, включая, например, группы, описанные в патенте США No. 5208020 или патенте EP 0 425 235 B1, Chari et al., Cancer Research 52:127-131 (1992), и патентной заявке США No. 10/960602, поданной 8 октября 2004 года, описания которых прямо включены в настоящее описание в качестве ссылок. Конъюгаты антитело-майтанзиноид, содержащие линкерный компонент SMCC, можно получать, как описано в патентной заявке США No. 10/960602, поданной 8 октября 2004 года. Линкерные группы включают в себя дисульфидные группы, тиоэфирные группы, неустойчивые к кислотам группы, фотолабильные группы, неустойчивые к пептидазам группы или неустойчивые к эстеразам группы, как описано в указанных выше патентах, где дисульфидные и тиоэфирные группы являются предпочтительными. Дополнительные линкерные группы описаны и приведены в качестве примеров в настоящем описании.
Конъюгаты антитела и майтанзиноида можно получать с использованием множества бифункциональных веществ для присоединения белка, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как 2,6-диизоцианат толуола) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Особенно предпочтительные вещества для присоединения включают в себя N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 (1978)) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP) для обеспечения дисульфидной связи.
Линкер можно присоединять к молекуле майтанзиноида в различных положениях, в зависимости от типа связи. Например, сложноэфирную связь можно получать посредством проведения реакции с гидроксильной группой с использованием общепринятых способов присоединения. Реакция может проходить в положении C-3, имеющем гидроксильную группу, в положении C-14, модифицированном гидроксиметилом, в положении C-15, модифицированном гидроксильной группой и в положении C-20, имеющем гидроксильную группу. В предпочтительном варианте осуществления образование связи происходит в положении C-3 майтанзинола или аналога майтанзинола.
Ауристатины и долостатины
В некоторых вариантах осуществления иммуноконъюгат содержит антитело по этому изобретению, конъюгированное с доластатинами или пептидными аналогами и производными долостатина, ауристатинами (патенты США No. 5635483; 5780588). Было показано, что доластатины и ауристатины препятствуют динамике микротрубочек, гидролизу GTP и делению ядер и клеток (Woyke et al (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) и обладают противоопухолевой (US 5663149) и противогрибковой активностью (Pettit et al (1998) Antimicrob. Agents Chemother. 42:2961-2965). Молекулу лекарственного вещества на основе доластатина или ауристатина можно присоединять к антителу через N(амино)-конец или C(карбоксильный)-конец пептидного лекарственного вещества (WO 02/088172).
Иллюстративные варианты осуществления ауристатина включают в себя связанные с N-концом молекулы лекарственного вещества на основе монометилауристатина DE и DF, описанные в "Monomethylvaline Compounds Capable of Conjugation to Ligands", US Ser. No. 10/983340, поданной 5 ноября 2004 года, описание которой прямо включено в настоящее описание в качестве ссылки в полном объеме.
Иллюстративные варианты осуществления ауристатина представляют собой MMAE и MMAF. Дополнительные иллюстративные варианты осуществления, включающие в себя MMAE или MMAF и различные линкерные компоненты (описанные в настоящем описании далее), представляют собой Ab-MC-vc-PAB-MMAF, Ab-MC-vc-PAB-MMAE, Ab-MC-MMAE и Ab-MC-MMAF.
Как правило, лекарственные вещества на основе пептидов можно получать посредством образования пептидной связи между двумя или более аминокислотами и/или фрагментами пептидов. Такие пептидные связи можно получать, например, в соответствии со способом синтеза в жидкой фазе (см. E. Schroder and K. Lubke, "The Peptides", volume 1, pp 76-136, 1965, Academic Press), который хорошо известен в области химии пептидов. Лекарственные средства на основе ауристатина/доластатина можно получать в соответствии со способами в: US 5635483; US 5780588; Pettit et al (1989) J. Am. Chem. Soc. 111:5463-5465; Pettit et al (1998) Anti-Cancer Drag Design 13:243-277; Pettit, G.R., et al. Synthesis, 1996, 719-725; и Pettit et al (1996) J. Chem. Soc. Perkin Trans. 1 5:859-863. См. также Doronina (2003) Nat Biotechnol 21(7):778-784; "Monomethylvaline Compounds Capable of Conjugation to Ligands", US Ser. No. 10/983340, поданную 5 ноября 2004 года, включенную в настоящее описание в качестве ссылки в полном объеме (в которой описаны, например, линкеры и способы получения соединений монометилвалина, таких как MMAE и MMAF, конъюгированных с линкерами).
Калихеамицин
В других вариантах осуществления иммуноконъюгат содержит антитело по этому изобретению, конъюгированное с одной или несколькими молекулами калихеамицина. Антибиотики семейства калихеамицина способны вызывать двухцепочечные разрывы ДНК в субпикомолярных концентрациях. Для получения конъюгатов семейства калихеамицина, см. патенты США 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все выданы American Cyanamid Company). Структурные аналоги калихеамицина, которые можно использовать, включают в себя, но не ограничиваются ими, γ1I, α2I, α3I, N-ацетил-γ1I, PSAG и ΘI1 (Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) и вышеупомянутые патенты США, выданные American Cyanamid). Другое противоопухолевое лекарственное средство, с которым можно конъюгировать антитело, представляет собой QFA, который представляет собой антифолат. Как калихеамицин, так и QFA оказывают действие внутриклеточно и с трудом пересекают плазматическую мембрану. Таким образом, клеточный захват этих веществ посредством опосредуемой антителом интернализации значительно повышает их цитотоксические эффекты.
Другие цитотоксические вещества
Другие противоопухолевые средства, которые можно конъюгировать с антителами по этому изобретению, включают в себя BCNU, стрептозоицин, винкристин и 5-фторурацил, семейство веществ, в совокупности известное как комплекс LL-E33288, описанный в патентах США 5053394, 5770710, а также эсперамицины (патент США 5877296).
Ферментативно активные токсины и их фрагменты, которые можно использовать, включают в себя A-цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, A-цепь экзотоксина (из Pseudomonas aeruginosa), A-цепь рицина, A-цепь абрина, A-цепь модецина, альфа-сарцин, белки тунга Форда, белки диантина, белки американского лаконоса (PAPI, PAPII и PAP-S), ингибитор момордики харантии, курцин, кротин, ингибитор мыльнянки лекарственной, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены. См., например, WO 93/21232, опубликованную 28 октября 1993.
Кроме того, настоящее изобретение относится к иммуноконъюгату, образованному антителом и соединением с активностью в отношении нуклеализа (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
Для селективного разрушения опухоли антитело может содержать высоко радиоактивный атом. Для получения радиоконъюгированных антител доступно множество радиоактивных изотопов. Примеры включают в себя At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Если конъюгат используют для детекции, он может содержать радиоактивный атом для сцинтиграфических исследований, например tc99m или I123, или спиновую метку для визуализации посредством ядерного магнитного резонанса (ЯМР) (также известной как магнитно-резонансная томография, mri), такую как также иод-123, иод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки можно встраивать в конъюгат известными способами. Например, пептид можно биологически синтезировать или его можно синтезировать посредством химического синтеза аминокислот с использованием пригодных предшественников аминокислот, включающих в себя, например, фтор-19 вместо водорода. Метки, такие как tc99m или I123, Re186, Re188 и In111, можно присоединять с помощью остатка цистеина в пептиде. Иттрий-90 можно присоединять через остаток лизина. Для встраивания йода-123 можно использовать способ с ЙОДОГЕНОМ (Fraker et al (1978) Biochem. Biophys. Res. Commun. 80: 49-57). В "Monoclonal Antibodies in ImmunoScintigraphy" (Chatal, CRC Press 1989) подробно описаны другие способы.
Конъюгаты антитела и цитотоксического вещества можно получать с использованием множества бифункциональных веществ для присоединения белка, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как 2,6-диизоцианат толуола) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин можно получать, как описано в Vitetta et al., Science 238:1098 (1987). Меченная углеродом-14 1-изотиоцианатбензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой иллюстративный хелатирующий агент конъюгации радионуклеотида с антителом. См. WO94/11026. Линкер может представлять собой "расщепляемый линкер", облегчающий высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать неустойчивый к кислотам линкер, чувствительный к пептидазам линкер, фотолабильный линкер, диметиловый линкер или содержащий дисульфид линкер (Chari et al., Cancer Research 52:127-131 (1992); патент США No. 5208020).
Соединения по этому изобретению прямо включают в себя, но не ограничиваются ими, ADC, полученный с помощью реагентов для поперечного сшивания: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, от Pierce Biotechnology, Inc., Rockford, IL., U.S.A). См. стр. 467-498, 2003-2004 Applications Handbook and Catalog.
Получение конъюгатов антитело-лекарственное средство
В конъюгатах антитело-лекарственное средство (ADC) по этому изобретению антитело (Ab) конъюгировано с одной или несколькими молекулами лекарственного вещества (D), например приблизительно с от 1 до приблизительно 20 молекул лекарственного вещества на антитело, посредством линкера (L). ADC формулы I можно получать несколькими способами с применением реакций, условий и реагентов органической химии, известных специалистам в данной области, включая: (1) проведение реакции нуклеофильной группы антитела с двухвалентным линкерным реагентом, с образованием Ab-L, посредством образования ковалентной связи, с последующей реакцией с молекулой лекарственного вещества D; и (2) проведение реакции нуклеофильной группы молекулы лекарственного средства с двухвалентным линкерным реагентом, с образованием D-L, посредством образования ковалентной связи, с последующей реакцией с нуклеофильной группой антитела. Дополнительные способы получения ADC описаны в настоящем описании.
Ab-(L-D)p I
Линкер может состоять из одного или нескольких линкерных компонентов. Иллюстративные линкерные компоненты включают в себя 6-малеимидокапроил ("MC"), малеимидопропаноил ("MP"), валин-цитруллин ("val-cit"), аланин-фенилаланин ("ala-phe"), п-аминобензилоксикарбонил ("PAB"), N-сукцинимидил-4-(2-пиридилтио)пентаноат ("SPP"), карбоксилат N-сукцинимидил-4-(N-малеимидометил)циклогексана-1 ("SMCC") и N-сукцинимидил-(4-йод-ацетил)аминобензоат ("SIAB"). Дополнительные линкерные компоненты известны в данной области, и некоторые из них описаны в настоящем описании. См. также "Monomethylvaline Compounds Capable of Conjugation to Ligands", US Ser. No. 10/983340, поданная 5 ноября 2004 года, содержание которой включено в настоящее описании в качестве ссылки в полном объеме.
В некоторых вариантах осуществления линкер может содержать аминокислотные остатки. Иллюстративные аминокислотные линкерные компоненты включают в себя дипептид, трипептид, тетрапептид или пентапептид. Иллюстративные дипептиды включают в себя: валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe). Иллюстративные трипептиды включают в себя: глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотные остатки, которые содержат аминокислотный линкерный компонент, включают в себя остатки природного происхождения, а также минорные аминокислоты и неприродные аминокислотные аналоги, такие как цитруллин. Аминокислотные линкерные компоненты можно конструировать и оптимизировать с точки зрения их селективности в отношении ферментативного расщепления конкретными ферментами, например, ассоциированной с опухолью протеазой, катепсином B, C и D или протеазой плазмина.
Структуры иллюстративных линкерных компонентов представлены ниже (где волнистой линией показаны участки ковалентного присоединения других компонентов ADC):

Дополнительные иллюстративные линкерные компоненты и их сокращения включают в себя (где представлены антитело (Ab) и линкер, и p представляет собой от 1 до приблизительно 8):


Нуклеофильные группы на антителах включают в себя, но не ограничиваются ими: (i) N-концевые аминогруппы, (ii) аминогруппы боковых цепей, например, лизина, (iii) тиоловые группы боковых цепей, например, цистеина, и (iv) гидроксил или аминогруппы сахара, если антитело является гликозилированным. Амино, тиоловая и гидроксильная группы являются нуклеофильными и обладают способностью к реакции с образованием ковалентных связей с электрофильными группами на линкерных группах и линкерных реагентах, включающих в себя: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галоформиаты и галоидангидриды; (ii) алкил и бензилгалоиды, такие как галоацетамиды; (iii) альдегиды, кетоны, карбоксильную и малеимидную группы. Определенные антитела имеют поддающиеся восстановлению дисульфиды между цепями, т.е. цистеиновые мостики. Реакционно-способные антитела для конъюгации с линкерными реагентами можно получить посредством обработки восстановителем, таким как DTT (дитиотреитол). Теоретически, каждый цистеиновый мостик, таким образом, образует два реакционно-способных тиоловых нуклеофила. Дополнительные нуклеофильные группы можно вводить в антитела посредством реакции лизинов с 2-иминотиоланом (реагент Трота) с превращением в результате в тиол. Реакционно-способные группы тиола можно вводить в антитело (или его фрагмент) посредством введения одного, двух, трех, четырех или более остатков цистеина (например, получая мутантные антитела, содержащие один или несколько неприродных аминокислотных остатков цистеина).
Конъюгаты антитело-лекарственное средство по этому изобретению также можно получать посредством модификации антитела с введением электрофильных групп, которые могут реагировать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. Сахара гликозилированных антител можно окислять, например, посредством окислителей, представляющих собой периодаты, с образованием групп альдегида или кетона, которые могут реагировать с аминогруппой на линкерных реагентах или на молекулах лекарственного средства. Полученные иминогруппы шиффова основания могут образовывать стабильную связь, или их можно восстанавливать, например, посредством борогидридных реагентов с образованием стабильных связей с амином. В одном варианте осуществления в реакции углеводной части гликозилированного антитела либо с оксидазой галактозы, либо с мета-периодатом натрия можно получать карбонильные группы (группы альдегида и кетона) в белке, которые могут реагировать с соответствующими группами на лекарственном веществе (Hermanson, Bioconjugate Techniques). В другом варианте осуществления можно проводить реакцию белков, содержащих N-концевые остатки серина или треонина, с мета-периодатом натрия с получением альдегида вместо первой аминокислоты (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3:138-146; US 5362852). Такой альдегид может реагировать с нуклеофилом молекулы лекарственного средства или линкера.
Аналогично нуклеофильные группы на молекуле лекарственного средства включают в себя, но не ограничиваются ими: группы амино, тиола, гидроксила, гидразида, оксима, гидразина, тиосемикарбазона, карбоксилата гидразина и арилгидразида, способные реагировать с образованием ковалентных связей с электрофильными группами на линкерных группах или линкерных реагентах, включающих: (i) активные сложные эфиры, такие как сложные эфиры с NHS, сложные эфиры с HOBt, галоформиаты и галоидангидриды; (ii) алкил и бензилгалоиды, такие как галоацетамиды; (iii) альдегиды, кетоны, карбоксильную и малеимидную группы.
Альтернативно можно получать слитый белок, содержащий антитело и цитотоксическое вещество, например, рекомбинантными способами или способами синтеза пептидов. Участок ДНК может содержать соответствующие участки, кодирующие две части конъюгата либо рядом друг с другом, либо разделенные участком, кодирующим линкерный пептид, который не нарушает требуемых свойств конъюгата.
В другом варианте осуществления антитело можно конъюгировать с "рецептором" (таким как стрептавидин) для применения в предварительном нацеливании на опухоль, где конъюгат антитело-рецептор вводят пациенту с последующим удалением несвязавшегося конъюгата из кровообращения с использованием вещества для очистки, а затем вводят "лиганд" (например, авидин), который конъюгируют с цитотоксическим веществом (например, радионуклеотидом).
Антитело (Ab)-MC-MMAE можно получать посредством конъюгации любого из антител, представленных в настоящем описании, с MC-MMAE следующим образом. Антитело, растворенное в 500 мМ борате натрия и 500 мМ хлориде натрия при pH 8,0, обрабатывают избытком 100 мМ дитиотреитола (DTT). После инкубации при 37°C в течение приблизительно 30 минут буфер заменяют посредством элюирования через смолу сефадекс G25 и элюируют посредством PBS с 1 мМ DTPA. Значение тиол/Ab оценивают посредством определения концентрации восстановленного антитела при поглощении в растворе при 280 нм и концентрации тиола посредством реакции с DTNB (Aldrich, Milwaukee, WI) и определения поглощения при 412 нм. Восстановленное антитело, растворенное в PBS, охлаждают на льду. Линкерный реагент для лекарственного средства, малеимидокапроил-монометил ауристатин E (MMAE), т.е. MC-MMAE, растворенный в DMSO, разбавляют в ацетонитриле и воде в известной концентрации и добавляют к охлажденному восстановленному антителу 2H9 в PBS. Приблизительно через один час добавляют избыток малеимида, чтобы погасить реакцию и присоединить к не вступившему в реакцию антителу группы тиола. Реакционную смесь концентрируют посредством ультрафильтрации центрифугированием и 2H9-MC-MMAE очищают и обессоливают посредством элиюирования через смолу G25 в PBS, фильтруют через 0,2-мкм фильтры в стерильных условиях и замораживают для хранения.
Антитело-MC-MMAF можно получать посредством конъюгации любого из антител, представленных в настоящем описании, с MC-MMAF в соответствии с протоколом, предусмотренным для получения Ab-MC-MMAE.
Антитело-MC-val-cit-PAB-MMAE получают посредством конъюгации любого из антител, представленных в настоящем описании, с MC-val-cit-PAB-MMAE в соответствии с протоколом, предусмотренным для получения Ab-MC-MMAE.
Антитело-MC-val-cit-PAB-MMAF получают посредством конъюгации любого из антител, представленных в настоящем описании, с MC-val-cit-PAB-MMAF в соответствии с протоколом, предусмотренным для получения Ab-MC-MMAE.
Антитело-SMCC-DM1 получают посредством конъюгации любого из антител, представленных в настоящем описании, с SMCC-DM1 следующим образом. Очищенное антитело превращают в производное посредством сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилата (SMCC, Pierce Biotechnology, Inc) для введения линкера SMCC. Конкретно, антитело в концентрации 20 мг/мл в смеси 50 мМ фосфат калия/50 мМ хлорид натрия/2 мМ ЭДТА, pH 6,5, обрабатывают 7,5 молярными эквивалентами SMCC (20 мМ в DMSO, 6,7 мг/мл). После перемешивания в течение 2 часов в атмосфере аргона при температуре окружающей среды реакционную смесь фильтруют через колонку с сефадексом G25, уравновешенную смесью 50 мМ фосфат калия/50 мМ хлорид натрия/2 мМ ЭДТА, pH 6,5. Содержащие антитело фракции собирают и оценивают.
Полученное таким образом антитело-SMCC разбавляют посредством смеси 50 мМ фосфат калия/50 мМ хлорид натрия/2 мМ ЭДТА, pH 6,5, до конечной концентрации приблизительно 10 мг/мл и подвергают реакции с 10 мМ раствором DM1 в диметилацетамиде. Реакционную смесь перемешивают при температуре окружающей среды в атмосфере аргона в течение 16,5 часов. Реакционную смесь для конъюгации фильтруют через колонку для гель-фильтрации с сефадексом G25 (1,5×4,9 см) с 1×PBS при pH 6,5. Отношение лекарственного средства DM1 к антителу (p) может составлять приблизительно от 2 до 5, как измеряют по поглощению при 252 нм и при 280 нм.
Ab-SPP-DM1 получают посредством конъюгации любого из антител, представленных в настоящем описании, с SPP-DM1 следующим образом. Очищенное антитело превращают в производное посредством N-сукцинимидил-4-(2-пиридилтио)пентаноата для введения групп дитиопиридила. Антитело (376,0 мг, 8 мг/мл) в 44,7 мл 50 мМ буфера на основе фосфата калия (pH 6,5), содержащего NaCl (50 мМ) и ЭДТА (1 мМ), обрабатывают SPP (5,3 молярных эквивалента в 2,3 мл этанола). После инкубации в течение 90 минут в атмосфере аргона при температуре окружающей среды проводят гель-фильтрацию реакционной смеси через колонку G25, уравновешенную 35 мМ цитратом натрия, 154 мМ NaCl, 2 мМ ЭДТА. Содержащие антитело фракции собирают и оценивают. Степень модификации антитела определяют, как описано выше.
Антитело-SPP-Py (приблизительно 10 мкмоль способных к высвобождению групп 2-тиопиридина) разбавляют посредством указанного выше буфера с 35 мМ цитратом натрия, pH 6,5, до конечной концентрации приблизительно 2,5 мг/мл. Затем к раствору антитела добавляют DM1 (1,7 эквивалентов, 17 мкмоль) в 3,0 мМ диметилацетамиде (DMA, 3% об./об. в конечной реакционной смеси). Реакцию проводят при температуре окружающей среды в атмосфере аргона в течение приблизительно 20 часов. Реакционную смесь помещают в колонку для гель-фильтрации с сефакрилом S300 (5,0 см × 90,0 см, 1,77 L), уравновешенную 35 мМ цитратом натрия, 154 мМ NaCl, pH 6,5. Скорость потока может составлять приблизительно 5,0 мл/мин, и собирают 65 фракций (20,0 мл каждая). Количество молекул лекарственного средства DM1, связанных с одной молекулой антитела (p'), определяют посредством измерения поглощения при 252 нм и 280 нм, и оно может составлять приблизительно от 2 до 4 молекул лекарственного средства DM1 на антитело 2H9.
Антитело-BMPEO-DM1 получают посредством конъюгации любого из антител, представленных в настоящем описании, с BMPEO-DM1 следующим образом. Антитело модифицируют с помощью бис-малеимидореагента BM(PEO)4 (Pierce Chemical), оставляя на поверхности антитела не вступившую в реакцию группу малеимидо. Реакцию можно проводить посредством растворения BM(PEO)4 в 50% смеси этанол/вода до концентрации 10 мМ и добавления в десятикратном избытке по молям к раствору, содержащему антитело в фосфатно-солевом буфере в концентрации приблизительно 1,6 мг/мл (10 микромолярный) и проведения реакции в течения 1 часа с образованием промежуточного соединения антитело-линкер, 2H9-BMPEO. Избыток BM(PEO)4 удаляют посредством гель-фильтрации (HiTrap column, Pharmacia) в 30 мМ цитрате, pH 6, с буфером с 150 мМ NaCl. DM1 приблизительно в 10-кратном избытке по молям растворяют в диметилацетамиде (DMA) и добавляют к промежуточному соединению 2H9-BMPEO. Также для растворения реагента с молекулами лекарственного средства можно использовать диметилформамид (DMF). Реакцию в реакционной смеси проводят в течение ночи с последующей гель-фильтрацией или диализом в PBS для удаления не вступившего в реакцию DM1. Для удаления высокомолекулярных агрегатов и получения очищенного 2H9-BMPEO-DM1 использовали гель-фильтрацию на колонках S200 в PBS.
D. Антагонисты c-met, включающие в себя нуклеиновые кислоты
В одном аспекте антагонист c-met по этому изобретению включает в себя молекулу нуклеиновой кислоты. Например, молекула нуклеиновой кислоты может содержать антисмысловой олигонуклеотид, ингибиторную/интерферирующую РНК (например, малую ингибиторную/интерферирующую РНК (siRNA)) или аптамер. Способы скрининга, идентификации и получения этих модуляторов в виде нуклеиновых кислот известны в данной области.
Например, было показано, что siRNA способны модулировать экспрессию гена, когда традиционные антагонисты, такие как низкомолекулярные антагонисты или антитела, оказались безуспешными. (Shi Y., Trends in Genetics 19(1):9-12 (2003)). Синтезированные in vitro двухцепочечные РНК, длина которых менее 30 нуклеотидов (например, приблизительно от 15 до 25, от 17 до 20, от 18 до 20, от 19 до 20 или от 21 до 23 нуклеотидов), могут выступать в качестве интерферирующих РНК (iRNA) и могут специфично ингибировать экспрессию гена (см., например, Fire A., Trends in Genetics (1999), 391; 806-810; патентные заявки США 09/821832, 09/215257; патент США No. 6506559; PCT/US0l/10188; европейскую заявку с серийным No. 00126325). Полагают, что эти iRNA действуют, по меньшей мере отчасти, опосредуя деградацию их РНК-мишеней. Однако поскольку их длина составляет менее 30 нуклеотидов, они не запускают механизм клеточной противовирусной защиты. Такие механизмы включают в себя продукцию интерферона и генерализованное прекращение синтеза белка в клетке-хозяине. На практике siRNA можно синтезировать, а затем клонировать в ДНК-векторы. Такие векторы можно трансфицировать и обеспечивать экспрессию siRNA на высоком уровне. Высокий уровень экспрессии siRNA используют для "нокдауна" или значительного снижения количества продуцируемого в клетке белка, и, таким образом, он пригоден в условиях в клетке, когда предполагают, что сверхэкспрессия белка связана с патологическим нарушением.
Аптамеры представляют собой молекулы нуклеиновой кислоты, которые способны связываться с молекулой-мишенью, такой как гиперстабилизированный белок c-met. Получение и терапевтическое применение аптамеров является общепринятым в данной области. См., например, патент США No. 5475096, и терапевтическую эффективность Макугена® (Eyetech, New York) для лечения связанной с возрастом дегенерации желтого пятна.
Антисмысловая технология является общепринятой в данной области. Дополнительные детали, касающиеся этой технологии, представлены в настоящем описании ниже.
E. Фармацевтические составы
Терапевтические составы антагонистов c-met, применяемых в соответствии с этим изобретением, получают для хранения посредством смешивания антагониста c-met, обладающего требуемой степенью чистоты, с необязательными фармацевтически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceuticals Sciences 16th edition, Osol, A. Ed. (1980)), в форме лиофилизированных составов или водных растворов. Приемлемые носители, эксципиенты или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают в себя буферы, такие как ацетат, Трис, фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензэтония; фенол, бутил или бензиловый спирт; алкилпарабены, такие как метил или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (менее приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды, и другие углеводы, включающие в себя глюкозу, маннозу, или декстрины; хелатирующие агенты, такие как ЭДТА; обеспечивающие тоничность вещества, такие как трегалоза и хлорид натрия; сахара, такие как сахароза, маннит, трегалоза или сорбит; поверхностно-активное вещество, такое как полисорбат; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как TWEEN®, PLURONICS® или полиэтиленгликоль (PEG).
Составы в рамках настоящей заявки могут содержать более одного активного соединения, при необходимости в случае конкретного показания для лечения, предпочтительно соединения с взаимодополняющими видами активности, которые не оказывают отрицательного воздействия друг на друга. Например, в дополнение к антагонисту c-met может быть желательным включение в один состав дополнительного модулятора, например второго антитела, которое связывает другой эпитоп на гиперстабилизированном белке c-met, или антитела против какой-либо другой мишени. Альтернативно или дополнительно композиция, кроме того, может содержать химиотерапевтическое средство, цитотоксическое вещество, цитокин, ингибирующее рост вещество, антигормональное вещество и/или кардиопротектор. Такие молекулы соответственно представлены в сочетании в количестве, которое является эффективным для предполагаемой цели.
Активные ингредиенты также можно заключать в микрокапсулы, полученные, например, посредством способов коацервации или межфазной полимеризации, например микрокапсулы на основе гидроксиметилцеллюлозы или желатина и микрокапсулы на основе поли-(метилметакрилата) соответственно, в коллоидные системы для доставки лекарственного средства (например, липосомы, микросферы с альбумином, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие способы описаны в Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1980).
Можно получать препараты с замедленным высвобождением. Пригодные примеры препаратов с замедленным высвобождением включают в себя полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, где матрицы находятся в форме обладающих формой изделий, например пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают в себя полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат), или поли(виниловый спирт)), полилактиды (патент США. No. 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, не поддающийся деградации этиленвинилацетат, поддающиеся деградации сополимеры молочной кислоты и гликолевой кислоты, такие как LUPRON DEPOT® (инъецируемые микросферы, состоящие из сополимера молочной кислоты и гликолевой кислоты и ацетата леупролида), и поли-D-(-)-3-гидроксимасляную кислоту.
Составы для применения для введения in vivo должны быть стерильными. Этого легко достигают посредством фильтрации через стерильные фильтрационные мембраны.
F. Лечение антагонистом c-met по этому изобретению
Антагонисты c-met по этому изобретению обладают различными нетерапевтическими способами применения. Антагонисты могут быть пригодны для определения стадии или выявления заболеваний, при которых происходит экспрессия гиперстабилизированного c-met (например, при радиофармацевтической визуализации). Антитела, олигопептиды и аптамеры также могут быть пригодны для очистки или иммунопреципитации гиперстабилизированного c-met из клеток для детекции и количественного определения гиперстабилизированного c-met in vitro, например, в ELISA или вестерн-блоттинге и для модуляции клеточных процессов в популяции клеток.
В настоящее время в зависимости от стадии злокачественной опухоли лечение злокачественной опухоли включает в себя один или сочетание из следующих ниже способов лечения: хирургическая операция с удалением злокачественной ткани, лучевая терапия и химиотерапия. Лечение, включающее в себя антагонисты c-met, может быть особенно желательным у пожилых пациентов, которые плохо переносят токсичность и побочные эффекты химиотерапии, и в случае метастазирующего заболевания, когда лучевая терапия обладает ограниченной применимостью. В случае терапевтического применения антагонисты c-met можно использовать отдельно или в комбинированной терапии, например совместно с гормонами, антиангиогенными средствами или меченными радиоактивной меткой соединениями, или с хирургической операцией, криотерапией и/или лучевой терапией. Антагонисты c-met можно вводить совместно с другими формами общепринятого лечения либо последовательно с предварительным или последующим общепринятым лечением. Химиотерапевтические лекарственные средства, такие как ТАКСОТЕР® (доцетаксел), ТАКСОЛ® (паклитаксел), эстрамустин и митоксантрон, используют для лечения злокачественной опухоли, в частности, у пациентов с высоким риском. Антагонисты c-met, как правило, вводят с терапевтически эффективной дозой химиотерапевтического средства. В другом варианте осуществления антагонист c-met вводят совместно с химиотерапией для снижения побочных эффектов вследствие применения химиотерапевтического средства, например паклитаксела. В Physicians' Desk Reference (PDR) описаны дозы этих веществ, которые используют для лечения различных злокачественных опухолей. Схема дозирования и дозы этих вышеупомянутых химиотерапевтических лекарственных средств, которые являются терапевтически эффективными, зависят от конкретной злокачественной опухоли, подлежащей лечению, степени выраженности заболевания и других факторов, известных квалифицированному в данной области терапевту, и их может определить терапевт.
Антагонисты c-met вводят пациенту-человеку в соответствии с известными способами, такими как внутривенное введение, например, в виде болюса или посредством постоянной инфузии в течение периода времени, посредством внутримышечного, внутрибрюшинного, интрацереброспинального, подкожного, внутрисуставного, интрасиновиального, подоболочечного, перорального, местного или ингаляционного способов. Внутривенное или подкожное введение антитела, олигопептида или низкомолекулярного органического вещества является предпочтительным в одном варианте осуществления этого изобретения.
С введением антагониста c-met можно комбинировать другие схемы лечения. Комбинированное введение включает в себя совместное введение с использованием отдельных составов или одного фармацевтического состава и последовательное введение в любом порядке, где предпочтительно существует промежуток времени между тем, как оба (или все) активных ингредиента совместно проявят свою биологическую активность. Предпочтительно такая комбинированная терапия приводит к синергическому терапевтическому эффекту и/или к снижению нежелательных побочных эффектов.
Также может быть желательным комбинирование введения антагониста c-met с введением лекарственного средства, направленного против другого антигена, ассоциированного с конкретным патологическим состоянием.
В другом варианте осуществления способы терапевтического лечения по настоящему изобретению включают в себя комбинированное введение молекулы антагониста c-met и одного или нескольких химиотерапевтических средств или ингибирующих рост веществ, включая совместное введение смесей различных химиотерапевтических средств. Химиотерапевтические средства включают в себя эстрамустина фосфат, преднимустин, цисплатин, 5-фторурацил, мелфалан, циклофосфамид, гидроксимочевину и гидроксимочевинатаксаны (такие как паклитаксел и доксетаксел) и/или антрациклиновые антибиотики. Получение и схемы дозирования для таких химиотерапевтических средств можно использовать в соответствии с инструкциями изготовителя, или как эмпирически определит квалифицированный специалист. Получение и схемы дозирования для таких лекарственных средств также описаны в Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992).
Антагонист c-met можно комбинировать с антигормональным соединением; например с антиэстрогеновым соединением, таким как тамоксифен; антипрогестероном, таким как онапристон (см. EP 616 812); или с антиандрогеном, таким как флутамид, в дозах, известных для таких молекул. В случае, когда подлежащая лечению злокачественная опухоль представляет собой андроген-независимую злокачественную опухоль, пациента можно предварительно подвергать терапии антиандрогенами, и, после того как опухоль становится андроген-независимой, пациенту можно вводить антагонист c-met.
Иногда также может быть преимущественным совместное введение пациенту с кардиопротектором (для профилактики или снижения дисфункции миокарда, ассоциированной с терапией) или одним или несколькими цитокинами. В дополнение к упомянутым выше схемам лечения пациенту можно проводить хирургическое удаление злокачественных клеток и/или лучевую терапию до, одновременно или после лечения антагонистом c-met. Пригодные дозировки для любого из указанных выше веществ для совместного введения представляют собой дозировки, используемые в настоящее время, и их можно снижать вследствие совместного действия (синергии) вещества или антагониста C-met.
Для профилактики или лечения заболевания дозировка и способ введения выбирает терапевт в соответствии с известными критериями. Соответствующая дозировка антагониста C-met зависит от типа заболевания, подлежащего лечению, как определено выше, тяжести и течения заболевания, введения антагониста c-met в профилактических или терапевтических целях, предшествующего лечения, клинического анамнеза пациента и ответа на антагонист c-met и суждения лечащего врача. Антагонист c-met пригодным образом вводят пациенту за один раз или на протяжении ряда введений. В одном варианте осуществления антагонист c-met вводят внутривенной инфузией или подкожными инъекциями. В зависимости от типа и тяжести заболевания первоначальная предполагаемая дозировка для введения пациенту может составлять от приблизительно 1 мкг/кг до приблизительно 50 мг/кг массы тела (например, приблизительно 0,1-15 мг/кг/доза) антитела, например, либо за одно, либо за несколько отдельных введений или посредством постоянной инфузии. Режим дозирования может включать в себя введение первоначальной ударной дозы, составляющей приблизительно 4 мг/кг, с последующей еженедельной поддерживающей дозой, составляющей приблизительно 2 мг/кг антитела-антагониста C-met. Однако могут быть пригодными другие схемы дозирования. Типичная суточная доза может варьировать от приблизительно 1 мкг/кг до 100 мг/кг или более, в зависимости от упомянутых выше факторов. В случае повторных введений на протяжении нескольких суток или более, в зависимости от состояния, лечение продолжают до тех пор, пока не произойдет требуемое подавление симптомов. Мониторинг хода этого лечения можно легко проводить посредством общепринятых способов и анализов и исходя из критериев, известных терапевту или другим специалистам в данной области.
Помимо введения полипептидного модулятора (например, полипептида, антитела и т.д.) пациенту, это изобретение относится к введению модулятора посредством генной терапии. Такое введение нуклеиновой кислоты, содержащей/кодирующей антагонист c-met, охватывается выражением "введение терапевтически эффективного количества антагониста c-met". См., например, WO96/07321, опубликованную 14 марта 1996 года, в отношении применения генной терапии для получения внутриклеточных антител.
Существует два основных подхода для введения нуклеиновой кислоты (необязательно содержащей вектор) в клетки пациента: in vivo и ex vivo. Для доставки in vivo нуклеиновую кислоту инъецируют непосредственно пациенту, как правило, в область, где требуется антагонист c-met. Для лечения ex vivo клетки пациента выделяют, в эти выделенные клетки вводят нуклеиновую кислоту и модифицированные клетки вводят пациенту либо непосредственно, либо, например, инкапсулированными в пористые мембраны, которые имплантируют пациенту (см., например, патенты США No. 4892538 и 5283187). Существует множество способов, доступных для введения нуклеиновых кислот в жизнеспособные клетки. Способы варьируют в зависимости от того, каким образом, in vitro или in vivo, нуклеиновую кислоту трансфицируют в клетки предполагаемого хозяина. Способы, пригодные для переноса нуклеиновой кислоты в клетки млекопитающих in vitro, включают в себя применение липосом, электропорацию, микроинъекцию, слияние клеток, DEAE-декстран, способ преципитации фосфатом кальция и т.д. Широко используемый вектор для доставки гена ex vivo представляет собой ретровирусный вектор.
В одном варианте осуществления способы переноса нуклеиновой кислоты in vivo включают в себя трансфекцию вирусными векторами (такими как аденовирус, вирус простого герпеса I типа или аденоассоциированный вирус) и системы на основе липидов (пригодные липиды для опосредуемого липидами переноса гена представляют собой, например, DOTMA, DOPE и DC-Chol). Для обзора известных в настоящее время протоколов генной маркировки и генной терапии см. Anderson et al., Science 256:808-813 (1992). См. также WO 93/25673 и приведенные в ней ссылки.
Антитела-антагонисты c-met по этому изобретению могут находиться в различных формах, охватываемых определением "антитело" в настоящем описании. Таким образом, антитела включают в себя полноразмерное или полное антитело, фрагменты антитела, антитело с природной последовательностью или варианты по аминокислотам, гуманизированные, химерные или слитые антитела и их функциональные фрагменты.
Это изобретение относится к композиции, содержащей антагонист c-met и носитель. В следующем варианте осуществления композиция может содержать антагонист c-met в сочетании с другими лекарственными средствами, такими как цитотоксические или ингибирующие рост вещества, включая химиотерапевтические средства. Это изобретение также относится к составам, содержащим антагонист c-met и носитель. В одном варианте осуществления состав представляет собой терапевтический состав, содержащий фармацевтически приемлемый носитель.
G. Изделия и наборы
Другой вариант осуществления этого изобретения представляет собой изделие, содержащее компоненты, пригодные для лечения нарушения с использованием антагониста c-met. Изделие содержит контейнер и этикетку или вкладыш в упаковку на контейнере или рядом с ним. Пригодные контейнеры включают в себя, например, бутылки, флаконы, шприцы и т.д. Контейнеры могут состоять из множества материалов, таких как стекло или пластик. Контейнер содержит композицию, которая является эффективной для лечения состояния и может обладать стерильным отверстием для доступа (например, контейнер может представлять собой пакет с внутривенным раствором или флакон с пробкой, проницаемой иглой для подкожной инъекции). По меньшей мере одно активное вещество в композиции представляет собой антагонист c-met по этому изобретению. На этикетке или вкладыше в упаковку указано, что композицию применяют для лечения конкретного нарушения. Этикетка или вкладыш в упаковку дополнительно содержит инструкции по введению композиции пациенту. Кроме того, изделие может дополнительно содержать второй контейнер, содержащий фармацевтически-приемлемый буфер, такой как бактериостатическая вода для инъекции (BWFI), фосфатно-солевой буфер, раствор Рингера и раствор декстрозы. Кроме того, он может включать в себя другие материалы, необходимые с коммерческой или потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Также предусмотрены наборы, которые являются пригодными для различных целей. Могут быть предусмотрены наборы, которые содержат антагонисты c-met по этому изобретению для выявления и количественного определения гиперстабилизированного c-met in vitro, например, в ELISA или вестерн-блоттинге. Как в случае изделия, набор содержит контейнер и этикетку или вкладыш на контейнере или рядом с контейнером. Контейнер содержит композицию, содержащую по меньшей мере один антагонист c-met по этому изобретению. Могут быть включены дополнительные контейнеры, которые содержат, например, разбавители и буферы, контрольные антитела. На этикетке или вкладыше в упаковку может быть представлено описание композиции, а также инструкции для предполагаемого применения in vitro или для выявления.
H. Антагонисты c-met, содержащие полипептиды, нуклеиновые кислоты и антитела
Конкретные формы и способы применения
В одном варианте осуществления нуклеиновые кислоты по этому изобретению включают в себя антисмысловые олигонуклеотиды/полинуклеотиды, содержащие одноцепочечные последовательности нуклеиновых кислот (либо РНК, либо ДНК), способные связываться с эндогенными кодирующими гиперстабилизированный c-met нуклеиновыми кислотами. Антисмысловые олигонуклеотиды в соответствии с настоящим изобретением содержат по меньшей мере фрагмент кодирующего участка ДНК гиперстабилизированного c-met. Такой фрагмент, как правило, содержит по меньшей мере приблизительно 14 нуклеотидов, предпочтительно от приблизительно 14 до 30 нуклеотидов. Возможность получать антисмысловой олигонуклеотид, исходя из последовательности кДНК, кодирующей данный белок, описана, например, в Stein and Cohen (Cancer Res. 48:2659, 1988) и van der Krol et al. (BioTechniques 6:958, 1988).
Связывание антисмысловых олигонуклеотидов для нацеливания на последовательности нуклеиновых кислот приводит к образованию дуплексов, которые блокируют транскрипцию или трансляцию последовательности-мишени посредством одного из ряда способов, включая повышение деградации дуплексов, преждевременную терминацию транскрипции или трансляции, или другими способами. Такие способы охватываются настоящим изобретением. Антисмысловые олигонуклеотиды, таким образом, можно использовать для блокирования экспрессии гиперстабилизированного белка c-met в клетках. Антисмысловые олигонуклеотиды дополнительно содержат олигонуклеотиды, имеющие модифицированные сахаро-фосфодиэфирные остовы (или другие связи сахаров, такие как описаны в WO 91/06629) и где такие связи сахаров являются устойчивыми к эндогенным нуклеазам. Такие олигонуклеотиды с устойчивыми связями сахаров являются стабильными in vivo (т.е. способны быть устойчивыми к ферментативной деградации), однако сохраняют специфичность последовательности, чтобы иметь возможность связываться с нуклеотидными последовательностями-мишенями.
Предпочтительные участки внутри гена для антисмыслового связывания включают в себя участок, включающий кодон инициации/начала трансляции (5'-AUG/5'-ATG) или кодон для терминации/остановки (5'-UAA, 5'-UAG и 5-UGA/5'-TAA, 5'-TAG и 5'-TGA) открытой рамки считывания (ORF) гена. Эти участки относятся к фрагменту мРНК или гена, который охватывает от приблизительно 25 до приблизительно 50 смежных нуклеотидов в любом направлении (т.е. 5' или 3') от кодона инициации или терминации трансляции. Другие иллюстративные участки для антисмыслового связывания включают в себя: интроны; экзоны; точки соединения интрон-экзон; открытую рамку считывания (ORF) или "кодирующую область", которая представляет собой участок между кодоном инициации трансляции и кодоном терминации трансляции; 5'-кэп мРНК, который содержит N7-метилированный остаток гуанозина, соединенный с последним 5'-остатком мРНК через 5'-5' трифосфатную связь, и включает в себя саму структуру 5'-кэпа, а также первые 50 нуклеотидов рядом с кэпом; 5'-нетранслируемую область (5'UTR), часть мРНК в 5'-направлении от кодона инициации трансляции и, таким образом, включающую в себя нуклеотиды между областью 5'-кэпа и кодоном инициации трансляции мРНК или соответствующие нуклеотиды в гене; и 3'-нетранслируемую область (3'UTR), часть мРНК в 3'-направлении от кодона терминации трансляции и, таким образом, включающую в себя нуклеотиды между кодоном терминации трансляции и 3'-концом мРНК или соответствующие нуклеотиды в гене.
Конкретные примеры антисмысловых соединений, пригодных для ингибирования экспрессии гиперстабилизированного полипептида c-met, включают в себя олигонуклеотиды, содержащие модифицированный остов или неприродные межнуклеозидные связи. Олигонуклеотиды, обладающие модифицированным остовом, включают в себя олигонуклеотиды, в которых сохранен атом фосфора в остове, и олигонуклеотиды, в которых отсутствует атом фосфора в остове. Для целей этого описания и как иногда упоминают в данной области, модифицированные олигонуклеотиды, которые не обладают атомом фосфора в их межнуклеозидном остове, также можно рассматривать как олигонуклеозиды. Иллюстративные модифицированные олигонуклеотидные остовы включают в себя, например, фосфоротиоаты, хиральные фосфоротиоаты, фосфородитиоаты, фосфотриэфиры, аминоалкилфосфотриэфиры, метил и другие алкилфосфонаты, включая 3'-алкиленфосфонаты, 5'-алкиленфосфонаты и хиральные фосфонаты, фосфинаты, фосфорамидаты, включая 3'-аминофосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотрэфиры, селенофосфаты и борфосфаты, обладающие нормальными связями 3'-5', их 2'-5' соединенные аналоги, и алкилфосфонаты с инвертированной полярностью, где одна или несколько межнуклеотидных связей представляет собой связь 3' с 3', 5' с 5' или 2' с 2'. Иллюстративные олигонуклеотиды с инвертированной полярностью содержат одну связь 3' с 3' в последней 3'-межнуклеотидной связи, т.е. один инвертированный остаток нуклеозида, который может не иметь основания (нуклеиновое основание отсутствует или обладает гидроксильной группой вместо него). Также охватываются различные соли, смешанные соли и формы свободных кислот. Иллюстративные патенты США, в которых описано получение содержащих фосфор связей, включают в себя, но не ограничиваются ими, патенты США No: 3687808; 4469863; 4476301; 5023243; 5177196; 5188897; 5264423; 5276019; 5278302; 5286717; 5321131; 5399676; 5405939; 5453496; 5455233; 5466677; 5476925; 5519126; 5536821; 5541306; 5550111; 5563253; 5571799; 5587361; 5194599; 5565555; 5527899; 5721218; 5672697 и 5625050, которые включены в настоящее описание в качестве ссылок.
Примеры модифицированных олигонуклеотидных остовов, которые не включают в себя атом фосфора, включают в себя остовы, которые образуются посредством короткоцепочечных алкильных или циклоалкильных межнуклеозидных связей, смешанных межнуклеозидных связей гетероатома и алкила или циклоалкила, или одной или нескольких короткоцепочечных гетероатомных или гетероциклических межнуклеозидных связей. Они включают в себя остовы, обладающие связями морфолино (частично образованные посредством части сахара в нуклеозиде); силоксановые остовы; сульфидные, сульфоксидные и сульфоновые остовы; остовы с формацетилом и тиоформацетилом; остовы с метиленформацетилом и тиоформацетилом; остовы с рибоацетилом; содержащие алкен остовы; остовы с сульфаматом; остовы с метиленимино и метиленгидразино; остовы с сульфонатом и сульфонамидом; остовы с амидом и другие остовы, обладающие смешанными частями из компонентов N, O, S и CH2. Репрезентативные патенты США, в которых описано получение таких олигонуклеозидов, включают в себя, но не ограничиваются ими, патенты США No.: 5034506; 5166315; 5185444; 5214134; 5216141; 5235033; 5264562; 5264564; 5405938; 5434257; 5466677; 5470967; 5489677; 5541307; 5561225; 5596086; 5602240; 5610289; 5602240; 5608046; 5610289; 5618704; 5623070; 5663312; 5633360; 5677437; 5792608; 5646269 и 5677439, которые включены в настоящее описание в качестве ссылок.
В других примерах антисмысловых олигонуклеотидов как связь с сахаром, так и межнуклеозидная связь, т.е. остов, нуклеотидных элементов замещены новыми группами. Элементы оснований сохраняют для гибридизации с соответствующим соединением-мишенью, представляющим собой нуклеиновую кислоту. Одно такое олигомерное соединение, олигонуклеотидный миметик, который, как было показано, обладает превосходными свойствами в отношении гибридизации, называют пептидной нуклеиновой кислотой (PNA). В соединениях PNA остов сахаров олигонуклеотида замещен содержащим амид остовом, в частности аминоэтилглициновым остовом. Нуклеиновые основания сохраняют и связывают прямо или непрямо с аза-атомами азота амидной части остова. Репрезентативные патенты США, в которых описано получение соединений PNA, включают в себя, но не ограничиваются ими, патенты США No.: 5539082; 5714331 и 5719262, которые включены в настоящее описание в качестве ссылок. Дополнительное описание соединений PNA можно найти в Nielsen et al., Science, 1991, 254, 1497-1500.
Примеры антисмысловых олигонуклеотидов включают в себя остовы с фосфоротиоатом и/или остовы с гетероатомом, и в частности -CH2-NH-O-CH2-, -CH2-N(CH3)-O-CH2- [известные в качестве остова с метилен(метилимино) или остова с MMI], -CH2-O-N(CH3)-CH2-, -CH2-N(CH3)-N(CH3)-CH2- и -O-N(CH3)-CH2-CH2- [где природная фосфодиэфирная связь представлена в виде -O-P-O-CH2-], описанные в приведенном выше патенте США No. 5489677, и остовы с амидом, приведенным выше патенте США No. 5602240. Дополнительные примеры представляют собой антисмысловые олигонуклеотиды, обладающие структурами остова морфолино из приведенного выше патента США No. 5034506.
Модифицированные олигонуклеотиды также могут содержать одну или несколько замещенных групп сахаров. Иллюстративные олигонуклеотиды содержат одну из следующих ниже групп во 2'-положении: OH; F; O-алкил, S-алкил или N-алкил; O-алкенил, S-алкенил или N-алкенил; O-алкинил, S-алкинил или N-алкинил; или O-алкил-O-алкил, где алкил, алкенил и алкинил может представляет собой замещенный или незамещенный алкил от C1 до С10, или алкенил и алкинил от C2 до C10. Особенно предпочтительными являются O[(CH2)nO]mCH3, O(CH2)nOCH3, O(CH2)nNH2, O(CH2)nCH3, O(CH2)nONH2 и O(CH2)nON[(CH2)nCH3)]2, где n и m представляют собой от 1 до приблизительно 10. Другие иллюстративные антисмысловые олигонуклеотиды содержат одну из следующих групп во 2'-положении: низший алкил от C1 до C10, замещенный низший алкил, алкенил, алкинил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, расщепляющая РНК группа, репортерная группа, интеркалятор, группа для улучшения фармакокинетических свойств олигонуклеотида или группа для улучшения фармакодинамических свойств олигонуклеотида и другие заместители, обладающие сходными свойствами. Одна возможная модификация включает в себя 2'-метоксиэтокси (2'-O-CH2CH2OCH3, также известный как 2'-O-(2-метоксиэтил) или 2'-MOE) (Martin et al., Helv. Chim. Acta, 1995, 78, 486-504), т.е. группу алкоксиалкокси. Следующая предпочтительная модификация включает в себя 2'-диметиламинооксиэтокси, т.е. группу O(CH2)2ON(CH3)2, также известную как 2'-DMAOE и 2'-диметиламиноэтоксиэтокси (также известную в данной области как 2'-O-диметиламиноэтоксиэтил или 2'-DMAEOE), т.е. 2'-O-CH2-O-CH2-N(CH2).
Следующая модификация включает в себя замкнутые нуклеиновые кислоты (LNA), в которых 2'-гидроксильная группа связана с 3'- или 4'-атомом углерода кольца сахара, формируя, таким образом, группу бициклического сахара. Связь может представлять собой группу метилена (-CH2-)n, соединяющую 2'-атом кислорода и 4'-атом углерода, где n представляет собой 1 или 2. LNA и их получение описано в WO 98/39352 и WO 99/14226.
Другие модификации включают в себя 2'-метокси (2'-O-CH3), 2'-аминопропокси (2'-OCH2CH2CH2NH2), 2'-аллил (2'-CH2-CH=CH2), 2'-O-аллил (2'-O-CH2-CH=CH2) и 2'-фтор (2'-F). 2'-модификация может находиться в арабино(вверху)-положении или рибо(внизу)-положении. Одна 2'-арабино модификация представляет собой 2'-F. Также аналогичные модификации можно проводить в других положениях олигонуклеотида, в частности в 3'-положении сахара или в 3'-концевом нуклеотиде или в 2'-5'-связанных олигонуклеотидах и в 5'-положении 5'-концевого нуклеотида. Олигонуклеотиды также могут обладать миметиками сахаров, таких как группы циклобутила вместо сахара пентофуранозила. Иллюстративные патенты США, в которых описано получение таких модифицированных структур сахаров, включают в себя, но не ограничиваются ими, патенты США No.: 4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5658873; 5670633; 5792747 и 5700920, которые включены в данное описание в качестве ссылки в полном объеме.
Олигонуклеотиды также могут включать в себя модификации или замещения в нуклеиновом основании (часто обозначаемом в данной области просто как "основание"). Как используют в настоящем описании, "немодифицированные" или "природные" нуклеиновые основания включают в себя пуриновые основания аденин (A) и гуанин (G) и пиримидиновые основания тимин (T), цитозин (C) и урацил (U). Модифицированные нуклеиновые основания включают в себя другие синтетические и природные нуклеиновые основания, такие как 5-метилцитозин (5-me-C), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил и другие алкилпроизводные аденина и гуанина, 2-пропил и алкилпроизводные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галоурацил и цитозин, 5-пропинил(-C≡C-CH3 или -CH2-C≡CH)-урацил и цитозин и другие алкинилпроизводные пиримидиновых оснований, 6-азоурацил, цитозин и тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-гало, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-гало, в частности 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 2-F-аденин, 2-аминоаденин, 8-азагуанин и 8-азааденин, 7-деазагуанин и 7-деазааденин и 3-деазагуанин и 3-деазааденин. Следующие модифицированные нуклеиновые основания включают в себя трициклические пиримидины, такие как феноксазинцитидин (1H-пиримидо[5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин (1H-пиримидо[5,4-b][1,4]бензотиазин-2(3H)-он), G-зажимы, такие как замещенный феноксазинцитидин (например, 9-(2-аминоэтокси)-H-пиримидо[5,4-b][1,4]бензоксазин-2(3H)-он), карбазолцитидин (2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин (H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он). Модифицированные нуклеиновые основания также могут включать в себя основания, в которых пуриновое или пиримидиновое основание замещено другими гетероциклами, например 7-деазааденин, 7-деазагуанозин, 2-аминопиридин и 2-пиридон. Следующие нуклеиновые основания включают в себя основания, описанные в патенте США No. 3687808, основания, описанные в The Concise Encyclopedia Of Polymer Science And Engineering, стр. 858-859, Kroschwitz, J. I, ed. John Wiley & Sons, 1990, и основания, описанные Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613. Некоторые из этих нуклеиновых оснований являются особенно пригодными для повышения аффинности связывания олигомерных соединений по этому изобретению. Они включают в себя 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и O-6-замещенные пурины, включая 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин. Было показано, что замещение 5-метилцитозином повышает стабильность дуплекса нуклеиновых кислот на 0,6-1,2°C (Sanghvi et al, Antisense Research and Applications, CRC Press, Boca Raton, 1993, pp. 276-278) и является иллюстративной заменой оснований, например, в сочетании с модификациями сахаров посредством 2'-O-метоксиэтилом. Репрезентативные патенты США, в которых описано получение модифицированных нуклеиновых оснований, включают в себя, но не ограничиваются ими: патент США No. 3687808, а также патенты США No.: 4845205; 5130302; 5134066; 5175273; 5367066; 5432272; 5457187; 5459255; 5484908; 5502177; 5525711; 5552540; 5587469; 5594121, 5596091; 5614617; 5645985; 5830653; 5763588; 6005096; 5681941 и 5750692, которые включены в настоящее описание в качестве ссылок.
Другая модификация антисмысловых олигонуклеотидов включает в себя химическое присоединение к олигонуклеотиду одной или нескольких групп или конъюгатов, которые повышают активность, распределение в клетке и захват клеткой олигонуклеотида. Соединения по этому изобретению могут включать в себя группы для конъюгации, ковалентно связанные с функциональными группами, такими как первичные или вторичные гидроксильные группы. Группы для конъюгации по этому изобретению включают в себя интеркаляторы, репортерные молекулы, полиамины, полиамиды, полиэтиленгликоли, полиэфиры, группы, которые повышают фармакодинамические свойства олигомеров, и группы, которые повышают фармакокинетические свойства олигомеров. Типичные группы для конъюгации включают в себя холестерины, липиды, катионные липиды, фосфолипиды, катионные фосфолипиды, биотин, феназин, фолат, фенантридин, антрахинон, акридин, флуоресцеины, родамины, кумарины и красители. Группы, которые повышают фармакодинамические свойства, в контексте этого изобретения, включают в себя группы, которые повышают захват олигомера, повышают устойчивость олигомера в отношении деградации и/или повышают прочность специфичной в отношении последовательности гибридизации с РНК. Группы, которые усиливают фармакокинетические свойства, в контексте этого изобретения, включают в себя группы, которые повышают захват олигомера, распределение, метаболизм или экскрецию. Группы для конъюгации включают в себя, но не ограничиваются ими, липидные группы, такие как группа холестерина (Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86, 6553-6556), холевую кислоту (Manoharan et al., Bioorg. Med. Chem. Let., 1994, 4, 1053-1060), тиоэфир, например гексил-S-тритилтиол (Manoharan et al., Ann. N.Y. Acad. Sci., 1992, 660, 306-309; Manoharan et al., Bioorg. Med. Chem. Let., 1993, 3, 2765-2770), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20, 533-538), алифатическую цепь, например остатки додекандиола или ундецила (Saison-Behmoaras et al., EMBO J., 1991, 10, 1111-1118; Kabanov et al., FEBS Lett., 1990, 259, 327-330; Svinarchuk et al., Biochimie, 1993, 75, 49-54), фосфолипид, например дигексадецил-rac-глицерин или 1,2-ди-O-гексадецил-rac-глицеро-3-H-фосфонат триэтиламмония (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654; Shea et al., Nucl. Acids Res., 1990, 18, 3777-3783), цепь полиамина или полиэтиленгликоля (Manoharan et al., Nucleosides & Nucleotides, 1995, 14, 969-973) или адамантан-уксусную кислоту (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654), группу пальмитила (Mishra et al., Biochim. Biophys. Acta, 1995, 1264, 229-237) или группу октадециламина или гексиламинокарбонилоксихолестерина. Олигонуклеотиды по этому изобретению также можно конъюгировать с активными лекарственными веществами, например с аспирином, варфарином, фенилбутазоном, ибупрофеном, супрофеном, фенбуфеном, кетопрофеном, (S)-(+)- пранопрофеном, карпрофеном, дансилсаркозином, 2,3,5-трийодбензойной кислотой, флуфенаминовой кислотой, фолиновой кислотой, бензотиадиазидом, хлортиазидом, диазепином, индометацином, барбитуратом, цефалоспорином, сульфа-лекарственным средством, противодиабетическим средством, антибактериальным средством или антибиотиком. Конъюгаты олигонуклеотид-лекарственное средство и их получение описаны в патентной заявке США c серийным No. 09/334130 (поданной 15 июня 1999 года) и в патентах США No.: 4828979; 4948882; 5218105; 5525465; 5541313; 5545730; 5552538; 5578717, 5580731; 5591584; 5109124; 5118802; 5138045; 5414077; 5486603; 5512439; 5578718; 5608046; 4587044; 4605735; 4667025; 4762779; 4789737; 4824941; 4835263; 4876335; 4904582; 4958013; 5082830; 5112963; 5214136; 5082830; 5112963; 5214136; 5245022; 5254469; 5258506; 5262536; 5272250; 5292873; 5317098; 5371241, 5391723; 5416203, 5451463; 5510475; 5512667; 5514785; 5565552; 5567810; 5574142; 5585481; 5587371; 5595726; 5597696; 5599923; 5599928 и 5688941, которые включены в настоящее описание в качестве ссылок.
Не обязательно, чтобы все положения данного соединения были единообразно модифицированными, и в действительности более одной из упомянутых выше модификаций может быть включено в отдельное соединение или даже в отдельный нуклеозид в олигонуклеотиде. Настоящее изобретение также относится к антисмысловым соединениям, которые представляют собой химерные соединения. "Химерные" антисмысловые соединения или "химеры" в контексте этого изобретения представляют собой антисмысловые соединения, в частности олигонуклеотиды, которые содержат два или более химически разделенных участка, каждый из которых состоит по меньшей мере из одного мономерного элемента, т.е. в случае олигонуклеотидного соединения, нуклеотида. Эти олигонуклеотиды, как правило, содержат по меньшей мере один участок, где олигонуклеотид является модифицированным, чтобы обеспечить устойчивость олигонуклеотида к деградации нуклеазами, повышенный захват клеткой и/или повышенную аффинность связывания с нуклеиновой кислотой-мишенью. Дополнительный участок олигонуклеотида может выполнять роль субстрата для ферментов, способных к расщеплению гибридов РНК:ДНК или РНК:РНК. В качестве примера РНКаза H представляет собой клеточную эндонуклеазу, которая расщепляет цепь РНК дуплекса РНК:ДНК. Активация РНКазы H, таким образом, приводит к расщеплению РНК-мишени, таким образом значительно повышая эффективность ингибирования олигонуклеотида экспрессии гена. Таким образом, аналогичные результаты часто можно получать с более короткими олигонуклеотидами при использовании химерных олигонуклеотидов, по сравнению с дезоксиолигонуклеотидами с фосфоротиоатом, гибридизующимися с тем же участком-мишенью. Химерные антисмысловые соединения по этому изобретению могут быть образованы в качестве комбинированных структур из двух или более олигонуклеотидов, модифицированных олигонуклеотидов, олигонуклеозидов и/или олигонуклеотидных миметиков, как описано выше. Иллюстративные химерные антисмысловые олигонуклеотиды включают в себя по меньшей мере один 2'-модифицированный сахар (предпочтительно 2'-O-(CH2)2-O-CH3) на 3'-конце для обеспечения устойчивости к нуклеазам, и участок по меньшей мере с 4 смежными 2'-H-сахарами для обеспечения активности РНКазы H. Такие соединения также обозначают в данной области как гибриды или гэпмеры. Иллюстративные гэпмеры обладают участками из 2'-модифицированных сахаров (предпочтительно 2'-O-(CH2)2-O-CH3) на 3'-конце и на 5'-конце, разделенными по меньшей мере одним участком, обладающим по меньшей мере 4 смежными 2'-H-сахарами, и могут включать в себя фосфоротиоатные связи остова. Репрезентативные патенты США, в которых описано получение таких гибридных структур, включают в себя, но не ограничиваются ими, патенты США No. 5013830; 5149797; 5220007; 5256775; 5366878; 5403711; 5491133; 5565350; 5623065; 5652355; 5652356 и 5700922, которые включены в данное описание в качестве ссылки в полном объеме.
Антисмысловые соединения, используемые в соответствии с этим изобретением, можно получать удобными и общепринятыми способами посредством хорошо известного способа твердофазного синтеза. Оборудование для такого синтеза продают несколько поставщиков, включая, например, Applied Biosystems (Foster City, Calif.). Дополнительно или альтернативно можно использовать любые другие способы такого синтеза, известные в данной области. Хорошо известно применение аналогичных способов для получения олигонуклеотидов, таких как фосфоротиоаты и алкилированные производные. Соединения по этому изобретению также можно смешивать, инкапсулировать, конъюгировать или иным образом объединять с другими молекулами, молекулярными структурами или смесями соединений, такими как, например, липосомы, нацеленные на рецептор молекулы, составы для перорального, ректального, местного введения или другие составы, для облегчения захвата, распределения и/или всасывания. Иллюстративные патенты США, в которых описано получение таких способствующих захвату, распределению и/или всасыванию составов, включают в себя, но не ограничиваются ими, патенты США No. 5108921; 5354844; 5416016; 5459127; 5521291; 5543158; 5547932; 5583020; 5591721; 4426330; 4534899; 5013556; 5108921; 5213804; 5227170; 5264221; 5356633; 5395619; 5416016; 5417978; 5462854; 5469854; 5512295; 5527528; 5534259; 5543152; 5556948; 5580575 и 5595756, которые включены в настоящее описание в качестве ссылок.
Другие примеры антисмысловых олигонуклеотидов включают в себя олигонуклеотиды, которые ковалентно связаны с органическими группами, такими как группы, описанные в WO 90/10048, и другими группами, которые повышают аффинность олигонуклеотида в отношении последовательностей нуклеиновых кислот-мишеней, такими как поли-(L-лизин). Более того, к смысловым или антисмысловым олигонуклеотидам можно присоединять интеркалирующие вещества, такие как эллиптицин и алкилирующие вещества или комплексы металлов для модификации специфичности в отношении связывания антисмыслового или смыслового олигонуклеотида для нуклеотидной последовательности-мишени.
Антисмысловые олигонуклеотиды можно вводить в клетку, содержащую последовательность нуклеиновая кислота-мишень, посредством любого способа переноса генов, включающего, например, опосредуемую CaPO4 трансфекцию ДНК, электропорацию или с использованием векторов для переноса генов, таких как вирус Эпштейна-Барр. В иллюстративном способе антисмысловой или смысловой олигонуклеотид встраивают в пригодный ретровирусный вектор. Клетку, содержащую последовательность нуклеиновой кислоты-мишень, приводят в контакт с рекомбинантным ретровирусным вектором, либо in vivo, либо ex vivo. Пригодные ретровирусные векторы включают в себя, но не ограничиваются ими, векторы, источником которых является ретровирус мыши M-MuLV, N2 (ретровирус, источником которого является M-MuLV), или двухкопийные векторы, обозначаемые как DCT5A, DCT5B и DCT5C (см. WO 90/13641).
Антисмысловые олигонуклеотиды также можно вводить в клетку, содержащую нуклеотидную последовательность-мишень, посредством получения конъюгата со связывающей лиганд молекулой, как описано в WO 91/04753. Пригодные связывающие лиганд молекулы включают в себя, но не ограничиваются ими, рецепторы клеточной поверхности, факторы роста, другие цитокины или другие лиганды, которые связываются с поверхностными рецепторами. Как правило, конъюгация связывающей лиганд молекулы предпочтительно по существу не препятствует способности связывающей лиганд молекулы связываться с соответствующей ей молекулой или рецептором или не блокирует проникновение смыслового или антисмыслового олигонуклеотида или его конъюгированного варианта в клетку.
Альтернативно, антисмысловой олигонуклеотид можно вводить в клетку, содержащую последовательность нуклеиновой кислоты-мишень посредством получения комплекса олигонуклеотид-липид, как описано в WO 90/10448. Комплекс антисмысловой олигонуклеотид-липид предпочтительно диссоциирует в клетке с помощью эндогенной липазы.
Длина антисмысловых молекул РНК или ДНК, как правило, составляет по меньшей мере приблизительно 5 нуклеотидов, альтернативно длина составляет по меньшей мере приблизительно 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145, 150, 155, 160, 165, 170, 175, 180, 185, 190, 195, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990 или 1000 нуклеотидов, где в этом контексте термин "приблизительно" означает указанную длину нуклеотидной последовательности плюс или минус 10% от указанной длины.
Антисмысловые РНК и ДНК можно использовать в качестве лекарственных средств для блокирования экспрессии определенных генов in vivo. К настоящему времени показано, что короткие антисмысловые олигонуклеотиды можно вводить в клетки, где они выполняют роль ингибиторов, несмотря на их низкие внутриклеточные концентрации вследствие их ограниченного захвата мембраной клетки (Zamecnik et al, Proc. Natl. Acad. Sci. USA 83:4143-4146 [1986]). Для повышения захвата олигонуклеотидов их можно модифицировать, например, посредством замены их отрицательно заряженных фосфодиэфирных групп незаряженными группами.
Существует много способов, доступных для введения нуклеиновых кислот в живые клетки. Способы варьируют, в зависимости от проведения трансфекции нуклеиновой кислоты либо в культивируемые клетки in vitro, либо в клетки предполагаемого хозяина in vivo. Способы, пригодные для переноса нуклеиновой кислоты в клетки млекопитающих in vitro, включают в себя применение липосом, электропорацию, микроинъекцию, слияние клеток, DEAE-декстран, способ преципитации с фосфатом кальция и т.д. Предпочтительные в настоящее время способы переноса генов in vivo включают в себя трансфекцию вирусными (как правило, ретровирусными) векторами и трансфекцию, которую опосредует белок вирусной оболочки-липосома (Dzau et al. Trends in Biotechnology 11, 205-210 [1993]). В некоторых случаях желательно предоставление источника нуклеиновой кислоты с веществом, которое нацеливает на клетки-мишени, таким как антитело, специфичное к мембранному белку клеточной поверхности или клетки-мишени, лиганд для рецептора на клетке-мишени и т.д. В случае применения липосом для нацеливания и/или для облегчения захвата можно использовать белки, которые связываются с мембранными белками клеточной поверхности, ассоциированными с эндоцитозом, например белки капсида или их фрагменты, тропные к конкретному типу клеток, антитела к белкам, которые периодически подвергаются интернализации, белки, которые нацеливают на внутриклеточную локализацию и повышают период полураспада в клетке. Способ опосредуемого рецептором эндоцитоза описан, например, Wu et al., J. Biol. Chem. 262, 4429-4432 (1987); и Wagner et al., Proc. Natl. Acad. Sci. USA 87, 3410-3414 (1990). Для обзора протоколов генного маркирования и генной терапии см. Anderson et al., Science 256, 808-813 (1992).
Полипептиды-антагонисты C-met и молекулы нуклеиновых кислот по этому изобретению можно использовать в диагностических целях для типирования тканей, где гиперстабилизированные полипептиды c-met могут дифференциально экспрессироваться в одной ткани по сравнению с другой, предпочтительно в пораженной ткани по сравнению с нормальной тканью того же типа ткани.
Это изобретение относится к способам скрининга соединений для выявления соединений, которые модулируют гиперстабилизированный c-met. Скрининговые анализы на кандидата для лекарственного средства-антагониста разрабатывают для выявления соединений, которые связываются или образуют комплексы с гиперстабилизированным полипептидом c-met, или иным образом препятствуют взаимодействию гиперстабилизированных полипептидов c-met с другими клеточными белками, включая, например, ингибирование экспрессии гиперстабилизированного полипептида c-met в клетках.
Можно проводить различные формы анализа, включая анализ белок-белкового связывания, биохимические скрининговые анализы, иммунологические анализы и клеточные анализы, которые хорошо описаны в данной области.
Общим для всех анализов для антагонистов является то, что в них проводят контактирование лекарственного средства-кандидата с гиперстабилизированным полипептидом c-met в условиях и на протяжении периода времени, достаточных для обеспечения взаимодействия этих двух компонентов.
В анализах связывания взаимодействие представляет собой связывание, и образовавшийся комплекс можно выделять из реакционной смеси или выявлять в ней. В конкретном варианте осуществления, гиперстабилизированный полипептид c-met или лекарственое средство-кандидат иммобилизуют на твердой фазе, например, на титрационном микропланшете, посредством ковалентного или нековалентного присоединения. Нековалентное присоединение, как правило, проводят посредством нанесения на твердую поверхность раствора гиперстабилизированного полипептида c-met и высушивания. Альтернативно можно использовать иммобилизованное антитело, например моноклональное антитело, специфичное в отношении гиперстабилизированного полипептида c-met, подлежащего иммобилизации, для прикрепления его к твердой поверхности. Анализ проводят посредством добавления неиммобилизованного компонента, который можно метить поддающейся детекции меткой, к иммобилизованному компоненту, например покрытой поверхности, содержащей прикрепленный компонент. После завершения реакции не вступившие в реакцию компоненты удаляют, например, посредством промывания и выявляют комплексы, прикрепленные к твердой поверхности. Если исходно неиммобилизованный компонент обладает поддающейся детекции меткой, выявление метки, иммобилизованной на поверхности, указывает на то, что произошло образование комплекса. Если исходно неиммобилизованный компонент не содержит метку, образование комплексов можно выявлять, например, с использованием меченого антитела, специфично связывающегося с иммобилизованным комплексом.
Если соединение-кандидат взаимодействует, но не связывается с гиперстабилизированным полипептидом c-met, его взаимодействие с гиперстабилизированным c-met можно оценивать хорошо известными способами выявления белок-белковых взаимодействий. Такие анализы включают в себя традиционные подходы, такие как, например, поперечное сшивание, коиммунопреципитация и совместная очистка посредством градиентов или хроматографических колонок. Кроме того, мониторинг белок-белковых взаимодействий можно проводить с использованием генетической системы на основе дрожжей, описанной Fields и коллегами (Fields and Song, Nature (London). 340:245-246 (1989); Chien et al., Proc. Natl. Acad. Sci. USA. 88:9578-9582 (1991)), как описано Chevray and Nathans, Proc. Natl. Acad. Sci. USA. 89: 5789-5793 (1991). Многие активаторы транскрипции, такие как GAL4, состоят из двух физически отдельных модульных доменов, где один выступает в качестве связывающего ДНК домена, а другой выполняет функцию домена активации транскрипции. Экспрессирующая система дрожжей, описанная в указанных выше публикациях (как правило, называемая "двухгибридной системой"), обладает преимуществом в виде этого свойства, и в ней используют два гибридных белка, где в одном из них белок-мишень является слитым со связывающим ДНК доменом GAL4 и в другом активирующие белки-кандидаты являются слитыми с доменом активации. Экспрессия репортерного гена GAL1-lacZ под контролем активируемого посредством GAL4 промотора зависит от восстановления активности GAL4 посредством белок-белкового взаимодействия. Колонии, содержащие взаимодействующие полипептиды, выявляют с помощью хромогенного субстрата для β-галактозидазы. Полный набор (MATCHMAKER™) для выявления белок-белковых взаимодействий между двумя конкретными белками с использованием двухгибридного способа является коммерчески доступным от Clontech. Эту систему также можно применять для картирования доменов белка, вовлеченных в специфичные для белка взаимодействия, а также для определения аминокислотных остатков, которые являются важными для этих взаимодействий.
Соединения, которые препятствуют взаимодействию гиперстабилизированного c-met и других внутриклеточных или внеклеточных компонентов, можно тестировать следующим образом: как правило, получают реакционную смесь, содержащую гиперстабилизированный c-met и внутриклеточный или внеклеточный компонент в условиях и в течение периода времени, обеспечивающих взаимодействие и связывание двух продуктов. Для тестирования способности соединения-кандидата ингибировать связывание реакцию проводят в отсутствие и в присутствии тестируемого соединения. Кроме того, в третью реакционную смесь можно добавлять плацебо, чтобы она выполняла роль положительного контроля. Мониторинг связывания (образования комплекса) между тестируемым соединением и внутриклеточным или внеклеточным компонентом, находящимся в смеси, проводят, как описано в настоящем описании выше. Образование комплекса в контрольной реакционной смеси(ях), но не в реакционной смеси, содержащей тестируемое соединение, указывает на то, что тестируемое соединение препятствует взаимодействию тестируемого соединения и его партнера по реакции.
Для анализа на антагонисты соединение, подлежащее скринингу на конкретную активность, можно добавлять к клетке, экспрессирующей гиперстабилизированный c-met, и способность соединения ингибировать представляющую интерес активность указывает на то, что соединение представляет собой антагонист гиперстабилизированного полипептида c-met. Гиперстабилизированный полипептид c-met можно метить, например, с помощью радиоактивности, чтобы количество молекул гиперстабилизированного полипептида c-met, представленных в клетке, можно было использовать для определения эффективности потенциального антагониста.
Потенциальный гиперстабилизированный антагонист c-met представляет собой антисмысловую конструкцию РНК или ДНК, полученную с использованием антисмысловой технологии, где, например, антисмысловая молекула РНК или ДНК действует посредством прямого блокирования трансляции мРНК посредством гибридизации с мРНК-мишенью и предотвращения трансляции белка. Антисмысловую технологию можно использовать для контроля экспрессии гена посредством образования тройной спирали или антисмысловой ДНК или РНК, где в основе обоих этих способов лежит связывание полинуклеотида с ДНК или РНК. Например, 5'-кодирующую часть последовательности полинуклеотида, которая кодирует зрелый гиперстабилизированный белок c-met, можно использовать для разработки антисмыслового олигонуклеотида РНК длиной от приблизительно 10 до 40 пар оснований. Олигонуклеотид ДНК разрабатывают, чтобы он был комплементарным участку гена, вовлеченного в транскрипцию (тройная спираль - см. Lee et al., Nucl. Acids Res., 6:3073 (1979); Cooney et al., Science, 241: 456 (1988); Dervan et al., Science. 251:1360 (1991)), предотвращая посредством этого транскрипцию и продукцию гиперстабилизированного полипептида c-met. Антисмысловой олигонуклеотид РНК гибридизуется с мРНК in vivo и блокирует трансляцию молекулы мРНК в гиперстабилизированный полипептид c-met (антисмысловая последовательность - Okano, Neurochem., 56:560 (1991); Oligodeoxynucleotides as Antisense Inhibitors of Gene Expression (CRC Press: Boca Raton, FL, 1988). Описанные выше олигонуклеотиды также можно доставлять к клеткам, чтобы антисмысловая РНК или ДНК могла экспрессироваться in vivo для ингибирования продукции гиперстабилизированного полипептида c-met. Если используют антисмысловую ДНК, предпочтительными являются олигодезоксирибонуклеотиды, источником которых является участок инициации трансляции, например, между приблизительно -10 и +10 положениями нуклеотидной последовательности гена-мишени.
Рибозимы представляют собой ферментативные молекулы РНК, способные катализировать специфичное расщепление РНК. Рибозимы действуют посредством специфичной в отношении последовательности гибридизации с комплементарной РНК-мишенью, с последующим эндонуклеолитическим расщеплением. Конкретные участки расщепления рибозимом в потенциальной РНК-мишени можно выявлять известными способами. Для более подробного описания см., например, Rossi, Current Biology, 4:469-471 (1994), и публикацию PCT No. WO 97/33551 (опубликованную 18 сентября 1997 года).
Молекулы нуклеиновой кислоты для образования тройной спирали, используемые для ингибирования транскрипции, должны быть одноцепочечными и должны состоять из дезоксинуклеотидов. Состав оснований этих олигонуклеотидов разрабатывают, чтобы он обеспечивал образование тройной спирали по правилам спаривания оснований Хугстена, которое, главным образом, требует наличия участков значительного размера из пуринов или пиримидинов на одной цепи дуплекса. Для более подробного описания см., например, публикацию PCT No. WO 97/33551, выше.
Эти небольшие молекулы можно выявлять посредством одного или нескольких скрининговых анализов, описанных в настоящем описании выше, и/или посредством любого другого способа скрининга, хорошо известного специалистам в данной области.
В одном варианте осуществления предпочтительными являются интернализующиеся антитела. Антитела могут обладать определенными свойствами, которые повышают доставку антител в клетки, или их можно модифицировать, чтобы они обладали таким свойствами. Способы для достижения этого известны в данной области. В другом варианте осуществления антитело можно экспрессировать в клетке-мишени посредством введения нуклеиновой кислоты, способной экспрессировать антитело, в клету-мишень. См., например, патенты США No. 6703019; 6329173 и публикацию PCT No. 2003/077945. Также для доставки антитела в клетки можно использовать липофекцию или липосомы. В случае, когда используют фрагменты антитела, как правило, предпочтительным является наименьший ингибиторный фрагмент, который специфично связывается с доменом для связывания белка-мишени. Например, исходя из последовательностей вариабельного участка антитела, можно сконструировать молекулы пептида, которые сохраняют способность связывать белковую последовательность-мишень. Такие пептиды можно синтезировать химически и/или получать посредством технологии рекомбинантных ДНК. См., например, Marasco et al, Proc, Natl. Acad. Sci. USA. 90: 7889-7893 (1993).
Проникновение модулирующих полипептидов в клетки-мишени можно повышать способами, известными в данной области. Например, определенные последовательности, такие как последовательности из HIV Tat или белка гомеодомена Antennapedia, способны приводить к эффективному захвату гетерологичных белков через мембраны клеток. См., например, Chen et al., Proc. Natl. Acad. Sci. USA (1999), 96:4325-4329.
Антитела-антагонисты c-met no этому изобретению могут представлять собой любое антитело, которое способно препятствовать активности c-met. Некоторые конкретные примеры включают в себя антитело против c-met, содержащее:
(а) по меньшей мере одну, две, три, четыре или пять последовательностей гипервариабельного участка (HVR), выбранных из группы, состоящей из:
(i) HVR-L1, содержащего- последовательность А1-А17, где А1-А17 представляет собой KSSQSLLYTSSQKNYLA (SEQ ID NO:4)
(ii) HVR-L2, содержащего последовательность В1-В7, где В1-В7 представляет собой WASTRES (SEQ ID NO:5)
(iii) HVR-L3, содержащего последовательность С1-С9, где 01-С9 представляет собой QQYYAYPWT (SEQ ID NO:6)
(iv) HVR-H1, содержащего последовательность D1-D10, где D1-D10 представляет собой GYTFTSYWLH (SEQ ID NO:20)
(v) HVR-H2, содержащего последовательность Е1-Е18, где Е1-Е18 представляет собой GMIDPSNSDTRFNPNFKD (SEQ ID NO:21), и
(vi) HVR-H3, содержащего последовательность F1-F11, где F1-F11 представляет собой XYGSYVSPLDY (SEQ ID NO:22) и Х представляет собой не R;
и (b) по меньшей мере один вариант HVR, где последовательность варианта HVR содержит модификацию по меньшей мере одного остатка последовательности, представленной в SEQ ID NO:4, 5, 6, 20, 21 или 22. В одном варианте осуществления HVR-L1 антитела по этому изобретению содержит последовательность SEQ ID NO:4. В одном варианте осуществления HVR-L2 антитела по этому изобретению содержит последовательность SEQ ID NO:5. В одном варианте осуществления HVR-L3 антитела по этому изобретению содержит последовательность SEQ ID NO:6. В одном варианте осуществления HVR-H1 антитела по этому изобретению содержит последовательность SEQ ID NO:20. В одном варианте осуществления HVR-H2 антитела по этому изобретению содержит последовательность SEQ ID NO:21. В одном варианте осуществления HVR-H3 антитела по этому изобретению содержит последовательность SEQ ID NO:22. В одном варианте осуществления HVR-H3 содержит TYGSYVSPLDY (SEQ ID NO:23). В одном варианте осуществления HVR-H3 содержит SYGSYVSPLDY (SEQ ID NO:24). В одном варианте осуществления антитело по этому изобретению, содержащее эти последовательности (в сочетании, как описано в настоящем описании), представляет собой гуманизированное антитело или антитело человека.
В одном аспекте это изобретение относится к антителу, содержащему один, два, три, четыре, пять или шесть HVR, где каждый HVR содержит последовательность, состоит из последовательности или по существу состоит из последовательности, выбранной из группы, состоящей из SEQ ID NO:4, 5, 6, 20, 21, 22, 23 или 24, и где SEQ ID NO:4 соответствует HVR-L1, SEQ ID NO:5 соответствует HVR-L2, SEQ ID NO:6 соответствует HVR-L3, SEQ ID NO:20 соответствует HVR-H1, SEQ ID NO:21 соответствует HVR-H2 и SEQ ID NO:22, 23 или 24 соответствует HVR-H3. В одном варианте осуществления антитело по этому изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждый из них, в этом порядке, содержит SEQ ID NO:4, 5, 6, 20, 21 и 23. В одном варианте осуществления антитело по этому изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждый из них, в этом порядке, содержит SEQ ID NO:4, 5, 6, 20, 21 и 24.
Варианты HVR в антителе по этому изобретению могут обладать модификациями одного или нескольких остатков в HVR. В одном варианте осуществления вариант HVR-L2 содержит 1-5 (1, 2, 3, 4 или 5) замен в любом сочетании в следующих положениях: В1 (М или L), В2 (Р, Т, G или S), ВЗ (N, G, R или Т), В4 (I, N или F), В5 (Р, I, L или G), В6 (A, D, Т или V) и В7 (R, I, М или G). В одном варианте осуществления вариант HVR-H1 содержит 1-5 (1, 2, 3, 4 или 5) замен в любом сочетании в следующих положениях: D3 (N, Р, L, S, A, I), D5 (I, S или Y), D6 (G, D, Т, K, R), D7 (F, H, R, S, Т или V) и D9 (М или V). В одном варианте осуществления вариант HVR-H2 содержит 1-4 (1, 2, 3 или 4) замен в любом сочетании в следующих положениях: Е7 (Y), Е9 (I), Е10 (I), E14 (Т или Q), Е15 (D, K, S, Т или V), Е16 (L), Е17 (Е, H, N или D) и Е18 (Y, Е или H). В одном варианте осуществления вариант HVR-НЗ содержит 1-5 (1, 2, 3, 4 или 5) замен в любом сочетании в следующих положениях: F1 (Т, S), F3 (R, S, H, Т, А, K), F4 (G), F6 (R, F, М, Т, Е, K, A, L, W), F7 (L, I, Т, R, K, V), F8 (S, A), F10 (Y, N) и F11 (Q, S, H, F). Буква (ы) в скобках после каждого положения указывают иллюстративное замещение (т.е. замену) аминокислот; как очевидно специалисту в данной области, пригодность других аминокислот в качестве аминокислот для замещения в контексте, описанном в настоящем описании, можно оценивать посредством общепринятых способов с использованием технологий, известных в данной области и/или описанных в настоящем описании. В одном варианте осуществления HVR-L1 содержит последовательность SEQ ID NO:4. В одном варианте осуществления F1 в варианте HVR-H3 представляет собой Т. В одном варианте осуществления F1 в варианте HVR-H3 представляет собой S. В одном варианте осуществления F3 в варианте HVR-H3 представляет собой R. В одном варианте осуществления F3 в варианте HVR-H3 представляет собой S. В одном варианте осуществления F7 в варианте HVR-H3 представляет собой Т. В одном варианте осуществления антитело по этому изобретению содержит вариант HVR-H3, где F1 представляет собой Т или S, F3 представляет собой R или S и F7 представляет собой Т.
В одном варианте осуществления антитело по этому изобретению содержит вариант HVR-H3, где F1 представляет собой Т, F3 представляет собой R и F7 представляет собой Т. В одном варианте осуществления антитело по этому изобретению содержит вариант HVR-H3, где F1 представляет собой S. В одном варианте осуществления антитело по этому изобретению содержит вариант HVR-H3, где F1 представляет собой Т и F3 представляет собой R. В одном варианте осуществления антитело по этому изобретению содержит вариант HVR-H3, где F1 представляет собой S, F3 представляет собой R и F7 представляет собой Т. В одном варианте осуществления антитело по этому изобретению содержит вариант HVR-H3, где F1 представляет собой Т, F3 представляет собой S, F7 представляет собой Т и F8 представляет собой S. В одном варианте осуществления антитело по этому изобретению содержит вариант HVR-H3, где F1 представляет собой Т, F3 представляет собой S, F7 представляет собой Т и F8 представляет собой А. В некоторых вариантах осуществления указанное антитело с вариантом HVR-H3 дополнительно содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1 и HVR-H2, где каждый из них содержит, в этом порядке, последовательность, представленную в SEQ ID NO:4, 5, 6, 20 и 21. В некоторых вариантах осуществления эти антитела дополнительно содержат консенсусную последовательность каркасной области тяжелой цепи подгруппы III человека. В одном варианте осуществления этих антител консенсусная последовательность каркасной области содержит замену в положении 71, 73 и/или 78. В некоторых вариантах осуществления этих антител положение 71 представляет собой А, 73 представляет собой Т и/или 78 представляет собой А. В одном варианте осуществления этих антител эти антитела дополнительно содержат консенсусную последовательность каркасной области легкой цепи κI человека.
В одном варианте осуществления антитело по этому изобретению содержит вариант HVR-L2, где В6 представляет собой V. В некоторых вариантах осуществления указанное антитело с вариантом HVR-L2 дополнительно содержит HVR-L1, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждый из них содержит, в этом порядке, последовательность, представленную в SEQ ID NO:4, 6, 20, 21 и 22. В некоторых вариантах осуществления указанное антитело с вариантом HVR-L2 дополнительно содержит HVR-L1, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждый из них содержит, в этом порядке, последовательность, представленную в SEQ ID NO:4, 6, 20, 21 и 23. В некоторых вариантах осуществления указанное антитело с вариантом HVR-L2 дополнительно содержит HVR-L1, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждый из них содержит, в этом порядке, последовательность, представленную в SEQ ID NO:4, 6, 20, 21 и 24. В некоторых вариантах осуществления эти антитела дополнительно содержат консенсусную последовательность каркасной области тяжелой цепи подгруппы III человека. В одном варианте осуществления этих антител, консенсусная последовательность каркасной области содержит замену в положении 71, 73 и/или 78. В некоторых вариантах осуществления этих антител положение 71 представляет собой А, 73 представляет собой Т и/или 78 представляет собой А. В одном варианте осуществления этих антител эти антитела дополнительно содержат консенсусную последовательность легкой цепи κ1 человека.
В одном варианте осуществления антитело по этому изобретению содержит вариант HVR-H2, где Е14 представляет собой Т, Е15 представляет собой K и Е17 представляет собой Е. В одном варианте осуществления антитело по этому изобретению содержит вариант HVR-H2, где Е17 представляет собой Е. В некоторых вариантах осуществления указанное антитело с вариантом HVR-H3 дополнительно содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1 и HVR-H3, где каждый из них содержит, в этом порядке, последовательность, представленную в SEQ ID NO:4, 5, 6, 20 и 22. В некоторых вариантах осуществления указанное антитело с вариантом HVR-H2 дополнительно содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1 и HVR-H3, где каждый из них содержит, в этом порядке, последовательность, представленную в SEQ ID NO:4, 5, 6, 20 и 23. В некоторых вариантах осуществления указанное антитело с вариантом HVR-H2 дополнительно содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1 и HVR-H3, где каждый из них содержит, в этом порядке, последовательность, представленную в SEQ ID NO:4, 5, 6, 20 и 24. В некоторых вариантах осуществления эти антитела дополнительно содержат консенсусную последовательность каркасной области тяжелой цепи подгруппы III человека. В одном варианте осуществления этих антител консенсусная последовательность каркасной области содержит замену в положении 71, 73 и/или 78. В некоторых вариантах осуществления этих антител положение 71 представляет собой А, 73 представляет собой Т и/или 78 представляет собой А. В одном варианте осуществления этих антител эти антитела дополнительно содержат консенсусную последовательность каркасной области легкой цепи κI человека.
В рамках настоящей заявки, состав также может содержать более одного активного соединения, если необходимо для конкретного показания для лечения, предпочтительно соединения с дополнительными видами активности, которые не оказывают отрицательного влияния друг на друга. Альтернативно или дополнительно, композиция может содержать вещество, которое усиливает ее функцию, такое как, например, цитотоксическое вещество, цитокин, химиотерапевтическое средство, ингибирующее рост вещество. Такие молекулы соответственно представлены в сочетании в количествах, которые являются эффективными для предполагаемой цели.
Ниже следуют примеры способов и композиций по этому изобретению. Понятно, что можно применять на практике различные другие варианты осуществления, определяемые общим описанием, представленным выше. Примеры приведены только для иллюстративных целей, и никоим образом не предназначены для ограничения объема настоящего изобретения.
ПРИМЕРЫ
Материалы и способы
Клеточная культура
Клеточные линии получали в American Type Culture Collection (ATCC), NCI Division of Cancer Treatment and Diagnosis tumor repository, или Japanese Health Sciences Foundation. Все клеточные линии, за исключением 293 и Rat 1A, поддерживали в RPMI 1640, дополненной 10% ЭТС (Sigma), пенициллин/стрептомицином (GIBCO), и 2 мМ L-глутамином. Клетки 293 и Rat 1A поддерживали в DMEM с высоким содержанием глюкозы и дополненной, как описано.
Плазмиды и стабильные клеточные линии
Полноразмерный Met WT-V5/His был описан ранее (Kong-Beltran et al, 2004). Met WT-V5/His выполняет роль матрицы для получения точковой мутации Y1003F с использованием праймеров, описанных ранее (Peschard et al, 2001) посредством сайт-направленного мутагенеза QuikChange (Stratagene) в соответствии с инструкциями изготовителя. Делецию экзона 14 проводили с использованием двух наборов праймеров, создающих новые участки рестрикции для NheI, фланкирующие экзон 14 Met (а.к. 963-1011) посредством сайт-направленного мутагенеза QuikChange, а затем расщепляли посредством NheI с последующим повторным лигированием плазмиды. Мутации подтверждали посредством секвенирования ДНК. Для получения стабильных клеточных линий Met в клетках Rat 1A 10 мкг каждой ДНК из pRK5TKneo, Met WT-V5/His, Met Y1003F-V5/His или Met ΔEx14-V5/His расщепляли посредством KpnI и очищали (Qiagen). Клетки Rat 1A трансфицировали посредством 4 мкг каждой ДНК в 6-луночном планшете с помощью липофектамина 2000 (Invitrogen) в соответствии с инструкциями изготовителя. На следующие сутки клетки трипсинизировали и высевали на 10-см чашки. Через двадцать четыре часа добавляли G418 (Sigma) в концентрации 500 мкг/мл. Селекцию продолжали приблизительно в течение двух недель, а затем проводили селекциею Met-положительных клонов посредством FACS с использованием антитела 3D6 (патент США. No. 6099841) и окрашивания посредством PE. В каждую лунку помещали одну клетку. Выращенные клоны лизировали и тестировали на Met посредством иммуноблоттинга с антителом V5 (Invitrogen).
Иммунопреципитация и вестерн-блот анализ
Для анализа экспрессии белка в замороженных образцах ткани ткань (~100 мг) гомогенизировали в 200 мкл буфера для лизиса клеток (Cell Signaling), содержащего смесь ингибиторов протеаз (Sigma), смеси I и II ингибиторов фосфатаз (Sigma), 50 мМ фторид натрия и 2 мМ ортованадат натрия с использованием гомогенизатора Polytron® (Kinematica). Затем клетки лизировали посредством осторожного качания в течение 1 часа при 4°C, с последующей предварительной очисткой посредством смеси сефарозы с белком A Fast Flow (Amersham) и сефарозы 4 с белком G Fast Flow (Amersham). Концентрации белка определяли с использованием реагента Брэдфорда (BioRad). Белки (20 мкг) последовательно разгоняли посредством SDS-PAGE, переносили на нитроцеллюлозную мембрану и проводили иммуноблоттинг с антителами против Met (DL-21, Upstate) или β-актина (I-19, Santa Cruz). Белки визуализировали посредством усиленной хемилюминесценции (ECL Plus, Amersham). Для исследований с коимунопреципитацией, включающих в себя трансфицированные Met и Cb1, 3 мкг каждой конструкции Met и 3 мкг Cb1-flag трансфицировали в клетки 293 с использованием FuGENE6 (Roche). На следующие сутки клетки стимулировали посредством rhuHGF в концентрации 100 нг/мл в течение 30 минут, а затем собирали с использованием 1% буфера для лизиса NP40 [50 мМ Трис (pH 7,45), 150 мМ NaCl, и 1% Nonidet 40], содержащего таблетку с полной смесью ингибиторов протеазы (Roche) и смесь ингибиторов фосфатазы II. Клеточный дебрис центрифугировали и 1 мг лизатов подвергали иммунопреципитации либо с 1,5 мкл антител против V5 (Invitrogen), либо с 2 мкг антитела против Cb1 (C-15, Santa Cruz) при 4°C при вращении в течение ночи с последующей инкубацией с гранулами белка G или A в течение 2 часов. Добавляли 2X буфер для образца (Invitrogen), содержащий 20 мМ DTT (Sigma), и образцы кипятили в течение 5 минут. Образцы помещали в 4-12% гели на основе Трис-глицина (Invitrogen) и переносили на 0,45-мкм мембраны на основе нитроцеллюлозы (Invitrogen). Мембрану блокировали посредством 5% обезжиренного молока в течение 1 ч с последующим иммуноблотингом с антителами против V5, поликлональными антителами против flag (Sigma) или антителами против P-Tyr (4G10, Upstate). Для исследований связывания, включающих в себя эндогенный Cb1, клетки 293 трансфицировали 6 мкг каждой конструкции ДНК на 10-см чашку с использованием FuGENE6. На следующие сутки клетки стимулировали посредством rhuHGF в концентрации 100 нг/мл в течение 30 минут, а затем собирали. Образцы подвергали иммунопреципитации посредством 2 мкг антитела против Cb1 или 1,5 мкг антитела против V5, с последующим иммуноблоттингом с антителами против V5 или против Cb1. Блот после иммунопреципитации с V5 промывали с использованием восстанавливающего буфера для промывания для вестерн-блота (Pierce) и повторно метили посредством P-Met Y1003 (Biosource), P-Met Y1234/Y12345 (Cell Signaling), P-Met Y1349 (Cell Signaling) или P-Met 1365 (Biosource). Для исследований деградации клетки 293 трансфицировали посредством 0,25 мкг pRK5TKneo, Met WT-V5/His, Met Y1003F-V5/His или мутантной формы Met ΔEx14-V5/His с использованием FuGENE6 в 6-луночном планшете. На следующие сутки клетки обрабатывали циклогексимидом в концентрации 10 мкг/мл (Sigma) в течение указанных периодов времени. Лизаты анализировали посредством SDS-PAGE и проводили иммуноблоттинг мембраны посредством антител против V5 или актина.
Анализ убиквитинилирования
Клетки 293 трансфицировали 3 мкг конструкций Met, 2 мкг Cb1-flag, 1 мкг HA-убиквитина и пустыми векторами pRK5TKneo или pFlag5a, если необходимо, с получением 6 мкг общей ДНК на образец с использованием FuGENE6. На следующие сутки клетки обрабатывали 25 мкМ MG-132 (Calbiochem) в течение 4 часов, а затем собирали. Клетки лизировали в 1% буфере для лизирования NP-40, содержащем ингибиторы, 25 мкМ MG-132 и 10 мМ N-этилмалеимид. Лизаты (1 мг) подвергали иммунопреципитации посредством 1,5 мкг антитела против V5 и проводили иммуноблоттинг с антителом против убиквитина (P4D1, Santa Cruz), а затем промывали и повторно метили антителом против V5.
Исследования передачи сигнала в клетке и ингибирования
Для исследования продолжительной передачи сигнала в стабильных клонах H226, H596, H358 или Rat 1A-Met клетки промывали посредством PBS, затем культивировали в отсутствие сыворотки в среде RPMI или DMEM, содержащей 0,5% BSA, 2 мМ глутамин и пенициллин/стрептомицин, в течение одного часа. К не содержащей сыворотки среде добавляли rhuHGF или моноклональное антитело-агонист Met, 3D6 (Genentech), на 10 минут. Затем монослой клеток промывали посредством PBS и инкубировали с не содержащей сыворотки средой, с последующим ее удалением через указанные промежутки времени. Затем клетки промывали один раз посредством PBS, лизировали посредством 1X буфера для образца SDS, содержащего 1X DTT (Invitrogen), обрабатывали ультразвуком в течение короткого промежутка времени и кипятили в течение 5 минут. Для анализа ингибирования рецептора Met к культивируемым без сыворотки клеткам добавляли антитело против Met 5D5 в не содержащую сыворотки среду в указанных концентрациях на 30 минут. Затем клетки стимулировали в течение 15 (для анализа активации Met) или 30 минут (для анализа Akt и MAPK) посредством rhuHGF в концентрации 100 нг/мл и лизировали посредством 1X буфера для образца SDS, содержащего DTT. После кипячения образцы анализировали посредством SDS-PAGE и проводили иммуноблоттинг посредством P-Met (Y1230/Y1234/Y1235, BioSource), P-Met (Y1234/Y1235), Met (DL-21), P-MAPK (E10, Cell Signaling), P-MAPK (Cell Signaling), P-Akt (587F11, Cell Signaling) или Akt (Cell Signaling). Используемые вторичные антитела представляли собой конъюгированные противокроличьи антитела-AlexaFluor680 (Molecular Probes) или конъюгированные противомышиные антитела-IRDye800 (Rockland Immunochemicals). Белки, перенесенные на нитроцеллюлозную мембрану, выявляли посредством сканирования инфракрасным лучом с использованием Odyssey (LiCor) в соответствии с рекомендованными изготовителем инструкциями для вестерн-блоттинга, а затем проводили количественное определение. Для анализа жизнеспособности клеток клетки выращивали в трех образцах в количестве ~1×104 клеток на лунку 96-луночных планшетах в RPMI, содержащей 0,5% ЭТС (среда для анализа), в течение ночи, а затем стимулировали средой для анализа, содержащей rhuHGF в концентрации 50 нг/мл. К нестимулированным клеткам добавляли среду для анализа без rhuHGF. Через 72 часа жизнеспособность клеток измеряли с использованием люминесцентного анализа жизнеспособности клеток Celltiter-Glo (Promega). Индексы стимуляции определяли посредством деления единиц для средней жизнеспособности клеток стимулированных посредством HGF культур на единицы для средней жизнеспособности клеток в нестимулированных культурах. Средние индексы стимуляции определяли исходя минимум из 3 отдельных экспериментов. Анализы ингибирования роста проводили сходным образом, либо с OA-5D5, либо с контрольным Ig, добавленным одновременно со стимуляцией посредством HGF.
Модель ксенотрансплантации in vivo
Самкам бестимусных мышей nude (Charles River, Hollister) инокулировали подкожно совокупность стабильных клеточных линий Rat1A, экспрессирующих Met WT, Met Y1003F, Met ΔEx14, или с контрольным вектором (5 миллионов клеток/мышь, n=5). Для стимуляции рецептора Met внутрибрюшинно вводили 10 мг/кг антитела-агониста Met 3D6, которое распознает только Met человека, один раз в неделю. Опухоли измеряли два раза в неделю с использованием цифрового устройства для измерения толщины, и объемы опухолей вычисляли с использованием следующего уравнения: Объем опухоли (мм3)=(π/6)(A)(B)(B). A=наибольшее значение толщины; B=наименьшее значение толщины.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Авторы настоящего изобретения отсеквенировали все кодирующие экзоны Met из панели образцов опухоли легкого и толстого кишечника, представляющих собой первичные опухоли, клеточные линии опухолей и первичные модели ксенотрансплантации опухоли. При проведении авторами настоящего изобретения секвенирования авторы настоящего изобретения выявили соматические гетерозиготные мутации в образцах первичной опухоли легкого в участках интронов, фланкирующих экзон 14 (Фиг. 1). Эти мутации были опухолеспецифичными, и их не выявили в неопухолевой ткани легкого тех же индивидуумов (данные не представлены). В H596, клеточной линии немелкоклеточного рака легкого (NSCLC), авторы настоящего изобретения выявили гомозиготную точковую мутацию в донорном участке для сплайсинга 3p. Наличие мутации в динуклеотидной консенсусной последовательности участка для сплайсинга и в расположенном выше полипиримидиновом тракте экзона 14 наблюдали в сочетании с тем, что экзон 13 и экзон 15 оставались в рамке считывания, позволяя предположить, что потенциальный транскрипт Met, лишенный экзона 14, тем не менее может продуцировать функциональный белок Met. Для решения этого вопроса авторы настоящего изобретения сначала провели амплификацию посредством RT-PCR РНК Met из мутантных опухолей и клеточной линии. Результатом всех трех мутаций в интроне был транскрипт с более короткой длиной по сравнению с транскриптом дикого типа, что согласуется с делецией экзона 14 (данные не представлены). Также авторы настоящего изобретения подтвердили отсутствие экзона 14 посредством секвенирования продуктов RT-PCR, и результаты авторов настоящего изобретения показали наличие делеции с сохранением рамки считывания, в результате которой удаляются аминокислоты с L964 до D1010 Met. Интересно, что мутантная форма рецептора является наиболее преобладающей экспрессируемой формой, несмотря на то, что образцы опухоли были гетерозиготными по делеции экзона 14 (данные не представлены), указывая на предпочтительную экспрессию транскрипта варианта. Это далее подтвердили посредством вестерн-блоттинга, показавшего преимущественную экспрессию укороченного белка Met. Образцы, содержащие эти мутации в интроне, представляли собой образцы дикого типа для K-ras, B-raf, EGFR и HER2 при секвенировании соответствующих экзонов (данные не представлены). В совокупности, эти результаты указывают на доминантный характер этих мутаций в интроне Met. Интересно, что вариант по сплайсингу Met, лишенный экзона 14, был ранее описан для нормальной ткани мыши, хотя функциональное последствие в отношении образования опухоли оставалось неопределенным (20, 21). Однако авторы настоящего изобретения не выявили экспрессии этого варианта по сплайсингу ни в одном исследуемом образце нормального легкого человека (данные не представлены). Кроме того, было подтверждено отсутствие этого варианта по сплайсингу в нормальной ткани человека, как описано ранее (21). Была описана кДНК, кодирующая вариант по сплайсингу, лишенный экзона 14, в образце первичного NSCLC человека; однако не оценивали ни роль соматического мутагенеза в участии в нарушении сплайсинга, ни функциональное последствие, если оно есть, любого мутантного c-met, который может экспрессироваться (22). Поскольку нуклеиновые кислоты, содержащие варианты по сплайсингу, не являются редкими в злокачественных клетках, функциональная значимость описанного варианта по сплайсингу остается неизвестной.
Делеция 47 аминокислот в экзоне 14 в околомембранном домене Met (L964-D1010) приводит к удалению участка фосфорилирования Y1003, необходимого для связывания Cb1 и отрицательной регуляции активированного рецептора. В более ранних исследованиях показано, что мутация Y1003F приводит к прекращению связывания Cb1 и к поддержанию активации Met (6). Авторы настоящего изобретения впервые подтвердили прекращение связывания Cb1 с ассоциированным с опухолью мутантным Met посредством исследований с коиммунопреципитацией. Клетки 293 трансфицировали посредством Met дикого типа (Met WT), мутантным Met Y1003F (Met Y1003F) и Met с делецией экзона 14 (Met ΔE×14) посредством трансфекции этими конструкциями Met с Cb1-flag клеток 293. Авторы настоящего изобретения выявили, что связывание Cb1 с Met ΔЕ×14 снижено по сравнению с WT Met (Фиг.2А), и подтвердили прекращение связывания Cb1 с Met Y1003F (6). Фосфорилирование тирозина Cb1 посредством Met WT и мутантных форм Met было равным, указывая на то, что мутации в Met не изменяют общего фосфорилирования Cb1. Данные авторов настоящего изобретения также указывают на то, что коиммунопреципитация эндогенного Cb1 происходит с Met WT, но не с Met ΔE×14 (Фиг.2В), что согласуется с выявленной коэкспрессией Met и Cb1. Кроме того, авторы настоящего изобретения исследовали участки фосфорилирования тирозина, необходимые для активации рецептора Met. Данные авторов настоящего изобретения указывают на то, что фосфорилирование Y1234/Y1235, Y1349 и Y1365 сохраняется как в Met WT, так и в Met ΔE×14 (Фиг.2В). Как и ожидалось, в Met WT, так и в Met ΔEx14 (Фиг. 2B). Как и ожидалось, в противоположность Met WT наблюдали прекращение фосфорилирования Y1003 в Met ΔEx14 (Фиг. 2B). Поскольку описано, что E3-лигазая активность Cb1 облегчает опосредуемую убиквитином деградацию рецептора (6, 8), проводили анализы убиквитинилирования на клетках, трансфицированных посредством Met WT, Met Y1003F и Met ΔEx14. Как для Met ΔEx14, так и для Met Y1003F показано повышенное убиквитинилирование по сравнению с Met WT в присутствии Cb1 (Фиг. 2C). Авторы настоящего изобретения подтвердили, что фосфорилирование Y1234/Y1235 сохранялось во всех конструкциях Met и, как и ранее, фосфо-Y1003 отсутствовал во всех мутантных формах (данные не представлены). Интересно, что при коэкспрессии с Cb1 был выявлен менее преобразованный Met WT по сравнению с мутантными формами или экспрессией Met WT отдельно (Фиг. 2C). Эти наблюдения позволяют предположить, что Met WT, который связывает Cb1, предпочтительно убиквитинилируется и деградируется (6, 24) в противоположность Met ΔEx14. Для определения того, приводит ли снижение убиквитинилирования Met ΔEx14 к отрицательной регуляции, клетки трансфицировали посредством конструкций Met и обрабатывали циклогексимидом для блокирования синтеза нового белка. Для Met ΔEx14 была показана замедленная отрицательная регуляция рецептора с течением времени по сравнению с Met WT (Фиг. 2D). Для мутантной формы Met Y1003F были показаны сходные результаты (данные не представлены). Существенным является то, что первичные опухоли, содержащие вариант по сплайсингу экзона 14, обладали повышенными уровнями белка Met по сравнению как с нормальной соседней легочной тканью соответствующего пациента, так и с аденокарциномами с Met дикого типа (данные не представлены), несмотря на равную экспрессию Met на транскрипционном уровне. Более того, анализ посредством иммуногистохимии экспрессии Met в этих опухолях пациентов с делецией экзона 14 выявил высокую экспрессию на мембране во всех опухолевых клетках; напротив, в опухолях с Met WT и в нормальных соседних тканях наблюдали спорадическую экспрессию Met (данные не представлены).
Для определения нарушения посредством снижения отрицательной регуляции Met ΔEx14 последующей передачи сигнала в клетке при стимуляции HGF, исследовали уровни фосфорилирования Met, Akt и MAPK в опухолевых клеточных линиях NSCLC, обладающих делецией экзона 14 (H596) или Met WT (H226 и H358). Было показано, что в клетках H596 уровни как фосфо-Met, так и фосфо-MAPK сохранялись вплоть до 3 часов после стимуляции посредством HGF, в то время в клеточных линиях как H226, так и H358, которые экспрессировали рецептор Met WT, было показано устойчивое снижение фосфорилирования с течением времени (Фиг. 2E). Интересно, что уровни фосфо-Akt не поддерживались с течением времени, несмотря на исходную активацию в ответ на HGF. Также исследовали фосфорилирование Stat3 и Stat5, однако не было выявлено повышения их активации (данные не представлены). Поскольку эти опухолевые клеточные линии были получены из различных генетических источников, авторы настоящего изобретения для сравнения получили стабильные клеточные линии в клетках Rat1A с пустым вектором, Met WT и Met ΔEx14. Для Rat1A с Met ΔEx14 было показано продолжительное фосфорилирование MAPK, но не активация Akt, по сравнению с Met WT при стимуляции посредством агониста Met 3D6, который активирует только рекомбинантный рецептор человека (25) (Фиг. 2F, 5), подтверждая данные, полученные для опухолевых клеточных линий NSCLC.
Последовательность длительной передачи сигнала Met и MAPK исследовали с помощью опосредуемой HGF пролиферации клеток H596, которые содержат Met с делецией 14 экзона, с помощью панели из 28 дополнительных клеточных линий NSCLC (Фиг. 3A). Клетки H596 стабильно проявляли наиболее высокий пролиферативный потенциал при стимуляции посредством HGF в этой панели клеточных линий NSCLC. Более того, для оценки роста in vivo при делеции Met мышам инокулировали стабильные клеточные линии Rat 1A с Met ΔEx14 и сравнивали с Rat 1A с Met WT в отношении способности образовывать опухоли. Повышенную пролиферацию клеток наблюдали в клетках Rat1a как с Met ΔEx14, так и с Met Y1003F, по сравнению с Met WT (данные не представлены). При стимуляции посредством 3D6 клетки Rat 1A с Met ΔEx14 обладали высокой способностью к образованию опухолей и приводили к развитию более крупных опухолей по сравнению с Rat 1A с Met WT (Фиг. 3B). Эти результаты согласовывались с повышенной онкогенной ролью Met с делецией 14 экзона.
Для определения возможности ингибирования антагонистами Met опухолевых клеток, обладающих делецией Met, клетки H596 обрабатывали известным ингибитором c-met (также обозначаемым как анти-Met OA-5D5 (26)). Анти-Met OA-5D5 представляет собой антитело, содержащее 3 иммуноглобулиновых полипептида - полную легкую цепь и тяжелую цепь, содержащую последовательности вариабельного домена (представленные на фиг. 9), и укороченную с N-конца тяжелую цепь, содержащую Fc-участок, который димеризуется с Fc-участком полноразмерной тяжелой цепи. Конструкция и получение анти-Met OA-5D5 также описаны в патентной заявке PCT No. PCT/US2004/042619 (поданной 17 декабря 2004 года). Фосфорилирование Met и MAPK снижалось при добавлении анти-Met OA-5D5 зависимым от дозы образом (Фиг. 4A, 6). Кроме того, обработка клеток H596 посредством OA-5D5 приводила к зависимому от дозы ингибированию пролиферации клеток зависимым от лиганда образом (Фиг. 4B). Эти результаты поддерживают терапевтический подход, включающий в себя воздействие на злокачественные опухоли, экспрессирующие c-met, который является гиперстабилизированным (такой как мутантный c-met, который обладает околомембранной делецией) посредством антагониста Met.
Несмотря на характер нарушения сплайсинга, свойственный клеткам опухоли, довольно неожиданным является то, что ассоциированный с опухолью вариант по сплайсингу в действительности кодирует мутантный рецепторный белок, который медленнее деградируется внутри клетки и который проявляет повышенную онкогенную активность. Данные авторов настоящего изобретения в значительной степени подтверждают, что процесс сплайсинга, запускаемый, например, посредством соматического мутагенеза, используется опухолями для активации онкогенного продукта гена. В данном исследовании, выявление разнообразных типов мутаций в интронах, которые дифференциально нарушают сборку сплайсеосомы и селективно удаляют экзон 14, показывает значимость такого мутагенного процесса в Met. Интересно, что делеции и вставки в околомембранном домене, по-видимому, участвуют в активации определенных рецепторных тирозинкиназ посредством изменения конформации рецептора и активации киназного домена (Hubbard, S Nature Rev Mol Cell Bio, 5:464, 2004). Околомембранная делеция KIT (Hirota et al Science 279:577, 1998) и PDGFRα (Heinrich, MC. et al Science 299:708, 2003) была выявлена в опухолях стромы желудочно-кишечного тракта; околомембранные внутренние тандемные повторы активируют FLT3 при остром миелоидном лейкозе (Nakao, M et al Leukemia 10: 1911, 1996). Однако выявление здесь авторами настоящего изобретения околомембранной делеции характеризует полностью отличающийся механизм активации Met, который замедляет отрицательную регуляцию рецептора, таким образом, приводя к мутантым белкам c-met со значительно повышенной стабильностью в злокачественных клетках. Эти данные позволяют предположить, что мутации, которые обеспечивают отрицательную регуляцию рецептора, могут приводить к онкогенной активации и запускать развитие опухоли.
ЧАСТИЧНЫЙ СПИСОК ССЫЛОК
1. L. Trusolino, P. M. Comoglio, Nat Rev Cancer 2, 289 (Apr, 2002).
2. C. Birchmeier, W. Birchmeier, E. Gherardi, G. F. Vande Woude, Nat Rev Mol Cell Biol 4, 915 (Dec, 2003).
3. C. Ponzetto et al., Cell 77, 261 (Apr 22, 1994).
4. K. M. Weidner et al, Nature 384, 173 (Nov 14, 1996).
5. G. Pelicci et al., Oncogene 10, 1631 (Apr 20, 1995).
6. P. Peschard et al, Mol Cell 8, 995 (Nov, 2001).
7. P. Peschard, N. Ishiyama, T. Lin, S. Lipkowitz, M. Park, J Biol Chem 279, 29565 (Jul 9, 2004).
8. A. Petrelli et al, Nature 416, 187 (Mar 14, 2002).
9. K. Shtiegman, Y. Yarden, Semin Cancer Biol 13, 29 (Feb, 2003).
10. M. D. Marmor, Y. Yarden, Oncogene 23, 2057 (Mar 15, 2004).
11. P. Peschard, M. Park, Cancer Cell 3, 519 (Jun, 2003).
12. J. M. Siegfried et al, Ann Thorac Surg 66, 1915 (Dec, 1998).
13. P. C. Ma et al, Anticancer Res 23, 49 (Jan-Feb, 2003).
14. B. E. Elliott, W. L. Hung, A. H. Boag, A. B. Tuck, Can J Physiol Pharmacol 80, 91 (Feb, 2002).
15. C. Seidel, M. Borset, H. Hjorth-Hansen, A. Sundan, A. Waage, Med Oncol 15, 145 (Sep, 1998).
16. G. Maulik et al, Cytokine Growth Factor Rev 13, 41 (Feb, 2002).
17. R. Wang, L. D. Ferrell, S. Faouzi, J. J. Maher, J. M. Bishop, J Cell Biol 153, 1023 (May 28, 2001).
18. L. Schmidt et al, Nat Genet 16, 68 (May, 1997).
19. M. Jeffers et al, Proc Natl Acad Sci USA 94, 11445 (Oct 14, 1997).
20. C. C. Lee, K. M. Yamada, J Biol Chem 269, 19457 (Jul 29, 1994).
21. C. M. Baek, S. H. Jeon, J. J. Jang, B. S. Lee, J. H. Lee, Exp Mol Med 36, 283 (Aug 31, 2004).
22. P. C. Ma et al., Cancer Res 65, 1479 (Feb 15, 2005).
23. P. C. Ma et al, Cancer Res 63, 6272 (Oct 1, 2003).
24. M. Jeffers, G. A. Taylor, K. M. Weidner, S. Omura, G. F. Vande Woude, Mol Cell Biol 17, 799 (Feb, 1997).
25. K. Ohashi et al., Nat Med 6, 327 (Mar, 2000).
26. Schwall, R. et al Proc Am Assoc Cancer Res 44, 1424 (2004).
Реферат
Изобретение относится к способу лечения опухоли путем введения субъекту антагониста c-met, где опухоль легкого содержит гиперстабилизированный полипептид c-met человека с делецией участка аминокислот L964 - D1010 аминокислотной последовательности (указана в формуле), благодаря чему деградация c-met снижена по сравнению с c-met дикого типа. Гиперстабилизированный полипептид c-met связывает лиганд c-met и обладает активностью c-met в отношении передачи сигнала. В изобретении показано, что антагонист вводят совместно с веществом, индуцирующим деградацию рецепторного белка. Антагонист c-met может представлять собой пептид-антагонист, антитело-антагонист c-met, в частности моновалентное антитело, гуманизированное, человеческое или химерное. Изобретение позволяет ингибировать активность c-met антагонистом за счет усиления клеточной деградации гиперстабилизированного белка c-met либо за счет ингибирования фосфорилирования гиперстабилизированного белка c-met или члена каскада передачи сигнала HGF-c-met. 9 з.п. ф-лы, 15 ил.
Формула
Документы, цитированные в отчёте о поиске
Самоусиливающиеся фармакологически контролируемыеэкспрессионные системы

Комментарии