Антитела против 5t4 и конъюгаты антитело-лекарственное средство - RU2018122629A
Код документа: RU2018122629A
Формула
1. Антитело против 5T4, содержащее определяющие комплементарность области (CDR) вариабельной области (VR) тяжелой цепи (HC) и легкой цепи (LC), выбранные из группы, состоящей из:
a. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:1 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:2;
b. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:3 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:4;
c. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:5 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:6;
d. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:7 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:8;
e. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:9 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:10;
f. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:11 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:12;
g. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:13 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:14;
h. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:15 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:16;
i. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:17 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:18;
j. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:19 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:20;
k. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:21 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:22;
l. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:23 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:24;
m. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:25 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:26;
n. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:27 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:28;
o. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:29 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:30;
p. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:31 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:32, и
q. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:33 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:34.
2. Антитело по п. 1, содержащее CDR HCVR и LCVR, выбранные из группы, состоящей из:
a. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:1 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:2;
b. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:5 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:6;
c. аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:11 и аминокислотных последовательностей CDR1, CDR2 и CDR3 SEQ ID NO:12;
где антитело является гуманизированным.
3. Гуманизированное антитело по п. 2, содержащее
a. аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:1 и аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:2, и аминокислотную последовательность HCVR SEQ ID NO:35 и аминокислотную последовательность LCVR SEQ ID NO:45;
b. аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:1 и аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:2, и аминокислотную последовательность HCVR SEQ ID NO:36 и аминокислотную последовательность LCVR SEQ ID NO:45;
c. аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:1 и аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:2, и аминокислотную последовательность HCVR SEQ ID NO:37 и аминокислотную последовательность LCVR SEQ ID NO:44;
d. аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:1 и аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:2, и аминокислотную последовательность HCVR SEQ ID NO:37 и аминокислотную последовательность LCVR SEQ ID NO:46;
e. аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:11 и аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:12; и аминокислотную последовательность HCVR SEQ ID NO:40 и аминокислотную последовательность LCVR SEQ ID NO:51;
f. аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:11 и аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:12; и аминокислотную последовательность HCVR SEQ ID NO:41 и аминокислотную последовательность LCVR SEQ ID NO:51;
g. аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:11 и аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:12; и аминокислотную последовательность HCVR SEQ ID NO:42 и аминокислотную последовательность LCVR SEQ ID NO:49;
h. аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:11 и аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:12; и аминокислотную последовательность HCVR SEQ ID NO:43 и аминокислотную последовательность LCVR SEQ ID NO:50;
i. аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:5 и аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:6; и аминокислотную последовательность HCVR SEQ ID NO:38 и аминокислотную последовательность LCVR SEQ ID NO:47;
j. аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:5 и аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:6; и аминокислотную последовательность HCVR SEQ ID NO:39 и аминокислотную последовательность LCVR SEQ ID NO:47; и
k. аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:5 и аминокислотные последовательности CDR1, CDR2 и CDR3 SEQ ID NO:6; и аминокислотную последовательность HCVR SEQ ID NO:39 и аминокислотную последовательность LCVR SEQ ID NO:48.
4. Антитело по любому из пп. 1-3, где антитело содержит по меньшей мере один сконструированный цистеин в положении в каркасной области тяжелой цепи или каркасной области легкой цепи.
5. Антитело по п. 4, где по меньшей мере один сконструированный цистеин присутствует в одном или более положений указанного антитела, выбранных из
40, 41 и 89 тяжелой цепи (в соответствии с нумерацией по Kabat); и
40 и 41 легкой цепи (в соответствии с нумерацией по Kabat).
6. Конъюгат антитело-лекарственное средство, содержащий антитело по любому из пп. 1-5.
7. Конъюгат антитело-лекарственное средство по п. 6, содержащий антитело по п. 4 или 5, где лекарственное средство-линкер сайт-специфически конъюгируют с антителом через по меньшей мере один сконструированный цистеин.
8. Конъюгат антитело-лекарственное средство по п. 6 или 7 формулы (I)
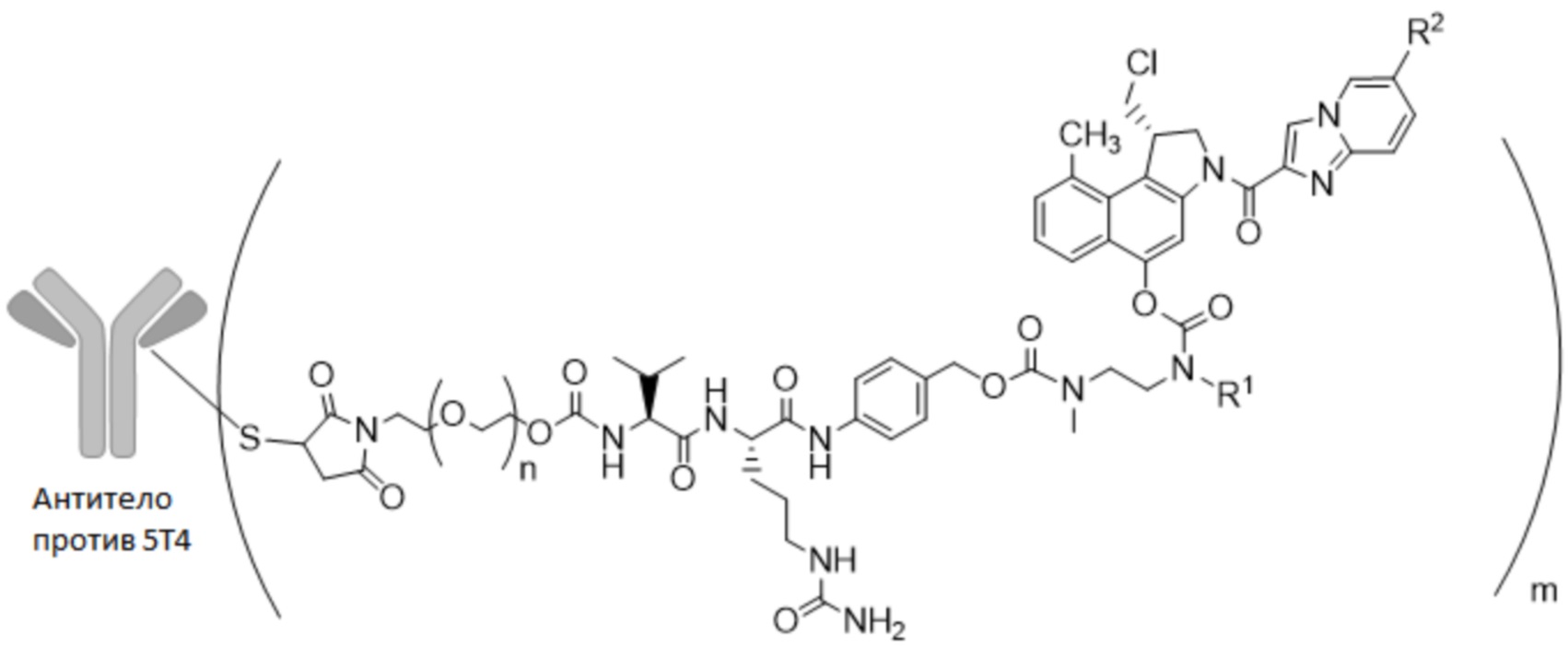
где
n представляет собой 0-3,
m представляет собой среднее DAR от 1 до 6,
R1 выбран из
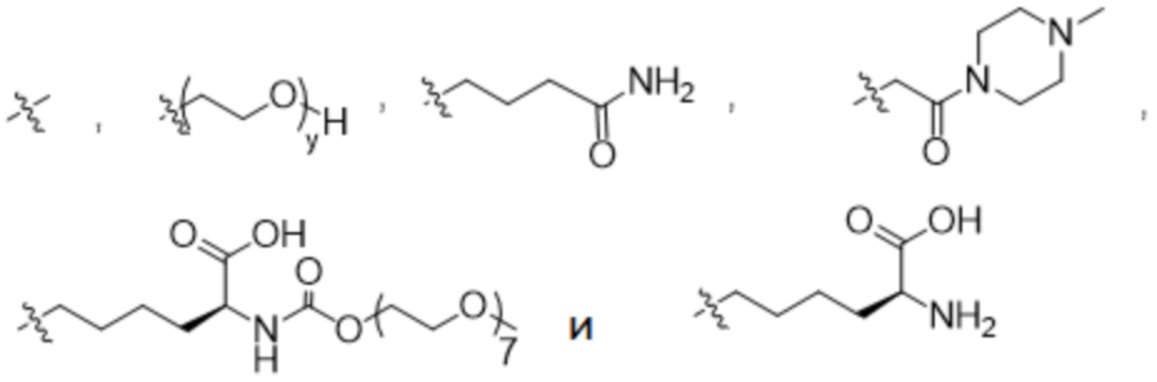
y представляет собой 1-16, и
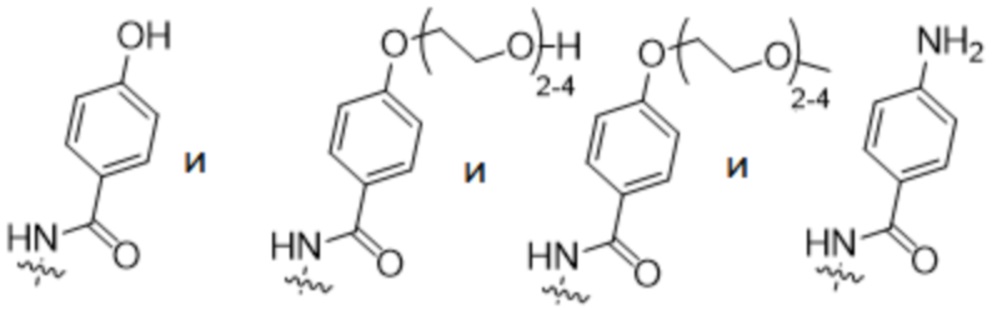
R2 выбран из
9. Конъюгат антитело-лекарственное средство по п. 8, где n представляет собой 0-1,
m представляет собой среднее DAR от 1,5 до 2,
R1 представляет собой
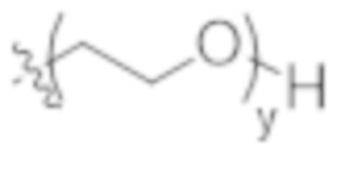
y представляет собой 1-4, и
R2 выбран из
10. Конъюгат антитело-лекарственное средство по любому из пп. 6-9 формулы (II)
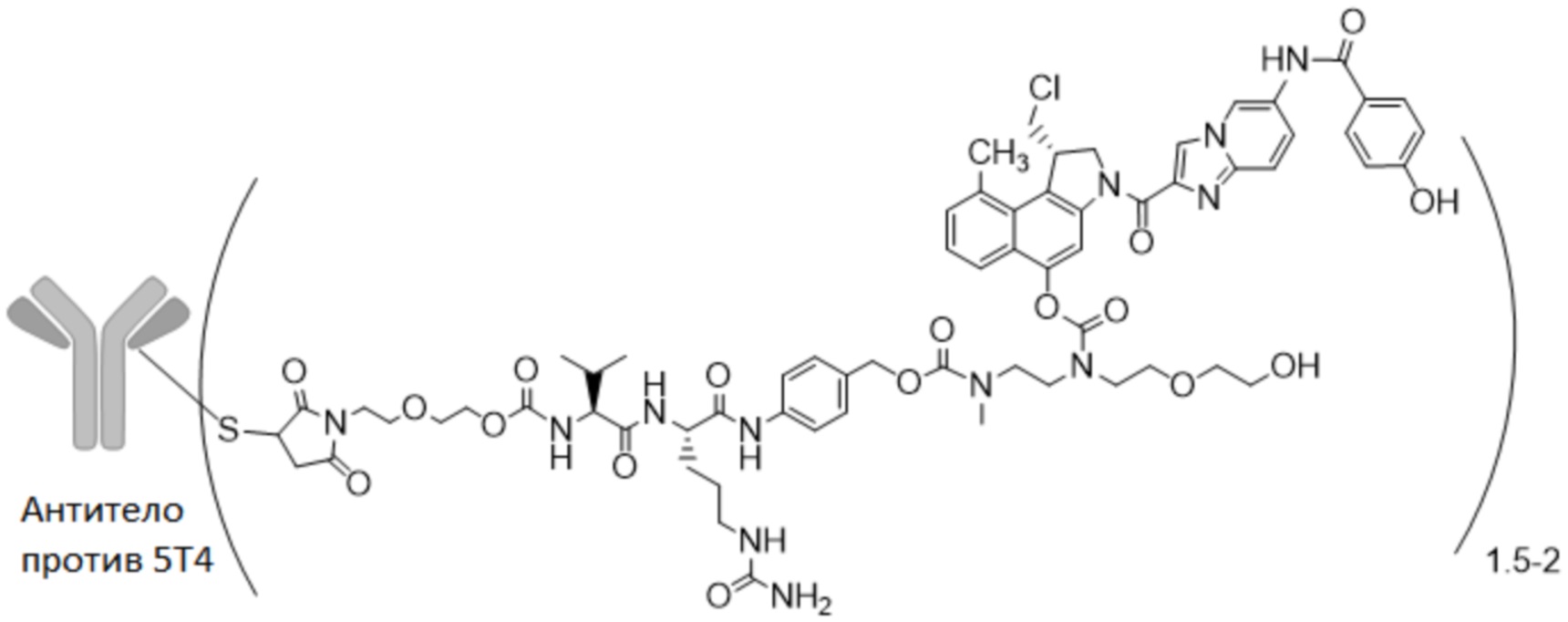
11. Конъюгат антитело-лекарственное средство по любому из пп. 6-10, где антитело против 5T4 представляет собой гуманизированное антитело, содержащее HCVR и LCVR, выбранные из группы, состоящей из:
a. аминокислотной последовательности HCVR SEQ ID NO:61 и аминокислотной последовательности LCVR SEQ ID NO:51;
b. аминокислотной последовательности HCVR SEQ ID NO:62 и аминокислотной последовательности LCVR SEQ ID NO:51;
c. аминокислотной последовательности HCVR SEQ ID NO:63 и аминокислотной последовательности LCVR SEQ ID NO:49;
d. аминокислотной последовательности HCVR SEQ ID NO:64 и аминокислотной последовательности LCVR SEQ ID NO:50;
e. аминокислотной последовательности HCVR SEQ ID NO:59 и аминокислотной последовательности LCVR SEQ ID NO:47; и
f. аминокислотной последовательности HCVR SEQ ID NO:60 и аминокислотной последовательности LCVR SEQ ID NO:48;
где лекарственное средство-линкер сайт-специфически конъюгируют с антителом против 5T4 через сконструированный цистеин в положении 41 тяжелой цепи.
12. Фармацевтическая композиция, содержащая антитело по любому из пп. 1-5 или конъюгат антитело-лекарственное средство по любому из пп. 6-11 и один или более фармацевтически приемлемых эксципиентов, предпочтительно в форме лиофилизированного порошка.
13. Применение антитела по любому из пп. 1-5, конъюгата антитело-лекарственное средство по любому из пп. 6-11 или фармацевтической композиции по п. 12 в качестве лекарственного средства.
14. Применение антитела, конъюгата антитело-лекарственное средство или фармацевтической композиции по п. 13 в лечении солидных опухолей и гематологических злокачественных новообразований человека.
15. Применение по п. 14, где солидные опухоли человека выбраны из группы, состоящей из рака молочной железы, рака желудка, колоректального рака, рака яичника, рака легких и мезотелиомы.
16. Комбинация антитела по любому из пп. 1-5, конъюгата антитело-лекарственное средство по любому из пп. 6-11 или фармацевтической композиции по п. 12 с терапевтическим антителом, химиотерапевтическим средством и/или ADC против связанной со злокачественной опухолью мишенью, отличной от антигена 5T4, для применения в лечении солидных опухолей и гематологических злокачественных новообразований человека.

Комментарии