Химерные и гуманизированные антитела против интегрина α5β1, которые модулируют ангиогенез - RU2346701C2
Код документа: RU2346701C2
Чертежи


















Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к химерным и гуманизированным антителам, которые специфично распознают интегрин α5β1, и к способам применения антитела для снижения или ингибирования ангиогенеза в ткани. Также раскрыты способы определения терапевтически приемлемых доз антител и содержащих их фармацевтических композиций.
Предпосылки изобретения
Ангиогенез представляет собой процесс образования новых кровеносных сосудов. Ангиогенез, также называемый неоваскуляризацией, в норме происходит во время эмбриогенеза и развития, а в полностью развитых организмах он случается при различных патологических состояниях, включающих в себя глазные заболевания, такие как диабетическая ретинопатия и дегенерация желтого пятна вследствие неоваскуляризации; состояния, ассоциированные с воспалением ткани, например ревматоидный артрит и воспалительное заболевание кишечника; и злокачественные опухоли, при которых образование кровеносных сосудов в растущей опухоли обеспечивает кислородом и питательными веществами опухолевые клетки, а также предоставляют путь, которым опухолевые клетки метастазируют по организму. Поскольку миллионы людей по всему миру подвержены этим заболеваниям, приложены значительные усилия для понимания механизмов, вовлеченных в ангиогенез, для разработки способов выявления и ингибирования такого нежелательного ангиогенеза.
Ангиогенез происходит в ответ на стимуляцию одним или несколькими факторами роста, и в нем также могут участвовать другие, пока не идентифицированные факторы. Эндотелиальные клетки, которые представляют собой клетки, выстилающие зрелые сосуды, в норме не пролиферируют. Однако в ответ на соответствующий стимул эндотелиальные клетки становятся активированными и начинают пролиферировать и мигрировать в неваскуляризованную ткань для образования новых кровеносных сосудов. В некоторых случаях клетки-предшественники активируются для дифференцировки в эндотелиальные клетки, которые образуют новые кровеносные сосуды.
Кровеносные сосуды окружены внеклеточным матриксом. В дополнение к стимуляции ростовыми факторами ангиогенез зависит от взаимодействий эндотелиальных клеток с внеклеточным матриксом, а также друг с другом. Активация эндотелиальных клеток ростовыми факторами и миграция во внеклеточный матрикс и взаимодействие с ним и данных клеток друг с другом зависит от рецепторов клеточной поверхности, экспрессируемых эндотелиальными клетками. Данные рецепторы клеточной поверхности, которые включают в себя рецепторы факторов роста и интегрины, специфично взаимодействуют с конкретными молекулами.
При патологических состояниях, таких как связанная с возрастом дегенерация желтого пятна и диабетическая ретинопатия, сниженный доступ кислорода к сетчатке приводит к состоянию гипоксии, который стимулирует секрецию ангиогенных факторов роста, таких как фактор роста сосудистого эндотелия (VEGF). Данная секреция индуцирует аномальную миграцию и пролиферацию эндотелиальных клеток в ткани глаза. Это приводит к васкуляризации тканей глаза и может индуцировать рубцевание роговицы, отслоение сетчатки и накопление жидкости в сосудистой оболочке, причем все они могут необратимо влиять на зрение и вести к слепоте.
Ангиогенез также ассоциирован с прогрессией и обострением воспалительных заболеваний, включая псориаз, ревматоидный артрит, остеоартрит и воспалительные заболевания кишечника, например язвенный колит и болезнь Крона. При воспалительном заболевании суставов, например, приток лимфоцитов в область, окружающую суставы, стимулирует ангиогенез в синовиальной выстилке. Данная повышенная васкуляризация обеспечивает средство большего притока лейкоцитов, который способствует разрушению хряща и кости в суставе. Ангиогенная васкуляризация, которая происходит при воспалительном заболевании кишечника, приводит к сходным эффектам в кишечнике.
Рост капилляров в атеросклеротических бляшках коронарных артерий представляет собой другое патологическое состояние, ассоциированное с индуцированными факторами роста. Избыточный поток крови в неоваскуляризованных бляшках может приводить к разрушению и геморрагии в наполненных кровью бляшках, высвобождению кровяных сгустков, которые могут в результате вызвать коронарный тромбоз.
Участие ангиогенеза в таких разнообразных заболеваниях, как злокачественные опухоли, глазные болезни и воспалительные заболевания, вызвало попытки идентифицировать способы специфического ингибирования ангиогенеза как средства лечения данных заболеваний. Для больных злокачественными опухолями данные способы лечения могут предоставлять существенное преимущество над используемыми в настоящее время способами, такими как химиотерапия, которые уничтожают или ослабляют не только опухолевые клетки-мишени, но также и нормальные пролиферирующие клетки пациента, такие как клетки крови, эпителиальные клетки и клетки, выстилающие просвет кишечника. Такое неспецифическое уничтожение химиотератевтическими средствами приводит к побочным эффектам, которые, в лучшем случае, неприятны и могут часто приводить к неприемлемой заболеваемости или смертности пациентов. Фактически нежелательные побочные эффекты, ассоциированные со способами лечения злокачественных опухолей, часто ограничивают лечение, которое может получить пациент.
Краткая сущность изобретения
Настоящее изобретение относится к терапевтическим химерным и гуманизированным антителам, направленным против интегрина α5β1; способам очистки данных антител и к способам их применения при лечении состояний, включающих в себя нежелательный ангиогенез в ткани.
В одном из осуществлений изобретение относится к нуклеиновой кислоте, кодирующей полипептид химерного или гуманизированного антитела против интегрина α5β1, характеризующийся 65%-й, предпочтительно превышающей 75%, более предпочтительно 85%-й, 90%-й, 95%-й, 97%-й или 99%-й идентичностью по последовательности в отношении одной или нескольких последовательностей, выбранных из группы, состоящей из SEQ ID NO: 1-12, 16, 18, 20, 22, 25-26, 28, 31-32. Наиболее предпочтительно нуклеиновая кислота кодирует полипептид химерного или гуманизированного антитела против интегрина α5β1, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2-6, 8-12, 16, 18, 20, 22, 25-26, 28, 31-32. Пептид, кодируемый данной нуклеиновой кислотой, может представлять собой одноцепочечное антитело или Fab в дополнение к Fab или антителу, включающим в себя некоторые пептиды, связанные дисульфидной связью.
Изобретение также относится к полипептиду, характеризующемуся 65%-й, предпочтительно превышающей 75%, более предпочтительно 85%-й, 90%-й, 95%-й, 97%-й или 99%-й идентичностью по последовательности в отношении одной или нескольких последовательностей, выбранных из группы, состоящей из SEQ ID NO: 1-12, 16, 18, 20, 22, 25-26, 28, 31-32. Более предпочтительно последовательность нуклеиновой кислоты кодирует полипептид, содержащий одну или несколько аминокислотных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 2-6, 8-12, 16, 18, 20, 22, 25-26, 28, 31-32. Данные пептиды включают в себя химерные, человеческие и гуманизированные антитела и Fab-фрагменты.
В другом осуществлении изобретение относится к химерным антителам против интегрина α5β1. Данные антитела содержат первый полипептид из первого источника, содержащий аминокислотную последовательность, характеризующуюся 65%-й, предпочтительно превышающей 75%, более предпочтительно 85%-й, 90%-й, 95%-й, 97%-й или 99%-й идентичностью в отношении аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, 7, 16, 18, 20, 22; и второй полипептид из второго источника, характеризующийся 65%-й, предпочтительно превышающей 75%, более предпочтительно 85%-й, 90%-й, 95%-й, 97%-й или 99%-й идентичностью в отношении константной области антитела из второго источника, где первый и второй полипептиды образуют белковый комплекс, который иммунореактивен в отношении интегрина α5β1. В предпочтительном осуществлении второй источник константной области представляет собой человеческий IgG. В другом предпочтительном осуществлении константная область представляет собой человеческий IgG4.
В другом предпочтительном осуществлении химерные антитела содержат первую полипептидную последовательность из первого источника, включающую в себя одну или несколько аминокислотных последовательностей, выбранных из группы, состоящей из SEQ ID NO: 1, 7, 16, 18, 20, 22; и вторую полипептидную последовательность из второго источника, включающую в себя последовательность константной области антитела второго источника, где первая и вторая полипептидные последовательности образуют белковый комплекс, который иммунореактивен в отношении интегрина α5β1.
В наиболее предпочтительном осуществлении изобретение относится к химерному антителу против интегрина α5β1, включающему в себя аминокислотную последовательность тяжелой цепи SEQ ID NO: 25 и аминокислотную последовательность легкой цепи SEQ ID NO: 26.
В альтернативном осуществлении изобретение относится к нуклеиновой кислоте, кодирующей вариабельную область тяжелой цепи химерного антитела против интегрина α5β1, включающую в себя SEQ ID NO: 19, и нуклеиновую кислоту, кодирующую вариабельную область тяжелой цепи химерного антитела против интегрина α5β1, включающую в себя SEQ ID NO: 21.
В дальнейшем предпочтительном осуществлении изобретение относится к Fab-фрагменту, происходящему из химерного антитела против интегрина α5β1, включающему аминокислотную последовательность тяжелой цепи SEQ ID NO: 25 и аминокислотную последовательность легкой цепи SEQ ID NO: 26. В наиболее предпочтительном осуществлении Fab-фрагмент содержит аминокислотную последовательность тяжелой цепи SEQ ID NO: 28 и аминокислотную последовательность легкой цепи SEQ ID NO: 26.
В дальнейшем предпочтительном осуществлении изобретение относится к гуманизированному антителу, происходящему от химерного антитела против интегрина α5β1, содержащего аминокислотную последовательность тяжелой цепи SEQ ID NO: 25 и аминокислотную последовательность легкой цепи SEQ ID NO: 26. В наиболее предпочтительном осуществлении гуманизированное антитело включает в себя аминокислотную последовательность тяжелой цепи SEQ ID NO: 28 и аминокислотную последовательность легкой цепи SEQ ID NO: 26.
В другом осуществлении изобретение относится к экспрессирующему вектору, содержащему одну или несколько нуклеиновых кислот, выбранных из группы, состоящей из SEQ ID NO: 15, 17, 19, 21, 23, 24, 27, 29, 30. В предпочтительном осуществлении экспрессирующий вектор содержит SEQ ID NO: 19 и 21.
В другом осуществлении изобретение относится к клетке, трансформированной экспрессирующим вектором, содержащим одну или несколько нуклеиновых кислот, выбранных из группы, состоящей из SEQ ID NO: 15, 17, 19, 21, 23, 24, 27, 29, 30. В предпочтительном осуществлении экспрессирующий вектор включает в себя SEQ ID NO: 19 и 21.
В другом осуществлении изобретение включает в себя фармацевтические композиции, содержащие описанные здесь химерные или гуманизированные антитела против интегрина α5β1. В некоторых осуществлениях данные композиции могут содержать средства, которые усиливают захват или локализацию терапевтического компонента, снижают воспаление или иначе обеспечивают локализованное облегчающее действие.
В одном из аспектов данного осуществления фармацевтическая композиция включает в себя крем для местного применения, который наносится непосредственно на поврежденную ткань. В другом аспекте фармацевтическое средство представляет собой раствор глазных капель, который наносится непосредственно в поврежденный глаз. Еще в одном аспекте фармацевтическое средство представляет собой инъецируемую форму, которая может наноситься системно для лечения поврежденной ткани одного или обоих глаз субъекта или для ингибирования неоангиогенеза в опухолевой ткани.
В другом осуществлении изобретение относится к способам подавления васкуляризации поврежденной ткани. Данные способы включают в себя нанесение одной или нескольких доз химерного или гуманизированного антитела против интегрина α5β1 на поврежденную ткань, где повреждение ткани может являться результатом физического или химического повреждения или заболевания.
В другом осуществлении изобретение относится к способу введения терапевтического антитела, предусматривающему получение фармацевтического средства, содержащего терапевтическое антитело, включающее в себя вариабельную область тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO: 2-6, 16, 20, и вариабельную область легкой цепи, независимо выбранную из группы, состоящей из SEQ ID NO: 8-12, 18, 22; и нанесение данного терапевтического антитела на поврежденную ткань. В данном осуществлении изобретения поврежденная ткань отвечает на повреждение усилением кровотока путем неоваскуляризации, а терапевтическое антитело ингибирует неоваскуляризацию. В одном из аспектов способ включает в себя инъекцию терапевтических антител в стекловидное тело больного или поврежденного глаза субъекта, у которого поражены оба глаза; инъекции в стекловидное тело одного глаза достаточно для лечения обоих глаз.
В другом осуществлении изобретение относится к способу очистки антител против интегрина α5β1. Данный способ предусматривает адсорбцию антитела, связывающегося с субстратом на аффинном в отношении антитела матриксе, и элюцию антитела с субстрата, причем для аффинного матрикса со связанным антителом используется раствор элюции, имеющий рН примерно от 3,0 до 5,5. Способ может, кроме того, предусматривать получение очищенного антитела. Антитела, подлежащие очистке с использованием данной процедуры, включают в себя те, которые содержат, по меньшей мере, две области CDR, независимо выбранных из тех, что представлены в аминокислотных SEQ ID NO: 1-12, 16, 18, 20, 22. Предпочтительно одна из выбранных CDR происходит из VL-цепи, а другая происходит из VH-цепи.
В другом аспекте данного способа очистки раствор элюции имеет рН примерно от 3,3 до 5,5. В других аспектах pH раствора элюции составляет примерно от 3,5 до 5,5. Еще одни аспекты включают в себя раствор элюции с pH примерно от 3,5 до 4,2. Дальнейшие аспекты включают в себя раствор элюции с pH примерно от 4,2 до 5,5.
Другое осуществление настоящего изобретения относится к способу оценки физиологического действия (например, антиангиогенных свойств), модулируемого гуманизированным антителом против интегрина α5β1, которое включает в себя как антитела, так и Fab-фрагменты. Данный способ предусматривает предоставление образца жизнеспособной ткани, способной к регенерации сосудов; создание повреждений данной жизнеспособной ткани, достаточных для продукции хороидальной неоваскуляризации; нанесение одной или нескольких доз гуманизированного антитела против интегрина α5β1 на данную жизнеспособную ткань; и мониторинг обработанной жизнеспособной ткани на предмет реваскуляризации. В предпочтительном осуществлении способ оценки включает в себя ткань глаза в качестве жизнеспособной ткани. В некоторых осуществлениях используется желтое пятно глаза. Также рассматриваются способы оценки, где используемая ткань глаза представляет собой ткань глаза живого примата (например, узконосой обезьяны).
В другом осуществлении способ оценки предусматривает инъекцию в стекловидное тело химерного или гуманизированного антитела против интегрина α5β1. В другом аспекте изобретения, когда повреждены оба глаза субъекта, инъекция антител в один глаз приводит к тому, что антитела, контактирующие с поврежденной тканью, присутствуют в обоих глазах.
Другой аспект способа оценки физиологического действия предусматривает создание очагов повреждения путем контакта жизнеспособной ткани со светом лазера. Данный свет лазера может иметь мощность примерно от 300 до 700 МВт, и время воздействия составляет не более 0,1 секунды, предпочтительно менее 0,05 секунды и наиболее предпочтительно менее чем примерно 0,01 секунды. Очаги повреждения должны составлять менее 200 мкм, предпочтительно менее 100 мкм, более предпочтительно примерно от 50 до 100 мкм в диаметре и наиболее предпочтительно около 75-25 мкм в диаметре.
Некоторые аспекты способа предусматривают стадию мониторинга, включающую в себя периодическое фотографирование очагов повреждения путем применения одной или нескольких доз гуманизированного антитела против интегрина α5β1. В одном из аспектов стадия мониторинга далее предусматривает непрямую офтальмоскопическую оценку задней камеры глаза и биомикроскопическую оценку переднего сегмента глаза. В другом аспекте способ предусматривает стадию мониторинга, которая включает в себя внутривенное введение флуоресцеиновой метки и оценку жизнеспособной ткани путем флуоресцеиновой ангиографии.
Способ оценки физиологического действия, модулируемого химерным или гуманизированным антителом против интегрина α5β1, также предусматривает аспект, в котором химерное или гуманизированное антитело против интегрина α5β1 содержит вариабельную область тяжелой цепи, характеризующуюся последовательностью, на 65%, предпочтительно более чем на 75%, более предпочтительно на 85%, 90%, 95%, 97% или 99% идентичной в отношении аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-6, 16, 20, и вариабельную область легкой цепи, выбранную независимо и характеризующуюся последовательностью, на 65%, предпочтительно более чем на 75%, более предпочтительно на 85%, 90%, 95%, 97% или 99% идентичной в отношении аминокислотной последовательности из группы, состоящей из SEQ ID NO: 7-12, 18, 22. Наиболее предпочтительно гуманизированное антитело против интегрина α5β1 содержит вариабельную область тяжелой цепи, характеризующуюся последовательностью, выбранной из группы, состоящей из SEQ ID NO: 1-6, 16, 20, и вариабельную область легкой цепи, независимо выбранную из группы, состоящей из SEQ ID NO: 7-12, 18, 22.
Способ оценки физиологического действия, модулируемого химерным или гуманизированным антителом против интегрина α5β1, также предусматривает аспект, в котором химерное или гуманизированное антитело против интегрина α5β1 содержит вариабельную область тяжелой цепи, характеризующуюся последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2-6, 16, 20, и вариабельную область легкой цепи, независимо выбранную из группы, состоящей из SEQ ID NO: 8-12, 18, 22.
Краткое описание чертежей
На Фиг.1 показаны аминокислотные последовательности (SEQ ID NO: 1-12) вариабельных областей тяжелых (VH) и легких (VL) цепей мышиного антитела против интегрина α5β1 (IIA1) и пяти гуманизированных антител, происходящих от мышиного оригинала (1.0-5.0).
На Фиг.2 показано выравнивание аминокислотных последовательностей (SEQ ID NO: 1-12), которое подчеркивает аминокислотные замены относительно мышиного оригинала (IIA1) в пяти гуманизированных антителах.
На Фиг.3 показаны: (А) последовательность нуклеиновой кислоты (SEQ ID NO: 13) и аминокислотная последовательность (SEQ ID NO: 46) VH IIA1; (В) последовательность нуклеиновой кислоты (SEQ ID NO: 14) и аминокислотная последовательность (SEQ ID NO: 47) IIA1 VL.
На Фиг.4 показаны: (А) последовательность нуклеиновой кислоты (SEQ ID NO: 15) и аминокислотная последовательность (SEQ ID NO: 16) VH антитела 200-4; (В) последовательность нуклеиновой кислоты (SEQ ID NO: 17) и аминокислотная последовательность (SEQ ID NO: 18) VL антитела 200-4.
На Фиг.5 показаны: (А) последовательность нуклеиновой кислоты (SEQ ID NO: 19) и аминокислотная последовательность (SEQ ID NO: 20) VH M200; (В) последовательность нуклеиновой кислоты (SEQ ID NO: 21) и аминокислотная последовательность (SEQ ID NO: 22) VL M200.
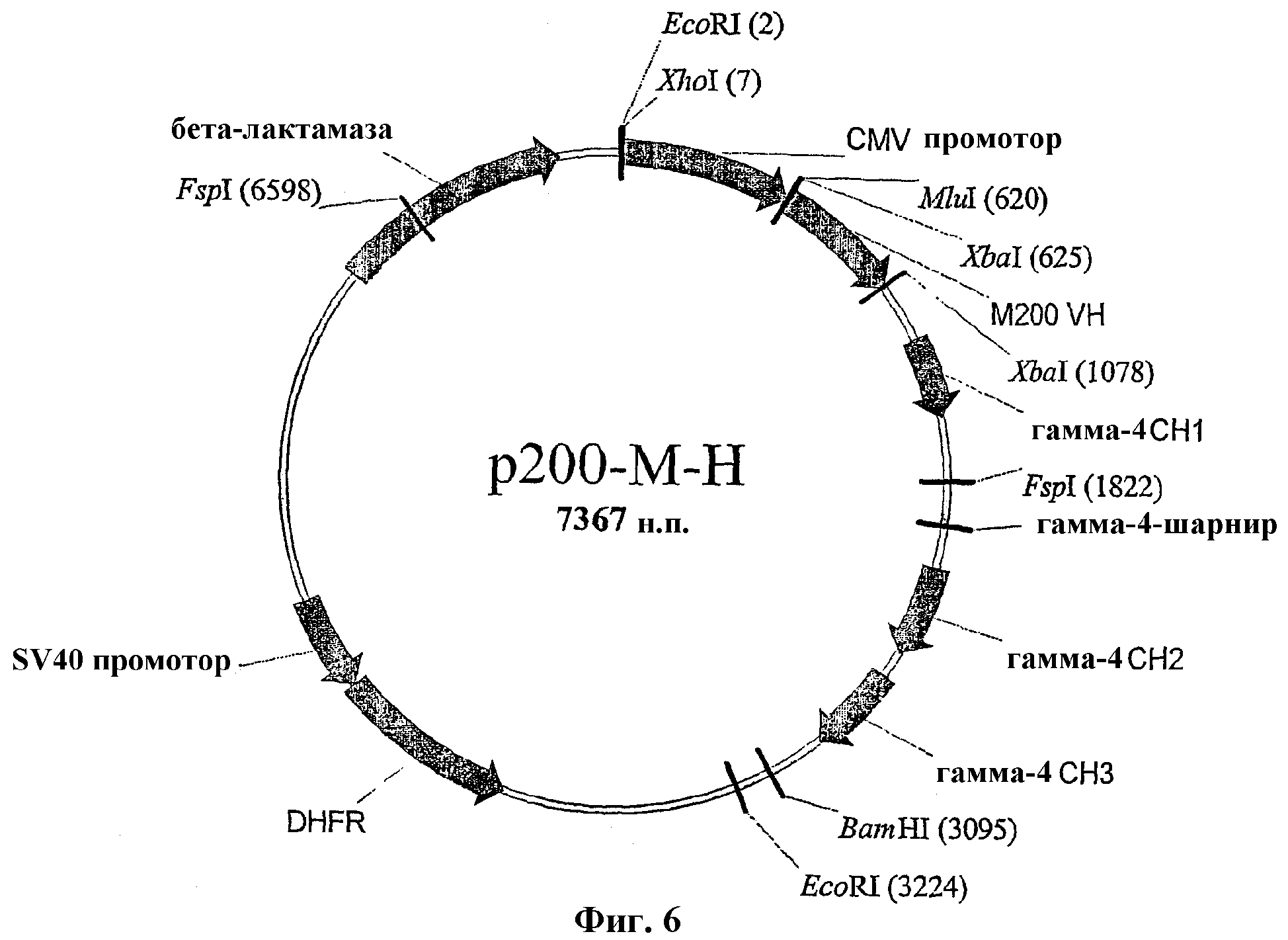
На Фиг.6 показана конструкция плазмиды р200-М-Н для экспрессии тяжелой цепи М200.
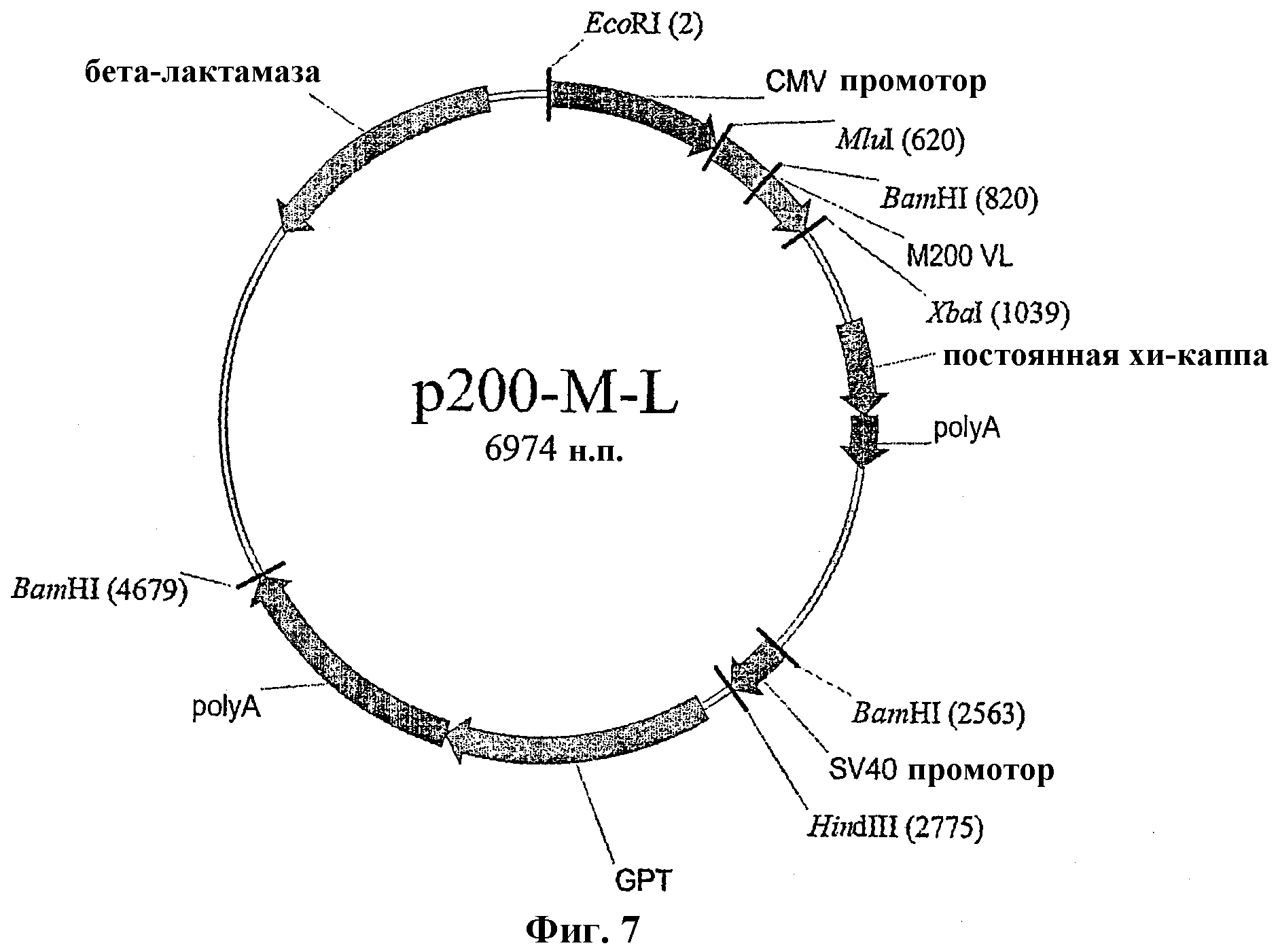
На Фиг.7 показана конструкция плазмиды p200-M-L для экспрессии легкой цепи M200.
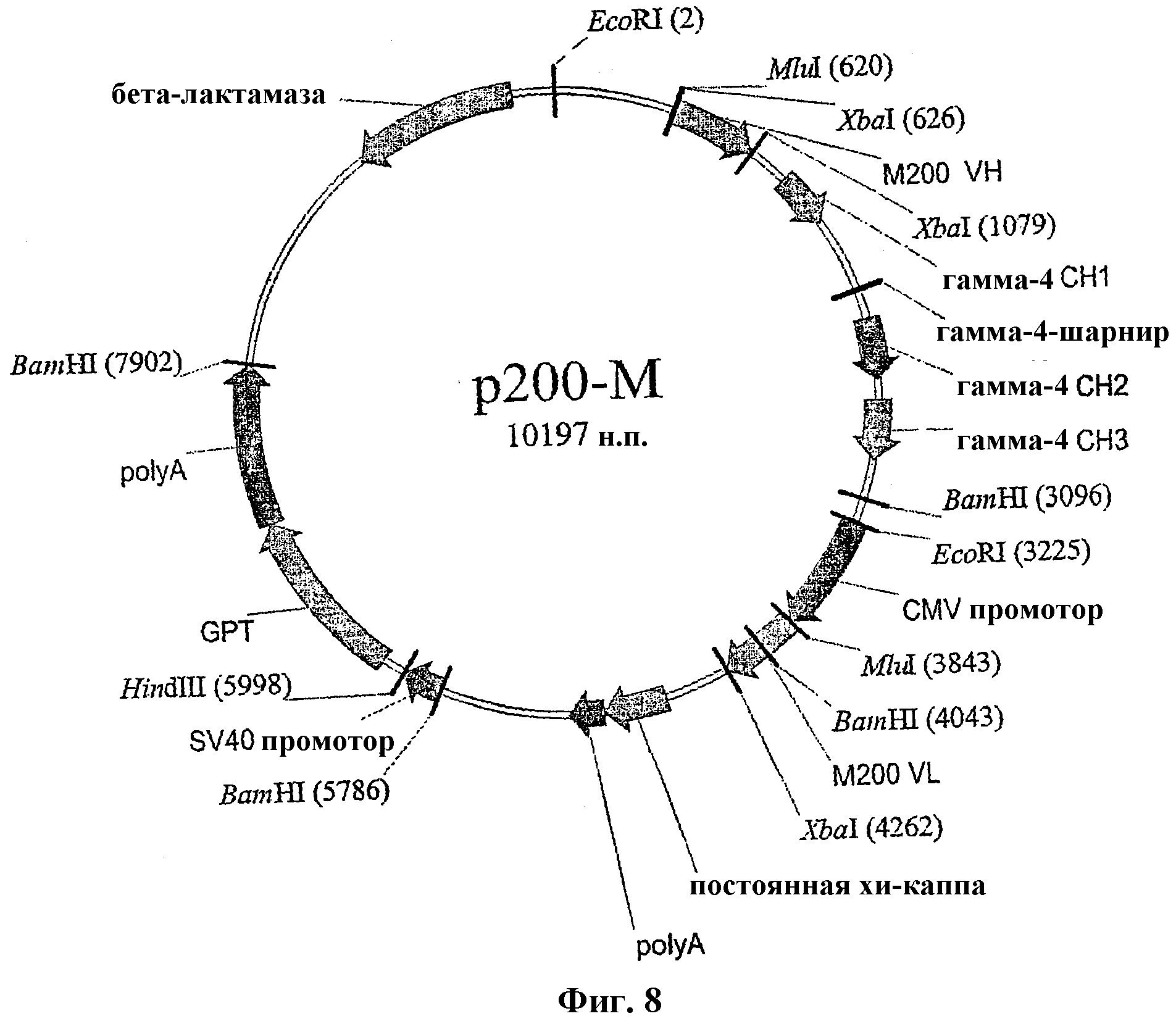
На Фиг.8 показана одна плазмида p200-M для экспрессии легкой и тяжелой цепей M200.
На Фиг.9 показаны полные последовательности ДНК тяжелой и легкой цепи M200 (SEQ ID NO: 23-24).
На Фиг.10 показаны полные аминокислотные последовательности тяжелой и легкой цепи M200 (SEQ ID NO: 25-26).
На Фиг.11 показана полная последовательность ДНК и аминокислотная последовательность тяжелой цепи F200 (SEQ ID NO: 27-28).
На Фиг.12 показаны полные последовательности ДНК тяжелой и легкой цепи huM200 (SEQ ID NO: 29-30).
На Фиг.13 показаны полные аминокислотные последовательности тяжелой и легкой цепи huM200 (SEQ ID NO: 31-32).
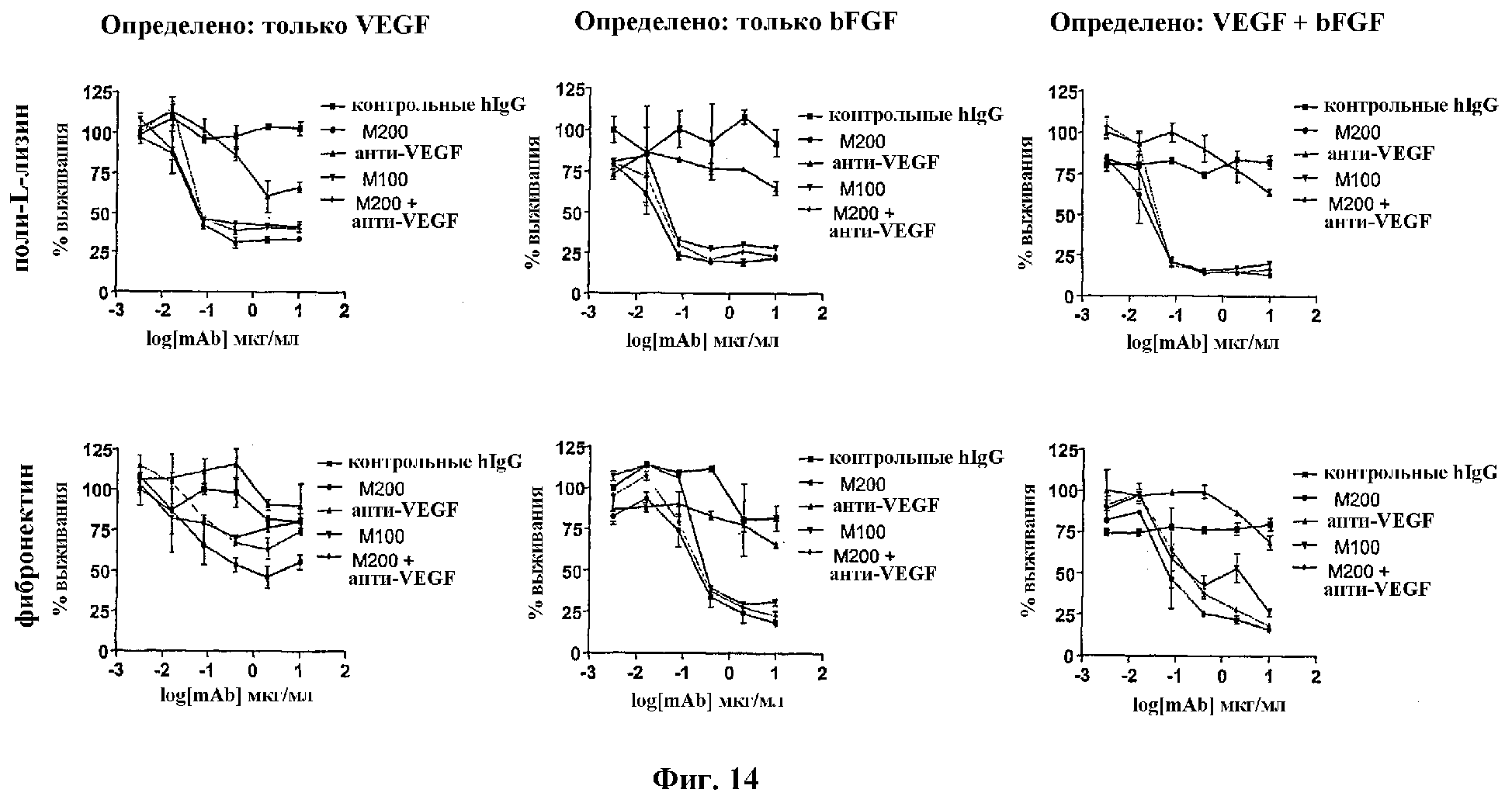
На Фиг.14 проиллюстрированы результаты, показывающие, что M200 представляет собой мощный ингибитор роста эндотелиальных клеток, обладающий антипролиферативными свойствами mAb против VEGF, HuMV833.
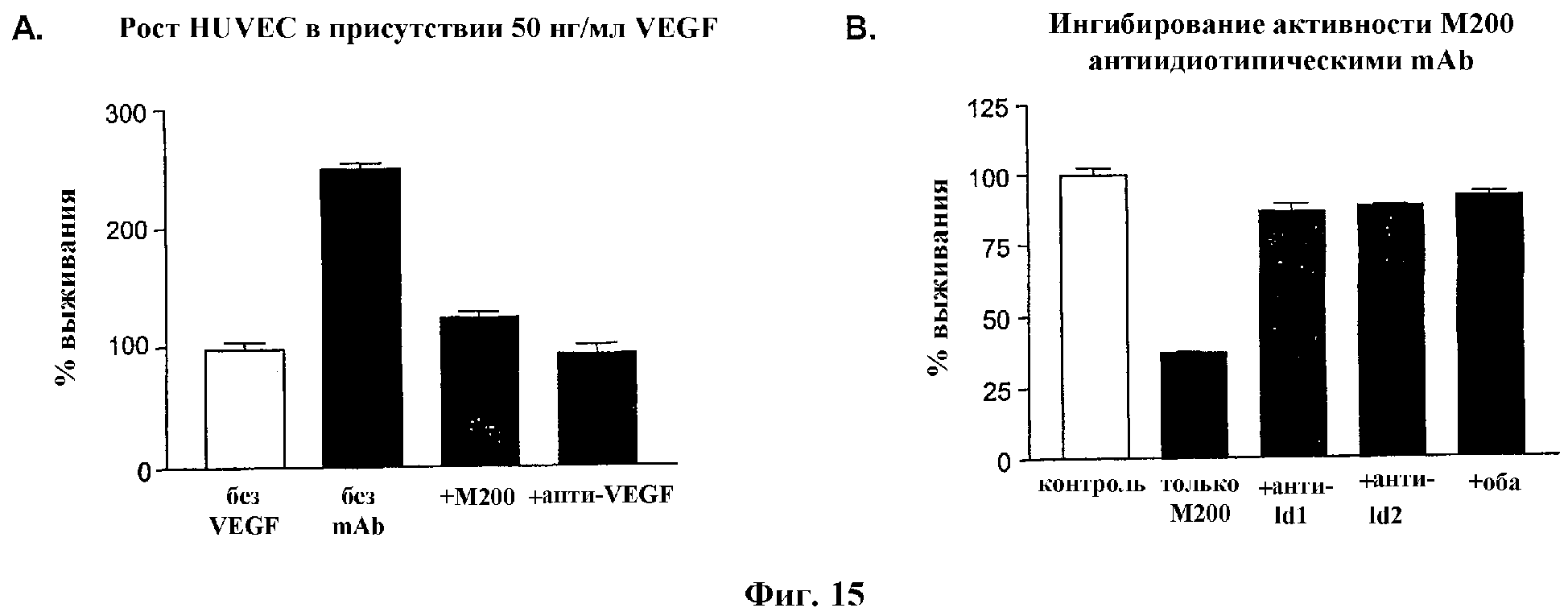
На Фиг.15 проиллюстрированы результаты, показывающие, что M200 ингибирует индуцированный VEGF рост клеток, и ингибирование активности M200 антиидиотипическими mAb.
На Фиг.16 проиллюстрированы результаты, показывающие: (A) индуцированную M200 клеточную гибель, визуализированную окрашиваем аннексина; (B) количественный анализ клеток с окрашенным аннексином посредством проточной цитометрии.
На Фиг.17 проиллюстрированы результаты, показывающие, что M200 вызывает повышение клеточной гибели в пролиферирующих HUVEC по сравнению со стареющими HUVEC.
На Фиг.18 приведены результаты анализа по образованию трубки in vitro, показывающие ингибирование ангиогенеза за счет F200.
На Фиг.19 показаны изображения флуоресцеиновой ангиографии индуцированных лазером очагов повреждения в глазах приматов на 20 сутки лечения (A) контролем (ритуксан) и (B) M200.
На Фиг.20 показаны изображения флуоресцеиновой ангиографии индуцированных лазером очагов повреждения левого и правого глаза отдельного примата на 13 сутки лечения контролем (A) (левый глаз) и (B) M200 (правый глаз).
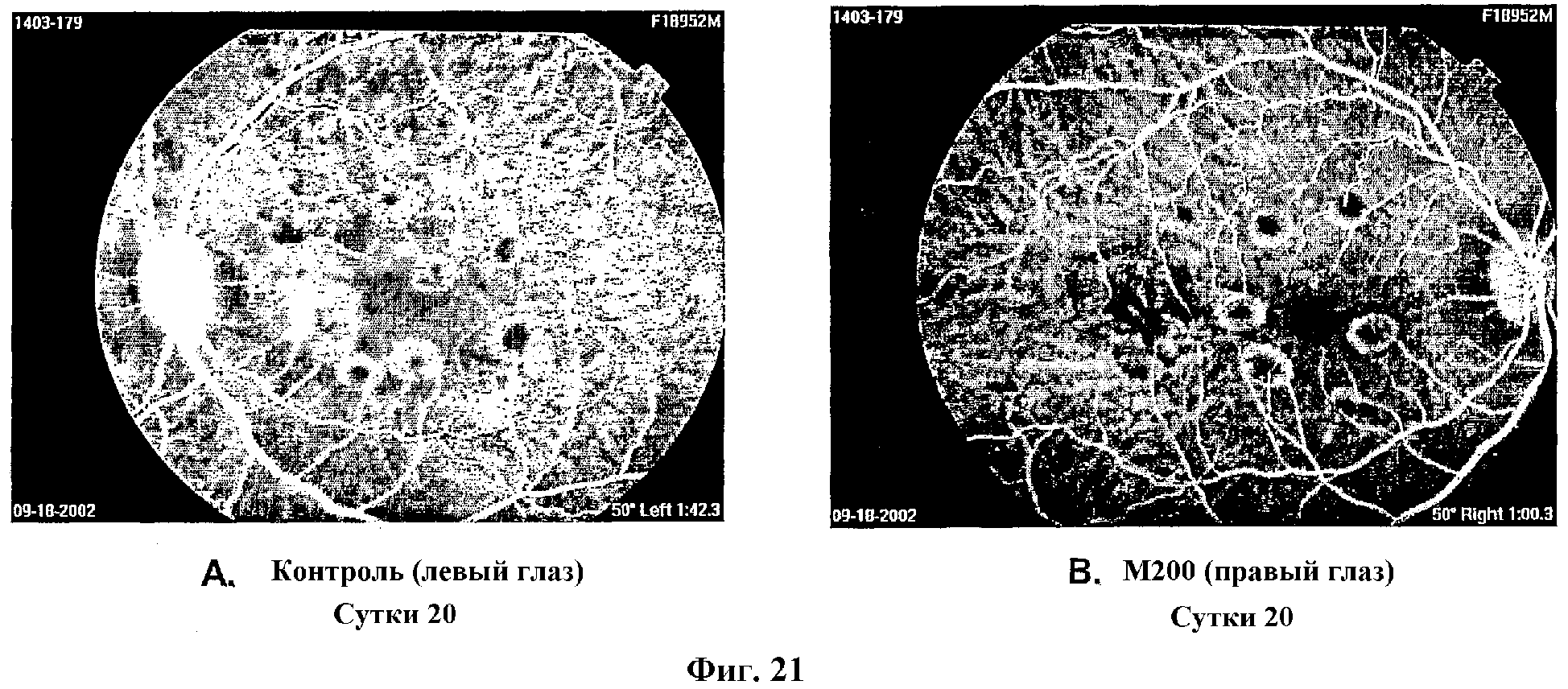
На Фиг.21 показаны изображения флуоресцеиновой ангиографии индуцированных лазером очагов повреждения левого и правого глаза отдельного примата на 20 сутки лечения контролем (A) (левый глаз) и (B) M200 (правый глаз).
На Фиг.22 показаны изображения флуоресцеиновой ангиографии индуцированных лазером очагов повреждения левого и правого глаза отдельного примата на 27 сутки лечения контролем (A) (левый глаз) и (B) M200 (правый глаз).
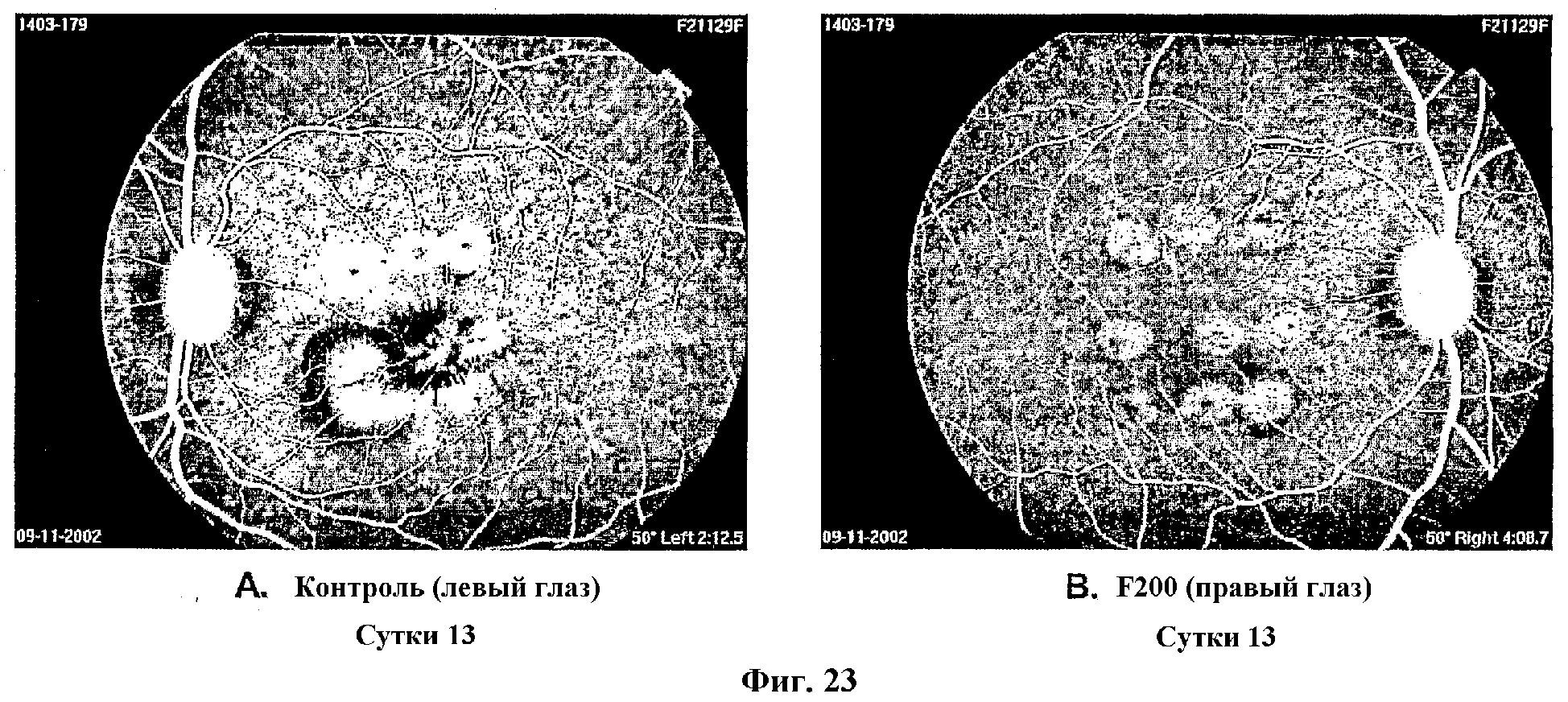
На Фиг.23 показаны изображения флуоресцеиновой ангиографии индуцированных лазером очагов повреждения левого и правого глаза отдельного примата на 13 сутки лечения контролем (A) (левый глаз) и (B) F200 (правый глаз).
На Фиг.24 показаны изображения флуоресцеиновой ангиографии индуцированных лазером очагов повреждения левого и правого глаза отдельного примата на 20 сутки лечения контролем (A) (левый глаз) и (B) F200 (правый глаз).
На Фиг.25 показаны изображения флуоресцеиновой ангиографии индуцированных лазером очагов повреждения левого и правого глаза отдельного примата на 27 сутки лечения контролем (A) (левый глаз) и (B) F200 (правый глаз).
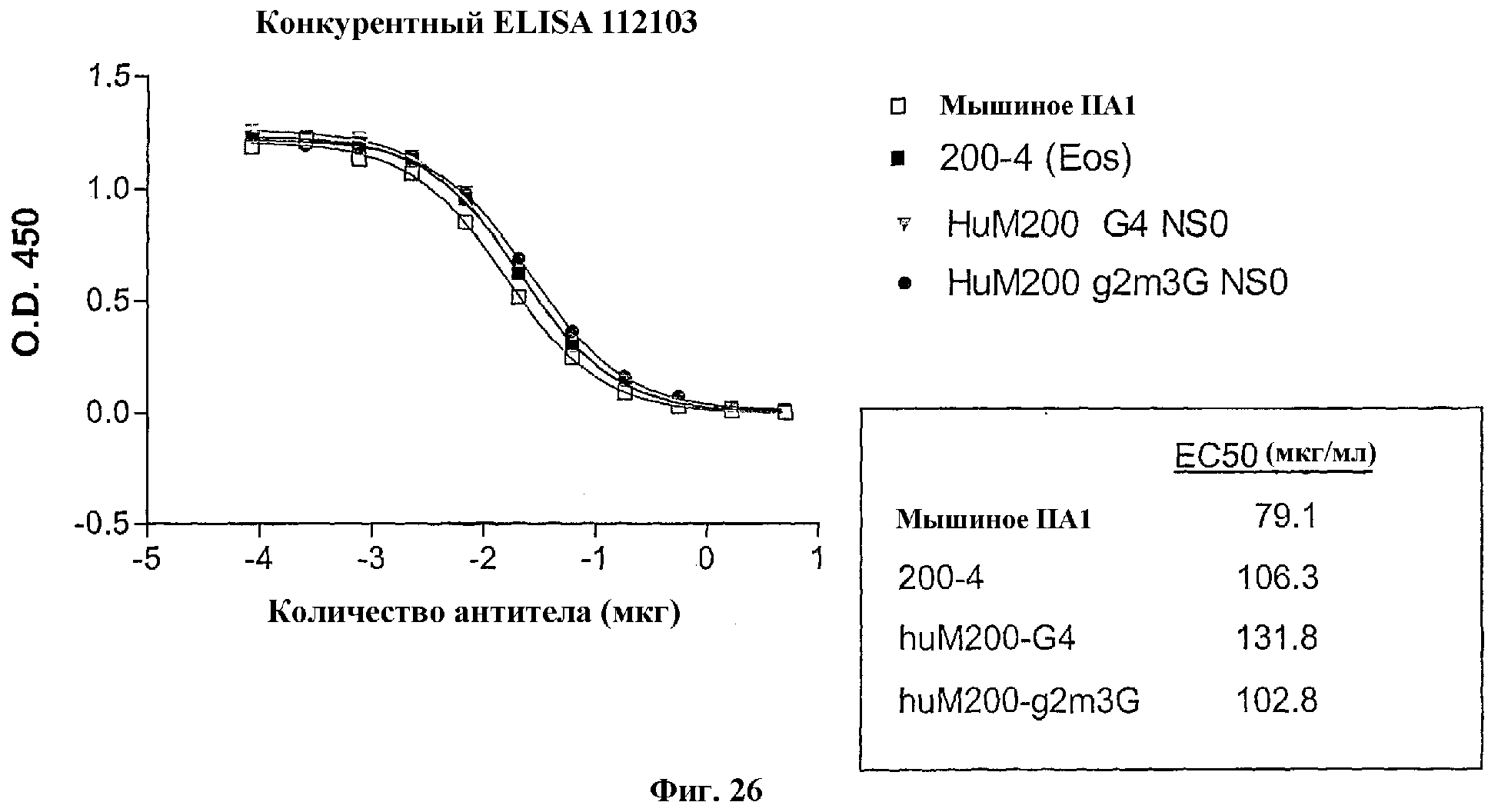
На Фиг.26 показаны результаты конкурентного ELISA-анализа связывания по сравнению сродства связывания мышиного антитела IIA1, химерного антитела M200 (200-4 EOS) и двух гуманизированных версий M200: huM200-G4 и huM200-g2m3G.
Подробное описание изобретения
I. Определения
Все используемые здесь технические и научные термины, кроме определенных иначе, имеют значение, обычно понимаемое специалистом в области, к которой принадлежит изобретение. Следующие ссылки предоставляют специалисту общее определение многих из используемых в настоящем изобретении терминов: Singleton et al., Dictionary of Microbiology and Molecular Biology (2nd ed. 1994); The Cambridge Dictionary of Science and Technology (Walker ed., 1988); The Glossary of Genetics, 5th Ed., R. Rieger et al. (eds.), Springer Verlag (1991) и Hale & Marham, The Harper Collins Dictionary of Biology (1991). При использовании здесь следующие термины имеют значения, приписываемые им, кроме иначе обозначенных случаев.
Используемый здесь термин «антитело» включает в себя ссылку на иммуноглобулиновую молекулу, способную к иммунной реакции с конкретным антигеном, и охватывает как поликлональные, так и моноклональные антитела. Термин также охватывает генетически сконструированные формы, такие как химерные антитела (например, гуманизированные мышиные антитела) и антитела-гетероконъюгаты (например, биспецифические антитела). Термин «антитело» также включает в себя антигенсвязывающие формы антител, включая фрагменты с антигенсвязывающей способностью (например, Fab', F(ab')2, Fab, Fv и rIgG). См. также Pierce Catalog and Handbook, 1994-1995 (Pierce Chemical Co., Rockford, Иллинойс). См. также, например, Kuby, J., lmmunology, 3rd Ed., W. H. Freeman & Co., New York (1998). Термин также относится к рекомбинантным одноцепочечным Fv-фрагментам (scFv). Термин «антитело» также охватывает бивалентные или биспецифические молекулы, диатела, триатела и тетратела. Бивалентные и биспецифические молекулы описаны, например, в Kostelny et al. (1992), J. Immunol. 148: 1547, Pack and Pluckthun (1992), Biochemistry 31: 1579, Hollinger et al., 1993, supra, Gruber et al. (1994), J. Immunol: 5368, Zhu et al. (1997), Protein Sci. 6: 781, Hu et al. (1996), Cancer Res. 56: 3055, Adams et al. (1993), Cancer Res. 53: 4026 и McCartney, et al. (1995) Protein Eng. 8: 301.
Антитело, способное к иммунной реакции с конкретным антигеном, может генерироваться рекомибинантными способами, такими как селекция библиотек рекомбинантных антител в фагах или сходных векторах, см., например, Huse et al., Science 246: 1275-1281 (1989); Ward et al., Nature 341: 544-546 (1989) и Vaughan et al., Nature Biotech. 14: 309-314 (1996), или путем иммунизации животного антигеном или ДНК, кодирующей антиген.
Обычно иммуноглобулин имеет тяжелую и легкую цепь. Каждая тяжелая и легкая цепь содержит константную область и вариабельную область (данные области также известны как «домены»). Вариабельные области легкой и тяжелой цепи содержат четыре «каркасных» области, которые прерываются тремя гипервариабельными областями, также называемыми «определяющими комплементарность областями» или «CDR». Содержание каркасных областей и CDR было определено. Последовательности каркасных областей различных легких и тяжелых цепей относительно консервативны в пределах вида. Каркасная область антитела, которая составлена каркасными областями легких и тяжелых цепей, служит для расположения и выравнивания CDR в трехмерном пространстве.
CDR в основном отвечают за связывание с эпитопом антигена. CDR каждой цепи обычно обозначают как CDR1, CDR2 и CDR3, пронумерованные последовательно с N-конца, и их также обычно идентифицируют по цепи, на которой расположена конкретная CDR. Таким образом, VH CDR3 расположена в вариабельном домене тяжелой цепи антитела, в котором она находится, тогда как VL CDR1 представляет собой CDR1 из вариабельного домена легкой цепи антитела, в котором она находится.
Ссылки на «VH» означают вариабельную область иммуноглобулиновой тяжелой цепи антитела, включая тяжелую цепь Fv, scFv или Fab. Ссылки на «VL» относятся к вариабельной области иммуноглобулиновой легкой цепи, включая легкую цепь Fv, scFv, dsFv или Fab.
Выражение «одноцепочечный Fv» или «scFv» относится к антителу, в котором вариабельные домены легкой и тяжелой цепи традиционного двухцепочечного антитела объединены с образованием одной цепи. Обычно линкерный пептид встраивают между двумя цепями, обеспечивая надлежащий фолдинг и создание активного участка связывания.
«Химерное антитело» представляет собой иммуноглобулиновую молекулу, в которой (a) константная область или ее часть изменена, замещена или обменена так, что антигенсвязывающий участок (вариабельная область) связан с константной областью другого или измененного класса, эффекторной функции и/или вида или с полностью отличной молекулой, которая дает химерному антителу новые свойства, например с ферментом, токсином, гормоном, фактором роста, лекарственным средством и т.д.; или (b) вариабельная область или ее часть изменена, замещена или обменена на вариабельную область, имеющую отличную или измененную специфичность в отношении антигена.
«Гуманизированное антитело» представляет собой иммуноглобулиновую молекулу, которая содержит минимальную последовательность, происходящую из иммуноглобулина, не относящегося к человеку. Гуманизированные антитела включают в себя человеческие иммуноглобулины (антитело-реципиент), в которых остатки из определяющей комплементарность области (CDR) реципиента заменены остатками из CDR вида, не относящегося к человеку (донорное антитело), такого как мышь, крыса или кролик, имеющей требуемую специфичность, сродство и емкость. В некоторых случаях каркасные остатки Fv в человеческом иммунглобулине заменяют соответствующими остатками, не относящимися к человеку. Гуманизированные антитела также могут содержать остатки, которые не находятся ни в антителе-реципиенте, ни в импортируемых последовательностях CDR или каркасных последовательностях. В общем, гуманизированное антитело включает в себя, по существу, все из, по меньшей мере, одного или обычно двух вариабельных доменов, в которых все или, по существу, все области CDR соответствуют таковым не относящегося к человеку иммуноглобулина, и все или, по существу, все каркасные области (FR) относятся к консенсусной последовательности человеческого иммуноглобулина. Гуманизированное антитело также оптимально содержит, по меньшей мере, часть иммуноглобулиновой константной области (Fc), обычно, от человеческого иммуноглобулина (Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988) и Presta, Curr. Op. Struct. Biol. 2: 593-596 (1992)). Гуманизацию можно проводить, по существу, следуя способу Winter и сотрудников (Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-327 (1988); Verhoeyen et al., Science 239: 1534-1536 (1988)), путем замены CDR или последовательностей CDR грызунов на соответствующие последовательности человеческого антитела. Соответственно, такие гуманизированные антитела представляют собой химерные антитела (патент США № 4816567), где участок, существенно меньший интактного человеческого вариабельного домена, заменен на соответствующую последовательность из не относящегося к человеку вида.
«Эпитоп» или «антигенная детерминанта» относится к участку антигена, с которым связывается антитело. Эпитопы могут образовываться из следующих друг за другом аминокислот или несмежных аминокислот, расположенных рядом из-за фолдинга третичной структуры белка. Эпитопы, образованные из следующих друг за другом аминокислот, обычно сохраняются при воздействии денатурирующих растворителей, в то время как эпитопы, образованные фолдингом третичной структуры, обычно теряются при обработке денатурирующими растворителями. Эпитоп обычно включает в себя, по меньшей мере, 3 и, более обычно, по меньшей мере, 5 или 8-10 аминокислот в уникальной пространственной конформации. Способы определения пространственной конформации эпитопа включают в себя, например, рентгеновскую кристаллографию и 2-мерный ядерный магнитный резонанс. См., например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66, Glenn E. Morris, Ed. (1996).
«pH-Чувствительное антитело против интегрина α5β1» относится к антителам, которые специфично распознают интегрин α5β1 и осаждаются из раствора, когда подвергаются иммунной очистке с использованием интегрина α5β1 в качестве лиганда при нейтральном или основном рН. pH-Чувствительные антитела против интегрина α5β1 обычно включают в себя две или более последовательностей CDR, независимо выбранных из любой из последовательностей VH или VL, показанных на Фиг.1.
«Ангиогенез» и «неоангигенез» относятся к образованию новых кровеносных сосудов, обычно в ответ на инсульт, повреждение или заболевание. Для целей данной заявки термин «повреждение» и его грамматические варианты предусматривает инсульт, заболевание или другое событие, которое ведет к ответу ткани, включающему в себя ангиогенез. Ангиогенез также происходит при образовании и метастазировании опухоли и в течение эмбриогенеза, роста и развития высших животных.
Термины «идентичный» или процентная «идентичность», в контексте двух или нескольких нуклеиновых кислот или полипептидных последовательностей, относятся к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или имеют конкретную процентную долю аминокислотных остатков или нуклеотидов, которые являются одинаковыми (т.е. идентичность около 60%, предпочтительно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более высокая идентичность по конкретной области, при сравнении и выравнивании на предмет максимального соответствия по окну сравнения или обозначенной области) при измерении с использованием алгоритмов сравнения последовательности BLAST или BLAST 2.0 с описанными ниже параметрами по умолчанию или путем выравнивания вручную и визуального наблюдения (см., например, веб-сайт NCBI http://www.ncbi.nlm.nih.gov/BLAST/ или тому подобное). Затем о таких последовательностях говорят как о «по существу идентичных». Данное определение относится или может быть отнесено к последовательности, комплементарной тестируемой. Данное определение также включает в себя последовательности, которые содержат делеции и/или добавления, а также те, которые содержат замены, а также встречающие в природе, например, полиморфные или аллельные варианты и полученные человеком варианты. Как описано ниже, предпочтительные алгоритмы могут вести счет за вставки и тому подобное. Предпочтительно идентичность существует по области, которая насчитывает в длину, по меньшей мере, около 25 аминокислот или нуклеотидов или, более предпочтительно, по области, которая в длину составляет 50-100 аминокислот или нуклеотидов.
Обычно для сравнения последовательностей одна последовательность действует как последовательность сравнения, с которой сравниваются тестируемые последовательности. При использовании алгоритмов сравнения последовательностей тестируемую последовательность и последовательность сравнения вводят в компьютер, если необходимо, обозначают координаты подпоследовательности и определяют параметры программы алгоритма последовательностей. Предпочтительно могут использоваться параметры программы по умолчанию или могут назначаться альтернативные параметры. Затем алгоритм сравнения последовательностей рассчитывает процентные идентичности по последовательности для тестируемых последовательностей на основе параметров программы.
Используемый здесь термин «окно сравнения» предусматривает ссылку на сегмент одного из некоторого количества следующих друг за другом положений, выбранных из группы, обычно состоящей из 20-600, обычно примерно 50-200, более обычно примерно 100-150, в которых последовательность может сравниваться с последовательностью сравнения из того же числа следующих друг за другом положений, после того как две последовательности оптимально выравнены. Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Оптимальные выравнивания последовательностей для сравнения могут проводиться, например, по алгоритму локальной гомологии Smith & Waterman, Adv. Appl. Math. 2: 482 (1981), по алгоритму выравнивания по гомологии Needleman & Wunsch, J. Mol. Biol. 48: 443 (1970), по способу поиска сходства Pearson & Lipman, Proc. Nat'1. Acad. Sci. USA 85: 2444 (1988), по компьютеризованным воплощениям данных алгоритмов (GAP, BESTFIT, FASTA, и TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, Висконсин) или путем выравнивания вручную и зрительного наблюдения (см., например, Current Protocols in Molecular Biology (Ausubel et al., eds. 1995 supplement)).
Предпочтительные примеры алгоритмов, которые подходят для определения процентной идентичности последовательностей и сходства последовательностей, включают в себя алгоритмы BLAST и BLAST 2.0, которые описаны в Altschul et al., Nuc. Acids Res. 25: 3389-3402 (1977) и Altschul et al., J. Mol. Biol. 215: 403-410 (1990). BLAST и BLAST 2.0 используют с описанными здесь параметрами для определения процентной идентичности последовательностей для нуклеиновых кислот и белков по изобретению. Программное обеспечение для выполнения анализов BLAST доступно для общественности через National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/). В данном алгоритме вначале участвует идентификация пар последовательностей с высоким коэффициентом (HSP) для определения коротких слов длиной W в последовательности запроса, которые или совпадают, или удовлетворяют некоторому положительному критическому коэффициенту T при выравнивании со словом сходной длины в последовательности из базы данных. Т обозначается как критический коэффициент окрестностного слова (Altschul et al., supra). Данные начальные соответствия окрестностных слов функционируют как зачатки для инициирующих поисков с целью нахождения содержащих их более длинных HSP. Соответствия слов продлеваются в обоих направлениях по каждой последовательности, пока накопительный коэффициент выравнивания может возрастать. Накопительные коэффициенты рассчитываются с использованием, например, для нуклеотидных последовательностей параметров M (коэффициент награды для пары совпадающих остатков; всегда >0) и N (коэффициент штрафа за несовпадающие остатки; всегда <0). Для аминокислотных остатков матрица коэффициентов используется для вычисления накопительного коэффициента. Продление совпадений слова в каждом направлении останавливается, когда накопительный коэффициент выравнивания падает на количество X от максимального достигнутого им значения; накопительный коэффициент достигает нуля или ниже вследствие накопления одного или нескольких выравниваний остатков с отрицательным коэффициентом или когда достигает конца одной из последовательностей. Параметры алгоритма BLAST W, T и X определяют чувствительность и скорость выравнивания. Программа BLASTN (для нуклеотидных последовательностей) использует по умолчанию длину слова (W), равную 11, ожидание (E), равное 10, M=5, N=-4, и сравнение обеих цепей. Для аминокислотных последовательностей программа BLASTP использует по умолчанию длину слова, равную 3, и ожидание (E), равное 10, и матрицу коэффициентов BLOSUM62 (см. Henikoff & Henikoff, Proc. Natl. Acad. Sci. USA 89: 10915 (1989)), выравнивание (B), равное 50, ожидание (E), равное 10, M=5, N=-4 и сравнение обеих цепей.
Алгоритм BLAST также выполняет статистический анализ сходства между двумя последовательностями (см., например, Karlin & Altschul, Proc. Nat'l. Acad. Sci. USA 90: 5873-5787 (1993)). Одной мерой сходства, предоставляемой алгоритмом BLAST, является вероятность наименьшей суммы (P(N)), которая обеспечивает индикатор вероятности того, что совпадение между двумя нуклеотидными или аминокислотными последовательностями произойдет случайно. Например, нуклеиновую кислоту считают сходной с последовательностью сравнения, если вероятность наименьшей суммы при сравнении тестируемой нуклеиновой кислоты с нуклеиновой кислотой сравнения составляет менее чем примерно 0,2, более предпочтительно менее чем примерно 0,01 и наиболее предпочтительно менее чем примерно 0,001. Логарифмические значения могут представлять собой большие отрицательные числа, например 5, 10, 20, 30, 40, 40, 70, 90, 110, 150, 170 и т.д.
Указание на то, что две последовательности нуклеиновой кислоты или два полипептида, по существу, идентичны, состоит в том, что полипептид, кодируемый первой нуклеиновой кислотой, обладает иммунологической перекрестной реактивностью с антителами, полученными против полипептида, кодируемого второй нуклеиновой кислотой, как описано выше. Таким образом, полипептид обычно, по существу, идентичен второму полипептиду, например, когда два пептида отличаются только консервативными заменами. Другое указание на то, что две последовательности нуклеиновой кислоты, по существу, идентичны, состоит в том, что данные две молекулы или комплементарные им молекулы гибридизуются друг с другом в жестких условиях, как описано ниже. Еще одним указанием на то, что две последовательности нуклеиновой кислоты, по существу, идентичны, является то, что для амплификации данных последовательностей могут использоваться одни и те же праймеры.
Термины «выделенный», «очищенный» или «биологически чистый» относятся к веществу, которое является по существу или в сущности чистым от компонентов, которые ему обычно сопутствуют при нахождении его в природном состоянии. Чистоту и гомогенность обычно определяют с использованием способов аналитической химии, таких как электрофорез в полиакриламидном геле или высокоэффективная жидкостная хроматография. Белок или нуклеиновая кислота, которая представляет собой преобладающий вид молекулы, присутствующий в препарате, является по существу очищенной. В частности, выделенная нуклеиновая кислота отделена от некоторых других открытых рамок считывания, которые в природе фланкируют данный ген и кодируют белки, отличные от белка, кодируемого данным геном. Термин «очищенный» в некоторых осуществлениях означает, что нуклеиновая кислота или белок дает, по существу, одну полосу в электрофорезном геле. Предпочтительно это значит, что нуклеиновая кислота или белок, по меньшей мере, на 85% чистые, более предпочтительно, по меньшей мере, на 95% чистые и наиболее предпочтительно, по меньшей мере, на 99% чистые. «Очищать» или «очистка» в других осуществлениях означает удаление, по меньшей мере, одной примеси из композиции, подлежащей очистке. В данном смысле очистка не требует, чтобы очищенное вещество было гомогенным, например 100%-й чистоты.
Термины «полипептид», «пептид» и «белок» используются здесь взаимозаменяемо для ссылки на полимер аминокислотных остатков. Данные термины относятся к полимерам аминокислот, в которых один или несколько аминокислотных остатков являются искусственным химическим миметиком соответствующей встречающейся в природе аминокислоты, а также к встречающимся в природе полимерам аминокислот, которые содержат модифицированные остатки, и к не встречающимся в природе полимерам аминокислот.
Термин «аминокислота» относится к встречающимся в природе и синтетическим аминокислотам, а также к аналогам аминокислот и миметикам аминокислот, которые функционируют сходно с встречающимися в природе аминокислотами. Встречающиеся в природе аминокислоты представляют собой те, которые кодируются генетическим кодом, а также те аминокислоты, которые позже модифицируются, например гидроксипролин, γ-карбоксиглутамат и O-фосфосерин. Аналоги аминокислот относятся к соединениям, которые имеют ту же самую базовую химическую структуру, что и встречающаяся в природе аминокислота, например α-углерод, который связан с водородом, карбоксильная группа, аминогруппа, R-группа, например гомосерин, норлейцин, метионинсульфоксид, метионинметилсульфоний. Такие аналоги могут иметь модифицированные R-группы (например, норлейцин) или модифицированные пептидные скелеты, но сохраняют ту же химическую структуру, как и встречающаяся в природе аминокислота. Миметики аминокислот относятся к химическим соединениям, которые имеют структуру, которая отличается от общей химической структуры аминокислоты, но которая функционирует сходным образом с встречающейся в природе аминокислотой.
Аминокислоты могут указываться здесь известными трехбуквенными символами или однобуквенными символами, рекомендованными Комиссией по биохимической номенклатуре IUPAC-IUB. Нуклеотиды, сходным образом, могут указываться их принятыми однобуквенными кодами.
Термин «консервативно модифицированные варианты» относится к аминокислотным последовательностям и к последовательностям нуклеиновой кислоты. В отношении конкретных последовательностей нуклеиновой кислоты консервативно модифицированные варианты относятся к тем нуклеиновым кислотам, которые кодируют идентичные или, по существу, идентичные аминокислотные последовательности, или, если нуклеиновая кислота не кодирует аминокислотную последовательность, к, по существу, идентичным или ассоциированным, например, следующим друг за другом в природе последовательностям. Вследствие вырожденности генетического кода большое количество функционально идентичных нуклеиновых кислот кодирует большинство белков. Например, кодоны GCA, GCC, GCG и GCU все кодируют аминокислоту аланин. Так, в каждой позиции, где кодоном определен аланин, кодон может быть изменен на другой из соответствующих кодонов, описанных без изменения кодируемого полипептида. Такие нуклеиновые кислоты представляют собой «молчащие варианты», которые являются видом консервативно модифицированных вариантов. Здесь каждая последовательность нуклеиновой кислоты, которая кодирует полипептид, также описывает молчащие варианты нуклеиновой кислоты. Специалист в данной области поймет, что в конкретном контексте каждый кодон в нуклеиновой кислоте (кроме AUG, который обычно является единственным кодоном для метионина, и TGG, который обычно является единственным кодоном для триптофана) может модифицироваться, давая функционально идентичную молекулу. Соответственно, часто молчащие варианты нуклеиновой кислоты, которая кодирует полипептид, подразумевается в описываемой последовательности в плане продукта экспрессии, но не в плане действительных последовательностей зонда.
Что касается аминокислотных последовательностей, то специалист в данной области поймет, что индивидуальные замены, делеции и добавления к нуклеиновой кислоте, пептидной, полипептидной или белковой последовательности, которые изменяют, добавляют или удаляют единственную нуклеиновую кислоту или малый процент аминокислот в кодируемой последовательности, представляют собой «консервативно модифицированный вариант», в котором изменение приводит к замене аминокислоты на химически сходную аминокислоту. В данной области хорошо известна таблица консервативных замен, предоставляющая функционально сходные аминокислоты. Такие консервативно модифицированные варианты добавляются к полиморфным вариантам, межвидовым гомологам и аллелям по изобретению и не исключают их. Обычно консервативные замены одной аминокислоты на другую включают в себя, например: 1) аланин (A), глицин (G); 2) аспарагиновую кислоту (D), глютаминовую кислоту (E); 3) аспарагин (N), глютамин (Q); 4) аргинин (R), лизин (K); 5) изолейцин (I), лейцин (L), метионин (M), валин (V); 6) фенилаланин (F), тирозин (Y), триптофан (W); 7) серин (S), треонин (T) и 8) цистеин (C), метионин (M) (см., например, Creighton, Proteins (1984)).
«Метка» или «детектируемый радикал» представляет собой композицию, которую можно детектировать спектроскопическими, фотохимическими, биохимическими, иммунохимическими, химическими или другими физическими средствами. Например, подходящие метки включают в себя флуоресцентные метки, электронноплотные реагенты, ферменты (например, такие как широко используемые в ELISA), биотин, дигоксигенин, или гаптены и белки, или другие сущности, которые могут стать детектируемыми, например, путем введения радиоактивной метки в пептид или могут применяться для выявления антител, специфично взаимодействующих с данным пептидом. Радиоактивный изотоп может представлять собой, например,3H,14C,32P,35S или125I.
В некоторых случаях, особенно относящихся к применению антител против интегрина α5β1, радиоизотопы используют в качестве токсичных радикалов, как описано ниже. Метки могут включаться в состав антител в любом положении. Может использоваться любой способ, известный в данной области, для конъюгирования антитела с меткой, включая те способы, что описаны Hunter et al., Nature, 144: 945 (1962); David et al., Biochemistry, 13: 1014 (1974); Pain et al., J. Immunol. Meth., 40: 219 (1981) и Nygren, J. Histochem. and Cytochem., 30: 407 (1982). Время жизни композиций радиоактивно меченных антител может продлеваться путем добавления веществ, которые стабилизируют радиоактивно меченный пептид или антитело и защищают его от деградации. Может использоваться любое вещество или комбинация веществ, включая те вещества, которые описаны в патенте США № 5961955.
«Аффинный в отношении антител матрикс» относится к любому материалу, способному преимущественно связывать антитело. Аффинные в отношении антител матриксные материалы включают в себя полипептиды, полисахариды, жирные кислоты, липиды, нуклеиновые кислоты, включая аптамеры, или их конъюгаты (например, гликопротеины, липопротеины, гликолипиды). В некоторых случаях аффинные в отношении антител матриксные материалы могут представлять собой макромолекулярную структуру, такую как мультибелковый комплекс, биологическую мембрану или вирус. Другие примеры аффинных в отношении антител матриксных материалов представляют собой белок A, белок G, лектины и Fc-рецепторы.
«Белок А» относится к высоко стабильному поверхностному рецептору, продуцируемому Staphylococcus aureus, который способен связывать Fc-часть иммуглобулинов, особенно IgG, из большого количества видов (Boyle, M. D. P. and K. J. Reis. Bacterial Fc Receptors. Biotechnology 5: 697-703 (1987)). Одна молекула белка А может одновременно связывать, по меньшей мере, 2 молекулы IgG (Sjöquist, J., Meloun, B. and Hjelm, H. Protein A isolated from Staphylococcus aureus after digestion with lysostaphin. Eur. J. Biochem. 29: 572-578 (1972)).
«Белок G» относится к ассоциированному с клеточной поверхностью белку из стрептококка, который с высоким сродством связывается с IgG. Он имеет три высокогомологичных IgG-связывающих домена. (См. Lian, et al. 1992. Journal of Mol. Biol. 228: 1219-1234 и Derrick and Wigley. 1994. Journal of Mol. Biol. 243: 906-918.)
Термин «рекомбинантный», когда он используется со ссылкой, например, на клетку, нуклеиновую кислоту, белок или вектор, указывает на то, что данная клетка, нуклеиновая кислота, белок или вектор были модифицированы путем введения гетерологичной нуклеиновой кислоты или белка или путем изменения природной нуклеиновой кислоты или белка или что данная клетка происходит из модифицированной таким образом клетки. Таким образом, например, рекомбинантные клетки экспрессируют гены, которые не находятся в природной (нерекомбинантной) форме данной клетки, или экспрессируют природные гены, которые в ином случае экспрессированы аномально, слабо экспрессированы или вовсе не экспрессированы. Под термином «рекомбинантная нуклеиновая кислота» здесь подразумевается нуклеиновая кислота, первоначально образованная in vitro, в общем, путем манипуляции нуклеиновой кислотой, например с использованием полимераз и эндонуклеаз, в форме, обычно отсутствующей в природе. Данным путем достигается функциональная связь различных последовательностей. Таким образом, выделенная нуклеиновая кислота в линейной форме или экспрессирующий вектор, образованный in vitro путем лигирования молекул ДНК, которые не объединены в норме, для целей данного изобретения рассматриваются как рекомбинантные. Понятно, что как только рекомбинантная нуклеиновая кислота была получена и повторно введена в клетку или организм хозяина, она будет реплицироваться нерекомбинантно, т.е. с использованием in vivo клеточных механизмов клетки-хозяина, а не путем манипуляций in vitro; однако такие нуклеиновые кислоты, будучи продуцированными рекомбинантно, хотя впоследствии и реплицируются нерекомбинантно, пока считаются рекомбинантными для целей изобретения. Сходным образом, «рекомбинантный белок» представляет собой белок, полученный рекомбинантными способами, т.е. путем экспрессии рекомбинантной нуклеиновой кислоты, как описано выше.
Термин «гетерологичный», когда он используется со ссылкой на часть нуклеиновой кислоты, указывает на то, что данная нуклеиновая кислота включает в себя две или более подпоследовательности, которые обычно в природе не находятся в тех же отношениях друг к другу. Например, данная нуклеиновая кислота обычно продуцируется рекомбинантно, имея две или более последовательности, например, из неродственных генов, сконструированных так, что получаются новая функциональная нуклеиновая кислота, например промотор из одного источника, а кодирующая область - из другого источника. Сходным образом, гетерологичный белок часто относится к двум или более подпоследовательностям, которые обычно в природе не находятся в тех же отношениях друг к другу (например, белок слияния).
«Промотор» определяется как массив контрольных последовательностей нуклеиновой кислоты, которые направляют транскрипцию нуклеиновой кислоты. При использовании здесь промотор включает в себя необходимые последовательности нуклеиновой кислоты вблизи сайта старта транскрипции, например в случае промотора полимеразы типа II, TATA-элемент. Промотор также необязательно содержит дистальные энхансерные или репрессорные элементы, которые могут располагаться на расстоянии нескольких тысяч пар оснований от точки начала транскрипции. «Конститутивный» промотор представляет собой промотор, который активен при большинстве условий окружения и развития. «Индуцируемый» промотор представляет собой промотор, который активен при регуляции окружения и развития. Термин «функционально связанный» относится к функциональной связи между последовательностью контроля экспрессии нуклеиновой кислоты (такой как промотор или массив участков связывания факторов транскрипции) и второй последовательностью нуклеиновой кислоты, где последовательность контроля экспрессии нуклеиновой кислоты направляет транскрипцию нуклеиновой кислоты, соответствующей второй последовательности.
«Экспрессирующий вектор» представляет собой конструкцию нуклеиновой кислоты, генерированную рекомбинантно или синтетически, с серией специфических элементов нуклеиновой кислоты, которые обеспечивают транскрипцию конкретной нуклеиновой кислоты в клетке-хозяине. Экспрессирующий вектор может представлять собой часть плазмиды, вируса или фрагмента нуклеиновой кислоты. Обычно экспрессирующий вектор включает в себя нуклеиновую кислоту, подлежащую транскрипции в функциональной связи с промотором.
Выражение «специфично (или селективно) связывается» с антителом или «специфично (или селективно) иммунореактивен с» ним, при отношении к белку или пептиду, указывает на реакцию связывания, которая определяет присутствие белка в гетерогенной популяции белков или других биологических веществ. Таким образом, при обозначенных условиях иммунного анализа определенные антитела связываются с конкретными белковыми последовательностями, по меньшей мере, в два раза сильнее фонового связывания и обычно более чем в 10-100 раз сильнее фонового связывания.
Специфичное связывание с антителом в таких условиях требует наличия антитела, которое выбрано по его специфичности в отношении конкретного белка. Например, антитела, полученные против конкретного белка, полиморфных вариантов, аллелей, ортологов и консервативно модифицированных вариантов, или вариантов сплайсинга, или их частей, могут быть выбраны для получения только тех поликлональных антител, которые специфично иммунореактивны в отношении интегрина α5β1 и не в отношении других белков. Данный отбор может достигаться путем вычитания антител, которые перекрестно взаимодействуют с другими молекулами. Различные форматы иммунного анализа могут использоваться для отбора антител, специфично иммунореактивных с конкретным белком. Например, твердофазные иммунные анализы ELISA рутинно используются для отбора антител, специфично иммунореактивных с белком (см., например, Harlow & Lane, Antibodies, A Laboratory Manual (1988) для описания форматов иммунного анализа и условий, которые могут использоваться для определения специфичной иммунореактивности).
Термины «раковые клетки», «трансформированные клетки» или «трансформация» в тканевой культуре относятся к спонтанным или индуцированным фенотипическим изменениям, которые не обязательно включают в себя захват нового генетического материала. Хотя трансформация может возникать вследствие инфекции трансформирующим вирусом и включения новой геномной ДНК или захвата экзогенной ДНК, она также может происходить спонтанно или вследствие воздействия канцерогена, с мутацией за счет этого эндогенного гена. Трансформация ассоциирована с фенотипическими изменениями, такими как иммортализация клеток, аберрантный контроль роста, неморфологическими изменениями и/или озлокачествлениями (см. Freshney, Culture of Animal Cells a Manual of Basic Technique (3rd ed. 1994)).
II. Введение
Настоящее изобретение относится к химерным и гуманизированным антителам против интегрина α5β1 с улучшенными свойствами по сравнению с существующими антителами против интегрина α5β1. Настоящее изобретение также относится к фармацевтическим композициям, включающим в себя новые антитела, и к улучшенным способам лечения состояний заболевания и повреждений в тканях, которые осложнены ангиогенезом.
Химерные и гуманизированные антитела по изобретению имеют более длительный период полужизни и менее антигенны при введении человеческому существу, чем существующие формы. Улучшение иллюстрировано в виде диаграмм на Фиг.2 и включает в себя изменение каркасных и константных областей мышиных антител против интегрина α5β1 (IIA1) для их «гуманизации».
Гуманизированные антитела, в общем, характеризуются, по меньшей мере, тремя потенциальными преимуществами для применения в терапии человека. Во-первых, они могут лучше взаимодействовать с иммунной системой человека, например, для более эффективного разрушения клеток-мишеней посредством комплементзависимой цитотоксичности (CDC) или антителозависимой клеточной цитотоксичности (ADCC). Во-вторых, иммунная система человека не должна распознавать данное антитело как чужеродное. В-третьих, период полужизни в крови человека будет сходным с таковым для встречающихся в природе антител человека, что позволяет вводить реже меньшие дозы.
Структурно гуманизированные антитела, в общем, содержат константные и каркасные (FR) области, которые имеют человеческое происхождение, и комплементарные доменные области (CDR), которые происходят из антитела животного, в котором было получено антитело против интегрина α5β1.
Структурно гуманизированные антитела, в общем, содержат области вариабельной цепи, происходящие из антитела животного, в котором было получено антитело против интегрина α5β1, и области константной цепи человеческого происхождения.
Функционально химерные и гуманизированные антитела против интегрина α5β1 специфично распознают интегрин α5β1 и предотвращают взаимодействие интегрина α5β1 с его рецептором.
Здесь предоставлены различные способы получения гуманизированных и химерных антител против интегрина α5β1. «Гуманизированные» антитела, в общем, представляют собой химерные или мутантные моноклональные антитела из мыши, крысы, хомяка, кролика или других видов, несущие домены человеческих константных и/или вариабельных областей или конкретные изменения. Способы получения «гуманизированных» или «химерных» антител против интегрина α5β1 хорошо известны специалистам в данной области и могут быть обнаружены в цитируемых здесь литературных ссылках и патентах.
III. Получение рекомбинантных химерных и гуманизированных антител против интегрина α5β1 и происходящих от них Fab-фрагментов
Антитела по настоящему изобретению получают путем иммунизации животного интегрином α5β1 или происходящим из него пептидом для индукции продукции антител против интегрина α5β1. Затем выделяют лимфоидную ткань, экспрессирующую данные антитела, и очищают нуклеиновые кислоты, кодирующие тяжелую и легкую цепи антител против интегрина α5β1. С очищенными нуклеиновыми кислотами затем манипулируют рекомбинантным путем (по способам, хорошо известным в данной области) для создания нуклеиновых кислот, кодирующих химерные, гуманизированные, одноцепочечные, Fab- или Fab2-антитела, которые специфично распознают интегрин α5β1.
Нуклеиновые кислоты, с которыми проводятся рекомбинантные манипуляции, затем используют для создания клеток, продуцирующих антитела против интегрина α5β1. Данные клетки продуцируют моноклональные антитела, которые ингибируют связывание интегрина α5β1 с его рецептором или предотвращают его, что приводит к ингибированию ангиогенеза в чувствительной ткани.
A. Получение клеток, продуцирующих антитела против интегрина α5β1 и нуклеиновых кислот, кодирующих данные антитела
Для получения рекомбинантных химерных и гуманизированных антител против интегрина α5β1 вначале должна быть выделена нуклеиновая кислота, кодирующая не относящиеся к человеку антитела против интегрина α5β1. Это обычно осуществляют путем иммунизации животного, например мыши, препаратом интегрина α5β1 или происходящим из него антигенным пептидом. Обычно мышей иммунизируют дважды внутрибрюшинно примерно 50 микрограммами белкового антигена на мышь. Сыворотки из иммунизированных мышей можно тестировать на активность антитела путем иммуногистологии или иммуноцитологии на любой системе хозяина, экспрессирующей такой полипептид, и посредством ELISA с экспрессированным полипептидом. Для иммуногистологии активные антитела по настоящему изобретению могут идентифицироваться с экспрессированным полипептидом. Для иммуногистологии активные антитела по настоящему изобретению могут идентифицироваться с использованием конъюгированного с биотином антителом против иммуноглобулина мыши с последующим применением авидин-пероксидазы и хромогенного субстрата пероксидазы.
Препараты таких реагентов коммерчески доступны, например, от Zymed Corp., Сан-Франциско, Калифорния. Мышей, сыворотки которых содержат детектируемые активные антитела по изобретению, можно зафиксировать через трое суток и удалить их селезенки для слияния и продукции гибридомы. Позитивные образцы надосадочной жидкости от таких гибридом могут идентифицироваться с использованием анализов, обычных для специалистов в данной области, например анализа путем вестерн-блотта.
Нуклеиновые кислоты, кодирующие требуемые цепи антител, могут затем выделяться, например, путем использования гибридомной мРНК или мРНК селезенки в качестве матрицы для PCR-амплификации генов тяжелой и легкой цепи [Huse, et al., Science 246: 1276 (1989)]. Нуклеиновые кислоты для продукции антител и интрател могут происходить из мышиных моноклональных гибридом с использованием данного способа [Richardson J. H., et al., Proc. Natl. Acad. Sci. USA 92: 3137-3141 (1995); Biocca S., et al., Biochem. and Biophys. Res. Comm., 197: 422-427 (1993) Mhashilkar, A. M., et al., EMBO J. 14: 1542-1551 (1995)]. Данные гибридомы обеспечивают надежный источник хорошо охарактеризованных реагентов для конструирования антител и являются особенно подходящими, когда охарактеризованы реакционная способность и сродство их эпитопов. Выделение нуклеиновой кислоты из выделенных клеток далее обсуждается в Clackson, T., et al., Nature 352: 624-628 (1991) (селезенка) и Portolano, S., et al., supra; Barbas, C. F., et al., supra; Marks, J. D., et al., supra; Barbas, C. F., et al., Proc. Natl. Acad. Sci. USA 88: 7978-7982 (1991) (лимфоциты периферической крови человека).
B. Создание рекомбинантных антител
Гуманизированные формы не относящихся к человеку (например, мышиных) антител представляют собой химерные молекулы иммуноглобулинов, иммуноглобулиновых цепей или их фрагментов (например, Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, происходящую из иммуноглобулина человека. Гуманизированные антитела включают в себя человеческие иммуноглобулины (антитело-реципиент), в которых остатки, образующие определяющую комплементарность область (CDR) реципиента, заменены на остатки из CDR не относящегося к человеку вида (донорное антитело), такого как мышь, крыса или кролик, характеризующиеся требуемой специфичностью, аффинностью и авидностью. В некоторых случаях каркасные остатки Fv человеческого иммуноглобулина заменяют на соответствующие не относящиеся к человеку остатки. Гуманизированные антитела могут также включать в себя остатки, которые не находятся ни в антителе-реципиенте, ни в импортированных последовательностях CDR или каркасных последовательностях. В общем, гуманизированное антитело включает в себя, по меньшей мере, один и обычно два вариабельных домена, в которых все или по существу все области CDR соответствуют таковым не относящегося к человеку иммуноглобулина, и все или по существу все области FR относятся к консенсусной последовательности человеческого иммуноглобулина. Гуманизированное антитело оптимально также включает в себя, по меньшей мере, часть иммуноглобулиновой константной области (Fc), обычно из человеческого иммуноглобулина [Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332: 323-329 (1988) и Presta, Curr. Op. Struct. Biol., 2: 593-596 (1992)].
Способы получения гуманизированных антител хорошо известны в данной области и везде полно описаны. См., например, Queen et al., патенты США № 5530101; 5585089; 5693761; 5693762; 6180370 (каждый из которых включен сюда полностью в качестве ссылки). Антитела могут подлежать гуманизации с использованием разнообразных способов, известных в данной области, например, пересадки CDR (EP 239400; публикация PCT WO 91/09967; патенты США № 5225539; 5530101 и 5585089), маскировки или изменения поверхности (EP 592106; EP 519596; Padlan, Mol. Immunol., 28: 489-498 (1991); Studnicka et al., Prot. Eng. 7: 805-814 (1994); Roguska et al., Proc. Natl. Acad. Sci. 91: 969-973 (1994), и перемешивания цепей (патент США № 5565332), причем все они включены сюда полностью в качестве ссылки.
Описано некоторое количество способов продукции рекомбинантных химерных антител. Может использоваться контролируемая перестройка доменов антитела, соединенных через дисульфидные связи, с образованием химерных антител (Konieczny et al., Haematologia, 14 (1): 95-99, 1981). Также технология рекомбинантной ДНК может использоваться для конструирования слияния генов между последовательностями ДНК, кодирующими вариабельные домены легких и тяжелых цепей мышиного антитела и константные домены легких и тяжелых цепей человеческого антитела. См., например, Morrison et al., Proc. Natl. Acad. Sci. USA, 81 (21): 6851-6855, 1984; Morrison, Science, 229: 1202-1207 (1985); Oi et al., BioTechniques 4: 214-221 (1986); Gillies et al., J. Immunol. Methods, 125: 191-202 (1989); патенты США № 5807715; 4816567 и 4816397, которые включены сюда полностью в качестве ссылки.
Последовательности ДНК, кодирующие антигенсвязывающие части или определяющие комплементарность области (CDR) мышиных моноклональных антител, могут быть пересажены молекулярными средствами на последовательности ДНК, кодирующие каркасы тяжелых и легких цепей человеческого антитела (Jones et al., Nature, 321 (6069): 522-525, 1986; Riechmann et al., Nature, 332 (6162): 323-327, 1988). Экспрессированные рекомбинантные продукты называют «переформированными» или гуманизированными антителами, и они содержат каркас легкой и тяжелой цепи человеческого антитела и распознающие антиген части, CDR, мышиного моноклонального антитела.
Другой способ продукции гуманизированных антител описан в патенте США № 5639641, включенном сюда в качестве ссылки. Данный способ предоставляет путем изменения поверхности гуманизированные антитела грызунов, которые имеют повышенную терапевтическую эффективность вследствие представления человеческой поверхности вариабельной области. По данному способу (1) осуществляют выравнивание положений набора вариабельных областей тяжелых и легких цепей антител с получением набора экспонированных на поверхность каркасных положений тяжелой и легкой цепи, где положения выравнивания для всех вариабельных областей, по меньшей мере, примерно на 98% идентичны; (2) для антитела грызуна (или его фрагмента) определяют набор каркасных, экспонированных на поверхность аминокислотных остатков вариабельной области тяжелой и легкой цепи; (3) идентифицируют набор каркасных, экспонированных на поверхность аминокислотных остатков вариабельной области тяжелой и легкой цепи, который наиболее близко идентичен набору экспонированных на поверхность аминокислотных остатков грызунов; (4) набор каркасных, экспонированных на поверхность аминокислотных остатков вариабельной области тяжелой и легкой цепи, определенный на стадии (2), замещают на набор каркасных, экспонированных на поверхность аминокислотных остатков вариабельной области тяжелой и легкой цепи, идентифицированный на стадии (3), за исключением тех аминокислотных остатков, которые находятся в пределах 5 Å от любого атома любого остатка определяющих комплементарность областей антитела грызуна; и (5) продуцируют гуманизированное антитело грызуна, имеющее специфичность связывания.
Сходный способ продукции гуманизированных антител описан в патентах США № 5693762; 5693761; 5585089 и 5530101, каждый из которых включен сюда в качестве ссылки. Данные способы включают в себя продукцию гуманизированных иммуноглобулинов, содержащих одну или несколько определяющих комплементарность областей (CDR) и возможные дополнительные аминокислоты из донорного иммуноглобулина и каркасную область из акцепторного человеческого иммуноглобулина. Каждая гуманизированная иммуноглобулиновая цепь обычно включает в себя, в дополнение к CDR, аминокислоты из каркаса донорного иммуноглобулина, которые способны взаимодействовать с CDR для осуществления сродства связывания, например одну или несколько аминокислот, которые непосредственно прилегают к CDR в донорном иммуноглобулине или находятся в пределах примерно 3 Å, как предсказано молекулярным моделированием. Тяжелая и легкая цепи могут каждая конструироваться путем использования любого из различных позиционных критериев, описанных в патентах США № 5693762; 5693761; 5585089 и 5530101, любой их комбинации или всех их. При сочетании с интактным антителом гуманизированные иммуноглобулины, по существу, не антигенны у людей и сохраняют, по существу, то же сродство к исходному антигену, что и донорные иммуноглобулины.
Дополнительный способ продукции гуманизированных антител описан в патентах США № 5565332 и 5733743, каждый из которых включен сюда в качестве ссылки. Данный способ сочетает концепцию гуманизации антител фагемидными библиотеками, также подробно описанными здесь. В общем смысле способ использует последовательности из антигенсвязывающего участка антитела или популяции антител, направленных против интересующего антигена. Таким образом, для единственного антитела грызуна последовательности, включающие в себя часть антигенсвязывающего участка антитела, могут комбинироваться с разнообразными репертуарами последовательностей человеческих антител, которые, в комбинации, могут создавать полный антигенсвязывающий участок.
Антигенсвязывающие участки, созданные данным способом, отличаются от тех, которые создаются путем пересадки CDR, в том, что только часть последовательности исходного антитела грызуна, вероятно, входит в контакты с антигеном сходным образом. Выбранные человеческие последовательности, вероятно, отличаются в последовательности и создают альтернативные контакты с антигеном по сравнению с таковыми исходного участка связывания. Однако затруднения, вызванные связыванием части исходной последовательности с антигеном и формы антигена и его антигенсвязывающих участков, по-видимому, направляют новые контакты человеческих последовательностей в ту же область эпитопа антигена. Поэтому данный процесс называют «запечатленный эпитопом отбор» (EIS).
Начиная с антитела животного, способ приводит к отбору антител, которые частично представляют собой человеческие антитела. Такие антитела могут быть достаточно сходными по последовательностями с человеческими антителами для того, чтобы быть использованными при терапии непосредственно или после изменения небольшого количества ключевых остатков. Различия по последовательности между компонентом выбранного антитела, относящимся к грызуну, и человеческими последовательностями, могут быть минимизированы посредством замены тех остатков, которые отличаются от остатков человеческих последовательностей, например, путем сайт-специфического мутагенеза отдельных остатков или путем пересадки CDR целых петель. Однако могут также создаваться антитела с полностью человеческими последовательностями. Поэтому EIS предоставляет способ получения частично человеческих или полностью человеческих антител, которые связываются с тем же эпитопом, что животные или частично человеческие антитела соответственно. В EIS репертуары фрагментов антитела могут экспонироваться на поверхности филаментного фага, и гены, кодирующие фрагменты с антигенсвязывающей активностью, могут быть выбраны путем связывания фага с антигеном.
Дополнительные способы гуманизации антител, рассматриваемые для применения по настоящему изобретению, описаны в патентах США № 5750078; 5502167; 5705154; 5770403; 5698417; 5693493; 5558864; 4935496 и 4816567, каждый из которых включен сюда в качестве ссылки.
Описанные способы продукции одноцепочечных антител (патент США № 4946778) могут адаптироваться для продукции одноцепочечных гуманизированных антител против интегрина α5β1.
C. Экспрессия рекомбинантных химерных или гуманизированных антител
Полученное в результате антитело можно экспрессировать путем одного или нескольких векторов, содержащих нуклеиновые кислоты, кодирующие антитело.
Предпочтительно, сегменты нуклеиновой кислоты, кодирующие тяжелые и легкие цепи антитела, находятся в одной транскрипционной единице с трансляцией одной или нескольких кодирующих нуклеиновых кислот под контролем последовательности IRES. Векторы включают в себя химические конъюгаты, такие как описанный в WO 93/64701, который имеет направляющий радикал (например, лиганд рецептора клеточной поверхности) и радикал, связывающий нуклеиновую кислоту (например, полилизин), вирусный вектор (например, основанный на ДНК или РНК вирусный вектор), белки слияния, такие как описанный в PCT/US 95/02140 (WO 95/22618), который представляет собой белок слияния, содержащий направляющий радикал (например, антитело, специфичное в отношении клетки-мишени), и радикал, связывающий нуклеиновую кислоту (например, протамин), плазмиды, фаг и т.д. Векторы могут быть хромосомными, нехромосомными или синтетическими.
Предпочтительные векторы включают в себя вирусные векторы, белки слияния и химические конъюгаты. Ретровирусные векторы включают в себя вирусы лейкоза мышей Молони. Предпочтительными являются вирусные векторы, основанные на ДНК. Данные векторы включают в себя поксвекторы, такие как ортопокс- или авипоксвекторы, герпесвирусные векторы, такие как вектор на основе вируса простого герпеса I (HSV) [Geller, A.I. et al., J. Neurochem., 64: 487 (1995); Lim, F., et al., in DNA Cloning: Mammalian Systems, D. Glover, Ed. (Oxford Univ. Press, Oxford England) (1995); Geller, A.I. et al., Proc. Natl. Acad. Sci.: U.S.A., 90: 7603 (1993); Geller, A.I., et al., Proc Natl. Acad. Sci. USA, 87: 1149 (1990)], аденовирусные векторы [LeGal LaSalle et al., Science, 259: 988 (1993); Davidson, et al., Nat. Genet. 3: 219 (1993); Yang, et al., J. Virol. 69: 2004 (1995)] и векторы на основе аденоассоциированных векторов [Kaplitt, M. G. et al., Nat. Genet. 8: 148 (1994)].
Поксвирусные векторы вводят ген в цитоплазму клетки. Авипоксвирусные векторы приводят лишь к кратковременной экспрессии нуклеиновой кислоты. Аденовирусные векторы, аденоассоциированные вирусные векторы и векторы на основе вируса простого герпеса (HSV) являются предпочтительными для введения нуклеиновой кислоты в нервные клетки. Аденовирусный вектор приводит к более краткосрочной экспрессии (примерно 2 месяца), чем аденоассоциированный вирус (примерно 4 месяца), который, в свою очередь, действует в течение более короткого времени, чем векторы HSV. Выбор конкретного вектора зависит от клетки-мишени и подлежащего лечению состояния. Введение может осуществляться стандартными способами, например, путем инфекции, трансфекции, трансдукции или трансформации. Примеры способов переноса генов включают в себя, например, голую ДНК, преципитацию CaPO4, DEAE-декстран, электропорацию, слияние протопласта, липофекцию, микроинъекцию в клетки и вирусные векторы.
Вектор может использоваться в отношении, по существу, любой клетки-мишени, такой как глиома. Например, для направления векторов может использоваться инъекция путем стереотаксиса (например, аденовирус, HSV) в требуемое положение. Кроме того, частицы могут доставляться путем интрацеребровентрикулярной (icv) инфузии с использованием системы инфузии мининасосом, такой как система инфузии SynchroMed. Способ, основанный на объемном потоке, называемый конвекцией, также доказал свою эффективность по доставке больших молекул в обширные области головного мозга и может использоваться при доставке вектора к клетке-мишени (Bobo et al., Proc. Natl. Acad. Sci. USA 91: 2076-2080 (1994); Morrison et al., Am. J. Physiol. 266: 292-305 (1994)). Другие способы, которые могут использоваться, включают в себя катетеры, внутривенную, парентеральную, внутрибрюшинную и подкожную инъекцию и пероральный и другие пути введения.
D. Выделение и характеристика рекомбинантных антител
Используемый здесь термин «антитела» включает в себя поликлональные антитела, аффинно очищенные поликлональные антитела, моноклональные антитела и антгенсвязывающие фрагменты, например протеолитические фрагменты F(ab')2 и Fab. Также охватываются генетически сконструированные интактные антитела или фрагменты, такие как химерные антитела, Fv-фрагменты, одноцепочечные антитела и тому подобное, как и синтетические антигенсвязывающие пептиды и полипептиды. Не относящиеся к человеку антитела могут гуманизироваться путем пересадки только не относящихся к человеку CDR на человеческие каркасные и константные области или путем введения целых не относящихся к человеку вариабельных доменов (необязательно «маскируя» их созданием подобной человеческой поверхности путем замены экспонированных остатков, где результатом является «маскированное» антитело). В некоторых случаях гуманизированные антитела могут сохранять не относящиеся к человеку остатки в каркасных доменах человеческой вариабельной области для усиления надлежащих характеристик связывания. Путем гуманизации антител может увеличиваться биологическое время полужизни и снижается потенциал для неблагоприятных иммунных реакций после введения. Альтернативные способы для генерирования или отбора антител, используемых здесь, включают использование воздействия in vitro на лимфоциты белка или пептида интегрина α5β1 и отбор библиотек дисплея антитела в фагах или сходных векторах (например, путем использования иммобилизированного или меченого белка или пептида интегрина α5β1).
E. Аффинная очистка
Аффинная очистка из набора антител или сывороток предоставляет специалисту-практику более однородный реагент. Способы обогащения антител против интегрина α5β1 с использованием матриксов, аффинных в отношении антител, с образованием аффинной колонки хорошо известны в данной области и доступны коммерчески (AntibodyShop, c/o Statens Serum Institut, Artillerivej 5, Bldg. P2, DK-2300 Copenhagen S). В кратком изложении матрикс, аффинный в отношении антитела, присоединяется к аффинной подложке (см., например; CNBR Sepharose (R), Pharmacia Biotech). Смесь, содержащую антитела, затем пропускают через аффинный матрикс, с которым связываются антитела. Связанные антитела высвобождаются способами, обычными для специалистов в данной области, с получением концентрированной объединенной фракции антител. Обогащенная концентрированная объединенная фракция антител может затем использоваться для дальнейших иммунологических исследований, некоторые из которых описаны здесь для примера. Хотя аффинные в отношении антител матриксы, используемые для выделения антител по настоящему изобретению, не сконструированы для специфичного распознавания антител против интегрина α5β1 по настоящему изобретению, это не ограничивает применимости аффинных матриксов для очистки антител, поскольку антитела экспрессируются в качестве рекомбинантных белков в системах, которые являются моноклональными по природе.
Выделенные антитела против интегрина α5β1 могут использоваться в иммунном анализе конкурентного связывания, как описано выше, при сравнении со вторым белком, который, как полагают, возможно, представляет собой вариант интегрина α5β1. Для проведения такого сравнения каждый из двух белков анализируют в широком интервале концентраций и определяют количество каждого белка, требуемого для ингибирования 50% связывания антисывороток с иммобилизованным белком. Если количество второго белка, требуемого для ингибирования 50% связывания, менее чем в 10 раз выше количества интегрина α5β1, требуемого для ингибирования 50% связывания, то говорят о том, что второй белок специфично связывает антитела, генерированные интегрином α5β1.
F. pH-чувствительная очистка антител
Некоторые антитела по настоящему изобретению проявляют склонность выпадать в осадок при аффинной очистке при нейтральном или основном pH. Другой аспект изобретения, направленный на это явление, относится к способу очистки pH-чувствительных антител, который предусматривает антитела, содержащие аминокислотные последовательности, указанные на Фиг.1-5, 10, 11 и 13, и химерные антитела, которые включают в себя мышиные вариабельные области, или имеют 80%-ную или более высокую идентичность по последовательности в отношении мышиной вариабельной области, или имеют 80%-ную или более высокую идентичность по последовательности в отношении областей CDR антител, показанных на Фиг.1-5. Способ, в общем, предусматривает проведение аффинной хроматографии на антитело с использованием хроматографической колонки, например ионообменной колонки, которая содержит связанный матрикс, аффинный в отношении антитела, с последующей элюцией антитела при pH, равном примерно от 3,0 до 5,5, предпочтительно примерно от 3,3 до 5,5 и более предпочтительно примерно от 3,5 до 4,2 или примерно от 4,2 до 5,5. Более низкие значения pH в данном интервале больше подходят для маломасштабной очистки, тогда как pH, равный примерно 4,2 или выше, считается более подходящим для более широкомасштабных операций. Выполнение способа очистки в пределах данного интервала приводит к получению продукта с малой агрегацией или без нее, наиболее предпочтительно, по существу, без агрегации.
Аффинная хроматография является одним из средств, известных в данной области для выделения или очистки вещества, такого как антитело или другая биологически активная макромолекула. Это, в общем, осуществляется путем пропускания раствора, содержащего антитело, через хроматографическую колонку, которая содержит один или несколько лигандов, специфично связывающих антитело, иммобилизированное на колонке. Такие группы могут экстрагировать антитело из раствора посредством аффинных взаимодействий с лигандом. По завершении антитело может быть снято с колонки путем элюции.
Поэтому данный аспект изобретения предусматривает способ очистки антител против интегрина α5β1 с использованием аффинного в отношении антител матрикса, связанного с субстратом, где улучшение касается элюции антител из связанного с субстратом аффинного в отношении антител матрикса с использованием раствора элюции, имеющего pH примерно от 3,0 до 5,5.
Более конкретно, данный аспект изобретения относится к способу очистки антител против интегрина α5β1, охватывающего (a) абсорбцию антитела на аффинный в отношении антитела матрикс, связанный с субстратом; и (b) элюции антител из связанного с субстратом аффинного в отношении антител матрикса с использованием раствора элюции, имеющего pH примерно от 3,0 до 5,5. В некоторых осуществлениях способ также предусматривает стадию (c) восстановления очищенного антитела.
Однако когда антитело подлежит дальнейшей очистке или лечению, на этом этапе специальная стадия восстановления может не требоваться.
Способ очистки включает в себя абсорбцию антител на аффинный в отношении антитела матрикс, связанный с субстратом. Могут использоваться различные формы матрикса, аффинного в отношении антитела. Единственным требованием является то, что молекула аффинного в отношении антитела матрикса будет обладать способностью связывать антитело, подлежащее очистке. Например, могут использоваться аффинный в отношении антитела матрикс, выделенный из природных источников, аффинный в отношении антитела матрикс, продуцированный путем способов рекомбинантной ДНК, модифицированные формы аффинного в отношении антитела матрикса или фрагменты данных материалов, которые сохраняют способность связываться с интересующими антителами. Типовые материалы для применения в качестве аффинных в отношении антитела матриксов включают в себя полипептиды, полисахариды, жирные кислоты, липиды, аптамеры нуклеиновых кислот, гликопротеины, липопротеины, гликолипиды, мультибелковые комплексы, биологическую мембрану, вирусы, белок А, белок G, лектины и Fc-рецепторы.
Матрикс, аффинный в отношении антител, присоединен к твердой фазе или подложке путем основного взаимодействия (например, путем неспецифического ионообменного связывания, путем гидрофобных/гидрофильных взаимодействий), или путем специфического взаимодействия (например, взаимодействия антиген-антитело), или путем ковалентного связывания между лигандом и твердой фазой. Альтернативно, промежуточное соединение, или спейсер, может присоединяться к твердой фазе, и аффинный в отношении антитела спейсер может иммобилизовываться на твердой фазе путем присоединения аффинного матрикса к спейсеру. Спейсер сам может быть лигандом (например, вторым лигандом), который характеризуется специфичной аффинностью связывания со свободным аффинным в отношении антитела матриксом.
Аффинный в отношении антитела матрикс может присоединяться к различным субстратам или подложкам. Обычно для данной цели используют ионообменные или соединяющие (например, активированные CNBr) смолы. Антитела могут сорбироваться на связанном с субстратом аффинном в отношении антитела матриксе с использованием различных процедур. Предпочтительно используется колоночная процедура, и антитела адсорбируются на колонке с использованием буферного раствора, полученного с подходящим буфером. Обычные буферы и условия работы хорошо известны в данной области.
Антитела могут элюироваться из связанного с субстратом аффинного в отношении антител матрикса с использованием общепринятых процедур, например элюции антител из колонки с использованием буферного раствора. Для минимизации преципитации рН-чувствительные антитела против интегрина α5β1 преимущественно элюируют буферным раствором, содержащим 0,1 M глицин, при pH 3,5. Для минимизациии деградации и/или денатурации температуру буферного раствора предпочтительно держат на уровне ниже 10°C, более предпочтительно на уровне или ниже 4°C. Из тех же соображений время, в течение которого антитела подвергаются кислым pH, также должно минимизироваться. Это осуществляется, например, путем добавления предварительно определенного количества основного раствора к элюированному раствору антител. Предпочтительно данный основной раствор представляет собой буферный раствор, более предпочтительно летучий основной буферный раствор, более предпочтительно раствор аммония.
Элюция антител из связанного с субстратом аффинного в отношении антитела матрикса может мониторироваться различными способами, хорошо известными в данной области. Например, если используется колоночная процедура, из колонок могут собираться фракции, и присутствие белка определяли путем измерения поглощения фракций. Если очистке подлежат антитела известной специфичности, присутствие антител во фракциях, собираемых из колонок, может измеряться способами иммунного анализа, например радиоиммунным анализом (RIA) или иммуноферментным анализом (EIA).
Способ по настоящему изобретению может осуществляться при любой подходящей температуре, которая, по существу, не приводит к деградации очищаемых антител или не может пагубно воздействовать на аффинный в отношении антител матрикс, связанный с субстратом. Предпочтительно используемая температура является комнатной температурой. Элюируемые из колонки с аффинным в отношении антител матриксом антитела могут восстанавливаться, если это требуется, с использованием различных способов, используемых в данной области.
G. Тестирование авидности
Тестирование авидности позволяет специалисту в данной области идентифицировать антитела, специфично распознающие один или несколько эпитопов интегрина α5β1. Антитела определяются как специфично связывающие, если 1) они преодолевают барьерный уровень связывающей активности и/или 2) они, по существу, перекрестно не взаимодействуют с родственными полипептидными молекулами. Во-первых, указанные здесь антитела связываются специфично, если они связываются с полипептидом, пептидом или эпитопом интегрина α5β1 с аффинностью связывания (Ka) 106 моль-1 или более, предпочтительно 107 моль-1 или более, более предпочтительно 108 моль-1 или более и наиболее предпочтительно 109 моль-1 или более. Аффинность связывания антитела может легко определяться специалистом в данной области, например, путем анализа по Скетчарду (Scatchard, Ann. NY Acad. Sci. 51: 660-72, 1949) или путем резонанса плазмонного зеркала с использованием BIAcore.
Во-вторых, антитела связываются специфично, если они значимо перекрестно не реагируют с родственными полипептидами. Антитела значимо перекрестно не реагируют со связанными полипептидными молекулами, например, если они выявляют полипептид интегрин α5β1, но неизвестные родственные полипептиды, при использовании стандартного анализа путем вестерн-блоттинга (Ausubel et al., ibid.). Примерами известных родственных полипептидов являются ортологи, белки того же вида, которые представляют собой членов интегринового семейства белков, полипептиды, показанные в выравнивании на Фиг.1, мутантные полипептиды интегрина α5β1 и тому подобное. Более того, антитела могут подвергаться «скринингу против» известных родственных полипептидов для выделения популяции, которая специфично связывается с интегрином α5β1. Например, антитела, полученные против человеческих полипептидов интегрина α5β1, адсорбируют на родственные полипептиды, зафиксированные на нерастворимом матриксе; антитела, специфичные в отношении человеческих полипептидов α5β1, протекают через матрикс при надлежащих буферных условиях. Такой скрининг обеспечивает выделение поликлональных и моноклональных антител, перекрестно не реагирующих с близкородственными полипептидами (Antibodies: A Laboratory Manual, Harlow and Lane (eds.), Cold Spring Harbor Laboratory Press, 1988; Current Protocols in Immunology, Cooligan, et al. (eds.), National Institutes of Health, John Wiley and Sons, Inc., 1995). Скрининг и выделение специфических антител хорошо известны в данной области (см. Fundamental Immunology, Paul (eds.), Raven Press, 1993; Getzoff et al., Adv. in Immunol. 43: 1-98, 1988; Monoclonal Antibodies: Principles and Practice, Goding, J. W. (eds.), Academic Press Ltd., 1996; Benjamin et al., Ann. Rev. Immunol. 2: 67-101, 1984). Репрезентативные примеры таких анализов включают в себя конкурентный иммуноэлектрофорез, радиоиммунный анализ, радиоиммунную преципитацию, сорбционный иммуноферментный анализ (ELISA), анализ путем дот-блотта или вестерн-блотта, анализ ингибирования или конкурентный анализ и сэндвич-анализ. Для обзора иммунологических процедур и процедур иммунного анализа, см. Basic and Clinical Immunology (Stites & Terr eds., 7th ed. 1991).
IV. Способы измерения эффективности при модулировании ангиогенеза
Настоящее изобретение относится к способам оценки физиологических эффектов, модулируемых гуманизированным антителом против интегрина α5β1. В качестве решения проблемы порога данные способы обеспечивают скрининг композиций, содержащих антитела по настоящему изобретению, для определения безопасных, эффективных терапевтических дозировок. Во время лечения некоторые из данных способов могут использоваться для мониторинга прогресса и модулирования дозировки с обеспечением оптимального клинического эффекта.
Данные способы включают в себя предоставление жизнеспособной ткани, совместимой с анализом или лечением; т.е. ткани, которая при повреждении, включая иммортализацию, претерпевает нежелательные события хороидальной неоваскуляризации, ингибирование или предотвращение которых улучшает прогноз пациента и/или исцеление поврежденной ткани. Обычные случаи, подходящие для лечения или исследования, представляют собой опухоли и ткань глаза, особенно желтое пятно глаза. Термин «опухоль» используется здесь широко в значении любого новообразованного патологического разрастания ткани. Для целей настоящего изобретения опухоль частично характеризуется ангиогенезом. Опухоль может быть доброкачественной, например гемангиомой, глиомой, тератомой и тому подобным, или может быть злокачественной, например карциномой, саркомой, глиобластомой, астроцитомой, нейробластомой, ретинобластомой и тому подобным. Термин «опухоль», в общем, используется для ссылки на доброкачественную или злокачественную опухоль, а термин «рак», в общем, используется для ссылки на злокачественную опухоль, с метастазами или без них. Злокачественные опухоли, которые могут диагностироваться с использованием способа по изобретению, включают в себя, например, карциномы, такие как рак легких, рак молочной железы, рак предстательной железы, рак шейки матки, рак поджелудочной железы, рак толстой кишки и рак яичника; и саркомы, такие как остеосаркома и саркома Капоши, при наличии того, что опухоль характеризуется, по меньшей мере, частично, ангиогенезом, ассоциированным с экспрессией интегрина α5β1 в новообразованных кровеносных сосудах. Для исследования данные ткани могут выделяться по процедурам, известным специалистам в данной области, и из легкодоступных для них источников.
При использовании для тестирования эффективности терапевтических антител по настоящему изобретению жизнеспособной ткани она должна вначале повреждаться с образованием очагов и провокацией хороидальной неоваскуляризации. Повреждение может осуществляться любыми подходящими средствами, включая механические, химические или биологические средства. Типовые механические средства повреждения включают в себя разрезание, прокалывание или фиксацию. Химические средства включают в себя нанесение на ткань средств, вызывающих некроз, апоптоз или потерю межклеточных контактов. Биологические средства включают в себя обработку инфекционными агентами, например вирусами, бактериями или прионами. Предпочтительный способ создания очагов повреждения осуществляется посредством применения лазера. Может использоваться любой лазер, способный повреждать ткань, причем предпочтительным типом являются газовые CO2-лазеры, наиболее предпочтительным типом является лазерный фотокоагулятор OcuLight GL (532 нм) с медицинским портативным адаптором с щелевой лампой IRIS. Другие лазерные источники также подходят при обеспечении того, что они могут продуцировать лазерный свет примерно от 300 до 700 МВт и повреждения, составляющие в диаметре менее чем примерно 200 мкм, предпочтительно менее чем примерно 100 мкм, более предпочтительно примерно от 50 до 100 мкм и наиболее предпочтительно примерно от 75 до 25 мкм в диаметре. Обычно излучение лазера применяется на ткани в течение долей секунды. Обычно менее 0,5 секунд, более предпочтительно менее 0,1 секунды, наиболее предпочтительно менее 0,05 секунд.
Применяемое антитело представляет собой химерное или гуманизированное антитело против интегрина α5β1. Предпочтительно данное антитело содержит вариабельную область тяжелой цепи, характеризующуюся последовательностью, на 65%, предпочтительно более чем на 75%, более предпочтительно на 85%, 90%, 95%, 97% или 99% идентичной в отношении аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1-6, 16, 20, и вариабельную область легкой цепи, выбранную независимо и характеризующуюся последовательностью, на 65%, предпочтительно более чем на 75%, более предпочтительно на 85%, 90%, 95%, 97% или 99% идентичной в отношении аминокислотной последовательности из группы, состоящей из SEQ ID NO: 7-12, 18, 22. Наиболее предпочтительно химерное или гуманизированное антитело против интегрина α5β1 содержит вариабельную область тяжелой цепи, характеризующуюся последовательностью, выбранной из группы, состоящей из SEQ ID NO: 2-6, 16, 20, 25, 28, 31, и вариабельную область легкой цепи, независимо выбранную из группы, состоящей из SEQ ID NO: 8-12, 18, 22, 26 и 32.
Антитела по настоящему изобретению могут вводиться независимо различными путями, например, внутривенно, перорально или непосредственно в область, подлежащую лечению, например непосредственно в неопластическую опухоль; посредством глазных капель, когда патологическое состояние затрагивает глаз; или интрасиновиально, когда данное состояние затрагивает сустав.
Количество терапевтического антитела, которое вводится субъекту, частично зависит от того, вводится ли средство для диагностических целей или для терапевтических целей. Способы определения эффективного количества средства для введения при диагностической или терапевтической процедуре хорошо известны в данной области и включают в себя клинические испытания фазы I, фазы II и фазы III.
С использованием способов настоящего изобретения эффективные количества могут определяться, например, титрованием дозировок для индивидуального тестирования субъектов и начертанием графика как функции неоангиогенного ингибирования.
Общее количество фармацевтического средства, которое может вводиться в единичной дозе, в виде болюса или путем инфузии через относительно короткие периоды времени или может вводиться с использованием протокола фракционированного лечения, в котором множественные дозы вводят через более длительные периоды времени. Как указано выше, специалисту в данной области известно, что концентрация конкретного средства, требуемая для обеспечения эффективного количества в область или области ангиогенеза, ассоциированного с экспрессией интегрина α5β1, у субъекта зависит от множества факторов, включающих в себя возраст и общее здоровье субъекта, а также путь введения, число случаев введения и природу фармацевтического средства. В свете данных факторов специалист в данной области подберет конкретную дозу с получением эффективного количества для эффективного противодействия специфичному связыванию интегрина α5β1 с его лигандом с обеспечением, таким образом, редукции или ингибирования ангиогенеза.
Мониторинг относящегося к клинике прогресса является другим аспектом настоящего изобретения. Мониторинг может проводиться любым подходящим способом, известным в данной области. Предпочтительные способы включают в себя микроскопию, ядерный магнитный резонанс и рентгеновское излучение. В случае глазной ткани может использоваться непрямая офтальмоскопическая оценка задней камеры глаза и биомикроскопическая оценка переднего сегмента глаза. Предпочтительный способ мониторинга степени хороидальной неоваскуляризации осуществляется внутривенно с использованием флуоресцентной метки и при оценке жизнеспособной ткани путем флуоресцентной ангиографии.
Предпочтительный способ скрининга эффективности антител против интегрина α5β1 в ингибировании или предотвращении неоангиогенеза состоит в создании очагов повреждения сетчатки животного, нанесения антител против α5β1 на повреждения и последующего мониторинга прогрессии неоангиогенеза в поврежденной ткани относительно подходящих контрольных экспериментов. Данный подход подробно обсуждается ниже в примере 6. Данные исследования привели к неожиданному обнаружению того, что применение антител против интегрина α5β1 на одном глазу субъекта приводит к лечению очагов повреждения в обоих глазах субъекта. Предполагается, что новообразованные кровеносные сосуды в поврежденной ткани «протекают», и это приводит к тому, что антитела, внесенные в один глаз, проникают в системную кровь, с которой переносятся в другой глаз. Этот результат поддерживает предположение, что нет разницы, применяются ли при лечении целые антитела или Fab-фрагменты. Данные результаты указывают на новый способ лечения повреждений глаза путем введения терапевтических антител против интегрина α5β1 по настоящему изобретению системно, например, путем внутривенной инъекции.
V. Терапевтические применения
Дополнительное осуществление изобретения относится к фармацевтическим композициям, включающим в себя описанные здесь терапевтические антитела. Данные композиции могут содержать средства, которые усиливают захват или локализацию терапевтического компонента, снижают воспаление или иным образом обеспечивают локализованное благоприятное действие.
Антитела по настоящему изобретению, которые могут использоваться для снижения или ингибирования ангиогенеза, ассоциированного с экспрессией интегрина α5β1, или фармацевтическая композиция, содержащая данные антитела, может использоваться для лечения любого патологического состояния, которое характеризуется, по меньшей мере частично, ангиогенезом. Специалисту в данной области известно, что данное средство может вводиться различными путями, включая, например, пероральный или парентеральный, в том числе внутривенный, внутримышечный, подкожный, интраорбитальный, интракапсулярный, интрасиновиальный, интраперитонеальный, интрацистернальный, или путем пассивного или облегченного всасывания в кожу с использованием, например, кожного пластыря или чрескожного ионтофореза. Более того, антитела могут вводиться путем инъекции, интубации, посредством суппозитория, перорально или местно, причем последний путь может быть пассивным, например путем прямого наложения мази или порошка, содержащего антитела, или активным, например с использованием назального спрея или ингалятора. Антитела также могут вводиться, если это требуется, путем местного спрея, причем в данном случае одним из компонентов композиция является подходящая сжатая жидкость для аэрозоля. Фармацевтическая композиция, если это требуется, также может вводиться в липосомы, микросферы или другие полимерные матриксы (Gregoriadis, Liposome Technology, Vol. 1 (CRC Press, Boca Raton, Fla. 1984), включенный сюда в качестве ссылки). Липосомы, например, которые состоят из фосфолипидов или иных липидов, являются нетоксичными, физиологически приемлемыми и метаболизируемыми носителями, которые относительно просто изготавливать и вводить.
Ангиогенез, ассоциированный с экспрессией интегрина α5β1, может происходить местно, например, в сетчатке субъекта, страдающего от диабетической ретинопатии, или может происходить более системно, например, у субъекта, страдающего от ревматоидного артрита или метастазирующей злокачественной неоплазии. Поскольку области ангиогенеза могут быть локализованными или более системно распределенными, специалист в данной области выберет конкретный путь и способ введения терапевтических антител по настоящему изобретению, частично основываясь на данном факторе.
Например, для субъекта, страдающего от диабетической ретинопатии, в случае, когда ангиогенез, ассоциированный с экспрессией интегрина α5β1, располагается в сетчатке, средство может входить в состав фармацевтической композиции, подходящей для применения в качестве глазных капель, которые могут вводиться непосредственно в глаз. Для сравнения, для субъекта, страдающего от метастазирующей карциномы, средство применяется в фармацевтической композиции, которая может вводиться внутривенно, перорально или другим способом, который системно распределяет средство. Таким образом, антитела по настоящему изобретению могут вводиться различными путями, например внутривенно, перорально или непосредственно в область лечения, например непосредственно в неопластическую опухоль; посредством глазных капель, где патологическое состояние затрагивает глаз; или интрасиновиально, где данное состояние затрагивает сустав.
Терапевтическое антитело вводят в эффективном количестве, которое представляет собой количество, достаточное для противодействия специфическому связыванию интегрина α5β1 с его лигандом у субъекта. В общем, средство-антагонист вводят в дозе, равной примерно от 0,0001 до 100 мг/кг массы тела, хотя она может в некоторой степени изменяться в зависимости от применения. Основываясь на результатах исследований эффективности, обсуждаемых выше, специалист может определить интервал эффективных дозировок для данного лечения. Оценки подлежащего введению количества могут подбираться соответствующим образом, например, когда средство надлежит вводить местно.
Предпочтительный способ введения антител по настоящему изобретению осуществляется путем инъекции, внутрикожно, внутривенно или непосредственно в сустав или ткань, которые страдают от повреждения. Например, когда повреждена ткань сетчатки, терапевтические антитела по настоящему изобретению могут инъецироваться в стекловидное тело пораженного глаза. Неожиданный результат настоящего изобретения состоит в том, что лечение, применяемое в отношении одного глаза, ведет к клинически благоприятным эффектам для обоих глаз (с учетом повреждения обоих глаз). Оказывается, что новообразованные сосуды «протекают», позволяя антителам, наносимым на первый глаз, проходить в кровяное русло, где они транспортируются в другой глаз. При нанесении на глаз таким образом доза предпочтительно составляет менее 5 мкМ, более предпочтительно от 0,5 до 2 мкМ и наиболее предпочтительно от 0,1 до 1,0 мкМ. Где это показано, лечение может принимать вид множественных доз, вводимых в пределах области или в течение периода времени. Дозировки во множественном формате могут все быть идентичными или могут определяться и применяться независимо. Данный результат ведет также к дополнительному способу лечения очагов повреждения с ассоциированным неоангиогенезом, предусматривающему системное введение эффективного количества терапевтического антитела (например, путем внутривенной инъекции), где неоангиогенез поврежденной ткани ингибируется или предотвращается.
Все цитируемые в данной спецификации публикации и патентные заявки включены сюда полностью в качестве ссылки, как если бы было конкретно и отдельно указано, что каждая отдельная публикация или патентная заявка включена в качестве ссылки.
Хотя предшествующее изобретение было описано в некоторых подробностях путем иллюстрации и примера для ясности и понимания, обычному специалисту в данной области согласно настоящему изобретению будет легко понять, что в него могут быть внесены некоторые изменения и модификации без отклонения от сущности и объема прилагаемой формулы изобретения.
Примеры
Как можно понять из предоставленного выше описания, настоящее изобретение имеет многочисленные применения. В соответствии с этим следующие примеры предоставлены с иллюстративными целями, и они ни в коей мере не предназначены для ограничения изобретения. Специалисты в данной области легко распознают различные некритичные параметры, которые могут изменяться или модифицироваться с получением, по существу, сходных результатов.
Пример 1 - Конструирование химеры M200 из мышиного антитела IIA1 против интегрина α5β1
В данном примере описано конструировании химерного антитела M200.
А. Исходные последовательности ДНК VH- и VL-доменов IIA1 и 200-4
Вариабельные домены тяжелой (VH) и легкой (VL) цепи мышиного антитела против человеческого α5β1 IIA1 (Pharmingen, San Diego, Калифорния) клонировали из кДНК гибридомы IIA1 и секвенировали как часть исходной конструкции антитела 200-4. На Фиг.3 показаны последовательности кДНК доменов VH (SEQ ID NO: 13) и VL (SEQ ID NO: 14) IIA1. Во время конструирования мышиного/человеческого химерного антитела IgG4 200-4 из IIA1 молчащие сайты рестрикции XhoI (CTCGAG) (SEQ ID NO: 33) вводили в каркасные области 4 в VH и VL IIA1. Последовательности ДНК VH (SEQ ID NO:15) и VL (SEQ ID NO: 17) 200-4, содержащие данные молчащие участки XhoI, обнаруженные в экспрессирующих химерных конструкциях DEF38 IIA1/человеческий G4 и NEF5 IIA1/K, показаны на Фиг.4. Данные последовательности VH и VL 200-4 использовали в качестве начальной точки для всех последующих манипуляций с рекомбинантной ДНК.
B. Конструирование мини-экзонов VH и VL M200
Домены VH и VL 200-4 в экспрессирующих химерных плазмидах DEF38 IIA1/человеческий G4 и NEF5 IIA1/K непосредственно объединяли с прилегающими к ним константными доменами посредством молчащих сайтов XhoI, без промежуточных интронов. Для того чтобы сделать данные вариабельные домены совместимыми с требуемыми экспрессирующими антитело векторами, основанными на геномной ДНК, было необходимым сконструировать «мини-экзоны», которые воссоздают функциональные донорные участки сплайсинга с 3'-концов вариабельной кодирующей области. Сравнения последовательностей выявили, что в VH- и VL-областях IIA1 задействованы мышиные сегменты JH4 и JK1 соответственно; поэтому мини-экзоны конструировали для воссоздания природных мышиных донорных участков связывания JH4 и JK1 после последней аминокислоты VH- и VL-доменов. Кроме того, удаляли сайты XhoI, восстанавливая каркасные последовательности 4, находящиеся в исходной гибридоме IIA1. Мини-экзоны фланкировали сайтами рестрикции: 5'- и 3'-концевые сайты XbaI (TCTAGA) (SEQ ID NO: 34) для мини-экзона VH и 5'-концевой MluI (ACGCGT) (SEQ ID NO: 35) и 3'-концевой XbaI (TCTAGA) (SEQ ID NO: 34) для мини-экзона VL.
Вариабельные домены рекомбинантного анатитела иногда содержат нежелательные участки альтернативного сплайсинга мРНК, которые могут дать начало видам мРНК, полученным в результате альтернативного сплайсинга. Такие участки могут теоретически существовать в мышином вариабельном домене, но становятся активными только в контексте гетерогенной экспрессии в клетке и/или новых акцепторных участках из химерной константной области. Использованием преимущества вырожденности кодонов для удаления потенциальных участков альтернативного сплайсинга при сохранении неизмененной аминокислотной последовательности можно удалить такой нежелательный альтернативный сплайсинг. Для выявления любых потенциальных участков альтернативного сплайсинга в мини-экзонах VH и VL M200 исходные конструкции анализировали программой предсказания участков сплайсинга от Center for Biological Sequence Analysis из Technical University of Denmark (http://www.cbs.dtu.dk/services/NetGene2/). Для обоих мини-экзонов 200-M идентифицировали верные донорные участки сплайсинга; однако в CDR3 мини-экзона VH и в CDR1 мини-экзона VL выявляли потенциальные донорные участки альтернативного сплайсинга. Для исключения возможности использования данных участков сплайсинга в конструкциях мини-экзонов были сделаны единичные молчащие замены пар оснований. В случае конструкции VH проводили молчащую замену кодона GGT на GGA в глицине-100 (нумерация по Кабату); для конструкции VL проводили молчащую замену кодона GTA на GTC в валине-29. В обоих случаях данные молчащие изменения элиминировали потенциальный вторичный донорный сигнал сплайсинга в V-генах.
Конечные конструкции мини-экзонов VH и VL M200 (SEQ ID NO: 19, 21), содержащие фланкирующие участки рестрикции, мышиные донорные участки сплайсинга, с удаленными участками XhoI 200-4 и с удаленными потенциальными донорными участками альтернативного сплайсинга показаны на Фиг.5.
C. Конструирование мини-экзона VH M200 и плазмиды p200-M-H
Сконструированный мини-экзон для VH M200, показанный на Фиг.5A, конструировали посредством основанного на PCR мутагенеза с использованием экспрессирующей химерной плазмиды DEF38IIAl/человеческий G4 200-4 в качестве исходной точки. В кратком изложении, область VH 200-4 амплифицировали из химеры DEF38 IIA1/человеческий G4 с использованием праймера №110 (5'- TTTTCTAGACCACCATGGCTGTCCTGGGGCTGCTT-3') (SEQ ID NO: 36), который отжигается на 5'-конце сигнальной последовательности VH 200-4 и прилегает к последовательности Kozak и сайту XbaI, и праймера №104 (5'-TTTTCTAGAGGTTGTGAGGAC TCACCTGAGGAGACGGTGACTGAGGT-3') (SEQ ID NO: 37), который отжигается на 3'-конце VH 200-4 и прилегает к участку XbaI. PCR-фрагмент длиной 469 н.п. клонировали в вектор pCR4Blunt-TOPO (Invitrogen) и подтверждали путем секвенирования ДНК, с образованием плазмиды p200M-VH-2.1. Данную промежуточную плазмиду затем использовали во второй реакции ПЦР-мутагенеза для удаления потенциального отклоняющегося участка сплайсинга в CDR3 и для добавления мышиного донорного участка сплайсинга JH4 с 3'-конца кодирующей VH области. Два комплементарных праймера №111 (5'-TGGAACTTACTACGGAATGACTA CGACGGGG-3') (SEQ ID NO:38) и №112 (5'-CCCCGTCGTAGTCATTCCGTAGTAAGTTCCA-3') (SEQ ID NO:39) конструировали для направленного изменения кодона GGT на GGA в глицине-100 (нумерация по Кабату) в CDR3 VH M200. Праймеры № 110 и №112 использовали в реакции PCR для образования фрагмента длиной 395 н.п. из 5'-конца мини-экзона VH M200 и в отдельной реакции PCR с праймерами №111 и №113 (5'- TTTTCTAGAGGCCATTCTTACCTGAGGAGACGGTGACTGAGGT-3') (SEQ ID NO: 40) генерировали фрагмент 101 н.п. из 3'-конца мини-экзона VH M200. Два PCR-продукта очищали в геле на 1,5%-й агарозе с низкой точкой плавления, комбинировали и соединяли в конечной реакции PCR с использованием праймеров №110 и №113. Конечный PCR-продукт длиной 465 н.п. очищали, расщепляли XbaI и клонировали в расщепленный XbaI и обработанный щелочной фосфатазой креветки вектор pHuHCg4.D. Конечную плазмиду p200-M-H (Фиг.6) подвергали ДНК-секвенированию для гарантии правильной последовательности мини-экзона VH 200-M между участками XbaI и для подтверждения верной ориентации вставки XbaI-XbaI.
D. Конструирование мини-экзона VL M200 и плазмиды p200-M-L
Сконструированный мини-экзон для VL M200, как показано на Фиг.5B, конструировали путем основанного на PCR мутагенеза с использованием экспрессирующей 200-4 плазмиды NEF5 IIA1/K в качестве исходной точки. Область VL амплифицировали из NEF5-IIA1-K с использованием праймера №101 (5'-TTTACGCGTCC ACCATGGATTTTCAGGTGCAGATT-3') (SEQ ID NO: 41), который отжигается на 5'-конце сигнальной последовательности и прилегает к последовательности Kozak и участку MluI, и праймера №102 (5'-TTTTCTAGATTAGGAAAG TGCACTTACGTTTGATTTCCAGCTTGGTGCC-3') (SEQ ID NO: 42), который отжигается на 3'-конце VL 200-4 и прилегает к участку XbaI. PCR-фрагмент длиной 432 н.п. клонировали в вектор pCR4Blunt-TOPO (Invitrogen) и подтверждали путем ДНК-секвенирования с образованием плазмиды p200M-VL-3.3. Затем данную промежуточную плазмиду использовали во второй реакции PCR-мутагенеза для удаления потенциальных отклоняющихся участков сплайсинга в CDR1 и для добавления мышиного донорного участка сплайсинга к 3'-концу кодирующей VL области. Два комплементарных праймера №114 (5'-TGCCAGTTCAAGTGTCAGTTCCAATTACTTG-3') (SEQ ID NO: 43) и №115 (5'-CAAGTAATTGGAACTGACACTTGA ACTGGCA-3') (SEQ ID NO: 44) конструировали для направления изменения кодона GTA на GTC в валине-29 (нумерация по Кабату) в CDR1 домена VL. Праймеры №101 и №115 использовали в реакции PCR для получения фрагмента длиной 182 н.п. из 5'-конца мини-экзона VL и в отдельной реакции PCR с праймерами №114 и №116 (5'-TTTTCTAGACTTTGGATTCTACTTAC GTTTGATTTCCAGCTTGGTGCC-3') (SEQ ID NO: 45) получали фрагмент длиной 280 н.п. из 3'-конца мини-экзона VL. Два продукта PCR очищали в геле на 1,5% агарозе с низкой температурой плавления, комбинировали и объединяли в конечной реакции PCR с использованием праймеров №101 и №116. Конечный продукт PCR длиной 431 н.п. очищали, расщепляли MluI и XbaI и клонировали в расщепленный MluI и XbaI, экспрессирующий легкую цепь вектор pHuCkappa.rgpt.dE. Конечную плазмиду p200-M-L (Фиг.7) подвергали ДНК-секвенированию для гарантии правильной последовательности для мини-экзона VL между участками MluI и XbaI.
E. Сочетание плазмид p200-M-H и p200-M-L с целью получения конечной экспрессирующей плазмиды p200-M
Для экспрессии M200 с одной плазмиды p200-M-H и p200-M-L расщепляли EcoRI и фрагмент EcoRI, несущий целый ген тяжелой цепи IgG4 из p200-M-H, лигировали в линеаризованную EcoRI p200-M-L с образованием плазмиды p200-M (Фиг.8). Крупномасштабный лишенный эндотоксинов препарат p200-M получали из 2,5 литров культуры E. coli с использованием набора Endotoxin-Free Plasmid Maxi-prep Kit (Qiagen). Структуру плазмиды подтверждали путем картирования ферментами рестрикции с использованием ферментов BamHI, XbaI, и FspI. Целую кодирующую область VH, VL, Ск и Cγ4 M200 подтверждали путем секвенирования ДНК. Последовательности ДНК для целой тяжелой цепи M200 (SEQ ID NO: 23) и легкой цепи M200 (SEQ ID NO: 24) показаны на Фиг.9. Соответствующие аминокислотные последовательности целой тяжелой цепи M200 (SEQ ID NO: 25) и легкой цепи M200 (SEQ ID NO: 26) показаны на Фиг.10.
Пример 2 - Получение Fab-фрагмента F200 из M200
В данном примере описано получение Fab-фрагмента F200.
Fab-фрагменты получают из исходного вещества IgG M200 путем ферментативного расщепления. В исходном препарате IgG обменивают буфер на 20 мМ фосфат натрия, 20 мМ N-ацетилцистеин, pH 7,0. Добавляли растворимый фермент папаин и смесь вращали при 37°C в течение 4 часов. После расщепления смесь пропускали через колонку с белком А для удаления Fc-фрагментов и нерасщепленного иммуноглобулина IgG. Тетратионат натрия добавляли до 10 мМ и инкубировали в течение 30 минут при комнатной температуре. Наконец, в данном препарате обменивали буфер на 20 мМ фосфат натрия, 100 мМ хлорид натрия, pH 7,4, для получения раствора F200.
Поскольку это Fab-фрагмент, ДНК и аминокислотные последовательности легкой цепи F200 совпадают с таковыми легкой цепи M200. Последовательность ДНК (SEQ ID NO: 27) и аминокислотная последовательность (SEQ ID NO: 28) целой тяжелой цепи F200 показаны на Фиг.11.
Пример 3 - Ингибирование пролиферации эндотелия in vitro за счет M200
В данном примере описано действие антитела M200 на пролиферацию эндотелия. M200 является высоко специфичным, функционально блокирующим моноклональным антителом против интегрина α5β1.
HUVEC высевали в 96-луночные планшеты с плотностью 5000 клеток/лунку в присутствии различных антител (M100, M200, анти-VEGF или контрольных IgG) в концентрациях, показанных на Фиг.14. Планшеты обрабатывали 10 мкг/мл фибронектина или 0,1% поли-L-лизина (PLL) и блокировали 2%-ным денатурированным нагреванием BSA. Клетки выращивали в определенной бессывороточной среде, содержащей примерно 2 нг/мл VEGF, bFGF или обоих. Через четверо суток после высевания в планшеты оценивали общую жизнеспособность путем использования анализа с солью тетразолия MTT (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид+++) (см., например, Wasserman & Twentyman, "Use of a colorimetric microtiter (MTT) assay in determining the radiosensitivity of cells from murine solid tumors, "Int. J. Radiat. Oncol. Biol. Phys. 15(3): 699-702 (1988); Romijn, JC, Verkoelen, CF, Schroeder, FH, "Application of the MTT assay to human prostate cancer cell lines in vitro: establishment of test conditions and assessment of hormone-stimulated growth and drug-induced cytostatic and cytotoxic effects," Prostate 12(1): 99-110 (1988)). Из данных вычитали фон и нормализовали на значения контроля, лишенного антител. Каждое значение данных получали в трех параллелях, и показанные данные представляют результаты трех отдельных экспериментов.
Как показано на Фиг.14, рост HUVEC ингибировали M200 в зависимой от дозы манере как PLL, так и фибронектином (0,40 нМ; максимальное ингибирование до 80%), в то время как контрольный IgG не имел эффекта. Более того, M100 (мышиное антитело, из которого происхошло M200) характеризуется идентичной способностью ингибировать клеточный рост.
Важно то, что, как показано на Фиг.14, высокоаффинное, блокирующее функцию mAb против VEGF HuMV833 (KD=5,84×10-11нМ), оказывало существенно меньшее ингибирующее действие на рост HUVEC при всех тестируемых условиях (45 нМ; максимальное ингибирование 40%). Обработка клеток M200 и HuMV833 одновременно не приводила к повышенному ингибиторному ответу.
Для данных, показанных на Фиг.15A, более высокую концентрацию VEGF (50 нг/мл) включали в анализ пролиферации HUVEC на фибронектине, как описано выше. Как показано на Фиг.15A, пролиферация HUVEC на фибронектине, стимулируемая VEGF ингибировалась M200 в степени, сходной с ингибированием HuMV833. Таким образом, опосредованное M200 цитостатическое действие было очевидным даже при повышенных уровнях стимуляции роста VEGF (50 нг/мл).
Два высокоаффинных антитела получали против области идиотипа M200 и определяли их способность блокировать связывание M200 с интегрином α5β1. Эти два антиидиотипических mAb (10 мкг/мл) включали в анализ пролиферации HUVEC, описанный выше, и оценивали на предмет действия M200-зависимого ингибирования роста HUVEC. Оба mAb могут ингибировать способность M200 (1 мкг/мл) подавлять пролиферацию HUVEC. Как показано на 15B, ингибиторная активность M200 полностью подавлялась антиидиотипическими mAb против M200.
Рассмотренные вместе, эти результаты указывают на то, что M200 ингибирует пролиферацию HUVEC по механизму, перекрывающему механизм действия антитела против VEGF HuMV833, также отличаясь от него в некоторых аспектах.
Пример 4 - Действие M200 на выживание эндотелиальных клеток
В данном примере описано действие антитела M200 на выживание эндотелиальных клеток.
Антитела против некоторых интегринов способны индуцировать клеточную гибель in vitro и in vivo. Недавно было показано, что блокирующие функцию mAb против α5β1 способствуют апоптозу в культивируемых эндотелиальных клетках человека по измерениям окрашивания аннексина V, расщепления каспазой-3 и фрагментации ДНК (Kim, et al., 2002).
Сходное окрашивание аннексина V проводили на HUVEC, выращиваемых при воздействии M200 или HuMV833. HUVEC, культивируемые в бессывороточной среде (содержащей VEGF и bFGF, кроме указанных иначе случаев), выращивали в присутствии M200 (10 мкг/мл), HuMV833 (10 мкг/мл) или ставроспорина (5 мкМ, положительный контроль). Клеточную гибель оценивали путем окрашивания аннексина V Alexa488 (зеленый) и Hoechst 33258 (голубой), с последующей флуоресцентной микроскопией (изображения флуоресцентной микроскопии, показанные на Фиг.16A). Параллельно клеточную гибель отслеживали путем проточной цитометрии через 16 часов после высевания (Фиг.16B).
Как показано на Фиг.16A и 16B, клетки, обработанные M200, характеризовались повышенным окрашиванием аннексина V, тогда как те, что были обработаны HuMV833, не характеризовались этим. Таким образом, M200, в отличие от HuMV833, как оказывается, способствует клеточной гибели в эндотелиальных клетках.
Кроме того, сравнивали действие M200 на покоящиеся и пролиферирующие клетки. HUVEC высевали и обеспечивали их пролиферацию в присутствии сыворотки и факторов роста (средняя панель), выращивали до смыкания (левая панель) или лишали сыворотки и факторов роста после достижения лог-фазы роста (правая панель). В каждом из случаев клетки оставляли необработанными (контроль) или инкубировали с M200 (10 мкг/мл) или ставроспорином (5 мкМ) в течение 16 часов и окрашивали на аннексин V посредством Alexa488.
Как показано на Фиг.17, M200 индуцировали клеточную гибель в делящихся HUVEC, но не в HUVEC, погруженных в состояние покоя контактным ингибированием или отменой факторов роста. Данные результаты указывают на то, что M200 селективно способствует клеточной гибели в пролиферирующих эндотелиальных клетках.
Пример 5 - Ингибирование образования трубки in vitro за счет F200
В данном примере описан анализ образования трубки, демонстрирующий ингибирование ангиогенеза in vitro за счет F200. HUVEC подмешивали в виде суспензии отдельных клеток к фибриновому сгустку (приготовленному из фибриногена и α-тромбина) вместе с человеческой сывороткой и смесью факторов роста (анализ по Фиг.18A включал в себя среду, дополненную 0,01 мг/мл rTGF-α и 0,1 мг/мл VEGF и HGF; анализ по Фиг.18В включал в себя среду, дополненную только 0,1 мг/мл VEGF; и анализ по Фиг.18С включал в себя среду, дополненную только 0,1 мг/мл bFGF). Тестируемое антитело добавляли в среду при указанных концентрациях. В течение периода 96 часов отдельные клетки HUVEC начинали мигрировать, организовывать контакты с другими клетками и матриксом, образовывать тяжи и, наконец, 3-мерные трубковидные структуры. Степень образования трубок подвергали количественному анализу через 6 суток путем фиксации 4% формальдегидом и окрашиванием Alexa488-фаллоидином. Как показано на изображениях и графиках средней флуоресценции, отображенных на Фиг.18, образование трубок значимо ингибировалось присутствием F200. Ингибирование образования трубок наблюдали в присутствии факторов роста, VEGF, HGF и смеси этих двух с rTGFα.
Пример 6 - Ингибирование in vivo CNV в глазах приматов за счет M200 и F200
В данном примере описано действие M200 и Fab F200 на развитие сосудов после лазерного кровоизлияния в желтом пятне глаза приматов. Базовая литература, описывающая исследования хороидальной неоваскуляризации в животных моделях, включает в себя: S. Ryan, "The Development of an Experimental Model of Subretinal Neovascularization in Disciform Macular Degeneration," Transactions of the American Ophthalmologic Society 77: 707-745 (1979); S. J. Ryan, "Subretinal Neovascularization: Natural History of an Experimental Model", Archives of Ophthalmology 100: 1804-1809 (1982); M. J. Tolentino et al., "Angiography of Fluoresceinated Anti-Vascular Endothelial Growth Factor Antibody and Dextrans in Experimental Choroidal Neovascularization," Archives of Ophthalmology 118: 78-84 (2000).
A. План эксперимента
Всего 8 обезьян назначали в группы лечения, как показано в таблице ниже.
M200 и F200 вводили в несущий буферный раствор. В качестве контрольной дозы вводили ритуксан. Хороидальную неоваскуляризацию (CNV) индуцировали на 1 сутки путем обработки лазером желтых пятен обоих глаз каждого животного, как описано ниже. Всем животным дозировали M200, F200, или контроль, как указано в таблице по одному разу в неделю в течение 4 недель. Первые сутки дозирования обозначали 1 сутками. Животных оценивали на предмет изменений клинических симптомов, массы тела и других параметров стандартными способами. Всех животных подвергали эвтаназии на 28 сутки.
B. Индукция хороидальной неоваскуляризации (CNV) лазером
Животные голодали в течение ночи перед лазерной обработкой и дозированием. Животных обезболивали кетамином-HCl (внутримышечно до наступления эффекта) с последующей комбинацией внутривенного введения кетамина и диазепама (до наступления эффекта) для процедуры лазерной обработки и дозирования.
Хороидальную неоваскуляризацию (CNV) индуцировали путем лазерной обработки желтых пятен обоих глаз. Очаги получали лазером на желтом пятне в виде стандартного профиля решетки из 9 пятен [лазерным фотокоагулятором OcuLight GL (532 нм) с медицинским портативным адаптором с щелевой лампой IRIS]. Лазерные пятна в правом глазу располагали в зеркальном порядке относительно левого глаза. Примерные лазерные параметры были следующими: размер пятна - 50-100 мкм; мощность лазера - 300-700 милливатт; время воздействия - 0,1 секунд. Параметры для каждого животного записывали в сутки обработки лазером. Фотографии получали с использованием камеры для сетчатки TRC-50EX Retina Camera и/или щелевой лампы SL-4ED с цифровой камерой CCD.
C. Дозирование
Инъекцию иммуноглобулина (тест) или контрольного вещества в стекловидное тело проводили в каждый глаз. Инъекция на 1 сутки происходила непосредственно после обработки лазером. Перед введением дозы в каждый глаз закапывали мидриатик (1% тропикамид). Глаза промывали разбавленным раствором антисептика (раствор 5% бетадина или его эквивалент), антисептик смывали 0,9% стерильным солевым раствором (или эквивалент) и в глаз закапывали две капли местного анестетика (пропаракаин или эквивалент). Расширитель век вставляли, чтобы поддерживать веки открытыми во время процедуры и глазное яблоко было открыто. Иглу дозировочного шприца проводили через склеру и pars plana примерно в 4 мм за каймой (limbus). Иглу направляли за хрусталик в середину стекловидного тела. Тестируемое вещество медленно вводили в стекловидное тело. Для зажима конъюнктивы, окружающей шприц, перед изъятием иглы использовали пинцет. Конъюнктиву держали пинцетом во время изъятия иглы и краткое время после него. Затем вынимали расширитель века. Непосредственно после дозирования глаза оценивали непрямым офтальмоскопом для идентификации и видимых проблем после дозирования. Местный антибиотик (Tobrex® или его эквивалент) может впрыскиваться в каждый глаз для предотвращения инфекции непосредственно после дозирования и через сутки после дозирования. Животных возвращали в их клетки после достаточного восстановления после анестезии.
Дозирование проводили на еженедельной основе по регламенту, приведенному ниже в таблице:
Уровни количества дозы в граммах были указаны для каждого глаза. Полагая средний объем глаза равным 2 мл, дозу на глаз назначали ˜150 мкг/мл M200 и ˜50 мкг/мл F200. В обоих случаях молярная концентрация M200 или F200 составляла 1 мкМ.
D. Мониторинг ингибирования ангиогенеза
Непрямую офтальмоскопию использовали для оценки задней камеры, и для оценки задней камеры глаза применяли биомикроскопию. Глаза оценивали по стандартным процедурам (Robert B. Hackett and T. O. McDonald. 1996, Dermatotoxicology. 5th Edition. Ed. By F. B. Marzulli and H. I. Maibach. Hemisphere Publishing Corp., Washington, D. C).
Флуоресцеиновую ангиографию проводили перед образованием очагов повреждения и через 5, 12, 19 и 26 суток после повреждения и начала лечения. Для поддержания седативного эффекта можно назначать комбинацию кетамина и диазепама (примерно 10 мг/кг кетамина и 0,5 мг/кг диазепама внутривенно). Для раскрытия глазных век использовали расширители век. Перед введением флуоресцеиновой метки каждое животное помещали на офтальмологическое кресло, которое поддерживало положение головы во время фотографирования. Фотографии получали с использованием камеры для глазного дна (TRC-50EX Retina Camera). Изображения снимали с использованием системы TOPCON IMAGEnetTM. Флуоресцеиновую метку (10% флуоресцеина натрия, примерно 0,1 мл/кг) инъецировали в головную или подкожную вену. Цветные и черно-белые фотографии получали в несколько моментов времени во время инъекции метки, включая артериальную фазу, раннюю артериовенозную фазу и несколько поздних артериовенозных фаз для мониторинга утечки флуоресцеина, ассоциированного с очагами CNV. Неизмененные изображения могут переноситься на компакт-диски для хранения и транспортировки.
Кроме того, глаза можно фотографировать (камера для сетчатки TRC-50EX Retina Camera и/или щелевая лампа SL-4ED, с цифровой камерой CCD). Животные перед этой процедурой могут быть подвергнуты легкому седативному действию кетамина-HCl, и для облегчения оценки в каждый глаз вводили несколько капель раствора мидриатика (обычно 1% тропикамид).
E. Результаты
Анализ изображений флуоресцеиновой ангиографии, полученных с использованием данных групп, ясно указывает на наличие CNV на 13 сутки и 20 сутки. CNV продолжал иметь место до 28 суток в контрольных группах (например, в группах 1, 4 (левый глаз) и 5 (левый глаз)). CNV был, наоборот, значимо снижен в глазах, обработанных M200 и F200 (например, группы 2, 3, 4 (правый глаз) и 5 (правый глаз)). Как показано на Фиг.19, на 20 сутки обработанный M200 глаз характеризовался малыми проявлениями CNV по отношению к глазу, обработанному только контролем.
На Фиг.20-25 показано действие M200 и F200 на CNV в правом глазу конкретной обезьяны по сравнению с действием контроля на левый глаз той же обезьяны на 13, 20 и 27 сутки. Значительное снижение CNV наблюдается в глазах субъекта, обработанных M200 или F200, по отношению к необработанным глазам. Относительное снижение CNV оказывается более высоким у субъектов, обработанных F200. Однако полагают, что данное очевидное различие имеет место вследствие утечки M200 через кровяное русло в необработанный левый глаз субъектов. То есть лечение M200 правого глаза субъекта также ингибирует CNV левого глаза, что приводит к менее очевидной разнице между глазами. Наоборот, M200 не уходит в необработанный глаз, что приводит к большему различию в ингибировании CNV между двумя глазами субъекта.
Пример 7 - Аффинность связывания M200, F200 и гуманизированных вариантов
A. Анализ кинетики посредством поверхностного плазмонного резонанса
Значения аффинности между AAB1/B2Fc и IIA1, M200 или F200 анализировали с использованием BIAcore 3000 и 2000 (BIAcore, Швеция). IIA1, M200 или F200 иммобилизировали на чипе Pioneer F1 с использованием стандартного набора связывания через аминогруппу (BIAcore). Поверхностный плазмонный резонанс измеряли со скоростью потока 50 мкл/мин при 24°C. Инъекция AAB1/B2Fc (фаза ассоциации) происходит в течение 180 секунд. Затем проводили мониторинг диссоциации в течение 3 часов. Кинетику связывания рассчитывали из данных, полученных при пяти различных концентрациях аналита (320 нМ, 160 нМ, 80 нМ, 40 нМ, 20 нМ), с использованием программы BIAevaluation. Применяли двойное вычитание контроля для избежания реакций от поверхности сравнения и контроля, представляющего собой только буфер. KD получали путем одновременного построения зависимости фаз ассоциации и диссоциации сенсограмм от серий концентрации аналита. Для M200 определяли KD, равную 0,367±0,132 нМ. Для F200 определяли KD, равную 0,332±0,065 нМ.
B. Аффинность HuM200, определяемая путем конкурентного анализа ELISA
Анализы ELISA с конкурентным связыванием могут проводиться для определения аффинности связывания HuM200 по сравнению с IIA1 и M200.
Лунки 96-луночных планшетов для ELISA (планшет, Nunc-Immuno MaxiSorp plate, NalgeNunc, Naperville, Иллинойс) покрывали 100 мкл 1,0 мкг/мл рекомбинантного растворимого белка слияния человеческий α5β1-интегрин-Fc в 0,2 M натрий-карбонат-бикарбонатном буфере (pH 9,4) в течение ночи при 4°C. После промывки буфером для промывки (PBS, содержащий 0,1% Tween 20) лунки блокировали 200 мкл блокирующего буфера Superblock (Pierce) в течение 30 мин и затем промывали буфером для промывки. Смесь биотинилированного мышиного IIA1 (0,1 мкг/тест) и конкурентного антитела (параллели серийных 3-кратных разведений конкурентных антител, начиная от 5 мг/мл) в буфере ELISA (PBS, содержащий 1% BSA и 0,1% Tween 20) наносили в планшеты для ELISA в конечном объеме 100 мкл на лунку. Планшеты для ELISA инкубировали в течение 1 ч при комнатной температуре, и промывали лунки буфером для промывки. Затем в каждую лунку вносили 100 мкл разведенного 1/1000 конъюгированного HRP стрептавидина (Pierce, Rockford, Иллинойс) в буфере для ELISA. После инкубации в течение 0,5 ч при комнатной температуре и промывки буфером для промывки в каждую лунку добавляли 100 мкл субстрата TMB. Поглощение считывали при 450 нм с использованием микропланшетного ридера VERSAmax (Molecular Devices, Menlo Park, Калифорния). Строили график зависимости конечной концентрации конкурента в реакционной смеси от поглощения при 450 нм.
HuM200 содержит аминокислотные последовательности тяжелых и легких цепей, показанные на Фиг.13 (SEQ ID NO: 31 и 32). HuM200 (также называемый HuM200-G4) включает в себя константную область из IgG4. Вторая гуманизированная версия M200 HuM200-g2m3G включает в себя те же вариабельные домены, что и HuM200, но содержит константную область IgG2.
Как показано на Фиг.26, две гуманизированные версии антитела M200, HuM200-G4 и HuM200-g2m3G, характеризуются кривой аффинности связывания, почти идентичной с таковой для M200. Кроме того, HuM200-G4 и HuM200-g2m3G характеризуются значениями IC50, равными 131,8 мкг/мл и 102,8 мкг/мл соответственно. Данные значения сравнимы с таковым, наблюдаемым для M200 (106,3 мкг/мл), и слегка превышают таковое для IIA1 (79,1 мкг/мл).





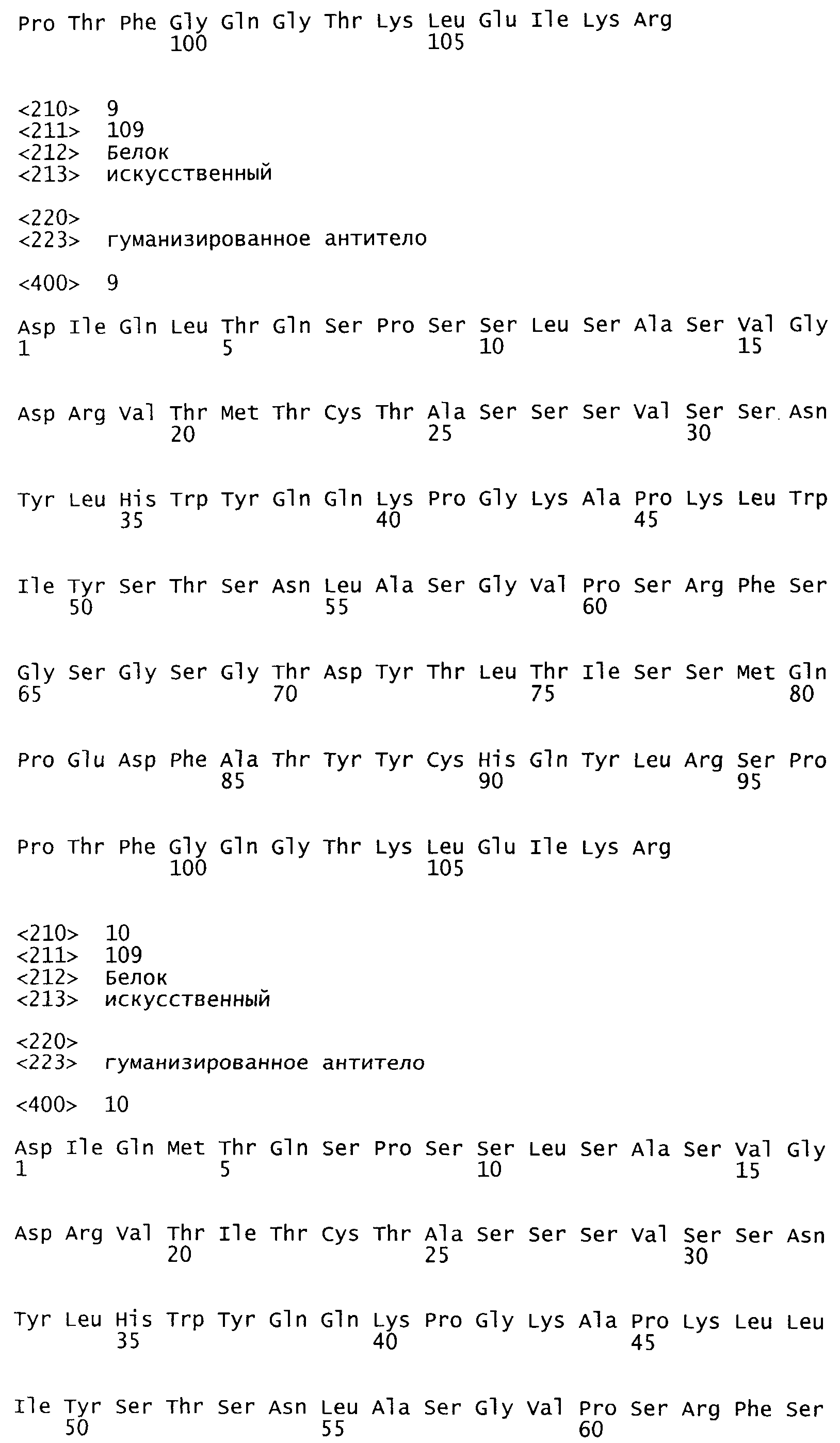






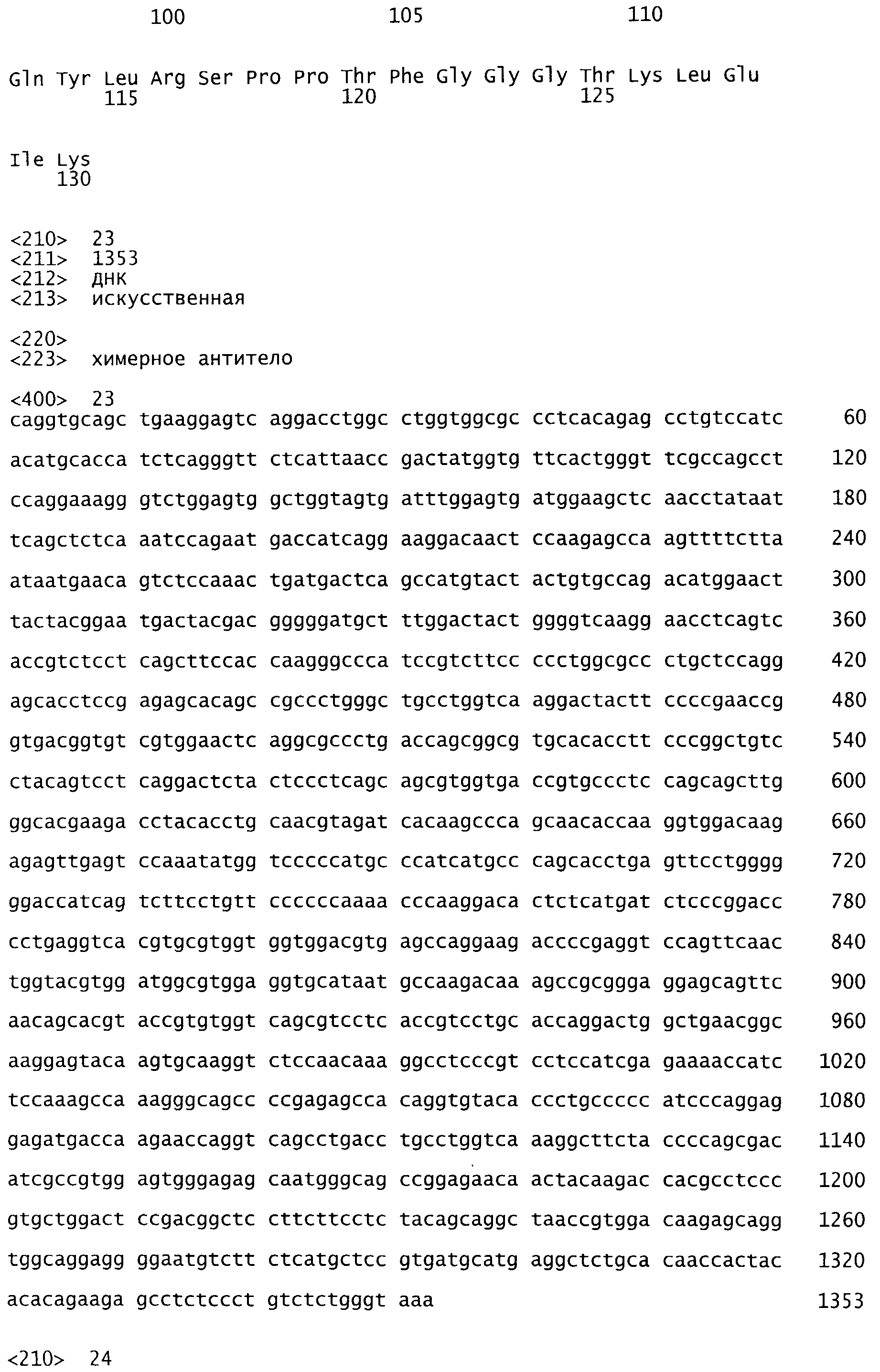






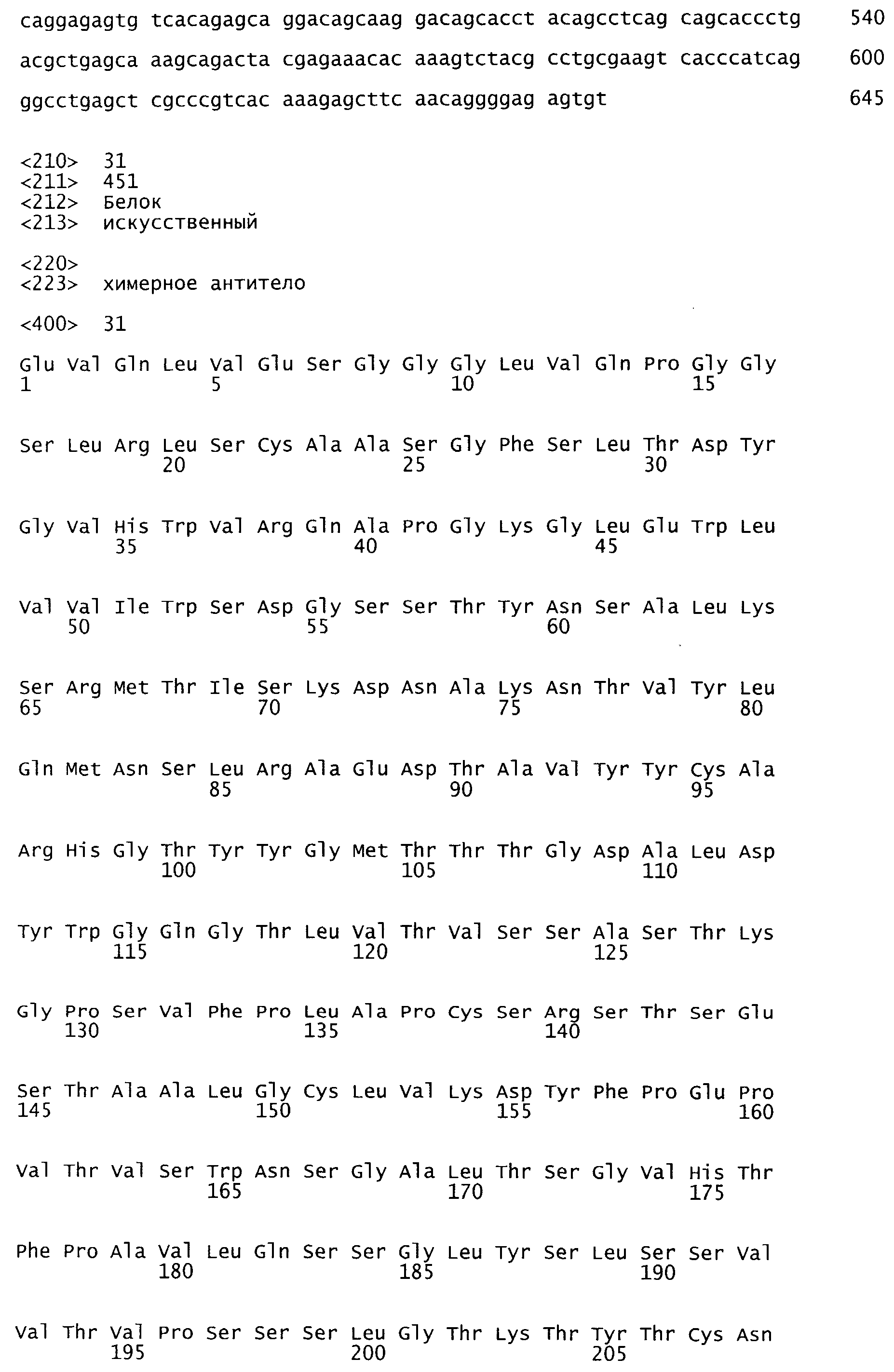






Реферат
Изобретение относится к медицине и касается химерных и гуманизированных антител против интегрина α5β1, которые модулируют ангиогенез. Сущность изобретения включает конкретные химерные и гуманизированные антитела, нуклеиновые кислоты, кодирующих аминокислотные последовательности тяжелых и легких цепей иммуноглобулина, векторов, экспрессирующих эти нуклеиновые кислоты, а также способа очистки антител. Преимущество изобретения заключается в создании препарата для снижения ангиогенеза. 9 н. и 21 з. п. ф-лы, 1 табл., 26 ил.

Комментарии