Пути терапевтического применения ингибитора c-raf - RU2018146886A
Код документа: RU2018146886A
Формула
1. Фармацевтическая комбинация, содержащая:
(A) ингибитор c-Raf, который представляет собой соединение A:
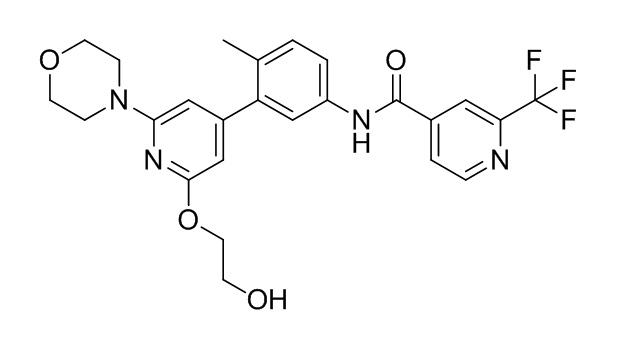
или его фармацевтически приемлемую соль;
и
(В) выделенную молекулу антитела, способную связываться с белком-1 запрограммированной смерти клетки (PD-1) человека, содержащую вариабельную область тяжелой цепи (VH), которая содержит аминокислотную последовательность HCDR1, HCDR2 и HCDR3 из BAP049-Clone-B или BAP049-Clone-E, как описано в таблице 1, и вариабельную область легкой цепи (VL), которая содержит аминокислотную последовательность LCDR1, LCDR2 и LCDR3 из BAP049-Clone-B или BAP049-Clone-E, как описано в таблице 1.
2. Фармацевтическая комбинация по п. 1, где молекула антитела к PD-1 содержит:
(a) вариабельную область тяжелой цепи (VH), которая содержит аминокислотную последовательность HCDR1 под SEQ ID NO: 4, аминокислотную последовательность HCDR2 под SEQ ID NO: 5 и аминокислотную последовательность HCDR3 под SEQ ID NO: 3; и вариабельную область легкой цепи (VL), которая содержит аминокислотную последовательность LCDR1 под SEQ ID NO: 13, аминокислотную последовательность LCDR2 под SEQ ID NO: 14 и аминокислотную последовательность LCDR3 под SEQ ID NO: 33;
(b) VH, которая содержит аминокислотную последовательность HCDR1 под SEQ ID NO: 1, аминокислотную последовательность HCDR2 под SEQ ID NO: 2 и аминокислотную последовательность HCDR3 под SEQ ID NO: 3; и VL, которая содержит аминокислотную последовательность LCDR1 под SEQ ID NO: 10, аминокислотную последовательность LCDR2 под SEQ ID NO: 11 и аминокислотную последовательность LCDR3 под SEQ ID NO: 32;
(c) VH, которая содержит аминокислотную последовательность HCDR1 под SEQ ID NO: 4, аминокислотную последовательность HCDR2 под SEQ ID NO: 5 и аминокислотную последовательность HCDR3 под SEQ ID NO: 3; и VL, которая содержит аминокислотную последовательность LCDR1 под SEQ ID NO: 13, аминокислотную последовательность LCDR2 под SEQ ID NO: 14 и аминокислотную последовательность LCDR3 под SEQ ID NO: 33; или
(d) VH, которая содержит аминокислотную последовательность HCDR1 под SEQ ID NO: 1, аминокислотную последовательность HCDR2 под SEQ ID NO: 2 и аминокислотную последовательность HCDR3 под SEQ ID NO: 3; и VL, которая содержит аминокислотную последовательность LCDR1 под SEQ ID NO: 10, аминокислотную последовательность LCDR2 под SEQ ID NO: 11 и аминокислотную последовательность LCDR3 под SEQ ID NO: 32.
3. Фармацевтическая комбинация по п. 1 или 2, где ингибитор c-Raf-киназы или его фармацевтически приемлемая соль и молекула антитела к PD-1 вводятся раздельно, одновременно или последовательно.
4. Фармацевтическая комбинация по п. 1 или 2, где ингибитор c-Raf-киназы находится в лекарственной форме для перорального применения, или где молекула антитела к PD-1 находится в инъекционной лекарственной форме.
5. Фармацевтическая комбинация по любому из пп. 1-4 для применения в лечении пролиферативного заболевания.
6. Фармацевтическая комбинация для применения по п. 5, где пролиферативное заболевание выбрано из солидной опухоли, которая содержит одно или несколько изменений митоген-активируемой протеинкиназы (MAPK), KRAS-мутантного NSCLC (немелкоклеточный рак легких), NRAS-мутантной меланомы, KRAS- и/или BRAF-мутантного NSCLC, KRAS- и/или BRAF-мутантного рака яичников и BRAF-мутантной меланомы, устойчивых к комбинированному лечению с помощью BRAFi/MEKi, где пролиферативное заболевание предпочтительно представляет собой NRAS-мутантную меланому или KRAS-мутантный NSCLC.
7. Фармацевтическая комбинация для применения по п. 6, где молекула антитела к PD-1 вводится в дозе от приблизительно 300 мг до 400 мг один раз каждые три недели или один раз в четыре недели.
8. Фармацевтическая комбинация для применения по п. 6 или 7, где молекула антитела к PD-1 вводится в дозе приблизительно 300 мг один раз в три недели.
9. Фармацевтическая комбинация для применения по п. 6 или 7, где молекула антитела к PD-1 вводится в дозе приблизительно 400 мг один раз в четыре недели.
10. Фармацевтическая комбинация для применения по п. 8 или 9, где ингибитор c-Raf-киназы вводится в дозе приблизительно 5-1200 мг в день; либо один раз в день, либо два раза в день, более предпочтительно один раз в день.
11. Фармацевтическая комбинация для применения по любому из пп. 5-10, где ингибитор c-Raf вводится в дозе приблизительно 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1050, 1100, 1150 или 1200 мг один раз в день.
12. Фармацевтическая комбинация для применения по любому из пп. 5-11, где ингибитор c-Raf вводится в дозе приблизительно 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1050, 1100, 1150 или 1200 мг один раз в день и молекула антитела к PD-1 вводится (i) в дозе приблизительно 300 мг один раз в три недели или (ii) в дозе приблизительно 400 мг один раз в четыре недели.
13. Фармацевтическая комбинация по любому из пп. 1-4 или фармацевтическая комбинация для применения по любому из пп. 5-12, где молекула антитела к PD-1 содержит:
(a) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 38, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 42;
(b) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 38, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 66;
(c) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 38, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 70;
(d) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 50, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 70;
(e) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 38, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 46;
(f) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 50, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 46;
(g) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 50, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 54;
(h) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 38, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 54;
(i) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 38, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 58;
(j) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 38, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 62;
(k) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 50, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 66;
(l) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 38, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 74;
(m) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 38, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 78;
(n) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 82, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 70;
(o) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 82, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 66; или
(p) вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 86, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 66.
14. Ингибитор c-Raf, который представляет собой соединение A:

или его фармацевтически приемлемую соль, для применения в комбинации с выделенной молекулой антитела, способной связываться с белком-1 запрограммированной смерти клетки (PD-1) человека, содержащей вариабельную область тяжелой цепи (VH), которая содержит аминокислотную последовательность HCDR1, HCDR2 и HCDR3 из BAP049-Clone-B или BAP049-Clone-E, как описано в таблице 1, и вариабельную область легкой цепи (VL), которая содержит аминокислотную последовательность LCDR1, LCDR2 и LCDR3 из BAP049-Clone-B или BAP049-Clone-E, как описано в таблице 1, для лечения солидной опухоли (например, солидной опухоли на поздней стадии), которая содержит по меньшей мере одно изменение митоген-активируемой протеинкиназы (MAPK).
15. Ингибитор c-Raf, который представляет собой соединение A:

или его фармацевтически приемлемую соль, для применения в комбинации с выделенной молекулой антитела, способной связываться с белком-1 запрограммированной смерти клетки (PD-1) человека, содержащей вариабельную область тяжелой цепи (VH), которая содержит аминокислотную последовательность HCDR1, HCDR2 и HCDR3 из BAP049-Clone-B или BAP049-Clone-E, как описано в таблице 1, и вариабельную область легкой цепи (VL), которая содержит аминокислотную последовательность LCDR1, LCDR2 и LCDR3 из BAP049-Clone-B или BAP049-Clone-E, как описано в таблице 1, для лечения рака, который выбран из NRAS-мутантной меланомы, KRAS-мутантного NSCLC (немелкоклеточный рак легких), BRAF-мутантного NSCLC, KRAS- и BRAF-мутантного NSCLC, KRAS-мутантного рака яичников, BRAF-мутантного рака яичников, и KRAS- и BRAF-мутантного рака яичников, и рецидивирующей или рефрактерной меланомы, мутантной по BRAF V600 (например, указанная меланома рецидивирует после неудачи комбинированной терапии с помощью BRAFi/MEKi или является рефрактерной в отношении комбинированной терапии с помощью BRAFi/MEKi).

Комментарии