Конструкции антител и хемокинов и их применение при иммунологических нарушениях - RU2252786C2
Код документа: RU2252786C2
Чертежи





















Описание
Данное изобретение относится к применению конструкции антитела и/или хемокина, которая связывается с хемокиновым рецептором, для получения фармацевтической композиции, предназначенной для устранения клеток, которые латентно инфицированы вирусом иммунодефицита приматов. Кроме того, данное изобретение относится к применению конструкции антитела и/или хемокина, которая связывается с хемокиновым рецептором, для получения фармацевтической композиции, предназначенной для лечения, профилактики и/или облегчения воспалительных заболеваний почек, воспалительных заболеваний кишечника, множественного склероза, заболеваний кожи, диабета или отторжения трансплантата. Далее, данное изобретение относится к конструкциям антитела и/или хемокина, в частности к конструкциям, в которых упомянутая конструкция антитела включает сайт связывания с хемокиновым рецептором 5 и сайт связывания с CD3 и в которых упомянутая конструкция хемокина включает RANTES и токсин. Изобретение также описывает полинуклеотиды, кодирующие упомянутые конструкции антител и/или хемокинов, и векторы и хозяев, содержащих упомянутые нуклеиновокислотные молекулы. Дополнительно, данное изобретение относится к композициям, включающим упомянутые конструкции антител, конструкции хемокинов, полинуклеотиды, векторы и/или хозяев. Предпочтительно упомянутая композиция представляет собой фармацевтическую композицию. Также описано применение конструкций антител, конструкций хемокинов, полинуклеотидов, хозяев и/или векторов для получения фармацевтической композиции для лечения, профилактики и/или облегчения иммунологических нарушений или для устранения латентно инфицированных клеток, где упомянутые клетки инфицированы вирусом иммунодефицита приматов, таким как ВИЧ-1. Данное изобретение также относится к способу лечения, профилактики и/или облегчения иммунологических нарушений или устранения клеток, которые латентно инфицированы вирусом иммунодефицита приматов. Кроме того, изобретение относится к комплекту, содержащему соединения по изобретению.
В тексте данного описания цитируются некоторые документы. Таким образом, каждый из документов, цитируемых здесь (включая любые спецификации производителей, инструкции и т.д.), приводится здесь в виде ссылки.
Заболеваемость иммунологическими нарушениями/заболеваниями, такими как аутоиммунные заболевания, воспалительные заболевания, а также инфекционные заболевания, не только увеличивается, но представляет серьезную опасность для здоровья всего человечества.
Например, в Германии около 1 % населения страдает таким аутоиммунным заболеванием, как ревматоидный артрит. Кроме того, имеется ряд других ревматоидных заболеваний, также ведущих к артриту. В настоящее время для лечения воспалительных заболеваний суставов используются три группы лекарственных средств - нестероидные противоревматические средства, препараты кортизона и препараты второго ряда, а также TNFα-блокирующие агенты. До сегодняшнего дня лечение было сфокусировано на местных инъекциях препаратов кортизона в комбинации с системным применением противовоспалительных средств или препаратов второго ряда.
Нестероидные противоревматические средства, которые обладают мягким обезболивающим и противовоспалительным действием, имеют тем не менее множество побочных эффектов при регулярном применении (например, при язвах ЖКТ, нефрозах). Высокое дозы препаратов кортизона при высоких дозах дают сильный противозастойный и обезболивающий эффект, однако приводят к быстрому рецидиву после прекращения лечения. Более того, препараты кортизона не могут остановить деструктивный процесс при заболеваниях суставов. Длительная терапия кортизоном обычно влечет за собой серьезные побочные эффекты (инфекции, синдром Кушинга, остеопороз, пергаментная кожа, расстройства метаболизма и гормональные расстройства). Существенный недостаток местных инъекций кортизона заключается в том, что активность мигрировавших лейкоцитов только снижается. Поскольку инфильтрирующие клетки не разрушаются, после прекращения терапии наступает быстрый рецидив. Как упоминалось выше, то же относится и к системному применению. Иногда развивается воспаление вследствие раздражающего воздействия кристаллов кортизона, усиливающееся после инъекции кортизона. Длительность действия инъекции кортизона очень неравномерна и может варьироваться от полной неэффективности до получения длительного эффекта в течение нескольких недель.
Препараты второго ряда в ревматологии используются для достижения долговременного подавления воспаления и для сокращения использования препаратов кортизона. Из-за существенной токсичности (аллергии, инфекции, злокачественные заболевания, почечная недостаточность, кризы кровяного давления, легочные заболевания) необходимо очень внимательное наблюдение врачей за пациентами. После начала лечения терапевтический эффект может не проявляться в течение первых трех месяцев. В настоящее время применяются 4 или 5 таких препаратов второго ряда, которые используют сначала индивидуально или комбинируют, если лечение неэффективно. О механизме действия препаратов второго ряда почти ничего не известно. До сих пор полностью не ясно, может ли применение препаратов второго ряда замедлить разрушение суставов. В последние годы в лечении ревматоидного артрита начали применять новую группу веществ, действие которых основано на блокировании веществ клеточного сигнала (в частности, TNFα) посредством моноклональных антител или растворимых рецепторных конструкций.
Кроме того, некоторые пациенты не реагируют на применяемые в настоящее время виды лечения. В других случаях традиционную терапию прекращают из-за непереносимых побочных эффектов.
Подобная ситуация, когда современные виды лечения имеют множество ограничений, наблюдается и для многих других воспалительных и аутоиммунных заболеваний, таких как почечные воспалительные заболевания, кишечные воспалительные заболевания, множественный склероз и отторжение трансплантата. Например, средства, используемые для лечения воспалительных и аутоиммунных заболеваний, включают противовоспалительные и иммунодепрессивные средства, такие как азатиоприн, циклофосфамид, глюкокортикоиды, например, преднизон и кортикостероиды; иммунодепрессанты, такие как циклоспорин А, такролимус (FK506), сиролимус (рапамицин); и протеиновые средства, такие как кальцинурин, β-интерферон, анти-ТМРα-моноклональные антитела (ремикад). Эти препараты показывают общие иммуномодулирующие эффекты, и поэтому их показатели эффективности и побочных эффектов могут накладывать серьезные ограничения на выбранные варианты лечения (Harrison’s Principles of Internal Medicine, eds. Fauci et al., 14th edition, McGraw-Hill publisher).
Для лечения кишечных воспалительных заболеваний (примерами которых являются болезнь Крона, язвенный колит) обычно используют такие противовоспалительные средства, как сульфасалазин (азулфидин) и глюкокортикоиды, такие как преднизон и, в некоторых случаях, TNFα-блокирующими препараты. При язвенном колите традиционно применяют иммунодепрессивную терапию такими препаратами, как азатиоприн, а пациентам с тяжелыми формами болезни назначают мощное иммунодепрессивное средство циклоспорин (Harrison’s Principles of Internal Medicine, eds. Fauci et al., 14th edition, McGraw-Hill publisher).
Во многих случаях при использовании имеющихся лекарственных средств достаточное снижение активности заболевания не достигается, так что иногда даже становится необходимым хирургическое вмешательство.
Почечные воспалительные заболевания (нефрит) обычно лечат, например, глюкокортикоидами, алкилирующими средствами и/или плазмаферезом. Подобные варианты лечения также применяются при системной красной волчанке (СКВ), синдроме Шегрена, полимиозите, дерматомиозите, смешанной болезни соединительных тканей, антифосфолипидном синдроме.
Для лечения некоторых из этих заболеваний на сегодняшний день существует лишь ограниченное количество терапевтических вариантов. Все эти болезни включают воспалительный компонент. Однако имеющимися в настоящее время препаратами воспалительный компонент не может быть подавлен в достаточной степени. Для некоторых препаратов, например алкилирующих средств, не должна превышаться максимальная для пациента пожизненная доза.
Отторжение трансплантата обычно лечат иммунодепрессивными средствами, включая азатиоприн, микофенолат мофетил, глюкокортикоиды, циклоспорин, такролимус (FK506), сиролимус (рапамицин). Комбинацию стероидов и низкой дозы мышиного моноклонального антитела ОКТЗ, связывающегося с Т-клетками, используют для того, чтобы вызвать анергию и истощение Т-клеток, а затем терапию продолжают с использованием иммунодепрессантов, например, циклоспорина. Человеческие антимышиные антитела I(HAMAs) имеют распространенные побочные эффекты и ограничивают использование ОКТЗ (Fauci et al. sic.2374-2381).
Способы лечения множественного склероза включают такие средства, которые воздействуют на иммунную систему в целом, например, противовоспалительные средства, такие как азатиоприн, циклофосфамид, преднизон, кортикостероиды, циклоспорин А, кальцинурин, рапамицин, β-интерферон (Fauci et al. sic.2415-2419; Wang (2000) J. Immunol 165, 548-57). Кроме того, применяется ряд неспецифических средств, которые могут улучшить качество жизни, включая физиотерапию и психофармацевтические средства. Ни один из вариантов лечения, упомянутых выше, не оказывает целительного действия. Даже самый многообещающий препарат, β-интерферон, лишь замедляет развитие болезни и при этом вызывает существенные побочные воздействия.
Далее, вирусом иммунодефицита человека типа 1 (ВИЧ-1), который является наиболее распространенной причиной СПИДа, уже инфицированы более 50 млн человек (включая умерших), и темпы нового инфицирования оцениваются приблизительно в 6 млн человек в год (эпидемические данные по СПИДу за декабрь 1999 (UNAIDS, Geneva, 1999), www. unaids.org). Тревожит также неопределенность относительно возможности эпидемии. Хотя глобальным эпицентром является центральная Африка, скорость инфицирования в последнее время увеличилась в странах бывшего СССР и в части южной и юговосточной Азии, включая Индию и Китай, где буквально сотни миллионов человек находятся в потенциальной опасности. В Соединенных Штатах новая волна инфекции выявлена у женщин, сексуальных меньшинств и младших поколений мужчин-гомосексуалистов. Комбинационная антиретровирусная терапия приносит клиническое облегчение многим пациентам, однако обладает высокой стоимостью и токсичностью, и СПИД остается смертельным заболеванием. Кроме того, подавляющему большинству инфицированных людей в мире эти лекарства недоступны. Таким образом, хотя демография (и в некоторых случаях естественный ход развития) СПИДа изменилась, эпидемия отнюдь не предотвращена; наоборот, болезнь развивается, расширяется и представляет еще большую опасность.
Вирус иммунодефицита человека (ВИЧ) не может войти в человеческую клетку, не связавшись сначала с двумя ключевыми молекулами на клеточной поверхности, CD4 и корецептором. Корецептор, который узнается в первую очередь, это CCR5, а позднее в жизненном цикле вируса другой хемокиновый рецептор, CXCR4, становится корецептором для ВИЧ-1 (D’SouZa, Nature Med. 2, 1293 (1996); Premack, Nature Med. 2, 1174; Fauci, Nature 384, 529 (1996)). Штаммы ВИЧ-1, которые в основном передаются половым путем, называются М-тропными вирусами. Эти штаммы ВИЧ-1 (также известные как NSI-первичные вирусы) могут реплицироваться в первичных CD4+ Т-клетках и макрофагах и используют хемокиновый рецептор CCR5 (реже - CCR3) в качестве корецептора. Т-тропные вирусы (иногда называемые Sl-первичными) также могут реплицироваться в первичных CD4+ Т-клетках, но кроме этого, могут заражать установившиеся линии CD4+ Т-клеток in vitro, что осуществляется посредством хемокинового рецептора CXCR4 (фузина). Многие из этих Т-тропных штаммов могут использовать CCR5 в дополнение к CXCR4, а некоторые посредством CCR5 могут входить в макрофаги, по крайней мере, в определенных in vitro условиях (D’SouZa, Nature Med. 2, 1293 (1996); Premack, Nature Med. 2, 1174; Fauci, Nature 384, 529 (1996)). Участвуют ли другие корецепторы в патогенезе ВИЧ-1, не выяснено, но из in vitro исследований может быть сделан вывод о существовании другого корецептора для некоторых Т-тропных штаммов. Поскольку М-тропные штаммы примерно на 90 % связаны с передачей ВИЧ половым путем, CCR5 является доминирующим корецептором для вируса у пациентов; передача (или системное закрепление) СХСR4-использующих (Т-тропных) штаммов происходит редко (D’SouZa, Nature Med. 2, 1293 (1996); Premack, Nature Med. 2, 1174; Fauci, Nature 384, 529 (1996), Paxton, Nature Med. 2, 412 (1996); Liu, Cell 86, 367 (1996); Samson, Nature 382, 722 (1996); Dean, Science 273, 1856 (1996); Huang, Nature Med. 2, 1240 (1996)). Однако когда SI-вирусы развиваются in vivo (или произошла передача), они особенно вирулентны и вызывают ускоренное прогрессирование болезни (D’SouZa, Nature Med. 2, 1293 (1996); Premack, Nature Med. 2, 1174; Fauci, Nature 384, 529 (1996), Schuitemaker, J. Virol. 66, 1354 (1992); Connor, J. Virol. 67, 1772 (1993); Richman, J. Infect. Dis. 169, 968 (1994); R.I. Connor et al., J. Exp. Med. 185, 621 (1997); Trkola, Nature 384, 184 (1996)).
Количество и природа корецепторных молекул на целевых клетках, а также предполагаемая способность штаммов ВИЧ-1 входить в клетки посредством различных корецепторов представляются факторами, которые определяют прогрессирование болезни. Эти факторы оказывают огромное влияние на механизмы ВИЧ-1-инфицирования как со стороны хозяина, так и со стороны вируса. Например, гомозиготный дефект (дельта 32) в CCR5 строго коррелирует с устойчивостью к ВИЧ-1-инфекции in vivo и in vitro. Индивидуумы, являющиеся гетерозиготными к дефектной аллели CCR5, в лучшем случае слабо защищены от инфекции и показывают лишь умеренно замедленное прогрессирование заболевания (Paxton, Nature Med. 2, 412 (1996); Liu, Cell 86, 367 (1996); Samson, Nature 382, 722 (1996); Dean, Science 273, 1856 (1996); Huang, Nature Med. 2, 1240 (1996)). Однако на уровень экспрессии CCR5 на активированных CD4+ Т-клетках могут влиять другие факторы, что, в свою очередь, влияет на эффективность ВИЧ-1 - инфекции in vitro (Trkola, Nature 384, 184 (1996); BleuI, Proc. Natl. Acad Sci. U.S.A. 94, 1925 (1997)). По причинам, которые пока не ясны, величина экспрессии CCR5 на клеточной поверхности (измеренная по МIР-1-связыванию) CD4+ Т-клеток от индивидуумов с двумя аллелями CCR5 дикого типа изменяется в 20 раз (Trkola, Nature 384, 184 (1996)) (см. фиг). Окрашивание CCRS-специфическим моноклональным антителом показывает столь же сильную изменчивость (Wu, J. Ехр. Med. 186:1373-81 (1997)). Такое изменение может быть намного сильнее эффекта от одной дефектной аллели CCR5. Причины такого изменения должны быть тщательно изучены, поскольку они открывают путь к контролируемым факторам, которые могут повысить устойчивость к заболеванию.
Клинические изоляты вирусов иммунодефицита приматов главным образом используют для вхождения хемокиновый рецептор CCR5 (Feng, Science 272, 872 (1996); Choe, Cell 85, 1135 (1996); Deng, Nature 381, 661 (1996); Dragic et al., Nature 381, р. 667; Doranz, Cell 85, 1149 (1996); Alkhatib, Science 272, 1955 (1996)). Для большинства изолятов ВИЧ-1, которые закрепились после передачи и доминируют в течение первых лет инфицирования, CCR5 является обязательным корецептором, и редкие индивидуумы, являющиеся генетически дефицитными в экспрессии CCR5, относительно устойчивы к инфекции ВИЧ-1 (Connor, J. Ехр. Med. 185, 621 (1997); Zhang, Nature 383, 768 (1996); Björndal, J. Virol. 71, 7478 (1997); Dean, Science 273,1856 (1996); Liu, Cell 86, 367 (1996); Paxton, Nature Med. 2, 412 (1996); Samson, Nature 382, 722 (1996)). Изоляты ВИЧ-1, появляющиеся позднее в ходе инфекции, в дополнение к CCR5 часто используют другие хемокиновые рецепторы, чаще всего CXCR4. Изучение химерных оболочечных гликопротеинов показало, что третья переменная (V3) петля gp120 является главным детерминантом использования хемокинового рецептора (см. ссылки, приведенные выше, а также Cocchi, Nature Med. 2, 1244 (1996); Bieniasz, EMBO J. 16, 2599 (1997); Speck, J. Virol. 71, 7136 (1997)). V3-делетированные версии gp120 не связываются с CCR5, хотя и происходит связывание с CD-4 на уровнях дикого типа. Антитела к петле V3 препятствуют gp-120-ССR5-связыванию (Trkola, Nature 384, 184 (1996); Wu, Nature 384, 179 (1996); Lapham, Science 274, 602 (1996); Bandres, J. Virol. 72, 2500 (1998); Hill, Science 71, 6296 (1997)). Эти результаты показывают участие петли V3 в связывании хемокиновых рецепторов.
Латентное состояние ВИЧ устанавливается на самых ранних стадиях инфекции, когда доминируют М-тропные штаммы. Заражение М-тропными штаммами зависит от присутствия CCR5 на целевой клетке. Важность CCR5 как незаменимого корецептора для М-тропного ВИЧ-1 подтверждается тем фактом, что индивидуумы с отсутствием CCR5 из-за гомозиготной делеции 32 пар оснований (дельта 32) являются высокоустойчивыми к ВИЧ-1-инфекции. В отличие от других маркеров, таких как CD4, CD25 или CD45RO, CCR5 присутствует только в определенной подгруппе лимфоцитов и других клеток, подверженных ВИЧ-инфекции (Rottmann (1997) Am J Pathol 151, 1341-1351; Naif (1998) J Virol 72, 830-836; Lee (1999) Proc. Natl. Acad Sci. 96, 5315-5220).
Некоторые подходы к лечению основаны на удалении латентно инфицированных клеток. Одна из стратегий состоит в доведении латентно инфицированных клеток до продуцирования вируса и последующей гибели клеток. В этом контексте одним из способов является введение IL-2 (TNFα, IL-6) в присутствии HAART, пока не исчерпается вирусный источник (Chun (1999) Nat. Med. 5, 651-655; Stellbrink (1999) Abstracts of the 6th Conference on Retroviruses and Opportunistic Infections (Foundations for Retrovirology and Human Health, Alexandria, VA), abstr. 358, p. 135). Предполагается, что эти клетки умирают после активации. Вопрос, может ли быть полностью уничтожен весь пул латентно инфицированных клеток, остается открытым.
Другая стратегия состояла в попытке специфического убивания латентно инфицированных клеток на основе экспрессии gp120 на клеточной поверхности. Были предложены иммунотоксины, узнающие gp120, но они оказались неудачными по двум причинам. Одна конструкция, протестированная на людях, представляла собой протеин, состоящий из растворимых CD4, сцепленных с экзотоксином А Pseudomonas aeroginosa (РЕ). Клинические результаты оказались неутешительными из-за дозоограничивающей гепатотоксичности при отсутствии каких-либо признаков эффективности, и программа была закрыта (Ashorn (1990) Proc. Natl. Acad. Sci. 87, 8889-8893; Berger (1998) Proc. Natl. Acad. Sci. 95, 11511-11513). Вторая причина неудачи состояла в том, что латентно инфицированные клетки не экспрессируют вирусные поверхностные гликопротеины, т.е. gр-120 и gр-41. Таким образом, способы, основанные на узнавании gр-120 или gр-41 для устранения латентно инфицированных клеток, являются неэффективными.
Другие способы устранения латентно инфицированных клеток основаны на устранении целого отдела CD4+ Т-клеток (Berger (1998) Proc. Natl. Acad. Sci. 95, 11511-11513), или СD25-положительного отдела (Bell (1993) Proc. Natl. Acad. Sci. 90, 1411-1415), отдела Т-лимфоцитов CD45RO (McCoig (1999) Proc. Natl. Acad. Sci. 96, 11482-11485). Однако эти маркеры не включают в достаточной мере все потенциально инфицированные клетки. Такие клетки включают, кроме CD4-положительных клеток, или Т-лимфоцитов, также макрофаги и негематопоэтические клетки.
В WO 98/18826 описано антитело, направленное против хемокинового рецептора 5 млекопитающих (например, человека), при этом упомянутое антитело предложено в способе ингибирования взаимодействия клетки, несущей CCR5, с потенциальным лигандом, таким как ВИЧ. Упомянутый способ предложен как ингибирующий ВИЧ-инфекцию. Кроме того, предложены варианты лечения воспалительных заболеваний, аутоиммунных заболеваний и отторжения трансплантата. Все эти варианты лечения основаны на допущении, что специфические антитела, такие как иммуноглобулиновые молекулы или их функциональные части, препятствуют взаимодействиям рецептор-лиганд. Однако способны ли эти антитела уничтожать соответствующие клетки, не выяснено. Кроме того, в WO 98/18826 только сделано предположение, что взаимодействие ВИЧ и рецептора CCR5 будет предотвращено и, следовательно, предотвращена ВИЧ-инфекция.
Лейкоциты, в частности Т-клетки, предположительно являются ключевыми регуляторами иммунного ответа на инфицирующие факторы и являются главными компонентами для инициирования и поддержания воспалительных процессов, таких как кишечные воспалительные заболевания и почечные воспалительные заболевания, воспалительные заболевания суставов, аутоиммунных нарушений, таких как множественный склероз и артрит, заболеваний кожи, таких как псориаз, диабета и отторжения трансплантата.
Поэтому техническая задача изобретения состоит в создании новых средств и способов, которые могут привести к подавлению активированных лейкоцитов, участвующих в иммунологических патологиях, таких как аутоиммунные заболевания, воспалительные процессы и/или вирусные инфекции иммунных клеток.
Соответственно данное изобретение относится к применению конструкции антитела и/или хемокина, которая связывается с хемокиновым рецептором, для получения фармацевтической композиции для устранения клеток, которые латентно инфицированы вирусом иммунодефицита приматов, предпочтительно вирусом иммунодефицита человека, наиболее предпочтительно ВИЧ-1.
В контексте данного изобретения связывание упомянутой конструкции антитела и/или хемокина, которая связывается с хемокиновым рецептором, приводит к уничтожению и/или деструкции целевой клетки, а именно клетки, латентно инфицированной упомянутым вирусом иммунодефицита приматов.
Данное изобретение выявило тот неожиданный факт, что высокоспецифические антитела, направленные против хемокинового рецептора, оказались неспособными разрушать, вызывать лизис и/или истощать клетки, которые экспрессируют упомянутый хемокиновый рецептор. Однако конструкции антител или хемокинов, описанные в данном изобретении, оказались способными специфически взаимодействовать с упомянутыми хемокиновый рецептор-положительными клетками и способными уничтожать упомянутые клетки. Упомянутое уничтожение/деструкция может быть достигнуто, например, за счет привлечения специфических эффекторных клеток, таких как моноциты, макрофаги, Т-клетки (особенно предпочтительными являются цитотоксические Т-клетки) или дендритических клеток. Хотя моноклональные антитела оказались успешными в деструкции/уничтожении злокачественных клеток (см., например, Maloney (1999), Sem. Oncol. 26, 76-78), они не показывают эффективности против определенных подтипов лейкоцитов (включая лимфоциты, полиядерные лейкоциты и моноциты), особенно ССR5-положительных моноцитов, Т-клеток и дендритических клеток, что подтверждается в данном описании и в прилагаемых примерах.
В данном изобретении выражение "конструкция антитела и/или хемокина" (т.е. конструкция антитела и/или конструкция хемокина) включает не только молекулы и многофункциональные конструкции и соединения, описанные здесь, но и их функциональные фрагменты. Функциональные фрагменты упомянутых конструкций представляют собой фрагменты, которые способны связываться или взаимодействовать с хемокиновым рецептором на целевой клетке и обеспечивать средства уничтожения, лизиса и/или разрушения упомянутой целевой клетки.
Специфические хемокиновые рецепторы по данному изобретению включают, но не ограничены, CXCR3, CXCR4, CXCR5, CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, XCR1, CCR10 и CX3CR1. Хемокины и/или хемокиновые лиганды, связывающиеся с упомянутыми хемокиновыми рецепторами, хорошо известны в данной области и показаны, среди прочего, в Табл.4. Кроме того, хемокины и соответствующие рецепторы описаны у Murphy (2000), Pharm. Reviews 52, 145-176. Хемокины, хемокиновые лиганды и/или рецепторы приматов являются предпочтительными, наиболее предпочтительными - человеческие хемокины/лиганды/рецепторы.
Данное изобретение также относится к применению конструкции антитела и/или хемокина, которая связывается с хемокиновым рецептором, для получения фармацевтической композиции для лечения, профилактики и/или облегчения воспалительных заболеваний почек, воспалительных заболеваний кишечника, множественного склероза, заболеваний кожи, аллергических реакций, диабета или отторжения трансплантата.
Упомянутые заболевания кожи включают, среди прочих, псориатические нарушения, атопический дерматит или хроническое воспаление кожи. В PBMCs, полученных от пациентов с псориазом, экспрессия CCR6 апрегулирована. В дополнение к этому лиганд CCR6 (CCL20=MIP3 альфа) и CCR6 апрегулированы в псориатической коже. Кроме того, CCL20-экспрессирующие кератиноциты совместно локализуются с инфильтрирующими кожу Т-клетками (Homey (2000) J. Immunol. 164, 6621-6632). Кроме того, CCR10 был обнаружен на меланоцитах, дермальных фибробластах, дермальных эндотелиальных клетках, Т-клетках и кожных клетках Лангерханса, но не кератиноцитах. Лиганд CCR10 (CCL27) имеет кожно-ассоциированный характер экспрессии (Homey (2000) J. Immunol. 164, 3465-3470; Cnarbonnier (1999) J. Exp. Med. 190, 1755-1768). Далее, CCR4 и его лиганд (TARC, MDC) апрегулированы в хронически воспаленной коже. Кроме того, CCR4 является хоуминг-рецептором для Т-клеток, входящих в кожу. CCR4+ Т-клетки представляют собой лишь небольшую субпопуляцию всех Т-клеток, и поэтому уничтожение CCR4+ Т-клеток показано для различных воспалительных заболеваний кожи (Campbell (1999) Nature 400, 776-780). Экспрессия CCR3 и эндотоксина усилена при атопическом дерматите и может участвовать в инициировании и поддержании воспаления (Yawalkar (1999) J. Invest. Dermatol. 113, 43-48).
Фактически все Т-клетки в тканях ревматоидного артрита, синовиальной жидкости и в различных воспаленных тканях, например при язвенном колите, хроническом вагините и саркоидозе, экспрессируют CXCR3, в то время как в нормальных лимфоузлах меньшее количество Т-клеток являются CXCR3-положительными.
Для множественного склероза было показано, что CCR5 и CXCR3 экспрессируются в большом количестве на Т-клетках, инфильтрирующих демиелинирующие поражения мозга, а также в периферической крови пораженных болезнью пациентов. Соответствующие лиганды М1Р-1α и IP-10 также были обнаружены в тромбоцитах (Balashov (1999) Proc. Natl. Acad Sci. 96, 6873-6878). Удаление Т-клеток заблокировало бы Т-клеточный активатор этого аутоиммунного заболевания.
Иммунохимический анализ экспрессии бета-хемокиновых рецепторов в посмертных тканях ЦНС пациентов с множественным склерозом (МС) показал, что в хронически пораженных МС участках экспрессия CCR2, CCR3 и CCR5 была ассоциирована с пенистыми макрофагами и активированной микроглией, в то время как в контрольной ткани ЦНС микроглиальными клетками экспрессировались низкие уровни этих хемокиновых рецепторов. CCR2 и CCR5 также присутствовали на больших количествах инфильтрирующих лимфоцитов, а в 5 из 14 случаев МС CCR3 и CCR5 также экспрессировались на астроцитах. Повышенная экспрессия CCR2, CCR3 и CCR5 в ЦНС при МС говорит о том, что эти бета-хемокиновые рецепторы и их лиганды играют определенную роль в патогенезе МС (Simpson, J. Neuroimmunol., 2000, 108, 192-200).
Высокая экспрессия CCR3 и CCR5 также была отмечена в лимфоузлах от пациентов с болезнью Ходжкина. В то время как CCR3 был в равной степени распределен в клетках CD4+ и CD8+, CCR5 был главным образом связан с клетками CD4+. Эти данные показывают, что хемокины участвуют в образовании ненеопластических лейкоцитных инфильтратов при болезни Ходжкина (Buri, Blood, 2001,97, 1543-8).
Периодонтальное заболевание представляет собой периферическую инфекцию с участием грам-отрицательных микроорганизмов. У пациентов с умеренным и прогрессирующим заболеванием в воспалительных инфильтратах были обнаружены клетки, экспрессирующие хемокиновый рецептор CCR5 (Gamonal, J. Periopdontal. Res., 2001, 36, 194-203 and Taubman, Crit. Rev. Oral. Biol. Med. 2001, 12, 125-35).
Диабет типа I считается Т-клеточно-опосредованным аутоиммунным заболеванием. Экспрессию рецептора CCR5 в поджелудочной железе связывали с прогрессированием диабета типа I в соответствующих животных моделях (Cameron (2000) J. Immunol. 165, 1102-1110). В частности, экспрессию CCR5 связывали с развитием инсулинита и спонтанного диабета типа I.
В соответствующих животных моделях диабета типа I с миграцией Т-клеток связаны специфические хемокины: RANTES, MCP-1, MCP-5, IP-10. Эти хемокины приводят к иммунному ответу th1 (Bradley (1999) J. Immunol. 162:2511-2520).
Упомянутое выше кишечное воспалительное заболевание может включать болезнь Крона и язвенный колит.
CCR9 экспрессируется на Т-клетках, мигрирующих в кишечник, и может участвовать в болезни Крона и язвенном колите. Все кишечные лимфоциты собственной пластинки (lamina propria) и интраэпителиальные лимфоциты экспрессируют CCR9 (Zabel (1999) J. Exp. Med. 190, 1241-1256).
Кроме того, конструкция антитела и/или хемокина, описанная в данном изобретении, также полезна для предотвращения осложнений во время и/или после трансплантаций, т.е. предотвращения отторжения трансплантата и заболевания "трансплантат против хозяина".
CCR7 экспрессируется на наивных Т-клетках и дендритических клетках и опосредует клеточную миграцию в лимфатические органы. Поэтому устранение CCR7+ клеток будет предотвращать иммунный ответ на новые антигены, например, после трансплантации. Такое лечение будет не иммунодепрессивным в целом, а избирательным для новых антигенов и будет ограничено временем приема лекарственных средств по изобретению, истощающих CCR7+ клетки (Forster (1999) Cell 99, 23-33). CXCR5 экспрессируется на наивных В-клетках в периферической крови и миндалинах, а также в Т-лимфоцитах. Устранение CXCR5+ В-клеток будет предотвращать формирование гуморального ответа. Кроме того, устранение Т-лимфоцитов будет снижать клеточный компонент иммунного ответа (Murphy (2000), Pharmacological Reviews 52, 145-176).
Для создания фармацевтических композиций для лечения аллергий и/или аллергических реакций могут быть использованы конструкции антител и/или хемокинов, описанные здесь. Было показано, что CCR3, который связывается с эндотоксином и RANTES, экспрессируется на эозинофилах, клетках Тh2, мачтовых клетках, базофилах, которые участвуют в аллергических реакциях (Romangnani (1999) Am. J. Pathol. 155, 1195-1204).
Для вышеупомянутых почечных заболеваний было показано, что CCR5-положительные Т-клетки могут играть определенную роль в интерстициальных процессах, ведущих к фиброзу. ССR5-положительные клетки были идентифицированы в интерстициальном инфильтрате различных гломерулярных и интерстициальных заболеваний, а также отторжения трансплантата. Упомянутые заболевания включают острый и хронический нефрит, IgA нефропатию и др. (Segerer (1999), Kidney Int. 56, 52-64).
В модели транзиторного иммунного комплексного гломерулонефрита (IC-GN) CCR1, CCR2 и CCR5 экспрессировались на ранней стадии и уже были даунрегулированы в момент пика протеинурии и инфильтрации лейкоцитов. Экспрессия CCR5 была локализована в гломерулах путем гибридизации in situ и количественной обратной транскрипционной (ОТ) ПЦР изолированных гломерул (Anders, J. Am. Soc. Nephrol., 2001, 12, 919-31). В почках 38 пациентов с несколькими почечными заболеваниями CCR1- и ССR5-положительные макрофаги и Т-клетки были обнаружены как в гломерулах, так и в интерстиции, что было показано иммуногистохимическим анализом. Количество почечных ССR5-положительных клеток резко снизилось во время выздоровления, обусловленного глюкокортикоидами (Furuichi, Am. J. Nephrol., 2000, 20, 291-9).
В предпочтительном варианте осуществления изобретение относится к применению конструкции антитела и/или хемокина, которая связывается с хемокиновым рецептором, для получения фармацевтической композиции, описанной выше, в которой упомянутый хемокиновый рецептор представляет собой хемокиновый рецептор 5 (CCR5). Предпочтительно, чтобы упомянутый CCR5 представлял собой человеческий CCR5.
Хемокиновый рецептор CCR5 является членом большого семейства G-протеин-сцепленных рецепторов с семью трансмембранными доменами, которые связываются с провоспалительными хемокинами RANTES, МIР1-α, МIР1-β и МСР-2. Хемокины действуют согласованно с адгезионными молекулами, индуцируя выброс лейкоцитов и направляя их миграцию к участкам повреждения ткани.
CCR5 экспрессируется на незначительной части Т-клеток и моноцитов и является основным корецептором для М-тропных штаммов ВИЧ-1, которые преобладают на ранней стадии ВИЧ-инфекции.
Таким образом, фармацевтическая композиция, описанная выше, особенно полезна для уничтожения CCR5+ лейкоцитов и могла бы быть полезной для удаления клеток, латентно инфицированных ВИЧ-1. Поэтому уничтожение CCR5+клеток должно снижать количество клеток, латентно инфицированных ВИЧ, и должно быть особенно полезно для в комбинации с активной антивирусной, предпочтительно антиретровирусной терапией.
В особенно предпочтительном варианте осуществления изобретения упомянутая конструкция антитела, которая связывается с хемокиновым рецептором, предпочтительно CCR5, в качестве первого антигена, и с антигеном CD3 эффекторной клетки в качестве второго антигена. Предпочтительно, упомянутый антиген CD3 находится на поверхности Т-клетки, предпочтительно цитотоксической Т-клетки. Поэтому упомянутый CD3 обозначает антиген, который экспрессируется на вышеупомянутых клетках и может быть частью многомолекулярного (Т-)клеточного рецепторного комплекса.
Биспецифические антитела могут быть сконструированы путем гибрид-гибридомных технологий, путем ковалентного связывания специфических антител или другими способами, например, на основе диатела (Kipriyanow, Int. J. Cancer 77 (1998), 763-773).
Предпочтительно, упомянутое биспецифическое антитело представляет собой конструкцию одноцепочечного антитела.
Хорошо известно, что Fv, минимальный фрагмент антитела, который содержит полный сайт узнавания и связывания антигена, состоит из димера из одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи (VH и VL) в нековалентной связи. В этой конфигурации, которая соответствует конфигурации, обнаруживаемой в нативных антителах, три определяющих комплементарность области (CDRs) каждого вариабельного домена взаимодействуют друг с другом, определяя сайт связывания антигена на поверхности VH-VL-димера. Эти шесть CDRs вместе придают антителу специфичность связывания с антигеном. Каркасные области (FRs), фланкирующие CDRs, имеют третичную структуру, которая по существу законсервирована в нативных иммуноглобулинах таких отличающихся видов, как человек и мышь. Эти FRs служат для поддержания CDRs в свойственной им ориентации. Константные домены не требуются для функции связывания, но могут способствовать стабилизации взаимодействия VH-VL. Даже один вариабельный домен (или половина Fv, содержащая только три CDRs, специфические к антигену), обладает способностью узнавать и связывать антиген, хотя обычно с более низкой аффинностью, чем целый сайт связывания (Painter, Biochem. 11 (1972), 1327-1337). Таким образом, упомянутым доменом сайта связывания конструкции антитела, определенной и описанной в данном изобретении, может быть пара доменов VH-VL, VH-VH, или VL-VL. различных иммуноглобулинов. Порядок доменов VH и VL внутри полипептидной цепи не имеет решающего значения в данном изобретении, и порядок доменов, приведенный выше, обычно может быть изменен без потери функции. Однако важно, чтобы домены VH и VL были расположены таким образом, чтобы сайт связывания антигена мог изгибаться нужным образом.
Различные части антител/иммуноглобулинов могут быть соединены посредством обычных способов или сконструированы в виде смежных протеинов посредством рекомбинантных ДНК-технологий, например таким образом, чтобы экспрессировалась молекула нуклеиновой кислоты, кодирующая цепь химерного или гуманизированного антитела, чтобы сконструировать смежный протеин (ср., например, Mack et al. (1995) Proc. Natl. Acad. Sci. USA, Vol.92, pp.7021-7025).
Предпочтительным является одноцепочечное антитело со следующими фрагментами Fv: фрагмент sc-Fv моноклонального антитела против хемокинового рецептора, предпочтительно против CCR5, и фрагмент sc-Fv моноклонального антитела против CD3. В этом случае оба фрагмента Fv направлены против хемокинового рецептора, и фрагмент Fv против CD3 может быть расположен в N-концевом положении. Порядок доменов антитела VL и VH может быть переменным в обеих конструкциях, предпочтителен порядок фрагмента Fv против CCR5 VL-VH, а порядок фрагмента Fv против CD3 - VH-VL. Линкеры между вариабельными доменами, а также между двумя фрагментами Fv могут состоять из пептидных линкеров, предпочтительно из гидрофильного гибкого глицин- и серин-содержащего линкера, содержащего 1-25 аминокислот. Дополнительная гистидиновая цепь, например, из 6 × His, в С- или N-концевом положении, может использоваться для упрощения очистки и обнаружения конструкции.
По сравнению с обычными биспецифическими антителами биспецифические одноцепочечные антитела имеют то преимущество, что они состоят только из одной протеиновой цепи и, таким образом, их состав является точно определенным. Они имеют низкий молекулярный вес, обычно <60 кДа, и могут легко вырабатываться в промышленном масштабе в подходящих клеточных линиях, например, в СНО-клетках, с использованием рекомбинантных технологий. Однако наиболее существенное преимущество состоит в том, что они не имеют константных доменов антитела и, таким образом, только активируют лизис Т-лимфоцитов, когда связываются с соответствующими целевыми клетками, т.е. с клетками, экспрессирующими хемокиновый рецептор. Поэтому одноцепочечные антитела часто более предпочтительны перед обычными биспецифическими антителами, поскольку их клиническое использование влечет за собой меньшее количество или менее тяжелые побочные эффекты.
Было обнаружено, что МС-1 специфически связывается с первой частью второй внеклеточной петли человеческого CCR5 и не дает перекрестного взаимодействия с CCR5, взятым от макака резус, как показано в прилагаемых примерах. Поэтому предпочтительно, чтобы конструкция упомянутого одноцепочечного антитела включала домены VL и VH антитела, специфического к хемокиновому рецептору, предпочтительно человеческому CCR5, и домены VL и VH антитела, специфического к антигену CD3. Упомянутым антителом, специфическим к человеческому CCR5, является антитело мыши к человеческому CCR5 МС-1, описанное, среди прочих, у Mack (1998), J. Exp. Med. 187, 1215-1224 и в прилагаемых примерах. Однако подразумевается также, что другие α-CCR5 антитела, такие как МС-5 (описанное в прилагаемых примерах и у Segerer (1999), loc. cit), могут быть использованы в данном изобретении. Антитело, специфическое к антигену CD3, может быть выбрано из группы, включающей антитела, узнающие гамма-, дельта-, эпсилон-, дзета-цепи, где особенно предпочтительными являются антитела, узнающие эпсилон-цепь и СD3-дзета-цепь (Jakobs (1997) Cancer Immunol Immunother. 44, 257-264; Mezzanzanica (1991) Cancer Res 51, 5716-5721). Примеры антител против эпсилон-цепи включают ОКТ-3 (WO 91/09968, Kung et al., Science 206, 347-349 (1979); Van Wauwe, J. Immunol. 124, 2708-2713 (1980); Transy, Eur. J. Immunol. 19, 947-950 (1989); Woodle, J. Immunol. 148, 2756-2763 (1992); Ada, Human. Antibod. Hybridomas, 41-47 (1994)) и TR66 (Traunecker (1991) EMBO J. 10, 3655-3659). Примеры моноклональных антител против СD3-дзета-цепи включают H2D9, TIA2 (оба от Becton Dickinson), G3 (Seroteck Ltd.).
В наиболее предпочтительном варианте использования данного изобретения домены VL и VH одноцепочечного антитела, описанные выше, расположены в порядке VL(MC-1)-VH(МС-1)-VH(CD3)-VL(CD3), где наиболее предпочтительно vH(MC-1) включает аминокислотную последовательность, показанную в SEQ ID NO: 12, где упомянутый VH(МС-1) включает аминокислотную последовательность, показанную в SEQ ID NO: 16, где упомянутый VH(CD3) включает аминокислотную последовательность, показанную в SEQ ID NO: 26 и/или где упомянутый VL(CD3) включает аминокислотную последовательность, показанную в SEQ ID NO: 28. Специфические части CDR антитела МС-1 показаны в SEQ ID NO: 29-34, где SEQ ID NO: 29 показывает CDR1 vl MC-1, SEQ ID NO: 30 показывает CDR2 vl MC-1, SEQ ID NO: 31 показывает CDR3 vl MC-1, SEQ ID NO: 32 показывает CDR1 vh MC-1, SEQ ID NO: 33 показывает CDR2 vh MC-1 и SEQ ID NO: 34 показывает CDR3 vh MC-1.
Упомянутое биспецифическое антитело может, кроме прочего, включать аминокислотную последовательность, кодируемую последовательностью нуклеиновой кислоты, показанной в SEQ ID NO: 17 или включает аминокислотную последовательность, показанную в SEQ ID NO: 18.
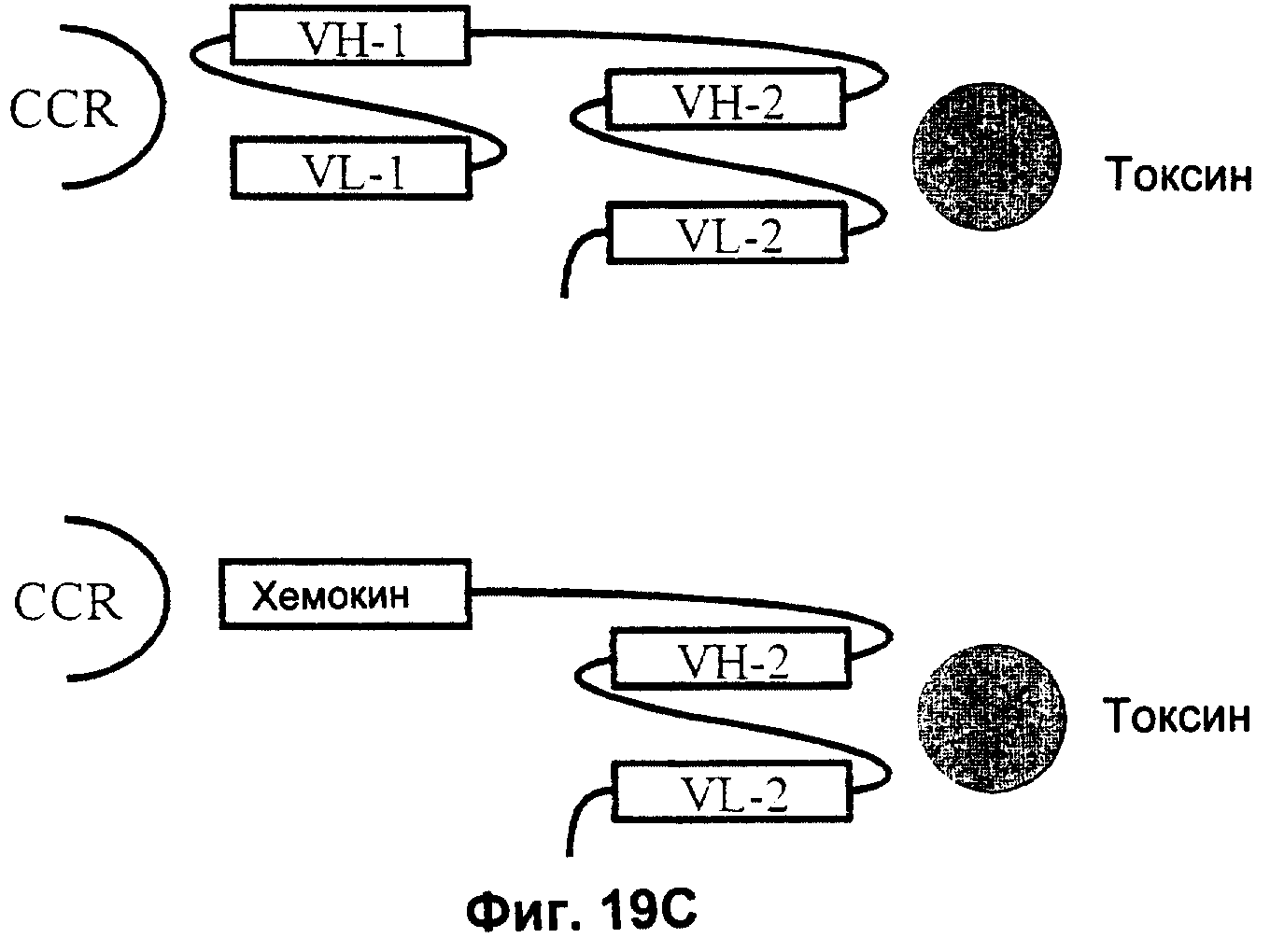
В другом варианте использования данного изобретения конструкция антитела представляет собой биспецифическое антитело, которое связывается с упомянутым хемокиновым рецептором в качестве первого антигена и с токсином в качестве второго антигена. Это антитело может быть ковалентно связано с упомянутым токсином, и упомянутая конструкция антитело-токсин может быть сконструирована путем химического присоединения, выработки слитого протеина или мозаичного протеина из упомянутого антитела и из модифицированного или немодифицированного прокариотического или эукариотического токсина. Кроме того, упомянутое антитело может быть соединено с упомянутым токсином через дополнительные мультимеризационные домены.
В следующем варианте использования данного изобретения упомянутая конструкция антитела может быть связана через мультимеризационный домен in vitro и/или in vivo со второй конструкцией антитела, которая связывается с антигеном CD3 и/или токсином. Упомянутый мультимеризационный домен может быть получен, например, путем гетеро(ди)меризации. Например, может быть использована гетеро(ди)меризационная область константных иммуноглобулиновых доменов. Другие мульти- и/или гетеро(ди)меризационные домены также известны в данной области и основаны на лейциновых зипперах, α- и β-цепях Т-клеточных рецепторов или молекулах МНС класса II. Кроме того, могут быть использованы jun- и fos-домены (de Kuif (1996) J. Biol Chem. 271, 7630-7634; Kostelny (1992), J. Immunol 148, 1547-1553). Дополнительные примеры мультимеризационных доменов включают р53- и MNT-домены, описанные в Sakamoto (1994) Proc. Natl. Acad Sci. USA 91, 8974-8978; Lee (1994) Nat. Struct. Biol. 1, 877-890; Jeffrey (1995) Science 267, 1498-5102 или Nooren (1999) Nat. Struct. Biol. 6, 755-759).
В следующем варианте осуществления изобретения вышеупомянутая хемокиновая конструкция представляет собой слитую конструкцию модифицированного или немодифицированного хемокина с модифицированным или немодифицированным токсином. Упомянутая конструкция может быть связана через мультимеризационный домен in vitro и/или in vivo с конструкцией антитела, которая связывается с антигеном CD3 и/или токсином. Пригодные мультимеризационные домены описаны в литературе и упоминались выше. Хемокин-токсиновые конструкции могут быть получены, например, путем химического присоединения, путем рекомбинантной технологии (как показано в прилагаемых примерах), или могут быть получены в виде слитого протеина из хемокина и модифицированного или немодифицированного прокариотического или эукариотического токсина. Наиболее предпочтительно, чтобы упомянутый хемокин связывался с человеческим хемокиновым рецептором CCR5 и включал, среди прочих, RANTES, МIР1-α, МIР1-β, МСР-2, МСР-3 или их фрагменты, способные связываться с упомянутым рецептором. Предпочтительным токсином может быть усеченная версия экзотоксина Pseudomonas, например РЕ38, РЕ40 или РЕ37. Наиболее предпочтителен в данном изобретении РЕ38.
Кроме того, по данному изобретению упомянутая хемокиновая конструкция может содержать хемокин, ковалентно связанный с конструкцией антитела, которая связывается с конструкцией антитела, способной связываться с антигеном CD3 и/или которая ковалентно связана с токсином.
В наиболее предпочтительном варианте использования данного изобретения конструкция антитела и/или хемокина представляет собой конструкцию гетероминитела, содержащую по меньшей мере антитело и/или хемокин, который связывается с хемокиновым рецептором, предпочтительно с рецептором CCR5, наиболее предпочтительно с человеческим рецептором CCR5. Упомянутая конструкция гетероминитела может включать по меньшей мере один токсин, и наиболее предпочтительно, чтобы упомянутая конструкция гетероминитела связывалась с хемокиновым рецептором, определенным выше и/или с антигеном CD3 эффекторной клетки. Предпочтительные хемокины включают хемокины, упомянутые выше, а предпочтительные токсины включают токсины, описанные выше, которые могут быть модифицированными или немодифицированными. Хемокины хорошо известны и описаны в данной области, например, у Murphy (1999), loc. cit. Поэтому предпочтительно, чтобы хемокин был выбран из группы, включающей RANTES, МIР1-α, МIР1-β, МСР-2 и МСР-3 или их функциональные фрагменты. Наиболее предпочтительным хемокином в данном изобретении является RANTES. Функциональными фрагментами упомянутых хемокинов являются такие фрагменты, которые способны связываться или взаимодействовать с упомянутым хемокиновым рецептором, предпочтительно, человеческим CCR5. Гетероминитела известны в данной области, и их получение описано, например, в WO 00/06605. Упомянутое гетероминитело может представлять собой многофункциональное соединение, содержащее по меньшей мере одно антитело и/или хемокин, связывающийся или взаимодействующий с хемокиновым рецептором, предпочтительно человеческим CCR5, и (дополнительно) может содержать токсин, как описано ниже, и/или сайт связывания с антигеном CD3.
В предпочтительном варианте осуществления конструкция антитела или хемокина для использования в данном изобретении представляет собой слитый (поли)пептид или мозаичный (поли)пептид. Упомянутый слитый (поли)пептид может включать лишь домены описанных выше конструкций, а также их функциональные фрагменты. Однако подразумевается также, что упомянутый слитый (поли)пептид может включать дополнительные домены и/или функциональные отрезки. Поэтому упомянутый слитый (поли)пептид может включать по меньшей мере один дополнительный домен, где упомянутый домен присоединен ковалентными или нековалентными связями. Образование связей и построение таких конструкций может быть основано на генетическом слиянии в соответствии с методами, известными в данной области (Sambrook et al., loc. cit, Ausubel, "Current Protocols in Molecular Biology", Green Publishing Assosiates and Wiley Interscience, N.Y. (1989)) или может выполняться, например, путем химической сшивки, как описано в WO 94/04686. Дополнительный домен, присутствующий в конструкции, предпочтительно может быть присоединен гибким линкером, преимущественно (поли)пептидным линкером, где упомянутый (поли)пептидный линкер предпочтительно включает гидрофильные аминокислотные цепочки с пептидными связями, имеющие длину, достаточную для покрытия расстояния между С-окончанием упомянутого дополнительного домена и N-окончанием пептида, (поли)пептида или антитела или наоборот. Упомянутый линкер может представлять собой, например, глициновый, сериновый и/или глицин/сериновый линкер. Дополнительные линкеры включают олигомеризационные домены. Олигомеризационные домены облегчают комбинирование двух или нескольких автоантигенов или их фрагментов в одной функциональной молекуле. Неограничивающие примеры олигомеризационных доменов включают лейциновые зипперы (такие как jun-fos, GCN4, Е/ЕВР; Kostelny, J. Immunol 148 (1992), 1547-1553; Zeng, Proc. Natl. Acad. Sci. USA 94 (1997), 3673-3678, Williams, Genes Dev. 5 (1991), 1553-1563; Suter, "Phage Display of Peptides and Proteins", Chapter 11, (1996), Academic Press), олигомеризационные домены из антител, такие как константные домены СН1 и CL (Mueller, FEBS Letters 422 (1998), 259-264) и/или тетрамеризационные домены, например GCN4-LI (Zerangue, Proc. Natl. Acad. Sd. USA 97 (2000), 3591-3595).
Кроме того, конструкция антитела или хемокина для использования в данном изобретении может содержать по меньшей мере один дополнительный домен, например домены, обеспечивающие средства очистки, в частности, гистидиновые отрезки. Упомянутый дополнительный домен(ы) может быть присоединен ковалентными или нековалентными связями.
Присоединение может быть основано на генетическом слиянии в соответствии со способами, известными в данной области и описанными здесь, или может выполняться, например, путем химической сшивки, как описано, в частности, в WO 94/04686. Дополнительный домен, присутствующий в конструкции, представленной в изобретении, предпочтительно может быть присоединен гибким линкером, преимущественно полипептидным линкером, к одному из доменов сайта связывания, при этом упомянутый полипептидный линкер включает гидрофильные аминокислотные цепочки с пептидными связями, имеющие длину, достаточную для покрытия расстояния между С-окончанием одного из упомянутых доменов и N-окончанием другого из упомянутых доменов, при этом упомянутый полипептид в водном растворе принимает конформацию, удобную для связывания. Предпочтительно, упомянутый полипептидный линкер представляет собой полипептидный линкер, определенный в вышеописанных вариантах осуществления. Полипептид по изобретению может дополнительно содержать расщепляемый линкер или сайт расщепления для протеиназ, таких как энтерокиназа.
Подразумевается также, что упомянутые конструкции для вариантов использования, композиций и способов по данному изобретению включают дополнительный домен(ы), который может функционировать как иммуномодулятор. Упомянутые иммуномодуляторы включают, но не ограничены, цитокины, лимфокины, Т-клеточные костимуляторные лиганды и т.д.
Достаточная активация, приводящая к примированию наивных Т-клеток, является критическим фактором для первичных иммунных ответов и зависит от двух сигналов, полученных от профессиональных APCs (антиген-презентующих клеток), таких как дендритические клетки. Первый сигнал является антиген-специфическим и обычно опосредован стимуляцией клонотипического Т-клеточного антигенного рецептора, которая индуцируется обработанным антигеном, представленным в окружении молекул МНС класса I или МНС класса II. Однако этого первичного стимула недостаточно для индуцирования примирующих ответов наивных Т-клеток, и требуется второй сигнал, который обеспечивается за счет взаимодействия специфических Т-клеточных поверхностных молекул, связывающихся с костимуляторными молекулами-лигандами на антиген-презентующих клетках, дополнительно поддерживающих пролиферацию примированных Т-клеток. Поэтому выражение "Т-клеточные костимуляторные лиганды" в свете данного изобретения означает молекулы, которые способны поддерживать примирование наивных Т-клеток в сочетании с первичным стимулом и которые включают, но не ограничены, членов семейства протеинов В7, в том числе В7-1 (CD80) и В7-2 (CD86).
Конструкция антитела и/или хемокина, определенная выше или описанная ниже, может включать дополнительную функцию(функции) рецептора или лиганда и может включать иммуномодулирующую эффекторную молекулу или ее фрагмент. Иммуномодулирующая эффекторная молекула положительно и/или отрицательно влияет на гуморальную и/или клеточную иммунную систему, особенно на ее клеточные и/или неклеточные компоненты, ее функции и/или ее взаимодействия с другими физиологическими системами. Упомянутая иммуномодулирующая эффекторная молекула может быть выбрана из группы, включающей цитокины, хемокины, ингибиторный фактор миграции макрофагов (MIF; описан, среди прочих, в Bernhagen (1998), Mol Med 76(3-4); 151-61 или Metz (1997), Adv Immunol 66, 197-223), Т-клеточные рецепторы и растворимые молекулы МНС. Такие иммуномодулирующие эффекторные молекулы хорошо известны в данной области и описаны, среди прочих, у Paul "Fundamental immunology", Raven Press, New York (1989). В частности, известные цитокины и хемокины описаны у Meager, "The Molecular Biology of Cytokines" (1998), John Wiley & Sons, Ltd., Chichester, West Sussex, England; (Bacon (1998). Cytokine Growth Factor Rev 9(2): 167-73; Oppenheim (1997). Clin Cancer Res 12, 2682-6; Taub, (1994) Ther. Immunol. 1(4), 229-46 или Michel, (1992). Semin Cancer Biol 3(1), 3-15).
Конструкции антител и/или хемокинов, описанные в данном изобретении и содержащие дополнительный функциональный домен(ы), могут быть, например, многофункциональными соединениями, такими как гетероминитела, описанные ниже.
Конструкции, предназначенные для использования в данном изобретении или описанные здесь, могут представлять собой конструкции, которые включают домены, имеющие происхождение от одного вида, предпочтительно от млекопитающих, более предпочтительно от человека. Однако химерные и/или гуманизированные конструкции также подразумеваются и входят в область данного изобретения.
В наиболее предпочтительном варианте осуществления композиция по изобретению включает конструкции, предназначенные для использования в данном изобретении или описанные здесь, которые представляют собой сшитую (поли)пептидную конструкцию. Как указано выше, упомянутая сшивка может осуществляться способами, известными в данной области, которые включают рекомбинантные и биохимические способы.
В следующем варианте использования данного изобретения конструкция антитела или конструкция хемокина включает по меньшей мере один токсин. Упомянутый токсин может представлять собой экзотоксин A Pseudomonas, токсин дифтерии и подобные токсины. Подразумевается также использование усеченных токсинов, таких как РЕ38 или РЕ40 токсина Pseudomonas, описанных в прилагаемых примерах.
Упомянутый токсин может быть связан с упомянутым антителом или хемокином способами, описанными выше. Также подразумевается, что упомянутый токсин может быть связан с антителом/хемокином посредством короткого пептидного линкера. Линкер предпочтительно состоит из гибкой и гидрофильной аминокислотной последовательности, в частности из глицинов и серинов. Предпочтительно упомянутый линкер имеет длину от 1 до 20 аминокислот.
До настоящего времени было сконструировано несколько слитых протеинов с экзотоксином A Pseudomonas. Большинство из них используются для узнавания и разрушения злокачественных клеток. Этот токсин активируется после протеолитического расщепления. Для конструкций по данному изобретению может быть использована усеченная версия токсина (РЕ38), так как полный протеин связывается с его первым доменом к повсеместно распространенному α2-макроглобулиновому рецептору и поэтому токсичен для большинства эукариотических клеток. Эта проблема может быть еще решена путем замены первого домена экзотоксина A Pseudomonas специфической последовательностью, изменяющей специфичность связывания токсина.
Кроме того, данное изобретение относится к применению конструкции хемокина, которая связывается с хемокиновым рецептором, для получения фармацевтической композиции для устранения клеток, которые латентноинфицированы вирусом иммунодефицита приматов, при этом упомянутая конструкция хемокина включает аминокислотную последовательность, показанную в SEQ ID NO: 24, или кодируемую нуклеотидной последовательностью, показанной в SEQ ID NO: 23.
Как указано выше, в предпочтительном варианте осуществления конструкции антител и/или хемокинов, предназначенные для использования в рамках изобретения, связываются или взаимодействуют с антигеном CD3. Предпочтительно упомянутый антиген CD3 находится на поверхности эффекторной клетки, а именно, Т-клетки, предпочтительно цитотоксической Т-клетки.
Наиболее предпочтительно использование конструкции антитела, в котором упомянутая конструкция включает сайт связывания с CCR5 и сайт связывания с CD3, и использование конструкции хемокина, в котором упомянутая конструкция включает RANTES, а упомянутый токсин представляет собой усеченный экзотоксин A Pseudomonas (РЕ38).
Таким образом, данное изобретение также относится к конструкциям антител, содержащим сайт связывания с CCR5 и сайт связывания с CD3, а также конструкции хемокинов, содержащим RANTES и усеченный экзотоксин А Pseudomonas (PE38).
Данное изобретение также относится к полинуклеотиду, кодирующему конструкцию антитела, определенную выше, или к полинуклеотиду, кодирующему конструкцию хемокина, определенную выше, при этом упомянутый полинуклеотид представляет собой полинуклеотид, включающий молекулу нуклеиновой кислоты, в частности кодирующую полинуклеид, показанный в SEQ ID NO: 18 или SEQ ID NO: 24; полинуклеотид, включающий молекулу нуклеиновой кислоты, показанную в SEQ ID NO: 17 или SEQ ID NO: 23; или (с) полинуклеотид, гибридизирующийся в строгих условиях с комплементарной нитью полинуклеотида (а) или (b).
В отношении полинуклеотидных/нуклеотидных последовательностей, определяемых пунктом (с), выражение "гибридизирующийся" в этом контексте следует относить к обычным условиям гибридизации, предпочтительно таким как гибридизация в 50% формамиде/6×SSC (хлорид натрия/цитрат натрия)/0,1% SDS (додецилсульфат натрия) и 100 мкг/мл ssDNA, при температурах гибридизации выше 37°С и температурах промывки в 0,1×SSC/0,1% SDS выше 55°С. Наиболее предпочтительно выражение "гибридизирующийся" относится к строгим условиям гибридизации, например, таким, которые описаны в Sambrook, "Molecular Cloning: A Laboratory Manual", Cold Spring Harbor Laboratory Press (1989), Cold Spring Harbor, N.Y., 1989. Подразумевается, что полинуклеотиды, определяемые пунктом (с), высокогомологичны полинуклеотидам, определяемым пунктом (а) и/или (b), при гомологичности по меньшей мере 95%, более предпочтительно по меньшей мере 97% и наиболее предпочтительно - 99% гомологичности с полинуклеотидами (а) и/или (b).
Таким образом, полинуклеотиды, определяемые пунктом (с), могут кодировать полипептиды, высокогомологичные полипептидам, определяемым пунктом (а) и/или (b). Опытный специалист в данной области может легко протестировать способность таких гомологичных полипептидов связываться с хемокиновыми рецепторами, в частности, с человеческим рецептором CCR5 и/или удалять, истощать и/или разрушать клетки, например клетки, инфицированные вирусом иммунодефицита приматов, таким как ВИЧ-1, или удалять, истощать и/или разрушать целевые клетки, участвующие в иммунологических нарушениях или описанные здесь. Опытный специалист в данной области может легко освоить in vitro, in vivo и ex vivo эксперименты, описанные в прилагаемых примерах, чтобы проверить связывающие и/или истощающие свойства таких конструкций.
Кроме того, упомянутая молекула полинуклеотида/нуклеиновой кислоты может содержать, например, тиоэфирные связи и/или нуклеотидные аналоги. Такие модификации могут быть полезны для стабилизации молекулы нуклеиновой кислоты против эндо- и экзонуклеаз в клетке. Упомянутые молекулы нуклеиновых кислот могут транскрибироваться соответствующим вектором, содержащим химерный ген, который обеспечивает возможность транскрипции упомянутой молекулы нуклеиновой кислоты в клетке. Молекула полинуклеотида/нуклеиновой кислоты композиции по данному изобретению может быть химерной молекулой нуклеиновой кислоты, полученной путем рекомбинантной технологии и содержащей любую из вышеупомянутых молекул нуклеиновых кислот, индивидуальную или в комбинации.
Упомянутым полинуклеотидом может быть, например, ДНК, кДНК, РНК или синтетическая ДНК или РНК, или рекомбинантная химерная молекула нуклеиновой кислоты, содержащая любой из этих полинуклеотидов, индивидуальный или в комбинации. Предпочтительно упомянутый полинуклеотид представляет собой часть вектора. Такие векторы могут содержать дополнительные гены, такие как маркерные гены, обеспечивающие возможность селекции упомянутого вектора в подходящей клетке-хозяине в соответствующих условиях. Предпочтительно полинуклеотид по изобретению оперативно связан с последовательностями для контроля экспрессии, которые обеспечивают возможность экспрессии в прокариотических или эукариотических клетках. Экспрессия упомянутого полинуклеотида включает транскрипцию полинуклеотида в транслируемую мРНК. Регуляторные элементы, обеспечивающие экспрессию в эукариотических клетках, предпочтительно клетках млекопитающих, хорошо известны специалистам. Обычно они включают регуляторные последовательности, обеспечивающие инициирование транскрипции и, возможно, поли-А-сигналы, обеспечивающие терминирование транскрипции и стабилизацию транскрипта. Дополнительные регуляторные элементы могут включать транскрипционные, а также трансляционные энхансеры и/или природно-ассоциированные или гетерологичные промоторные области. Возможные регуляторные элементы, разрешающие экспрессию в прокариотических клетках-хозяевах, включают, например, промотор PL, lac, trp или tac в Е.coli, a примеры регуляторных элементов, разрешающих экспрессию в эукариотических клетках-хозяевах, включают промотор АОХ1 или GAL1 в дрожжах или CMV-, SV40-, RSV-промотор (вирус Rous sarcoma), CMV-энхансер, SV40-энхансер или глобининтрон в клетках млекопитающих или других животных. Кроме элементов, ответственных за инициирование транскрипции, такие регуляторные элементы могут также включать сигналы терминирования транскрипции, такие как SV40-поли-А-сайт или tk-поли-А-сайт, ниже от полинуклеотида. Кроме того, в зависимости от используемой системы экспрессии в кодирующую последовательность полинуклеотида по изобретению могут добавляться лидерные последовательности, способные направлять полипептид в определенный клеточный отдел или секретирующие его в среду, и хорошо известные в данной области; см. также прилагаемые примеры. Лидерную последовательность (последовательности) собирают в соответствующей фазе вместе с трансляционной, инициирующей и терминирующей последовательностями, и предпочтительно лидерной последовательностью, способной направлять секрецию транслируемого протеина, или его части, в периплазматическое пространство или внеклеточную среду. Как вариант, гетерологичная последовательность может кодировать слитый протеин, включающий N-концевой идентификационный пептид, придающий желаемые характеристики, например, стабилизацию или упрощенную очистку экспрессируемого рекомбинантного продукта; см. выше. Пригодные в этом отношении векторы экспрессии известны в данной области и включают, например, вектор экспрессии кДНК Окаяма-Берга, вектор pcDV1 (Pharmacia), pCDM8, pRc/CMV, pcDNAI, pcDNAS (Invitrogene) или pSPORT1 (GIBCO BRL).
Предпочтительно последовательности для контроля экспрессии представляют собой эукариотические промоторные системы в векторах, способных к трансформации или трансфекции эукариотических клеток-хозяев, но могут быть также использованы и контрольные последовательности для прокариотических хозяев. После того как вектор был встроен в соответствующего хозяина, хозяина поддерживают в условиях, пригодных для высокого уровня экспрессии нуклеотидных последовательностей, а затем, если это желательно, может быть произведен сбор и очистка полипептида по изобретению; см. прилагаемые примеры.
Как указано выше, полинуклеотид по изобретению может быть использован индивидуально или как часть вектора для экспрессии конструкции антитела и/или хемокина, предназначенной для использования по изобретению или в клетках, например, для лечения иммунологических нарушений или в антивирусной терапии. Полинуклеотиды или векторы, содержащие ДНК-последовательность (последовательности), кодирующую любой из вышеописанных полипептидов, вводят в клетки, которые, в свою очередь, продуцируют полипептид, представляющий интерес. Поэтому упомянутые полинуклеотиды и векторы могут быть использованы для генной терапии. Генная терапия, которая основана на введении терапевтических генов в клетки путем ex-vivo или in-vivo технологий, является одним из наиболее важных применений генного переноса. Подходящие векторы, способы доставки генов для in-vitro или in-vivo генной терапии описаны в литературе и известны специалистам; см., например, Giordano, Nature Medicine 2 (1996), 534-539; Schaper, Circ. Res. 79 (1996), 911-919; Anderson, Science 256 (1992), 808-813, Verma, Nature 389 (1994), 239; Isner, Lancet 348 (1996), 370-374; Muhlhauser, Circ. Res. 77 (1995), 1077-1086; Onodera, Blood 91 (1998), 30-36; Verma, Gene Ther. 5 (1998), 692-699; Nabel, Ann. N.Y. Acad. Sci. 811 (1997), 289-292; Verzeletti, Hum. Gene Ther. 9 (1998), 2243-51; Wang, Nature Medicine 2 (1996), 714-716; WO 94/29469; WO 97/00957; US 5,580,859; US 5,589,466 или Schaper, Current Opinion in Biotechnology 7 (1996), 635-640, и ссылки, приведенные там. Могут быть сконструированы полинуклеотиды и векторы по изобретению для прямого введения в клетку или для введения через липосомы или вирусные векторы (например, аденовирусные, ретровирусные). Предпочтительно упомянутая клетка представляет собой germ-line клетку, эмбриональную клетку или яйцеклетку или их производные; наиболее предпочтительно упомянутая клетка представляет собой стволовую клетку. Примером эмбриональной стволовой клетки может служить стволовая клетка, описанная у Nagy, Proc. Natl. Acad. Sci. USA 90 (1993), 8424-8428.
В соответствии с вышеизложенным, данное изобретение относится к векторам, в частности плазмидам, космидам, вирусам и бактериофагам, традиционно используемым в генной инженерии, которые включают полинуклеотид, кодирующий полипептид по изобретению. Предпочтительно упомянутый вектор представляет собой вектор экспрессии и/или вектор генного переноса или таргетинг-вектор. Векторы экспрессии, полученные из вирусов, таких как ретровирусы, вирус коровьей оспы, адено-ассоциированные вирусы, вирус герпеса или вирус бычьей папилломы, могут быть использованы для доставки полинуклеотидов или вектора по изобретению в целевые популяции клеток. Для конструирования рекомбинантных векторов могут быть использованы способы, хорошо известные специалистам; см., например, технологии, описанные в Sambrook, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory (1989) N.Y. и Ausubel, Current Protocols in Molecular Biology, Green Publishing Assosiates and Wiley Interscience, N.Y. (1989). В альтернативе полинуклеотиды и векторы по изобретению могут быть реконструированы в липосомы для доставки в целевые клетки. Векторы, содержащие полинуклеотиды по изобретению, могут быть перенесены в клетку-хозяина хорошо известными способами, которые выбираются в зависимости от типа клеточного хозяина. Например, кальциево-хлоридную трансфекцию обычно используют для прокариотических клеток, а кальциево-фосфатную обработку или электропорацию можно использовать для других клеточных хозяев; см. Sambrook, выше. После экспрессии полипептиды по данному изобретению могут быть очищены в соответствии со стандартными методиками, включая осаждение сульфатом аммония, аффинные колонки, колоночную хроматографию, гель-электрофорез и т.п.; см. Scopes, "Protein Purification", Springer-Verlag, N.Y. (1982). Для фармацевтического использования предпочтительны по существу чистые полипептиды с гомогенностью по меньшей мере 90-95%, наиболее предпочтительна гомогенность 98-99% или более. После очистки, частичной или до требуемой гомогенности, полипептиды могут быть использованы в лечебных целях (включая экстракорпоральное использование) или для разработки и выполнения аналитических методик.
В следующем варианте осуществления данное изобретение относится к клетке, содержащей полинуклеотид или вектор, описанный выше, или к хозяину, трансформированному вектором по изобретению. Предпочтительно упомянутый хозяин/клетка представляет собой эукариотическую клетку, наиболее предпочтительно клетку млекопитающего, если предусмотрено терапевтическое использование полипептида. Конечно, дрожжевые и менее предпочтительные прокариотические, например, бактериальные клетки также могут использоваться, в частности, если продуцируемый полипептид используется в качестве диагностического средства.
Полинуклеотид или вектор по изобретению, который присутствует в клетке-хозяине, может быть встроен в геном клетки-хозяина или может поддерживаться экстрахромосомно.
Выражение "прокариотический" включает все бактерии, которые могут быть трансформированы или трансфектированы молекулами ДНК или РНК для экспрессии полипептида по изобретению. Прокариотические хозяева могут включать грам-отрицательные и грам-положительные бактерии, такие как Е.coli, S.typhimurium, Serratia marcescens и Bacillus subtilis. Выражение "эукариотический" включает клетки дрожжей, высших растений, насекомых и предпочтительно млекопитающих. В зависимости от хозяина, используемого в рекомбинантном производстве, полипептиды по данному изобретению могут быть гликозилированными или негликозилированными. Полипептиды по данному изобретению могут также включать исходные метиониновые аминокислотные остатки. Полинуклеотид, кодирующий полипептид по изобретению, может быть использован для трансформации или трансфекции хозяина при помощи любой из технологий, хорошо известных специалистам в данной области. Особенно предпочтительным является использование плазмиды или вируса, содержащего кодирующую последовательность полипептида по изобретению и генетически слитый с ней N-концевой Flag-таг и/или С-концевой His-таг. Предпочтительно длина упомянутого Flag-тага составляет 4-8 аминокислот, наиболее предпочтительно 8 аминокислот. Способы получения слитых оперативно связанных генов и экспрессирования их, например, в клетках млекопитающих и бактерий хорошо известны (Sambrook, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 1989). Генетические конструкции и способы, описанные там, могут быть использованы для экспрессии полипептида по изобретению в эукариотических или прокариотических хозяевах. Как правило, векторы экспрессии, содержащие промоторные последовательности, которые повышают эффективность транскрипции инсертированного полинуклеотида, используются в сочетании с хозяином. Вектор экспрессии обычно содержит источник репликации, промотор и терминатор, а также специфические гены, способные обеспечивать фенотипическую селекцию трансформированных клеток. Кроме того, для крупномасштабного производства конструкций антител и/или хемокинов по изобретению могут использоваться трансгенные животные, предпочтительно млекопитающие, содержащие клетки по изобретению. Наиболее предпочтительно упомянутые трансгенные животные продуцируют конструкцию антитела по изобретению.
Таким образом, в следующем варианте осуществления данное изобретение относится к способу получения полипептида, описанного выше, включающего культивирование клетки (хозяина) по изобретению в условиях, пригодных для экспрессии конструкции антитела и/или хемокина, и изолирование полипептида из клетки или среды культуры.
Трансформированные хозяева могут выращиваться в ферментерах и культивироваться способами, известными в данной области, для достижения оптимального роста клеток. Продуцируемые конструкции по изобретению могут быть затем изолированы из среды роста, клеточных лизатов или клеточных мембранных фракций. Изоляция и очистка полипептидов по изобретению, например, продуцируемых микробами, может производиться любыми обычными способами, такими как препаративная хроматография и иммунологическое разделение, например, с использованием моноклональных или поликлональных антител, например, к тагу или к полипептиду по изобретению, или способами, описанными в прилагаемых примерах.
В зависимости от клетки-хозяина могут потребоваться технологии ренатурации для получения соответствующей конформации. Если необходимо, могут быть сделаны точечные замещения в ДНК с целью поиска оптимизации связывания с использованием обычного кассетного мутагенеза или другой методики протеиновой инженерии, например, описанной здесь. Получение полипептидов по изобретению может также зависеть от знания аминокислотной последовательности (или соответствующей ДНК- или РНК-последовательности) биоактивных протеинов, таких как ферменты, токсины, факторы роста, факторы дифференциации клеток, рецепторы, антиметаболиты, гормоны или различные цитокины или лимфокины. Такие последовательности описаны в литературе и содержатся в компьютеризованных банках данных.
Данное изобретение также относится к конструкции антитела или конструкции хемокина, кодируемой полинуклеотидом, описанным выше, или продуцируемой способом, описанным выше.
Кроме того, конструкции по изобретению могут быть использованы для лечения иммунологических нарушений, в частности аутоиммуных заболеваний, аллергических заболеваний, воспалительных заболеваний и СПИДа (ВИЧ-инфекции), как описано в прилагаемых примерах.
В дополнение к этому данное изобретение относится к композициям, включающим полинуклеотид, вектор, хозяина, конструкцию антитела и/или конструкцию хемокина по изобретению.
Выражение "композиция" в контексте данного изобретения включает по меньшей мере один полинуклеотид, вектор, хозяина, конструкцию антитела и/или конструкцию хемокина, описанные здесь. Упомянутая композиция может также (необязательно) включать другие молекулы, индивидуальные или в комбинации, такие как молекулы, способные модулировать и/или создавать помехи работе иммунной системы. Композиция может быть твердой, жидкой или газообразной и может иметь форму, например, порошка (порошков), таблетки (таблеток), раствора (растворов) или аэрозоля (аэрозолей). В предпочтительном варианте осуществления упомянутая композиция включает по меньшей мере два, предпочтительно три, более предпочтительно четыре компонента, описанных в изобретении.
Предпочтительно упомянутая композиция представляет собой фармацевтическую композицию, содержащую также (необязательно) фармацевтически приемлемый носитель, разжижитель и/или наполнитель.
Примеры подходящих фармацевтических носителей хорошо известны в соответствующей области и включают буферные солевые растворы, воду, эмульсии, такие как масляно-водные эмульсии, различные типы увлажняющих веществ, стерильные растворы и т.д. Композиции, содержащие такие носители, могут быть приготовлены известными традиционными способами. Эти фармацевтические композиции могут вводиться субъекту в приемлемых дозах. Введение соответствующих композиций может осуществляться различными путями, например внутривенно, интраперитонеально, подкожно, внутримышечно или путем местного или внутрикожного применения. Дозировки будут определяться лечащим врачом в зависимости от клинических факторов. Как известно в медицине, дозировки для каждого пациента зависят от многих факторов, таких как вес пациента, площадь поверхности тела, возраст, конкретное применяемое соединение, пол, продолжительность и способ применения, общее состояние здоровья, а также от других лекарств, применяемых одновременно. Типичная дозировка для регулярного приема фармацевтической композиции должна быть в диапазоне от 1 мкг до 10 мг единиц в день. Если применяется непрерывное вливание, дозировка также должна быть в диапазоне от 1 мкг до 10 мг единиц на кг веса тела в минуту соответственно. Однако более предпочтительная дозировка для непрерывного вливания может быть в диапазоне от 0,01 мкг до 10 мг единиц на кг веса тела в час. Наиболее предпочтительные дозы перечислены ниже. Прогресс можно наблюдать путем периодической оценки. Дозы будут варьироваться, но предпочтительная дозировка для внутривенного применения ДНК составляет от ~106 до 1012 копий молекулы ДНК. Применение композиций по изобретению может быть местным или системным. В основном применение будет парентеральным, т.е. внутривенным, однако наружное применение также предусматривается. ДНК может также применяться непосредственно на целевом участке, например, путем биолистической доставки во внутренний или наружный целевой участок или при помощи катетера в определенный участок артерии. Препараты для парентерального применения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примеры неводных растворителей включают пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и органические эфиры, пригодные для инъекций, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, включая солевые и буферные среды. Парентеральные носители включают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, лактированный раствор Рингера или жирные масла. Внутривенные носители включают жидкие и питательные добавки, электролитные добавки (например, на основе декстрозы Рингера) и т.п. Также могут присутствовать консерванты и другие добавки, такие как противомикробные добавки, антиоксиданты, хелатирующие агенты, инертные газы и др. В дополнение к этому фармацевтическая композиция по данному изобретению может содержать протеиновые носители, например сывороточный альбумин или иммуноглобулин, предпочтительно человеческого происхождения. Кроме того, подразумевается, что фармацевтическая композиция по данному изобретению может содержать дополнительные биологически активные вещества в зависимости от предназначения фармацевтической композиции. Такие вещества могут представлять собой лекарственные препараты, воздействующие на иммунную систему, препараты, используемые в лечении вирусных инфекций, в частности лечении ВИЧ (например, HAART) и СПИДа и/или противовоспалительные лекарства. Например, подразумевается, что пациенты на самых ранних стадиях проходят лечение HAART, пока вирусная нагрузка не упадет ниже обнаружимого уровня на период от нескольких недель до нескольких месяцев. Раннее лечение инфицированных пациентов HAART предотвращает переход вирусных штаммов от использования CCR5 к другим хемокиновым рецепторам, таким как CXCR4 (Connor (1997) J. Exp. Med. 185, 621-628). Конструкции, описанные в данном изобретении, например конструкцию CCR5xCD3, назначают в дополнение к HAART для устранения латентно инфицированных клеток, а также клеток, склонных к повторной инфекции ВИЧ-1. Уничтожение CCR5+ клеток повторяют от 1 до 10 раз. Дозы CCR5xCD3 находятся в диапазоне от 0,5 до 10 мкг/м2, предпочтительно от 10 до 100 мкг/м2. Дозы могут вводиться внутривенно, подкожно и/или в цереброспинальную жидкость. После нескольких циклов лечения биспецифическим антителом прерывают HAART и проводят тщательное наблюдение за вирусной нагрузкой. Если вирусная нагрузка поднимается выше обнаружимого уровня, проводят новый цикл лечения HAART и биспецифическим антителом, как описано выше.
В данном изобретении предусматривается, что различные полинуклеотиды и векторы по изобретению применяются индивидуально или в любой комбинации с использованием стандартных систем доставки векторов и/или генов и, возможно, вместе с фармацевтически приемлемым носителем или наполнителем. После введения упомянутые полинуклеотиды или векторы могут стабильно встраиваться в геном субъекта. Предпочтительно, упомянутым субъектом является человек.
С другой стороны, могут быть использованы вирусные векторы, специфические к определенным клеткам или тканям и устойчивые в упомянутых клетках. Пригодные фармацевтические носители и наполнители хорошо известны в данной области. Фармацевтические композиции, изготовленные по изобретению, могут быть использованы для профилактики или лечения или замедления различных видов иммунологических заболеваний, которые могут быть связаны с воспалением, в частности, кишечными воспалительными заболеваниями, почечными воспалительными заболеваниями, воспалительными заболеваниями суставов, такими как (хронический) артрит. Кроме того, фармацевтическая композиция по данному изобретению может быть использована для устранения клеток, латентно инфицированных вирусом, предпочтительно вирусом иммунодефицита приматов, более предпочтительно ВИЧ(-1).
Кроме того, возможно использование фармацевтической композиции по изобретению, которая содержит полинуклеотид или вектор по изобретению, в генной терапии. К подходящим системам доставки генов относятся, среди прочих, липосомы, рецептор-опосредованные системы доставки, голые ДНК и вирусные векторы, такие как вирусы герпеса, ретровирусы, аденовирусы и адено-ассоциированные вирусы. Доставка нуклеиновых кислот в специфические участки тела для генной терапии может также осуществляться с использованием системы биолистической доставки, например, описанной Williams (Proc. Natl. Acad. Sci. USA 88 (1991), 2726-2729). Другие способы доставки нуклеиновых кислот включают частицеопосредованный генный перенос, например, описанный у Verma, Gene Ther. 15 (1998), 692-699.
Следует понимать, что введенные полинуклеотиды и векторы экспрессируют генный продукт после введения в упомянутую клетку и предпочтительно остаются в этом состоянии в течение жизни упомянутой клетки. Например, клеточные линии, которые стабильно экспрессируют полинуклеотид под контролем соответствующих регуляторных последовательностей, могут быть сконструированы способами, хорошо известными специалистам в данной области. Вместо использования векторов экспрессии, которые содержат вирусные источники репликации, клетки-хозяева могут быть трансформированы полинуклеотидом по изобретению и селектируемым маркером в одной и той же или в разных плазмидах. После введения чужеродной ДНК сконструированные клетки могут быть оставлены для роста в течение 1-2 дней в обогащенной среде, а затем перенесены в селективную среду. Селектируемый маркер, содержащийся в рекомбинантной плазмиде, придает устойчивость к селекции и дает возможность селекции клеток, имеющих стабильно встроенную в хромосомы плазмиду и растущих с образованием фокусов, которые, в свою очередь, могут быть клонированы и расширены в клеточные линии.
Может быть использован ряд систем селекции, включающих, но не только, тимидинкиназу симплексного вируса герпеса (Wigler, Cell 11(1977), 223), гипоксантин-гуанин-фосфорибозилтрансферазу (Szybalska, Proc. Natl. Acad. Sci. USA 48-(1962), 2026) и аденин-фосфорибозилтрансферазу (Lowy, Cell 22 (1980), 817) в клетках tk-, hgprt- или aprt- соответственно. Кроме того, может быть использована устойчивость к антиметаболитам в качестве основы селекции на dhfr, который придает устойчивость к метотрексату (Wigler, Proc. Natl. Acad. Sci. USA 77 (1980), 3567; O’Hare, Proc. Natl. Acad. Sci. USA 78 (1981), 1527), gpt, который придает устойчивость к микофенольной кислоте (Mulligan, Proc. Natl. Acad. Sci. USA 78 (1981), 2072); nео, который придает устойчивость к аминогликозиду G-418 (Colberre-Garapin, J. Mol. Biol. 150 (1981), 1); hygro, который придает устойчивость к гидромицину (Santerre, Gene 30 (1984), 147); или к пуромицину (pat, пуромицин-N-ацетилтрансфераза). Описаны также другие селектируемые гены, например trpB, который позволяет клеткам использовать индол вместо триптофана; hisD, который дает возможность клеткам использовать гистинол вместо гистидина (Hartman, Proc. Natl. Acad. Sci. USA 85 (1988), 8047); ODC (орнитин-декарбоксилаза), который придает устойчивость к ингибитору орнитин-декарбоксилазы, 2-(дифторметил)-DL-орнитин, DFMO (McConlogue, 1987, In: Current Communications in Molecular Biology, Cold Spring Harbor Laboratory ed.).
В следующем варианте осуществления данное изобретение относится к композиции, предпочтительно фармацевтической композиции, описанной выше, которая дополнительно содержит лекарственное средство для лечения иммунологического нарушения или лекарственное средство для лечения ВИЧ-инфекции.
Упомянутое лечение ВИЧ-инфекции может представлять собой HAART. HAART-терапия включает коктейль трех классов антивирусных препаратов. Эти классы включают нуклеозидные ингибиторы обратной транскриптазы (NRTI), ненуклеозидные ингибиторы обратной транскриптазы (NNRTI) и ингибиторы протеазы (PI). Сочетают обычно от 2 до 4 препаратов предпочтительно из более чем одного класса для снижения вирусной нагрузки до почти необнаружимых уровней. Продукты, схемы дозирования и распространенные побочные эффекты приведены в прилагаемых табл.I-III.
Упомянутое лечение иммунологического нарушения может включать противовоспалительные средства и иммунодепрессивные средства.
Противовоспалительные средства могут быть выбраны из группы, включающей азатиоприн, циклофосфамид, глюкокортикоиды, например преднизон и кортикостероиды. Иммунодепрессанты могут включать циклоспорин А, такролимус (FK506), сиролимус (рапамицин). Протеиновые препараты могут включать кальцинурин, β-интерферон, анти-ТМРα-моноклональные антитела (ремикад). Дозировки и использование противовоспалительных средств и иммунодепрессантов описано, среди прочих, у Fauci et al., sic. Дополнительные варианты лечения известны специалистам и, среди прочих, описаны выше.
В наиболее предпочтительном варианте осуществления данное изобретение относится к способу лечения, профилактики и/или облегчения иммунологического нарушения или устранения клеток, которые латентно инфицированы вирусом иммунодефицита приматов, включающему введение субъекту, нуждающемуся в таком лечении, профилактике и/или облегчении, эффективного количества соединений и/или композиций, предпочтительно фармацевтических композиций по данному изобретению.
Конструкции, описанные здесь, особенно полезны для специфического разрушения хемокинов рецептор-положительных клеток. Например, биспецифическое антитело, связывающееся одновременно с CCR5 на целевых клетках и с CD3 на Т-клетках, перенаправляет цитотоксические Т-клетки на CCR5-положительные целевые клетки. Как показано в прилагаемых примерах, конструкция антитела специфически уничтожает ССР5-положительные Т-клетки и моноциты, но неактивна против клеток, не экспрессирующих CCR5, таких как CCR5-дефицитные Δ32/Δ32 РВМС. Кроме того, в in vitro/ex vivo опытах конструкция биспецифического антитела устраняла более 95% ССР5-положительных моноцитов и Т-клеток из синовиальной жидкости пациентов с артритом. Другие конструкции, такие как конструкции хемокинов, например, слитый протеин хемокина RANTES и усеченной версии экзотоксина A Pseudomonas (PE38), способны связываться с CCR5 и даунмодулировать рецептор с клеточной поверхности, как показано в прилагаемых примерах. В течение 48 часов RANTES-PE38 полностью разрушила CCR5-положительные СНО-клетки при концентрации 2 нМ. Цитотоксический эффект против ССR5-отрицательных СНО-клеток не был обнаружен.
Основанное на преобладании ССR5-положительных Т-клеток и моноцитов в инфильтрате хронически воспаленной ткани, специфическое уничтожение CCR5-положительных клеток представляет собой новую концепцию в лечении иммунологических нарушений.
Как указано выше, благодаря тому факту, что в ВИЧ-инфицированных клетках присутствуют специфические хемокиновые рецепторы, а именно CCR5, соединения и композиции по изобретению особенно полезны для уничтожения/устранения клеток, латентно инфицированных вирусом иммунодефицита приматов.
Данное изобретение также относится к применению полинуклеотида, вектора, хозяина, конструкции антитела и/или конструкции хемокина по данному изобретению для получения фармацевтической композиции для лечения, профилактики и/или облегчения иммунологического нарушения или для получения фармацевтической композиции для устранения латентно инфицированных клеток, где упомянутые клетки инфицированы вирусом иммунодефицита приматов, таким как вирус иммунодефицита человека, в частности, ВИЧ-1.
Упомянутые иммунологические нарушения могут представлять собой аутоиммунные заболевания, заболевания кожи, аллергические заболевания, воспалительные заболевания, диабет и отторжение трансплантата, где упомянутое аутоиммунное заболевание выбирают из группы, включающей множественный склероз, диабет типа I, ревматоидный артрит. Упомянутые заболевания кожи могут включать псориатические поражения, псориаз, атрофический дерматит и т.п. Воспалительные заболевания, упомянутые здесь, выбирают из группы, включающей воспалительные заболевания суставов, почечные воспалительные заболевания, кишечные воспалительные заболевания. В частности, упомянутое кишечное воспалительное заболевание может представлять собой болезнь Крона, саркоидоз, системный склероз, коллагеноз, миозит, неврит. Почечные воспалительные заболевания могут включать нефрит, гломерулонефрит, люпус-нефрит или IgA нефропатию.
В разнообразных хронических воспалительных заболеваниях было обнаружено впечатляющее аккумулирование ССR5-положительных Т-клеток и макрофагов на участке воспаления. Аккумулирование CCR5+ клеток было продемонстрировано в нескольких типах воспалительных заболеваний, таких как артрит, почечные воспалительные заболевания, отторжение трансплантата, аутоиммунные заболевания, такие как множественный склероз, и кишечные воспалительные заболевания. В противоположность этому, в периферической крови этих пациентов лишь незначительное количество Т-клеток и моноцитов экспрессируют CCR5. Таким образом, CCR5 представляется прекрасным маркером для идентификации лейкоцитов, участвующих в хроническом воспалении. Наличие 32-bр делеции в гене CCR5, которая предотвращает экспрессию CCR5, позволяет изучить патофизиологическую роль CCR5 в хронических воспалительных заболеваниях. Среди пациентов с ревматоидным артритом ССR5-дефицитные (Δ32/Δ32) индивидуумы встречаются гораздо реже. Кроме того, средняя жизнеспособность почечных трансплантатов значительно дольше у CCR5-Δ32/Δ32-пациентов. Эти результаты показывают, что целью для терапевтического вмешательства должен быть CCR5. Кроме того, преобладание CCR5-положительных лейкоцитов в пораженной ткани в противоположность редкой экспрессии CCR5 в лейкоцитах периферической крови означает, что специфическое устранение ССR5-положительных лейкоцитов путем может быть терапевтически полезным за счет снижения количества инфильтрирующих клеток при хроническом воспалении, отторжении трансплантата и аутоиммунных заболеваниях, таких как множественный склероз, без существенного истощения лейкоцитов периферической крови. Устранение ССR5-положительных лейкоцитов из воспалительного инфильтрата принесет большую терапевтическую пользу, чем простое блокирование хемокиновых рецепторов этих клеток, так как они уже инфильтрировали ткань.
Как указано в прилагаемых примерах, конструкции антител и/или хемокинов особенно полезны для лечения, профилактики и/или облегчения воспалительных заболеваний суставов. Поэтому композиции по данному изобретению особенно полезны для лечения воспалительных заболеваний суставов, таких как артрит, в частности хронический артрит.
Кроме того, данное изобретение относится к медицинским способам и вариантам использования, в которых композиция, предпочтительно фармацевтическая композиция, должна применяться в комбинации с антивирусными средствами и/или в комбинации с препаратами, используемыми при лечении СПИДа.
Как указано выше, основная проблема при лечении СПИДа заключается в присутствии латентно ВИЧ-инфицированных клеток. Совеременные варианты лечения основаны на антивирусных препаратах, препятствующих работе двух ферментов вируса BИЧ, его протеазы и обратной транскриптазы. Протеаза незаменима для расщепления инактивных вирусных препротеинов для образования активных продуктов, а обратная транскриптаза требуется для выработки промежуточной ДНК вирусного генома РНК. Затем промежуточная ДНК может встраиваться в геном хозяина и оставаться там в скрытой - латентной форме. Наиболее эффективный вариант лечения включает высокоактивную антиретровирусную терапию (HAART) - курс лечения, состоящий из комбинации по меньшей мере трех антиретровирусных препаратов и обычно включающий по меньшей мере один препарат класса ингибиторов протеазы. Появление высокоактивной антиретровирусной терапии (HAART) оказало существенное воздействие на ВИЧ-1-инфицированных пациентов, снизив циркулирование вируса до необнаружимых уровней (Oxenius (2000) Proc. Natl. Acad. Sci. 97, 3383-3387; Perelson (1997) Nature (London) 387, 188-191; Hammer (1997) N. Engl. J. Med. 337, 725-733; Gulick (1997) N. Engl. J. Med. 337, 734-739). Несмотря на это, латентно инфицированные клетки могут оставаться у этих пациентов в течение значительных периодов времени (Chun (1997) Nature (London) 387, 183-188; Chun (1998) Proc. Natl. Acad. Sci. USA 95, 8869-8873; Zhang (1999) N. Engl. J. Med. 340, 1605-1613); если HAART прекратить, эти клетки могут продуцировать вирус (Harrigan (1999) AIDS 13, F59-F62). Пул латентно инфицированных клеток вырабатывается только во время первичной инфекции ВИЧ-1 (Chun (1998) Proc. Natl. Acad. Sci. USA 95, 8869-8873). Вследствие предполагаемого длительного полупериода существования вирусных резервуаров (Zhang (1999) N. Engl. J. Med. 340, 1605-1613, Finzi (1999) Nat. Med 5, 512-517) и побочных эффектов, а также высокой стоимости хронической терапии HAART (Flexner (1998) N. Engl. J. Med. 338, 1281-1292; Carr (1998) Lancet 351, 1881-1883) необходима разработка новых стратегий устранения латентного резервуара. В то время как лечение HAART оказалось весьма успешным в подавлении плазменной виремии у ВИЧ-инфицированных пациентов, все же остаются устойчивые резервуары ВИЧ, в том числе в латентно инфицированных CD4+ Т-клетках и других клетках в мозге, в кишечно-ассоциированной лимфоидной ткани и половых путях (Chun (1999) Proc. Natl. Acad. Sci. USA 96, 10958-10961). Повторное появление плазменной виремии у ВИЧ-инфицированных пациентов после прерывания HAART обусловлено этими скрытыми вирусными резервуарами, и HAART не может устранить эти резервуары (Chun (2000) Nature Med. 6, 757-761). Поэтому даже HAART только подавляет вирусную репликацию и снижает вирусную нагрузку, но не предотвращает появление латентно инфицированных клеток и не устраняет такие клетки. Передача ВИЧ-1 зависит от присутствия CCR5, поскольку индивидуумы с гомозиготной делецией А32 аллели CCR5 высокоустойчивы к инфекции ВИЧ-1. Хотя высокоактивная антиретровирусная терапия может эффективно подавлять репликацию ВИЧ-1, полное уничтожение ВИЧ до сегодняшнего дня не было достигнуто. Главное препятствие представляется в неактивности антиретровирусной терапии против латентно инфицированных клеток, которые могут выживать в течение нескольких лет и функционировать как эндогенный источник ВИЧ-1. Многие из этих клеток не экспрессируют вирусные протеины и могут уклоняться от иммунного ответа. Однако большинство латентно инфицированных клеток все еще могут экспрессировать CCR5, так как этот рецептор необходим для первичной инфекции. Соединения по данному изобретению особенно полезны для уничтожения CCR5+ клеток и должны существенно снижать количество латентно инфицированных ВИЧ+-клеток. Другие стратегии устранения ВИЧ-1 -инфицированных клеток, которые основаны на специфическом узнавании вирусных протеинов, например, экспрессируемого на поверхности gр120, будут менее эффективными против латентно инфицированных клеток, так как вирус в этих клетках является скрытым.
Поэтому композиции по данному изобретению особенно полезны в методах котерапии, которые приводят к уничтожению ВИЧ-инфицированных клеток, предпочтительно ССR5-положительных клеток. Предпочтительно, чтобы композиция по данному изобретению использовалась в комбинации с HAART. Поэтому конструкция по изобретению может быть использована в ВИЧ-терапии в комбинации с HAART, как показано в прилагаемых примерах. Продукты, схемы дозирования и распространенные побочные эффекты приведены в прилагаемых табл.I, II и III.
Упомянутая комбинация может включать совместное применение, а также применение до или после лечения другим антивирусным, предпочтительно антиретровирусным, наиболее предпочтительно анти-ВИЧ препаратом.
Данное изобретение также относится к комплекту, включающему полинуклеотид, вектор, хозяина, конструкцию антитела и/или конструкцию хемокина по данному изобретению.
Предпочтительно, комплект по данному изобретению дополнительно (необязательно) включает раствор(ы) для хранения и/или другие реагенты или материалы, требуемые для проведения исследовательских или терапевтических мероприятий. Упомянутый комплект может включать, среди прочего, лекарственные средства, используемые в лечении иммунологических нарушений, описанных здесь, и/или используемые в лечении СПИД. Кроме того, части комплекта могут быть упакованы отдельно в ампулы или флаконы или объединены вместе в контейнерах или многоконтейнерных блоках.
На фигурах показано:
Фигура 1.
Экспрессия различных хемокиновых рецепторов (обозначенных на оси х) на Т-клетках (первая и вторая панель), моноцитах (третья панель) и нейтрофилах (четвертая панель) в периферической крови (белые колонки) и синовиальной жидкости (серые колонки) пациентов с артритом, отличным от подагры. Каждая точка представляет одного пациента, а средние значения приведены в виде полос. Экспрессия CXCR1 и CXCR2 на нейтрофилах приведена как интенсивность флуоресценции на оси у, а во всех других случаях показано процентное содержание рецептор-положительных клеток.
Фигура 2.
Точечные графики FACS-анализа, показывающие экспрессию CCR5, CCR2 и CXCR4 на лейкоцитах в периферической крови (слева) и синовиальной жидкости (справа) одного пациента с ревматоидным артритом. Границы были установлены в соответствии с контролями изотипов и показаны в виде вертикальных линий. В синовиальной жидкости большинство Т-клеток и моноцитов показывают высокий уровень экспрессии CCR5, а в периферической крови лишь незначительное количество этих клеток экспрессируют низкие уровни CCR5.
Фигура 3.
Схема биспецифического одноцепочечного антитела. Одноцепочечный фрагмент αCCR5 (CCR5 VL/CCR5 VH), полученный из гибридомы МС-1, слит с N-окончанием одноцепочечного фрагмента, направленного против CD3 (CD3 VL/CD3VH). Связывание биспецифического антитела с СD3+-Т-клетками и CCR5-положительными целевыми клетками приводит к сшивке CD3, активации эффекторных Т-клеток и лизису ССR5-положительных целевых клеток.
Фигура 4.
SDS-PAGE очищенного биспецифического одноцепочечного антитела αCCR5-αCD3. Видна единственная полоса около 60 кДа в восстанавливающих (слева) и невосстанавливающих (справа) условиях. Деградация или протеолиз биспецифического антитела не обнаружены.
Фигура 5.
Схема конструкции хемокин-токсин RANTES-PE38. Хемокин RANTES слит с М-окончанием усеченной версии экзотоксина A Pseudomonas. В то время как усеченный токсин неспособен связываться с эукариотическими клетками, посредством компонента RANTES слитый протеин связывается с CCR5 и интернализируется в клетке. За счет этого токсин ингибирует синтез протеинов и индуцирует смерть клетки.
Фигура 6.
SDS-PAGE (слева) и вестерн-блоттинг (справа) очищенного протеина RANTES-PE38. Видна отчетливая полоса ожидаемого размера около 46 кДа в SDS-PAGE и вестерн-блоттинге при окрашивании Кумасси.
Фигура 7.
Связывание биспецифического антитела αCCR5-αCD3 с αCD3 на CCR5-дефицитных лимфоцитах. Совместное окрашивание CD4 и CD8 показало, что биспецифическое антитело связывается с субпопуляцией СD4+/СD8+-Т-клеток. Многоцветный анализ показал, что связывание с другими популяциями клеток не происходило.
Фигура 8.
Связывание биспецифического антитела aCCR5-aCD3 с CCR5 на трансфектированных СНО-клетках. СНО-клетки, трансфектированные CCR5, показаны черным цветом, а СХСR4-положительные СНО-клетки, служившие в качестве отрицательного контрольного опыта, показаны белым цветом.
Фигура 9.
Связывание биспецифического антитела фCCR5-αCD3 с CCR5 на культивированных моноцитах. Моноциты от ССR5-положительного донора показаны черным цветом, а моноциты от ССR5-дефицитного (Δ32/Δ32) донора, служившие в качестве отрицательного контрольного опыта, показаны белым цветом.
Фигура 10.
ССR5-специфические моноклональные антитела сравнивали по их способности индуцировать даунмодулирование CCR5 при помощи анализа FACS. Mab MC-1 (квадратики) и родительское антитело биспецифического антитела αCCR5-αCD3 показали существенную интернализацию, в то время как МС-4 (треугольники) не показало индуцирования интернализации CCR5. Клетки СНО-CCR5 инкубировали при различных концентрациях в течение 30 минут при 37° С.
Фигура 11.
Даунмодуляция CCR5 с поверхности РВМС при использовании RANTES-РЕ38 (белые символы) и RANTES (черные символы). Поверхностную экспрессию CCR5 определяли на лимфоцитах (квадратики) и моноцитах (кружки) и представили на графике в виде % от среды как контрольного опыта. Слитый протеин RANTES-РЕ38 способен даунмодулировать CCR5 с клеточной поверхности с несколько более низкой эффективностью, чем немодифицированный RANTES.
Фигура 12.
Уничтожение ССR5-положительных моноцитов биспецифическим антителом. ССR5-дефицитные РВМС (Δ32/Δ32) или РВМС дикого типа (WT-PBMC) культивировали в течение ночи и инкубировали с биспецифическим антителом (100 нг/мл) или средой в качестве контрольного опыта в течение 20 часов. Оставшиеся моноциты (Мо) и лимфоциты (Ly) идентифицировали по их светорассеивающим свойствам в FACS. ССR5-положительные моноциты дикого типа были полностью уничтожены биспецифическим антителом, в то время как ССR5-дефицитные моноциты выжили.
Фигура 13.
Уничтожение ССR5-положительных моноцитов биспецифическим антителом. Реакция на дозу, показывающая уничтожение культивированных моноцитов при различных концентрациях биспецифического антитела αCCR5-αCD3. Более 90 % моноцитов были уничтожены при концентрации 33 нг/мл.
Фигура 14.
Биспецифическое антитело αCCR5-αCD3 уничтожает лимфоциты и моноциты в синовиальной жидкости пациента с хроническим артритом. Свежеотобранную синовиальную жидкость инкубировали с различными концентрациями биспецифического антитела или среды в качестве контрольного опыта в течение 20 часов и анализировали методом FACS. Более 95% обоих типов клеток были уничтожены при концентрации 31 нг/мл.
Фигура 15.
Биспецифическое антитело αCCR5-αCD3 уничтожает лимфоциты и моноциты в синовиальной жидкости пациента с хроническим артритом. Свежеотобранную синовиальную жидкость инкубировали с биспецифическим антителом (500 нг/мл) или среды в качестве контрольного опыта в течение 20 часов и анализировали методом FACS (анализ прямого и бокового светорассеяния). Биспецифическое антитело полностью уничтожило ССR5-положительные моноциты и лимфоциты, в то время как ССR5-отрицательные гранулоциты (PMN) выжили. В соответствии с нашими предшествующими данными, все моноциты и лимфоциты в этой синовиальной жидкости экспрессировали CCR5, а на гранулоцитах (PMN) экспрессии CCR5 не было обнаружено.
Фигура 16.
Эффективность биспецифического одноцепочечного антитела αCCR5-αCD3 в уничтожении ССR5-положительных моноцитов сравнили с эффективностью двух немодифицированных моноклональных антител МС-1 и МС-5. РВМС от двух разных доноров (F и N) культивировали в течение ночи и затем инкубировали 24 часа в среде в присутствии или в отсутствие конструкции антитела и моноклонального антитела. Концентрации обозначены на диаграмме. Клетки извлекли полностью и проанализировали методом FACS с подсчетом выживших моноцитов и лимфоцитов. Показаны результаты двух опытов для каждого донора РВМС. Неожиданным оказалось то, что только биспецифическое антитело было способно существенно уничтожать ССR5-положительные моноциты, в то время как немодифицированные моноклональные антитела были практически неэффективными.
Фигура 17.
Пример анализа прямого и бокового светорассеяния в показательном опыте, представленном на Фиг.16, демонстрирующий, что только биспецифическое одноцепочечное антитело αCCR5-αCD3 способно уничтожать моноциты в левой нижней четверти. Для сравнения локализации различных типов клеток см. также Фиг.12, левая панель.
Фигура 18.
Деструкция ССR5-положительных СНО-клеток конструкцией хемокин-токсин RANTES-PE38. ССR5-положительные СНО-клетки и СХСR4-положительные СНО-клетки инкубировали 40 часов с конструкцией хемокин-токсин (10 нМ) и анализировали методом FACS. Мертвые клетки находятся в левой верхней части графика прямого и бокового светорассеяния. Конструкция RANTES-PE38 полностью разрушила ССR5-положительные СНО-клетки, в то время как эффекта на CXCR4-положительные СНО-клетки она не оказала.
Фигура 19.
Примеры конструкций антител и/или хемокинов, связывающихся с хемокиновый рецептор (ССR)-экспрессирующими клетками и сконструированных путем соединения пептидной связью или мультимеризационными доменами: (А) показывает различные примеры конструкций антител и хемокинов, которые взаимодействуют с эффекторной клеткой путем связывания с поверхностным антигеном эффекторной клетки, (В) показывает примеры конструкций антител и/или хемокинов, связанных с токсином, (С) показывает примеры конструкций антител и/или хемокинов, которые содержат сайт связывания антитела с токсином.
Фигура 20.
4×105 ССR5+СНО-клеток инкубировали с 19,5 нг/мл scFv CCR5×CD3 в течение 30 минут при 4°С. После промывки клетки инкубировали 45 минут при 4°С с 20 мкг/мл моноклонального антитела анти-His-Tag. Связывание scFv CCR5×CD3 определяли при помощи моноклонального козьего антимышиного IgG F(ab’)2-PE-конъюгированного антитела и анализировали в проточном цитометре с использованием программного обеспечения CellQuest. Анализ методом нелинейной регрессии выполняли при помощи GraphPad Prizm.
Фигура 21.
Цитотокисческую активность scFv CCR5×CD3 тестировали путем анализа на основе FACS с ССR5+СНО-клетками в качестве целевых и CD3+-T-лимфoцитoв в качестве эффекторных клеток. CD3+-T-клетки изолировали из периферической крови. В ССR5+СНО-клетки ввели метку 12 мкМ РКН26. Клетки в соотношении 5:1 эффекторных к целевым инкубировали при различном разбавлении scFv CCR5× CD3 от 320 нг/мл до 0,3 пг/мл в течение 16 часов 37°С и 5% СO2. После окрашивания 1 мкг/мл пропидия иодида (PI) клетки анализировали методом проточной цитометрии. Для проверки специфичности scFv CCR5×CD3-oпocpeдoвaннoгo лизиса стабильно СХСR4-трансфектированные клетки СНО использовали в качестве отрицательных контрольных целевых клеток. Анализ на цитотоксичность выполняли в условиях, идентичных описанным для ССR5+СНО-клеток. Специфический лизис CCR5+CHO-клеток рассчитывали с использованием программного обеспечения CellQuest (Becton Dickinson), а анализ методом нелинейной регрессии выполняли при помощи GraphPad Prizm. Сигмоидальная кривая реакции на дозу показала величину ЕС50 912 пг/мл. Цитотоксического эффекта scFv CCR5×CD3 при использовании CXCR4+ СНО-клеток в качестве целевых не было обнаружено.
Фигура 22.
Цитотокисческую активность scFv CCR5×CD3 также тестировали с использованием СD3-положительной Т-клеточной линии СВ15 в качестве эффекторных клеток путем анализа на основе FACS. CCR5+CHO целевые клетки, меченные 10 мкМ РКН26, использовали в соотношении 10:1 эффекторных к целевым и инкубировали с 100 мкл scFv CCR5×CD3 при различном разбавлении (от 40 мкг/мл до 0,15 нг/мл) в течение 6 часов 37°С и 5% СO2. Клетки окрасили 1 мкг/мл пропидия иодида (PI) и анализировали в двух параллельных опытах в проточном цитометре.
Специфический лизис ССR5+СНО-клеток рассчитывали с использованием программного обеспечения CellQuest (Becton Dickinson), а анализ методом нелинейной регрессии выполняли при помощи GraphPad Prizm. Сигмоидальная кривая реакции на дозу показала величину ЕС50 12,8 нг/мл.
Фигура 23.
Реактивность МС-1 с А) человеческими РВМС и В) РВМС резуса. РВМС (сплошная линия), РВМС с РЕ-конъюгированным козьим антимышиным антителом (точечная линия) и РВМС с МС-1 и РЕ-конъюгированным козьим антимышиным антителом (жирная сплошная линия). Связывание МС-1 с человеческими РВМС (А), но не с РВМС резуса (В) показано маркерной линией М1.
Далее изобретение будет описано со ссылками на следующие биологические примеры, которые приведены лишь для иллюстрации и не ограничивают область данного изобретения.
Пример 1: Клеточные линии, препарирование РВМС, синовиальная жидкость
1.1 Выработка клеточной линии СНО, экспрессирующей человеческий CCR5 кДНК-последовательность CCR5 амплифицировали из геномной ДНК человеческого РВМС путем ПЦР с Pfu-полимеразой (Stratagene), с олигонуклеотидными праймерами
SEQ ID NO. 1: 5’ GGA АСА AGA TGG ATT ATC AAG TGT С 3’
SEQ ID NO. 2: 5’ CTG TGT ATG AAA ACT AAG CCA TGT G 3’
Амплифицированный фрагмент очистили на геле, лигировали в скрипт-вектор PCR-Script Amp Sk(+) (Stratagene) и секвенировали. После субклонирования в вектор PEF-DHFR DHFR-дефицитные СНО-клетки трансфектировали путем электропорации и селектировали на стабильную экспрессию в безнуклеотидной среде MEM с 10% диализированного FCS, как описано ниже. FACS-анализ показал гомогенность СНО/ССR5-трансфектированных клеток.
1.2 Очистка РВМС
РВМС изолировали из светлого слоя кровяных сгустков здоровых доноров путем градиентного центрифугирования Ficoll. Специально использовали РВМС от доноров с гомозиготной делецией 32 пар оснований в аллели CCR5 (Δ32/Δ32), предотвращающей поверхностную экспрессию CCR5. В частности, светлые слои кровяных сгустков разбавили 1:2 в 0,9% NaCI и 35 мл поместили сверху 15 мл Ficoll Paque и центрифугировали 25 минут при 400 g. Прозрачную интерфазу собрали и удалили тромбоциты путем трех последовательных промывок и этапов центрифугирования при 100 g в течение 6 минут в RPMI с FCS. Свежеизолированные моноциты экспрессировали очень низкий уровень CCR5, но экспрессия была сильно индуцирована после культивирования РВМС в RPMI с 10 % FCS в течение 24-48 часов при 37°С. Количество FCS не влияло на эту индукцию. Экспрессия CCR5 на лимфоцитах во время культивирования не изменилась.
1.3 Синовиальная жидкость
Синовиальную жидкость пациентов с артритом получили из диагностической или лечебной пункции сустава и использовали для опытов без дальнейшего препарирования. Согласие было получено от всех пациентов. Синовиальную жидкость и образцы крови получили одновременно от 23 пациентов с гонитом из диагностической или лечебной пункции. Диагнозы включали ревматоидный артрит (7), реактивный артрит (3), недифференцированный гонит (4), псориатический артрит (3), остеоартрит (2), анкилозирующий спондилит (1) и подагру (3) в соответствии с критериями ACR, где они были применимы. Письменное согласие было получено от всех пациентов. Синовиальную жидкость анализировали путем оптической микроскопии. Для статистического анализа использовали t-тест Стьюдента и парный t-тест.
1.4 Анализ экспрессии хемокинового рецептора в образцах цельной крови и синовиальной жидкости
Сразу после пункции СЖ (синовиальной жидкости) изолировали лейкоциты путем двух этапов промывки 5 % PBS в NaCI 0,9%. Клетки синовиальной жидкости и цельную кровь (содержащую 1 мМ EDTA) инкубировали на льду с моноклональными антителами к хемокиновым рецепторам и соответствующими контролями изотипов при концентрации 10 мкг/мл. Использовали следующие антитела: к CCR5 - МС-1 (Mack (1998), J. Exp. Med. 187, 1215-1224), к CCR2 - DOC-3, который специфически связывается с CCR2 (9), к CCR1 - Clone 53504 (R&D-Systems), к CXCR1 - 5А12 (Pharmingen), к CXCR2 - 6С6 (Pharmingen) и к CXCR4 - 12G5 (Pharmingen), контроли изотипов lgG1, lgG2a и lgG2b (Sigma). После двух этапов промывки клетки инкубировали 30 минут на льду с фрагментом F(ab)2 РЕ-конъюгированного кроличьего антимышиного антитела (R439, DAKO). Клетки дважды промыли и инкубировали с 10 % сывороткой мыши, а затем комбинацией CD4-FITC, CD8-PECy5 и CD14-APC (Immunotech). После лизиса эритроцитов клетки сразу анализировали проточной цитометрией (Becton-Dockinson). Расчеты выполняли при помощи программного обеспечения CellQuest. Хэлперные Т-клетки, цитотоксические Т-клетки, моноциты и нейтрофилы идентифицировали по их светорассеивающим свойствам и экспрессии или отсутствию CD4, CD8 и CD14. Экспрессию хемокинового рецептора рассчитывали после определения границ в соответствии с контролями изотипов.
Как в острых, так и в хронических выпотах суставов мы обнаружили постоянно увеличивающееся процентное содержание CD4+ и CD8+ Т-клеток, которые экспрессировали хемокиновый рецептор CCR5, по сравнению с периферической кровью. Эти данные хорошо согласуются с предыдущими сообщениями (Mack (1999) Arthritis Rheum. 42, 981-988; Qin (1998) J. Clin. Invest 101, 746-754).
Экспрессия хемокинового рецептора на Т-клетках в некристаллически индуцированном артрите: около 88 % CD4+ Т-клеток и 93 % CD8+ Т-клеток из синовиальной жидкости были положительно окрашенными на хемокиновый рецептор CCR5. Подобным образом, большая часть CD4+ и CD8+ Т-клеток в СЖ экспрессировали CCR2 (66% и 48%) (Фиг.1). В противоположность этому, в периферической крови лишь незначительная часть Т-клеток экспрессировала хемокиновый рецептор CCR5 или CCR2. В наибольшей степени синовиальная жидкость была обогащена ССR5+-хэлперными Т-клетками (соотношение в крови/в синовиальной жидкости = 1:4). Большинство Т-лимфоцитов были положительно окрашенными на CXCR4 в обоих отделах. CXCR1, CXCR2 и CCR1 экспрессировались только незначительной и переменной частью Т-клеток (Фиг.1). Типичный пример одного пациента представлен на Фиг.2, который показывает экспрессию CCR5, CCR2 и CXCR4 на лейкоцитах в периферической крови и синовиальной жидкости.
Экспрессия хемокиновых рецепторов на моноцитах в некристаллически индуцированном артрите: в соответствии с предшествующими данными, большинство моноцитов в СЖ экспрессировали CCR5. Кроме того, сниженная экспрессия CXCR1, CXCR2, CXCR4 и CCR1 наблюдалась на моноцитах в синовиальной жидкости по сравнению с периферической кровью (Фиг.1, 2). Была обнаружена не только сниженная частота рецептор-положительных клеток, но также и более низкая плотность хемокиновых рецепторов на клеточной поверхности (данные не показаны). Никакой разницы в связи с поставленными диагнозами, длительностью выпота из суставов или предшествующим лечением не было обнаружено. CCR2 экспрессировался в равной степени всеми моноцитами в обоих отделах (Фиг.1, 2).
Экспрессия хемокиновых рецепторов на нейтрофилах в некристаллически индуцированном артрите: острый артрит характеризуется быстрым притоком нейтрофилов в воспаленный сустав. Поэтому анализировали экспрессию хемокиновых рецепторов на нейтрофилах из выпота воспаленных суставов. Впервые описана высокая экспрессия CXCR4 на большой фракции нейтрофилов (60%) из синовиальной жидкости пациентов с острым и хроническим артритом, в то время как гораздо более низкая экспрессия была обнаружена в периферической крови (24 %) (Фиг.1, 2). В артритах, отличных от подагры, на нейтрофилах из синовиальной жидкости экспрессия CXCR1 и CXCR2 была снижена примерно на 50% по сравнению с периферической кровью. CCR1 экспрессировался лишь незначительной частью нейтрофилов в обоих отделах.
1.5 Определение генотипа CCR5
Геномную ДНК получали из замороженных образцов крови путем аффинной хроматографии (Roche Diagnostics). Затем фрагмент гена CCR5, содержащий потенциальную делецию 32 пар оснований, амплифицировали при помощи 40 циклов ПЦР с Taq-полимеразой. Праймеры представляли собой
SEQ ID NO. 3: 5’ TTT ACCAAGA TCT САА ААА GAA G 3’
SEQ ID NO. 4: 5’ GGA GAA GGA CAA TGT TGT AGG 3’
Различия в длине ПЦР-фрагментов (274 или 242 bp) позволили идентифицировать CCR5 дикого типа и аллели ССR5-Δ32.
Пример 2: Конструкция биспецифического антитела
2.1 Выработка моноклональных антител против человеческого CCR5
Для выработки моноклональных антител против человеческого CCR5 пять мышей BALB/c иммунизировали интраперитонеально (и.п.) с четырехнедельными интервалами сначала 1×107 РВМС, культивированных в течение 10 дней в IL-2 (100 ед./мл), а затем шестью последовательными и.п. инъекциями 1×107 СНО-клеток, экспрессирующих высокие уровни CCR5. С этой целью ССR5-трансфектированные СНО-клетки выращивали в присутствии 20 нМ метотрексата для амплификации экспрессии CCR5, и выбрали один клон, экспрессирующий высокие уровни CCR5. Через 4 дня после последней инъекции СНО/ССR5-клеток удалили селезенки и клетки слили с клеточной линией Р3Х63-Аg8. Супернатанты из ~6000 гибридом подвергли скринингу путем слияния при помощи проточной цитометрии на стабильные СНО/ССR5-клетки, и обнаружили моноклональные антитела против CCR5 (МС-1, МС-4, МС-5) после третьего слияния. Специфичность МС-1 (lgG1), МС-4, МС-5 тестировали на СНО-клетки, стабильно трансфектированные CCR1-3 и CXCR4. Во всех случаях связывание не было обнаружено. Кроме того, антитела не реагируют со свежеизолированными PBMCs и культивированными PBMCs от донора, гомозиготного по делеции А32 в гене CCR5.
2.2 Клонирование вариабельных доменов Mab МС-1 к CCR5
Легкий (VL) и тяжелый (VH) вариабельные домены из αССR5-гибридомы МС-1 клонировали с использованием ПЦР-амплификации (Orandi (1989) Proc. Natl. Acad. Sci. 86, 3833).
Обратную транскрипцию (ОТ) проводили со случайными гексамерными нуклеотидами и обратной транскриптазой Super-Script (Gibco). Вариабельные домены амплифицировали путем ПЦР с Pfu-полимеразой, субклонировали в вектор PCR-Script Amp Sk(+) (Stratagene) и секвенировали.
Для ПЦР-амплификации VL(1) использовали следующие праймеры:
SEQ ID NO. 5: 5’ GACATTCAGC TGACCCAGTC TCCA 3’
SEQ ID NO. 6: 5’ GTTTTATTTC CAGCTTGGTC CC 3’
Для ПЦР-амплификации VH(1) использовали следующие праймеры:
SEQ ID NO. 7: 5’ ACCATGGGAT GGAGCTGTGT CATGCTCTT
SEQ ID NO. 8: 5’ TGAGGAGACG GTGACCGTGG TCCCTTGGCC CCAG
Нуклеотидная последовательность VL(1), полученная путем ОТ ПЦР - SEQ ID NO. 9:

2.3 Конструкция и экспрессия биспецифического одноцепочечного антитела CCR5×CD3
Схематическое изображение строения и механизма действия биспецифического одноцепочечного антитела CCR5×CD3 показано на Фиг.3. Как было описано выше, легкий и тяжелый вариабельные домены соединили в одноцепочечный фрагмент с использованием линкера (Gly4Ser1)3 и экспрессировали в периплазматическом пространстве Е. coli для проверки связывания рекомбинантного протеина с CCR5.
Затем субклонировали последовательность ДНК одноцепочечного фрагмента αCCR5 при помощи BsrG1 and BspE1 в эукариотический вектор экспрессии (pEF-DHFR), который уже содержал одноцепочечный фрагмент, направленный против CD3, с прикрепленным у С-окончания хвостом из 6 гистидиновых остатков (Mack (1995) Proc. Natl. Acad. Sci. 92, 7021). Одноцепочечные фрагменты αCR5 и αCD3 соединили линкером, кодирующим Gly4Seri (см. Фиг.3).
Выбран следующий порядок доменов: VL(1)-VH(1)-VH(2)-VL(2), где (1) означает специфичность к CCR5, а (2) означает специфичность к CD3. Биспецифическое антитело CCR5xCD3 имеет следующую нуклеотидную последовательность, SEQ ID NO. 17:

Бипецифическое антитело CCR5×CD3 имеет следующую протеиновую последовательность, SEQ ID NO. 18:
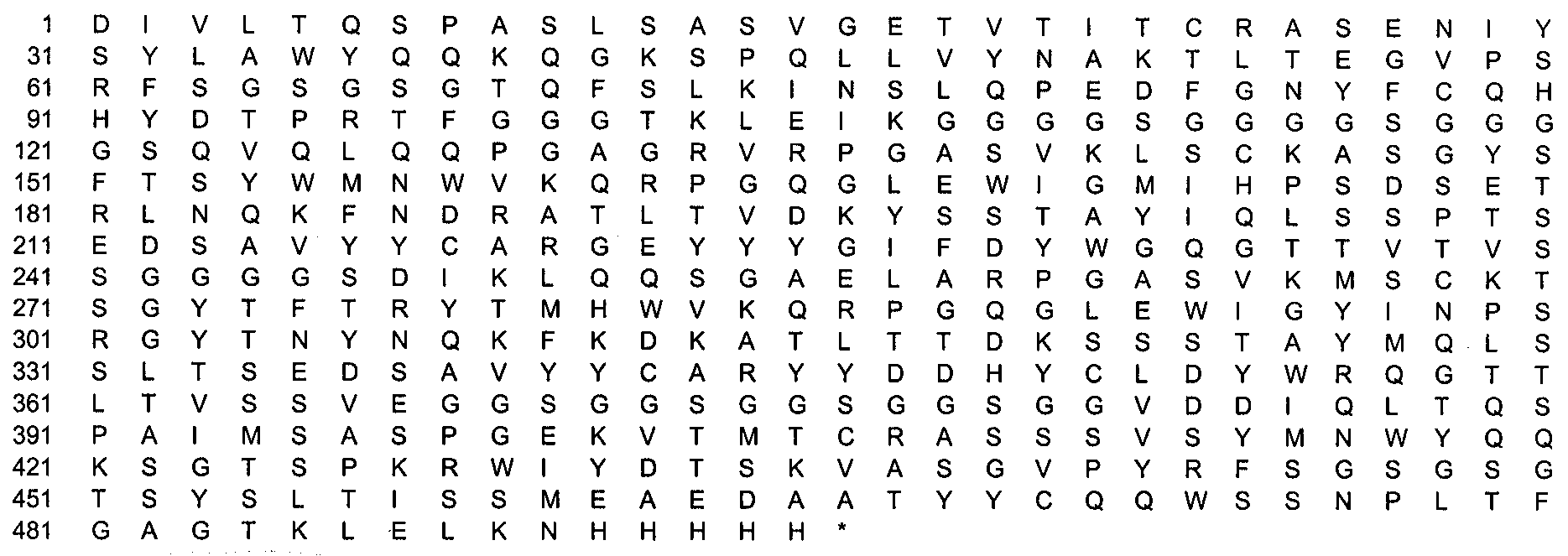
Биспецифическое антитело экспрессировали в DHFR-дефицитных СНО-клетках и очистили от супернатанта культуры путем аффинной хроматографии на иммобилизованных ионах Ni2+ (Hochuli (1988) Biotechnology 6. 1321-1325; Ni-NTA, Qlagen).
Таким образом, для конструирования биспецифических антител может быть использована, например, одноцепочечная технология (Mack et al. (1995) Proc. Natl. Acad. Sci. USA, 92: 7021-7025; Mack et al. (1997) J. Immunol. 158: 3965-3970). В этом случае, как показано схематически на Фиг.3 (вверху), вариабельные домены легкой (VL) и тяжелой (VH) иммуноглобулиновых цепей двух различных антител сливают в определенном порядке и, возможно, добавляют гистидиновую цепь из 6×His. Слияние выполняют на основе ДНК, так что после экспрессии образуется протеиновая цепь с четырьмя различными доменами (сравните Фигуры 3 (вверху)). Прикрепленная гистидиновая цепь обеспечивает возможность простой и эффективной очистки посредством иммобилизованных ионов Ni за один этап.Фиг.3 (вверху) показывает предпочтительный вариант конструкции биспецифического антитела, связывающегося с антигеном CD3 на поверхности эффекторной клетки и человеческим CCR5 на поверхности лейкоцитов как целевых клеток.
Затем одноцепочечное антитело с определенной специфичностью генерируют посредством слияния-ПЦР путем инсертирования линкера из (Gly4Ser1)3 между двумя вариабельными доменами антитела. В последующем слиянии-ПЦР фрагмент антитела против CCR5 сливают с уже известным (опубликованным) фрагментом к CD3 с инсертированием линкера, состоящего из Gly4Ser1 (ср. Mack et al., выше).
Для экспрессии биспецифического антитела соответствующую последовательность ДНК субклонируют в эукариотический вектор экспрессии (например, PEF-DHFR, Mack et al. (1995) PNAS, выше) и трансфектируют в DHFR-дефицитные СНО-клетки посредством электропорации. Биспецифическое антитело очищают от супернатанта стабильно трансфектированных СНО-клеток путем аффинной хроматографии на Ni-NTA, где элюирование осуществляется за счет снижения величины рН. Затем регулируют рН и доводят протеин до нужной концентрации. Общий выход после очистки составил около 900 мкг/л супернатанта культуры. SDS-PAGE показала единственную полосу около 60 кДа в восстанавливающих и невосстанавливающих условиях и отсутствие обнаружимого протеолиза или деградации протеина (Фиг.4).
Пример 3: Экспрессия и очистка слитого протеина хемокин-токсин
Схематическое изображение строения и механизма действия слитого хемокин-токсинового протеина RANTES-PE38 показаны на Фиг.5. ПЦР-фрагмент RANTES, генерированный с праймерами Р1 и Р2, субклонировали при помощи StuI и Sall в вектор для периплазматической экспрессии в Е. coli (Mack (1995) Proc. Natl. Acad. Sci. 92, 7021). Рестрикционный сайт StuI был заранее введен у 3’-окончания сигнальной последовательности ОрmА. ДНК усеченной версии экзотоксина А Pseudomonas (PE38; Theuer (1993) Cancer Res. 53, 340), амплифицировали путем ПЦР с Pfu-полимеразой с использованием праймеров Р3 и Р4 и субклонировали при помощи BspE1 и Hind III в вектор, который уже содержал “ДНК RANTES. Праймер Р4 также добавил хвост из 6 гистидиновых остатков у 3’-окончания PE38. Во время периплазматической экспрессии сигнальная последовательность ОрmА отщепилась, так что рекомбинантный протеин начинался с первой аминокислоты RANTES. Прикрепленный у С-окончания хвост из 6 гистидиновых остатков дал возможность очистки путем аффинной хроматографии на Ni-NTA (Qiagen).
Список праймеров:
SEQ ID NO. 19: 5’ AAAGGCCTCCCCATATTCCTCGGA
SEQ ID NO. 20: 5’ AAAGTCGACTCCGGACATCTCCAAAGAGTTGATGTAC
SEQ ID NO. 21: 5’ AATCCGGAGGCGGCAGCCTGGCCGC
SEQ ID NO. 22: 5’ GGGAAGCTTAGTGATGGTGATGGTGATGCTTCAGGTCCTCGCGCGG
Как описано выше, последовательность ДНК RANTES слили с последовательностью усеченной версии экзотоксина A Pseudomonas (PE38) (Theuer (1993) Cancer Res. 53, 340). В первой версии конструкции между RANTES и PE38 был помещен линкер Gly-Ser. Однако это привело к существенной протеолитической деградации слитого протеина во время экспрессии в Е.coli (данные не приводятся). В попытке стабилизировать конструкцию линкер и три первые аминокислоты PE38 удалили. Новый слитый протеин не показывал протеолиза во время экспрессии в Е.coli, что продемонстрировали SDS-PAGE (Фиг.6, левая панель) и вестерн-блоттинг (Фиг.6, правая панель). Соответствующие конструкции показаны в SEQ ID NOs.22 и 24 соответственно.
Пример 4: Связывание биспецифического антитела с целевыми антигенами CCR5 и CD3
Связывание биспецифического одноцепочечного антитела с СНО-клетками или РВМС определяли путем анализа FACS (Фиг.7-9). Клетки инкубировали с биспецифическим антителом в течение 60 минут на льду, а затем с антителом к 6×His (Dianova, Hamburg, Germany) и фрагментом F(ab)2 РЕ-конъюгированного кроличьего антимышиного антитела (R439, DAKO, Hamburg, Germany). Так как биспецифическое антитело связывается также с CCR5, мы проводили анализ с РВМС, которые не экспрессируют CCR5 вследствие гомозиготной делеции 32 пар оснований в ССР5-аллелях. Антитело показало хорошее связывание с субпопуляцией лимфоцитов. Совместное окрашивание с антителами к CD4 и CD8 идентифицировало эту субпопуляцию как CD4- и СО6-положительные Т-лимфоциты (Фиг.7). Кроме того, биспецифическое антитело связывалось с Т-клетками в комплекте с моноклональным антителом ОКТ-3 к CD3 (данные не показаны).
Связывание биспецифического антитела против CCR5 было продемонстрировано на СНО-клетках, чрезмерно экспрессирующих CCR5, и человеческих моноцитах (Фиг.8 и 9). Антитело показало превосходное связывание с ССR5-трансфектированными СНО-клетками (Фиг.8) и культивированными моноцитами (Фиг.9), в то время как связывания с СНО-клетками, трансфектированными CXCR4 или с культивированными моноцитами от донора с гомозиготной делецией CCR5-Δ32/Δ32 не было обнаружено. Культивирование моноцитов в течение ночи индуцировало экспрессию CCR5 на моноцитах дикого типа, в то время как моноциты от доноров с гомозиготной делецией ССR5-Δ32/Δ32 не экспрессировали CCR5. Кроме того, мы показали, что ССR5-сигнал, обнаруживаемый биспецифическим антителом на культивированных моноцитах, может быть снижен до величин менее 15% путем преинкубации моноцитов в течение 30 минут при 37°С с AOP-RANTES (данные не показаны), который, как известно, эффективно индуцирует интернализацию CCR5 и снижает связывание ССR5-антител (25).
Пример 5: Даунмодулирование хемокиновых рецепторов
5.1 Даунмодулирование CCR5 моноклональным антителом МС-1 к CCR5
Измерили эффект одного МС-1 на поверхностную экспрессию человеческого CCR5. Для сравнения использовали другое моноклональное антитело против CCR5 МС-4. СНО-ССR5-клетки инкубировали с различными концентрациями антитела МС-1 и МС-4 в течение 30 минут при 37°С. Клетки поместили на лед и окрашивали МС-1 и МС-4 соответственно при концентрации 15 мкг/л в течение часа на льду с последующим обнаружением при помощи вторичного антитела (кроличье антимышиное-ПТС, F313 от DAKO). Анализ проводили на FACSCalibur. Инкубация с МС-1 при 37°С в течение 30 минут привела к даунмодулированию человеческих CCR5 на 40% при концентрации 10 мкг/мл (Фиг.10).
5.2 Даунмодулирование CCR5 конструкцией хемокин-токсин
Слияние RANTES с N-окончанием усеченной версией экзотоксина А Pseudomonas предположительно должна была привести к специфическому связыванию конструкции с клетками, экспрессирующими рецепторы RANTES, такие как CCR5, CCR1 и CCR3. Интернализация хемокиновых рецепторов после связывания модифицированного токсина должна усилить клеточное поглощение и цитотоксическую активность конструкции (Фиг.5, нижняя панель). Поэтому мы анализировали способность RANTES-PE38 интернализировать CCR5 с поверхности первичных моноцитов и Т-клеток (Фиг.11, белые символы). Интернализация CCR5 означала бы, что конструкция способна связываться с CCR5, и что RANTES остается функционально активным после слияния с РЕ38. Как показано на Фиг.11, конструкция способна интернализировать CCR5 с поверхности моноцитов и лимфоцитов. Немодифицированный RANTES служил в качестве положительного контрольного опыта и был чуть более эффективным, чем RANTES-PE38 (Фиг.11, черные символы).
РВМС инкубировали в течение 30 минут при 37°С с различными концентрациями RANTES или RANTES-PE38, разбавленных в RPMI с 10 % FCS в объеме 100 мкл. Среду использовали в качестве контрольного опыта. Клетки окрашивали на льду для определения поверхностной экспрессии CCR5 с использованием моноклонального антитела МС-1 или среды в качестве отрицательного контрольного опыта с последующим введением РЕ-конъюгированного антимышиного антитела R439. FACS-анализ выполняли на FACSCalibur (Becton-Dickinson) и с использованием программного обеспечения CellQuest. Лимфоциты и моноциты определяли по их прямому и боковому светорассеянию и экспрессии CD14, CD4 и CD8. Относительную поверхностную экспрессию CCR5 рассчитывали как [средняя флуоресценция канала (опыта) -средняя флуоресценция канала (отрицательного контрольного опыта)]/[средняя флуоресценция канала (среды) - средняя флуоресценция канала (отрицательного контрольного опыта)].
Пример 6: Уничтожение клеток антителом CCR5×CD3 и RANTES-PE38
6.1 ССR5-специфическое уничтожение моноцитов в культивированных PBMCs
РВМС от доноров с CCR5 дикого типа (WT) или ССR5-дефицтных (Δ32/Δ32) доноров инкубировали в течение ночи для индуцирования экспрессии CCR5 на моноцитах. Культивированные РВМС инкубировали с различными концентрациями очищенных биспецифических антител α CCR5-αCD3 или среды в качестве контрольного опыта в течение 20 часов. Выжившие клетки анализировали на FACSCalibur и подсчитывали.
Для проверки способности биспецифического одноцепочечного антитела αCCR5-αCD3 уничтожать ССR5-положительные первичные клетки мы инкубировали человеческие РВМС с антителом (Фиг.12). Перед инкубацией РВМС культивировали в течение ночи для апрегулирования экспрессии CCR5 на моноцитах. Перенаправляя цитотоксические Т-клетки, биспецифическое антитело уничтожает большинство моноцитов в пределах 20 часов в зависимости от концентрации (Фиг.13) при почти полном устранении ССR5-положительных клеток при концентрации 10 нг/мл. Чтобы удостовериться, что уничтожение моноцитов обусловлено индуцированной экспрессией на них CCR5, тот же опыт выполняли с РВМС от донора с гомозиготной делецией 32 bp в аллели CCR5, которая предотвращает поверхностную экспрессию CCR5. Через 20 часов уничтожения ССR5-дефицитных моноцитов не было обнаружено, что указывает на тот факт, что уничтожение клеток биспецифическим антителом ограничено моноцитами, которые экспрессируют CCR5 (Фиг.12), сравните нижнюю правую панель с верхней правой панелью; левые панели показывают отрицательные контрольные опыты. Моноциты (Мо) и лимфоциты (Ly) идентифицировали по их прямому и боковому светорассеянию. Моноциты видны в нижней левой четверти, см. стрелки.
6.2 Уничтожение моноцитов и Т-лимфоцитов из синовиальной жидкости пациентов с артритом
Свежеотобранную синовиальную жидкость пациентов с артритом инкубировали с различными концентрациями очищенных биспецифических антител αCCR5-αCD3 или среды в качестве контрольного опыта в течение 20 часов. Выжившие клетки анализировали на FACSCalibur и подсчитывали.
Биспецифическое одноцепочечное антитело потенциально может применяться для уничтожения ССR5-положительных Т-клеток и моноцитов из воспаленных суставов пациентов с артритом. Поэтому определяли уничтожение ССR5-положительных клеток в синовиальной жидкости пациентов с различными типами артрита. Ранее было показано, что большинство Т-клеток и моноцитов в синовиальной жидкости воспаленных суставов экспрессируют CCR5 (Mack (1999) loc. cit.). В синовиальных образцах, полученных перед опытами по уничтожению, анализом FACS было подтверждено, что большинство лимфоцитов и моноцитов экспрессируют CCR5, в то время как на гранулоцитах экспрессии CCR5 не было обнаружено (данные не показаны). Для опытов по уничтожению синовиальную жидкость инкубировали ex vivo с различными концентрациями биспецифического антитела в течение 20 часов (Фиг.14). Синовиальную жидкость инкубировали сразу после проведения пункции без всякого препарирования, чтобы условия in vitro были максимально сходными с условиями in vivo, когда антитело будет присутствовать внутри воспаленных суставов. Как показано на Фиг.14, биспецифическое антитело индуцировало уничтожение большинства лимфоцитов и моноцитов в синовиальной жидкости, в то время как гранулоциты, которые не экспрессируют CCR5, остались незатронутыми. Показательный FACS-анализ уничтожения моноцитов и лимфоцитов в синовиальной жидкости при концентрации 0,5 мкг/мл αCCR5-αCD3 приведен на Фиг.15. Только ССR5-отрицательные нейтрофилы (PMN, полиморфонуклеарные клетки) не подвержены действию биспецифического антитела.
Антитела инкубировали с синовиальной жидкостью от одного до нескольких дней. Уже через 24 часа ССR5-положительные лимфоциты и моноциты почти исчезли. Когда среду проверили после более длительной инкубации, моноциты дифференцировались в макрофаги, видимые на дне колбы с культурой. После соответствующей инкубации с биспецифическим антителом макрофаги были уже не видны.
Соответствующий результат может быть получен при инкубации культивированных РВМС с биспецифическим антителом, как описано выше. В этом случае наблюдается почти полное уничтожение ССR5-положительных моноцитов и почти полное уничтожение ССR5-положительных Т-лимфоцитов. Уничтожение ССR5-положительных Т-клеток и моноцитов показано графически.
Эти результаты показывают, что конструкция по данному изобретению способна разрушать ССR5-положительные моноциты. Это относится как к моноцитам из суставной жидкости, так и к моноцитам крови, которые экспрессируют CCR5 при дифференциации в макрофаги. Уничтожение моноцитов/макрофагов происходит в пределах нескольких часов (<24 ч). В частности, уничтожение моноцитов/макрофагов в суставах имеет большое преимущество в терапии, поскольку в основном именно эти клетки ответственны за разрушение суставов. Более того, для активации Т-лимфоцитов также требуется взаимодействие с макрофагами, так что одновременно подавляется функция Т-лимфоцитов.
В дополнение к уничтожению моноцитов/макрофагов наблюдается существенное снижение количества ССR5-положительных Т-лимфоцитов.
6.3 Сравнение эффективности биспецифического антитела α*CCR5-αCD3 и моноклональных антител
Эффективность биспецифического одноцепочечного антитела αCCR5-αCD3 в уничтожении ССR5-положительных моноцитов сравнивали с эффективностью двух немодифицированных моноклональных антител. РВМС от двух разных доноров (F и N) культивировали в течение ночи и затем инкубировали 24 часа со средой, с биспецифическим одноцепочечным антителом (125 нг/мл), МС-1 (5 мкг/мл) и МС-5 (5 мкг/мл). Моноклональное антитело МС-1, родительское антитело для биспецифического одноцепочечного антитела, имеет изотип мышиного lgG1, а антитело МС-5 имеет изотип lgG-2a. Клетки извлекли полностью и проанализировали методом FACS с подсчетом выживших моноцитов и лимфоцитов.
Фиг.16 показывает тот неожиданный факт, что только биспецифическое антитело было способно в значительной степени уничтожать ССR5-положительные моноциты, в то время как немодифицированные моноклональные антитела были практически неэффективными даже при концентрации в 40 раз выше по сравнению с биспецифическим антителом αCCR5-αCD3. Анализ FACS с использованием свойств прямого и бокового светорассеяния лимфоцитов и моноцитов показывает, что только биспецифическое антитело αCCR5-αCD3, но не моноклональные антитела способно уничтожать культивированные моноциты (Фиг.17; сравните верхнюю правую панель с нижними панелями).
6.4 Уничтожение клеток, экспрессирующих хемокиновый рецептор, конструкцией RANTES-PE38
СНО-клетки, экспрессирующие CCR5 или CXCR4, выращивали до субслияния в 24-луночной пластине культур и инкубировали с различными концентрациями очищенного RANTES-PE38 или среды в качестве контрольного опыта. Через 40 часов прикрепившиеся и неприкрепившиеся клетки извлекли и проанализировали методом FACS для измерения процента мертвых клеток. Ранее было установлено, что мертвые (пропидия иодид-положительные) СНО клетки могут быть идентифицированы по их светорассеивающим свойствам.
Далее анализировали цитотоксическую активность RANTES-PE38. С этой целью мы инкубировали СНО-клетки, экспрессирующие человеческий CCR5, мышиный CCR5 и человеческий CXCR4 с различными концентрациями хемокин-токсина или среды. Выживших (прикрепившихся) человеческих или мышиных CCR5-положительных СНО-клеток не было обнаружено оптическим микроскопом через 40 часов инкубации всего с 10 нм RANTES-PE38. В противоположность этому, регулярный рост и выживание наблюдались при инкубации ССR5-положительных клеток со средой или при инкубации СХСR4-положительных СНО-клеток с равными концентрациями хемокин-токсина (данные не показаны). Для количественной оценки мертвых клеток прикрепившиеся и неприкрепившиеся клетки анализировали методом FACS. Ранее было установлено, что живые и мертвые СНО клетки могут быть идентифицированы по их светорассеивающим свойствам; положение мертвых и живых клеток показано стрелками (Фиг.18). Как показано на Фиг.18, цитотоксический эффект RANTES-PE38 на СНО клетки, экспрессирующие CXCR4, не был обнаружен, в то время как СНО-клетки, экспрессирующие человеческий CCR5, были полностью убиты концентрацией 10 нМ RANTES-PE38.
Эти опыты показывают, что RANTES-PE38 способен интернализовать CCR5 с поверхности клеток и индуцировать уничтожение клеток, экспрессирующих рецепторы RANTES hCCR5 или mCCR5. Инактивность конструкции против CXCR4-положительных СНО-клеток показывает, что цитотоксическая активность конструкции ограничена клетками, которые экспрессируют специфические хемокиновые рецепторы.
Пример 7: Анализ вирусной инфекции на стабильно трансфектированных клетках
Клетки GHOST 34 CCR5 были выведены из клеток HOS/CD4, стабильно экспрессирующих CCR5, и предоставлены Дэном Литтманом (Skirball Institute, New York). 2,5×104 клеток в 48-луночных пластинах подвергли действию 100 мкл хемокина при соответствующем разбавлении в течение 30 минут при 37°С. Добавили 100 мкл NSI, ССR5-зависимого штамма ВИЧ-1, SF 162 при концентрации 1000 фокусообразующих единиц/мл (FFU/мл) и инкубировали клетки еще 3 часа. Затем клетки промыли и инкубировали в среде, содержащей соответствующий хемокин в течение 4 дней перед фиксацией, окрашиванием in situ на продуцирование р24 и оценки фокусов инфекции, как описано выше.
Пример 8: Концентрационно-зависимое связывание CCR5×CD3 с CCR5-экспрессируюшими СНО-клетками.
Клетки яичника китайского хомяка, стабильно трансфектированные CCR5 (ССR5+СНО), использовали в качестве целевых клеток для исследований по связыванию биспецифического scFv CCR5×CD3 (как описано в Примере 2 и показано на Фиг.3). Эти клетки были отрицательными на CD3 и в более чем 95% случаев положительными на CCR5, что было показано анализом на связывание с родительским антителом МС-1 (как описано в Примере 5 и показано на Фиг.10). Связывание оценивали путем проточной цитометрии на основе анализа на связывание. 4×105 CCR5+CHO-клeтoк пересуспендировали в 50 мкл буфера FACS (PBS с 1 % тепло-инактивированной эмбриональной телячьей сыворотки (FCS) и 0,05 % Na3 N), содержащего scFv CCR5×CD3 при различном разбавлении от 20 мкг/мл до 19,5 нг/мл. Клетки инкубировали в 96-луночной микротитровальной пластине в течение 30 минут при 4°С. Клетки дважды промыли буфером FACS и инкубировали 45 минут при 4°С с 20 мкг/мл моноклонального антитела против His-Тag (Dianova). Специфически связанный scFv CCR5×CD3 обнаруживали при помощи козьего антимышиного IgG F(аb’)2-РЕ-конъюгированного антитела (Dianova). После промывки клетки анализировали в проточном цитометре FACSCalibur (Becton-Dickinson) с использованием программного обеспечения CellQuest (Becton-Dickinson) для расчета медиан интенсивности флуоресценции для образцов с различной концентрацией. Анализ методом нелинейной регрессии выполняли при помощи GraphPad Prizm (Version 3.02). Концентрационно-зависимое связывание scFv CCR5×CD3 с ССR5-экспрессирующими СНО-клетками было зарегистрировано с величиной КD 0,86 мкг/мл (Фиг.20).
Пример 9: Цитотоксическая активность CCR5×CD3 с первичными Т-лимфоцитами в качестве эффекторных клеток
Способность scFv CCR5×CD3 (описанного в Примере 2 и показанного на Фиг.3) опосредовать цитотоксичность к ССR5-положительным клеткам исследовали с использованием стабильно трансфектированных CCRS+CHO в качестве целевых клеток и СD3-положительных Т-лимфоцитов, полученных из периферической крови, в качестве эффекторных клеток. Цитотоксичность определяли при помощи анализа на основе FACS.
СD3-положительные Т-клетки (включая CD4+ и CD8+ клетки) изолировали из периферической крови путем отрицательной селекции с использованием колонки обогащения человеческих Т-клеток (R&D Systems). С этой целью подготовили РВМС путем стандартного градиентного разделения Ficoll-Hypaque и внесли их в колонку. В-клетки и моноциты связались с матрицей колонки, а Т-клетки элюировались. Обогащенные Т-клетки промыли средой и использовали в качестве эффекторных клеток.
Для различения целевых клеток и эффекторных клеток в проточной цитометрии в ССR5+СНО-клетки ввели метку алифатическим мембранным красителем РКН26 (Sigma) при конечной концентрации 12 мкМ. 0,5×105 меченных ССR5+СНО-клеток и 2,5×105 CD3+ Т-клеток засеяли в 96-луночную микротитровальную пластину при соотношении эффекторных и целевых клеток 5:1. 100-мкл порции scFv CCR5×CD3 с различным разбавлением от 320 нг/мл до 0,3 пг/мл инкубировали с клетками в течение 16 часов при 37°С во влажной атмосфере при 5% СO2. Затем клетки центрифугировали 3 минуты при 600 g и клеточные шарики пересуспендировали в 200 мкл буфера FACS (PBS, 1% FCS и 0,05% Na3N). После окрашивания 1 мкг/мл пропидия иодида (PI) клетки анализировали в парных опытах в проточном цитометре (FACSCalibur, Becton-Dickinson).
Для подтверждения специфичности scFv ССR5×СD3-опосредованного лизиса стабильно СХСR4-трансфектированные СНО-клетки использовали в качестве отрицательных контрольных целевых клеток. Анализ на цитотоксичность выполняли в условиях, идентичных описанным для ССR5+СНО-клеток.
Специфический лизис ССR5+СНО-клеток рассчитывали с использованием программного обеспечения CellQuest (Becton-Dickinson), а анализ методом нелинейной регрессии выполняли при помощи GraphPad Prizm. Сигмоидальная кривая реакции на дозу (Фиг.21) показала величину ЕС50 912 пг/мл. Цитотоксического эффекта scFv CCR5×CD3 при использовании CXCR4+ СНО-клеток в качестве целевых не было обнаружено.
Пример 10: Цитотоксическая активность CCR5×CD3 с клоном Т-клеток СВ15 в качестве эффекторных клеток
Цитотоксическую активность scFv CCR5×CD3 (описанного в Примере 2 и показанного на Фиг.3) в отношении ССR5-положительных клеток также исследовали с использованием СО3-положительной клеточной линии СВ15 (CD4+) в качестве эффекторных клеток. Для определения цитотоксичности проводили анализ на основе FACS с ССR5-трансфектированными СНО-клетками (CCR5+CHO) в качестве целевых клеток.
В клетки CCR5+CHO ввели метку алифатическим мембранным красителем РКН26 (Sigma) при конечной концентрации 10 мкМ. Эффекторные и целевые клетки инкубировали в микротитровальной пластине при соотношении 10:1 со 100 мкл scFv CCR5×CD3 при различном разбавлении от 40 мкг/мл до 0,15 нг/мл в течение 6 часов при 37°С во влажной атмосфере при 5% СO2. Затем клетки центрифугировали 3 минуты при 600 g, и клеточные шарики пересуспендировали в 200 мкл буфера FACS (PBS, 1% FCS и 0,05% Na3N). После окрашивания 1 мкг/мл пропидия иодида (PI) клетки анализировали в парных опытах в проточном цитометре (FACSCalibur, Becton-Dickinson).
Специфический лизис ССR5+СНО-клеток рассчитывали с использованием программного обеспечения CellQuest (Becton-Dickinson), а анализ методом нелинейной регрессии выполняли при помощи GraphPad Prizm. Сигмоидальная кривая реакции на дозу (Фиг.22) показала величину ЕС50 12,8 нг/мл.
Результаты, полученные при использовании клона Т-клеток СВ15 в качестве эффекторных клеток, в анализе биоактивности показали, что специфический лизис, опосредованный scFv CCR5×CD3, не ограничивается цитотоксической активностью CD8+ CTL, так как СD4+-Т-кпетки также участвуют в этом процессе.
Пример 11: Картирование эпитопа родительского ССR5-специфичсского моноклонального антитела МС-1. используемого для конструкции scFv CCR5×CD3
Эпитоп родительского ССR5-специфического моноклонального антитела МС-1, используемого для конструкции scFv CCR5×CD3 (описанного в Примере 2 и показанного на Фиг.3), картировали путем проточной цитометрии с использованием панели из -70 клеточных линий СНО-К1, стабильно экспрессирующих химерные и точечные мутантные рецепторы (Samson, J. Biol. Chem., 1997, 272, 24934-24941; Lee, J. Biol. Chem., 1999, 274, 9617-9626; Blanpain, Blood, 2000, 96, 1638-1645). Клетки инкубировали 30 минут на льду с mab МС-1, промыли и окрасили РЕ-конъюгированным антимышиным lg-антителом (Sigma). Клетки СНО-К1, экспрессирующие CCR2b, использовали в качестве отрицательного контрольного опыта. Как выяснилось, МС-1 узнает первую часть второй внеклеточной петли (ECL2) молекулы CCR5 (данные не показаны). ECL2 занимает диапазон аа 168-199 (RSQ KEGLHYTCSS HFPYSQYQFW KNFQTLKIV) и расположена между трансмембранными областями 4 и 5 CCR5, как описано у Chen, J. Virol., 1997, 71, 2705-2714.
Аминокислотные последовательности CCR5 человека и макака резус отличаются в восьми аминокислотах, при этом два аминокислотных изменения находятся в ECL2 в положении аа 171 (К→R) и аа 198 (I→M) (Chen, J. Virol., 1997, 71, 2705-2714). В связи с этими аминокислотными изменениями исследовали потенциальную перекрестную реакционноспособность МС-1 с ECL2 CCR5 макака резус с использованием PBMCs человека и резуса в анализе на основе FACS. РВМС обоих видов изолировали путем стандартного градиентного центрифугирования Ficoll. 5×105 клеток суспендировали в 50 мкл буфера FACS и добавили 50 мкг/мл МС-1. После 30 минут инкубации при 4°С клетки промыли и окрашивали козьим антимышиным IgG F(аb’)2-РЕ-конъюгированным моноклональным антителом (Dianova) в течение 30 минут при 4°С в темноте. Клетки промыли и исследовали в проточном цитометре (FACSCalibur Becton-Dickinson).
Как показано на Фиг.23, МС-1 связывается исключительно с человеческим CCR5 и не реагирует с CCR5 от макака резус. Эти данные показывают, что эпитоп, узнаваемый МС-1, является специфическим для человеческого CCR5 и что лизин в положении 171 и изолейцин в положении 198 в последовательности человеческого CCR5 являются необходимыми для этой специфичности. Основное участие в специфическом узнавании человеческого эпитопа CCR5 моноклональным антителом МС-1 принимает лизин в положении аа 171, расположенный в первой части ECL2.
Пример 12: scFv ССR5×СD3-опосредованное снижение продуцирования вируса в ВИЧ-1-инфицированных моноцитах
Препарировали РВМС из свежих светлых слоев кровяного сгустка здоровых доноров путем стандартного градиентного центрифугирования Ficoll и изолировали моноциты путем сцепления с культуральными колбами в течение ночи. Остальные PBL отделили и культивировали отдельно при 37°С во влажной атмосфере при 5% СO2.
Моноциты засеяли в 48-луночную микротитровальную пластину с плотностью 5×104 клеток/лунку и инфицировали М-тропным штаммом ВИЧ-1 Bal (moi=1) в течение ночи при 37°С во влажной атмосфере при 5% СO2. Вирус удалили путем промывки, а моноциты продолжали культивировать с нестимулированными PBL (15× 104 на лунку) + scFv CCR5×CD3 (1 мкг/мл) + AZT (75 мкМ) или только с нестимулированными PBL (15×104 на лунку) в качестве отрицательного контрольного опыта. Через 5 дней после инфицирования (p.i.) моноциты промыли и культивировали в отсутствие AZT или антитела. Супернатант собрали на 15 день p.i. и оценили репликацию ВИЧ-1 путем измерения р24 методом ELISA. Такой экспериментальный подход показал снижение вирусной репликации на 75 % в образцах, содержащих scFv CCR5×CD3 (75 нг/мл р24) по сравнению с контрольными без scFv CCR5×CD3 (300 нг/мл р24).


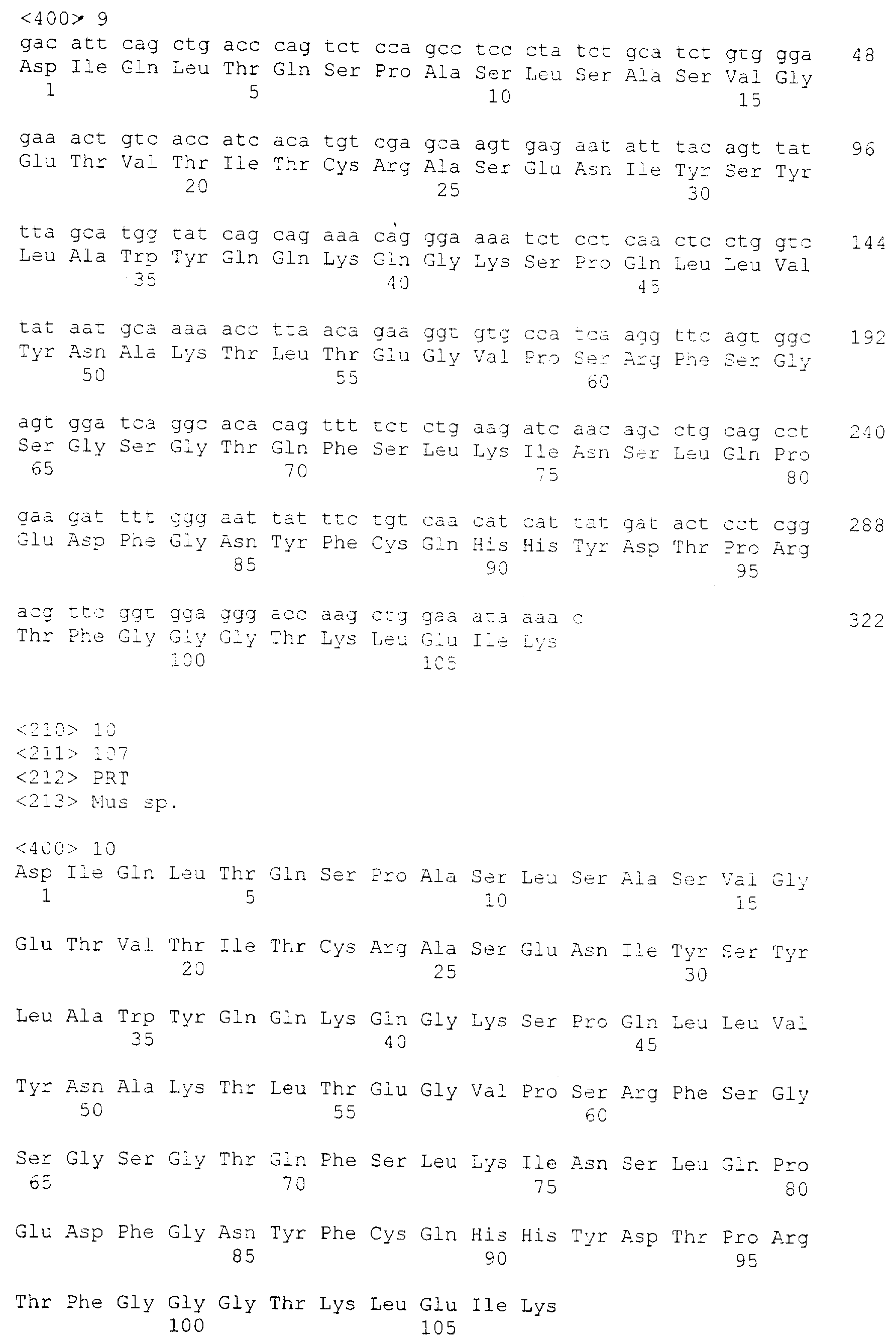




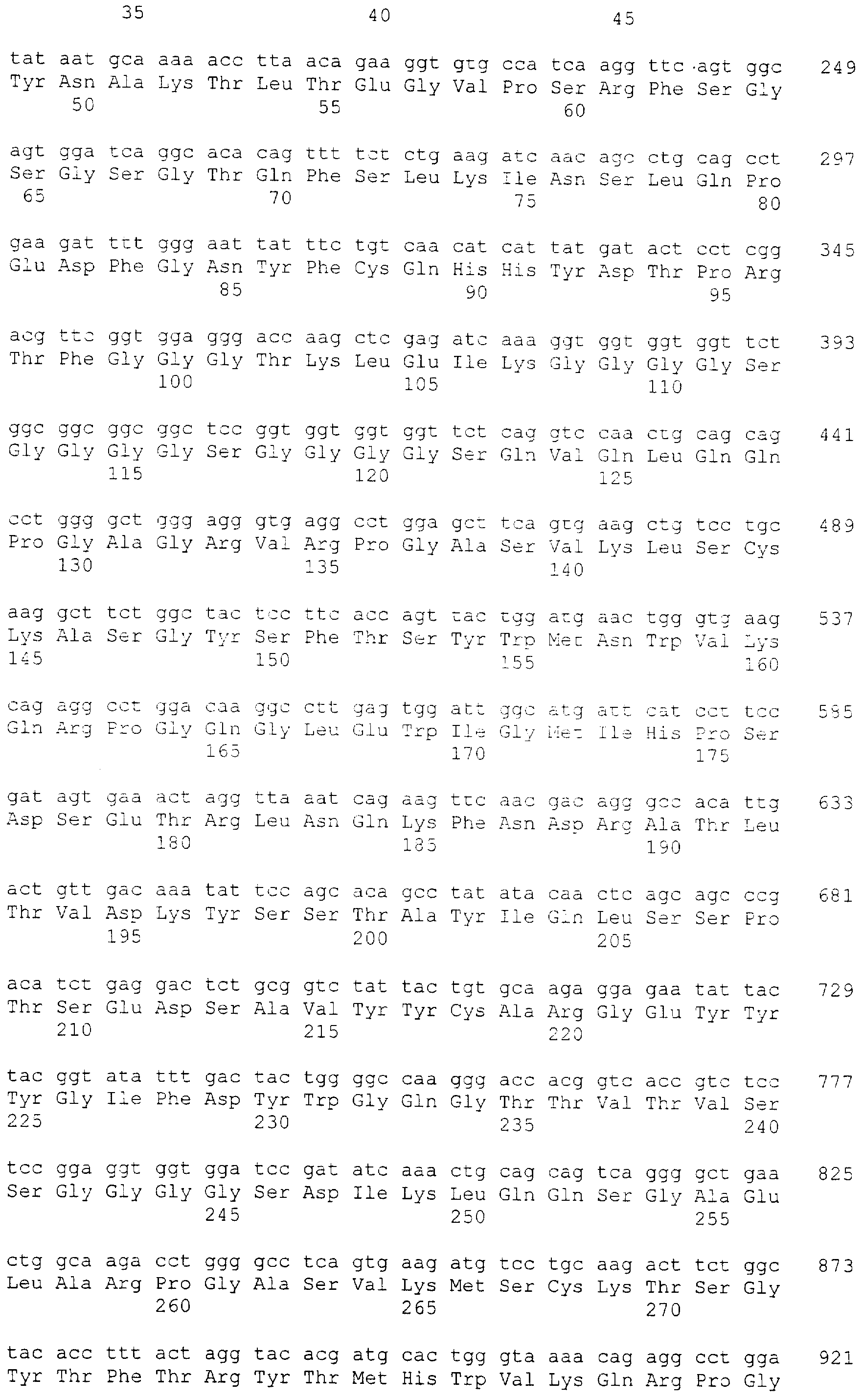










Реферат
Изобретение относится к области применения конструкции антитела и/или хемокина, которая связывается с хемокиновым рецептором, для получения фармацевтической композиции для устранения клеток, которые латентно инфицированы вирусом иммунодефицита приматов. Сущность изобретения состоит в применении конструкции антитела и/или хемокина, которая связывается с хемокиновым рецептором, для получения фармацевтической композиции для лечения, профилактики и/или облегчения воспалительных заболеваний почек, воспалительных заболеваний кишечника, множественного склероза заболеваний кожи, диабета или отторжения трансплантата. Изобретение относится также к конструкциям антитела и/или хемокина, в которых конструкция антитела включает сайт связывания с хемокиновым рецептором 5 и сайт связывания с CD3 и в которых конструкция хемокина включает RANTES и токсин. Изобретение также описывает полинуклеотиды, кодирующие упомянутые конструкции антител и/или хемокинов, и векторы и хозяев, содержащих нуклеиновокислотные молекулы. Технический результат - расширение арсенала средств для генетического лечения иммунологических нарушений. 14 с. и 63 з.п.ф-лы, 4 табл., 23 ил.


Комментарии