Легковыделяемые биспецифические антитела с природным иммуноглобулиновым форматом - RU2569157C2
Код документа: RU2569157C2
Чертежи








Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к антигенсвязывающим белкам или антителам с гетеродимерами тяжелых цепей, т.е. антителам с двумя тяжелыми цепями иммуноглобулинов, которые отличаются по меньшей мере одной аминокислотой, что позволяет проводить выделение антигенсвязывающего белка на основе различной аффинности к аффинному реагенту тяжелой цепи иммуноглобулина и модифицированной или мутированной тяжелой цепи иммуноглобулина. Изобретение также относится к антигенсвязывающим белкам (в том числе, к биспецифическим антителам), которые имеют участки СН2 и СН3 IgG с различными аффинностями к белку А, что обеспечивает их быстрое выделение за счет различного связывания участков IgG с белком А.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Антитела представляют собой многофункциональные молекулы, обладающие уникальной специфичностью связывания мишеневого антигена, а также способностью к взаимодействию с иммунной системой посредством механизмов, которые являются антиген-независимыми. Многие биологические лекарственные средства, используемые в настоящее время для лечения рака, представляют собой моноклональные антитела, направленные против антигенов, которые, как правило, сверхэкспрессированы на мишеневой злокачественной клетке. Если такие антитела связывают опухолевые клетки, то они могут запускать механизм антитело-зависимой клеточной цитотоксичности (ADCC) или комплемент-зависимой цитотоксичности (CDC). К сожалению, злокачественные клетки часто обладают механизмами, которые подавляют эти нормальные иммунные ответы.
В последние годы значительные усилия были направлены на создание терапевтических средств, аналогичных антителам, которые обладают более чем одной антиген-связывающей специфичностью, например, биспецифических антител. В случае способов лечения злокачественной опухоли, полиспецифический характер может обеспечить возможность применения, например, одной связывающей специфичности для нацеливания молекулы к антигену опухолевой клетки, а другой связывающей специфичности для индукции ответа, который в норме отсутствует в иммунной системе. Биспецифические антитела также могут быть использованы в качестве лигандов-заменителей для двухкомпонентных гетеродимерных рецепторных систем, которые в норме активируются их природным лигандом, который связывает и объединяет оба компонента.
В данной области разработаны различные форматы для направления терапевтического потенциала, обусловленного молекулами с многочисленными связывающими специфичностями. Желательно, такие молекулы должны представлять собой удобные в работе белки, которые легко получать и очищать, и которые обладают подходящими свойствами in vivo, например, фармакокинетикой, подходящей для намеченной мишени, минимальной иммуногенностью и, если необходимо, эффекторными функциями обычных антител.
Самый прямой способ получения биспецифического антитела (экспрессия двух различных антител в одной клетке) приводит к получению нескольких видов, поскольку соответствующие тяжелые цепи образуют и гомо- и гетеродимеры, а нужны только гетеродимеры. Также, легкие и тяжелые цепи могут образовать пару несоответствующим образом. Ниже описаны некоторые примеры форматов, которые пытаются разрешить эти проблемы различными способами.
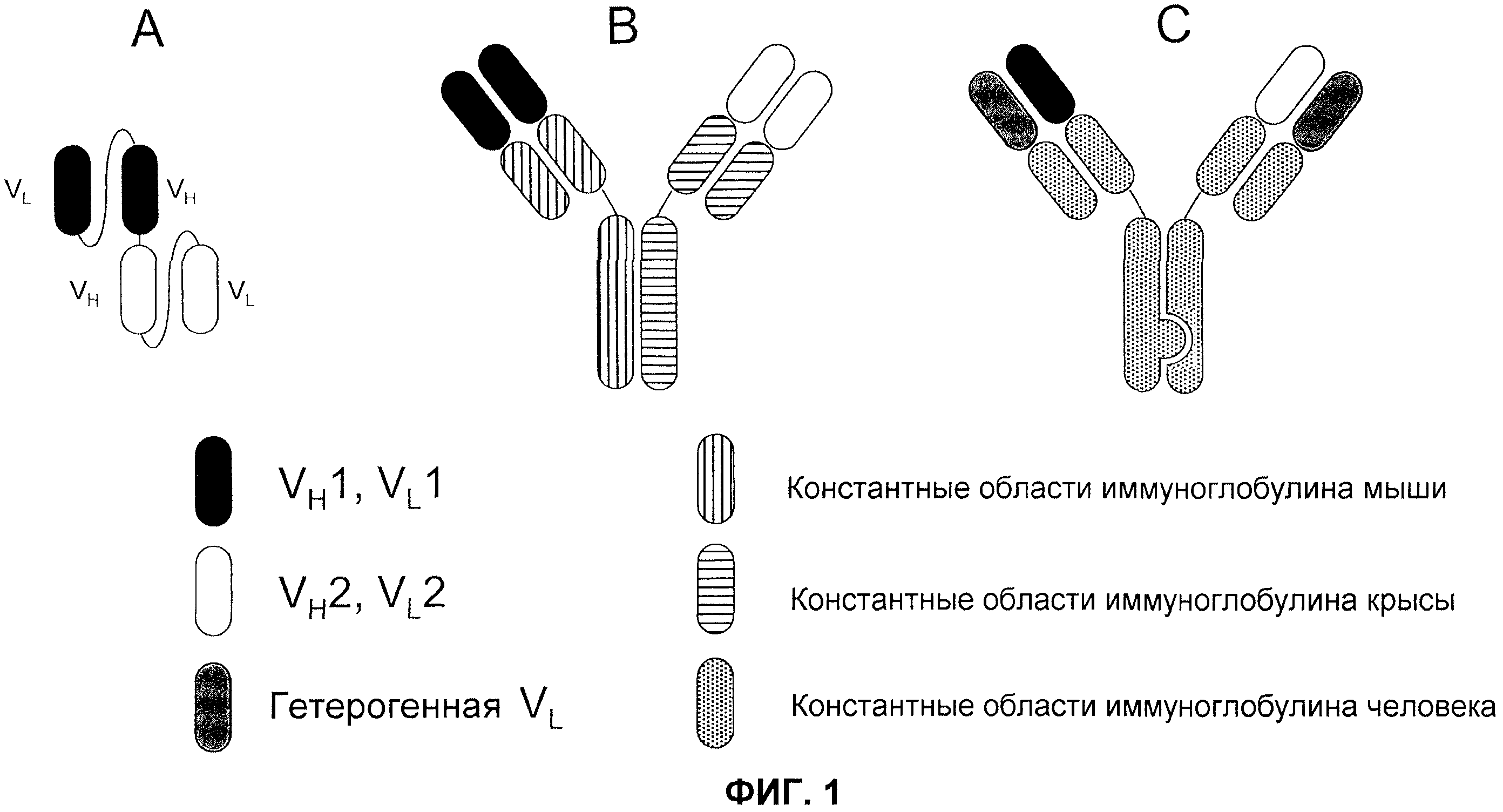
Один из форматов, используемый для биспецифичных молекул-активаторов Т-клеток (BiTE) (см., например. Wolf, E. et al. (2005) Drug Discovery Today 10:1237-1244)), основан на элементах одноцепочечного вариабельного фрагмента (scFv). scFv состоит из вариабельных областей легкой и тяжелой цепи антител, соединенных посредством гибкого линкера, который, как правило, может сворачиваться соответствующим образом и благодаря этому области могут связывать "свой" антиген. BiTE последовательно соединяет две различные специфичности scFv на одной цепи (см. фиг.1А). Подобная конфигурация предотвращает получение молекул с двумя копиями вариабельной области одной и той же тяжелой цепи. Кроме того, конструируют конфигурацию линкера для обеспечения правильного объединения соответствующих легких и тяжелых цепей.
Формат BiTE имеет некоторые недостатки. Во-первых, общеизвестно, что молекулы scFv склонны к агрегации. И хотя иммуногенность линкеров scFv по общему мнению является низкой, нельзя исключить возможность продукции антител против BiTE. Отсутствие участка Fc в формате BiTE также делает его время полужизни в сыворотке очень короткой, и это влечет за собой сложности вследствие частых повторных введений или вследствие непрерывной инфузии посредством помпы. В конечном итоге, отсутствие Fc также подразумевает отсутствие эффекторных функций, опосредованных Fc, которые могут являться эффективными в некоторых условиях.
Второй формат (фиг.1В) представляет собой гибрид моноклонального антитела мыши и крысы, и основывается на модификации общепринятой аффинной хроматографии с белком А (см., например, Lindhofer, H. et al. (1995) J. Immunol. 155:219-225)). В данном формате, антитело IgG2a мыши и IgG2b крысы продуцируются вместе в одной клетке (например, либо в виде квадромы, полученной слиянием двух гибридом, либо в сконструированных клетках СНО). Так как легкие цепи каждого антитела связываются преимущественно тяжелыми цепями родственных видов, то можно получить только три отдельных вида антител: два исходных антитела, и гетеродимер двух антител, содержащий одну пару тяжелой/легкой цепи каждого, связанную посредством их участков Fc. Требуемый гетеродимер можно легко очищать из смеси, так как его свойства связывания с белком А отличаются от свойств связывания исходных антител: IgG2b крысы не связывается с белком А, в то время как IgG2a мыши связывается. Таким образом, гетеродимер мышь-крыса связывается с белком А, но элюируется при более высоком значении рН, чем гомодимер IgG2a мыши, и это делает возможным селективную очистку биспецифического антитела. Как и в случае с форматом BiTE, этот гибридный формат обладает двумя моновалентными антигенсвязывающими участками.
Недостатком гибрида мышь/крыса в том, что он не является человеческим, это, вероятно, вызовет иммунный ответ у пациента, что может иметь побочные эффекты (например, реакции «НАМА» или «HARA»), и/или нейтрализовать эффект терапии.
На современном уровне техники обсуждали третий формат, обозначаемый как «выступы-во-впадины» (фиг.1C), как возможно эффективный для получения биспецифических антител (патент США №7183076). В этой стратегии, конструируют участки Fc из двух антител для создания одного выступающего «выступа», и другой комплементарной «впадины». Утверждают, что будучи полученными в одной и той же клетке, тяжелые цепи преимущественно образуют гетеродимеры, а не гомодимеры, посредством объединения сконструированных «выступов» с конструированными «впадинами». Проблемы правильного спаривания легкой и тяжелой цепи решают посредством выбора антител, которые обладают различными специфичностями, но используют одинаковые легкие цепи.
Недостаток этого формата состоит в том, что стратегия «выступы-во-впадины» может приводить к продукции значительного количества гомодимеров, что, таким образом, влечет за собой дополнительные стадии очистки. Эта проблема осложняется тем фактом, что контаминирующие виды по многим своим свойствам очень похожи на желаемые виды. Сконструированные формы могут также являться иммуногенными, так как мутации, вводимые для создания «выступов» и «впадин», привносят чужеродные последовательности.
Сохраняется необходимость в формате биспецифического антитела, в частности для терапевтического применения, который минимизирует некоторые или все недостатки, перечисленные выше.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 проиллюстрировано три формата биспецифического антитела: (А) биспецифический активатор Т-клеток (BiTE); (В) гибрид мышь-крыса; и (С) "выступы-во-впадины" с общей легкой цепью.
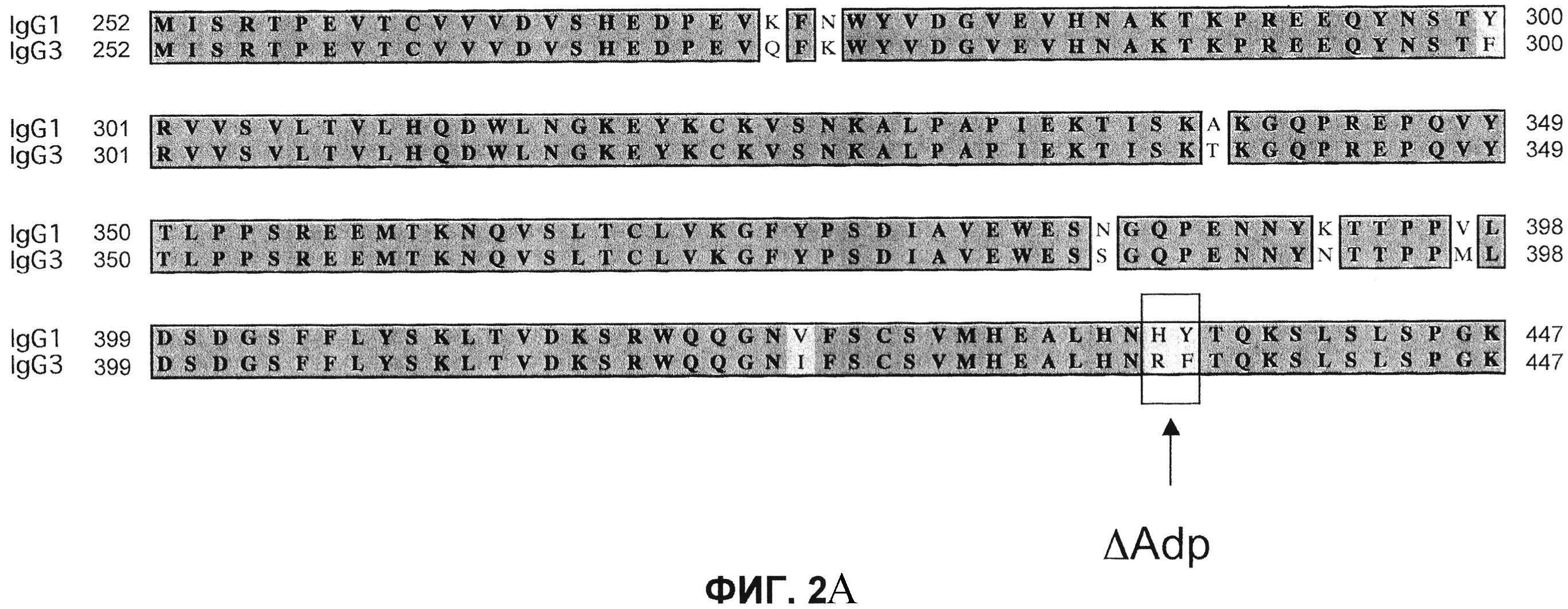
На фиг.2 проиллюстрирована модификация FcAAdp: (A) выравнивание Fc-областей IgC1 человека (SEQ ID NO:1) и IgG3 (SEQ ID NO:3), демонстрирующее модификацию FcAAdp, окаймленную рамкой; (В) схематическое изображение биспецифического антитела FcAAdp.
На фиг.3 проиллюстрировано выравнивание доменов СН3 IgG1 человека (с использованием нумерации экзонов IMGT и нумерацию EU), IgG2, и IgG4, с дипептидной модификацией AAdp и без дипептидной модификации AAdp, а также IgG3.
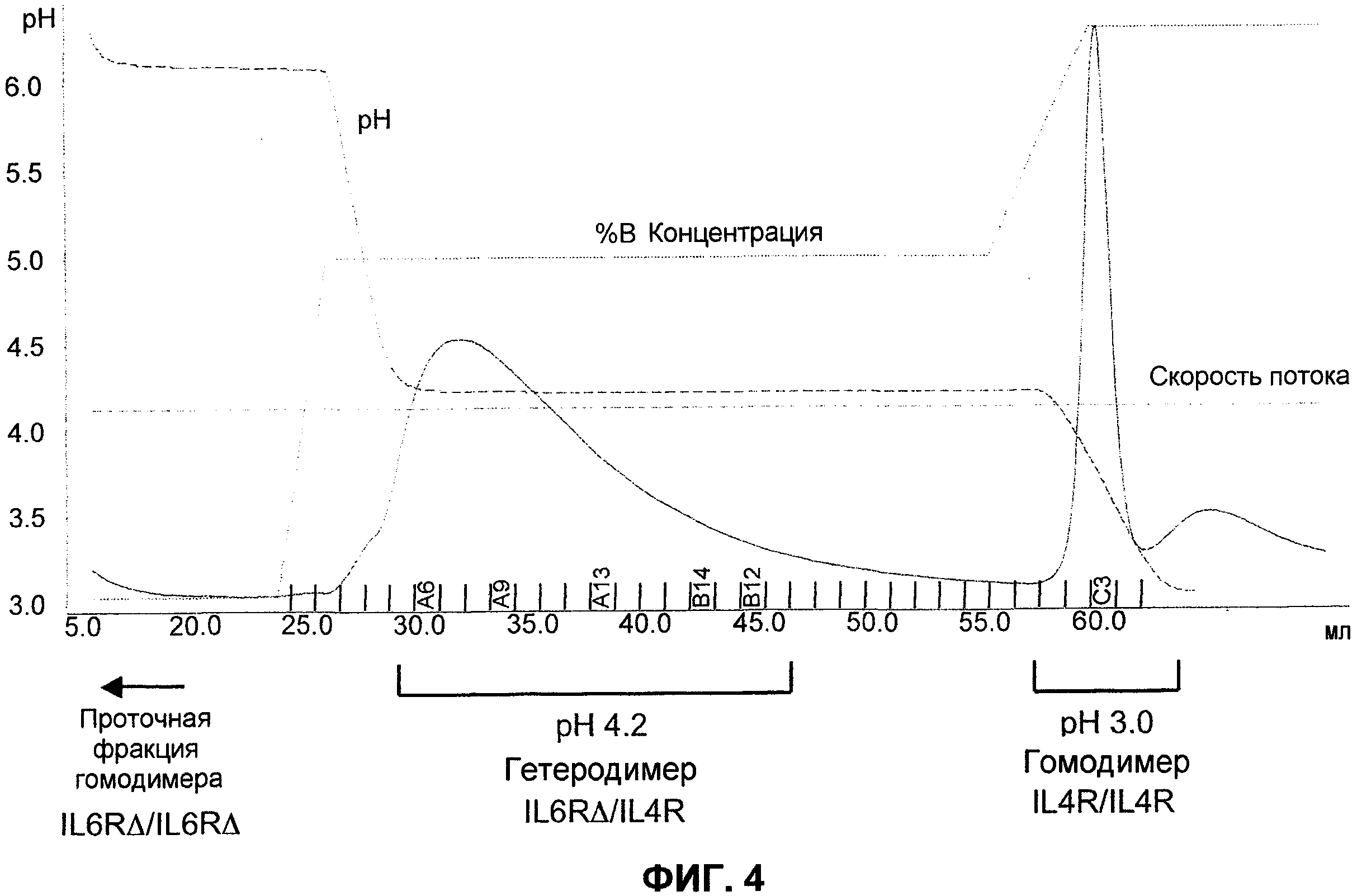
На фиг.4 показана регистрация результатов выделения биспецифического антитела на колонке с белком А, которые показывают профиль элюции с использованием ступенчатого градиента.
На фиг.5 представлен профиль связывания IL4-Ra и IL-6Ra в BIACORE™ для фракций, элюированных с колонки при хроматографическом разделения, показанном на фиг.4. Антитела во фракциях захватывали иммобилизованными антителами против Fc и затем растворимые IL-4Ra или IL-6Ra исследовали на связывание с захваченными антителами.
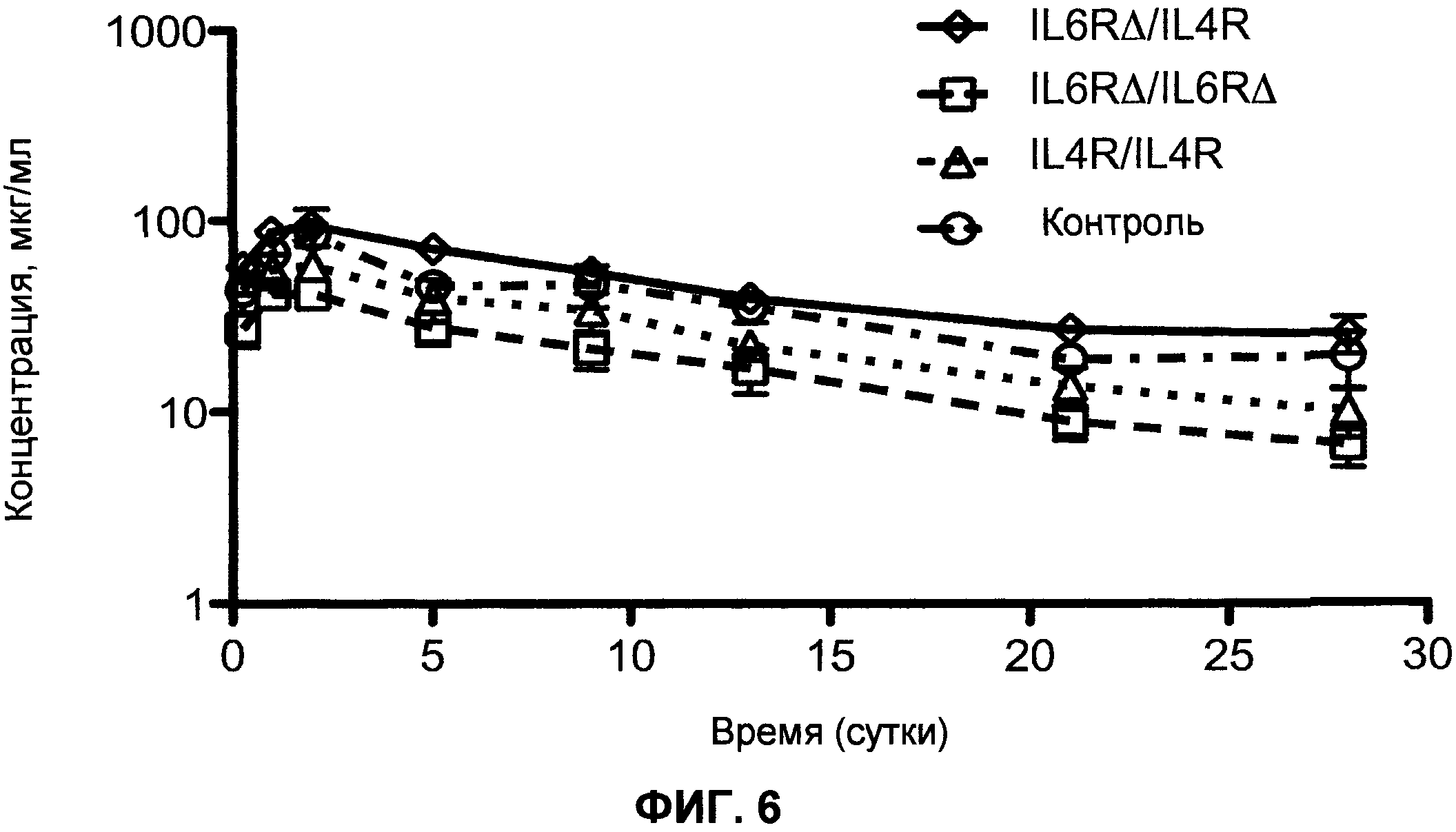
На фиг.6 показан фармакокинетический профиль биспецифического антитела FcΔAdp (IL-6RΔ/IL-4R), гомодимера FcΔAdp (IL-6RΔ/IL-6RΔ), антитела IgG1 с последовательностью СН3 дикого типа (IL-4R/IL-4R) и контрольного моноспецифического антитела.
На фиг.7 проиллюстрирована эффективность биспецифического антитела CD20×CD3ΔAdp в анализе цитолиза клеток Raji.
На фиг.8 проиллюстрирован неспецифический цитолиз клеток (293) с биспецифическим антителом CD20×CD3ΔAdp.
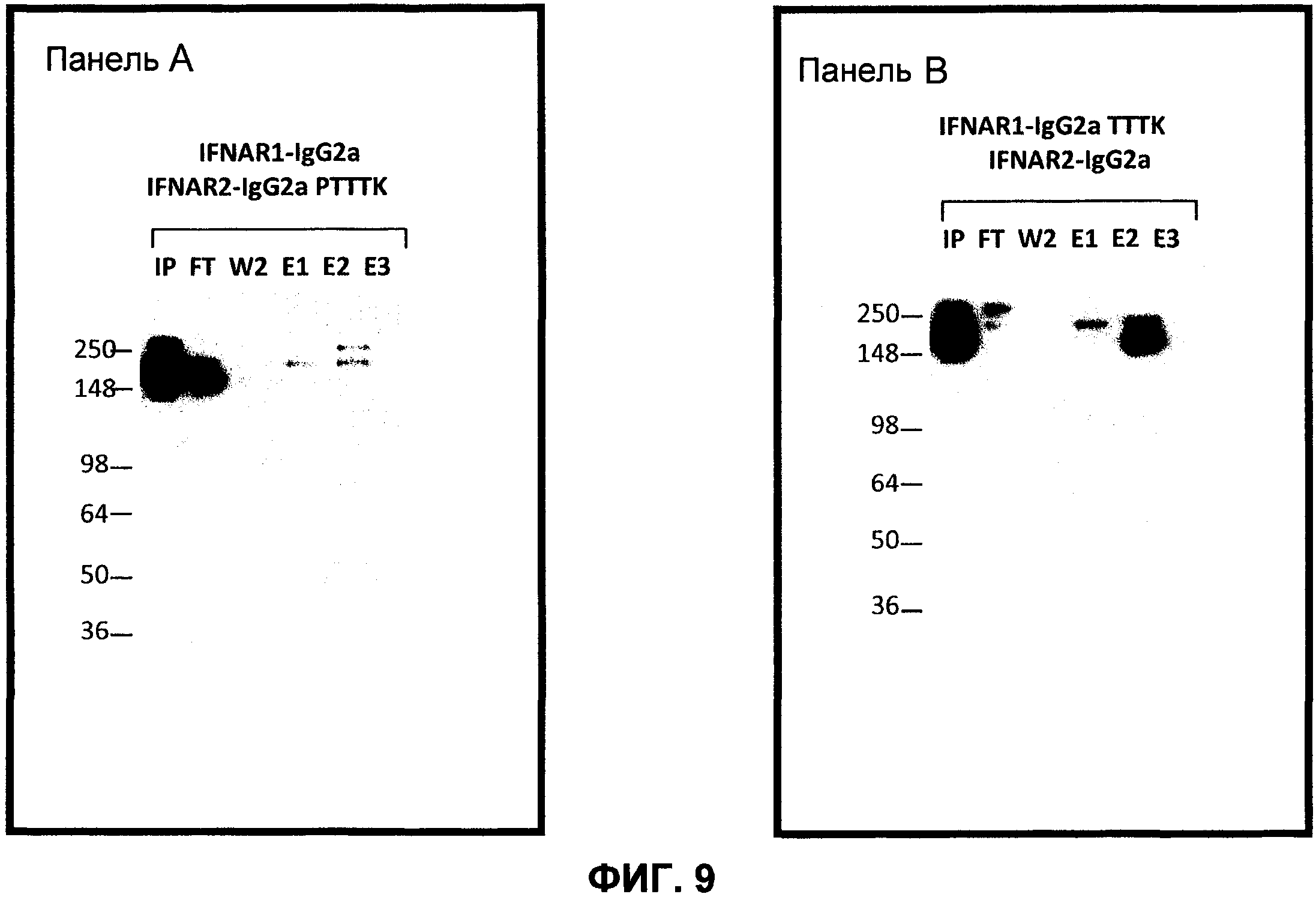
На фиг.9 показаны результаты экспериментов по экспрессии, с использованием различных гетеродимеров mFc. Панель А: анализ Вестерн-блоттинг зависящего от рН разделения гетеродимерного mIgG2a/mIgG2aPTTTK от гомодимерного mIgG2a и гомодимерного IgG2aPTTTK; панель В: анализ Вестерн-блоттинг зависящего от рН разделения гетеродимерного mIgG2a/mIgG2aTTTK от гомодимерного mIgG2a и гомодимерного IgG2aTTTK; IP=исходная фракция; FT=фракция, пропущенная через колонку; W2=вторая промывка (1× PBS рН 7,2); E1 = первая элюция (20 мМ Na цитрат, 1М NaCl рН 5,5); Е2 = вторая элюция (20 мМ Na цитрат, 1М NaCl; 57% рН 5,5+43% рН 2,6); Е3 = третья элюция (20 мМ Na цитрат, 1М NaCI рН 2,6).
На фиг.10 проиллюстрировано предпочтительное образование гетеродимеров мутантов IgG2a над образованием гетеродимеров смешанных изотипов (например, mIgG2a и mIgG1), с использованием соотношения 4:1 для конструкта IFNAR1:IFNAR2. Дорожка 1: IFNAR1-IgG2a:IFNAR2-IgG1; дорожка 2: INFAR1-IgG2a:IFNAR2-IgG2aTTT; дорожка 3: IFNAR1-IgG2a:IFNAR2-IgG2aTTTK; дорожка 4: IFNAR1-IgG2a:IFNAR2-IgG2aPTTTK; дорожка 5: IFNAR1-IgG2a:IFNAR2-IgG2aRF.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение по меньшей мере отчасти основано на использовании в биспецифическом антигенсвязывающем белке двух последовательностей константного домена СН3 тяжелой цепи иммуноглобулина, которые отличаются по меньшей мере одной аминокислотой. Отличие по меньшей мере в одной аминокислоте приводит к повышенной эффективности при выделении белка, так как отличие приводит к различной способности последовательностей домена СН3 связываться с аффинным средством.
В одном из аспектов, разработан антигенсвязывающий белок, содержащий первый и второй полипептид, первый полипептид содержит, от N-конца до С-конца, первую антигенсвязывающую область, которая селективно связывает первый антиген, за которым следует константная область, которая содержит первую область СН3 IgG человека, выбранного из IgG1 (SEQ ID NO:1), IgG2 (SEQ ID NO:3), IgG4 (SEQ ID NO:5), и их комбинацию; и, второй полипептид, содержащий, от N-конца до С-конца, вторую антигенсвязывающую область, которая селективно связывает второй антиген, с последующей константной областью, которая содержит вторую область СН3 IgG человека, выбранную из IgG1, IgG2, IgG4, и их комбинацию, где вторая область СН3 содержит модификацию, которая снижает или устраняет связывание второго домена СН3 с белком А.
В одном из вариантов осуществления вторая область СН3 содержит модификацию 95R (при нумерации экзонов IMGT; 435R при нумерации EU). В другом варианте осуществления вторая область СН3 дополнительно содержит модификацию 96F (IMGT; 436F при EU). В конкретных вариантах осуществления, вторая область СН3 выбрана из SEQ ID NO:2, SEQ ID NO:4 и SEQ ID NO:6.
В одном из вариантов осуществления вторая область СН3 происходит из модифицированного IgG1 человека (SEQ ID NO:2) и дополнительно содержит модификацию, выбранную из группы, состоящей из D16E, L18M, N44S, K52N, V57M и V82I (IMGT; D356E, L358M, N384S, K392N, V397M и V422I при EU).
В одном из вариантов осуществления вторая область СН3 происходит из модифицированного IgG2 человека (SEQ ID NO:4) и дополнительно содержит модификацию, выбранную из группы, состоящей из N44S, K52N и V82I (IMGT; N384S, K392N и V422I при EU).
В одном из вариантов осуществления вторая область СН3 происходит из модифицированного IgG4 человека (SEQ ID NO:6), и дополнительно содержит модификацию, выбранную из группы, состоящей из Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q и V422I при EU).
В одном из вариантов осуществления домен СН3 происходит из химерного домена, который содержит последовательности из двух или более IgG1 человека, IgG2 человека, IgG3 человека и IgG4 человека.
В одном из вариантов осуществления домен СН3 происходит из IgG1 человека, IgG2 человека или IgG4 человека, и антигенсвязывающий белок дополнительно содержит домен СН1 и СН2, где домен СН1 и домен СН2 независимо выбраны из группы, состоящей из домена СН1 или СН2 IgG1 человека, домена СН1 или СН2 IgG2 человека, химерного IgG1/IgG2 человек/человек или химерного IgG1/IgG3 человек/человек или химерного домена IgG2/IgG3 человек/человек или химерного IgG1/IgG4 человек/человек или химерного IgG3/IgG4 или химерного домена IgG2/IgG4. В конкретном варианте осуществления химерные домены IgG1/IgG2, IgG1/IgG3, IgG2/IgG3, IgG1/IgG4, IgG3/IgG4 и IgG2/IgG4 являются неиммунсгонными или по существу неиммуногенными для человека.
В одном из вариантов осуществления антигенсвязывающий белок дополнительно содержит легкую цепь иммуноглобулина. В одном из вариантов осуществления легкая цепь иммуноглобулина выбрана из легкой цепи лямбда и каппа человека.
В одном из вариантов осуществления каждая первая и вторая антигенсвязывающие области содержат по меньшей мере один CDR, в другом варианте осуществления по меньшей мере два CDR, в другом варианте осуществления каждая содержит три CDR. В конкретном варианте осуществления CDR происходят из тяжелой цепи иммуноглобулина. В другом конкретном варианте осуществления тяжелая цепь представляет собой тяжелую цепь иммуноглобулина человека.
В одном из вариантов осуществления первая антигенсвязывающая область содержит первый вариабельный домен тяжелой цепи иммуноглобулина, а вторая антигенсвязывающая область содержит второй вариабельный домен тяжелой цепи иммуноглобулина.
В одном из вариантов осуществления первый и второй вариабельные домены тяжелой цепи иммуноглобулина независимо выбирают из домена иммуноглобулина мыши, крысы, хомяка, кролика, макака, человекообразной обезьяны и человека.
В одном из вариантов осуществления первый и второй вариабельные домены тяжелой цепи иммуноглобулина независимо содержат CDR человека, CDR мыши, CDR крысы, CDR кролика, CDR макака, CDR человекообразной обезьяны и гуманизированные CDR. В одном из вариантов осуществления CDR происходит из человека и является соматически мутированным.
В одном из вариантов осуществления первый и второй вариабельные домены тяжелой цепи иммуноглобулина содержат каркасную область человека (FR). В одном из вариантов осуществления FR человека представляет собой соматически мутированный FR человека.
В одном из вариантов осуществления первую и/или вторую антигенсвязывающие области получают скринингом фаговой библиотеки, содержащей вариабельные области антитела, по реактивности по отношению к представляющему интерес антигену. В другом варианте осуществления первую и/или вторую антигенсвязывающие области получают иммунизацией животного, не являющегося человеком, такого как мышь, крыса, кролик, макака или человекообразная обезьяна, представляющим интерес антигеном и идентификацией последовательности нуклеиновой кислоты вариабельной области антитела, кодирующей вариабельную область, специфичную для представляющего интерес антигена. В конкретном варианте осуществления животное, не являющееся человеком, содержит один или несколько генов вариабельной области иммуноглобулина человека. В другом конкретном варианте осуществления один или несколько генов вариабельной области иммуноглобулина человека представлены в животном, не являющемся человеком, внехромосомно, в виде перестановки в локусе эндогенного иммуноглобулина, или в виде трансгена, случайным образом интегрированного в геном животного, не являющегося человеком. В одном из вариантов осуществления первую и/или вторую антигенсвязывающие области получают из гибридомы или квадромы, в другом варианте осуществления посредством скрининга иммунных клеток иммунизированного животного, не являющегося человеком, используя сортировку клеток.
В одном из вариантов осуществления антигенсвязывающий белок представляет собой биспецифическое антитело. В одном из вариантов осуществления биспецифическое антитело полностью является биспецифическим антителом человека и независимо обладает аффинностью для каждого эпитопа в микромолярном, наномолярном или пикомолярном диапазоне.
В одном из вариантов осуществления антигенсвязывающий белок является неиммуногенным или по существу неиммуногенным для человека. В конкретном варианте осуществления антигенсвязывающий белок не содержит неприродный эпитоп для Т-клетки человека. В одном из вариантов осуществления модификация области СН3 является неиммуногенной или по существу неиммуногенной для человека. В конкретном варианте осуществления модификация области СН3 не приводит в результате к образованию неприродного эпитопа для Т-клетки человека.
В одном из вариантов осуществления антигенсвязывающий белок содержит тяжелую цепь, где тяжелая цепь является неиммуногенной или по существу неиммуногенной для человека. В одном из вариантов осуществления тяжелая цепь имеет аминокислотную последовательность, которая не содержит неприродный эпитоп для Т-клетки. В одном из вариантов осуществления тяжелая цепь содержит аминокислотную последовательность, протеолиз которой не может привести к образованию аминокислотной последовательности из приблизительно 9 аминокислот, которые являются иммуногенными для человека. В конкретном варианте осуществления человек представляет собой человека, который подвергся действию антигенсвязывающего белка. В одном из вариантов осуществления тяжелая цепь содержит аминокислотную последовательность, протеолиз которой не может привести к образованию аминокислотной последовательности, состоящей из приблизительно 13-17 аминокислот, которые являются иммуногенными для человека. В конкретном варианте осуществления человек представляет собой человека, который подвергся действию антигенсвязывающего белка.
В одном из аспектов, представлен биспецифический связывающий белок, содержащий модификации в СН2 и/или СН3, как описано в настоящем документе, где биспецифический связывающий белок содержит первую связывающую молекулу, которая специфически распознает антиген на В-клетке, и вторую связывающую молекулу, которая специфично распознает антиген на Т-клетке.
В одном из вариантов осуществления связывающий белок представляет собой биспецифическое антитело. В конкретном варианте осуществления биспецифическое антитело содержит тяжелую цепь IgG1 человека и тяжелую цепь IgG1ΔAdp человека. В одном из вариантов осуществления первая связывающая молекула представляет собой вариабельный домен тяжелой цепи человека, который специфично распознает CD20. В одном из вариантов осуществления вторая связывающая молекула представляет собой вариабельный домен тяжелой цепи иммуноглобулина человека, который специфично распознает CD3. В одном из вариантов осуществления биспецифическое антитело демонстрирует, в анализе цитолиза Raji, ЕС50 приблизительно равное 2,8-3,2×10-12 M или приблизительно равное 2,8-3,0×10-12 M, и демонстрирует не более, чем приблизительно 1-10%, или 1-5% неспецифического цитолиза в анализе неспецифического клеточного цитолиза, где "фоновая" клетка не содержит эпитоп CD20. В конкретном варианте осуществления "фоновая" клетка представляет собой клетку 293. В другом конкретном варианте осуществления неспецифический клеточный цитолиз в анализе измеряют в концентрации биспецифического антитела от приблизительно 10-8 М до приблизительно 10-14 М.
В одном из аспектов, был создан способ для получения биспецифического антитела, где способ предусматривает: получение последовательности нуклеиновой кислоты, кодирующей первую тяжелую цепь иммуноглобулина, содержащую первый вариабельный домен, который распознает первый эпитоп, где первая тяжелая цепь иммуноглобулина содержит константный домен изотипов IgG1, IgG2 или IgG4, или химерный константный домен этих изотипов; получение второй последовательности нуклеиновой кислоты, кодирующей вторую тяжелую цепь иммуноглобулина, содержащую второй вариабельный домен, который распознает второй эпитоп, где вторая тяжелая цепь иммуноглобулина содержит константный домен изотипов IgG1, IgG2 или IgG4 или химерный константный домен этих изотипов, который содержит модификацию в его домене СН3, которая устраняет или снижает связывание с белком А; получение третьей последовательности нуклеиновой кислоты, кодирующей легкую цепь иммуноглобулина, которая образует пару с первой и второй тяжелой цепью иммуноглобулина; введение первой, второй и третьей последовательности нуклеиновой кислоты в клетку млекопитающего/что позволяет клетке экспрессировать иммуноглобулин, и выделение иммуноглобулина с использованием белка А.
В одном из вариантов осуществления клетка выбрана из СНО, COS, 293, HeLa и клетки сетчатки, экспрессирующей вирусную последовательность нуклеиновой кислоты (например, клетка PERC.6™).
В одном из аспектов, представлен биспецифический антигенсвязывающий белок, который содержит первую специфичность, которая связывает антиген и вторую специфичность, которая активирует рецептор, где биспецифический антигенсвязывающий белок содержит первый полипептид, содержащий первый домен СН3 IgG1, IgG2 или IgG4, который содержит связывающую белок А детерминанту, и второй полипептид, содержащий второй домен СН3 IgG1, IgG3 или IgG4, который лишен связывающей белок А детерминанты.
В одном из вариантов осуществления вторая специфичность, которая активирует рецептор, связывает рецептор с Ко, которая представлена в молярном, миллимолярном, микромолярном, наномолярном или пикомолярном диапазоне.
В одном из вариантов осуществления вторая специфичность связывает рецептор, выбранный из рецептора, связывающего G-белок, рецептора тирозинкиназы, интегрина и Toll-подобного рецептора.
В одном из вариантов осуществления вторая специфичность связывается с рецептором и вызывает изменение рецептора или субъединицы или белка, физически связанного с ним для осуществления фосфорилирования серина, треонина или тирозина; обуславливает циклитизацию нуклеотида (например, цАМФ, цАДФ или цГМФ); обуславливает продукцию фосфатидилинозитола или его производных (например, IP3 или PIP3); обуславливает продукцию липидного вторичного мессенджера (например, диацилглицерола, церамида, лизофосфатидной кислоты, эйкозаноида); обуславливает дефосфорилирование (например, фосфатазную активность); обуславливает фосфорилирование липида для образования вторичного мессенджера; обуславливает гидролиз вторичного мессенджера; обуславливает протеолиз; обуславливает окислительно-восстановительный путь передачи сигнала; обуславливает перемещение белка в клеточные органеллы (например, в ядро); обуславливает агрегацию рецептора (самого с собой) для образования гомо- или (с другими рецепторами) гетеромультимеров; или обуславливает открытие или закрытие трансмембранного канала.
В одном из аспектов, предоставлен способ получения биспецифического антитела, включающий: выделение представляющего интерес биспецифического антитела из квадромы, где представляющее интерес биспецифическое антитело содержит первую тяжелую цепь, которая представляет собой изотип IgG1, IgG2 или IgG4, вторую тяжелую цепь, которая представляет собой изотип IgG1, IgG2 или IgG4, обладающий константным доменом/ который содержит модификацию в своем домене СН3, который устраняет или снижает связывание с белком А, где представляющее интерес биспецифическое антитело выделяют, используя белок А.
В одном из аспектов, предоставлен способ получения биспецифического антитела, включающий стадию выделения из разрушенной клетки или смеси антител биспецифического антитела, имеющего селективно модифицированные домены СН3 IgG1, IgG2 или IgG4, где селективно модифицированный домен СН3 является неиммуногенным или по существу неиммуногенным для человека, и где модификация приводит к получению биспецифического антитела с гетеродимерной тяжелой цепью, мономеры которых обладают различной аффинностью к белку А и биспецифическое антитело выделяют из разрушенной клетки или смеси, используя белок А.
В одном из вариантов осуществления биспецифическое антитело выделяют, используя аффинную подложку с белком А, где биспецифическое антитело элюируется при рН от приблизительно 3,9 до приблизительно 4,4, от приблизительно 4,0 до приблизительно 4,3, от приблизительно 4,1 до приблизительно 4,2 или приблизительно рН 4,2. В одном из вариантов осуществления биспецифическое антитело элюируется при рН приблизительно 4, 4,1, 4,2, 4,3, 4,4 или 4,5.
В одном из вариантов осуществления биспецифическое антитело выделяют, используя аффинную подложку с белком А и градиент рН или стадию, где градиент рН или стадия включает ионный модификатор. В конкретном варианте осуществления ионный модификатор представлен в молярной концентрации от приблизительно 0,5 до приблизительно 1,0. В конкретном варианте осуществления ионный модификатор представляет собой соль. В одном из вариантов осуществления ионный модификатор выбран из группы, состоящей из бериллия, лития, натрия и калиевых солей ацетата; натрия и калия бикарбонатов; лития, натрия, калия и цезия карбонатов; лития, натрия, калия, цезия и хлорида магния;
натрия и калия фторидов; натрия, калия и кальция нитратов/натрия и калия фосфатов; и кальция и сульфата магния. В конкретном варианте осуществления ионный модификатор представляет собой галоидную соль щелочного металла или щелочноземельного металла. В конкретном варианте осуществления ионный модификатор представляет собой хлорид натрия.
В одном из аспектов, связывающий белок, содержащий Fc, где Fc содержит первый домен СН3, который модифицирован как описано в настоящем документе и второй СН3, который не модифицируют, с тем, чтобы создать гетеродимерный Fc, где избирательная модификация приводит к тому, что связывающий белок элюируется из аффинного материала с белком А при единицах рН, равных 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2, 1,3 или 1,4, более высоких, чем единицы рН для соответствующего связывающего белка, который не имел избирательной модификации.
В одном из вариантов осуществления селективно модифицированный связывающий белок элюируется при рН приблизительно 4,2, тогда как немодифицированный связывающий белок элюируется при рН приблизительно 3. В одном из вариантов осуществления селективно модифицированный связывающий белок элюируется при значении рН приблизительно равном 4,5, тогда как немодифицированный связывающий белок элюируется при значении рН, приблизительно равном 3,5. В одном из вариантов осуществления селективно модифицированный связывающий белок элюируется при значении рН, приблизительно равном 4, тогда как немодифицированный связывающий белок элюируется при значении рН, приблизительно равном 2,8-3,5, 2,8-3,2 или 2,8-3. В одном из вариантов осуществления селективно модифицированный связывающий белок элюируется при значении рН, приблизительно равном 4,2, тогда как немодифицированный связывающий белок элюируется при значении рН приблизительно равном 2,8. В одном из вариантов осуществления селективно модифицированный связывающий белок элюируется при значении рН приблизительно равном 4,4, тогда как немодифицированный связывающий белок элюируется при значении рН приблизительно равном 3,6. В этих вариантах осуществления, «немодифицированный» относится к отсутствию модификации в 435 (нумерация EU), или отсутствию модификации в 435 и 436 (нумерация EU), в обоих доменах СН3.
Любые варианты осуществления и аспекты, описываемые в настоящем документе можно использовать в комбинации друг с другом, если не указано иначе или не очевидно из контекста. Другие варианты осуществления будут очевидны специалистам в данной области из обзора последующего описания.
ПОДРОБНОЕ ОПИСАНИЕ
Изобретение не ограничено конкретными способами и описанными экспериментальными условиями, по существу способы и условия могут изменяться. Также следует понимать, что используемая в настоящем документе терминология представлена только для описания конкретных вариантов осуществления, и не предназначена для ограничения, так как объем настоящего изобретения определен пунктами формулы изобретения.
Если не определено иначе, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понимается специалистом в данной области, к которому относится настоящее изобретение. Несмотря на то, что в практическом осуществлении или анализе по настоящему изобретению можно использовать любые способы и материалы, похожие или эквивалентные способам и материалам, описываемым в настоящем документе, конкретные способы и материалы описаны в документе. Все указанные публикации включены, таким образом, в качестве ссылки.
Как используется в настоящем документе термин «антитело» включает молекулы иммуноглобулинов, состоящие из четырех полипептидных цепей, двух тяжелых цепей (Н) и двух легких цепей (L), связанных дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращено в настоящем документе как HCVR или VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена, СН1, СН2 и СН3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращено в настоящем документе как LCVR или VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен CL. Области VH и VL можно дополнительно подразделять на области гипервариабельности, обозначаемые определяющими комплементарность областями (CDR), перемежающиеся с областями, которые являются более консервативными, обозначаемые каркасными областями (FR). Каждый VH и VL состоит из трех CDR и четырех FR, расположенные от аминоконца до карбоксиконца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 (CDR тяжелой цепи могут быть сокращены как HCDR1, HCDR2 и HCDR3; CDR легкой цепи могут быть сокращены как LCDR1, LCDR2 и LCDR3. Термин «высокая аффинность» антитела относится к таким антителам, которые обладают аффинностью связывания со своей мишенью по меньшей мере равной 10-9 М, по меньшей мере 10-10 М; по меньшей мере 10-11 М; или по меньшей мере 10-12 М, как измерено поверхностным плазменным резонансом, например, BIACORE™ или аффинной ELISA в растворе.
Выражение «антигенсвязывающий белок» включает белок, имеющий по меньшей мере один CDR и способный к избирательному распознаванию антигена, т.е. белок, который является способным к связыванию антигена с KD, которая представлена по меньшей мере в микромолярном диапазоне. Для терапевтических антигенсвязывающих белков (например, терапевтических антител) обычно требуется KD, которая представлена в наномолярном или пикомолярном диапазоне. Выражение «антигенсвязывающий белок» также включает белок, содержащий первый и второй домен СН3, как описано в настоящем документе и первый белок или распознающий лиганд домен и второй белок или распознающий лиганд домен, где первый белок или распознающий лиганд домен и второй белок или распознающий лиганд домен, каждый независимо распознает один и тот же белок или лиганд или вместе распознают один и тот же белок или лиганд, или каждый независимо распознает различные белок или лиганд. Одним из примеров такого белка является иммуноадгезин, содержащий слитый белок - (гетеро- или гомо-) димер, где полипептиды димера представляют собой слитые полипептиды, которые содержат рецепторный компонент или лигандный компонент, где лигандный компонент включает аминокислотную последовательность, связывающую рецептор.
Выражение «биспецифическое антитело» включает антитело, способное селективно связывать два или более эпитопа. Биспецифические антитела, как правило, включают две различные тяжелые цепи, где каждая тяжелая цепь специфически связывает разные эпитопы или на различных молекулах (например, антигенах) или на одной и той же молекуле (например, на одном и том же антигене). Если биспецифическое антитело способно селективно связывать два различных эпитопа (первый эпитоп и второй эпитоп), аффинность первой тяжелой цепи для первого эпитопа как правило будет по меньшей мере от одного до двух или трех или четырех порядков ниже, чем аффинность первой тяжелой цепи для второго эпитопа и наоборот. Эпитопы, распознаваемые биспецифическим антителом могут представлять собой одну и ту же или различную мишень (например, на одном и том же или различном белке). Биспецифические антитела можно получать, например, комбинированием тяжелых цепей, которые распознают различные эпитопы на одном и том же антигене. Например, последовательности нуклеиновой кислоты, кодирующие вариабельные последовательности тяжелой цепи, которые распознают различные эпитопы одного и того же антигена могут быть слиты с последовательностями нуклеиновой кислоты, кодирующими различные константные области тяжелой цепи, и такие последовательности можно экспрессировать в клетке, которая экспрессирует легкую цепь иммуно глобулин а. Типичное биспецифическое антитело имеет две тяжелые цепи, где каждая имеет три CDR тяжелой цепи, с последующим (от N-конца до С-конца) доменом СН1, шарнирной областью, доменом СН2 и доменом СН3, и легкой цепью иммуноглобулина, которая или не наделена антигенсвязывающей специфичностью, но может объединяться с каждой из тяжелой цепей, или может объединяться с каждой из тяжелых цепей и может связывать один или несколько эпитопов, ограниченных антигенсвязывающими областями тяжелой цепи, или может объединяться с каждой из тяжелых цепей и способствует связыванию или одной или обеих тяжелых цепей с одним или обоими эпитопами.
Термин «клетка» включает любую клетку, которая является подходящей для экспрессии рекомбинантной последовательности нуклеиновой кислоты. Клетки включают клетки прокариот и эукариот (одноклеточные или многоклеточные), бактериальные клетки (например, штаммы Е. coil, Bacillus spp., Streptomyces spp., и т.д.), клетки микобактерий, клетки грибов, дрожжевые клетки (например, 5. cerevlslae, S. pombe, P. pastoris, P. mekhanolica и т.д.), растительные клетки, клетки насекомых (например, SF-9, SF-21, клетки насекомых, инфицированные бакуловирусом, Trichoplusia ni, и т.д.), не относящиеся к человеку животные клетки, клетки человека, или слияния клеток, такие как, например, гибридомы или квадромы. В некоторых вариантах осуществления клетка представляет собой клетку человека, макака, человекообразной обезьяны, хомяка, крысы или мыши. В некоторых вариантах осуществления клетка является эукариотической и выбрана из следующих клеток: СНО (например, СНО K1, DXB-11 СНО, Veggie-CHO), COS (например, COS-7), клетки сетчатой оболочки глаза, Vero, CV1, почек (например, НЕК293, 293 EBNA, MSR 293, MDCK, HaK, ВНК), HeLa, HepG2, WI38, MRC 5, Colo205, HB 8065, HL-60, (например, BHK21), Jurkat, Daudi, A431 (эпидермальная), CV-1, U937, 3Т3, клеток L, клеток С127, SP2/0, NS-0, ММТ 060562, клеток Сертоли, клеток BRL 3А, клеток НТ1080, миеломной клетки, опухолевой клетки и клеточной линии, полученной из указанных выше клеток. В некоторых вариантах осуществления клетка включает один или несколько вирусных генов, например, клетка сетчатой оболочки глаза, которая экспрессирует вирусный ген (например, клетки PER.C6™).
Выражение «определяющая комплементарность область» или термин «CDR» включает аминокислотную последовательность, кодируемую последовательностью нуклеиновой кислоты генов иммуноглобулина организма, которые, как правило, (т.е., у животных дикого типа) присутствует между двумя каркасными областями в вариабельной области легкой или тяжелой цепи молекулы имуноглобулина (например, антитела или рецептора Т-клетки). CDR может кодироваться, например, последовательностью зародышевой линии или перестроенной или неперестроенной последовательностью, и, например, природной или зрелой В-клеткой или Т-клеткой. В некоторых случаях (например, для CDR3), CDR могут быть кодированы двумя или более последовательностями (например, последовательностями зародышевой линии), которые не являются смежными (например, в неперестроенной последовательности нуклеиновой кислоты), но являются смежными в последовательности нуклеиновой кислоты в В-клетке, например, в результате сплайсинга или соединения последовательностей (например, рекомбинация V-D-J для образования тяжелой цепи CDR3).
Выражение «тяжелая цепь» или «тяжелая цепь иммуноглобулина» включает последовательность константной области тяжелой цепи иммуноглобулина любого организма, и если не указано иначе, включает вариабельный домен тяжелой цепи. Вариабельные домены тяжелой цепи включают три области CDR тяжелой цепи и четыре FR, если не указано иначе. Фрагменты тяжелых цепей включают CDR, CDR и Fs, и их комбинации. Характерная тяжелая цепь дополнительно содержит вариабельный домен (с N-конца до С-конца), домен СН1, шарнирную область, домен СН2 и домен СН3. Функциональный фрагмент тяжелой цепи включает фрагмент, который способен специфически распознавать антиген (например, распознавание антигена с Ко в микромолярном, наномолярном или пикомолярном диапазоне), который способен экспрессироваться и секретироваться из клетки, и который содержит по меньшей мере один CDR.
Выражение «содержащий Fc белок» включает антитела, биспецифические антитела, иммуноадгезины и другие связывающие белки, которые содержат по меньшей мере функциональную часть области СН2 и СН3 иммуноглобулина. «Функциональная часть» относится к областям СН2 и СН3, которые могут связывать рецептор Fc (например, FcγR; или FcRn, т.е., неонатальный рецептор Fc) и/или которые могут принимать участие в активации комплемента. Если области СН2 и СН3 содержат делеции, замены и/или вставки или другие модификации, которые не позволяют областям связывать любой рецептор Fc и также не позволяют активировать комплемент, то области СН2 и СН3 не являются функциональными.
Содержащие Fc белки могут содержать модификации в иммуноглобулиновых доменах, включающие такие модификации, 26 которые оказывают влияние на одну или несколько эффекторных функций связывающего белка (например, модификации, которые затрагивают связывание FcγR, связывание FcRn и таким образом, влияют на время полужизни, и/или активность CDC). Такие модификацию включают, но ими не ограничиваются, следующие модификации и их комбинации, со ссылкой к нумерации EU константной области иммуноглобулина: 238, 239, 248, 249, 250, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 297, 298, 301, 303, 305, 307, 308, 309, 311, 312, 315, 318, 320, 322, 324, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 337, 338, 339, 340, 342, 344, 356, 358, 359, 360, 361, 362, 373, 375, 376, 378, 380, 382, 383, 384, 386, 388, 389, 398, 414, 416, 419, 428, 430, 433, 434, 435, 437, 438 и 439.
Например, но не в качестве ограничения, связывающий белок представляет собой белок, содержащий Fc и демонстрирует увеличенное время полужизни в сыворотке (по сравнению с тем же белком, содержащим Fc без перечисленных модификаций) и имеет модификацию в положении 250 (например, Е или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или Т), 254 (например, S или Т) и 256 (например, S/R/Q/E/D или Т); или модификацию в положении 428 и/или 433 (например, L/R/SI/P/Q или K) и/или 434 (например, H/F или Y); или модификацию в положении 250 и/или 428; или модификацию в положении 307 или 308 (например, 308F, V308F) и 434. В другом примере, модификация может включать модификацию 428L (например, M428L) и 434S (например, N434S); модификацию 428L, 2591 (например, V259I) и 308F (например, V308F); модификацию 433К (например, Н433К) и 434 (например, 434Y); модификацию 252, 254 и 256 (например, 252Y, 254Т и 256Е); модификацию 250Q и 428L (например, T250Q и M428L); модификацию 307 и/или 308 (например, 308F или 308Р).
Выражение «ионный модификатор» включает группы, которые снижают или устраняют неспецифические (т.е., неаффинные) ионные взаимодействия между белками. «Ионные модификаторы» включают, например, соли, ионные комбинации металлов группы I и группы II с ацетатом, бикарбонатом, карбонатом, галогеном (например, хлоридом или фторидом), нитратом, фосфатом или сульфатом. Неограничивающий иллюстративный перечень «ионных модификаторов» включает бериллий, литий, натрий и калиевые соли ацетата; натрия и калия бикарбонаты; лития, натрия, калия и цезия карбонаты; лития, натрия, калия, цезия и хлорида магния; натрия и калия фториды; натрия, калия и кальция нитраты; натрия и калия фосфаты; и кальция и сульфат магния. «Ионные модификаторы» включают такие группы, которые оказывают ионное воздействие, которые, при добавлении к линейному или ступенчатому градиенту рН, или при уравновешивании носителя с белком А в «ионном модификаторе» и применении линейного или ступенчатого градиента рН, приводят к увеличению промежутка между единицами рН при элюции гомодимерного IgG и гетеродимерного IgG (например, IgG дикого типа человека и подобного IgG, но несущего одну или несколько модификаций в его домене СН3, как описано в настоящем документе). Подходящую концентрацию «ионного модификатора» можно определять посредством его концентрации, применяя колонку, упомянутую выше, линейный или ступенчатый градиент рН, с увеличением концентрации «ионного модификатора» до тех пор, пока не достигнут максимального промежутка при данном ступенчатом или линейном градиенте рН.
Выражение «легкая цепь» включает последовательность константной области легкой цепи иммуноглобулина из любого организма, и, если не указано иначе, включает легкие цепи каппа и лямбда человека. Вариабельные домены легкой цепи (VL), как правило, включают три CDR легкой цепи и четыре каркасных области (FR), если не указано иначе. Как правило, полноразмерная легкая цепь включает, от аминоконца до карбоксильного конца, домен VL, который включает FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4 и константный домен легкой цепи. Легкие цепи, которые можно использовать по настоящему изобретению, включают такие легкие цепи, которые, например, не связывают селективно или первый или второй антиген, селективно связанный антигенсвязывающим белком. Подходящие легкие цепи включают легкие цепи, которые можно идентифицировать посредством скрининга обычно используемых легких цепей в существующих библиотеках антител (библиотеки в жидкостях или компьютерного моделирования), где легкие цепи по существу не влияют на аффинность и/или избирательность антигенсвязывающих доменов антигенсвязывающего белка. Подходящие легкие цепи включают такие легкие цепи, которые могут связывать один или оба эпитопа, которые связаны антигенсвязывающими областями антигенсвязывающего белка.
Выражение «микромолярный диапазон» предназначен для обозначения микромолярности 1-999; выражение «наномолярный диапазон» предназначен для обозначения наномолярности 1-999; выражение «пикомолярный диапазон» предназначен для обозначения пикомолярности 1-999.
Выражение «соматически мутированный» включает последовательность нуклеиновой кислоты из В-клетки, которая подверглась действию механизма переключению класса, где последовательность нуклеиновой кислоты вариабельной области иммуноглобулина (например, тяжелая цепь вариабельного домена или содержащая последовательность CDR или FR тяжелая цепь) в В-клетке, которую подвергли механизму переключения класса, не идентична последовательности нуклеиновой кислоты в В-клетке до переключения класса, такой как, например, различие в CDR или каркасной последовательности нуклеиновой кислоты между В-клеткой, которая не подверглась переключению класса и В-клеткой, которая подверглась действию механизма переключения класса. «Соматически мутированный» включает последовательности нуклеиновой кислоты В-клетки с созревшей аффинностью, которая не идентична соответствующим последовательностям в В-клетках, которые не являются аффинно созревшими (т.е., последовательности в геноме клеток зародышевой линии). Выражение «соматически мутированный» также включает последовательность нуклеиновой кислоты из В-клетки после представления В-клетки представляющему интерес антигену, где последовательность нуклеиновой кислоты отличается от соответствующей последовательности нуклеиновой кислоты до представления В-клетки представляющему интерес антигену. Выражение «соматически мутированный» относится к последовательностям антител, которые были получены от животного, например, мыши, имеющей последовательность нуклеиновой кислоты вариабельной области иммуноглобулина человека, в ответ на антигенную стимуляцию, и которые является следствием процессов отбора, природно-действующих у такого животного.
Выражение «вариабельный домен» включает аминокислотную последовательность легкой или тяжелой цепи иммуноглобулина (модифицированных как требуется), которые содержат следующие аминокислотные области, в последовательности от N-конца до С-конца (если не указано иначе): FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. «Вариабельный домен» включает аминокислотную последовательность, способную сворачиваться в канонический домен (VH или VL), обладающий двойной бета-складчатой структурой, где бета-складчатые структуры соединены дисульфидной связью между остатком первой бета-складчатой структурой и второй бета-складчатой структурой.
Биспецифические антитела с модифицированными областями СН3 IgG
Авторы изобретения разработали новый формат, в котором комбинируются общепринятая стратегия легких цепей с использованием схемы избирательной очистки с белком А, которую можно использовать с компонентами антитела человека.
Так как ранее отмечено (Lindhofer, H. et al. (1995) J. Immunol. 155:219-225)), что IgG3 человека не связывается с белком А, то его теоретически можно использовать вместе с любыми другими тремя подклассами IgG человека в способе очистки, схожим со способом очистки, используемом для гибридов мышь-крыса. Однако, хотя последовательности всех четырех подклассов IgG человека являются высокогомологичными, не известно будут ли области Fc IgG1, IgG2 и IgG4 образовывать гомодимеры с IgG3; даже лишь преимущественное формирование гомодимеров будет, при некоторых условиях, иметь отрицательное влияние на общий выход желаемых гетеродимеров (например, выделение из квадром). Дополнительные модификации также могут быть необходимы для компенсирования различий между шарнирной областью IgG3 и шарнирной областью других подклассов. Дополнительные модификации были бы также предпочтительны в некоторых случаях, не требующих наличия полноразмерного Fc IgG3, из-за возможного влияния на эффекторные функции.
Таким образом, авторы изобретения разработали «минимальный» формат, который использует, по случайности, простую определяющую детерминанту для связывания белка А. Сообщали (Jendeberg, L. et al. (1997) J. Immunological Meth, 201:25-34)), что неспособность IgG3 к связыванию белка А определяется одним аминокислотным остатком Arg435 (нумерация EU; Arg95 no IMGT), соответствующую позицию которого в других подклассах IgG занимает остаток гистидина. Таким образом, вместо IgG3 возможно использовать последовательность IgG1, в которой His435 заменен на Arg. Таким образом, согласно новой схеме очистки наличие единственной точечной мутации в IgG1 должно быть достаточным для получения различных значений аффинностей связывания. Данная модификация будет названа IgG1ΔA, для обозначения неспособности иммуноглобулина к связыванию белка А (и, аналогично, IgG2ΔA и IgG4ΔA или в более общем смысле, FcΔА).
Однако обозначенная точечная мутация приводит к образованию новой пептидной последовательности, которая, возможно, за счет мутации может быть иммуногенной. Точечная мутация, теоретически, может быть нагружена на молекулу МНС класса II и презентирована Т-клеткам, и таким образом, вызывать иммунный ответ. Для предотвращения этой опасности можно использовать дипептидную мутацию, H435R/Y436F (нумерация EU; H95R/Y96F по IMGT). Последовательность, полученная в результате в области модификации, является идентичной соответствующей последовательности IgG3 (см. фиг.2А), и таким образом, можно было бы ожидать, что она будет иммунологически «невидимой», так как не присутствовало бы неприродных коротких пептидов, пригодных для презентации Т-клеткам. Опубликовано, что такой двойной мутант по-прежнему не связывает белок A (Jendeberg, L. et al. (1997) J. Immunological Meth. 201:25-34). В результате дипептидная мутация не включает какие-либо остатки, которые, как полагают, создают возможность димерного взаимодействия Fc, таким образом маловероятно, что мутация затрагивает формирование гетеродимеров. Эту дипептидную мутацию обозначают как «IgG1ΔAdp» (и, аналогично, IgG2ΔAdp, IgG4ΔAdp и FcΔAdp). Положение дипептидной модификации в IgG1, IgG2 и IgG4 показано на фиг.3 в последовательностях, обозначенных IgG1ΔAdp, IgG2ΔAdp и IgG4ΔAdp, представленных вместе с последовательностью дикого типа домена СН3 IgG человека, а также hIgG3, демонстрирующей нумерацию экзонов IMGT и нумерацию EU.
Модификация FcΔAdp не включает какие-либо остатки, которые, как полагают, образуют возможность димерного взаимодействия Fc, таким образом, маловероятно, что модификация FcΔAdp затрагивает формирование гетеродимеров. Так как FcΔAdp является очень небольшой, ее, вероятно, также можно включать в другие сконструированные формы Fc. IgG2ΔAdp и IgG4ΔAdp могут быть полезными в случаях, при которых желательно наличие эффекторных функций (или их потеря), связанные с каждым из последних.
В сущности, формат биспецифического антитела, описанный выше, включает два антитела с различной специфичностью, которые используют одинаковые легкие цепи, где Fc-область одной из них модифицируют согласно формату FcΔAdp (см. фиг.2В). Его конфигурация соответствует конфигурации природного антитела человека, и таким образом, должна разделять присущие ему положительные свойства, включающие низкую склонность к агрегации, стабильность in vivo, минимальную иммуногенность, биораспределение, аналогичное биораспределению антител, хорошую фармакокинетику, и, необязательно, эффекторные функции. Разработаны способы выделения таких биспецифических антител, которые являются относительно быстрыми и простыми в исполнении.
Биспецифические связывающие белки с модифицированными областями СН IgG мыши.
Авторы изобретения разработали способ быстрого выделения связывающих белков, содержащих тяжелую цепь иммуноглобулина (или его фрагмента, содержащего функциональные СН2 и СН3), которые являются гетеродимерными в отношении одной или нескольких аминокислот в домене СН3. Тщательный отбор модификаций в домене СН IgG мыши и применение технологии индивидуального разделения предоставляет возможность быстрого выделения связывающего белка, содержащего две селективно модифицированных области СН мыши из гомодимеров и гетеродимеров, которые не содержат модификации.
IgG1 мыши, который содержит пролин в положении 247, треонин 34 в положении 252, 254 и 256 и лизин в положении 258, только слабо связывается с белком А. Однако, IgG2a и IgG2b мыши содержат различные остатки в этих положениях (за исключением положений 256 и 258 IgG2b) и IgG2a и 2b мыши хорошо связываются с белком А. Избирательное модифицирование областей СН двух IgG мыши в способе получения антитела, которое является гетеродимерным по тяжелым цепям, будет придавать такому антителу различные свойства связывания с белком А. Таким образом, разрабатываются различные схемы выделения на основе белка А, что предусматривает быстрое отделение модифицированного гетеродимера от любого гомодимера IgG мыши, будь то гомодимер IgG1 (который только очень слабо связал бы, если бы связывание произошло, белок А) или гомодимер IgG2a мыши, гомодимер IgG2b мыши или гетеродимер IgG2a/IgG2b. Например, биспецифическое антитело, обладающее двумя различными вариабельными доменами тяжелой цепи, но одного изотипа, например, IgG2a, можно экспрессировать в подходящей экспрессионной системе, которая задействует последовательности тяжелой цепи, где модифицируют только одну из СН областей IgG2a для снижения действия или удаления детерминанты, связывающей белок А. Таким образом, только одна из областей СН IgG2a будет демонстрировать значимую аффинность для белка А, и любое антитело, образованное из димера немодифицированного IgG2a и модифицированного IgG2a будет быстро выделено из модифицированного гетеродимера.
В различных вариантах осуществления, антитело, отличающееся тем, что одна область СН димера Fc содержит модифицированную область СН, в то время как другая область СН димера Fc лишена модификаций. Область СН IgG модифицируют для включения конкретных аминокислот в конкретные положения (нумерация EU), выбранных из группы, состоящей из: 2521, 254Т и 256Т; 252Т, 254Т, 256Т и 258К; 247Р, 252Т, 254Т, 256Т и 258К; 435R и 436F; 252Т, 254Т, 256Т, 435R и 436F; 252Т, 254Т, 256Т, 258К, 435R и 436F; 24tP, 252Т, 254Т, 256Т, 258К, 435R и 436F; и 435R. В конкретном варианте осуществления выполняют конкретную группу модификаций, выбранных из групп, состоящих из: М252Т, S254T, S256T; М252Т, S254T, S256T, I258K; I247P, М252Т, S254T, S256T, I258K; H435R, H436F; М252Т, S254T, S256T, H435R, H436F; М252Т, S254T, S256T, I258K, H435R, H436F; I247P, М252Т, S254T, S256T, I258K, H435R, H436F; и H435R.
Гетеродимерные связывающие белки, основанные на IgG мыши, можно использовать для множества вариантов применения. Например, такие связывающие белки предусматривают способ выделения биспецифических антител с константными доменами мыши, где модификации не влияют или по существу не влияют на связывание антитела с одним или несколькими Fc-рецепторами мыши так, что антитело может принимать участие, например, в ADCC или CDC и также связывать два или более эпитопов на одной или различных мишенях.
В одном из аспектов, способ выделения связывающего белка включает первую область СН IgG мыши и вторую область СН IgG мыши, где первую область СН IgG модифицируют (но не вторую область СН IgG), с тем, чтобы снизить или устранить аффинность связывания с белком А первой области СН IgG мыши, но не второй области СН IgG мыши, и где связывающий белок содержит первый связывающий фрагмент, который связывает первый эпитоп и вторую связывающую детерминанту, которая связывает второй эпитоп.
В одном из вариантов осуществления модификации не изменяют или по существу не изменяют аффинность связывания связывающего белка с Fc-рецептором. В одном из вариантов осуществления связывающий белок содержит модификации, которые увеличивают или снижают аффинность связывающего белка к Fc-рецептору.
В одном из вариантов осуществления модификация не изменяет или по существу не изменяет время полужизни связывающего белка в сыворотке мыши, содержащей нативные FcγR-рецепторы мыши и/или нативный FcRn мыши, по сравнению с соответствующим связывающим белком, который не имеет модификаций.
В одном из вариантов осуществления модификация не изменяет или по существу не изменяет, по сравнению со связывающим белком, который не имеет модификации, время полужизни связывающего белка в сыворотке мыши, которая содержит замену нативных высокоаффинных и низкоаффинных FcγR-рецепторов мыши и/или FcRn-рецептор.
В одном из вариантов осуществления первый и второй эпитопы различны и представлены на различных клетках или на различных белках. В одном из вариантов осуществления первый эпитоп и второй эпитоп различны и представлены на одной и той же клетке или белке.
В одном из вариантов осуществления Fc-рецептор выбран из высокоаффинного Fc-рецептора, низкоаффинного Fc-рецептора и FcRn. В конкретном варианте осуществления Fc-рецептор выбран из одного или нескольких FcRn мыши, FcγR мыши, FcyRIIB мыши, FcγRIII мыши, FcγRIV мыши и их комбинации. В конкретном варианте осуществления Fc-рецептор выбирают из одного или нескольких FcRn человека, FcγR человека, FcγRIIB человека, FcγRIIC человека, FcγRIIIB человека, FcγRIIIA человека, FcγRIIA человека и их комбинации.
Иммуногенность
Одним преимуществом многих вариантов осуществления изобретения является возможность использования модификации для создания биспецифического антитела, которое является как быстро выделяемым, основанным на различном связывании с белком А, так и неиммуногенным или по существу неиммуногенным для человека. Эта характеристика делает такие варианты осуществления особенно подходящим при создании биспецифических антител для применения в качестве терапевтических средств для человека и при создании иммуноадгезинов, которые например, являются неиммуногенными или по существу неимуногенными (с применением связывающих молекул человека, т.е., рецепторных компонентов человека и/или лигандов человека). Эта характеристика связана с биспецифическими антителами, обладающими доменами СН3 с модификациями H95R/Y96F (нумерация IMGT) в IgG1, IgG2 и IgG3, и такими доменами СН3, которые содержат дополнительные модификации, что приводит в результате к модифицированному положению, отражающему последовательность дикого типа различных изотипов IgG. Таким образом, хотя модификация не присутствует в природе, связанная с конкретным изотипом IgG модифицированная последовательность локально идентична последовательности дикого типа различных изотипов IgG, и как ожидают, модификация не будет иммуногенной или по существу иммуногенной. Также возможно, что модификация является неиммуногенной даже если ее последовательность локально не идентична любой нативной последовательности; такие модификации также могут быть полезны. Минимальная точечная мутация H95R (нумерация IMGT), при отсутствии иммуногенности, будет, таким образом, представлять собой подходящий вариант осуществления изобретения.
Таким образом, разработаны биспецифические антитела, которые являются неиммуногенным или по существу неиммуногенным для человека, в отношении их константных доменов тяжелой цепи, но, которые, тем не менее, содержат одну или несколько различных модификаций в константном домене тяжелой цепи, включая модификацию, которая приводит к различной аффинности константных доменов тяжелой цепи в отношении аффинного реагента {например, белка А). Модификации включают те, которые описаны в настоящем документе. В конкретном варианте осуществления биспецифическое антитело, которое является неиммуногенным или по существу неиммуногенным для человека в отношении его домена CH3, даже с селективно модифицированной тяжелой цепью, представляет собой IgG1, IgG2 или IgG4 человека, содержащие домен СН3, который включает одну из следующих модификаций (или, в другом варианте осуществления, по существу содержит одну из следующих модификаций): H95R или H95R и Y96F (нумерация IMGT).
Как ожидают, биспецифические антитела являются неиммуногенными или по существу неиммуногенными, в отношении людей, у которых не была нарушена в какой-либо значительной степени толерантность к изоформам IgG1, IgG2 и IgG4 человека.
В частности, как ожидают, модификация FcΔAdp является иммунологически «невидимой», так как связывающая бороздка молекул МНС класса II вмещает 9-мерный пептид, который содержит основную детерминанту, распознаваемую различными петлями рецептора Т-клеток, таким образом маловероятно, что пептиды, лишенные любой природной 9-мерной подпоследовательности будут вызывать иммунный ответ. Однако, пептиды, длиннее чем 9-мерные (как правило, от приблизительно 13 до 17 мерный) связываются МНС класса II, и возможно, что выступающие сегменты могут потенциально оказывать влияние на связывание. Таким образом, дополнительные модификации (дополнительно к модификации FcΔAdp), которые устраняют более длинные неприродные последовательности могут дополнительно снижать возможность развития иммуногенности. Одним конкретным примером является модификация V422I (EU; V82I по нумерации IMGT), которая увеличивает длину минимального неприродного пептида на величину от 14 до 39 остатков в IgG1ΔAdp и до 43 остатков в аналогично обозначенном IgG2ΔAdp.Другим примером является модификация L445P (EU; L105P по нумерации IMGT) в IgG4ΔAdp, которая увеличивает длину на величину от 10 до 14 остатков.
Фармакокинетика
Участок связывания для белка А перекрывается с участком связывания для неонатального Fc-рецептора, FcRN, который, как полагают, отвечает за придание иммуноглобулинам более длительного времени полужизни в сыворотке. Таким образом, модификации, располагающиеся поблизости от участка связывания белка А, увеличивают возможность того, что формат иммуноглобулина, представленный в настоящем документе, может иметь более короткое время полужизни в сыворотке, чем формат IgG1, 2 и 4, учитывая то, что IgG3 человека обладает более коротким временем полужизни в сыворотке (приблизительно 7 суток), по сравнению с другими подклассами IgG (приблизительно 21 сутки). Показано, что некоторые мутанты Fc, с измененным His435, не связывают FcRN и у мышей обладают более коротким временем полужизни. Однако фармакокинетический анализ показал, что время полужизни в сыворотке гетеродимера IgG1ΔA/IgG1 не существенно отличается от времени полужизни гомодимера IgG1 (см. пример 2). Таким образом, мутация IgG1ΔAdp имеет преимущество при удалении способности связывания с белком А, в то время как все еще сохраняет более длинное время полужизни IgG1.
Таким образом, в одном из вариантов осуществления разработан биспецифичный антигенсвязывающий белок, который включает модификацию домена СН3, как описано в настоящем документе, где антигенсвязывающий белок демонстрирует фармакокинетический профиль, эквивалентный профилю такого же биспецифичного антигенсвязывающего белка, который не имеет модификации в домене СН3. В одном из вариантов осуществления разработано биспецифическое антитело, которое содержит гетеродимерный Fc IgG1ΔA/IgG1, где биспецифическое антитело имеет время полужизни в сыворотке, которое приблизительно в 1,5 раза, приблизительно в 2 раза, приблизительно в 2,5 раза или приблизительно в 3 раза выше, чем время полужизни биспецифического антитела, которое в другом отношении является идентичным, но содержит домен СН3 IgG3 или которое в другом отношении идентично, но содержит по меньшей мере одну тяжелую цепь IgG3. В одном из вариантов осуществления разработано биспецифическое антитело, содержащее гетеродимерный Fc IgG1ΔA/IgG1, где биспецифическое антитело демонстрирует время полужизни в сыворотке, которое является приблизительно таким же, что и время полужизни биспецифического антитела без модификации IgG1ΔA (т.е., гомодимерное биспецифическое антитело IgG1). Тяжелые цепи иммуноглобулинов
Вариабельные области тяжелой цепи иммуноглобулина, которые можно использовать для создания биспецифических антител с желаемыми характеристиками (например, желаемой специфичностью, аффинностью, функциональными свойствами, например, блокирующие, неблокирующие, ингибирующие, активирующие, и т.д.) можно получать, используя любой известный в данной области способ. Желаемые тяжелые цепи можно затем конструировать посредством клонирования последовательностей нуклеиновой кислоты, содержащей вариабельные области в конструкты, обладающие желаемыми константными областями тяжелой цепи, описываемыми в настоящем документе.
В одном из вариантов осуществления первая тяжелая цепь содержит вариабельную область, которая кодируется нуклеиновой кислотой, полученной из генома зрелой В-клетки первого животного, которое иммунизировано первым антигеном и первую тяжелую цепь, которая специфично распознает первый антиген. В конкретном варианте осуществления вторая тяжелая цепь содержит вариабельную область, которая кодируется нуклеиновой кислотой, которую получают из генома зрелой В-клетки второго животного, которое иммунизировано вторым антигеном, и вторая тяжелая цепь специфично распознает второй антиген.
В одном из вариантов осуществления первое животное и/или второе животное представляют собой генетически модифицированное животное, содержащее неперестроенную вариабельную область тяжелой цепи иммуно глобулин а человека. В одном из вариантов осуществления первое животное и/или второе животное представляет собой генетически модифицированное животное, содержащее неперестроенную вариабельную область тяжелой цепи иммуноглобулина человека и константную область иммуноглобулина человека. В одном из вариантов осуществления первое животное и/или второе животное представляет собой генетически модифицированную мышь, которая содержит неперестроенную вариабельную область тяжелой цепи иммуноглобулина человека.
Последовательности вариабельной области тяжелой цепи иммуноглобулина можно получать любым другим известным в данной области способом, например, посредством фагового дисплея, и полученные таким образом последовательности можно использовать для создания нуклеиново-кислотных конструктов, соединенных с нуклеиновыми кислотами, кодирующими любую подходящую тяжелую цепь, например, тяжелые цепи с модифицированными доменами СН3, как описано в настоящем документе, и помещать в экспрессирующую конструкцию и переносить в клетку, способную к созданию тяжелой цепи, например в присутствии подходящей легкой цепи. Легкие цепи иммуноглобулинов
Биспецифические антитела, содержащие две тяжелые цепи, которые распознают два различных эпитопа (или два различных антигена) более легко выделять, если они могут образовать пару с одинаковыми легкими цепями (т.е., легкими цепями, имеющими идентичные вариабельные и константные домены). В данной области известны различные способы создания легких цепей, которые могут образовывать пару с двумя тяжелыми цепями различной специфичности, не затрагивая при этом или по существу не затрагивая способность к избирательности и/или аффинность вариабельного домена тяжелой цепи по отношению к его антигену-мишени.
В одном из подходов, легкую цепь можно отбирать посредством исследования статистических данных использования всех вариабельных доменов легких цепей, определяя наиболее часто используемую легкую цепь в антителе человека, и образуя пару, в которой легкая цепь взаимодействует с двумя тяжелыми цепями различной специфичности.
В другом подходе, легкую цепь можно отобрать, изучая последовательность легкой цепи в библиотеке в формате фагового дисплея (например, библиотека в формате фагового дисплея, содержащая последовательность вариабельной области легкой цепи человека, например, библиотека ScFv человека) и отбирая из библиотеки наиболее общеупотребительную вариабельную область легкой цепи.
В другом подходе, легкую цепь можно отбирать, исследуя библиотеку вариабельных последовательностей легких цепей в формате фагового дисплея, используя вариабельные последовательности обоих тяжелых цепей в качестве зондов. Легкую цепь, которая связывается с обоими вариабельными последовательностями тяжелой цепи отбирают в качестве легкой цепи для связывания с тяжелыми цепями и обеспечивают связывание и/или активацию в отношении обоих эпитопов.
В другом подходе, легкую цепь можно отбирать комбинированием известных легких цепей с желаемыми тяжелыми цепями и исследованием полученного в результате биспецифического антитела на специфичность связывания, аффинность и/или способность к активации.
В тех случаях, когда при осуществлении любого из подходов при отборе легкой цепи встречаются трудности (например, легкая цепь оказывает влияние на связывание с антигеном одной или обеих тяжелых цепей или легкая цепь не связывается в достаточной степени с одной или обеими тяжелыми цепями), легкая цепь может совпадать с легкой цепью, родственной тяжелым цепям, и модификации в легкой цепи создают с целью большей совместимости характеристик последовательностей, характерных для родственных легких цепей обеих тяжелых цепей. При необходимости минимизировать возможность иммуногенности, модификации, предпочтительно, приводят в результате к получению последовательностей, которые присутствуют среди известных последовательностей легкой цепи, таким образом, является маловероятным, что протеолетический процессинг приведет к получению эпитопа для Т-клетки, если исходить из параметров и способов, известных в данной области для оценки вероятности возникновения иммуногенности (т.е., компьютерное моделирование, анализы в жидкостях).
Антитела и связывающие белки
Композиции и способы особенно подходят для создания биспецифических антител человека, т.е. биспецифических антител, содержащих константные и вариабельные домены иммуноглобулина человека. В некоторых вариантах осуществления, антитела человека включают такие антитела, которые обладают вариабельными и константными доменами тяжелой цепи, полученными из последовательностей иммуноглобулинов зародышевой линии человека, в некоторых вариантах осуществления полученных из соматически мутированных последовательностей иммуноглобулинов человека (полученных, например, от животного, которое содержит последовательности генов иммуноглобулина человека). В некоторых вариантах осуществления, вариабельные или константные области иммуноглобулина человека могут включать аминокислотные остатки, не кодируемые иммуноглобулиновыми последовательностями зародышевой линии человека или кодируемые в результате наличия рекомбинации и/или сплайсинга, например, в CDR и в частности CDR3. Антитела человека не предназначены для включения антител, в которых последовательности CDR, полученные из зародышевой линии других видов млекопитающих, таких как мышь, трансплантированы в каркасные последовательности человека. Такие антитела обозначают как гуманизированные или химерные антитела. Антитела человека не включают антитела, содержащие мутации, например, введенные in vitro случайным или сайт-специфическим мутагенезом, а мутации являются, предпочтительно, неиммуногенными для человека.
Способы и композиции можно использовать для создания химерных антител, предпочтительно, неиммуногенных для человека, или с низкой иммуногенностью. Химерные антитела представляют собой антитела, в которых одна из вариабельных областей тяжелой цепи или каркасная или CDR или константная область тяжелой цепи или домен происходит из различных видов (например, человека и мыши или человека и примата). В некоторых вариантах осуществления химерные антитела включают антитела, обладающие вариабельной областью тяжелой цепи, происходящей из не принадлежащего к человеку вида (например, мыши) и константной области тяжелой цепи человека. В некоторых вариантах осуществления химерные антитела включают антитела, обладающие вариабельной областью тяжелой цепи человека и константной областью тяжелой цепи не принадлежащего к человеку вида (например, мыши). В различных вариантах осуществления области, происходящие из мыши, идентичны или по существу идентичны последовательности зародышевой линии иммуноглобулина человека с соматической гипермутацией или без нее. Химерные антитела также включают антитела, обладающие константной областью легкой цепи, которая идентична или по существу идентична зародышевой линии иммуноглобулина человека и не принадлежащей к человеку (например, мышь) тяжелой цепью или человеческой/не принадлежащей человеку химерной тяжелой цепью. Химерные антитела включают антитела, обладающие константным доменом легкой цепи, который идентичен или по существу идентичен не принадлежащей к человеку (например, мышь) последовательности иммуноглобулина зародышевой линии и тяжелой цепью человеческого происхождения или химерной тяжелой цепью или человеческой/не принадлежащей человеку химерной тяжелой цепью.
В некоторых вариантах осуществления представлены композиции и способы для получения антител с созревшей аффинностью. В некоторых вариантах осуществления антитело с созревшей аффинностью содержит одно или несколько изменений в одном или нескольких CDR, которые приводят к более высокой аффинности (например. Ко в наномолярном или пикомолярном диапазоне) антитела по отношению к его мишеневому антигену, по сравнению с по существу идентичным антителом, которое не содержит изменений. Антитела с созревшей аффинностью можно получать любым подходящим способом, известным в данной области, например, случайным или сайт-специфическим мутагенезом CDR и/или каркасных областей с последующим скринингом аффинности, перестановкой домена VH и т.д.
В некоторых вариантах осуществления антитела представляют собой нейтрализующие антитела. Нейтрализующие антитела включают антитела, способные к нейтрализации, ингибированию или предотвращению биологической активности антигенов. Нейтрализующие антитела включают антитела, которые, при связывании с антигеном, предотвращают или снижают способность антигенов взаимодействовать с природной мишенью антигена in vivo и in vitro. Примеры нейтрализующих антител включают антитела к белковому лиганду биологического рецептора, который предотвращает связывание лиганда с рецептором, или антитело к биологическому рецептору, который предотвращает связывание рецептора и его лиганду, при этом связывание лиганда в отсутствие антитела побуждает рецептор вызывать изменения внутри клетки. Определение того, является ли антитело нейтрализующим антителом, как правило, влечет за собой проведение функционального исследования, где измеряют эффект антител на биологическую активность антигена.
Способы и композиции по изобретению также могут использоваться для различных вариантов применения в отношении антител и других связывающих белков. Краткое описание некоторых эффективных вариантов применения представлены в настоящем документе.
Можно создать биспецифические связывающие белки, которые включают специфичность связывания по отношению к опухолевым антигенам и антигенам Т-клеток, которые нацелены на антиген на клетке, например, на CD20 и также нацелены на антиген на Т-клетке, например, на CD3. Таким образом, биспецифическое антитело нацелено на обе представляющие интерес клетки у пациента (например, на В-клетку у пациента с лимфомой, посредством связывания CD20), а также на Т-клетку пациента. Биспецифическое антитело, в различных вариантах осуществления сконструировано таким образом, чтобы активировать Т-клетку при связывании CD3, таким образом связывая Т-клеточную активацию с конкретной, выбранной опухолевой клеткой.
Также можно получать биспецифичные связывающие белки, которые содержат две связывающие молекулы, каждая из которых нацелена на партнера по связыванию (т.е., каждая нацелена на различные мишени) на поверхности одной и той же клетки. Такое конструирование особенно подходит для нацеливания на конкретные клетки или типы клеток, которые экспрессируют обе мишени на поверхности одной и той же клетки. Несмотря на то, что мишени могут присутствовать по отдельности на других клетках, связывающие молекулы этих связывающих белков выбирают таким образом, чтобы каждая связывающая молекула связывала свою мишень с относительно низкой аффинностью (например, низкой микромолярной или высокой наномолярной, например KD выше ста наномолей, например 500, 600, 700, 800 наномолей). Таким образом, пролонгированное связывание мишени благоприятно только в случаях, когда две мишени близко расположены на одной и той же клетке.
Можно получать биспецифические связывающие белки, которые содержат две связывающие молекулы, которые связывают одну и ту же мишень, каждая в различном эпитопе одной и той же мишени. Такое конструирование особенно подходит для максимального увеличения возможности успешного блокирования мишени связывающим белком. Одну и ту же биспецифическую связывающую молекулу можно нацеливать на многочисленные внеклеточные петлевые структуры, например, трансмембранный канал или клеточный поверхностный рецептор.
Можно получать биспецифические связывающие белки, которые включают две связывающие молекулы, которые кластерируют и активируют негативные регуляторы иммунного пути передачи сигнала с целью иммунной супрессии. Подавление в значении цис можно достигать, когда мишени представлены на одной и той же клетке; подавление в значении транс можно достигать, когда мишени представлены на различных клетках. Подавление в значении цис, например, можно получать со специфическим связывающим белком, обладающим связывающей группой к IgGRIIb и связывающей группой к FelD1, так как IgGRIIb способен к кластерированию только в присутствие FelD1, с целью подавления иммунного ответа к FelD1. Подавления в значении транс, можно достигать, например, посредством биспецифического связывающего белка, обладающего связывающей группой к BTLA и связывающей группой, которая специфично связывает представляющий интерес тканеспецифический антиген, таким образом, кластерирование ингибиторной молекулы BTLA происходит только в выбранной мишеневой ткани, которая, возможно, связана с аутоиммунными заболеваниями.
Можно получать биспецифические связывающие белки, которые активируют многокомпонентные рецепторы. При таком конструировании, две связывающие молекулы, направляли против двух компонентов рецепторного связывания, поперечного связывания рецептора и активирования передачи сигнала с рецептора. Это можно осуществить, например, используя биспецифический связывающий белок со связывающей группой, которая связывает IFNAR1 и связывающей группой, которая связывает 1FNAR2, где связывание приводит к поперечному связыванию рецептора. Такой биспецифический связывающий белок можит являться альтернативой лечению интерфероном.
Можно получать биспецифические связывающие белки, которые осуществляют транспорт связывающих молекул через полупроницаемые барьеры, например, гематоэнцефалический барьер. При таком конструировании, одна связывающая молекула связывает мишень, которая может проходит через конкретный избирательный барьер; другая связывающая молекула нацелена на молекулу с терапевтической активностью, где мишеневая молекула с терапевтической активностью не может, в обычных условиях, пересекать барьер. Это свойство биспецифического связывания белка подходит для доставки терапевтических средств к тканям, которых терапевтическое средство иначе бы не достигло. Некоторые примеры включают нацеливание рецептора pIGR для транспортировки терапевтического средства в желудочно-кишечный тракт или легкие, или нацеливание трансферринового рецептора для транспортировки терапевтического средства через гематоэнцефалический барьер.
Можно получать биспецифические связывающие белки, которые транспортируют связывающие молекулы в конкретные клетки или типы клеток. При этом конструировании, одна связывающая молекула нацелена на клеточный поверхностный белок (например, рецептор), который легко интернализуется в клетку. Другая связывающая молекула нацелена на внутриклеточный белок, в тех случаях, когда связывание внутриклеточного белка вызывает терапевтический эффект.
Можно получать биспецифические связывающие белки, которые связывают поверхностный рецептор фагоцитарной иммунной клетки и поверхностную молекулу инфекционного патогена (например, дрожжей или бактерии), для передачи инфекционного патогена в окружение фагоцитарной иммунной клетки для облегчения фагоцитоза патогена. Примером такого конструирования было бы биспецифическое антитело, которое нацелено на молекулы CD64 или CD89, а также на патоген.
Можно получать биспецифические связывающие белки, которые имеют вариабельную область антитела в качестве одной из связывающих молекул, а в качестве второй связывающей молекулы не относящаяся к Ig молекула. Вариабельная область антитела осуществляет нацеливание, в то время как не относящаяся к Ig молекула представляет собой эффектор или токсин, соединенный с Fc. Таким образом, лиганд (например, эффектор или токсин) доставляют к мишени, связанной вариабельной областью антитела.
Можно получать биспецифические связывающие белки, которые имеют две молекулы, где каждая связывается с областью Ig (например, последовательностью Ig, содержащей области СН2 и СН3) таким образом, что любые две белковые молекулы можно приблизить друг к другу за счет Fc. Примеры такого конструирования включают ловушки, например гомо- или гетеродимерные молекулы-ловушки. Нуклеиновые кислоты
Последовательности нуклеиновой кислоты, кодирующие моноклональные антитела можно получать любыми подходящими способами, известными в данной области. Примеры подходящих способов получения моноклональных антител (и их последовательности нуклеиновой кислоты) включают, например, гибридомный способ (см., например, Kohler et al. (1975) Nature 256:495-497) или фаговой библиотеки антител (см., например, см. Clackson et al. (1991) Nature 352:624-628).
В различных вариантах осуществления вариабельные домены тяжелой цепи получают из последовательностей нуклеиновой кислоты генетически модифицированного животного или трансгенного животного. В некоторых вариантах осуществления области получают из животного, которое содержит минилокус иммуноглобулина человека. В некоторых вариантах осуществления области получают из мышей, содержащих одну или несколько внехромосомных нуклеиновых кислот, которые содержат одну или несколько нуклеиновых кислот, кодирующих последовательности иммуноглобулина. В различных вариантах осуществления животное может иметь одну или несколько неперестроенных последовательностей нуклеиновых кислот иммуноглобулина человека. В некоторых вариантах осуществления животное включает последовательности вариабельной области легкой цепи человека, в некоторых вариантах осуществления вариабельные последовательности тяжелой цепи человека, в некоторых вариантах осуществления вариабельные последовательности тяжелой и легкой цепи, и в некоторых вариантах осуществления дополнительно содержит последовательности константной области человека. В конкретном варианте осуществления последовательности нуклеиновой кислоты получают из мыши, у которой эндогенные сегменты вариабельных генов тяжелой цепи и сегменты вариабельных генов легкой цепи мыши заменены на сегменты вариабельных генов тяжелой цепи и сегменты вариабельных генов легкой цепи человека.
В некоторых вариантах осуществления последовательности нуклеиновой кислоты получают из "наивных" В или Т-клеток такого животного. В других вариантах осуществления последовательности нуклеиновой кислоты получают из В или Т-клеток животного, которое иммунизировано антигеном, представляющим интерес.
В различных вариантах осуществления последовательности нуклеиновой кислоты получают из клеток, амплифицируя их с праймерами, включающими, например, наборы вырожденных праймеров, которые содержат одну или несколько FR, соединительную цепь или константные последовательности.
В различных вариантах осуществления вариабельные домены тяжелой цепи получают из нуклеиновых кислот животного, которое иммунизировано представляющим интерес антигеном. Например, не относящееся к человеку трансгенное или генетически модифицированное животное иммунизируют представляющим интерес антигеном (например, подвергая животное воздействию антигена или клетки, несущей антиген или нуклеиновой кислоты, кодирующей экспрессируемую форму антигена), позволяя животному перенести иммунный ответ, выделяют иммунные клетки из животного (например, В-клетки), необязательно иммортализующие клетки, и скринируют клетки для идентификации реакционной способности к антигену и/или идентификации и/или выделения последовательности нуклеиновой кислоты, которая кодирует вариабельную область иммуно глобулин а, который способен распознавать антиген, будучи помещенным в условия антитела. В некоторых вариантах осуществления клетка представляет собой В-клетку. В некоторых вариантах осуществления В-клетку иммунизированного животного используют для создания гибридомы, и идентифицируют В-клетки, экспрессирующие антитела, которые специфично распознают эпитоп антигена и идентифицируют и/или выделяют последовательности нуклеиновой кислоты, которые кодируют аминокислотную последовательность вариабельной области.
В некоторых вариантах осуществления нуклеиновые кислоты получают из человекообразных, нечеловекообразных приматов (например, человекообразных обезьян, таких как шимпанзе), макак (например, яванская или резус), грызунов (например, мыши, крысы, хомяки), осла, коз, овцы и т.д.
В некоторых вариантах осуществления тяжелые цепи содержат последовательности, которые получают из клеток человека. Например, эмбриональных клеток человека, подвергающихся воздействию антигена in vitro и помещенных в подходящее животное-хозяина (например, мышь SCID).
В некоторых вариантах осуществления нуклеиновые кислоты встраивают в клетку, используя вектор. Векторы включают, например, плазмиды, космиды, ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы растений, YAC, ВАС, эписомы, полученные на основе EBV.
В некоторых вариантах осуществления нуклеиновые кислоты представлены в векторе экспрессии или экспрессирующей конструкции. В некоторых вариантах осуществления вектор экспрессии или конструкт представляет собой вектор, который содержит промотор, функционально связанный с представляющей интерес последовательностью нуклеиновой кислоты, такой как представляющая интерес последовательность нуклеиновой кислоты, которая способна экспрессироваться в подходящих условиях в подходящей клетке. Векторы экспрессии или конструкты могут включать лидерные последовательности, энхансеры, промоторные элементы, которые усиливают транскрипцию или трансляцию, последовательности, останавливающие транскрипцию, сплайсируемые последовательности, усиливающие транскрипцию интроны, элементы IRES, маркерные гены, выделенные последовательности, участки распознавания рекомбиназы, гомологичные плечи, вирусные последовательности, операторы (например, прокариотические операторы) и т.д. В некоторых вариантах осуществления векторы экспрессии содержат элементы, которые предусматривают индуцируемую экспрессию, например, прокариотический оператор, функционально связанный с эукариотическим промотором. В некоторых вариантах осуществления экспрессию индуцируют при добавлении индуктора экспрессии. В других вариантах осуществления экспрессию индуцируют устранением ингибитора экспрессии. В некоторых вариантах осуществления экспрессию индуцируют изменением температуры.
В некоторых вариантах осуществления одна или несколько нуклеотидных последовательностей тяжелой цепи представлены на одном и том же векторе. В некоторых вариантах осуществления последовательность нуклеиновой кислоты тяжелой цепи и последовательность нуклеиновой кислоты легкой цепи в настоящем документе представлены на одном и том же векторе. В одном из вариантов осуществления две последовательности нуклеиновой кислоты тяжелой цепи и последовательность нуклеиновой кислоты легкой цепи представлены в одном и том же векторе.
В некоторых вариантах осуществления нуклеиновые кислоты экспрессируются в клетке, которая содержит одну или несколько нуклеиновых кислот из вируса. В конкретных вариантах осуществления, вирус выбирают из аденовируса, аденоассоциированного вируса, SV-40, вируса Эпштейна-Барра, ретровируса, лентивируса, бакуловируса, коронавируса, вируса простого герпеса, полиовируса, вируса лихорадки леса Семлики, вируса Sindbis и вируса вакцинии.
Клетки-хозяева представляют собой клетки, которые могут быть трансформированы для экспрессии представляющей интерес нуклеиновой кислоты. В различных вариантах осуществления трансформация включает изменение нуклеиново-кислотного состава клетки таким образом, чтобы она содержала экзогенные нуклеиновые кислоты (например, нуклеиновую кислоту, не присутствующую в клетке в природе или одну или несколько дополнительных копий нуклеиновой кислоты, соответствующих последовательности нуклеиновой кислоты, представленной в клетке в природе). Нуклеиново-кислотный состав клетки можно изменять любыми подходящими способами, известными в данной области, например, интегрированием нуклеиновой кислоты в клеточный геном или помещением ее в клетку во внехромосомной или внегеномной форме. В некоторых вариантах осуществления нуклеиново-кислотное содержимое клетки можно изменять таким образом, чтобы клетка временно экспрессировала представляющую интерес нуклеиновую кислоту, или нуклеиново-кислотное содержимое можно изменять таким образом, чтобы клетка стабильно экспрессировала представляющую интерес нуклеиновую кислоту. В некоторых вариантах осуществления изменение в генетическом содержимом клетки наследуется при делении клетки.
Выделение биспецифического антигенсвязывающего белка
После того как выбрали подходящий набор модификаций, основываясь на информации, предоставленной в настоящем документе, были предприняты попытки выделить биспецифический антигенсвязывающий белок, используя способы, известные в данной области. Обычно применяемые опубликованные способы не при всех условиях могут обеспечить хорошее разделение.
Lindhofer et al. сконструировал биспецифическое антитело с гетеродимерной тяжелой цепью, где одна тяжелая цепь связывает белок A (IgG мыши), а другая тяжелая цепь не связывает белок А (IgG крысы), и успешно отделил гетеродимерное биспецифическое антитело крыса/мышь из смеси квадром и димеров мышь/мышь крыса/крыса, используя ступенчатый градиент рН со значениями от нейтрального до рН 5,8 для элюции гетеродимера и затем ступенчатый градиент со значениями рН от 5,8 до 3,5 для элюции гомодимера мышь/мышь. (См. Lindhofer et al. (1995) Preferential species-restricted heavy/light chain pairing in rat/mouse quadromas: Implications for a single-step purification of bispecific antibodies. J. Immunol. 155(1):219-225).
Подход Lindhofer не подходит при применении его для отделения гомодимера IgG1 из гетеродимера IgG1 с двумя тяжелыми цепями IgG1, которые являлись идентичными, за исключением того, что один из доменов СН3 IgG1 содержал дипептидную модификацию H435R/Y436F. Авторы изобретения обнаружили, что при линейном градиенте рН, IgG1 с модифицированным дипептидом элюировался при рН со значением приблизительно 3,9, тогда как гомодимер IgG1 элюировался при рН со значением приблизительно 3,7. Различие в значениях рН посчитали недостаточным для достижения хорошего отделения гетеродимера от гомодимера, используя способ Lindhofer. Предсказуемым образом различие не воспроизводилось.
Изменение в характере хроматографии наблюдали в процессе хроматографии, при использовании довольно значительной ионной силы, вносимой ионной силой буферного раствора для сохранения конкретного значения рН или градиента. Но успешного разделения не достигали добавлением органического модификатора (1-59 пропанол). Напротив, несколько неожиданным явилось то, что для некоторых хроматографических процессов добавление от 0,5 молярного до 1,0 молярного ионного модификатора (например, NaCl) радикально и непредвиденно увеличило разделение гомодимерного IgG1 и гетеродимерного IgG1. Добавление ионного модификатора расширило диапазон рН для элюции (1,2 единиц рН с ионным модификатором, но 0,2 единицы рН без ионного модификатора), таким образом, при ступенчатом градиенте рН возможно успешное разделение двух видов. В других хроматографических процессах, однако, успешного разделения достигли при концентрации NaCl всего приблизительно 150 мМ (см. пример 4). Для того, чтобы убедиться, что можно достичь успешного разделения, в одном из вариантов осуществления выделение биспецифического антигенсвязывающего белка выполнили в присутствии ионного модификатора с молярностью от приблизительно 0,5 до приблизительно 1,0.
Таким образом, в одном из вариантов осуществления способ разделения биспецифического антигенсвязывающего белка, содержащего гетеродимерный IgG с одной цепью, содержащей модификацию как описано в настоящем документе, включает стадию использования градиента рН в присутствии ионного модификатора. В одном из вариантов осуществления ионный модификатор представлен в концентрации, достаточной для максимального увеличения в различии рН между элюцией с подложки с белком А гомодимера IgG и гетеродимера IgG, как описано в настоящем документе (т.е., с модификациями СН3). В конкретном варианте осуществления ионный модификатор представлен в молярной концентрации от приблизительно 0,5 до приблизительно 1,0. В другом конкретном варианте осуществления ионный модификатор представлен в молярной концентрации от приблизительно 0,15 до приблизительно 0,5.
В одном из вариантов осуществления ионный модификатор представляет собой соль. В одном из вариантов осуществления ионный модификатор представляет собой соль щелочного металла или щелочноземельного металла и галоген. В конкретном варианте осуществления соль представляет собой хлористую соль щелочного металла или щелочноземельного металла, например, NaCl, KCl, LiCl, CaCl2, MgCl2. В конкретном варианте осуществления соль представлена в молярности приблизительно 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0.
В одном из вариантов осуществления значение градиента рН составляет от приблизительно рН 3,9 до приблизительно рН 4,5, в другом варианте осуществления от приблизительно рН 4,0 до приблизительно рН 4,4 и в другом варианте осуществления от приблизительно рН 4,1 до приблизительно рН 4,3. В конкретном варианте осуществления градиент представляет собой линейный градиент.
В одном из вариантов осуществления градиент рН представляет собой ступенчатый градиент. В одном из вариантов осуществления способ включает применение для уравновешивания колонки с белком А (уравновешенной, например, PBS или другим подходящим буфером или жидкостью) значения рН приблизительно 3,9, значения рН приблизительно 4,0, значения рН приблизительно 4,1, значения рН приблизительно 4,2, значения рН приблизительно 4,3 или значения рН приблизительно 4,4. В конкретном варианте осуществления значение рН составляет приблизительно 4,2.
В одном из вариантов осуществления биспецифическое антитело, содержащее гетеродимерный IgG с доменом СН3 элюируется с подложки с белком А в одной или нескольких фракциях, по существу не содержащих негетеродимерный IgG. В конкретном варианте осуществления элюированные фракции биспецифического антитела содержат менее чем приблизительно 1%, 0,5% или 0,1% суммарного белка по массе, который представляет собой негетеродимерное антитело.
ПРИМЕРЫ
Следующие примеры используют для представления описания специалистам в данной области того, каким образом получить и использовать способы и композиции по изобретению, и не предназначены для ограничения объема того, что авторы изобретения рассматривают в качестве своего изобретения. Были предприняты усилия для обеспечения точности используемых значений (например, количества, температура и т.д.), но необходимо учитывать некоторые экспериментальное ошибки отклонения. Если не указано иначе, части представляют собой массовые части, молекулярная масса представляет собой среднюю молекулярную массу, температура представлена в градусах Цельсия, и давление представлено в значении, соответствующем атмосферному или около атмосферного.
Пример 1: Биспецифический антигенсвязывающий белок IL-4Ra/IL-6Ra
Выявлено, что два известных антитела изотипа IgG1 человека, одно против IL-4Ra, а другое против IL-6Ra, имели легкие цепи, которые отличались только четырьмя аминокислотами. Эксперимент по совместной экспрессии показал, что легкая цепь антитела против IL-4Ra могла быть замещена легкой цепью из IL-6Ra и все еще сохранять высокую связывающую способность к IL-4Ra, таким образом позволяя ему продуцировать биспецифическое антитело, используя тяжелую цепь антитела против IL-4Ra и тяжелую цепь антитела против IL-6Ra и одну и ту же легкую цепь. Таким образом, модифицировали тяжелую цепь антитела IL-6Ra для создания FcΔAdp (т.е., дипептидную модификацию СН3 H95R/Y96F, по нумерации экзонов IMGT).
Легкую цепь антитела против IL-6Ra затем совместно экспрессировали в клетках СНО с тяжелыми цепями антитела против IL4Ra/Fc и против IL6Ra/FcΔAdp, и кондиционированную среду из эти клеток подвергли хроматографии с белком А. После загрузки колонки с белком А клеточным супернатантами, содержащими смесь гомо и гетеродимеров, проводили элюцию со ступенчатым градиентом рН, получаемым различной комбинацией двух буферов (А: 100 мМ цитрата Na, 150 мМ NaCl, рН 6,0 и В: 100 мМ цитрата Na, 150 мМ NaCl, рН 3,0; см. фиг.4), получая, таким образом, три ступени при рН 6,0, рН 4,2 и рН 3,0, соответственно. На фиг.4, IL-4R обозначает против IL-4Ra и IL-6RA обозначает против IL-6Ra (IgG1ΔAdp). Указанные фракции с колонки исследовали на связывание с белками IL-6Ra и IL-4Ra (см. фиг.5). Выполняли ступенчатую элюцию, что приводило к появлению одного пика при элюции при значении рН, равном 4,2, и второму пику при значении рН равном 3,0 (фиг.4). Анализ BIACORE™ показал, что проточный материал мог связывать растворимый IL-6Ra, но не IL-4Ra, как и ожидалось (фиг.5). Фракции, соответствующие пику при значении рН, равному 4,2 могли связывать приблизительно равные количества IL-6Ra и IL-4Ra, что согласуется с наличием гетеродимеров. Фракции, соответствующие пику элюции при значении рН, равном 3,0 могли связывать только IL-4Ra, а не IL-6Ra, что согласуется с ожидаемым гомодимером против IL-4Ra. Это доказывает, что гетеродимерное биспецифическое антитело могло быть эффективно выделено с использованием хроматографии с белком А, с простым ступенчатым градиентом рН.
Пример 2: Фармакокинетика белков FcΔAdp
Для тестирования того, оказала ли влияние модификация FcΔAdp на фармакокинетику гетеродимерной молекулы, содержащей Fc/FcΔAdp, мышам вводили очищенные гетеродимерные виды белков против IL-4Ra/против IL-6Ra, описанные выше, и концентрации иммуноглобулина человека в сыворотке измеряли в течение периода 28 суток (фиг.6; Таблица 1). Время полужизни в сыворотке гетеродимера составляло приблизительно 10 суток, аналогично гетеродимеру дикого типа. Это доказывает, что модификации FcΔAdp не оказывают видимого действия на время полужизни в сыворотке.
Пример 3: Биспецифический антигенсвязывающий белок CD20/CD3
Выявлено, что тяжелая цепь известного антитела против CD20 человека, будучи совместно экспрессированной с легкой цепью известного (активирующего) антитела против CD3 человека, все еще способна связывать CD20. Легкую цепь белка против CD3 затем подвергали совместной экспрессии или с тяжелой цепью белка против CD20/Fc, тяжелой цепью белка против CD3/FcΔAdp, или обоими тяжелыми цепями. Полученную в результате смешанную популяцию гомо- и гетеродимеров затем использовали в биоанализе для определения способности к уничтожению клеток-мишеней, экспрессирующих CD20 (фиг.7). В кратком изложении, 2×107 РВМС клеток человека активировали 6×107 гранул CD3×CD28 (Invitrogen) в течение 72 часов. Тридцать единиц IL-2 (система R&D) затем добавляли и клетки инкубировали дополнительно в течение 24 часов. Клетки затем разделяли до концентрации 0,5×106/мл и добавляли дополнительные 30 Ед IL-2. Клетки затем инкубировали дополнительные 48 часов и использовали в биоанализе. В сутки биоанализа 2×106/мл клеток-мишеней, экспрессирующих CD20 (Raji) метили в течение 30 минут 8 мкМ кальцеина-АМ (Invitrogen). Промытые клетки-мишени добавляли к активированным клеткам hPBMC в отношении 1:10 мишень:эффекторные клетки (общее количество клеток на лунку 220000) в 200 микролитрах суммарного объема с указанным количеством супернатанта, содержащего антитело. Клетки инкубировали в течение 2 часов и получали супернатант и количественно определяли флуоресценцию. Цитотоксичность измеряли, рассчитывая отношение специфической флуоресценции к максимальной флуоресценции. Ни отдельно антитело против CD20 (использующее легкую цепь белка против CD3) ни антитело против CD3 не смогли вызвать цитолиз клеток-мишеней; даже смешивание двух реагентов не оказало действия. Однако, в случае, если все три компонента подвергались совместной экспрессии, наблюдали значительный цитолиз, что показывает, что эффект был вызван наличием гетеродимерных биспецифических видов. Основываясь на расчетном количестве биспецифического антитела в супернатанте временно трансфицированных клеток СНО, EC50 Для цитолиза определили приблизительно равной 15 пМ.
Пример 4: Специфичность клеточного цитолиза у очищенного биспецифического антигенсвязывающего белка CD20/CD3
Супернатанты клеток СНО из эксперимента по трансфекции, который описаны в примере 3, подвергали аффинной хроматографии с белком А, используя ступенчатый градиент для элюции. Ступенчатый градиент получали посредством изменения комбинаций двух буферов (А: 20 мМ цитрата Na, 1М NaCl, рН 5,2; В: 20 мМ Na цитрат, 1М NaCl, рН 2,7). Таким образом, чтобы получить три ступени при значениях рН, равных 5,2, рН 4,2 и рН 2,8 соответственно. Белок, соответствующий пику элюции при рН 4,2 затем использовали в анализе цитолиза, как описано в примере 3. Цитолиз мишени наблюдали при ЕС5о равной 3 пМ (фиг.8). Дополнительный анализ цитотоксичности проводили для исследования специфичности наблюдаемого цитолиза к мишени. В этом эксперименте меченые клетки-мишени, экспрессирующие CD20 (Raji) или не экспрессирующие CD20 (293), инкубировали с активированными РВМС человека. Каждый тип клетки-мишени добавляли для анализа или отдельно или в комбинации с немеченными клетками-мишенями другого типа. Во всех случаях клетки-мишени, экспрессирующие CD20 подвергались специфичному цитолизу при ЕС50, равной 3 рМ, тогда как клеточная линия, не экспрессирующая CD20 не подвергалась цитолизу.
Пример 5: Разделение с белком А селективно модифицированного hIgG2 Fc
Селективно модифицированный гетеродимерный IgG2 человека Fc/ΔAdpFc и немодифицированный гомодимерный IgG2 человека Fc/Fc впервые получены способом "связывания и промывки" через колонку с белком A (rProtein A FF, GE). Для дополнительного отделения hIgG2 Fc/ΔAdpFc из hIgG2 Fc/Fc, проводили элюцию посредством ступенчатого градиента, используя систему SMART™ (GE), как указано далее. Система растворов состояла из раствора A (PBS, IX), раствора В (20 мМ цитрата натрия и 1М NaCl, pH 5,5) и раствора С (20 мМ цитрата натрия и 1М NaCl, pH 2,5). Элюцию начали с изократического элюирования с 100% А в первые 20 мин с последующим мгновенным переключением до 100% В в 20 мин. Затем начинали линейный градиент до 33,5% С и 66,5% В в течение следующих 10 мин; концентрацию 33,5% раствора С сохраняли в течение 20 мин до полной элюции первого пика (Fc/ΔAdpFc). Линейный градиент от 33,5% С до 100% С следовал в течение следующих 30 мин. Скорость потока поддерживали на уровне 250 микролитров/мин и результаты хроматограммы детектировали при 280 нм детектором UV. hIgG2 Fc/ΔAdpFc элюировался при pH 4,5, тогда как hIgG2 элюировался при pH 3,5.
Пример 6: Разделение с белком А селективно модифицированного hIgG4 Fc
Селективно модифицированный гетеродимерный IgG4 человека (Fc/ΔAdpFc) и немодифицированный гомодимерный IgG4 (Fc/Fc) впервые получены способом "связывания и промывки" через колонку с белком A (rProtein A FF, GE). Для дополнительного отделения hIgG4 Fc/ΔAdpFc из hIgG4 Fc/Fc, проводили элюцию посредством ступенчатого градиента, используя систему SMART™ (GE), как указано далее. Система растворов состояла из раствора A (PBS, 1X), раствора В (20 мМ цитрата натрия и 1М NaCl, pH 5,1) и раствора С (20 мМ цитрата натрия и 1М NaCl, pH 2,8). Элюцию начали с изократического элюирования с 100% А в первые 20 мин с последующим мгновенным переключением до 100% В в 20 мин. Затем начинали линейный градиент до 50% С и 50% В в течение следующих 10 мин; концентрацию 50% раствора С сохраняли в течение 20 мин вплоть до полной элюции первого пика (Fc/ΔAdpFc). Линейный градиент от 50% С до 100% С следовал в течение следующих 30 мин. Скорость потока поддерживали на уровне 250 микролитров/мин и результаты хроматограмм детектировали при 280 нм посредством детектора UV. hIgG4 Fc/ΔdpFc элюировался при pH приблизительно 4, тогда как гомодимер элюировался в течение градиента pH от приблизительно 4 до pH 2,8.
Пример 7: Разделение с белком А селекч-ивно модифицированного hIgG1 CD3×CD20
Селективно модифицированный гетеродимерный IgG1 против hCD3×CD20 (Fc/ΔAdpFc) и немодифицированный гомодимерный белок против hCD20 разделяли на колонке в 1 мл rProtein AFF (GE Biosciences), как указано далее. Система растворов представляла собой буфер А1 (PBS 1X), буфер А2 (20 мМ цитрата натрия и 1М NaCl pH 5,1), буфер В (20 мМ цитрата натрия и 1М NaCl pH 2,8). Смешанный образец подвергали связыванию и промывали в PBS и буфере А2. Ступенчатый градиент использовали для получения рН 4,2, при котором элюировался биспецифический CD3*×CD20 IgG1 (Fc/ΔAdpFc), затем использовали линейный градиент рН 4,2-2,8, при котором элюировался гомодимерный IgG1 против hCD20.
Пример 8: Аффинность связывания модифицированных СН3 с рецепторами Fc
Аффинность связывания биспецифического антитела изотипа IgG1 человека с модификацией ΔАар (H435R и Y436F, нумерация EU) с различными рецепторами Fc человека тестировали в анализе стационарного равновесия связывания Biacore™.
В кратком изложении, чип на основе карбоксиметилированного декстрана (СМ5) со связанным с амином mAb против penta-his (Qiagen) использовали для связывания различных конструктов рецепторов Fc человека. Далее с поверхностями различных покрытых белками против penta-his чипов СМ5 связывали эктодомены рецептора Fc, меченые his: FcγRI, FcγRIIA(полиморф R131), FcγRIIB и FcγRIIIB (каждый из которых получен R&D Systems); и FcγRIIA(полиморф Н131), FcγRIIIA(полиморф V176) и FcγRIIIA (полиморф F176) (каждый получен от Regeneron). Антитела пропускали через поверхность из расчета трех концентраций для высокоаффинного эктодомена рецептора FcγRI (25 нМ, 50 нМ и 100 нМ), и из расчета между микромолярностью 5 до наномолярности 39 для низкоаффинных эктодоменов рецептора FcγR и определяли значение констант скорости ассоциации и диссоциации (ka и kd) и использовали их для расчета равновесной константы диссоциации антител (KDs). Исследования связывания проводили при комнатной температуре, используя буфер HBS-T рН 7,2. Определили Kds для контрольного антитела (hmAb), антитела против CD20 и антитела против модификации CD3Δdp, и биспецифического антитела CD20×CD3Δdp. Значения Ко для антитела против CD3Δdp не показало значимых различий в связывании с любым из тестируемых рецепторов Fc, по сравнению с немодифицированным изотипом антител hIgG1 (таблица 2).
Пример 9: Фармакокинетика биспецифического hIgG1ΔAdp у мышей hFcRn
Фармакокинетическую скорость выведения биспецифического антитела IgG1ΔAdp против hCD3/hCD20 и его контролей, связанных с антителом (IgG против hCD3 и гомодимер IgGΔAdp против hCD3) определяли у мышей дикого типа (WT) и мышей, гомозиготных по замене FcRn мыши геном hFcRn (мышь hFcRn). Мыши дикого типа и мыши hFcRn представляли собой гибридные линии с исходной, содержащей C57BL6 (75%) и 129Sv (25%). Группы содержали по 4 мыши или WT или hFcRn, за исключением случая с одной группой мышей WT, получившей изотипически сходное контрольное антитело IgG1, в которой группа содержала 3 мыши. Мыши получили 1 мг/кг изотипически сходного (hIgG1) контрольного антитела, биспецифического IgG1ΔAdp против hCD3×CD20, IgG1 против hCD3 или гомодимера IgG1ΔAdp против hCD3. Все тестируемые компоненты вводили подкожно. Кровь собирали в 0 ч, 6 ч, 1 сут, 2 сут, 3 сут, 4 сут, 7 сут, 10 сут, 14 сут, 21 сут и 30 сут.
Уровни антител человека в сыворотке определяли "сэндвич" способом ELISA. В кратком изложении, поликлональным антителом козы против IgG человека (Fc-специфичное) (Jackson ImmunoResearch) покрыли 96-луночные планшеты из расчета концентрации один микрограмм/мл и инкубировали в течение ночи при 4°С. Затем планшеты блокировали БСА, образцы сыворотки в 6 кратных серийных разведениях и стандартные образцы соответствующих антител в 12-кратных серийных разведениях добавляли к планшету и инкубировали в течение одного часа при комнатной температуре. После промывания для удаления несвязавшегося антитела, детектировали связанные антитела человека, используя то же поликлональное антитело козы против IgG человека (Fc-специфичное), конъюгированное с пероксидазой хрена (HRP) (Jackson IminunoRe search) и выявляли посредством стандартного колориметрического тетраметилбензидинового субстрата (ТМВ) согласно рекомендациям производителя. Оптическую плотность при 450 нм регестрировали на спектрофотометре для чтения планшетов и рассчитывали концентрацию hIgG в образцах сыворотки, используя контрольную кривую, которую получали на той же плашке.
Не наблюдали значимого различия во времени полужизни в сыворотке четырех тестируемых антител IgG1 в течение периода в 30 суток. В частности, не наблюдали значимого различия между антителами IgG1, имеющими модификацию ДАар и антителами IgG1 дикого типа. Не наблюдали различия среди антител мышей дикого типа (mFcRn) или мышей, имеющих гуманизированное антитело FcRn (hFcRn). Как и ожидалось, у мышей hFcRn наблюдали немного ускоренный клиренс, по сравнению с мышами дикого типа. Результаты представлены в таблице 3.
Пример 10: Крупномасштабное выделение в буфере с низким содержанием соли
Биспецифическое антитело CD3×CD20ΔAdp выделяли по изобретению из крупномасштабной культуры. В кратком изложении, клеточную линию СНО-K1, экспрессирующую биспецифическое антитело против hCD3×CD20ΔAdp (модификация в тяжелой цепи CD3) культивировали в 11-литровом биореакторе. Клетки, несущие биспецифическое антитело вырастали до плотности приблизительно 8,25×106 клеток/мл, выход приблизительно 250-350 мг антитела/л. В отличие от этого выход контрольного антитела против hCD3 составил приблизительно 100-150 мг/л.
Антитело выделяли на смоле MabSelect SuRe™ (GE) (толщина слоя 20 см, 1 см ID), уравновешенной 10 мМ фосфата натрия, 0,5М NaCl, pH 7,2, осветленную клеточную культуру наносили до 19 г/л, и колонку промывали 10 мМ фосфата натрия, 0,5 М NaCl, pH 7,2, из расчета 3 объемов колонки, с последующим промыванием 20 мМ фосфата натрия, pH 7,2 (без NaCl) из расчета 2 объемов колонки. Антитело элюировали 40 мМ ацетата, pH 3,0.
Моноспецифическое антитело против CD30 элюировалось при pH 3,6, тогда как биспецифическое антитело hCD3×CD20DAdp элюировалось при pH 4,4.
Пример 11: Избирательная элгоция гетеродимеров мыши в среднем диапазоне значений pH с колонки с белком А
Клетки СНО-K1 временно трансфицировали экспрессирующими конструкциями внеклеточного домена IFNAR1 человека (hIFNAR1) и IFNAR2 человека (hIFNAR2), слитого с последовательностью дикого типа или мутантной последовательностью (ТТТК или РТТК) mIgG2a Fc. Отношение между hIFNAR1-mFc и hIFNAR2-mFc поддерживали из расчета 1:1 посредством трансфицирования клеток равными количествами двух экспрессионных плазмид. Среду для культивирования собирали через 4 суток после трансфекции и подвергали очистке с белком А, используя центрифужные колонки объемом 0,2 мл NACl Protein A Plus™ (Thermo Scientific/Pierce). В кратком изложении, колонки уравновешивали 1×PBS, pH 7,2. Один мл среды для культивирования СНО-K1 инкубировали со смолой с белком А в течение 10 минут при комнатной температуре. Колонку затем промывали три раза 1×PBS, pH 7,2. Связанные белки элюировали буфером с 20 мМ цитрата натрия, содержащим 1 М NaCl. Проводили три элюции, используя 0,4 мл элюирующего буфера с понижающими значениями pH. Белки в различных фракциях определяли посредством анализа вестерн-блоттинг.
Результаты показали, что при элюции с градиентом pH возможно отделение гетеродимеров дикого типа и звездчатого мутанта mIgG2a от гомодимеров дикого типа mIgG2a (см. фракцию Е1 на обоих гелях фиг.9).
Пример 12: Преимущественное образование гетеродимеров мутантов mIgG2a над гетеродимерами изотипов
Конструировали ДНК плазмиды для экспрессии в млекопитающих внеклеточных доменов рецепторов интерферона I типа (hIFNAR1 и hIFNAR2) с С-концевым Fc мыши (mIgG2a или mIgG1). Мутации в последовательности mIgG2a вводили, используя сайт-специфический мутагенез. Мутанты представляли собой ТТТ=М252Т, S254T, S256T; TTTK=М252Т, S254T, S256T, I258K; РТТТК=I247P, М252Т, S254T, S256T, I258K; RF=H435R, H436F. Клетки СНО-K1 временно трансфицировали экспрессирующими конструкциями. Отношение между IFNAR1-mFc и IFNAR2-mFc поддерживали из расчета 4:1 посредством трансфекции клеток 4-кратным избытком экспрессирующей плазмиды hIFNAR1-mFc (hIFNAR1-mIgG2a) по сравнению с hIFNAR2-mFc (mIgG1 или мутантный mIgG2a). Среду для культивирования собирали через 4 суток после трансфекции и белки mFc детектировали анализом вестерн-блоттинг.
Результат показал, что образование гетеродимеров между mIgG2a и mIgG1 намного менее эффективно, чем образование гетеродимеров между mIgG2a дикого типа и мутантами mIgG2a (сравни дорожки 1, 2, 5 фиг.10). Отношение 4:1 конструкт IFNAR1:IFNAR2 использовали для поддержания избытка конструкта IgG2a дикого типа в эксперименте.
Реферат
Изобретение относится к биохимии. Описан способ получения антигенсвязывающего белка, который является гетеродимерным в отношении связывания белка А. Культивируют клетки, содержащие первую нуклеиновую кислоту, кодирующую первую тяжелую цепь иммуноглобулина, содержащую первый вариабельный домен, который распознает первый эпитоп и вторую нуклеиновую кислоту, кодирующую вторую тяжелую цепь иммуноглобулина, содержащую второй вариабельный домен, который распознает второй эпитоп, где вторая область СН3 содержит модификацию, которая снижает или предотвращает связывание второй области СН3 с белком А по сравнению с первой областью СН3, а также третью нуклеиновую кислоту, кодирующую легкую цепь иммуноглобулина, которая образует пару с первой и второй тяжелыми цепями иммуноглобулина. Изобретение решает проблему загрязнения побочными продуктами биспецифических антигенсвязывающих белков А. 18 з.п. ф-лы, 10 ил., 3 табл., 12 пр.
Формула
культивирование клетки, содержащей
(i) первую нуклеиновую кислоту, кодирующую первую тяжелую цепь иммуноглобулина, содержащую первый вариабельный домен, который распознает первый эпитоп, причем первая тяжелая цепь иммуноглобулина содержит первую область СН3 IgG человека, выбранную из IgG1, IgG2 и IgG4, где первая область СН3 связывается с белком А;
(ii) вторую нуклеиновую кислоту, кодирующую вторую тяжелую цепь иммуноглобулина, содержащую второй вариабельный домен, который распознает второй эпитоп, причем вторая тяжелая цепь иммуноглобулина содержит вторую область СН3 IgG человека, выбранную из IgG1, IgG2 и IgG4, где вторая область СН3 содержит модификацию, которая снижает или предотвращает связывание второй области СН3 с белком А по сравнению с первой областью СН3;
(iii) третью нуклеиновую кислоту, кодирующую легкую цепь иммуноглобулина, которая образует пару с первой и второй тяжелыми цепями иммуноглобулина;
в условиях, обеспечивающих экспрессию клеткой первой и второй тяжелых цепей иммуноглобулина и легкой цепи иммуноглобулина с образованием антигенсвязывающего белка, где антигенсвязывающий белок является гетеродимерным в отношении связывания белка А.
(a) последовательности первой и второй нуклеиновых кислот находятся на одном и том же векторе или вирусе;
(b) последовательности первой и третьей нуклеиновых кислот находятся на одном и том же векторе или вирусе; или
(c) последовательности первой, второй и третьей нуклеиновых кислот находятся на одном и том же векторе или вирусе.

Комментарии