Ингибирование ангиогенеза - RU2471498C2
Код документа: RU2471498C2
Чертежи

























































































Описание
Область изобретения
Изобретение в основном относится к ингибированию воспалительного клеточно-опосредованного ангиогенеза. В частности, изобретение относится к предупреждению или лечению опухолевого ангиогенеза и ингибированию развития опухоли, с использованием антагонистов Bv8, таких как антитела против Bv8.
Предпосылки изобретения
Точно установлено, что ангиогенез играет важную роль в развитии опухоли и метастазах, и меры против ангиогенеза представляют собой клинически подтвержденную противораковую стратегию (Folkman, J., Nat Med 1, 27-31 (1995); Ferrara, N. and Kerbel, R.S., Nature 438, 967-974 (2005); Carmeliet, P. Nat Med 9, 653-660 (2003)). Ангиогенез также играет роль ключевого патогенетического фактора во многих других заболеваниях, включая возрастную дегенерацию желтого пятна (AMD). Сообщалось, что хороидальная неоваскуляризация зависит по меньшей мере частично от инфильтрации нейтрофилами (Zhou et al., Mol. Vis 11; 414-424 (2005)). Традиционно считается, что опухолевые клетки являются основным источником медиаторов ангиогенеза (Folkman, J., N Engl J Med 385, 1182-1186 (1971)). Действительно, многие исследования показали, что злокачественные клетки могут продуцировать многие ангиогенные факторы, включая фактор роста эндотелия сосудов A (VEGF-A), ангиопоэтины, фактор роста гепатоцитов (HGF) и основной фактор роста фибробластов (bFGF), и различные мутации онкогенов или генов супрессоров опухолей могут привести к увеличенному образованию по меньшей мере некоторых из этих факторов (Rak, J., et al., Cancer Res 55, 4575-4580 (1995); Wizigmann, et al., Cancer Res 55, 1358-1364 (1995)). Однако теперь неопровержимые доказательства поддерживают представление о том, что строма, состоящая из фибробластов, перицитов, мезенхимальных стволовых клеток и воспалительных иммунных клеток, а также эндотелиальные предшественники также вносят вклад в рост опухоли не только посредством секреции ангиогенных факторов, но также посредством модуляции иммунной системы (Hanahan, D. and Weinberg, R. A., Cell 100, 57-70 (2000); Coussens, L.M. and Werb, Z., Nature 420, 860-867 (2002); Blankenstein T., Curr Opin. Immunol. 17:180-186 (2005); Karnoub et al., Nature 449:557-563 (2005); Orimo et al., Cell Cycle 5:1497-1601 (2006); and Rafii, S. et al., Nat Rev Cancer 2, 826-835 (2002)). Теоретически, некоторые из этих клеток могут подавлять рост опухоли с помощью механизмов иммунологического надзора, но множество доказательств указывает на то, что заметная инфильтрация лейкоцитами и другими воспалительными клетками в опухолях несет неблагоприятный прогноз (Coussens. et al., выше).
Последние исследования напрямую вовлекают различные популяции миелоидных клеток в регулирование опухолевого ангиогенеза (Da Palma, M., et al., Nat. Med. 9, 789-795 (2003); Yang, L. et al., Cancer Cell 6, 409-421 (2004); De Palma M., et al., Cancer Cell 8, 211-226 (2005)) и VEGF-индуцированной неоваскуляризации у взрослых (Grunewald, M. et al., Cell 124, 175-189 (2006)). В самых последних исследованиях предоставлено доказательство роли миелоидных клеток CD11b+Gr1+ в опосредовании рефрактерности к терапии против VEGF в некоторых моделях опухолей (Shojaei, F. et al., Cell 124, 175-189 (2006)). Описывалась роль нейтрофилов в инициации включения ангиогенеза в трансгенных моделях многостадийного канцерогенеза (Nozawa, H. et al., Proc. Natl. Acad. Sci USA 103, 12493-12498 (2006)). Миелоидные клетки могут локально секретировать ангиогенные факторы или продуцировать протеазы, такие как матриксная металлопротеиназа-9 (Yang, L., et al., выше; Nozawa et al., выше; van Kempen, L. C. et al., Eur J Cancer 42, 728-734 (2006)), которые в свою очередь могут способствовать ангиогенезу посредством увеличения биодоступности и активности VEGF-A в микроокружении опухоли (Bergers G., et al., Nat Cell. Biol 2, 737-744 (2000)). Тем не менее, наше понимание механизмов, с помощью которых миелоидные клетки мобилизуются из КM и способствуют опухолеобразованию, остается неполным.
Bv8 и EG-VEGF представляют собой близко связанные секретируемые белки, также обозначаемые как прокинетицин-1 и -2, которые структурно принадлежат к более крупному классу пептидов, определяемому по мотиву пяти дисульфидных мостиков, который называют колипазным фолдом (DeCouter, J. et al., Nature 420, 860-867 (2002); LeCouter. J. et al., Proc. Natl. Acad. Sci USA 100, 2685-2690 (2003); Li, M. et al., Mol. Pharmacol. 59, 692-698 (2001)). Изначально Bv8 идентифицировали как секретируемый белок из кожи лягушки Bombina variegate (Mollay, C. et al., Eur J Pharmacol. 374, 189-196 (1999)). Клонирование и экспрессия Bv8 описаны в WO 03/020892, который опубликован 13 марта 2003 года. Bv8 и EG-VEGF связываются с двумя близко связанными сопряженными с G-белком рецепторами (GPCR), EG-VEGF/PKR-1 (R1) и EG-VEGF/PKR-2 (R2) (Masuda, Y et al., Biochem Biophys Res Commun 293, 496-402 (2002); Lin, D.C. et al., J Biol. Chem. 277, 19276-19280 (2002)). EG-VEGF и Bv8 охарактеризованы как митогены, селективные к особым типам эндотелиальных клеток (LeCouter, J. et al., (2001) и (2003), выше). Для этого семейства описаны другие активности, включая ноцицепцию (Mollay, C. et al., выше), двигательную активность желудочно-кишечного тракта (Li, M. et al., выше), регулирование суточного локомоторного ритма (Cheng, M. Y., et al., Nature 417, 405-410 (2002)) и нейрогенез обонятельной луковицы (Matsumoto, S., et al., Proc. Natl. Acad. Sci USA 103, 4140-4145 (2006)). Кроме того, Bv8 или EG-VEGF стимулировали образование гранулоцитарных или моноцитарных колоний in vitro (LeCouter, J. et al., (2003), выше; Dorsch, M. et al., J Leukoc Biol. 78(2), 426-34 (2005)). Bv8 охарактеризован как хемоаттрактант для макрофагов (LeCouter et al., Proc. Natl. Acad. Sci USA 101, 16813-16919 (2004)).
Признание фактора роста эндотелия сосудов (VEGF) в качестве основного регулятора ангиогенеза в патологических состояниях приводило ко многим попыткам блокировать активности VEGF. VEGF представляет собой один из наиболее охарактеризованных и самых мощных положительных регуляторов ангиогенеза. См., например, Ferrara, N. & Kerbel, R.S. Angiogenesis as a therapeutic target. Nature 438:967-74 (2005). В дополнение к тому, что он является ангиогенным фактором в ангиогенезе и васкулогенезе, VEGF, в качестве плеотропного фактора роста, проявляет многие биологические эффекты в различных физиологических процессах, таких как выживаемость эндотелиальных клеток, проницаемость сосудов и вазодилятация, хемотаксис моноцитов и поступление кальция. Ferrara and Davis-Smyth (1997) Endocrine Rev. 18:4-25. Кроме того, сообщалось об исследованиях митогенных эффектов VEGF на некоторые неэндотелиальные типы клеток, такие как пигментные клетки эпителия сетчатки, клетки протока поджелудочной железы и Шванновские клетки. См., например, Guerrin et al. J. Cell Physiol. 164:385-394 (1995); Oberg-Welsh et al. Mol. Cell. Endocrinol. 126:125-132 (1997); и Sondell et al. J. Neurosci. 19:5731-5740 (1999).
Признание фактора роста эндотелия сосудов (VEGF) в качестве основного регулятора ангиогенеза в патологических состояниях привело ко многим попыткам блокировать активности VEGF. Ингибиторные антитела против рецептора VEGF, растворимые рецепторные конструкции, антисмысловые стратегии, аптамеры РНК против VEGF и низкомолекулярные ингибиторы VEGF рецептора тирозинкиназы (RFK), все были предложены для использования для того, чтобы препятствовать передаче сигналов посредством VEGF. См., например, Siemeister et al. Cancer Metastasis Rev. 17:241-248 (1998). Было показано, что нейтрализующие антитела против VEGF подавляют рост многих линий опухолевых клеток человека у голых мышей (Kim et al. Nature 362:841-844 (1993); Warren et al. J. Clin. Invest. 95:1789-1797 (1995); Borgstrom et al. Cancer Res. 56:4032-4039 (1996); and Melnyk et al. Cancer Res. 56:921-924 (1996)), а также подавляют внутриглазной ангиогенез в моделях ишемических расстройств сетчатки (Adamis et al. Arch. Ophthalmol. 114:66-71 (1996)). Действительно, гуманизированное антитело против VEGF, бевацизумаб (АВАСТИН®, Genentech, South San Francisco, CA), было одобрено Управлением по продовольствию и лекарствам США в сочетании с внутривенной химиотерапией на основе 5-фторурацила (5-FU) для терапии первого или второго ряда пациентов с метастатической карциномой толстой или прямой кишки и в сочетании с карбоплатином и паклитакселом для терапии первой линии пациентов с нерезектабельным, локально запущенным, рецидивирующим или метастазирующим несквамозным немелкоклеточным раком легких (НМКРЛ). См., например, Ferrara et al., Nature Reviews Drug Discovery, 3:391-400 (2004).
Однако способность терапевтических соединений длительно препятствовать росту опухоли часто ограничивается развитием устойчивости к лекарственному средству. Некоторые механизмы устойчивости к различным цитотоксическим соединениям были установлены и функционально описаны, в основном на одноклеточных моделях опухолей. См., например, Longley, D.B. & Johnston, P. G. Molecular mechanisms of drug resistance. J Pathol. 205:275-92 (2005). Кроме того, взаимодействия стромы хозяйского организма и опухолевых клеток могут участвовать в фенотипах с устойчивостью к лекарственным средствам. Стромальные клетки секретируют множество проангиогенных факторов и не склонны к такой генетической нестабильности и увеличению уровня мутаций, как у опухолевых клеток (Kerbel, R. S. Inhibition of tumor angiogenesis as a strategy to circumvent acquired resistance to anti-cancer therapeutic agents. Bioessays 13:31-6 (1991)). Рассмотрено в Ferrara & Kerbel и Hazlehurst et al., в Ferrara, N. & Kerbel, R. S. Angiogenesis as a therapeutic target. Nature 438:967-74 (2005); и Hazlehurst, L.A., Landowski, T.H. & Dalton, W.S. Role of the tumor microenviroment in mediating de novo resistance to drugs and physiological mediators of cell death. Oncogene 22:7396-402 (2003).
В доклинических моделях блокада передачи сигналов посредством передачи сигналов VEGF с помощью гуманизированного моноклонального антитела бевацизумаб (АВАСТИН, Genentech, South San Francisco, CA) или мышиного предшественника бевацизумаба (A4.6.1 (гибридомная клеточная линия, продуцирующая A4.6.1, депонированная 3/29/91, ATCC HB-10709)) значительно ингибировала рост опухоли и снижала опухолевый ангиогенез в большинстве протестированных ксенотрансплантатных моделей (рассмотрено в Gerber & Ferrara in Gerber, H. P. & Ferrara, N. Pharmacology and pharmacodynamics of bevacizumab as monotherapy or in combination with cytotoxic therapy in preclinical studies. Cancer Res 65:671-80 (2005)). Фармакологические эффекты монотерапии против VEGF были лучше всего выражены, когда лечение начинали на ранних стадиях роста опухоли. Если лечение откладывали до тех пор, когда опухоль хорошо развивалась, типично ингибиторные эффекты были временными и опухоли, в конце концов, развивали устойчивость. См., например, Klement, G. et al. Differences in therapeutic indexes of combination metronomic chemotherapy and an anti-VEGFR-2 antibody in multidrug-resistant human breast cancer xenografts. Clin. Cancer Res 8:221-32 (2002). Клеточные и молекулярные события, лежащие в основе такой устойчивости к лечению против VEGF, носят комплексный характер. См., например, Casanovas, O., Hicklin, D. J., Bergers, G. & Hanahan, D. Drug resistance by evasion of antiangiogenic targeting of VEGF signaling in late-stage pancreatic islet tumors. Cancer Cell 8:299-309 (2005); и Kerbel, R.S. et al. Possible mechanisms of acquired resistance to anti-angiogenic drugs: implications for the use of combination therapy approaches. Cancer Metastasis Rev 20:79-86 (2001). Может быть вовлечено множество факторов. Например, сочетание лечения соединениями, направленными на передачу сигналов посредством VEGF и фактора роста фибробластов (FGF), повышало эффективность и задерживало наступление устойчивости у опухолей на поздних стадиях в генетической модели канцерогенеза в панкреатическом островке. См., Casanovas, O., Hicklin, D. J., Bergers, G. & Hanahan, D. Drug resistance by evasion of antiangiogenic targeting of VEGF signaling in late-stage pancreatic islet tumors. Cancer Cell 8, 299-309 (2005). Другие исследователи выделяли стромальные фибробласты, которые инфильтрируют опухоли, в качестве возможного источника альтернативных проангиогенных факторов. См., например, Dong, J. et al. VEGF-null cells require PDGFR alpha signaling-mediated stromal fibroblast recruitment for tumorigenesis. Embo J 23:2800-10 (2004); и Orimo, A. et al. Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion. Cell 121:335-48 (2005).
Воспалительные клетки могут участвовать в ангиогенезе посредством секреции воспалительных цитокинов, которые могут влиять на активацию клеток эндотелия, их пролиферацию, миграцию и выживаемость (рассмотрено в Albini et al. и Balkwill et al. in Albini, A., Tosetti, F., Benelli, R. & Noonan, D. M. Tumor inflammatory angiogenesis and its chemoprevention. Cancer Res 65: 10637-41 (2005); и Balkwill, F., Charles, K. A. & Mantovani, A. Smoldering and polarized inflammation in the initiation and promotion of malignant disease. Cancer Cell 7:211-7 (2005)). Некоторые воспалительные клетки, которые инфильтрируют опухоли, секретируют проангиогенные факторы, включая моноциты/макрофаги (см., например, De Palma, M. et al. Tie2 identifies a hematopoietic lineage of pro-angiogenic monocytes required for tumor vessel formation and a mesenchymal population of pericyte progenitors. Cancer Cell 8:211-26 (2005); и, Yang, L. et al. Expansion of myeloid immune suppressor Gr+CD11b+ cells in tumor-bearing host directly promotes tumor angiogenesis. Cancer Cell 6:409-21 (2004)), T- и B-лимфоциты (см., например, Freeman, M. R. et al. Peripheral blood T-lymphocytes and lymphocytes infiltrating human cancers express vascular endothelial growth factor: a potential role for T-cells in angiogenesis. Cancer Res 55:4140-5 (1995)), васкулярные лейкоциты (см., например, Conejo-Garcia, J. R. et al. Vascular leukocytes contribute to tumor vascularization. Blood 105:679- 81 (2005)), дендритные клетки (см., например, Conejo-Garcia, J. R. et al. Tumor-infiltrating dentritic cell precursors recruited by a beta-defensin contribute to vasculogenesis under the influence of Vegf-A. Nat Med 10:950-8 (2004)), нейтрофилы (см., например, Coussens, L.M., Tinkle, C.L., Hanahan, D. & Werb, Z. MMP-9 supplied by bone marrow-derived cells contributes to skin carcinogenesis. Cell 103:481-90 (2000)) и тучные клетки (см., например, Coussens, L. M. et al. Inflammatory mast cells upregulate angiogenesis during squamous epithelial carcinogenesis. Genes Dev 13:382-97 (1999); и (рассмотрено в de Visser and Coussens in de Visser, K.E., Eichten, A. & Coussens, L. M. Paradoxical roles of the immune system during cancer development. Nat. Rev. Cancer. 6:24-37 (2006)). Было выдвинуто предположение о том, что эндотелиальные клетки-предшественники, полученные из костного мозга (EPC (см., например, Lyden, D. et al. Impaired recruitment of bone-marrow-derived endothelial and hematopoietic precursor cells blocks tumor angiogenesis and growth. Nat Med 7, 1194-201 (2001)), и периваскулярные клетки-предшественники (см., например, Song, S., Ewald, A.J., Stallcup, W., Werb, Z. & Bergers, G. PDGFRbeta+ perivascular progenitor cells in tumours regulate pericyte differentiation and vascular survival. Nat. Cell. Biol. 7:870-9 (2005)) вносят вклад в образование сосудов в некоторых экспериментальных моделях опухолевого роста (рассмотрено в Rafii et al. in Rafii, S., Lyden, D.. Benezra, R., Hattori, K. & Heissig, B. Vascular and haematopoietic stem cells: novel targets for anti-angiogenesis therapy? Nat. Rev. Cancer 2:826-35 (2002)). Было показано, что миелоидная линия дифференцировки гематопоэтических клеток, включая связанные с опухолью макрофаги (TAM), стимулирует ангиогенез или напрямую посредством секреции ангиогенных факторов, или опосредованно через продукцию протеаз, расщепляющих внеклеточный матрикс, которые, в свою очередь, высвобождают изолированные ангиогенные факторы (рассмотрено в Lewis, CE. & Pollard, J. W. Distinet role of macrophages in different tumor microenviroments. Cancer Research 66:605-612 (2006); и Naldini, A. & Carraro, F. Role of inflammatory mediators in angiogenesis. Curr Drug Targets Inflamm Allergy 4:3-8 (2005)). Среди миелоидных клеточных линий дифференцировки клетки-предшественники CD11b+Gr1+, выделенные из селезенок мышей, несущих опухоли, ускоряли ангиогенез при совместной инъекции с опухолевыми клетками (см., например, Yang, L. et al. Expansion of myeloid immune suppressor Gr+CD11b+ cells in tumor-bearing host directly promotes tumor angiogenesis. Cancer Cell 6:409-21 (2004)), и количество макрофагов, которые инфильтрируют опухоли, коррелировало с неблагоприятным прогнозом в некоторых опухолях человека (рассмотрено в Balkwill et al., в Balkwill, F., Charles, K.A. & Mantovani, A. Smoldering and polarized inflammation in the initiation and promotion of malignant disease. Cancer Cell 7:211-7 (2005)). Однако в другом исследовании макрофаги ингибировали рост экспериментальных опухолей у мышей, что указывает на то, что они обладают потенциалом для противораковой терапии. См., например, Kohchi, C. et al. Utilization of macrophages in anticancer therapy: the macrophage network theory. Anticancer Res 24:3311-20 (2004). В Shojaei, F. Wu, et al. Tumor refractoriness to anti-VEGF therapy is mediated by CD11b(+)Gr1(+) myeloid cells. Nat Biotechnology 2007 25(8):911-20 сообщалось о роли миелоидных клеток CD11b(+)Gr1(+) в устойчивости опухолей к лечению антителами против VEGF. Подобные открытия раскрыты в одновременно рассматриваемой заявке США с серийным номером 11/692681, которая подана 28 марта 2007 года.
Несмотря на относительный избыток миелоидных клеток и их способность продуцировать проангиогенные факторы, их роль в устойчивости опухоли к лечению против VEGF остается неизвестной. Существует необходимость узнать и понять биологические функции миелоидных клеток, устойчивых опухолей и факторов, которые они продуцируют. Настоящее изобретение исследует эти и другие потребности, что будет ясно из обзора следующего раскрытия.
Сущность изобретения
Настоящее изобретение основано, по меньшей мере частично, на экспериментальных данных, которые указывают на то, что Bv8 регулирует мобилизацию клеток CD11b+Gr1+ из костного мозга (КМ) в процессе развития опухоли и способствует опухолевому ангиогенезу. Таким образом, настоящее изобретение относится к способам и композициям для диагностики и лечения опухолей, устойчивых к лечению с помощью антагонистов VEGF.
В одном из аспектов изобретение относится к способу лечения опухоли, который включает введение млекопитающему субъекту, такому как субъект-человек, который обладает опухолью, которую предварительно лечили антагонистом фактора роста эндотелия сосудов (VEGF), эффективного количества антагониста Bv8. Субъект-человек может быть, но не обязан быть, рефрактерным к лечению антагонистом VEGF.
В одном из вариантов осуществления антагонист VEGF представляет собой антитело против VEGF или его фрагмент, где антитело против VEGF может представлять собой, например, бевацизумаб или его фрагмент или вариант.
В другом варианте осуществления антагонист Bv8 представляет собой моноклональное антитело против Bv8 или против рецептора Bv8 или его фрагмента, где рецептор Bv8 может представлять собой PKR-1/EG-VEGFR1 или PKR-2/EG-VEGFR2. Bv8, с которым связывается антитело, представляет собой полипептид Bv8 с нативной последовательностью млекопитающего, подвергавшегося лечению. Сходным образом рецептор Bv8, с которым связывается антитело, представляет собой рецептор Bv8 с нативной последовательностью млекопитающего, подвергавшегося лечению.
Антитела или фрагменты антител могут быть химерными, гуманизированными или человеческими. В дополнительном варианте осуществления субъекту дополнительно вводили антитело против VEGF, где VEGF может представлять собой любую молекулу VEGF, в частности, включая без ограничения 165-аминокислотный фактор роста эндотелиальных клеток сосудов, и родственные 121-, 145-, 189- и 206-аминокислотные факторы роста эндотелиальных клеток сосудов, вместе с встречающимися в природе их аллельными и процессированными формами. В конкретном варианте осуществления антитело против VEGF представляет собой бевацизумаб или его фрагмент или вариант.
В другом варианте осуществления в дополнение к введению антагониста Bv8 и необязательно антагониста VEGF млекопитающего субъекта, такого как пациент-человек, лечат с помощью одного или нескольких дополнительных средств, снижающих миелоидные клетки, таких как антагонист Gr1, ингибитор эластазы, антагонист MCP-1 и/или антагонист MIP-1 альфа.
В еще одном варианте осуществления, подвергавшийся лечению млекопитающий субъект, такой как субъект-человек, подвергается химиотерапии и/или лучевой терапии, где химиотерапия может включать, например, введение цитотоксического средства. Предпочтительно, дополнительное лечение представляет собой лечение, которое известно как «мера заботливости» для лечения специфической целевой опухоли.
Опухоль может представлять собой любой вид доброкачественной или злокачественной опухоли, включая без ограничения карциному, включая аденокарциному, лимфому, бластому, меланому, саркому и лейкемию. Предпочтительным раком в настоящем документе является рак толстого кишечника, рак прямой кишки, рак легких и рак молочной железы, в частности, метастатическая карцинома толстой или прямой кишки или несквамозный немелкоклеточный рак легких (НМКРЛ).
В конкретном варианте осуществления вышеупомянутый способ дополнительно содержит стадию мониторинга эффективности лечения посредством определения количества и/или частоты циркулирующих и/или костномозговых клеток CD11b+Gr1+ в биологическом образце, полученном из млекопитающего субъекта, такого как человек, по отношению к количеству или частоте до лечения.
В другом аспекте изобретение относится к способу лечения опухоли, который включает
(a) введение млекопитающему субъекту, который несет опухоль, такому как человек, эффективного количества антагониста Bv8, и
(b) мониторинг эффективности указанного лечения посредством определения количества и/или частоты циркулирующих и/или костномозговых клеток CD11b+Gr1+ в биологическом образце, который получен от млекопитающего субъекта, такого как человек, по отношению к количеству или частоте до лечения, где сниженное количество или частота указывает на то, что лечение является эффективным.
В дополнительном аспекте изобретение относится к способу ингибирования ангиогенеза, опосредованного воспалительными клетками, у млекопитающего, такого как субъект-человек, включающий введение субъекту эффективного количества антагониста Bv8.
Антагонист может представлять собой, например, моноклональное антитело против Bv8 или против рецептора Bv8 или его фрагмент, которое может быть химерным, гуманизированным или человеческим. Bv8, с которым связывается антитело, представляет собой Bv8 с нативной полипептидной последовательностью млекопитающего, подвергавшегося лечению. Сходным образом рецептор Bv8, с которым связывается антитело, представляет собой рецептор Bv8 с нативной последовательностью млекопитающего, подвергавшегося лечению.
Способ может дополнительно содержать стадию мониторинга эффективности лечения посредством определения количества и/или частоты циркулирующих и/или костномозговых клеток CD11b+Gr1+ в биологическом образце, полученном от млекопитающего субъекта, такого как человек, по отношению к количеству или частоте до лечения.
В другом варианте осуществления способ может дополнительно содержать введение дополнительного ингибитора ангиогенеза, такого как, например, антитело к ангиогенному фактору.
Примеры ангиогенных факторов включают без ограничения фактор роста эндотелия сосудов (VEGF), ангиопоэтины, фактор роста гепатоцитов (HGF) и основной фактор роста фибробластов (bFGF).
В еще одном аспекте изобретение относится к способу для идентификации субъекта-человека, который несет опухоль, для лечения с помощью антагониста Bv8, который включает определение рефрактерности к лечению антагонистом VEGF.
В еще одном дополнительном аспекте изобретение относится к ингибированию мобилизации нейтрофилов, которая стимулируется с помощью G-CSF, посредством введения только антагониста Bv8 или его сочетания с антагонистом G-CSF.
Также изобретение касается ингибирования миграции клеток миелоидной линии дифференцировки, которая опосредована Bv8, с помощью антагонистов Bv8.
Также изобретение касается снижения количества миелоидных клеток CD11b+Gr1+ для ингибирования развития и/или роста опухоли посредством введения антагониста Bv8.
В другом аспекте изобретение относится к способу лечения опухоли, который включает введение субъекту-человеку, который несет опухоль, эффективного количества антагониста G-CSF.
В конкретном варианте осуществления антагонист G-CSF представляет собой антитело против G-CSF или фрагмент антитела. Антитело или фрагмент антитела могут быть химерными, гуманизированными или человеческими. Необязательно антагонист G-CSF вводят в сочетании с антагонистом Bv8 и/или антагонистом VEGF, такими как, например, антитело против Bv8 и/или антитело против VEGF.
В другом варианте осуществления антагонист G-CSF вводят в сочетании с другим противоопухолевым средством и/или схемой лечения, например, с химиотерапией и/или лучевой терапией.
В еще одном аспекте изобретение относится к способу для ингибирования миграции нейтрофилов у субъекта-человека, включающему введение субъекту эффективного количества антагониста Bv8.
В дополнительном аспекте изобретение относится к способу для лечения ненеопластического состояния, который благоприятным образом следует из антиангиогенной терапии и включает введение субъекту-человеку, у которого предварительно диагностировали такое ненеопластическое состояние и которого лечили антагонистом фактора роста эндотелия сосудов (VEGF), эффективного количества антагониста Bv8.
В одном из вариантов осуществления ненеопластическое состояние представляет собой рефрактерность к лечению антагонистом VEGF.
Ненеопластическое состояние может быть выбрано, например, из группы, состоящей из нежелательной или аберрантной гипертрофии, артрита, ревматоидного артрита (РА), псориаза, псориатических бляшек, саркоидоза, атеросклероза, атеросклеротических бляшек, эдемы при инфаркте миокарда, диабетических и других пролиферативных ретинопатий, ретролентальной фиброплазии, неоваскулярной глаукомы, возрастной дегенерации желтого пятна, диабетического отека желтого пятна, роговичной неоваскуляризации, неоваскуляризации трансплантата роговицы, отторжения трансплантата роговицы, неоваскуляризации сетчатки/хороидальной оболочки, неоваскуляризации угла (краснота), неоваскулярного заболевания глаза, васкулярного рестеноза, артериовенозных мальформаций (АВМ), менингиомы, гемангиомы, ангиофибромы, гиперплазий щитовидной железы (включая базедову болезнь), трансплантации роговицы и другой ткани, хронического воспаления, воспаления легких, острого повреждения легких/ОРДС, сепсиса, первичной легочной гипертензии, злокачественных экссудатов легких, отека мозга (например, связанного с острым нарушением мозгового кровообращения/закрытым повреждением головы/травмой), синовиального воспаления, образования паннуса при РА, оссифицирующего миозита, гипертрофического остеогенеза, остеоартрита (OA), рефрактерного асцита, поликистоза яичника, эндометриоза, болезней, связанных с жидкостями «третьего пространства» (панкреатита, синдрома межфасциального пространства, ожогов, заболевания кишечника), фибромы матки, преждевременных родов, хронического воспаления, такого как ВЗК (болезнь Крона и язвенный колит), отторжения аллотрансплантата почки, воспалительного заболевания кишечника, нефротического синдрома, нежелательного или аберрантного роста тканевой массы (не раковой), ожирения, роста массы жировой ткани, гемофилической артропатии, гипертрофированных рубцов, ингибирования роста волос, синдрома Ослера-Вебера, пиогенной глаукомы, ретролентальных фиброплазий, склеродермии, трахомы, слипания сосудов, синовита, дерматита, предэклампсии, асцита, перикардиального выпота и плеврального выпота.
В еще одном дополнительном аспекте изобретение относится к нейтрализующему антителу против Bv8 и композиции, которая содержит такое антитело.
В конкретном варианте осуществления нейтрализующее антитело связывается по существу с тем же эпитопом или с тем же эпитопом, что и мышиное антитело 3F1 или 2B9 против Bv8. Как и ранее, антитело может представлять собой фрагмент антитела и может быть химерным, гуманизированным или человеческим.
Краткое описание чертежей
На всем протяжении описания, КМ=костный мозг и ПК=периферическая кровь.
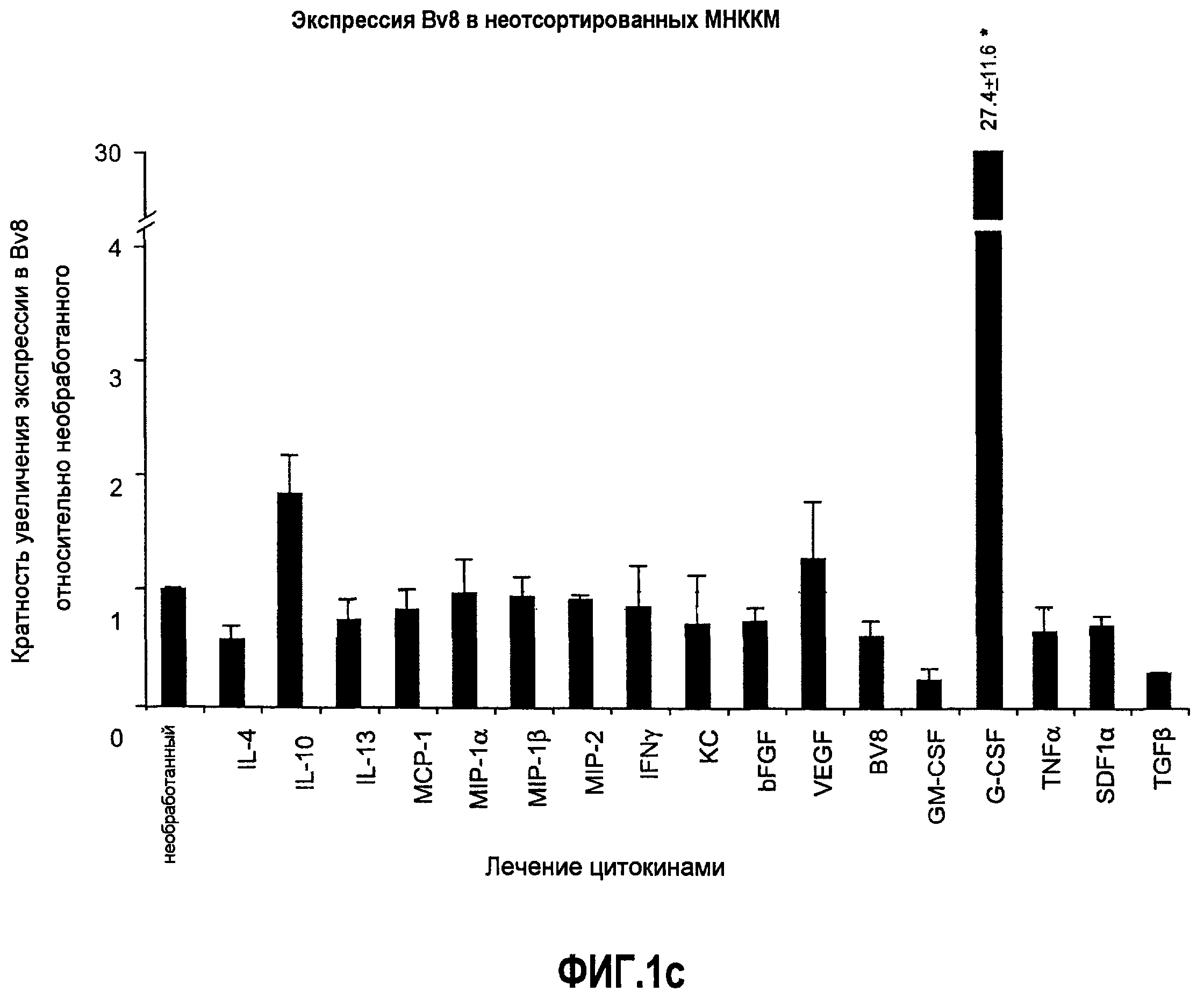
Фиг.1. Регулирование экспрессии Bv8 и активности в клетках КМ. a. Опухоли индуцируют экспрессию белка Bv8 в КМ. Бежевым голым мышам имплантировали опухолевые клетки A673 или HM7. Специфический ELISA показал более высокие (p<0,05) уровни Bv8 в МНККМ у мышей с имплантированной опухолью по отношению к мышам с имплантированным Matrigel™ через шесть дней. b. Экспрессия Bv8 в особенности апрегулировалась в подклассе CD11b+Gr1+ клеток КМ. Бежевым голым мышам имплантировали клетки A673, HM7, HPAC, Calu-6 и Jurkat. Через 10 дней миелоидные клетки CD11b+Gr1+ выделяли из КМ мышей и Taqman™-анализ определил экспрессию Bv8 в миелоидных и немиелоидных (CD11b-Gr1-) подклассах. Сноски указывают на значительные различия (p<0,05) при сравнении CD11b+Gr+ для каждой опухоли в соответствующей CD11b-Gr1- популяции, c. G-CSF является основным индуктором экспрессии Bv8. МНККМ выделяли из наивных мышей и инкубировали с сериями цитокинов и хемокинов и экспрессию Bv8 оценивали с помощью Taqman™, как описано в способах. d. G-CSF является основным индуктором Bv8 в клетках CD11b+Gr1+. МНККМ выделяли из мышей Balb-c и сортировали на CD11b+Gr1+ и CD11b-Gr1- подклассы с помощью клеточного сортера с возбуждением флуоресценции. Цельный КМ, популяции CD11b+Gr1+ и CD11b-Gr1- обрабатывали с использованием SDF1α, G-CSF и GM-CSF, как описано в способах. e. Гипоксия увеличивает апрегуляцию Bv8 посредством G-CSF в миелоидных клетках. КМ CD11b+Gr1+ инкубировали с G-CSF в концентрациях 20 или 2500 пг/мл как в условиях нормоксии, так и гипоксии (1% O2) в течение 4 часов. f. Уровни Bv8 значительно повышены в КМ после инъекции G-CSF. Мышам Balb-c делали подкожную инъекцию G-CSF в день 0 и затем ежедневно в течение 8 дней. Образцы КМ забирали в дни 1, 3, 6 и 8 и уровни белка Bv8 измеряли, как описано. g. Лечение антагонистом G-CSF ингибирует апрегуляцию Bv8, которую вызвал G-CSF. Свежевыделенные МНККМ инкубировали с опухолевым лизатом HM7 и различными концентрациями антагониста G-CSF, как указано. Экспрессию Bv8 наблюдали в МНККМ с помощью Taqman™. h. Антагонист G-CSF снижает уровень Bv8 в КМ мышей, которые не несут опухоль. Голых мышей Balb/c обрабатывали с использованием PBS, контрольного IgG и антагониста G-CSF и уровни Bv8 в МНККМ измеряли посредством ELISA, как описано в способах. i. Антагонист G-CSF снижает уровень Bv8 в КМ мышей, которые несут опухоль HM7. Подробности см. в способах. Через сорок восемь часов после имплантации опухоли или Matrigel™, уровни белка Bv8 измеряли в МНККМ, как описано. j. Bv8 играет роль в мобилизации нейтрофилов, которая вызвана G-CSF. Голых мышей Balb/c лечили интраперитонеально с использованием нескольких средств, включая антитела против G-CSF, против Bv8, контрольные мАТ и контрольный IgG дважды за 12 часов, как описано в способах. У всех мышей было кровотечение через 6 часов после последней инъекции, и частоту клеток CD11b+Gr1+ определяли на проточном цитометре FACSCalibur (Becton Dickinson), как описано.
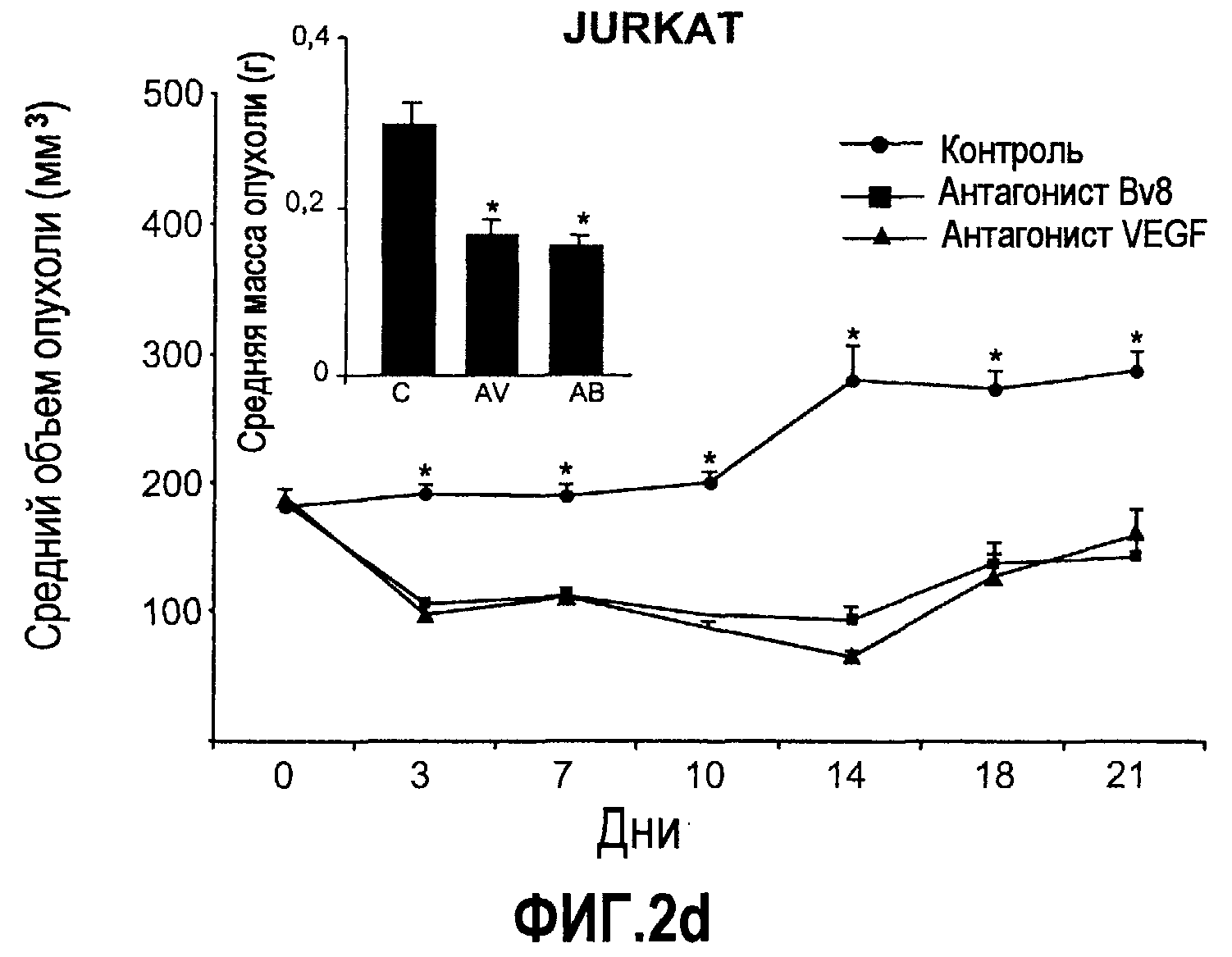
Фиг.2. Влияние антител против Bv8 на рост линий опухолевых клеток, которые трансплантировали в голых мышей. Опухолевые клетки A673 (a), HM7 (b), HPAC (c) и Jurkat (d) имплантировали в голых мышей Balb-c, как описано в тексте. Лечение с использованием контрольных мАТ (против Ragweed), мАТ против Bv8 или против VEGF-A (n~10) инициировали через 24-48 часов после инокулирования опухолевых клеток. Объем опухолей измеряли дважды в неделю. Массу опухоли определяли в конце эксперимента. Данные приведены в виде средних значений + средняя квадратичная ошибка средней (SEM). Сноски указывают на значительную разницу для мАТ против Bv8 или против VEGF по сравнению с контрольными группами лечения (p<0,05). e. МАТ против Bv8 и против VEGF обладают дополнительным эффектом по ингибированию роста опухолей, устойчивых к мАТ против VEGF. Бежевым голым мышам имплантировали клетки TIB42 и обрабатывали с использованием контрольных антител, антител против Bv8, антител против VEGF и антител против Bv8 плюс антитела против VEGF. На вложенной диаграмме приведены конечные массы опухолей во всех четырех группах лечения. C: контроль, AV: АТ против VEGF, AB: АТ против Bv8.
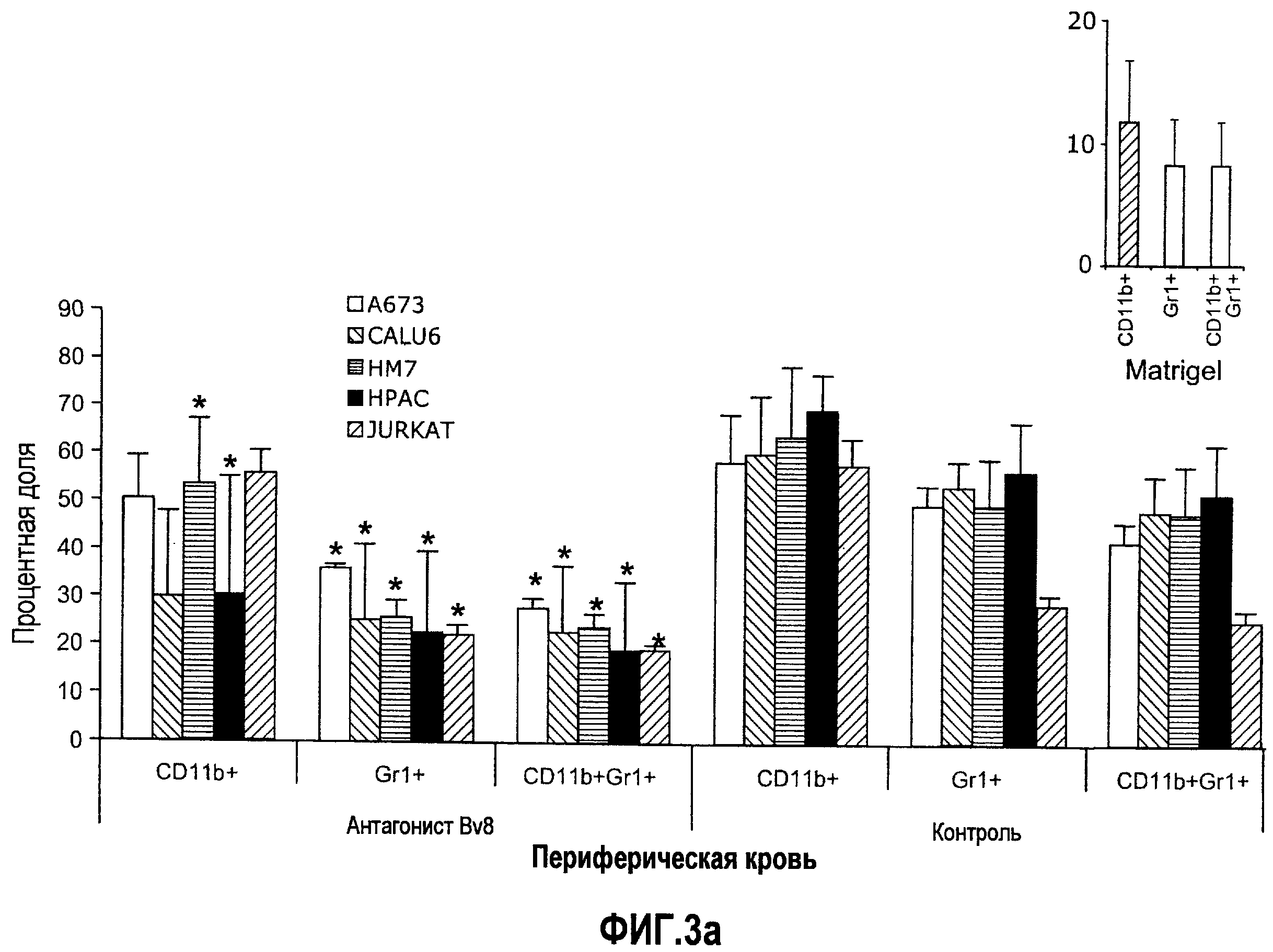
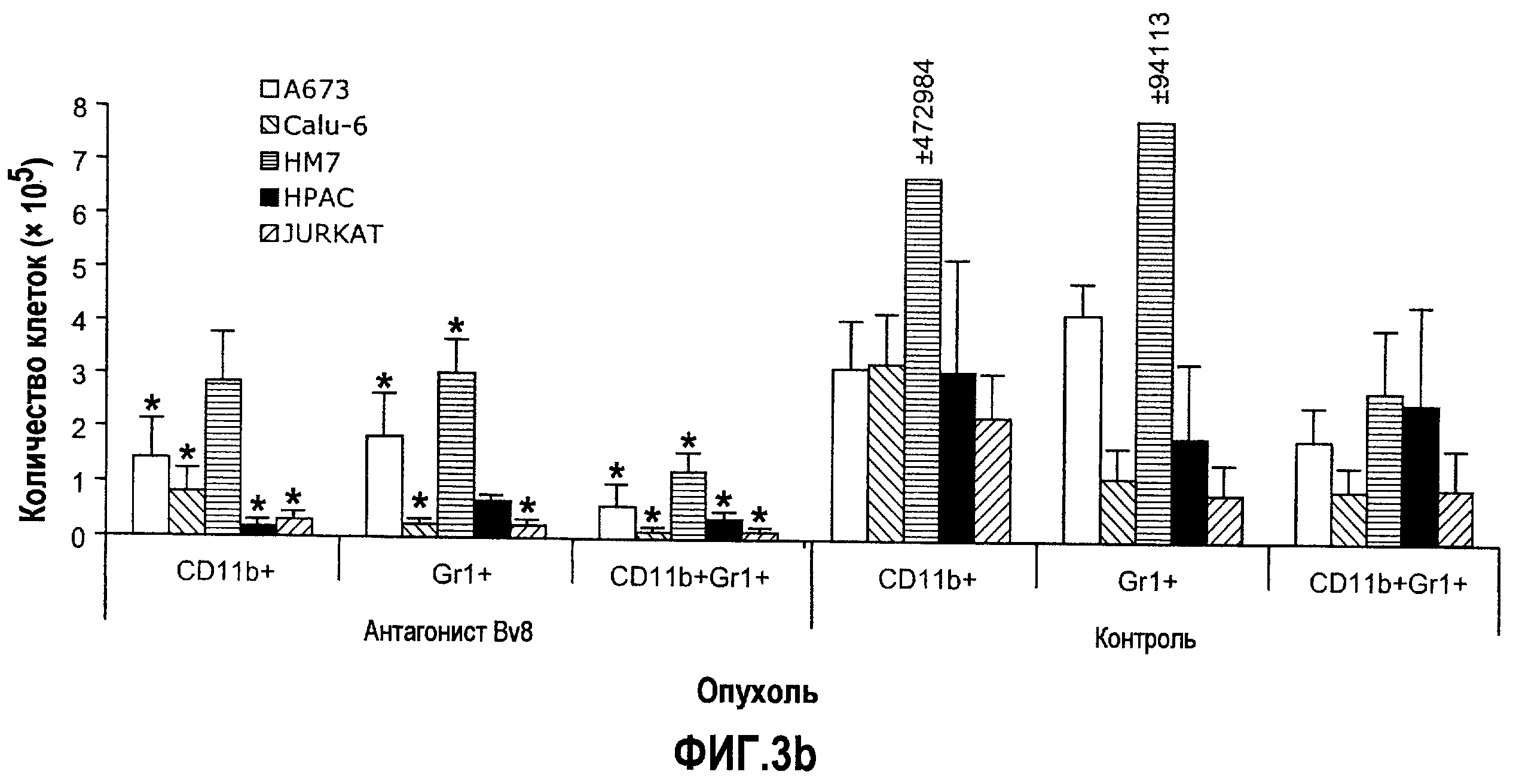
Фиг.3. Лечение с использованием АТ против Bv8 снижает клетки CD11b+Gr1+ в ПК и в опухолях в некоторых моделях, a и b. Голым мышам (n=5) имплантировали клетки A673, Calu6, HM7, HPAC и Jurkat. Затем мышей лечили с использованием мАТ против Bv8 или контрольных мАТ, как описано в способах. Анализ осуществляли через 10 дней после имплантирования опухоли, и частоту клеток CD11b+, Gr1+ и CD11b+Gr1+ измеряли в ПК (a) и опухолях (b), как описано. На вложенной диаграмме в части a приведена частота клеток CD11b+, Gr1+ и CD11b+Gr1+ в мышах Matrigel™. c и d. Внутриопухолевая инъекция КМ CD11b+Gr1+ может превосходить ингибирование роста при лечении с использованием мАТ против Bv8. Голым мышам имплантировали опухоли A673 (c) и HM7 (d) и их лечили с использованием мАТ против Bv8 или контрольных мАТ. На 7-й день (обозначено стрелками) клетки CD11b+Gr1+ выделяли из КМ мышей, праймировали опухолями A673 и HM7 с использованием бус с CD11b+. Очищенную популяцию инъецировали непосредственно в мышей, несущих опухоли, и лечение продолжали, как описано.
Фиг.4. Bv8 регулирует опухолевый ангиогенез. Иммунодефицитным мышам имплантировали 5·106 клеток HM7, как описано. Через 5 дней после имплантации мышам инъецировали 107 КОЕ Av-Bv8, Av-VEGF или Av-LacZ. a. Измерение конечного объема опухоли во всех группах лечения указывает на значительную разницу объемов опухолей Av-Bv8 и Av-VEGF по сравнению с опухолями Av-LacZ, b. Частота клеток CD11b+Gr1+ в периферической крови (ПК) была выше в мышах с Av-Bv8 по сравнению с животными с Av-VEGF и Av-LacZ. с и d. Анализ микро-КТ показал увеличенный объем сосудов (c) у мышей, которым инъецировали Bv8- и VEGF- аденовирусы по сравнению с мышами с инъекциями LacZ. e. Приведены репрезентативные изображения опухолей с инъекциями Av-LacZ, Av-VEGF и Av-Bv8. Сосудистые сети и опухоли показаны красным и серым, соответственно. f. Лечение с использованием мАТ против Bv8 ингибирует рост опухоли посредством влияния на сосуды опухоли. Голым мышам имплантировали клетки HM7 и их лечили с использованием антител против Bv8, против VEGF или контрольных антител. В соответствии с данными на фиг.2b, лечение с использованием как АТ против Bv8, так и АТ против VEGF привело к значительному ингибированию роста опухоли по сравнению с контролем. g. Лечение с использованием АТ против Bv8 снижает частоту циркулирующих CD11b+Gr1+ в ПК по сравнению с АТ против VEGF и контролем. h и i. Анализ микро-КТ, описанный выше, показал значительное снижение объема сосудов (h) и плотности сосудов (i) для АТ против Bv8 по сравнению с контрольными мышами. Степень ингибирования схожа с таковой, обеспечиваемой при лечении с использованием мАТ против VEGF. j. Репрезентативные ангиографические данные микро-КТ приведены для лечения с использованием мАТ против Bv8, против VEGF и контроля. Сосудистые сети и опухоли показаны красным и серым, соответственно.
Фиг.5. Лечение с использованием мАТ против VEGF индуцирует экспрессию Bv8. a-d. Голым мышам имплантировали клетки HM7 и обрабатывали с использованием мАТ против VEGF или контрольных мАТ, как описано. Концентрации белка Bv8 измеряли в КМ (a), ПК (b), селезенке (c) и опухолях (d) на 1, 3, 6, 9, 12 и 15 день после имплантирования опухоли. Все эксперименты осуществляли параллельно с наивными мышами, которым имплантировали Matrigel™. e. Данные ИГХ, дополнительно подтверждающие инфильтрацию нейтрофилами у животных с имплантированными A673 и HM7. Предоставлены фиксированные в формалине срезы из мышей, которые несли A673 или HM7 и которых лечили с использованием контроля, антител против Bv8 или против VEGF в течение 15 дней. Срезы окрашивали антителами против Gr1, как описано в «Способах». f. Клетки CD11b+ являются основными источником Bv8 в опухолях. Бежевым голым мышам имплантировали клетки A673, Calu-6, HM7, HPAC и Jurkat и их умерщвляли через 10 дней после трансплантации опухолевых клеток. Популяции клеток, обогащенных CD11b+, выделяли с использованием микробус CD11b, как описано. Экспрессию Bv8 анализировали с использованием праймеров Taqman™, которые специфичны к мышиным транскриптам Bv8. Данные нормализовали с использованием мышиной GAPDH.
Фиг.6. АТ против Bv8 обладало дополнительными эффектами при использовании с АТ против VEGF или цитотоксической химиотерапией. a и b. Лечение с использованием АТ против Bv8 является наиболее эффективным, когда лечение инициируют на ранней стадии развития опухоли. Голым мышам имплантировали опухоли HM7 (a) и A673 (b) и не назначали какого-либо лечения до тех пор, пока опухоли не достигали ~400 мм3. Затем мышей лечили контролем, антителами против Bv8, против VEGF или сочетанием (АТ против VEGF плюс АТ против Bv8). Объем опухоли измеряли, как описано. *Обозначает значительную разницу (p<0,05) объемов опухолей при комбинированном лечении по сравнению с монотерапией с использованием АТ против VEGF. c и d. АТ против Bv8 обладает дополнительным действием на опухоли, устойчивые к лечению АТ против VEGF, при использовании в сочетании с АТ против VEGF. Голым мышам (c) и мышам C57B1/6 (d) имплантировали клетки EL4 и подвергали лечению с использованием контроля, АТ против Bv8, АТ против VEGF или сочетания. Объем опухоли и конечную массу опухоли измеряли, как описано. *Обозначает значительную разницу (p<0,5) объемов опухолей в контроле по сравнению с каждым видом монотерапии или комбинированным лечением. Разницы объемов опухолей также значительны при сравнении сочетания с каждым видом монотерапии. e. Лечение цисплатином и антителом против VEGF увеличивает концентрацию Bv8 в сыворотке. Бежевым голым мышам имплантировали клетки A673 и их лечили с использованием PBS, цисплатина (5 мг/кг) плюс контрольное антитело, цисплатина плюс АТ против Bv8 или цисплатина плюс АТ против VEGF или сочетания цисплатина, АТ против Bv8 и АТ против VEGF. Концентрации белка Bv8 в сыворотке измеряли с помощью ELISA. f. Химиотерапия плюс АТ против VEGF и АТ против Bv8 могут эффективно подавлять рост опухоли в установившихся опухолях A673. Бежевым голым мышам инъецировали клетки A673 и назначали лечение, как указано выше, через 13 дней после имплантации опухолевых клеток. *Обозначает значительную разницу (p<0,05) между способами комбинированного лечения и цисплатином плюс контроль.
Фиг.7. Нуклеотидная последовательность (SEQ ID NO:1) кДНК, которая кодирует гомолог Bv8 человека. Жирным и подчеркнутым шрифтом обозначены позиции, которые соответствуют стартовому кодону и стоп-кодону.
Фиг.8. Аминокислотная последовательность (SEQ ID NO:2) полипептида гомолога Bv8 человека, которая получена из кодирующей последовательности из SEQ ID NO:1. Предполагаемая сигнальная последовательность состоит из аминокислот с 1 по 21.
Фиг.9. Нуклеотидная последовательность (SEQ ID NO:3) кДНК, которая кодирует вариант альтернативного сплайсинга гомолога Bv8 человека. Жирным и подчеркнутым шрифтом обозначены позиции, которые соответствуют стартовому кодону и стоп-кодону.
Фиг.10. Аминокислотная последовательность (SEQ ID NO:4) полипептида гомолога Bv8 человека, которая получена из кодирующей последовательности из SEQ ID NO:3.
Фиг.11. Нуклеотидная последовательность (SEQ ID NO:5) гомолога Bv8 мыши. Жирным и подчеркнутым шрифтом обозначены позиции, которые соответствуют стартовому кодону и стоп-кодону.
Фиг.12. Аминокислотная последовательность (SEQ ID NO:6) полипептида гомолога Bv8 мыши, которая получена из кодирующей последовательности из SEQ ID NO:5.
Фиг.13. Выравнивание мышиного (SEQ ID NO:37) и человеческого (SEQ ID NO:2) гомологов Bv8. Возможный гепарин-связывающий домен обозначен рамкой. Как показано, этот домен отсутствует в транскрипте после альтернативного сплайсинга. Мышиный и человеческий гомологи Bv8 идентичны приблизительно на 96%.
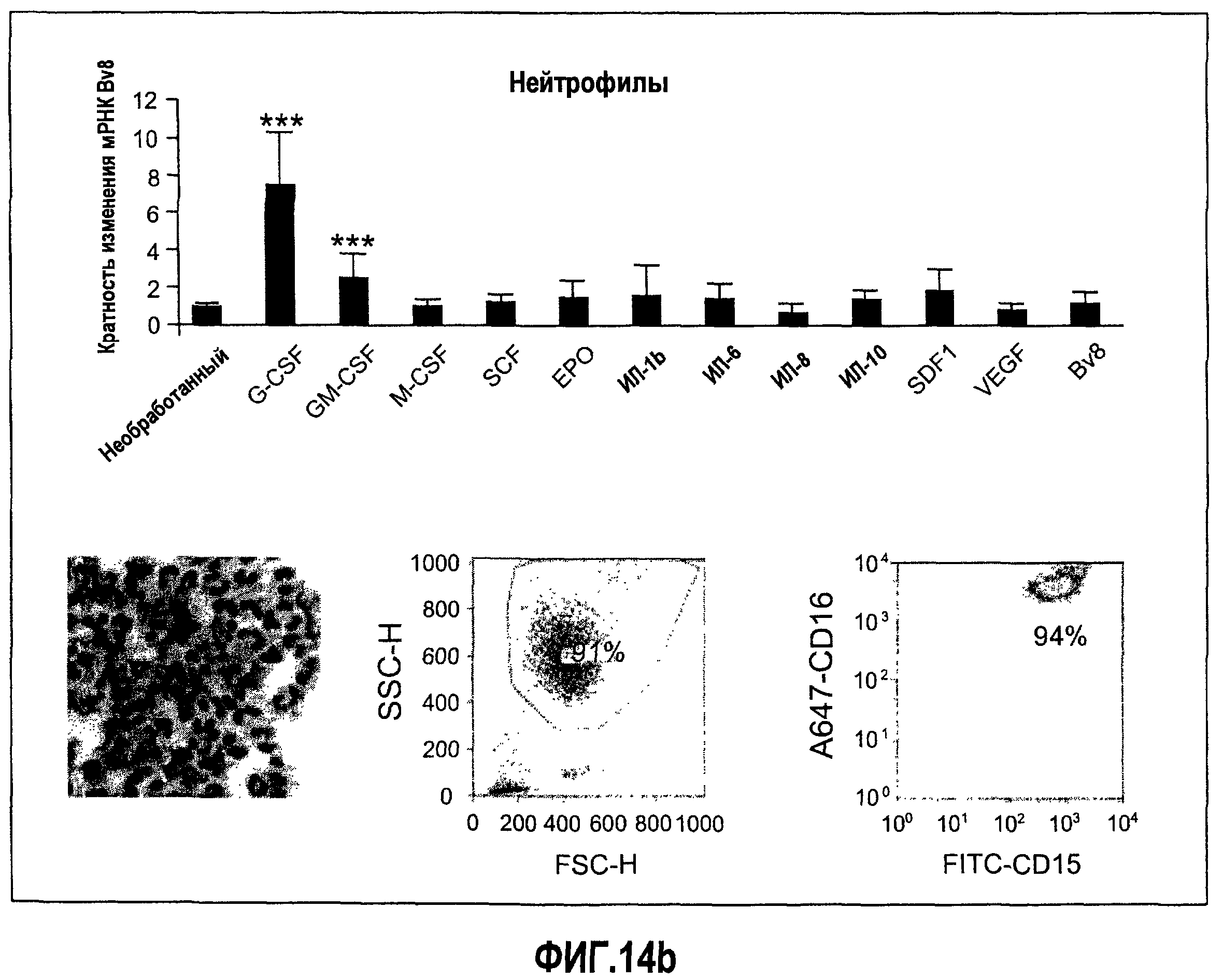
Фиг.14 (а-d). Регулирование экспрессии Bv8 in vitro с использованием очищенных клеток крови человека и свежих клеток костного мозга. Клетки обрабатывали с использованием различных цитокинов или хемокинов в концентрациях 10 нг/мл в течение 4 часов перед экстрагированием РНК и анализом экспрессии Bv8 с помощью Taqman. Все данные дополнительно нормализовали по отношению к внутреннему контрольному гену RPL19 в качестве изменения укладки, при этом необработанный образец принимали за 1. Для исследования использовали 20 различных человеческих доноров, не принимающих лекарственные средства, как описано в Материалах и способах. Репрезентативные изображения очищенных клеток и их экспрессируемые маркеры, установленные с помощью FACS, приведены справа. (A) Свежие клетки костного мозга, (B) нейтрофилы, (C) моноциты, (D) лимфоциты. ***p<0,01 по сравнению с необработанным контролем.
Фиг.15(а, b). Регулирование экспрессии рецептора Bv8 PKR2/EG-VEGFR2 с помощью различных G-CSF-связанных цитокинов в клетках костного мозга человека и нейтрофилах. (A) Свежие выделенные нейтрофилы или (B) костномозговые клетки обрабатывали с использованием различных G-CSF-связанных цитокинов. После 4 часов инкубирования in vitro, клетки собирали и РНК экстрагировали для определения экспрессии PKR2/EG-VEGFR2 с помощью Taqman. RPL19 использовали в качестве внутреннего контрольного гена для нормализации. Эксперименты осуществляли с использованием 3 независимых здоровых доноров. Приведен ответ каждого отдельного донора на цитокины, и во вставках построены диаграммы средних уровней экспрессии для всех 3 доноров. ***p<0,01 по сравнению с необработанным контролем.
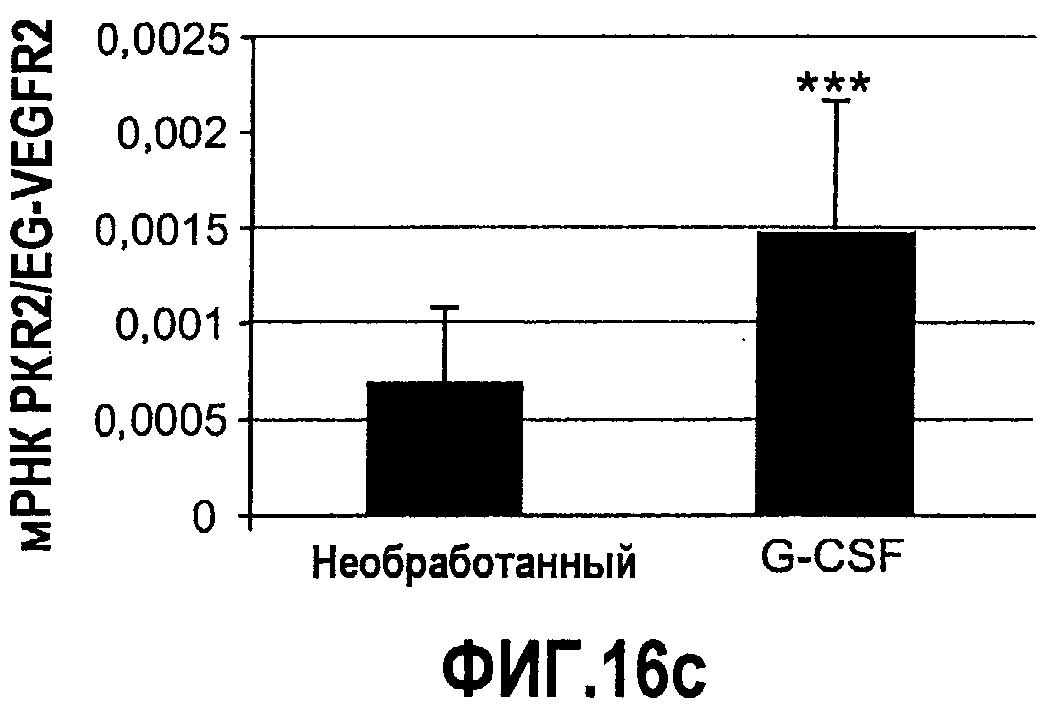
Фиг.16(а-с). Bv8 и PKR2/EG-VEGFR2 апрегулировались в мононуклеарных клетках доноров, которых лечили с использованием G-CSF. Белые клетки крови индивидуумов, которых лечили с использованием G-CSF (n=12), и индивидуумов, которых не лечили (n=11) (непарный), в кратком изложении промывали и осаждали центрифугированием перед экстрагированием РНК или лизисом в буфере RIPA, который содержит ингибитор протеиназы. Осуществляли Taqman-анализ экспрессии Bv8 (A), PKR2/EG-VEGFR2 (C) и специфический ELISA с Bv8 человека (B). Данные Taqman нормализовали к экспрессии RPL19 и данные ELISA нормализовали к общей концентрации белка. ***p<0,01 по сравнению с необработанным контролем.
Фиг.17(а, b). Описание белка Bv8, который продуцируют нейтрофилы человека. (A) Нейтрофилы человека выделяли и лизировали, как описано в Материалах и способах. Лизат наносили на гепарин-сефарозу, как описано. Фракции 9, 10 и 11, которые элюировали в присутствии ~0,4 М NaCl, обладали самыми высокими уровнями Bv8. Приведенные здесь данные репрезентативны для 3 независимых выделений. (B) Биологическая активность Bv8 человека, очищенного от нейтрофилов человека. Клетки GeneBLAzer NFAT-CHO, трансфицированные с использованием PKR1/EG-VEGFR1, использовали для обнаружения Bv8-индуцированной активации нисходящего G-белок-связанного рецепторного пути передачи сигнала. Рекомбинантный Bv8 человека использовали в концентрации 20 нг/мл, который служил в качестве положительного контроля, и VEGF человека использовали в концентрации 200 нг/мл, который служил в качестве отрицательного контроля. Данные дополнительно нормализовали по изменению укладки, при этом необработанные лунки принимали за 1. ***p<0,01 по сравнению с необработанным или буферным контролем. Проводили три независимых исследования.
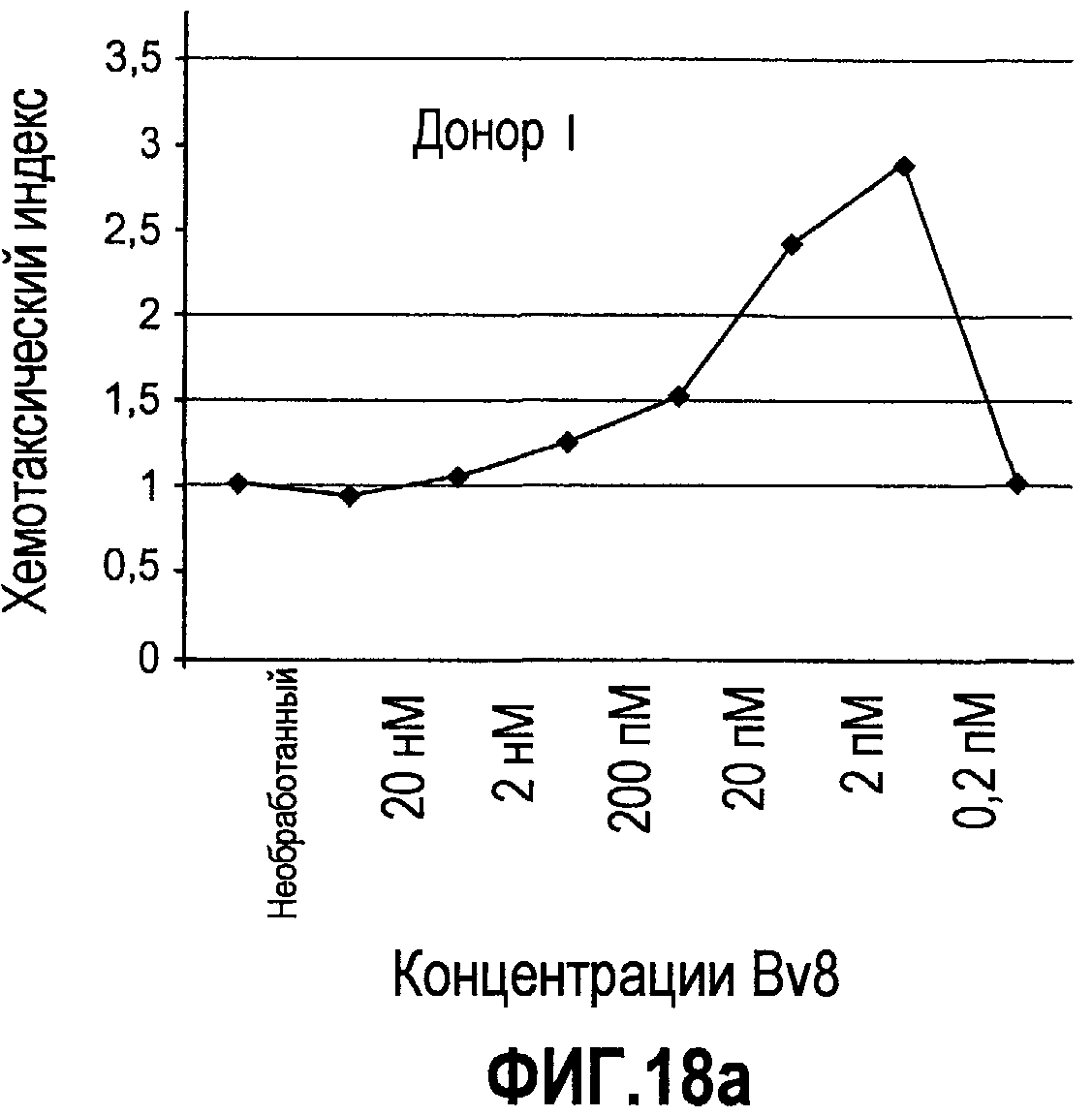
Фиг.18(а-d). Миграция нейтрофилов в ответ на Bv8. 106 нейтрофилов, суспендированных в HBSS, содержащем 0,2% БСА, помещали в межлуночную вставку с размером пор 5 мкм. В нижнюю камеру добавляли только среду или среду с очищенным рекомбинантным Bv8 человека (0,2 пМ-20 нМ) или с другим известным хемотаксическим фактором, таким как SDF-1α, в различных концентрациях (до 20 нМ). После 3 часов при 37°C клетки в нижней камере подсчитывали, и данные дополнительно нормализовали по кратности увеличения, при этом необработанные образцы принимали за 1. Эксперименты осуществляли на 6 здоровых донорах.
Дополнительная фиг.1(а, b). Описание белка Bv8, который продуцируют МНККМ. a. Мононуклеарные клетки, полученные из костного мозга мыши, (МНККМ) выделяли и лизировали, как описано в разделе о материалах и способах примера 1. Лизат наносили на колонку с гепарин-сефарозой™, которую предварительно уравновешивали в 20 мМ Tris pH 7,2, 50 мМ NaCl. Колонку элюировали в градиенте NaCl, как описано в материалах и способах. Концентрации Bv8 в каждой фракции измеряли с помощью ELISA. Фракции 13 и 14, элюированные в присутствии приблизительно 0,4 М NaCl, обладали самыми высокими уровнями Bv8. b. В соответствии с данными ELISA, анализ вестерн-блоттинга показал, что фракции 13 и 14 высоко обогащены Bv8.
Дополнительная фиг.2(а-f). G-CSF является ключевым регулятором экспрессии Bv8 у здоровых мышей и у мышей, несущих опухоль. a. Уровни Bv8 значительно повышены в сыворотке после инъекции G-CSF. Голым мышам Balb-c интраперитонеально инъецировали G-CSF в 0 день и затем ежедневно в течение 8 дней. Образцы забирали на 1, 3, 6 и 8 день. b. В предшествующем эксперименте показано повышенное количество циркулирующих нейтрофилов у мышей, которых обрабатывали с использованием G-CSF. c и d. Голых мышей Balb/c лечили с использованием PBS, контрольного IgG и АТ против G-CSF в течение 8 последующих дней, и частоту клеток CD11b+Gr1+ в периферической крови (ПК) (c) и КМ (d) определяли с использованием FACS окрашивания, как описано. e и f. Голых мышей Balb/c предварительно лечили антителами против G-CSF или контрольным IgG за 12 часов до имплантации опухоли и Matrigel™. Мышей, которые несли Matrigel™ и опухоль, лечили антителом против G-CSF или контрольным IgG в течение двух последующих дней. При финальном анализе частота CD11b+Gr1+ в ПК (e) и КМ (f) исследовали с использованием FACS.
Дополнительная фиг.3(а-j). a. Bv8 индуцирует межлуночную миграцию CD11+Gr1+ миелоидных клеток. Контролями являлись PBS или только среда. b и c. Экспрессия рецепторов Bv8 в МНККМ. Бежевым голым мышам имплантировали клетки A673, HM7, HPAC или Calu-06, как описано. Через 10 дней миелоидные клетки CD11b+Gr1+ выделяли из КМ и осуществляли Taqman™-анализ для исследования экспрессии EG-VEGFR в миелоидном и немиелоидном (CD11b-Gr1-) подклассах опухоли по сравнению с мышами, которым имплантировали Matrigel™. Этот анализ показал более высокую экспрессию EG-VEGF/PKR2 (c) по сравнению с EG-VEGF/PKR1, (b) в МНККМ. d. Bv8 изменяет судьбу прогенеторной популяции миелоидных клеток (CD11b+Gr1+), а также ингибирует клеточную смерть в популяции Lin-. Фракцию Lin-, выделенную из МНККМ бежевых голых мышей, инкубировали с Bv8 в течение 5 дней и частоту клеток CD11b+Gr1+ оценивали на приборе FACSCalibur. Кроме того, окрашивание в 7AAD использовали для измерения количества погибших клеток в каждой группе лечения. e. Bv8 индуцирует клоногенные возможности клеток-предшественников. Популяцию Lin- обрабатывали с использованием Bv8 или PBS в течение 5 дней и высевали на метилцеллюлозу (7500 клеток на лунку), и инкубировали в 5% CO2 и 37°C в течение 15 дней. Лейкоцитарная формула и общее количество колоний раскрыли значительные клоногенные возможности клеток, обработанных с использованием Bv8. f. Bv8 является фактором выживания для миелоидных популяций. Клетки CD11b+Gr1+, выделенные из МНККМ бежевых/голых мышей, культивировали в среде и обрабатывали с использованием Bv8 (300 нг/мл) в течение 5 дней. Гибель клеток измеряли на приборе FACSCalibur с использованием окрашивания в 7AAD. g и h. Прекращение лечения с использованием АТ против Bv8 приводит к быстрому росту опухоли. Мышам имплантировали опухоли A673 (e) или HM7 (f) и лечили их антителами против Bv8 или контрольными антителами, как описано. Лечение останавливали на 7 день после имплантирования, что отмечено на фиг.3h стрелкой. i и j. Остановка лечения антителом против Bv8 приводит к возобновлению реакции опухолей A673 (i) и HM7 (j) на клетки CD11+Gr1+.
Дополнительная фиг.4. Влияние антител против Bv8 на гемопоэз у мышей, которые не несут опухоль. Голых мышей Balb/c лечили с использованием PBS, контрольного антитела или антитела против Bv8 в терапевтических дозах в течение 3 недель. Массы тела (a), массы органов (b), а также линии дифференцировки миелоидных и лимфоидных клеток анализировали в КМ (c), селезенке (d) и ПК (e).
Дополнительная фиг.5. Лечение антителами против Bv8 снижает количество клеток CD11b+Gr1+ в ПК и в опухолях на модели A673. Бежевым/голым мышам имплантировали 5×106 клеток A673 и назначали лечение антителами против Bv8, которое начинали с этого времени через 48 часов после имплантации дважды в неделю. Кинетику CD11b+ (данные не приведены), Gr1+ (данные не приведены) и клеток CD11b+Gr1+ наблюдали в различные моменты времени (т.е. на 5, 10, 19 и 29 день после имплантации) у мышей, которых лечили антителами против Bv8 и контрольными АТ. a. МНККМ выделяли из каждой группы лечения и подвергали процедуре окрашивания, как описано в разделе о материалах и способах примера 1. b. У мышей было кровотечение во все моменты времени и частоту CD11b+Gr1+ измеряли с использованием FACSCalibur. c. Опухолевые клетки подсчитывали по отдельности и количество клеток CD11b+Gr1+ вычисляли умножением частоты этих клеток на общее количество опухолевых клеток. Сноски обозначают значительную разницу (p<0,05) в каждый момент времени при сравнении мышей, которых лечили антителами против Bv8, с соответствующей контрольной популяцией.
Дополнительная фиг.6(а-d). Репрезентативные FACS профили популяций клеток CD11b, Gr1 и CD11b+Gr1+ у мышей, которые несут опухоли. Бежевым голым мышам (n=5) имплантировали 5×106 клеток A673, Calu6, HM7, HPAC или Jurkat. Мышей лечили моноклональными антителами против Bv8 или контрольными мАТ, как описано в разделе о материалах и способах примера 1. Мышей анализировали на 10 день после имплантирования опухоли и частоту клеток CD11b+, Gr1+ и CD11b+Gr1+ измеряли в КМ, ПК, опухолях и селезенках, как описано.
Дополнительная фиг.7(а-c). Имплантирование ткани увеличивает частоту CD11b+Gr1+ в КМ и селезенке. Бежевым голым мышам (n=5) имплантировали 5×106 клеток A673, Calu6, HM7, HPAC или Jurkat. Мышей лечили контрольными моноклональными антителами против Bv8, как описано в материалах и способах, и клетки КМ или селезенки затем выделяли из мышей, несущих опухоль, и окрашивали антителами против G11 и против CD11b. На диаграммах показаны процентные доли клеток CD11b+, Gr1+ и CD11b+Gr1+ в КМ (a) и селезенке (b). На вкладке в правом верхнем углу приведены частоты клеток CD11b+, Gr1+ и CD11b+Gr1+ у мышей, которым имплантировали Matrigel™. c. Лечение с использованием АТ против Bv8 снижает клоногенные возможности МНККМ и спленоцитов. Голым мышам имплантировали клетки A673 и HM7 и затем их лечили антителами против Bv8 или контрольными антителами, как описано. МНККМ и спленоциты получали из мышей, которые несут опухоль, через 10 дней после имплантирования опухоли и высевали для подсчета КОЕ.
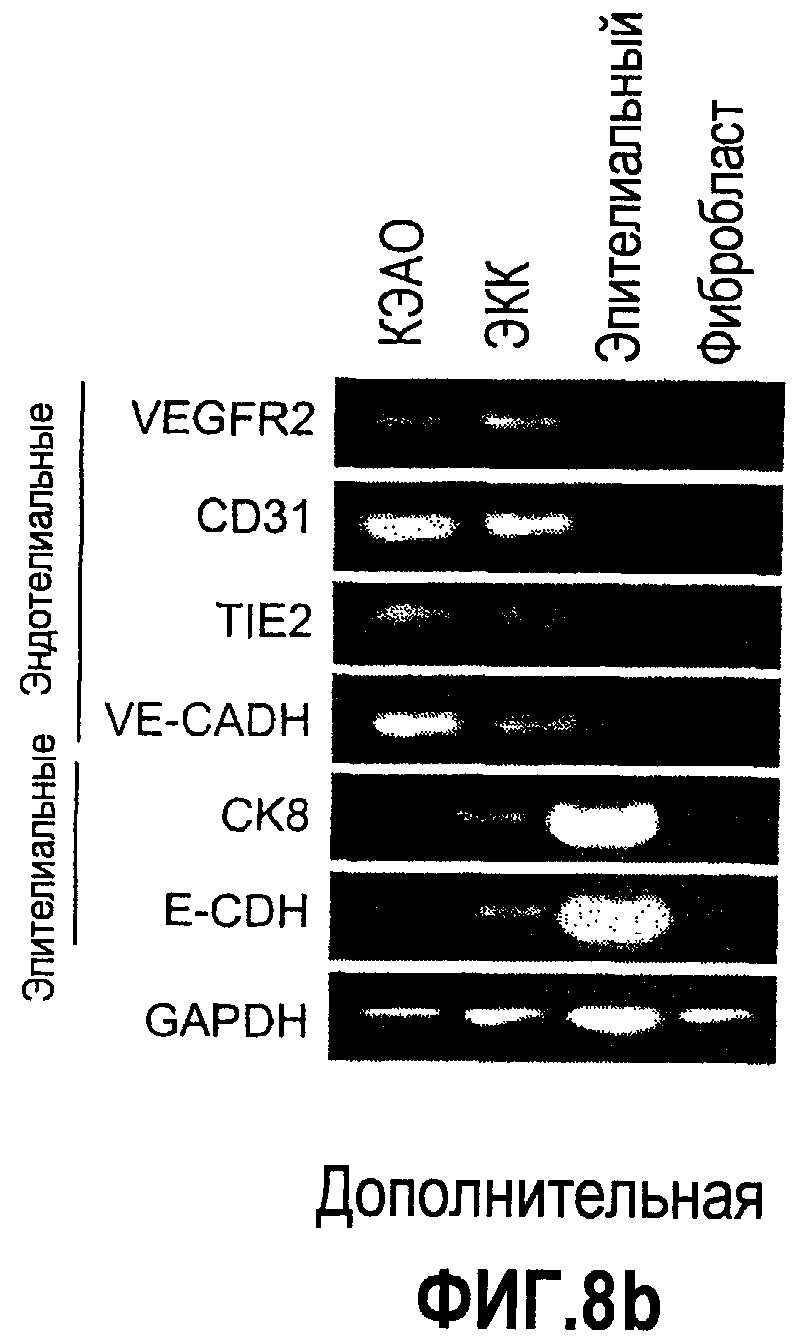
Дополнительная фиг.8(a-d). Bv8 стимулирует образование трубочек в КЭАО и не стимулирует рост опухолевых клеток, a. Bv8 индуцирует образование трубочек in vitro в эндотелиальных клетках. КЭАО высевали на плашки, покрытые Matrigel™, и затем инкубировали или в минимальной среде (контроль, Bv8 или VEGF-A, с антителом против Bv8 или без него, как описано в разделе о материалах и способах примера 1). На изображениях (фазовый контраст; исходное увеличение 20×) показано появление эндотелиальных трубочек после инкубации в течение 36 часов. b. КЭАО экспрессируют обычные маркеры эндотелиальных клеток. Идентичность КЭАО, которые использовались в экспериментах, подтверждали с помощью проточной цитометрии (данные не приведены) и RT-ПЦР с использованием CD31, VEGFR2, TIE2, VE-CADH, CK8 и E-CDF1 в КЭАО, эндотелиальных клетках кожи (ЭКК), эпителиальных клетках и фибробластах. GAPDH использовали в качестве внутреннего контроля. c. КЭАО активируют передачу сигнала посредством MAPK в ответ на стимуляцию Bv8. Клетки обрабатывали с использованием Bv8 (200 нг/мл), VEGF (положительный контроль; 40 нг/мл), полной среды (ПС) или имитации (0,5% DSA) в течение 5, 10 и 20 минут при 37°C. Анализ вестерн-блоттинга, описанный в разделе о материалах и способах примера 1, обнаружил фосфорилированную MAPK (P-MAPK) в клетках, которые обрабатывали с использованием Bv8, тогда как имитация обработки (PBS) не индуцировала активацию P-MAPK. d. Bv8 не индуцирует пролиферацию опухолевых клеток. Клетки A673, Calu-6, HM7 и HPAC обрабатывали с использованием различных концентраций рекомбинантного Bv8 и затем подавали импульсы в присутствии BrdU. Пролиферацию определяли количественно по встраиванию BrdU.
Дополнительная фиг.9(а, b). a. Bv8 способствует опухолевому ангиогенезу. Мыши, которые несли опухоль HM7, получали однократную внутриопухолевую дозу Ad-LacZ, Av-Bv8 низкого титра, Av-Bv8 высокого титра и Av-VEGF через 5 дней после имплантирования опухоли. Площади сосудистой поверхности измеряли через 4 дня после доставки аденовируса с использованием окрашивания срезов опухоли в MECA-32. b. Лечение с использованием АТ против Bv8 приводит к ингибированию опухолевого ангиогенеза. Бежевым голым мышам имплантировали клетки Jurkat и лечили контрольными АТ (срезы a-c), АТ против Bv8 (срезы d-f) и АТ против VEGF (срезы g-i). Следует отметить заметное подавление опухолевого ангиогенеза при лечении антителами против Bv8 или против VEGF. Срезы 1, b, s, e, g, h и H&E окрашивание и срезы c, f, t окрашивали в MECA-32 (площади опухолей указаны с помощью сноски).
Дополнительная фиг.10. Роль Bv8 в росте опухоли. Опухолевые клетки и строма, связанная с опухолью, подают сигналы апрегуляции Bv8 в КМ посредством высвобождения хемокинов и цитокинов, таких как G-CSF, ИЛ-6 и SDF-1. Bv8 может усиливать мобилизацию миелоидных клеток, которая вызвана посредством G-CSF в аутокринных и паракринных механизмах. Известно, что некроз опухоли способствует инфильтрации миелоидными клетками. Миелоидные клети, стремясь в микроокружение опухоли с помощью разнообразных механизмов, могут локально продуцировать Bv8, который, в свою очередь, напрямую стимулирует пролиферацию эндотелиальных клеток и ангиогенез. Цитокины, гипоксия и лечение антителами против VEGF могут приводить к увеличению экспрессии Bv8 миелоидными клетками в микроокружении опухоли. Bv8, который продуцируют миелоидные клетки, инфильтрирующие опухоль, также может сигнализировать костному мозгу о дополнительной мобилизации, миграции через эндотелий и стремлении миелоидных клеток в микроокружение опухоли.
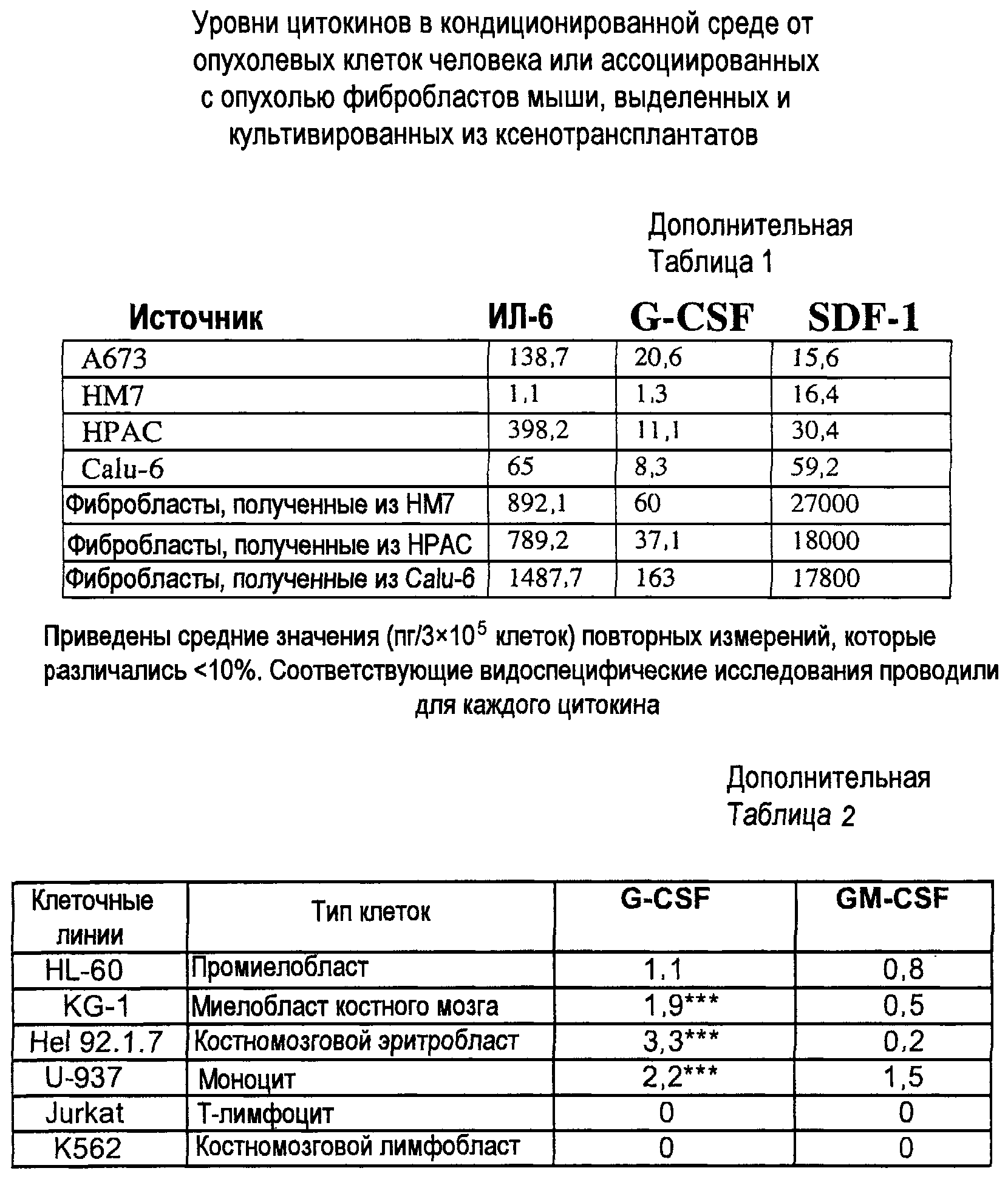
Дополнительная таблица 1. Уровни цитокинов в кондиционированной среде из опухолевых клеток человека или ассоциированных с опухолью фибробластов мыши, выделенных и культивированных из ксенотрансплантатов.
Дополнительная таблица 2. Различные клеточные линии обрабатывали с использованием или G-CSF, или GM-CSF в концентрации 10 нг/мл в течение 4 часов. Затем экстрагировали РНК и проводили Taqman-анализ с использованием RPL19 в качестве облигатного гена для нормализации. Было показано, что кратность изменения при отсутствии обработки составляет 1. ***p<0,01 по сравнению с необработанным контролем. Проводили три независимых исследования.
Подробное описание изобретения
Перед тем как описать настоящее изобретение в деталях, следует понять, что это изобретение не ограничено конкретными композициями или биологическими системами, которые, конечно, могут меняться. Также следует понять, что терминология, которую используют в настоящем документе, лишь служит цели описания конкретных вариантов осуществления и не используется в качестве ограничения. Используемые в этом описании и приложенной формуле изобретения формы единственного числа включают формы множественного числа до тех пор, пока контекст не будет ясно указывать на иное. Таким образом, например, упоминание о «молекуле» необязательно включает сочетание двух или более таких молекул и т.п.
A. Определения
Термины «Bv8», «гомолог Bv8», «прокинетицин-2» (также известный как «PK2», KAL4» и «MIT1») используют в настоящем документе взаимозаменяемо, и они относятся к нативной последовательности, полипептиду Bv8, вариантам Bv8 и химерному Bv8, каждый из которых определен в настоящем документе.
Нуклеиновая кислота Bv8 представляет собой РНК или ДНК, которая кодирует полипептид Bv8, как определено выше, или которая гибридизуется с такой ДНК или РНК и остается стабильно связанной с ней при строгих условиях гибридизации, и обладает длиной больше чем приблизительно 10 нуклеотидов. Строгие условия представляют собой условия, при которых (1) используют низкую ионную силу и высокую температуру при промывании, например, 0,15 М NaCl/0,015 М цитрат натрия/0,1% NaDodSO4 при 50°C, или (2) при гибридизации используют денатурирующее средство, такое как формамид, например, 50% (об./об.) формамид с 0,1% бычьего сывороточного альбумина/0,1% фиколл/0,1% поливинилпирролидон/50 мМ натрий-фосфатный буфер при pH 6,5 с 750 мМ NaCl, 75 мМ цитрат натрия при 42°C.
Нуклеиновая кислота является функционально связанной, когда она находится в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Нуклеиновая кислота Bv8 может быть функционально связана с другой последовательностью нуклеиновой кислоты в векторе из условия, чтобы она могла экспрессироваться в конкретном хозяйском организме. Это можно осуществить способами, которые хорошо известны в данной области. Например, ДНК для препоследовательности или секреторной лидерной последовательности функционально связана с ДНК для полипептида, если она экспрессируется в виде пребелка, который участвует в секреции полипептида; промоторы или энхансер функционально связаны с кодирующей последовательностью, если они влияют на транскрипцию последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен так, чтобы облегчать трансляцию. Как правило, «функционально связан» обозначает, что ДНК последовательности, подлежащие связыванию, являются смежными, и в случае секреторной лидерной последовательности, смежны и в фазе считывания. Однако энхансеры не должны быть смежными. Связывание выполняют посредством легирования в подходящих участках рестрикции. Если такие сайты отсутствуют, то используют синтетические олигонуклеотидные адаптеры или линкеры в соответствии с обычной практикой.
«Нативная последовательность Bv8» содержит полипептид, который обладает такой же аминокислотной последовательностью, как Bv8, который получен из природы, независимо от способа изготовления. Таким образом, нативная последовательность Bv8 может содержать аминокислотную последовательность встречающегося в природе Bv8 человека, Bv8 мыши или Bv8 из любого другого вида млекопитающих. Например, полноразмерная нативная аминокислотная последовательность Bv8 человека приведена на фиг.8 (SEQ ID NO:2). Вторая полноразмерная нативная последовательность Bv8 человека приведена на фиг.10 (SEQ ID NO:4). Эти две последовательности являются результатом альтернативного сплайсинга экзона, который кодирует канонический гепарин-связывающий домен. Таким образом, нативный Bv8 человека, аминокислотная последовательность которого приведена на фиг.8 (SEQ ID NO:2), содержит гепарин-связывающий домен, тогда как нативная последовательность Bv8, которая изображена на фиг.10 (SEQ ID NO:4), его не содержит. Нативная аминокислотная последовательность Bv8 мыши приведена на фиг.12 (SEQ ID NO:6). Последовательности Bv8 человека и мыши также раскрыты, например, в Wechselberger et al. (FEBS Lett. 462:177-181 (1999)) и Li et al. (Mol. Pharm. 59:692-698 (2001)). Такая нативная последовательность Bv8 может быть выделена из природы или может быть изготовлена с помощью рекомбинантных и/или синтетических средств. Термин «нативная последовательность Bv8», в частности, включает встречающиеся в природе препро-, про- и зрелые формы и усеченные формы Bv8, встречающиеся в природе вариантные формы (например, образующиеся в результате альтернативного сплайсинга, такие как формы, которые приведены на фиг.10 (SEQ ID NO:4)), и встречающиеся в природе аллельные варианты. Предпочтительная нативная последовательность Bv8 представляет собой полноразмерную нативную последовательность Bv8 человека, которая приведена на фиг.8 (SEQ ID NO:2).
«Варианты Bv8» представляют собой биологически активные полипептиды Bv8, которые содержат аминокислотную последовательность, которая отличается от нативных последовательностей полипептида Bv8, например, таких, которые приведены на фиг.8, 10 и 12 (SEQ ID NO:2, 4 и 6) для Bv8 человека и мыши, вследствие инсерции, делеции, модификации и/или замены одного или нескольких аминокислотных остатков в нативной последовательности. Как правило, варианты Bv8 обладают менее чем 100% идентичностью последовательностей с нативной последовательностью Bv8, например, с последовательностью Bv8 человека с фиг.8 (SEQ ID NO:2). Однако, как правило, биологически активный вариант Bv8 будет содержать аминокислотную последовательность по меньшей мере приблизительно с 70% идентичностью аминокислотных последовательностей с аминокислотной последовательностью встречающегося в природе Bv8, например, Bv8 человека с фиг.8 (SEQ ID NO:2), предпочтительно по меньшей мере приблизительно с 75%, более предпочтительно по меньшей мере приблизительно с 80%, даже более предпочтительно по меньшей мере приблизительно с 85%, даже более предпочтительно по меньшей мере приблизительно с 90%, еще более предпочтительно по меньшей мере приблизительно с 95% и еще более предпочтительно по меньшей мере приблизительно с 99% идентичностью аминокислотных последовательностей, с инкрементом в 1%. Варианты Bv8 включают пептидные фрагменты по меньшей мере из 5 аминокислот, которые сохраняют биологическую активность соответствующей нативной последовательности полипептида Bv8. Варианты Bv8 также включают полипептиды Bv8, в которых один или несколько аминокислотных остатков добавлены на N- или C-конец или внутрь нативной последовательности Bv8. Варианты Bv8 также включают полипептиды Bv8, в которых несколько аминокислотных остатков удалены и необязательно заменены на один или несколько аминокислотных остатков. Варианты Bv8 также могут быть ковалентно модифицированы, например, посредством замены на молекулу, которая отличается от встречающихся в природе аминокислот, или посредством модификации аминокислотного остатка, чтобы изготовить аминокислоту, которая не встречается в природе. Варианты Bv8 могут содержать гепарин-связывающий домен.
В основном, полипептидный «вариант» (т.е. вариант любого полипептида, который описан в настоящем документе) обозначает биологически активный полипептид, который обладает по меньшей мере приблизительно 80% идентичностью аминокислотных последовательностей с соответствующей нативной последовательностью полипептида. Такие варианты включают, например, полипептиды, в которых один или несколько аминокислотных остатков (встречающихся в природе аминокислот и/или не встречающихся в природе аминокислот) добавлены или удалены на N- и/или C-конце полипептида. Как правило, вариант будет обладать по меньшей мере приблизительно 80% идентичностью аминокислотных последовательностей, или по меньшей мере приблизительно 90% идентичностью аминокислотных последовательностей, или по меньшей мере приблизительно 95% или большей идентичностью аминокислотных последовательностей с последовательностью нативного полипептида. Варианты также включают полипептидные фрагменты (например, субпоследовательности, усеченные фрагменты и т.д.), типично биологически активные, из нативной последовательности.
«Процент (%) идентичности аминокислотных последовательностей» в настоящем документе определяют как процентную долю аминокислотных остатков в кандидатной последовательности, которые идентичны аминокислотным остаткам в выбранной последовательности, после выравнивания последовательности и вставления пропусков, при необходимости, для достижения максимального процента идентичности последовательностей, и при этом любые консервативные замены не учитываются при расчете идентичности последовательности. Выравнивание с целью определить процент идентичности аминокислотных последовательностей можно выполнить различными способами, которые известны специалистам в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN, ALIGN-2 или Megalign (DNASTAR). Специалисты в данной области могут определить подходящие параметры для измерения выравнивания, включая любые алгоритмы, которые необходимы для того, чтобы получить максимальное выравнивание на всем протяжении последовательности, которая подлежит сравнению. Однако для целей настоящего документа значения % идентичности аминокислотных последовательностей получали, как описано ниже, с использованием компьютерной программы сравнения последовательностей ALIGN-2. Компьютерная программа сравнения последовательностей ALIGN-2, которая написана в Genentech, Inc., была подана с пользовательской документацией в Бюро регистрации авторских прав США, Washington D.C., 20559, где она зарегистрирована под номером регистрации авторского права США TXU510087 и общедоступна в Genentech, Inc., South San Francisco, California. Программа ALIGN-2 должна быть скомпилирована для использования в операционной системе UNIX, например, в Digital UNIX V4.0D. Все параметры сравнения последовательностей были установлены программой ALIGN-2 и не изменялись.
Для целей настоящего документа, % идентичности аминокислотных последовательностей заданной аминокислотной последовательности A относительно, с или по отношению к заданной аминокислотной последовательности B (которая альтернативно может быть обозначена как заданная аминокислотная последовательность A, которая обладает или имеет определенный % идентичности аминокислотных последовательностей относительно, с или по отношению к заданной аминокислотной последовательности B) вычисляют следующим образом:
на 100 умножают отношение X/Y,
где Х представляет собой количество аминокислотных остатков, которые помечены как идентичные совпадения программой выравнивания последовательностей ALIGN-2 в выравнивании A и B, которое выполняет эта программа, и где Y представляет собой общее количество аминокислотных остатков в B. Следует отметить, что если длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, % идентичности аминокислотной последовательности A относительно B не будет равен % идентичности аминокислотной последовательности B относительно A.
Молекула «химерного Bv8» представляет собой полипептид, который содержит полноразмерный Bv8 или один или несколько его доменов, которые слиты или связаны с гетерологичным полипептидом. Молекула химерного Bv8, как правило, будет обладать по меньшей мере одним общим биологическим свойством вместе с встречающимся в природе Bv8. Примером химерной молекулы Bv8 является молекула, которую маркировали эпитопом для целей очистки. Другой химерной молекулой Bv8 является иммуноадгезин Bv8.
Термин «меченный эпитопом» при использовании в настоящем документе относится к химерному полипептиду, который содержит Bv8, слитный с «маркерным полипептидом». Маркерный полипептид содержит достаточное количество остатков, чтобы предоставить эпитоп, против которого может быть изготовлено антитело, который достаточно короток, чтобы не препятствовать биологической активности Bv8. Маркерный полипептид предпочтительно является в известной степени уникальным для того, чтобы антитело против него по существу не проявляло перекрестную реактивность с другими эпитопами. Подходящие маркерные полипептиды, как правило, содержат по меньшей мере 6 аминокислотных остатков и обычно приблизительно 8-50 аминокислотных остатков (предпочтительно приблизительно 9-30 остатков). Предпочтительными являются полигистидиновые последовательности, которые связываются с nickle, что делает возможным выделение меченого белка с помощью Ni-NTA хроматографии, как описано (см., например, Lindsay et al. Neuron 17:571-574 (1996)).
«Выделенный Bv8» обозначает Bv8, который был очищен от источника Bv8 или был изготовлен рекомбинантным или синтетическим способом и очищен. Очищенный Bv8 по существу не содержит другие полипептиды или пептиды. Здесь «по существу не содержит» обозначает приблизительно менее чем 5%, предпочтительно приблизительно менее чем 2%, более предпочтительно приблизительно менее чем 1%, даже более предпочтительно приблизительно менее чем 0,5%, наиболее предпочтительно приблизительно менее чем 0,1% загрязнение другими белками источника.
«По существу чистый» белок обозначает композицию, которая содержит по меньшей мере приблизительно 90% по массе этого белка, относительно общей массы этой композиции, предпочтительно по меньшей мере приблизительно 95% по массе, более предпочтительно по меньшей мере приблизительно 90% по массе, даже более предпочтительно по меньшей мере приблизительно 95% по массе. «По существу гомогенный» белок обозначает композицию, которая содержит по меньшей мере приблизительно 99% белка по массе, относительно общей массы композиции.
Термин «антагонист» при использовании в настоящем документе относится к молекуле, которая способна нейтрализовать, блокировать, ингибировать, аннулировать, снижать или препятствовать активности белка по изобретению, включая его связывание с одним или несколькими рецепторами в случае лиганда или связывание с одним или несколькими лигандами в случае рецептора. Антагонисты включают антитела и их антигенсвязывающие фрагменты, белки, пептиды, гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, биоорганические молекулы, пептидомиметики, фармакологические средства и их метаболиты, транскрипционные и трансляционные управляющие последовательности и т.п. Антагонисты также включают низкомолекулярные ингибиторы белка по изобретению и слитые белки, рецепторные молекулы и производные, которые избирательно связываются с белком, таким образом препятствуя его связыванию с мишенью, варианты антагониста белка, антисмысловые молекулы, нацеленные на белок по изобретению, РНК аптамеры и рибозимы против белка по изобретению.
«Блокирующее антитело» или «антитело-антагонист» представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, с которым оно связывается. Некоторые блокирующие антитела или антитела-антагонисты по существу или полностью ингибируют биологическую активность антигена.
Термин «антагонист Bv8», как применяют в настоящем документе, относится к любой молекуле, которая частично или полностью блокирует, ингибирует или нейтрализует способность нативной последовательности Bv8 модулировать мобилизацию миелоидных клеток и/или способствовать ангиогенезу в процессе развития опухоли. Пригодные молекулы антагонистов в частности включают антитела-антагонисты или их антигенсвязывающие фрагменты, белки, пептиды, гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, биоорганические молекулы, пептидомиметики, фармакологические средства и их метаболиты, транскрипционные и трансляционные управляющие последовательности и т.п. Антагонисты также включают низкомолекулярные ингибиторы Bv8 и слитые белки, рецепторные молекулы и производные, которые избирательно связываются с Bv8, таким образом нарушая их связывание с мишенью, варианты антагонистов Bv8, антисмысловые молекулы, нацеленные на Bv8, РНК аптамеры и рибозимы против Bv8.
В частности, антагонисты Bv8 включают без ограничения антитела и фрагменты антител, избирательно связывающиеся с нативной последовательностью полипептида Bv8, или нативную последовательность рецепторного полипептида Bv8 (PKR-1/EG-VEGFR1 или PKR-2/EG-VEGFR2). Способы идентификации антагонистов полипептида Bv8 могут содержать приведение полипептида Bv8 в контакт с кандидатной молекулой антагониста и измерение обнаружимого изменения способности Bv8 модулировать мобилизацию миелоидных клеток и/или способствовать опухолевому ангиогенезу.
«Активный» или «активность», применительно к Bv8 или G-CSF, для целей настоящего документа относится к форме(ам) Bv8 или G-CSF, которые сохраняют биологическую и/или иммунологическую активность нативного или встречающегося в природе Bv8 или G-CSF, где «биологическая» активность относится к биологической функции (или ингибиторной или стимулирующей), которую выполняет нативный или встречающийся в природе Bv8 или G-CSF, отличающейся от способности индуцировать образование антитела против антигенного эпитопа, который предоставлен нативным или встречающимся в природе Bv8 или G-CSF, и «иммунологическая» активность относится к способности индуцировать образование антитела против антигенного эпитопа, который предоставлен нативным или встречающимся в природе Bv8 или G-CSF. Предпочтительной биологической активностью Bv8 является способность модулировать мобилизацию миелоидных клеток и/или способствовать опухолевому ангиогенезу.
«Рецептор Bv8» представляет собой молекулу, с которой связывается Bv8 и которая опосредует биологические свойства Bv8. Следовательно, значение термина «рецептор Bv8» включает PKR1/EG-VEGF рецептор-1 и PKR2/KG-VEGF рецептор-2 (LeCouter et al., 2003, Proc. Natl. Acad. Sci USA, 100:2685-2690; Lin et al. 2002, J. Biol. Chem., 277:19276-19280; Masuda et al.. 2002, Biochem. Biophys. Res Commim., 293:396-402).
Термин «VEGF», как применяют в настоящем документе, относится к нативной последовательности фактора роста эндотелия сосудов и его вариантам.
Термины «VEGF» и «VEGF-A» используют взаимозаменяемо для обозначения нативной 165-аминокислотной последовательности фактора роста эндотелиальных клеток сосудов и связанных 121-, 145-, 183-, 189- и 206- аминокислотных факторов роста эндотелиальных клеток сосудов, как описано авторами Leung et al. Science, 246:1306 (1989), Houck et al. Mol. Endocrin., 5:1806 (1991), и Robinson & Stringer, Journal of Cell Science, 144(5):853-865 (2001), вместе с встречающимися в природе их аллельными и процессированными формами, также их вариантами. VEGF-A является частью семейства генов, которое включает VEGF-B, VEGF-C, VEGF-D, VEGF-E, VEGF-F и PIGF. VEGF-A в основном связывается с двумя высокоаффинными рецепторными тирозинкиназами, VEGFR-1 (Flt-1) и VEGFR-2 (Flk-1/KDR), последний является основным трансмиттером митогенных сигналов клеток эндотелия сосудов VEGF-A. Термин «VEGF» или «VEGF-A» также относится к VEGF из видов, не являющихся человеком, таких как мышь, крыса или примат. Иногда VEGF из конкретных видов обозначают с помощью терминов, таких как hVEGF VEGF человека или mVEGF для VEGF мыши. Термин «VEGF» также используют для обозначения усеченных форм или фрагментов полипептида, которые содержат аминокислоты с 8 до 109 или с 1 до 109 из 165-аминокислотного фактора роста эндотелиальных клеток сосудов человека. Упоминание о любой такой форме VEGF может быть обозначено в настоящей заявке, например, как «VEGF (8-109)», «VEGF (1-109)» или «VEGF165». Положения аминокислот для «усеченного» нативного VEGF пронумерованы в соответствии с нативной последовательностью VEGF. Например, 17 положение аминокислоты (метионин) в усеченном нативном VEGF также является 17 положением (метионин) в нативном VEGF. Усеченный нативный VEGF обладает аффинностью связывания с рецепторами KDR и Flt-1, которая сравнима с нативной последовательностью VEGF.
«Антагонист VEGF» относится к молекуле (пептидил или непептидил), которая способна нейтрализовывать, блокировать, ингибировать, аннулировать, снижать или препятствовать активностям VEGF с нативной последовательностью, включая его связывание с одним или несколькими рецепторами VEGF. Антагонисты VEGF включают антитела против VEGF и их антигенсвязывающие фрагменты, рецепторные молекулы и производные, которые избирательно связываются с VEGF, таким образом нарушая его связывание с одним или несколькими рецепторами (например, растворимыми рецепторными белками VEGF, или их фрагментами, которые связываются с VEGF, или химерными рецепторными белками VEGF), антитела против рецептора VEGF и антагонисты рецептора VEGF, такие как низкомолекулярные ингибиторы VEGFR тирозинкиназ, и слитые белки, например, VEGF-Trap (Regeneron), VEGF121-гелонин (Peregine). Антагонисты VEGF также включают варианты антагонистов VEGF, антисмысловые молекулы, которые нацелены на VEGF, РНК аптамеры и рибозимы против VEGF или рецепторов VEGF. Антагонисты VEGF, которые можно использовать в способах по изобретению, дополнительно включают пептидильные или непептидильные соединения, которые избирательно связываются с VEGF, например, антитела против VEGF и их антигенсвязывающие фрагменты, полипептиды или их фрагменты, которые избирательно связываются с VEGF; антисмысловые олигомеры нуклеиновых оснований, которые комплементарны по меньшей мере фрагменту молекулы нуклеиновой кислоты, которая кодирует полипептид VEGF; маленькие РНК, которые комплементарны по меньшей мере фрагменту молекулы нуклеиновой кислоты, которая кодирует полипептид VEGF; рибозимы, которые нацелены на VEGF; пептидные антитела к VEGF и аптамеры к VEGF. В одном из вариантов осуществления антагонист VEGF снижает или ингибирует, по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более, уровень экспрессии или биологическую активность VEGF. В другом варианте осуществления VEGF, который ингибируется антагонистом VEGF, представляет собой VEGF (8-109), VEGF (1-109) или VEGF165.
Термин «антитело против VEGF» или «антитело, которое связывается с VEGF» относится к антителу, которое способно связываться с VEGF с достаточной аффинностью и избирательностью, так что антитело можно использовать в качестве диагностического и/или терапевтического средства, нацеленного на VEGF. Например, антитело против VEGF по изобретению можно использовать в качестве терапевтического средства, которое направлено и препятствует заболеваниям или состояниям, в которые вовлечена активность VEGF. См., например, патенты США 6582959, 6703020; WO 98/45332; WO 96/30046; WO 94/10202, WO 2005/044853; EP 0666868B1; патентные заявки США 20030206899, 20030190317, 20030203409, 20050112126, 20050186208 и 20050112126; Popkov et al., Journal of Immunological Methods 288:149-164 (2004) и WO 2005012359. Выбранное антитело обычно должно обладать достаточно большой аффинностью связывания с VEGF, например, антитело может связываться с hVEGF при величине Kd между 100 нМ-1 пМ. Аффинности антител можно определить с помощью анализа на основе поверхностного плазмонного резонанса (например, анализа BIAcore™, как описано в публикации заявки PCT № WO 2005/012359); твердофазного иммуноферментного анализа (ELISA) и конкурентных тестов (например, РИА). Антитело можно подвергнуть другим тестам на биологическую активность, например, для оценки его эффективности в качестве терапевтического средства. Такие тесты известны в данной области и зависят от антигенной мишени и предполагаемого использования антитела. Примеры включают анализ ингибирования с эндотелиальными клетками пупочной вены человека; анализы на ингибирование роста опухолевых клеток (например, как описано в WO 89/06692); тесты на обусловленную антителами клеточную цитотоксичность (АЗКЦ) и комплемент-опосредованную цитотоксичность (КЗЦ) (патент США 5500362) и тесты на агонистическую активность или гемопоэз (см. WO 95/27062). Антитело против VEGF обычно не будет связываться ни с другими гомологами VEGF, такими как VEGF-B, VEGF-C, VEGF-D или VEGF-E, ни с другими факторами роста, такими как PIGF, PDGF или bFGF. В одном из вариантов осуществления антитела против VEGF включают моноклональное антитело, которое связывается с тем же эпитопом, что и моноклональное антитело A4.6.1 против VEGF, продуцируемое гибридомой ATCC HB 10709; рекомбинантное гуманизированное моноклональное антитело против VEGF, изготовленное в соответствии с Presta et al. (1997) Cancer Res. 57:4593-4599, включая в качестве неограничивающих примеров антитело, которое известно как «бевацизумаб (BV)», также известное как «rhuMAb VEGF» или «АВАСТИН®». Бевацизумаб содержит мутировавшие каркасные области IgG1 человека и антигенсвязывающие гипервариабельные области из моноклонального антитела мыши A.4.6.1 против hVEGF, которое блокирует связывание VEGF человека с его рецепторами. Приблизительно 93% аминокислотной последовательности бевацизумаба, включая большую часть каркасных областей, получено из IgG1 человека, и приблизительно 7% последовательности получено из мышиного антитела A4.6.1. Бевацизумаб обладает молекулярной массой приблизительно 149000 Да и гликозилированием. Бевацизумаб и другие гуманизированные антитела против VEGF более подробно описаны в патенте США № 6884879, опубликованном 26 февраля 2005 года. Дополнительные предпочтительные антитела включают серии антител G6 или B20 (например, G6-23, G6-31, B20-4.1), как описано в публикации заявки PCT № WO 2005/012359. Дополнительные предпочтительные антитела см. в патентах США №№ 7060269, 6582959, 6703020; 6054297; WO98/45332; WO 96/30046; WO94/10202; EP 0666868B1; публикациях патентных заявок США №№ 2006009360, 20050186208, 20030206899, 20030190317, 20030203409 и 20050112126 и Popkov et al., Journal of Immunological Methods 288:149-164 (2004).
«Серия антител G6» по данному изобретению представляет собой антитело против VEGF, которое получено из последовательности антитела G6 или антитела, полученного из G6 в соответствии с любой фиг.7, 24-26 и 34-35 из публикации заявки PCT № WO 2005/012359.
«Гематопоэтическая стволовая клетка/клетка-предшественник» или «эмбриональная гематопоэтическая клетка» представляет собой клетку, которая способна дифференцироваться для образования более детерминированного или зрелого типа клеток крови. «Линии дифференцировки лимфоидных клеток крови» представляют собой такие гематопоэтические клетки-предшественники, которые способны дифференцироваться с образованием лимфоцитов (B-клеток или T-клеток). Подобным образом, «лимфопоэз» представляет собой образование лимфоцитов. «Линии дифференцировки эритроидных клеток крови» представляют собой такие гематопоэтические клетки-предшественники, которые способны дифференцироваться с образованием эритроцитов (красные клетки крови), и «эритропоэз» представляет собой образование эритроцитов.
Фраза «линии дифференцировки миелоидных клеток крови» для целей настоящего документа включает все гематопоэтические клетки-предшественники, отличающиеся от линий дифференцировки лимфоидных и эритроидных клеток крови, как определено выше, и «миелопоэз» затрагивает образование клеток (которые отличаются от лимфоцитов и эритроцитов).
Миелоидная клеточная популяция может быть обогащена миелоидными иммунными клетками, которые представляют собой Gr1+/CD11b+ (или CD11b+Gr1+) или Gr1+/Mac-1+. Эти клетки экспрессируют маркер миелоидных клеток из макрофагальной линии дифференцировки, CD11b, и маркер гранулоцитов, Gr1. Gr1+/CD11b+ могут быть отобраны с помощью иммуноадгезивного пэннинга, например, с использованием антитела к Gr1+.
«Средство, снижающее миелоидные клетки» или «средство для снижения миелоидных клеток» относится к средству, которое снижает или удаляет миелоидную клеточную популяцию. Типично средство, снижающее миелоидные клетки, будет снижать или удалять миелоидные клетки, CD11b+Gr1+, моноциты, макрофаги и т.д. Примеры средств, снижающих миелоидные клетки, включают в качестве неограничивающих примеров, антагонист Gr1+, антагонист CD11b, антагонист CD18, ингибитор эластазы, антагонист MCP-1, антагонист MIP-1 альфа и т.д.
Термин «антагонист Gr1» при использовании в настоящем документе относится к молекуле, которая связывается с Gr1 и ингибирует или по существу снижает биологическую активность Gr1. Неограничивающие примеры антагонистов Gr1 включают антитела, белки, пептиды, гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, биоорганические молекулы, пептидомиметики, фармакологические средства и их метаболиты, транскрипционные и трансляционные управляющие последовательности и т.п. В одном из вариантов осуществления изобретения антагонист Gr1 представляет собой антитело, в частности антитело против Gr1, которое связывается с Gr1 человека.
Термин «антагонист CD11b» при использовании в настоящем документе относится к молекуле, которая связывается с CD11b и ингибирует или по существу снижает биологическую активность CD11b. Обычно антагонист будет блокировать (частично или полностью) способность клетки (например, незрелой миелоидной клетки) экспрессировать субъединицу CD11b на ее клеточной поверхности для связывания с эндотелием. Неограничивающие примеры антагонистов CD11b включают антитела, белки, пептиды, гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, биоорганические молекулы, пептидомиметики, фармакологические средства и их метаболиты, транскрипционные и трансляционные управляющие последовательности и т.п. В одном из вариантов осуществления изобретения антагонист CD11b представляет собой антитело, в частности антитело против CD11b, которое связывается с CD11b человека. Образцовые антитела к CD11b включают MY904 (патент США № 4840793); 1B6c (см. Zhang et al., Brain Research 698:79-85 (1995)); CBRN1/5 и CBRM1/19 (WO94/08620).
Термин «антагонист CD18» при использовании в настоящем документе относится к молекуле, которая связывается с CD18 (предпочтительно CD18 человека) и ингибирует или по существу снижает биологическую активность CD18. Обычно антагонист будет блокировать (частично или полностью) способность клетки (например, нейтрофила) экспрессировать субъединицу CD18 на ее клеточной поверхности для связывания с эндотелием. Неограничивающие примеры антагонистов CD18 включают антитела, белки, пептиды, гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, биоорганические молекулы, пептидомиметики, фармакологические средства и их метаболиты, транскрипционные и трансляционные управляющие последовательности и т.п. В одном из вариантов осуществления изобретения антагонист CD18 представляет собой антитело.
Примеры антител против CD18 включают MHM23 (Hildreth et al., Eur. J. Immunol, 13:202-208 (1983)); M18/2 (IgG2a; Sanches-Madrid et al. J. Exp. Med. 158:586-602 (1983)); H52 (American Type Culture Collection (ATCC) Deposit HB 10160); Masl91c и 10T18 (Vermot Desroches et al., Scand. J. Immunol. 33:277-286 (1991)) и NA-8 (WO 94/12214). В одном из вариантов осуществления антитело представляет собой антитело, которое связывается с эпитопом CD18, с которым связывается или MHM23, или Н52. В одном из вариантов осуществления изобретения антитело обладает высокой аффинностью к полипептиду CD18. В определенных вариантах осуществления антитело может связываться с областью во внеклеточном домене CD18, который ассоциирует с CD11b, и антитело также может диссоциировать a и P цепи (например, антитело может диссоциировать комплекс CD11b и CD18, как в случае антитела MHM23).
Моноцитарный хемотаксический белок (MCP-1) представляет собой хемокин, который участвует во врожденном иммунитете и Th2 эффекторном ответе, и дифференциации CD4+ T-клеток. См., например, Paul, W. E., Fundamental Immunology, 5th Edition, Lippincott Williams & Wilkins, (Philadelphia, 2003) стр.801-840.
Термин «антагонист MCP-1» при использовании в настоящем документе относится к молекуле, которая связывается с MCP-1 и ингибирует или по существу снижает биологическую активность MCP-1. Неограничивающие примеры антагонистов MCP-1 включают антитела, белки, пептиды, гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, биоорганические молекулы, пептидомиметики, фармакологические средства и их метаболиты, транскрипционные и трансляционные управляющие последовательности и т.п. В одном из вариантов осуществления изобретения антагонист MCP-1 представляет собой антитело, в частности антитело против MCP-1, которое связывается с MCP-1 человека.
Макрофагальные воспалительные белки альфа и бета (MIP-1 альфа и бета) являются известными хемокинами. MIP-1 альфа участвует во врожденном иммунитете и Th1 эффекторном ответе, и дифференциации CD4+ T-клеток. См., например, Paul, W. E., Fundamental Immunology, 5th Edition, Lippincott Williams & Wilkins, (Philadelphia, 2003), стр.801-840.
Термин «антагонист MIP-1 альфа» при использовании в настоящем документе относится к молекуле, которая связывается с MIP-1 альфа и ингибирует или по существу снижает биологическую активность MIP-1 альфа. Неограничивающие примеры антагонистов MIP-1 альфа включают антитела, белки, пептиды, гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, биоорганические молекулы, пептидомиметики, фармакологические средства и их метаболиты, транскрипционные и трансляционные управляющие последовательности и т.п. В одном из вариантов осуществления изобретения антагонист MIP-1 альфа представляет собой антитело, в частности антитело против MIP-1 альфа, которое связывается с MIP-1 альфа человека.
«URCGP» относится к белку, который апрегулирован в клетках CD11b+Gr+1 из опухолей, устойчивых к антителам против VEGF. URCGP включают в качестве неограничивающих примеров эластазу нейтрофилов, CD14, expi, I1-13R, LDLR, TLR-1, RLF, Endo-Lip, SOCS13, FGF13, ИЛ-4R, ИЛ-11R, ИЛ-1RII, IFN TM1, TNFRSF18, WNT5A, секреторный мембранный переносчик 1, HSP86, EGFR, EphRB2, GPCR25, HGF, ангиопоэтин-подобный-6, Eph-RA7, семафорин VIb, нейротрофин 5, клаудин-18, MDC 15, ECM и ADAMTS7B. В определенном варианте осуществления URCGP относятся к ИЛ-13R, TLR-1, Endo-Lip, FGF13 и/или ИЛ-4R.
A «DRCGP» относится к белку, который даунрегулирован в клетках CD11b+Gr1+ из опухолей, устойчивых к антителам против VEGF. DRCGP включают в качестве неограничивающих примеров THBS1, Crea7, аквапорин-1, белок семейства растворимых переносчиков (SCF38), аполипопротеин E (APOE), белок, связывающий жирные кислоты (FABP), NCAM-140, фибронектин типа III, WIP, CD74, ICAM-2, Jagged 1, Itga4, ITGB7, TGF-BII-R, TGFb IEP, Smad4, BMPR1A, CD83, дектин-1, CD48, E-селектин, ИЛ-15, супрессор цитокиновой сигнализации 4, Cytor4 и CX3CR1. В определенном варианте осуществления DRCGP относятся к THBS1 и/или Crea7.
«URRTP» относится к белку, который апрегулирован в опухолях, устойчивых к антителам против VKGF. URRTP включают в качестве неограничивающих примеров Notch2, DMD8, MCP-1, ITGB7, G-CSF, ИЛ-8R, MIP2, MSCA, GM-CSF, ИЛ-1R, Meg-SF, HSP1A, ИЛ-1R, G-CSFR, IGF2, HSP9A, FGF18, ELM1, Ledgfa, фагоцитарный рецептор типа A, макрофагальный лектин C-типа, Pigr3, макрофагальный SRT-1, G белок-связанный рецептор, ScyA7, ИЛ-1R2, ИЛ-1 индуцируемый белок, ИЛ-1 бета и предшественник ILIX. В определенном варианте осуществления URRTP относятся к MSCA, MIP2, ИЛ-8R и/или G-CSF.
«DRRTP» относится к белку, который даунрегулирован в опухолях, устойчивых к антителам против VEGF. URRTP включают в качестве неограничивающих примеров ИЛ-10R2, Erb-2.1, кавеолин 3, Semcap3, INTG4, THBSP-4, ErbB3, JAM, Eng, JAM, Eng, JAM-2, Pecam1, Tlr3, TGF-B, FIZZ1, Wfs1, TP 14A, EMAP, SULF-2, внеклеточный матрикс 2, CTFG, TFPI, XCP2, Ramp2, ROR-alpha, эфрин B1, SPARC-подобный 1 и семафорин A. В определенных вариантах осуществления DRRTP относятся к ИЛ-10R2, THBSP-4 и/или JAM-2.
Термин «обнаружение» использован в самом широком смысле, который включает как количественные, так и качественные измерения молекул-мишеней.
Термин «биологический образец» относится к пробе из организма любого животного, но предпочтительно из организма млекопитающего, более предпочтительно из организма человека. Такие образцы включают биологические жидкости, такие как кровь, сыворотка, плазма, костный мозг, стекловидная жидкость, лимфа, синовиальная жидкость, фолликулярная жидкость, семенная жидкость, амниотическая жидкость, молоко, цельная кровь, моча, спинномозговая жидкость, слюна, мокрота, слезы, продукты испарения тела, слизь и тканевая среда для культивирования, а также тканевые экстракты, такие как гомогенизированная ткань, и клеточные экстракты. Предпочтительным биологическим образцом в настоящем документе является образец сыворотки, плазмы, мочи или костного мозга.
Термин «антитело» использован в самом широком смысле и в частности включает моноклональные антитела (включая полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела, полиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител, и фрагменты антител (см. ниже) при условии, что они проявляют желательную биологическую активность.
Если не указано иное, выражение «поливалентное антитело» используют на всем протяжении этого описания для обозначения антитела, которое содержит три или более антигенсвязывающих участка. Типично поливалентное антитело сконструировано так, чтобы содержать три или более антигенсвязывающих участка, и, как правило, не является нативной последовательностью антитела IgM или IgA.
«Фрагменты антител» содержат только часть интактного антитела и, как правило, содержат антигенсвязывающий участок из интактного антитела, и таким образом сохраняют способность связываться с антигеном. Примеры фрагментов антител, попадающих под настоящее определение, включают: (i) Fab-фрагмент, который содержит домены VL, CL, VH и CH1; (ii) Fab'-фрагмент, который представляет собой Fab-фрагмент, содержащий один или несколько цистеиновых остатков на C-конце домена CH1; (iii) Fd-фрагмент, который содержит домены VH и CH1; (iv) Fd'-фрагмент, который содержит домены VH и CH1 и один или несколько цистеиновых остатков на C-конце домена CH1; (v) Fv-фрагмент, который содержит домены VL и VH из одного плеча антитела; (vi) dAb-фрагмент (Ward et al., Nature 341, 544-546 (1989)), который состоит из домена VH; (vii) выделенные области CDR; (viii) F(ab')2-фрагменты, бивалентные фрагменты, которые содержат два Fab'-фрагмента, соединенных дисульфидным мостиком в шарнирной области; (ix) одноцепочечные молекулы антител (например, одноцепочечная Fv; scFv) (Bird et al., Science 242:423-426 (1988); и Huston et al., PNAS (USA) 85:5879-5883 (1988)); (x) «диатела» с двумя антигенсвязывающими участками, которые содержат вариабельный домен тяжелой цепи (VH), который соединен с вариабельным доменом легкой цепи (VL) в одной полипептидной цепи (см., например, EP 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); (xi) «линейные антитела», которые содержат пару тандемных Fd-сегментов (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих областей (Zapata et al. Protein Eng. 8(10):1057-1062 (1995) и патент США № 5641870).
Термин «моноклональное антитело», как применяют в настоящем документе, относится к антителу, которое получено из популяции по существу гомогенных антител, т.е. отдельные антитела, которые содержит популяция, являются идентичными за исключением возможных мутаций, например, мутаций, встречающихся в природе, которые могут присутствовать в незначительных количествах. Таким образом, модификатор «моноклональное» указывает на характер антитела, которое не является смесью отдельных антител. Моноклональные антитела являются высокоспецифичными и направлены против одного антигена. В определенных вариантах осуществления моноклональное антитело типично включает антитело, которое содержит полипептидную последовательность, которая связывается с мишенью, где мишень-связывающая полипептидная последовательность была получена с помощью процесса, который включает выбор одной мишень-связывающей полипептидной последовательности из множества полипептидных последовательностей. Например, процесс выбора может представлять собой выбор уникального клона из множества клонов, например, из пула клонов гибридомы, фаговых клонов или клонов рекомбинантной ДНК. Следует понимать, что выбранная мишень-связывающая последовательность может быть дополнительно изменена, например, для улучшения аффинности к мишени, для гуманизации мишень-связывающей последовательности, для улучшения ее продукции в клеточной культуре, для снижения ее иммуногенности in vivo, для создания полиспецифического антитела и т.д., и что антитело, которое содержит измененную мишень-связывающую последовательность, также является моноклональным антителом по данному изобретению. В отличие от препаратов поликлональных антител, которые типично включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. В дополнение к их избирательности, препараты моноклональных антител полезны тем, что типично они не загрязнены другими иммуноглобулинами.
Модификатор «моноклональное» указывает на характер антитела, которое по существу получено из гомогенной популяции антител, и он не должен толковаться как требование изготавливать антитело с помощью какого-либо конкретного способа. Например, моноклональные антитела для использования в соответствии с настоящим изобретением могут быть изготовлены множеством способов, включая, например, гибридомный способ (например, Kohler and Milstein, Nature, 256:495-97 (1975); Hongo et al., Hybridoma, 14 (3):253-260 (1995), Harlow et al., Antibodies: A laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N. Y., 1981)), способ c рекомбинантной ДНК (см., например, патент США № 4816567), технологии фагового дисплея (см., например, Clackson et al., Nature, 352:624-628 (1991); Marks et al., J. Mol. Biol. 222:581-597 (1991); Sidhu et al., J. Mol. Biol. 338(2):299-310 (2004); Lee et al., J. Mol. Biol. 340(5):1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34):12467-12472 (2004); и Lee et al., J. Immunol. Methods 284(1-2):119-132(2004), и технологии для изготовления антител человека или антител, похожих на антитела человека, в животных, которые содержат фрагментарные или целые локусы или гены иммуноглобулинов человека, которые кодируют последовательности иммуноглобулинов человека (см., например, WO 1998/24893; WO 1996/34096; WO 1996/33735; WO 1991/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA 90:2551 (1993); Jakobovits et al., Nature 362:255-258 (1993); Bruggemann et al., Year in Immunol. 7:33 (1993); патенты США №№ 5545807; 5545806; 5569825; 5625126; 5633425 и 5661016; Marks et al., Bio/Technology 10:779-783 (1992); Lonberg et al., Nature 368:856-859 (1994); Morrison, Nature 368:812-813 (1994); Fishwild et al., Nature Biotechnol. 14:845-851 (1996); Neuberger, Nature Biotechnol. 14:826 (1996) и Lonberg and Huszar, Intern. Rev. Immunol. 13:65-93 (1995).
В настоящем документе моноклональные антитела, в частности, включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, которые получены из определенных видов или принадлежат к определенному классу или подклассу антител, тогда как остатки цепи(ей) идентичны или гомологичны соответствующим последовательностям в антителах, которые получены из других видов или принадлежат к другому классу или подклассу антител, а также фрагменты таких антител при условии, что они проявляют желательную биологическую активность (патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
«Гуманизированные» формы не принадлежащих человеку (например, мышиных) антител представляют собой химерные антитела, которые содержат минимальную последовательность, которая получена не из иммуноглобулина человека. Преимущественно гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельной области реципиента замещены на остатки из гипервариабельной области вида, не являющегося человеком (донорное антитело), такого как мышь, крыса, кролик, или не являющегося человеком примата, обладающего желаемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасной области (FR) иммуноглобулина человека замещают соответствующими не принадлежащими человеку остатками. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаружены в реципиентном антителе или в донорном антителе. Эти модификации выполняют для дополнительного повышения эффективности антитела. В основном гуманизированное антитело будет содержать по существу все из по меньшей мере одного, и типично двух вариабельных доменов, в которых все или по существу все гипервариабельные петли соответствуют гипервариабельным петлям иммуноглобулина не человека и все или по существу все FR представляют собой FR последовательности иммуноглобулина человека. Также гуманизированное антитело необязательно будет содержать по меньшей мере часть константной области иммуноглобулина (Fc), типично часть константной области иммуноглобулина человека. Более подробно, см. Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). См. также, например, Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994); и патенты США №№ 6982321 и 7087409. См. также van Dijk and van de Winkel, Curr. Opin. Pharmacol, 5:368-74 (2001). Антитела человека могут быть изготовлены посредством введения антигена трансгенному животному, которое было модифицировано для того, чтобы продуцировать такие антитела в ответ на антигенный стимул, но эндогенные локусы которых были заблокированы, например, иммунизированные ксеномыши (см., например, патенты США №№ 6075181 и 6150584 относительно технологии XENOMOUSE™). См. также, например. Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006) относительно антител человека, созданных с помощью технологии B-клеточной гибридомы.
«Антитело человека» представляет собой антитело, которое обладает аминокислотной последовательностью, которая соответствует аминокислотной последовательности антитела, продуцируемого человеком и/или изготовленного с использованием любых технологий для изготовления антител человека, как описано в настоящем документе. Это определение антитела человека, в частности, исключает гуманизированное антитело, которое содержит не принадлежащие человеку антигенсвязывающие остатки. Антитела человека могут быть изготовлены с использованием различных способов, известных в данной области. В одном из вариантов осуществления антитело человека выбрано из фаговой библиотеки, где эта фаговая библиотека экспрессирует антитела человека (Vaughan et al. Nature Biotechnology 14:309-314 (1996): Sheets et al. PNAS (USA) 95:6157-6162 (1998); Hoogenboom and Winter, J. Mol. Biol, 227:381 (1991); Marks et al., J. Mol. Biol, 222:581 (1991)). Антитела человека также могут быть изготовлены посредством введения локусов иммуноглобулина человека в трансгенных животных, например, мышей, в которых эндогенные гены иммуноглобулинов частично или полностью инактивированы. При стимуляции наблюдается образование антител человека, которое во всех отношениях очень похоже на процесс, наблюдаемый у людей, включая реаранжировку генов, сборку и антительный репертуар. Этот подход описан, например, в патентах США №№ 5545807; 5545806; 5569825; 5625126; 5633425; 5661016 и в следующих научных публикациях: Marks et al., Bio/Technology 10:779-783 (1992); Lonberg et al., Nature 368:856-859 (1994); Morrison, Nature 368:812-13 (1994); Fishwild et al., Nature Biotechnology 14:845-51 (1996); Neuberger, Nature Biotechnology 14:826 (1996); Lonberg and Huszar, Intern. Rev. Immunol. 13:65-93 (1995). Альтернативно антитело человека может быть изготовлено посредством иммортализации B лимфоцитов человека, продуцирующих антитело, направленное против целевого антигена (такие B лимфоциты могут быть получены от человека или могут быть иммунизированы in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, стр.77 (1985); Boerner et al., J. Immunol, 147 (1):86-95 (1991); и патент США № 5750373.
Термин «вариабельный» относится к тому факту, что последовательности определенных участков вариабельных доменов широко различаются среди антител и участвуют в связывании и специфичности каждого конкретного антитела к его конкретному антигену. Однако вариабельность не одинаково распространена на всем протяжении вариабельных доменов антител. Она сосредоточена в трех сегментах, которые называются гипервариабельными областями, в вариабельных доменах как легкой, так и в тяжелой цепи. Более консервативные части вариабельных доменов называются каркасными областями (FR). Вариабельные домены нативной тяжелой и легкой цепей содержат по четыре FR, в основном принимая конфигурацию складчатого бета-слоя, который соединен тремя гипервариабельными областями, образующими петли, которые соединяют структуру складчатого бета-слоя и в некоторых случаях образуют его часть. Гипервариабельные области в каждой цепи удерживаются вместе в непосредственной близости с помощью FR и вместе с гипервариабельными областями из другой цепи вносят вклад в образование антигенсвязывающего сайта антитела (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены не вовлечены непосредственно в связывание антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности.
Термины «гипервариабельная область», «HVR» или «HV» при использовании в настоящем документе относятся к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Например, термин гипервариабельная область относится к областям вариабельного домена антитела, которые представляют собой гипервариабельные последовательности и/или образуют структурно заданные петли. Как правило, антитела содержат шесть HVR; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). В нативных антителах H3 и L3 проявляют наибольшее разнообразие из всех шести HVR, и в частности полагают, что H3 играет уникальную роль в придании специфичности антителам. См., например, Xu et al., Immunity 13:37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, N.J, 2003). Действительно, встречающиеся в природе верблюжьи антитела, состоящие только из тяжелой цепи, являются функциональными и стабильными при отсутствии легкой цепи. См., например, Hamers-Casterman et al., Nature 363:446-448 (1993); Sheriff et al, Nature Struct. Biol. 3:733-736 (1996).
В настоящем документе заключено и используется несколько способов описания HVR. Гипервариабельные участки Кабата (CDR) основаны на изменчивости последовательности и являются наиболее общеупотребительными (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Напротив, Chothia опирается на расположение структурных петель (Chothia and Lesk J Mol. Biol. 196:901-917 (1987)). AbM HVR представляют компромисс между HVR Кабата и структурными петлями Chothia и используются в программном обеспечении для моделирования антител Oxford Molecular's AbM. «Контактные» HVR основаны на анализе доступных комплексных кристаллических структур. Остатки из каждого из этих HVR приведены ниже.
HVR могут содержать следующие «расширенные HVR»: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL и 26-35 (H1), 50-65 или 49-65 (H2) и 93-102, 94-102 или 95-102 (H3) в VH. Остатки вариабельного домена пронумерованы в соответствии с Kabat el al., выше, для каждого из этих определений.
Остатки «каркасной области» или «FR» представляют собой остатки вариабельного домена, отличающиеся от остатков гипервариабельной области, которые определены в настоящем документе.
Термины «нумерация остатков вариабельного домена по Кабату» или «нумерация аминокислотного положения по Кабату» и их варианты относятся к системе нумерации, которая используется для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи сборки антител в Kabat et al., выше. При использовании этой системы нумерации фактическая линейная аминокислотная последовательность может содержать меньше или больше аминокислот, которые соответствуют удалению или вставке FR или HVR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать вставку из одной аминокислоты (остаток 52a по Кабату) после остатка 52 в H2 и аминокислоты вставки (например, остатки 82a, 82b и 82c и т.д. по Кабату) после остатка 82 в FR тяжелой цепи. Нумерация остатков по Кабату может быть определена для заданного антитела посредством выравнивания участков гомологии относительно последовательности антитела со «стандартной» нумерацией последовательности по Кабату.
На всем протяжении настоящего описания и формулы изобретения система нумерации по Кабату, как правило, используется при указании остатка в вариабельном домене (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). «Система нумерации по EU» или «EU индекс», как правило, используются при указании остатка в константной области тяжелой цепи иммуноглобулина (например, о EU индексе сообщалось в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), который явно включен в настоящий документ в качестве ссылки). До тех пор, пока не будет указано иное в настоящем документе, указания номеров остатков в вариабельном домене антитела обозначают нумерацию остатков согласно системе нумерации по Кабату. До тех пор, пока не будет указано иное в настоящем документе, указания номеров остатков в константном домене антитела обозначают нумерацию согласно системе нумерации по EU (например, см. предварительная заявка США № 60/640323, фигура для нумерации по EU).
В зависимости от аминокислотных последовательностей константных доменов их тяжелых цепей, антитела (иммуноглобулины) могут быть приписаны к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут делиться на дополнительные подклассы (изотипы), например, IgG1 (включая аллотипы не A и A), IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ, соответственно. Структуры и трехмерные конфигурации субъединиц различных классов иммуноглобулинов хорошо известны и в целом описаны, например, в Abbas et al. Cellular and Mol. Immunology, 4th ed. (W. B. Saundcrs, Co., 2000). Антитело может являться частью более крупной слитой молекулы, образованной с помощью ковалентной или нековалентной связи антитела с одним или несколькими другими белками или пептидами.
«Легкие цепи» антител (иммуноглобулинов) из любых видов позвоночных могут быть приписаны к одному из двух точно определяемых типов, которые называются каппа (κ) и лямбда (λ), на основе аминокислотных последовательностей их константных доменов.
Термин «Fc-область» используется для обозначения C-концевой области тяжелой цепи иммуноглобулина, которая может быть получена посредством расщепления интактного антитела папаином. Fc-область может представлять собой нативную последовательность Fc-области или вариант Fc-области. Несмотря на то, что границы Fc-области тяжелой цепи иммуноглобулина могут меняться, Fc-область тяжелой цепи IgG человека обычно определяют по фрагменту секвенирования от аминокислотного остатка приблизительно в положении Cys226, или приблизительно от положения Pro230, до карбоксильного конца Fc-области. C-концевой лизин (остаток 447 согласно системе нумерации по EU) Fc-области может быть удален, например, в процессе изготовления или очистки антитела, или при рекомбинантном конструировании нуклеиновой кислоты, которая кодирует тяжелую цепь антитела. Таким образом, композиция интактных антител может содержать популяции антител, в которых удалены все остатки K447, популяции антител, в которых остатки K447 не удалены, и популяции антител, содержащие смесь антител как с остатком K447, так и без него. Fc-область иммуноглобулина в целом содержит два константных домена, домен CH2 и домен CH3, и необязательно содержит домен CH4.
Если в настоящем документе не указано иное, нумерация остатков в тяжелой цепи иммуноглобулина представляет собой нумерацию по EU индексу, который приведен в Kabat et al, выше. «EU индекс, который приведен в Kabat» относится к нумерации остатков в EU антителе IgG1 человека.
Под «цепью Fc-области» в настоящем документе подразумевается одна из двух полипептидных цепей Fc-области.
«Домен CH2» Fc-области IgG человека (также обозначаемый как домен «Cg2») обычно простирается приблизительно от аминокислотного остатка в положении 231 приблизительно до аминокислотного остатка в положении 340. Домен CH2 уникален тем, что он спарен не вплотную с другим доменом. Точнее, две N-связанные разветвленные углеводные цепи вставлены между двумя доменами CH2 интактной нативной молекулы IgG. Предполагалось, что углевод может обеспечивать замену для домен-доменного спаривания и помогает стабилизировать домен CH2. Burton, Molec. Immunol. 22:161-206 (1985). В настоящем документе домен CH2 может представлять собой нативную последовательность домена CH2 или варианта домена CH2.
«Домен CH3» содержит фрагмент секвенирования из остатков, расположенных на C-конце домена CH2 в Fc-области (т.е. приблизительно от аминокислотного остатка от положения 341 приблизительно до аминокислотного остатка в положении 447 в IgG). В настоящем документе CH3-область может представлять собой нативную последовательность домена CH3 или варианта домена CH3 (например, домен CH3 с встроенным «бугорком» в одной его цепи и соответствующей встроенной «полостью» в другой его цепи; см. патент США № 5821333, который явно включен в настоящий документ в качестве ссылки). Такие варианты домена CH3 можно использовать для изготовления поливалентных (например, бивалентных) антител, как описано в настоящем документе.
«Шарнирная область», как правило, определяется как фрагмент секвенирования приблизительно от Glu216, или приблизительно Cys226, приблизительно до Pro230 IgG1 человека (Burton, Molec. Immunol. 22:161-206 (1985)). Шарнирные области других изотипов могут быть выровнены относительно последовательности IgG1 посредством совмещения первого и последнего остатков цистеина, которые образуют дисульфидные связи внутри тяжелой цепи, в одинаковых положениях. В настоящем документе шарнирная область может представлять собой шарнирную область с нативной последовательностью или вариант шарнирной области. Две полипептидные цепи варианта шарнирной области, как правило, сохраняют по меньшей мере один остаток цистеина на полипептидную цепь, так что две полипептидные цепи варианта шарнирной области могут образовать дисульфидную связь между двумя цепями. В настоящем документе предпочтительная шарнирная область представляет собой шарнирную область человека с нативной последовательностью, например, шарнирную область IgG1 человека с нативной последовательностью.
«Функциональная Fc-область» обладает по меньшей мере одной «эффекторной функцией» Fc-области с нативной последовательностью. Образцовые «эффекторные функции» включают связывание C1q; обусловленную комплементом цитотоксичность (КЗЦ); связывания рецептора Fc; обусловленную антителами опосредованную клетками цитотоксичность (АЗКЦ); фагоцитоз; понижающее регулирование рецепторов клеточной поверхности (например, B-клеточного рецептора; BCR) и т.д. Как правило, для таких эффекторных функций необходимо, чтобы Fc-область была объединена со связывающим доменом (например, вариабельный домен антитела), и эти функции могут быть оценены с использованием различных тестов, известных в данной области, для оценки таких эффекторных функций антитела.
«Fc-область с нативной последовательностью» содержит аминокислотную последовательность, которая идентична аминокислотной последовательности Fc-области, которая найдена в природе. Fc-область нативной последовательности человека включает Fc-область IgG1 человека с нативной последовательностью (аллотипы не A и A); Fc-область IgG2 человека с нативной последовательностью; Fc-область IgG3 человека с нативной последовательностью и Fc-область IgG4 человека с нативной последовательностью, а также их варианты, встречающиеся в природе.
«Интактное» антитело представляет собой антитело, которое содержит антигенсвязывающую вариабельную область, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи, CH1, CH2 и CH3. Константные домены могут представлять собой константные домены с нативными последовательностями (например, константные домены человека с нативными последовательностями) или варианты их аминокислотных последовательностей. Предпочтительно интактное антитело обладает одной или несколькими эффекторными функциями.
«Родительское антитело» или антитело «дикого типа» представляет собой антитело, которое содержит аминокислотную последовательность, в которой отсутствует одно или несколько изменений аминокислотных последовательностей по сравнению с вариантом антитела, который раскрыт в настоящем документе. Таким образом, родительское антитело, как правило, содержит по меньшей мере одну гипервариабельную область, аминокислотная последовательность которой отличается от аминокислотной последовательности соответствующей гипервариабельной области варианта антитела, который раскрыт в настоящем документе. Родительский полипептид может содержать антитело с нативной последовательностью (т.е. встречающуюся в природе) (включая встречающийся в природе аллельный вариант) или антитело с уже существовавшими модификациями аминокислотной последовательности (такими как инсерции, делеции и/или другие изменения), последовательности, которая встречается в природе. На всем протяжении раскрытия, антитело «дикого типа», «ДТ», «дт» и «родительское» антитело используют взаимозаменяемо.
Как применяют в настоящем документе, «вариант антитела» относится к антителу, которое содержит аминокислотную последовательность, которая отличается от аминокислотной последовательности родительского антитела. Предпочтительно вариант антитела содержит вариабельный домен тяжелой цепи или вариабельный домен легкой цепи, содержащие аминокислотные последовательности, которые не обнаружены в природе. Такие варианты обязательно обладают менее чем 100% идентичностью последовательностей или сходством с родительским антителом. В предпочтительном варианте осуществления вариант антитела будет содержать аминокислотную последовательность с приблизительно от 75% до менее чем 100% идентичностью аминокислотных последовательностей или сходством с аминокислотной последовательностью вариабельного домена или тяжелой или легкой цепи родительского антитела, более предпочтительно с приблизительно от 80% до менее чем 100%, более предпочтительно с приблизительно от 85% до менее чем 100%, более предпочтительно с приблизительно от 90% до менее чем 100% и наиболее предпочтительно с приблизительно от 95% до менее чем 100%. Вариант антитела, как правило, представляет собой вариант, который содержит одно или несколько изменений аминокислот внутри или около его одной или нескольких гипервариабельных областей.
«Вариант Fc-области» содержит аминокислотную последовательность, которая отличается от аминокислотной последовательности Fc-области с нативной последовательностью посредством по меньшей мере одной аминокислотной модификации. В определенных вариантах осуществления вариант Fc-области содержит по меньшей мере одну замену аминокислоты по сравнению с Fc-областью с нативной последовательностью или с Fc-областью родительского полипептида, например, приблизительно от одной приблизительно до десяти замен аминокислот, и предпочтительно приблизительно от одной приблизительно до пяти замен аминокислот в Fc-области с нативной последовательностью или в Fc-области родительского полипептида, например, приблизительно от одной приблизительно до десяти замен аминокислот, и предпочтительно приблизительно от одной приблизительно до пяти замен аминокислот в Fc-области с нативной последовательностью или в Fc-области родительского полипептида. Вариант Fc-области в настоящем документе типично будет обладать, например, по меньшей мере приблизительно 80% идентичностью последовательности относительно Fc-области с нативной последовательностью и/или относительно Fc-области родительского полипептида, или к тому же по меньшей мере приблизительно 90% идентичностью последовательности, или к тому же по меньшей мере приблизительно 95% или большей идентичностью последовательности.
«Эффекторные функции» антитела относятся к тем биологическим активностям, которые относятся к Fc-области (Fc-области с нативной последовательностью или аминокислотной последовательности варианта Fc-области) антитела и меняются в соответствии с изотипом антитела. Примеры эффекторных функций антитела включают: связывание с C1q и обусловленную комплементом цитотоксичность (КЗЦ); связывание с рецептором Fc; антителозависимую клеточно-опосредованную цитотоксичность (АЗКЦ); фагоцитоз; понижающее регулирование рецепторов клеточной поверхности (например, B-клеточного рецептора) и активацию B-клеток.
«Антителозависимая клеточно-опосредованная цитотоксичность» или «АЗКЦ» относится к форме цитотоксичности, при которой секретированные Ig связываются с рецепторами Fc (FcR), которые представлены на определенных цитотоксических клетках (например, естественных киллерах (NK), нейтрофилах и макрофагах), давая этим цитотоксическим эффекторным клеткам возможность избирательно связываться с несущей антиген клеткой-мишенью и впоследствии убивать клетку-мишень с помощью цитотоксинов. Основные клетки, которые опосредуют АЗКЦ, NK клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Данные об экспрессии FcR на гемопоэтических клетках объединены в таблице 3 на стр.464 в статье Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Для оценки АЗКЦ активности интересующей молекулы можно осуществить тест на АЗКЦ in vitro, который описан в патенте США №№ 5500362 или 5821337. Для такого анализа можно использовать эффекторные клетки, которые включают мононуклеарные клетки периферической крови (МКПК) и естественных киллеров (NK). Альтернативно, или дополнительно, АЗКЦ активность интересующей молекулы можно оценить in vivo, например, в животной модели, такой как раскрыта в Clyncs et al. PNAS (USA) 95:652-656 (1998).
«Эффекторные клетки человека» представляют собой лейкоциты, которые экспрессируют один или несколько FcR и осуществляют эффекторные функции. В определенных вариантах осуществления клетки экспрессируют по меньшей мере FcγRIII и осуществляют АЗКЦ эффекторную функцию(и). Примеры лейкоцитов человека, которые опосредуют АЗКЦ, включают мононуклеарные клетки периферической крови (МКПК), естественные киллеры (NK), моноциты, цитотоксические T-клетки и нейтрофилы; при этом МКПК и NK клетки, как правило, являются предпочтительными. Эффекторные клетки могут быть выделены из их нативного источника, например, из крови или МКПК, как описано в настоящем документе.
«Рецептор Fc» или «FcR» обозначает рецептор, который связывается с Fc-областью антитела. В некоторых вариантах осуществления FcR представляет собой нативный FcR человека. В некоторых вариантах осуществления FcR представляет собой рецептор, который связывается с антителом IgG (гамма-рецептор), и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и формы этих рецепторов, полученные в результате альтернативного сплайсинга. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые обладают схожими аминокислотными последовательностями, которые отличаются в основном своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит иммунорецепторный тирозиновый активирующий мотив (ITAM) в своем цитоплазматическом домене. Ингибирующий рецептор FcγRIIB содержит иммунорецепторный тирозиновый ингибирующий мотив (ITIM) в своем цитоплазматическом домене, (см., например, Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). Обзор FcR приведен, например, в Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). Другие FcR, включая рецепторы, которые будут идентифицированы в будущем, попадают под значение термина «FcR» в настоящем документе.
Термин «рецептор Fc» или «FcR» также включают неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG в плод (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)) и регулирование гомеостаза иммуноглобулинов. Известны способы измерения связывания с FcRn (см., например, Ghetie and Ward., Immunol. Today 18(12):592-598 (1997); Ghetie et al., Nature Biotechnology, 15(7):637-640 (1997); Hinton et al., J. Biol. Chem. 279(8):6213-6216 (2004); WO 2004/92219 (Hinton et al.).
Можно оценить связывание с FcRn человека in vivo и время полужизни полипептидов с высокой аффинностью связывания с FcRn человека в сыворотке, например, на трансгенных мышах или трансфицированных человеческих клеточных линиях, которые экспрессируют FcRn человека, или на приматах, которым вводили полипептиды с вариантом Fc-области. WO 2000/42072 (Presta) описывает варианты антител с улучшенным или уменьшенным связыванием с FcR. См. также, например, Shields et al. J. Biol. Chem. 9(2):6591-6604 (2001).
«Обусловленная комплементом цитотоксичность» или «КЗЦ» относится к лизису клетки-мишени в присутствии комплемента. Активация классического пути комплемента начинается со связывания первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связаны со своим узнаваемым антигеном. Для оценки активации комплемента можно выполнить, например, тест на КЗЦ, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996). Полипептиды вариантов с измененными аминокислотными последовательностями Fc-области (полипептиды с вариантом Fc-области) и повышенной или пониженной способностью связываться с C1q раскрыты, например, в патенте США № 6194551 B1 и WO 1999/51642. См. также, например, Idusogie et al. J. Immunol. 164:4178-4184 (2000).
«Аффинно зрелое» антитело представляет собой антитело с одним или несколькими изменениями в их одной или нескольких CDR, которые ведут к улучшению аффинности антитела к антигену, по сравнению с родительским антителом, которое не обладает таким изменением(ями). В одном из вариантов осуществления аффинно зрелое антитело обладает наномолярной или даже пикомолярной аффинностью к целевому антигену. Аффинно зрелые антитела изготавливают известными в данной области способами. Marks et al. Bio/Technology 10:779-783 (1992) описывает созревание аффинности посредством шаффлинга доменов VH и VL. Случайный мутагенез CDR и/или каркасные остатки описаны в публикациях: Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); and Hawkins et al, J. Mol. Biol. 226:889-896 (1992).
«Гибкий линкер» в настоящем документе относится к пептиду, который содержит два или более аминокислотных остатка, соединенных пептидной связью(ями), и предоставляет больше ротационной свободы для двух полипептидов (например, двух Fd-областей), соединенных с его помощью. Такая ротационная свобода двух или более антигенсвязывающих участков, к которым присоединен гибкий линкер, предоставляет каждому из них возможность более эффективного доступа к целевому антигену(ам). Примеры пригодных гибких линкерных пептидных последовательностей включают gly-ser, gly-ser-gly-ser (SEQ ID NO:34), ala-ser и gly-gly-gly-ser (SEQ ID NO:35).
«Домен димеризации» образован посредством соединения по меньшей мере двух аминокислотных остатков (как правило, остатков цистеина) или по меньшей мере двух пептидов или полипептидов (которые могут обладать как одинаковыми, так и различающимися аминокислотными последовательностями). Пептиды или полипептиды могут взаимодействовать друг с другом посредством ковалентной и/или нековалентной связи(ей). Примеры доменов димеризации в настоящем документе включают Fc-область; шарнирную область; домен CH3; домен CH4; пару CH1-CL; «интерфейс» сконструированного «выступа» и/или «бугорка», как описано в патенте США № 5821333, явно включенном в настоящий документ в качестве ссылки; лейциновую молнию (например, лейциновая молния jun/fos, см. Kostelney et al., J. Immunol., 148:1547-1553 (1992); или дрожжевую лейциновую молнию GCN4); изолейциновую молнию; рецепторную димерную пару (например, рецептор интерлейкина 8 (ИЛ-8R) и интегриновые гетеродимеры, такие как LFA-I и GPIIIb/IIIa) или их область(и) димеризации; димерные полипептиды-лиганды (например, фактор роста нервов (NGF), нейротрофин-3 (NT-3), интерлейкин 8 (ИЛ-8), фактор роста эндотелия сосудов (VEGF), VEGF-C, VEGF-D, члены PDGF и выделенный из мозга нейротрофический фактор (BDNF); см. Arakawa et al. J Biol. Chem. 269(45):27833-27839 (1994) и Radziejewski et al. Biochem 32(48):1350 (1993)), или их область(и) димеризации; пару остатков цистеина, которая способна образовывать дисульфидную связь; пару пептидов или полипептидов, каждый из которых содержит по меньшей мере один остаток цистеина (например, приблизительно от одного, двух или трех приблизительно до десяти остатков цистеина) так, чтобы между пептидами или полипептидами могла образоваться дисульфидная связь(и) (далее в настоящем документе «синтетическая шарнирная область»); и вариабельные домены антитела. Наиболее предпочтительным доменом димеризации в настоящем документе является Fc-область или шарнирная область.
«Функциональный антигенсвязывающий участок» антитела представляет собой участок, который способен связываться с целевым антигеном. Аффинность связывания антигенсвязывающего участка с антигеном необязательно должна быть такой же высокой, как у родительского антитела, из которого получен антигенсвязывающий участок, но способность связываться с антигеном должна поддаваться измерению с использованием любого одного из многих способов, которые известны для оценки связывания антитела с антигеном. Кроме того, аффинности связывания каждого антигенсвязывающего участка поливалентного антитела с антигеном в настоящем документе не должны быть одинаковыми в количественном отношении. Для мультимерных антител в настоящем документе количество функциональных антигенсвязывающих участков может быть оценено с использованием анализа с ультрацентрифугой. В соответствии с этим способом анализа комбинируют различные соотношения целевого антигена и мультимерного антитела и вычисляют среднюю молекулярную массу комплексов, предполагая различные количества функциональных связывающих сайтов. Эти теоретические величины сравнивают с фактически полученными экспериментальными величинами для того, чтобы оценить количество функциональных связывающих сайтов.
Антитело, обладающее «биологическим признаком» обозначенного антитела, представляет собой антитело, которое обладает одним или несколькими биологическими характеристиками этого антитела, которые отличают его от других антител, которые связываются с тем же антигеном.
В целях скрининга антител, которые связываются с эпитопом на антигене, с которым связывается интересующее антитело, можно провести стандартный тест на перекрестную блокировку, такой как описано в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988).
Термин «эпитоп» используют для обозначения на белковых антигенах сайтов связывания с (моноклональными или поликлональными) антителами.
Под «антителом-антагонистом Bv8» понимают антитело, которое является антагонистом Bv8, как определено выше в настоящем документе, и таким образом частично или полностью блокирует, ингибирует или нейтрализует способность Bv8 модулировать миелоидную мобилизацию и/или способствовать ангиогенезу в процессе развития опухоли.
Термин «иммуноадгезин Bv8» используется взаимозаменяемо с термином «химера Bv8-иммуноглобулин» и относится к химерной молекуле, в которой соединены по меньшей мере часть молекулы Bv8 (нативная или вариант) и последовательность иммуноглобулина. Последовательность иммуноглобулина предпочтительно, но необязательно, представляет собой константный домен иммуноглобулина. Иммуноадгезины могут обладать многими важными химическими и биологическими свойствами антитела человека. Поскольку иммуноадгезины могут быть сконструированы из последовательности белка человека с желаемой специфичностью, которая соединена с соответствующей шарнирной областью иммуноглобулина человека и последовательностью константного домена (Fc), интересующая специфичность связывания может быть получена с использованием исключительно человеческих компонентов. Такие иммуноадгезины являются минимально иммуногенными для пациента и безопасны для хронического или повторного использования.
Примеры гомомультимерных иммуноадгезинов, которые были описаны для терапевтического использования, включают CD4-IgG иммуноадгезин для блокирования связывания ВИЧ с CD4 на клеточной поверхности. Данные, полученные в I фазе клинических исследований, в которой CD4-IgG вводили беременным женщинам непосредственно перед доставкой, указывает на то, что иммуноадгезин может быть эффективен при предупреждении переноса ВИЧ от матери к плоду (Ashkenazi et al., Intern. Rev. Immunol. 10:219-227 (1993)). Также был разработан иммуноадгезин, который связывается с фактором некроза опухоли (TNF). TNF является провоспалительным цитокином, для которого было показано, что он является основным медиатором септического шока. Основываясь на модели септического шока на мышах, было показано, что иммуноадгезин рецептора THF является перспективным кандидатом для клинического применения при лечении септического шока (Ashkenazi, A. et al. (1991) PNAS USA 88:10535-10539). Энбрел® (этанерсепт), иммуноадгезин, который содержит последовательность рецептора TNF, которая слита с Fc-областью IgG, был одобрен Управлением по продовольствию и лекарствам США (FDA) 2 ноября 1998 года для лечения ревматоидного артрита. Новое расширенное применение Энбрела® при лечении ревматоидного артрита было одобрено FDA 6 июня 2000 года. Актуальные сведения о блокаторах TNF, включая Энбрел®, см. в Lovell et al., N. Engl. J Med. 342:763-169 (2000), и сопроводительной редакционной статье на стр.810-811; и Weinblatt et al., N. Engl. J. Med. 340:253-259 (1999); рассмотрено в Maini and Taylor, Annu. Rev. Med. 51:207-229 (2000).
Если два плеча иммуноадгезиновой структуры обладают различными специфичностями, иммуноадгезин называют «биспецифическим иммуноадгезином» по аналогии с биспецифическими антителами. Dietsch et al., J. Immunol. Methods 162:123 (1993) описывают такой биспецифический иммуноадгезин, объединяющий внеклеточные домены адгезионных молекул, E-селектина и P-селектина, каждый из которых в природе экспрессируется различными типами клеток. Исследования связывания указывают на то, что созданный таким образом слитный белок биспецифического иммуноглобулина обладает увеличенной способностью к связыванию с миелоидной клеточной линией по сравнению с моноспецифическими иммуноадгезинами, из которых он был получен.
Термин «гетероадгезин» используют взаимозаменяемо с выражением «химерный гетеромультимерный адгезин» и относится к сложным химерным молекулам (аминокислотные последовательности), в которых каждая химерная молекула сочетает биологически активную часть, такую как внеклеточный домен каждого из мономеров гетеромультимерного рецептора, с доменом мультимеризации. «Домен мультимеризации» способствует стабильному взаимодействию химерных молекул в гетеромультимерном комплексе. Домены мультимеризации могут взаимодействовать через последовательность иммуноглобулина, лейциновую молнию, гидрофобную область, гидрофильную область, или три тиола, которые образуют межмолекулярную дисульфидную связь между химерными молекулами химерного гетеромультимера. Домен мультимеризации может содержать константную область иммуноглобулина. Кроме того, область мультимеризации может быть сконструирована так, чтобы стерические взаимодействия не только способствовали стабильному взаимодействию, то также способствовали преобладанию образования гетеродимеров над образованием гомодимеров из смеси мономеров. «Выступы» конструируют посредством замещения аминокислоты с маленькой боковой цепью в области контакта первого полипептида на аминокислоту с большой боковой цепью (например, тирозин или триптофан). Компенсаторные «полости» идентичного или схожего с выступами размера необязательно создают в области контакта второго полипептида посредством замещения аминокислоты с большой боковой цепью на аминокислоту с меньшей цепью (например, аланин или треонин). Последовательность иммуноглобулин предпочтительно, но необязательно, представляет собой константный домен иммуноглобулина. Фрагмент иммуноглобулина в химерах по настоящему изобретению может быть получен из субтипов IgG1, IgG2, IgG3 или IgG4, IgA, IgE, IgD или IgM, но предпочтительно из IgG1 или IgG3.
Как применяют в настоящем документе, «лечение» является подходом для достижения благоприятных или желаемых клинических результатов. Для целей данного изобретения благоприятные или желаемые клинические результаты включают в качестве неограничивающих примеров облегчение симптомов, уменьшение тяжести заболевания, стабилизацию (т.е. неухудшение) болезненного состояния, задержку или замедление развития заболевания, уменьшение интенсивности или облегчение болезненного состояния и ремиссию (как частичную, так и полную), как обнаружимую, так и необнаружимую. «Лечение» также может обозначать увеличение продолжительности жизни по сравнению с ожидаемой продолжительностью жизни при отсутствии лечения. «Лечение» представляет собой вмешательство, выполняемое с намерением предупредить развитие или изменение патологии заболевания. Таким образом, «лечение» относится как к терапевтическому лечению, так и к профилактическим или предупредительным мерам. Нуждающиеся в лечении включают тех, кто уже болен, а также тех, у кого следует предупредить заболевание. В частности, лечение может непосредственно предупреждать, замедлять или иным образом снижать патологическую клеточную дегенерацию или повреждение, такую как патологическое воздействие заболевания или состояний, связанных с мобилизацией миелоидных клеток и/или с опухолевым ангиогенезом.
Термин «эффективное количество» или «терапевтически эффективное количество» относится к количеству лекарственного средства, которое эффективно для лечения заболевания или расстройства у млекопитающего. В случае рака эффективное количество лекарственного средства может снижать количество злокачественных клеток; уменьшать размер опухоли; ингибировать (т.е. замедлять до некоторой степени и типично останавливать) инфильтрацию периферических органов злокачественными клетками; ингибировать (т.е. замедлять до некоторой степени и типично останавливать) метастазирование опухоли; ингибировать, до некоторой степени, рост опухоли; делать возможным лечение опухоли с устойчивостью, и/или облегчать до некоторой степени один или несколько симптомов, связанных с заболеванием. В тех случаях, когда лекарственное средство может предотвращать рост и/или убивать существующие злокачественные клетки, оно может быть цитостатическим и/или цитотоксическим. Для лечения рака эффективность in vivo может быть измерена, например, посредством оценки длительности жизни, времени прогрессирования заболевания (ВПЗ), уровней ответа (УО), длительности ответа и/или качества жизни.
«Хроническое» введение относится к введению средства(в) в непрерывном режиме в противоположность срочному режиму с тем, чтобы поддерживать начальный терапевтический эффект (активность) в течение увеличенного периода времени. «Прерывающееся» введение представляет собой лечение, которое выполняют не непрерывно без перерывов, а циклически.
«Млекопитающее» для целей лечения относится к любому животному, которое классифицировано как млекопитающее, включая людей, других высших приматов, домашних и сельскохозяйственных животных и животных в зоопарке, спортивных или ручных животных, таких как мыши, крысы, собаки, кошки, крупный рогатый скот, лошади, овцы, свиньи, козы, кролики и т.д. Предпочтительно млекопитающим является человек.
«Опухоль», как применяют в настоящем документе, относится к любому неопластическому росту и пролиферации клеток, или злокачественных или доброкачественных, и всем предраковым и злокачественным клеткам и тканям.
Термины «рак» и «раковый» указывают или описывают физиологическое состояние у млекопитающих, которое типично отличается нерегулируемым клеточным ростом. Примеры рака включают в качестве неограничивающих примеров карциному, лимфому, бластому, саркому, и лейкемию или лимфолейкоз. Более конкретные примеры таких раков включают рак почки или ренальный рак, рак молочной железы, рак толстого кишечника, рак прямой кишки, колоректальный рак, рак легких, включая мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и плоскоклеточную карциному легких, плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак шейки матки, рак яичников, рак предстательной железы, рак печени, рак мочевого пузыря, рак брюшной полости, гепатоцеллюлярную карциному, рак желудка, включая гастроинтестинальный рак, гастроинтестинальные стромальные опухоли (GIST), рак поджелудочной железы, рак головы и шеи, глиобластому, ретинобластому, астроцитому, текому, арренобластомы, гепатому, гематологические злокачественные опухоли, включая неходжкинскую лимфому (NHL), множественную миелому и острые гематологические злокачественные опухоли, эндометриальную или маточную карциному, эндометриоз, фибросаркомы, хориокарциному, карциному слюнной железы, рак женских наружных половых органов, рак щитовидной железы, карциномы пищевода, печеночную карциному, анальную карциному, карциному пениса, назофарингеальную карциному, ларингеальные карциномы, саркому Капоши, меланому, карциномы кожи, шванному, олигодендроглиому, нейробластомы, рабдомиосаркому, остеогенную саркому, лейомиосаркомы, карциномы мочевыводящих путей, щитовидные карциномы, эмбриональную нефрому, а также B-клеточную лимфому (включая фолликулярную неходжкинскую лимфому (NHL)/лимфому низкой степени злокачественности; мелкоклеточую неходжкинскую лимфому; фолликулярную неходжкинскую лимфому/лимфому средней степени злокачественности; диффузную NHL средней степени злокачественности; иммунобластную NHL высокой степени злокачественности; лимфобластную NHL высокой степени злокачественности; мелкоклеточную нерасщепленную NHL высокой степени злокачественности; NHL с массивным поражением; лимфому клеток мантии; СПИД-ассоциированную лимфому; и макроглобулинемию Вальденстрема); хроническую лимфоцитарную лейкемию (ХЛЛ); острую лимфобластическую лейкемию (АЛЛ); волосатоклеточную лейкемию; хроническую миелобластную лейкемию; и посттрансплантационное лимфопролиферативное заболевание (PTLD), а также аномальную пролиферацию сосудов, связанную с факоматозом, эдемой (например, эдемой, которая связана с опухолями мозга), и синдром Мейгса. «Опухоль», как применяют в настоящем документе, относится к любому неопластическому росту и пролиферации клеток, как злокачественных, так и доброкачественных, и всем предраковым и злокачественным клеткам и тканям.
Термин «опухоль с устойчивостью» относится к раку, злокачественным клеткам или к опухоли, которые не отвечают полностью, или утрачивают или проявляют сниженный ответ в течение курса противораковой терапии на противораковую терапию, которая содержит по меньшей мере антагонист VEGF. Опухоль с устойчивостью также относится к опухоли, которая диагностирована как устойчивая в настоящем документе (также в настоящем документе обозначается как «опухоль с устойчивостью к антителам против VEGF»). В определенных вариантах осуществления имеет место увеличение клеток CD11b+Gr1+ в опухоли с устойчивостью по сравнению с опухолью, которая чувствительна к лечению, которое включает по меньшей мере антагонист VEGF.
Термин «антинеопластическая композиция» относится к композиции, которую можно использовать при лечении рака, которая содержит по меньшей мере одно активное терапевтическое средство, например, «противораковое средство». Примеры терапевтических средств (противораковых средств) включают, но без ограничений, например, химиотерапевтические средства, ингибирующие рост средства, цитотоксические средства, средства, которые используют при лучевой терапии, средства против ангиогенеза, апоптотические средства, антитубулиновые средства, токсины и другие средства для лечения рака, например, нейтрализующее антитело против VEGF, антагонист VEGF, АТ против HER-2, АТ против CD20, антагонист рецептора эпидермального фактора роста (EGFR) (например, ингибитор тирозинкиназы), ингибитор HER1/EGFR, эрлотиниб, ингибитор ЦОГ-2 (например, целекоксиб), интерфероны, цитокины, антагонисты (например, нейтрализующие антитела), которые связываются с одним или несколькими из рецепторов ErbB2, ErbB3, ErbB4 или VEGF, ингибиторы рецепторных тирозинкиназ для тромбоцитарного фактора роста (PDGF) и/или фактора стволовых клеток (SCF) (например, иматиниба мезилат (Гливек® Novartis)), TRAIL/Apo2, и другие биологически активные и органические химические средства и т.д. Их сочетания также включены в изобретение.
Термин «цитотоксическое средство», как применяют в настоящем документе, относится к субстанции, которая ингибирует или предотвращает функцию клеток и/или вызывает разрушение клеток. Термин включает радиоактивные изотопы (например,211At,131I,125I,90Y,186Re,188Re,153Sm,212Bi,32P и радиоактивные изотопы Lu), химиотерапевтические средства и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты.
«Ингибирующее рост средство» при использовании в настоящем документе относится к соединению или композиции, которая ингибирует рост клеток in vitro и/или in vivo. Таким образом, ингибирующее рост средство может представлять собой средство, которое значительно снижает долю клеток в S-фазе. Примеры ингибирующих рост средств включают средства, которые блокируют прохождение клеточного цикла (на стадии, отличающейся от S фазы), такие как средства, которые вызывают задержку в G1 и задержку в М-фазе. Классические блокаторы М-фазы включают препараты из барвинка (винкристин и винбластин), ТАКСОЛ®, и ингибиторы topo II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Эти средства, задерживающие G1, также побочно задерживают S-фазу, например, ДНК алкилирующие средства, такие как тамоксифен, преднизон, дакарбазин, мехлоретамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, entitled «Cell cycle regulation, oncogenes, and antineoplastic drugs» by Murakami et al. (WB Saunders: Philadelphia, 1995), в частности стр.13.
«Химиотерапевтическое средство» представляет собой химическое соединение, которое можно использовать при лечении рака. Примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и ЦИТОКСАН© циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентрифосфорамид и триметилоломеламин; ацетогенины (в частности, буллатацин и буллатацинон); дельта-9-тетрагидроканнабиол (дронабинол, МАРИНОЛ®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (ГИКАМТИН®), CPT-11 (иринотекан, КАМПТОСАР®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его адозелезиновые, карзелезиновые и бизелезиновые синтетические аналоги); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицин (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CB1-TM1); элейтеробин; панкратистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, мехлоретаминоксид гидрохлорид, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урацилиприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности калихеамицин гаммаII и калихеамицин омегаII (см., например, Agnew, Chem Intl. Ed. Engl, 33:183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также неокарциностатиновый хромофор и родственные хромопротеиновые энедииновые хромофорные антибиотики), алкациномизины, актиномицин, аутрамицин, азасерин, блеомицины, актиномицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая АДРИАМИЦИН®, морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин, липосомную инъекцию доксорубицина HCl (ДОКСИЛ®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, келамицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (ГЕМЗАР®), тегафур (УФТОРАЛ®), капецитабин (КСЕЛОДА®), эпотилон и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; антиадренергические препараты, такие как аминоглутетимид, митотан, трилостан; подкрепитель фолиевой кислоты, например, фролиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиниум ацетат; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2”-трихлортриэтиламин; трихотецены (в частности T-2 токсин, верракурин A, роридин A и ангуидин); уретан; виндезин (ЭЛДИЗИН®, ФИЛДЕЗИН®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); тиотепа; таксоиды, например, паклитаксел (ТАКСОЛ®), состав с наночастицами, сконструированными из альбумина паклитаксел (АБРАКСАНТМ), и доксетаксел (ТАКСОТЕР®); хлоранбуцил; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (ВЕЛБАН®); платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ОНКОВИН®); оксалиплатин; лейкововин; винорелбин (НАВЕЛЬБИН®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметиломитин (DMFO); ретиноиды, такие как ретиноевая кислота; фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленных средств; а также сочетания двух или более вышеперечисленных средств, такие как CHOP, сокращение для комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, сокращение для схемы лечения оксалиплатином (ЭЛОКСАТИН™) в сочетании с 5-FU и лейкововином.
Также в это определение включены противогормональные средства, которые регулируют, снижают, блокируют или ингибируют действие гормонов, которое может способствовать росту рака, и часто встречаются в форме системного лечения. Сами они могут являться гормонами. Примеры включают антиэстрогены и селективные модуляторы рецептора эстрогена (SERM), включая, например, тамоксифен (включая НОЛВАДЕКС® тамоксифен), ралоксифен (ЭВИСТА®), дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (ФАРЕСТОН®); антипрогестероны; понижающие регуляторы рецептора эстрогена (ERD); средства, которые подавляют или выключают яичники, например, агонист лютеинизирующего релизинг-гормона (LHRH), такой как лейпролида ацетат (ЛУПРОН® и ЭЛИГАРД®), гозерелина ацетат, бусерелина ацетат и триптерилин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует образование эстрогена в надпочечниках, например, такие как 4(5)-имидазолы, аминоглютетимид, мегестрола ацетат (МЕГАЗА®), экземестан (АРОМАЗИН®), форместани, фадрозол, ворозол (РИВИЗОР®), летрозол (ФЕМАРА®) и анастрозол (АРИМИДЕКС®). Кроме того, такое определение химиотерапевтических средств включает бисфосфонаты, такие как клодронат (например, БОНЕФОС® или ОСТАК®), этидронат (ДИДРОКАЛ®), NE-58095, золедроновую кислоту/золедронат (ЗОМЕТА®), алендронат (ФОСАМАКС®), памидронат (АРЕДИЯ®), тилудронат (СКЕЛИД®) или ризедронат (АКТОНЕЛ®); а также троксацитабин (1,3-диоксолановый аналог нуклеозида цитозина); антисмысловые олигонуклеотиды, в частности, антисмысловые олигонуклеотиды, которые ингибируют экспрессию генов в пути передачи сигнала, участвующем в аберрантной клеточной пролиферации, такие как, например, PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина ТЕРАТОП® и генотерапевтические вакцины, например, вакцина АЛЛОВЕКТИН®, вакцина ЛЕЙВЕКТИН® и вакцина ВАКСИД®; ингибитор топоизомеразы 1 (например, ЛУРТОТЕКАН®); rmRH (например, АБАРЕЛИКС®); лапатиниб дитозилат (двойной низкомолекулярный ингибитор тирозинкиназы ErbB-2 и EGFR, также известный как GW572016); ингибиторы ЦОГ-2, такие как целекоксиб (ЦЕЛЕБРЕКС®; 4-(5-(4-метилфенил)-3-(трифторметил)-1H-пиразол-1-ил)бензолсульфонамид; и фармацевтически приемлемой соли, кислоты или производные любого из перечисленных выше средств.
Термин «цитокин» является общим термином для белков, которые высвобождаются одной клеточной популяцией, которые действуют на другие клетки в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. Цитокины включают гормоны роста, такие как гормон роста человека, N-метионил гормон роста человека и бычий гормон роста; гормон околощитовидной железы; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (ФСГ), тиреотропный гормон (ТТГ) и лютеинизирующий гормон (ЛГ); печеночный фактор роста; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухоли-альфа и -бета; мюллерова ингибирующая субстанция; мышиный гонадотропин-ассоциированный пептид; ингибин; активин; факторы роста эндотелия сосудов (например, VEGF, VEGF-B, VEGF-C, VEGF-D, VEGF-E); плацентарный фактор роста (PIGF); тромбоцитарные факторы роста (PDGF, например, PDGFA, PDGFB, PDGFC, PDGFD); интегрин; тромбопоэтин (TPO); факторы роста нервов, такие как NGF-альфа; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-альфа и TGF-бета; инсулиноподобный фактор роста-I и -II; эритропоэтин (EPO); остеоиндуктивные факторы; интерфероны, такие как интерферон-альфа, -бета и -гамма, колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагальный CSF (GM-CSF); и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как ИЛ-1, ИЛ-1 альфа, ИЛ-1 бета, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-8, ИЛ-9, ИЛ-10, ИЛ-11, ИЛ-12, ИЛ-13, ИЛ-14, ИЛ-15, ИЛ-16, ИЛ-17, ИЛ-18, ИЛ-19, ИЛ-20-ИЛ-30; секретоглобин/утероглобин; онкостатин М (OSM); фактор некроза опухоли, такой как TNF-альфа или TNF-бета; и другие полипептидные факторы, включая LIF и лиганд kit (KL). Как применяют в настоящем документе, термин цитокин включает белки из естественных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты цитокинов с нативными последовательностями.
Термин «пролекарство», как применяется в этой заявке, относится к предшественнику или производной форме фармацевтически активной субстанции, которая менее цитотоксична для опухолевых клеток по сравнению с родительским лекарственным средством и допускает ферментативную активацию или превращение в более активную родительскую форму. См., например, Wilman, «Prodrugs in Cancer Chemotherapy» Biochemical Society Transactions, 14, стр.375-382, 615th Meeting Belfast (1986) и Stella et al, «Prodrugs: A Chemical Approach to Targeted Drug Delivery», Directed Drug Delivery, Borchardt et al., (ed.), стр.247-267, Humana Press (1985). Пролекарства по данному изобретению включают в качестве неограничивающих примеров, фосфат-содержащие пролекарства, тиофосфат-содержащие пролекарства, сульфат-содержащие пролекарства, пептид-содержащие пролекарства, пролекарства с модифицированными D-аминокислотами, гликозилированные пролекарства, бета-лактам-содержащие пролекарства, необязательно замещенные феноксиацетамид-содержащие пролекарства или необязательно замещенные фенилацетамид-содержащие пролекарства, 5-фторцитозин и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активное цитотоксическое свободное лекарственное средство. Примеры цитотоксических лекарственных средств, из которых могут быть получены пролекарства, которые образованы для использования в этом изобретении, включают в качестве неограничивающих примеров описанные выше химиотерапевтические средства.
«Ангиогенный фактор или средство» представляет собой фактор роста, который стимулирует развитие кровеносных сосудов, например, способствует ангиогенезу, росту клеток эндотелия, стабильности кровеносных сосудов и/или васкулогенезу и т.д. Например, ангиогенные факторы включают в качестве неограничивающих примеров, например, VEGF и члены семейства VEGF, PIGF, семейство PDGF, семейство факторов роста фибробластов (FGF), лиганды TIE (ангиопоэтины), эфрины, ANGPTL3, ANGPTL4 и т.д. Также они будут включать факторы, которые ускоряют заживление ран, такие как гормон роста, инсулиноподобный фактор роста-I (IGF-I), VIGF, эпидермальный фактор роста (EGF), CTGF и члены его семейства и TGF-α и TGF-β. См., например, Klagsbrun and D'Amore, Annu. Rev. Physiol., 53:217-39 (1991); Streit and Detmar, Oncogene, 22:3172-3179 (2003); Ferrara & Alitalo, Nature Medicine 5(12):1359-1364 (1999); Tonini et al., Oncogene, 22:6549-6556 (2003) (например, в таблице 1 перечислены ангиогенные факторы); и Sato Int. J. Clin. Oncol., 8:200-206 (2003).
«Средство против ангиогенеза» или «ингибитор ангиогенеза» относится к низкомолекулярной субстанции, полинуклеотиду, полипептиду, выделенному белку, рекомбинантному белку, антителу или их конъюгатам или слитным белкам, которые ингибируют ангиогенез, васкулогенез или нежелательную проницаемость сосудов, или напрямую или опосредованно. Например, средство против ангиогенеза представляет собой антитело или другой антагонист ангиогенного средства, как определено выше, например, антитела к VEGF, антитела к рецепторам VEGF, низкомолекулярные соединения, которые блокируют передачу сигнала от рецептора VEGF (например, PTK787/ZK2284, SU6668, SUTENT/SU11248 (сунитиниб малат), AMG706). Антиангиогенные средства также включают нативные ингибиторы ангиогенеза, например, ангиостатин, эндостатин и т.д. См., например, Klagsbrun and D'Amore, Annu. Rev. Physiol, 53:217-39 (1991); Streit and Detmar, Oncogene, 22:3172-3179 (2003) (например, в таблице 3 перечислены антиангиогенные терапевтические средства при злокачественной меланоме); Ferrara & Alitalo, Nature Medicine 5(12):1359-1364 (1999); Tonini et al., Oncogene, 22:6549-6556 (2003) (например, в таблице 2 перечислены антиангиогенные факторы); и Sato Int. J. Clin. Oncol. 8:200-206 (2003) (например, в таблице 1 перечислены антиангиогенные средства, использовавшиеся в клинических испытаниях).
Термин «иммуносупрессирующее средство», как применяют в настоящем документе, относится к субстанциям, которые подавляют или скрывают иммунную систему млекопитающего, которое подлежит лечению в настоящем документе. Он будет включать субстанции, которые подавляют образование цитокинов, даунрегулируют или подавляют экспрессию аутоантигена или скрывают антигены MHC. Примеры таких средств включают 2-амино-6-арил-5-замещенные пиримидины (см. патент США № 4665077); нестероидные противовоспалительные лекарственные средства (НПВС); ганцикловир, такролимус, глюкокортикоиды, такие как кортизол или альдостерон, противовоспалительные средства, такие как ингибиторы циклооксигеназы, ингибиторы 5-липоксигеназы или антагонист рецептора лейкотриенов; антагонисты пуринов, такие как азатиоприн или микофенолат мофетил (MMF); алкилирующие средства, такие как циклофосфамид; бромокриптин; даназол; дапсон; глутаральдегид (который скрывает MHC антигены, как описано в патенте США № 4120649); антиидиотипические антитела для MHC антигенов и MHC фрагментов; циклоспорин A; стероиды, такие как кортикостероиды или глюкокортикостероиды или аналоги глюкокортикоидов, например, преднизон, метилпреднизолон и дексаметазон; ингибиторы дигидрофолатредуктазы, такие как метотрексат (перорально или подкожно); гидроксиклорохин; сульфасалазин; лефлуномид; цитокин или антитела к рецепторам цитокинов, включая антитела против интерферона альфа, бета или гамма, антитела против фактора некроза опухоли-альфа (инфликсимаб или адалимумаб), иммуноадгезин против TNF-альфа (этанерсепт), антитела против фактора некроза опухоли-бета, антитела против интерлейкина-2 и антитела против рецептора ИЛ-2; антитела против LFA-1, включая антитела против CD11a и против CD18; антитела против L3T4; гетерологичный антилимфоцитарный иммуноглобулин; антитела pan-T, предпочтительно антитела против CD3 или против CD4/CD4a: растворимый пептид, содержащий домен связывания с LFA-3 (WO 1990/08187, опубликовано 26 июля 1990); стрептокиназу; TGF-бета; стрептодорназу; РНК или ДНК хозяйского организма; FK506; RS-61443; дезоксиспергуалин; рапамицин; T-клеточный рецептор (Cohen et al., патент США № 5114721); фрагменты T-клеточного рецептора (Offner et al., Science, 251:430-432 (1991); WO 1990/11294; Ianeway, Nature, 341:482 (1989); и WO 1991/01 133); и антитела T-клеточного-рецептора (EP 340109), такие как T10B9.
Примерами «нестероидных противовоспалительных лекарственных средств» или «НПВС» являются ацетилсалициловая кислота, ибупрофен, напроксен, индометацин, сулиндак, толметин, включая их соли и производные и т.д.
«Патология» заболевания включает все феномены, которые подвергают опасности здоровье пациента. Для рака она включает, без ограничения, ненормальный или неконтролируемый клеточный рост, метастазирование, помеха нормальному функционированию соседних клеток, высвобождение цитокинов или других секретируемых продуктов в ненормальных количествах, подавление или ухудшение воспалительного или иммунологического ответа и т.д.
Введение «в сочетании с» одним или несколькими дополнительными терапевтическими средствами включает одновременное (совместное) и последовательное введение в любом порядке.
«Носители», как применяют в настоящем документе, включают фармацевтически приемлемые носители, эксципиенты или стабилизаторы, которые нетоксичны для клеток или млекопитающего, подвергаемых их воздействию при используемых дозах и концентрациях. Часто физиологически приемлемый носитель представляет собой водный pH буферный раствор. Примеры физиологически приемлемых носителей включают буферы, такие как фосфорную, лимонную и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярный (приблизительно менее чем 10 остатков) полипептид; белки, например, сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие средства, такие как ЭДТА; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионные поверхностно-активные вещества, такие как TWEEN™, полиэтиленгликоль (ПЭГ) и PLURONICS™.
«Липосома» представляет собой маленькую везикулу, которая состоит из различных типов липидов, фосфолипидов и/или поверхностно-активных веществ, которые могут использоваться для доставки лекарственного средства (такого как полипептид Bv8 или антитело к нему) млекопитающему. Компоненты липосомы обычно собраны в двухслойную структуру, похожую на липидную структуру биологических мембран.
«Низкомолекулярное соединение» в настоящем документе определено как обладающее молекулярной массой ниже приблизительно 500 Да.
«Изменение аминокислоты» относится к изменению в аминокислотной последовательности предварительно определенной аминокислотной последовательности. Образцовые изменения включают инсерции, замены и делеции. «Замена аминокислоты» относится к замещению существующего аминокислотного остатка в предварительно определенной аминокислотной последовательности на другой отличающийся аминокислотный остаток.
«Замещающий» аминокислотный остаток относится к аминокислотному остатку, который замещает или заменяет другой аминокислотный остаток в аминокислотной последовательности. Замещающий остаток может быть встречающимся в природе или не встречающимся в природе аминокислотным остатком.
«Аминокислотная инсерция» относится к введению одного или нескольких аминокислотных остатков в предварительно определенную аминокислотную последовательность. Аминокислотная инсерция может содержать «пептидную инсерцию», в случае чего пептид, который содержит два или более аминокислотных остатка, который соединен посредством пептидной связи(ей), введен в предварительно определенную аминокислотную последовательность. Когда аминокислотная инсерция касается инсерции пептида, вставляемый пептид может быть создан с помощью случайного мутагенеза так, чтобы он обладал аминокислотной последовательностью, которая не существует в природе. Изменение аминокислоты, «смежное с гипервариабельной областью», относится к введению или замене одного или нескольких аминокислотных остатков на N-конце и/или C-конце гипервариабельной области так, чтобы по меньшей мере один из встроенных или замещенных аминокислотных остатков образовывал пептидную связь с N-концевым или C-концевым аминокислотным остатком рассматриваемой гипервариабельной области.
«Встречающийся в природе аминокислотный остаток» представляет собой остаток, кодируемый генетическим кодом, который, как правило, выбран из группы, состоящей из: аланина (Ala); аргинина (Arg); аспарагина (Asn); аспарагиновой кислоты (Asp); цистеина (Cys); глутамина (Gln); глутаминовой кислоты (Glu); глицина (Gly); гистидина (His); изолейцина (Ile): лейцина (Leu); лизина (Lys); метионина (Met); фенилаланина (Phe); пролина (Pro); серина (Ser); треонина (Thr); триптофана (Trp); тирозина (Tyr) и валина (Val).
«Не встречающийся в природе аминокислотный остаток» в настоящем документе представляет собой аминокислотный остаток, отличающийся от встречающихся в природе аминокислотных остатков, перечисленных выше, которые способны ковалентно связываться со смежными аминокислотными остатками в полипептидную цепь. Примеры не встречающихся в природе аминокислотных остатков включают норлейцин, орнитин, норвалин, гомосерин и другие аналоги аминокислотных остатков, такие как те, что описаны в Ellman et al. Meth. Enzym. 202:301-336 (1991). Для создания таких не встречающихся в природе аминокислотных остатков можно использовать процедуру по Noren et al. Science 244: 182 (1989) и Ellman et al., выше. В кратком изложении, эти процедуры используют химическую активацию супрессорной тРНК с не встречающимся в природе аминокислотным остатком с последующей транскрипцией и трансляцией РНК in vitro.
Как применяют в настоящем документе, антитело с «высокой аффинностью» представляет собой антитело, которое обладает KD, или константой диссоциации, в наномолярном (нМ) диапазоне или даже лучше. KD в «наномолярном диапазоне или даже лучше» можно обозначить как X нМ, где X представляет собой число приблизительно менее чем 10.
Термин «нитевидный фаг» относится к вирусной частице, которая способна представлять гетерогенный полипептид на своей поверхности, и включает без ограничения fl, fd, Pfl и M13. Нитевидный фаг может содержать селективный маркер, такой как тетрациклин (например, «fd-tet»). Различные системы нитевидного фагового дисплея хорошо известны специалистам в данной области (см., например, Zacher et al. Gene 9:127-140 (1980), Smith et al. Science 228:1315-1317 (1985); и Parmley and Smith Gene 73:305-318 (1988)).
Термин «пэннинг» используется для обозначения нескольких циклов процесса скрининга при идентификации и выделении фагов, несущих соединения, такие как антитела, с высокой аффинностью и специфичностью к мишени.
Термин «малая интерферирующая РНК (миРНК)» относится к малым двухцепочечным РНК, которые вмешиваются в экспрессию генов. миРНК представляют собой посредник интерференции РНК, процесса выключения гомологичных генов с помощью двухцепочечной РНК. миРНК типично состоит из двух одноцепочечных РНК длиной приблизительно 15-25 нуклеотидов, которые образуют дуплекс, который может содержать одноцепочечный выступ(ы). Процессинг двухцепочечной РНК ферментативным комплексом, например, полимеразами, приводит к расщеплению двухцепочечной РНК с образованием миРНК. Антисмысловая цепь миРНК используется РНК интерферирующим (RNAi) сайленсинг-комплексом для того, чтобы направлять расщепление мРНК, таким образом, способствуя деградации мРНК. Для выключения определенного гена с использованием миРНК, например, в клетке млекопитающего, область спаривания оснований выбирают так, чтобы избежать возможной комплементарности с посторонней мРНК. В данной области были идентифицированы RNAi сайленсинг-комплексы, например, такие как описаны в Fire et al., Nature 391:806-811 (1998) и McManus et al., Nat. Rev. Genet. 3(10):737-47 (2002).
Термин «интерферирующая РНК (RNAi)» применяют в настоящем документе для обозначения двухцепочечной РНК, которая приводит к каталитическому расщеплению определенной мРНК и которую таким образом можно использовать для подавления/снижения экспрессии конкретного гена.
«Эффективное количество» представляет собой количество, которое достаточно для того, чтобы вызвать благоприятные или желаемые терапевтические (включая превентивные) результаты. Эффективное количество можно вводить за одно или несколько введений.
Как применяют в настоящем документе, выражения «клетка», «клеточная линия» и «клеточная культура» используют взаимозаменяемо и все эти обозначения включают потомство. Таким образом, слова «трансформанты» и «трансформированные клетки» включают изначально использованную клетку и культуры, полученные из нее независимо от количества переносов. Также следует понимать, что все потомство может не быть точно идентичным по содержащейся ДНК, из-за преднамеренных или случайных мутаций. Термин «потомство» относится к любым и всем дочерним клеткам каждого поколения, следующим за исходно трансформированной клеткой или клеточной линией. Включено мутантное потомство, которое обладает той же функцией или биологической активностью, которые наблюдались у исходно трансформированной клетки. Когда будут подразумеваться отдельные обозначения, это будет ясно из контекста.
«Строгость» реакций гибридизации легко определяется специалистом в данной области и, как правило, представляет собой эмпирическое вычисление в зависимости от длины зонда, температуры отмывки и концентрации соли. В основном более длинные зонды требуют более высоких температур для должного отжига, тогда как более короткие зонды требуют более низких температур. Как правило, гибридизация зависит от способности денатурированной ДНК к повторному отжигу, когда комплементарные цепочки присутствуют в условиях ниже их температуры плавления. Чем выше степень желаемой идентичности между зондом и гибридизуемой последовательностью, тем выше относительная температура, которую можно использовать. В результате это будет приводить к тому, что относительные температуры будут делать условия реакции более строгими, тогда как более низкие температуры будут вести к менее строгим условиям. Дополнительные подробности и объяснение относительно строгости реакции гибридизации см. в Ausubel et al., Current Protocols in Molecular Biology, Wiley Interscience Publishers (1995).
«Условия с высокой строгостью», как определено в настоящем документе, определяются следующим: (1) использование низкой ионной силы и высокой температуры при отмывке; 0,015 М хлорид натрия/0,0015 М цитрат натрия/0,1% додецилсульфат натрия при 50°C; (2) использование денатурирующего средства в процессе гибридизации; 50% (об./об.) формамид с 0,1% бычьего сывороточного альбумина/0,1% фиколла/0,1% поливинилпирролидона/50 мМ натрий-фосфатный буфер при pH 6,5 с 750 мМ хлоридом натрия, 75 мМ цитратом натрия при 42°C; или (3) использование 50% формамида, 5×SSC (0,75 М NaCl, 0,075 М цитрат натрия), 50 мМ фосфата натрия (pH 6,8), 0,1% пирофосфата натрия, 5x раствор Денхардта, сонифицированная ДНК спермы лосося (50 мкг/мл), 0,1% SDS, и 10% декстран сульфата при 42°C, и отмывка при 42°C в 0,2×SSC (хлорид натрия/цитрат натрия) и 50% формамиде при 55°C, с последующей отмывкой в очень строгих условиях, которые состоят из 0,1×SSC, содержащего ЭДТА, при 55°C.
«Условия с умеренной строгостью» можно найти в Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press, 1989, и включают инкубирование в течение ночи при 37°C в растворе, который содержит: 20% формамид, 5×SSC (150 мМ NaCl, 15 мМ трицитрат натрия), 50 мМ фосфат натрия (pH 7,6), 5× раствор Денхардта, 10% декстран сульфат и 20 мг/мл денатурированной порезанной ДНК из спермы лосося, с последующей отмывкой фильтров в 1×SSC приблизительно при 37-50°C. Квалифицированный специалист знает, как по мере необходимости подобрать температуру, ионную силу и т.п., которые соответствуют таким факторам, как длина зонда и т.п.
B. Подробное описание
Настоящее изобретение основано, по меньшей мере частично, на понимании того, что Bv8 играет важную роль в клеточных и молекулярных событиях, которые ведут к устойчивости опухолей к лечению, включая введение по меньшей мере одного антагониста VEGF, такого как антитело против VEGF. Также изобретение основано на понимании того, что экспрессия Bv8 тонко реагирует на G-CSF и таким образом связана с основными гомеостатическим механизмом, вовлеченным в регулирование дифференциации и образования нейтрофилов.
В совместно поданной заявке № 11/692681, от 28 марта 2007 г., полное раскрытие которой явно включено по ссылке в настоящий документ, описана корреляция между увеличением численности гематопоэтических клеток, полученных из костного мозга, и развитием устойчивости опухоли к лечению антителами против VEGF. Иммунная система содержит гематопоэтические клетки, которые включают эритроциты, лимфоциты и клетки миелоидной линии дифференцировки. Все эти типы клеток происходят из одних и тех же плюрипотентных стволовых клеток. У взрослых гемопоэз происходит в костном мозге, где стволовые клетки делятся редко для образования дополнительных стволовых клеток (самоподдержание) и различных детерминированных клеток-предшественников. Они представляют собой детерминированные клетки-предшественники, которые будут в ответ на особые регуляторные факторы продуцировать гематопоэтические клетки. Регуляторные факторы в основном продуцируются окружающими стромальными клетками, а также в других тканях, и включают, например, колониестимулирующие факторы (CSF), эритропоэтин (EPO), интерлейкин 3 (ИЛ-3), гранулоцитарный/макрофагальный CSF (GM-CSF), гранулоцитарный CSF (G-CSF), макрофагальный CSF (M-CSF) и STEEL фактор. Предполагалось, что изменения в иммунной системе раковых пациентов содействуют неспособности или пониженной способности иммунной системы к развитию успешной атаки против рака, таким образом, делая возможным прогрессирующий рост опухоли. См., например, Gabrilovich et al., Antibodies to Vascular Endotelial Growth Factor Enhances the Efficacy of Cancer Immunotherapy by Improving Endogenous Dendritic Cell Function, Clinical Cancer Research 5:2963-2970 (1999). Факторы, продуцируемые опухолями, могут вести к аномальному миелопоэзу и могут вести к подавлению иммунного ответа на опухоль. См., например, Kusmartsev and Gabrilovich, Immature myeloid cells and cancer-associated immune suppression. Caner Immunol Immunothera. 51:293-298 (2002).
Недавние исследования вовлекают миелоидные клетки CD11b+Gr1+ непосредственно в опосредование рефрактерности к лечению антителами против VEGF. (Shojaei, F., et al., Nature Biotechnol. 25:911-20 (2007)), и совместно поданная заявка с серийным № 11/692681. Семейство CD11/CD18 обладает структурным и генетическим сходством с более крупным интегриновым семейством рецепторов, которые модулируют адгезивные взаимодействия клеток, которые включают: эмбриогенез, адгезию к внеклеточным субстратам и дифференциацию клеток (Hynes, R. O., Cell 48:549-554 (1987); Kishimoto et al., Adv. Immunol. 46:149-182 (1989); Kishimoto et al. Cell 48:681-690 (1987); и Ruoslahti et al., Science 238:491-497 (1987)). Интегрины представляют собой класс мембрано-связанных гетеродимеров, которые содержат α-субъединицу, нековалентно связанную с β-субъединицей. β-субъединицы, как правило, способны образовывать связи более чем с одной α-субъединицей, и гетеродимеры, обладающие общей β-субъединицей, были классифицированы как подсемейства в интегриновой популяции (Larson and Springer, Structure and function of leukocyte integrins, Immunol, Rev. 114:181-217 (1990)).
Было обнаружено, что молекулы интегринов семейства CD11/CD18 и их клеточные лиганды опосредуют множество межклеточных взаимодействий, в частности при воспалении. Было показано, что эти белки критичны для адгезивных функций в иммунной системе (Kishimoto et al., Adv. Immunol. 46:149-182 (1989)). Было показано, что моноклональные антитела к LFA-1 блокируют адгезию лейкоцитов к эндотелиальным клеткам (Dustin et al., J Cell. Biol. 107:321-331 (1988); Smith et al., J. Clin. Invest. 83:2008-2017 (1989)) и ингибируют активацию T-клеток (Kuypers et al., Res. Immunol, 140:461 (1989)), образование конъюгатов, необходимое для антиген-специфичного убийства с помощью цитотоксических Т-лимфоцитов (Kishimoto et al., Adv. Immunol. 46:149-182 (1989)), T-клеточную пролиферацию (Davignon et al., J. Immunol. 127:590-595 (1981)) и убийство с помощью NK клеток (Kxensky et al., J. Immunol. 131:611-616 (1983)).
Семейство CD11/CD18 адгезивных рецепторных молекул содержит четыре близко связанных гликопротеина клеточной поверхности, LFA-1 (CD11a/CD18), Mac-1 (CD11b/CD18), p150.95 (CD11c/CD18) и (CD11d/CD18). Каждый из этих гетеродимеров обладает уникальной α-цепью (CD11a, b, c или d) и неизменной β-цепью (CD18). CD18 интегрины, расположенные на лейкоцитах, могут связываться с молекулой межклеточной адгезии 1 (ICAM-1), которая экспрессируется на эндотелии сосудов и других клетках, таким образом опосредуя адгезию лейкоцитов и миграцию через эндотелий. LFA-1 присутствует на поверхности всех зрелых лейкоцитов, за исключением a подкласса макрофагов, и считается основным лимфоидным интегрином. Экспрессия Mac-1, p150.95 и CD11d/CD18 преимущественно подтверждена для клеток миелоидной линии дифференцировки (которая включает нейтрофилы, моноциты, макрофаги и тучные клетки). CD11b+Gr1+ являются маркерами, которые также найдены на миелоидных клетках. Предполагалось, что баланс между зрелыми и незрелыми миелоидными клетками является индикатором рака, и при прогрессивном росте опухоли баланс сдвигается в сторону незрелых миелоидных клеток со сниженной функцией дендритных клеток. См., например, Kusmartsev and Gabrilovich, Immature myeloid cells and cancer-associated immune suppression. Caner Immunol. Immunothera. 51:293-298 (2002). Сдвиг баланса, например, посредством дифференциации незрелых миелоидных клеток у мышей, несущих опухоль, улучшает действие противораковых вакцин. См., Kusmartsev et al., All-trans-Retinoic Acid Eliminates Immature Myeloid Cells from Tumor-bearing Mice and Improves the Effect of Vaccination. Cancer Research 63:4441-4449 (2003). Также было замечено, что у раковых пациентов уровень VEGF в циркуляции коррелировал с увеличением количества незрелых миелоидных клеток. См. Almand et al., Clinical significance of defective dendritic cells differentiation in cancer. Clin Cancer Res 6:1755 (2000).
Было показано, что мобилизация и активация миелоидных CD11b+Gr1+ клеток может приводить к устойчивости к лечению антителами против VEGF. Также было показано, что миелоидные CD11b+Gr1+ клетки из костного мозга, выделенные из мышей, несущих опухоль, могут обеспечивать устойчивость опухолей к лечению антителами против VEGF, и кондиционированная среда от опухолей, устойчивых к лечению антителами против VEGF (но не от опухолей, чувствительных к лечению антителами против VEGF), стимулировала миграцию CD11b+Gr1+ клеток.
Экспериментальные данные, описываемые в настоящем документе, показывают, что Bv8 регулирует мобилизацию CD11b+Gr1+ клеток из костного мозга в процессе развития опухоли и также локально способствует опухолевому ангиогенезу. Следовательно, Bv8 является перспективной мишенью для лечения опухолей, устойчивых к лечению антагонистами VEGF.
Описываемые в настоящем документе данные также указывают на то, что экспрессия Bv8 тонко реагирует на G-CSF и, таким образом, связана с основным механизмом, участвующим в регулировании дифференцинации и образования нейтрофилов. Благодаря той значительной роли, которую играет Bv8 в патологии неопухолевых видов ангиогенеза, опосредованного воспалительными клетками, Bv8 также является многообещающей мишенью для ингибирования нежелательного ангиогенеза, в основном опосредованного воспалительными клетками.
C. Изготовление антител против Bv8, которые действуют как ингибиторы опухолевого ангиогенеза
Антитела, идентифицированные с помощью тестов на связывание и активность по настоящему изобретению, могут быть изготовлены с помощью известных в данной области способов, включая способы с рекомбинантными ДНК.
i) Изготовление антигена
Растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами, можно использовать в качестве иммуногенов при создании антител. Касательно трансмембранных молекул, таких как рецепторы, их фрагменты (например, внеклеточный домен рецептора) можно использовать в качестве иммуногена. Альтернативно клетки, которые экспрессируют трансмембранную молекулу, можно использовать в качестве иммуногена. Такие клетки могут быть получены из природного источника (например, раковых клеточных линий) или могут представлять собой клетки, которые были трансформированы рекомбинантными способами для того, чтобы экспрессировать трансмембранную молекулу. Другие антигены и их формы, которые можно использовать для изготовления антител, будут следовать из области техники.
(ii) Поликлональные антитела
Поликлональные антитела предпочтительно индуцированы в животных с помощью множественных подкожных (sc) или интраперитонеальных (ip) инъекций подходящего антигена и адъюванта. Можно использовать образование конъюгата подходящего антигена с белком, которой обладает иммуногенностью у видов, подлежащих иммунизации, например, гемоцианин морского блюдца, сывороточный альбумин, бычий тироглобулин или ингибитор трипсина соевых бобов с использованием бифункционального или производного средства, например, малеимидобензоил сульфосукцинимидного эфира (конъюгирование через остатки цистеина), N-гидроксисукцинимида (через остатки лизина), глутаральдегида, янтарного ангидрида, SOCl2 или R1N=C=NR, где R и R1 представляют собой различные алкильные группы.
Животных иммунизировали против антигена, иммуногенного конъюгата или производных посредством объединения, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда, и инъецировали раствор внутрикожно в нескольких местах. Через один месяц животных повторно иммунизировали с использованием от 1/5 до 1/10 от исходного количества пептида или конъюгата в полном адъюванте Фрейнда посредством подкожных инъекций в нескольких местах. Через 7-14 дней у животных брали кровь и оценивали титр антител в сыворотке. Животных иммунизировали повторно до выхода титров на уровень плато. Предпочтительно животное повторно иммунизировали конъюгатом того же антигена, конъюгированным с другим белком и/или с использованием другого сшивающего реактива. Конъюгаты также могли быть изготовлены в культуре рекомбинантных клеток в виде слитых белков. Также надлежаще использовали агрегирующие средства, такие как алюминиевые квасцы, для усиления иммунного ответа.
(iii) Моноклональные антитела
Моноклональные антитела могли изготавливать с использованием гибридомного способа, который впервые описан в Kohler et al., Nature, 256:495 (1975), или могли изготавливать способами с рекомбинантными ДНК (патент США № 4816567). В гибридомном способе мышь или другое подходящее животное-хозяин, такое как хомяк или макака, иммунизировали, как описано выше в настоящем документе, чтобы выделить лимфоциты, которые продуцируют или способны продуцировать антитела, которые будут избирательно связываться с белком, который использовали для иммунизации. Альтернативно лимфоциты могли быть иммунизированы in vitro. Затем лимфоциты сливали с миеломными клетками с использованием подходящего фактора, вызывающего слияние клеток, такого как полиэтиленгликоль, для образования гибридомной клетки (Goding, Monoclonal Antibodies: Principles and Practice, стр.59-103 (Academic Press, 1986)).
Таким образом изготовленные гибридомные клетки высевали и выращивали в подходящей среде для культивирования, которая предпочтительно содержала одну или несколько субстанций, которые ингибируют рост и выживание неслитых, родительских миеломных клеток. Например, если у родительских миеломных клеток отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (ГГФРТ или ГФРТ), среда для культивирования гибридом типично будет включать гипоксантин, аминоптерин и тимидин (среда ГАТ), которые предотвращают рост ГГФРТ-дефицитных клеток.
Предпочтительные миеломные клетки представляют собой клетки, которые эффективно сливаются, поддерживают высокий стабильный уровень продукции антитела посредством выбранных антитело-продуцирующих клеток и чувствительны к среде, такой как среда ГАТ. Среди них предпочтительными линиями миеломных клеток являются миеломные линии мыши, такие как те, что получены из мышиных опухолей MOPC-21 и MPC-11 и доступны в Salk Institute Cell Distribution Center, San Diego, Calif. USA, и клетки SP-2 или X63-Ag8-653, которые доступны в American Type Culture Collection, Rockville, Md. USA. Также описывалось, что человеческую миеломную и мышино-человеческую гетеромиеломную клеточные линии также можно использовать для изготовления моноклональных антител человека (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonad Antibody Production Techniques and Applications, стр.51-63 (Marcel Dekker, Inc., New York, 1987)).
В среде для культивирования, в которой росли гибридомные клетки, оценивали образование моноклональных антител, направленных против антигена. Предпочтительно специфичность связывания моноклональных антител, образованных гибридомными клетками, определяли посредством иммунопреципитации или посредством теста на связывание in vitro, например, радиоиммунологического анализа (РИА) или твердофазного иммуноферментного анализа (ELISA).
После того, как гибридомные клетки идентифицировали в качестве продуцирующих антитела с желаемой специфичностью, аффинностью и/или активностью, клоны могли быть субклонированы посредством серийных разведений и выращены стандартными способами (Goding, Monoclonal Antibodies: Principles и Practice, стр.59-103 (Academic Press, 1986)). Подходящие для этой цели среды для культивирования включают, например, среды D-MEM или RPMI-1640. Кроме того, гибридомные клетки можно выращивать in vivo в животном в виде асцитных опухолей.
Моноклональные антитела, секретированные субклонами, соответствующим образом выделяли из среды для культивирования, асцитной жидкости или сыворотки с помощью традиционных процедур очистки иммуноглобулинов, таких как, например, белок A-сефароза, хроматография на гидроксиапатите, электрофорез в геле, диализ или аффинная хроматография.
ДНК, которая кодирует моноклональные антитела, может быть легко выделена и секвенирована с использованием традиционных процедур (например, с использованием олигонуклеотидных зондов, которые способны связываться в частности с генами, кодирующими тяжелую и легкую цепи моноклональных антител). Гибридомные клетки служат в качестве предпочтительного источника такой ДНК. После выделения ДНК можно поместить в экспрессирующие векторы, которыми затем можно трансфицировать клетки-хозяева, такие как клетки E. coli, обезьяньи клетки COS, клетки яичника китайского хомячка (CHO) или миеломные клетки, которые в противном случае не образуют белки иммуноглобулинов, для того чтобы добиться синтеза моноклональных антител в рекомбинантных клетках-хозяевах. Более подробно изготовление рекомбинантных антител будет описано ниже.
В дополнительном варианте осуществления антитела или фрагменты антител могут быть выделены из фаговых библиотек антител, созданных с использованием способов, которые описаны в McCafferty et al., Nature, 348:552-554 (1990).
Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991) описывают выделение антител человека и мыши, соответственно, с использованием фаговых библиотек. В последующих публикациях описано изготовление высокоаффинных (нМ диапазон) антител человека посредством перестановки цепей (Marks et al., Bio/Technology, 10:779-783 (1992)), а также комбинаторной инфекции и рекомбинации in vivo в качестве стратегии для конструирования очень больших фаговых библиотек (Waterhouse et al., Nuc. Acids. Res., 21:2265-2266 (1993)). Таким образом, эти способы представляют собой конкурентные альтернативы традиционным гибридомным способам получения моноклональных антител для выделения моноклональных антител.
ДНК также может быть модифицирована, например, посредством замены гомологичных мышиных последовательностей на кодирующую последовательность константных доменов тяжелой и легкой цепей человека (патент США № 4816567; Morrison, et al., Proc. Natl. Acad. Sci. USA, 81:6851 (1984)), или посредством ковалентного соединения кодирующей последовательности с полной или частичной кодирующей последовательностью неиммуноглобулинового полипептида.
Типично такими неиммуноглобулиновыми полипептидами заменяют константные домены антитела или ими заменяют вариабельные домены одного антигенсвязывающего участка антитела для создания химерного бивалентного антитела, которое содержит один антигенсвязывающий участок, обладающий специфичностью к антигену, и второй антигенсвязывающий участок, обладающий специфичностью ко второму антигену.
(iv) Гуманизированные антитела и антитела человека
Гуманизированное антитело содержит один или несколько аминокислотных остатков, которые введены в него из источника, который не принадлежит человеку. Эти не принадлежащие человеку аминокислотные остатки часто обозначают как «импортные» остатки, которые типично берут из «импортного» вариабельного домена. По существу гуманизация может быть выполнена по следующему способу Winter'а и его коллег (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), посредством замены CDR грызунов или CDR последовательностей соответствующими последовательностями антитела человека. Таким образом, такие «гуманизированные» антитела представляют собой химерные антитела (патент США № 4816567), где по существу менее чем интактный вариабельный домен человека был заменен на соответствующую последовательность из видов, не являющихся человеком. фактически, гуманизированные антитела типично представляют собой антитела человека, в которых некоторые остатки CDR и возможно некоторые остатки FR замещены остатками из аналогичных сайтов антител грызунов.
Выбор вариабельных доменов человека, как из легкой, так и из тяжелой цепи, подлежащих использованию при изготовлении гуманизированных антител, является очень важным с точки зрения снижения иммуногенности. В соответствии с так называемым способом «наилучшего соответствия», проводят скрининг последовательности вариабельного домена антитела грызуна против целой библиотеки известных последовательностей вариабельного домена человека. Затем последовательность человека, которая ближе всего к последовательности грызуна, принимают в качестве каркаса человека (FR) для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987)). В другом способе используется конкретный каркас, выведенный из консенсусной последовательности легкой или тяжелой цепей из всех антител человека конкретной подгруппы. Тот же каркас можно использовать для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad Sci. USA, 89:4285 (1992); Presta et al., J. Immnol., 151:2623 (1993)).
Также важно, чтобы антитела были гуманизированы с сохранением высокой аффинности к антигену и других благоприятных биологических признаков. Для достижения этой цели, в соответствии с предпочтительным способом, гуманизированные антитела изготавливают посредством процесса анализа родительских последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов обычно доступны и хорошо знакомы специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных кандидатных последовательностей иммуноглобулинов. Экспертиза этих изображений делает возможным анализ вероятной роли остатков в функционировании кандидатной последовательности иммуноглобулина, т.е. анализ остатков, которые влияют на способность кандидатного иммуноглобулина связывать свой антиген. Таким образом, остатки из FR могут быть выбраны и объединены из последовательности реципиента и импортной последовательности, так что могут быть достигнуты желаемые признаки антитела, такие как увеличенная аффинность к целевому антигену(ам). В основном остатки CDR непосредственно и в наибольшей степени участвуют в воздействии на связывание антигена.
Альтернативно, теперь возможно создавать трансгенных животных (например, мышей), которые способны после иммунизации продуцировать полный репертуар антител человека при отсутствии эндогенного образования иммуноглобулинов. Например, сообщалось, что гомозиготная делеция гена шарнирной области тяжелой цепи (J. sub. H) антитела в химерных и мутантных по зародышевой линии мышах приводит к полному ингибированию эндогенной продукции антител. Перенос набора генов иммуноглобулинов зародышевой линии человека в таких мутантных по зародышевой линии мышей приводит к образованию антител человека после антигенной стимуляции. См., например, Jakobovits et al, Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immune, 7:33 (1993); и Duchosal et al. Nature 355:258 (1992). Антитела человека также могут быть получены из библиотек фаговых дисплеев (Hoogenboom et al., J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1991); Vaughan et al. Nature Biotech 14:309 (1996)). Создание антител человека из антительных библиотек фагового дисплея дополнительно описано ниже.
(v) Фрагменты антител
Для изготовления фрагментов антител были разработаны различные способы. Традиционно эти фрагменты получали посредством протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако теперь эти фрагменты могут быть изготовлены непосредственно с помощью рекомбинантных клеток-хозяев. Например, фрагменты антител могут быть выделены из антительных фаговых библиотек, которые обсуждались ранее. Альтернативно фрагменты Fab'-SH могут быть получены непосредственно из E. coli и химически соединены для образования F(ab')2 фрагментов (Carter et al., Bio/Technology 10:163-167 (1992)). В другом варианте осуществления, как описано в примере ниже, F(ab')2 образован с использованием лейциновой молнии GCN4, которая способствует сборке молекулы F(ab')2. Согласно другому подходу, F(ab')2 фрагменты могут быть выделены непосредственно из культуры рекомбинантной клетки-хозяина. Другие способы для изготовления фрагментов антител очевидны практикующим специалистам. В других вариантах осуществления выбранное антитело представляет собой одноцепочечный фрагмент Fv (scFv). См. WO 93/16185.
(vi) Полиспецифические антитела
Полиспецифические антитела обладают избирательным связыванием по меньшей мере с двумя различными эпитопами, где эпитопы обычно из различных антигенов. Поскольку обычно такие молекулы будут связываться только с двумя различными эпитопами (т.е. биспецифические антитела, бсАТ), антитела с дополнительными специфичностями, такие как триспецифические антитела, заключены в это выражение при использовании в настоящем документе. Примеры бсАТ включают антитела, у которых одно плечо направлено против Bv8 и другое плечо направлено против VEGF или EG-VEGF.
Способы изготовления биспецифических антител известны в данной области. Традиционное изготовление полноразмерных биспецифических антител основано на совместной экспрессии двух пар из тяжелой цепи и легкой цепи иммуноглобулина, где две цепи обладают различными специфичностями (Millstein et al., Nature, 305:537-539 (1983)). В силу случайного ассортимента тяжелой и легкой цепей иммуноглобулина, эти гибридомы (квадромы) продуцируют потенциальную смесь из 10 различных молекул антител, из которых только одна обладает правильной биспецифической структурой. Очистка правильных молекул, которую обычно выполняют на стадиях аффинной хроматографии, является довольно затруднительной, а выходы продуктов являются низкими. Схожие процедуры раскрыты в WO 93/08829 и в Traunecker et al., EMBO J., 10:3655-3659 (1991). Согласно другом подходу, вариабельные домены антитела с желаемыми специфичностями связывания (сочетание сайтов антитело-антиген) сливают в последовательности константных доменов иммуноглобулина. Слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, который содержит по меньшей мере часть шарнирной, CH2 и CH3-областей. Предпочтительно он содержит первую константную область (CH1) тяжелой цепи, которая содержит сайт, необходимый для связывания с легкой цепью, который присутствует по меньшей мере в одной из слитных последовательностей. ДНК, которая кодирует слитую последовательность тяжелой цепи иммуноглобулина и, при желании, легкую цепь иммуноглобулина, встраивают в раздельные экспрессирующие векторы и совместно трансфицируют в подходящий хозяйский организм. Это предусматривает большую гибкость в подборе взаимных пропорций трех полипептидных фрагментов в вариантах осуществления, когда в неравных соотношениях используют три полипептидные цепи, использованные в конструкции, которая обеспечивает оптимальные выходы. Однако можно встраивать кодирующие последовательности двух или всех трех полипептидных цепей в один экспрессирующий вектор, когда экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высоким выходам, или когда соотношения не обладают особым значением.
В предпочтительном варианте осуществления этого подхода биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания на одном плече и пары из гибридной тяжелой цепи и легкой цепи иммуноглобулина (которая обеспечивает второй специфичностью) на другом плече. Было обнаружено, что эта асимметричная структура облегчает выделение желаемого биспецифического соединения из нежелательных сочетаний цепей иммуноглобулинов, поскольку присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы предусматривает легкий способ выделения. Этот подход раскрыт в WO 94/04690. Более подробно о создании биспецифических антител см., например, Suresh et al., Methods in Enzymology, 121:210 (1986).
Согласно другому подходу, который описан в WO 96/27011, область контакта в паре молекул антитела может быть сконструирована таким образом, чтобы сделать максимальным процент гетеродимеров, которые собирают из культуры рекомбинантных клеток. Предпочтительная область контакта содержит по меньшей мере часть домена CH3 константного домена антитела. В этом способе одну или несколько аминокислот с маленькими боковыми цепями из области контакта первой молекулы антитела замещают на аминокислоты с более крупными боковыми цепями (например, тирозин или триптофан). Компенсирующие «полости», размеры которых идентичны или схожи с размерами большой боковой цепи(ей), создают в области контакта второй молекулы антитела посредством замещения аминокислот с большими боковыми цепями на аминокислоты с меньшими боковыми цепями (например, аланин или треонин). Это обеспечивает механизм для увеличения выхода гетеродимера относительно других нежелательных конечных продуктов, таких как гомодимеры.
Биспецифические антитела включают сшитые или «гетероконъюгированные» антитела. Например, одно из антител в гетероконъюгате может быть соединено с авидином, а другое - с биотином. Такие антитела предлагались, например, для нацеливания клеток иммунной системы на нежелательные клетки (патент США № 4676980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373). Гетероконъюгированные антитела могут быть изготовлены с использованием любого способа ковалентного сшивания. Подходящие сшивающие средства хорошо известны в данной области и раскрыты в патенте США № 4676980, наряду со многими способами сшивания.
Способы создания биспецифических антител из фрагментов антител также описаны в литературе. Например, биспецифические антитела могут быть изготовлены с использованием химического связывания. Brennan et al., Science 229:81 (1985) описывают процедуру, в которой интактные антитела протеолитически расщепляли для создания фрагментов F(ab')2. Эти фрагменты восстанавливали в присутствии дитиолового комплексообразователя арсенита натрия для стабилизации соседних дитиолов и предотвращения образования межмолекулярных дисульфидных связей. Затем полученные фрагменты Fab' превращали в производные тионитробензоата (TNB). Затем одно из Fab'-TNB производных восстанавливали до Fab'-тиола посредством восстановления с меркаптоэтиламином и смешивали с эквимолярным количеством другого Fab'-TNB производного для образования биспецифического антитела. Изготовленные биспецифические антитела можно использовать в качестве средств для избирательной иммобилизации ферментов.
Fab'-SH фрагменты также могут быть получены непосредственно из E. coli и могут быть химически соединены для образования биспецифических антител. Shalaby et al., J. Exp. Med., 175:217-225 (1992) описывают изготовление полностью гуманизированного биспецифического антитела в виде молекулы F(ab')2. Каждый фрагмент Fab' отдельно секретировался из E. coli и подвергался направленному химическому связыванию in vitro для образования биспецифического антитела.
Также описаны различные способы для изготовления и выделения фрагментов биспецифических антител непосредственно из культуры рекомбинантных клеток. Например, биспецифические антитела изготавливали с использованием лейциновых молний. Kostelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды с лейциновыми молниями из белков Fos и Jun соединяли с фрагментами Fab' двух различных антител посредством слияния генов. Гомодимеры антител восстанавливали в шарнирной области для получения мономеров и затем повторно окисляли для получения гетеродимеров антител. Этот способ также можно использовать для изготовления гомодимеров антител. Технология «диател», которая описана авторами Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993), предоставляет альтернативный механизм изготовления фрагментов биспецифического антитела. Фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) с помощью линкера, который слишком короток, чтобы сделать возможным спаривание двух доменов одной цепи. Таким образом, домены VH и VL одного фрагмента принуждены к спариванию с комплементарными доменами VL и VH другого фрагмента, посредством чего создаются два антигенсвязывающих сайта. Также сообщалось о другой стратегии изготовления фрагментов биспецифических антител посредством использования димеров одноцепочечных Fv (scFv). См. Gruber et al., J. Immunol. 152:5368 (1994).
Рассматривались антитела более чем с двумя валентностями. Например, могут быть изготовлены триспецифические антитела. Tuft et al. J. Immunol. 147:60 (1991).
(vii) Проектирование эффекторной функции
Может возникнуть желание модифицировать антитело по изобретению в отношении эффекторной функции с тем, чтобы увеличить эффективность антитела. Например, остаток(ки) цистеина можно ввести в Fc-область, посредством чего сделать возможным образование дисульфидной связи между цепями в этой области. Созданное таким образом гомодимерное антитело может обладать улучшенной способностью к интернализации и/или улучшенными обусловленным комплементом уничтожением клеток и антителозависимой клеточной цитотоксичностью (АЗКЦ). См. Caron et al., J. Exp Med. 176: 1191-1 (1992) и Shopes, B. J. Immunol. 148:2918-2922 (1992). Гомодимерные антитела с увеличенной противоопухолевой активностью также могут быть изготовлены с использованием гетеробифункциональных кросс-линкеров, как описано в Wolff et al. Cancer Research 53:2560-2565 (1993). Альтернативно может быть спроектировано антитело, которое обладает двойными Fc-областями и посредством этого может обладать увеличенным лизисом с помощью комплемента и способностью к АЗКЦ. См. Stevenson et al. Anti-Cancer Drug Design 3:219-230 (1989).
(viii) Слияние антитела и эпитопа связывания рецептора спасения
В определенных вариантах осуществления может быть желательным использование фрагмента антитела, а не интактного антитела, например, для увеличения проникновения в опухоль. В этом случае может быть желательно модифицировать фрагмент антитела для увеличения его времени полужизни в сыворотке. Этого можно достичь, например, посредством встраивания эпитопа связывания рецептора спасения во фрагмент антитела (например, посредством мутации в соответствующей области во фрагменте антитела или посредством встраивания эпитопа в пептидную метку, которую затем сливают с фрагментом антитела или на конце или посередине, например, посредством синтеза ДНК или пептидов).
Эпитоп связывания рецептора спасения предпочтительно образует область, в которой один или несколько аминокислотных остатков из одной или двух петель Fc-домена перенесены в аналогичное положение фрагмента антитела. Даже более предпочтительно, перенесены три остатка или более из одной или двух петель Fc-домена. Еще более предпочтительно, эпитоп взят из домена CH2 Fc-области (например, из IgG) и перенесен в область CH1, CH3 или V. sub. H, или более чем одну такую область антитела. Альтернативно эпитоп взят из домена CH2 Fc-области и перенесен в область CL или область VL или в обе эти области фрагмента антитела.
(ix) Другие ковалентные модификации антител
Ковалентные модификации антител включены в объем данного изобретения. Они могут быть выполнены посредством химического синтеза или посредством ферментативного или химического расщепления антитела, если возможно. Другие типы ковалентных модификаций антитела введены в молекулу посредством реакции целевых аминокислотных остатков антитела с органическим производным средством, которое способно реагировать с выбранными боковыми цепями или N- или C-концевыми остатками. Примеры ковалентных модификаций описаны в патенте США № 5534615, который явно включен в настоящий документ в качестве ссылки. Предпочтительный вид ковалентной модификации антитела включает связывание антитела одним из нескольких небелковых полимеров, например, с полиэтиленгликолем, полипропиленгликолем или полиоксиалкиленами, способом, который приведен в патентах США №№ 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337.
Изобретение также относится к иммуноконъюгатам, которые содержат антитело, описываемое в настоящем документе, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или его фрагмент) или радиоактивный изотоп (т.е. радиоконъюгат). Для изготовления радиоконъюгатов антитела доступны различные радионуклиды. В качестве неограничивающих примеров включены, например,212Bi,131I,131In,90Y и186Re.
Химиотерапевтические средства, которые можно использовать при создании таких иммуноконъюгатов, были описаны выше. Например, BCNU, стрептозоцин, винкристин, 5-фторурацил, семейство средств, известное под общим названием LL-E33288 комплекс, которое описано в патентах США 5053394, 5770710, эсперамицины (патент США 5877296) и т.д. (см. также определение химиотерапевтических средств в настоящем документе), могут быть конъюгированы с антителами по изобретению или их фрагментами.
Для избирательного разрушения опухоли антитело может содержать высокорадиоактивный атом. Для изготовления радиоконъюгированных антител или их фрагментов доступны различные радиоактивные изотопы. В качестве неограничивающих примеров включены, например,211At,131I,125I,90Y,186Re,188Re,153Sm,212Bi,32P,212Pb,111In, радиоактивные изотопы Lu и т.д. Когда конъюгат используют для диагностики, он может содержать радиоактивный атом для сцинтиграфических исследований, например99mtc или123I, или спиновую метку для ядерно-магнитной резонансной (ЯМР) томографии (также известной как магнитно-резонансная томография, МРТ), такую как йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки могут быть встроены в конъюгат известными способами. Например, пептид может быть получен биосинтезом или может быть синтезирован посредством химического синтеза аминокислот с использованием пригодных предшественников аминокислот с использованием, например, фтора-19 вместо водорода. Метки, такие как99mtc или123I,186Re,188Re и111In, могут быть присоединены через остаток цистеина в пептиде. Иттрий-90 может быть присоединен через остаток лизина. Способ IODOGEN (Fraker et al. (1978) Biochem. Biophys. Res. Commun. 80:49-57 можно использовать для встраивания йода-123. См., например, Monoclonal Antibodies in immunoscintigraphy (Chatal, CRC Press 1989), в которой подробно описаны другие способы.
Ферментативно активные токсины и их фрагменты, которые можно использовать, включают цепь A токсина дифтерии, несвязанные активные фрагменты дифтерийного токсина, цепь A экзотоксина (из Pseudomonas aeruginosa), цепь A рицина, цепь A абрина, цепь A модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolacca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, неомицин и трихотецины. См., например, WO 93/21232 от 28 октября 1993 года.
Конъюгаты антитела и цитотоксического средства изготавливали с использованием различных средств для соединения бифункциональных белков, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил) циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (таких как диметил адипимидат HCL), активных эфиров (таких как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис-(п-азидобензоил) гександиамин), бис-диазониевые производные (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол 2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть изготовлен, как описано в Vitetta et al. Science 238:1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилен триаминпентауксусная кислота (MX-DTPA) является образцовым хелатирующим агентом для конъюгирования радионуклеотида с антителом. См. WO 94/11026. Линкер может представлять собой «расщепляемый линкер», облегчающий высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать линкер, разлагающийся в кислой среде, пептидаза-чувствительный линкер, фотолабильный линкер, диметиловый линкер или дисульфид-содержащий линкер (Chari et al., Cancer Research 52:127-131 (1992); патент США № 5208020). Альтернативно слитный белок, который содержит антитело против VEGF и/или против белка по изобретению и цитотоксическое средство, может быть изготовлен, например, с помощью рекомбинантных способов или пептидного синтеза. ДНК может содержать соответствующие области, которые кодируют две части конъюгата, которые расположены или смежно друг с другом или разделены областью, которая кодирует линкерный пептид, который не нарушает желаемых свойств конъюгата.
В определенных вариантах осуществления антитело конъюгировано с «рецептором» (как стрептавидин) для использования при предварительном нацеливании на опухоль, где конъюгат антитело-рецептор вводят пациенту с дальнейшим удалением несвязанного конъюгата из циркуляции с использованием очищающего средства и последующим введением «лиганда» {например, авидина), который конъюгирован с цитотоксическим средством (например, с радионуклеотидом). В определенных вариантах осуществления иммуноконъюгат образован между антителом и соединением с нуклеолитической активностью (например, с рибонуклеазой или ДНК эндонуклеазой, такой как дезоксирибонуклеаза; ДНКаза).
Изобретение относится к антителу по изобретению, которое конъюгировано с одной или несколькими молекулами майтанзиноида. Майтанзиноиды представляют собой митотические ингибиторы, которые действуют посредством ингибирования полимеризации тубулина. Майтанзин впервые был выделен из восточно-африканского кустарника Maytenus serrata (патент США № 3896111). Впоследствии было открыто, что определенные микробы также продуцируют майтанзиноиды, такие как майтанзинол и C-3 майтанзиноловые эфиры (патент США № 4151042). Синтетический майтанзинол и его производные и аналоги раскрыты, например, в патентах США №№ 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533.
Антитело по изобретению может быть конъюгировано с молекулой майтанзиноида без значительного снижения биологической активности как антитела, так и молекулы майтанзиноида. В среднем 3-4 молекулы майтанзиноида, конъюгированные с одной молекулой антитела, проявляют эффективность в отношении увеличения цитотоксичности целевых клеток без отрицательного воздействия на функцию или растворимость антитела, несмотря на то, что предположительно даже одна молекула токсина на антитело будет увеличивать цитотоксичность в сравнении с использованием голого антитела. Майтанзиноиды хорошо известны в данной области и могут быть синтезированы известными способами или выделены из природных источников. Пригодные майтанзиноиды раскрыты, например, в патенте США № 5208020 и в других патентах и непатентных публикациях, которые упоминались выше в настоящем документе. В одном из вариантов осуществления майтанзиноиды представляют собой майтанзинол и аналоги майтанзинола с модификациями по ароматическому кольцу или другим положениям в молекуле майтанзинола, например, различные эфиры майтанзинола.
Для изготовления конъюгатов антитело-майтанзиноид существует множество линкерных групп, которые известны в данной области, включая, например, группы, которые раскрыты в патенте США № 5208020 или патенте EP 0425235 B1 и Chari et al., Cancer Research 52:127-131 (1992). Линкерные группы включают дисульфидные группы, тиоэфирные группы, кислотно-лабильные группы, фотолабильные группы, пептидазно-лабильные группы или эстеразно-лабильные группы, как раскрыто в вышеупомянутых патентах, дисульфидные и тиоэфирные группы предпочтительны.
Конъюгаты антитела и майтанзиноида могут быть изготовлены с использованием различных средств для соединения бифункциональных белков, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил) циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметил адипимидат HCL), активные эфиры (такие как дисукцинимидил суберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис-(п-азидобензоил)гександиамин), бис-диазониевые производные (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол 2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Типичные средства для соединения включают N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 [1978]) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP) для предоставления дисульфидной связи.
Линкер может быть присоединен к молекуле майтанзиноида в различных положениях, в зависимости от типа связи. Например, эфирная связь может быть образована посредством реакции с гидроксильной группой с использованием традиционных способов соединения. Реакция может происходить в положении C-3, содержащем гидроксильную группу, положении C-14, модифицированном гидроксиметилом, положении C-15, модифицированном гидроксильной группой, и положении C-20, содержащем гидроксильную группу. Связь образована в положении C-3 майтанзинола или аналога майтанзинола.
Другой интересующий иммуноконъюгат содержит антитело по изобретению, которое конъюгировано с одной или несколькими молекулами калихеамицина. Семейство антибиотиков калихеамицинов способно образовывать двухцепочечные разрывы ДНК при субпикомолярных концентрациях. Для изготовления конъюгатов с калихеамициновым семейством, см. патенты США 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все принадлежат American Cyanamid Company). Структурные аналоги калихеамицина, которые можно использовать, включают в качестве неограничивающих примеров γ1I, α2I, α3I, N-ацетил-γ1I, PSAG и θI1 (Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) и указанные выше патенты США для American Cyanamid). Другим противоопухолевым лекарственным средством, с которым антитело может быть конъюгировано, является QFA, который является антифолатом. Как калихеамицин, так и QFA обладают внутриклеточными местами приложения действия и не без труда проникают через плазматическую мембрану. Следовательно, клеточный захват этих средств посредством антитело-опосредованной интернализации значительно увеличивает их цитотоксические эффекты.
(x) Создание антител из синтетических фаговых библиотек антител
В предпочтительном варианте осуществления изобретение относится к способу создания и отбора новых антител с использованием уникального подхода фагового дисплея. Подход включает создание синтетических фаговых библиотек антител на основе одного шаблона каркаса, разработку достаточного разнообразия в вариабельных доменах, представление полипептидов, обладающих разнообразными вариабельными доменами, на дисплее, отбор кандидатных антител с высокой аффинностью к целевому антигену и выделение выбранных антител.
Подробности о способах фагового дисплея можно найти, например, в WO 03/102157 от 11 декабря 2003 г., полное раскрытие которого явно включено в настоящий документ в качестве ссылки.
В одном из аспектов библиотеки антител, использованные в изобретении, могут быть созданы посредством мутаций в доступных растворителю и/или сильно изменчивых положениях по меньшей мере в одном CDR вариабельного домена антитела. В некоторые или все CDR могут быть введены мутации с использованием способов, предоставленных в настоящем документе. В некоторых вариантах осуществления может быть предпочтительно создавать библиотеки разнообразных антител посредством мутаций в положениях в CDRH1, CDRH2 и CDRH3 для получения единой библиотеки или посредством мутаций в положениях в CDRL3 и CDRH3 для получения единой библиотеки или посредством мутаций в положениях в CDRL3 и CDRH1, CDRH2 и CDRH3 для создания единой библиотеки.
Например, может быть создана библиотека вариабельных доменов антител, которые содержат мутации в доступных растворителю и/или высоко изменчивых положениях в CDRH1, CDRH2 и CDRH3. Может быть создана другая библиотека, содержащая мутации в CDRL1, CDRL2 и CDRL3. Эти библиотеки также могут использоваться в сочетании друг с другом для создания связывающихся конструкций с желаемыми аффинностями. Например, после одного или нескольких раундов отбора из библиотек тяжелых цепей для связывания с целевым антигеном, на дополнительных раундах отбора библиотеку легких цепей в популяции связывающихся конструкций тяжелых цепей можно заместить для увеличения аффинности связок.
Предпочтительно библиотеку создают посредством замены исходных аминокислот на альтернативные аминокислоты в последовательности области CDRH3 вариабельной области тяжелой цепи. Полученная библиотека может содержать множество последовательностей антител, в которых разнообразие последовательностей в основном представлено в последовательности области CDRH3 тяжелой цепи.
В одном из аспектов библиотеку создают в рамках последовательности гуманизированного антитела 4D5 или последовательности каркасных аминокислот в последовательности гуманизированного антитела 4D5. Предпочтительно библиотеку создают посредством замены по меньшей мере остатков 95-100a тяжелой цепи на аминокислоты, кодируемые набором кодонов DVK, где набор кодонов DVK используется для кодирования набора альтернативных аминокислот для каждого из этих положений. Пример набора олигонуклеотидов, который можно использовать для создания этих замен, содержит последовательность (DVK)7. В некоторых вариантах осуществления библиотеку создают посредством замены остатков 95-100a на аминокислоты, кодируемые двумя наборами кодонов DVK и NNK. Пример набора олигонуклеотидов, который можно использовать для создания этих замен, содержит последовательность (DVK)6(NNK). В другом варианте осуществления библиотеку создают посредством замены по меньшей мере остатков 95-100a на аминокислоты, кодируемые наборами кодонов DVK и NNK. Пример набора олигонуклеотидов, который можно использовать для создания этих замен, содержит последовательность (DVK)5(NNK). Другой пример набора олигонуклеотидов, которые можно использовать для создания этих замен, содержит последовательность (NNK)6. Другие примеры пригодных олигонуклеотидных последовательностей может определить профессионал в данной области в соответствии с критериями, которые описаны в настоящем документе.
В другом варианте осуществления использованы другие конструкции CDRH3 для выделения высокоаффинных связывающихся конструкций и для выделения конструкций, связывающихся с различными эпитопами. Диапазон длин CDRH3, созданного в этой библиотеке, составляет от 11 до 13 аминокислот, хотя также могут быть созданы длины, отличающиеся от созданных. Изменчивость H3 можно увеличить с использованием наборов кодонов NNK, DVK и NVK, так же как и более ограниченную изменчивость на N- и/или C-конце.
Также можно создать изменчивость в CDRH1 и CDRH2. При разработке изменчивости CDR-H1 и H2 придерживаются стратегии нацеливания на имитацию репертуара природных антител, как описано, с использованием модификаций, которые сфокусированы на разнообразии, которое совпадает с природным разнообразием более точно, чем предыдущая конструкция.
Для разнообразия CDRH3 можно раздельно сконструировать несколько библиотек с различными длинами H3 и затем объединить их для отбора конструкций, которые связываются с целевыми антигенами. Несколько библиотек можно объединить вместе и сортировать с использованием способов отбора на твердой фазе и отбора в растворе, как описано выше и ниже и в настоящем документе. Можно использовать несколько стратегий сортировки. Например, один вариант использует сортировку на мишени, которая связана с твердой фазой, с последующей сортировкой по метке, которая может быть представлена в слитном полипептиде (например, метка анти-gD), за которой следует другая сортировка на мишени, связанной с твердой фазой. Альтернативно, сначала можно проводить сортировку библиотек на мишени, связанной с твердой поверхностью, а затем сортировать элюированные связывающиеся конструкции с использованием связывания в жидкой фазе при уменьшении концентрации целевого антигена. Использование комбинаций различных способов сортировки обеспечивает минимизацию отбора только сильно экспрессируемых последовательностей и обеспечивает отбор множества различных высокоаффинных клонов.
Из библиотек могут быть выделены связывающиеся конструкции с высокой аффинностью к целевому антигену. Ограничение разнообразия в области H1/H2 снижает вырожденность приблизительно в 104-105 раз и делает возможным более значительное разнообразие H3, предоставляя более высокоаффинные связывающиеся конструкции. Использование библиотек с различными типами разнообразия в CDRH3 (например, использование DVK или NVT) обеспечивает выделение связывающихся конструкций, которые могут связываться с различными эпитопами целевого антигена.
Было обнаружено, что у связывающихся конструкций, выделенных из объединенных библиотек, как описано выше, можно дополнительно улучшить аффинность посредством предоставления ограниченного разнообразия в легкой цепи. В этом варианте осуществления разнообразие в легкой цепи создают следующим образом в CDRL1: положение аминокислоты 28 кодируется RDT; положение аминокислоты 29 кодируется RKT; положение аминокислоты 30 кодируется RVW; положение аминокислоты 31 кодируется ANW; положение аминокислоты 32 кодируется THT; необязательно, положение аминокислоты 33 кодируется CTG; в CDRL2: положение аминокислоты 50 кодируется KBG; положение аминокислоты 53 кодируется AVC; и необязательно положение аминокислоты 55 кодируется GMA; в CDRL3: положение аминокислоты 91 кодируется TMT или SRT или обоими; положение аминокислоты 92 кодируется DMC; положение аминокислоты 93 кодируется RVT; положение аминокислоты 94 кодируется NHT; и положение аминокислоты 96 кодируется TWT или YKG или обоими.
В другом варианте осуществления создают библиотеку или библиотеки с разнообразием в областях CDRH1, CDRH2 и CDRH3. В этом варианте осуществления разнообразие в CDRH3 создают с использованием различных длин областей H3 и в основном с использованием наборов кодонов XYZ и NNK или NNS. Библиотеки могут быть созданы с использованием отдельных олигонуклеотидов и объединены, или олигонуклеотиды могут быть объединены для создания подкласса библиотек. В этом варианте осуществления библиотеки могут быть отсортированы против мишени, связанной с твердой фазой. Клоны, выделенные в результате многих сортировок, могут быть подвергнуты скринингу специфичности и аффинности с использованием тестов ELISA. По специфичности клоны могут подвергаться скринингу против желаемых целевых антигенов, а также других нецелевых антигенов. Те конструкции, которые связываются с целевым антигеном, затем могут подвергаться скринингу по аффинности в конкурентном тесте ELISA на связывание в растворе или конкурентном капельном тесте. Связывающиеся конструкции с высокой аффинностью могут быть выделены из библиотек с использованием наборов кодонов XYZ, которые изготовлены, как описано выше. Эти связывающиеся конструкции можно легко синтезировать в клеточной культуре в виде антител или антиген-связывающих фрагментов с высоким выходом.
В некоторых вариантах осуществления может быть желательно создать библиотеки с более широким разнообразием длин области CDRH3. Например, может быть желательно создать библиотеки с областями CDRH3 в диапазоне приблизительно от 7 до 19 аминокислот.
Связывающиеся конструкции с высокой аффинностью, выделенные из библиотек из этих вариантов осуществления, можно легко синтезировать в культурах бактериальных и эукариотических клеток с высоким выходом. Можно разработать векторы для легкого удаления последовательностей, таких как метки gD, последовательность компонента белковой вирусной оболочки, и/или для добавления в константную область последовательностей, чтобы обеспечить синтез полноразмерных антител или антиген-связывающих фрагментов с высоким выходом.
Библиотека с мутациями в CDRH3 может быть объединена с библиотекой, содержащей альтернативные версии других CDR, например CDRL1, CDRL2, CDRL3, CDRH1 и/или CDRH2. Таким образом, например, в одном из вариантов осуществления библиотеку CDRH3 объединяют с библиотекой CDRL3, созданной в рамках последовательности гуманизированного антитела 4D5 с альтернативными аминокислотами в положениях 28, 29, 30, 31 и/или 32 с использованием предварительно определенных наборов кодонов. В другом варианте осуществления библиотека с мутациями в CDRH3 может быть объединена с библиотекой, которая содержит альтернативные CDRH1 и/или CDRH2 вариабельного домена тяжелой цепи. В одном из вариантов осуществления библиотека CDRH1 создана с использованием последовательности гуманизированного антитела 4D5 с альтернативными аминокислотами в положениях 28, 30, 31, 32 и 33. Библиотека CDRH2 может быть создана с использованием последовательности гуманизированного антитела 4D5 с альтернативными аминокислотами в положениях 50, 52, 53, 54, 56 и 58 с использованием предварительно определенных наборов кодонов.
(xi) Варианты антител
Новые антитела, созданные из фаговых библиотек, могут быть дополнительно модифицированы для создания мутантов антител с улучшенными физическими, химическими и/или биологическими свойствами относительно родительского антитела. Когда в качестве теста используют тест на биологическую активность, мутантное антитело в выбранном тесте предпочтительно обладает биологической активностью, которая по меньшей мере приблизительно в 10 раз выше, предпочтительно по меньшей мере приблизительно в 20 раз выше, более предпочтительно по меньшей мере приблизительно в 50 раз выше и иногда по меньшей мере приблизительно в 100 раз или 200 раз выше, чем биологическая активность родительского антитела в этом тесте. Например, мутантное антитело против Bv8 предпочтительно обладает аффинностью связывания с Bv8, которая по меньшей мере приблизительно в 10 раз сильнее, предпочтительно по меньшей мере приблизительно в 20 раз сильнее, более предпочтительно по меньшей мере приблизительно в 50 раз сильнее и иногда по меньшей мере приблизительно в 100 раз или 200 раз сильнее, чем аффинность связывания родительского антитела.
Для создания мутантного антитела одно или несколько изменений аминокислот (например, замен) вводят в одну или несколько гипервариабельных областей родительского антитела. Альтернативно, или кроме того, одно или несколько изменений (например, замен) остатков каркасной области могут быть введены в родительское антитело, когда это приводит к улучшению аффинности связывания мутантного антитела с антигеном из млекопитающего второго вида. Примеры остатков каркасной области для модификации включают остатки, которые нековалентно напрямую связываются с антигеном (Amit et al. (1986) Science 233:747-753); взаимодействуют с CDR или влияют на его конформацию (Chothia et al. (1987) J. Mol. Biol 196:901-917); и/или входят в область контакта VL-VH (EP 239400 B1). В определенных вариантах осуществления модификация одного или нескольких таких остатков каркасной области приводит к увеличению аффинности связывания антитела с антигеном из млекопитающего второго вида. Например, от приблизительно одного до приблизительно пяти каркасных остатков могут быть изменены в этом варианте осуществления изобретения. Иногда, этого может быть достаточно для получения мутантного антитела, которое пригодно для использования в доклинических исследованиях, даже когда не был изменен ни один остаток гипервариабельной области. Однако обычно мутантное антитело будет содержать дополнительное изменение(я) гипервариабельной области.
Измененные остатки гипервариабельной области могут быть изменены случайным образом, в частности, когда исходная аффинность связывания родительского антитела такова, что такие случайным образом изготовленные мутантные антитела могут быть быстро проверены скринингом.
Одна эффективная процедура для создания таких мутантных антител называется «аланиновый сканирующий мутагенез» (Cunningham and Wells (1989) Science 244:1081-1085). Здесь, один или несколько остатков гипервариабельной области заменяют на остатки аланина или полиаланина, чтобы изменить взаимодействие аминокислот с антигеном из млекопитающего второго вида. Затем те остатки гипервариабельной области, которые проявляют функциональную чувствительность к заменам, уточняют посредством введения дополнительных или других мутаций в сайты замен. Таким образом, поскольку сайт для введения изменения в аминокислотную последовательность предварительно определен, природу мутации per se не нужно определять предварительно. Проводят скрининг биологической активности ala-мутантов, образованных этим способом, как описано в настоящем документе.
Обычно начинают с консервативной замены, такой как приведена ниже под заголовком «Предпочтительные замены». Если такие замены приводят к изменению биологической активности (например, аффинности связывания), тогда вводят дополнительные значащие изменения, обозначенные «Примеры замен» в таблице 1, или как дополнительно описано ниже в отношении классов аминокислот, и проводят скрининг продуктов.
Предпочтительные замены:
Могут быть выполнены даже более значимые модификации биологических свойств антител посредством отбора замен, которые значительно отличаются по их эффекту на сохранение (a) структуры полипептидного остова в области замены, например, в виде конформации складчатого слоя или спирали, (b) заряда или гидрофобности молекулы в целевом сайте, или (c) объема боковой цепи. Встречающиеся в природе остатки разделены на группы на основе общих свойств боковой цепи:
(1) гидрофобные: норлейцин, met, ala, val, leu, ile;
(2) нейтральные гидрофильные: cys, ser, thr, asn, gln;
(3) кислые: asp, glu;
(4) основные: his, lys, arg;
(5) остатки, которые влияют на ориентацию цепи: gly, pro; и
(6) ароматические: trp, tyr, phe.
Неконсервативные замены повлекут за собой обмен члена одного из этих классов на другой класс.
В другом варианте осуществления сайты, выбранные для изменения, подвергались созреванию аффинности с использованием фагового дисплея (см. выше).
Молекулы нуклеиновой кислоты, кодирующие аминокислотные последовательности мутантов, изготавливали посредством различных известных в данной области способов. Эти способы включают в качестве неограничивающих примеров олигонуклеотид-опосредованный (или сайт-специфический) мутагенез, ПЦР мутагенез и кассетный мутагенез ранее изготовленных мутантов или немутантных версий родительского антитела. Предпочтительным способом для изготовления мутантов является сайт-специфический мутагенез (см., например, Kunkel (1985) Proc. Natl. Acad. Sci. USA 82:488).
В определенных вариантах осуществления мутантное антитело будет содержать в гипервариабельной области только один замененный остаток. В других вариантах осуществления два или более остатка в гипервариабельной области родительского антитела будут заменены, например, приблизительно от двух приблизительно до десяти замен в гипервариабельной области. Как правило, мутантное антитело с улучшенными биологическими свойствами будет содержать аминокислотную последовательность, которая обладает по меньшей мере 75% идентичностью аминокислотных последовательностей или сходством с аминокислотной последовательностью вариабельного домена или тяжелой или легкой цепи родительского антитела, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95%. Идентичность или сходство в отношении этой последовательности определяют в настоящем документе как процентную долю аминокислотных остатков в кандидатной последовательности, которые идентичны (т.е. одинаковые остатки) или схожи (т.е. аминокислотный остаток из одной группы, основанной на общих свойствах боковой цепи, см. выше) с остатками родительского антитела, после выравнивания последовательностей и, при необходимости, введения пропусков для достижения максимального процента идентичности последовательностей. Ни одно из N-концевых, C-концевых или внутренних удлинений, делеций или инсерций в последовательности антитела за пределами вариабельного домена не будет рассматриваться в качестве изменения идентичности или сходства последовательностей.
После изготовления мутантного антитела определяют биологическую активность этой молекулы относительно родительского антитела. Как указано выше, это может включать определение аффинности связывания и/или других биологических активностей антитела. В предпочтительном варианте осуществления изобретения изготавливают панель мутантных антител и проводят скрининг аффинности связывания с антигеном или его фрагментом. Одно или несколько мутантных антител, которые выбраны в результате этого начального скрининга, необязательно подвергают одному или нескольким дополнительным тестам на биологическую активность, чтобы подтвердить, что мутантное антитело(а) с увеличенной аффинностью связывания действительно можно использовать, например, для доклинических исследований.
Выбранное таким образом мутантное антитело(а) можно подвергнуть дополнительным модификациям, зачастую в зависимости от предполагаемого использования антитела. Такие модификации могут включать дальнейшее изменение аминокислотной последовательности, слияние гетерологичным полипептидом(ами) и/или ковалентные модификации, такие как модификации, которые разъяснены ниже. Относительно изменения аминокислотной последовательности, примеры модификаций разъяснены выше. Например, любой остаток цистеина, не участвующий в поддержании правильной конформации мутантного антитела, также может быть заменен, как правило, на серин, для улучшения окислительной стабильности молекулы и предупреждения неправильного перекрестного сшивания.
И, наоборот, цистеиновая связь(и) могут быть добавлены в антитело для улучшения его стабильности (особенно, когда антитело представляет собой фрагмент антитела, например, Fv-фрагмент). Другой тип аминокислотного мутанта содержит измененный мотив гликозилирования. Это может быть достигнуто посредством удаления одной или нескольких молекул углеводов, найденных в антителе, и/или добавления одного или нескольких сайтов гликозилирования, которые отсутствуют в антителе. Гликозилирование антител типично представляет собой или N-гликозилирование или O-гликозилирование. N-гликозилирование относится к присоединению молекулы углевода к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X представляет собой любую аминокислоту кроме пролина, представляют собой последовательности распознавания для ферментативного присоединения молекулы углевода к боковой цепи аспарагина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. O-гликозилирование относится к присоединению одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, чаше всего к серину или треонину, хотя также могут быть использованы 5-гидроксипролин или 5-гидроксилизин. Добавление сайтов гликозилирования в антитело традиционно выполняют посредством изменения аминокислотной последовательности так, чтобы она содержала одну или несколько из вышеописанных трипептидных последовательностей (для сайтов N-гликозилирования). Изменение также может быть выполнено посредством добавления или замены одним или несколькими остатками серина или треонина в последовательности исходного антитела (для сайтов O-гликозилирования).
Когда антитело содержит Fc-область, присоединенный к ней углевод может быть изменен. Например, антитела со зрелой углеводной структурой, в которой отсутствует фукоза, присоединенная к Fc-области антитела, описаны в патентной заявке США № US 2003/0157108 (Presta, L.). См. также US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Антитела с разрезанным N- ацетилглюкозамином (GlcNAc) в углеводе, присоединенном к Fc-области антитела, упоминались в WO 2003/011878, Jean-Mairet et al. и патенте США № 6602684, Umana et al. Об антителах по меньшей мере с одним остатком галактозы в олигосахариде, который присоединен к Fc-области антитела, сообщалось в WO 1997/30087, Patel et al. См. также WO 1998/58964 (Raju, S.) и WO 1999/22764 (Raju, S.) касательно антител с измененным углеводом, присоединенным к их Fc-области. Также в US 2005/0123546 (Umana et al.) см. про антигенсвязывающие молекулы с модифицированным гликозилированием.
Предпочтительный вариант гликозилирования в настоящем документе содержит Fc-область, где в присоединенной к Fc-области углеводной структуре отсутствует фукоза. Такие варианты обладают улучшенной функцией АЗКЦ. Необязательно в настоящем документе Fc-область дополнительно содержит одну или несколько замен аминокислот, которые дополнительно улучшают АЗКЦ, например, замены в положениях 298, 333 и/или 334 Fc-области (нумерация остатков по Eu). Примеры публикаций, имеющих отношение к «дефукозилированным» или «фукозонедостаточным» антителам, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87:614 (2004). Примеры клеточных линий, которые продуцируют дефукозилированные антитела, включают клетки Lec13 CHO с дефицитом фукозилирования белка (Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986); заявка на патент США № US 2003/0157108 A1, Presta, L; и WO 2004/056312 A1, Adams et al., в частности, в примере 11), и клеточные линии с нокаутом, например, гена альфа-1,6-фукозилтрансферазы, FUT8, клетки CHO с нокаутом (Yamane-Ohnuki et al. Biotech. Bioeng. 87:614 (2004)).
(xii) Изготовление рекомбинантных антител
Для изготовления рекомбинантного антитела нуклеиновую кислоту, которая его кодирует, выделяют и встраивают в реплицируемый вектор для дальнейшего клонирования (амплификация ДНК) или для экспрессии. ДНК, кодирующую моноклональное антитело, легко выделить и секвенировать с использованием традиционных процедур (например, с использованием олигонуклеотидных зондов, которые способны связываться, в частности, с генами, кодирующими тяжелую и легкую цепи антитела). Доступно множество векторов. Компоненты вектора, как правило, включают в качестве неограничивающих примеров один или несколько из следующих компонентов: сигнальная последовательность, участок начала репликации, один или несколько маркерных генов, энхансерный элемент, промоторы и последовательность терминации транскрипции (например, как описано в патенте США № 5534615, специально включенном в настоящий документ в качестве ссылки).
Клетки-хозяева, пригодные для клонирования или экспрессии ДНК в векторах, в настоящем документе представляют собой прокариотические, дрожжевые или высшие эукариотические клетки, которые описаны выше. Пригодные для этой цели прокариоты включают эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serrafia, например, Serratia marcescans, и Shigeila, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, которая раскрыта в DD 266710 от 12 апреля 1989 года), Pseudomonas, такие как P. aeruginosa и Streptomyces. Одним из предпочтительных клонирующих реципиентов E. coli является E. coli 294 (ATCC 31446), хотя пригодны и другие штаммы, такие как E. coli B, E. coli Х1776 (ATCC 31537) и E. coil W3110 (ATCC 27325). Эти примеры являются иллюстративными, а не ограничивающими.
В дополнение к прокариотам, эукариотические микроорганизмы, такие как мицелиальные грибы или дрожжи, пригодны в качестве хозяев для клонирования или экспрессии антитело-кодирующих векторов. Saccharomyces cerevisiae, или обычные пекарские дрожжи, являются наиболее общеупотребительными среди низших эукариотических микроорганизмов-хозяев. Однако множество других родов, видов и штаммов широко доступно и может использоваться в настоящем документе, например, Schizosaccharomyces pombe; хозяйские организмы Kluyveromyces, такие как, например, K. lactis, K. Fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070); Candida; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и мицелиальные грибы, например, такие как хозяйские организмы Neurospora, Penicillium, Tolypocladium и Aspergillus, такие как A. nidulans и A. niger.
Пригодные клетки-хозяева для экспрессии гликозилированного антитела получают из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие пермиссивные клетки-хозяева насекомых из таких хозяйских организмов, как Spodoptera frugiperda (гусеница), Aedes aegypti (москит), Aedes albopictus (москит), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Общедоступны различные вирусные штаммы для трансфекции, например, вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы можно использовать в настоящем документе в качестве вируса по настоящему изобретению, особенно для трансфекции клеток Spodoptera frugiperda. Растительные клеточные культуры из хлопка, кукурузы, картофеля, соевых бобов, петунии, томата и табака также могут использоваться в качестве хозяйских организмов.
Однако больший интерес представляют клетки позвоночных, и размножение клеток позвоночных в культуре (тканевая культура) стало рутинной процедурой. Примеры хозяйских клеточных линий млекопитающих, которые можно использовать, включают линию клеток CV1 из почки обезьяны, трансформированных вирусом SV40 (COS-7, ATCC CRL 1651); эмбриональную линию из почки человека (293 или клетки 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки новорожденного хомяка (BHK, ATCC CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); мышиные клетки Сертоли (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки зеленой африканской обезьяны (VERO-76, ATCC CRL-1587); клетки цервикальной карциномы человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); бычьи крысиные клетки печени (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); мышиную опухоль молочной железы (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N. Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4 и линию гепатомы человека (Hep G2).
Клетки-хозяева клонировали с использованием вышеописанных экспрессионных или клонирующих векторов для продукции антитела и культивировали в традиционных питательных средах, модифицированных соответствующим образом, чтобы индуцировать промоторы, отбирать трансформанты или амплифицировать гены, кодирующие желаемые последовательности.
Клетки-хозяева, используемые для синтеза антитела по данному изобретению, можно культивировать в различных средах. Коммерчески доступные среды, такие как F10 Хама (Sigma), минимальная поддерживающая среда (MEM) (Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла ((DMEM), Sigma), пригодны для культивирования клеток-хозяев. Кроме того, любую среду, описанную в публикациях Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патенты США №№ 4767704; 4657866; 4927762; 4560655 или 5122469; WO 90/03430; WO 87/00195 или патент США № Re. 30985, можно использовать в качестве среды для культивирования клеток-хозяев. В любую из этих сред по мере необходимости можно добавлять гормоны и/или другие факторы роста (такие как инсулин, трансферрин или эпидермальный фактор роста), соли (такие как хлорид натрия, кальция, магния и фосфат), буферы (такие как HEPES), нуклеотиды (такие как аденозин и тимидин), антибиотики (такие как ГЕНТАМИЦИН™), микроэлементы (определяемые как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозу или эквивалентный источник энергии. Любые другие необходимые добавки могут быть включены в соответствующих концентрациях, которые будут известны специалистам в данной области. Условия культивирования, такие как температура, pH и т.п., являются такими же, как уже использованные для клеток-хозяев, выбранных для экспрессии, и будут очевидны среднему специалисту.
При использовании рекомбинантных способов антитело может продуцироваться внутриклеточно, в периплазматическом пространстве или непосредственно секретироваться в среду. Если антитело продуцируется внутриклеточно, на первой стадии дебрис из макрочастиц, или из клеток-хозяев или из лизированных клеток, удаляют, например, посредством центрифугирования или ультрафильтрации. Когда антитело секретируется в среду, супернатанты из таких систем экспрессии, как правило, сначала концентрируют с использованием коммерчески доступного фильтра для концентрирования белка, например, установка для ультрафильтрации Amicon или Millipore Pellicon. Ингибитор протеазы, такой как PMSF, может быть включен в любую из вышеупомянутых стадий для ингибирования протеолиза, а антибиотики могут быть включены для предотвращения роста случайных контаминантов.
Композиция антитела, изготовленная из клеток, может быть очищена с использованием, например, гидроксилапатитной хроматографии, электрофореза в геле, диализа и аффинной хроматографии, при этом аффинная хроматография является предпочтительным способом очистки. Пригодность белка A в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, который присутствует в антителе. Белок A можно использовать для очистки антител, которые основаны на тяжелых цепях γ, γ2 или γ4 человека (Lindmark et al., J. Immunol. Meth. 62: 1-13 (1983)). Белок G рекомендован для всех мышиных изотипов и для γ3 человека (Guss et al., EMBO J. 5:1567-1575 (1986)). Матрицей, к которой присоединяют аффинный лиганд, чаще всего является агароза, но доступны и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, делают возможными более высокие скорости потока и более короткое время обработки, чем те, что можно достичь при использовании агарозы. Когда антитело содержит домен CH3, для очистки можно использовать смолу Bakerbond ABX™ (J. T. Baker, Phillipsburg, N.J.). Другие способы очистки белка, такие как фракционирование на ионообменной колонке, преципитация этанолом, ВЭЖХ с обращенной фазой, хроматография на диоксиде кремния, хроматография на гепарин-сефарозе™, хроматография на анионо- или катионообменной смоле (например, колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и преципитация сульфатом аммония также доступны в зависимости от того, какое антитело подлежит очистке.
D. Использование антагонистов Bv8
Антагонисты Bv8 по настоящему изобретению можно использовать отдельно или в сочетании с другим терапевтическим средством(ами) для ингибирования ангиогенеза, в частности, обусловленного воспалительными клетками ангиогенеза и/или опухолеобразования.
Основными мишенями для способов лечения по настоящему изобретению являются опухоли, которые проявляют или о которых известно, что они обладают устойчивостью к лечению антагонистами VEGF, в частности антителами против VEGF.
Примеры заболеваний и расстройств, подлежащих лечению способами по настоящему изобретению, включают неопластические расстройства, такие как расстройства, описанные в настоящем документе под терминами «рак» и «раковый». Ненеопластические состояния, которые восприимчивы к лечению антагонистами по изобретению, включают в качестве неограничивающих примеров, например, нежелательную или аберрантную гипертрофию, артрит, ревматоидный артрит (РА), псориаз, псориатические бляшки, саркоидоз, атеросклероз, атеросклеротические бляшки, эдемы при инфаркте миокарда, диабетические и другие пролиферативные ретинопатии, включая синдром Терри, ретролентальную фиброплазию, неоваскулярную глаукому, возрастную дегенерацию желтого пятна, диабетический отек желтого пятна, роговичную неоваскуляризацию, неоваскуляризацию трансплантата роговицы, отторжение трансплантата роговицы, неоваскуляризацию сетчатки/хороидальной оболочки, неоваскуляризацию угла (краснота), неоваскулярные заболевания глаза, васкулярный рестеноз, артериовенозную мальформацию (АВМ), менингиому, гемангиому, ангиофиброму, гиперплазию щитовидной железы (включая базедову болезнь), трансплантацию роговицы и другой ткани, хроническое воспаление, воспаление легких, острое повреждение легких/ОРДС, сепсис, первичную легочную гипертензию, злокачественные экссудаты легких, отек мозга (например, ассоциированный с острым инсультом/закрытым повреждением головы/травмой), синовиальное воспаление, образование паннуса при РА, оссифицирующий миозит, гипертрофический остеогенез, остеоартрит (OA), рефрактерный асцит, поликистоз яичника, эндометриоз, болезней, связанных с жидкостями «третьего пространства» (панкреатит, синдром межфасциального пространства, ожоги, заболевание кишечника), фиброму матки, преждевременные роды, хроническое воспаление, такое как ВЗК (болезнь Крона и язвенный колит), отторжение аллотрансплантата почки, воспалительное заболевание кишечника, нефротический синдром, нежелательный или аберрантный рост тканевой массы (не раковой), ожирение, рост массы жировой ткани, гемофилическую артропатию, гипертрофированные рубцы, ингибирование роста волос, синдром Ослера-Вебера, пиогенную глаукому, ретролентальные фиброплазии, склеродермию, трахому, слипание сосудов, синовит, дерматит, предэклампсию, асцит, перикардиальный выпот (например, связанный с перикардитом) и плевральный выпот.
Изобретение относится к комбинированным способам лечения, в которых антагонист Bv8 по настоящему изобретению вводят в сочетании с другим способом лечения. Сочетание способов лечения, в частности, включает введение антагониста Bv8 в настоящем документе в сочетании с антагонистом VEGF, например, антителом против VEGF. Кроме того, или альтернативно, антагонисты Bv8 в настоящем документе можно вводить в сочетании с одним или несколькими дополнительными средствами, например, средством, снижающим миелоидные клетки, противораковыми средствами или препаратами, средствами против ангиогенеза или препаратами против неоваскуляризации для лечения различных неопластических или ненеопластических состояний, таких как обусловленный воспалительными клетками ангиогенез или опухолеобразование. В одном из вариантов осуществления неопластическое или ненеопластические состояние отличается патологическим расстройством, ассоциированным с аберрантным или нежелательным ангиогенезом, который устойчив к лечению антагонистами VEGF. Антагонисты по изобретению можно вводить последовательно или в сочетании с другим средством, которое эффективно для этих целей, или в одной композиции или в виде отдельных композиций. Альтернативно, или дополнительно, можно вводить несколько антагонистов, средств и/или агонистов по изобретению.
Введение антагониста и/или средств можно выполнять одновременно, например, в виде одной композиции или в виде двух или более отдельных композиций с использованием одного или различных путей введения. Альтернативно, или дополнительно, введение можно выполнять последовательно в любом порядке. В определенных вариантах осуществления интервалы в диапазоне от минут до дней до недель до месяцев могут присутствовать между введениями двух или более композиций. Например, первым может быть введен антагонист VEGF, за которым следует другой антагонист или средство, например, средство, снижающее миелоидные клетки, по изобретению (отличающееся от антагониста VEGF). Однако также рассматривается одновременное введение или сначала введение другого антагониста или средства по изобретению.
Вводимые эффективные количества терапевтических средств будут предоставлены на усмотрение врача или ветеринара. Подбор и введение дозы выполнены так, чтобы достичь максимального управления состояниями, подлежащими лечению. Доза дополнительно будет зависеть от таких факторов, как вид терапевтического средства, подлежащего использованию, и конкретный подлежащий лечению пациент. Пригодные дозировки антагониста VEGF представляют собой дозировки, используемые в настоящее время, и могут быть снижены благодаря комбинированному действию (синергизму) антагониста VEGF и другого антагониста по изобретению. В определенных вариантах осуществления сочетание ингибиторов потенцирует эффективность одного ингибитора. Термин «потенцировать» относится к улучшению эффективности терапевтического средства при его обычной или одобренной дозе. См. также в настоящем документе раздел, озаглавленный «Фармацевтические композиции».
Антиангиогенная терапия в отношении рака представляет собой стратегию лечения злокачественных опухолей, нацеленную на ингибирование развития кровеносных сосудов опухоли, необходимых для доставки питательных веществ для поддержания роста опухоли. Поскольку ангиогенез вовлечен как в первичный рост опухоли, так и в метастазирование, антиангиогенное лечение, предоставленное изобретением, допускает ингибирование неопластического роста опухоли в первичной локализации, а также предотвращение метастазирования опухолей в места вторичной локализации, следовательно, делая возможной атаку опухоли другими способами лечения. В одном из вариантов осуществления изобретения противораковое средство или препарат представляет собой антиангиогенное средство. В другом варианте осуществления противораковое средство представляет собой химиотерапевтическое средство.
Многие антиангиогенные средства были идентифицированы и известны в данной области, включая средства, которые перечислены в настоящем документе, например, перечисленные в «Определениях», и, например, в публикациях Carmeliet and Jain, Nature 407:249-257 (2000); Ferrara et al., Nature Reviews:Drug Discovery, 3:391-400 (2004); и Sato Int. J. Clin. Oncol, 8:200-206 (2003). См. также патентную заявку США US 20030055006. В одном из вариантов осуществления антагонист по изобретению используют в сочетании с нейтрализующим антителом против VEGF (или фрагментом) и/или другим антагонистом VEGF или антагонистом рецептора VEGF, включая в качестве неограничивающих примеров, например, растворимые фрагменты рецептора VEGF (например, VEGFR-1, VEGFR-2, VEGFR-3, нейропиллины (например, NRP1, NRP2)), аптамеры, способные блокировать VEGF или VEGFR, нейтрализующие антитела против VEGFR, низкомолекулярные ингибиторы тирозинкиназ VEGFR (RTK), антисмысловые стратегии для VEGF, рибозимы против VEGF или рецепторов VEGF, варианты антагонистов VEGF и любые их сочетания. Альтернативно, или дополнительно, два или более ингибитора ангиогенеза необязательно могут быть введены пациенту совместно в дополнение к антагонисту VEGF и другому средству по изобретению. В определенном варианте осуществления одно или несколько дополнительных терапевтических средств, например, противораковых средств, можно вводить в сочетании со средством по изобретению, антагонистом VEGF и/или средством против ангиогенеза.
В определенных аспектах по изобретению другие терапевтические средства можно использовать для комбинирования противоопухолевой терапии с антагонистами Bv8 по изобретению, включая другие способы лечения рака (например, хирургическое, радиологическое лечение (например, использование облучения или введение радиоактивных субстанций), химиотерапия, лечение противораковыми средствами, которые перечислены в настоящем документе и известны в данной области, или их сочетания). Альтернативно, или дополнительно, два или более антитела, связывающие один или два или более различных антигенов, описываемых в настоящем документе, могут быть введены пациенту совместно. Иногда, может быть благоприятно также вводить пациенту один или несколько цитокинов.
В определенных аспектах изобретение относится к способу блокирования или снижения роста опухоли с устойчивостью или роста злокачественной клетки посредством введения эффективных количеств антагониста VEGF и антагониста по изобретению и одного или нескольких химиотерапевтических средства пациенту, склонному к раку или с диагностированным раком. Различные химиотерапевтические средства можно использовать в комбинированных способах лечения по изобретению. В настоящем документе предоставлен образцовый и неограничивающий список химиотерапевтических средств, рассмотренный в разделе «Определения».
Среднему специалисту в данной области будет понятно, что подходящие дозы химиотерапевтических средств, как правило, будут примерно соответствовать дозам, которые уже используются в клинике, где химиотерапевтические средства вводят отдельно или в сочетании с другими химиотерапевтическими средствами. Вероятно, вариация дозировок будет происходить в зависимости от состояния, подлежащего лечению. Врач, вводящий лекарственный препарат, будет способен определить подходящую дозу для отдельного субъекта.
Изобретение также относится к способам и композициям для ингибирования или предупреждения рецидива роста опухоли или рецидива роста злокачественных клеток. Рецидив роста опухоли или рецидив роста злокачественных клеток используют для описания состояния, в котором пациенты, которые проходят или проходили лечение с помощью одного или нескольких доступных в настоящее время способов лечения (например, способов лечения рака, таких как химиотерапия, лучевая терапия, хирургическая операция, гормональная терапия и/или биологическая терапия/иммунотерапия, лечение антителами против VEGF, особенно по стандартной схеме лечения конкретного рака), не отвечают клиническим требованиям для лечения пациентов, или пациенты более не получают какой-либо положительный эффект от лечения, так что эти пациенты нуждаются в дополнительном эффективном лечении. Как применяют в настоящем документе, эта фраза также относится к состоянию «невосприимчивого/рефрактерного» пациента, например, которое описывает пациентов, которые, реагируя на лечение, также страдают от побочных эффектов, развивают резистентность, не реагируют на лечение, не реагируют на лечение в достаточной мере и т.д. В различных вариантах осуществления рак представляет собой рецидив роста опухоли или рецидив роста злокачественных клеток, где количество злокачественных клеток не было значительно снижено или было увеличено, или размер опухоли не был значительно уменьшен или был увеличен, или потерпели неудачу все дополнительные попытки уменьшить размер или количество злокачественных клеток. Определение склонности злокачественных клеток к рецидиву роста опухоли или рецидиву роста злокачественных клеток можно выполнить или in vivo, или in vitro с помощью любого известного в данной области способа для оценки эффективности лечебного воздействия на злокачественные клетки, с использованием принятых в данной области признаков «рецидива» или «рефрактерности» или «невосприимчивости» в таком контексте. Опухоль, устойчивая к лечению антагонистами VEGF, является примером рецидивирующего роста опухоли.
Изобретение относится к способам блокирования или снижения рецидивирующего роста опухоли или рецидива роста злокачественных клеток у субъекта посредством введения одного или нескольких антагонистов по изобретению для блокирования или снижения рецидивирующего роста опухоли или рецидива роста злокачественных клеток у субъекта. В определенных вариантах осуществления антагонист можно вводить вслед за противораковым средством. В определенных вариантах осуществления антагонисты по изобретению вводят одновременно противораковой терапией, например, химиотерапией. Альтернативно, или дополнительно, лечение антагонистами чередуют с другими способами лечения рака, которые можно выполнять в любом порядке. Изобретение также относится к способам для введения одного или нескольких ингибирующих антител для предотвращения появления или рецидива рака у пациентов, предрасположенных к раку. Как правило, субъект подвергался или параллельно подвергается противораковой терапии. В одном из вариантов осуществления противораковая терапия представляет собой лечение средством против ангиогенеза, например, антагонистом VEGF. Средство против ангиогенеза включает средства, известные в данной области, и средства, которые можно найти в настоящем документе в «Определениях». В одном из вариантов осуществления средством против ангиогенеза являются нейтрализующее антитело против VEGF или фрагмент (например, гуманизированное A4.6.1, АВАСТИН® (Genentech, South San Francisco, CA), Y0317, M4, G6, B20, 2C3, и т.д.). См., например, патенты США 6582959, 6884879, 6703020; WO 98/45332; WO 96/30046; WO 94/10202; EP 0666868 B1; патентные заявки США 20030206899, 20030190317, 20030203409 и 20050112126; Popkov et al., Journal of Immunological Methods 288:149-164 (2004); и WO 2005012359. Дополнительные средства можно вводить в сочетании с антагонистом VEGF и антагонистом по изобретению для блокирования или снижения рецидивирующего роста опухоли или рецидивирующего роста злокачественных клеток, например, см. раздел «Способы комбинированного лечения» в настоящем документе.
В одном из вариантов осуществления антагонисты Bv8 по изобретению можно вводить в сочетании с одним или несколькими средствами, снижающими миелоидные клетки, включая в качестве неограничивающих примеров лекарственные средства, которые снижают экспрессию Gr1, эластазы нейтрофилов, MCP-1, MIP-1 альфа, URCGP или URRTP. Средства, снижающие миелоидные клетки, для использования в сочетании с антагонистами Bv8 по настоящему изобретению в частности включают антагонисты Gr1, антагонисты Cd11b, антагонисты CD18, ингибиторы эластазы, антагонисты MCP-1, антагонисты MIP-1 альфа, клодронат, по отдельности или в любом сочетании.
Кроме того, антагонисты Bv8 по настоящему изобретению можно вводить в сочетании с гормональными, радиационными и химиотерапевтическими средствами, таким образом повторно сенсибилизируя злокачественные клетки одним или несколькими из этих средств, которые затем могут быть введены (или можно продолжать введение) для лечения или ведения рака, включая предупреждение метастазирования.
Опухоль, восприимчивую к лечению антагонистом VEGF, можно определить посредством предоставления одной или нескольких тестовых клеточных популяций субъекта, которые содержат клетки, способные экспрессировать одну или несколько последовательностей нуклеиновых кислот, которые гомологичны нуклеиновой кислоте, которая кодирует URCGP, DRCGP, URRTP или DRRTP. Экспрессию последовательностей сравнивают с эталонной клеточной популяцией. Можно использовать любую эталонную клеточную популяцию, при условии, что известен статус восприимчивости клеток в эталонной клеточной популяции к антагонисту VEGF. Сравнение можно осуществить на тестируемых и эталонных образцах, измеренных одновременно или раздельно во времени. Примером последнего является использование накопленной информации об экспрессии, например, базы данных о последовательностях, в которой собрана информация относительно уровней экспрессии известных последовательностей в клетках с известным статусом восприимчивости. В определенных вариантах осуществления эталонная клеточная популяция обогащена миелоидными клетками CD11b+Gr1+. В определенных вариантах осуществления эталонная клеточная популяция обогащена опухолевыми клетками.
Опухоли, устойчивые к лечению антагонистами VEGF, также можно идентифицировать с использованием наборов диагностических маркеров, которые предоставлены в совместно поданной заявке с серийным № 11/692682 от 28 марта 2007 года. Например, набор маркеров может содержать два или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, девять или более, десять или более, двенадцать или более, тринадцать или более, четырнадцать или более, пятнадцать или более, двадцать или более или полный набор молекул. Молекула представляет собой нуклеиновую кислоту, которая кодирует белок или белок с измененной экспрессией и/или активностью, и выбрана из следующих: Notch2, DMD8, MCP-1, ITGB7, G-CSF, ИЛ-8R, MIP2, MSCA, GM-CSF, ИЛ-1R, Meg-SF, HSP1A, ИЛ-1R, G-CSFR, ИЛ-10R1, Erb-2.1, кавеолин 3, Semcap3, INTG4, THBSP-4, ErbB3, JAM, Eng, JAM, Eng, JAM-2, Pecam1, Tlr3, эластаза нейтрофилов, CD14, expi, ИЛ-13R, LDLR, TLR-1, RLF, Endo-Lip, SOCS13, FGF13, ИЛ-4R, THBS1, Crea7, аквапорин-1, SCF38, APOE, FABP, ИЛ-11R, ИЛ-1RII, IFN TM1, TNFRSF18, WNT5A, секреторный мембранный переносчик 1, HSP86, EGFR, EphRB2, GPCR25, HGF, ангиопоэтиподнобный-6, Eph-RA7, семафорин VIb, нейротрофин 5, клаудин-18, MDC15, ECM, ADAMTS7B, NCAM-140, фибронектин III типа, WIP, CD74, ICAM-2, Jagged1, Itga4, ITGB7, TGF-BII-R, TGFb IEP, Smad4, BMPR1A, CD83, дектин-1, CD48, E-селектин, ИЛ-15, супрессор цитокиновой передачи сигналов 4, Cytor4, CX3CR1, IGF2, HSP9A, FGF18, ELM1, Ledgfa, фагоцитарный рецептор типа A, макрофагальный лектин C-типа, Pigr3, макрофагальный SRT-1, G белок-связанный рецептор, ScyA7, ИЛ-1R2, ИЛ-1 индуцибельный белок, ИЛ-1 бета, прекурсор ILIX, TGF-B, FIZZ1, Wfs1, TP 14A, EMAP, SULF-2, внеклеточный матрикс 2, CTFG, TFPI, XCP2, Ramp2, ROR-альфа, эфрин B1, SPARC-подобный 1 и семафорин A. В одном из вариантов осуществления изобретения предоставлено антитело, которое обнаруживает белок. В одном из вариантов осуществления молекулы получены из клеток CD11b+Gr1+ и включают, например, ИЛ-13R, TLR-1, Endo-Lip, FGF13, ИЛ-4R, THBS1 и Crea7. В другом варианте осуществления молекулы получены из опухолей с устойчивостью и включают, например, MSCA, MIP2, ИЛ-8R, G-CSF, ИЛ-10R2, THBSP-4 и JAM-2.
E. Фармацевтические композиции и введение
Антагонисты Bv8, такие как антитела против Bv8, по настоящему изобретению, отдельно или в сочетании с другими терапевтическими средствами, вводят пациенту-человеку, в соответствии с известными способами, такими как внутривенное введение ударной дозы или посредством непрерывной инфузии в течение периода времени, через внутримышечный, интраперитонеальный, интрацереброспинальный, подкожный, внутрисуставной, интрасиновиальный, интратекальный, пероральный, местный или ингаляционный путь и/или посредством подкожного введения.
В определенных вариантах осуществления лечение по изобретению включает комбинированное введение антагониста Bv8 и антагониста VEGF и/или одного или нескольких средств, снижающих миелоидные клетки, или химиотерапевтических средств. В одном из вариантов осуществления присутствуют дополнительные противораковые средства, например, одно или несколько различных средств против ангиогенеза, одно или несколько химиотерапевтических средств и т.д. В изобретении также рассматривается введение нескольких ингибиторов, например, нескольких антител к одному антигену или нескольких антител к различным белкам по изобретению. В одном из вариантов осуществления в настоящем документе коктейль из различных химиотерапевтических средств вводят вместе с антагонистом Bv8. Комбинированное введение включает совместное введение, с использованием отдельных составов или единого фармацевтического состава, и/или последовательное введение в любом порядке. Например, антагонист VEGF может предшествовать, следовать или чередоваться с введением антагониста Bv8, или к тому же может быть введен одновременно. В одном из вариантов осуществления имеет место период времени, в течение которого оба (или все) активных средства одновременно проявляют свои биологические активности.
Для предупреждения или лечения заболевания подходящая дозировка средства по изобретению будет зависеть от вида заболевания, подлежащего лечению, как определено выше, тяжести и течения заболевания, вводили ли ингибитор для превентивных или терапевтических целей, предшествующей терапии, истории болезни пациента и ответа на ингибитор, и усмотрения лечащего врача. Ингибитор соответствующим образом вводят пациенту за один раз или в виде серии введений. В схеме комбинированного лечения композиции по изобретению вводят в терапевтически эффективном количестве или терапевтически синергическом количестве. Как применяют в настоящем документе, терапевтически эффективное количество представляет собой такое количество, при котором введение композиции по изобретению и/или совместное введение антагониста VEGF и одного или нескольких других терапевтических средств приводит к уменьшению или подавлению целевого заболевания или состояния. Эффект от введения комбинации средств может быть аддитивным. В одном из вариантов осуществления результатом введения является синергетический эффект. Терапевтически синергетическое количество представляет собой количество антагониста VEGF и одного или нескольких других терапевтических средств, например, антагониста Bv8 и необязательно средства, снижающего миелоидные клетки, химиотерапевтического средства и/или противоракового средства, которое необходимо для синергетического или значительного уменьшения или элиминации состояния или симптомов, связанных с конкретным заболеванием.
В зависимости от вида и тяжести заболевания, приблизительно от 1 мкг/кг до 50 мг/кг (например, 0,1-20 мг/кг) антагониста Bv8, антагониста VEGF, средства, снижающего миелоидные клетки, химиотерапевтического средства или противоракового средства представляют собой начальную возможную дозировку для введения пациенту, например, или посредством одного или нескольких отдельных введений, или посредством непрерывной инфузии. Типичная дневная дозировка может варьировать приблизительно от 1 мкг/кг приблизительно до 100 мг/кг или более, в зависимости от факторов, которые отмечены выше. При повторных введениях через несколько дней или более, в зависимости от состояния, лечение продолжают до тех пор, пока не наступит желаемое подавление симптомов заболевания. Однако можно использовать другие режимы дозирования. Типично практикующий врач будет вводить молекулы по изобретению до тех пор, пока дозировка не достигнет значения, которое обеспечивает необходимый биологический эффект. За прогрессом лечения по изобретению легко наблюдать с помощью общепринятых способов и тестов.
Например, схемы изготовления и дозирования для ингибиторов ангиогенеза, например, антител против VEGF, таких как АВАСТИН® (Genentech), могут применяться в соответствии с инструкциями производителя или быть определены эмпирически квалифицированным практиком. В другом примере схемы изготовления и дозирования для таких химиотерапевтических средств могут применяться согласно инструкциям производителя или быть определены эмпирически квалифицированным практиком. Схемы изготовления и дозирования для химиотерапевтических средств также описаны в Chemotherapy Service Ed, MC. Perry, Williams & Wilkins, Baltimore, MD (1992).
Эффективность лечения по изобретению может быть измерена с помощью различных ожидаемых результатов, общеупотребительных при оценке неопластических или ненеопластических расстройств. Например, способы лечения злокачественных опухолей можно оценить посредством, например, но без ограничений, регрессии опухоли, сокращения массы или размера опухоли, времени до прогрессирования заболевания, продолжительности существования, выживаемости без прогрессирования, общего показателя ответной реакции, длительности ответа, качества жизни, экспрессии и/или активности белка. Поскольку антиангиогенные средства, описываемые в настоящем документе, нацелены на сосудистую сеть опухоли и необязательно на сами неопластические клетки, они представляют уникальный класс противораковых лекарственных средств и, следовательно, могут потребовать уникальных количественных показателей и определений для клинических реакций на лекарственные средства. Например, уменьшение опухоли более чем на 50% при двухмерном анализе является стандартным порогом, чтобы признать реакцию. Однако ингибиторы по изобретению могут вызывать ингибирование распространения метастазов без уменьшения первичной опухоли, или могут просто оказывать на опухоль статический эффект. Таким образом, можно использовать подходы для определения эффективности лечения, включая, например, измерение маркеров ангиогенеза в плазме и моче и измерение реакции посредством рентгеновской визуализации.
В другом варианте осуществления изобретения предоставлено промышленное изделие, содержащее материалы, которые можно использовать для лечения заболеваний или диагностики заболеваний, описанных выше. Промышленное изделие содержит контейнер, этикетку и вкладыш в упаковку. Пригодные контейнеры включают, например, бутылки, сосуды, шприцы и т.д. Контейнеры могут быть выполнены из различных материалов, таких как стекло или пластик. В одном из вариантов осуществления контейнер содержит композицию, которая эффективна для лечения состояния и может иметь стерильный входной канал (например, контейнер может представлять собой емкость для внутривенного раствора или сосуд с затычкой, протыкаемой иглой для подкожных инъекций). По меньшей мере одно активное средство в композиции является модулятором VEGF, и по меньшей мере второе активное средство представляет собой средство, снижающее миелоидные клетки, и/или химиотерапевтическое средство. Этикетка, расположенная на контейнере или прикрепленная к нему, указывает на то, что композиция используется для лечения выбранного состояния. Промышленное изделие может дополнительно содержать второй контейнер, который содержит фармацевтически приемлемый буфер, например, фосфатно-солевой буфер, раствор Рингера и раствор декстрозы.
Дополнительные подробности изобретения проиллюстрированы с помощью следующих неограничивающих примеров.
Пример 1
Материалы и способы
Анализ экспрессии генов с помощью Taqman™
РНК из тканей или клеток изготавливали с использованием RNeasy Mini Kit® (Qiagen). Использовали по 50 нг общей РНК на реакцию анализа ПЦР в реальном времени (Taqman™). Для мышиного/человеческого Bv8 и EG-VEGF/Bv8 рецептора 1 (PKR-1/EG-VEGFR1, R-1), РНК из семенников (BD Biosciences) служила в качестве контроля. Для мышиного/человеческого EG-VEGF/Bv8 рецептора 2 (PKR-2/EG-VEGFR2, R2), гипоталамус или цельный мозг (BD Biosciences) служил в качестве контрольных тканей. Реакции проводили в режиме 9600 Emulation mode на системе 7500 Real (Perkin Elmer) time PCR (Applied Biosystems) и по калибровочной кривой определяли абсолютное количество с использованием программного обеспечения Sequenct Detection System (SDS). Уровень экспрессии каждого гена дополнительно определяли количественно относительно облигатного гена RPL19 в том же образце. Для подтверждения экспрессии VEGFR-1, VEGFR-2, EG-VEGF/Bv8 R1 и EG-VEGF/Bv8 R2 в опухоль-ассоциированных эндотелиальных клетках, стандартную RT-ПЦР проводили с использованием системы Titan One Tube™ RT-PCR (Roche), и конечные продукты проверяли в 2% агарозном геле (Invitrogen) для уточнения размеров. У праймеров Taqman™ были следующие последовательности:
Мышиный Bv8 прямой: GCA TGA CAG GAG TCA TCA TTT T (SEQ ID NO:7), обратный: AAA TGG CAG GAT ATC AGG AAA (SEQ ID NO:8), зонд: AAA CTT TAT TTG TAA CCC AAA GGT CTA ATG TAA ATG GA (SEQ ID NO:9);
Человеческий Bv8 прямой: ATG GCA CGG AAG CTA GGA (SEQ ID NO:10), обратный: GCA GAG CTG AAG TCC TCT TGA (SEQ ID NO:11), зонд: TGC TGC TGG ACC CTT CCT AAA CCT (SEQ ID NO:12);
Мышиный Bv8 R1 прямой: CAG CGC ACA TGA AGA CTT G (SEQ ID NO:13), обратный: GTC ATC TTC GGT TTC CTG AGT (SEQ ID NO:14), зонд: TCC AGG CAG CAC CCC TGA TG (SEQ ID NO:15);
Мышиный Bv8 R2 прямой: GAA CTC CAC GTG AGC GCA (SEQ ID NO:16), обратный: GGG TCC CAT GTT GAT GAT GC (SEQ ID NO:17), зонд: CTC CCT GAT ACA CAC CAG CCC ACC TG (SEQ ID NO:18);
Человеческий Bv8 R1 прямой: CTG GAA GGC TTC TTA CAA TGG (SEQ ID NO:19), обратный: GGC ATC CCA ATT GTC TTG A (SEQ ID NO:20), зонд: TCC AGG TCT GCA CTG GAC TTA CCG (SEQ ID NO:21);
Человеческий Bv8 R2 прямой: TCA CCA TCG TTC GTG ACT TC (SEQ ID NO:22), обратный: AGA AGG CAG TGA GGT AGT GCT T (SEQ ID NO:23), зонд: TCC TTC ACG AAC ACA GTG GGG AA (SEQ ID NO:24);
Мышиный RPL19 прямой: AGG TCA AAG GGA ATG TGT TCA AA (SEQ ID NO:25), обратный: CCT TGT CTG CCT TCA GCT TGT (SEQ ID NO:26), зонд: ACA AGC GCA TCC TCA TGG AGC ACA TC (SEQ ID NO:27);
Человеческий RPL19 прямой: CGC AAG CGC CGT GAA (SEQ ID NO:28), обратный: GGT CTC TTC CTC CTT GGA TAA ACT C (SEQ ID NO:29), зонд: CCA GGC CAA GAA GGA GGA GAT CAT CA (SEQ ID NO:30);
Проточная цитометрия
Мононуклеарные клетки КМ (МНККМ), ПК и опухолевые клетки собирали у мышей, которым имплантировали несколько типов опухолей. Красные кровяные клетки лизировали с использованием буфера для лизиса Ack (Cambrax, MA), с последующим окрашиванием крысиными антителами против CD11b мыши (Myletnyi Biotech, CA), конъюгированными с APC, и крысиными антителами против Gr1 мыши (BD Biosciences, CA), конъюгированными с PE. Для удаления мертвых клеток добавляли 7AAD (аминоактиномицин D; BD Biosciences CA) во все образцы перед регистрацией данных на приборе FACSCalibur.
Тесты на миграцию
МНККМ выделяли из наивных бежевых голых мышей и популяцию CD11b+Gr1+ отсортировывали с использованием микробус для CD11b (Miltenyi Biotech, CA), в соответствии с протоколами, предоставленными производителем. Аликвоту отсортированных клеток окрашивали антителами против CD11bAPC и против Gr1-PE, чтобы гарантировать чистоту (100%) клеток CD11b+Gr1+. Для теста на миграцию 2,0·105 клеток высевали в верхнюю камеру проницаемых лунок (Corning Incorporated, NY). В нижней камере содержалось 600 мкл среды (IMDM (Gibco BRL, CA) с добавлением BIT (Stem Cell Technologies, BC, Canada), содержащей Bv8 человека, контрольное антитело и мышиный рекомбинантный VEGF в отдельных лунках. Клетки инкубировали при 37°C и 5% CO2 в течение 9 часов и миграцию клеток CD11b+Gr1+ оценивали посредством подсчета клеток в нижней камере.
Регулирование экспрессии гена Bv8 в культивируемых клетках BMMN
Рекомбинантные мышиные MCP-1, MIP-1α, MIP-1β, MIP-2, bFGF, VEGF, GM-CSF, G-CSF, SDF-1 и TNFα приобретали в R&D Systems (Minneapolis, MN). Рекомбинантные мышиные KC, IFNγ, Bv8 (прокинетицин-2), ИЛ-4, ИЛ-10, ИЛ-13, TGF-β приобретали в PeproTech Inc. (Rocky Hill, New Jersey). Все цитокины использовали в концентрации 10 нг/мл за исключением VEGF и Bv8, которые тестировали при концентрациях 50 нг/мл. Кондиционированную среду использовали в разведении 1:3 (конечная концентрация FBS составляла 0,17%). Данные нормализовали относительно общего количества клеток. Клетки КМ вымывали из костей задних конечностей мышей струей среды DMEM, содержащей 10% FBS. Клетки центрифугировали при 1200 об/мин в течение 5 мин и ресуспендировали в среде HBSS, содержащей 0,2% БСА (слабый эндотоксин, Serologicals Corp. Norcross, GA). Два миллиона клеток инкубировали в 24-луночных планшетах с различными цитокинами в течение 4 часов при 37°C в инкубаторе с 5% CO2. Затем клетки переносили в пробирки Эппендорф, центрифугировали и лизировали в РНК буфере для лизиса (Qiagen, Valencia, CA). Экспрессию Bv8 оценивали с помощью Taqman™ с использованием RPL19 (рибосомальный белок L19) в качестве облигатного контрольного гена. В некоторых случаях КМ клетки CD11b+Gr1+ или CD11b-Gr1- получали с использованием FACS-сортировки.
Для проверки действия антител против G-CSF на экспрессию гена Bv8, вызванную опухолевым окружением, МНККМ, выделенные из Balb/c голых мышей, обрабатывали в течение 4 часов или лизатами опухолей HM7, которые были имплантированы мышам на 24-36 часов, или контрольным буфером. Опухолевые лизаты предварительно инкубировали с козьим нейтрализующим поликлональным IgG против G-CSF (AF-414-NA, R&D Systems) или контрольным козьим IgG (R&D Systems) при различных концентрациях в течение 45 мин перед добавлением к МНККМ. Подтверждали способность IgG против G-CSF блокировать мышиный и человеческий G-CSF. Впоследствии оценивали экспрессию Bv8 в МНККМ с использованием теста Taqman™. Для исследования использовали 9 животных и анализировали данные из 3 независимых исследований.
Сбор среды, кондиционированной опухолевыми клетками
Клетки A673, HM7, HPAC и Calu6 культивировали в средах для выращивания до тех пор, пока они не достигали ~90% конфлюентности. Затем среды для выращивания заменяли на среду DMEM:F12 (50:50), содержащую 0,5% FBS. Экспоненциально растущим клеткам TIB42 при плотности 5×105/мл среду заменяли на DMEM:F12, содержащую 0,5% FBS. Кондиционированную среду собирали после трех дней инкубирования. Жизнеспособность клеток и общее количество клеток измеряли с использованием анализатора жизнеспособности клеток Vi-Cell™XR (Beekman Coulter).
Тесты на пролиферацию опухолевых клеток
Клетки A673, HM7, HPAC и Calu6 трипсинизировали и промывали в среде, содержащей 0,5% FBS, перед высеванием в 96-луночные черные Viewplate (Packard Bioscience Company. Meriden. CT). Клетки инкубировали с различными количествами Bv8 (PeproTech Inc., Rocky Hill, NJ) в течение 3 дней. Среда, содержащая 10% FBS, служила в качестве положительного контроля. Клеточную пролиферацию оценивали по инкорпорированию BrdU с использованием набора Cell Proliferation ELISA (Roche).
Исследования G-CSF и антител против G-CSF in vivo
Мышам Balb/c в возрасте восьми недель подкожно инъецировали 10 мкг рекомбинантного G-CSF человека (Neupogen, Amgen) ежедневно в течение восьми последующих дней. Контрольные животные получали PBS. В конце исследования для анализа забирали образцы КМ, цельной крови и селезенки. Одну группу животных содержали в течение двух дней после отмены G-CSF. Количество нейтрофилов определяли с использованием автоматического цитофлуометрического гематологического анализатора с высоким разрешением (CellDyn 3000). Уровни Bv8 в сыворотке и КМ измеряли с помощью ELISA. Для определения роли Bv8 в G-CSF-индуцированной мобилизации клеток CD11b+Gr1+, голые мыши Balb/c получали две дозы антител против Bv8 (5+5 мг/кг), с перерывом в 12 часов, за которыми следовал G-CSF (R&D Systems; 2 мкг/мышь) через четыре часа после второй дозы мАТ. В качестве положительного контроля использовали крысиные АТ против G-CSF мыши (Mab414, R&D Systems; 10 мкг/мышь), которые давали через такой же интервал, что и АТ против Bv8, за которым следовал мышиный G-CSF. Через шесть часов у мышей забирали кровь и определяли частоту клеток CD11b+Gr1+, как описано. Для определения роли G-CSF в регулировании экспрессии Bv8 при отсутствии опухоли, голые мыши Balb/c ежедневно получали интраперитонеальные инъекции контрольного крысиного IgG (Genentech) или крысиных мАТ против G-CSF (Mab414, R&D Systems, 10 мкг/мышь) в течение восьми последующих дней. Животных умерщвляли, и все белки экстрагировали из МНККМ. Уровни Bv8 измеряли в помощью ELISA, как описано. Для оценки влияния G-CSF на регулирование экспрессии Bv8 в опухолях, голым мышами Balb/c предварительно вводили по 10 мкг крысиных мАТ против G-CSF или крысиного IgG, как описано выше, через 12 часов после имплантации клеток HM7 (5·106 клеток на мышь). В качестве контроля имплантировали пустой Matrigel™. Затем животным вводили антитела ежедневно в течение двух дней. Через 48 часов после имплантации Matrigel™ или опухоли мышей умерщвляли, и уровни Bv8 в МНККМ измеряли, как описано выше.
Создание и скрининг нейтрализующих антител против Bv8
Создавали мышиные моноклональные антитела, направленные против рекомбинантного белка Bv8 человека. Проводили скрининг антитела с использованием двух независимых тестов. Один тест основан на способности белка Bv8 индуцировать пролиферацию эндотелиальных клеток, выделенных из коры надпочечников коровы, как описано (LeCouter et al., 2003, выше). Второй тест основан на способности Bv8 индуцировать каскад передачи сигналов в клетках яичника китайского хомячка (CHO), которые стабильно экспрессируют все его рецепторы. В кратком изложении, клетки CHO, которые стабильно экспрессируют ген β-лактамазы под контролем промоторов NFAT (Invitrogen), выращивали в DMEM с добавлением 10% эмбриональной телячьей сыворотки. кДНК PKR1 или PKR2 человека (Masuda, Y., et al, выше, и Lin, D. C. et al., выше) переносили в pMSCV-Hygromycin. Клетки, которые экспрессировали перенесенный ген, отбирали в 500 мг/мл гигромицина в течение 2 недель. Затем отвечающие клетки выделяли посредством FACS-сортировки по их способности расщеплять флуоресцентный субстрат CCF4 на основе FRET с последующей 16-часовой стимуляцией с использованием hBv8, как предлагалось производителем. Нейтрализующие антитела идентифицировали по их способности блокировать Bv8-индуцированную экспрессию β-лактамазы. Клетки CHO с β-лактамазой под контролем NFAT и PKR1 или PKR2 стимулировали с помощью hBv8 в концентрации 100-200 нг/мл в течение 16 часов в присутствии или в отсутствие очищенных моноклональных антител мыши против Bv8 в различных концентрациях. После стимулирования клетки инкубировали с CCF4 в течение 1 часа и флуоресценцию измеряли в ридере 96-луночных планшетов Envision™ (Perkin Elmer). Для того чтобы напрямую установить роль Bv8 в процессе опухолеобразования, использовали нейтрализующие моноклональные антитела (мАТ) против Bv8. Использовали мышиные мАТ 3F1 и 2B9, которые проявляют перекрестную реактивность с Bv8 мыши и человека. Эти мАТ выбирали, исходя из их способности ингибировать Bv8-стимулированную клеточную пролиферацию эндотелия коры надпочечников (LeCouter et al., Nature 412:877-884 (2001)) и ингибировать передачу сигналов в клетках CHO, трансфицированных с помощью Bv8 GPCR. мАТ 2B9 максимально ингибировали ~70% митогенного эффекта белков Bv8 человека и мыши, тогда как мАТ 3F1 ингибировали 50%. Однако сочетание двух мАТ, каждое в концентрации 5-10 мкг/мл, полностью блокировало митогенные эффекты, вызванные 100 нг/мл Bv8 человека или мыши. Антитела, которые тестировали по отдельности или в комбинации, не обладали действием на пролиферацию клеток эндотелия при базовых условиях или после стимуляции структурно отдаленным VEGF-A или структурно близким EG-VHGF. Также, ни мАТ против Bv8, ни сам Bv8 не имели обнаружимого эффекта на пролиферацию линий опухолевых клеток, которые тестировали в этом исследовании, в широком диапазоне концентраций (данные не приведены).
Для определения наиболее эффективной схемы лечения in vivo, в начальных экспериментах проводили исследования эффекта дозы для мАТ 3F1 и 2B9, по отдельности и в сочетании, в модели A673. Как было предсказано по данным, полученным in vitro, сочетание двух мАТ было более эффективным, чем отдельное мАТ. Введением 5 мг/кг каждого мАТ дважды в неделю достигали максимального ингибиторного воздействия на рост опухоли. Следовательно, эту схему использовали во всех последующих решающих экспериментах. В дополнение к рабдомиосаркоме A673 тестировали дополнительные модели, включая клеточные линии HM-7 человека, Jurkat, HPAC и Calu-6 и мышиные лимфомы EL-4 и TIB42.
Исследования опухолей in vivo
Линии опухолевых клеток человека Calu-6, A-673, JURKAT, HPAC и HM7, а также линии мышиных лимфом EL-4 и TIB42 выращивали в среде Хама F12, DMEM 1:1 с низким содержанием глюкозы с добавлением 10% об./об. FBS, 1% об./об. пенициллина/стрептомицина, 2 мМ L-Gln и 1 мкг/мл Фунгизона™ (Invitrogen™, CA). Клетки инкубировали при 37°C в атмосфере из 95% воздуха/5% CO2. Для экспериментов по ксенотрансплантации на мышах, опухолевые клетки суспендировали в концентрации 1·108 клеток/мл и инъецировали (100 мкл/мышь) подкожно сзади в бок или мышам Balb/c или бежевым голым XID иммунодефицитным мышам (Harlan Sprague Dawley, IN). В моменты времени через 24 или 48 часов после инокуляции опухолевых клеток начинали интраперитонеальное введение мАТ 2B9 и 3F1 против Bv8, при общей дозе 10 мг/кг (по 5 мг/кг каждого мАТ) (n=10). В качестве контролей использовали мАТ против Ragweed и мАТ G6.31 или B20 против VEGF (Liang, W.C., et ah, J Biol. Chem. 281, 951-961 (2006)). Впоследствии мыши получали препараты дважды в неделю. Объем опухолей вычисляли каждый второй день с использованием формулы объема эллипсоида (6×L×W×H, где L = длина, W = ширина и H = высота) (Tomayko, M.M. and Reynolds, C.P., Cancer Chemother Pharmacol 24, 148-154 (1989)). Для статистического анализа различий между группами осуществляли однофакторный дисперсионный анализ с последующим Tukey USD парным анализом с использованием программного обеспечения JMP (SAS Institute Inc.). Значимым считали p-значение <0,005.
Гистологический анализ и иммуногистохимия
Опухоли фиксировали в формалине с нейтральным буфером в течение 24 часов перед заливкой в парафин. Осуществляли окрашивание H&E и иммуногистохимию. В кратком изложении, иммуногистохимическое окрашивание крысиными мАТ MECA-32 против PLVAP мыши (BD-Pharmingen) осуществляли с использованием Target antigen retrieval solution (DAKO) при 99°C, а затем при комнатной температуре, каждая стадия в течение 20 минут. Затем основное антитело обнаруживали с использованием биотинилированного вторичного антитела (Vector) и реактивов Vectastain ABC Elite™. Продукт реакции получали с использованием Metal Enhanced DAB (Pierce Chemical, IL). Срезы слегка контрокрашивали гематоксилином, дегидратировали и накрывали покровными стеклами.
Конструирование аденовирусных векторов
Аденовирусные векторы, кодирующие LacZ и mVEGF164, описывались ранее (LeCouter et al., 2001, выше). Аденовирусный mBv8 создавали с использованием аденовирусной векторной системы AdEasy XL™ (Stratagene). кДНК mBV8 с 6-гис-тагом (SEQ ID NO:36) на ее C-конце клонировали между сайтами XhoI и HindIII вектора pShuttle-CMV. Полученную плазмиду pShuttle-CMV-mBV8 подвергали рекомбинации с pAdEasy-1™ в BJ5183-AD-1, компетентном штамме для электропорации, который предварительно трансформировали аденовирусным каркасом. Затем рекомбинантную аденовирусную Bv8 плазмиду трансфицировали в клетки AD-293 для сборки вирусных частиц. Основные растворы аденовируса очищали с помощью градиента CsCl. Аденовирус титровали с использованием Adeno-X rapid™ titer kit (Clontech).
Выделение и описание клеток эндотелия, ассоциированных с опухолью
Клетки эндотелия, ассоциированные с опухолью (КЭАО), выделяли с использованием системы сортировки на магнитных бусах (Miltenyi Biotech), по существу, как описывалось ранее (Hida et al., Cancer Res 64:8249-8255 (2004)). В кратком изложении, мышиные клетки лимфомы TIB42 инъецировали сзади в бок самкам бежевых голых мышей. Когда опухоли достигали размера ~1000 мм3, их иссекали, измельчали и расщепляли коллагеназой II (Worthington Biochemical Corporation). Затем клеточные суспензии фильтровали с использованием фильтров от 100 мкм до 40 мкм. В конце клетки CD31+ сортировали с использованием антитела ФИТЦ-CD31 (BD Biosciences) по инструкциям производителя. T-клетки CD31 высевали на покрытые желатином чашки в присутствии среды EGM-2MV (Cambrex). После 24 часов культивирования неприлипающие клетки CD31+ удаляли посредством промывания несколько раз в PBS.
Для RT-ПЦР РНК экстрагировали из культивированных клеток с использованием RNeasy™ minikit (QIAGEN). Для указанных экспериментов для каждой 50 мкл реакции использовали 80 нг РНК, и кДНК амплифицировали в течение 28 циклов. Последовательности праймеров доступны по запросу. Клетки TIB42-КЭАО голодали в течение 6 часов в минимальной среде с добавлением 0,5% БСА.
Затем клетки стимулировали рекомбинантным Bv8 человека (200 нг/мл; PeproTech), полной средой (ПС), VEGF (100 нг/мл; PeproTech) или БСА (0,5%). Клеточные экстракты собирали в указанные моменты времени. Анализ вестерн-блоттинга экстрактов из клеток TIB42-КЭАО осуществляли с использованием PhosphoPlus p44/42 MAPK™ antibody kit (Cell signaling). Для оценки непротиворечивости и воспроизводимости этого результата каждое условие тестировали дважды, и эксперименты проводили три раза, получая схожие результаты.
Для оценки образования трубочек in vitro клетки TIB42-КЭАО (6-8 пересевов) морили голодом в течение 5 часов в среде, не содержащей сыворотки. После этого клетки собирали и ресуспендировали в среде, не содержащей сыворотки, с добавлением 5% БСА и обрабатывали с использованием VEGF-A (100 нг/мл), Bv8 (200 нг/мл) или без добавления чего-либо (контроль). Для тестирования специфичности Bv8 инкубировали в присутствии мАТ против Bv8 (10 мкг/мл). 5·105 клеток высевали в каждую лунку 24-луночного планшета с предварительно нанесенным Matrigel™ (BD Biosciences) и образование трубочек оценивали через 36 часов.
Микрокомпьютерная томография сосудов
Животные, несущие опухоль HM7, получали интраперитонеальную инъекцию 50 мкл гепарина за 10 минут до умерщвления посредством вдыхания диоксида углерода. Грудную полость вскрывали, выполняли разрез верхушки сердца и вводили полиэтиленовую канюлю (внутренний диаметр 0,58 мм, наружный диаметр 0,96 мм) через левый желудочек и закрепляли в восходящей аорте с помощью шелковой хирургической нити 5-0. 17 мл раствора 0,1 мМ нитропруссида натрия в 0,9% физиологическом растворе перфузировали со скоростью 6 мл/мин, чтобы обеспечить состояние максимального расширения сосудов и удалить кровь. MICROFIL® (Carver, MA), коммерчески доступный латекс с хроматом свинца, изготавливали согласно рекомендациям производителя и перфузировали 17 мл со скоростью 2 мл/мин. Влитой латексной смеси позволили полимеризоваться при комнатной температуре в течение шестидесяти минут перед рассечением интересующих тканей. Рассеченные опухоли погружали в 10% формалин с нейтральным буфером.
Затем опухоли визуализировали с использованием системы рентгеновской микрокомпьютерной томографии (микро-КТ) μCT40™ (SCANCO Medical, Basserdorf, Switzerland). При визуализации опухолей использовали соевое масло в качестве фоновой среды. Изображения микро-КТ получали с помощью рентгеновской трубки, работающей при уровне энергии 45 кВ, токе 177 мкА и времени интеграции 300 миллисекунд. Осевые изображения получали при изотропном разрешении 16 мкм.
Сеть сосудов и опухоль выделяли посредством серии стадий обработки изображения. Порог интенсивности в 1195 единиц Хаунсфилда (ЕХ) и морфологическую фильтрацию (эрозия и расширение) применяли к волюметрическим данным микро-КТ изображения для того, чтобы получить объем сосудов (ОС). Объем опухоли (ОО) отделяли от фона схожим образом при пороге интенсивности -8 ЕХ. Плотность сосудов (ОС/ОО) определяли из отношения ОС к ОО. Пороги интенсивности для опухоли и сосудов определяли посредством визуального исследования результатов сегментирования подкласса образцов. Вычисления осуществляли с помощью алгоритма анализа изображений собственной разработки, который написан на C++ и Python и используется в библиотеке программного обеспечения для обработки изображений AVW (AnalyzeDirect Inc., Lenexa, KS). Трехмерные (3D) изображения поверхности были созданы по микро-КТ данным с помощью пакета программного обеспечения для анализа изображений Analyze 6.0 (AnalyzeDirect Inc., Lenexa, KS). Статистический анализ осуществляли с помощью пакета статистического программного обеспечения JMP (SAS Institute Inc., Cary, NC, USA). Групповое сравнение для микро-КТ метрик (ОС, ОО, ОС/ОО) оценивали по тесту Даннета для множественных сравнений. Значимыми считались p-значения менее 0,05.
Частичная очистка белка Bv8 и анализ вестерн-блоттинга лизата МНККМ
Мышам Balb/c (n=20) подкожно инъецировали G-CSF человека (10 мкг/день, Amgen) и интраперитонеально инъецировали mGM-CSF (0,5 мкг/день, PeproTech) ежедневно в течение 4 дней, для увеличения популяции CD11b+Gr1+. На пятый день выделяли клетки КМ и клеточный осадок ресуспендировали в 2 мл 0,5% Triton X-100™. Затем клеточный лизат с силой прокачивали через иглу 25 калибра 4 раза и концентрацию соли доводили до 50 мМ NaCl. Общий экстракт наносили на колонку с гепарин-сефарозой® (Hi-Trap, 1 мл), которую предварительно уравновешивали в 20 мМ Tris pH 7,2, 50 мМ NaCl. Колонку элюировали с использованием двухступенчатого линейного градиента: от 50 мМ до 1 М NaCl и затем от 1 М до 2 М NaCl в 20 мМ Tris, pH 7,2. Скорость потока составляла 1 мл/мин. Оптическую плотность наблюдали при 280 нм. Фракции по 1 мл собирали и тестировали на mBv8 с использованием ELISA и вестерн-блоттинга. Для анализа вестерн-блоттинга по 100 мкл из фракций концентрировали в 4 раза с использованием Microcon YM-3® spin column (MILLIPORE), и затем загружали на 4-20% SDS-PAGE (Invitrogen). Блоттинг окрашивали в течение ночи с использованием сочетания трех антител хомячка против mBv8 (2D3, 3B8 и 4E10) при общей концентрации 10 мкг/мл в блокирующем буфере (PBST, 0,1% Tween20 в PBS и 5% обезжиренного молока). После трех промываний блоттинг инкубировали с козьим IgG против антител хомяка, конъюгированным с пероксидазой хрена (ImmunoResearch Laboratories), и затем проявляли с использованием усиленной хемилюминесценции плюс Western-blotting Detection System™ (GE Healthcare Bio-Science).
Твердофазный иммуноферментный анализ мышиного Bv8 (ELISA)
96-микролуночные планшеты MaxiSorp® (Nalge Nunc International, Rochester, NY) покрывали антителом 3F1 1,0 мг/мл (мышиное антитело против Bv8, которое также связывается с Bv8 мыши в 50 мМ карбонатном буфере, pH 9,6, при 4°C в течение ночи). Планшеты промывали в PBS, содержащем 0,05% полисорбата 20, и блокировали в 0,5% бычьем сывороточном альбумине, 10 м.д. Proclin 300® (Supelco, Bellefonte, PA) в PBS при комнатной температуре в течение 1 часа. После промывания планшетов стандарты BV8 мыши (0,039-2,50 нг/мл в двухкратном серийном разведении, Genentech) и образцы (минимальное разведение 1:10) в PBS, содержащем 0,5% бычьего сывороточного альбумина, 0,05% полисорбата 20, 10 м.д. Proclin 300© (Supelco, Bellefonte, PA) и 0,35н. NaCl (буфер для образцов), добавляли в планшеты. Планшеты инкубировали в течение 2 часов при комнатной температуре. Несвязанные антитела удаляли на стадии промывания. Антитела, связанные с планшетами, обнаруживали посредством добавления биотинилированного антитела 4E10 (антитело хомяка против BV8 мыши, Genentech), за которым следовал стрептавидин-HRP (GE Healthcare, Buckinghamshire, United Kingdom) и 3,3',5,5'-тетраметилбензидин (Kirkegaard & Perry Laboratories, Gaithersburg, MD) в качестве субстрата. Реакцию останавливали добавлением 1 М фосфорной кислоты. Оптическую плотность считывали при 450 нм на стакер-ридере Titertek™ (ICN, Costa Mesa, CA). Кривые титрования стандартов подгоняли с использованием четырехпараметрической регрессионной программы аппроксимации кривой по точкам (Genentech). Результаты, которые попадали в диапазон калибровочной кривой, использовали для вычисления концентраций Bv8 мыши в образцах.
Этот тест может выдержать 10% мышиную сыворотку и 10% буфер для лизиса и обладает чувствительностью всего 0,39 нг/мл для образцов сыворотки и тканевых лизатов. Он специфичен к BV8. IgG1 человека G6-31 против VEGF, G-CSF человека и VEGF человека до 30 мг/мл или EG-VEGF человека до 5 мг/мл дают только фоновый сигнал. Этот твердофазный иммуноферментный анализ (ELISA) также обнаруживает Bv8 человека, но с эффективностью 26% или менее. Присутствие 3F1 против Bv8 до 14 нг/мл и 2B9 против Bv8 до 124 нг/мл в значительной степени не влияет на обнаружение 0,5 нг/мл BV8 в буфере для образца.
Результаты
Для того чтобы определить, влияет ли рост опухоли в удаленном месте на экспрессию Bv8 в КМ, опухолевые клетки A673 и HM7 трансплантировали иммунодефицитным мышам. Как показано на фиг.1a, имплантирование обеих опухолей приводило к значительному увеличению уровней Bv8 в КМ по результатам ELISA по сравнению с имплантацией пустого Matrigel™.
Чтобы охарактеризовать белок Bv8, продуцируемый в КМ, и валидировать наш ELISA, лизат мононуклеарные клетки костного мозга (МНККМ) мыши подвергли аффинной хроматографии на гепарин-сефарозе. Как проиллюстрировано на дополнительной (далее в настоящем документе Д) фиг.1a, Bv8 сильно связывался с колонкой и его элюировали в виде одного пика в присутствии ~0,4 М NaCl. Это подтверждали анализом вестерн-блоттинга, который показал присутствие ожидаемой полосы ~9 кДа в иммунологически реактивных фракциях (Д фиг.1b).
МНККМ содержат несколько подклассов клеток, в основном миелоидной и лимфоидной линий дифференцировки. Чтобы выявить подкласс МНККМ, обогащенный Bv8, несколько линий опухолевых клеток, включая A673, Calu-6, HM7, HPAC и Jurkat имплантировали мышам. Анализ Taqman™ показал высокий уровень экспрессии Bv8 в миелоидных клетках CD11b+Gr1+ (состоят в основном из нейтрофилов, а также включают клетки макрофагальной линии дифференцировки (Yang et al., Cancer Cell 6:409-421 (2004); Dahl et al., Nat Immunol. 4:1029-1036 (2003); Lagasse and Weissman, J Immunol Methods 197:139-150 (1996)) по сравнению с клетками CD11b-Gr1- (главным образом не принадлежат к миелоидному подклассу) (фиг.1b).
Чтобы идентифицировать молекулы, потенциально участвующие в регулировании экспрессии Bv8, проверяли способность панели цитокинов/хемокинов индуцировать экспрессию Bv8 в неотсортированных МНККМ с помощью Taqman™. Большинство цитокинов не вызывало какого-либо значительного повышающего регулирования Bv8 в МНККМ (фиг.1c). Однако G-CSF (10 нг/мл) приводил к резкому апрегулированию Bv8 (более чем в 27 раз, фиг.1c). Ни одни из протестированных цитокинов не привел к заметному повышающему регулированию VEGF-A (данные не приведены).
Анализ различных подклассов МНККМ выявил, что G-CSF приводит к повышающему регулированию Bv8 более чем в 100 раз выше фонового уровня в очищенных клетках CD11b+Gr1+ (фиг.1d). По существу более низкое повышающее регулирование Bv8, опосредованное G-CSF, обнаруживали в цельном КМ или во фракции CD11b-Gr1-. К удивлению, GM-CSF не обладал эффектом на экспрессию Bv8 (фиг.1c и d), таким образом подчеркивая высокоспецифичную природу регулирования этого фактора. Примечательно, что ИЛ-6 и SDF-1, которые не оказывали какой-либо значимой стимуляции при тестировании на неотсортированных клетках КМ, приводили к значительному 2-3-кратному повышающему регулированию Bv8, когда их тестировали на очищенных клетках CD11b+Gr1+ (фиг.1c и d).
Чтобы более подробно охарактеризовать ответ на G-CSF у клеток CD11b+Gr1+, проверяли, может ли этот цитокин при физиологически более уместных концентрациях индуцировать экспрессию Bv8. Также предшествующие исследования показали, что экспрессия гена Bv8 может быть увеличена с помощью гипоксии (LeCouter et al., 2003, выше), и таким образом хотели проверить, может ли гипоксия модулировать ответ Bv8 на G-CSF. Как показано на фиг.1e, всего лишь 20 пг/мл G-CSF приводили к стимуляции экспрессии Bv8 ~ в 10 раз в условиях гипоксии. Такая стимуляция была значительно выше, чем стимуляция, обнаруженная в условиях нормоксии (~ в 5 раз). В дополнение к исследованиям in vitro, повышающее регулирование Bv8 с помощью G-CSF верифицировали in vivo. Введение рекомбинантного G-CSF мышам Balb/c приводило к зависящему от времени и дозы увеличению уровней белка Bv8 в КМ (фиг.1f) и в сыворотке (фиг.2a), которое совпадало с увеличением в нейтрофилах периферической крови (ПК) (фиг.2b). Схожие результаты получали у голых мышей Balb/c (данные не приведены). Примечательно, что всего лишь через 24 часа после введения G-CSF уровни Bv8 в КМ увеличивались ~ в 30 раз выше фонового уровня. Уровни в сыворотке также существенно увеличивались. Bv8 в КМ и сыворотке возвращался к уровням, близким к исходным, в течение 48 часов после прекращения введения G-CSF, указывая на то, что Bv8 строго регулируется с помощью G-CSF в КМ. Однако введение G-CSF не обладало эффектом на уровни Bv8 в почках, мозге и печени (данные не приведены).
G-CSF является основным регулятором гранулопоэза, который заставляет миелоидные/гранулоцитарные клетки-предшественники дифференцироваться в нейтрофилы. G-CSF также играет ключевую роль в мобилизации нейтрофилов из КМ в ответ на различные окружающие воздействия и секретируется несколькими типами клеток, включая эндотелиальные клетки и фибробласты (Christopher, M.J. & Link, D. C, Curr Opin. Hematol. 14, 3-8 (2007)). Кроме того, G-CSF вместе с другими гематопоэтическими цитокинами, включая ИЛ-6 и SDF-1, конститутивно экспрессируется опухолью и/или стромальными клетками в злокачественных опухолях (рассмотрено в Mueller, M. M. & Fusenig, N.H., Differentiation 70, 486-497 (2002)). Чтобы проверить, экспрессируются ли G-CSF, ИЛ-6 или SDF-1 в использованных моделях опухолей, уровни этих цитокинов измеряли в среде, которую кондиционировали опухолевые клетки или фибробласты, ассоциированные с опухолью. Как показано в Д таблице 1, они обнаруживались, хотя и в разных концентрациях, в обоих компартментах. Таким образом, повышающее регулирование Bv8, опосредованное G-CSF (и/или другим цитокином), в КМ может содействовать мобилизации миелоидных клеток. Последующий хоуминг этих клеток в опухоль может регулироваться дополнительными цитокинами и также возможно с помощью Bv8, который секретируют миелоидные клетки, ассоциированные с опухолью.
Для определения возможной роли G-CSF в регулировании экспрессии Bv8 в опухолевом микроокружении, культивированные МНККМ инкубировали с аликвотами лизатов опухолей HM7 в присутствии антител против G-CSF или контрольных антител (фиг.1g). Анализ транскриптов Bv8 показал значительное зависящее от дозы снижение экспрессии Bv8 в МНККМ, обработанных антителами против G-CSF по сравнению с лунками, которые обрабатывали контрольным IgG. Примечательно, что в присутствии антагониста G-CSF уровень экспрессии Bv8 опустился ниже уровней до стимуляции, указывая на беспрепятственное действие ингибиторов экспрессии Bv8, присутствующих в гомогенате опухоли. Исследования in vivo подтвердили ключевую роль G-CSF в регулировании экспрессии Bv8. Белок Bv8 был значительно снижен у мышей, не несущих опухоль, которых лечили антагонистом G-CSF по сравнению с контролями (фиг.1h).
Затем проверяли, играет ли G-CSF роль в опосредовании повышающего регулирования Bv8 в КМ мышей, несущих опухоль. Как показано на фиг.1i, моноклональное антитело против G-CSF, но не контрольное IgG, фактически устраняло пик в белке Bv8, который наблюдали в BM сразу после имплантирования опухоли. Очень схожие результаты получали для поликлонального козьего IgG против G-CSF (данные не приведены). Лечение антагонистами G-CSF также приводило к значительному снижению частоты клеток CD11b+Gr1+ как в циркуляции, так и в КМ, у безопухолевых мышей и мышей, несущих опухоли (Д фиг.2c-f). Следовательно, до тех пор, пока не исключено участие дополнительных факторов, наши наблюдения указывают на то, что экспрессия Bv8 зависит от G-CSF, как in vitro, так и in vivo.
Установив сильное повышающее регулирование Bv8 с помощью G-CSF, исследователи желали определить, может ли Bv8 содействовать мобилизации нейтрофилов, которая индуцирована рекомбинантным G-CSF (фиг.1j). Субмаксимальная доза G-CSF (2 мкг) индуцировала у мышей в течение шести часов значительную мобилизацию CD11b+Gr1+ в периферическую кровь. Эффект G-CSF полностью блокировался антителом против G-CSF. Антитела против Bv8 (в дальнейшем также антагонист Bv8) также ингибировали мобилизацию клеток CD11b+Gr1+, опосредованную G-CSF (фиг.1j). Однако АТ против Bv8 обладали небольшим эффектом на мобилизацию, индуцированную максимальной дозой G-CSF (10 мкг). Следовательно, Bv8 может выполнять функцию модулирования или усиления мобилизации нейтрофилов, которая вызвана с помощью G-CSF.
Bv8 способствовал миграции клеток CD11b+Gr1+ из КМ в тесте на миграцию in vitro в степени, сравнимой с SDF-1 (Д фиг.3a). АТ против Bv8 полностью ингибировали миграцию миелоидных клеток, которую стимулировал Bv8, но не обладали каким-либо эффектом на миграцию, индуцированную SDF-1, таким образом, подтверждая специфичность этих эффектов. Анализ Taqman™ рецепторов Bv8, R1 и R2 (Д фиг.3b и c), в BM показал более высокую экспрессию R2 по сравнению с R1. Однако вопрос о точном вкладе R1 по сравнению с R2 в опосредование передачи сигнала от Bv8 в МНККМ остается открытым. Эти наблюдения указывают на то, что повышающее регулирование Bv8 и его рецепторов, которое зависит от типа клеток, является частью программы активации генов в костном мозге после имплантации опухоли. Чтобы более подробно охарактеризовать эффекты Bv8 на клетки кроветворной системы, из костного мозга наивных мышей выделяли клетки, истощенные в плане дифференциации (Lin-, в которых отсутствуют клетки CD11b+Gr1+), и клетки CD11b+Gr1+ и обрабатывали с использованием рекомбинантного Bv8. Анализ популяции Lin- показал более высокую экспрессию у клеток CD11b+Gr1+ среди клеток, обработанных с использованием Bv8, по сравнению с контролями, указывая на то, что Bv8 направляет развитие прогенеторной популяции в сторону клеток миелоидной линии дифференцировки (Д фиг.3d). Кроме того, анализ выживаемости клеток показал, что количество погибших клеток в лунках с Bv8 был значительно ниже, чем в контролях, указывая на то, что Bv8 является возможным фактором выживания для примитивных кроветворных клеток (Д фиг.3d). Чтобы провести функциональную оценку воздействия Bv8 на клетки Lin-, выполняли анализ колониеобразования клетками, обработанными с использованием Bv8, который показал более высокое количество колоний (p<0,05) по сравнению с контрольными клетками (Д фиг.3e). Анализ клеток CD11b+Gr1+ дополнительно подтвердил роль Bv8 как фактора выживания, поскольку клетки, обработанные с использованием Bv8, содержали меньше погибших клеток по сравнению с контролями (Д фиг.3f). В конечном счете, обработка клеток CD11b+Gr1+ с помощью Bv8 приводила к активации пути MAPK, обладающей динамическим характером (данные не приведены).
Чтобы выяснить роль Bv8 в нормальном гемопоэзе, антитела против Bv8 или против Ragweed (в дальнейшем контроль) тестировали на безопухолевых мышах. Ни АТ против Bv8, ни контроль не проявили какое-либо достоверное воздействие на нормальный гемопоэз и гематологические параметры у голых мышей Balb/c (Д фиг.4). Это данные указывают на то, что при гомеостазе, физиологических условиях, Bv8 играет очень ограниченную роль в регулировании гемопоэза.
Чтобы исследовать значение Bv8 для роста опухоли in vivo, проверяли, изменяет ли введение АТ против Bv8 или контрольных антител рост нескольких линий опухолевых клеток, которые трансплантировали иммунодефицитным мышам. Как показано на фиг.2, введение антител против Bv8 приводило к значительному уменьшению объема опухоли и конечной массы опухоли по сравнению с контрольными животными во всех исследованных моделях опухолей. В модели A673 ингибирование роста составило ~80% и приближалось к значению, полученному для мАТ G6.31 против VEGF (в дальнейшем также антагонист VEGF) или B20 (данные не приведены), которое блокирует VEGF-A мыши и человека (Liang et al., J Biol. Chem. 281:951-961 (2006)) (фиг.2a). На модели опухоли HM7 также продемонстрировано значительное ингибирование роста при лечении антителами против Bv8 (фиг.2b). Значительное ингибирование также наблюдали у опухолей, полученных из клеточных линий HPAC человека (фиг.2c) и Jurkat (фиг.2d). Указанные эксперименты по имплантированию опухолей осуществляли на голых мышах Balb/c. Схожие результаты получали также на бежевых голых мышах (данные не приведены). В дополнение к человеческим ксенотрансплантатам, было показано, что АТ против Bv8 отдельно или в сочетании с антителами против VEGF эффективны для уменьшения объема опухоли у опухолей TIB-42 с устойчивостью к антагонистам VEGF (фиг.2f). Отмена лечения приводила к быстрому росту опухоли у мышей, несущих опухоли A673 (Д фиг.3g) и HM7 (Д фиг.3h). Кроме того, исследование опухолей выявило увеличение количества инфильтрирующих клеток CD11b+Gr+ (Д фиг.3i и j).
Чтобы проследить миелоидные клетки на различных стадиях опухолеобразования, исследовали кинетику клеток CD11b+Gr1+ в КМ, ПК и опухолях на модели A673 в различные моменты времени (Д фиг.5). Исследование КМ не выявило каких-либо значимых отличий в частоте клеток CD11b+Gr1+ (Д фиг.5a) между мышами, которых лечили антителами против Bv8, и контрольными мышами. Однако имело место значительное снижение количества (данные не приведены) и частоты клеток CD11b+Gr1+ в ПК у мышей, которых лечили антителами против Bv8, по сравнению с контрольными мышами во все исследованные моменты времени (Д фиг.5b). Кроме того, обнаружили значительное снижение количества клеток CD11b+Gr1+ в опухолях A673 в некоторые моменты времени в опухолях, которые обрабатывали антителами против Bv8, по сравнению с контролями (Д фиг.5c). С использованием проточной цитометрии (представительные профили FACS приведены на Д фиг.6), кинетику популяций CD11b+Gr1+ также исследовали в ПК, опухолях, КМ и селезенке у мышей, которым имплантировали клетки Calu-6, HM7, HPAC и Jurkat (фиг.3a и b, а также Д фиг.7d и e). В соответствии с исследованиями динамики опухолей A673, лечение антителами против Bv8 приводило к значительному снижению частоты клеток CD11b+Gr1+ в ПК также во всех моделях опухолей, упомянутых выше (фиг.3a). Значительное снижение количества CD11b+Gr1+ также наблюдалось в опухолях у животных, которых лечили антителами против Bv8 (фиг.3b). Эти наблюдения указывают на то, что Bv8 регулирует мобилизацию и возможно хоуминг клеток CD11b+Gr1+ в опухоли. Кроме того, нейтрофилы (в основном идентифицированные по экспрессии Gr1 (Okazaki, T. et al, Int Immunol. 18, 1-9 (2006)), похоже, являются основной популяцией, на которой сказывается лечение антителами против Bv8.
В предшествующих исследованиях было показано, что трансплантация миелоидных клеток, включая клетки CD11b+Gr1+, увеличивает рост опухоли, тогда как их недостаток может замедлять рост. Чтобы напрямую оценить роль миелоидного подкласса в росте опухоли, который регулирует Bv8, клетки CD11b+Gr1+ выделяли из КМ мышей, несущих опухоли A673 или HM7, через 7 дней после имплантирования опухоли и инъецировали их в опухоли. Это приводило к более быстрому росту опухоли у животных, которых лечили антителами против Bv8 (фиг.3c и d). Следовательно, избыток клеток CD11b+Gr1+ может преодолевать ингибирование роста опухоли, вызванное лечением с антителами против Bv8. Чтобы дополнительно охарактеризовать миелоидный подкласс в костном мозге и опухолях, авторы использовали F480 в качестве маркера инфильтрации макрофагам в подклассе CD11b. Обнаружили, что лечение антителами против Bv8 приводит к небольшому снижению количества макрофагов (CD11b+F480+), как в костном мозге, так и в опухолях у мышей, которым имплантировали A673 (данные не приведены). Следовательно, похоже, что антитело против Bv8 воздействует в опухолях на гранулоцитарный и в меньшей степени на макрофагальный подклассы.
Значительное увеличение частоты CD11b+Gr1+ наблюдали в КМ и селезенке мышей, несущих опухоль, по сравнению с мышами с имплантированным Matrigel™ (Д фиг.7a и b). Однако, в отличие от снижения, которое наблюдали в ПК и опухоли, лечение антителами против Bv8 заметно не изменило частоту клеток CD11b+Gr1+ в КМ и селезенке. Анализ колониеобразования для КМ и спленоцитов, выделенных из мышей, несущих опухоли A673 и HM7 (Д фиг.7c), показал, что количество колоний у мышей, которых лечили антителами против Bv8, было значительно снижено по сравнению с контрольными мышами. Эти наблюдения указывают на то, что нейтрализация Bv8 in vivo ослабляет способность спленоцитов и клеток из КМ дифференцироваться и образовывать колонии in vitro.
Маловероятно, что величина противоопухолевого воздействия антител против Bv8 объясняется только снижением количества клеток CD11b+Gr1+ в опухолях, которое, как ожидается, ведет к снижению уровней MMP-9 и VEGF-A (Yan et al., Cancer Cell 6:409-421 (2004); Nozawa et al., Proc. Natl. Acad. Sci. USA 103:12493-12498 (2006)). Вероятно, что местная нейтрализация активности Bv8 является основным механизмом противоопухолевого воздействия антагонистов Bv8. Bv8 и родственный EG-VEGF охарактеризованы как митогены, обладающие селективностью к определенным типам эндотелиальных клеток (Bergers, G. et al., Nat Cell Biol. 2, 737-744 (2000); Lin, R. et al., J Biol. Chem. 277, 8724-8729 (2002)). Следовательно, исследователи решили установить, воздействует ли Bv8 на сосудистую сеть опухоли. Устанавливали и охарактеризовывали культуры эндотелиальных клеток, ассоциированных с опухолями, (КЭАО) из ксенотрансплантированных опухолей. КЭАО образовывали трубочки в Matrigel™ в ответ на VEGF-A, тогда как в контрольных лунках проявлялись незначительные или нулевые признаки образования трубочек (Д фиг.8a). Добавление белка Bv8 способствовало образованию трубочек в степени, сравнимой с образованием трубочек, индуцированным с помощью VEGF-A (Д фиг.8a). Антитела против Bv8 блокировали образование трубочек, индуцированное с помощью Bv8, но не ингибировали образование трубочек, индуцированное с помощью VEGF. Эти наблюдения подтверждают специфичность этих эффектов, а также указывают на то, что Bv8 и VEGF используют различные пути, чтобы индуцировать образование трубочек в КЭАО. ПЦР анализ подтвердил экспрессию маркеров эндотелиальных клеток, но не эпителиальных клеток, такие как CD31, VEGFR2 и Tie2 в КЭАО, подтверждая эндотелиальную природу КЭАО (Д фиг.8b). В соответствии с этими наблюдениями, Bv8 или VEGF-A проводили к сильной индукции MAP-киназного фосфорилирования в КЭАО (Д фиг.8c). Анализ Taqman™ показал в КЭАО экспрессию как EG-VEGF/PKR-1, так и EG-VEGF/PKR-2 (данные не приведены). Однако рекомбинантный Bv8 оказался неспособным стимулировать пролиферацию некоторых линий опухолевых клеток in vitro (Д фиг.8d), дополнительно подтвердив гипотезу о том, что в опухолевом окружении Bv8 в основном нацелен на эндотелиальные клетки.
Чтобы подтвердить гипотезу о том, что Bv8 может локально способствовать опухолевому ангиогенезу, рекомбинантный аденовирус, кодирующий mBv8 (Av-Bv8), доставляли внутрь опухолей у мышей, несущих опухоль HM7. Av-LacZ и Av-VEGF служили в качестве отрицательного и положительного контролей, соответственно. Чтобы минимизировать системные эффекты рекомбинантных белков, вводили низкие титры вируса (107 БОЕ). По сравнению с контролем Av-LacZ, Av-Bv8 приводил к увеличению объема опухолей, которое сравнимо с увеличением объема, которое индуцирует Av-VEGF (фиг.4a). В соответствии с наблюдениями in vitro, введение Av-Bv8 приводило к увеличенной мобилизации CD11b+Gr1+ по сравнению с Av-LacZ и Av-VEGF (фиг.4b). Более высокие титры (109 БОЕ) Av-Bv8 также увеличивали рост опухоли и приводили к повышенной мобилизации клеток CD11b+Gr1+ в ПК и в опухоли (данные не приведены).
Для оценки сосудистой сети опухоли использовали рентгеновскую микрокомпьютерную томографию (микро-КТ) (Garcia-Sanz, A., et al., Hypertension 31, 440-444 (1998); Maehara, N., Eur radiol 13, 1559-1565 (2003); Kwon, H.M. et al., J Clin. Invest 101, 1551-1556 (1998)). Микро-КТ предоставляет всесторонний анализ сосудистой сети опухоли во всей опухоли и таким образом может преодолеть некоторые ограничения, присущие некоторым другим подходам, таким как иммуногистохимия (ИГХ). Такой анализ показал, что Av-Bv8 и Av-VEGF обладали почти неотличимыми эффектами, поскольку оба приводили к увеличению (p<0,05) объема сосудов (фиг.4c) по сравнению с группой Av-LacZ. Представительные изображения всей массы опухоли из каждой группы лечения приведены на фиг.4e. Изображения поверхности выделенной сосудистой сети (красная) и опухоли (серая) созданы с помощью алгоритма обработки изображений, который определяет объемные участки, использованные в анализе. ИГХ с MECA-32 подтвердила значительное увеличение площади поверхности сосудов в опухолях HM7 после введения Av-Bv8 по отношению к контролю Av-LacZ (Д фиг.9a).
Чтобы дополнительно исследовать роль Bv8 в опухолевом ангиогенезе с использованием подхода утраты функции, анализировали сосудистую сеть опухоли в опухолях HM7, которые лечили антителами против Bv8, против VEGF или контрольными антителами. В соответствии с экспериментами, проиллюстрированными на фиг.2, лечение с использованием АТ против Bv8 приводило к значительному уменьшению объема опухоли (фиг.4f) и циркулирующих клеток CD11b+Gr1+ (фиг.4g) по сравнению с контрольными мышами. С использованием такого же микро-КТ ангиографического подхода, как описано выше, анализ сосудистой сети опухоли раскрыл значительное уменьшение объема сосудов в группах лечения антителами против Bv8 и против VEGF по отношению к контрольным опухолям (фиг.4h). Плотность кровеносных сосудов (ОС/ОО) также была значительно снижена в группах лечения антителами против Bv8 и против VEGF по отношению к контролю (фиг.4i). Данные микро-КТ подтверждают гипотезу о том, что ингибирование роста опухоли у мышей, которых лечили антителами против Bv8, является результатом ингибирования развития сосудов опухоли. Представительное изображение всей опухолевой массы приведено на фиг.4j. Следовательно, с использованием подходов приобретения и утраты функции, наши данные указывают на то, что Bv8 способствует росту опухоли в основном посредством индукции опухолевого ангиогенеза. Гистологические исследования также согласовывались с ролью Bv8 в стимулировании опухолевого ангиогенеза (Д фиг.9b). Анализ эндотелиальных клеток в опухолях Jurkat показал, что, подобно антителам против VEGF, введение антител против Bv8 заметно ингибировало васкуляризацию опухоли.
Чтобы динамически охарактеризовать экспрессию Bv8 в различных тканях (фиг.5), измеряли уровни белка Bv8 в КМ (фиг.5a), ПК (фиг.5b), селезенке (фиг.5c) и опухолях (фиг.5d) у мышей, несущих опухоли HM7, которых лечили контрольными антителами или антителами против VEGF. Анализ уровней белка Bv8 у контрольных мышей выявил пик вскоре после имплантирования опухоли в КМ, ПК и селезенке. Однако мыши, которых лечили антителами против VEGF, показывали минимальную экспрессию Bv8 на таких ранних стадиях, возможно, благодаря эффективному подавлению опухоли, вызванному лечением. Однако в более поздние моменты времени, которые совпадают с началом VEGF-независимого роста опухоли, уровни Bv8 значительно увеличивались у мышей, которых лечили антителами против VEGF, в частности в ПК, селезенке и опухолях (фиг.5b-d). В соответствии с этими наблюдениями, наблюдали значительную инфильтрацию клеток Gr1+ в неопластические области опухолей A673 и HM7, которые лечили антителами против VEGF на 15 или 21 день (фиг.5e). Возможное объяснение состоит в том, что длительная гипоксия и/или некроз опухоли, вызванные антителами против VEGF, запустили активацию КМ и рекрутинг нейтрофилов. Эти находки согласовываются с ранними экспериментами, которые показали, что в некоторых мышиных моделях опухолей лечение антителами против VEGF приводит к повышающему регулированию мРНК Bv8, указывая на то, что Bv8 может способствовать устойчивости к терапии антагонистами VEGF (данные не приведены). Чтобы более точно определить источники Bv8 в опухолях, разделяли клеточные популяции опухолей A673, Calu-6, HM7, HPAC и Jurkat на фракции CD11b+ и CD11b-. Анализ Taqman™ показал значительное повышающее регулирование транскрипта mBv8 во фракции CD11b+ по сравнению с отрицательной фракцией (фиг.5f). Однако с использованием праймеров для Bv8 человека, в ПЦР не установили никакого Bv8 человека в обеих популяциях (фиг.5f), т.е. ассоциированных с опухолью CD11b+ и CD11b-, указывая на то, что строма опухоли, особенно миелоидные клетки, является основным источником Bv8 во всех исследованных опухолях. В соответствии с этими наблюдениями, среди протестированных ни одна линия опухолевых клеток не продуцировала уровни белка Bv8 in vitro, которые можно обнаружить с помощью ELISA (данные не приведены).
Следовательно, лечение антителами против Bv8 может быть наиболее эффективным при комбинировании с антителами против VEGF. Чтобы проверить эту гипотезу, мышам имплантировали клетки HM7 (фиг.6a) или A673 (фиг.6b) и начинали лечение, когда опухоли достигали объема ~400 мм3. Вследствие того, что уровни Bv8 в опухолях были низкими, лечение антителами против Bv8 обладало меньшим эффектом на ингибирование роста опухоли как в опухоли HM7, так и A673, по сравнению с лечением на ранней стадии (фиг.2). Антитела против VEGF обеспечивали более полное ингибирование, но опухоли, в конечном счете, ускользали. Однако лечение сочетанием антител против VEGF и против Bv8 значительно (p<0,05) ингибировало рост опухоли по сравнению с монотерапией каждым антителом из двух. Подобным образом, комбинированное лечение приводило к значительному уменьшению объема и массы опухолей в мышиных лимфомах TIB42 (фиг.2e) и EL-4 (фиг.6c), обе опухоли устойчивы к лечению антагонистами VEGF. Следовательно, данные указывают на то, что лечение с использованием АТ против Bv8 содержит возможность комбинированного лечения опухолей, которые устойчивы к лечению антагонистами VEGF.
Чтобы подтвердить, что эффекты антител против Bv8 не ограничиваются иммунодефицитными мышами, иммунодефицитным и иммунокомпетентным мышам имплантировали мышиную клеточную линию EL-4, устойчивую к антагонистам VEGF, и тестировали эффекты монотерапии антителами против Bv8 или антителами против VEGF, а также комбинации. Как показано на фиг.6, c и d, эффекты таких способов лечения были почти неразличимыми у двух штаммов. Эти наблюдения указывают на то, что антитела против Bv8 могут подавлять рост опухоли даже в присутствии интактной иммунной системы. Дополнительным подтверждением этого заключения служит то, что лечение антителами против Bv8 ингибирует запуск ангиогенеза в модели многостадийного канцерогенеза Rip-Tag на иммунокомпетентных мышах (неопубликованные наблюдения).
Известно, что цитотоксические средства приводят к мобилизации гемопоэтических клеток из КМ (Neben, S. et al., Blood 81, 1960-1967 (1993)). Кроме того, вызванный химиотерапией некроз опухоли может привести к высвобождению хемокинов, таких как G-CSF, с последующим компенсаторным повышением образования нейтрофилов (Kavgaci, H. et al., J Exp CHn Cancer Res 21, 475-479 (2002)). Следовательно, исследователи решили установить, может ли лечение цитотоксическими средствами, отдельно или в сочетании с антагонистом VEGF, повлиять на эффективность лечения антителами против Bv8. Для этой цели мышам имплантировали клетки A673 и обрабатывали их цисплатином, отдельно или в сочетании с антителом против Bv8, антителом против VEGF или с сочетанием двух способов лечения. Уровень Bv8 в сыворотке значительно (p<0,05) увеличивался у мышей, которых лечили цисплатином, отдельно или в сочетании с антителами против VEGF (фиг.6e). Как антитела против Bv8, так и антитела против VEGF увеличивали противоопухолевую активность цисплатина. Однако сочетание цисплатина с антителом против VEGF и антителом против Bv8 проводило к почти полному ингибированию роста опухоли в A673 (p<0,05; фиг.6f). Следовательно, лечение антителами против Bv8 можно использовать в качестве дополнительного средства в сочетании с антителом против VEGF или цитотоксическими средствами. На Д фиг.8 проиллюстрирована роль Bv8 в опухолеобразовании.
Увеличивающиеся доказательства указывают на то, воздействие или на рекрутинг опухоли, или на ангиогенные свойства миелоидных клеток может представлять собой новую противораковую стратегию (Shojaei, F., et al., Nature Biotechnol. 25:911-20 (2007)). Однако прогресс в достижении этой цели затруднен сложностью и возможной избыточностью медиаторов. Наши наблюдения указывают на то, что, несмотря на такую сложность, блокирование действия отдельного цитокина, Bv8, обладает достаточным влиянием на рост нескольких типов опухолей. Таким образом, эти данные увеличивают вероятность того, что Bv8 или его рецепторы являются терапевтическими мишенями для будущей антиангиогенной терапии. Дополнительные исследования требуются для более точного установления роли этой системы сигнализации в различных типах опухолей и на различных стадиях развития опухоли. Примечательно, что в недавних исследованиях было показано, что введение G-CSF может ускорять рост опухоли (Okazaki, T., et al., выше; Hirbe, A.C., et al., Blood 109, 3424-3431 (2007)). Вероятность вклада Bv8 апрегулирования в такие эффекты является интересной перспективой, которая заслуживает дополнительного исследования. С другой стороны, антитела против G-CSF, снижая экспрессию Bv8, могут подавлять рост опухоли. В лаборатории изобретателей исследуют эту возможность.
В конечном счете, наблюдение о том, что экспрессия Bv8 тонко реагирует на G-CSF, связывает Bv8 с основным механизмом гомеостаза, который участвует в регулировании дифференциации и образования нейтрофилов. Следовательно, возможно, что Bv8 играет более значительную патофизиологическую роль, включая неопухолевые виды ангиогенеза, опосредованные воспалительными клетками.
Пример 2
Материалы и способы
Выделение всех костномозговых клеток человека из свежих коллекций костного мозга
Свежие образцы костного мозга получали из ALLCELLS (Emeryville, CA). Сначала костный мозг разбавляли 10% FBS-содержащей DMEM и затем пропускали через 40-мкм клеточное сито (BD Biosciences, Bedford, MA) для удаления тканевого дебриса. Клетки центрифугировали при 1200 об/мин в течение 5 мин, и красные кровяные клетки лизировали при охлажденном льдом 0,2% NaCl в течение 30 секунд с последующим добавлением охлажденного льдом 1,6% NaCl.
Выделение нейтрофилов, моноцитов и лимфоцитов из периферической крови
Использовали процедуры выделения, которые описаны ранее (Kulczycki A, Jr. J Immunol. 133:849-854 (1984)), с минимальными изменениями. В кратком изложении, свежую гепаринизированную кровь здорового человека (Health Services, Genentech Inc.) наносили на CAPPEL LSM Lymphocyte Separation Medium (MP Biomedicals, Solon, Ohio). После центрифугирования при 3000 об/мин в течение 15 минут без остановки, плазму удаляли и моноциты собирали на границе раздела фаз. Моноциты дополнительно очищали с использованием Monocyte isolation kit II (Miltenyi Biotec, Auburn, CA) и FACS-сортировки. Чистоту клеточной популяции оценивали с помощью FACS по экспрессии CD14+ CD16-. Лимфоциты собирали посредством сбора клеток, связывающихся с колонкой, и их чистоту проверяли по экспрессии CD3 для T-лимфоцитов и экспрессии CD19 для B-лимфоцитов. Нейтрофилы собирали посредством осторожного удаления слоя непосредственно над красными кровяными клетками с последующим добавлением HBSS (без Ca2+ и Mg2+) и 6% декстрана 500 (GE Healthcare Bio-sciences AB, Sweden), изготовленного в 0,9% NaCl. После того, как в течение 30-60 минут красные кровяные клетки оседали при КТ, удаляли нейтрофилы в супернатанте. Затем все оставшиеся красные кровяные клетки удаляли, пока >90% их не было элиминировано. Чистоту клеток оценивали с помощью FACS анализа по экспрессии CD15+CD16+. Все три популяции из периферической крови (нейтрофилы, моноциты и лимфоциты) обладали чистотой >95% согласно морфологическому и FACS анализу. Затем перед использованием клетки один раз промывали в HBSS, содержащем 0,2% БСА (слабый эндотоксин, Serologicals, Corp. Norcross, GA).
Анализ экспрессии генов с помощью Taqman
РНК изготавливали с использованием RNeasy™ Mini Kit (Qiagen). Для анализа с помощью ПЦР в реальном времени (Taqman) использовали по 50 нг общей РНК на реакцию. Для Bv8 человека РНК семенников (BD Biosciences) служила в качестве контроля. Реакции проводили в режиме 9600 Emulation mode на приборе 7500 Real time PCR system (Applied Biosystems, Foster City, CA), и по калибровочной кривой определяли абсолютное количество с использованием программного обеспечения Sequenct Detection System (SDS). Уровень экспрессии каждого гена дополнительно определяли количественно относительно облигатного гена RPL19 в том же образце. У праймеров Taqman™ были следующие последовательности:
Человеческий Bv8 прямой: ATG GCA CGG AAG CTA GGA (SEQ ID NO:10), обратный: GCA GAG CTG AAG TCC TCT TGA (SEQ ID NO:11), зонд: TGC TGC TGG ACC CTT CCT AAA CCT (SEQ ID NO:12).
Человеческий RPL19 прямой: CGC AAG CGC CGT GAA (SEQ ID NO:28), обратный: GGT CTC TTC CTC CTT GGA TAA AGT C (SEQ ID NO:29), зонд: CCA GGC CAA GAA GGA GGA GAT CAT CA (SEQ ID NO:30).
Человеческий VEGF-специфический прямой: AAT GAC GAG GGC CTG GAG T (SEQ ID NO:31), обратный: TTG ATC CGC ATA ATC TGC ATG (SEQ ID NO:32), зонд: TGT GCC CAC TGA GGA GTC CAA CAT CA (SEQ ID NO:33).
Реактивы для Taqman для человеческих PKR1/EG-VEGFR1 и PKR2/EG-VEGFR2 получали из Applied Biosystems.
Регулирование экспрессии гена Bv8 в культивированных кровяных клетках
Рекомбинантные человеческие MCP-1, MIP-1α, MIP-1β, MIP-2, bFGF, VEGF, GM-CSF, G-CSF, SDF-1α, M-CSF, эритропоэтин (EPO) и TNFα приобретали в R&D Systems (Minneapolis, MN). Рекомбинантные человеческие ИЛ-8, IFNγ, Bv8 (прокинетицин-2), ИЛ-4, ИЛ-10, ИЛ-13, TGF-β приобретали в PeproTech Inc. (Rocky Hill, New Jersey). SCF (фактор стволовых клеток) приобретали в Invitrogen Biosource (Carlsbad, CA). В некоторых случаях использовали G-CSF из Amgen (Neupogen/Filgrastim). Все цитокины использовали в концентрации 10 нг/мл. Свежеочищенные клетки промывали и ресуспендировали в среде HBSS, содержащей 0,2% БСА (слабый эндотоксин, Serologicals Corp. Norcross, GA). Два миллиона клеток инкубировали в 24-луночных планшетах с различными цитокинами и хемокинами в течение 4 часов при 37°C в инкубаторе с 5% CO2. Затем клетки переносили в пробирки Эппендорф, центрифугировали и лизировали в РНК буфере для лизиса (Qiagen, Valencia, CA). Экспрессию Bv8 оценивали с помощью Taqman с RPL19 (рибосомальный белок L19) в качестве облигатного контрольного гена.
Частичная очистка белка Bv8 из нейтрофилов периферической крови
Нейтрофилы из 500 мл свежей крови человека выделяли, как описано выше. Клеточные осадки суспендировали в 10 мл 0,5% Triton X-100 с ингибиторами протеиназы (Roche) и лизировали при 4°C в течение 10 минут на шейкере. Затем клеточные лизаты дважды с силой прокачивали через иглу 25 калибра, и концентрацию соли доводили до 50 мМ NaCl, 20 мМ Tris HCl (pH 7,3). Суммарный экстракт наносили на колонку с гепарин-сефарозой (Amersham Biosciences, Sweden), которую предварительно уравновешивали в 20 мМ Tris pH 7,2, 50 мМ NaCl и 0,5% Triton X-100. Колонку элюировали с использованием линейного градиента: от 50 мМ до 2M NaCl в 20 мМ Tris, pH 7,3, в присутствии 0,5% Triton X-100. Скорость потока составляла 1 мл/мин. Оптическую плотность наблюдали при 280 нм. Фракции по 1 мл собирали и тестировали на Bv8 человека с помощью ELISA. Затем пиковые фракции Bv8 и несколько внепиковых фракций объединяли и концентрировали в 10 раз с использованием Microcon Centrifugal Filter Devices, Ultracel YM-3 (Millipore, Bedford, MA), и тестировали их биологическую активность.
Твердофазный иммуноферментный анализ Bv8 человека (ELISA)
96-луночные микролуночные планшеты MaxiSorp® (Nalge Nunc International, Rochester, NY) покрывали мышиным моноклональным антителом 3F1 1,0 мкг/мл (Genentech Inc.) в 50 мМ карбонатном буфере, pH 9,6, при 4°C в течение ночи. Планшеты промывали в PBS, содержащем 0,05% полисорбата 20, и блокировали 0,5% бычьим сывороточным альбумином, 15 мд (миллионных долей) Proclin 300 (Supelco, Bellefonte, PA) в PBS при комнатной температуре в течение 1 часа. После промывания планшетов стандарты Bv8 человека (0,020-2,5 нг/мл в двухкратном серийном разведении, PeproTech, Rocky Hill, NJ) и образцы (минимальное разведение 1:10) в PBS, содержащем 0,5% бычий сывороточный альбумин, 0,05% полисорбат 20, 15 мд Proclin 300 (Supelco, Bellefonte, PA) и 0,35н. NaCl (буфер для образца), серийно разводили и добавляли в каждую лунку. Планшеты инкубировали в течение 2 часов при комнатной температуре, после чего следовала стадия промывания. Связанное Bv8 обнаруживали добавлением вторичного антитела, биотинилированного антитела клона 3B8 хомяка против Bv8 (Genentech Inc.) с последующим добавлением стрептавидин-HRP (GE Healthcare, Buckinghamshire, United Kingdom) и 3,3',5,5'-тетраметил бензидина (Kirkegaard & Perry Laboratories, Gaithersburg, MD) в качестве субстрата. Реакцию останавливали добавлением 1 М фосфорной кислоты. Оптическую плотность считывали при 450 нм на ридере микропланшетов ThermoMax (Molecular Devices, Menlo Park, CA). Кривые титрования стандартов вычисляли с использованием четырехпараметрической регрессионной программы аппроксимации кривой по точкам (Genentech Inc). Концентрацию Bv8 человека вычисляли посредством экстраполяции значений оптической плотности образцов по диапазону данных на калибровочной кривой. ELISA для Bv8 способен проводить измерения в буфере для лизиса с концентрацией вплоть до 10% и обладает чувствительностью для обнаружения Bv8 всего 0,20 нг/мл в тканевых лизатах. ELISA специально разрабатывали и оптимизировали для Bv8, поскольку человеческие EG-VEGF, VEGF-A, VEGF-C и G-CSF (R&D Systems, Minneapolis, MN) вплоть до 30 мкг/мл давали только фоновый сигнал; присутствие этих молекул и антител против VEGF (Genentech Inc.) в концентрации до 30 мкг/мл не влияло на обнаружение 100 пг/мл Bv8 человека в буфере для образцов. Этот ELISA также способен обнаруживать мышиный Bv8, но с чувствительностью менее 7%.
Анализ биологической активности Bv8
Клетки GeneBLAzer® NFAT-CHO получали из Invitrogen Corporation (Carlsbad, CA). Клетки стабильно трансфицировали генами PKR1/EG-VEGFR1 и выращивали в DMEM (с высокой концентрацией глюкозы), которая содержала 10% диализированную сыворотку, 001 мМ NEAA, 2 мМ GlutaMax™ (Gibco), 1 мМ пирувата натрия, 10 мкг/мл зеоцина, 500 мкг/мл гигромицина. Клетки высевали в 96-луночные Viewplate (Packard) при 2,5×104 в 80 мл/лунка в 1% DMEM в течение ночи при 5% CO2, 37°C. На следующий день клетки обрабатывали различными колоночными фракциями, которые концентрировали на Microcon Centrifugal Filter Devices (Ultracel YM-3) из Millipore. 0,2-0,02 нг/мл hBv8 (Peprotech Inc.), изготовленного в 1% DMEM, использовали в качестве положительного контроля. Через 1 час среду удаляли и заменяли на 80 мл раствора Хэнка, содержащего 0,1% БСА и 6х буфер для нанесения, содержащий 1 мМ CCF4 (Invitrogen Corporation). Планшеты инкубировали в течение 1,5 часов при комнатной температуре в темноте и считывали на ридере планшетов Wallac при длине волны возбуждающего света 410 нм и длине волны испускаемого света 450/520 нм. Отрицательными контролями были клетки, в которые не добавляли лиганды, и контрольная среда в чистом виде. Клетки CHO стимулировали рекомбинантным Bv8 человека или объединяли фракции за 1 час до добавления β-лактамазного субстрата CCF4. Для оценки специфичности колоночных фракций антитела 2B9 и 3F1 против Bv8 добавляли в концентрации 20 мг/мл.
Анализ белых кровяных клеток от доноров, получавших G-CSF
Белые клетки периферической крови получали от здоровых доноров после 4-5 дней введения G-CSF посредством афереза (Cellular Therapy and Cell Processing Facilities, Fred Hutchinson Cancer Research Center, Seattle, WA). Белые клетки крови необработанных индивидуумов собирали с помощью той же процедуры и использовали в качестве непарных контролей. Затем клетки концентрировали и ресуспендировали в криопротективной среде с сывороточным альбумином человека плюс 10% DMSO. После оттаивания при 3°C на водяной бане, жизнеспособность клеток составляла >95% по исключающему тесту с трипаном голубым. В кратком изложении клетки промывали в буфере HBSS, содержащем 0,2% БСА, и лизировали или в РНК буфере для лизиса (Qiagen), или в буфере RIPA, содержащем ингибиторы протеиназы (Roche) для выделения РНК или измерения белков.
Хемотаксис нейтрофилов периферической крови
106 клеток промывали в HBSS, содержащем 0,2% БСА, перед тем как поместить их во вставку для проницаемых лунок с размером пор 5 мкм (Corning Incorporated, Lowell, MA). В нижнюю камеру добавляли чистую среду или среду с различными цитокинами в различных концентрациях (максимум 200 нг/мл). После трех часов при 37°C клетки в нижней камере переносили, смешивали с 9 мл раствора ZPAK и подсчитывали на Z2 Coulter Particle Count and Size Analyzer (Beckman Coulter, Fullerton, CA).
Культура клеток лейкемии человека
Клетки U937, HL-60, THP-1, Hel 92.1.7, KG-1, K562, Jurkat получали из ATCC® (Manassas, VA). Большинство клеток выращивали в 10% FBS-содержащей RPMI. Клетки KG-1 выращивали в 20% FBS-содержащей модифицированной по способу Искова среде Дульбекко. Для клеток THP-1 использовали 10% FBS-содержащую RPMI с пируватом натрия, HEPES и β-меркаптоэтанолом. Для исследования регулирования использовали 1 миллион клеток с жизнеспособностью более 95%. Исследования регулирования осуществляли как при нормоксии, так и при гипоксии в течение 4 часов в 1 мл среды HBSS, содержащей 0,2% БСА.
Статистический анализ
Для вычисления статистической значимости использовали критерий Стьюдента.
Результаты
Регулирование Bv8 в костном мозге человека и различных клетках крови
Ранее сообщалось, что G-CSF приводит к существенному повышающему регулированию (>30 раз) экспрессии Bv8 в мышиных костномозговых клетках и периферических нейтрофилах (Shojaei et al. Nature 450:825-831 (2007) и пример 1).
В настоящем исследование оценивали, является ли G-CSF индуктором экспрессии Bv8 также и в выделенных периферических нейтрофилах человека и клетках цельного костного мозга. 10 нг/мл G-CSF приводили в среднем к 7-кратной (диапазон от 6 до 12) индукции экспрессии Bv8 в течение 4 часов. Меньшая кратность увеличения по сравнению с мышиными нейтрофилами можно объяснить, по меньшей мере частично, высокой базальной экспрессией Bv8 в клетках человека (данные не приведены). Исследования динамики указывают на то, что G-CSF индуцирует мРНК Bv8 в течение 4 часов и эффект сохраняется до 24 часов (данные не приведены). Исследователи идентифицировали GM-CSF как дополнительный положительный регулятор экспрессии Bv8 в человеческих костномозговых клетках и нейтрофилах (фиг.14а и b). Значимое ~2,5-кратное увеличение экспрессии Bv8 наблюдали при концентрации GM-CSF 10 нг/мл. Это расходится с мышиными нейтрофилами, которые не проявляют индукцию Bv8 с помощью GM-CSF. Другие протестированные цитокины, включающие ИЛ-6, ИЛ-1β и EPO (эритропоэтин), не обладают стимулирующим действием на экспрессию Bv8 человека в нейтрофилах или костномозговых клетках.
В отличие от нейтрофилов, моноциты и лимфоциты не проявляют какого-либо изменения экспрессии Bv8 в ответ на G-CSF (фиг.14с и d). Удивительно, что GM-CSF снижал экспрессию Bv8 в моноцитах человека, приблизительно при 75% ингибировании через 4 часа после обработки. ИЛ-10 апрегулировали экспрессию Bv8 в моноцитах и лимфоцитах, тогда как SDF-1α проявлял значительные стимулирующее действие на моноциты (фиг.14с и d). Более низкий базальный уровень экспрессии Bv8 обнаруживали в моноцитах и лимфоцитах по сравнению с базальным уровнем в нейтрофилах или костномозговых клетках (данные не приведены).
В заключение, эффекты G-CSF и GM-CSF на экспрессию гена Bv8 в нейтрофилах были достаточно уникальными, тогда как два родственных цитокина, M-CSF и SCF, не проявляли эффекта.
Регулирование рецепторов Bv8 в человеческих костномозговых клетках и нейтрофилах
В отличие от мышиных нейтрофилов, которые экспрессируют как PKR1/EG-VEGFR1, так и PKR2/EG-VEGFR2, выделенные нейтрофилы человека на поддающемся обнаружению уровне экспрессируют только PKR2/EG-VEGFR2. После 4 часов инкубирования in vitro, GM-CSF, но не G-CSF, вызывал значительное повышение регулирования экспрессии PKR2/EG-VEGFR2 (в среднем при 4-кратной индукции) (фиг.15а). Похоже, что в костном мозге человека как G-CSF, так и GM-CSF регулируют PKR2/EG-VEGFR2 до значительного уровня (фиг.15b).
Апрегулирование Bv8 и PKR2/EG-VEGFR2 в мобилизованных периферических мононуклеарных клетках из доноров, которых обрабатывали с использованием G-CSF
Мононуклеарные клетки периферической крови из 11 необработанных и 12 обработанных с использованием G-CSF индивидуумов получали с помощью афереза. Исследовали экспрессию гена Bv8 с помощью Taqman, а также измеряли уровень белка Bv8 с помощью ELISA. Приблизительно 4,5-увеличение экспрессии Bv8 и 10-кратное увеличение уровня белка обнаруживали в G-CSF-мобилизованных мононуклеарных клетках по сравнению с мононуклеарными клетками из необработанных доноров (фиг.16). Схожим образом, PKR2/HG-VEGFR2, но не PKR1/HG-VEGFR1, обнаруживались в клинически собранных белых клетках крови, когда пациентов обрабатывали с использованием G-CSF в течение 4-5 дней. Мононуклеарные клетки из индивидуумов, обработанных с использованием G-CSF, проявляли значительную индукцию экспрессии PKR2/EG-VEGFR2 (~2-кратную) по сравнению с необработанными контрольными образцами (фиг.16b).
Bv8, продуцируемый нейтрофилами человека, является биологически активным
Чтобы охарактеризовать белок Bv8, растворяли осадки из периферических нейтрофилов человека в 0,5% Triton® X-100. Затем лизаты нейтрофилы подвергали аффинной хроматографии на гепарин-сефарозе, как описано в материалах и способах. Как показано на фиг.14а, Bv8 связывался с колонкой и элюировался в присутствии ~0,4 М NaCl, подобно мышиному белку Bv8. В ELISA дополнительно подтверждали присутствие Bv8 во фракциях 9, 10 и 11 (фиг.17а).
Поскольку было обнаружено, что даже следовые количества Triton® X-100 обладают значительной цитотоксичностью для эндотелиальных клеток в тестах на пролиферацию, исследователи решили тестировать активность полученного из нейтрофилов белка Bv8 в тесте, для которого нужно меньше времени для стимуляции. Авторы использовали преимущество клеток CHO, стабильно трансфицированных с использованием PKR1/EG-VEGFR1, как описано в Материалах и способах. Как ожидалось, рекомбинантный Bv8 человека (0,2-200 нг/мл) вызывал дозозависимую стимуляцию (данные не приведены). Как показано на фиг.17b, колоночные фракции, содержавшие иммунореактивный Bv8, проявляли значительную стимуляцию по сравнению с контрольным буфером с Triton® X-100. Однако побочные фракции, не содержавшие иммунореактивный Bv8, не проявляли стимулирующего эффекта. Также антитела против Bv8 блокировали стимуляцию с помощью объединенных фракций, содержащих Bv8. VEGF-A, который тестировали в концентрации до 200 нг/мл, не вызывал какого-либо ответа, дополнительно подтверждая специфичность этих эффектов.
Влияние Bv8 на миграцию нейтрофилов
Тестировали возможность того, что Bv8 может обладать хемотаксическими эффектами на нейтрофилы человека. Как показано на фиг.18, Bv8 индуцировал значительную стимуляцию хемотаксиса, при этом минимальный эффект составил ~3-кратное увеличение относительно контроля. Примечательно, что максимальная стимуляция происходила при очень низкой концентрации Bv8 (~2 пМ). Схожий характер наблюдали у 6 независимых доноров (фиг.18). Другие хемотаксические факторы, такие как SDF-1α, ИЛ-8 и G-CSF, требовали более высоких концентраций (20 нМ) для того, чтобы стимулировать миграцию нейтрофилов. VEGF и MCP-1 не проявляли каких-либо эффектов при всех протестированных концентрациях (данные не приведены).
Экспрессия Bv8 в различных клеточных линиях лейкемии человека и регулирование с помощью G-CSF
Чтобы определить, экспрессируется ли Bv8 клетками лейкемии, тестировали панель клеточных линий человека. Экспрессия Bv8 в клеточных линиях Jurkat и K562 не поддавалась обнаружению (данные не приведены). Однако поддающиеся обнаружению уровни мРНК Bv8 обнаруживали в клеточных линиях HL-60, KG-1, Hel 92.1.7 и U937. G-CSF в концентрации 10 нг/мл индуцировал увеличение экспрессии Bv8 (в 2-3 раза) в нескольких клеточных линиях (Д таблица 2). Однако для GM-CSF не наблюдали значительной индукции ни в одной протестированной клеточной линии. Ни G-CSF, ни GM-CSF не изменял экспрессию Bv8 в клеточной линии острой промиелоцитарной лейкемии HL-60.
Обсуждение
Хорошо известно, что нейтрофилы и другие миелоидные клетки выполняют роль во врожденном иммунитете, обеспечивая первую линию защиты от патогенов (Bendelac and Fearon, Curr Opin. Immunol. 9:1-3 (1997). Также, твердо установлено, что эти клетки участвуют в различных острых и хронических воспалительных процессах (O'Shea and Murray, Immunity 28:477-487 (2008). Кроме того, связь между воспалительными клетками и раком, о существовании которой впервые предположили в 19-м веке, в настоящее время получила широкое экспериментальное и клиническое подтверждение (рассмотрено в Coussens and Werb, Nature 420:860-867 (2002); Lin and Karin, J Clin. Invest 117:1175-1183 (2007)). Секреция различных провоспалительных цитокинов и хемокинов может напрямую способствовать росту опухоли и ангиогенезу. Кроме того, инфильтрирующие опухоль миелоидные клетки могут способствовать росту опухоли в силу их способности к даунрегуляции иммунных ответов на субтипы T-клеток, включая клетки CD4+ и CD8+, откуда следует обозначение миелоидные супрессорные клетки (МСК) по меньшей мере для подкласса клеток CD11b+Gr1+ (рассмотрено в Talmadge J.E, Clin. Cancer Res 3:5243-5248 (2007)).
В недавних исследованиях проверяли гипотезу о том, что миелоидные клетки также могут играть роль в опосредовании рефрактерности к антагонистам VEGF в моделях опухолей (Shojaei et al., Nature Biotechnology 25:911-920 (2007)). Опухоли с устойчивостью к антагонистам VEGF связывали со значительным увеличением частоты клеток CD11b+Gr1+, инфильтрирующих опухоль, по сравнению с чувствительными опухолями (Shojaei et al., выше). При оценке механизма VEGF-независимого ангиогенеза, опосредованного клетками CD11b+Gr1+, ортолог секретируемого белка Bv8 идентифицировали как критический регулятор (Shojaei et al., Nature 450:825-831 (2007)). Эти исследования, включая данные, предоставленные в примере 1, предоставляют доказательство того, что Bv8 является посредником при мобилизации миелоидных клеток и ангиогенезе в процессе развития опухоли не только при ксенотрансплантации (Shojaei et al., Nature, 2007, выше), но также в моделях развития рака на трансгенных мышах (Shojaei et al., Proc. Natl. Acad. Sci USA 105:2640-2645 (2008)).
Настоящее исследование нацелено на описание экспрессии Bv8 в костном мозге человека и зрелых клетках крови. Анализ показывает, что регулирование экспрессии Bv8 в клетках крови человека с помощью различных цитокинов обладает специфичностью к типу клеток. Подобно мышам, самая высокая экспрессия Bv8 была в костномозговых клетках и нейтрофилах, тогда как в моноцитах и лимфоцитах обнаруживали более низкий уровень. Чтобы подтвердить биологическую активность белка Bv8, Bv8 частично очищали от нейтрофилов человека, и его активность регистрировали в биологическом анализе. Кроме того, в настоящем исследовании идентифицировали новую активность Bv8, способность стимулировать миграцию нейтрофилов при очень низкой концентрации in vitro, указывая на то, что Bv8, возможно из источников, отличных от других нейтрофилов, может физиологически регулировать миграцию нейтрофилов. Кроме того, настоящие результаты показывают, что из двух рецепторов Bv8 только PKR2/EG-VEGFR2 экспрессировался как в выделенных нейтрофилах человека и клетках, мобилизованных с помощью G-CSF, показывая, что он действительно является основным рецептором, вовлеченным в гемопоэтические эффекты Bv8.
G-CSF был основным индуктором экспрессии Bv8 в нейтрофилах и костномозговых клетках, хотя он не обладал воздействием на моноциты и лимфоциты. Важно, что повышающее регулирование Bv8 можно показать in vivo, которое оценивали по увеличенной экспрессии в периферической крови доноров, которых обрабатывали с помощью G-CSF. G-CSF может продуцироваться стромальными клетками, фибробластами и эндотелиальными клетками в опухолевом микроокружении. Повышающее регулирование Bv8 в нейтрофилах человека и костномозговых клетках с помощью GM-CSF было интригующим, поскольку этот фактор не вызывал такого эффекта в мононуклеарных клетках мыши. Действительно, известно, что как G-CSF, так и GM-CSF модулируют пролиферацию, дифференциацию, выживаемость и созревание нейтрофилов и моноцитов из костного мозга. Также оба фактора могут продуцироваться различными негемопоэтическими клетками, включая фибробласты, эндотелиальные клетки, кератиноциты и опухолевые клетки. Кроме того, несколько сообщений указывают на то, что колониестимулирующие факторы могут способствовать злокачественному росту, по меньшей мере в экспериментальных системах (Karcher et al., Int J Cancer 118:2182-2189 (2006); Morales-Arias et al., Cancer 110:1568-1577 (2007); Okazaki et al., International Immunology 18:1-9 (2006)).
ИЛ-10 и SDF-1α значительно апрегулировали экспрессию Bv8 в моноцитах человека. В лимфоцитах ИЛ-10 был основным индуктором экспрессии Bv8. Примечательно, что многочисленные данные подтверждают роль макрофагов и лимфоцитов, инфильтрирующих опухоль, в секретировании ангиогенных факторов, таких как VEGF (Freeman et al., Cancer Res 55:4140-4145 (1995); Lewis and Murdoch, Am J Pathol. 167-627-635 (2005)). Следовательно, Bv8, продуцируемый этими типами клеток, может способствовать ангиогенезу и также может иметь дополнительные регуляторные функции, которые еще предстоит выявить. Исходно охарактеризованный как цитокин, продуцируемый T-хелперами 2 типа (Th2) (Boyman et al., Curr Opin. Immunol. 19:320-326 (2007)), ИЛ-10 также был вовлечен в ангиогенез (Silvestre et al., Circ Res. 87:448-452 (2000); Sakamoto et al., Int J Cancer 118:1909-1914 (2006)).
В заключение, исследования изобретателей показали, что экспрессия и регулирование Bv8 в гемопоэтических клетках человека по существу сохранено относительно мыши, что обеспечивает основу для дальнейшего исследования патофизиологической роли Bv8 в опухолях и воспалительных заболеваниях человека и для терапевтического применения ингибиторов Bv8.
Все источники, цитировавшиеся на всем протяжении раскрытия, посредством этого явно включены по ссылке в полном объеме.
Поскольку настоящее изобретение описано со ссылками на то, что можно рассматривать как конкретные варианты осуществления, следует понимать, что изобретение не ограничено такими вариантами осуществления. Напротив, предусмотрено, что изобретение относится к различным модификациям и эквивалентам, заключенным в сущности и объеме приложенной формулы изобретения.
На всем протяжении настоящей заявки, включая формулу изобретения, термин «который содержит» используется как включающая, неограничивающая, переходная фраза, которая не исключает дополнительные, неуказанные элементы или стадии способа.
Реферат
Настоящая группа изобретений относится к медицине, а именно онкологии. Изобретения могут быть использованы для способа лечения опухоли, устойчивой к лечению антагонистом VEGF, а также для способа идентификации субъекта-человека, несущего опухоль для лечения антагонистом Bv8. Для этого вводят эффективное количество антагониста Bv8. Опухоль при этом предварительно лечат антагонистом фактора роста эндотелия сосудов (VEGF), а антагонист Bv8 представляет собой антитело против Bv8 или его фрагмент, а также проводят определение того, что субъект рефрактерен к лечению антагонистом VEGF. Изобретения обеспечивают эффективное лечение пациентов с опухолями, устойчивыми к антагонистам VEGF. 2 н. и 19 з.п. ф-лы, 105 ил., 3 табл.
Формула
Документы, цитированные в отчёте о поиске
Производные адамантана, способ их получения, фармацевтическая композиция на их основе, способ ее получения и способ воздействия на иммуносупрессию

Комментарии