Ингибирование метастазирования опухоли при помощи антагонистов bv8 или g-csf - RU2567803C2
Код документа: RU2567803C2
Чертежи












Описание
Родственные заявки
Данная заявка, которая не является предварительной заявкой на патент, была подана согласно разделу 37 Свода федеральных правил 1.53(b)(1) и притязает согласно разделу 35 Кодекса законов США на приоритет предварительной заявки на патент № 61/230571, поданной 31 июля 2009 г., и предварительной заявки на патент № 61/350558, поданной 2 июня 2010 г., которые включены в настоящее описание изобретения в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение главным образом относится к композициям и способам, которые пригодны для лечения состояний и заболеваний, ассоциированных с развитием кровеносных сосудов и метастазированием опухолей. Настоящее изобретение, в частности, относится к профилактике или лечению метастазирования опухоли при помощи антагонистов G-CSF и/или антагонистов Bv8.
Уровень техники
Хорошо известно, что развитие кровеносных сосудов (ангиогенез) играет важную роль в прогрессировании и метастазировании опухоли, поэтому ингибирование развития кровеносных сосудов является клинически обоснованной стратегией лечения рака (Folkman, Nat. Med. 1, 27-31 (1995); Ferrara and Kerbel, Nature 438, 967-974 (2005); Carmeliet, Nat. Med. 9, 653-660 (2003)).
На протяжении последних нескольких лет объектом всестороннего исследования было воздействие разных типов клеток, выделяемых из костного мозга (ВМ), на развитие кровеносных сосудов опухоли (Coussens and Werb, Nature 420, 860-867 (2002); Rafii et al., Nat. Rev. Cancer 2:826-35 (2002); De Palma et al., Trends Immunol. 28:519-524 (2007); Shojaei et al., Trends Cell Biol. 18:372-378, 2008)). Из всех исследованных типов клеток в опухолях и в периферической крови (РВ) имеющих опухоли животных часто повышено содержание CD11b+Grl+ клеток, при этом установлено, что указанные клетки стимулируют развитие кровеносных сосудов опухоли (Yang et al., Cancer Cell 6, 409-421 (2004)) и подавляют иммунные функции, попадая, таким образом, под определение супрессорных клеток, выделенных из миелоидных клеток (MDSC) (Bronte et al., Blood 96:3838-3846 (2000)). Однако механизмы, инициирующие периферическую активацию, хоминг опухоли и приобретение CD11b+Grl+ клетками проангиогенных свойств, требуют дальнейшего исследования.
CD11b+Grl+ клетки продуцируют несколько ангиогенных факторов, в том числе Bv8, секретируемый белок, который ранее был охарактеризован как митоген для специфичных эндотелиальных клеток, как фактор роста для предшественников гемопоэтических клеток (LeCouter et al., Proc. Natl. Acad. Sci. USA 100, 2685-2690 (2003); LeCouter et al., Proc. Natl. Acad. Sci. USA 101, 16813-16818 (2004)), и как нейромодулятор (Cheng et al., Nature 417, 405-410 (2002); Matsumoto et al., Proc. Natl. Acad. Sci. USA 103; 4140-4145 (2006)). Исследование нескольких ксенотрансплантатов, а также трансгенной модели рака (RIP-Tag) позволило предположить, что Bv8 стимулирует ангиогенез опухоли вследствие повышенной периферической активации миелоидных клеток и локальной стимуляции развития кровеносных сосудов (Shojaei et al., Nature 450:825-831 (2007); Shojaei et al., Proc. Natl. Acad. Sci. USA 105:2640-2645 (2008)). В научной литературе было отмечено, что колониестимулирующий фактор гранулоцитов (G-CSF) является сильным индуктором экспрессии Bv8 как in vitro, так и in vivo (Shojaei et al., Proc. Natl. Acad. Sci. USA 106(16):6742-7 (2009)). В физиологическом отношении G-CSF играет важную роль в активации гемопоэтических стволовых клеток, клеток-предшественников и зрелых клеток, в частности, нейтрофилов, в кровотоке (Rapoport et al., Blood Rev. 6:43-57 (1992); Lieschke et al., Blood 84:1737-1746 (1994)). G-CSF также необходим для дифференцировки клеток-предшественников в клетки линии гранулоцитов, такие как нейтрофилы, эозинофилы и базофилы. Хотя в нескольких научных отчетах было высказано предположение, что введение G-CSF усиливает развитие кровеносных сосудов и рост опухоли (Natori et al., Biochem Biophys. Res. Commun. 297:1058-1061 (2002); Okazaki, T. et al., Int. Immunol. 18, 1-9 (2006)), все еще нет достоверных свидетельств участия данного фактора в онкогенезе.
Метастазирование представляет собой сложный ряд стадий, на протяжении которых раковые клетки покидают место образования первичной опухоли и мигрируют в другие части тела с кровотоком или по лимфатической системе. Метастазирующие опухоли весьма характерны на поздних стадиях рака. Метастазирование является основной причиной смерти от солидных опухолей. К сожалению, применяемые в настоящее время методы лечения редко позволяют вылечить метастазирующий рак.
Таким образом, необходимо исследовать и установить, каким образом можно эффективно ингибировать, предотвращать и лечить развитие кровеносных сосудов и метастазирование опухоли. Предметом настоящего изобретения являются вышеуказанные и другие цели, которые станут очевидными из приведенного ниже описания изобретения.
Сущность изобретения
В основе настоящего изобретения лежит, по меньшей мере частично, открытие того, что G-CSF и Bv8 участвуют в развитии кровеносных сосудов и метастазировании опухоли.
Одним объектом настоящего изобретения являются способы ингибирования или уменьшения метастазирования опухоли, которые включают введение субъекту эффективного количества антагониста G-CSF. В определенных вариантах осуществления изобретения указанный способ дополнительно включает введение субъекту эффективного количества антагониста Bv8. В определенных вариантах осуществления изобретения антагонист G-CSF ингибирует или уменьшает распространение первичной опухоли в предметастатический орган субъекта. В определенных вариантах осуществления изобретения уменьшение метастазирования опухоли включает уменьшение размера и числа легочных метастазов. В определенных вариантах осуществления изобретения ингибирование или уменьшение метастазирования опухоли включает снижение уровней экспрессии одной или нескольких следующих молекул: G-CSF, Bv8, PKR1, MMP-9, S100A8 или S100A9. В определенных вариантах осуществления изобретения ингибирование или уменьшение метастазирования опухоли включает снижение уровней экспрессии G-CSF и PKR1. В определенных вариантах осуществления изобретения ингибирование или уменьшение метастазирования опухоли включает снижение уровней экспрессии ММР-9, S100A8 и S100A9. В определенных вариантах осуществления изобретения ингибирование или уменьшение метастазирования опухоли включает снижение уровней экспрессии Bv8, MMP-9, S100A8 и S100A9. В определенных вариантах осуществления изобретения ингибирование или уменьшение метастазирования опухоли включает снижение уровней экспрессии G-CSF, Bv8 и PKR1. В определенных вариантах осуществления изобретения уровни экспрессии являются уровнями экспрессии мРНК. В определенных вариантах осуществления изобретения уровни экспрессии являются уровнями экспрессии белка. В определенных вариантах осуществления изобретения уровни экспрессии одной или нескольких указанных молекул снижают в предметастатическом органе субъекта. В определенных вариантах осуществления изобретения предметастатическим органом является легкое. В опеределенных вариантах осуществления изобретения предметастатическим органом является печень.
В определенных вариантах осуществления изобретения указанные способы дополнительно включают введение субъекту эффективного количества антагониста VEGF. В определенных вариантах осуществления изобретения субъекта предварительно подвергают лечению антагонистом VEGF. В определенных вариантах осуществления изобретения антагонист VEGF является антителом против VEGF или его фрагментом. В определенных вариантах осуществления изобретения антитело против VEGF является бевацизумабом, его фрагментом или вариантом. В определенных вариантах осуществления изобретения указанные способы дополнительно включают введение субъекту эффективного количества химиотерапевтического средства.
Одним объектом настоящего изобретения являются способы снижения уровня экспрессии G-CSF, Bv8, PKR1, MMP-9, S100A8 или S100A9 в предметастатическом органе, которые включают введение субъекту эффективного количества антагониста G-CSF и/или антагониста Bv8. Другим объектом изобретения являются способы снижения уровня экспрессии одной или нескольких следующих молекул: G-CSF, Bv8, PKR1, MMP-9, S100A8 или S100A9, в предметастатическом органе, которые включают введение субъекту эффективного количества антагониста G-CSF и/или антагониста Bv8. В определенных вариантах осуществления изобретения уровни экспрессии PKR1, MMP-9, S100A8 и/или S100A9 снижают в предметастатическом органе субъекта при введении указанному субъекту антагониста G-CSF. В определенных вариантах осуществления изобретения уровни экспрессии PKR1, MMP-9, S100A8 и/или S100A9 снижают в предметастатическом органе субъекта при введении указанному субъекту антагониста Bv8. В определенных вариантах осуществления изобретения уровни экспрессии Bv8, MMP-9, S100A8 и/или S100A9 снижают в предметастатическом органе субъекта при введении указанному субъекту антагониста G-CSF. В определенных вариантах осуществления изобретения уровни экспрессии Bv8, MMP-9, S100A8 и/или S100A9 снижают в предметастатическом органе субъекта при введении указанному субъекту антагониста Bv8. В определенных вариантах осуществления изобретения уровни экспрессии MMP-9, A100A8 и S100A9 снижают в предметастатическом органе субъекта при введении указанному субъекту антагониста G-CSF. В определенных вариантах осуществления изобретения уровни экспрессии MMP-9, S100A8 и S100A9 снижают в предметастатическом органе субъекта при введении указанному субъекту антагониста Bv8. В определенных вариантах осуществления изобретения уровни экспрессии G-CSF и PKR1 снижают в предметастатическом органе субъекта при введении указанному субъекту антагониста G-CSF. В определенных вариантах осуществления изобретения уровни экспрессии G-CSF, PKR1 и ММР-9 снижают в предметастатическом органе субъекта при введении указанному субъекту антагониста G-CSF.
Одним объектом настоящего изобретения являются способы ингибирования миграции метастазирующих опухолевых клеток в предметастатический орган, которые включают введение субъекту эффективного количества антагониста G-CSF или антагониста Bv8. Другим объектом изобретения являются способы ингибирования миграции нейтрофилов в предметастатический орган, которые включают введение субъекту эффективного количества антагониста G-CSF или антагониста Bv8. В определенных вариантах осуществления изобретения указанные способы включают введение субъекту эффективного количества антагониста G-CSF и эффективного количества антагониста Bv8.
В определенных вариантах осуществления изобретения предметастатическим органом субъекта является легкое, печень, головной мозг, кость или лимфатический узел. В определенных вариантах осуществления изобретения предметастатическим органом субъекта является легкое или печень. В определенных вариантах осуществления изобретения предметастатическим органом субъекта является легкое.
В определенных вариантах осуществления изобретения антагонист G-CSF является антителом против G-CSF. В определенных вариантах осуществления изобретения антитело против G-CSF является моноклональным антителом. В определенных вариантах осуществления изобретения антитело против G-CSF является гуманизированным антителом. В определенных вариантах осуществления изобретения антитело против G-CSF является человеческим антителом.
В определенных вариантах осуществления изобретения антагонист Bv8 является антителом против Bv8. В определенных вариантах осуществления изобретения антагонист Bv8 является антителом против PKR1. В определенных вариантах осуществления изобретения антитело против Bv8 или антитело против PKR1 является моноклональным антителом. В определенных вариантах осуществления изобретения антитело против Bv8 или антитело против PKR1 является гуманизированным антителом. В определенных вариантах осуществления изобретения антитело против Bv8 или антитело против PKR1 является человеческим антителом.
Одним объектом настоящего изобретения являются способы прогнозирования вероятности эффективного реагирования опухоли субъекта на лечение антагонистом G-CSF и/или антагонистом Bv8, которые включают определение наличия в образце, полученном у субъекта, клетки, экспрессирующей Bv8, PKR1 и/или G-CSF на уровне выше уровня экспрессии в эталонном образце, при этом обнаружение указанной клетки показывает, что субъект имеет опухоль, которая будет эффективно реагировать на лечение указанным антагонистом G-CSF и/или антагонистом Bv8. В определенных вариантах осуществления изобретения обнаружение клетки, экспрессирующей Bv8, PKR1 и G-CSF на уровнях выше уровней экспрессии в эталонном образце, показывает, что субъект имеет опухолевые клетки, которые будут эффективно реагировать на лечение указанным антагонистом G-CSF и/или антагонистом Bv8. В определенных вариантах осуществления изобретения измеряют уровни экспрессии мРНК в Bv8, PKR1 и/или G-CSF. В определенных вариантах осуществления изобретения измеряют уровни экспрессии белка в Bv8, PKR1 и/или G-CSF. В определенных вариантах осуществления изобретения опухоль является метастазирующей опухолью.
Другим объектом настоящего изобретения являются способы прогнозирования вероятности эффективного реагирования опухоли субъекта на лечение антагонистом G-CSF и/или антагонистом Bv8, которые включают определение наличия в образце, полученном у субъекта, функционального человеческого аналога CD11b+Gr1+ клетки, экспрессирующей Bv8 на уровне выше уровня экспрессии в эталонном образце, при этом обнаружение указанного функционального человеческого аналога CD11b+Gr1+ клетки показывает, что субъект имеет опухоль, которая будет эффективно реагировать на лечение указанным антагонистом G-CSF и/или антагонистом Bv8. В определенных вариантах осуществления изобретения измеряют уровень экспрессии мРНК в Bv8. В определенных вариантах осуществления изобретения измеряют уровень экспрессии белка в Bv8. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются незрелыми миелоидными клетками человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются супрессорными клетками, выделенными из миелоидных клеток человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются предшественниками нейтрофилов, моноцитов или макрофагов человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются нейтрофилами, моноцитами или макрофагами человека. В определенных вариантах осуществления изобретения опухоль является метастазирующей опухолью.
Еще одним объектом настоящего изобретения являются способы прогнозирования вероятности эффективного реагирования опухоли субъекта на лечение антагонистом G-CSF и/или антагонистом Bv8, которые включают определение наличия в образце, полученном у субъекта, более высокого числа или большей частоты встречаемости функционального человеческого аналога CD11b+Gr1+ клеток по сравнению с эталонным образцом, при этом более высокое число или большая частота встречаемости функционального человеческого аналога CD11b+Gr1+ клеток показывает, что субъект имеет опухоль, которая будет эффективно реагировать на лечение указанным антагонистом G-CSF и/или антагонистом Bv8. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются незрелыми миелоидными клетками человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются супрессорными клетками, выделенными из миелоидных клеток человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются предшественниками нейтрофилов, моноцитов или макрофагов человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются нейтрофилами, моноцитами или макрофагами. В определенных вариантах осуществления изобретения опухоль является метастазирующей опухолью.
Одним объектом настоящего изобретения являются способы лечения опухоли у субъекта антагонистом G-CSF и/или антагонистом Bv8, которые включают (а) определение наличия в образце, полученном у субъекта, клетки, экспрессирующей Bv8, PKR1 и/или G-CSF на уровне выше уровня экспрессии в эталонном образце, и (b) введение субъекту эффективного количества указанного антагониста G-CSF и/или антагониста Bv8, если данный образец включает клетку, экспрессирующую Bv8, PKR1 и/или G-CSF на уровне выше уровня экспрессии в эталонном образце. В определенных вариантах осуществления изобретения указанная клетка является функциональным человеческим аналогом CD11b+Gr1+ клетки. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются незрелыми миелоидными клетками человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются супрессорными клетками, выделенными из миелоидных клеток человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются предшественниками нейрофилов, моноцитов или макрофагов человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются нейтрофилами, моноцитами или макрофагами. В определенных вариантах осуществления изобретения указанная клетка является метастазирующей опухолевой клеткой. В определенных вариантах осуществления изобретения указанные клетки выделяют из предметастатического органа субъекта. В некоторых вариантах осуществления изобретения субъекту вводят эффективное количество указанного антагониста G-CSF и/или антагониста Bv8, если образец включает клетку, экспрессирующую Bv8, PKR1 и G-CSF на уровнях выше уровней экспрессии в эталонном образце.
В определенных вариантах осуществления изобретения измеряют уровни экспрессии мРНК в Bv8, PKR1 и/или G-CSF. В определенных вариантах осуществления изобретения измеряют уровни экспрессии белка в Bv8, PKR1 и/или G-CSF.
Другим объектом настоящего изобретения являются способы лечения опухоли у субъекта антагонистом G-CSF и/или антагонистом Bv8, которые включают (а) определение наличия в образце, полученном у субъекта, более высокого числа или большей частоты встречаемости функционального человеческого аналога CD11b+Gr1+ клеток по сравнению с эталонным образцом, и (b) введение субъекту эффективного количества указанного антагониста G-CSF и/или антагониста Bv8, если данный образец характеризуется более высоким числом или большей частотой встречаемости функционального человеческого аналога CD11b+Gr1+ клеток по сравнению с эталонным образцом. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются незрелыми миелоидными клетками человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются супрессорными клетками, выделенными из миелоидных клеток человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются предшественниками нейтрофилов, моноцитов или макрофагов человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются нейтрофилами, моноцитами или макрофагами. В определенных вариантах осуществления изобретения опухоль является метастазирующей опухолью.
Другим объектом настоящего изобретения являются способы лечения опухоли, включающие (а) введение имеющему опухоль субъекту эффективного количества антагониста G-CSF, и (b) контролирование эффективности указанного лечения путем определения числа или частоты встречаемости функционального человеческого аналога CD11b+Gr1+ клеток в образце, полученном у данного субъекта после лечения, по сравнению с числом или частотой встречаемости функционального человеческого аналога CD11b+Gr1+ клеток в образце, полученном у субъекта до лечения, при этом меньшее число или более низкая частота встречаемости функционального человеческого аналога CD11b+Gr1+ клеток в образце, полученном у субъекта после лечения, свидетельствует об эффективности лечения. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются незрелыми миелоидными клетками человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются супрессорными клетками, выделенными из миелоидных клеток человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются предшественниками нейтрофилов, моноцитов или макрофагов человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются нейтрофилами, моноцитами или макрофагами. В определенных вариантах осуществления изобретения опухоль является метастазирующей опухолью.
Другим объектом настоящего изобретения являются способы лечения опухоли, включающие (а) введение имеющему опухоль субъекту эффективного количества антагониста G-CSF и/или антагониста Bv8, и (b) контролирование эффективности указанного лечения путем определения уровня экспрессии Bv8, MMP-9, S100A8 или S100A9 в образце, полученном у субъекта после лечения, по сравнению с уровнем экспрессии Bv8, MMP-9, S100A8 или S100A9 в образце, полученном у субъекта до лечения, при этом более низкий уровень экспрессии Bv8, MMP-9, S100A8 или S100A9 в образце, полученном у субъекта после лечения, свидетельствует об эффективности лечения.
В определенных вариантах осуществления изобретения уровни экспрессии по меньшей мере двух из четырех следующих молекул: Bv8, MMP-9, S100A8 и S100A9, являются более низкими в образце, полученном у субъекта после лечения, по сравнению с образцом, полученным у данного субъекта до лечения. В определенных вариантах осуществления изобретения уровни экспрессии по меньшей мере трех из четырех следующих молекул: Bv8, MMP-9, S100A8 и S100A9, являются более низкими в образце, полученном у субъекта после лечения, по сравнению с образцом, полученным у данного субъекта до лечения. В определенных вариантах осуществления изобретения измеряют уровни экспрессии мРНК в Bv8, MMP-9, S100A8 и/или S100A9. В определенных вариантах осуществления изобретения измеряют уровни экспрессии белка в Bv8, MMP-9, S100A8 или S100A9. В определенных вариантах осуществления изобретения опухоль является метастазирующей опухолью.
В определенных вариантах осуществления изобретения уровни экспрессии мРНК в Bv8, MMP-9, S100A8 и/или S100A9 повышены в предметастатическом легком и/или метастатическом легком. В определенных вариантах осуществления изобретения уровни экспрессии белка в Bv8, MMP-9, S100A8 и/или S100A9 повышены в предметастатическом легком и/или метастатическом легком. В определенных вариантах осуществления изобретения уровни экспрессии мРНК в Bv8, MMP-9, S100A8 и/или S100A9 повышены в предметастатической ткани или опухолевой ткани. В определенных вариантах осуществления изобретения уровни экспрессии белка в Bv8, MMP-9, S100A8 и/или S100A9 повышены в предметастатической ткани или опухолевой ткани. В определенных вариантах осуществления изобретения лечение антителом против Bv8 является эффективным, если уровень экспрессии мРНК в Bv8 и/или ММР-9 снижается после лечения антителом против Bv8. В определенных вариантах осуществления изобретения лечение антителом Bv8 снижает уровень экспрессии мРНК в Bv8 и/или ММР-9 в предметастатических легких. В определенных вариантах осуществления изобретения лечение антителом против Bv8 является эффективным, если уровень экспрессии белка в Bv8 и/или ММР-9 снижается после лечения антителом против Bv8. В определенных вариантах осуществления изобретения лечение антителом против Bv8 снижает уровень экспрессии белка в Bv8 и/или ММР-9 в предметастатических легких. В определенных вариантах осуществления изобретения лечение антителом против G-CSF является эффективным, если уровень экспрессии мРНК в Bv8 и/или ММР-9 снижается после лечения антителом против G-CSF. В определенных вариантах осуществления изобретения лечение антителом против G-CSF снижает уровень экспрессии мРНК в Bv8 и/или ММР-9 в предметастатических легких и/или метастатических легких. В определенных вариантах осуществления изобретения лечение антителом против G-CSF является эффективным, если уровень экспрессии белка в Bv8 и/или ММР-9 снижается после лечения антителом против G-CSF. В определенных вариантах осуществления изобретения лечение антителом против G-CSF снижает уровень экспрессии белка в Bv8 и/или ММР-9 в предметастатических легких и/или метастатических легких. В определенных вариантах осуществления изобретения лечение антителом против PKR1 является эффективным, если уровень экспрессии мРНК в Bv8 и/или ММР-9 снижается после лечения антителом против PKR1. В определенных вариантах осуществления изобретения лечение антителом против PKR1 снижает уровень экспрессии мРНК в Bv8 и/или ММР-9 в предметастатических легких и/или метастатических легких. В определенных вариантах осуществления изобретения лечение антителом против PKR1 является эффективным, если уровень экспрессии белка в Bv8 и/или ММР-9 снижается после лечения антителом против PKR1. В определенных вариантах осуществления изобретения лечение антителом против PKR1 снижает уровень экспрессии белка в Bv8 и/или ММР-9 в предметастатических легких и/или метастатических легких.
В определенных вариантах осуществления изобретения опухоль является метастазирующей опухолью. В определенных вариантах осуществления изобретения лечение антагонистами G-CSF и/или антагонистами Bv8 предотвращает метастазирование метастазирующей опухоли в предметастатические ткани или предметастатические органы тела. В определенных вариантах осуществления изобретения образец, полученный у субъекта, представляет собой ткань, плазму, сыворотку или любые их комбинации. В определенных вариантах осуществления изобретения образцы, используемые в указанных способах, получают из предметастатического или метастатического органа. В определенных вариантах осуществления изобретения предметастатическим или метастатическим органом является легкое, печень, головной мозг, кость, лимфатический узел или яичник. В определенных вариантах осуществления изобретения образцы получают из предметастатической или метастатической ткани. В определенных вариантах осуществления изобретения предметастатическую или метастатическую ткань получают из легкого, печени, головного мозга, яичника, лимфатического узла, кости или костного мозга субъекта. В определенных вариантах осуществления изобретения указанный образец является образцом ткани, полученным из предметастатического органа. В определенных вариантах осуществления изобретения образец, полученный из предметастатического органа или предметастатической ткани, не содержит опухолевых клеток. В определенных вариантах осуществления изобретения образец представляет собой ткань первичной опухоли.
В определенных вариантах осуществления изобретения уровень экспрессии мРНК гена измеряют методом количественной ПЦР с обратной транскрипцией (qRT-PCR) или количественной ПЦР (qPCR). В определенных вариантах осуществления изобретения уровень экспрессии мРНК измеряют при помощи микроматрицы. В определенных вариантах осуществления изобретения уровень экспрессии мРНК измеряют методом гибридизации in situ (ISH). В определенных вариантах осуществления изобретения уровень экспрессии белка в гене измеряют методом иммуногистохимии (IHC).
Другим объектом настоящего изобретения являются способы ингибирования мобилизации функционального человеческого аналога CD11b+Gr1+ клеток из костного мозга в предметастатический или метастатический орган, которые включают введение субъекту эффективного количества антагониста G-CSF и/или антагониста Bv8. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются незрелыми миелоидными клетками человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются супрессорными клетками, выделенными из миелоидных клеток человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются предшественниками нейтрофилов, моноцитов или макрофагов человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются нейтрофилами, моноцитами или макрофагами человека.
Одним объектом настоящего изобретения являются способы лечения у субъекта рецидивирующей опухоли или опухоли, устойчивой к противораковой терапии, которые включают введение субъекту эффективного количества антагониста G-CSF. В определенных вариантах осуществления изобретения противораковая терапия включает использование антагониста VEGF. В определенных вариантах осуществления изобретения антагонист VEGF является антителом против VEGF или его фрагментом. В определенных вариантах осуществления изобретения антитело против VEGF является бевацизумабом, его фрагментом или вариантом.
Одним объектом настоящего изобретения являются способы лечения доброкачественной, предраковой или неметастазирующей опухоли у субъекта, которые включают введение указанному субъекту эффективного количества антагониста G-CSF и/или антагониста Bv8. В определенных вариантах осуществления изобретения введение антагониста G-CSF и/или антагониста Bv8 предотвращает развитие доброкачественной, предраковой или неметастазирующей опухоли в инвазивный или метастазирующий рак. В определенных вариантах осуществления изобретения доброкачественная, предраковая или неметастазирующая опухоль является опухолью в стадии 0, стадии I или стадии II. В определенных вариантах осуществления изобретения введение антагониста G-CSF и/или антагониста Bv8 предотвращает прогрессирование доброкачественной, предраковой или неметастазирующей опухоли в рак стадии III или стадии IV. В определенных вариантах осуществления изобретения введение антагониста G-CSF и/или антагониста Bv8 уменьшает объем опухоли.
Другим объектом настоящего изобретения являются способы лечения субъекта с операбельным раком, которые включают введение указанному субъекту эффективного количества антагониста G-CSF и/или антагониста Bv8 и выполнение хирургической операции, в результате которой удаляют раковую опухоль. В определенных вариантах осуществления изобретения антагонист G-CSF и/или антагонист Bv8 вводят субъекту до выполнения хирургической операции. В определенных вариантах осуществления изобретения указанные способы дополнительно включают стадию введения субъекту эффективного количества антагониста G-CSF и/или антагониста Bv8 после хирургической операции для предотвращения рецидива рака. В определенных вариантах осуществления изобретения введение антагониста G-CSF и/или антагониста Bv8 предотвращает пролиферацию микрометастазов.
Другим объектом настоящего изобретения являются способы лечения субъекта с операбельным раком при помощи вспомогательной противораковой химиотерапии, которые включают введение указанному субъекту антагониста G-CSF и/или антагониста Bv8.
Другим объектом настоящего изобретения являются способы предотвращения рецидива рака у субъекта, которые включают введение указанному субъекту антагониста G-CSF и/или антагониста Bv8, что позволяет предотвратить рецидив рака у данного субъекта. Другим объектом настоящего изобретения являются способы уменьшения вероятности рецидива рака у субъекта, которые включают введение указанному субъекту антагониста G-CSF и/или антагониста Bv8, что позволяет уменьшить вероятность рецидива рака у данного субъекта. В определенных вариантах осуществления изобретения введение антагониста G-CSF и/или антагониста Bv8 предотвращает или уменьшает вероятность рецидива клинически обнаруживаемой опухоли или ее метастазов. В определенных вариантах осуществления изобретения субъект был подвергнут радикальной хирургической операции до введения антагониста G-CSF и/или антагониста Bv8.
Другим объектом настоящего изобретения являются способы предотвращения повторного роста опухоли у субъекта, которые включают стадии удаления опухоли и последующего введения субъекту антагониста G-CSF и/или антагониста Bv8. Другим объектом настоящего изобретения являются способы предотвращения рецидива рака у субъекта, имеющего опухоль, которые включают удаление опухоли и последующее введение указанному субъекту антагониста G-CSF и/или антагониста Bv8. В определенных вариантах осуществления изобретения указанные способы дополнительно включают период времени между удалением опухоли и введением антагониста G-CSF и/или антагониста Bv8, который является достаточным для полного заживления послеоперационного рубца или уменьшения риска расхождения краев раны.
В определенных вариантах осуществления изобретения вводимый антагонист G-CSF является антителом против G-CSF или его фрагментом. В определенных вариантах осуществления изобретения вводимый антагонист Bv8 является антителом против Bv8 или его фрагментом. В определенных вариантах осуществления изобретения вводимый антагонист Bv8 является антителом против PKR1 или его фрагментом.
В определенных вариантах осуществления изобретения антагонисты и антитела по настоящему изобретению вводят последовательно. В определенных вариантах осуществления изобретения антагонисты и антитела по настоящему изобретению вводят одновременно.
Одним объектом настоящего изобретения являются способы ингибирования метастазирования опухоли в легкое, печень, головной мозг, яичник, лимфатический узел и/или кость, которые включают введение субъекту эффективного количества антитела против G-CSF и/или антитела против Bv8. Другим объектом настоящего изобретения являются способы ингибирования метастазирования опухоли в легкое, которые включают введение субъекту эффективного количества антитела против G-CSF, которое ингибирует метастазирование опухоли в предметастатическое легкое. Другим объектом настоящего изобретения являются способы ингибирования метастазирования опухоли в легкое, которые включают введение субъекту эффективного количества антитела против Bv8, которое ингибирует метастазирование опухоли в предметастатическое легкое. Другим объектом настоящего изобретения являются способы ингибирования метастазирования опухоли в легкое, которые включают введение субъекту эффективного количества антитела против PKR1, которое ингибирует метастазирование опухоли в предметастатическое легкое. Другим объектом настоящего изобретения являются способы ингибирования метастазирования опухоли в легкое, которые включают введение субъекту эффективного количества антитела против G-CSF и эффективного количества антитела против Bv8. Другим объектом настоящего изобретения являются способы ингибирования метастазирования опухоли в легкое, которые включают введение субъекту эффективного количества антитела против G-CSF и эффективного количества антитела против PKR1. Другим объектом настоящего изобретения являются способы ингибирования метастазирования опухоли в легкое, которые включают введение субъекту эффективного количества антитела против Bv8 и эффективного количества антитела против PKR1.
Другим объектом настоящего изобретения являются способы ингибирования метастазирования опухоли в печень, которые включают введение субъекту эффективного количества антитела против G-CSF, которое ингибирует метастазирование опухоли в предметастатическую печень. Другим объектом настоящего изобретения являются способы ингибирования метастазирования опухоли в печень, которые включают введение субъекту эффективного количества антитела против Bv8, которое ингибирует метастазирование опухоли в предметастатическую печень. Другим объектом настоящего изобретения являются способы ингибирования метастазирования опухоли в печень, которые включают введение субъекту эффективного количества антитела против PKR1, которое ингибирует метастазирование опухоли в предметастатическую печень.
В определенных вариантах осуществления изобретения антитела или фрагменты антител могут быть химерными, гуманизированными или человеческими.
В определенных вариантах осуществления изобретения способы по настоящему изобретению дополнительно включают введение субъекту эффективного количества антагониста VEGF. В определенных вариантах осуществления изобретения субъект имеет опухоль, которая ранее была подвергнута лечению антагонистом VEGF. В определенных вариантах осуществления изобретения субъект имеет рецидивирующую опухоль или опухоль, устойчивую к воздействию антагониста VEGF. В определенных вариантах осуществления изобретения антагонист VEGF является антителом против VEGF или его фрагментом. В определенных вариантах осуществления изобретения антитело против VEGF является бевацизумабом, его фрагментом или вариантом. В определенных вариантах осуществления изобретения способы по настоящему изобретению дополнительно включают введение субъекту эффективного количества химиотерапевтического средства. В определенных вариантах осуществления изобретения подвергаемый лечению субъект проходит курс химиотерапии и/или лучевой терапии, при этом химиотерапия, например, может включать введение цитотоксического агента. В определенных вариантах осуществления изобретения дополнительное лечение является лечением, известным как “стандартная медицинская помощь”, предоставляемая в отношении конкретной опухоли. В определенных вариантах осуществления изобретения антагонист G-CSF вводят в комбинации с другим противоопухолевым средством и/или другой схемой лечения, такой как химиотерапия и/или лучевая терапия. В определенных вариантах осуществления изобретения антагонист Bv8 вводят в комбинации с другим противоопухолевым средством и/или другой схемой лечения, такой как химиотерапия и/или лучевая терапия. В определенных вариантах осуществления изобретения способы по настоящему изобретению дополнительно включают введение дополнительного ингибитора развития кровеносных сосудов, такого как, например, антитело к ангиогенному фактору.
В определенных вариантах осуществления изобретения субъект является млекопитающим. В определенных вариантах осуществления изобретения субъект является человеком. В определенных вариантах осуществления изобретения у субъекта диагностирован рак. В определенных вариантах осуществления изобретения опухоль является раковой опухолью. В определенных вариантах осуществления изобретения метастазирующая опухоль является раковой опухолью. В определенных вариантах осуществления изобретения рак является раком ободочной кишки, раком легкого, раком молочной железы, раком почки, раком яичника, раком предстательной железы, раком мочевого пузыря, меланомой или глиобластомой.
Любой вышеописанный вариант осуществления изобретения или любая комбинация рассмотренных вариантов осуществления изобретения относится к любому и всем способам по настоящему изобретению, представленным в настоящем описании изобретения.
Краткое описание чертежей
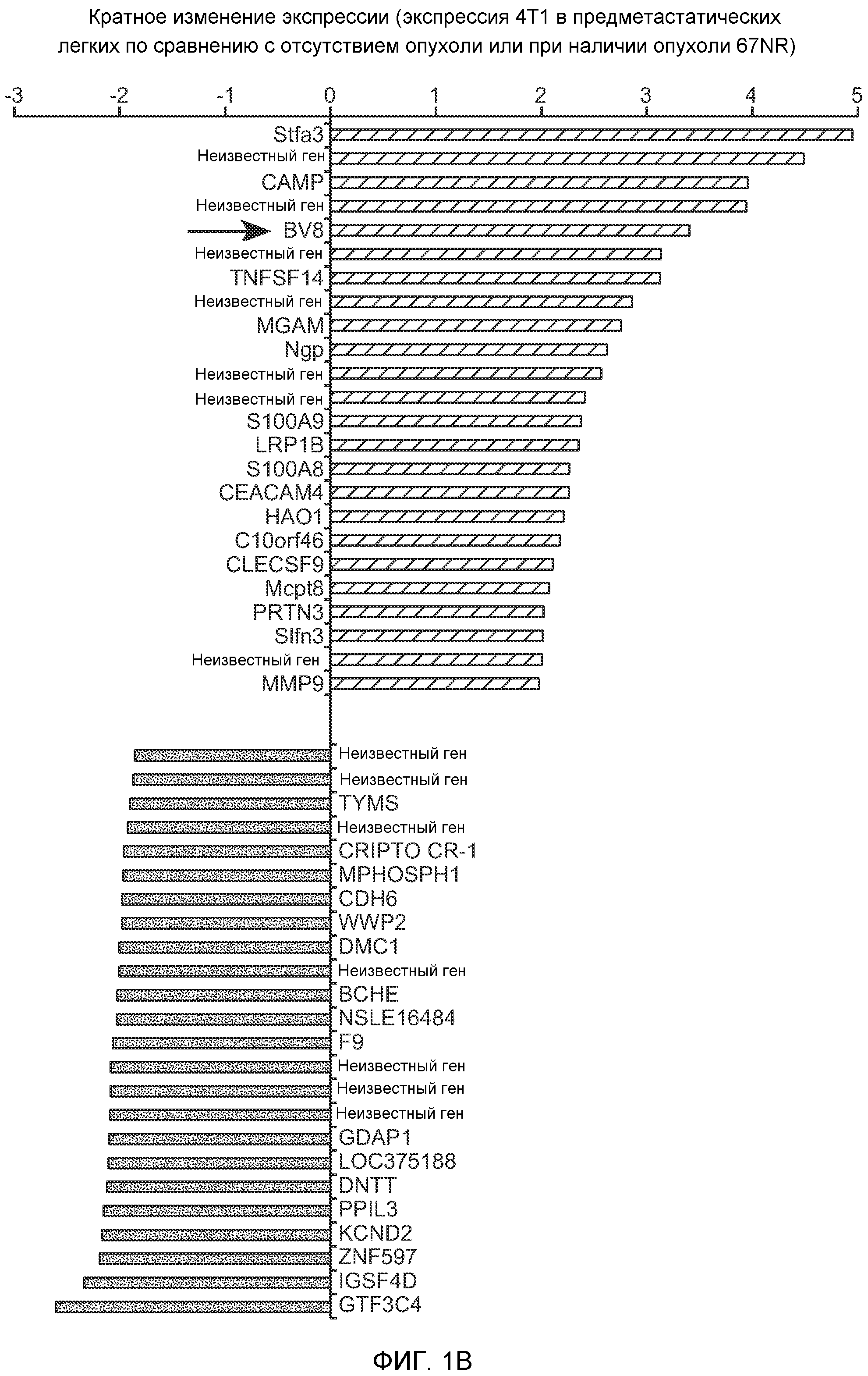
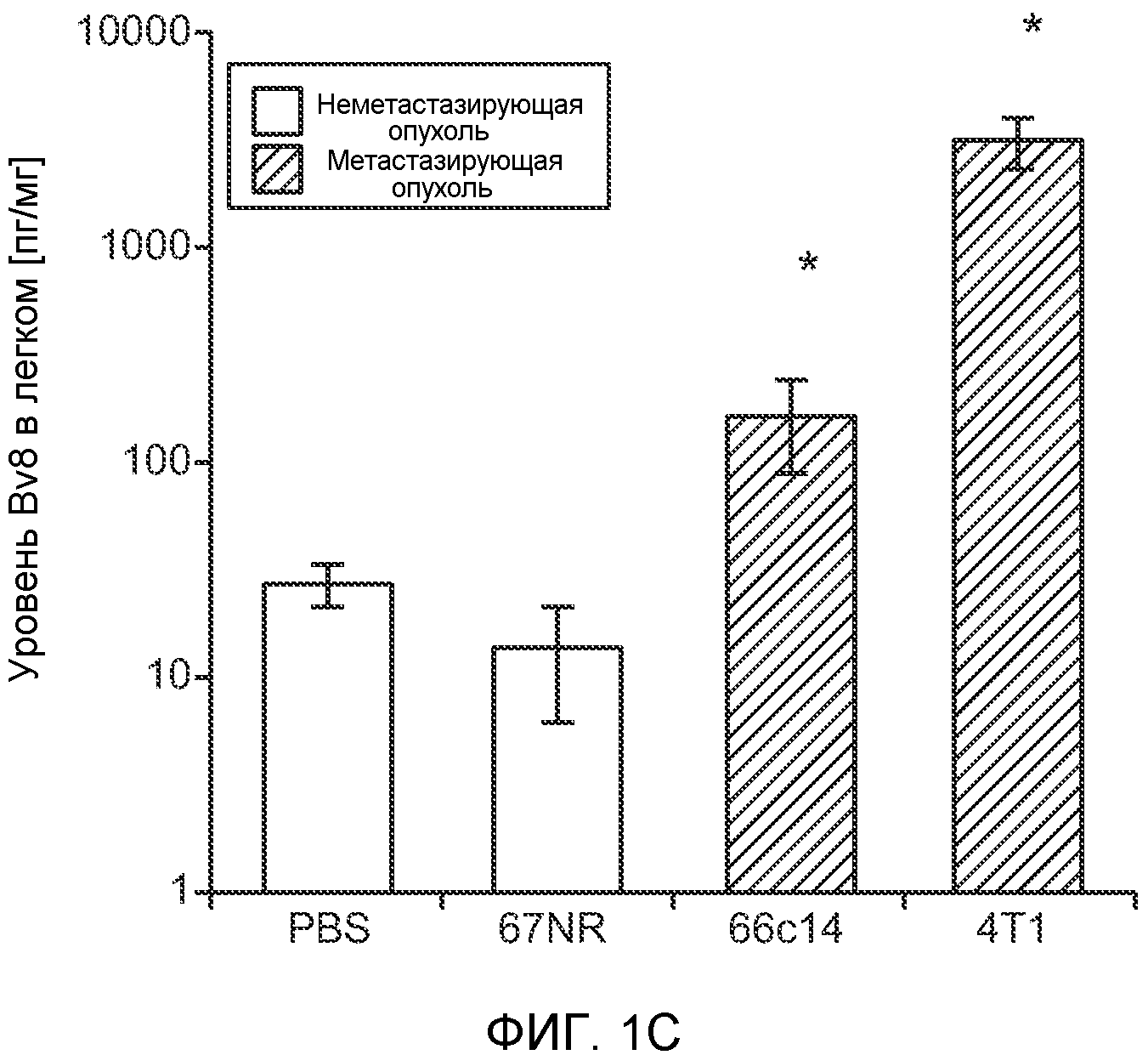
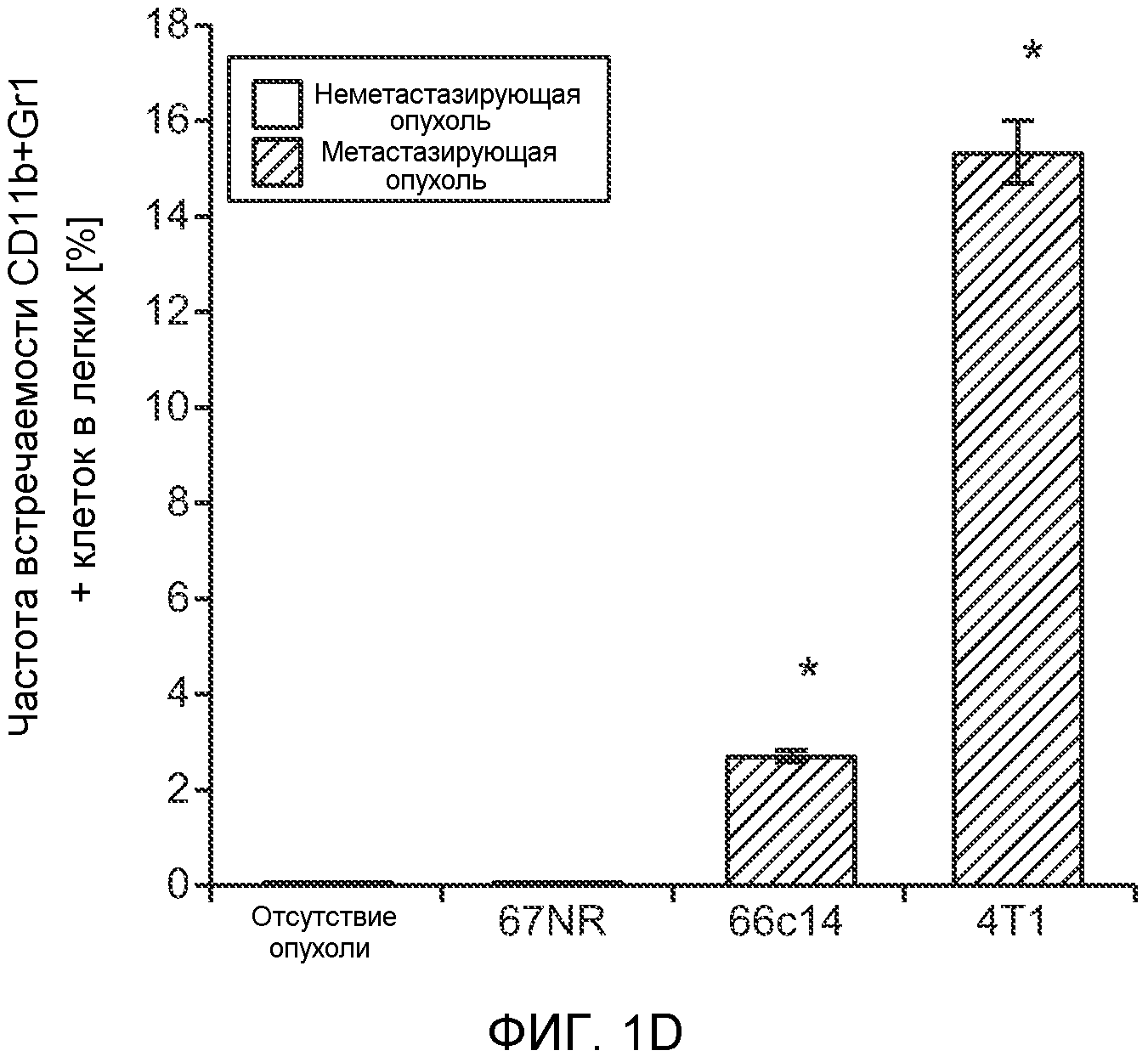
Фигура 1. Уровень Bv8 сильно повышен в предметастатических легких мышей, имеющих метастазирующие опухоли. А. Протокол и результаты микроматричного исследования, целью которого является сравнение экспрессии генов в легких мышей Balb/c, не имеющих опухолей, мышей, имеющих неметастазирующие опухоли 67NR и метастазирующие опухоли 4Т1. Профиль экспрессии генов “метастазирующей опухоли” четко отличается от профилей экспрессии генов у мышей, не имеющих опухолей, и мышей, имеющих неметастазирующие опухоли. Каждый столбец, представляющий профиль, относится к одной мыши. В. Схематическое представление 24 генов, характеризующихся повышенной и пониженной экспрессией в предметастатических легких мышей, имеющих опухоли 4Т1, по сравнению с мышами, не имеющими опухолей, или мышами, имеющими опухоли 67NR. С. Концентрации белка Bv8 в предметастатических легких мышей, имеющих разные опухоли (n=3 в одной группе). D. Анализ методом FACS CD11b+Gr1+ клеток в предметастатических легких мышей Balb/c, имеющих разные опухоли. На графиках представлены средние значения ± стандартная ошибка среднего.
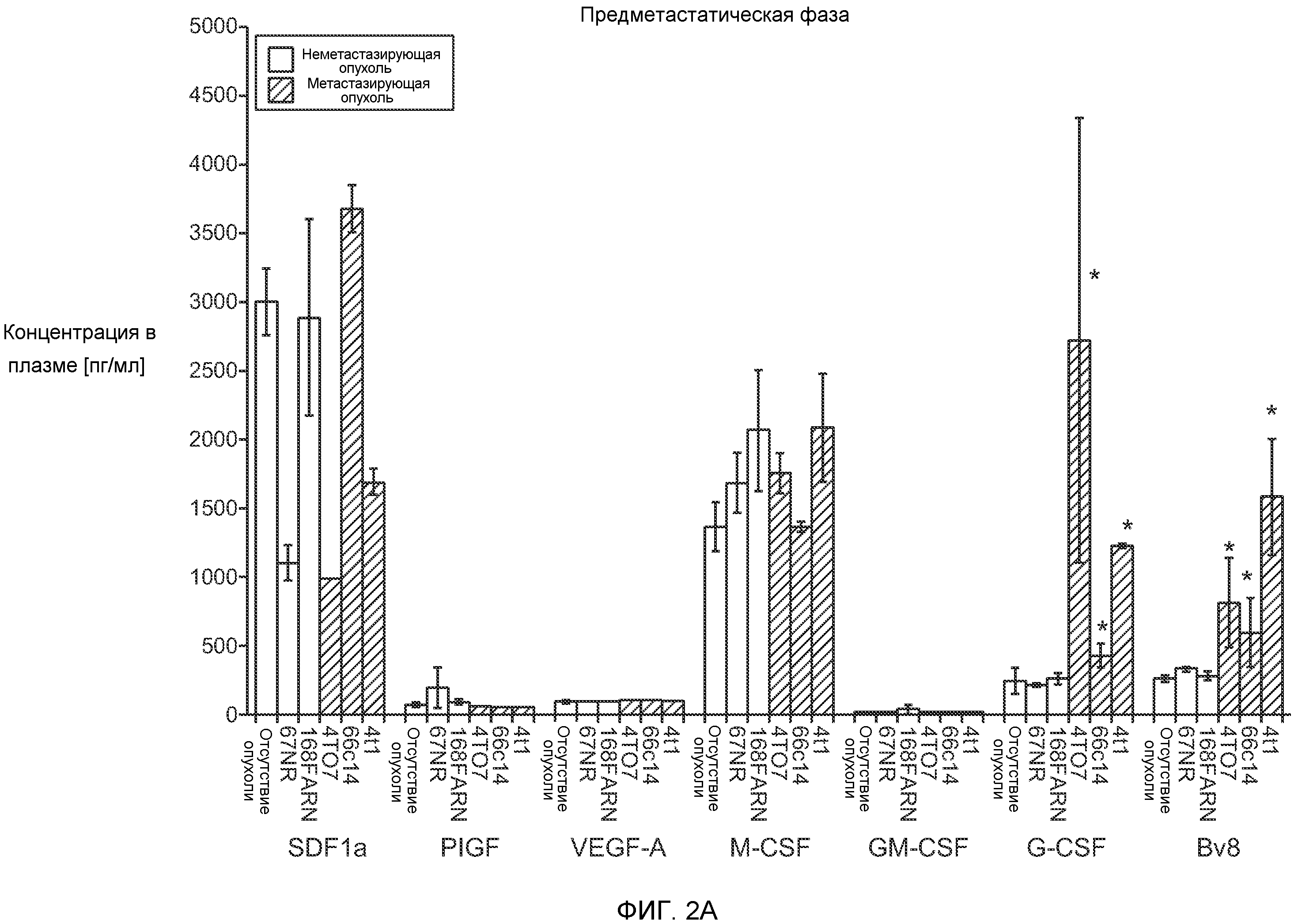
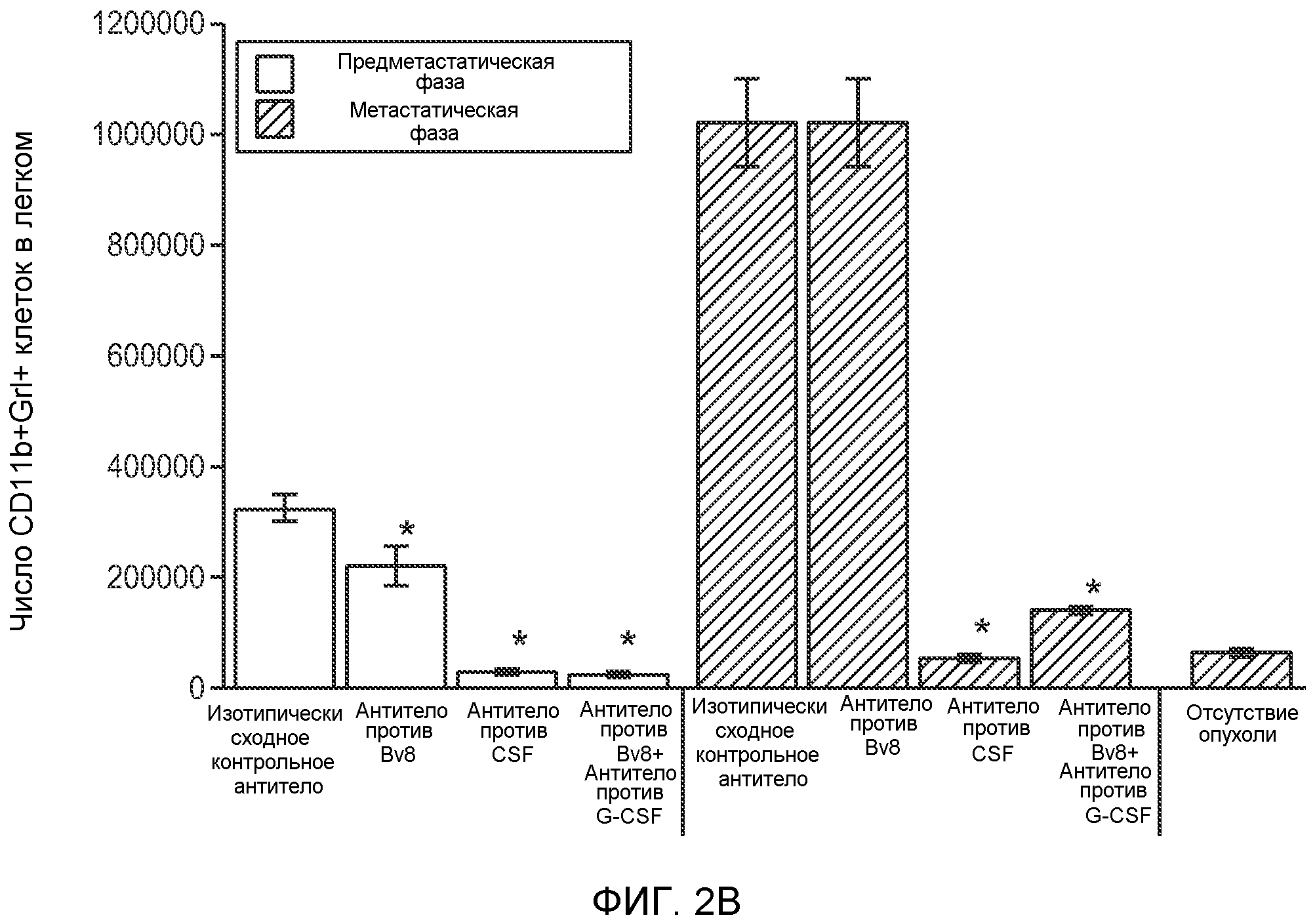
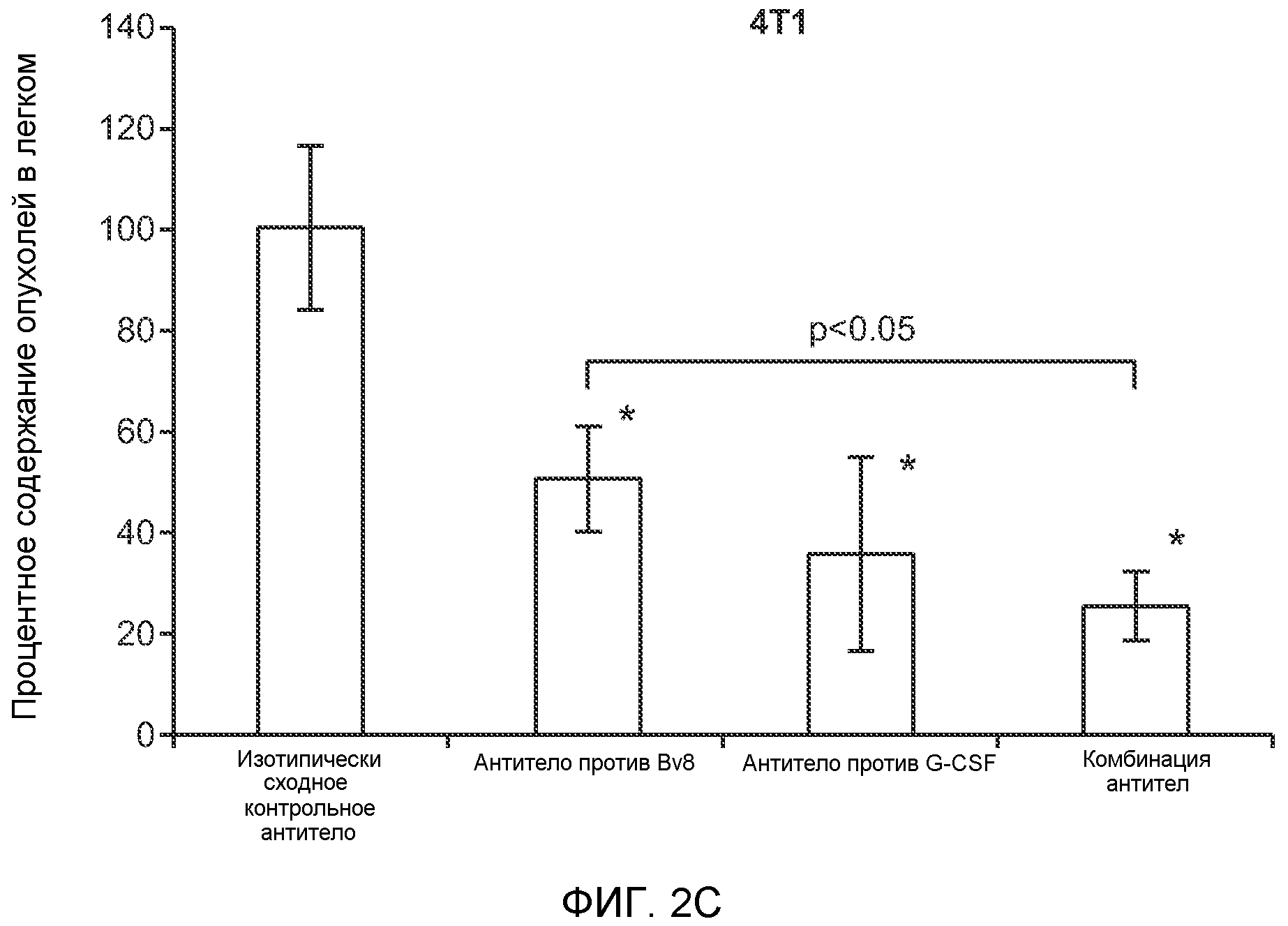
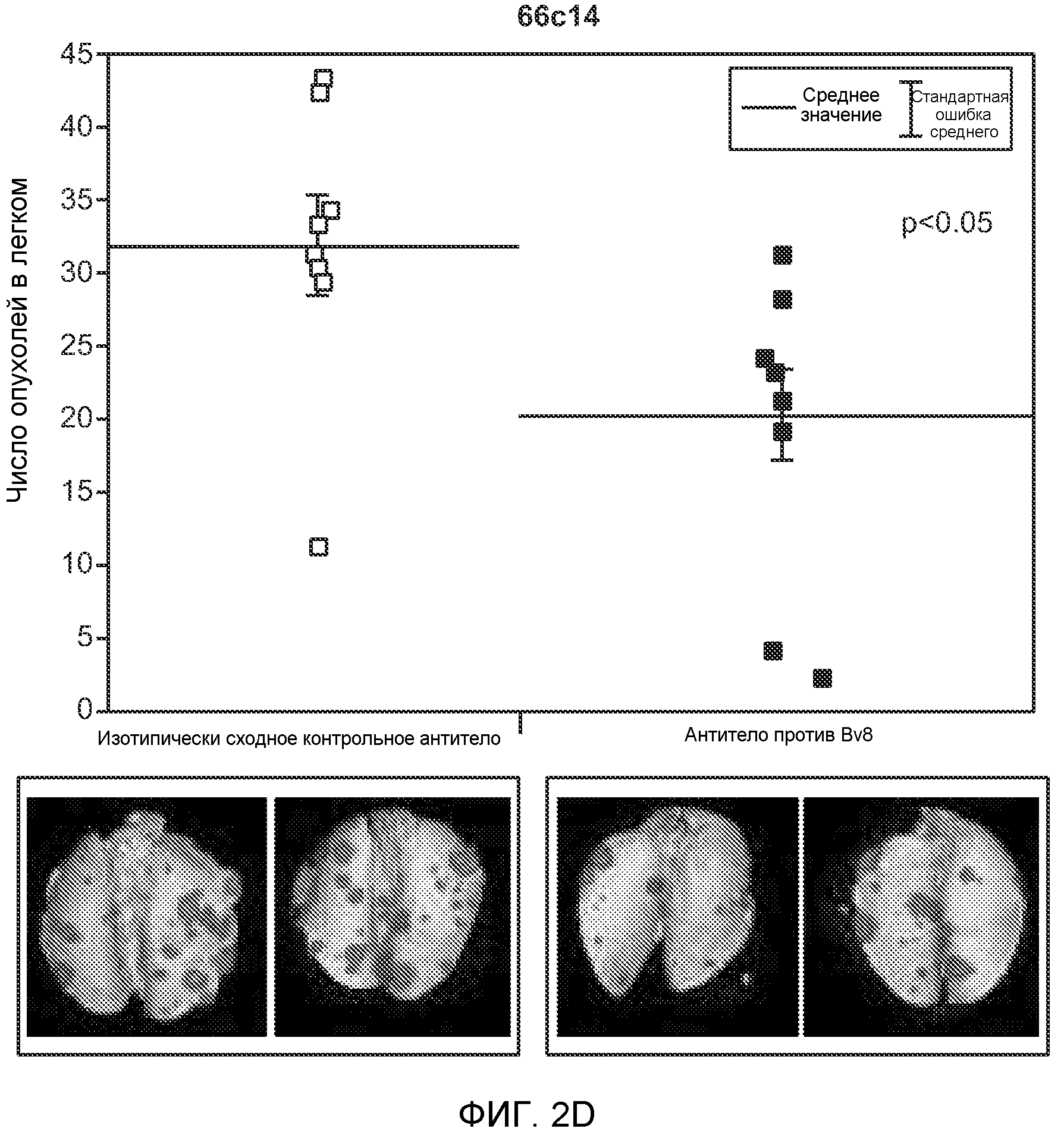
Фигура 2. Повышенные уровни G-CSF и Bv8 ассоциированы с метастатическим фенотипом. А. Уровни SDF1α, PlGF, VEGF-A, M-CSF, GM-CSF, G-CSF и Bv8 в плазме через две недели после инокуляции клеток неметастазирующих или метастазирующих опухолей. Звездочкой (*) отмечено значимое отличие от группы мышей, не имеющих опухолей. В. Анализ общего числа CD11b+Grl+ клеток в легких мышей, имеющих опухоли 4Т1 и подвергнутых лечению антителом против Bv8, антителом против G-CSF или их комбинацией (n=10 в одной группе). Клетки 4Т1 ортотопически инокулировали в жировое тело 4-й молочной железы самок мышей CB6F1. Лечение антителами начинали через 2 дня после инокуляции клеток и выполняли в соответствии с описанием, приведенным в разделе “Материалы и методы” примера 1. Легкие перфузировали физиологическим раствором с фосфатным буфером (PBS) и удаляли через 1 неделю (предметастатическая фаза) или через 5,5 недели (метастатическая фаза) после инокуляции клеток. Звездочкой (*) отмечено значимое отличие от соответствующей группы, которой вводили ISO. С. Число опухолей в легких мышей, имеющих опухоли 4Т1 и подвергнутых лечению, представленному в блоке В. Анализ выполняли через 5,5 недели после инокуляции опухолей. ISO означает изотипически сходное контрольное антитело (n=5 в одной группе). Звездочкой (*) отмечено значимое отличие от группы мышей, не имеющих опухолей. D. Число опухолей в легких, исследованных при помощи компьютерной микротомографии (микро-СТ), у мышей Balb-c, имеющих опухоли 66с14, которым вводили контрольное антитело (ISO) или антитело против Bv8 (n=8 в одной группе мышей, которым вводили ISO, и n=10 в одной группе мышей, которым вводили антитело против Bv8). Под графиком представлены изображения (2 в одной группе) типичных легких, сканированных методом микро-СТ, на которых показаны метастатические узелки (красный цвет) в группах, которым вводили ISO и антитело против NBv8. Данные представлены в виде средних значений ± стандартная ошибка среднего.
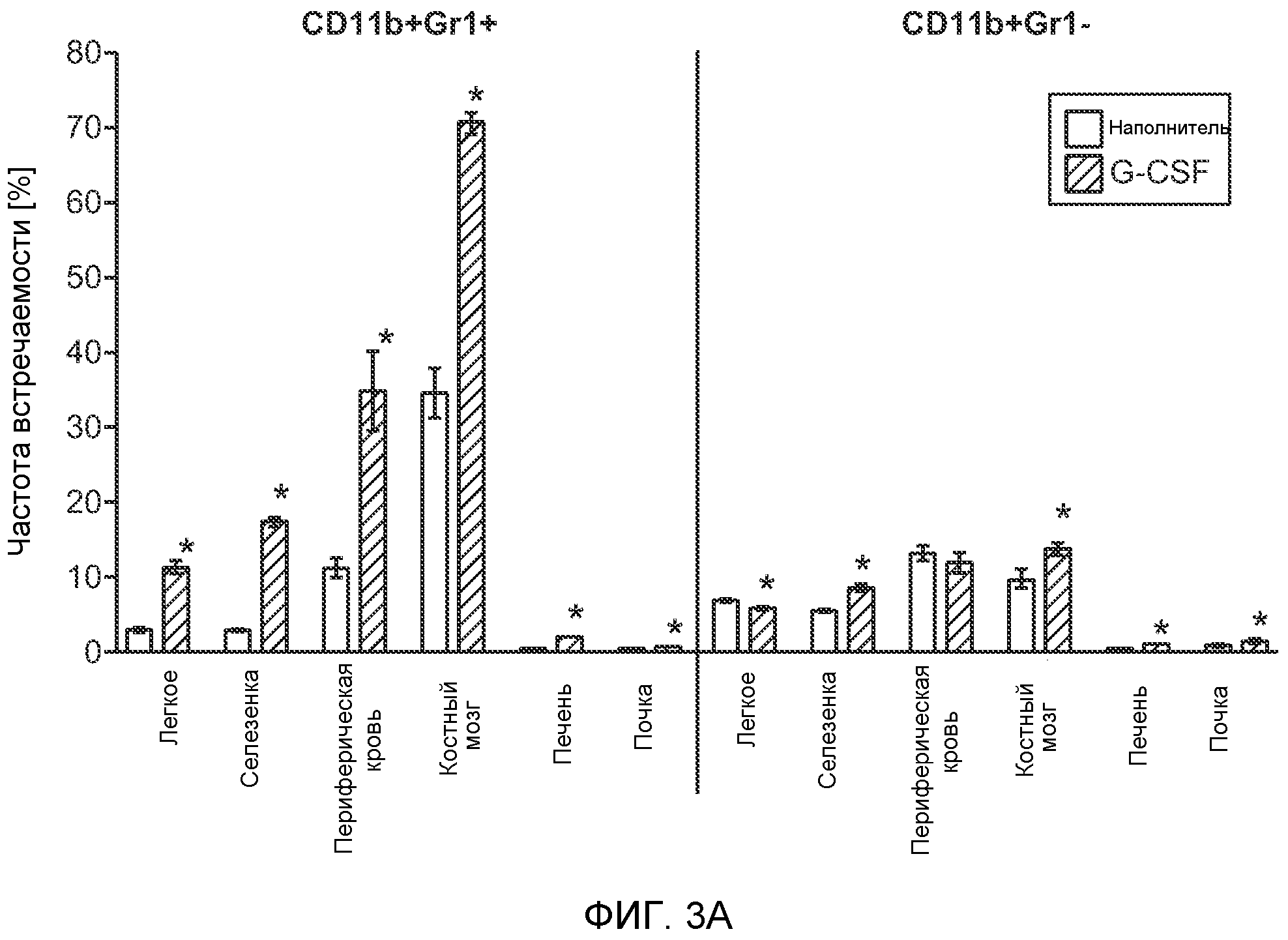
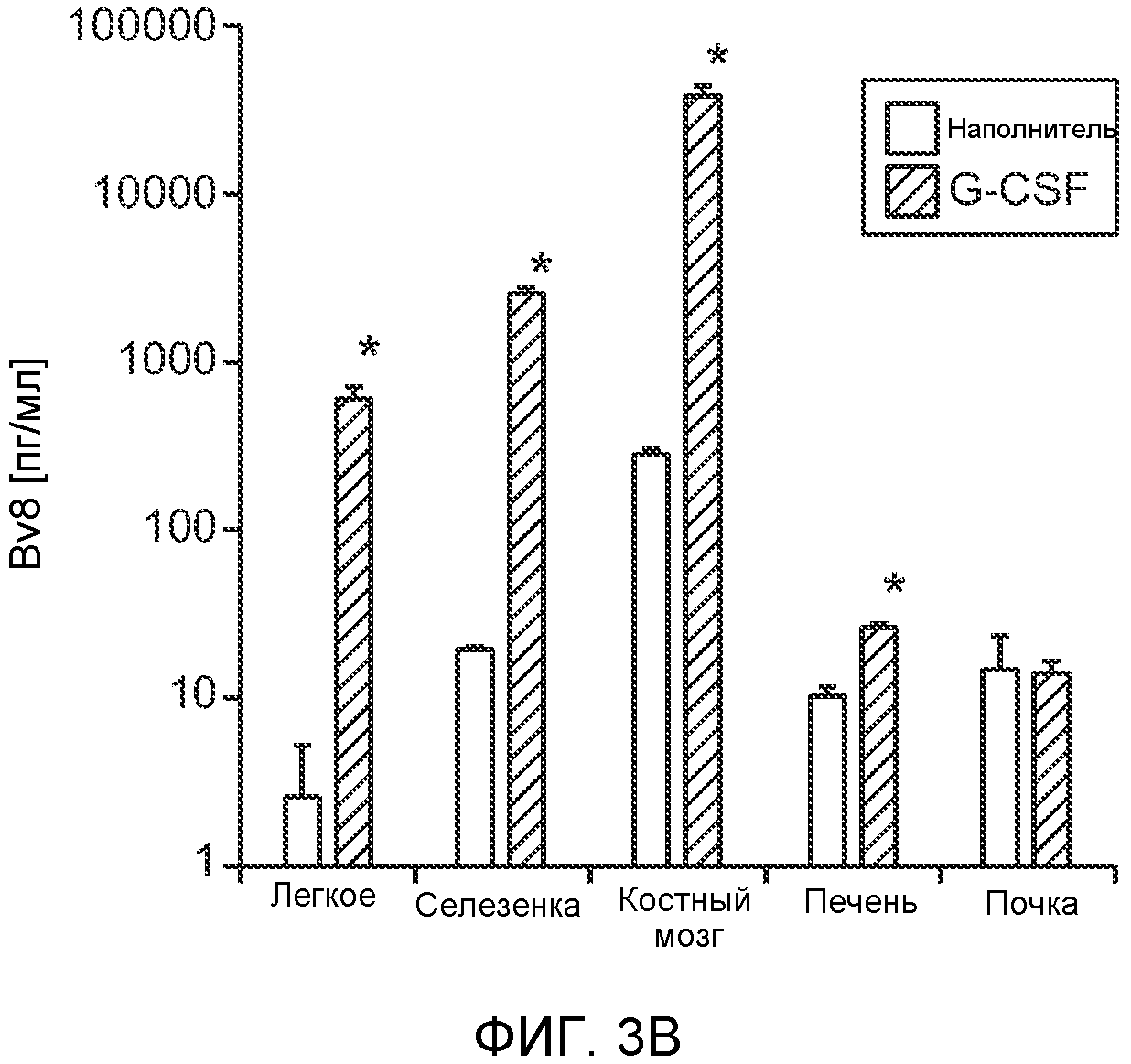
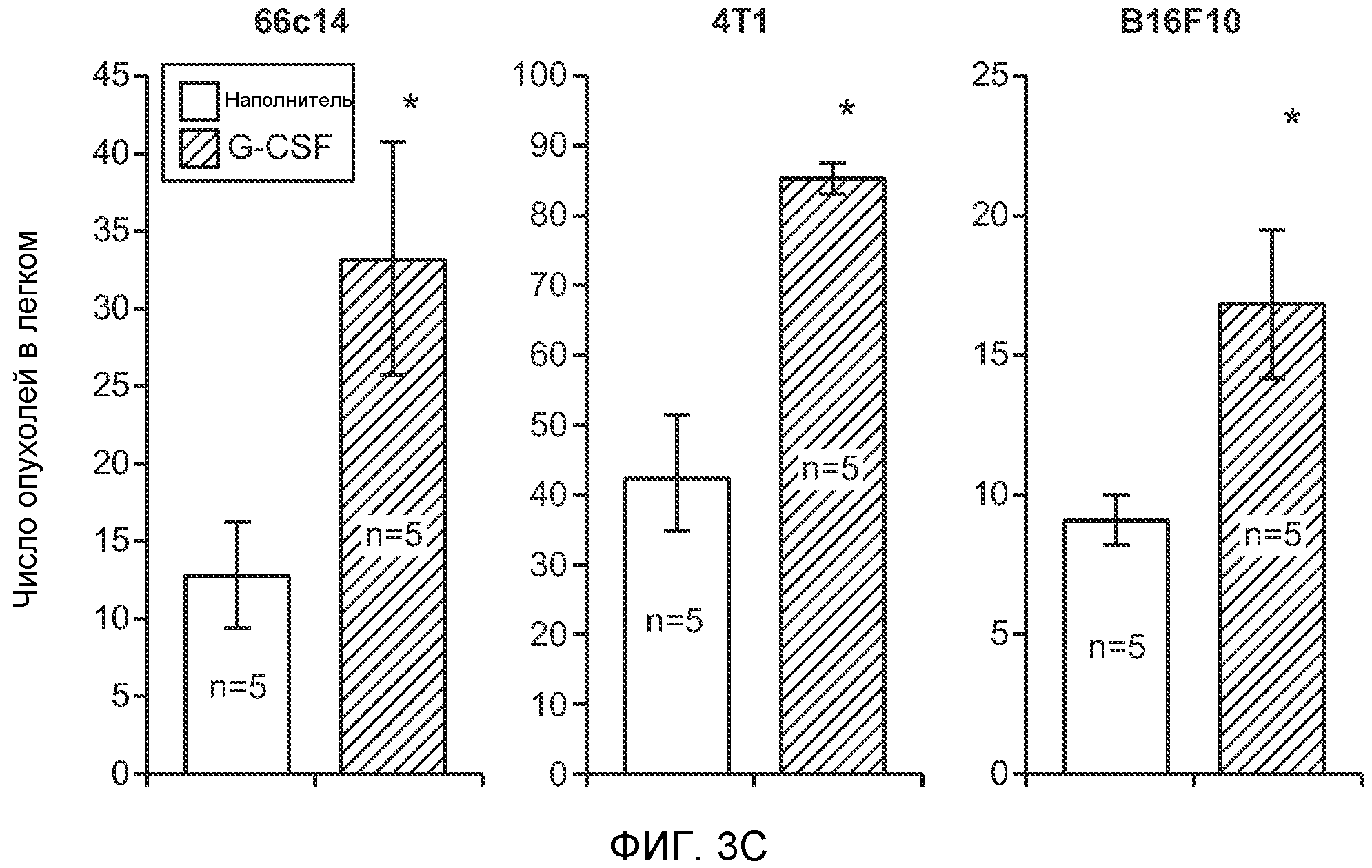
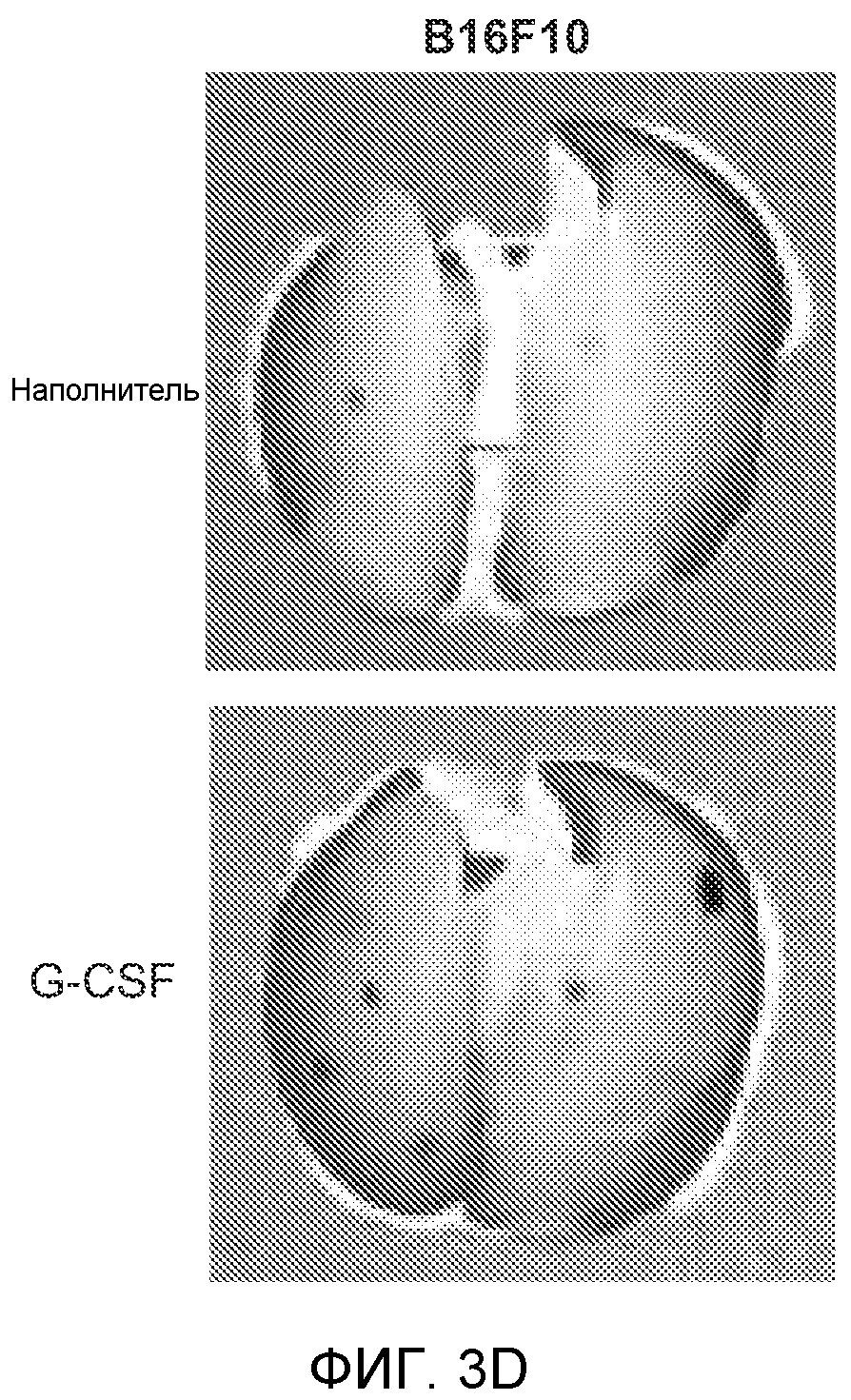
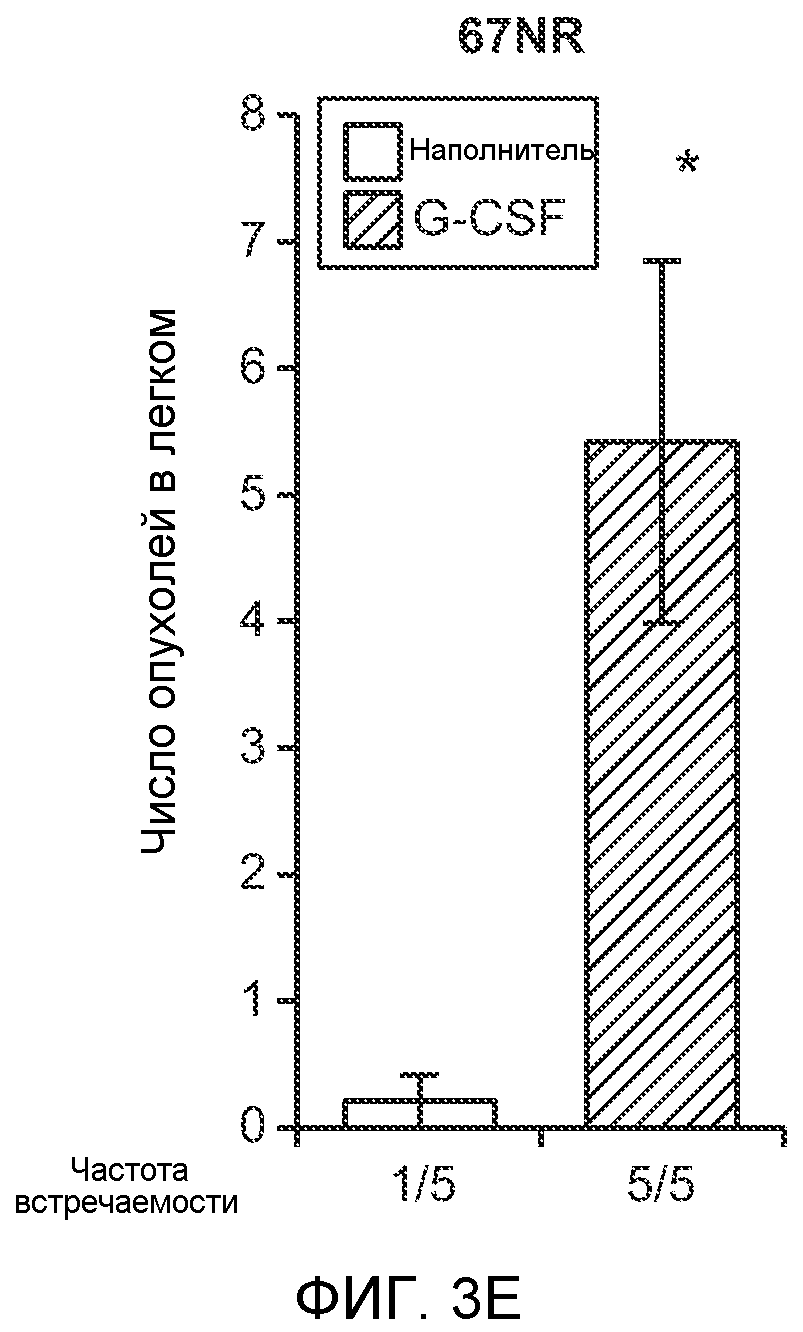
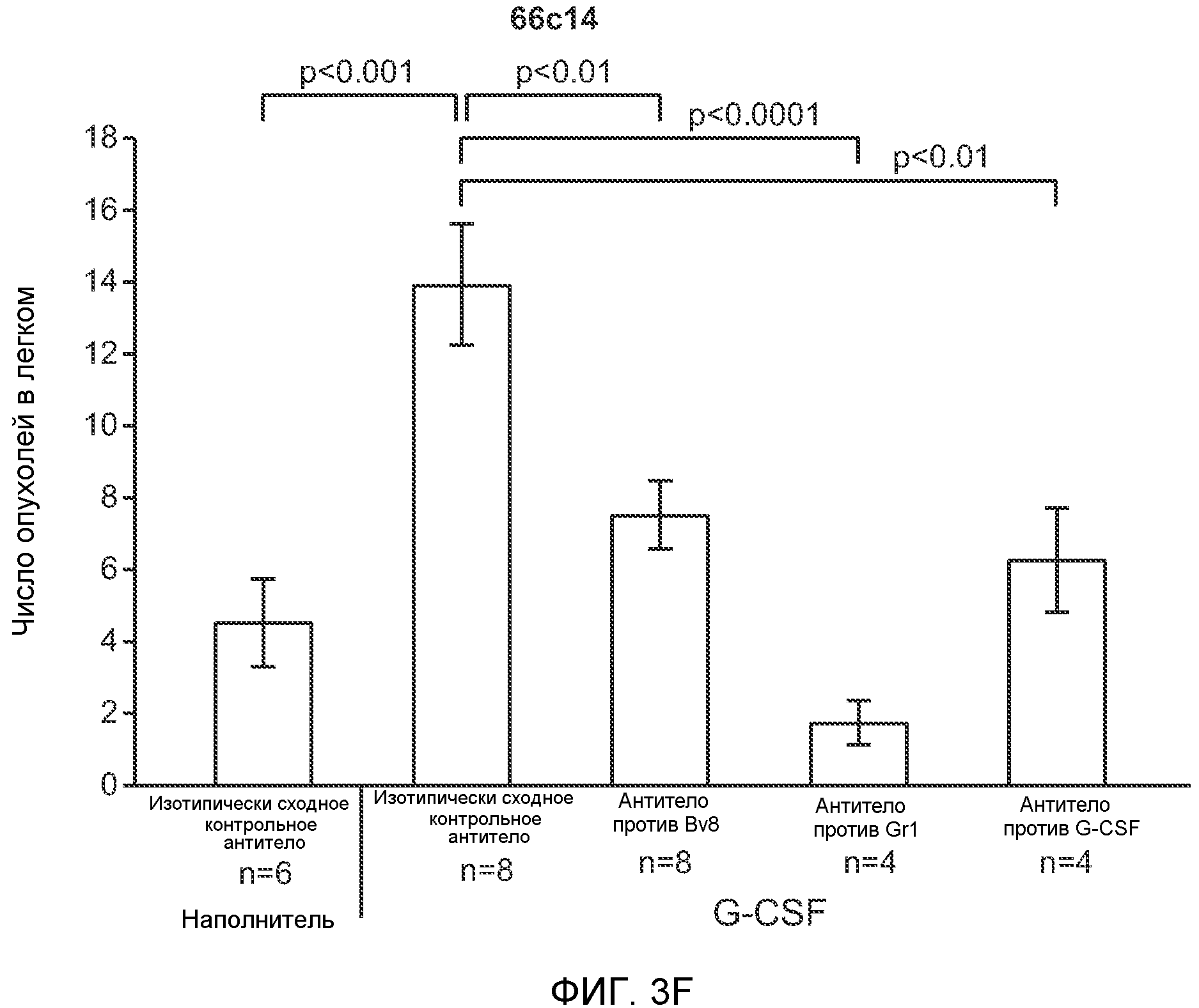
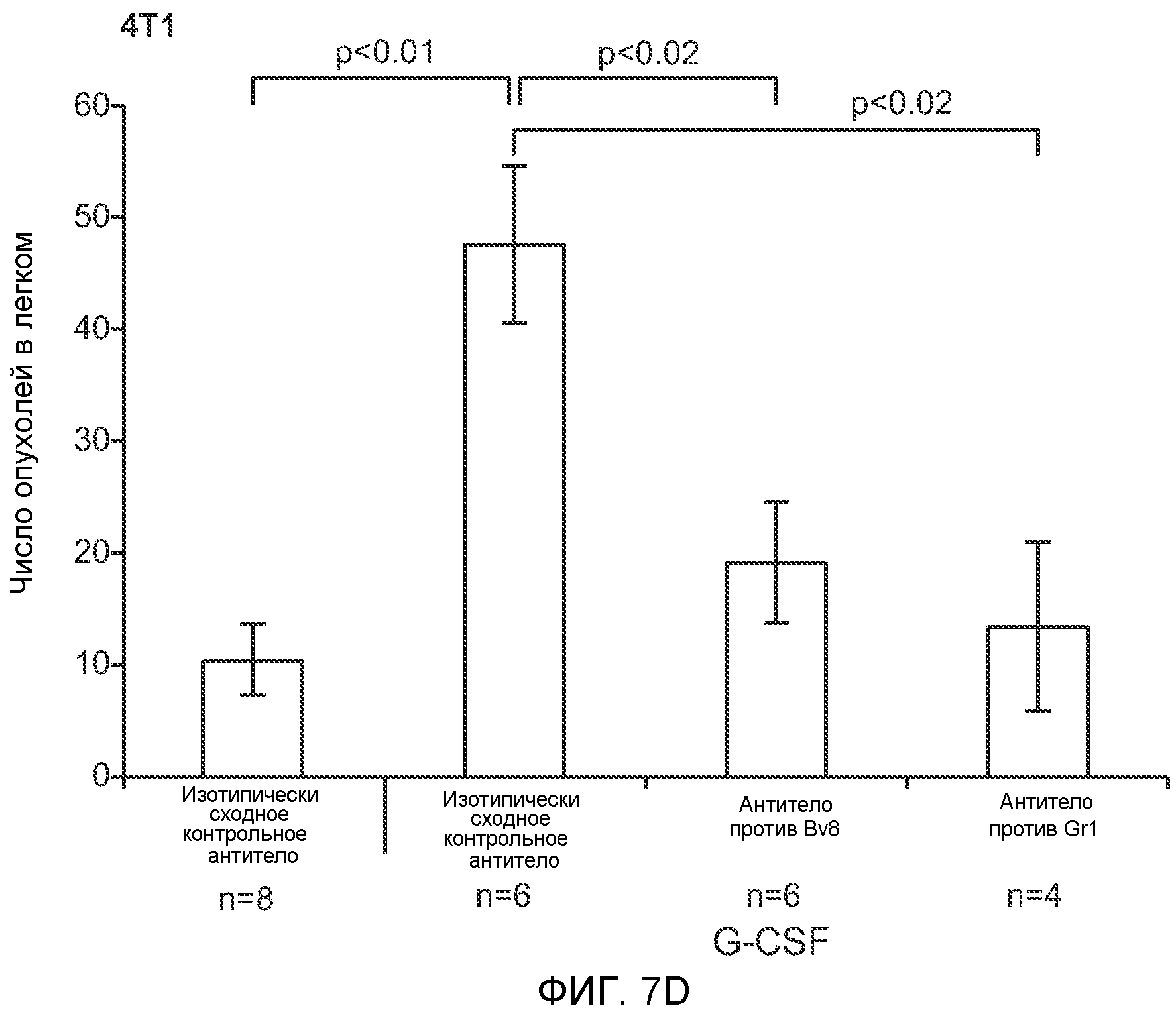
Фигура 3. G-CSF инициирует образование предметастатической “ниши” и усиливает метастатический потенциал нескольких опухолей. А. Анализ методом FACS Cd11b+Grl+ клеток в тканях, выделенных в мышей, которым вводили наполнитель или rG-CSF человека (в течение 5 дней, 10 мкг/мышь). Ткани были получены через двадцать четыре часа после введения последней дозы rG-CSF. Мышей перфузировали PBS до удаления тканей (n=5 в одной группе). Звездочкой (*) отмечено значимое отличие от группы, которой вводили наполнитель. Данные представлены в виде процентного значения Cd11b+Grl+ (или Cd11b+Grl-) клеток от общего числа жизнеспособных клеток. В. Уровни Bv8, измеренные методом ELISA в тканях, соответствующих органам, представленным в блоке А. Значения были нормализованы относительно общего содержания белка и использованы для построения графика в логарифмическом масштабе. Звездочкой (*) отмечено значимое отличие от группы, которой вводили наполнитель (n=5 в одной группе). С. Число опухолей в легких мышей, которым предварительно вводили rG-CSF (10 мкг/мышь, столбцы серого цвета) или наполнитель (столбцы белого цвета) в течение 5 дней. После введения G-CSF мышам (5 в одной группе) внутривенно инъецировали (в хвостовую вену) опухолевые клетки (10000 клеток/мышь). Клетки 66с14 и 4Т1 инъецировали мышам Balb/c и клетки B16F10 инъецировали мышам C57BL/6. rG-CSF вводили в течение последующих 5 дней. Легкие исследовали на наличие видимых опухолей через 3 недели после инокуляции клеток. Звездочкой (*) отмечено значимое различие между мышами, которым вводили наполнитель и G-CSF (n=5 в одной группе). D. Репрезентативные изображения легких мышей, которым инъецировали клетки B16F10 и предварительно вводили наполнитель или rG-CSF, как показано в блоке С. В легких мышей, которым вводили rG-CSF, обнаружено большее число опухолей (черные пятна). Е. Число опухолей в легких мышей Balb/c, которым внутривенно инъецировали неметастазирующие клетки 67NR и вводили rG-CSF человека, как показано в блоке С. Мышей исследовали на наличие видимых опухолей в легких через 3 недели после инокуляции клеток. Звездочкой (*) отмечено значимое отличие. Частота встречаемости использована для определения числа мышей с обнаруживаемыми опухолями в легких (n=5 в одной группе). F. Число опухолей в легких мышей, которым ежедневно вводили rG-CSF мыши (2,5 мкг/мышь) и затем вводили контрольное антитело (ISO), антитело против Bv8, антитело против Grl или антитело против G-CSF и внутривенно инъецировали клетки 66с14, как описано в разделе “Материалы и методы” примера 1. Легкие исследовали на наличие опухолей через 3 недели после инокуляции клеток. Данные представлены в виде средних значений ± стандартная ошибка среднего.
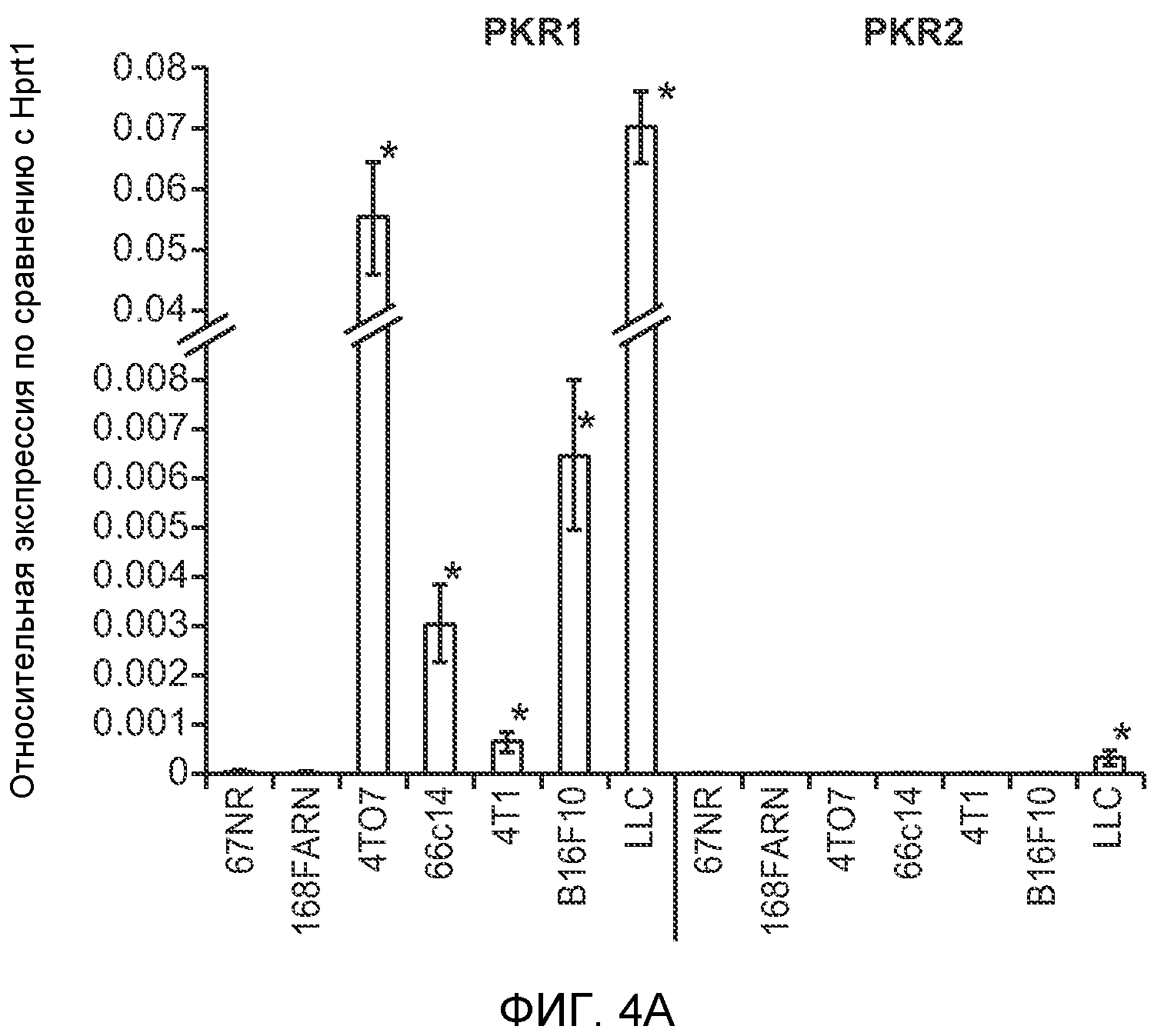
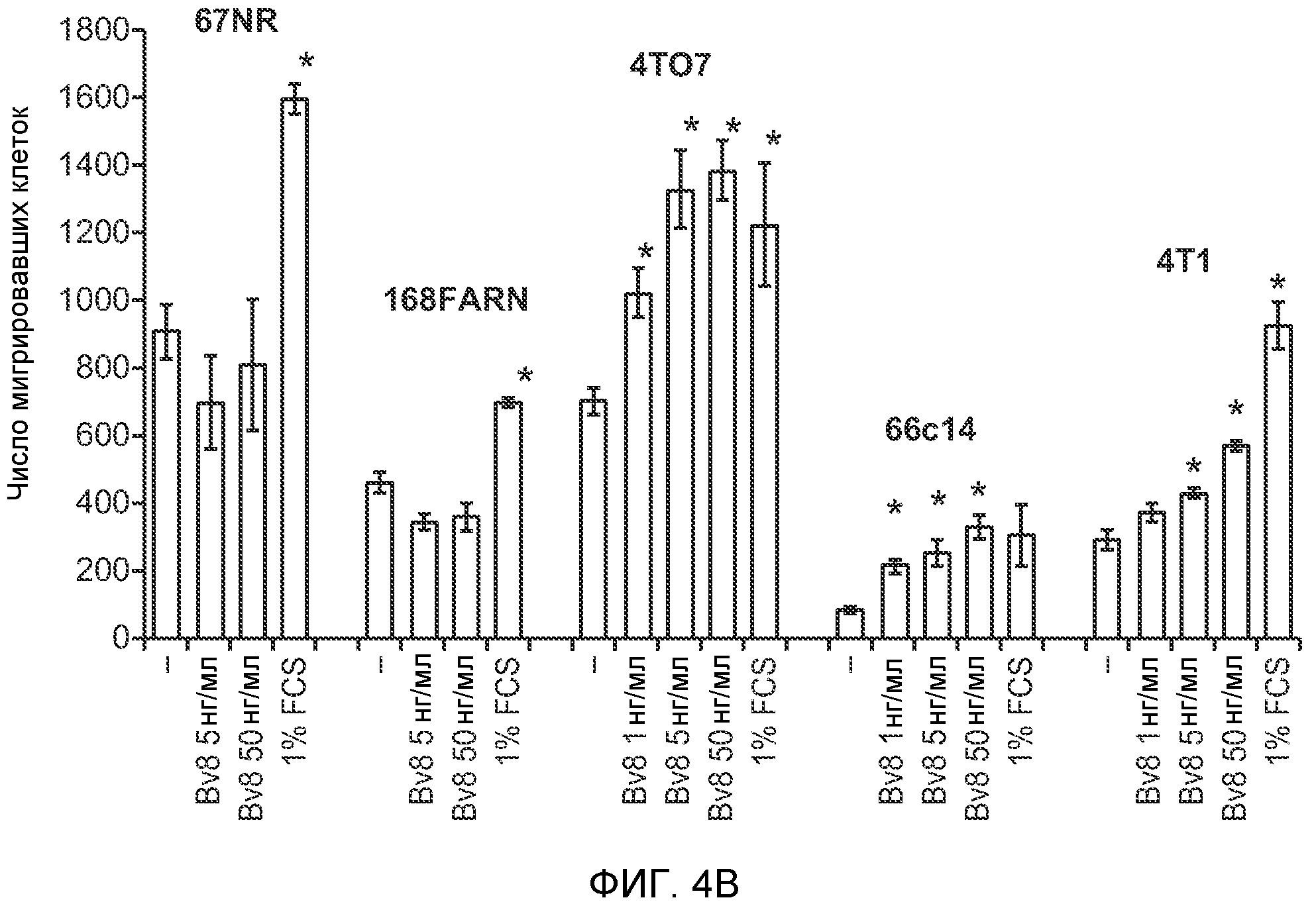
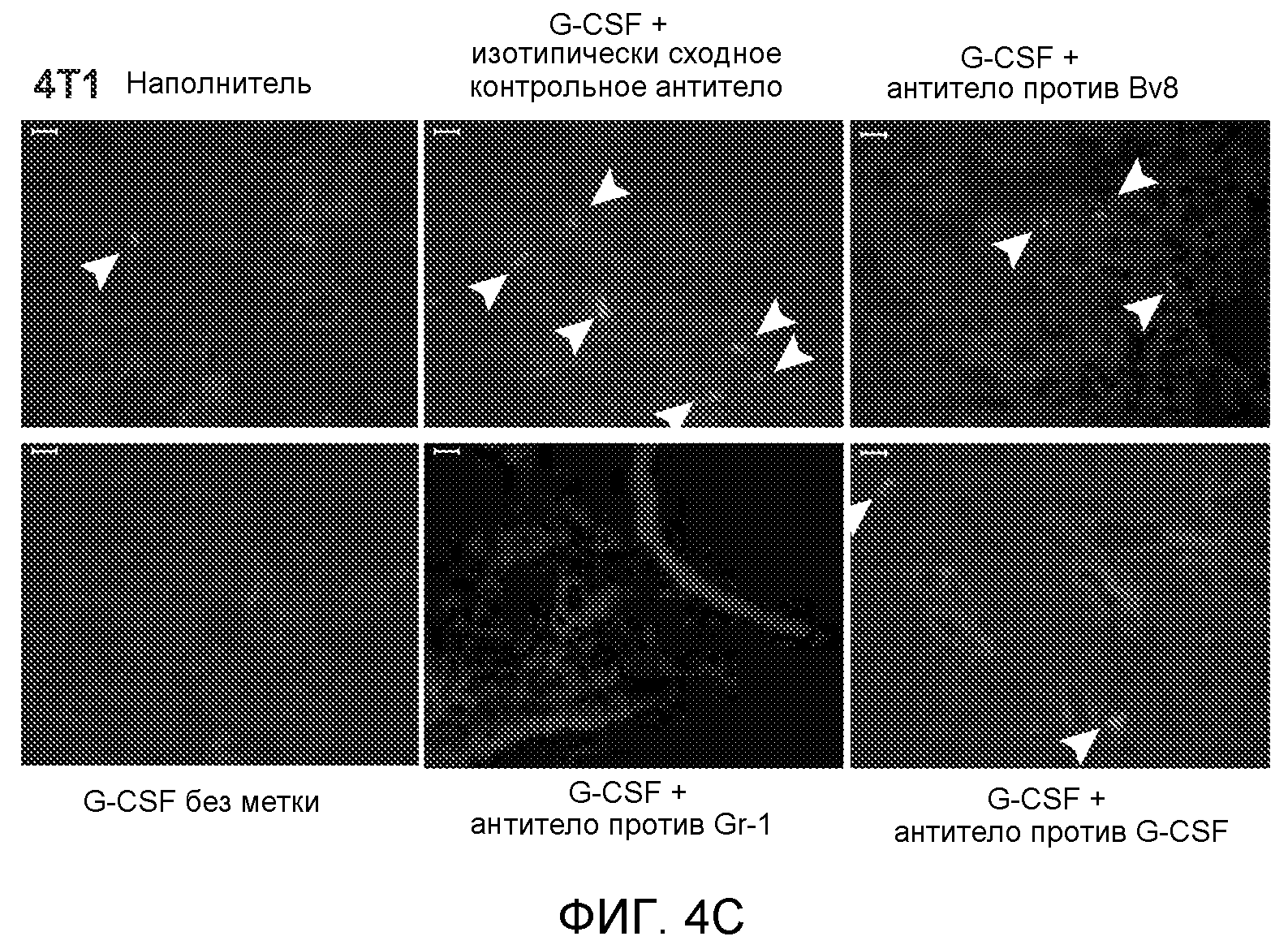
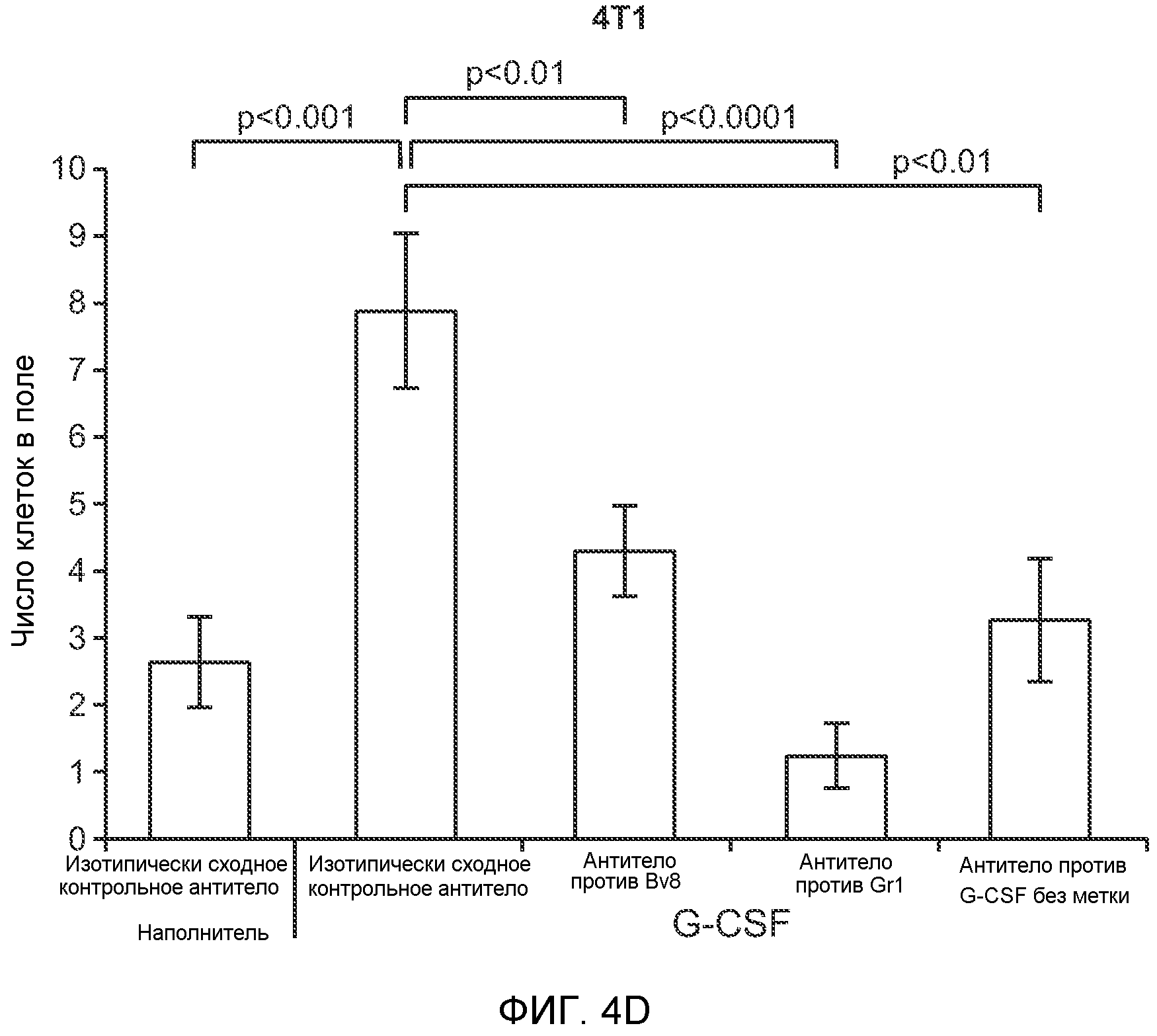
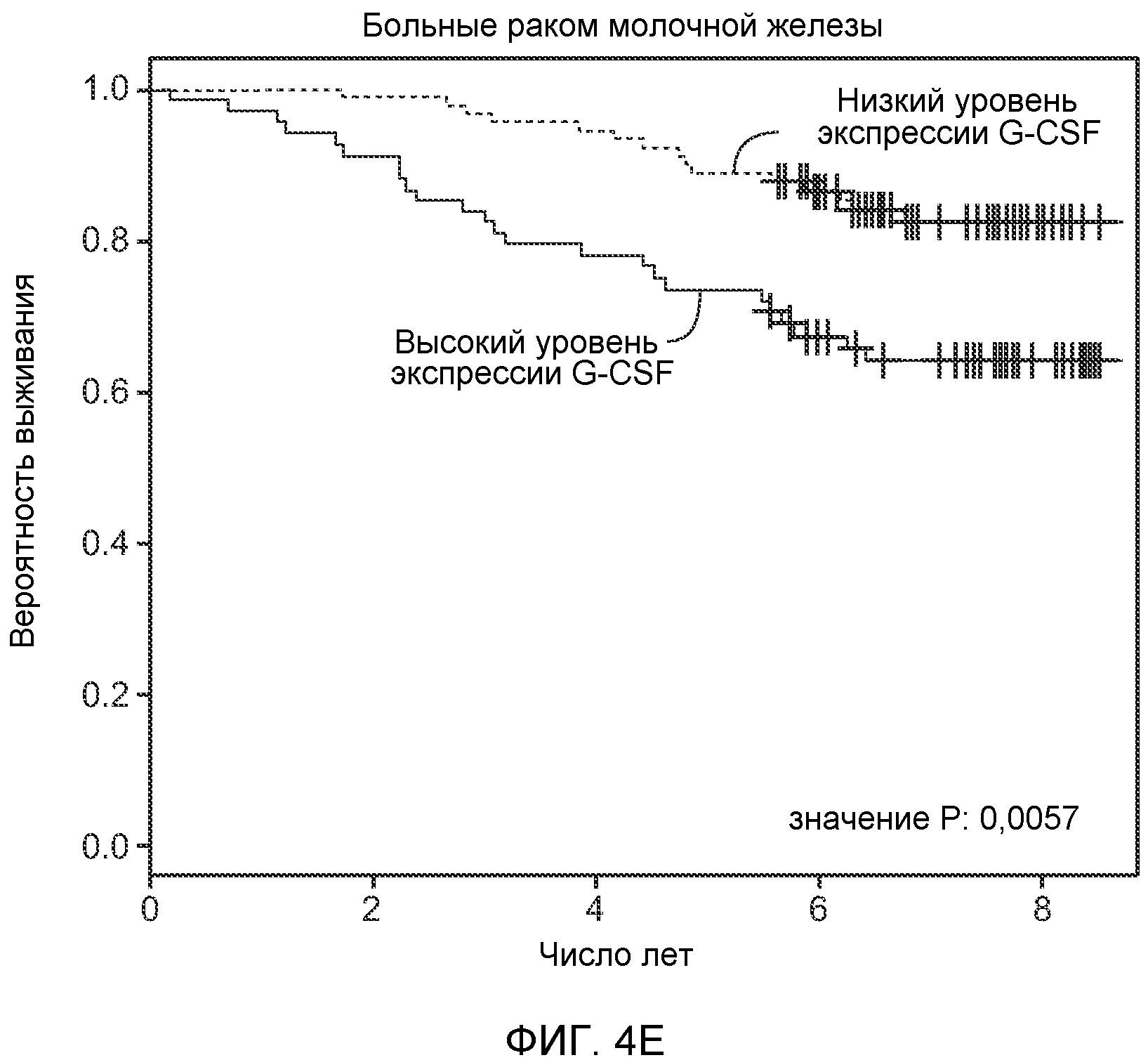
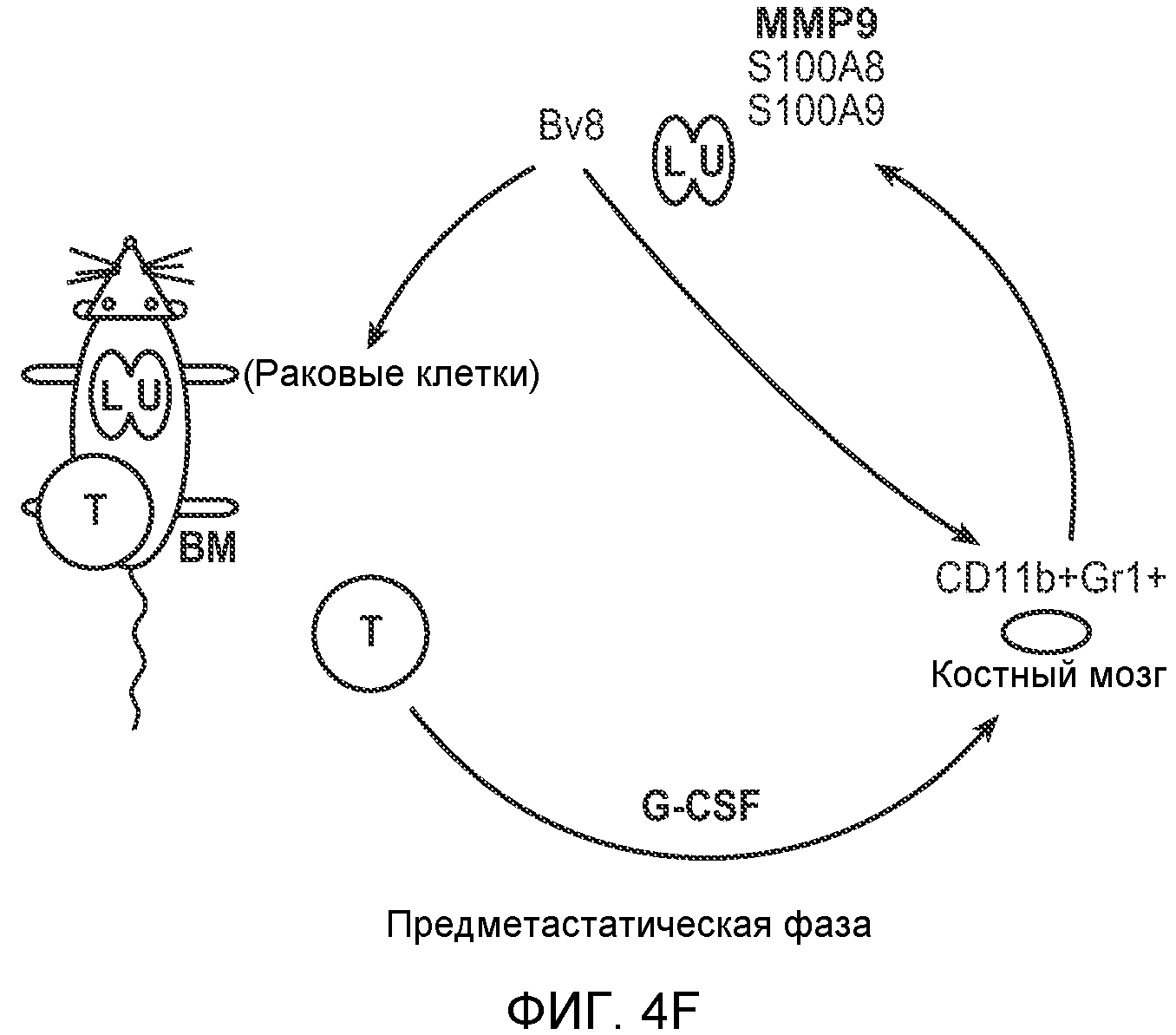
Фигура 4. Bv8 опосредует G-CSF-индуцированное метастазирование путем усиления миграции раковых клеток. А. Анализ методом qRT-PCR экспрессии PKR1 и PKR2 неметастазирующими и метастазирующими раковыми клетками in vitro. Данные представлены в виде значений, нормализованных относительно экспрессии Hprt1 (n=6 в одной группе). Звездочкой (*) отмечено значимое отличие от клеток 67NR. В. Миграция неметастазирующих и метастазирующих клеток в результате увеличения концентрации Bv8 человека. 1% FBS использовали в качестве положительного контрольного образца. Клетки, которые мигрировали из лунки с 8-мкм порами, сенсибилизированной коллагеном, подсчитывали через 16 часов после начала выполнения анализа (n=5 в одной группе). Звездочкой (*) отмечено значимое отличие от группы, не подвергаемой воздействию. С. Выделение клеток 4Т1 из сосудов in vivo, измеренное через 36 часов после внутривенной инокуляции (в хвостовую вену) клеток, меченных зеленым красителем CellTracker Green. Голым мышам Balb/c предварительно вводили rG-CSF (2,5 мкг/мышь, ежедневно) в течение 5 последующих дней и затем вводили контрольное антитело (ISO), антитело против Bv8, антитело против Grl или антитело против G-CSF. Термин “отсутствие метки” означает группу мышей, которым инокулировали клетки, не меченные зеленым красителем CellTracker Green. На изображениях показаны опухолевые клетки 4Т1 (отмеченные белыми стрелками) в репрезентативных срезах легких. Масштаб = 50 мкм. D. Количественная оценка результатов анализа выделения клеток из сосудов in vivo, показанного в блоке С. В среднем были использованы три мыши в группе, при этом анализу были подвергнуты 15 изображений (5 произвольных срезов для одной мыши). Е. Кривые Каплана-Мейера, представляющие вероятность выживания больных раком молочной железы, построены с использованием базы данных для рака молочной железы Павитана, созданной на основе экспрессии G-CSF. Кривые указывают на сильную корреляцию между высокими уровнями G-CSF и более низким выживанием. F. Схематическая модель роли G-CSF и Bv8 в метастазировании. LU означает легкое, Т означает первичную опухоль, ВМ означает костный мозг. Данные представлены в виде средних значений ± стандартная ошибка среднего.
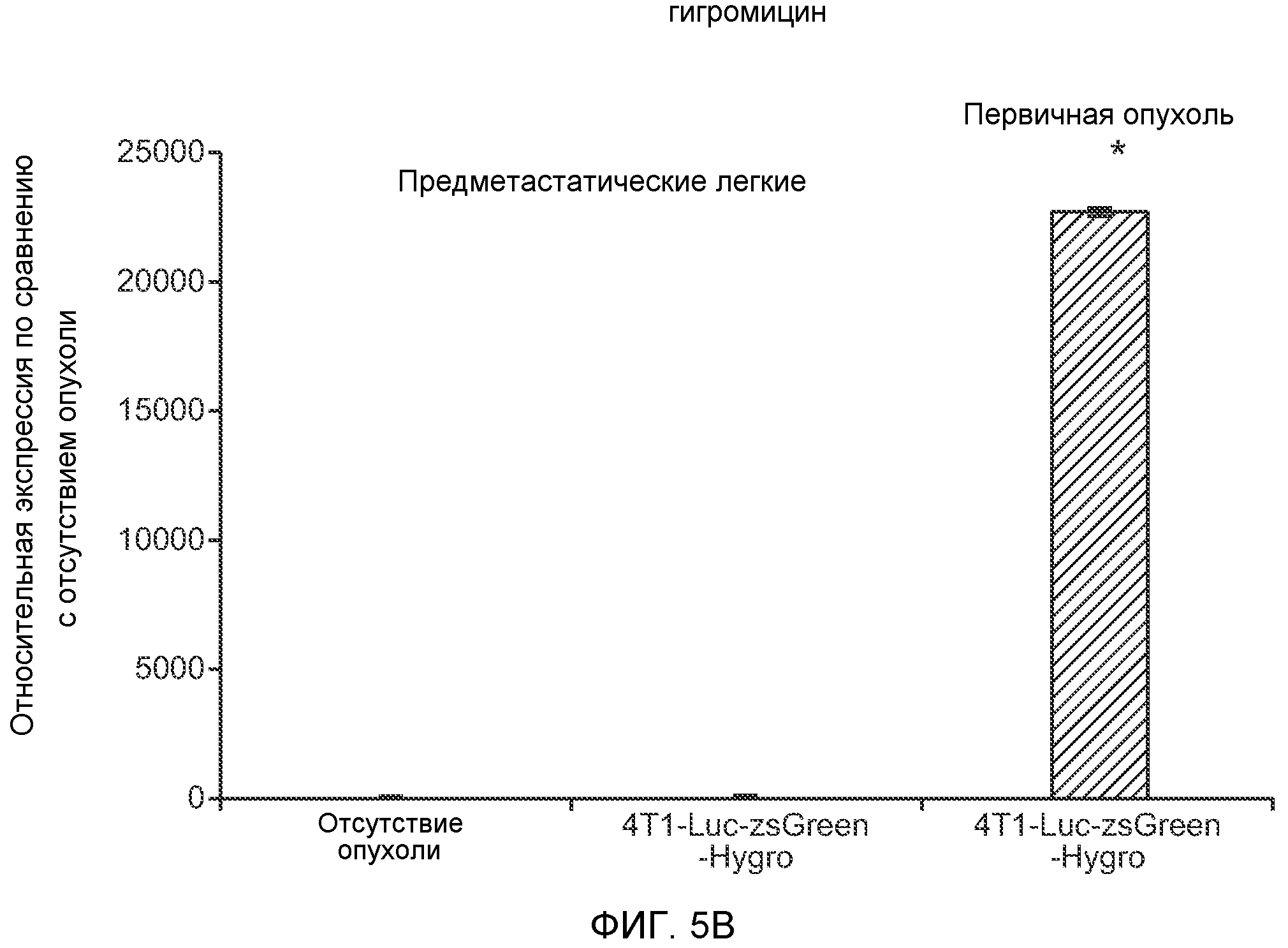
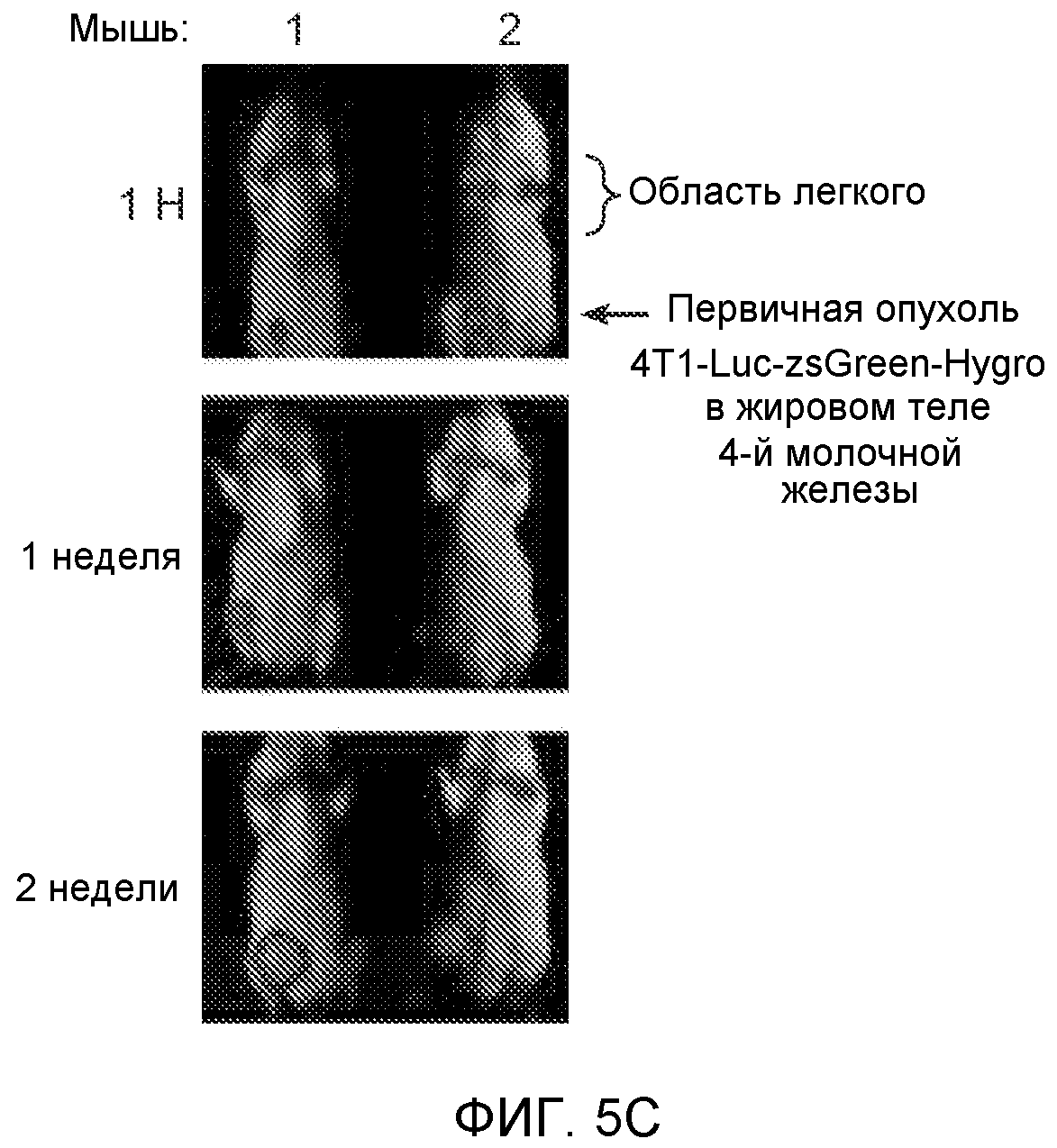
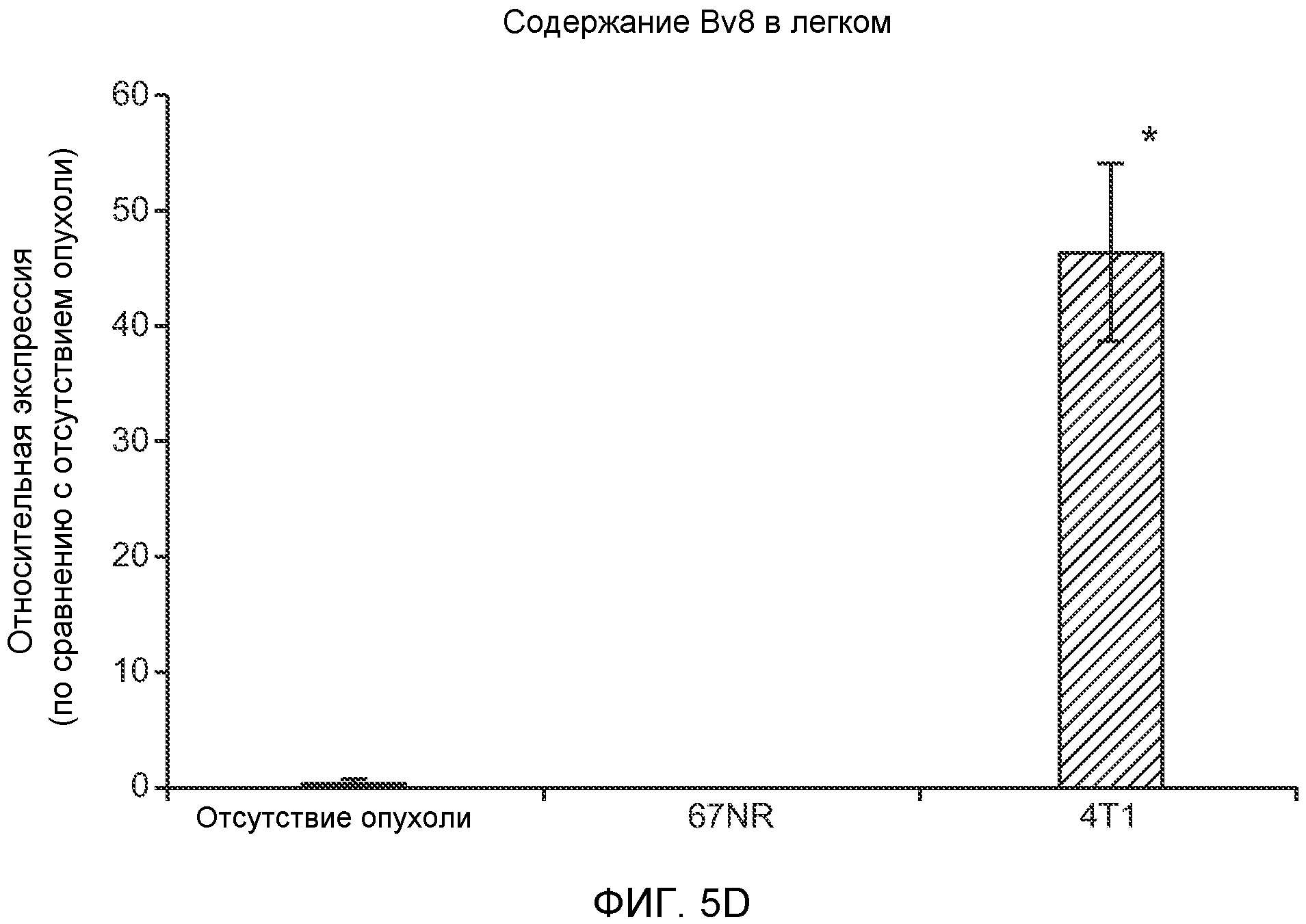
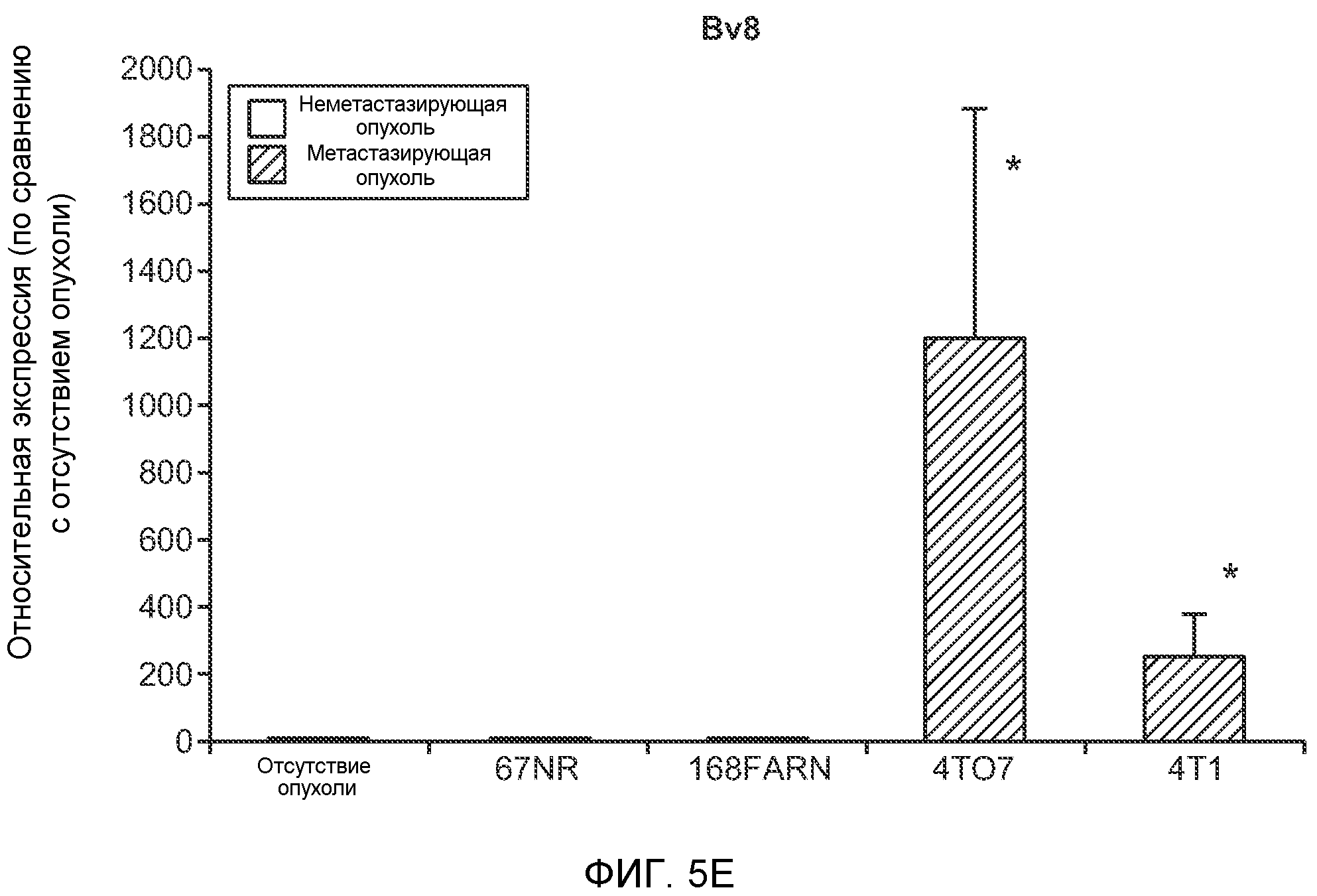
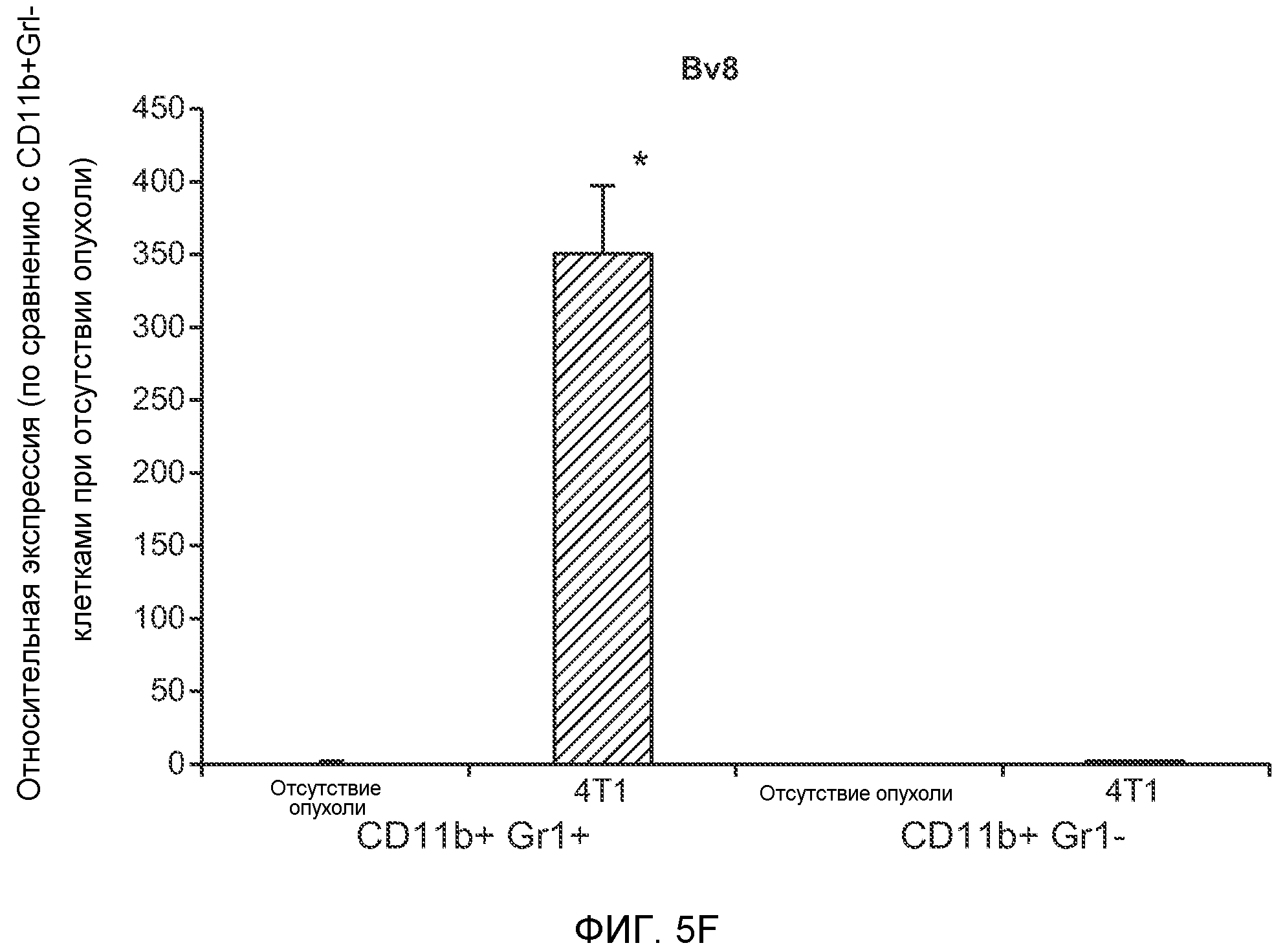
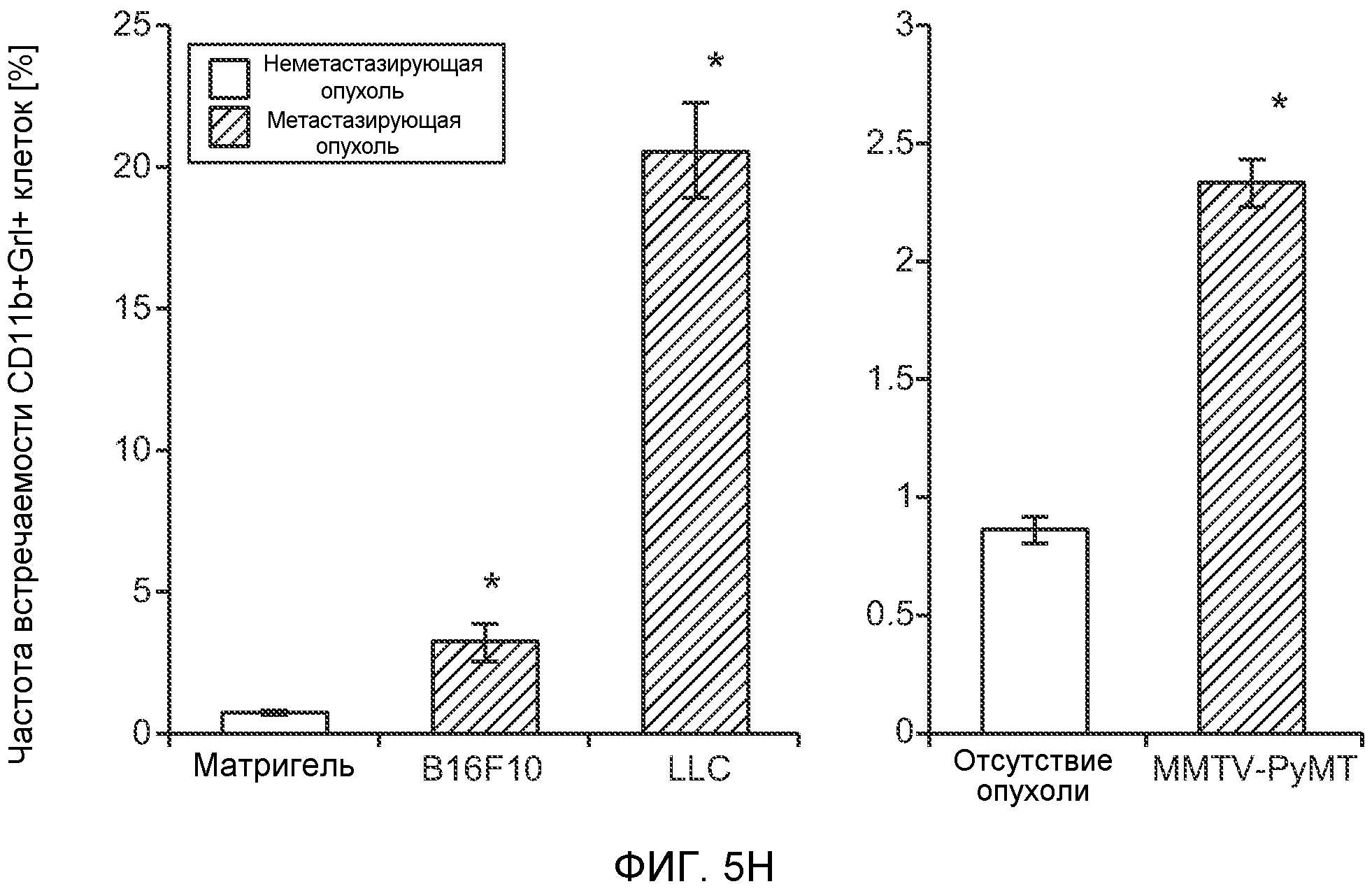
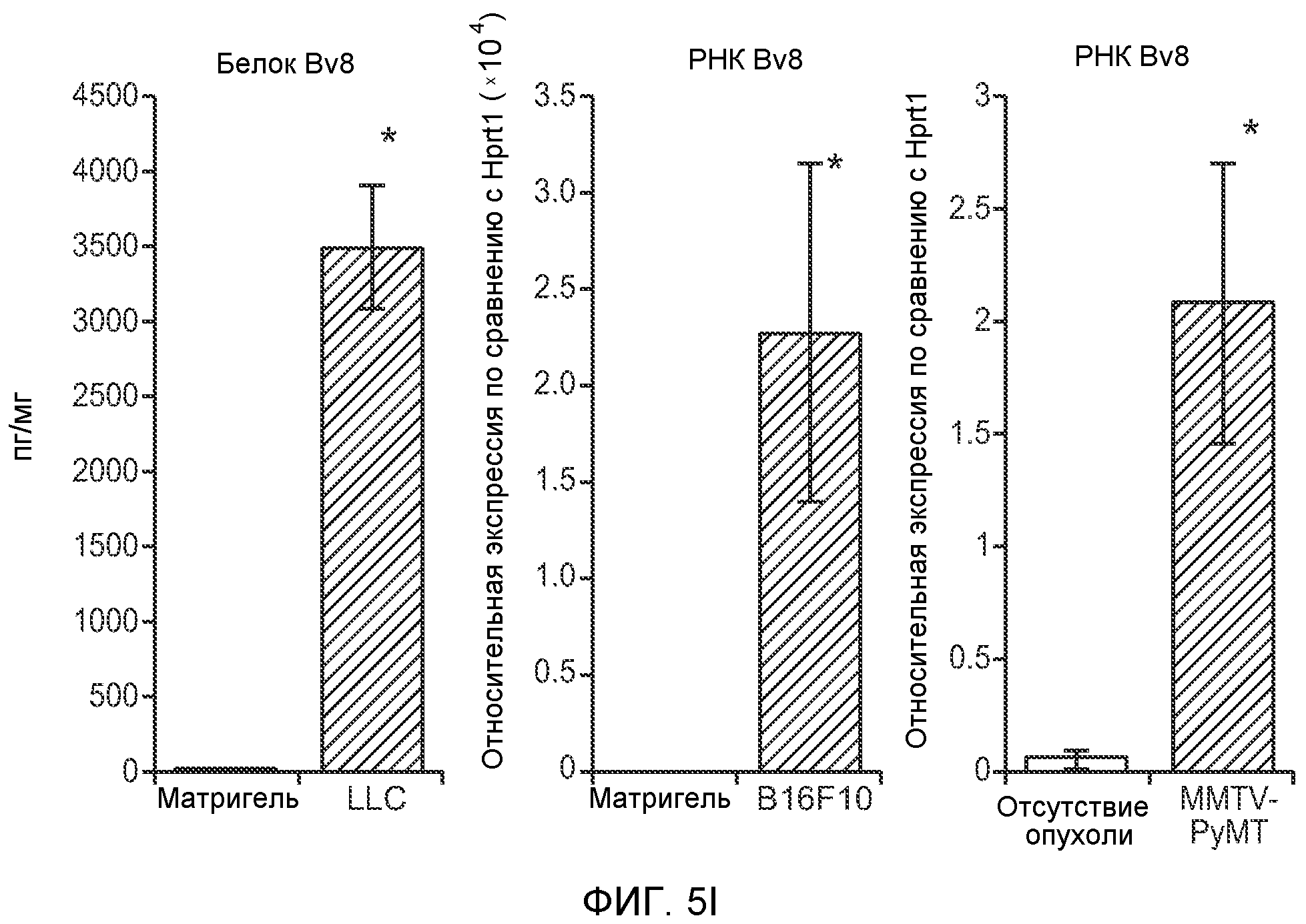
Фигура 5. В предметастатических легких отсутствуют опухоли во время получения ткани. Дополнительный анализ предметастатических легких мышей, имеющих опухоли. А. Схематическое представление линий 4Т1-родственных клеток, использованных в исследовании, с известными метастатическими участками. В. Анализ методом qRT-PCR экспрессии гена гигромицина в легких или первичных опухолях, показывающий отсутствие сигнала гигромицина в легких у мышей, имеющих опухоли 4T1-Luc-zsGreen-Hygro. Следует отметить наличие положительного сигнала первичной опухоли. Легкие удаляли через 6 дней после инокуляции опухолевых клеток. С. Визуализация BL1 у мышей, имеющих опухоли 4Т1-Luc-zsG-Hygro. Следует отметить отсутствие сигнала в легких и наличие положительного сигнала в первичной опухоли. D. Анализ методом qRT-PCR экспрессии Bv8 в тканях легкого при помощи микроматричного анализа. Е. Анализ методом qRT-PCR экспрессии Bv8 в предметастатических легких мышей, имеющих неметастазирующие и метастазирующие опухоли. F. Анализ методом qRT-PCR уровней транскриптов Bv8 в Cd11b+Grl+ и Cd11b+Grl- клетках, выделенных из ткани легкого мышей, не имевших опухолей, или мышей, имевших опухоли 4Т1. G. Примеры окрашивания Bv8 красителем IHC в предметастатических легких мышей, имеющих опухоли 67NR или 4Т1. Темные пятна в ткани предметастатических легких, имеющих опухоли 4Т1, указывают на наличие Bv8-положительных клеток. Клетки 67NR или 4Т1 ортотопически инокулировали в жировое тело 4-й молочной железы, легкие удаляли через 1 неделю и Bv8 обнаруживали при помощи IHC в соответствии с описанием, приведенным в разделе “Материалы и методы” примера 1. Масштаб равен 50 мкм. Н. Анализ методом FACS Cd11b+Grl+ клеток в предметастатических легких мышей, имеющих опухоли B16F10 и LLC (мыши, которым вводили матригель, были использованы в качестве контрольной группы), а также мышей с опухолями MMTV-PyMT (PyMT-отрицательные сиблинги были использованы в качестве контрольной группы) (n=5 в одной группе). I. Уровни экспрессии Bv8 в предметастатических легких мышей, имевших опухоли LLC (белок Bv8 измеряли методом ELISA), B16F10 и MMTV-PyMT (РНК Bv8 измеряли методом qRT-PCR). Данные представлены в виде экспрессии по сравнению с экспрессией в ткани без опухоли. Значения показаны в виде средних значений ± стандартная ошибка среднего.
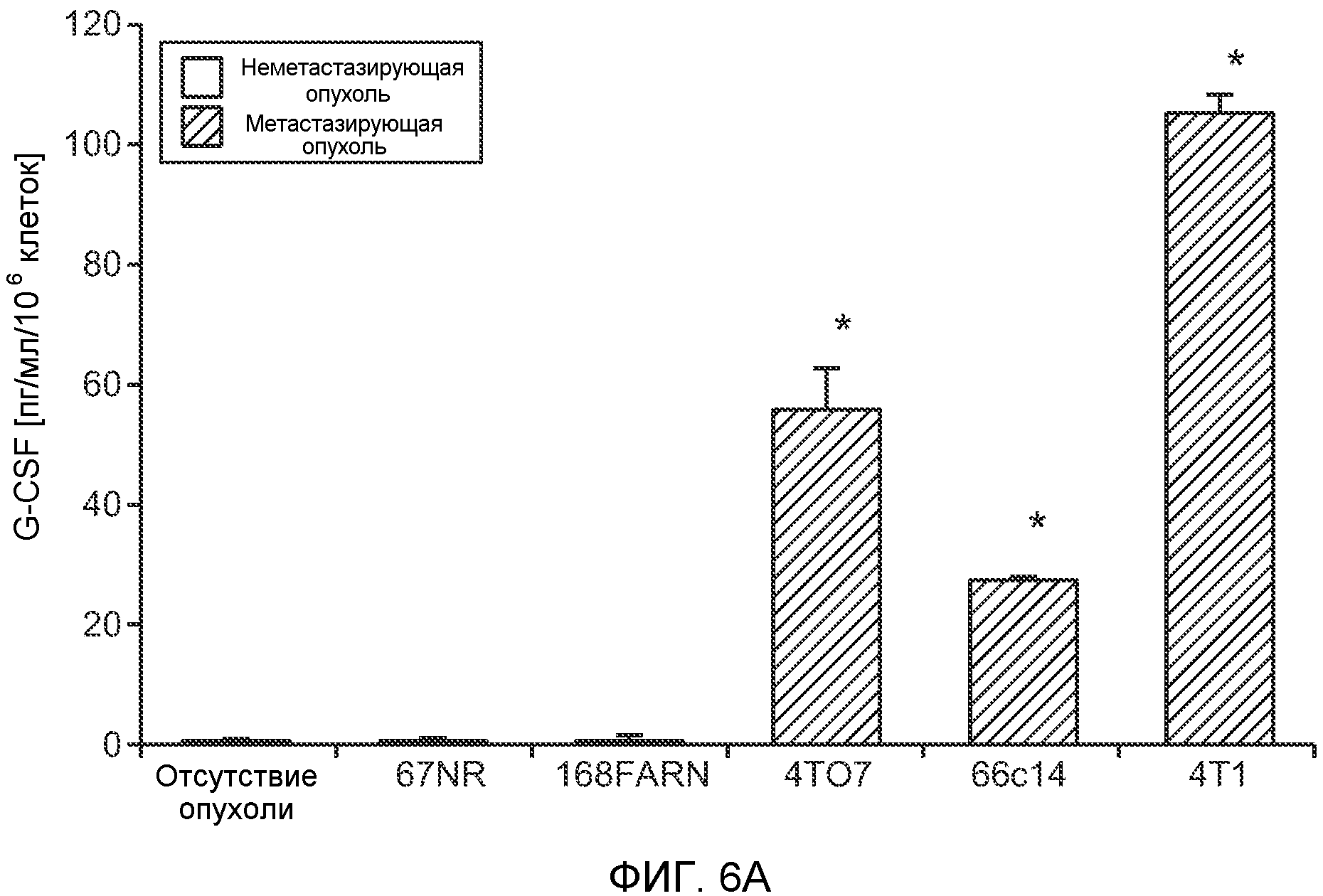
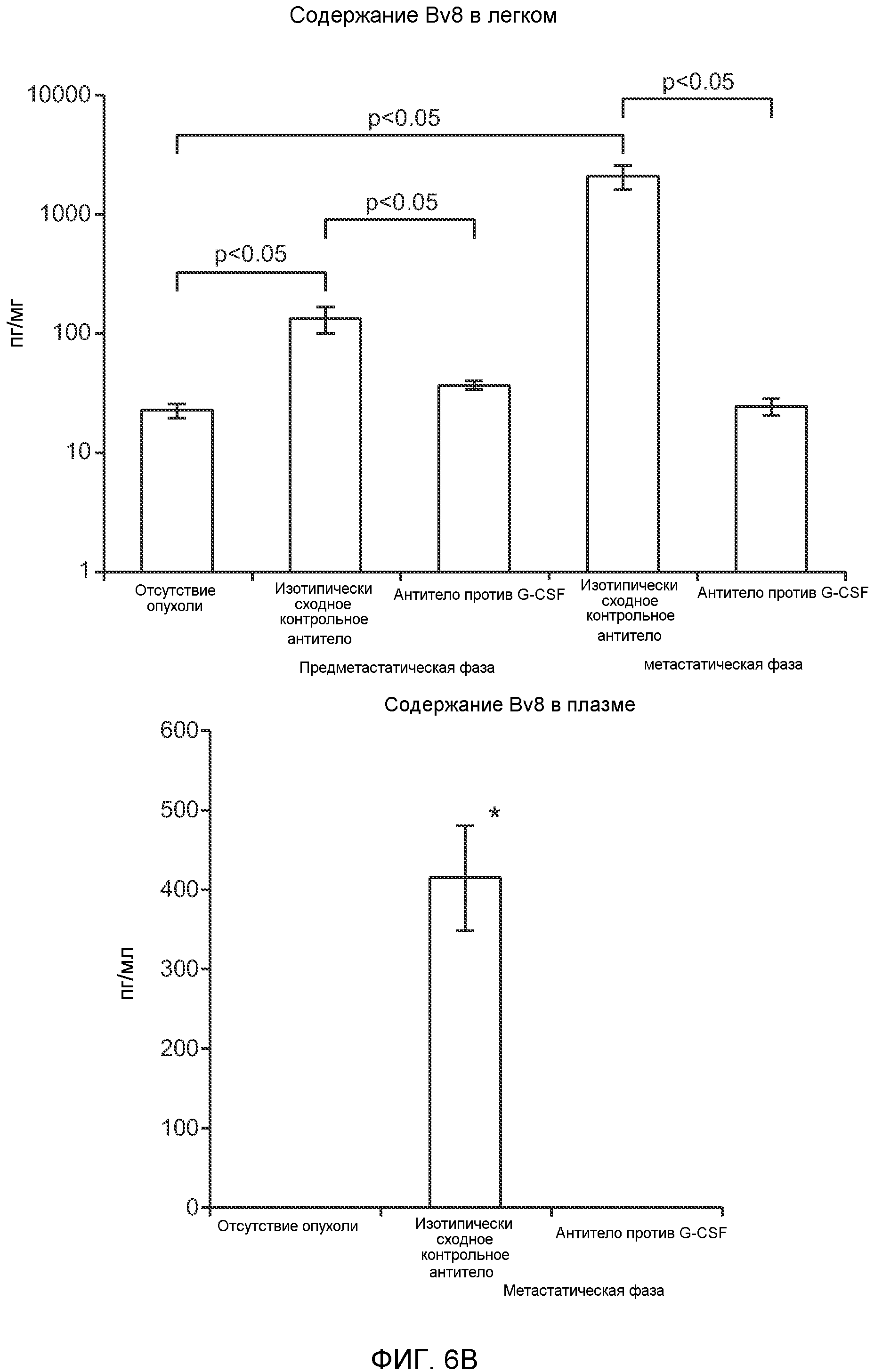
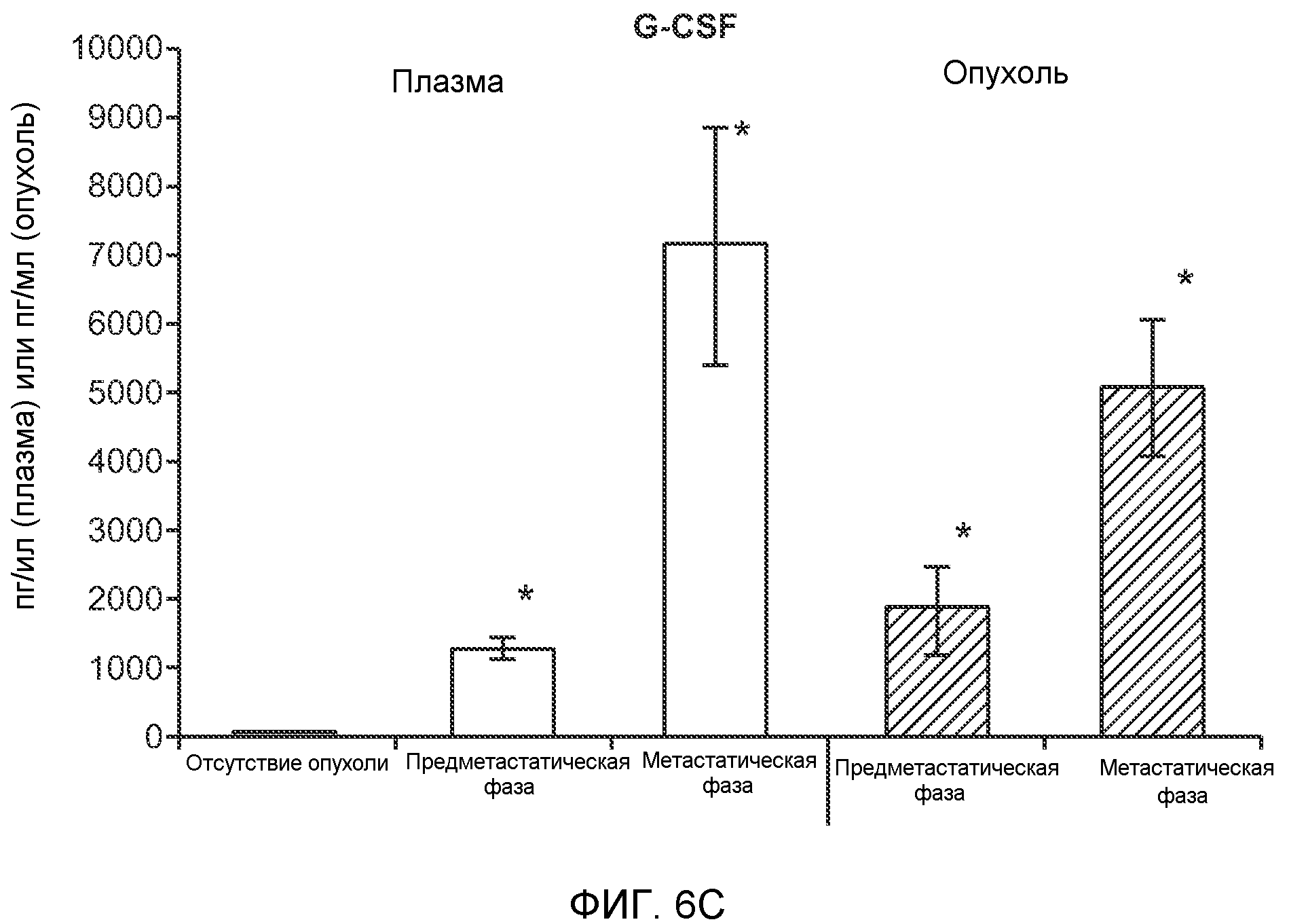
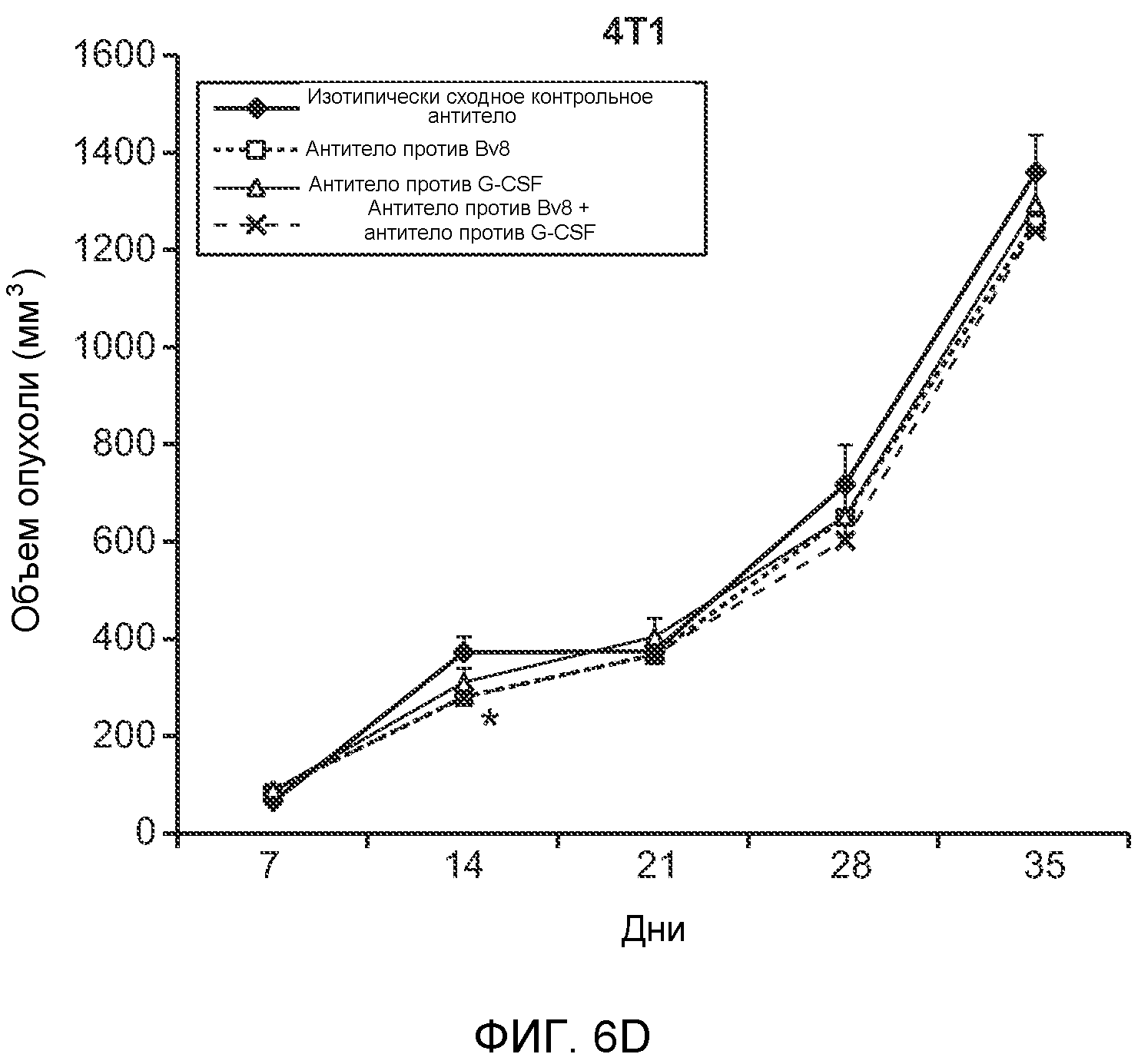
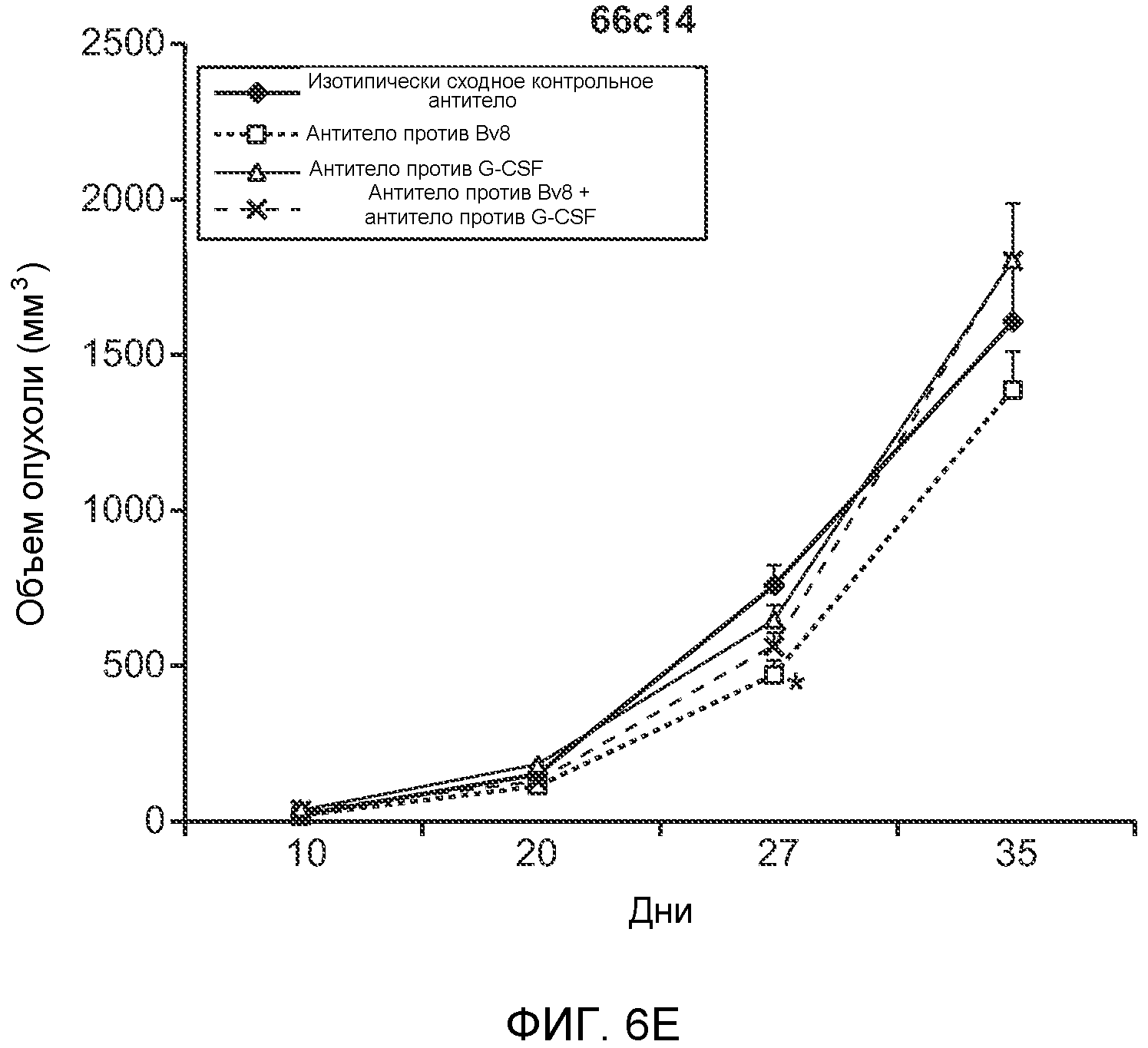
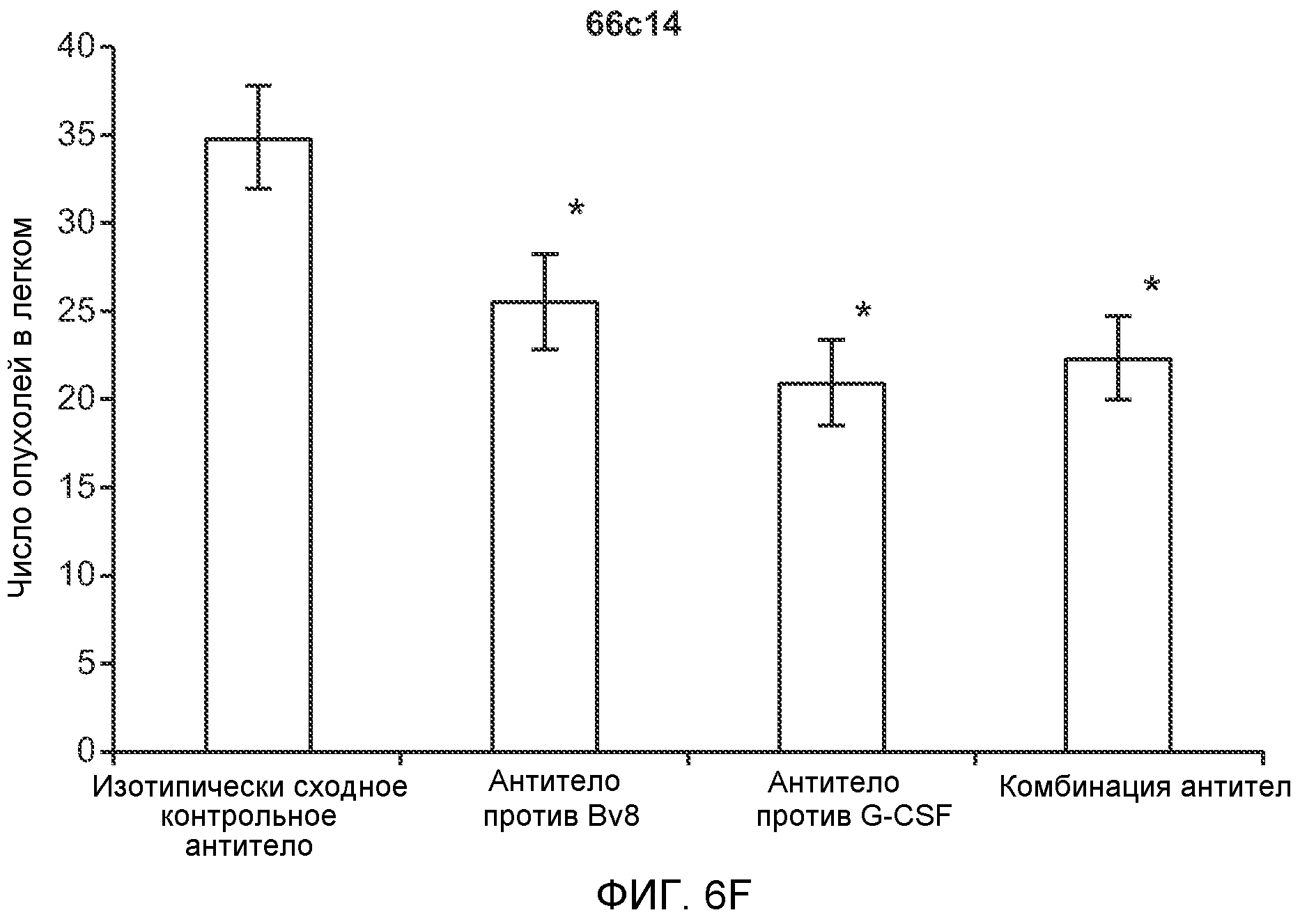
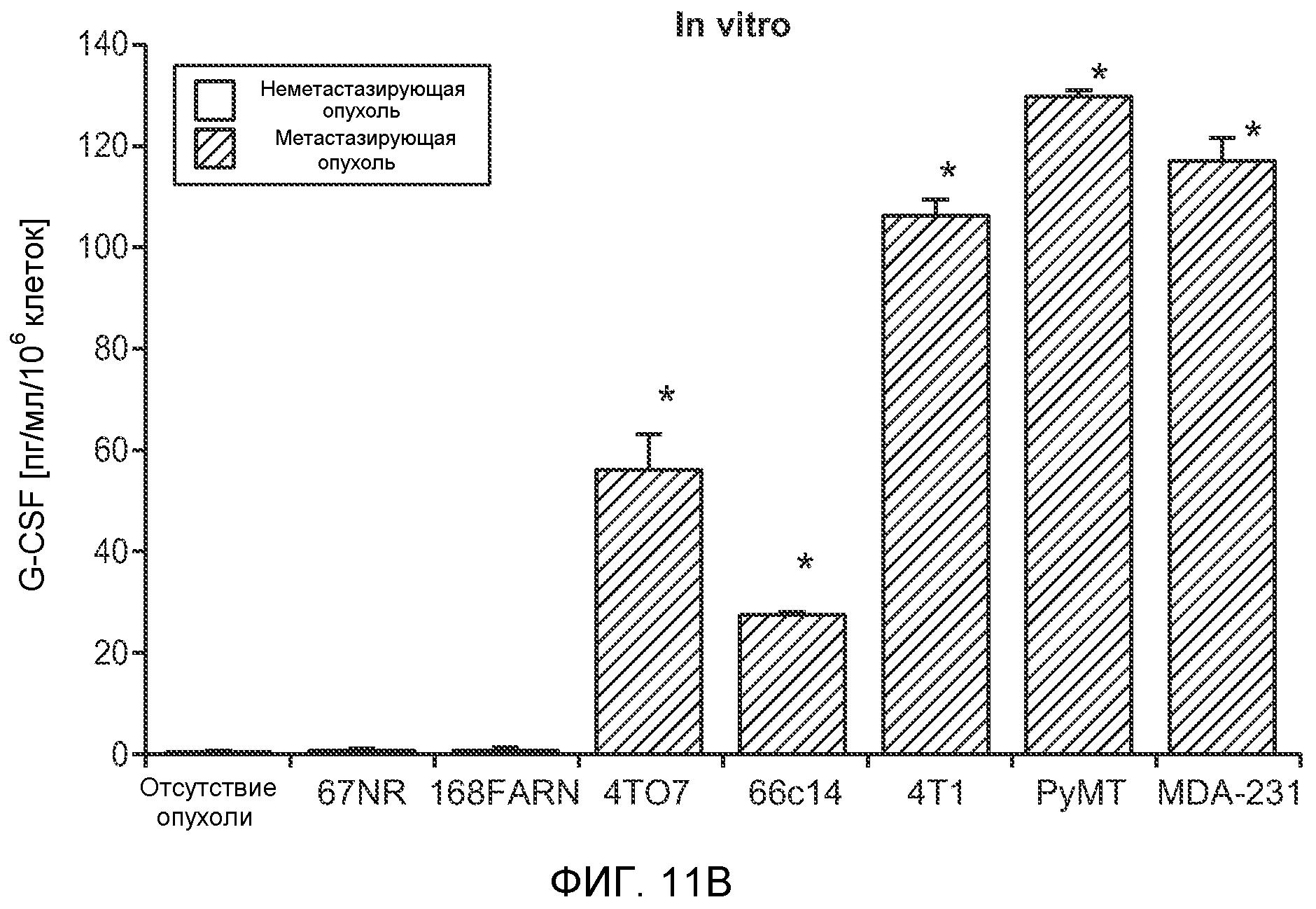
Фигура 6. Дополнительный анализ экспрессии G-CSF и Bv8 у мышей, имеющих опухоли. Дополнительный анализ опухолевой массы. А. Концентрации G-CSF в супернатантах культур клеток определяли после инкубации в течение 48 часов в соответствии с описанием, приведенным в разделе “Материалы и методы” примера 1 (n=3 в одной группе). Звездочкой (*) отмечено значимое отличие от группы мышей, не имеющих опухолей. В. Уровни Bv8 в легких и плазме мышей, имеющих опухоли Т41, которым вводили контрольное антитело (ISO) или антитело против G-CSF (n=5 в одной группе). Звездочкой (*) отмечено значимое отличие от группы мышей, не имеющих опухолей. С. Уровни G-CSF в плазме и опухоли у мышей, имеющих опухоли 4Т1, в предметастатической и метастатической фазах (n=5 в одной группе). Звездочкой (*) отмечено значимое отличие от группы мышей, не имеющих опухолей. D. Рост первичной опухоли 4Т1 у мышей, которым вводили контрольное антитело (ISO), антитело против Bv8, антитело против G-CSF или оба антитела (n=10 в одной группе). Клетки 4Т1 ортотопически инокулировали в жировое тело 4-й правой молочной железы самок мышей CB6F1. Звездочкой (*) рядом с группой, которой вводили антитело против Bv8, отмечено значимое отличие от группы, которой вводили контрольное антитело ISO. Е. Рост первичной опухоли 66с14 у мышей, которым вводили контрольное антитело (ISO), антитело против Bv8, антитело против G-CSF и оба антитела (n=10 в одной группе). Клетки 66с14 ортотопически инокулировали в жировое тело 4-й правой молочной железы самок мышей Balb/c. Звездочкой (*) рядом с группой, которой вводили антитело против Bv8, отмечено значимое отличие от группы, которое вводили антитело ISO. F. Число опухолей в легких мышей, имеющих опухоли 66с14, через 6 недель после инокуляции опухолевых клеток. Опухоли имплантировали и проводили лечение так, как показано в блоке Е (n=10 в одной группе). Звездочкой (*) отмечено значимое отличие от группы, которой вводили антитело ISO. На графиках представлены средние значения ± стандартная ошибка среднего.
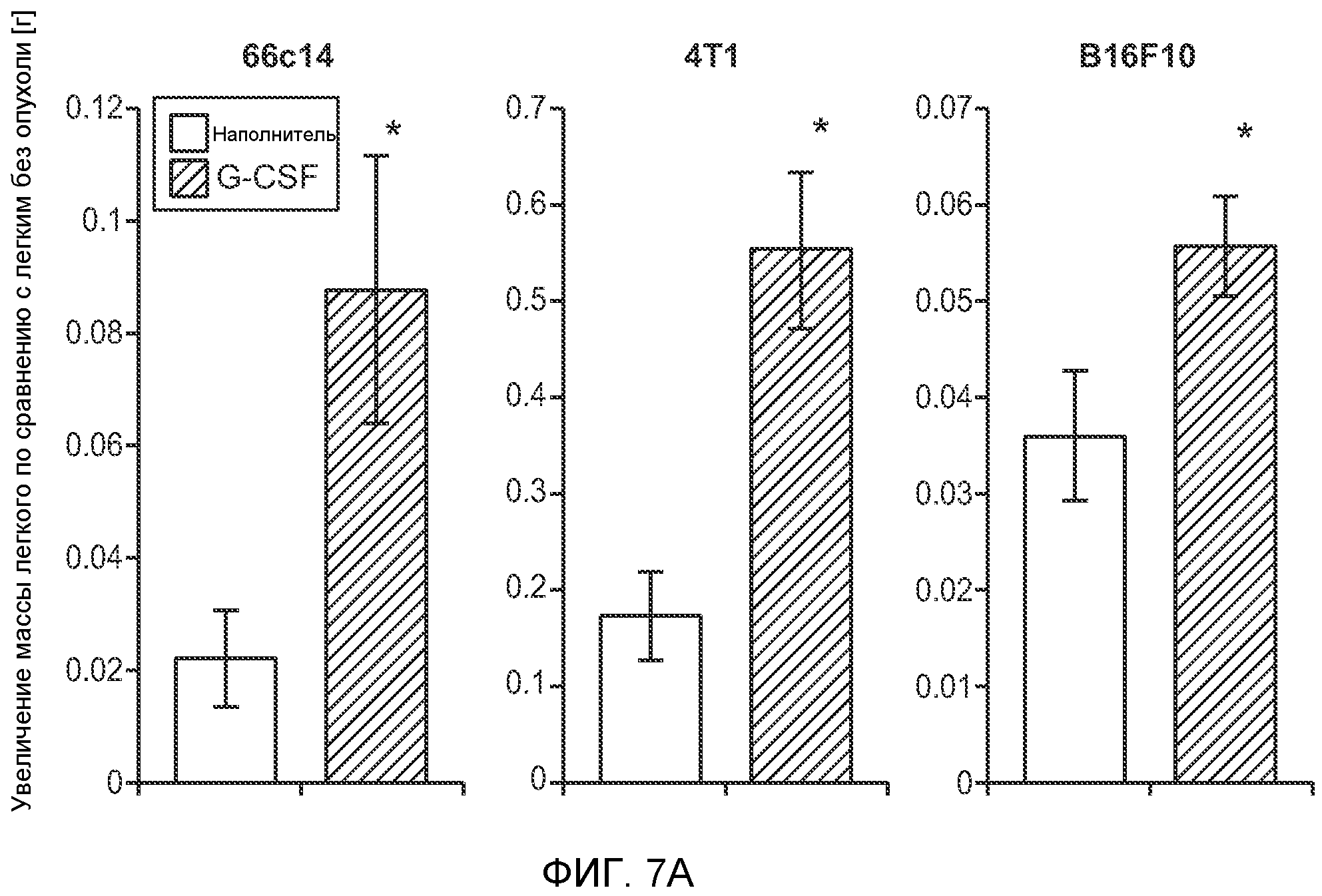
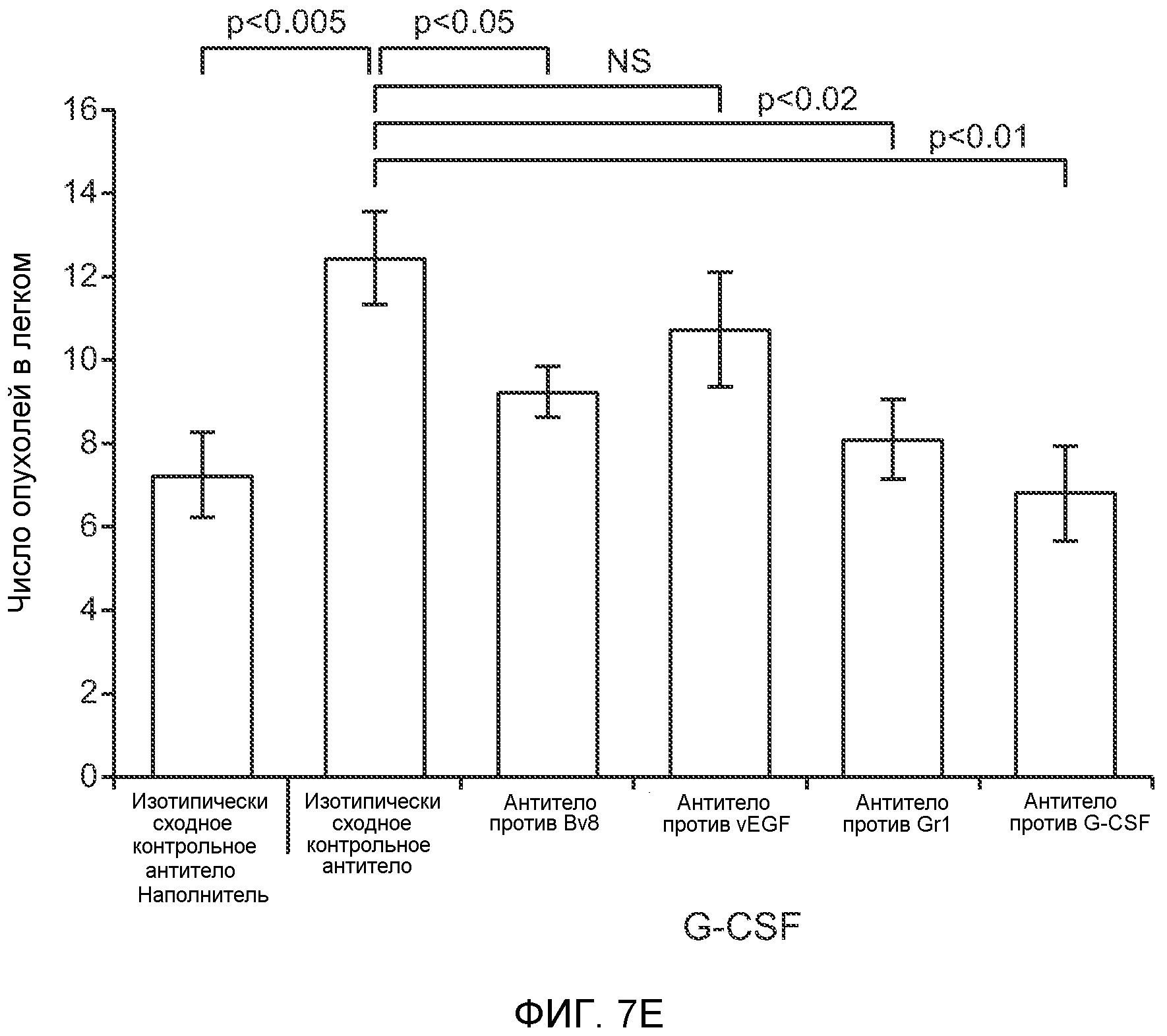
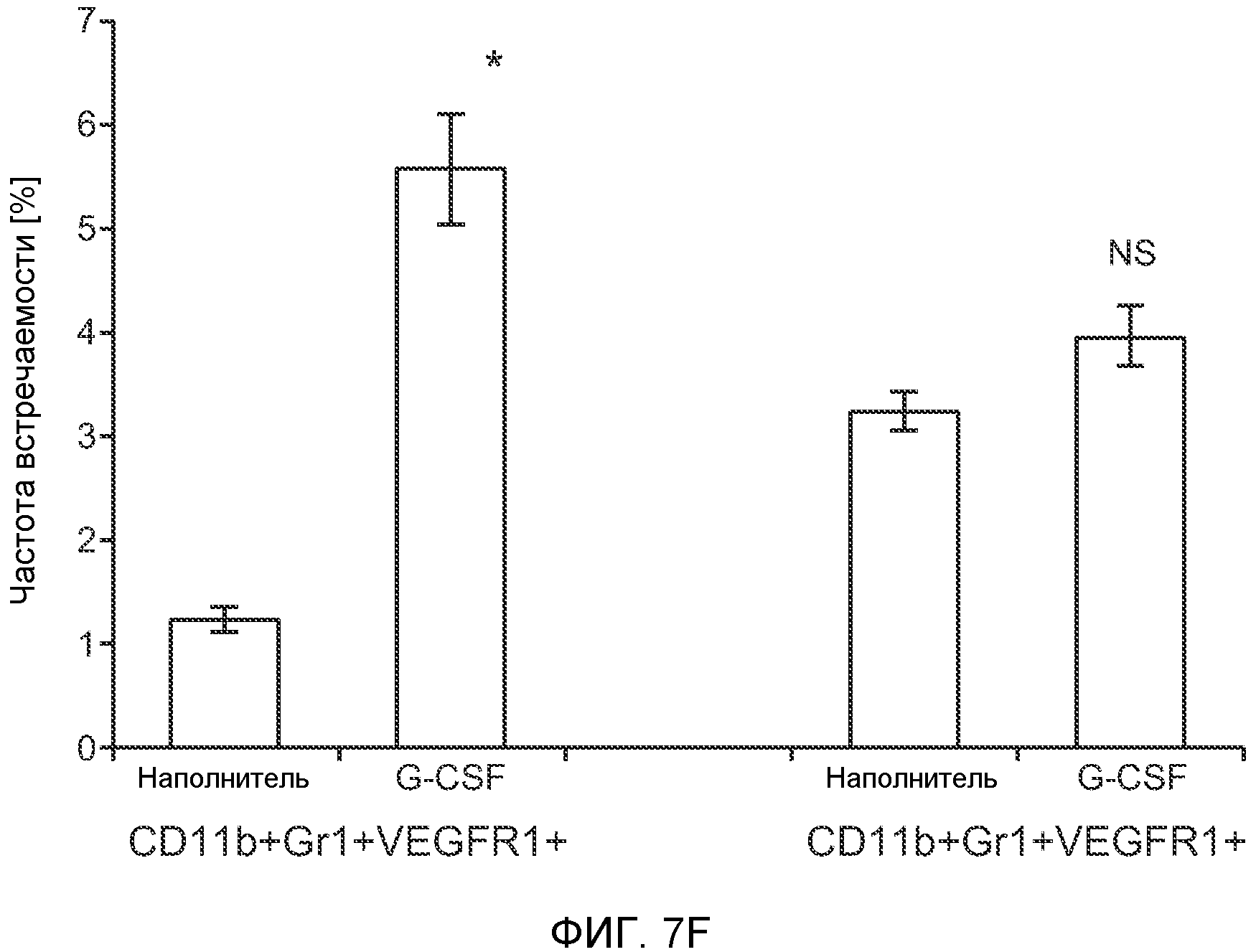
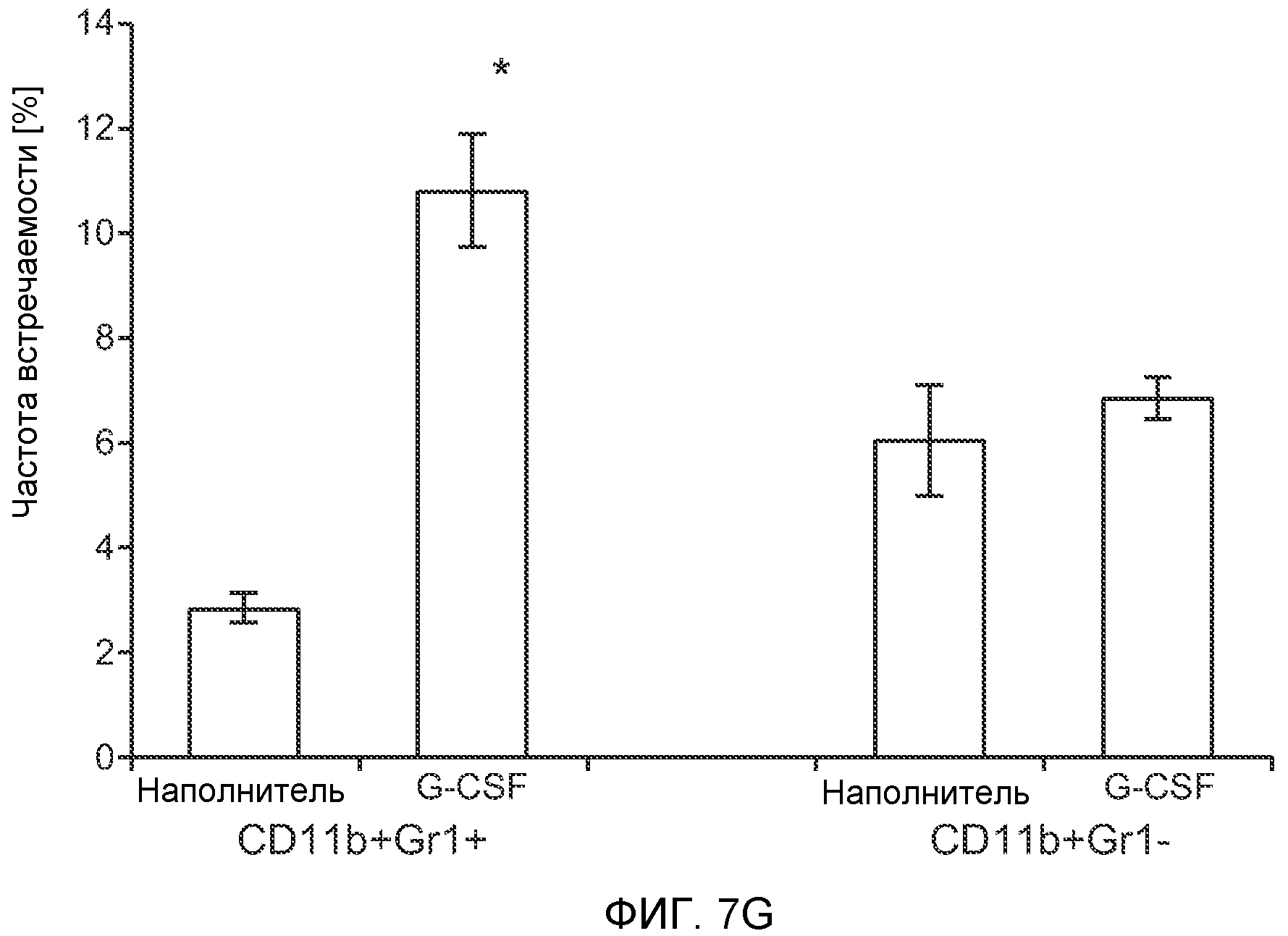
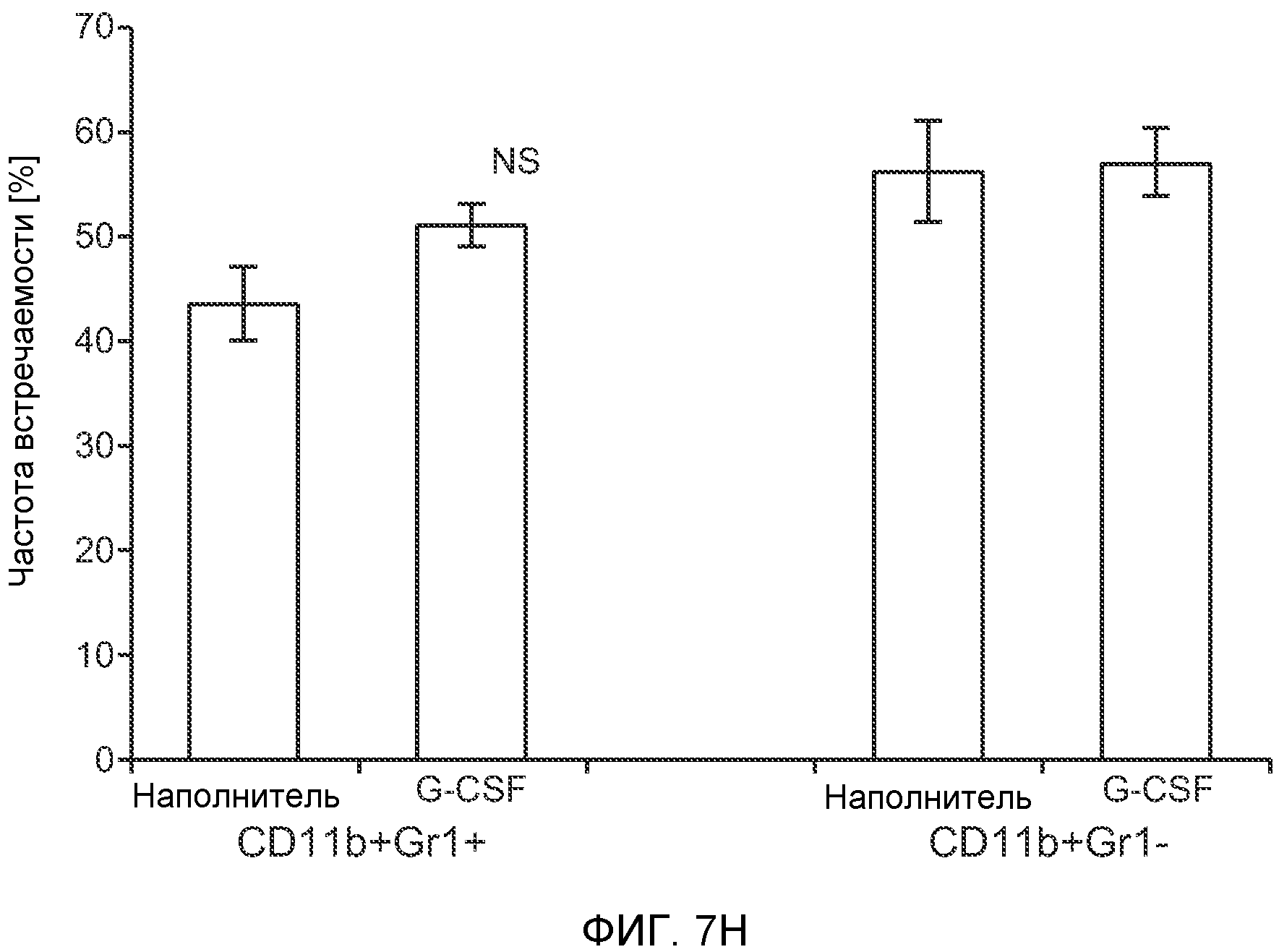
Фигура 7. Анализ G-CSF-индуцированного метастазирования у мышей, которым внутривенно (в хвостовую вену) инъецировали раковые клетки. А. Увеличение массы легких (по сравнению с легкими мышей, не имевших опухолей) после инокуляции опухолевых клеток и введения rG-CSF человека или наполнителя. Данные соответствуют группам, показанным на фиг.3С. Звездочкой (*) отмечено значимое отличие (n=5 в одной группе). В. Окрашивание красителем H&E легких мышей, которым инъецировали клетки 67NR и вводили наполнитель или G-CSF. Следует отметить наличие опухолей в группе, которой вводили G-CSF. Масштаб увеличенных изображений = 50 мкм. Т означает площадь опухоли, L означает площадь нормального легкого. С. Анализ методом FACS Cd11b+Grl+ клеток в легких мышей, которым ежедневно (в течение 3 дней) вводили rG-CSF мыши (1 мкг/мышь) или наполнитель и вводили контрольное антитело (ISO), антитело против Bv8, антитело против Grl или антитело против G-CSF, в соответствии с описанием, приведенным в разделе “Материалы и методы” примера 1 (n=5 в одной группе). D. Число опухолей в легких мышей через 3 недели после инокуляции клеток 4Т1. Мышам предварительно вводили (ежедневно) наполнитель или rG-CSF человека и вводили контрольное антитело (ISO), антитело против Bv8 или антитело против Grl. rG-CSF и антитела продолжали вводить в течение 5 дней после инокуляции раковых клеток. Е. Число опухолей в легких мышей, инокулированных клетками 4Т1. Легкие исследовали через 3 недели. Животным также вводили контрольное антитело (ISO), антитело против Bv8, антитело против VEGF, антитело против Grl или антитело против G-CSF. F. Анализ методом FACS VEGFR1+ клеток в легких мышей, которым ежедневно вводили rG-CSF мыши или наполнитель в течение 3 последующих дней. G. Анализ методом FACS Cd11b+Grl+ (и Grl-) клеток в легких мышей, которым ежедневно вводили rG-CSF мыши или наполнитель, как показано в блоке F. Н. Распределение VEGFR1+ клеток среди всех Cd11b+Grl+ (или Grl-) клеток у мышей, которым вводили наполнитель или rG-CSF мыши, определяли так же, как показано в блоках F и G. В блоках F, G и Н звездочкой (*) отмечено значимое отличие от группы, которой вводили наполнитель, NS означает незначимое отличие (n=5 в одной группе). Значения представлены в виде средних значений ± стандартная ошибка среднего.
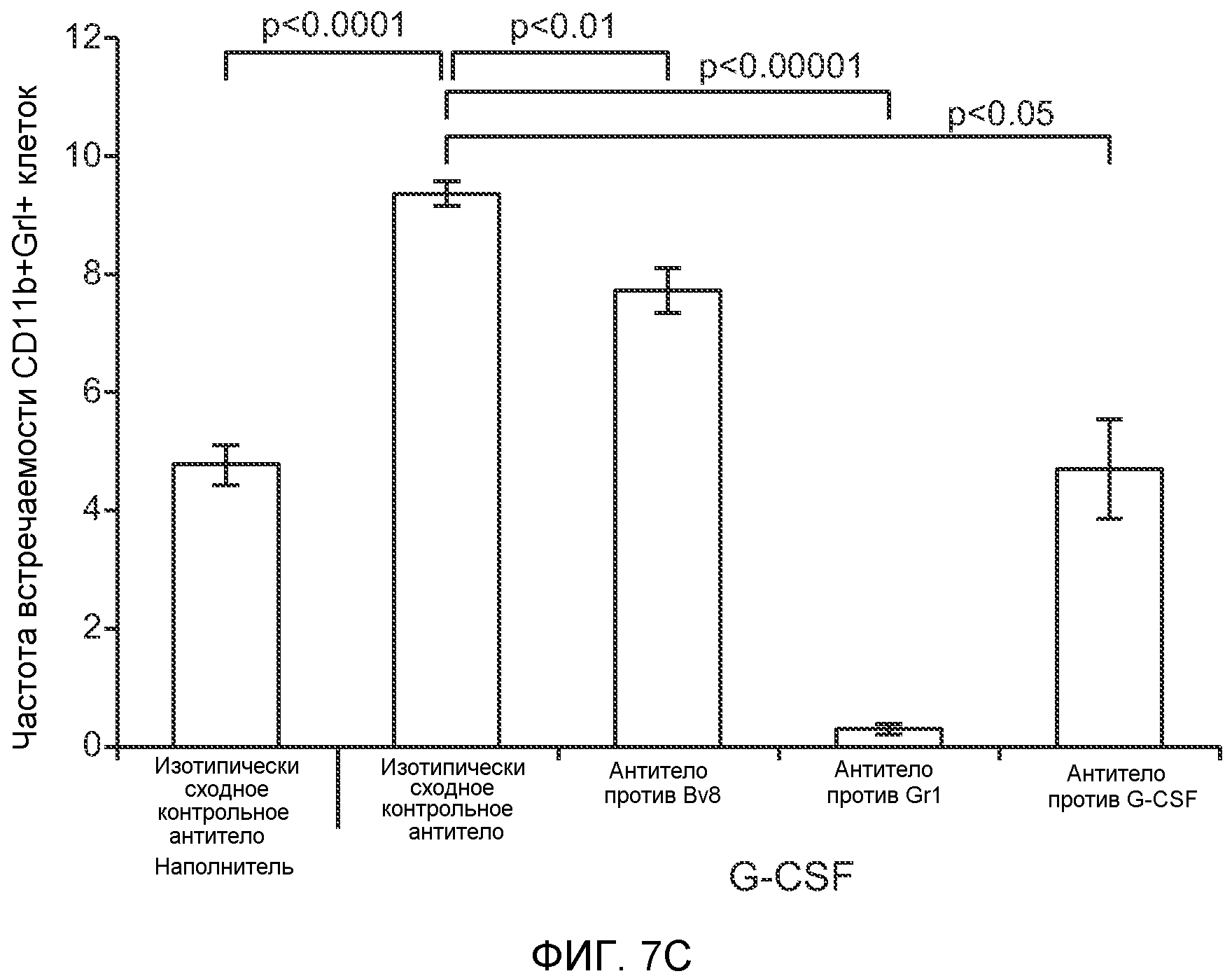
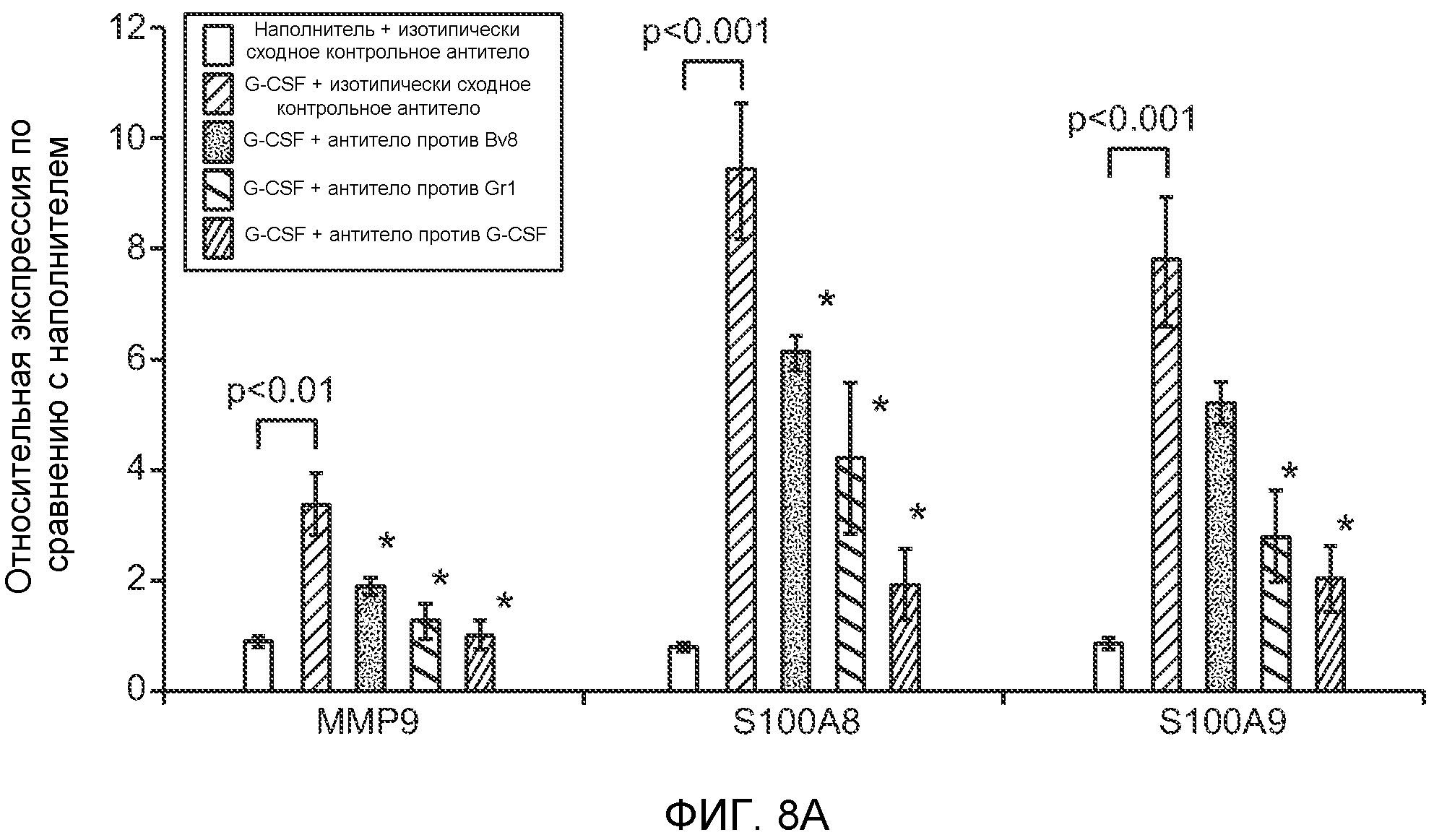
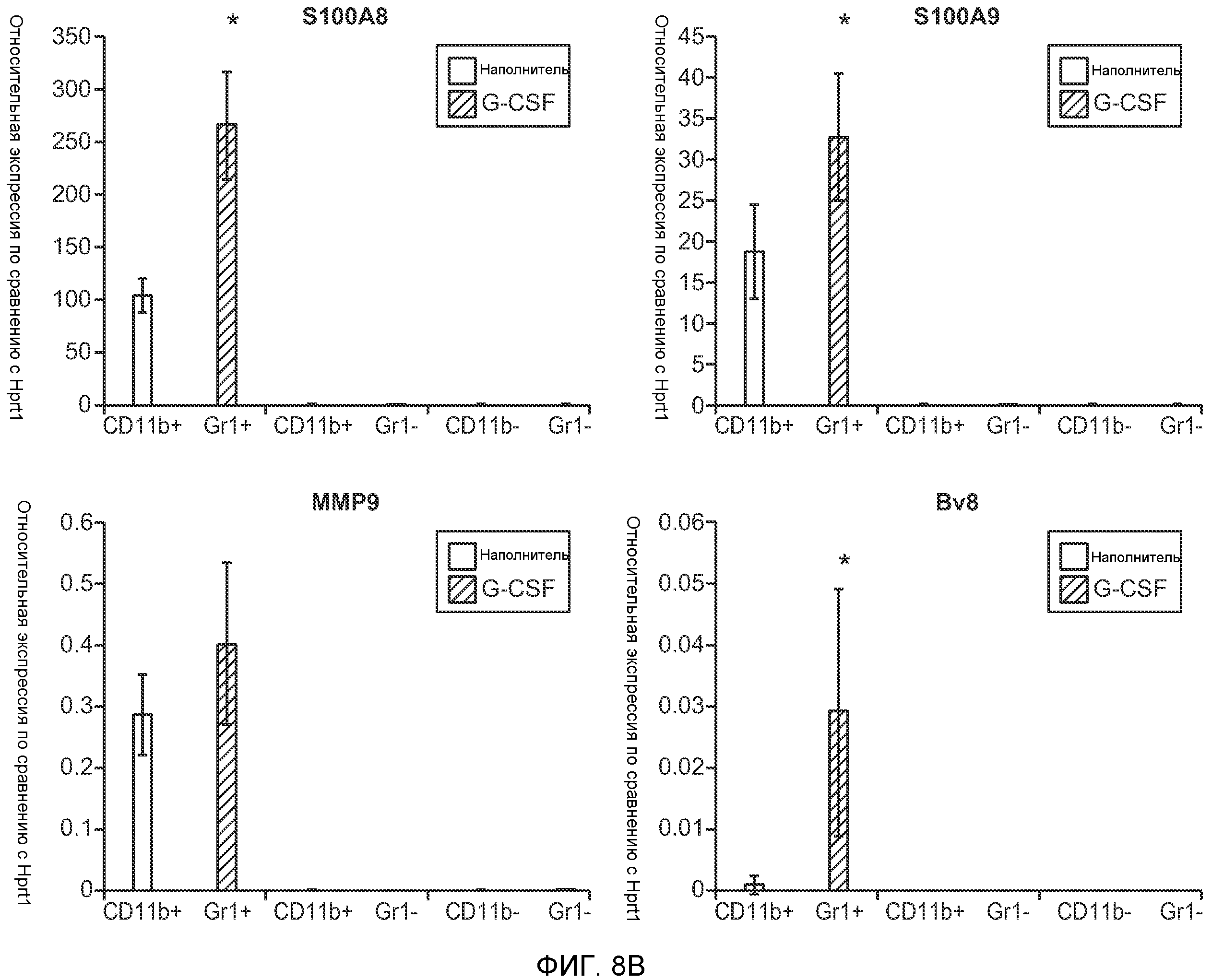
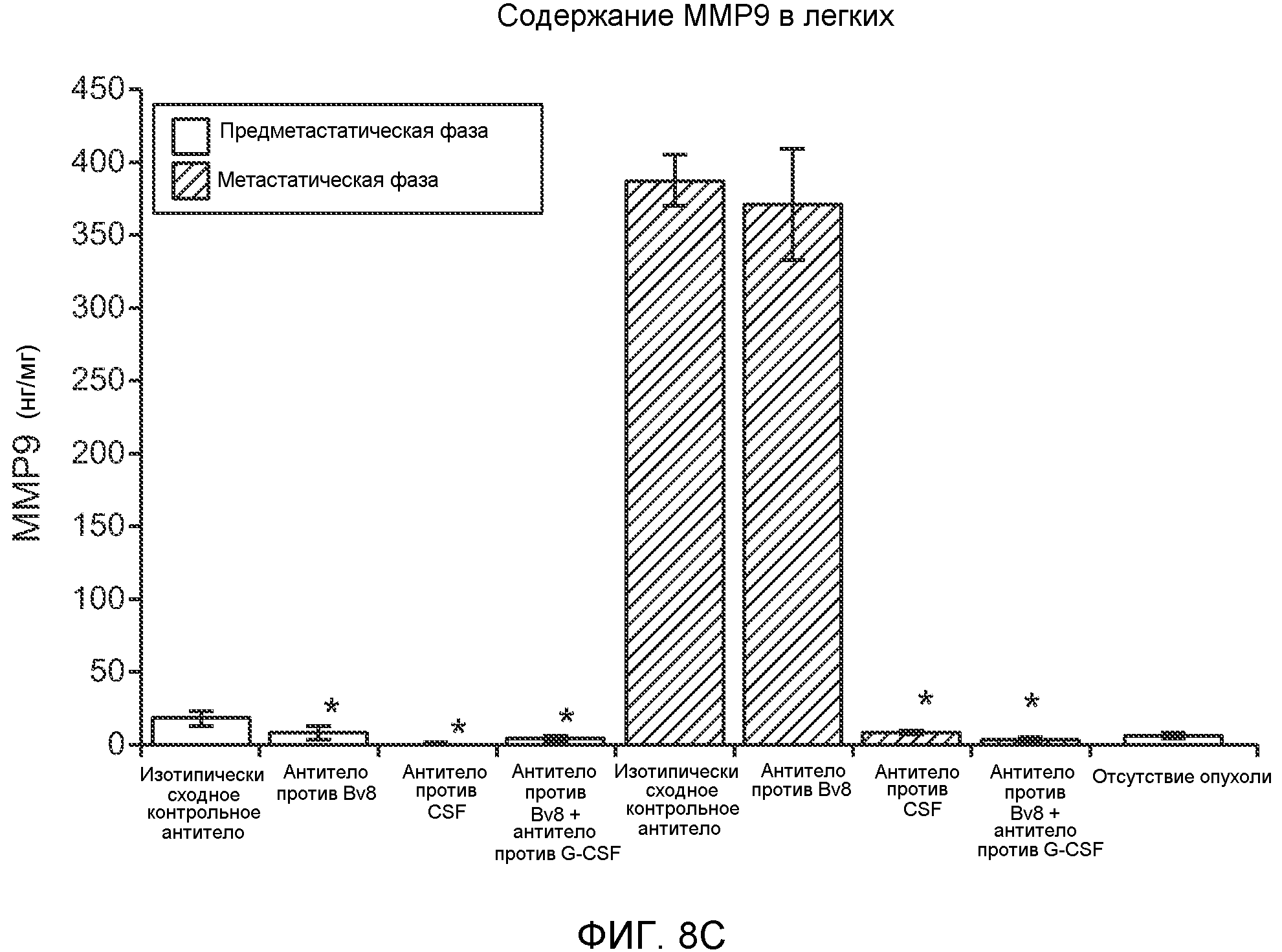
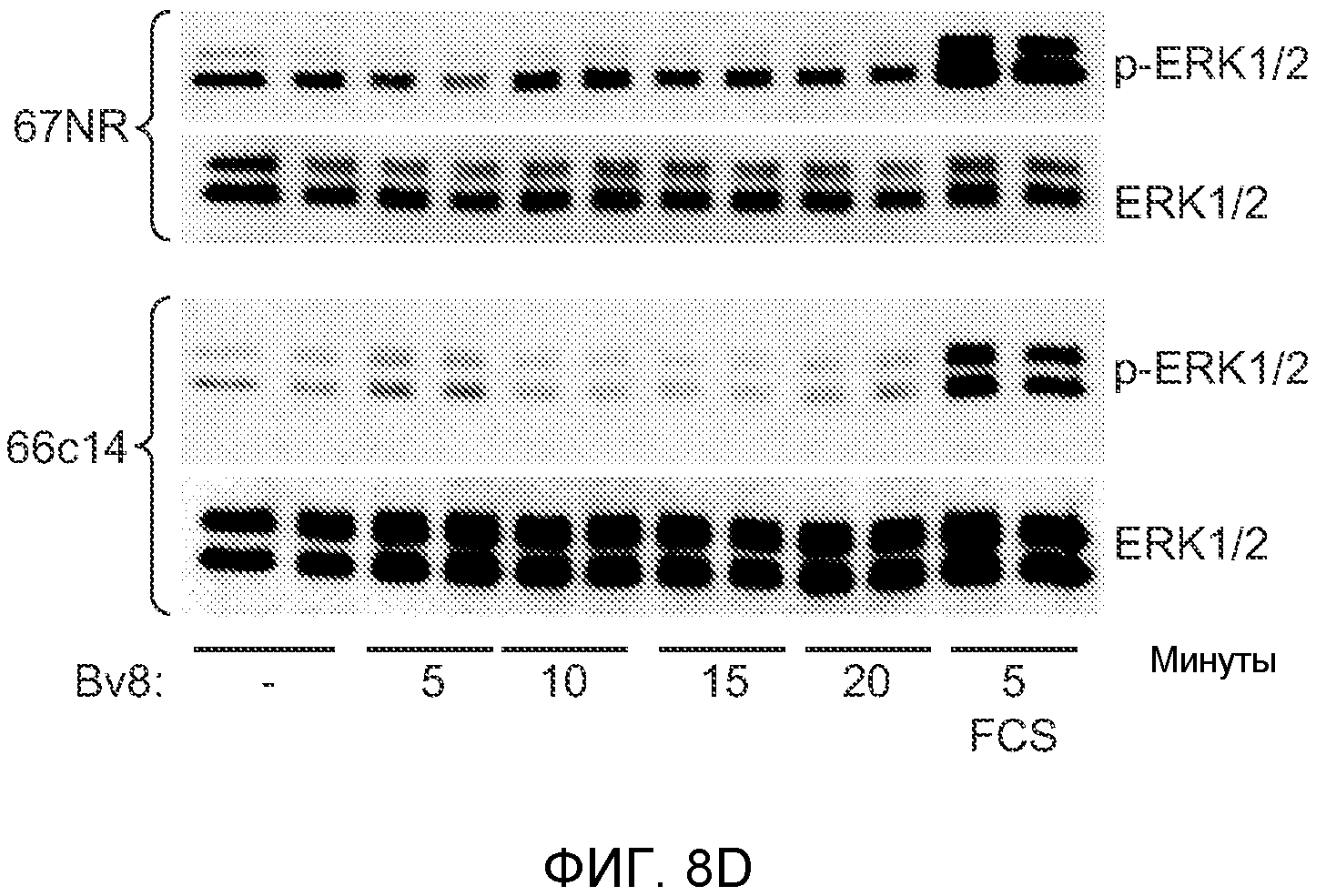
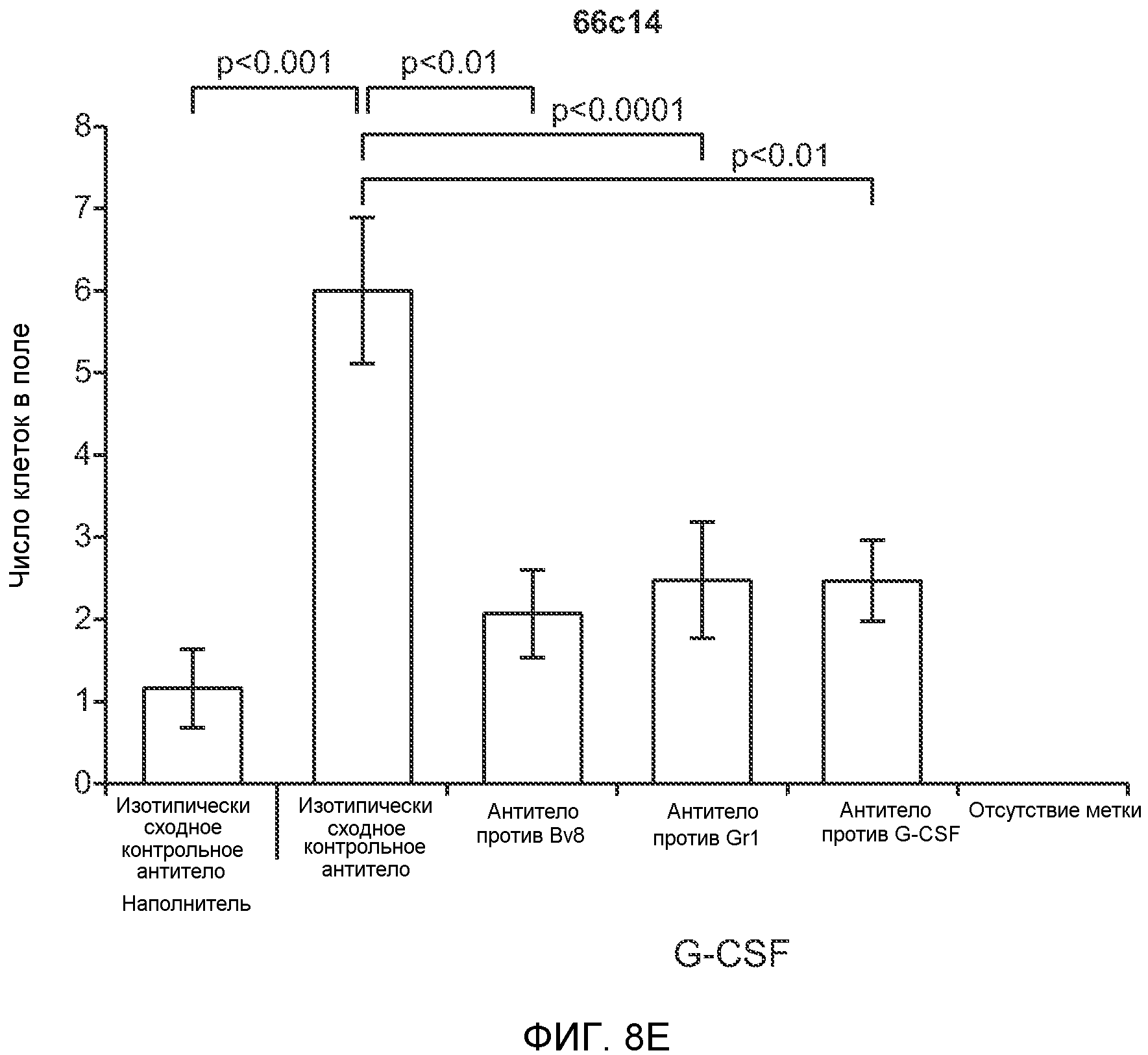
Фигура 8. Механизмы, определяющие образование G-CSF-инициированной предметастатической микросреды. А. Анализ методом qRT-PCR экспрессии генов ММР-9, S100A8 и S100A9 во всей ткани легкого у мышей, которым предварительно вводили наполнитель или rG-CSF мыши (1 мкг/мышь, ежедневно, в течение 3 дней) и затем вводили контрольное антитело (ISO), антитело против Bv8, антитело против Grl или антитело против G-CSF. Звездочкой (*) отмечено значимое отличие от группы, которой вводили G-CSF+ISO (n=5 в одной группе). В. Экспрессия генов Bv8, S100A8, S100A9 и ММР9, измеренная методом qRT-PCR в Cd11b+Grl+ (или Grl-) клетках, выделенных из легких мышей, которым предварительно вводили наполнитель или rG-CSF. Из тканей были получены взвеси единичных клеток, клетки окрашивали специфическими антителами против Cd11b и против Grl, популяции двукратно-положительных клеток (Cd11b+Grl+), Cd11b+Grl- клеток и двукратно-отрицательных клеток (Cd11b-Grl-) выделяли методом FACS. Из клеток выделяли полную РНК и методом qRT-PCR измеряли экспрессию генов. Данные представлены в виде экспрессии относительно Hprtl (n=5 в одной группе). Звездочкой (*) отмечено значимое отличие от группы, которой вводили наполнитель. С. Концентрацию ММР-9 измеряли методом ELISA в предметастатических или метастатических легких мышей, имевших ортотопически инокулированные опухоли 4Т1, которым вводили контрольное антитело (ISO), антитело против Bv8, антитело против G-CSF или комбинацию антитела против Bv8 и антитела против G-CSF (n=5 в одной группе). Термин “naive” означает легкие мышей без опухоли. Образцы получены из соответствующего эксперимента, показанного на фиг.2В. Звездочкой (*) отмечено значимое отличие от группы, которой вводили контрольное антитело ISO. D. Анализ методом иммуноблоттинга, показывающий наличие фосфорилирования ERK1/2 (p-ERK1/2) при стимулировании клеток 67NR и 66с14 белком Bv8. Клетки стимулировали Bv8 (5 нг/мл) или 1% FBS в указанные периоды времени. Представлены дублированные образцы. Е. Количественное определение выделения клеток 66с14 из сосудов in vivo, произведенное через 36 часов после внутривенной инокуляции (в хвостовую вену) клеток, меченных зеленым красителем CellTracker Green. Мышам предварительно вводили rG-CSF мыши (2,5 мкг/мышь, ежедневно) в течение 5 последующих дней и затем вводили контрольное антитело (ISO), антитело против Bv8, антитело против Grl или антитело против G-CSF. Термин “отсутствие метки” означает группу мышей, которым инокулировали клетки, не меченные зеленым красителем CellTracker Green. Значения представлены в виде средних значений ± стандартная ошибка среднего.
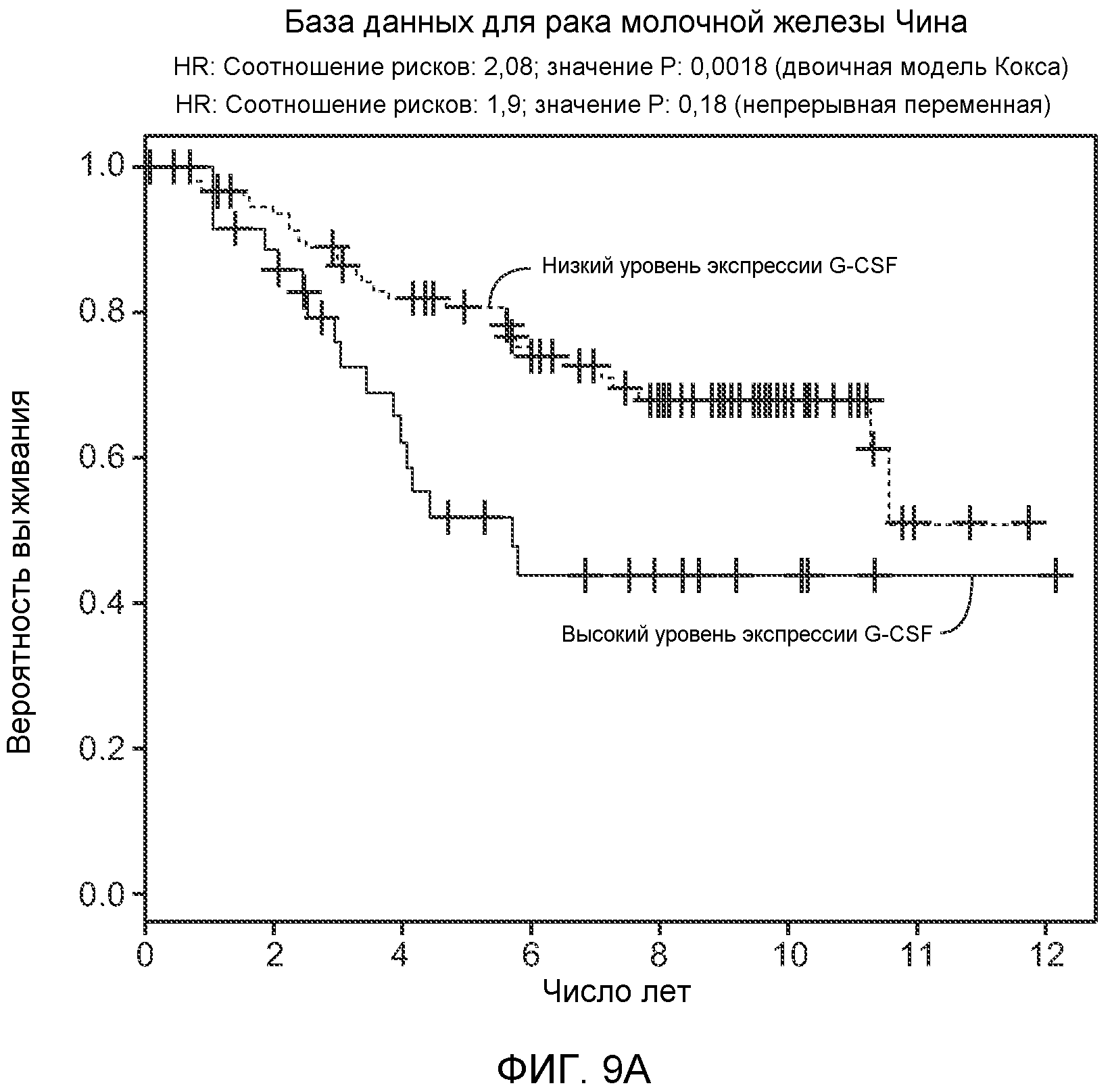
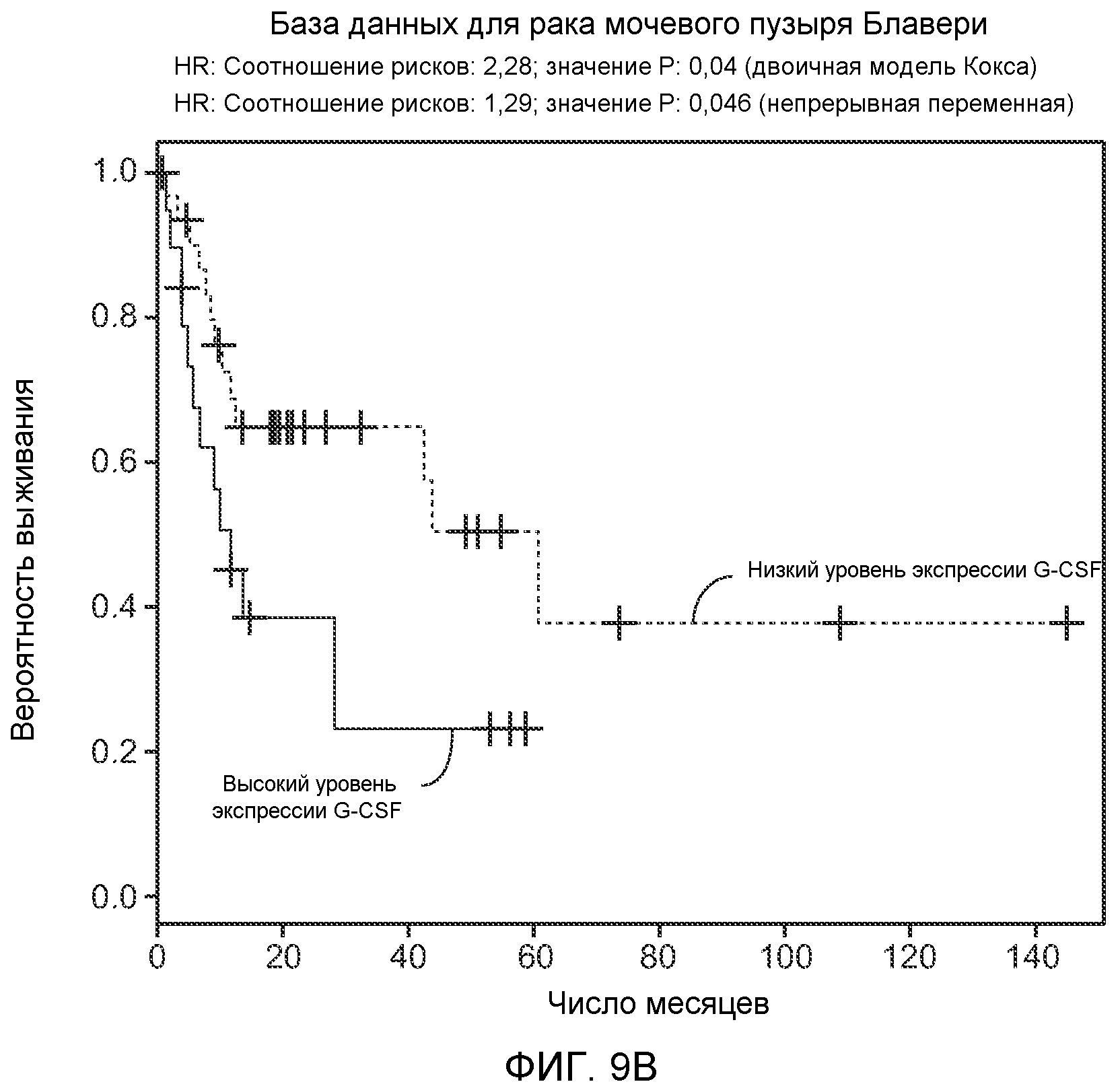
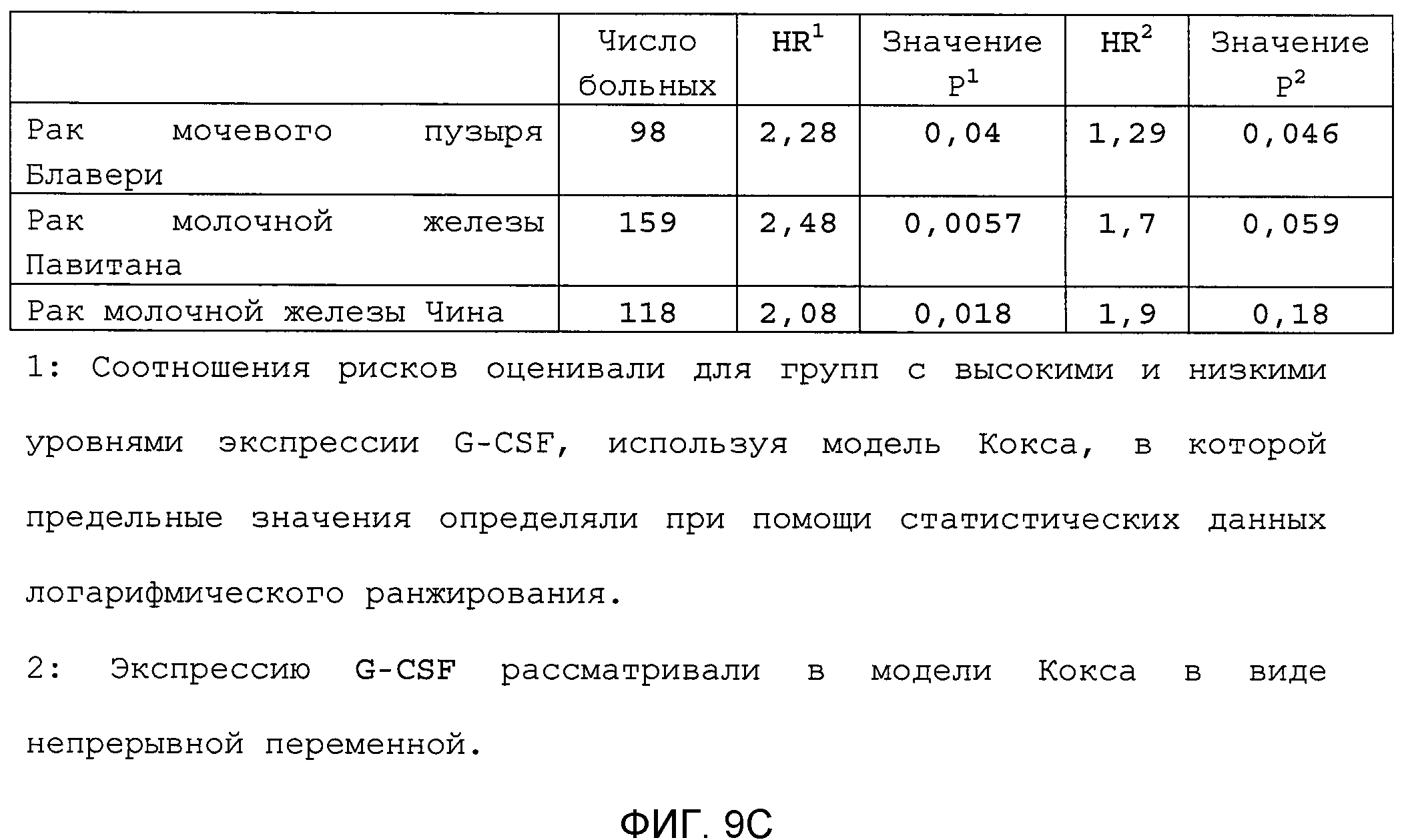
Фигура 9. Высокая экспрессия G-CSF у больных раком ассоциирована с более низким выживанием. А. Кривые Каплана-Мейера, показывающие вероятность выживания больных раком молочной железы в группе рака молочной железы Чина, созданной на основе экспрессии G-CSF. График показывает высокую корреляцию между высокими уровнями G-CSF и более низким выживанием. В. Кривая Каплана-Мейера, показывающая вероятность выживания больных раком мочевого пузыря в группе рака мочевого пузыря Блавери, созданной на основе экспрессии G-CSF. График показывает высокую корреляцию между высокими уровнями G-CSF и меньшей продолжительностью жизни. С. Краткий обзор данных, использованных в данном исследовании для анализа клинической значимости G-CSF.
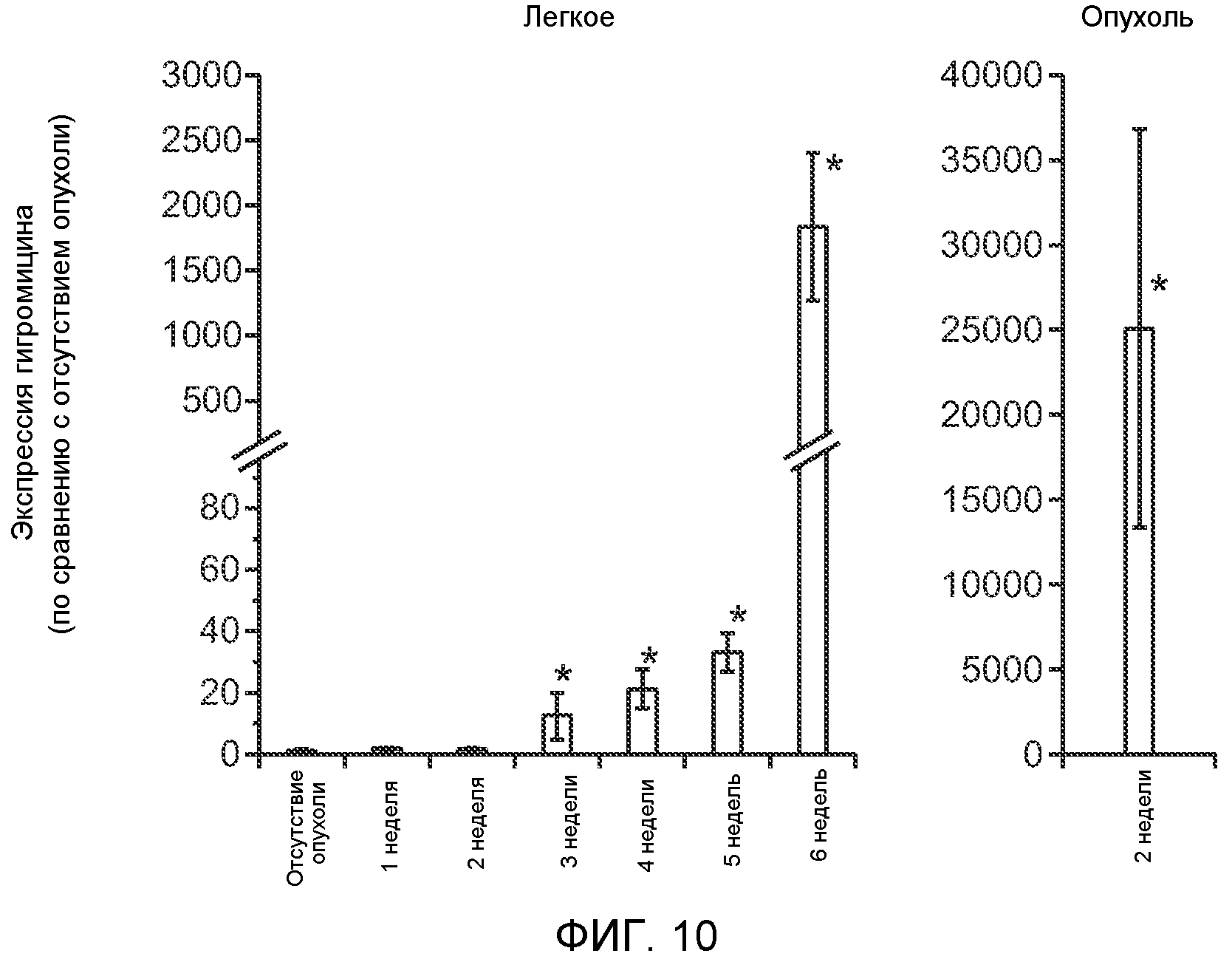
Фигура 10. В предметастатических легких отсутствуют опухоли во время получения ткани. Дополнительный анализ предметастатических легких мышей, имеющих опухоли. Определение времени метастазирования опухоли в легкие мышей, имеющих опухоль 4Т1, анализ методом qRT-PCR экспрессии гена гигромицина в легких или первичных опухолях, свидетельствующий об отсутствии сигнала гигромицина в легких в течение 2 недель после инокуляции опухолей 4Т1-Luc-zsGreen-Hygro. Следует отметить наличие положительного сигнала первичной опухоли. Легкие удаляли через каждые 7 дней после инокуляции опухоли и исследовали в отношении наличия гена гигромицина, который указывает на присутствие раковых клеток в ткани.
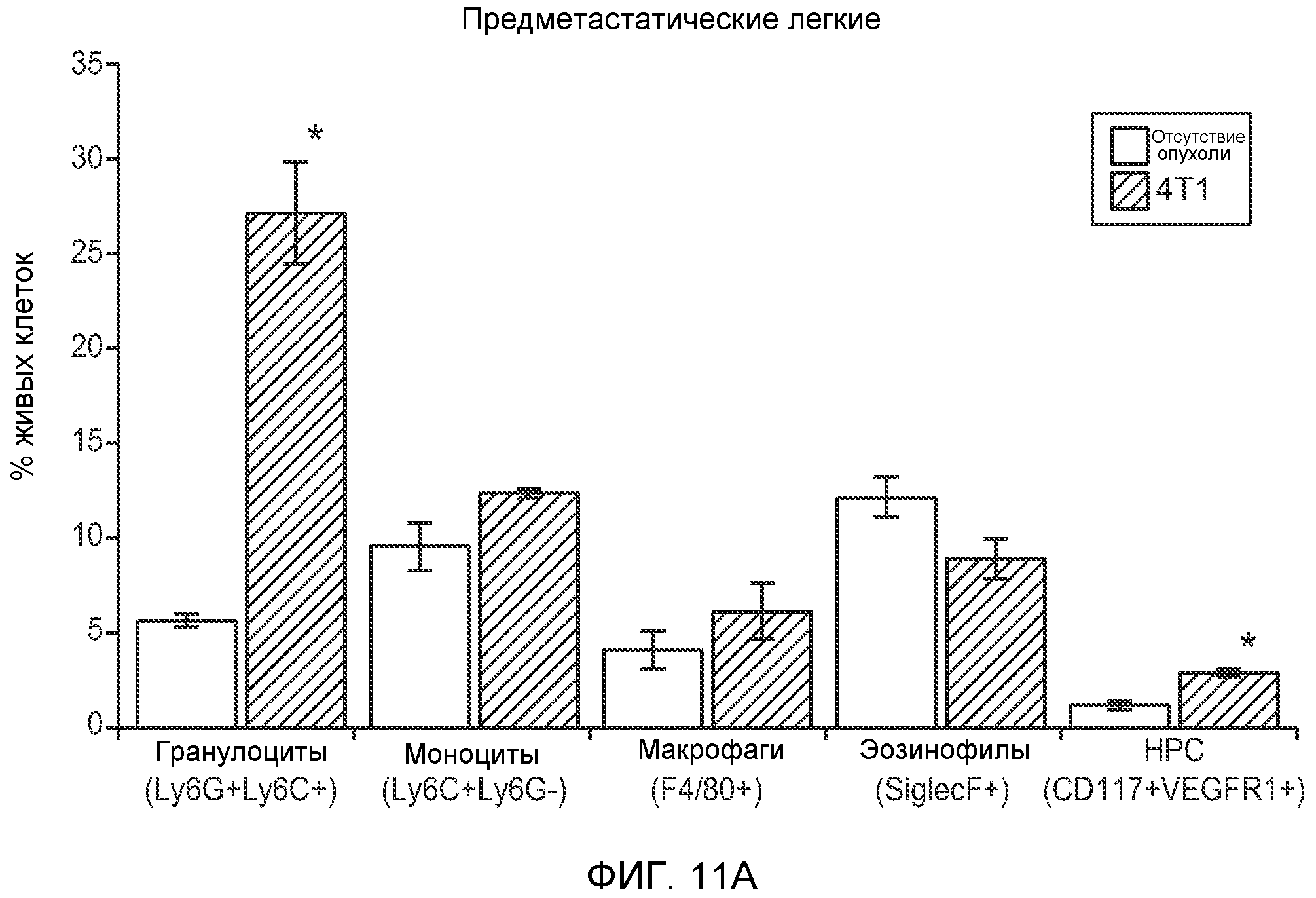
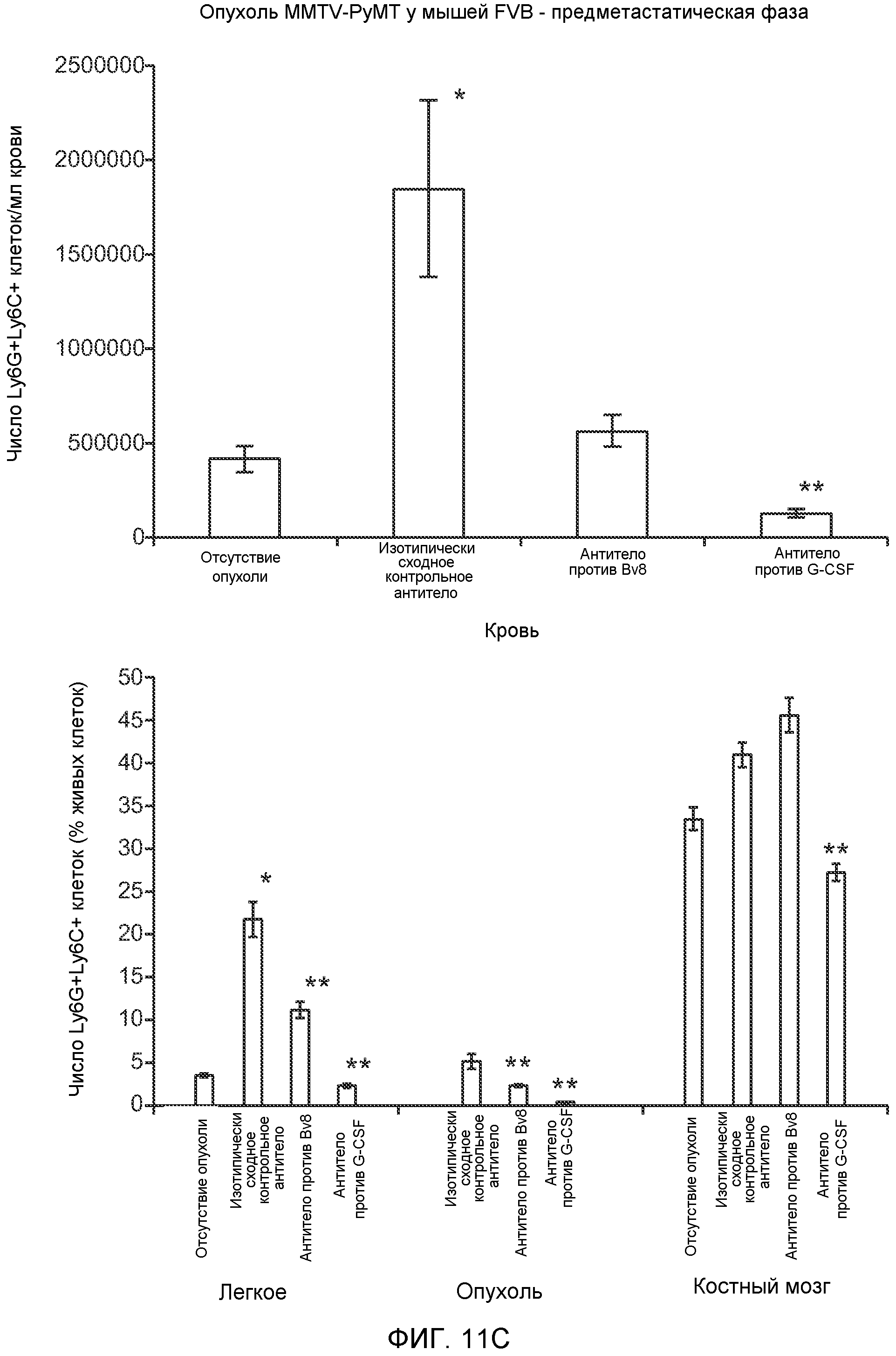
Фигура 11. Анализ методом FACS Cd11b+Grl+ клеток в предметастатических тканях. Дополнительный анализ экспрессии Bv8 и G-CSF. А. Анализ методом FACS популяций разных клеток в предметастатических легких мышей, имеющих опухоли 4Т1, через 2 недели после инокуляции опухоли. В. Концентрации G-CSF в супернатантах культур клеток после инкубации в течение 48 часов (n=3 в одной группе). Звездочкой (*) отмечено значимое отличие от групп мышей, не имеющих опухолей, и мышей, имеющих неметастазирующие опухоли. С. Число Ly6G+Ly6C+ клеток в периферической крови мышей FVB, не имеющих опухолей или имеющих опухоли РуМТ, которым вводили изотипически сходный IgG (ISO), антитело против Bv8 (2D3) или антитело против GCSF (верхний блок). Анализ методом FACS Ly6G+Ly6C+ клеток в легком, первичной опухоли и костном мозге мышей FVB, не имеющих опухолей или имеющих опухоли РуМТ (нижний блок). Звездочкой (*) отмечено значимое отличие от группы мышей, не имеющих опухолей, и двумя звездочками (**) отмечено значимое отличие от группы мышей, которым вводили контрольное антитело ISO.
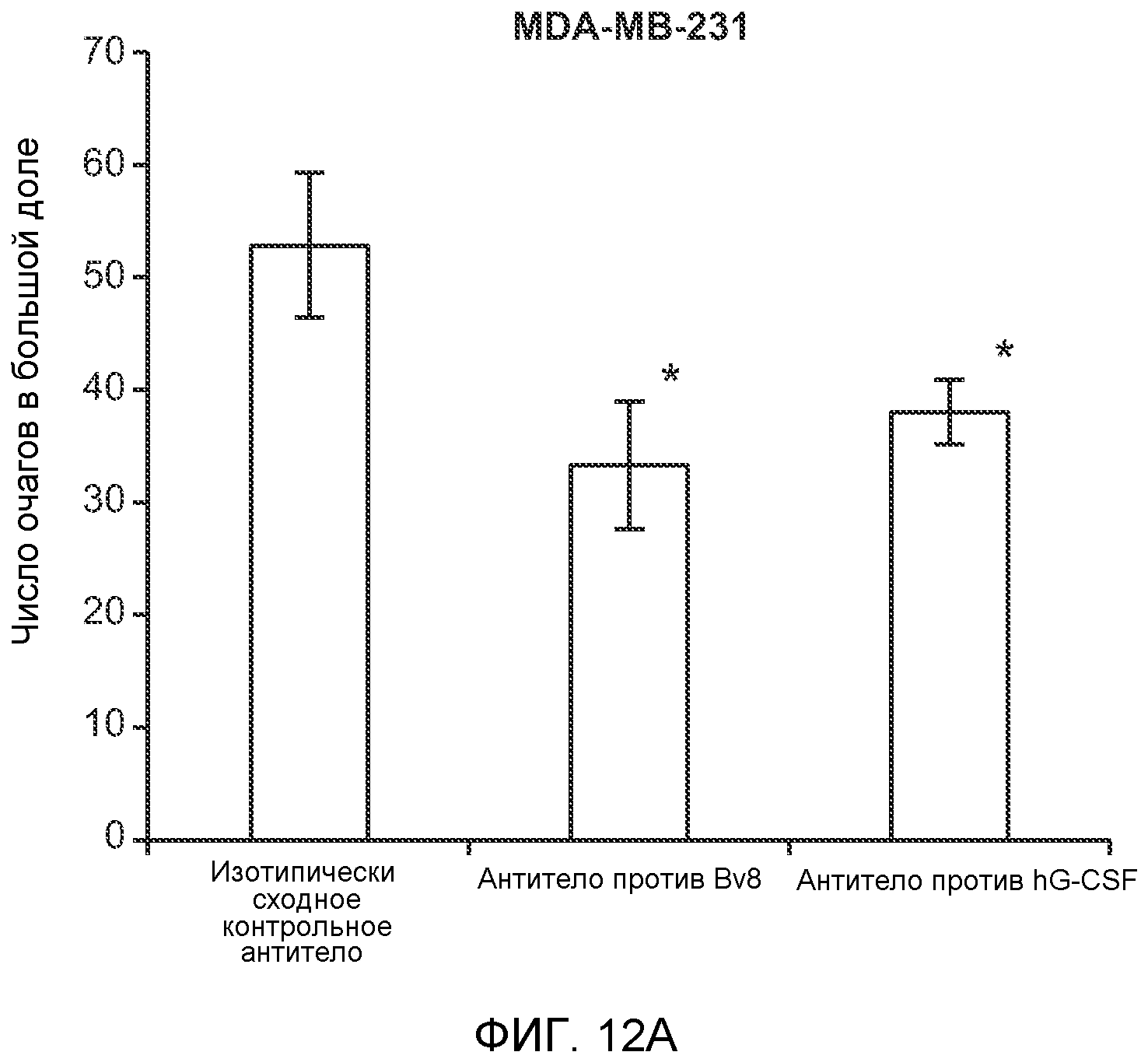
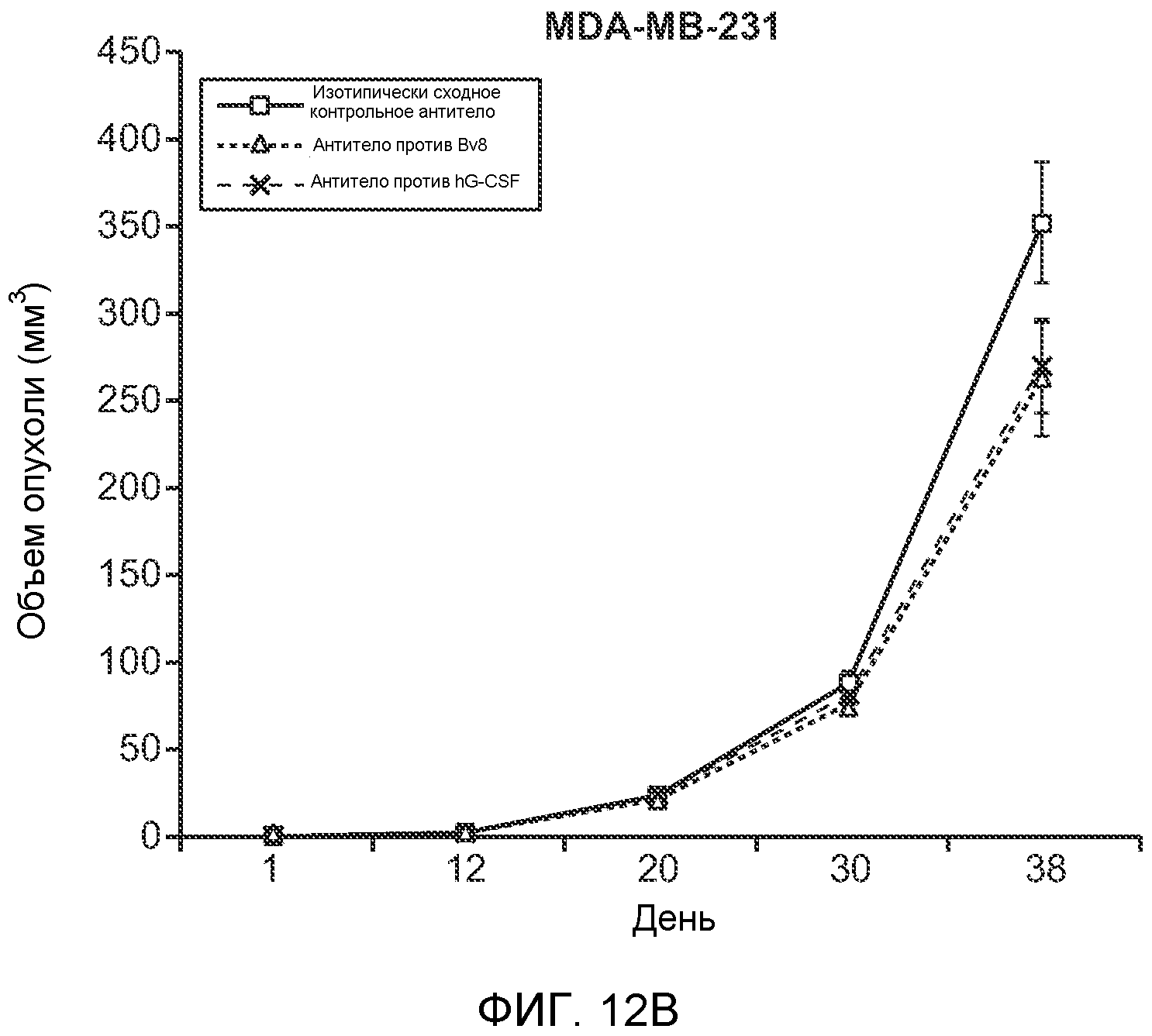
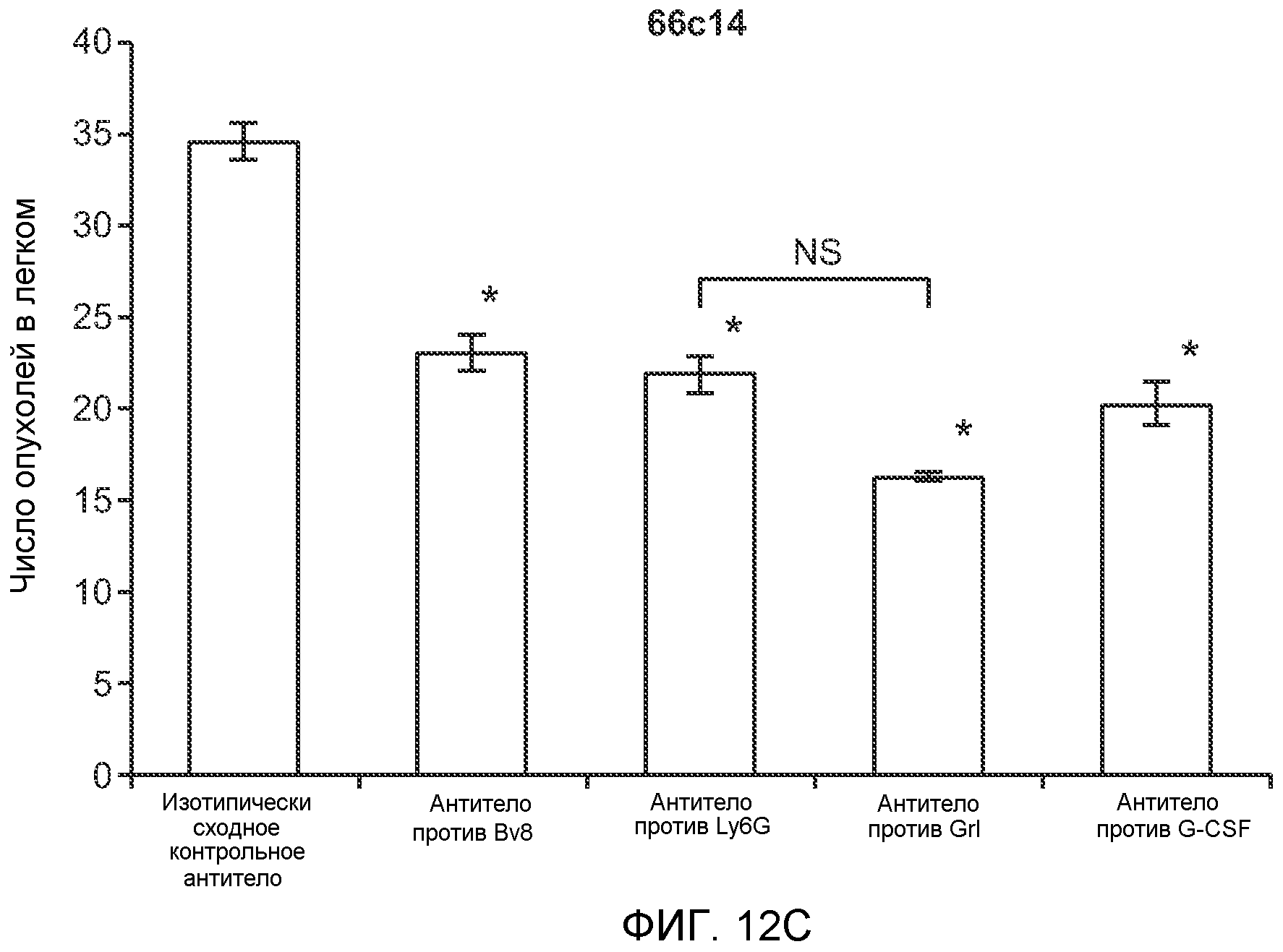
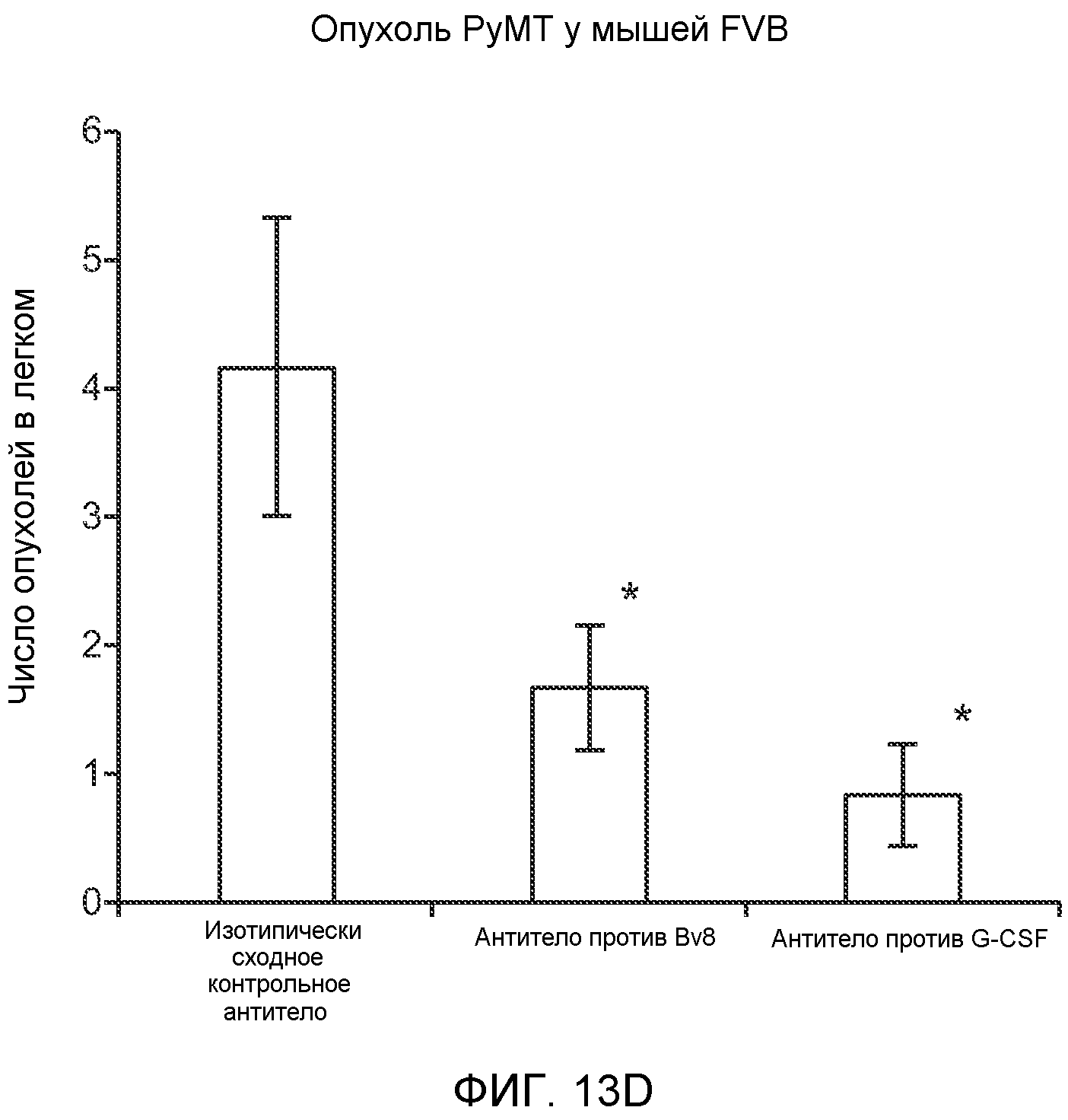
Фигура 12. Повышенные уровни G-CSF и Bv8 ассоциированы с метастазирующим фенотипом. А. Число очагов опухолей в легких мышей SCID/bg, имеющих опухоли MDA-MB-231-X1.1, которым вводили антитело против Bv8 (2D3) или антитело против G-CSF в течение 6 недель (n=10 в одной группе). Звездочкой (*) отмечено значимое отличие от группы, которой вводили контрольное антитело ISO. В. Рост первичной опухоли MDA-MB-231-X1.1 у мышей SCID/bg, которым вводили контрольное антитело (ISO), антитело против Bv8 (2D3) или антитело против G-CSF (n=10 в одной группе). С. Число опухолей в легких голых мышей Balb-c, имеющих опухоли 66с14, которым вводили указанное антитело (n=10 в одной группе). Звездочкой (*) отмечено значимое отличие от группы, которой вводили контрольное антитело ISO. Данные представлены в виде средних значений ± стандартная ошибка среднего.
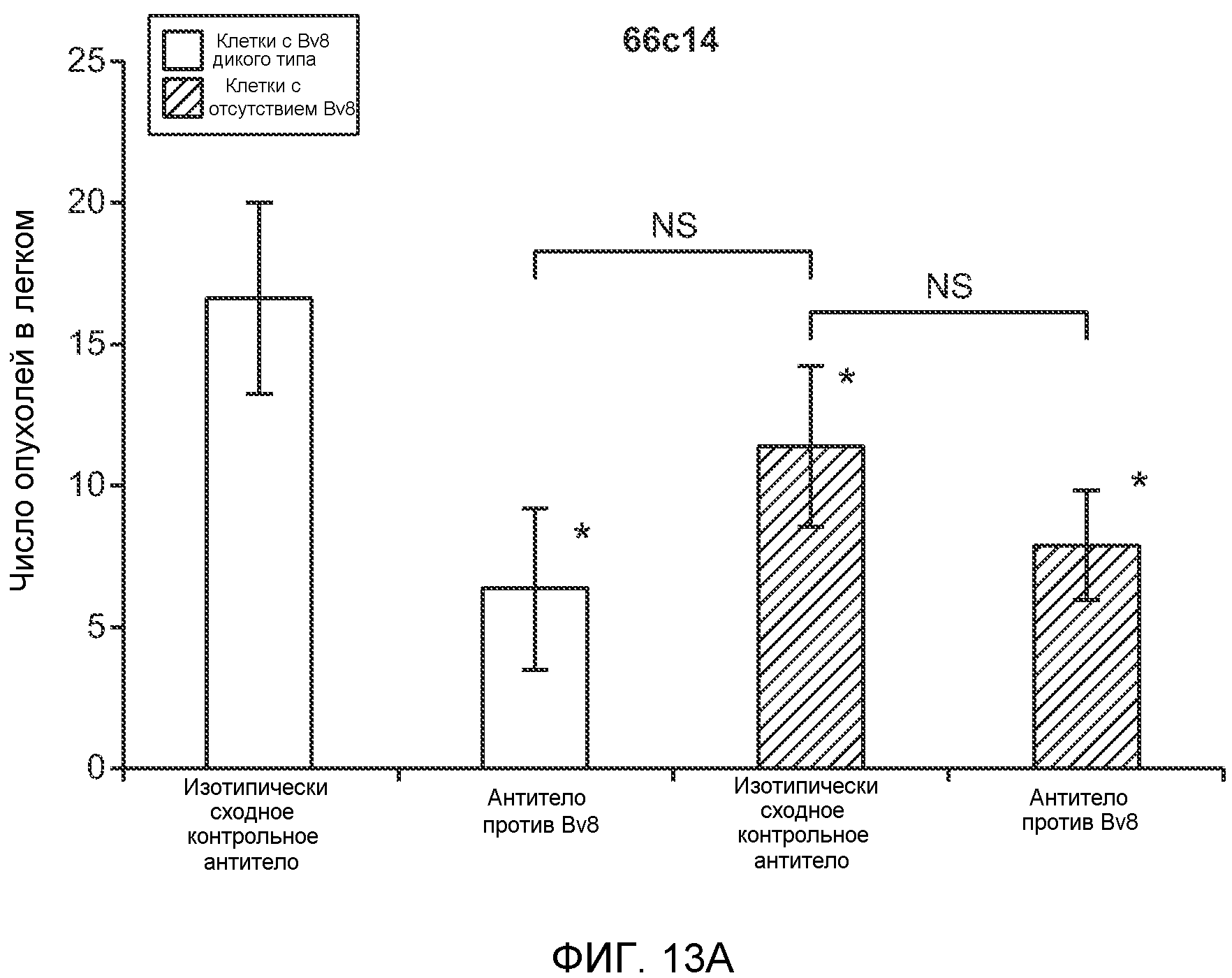
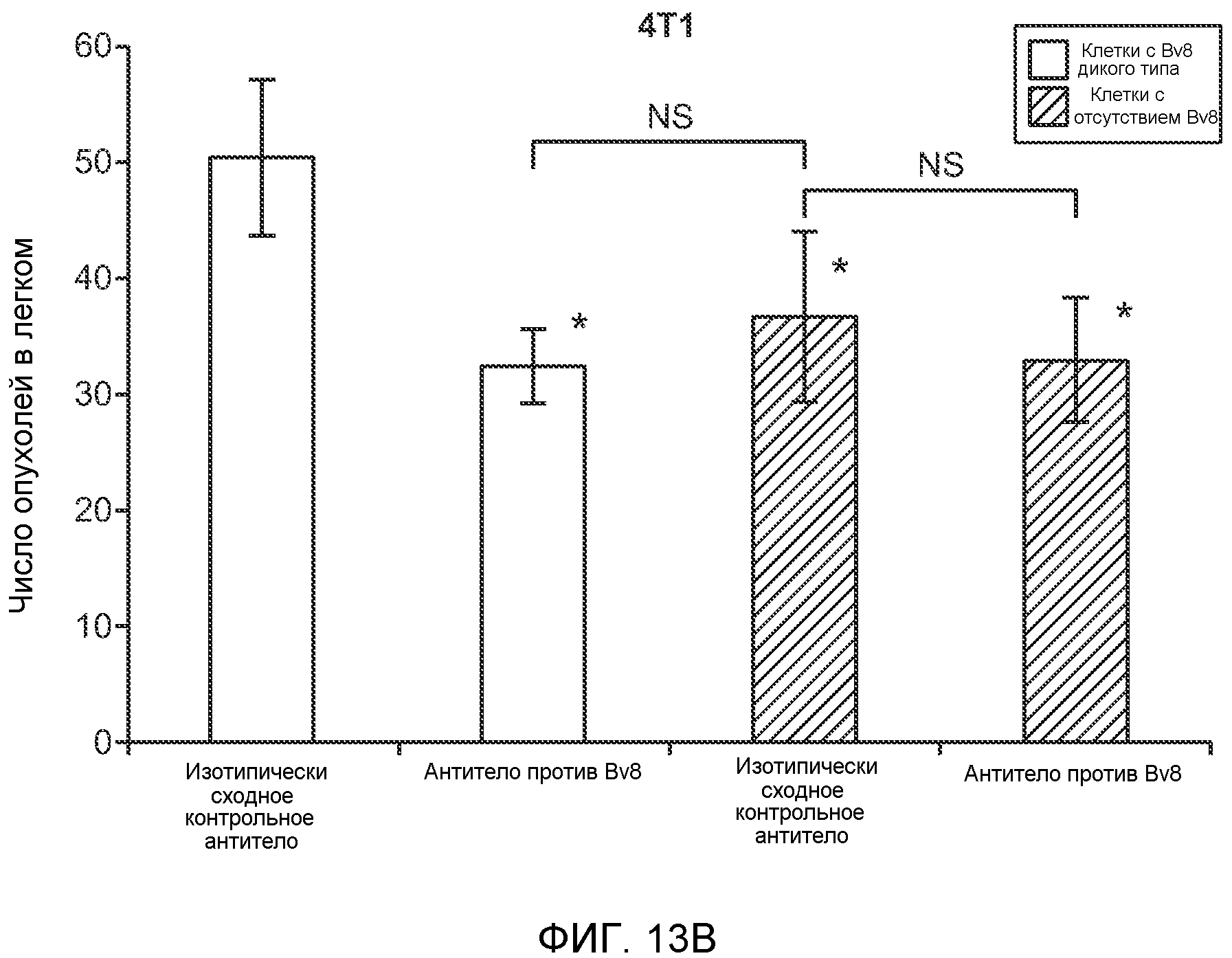
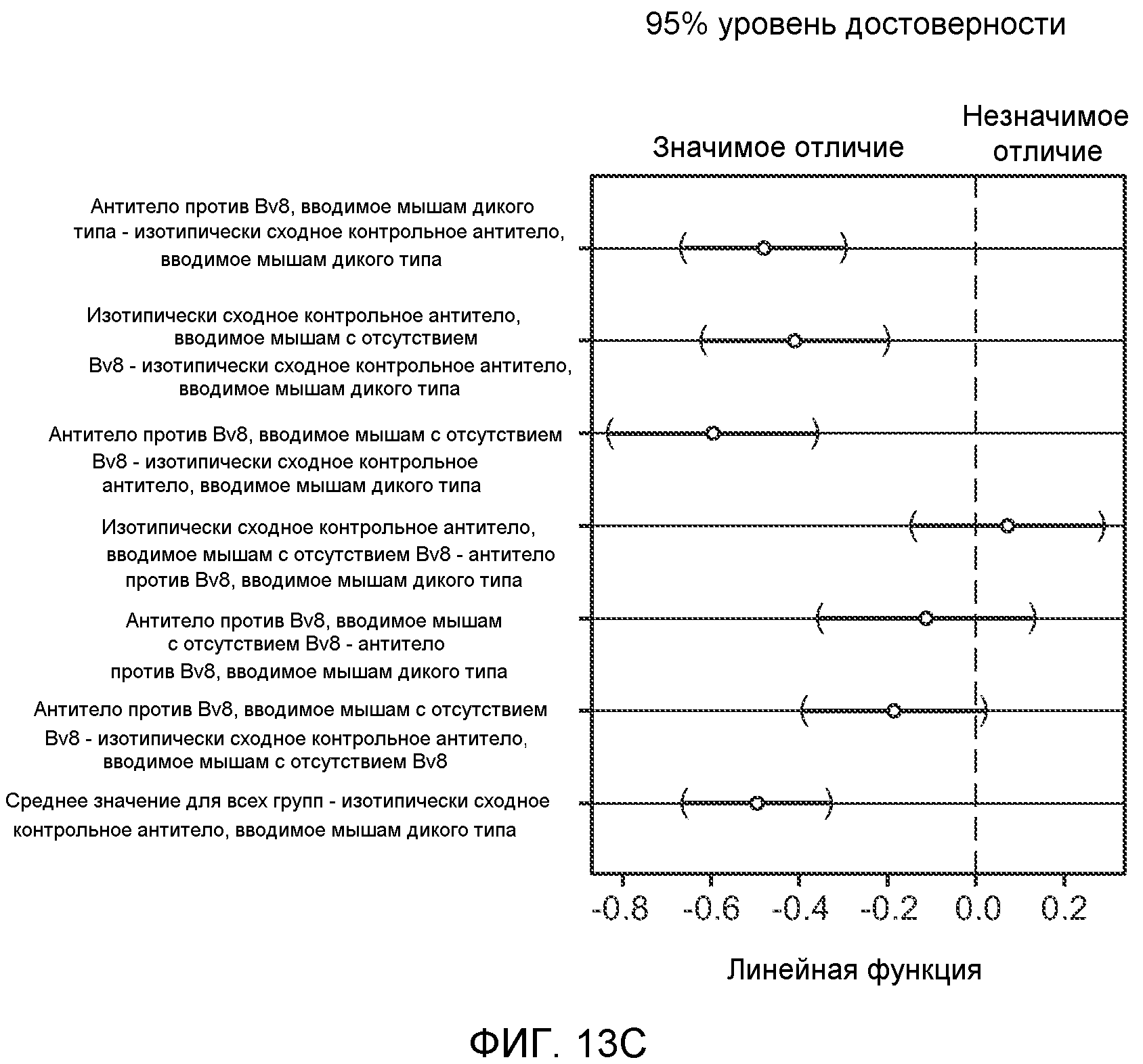
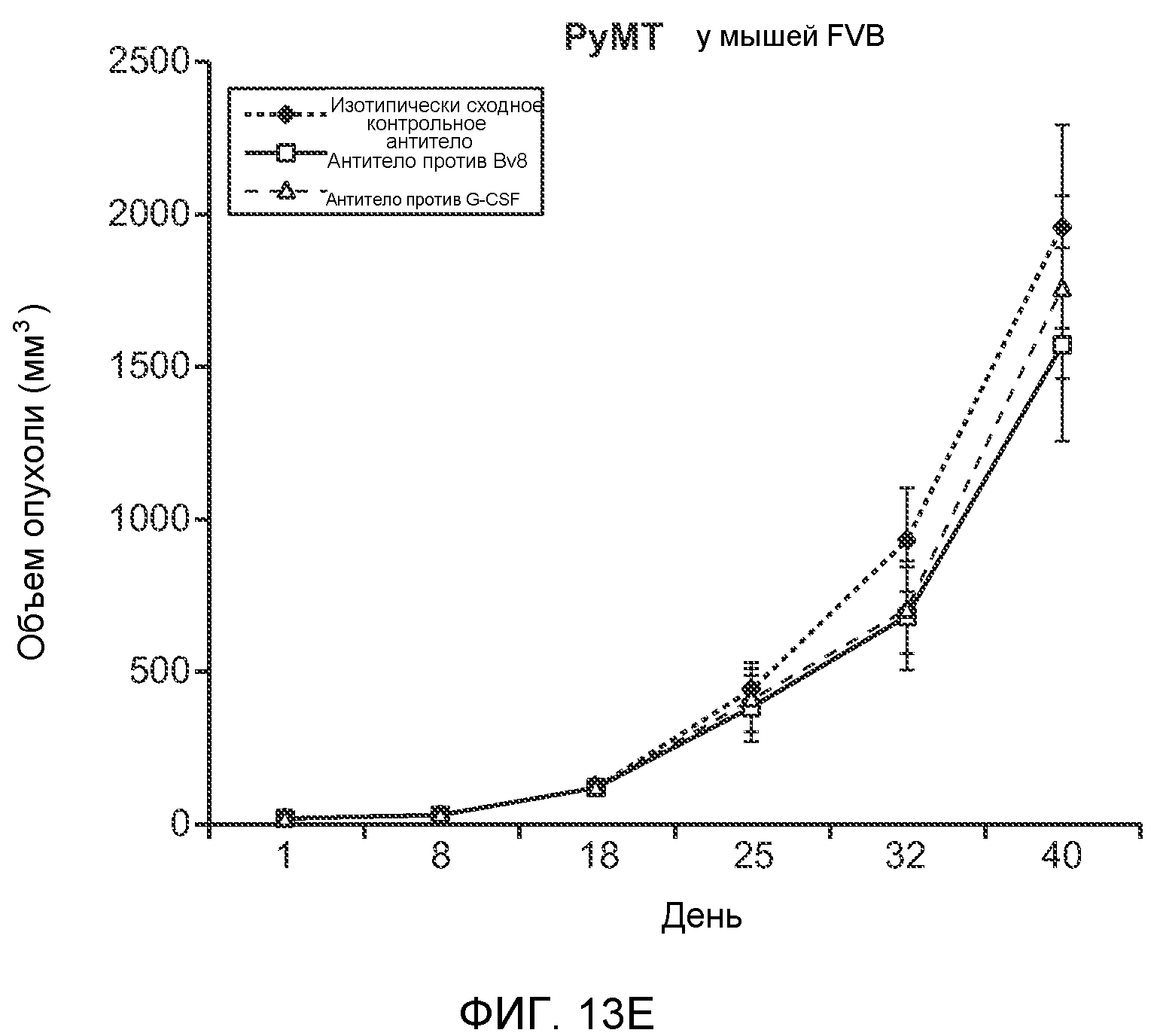
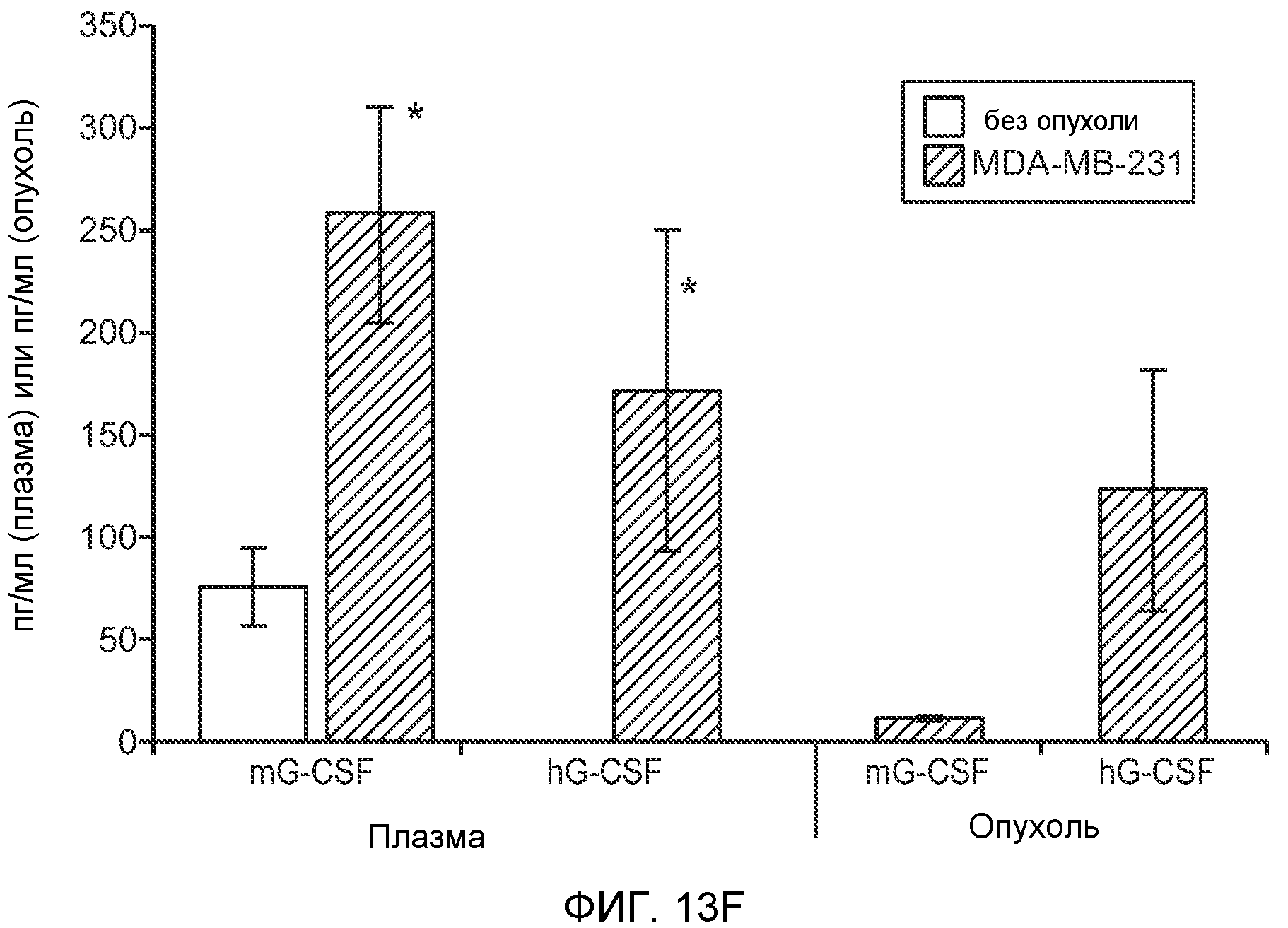
Фигура 13. Анализ опухолевой массы в легких и роста первичной опухоли у мышей, имеющих ортотопически инокулированные опухоли. А и В. Число легочных метастазов у мышей, содержащих мононуклеарные клетки костного мозга (BMMNC) с Bv8 дикого типа (WT) или с отсутствием Bv8 (KO), которые были получены в результате трансплантации эмбриональной печени. Мышам инокулировали опухоли 66с14, блок А, или 4Т1, блок В (ортотопическая модель), и вводили изотипически сходный контрольный IgG (ISO) или антитело против Bv8 (2B9+3F1). Звездочкой (*) отмечено значимое отличие от группы мышей дикого типа, которым вводили изотипически сходное контрольное антитело. С. Краткий обзор данных статистического анализа при выполнении экспериментов с использованием Bv8 дикого типа и при отсутствии Bv8, показанных в блоках А и В. Следует отметить, что сравнение является значимым только в том случае, если значения линейной функции меньше 0. Статистическая значимость была достигнута только для следующих сравнений: антитело против Bv8, вводимое мышам дикого типа, в сравнении с изотипически сходным контрольным антителом, вводимым мышам дикого типа; изотипически сходное контрольное антитело, вводимое мышам с отсутствием Bv8, в сравнении с изотипически сходным контрольным антителом, вводимым мышам дикого типа; антитело против Bv8, вводимое мышам с отсутствием Bv8, в сравнении с изотипически сходным контрольным антителом, вводимым мышам дикого типа; и изотипически сходное контрольное антитело в сравнении со всеми другими группами. D. Число метастазов в легком у мышей FVB, имеющих опухоли MMTV-PyMT, через 7 недель после инокуляции опухоли. Опухоли имплантировали и проводили соответствующее лечение (n=6 в одной группе). Звездочкой (*) отмечено значимое отличие от группы, которой вводили изотипически сходное контрольное антитело (ISO). Е. Рост первичной опухоли MMTV-PyMT у мышей FVB, которым вводили контрольное антитело (ISO), антитело против Bv8 (2D3) или антитело против G-CSF (n=10 в одной группе). F. Уровень экспрессии G-CSF мыши и человека (mG-CSF и hG-CSF) в плазме и первичной опухоли у мышей, имеющих опухоли MDA-MB-231-X1.1. Звездочкой (*) отмечено значимое отличие от группы мышей, не имеющих опухолей. Данные представлены в виде средних значений ± стандартная ошибка среднего.
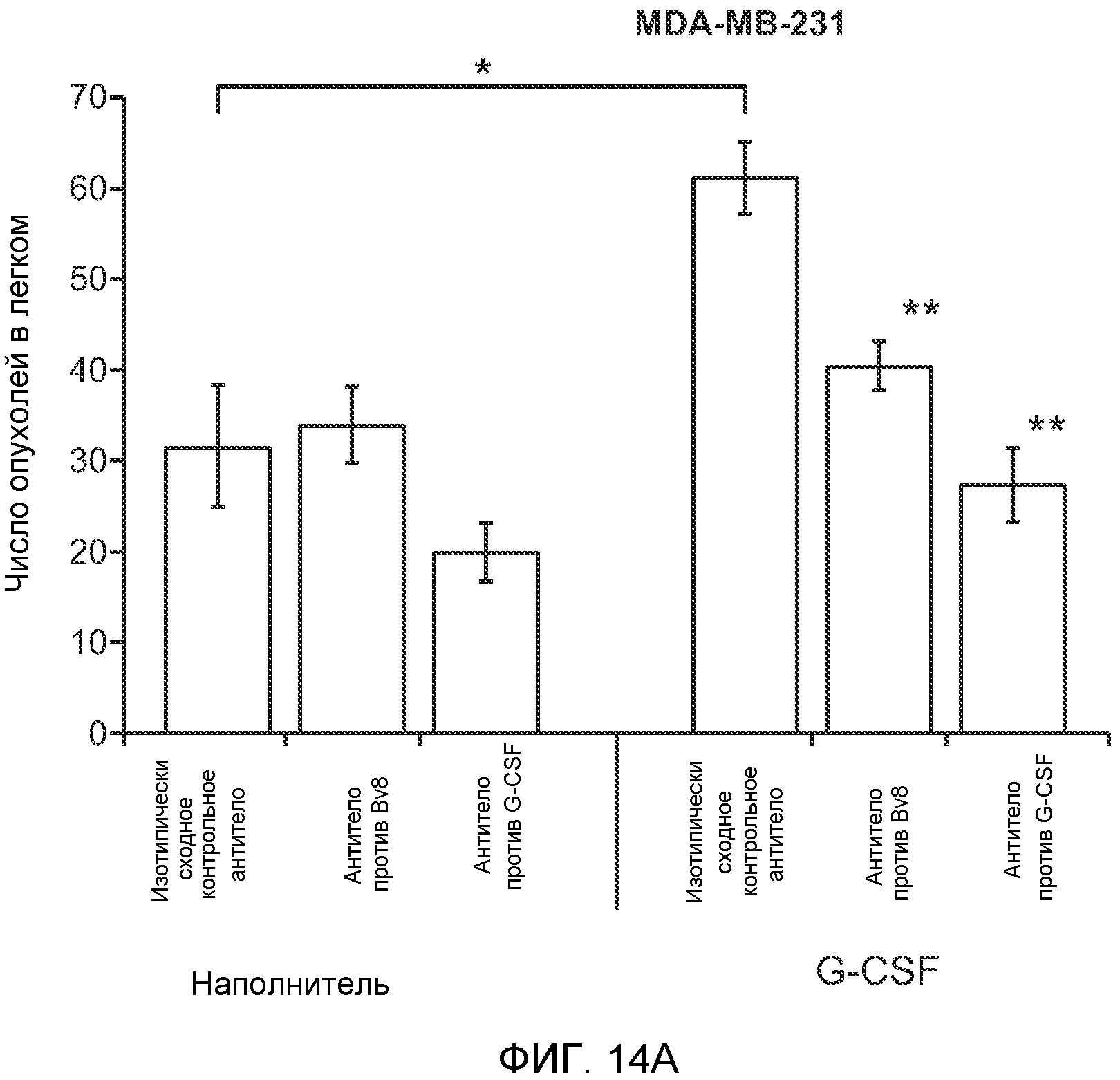
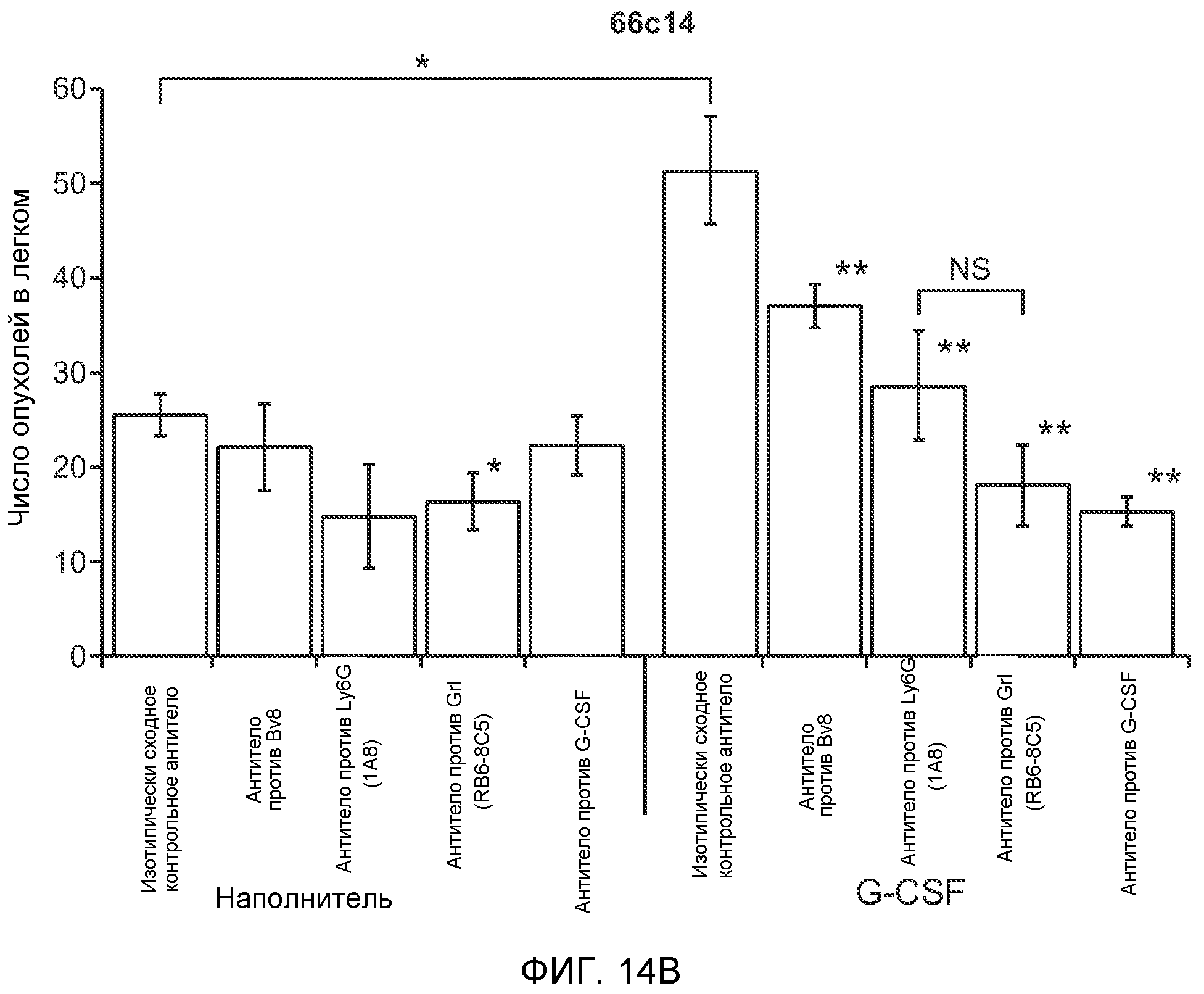
Фигура 14. G-CSF инициирует образование предметастатической “ниши” и усиливает метастатический потенциал нескольких опухолей. А. Число опухолей в легких мышей, которым ежедневно вводили наполнитель или rG-CSF мыши (2,5 мкг/мышь), затем вводили контрольное антитело (ISO), антитело против Bv8 (2D3) или антитело против G-CSF и внутривенно инъецировали клетки MDA-MB-231-L1.1 (n=5 в одной группе). В. Число опухолей в легких мышей, которым ежедневно вводили наполнитель или rG-CSF (2,5 мкг/мышь), затем вводили контрольное антитело (ISO), антитело против Bv8 (2D3), антитело против Ly6G, антитело против Grl или антитело против G-CSF и внутривенно инъецировали клетки 66с14. Легкие исследовали на наличие опухолей через 3 недели после инокуляции клеток (n=10 в одной группе). В блоках А и В звездочкой (*) отмечено значимое отличие от группы, которой вводили наполнитель и контрольное антитело ISO, и двумя звездочками (**) отмечено значимое отличие от группы, которой вводили G-CSF и контрольное антитело ISO. Данные представлены в виде средних значений ± стандартная ошибка среднего.
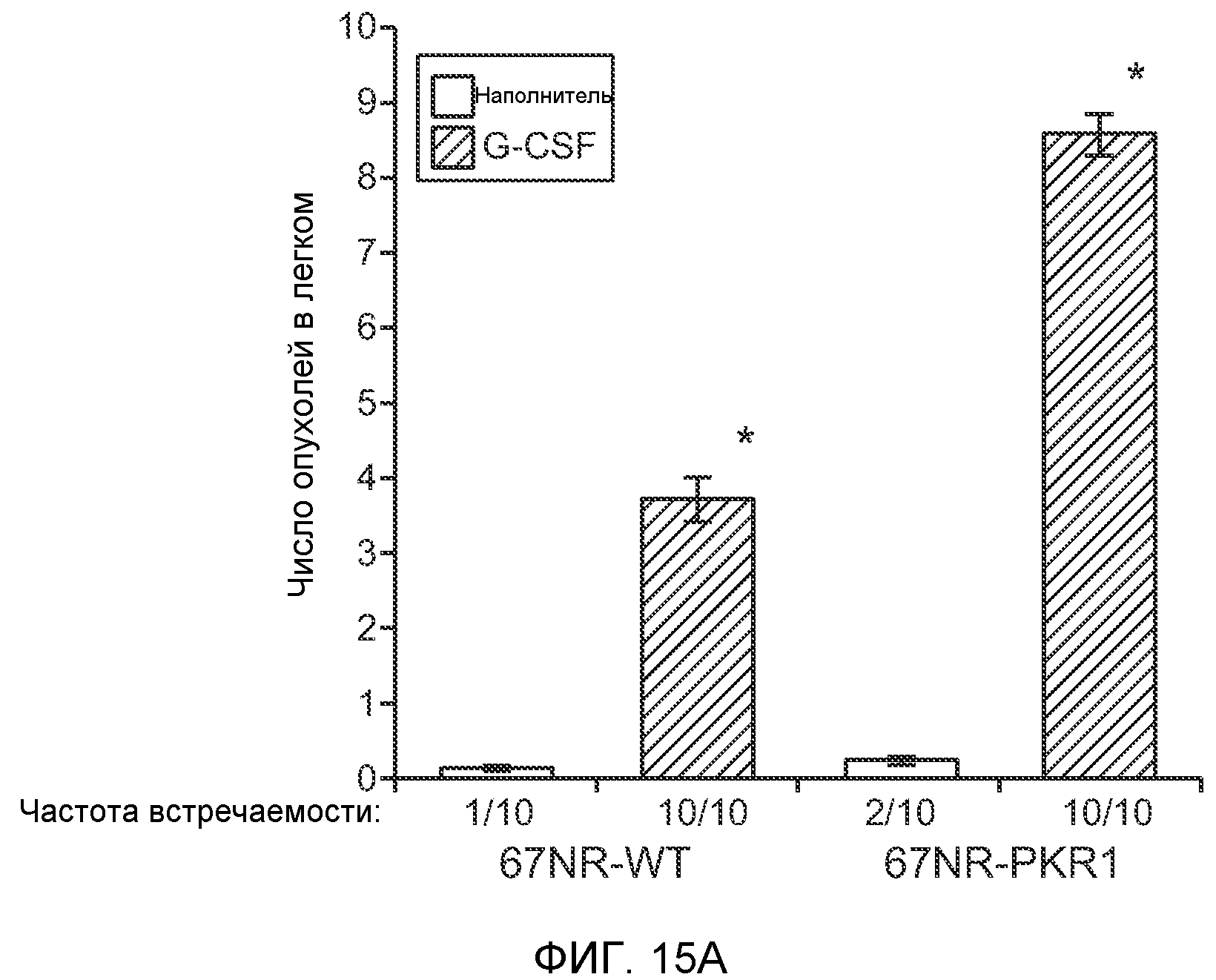
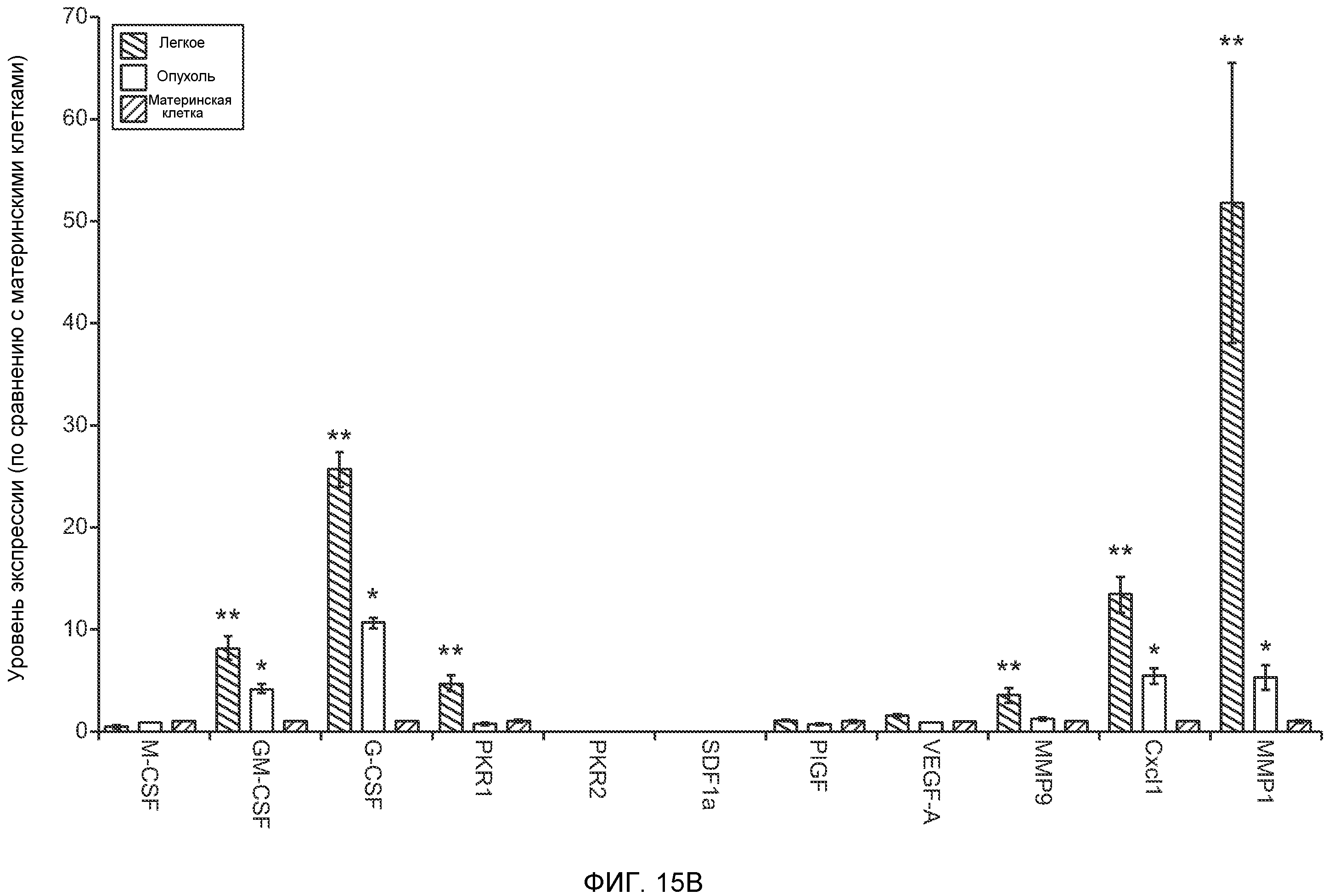
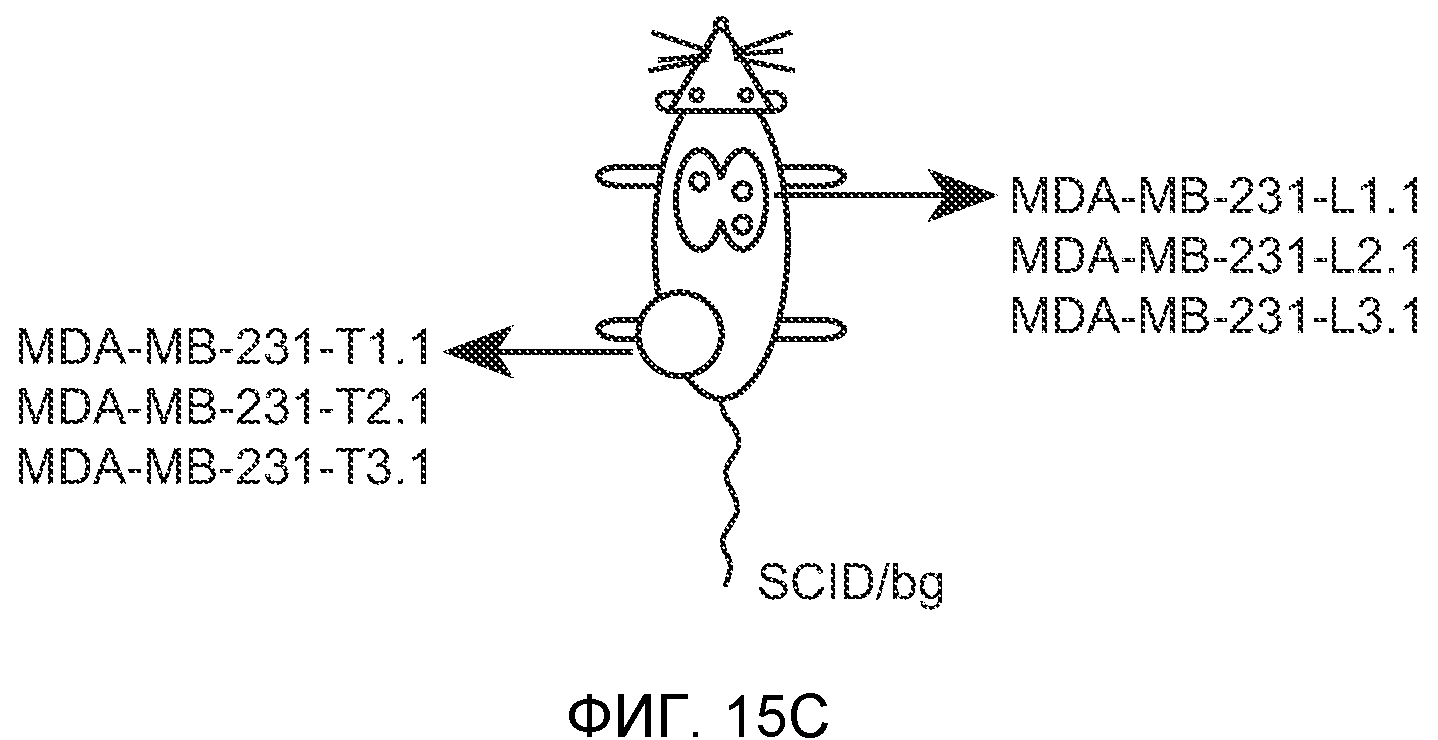
Фигура 15. Bv8 опосредует G-CSF-индуцированное метастазирование опухоли путем усиления миграции раковых клеток. А. Число опухолей в легких мышей Balb/c, которым внутривенно инъецировали клетки 67NR или 67NR-PKR1. Мышам предварительно вводили наполнитель или rG-CSF человека. Мышей исследовали на наличии видимых опухолей в легких через 3 недели после инокуляции клеток. Звездочкой (*) отмечено значимое различие между мышами, которым вводили наполнитель и G-CSF. Частота встречаемости использована для определения числа мышей с обнаруживаемыми опухолями в легких (n=10 в одной группе). В. Анализ экспрессии генов в клетках MDA-MB-231, которые были выделены из легочных метастазов (легкое) или из первичных опухолей (опухоль). В каждой группе исследовали три независимые линии клеток (для легкого: линии клеток L1.1, L2.1 и L3.1; для опухоли: линии клеток Т1.1, Т2.1 и Т3.1). Экспрессию сравнивали с линией материнских клеток MDA-MB-231-D3H1. Звездочкой (*)отмечено значимое отличие от линии материнских клеток, и двумя звездочками (**) отмечено значимое отличие от линий опухолевых или материнских клеток. Данные представлены в виде средних значений ± стандартная ошибка среднего. С. Схематическое изображение клонов MDA-MB-231, использованных для анализа экспрессии генов на фиг.15В. Клетки MDA-MB-231-D3H1 инъецировали в жировое тело 4-й молочной железы или в хвостовую вену мышей SCID/bg. Раковые клетки из образовавшихся опухолей (в молочной железе или легком) выделяли и размножали in vitro. Для каждой ткани были получены три независимые линии клеток (L1.1, L2.1 и L3.1 из трех отдельных легких и Т1.1, Т2.1 и Т3.1 из трех независимых первичных опухолей).
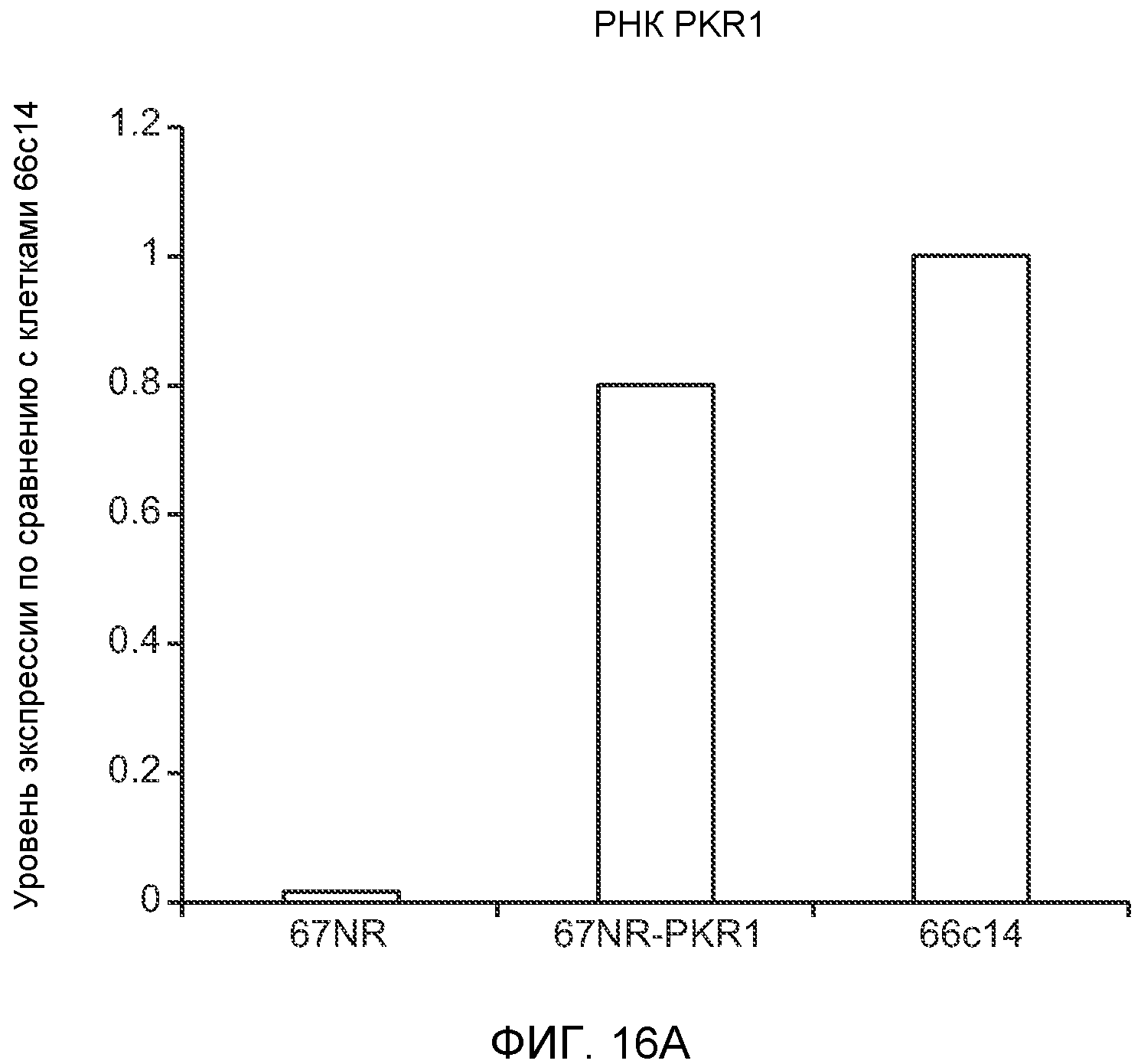
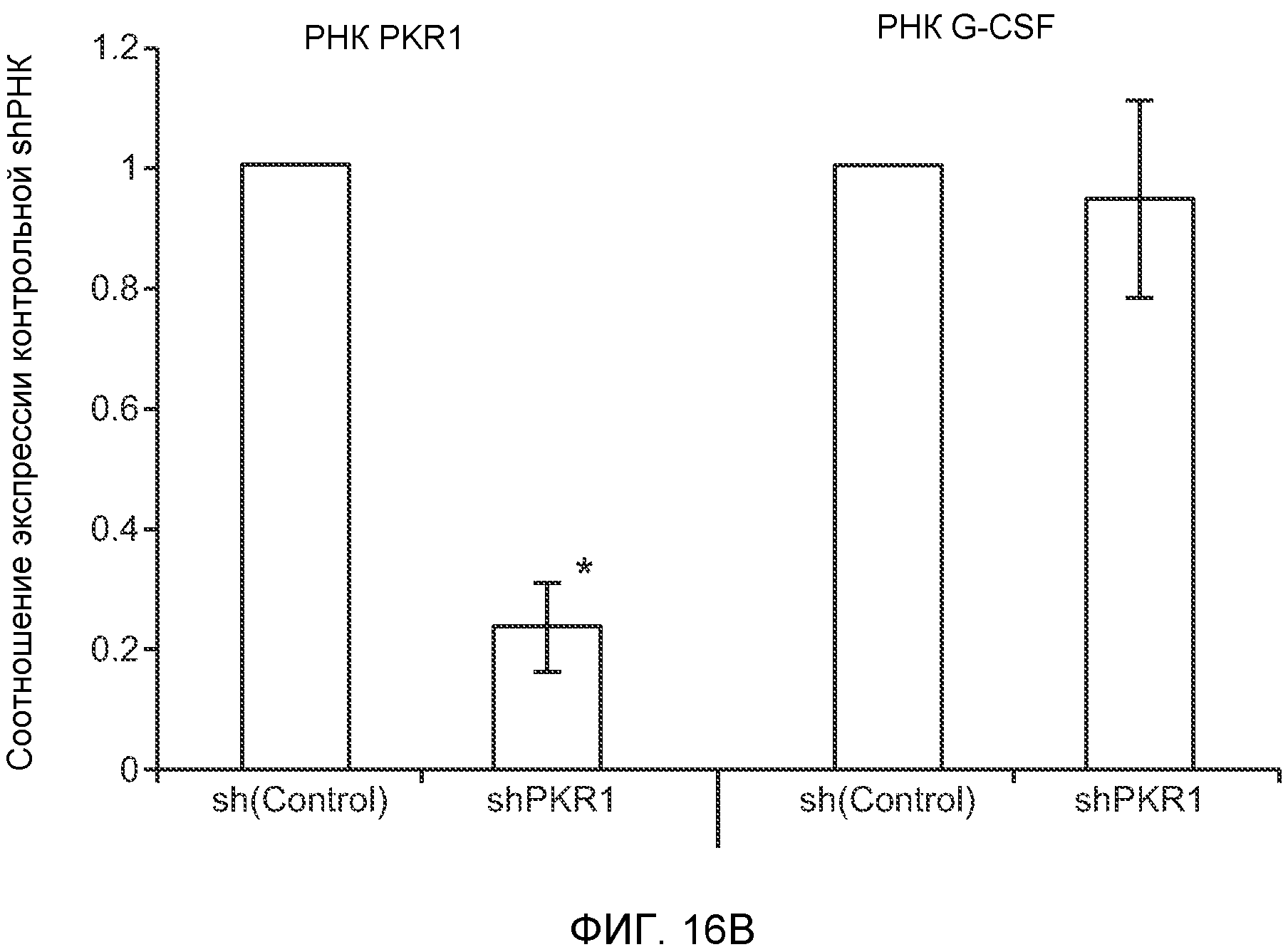
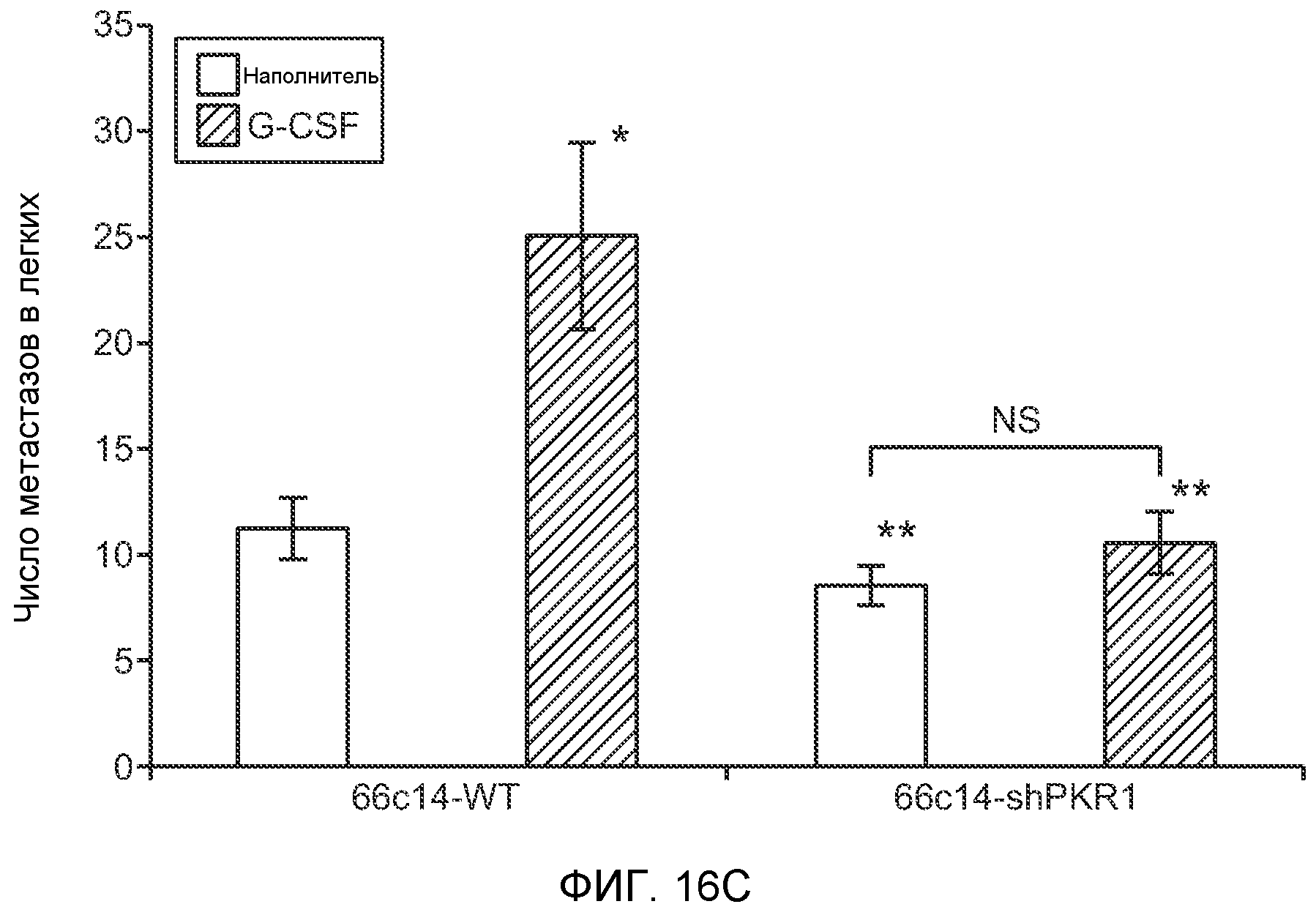
Фигура 16. Механизмы, определяющие образование G-CSF-инициированной предметастатической микросреды. А. Анализ методом qRT-PCR экспрессии PKR1 в клетках 67NR, сверхэкспрессирующих PKR1. Следует отметить, что данный уровень экспрессии сравним в клетками 66с14. В. Анализ методом qRT-PCR экспрессии PKR1 и G-CSF в клетках 66с14, экспрессирующих shРНК, направленно воздействующую на PKR1 (shPKR1). Следует отметить, что shPKR1 не воздействует на G-CSF. Термин sh(Control) означает выровненную shРНК, использованную в качестве контрольной РНК. Звездочкой (*) отмечено значимое отличие от группы, содержащей контрольную shРНК. С. Число опухолей в легких мышей, которым предварительно вводили наполнитель или G-CSF и инъецировали клетки 66с14 или 66с14-shPKR1. Анализ выполняли через 3 недели после инокуляции клеток. Звездочкой (*) отмечено значимое отличие от группы, которой вводили клетки 66с14 и контрольное антитело ISO дикого типа, и двумя звездочками (**) отмечено значимое отличие от группы, которой вводили клетки 66с14 и G-CSF дикого типа (n=10 в одной группе). Данные представлены в виде средних значений ± стандартная ошибка среднего.
Подробное описание изобретения
Прежде чем перейти к подробному описанию настоящего изобретения следует отметить, что данное изобретение не ограничено конкретными композициями или биологическими системами, которые, несомненно, могут изменяться. Также следует отметить, что терминология, использованная в настоящем описании изобретения, предназначена только для описания конкретных вариантов осуществления изобретения и не ограничивает объем изобретения.
За исключением особо оговоренных случаев технические и научные термины, использованные в настоящем описании изобретения, имеют значения, обычно используемые специалистами в данной области, к которой относится настоящее изобретение. В публикациях Singleton et al., Dictionary of Microbiology and Molecular Biology, 2nd ed., J. Wiley & Sons (New York, N.Y., 1994) и March, Advanced Organic Chemistry Reactions, Mechanisms and Structure, 4th ed., John Wiley & Sons (New York, N.Y., 1992) приведены общепринятые значения многих терминов, использованных в настоящей заявке. Все материалы, приведенные в настоящей заявке, в том числе заявки на патент и публикации, полностью включены в настоящее описание изобретения в качестве ссылки.
А. Определения терминов
В настоящем описании изобретения использованы приведенные ниже термины, и тогда, когда это возможно, термины, использованные в единственном числе, также включают формы множественного числа и наоборот. В тех случаях, когда какое-либо определение термина, приведенное ниже, противоречит любому документу, включенному в настоящее описание изобретения в качестве ссылки, нижеследующее определение термина является приоритетным.
Термины “колониестимулирующий фактор гранулоцитов”, “G-CSF”, “колониестимулирующий фактор 3” и “CSF3” имеют взаимозаменяемые значения и означают полноразмерный полипептид и/или активные фрагменты полноразмерного полипептида.
Термин “G-CSF с нативной последовательностью” означает полипептид, имеющий такую же аминокислотную последовательность, что и природный G-CSF, независимо от способа получения. Таким образом, G-CSF с нативной последовательностью может иметь аминокислотную последовательность природного G-CSF человека, G-CSF мыши или G-CSF любого другого вида млекопитающих. Примеры аминокислотных последовательностей G-CSF человека с нативной последовательностью показаны в SEQ ID NO:8, 10, 12 и 14. Последовательности G-CSF человека и мыши описаны также, например, в публикациях Nagata et al., Nature 319, 415-418 (1986); Nagata et al., EMBO J. 5, 575-581 (1986) и Tsuchiya et al., Proc. Natl. Acad.Sci. 83(20), 7633-7637 (1986). Такой G-CSF с нативной последовательностью может быть получен в природе или продуцирован рекомбинантными и/или синтетическими методами. В определение термина “G-CSF с нативной последовательностью” входят природные препро, про, зрелые и усеченные формы G-CSF, природные вариантные формы и природные аллельные варианты.
“Варианты G-CSF” представляют собой биологически активные полипептиды G-CSF, которые имеют аминокислотную последовательность, отличающуюся от последовательности полипептида G-CSF с нативной последовательностью человека и мыши вследствие инсерции, делеции, модификации и/или замены одного или нескольких аминокислотных остатков в нативной последовательности. Варианты G-CSF обычно менее чем на 100% идентичны G-CSF с нативной последовательностью, как, например, последовательности G-CSF человека, показанные в SEQ ID NO:8, 10, 12 и 14. Однако биологически активный вариант G-CSF обычно имеет аминокислотную последовательность, которая по меньшей мере примерно на 70% идентична аминокислотной последовательности природного G-CSF. В определенных вариантах осуществления изобретения биологически активный вариант G-CSF имеет аминокислотную последовательность, которая по меньшей мере примерно на 75%, примерно на 80%, примерно на 85%, примерно на 90%, примерно на 95% или по меньшей мере примерно на 99%, с приращениями, равными 1%, идентична аминокислотной последовательности природного G-CSF. В определенных вариантах осуществления изобретения варианты G-CSF включают фрагменты пептидов, включающие по меньшей мере 5 аминокислот, которые сохраняют биологическую активность соответствующего полипептида G-CSF с нативной последовательностью. Варианты G-CSF также включают полипептиды G-CSF, в которых один или несколько аминокислотных остатков добавлены к N- или С-концу или внутри нативной последовательности G-CSF. Варианты G-CSF также включают полипептиды G-CSF, в которых несколько аминокислотных остатков удалены и необязательно заменены одним или несколькими аминокислотными остатками. Варианты G-CSF могут быть также ковалентно модифицированы, например, путем замены аминокислотного остатка частью, не являющейся природной аминокислотой, или путем модификации аминокислотного остатка с получением аминокислоты, отличной от природной аминокислоты.
Термин “антагонист G-CSF” в использованном здесь значении означает молекулу, которая связывается с G-CSF и ингибирует или существенно снижает биологическую активность G-CSF. Неограничивающие примеры антагонистов G-CSF включают антитела или их антигенсвязывающие фрагменты, белки, пептиды, гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, биоорганические молекулы, миметики пептидов, фармакологические средства и их метаболиты, последовательности, регулирующие транскрипцию и трансляцию, и тому подобные. Антагонисты также включают низкомолекулярные ингибиторы G-CSF, антисмысловые молекулы к G-CSF, аптамеры РНК и рибозимы против G-CSF. В одном варианте осуществления изобретения антагонист G-CSF является антителом, в частности, антителом против G-CSF или его фрагментом, связывающимся с G-CSF человека.
Термин “антитело-антагонист G-CSF” означает антитело, которое является антагонистом G-CSF в соответствии с приведенным выше определением и, таким образом, частично или полностью блокирует, ингибирует или нейтрализует способность модулировать активацию Cd11b+Grl+ клеток или функционального человеческого аналога CD11b+Grl+ клеток, модулировать экспрессию Bv8, стимулировать развитие кровеносных сосудов опухоли и/или метастазирование опухоли. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются незрелыми миелоидными клетками человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются супрессорными клетками, выделенными из миелоидных клеток человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются предшественниками нейтрофилов, моноцитов или макрофагов человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются нейтрофилами, моноцитами или макрофагами.
Термины “Bv8”, “гомолог Bv8”, “прокинетицин-2” (известный также как “РК2”, “KAL4” и “MIT1”) имеют взаимозаменяемые значения и означают полноразмерный полипептид и/или активные фрагменты полноразмерного полипептида.
Термин “Bv8 с нативной последовательностью” означает полипептид, имеющий такую же аминокислотную последовательность, что и природный Bv8, независимо от способа получения. Таким образом, Bv8 с нативной последовательностью может иметь аминокислотную последовательность природного Bv8 человека, Bv8 мыши или Bv8 любого другого вида млекопитающих. Например, аминокислотная последовательность Bv8 человека с полноразмерной нативной последовательностью показана в SEQ ID NO:2. Вторая аминокислотная последовательность Bv8 человека с полноразмерной нативной последовательностью показана в SEQ ID NO:4. Две указанные последовательности являются результатом альтернативного сплайсинга экзона, кодирующего канонический гепаринсвязывающий домен. Таким образом, Bv8 человека с нативной последовательностью, аминокислотная последовательность которого показана в SEQ ID NO:2, включает гепаринсвязывающий домен, в то время как Bv8 с нативной последовательностью, показанный в SEQ ID NO:4, не имеет такого домена. Аминокислотная последовательность Bv8 мыши с нативной последовательностью показана в SEQ ID NO:6. Последовательности Bv8 человека и мыши также описаны, например, в публикациях Wechselberger et al. (FEBS Lett. 462:177-181 (1999)) и Li et al. (Mol. Pharm. 59:692-698 (2001)). Такой Bv8 с нативной последовательностью может быть получен в природе или продуцирован рекомбинантными и/или синтетическими методами. В определение термина “Bv8 с нативной последовательностью” входят природные препро, про, зрелые и усеченные формы Bv8, природные вариантные формы (например, альтернативно сплайсированные формы, показанные в SEQ ID NO:4), и природные аллельные варианты. В определенных вариантах осуществления изобретения Bv8 с нативной последовательностью является Bv8 человека с полноразмерной нативной последовательностью, показанной в SEQ ID NO:2. В определенных вариантах осуществления изобретения Bv8 с нативной последовательностью является Bv8 человека с полноразмерной нативной последовательностью, показанной в SEQ ID NO:4.
“Варианты Bv8” представляют собой биологически активные полипептиды Bv8, которые имеют аминокислотную последовательность, отличающуюся от последовательности полипептида Bv8 с нативной последовательностью, показанной в SEQ ID NO:2, 4 и 6 для Bv8 человека и мыши, вследствие инсерции, делеции, модификации и/или замены одного или нескольких аминокислотных остатков в нативной последовательности. Варианты Bv8 обычно менее чем на 100% идентичны Bv8 с нативной последовательностью, например, Bv8 человека, показанному в SEQ ID NO:2 или SEQ ID NO:4. Однако биологически активный вариант Bv8 обычно имеет аминокислотную последовательность, которая по меньшей мере примерно на 70% идентична аминокислотной последовательности природного Bv8. В определенных вариантах осуществления изобретения биологически активный вариант Bv8 имеет аминокислотную последовательность, которая по меньшей мере примерно на 75%, примерно на 80%, примерно на 85%, примерно на 90%, примерно на 95% и по меньшей мере примерно на 99%, с приращениями, равными 1%, идентична аминокислотной последовательности природного Bv8. Варианты Bv8 включают фрагменты пептидов, содержащие по меньшей мере 5 аминокислот, которые сохраняют биологическую активность соответствующего полипептида Bv8 с нативной последовательностью. Варианты Bv8 также включают полипептиды Bv8, в которых один или несколько аминокислотных остатков добавлены к N- или С-концу или внутри нативной последовательности Bv8. Варианты Bv8 также включают полипептиды Bv8, в которых несколько аминокислотных остатков удалены и необязательно заменены одним или несколькими аминокислотными остатками. Варианты Bv8 также могут быть ковалентно модифицированы, например, путем замены аминокислотного остатка частью, не являющейся природной аминокислотой, или путем модификации аминокислотного остатка с получением аминокислоты, отличной от природной аминокислоты. Варианты Bv8 могут включать гепаринсвязывающий домен.
Термин “антагонист Bv8” в использованном здесь значении означает любую молекулу, которая частично или полностью блокирует, ингибирует или нейтрализует способность Bv8 с нативной последовательностью модулировать активацию Cd11b+Grl+ клеток или функционального человеческого аналога Cd11b+Grl+ клеток для стимуляции образования кровеносных сосудов в процессе развития опухоли и/или метастазирования опухоли. Приемлемые молекулы-антагонисты включают, в частности, антитела-антагонисты или их антигенсвязывающие фрагменты, белки, пептиды, гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, биоорганические молекулы, миметики пептидов, фармакологические средства и их метаболиты, последовательности, регулирующие транскрипцию и трансляцию, и тому подобные. Антагонисты также включают низкомолекулярные ингибиторы Bv8, слитые белки, молекулы рецепторов и их производные, которые специфически связываются с Bv8, препятствуя, таким образом, его связыванию с мишенью, варианты антагонистов Bv8, антисмысловые молекулы к Bv8, аптамеры РНК и рибозимы против Bv8.
Антагонисты Bv8, в частности, включают, не ограничиваясь ими, антитела и фрагменты антител, специфически связывающиеся с полипептидом Bv8 с нативной последовательностью или полипептидом рецептора Bv8 с нативной последовательностью (PKR1/EG-VEGFR1 или PKR2/EG-VEGFR2). В определенных вариантах осуществления изобретения антагонист Bv8 является антагонистом PKR1. В определенных вариантах осуществления изобретения антагонист PKR1 является антителом против PKR1. Методы идентификации антагонистов полипептида Bv8 могут включать контактирование полипептида Bv8 с молекулой антагониста-кандидата и измерение детектируемого изменения способности Bv8 модулировать активацию Cd11b+Grl+ клеток или функционального человеческого аналога CD11b+Grl+ клеток, стимулировать развитие кровеносных сосудов опухоли и/или метастазирование опухоли.
Термин “антитело-антагонист Bv8” означает антитело, которое является антагонистом Bv8 в соответствии с приведенным выше определением и, таким образом, частично или полностью блокирует, ингибирует или нейтрализует способность Bv8 модулировать активность Cd11b+Grl+ клеток или функционального человеческого аналога CD11b+Grl+ клеток, стимулировать развитие кровеносных сосудов опухоли и/или метастазирование опухоли.
“Рецептор Bv8” представляет собой молекулу, с которой связывается Bv8 и которая опосредует биологические свойства Bv8. Поэтому в определение термина “рецептор Bv8” входят PKR1/GPR73/EG-VEGF рецептор-1/PROKR1 и PKR2/GPR73L1/EG-VEGF рецептор-2/PROKR2 (LeCouter et al., 2003, Proc. Natl. Acad. Sci. USA, 100:2685-2690; Lin et al., 2002, J. Biol. Chem., 277:19276-19280; Masuda et al., 2002, Biochem. Biophys. Res. Commun., 293:396-402).
Термины “биологическая активность” и “биологически активный” применительно к полипептиду означают способность молекулы специфически связываться и регулировать клеточные реакции, например, пролиферацию, миграцию и т.д. Клеточные реакции также включают реакции, опосредуемые рецептором, которые включают, не ограничиваясь ими, миграцию и/или пролиферацию. В данном контексте термин “модулировать” означает как стимуляцию, так и ингибирование.
Термин “активный” или “активность” применительно к Bv8 или G-CSF в соответствии с целями настоящего изобретения означает формы Bv8 или G-CSF, которые сохраняют биологическую и/или иммунологическую активность нативного или природного Bv8 или G-CSF, при этом термин “биологическая” активность означает биологическую функцию (ингибирующую или стимулирующую), вызываемую нативным или природным Bv8 или G-CSF, помимо способности индуцировать продуцирование антитела против антигенного эпитопа в нативном или природном Bv8 или G-CSF, и термин “иммунологическая” активность означает способность индуцировать продуцирование антитела против антигенного эпитопа в нативном или природном Bv8 или G-CSF. В определенных вариантах осуществления изобретения биологическая активность G-CSF представляет собой способность модулировать активность Cd11b+Grl+ клетки (или функционального человеческого аналога CD11b+Grl+ клетки) и экспрессию Bv8, стимулировать развитие кровеносных сосудов опухоли и/или метастазирование опухоли. В определенных вариантах осуществления изобретения биологическая активность Bv8 представляет собой способность модулировать активность Cd11b+Grl+ клетки (или функционального человеческого аналога CD11b+Grl+ клетки), стимулировать развитие кровеносных сосудов опухоли и/или метастазирование опухоли. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются незрелыми миелоидными клетками человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются супрессорными клетками, выделенными из миелоидных клеток человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются предшественниками нейтрофилов, моноцитов или макрофагов человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются нейтрофилами, моноцитами или макрофагами человека.
“Гемопоэтическая стволовая клетка/клетка-предшественник” или “первичная гемопоэтическая клетка” является клеткой, способной дифференцировать с образованием более коммитированной или зрелой клетки крови. “Линии лимфоидных клеток крови” представляют собой гемопоэтические клетки-предшественники, способные дифференцировать с образованием лимфоцитов (В-клетки или Т-клетки). Аналогичным образом, “лимфопоэз” представляет собой образование лимфоцитов. “Линии эритроидных клеток крови” представляют собой гемопоэтические клетки-предшественники, способные дифференцировать с образованием эритроцитов (красных кровяных телец), и “эритропоэз” представляет собой образование эритроцитов.
Фраза “линии миелоидных клеток крови” в соответствии с целями настоящего изобретения означает все гемопоэтические клетки-предшественники, отличные от линий лимфоидных и эритроидных клеток крови в соответствии с приведенным выше определением, и “миелопоэз” представляет собой образование клеток крови (отличных от лимфоцитов и эритроцитов).
В определенных вариантах осуществления изобретения популяция миелоидных клеток может быть обогащена миелоидными иммунокомпетентными клетками, которые представляют собой Grl+/CD11b+ клетки (или CD11b+Grl+) или Grl+/Mac-1+ клетки. В определенных вариантах осуществления изобретения популяция миелоидных клеток человека может быть обогащена миелоидными иммунокомпетентными клетками, которые являются функциональным человеческим аналогом Grl+/CD11b+ клеток (или функциональным человеческим аналогом CD11b+Grl+ клеток). См., например, публикации Almand, B. et al., J. Immunol. 166, 678-689 (2001); Young, M.R. & Lathers, D.M., Int. J. Immunopharmacol. 21, 241-252 (1999). В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются незрелыми миелоидными клетками человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются супрессорными клетками, выделенными из миелоидных клеток человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются предшественниками нейтрофилов, моноцитов или макрофагов человека. В определенных вариантах осуществления изобретения человеческие клетки-аналоги являются нейтрофилами, моноцитами или макрофагами. В определенных вариантах осуществления изобретения миелоидные иммунокомпетентные клетки экспрессируют маркер для миелоидных клеток линии макрофагов, CD11b, и маркер для гранулоцитов, Grl. Grl+/CD11b+ клетка может быть отобрана методом иммуноадгезивного пэннинга, например, с использованием антитела к Grl+.
Термин “антагонист Grl” в использованном здесь значении означает молекулу, которая связывается с Grl и ингибирует или существенно ослабляет биологическую активность Grl. Неограничивающие примеры антагонистов Grl включают антитела, белки, пептиды гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, биоорганические молекулы, миметики пептидов, фармакологические средства и их метаболиты, последовательности, регулирующие транскрипцию и трансляцию, и тому подобные. Антагонисты могут также включать низкомолекулярные ингибиторы Grl, антисмысловые молекулы к Grl, аптамеры РНК и рибозимы против Grl. В одном варианте осуществления изобретения антагонист Grl является антителом, в частности, антителом против Grl или его фрагментом, связывающимся с Grl человека. В определенных вариантах осуществления изобретения антитело против Grl способно ингибировать биологическую активность G-CSF.
Термин “VEGF” или “VEGF-A” в использованном здесь значении означает эндотелиальный фактор роста сосудов человека, состоящий из 165 аминокислот, и родственные эндотелиальные факторы роста сосудов человека, состоящие из 121, 189 и 206 аминокислот, описанные в публикациях Leung et al. (1989) Science 246:1306, и Houck et al. (1991) Mol. Endocrin., 5:1806, наряду с их природными аллельными и процессированными формами. Термин “VEGF” также означает VEGF видов, отличных от человека, таких как мышь, крыса или примат. VEGF конкретного вида иногда определяется такими терминами, как hVEGF для VEGF человека, mVEGF для VEGF мыши и т.д. Термин “VEGF” также используется для обозначения усеченных форм полипептида, включающих 8-109 или 1-109 аминокислот, эндотелиального фактора роста сосудов человека, состоящего из 165 аминокислот. Такие формы VEGF могут быть обозначены в настоящей заявке терминами “VEGF (8-109)”, “VEGF (1-109)” или “VEGF165”. Положения аминокислот в усеченном нативном VEGF пронумерованы так же, как в последовательности нативного VEGF. Например, положение 17 аминокислоты (метионина) в усеченном нативном VEGF также является положением 17 (метионина) в нативном VEGF. Усеченный нативный VEGF обладает сродством связывания к рецепторам KDR и Flt-1, сравнимым с нативным VEGF.
Термин “биологическая активность VEGF” означает связывание с любым рецептором VEGF или любую сигнальную активность VEGF, такую как регулирование нормального или аномального образования и развития кровеносных сосудов (Ferrara and Davis-Smyth (1997) Endocrine Rev. 18:4-25; Ferrara (1999) J. Mol. Med. 77:527-543); стимуляция образования и развития кровеносных сосудов плода (Carmeliet et al., (1996) Nature 380:435-439; Ferrara et al. (1996) Nature 380:439-442) и модуляция циклической пролиферации кровеносных сосудов в половых путях женщин, а также для роста костей и образования хрящей (Ferrara et al. (1998) Nature Med. 4:336-340; Gerber et al. (1999) Nature Med. 5:623-628). Помимо выполнения функции фактора, определяющего образование и развитие кровеносных сосудов, VEGF в качестве плейотропного фактора роста выполняет многие биологические функции в других физиологических процессах, такие как сохранение жизнеспособности эндотелиальных клеток, обеспечение проницаемости и расширения кровеносных сосудов, хемотаксис моноцитов и приток кальция (Ferrara and Davis-Smyth (1997), см. выше, и Cebe-Suarez et al., Cell. Mol. Life Sci. 63:601-615 (2006)). Кроме того, в результате выполнения исследований было обнаружено митогенное воздействие VEGF на неэпителиальные клетки нескольких типов, такие как эпителиальные клетки пигмента сетчатки, клетки протоков поджелудочной железы и шванновские клетки. Guerrin et al. (1995) J. Cell Physiol. 164:385-394; Oberg-Welsh et al. (1997) Mol. Cell. Endocrinol. 126:125-132; Sondell et al. (1999) J. Neurosci. 19:5731-5740.
Термин “антагонист VEGF” означает молекулу, способную нейтрализовать, блокировать, ингибировать, аннулировать, ослаблять или препятствовать активности VEGF, включающей, но не ограничивающейся ею, связывание с одним или несколькими рецепторами VEGF. Антагонисты VEGF включают, не ограничиваясь ими, антитела против VEGF и их антигенсвязывающие фрагменты, молекулы рецепторов и производные, которые специфически связываются с VEGF, препятствуя его связыванию с одним или несколькими рецепторами, антитела против рецепторов VEGF и антагонисты рецепторов VEGF, такие как низкомолекулярные ингибиторы тирозинкиназ VEGFR. Термин “антагонист VEGF” в использованном здесь значении означает, в частности, такие молекулы, как антитела, фрагменты антител, другие связывающие полипептиды, пептиды и малые молекулы, отличные от пептидов, которые связываются с VEGF и могут нейтрализовать, блокировать, ингибировать, аннулировать, ослаблять или препятствовать активности VEGF. Таким образом, термин “активность VEGF” специфически означает биологические активности, опосредуемые VEGF.
“Антитело против VEGF” является антителом, связывающимся с VEGF с достаточным сродством и специфичностью. В одном варианте осуществления изобретения антитело против VEGF может быть использовано в качестве терапевтического средства, направленно воздействующего и препятствующего развитию болезней или состояний, обусловленных активностью VEGF. Антитело против VEGF обычно не связывается с другими гомологами VEGF, такими как VEGF-B или VEGF-C, с другими факторами роста, такими как PlGF, PDGF или bFGF. В одном варианте осуществления изобретения антитела против VEGF включают моноклональное антитело, которое связывается с тем же эпитопом, что и моноклональное антитело против VEGF А4.6.1, продуцируемое гибридомой АТСС НВ 10709; рекомбинантное гуманизированное моноклональное антитело против VEGF (см. публикацию Presta et al. (1997) Cancer Res. 57:4593-4599), которое включает, не ограничиваясь им, антитело, известное как “бевацизумаб (BV)”, также известное как “rhuMab VEGF” или “AVASTIN®”. В настоящее время AVASTIN® является коммерчески доступным препаратом. Бевацизумаб включает каркасные области мутированного IgG1 человека и антигенсвязывающие гипервариабельные участки из мышиного антитела А4.6.1, которые блокируют связывание VEGF человека с его рецепторами. Примерно 93% аминокислотной последовательности бевацизумаба, включая большинство каркасных областей, выделено из IgG1 человека и примерно 7% последовательности выделено из мышиного антитела А4.6.1. Бевацизумаб имеет молекулярную массу, равную примерно 149000 Дальтон, и гликозилирован. Бевацизумаб и другие гуманизированные антитела против VEGF более подробно описаны в патенте США № 6884879, выданном 26 февраля 2005 г. Дополнительные антитела против VEGF включают антитела серии G6 или В20 (например, G6-23, G6-31, B20-4.1), описанные в публикации заявки РСТ № WO2005/012359. Для ознакомления с дополнительными антителами см. патенты США №№ 7060269, 6582959, 6703020, 6054297, WO98/45332, WO 96/30046, WO 94/10202, европейский патент № 0666868В1, публикации заявок на патент США №№ 2006009360, 20050186208, 20030206899, 20030190317, 20030203409 и 20050112126 и публикацию Popkov et al., Journal of Immunological Methods 288:149-164 (2004).
Термин “полипептид серии В20” в использованном здесь значении означает полипептид, включающий антитело, которое связывается с VEGF. Полипептиды серии В20 включают, не ограничиваясь ими, антитела, выделенные из последовательности антитела В20, или антитело, выделенное из В20, которые описаны в публикации заявки на патент США № 20060280747, публикации заявки на патент США № 20070141065 и/или публикации заявки на патент США № 20070020267, которые включены в настоящее описание изобретения в качестве ссылки. В одном варианте осуществления изобретения полипептид серии В20 является антителом В20-4.1, описанным в публикации заявки на патент США № 20060280747, публикации заявки на патент США № 20070141065 и/или публикации заявки на патент США № 20070020267. В другом варианте осуществления изобретения полипептид серии В20 является антителом В20-4.1.1, описанным в заявке на патент США № 12/315220, которая включена в настоящее описание изобретения в качестве ссылки.
Термин “полипептид серии G6” в использованном здесь значении означает полипептид, включающий антитело, которое связывается с VEGF. Полипептиды серии G6 включают, не ограничиваясь ими, антитела, выделенные из последовательности антитела G6, или антитело, выделенное из G6, которое описано в публикации заявки на патент США № 20060280747, публикации заявки на патент США № 20070141065 и/или публикации заявки на патент США № 20070020267. Полипептиды серии G6, описанные в публикации заявки на патент США № 20060280747, публикации заявки на патент США № 20070141065 и/или публикации заявки на патент США № 20070020267, включают, не ограничиваясь ими, G6-8, G6-23 и G6-31.
Термин “метастазирование” означает распространение рака из места первоначального образования в другие части тела. Раковые клетки могут отделяться от первичной опухоли, проникать в лимфатические и кровеносные сосуды, циркулировать с кровотоком и расти в удаленном очаге (метастазировать) в нормальных тканях других частей тела. Метастазирование может быть местным или удаленным. Метастазирование является последовательным процессом, зависящим от опухолевых клеток, отделяющихся от первичной опухоли, перемещающихся с кровотоком или по лимфатической системе и оседающих в удаленном месте. Опухолевые клетки, достигшие другого места, проникают через стенки кровеносных или лимфатических сосудов, продолжают размножаться и в конечном итоге образуют другую опухоль. Указанные клетки обеспечивают поступление крови в новую опухоль и могут расти, образуя угрожающую жизни массу. В определенных вариантах осуществления изобретения такая новая опухоль определяется как метастазирующая (или вторичная) опухоль. В определенных вариантах осуществления изобретения термин “метастазирующая опухоль” означает опухоль, которая способна метастазировать, но еще не метастазировала в другие ткани или органы тела. В определенных вариантах осуществления изобретения термин “метастазирующая опухоль” означает опухоль, которая метастазировала в другие ткани и органы тела. В определенных вариантах осуществления изобретения метастазирующие опухоли состоят из метастазирующих опухолевых клеток.
Термин “метастатический орган” или “метастатическая ткань” использован в настоящем описании изобретения в широком значении и означает орган или ткань, в которые распространились раковые клетки из первичной опухоли или раковые клетки из другой части тела. Примеры метастатического органа и метастатической ткани включают, не ограничиваясь ими, легкое, печень, головной мозг, яичник, кость, костный мозг и лимфатический узел.
Термин “предметастатический орган” или “предметастатическая ткань” в использованном здесь значении означает орган или ткань, в которых не обнаружены раковые клетки из первичной опухоли или из другой части тела. В определенных вариантах осуществления изобретения термин “предметастатический орган” или “предметастатическая ткань” в использованном здесь значении означает орган или ткань, которые находятся в фазе, предшествующей распространению раковых клеток из первичной опухоли или из другой части тела в данный орган или ткань. Примеры предметастатического органа или предметастатической ткани включают, не ограничиваясь ими, легкое, печень, головной мозг, яичник, кость, костный мозг и лимфатический узел.
Термин “микрометастазирование” означает небольшое число клеток, мигрировавших из первичной опухоли в другие части тела. Микрометастазирование может быть обнаружено или не обнаружено при обследовании или диагностике.
Термин “неметастазирующий” означает опухоль, которая является доброкачественной или остается в месте первоначальной локализации, не проникает в систему лимфатических или кровеносных сосудов или в другие ткани. В определенных вариантах осуществления изобретения неметастазирующая опухоль представляет собой любую опухоль, которая может быть охарактеризована как рак в стадии 0, I или II и иногда рак в стадии III.
Определение степени развития опухоли или рака как “стадия 0”, “стадия I”, “стадия II”, “стадия III” или “стадия IV” означает классификацию опухоли или рака с использованием методов общей классификации по стадиям или обозначения стадий римскими цифрами, известными в данной области. Хотя фактическая стадия рака зависит от типа рака, как правило, рак в стадии 0 является поражением in situ, рак в стадии I является небольшой локализованной опухолью, рак в стадии II и III является локальной запущенной опухолью, которая проникает в локальные лимфатические узлы, и рак в стадии IV является метастазирующим раком. Квалифицированному врачу известны специфические стадии развития опухоли каждого типа.
Термин “первичная опухоль” или “первичный рак” означает первоначальный рак, который не метастазирует в другую ткань, орган или часть тела субъекта. В определенных вариантах осуществления изобретения первичная опухоль состоит из первичных опухолевых клеток.
Термин “доброкачественная опухоль” или “доброкачественный рак” означает опухоль, локализованную в месте образования, которая не обладает способностью инфильтрировать, проникать или метастазировать в удаленное место.
Термин “рецидив рака” в использованном здесь значении означает повторное возникновение рака после лечения, и в определение данного термина входит повторное возникновение рака в первоначально пораженном органе, а также в удаленном органе, когда рак возникает за пределами первоначально пораженного органа.
Термин “дремлющее состояние опухоли” означает продолжительное неактивное состояние, в соответствии с которым опухолевые клетки присутствуют, но опухоль не развивается. Дремлющая опухоль может быть обнаружена или не обнаружена при обследовании или диагностике.
Термин “опухолевая масса” означает количество раковых клеток, размер опухоли и величину рака в теле. Опухолевая масса также определяется как опухолевая нагрузка.
Термин “число опухолей” означает количество опухолей.
Термин “URMCNA” означает нуклеиновые кислоты, содержание которых повышено в опухолях, предметастатических органах и/или метастатических органах. URMCNA включают, не ограничиваясь ими, Stfa3, CAMP, Bv8, TNFSF14, MGAM, Ngp, S100A8, S100A9, LRP1B, CEACAM4, HAO1, C10orf46, CLECSF9, Mcpt8, PRTN3, Slfn3 и ММР-9. В определенных вариантах осуществления изобретения URMCNA означают Bv8, S100A8, S100A9 и ММР-9.
Термин “URMCP” означает белки, содержание которых повышено в опухолях, предметастатических органах и/или метастатических органах. URMCP включают, не ограничиваясь ими, Stfa3, CAMP, Bv8, TNFSF14, MGAM, Ngp, S100A8, S100A9, LRP1B, CEACAM4, HAO1, C10orf46, CLECSF9, Mcpt8, PRTN3, Slfn3 и ММР-9. В определенных вариантах осуществления изобретения URMCP означают Bv8, S100A8, S100A9 и ММР-9.
Термин “DRMCNA” означает нуклеиновые кислоты, содержание которых понижено в опухолях, предметастатических органах и/или метастатических органах. DRMCNA включают, не ограничиваясь ими, TYMS, CRIPTO CR-1, MPHOSPH1, CDH6, WWP2, DMC1, BCHE, NSLE16484, F9, GDAP1, LOC375188, DNTT, PPIL3, KCND2, ZNF597, IGSF4D и GTF3C4.
Термин “DRMCP” означает белки, содержание которых понижено в опухолях, предметастатических органах и/или метастатических органах. DRMCP включают, не ограничиваясь ими, TYMS, CRIPTO CR-1, MPHOSPH1, CDH6, WWP2, DMC1, BCHE, NSLE16484, F9, GDAP1, LOC375188, DNTT, PPIL3, KCND2, ZNF597, IGSF4D и GTF3C4.
Термин “образец” в использованном здесь значении означает композицию, полученную или выделенную у обследуемого субъекта, которая содержит клетки и/или другие молекулы, подлежащие исследованию и/или идентификации, например, на основании физических, биохимических, химических и/или физиологических характеристик. В определенных вариантах осуществления изобретения в определение данного термина входит кровь и другие жидкие образцы биологического происхождения и образцы ткани, такие как биопсийные образцы или выделенные из них культуры тканей или клетки. Источником образца ткани может быть плотная ткань свежеполученного, замороженного и/или консервированного органа, образца ткани, биоптата или аспирата; кровь или любые компоненты крови; биологические жидкости и клетки, полученные на любом сроке беременности или развития субъекта, или плазма.
В другом варианте осуществления изобретения в определение данного термина входят биологические образцы, исследуемые любым способом после их получения, например, путем обработки реагентами, солюбилизации или обогащения определенными компонентами, такими как белки или полинуклеотиды, или погружения в полутвердую или твердую матрицу для получения срезов. В определенных вариантах осуществления изобретения термин “срез” образца ткани означает отдельную часть или кусочек образца ткани, например, тонкий слой ткани или клеток, отрезанный от образца ткани.
Образцы включают, не ограничиваясь ими, первичные или культивируемые клетки или линии клеток, супернатанты клеток, клеточные лизаты, тромбоциты, сыворотку, плазму, жидкость стекловидного тела, лимфатическую жидкость, синовиальную жидкость, фолликулярную жидкость, семенную жидкость, амниотическую жидкость, молоко, цельную кровь, мочу, спинномозговую жидкость, слюну, мокроту, слезы, пот, слизь, опухолевые лизаты и среду культуры ткани, а также тканевые экстракты, такие как гомогенизированная ткань, опухолевая ткань и клеточные экстракты.
В одном варианте осуществления изобретения образец является клиническим образцом. В другом варианте осуществления изобретения образец используют при выполнении диагностического анализа. В определенных вариантах осуществления изобретения образец получают из предметастатического органа или предметастатической ткани. В определенных вариантах осуществления изобретения образец получают из первичной опухоли или метастазирующей опухоли. Биопсию ткани часто используют для получения репрезентативного образца опухолевой ткани. Альтернативно опухолевые клетки могут быть получены непрямым способом в виде тканей или жидкостей, которые, как известно, содержат представляющие интерес опухолевые клетки. Например, образцы тканей, пораженных раком легких, могут быть получены путем резекции, бронхоскопии, аспирации при помощи тонкой иглы, бронхиальной биопсии или из мокроты, плевральной жидкости или крови.
В определенных вариантах осуществления изобретения образец получают у субъекта или больного до лечения антагонистом G-CSF и/или антагонистом Bv8. В определенных вариантах осуществления изобретения образец получают у субъекта или больного после лечения антагонистом G-CSF и/или антагонистом Bv8. В определенных вариантах осуществления изобретения образец получают у субъекта или больного до лечения антагонистом VEGF. В определенных вариантах осуществления изобретения образец получают у субъекта или больного после лечения антагонистом VEGF. В определенных вариантах осуществления изобретения образец получают у субъекта или больного до лечения антителом против VEGF. В определенных вариантах осуществления изобретения образец получают у субъекта или больного после лечения антителом против VEGF. В определенных вариантах осуществления изобретения образец получают до метастазирования рака. В определенных вариантах осуществления изобретения образец получают после метастазирования рака.
Термин “эталонный образец” в использованном здесь значении означает любой образец, стандарт или уровень, используемый для сравнения. В одном варианте осуществления изобретения эталонный образец получают из здоровой и/или небольной части тела того же субъекта или больного. В другом варианте осуществления изобретения эталонный образец получают из не подвергнутой лечению ткани и/или клетки тела того же субъекта или больного.
В определенных вариантах осуществления изобретения эталонный образец представляет собой единичный образец или несколько объединенных образцов одного субъекта или больного, которые были получены в один или несколько разных периодов времени, отличных от времени получения обычного образца. Например, эталонный образец получают в более ранний период времени у того же субъекта или больного по сравнению с получением обычного образца. Такой эталонный образец может быть полезен, если он получен во время первоначальной диагностики рака, при этом обычный образец получают позднее, когда рак становится метастазирующим.
В одном варианте осуществления изобретения эталонный образец получают из здоровой и/или небольной части тела человека, который не является указанным субъектом или больным. В другом варианте осуществления изобретения эталонный образец получают из не подвергнутой лечению ткани и/или клетки тела человека, который не является вышеуказанным субъектом или больным.
В определенных вариантах осуществления изобретения эталонный образец включает все типы биологических образцов, указанных выше при описании термина “образец”, получаемых у одного или нескольких человек, которые не являются вышеуказанным субъектом или больным. В определенных вариантах осуществления изобретения эталонный образец получают у одного или нескольких человек, больных раком, которые не являются вышеуказанным субъектом или больным.
В определенных вариантах осуществления изобретения эталонный образец представляет собой несколько объединенных образцов, полученных у одного или нескольких здоровых людей, которые не являются вышеуказанным субъектом или больным. В определенных вариантах осуществления изобретения эталонный образец представляет собой несколько объединенных образцов, полученных у одного или нескольких человек, больных раком, которые не являются вышеуказанным субъектом или больным. В определенных вариантах осуществления изобретения эталонный образец представляет собой смешанные образцы РНК, полученные из предметастатических органов или предметастатических тканей одного или нескольких человек, которые не являются вышеуказанным субъектом или больным. В определенных вариантах осуществления изобретения эталонный образец представляет собой смешанные образцы РНК, полученные из предметастатических органов или предметастатических тканей одного или нескольких человек, больных раком, которые не являются вышеуказанным субъектом или больным.
Уровень экспрессии/содержание гена, белка или биомаркера в первом образце является повышенным по сравнению с уровнем экспрессии/содержанием во втором образце, если уровень экспрессии/содержание гена, генного продукта, например, белка или биомаркера, в первом образце выше, чем уровень экспрессии/содержание гена, генного продукта, например, белка или биомаркера, во втором образце. Уровни экспрессии/содержание можно определить на основании любых приемлемых критериев, известных в данной области, которые включают, не ограничиваясь ими, мРНК, кДНК, белки, фрагменты белков и/или копию гена. Уровни экспрессии/содержание можно определить в качественном и/или количественном отношении.
В определенных вариантах осуществления изобретения уровень экспрессии/содержание гена, генного продукта, например, белка или биомаркера, в первом образце по меньшей мере примерно на 5%, 10%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90% или 100% выше уровня экспрессии/содержания соответствующего гена, генного продукта, например, белка или биомаркера, обнаруженного стандартными методами, известными в данной области, например, рассмотренными в настоящем описании изобретения, по сравнению со вторым образцом. В определенных вариантах осуществления изобретения уровень экспрессии/содержание гена, генного продукта, например, белка или биомаркера, в первом образце по меньшей мере примерно в 1,5 раза, 1,75 раза, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 25 раз, 50 раз, 75 раз или 100 раз выше уровня экспрессии/содержания соответствующего гена, генного продукта, например, белка или биомаркера, во втором образце. В определенных вариантах осуществления изобретения первый образец является образцом, полученным у субъекта, и второй образец является эталонным образцом.
В определенных вариантах осуществления изобретения термин “снижение” или “уменьшение” в использованном здесь значении означает общее снижение уровня экспрессии/содержания гена, генного продукта, например, белка или биомаркера, в первом образце примерно на 5%, 10%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95% или 100% по сравнению с уровнем экспрессии/содержанием соответствующего гена, генного продукта, например, белка или биомаркера, обнаруженного стандартными методами, известными в данной области, например, рассмотренными в настоящем описании изобретения, по сравнению со вторым образцом. В определенных вариантах осуществления изобретения термин “уменьшение” означает снижение уровня экспрессии/содержания гена или биомаркера в первом образце по меньшей мере примерно в 0,9 раза, 0,8 раза, 0,7 раза, 0,6 раза, 0,5 раза, 0,4 раза, 0,3 раза, 0,2 раза, 0,1 раза, 0,05 раза или 0,01 раза по сравнению с уровнем экспрессии/содержанием соответствующего гена или биомаркера во втором образце. В определенных вариантах осуществления изобретения первый образец является образцом, полученным у субъекта, и второй образец является эталонным образцом.
В определенных вариантах осуществления изобретения образцы нормализуют относительно различий в количестве анализируемой РНК или белка и изменчивости в количестве используемых образцов РНК или белка. Такая нормализация может быть произведена путем измерения и включения экспрессии определенных нормализующих генов, в том числе хорошо известных обязательных генов, таких как GAPDH. Альтернативно нормализация может быть основана на среднем или усредненном сигнале всех анализированных генов или большой совокупности указанных генов (подход на основе глобальной нормализации). Путем последовательного исследования генов измеренное нормализованное количество мРНК или белка опухоли субъекта сравнивают с количеством, обнаруженным в эталонной совокупности генов. Нормализованные уровни экспрессии для каждой мРНК или белка исследованной опухоли субъекта могут быть представлены в виде процентного значения уровня экспрессии, измеренного в эталонной совокупности генов. Уровень экспрессии, измеренный в конкретном образце субъекта, подвергнутом анализу, должен находиться в указанном процентном диапазоне, который может быть определен методами, хорошо известными в данной области.
Термин “обнаружение” использован в самом широком значении и включает как качественные, так и количественные измерения молекулы-мишени. Обнаружение включает любые способы обнаружения, в том числе прямое и непрямое обнаружение.
Термины “полинуклеотид” или “нуклеиновая кислота” имеют взаимозаменяемые значения и означают полимеры нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут быть дезоксирибонуклеотидами, рибонуклеотидами, модифицированными нуклеотидами или основаниями и/или их аналогами или любым субстратом, который может быть введен в полимер при помощи ДНК- или РНК-полимеразы или при помощи реакции синтеза. Полинуклеотид может включать модифицированные нуклеотиды, таких как метилированные нуклеотиды и их аналоги.
Термин “олигонуклеотид” в использованном здесь значении, как правило, означает короткие, обычно одноцепочечные, синтетические полинуклеотиды, которые обычно, но не обязательно, имеют длину менее примерно 200 нуклеотидов. Термины “олигонуклеотид” и “полинуклеотид” не являются взаимоисключающими. Приведенное выше описание полинуклеотидов в равной степени и полностью применимо к олигонуклеотидам.
В определенных вариантах осуществления изобретения полинуклеотиды способны специфически гибридизироваться с геном в условиях разной степени строгости. Специалист в данной области может легко определить “строгость” реакций гибридизации, которую обычно вычисляют эмпирическим путем в зависимости от длины зонда, температуры промывки и концентрации соли. Как правило, более длинные зонды требуют более высоких температур для правильного отжига, в то время как для более коротких зондов необходимы более низкие температуры. Гибридизация обычно зависит от способности денатурированной ДНК повторно гибридизироваться, когда комплементарные цепи находятся в среде ниже температуры плавления. Чем больше степень желаемой гомологии между зондом и гибридизируемой последовательностью, тем выше относительная температура, которая может быть использована. Из вышеизложенного следует, что более высокие относительные температуры делают условия реакции более строгими и более низкие температуры соответствуют менее строгим условиям реакции. Для ознакомления с более подробным описанием и объяснением строгости реакций гибридизации см. публикацию Ausubel et al., Current Protocols in Molecular Biology, Wiley Interscience Publishers (1995).
Строгие условия или особо строгие условия можно определить по следующим признакам: (1) использование низкой ионной силы и высокой температуры для промывки, например, 0,015 М хлорида натрия/0,0015 М цитрата натрия/0,1% додецилсульфата натрия при 50°С; (2) использование во время гибридизации денатурирующего агента, такого как формамид, например, 50% (об./об.) формамида и 0,1% бычьего сывороточного альбумина/0,1% фиколла/0,1% поливинилпирролидона/50 мМ натрий-фосфатного буфера при рН 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°С; или (3) использование 50% формамида, 5-кратного объема SSC (0,75 М NaCl, 0,075 М цитрата натрия), 50 мМ фосфата натрия (рН 6,8), 0,1% пирофосфата натрия, 5-кратного объема раствора Денхардта, обработанной ультразвуком ДНК спермы лосося (50 мкг/мл), 0,1% SDS и 10% сульфата декстрана при 42°С и выполнение промывки при 42°С в 0,2-кратном объеме SSC (хлорид натрия/цитрат натрия) и 50% формамида при 55°С с последующей промывкой в особо строгих условиях в 0,1-кратном объеме SSC, содержащем EDTA, при 55°С.
Умеренно строгие условия можно определить согласно описанию, приведенному в публикации Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press, 1989, причем в умеренно строгих условиях промывной раствор и условия гибридизации (например, температура, ионная сила и % SDS) являются менее строгими по сравнению с вышеописанными условиями. Примером умеренно строгих условий является инкубация в течение ночи при 37°С в растворе, включающем 20% формамида, 5-кратный объем SSC (150 мМ NaCl, 15 мМ тринатрийцитрата), 50 мМ фосфата натрия (рН 7,6), 5-кратный объем раствора Денхардта, 10% сульфата декстрана и 20 мг/мл денатурированной, гидродинамически фрагментированной ДНК спермы лосося, с последующей промывкой фильтров в 1-кратном объеме SSC при температуре около 37-50°С. Специалисту в данной области должно быть известно, как отрегулировать температуру, ионную силу и т.д. в соответствии с такими факторами, как длина зонда и тому подобные.
“Выделенная” молекула нуклеиновой кислоты является молекулой нуклеиновой кислоты, которая идентифицирована и отделена по меньшей мере от одной загрязняющей молекулы нуклеиновой кислоты, с которой данная молекула обычно ассоциирована в природном источнике нуклеиновой кислоты полипептида. Выделенная молекула нуклеиновой кислоты отличается по форме и окружению, в которых она находится в природе. Поэтому выделенные молекулы нуклеиновой кислоты отличаются от молекулы нуклеиновой кислоты, находящейся в естественных клетках. Однако в определение выделенной молекулы нуклеиновой кислоты входит молекула нуклеиновой кислоты, находящаяся в клетках, которые обычно экспрессируют полипептид, когда, например, локализация указанной молекулы нуклеиновой кислоты в хромосоме отличается от локализации в естественных клетках.
“Праймер” обычно представляет собой короткий одноцепочечный полинуклеотид, содержащий свободную 3'-концевую ОН группу, которая связывается с мишенью, потенциально присутствующей в исследуемом образце, путем гибридизации с последовательностью-мишенью и, таким образом, стимулирует полимеризацию полинуклеотида, комплементарного мишени.
Термин “конститутивный ген” означает группу генов, кодирующих белки, активность которых имеет важное значение для сохранения функции клетки. Указанные гены обычно одинаково экспрессированы во всех типах клеток.
Термин “биомаркер” в использованном здесь значении обычно означает молекулу, включающую ген, белок, углеводную структуру или гликолипид, экспрессия которой внутри или снаружи ткани или клетки млекопитающего может быть обнаружена стандартными методами (или методами, рассмотренными в настоящем описании изобретения), и которая может быть использована для диагностики и/или прогнозирования восприимчивости клетки или ткани млекопитающего к схемам лечения на основе ингибирования развития кровеносных сосудов, например, при помощи средства, препятствующего развитию кровеносных сосудов, такого как ингибитор, специфичный к VEGF, ингибитор, специфичный к Bv8, ингибитор, специфичный к G-CSF. В определенных вариантах осуществления изобретения определяемая экспрессия такого маркера может быть выше или ниже, чем в эталонном образце. Экспрессия таких биомаркеров может быть определена при помощи высокопроизводительного мультиплексного иммуноанализа, коммерчески доступного в компании Rules Based Medicine, Inc. или Meso Scale Discovery. Экспрессию биомаркеров можно также определить, например, при помощи анализа методом ПЦР или FACS, иммуногистохимического анализа или анализа генов с использованием чипа.
Термин “матрица” или “микроматрица” в использованном здесь значении означает упорядоченное расположение гибридизируемых элементов матрицы, предпочтительно полинуклеотидных зондов (например, олигонуклеотидов) на субстрате. Субстрат может быть твердым субстратом, таким как предметное стекло, или полутвердым субстратом, таким как нитроцеллюлозная мембрана. Нуклеотидные последовательности могут представлять собой ДНК, РНК или любые их перестановки.
Термин “ген-мишень”, “биомаркер-мишень”, “последовательность-мишень”, “нуклеиновая кислота-мишень” или “белок-мишень” в использованном здесь значении означает представляющий интерес полинуклеотид или белок, который желательно обнаружить. Термин “матрица” в использованном здесь значении означает полинуклеотид, содержащий нуклеотидную последовательность-мишень. В некоторых случаях термины “последовательность-мишень”, “матричная ДНК”, “матричный полинуклеотид”, “нуклеиновая кислота-мишень”, “полинуклеотид-мишень” и их варианты имеют взаимозаменяемые значения.
Термин “амплификация” в использованном здесь значении обычно означает процесс продуцирования нескольких копий требуемой последовательности. Термин “несколько копий” означает по меньшей мере 2 копии. “Копия” необязательно означает полную комплементарность или идентичность полученной последовательности матричной последовательности. Например, копии могут включать аналоги нуклеотидов, такие как дезоксиинозин, намеренные изменения последовательности (такие как изменения последовательности, внесенные праймером, включающей последовательность, которая гибридизирует с матрицей, но не является комплементарной данной матрице) и/или ошибки последовательности, возникающие во время амплификации.
Полипептид с “нативной последовательностью” включает полипептид, имеющий такую же аминокислотную последовательность, что и природный полипептид. Таким образом, полипептид с нативной последовательностью может иметь аминокислотную последовательность природного полипептида любого млекопитающего. Такой полипептид с нативной последовательностью может быть получен в природе или может быть продуцирован рекомбинантными или синтетическими методами. В определение термина “полипептид с нативной последовательностью” входят природные усеченные или секретированные формы полипептида (например, последовательность внеклеточного домена), природные вариантные формы (например, альтернативно сплайсированные формы) и природные аллельные варианты такого полипептида.
“Выделенный” полинуклеотид или “выделенное” антитело представляют собой элементы, которые были идентифицированы, отделены и/или выделены из природного окружения. Загрязняющие компоненты природного окружения являются веществами, которые могут препятствовать диагностическому или терапевтическому использованию полипептида и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В определенных вариантах осуществления изобретения полипептид должен быть очищен (1) более чем на 95 масс.% полипептида при определении методом Лоури или более чем на 99 масс.%, (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности, при помощи секвенатора с центрифужной чашей, или (3) до гомогенного состояния методом SDS-PAGE в восстановительных или невосстановительных условиях с окрашиванием кумасси голубым или серебром. Выделенный полипептид включает полипептид in situ в рекомбинантных клетках, так как отсутствует по меньшей мере один компонент природной среды полипептида. Однако выделенный полипептид обычно получают, выполняя по меньшей мере одну стадию очистки.
“Полипептидная цепь” представляет собой полипептид, в котором каждый домен соединен с другим доменом пептидной связью в отличие от взаимодействия при помощи нековалентных связей или дисульфидных связей.
“Вариант” полипептида означает биологически активный полипептид, имеющий аминокислотную последовательность, которая по меньшей мере примерно на 80% идентична соответствующему полипептиду с нативной последовательностью. Такие варианты включают, например, полипептиды, в которых в положении N- и/или С-конца полипептида добавлены или удалены один или несколько аминокислотных остатков (природная аминокислота и/или неприродная аминокислота). Аминокислотная последовательность варианта обычно по меньшей мере примерно на 80%, по меньшей мере примерно на 90% или по меньшей мере примерно на 95% или больше идентична полипептиду с нативной последовательностью. Варианты также включают фрагменты нативной последовательности полипептида (например, субпоследовательности, усечения и т.д.), которые обычно являются биологически активными.
Термин “вариант белка” в использованном здесь значении означает вышеописанный вариант и/или белок, включающий одну или несколько мутаций аминокислот в нативной последовательности белка. Одна или несколько мутаций аминокислот необязательно включают замены аминокислот. Белок и его варианты, пригодные для использования в настоящем изобретении, могут быть получены разными методами, хорошо известными в данной области. Варианты аминокислотной последовательности белка могут быть получены при помощи мутаций в ДНК белка. Такие варианты включают, например, делеции, инсерции или замены остатков в аминокислотной последовательности белка. Может быть создана любая комбинация делеций, инсерций и замен для получения конечной конструкции, обладающей требуемой активностью. Мутации, выполняемые в ДНК, кодирующей данный вариант, не должны выводить последовательность из рамки считывания и предпочтительно не должны создавать комплементарные области, способные продуцировать вторичную структуру мРНК. Европейский патент № 75444А.
В определенных вариантах осуществления изобретения “вариант” полипептида (то есть вариант любого полипептида, рассмотренного в настоящем описании изобретения) представляет собой биологически активный полипептид, аминокислотная последовательность которого по меньшей мере примерно на 80% идентична соответствующему полипептиду с нативной последовательностью. Такие варианты включают, например, полипептиды, в которых в положении N- и/или С-конца полипептида добавлены или удалены один или несколько аминокислотных остатков (природная аминокислота и/или неприродная аминокислота). Аминокислотная последовательность варианта обычно по меньшей мере примерно на 80%, по меньшей мере примерно на 90% или по меньшей мере примерно на 95% или больше идентична полипептиду с нативной последовательностью. Варианты также включают фрагменты нативной последовательности полипептида (например, субпоследовательности, усечения и т.д.), которые обычно являются биологически активными.
“Процентное значение (%) идентичности аминокислотной последовательности” определяется в настоящем описании изобретения как процентное значение аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в выбранной последовательности, после сравнительного анализа последовательностей и введения разрывов, в случае необходимости, для достижения максимального процентного значения идентичности последовательностей без учета консервативных замен в качестве части идентичности последовательности. Сравнительный анализ с целью определения процентного значения идентичности аминокислотной последовательности может быть выполнен разными способами, известными специалистам в данной области, например, при помощи общедоступного программного обеспечения, такого как BLAST, BLAST-2, ALIGN, ALIGN-2 или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для измерения соответствия, включая любые алгоритмы, необходимые для достижения максимального соответствия по всей длине сравниваемых последовательностей. Однако в соответствии с целями настоящего изобретения процентные значения идентичности аминокислотных последовательностей определяют в соответствии с приведенным ниже описанием с использованием компьютерной программы сравнения последовательностей ALIGN-2. Компьютерная программа сравнения последовательностей ALIGN-2, созданная в компании Genentech, Inc., была подана вместе с документацией пользователя в ведомство по охране авторского права США, Washington D.C., 20559, где она была зарегистрирована под регистрационным номером авторского права США TXU510087, и может быть приобретена в компании Genentech, Inc., South San Francisco, California. Программа ALIGN-2 должна быть компилирована для использования в операционной системе UNIX, например, цифровой операционной системе UNIX V4.0D. В программе ALIGN-2 заданы все параметры сравнения последовательностей, которые не могут быть изменены.
В соответствии с целями настоящего изобретения процентное значение идентичности данной аминокислотной последовательности А с данной аминокислотной последовательностью В (приведенное выше выражение можно перефразировать следующим образом: процентное значение идентичности данной аминокислотной последовательности А, обладающей определенной идентичностью с данной аминокислотной последовательностью В) вычисляют следующим образом:
результат деления Х/Y, умноженный на 100,
где Х означает число аминокислотных остатков, которые были оценены программой сравнения последовательностей ALIGN-2 как идентично совместимые при выполнении сравнительного анализа А и В, и где Y означает общее число аминокислотных остатков в последовательности В. Следует отметить, что в тех случаях, когда длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, процентное значение идентичности аминокислотной последовательности А в отношении В не будет равно процентному значению идентичности аминокислотной последовательности В в отношении А.
Термин “антагонист” в использованном здесь значении означает молекулу, способную нейтрализовать, блокировать, ингибировать, аннулировать, уменьшать или препятствовать активности белка, включая его связывание с одним или несколькими рецепторами в случае лиганда или связывание с одним или несколькими лигандами в случае рецептора. Антагонисты включают антитела и их антигенсвязывающие фрагменты, белки, пептиды, гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, биоорганические молекулы, миметики пептидов, фармакологические средства и их метаболиты, последовательности, регулирующие транскрипцию и трансляцию, и тому подобные. Антагонисты также включают низкомолекулярные ингибиторы и слитые белки, молекулы рецепторов и производные, которые специфически связываются с белком, препятствуя его связыванию с мишенью, варианты антагонистов белка, антисмысловые молекулы к белку, аптамеры РНК и рибозимы против белка.
Термин “антитело” использовано в самом широком значении и означает моноклональные антитела (включая полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела, мультиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител, и фрагменты антител (см. ниже), если они проявляют требуемую биологическую активность.
За исключением особо оговоренных случаев выражение “поливалентное антитело” использовано в настоящем описании изобретения для обозначения антитела, включающего три или более антигенсвязывающих сайтов. Поливалентное антитело обычно имеет три или более антигенсвязывающих сайтов и, как правило, не является антителом IgM или IgA с нативной последовательностью.
“Блокирующее” антитело или антитело-“антагонист” является таким антителом, которое ингибирует или снижает биологическую активность антигена, с которым оно связывается. Определенные блокирующие антитела или антитела-антагонисты существенно или полностью ингибируют биологическую активность антигена.
“Антитело-агонист” в использованном здесь значении является антителом, которое частично или полностью имитирует по меньшей мере одну из функциональных активностей представляющего интерес полипептида.
“Фрагменты антитела” включают только часть интактного антитела, в том числе антигенсвязывающий сайт интактного антитела, и, таким образом, сохраняют способность связываться с антигеном. Примеры фрагментов антитела, входящих в данное определение, включают: (i) Fab-фрагмент, содержащий VL, CL, VH и СН1 области; (ii) Fab'-фрагмент, который является Fab-фрагментом, содержащим один или несколько остатков цистеина у С-конца СН1 области; (iii) Fd-фрагмент, содержащий VH и СН1 области; (iv) Fd'-фрагмент, содержащий VH и СН1 области и один или несколько остатков цистеина у С-конца СН1 области; (v) Fv-фрагмент, содержащий VL и VH области одного домена антитела; (vi) фрагмент dAb (Ward et al., Nature 341, 544-546 (1989)), который состоит из VH области; (vii) выделенные CDR-области; (viii) F(ab')2-фрагменты, двухвалентный фрагмент, включающий два Fab'-фрагмента, связанные дисульфидным мостиком в шарнирной области; (ix) молекулы одноцепочечных антител (например, одноцепочечный Fv-фрагмент; scFv-фрагмент) (Bird et al., Science 242:423-426 (1988); и Huston et al., PNAS (USA) 85:5879-5883 (1988)); (x) “диатела” с двумя антигенсвязывающими сайтами, включающие вариабельную область тяжелой цепи (VH), соединенную с вариабельной областью легкой цепи (VL) в одной полипептидной цепи (см., например, европейский патент № 404097; WO 93/11161; и публикацию Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); (xi) “линейные антитела”, включающие два спаренных Fd-сегмента (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют две антигенсвязывающие области (Zapata et al., Protein Eng. 8(10):1057-1062 (1995); и патент США № 5641870).
Термин “моноклональное антитело” в использованном здесь значении означает антитело, полученное из популяции по существу гомогенных антител, то есть отдельные антитела, образующие популяцию, являются идентичными за исключением возможных мутаций, например, природных мутаций, которые могут присутствовать в незначительных количествах. Таким образом, определение “моноклональное” означает, что антитело не является смесью отдельных антител. Моноклональные антитела являются высоко специфическими и направлены против одного антигена. В определенных вариантах осуществления изобретения моноклональное антитело обычно является антителом, включающим полипептидную последовательность, связывающуюся с мишенью, при этом связывающуюся с мишенью полипептидную последовательность получают способом, который включает отбор полипептидной последовательности, связывающейся с одной мишенью, из множества полипептидных последовательностей. Например, процесс отбора может включать отбор единственного клона из множества клонов, таких как пул клонов гибридом, клонов фагов или клонов рекомбинантных ДНК. Следует отметить, что выбранная последовательность, связывающаяся с мишенью, может быть дополнительно изменена, например, с целью повышения сродства к мишени, гуманизации последовательности, связывающейся с мишенью, улучшения продуцирования в культуре клеток, уменьшения иммуногенности in vivo, создания мультиспецифического антитела и т.д., и что антитело, включающее измененную последовательность, связывающуюся с мишенью, также является моноклональным антителом по настоящему изобретению. В отличие от препаратов поликлональных антител, которые обычно включают разные антитела, направленные против разных антигенных детерминант (эпитопов), каждое моноклональное антитело направлено против одной антигенной детерминанты на антигене. Помимо специфичности преимуществом препаратов моноклональных антител является то, что они обычно не загрязнены другими иммуноглобулинами.
Определение “моноклональное” означает, что данное антитело получено по существу из гомогенной популяции антител, и получение такого антитела не ограничено каким-либо конкретным методом. Например, моноклональные антитела, предназначенные для использования в соответствии с настоящим изобретением, могут быть получены разными методами, включающими, например, метод гибридом (см., например, публикации, Kohler and Milstein, Nature, 256:495-97 (1975); Hongo et al., Hybridoma, 14 (3):253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981)), методы рекомбинантных ДНК (см., например, патент США № 4816567), методы отображения на фаге (см., например, публикации Clackson et al., Nature, 352:624-628 (1991); Marks et al., J. Mol. Biol. 222:581-597 (1991); Sidhu et al., J. Mol. Biol. 338(2):299-310 (2004); Lee et al., J. Mol. Biol. 340(5):1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34):12467-12472 (2004); и Lee et al., J. Immunol. Methods 284(1-2):119-132(2004)) и методы продуцирования человеческих и подобных человеческим антител в организме животных, содержащих часть или все локусы или гены иммуноглобулина человека, кодирующие последовательности иммуноглобулина человека (см., например, публикации WO 1998/24893; WO 1996/34096; WO 1996/33735; WO 1991/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA 90:2551 (1993); Jakobovits et al., Nature 362:255-258 (1993); Bruggemann et al., Year in Immunol. 7:33 (1993); патенты США №№ 5545807, 5545806, 5569825, 5625126, 5633425 и 5661016; Marks et al., Bio/Technology 10:779-783 (1992); Lonberg et al., Nature 368:856-859 (1994); Morrison, Nature 368:812-813 (1994); Fishwild et al., Nature Biotechnol. 14:845-851 (1996); Neuberger, Nature Biotechnol. 14:826 (1996); и Lonberg and Huszar, Intern. Rev. Immunol. 13:65-93 (1995).
Моноклональные антитела по настоящему изобретению, в частности, включают “химерные” антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, выделенных из определенного вида или относящихся к определенному классу или подклассу антител, в то время как остальная цепь (цепи) идентична или гомологична соответствующим последовательностям в антителах, выделенных из другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, если указанные фрагменты проявляют требуемую биологическую активность (патент США № 4816567 и публикация Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
“Гуманизированные” формы антител, отличных от человеческих (например, мышиных антител), являются химерными антителами, содержащими минимальную последовательность, выделенную из иммуноглобулина, отличного от человеческого. В большинстве случаев гуманизированные антитела являются иммуноглобулинами человека (реципиентное антитело), в которых остатки из гипервариабельного участка реципиента заменены остатками из гипервариабельного участка вида, отличного от человека (донорское антитело), такого как мышь, крыса, кролик или примат кроме человека, обладающего требуемой специфичностью, сродством и активностью. В некоторых случаях остатки каркасной области (FR) иммуноглобулина человека заменены соответствующими остатками, отличными от человеческих. Кроме того, гуманизированные антитела могут включать остатки, отсутствующие в реципиентном антителе или донорском антителе. Указанные модификации выполняют для дальнейшего улучшения характеристик антител. Гуманизированное антитело обычно включает по существу все за исключением по меньшей мере одной и обычно двух вариабельных областей, в которых все или по существу все гипервариабельные петли соответствуют петлям иммуноглобулина, отличного от человеческого, и все или по существу все каркасные области выделены из последовательности иммуноглобулина человека. Гуманизированное антитело также необязательно включает по меньшей мере часть константной области (Fc) иммуноглобулина, обычно иммуноглобулина человека. Для более подробного ознакомления с гуманизированными антителами см. публикации Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). См. также, например, публикации Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994); и патенты США №№ 6982321 и 7087409. См., также van Dijk and van de Winkel, Curr. Opin. Pharmacol., 5:368-74 (2001). Человеческие антитела могут быть также получены путем введения антигена трансгенному животному, которое было модифицировано с целью продуцирования таких антител в ответ на антигенную стимуляцию и у которого были инактивированы эндогенные локусы, например, иммунизированным ксеногенным мышам (см., например, патенты США №№ 6075181 и 6150584 для ознакомления с методом XENOMOUSE™). См. также, например, публикацию Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3567 (2006) для ознакомления с человеческими антителами, созданными методом гибридом В-клеток человека.
“Человеческое антитело” является антителом, которое содержит аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, продуцированного человеком, и/или было получено любыми методами получения человеческих антител, рассмотренными в настоящем описании изобретения. В данное определение человеческого антитела не входит гуманизированное антитело, включающее антигенсвязывающие остатки, отличные от человеческих. Человеческие антитела могут быть получены разными методами, известными в данной области. В одном варианте осуществления изобретения человеческое антитело выбирают из библиотеки фагов, экспрессирующей человеческие антитела (Vaughan et al., Nature Biotechnology 14:309-314 (1996): Sheets et al., PNAS (USA) 95:6157-6162 (1998); Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991)). Человеческие антитела могут быть также получены путем введения локусов иммуноглобулина человека трансгенным животным, например, мышам, у которых эндогенные гены иммуноглобулина были частично или полностью инактивированы. В результате антигенной стимуляции происходит продуцирование человеческих антител, которые близко соответствуют антителам, имеющимся у человека, по всем показателям, таким как реаранжировка генов, сборка и спектр антител. Данный метод описан, например, в патентах США №№ 5545807, 5545806, 5569825, 5625126, 5633425, 5661016 и в следующих научных публикациях: Marks et al., Bio/Technology 10:779-783 (1992); Lonberg et al., Nature 368:856-859 (1994); Morrison, Nature 368:812-13 (1994); Fishwild et al., Nature Biotechnology 14:845-51 (1996); Neuberger, Nature Biotechnology 14:826 (1996); Lonberg and Huszar, Intern. Rev. Immunol. 13:65-93 (1995). Альтернативно человеческое антитело может быть получено путем иммортализации В-лимфоцитов человека, продуцирующих антитело против антигена-мишени (такие В-лимфоциты могут быть выделены у субъекта или могут быть иммунизированы in vitro). См., например, публикации Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985); Boerner et al., J. Immunol., 147(1):86-95 (1991) и патент США № 5750373.
Термин “вариабельный” показывает, что последовательности определенных частей вариабельных областей существенно отличаются в разных антителах и служат для связывания и определения специфичности каждого конкретного антитела в отношении определенного антигена. Однако вариабельность распределена неравномерно в вариабельных областях антител. Вариабельность сконцентрирована в трех сегментах, именуемых гипервариабельными участками, вариабельных областей легкой цепи и тяжелой цепи. Более консервативные части вариабельных областей именуются каркасными областями (FR). Вариабельные области нативных тяжелых и легких цепей включают четыре каркасные области, которые в большинстве имеют бета-складчатую конфигурацию и соединены тремя гипервариабельными участками, образующими петли, соединяющие и в некоторых случаях образующие часть бета-складчатой структуры. Гипервариабельные участки в каждой цепи удерживаются в непосредственной близости друг от друга каркасными областями, при этом гипервариабельные участки из другой цепи способствуют образованию антигенсвязывающего сайта антител (см. публикацию Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Константные области не участвуют непосредственно в связывании антитела с антигеном, но выполняют разные эффекторные функции, такие как участие антитела в антителозависимой токсичности клетки.
Термин “гипервариабельный участок”, “HVR” или “HV”, в использованном здесь значении означает аминокислотные остатки антитела, отвечающие за связывание с антигеном. Например, термин “гипервариабельный участок” означает участки вариабельной области антитела, характеризующиеся гипервариабельностью последовательности и/или образующие петли, имеющие определенную структуру. Антитела обычно включают шесть гипервариабельных участков: три в VH области (Н1, Н2, Н3) и три в VL области (L1, L2, L3). В нативных антителах Н3 и L3 характеризуются наибольшей вариабельностью из шести HVR, при этом считается, что Н3 имеет особенно важное значение для сообщения антителам точной специфичности. См., например, публикации Xu et al., Immunity 13:37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, NJ, 2003). Природные антитела верблюда, состоящие только из тяжелой цепи, действительно функционируют и остаются устойчивыми при отсутствии легкой цепи. См., например, публикации Hamers-Casterman et al., Nature 363:446-448 (1993); Sheriff et al., Nature Struct. Biol. 3:733-736 (1996).
Существует несколько классификаций гипервариабельных участков, которые входят в объем настоящего изобретения. Наиболее часто используется классификация, включающая определяющие комплементарность области (CDR) Кабата, идентифицируемые на основании вариабельности последовательностей (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Классификация Хотиа относится к локализации структурных петель (Chotia and Lesk, J. Mol. Biol. 196:901-917 (1987)). Гипервариабельные участки AbM представляют собой компромисс между гипервариабельными участками (HVR) Кабата и структурными петлями Хотиа, и данная классификация использована в программном обеспечении моделирования антител AbM Oxford Molecular. “Контактные” HVR определяются на основе анализа существующих сложных кристаллических структур. Ниже приведены остатки всех гипервариабельных участков.
Гипервариабельные участки могут включать “удлиненные HVR”, в частности: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL-области и 26-35 (Н1), 50-65 или 49-65 (Н2) и 93-102, 94-102 или 95-102 (Н3) в VH-области. Остатки вариабельной области во всех классификациях пронумерованы в соответствии с нумерацией, принятой в приведенной выше публикации Kabat et al.
Остатки “каркасной области” или “FR” представляют собой остатки вариабельной области, отличные от остатков гипервариабельных участков, рассмотренных в настоящем описании изобретения.
Термин “нумерация остатков вариабельной области по Кабату” или “нумерация положений аминокислот по Кабату” и его варианты означают систему нумерации, используемую для вариабельных областей тяжелой цепи или вариабельных областей легкой цепи компиляции антител в приведенной выше публикации Kabat et al. При использовании данной системы нумерации фактическая линейная аминокислотная последовательность может содержать меньше или больше аминокислот, соответствующих укорачиванию или инсерции в каркасную область (FR) или гипервариабельный участок (HVR) вариабельной области. Например, вариабельная область тяжелой цепи может включать одну вставку аминокислоты (остаток 52а по нумерации Кабата) после остатка 52 Н2 и остатки (например, остатки 82а, 82b и 82с и т.д. по нумерации Кабата), вставленные после остатка 82 каркасной области тяжелой цепи. Нумерация остатков Кабата может быть определена для данного антитела в результате выполнения сравнительного анализа гомологичных областей последовательности антитела со “стандартной” пронумерованной последовательностью Катаба.
В настоящем описании изобретения и формуле изобретения обычно использована нумерация Кабата при определении остатка в вариабельной области (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, публикация Kabat et al., Sequences of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)). “Система нумерации EU” или “индекс EU” обычно используется при определении остатка в константной области тяжелой цепи иммуноглобулина (например, индекс EU приведен в публикации Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), которая включена в настоящее описание изобретения в качестве ссылки). За исключением особо оговоренных случаев номера остатков в вариабельной области антител определяются по системе нумерации Кабата. За исключением особо оговоренных случаев номера остатков в константной области антител определяются по системе нумерации EU (см., например, предварительную заявку на патент США № 60/640323, фигуры для нумерации EU).
В зависимости от аминокислотных последовательностей константных областей тяжелых цепей антитела (иммуноглобулины) могут быть отнесены к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из указанных классов могут быть дополнительно разделены на подклассы (изотипы), например, IgG1 (включающий аллотип А и аллотип, отличный от А), IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелой цепи, соответствующие разным классам иммуноглобулинов, именуются соответственно α, δ, ε, γ и µ. Структуры субъединиц и трехмерные конфигурации разных классов иммуноглобулинов хорошо известны и описаны, например, в публикации Abbas et al., Cellular and Mol. Immunology, 4th ed. (W.B. Saunders, Co., 2000). Антитело может быть частью более крупной слитой молекулы, образованной путем ковалентного или нековалентного связывания антитела с одним или несколькими другими белками или пептидами.
“Легкие цепи” антител (иммуноглобулинов) любого вида позвоночных могут быть отнесены к одному из двух четко выраженных типов, именуемых каппа (κ) и лямбда (λ), на основании аминокислотных последовательностей константных областей.
Термин “Fc-область” означает С-концевую область тяжелой цепи иммуноглобулина, которая может быть образована при расщеплении папаином интактного антитела. Fc-область может быть Fc-областью нативной последовательности или вариантной Fc-областью. Хотя границы Fc-области тяжелой цепи иммуноглобулина могут изменяться, Fc-область тяжелой цепи IgG человека обычно определяется участком от аминокислотного остатка примерно в положении Cys226 или примерно от положения Pro230 до карбоксильного конца Fc-области. С-концевой лизин (остаток 447 в соответствии с системой нумерации EU) Fc-области может быть удален, например, во время продуцирования или очистки антитела или в процессе создания методами рекомбинантных ДНК нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Таким образом, интактные антитела могут включать популяции антител, у которых удалены все остатки К447, популяции антител, у которых не удалены остатки К447, и популяции антител, включающие смесь антител с остатком К447 и без указанного остатка. Fc-область иммуноглобулина обычно включает две константные области, СН2-область и СН3-область, и необязательного включает СН4-область.
За исключением особо оговоренных случаев нумерация остатков в тяжелой цепи иммуноглобулина соответствует индексу EU в приведенной выше публикации Kabat et al. “Индекс EU по Кабату” представляет собой нумерацию EU остатков антитела IgG1 человека.
Термин “цепь Fc-области” означает одну из двух полипептидных цепей Fc-области.
“CH2-область” Fc-области IgG человека (также определяемая как “Cg2”-область) обычно охватывает участок от аминокислотного остатка примерно в положении 231 до аминокислотного остатка примерно в положении 340. СН2-область является уникальной в том отношении, что она не спарена непосредственно с другой областью. Между двумя СН2-областями молекулы интактного нативного IgG расположены две N-связанные разветвленные углеводные цепи. Существует мнение, что углевод заменяет спаривание доменов и помогает стабилизировать СН2-область. Burton, Molec. Immunol. 22:161-206 (1985). СН2-область по настоящему изобретению может быть СН2-областью нативной последовательности или вариантной СН2 областью.
“СН3-область” включает участок от С-концевых остатков до СН2-области в Fc-области (то есть от аминокислотного остатка примерно в положении 341 до аминокислотного остатка примерно в положении 447 IgG). СН3-область по настоящему изобретению может быть СН3-областью нативной последовательности или вариантной СН3-областью (например, СН3-область с введенной “выпуклостью” в одной цепи и соответствующей введенной “впадиной” в другой цепи; см. патент США № 5821333, включенный в настоящее описание изобретения в качестве ссылки). Такие вариантные СН3-области могут быть использованы для создания мультиспецифических (например, биспецифических) антител, рассмотренных в настоящем описании изобретения.
“Шарнирная область” обычно представляет собой участок от примерно остатка Glu216 или Cys226 до примерно остатка Pro230 IgG1 человека (Burton, Molec. Immunol. 22:161-206 (1985)). Шарнирные области IgG других изотипов можно совместить с последовательностью IgG1, помещая в одинаковые положения первый и последний остатки цистеина, образующие S-S связи между тяжелыми цепями. Шарнирная область по настоящему изобретению может быть шарнирной областью нативной последовательности или вариантной шарнирной областью. Две полипептидные цепи вариантной шарнирной области обычно сохраняют по меньшей мере один остаток цистеина в полипептидной цепи, благодаря чему две полипептидные цепи вариантной шарнирной области могут образовывать дисульфидную связь между двумя цепями. Предпочтительная шарнирная область по настоящему изобретению является шарнирной областью нативной последовательности человека, например, шарнирной областью нативной последовательности IgG1 человека.
“Функциональная Fc-область” выполняет по меньшей мере одну “эффекторную функцию” Fc-области нативной последовательности. Типичные “эффекторные функции” включают связывание C1q; комплементзависимую цитотоксичность (CDC); связывание Fc-рецептора; антителозависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; уменьшение экспрессии рецепторов на поверхности клетки (например, В-клеточного рецептора; BCR) и т.д. Такие эффекторные функции обычно требуют объединения Fc-области со связывающим доменом (например, вариабельной областью человека) и могут быть определены с помощью разных анализов, известных в данной области для оценки таких эффекторных функций антитела.
“Fc-область нативной последовательности” включает аминокислотную последовательность, идентичную аминокислотной последовательности Fc-области, встречающейся в природе. Fc-области нативной последовательности человека включают Fc-область нативной последовательности IgG1 человека (аллотип А и аллотип, отличный от А); Fc-область нативной последовательности IgG2 человека; Fc-область нативной последовательности IgG3 и Fc-область нативной последовательности IgG4 человека, а также их природные варианты.
“Интактное” антитело является антителом, включающим антигенсвязывающую вариабельную область, а также константную область легкой цепи (CL) и константные области тяжелой цепи СН1, СН2 и СН3. Константные области могут представлять собой константные области нативной последовательности (например, константные области нативной последовательности человека) или их варианты аминокислотной последовательности. Интактное антитело предпочтительно выполняет одну или несколько эффекторных функций.
“Материнское антитело” или антитело “дикого типа” является антителом, включающим аминокислотную последовательность, в которой отсутствует одно или несколько изменений аминокислотной последовательности по сравнению с вариантом антитела, рассмотренным в настоящем описании изобретения. Таким образом, материнское антитело обычно имеет по меньшей мере один гипервариабельный участок, аминокислотная последовательность которого отличается от аминокислотной последовательности соответствующего гипервариабельного участка варианта антитела, рассмотренного в настоящем описании изобретения. Материнский полипептид может включать антитело с нативной последовательностью (то есть природное антитело) (в том числе природный аллельный вариант) или антитело с ранее существовавшими модификациями природной аминокислотной последовательности (такими как инсерции, делеции и/или другие изменения). В настоящем описании изобретения термины “антитело дикого типа”, “антитело WT”, “антитело wt” и “материнское” или “родительское” антитело имеют взаимозаменяемые значения.
В использованном здесь значении термин “вариант антитела” или “вариантное антитело” означает антитело, в котором аминокислотная последовательность отличается от аминокислотной последовательности материнского антитела. Вариант антитела предпочтительно включает вариабельную область тяжелой цепи или вариабельную область легкой цепи, аминокислотная последовательность которой не встречается в природе. Такие варианты обязательно характеризуются менее чем 100% идентичностью или сходством последовательности с материнским антителом. В предпочтительном варианте осуществления изобретения вариант антитела имеет аминокислотную последовательность, которая идентична или подобна аминокислотной последовательности вариабельной области тяжелой или легкой цепи материнского антитела в пределах от около 75% до менее 100%, более предпочтительно от около 80% до менее 100%, более предпочтительно от около 85% до менее 100%, еще предпочтительнее от около 90% до менее 100% и наиболее предпочтительно от около 95% до менее 100%. Вариант антитела обычно включает одно или несколько изменений аминокислот в одном или нескольких гипервариабельных участках или рядом с одним или несколькими гипервариабельными участками.
“Вариантная Fc-область” включает аминокислотную последовательность, которая отличается от Fc-области нативной последовательности по меньшей мере модификацией одной аминокислоты. В определенных вариантах осуществления изобретения вариантная Fc-область включает по меньшей мере одну замену аминокислоты по сравнению с Fc-областью нативной последовательности или Fc-областью материнского полипептида, например, от одной до около десяти замен аминокислот и предпочтительно от одной до около пяти замен аминокислот в Fc-области нативной последовательности или в Fc-области материнского полипептида, например, от одной до около десяти замен аминокислот и предпочтительно от одной до около пяти замен аминокислот в Fc-области нативной последовательности или в Fc-области материнского полипептида. Вариантная Fc-область обычно по меньшей мере примерно на 80% идентична Fc-области нативной последовательности и/или Fc-области материнского полипептида либо идентична по меньшей мере примерно на 90% или по меньшей мере примерно на 95% или больше.
“Эффекторные функции” антитела представляют собой биологические активности Fc-области (Fc-области нативной последовательности или вариантной Fc-области аминокислотной последовательности) антитела и изменяются в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплементзависимую цитотоксичность (CDC); связывание Fc-рецептора; антителозависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; уменьшение экспрессии рецепторов на поверхности клетки (например, В-клеточного рецептора) и активацию В-клеток.
“Антителозависимая клеточно-опосредованная цитотоксичность” или “ADCC” означает форму цитотоксичности, в соответствии с которой секретированный Ig, связанный Fc-рецепторами (FcR), присутствующими на определенных цитотоксических клетках (например, естественных клетках-киллерах (NK), нейтрофилах и макрофагах), позволяет указанным цитотоксическим эффекторным клеткам специфически связываться с несущей антиген клеткой-мишенью и затем уничтожать указанную клетку-мишень цитотоксинами. Основные клетки, опосредующие ADCC, NK-клетки, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках суммирована в таблице 3 на странице 464 публикации Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Для оценки активности ADCC представляющей интерес молекулы может быть выполнен анализ ADCC in vitro, описанный в патенте США № 5500362 или 5821337. Эффекторные клетки, пригодные для выполнения таких анализов, включают мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK). Альтернативно или дополнительно активность ADCC представляющей интерес молекулы можно определить in vivo, например, в животной модели, аналогичной рассмотренной в публикации Clynes et al., PNAS (USA) 95:652-656 (1998).
“Эффекторные клетки человека” представляют собой лейкоциты, которые экспрессируют один или несколько Fc-рецепторов и выполняют эффекторные функции. В определенных вариантах осуществления изобретения указанные клетки экспрессируют по меньшей мере FcγRIII и выполняют одну или несколько эффекторных функций ADCC. Примеры лейкоцитов человека, опосредующих ADCC, включают мононуклеарные клетки периферической крови (РВМС), естественные клетки-киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы, при этом РВМС и NK-клетки обычно являются предпочтительными. Эффекторные клетки могут быть выделены из естественного источника, например, из крови или РВМС, рассмотренных в настоящем описании изобретения.
“Fc-рецептор” или “FcR” является рецептором, который связывается с Fc-областью антитела. В некоторых вариантах осуществления изобретения FcR является нативным FcR человека. В некоторых вариантах осуществления изобретения FcR является рецептором, который связывается с IgG антителом (гамма-рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, в том числе аллельные варианты и альтернативно сплайсированные формы указанных рецепторов. Рецепторы FcγRII включают FcγRIIA (”активирующий рецептор”) и FcγRIIB (”ингибирующий рецептор”), которые имеют подобные аминокислотные последовательности, отличающиеся главным образом цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в цитоплазматическом домене активирующий фрагмент на основе тирозина иммунорецептора (ITAM). Ингибирующий рецептор FcγRIIB содержит в цитоплазматическом домене ингибирующий фрагмент на основе тирозина иммунорецептора (ITIM). (См., например, публикацию Daeron, Annu. Rev. Immunol., 15:203-234 (1997)). Fc-рецепторы рассмотрены, например, в публикациях Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). Другие Fc-рецепторы, в том числе рецепторы, которые могут быть обнаружены в будущем, также входят в определение термина “FcR”, приведенного в настоящем описании изобретения.
Термин “Fc-рецептор” или “FcR” также включает неонатальный рецептор, FcRn, который отвечает за перенос IgG матери в плод (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)) и регуляцию гомеостаза иммуноглобулинов. Известны методы измерения связывания с FcRn (см., например, публикации Ghetie and Ward., Immunol. Today 18(12):592-598 (1997); Ghetie et al., Nature Biotechnology, 15(7):637-640 (1997); Hinton et al., J. Biol. Chem. 279(8):6213-6216 (2004); WO 2004/92219 (Hinton et al.).
Связывание с FcRn человека in vivo и время полужизни в кровяном русле полипептидов, связывающихся с высокой степенью сродства с FcRn человека, можно исследовать, например, в трансгенных мышах, линиях трансфицированных клеток человека, экспрессирующих FcRn человека, или в приматах, которым вводят полипептиды с вариантной Fc-областью. В публикации WO 2000/42072 (Presta) описаны варианты антител с повышенным или пониженным связыванием с Fc-рецепторами. См. также, например, публикацию Shields et al., J. Biol. Chem. 9(2):6591-6604 (2001).
Термин “комплементзависимая цитотоксичность” или “CDC” означает лизис клетки-мишени в присутствии комплемента. Классический путь активации комплемента инициируется в результате связывания первого компонента системы комплементов (C1q) с антителами (соответствующего подкласса), связанными с родственным антигеном. Для определения активации комплемента может быть выполнен анализ CDC, описанный, например, в публикации Gazzano-Santoro et al., Immunol. Methods 202:163 (1996). Варианты полипептидов с измененными аминокислотными последовательностями Fc-области (полипептиды с вариантной Fc-областью) и повышенной или пониженной C1q-связывающей способностью описаны, например, в патенте США № 6194551 В1 и WO 1999/51642. См. также, например, публикацию Idusogie et al., J. Immunol. 164:4178-4184 (2000).
Антитело с “созревшей аффинностью” является антителом с одним или несколькими изменениями в одной или нескольких CDR-областях, что вызывает повышение сродства антитела к антигену по сравнению с материнским антителом, в котором отсутствуют такие изменения. В одном варианте осуществления изобретения антитело с созревшей аффинностью обладает наномолярным или даже пикомолярным сродством к антигену-мишени. Антитела с созревшей аффинностью получают методами, известными в данной области. В публикации Marks et al., Bio/Technology 10:779-783 (1992) описано созревание аффинности путем перестановки VH и VL областей. Неспецифический мутагенез остатков CDR и/или каркасной области описан в публикациях: Barbas et al., Proc. Nat. Acad. Sci., USA 91:3809-3813 (1994); Schier et al., Gene 169:147-155 (1995); Yelton et al., J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); и Hawkins et al., J. Mol. Biol. 226:889-896 (1992).
Термин “гибкий линкер” в использованном здесь значении означает пептид, который включает два или более аминокислотных остатков, связанных пептидной связью, и обеспечивает большую свободу вращения для двух связанных полипептидов (таких как две Fd-области). Такая свобода вращения позволяет двум или более антигенсвязывающим сайтам, соединенным гибким линкером, более эффективно достигать антигена-мишени. Примеры приемлемых пептидных последовательностей гибких линкеров включают gly-ser, gly-ser-gly-ser (SEQ ID NO:18), ala-ser и gly-gly-gly-ser (SEQ ID NO:19).
“Домен димеризации” образуется в результате связывания по меньшей мере двух аминокислотных остатков (обычно остатков цистеина) или по меньшей мере двух пептидов или полипептидов (которые могут иметь одинаковые или разные аминокислотные последовательности). Пептиды или полипептиды могут взаимодействовать друг с другом при помощи ковалентного и/или нековалентного связывания. Примеры доменов димеризации включают Fc-область, шарнирную область, СН3-область, СН4-область, спаренную СН1-CL область, “область контакта” с созданным “выступом” и/или “выпуклостью”, описанную в патенте США № 5821333, который включен в настоящее описание изобретения в качестве ссылки, лейциновую “застежку-молнию” (например, лейциновую “застежку-молнию” jun/fos (см. публикацию Kostelney et al., J. Immunol., 148:1547-1553 (1992)) или лейциновую “застежку-молнию” GCN4 дрожжей), изолейциновую “застежку-молнию”, спаренные димеры рецепторов (например, рецептор интерлейкина-8 (IL-8R) и гетеродимеры интегрина, такие как LFA-1 и GPIIIb/IIIa) или их области димеризации, полипептиды димерных лигандов (например, фактор роста нервов (NGF), нейротрофин-3 (NT-3), интерлейкин-8 (IL-8), эндотелиальный фактор роста сосудов (VEGF), VEGF-C, VEGF-D, члены PDGF и нейротрофический фактор головного мозга (BDNF); см. публикации Arakawa et al., J. Biol. Chem. 269(45):27833-27839 (1994) и Radziejewski et al., Biochem. 32(48):1350 (1993)) или их области димеризации, два остатка цистеина, способные образовывать дисульфидную связь, два пептида или полипептида, каждый из которых содержит по меньшей мере один остаток цистеина (например, от одного, двух или трех до десяти остатков цистеина), благодаря чему между указанными пептидами или полипептидами может образовываться дисульфидная связь (дополнительно именуемая “синтетическим шарниром”), и вариабельные области антитела. Наиболее предпочтительным доменом димеризации в настоящем изобретении является Fc-область или шарнирная область.
“Функциональный антигенсвязывающий сайт” антитела является сайтом, способным связывать антиген-мишень. Сродство связывания антигена антигенсвязывающего сайта необязательно является таким же сильным, как у материнского антитела, из которого был выделен антигенсвязывающий сайт, но способность связывать антиген можно измерить при помощи разных методов, известных для оценки связывания антитела с антигеном. Кроме того, сродство связывания антигена каждого антигенсвязывающего сайта поливалентного антитела необязательно должно быть таким же в количественном отношении. В многомерных антителах по настоящему изобретению число функциональных антигенсвязывающих сайтов можно определить методом ультрацентрифугирования. В соответствии с указанным методом анализа антиген-мишень и многомерное антитело объединяют в разных соотношениях и вычисляют среднюю молекулярную массу комплексов, принимая во внимание разное число функциональных антигенсвязывающих сайтов. Полученные теоретические значения сравнивают с фактическими экспериментальными данными, полученными для определения числа функциональных антигенсвязывающих сайтов.
Антитело, обладающее “биологическим свойством” установленного антитела, является таким антителом, которое обладает одним или несколькими биологическими свойствами данного антитела, которые отличают его от других антител, связывающихся с тем же антигеном.
Для поиска антител, которые связываются с эпитопом на антигене, связанном представляющим интерес антителом, может быть выполнен стандартный перекрестноблокирующий анализ, аналогичный описанному в публикации Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988).
Термин “эпитоп” означает центры связывания для (моноклональных или поликлональных) антител на белковых антигенах.
В использованном здесь значении термин “лечение” означает метод получения благоприятных или желаемых клинических результатов. В соответствии с целями настоящего изобретения благоприятные или желаемые клинические результаты включают, не ограничиваясь ими, ослабление симптомов, уменьшение тяжести заболевания, стабилизированное (то есть не ухудшающееся) состояние болезни, задержку или замедление прогрессирования болезни, улучшение или временное ослабление проявления болезни и ремиссию (частичную или полную), обнаруживаемую или необнаруживаемую. Термин “лечение” может также означать продление времени выживания по сравнению с ожидаемым выживанием при отсутствии лечения. Термин “лечение” означает вмешательство, выполняемое с целью предотвращения развития или изменения патологии нарушения. Таким образом, термин “лечение” означает как терапевтическое лечение, так и профилактические или превентивные меры. Субъектами, нуждающимися в лечении, являются такие субъекты, у которых уже диагностировано нарушение, а также субъекты, у которых необходимо предотвратить возникновение нарушения. В частности, лечение может быть направлено на предотвращение, замедление или уменьшение патологии дегенерации или поражения клеток, такой как патология заболевания или состояний, ассоциированных с метастазированием опухоли, миграцией опухолевых клеток и/или активацией Cd11b+Grl+ клеток.
Термин “эффективное количество” или “терапевтически эффективное количество” означает количество лекарственного средства, необходимое для эффективного лечения заболевания или нарушения у субъекта. В определенных вариантах осуществления изобретения эффективное количество является количеством, достаточным для достижения благоприятных или желаемых терапевтических (в том числе профилактических) результатов. Эффективное количество может быть введено один или несколько раз. В определенных вариантах осуществления изобретения эффективное количество означает количество, позволяющее при вводимых дозах и в течение необходимых периодов времени достичь желаемого терапевтического или профилактического результата. Терапевтически эффективное количество вещества/молекулы по настоящему изобретению может изменяться в зависимости от таких факторов, как состояние болезни, возраст, пол, масса тела субъекта и способности данного вещества/молекулы вызывать желаемую реакцию у субъекта. Терапевтически эффективным количеством является такое количество, в котором любые токсические или вредные эффекты данного вещества/молекулы перевешиваются терапевтически благоприятным воздействием. В случае рака эффективное количество лекарственного средства может уменьшить число раковых клеток, сократить объем опухоли, ингибировать (то есть замедлить в некоторой степени или практически прекратить) инфильтрацию раковых клеток в периферические органы, ингибировать (то есть замедлить в некоторой степени или практически прекратить) метастазирование опухоли, подавить в некоторой степени рост опухоли, обеспечить лечение опухоли и/или ослабить в некоторой степени один или несколько симптомов, ассоциированных с данным нарушением. Лекарственное средство может быть цитостатическим и/или цитотоксическим в зависимости от степени, в которой оно может предотвращать рост и/или уничтожать существующие раковые клетки.
Термин “профилактически эффективное количество” означает количество, позволяющее при вводимых дозах и в течение необходимых периодов времени достичь желаемого профилактического результата. Поскольку профилактическая доза используется для введения субъектам до возникновения заболевания или на ранней стадии заболевания, то профилактически эффективное количество обычно, но не обязательно, меньше терапевтически эффективного количества.
В случае предраковых, доброкачественных опухолей или опухолей на ранней или поздней стадии развития терапевтически эффективное количество ингибитора развития кровеносных сосудов может сократить число раковых клеток, уменьшить объем первичной опухоли, ингибировать (то есть замедлить в некоторой степени и предпочтительно прекратить) инфильтрацию раковых клеток в периферические органы, подавить (то есть замедлить в некоторой степени или предпочтительно прекратить) метастазирование опухоли, ингибировать или замедлить в некоторой степени рост или прогрессирование опухоли и/или ослабить в некоторой степени один или несколько симптомов, ассоциированных с нарушением. Лекарственное средство может быть цитостатическим и/или цитотоксическим в зависимости от степени, в которой оно может предотвращать рост и/или уничтожать существующие раковые клетки.
Термин “индивидуум”, “субъект” или “больной” означает позвоночное. В определенных вариантах осуществления изобретения позвоночное является млекопитающим. Млекопитающие включают, не ограничиваясь ими, сельскохозяйственных животных (таких как коровы), спортивных животных, домашних животных (таких как кошки, собаки и лошади), приматов, мышей и крыс. В определенных вариантах осуществления изобретения млекопитающее является человеком.
Термин “поддерживающая терапия” означает схему лечения, назначаемую для уменьшения вероятности рецидива или прогрессирования заболевания. Поддерживающая терапия может проводиться в течение любого периода времени, включая длительные периоды времени, например, в течение всей жизни субъекта. Поддерживающая терапия может проводиться после первичного лечения или совместно с первичным или дополнительным лечением. Дозы, используемые в поддерживающей терапии, могут изменяться и включать более низкие дозы по сравнению с дозами, используемыми в других типах лечения.
Термин “вспомогательная противоопухолевая терапия” или “предоперационная терапия” в использованном здесь значении означает лечение, проводимое до выполнения хирургической операции. Целью вспомогательной противоопухолевой терапии является проведение неотложного системного лечения, позволяющего уничтожить микрометастазы, которые в противном случае будут пролиферировать при проведении после хирургической операции системного лечения. Вспомогательная противоопухолевая терапия может также помочь уменьшить объем опухоли, благодаря чему могут быть полностью удалены ранее не подлежавшие удалению опухоли или сохранены части органов и их функции. Кроме того, вспомогательная противоопухолевая терапия позволяет оценить эффективность лекарственных средств in vivo, что может способствовать выбору последующих методов лечения.
Термин “вспомогательная терапия” в использованном здесь значении означает лечение, проводимое после выполнения хирургической операции при отсутствии остаточных признаков заболевания с целью уменьшения риска рецидива заболевания. Целью вспомогательной терапии является предотвращение рецидива рака и, следовательно, уменьшение вероятности смерти от рака.
Термин “стандартная” химиотерапия в использованном здесь значении означает химиотерапевтические средства, обычно используемые для лечения конкретного рака.
Термин “радикальная хирургическая операция” означает полное удаление опухоли и окружающей ткани, а также любых пораженных лимфатических узлов.
“Операбельный” рак является раком, ограниченным первичным органом и подлежащим хирургическому удалению.
Термин “опухоль” в использованном здесь значении означает рост и пролиферацию всех опухолевых клеток, злокачественных или доброкачественных, и все предраковые и раковые клетки и ткани. Термины “рак”, “раковый”, “пролиферативное нарушение клеток”, “пролиферативное нарушение” и “опухоль” не являются взаимоисключающими в настоящем описании изобретения.
Опухоль может быть солидной опухолью, несолидной опухолью или опухолью мягких тканей. Примеры опухолей мягких тканей включают лейкоз (например, хронический миелолейкоз, острый миелолейкоз, острый лимфобластный лейкоз взрослых, острый лимфобластный лейкоз зрелых В-клеток, хронический лимфоцитарный лейкоз, полиморфоцитарный лейкоз или волосатоклеточный лейкоз) или лимфому (например, неходжкинскую лимфому, Т-клеточную лимфому кожи или болезнь Ходжкина). Солидная опухоль включает любой рак тканей тела, отличных от крови, костного мозга или лимфатической системы. Солидные опухоли можно дополнительно разделить на опухоли эпителиального и неэпителиального происхождения. Примеры солидных опухолей включают опухоли ободочной кишки, молочной железы, предстательной железы, легкого, почки, печени, поджелудочной железы, яичника, головы и шеи, полости рта, желудка, двенадцатиперстной кишки, тонкой кишки, толстой кишки, желудочно-кишечного тракта, ануса, желчного пузыря, губы, носоглотки, кожи, матки, мужских половых органов, органов мочевыделения, мочевого пузыря и кожи. Солидные опухоли неэпителиального происхождения включают саркомы, опухоли головного мозга и опухоли костей.
Термины “рак” и “раковый” служат для описания физиологического состояния у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Примеры рака включают, не ограничиваясь ими, карциному, лимфому, бластому, саркому и лейкоз или лимфоидные злокачественные новообразования. Более конкретные примеры таких раков включают, не ограничиваясь ими, плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легкого, в том числе мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточный рак легкого, рак брюшины, печеночно-клеточный рак, рак желудка, включающий рак желудочно-кишечного тракта и рак стромы желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, рак мочевых путей, гепатому, рак молочной железы, рак ободочной кишки, рак прямой кишки, колоректальный рак, рак эндометрия или матки, рак слюнной железы, рак почки, рак предстательной железы, рак женских наружных половых органов, рак щитовидной железы, карциному печени, карциному ануса, рак полового члена, меланому, поверхностный рак, злокачественную меланому лентиго, лентикулярные меланомы, узелковые меланомы, множественную миелому и В-клеточную лимфому (включающую низкодифференцированную/фолликулярную неходжкинскую лимфому (NHL); В-клеточную (SL) NHL; среднедифференцированную/ фолликулярную NHL; среднедифференцированную генерализованную NHL; высокодифференцированную иммунобластную NHL; высокодифференцированную лимфобластную NHL; высокодифференцированную мелкоклеточную NHL; генерализованную NHL; лимфому клеток коры головного мозга; обусловленную СПИДом лимфому и макроглобулинемию Вальденстрема); хронический лимфолейкоз (CLL); острый лимфобластный лейкоз (ALL); волосатоклеточный лейкоз; хронический миелобластный лейкоз и посттрансплантационное лимфопролиферативное нарушение (PTLD), а также аномальную пролиферацию сосудов, ассоциированную с факоматозом, отек (ассоциированный с опухолями головного мозга), синдром Мейгса, рак головного мозга, рак головы и шеи и ассоциированные метастазы. В определенных вариантах осуществления изобретения рак, подлежащий лечению антителом против G-CSF, антителом против Bv8, антителом против PKR1 или любой их комбинацией, включает рак молочной железы, колоректальный рак, рак прямой кишки, немелкоклеточный рак легкого, глиобластому, неходжкинскую лимфому (NHL), рак почки, рак предстательной железы, меланому, рак печени, рак поджелудочной железы, саркому мягких тканей, саркому Капоши, карциноидную саркому, рак головы и шеи, рак яичника и множественную миелому. В некоторых вариантах осуществления изобретения рак выбирают из группы, состоящей из мелкоклеточного рака легкого, глиобластомы, нейробластомы, меланомы, рака молочной железы, рака желудка, колоректального рака (CRC) и печеночно-клеточного рака. В некоторых вариантах осуществления изобретения рак выбирают из группы, состоящей из немелкоклеточного рака легкого, колоректального рака, рака почки, рака яичника, рака предстательной железы, глиобластомы и рака молочной железы, включая метастазирующие формы указанных раков.
Термин “рак” означает совокупность пролиферативных нарушений, которые включают, не ограничиваясь ими, предраковый рост тканей, доброкачественные опухоли, злокачественные опухоли и дремлющие опухоли. Доброкачественные опухоли постоянно локализованы в месте возникновения и не обладают способностью инфильтрации, проникновения или метастазирования в удаленные части тела. Злокачественные опухоли проникают в окружающие ткани и разрушают такие ткани. Указанные опухоли могут также приобрести способность отделяться от места возникновения и распространяться в другие части тела (метастазировать) обычно с кровотоком или по лимфатической системе в местах расположения лимфатических узлов. Дремлющие опухоли являются неактивными опухолями, в которых опухолевые клетки присутствуют, но опухоль не прогрессирует. Первичные опухоли классифицируют по типу ткани, в которой они возникают; метастазирующие опухоли классифицируют по типу ткани, из которой выделены раковые клетки. С течением времени клетки злокачественной опухоли становятся более аномальными и менее похожими на нормальные клетки. Такое изменение внешнего вида раковых клеток именуется степенью развития опухоли, при этом раковые клетки определяют как хорошо дифференцированные, умеренно дифференцированные, плохо дифференцированные или недифференцированные. Хорошо дифференцированные клетки имеют нормальный внешний вид и подобны нормальным клеткам, из которых они образовались. Недифференцированные клетки являются настолько измененными клетками, что уже невозможно определить происхождение таких клеток.
Эпителиальные раки обычно развиваются от доброкачественной опухоли до прединвазивной стадии (например, карциномы in situ) и злокачественного рака, который проникает через базальную мембрану и поражает субъэпителиальную строму.
Термин “дисплазия” означает любой аномальный рост или развитие ткани, органа или клеток. В определенных вариантах осуществления изобретения дисплазия представляет собой высокую степень развития или предраковое состояние.
Термин “резистентная опухоль” или “VEGF-независимая опухоль” означает рак, раковые клетки или опухоль, которая совершенно не реагирует, перестает реагировать или характеризуется снижением реакции в процессе проведения противораковой терапии на противораковые средства, включающие по меньшей мере антагонист VEGF. В определенных вариантах осуществления изобретения резистентная опухоль является опухолью, устойчивой к лечению антителами против VEGF. В одном варианте осуществления изобретения антитело против VEGF является бевацизумабом. В определенных вариантах осуществления изобретения резистентная опухоль является опухолью, которая не реагирует на противораковую терапию, включающую применение по меньшей мере антагониста VEGF. В определенных вариантах осуществления изобретения резистентная опухоль является опухолью, которая изначально не реагирует или является устойчивой к противораковой терапии, включающей применение по меньшей мере антагониста VEGF. В определенных вариантах осуществления изобретения резистентная опухоль является опухолью, которая после первоначальной сильной реакции на противораковую терапию, включающую применение по меньшей мере антагониста VEGF, возобновляет рост несмотря на продолжающееся проведение противораковой терапии.
Термин “не поддающийся лечению” означает устойчивость или отсутствие реакции заболевания или состояния на лечение (например, число злокачественных плазматических клеток увеличивается даже при проведении лечения). В определенных вариантах осуществления изобретения термин “не поддающийся лечению” означает устойчивость или отсутствие реакции на любое предшествующее лечение, которое включает применение, не ограничиваясь ими, антагониста VEGF, средств, препятствующих развитию кровеносных сосудов, и химиотерапевтических средств. В определенных вариантах осуществления изобретения термин “не поддающийся лечению” означает изначальное отсутствие реакции заболевания или состояния на любое предшествующее лечение, включающее применение антагониста VEGF, средств, препятствующих развитию кровеносных сосудов, и/или химиотерапевтических средств. В определенных вариантах осуществления изобретения антагонист VEGF является антителом против VEGF.
Термин “рецидив” означает возврат заболевания субъекта к состоянию до лечения, в частности, возврат симптомов после явного или частичного выздоровления. В определенных вариантах осуществления изобретения рецидив означает процесс возврата к состоянию, имевшему место до лечения, которое включает применение, не ограничиваясь ими, антагониста VEGF, средств, препятствующих развитию кровеносных сосудов, и химиотерапевтических средств. В определенных вариантах осуществления изобретения рецидив означает процесс возврата к состоянию после первоначальной сильной реакции на противораковую терапию, включающую применение антагониста VEGF, средств, препятствующих развитию кровеносных сосудов, и/или химиотерапевтических средств. В определенных вариантах осуществления изобретения антагонист VEGF является антителом против VEGF.
Термин “противораковая терапия” означает терапию, применяемую для лечения рака. Примеры противораковых терапевтических средств включают, не ограничиваясь ими, химиотерапевтические средства, ингибиторы роста, цитотоксические агенты, средства, используемые в лучевой терапии, средства, препятствующие развитию кровеносных сосудов, апоптозные средства, антитубулиновые средства и другие средства, применяемые для лечения рака, такие как антитела против HER-2, антитела против CD20, антагонист рецептора эпидермального фактора роста (EGFR) (например, ингибитор тирозинкиназы), ингибитор HER1/EGFR (например, эрлотиниб (TARCEVA®), ингибиторы тромбоцитарного фактора роста (например, GLEEVEC® (мезилат иматиниба)), ингибитор СОХ-2 (например, целекоксиб), ERBITUX® (цетуксимаб, имклон), интерфероны, цитокины, антагонисты (например, нейтрализующие антитела), связывающиеся с одной или несколькими следующими мишенями, такими как рецепторы ErbB2, ErbB3, ErbB4, PDGFR-бета, BlyS, APRIL, BCMA или VEGF, TRAIL/Apo2, другие биоактивные и органические химические вещества и т.д. В объем настоящего изобретения также входят комбинации указанных средств.
Термин “противоопухолевая композиция” означает композицию, применяемую для лечения рака, которая включает по меньшей мере одно активное терапевтическое средство, например, “противораковое средство”. Примеры терапевтических средств (противораковых средств) включают, не ограничиваясь ими, химиотерапевтические средства, ингибиторы роста, цитотоксические агенты, средства, используемые в лучевой терапии, средства, препятствующие развитию кровеносных сосудов, апоптозные средства, антитубулиновые средства, токсины и другие средства, применяемые для лечения рака, например, нейтрализующее антитело против VEGF, антагонист VEGF, антитело против HER-2, антитело против CD20, антагонист рецептора эпидермального фактора роста (EGFR) (например, ингибитор тирозинкиназы), ингибитор HER1/EGFR, эрлотиниб, ингибитор СОХ-2 (например, целекоксиб), интерфероны, цитокины, антагонисты (например, нейтрализующие антитела), связывающиеся с одним или несколькими рецепторами ErbB2, ErbB3, ErbB4 или VEGF, ингибиторы тирозинкиназы рецепторов для тромбоцитарного фактора роста (PDGF) и/или фактор самоподдержания стволовых клеток (SCF) (например, мезилат иматиниба (Gleevec® Novartis)), TRAIL/Apo2, другие биоактивные и органические химические вещества и т.д. В объем настоящего изобретения также входят комбинации указанных средств.
Термин “цитотоксический агент” в использованном здесь значении означает вещество, которое ингибирует или препятствует выполнению функции клеток и/или вызывает разрушение клеток. В определение данного термина входят радиоактивные изотопы (например,211At,131I,125I,90Y,186Re,188Re,153Sm,212Bi,32P и радиоактивные изотопы Lu), химиотерапевтические средства и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, в том числе их фрагменты и/или варианты.
Термин “ингибитор роста” в использованном здесь значении означает соединение или композицию, ингибирующую рост клетки in vitro и/или in vivo. Таким образом, ингибитор роста может быть ингибитором, который существенно уменьшает процентное число клеток в S-фазе. Примеры ингибиторов роста включают средства, блокирующие развитие клеточного цикла (на стадии, отличной от S-стадии), в частности, средства, которые блокируют G1 и вызывают прекращение клеточного цикла в М-фазе. Классические блокаторы М-фазы включают средства на основе барвинка (винкристин и винбластин), TAXOL® и ингибиторы topo II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Средства, блокирующие G1, также вызывают прекращение клеточного цикла в S-фазе, например, ДНК-алкилирующие средства, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-С. С дополнительной информацией по данному вопросу можно ознакомиться в публикации The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, entitled “Cell cycle regulation, oncogenes, and antineoplastic drugs” by Murakami et al. (W.B. Saunders: Philadelphia, 1995), в частности, стр.13.
“Химиотерапевтическое средство” является химическим соединением, предназначенным для лечения рака. Примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид CYTOXAN®; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включающие альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (в частности, буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (в том числе синтетический аналог топотекан (HYCAMTIN®), СРТ-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (в том числе его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (в том числе синтетические аналоги, KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урацилиприт, нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности, калихеамицин гамма 1I и калихеамицин омега I1 (см., например, публикацию Agnew, Chem. Intl. Ed. Engl., 33:183-186 (1994)); динемицин, в том числе динемицин А, эсперамицин, а также хромофор неокарциностатин и родственные хромофоры энедииновых антибиотиков хромопротеина), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицин, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (в том числе ADRIAMYCIN®, морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин, инъецируемые липосомы на основе гидрохлорида доксорубицина (DOXIL®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофенольная кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; пеметрексед (ALIMTA®); гемицитабин (GEMZAR®); антиметаболиты, такие как метотрексат, гемцитабин (GEMZAR®), тегафур (UFTORAL®), капецитабин (XELODA®), эпотилон и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; ангалоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; антиадренергические средства, такие как аминоглутетимид, митотан, трилостан; восполнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамид-гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демекольцин; диазиквон; элфорнитин; ацетат эллиптиния; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидаимин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; комплекс полисахарида PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2”-трихлортриэтиламин; трихотецены (в частности, токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин (ELDISINE®, FILDESIN®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (”Ara-C”); тиотепа; таксоиды, например, паклитаксел (TAXOL®), препарат паклитаксела из наночастиц альбумина (ABRAXANE®) и доксетаксел (TAXOTERE®); хлоранбуцил; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (VELBAN®); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ONCOVIN®); оксалиплатин; лейкововин; винорелбин (NAVELBINE®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; фармацевтически приемлемые соли, кислоты или производные вышеуказанных средств, а также комбинации двух или более вышеуказанных средств, такие как СНОР, аббревиатура комбинированной терапии, включающей циклофосфамид, доксорубицин, винкристин и преднизолон, и FOLFOX, аббревиатура схемы лечения, включающей оксалиплатин (ELOXATIN™) в сочетании с 5-FU и лейкововином.
В определение данного термина также входят антигормональные средства, регулирующие, уменьшающие, блокирующие или ингибирующие действие гормонов, способных стимулировать рост рака, которые часто назначают в виде системного или общего лечения. Указанные средства могут быть самими гормонами. Примеры таких средств включают антиэстрогены и селективные модуляторы рецепторов эстрогенов (SERM), включающие, например, тамоксифен (в том числе тамоксифен NOLVADEX®), ралоксифен (EVISTA®), дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (FARESTON®); антипрогестероны; средства, снижающие уровень рецепторов эстрогена (ERD); средства, подавляющие или блокирующие функцию яичников, например, агонисты релизинг-фактора лютеинизирующего гормона (LHRH), такие как ацетат лейпролида (LUPRON® и ELIGARD®), ацетат госерелина, ацетат бусерелина и триптерелин; другие антиандрогенные средства, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, ингибирующие фермент ароматазу, которые регулируют продуцирование экстрогенов в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола (MEGASE®), эксеместан (AROMASIN®), форместан, фадрозол, ворозол (RIVISOR®), летрозол (FEMARA®) и анастрозол (ARIMIDEX®). Кроме того, в такое определение химиотерапевтических средств входят бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат (DIDROCAL®), NE-58095, золедроновая кислота/золедронат (ZOMETA®), алендронат (FOSAMAX®), памидронат (AREDIA®), тилудронат (SKELID®) или ризедронат (ACTONEL®), а также троксацитабин (аналог 1,3-диоксоланнуклеозидцитозина); антисмысловые олигонуклеотиды, ингибирующие экспрессию генов в сигнальных путях, определяющих пролиферацию аберрантных клеток, такие как, например, РКС-альфа, Raf, H-Ras, и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE® и вакцины для генотерапии, например, вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; ингибитор топоизомеразы 1 (например, LURTOTECAN®); rmRH (например, ABARELIX®); дитозилат лапатиниба (двойной низкомолекулярный ингибитор тирозинкиназы, включающий ErbB-2 и EGFR, известный также как GW572016); ингибиторы СОХ-2, такие как целекоксиб (CELEBREX®; 4-(5-(4-метилфенил)-3-(трифторметил)-1Н-пиразол-1-ил)бензолсульфонамид; и фармацевтически приемлемые соли, кислоты или производные вышеуказанных средств.
Термин “цитокин” является общим термином, служащим для обозначения белков, выделяемых одной популяцией клеток, которые воздействуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. К цитокинам относятся гормоны роста, такие как гормон роста человека, N-метиониловый гормон роста человека и гормон роста крупного рогатого скота; паращитовидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреостимулирующий гормон (TSH) и лютеинизирующий гормон (LH); фактор роста печени; фактор роста фибробластов; пролактин; плацентарный лактоген; альфа- и бета-фактор некроза опухолей; ингибитор муллериана; пептид, ассоциированный с гонадотропином мыши; ингибин; активин; эндотелиальные факторы роста сосудов (например, VEGF, VEGF-B, VEGF-C, VEGF-D, VEGF-E); плацентарный фактор роста (PlGF); тромбоцитарные факторы роста (PDGF, например, PDGFA, PDGFB, PDGFC, PDGFD); интегрин; тромбопоэтин (ТРО); факторы роста нервов, такие как альфа-NGF; тромбоцитарный фактор роста; трансформирующие факторы роста (TGF), такие как альфа-TGF и бета-TGF; инсулиноподобный фактор роста I и II; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, такие как альфа-, бета- и гамма-интерферон, колониестимулирующие факторы (CSF), такие как CSF макрофагов (М-CSF); CSF гранулоцитов и макрофагов (GM-CSF) и CSF гранулоцитов (G-CSF); интерлейкины (IL), такие как IL-1, альфа-IL-1, бета-IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-30; секретоглобин/утероглобин; онкостатин М (OSM); фактор некроза опухолей, такой как альфа-TNF или бета-TNF; и другие полипептидные факторы, включающие LIF и общий лиганд (KL). В использованном здесь значении термин “цитокин” означает белки, полученные из природных источников или из культуры рекомбинантных клеток, и биологически активные эквиваленты цитокинов с нативной последовательностью.
Термин “пролекарство” в значении, использованном в настоящей заявке, означает предшественник или производную форму фармацевтически активного вещества, которая является менее цитотоксичной для опухолевых клеток по сравнению с исходным лекарственным средством и может быть ферментативно активирована или превращена в более активную исходную форму. См., например, публикации Wilman, "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, 14, pp. 375-382, 615th Meeting Belfast (1986) и Stella et al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery," Directed Drug Delivery, Borchardt et al., (ed.), pp. 247-267, Humana Press (1985). Пролекарства по настоящему изобретению включают, не ограничиваясь ими, фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидсодержащие пролекарства, пролекарства, модифицированные D-аминокислотой, гликозилированные пролекарства, бета-лактамсодержащие пролекарства, необязательно замещенные феноксиацетамидсодержащие пролекарства или необязательно замещенные фенилацетамидсодержащие пролекарства, 5-фторцитозин и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активный цитотоксический свободный агент. Примеры цитотоксических агентов, из которых может быть получена пролекарственная форма, пригодная для использования в настоящем изобретении, включают, не ограничиваясь ими, вышеописанные химиотерапевтические средства.
“Ангиогенный фактор или агент” является фактором роста, который стимулирует развитие кровеносных сосудов, например, стимулирует ангиогенез, рост эндотелиальных клеток, устойчивость кровеносных сосудов и/или образование сосудов и т.д. Например, ангиогенные факторы включают, не ограничиваясь ими, VEGF и члены семейства VEGF, PlGF, семейство PDGF, семейство факторов роста фибробластов (FGF), лиганды TIE (ангиопротеины), эфрины, ANGPTL3, ANGPTL4 и т.д. В определение данного термина также входят факторы, ускоряющие заживление ран, такие как гормон роста, инсулиноподобный фактор роста I (IGF-I), VIGF, эпидермальный фактор роста (EGF), CTGF и члены его семейства, TGF-α и TGF-β. См., например, публикации Klagsbrun and D'Amore, Annu. Rev. Physiol., 53:217-39 (1991); Streit and Detmar, Oncogene, 22:3172-3179 (2003); Ferrara & Alitalo, Nature Medicine 5(12):1359-1364 (1999); Tonini et al., Oncogene, 22:6549-6556 (2003) (например, в таблице 1 приведены ангиогенные факторы), и Sato, Int. J. Clin. Oncol., 8:200-206 (2003).
Термин “средство, препятствующее развитию кровеносных сосудов” или “ингибитор развития кровеносных сосудов” означает низкомолекулярное вещество, полинуклеотид, полипептид, выделенный белок, рекомбинантный белок, антитело, конъюгаты или их слитые белки, которые прямо или непрямо ингибируют развитие кровеносных сосудов, образование сосудов или нежелательную проницаемость сосудов. Например, средство, препятствующее развитию кровеносных сосудов, является антителом или другим антагонистом вышеуказанного ангиогенного средства, например, антителами к VEGF, антителами к рецепторам VEGF, малыми молекулами, блокирующими передачу сигналов рецептора VEGF (например, PTK787/ZK2284, SU6668, SUTENT/SU11248 (малат сунитиниба), AMG706, сорафениб (NEXAVAR®), акситиниб и пазопаниб). Средства, препятствующие развитию кровеносных сосудов, также включают природные ингибиторы развития кровеносных сосудов, например, ангиостатин, эндостатин и т.д. См., например, публикации Klagsbrun and D'Amore, Annu. Rev. Physiol., 53:217-39 (1991); Streit and Detmar, Oncogene, 22:3172-3179 (2993) (например, в таблице 3 приведены терапевтические средства, препятствующие развитию кровеносных сосудов, применяемые для лечения злокачественной меланомы); Ferrara & Alitalo, Nature Medicine 5(12):1359-1364 (1999); Tonini et al., Oncogene, 22:6549-6556 (2993) (например, в таблице 2 приведены факторы, препятствующие развитию кровеносных сосудов); и Sato, Int. J. Clin. Oncol., 8:200-206 (2003) (например, в таблице 1 приведены средства, препятствующие развитию кровеносных сосудов, применяемые в клинических исследованиях).
Термин “иммуносупрессорный агент” в использованном здесь значении означает вещества, которые подавляют или маскируют иммунную систему подвергаемого лечению млекопитающего. В определение данного термина входят вещества, которые подавляют продуцирование цитокинов, снижают или подавляют экспрессию аутоантигенов или маскируют антигены МНС. Примеры таких агентов включают 2-амино-6-арил-5-замещенные пиримидины (см. патент США № 4665077); нестероидные противовоспалительные средства (NSAID); ганцикловир, такролимус, глюкокортикоиды, такие как кортизол или альдостерон, противовоспалительные средства, такие как ингибитор циклооксигеназы, ингибитор 5-липоксигеназы или антагонист рецепторов лейкотриена; антагонисты пурина, такие как азатиоприн или микофенолят-мофетил (MMF); алкилирующие агенты, такие как циклофосфамид; бромкриптин; даназол; дапсон; глутаровый альдегид (маскирующий антигены МНС, который описан в патенте США № 4120649); антиидиотипические антитела к антигенам МНС и фрагментам МНС; циклоспорин А; стероиды, такие как кортикостероиды, глюкокортикостероиды, или аналоги глюкокортикоидов, например, преднизон, метилпреднизолон и дексаметазон; ингибиторы дигидрофолат-редуктазы, такие как метотрексат (для перорального или подкожного введения); гидроксиклороквин; сульфасалазин; лефлуномид; антитела к цитокинам или рецепторам цитокинов, включающие антитела против альфа-, бета- или гамма-интерферона, антитела против фактора некроза опухолей (инфликсимаб или адалимумаб), иммуноадгезин против альфа-TNF (этанерцепт), антитела против бета-фактора некроза опухолей, антитела против интерлейкина-2 и антитела против рецептора IL-2; антитела против LFA-1, включающие антитела против CD11a и CD18; антитела против L3T4; гетерологичные антитела против глобулина лимфоцитов; пан-Т-клеточные антитела, предпочтительно антитела против CD3 или CD4/CD4a; растворимый пептид, содержащий LFA-3-связывающий домен (WO 1990/08187, опубликованная 26 июля 1990 г.); стрептокиназа; бета-TGF; стрептодорназа; РНК или ДНК хозяина; FK506; RS-61443; дезоксиспергуалин; рапамицин; Т-клеточный рецептор (Cohen et al., патент США № 5114721); фрагменты Т-клеточного рецептора (Offner et al., Science, 251:430-432 (1991); WO 1990/11294; Ianeway, Nature, 341:482 (1989); и WO 1991/01133); и антитела против Т-клеточных рецепторов (европейский патент 340109), такие как Т10В9.
Примерами “нестероидных противовоспалительных средств” или “NSAID” являются ацетилсалициловая кислота, ибупрофен, напроксен, индометацин, сулиндак, толметин, в том числе их соли и производные, и т.д.
Термин “патология” болезни означает все явления, которые ухудшают жизнь субъекта. В случае рака в определение данного термина входят, не ограничиваясь ими, аномальный или неконтролируемый рост клеток, метастазирование, препятствие нормальному функционированию соседних клеток, выделение цитокинов или других продуктов секреции на аномальных уровнях, подавление или обострение воспалительной или иммунологической реакции и т.д.
Введение “в комбинации с” одним или несколькими другими терапевтическими средствами включает одновременное и последовательное введение в любом порядке.
Термин “одновременно” в использованном здесь значении означает введение двух или более терапевтических средств, которое по меньшей мере частично совпадает по времени. Таким образом, одновременное введение включает схему введения лекарственных средств, в соответствии с которой введение одного или нескольких средств продолжается после прекращения введения одного или нескольких других средств.
“Постоянное” введение означает введение лекарственных средств в непрерывном режиме, в отличие от временного введения, с целью сохранения первоначального терапевтического эффекта (активности) в течение продолжительного периода времени. “Периодическое” введение представляет собой лечение, которое не является постоянным, то есть проводимым без перерывов, а скорее циклическим по своему характеру.
Термин “носители” в использованном здесь значении означает фармацевтически приемлемые носители, наполнители или стабилизаторы, которые являются нетоксичными для клетки или млекопитающего в используемых дозах и концентрациях. Физиологически приемлемым носителем часто является раствор с буферной добавкой и водным значением рН. Примеры физиологически приемлемых носителей включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включающие аскорбиновую кислоту; низкомолекулярный (менее примерно 10 остатков) полипептид; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как твин™, полиэтиленгликоль (PEG) и плюроник™.
“Липосома” является маленьким пузырьком, состоящим из разных типов липидов, фосфолипидов и/или поверхностно-активного вещества, который предназначен для доставки лекарственного средства (такого как полипептид Bv8 или антитело к нему) млекопитающему. Компоненты липосомы обычно образуют двуслойную структуру, аналогичную расположению биологических мембран в липиде.
”Малая молекула” в соответствии с определением, использованным в настоящем описании изобретения, имеет молекулярную массу менее примерно 500 Дальтон.
Термин “изменение аминокислот” означает изменение заранее определенной аминокислотной последовательности. Типичные изменения включают инсерции, замены и делеции. Термин “замена аминокислоты” означает замену существующего аминокислотного остатка в заранее определенной аминокислотной последовательности другим аминокислотным остатком.
Термин “заменяющий” аминокислотный остаток означает аминокислотный остаток, заменяющий или замещающий другой аминокислотный остаток в аминокислотной последовательности. Заменяющий остаток может быть природным или неприродным аминокислотным остатком.
Термин “инсерция аминокислоты” означает введение одного или нескольких аминокислотных остатков в заранее определенную аминокислотную последовательность. Инсерция аминокислоты может включать “инсерцию пептида”, в соответствии с которой пептид, включающий два или более аминокислотных остатка, связанных пептидной связью, вводят в заранее определенную аминокислотную последовательность. Пептид, вводимый путем инсерции аминокислоты, может быть получен при помощи неспецифического мутагенеза с созданием аминокислотной последовательности, не существующей в природе. Изменение аминокислоты “рядом с гипервариабельным участком” означает введение или замену одного или нескольких аминокислотных остатков у N-конца и/или С-конца гипервариабельного участка, при этом по меньшей мере один вводимый или заменяющий аминокислотный остаток образует пептидную связь с N-концевым или С-концевым аминокислотным остатком рассматриваемого гипервариабельного участка.
“Природный аминокислотный остаток” является остатком, кодированным генетическим кодом, который обычно выбирают из группы, состоящей из аланина (Ala), аргинина (Arg), аспарагина (Asn), аспарагиновой кислоты (Asp), цистеина (Cys), глутамина (Gln), глутаминовой кислоты (Glu), глицина (Gly), гистидина (His), изолейцина (Ile), лейцина (Leu), лизина (Lys), метионина (Met), фенилаланина (Phe), пролина (Pro), серина (Ser), треонина (Thr), триптофана (Trp), тирозина (Tyr) и валина (Val).
“Неприродный аминокислотный остаток” является аминокислотным остатком, отличным от вышеуказанных природных аминокислотных остатков, который способен ковалентно связываться со смежными аминокислотными остатками в полипептидной цепи. Примеры неприродных аминокислотных остатков включают норлейцин, орнитин, норвалин, гомосерин и другие аналоги аминокислотных остатков, описанные в публикации Ellman et al., Meth. Enzym., 202:301-336 (1991). Неприродные аминокислотные остатки могут быть созданы методами, рассмотренными в публикациях Noren et al., Science 244:182 (1989) и Ellman et al., см. выше. Указанные методы включают химическую активацию супрессорной мРНК неприродным аминокислотным остатком с последующим выполнением транскрипции и трансляции РНК in vitro.
В использованном здесь значении антитело с “высоким сродством” является антителом, имеющих значение Кd или константы диссоциации в наномолярном (нМ) диапазоне или выше. Значение Кd в “наномолярном диапазоне или выше” может быть обозначено Х нМ, где Х означает число меньше примерно 10.
Термин “сродство связывания” обычно означает суммарную силу нековалентных взаимодействий между одним связывающим центром молекулы (например, антитела) и партнером связывания (например, антигеном). За исключением особо оговоренных случаев термин “сродство связывания” в использованном здесь значении означает присущее молекуле сродство связывания, которое отражает взаимодействие в соотношении 1:1 между членами связывающейся пары (например, антитела и антигена). Сродство молекулы Х к партнеру Y обычно может быть представлено константой диссоциации (Кd), которая является обратной величиной константы ассоциации (Ка). Сродство можно измерить обычными методами, известными в данной области, в том числе методами, рассмотренными в настоящем описании изобретения. Низкоаффинные антитела обычно медленно связываются с антигеном и/или легко диссоциируют, в то время как высокоаффинные антитела обычно быстрее связываются с антигеном и/или дольше остаются связанными. В данной области известны разные методы измерения сродства связывания, и любые из указанных методов могут быть использованы в соответствии с целями настоящего изобретения. Ниже представлены специальные иллюстративные варианты осуществления изобретения, относящиеся к измерению сродства связывания.
В определенных вариантах осуществления изобретения величины “КD”, “Кd”, “Кd” или “значение Кd”, используемые в настоящем изобретении, измеряют методами определения резонанса поверхностных плазмонов в устройстве BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С на чипах с иммобилизованными антигенами СМ5 при ~10 реакционных единицах (RU). Биосенсорные чипы из карбоксиметилированного декстрана (СМ5, BIACORE, Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разводят 10 мМ ацетата натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ) перед введением со скоростью потока, равной 5 мкл/мин, для достижения примерно 10 реакционных единиц (RU) связанного белка. После введения антигена вводят 1 М раствор этаноламина для блокирования непрореагировавших групп. Для измерений кинетики несколько титров полипептида, например, полноразмерного антитела, вводят в PBS с 0,05% поверхностно-активного вещества твина-20™ (PBST) при 25°С и скорости потока, равной примерно 25 мкл/мин. Скорости ассоциации (Кon) и скорости диссоциации (Кoff) вычисляют, используя простую модель связывания Лангмуира “один к одному” (программное обеспечение оценки, версия 3.2, BIACORE®), путем одновременного совмещения сенсограмм ассоциации и диссоциации. Константу равновесной диссоциации (Кd) вычисляют в виде отношения Кoff/Kon. См., например, публикацию Chen et al., J. Mol. Biol. 293:865-881 (1999). Если скорость ассоциации превышает 106 М-1 с-1 при измерении методом определения резонанса поверхностных плазмонов, то скорость ассоциации можно определить методом тушения флуоресценции, позволяющим измерить увеличение или уменьшение интенсивности флуоресценции (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм), при 25°С с использованием 20 нМ антитела против антигена в PBS, рН 7,2, в присутствии возрастающих концентраций антигена, производя измерение в спектрометре, таком как спектрофотометр, оснащенный устройством остановки потока, (Aviv Instrument) или спектрофотометр SLM-AMINCO™ серии 8000 (ThermoSpectronic) со встряхиваемой кюветой.
Термин “нитчатый фаг” означает вирусную частицу, способную отображать на своей поверхности гетерогенный полипептид, и в определение данного термина входят, не ограничиваясь ими, f1, fd, Pf1 и М13. Нитчатый фаг может содержать селектируемый маркер, такой как тетрациклин (например, “fd-tet”). Специалистам в данной области хорошо известны разные системы отображения на нитчатом фаге (см., например, публикации Zacher et al., Gene 9:127-140 (1980), Smith et al., Science 228:1315-1317 (1985) и Parmley and Smith, Gene 73:305-318 (1988)).
Термин “пэннинг” означает несколько циклов анализа в процессе идентификации или выделения фагов, несущих соединения, такие как антитела с высоким сродством или специфичностью к мишени.
Термин “коротная интерферирующая РНК (киРНК)” означает малую двухцепочечную РНК, препятствующую экспрессии гена. киРНК опосредуют интерференцию РНК, в процессе выполнения которой двухцепочечная РНК блокирует гомологичные гены. киРНК обычно состоит из двух одноцепочечных РНК длиной около 15-25 нуклеотидов, образующих дуплекс, который может включать перекрывание одноцепочечных РНК. В результате обработки двухцепочечной РНК ферментным комплексом, например, полимеразами, происходит расщепление двухцепочечной РНК с образованием киРНК. Антисмысловая цепь киРНК использована блокирующим комплексом интерферирующей РНК (РНКи) для управления расщеплением мРНК, что позволяет стимулировать разрушение мРНК. Для блокирования специфического гена с помощью киРНК, например, в клетке млекопитающего, область спаривания оснований выбирают так, чтобы избежать возможной комплементарности с неродственной мРНК. Блокирующие комплексы РНКи известны в данной области и описаны, например, в публикациях Fire et al., Nature 391:806-811 (1998) и McManus et al., Nat. Rev. Genet. 3(10):737-47 (2002).
Термин “интерферирующая РНК (РНКи)” в использованном здесь значении означает двухцепочечную РНК, образующуюся в результате каталитического расщепления специфической мРНК, которая может быть использована для ингибирования/уменьшения экспрессии конкретного гена.
В использованном здесь значении термины “клетка”, “линия клеток” и “культура клеток” имеют взаимозаменяемые значения, и в определение всех указанных терминов входит потомство. Таким образом, термины “трансформанты” и “трансформированные клетки” означают первичную клетку субъекта и полученные из них культуры независимо от числа переносов. Кроме того, следует отметить, что ДНК всего потомства не может быть совершенно идентичной вследствие намеренных или случайных мутаций. Термин “потомство” означает любое и все потомство каждого поколения первоначально трансформированной клетки или линии клеток. В определение данного термина входит мутантное потомство, характеризующееся такой же функциональной или биологической активностью, что и первоначально трансформированная клетка. Использование других обозначений должно быть ясно из контекста.
Специалист в данной области может легко определить “строгость” реакций гибридизации, которую обычно вычисляют эмпирическим путем в зависимости от длины зонда, температуры промывки и концентрации соли. Как правило, более длинные зонды требуют более высоких температур для правильного отжига, в то время как для более коротких зондов необходимы более низкие температуры. Гибридизация обычно зависит от способности денатурированной ДНК повторно гибридизировать, когда комплементарные цепи находятся в среде ниже температуры плавления. Чем выше степень желаемой идентичности между зондом и гибридизируемой последовательностью, тем выше относительная температура, которая может быть использована. Из вышеизложенного следует, что более высокие относительные температуры делают условия реакции более строгими и более низкие температуры соответствуют менее строгим условиям реакции. Для ознакомления с более подробным описанием и объяснением строгости реакций гибридизации см. публикацию Ausubel et al., Current Protocols in Molecular Biology, Wiley Interscience Publishers (1995).
“Строгие условия гибридизации” в соответствии с определением, приведенным в настоящем описании изобретения, можно охарактеризовать следующим образом: (1) использование низкой ионной силы и высокой температуры для промывки; 0,015 М хлорида натрия/0,0015 М цитрата натрия/0,1% додецилсульфата натрия при 50°С; (2) использование во время гибридизации денатурирующего агента; 50% (об./об.) формамида и 0,1% бычьего сывороточного альбумина/0,1% фиколла/0,1% поливинилпирролидона/50 мМ натрий-фосфатного буфера при рН 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°С; или (3) использование 50% формамида, 5-кратного объема SSC (0,75 М NaCl, 0,075 М цитрата натрия), 50 мМ фосфата натрия (рН 6,8), 0,1% пирофосфата натрия, 5-кратного объема раствора Денхардта, обработанной ультразвуком ДНК спермы лосося (50 мкг/мл), 0,1% SDS и 10% сульфата декстрана при 42°С, и выполнение промывки при 42°С в 0,2-кратном объеме SSC (хлорид натрия/цитрат натрия) и 50% формамида при 55°С с последующей промывкой в строгих условиях в 0,1-кратном объеме SSC, содержащем EDTA, при 55°С.
“Умеренно строгие условия” можно охарактеризовать согласно описанию, приведенному в публикации Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press, 1989, при этом умеренно строгие условия гибридизации включают инкубацию в течение ночи при 37°С в растворе, включающем 20% формамида, 5-кратный объем SSC (150 мМ NaCl, 15 мМ тринатрийцитрата), 50 мМ фосфата натрия (рН 7,6), 5-кратный объем раствора Денхардта, 10% сульфата декстрана и 20 мг/мл денатурированной, гидродинамически фрагментированной ДНК спермы лосося, с последующей промывкой фильтров в 1-кратной объеме SSC при температуре около 37-50°С. Специалисту в данной области должно быть известно, как отрегулировать температуру, ионную силу и т.д. в соответствии с такими факторами, как длина зонда и тому подобные.
В. Подробное описание
В основе настоящего изобретения по меньшей мере частично лежит признание того, что G-CSF и Bv8 играют важную роль в клеточных и молекулярных процессах, вызывающих метастазирование опухолей.
В совместно рассматриваемой заявке № 11/692681, поданной 28 марта 2007 г., которая полностью включена в настоящее описание изобретения в качестве ссылки, описана корреляция между рекрутингом гемопоэтических клеток костного мозга и устойчивостью опухоли к лечению антителами против VEGF. В публикации совместно рассматриваемой заявки РСТ № WO 2009/039337, поданной 19 сентября 2008 г., которая полностью включена в настоящее описание изобретения в качестве ссылки, описана роль Bv8 в клеточных и молекулярных процессах, вызывающих устойчивость опухоли к лечению антителами против VEGF.
Метастазирование является главной причиной смерти от солидных опухолей. Процесс метастазирования предполагает отделение опухолевых клеток, их проникновение во внеклеточный матрикс и затем внутрь сосудов, перенос по кровеносным или лимфатическим сосудам, выделение из сосудов на новом месте и наконец образование вторичных опухолей (Nguyen, D.X. & Massague, J. Nat. Rev. Genet. 8, 341-352 (2007)). Кроме того, полученные данные позволяют предположить, что опухоли могут модифицировать удаленную микросреду до прибытия метастазирующих опухолевых клеток с целью создания так называемой “предметастатической ниши” (Psaila, B. & Lyden, D. Nat. Rev. Cancer 9, 285-293 (2009)). Способность опухолей поражать удаленные ткани позволяет раковым клеткам направленно воздействовать на определенные органы, в которых они могут инициировать рост вторичной опухоли, и подтверждает гипотезу “семени и почвы” (Paget, S., Cancer Metastasis Rev. 8(2), 98-101 (1989)). Считается, что клетки костного мозга (BMDC) являются основным типом клеток, заполняющих указанную нишу (Kaplan, R.N. et al., Nature 438, 820-827 (2005); Hiratsuka, S. et al., Nat. Cell Biol. 8, 1369-1375 (2006)).
Несмотря на участие в процессе метастазирования молекул нескольких типов (Kaplan, R.N. et al., Nature 438, 820-827 (2005); Hiratsuka, S. et al., Nat. Cell Biol. 8, 1369-1375 (2006); Yamamoto, M. et al., Cancer Res. 68, 9754-9762 (2008); Kim, S. et al., Nature 457, 102-106 (2009); Erler, J.T. et al., Cancer Cell 15, 35-44 (2009)), до сих пор полностью не известны механизмы создания опухолями указанной ниши и фактической роли данной ниши в метастазировании опухоли.
Стимуляция органоспецифических предметастатических участков является важной стадией метастазирования, но механизмы, лежащие в основе формирования предметастатической ниши, изучены не полностью. Данные, приведенные в настоящем описании изобретения, показывают, что опухоли, обладающие способностью метастазировать, секретируют колониестимулирующий фактор гранулоцитов (G-CSF), который активирует Cd11b+Grl+ клетки из костного мозга и облегчает их последующий хоминг в удаленных органах до прибытия опухолевых клеток. Экспрессия G-CSF согласуется с метастатическим потенциалом исследованных опухолей. Кроме того, данные, приведенные в настоящем описании изобретения, показывают, что G-CSF-активированные Cd11b+Grl+ клетки локально продуцируют проангиогенный белок Bv8. Лечение антителами против G-CSF или Bv8 значительно уменьшает метастазирование в легкие. Полученные данные также указывают на новую роль Bv8, способность стимулировать миграцию опухолевых клеток, которая связана с экспрессией одного из двух рецепторов Bv8 (PKR-1/GPR73). И наконец, данные, приведенные в настоящем описании изобретения, показывают, что рекомбинантного G-CSF достаточно для инициации формирования ниши и увеличения числа Cd11b+Grl+ клеток в органоспецифических метастатических участках. Таким образом повышается метастазирующая способность нескольких опухолей. Поэтому данные, приведенные в настоящем описании изобретения, позволяют предположить, что G-CSF является главным регулятором метастазирования.
С. Создание антител против G-CDF, антител против Bv8 и антител против PKR1, действующих в качестве ингибиторов развития кровеносных сосудов и метастазирования опухолей
Антитела, обнаруженные в результате выполнения анализов связывания и активности по настоящему изобретению, могут быть получены методами, известными в данной области, включая методы рекомбинантных ДНК.
(i) Получение антигенов
Для создания антител в качестве иммуногенов могут быть использованы растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами. В качестве иммуногена могут быть использованы трансмембранные молекулы, такие как рецепторы и их фрагменты (например, внеклеточный домен рецептора). Альтернативно в качестве иммуногена могут быть использованы клетки, экспрессирующие трансмембранную молекулу. Такие клетки могут быть получены из природного источника (например, линий раковых клеток) или могут представлять собой клетки, трансформированные рекомбинантными методами для экспрессии трансмембранной молекулы. Специалистам в данной области должны быть известны другие антигены и их формы, пригодные для получения антител.
(ii) Поликлональные антитела
Поликлональные антитела предпочтительно получают у животных в результате нескольких подкожных (sc) или внутрибрюшинных (ip) инъекций родственного антигена и адъюванта. Родственный антиген может быть конъюгирован с белком, который является иммуногенным для иммунизируемого вида, таким как, например, гемоцианин лимфы улитки, сывороточный альбумин, бычий тироглобулин или ингибитор соевого трипсина, с использованием бифункционального или производного агента, например, сложного эфира малеимидобензоилсульфосукцинимида (конъюгирование по остаткам цистеина), N-гидроксисукцинимида (по остаткам лизина), глутарового альдегида, янтарного ангидрида, SOCI2 или R1N=C=NR, где R и R1 являются разными алкильными группами.
Животных иммунизируют против антигена, иммуногенных конъюгатов или производных, объединяя, например, 100 мкг или 1 мкг белка или конъюгата (соответственно для кроликов или мышей) с 3 объемами полного адъюванта Фрейнда, после чего полученный раствор инъецируют внутрикожно в несколько мест. Через один месяц животных повторно иммунизируют 1/5-1/10 первоначального количества пептида или конъюгата в полном адъюванте Фрейнда при помощи подкожной инъекции в несколько мест. Через 7-14 дней у животных берут пробы крови и анализируют сыворотку в отношении титра антител. Животных продолжают иммунизировать до получения платообразных титров. Животных предпочтительно иммунизируют конъюгатом одного и того же антитела, но конъюгированного с другим белком и/или при помощи другого перекрестносшивающего реагента. Конъюгаты могут быть также получены в культуре рекомбинантных клеток в виде белковых гибридов. Кроме того, для усиления иммунной реакции также используют агрегирующие агенты, такие как квасцы.
(iii) Моноклональные антитела
Моноклональные антитела могут быть получены методом гибридом, который был впервые описан в публикации Kohler et al., Nature, 256:495 (1975), или методами рекомбинантных ДНК (патент США № 4816567). При использовании метода гибридом мышь или другое приемлемое животное-хозяин, такое как хомячок или макак, иммунизируют в соответствии с приведенным выше описанием, вызывая образование лимфоцитов, продуцирующих или способных продуцировать антитела, которые специфически связываются с белком, используемым для иммунизации. Альтернативно лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты гибридизируют с миеломными клетками, используя приемлемый гибридизирующий агент, такой как полиэтиленгликоль, для образования клетки гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Клетки гибридомы, полученные таким образом, высевают и выращивают в приемлемой культуральной среде, которая предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживание негибридизированных, материнских миеломных клеток. Например, если в материнских миеломных клетках отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (HGPRT или HPRT), культуральная среда для гибридом обычно включает гипоксантин, аминоптерин и тимидин (среда НАТ), которые предотвращают рост клеток с отсутствием HGPRT.
Предпочтительными миеломными клетками являются такие клетки, которые эффективно гибридизируют, обеспечивают устойчивое продуцирование антитела на высоком уровне выбранными антителопродуцирующими клетками и являются чувствительными к такой среде, как среда НАТ. Предпочтительными линиями миеломных клеток являются мышиные линии миеломных клеток, например, полученные из мышиных опухолей МОРС-21 и МРС-11, предоставляемых Salk Institute Cell Distribution Center, San Diego, Calif. USA, и клетки SP-2 или X63-Ag8-653, предоставляемые Американской коллекцией типовых культур, Rockville, Md., USA. Описанные в научной литературе линии миеломных клеток человека и линии гетеромиеломных клеток мыши-человека также могут быть использованы для продуцирования человеческих моноклональных антител (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой выращивают клетки гибридомы, анализируют в отношении продуцирования моноклональных антител против данного антигена. Специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяют методом иммунопреципитации или при помощи анализа связывания in vivo, такого как радиоиммуноанализ (RIA) или твердофазный иммуноферментный анализ (ELISA).
После идентификации клеток гибридомы, продуцирующих антитела с требуемой специфичностью, сродством и/или активностью, клоны могут быть субклонированы способами с ограниченным разведением и выращены стандартными методами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Культуральные среды, приемлемые для достижения указанной цели, включают, например, среду DMEM или RPMI-1640. Кроме того, клетки гибридомы могут быть выращены in vivo в виде асцитических опухолей у животных.
Моноклональные антитела, секретированные субклонами, отделяют от культуральной среды, асцитной жидкости или сыворотки стандартными методами очистки иммуноглобулинов, такими как, например, хроматография на протеин А-сефарозе, хроматография на гидроксиапатите, гель-электрофорез, диализ или аффинная хроматография.
ДНК, кодирующую моноклональные антитела, легко выделяют и секвенируют стандартными методами (например, при помощи олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи моноклональных антител). Клетки гибридомы являются предпочтительным источником такой ДНК. Выделенную ДНК можно ввести в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E.coli, клетки COS обезьян, клетки яичника китайского хомячка (СНО) или миеломные клетки, которые иначе не продуцируют белок иммуноглобулина, для синтеза моноклональных антител в рекомбинантных клетках-хозяевах. Продуцирование антител методами рекомбинантных ДНК более подробно описано ниже.
В другом варианте осуществления изобретения антитела или фрагменты антител могут быть выделены из библиотек отображения антител на фаге, созданных методами, описанными в публикации McCafferty et al., Nature 348:552-554 (1990).
В публикациях Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991) описано выделение соответственно мышиных и человеческих антител с использованием библиотек фагов. В следующих публикациях описано продуцирование высокоаффинных (нМ диапазон) человеческих антител путем перестановки цепи (Marks wt al., Bio/Technology, 10:779-783 (1992)), а также комбинаторного инфицирования и рекомбинации in vivo в качестве метода создания очень больших библиотек фагов (Waterhouse et al., Nuc. Acids Res., 21:2265-2266 (1993)). Таким образом, указанные методы являются обоснованными альтернативами традиционным методам гибридом, секретирующих моноклональные антитела, для выделения моноклональных антител.
ДНК также может быть модифицирована, например, путем введения кодирующей последовательности для константных областей тяжелой и легкой цепей человека вместо гомологичных мышиных последовательностей (патент США № 4816567; публикация Morrison, et al., Proc. Natl. Acad. Sci. USA, 81:6851 (1984)) или путем ковалентного связывания с кодирующей последовательностью иммуноглобулина всей или части кодирующей последовательности полипептида, отличного от иммуноглобулина.
Такими полипептидами, отличными от иммуноглобулинов, обычно заменяют константные области антитела или вариабельные области одного антигенсвязывающего сайта антитела с целью создания химерного двухвалентного антитела, включающего один антигенсвязывающий сайт, обладающий специфичностью к одному антигену, и другой антигенсвязывающий сайт, обладающий специфичностью к другому антигену.
(iv) Гуманизированные и человеческие антитела
Гуманизированное антитело имеет один или несколько аминокислотных остатков, введенных в него из источника, отличного от человека. Указанные аминокислотные остатки, отличные от человеческих, часто определяются как “импортные” остатки, которые обычно получают из “импортной” вариабельной области. Гуманизация может быть выполнена методом, описанным Винтером с соавторами (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Sience, 239:1534-1536 (1988)), путем замены соответствующих последовательностей человеческого антитела CDR-областями или последовательностями CDR-областей грызунов. Таким образом, такие “гуманизированные” антитела являются химерными антителами (патент США № 4816567), в которых часть интактной вариабельной области человека заменена соответствующей последовательностью вида, отличного от человека. Гуманизированные антитела обычно являются человеческими антителами, в которых некоторые остатки CDR и, возможно, некоторые остатки FR заменены остатками из аналогичных сайтов в антителах грызунов.
Выбор вариабельных областей человека как легкой, так и тяжелой цепей, используемых для создания гуманизированных антител, имеет важное значение для уменьшения антигенности. В соответствии с так называемым методом “наибольшего соответствия” последовательность вариабельной области антитела грызуна сравнивают со всей библиотекой известных последовательностей вариабельной области человека. Последовательность человека, которая ближе всего соответствует последовательности грызуна, выбирают в качестве каркасной области (FR) человека для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987)). В другом методе используют конкретную каркасную область, выделенную из консенсусной последовательности всех человеческих антител, относящихся к определенной подгруппе легких или тяжелых цепей. Одна и та же каркасная область может быть использована для нескольких разных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993)).
Важное значение имеет то, что антитела должны быть гуманизированы с сохранением высокого сродства к антигену и других благоприятных биологических свойств. В соответствии с предпочтительным методом получения гуманизированных антител выполняют анализ исходных последовательностей и разных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулина являются общедоступными и известны специалистам в данной области. Существуют компьютерные программы, иллюстрирующие и отображающие вероятные трехмерные конформационные структуры выбранных последовательностей иммуноглобулинов-кандидатов. Исследование указанных изображений позволяет анализировать вероятную роль остатков в функционировании последовательности иммуноглобулина-кандидата, то есть анализировать остатки, влияющие на способность иммуноглобулина-кандидата связываться с антигеном. Таким образом остатки каркасной области (FR) могут быть выбраны и объединены с реципиентными и импортными последовательностями с возможностью достижения требуемого свойства антитела, такого как более высокое сродство к антигену-мишени. Как правило, остатки CDR непосредственно и в большой степени влияют на связывание антигена.
Альтернативно в настоящее время могут быть созданы трансгенные животные (например, мыши), способные в результате иммунизации продуцировать полный спектр человеческих антител при отсутствии продуцирования эндогенного иммуноглобулина. Например, в научной литературе было отмечено, что гомозиготная делеция гена (J.sub.H) соединительной области тяжелой цепи антитела у химерных и гаметических мутантных мышей вызывает полное ингибирование продуцирования эндогенных антител. Введение гаметического гена иммуноглобулина человека таким гаметическим мутантным мышам вызывает продуцирование человеческих антител при антигенной стимуляции. См., например, публикации Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993); и Duchosal et al., Nature, 355:258 (1992). Человеческие антитела также могут быть получены из библиотек отображения на фаге (Hoogenboom et al., J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1991); Vaughan et al., Nature Biotech., 14:309 (1996)). Получение человеческих антител из библиотек отображения антител на фаге более подробно описано ниже.
(v) Фрагменты антител
Разработаны разные методы получения фрагментов антител. Указанные фрагменты традиционно получают в результате протеолитического расщепления интактных антител (см., например, публикации Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако в настоящее время такие фрагменты могут быть продуцированы непосредственно в рекомбинантных клетках-хозяевах. Например, фрагменты антитела могут быть выделены из рассмотренных выше библиотек отображения антител на фаге. Альтернативно Fab'-SH фрагменты могут быть выделены непосредственно из E. coli и химически связаны с образованием F(ab')2-фрагментов (Carter et al., Bio/Technology, 10:163-167 (1992)). В другом варианте осуществления изобретения, описанном в приведенном ниже примере, F(ab')2-фрагмент получают, используя лейциновую застежку-молнию GCN4 для стимуляции сборки F(ab')2 молекулы. В соответствии с другим подходом F(ab')2-фрагменты могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. Квалифицированному специалисту должны быть известны другие методы продуцирования фрагментов антител. В других вариантах осуществления изобретения выбранное антитело является одноцепочечным Fv-фрагментом (scFv). См. WO93/16185.
(vi) Мультиспецифические антитела
Мультиспецифические антитела обладают специфичностью связывания в отношении по меньшей мере двух разных эпитопов, которые обычно относятся к разных антигенам. Хотя такие молекулы обычно связываются только с двумя разными эпитопами (то есть биспецифические антитела, BsAb), в определение данного термина, использованного в настоящем описании изобретения, входят антитела с дополнительными специфичностями, в частности, триспецифические антитела. Примеры BsAb включают антитела, у которых один домен направлен против Bv8 или G-CSF и другой домен направлен против VEGF или EG-VEGF.
В данной области известны методы создания биспецифических антител. Традиционный метод продуцирования полноразмерных биспецифических антител основан на коэкспрессии двух пар тяжелых цепей-легких цепей иммуноглобулина, из которых две цепи обладают разными специфичностями (Millstein et al., Nature, 305:537-539 (1983)). Благодаря случайной реаранжировке тяжелых и легких цепей иммуноглобулина указанные гибридомы (квадромы) продуцируют потенциальную смесь из 10 разных молекул антител, из которых только одна молекула имеет правильную биспецифическую структуру. Очистка правильной молекулы, которую обычно выполняют при помощи аффинной хроматографии, является довольно сложным процессом, при этом выход продукта является низким. Аналогичные методы описаны в WO 93/08829 и публикации Traunecker et al., EMBO J., 10:3655-3659 (1991). В соответствии с другим методом вариабельные области антитела с требуемыми специфичностями связывания (антигенсвязывающие сайты антитела) гибридизируют с последовательностями константных областей иммуноглобулина. Гибридизацию предпочтительно выполняют с константной областью тяжелой цепи иммуноглобулина, включающей по меньшей мере часть шарнирной области, СН2- и СН3-области. Желательно, чтобы по меньшей мере в одном из гибридов первая константная область тяжелой цепи (СН1) содержала сайт, необходимый для связывания с легкой цепью. ДНК, кодирующие гибриды тяжелой цепи иммуноглобулина и при желании легкой цепи иммуноглобулина, вводят в отдельные экспрессирующие векторы и котрансфицируют в приемлемый организм-хозяин. Такой подход создает большую гибкость в регулировании взаимных пропорций трех полипептидных фрагментов, когда использование в конструкции трех полипептидных цепей в разных соотношениях обеспечивает оптимальный выход. Однако можно ввести кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор, когда экспрессия по меньшей мере двух полипептидных цепей в одинаковых соотношениях обеспечивает высокий выход или когда соотношения не имеют особого значения.
В определенных вариантах осуществления изобретения биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина, обеспечивающей первую специфичность связывания в одном домене, и гибридной пары тяжелая цепь-легкая цепь иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом домене. Установлено, что такая асимметричная структура облегчает отделение требуемого биспецифического соединения от нежелательных комбинаций цепей иммуноглобулина, так как присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы облегчает отделение. Данный метод описан в WO 94/04690. Для более подробного ознакомления с биспецифическими антителами см., например, публикацию Suresh et al., Methods in Enzymology, 121:210 (1986).
В соответствии с другим методом, описанным в WO 96/27011, область контакта между парой молекул антител может быть создана с возможностью максимального увеличения процентного содержания гетеродимеров, выделяемых из культуры рекомбинантных клеток. Предпочтительная область контакта включает по меньшей мере часть СН3 области антитела. При выполнении данного метода одну или несколько коротких боковых цепей аминокислот в области контакта первой молекулы антитела заменяют более длинными боковыми цепями (например, тирозином или триптофаном). В области контакта второй молекулы антитела создают компенсирующие “впадины”, размер которых идентичен или подобен большим боковым цепям, для чего большие боковые цепи аминокислот заменяют более короткими цепями (например, аланином или треонином). Такой подход обеспечивает механизм увеличения выхода гетеродимера по сравнению с нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела включают перекрестносшитые или “гетероконъюгатные” антитела. Например, одно из антител в гетероконъюгате может быть связано с авидином, другое антитело может быть связано с биотином. Такие антитела, например, были предложены для направленного воздействия клеток иммунной системы на нежелательные клетки (патент США № 4676980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373). Гетероконъюгатные антитела могут быть созданы любыми известными методами перекрестного сшивания. Приемлемые перекрестносшивающие агенты хорошо известны в данной области и описаны в патенте США № 4676980 наряду с рядом методов перекрестного сшивания.
В научной литературе также описаны методы создания биспецифических антител из фрагментов антител. Например, биспецифические антитела могут быть получены методом химического связывания. В публикации Brennan et al., Science 229:81 (1985) описан метод, в соответствии с которым интактные антитела протеолитически расщепляют с образованием F(ab')2-фрагментов. Указанные фрагменты восстанавливают в присутствии дитиолсодержащего комплексообразующего агента арсенита натрия для стабилизации соседних дитиоловых групп и предотвращения образования межмолекулярных дисульфидных связей. Полученные такие образом Fab'-фрагменты затем превращают в тионитробензоатные (TNB) производные. Одно из Fab'-TNB производных затем снова превращают в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого Fab'-TNB производного с образованием биспецифического антитела. Полученные биспецифические антитела могут быть использованы в качестве агентов для селективной иммобилизации ферментов.
Fab'-SH фрагменты также могут быть непосредственно получены из E. coli и могут быть химически связаны с образованием биспецифических антител. В публикации Shalaby et al., J. Exp. Med., 175:217-225 (1992) описано получение F(ab')2 молекулы полностью гуманизированного биспецифического антитела. Каждый Fab'-фрагмент отдельно секретируют из E. coli и подвергают направленному химическому связыванию in vitro с образованием биспецифического антитела.
В научной литературе также описаны разные методы получения и выделения фрагментов биспецифических антител непосредственно из культуры рекомбинантных клеток. Например, биспецифические антитела были получены с помощью лейциновых застежек-молний. Kostelny et al., J. Immunol., 148(50:1547-1553 (1992). Пептиды лейциновой застежки-молнии, полученные из белков Fos и Jun, связывали с Fab'-частями двух разных антител путем слияния генов. Гомодимеры антител восстанавливали в шарнирной области с образованием мономеров и затем повторно окисляли с образованием гетеродимеров антител. Данный метод может быть также использован для продуцирования гомодимеров антител. Метод получения “диатела”, описанный в публикации Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993), представляет собой альтернативный механизм получения фрагментов биспецифических антител. Указанные фрагменты включают вариабельную область тяжелой цепи (VH), соединенную с вариабельной областью легкой цепи (VL) при помощи линкера, который является слишком коротким для спаривания двух областей в одной цепи. Поэтому VH и VL области одного фрагмента принудительно спариваются с комплементарными VL и VH областями другого фрагмента с образованием двух антигенсвязывающих сайтов. В научной литературе также описан еще один метод получения фрагментов биспецифических антител с использованием одноцепочечных Fv (sFv) димеров. См. публикацию Gruber et al., J. Immunol., 152:5368 (1994).
В объем настоящего изобретения входят антитела более чем с двумя валентностями. Например, могут быть получены триспецифические антитела, Tuft et al., J. Immunol., 147:60 (1991).
(vii) Формирование эффекторной функции
Может быть желательно модифицировать в антителе по настоящему изобретению эффекторную функцию, чтобы повысить эффективность антитела. Например, в Fc-область могут быть введены остатки цистеина, делающие возможным образование дисульфидной связи между цепями в данной области. Полученное таким образом гомодимерное антитело может обладать лучшей интернализирующей способностью и/или более высокой комплемент-опосредованной эффективностью лизиса клеток и антителозависимой клеточно-опосредованной цитотоксичностью (ADCC). См. публикации Caron et al., J. Exp. Med. 176:1191-1195 (1992) и Shopes, B.J. Immunol. 148:2918-2922 (1992). Гомодимерные антитела с более высокой противоопухолевой активностью могут быть также получены при помощи гетеробифункциональных перекрестносшивающих агентов, описанных в публикации Wolff et al., Cancer Research, 53:2560-2565 (1993). Альтернативно может быть создано антитело, имеющее две Fc-области и, следовательно, обладающее более сильной комплемент-опосредованной способностью лизиса клеток и ADCC. См. публикацию Stevenson et al., Anti-Cancer Drug Design, 3:219-230 (1989).
(viii) Гибриды антитела и восстанавливающего рецепторсвязывающего эпитопа
В определенных вариантах осуществления изобретения может быть желательно использовать фрагмент антитела, а не интактное антитело, например, для лучшего проникновения в опухоль. В данном случае может быть желательно модифицировать фрагмент антитела с целью увеличения времени полужизни в кровотоке. Указанная цель может быть достигнута, например, путем введения во фрагмент антитела восстанавливающего рецепторсвязывающего эпитопа (например, путем мутации соответствующей области фрагмента антитела или введения эпитопа в пептидную метку, которую затем гибридизируют с фрагментом антитела у любого конца или в середине, например, методом синтеза ДНК или пептидов).
Восстанавливающий рецепторсвязывающий эпитоп предпочтительно образует область, в которой один или несколько любых аминокислотных остатков из одной или двух петель Fc-области переносят в аналогичное положение фрагмента антитела. Более предпочтительно переносят три или более остатков из одной или двух петель Fc-области. Еще предпочтительнее указанный эпитоп берут из СН2-области Fc-области (например, из IgG) и переносят в СН1, СН3 или V.sub.H область или в несколько таких областей антитела. Альтернативно указанный эпитоп берут из СН2-области Fc-области и переносят в CL-область, VL-область или обе области фрагмента антитела.
(ix) Другие ковалентные модификации антител
В объем настоящего изобретения входят ковалентные модификации антител. Ковалентные модификации могут быть выполнены путем химического синтеза или путем ферментативного или химического расщепления антитела, где это возможно. Ковалентные модификации антитела других типов выполняют в молекуле, осуществляя взаимодействие аминокислотных остатков антитела с органическим дериватизирующим агентом, способным взаимодействовать с выбранными боковыми цепями или N- или С-концевыми остатками. Примеры ковалентных модификаций приведены в патенте США № 5534615, который включен в настоящее описание изобретения в качестве ссылки. Предпочтительным типом ковалентной модификации антитела является связывание антитела с одним из целого ряда небелковых полимеров, например, с полиэтиленгликолем, полипропиленгликолем или полиоксиалкиленами, методом, описанным в патентах США №№ 4640835, 4496689, 4301144, 4670417, 4791192 или 4179337.
Настоящее изобретение также относится к иммуноконъюгатам, включающим антитело по настоящему изобретению, конъюгированное с цитотоксическим агентом, таким как химиотерапевтическое средство, токсин (например, ферментативно активный токсин бактериального, грибного, растительного или животного происхождения или его фрагменты) или радиоактивный изотоп (то есть радиоконъюгат). Существуют разные радиоактивные изотопы, предназначенные для получения радиоконъюгатных антител. Примеры радиоактивных изотопов включают, не ограничиваясь ими,212Bi,131I,131In,90Y и186Re.
Химиотерапевтические средства, используемые при создании таких иммуноконъюгатов, были описаны выше. Например, с антителами по настоящему изобретению или их фрагментами могут быть конъюгированы BCNU, стрептозоицин, винкристин, 5-фторурацил, семейство агентов, известных как комплекс LL-E33288, описанный в патентах США №№ 5053394 и 5770710, эсперамицины (патент США № 5877296) и т.д. (см. также определение химиотерапевтических средств, приведенное в настоящем описании изобретения).
Для избирательного разрушения опухоли антитело может включать радиоактивный атом. Существует целый ряд радиоактивных изотопов, предназначенных для получения радиоконъюгированных антител или их фрагментов. Примеры таких радиоактивных изотопов включают, не ограничиваясь ими,211At,131I,125I,90Y,186Re,188Re,153Sm,212Bi,32P,212Pb,111In, радиоактивные изотопы Lu и т.д. Конъюгат, используемый для диагностики, может включать радиоактивный атом для сцинтиграфических исследований, например,99mtc или123I, или спиновую метку для ядерно-магнитно-резонансной (ЯМР) томографии (также известной как магнитно-резонансная томография, MRI), такую как йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки могут быть введены в конъюгат известными методами. Например, пептид может быть синтезирован методом биологического синтеза или химического синтеза аминокислот с использованием приемлемых предшественников аминокислот, включающих, например, фтор-19, вместо водорода. Метки, такие как99mtc или123I,186Re,188Re и111In могут быть присоединены с помощью остатка цистеина в пептиде. Иттрий-90 может быть присоединен с помощью остатка лизина. Метод IODOGEN (Fraker et al., Biochem. Biophys. Res. Commun. 80:49-57 (1978)) может быть использован для введения йиода-123. См., например, публикацию Monoclonal Antibodies in Immunoscintigraphy (Chatal, CRC Press 1989), в которой подробно описаны другие методы.
Ферментативно активные токсины и их фрагменты, которые могут быть использованы в настоящем изобретении, включают α-цепь дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, α-цепь экзотоксина (из Pseudomonas aeruginosa), α-цепь рицина, α-цепь абрина, α-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolacca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, неомицин и трикотецены. См., например, WO 93/21232, опубликованную 28 октября 1993 г.
Конъюгаты антитела и цитотоксического агента получают, используя разные агенты, связывающие бифункциональные белки, такие как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как гидрохлорид диметиладипимидата), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бисазидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бисдиазония (такие как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицина может быть получен в соответствии с описанием, приведенным в публикации Vitetta et al., Science 238:1098 (1987). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминопентауксусная кислота (МХ-DTPA) является типичным хелатообразующим агентом для конъюгирования радионуклеотида с антителом. См. WO 94/11026. Линкер может быть “расщепляемым линкером”, облегчающим высвобождение цитотоксического лекарственного средства в клетку. Например, может быть использован кислотолабильный линкер, пептидазачувствительный линкер, фотолабильный линкер, диметиловый линкер или дисульфидсодержащий линкер (Chari et al., Cancer Research, 52:127-131 (1992); патент США № 5208020).
Альтернативно слитый белок, включающий антитело против VEGF и/или антитело против белка по настоящему изобретению и цитотоксический агент, может быть получен, например, методами рекомбинантных ДНК или методом синтеза пептидов. ДНК может включать соответствующие области, кодирующие две части конъюгата, смежные друг с другом или разделенные областью, кодирующей линкерный пептид, который не ухудшает требуемые свойства конъюгата.
В определенных вариантах осуществления изобретения антитело может быть конъюгировано с “рецептором” (таким как стрептавидин) для предварительного направленного воздействия на опухоль, при этом сначала субъекту вводят конъюгат антитела с рецептором, затем удаляют несвязанный конъюгат из кровотока, используя очищающий агент, после чего вводят “лиганд” (например, авидин), конъюгированный с цитотоксическим агентом (например, радионуклеотидом). В определенных вариантах осуществления изобретения иммуноконъюгат получают, используя антитело и соединение с нуклеолитической активностью (например, рибонуклеазу или ДНК-эндонуклеазу, такую как дезоксирибонуклеаза; ДНКаза).
Настоящее изобретение относится к антителу по настоящему изобретению, конъюгированному с одной или несколькими молекулами майтанзиноидов. Майтанзиноиды являются митотическими ингибиторами, подавляющими полимеризацию тубулина. Майтанзин был впервые выделен из восточноафриканского кустарника Maytenus serrata (патент США № 3896111). Затем было обнаружено, что определенные микробы также продуцируют майтанзиноиды, такие как майтанзинол и сложные эфиры майтанзинола в положении С-3 (патент США № 4151042). Синтетический майтанзинол, его производные и аналоги описаны, например, в патентах США №№ 4137230, 4248870, 4256746, 4260608, 4265814, 4294757, 4307016, 4308268, 4308269, 4309428, 4313946, 4315929, 4317821, 4322348, 4331598, 4361650, 4364866, 4424219, 4450254, 4362663 и 4371533.
Антитело по настоящему изобретению может быть конъюгировано с молекулой майтанзиноида без существенного ослабления биологической активности антитела или молекулы майтанзиноида. В среднем 3-4 молекулы майтанзиноида, конъюгированные с одной молекулой антитела, эффективно повышают цитотоксичность клеток-мишеней, не оказывая негативного воздействия на функцию или растворимость антитела, хотя даже одна молекула токсина/антитела повышает цитотоксичность по сравнению с использованием голого антитела. Майтанзиноиды хорошо известны в данной области и могут быть синтезированы известными методами или выделены из природных источников. Приемлемые майтанзиноиды описаны, например, в патенте США № 5208020, других патентах и публикациях, не являющихся патентами, ссылка на которые была сделана выше. В одном варианте осуществления изобретения майтанзиноиды представляют собой майтанзинол и аналоги майтанзинола, модифицированные в ароматическом кольце или других положениях молекулы майтанзинола с получением, например, разных сложных эфиров майтанзинола.
В данной области известно много связывающих групп, используемых для получения конъюгатов антитела с майтанзиноидом, которые включают, например, группы, описанные в патенте США № 5208020 или европейском патенте № 0425235 В1 и в публикации Chari et al., Cancer Research, 52:127-131 (1992). Связывающие группы включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, пептидазалабильные группы или эстеразалабильные группы, описанные в вышеуказанные патентах, при этом более предпочтительными являются дисульфидные и тиоэфирные группы.
Конъюгаты антитела с майтанзиноидом могут быть получены при использовании разных бифункциональных связывающих белок агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолат (IT), бифункциональные производные сложных имидоэфиров (такие как гидрохлорид диметиладипимидата), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бисазидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бисдиазония (такие как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Типичные связывающие агенты включают N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 (1978) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP), используемые для образования дисульфидной связи.
Линкер может быть присоединен к молекуле майтанзиноида в разных положениях в зависимости от типа связи. Например, сложноэфирная связь может быть образована в результате осуществления взаимодействия с гидроксильной группой стандартными методами связывания. Взаимодействие может происходить в положении С-3, в котором находится гидроксильная группа, положении С-14, модифицированном гидроксиметилом, положении С-15, модифицированном гидроксильной группой, и положении С-20, в котором находится гидроксильная группа. Связь образуется в положении С-3 майтанзинола или аналога майтанзинола.
Другой представляющий интерес иммуноконъюгат включает антитело по настоящему изобретению, конъюгированное с одной или несколькими молекулами калихеамицина. Семейство антибиотиков калихеамицинов способно разрушать двухцепочечную ДНК в субпикомолярных концентрациях. Для ознакомления с получением конъюгатов семейства калихеамицинов см. патенты США №№ 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все патенты принадлежат компании American Cyanamid). Структурные аналоги калихеамицина, которые могут быть использованы в настоящем изобретении, включают, не ограничиваясь ими, γ1I, α2I, α3I, N-ацетил-γ1I, PSAG и θI1 (Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) и вышеуказанные патент США, принадлежащие компании American Cyanamid). Еще одним противоопухолевым средством, с которым может быть конъюгировано антитело по настоящему изобретению, является QFA, которое представляет собой антитело против фолата. Как калихеамицин, так и QFA содержат внутриклеточные активные центры и плохо проникают через плазматическую мембрану. Поэтому поглощение клеткой указанных агентов в результате антителоопосредованной интернализации значительно усиливает их цитотоксическое действие.
(х) Создание антител из синтетических библиотек отображения антител на фаге
Определенные варианты осуществления изобретения относятся к способу создания и отбора новых антител при помощи уникального метода отображения на фаге. Данный метод включает создание синтетических библиотек отображения антител на фаге на одной каркасной матрице, выполнение достаточного числа изменений в вариабельных областях, отображение полипептидов с измененными вариабельными областями, отбор антител-кандидатов, обладающих высоким сродством к антигену-мишени, и выделение отобранных антител.
Подробное описание методов отображения на фаге можно найти, например, в WO03/102157, опубликованной 11 декабря 2003 г., которая включена в настоящее описание изобретения в качестве ссылки.
В соответствии с одним объектом изобретения библиотеки антител, используемые в настоящем изобретении, могут быть созданы путем мутирования доступных для растворителя и/или в высшей степени разнообразных положений по меньшей мере в один CDR вариабельной области антитела. Методами, рассмотренными в настоящем описании изобретения, могут быть мутированы некоторые или все CDR-области. В некоторых вариантах осуществления изобретения может быть желательно создать разнообразные библиотеки антител путем выполнения мутаций в положениях CDRH1, CDRH2 и CDRH3 с созданием одной библиотеки, выполнения мутаций в положениях CDRL3 и CDRH3 с созданием одной библиотеки или выполнения мутаций в положениях CDRL3 и CDRH1, CDRH2 и CDRH3 с созданием одной библиотеки.
Например, может быть создана библиотека вариабельных областей антитела, имеющих мутации в доступных для растворителя и/или различных положениях CDRH1, CDRH2 и CDRH3. Другая библиотека может быть создана с мутациями в CDRL1, CDRL2 и CDRL3. Указанные библиотеки могут быть также использованы вместе для создания цепей, обладающих требуемым сродством. Например, после одного или нескольких циклов отбора библиотек тяжелых цепей для связывания с антигеном-мишенью в популяцию тяжелых цепей может быть введена библиотека легких цепей для выполнения последующих циклов отбора с целью повышения сродства связывания.
Библиотеку предпочтительно создают путем замены первоначальных аминокислот вариантными аминокислотами в CDRH3 вариабельной области последовательности тяжелой цепи. Полученная библиотека может содержать множество последовательностей антител, отличающихся главным образом в CDRH3 области последовательности тяжелой цепи.
В соответствии с одним объектом настоящего изобретения библиотеку создают с использованием последовательности гуманизированного антитела 4D5 или последовательности каркасных аминокислот последовательности гуманизированного антитела 4D5. Библиотеку предпочтительно создают, заменяя по меньшей мере остатки 95-100а тяжелой цепи аминокислотами, кодированными кодоном DVK, используемым для кодирования вариантных аминокислот в указанных положениях. Примером совокупности олигонуклеотидов, используемой для выполнения указанных замен, является последовательность (DVK)7. В некоторых вариантах осуществления изобретения библиотеку создают, заменяя остатки 95-100а аминокислотами, кодированными кодонами DVK и NNK. Примером совокупности олигонуклеотидов, используемой для выполнения указанных замен, является последовательность (DVK)6(NNK). В другом варианте осуществления изобретения библиотеку создают, заменяя по меньшей мере остатки 95-100а аминокислотами, кодированными кодонами DVK и NNK. Примером совокупности олигонуклеотидов, используемых для выполнения указанных замен, является последовательность (DVK)5(NNK). Другим примером совокупности олигонуклеотидов, используемой для выполнения указанных замен, является последовательность (NNK)6. На основании критериев, представленных в настоящем описании изобретения, специалист в данной области может определить другие примеры приемлемых олигонуклеотидных последовательностей.
В другом варианте осуществления изобретения разные структуры CDRH3 областей используют для выделения последовательностей с высокой степенью сродства и для разных эпитопов. Длина CDRH3 областей, созданных в данной библиотеке, составляет от 11 до 13 аминокислот, хотя могут быть также созданы последовательности другой длины. Вариабельность Н3-областей может быть достигнута благодаря использованию кодонов NNK, DVK и NVK, а также более ограниченной вариабельности N- и/или С-конца.
Различные последовательности могут быть также получены в CDRH1 и CDRH2 областях. Целью создания CDR-H1 и -Н2 областей является имитация спектра описанных природных антител при наличии модификации, обеспечивающей более близкое соответствие вариабельности природных антител по сравнению с ранее созданными антителами.
Для достижения вариабельности CDRH3 областей могут быть отдельно созданы многочисленные библиотеки с разной длиной Н3-областей, которые затем объединяют для отбора последовательностей, связывающихся с антигенами-мишенями. Многочисленные библиотеки могут быть сгруппированы и исследованы методами отбора на твердом носителе и сортировки в растворе, описанными в предшествующих публикациях и в настоящем описании изобретения. Могут быть использованы разные методы сортировки. Например, один метод включает сортировку на мишени, связанной с твердым носителем, с последующим обнаружением метки, которая может присутствовать на слитом полипептиде (например, метка против gD), и еще одну сортировку на мишени, связанной с твердым носителем. Альтернативно библиотеки могут быть подвергнуты сортировке сначала на мишени, связанной с твердой поверхностью, после чего элюированные последовательности сортируют в фазе раствора, обеспечивающего связывание с антигеном-мишенью в более низких концентрациях. Использование комбинаций разных методов сортировки позволяет свести к минимуму отбор только высоко экспрессированных последовательностей и обеспечивает отбор целого ряда разных клонов с высокой степенью сродства.
Из библиотек могут быть выделены последовательности с высокой степенью сродства к антигену-мишени. Ограниченная вариабельность Н1/Н2 области уменьшает вырожденность генетического кода примерно в 104-105 раз и обеспечивает большую вариабельность Н3-области с целью создания последовательностей с более высокой степенью сродства. Использование библиотек с разными типами вариабельности CDRH3 области (например, использование DVK или NVT) позволяет выделить последовательности, которые могут связываться с разными эпитопами антигена-мишени.
При исследовании последовательностей, выделенных из вышеописанных сгруппированных библиотек, было обнаружено, что сродство можно еще больше увеличить, обеспечивая ограниченную вариабельность в легкой цепи. В данном варианте осуществления изобретения вариабельность легкой цепи достигается в CDRL1 области следующим образом: аминокислота в положении 28 кодирована RDT, аминокислота в положении 29 кодирована RKT, аминокислота в положении 30 кодирована RVW, аминокислота в положении 31 кодирована ANW, аминокислота в положении 32 кодирована ТНТ и необязательно аминокислота в положении 33 кодирована CTG; в CDRL2 области: аминокислота в положении 50 кодирована KBG, аминокислота в положении 53 кодирована AVC и необязательно аминокислота в положении 55 кодирована GMA; в CDRL3 области: аминокислота в положении 91 кодирована ТМТ, SRT или обеими последовательностями; аминокислота в положении 92 кодирована DMC, аминокислота в положении 93 кодирована RVT, аминокислота в положении 94 кодирована NHT, и аминокислота в положении 96 кодирована TWT, YKG или обеими последовательностями.
В другом варианте осуществления изобретения создают одну или несколько библиотек с вариабельностью в CDRH1, CDRH2 и CDRH3 областях. В данном варианте осуществления изобретения вариабельность в CDRH3 области достигается при использовании Н3-областей разной длины и главным образом совокупностей кодонов XYZ и NNK или NNS. Библиотеки могут быть созданы с использованием отдельных олигонуклеотидов, или олигонуклеотиды могут быть сгруппированы для создания подмножества библиотек. Библиотеки по данному варианту осуществления изобретения могут быть подвергнуты сортировке с использованием мишени, связанной с твердым носителем. Клоны, выделенные в результате выполнения нескольких сортировок, могут быть исследованы в отношении специфичности и сродства при помощи анализов ELISA. Специфичность клонов может быть исследована относительно требуемых антигенов-мишеней, а также других антигенов, не являющихся мишенями. Последовательности, связывающиеся с антигеном-мишенью, затем могут быть исследованы в отношении сродства при помощи конкурентно-связывающего анализа ELISA в растворе или капельного конкурентного анализа. Последовательности с высокой степенью сродства могут быть выделены из библиотеки с использованием совокупностей кодонов XYZ, полученных в соответствии с приведенным выше описанием. Указанные последовательности могут быть легко получены в культуре клеток в виде антител или антигенсвязывающих фрагментов с высоким выходом.
В некоторых вариантах осуществления изобретения может быть желательно создать библиотеки с большей вариабельностью длин CDRH3 области. Например, может быть желательно создать библиотеки с CDRH3 областями, содержащими от около 7 до 19 аминокислот.
Последовательности с высоким сродством, выделенные из библиотек по данным вариантам осуществления изобретения, могут быть легко продуцированы в культуре бактериальных и эукариотических клеток с высоким выходом. Могут быть созданы векторы, позволяющие легко удалить последовательности, такие как метки gD, последовательность вирусного белка оболочки, и/или добавить аминокислоты в последовательности константных областей для получения полноразмерных антител или антигенсвязывающих фрагментов с высоким выходом.
Библиотека с мутациями в CDRH3 области может быть объединена с библиотекой, содержащей разные варианты других CDR-областей, например, CDRL1, CDRL2, CDRL3, CDRH1 и/или CDRH2. Таким образом, например, в одном варианте осуществления изобретения библиотеку CDRH3 областей объединяют с библиотекой CDRL3 областей, созданной на основе последовательности гуманизированного антитела 4D5 при наличии вариантных аминокислот в положениях 28, 29, 30, 31 и/или 32 с использованием заранее определенных совокупностей кодонов. В другом варианте осуществления изобретения библиотека с мутациями в CDRH3 области может быть объединена с библиотекой, включающей вариантные CDRH1 и/или CDRH2 вариабельные области тяжелой цепи. В одном варианте осуществления изобретения библиотека CDRH1 областей создана на основе последовательности гуманизированного антитела 4D5 при наличии вариантных аминокислот в положениях 28, 30, 31, 32 и 33. Библиотека CDRH2 областей может быть создана на основе последовательности гуманизированного антитела 4D5 при наличии вариантных аминокислот в положениях 50, 52, 53, 54, 56 и 58 с использованием заранее определенных совокупностей кодонов.
(xi) Варианты антител
Новые антитела, созданные из библиотек фагов, могут быть дополнительно модифицированы с целью создания мутантов антител с улучшенными физическими, химическими и/или биологическими свойствами по сравнению с материнским антителом. Биологическая активность мутанта антитела при исследовании с помощью анализа биологической активности предпочтительно должна быть по меньшей мере примерно в 10 раз выше, предпочтительно по меньшей мере примерно в 20 раз выше, более предпочтительно по меньшей мере примерно в 50 раз выше и иногда по меньшей мере примерно в 100 или 200 раз выше биологической активности материнского антитела, исследованного при помощи указанного анализа. В определенных вариантах осуществления изобретения мутант антитела против Bv8 или мутант антитела против G-CSF обладает сродством связывания соответственно к Bv8 или G-CSF, которое по меньшей мере примерно в 10 раз больше, предпочтительно по меньшей мере примерно в 20 раз больше, более предпочтительно по меньшей мере примерно в 50 раз больше и иногда по меньшей мере примерно в 100 или 200 раз больше сродства связывания материнского антитела.
Для создания мутанта антитела в одном или нескольких гипервариабельных участках материнского антитела изменяют (например, заменяют) одну или несколько аминокислот. Альтернативно или дополнительно в материнском антителе можно изменить (например, заменить) один или несколько остатков в каркасной области, что позволяет увеличить сродство связывания мутанта антитела к антигену из другого вида млекопитающего. Примеры модифицируемых остатков в каркасной области включают остатки, которые нековалентно связываются непосредственно с антигеном (Amit et al. (1986) Science 233:747-753); взаимодействуют/воздействуют на конформацию CDR-области (Chothia et al. (1987) J. Mol. Biol. 196:901-917) и/или участвуют в контактировании VL-VH (европейский патент № 239400 В1). В определенных вариантах осуществления изобретения модификация одного или нескольких таких остатков в каркасной области повышает сродство связывания антитела к антигену из другого вида млекопитающего. Например, в данном варианте осуществления изобретения можно изменить примерно от одного до около пяти остатков в каркасной области. Иногда такого количества замен может быть достаточно для получения мутанта антитела, пригодного для использования в доклинических исследованиях, даже без изменения остатков в гипервариабельных участках. Однако обычно мутант антитела включает дополнительные изменения в гипервариабельных участках.
Остатки, изменяемые в гипервариабельных участках, могут быть изменены произвольно, особенно в тех случаях, когда исходное сродство связывания материнского антитела позволяет легко исследовать такие произвольно созданные мутанты антител.
Одним приемлемым методом создания таких мутантов антител является “мутагенез методом сканирования аланином” (Cunningham and Wells (1989) Science 244:1081-1085). В соответствии с данным методом один или несколько остатков гипервариабельного участка заменяют остатками аланина или полиаланина для воздействия на взаимодействие аминокислот с антигеном из другого вида млекопитающего. Остатки гипервариабельного участка, функционально реагирующие на выполняемые замены, затем улучшают путем введения других мутаций в положение заменяемых сайтов. Таким образом, несмотря на то, что сайт для изменения аминокислотной последовательности определен заранее, характер мутации не требует предварительного определения. Ала-мутанты, полученные таким образом, исследуют в отношении биологической активности в соответствии с описанием, приведенным в настоящем изобретении.
Модификацию обычно начинают с консервативных замен, представленных ниже под заголовком “предпочтительные замены”. Если такие замены вызывают изменение биологической активности (например, сродства связывания), выполняют более существенные изменения, указанные под заголовком “иллюстративные замены” в нижеследующей таблице или более подробно описанные ниже со ссылкой на классы аминокислот, после чего продукты исследуют.
Биологические свойства антител могут быть изменены в еще большей степени при выборе замен, которые существенно отличаются по своему влиянию на сохранение (а) структуры полипептидного остова в области замены, например, в виде складчатой или спиральной конформации, (b) заряда или гидрофобности молекулы на сайте-мишени или (с) длины боковой цепи. Природные остатки разделены на группы на основании общих свойств боковых цепей:
(1) гидрофобные: норлейцин, met, ala, val, leu, ile;
(2) нейтральные гидрофильные: cys, ser, thr, asn, gln;
(3) кислотные: asp, glu;
(4) основные: his, lys, arg;
(5) остатки, влияющие на ориентацию цепи: gly, pro; и
(6) ароматические: trp, tyr, phe.
Неконсервативные замены предполагают замену остатка одного из указанных классов остатком другого класса.
В другом варианте осуществления изобретения сайты, выбранные для модификации, характеризуются созревшей аффинностью, определяемой методом отображения на фаге (см. выше).
Молекулы нуклеиновых кислот, кодирующих мутанты аминокислотных последовательностей, получают разными методами, известными в данной области. Указанные методы включают, не ограничиваясь ими, сайтнаправленный мутагенез с использованием олигонуклеотидов, мутагенез методом ПЦР и кластерный мутагенез ранее полученного мутанта или немутантного варианта материнского антитела. Предпочтительным методом создания мутантов является сайтнаправленный мутагенез (см., например, публикацию Kunkel (1985) Proc. Natl. Acad. Sci. USA 82:488).
В определенных вариантах осуществления изобретения в мутанте антитела заменяют только один остаток гипервариабельного участка. В других вариантах осуществления изобретения заменяют два или более остатков гипервариабельного участка материнского антитела, например, выполняют от около двух до около десяти замен в гиперварибельном участке.
Мутант антитела с лучшими биологическими свойствами обычно имеет аминокислотную последовательность, которая по меньшей мере на 75%, более предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, еще предпочтительнее по меньшей мере на 90% и наиболее предпочтительно по меньшей мере на 95% идентична или подобна аминокислотной последовательности вариабельной области тяжелой или легкой цепи материнского антитела. Идентичность или сходство с указанной последовательностью определяют в виде процентного содержания аминокислотных остатков в последовательности-кандидате, которые идентичны (то есть являются такими же остатками) или подобны (то есть являются аминокислотными остатками, относящимися к той же группе на основании общих свойств боковых цепей, см. выше) остаткам материнского антитела после выполнения сравнительного анализа последовательностей и введения при необходимости разрывов для достижения максимальной идентичности последовательностей в процентном выражении. Считается, что никакие добавления, делеции или инсерции у N-конца, С-конца или внутри цепи, произведенные в последовательности антитела за пределами вариабельной области, не влияют на идентичность или подобие последовательностей.
После получения мутанта антитела определяют биологическую активность данной молекулы по сравнению с материнским антителом. Как было отмечено выше, такое исследование может включать определение сродства связывания и/или биологической активности антитела. В предпочтительном варианте осуществления изобретения создают панель мутантов антител, которую исследуют в отношении сродства связывания к антигену или его фрагменту. Один или несколько мутантов антител, отобранных в результате выполнения первоначального исследования, необязательно подвергают одному или нескольким другим исследованиям биологической активности для подтверждения того, что мутант антитела с более высоким сродством связывания действительно является полезным, например, для использования в доклинических исследованиях.
Отобранный таким образом мутант(ы) антитела может быть подвергнут дальнейшей модификации, которая часто зависит от предполагаемого применения антитела. Такие модификации могут включать дальнейшее изменение аминокислотной последовательности, гибридизацию с одним или несколькими гетерологичными полипептидами и/или модификации ковалентных связей, рассмотренные ниже. Что касается изменений аминокислотной последовательности, то иллюстративные модификации была представлены выше. Например, любой остаток цистеина, не участвующий в сохранении требуемой конформации мутанта антитела, может быть также заменен, как правило, серином, для повышения устойчивости молекулы к окислению и предотвращения аберрантного перекрестного связывания. И наоборот, в антитело могут быть добавлены цистеиновые связи для повышения устойчивости антитела (особенно в тех случаях, когда антитело является фрагментом антитела, таким как Fv-фрагмент). Аминокислотный мутант другого типа характеризуется измененным паттерном гликозилирования. Такое изменение может быть достигнуто в результате делеции одной или нескольких углеводных частей, обнаруженных в антителе, и/или добавления одного или нескольких сайтов гликозилирования, отсутствующих в данном антителе. Гликозилирование антител обычно является N-связанным или О-связанным гликозилированием. N-связанное гликозилирование предполагает присоединение углеводной части к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, где Х означает любую аминокислоту за исключением пролина, представляют собой последовательности узнавания для ферментативного присоединения углеводной части к боковой цепи аспарагина. Таким образом, присутствие указанных трипептидных последовательностей в полипептиде вызывает образование потенциального сайта гликозилирования. О-связанное гликозилирование предполагает присоединение одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, обычно к серину или треонину, хотя также может быть использован 5-гидроксипролин или 5-гидроксилизин. Добавление сайтов гликозилирования в антитело обычно сопровождается изменением аминокислотной последовательности, которая приобретает одну или несколько вышеуказанных трипептидных последовательностей (для сайтов N-связанного гликозилирования). Изменение может также включать добавление или замену одного или нескольких остатков серина или треонина в последовательности исходного антитела (для сайтов О-связанного гликозилирования).
В антителе, включающем Fc-область, может быть изменен присоединенный в нему углевод. Например, антитела со зрелой углеводной структурой, в которой отсутствует фукоза, присоединенная к Fc-области антитела, описаны в заявке на патент США № US 2003/0157108 (Presta, L.). См. также заявку на патент США № US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Антитела, содержащие разделяющий N-ацетилглюкозамин (GlcNAc) в углеводе, присоединенном к Fc-области антитела, рассмотрены в публикации WO2003/011878, Jean-Mairet et al., и патенте США № 6602684, Umana et al. Антитела, содержащие по меньшей мере один остаток галактозы в олигосахариде, присоединенном к Fc-области антитела, представлены в публикации WO 1997/30087, Patel et al. См. также публикации WO 1998/58964 (Raju, S.) и WO 1999/22764 (Raju, S), в которых рассмотрены антитела с измененным углеводом, присоединенным к Fc-области. См. также заявку на патент США № US 2005/0123546 (Umana et al.) для ознакомления с антигенсвязывающими молекулами с модифицированным гликозилированием.
Предпочтительный вариант гликозилирования по настоящему изобретению включает Fc-область, к которой присоединен углевод с отсутствием фукозы. Такие варианты обладают лучшей функцией ADCC. Fc-область дополнительно необязательно включает одну или несколько замен аминокислот, которые еще больше улучшают ADCC, например, замены в положениях 298, 333 и/или 334 Fc-области (нумерация остатков EU). Примеры публикаций, относящихся к антителам с отсутствием фукозы, включают: заявки на патент US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; публикации Okazaki et al., J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al., Biotech. Bioeng. 87:614 (2004). Примеры линий клеток, продуцирующих антитела без фукозы, включают клетки СНО Lec13 с отсутствием фукозилирования белка (Ripka et al., Arch. Biochem. Biophys. 249:533-545 (1986); заявка на патент США № US 2003/0157108 A1, Presta, L., и WO 2004/056312 A1, Adams et al., в частности, в примере 11) и линии клеток с отсутствием гена, такого как ген альфа-1,6-фукозилтрансферазы, клетки СНО с отсутствием гена FUT8 (Yamane-Ohnuki et al., Biotech. Bioeng. 87:614 (2004)).
(xii) Получение антител методом рекомбинантных ДНК
Для получения антитела методом рекомбинантных ДНК выделяют кодирующего его нуклеиновую кислоту и вводят в вектор репликации для последующего клонирования (амплификации ДНК) или экспрессии. ДНК, кодирующую моноклональное антитело, можно легко выделить и секвенировать стандартными методами (например, при помощи олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелую и легкую цепи антитела). Существует много векторов. Компоненты вектора обычно включают, не ограничиваясь ими, один или несколько следующих элементов: сигнальную последовательность, ориджин репликации, один или несколько генов-маркеров, энхансер, промотор и последовательность терминации транскрипции (например, описанные в патенте США № 5534615, включенном в настоящее описание изобретения в качестве ссылки).
Приемлемыми клетками-хозяевами для клонирования или экспрессии ДНК в векторах по настоящему изобретению являются прокариоты, дрожжи или вышеописанные высшие эукариотические клетки. Прокариоты, пригодные для указанной цели, включают эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serrafia, например, Serratia marcescans, и Shigeila, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, описанные в DD 266710, опубликованной 12 апреля 1989 г.), Pdeudomonas, такие как P. aeruginosa, и Streptomyces. Одним предпочтительным хозяином для клонирования в E. coli является штамм E. coli 294 (ATCC 31446), хотя также могут быть использованы другие штаммы, такие как E. coli B, Е. coli X 1776 (ATCC 31537) и E. coli W3110 (ATCC 27325). Приведенные примеры являются иллюстративными и не ограничивают объем изобретения.
Помимо прокариотов, приемлемыми хозяевами для клонирования или экспрессии антителокодирующих векторов являются эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи. Saccharomyces cerevisiae или обычные пекарские дрожжи являются наиболее часто используемыми низшими эукариотическими микроорганизмами-хозяевами. Однако существует целый ряд других родов, видов и штаммов, пригодных для использования в настоящем изобретении, таких как Schizosaccharomyces pombe; хозяева Kluyveromyces, такие как, например, K. lactis, K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. thermotolerans и K. marxianus; yarrowia (европейский патент № 402226), Pichia pastoris (европейский патент № 183070), Candida, Trichoderma reesia (европейский патент № 244234), Neurospora crassa, Schwanniomyces, такие как Schwanniomyces occidentalis, и нитчатые грибы, такие как, например, Neurospora, Penicillium, Tolypocladium, и хозяева Aspergillus, такие как A. nidulans и A. niger.
Приемлемые клетки-хозяева для экспрессии гликозилированного антитела получают из многоклеточных организмов. Примеры клеток беспозвоночных включают растительные клетки и клетки насекомых. Были обнаружены многочисленные бакуловирусные штаммы и варианты, а также соответствующие пригодные клетки-хозяева насекомых, полученные из таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (дрозофила) и Bombys mori. Существует целый ряд общедоступных вирусных штаммов, пригодных для трансфекции, например, вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы могут быть использованы в качестве вирусов по настоящему изобретению, в частности, для трансфекции клеток Spodoptera frugiperda. Культуры растительных клеток хлопчатника, кукурузы, картофеля, сои, петунии, томатов и табака также могут быть использованы в качестве хозяев.
Однако наибольший интерес представляют клетки позвоночных, и размножение клеток позвоночных в культуре (культуре тканей) является обычной практикой. Примерами пригодных линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированных SV40 (COS-7, ATCC CRL 1651); линия клеток эмбриональной почки человека (клетки 293 или клетки 293, субклонированные для выращивания в суспензионной культуре, Graham et al., J. Gen. Virol. 36:59 (1977)); клетки почки детеныша хомячка (ВНК, АТСС CCL 10); клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); мышиные клетки Сертоли (ТМ4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1, ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки рака шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени буйволовой крысы (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (ММТ 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC5; клетки FS4 и линия клеток гепатомы человека (Hep G2).
Клетки-хозяева трансформируют вышеуказанными экспрессирующими или клонирующими векторами для продуцирования антител и культивируют в обычных питательных средах, модифицированных соответствующим образом для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих требуемые последовательности.
Клетки-хозяева, используемые для продуцирования антитела по настоящему изобретению, можно культивировать в разных средах. Для культивирования клеток-хозяев пригодны коммерчески доступные среды, такие как среда Хэма F10 (Sigma-Aldrich, St. Louis, MO), минимальная поддерживающая среда ((МЕМ), Sigma-Aldrich, St. Louis, MO), RPMI-1640 (Sigma-Aldrich, St. Louis, MO) и модифицированная по способу Дульбекко среда Игла ((DMEM), Sigma-Aldrich, St. Louis, MO). Кроме того, в качестве культуральных сред для клеток-хозяев могут быть использованы любые среды, описанные в публикациях Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патентах США №№ 4767704, 4657866, 4927762, 4560655 или 5122469; WO 90/03430, WO 87/00195 или патенте США № Re 30985. Любые из указанных сред при необходимости могут быть дополнены гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, фосфат, кальций и магний), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как GENTAMICIN™), следовыми элементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. В среды могут быть также введены любые другие необходимые добавки в соответствующих концентрациях, которые должны быть известны специалистам в данной области. Условия культивирования, такие как температура, рН и тому подобные, аналогичны ранее используемым для экспрессии в отобранных клетках-хозяевах и должны быть известны квалифицированному специалисту.
При использовании методов рекомбинантных ДНК антитело может быть продуцировано внутри клетки, в периплазматическом пространстве или секретированы непосредственно в среду. Если антитело продуцировано внутри клетки, то на первой стадии удаляют дебрис клеток-хозяев или лизированных клеток, например, центрифугированием или ультрацентрифугированием. Если антитело секретировано в среду, сначала концентрируют супернатанты таких экспрессирующих систем при помощи коммерчески доступного фильтра для концентрирования белка, такого как, например, ультрафильтрующее устройство Amicon или Millipore Pellicon. На любой из вышеуказанных стадий может быть использован ингибитор протеазы, такой как PMSF, для подавления протеолиза и антибиотики для предотвращения роста побочных загрязняющих примесей.
Композиция антител, полученных из клеток, может быть очищена, например, при помощи хроматографии на гидроксилапатите, гель-электрофореза, диализа и аффинной хроматографии, при этом предпочтительным методом очистки является аффинная хроматография. Пригодность протеина А в качестве аффинного лиганда зависит от вида и изотипа любой Fc-области иммуноглобулина, присутствующей в антителе. Протеин А может быть использован для очистки антител, полученных на основе γ, γ2 или γ4 тяжелых цепей человека (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Протеин G рекомендован для всех изотипов мышей и γ3 человека (Guss et al., EMBO J. 5:1567-1575 (1986)). Матрица, с которой связывают аффинный лиганд, чаще всего является агарозой, но существуют также другие матрицы. Матрицы, устойчивые к механическому воздействию, такие как стекло с контролируемым размером пор или полистиролдивинилбензол, обеспечивают более высокие скорости потока и более короткое время обработки по сравнению с агарозой. Для очистки антитела, содержащего СН3 область, используют смолу ABX™ Bakerbond (J.T. Baker, Phillipsburg, N.J.). В зависимости от выделяемого антитела также могут быть использованы другие методы очистки белка, такие как фракционирование на ионообменной колонке, преципитация этанолом, ВЭЖХ с обращенной фазой, хроматография на кремнеземе, хроматография на гепарине SEPHAROSE™, хроматография на анионообменной или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматографическое фокусирование, SDS-PAGE и преципитация сульфатом аммония.
D. Использование антагонистов G-CSF и антагонистов Bv8
Антагонисты G-CSF и антагонисты Bv8 по настоящему изобретению могут быть использованы отдельно или в комбинации с другими терапевтическими средствами для ингибирования развития кровеносных сосудов, метастазирования опухоли, миграции опухолевых клеток и/или модуляции активации Cd11b+Grl+ клеток или функционального человеческого аналога Cd11b+Grl+ клеток.
Главными мишенями для способов лечения по настоящему изобретению являются метастазирующие опухоли и опухоли, способные метастазировать в предметастатические органы или предметастатические ткани. Способы лечения по настоящему изобретению также направлены против опухолей, секретирующих G-CSF, активизирующего Cd11b+Grl+ клетки или функциональный человеческий аналог Cd11b+Grl+ клеток из костного мозга, инициируя таким образом создание предметастатической ниши. Примеры человеческих клеток-аналогов включают незрелые миелоидные клетки человека, миелоидные супрессорные клетки человека, предшественники нейтрофилов, моноцитов и макрофагов человека и нейтрофилы, моноциты и макрофаги человека. Способы лечения по настоящему изобретению также направлены против опухолей, характеризующихся повышенной экспрессией G-CSF, Bv8, PKR1, MMP-9, S100A8 и/или S100A9.
Примеры заболеваний и нарушений, подлежащих лечению способами по настоящему изобретению, включают неопластические нарушения, определяемые в настоящем описании изобретения терминами “рак” и “раковый”. В определенных вариантах осуществления изобретения заболевание, подлежащее лечению способами по настоящему изобретению, является метастазирующей опухолью или метастазирующим раком.
Способы лечения по настоящему изобретению также предназначены для лечения доброкачественной опухоли, предраковой опухоли или неметастазирующего рака, при этом такое лечение позволяет предотвратить развитие доброкачественной опухоли, предраковой опухоли или неметастазирующего рака в метастазирующий рак.
Настоящее изобретение дополнительно относится к способам прогнозирования способности метастазирующей опухоли эффективно реагировать на лечение антагонистами G-CSF и/или антагонистами Bv8. Примеры таких способов включают определение в образце, полученном у субъекта, наличия клетки, экспрессирующей Bv8, PKR1 и/или G-CSF. В определенных вариантах осуществления изобретения вышеуказанная экспрессия является экспрессией мРНК. В определенных вариантах осуществления изобретения вышеуказанная экспрессия является экспрессией белка. В определенных вариантах осуществления изобретения уровень экспрессии мРНК гена измеряют методом количественной ПЦР с обратной транскрипцией (qRT-PCR) или количественной ПЦР (qPCR). В другом варианте осуществления изобретения уровень экспрессии мРНК измеряют с помощью микроматрицы. В другом варианте осуществления изобретения уровень экспрессии мРНК измеряют при помощи гибридизации in situ (ISH). В определенных вариантах осуществления изобретения уровень экспрессии белка гена измеряют при помощи иммуногистохимического анализа (IHC). В определенных вариантах осуществления изобретения указанное лечение предотвращает развитие доброкачественной опухоли, предраковой опухоли или неметастазирующего рака в метастазирующий рак. В определенных вариантах осуществления изобретения лечение антагонистами G-CSF и/или антагонистами Bv8 предотвращает метастазирование метастазирующего рака в предметастатические ткани или органы тела.
В определенных вариантах осуществления изобретения эффективность лечения антагонистами G-CSF и/или антагонистами Bv8 можно контролировать, определяя уровень экспрессии G-CSF, Bv8, PKR1, MMP-9, S100A8 или S100A9 в предметастатическом органе или предметастатической ткани. В определенных вариантах осуществления изобретения уровни экспрессии мРНК и/или уровни экспрессии белка Bv8, MMP-9, S100A8 и/или S100A9 являются повышенными в предметастатическом легком и/или метастатическом легком. В определенных вариантах осуществления изобретения лечение антителом против Bv8 является эффективным в том случае, если уровень экспрессии мРНК и/или уровень экспрессии белка Bv8 и/или ММР-9 снижается после лечения антителом против Bv8. В определенных вариантах осуществления изобретения лечение антителом против Bv8 вызывает снижение уровня экспрессии мРНК, белка Bv8 и/или ММР-9 в предметастатических легких. В определенных вариантах осуществления изобретения лечение антителом против G-CSF является эффективным, если уровень экспрессии мРНК и/или уровень экспрессии белка Bv8 и/или ММР-9 снижается после лечения антителом против G-CSF. В определенных вариантах осуществления изобретения лечение антителом против G-CSF вызывает снижение уровня экспрессии мРНК и/или уровня экспрессии белка Bv8 и/или ММР-9 в предметастатических легких и/или метастатических легких.
Настоящее изобретение относится к комбинированной терапии, в соответствии с которой антагонист G-CSF или антагонист Bv8 по настоящему изобретению вводят совместно с проведением другого лечения. Комбинированная терапия, в частности, включает введение антагониста G-CSF и/или антагониста Bv8 в комбинации с антагонистом VEGF, таким как антитело против VEGF. Дополнительно или альтернативно антагонисты G-CSF и/или антагонисты Bv8 по настоящему изобретению можно вводить в комбинации с одним или несколькими другими средствами, например, противораковыми средствами или лечебными препаратами, средствами, препятствующими развитию кровеносных сосудов, или средствами, препятствующими образованию новых сосудов, для лечения разных неопластических состояний.
Антагонист G-CSF или антагонист Bv8 по настоящему изобретению можно вводить последовательно или вместе с другим средством, предназначенным для указанных целей, в одной композиции или в виде отдельных композиций.
Антагонист и/или лекарственные средства можно вводить одновременно, например, в виде одной композиции или в виде двух или более отдельных композиций одним и тем же или разными способами введения. Альтернативно или дополнительно введение можно производить последовательно в любом порядке. В определенных вариантах осуществления изобретения интервалы времени между введением двух или более композиций могут составлять от нескольких минут до нескольких дней, нескольких недель и нескольких месяцев. Например, антагонист VEGF может быть введен первым с последующим введением другого антагониста или лекарственного средства. Однако в объем настоящего изобретения также входит одновременное введение или предшествующее введение другого антагониста или лекарственного средства по настоящему изобретению.
Эффективные количества вводимых терапевтических средств определяет лечащий врач или ветеринар по собственному усмотрению. Вводимые дозы определяют с возможностью достижения максимально эффективного лечения состояний. Величина дозы дополнительно зависит от таких факторов, как тип используемого терапевтического средства и конкретного субъекта, подлежащего лечению. Приемлемые дозы антагониста VEGF соответствуют используемым в настоящее время и могут быть уменьшены благодаря объединенному действию (синергии) антагониста VEGF и другого антагониста по настоящему изобретению. В определенных вариантах осуществления изобретения комбинация ингибиторов потенцирует эффективность отдельно используемого ингибитора. Термин “потенцирование” означает повышение эффективности терапевтического средства при введении стандартной или утвержденной дозы. См. также раздел, озаглавленный “Фармацевтические композиции”, в настоящем описании изобретения.
Терапия, препятствующая развитию кровеносных сосудов, применительно к раку означает методику лечения рака, целью которой является ингибирование развития кровеносных сосудов опухоли, необходимых для доставки питательных веществ, поддерживающих рост опухоли. Поскольку развитие кровеносных сосудов необходимо как для роста первичной опухоли, так и метастазирования опухоли, лечение, препятствующее развитию кровеносных сосудов, по настоящему изобретению может ингибировать неопластический рост опухоли в месте возникновения, а также предотвращать метастазирование опухолей в другие части тела, позволяя воздействовать на опухоли другими средствами. В одном варианте осуществления изобретения противораковое средство является средством, препятствующим развитию кровеносных сосудов. В другом варианте осуществления изобретения противораковое средство является химиотерапевтическим средством.
В данной области идентифицированы и известны многие средства, препятствующие развитию кровеносных сосудов, в том числе средства, представленные в настоящем описании изобретения, например, в разделе “Определения терминов” и в публикациях Carmeliet and Jain, Nature 407:249-257 (2000); Ferrara et al., Nature Reviews: Drug Discovery, 3:391-400 (2004); и Sato, Int. J. Clin. Oncol., 8:200-206 (2003). См. также заявку на патент США US 20030055006. В одном варианте осуществления изобретения антагонист G-CSF и/или антагонист Bv8 используют в комбинации с нейтрализующим антителом против VEGF (или его фрагментом) и/или с другим антагонистом VEGF или антагонистом рецептора VEGF, которые включают, не ограничиваясь ими, например, растворимые фрагменты рецептора VEGF (например, VEGFR-1, VEGFR-2, VEGFR-3, фрагменты нейропилинов (например, NRP1, NRP2)), аптамеры, способные блокировать VEGF или VEGFR, нейтрализующие антитела против VEGFR, низкомолекулярные ингибиторы тирозинкиназ VEGFR (RTK), антисмысловые молекулы к VEGF, рибозимы против VEGF или рецепторов VEGF, варианты антагонистов VEGF и любые их комбинации. Альтернативно или дополнительно субъекту могут быть необязательно совместно введены два или более ингибиторов развития кровеносных сосудов помимо антагониста VEGF, антагониста G-CSF и/или антагониста Bv8. В определенных вариантах осуществления изобретения одно или несколько дополнительных терапевтических средств, например, противораковых средств, могут быть введены в комбинации с антагонистом G-CSF, антагонистом Bv8, антагонистом VEGF и/или средством, препятствующим развитию кровеносных сосудов.
В соответствии с определенными объектами изобретения другие терапевтические средства, пригодные для использования в комбинированной противоопухолевой терапии вместе с антагонистами G-CSF или антагонистами Bvc8, включают другие методы лечения рака (например, хирургическую операцию, радиологические методы лечения (например, облучение или введение радиоактивных веществ), химиотерапию, лечение противораковыми средствами, представленными в настоящем описании изобретения и известными в данной области, либо комбинации указанных методов). Альтернативно или дополнительно субъекту могут быть одновременно введены два или более антител, связывающихся с одним и тем же либо с двумя или более разными антигенами, рассмотренными в настоящем описании изобретения. Иногда благоприятный эффект дает также введение субъекту одного или нескольких цитокинов.
Определенные объекты настоящего изобретения относятся к способу ингибирования метастазирования опухоли путем введения субъекту с подозрением на рак или с диагностированным раком эффективных количеств антагониста VEGF, антагониста G-CSF и/или антагониста Bv8 и одного или нескольких химиотерапевтических средств. В комбинированной терапии по настоящему изобретению могут быть использованы разные химиотерапевтические средства. Иллюстративный и неограничивающий объем изобретения список химиотерапевтических средств приведен в настоящем описании изобретения под заголовком “Определения терминов”.
Специалистам в данной области должно быть понятно, что приемлемые дозы химиотерапевтических средств обычно соответствуют используемым в клинической терапии, когда химиотерапевтические средства вводят отдельно или в комбинации с другими химиотерапевтическими средствами. Доза может быть изменена в зависимости от подлежащего лечению состояния. Лечащий врач может самостоятельно определить дозу, необходимую для конкретного субъекта.
Настоящее изобретение относится к способам лечения субъекта, у которого возник рецидив или который оказался невосприимчивым к предшествующему лечению противораковыми средствами, и к композициям для осуществления указанных способов. Настоящее изобретение также относится к способам лечения рецидивирующего роста опухоли или рецидивирующего роста раковых клеток и к композициям для осуществления указанных способов. Термин “рецидивирующий рост опухоли” или “рецидивирующий рост раковых клеток” использован для описания состояния, лечение которого, осуществляемое одним или несколькими применяемыми в настоящее время методами лечения (например, противораковая терапия, такая как химиотерапия, лучевая терапия, хирургическая операция, гормональная терапия и/или биологическая терапия/иммунотерапия, терапия антителами против VEGF, в частности, стандартная схема лечения конкретного рака), является клинически неэффективным для субъектов, или субъекты более не испытывают благоприятного воздействия от такого лечения и нуждаются в дополнительной эффективной терапии. В определенных вариантах осуществления изобретения указанный термин может также означать состояние “невосприимчивого к лечению” субъекта, который, например, реагирует на лечение, но страдает от побочных эффектов, у которого возникает устойчивость к лечению, который не реагирует на лечение или не реагирует на лечение в достаточной степени и т.д. В разных вариантах осуществления изобретения рак представляет собой рецидивирующий рост опухоли или рецидивирующий рост раковых клеток, когда количество раковых клеток существенно не уменьшается или увеличивается, либо объем опухоли существенно не уменьшается или увеличивается, либо не происходит дальнейшего уменьшения объема опухоли или количества раковых клеток. Рецидивирующий рост опухоли или рецидивирующий рост раковых клеток можно определить in vivo или in vitro любым методом, известным в данной области и применяемым для оценки эффективности лечения раковых клеток, определяемых принятыми в данной области терминами “рецидив”, “неподдающийся лечению” или “невосприимчивый к лечению”, а также терминами, приведенными в настоящем описании изобретения под заголовком “Определения терминов”.
Кроме того, антагонисты G-CSF или антагонисты Bv8 можно вводить в комбинации с гормональными, радиационными и химиотерапевтическими средствами, возвращающими восприимчивость раковых клеток к одному или нескольким указанным средствам, которые затем начинают вводить (или продолжают вводить) для лечения рака, включая метастазирующий рак, и для предотвращения образования метастазов.
Настоящее изобретение также частично основано на идентификации биомаркеров, используемых для выявления субъектов, эффективно реагирующих на лечение антагонистом G-CSF и/или антагонистом Bv8. Указанные биомаркеры также пригодны для прогнозирования и контролирования эффективности такого лечения. Например, больной раком может быть подвергнут биопсии для получения образца ткани или клеток, который может быть исследован при помощи разных анализов in vitro для определения увеличения или уменьшения экспрессии G-CSF, PKR1 или одного или нескольких генов, указанных как URMCNA или DRMCNA, по сравнению с эталонным образцом. Образец, включающий биомаркер-мишень, может быть получен методами, хорошо известными в данной области и пригодными для конкретного типа и локализации исследуемого рака. Биопсию тканей часто используют для получения репрезентативного кусочка раковой ткани. Сравнению могут быть подвергнуты обычные образцы и эталонные образцы, исследованные одновременно или в разные периоды времени. Таким образом, методы и анализы, рассмотренные в настоящем описании изобретения, представляют собой удобные, эффективные и потенциально экономичные средства получения данных и информации, позволяющих оценить пригодность или эффективность методов, применяемых для лечения больных раком.
При осуществлении способов по настоящему изобретению образец ткани или клеток млекопитающего получают и исследуют в отношении экспрессии одного или нескольких биомаркеров. Экспрессию различных биомаркеров в образце можно исследовать целым рядом методов, многие из которых известны в данной области, знакомы квалифицированному специалисту и включают, не ограничиваясь ими, иммуногистохимический анализ и/или анализ методом вестерн-блоттинга, иммунопреципитацию, анализы молекулярного связывания, ELISA, ELIFA, сортировку клеток с возбуждением флуоресценции (FACS) и тому подобные, количественные анализы крови (например, анализ сыворотки ELISA, используемый для исследования, например, уровней экспрессии белка), биохимические анализы ферментативной активности, гибридизацию in situ, анализ методом нозерн-блоттинга и/или анализы мРНК методом ПЦР, а также любые анализы, которые могут быть выполнены с использованием генов и/или тканей. Типичные методы оценки состояния генов и генных продуктов описаны, например, в публикации Ausubel et al., eds., 1995, Current Protocols In Molecular Biology, Units 2 (нозерн-блоттинг), 4 (саузерн-блоттинг), 15 (иммуноблоттинг) и 18 (анализ методом ПЦР). Также могут быть использованы мультиплексные иммуноанализы, выполняемые компаниями Rules Based Medicine или Meso Scale Discovery (MSD).
Способы по настоящему изобретению дополнительно включают исследование наличия и/или экспрессии мРНК в одном или нескольких генах-мишенях, представленных как URMCNA или DRMCNA, в образце ткани или клеток. Гены-мишени также включают G-CSF и PKR1. Методы исследования мРНК в клетках хорошо известны и включают, например, анализы гибридизации с использованием зондов комплементарной ДНК (такие как гибридизация in situ с использованием меченых рибозондов, специфичных к одному или нескольким генам, представленным как URMCNA, DRMCNA, G-CSF или PKR1, нозерн-блоттинг и родственные методы) и разные анализы амплификации нуклеиновых кислот (такие как ПЦР с обратной транскрипцией с использованием комплементарных праймеров, специфичных к одному или нескольким генам, представленным как URMCNA, DRMCNA, G-CSF или PKR1, или другие методы обнаружения типа амплификации, такие как, например, анализ разветвленной ДНК, SISBA, TMA и тому подобные).
Образцы ткани или клеток млекопитающих могут быть использованы для анализа мРНК методами нозерн-блоттинга, дот-блоттинга или ПЦР. Например, анализы методом ПЦР с обратной транскрипцией (RT-PCR), такие как анализы методом количественной ПЦР, хорошо известны в данной области. В иллюстративном варианте осуществления изобретения метод обнаружения мРНК-мишени в биологическом образце включает получение кДНК из образца путем обратной транскрипции с использованием по меньшей мере одним праймером, амплификацию полученной таким образом кДНК с использованием полинуклеотида-мишени в качестве смыслового и антисмыслового праймеров для амплификации кДНК-мишеней и обнаружение наличия амплифицированной кДНК-мишени. Кроме того, такие методы могут включать одну или несколько стадий, позволяющих определить уровни мРНК-мишени в биологическом образце (например, путем одновременного исследования уровней сравнительной контрольной последовательности мРНК обязательного гена, такого как член семейства актинов). Необязательно можно определить последовательность амплифицированной кДНК-мишени. В определенных вариантах осуществления изобретения способы по настоящему изобретению включают исследование или обнаружение мРНК, таких как мРНК-мишени, в образце ткани или клеток микроматричными методами.
В некоторых вариантах осуществления изобретения экспрессию белков-мишеней в образце исследуют методами иммуногистохимии и окрашивания. Установлено, что иммуногистохимическое окрашивание срезов тканей является надежным методом оценки или обнаружения белков в образце. При выполнении иммуногистохимии (”IHC”) обычно используют антитело для зондирования и визуализации клеточных антигенов in situ хромогенными или флуоресцентными методами.
Диагностические маркеры для белков-мишеней могут включать одну, две или более, три или более, четыре или более, пять или более, шесть или более, семь или более, восемь или более, девять или более, десять или более, двенадцать или более, тринадцать или более, четырнадцать или более, пятнадцать или более либо всю совокупность молекул, представленных как URMCP или DRMCP. Указанная молекула является нуклеиновой кислотой, кодирующей белок или белок с измененной экспрессией и/или активностью, которую выбирают из следующих молекул: G-CSF, Bv8, PKR1, Stfa3, CAMP, TNFSF14, MGAM, Ngp, S100A8, S100A9, LRP1B, CEACAM4, HAO1, C10orf46, CLECSF9, Mcpt8, PRTN3, Slfn3, MMP-9, TYMS, CRIPTO CR-1, MPHOSPH1, CDH6, WWP2, DMC1, BCHE, NSLE16484, F9, GDAP1, LOC375188, DNTT, PPIL3, KCND2, ZNF597, IGSF4D и GTF3C4. Определенные варианты осуществления изобретения относятся к одному или нескольким антителам, используемым для обнаружения одного или нескольких белков-мишеней.
Е. Фармацевтические композиции и способы их введения
Антагонисты G-CSF и антагонисты Bv8, такие как антитела против G-CSF, антитела против Bv8 и антитела против PKR1 по настоящему изобретению, вводят больному человеку отдельно или в комбинации с другими терапевтическими средствами известными способами, такими как внутривенное введение в виде инъекции ударной дозы вещества или непрерывного вливания в течение определенного периода времени, внутримышечное, внутрибрюшинное, интрацереброспинальное, подкожное, интраартикулярное, внутрисуставное, подоболочечное, пероральное, местное введение или введение путем ингаляции.
В определенных вариантах осуществления изобретения лечение по настоящему изобретению предполагает комбинированное введение антагониста G-CSF или антагониста Bv8 и антагониста VEGF и/или химиотерапевтического средства. В одном варианте осуществления изобретения вводят дополнительные противораковые средства, например, одно или несколько других средств, препятствующих развитию кровеносных сосудов, одно или несколько химиотерапевтических средств и т.д. Настоящее изобретение также относится к введению нескольких ингибиторов, например, нескольких антител к одному и тому же антигену или нескольких антител к разным белкам по настоящему изобретению. В одном варианте осуществления изобретения субъекту вводят коктейль из разных химиотерапевтических средств вместе с антагонистом Bv8 по настоящему изобретению. Комбинированное введение включает совместное введение отдельных препаратов или одного фармацевтического препарата и/или последовательное введение в любом порядке. Например, антагонист VEGF можно вводить до, после, поочередно или одновременно с введением антагониста G-CSF или антагониста Bv8. В одном варианте осуществления изобретения оба (или все) активных агента одновременно проявляют свою биологическую активность в течение определенного периода времени.
Соответствующая доза лекарственного средства по настоящему изобретению, используемого для профилактики или лечения заболевания, зависит от типа подлежащего лечению заболевания, тяжести и продолжительности заболевания, введения ингибитора в профилактических или лечебных целях, предшествующего лечения, клинической истории болезни субъекта и восприимчивости к воздействию ингибитора, а также от решения лечащего врача. Ингибитор вводят субъекту однократно или в виде нескольких курсов лечения. В случае комбинированной терапии композиции по настоящему изобретению вводят в терапевтически эффективном количестве или в терапевтическом синергически действующем количестве. В использованном здесь значении терапевтически эффективное количество является таким количеством, которое при введении композиции по настоящему изобретению и/или совместном введении антагониста VEGF и одного или нескольких других терапевтических средств вызывает ослабление или подавление развития болезни или состояния, против которых направлено лечение. Эффект введения комбинации средств может быть аддитивным. В одном варианте осуществления изобретения результатом введения является синергическое действие. Терапевтическое синергически действующее количество является таким количеством антагониста VEGF и одного или нескольких других терапевтических средств, например, антагониста G-CSF и/или антагониста Bv8 и необязательно химиотерапевтического средства и/или противоракового средства, которое необходимо для достижения синергического действия или существенного ослабления или устранения состояния или симптомов, ассоциированных с конкретным заболеванием.
В зависимости от типа и тяжести заболевания начальная доза составляет примерно 1 мкг/кг - 50 мг/кг (например, 0,1-20 мг/кг) антагониста G-CSF, антагониста Bv8, антагониста VEGF, химиотерапевтического средства и/или противоракового средства в виде одного или нескольких отдельных введений или непрерывного вливания. Типичная суточная доза может составлять от около 1 мкг/кг до около 100 мг/кг или более в зависимости от вышеуказанных факторов. Введение указанных доз повторяют в зависимости от состояния в течение нескольких дней или более продолжительного периода времени до достижения желаемого подавления симптомов заболевания. Однако могут быть использованы другие схемы введения лекарственных средств. Обычно лечащий врач увеличивает количество вводимых молекул по настоящему изобретению до достижения дозы, обеспечивающей требуемое биологическое действие. Ход лечения по настоящему изобретению можно легко контролировать при помощи стандартных методов и анализов.
Препараты и схемы применения ингибиторов развития кровеносных сосудов, например, антител против VEGF, таких как AVASTIN® (Genentech, South San Francisco, CA), могут быть выбраны в соответствии с инструкциями производителей или определены эмпирически квалифицированным лечащим врачом. В другом примере препараты и схемы применения таких химиотерапевтических средств могут быть выбраны в соответствии с инструкциями производителей или определены эмпирически квалифицированным лечащим врачом. Препараты и схемы применения химиотерапевтических средств также описаны в публикации Chemotherapy Service Ed., M.C. Perry, Williams & Wilkins, Baltimore, MD (1992).
Эффективность лечения по настоящему изобретению можно определить по разным признакам, обычно используемым для оценки неопластических нарушений. Например, лечение рака можно оценить по следующим признакам, которые включают, не ограничиваясь ими, регрессию опухоли, уменьшение массы или объема опухоли, период времени до прогрессирования заболевания, продолжительность выживания, выживание без прогрессирования опухоли, общая степень реакции, продолжительность реакции, качество жизни, экспрессия и/или активность белка. Так как средства, препятствующие развитию кровеносных сосудов, по настоящему изобретению направленно воздействуют на сосудистую сеть опухоли и не обязательно на сами раковые клетки, то такие средства представляют собой уникальный класс противораковых средств и поэтому могут потребовать специальных показателей определения клинической реакции на лекарственные средства. Например, уменьшение опухоли более чем на 50% при выполнении двумерного анализа является стандартным показателем для признания реакции на проводимое лечение. Однако ингибиторы по настоящему изобретению могут подавлять распространение метастазов без уменьшения первичной опухоли или могут просто оказывать онкостатическое действие. Таким образом, для определения эффективности лечения по настоящему изобретению могут быть использованы методы, включающие, например, измерение маркеров развития кровеносных сосудов в плазме или моче и измерение реакции при помощи радиологической визуализации.
Другой вариант осуществления изобретения относится к изделию, содержащему материалы, предназначенные для лечения или диагностики вышеуказанных нарушений. Изделие по настоящему изобретению включает емкость, этикетку и вкладыш в упаковку. Приемлемыми емкостями являются, например, бутылочки, пузырьки, шприцы и т.д. Емкости могут быть изготовлены из разных материалов, таких как стекло или пластик. В одном варианте осуществления изобретения емкость содержит композицию, предназначенную для эффективного лечения состояния, и имеет стерильное отверстие для доступа (например, емкость может представлять собой мешок с раствором для внутривенного вливания или пузырек, закрытый пробкой, проницаемой для иглы для подкожных инъекций). По меньшей мере один активный агент в композиции является антагонистом G-CSF или антагонистом Bv8. В определенных вариантах осуществления изобретения активный агент является антителом против G-CSF. В определенных вариантах осуществления изобретения активный агент является антителом против Bv8. На этикетке, прикрепляемой или прилагаемой к емкости, указано, что данная композиция предназначена для лечения выбранного состояния. В определенных вариантах осуществления изобретения емкости содержат совокупность маркеров, позволяющих диагностировать метастазирующие опухоли, эффективно реагирующие на лечение антагонистом G-CSF и/или антагонистом Bv8. В определенных вариантах осуществления изобретения по меньшей мере один агент в композиции является маркером для обнаружения G-CSF, PKR1, URMCNA, URMCP, DRMCNA и/или DRMCP. Изделие по настоящему изобретению может дополнительно включать вторую емкость, содержащую фармацевтически приемлемый буфер, такой как физиологический раствор с фосфатным буфером, раствор Рингера и раствор декстрозы.
Настоящее изобретение более подробно проиллюстрировано в нижеследующих примерах, не ограничивающих объем изобретения.
Пример 1
Материалы и методы
Линии клеток. Линии клеток опухоли молочной железы мышей 67NR, 168FARN, 4TO7 и 66с14 (Dexter D.L. et al., Cancer Res. 38, 3174 (1978); Aslakson C.J. and Miller F.R., Cancer Res. 52, 1399 (1992)) были предоставлены Ф. Миллером (Karmanos Cancer Institute, Detroit, MI). Клетки рака молочной железы 4Т1, рака легкого Льюиса (LLC) и клетки меланомы мыши B16F10 были приобретены в АТСС. Клетки MDA-MB-231-D3H1 (клетки MDA-MB-231, устойчиво экспрессирующие люциферазу) были предоставлены компанией Xenogen (Alameda, CA). Клетки MDA-MB-231-X1.1 являются GFP-экспрессирующими клетками, которые были предварительно пассированы в мышах с целью создания линии высокоонкогенных клеток. Указанные клетки были созданы в результате трансфекции материнских клеток MDA-MB-231 вектором, экспрессирующим GFP и пуромицин. Затем GFP-положительные клетки подкожно инъецировали (в матригеле) мышам SCID/bg. Видимые опухоли удаляли, и онкогенные клетки выделяли и размножали. Все линии клеток рака молочной железы культивировали в среде IMDM за исключением клеток MDA-MB-231, LLC и B16F10, которые выращивали в среде DMEM (Invitrogen, Carlsbad, CA). Среды IMDM и DMEM были дополнены 10% FBS (Sigma, St. Louis, MO). Все клетки сохраняли в инкубаторе с 5% СО2 и 80% влажностью при 37°С.
Мыши. Мыши с мышиным раком молочной железы MMTV-PyMT были предоставлены McMaster University, Ontario. Самки мышей Balb/c, голые мыши Balb/c, CB6F1 (помесь самок BALB/c и самцов C57BL/6) были предоставлены Charles River Laboratory (Hollister, CA). Самки мышей C57BL/6 были предоставлены The Jackson Laboratory (Sacramento, CA). Содержание животных и методы исследования соответствовали федеральным нормам и были утверждены Комитетом по контролю за уходом и использованием животных.
Модели опухолей. Клетки 67NR, 168FARN, 4TO7, 66c14 и 4Т1 ортотопически инъецировали в жировое тело 4-й правой молочной железы самок мышей Balb/c или CB6F1 в количестве 200000 клеток/10 мкл PBS. Лечение антителами против Bv8 проводили в соответствии с ранее приведенным описанием (Shojaei, F. et al., Nature 450, 825-831 (2007)). Лечение антителами против Bv8 начинали (5 мг/кг каждого моноклонального антитела 2В9 и 3F1) через 2 дня после инокуляции опухолевых клеток при помощи внутрибрюшинного способа введения. Моноклональное антитело против полиноза (10 мг/кг) было использовано в качестве контрольного антитела. Антитела вводили имеющим опухоли мышам дважды в неделю. Нейтрализующее моноклональное антитело против G-CSF мыши (МАВ414) и контрольный изотипически сходный IgG (R&D Systems, Minneapolis, MN) вводили в дозе 25 мкг/мышь через день. Объемы опухолей вычисляли через день с помощью формулы объема эллипсоида (0,5×L×W2, где L означает длину и W означает ширину).
Клетки B16F10 и LLC повторно суспендировали в концентрации 1×108 клеток на мл матригеля (уменьшенное содержание фактора роста; BD Pharmingen, San Jose, CA) и инъецировали (100 мкл) подкожно в заднюю лапу мышей C57BL/6. Ткани, полученные у мышей, имевших опухоли B16F10 или LLC, анализировали в отношении содержания Cd11b+Grl+ клеток и экспрессии Bv8 через 15 дней после инокуляции опухоли, причем в указанный период времени раковые клетки не были обнаружены в ткани легких.
Ткани, полученные у самок мышей MMTV-PyMT, анализировали в возрасте 8 недель (не было обнаружено видимых легочных метастазов) и 12 недель (были ясно видны метастатические узлы) в отношении экспрессии G-CSF и Bv8 в плазме и ткани легких. MMTV-PyMT-отрицательные сиблы (однопометные животные с отсутствием трансгена, определенного генотипированием), использованные в качестве контрольных животных, определяются в настоящем описании изобретения как животные, не имеющие опухолей. Для исследования антител против Bv8 и антител против G-CSF клетки MMTV-PyMT выделяли из первичных опухолей самок в возрасте 12 недель. Все выделенные клетки (опухоли и стромы) подсчитывали и повторно суспендировали в концентрации 2×107 клеток/мл PBS:матригеля (смесь 1:1) (уменьшенное содержание фактора роста; BD Pharmingen, San Jose, CA) и инъецировали (50 мкл) в жировое тело 4-й молочной железы мышей FVB. Выделенные клетки также культивировали в среде DMEM, содержащей FBS. Лечение антителом против Bv8 (10 мг/кг моноклонального антитела 2D3) или антителом против G-CSF мыши (антитело против G-CSF, 2,5 мг/кг, МАВ414 компании R&D Systems, Minneapolis, MN) начинали через 2 дня после инокуляции опухоли внутрибрюшинным способом введения. В конце исследования легкие перфузировали PBS и фиксировали в формалине. Затем срезы толщиной 7 мкм окрашивали H&E и подсчитывали опухоли в легких. В среднем анализировали три среза (сделанных на расстоянии 250 мкм) в каждом легком.
Клетки MDA-MB-231-X1.1 повторно суспендировали в концентрации 4×107 клеток/мл PBS:матригеля (смесь 1:1) (BD Pharmingen, San Jose, CA) и инъецировали (50 мкл) в жировое тело 4-й молочной железы мышей SCID/bg. Лечение антителом против Bv8 (10 мг/кг моноклонального антитела 2D3) или антителом против G-CSF человека (антитело против hG-CSF, 2,5 мг/кг, МАВ214 компании R&D Systems, Minneapolis, MN) начинали через 2 дня после инокуляции опухолевых клеток внутрибрюшинным способом введения. Изотипически сходный IgG использовали в качестве контрольного антитела. Антитела вводили имеющим опухоли мышам три раза в неделю. В конце исследования легкие перфузировали PBS и фиксировали в параформальдегиде в течение 16 часов. Затем легкие переносили в раствор 30% сахарозы/PBS. Число метастатических очагов определяли, помещая целые легкие под флуоресцентный микроскоп и подсчитывая GFP-положительные очаги в ткани (состоящие более чем из 2 клеток во избежание подсчета единичных раковых клеток, захваченных сосудистой сетью легких).
Альтернативно для исследований, включающих инъецирование рекомбинантного G-CSF голым самкам мышей Balb/c, использовали моноклональное антитело 2D3 хомячка против Bv8 мыши (Shojaei, F. et al., Proc. Natl. Acad. Sci. USA (2009)), пригодное для выполнения иммунонейтрализаци и иммуногистохимии (Genentech, South San Francisco, CA), которое вводили в дозе 10 мг/кг два раза в неделю.
Создание мышей с отсутствием Bv8. Для оценки влияния отсутствия эндогенного Bv8 в моделях опухолей были созданы мыши, не имеющие Bv8 в мононуклеарных клетках, выделенных из костного мозга (BMMNC), в результате трансплантации клеток эмбриональной печени без Bv8. Для создания мышей с отсутствием Bv8, клон ВАС mVRPA BAC 133 N12 (Research Genetics), содержащий ген Bv8 мыши, и направленно воздействующий вектор TNLOX1-3 с тремя сайтами loxP использовали для создания конструкции, позволяющей целенаправленно получить мышей с отсутствием гена Bv8 и обусловленной отсутствием данного гена делецией аллеля Bv8. Клоны ES с кластером PGK-Neo, направленно воздействующим на экзон 2, исследовали методом саузерн-блоттинга и электропорировали рекомбиназу Cre для эксцизии селектируемого кластера PGK-Neo и экзона 2 для удаления Bv8. Шесть клонов с отсутствием Bv8 инъецировали в бластоциты мышей C57BL/6. Химеры, передающие разрушающую мутацию через зародышевую линию клеток, скрещивали с мышами C57Bl/6. Мышей содержали в инбредной генетической среде 129SvEv и подвергали обратному скрещиванию с мышами C57BK/6.
Трансплантация эмбриональной печени и инокуляция опухоли облученному смертельной дозой хозяину. Клетки эмбриональной печени (FL) выделяли из эмбрионов мышей дикого типа (WT) или с отсутствием Bv8 (KO) в Е13.5-14.5 дни беременности. Беременных мышей умерщвляли в 13.5-14.5 дни беременности, клетки FL удаляли под микропрепаровальной лупой и сразу же помещали на чашку Петри, содержащую холодную среду DMEM для испытуемых компонентов. Взвесь единичных клеток получали в результате интенсивного пипетирования клеток FL и пропускания клеток через фильтр для клеток с размером пор 40 микрон (BD Falcon, CA). Затем в клетках FL лизировали эритроциты, используя буфер для лизиса АСК (Cambrex, MA), выдерживали в среде DMEM для испытуемых компонентов и использовали для трансплантации облученным смертельной дозой мышам.
Перед трансплантацией мышей CB6F1 облучали смертельной дозой 1080 Рад в Cs-облучателе для уничтожения эндогенных BMMNC в хозяине и затем внутривенно инъецировали 4х105 цельных клеток эмбриональной печени в 100 мкл PBS.
Через четыре недели после трансплантации FL клетки 4Т1 или 66с14 инокулировали в жировое тело 4-й молочной железы мышей CB6F1 в соответствии с приведенным описанием. Изотипически сходное контрольное антитело или антитело против Bv8 (2В9 и 3F1) вводили в соответствии с приведенным описанием (Shojaei, F. et al., Nature 450, 825-831 (2007)). Легкие исследовали на наличие метастазов при помощи компьютерной микротомографии или подсчитывали видимые опухоли на поверхности легких.
Создание линий клеток Luc-zsGreen-Hydro. Вектор pMSCV, кодирующий слитый белок люцифераза-zsGreen (функциональный гибрид люциферазы светляка и zsGreen) был получен путем введения кДНК люциферазы в рамке считывания с кДНК zsGreen в вектор pMSCV-zsGreen. Вектор pMSCV кодировал ген, устойчивый к гигромицину.
Для получения клеток 67NR и 4Т1, устойчиво экспрессирующих гибрид люцифераза-zsGreen, клетки трансфицировали вектором pMSCV-Luc-zsGreen-Hygro, используя трансфицирующий реагент FuGENE, в соответствии с инструкциями производителя (Roche, Indianapolis, IN). Устойчивые к гигромицину клетки отбирали, культивируя трансфицированные клетки в присутствии 200 мкг/мл гигромицина в течение 10 дней. Люцифераза-zsGreen-положительные клетки сортировали при помощи проточной цитометрии на основании экспрессии zsGreen и подтверждали экспрессию люциферазы путем измерения активности люциферазы в двойной системе анализа гена-репортера люциферазы (Promega, San Luis Obispo, CA). Клетки, экспрессирующие zsGreen и люциферазу, размножали в присутствии гигромицина (100 мкг/мл) и использовали для последующих экспериментов.
Отбор клеток MDA-MB-231 in vivo. Для создания линии клеток MDA-MB-231, характеризующихся более высоким метастатическим потенциалом в легких, 5×105 клеток MDA-MB-231-D3H1 в PBS инъецировали в хвостовую вену мышей SCID/bg. Через 6 недель (когда биолюминесцентная визуализация показала наличие растущих опухолей в легких) у трех мышей удаляли легкие, иссекали опухолевые клетки и размножали в культуре. Были созданы три независимые линии клеток (полученные у трех разных мышей), получившие названия MDA-MB-231-L1.1, -L2.1 и -L3.1. Для получения онкогенных клеток в месте образования первичной опухоли 1×106 клеток MDA-MB-231-D3H1 инокулировали в матригеле в жировое тело 4-й молочной железы мышей SCID/bg. Первичные опухоли удаляли, клетки иссекали и размножали в культуре. Были созданы три независимые линии клеток (полученные у трех разных мышей), получившие названия MDA-MB-231-T1.1, -T2.1 и -Т3.1. Для анализа экспрессии генов вновь полученные линии клеток высевали с плотностью 500000 клеток/лунку (на 6-луночные планшеты) и через 48 часов собирали РНК, которую использовали для выполнения последующих анализов экспрессии методом qRT-PCR.
Получение клеток 66c14-shPKR1 и 67NR-PKR1. Для создания клеток 66с14 с пониженной экспрессией PKR1 клетки 66с14 трансфицировали вектором shРНК, направленно воздействующим на PKR1 мыши (shPKR1, Open Biosystems, Huntsville, AL), и выделяли клоны, устойчиво экспрессирующие shPKR1, для чего клетки культивировали в присутствии пуромицина (5 мкг/мл). В качестве контрольного эксперимента клетки 66с14 трансфицировали вектором, экспрессирующим shРНК ненаправленного действия (контрольная shРНК). Для создания клеток 67NR, сверхэкспрессирующих PKR1, клетки 67NR котрансфицировали вектором, содержащим кластер CMV-PKR1, вместе с вектором, несущим ген устойчивости к зеоцину. Клетки, устойчиво экспрессирующие PKR1, отбирали в присутствии зеоцина (200 нг/мл). Затем клетки инъецировали в хвостовую вену мышам Balb/c, которым предварительно вводили наполнитель или G-CSF. Через 3 недели легкие удаляли и проверяли наличие видимых опухолей. Аутентичность опухолей в легких была подтверждена окрашиванием H&E.
Получение образца РНК и выполнение анализа методом количественной ПЦР с обратной транскрипцией (qRT-PCR). Полная РНК без ДНК была получена из PBS-перфузированных легких при помощи набора RNeasy (Qiagen, Germany) в соответствии с инструкциями производителя. Одностадийную количественную ПЦР с обратной транскрипцией выполняли в общем объеме, равном 50 мкл, используя набор для одностадийной qRT-PCR SuperScript III Platinum (Invitrogen, Carlsbad, CA) или рабочую смесь для одностадийной RT-PCR TaqMan (Applied Biosystems, Foster City, CA) и 100 нг полной РНК. Для выполнения анализа экспрессии гена TaqMan были использованы следующие смеси праймеров и зондов: Bv8 (идентификатор анализа: Mm00450080_m1), MMP9 (идентификатор анализа: Mm00442991_m1), S100A8 (идентификатор анализа: Mm00496696_g1), S100A9 (идентификатор анализа: Mm00656925_m1), G-CSF (идентификатор анализа: Hs99999083_m1), M-CSF (идентификатор анализа: Hs99999084_m1), GM-CSF (идентификатор анализа: Hs00929873_m1), VEGF-A (идентификатор анализа: Hs00900054_m1), PlGF (идентификатор анализа: Hs01119262_m1), SDF1α (идентификатор анализа: Hs00171022_m1), Cxcl1 (идентификатор анализа: Hs00236927_m1), MMP1 (идентификатор анализа: Hs00899658_m1), PKR1 (идентификатор анализа: Mm00517546_m1 и Hs03044877_m1), PKR2 (идентификатор анализа: Mm00769571_m1 и Hs03046077_m1), Hprtl (идентификатор анализа: Mm00446968_m1 и Hs99999909_m1), GAPDH (идентификатор анализа: Mm99999915_g1 и Hs99999905_m1). Экспрессия гигромицина была обнаружена при помощи специальных праймеров и зонда TaqMan (Applied Biosystems, Foster City, CA): прямой праймер: CCGCAAGGAATCGGTCAAT (SEQ ID NO:15); обратный праймер: GATCAGCAATCGCGCATATG (SEQ ID NO:16); зонд TaqMan: 6FAM - CACTACATGGCGTGATT - MGBNFQ (SEQ ID NO:17) (нефлуоресцентный гаситель, связывающийся с бороздкой в спирали молекулы, Applied Biosystems, Foster City, CA).
Реакции выполняли в системе для выполнения ПЦР в реальном времени 7500 Applied Biosystems в следующих условиях: стадия обратной транскрипции (15 минут при 48°С), затем стадия денатурации при 95°С и 40 циклов по 15 сек при 95°С и 1 минута при 60°С. Уровни экспрессии генов в каждом образце определяли при помощи относительного количественного метода с использованием мРНК GAPDH или Hprtl в качестве эндогенного контрольного образца.
Получение образца на микроматрице и выполнение анализа. Мышам Balb/c инъецировали PBS (не имевшим опухолей), неметастазирующие клетки 67NR (200000 клеток в PBS одной мыши) или метастазирующие клетки 4Т1 (200000 клеток в PBS одной мыши). Было использовано пять мышей для каждого состояния. Через шесть дней после инокуляции опухолевых клеток (или после достижения опухолями объема, равного примерно 50 мм3) мышей умерщвляли и легкие перфузировали PBS для полного удаления крови из сосудистой сети легких. Очищенные доли легких погружали в RNAlater (Qiagen, Germany) для стабилизации РНК. Полную РНК выделяли в соответствии с описанием, приведенным в разделе “Получение РНК” и использовали для последующего выполнения микроматричного анализа. Для анализа профиля экспрессии образцов тканей использовали микроматрицы Affymetrix (мышь 430-v2). Один образец из группы 4Т1 был исключен из конечного анализа из-за очень плохого качества данных. Полученные данные обрабатывали с помощью программы, соответствующей рекомендациям, приведенным в публикации Choe, et al., Genome Biol. 6, R16 (2005).
Клонирование и экспрессия mG-CSF. Для получения конструкции, временно экспрессирующей G-CSF мыши, фрагмент, полученный методом ПЦР, который содержал консенсусную последовательность Козака и кодирующую область mG-CSF с меткой 6×His у С-конца, амплифицировали из кДНК мыши IMAGE клона № 40129682 (Open Biosystems) и вводили в сайты ClaI и EcoRI вектора pRK. Полученную конструкцию затем использовали для временной трансфекции клеток СНО. Супернатанты собирали и рекомбинантный белок mG-CSF очищали на колонке Ni-NTA и затем на колонке для гель-хроматографии.
Исследования G-CSF и антитела против G-CSF in vivo. Для исследования воздействия G-CSF на активацию и хоминг миелоидных клеток в удаленных органах восьминедельным самкам мышей Balb/c или голым мышам Balb/c ежедневно подкожно инъецировали 10 мкг рекомбинантного G-CSF человека (Neupogen, Amgen, Thousand Oaks, CA) или рекомбинантный G-CSF мыши в течение пяти последующих дней. Исходный раствор G-CSF разводили до требуемой концентрации стерильным PBS (Invitrogen, Carlsbad, CA). Контрольным животным вводили PBS в качестве наполнителя. В конце исследования (через 24 часа после последней инъекции G-CSF) мышей перфузировали PBS и брали ткани (легкое, костный мозг, цельную кровь, селезенку, печень и почку) на анализ. Cd11b+Grl+ или Ly6G+Ly6C+ клетки анализировали в соответствии с описанием, приведенным в разделе “Проточная цитометрия”. Уровни Bv8 в тканях измеряли при помощи описанного анализа ELISA.
Чтобы определить роль Bv8 в G-CSF-индуцированной активации Cd11b+Grl+ клеток, голым мышам Balb/c ежедневно (в течение пяти дней) вводили антитело против Bv8 2D3 (2,5 мг/кг) и через 6 часов вводили G-CSF мыши (Genentech, South San Francisco, CA). Антитело против gp120 (Genentech, South San Francisco) использовали в качестве изотипически сходного контрольного антитела. В некоторых экспериментах мышам вводили антитело крысы против Grl (50 мкг/мышь, клон RB6-8C5, eBioscience, San Diego, CA) или антитело против Ly6G (50 мкг/мышь, клон 1А8, BD Bioscience, San Jose, CA). В качестве положительного контрольного антитела использовали моноклональное антитело крысы против G-CSF мыши (50 мкг/мышь, МАВ414, R&D Systems, Minneapolis, MN), которое вводили одновременно с антителом против Bv8 с последующим введением G-CSF мыши.
Для определения роли G-CSF в метастазировании опухолей мышам Balb/c, голым мышам Balb/c, мышам C57BL/6 или SCID/bg предварительно вводили G-CSF человека или мыши (10 мкг/мышь) в соответствии с приведенным выше описанием. Затем в хвостовую вену инъецировали 10000 клеток (66с14, 4Т1, 67NR, B16F10 или MDA-MB-231-L1.1) в 100 мкл PBS. G-CSF продолжали вводить в течение 5 дней после инъекции раковых клеток. Мышей исследовали на наличие опухолей в легких через 3 недели (4 недели для 67NR и 5 недель для опухолей MDA-MB-231-L1.1) после инъекции раковых клеток. Легкие перфузировали PBS, фиксировали в формалине и подсчитывали видимые опухоли. Аутентичность опухолей в легких была подтверждена окрашиванием H&E.
Чтобы определить роль Bv8, Grl+ или Ly6G+ клеток в G-CSF-индуцированном метастазировании, мышам предварительно вводили наполнитель или G-CSF мыши (2,5 мкг/мышь) и затем в течение 5 дней вводили антитела против Bv8, Grl, Ly6G или G-CSF в соответствии с приведенным выше описанием. Антитело против VEGF (G6.31, Genentech, South San Francisco, CA) вводили в дозе 5 мг/кг через день. Введение антител было прекращено после инокуляции опухолевых клеток.
Анализ миграции. Клетки обрабатывали трипсином, промывали средой IMDM без FBS и повторно суспендировали в концентрации 100000 клеток/мл. 300 мкл взвеси клеток вводили в верхнюю лунку 24-луночного планшета с системой вставок FluoroBlok (8,0 мкм, BD Bioscience), который сенсибилизировали коллагеном типа I (BD Biosciences, San Jose, CA) в течение 1 часа до выполнения анализа. В нижнюю лунку вводили 1 мл среды IMDM с указанной концентрацией Bv8 человека (Peprotech, Rocky Hill, NJ). Среду IMDM с 1% FCS использовали в качестве положительного контрольного образца. Планшеты инкубировали в течение 16 часов. Клетки, мигрировавшие через мембрану, метили флуоресцентным красителем Calcein AM (BD Biosciences, San Jose, CA). Были получены изображения меченых клеток (система микроскопа Zeiss), после чего клетки подсчитывали при помощи программного обеспечения ImageJ (NIH).
Сбор кондиционированных сред из опухолевых клеток. Клетки 67NR, 168FARN, 4TO7, 66C14 и выделенные из 4Т1 клетки MMTV-PyMT и MDA-MB-231-X1.1 выращивали в соответствии с описанием, приведенным в разделе “Линия клеток”. После достижения 90% слияния среды заменяли бессывороточной средой IMDM. Кондиционированные среды собирали после инкубации в течение двух дней и измеряли жизнеспособность клеток и общее число клеток, используя устройство Vi-Cell XR (Beckman Coulter, Fullerton, CA). Собранные среды исследовали на наличие цитокинов в соответствии с описанием, приведенным в разделе “ELISA”. Все данные были нормализованы относительно общего числа клеток.
Анализ выхождения клеток из сосудов in vivo. Клетки 66с14 или 4Т1 выращивали до достижения 90% слияния и метили 10 мкМ зеленого красителя CMFDA CellTracker (Invitrogen, Carlsbad, CA) в течение 30 минут в соответствии с инструкциями производителя. Меченые клетки обрабатывали трипсином, промывали PBS и подсчитывали, затем 100000 меченых клеток в 100 мкл PBS внутривенно инъецировали в хвостовую вену голым мышам Balb/c, которым предварительно вводили G-CSF мыши (2,5 мкг/мышь, ежедневно в течение 5 дней) в присутствии антитела против Bv8 (2B9+3F1), антитела против Grl, антитела против G-CSF или изотипически сходного контрольного (ISO) антитела в соответствии с описанием, приведенным в разделе “G-CSF”. Для получения отрицательных контрольных животных немеченные клетки 66с14 или 4Т1 инъецировали мышам, которым предварительно вводили G-CSF и изотипически сходное контрольное антитело (ISO). G-CSF и антитело продолжали вводить еще один день после инокуляции клеток. Мышей умерщвляли через 36 часов после инокуляции клеток, легкие перфузировали PBS, удаляли и фиксировали в параформальдегиде. Фиксированные легкие погружали в соединение О.С.Т. (Tissue-Tek, Torrance, CA), замораживали и получали 5 мкм срезы. Срезы контрастно окрашивали DAPI и покрывали средой для заливки ProLong Gold (Invitrogen, Carlsbad, CA). Получали изображения клеток и вручную подсчитывали клетки, меченные флуоресцентным красителем. В среднем были использованы три мыши в одной группе, и был выполнен анализ 15 изображений (5 произвольных срезов одной мыши). Конечные значения были представлены в виде среднего числа клеток в поле.
Гистологический анализ (H&E). Ткань, фиксированную в формалине, дегидратировали и погружали в парафин. Срезы толщиной 5 мкм очищали от воска, повторно гидратировали и окрашивали гематоксилином и эозином стандартным методом.
Иммуногистохимический (IHC) анализ Bv8. Иммуногистохимический анализ Bv8 выполняли в соответствии с ранее представленным описанием (Shojaei. F. et al., Proc. Natl. Acad. Sci. USA (2009)). Удаляли предметастатические легкие у PBS-перфузированных мышей, имевших опухоли 67NR или 4Т1, и фиксировали в формалине с нейтральным буфером. Срезы толщиной 5 мкм, погруженные в парафин, очищали от воска и повторно гидратировали. После восстановления антигена при помощи универсального буфера для снятия покрытия (Biocare Medical, Concord, CA) в аппарате высокого давления (Biocare Medical, Concord, CA) срезы блокировали реагентом, блокирующим пероксидазу (DAKO, Glostrup, Denmark), в течение 5 минут, и затем блокировали раствором, блокирующим белок (DAKO, Glostrup, Denmark) в течение 30 минут. Затем срезы инкубировали с моноклональным антителом хомячка против Bv8 мыши 2D3 (Genentech, South San Francisco, CA) или с IgG1 хомячка (BD Pharmingen, San Jose, CA) в количестве 10 мкг/мл в течение 1 часа при комнатной температуре. Срезы окрашивали биотинилированным антителом козы против антитела хомячка (Jackson Immuno Research, West Grove, PA) в течение 30 минут при комнатной температуре и инкубировали с реагентами Vectastain ABC Elite (Vector Laboratories, Burlingame, CA). Затем срезы инкубировали с раствором субстрата пероксидазы (DAB с металлом; Pierce Chemical, Rockford, IL) до достижения требуемой интенсивности. И наконец, среды контрастно окрашивали гематоксилином, дегидратировали и накрывали покровным стеклом.
ELISA. Плазму собирали в пробирки, обработанные EDTA. Мышей перфузировали PBS, удаляли небольшие кусочки тканей легких, селезенки, опухолей, почек и костного мозга и сразу же замораживали в жидком азоте. Затем ткани лизировали в буфере RIPA и измеряли общее содержание белка методом Брэдфорда в соответствии с инструкциями производителя (Pierce). Уровни белка Bv8 в плазме и лизатах тканей измеряли методом ELISA в соответствии с приведенным описанием (Shojaei, F. et al., Nature 450, 825-831 (2007); Shojaei, F. et al., Proc. Natl. Acad. Sci. USA (2009)). Уровни G-CSF, GM-CSF, M-CSF, SDF1α, PlGF, VEGF и ММР9 измеряли при помощи наборов ELISA, специфичных для разных видов (R&D System, Minneapolis, MN). Все значения были нормализованы относительно общего содержания белка.
Проточная цитометрия (FACS). Мышей перфузировали PBS. Ткани легких, селезенок, опухолей, почек и костного мозга удаляли, измельчали и фильтровали для получения взвесей единичных клеток. Для выполнения нескольких экспериментов кусочки тканей опухолей и легких ферментативно расщепляли смесью коллагеназы и диспазы (Roche) и затем механически диссоциировали при помощи иглы номер 16. Эритроциты лизировали, используя буфер для лизиса АСК (Lonza, Basel, Switzerland). Клетки инкубировали с моноклональным антителом крысы против CD16/CD32 мыши (BD Biosciences, San Jose, CA) для предотвращения неспецифического связывания антител и окрашивали следующими антителами, конъюгированными с флуорофорами: антитело против cd45 (30-F11), антитело против cd11b (M1/70), антитело против F4/80 (ВМ8), антитело против cd11c (N418), антитело против cd117 (2В8) (все антитела были предоставлены компанией Bioscience, San Diego, CA), антитело против Ly6G (1A8), антитело против Ly6C (AL-21), антитело против Grl (RB6-8C5), антитело против SiglecF (Е50-2440) (все антитела были предоставлены компанией BD Biosciences, San Jose, CA) и антитело против Flt-1 (141522) (R&D Systems, Minneapolis, MN). Йодид пропидия (Sigma-Aldrich, St. Louis, MO) использовали для распознавания жизнеспособных и мертвых клеток. Данные, полученные с помощью устройств FACSCalibur или BD LSR II (BD Biosciences, San Jose, CA), анализировали, используя программное обеспечение FlowJo (Tree Star, Ashland, OR) или программу BD FACSDiva.
Сортировка Cd11b+Gr1+ клеток. Подготовленные легкие окрашивали антителами Cd11b-APC и Grl-FITC в соответствии с описанием, приведенным в разделе “Проточная цитометрия”. Требуемые клетки сортировали в устройстве FACS, подтверждали чистоту клеток и сразу же удаляли РНК в соответствии с описанием, приведенным в разделе “Выделение РНК”. Чистота сортированных популяций клеток в среднем была равна 99%.
Иммуноблоттинг p-ERK. Клетки высевали с плотностью 10000 клеток/100 мкл среды 10% FCS/IMDM. Через двадцать четыре часа среды заменяли бессывороточной средой IMDM и клетки выращивали на минимальной среде в течение 24 часов. Клетки стимулировали 5 мг/мл Bv8 человека (Peprotech, Rocky Hill, NJ) в течение 5, 10, 15 и 20 мингут, сразу же лизировали и кипятили в трис-глициновом буфере для образца, содержащем SDS (Invitrogen, Carlsbad, CA). Одинаковые объемы лизатов подвергали электрофорезу SDS-PAGE и исследовали методом иммуноблоттинга на наличие фосфорилированной или общей киназы МАР р44/р42 (ERK1 и ERK2) с использованием специфических антител (Cell Signaling Technology, Danvers, MA).
Анализ методом компьютерной микротомографии. Методы подготовки, визуализации и анализа легких были подробно описаны ранее (Caunt, M. et al., Cancer Cell 13, 331-342 (2008)). Мышей анестезировали 5% изофлураном. Обнажали сердце и легкие и удаляли левую и правую артерии. В правый желудочек вводили тупоконечную иглу номер 24 и перфузировали 10 мл PBS для удаления крови из сосудистой сети легких. Легкие удаляли и наполняли 10% формалином с нейтральным буфером (NBF). Легкие погружали в 10% NBF на 24 часа, затем погружали в 20% раствор контрастного вещества на основе йода для рентгеновской компьютерной томографии, Isovue370 (Bracco Diagnostics Inc., Princeton, NJ) и разводили PBS в течение 24 часов. Затем легкие перфузировали через трахею 20 мл соевого масла (Sigma-Aldrich, St. Louis, MO) для удаления избытка контрастного вещества. Легкие визуализировали в соевом масле с целью создания фоновой среды для томографии.
Легкие мышей визуализировали ex-vivo в системе для рентгеновской компьютерной микротомографии (микро-СТ) µCT 40 (SCANCO Medical, Basserdorf, Switzerland). Изображения компьютерной микротомографии были получены при использовании рентгеновской трубки со следующими параметрами: уровень энергии 45 кВ, ток 177 мкА и время интеграции 450 миллисекунд. Изображения в осевой проекции были получены при изотропном разрешении 20 мкм. Опухоли легких (количество и объем) оценивали при помощи алгоритма полуавтоматического анализа изобретений, который включает стадию проверки обученным специалистом. Потенциальную массу опухоли выделяли, выполняя несколько стадий обработки изображений (Caunt, M. et al., Cancer Cell 13, 331-342 (2008)). В программном обеспечением для анализа изображений с кодом С++ были использованы библиотеки программного обеспечения для анализа изобретений Analyze (AnelyzeDirect Inc., Lenexa, KS, USA). Выделенные объекты оценивал специалист в области работы с программным обеспечением трехмерной визуализации Analyze. Отдельные объекты были признаны или отвергнуты в качестве возможных опухолей на основании внешнего вида объекта и его локализации в легком. Для каждого легкого производили подсчет опухолей, определяли объем отдельной опухоли и общий объем опухолей.
Биолюминесцентная визуализация (BLI). Мышам внутрибрюшинно инъецировали 200 мкл 200 мг/мл D-люциферина (Invitrogen, Carlsbad, CA), во время визуализации мышей анестезировали изофлураном (Henry Schein, Sparks, NV), вводимым через нос, и сохраняли температуру тела с помощью согревающей подушки. Биолюминесцентные изображения были получены при помощи охлажденной усиленной фотокамеры устройства с зарядовой связью, прикрепленной к светонепроницаемой визуализирующей камере (Stanford Photonics, Palo Alto, CA). Время получения изобретений обычно составляло менее 5 минут. Изображения обрабатывали путем сравнения эталонного изображения с данными люминесцентного изображения.
Анализ общедоступных данных микроматричного анализа. База данных для рака мочевого пузыря Блавери (Blaveri, E. et al., Clin. Cancer Res. 11, 7012-7022 (2005)) была получена на сайте http://waldman.ucsf.edu/bladder/blaveri.cgh/. База данных для рака молочной железы Чина (Chin, K. et al., Cancer Cell 10, 529-541 (2006)) была получена на сайте caArray (http://caarray.nci.nih.gov/), и данные для рака молочной железы Павитана (Pawitan, Y. et al., Breast Cancer Res. 7, R953-964 (2005)) были получены на сайте Gene Expression Omnibus (http://www.ncbi.nlm.nih.gov/geo/GSE1456). При выполнении анализа выживания были использованы два метода: 1) модель пропорциональных рисков Кокса для оценки взаимосвязи экспрессии гена G-CSF, служащей в качестве постоянной переменной, с выживаемостью, 2) в каждой базе данных был выбран оптимальный порог экспрессии гена G-CSF путем исследования ряда предельных количественных значений экспрессии гена G-CSF при помощи критерия логарифмического ранжирования. Кривые выживания Каплана-Майера строили для двух подгрупп на основании выявленных оптимальных предельных значений и затем использовали модель Кокса для оценки соотношений рисков в двух группах.
Статистический анализ. За исключением особо оговоренных случаев использовали t-критерий Стьюдента для выполнения всех статистических анализов, при этом значимым считалось значение Р≤0,05. На графиках представлены средние значения ± стандартная ошибка среднего. Все эксперименты повторяли по меньшей мере дважды, и в исследованиях представлены репрезентативные данные. Для исследования опухолей в экспериментах по трансплантации эмбриональной печени обобщенная линейная модель с ошибками и распределением Пуассона была подобрана в соответствии с данными.
Результаты и их обсуждение
Метастазироване опухолей является главной причиной смерти от солидных опухолей. Для метастазирования опухолевые клетки должны отделиться от опухоли, проникнуть во внеклеточных матрикс и затем внутрь сосудов, мигрировать по кровеносным или лимфатическим сосудам, выделиться из сосудов в месте локализации вторичной опухоли и, наконец, образовать вторичные опухоли (Nguyen, D.X. & Massague, J. Nat. Rev. Genet. 8, 341-352(2007)). Кроме того, полученные данные позволяют предположить, что опухоли могут модифицировать удаленную микросреду до прибытия метастазирующих опухолевых клеток с созданием так называемой “предметастатической ниши” (Psaila, B. & Lyden, D. Nat. Rev. Cancer 9, 285-293 (2009)). Способность опухолей поражать удаленные ткани позволяет раковым клеткам направленно воздействовать на конкретные органы, в которых они могут инициировать рост вторичных опухолей, и подтверждает гипотезу “семени и почвы” (Paget, S. Cancer Metastasis Rev. 8(2), 98-101 (1989)). Считается, что клетки, выделенные из костного мозга, (BMDC) являются основным типом клеток, заполняющих указанную нишу (Kaplan, R.N. et al., Nature 438, 820-827 (2005); Hiratsuka, S. et al., Nat. Cell Biol. 8, 1369-1375 (2006)).
Несмотря на участие в процессе метастазирования опухолей молекул нескольких типов (Kaplan, R.N. et al., Nature 438, 820-827 (2005); Hiratsuka, S. et al., Nat. Cell Biol. 8, 1369-1375 (2006); Yamamoto, M. et al., Cancer Res. 68, 9754-9762 (2008); Kim, S. et al., Nature 457, 102-106 (2009); Erler, J.T. et al., Cancer Cell 15, 35-44 (2009), до сих пор до конца не известны механизмы создания опухолями указанной ниши и фактической роли данной ниши в метастазировании опухолей. Для исследования изменений, инициируемых первичными опухолями в удаленных органах, был выполнен микроматричный анализ кДНК всех тканей легкого, полученных у мышей, не имевших опухолей, у мышей, имевших неметастазирующие опухоли (67NR) или метастазирующие (4Т1) опухоли молочной железы в предметастатической фазе (фиг.1А). В качестве модели были использованы 4Т1-родственные линии клеток рака молочной железы мыши (Dexter, D.L. et al., Cancer Res. 38, 3174-3181 (1978); Aslakson, C.J. & Miller, F.R. Cancer Res. 52, 1399-1405 (1992)), которые образуют фенотипический спектр в диапазоне от неметастазирующих клеток (67NR, 168FARN) до клеток, способных пройти все стадии метастазирования (4ТО7, 66с14 и 4Т1) (фиг.5А). Недавно анализ указанных линий клеток позволил идентифицировать новые гены, регулирующие образование метастазов (Yang, J. et al., Cell 117, 927-939 (2004)). Для гарантии того, что исследованные ткани были действительно предметастатическими, клетки 4Т1, экспрессирующие люциферазу-zsGreen и гигромицин (клетки 4Т1-Luc-zsG-Hyg), ортотопически инокулировали в жировое тело 4-й молочной железы и удаляли легкие через 6 дней. В указанный момент времени в легких не были обнаружены раковые клетки 4Т1-Luc-zsG-Hyg при исследовании методом qRT-PCR, позволяющим обнаружить гигромицин (фиг.5В и фиг.10). Кроме того, при помощи биолюминесцентной визуализации на данной стадии в легких не были обнаружены люцифераза-положительные клетки 4Т1 (фиг.5С). Таким образом, любой сигнал, обнаруженный при выполнении данного анализа экспрессии генов, не был ассоциирован с раковыми клетками.
В выполненных исследованиях период развития опухоли при отсутствии обнаруживаемых раковых клеток в легких получил название предметастатической фазы, при этом стадия, на которой могут быть обнаружены даже единичные раковые клетки или опухоли в легких, получила название метастатической фазы.
В результате выполненного анализа было выявлено двукратное повышение экспрессии 260 генов и понижение экспрессии 274 генов в легких мышей, имевших опухоли 4Т1, по сравнению с легкими мышей, не имевших опухолей, или мышей, имевших неметастазирующие опухоли 67NR (фиг.1А). Основное внимание было сфокусировано на Bv8, так как данный ген является одним из наиболее сверхэкспрессированных генов (фиг.1В). Bv8 является секретируемым белком, который ранее был охарактеризован как проангиогенный фактор (LeCouter, J. et al., Proc. Natl. Acad. Sci. USA 100, 2658-2690 (2003)), фактор роста гемопоэтических клеток-предшественников (LeCouter, J. et al., Proc. Natl. Acad. Sci. USA 101, 16813-16818 (2004)), а также как нейромодулятор (Cheng, M.Y. et al., Nature 417, 405-410 (2002); Matsumoto, S. et al., Proc. Natl. Acad. Sci. USA 103, 4140-4145 (2006)). Кроме того, недавно было установлено, что Bv8 экспрессирован Cd11b+Grl+ миелоидными клетками и опосредует рост опухолей, устойчивых к воздействию антитела против VEGF (Shojaei, F. et al., Nature 450, 825-831 (2007)). Анализ методом qRT-PCR экспрессии Bv8 в тканях легкого подтвердил результаты микроматричного анализа (фиг.5D). Кроме того, впервые была обнаружена сильная корреляция между высокой экспрессией Bv8 в предметастатических легких и метастатическим потенциалом исследованных опухолей (фиг.1С и фиг.5Е). Установлено, что Bv8 высоко экспрессирован Cd11b+Grl+ миелоидными клетками (Shojaei, F. et al., Nature 450, 825-831 (2007)), в связи с чем, было предположено, что метастазирующие опухоли могут модифицировать микросреду легких путем активации Cd11b+Grl+ клеток из костного мозга и последующего хоминга в легких. Для проверки данной гипотезы была измерена частота инфильтрации Cd11b+Grl+ клеток в ткани легких в предметастатической фазе (фиг.1D). Было обнаружено повышенное число указанных клеток у мышей, имевших метастазирующие опухоли 4ТО7, 66с14 и 4Т1, в то время как в легких мышей, имевших неметастазирующих опухоли 67NR и 168FARN, не было выявлено увеличения числа CD11b+Grl+ клеток (фиг.1D). Кроме того, Cd11b+Grl+ клетки, выделенные из легких мышей, имевших опухоли 4Т1, высоко экспрессировали Bv8 (фиг.5F). Однако в Cd11b+Grl- клетках были обнаружены лишь предельные уровни транскриптов Bv8 и по существу не было обнаружено транскриптов в Cd11b+Grl+ клетках, выделенных у мышей, не имевших опухолей, из чего следует, что первичные опухоли секретируют факторы, повышающие уровни Bv8 в Cd11b+Grl+ клетках (фиг.5F). Ткань легкого окрашивали антителом против Bv8, при этом Bv8-положительные клетки были обнаружены только в легких, удаленных у мышей, имевших метастазирующие опухоли (фиг.5G). Также была обнаружена повышенная частота встречаемости Cd11b+Grl+ клеток в предметастатических легких мышей, имевших дополнительные метастазирующие опухоли, такие как B16F10, LLC, и генетическую модель рака молочной железы, MMTV-PyMT (фиг.5Н). Аналогичным образом была обнаружена повышенная экспрессия Bv8 в легких указанных мышей (фиг.5I). Таким образом, Cd11b+Grl+ клетки, экспрессирующие Bv8, по-видимому, являются главным компонентом предметастатической микросреды. Для дальнейшего определения состава такой микросреды был выполнен анализ FACS для исследования CD11b+Grl+ клеток и выявления дополнительных типов клеток в предметастатических легких (фиг.11А). Такой анализ позволил выявить специфическую аккумуляцию Ly6C+Ly6G+ гранулоцитов и среднюю аккумуляцию Ly6C+Ly6G- моноцитов в предметастатических легких мышей, имевших опухоли 4Т1 (фиг.11А). Не было обнаружено существенных изменений в частоте встречаемости макрофагов (F4/80+ клетки), эозинофилов (SiglecF+ клетки) или дендритных клеток под воздействием первичной опухоли (см., например, фиг.11А). В легких мышей, не имевших опухолей или имевших опухоли, также не было обнаружено мастоцитов. Кроме того, было обнаружено присутствие ранее описанных VEGFR1+CD117+ гемопоэтических клеток-предшественников (Kaplan, R.N. et al., Nature 438, 820 (2005)), хотя их частота встречаемости была гораздо ниже по сравнению с Ly6G+Ly6C+ клетками (2,7% для НРС по сравнению с 27% для Ly6G+Ly6C+ клеток) (фиг.11А). Был сделан вывод о том, что метастазирующие опухоли индуцируют специфическую аккумуляцию гранулоцитов (определяемых как Ly6C+Ly6G+ клетки в популяции Cd45+Cd11b+ клеток) и среднюю аккумуляцию моноцитов (Ly6C+Ly6G- клетки) (фиг.11А).
Чтобы определить, какие цитокины, секретируемые опухолевыми клетками, могут отвечать за инициацию образования ниши, в плазме были измерены уровни нескольких кандидатов, а именно эндотелиального фактора роста сосудов (VEGF)-A, плацентарного фактора роста (PlGF), стромального фактора (SDF)1α, колониестимулирующего фактора макрофагов (M-CSF), CSF гранулоцитов-макрофагов (GM-CSF), CSF гранулоцитов (G-CSF) и Bv8 у мышей, не имевших опухолей или имевших опухоли (фиг.2А). Весьма удивительным было то, что только уровни G-CSF и Bv8 в плазме коррелировали со способностью опухоли образовывать метастазы. Подобная корреляция была обнаружена в метастатической фазе. Было установлено, что G-CSF высоко экспрессирован также в плазме мышей, имевших опухоли MMTV-PyMT. Интересно отметить, что у мышей, имевших опухоли MDA-MB-231, были обнаружены повышенные уровни G-CSF человека и мыши в опухоли и плазме, из чего следует, что клетки-хозяева, инфильтрующие опухоль, также являются значительным источником G-CSF (фиг.13F). G-CSF является основным регулятором гранулопоэза, продуцируемого клетками разных типов (Metcalf, D. Nature 339, 27-30 (1989), играет главную роль в активации нейтрофилов из костного мозга (Christopher, M.J. & Link, D.C. Curr. Opin. Hematol. 14, 3-8 (2007)) и, как недавно было установлено, опосредует устойчивость опухоли к терапии антителами против VEGF (Shojaei, F. et al., 106(16), 6742-6747, Proc. Natl. Acad. Sci. USA (2009)). Другой привлекательной особенностью G-CSF в качестве потенциального регулятора процесса вдали от места возникновения опухоли, такого как образование предметастатической ниши, является его эндокринный характер воздействия (Metcalf, D. Nature 339, 27-30 (1989)). Было установлено, что G-CSF выделяется клетками метастазирующих опухолей и не выделяется клетками неметастазирующих опухолей как in vitro (фиг.6А и фиг.11В), так и in vivo. Кроме того, введение мышам, имевшим опухоли 4Т1, антитела против G-CSF предотвращало активацию и хоминг Cd11b+Grl+ клеток в легких (фиг.2В), а также снижало уровни Bv8 в легких и плазме (фиг.6В). Полученные данные позволяют предположить, что G-CSF является основным цитокином, секретируемым метастазирующими опухолями для формирования предметастатической микросреды с высоким содержанием Cd11b+Grl+ клеток. Введение мышам антитела против Bv8 уменьшало миграцию Cd11b+Grl+ клеток в предметастатические легкие мышей, имевших опухоли 4Т1 (фиг.2В), хотя введение указанного антитела не оказывало существенного воздействия в метастатической фазе (5,5 недель после инокуляции опухолевых клеток). Кроме того, введение мышам, имевшим опухоли MMTV-PyMT, антитела против G-CSF предотвращало миграцию Ly6G+Ly6C+ клеток в периферическую кровь и хоминг указанных клеток в легких (фиг.11С). Отсутствие реакции на введение антитела против Bv8 на поздних стадиях развития опухоли может быть связано с очень большими количествами G-CSF, выделяемыми первичными опухолями (фиг.6С).
Чтобы определить значение G-CSF и Bv8 в прогрессировании метастазирующих опухолей, опухолевые клетки 66с14 или 4Т1 ортотопически инокулировали в жировое тело 4-й молочной железы мышей Balb/c или CB6F1, после чего мышам вводили антитело против Bv8, антитело против G-CSF или оба антитела (комбинацию антител). Введение начинали через 2 дня после инокуляции опухолевых клеток и определяли число метастатических узлов в легких через 6 недель (для модели 66с14) или 5,5 недели (для модели 4Т1) после инокуляции опухолевых клеток. Несмотря на то, что не было обнаружено каких-либо изменений в росте первичной опухоли в указанных моделях опухолей (фиг.6D и 6Е), было отмечено значительное уменьшение числа опухолей в легких мышей, которым вводили антитело против Bv8 или антитело против G-CSF. У мышей, имевших опухоли 4Т1, введение антитела против Bv8 вызвало уменьшение числа видимых опухолей на 50%, введение антитела против G-CSF вызвало уменьшение на 65%, и комбинация антител вызвала уменьшение на 75% по сравнению с соответствующими группами изотипически совместимых контрольных антител (фиг.2С). У мышей, имевших опухоли 66с14, введение антитела против Bv8 вызвало уменьшение числа опухолей в легких на 30% и введение антитела против G-CSF вызвало уменьшение на 43% (фиг.6F). Аналогичные результаты были получены при выполнении анализа методом компьютерной микротомографии для количественного определения числа микро- и макроопухолей в легких мышей, имевших опухоли 66с14 или 4Т1, которым вводили антитело против Bv8 (фиг.2D). Важно отметить, что метастазирование ортотопических опухолей 4Т1 или 66с14 сократилось до уровня, сравнимого с введением антитела против Bv8, когда опухоли инокулировали мышам с отсутствием Bv8 в BMMNC (фиг.13А, 13В и 13С). Затем была исследована эффективность антитела против Bv8 и антитела против G-CSF в других моделях рака молочной железы, а именно MDA-MB-231 человека (фиг.12А) и MMTV-PyMT мыши (фиг.13D). В обеих моделях введение антитела против Bv8 или антитела против G-CSF вызывало уменьшение образования легочных метастазов (фиг.12В и 13Е).
Для прямой оценки роли Cd11b+Grl+ клеток в метастазировании опухолей мышам, имевшим ортотопические опухоли 66с14, вводили антитело против Grl (клон RB6-8C5, элиминирующий моноциты и нейтрофилы) или антитело против Ly6G (клон 1А8, специфически элиминирующий нейтрофилы (Daley, J.M. et al., J. Leukoc. Biol. 83, 64 (2008)) (фиг.12С). Введение каждого антитела существенно уменьшало количество легочных метастазов до степени, сравнимой с введением антитела против Bv8 или антитела против G-CSF. Однако введение антитела против Grl вызывало несколько более выраженное ингибирование метастазирования опухоли по сравнению с введением антитела против Ly6G, из чего следует, что, хотя Ly6G+Ly6C+ нейтрофилы в значительной степени отвечают за метастазирование опухолей в исследованных моделях, моноциты также, по-видимому, способствуют данному процессу.
Была предпринята попытка проверить гипотезу, состоящую в том, что G-CSF положительно воздействует на метастазирование опухолей. Во-первых, необходимо было определить, действительно ли введение G-CSF является достаточным для инициации создания предметастатической ниши. Была исследована частота встречаемости Cd11b+Grl+ клеток у мышей, которым ежедневно вводили рекомбинантный G-CSF (rG-CSF) в течение 5 последующих дней (фиг.3А). Введение rG-CSF вызывало активацию Cd11b+Grl+ клеток, так как было обнаружено значительное увеличение указанных клеток в костном мозге, периферической крови и селезенке. Было обнаружено значительное увеличение частоты встречаемости Cd11b+Grl+ клеток в легких (фиг.3А) с последующим повышением экспрессии Bv8 (фиг.3В). Кроме того, была обнаружена более высокая частота встречаемости Cd11b+Grl+ клеток и повышенная экспрессия Bv8 в печени, еще одном органе, являющемся мишенью для метастазирования исследованных опухолей. Не было обнаружено повышение экспрессии Bv8 в тканях, которые обычно не являются мишенями для метастазирования, таких как почка (фиг.3В). Чтобы определить, вызывают ли указанные явления повышение метастатического потенциала, мышам вводили rG-CSF в течение 5 последующих дней до и после инъецирования опухолевых клеток в хвостовую вену. Целью исследования было определение возможной роли G-CSF и G-CSF-инициированной предметастатической ниши на последних стадиях метастазирования, таких как проникновение клеток из сосудов в ткани, выживание клеток и рост опухолей в удаленных органах. Мышам инъецировали линию неметастазирующих опухолевых клеток 67NR или линии агрессивных клеток 66с14, 4Т1 и B16F10. У мышей, которым вводили rG-CSF, было отмечено значительное увеличение числа опухолей в легких (фиг.3С и 3D). Затем происходило значительное увеличение массы легких, соответствующее числу видимых опухолей (фиг.7А). Следует отметить, что линия неметастазирующих клеток 67NR начинала метастазировать в легких, если мышам предварительно вводили G-CSF (фиг.3Е). Аутентичность опухолей у мышей, которым предварительно вводили G-CSF, была подтверждена при помощи гистологического анализа срезов, окрашенных H&E (фиг.7В).
Чтобы определить роль Bv8 в образовании G-CSF-индуцированной предметастатической ниши, мышам вводили rG-CSF и антитело против Bv8. Введение антитела против Bv8 значительно сокращало увеличение числа Cd11b+Grl+ клеток в легких (фиг.7С). Кроме того, антитело против Grl полностью аннулировало воздействие G-CSF на Cd11b+Grl+ клетки. Аналогичным образом введение антитела против G-CSF полностью предотвращало действие G-CSF (фиг.7С). Для дальнейшего исследования роли Bv8 в G-CSF-стимулированном метастазировании опухолей, в хвостовую вену мышам, которым предварительно вводили G-CSF в присутствии или отсутствии антитела против Bv8, инъецировали клетки 66с14 или 4Т1. Введение антитела против Bv8 существенно уменьшало G-CSF-индуцированное метастазирование в легкие клеток 66с14 (фиг.3F), 4Т1 (фиг.7D) и MDA-MB-231 (фиг.14А). Введение антитела против Grl или антитела против Ly6G также заметно ингибировало действие G-CSF (фиг.14В, фиг.3F и фиг.7D), указывая на то, что нейтрофилы в основном отвечают за G-CSF-индуцированную предметастатическую активацию клеток и метастазирование опухолей. Также была исследована способность антитела против VEGF предотвращать G-CSF-индуцированное метастазирование опухолей. В отличие от введения антитела против Bv8, введение антитела против VEGF не предотвращало действие G-CSF (фиг.7Е), из чего следует, что G-CSF-стимулированное образование метастазов в легких не зависит от VEGF. Следует отметить, что не было обнаружено какого-либо увеличения массы метастазирующей опухоли в присутствии антитела против VEGF, о чем сообщалось при использовании других методов лечения, препятствующих образованию кровеносных сосудов (Paez-Ribes, M. et al., Cancer Cell 15, 220-231 (2009); Ebos, J.M. et al., Cancer Cell 15, 232-239 (2009)).
Дополнительно был исследован хоминг популяции миелоидных клеток в легких под воздействием G-CSF в связи с экспрессией рецептора VEGF (VEGFR-1), так как ранее в научной литературе сообщалось, что указанный рецептор экспрессирован гемопоэтическими клетками в предметастатической нише (Kaplan, R.N. et al., Nature 438, 820-827 (2005)). После введения rG-CSF было обнаружено значительное увеличение частоты встречаемости Cd11b+Grl+VEGFR1+ клеток в легких (фиг.7F), что соответствовало увеличению частоты встречаемости Cd11b+Grl+ клеток (фиг.7G). Более детальный анализ показал, что примерно 44% Cd11b+Grl+ клеток являются VEGFR1+ клетками (фиг.7Н). Однако на указанный показатель значительно не повлияло введение rG-CSF (фиг.7Н). Таким образом, полученные результаты показывают, что Cd11b+Grl+ клетки в G-CSF-индуцированной предметастатической нише частично соответствуют характеристикам клеток, которые, как ранее сообщалось, инициируют образование указанной ниши (Kaplan, R.N. et al., Nature 438, 820-827 (2005)).
Микроматричный анализ показал, что, помимо Bv8, в предметастатических легких присутствует целый ряд факторов, которые, как ранее было установлено, стимулируют метастазирование опухолей, таких как ММР-9 (Hiratsuka, S. et al., Cancer Cell 2, 289-300 (2002); Acuff, H.B. et al., Cancer Res. 66, 259-266 (2006)), S100A8 и S100A9 (Hiratsuka, S. et al., Nat. Cell Biol. 8, 1369-1375 (2006)) (фиг.1В). В то время как ММР-9 стимулирует инвазию (Hiratsuka, S. et al., Cancer 2, 289-300 (2002)) и выживание (Acuff, H.B. et al., Cancer Res. 66, 259-266 (2006)) опухолевых клеток в легких, S100A8 и S100A9 опосредуют рекрутинг миелоидных и опухолевых клеток в легкие (Hiratsuka, S. et al., Nat. Cell Biol. 8, 1369-1375 (2006)). Чтобы исследовать способность G-CSF/Bv8 оказывать прометастатическое действие, по меньшей мере частично, за счет изменения экспрессии указанных молекул, были измерены их уровни экспрессии в легких мышей, которым вводили rG-CSF. Было установлено, что экспрессия всех трех молекул значительно повышена (фиг.8А). Введение антитела против Bv8 существенно уменьшало G-CSF-индуцированную экспрессию ММР-9, S100A8 и S100A9 (фиг.8А). Полученные результаты соответствуют более низкой частоте встречаемости Cd11b+Grl+ в легких мышей, которым вводили антитело против Bv8 (фиг.7С). Аналогично эксперименту по исследованию ортотопически инокулированных опухолей действие антитела против Bv8 было обнаружено только тогда, когда мышам вводили низкие дозы rG-CSF (фиг.7С), и не было обнаружено при инъецировании максимальной дозы rG-CSF. Cd11b+Grl+ клетки, выделенные из легких, которые были подвергнуты воздействию G-CSF, экспрессировали ММР-9, S100A8 и S100A9 на значительных уровнях, наряду с Bv8 (фиг.8В). Аналогичные результаты были получены у мышей, которым ортотопически инокулировали клетки 4Т1 и вводили антитело против Bv8 или антитело против G-CSF (фиг.2С). Экспрессия ММР-9 была значительно снижена в результате введения антитела против Bv8 в предметастатические легкие (фиг.8С), в то время как введение антитела против G-CSF также уменьшало экспрессию ММР-9 в метастатических легких (фиг.8С). Пониженная экспрессия ММР-9 соответствовала более низкой частоте встречаемости Cd11b+Grl+ клеток в легких (фиг.2В). Таким образом, полученные данные позволяют признать большую роль G-CSF по сравнению с Bv8, ММР-9, S100A8 и S100A9 в образовании предметастатической микросреды.
Введение антитела против Bv8 эффективно предотвращало воздействие G-CSF на образование легочных метастазов (фиг.3F и фиг.7D). Однако такое же введение лишь частично ингибировало G-CSF-индуцированную активацию и хоминг Cd11b+Grl+ клеток в предметастатических легких (фиг.С). Полученные данные позволяют предположить, что механизм, в соответствии с которым Bv8 стимулирует метастазирование опухолей, можно лишь частично объяснить модуляцией активации Cd11b+Grl+ клеток в ткани легких. Чтобы определить возможность участия дополнительных механизмов в регулировании метастазирования опухолей геном Bv8, была исследована способность Bv8 непосредственно воздействовать на опухолевые клетки. Были измерены уровни экспрессии рецепторов Bv8 (PKR-1/GPR73 и PKR-2/GPR73L1) в неметастазирующих и метастазирующих опухолевых клетках. Была обнаружена значительная экспрессия PKR-1 в линиях метастазирующих опухолевых клеток (4ТО7, 66с14, 4Т1, а также в B16F10 и LLC), в то время как линии неметастазирующих клеток (67NR и 168FARN) характеризовались гораздо более низкими или необнаруживаемыми уровнями PKR-1 (фиг.4А). Рецептор PKR-2 не был обнаружен во всех исследованных линиях клеток, за исключением клеток LLC (фиг.4А). Чтобы определить функциональную способность PKR-1, опухолевые клетки стимулировали Bv8 и затем измеряли уровни фосфорилированного ERK1/2 (фиг.8D). Значительная активация ERK1/2 под воздействием Bv8 была обнаружена только в линиях метастазирующих клеток, из чего следует, что передача сигналов Bv8 в указанные клетки действительно имеет функциональное значение (фиг.8D). Было установлено, что Bv8 стимулирует миграцию миелоидных клеток (Chin, K. et al., Cancer Cell 10, 529-541 (2006)). Поэтому была исследована способность Bv8 стимулировать также миграцию метастазирующих опухолевых клеток. Действительно была обнаружена более высокая миграция в ответ на увеличение концентрации Bv8 (фиг.4В). В отличие от этого, линии неметастазирующих клеток не характеризовались более высокой миграцией под воздействием Bv8. Следовательно, помимо регулирования активации и хоминга Cd11b+Grl+ клеток в предметастатической нише, Bv8 может регулировать метастазирование опухолей в результате прямого воздействия на опухолевые клетки. И наконец, для подтверждения того, что G-CSF-индуцированная предметастатическая ниша облегчает миграцию опухолевых клеток in vivo, голым мышам Balb/c, которым предварительно вводили G-CSF в присутствии или отсутствии антител против Bv8, Grl или G-CSF, инъецировали клетки 4Т1 или 66с14, меченные зеленым флуоресцентным красителем CellTracker Green (для облегчения слежения in vivo за инъецированными клетками). Через тридцать шесть часов определяли число опухолевых клеток, способных выделяться из сосудов и засевать ткань легких. Было обнаружено значительное увеличение числа опухолевых клеток в легких мышей, которым предварительно вводили G-CSF, по сравнению с контрольными мышами (фиг.4С и 4D, фиг.8Е). Данный эффект был значительно уменьшен при введении антител против Bv8. Аналогичные результаты были получены при введении мышам антитела против Grl или антитела против G-CSF (фиг.4С и 4D, фиг.8Е).
Клетки 67NR проявляют свойства метастазирования при инъецировании в хвостовую вену мышей, которым предварительно вводили G-CSF (фиг.3Е), вероятно, вследствие существенного увеличения экспрессии ММР-9 или других прометастатических молекул в G-CSF-стимулированных легких. Был сделан вывод о том, что метастазирование клеток 67NR может быть повышено в результате сверхэкспрессии PKR-1. Действительно сверхэкспрессия PKR-1 в клетках 67NR на уровне, сравнимом с клетками 66с14 (фиг.16А), вызывала значительное увеличение метастазирования клеток 67NR у мышей, которым предварительно вводили G-CSF (фиг.15А). И наоборот, клетки 66с14 с отсутствием PKR-1 (фиг.16В) образовывали значительно меньшее число G-CSF-индуцированных метастазов по сравнению с клетками, экспрессирующими контрольную shРНК (фиг.16С). Таким образом, Bv8 может действовать в качестве хемоаттрактанта для опухолевых клеток in vivo и стимулировать их выделение из сосудов в предметастатические легкие.
Чтобы определить наличие более высоких уровней экспрессии G-CSF или PKR-1 в опухолевых клетках, заселяющих легкие, производили in vivo клоновый отбор клеток MDA-MB-231, находящихся в первичной опухоли или способных образовывать метастазы в легких (фиг.15С). Аналогичный метод ранее был использован для идентификации совокупностей генов, опосредующих метастазирование рака молочной железы в легкое (Minn, A.J. et al., Nature 436, 518 (2005)) и другие органы (Bos, P.D. et al., Nature 459, 1005 (2009); Lu, X. et al., Genes Dev. 23, 1882 (2009)). Анализ профиля экспрессии генов показал, что клетки MDA-MB-231, выделенные из легких, экспрессируют на гораздо более высоких уровнях G-CSF и PKR-1, а также GM-CSF, MMP-9 и ранее идентифицированные Cxcll и ММР-1 (Minn, A.J. et al., Nature 436, 518 (2005)) по сравнению с клетками, выделенными из первичной опухоли, или материнскими клетками (фиг.15В). Важно отметить, что не было обнаружено увеличения экспрессии PKR-2, M-CSF, SDF1α, VEGF-A или PlGF, из чего следует, что для метастазирования раковые клетки избирательно увеличивают экспрессию небольшой группы генов, включающих G-CSF и PKR-1.
Были исследованы общедоступные базы данных для выявления возможной связи между экспрессией G-CSF в первичных опухолях и исходом заболевания. Были исследованы три совокупности данных микроматричного анализа: две совокупности данных для рака молочной железы (базы данных для рака молочной железы Павитана и рака молочной железы Чина (Pawitan, Y. et al., Breast Cancer Res. 7, R953-964 (2005); Chin, K. et al., Cancer Cell 10, 529-541 (2006)) и одна совокупность данных для больных раком мочевого пузыря (база данных для рака мочевого пузыря Блавери (Blaveri, E. et al., Clin. Cancer Res. 11, 7012-7022 (2005)). Была выявлена сильная негативная корреляция между выживанием больных раком молочной железы и высокой экспрессией G-CSF (фиг.4Е и фиг.9А). Аналогичная корреляция была обнаружена у больных раком мочевого пузыря (фиг.9В). Детальный статистический анализ показан на фиг.9С.
Было установлено, что Cd11b+Grl+ клетки и миелоидные клетки других типов облегчают рост опухоли в мышиных моделях в ряде исследований (Yang, L. et al., Cancer Cell 6, 409-421 (2004); Shojaei, F. et al., Nat. Biotechnol. 25, 911-920 (2007); De Palma, M. et al., Trends Immunol. 28, 519-524 (2007); Murdoch, C. et al., Nat. Rev. Cancer 8, 618-631 (2008)). Важно отметить, что человеческие аналоги указанных клеток также сверхпродуцированы у больных раком (Almand, B. et al., J. Immunol. 166, 678-689 (2001); Young, M.R. & Lathers, D.M., Int. J. Immunopharmacol. 21, 241-252 (1999)). Недавно было установлено, что Cd11b+Grl+ клетки стимулируют инвазию и метастазирование в месте образования первичной опухоли вследствие повышенного продуцирования ММР и TGF-β1 (Yang, L. et al., Cancer Cell 13, 23-35 (2008)).
Данные, представленные в настоящем описании изобретения, позволяют предположить, что роль Cd11b+Grl+ клеток в образовании метастазов не ограничивается первичной опухолью, и, как было впервые показано авторами изобретения, содержание указанных клеток в предметастатических легких повышается с целью создания микросреды, опосредующей конечные стадии метастазирования опухолей, такие как выделение опухолевых клеток из сосудов, выживание и рост вторичных опухолей (фиг.4F). Секретируемый опухолью G-CSF активирует Cd11b+Grl+ клетки, выделяемые из костного мозга, и индуцирует экспрессию Bv8. В свою очередь, Bv8 действует в качестве хемоаттрактанта для выделенных из костного мозга Cd11b+Grl+ клеток и облегчает их хоминг в легком до прибытия опухолевых клеток. Находясь в легких, Cd11b+Grl+ клетки служат в качестве источника Bv8, MMP-9, S100A8 и S100A9. Указанные молекулы могут еще более облегчать метастазирование путем стимулирования инвазии или дальнейшего переноса BMDC в легкие (Hiratsuka, S. et al., Cancer Cell 2, 289-300 (2002); Acuff, H.B. et al. Cancer Res. 66, 259-266 (2006); Yang, L. et al., Cancer Cell 6, 409-421 (2004)). Также была обнаружена повышенная экспрессия Bv8 в печени мышей, которым предварительно вводили G-CSF, из чего следует, что прометастатическое действие G-CSF и Bv8 может быть не ограничено легкими и может быть обнаружено в других органах.
Все материалы, приведенные в данной заявке, полностью включены в настоящее описание изобретения в качестве ссылки.
Несмотря на то, что настоящее изобретение описано со ссылкой на конкретные варианты осуществления, должно быть понятно, что данное изобретение не ограничено такими вариантами осуществления. В объем изобретения входят разные модификации и эквиваленты, определяемые сущностью и объемом прилагаемой формулы изобретения.
В настоящей заявке на патент, включая формулу изобретения, термин “включающий” имеет широкое, не ограниченное определенными элементами значение, не исключающее возможность использования дополнительных, неуказанных элементов или стадий способов.
Реферат
Настоящее изобретение относится к области медицины и биотехнологии. Предложен способ ингибирования метастазирования G-CSF секретирующей первичной опухоли in vivo. Субъекту вводят эффективное количество антитела против G-CSF или его антигенсвязывающего фрагмента после удаления первичной опухоли. Использование изобретения обеспечивает новый способ ингибирования метастазирования G-CSF секретирующей первичной опухоли, что может найти применение в терапии опухолей. 6 з.п. ф-лы, 16 ил., 2 табл., 1 пр.

Комментарии