Способы и композиции для предотвращения ошибки включения норлейцина в белки - RU2681928C2
Код документа: RU2681928C2
Чертежи










































Описание
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет по предварительной заявке США No. 61/777.700, поданной 11 Марта 2013, и предварительной заявке США No. 61/703,142, поданной 19 Сентября 2012, обе из которых включены в настоящую заявку посредством ссылки в полном объеме.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит Список Последовательностей, который был представлен в формате ASCII посредством EFS-Web и включен в настоящую заявку посредством ссылки в полном объеме. Указанная копия ASCII, созданная 11 июля 2013, названа P4967R1-WO_SL.txt и составляет 45,847 байт.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам и композициям для предотвращения ошибки включения норлейцина в белки в процессе получения рекомбинантного белка в бактерии. Настоящее изобретение также обеспечивает клетку-хозяина микроорганизма и молекулу нуклеиновой кислоты для применения в способах и композициях представленных в настоящем изобретении.
УРОВЕНЬ ТЕХНИКИ
Норлейцин, аналог аминокислоты метионин, может быть ошибочно включен в белки вместо остатков метионина. При экспрессии в Escherichia coli (Е. coli), многие гетерологичные белки имеют ошибочные включения норлейцина в месте, где должны наблюдаться остатки метионина. Ошибки включения норлейцина в белки, особенно в гетерологичные белки, полученные с помощью рекомбинантных способов, как правило, считаются нежелательными в связи с тем, в частности, что приводит к получению измененных белков, имеющих нежелательные свойства.
Ошибки включения норлейцина в положении метионина в процессе получения рекомбинантного белка в Е. coli наблюдается в течение более 50 лет.(См., напр., Munier and Cohen (1959) Biochim Biophys Acta 31:378-391; Cohen and Munier (1956) Biochim Biophys Acta 21:592-593; Cohen and Munier (1959) Biochim Biophys Acta 31:347-356; и Cowie et al, (1959) Biochim Biophys Acta 34:39-46.) Например, приблизительно 14% остатков метионина в метиониле бычьего соматотропина (MBS) обнаруживают ошибки включения норлейцина в ходе рекомбинантного производства данного белка в Е. coli, и приблизительно 6% остатков метионина в нативных белках Е. coli также заменены норлейцином. (См. Bogosian et al., (1989) J Biol Chem 264:531-9.) В другом примере, получение интерлейкина-2 в минимальной среде Е. coli в результате ферментации в приблизительно 19% остатков метионина в рекомбинантном белке было заменено норлейцином. (См. Tsai et al, (1988) Biochem Biophys Res Commun 156:733-739). Другие исследования показали, что ошибки включения остатка норлейцина в белок могут происходить как на внутренних остатках метионина, так и на аминоконцевом остатке метионина. (См. Brown (1973) Biochim Biophys Acta 294:527-529; и Barker and Bruton (1979) J Mol Biol 133:217-231).
Норлейцин конкурирует с метионином за включение в белки из-за беспорядочной природы фермента метионил тРНК синтетазы (MetG). (См. Trupin et al, (1966) Biochem Biophys Res Commun 24:50-55; и Fersht and Dingwall (1979) Biochemistry 18:1250-1256). Кинетические исследования с ферментом MetG Е. coli показали, что ацилирование MetG приблизительно в 4 раза выше с метионином по сравнению с норлейцином. (См. van Hest et al, (2000) Am Chem Soc 122:1282-1288). В связи с ослабленной субстратной специфичностью MetG, норлейцин может заменять метионин в реакции ацилирования, приводящей к ошибке включения норлейцина в белки вместо метионина.
Ошибки включения остатков норлейцина в остатках метионина в полученном рекомбинантном белке, как правило, считается нежелательным. Рекомбинантные белки или полипептиды, содержащие ошибки включения остатков норлейцина, могут показывать измененную структуру и функциональные признаки, такие как, например, измененную чувствительность к протеолизу, уменьшение биологической активности или повышение иммуногенности.
Различные стратегии были разработаны для снижения или предотвращения ошибки включения норлейцина в процессе получения рекомбинантного белка. Например, дополнение клеточной культуральной среды с метионином в ходе процесса ферментации (путем непрерывной или болюсной подачи/добавления метионина) применяли для обеспечения того, чтобы излишний метионин был доступен для клеток, таким образом, снижая вероятность неправильной нагрузки метиониловой тРНК с норлейцином. (См., напр., патент США No. 5,599,690). В то время как непрерывная или болюсная подача/добавление метионина снижает степень ошибки включения норлейцина в рекомбинантные белки, операционная сложность и стоимость процесса ферментации может увеличиться. Кроме того, непрерывная или болюсная подача/добавление метионина в процессе ферментации может привести к нежелательному разбавлению содержимого ферментера, что приводит к уменьшению плотности клеток и снижению выхода продукта.
Удаление генов, вовлеченных в биосинтетический путь метаболизма норлейцина, таких как, например, удаление генов оперона лейцина (leuA, leuB, leuC, и leuD) или удаление генов, кодирующих трансаминазу, таких как ilvE или tyrB, также применяли для снижения ошибки включения норлейцина в белки. (См. Bogosian et al, (1989) J Biol Chem 264:531-539; Tsai et al, (1989) Biochem Biophys Res Commun 156:733-739; и Randhawa et al, (1994) Biochemistry 33:4352-4362). Делеция генов биосинтетического пути метаболизма для предотвращения ошибки включения норлейцина, при этом, может требовать добавления других аминокислот (таких как лейцин или изолейцин) к культуральной среде в процессе ферментации, столько же генов, вовлеченных в биосинтез норлейцина, являются также вовлеченными в биосинтез аминокислот с разветвленной цепью. (См. Bogosian et al, (1989) J Biol Chem 264:531-539; см. Фигуру 8 рассматриваемого описания).
Другую стратегию применяют для предотвращения ошибки включения норлейцина, связанную с ко-экспрессией ферментов, которые разрушают норлейцин, включая, например, дегидрогеназу аминокислот и оксидазу аминокислот. Этот подход, однако, требует сверхэкспрессии данных ферментов, которая может быть нежелательной в процессе производства рекомбинантного белка, и может привести к снижению выхода рекомбинантного белка. (См., напр., публикацию заявки на патент США No. US2007/0009995). Кроме того, сверхэкспрессия данных ферментов может привести к разрушению других аналогичных аминокислот в ходе ферментативного процесса. Изменение первичной аминокислотной последовательности полипептида, выраженной путем замены кодонов метионина с другими кодонами, также осуществлялось для предотвращения ошибки включения норлейцина. (См. напр., патент США No. 5,698,4180). Такие замены, при этом, могут привести к снижению активности или структурным изменениям в полученном белке, очень нежелательный результат для получения рекомбинантного белка в биотехнологической промышленности.
Как отмечалось выше, существующие способы, применяемые для предотвращения ошибки включения норлейцина в процессе получения рекомбинантного белка в микроорганизмах, сопряжены с различными недостатками; таким образом, существует потребность в новых способах, пригодных для предотвращения или снижения ошибки включения норлейцина в белки, особенно в процессе получения рекомбинантного белка в микроорганизмах, таких как Е. coli.
Настоящее изобретение удовлетворяет эту потребность путем обеспечения разработанных клеток-хозяев микроорганизмов эффективных для предотвращения ошибки включения норлейцина в процессе получения рекомбинантного белка в микроорганизмах, таких как, например, бактерии. Настоящее изобретение обеспечивает, среди прочего, клетки-хозяева Е. coli, включающие мутировавшие аллели metA и metK {т.е., измененные последовательности нуклеиновых кислот metA и metK), которые приводят к производству метионина микроорганизмами в степени или объеме, достаточном для снижения или предотвращения ошибки включения норлейцина в белки и полипептиды. Анализ рекомбинантных белков, полученных с использованием таких клеток-хозяев, показал, что ошибки включения остатков норлейцина вместо остатков метионина были устранены. Настоящее изобретение также показывает, что эффективность процесса ферментации с применением таких клеток-хозяев Е. coli, в том числе, рост клеток-хозяев и титры рекомбинантного белкового продукта с использованием таких клеток-хозяев Е. coli, были сопоставима с той, которые наблюдали в контрольных клетках-хозяевах.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает, в частности, способы и композиции для предотвращения или снижения ошибки включения норлейцина в белки и полипептиды. Способы и композиции согласно настоящему изобретению являются пригодными для предотвращения или снижения ошибки включения норлейцина в гетерологичные (напр., рекомбинантные) белки и полипептиды, экспрессированные микроорганизмами, такими как, например, бактерии (напр., Е. coli).
В некоторых вариантах осуществления, настоящее изобретение обеспечивает способы для предотвращения или снижения ошибки включения норлейцина в белок или полипептид, экспрессированный микроорганизмом, в которых микроорганизмы производят метионин в степени или объеме, достаточном для предотвращения или снижения ошибки включения норлейцина в белок или полипептид. В некоторых вариантах осуществления изобретения, микроорганизм представляет собой микроорганизм, резистентный по механизму обратной связи или нечувствительный по механизму обратной связи к гомосерин сукцинилтрансферазе. В других вариантах осуществления изобретения, микроорганизм представляет собой микроорганизм, включающий мутантный аллель metA, мутантный аллель metK или мутантный аллель metA и мутантный аллель metK.
В некоторых вариантах осуществления, настоящее изобретение обеспечивает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, в котором микроорганизм содержит мутантную аллель metA, где мутантная аллель metA включает последовательность нуклеиновой кислоты, кодирующую аминокислотную замену в MetA, выбранной из группы, состоящей из замены аргинина на цистеин в положении аминокислоты 27, замены глутамина на глутаминовую кислоту в положении аминокислоты 64, замены тирозина на цистеин в положении аминокислоты 294, замены изолейцина на серии в положении аминокислоты 296, и замены пролина на лейцин в положении аминокислоты 298. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит последовательность аминокислоты, кодирующую аминокислотные замены в MetA, включающую замену изолейцина на серии в положении аминокислоты 296 и замену пролина на лейцин в положении аминокислоты 298. Положения аминокислот MetA, описанных в настоящем описании, относительно аминокислотной последовательности MetA дикого типа, как показано на Фигуре 7А и SEQ ID NO: 29.
В другом варианте осуществления, настоящее изобретение обеспечивает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, в котором микроорганизм содержит мутантный аллель metA, где мутантный аллель metA включает последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, и SEQ ID NO: 26.
Как указано выше, настоящее изобретение предлагает способы предотвращения или снижения ошибки включения норлейцина в белок или полипептид, экспрессируемый микроорганизмом, где микроорганизм производит метионин в степени или объеме, достаточном для предотвращения или снижения ошибки включения норлейцина в белок или полипептид. В других вариантах осуществления, настоящее изобретение обеспечивает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, экспрессируемый микроорганизмом, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм представляет собой микроорганизм де-репрессированный для выработки метионина. В некоторых вариантах осуществления изобретения, микроорганизм является де-репрессированным для выработки метионина в связи с частичной потерей функции S-аденозилметионин синтазы. В других вариантах осуществления, настоящее изобретение предлагает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, экспрессированный микроорганизмом, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм включает мутантный аллель metK. В некоторых вариантах осуществления изобретения, мутантный аллель metK приводит к частичной потери функции MetK.
В некоторых вариантах осуществления, настоящее изобретение предлагает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм включает мутантный аллель metK, в котором мутантный аллель metK содержит последовательность нуклеиновой кислоты, кодирующую аминокислотную замену в MetK, включая замену валина на глутаминовую кислоту в положении аминокислоты 185. В других вариантах осуществления, настоящее изобретение обеспечивает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм включает мутантный аллель metK, в котором мутантный аллель metK включает последовательность нуклеиновой кислоты, содержащую делецию основания цитозина в положении 1132 остатка нуклеиновой кислоты аллеля metK. Положения аминокислот MetK, описанные в настоящем описании, представлены относительно аминокислотной последовательности MetK дикого типа, как показано на Фигуре 8А и SEQ ID NO: 30. Положения нуклеиновых кислот metK, описанных в настоящем описании, представлены относительно последовательности нуклеиновой кислоты metK дикого типа, как показано на Фигуре 8 В и SEQ ID NO: 32.
В некоторых вариантах осуществления, настоящее изобретение предлагает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм включает мутантную аллель metK, в котором мутантная аллель metK содержит последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28.
В других вариантах осуществления, настоящее изобретение обеспечивает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм содержит мутантный аллель metA и аллель metK. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит последовательность нуклеиновой кислоты, кодирующую замену тирозина на цистеин в положении аминокислоты 294 MetA, и мутантный аллель metK содержит последовательность нуклеиновой кислоты, кодирующую замену валина на глутаминовую кислоту в положении аминокислоты 185 MetK. В других вариантах осуществления, настоящее изобретение обеспечивает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм содержит мутантный аллель metA и аллель metK, в котором мутантный аллель metA содержит последовательность нуклеиновой кислоты, кодирующую замену тирозина на цистеин в положении аминокислоты 294 MetA, и в котором мутантный аллель metK содержит последовательность нуклеиновой кислоты, содержащую делецию основания цитозина положении 1132 остатка нуклеиновой кислоты аллеля metK.
В других вариантах осуществления, настоящее изобретение обеспечивает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм включает мутантный аллель metA и мутантный аллель metK, где мутантный аллель metA содержит последовательность нуклеиновой кислоты SEQ ID NO: 24, и мутантный аллель metK содержит последовательность нуклеиновой кислоты SEQ ID NO: 27. В других вариантах осуществления, настоящее изобретение обеспечивает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм включает мутантный аллель metA и мутантный аллель metK, в котором мутантный аллель metA содержит последовательность нуклеиновой кислоты SEQ ID NO: 24, и мутантный аллель metK содержит последовательность нуклеиновой кислоты SEQ ID NO: 28.
Настоящее изобретение дополнительно обеспечивает клетку-хозяина микроорганизма, пригодную для предотвращения или снижения ошибки включения норлейцина в белки или полипептиды, экспрессируемые клеткой-хозяином микроорганизмом. Настоящее изобретение также обеспечивает клетку-хозяина микроорганизма для применения в экспрессии белков или полипептидов с помощью клетки-хозяина микроорганизма, в которой экспрессированные белки или полипептиды являются свободными от ошибки включения норлейцина. В некоторых вариантах осуществления изобретения, клетка-хозяин микроорганизма представляет собой бактерии. В других вариантах осуществления изобретения, клетка-хозяин микроорганизма представляет собой Е. coli.
Настоящее изобретение обеспечивает микроорганизм (напр., клетку-хозяина микроорганизма), где микроорганизм производит метионин в степени или объеме, достаточном для предотвращения или снижения ошибки включения норлейцина в белки или полипептиды, экспрессируемые микроорганизмом. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, где микроорганизм представляет собой микроорганизм, резистентный по механизму обратной связи или нечувствительный по механизму обратной связи к гомосерин сукцинилтрансферазе. В других вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, включающий мутантный аллель metA. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, включающий мутантный аллель metA, где мутантный аллель metA содержит последовательность нуклеиновой кислоты, кодирующую аминокислотную замену в MetA, выбранную из группы, состоящей из замены аргинина на цистеин в положении аминокислоты 27, замены глутамина на глутаминовую кислоту в положении аминокислоты 64, замены тирозина на цистеин в положении аминокислоты 294, замены изолейцина на серии в положении аминокислоты 296, и замены пролина на лейцин в положении аминокислоты 298. В некоторых вариантах осуществления изобретение, клетка-хозяин микроорганизма представляет собой бактерии. В других вариантах осуществления изобретение, клетка-хозяин микроорганизма представляет собой Е. coli.
В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, включающий мутантный аллель metA, где мутантный аллель metA содержит последовательность нуклеиновой кислоты, кодирующую больше, чем одну аминокислотную замену в MetA. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит последовательность нуклеиновой кислоты, кодирующую замену изолейцина на серии в положении аминокислоты 296 в MetA и замену пролина на лейцин в положении аминокислоты 298 в MetA. В некоторых вариантах осуществления изобретения, клетка-хозяин микроорганизма представляет собой бактерии. В других вариантах осуществления изобретения, клетка-хозяин микроорганизма представляет собой Е. coli.
В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, который включает мутантный аллель metA, где мутантный аллель metA содержит последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:23, SEQ ID NO: 24, SEQ ID NO: 25, и SEQ ID NO: 26. В некоторых вариантах осуществления изобретения, клетка-хозяин микроорганизма представляет собой бактерии. В других вариантах осуществления изобретения, клетка-хозяин микроорганизма представляет собой Е. coli.
Настоящее изобретение обеспечивает микроорганизм {напр., клетку-хозяина микроорганизма), где микроорганизм производит метионин в степени или объеме, достаточном для предотвращения или снижения ошибки включения норлейцина в белки или полипептиды, экспрессируемые микроорганизмом. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, где микроорганизм является де-репрессированным для выработки метионина. В некоторых аспектах изобретения, микроорганизм де-репрессирован для выработки метионина в результате частичной потери функции S-аденозилметионин синтазы. В других вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, содержащий мутантный аллель metK. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, содержащий мутантный аллель metK, в котором мутантный аллель metK включает последовательность нуклеиновой кислоты, кодирующую аминокислотную замену в MetK, включающую замену валина на глутаминовую кислоту в положении аминокислоты 185. В других вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, включающий мутантный аллель metK, в котором мутантный аллель metK содержит последовательность нуклеиновой кислоты, содержащую делецию основания цитозина в положении 1132 остатка нуклеиновой кислоты в аллеле metK. В некоторых вариантах осуществления изобретения, клетка-хозяин микроорганизма представляет собой бактерии. В других вариантах осуществления изобретения, клетка-хозяин микроорганизма представляет собой Е. coli.
В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, который включает мутантный аллель metK, где мутантный аллель metK содержит последовательность нуклеиновой кислоты, выбранной из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28. В некоторых вариантах осуществления изобретения, клетка-хозяин микроорганизма представляет собой бактерии. В других вариантах осуществления изобретения, клетка-хозяин микроорганизма представляет собой Е. coli.
Настоящее изобретение также обеспечивает клетку-хозяина микроорганизма, содержащую различные комбинации мутантных аллелей metA и мутантных аллелей metK. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, включающий мутантный аллель metA и мутантный аллель metK, где мутантный аллель metA содержит последовательность нуклеиновой кислоты, кодирующую аминокислотную замену в MetA, включающую замену тирозина на цистеин в положении аминокислоты 294, и, где мутантный аллель metK содержит последовательность нуклеиновой кислоты, кодирующую аминокислотную замену в MetK, включающую замену валина на глутаминовую кислоту в положении аминокислоты 185. В других вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, включающий мутантный аллель metA и мутантный аллель metK, где мутантный аллель metA содержит последовательность нуклеиновой кислоты, кодирующую аминокислотную замену в MetA, включающую замену тирозина на цистеин в положении аминокислоты 294, и где мутантный аллель metK содержит делецию основания цитозина в положении 1132 в остатке нуклеиновой кислоты аллеля metK. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, где микроорганизм включает мутантный аллель metA и мутантный аллель metK, в котором мутантный аллель metA содержит последовательность нуклеиновой кислоты SEQ ID NO:24, и в котором мутантный аллель metK содержит последовательность нуклеиновой кислоты SEQ ID NO:27. В других вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, который включает мутантный аллель metA и мутантный аллель metK, где мутантный аллель metA содержит последовательность нуклеиновой кислоты SEQ ID NO:24, и где мутантный аллель metK последовательность нуклеиновой кислоты SEQ ID NO:28. В некоторых вариантах осуществления изобретения, клетка-хозяин микроорганизма представляет собой бактерии. В других вариантах осуществления изобретения, клетка-хозяин микроорганизма представляет собой Е. coli.
Настоящее изобретение также обеспечивает выделенные молекулы нуклеиновой кислоты для применения в способах настоящего изобретения. В некоторых аспектах, настоящее изобретение обеспечивает выделенные молекулы нуклеиновой кислоты metA (т.е., выделенные молекулы нуклеиновой кислоты, кодирующие MetA). В некоторых вариантах осуществления, настоящее изобретение обеспечивает выделенную молекулу нуклеиновой кислоты metA, где молекула нуклеиновой кислоты metA содержит последовательность нуклеиновой кислоты, кодирующую аминокислотную замену в MetA, выбранную из группы, состоящей из замены аргинина на цистеин в положении аминокислоты 27, замены глутамина на глутаминовую кислоту в положении аминокислоты 64, замены тирозина на цистеин в положении аминокислоты 294, замены изолейцина на серии в положении аминокислоты 296, и замены пролина на лейцин в положении аминокислоты 298. В других вариантах осуществления изобретения, выделенная молекула нуклеиновой кислоты metA, предложенная настоящим изобретением, содержит последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, и SEQ ID NO: 26. Применение этих выделенных молекул нуклеиновой кислоты metA и их последовательностей для производства микроорганизмов для применения в предотвращении или снижении ошибки включения норлейцина в белки или полипептиды специально предусмотрено настоящим изобретением.
Настоящее изобретение также обеспечивает выделенные молекулы нуклеиновой кислоты metK (т.е., выделенные молекулы нуклеиновой кислоты, кодирующие MetK). В некоторых вариантах осуществления, настоящее изобретение обеспечивает молекулу нуклеиновой кислоты metK, где молекула нуклеиновой кислоты metK содержит последовательность нуклеиновой кислоты, кодирующую аминокислотную замену в MetK, включающую замену валина на глутаминовую кислоту в положении аминокислоты 185. В других вариантах осуществления, настоящее изобретение обеспечивает молекулу нуклеиновой кислоты metK, где молекула нуклеиновой кислоты metK включает делецию цитозина нуклеиновой кислоты в остатке нуклеиновой кислоты 1132 аллеля metK. В других вариантах осуществления изобретения, молекула нуклеиновой кислоты metK, обеспеченная настоящим изобретением, содержит последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28. Применение этих выделенных молекул нуклеиновой кислоты metK и их последовательностей для производства микроорганизмов для применения в предотвращении или снижении ошибки включения норлейцина в белки или полипептиды специально предусмотрено настоящим изобретением.
Настоящее изобретение обеспечивает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую анти-VEGF антитела или фрагмент анти-VEGF антитела. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 46, и нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 47. В некоторых вариантах осуществления изобретения, нуклеиновая кислота, кодирующая аминокислотную последовательность SEQ ID NO: 46, представляет собой нуклеиновую кислоту последовательностью SEQ ID NO: 33. В некоторых вариантах осуществления изобретения, нуклеиновая кислота, кодирующая аминокислотную последовательность SEQ ID NO: 47, представляет собой нуклеиновую кислоту последовательностью SEQ ID NO: 34. В некоторых вариантах осуществления, настоящее изобретение предлагает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA, где микроорганизм дополнительно включает нуклеиновую кислоту, имеющую нуклеотидную последовательность, соответствующую SEQ ID NO: 33, и нуклеиновую кислоту, имеющую нуклеотидную последовательность, соответствующую SEQ ID NO: 34. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, и SEQ ID NO: 26. В некоторых аспектах изобретения, микроорганизм представляет собой бактерии, напр., Е. coli.
Настоящее изобретение предлагает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую анти-VEGF антитело или фрагмент анти-VEGF антитела. В некоторых вариантах осуществления, настоящее изобретение предлагает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 46, и нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 47. В некоторых вариантах осуществления изобретения, нуклеиновая кислота, кодирующая аминокислотную последовательность SEQ ID NO: 46, представляет собой нуклеиновую последовательность SEQ ID NO: 33. В некоторых вариантах осуществления изобретения, нуклеиновая кислота, кодирующая аминокислотную последовательность SEQ ID NO: 47, представляет собой нуклеиновую последовательность SEQ ID NO: 34. В некоторых вариантах осуществления, настоящее изобретение предлагает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, имеющую нуклеиновую последовательность, соответствующую SEQ ID NO: 33, и нуклеиновую кислоту, имеющую нуклеиновую последовательность, соответствующую SEQ ID NO: 34. В некоторых вариантах осуществления изобретения, мутантный аллель metK содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28. В некоторых аспектах изобретения, микроорганизм представляет собой бактерии, напр., Е. coli.
Настоящее изобретение обеспечивает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA и мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую анти-VEGF или фрагмент анти-VEGF антитела. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA и мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 46 и нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 47. В некоторых вариантах осуществления изобретения, нуклеиновая кислота, кодирующая аминокислотную последовательность SEQ ID NO: 46, представляет собой нуклеиновую последовательность SEQ ID NO: 33. В некоторых вариантах осуществления изобретения, нуклеиновая кислота, кодирующая аминокислотную последовательность SEQ ID NO: 47, представляет собой нуклеиновую последовательность SEQ ID NO: 34. В некоторых вариантах осуществления, настоящее изобретение предлагает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA и мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, имеющую нуклеиновую последовательность, соответствующую SEQ ID NO: 33, и нуклеиновую кислоту, имеющую нуклеиновую последовательность, соответствующую SEQ ID NO: 34.. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, и SEQ ID NO: 26, и мутантный аллель metK содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28. В некоторых аспектах изобретения, микроорганизм представляет собой бактерии, напр., Е. coli.
Настоящее изобретение предлагает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую антитело против Фактора D иди фрагмент антитела против Фактора D. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 48, и нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 49. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, и SEQ ID NO: 26. В некоторых аспектах изобретения, микроорганизм представляет собой бактерии, напр., Е. coli.
Настоящее изобретение предлагает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую антитело против Фактора D или фрагмент антитела против Фактора D. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 48, и нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 49. В некоторых вариантах осуществления изобретения, мутантный аллель metK содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO:27 и SEQ ID NO: 28. В некоторых аспектах изобретения, микроорганизм представляет собой бактерии, напр., Е. coli.
Настоящее изобретение предлагает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA и мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую антитело против Фактора D или фрагмент антитела против Фактора D. В некоторых вариантах осуществления, настоящее изобретение предлагает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA и мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 48, и нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 49. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, и SEQ ID NO: 26, и мутантный аллель metK содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28. В некоторых аспектах изобретения, микроорганизм представляет собой бактерии, напр., Е. coli.
Настоящее изобретение предлагает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую анти-МЕТ антитело или фрагмент анти-МЕТ антитела. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 50, нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 51, и нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 52. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, и SEQ ID NO: 26. В некоторых аспектах изобретения, микроорганизм представляет собой бактерии, напр., Е. coli.
Настоящее изобретение предлагает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую анти-МЕТ антитело или фрагмент анти-МЕТ антитела. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 50, нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 51, и нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 52. В некоторых вариантах осуществления изобретения, мутантный аллель metK содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28. В некоторых аспектах изобретения, микроорганизм представляет собой бактерии, напр., Е. coli.
Настоящее изобретение обеспечивает микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA и мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую анти-МЕТ антитело или фрагмент анти-МЕТ антитела. В некоторых вариантах осуществления, настоящее изобретение микроорганизм, содержащий нуклеиновую кислоту, включающую мутантный аллель metA и мутантный аллель metK, где микроорганизм дополнительно содержит нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 50, нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 51, и нуклеиновую кислоту, кодирующую аминокислотную последовательность SEQ ID NO: 52. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, и SEQ ID NO: 26, и мутантный аллель metK содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28. В некоторых аспектах изобретения, микроорганизм представляет собой бактерии, напр., Е. coli.
Настоящее изобретение дополнительно предлагает способ получения белка или полипептида в бактериальной клетке-хозяине, свободного от ошибки включения норлейцина, при этом способ включает экспрессию нуклеиновой кислоты в бактериальной клетке-хозяине, кодирующей белок или полипептид, где бактериальная клетка-хозяин содержит мутантный аллель metA, мутантный аллель metK, или мутантный аллель metA и мутантный аллель metK, в результате чего получают белок или полипептид свободный от ошибки включения норлейцина. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, и SEQ ID NO: 26, и мутантный аллель metK содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28.
Настоящее изобретение также предлагает способ получения антитела или фрагмента антитела в бактериальной клетке-хозяине, где антитело или фрагмент антитела является свободным от ошибки включения норлейцина, при этом способ включает экспрессию нуклеиновой кислоты в бактериальной клетке-хозяине, кодирующей антитело или фрагмент антитела, где бактериальная клетка-хозяин содержит мутантный аллель metA, мутантный аллель metK, или мутантный аллель metA и мутантный аллель metK, в результате чего получают антитело или фрагмент антитела свободный от ошибки включения норлейцина. В некоторых аспектах изобретения, способ получения антитела или фрагмента антитела в бактериальной клетке хозяине свободного от ошибки включения норлейцина согласно настоящему изобретению включает экспрессию нуклеиновой кислоты в бактериальной клетке-хозяине, кодирующей тяжелую цепь полипептида антитела, и нуклеиновой кислоты, кодирующей легкую цепь полипептида антитела. В некоторых аспектах настоящего изобретения, тяжелая цепь полипептида антитела представляет собой тяжелую цепь полипептида Fab фрагмента антитела, а легкая цепь полипептида антитела представляет собой легкую цепь полипептида Fab фрагмента антитела. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, и SEQ ID NO: 26, и мутантный аллель metK содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28.
В некоторых вариантах осуществления, настоящее изобретения обеспечивает способ получения анти-VEGF антитела или фрагмента анти-VEGF антитела в бактериальной клетке-хозяине, где анти-VEGF антитело или фрагмент анти-VEGF антитела является свободным от ошибки включения норлейцина, при этом способ включает экспрессию нуклеиновой кислоты в бактериальной клетке-хозяине, кодирующей анти-VEGF антитело или фрагмент анти-VEGF антитела, где бактериальная клетка-хозяин содержит мутантный аллель metA, мутантный аллель metK, или мутантный аллель metA и мутантный аллель metK, в результате чего получают анти-VEGF антитело или фрагмент анти-VEGF антитела свободный от ошибки включения норлейцина. В некоторых вариантах осуществления изобретения, способ включает экспрессию нуклеиновой кислоты в бактериальной клетке-хозяине, кодирующей тяжелую цепь полипептида анти-VEGF антитела или тяжелую цепь полипептида фрагмента анти-VEGF антитела или его фрагмент и нуклеиновой кислоты, кодирующей легкую цепь полипептида анти-VEGF антитела или легкую цепь полипептида фрагмента анти-VEGF антитела или его фрагмент.В некоторых аспектах изобретения, тяжелая цепь анти-VEGF антитела и легкая цепь анти-VEGF антитела представляют собой полноразмерную тяжелую цепь и легкую цепь полипептидов анти-VEGF антитела. В других аспектах изобретения, тяжелая цепь анти-VEGF антитела представляет собой тяжелую цепь полипептида Fab фрагмента антитела, а легкая цепь анти-VEGF антитела представляет собой легкую цепь полипептида Fab фрагмента антитела. В некоторых вариантах осуществления изобретения, тяжелая цепь анти-VEGF антитела содержит аминокислотную последовательность SEQ ID NO: 47, а легкая цепь анти-VEGF антитела содержит аминокислотную последовательность SEQ ID NO: 46. В некоторых вариантах осуществления изобретения, нуклеиновая кислота, кодирующая аминокислотную последовательность SEQ ID NO: 47, представляет собой нуклеиновую последовательность SEQ ID NO: 34. В некоторых вариантах осуществления изобретения, нуклеиновая последовательность, кодирующая аминокислотную последовательность SEQ ID NO: 46, представляет собой нуклеиновую последовательность SEQ ID NO: 33. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, и SEQ ID NO: 26. В некоторых вариантах осуществления изобретения, мутантный аллель metK содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28.
Изобретение дополнительно предлагает анти-VEGF антитело или фрагмент анти-VEGF антитела, полученное с помощью любого из способов, описанных в настоящем изобретении, где анти-VEGF антитело или фрагмент анти-VEGF антитела является свободным от ошибки включения норлейцина.
В некоторых вариантах осуществления, настоящее изобретения обеспечивает способ получения антитела против Фактора D или фрагмента антитела против Фактора D в бактериальной клетке-хозяине, где антитела против Фактора D или фрагмент антитела против Фактора D является свободным от ошибки включения норлейцина, при этом способ включает экспрессию нуклеиновой кислоты в бактериальной клетке-хозяине, кодирующей антитело против Фактора D или фрагмент антитела против Фактора D, в котором бактериальная клетка-хозяин содержит мутантный аллель metA, мутантный аллель metK, или мутантный аллель metA и мутантный аллель metK, в результате чего получают антитело против Фактора D или фрагмент антитела против Фактора D свободное от ошибки включения норлейцина. В некоторых вариантах осуществления изобретения, способ включает экспрессию нуклеиновой кислоты в бактериальной клетке-хозяине, кодирующей тяжелую цепь полипептида антитела против Фактора D или тяжелую цепь полипептида фрагмента антитела против Фактора D или ее фрагмент, и нуклеиновой кислоты, кодирующей легкую цепь полипептида антитела против Фактора D или легкую цепь полипептида фрагмента антитела против Фактора D или ее фрагмент.В некоторых аспектах настоящего изобретения, тяжелая цепь антитела против Фактора D и легкая цепь антитела против Фактора D являются полноразмерной тяжелой цепью и легкой цепью полипептидов антитела против Фактора D. В других аспектах настоящего изобретения, тяжелая цепь антитела против Фактора D представляет собой тяжелую цепь полипептида Fab фрагмента антитела, а легкая цепь антитела против Фактора D представляет собой легкую цепь полипептида Fab фрагмента антитела. В некоторых вариантах осуществления изобретения, тяжелая цепь антитела против Фактора D включает аминокислотную последовательность SEQ ID NO: 49, а легкая цепь антитела против Фактора D включает аминокислотную последовательность SEQ ID NO: 48. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, и SEQ ID NO: 26. В некоторых вариантах осуществления изобретения, мутантный аллель metK содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28.
Изобретение дополнительно обеспечивает антитело против Фактора D или фрагмент антитела против Фактора D, полученные с помощью любого из способов, описанных в настоящем изобретении, при этом антитело против Фактора D или фрагмент антитела против Фактора D является свободным от ошибки включения норлейцина.
В некоторых вариантах осуществления, настоящее изобретение предлагает способ получения анти-МЕТ антитела или фрагмента анти-МЕТ антитела в бактериальной клетке-хозяине, где анти-МЕТ антитело или фрагмента анти-МЕТ антитела является свободным от ошибки включения норлейцина, при этом способ включает экспрессию нуклеиновой кислоты в бактериальной клетке-хозяине, кодирующей анти-МЕТ антитело или фрагмент анти-МЕТ антитела, где бактериальная клетка-хозяин содержит мутантный аллель metA, мутантный аллель metK, или мутантный аллель metA и мутантный аллель metK, в результате чего получают анти-МЕТ антитело или фрагмент анти-МЕТ антитела свободный от ошибки включения норлейцина. В некоторых вариантах осуществления изобретения, способ включает экспрессию нуклеиновой кислоты в бактериальной клеткой-хозяином, кодирующей тяжелую цепь полипептида анти-МЕТ антитела или тяжелую цепь полипептида фрагмента анти-МЕТ антитела или ее фрагмент и нуклеиновой кислоты, кодирующей легкую цепь полипептида анти-МЕТ антитела или легкую цепь полипептида фрагмента анти-МЕТ антитела или ее фрагмент. В некоторых аспектах изобретения, тяжелая цепь анти-МЕТ антитела и легкая цепь анти-МЕТ антитела представляют собой полноразмерную тяжелую цепь и легкую цепь полипептидов анти-МЕТ антитела. В других аспектах настоящего изобретения, тяжелая цепь анти-МЕТ антитела представляет собой тяжелую цепь полипептида Fab фрагмента антитела, а легкая цепь анти-МЕТ антитела представляет собой легкую цепь полипептида Fab фрагмента антитела. В некоторых вариантах осуществления изобретения, тяжелая цепь анти-МЕТ антитела содержит аминокислотную последовательность SEQ ID NO: 51, тяжелая цепь фрагмента анти-МЕТ антитела содержит аминокислотную последовательность SEQ ID NO: 52, и легкая цепь анти-МЕТ антитела содержит аминокислотную последовательность SEQ ID NO: 50. В некоторых вариантах осуществления изобретения, мутантный аллель metA содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, и SEQ ID NO: 26. В некоторых вариантах осуществления изобретения, мутантный аллель metK содержит нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28.
Настоящее изобретение дополнительно предлагает анти-МЕТ антитело или фрагмент анти-МЕТ антитела, полученный с помощью любого из способов, описанных в настоящем изобретении, где анти-МЕТ антитело или фрагмент анти-МЕТ антитела является свободным от ошибки включения норлейцина.
В различных аспектах настоящего изобретения, мутантный микроорганизм, содержащий одну или несколько нуклеиновых последовательностей, обеспеченных настоящим изобретение, представляет собой бактерии; в других аспектах настоящего изобретения, микроорганизм представляет собой Е. coli. Настоящее изобретение в частности относится к применению микроорганизма, описанного в настоящем изобретении, для получения гетерологичных (напр., рекомбинантных) полипептидов и гетерологичных (напр., рекомбинантных) белков, где ошибка включения норлейцина в гетерологичные полипептиды и гетерологичные белки снижена, существенно снижена, существенно устранена или предотвращена.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фигуре 1 представлена нуклеиновая последовательность metA(R27C), соответствующая SED ID NO: 23.
На Фигуре 2 представлена нуклеиновая последовательность metA(Y294C), соответствующая SED ID NO: 24.
На Фигуре 3 представлена нуклеиновая последовательность metA(I296S/P298L), соответствующая SED ID NO: 25.
На Фигуре 4 представлена нуклеиновая последовательность metA(Q64E) соответствующая SED ID NO: 26.
На Фигуре 5 представлена нуклеиновая последовательность metK(V185E) соответствующая SED ID NO: 27.
На Фигуре 6 представлена нуклеиновая последовательность metK(c1132del) соответствующая SED ID NO: 28.
На Фигурах 7А и 7В представлена аминокислотная последовательность и нуклеиновая последовательность MetA дикого типа, соответствующая SEQ ID NO: 29 и SEQ ID NO: 31, соответственно.
На Фигурах 8А и 8В представлена аминокислотная последовательность и нуклеиновая последовательность MetK дикого типа, соответствующая SEQ ID NO: 30 и SEQ ID NO: 32, соответственно.
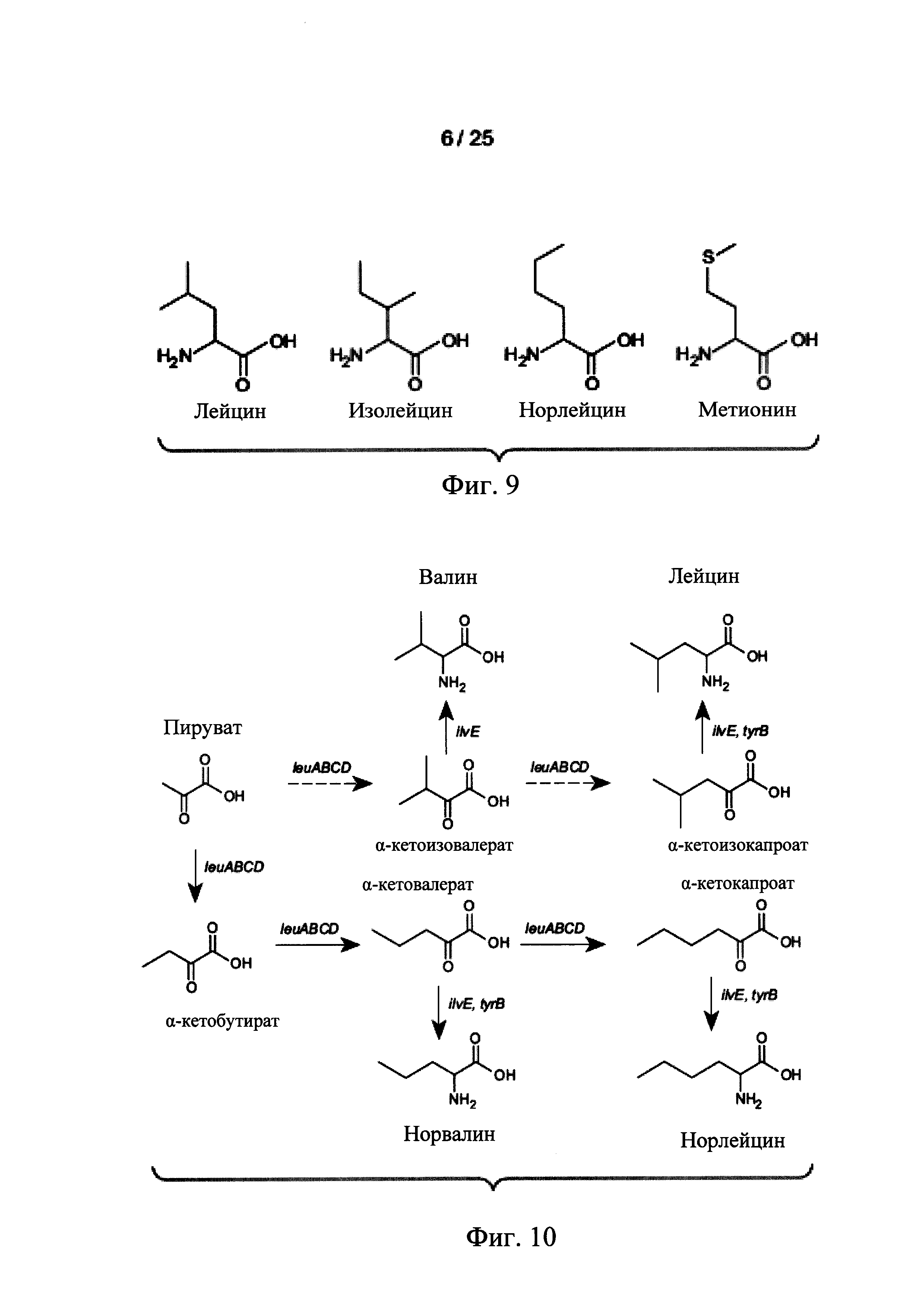
На Фигуре 9 представлена структура норлейцина и аналогов норлейцина. Норлейцин является структурный аналогом метионина, в котором атом серы (S) заменен митиленовой группой (т.е., -СН2).
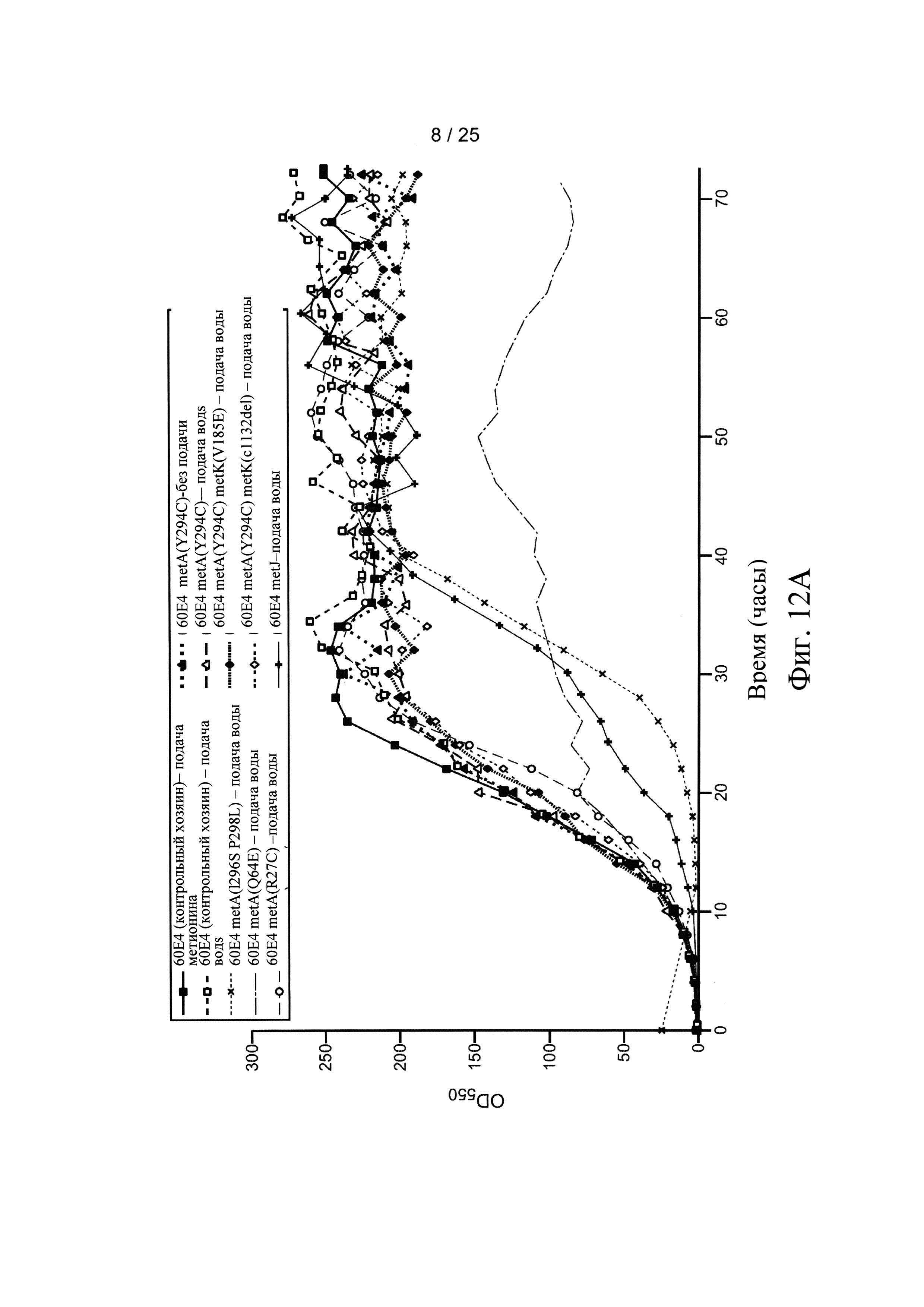
На Фигуре 10 представлен схематически биосинтетический путь метаболизма норлейцина в Е. coli. Пунктирная стрелка указывает, что нужно выполнить несколько действий. Пируват превращается в α-кетокапроат с помощью троекратного процесса удлинение цепи кетокислоты, катализируемый ферментами, кодируемые опероном лейцина leuABCD. Промежуточный а-кетокапроат является трансаминированный в норлейцин с помощью трансаминазы IlvE или TyrB.
На Фигуре 11 представлен биосинтез и регуляция метионина в Е. coli. Пунктирная стрелка указывает ингибирование по типу обратной связи и открытые стрелки указывают подавление. Метионин и S-аденозилметионин (SAM) являются ингибиторами по типу обратной связи фермента MetA. Репрессор MetJ и его ко-репрессор SAM ингибируют транскрипцию ферментов в регулоне метионина.
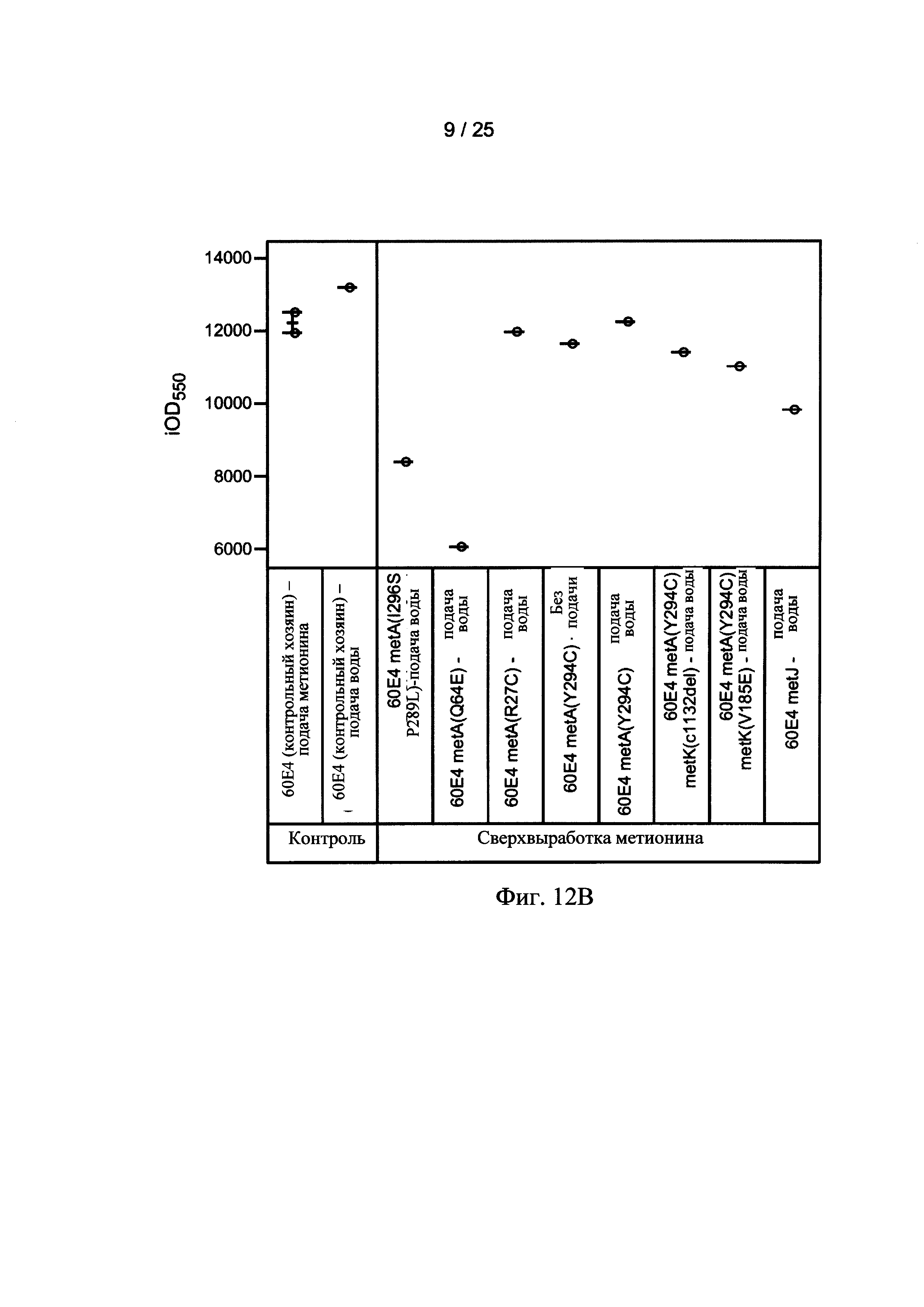
На Фигурах 12А, 12В, и 12С приведены тенденции роста, как измеряется с помощью OD550 (Фигура 12А) и iOD550 (Фигура 12В) 10 L Е. coli ферментации. Ферментации контрольных хозяев (60Е4) осуществлялись с непрерывной подачей метионина (■) или непрерывной подачей воды (□) (Фигура 12А). Ферментация хозяев 60Е4 metA(Y294C) осуществляли с непрерывной подачей воды (Δ) или без подачи (▲) (Фигура 12А). На Фигуре 12С показаны тенденции роста для контрольных хозяев 60Е4 без подачи (квадраты), для контрольных хозяев 60Е4 с подачей метионина (кружки), и хозяев 60Е4 metA(Y294C) без подачи (треугольники). Ферментация с использованием других мутантов осуществляли с непрерывной подачей воды.
На Фигурах 13А и 13В показаны внеклеточные (Фигура 13А) и внутриклеточные (Фигура 13В) уровни метионина для ферментации контрольных хозяев (□) и клеток-хозяев 60Е4 metA(Y294C) (Δ), осуществляемой с непрерывной подачей воды. Уровни фосфатов во внеклеточной среде также показаны пунктирными линиями (Фигура 13А) и (Фигура 13В) для ферментации контрольных клеток-хозяев (□) и клеток-хозяев 60Е4 metA (Y294C) (Δ), осуществляемой с непрерывной подачей воды.
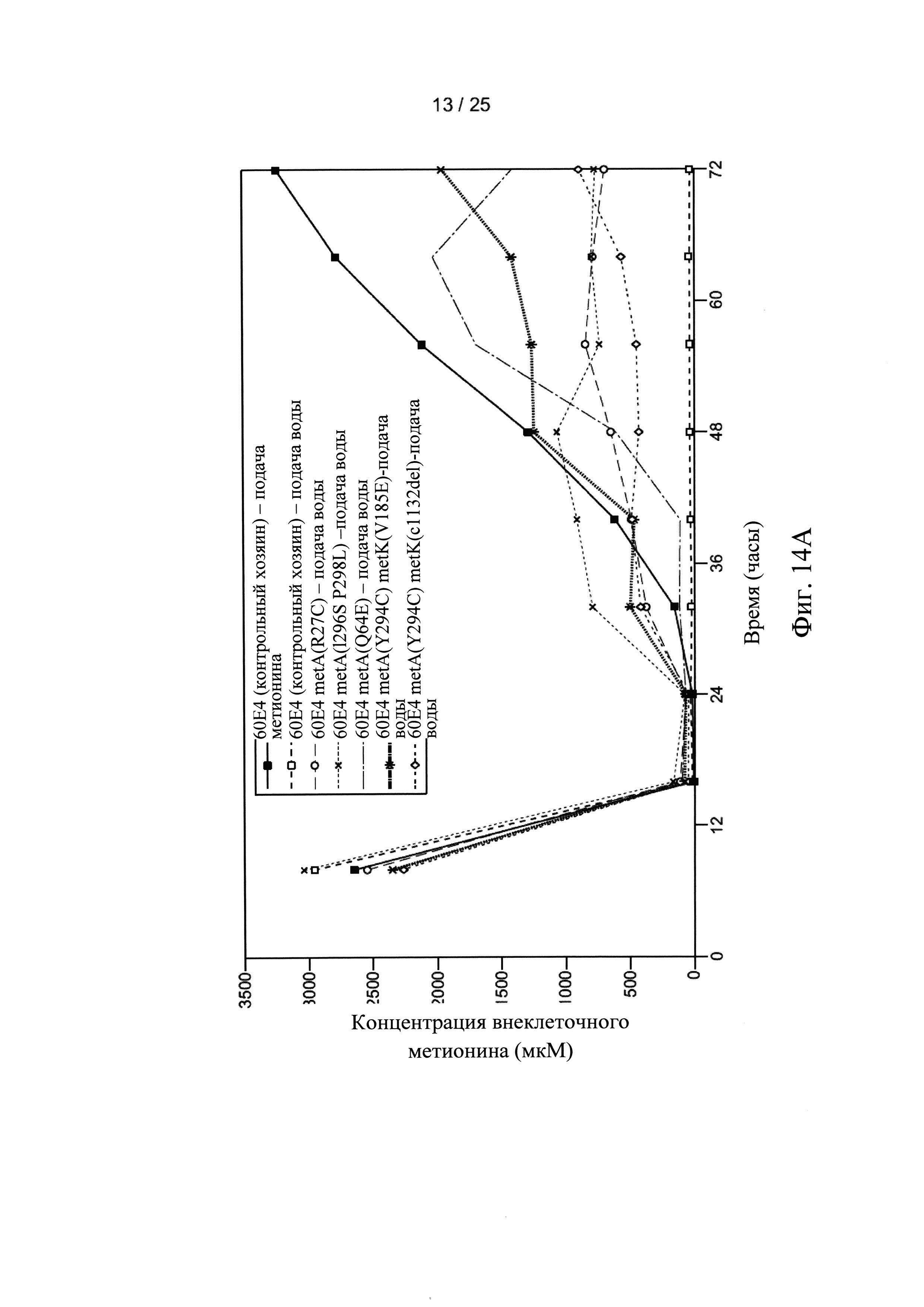
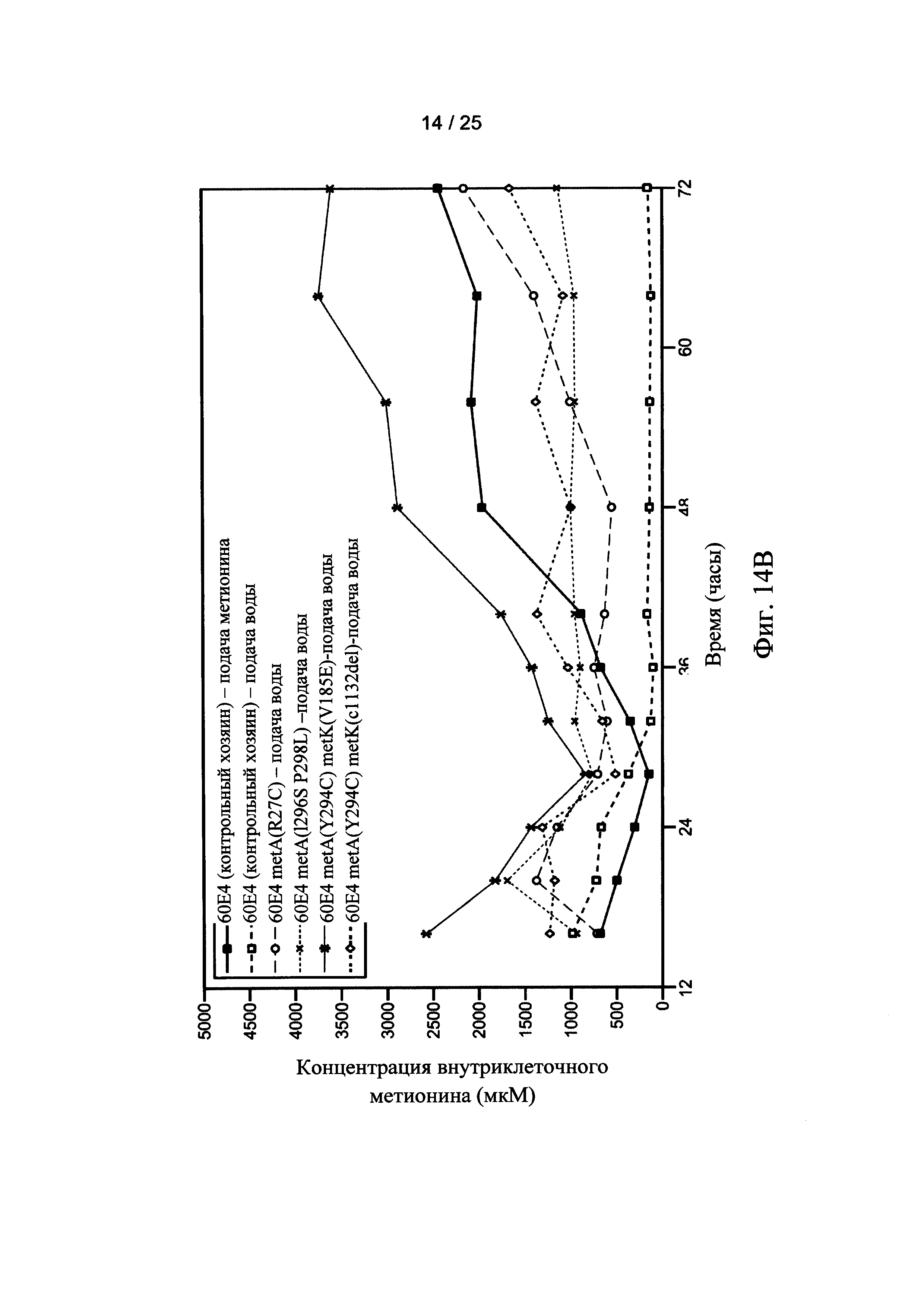
На Фигуре 14А и 14В показаны внеклеточные (Фигура 14А) и внутриклеточные (Фигура 14В) уровни метионина для мутантных штаммов клеток-хозяев по настоящему изобретению. Внеклеточные и внутриклеточные уровни метионина также показаны для двух ферментаций контрольных клеток-хозяев, осуществляемых с непрерывной подачей метионина (■) или непрерывной подачей воды (□), соответственно.
На Фигуре 15 показаны внеклеточные уровни фосфата в процессе ферментации.
На Фигурах 16А и 16В показан конец выполнения титра (Фигура 16А) и зависимость титра (Фигура 16В) от времени ферментации клетки-хозяина Е. coli. Ферментация контрольной клетки-хозяина (60Е4) осуществлялась с непрерывной подачей метионина (■) или непрерывной подачей воды (□). Ферментация 60Е4 metA клетки-хозяина (Y294C) осуществлялась с непрерывной подачей воды (Δ) или без подачи (▲). Ферментации с использованием других мутантных клеток-хозяев осуществлялись с непрерывной подачей воды.
На Фигурах 17А и 17В приведены результаты вестерн-блоттинга, выполненного на образцах питательной среды цельных клеток, полученных в ходе ферментаций клетки-хозяина 60Е4 (контрольная клетка-хозяин) 60Е4 metA клетки-хозяина (Y294C), соответственно.
На Фигурах 18А и 18В представлены нуклеиновые последовательности легкой цепи и тяжелой цепи Fab фрагмента антитела ингибитора фактора роста эндотелия сосудов (анти-VEGF), соответствующие SEQ ID NO: 33 и SEQ ID NO: 34, соответственно. На Фигурах 19А и 19В представлены тенденции роста ферментации 10 л Е. coli, как измерено OD550. Контрольные хозяева (66F8 или 64 В4) процессы ферментации AF2 или AF3, соответственно, выполняли без подачи (квадраты) или непрерывной подачей метионина (кружки). Ферментации хозяев 66F8 metA(Y294C) и 64 В4 metA(Y294C) осуществляли без подачи (треугольники).
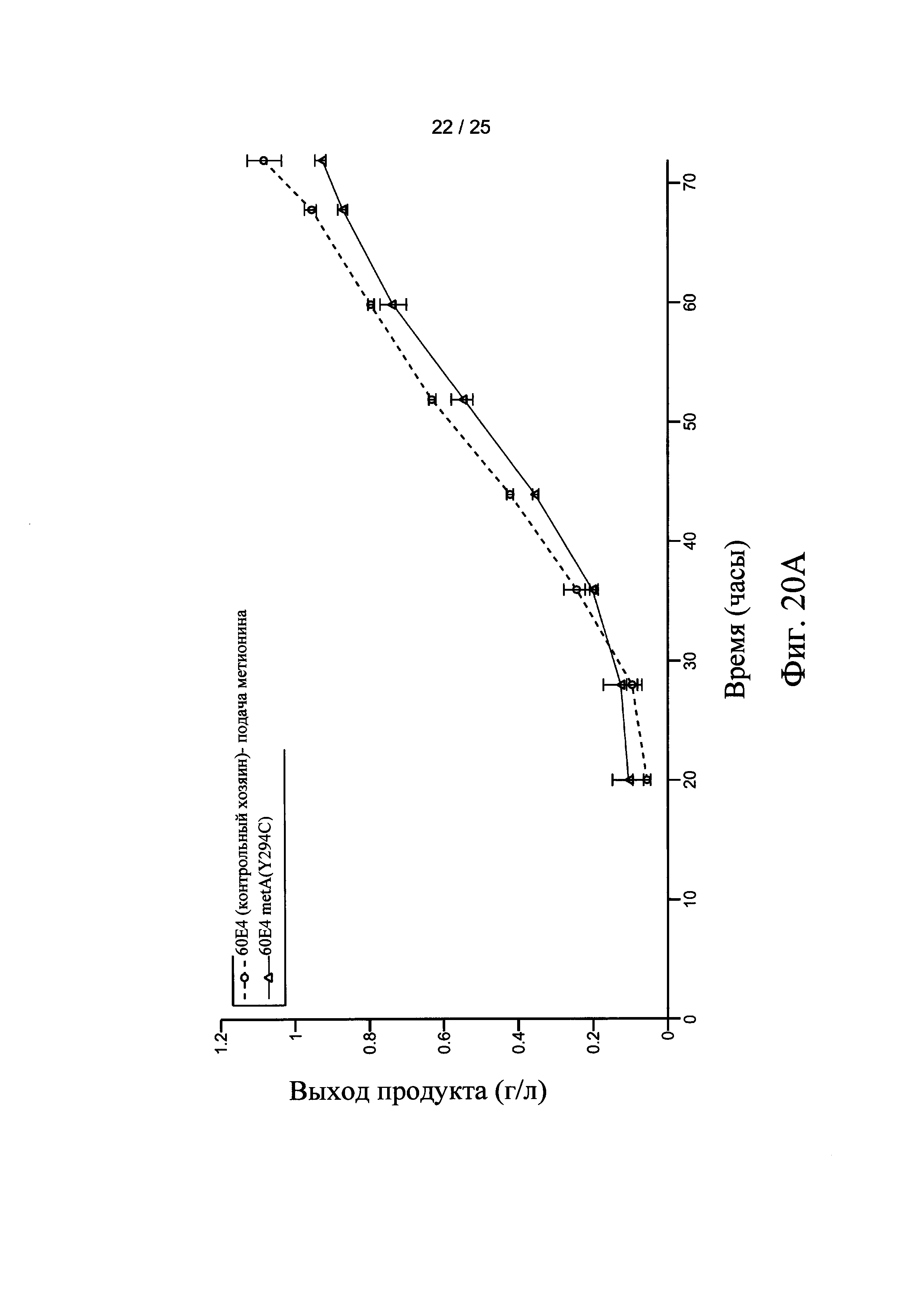
На Фигурах 20А, 20В, и 20С представлен выход продукта рекомбинантного белка с использованием штамма-хозяина 60Е4 (контрольный хозяин) и 60Е4 metA(Y294C), 66F8 (контрольный хозяин) и 66F8 metA(Y294C), и 64В4 (контрольный хозяин) и 64В4 metA(Y294C), соответственно.
На Фигурах 21А и 21В показаны аминокислотные последовательности легкой цепи и тяжелой цепи Fab фрагмента антитела ингибитора фактора роста эндотелия сосудов (анти-VEGF), соответствующие SEQ ID NO: 46 и SEQ ID NO: 47, соответственно.
На Фигурах 22А и 22 В показаны аминокислотные последовательности легкой цепи и тяжелой цепи Fab фрагмента антитела против Фактора D, соответствующие SEQ ID NO: 48 и SEQ ID NO: 49, соответственно.
На Фигурах 23А, 23В, и 23С показаны аминокислотные последовательности легкой цепи (SEQ ID NO: 50), тяжелой цепи (SEQ ID NO: 51) и фрагмента тяжелой цепи (SEQ ID NO: 52) анти-МЕТ антитела.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает, в том числе, способы и композиции для предотвращения ошибки включения норлейцина в белки или полипептиды, в частности в процессе получения рекомбинантного белка в микроорганизмах. Настоящее изобретение также предлагает клетку-хозяина микроорганизма и молекулы нуклеиновой кислоты для применения в способах настоящего изобретения.
Общие Методы
Практически настоящее изобретение будет применять, если не указано иного, общепринятые методы клеточной биологии, культуры клеток, молекулярной биологии (в том числе рекомбинантные технологии), микробиологии, биохимии, и иммунологии, которые известны и доступны специалистам в данной области техники. Такие методы описаны в литературе, такой как, Molecular Cloning: A laboratory Manual, третье издание (Sambrook et al., 2001) Cold Spring Harbor Press; Oligonucleotide Synthesis (P. Herdewijn, ed., 2004); Animal Cell Culture (R.I. Freshney, ed., 1987); Methods in Enzymology (Academic Press, Inc.); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); и Short Protocols in Molecular Biology (Wiley and Sons, 1999). Экспрессия фрагментов антител и полипептидов в бактериях описана в, например, патентах США Nos. 5,648,237, 5,789,199, и 5,840,523 (см. также Charlton, Methods in Molecular Biology, Vol.248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), pp. 245-254, описывает экспрессию фрагментов антител в Е. coli.).
Если не указано иного, все технические и научные термины, используемые в настоящем изобретении, имеют такое же значение, как обычно понимается средним специалистом в данной области техники, к которой принадлежит настоящее изобретение.
Определения
Термины "гетерологичный белок" или "гетерологичный полипептид" относится к белку или полипептиду, синтезированному не в природе или полученному с помощью клетки или организма (напр., микроорганизма) представляющий интерес. Например, клетки Е. coli могут вырабатывать человеческий белок или человеческий полипептид, и человеческий белок или человеческий полипептид, полученный таким образом, является гетерологичный белком или гетерологичным полипептидом. Особый интерес в контексте настоящего изобретения представляют эти гетерологичные белки или гетерологичные полипептиды, содержащие метионин. Гетерологичный белок или гетерологичный полипептид, как используется в настоящем изобретении, относится к рекомбинантному белку или рекомбинантному полипептиду.
Термин "ошибка включения норлейцина" относится к включению остатка норлейцина в белок или полипептид, для которого остаток метионина закодирован соответствующей нуклеиновой кислотой, кодирующей белок или полипептид.
Термины "мутантный аллель" или "мутировавший аллель" относится к аллелю, имеющему нуклеиновую последовательность, которая отлична от или изменена от нуклеиновой последовательности аллеля дикого-типа (т.е., как встречается в природе в клетке или микроорганизме, представляющий интерес).
Термины "мутантный микроорганизм" или "мутировавший микроорганизм" относится к микроорганизму, который содержит один или несколько мутантных аллелей или мутировавших аллелей.
Фраза "по существу уменьшенный" или "по существу отличный" как используется в настоящем изобретении, относится к достаточно высокой степени различия между двумя числовыми значениями (обычно один, связанный с молекулой, и другой, связанный с референсной/сопоставленной молекулой) таким образом, что специалист в данной техники будет учитывать отличия между двумя значениями, статистически значимыми в контексте биологической характеристики, измеренной указанными значениями (напр., содержание норлейцина в белке или полипептиде).
"Выделенная" нуклеиновая кислота относится к молекуле нуклеиновой кислоты, которая отделена от компонента ее природной среды. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат молекулу нуклеиновой кислоты, но молекула нуклеиновой кислоты присутствует внехромосомно или в хромосомном участке, который отличается от его хромосомного участка в природе.
"Выделенная молекула нуклеиновой кислоты metA" или "выделенная молекула нуклеиновой кислоты metK'' относится к одной или нескольким молекулам нуклеиновой кислоты, кодирующих MetA или MetK, соответственно, в том числе такие молекулы нуклеиновой кислоты в одном векторе или отдельных векторах, и такие молекулы нуклеиновых кислот присутствуют в одном или нескольких участках в клетке-хозяине. "Выделенная молекула нуклеиновой кислоты metA" или "выделенная молекула нуклеиновой кислоты metK" также относится к мутантному аллелю metA или мутантному аллелю metK.
Фраза "белок или полипептид свободный от ошибки включения норлейцина" относится к белку или полипептиду, который содержит не обнаруживаемые уровни остатков норлейцина.
Ссылка на "приблизительное" значение или параметр в настоящем изобретении относится к обычному интервалу погрешности для соответствующего значения, хорошо известному специалисту в данной области техники. Ссылка на "приблизительное" значение или параметр в настоящем изобретении включает (и описывает) аспекты, которые направлены к этому значению или параметру, по существу. Например, описание со ссылкой на "приблизительно X" включает описание "X."
Способы предотвращения или снижения ошибки включения норлейцина
Настоящее изобретение относится, в частности, к способам и композициям, пригодным для предотвращения или снижения ошибки включения норлейцина в белки или полипептиды, в том числе в процессе получения рекомбинантного белка в микроорганизмах.
Ошибка включения остатка норлейцина вместо остатков метионина в процессе получения рекомбинантного белка в Е. coli было описано ранее. Одним из подходов в настоящее время, применяемых для предотвращения или снижения ошибки включения норлейцина, является непрерывная или болюсная подача метионина в культуральную среду в ходе процесса ферментации. Хотя эта стратегия является эффективной в снижении ошибки включения норлейцина, некоторые эксплуатационные недостатки связаны с непрерывной или болюсной подачей или добавлением метионина в ходе процесса ферментации. Например, непрерывная или болюсная подача к культуре увеличивает эксплуатационную сложность и общую стоимость процесса ферментации. Кроме того, подача метионина приводит к нежелательному разбавлению ферментативной среды, что приводит к низкой плотности клеток и, вероятно, низкому выходу продукта.
Для преодоления этих недостатков, настоящее изобретение предлагает альтернативу непрерывной или болюсной подаче метионина для предотвращения или снижения ошибки включения норлейцина в полученном гетерологичном белке или полипептиде. В частности, настоящее изобретение предлагает клетки-хозяева микроорганизма (напр., Е. coli), созданные для выработки метионина в степени или объеме, достаточном для предотвращения или снижения ошибки включения норлейцина в ходе получения рекомбинантного белка, в том числе при получении рекомбинантного белка, осуществляемом при высокой плотности клеток-хозяев.
Мутантные клетки-хозяева Е. coli, применяемые для масштабной выработки метионина, описывались ранее. (См., напр., Chattopadhyay et al., (1991) J Gen Microbiol 137:685-691; Nakamori et al, (1999) Appl Microbiol Biotechnol 52:179-185; Usuda and Kurahashi (2005) Appl Environ Microbiol 71:3228-3234; публикация заявки на международный патент No. WO 2005/111202 2005; и публикация патента США No. US2009/0298135). Многие из этих мутантных штаммов Е. coli содержат мутации в трех генах, связанных с регуляцией биосинтеза метионина: metJ, metA, и metK.
Регуляция транскрипции биосинтеза метионина в Е. coli включает фермент MetJ (продукт гена metJ). MetJ является транскрипционным репрессором, который, при связывании с его ко-репрессором S-аденозилметионином (SAM), подавляет транскрипцию генов в регулоне метионина, таким образом регулируя уровни метионина в клетке. (См., напр., Marines (2006) et al., Biochem J 396:227-234). Как сообщалось ранее, химический мутагенез Е. coli с последующим отбором для роста на этионине (токсичном аналоге метионина) приводит к выделению серина на мутацию аспарагина в положении аминокислоты 54 (S54N) в MetJ, что приводит к де-репрессии ферментов биосинтеза метионина и увеличивает выработку метионина. (См. Nakamori et al, (1999) Appl Microbiol Biotechnol 52:179-185.) Полное разрушение гена metJ также приводит к де-репрессии ферментов, вовлеченных в биосинтетический путь метаболизма метионина, и сверхсинтезу метионина. (См. Usuda and Kurahashi (2005) Appl Environ Microbiol 71:3228-3234).
Биосинтез метионина в E.coli также регулируется путем ингибирования по типу обратной связи (метионином и SAM) гомосерин сукцинилтрансферазы (продукт гена metA), фермент вовлечен в первой стадии биосинтеза метионина. (См., напр., Born and Blanchard (1999) Biochemistry 38:14416-14423). Резистентность по механизму обратной связи MetA (продукт гена metA) мутантов в Е. coli, приводящая к отмене регуляции биосинтеза метионина, была выделена ранее путем отбора для роста на токсическом аналоге метионина α-метил метионине. (См. Usuda and Kurahashi (2005) Appl Environ Microbiol 71:3228-3234; и публикацию заявки на международный патент No. WO 2005/111202).
Ген metK кодирует фермент S-аденозилметионин синтазу, который превращает метионин в S-аденозилметионин. (См. Markham et al, (1980) J Biol Chem 255:9082-9092). Частичная потеря функции мутантов MetK приводит к низким уровням SAM и, следовательно, де-репрессии ферментов биосинтеза метионина (SAM является ко-репрессором для MetJ) была предварительно выделены путем отбора для роста на токсичных аналогах метионина, норлейцине и этионине. (См. Chattopadhyay et al, (1991) Gen Microbiol 137:685-691; Usuda and Kurahashi (2005) Appl Environ Microbiol 71:3228-3234; и публикацию заявки на международный патент No. WO 2005/111202).
В настоящем изобретении, конкретные остатки нуклеиновых кислот были мутированы в гене metA дикого типа, что привело к следующим заменам аминокислот в MetA (см. Фигуру 7А и SEQ ID NO: 29 для аминокислотной последовательности MetA дикого типа): замена аргинина на цистеин в положении аминокислоты 27 (R27C); замена глутамина на глутаминовую кислоту в положении аминокислоты 64 (Q64E); замена тирозина на цистеин в положении аминокислоты 294 (Y294C); замена изолейцина на серии в положении аминокислоты 296 (I296S); и замена пролина на лейцин в положении аминокислоты 298 (P298L). Клетки-хозяева Е. coli, содержащие одну или несколько таких аминокислотных замен MetA, вырабатывают метионин в степени или объеме, достаточном, чтобы привести к предотвращению ошибки включения норлейцина в экспрессируемых гетерологичных белках.
В некоторых вариантах осуществления, настоящее изобретение предлагает различные мутантные аллели metA, кодирующие аминокислотные замены в MetA R27C, Q64E, Y294C, I296S, и P298L (по сравнению с аминокислотной последовательностью MetA дикого типа; Фигура 7 и SEQ ID NO:29). Такие мутантные аллели metA приводят к резистентности по механизму обратной связи фермента MetA. Мутантные аллели metA были введены в клетки-хозяева Е. coli (60Е4) с использованием метода аллельного обмена (см. Материалы и Методы ниже) для получения мутантной клетки-хозяина Е. coli штамма 66Н6 (60Е4 metA(R27C)), 66Н8 (60Е4 metA(Y294C)), 67В8 (60Е4 metA(Q64E)), и 67В9 (60Е4 metA(l296S P298L)). Полученные мутантные клетки-хозяева Е. coli оценивали на ошибки включения норлейцина в ходе получения рекомбинантного белка, осуществляемой без непрерывной подачи метионина. (См. Пример 4 ниже).
Все ссылки на положения аминокислот в MetA сделаны, исходя из гомосерин сукцинилтрансферазы, кодируемой геном metA Е. coli, показаны на Фигурах 7А и 7В, соответствующие SEQ ID NO: 29 и SEQ ID NO: 31. Ссылки на положения аминокислот сделаны с первой аминокислоты метионина, считая как положение аминокислоты номер 1. Относительные положения соответствующих участков ферментов гомосерин сукцинилтрансферазы от других организмов могут быть определены специалистом в данной области техники, например, простым выравниванием последовательности.
В настоящем изобретении, нуклеиновая кислота в гене metK дикого типа была мутирована, что привело к замене аминокислоты валина на глутаминовую кислоту в положении аминокислоты 185 (V185E) в MetK. (См. Фигуру 8А и SEQ ID NO: 30 для аминокислотной последовательности MetK дикого типа). Кроме того, конкретная нуклеиновая кислота была удалена в основании цитозина положении 1132 в гене metK (c1132del). Клетки-хозяева Е. coli, содержащие один или несколько этих мутантных аллелей metK, вырабатывают метионин в степени или объеме, достаточном, чтобы привести к предотвращению ошибки включения норлейцина в экспрессируемых гетерологичных белках.
В некоторых вариантах осуществления, настоящее изобретение также предлагает различные мутантные аллели metK, кодирующие аминокислотную замену V185E или делеция основания цитозина в положении 1132 в аллеле metK (c1132del). Такие мутантные аллели metK приводят к частичной потери функции ферментов MetK. Мутантные аллели metK были введены в различные клетки-хозяева Е. coli (66Н8; 60Е4 metA(Y294C), см. выше) с использованием метода аллельного обмена (см. Материалы и Методы ниже) для получения штаммов клетки-хозяина Е. coli 67С2 (66Н8 metK(y185E)) и 67СЗ (66Н8 metK(c1132del)), соответственно. Полученные мутантные клетки-хозяева Е. coli оценивали на ошибки включения норлейцина в ходе полечения рекомбинантного белка, выполняемого без непрерывной подачи метионина. (См. пример 4 ниже.)
Все ссылки на положения аминокислот в MetK сделаны, исходя из S-аденозилметионин синтазы, кодируемой геном metK Е. coli, показаны на Фигурах 8А и 8 В, соответствующие SEQ ID NO: 30 и SEQ ID NO: 32. Ссылки на положения аминокислот были сделаны с первой аминокислоты метионина, считая как положение аминокислоты номер 1. Относительные положения соответствующих участков в ферментах S-аденозилметионин синтазы от других организмов могут быть определены специалистом в данной области техники, например, простым выравниванием последовательности.
Молекулы нуклеиновой кислоты для metA и metK
В качестве примера, настоящее изобретение применяет выделенные молекулы нуклеиновой кислоты, содержащие нуклеиновые последовательности metA и metK, которые отличаются от нуклеиновых последовательностей metA и metK дикого типа. Нуклеиновые последовательности metA и metK, предложенные настоящим изобретением, кодируют различные аминокислотные замены, притом кодированные metA дикого типа (аргинин в положении аминокислоты 27 заменен цистеином (R27C); глутамин в положении аминокислоты 64 заменен глутаминовой кислотой (Q64E); тирозин в положении аминокислоты 294 заменен цистеином (Y294C); изолейцин в положении аминокислоты 296 заменен серином (I296S); пролин в положении аминокислоты 298 заменен лейцином (P298L); и изолейцин в положении аминокислоты 296 заменен серином (I296S) и пролин в положении аминокислоты 298 заменен лейцином (P298L)); и притом кодированные metK дикого типа (валин в положении аминокислоты 185 заменен глутаминовой кислотой (V185E) и нуклеиновые последовательности, включающие делецию основания цитозина в положении 1132 (cde11132del)). Применение любой нуклеиновой последовательности, кодирующей аллель metA или аллель metK который приводит к этим аминокислотным заменам, особым образом предусмотрены настоящим изобретением для применения в способах по настоящему изобретению.
Настоящее изобретение также предусматривает выделенные молекулы нуклеиновой кислоты metA, кодирующие различные измененные ферменты MetA (т.е., кодирующие различные мутантные гомосерин сукцинилтрансфераза ферменты). В некоторых вариантах осуществления, настоящее изобретение обеспечивает выделенную молекулу нуклеиновой кислоты, где молекула нуклеиновой кислоты включает нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25 и SEQ ID NO: 26.
Настоящее изобретение также предусматривает выделенные молекулы нуклеиновой кислоты metK, кодирующие различные измененные ферменты MetK (т.е., кодирующие различные мутантные S-аденозилметионин ферменты). В некоторых вариантах осуществления, настоящее изобретение предлагает выделенную молекулу нуклеиновой кислоты, где молекула нуклеиновой кислоты включает нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28.
Настоящее изобретение также предусматривает, в качестве примера, различные комбинации мутантных аллелей metA и соответствующих выделенных молекул нуклеиновой кислоты, содержащих нуклеиновые последовательности, кодирующие следующие аминокислотные замены в MetA: аргинин в положении аминокислоты 27 заменен на цистеин (R27C); глутамин в положении аминокислоты 64 заменен глутаминовой кислотой (Q64E); тирозин в положении аминокислоты 294 заменен цистеином (Y294C); изолейцин в положении аминокислоты 296 заменен серином (I296S); пролин в положении аминокислоты 298 заменен лейцином (P298L); и изолейцин в положении аминокислоты 296 замене серином (I296S) и пролин в положении аминокислоты 298 заменен лейцином (P298L). В некоторых аспектах изобретения, мутантные аллели metA, предложенные настоящим изобретением, приводят к резистентности по механизму обратной связи (т.е., невосприимчивости по механизму обратной связи) ферментов MetA. Положения аминокислот в отношении аминокислотной последовательности MetA дикого типа как показано на Фигуре 7А и SEQ ID NO: 29.
Настоящее изобретение также обеспечивает, в качестве примера, различные комбинации мутантных аллелей metK и соответствующих выделенных молекул нуклеиновых кислот, содержащих нуклеиновую последовательность, кодирующую следующие аминокислотные замены в MetK: валин в положении аминокислоты 185 замене глутаминовой кислотой (V185E). Настоящее изобретение также обеспечивает нуклеиновые последовательности, содержащие делецию основания цитозина в положении 1132 (c1132del) аллеля metK. В некоторых аспектах, мутантные аллели metK, обеспеченные настоящим изобретением, приводят к частичной потери функции ферментов MetK. Положения аминокислот в отношении к аминокислотным последовательностям MetK дикого типа как показано на Фигуре 8А и SEQ ID NO: 30.
Микроорганизмы для применения в предлагаемых способах
Как описано в настоящем изобретении и в качестве примера, клетки-хозяева Е. coli были созданы для выработки бактериями метионина в степени или объеме, достаточном для предотвращения или снижения ошибки включения норлейцина в ходе получения рекомбинантного белка, в том числе получения рекомбинантного белка, осуществляемого при высокой плотности клеток. Соответственно, в некоторых вариантах осуществления, предлагаемых настоящим изобретением, настоящее изобретение обеспечивает мутантные штаммы микроорганизмов (т.е., мутантные клетки-хозяева микроорганизмов), которые вырабатывают метионин в степени или объеме, достаточном для снижения или предотвращения ошибки включения норлейцина в белки или полипептиды (напр., в степени или объеме, достаточном для снижения или предотвращения ошибки включения норлейцина в рекомбинантные белки или рекомбинантные полипептиды, или в степени или объеме, достаточном для снижения или предотвращения ошибки включения норлейцина в гетерологичные белки или гетерологичные полипептиды).
Исходные клетки-хозяева Е. coli пригодны для применения в способах, предложенных настоящим изобретением, в том числе, например, (но не ограничиваясь ими) Е. coli W3110, Е. coli 294, Е. coli X1776, и т.д. эти примеры клеток-хозяев Е. coli являются иллюстративными, но не ограничивающими. Штамм W3110 Е. coli является общим штаммом-хозяином для продукта ферментации рекомбинантной ДНК. Мутантные клетки-хозяева Е. coli любые из вышеперечисленных штаммов клеток-хозяев Е. coli могут также быть использованы в качестве исходных клеток-хозяев, которые затем дополнительно модифицированы для содержания мутировавших аллелей metA и/или metK, описанных в настоящем изобретении.
Настоящее изобретение показывает, что применение клеток-хозяев Е. coli, включающих различные мутантные аллели и комбинации мутантных аллелей для metA и metK в полученном рекомбинантном белке, было эффективно в предотвращении ошибки включения норлейцина в экспрессируемые рекомбинантные белки. (См. Пример 4 ниже.)
Настоящее изобретение предлагает микроорганизм, где микроорганизм вырабатывает метионин в степени или объеме, достаточном для предотвращения или снижения ошибки включения норлейцина в белки или полипептиды. В некоторых аспектах, настоящее изобретение обеспечивает микроорганизм, где микроорганизм представляет собой микроорганизм, резистентный по механизму обратной связи или нечувствительный по механизму обратной связи к гомосерин сукцинилтрансферазе. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, содержащий мутантный аллель metA. В других вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, содержащий мутантный аллель metA, где мутантный аллель metA кодирует аминокислотную замену R27C в MetA, аминокислотную замену Q64E в MetA, аминокислотную замену Y294C в MetA, аминокислотную замену I296S в MetA, или аминокислотную замену P298L в MetA. В некоторых вариантах осуществления, настоящее изобретение обеспечивает микроорганизм, содержащий мутантный аллель metA, кодирующий более, чем одну аминокислотную замену, описанную выше, в том числе, например, мутантный аллель metA кодирует аминокислотную замену I296S и аминокислотную замену P298L в MetA. В различных аспектах изобретения, микроорганизм, содержащий любую одну или несколько нуклеиновых последовательностей, предложенных настоящим изобретением, представляет собой бактерии; в других аспектах изобретения, микроорганизм представляет собой Е. coli. Настоящее изобретение конкретно относится к применению микроорганизмов, описанных в настоящем изобретении, для получения гетерологичных (напр., рекомбинантных) полипептидов и гетерологичных (напр., рекомбинантных) белков, в которых ошибки включения норлейцина в гетерологичные полипептиды и гетерологичные белки снижены или предотвращены.
Как описано выше, настоящее изобретение предлагает микроорганизмы, содержащие один или несколько мутантных аллелей metA. В некоторых вариантах осуществления изобретения, мутантные аллели metA, кодирующие аминокислотную замену R27C в MetA, кодирующие аминокислотную замену Q64E в MetA, кодирующие аминокислотную замену Y294C в MetA, или кодирующие аминокислотную замену I296S и P298L в MetA, кодируются нуклеиновой последовательностью, включающей SEQ ID NO: 23 (R27C), SEQ ID NO: 26 (Q64E), SEQ ID NO: 24 (Y294C), или SEQ ID NO: 25 (I296S и P298L), соответственно. В других вариантах осуществления, микроорганизмы, предложенные настоящим изобретением, содержат мутантные аллели metA, кодированные нуклеиновой последовательностью, включающей SEQ ID NO: 23 (R27C), SEQ ID NO: 26 (Q64E), SEQ ID NO: 24 (Y294C), или SEQ ID NO: 25 (I296S и P298L). В различных аспектах изобретения, микроорганизм, содержащий любую одну или несколько нуклеиновых последовательностей, предложенных настоящем изобретением, представляет собой бактерии; в других аспектах изобретения, микроорганизм представляет собой Е. coli. Настоящее изобретение конкретно предлагает применение микроорганизмов, описанных в настоящем изобретении, для получения гетерологичных (напр., рекомбинантных) полипептидов polypeptides и гетерологичных (напр., рекомбинантных) белков, в которых ошибки включения норлейцина в гетерологичные полипептиды и гетерологичные белки снижены или предотвращены.
Как указано выше, настоящее изобретение предлагает способы предотвращения или снижения включения норлейцина в белки и полипептиды, экспрессируемые микроорганизмом, где микроорганизм представляет собой микроорганизм, который вырабатывает метионин в степени или объеме, достаточном для предотвращения или снижения ошибки включения норлейцина в белки или полипептиды. В некоторых аспектах, настоящее изобретение предлагает микроорганизм, где микроорганизм представляет собой микроорганизм де-репрессированный для выработки метионина. В некоторых вариантах осуществления, настоящее изобретение предлагает микроорганизм, содержащий мутантный аллель metK. В других вариантах осуществления, настоящее изобретение предлагает микроорганизм, содержащий мутантный аллель metK, где мутантный аллель metK кодирует аминокислотную замену V185E в MetK. В некоторых вариантах осуществления, настоящее изобретение предлагает микроорганизм, содержащий мутантный аллель metK, где мутантный аллель metK включает делецию цитозина нуклеиновой кислоты в остатке нуклеиновой кислоты 1132 аллеля metK. В различных аспектах изобретения, микроорганизм, включающий любую одну или несколько нуклеиновых последовательностей, предложенных настоящим изобретением, представляет собой бактерии; в других аспектах, микроорганизм представляет собой Е. coli. Настоящее изобретение конкретно предлагает применение микроорганизмов, описанных настоящим изобретением, для получения гетерологичных (напр., рекомбинантных) полипептидов и гетерологичных (напр., рекомбинантных) белков, где ошибки включения норлейцина в гетерологичные полипептиды и гетерологичные белки снижены или предотвращены.
Как описано выше, настоящее изобретение предлагает микроорганизмы, содержащие одну или несколько мутантных аллелей metK. В некоторых вариантах осуществления настоящего изобретения, мутантные аллели metK, кодирующие аминокислотную замену V185E в MetK, или включающие делецию цитозина нуклеиновой кислоты в остатке нуклеиновой кислоты 1132 аллеля metK, кодируются нуклеиновой последовательностью, включающей SEQ ID NO: 27 (V185E) или нуклеиновой последовательностью, включающей SEQ ID NO: 28 (c1132del), соответственно. В других вариантах осуществления настоящего изобретение, микроорганизмы, предлагаемые настоящим изобретением, содержат мутантные аллели metK, кодированные нуклеиновой последовательностью, включающей SEQ ID NO: 27 (V185E) или SEQ ID NO: 28 (cl 132del). В различных аспектах изобретения, микроорганизм, содержащий любую одну или несколько нуклеиновых последовательностей, предложенных настоящим изобретением, представляет собой бактерии; в других аспектах, микроорганизм представляет собой Е. coli. Настоящее изобретение конкретно предлагает применение любых микроорганизмов, описанных в настоящем изобретении, для получения гетерологичных (напр., рекомбинантных) полипептидов и гетерологичных (напр., рекомбинантных) белков, где ошибки включения норлейцина в гетерологичные полипептиды и гетерологичные белки снижены или предотвращены.
Применение любой нуклеиновой последовательности, кодирующей аллели metA или metK, которые приводят к аминокислотным заменам, описанных настоящим изобретением, в частности предусмотрены настоящим изобретением для применения в способах по настоящему изобретению.
В других вариантах осуществления, настоящее изобретение предлагает микроорганизм, содержащий мутантный аллель metA и мутантный аллель metK. В некоторых вариантах осуществления изобретения, микроорганизм, предлагаемый настоящим изобретением, представляет собой микроорганизм, содержащий мутантный аллель metA и мутантный аллель metK, где мутантный аллель metA кодирует аминокислотную замену Y294C в MetA и мутантный аллель metK кодирует аминокислотную замену V185E в MetK. В некоторых вариантах осуществления, предложенных настоящим изобретением, микроорганизм представляет собой микроорганизм, содержащий мутантный аллель metA и мутантный аллель metK, где мутантный аллель metA кодирует аминокислотную замену Y294C в MetA и мутантный аллель metK включает делецию цитозина нуклеиновой кислоты в остатке нуклеиновой кислоты 1132 аллеля metK. В различных аспектах изобретения, микроорганизм, содержащий любую одну или несколько нуклеиновых последовательностей, предложенных настоящим изобретением, представляет собой бактерии; в других аспектах изобретения, микроорганизм представляет собой Е. coli. Настоящее изобретение в частности предлагает применение любого микроорганизма, описанного в настоящем изобретении, для получения гетерологичных (напр., рекомбинантных) полипептидов и гетерологичных (напр., рекомбинантных) белков, где ошибки включения норлейцина в гетерологичные полипептиды и гетерологичные белки снижены или предотвращены.
Производство штаммов микроорганизмов
Настоящее изобретение предлагает способы производства микроорганизмов (напр., клеток-хозяев Е. coli), где микроорганизмы вырабатывают метионин в степени или объеме, достаточном для снижения или предотвращения ошибки включения норлейцина в полипептиды и белки. В качестве примера, клетки-хозяева Е. coli, содержащие мутантные аллели metA и/или мутантные аллели metK, были получены с использованием метода аллельного обмена, как известно из уровня техники и как ранее описано. (См. Metcalf et al, (1994) Gene 138:1-7; and Bass et al, (1996) J Bacteriol 178: 1154-61; см. раздел Материалы и Методы настоящего описания). Настоящее изобретение не ограничивается средствами, с помощью которых клетки-хозяева Е. coli, включающие мутантные аллели metA и мутантные аллели metK, были получены. Различные способы для введения мутантных аллелей или иным способом получение штаммов микроорганизмов (напр., бактерий, Е. coli), содержащих мутантные аллели, хорошо известны специалистам в данной области техники.
Предотвращение и снижение ошибки включения норлейцина
Способы и композиции по настоящему изобретению могут применяться для получения гетерологичных или рекомбинантных белков или полипептидов, и могут использоваться как в больших, так и малых масштабах получения белка или полипептида. Способы и композиции по настоящему изобретению в частности пригодны для ферментации в высокой плотности микроорганизмов, таких как, например, клеток-хозяев Е. coli, для получения рекомбинантных белков и полипептидов. Способы и композиции, предложенные настоящим изобретением, пригодны для рекомбинантного производства белков и полипептидов, в частности для рекомбинантного производства белков и полипептидов, в которых ошибки включения норлейцина нежелательны, таких как, например, в рекомбинантных белках и полипептидах для применения в различных исследованиях и терапевтическом применении.
В некоторых вариантах осуществления, настоящее изобретение предлагает способы предотвращения или снижения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм представляет собой микроорганизм, резистентный по механизму обратной связи или нечувствительный по механизму обратной связи к гомосерин сукцинилтрансферазе. В других вариантах осуществления, настоящее изобретение предлагает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм представляет собой микроорганизм де-репрессированным для выработки метионина. В некоторых вариантах осуществления изобретения, микроорганизм представляет собой микроорганизм, резистентный по механизму обратной связи или нечувствительный по механизму обратной связи к гомосерин сукцинилтрансферазе, который содержит мутантный аллель metA. В некоторых вариантах осуществления изобретения, микроорганизм, де-репрессированный для выработки метионина, представляет собой микроорганизм, который содержит мутантный аллель metK. В других вариантах осуществления изобретения, микроорганизм для применения в предотвращении или снижении ошибки включения норлейцина содержит мутантный аллель metA и мутантный аллель metK.
В некоторых вариантах осуществления, настоящее изобретение предлагает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм содержит мутантный аллель metA, где мутантный аллель metA включает нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 26, и SEQ ID NO: 26. В других вариантах осуществления, настоящее изобретение предлагает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм содержит мутантный аллель metA, где мутантный аллель metA включает нуклеиновую последовательность, кодирующую MetA, где нуклеиновая последовательность кодирует аминокислотную замену в MetA, выбранную из группы, состоящей из R27C, Q64E, Y294C, I296S, и P298L. В других вариантах осуществления изобретения, нуклеиновая последовательность кодирует аминокислотные замены в MetA, состоящие из I296S и P298L. Положения аминокислот по отношению к аминокислотной последовательности MetA дикого типа как показано на Фигуре 7А и SEQ ID NO: 29.
В некоторых вариантах осуществления, настоящее изобретение предлагает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм содержит мутантный аллель metK, где мутантный аллель metK включает нуклеиновую последовательность, выбранную из группы, состоящей из SEQ ID NO: 27 и SEQ ID NO: 28. В некоторых вариантах осуществления, настоящее изобретение предлагает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм содержит мутантный аллель metK, где мутантный аллель metK включает нуклеиновую последовательность, кодирующую MetK, где нуклеиновая последовательность кодирует аминокислотную замену V185E в MetK. В других вариантах осуществления изобретения, нуклеиновая последовательность включает делецию основания цитозина в остатке нуклеиновой кислоты 1132 в аллеле metK. Положения аминокислот по отношения к аминокислотной последовательности MetK дикого типа как показано на Фигуре 8А и SEQ ID NO: 30.
В некоторых вариантах осуществления, настоящее изобретение предлагает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм содержит мутантный аллель metA и мутантный аллель metK, и кроме того, где мутантный аллель metA включает нуклеиновую последовательность SEQ ID NO: 24, и мутантный аллель metK включает нуклеиновую последовательность SEQ ID NO: 27. В некоторых вариантах осуществления, настоящее изобретение предлагает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм содержит мутантный аллель metA и мутантный аллель metK, где мутантный аллель metA включает нуклеиновую последовательность SEQ ID NO: 24, и мутантный аллель metK включает нуклеиновую последовательность SEQ ID NO: 28.
В некоторых вариантах осуществления, настоящее изобретение предлагает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм содержит мутантный аллель metA и аллель metK где мутантный аллель metA включает нуклеиновую последовательность, кодирующую аминокислотные замены Y294C в MetA, и мутантный аллель metK включает нуклеиновую последовательность, кодирующую аминокислотные замены V185E в MetK. В некоторых вариантах осуществления, настоящее изобретение предлагает способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид, при этом способ включает экспрессию белка или полипептида в микроорганизме, где микроорганизм содержит мутантный аллель metA и аллель metK, где микроорганизм включает мутантный аллель metA включает нуклеиновую последовательность, кодирующую аминокислотную замену Y294C в MetA, и мутантный аллель metK включает нуклеиновую последовательность, включающую делецию основания цитозина в положении остатка нуклеиновой кислоты 1132 в аллеле metK. Положения аминокислот по отношению в аминокислотной последовательности MetA дикого типа как показано на Фигуре 7А и SEQ ID NO: 29 и по отношению в аминокислотной последовательности MetK дикого типа как показано на Фигуре 8А и SEQ ID NO: 30.
В некоторых аспектах изобретения, способы снижения или предотвращения ошибки включения норлейцина в белок или полипептид с помощью микроорганизма, предложенного настоящим изобретением, при этом микроорганизм представляет собой бактерии, в частности Е. coli. В других аспектах изобретения, белок или полипептид представляет собой гетерологичный белок или гетерологичный полипептид, или рекомбинантный белок или рекомбинантный полипептид. Например, микроорганизм может содержать нуклеиновую кислоту, кодирующую белок или полипептид гетерологичный для микроорганизма; напр., микроорганизм трансформировали нуклеиновой кислотой, кодирующий белок или полипептид, гетерологичный для микроорганизма, которой может быть, например, ДНК (напр., кДНК или геномная ДНК), как с использованием рекомбинантного вектора экспрессии. В других аспектах изобретения, способ дополнительно включает культивирование микроорганизмов при условиях, подходящих для экспрессии белка или полипептида. В некоторых вариантах осуществления изобретения, микроорганизм растет в культуральной среде, где культуральная среда содержит низкую концентрацию метионина. Белок или полипептид может затем быть восстановлен, очищен, и т.д.; восстановление может быть, например, из периплазмы или культуральной среды микроорганизмов. В некоторых аспектах настоящего изобретения, культивирование осуществляют в ферментаторе, таком как, например, культивирование при условиях ферментации высокой плотности клеток.
Гетерологичная нуклеиновая кислота, кодирующая гетерологичный белок или полипептид, подходит для встраивания в воспроизводимый вектор для экспрессии в микроорганизмах при контроле подходящего промотера. Многие векторы являются доступными для этой цели, и выбор соответствующего вектора будет зависеть от, например, размера нуклеиновой кислоты для встраивания в вектор или конкретной летки-хозяина микроорганизма для трансформации вектора. Подходящие векторы хорошо известны специалисту в данной области техники.
Способы и композиции, предложенные настоящим изобретением, являются особенно пригодными для получения рекомбинантных белков и полипептидов, в которых ошибки включения норлейцина нежелательны, такие как, например, в рекомбинантных белках и полипептидах для применения в различных терапевтических, медицинских, научных и диагностических исследованиях. Например, способы и композиции по настоящему изобретению подходят для рекомбинантного производства антител для лечебных целей, таких как, например, поликлональных и моноклональных антител для медицинского и фармацевтического применения. Примеры поликлональных и моноклональных антител для медицинского и фармацевтического применения включают, но не ограничиваются ими, анти-VEGF антитела, антитела против Фактора D, антитела против фактора роста гепатоцитов (напр., анти-МЕТ антитела), и т.д.
Способы и композиции по настоящему изобретению также пригодны для получения фрагментов антител. Примеры фрагментов антител включают, но не ограничиваются ими, Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; молекулы одноцепочечных антител (напр., scFv); и мультиспецифические антитела, образованные из фрагментов антител. Получение рекомбинантных антител, как предлагают способы, композиции и микроорганизмы по настоящему изобретению, может осуществляться путем экспрессии нуклеиновой кислоты, кодирующей тяжелую цепь полипептида антитела, и экспрессии нуклеиновой кислоты, кодирующей легкую цепь полипептида антитела в микроорганизме, как описано выше (напр., бактериальной клетке-хозяине, Е. coli). В некоторых аспектах изобретения, тяжелая цепь антитела и легкая цепь антитела представляют собой полноразмерную тяжелую цепь и легкую цепь полипептидов антитела. В других аспектах изобретения, тяжелая цепь антитела представляет собой тяжелую цепь Fab фрагмента антитела, и легкая цепь антитела представляет собой легкую цепь Fab фрагмента антитела.
Способы и композиции по настоящему изобретению также пригодны для получения мультиспецифичных антител, напр., биспецифических антител. Мультиспецифичные антитела представляют собой антитела, которые обладают специфичностью связывания для, по меньшей мере, двух различных эпитопов. Примерные мультиспецифичные антитела могу связываться с двумя различными эпитопами белка, или могут связывать два различных эпитопа двух различных белков. Биспецифические антитела могут быть получены в виде полноразмерных антител или фрагментов антител (напр., F(ab')2 биспецифические антитела). Методы изготовления мультиспецифических антител включают, но не ограничиваются ими, рекомбинантную ко-экспрессию двух пар тяжелая цепь-легкая цепь иммуноглобулина различной специфичности (см. Milstein and Cuello, Nature 305: 537 (1983); публикацию международной заявки No. WO 93/08829; Traunecker et al., EMBO J. 10: 3655 (1991)); и разработка "выступ-во-впадину" (см., напр., патент США No. 5,731,168).
Кроме того, способы и композиции по настоящему изобретению пригодны для плучения других биомолекул для терапевтических и научных исследований, таких как, например, гормон роста человека (соматотропин), инсулин, и т.д.
ПРИМЕРЫ
Ниже приведены примеры способов и композиций по настоящему изобретению. При этом, различные другие варианты осуществления изобретения могут применяться, с учетом общего описания, приведенного выше.
Материалы и Методы
Штаммы бактерий, плазмиды и условия роста
Штаммы бактерий, используемые в Примерах, описанных в настоящем изобретении, представляют собой производные штамма W3110 Е. coli. (См. Bachmann (1972) Bacteriol Rev 36:525-557). Выбор антибиотика поддерживали для всех маркеров в следующих концентрациях: карбенициллин (плазмидный или хромосомный), 50 мкг/мл; канамицин (хромосомный), 30 мкг/мл; тетрациклин (плазмидный или хромосомный), 10 мкг/мл.
Конструкция штамма и плазмиды
Олигонуклеотиды, используемые для конструкции плазмид и бактериальных штаммов (т.е., Е. coli) перечислены в Таблице 1 ниже. Стандартные методики применялись для клонирования, анализа ДНК, ПЦР-амплификации, трансформации, электропорации, и Р1 трансдукции. Хромосомные аллели были изменены с помощью Р1 трансдукции. Аллель metJ::KanR был получен от бактериального штамма JW3909-1, который получен от The Coli Genetic Stock Center (CGSC, Yale University). Все аллельные замены были подтверждены ПЦР анализом.


Ген metA амплифицировали с помощью ПЦР из бактериального штамма W3110 (Bachmann (1972) Bacteriol Rev 36:525-557) с использованием праймеров SacI-metAflank-F и SalI-metAflank-R, расщепляли с SacI и SalI, и лигировали в SacI и SalI расщепленную плазмиду pS1080 для получения плазмиды pS1080-metAflank. Плазмиды pS1080- metAflank(R27C), pS1080-metAflank(Q64E), pS1080-metAflank(Y294C), и pS1080-metAflank(I296SP298L) были сконструированы путем мутагенеза плазмиды pS1080-metAflank с использованием набора QuikChange kit (Stratagene) и следующими наборами праймеров: (QC-metAR27C-F; QC-metAR27C-R), (QC-metAQ64E-F;QC-metAQ64E-R), (QC-metAY294C-F;QC-metAY294C-R) и (QC-metAI296SP298L-F;QC-metAI296SP298L-R), соответственно.
Ген metK был амплифицирован с помощью ПЦР из бактериального штамма W3110 с использованием праймеров SacI-wefATflank-F и Sall-mefATlank-R, расщепляли с SacI и SalI, и лигировали в SacI и SalI расщепленную плазмиду pS1080 для получения плазмиды р81080-metKflank. Плазмиды pS1080-metKflank(V185E) и pS1080-metKflank(cll32del) были сконструированы путем мутагенеза плазмиды pS1080-metKflank с использование набора QuikChange kit (Stratagene) и следующим набором праймеров: (QC-metKV185E-F;QC-metKV185E-R), и (QC-metKc1l32del-F;QC-metKc1132del-R), соответственно.
Аллельный обмен осуществляли с использование способов, описанных ранее. (См. Metcalf et al., (1994) Gene 138:1-7; и Bass et al., (1996) J Bacteriol 178: 1154-61).
Как указано выше, аллельный обмен выполняли с использованием протокола, описанного Metcalf et al. (выше) с изменениями, внесенными Bass et al. (выше). Коинтеграт переносили в теневой фенотип клеток-хозяев 60Е4 или теневой фенотип клеток-хозяев 66Н8. После негативного отбора сахарозы, проводили скрининг сахароза-резистентных колонии на чувствительность к карбенициллину с помощью реплики полос на планшетах LB агара и LB агара, содержащих карбенициллин. Карбенициллин-чувствительные колонии затем выделяли и аллельный обмен осуществляли с помощью ПЦР-амплификации в целой metA или metK рамке считывания с последующим ДНК секвенированием. Вектор суицидной плазмиды pS1080 содержит условный R6Ky происхождения и карбенициллин резистентный селективный маркер, а также негативно отобранный ген sacB, который придает чувствительность к сахарозе.
Бактериальные штаммы и плазмиды, используемые в экспериментах, описанных в настоящем изобретении, приведены в Таблице 2 ниже.


Ферментация
Штамм-хозяин 60Е4 Е. coli трансформировали с pBR322 на основе экспрессионной плазмиды, содержащей полинуклеиновую кислоту, кодирующую легкую цепь и тяжелую цепь антигенсвязывающего (Fab) фрагмента анти-VEGF антитела (SEQ ID NO: 33 и SEQ ID NO: 34, соответственно). (См. анти-VEGF антитело Y0317 в публикации международной заявки No. WO 1998/45331; публикации международной заявки No. WO2002/40697 (Пример 2, описывающий ферментацию анти-VEGF антитела Y0317); и Chen et al., (1999) J Mol Biol 293:865-881, анти-VEGF антитело Y0317, каждое из которых включено посредством ссылки в полном объеме в настоящее изобретение).
Штамм-хозяин 66F8 Е. coli трансформировали с экспрессионной плазмидой, содержащей полинуклеиновую кислоту, кодирующую легкую цепь и тяжелую цепь антигенсвязывающего (Fab) фрагмента антитела против Фактора D, соответствующую аминокислотной последовательности SEQ ID NO: 48 и SEQ ID NO: 49, соответственно. (См. антитело против Фактора D номер 238-1 в публикации международной заявки No. WO 2009/134711 и антитело против Фактора D номер 111 в публикации международной заявки No. WO 2008/055206, каждая из которых включена посредством ссылки в полном объеме в настоящее изобретение).
Штамм-хозяин 64В4 Е. coli трансформировали с экспрессионной плазмидой, содержащей полинуклеиновую кислоту, кодирующую легкую цепь, тяжелую цепь и фрагмент тяжелой цепи анти-МЕТ антитела, соответствующие аминокислотной последовательности SEQ ID NO: 50, SEQ ID NO: 51, и SEQ ID NO: 52, соответственно.
Экспрессия рекомбинантных тяжелой цепи и легкой цепи полипептидов Fab фрагмента контролировалась промотером phoA с индукцией, происходящей при истощении неорганических фосфатов в среде. (См. Laird et al, (2005) Protein Expr Purif 39:237-246.) Тяжелая цепь и легкая цепь полипептидов Fab фрагмента были направлены на экспорт в периплазму Е. coli с помощью STII-сигнальной последовательности, где продукт был объединенный. Ферментацию при высокой плотности клеток в 10 л рабочего объема (WV) проводили, как описано ранее. (См. Simmons et al, (2002) J Immunol Methods 263:133-147.) при плотности клеток приблизительно 200 OD550, начинают непрерывную подачу 3% метионина или воды и подают оставшийся процесс ферментации.
Три различных процесса ферментации были исследованы с использованием клетки-хозяина 60Е4 (процесс ферментации AF1), клетки-хозяина 66F8 (процесс ферментации AF2), и клетки-хозяина 64В4 (процесс ферментации AF3). (См. Пример 5 и Таблицу 4 ниже).
Очистка
После завершения ферментации, питательную среду цельных клеток охлаждали до <15°С в ферментере и охлажденную питательную среду обрабатывали для очистки белков. Один объем охлажденной питательной среды смешивали с 0.06 объемов MgSO4 (конечной концентрации 60 мМ) и титровали до рН 3.8 с лимонной кислотой (1 М). Клетки затем разрушали с использованием микрофлюидайзера при приблизительно 12,000 psi (Microfluidics, Redwood Shores, CA) и разрушенные клетки инкубировали при 35°С в течение 3 часов с непрерывным встряхиванием. Гомогенат разбавляли в 3 раза с холодной дистиллированной водой и разбавленный гомогенат центрифугировали при 6,000×g с использованием углового ротора при 4°С в течение 20 минут. Супернатант фильтровали с использованием 0.22 мкм фильтров и титровали до рН 7.5 с 1.5 М Трис-основанием.
Рекомбинантный Fab белок очищали с использованием аффинной хроматографией на белке G как указано ниже. Колонки для хроматографии Poly-prep (Bio Rad) заполняли с Protein G Sepharose 4 Fast Flow resin (GE Healthcare) и уравновешивали с, по меньшей мере, 5 объемами колонки PBS, рН 7.2. Фильтрованный супернатант загружали в колонку, заполненную Белком G, дважды промывали с PBS, и элюировали с 50 мМ лимонной кислоты. Конечный пул Fab белка титровали до рН 7 с 1.5 М Трис-основанием и анализировали на содержание норлейцина, как описано ниже. Это соответствует очистки для процесса ферментации AF1.
Были использованы три различных процесса очистки продукта рекомбинантных белков, каждый конкретно для процесса ферментации AF1 (для клетки-хозяина 60Е4), AF2 (для клетки-хозяина 66F8), или AF3 (для клетки-хозяина 64 В4). (См. Пример 7 и Таблицу 6 ниже).
Аминокислотный анализ
Для определения внутриклеточного уровня метионина, образцы питательной среды цельных, содержащих 87.6×109 клеток, осаждали центрифугированием при 17,000xg в течение 5 минут при 4°С, один раз промывали в PBS, и затем ресуспендировали в буфере для экстракции (10 мМ Трис, 5 мМ EDTA, 5 мМ иодоацетамида (IAM), 0.2 мг/мл лизоцима, рН 6.8). клетки затем лизировали двумя циклами разрушения ультразвуком, и затем центрифугировали в течение 20 минут при 13,500 rpm для удаления клеточного дебриса. Супернатанты переносили в 0.2 мкм фильтры микроцентрифужных пробирок (Bio Rad) и центрифугировали при 17,000×g в течение 5 минут при 4°С. Фильтрат удаляли и аминокислоты анализировали, как описано ранее (Feeney et al., (2013) Biotechnology and Bioengineering, 110:1087-1097). Для определения уровня внеклеточного метионина, образцы супернатанта приготавливали из питательной среды цельных клеток, собранной в процессе ферментации, после центрифугирования в течение 3 минут при 14,000×rpm разбавляли и аминокислоты анализировали, как описано ниже. (См. Feeney et al., (2013) Biotechnology and Bioengineering, 110:1087-1097.)
Концентрации аминокислот анализировали с использованием метода обратно-фазовой ВЭЖХ. Образцы, содержащие аминокислоты, обрабатывали с 6-аминохинолил-N-гидроксисукцинимидильным карбаматом для получения сильнофлюоресцирующих производных. (См. Cohen and Michaud (1993) Anal Biochem 211:279-287.) ВЭЖХ анализ применяли для определения следующих аминокислот с пределом обнаружения 0.01 мМ: гистидин, аспарагин, серии, глутамин, аргинин, глицин, аспартат, глутамат, треонин, аланин, пролин, орнитин, цистеин, лизин, тирозин, метионин, валин, изолейцин, лейцин, фенилаланин и триптофан.
Уровни фосфатов
Уровни фосфатов измеряли с использованием COBAS Integra 400 (Roche Diagnostics) согласно способам, опубликованных ранее. (См. Taussky and Shorr (1953) J Biol Chem 202:675-685.)
Измерения титра
Образцы питательной среды цельных клеток разбавляли 6 раз с буфером для экстракции (10 мМ Трис, 5 мМ EDTA, 5 мМ IAM, 0.2 мг/мл лизоцима, рН 6.8) и инкубировали в течение 10 минут на льду. После двух циклов разрушения ультразвуком, образцы центрифугировали при 17,000×g в течение 20 минут при 4°С. Титр продукта определяли из супернатантов с использованием ВЭЖХ.
Интегральные измерения OD550
Интегральный OD550 определяли с использованием вычисления интеграла по формуле трапеции с применением следующей формулы:
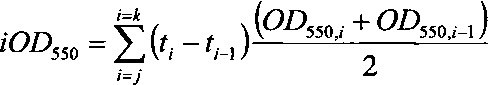
где,
j = индекс первого измерения, выполненного при или после 24 часов культивирования; k = общее количество выполненных OD550 измерений; ti = прошедшее время культивирования в часах при измерении i; OD550,i=OD550 при измерении i.
Анализ норлейцина
Для анализа содержания норлейцина, очищенные образцы рекомбинантных белков подвергали расщеплению трипсином на основе способа, описанного ранее. (См. Yu et al, (2009) Anal Chem 81:9282-9290). Анализ пептидной карты выполняли с использованием обратно-фазовой ВЭЖХ и в рабочем режиме жидкостной хроматографии тандемной масс-спектрометрии (LC/MS), как описано ранее. (См. Yu et al, (2009) Anal Chem 81:9282-9290; and Yu et al, (2011) Anal Chem 83:5912-5919). Измерение массы с высокой разрешающей способностью выполняли с прибором LTQ-Orbitrap XL (Thermo Scientific, San Jose, US) с использованием полного-MS исследования сканированием с разрешением, установленным на 60,000 при m/z 400, с последующей ионной ловушкой MS2, сканирующей ионы, представляющие интерес.Для определения относительного уровня норлейцина в полипептидах, извлеченные ионные хроматограммы были получены как для метионин-содержащих, так и для норлейцин-содержащих пептидов с использованием преобладающего заряженного состояния с окном для выгрузки моноизотромного m/z±10 ppm. Относительное количество норлейцин-содержащих видов по сравнению с метионин-содержащими видами рассчитывали с использованием соответствующих интегральных площадей пика.
Вестерн-блоттинг
Образцы питательной среды цельных клеток, полученные в процессе ферментации, разбавляли 6 раз с буфером для экстракции (10 мМ Трис, 5 мМ EDTA, 5 мМ IAM, 0.2 мг/мл лизицома, рН 6.8) и инкубировали в течение 10 минут на льду. После двух циклов разрушения ультразвуком, образцы центрифугировали при 17,000xg в течение 25 минут при 4°С. Образцы загружали на 4-12% Трис-Глицерин гели при невосстанавливающихся условиях. Белки переносили на нитроцеллюлозные мембраны с использованием системы iBlot Blotting System (Invitrogen). Мембраны блокировали с 0.5% Желатином в буфере NET (150 мМ NaCl, 5 мМ EDTA, 50 мМ Трис, 0.05% ТритонХ-100) в течение 30 минут, с последующей инкубацией в 1:300,000 разбавленной фракцией козьих IgG конъюгированных с пероксидазой к человеческим Fab IgG (MP Biomedical) в блокирующем буфере. После промывания 3 раза с буфером NET, блоты визуализировались на рентгеновской пленке с использованием Western Lightning ECL Substrate (PerkinElmer) после 5 секунд рентгеноэкспонирования.
Пример 1. Ошибки включения норлейцина в процессе ферментации Е. coli
Как описано выше, ошибки включения норлейцина часто происходят в процессе получения рекомбинантного белка в Е. coli. Степень ошибки включения норлейцина в процессе получения рекомбинантного белка зависит от многих факторов, таких как, например, природа рекомбинантного белка, использованием процесса ферментации, и состав ферментативной среды. (См., напр., Bogosian et al, (1989) Biol Chem 264:531-539).
Для изучения ошибки включения норлейцина в рекомбинантный белок, экспрессируемый в процессе ферментации, выполняли следующее исследование. Штамм-хозяин 60Е4 Е. coli преобразовывали с плазмидой, содержащей нуклеиновую последовательность, кодирующую легкую цепь и тяжелую цепь Fab фрагмента антитела (SEQ ID NO: 31 и SEQ ID NO: 32, соответственно) и использовали в последующих исследованиях ферментации с использованием подачи воды или подачи метионина, согласно способам, описанным ранее. Экспрессированные рекомбинантные белки затем анализировали на содержание норлейцина с использованием способов, описанных выше.
Как показано в Таблице 3 ниже, приблизительно 5-10% ошибки включения норлейцина наблюдали в каждом из рекомбинантных полипептидов, экспрессированных в клетке-хозяине 60Е4 Е. coli при отсутствии непрерывной подачи метионина (т.е., подавали воду). Как и ожидалось, при наличии непрерывной подачи метионина, норлейцин был не обнаружен (ND) в любом экспрессируемом рекомбинантном полипептиде.


Эти результаты подтверждают, что ошибки включения норлейцина происходят в рекомбинантном белке, полученном в бактериях при отсутствии подачи метионина.
Пример 2. Конструкция биосинтетического пути метаболизма метионина мутантных клеток-хозяев Е. coli
Как указано выше, непрерывная подача метионина в процессе ферментации рекомбинантного белка часто используется для предотвращения ошибки включения норлейцина. Как показано выше в Примере 1, постоянная подача метионина предусматривает, что достаточно метионина было доступно для клетки-хозяина, таким образом, снижая или предотвращая ошибки включения норлейцина в процессе получения рекомбинантного белка. Для изучения влияния с использованием клетки-хозяина Е. coli, содержащей мутантные аллели metA и/или metK, на ошибки включения норлейцина, вместо использования постоянной подачи метионина, были проведены следующие исследования.
В настоящем исследовании аллели metA, содержащие мутации R27C, Q64E, Y294C, I296S, и P298L, которые приводят к резистентности по механизму обратной связи MetA, вводили в клетки-хозяева 60Е4 с использованием метода аллельного обмена (см. Материалы и Методы выше) для получения бактериальной клетки-хозяина штаммов 66Н6 (60Е4 metA(R27C)), 66Н8 (60Е4 metA(Y294C)), 67 В8 (60Е4 metA(Q64E)), и 67 В9 (60Е4 metA(I296S P298L)), соответственно. (См. Таблицы 2 и 3 выше).
Аллели metK, содержащие мутации V185E и c1132del (делецию основания цитозина в положении 1132 в гене metK), которые приводят к частичной потере функции MetK ферментов, вводили в клетки-хозяева 66Н8 (60Е4 metA(y294C)) с использованием метода аллельного обмена (см. Материалы и Методы выше) для получения бактериальной клетки-хозяина штаммов 67С2 (66Н8 metK(V185E)) и 67С3 (66Н8 metK(c1132del)), соответственно. (См. Таблицы 2 и 3 выше).
Эти клетки-хозяева Е. coli оценивали на ошибки включения норлейцина в процессе получения рекомбинантного белка в ферментативном процессе, осуществляемом без непрерывной подачи метионина. (См. Пример 3 ниже).
Пример 3. Результаты ферментации
Ферментации в небольших масштабах (10 л) без непрерывной подачи метионина выполняли с использованием мутантных бактериальных штаммов с биосинтетическим путем метаболизма метионина, сконструированных в этом исследовании. (См. Таблицу 1). Подача метионина была либо заменена подачей воды или без подачи была использована в ходе процесса ферментации в этих экспериментах. Три ферментации 10 л выполняли с использованием контрольной клетки-хозяина штамма 60Е4 следующим образом: 1) непрерывной подачи метионина, 2) непрерывной подачи воды, и 3) без подачи.
Тенденция ферментации для роста клеток, как контролируется OD550, показана на Фигуре 12А. Независимо от характера подачи (метионина, воды или без подачи), рост мутантных бактериальных клеток-хозяев 60Е4 с биосинтетическим путем метаболизма метионина metA(R27C), 60Е4 metA(Y294C), 60Е4 metA(Y294C) metK(V185E), и 60E4 metA(Y29AC) metK(c1132del) был сопоставим с тем, который наблюдали в контрольной клетке-хозяине в ходе фазы роста ферментации (5-28 часов). Однако, двойные мутантные клетки-хозяева 60Е4 metA(Y294C) metK(V185E), и 60Е4 met(Y294C) metK(c1132del) имели более низкий iOD550 (площадь под кривой роста от 24 часов и до конца ферментации) по сравнению с тем, что наблюдали при ферментации контрольной клетки-хозяине. (См. Фигуру 12В.) Ферментация, осуществляемая с подачей воды с использованием клеток-хозяев 60Е4 и 60Е4 metA(Y29AC), имела несколько больше iOD550 по сравнению с тем, что наблюдали при ферментации контрольных клеток-хозяев, осуществляемой с подачей метионина, и ферментации клеток-хозяев 60Е4 metA(Y294C), осуществляемой без подачи, соответственно. Мутантные клетки 60Е4 ΔmetJ::kanR и 60Е4 metA(Y296S P298L) имели более длинную фазу адаптации и как результат имели более низкую iOD550 по сравнению с наблюдаемой при ферментации в контрольных клетках-хозяевах. (См. Фигуры 12А и 12В). Мутантные клетки-хозяева 60Е4 metA(Q64E) плохо росли в ферментаторе, достигали максимум OD550 150, которая приблизительно 30-40% ниже по сравнению с максимальным OD550, полученным при ферментации с использованием других мутантных клеток-хозяев. (См. Фигуру 12А). После 20 часов, рост мутантных клеток-хозяев 60Е4 metA(Q64E) достигает насыщения и как результат, ферментация с использованием этих мутантных клеток-хозяев имеет более низкое iOD550. (См. Фигуры 12А и 12В.)
Наличие или отсутствие подачи метионина в процессе ферментации не влияло на рост клеток-хозяев 60Е4. (См. Фигуру 12С).
Ферментация с использованием мутантов с биосинтетическим путем метаболизма метионина накапливала высокие уровни метионина как in vivo (т.е., внутриклеточно) так и во внеклеточной среде по сравнению с тем, что наблюдали при ферментации контрольных клеткок-хозяев. (См. Фигуры 13А, 13В, 14А, и 14В). В начале ферментационного процесса имеется избыток метионина (>3 мМ) в ферментативной среде. Как клетки начинали расти, они поглощали метионин для синтеза белка, роли донора метальной группы и других функций. В результате, концентрация внеклеточного метионина постепенно снижается как клетки продолжали расти и внеклеточный уровень метионина достигал менее заметных уровней (<10 мкМ) в приблизительно 16 часов. (См. Фигуры 13А и 14А).
Через 16 часов внутриклеточные концентрации метионина варьировали от 0.5-2.5 мМ (концентрация с учетом клеточного объема) среди различных хозяев. (См. Фигуры 13В и 14В). При таких высоких внутриклеточных концентрациях метионина, MetA дикого типа будет сильно ингибирован; однако, резистентность по механизму обратной связи MetA мутантов может только быть слабо ингибирована и, следовательно, позволяла мутантным клеткам-хозяевам вырабатывать метионин посредством биосинтетического пути метаболизма метионина. (См. Usuda and Kurahashi (2005) Appl Environ Microbiol 71:3228-3234). Кроме того, внутриклеточные уровни метионина продолжали снижаться приблизительно до 28 часов, в результате чего рост клеток был существенно замедлен. Не исключено, что ферментация в процессе фазы роста бактерий (5-28 часов), скорость при которой метионин использовался для синтеза белка и других клеточных функций, могла превышать скорость, с которой метионин синтезировали in vivo. Это может объяснять постепенное уменьшение внутриклеточных уровней метионина по окончанию фазы роста.
В ходе фазы образования продукта ферментации рекомбинантного белка (28 часов до окончания ферментации), сверхпроизводство метионина клетками-хозяевами продолжалось синтезом метионина in vivo и внутриклеточные уровни метионина продолжали увеличиваться в ходе этой фазы ферментативного процесса. (См. Фигуры 13В и 14В). Эти результаты показали, что в ходе фазы образования продукта ферментации рекомбинантного белка, скорость биосинтеза метионина превышала скорость, с которой метионин был использован для различных внутриклеточных функций.
В ходе ферментации контрольной клетки-хозяина, осуществляемой с непрерывной подачей воды, внеклеточные и внутриклеточные уровни метионина продолжали снижаться, достигая уровней ниже предела обнаружения при анализе (10 мкМ) за приблизительно 16 часов для внеклеточного метионина и за приблизительно 24 часа для внутриклеточного метионина. Для ферментации контрольного хозяина, осуществляемой с непрерывной подачей метионина, подача гарантировала избыточный метионин в клетке после приблизительно 26 часов, момент времени, в который подача началась. В ходе фазы образования продукта ферментации, двойные мутантные клетки-хозяева 60Е4 metA(Y294C) metK(V185E) накапливали больше внутриклеточного метионина по сравнению с тем, что наблюдали при ферментации контрольной клетки-хозяина, осуществляемой с непрерывной подачей метионина.
Длительная фаза адаптации клеток-хозяев 60Е4 metA(I296S P298L) и 60Е4 ΔmetJ::kanR и слабый рост клеток-хозяев 60Е4 metA(Q64E) по сравнению с наблюдаемым в контрольных клетках-хозяевах потенциально мог быть следствием накопления высокого уровня гомоцистеина, токсичного промежуточного продукта в биосинтетическом пути метаболизма метионина. (См. Roe et al, (2002) Microbiology 148:2215-2222; См. Фигуру 12А). Было показано ранее, что гомоцистеин ингибирует фермент, вовлеченный в первую стадию биосинтетическом пути метаболизма изолейцина, треониндезаминазы, вызывая ингибирование роста. (См. Tuite et al, (2005) J Bacteriol 187:4362-4371). Это исследовали с помощью измерения внутриклеточных уровней изолейцина в мутантных клетках-хозяевах. Анализ показал, что внутриклеточные уровни изолейцина были сопоставимы с наблюдаемыми в ходе ферментации в контрольных клетках-хозяевах (данные не показаны). Вероятность влияния гомоцистеина, имеющего другие токсические влияния, на рост клеток не может быть полностью исключена. В это время, однако, эти различия в росте среди мутантов не полностью изучены.
Динамика для титров продуцируемого белка и данных вестерн-блоттинга показана на Фигурах 16А, 16В, и 17. Инокулированная ферментация от клеток-хозяев 60Е4 metA(Q64E) продуцировали меньше продукта, чем наблюдалось в других клетках-хозяевах. За исключением короткого периода между 45-50 часами, уровни фосфатов не истощались в ходе ферментации клеток 60Е4 metA(Q64E) (Фигура 15); таким образом, синтез рекомбинантного был низким. Удлиненная фаза адаптации мутантных клеток-хозяев 60Е4 metA(l296S P298L) и 60Е4 ΔmetJ::kanR приводила к истощению фосфатов после 40 часов, что составляет приблизительно 12 часов дольше, чем обычно наблюдали; следовательно, ферментации с использованием этих клеток-хозяев имела низкие титры продукта белка по сравнению с наблюдаемыми в других мутантных клетках-хозяевах, что истощило фосфаты ранее. (См. Фигуры 12А, 15 и 16А). Ферментации с использованием клеток-хозяев 60Е4 metA(K27C) и 60Е4 metA(Y294C) продуцировали наибольшие титры продукта белка среди всех исследованных мутантных клеток-хозяев.
Ферментациями с применением двойных мутантных клеток-хозяев metA metK, 60Е4 metA(Y294C) metK(W185E) и 60E4 metA(Y294C) metK(c1132del) получали немного ниже титры продукта белка, несмотря на то, что обладали сопоставимым ростом с контрольными клетками-хозяевами. Эти двойные мутантные клетки-хозяева имели мутацию в гене metK, которая приводит к частичной потери функции MetK. Продуктом MetK является s-аденозилметионин (SAM), донор метальной группы для многих реакций в бактериальных клетках. Не известно, однако, почему снижение уровней SAM влияло на титры продукта белка. Непрерывная подача в ходе процесса ферментации могла приводить к разбавлению культуральной среды, что могло бы привести к низкой плотности клеток и возможным низким титрам продукта. Рост и титры ферментации клеток-хозяев 60Е4 metA(Y294C) без любой подачи было сопоставимо с наблюдаемым при ферментации с использованием тех же клеток-хозяев с непрерывной подачей воды.
Пример 4. Ошибки включения норлейцина
Как описано выше, ошибки включения норлейцина в белки в связи с уровнями метионина в клетках достаточно низкие, что норлейцин может конкурировать за остатки метионина в нагрузки метиониловой тРНК в процессе синтеза белка. Как показано в Примере 1 выше, ферментация контрольных клеток-хозяев осуществлялась без подачи метионина, что привело к высокому уровню ошибки включения норлейцина в рекомбинантный белок (Таблица 3). Низкие уровни внутриклеточного метионина в процессе фазы образования продукта при ферментации контрольных клеток-хозяев, осуществляемой без подачи метионина, указывала на то, что остатки норлейцина могут конкурировать за остатки метионина в рекомбинантном белке. Однако, высокие уровни внеклеточного и внутриклеточного метионина наблюдали в процессе фазы образования продукта при ферментации мутантных клеток-хозяев. (См. Фигуры 13В и 14В). В результате повышенных внутриклеточных уровней метионина, ошибки включения норлейцина, как ожидалось, будут минимальными или исключены при использовании ферментации таких клеток-хозяев.
Расщепление трипсином рекомбинантного белка дало 2 пептида, содержащих метионин: пептид 1: LSCAASGYDFTHYGM34NWVR (SEQ ID NO: 35); и пептид 2: STAYLQM83NSLR (SEQ ID NO: 36). Анализ пептидной карты указывает на то, что пулы рекомбинантного белка, очищенного от ферментаций мутантных клеток-хозяев, содержали меньше, чем обнаруживаемые уровни ошибки включения норлейцина, при том, что ферментация контрольных клеток-хозяев, осуществляемая без подачи метионина, накапливала высокие уровни ошибки включения норлейцина в обоих пептидах, содержащих метионин. (См. Таблицу 3). Эти результаты показывают, что использование штаммов клеток-хозяев Е. coli по настоящему изобретению, приводило к снижению или предотвращению включения норлейцина в гетерологичные (напр., рекомбинантные) полипептиды.
Пример 5. Дополнительные бактериальные клетки-хозяева
Кроме того, эксперименты проводили с использованием клеток-хозяев 60Е4 или клеток-хозяев, полученных из 60Е4, двое других бактериальных клеток-хозяев были разработаны и изучены на рост, ошибки включения норлейцина и получение рекомбинантных белков, следующим образом.
Бактериальные клетки-хозяева 66F8 и 64В4 (а также бактериальные клетки-хозяева 60Е4) описаны выше в Таблице 2. Как показано в Таблице 2, существуют некоторые отличия в генотипе клеток-хозяев 60Е4 по сравнению с клетками-хозяевами 66F8 и 64В4 (которые разделяют похожий генотип).
Три различных процесса ферментации изучали с применением клеток-хозяев 60Е4 (процесс ферментации AF1), клеток-хозяев 66F8 (процесс ферментации AF2), и клеток-хозяев 64В4 (процесс ферментации AF3). Таблица 4 ниже показывает отличия в различных параметрах ферментации (рН, перемешивание, продолжительность культивирования и время начала подачи) каждого из изучаемых процессов ферментации (AF1, AF2, и AF3).


Аллель metA(Y294C) вводили в клетки-хозяева 66F8 и 64В4 с использованием способов, как описано выше в Примере 1 для клеток-хозяев 60Е4. Ферментации осуществляли с использованием 66F8 metA(Y294C) и 64В4 metA(Y294C), используя процесс ферментации AF2 и AF3, соответственно, показанный рост клеток-хозяев сопоставим с наблюдаемым у родительских клеток-хозяев. (См. Фигуры 19А и 19В; и Таблицу 5 ниже).
Пример 6. Сравнение темпа роста клеток-хозяев Е. coli и выхода продукта рекомбинантного белка
Темпы роста и выход продукта рекомбинантного белка были исследованы в клетках-хозяевах Е. coli каждого штамма 60Е4 metA(Y294C), 66F8 metA(Y294C), и 64 В4 metA(Y294C) с использованием процесса ферментации AF1, AF2, AF3, соответственно. Ферментации 10 л осуществляли, как описано выше в Примере 3 для клеток-хозяев штамма 60Е4, с использованием модификации процесса ферментации, как указано выше в Таблице 4 для каждого процесса ферментации.
Темпы роста и выход продукта рекомбинантного белка, наблюдаемые для различных клеток-хозяев штамма 60Е4, подробно рассмотрены выше в Примере 3.
Как показано на Фигурах 20А, 20В, и 20С, выход продукта рекомбинантного белка, наблюдаемый с использованием штаммов-хозяев 60Е4 metA(Y294C), 66F8 metA(Y294C), и 64 В4 metA(Y294C), был сопоставим с наблюдаемым при использовании штаммов-хозяев 60Е4, 66F8, и 64В4. (См. также Таблицу 5 ниже). Наличие или отсутствие подачи метионина не влияло на выход рекомбинантного белка от ферментации клеток-хозяев 60Е4.
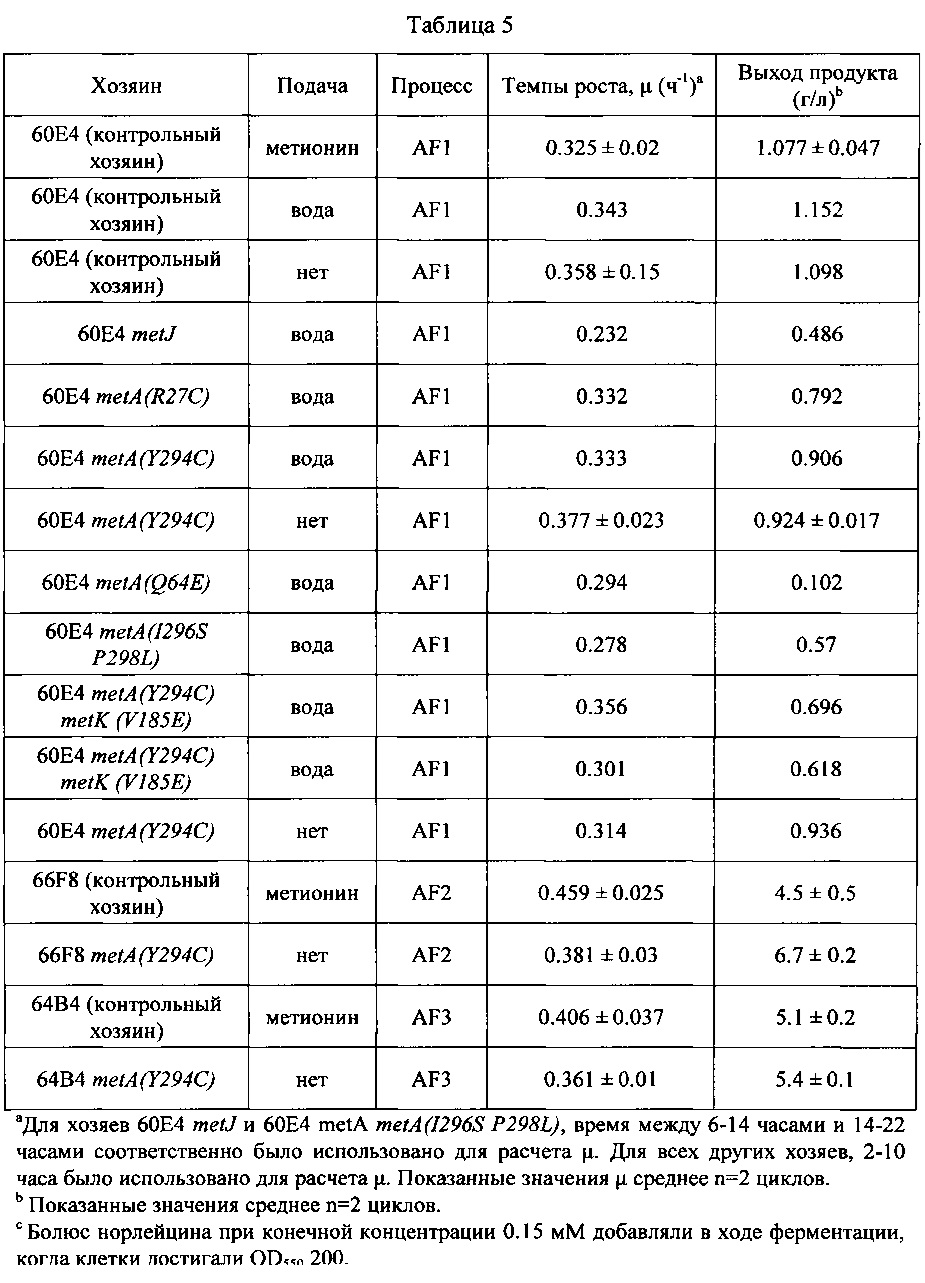
Пример 7. Сравнение ошибки включения норлейцина
Использовали три различных процесса очистки продукта рекомбинантного белка, каждый конкретно для процесса ферментации AF1 (для клеток-хозяев 60Е4), AF2 (для клеток-хозяев 66F8), и AF3 (для клеток-хозяев 64В4). Таблица 6 ниже показывает отличия различных процессов очистки, используемых для каждого исследуемого процесса ферментации (т.е., AF1, AF2, и AF3).

Определение количества норлейцина осуществляли с использованием анализа LC-MS на триптических пептидах для каждого из продуктов рекомбинантного белка, как описано выше.
Расщеплением рекомбинантного белка трипсином, полученного с помощью хозяев 60Е4, получали 2 пептида, содержащих метионин (Таблица 7). Расщеплением рекомбинантного белка трипсином, полученного с помощью хозяев 66F8, получали 3 пептида, содержащих метионин (Таблица 8). Расщеплением рекомбинантного белка трипсином, полученного с помощью хозяев 64В4, получали 6 пептидов, содержащих метионин (Таблица 9).



Рекомбинантный белок, очищенный от процесса ферментации AF1, осуществляемого без подачи метионина, с использованием хозяев 60Е4, накапливал 5.1% и 10% норлейцина на двух остатках метионина в белке (Таблица 7). Норлейцин не был обнаружен в рекомбинантном белке, очищенном от процесса ферментации AF1 осуществляемого без подачи метионина, с использованием хозяев 60Е4 metA(Y294C) (Таблица 7), 60Е4 metA(R27C), 60Е4 metA(Y294C) metK(V185E), и 60Е4 metA(Y294C) metK(c1132del) (данные не показаны).
При ферментации хозяев 60Е4 metA(Y294C) с добавлением норлейцина (0.15 мМ конечной концентрации) в ферментативную среду, норлейцин не обнаруживали в рекомбинантном белке, что указывает на то, что бактериальные клетки-хозяева по настоящему изобретению вырабатывали достаточно норлейцина в клетке для предотвращения ошибки включения норлейцина в ходе синтеза рекомбинантного белка.
Приблизительно 2.7%, 0.7%, и 1% ошибки включения норлейцина наблюдали в трех триптических пептидах, содержащих метионин, полученных от рекомбинантного белка, полученного с использованием процесса ферментации AF2, осуществляемого без подачи метионина, с использованием хозяев 66F8. (См. Таблицу 8). Подобным образом имелись приблизительно 1.3%, 1.3%, 2.4%, 2.2%, 1.5%, и 1.3% ошибки включения норлейцина в шести триптических пептидах, содержащих метионин, полученных от рекомбинантного белка, выработанного с использованием процесса AF3, осуществляемого без подачи метионина, с использованием хозяев 64В4. (См. Таблицу 9). Кроме того, норлейцин не обнаружили в рекомбинантных белках, очищенных от процессов ферментации AF2 и AF3 с использованием хозяев 66F8 metA(Y294C) и 64 В4 metA(Y294C), соответственно. (См. Таблицы 8 и 9 выше.)
Анализ триптической пептидной карты указывает, что пулы рекомбинантного белка, очищенные от ферментаций мутантных клеток-хозяев, содержали менее, чем обнаруживаемые уровни ошибки включения норлейцина, в то время как ферментация контрольных клеток-хозяев, осуществляемая без подачи метионина, накопили высокие уровни норлейцина в пептидах, содержащих метионин. Эти результаты показывают, что применение штаммов клеток-хозяев Е. coli по настоящему изобретению приводит к снижению или предотвращению включения норлейцина в гетерологичные (напр., рекомбинантных) полипептидов.
Хотя вышеизложенное изобретение описано довольно подробно для наглядности и пример для ясности понимания, описания и примеры не должны быть истолкованы как ограничивающие объем изобретения. Раскрытие всей патентной и научной литературы, приведенной в настоящем описании, специально включены в настоящее изобретение в полном объеме посредством ссылки.
Реферат
Изобретение относится к биотехнологии. Предложены клетка-хозяин E.coli для получения анти-VEGF антитела или антигенсвязывающего фрагмента анти-VEGF, свободных от ошибки включения норлейцина, клетка-хозяин E.coli для получения антитела против фактора D или антигенсвязывающего фрагмента против фактора D, свободных от ошибки включения норлейцина, и Клетка-хозяин E.coli для получения анти-МЕТ антитела или антигенсвязывающего фрагмента анти-МЕТ, свободных от ошибки включения норлейцина. При этом клетка-хозяин содержит мутантный аллель metA, включающий последовательность нуклеиновой кислоты, кодирующую аминокислотную замену в MetA, выбранную из группы, состоящей из замены аргинина на цистеин в положении аминокислоты 27, замены глутамина на глутаминовую кислоту в положении аминокислоты 64, замены тирозина на цистеин в положении аминокислоты 294, замены изолейцина на серин в положении аминокислоты 296, замены пролина на лейцин в положении аминокислоты 298, замены изолейцина на серин в положении аминокислоты 296 и замены пролина на лейцин в положении аминокислоты 298. Также клетка-хозяин дополнительно содержит нуклеиновую кислоту, кодирующую целевой белок. Предложен также способ получения анти-VEGF антитела или антигенсвязывающего фрагмента анти-VEGF, свободных от ошибки включения норлейцина, способ получения антитела против Фактора D или антигенсвязывающего фрагмента против Фактора D, свободных от ошибки включения норлейцина, и способ получения анти-МЕТ антитела или антигенсвязывающего фрагмента анти-МЕТ, свободных от ошибки включения норлейцина, использующие соответствующие вышеуказанные клетки-хозяева. Изобретение эффективно в предотвращении включения норлейцина в белки в ходе получения рекомбинантного белка в бактериях. 6 н. и 10 з.п. ф-лы, 23 ил., 9 табл., 7 пр.

Комментарии