Получение белков в культуральных средах без глутамина - RU2639288C2
Код документа: RU2639288C2
Чертежи


















Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится главным образом к культуральным средам без глутамина. Изобретение дополнительно рассматривает получение рекомбинантных белков, таких как антитела, в клеточной культуре млекопитающих без глутамина.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Клетки млекопитающих стали доминирующими системами для получения белков млекопитающих для применения в медицинской практике главным образом из-за их способности продуцировать правильно уложенные и собранные гетерологичные белки и наличия у них возможности для посттрансляционных модификаций. Общепринятым является наличие глутамина в средах культивирования клеток во время рекомбинантного получения гетерологичных белков, включая антитела. L-глутамин является незаменимой аминокислотой, которая является основным источником энергии и азота для клеток в культуре. Наиболее коммерчески доступные среды составлены с использованием свободного L-глутамина, который либо включают в основную смесь, либо добавляют к композициям жидких сред в момент использования. Таким образом, все питательные среды для выращивания клеток млекопитающих содержат глутамин за исключением таковых для трансфицированных глутаминсинтетазой клеточных линий, таких как клеточные линии GS NS0 и GS CHO, где в самих клетках продуцируется глутамин, необходимый для роста. Глутамин широко используется в различных концентрациях обычно в диапазоне от 1 до 20 мМ в основных средах и в более высоких концентрациях в кормовых добавках для подпитки. Например, концентрация L-глутамина равна 0,5 мМ в питательной среде Ames и 10 мМ в питательной среде MCDP 131. Питательная смесь DMEM/Ham’s F-12 (50:50) обычно используется в качестве исходной композиции для индивидуально изготовляемых питательных сред, используемых с клетками яичника китайского хомячка (CHO). Концентрация L-глутамина в питательной смеси DMEM/Ham’s F-12 равна 2,5 мМ. Концентрация L-глутамина в бессывороточной/безбелковой среде для выращивания клеток гибридомы равна 2,7 мМ. Концентрация L-глутамина в питательных средах DMEM, GMEM, IMDM и H-Y равна 4 мМ, из которых IMDM обычно используется в качестве исходной композиции для индивидуально изготовляемых питательных сред для выращивания клеток гибридомы. Как правило, считается, что клетки гибридомы растут лучше в концентрациях L-глутамина, превышающих средние уровни, создаваемые в питательных средах. (Dennis R. Conrad, Glutamine in Cell Culture, Sigma-Aldrich Media Expert)
Было показано, что глутамин является главным источником аммиака, накапливаемого в клеточной культуре (см. обзор Markus Schneider, et al. 1996, Journal of Biotechnology 46:161-185). Таким образом, уменьшение концентрации глутамина в культуральных средах значительно снижало накопление NH4+, приводя к снижению цитотоксичности (см. выше Markus Schneider, et al. 1996). Сниженная цитотоксичность NH4+ обусловливала более высокую жизнеспособность клеток, таким образом, увеличивала продолжительность жизни культуры. На основе расчетного исследования потребления глутамина, используя клетки CHO, было предположено, что клетки могут потреблять глутамин со скоростью 0,3-0,4 мМ в день (Miller, et al. 1988, Biotechnol. Bioeng. 32: 947-965). Altamirano et al. (2001, J. Biotechnol. 110:171-9) изучали влияние замены глутамина на глутамат и баланс между метаболизмом глутамата и глюкозы на перераспределение клеток СНО, продуцирующих рекомбинантный тканевой активатор плазминогена (rhut-PA). Когда глутамин был заменен на глутамат и уравновешен катаболизмом глюкозы (соотношение углерода и азота, соотношение C/N), было обнаружено, что клеточный метаболизм перераспределен и вынужден использовать источник углерода и энергии более предпочтительно для продукции rhut-PA. Было также опубликовано, что клетки СНО в плотно прилегающих культурах клеток могут расти в отсутствие добавленного глутамина благодаря активности эндогенной глутаминсинтетазы, позволяющей клеткам синтезировать глутамин из глутаминовой кислоты в среде (Sanfeliu and Stephanopoulos, 1999, Biotechnol. Bioeng. 64:46-53). Однако, по сравнению с контрольными культурами в содержащих глутамин питательных средах скорость клеточного роста в питательных средах без глутамина была медленнее с повышенной фракцией клеток, находящихся в фазе G0/G1. Истощение запасов как глутамина, так и глутаминовой кислоты действительно вызывало клеточную гибель.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано, по меньшей мере, частично, на неожиданном обнаружении того, что мало того, что рекомбинантные белки могут быть продуцированы в клетке-хозяине млекопитающего, используя питательную среду для продукции без глутамина без какого-либо значимого неблагоприятного эффекта, фактически использование питательной среды без глутамина в фазе продукции значительно увеличивают жизнеспособность клеток, продолжительность жизни культуры, специфическую продуктивность и/или конечный титр рекомбинантного белка.
Настоящее изобретение также основано на неожиданном обнаружении того, что добавление аспарагина в питательную среду для продукции без глутамина может дополнительно увеличивать жизнеспособность клетки, продолжительность жизни культуры, специфическую продуктивность и/или конечный титр рекомбинантного белка в клетке-хозяине млекопитающего, используя среду для продукции без глутамина без какого-либо значимого неблагоприятного эффекта.
В одном аспекте изобретение рассматривает способ получения полипептида в клетке-хозяине млекопитающего, экспрессирующей указанный полипептид, включающий культивирование клетки-хозяина млекопитающего в фазе продукции клеточной культурой в культуральной среде для продукции без глутамина, дополненной аспарагином.
В одном варианте осуществления изобретения клеткой-хозяином млекопитающего является клетка яичника китайского хомячка (СНО).
В другом варианте осуществления изобретения клеткой-хозяином млекопитающего является клетка СНО dhfr-.
В еще одном варианте осуществления изобретения среда для продукции является бессывороточной.
В дополнительном варианте осуществления изобретения культуральная среда для продукции включает один или несколько ингредиентов, выбранных из группы, состоящей из:
1) источника энергии;
2) незаменимых аминокислот;
3) витаминов;
4) свободных жирных кислот; и
5) следовых элементов.
В ином дополнительном варианте осуществления изобретения, где культуральная среда для продукции дополнительно включает один или несколько ингредиентов, выбранных из группы, состоящей из:
1) гормонов и других ростовых факторов;
2) солей и буферов; и
3) нуклеозидов.
Во всех вариантах осуществления изобретения фаза продукции может, например, быть фазой периодической или подпитываемой культуры.
Во всех вариантах осуществления изобретения способ может дополнительно включать этап выделения указанного полипептида.
В дополнительном варианте осуществления изобретения после выделения может следовать определение одного или нескольких параметров: жизнеспособности клеток, продолжительности жизни культуры, специфической продуктивности и конечного титра рекомбинантного белка вслед за выделением.
В ином дополнительном варианте осуществления изобретения по меньшей мере один из параметров - жизнеспособность клеток, продолжительность жизни культуры, специфическая продуктивность и конечный титр рекомбинантного белка - увеличен относительно того же самого полипептида, продуцированного в содержащей глутамин питательной среде для продукции такого же состава.
В дополнительном аспекте изобретение рассматривает готовую к использованию культуральную питательную среду без глутамина для получения полипептида в фазе продукции.
В еще одном варианте осуществления изобретения полипептид является гликопротеином млекопитающих.
В других вариантах осуществления изобретения полипептид выбран из группы, состоящей из антител, фрагментов антител и иммуноадгезинов.
Во всех вариантах осуществления изобретения полипептид может, например, быть антителом или биологически функциональным фрагментом антитела. Иллюстративные фрагменты антитела включают Fab, Fab’, F(ab’)2, scFv, (scFv)2, dAb, фрагменты определяющих комплементарность областей (CDR), линейные антитела, одноцепочечные молекулы антитела, минитела, диатела и мультиспецифичные антитела, образованные из фрагментов антитела.
В ином дополнительном варианте осуществления изобретения антитело или фрагмент антитела является химерным, гуманизированным или человеческим.
Терапевтические антитела включают, помимо прочего, антитела против HER2, антитела против CD20; антитела против IL-8; антитела против VEGF; антитела против CD40; антитела против CD11a; антитела против CD18; антитела против IgE; антитела против рецептора Apo-2; антитела против Тканевого фактора (TF); антитела против интегрина α4β7 человека; антитела против EGFR; антитела против CD3; антитела против CD25; антитела против CD4; антитела против CD52; антитела против рецептора Fc; антитела против раковоэмбрионального антигена (СЕА); антитела, направленные против эпителиальных клеток молочной железы; антитела, связывающиеся с клетками карциномы толстой кишки; антитела против CD38; антитела против CD33; антитела против CD22; антитела против EpCAM; антитела против GpIIb/IIIa; антитела против RSV; антитела против CMV; антитела против HIV; антитела против гепатита; антитела против CA 125; антитела против avβ3; антитела против почечно-клеточной карциномы человека; антитела против 17-1А человека; антитела против колоректальной опухоли человека; антитело R24 по выявлению меланомы человека, направленное против ганглиозида GD3; антитела против плоскоклеточной карциномы человека; и антитела против лейкоцитарного антигена человека (HLA) и антитела против HLA-DR.
В других вариантах осуществления изобретения терапевтическим антителом является антитело, связывающееся с рецептором HER, VEGF, IgE, CD20, CD11a, CD40 или DR5.
В других вариантах осуществления изобретения терапевтическим антителом является антитело против BR3 или иммуноадгезин BR3-Fc.
В других вариантах осуществления метода по настоящему изобретению полипептид, экспрессируемый в рекомбинантной клетке-хозяине, является терапевтическим полипептидом. Например, терапевтический полипептид может быть выбран из группы, состоящей из гормона роста, включая гормон роста человека и гормон роста крупного рогатого скота; фактора высвобождения гормона роста; паратиреоидного гормона; тиреотропного гормона; липопротеинов; альфа-1-антитрипсина; А-цепи инсулина; В-цепи инсулина; проинсулина; фолликулостимулирующего гормона; кальцитонина; лютеинизирующего гормона; глюкагона; факторов свертывания крови, таких как фактор VIIIC, фактор IX, тканевой фактор и фактор Виллебранда; противосвертывающих факторов, таких как протеин С; предсердного натрийуретического фактора; сурфактанта легкого; активатора плазминогена, такого как урокиназа или мочевой или тканевой активатор плазминогена человека (t-PA); бомбезина; тромбина; гемопоэтического ростового фактора; фактора некроза опухолей альфа и бета; энкефалиназы; RANTES (регулируемого при активации нормальных Т-клеток, его экспрессирующих и секретирующих); макрофагального белка воспаления человека (MIP-1-альфа); сывороточного альбумина, такого как сывороточный альбумин человека; мюллерова ингибирующего фактора; А-цепи релаксина; В-цепи релаксина; прорелаксина; мышиного гонадотропин-ассоциированного пептида; микробного белка, такого как бета-лактамаза; ДНКазы; IgE; ассоциированного с цитотоксическими Т-лимфоцитами антигена (CTLA), такого как CTLA-4; ингибина; активина; фактора роста сосудистого эндотелия (VEGF); рецепторов к гормонам или ростовым факторам; протеина А или D; ревматоидных факторов; нейротрофического фактора, такого как костный нейротрофический фактор (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6), или фактора роста нервов, такого как NGF-β; тромбоцитарного ростового фактора (PDGF); фактора роста фибробластов, такого как aFGF и bFGF4; эпидермального ростового фактора (EGF); трансформирующего ростового фактора (TGF), такого как TGF-альфа и TGF-бета, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобного ростового фактора-I и -II (IGF-I и IGF-II); des(1-3)-IGF-I (мозгового IGF-I); связывающих инсулиноподобный ростовой фактор белков; белков CD, таких как CD3, CD4, CD8, CD19, CD20, CD34 и CD40; эритропоэтина; остеоиндуктивных факторов; иммунотоксинов; костного морфогенетического белка (BMP); интерферона, такого как интерферон-альфа, -бета и -гамма; колониестимулирующих факторов (CSF), например, M-CSF, GM-CSF и G-CSF; интерлейкинов (IL), например, IL-1 - IL-10; супероксиддисмутазы; Т-клеточных рецепторов; поверхностных мембранных белков; комплементзависимого стимулятора гемолиза; вирусного антигена, такого как, например, часть оболочки AIDS; транспортных белков; «хоминг»-рецепторов; аддрессинов; регуляторных белков; интегринов, таких как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; опухолеассоциированного антигена, такого как рецептор HER2, HER3 или HER4; и фрагментов указанных полипептидов.
Во всех вариантах осуществления изобретения рекомбинантной клеткой-хозяином может быть эукариотическая клетка-хозяин, такая как клетка-хозяин млекопитающего, включая, например, клетки яичника китайского хомячка (СНО).
Эти и другие аспекты будут очевидными из приведенного ниже описания, включая Примеры и прилагаемую формулу изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1. Анализ титра антитела Apomab с помощью кубического построения, являющегося результатом факторного полного плана эксперимента (DOE), оценивающего влияние различных концентраций глутамина, глутамата, аспарагина и аспартата. Модель прогнозирует, что наибольший титр достигается в питательной среде без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой.
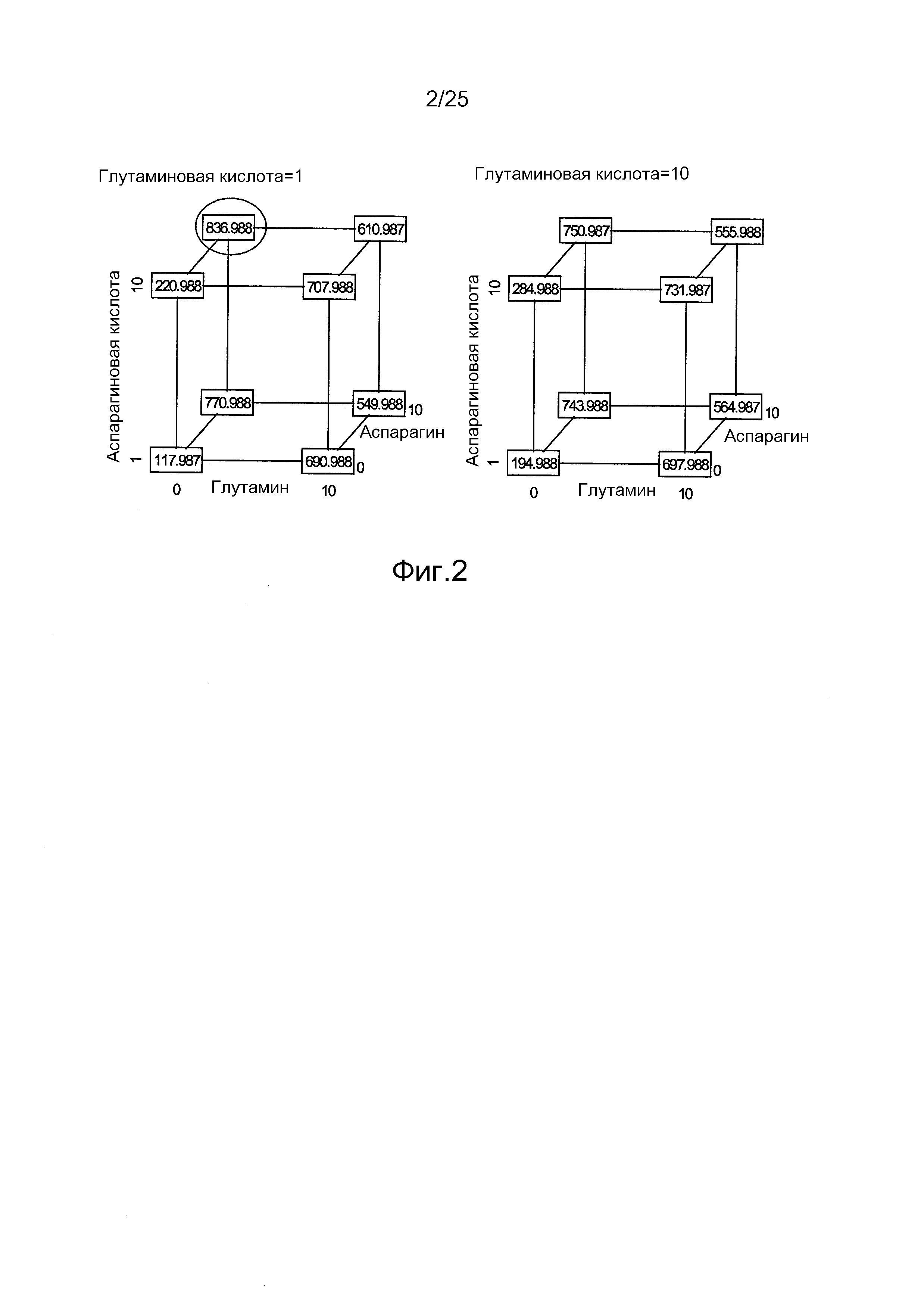
Фиг.2. Анализ титра иммуноадгезина BR3-Fc с помощью кубического построения, являющегося результатом полнофакторного DOE, оценивающего влияние различных концентраций глутамина, глутамата, аспарагина и аспартата. Модель прогнозирует, что наибольший титр достигается в питательной среде без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой.
Фиг.3. Анализ титра антитела против VEGF с помощью кубического построения, являющегося результатом полнофакторного DOE, оценивающего влияние различных концентраций глутамина, глутамата, аспарагина и аспартата. Модель прогнозирует, что наибольший титр достигается в питательной среде без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой.
Фиг.4. Влияние аспарагина в условиях отсутствия глутамина, низкой концентрации глутамата и высокой концентрации аспартата на титр антитела Apomab. В питательной среде без глутамина титр антитела Apomab значительно увеличился в присутствии 2,5-15 мМ аспарагина по сравнению с культурами в отсутствие глутамина без аспарагина. В этих условиях наличие или отсутствие глутамата не оказывало влияния на титр.
Фиг.5. Получение титра антитела Apomab при различных концентрациях аспарагина и аспартата в условиях отсутствия глутамина и низкой концентрации глутамата. Положительный эффект титрования наблюдали при повышении концентрации аспартата от 0 до 10 мМ в этих условиях.
Фиг.6А-С. Влияние питательной среды без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на титр. Конечный титр для антитела Apomab, антитела против VEGF и иммуноадгезина BR3-Fc был значительно выше в питательной среде без глутамина по сравнению с содержащей глутамин питательной средой.
Фиг.7А и В. Влияние питательной среды DMEM/F12 без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на титр. Конечный титр для антитела Apomab и антитела против VEGF был значительно выше в питательной среде DMEM/F12 без глутамина по сравнению с содержащей глутамин питательной средой DMEM/F12.
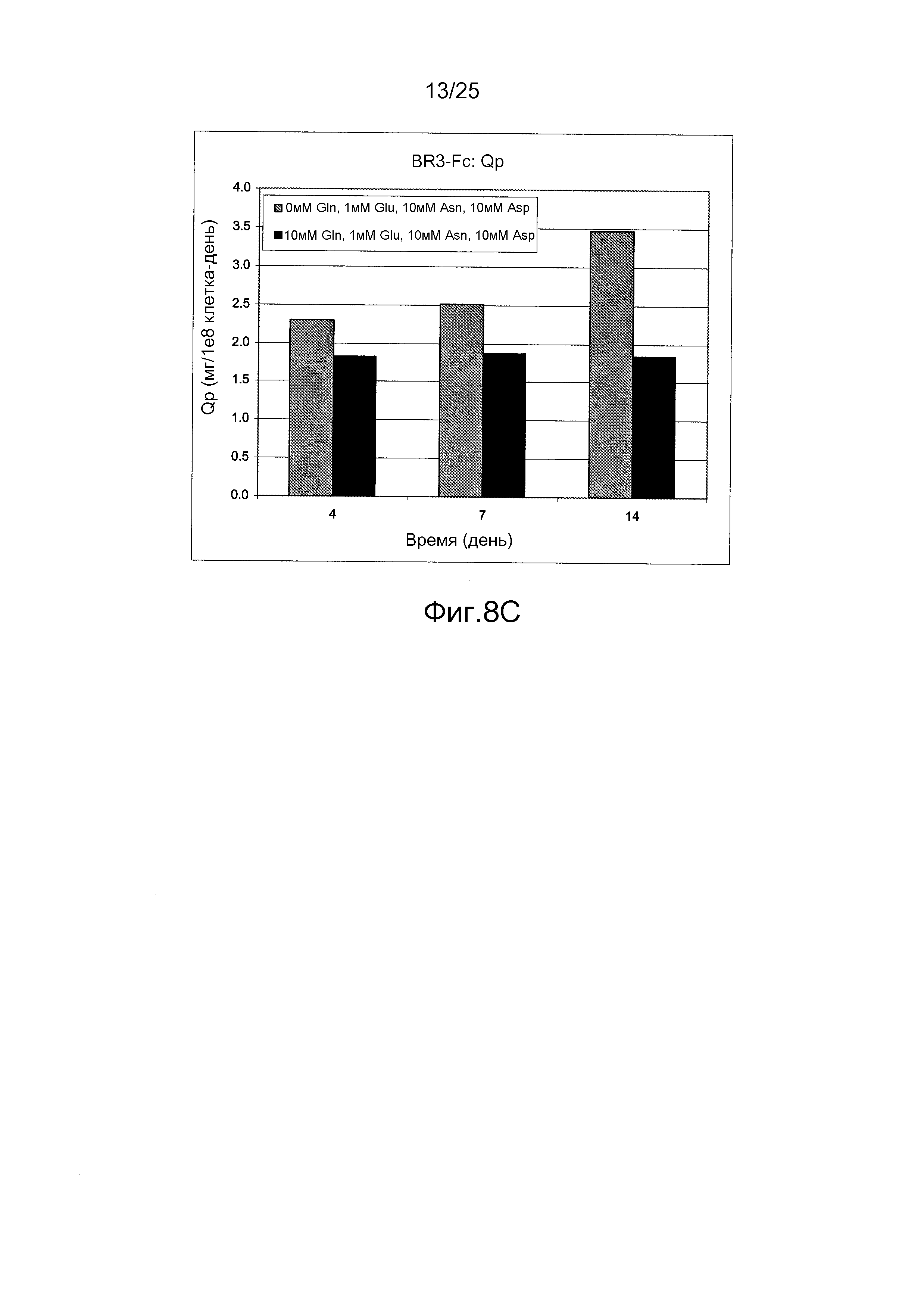
Фиг.8А-С. Влияние питательной среды без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на клеточно-специфичную продуктивность (Qp). Клеточно-специфичная продуктивность для антитела Apomab, антитела против VEGF и иммуноадгезина BR3-Fc была значительно выше в питательной среде без глутамина по сравнению с содержащей глутамин питательной средой.
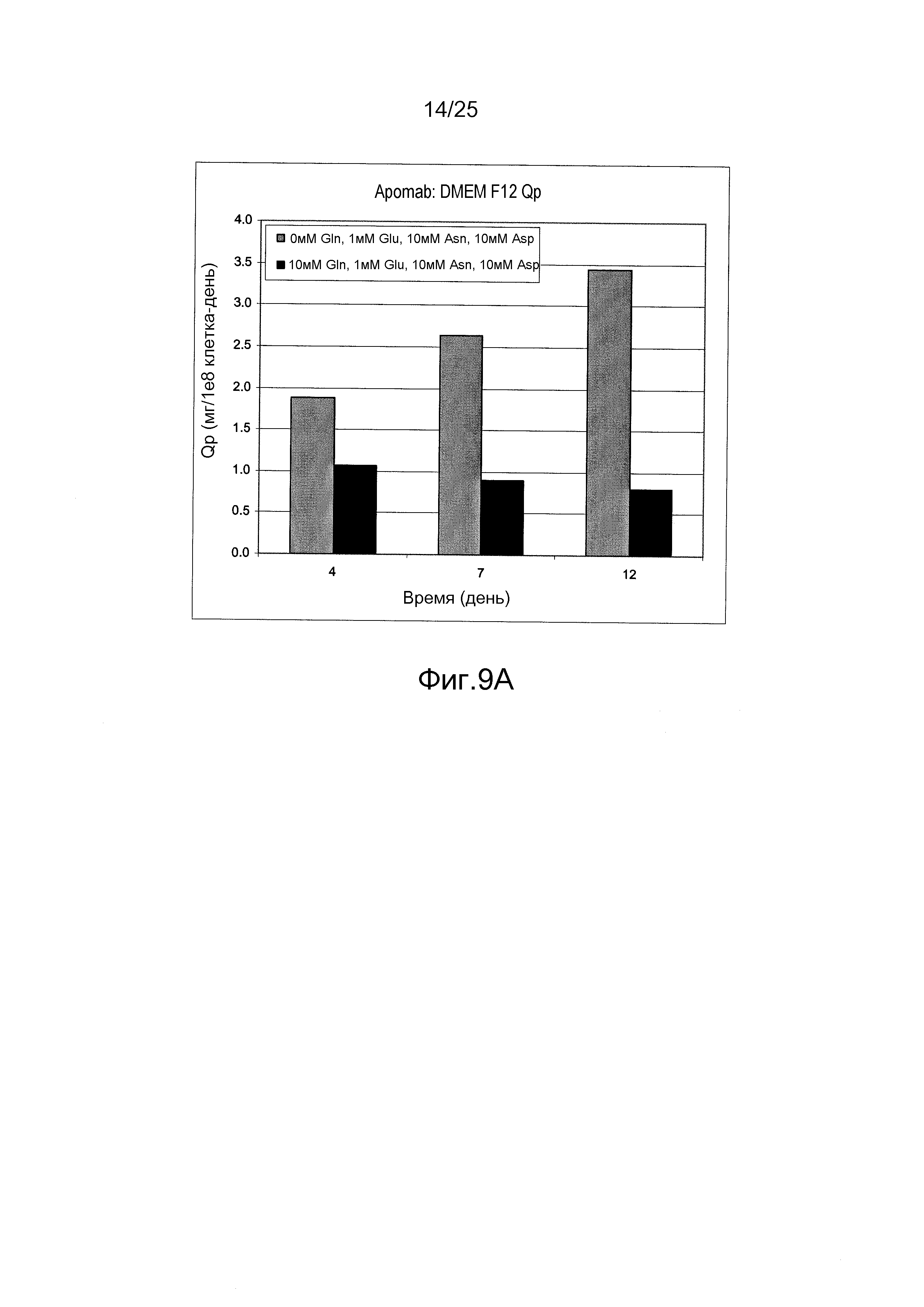
Фиг.9А и В. Влияние питательной среды DMEM/F12 без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на клеточно-специфичную продуктивность (Qp). Клеточно-специфичная продуктивность для антитела Apomab и антитела против VEGF была значительно выше в питательной среде DMEM/F12 без глутамина по сравнению с содержащей глутамин питательной средой DMEM/F12.
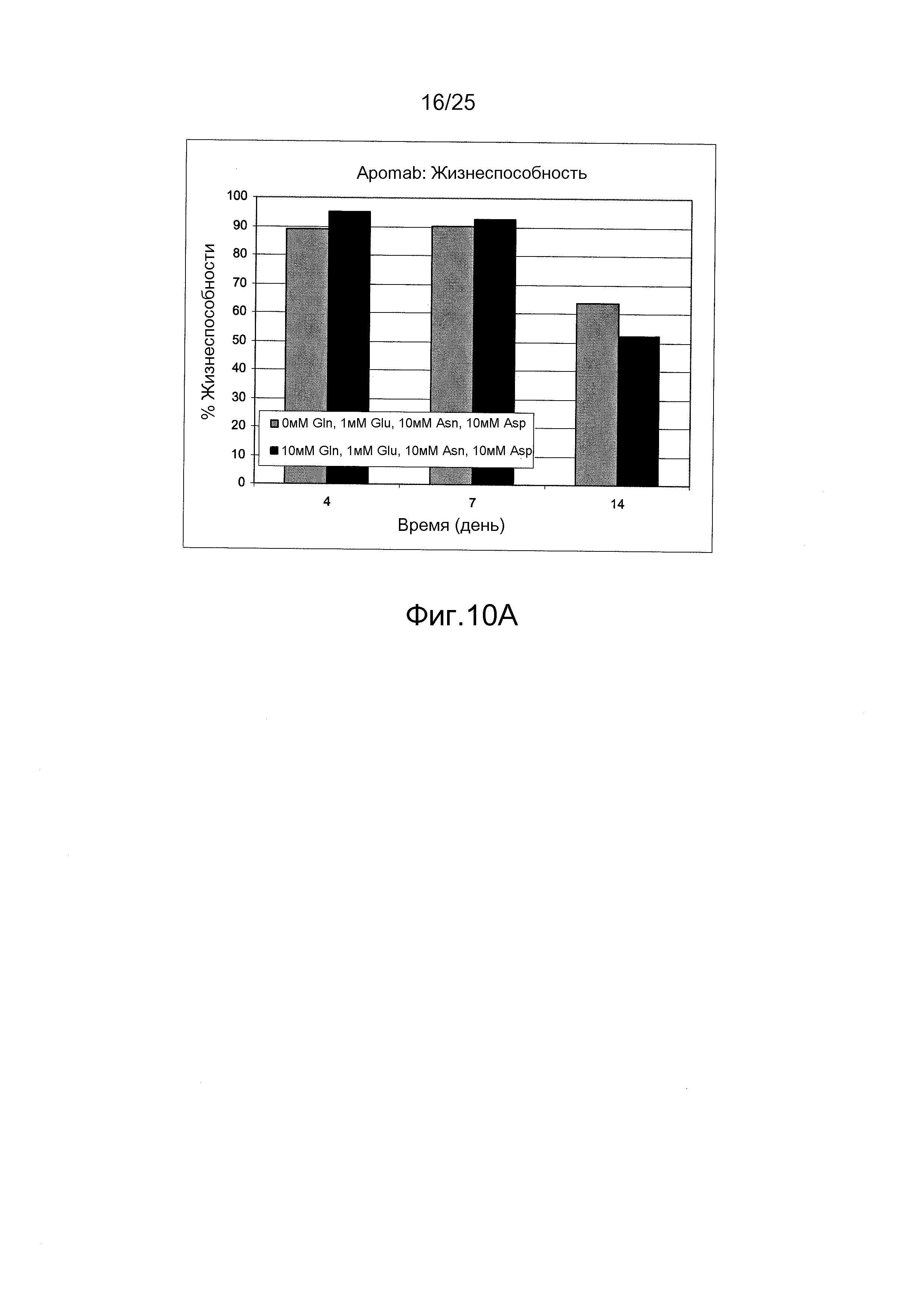
Фиг.10А-С. Влияние питательной среды без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на жизнеспособность клеток. Жизнеспособность клеток для антитела Apomab, антитела против VEGF и иммуноадгезина BR3-Fc была выше в питательной среде без глутамина по сравнению с содержащей глутамин питательной средой.
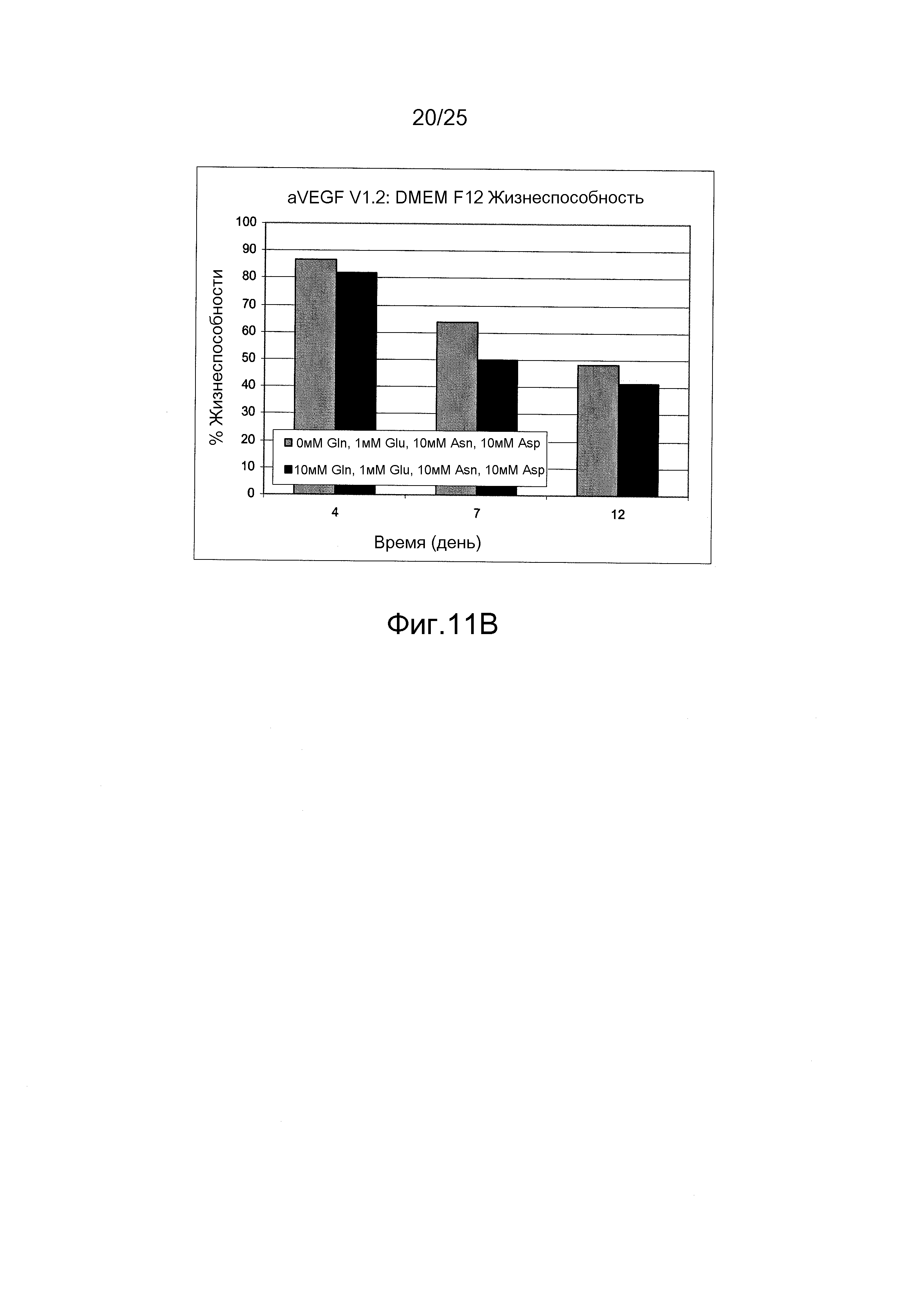
Фиг.11 А и В. Влияние питательной среды DMEM/F12 без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на жизнеспособность клеток. В питательной среде DMEM/F12 жизнеспособность клеток не была стабильно улучшена в питательной среде без глутамина. Жизнеспособность была выше для антитела Apomab, но ниже для антитела против VEGF по сравнению с содержащей глутамин питательной средой.
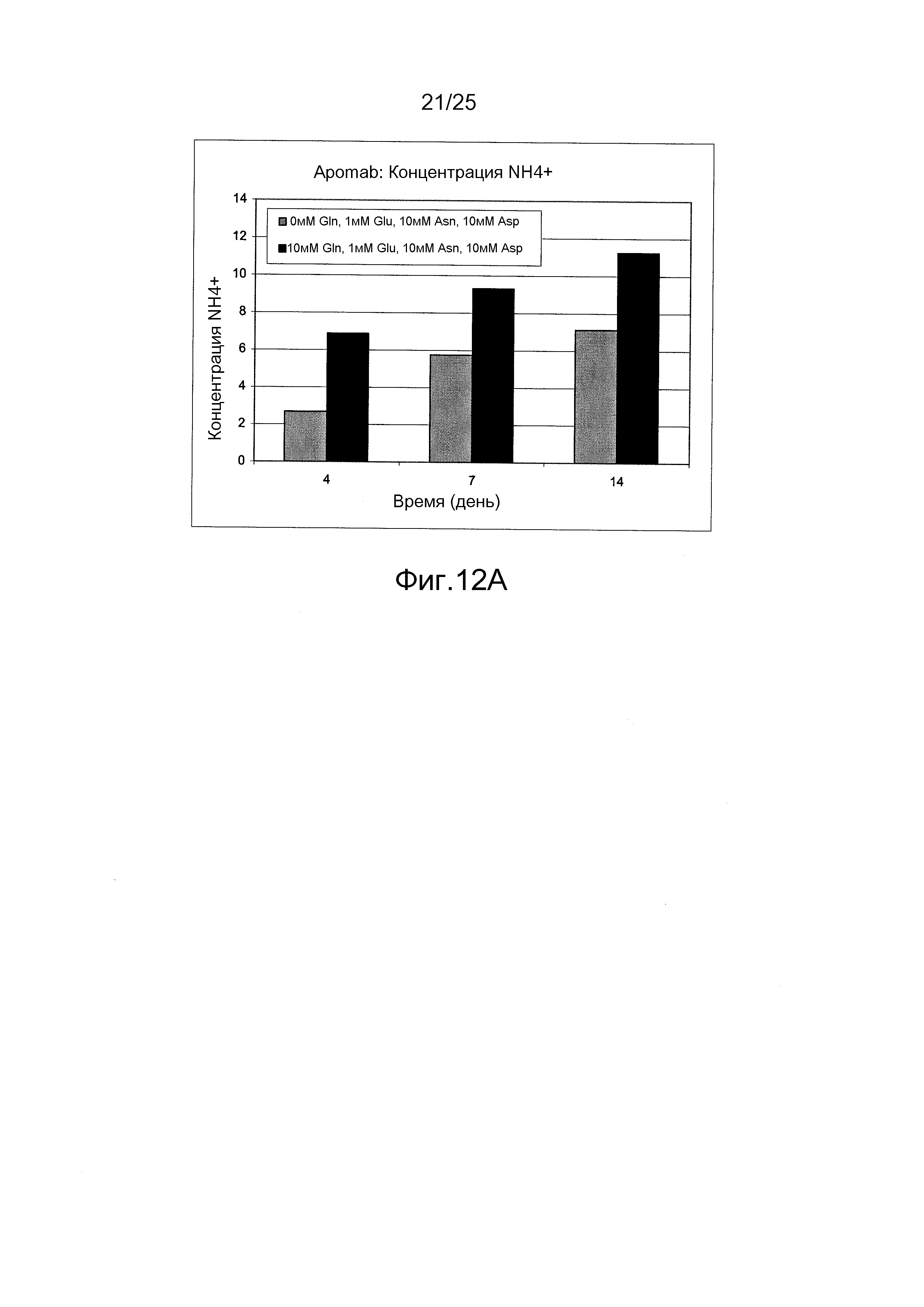
Фиг.12А-С. Влияние питательной среды без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на образование аммиака. Уровень аммиака был, как правило, ниже в культурах клеток без глутамина по сравнению с содержащими глутамин культурами.
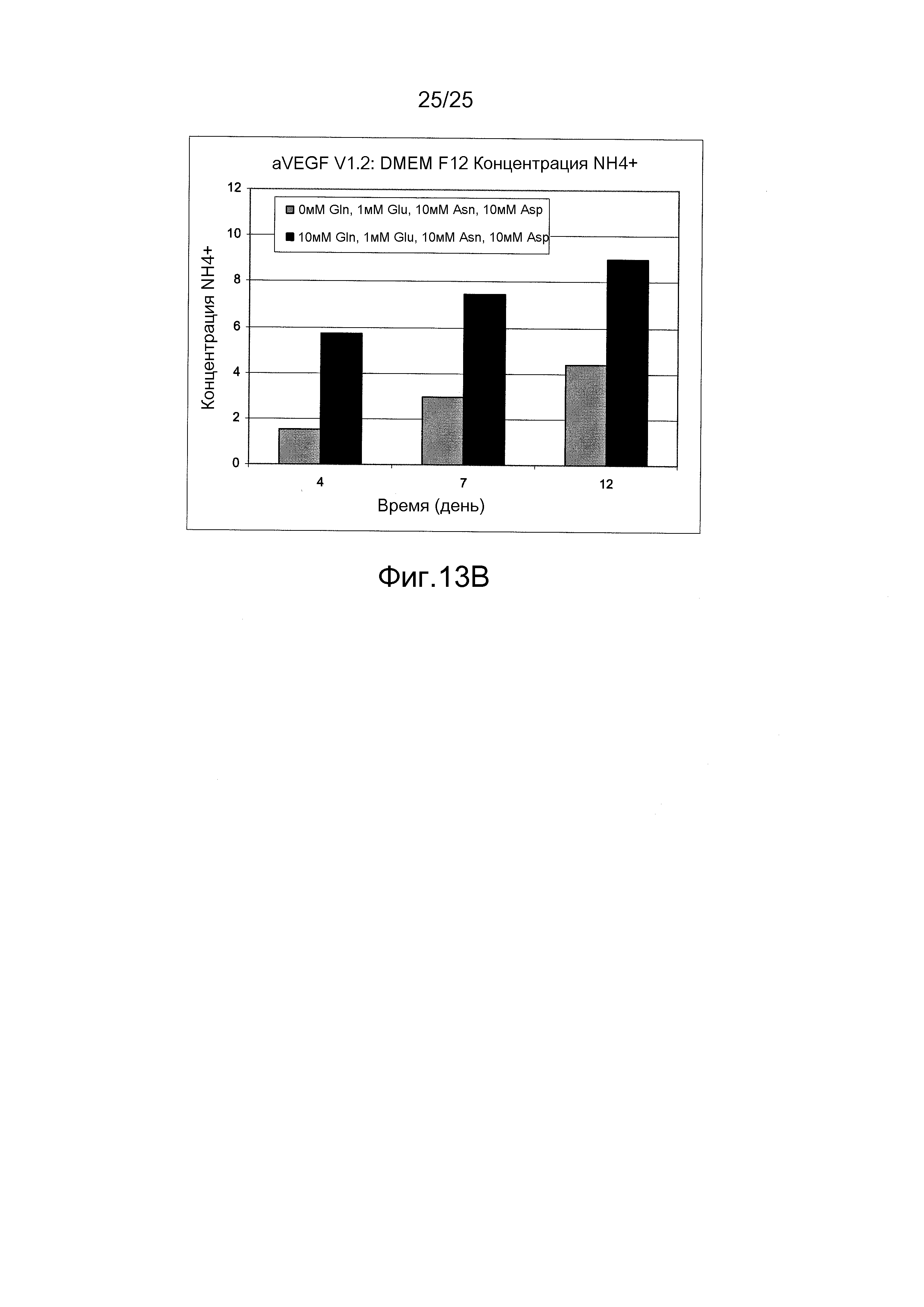
Фиг.13А и В. Влияние питательной среды DMEM/F12 без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на образование аммиака. Уровень аммиака был значительно снижен в питательной среде DMEM/F12 без глутамина по сравнению с содержащей глутамин питательной средой DMEM/F12.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
А. Определения
Термины «среда культивирования клеток», «культуральная среда» и «питательная смесь» относятся к питательному раствору, используемому для выращивания клеток млекопитающих, который, как правило, обеспечивает по меньшей мере одним компонентом из одной или нескольких нижеперечисленных категорий:
1) источником энергии, как правило, в форме углевода, такого как глюкоза;
2) некоторыми или всеми незаменимыми аминокислотами и обычно основным набором из двадцати аминокислот плюс цистин;
3) витаминами и/или другими органическими соединениями, как правило, требуемыми в низких концентрациях;
4) свободными жирными кислотами; и
5) следовыми элементами, где под следовыми элементами понимают неорганические соединения или природные элементы, которые обычно требуются в очень низких концентрациях, как правило, в микромолярном диапазоне.
Питательная смесь может в некоторых случаях быть дополнена одним или несколькими компонентами из любых нижеперечисленных категорий:
1) гормонами и другими ростовыми факторами как, например, инсулин, трансферрин и эпидермальный ростовой фактор;
2) солями и буферами, такими как, например, кальций, магний и фосфат; и
3) нуклеозидами, такими как, например, аденозин и тимидин.
Среда культивирования клеток является, как правило, «бессывороточной», когда среда по существу лишена сыворотки из любого источника млекопитающих (например, фетальная телячья сыворотка (FBS)). Под выражением «по существу лишена» понимают то, что среда культивирования клеток содержит приблизительно 0-5% сыворотки, предпочтительно приблизительно 0-1% сыворотки и наиболее предпочтительно приблизительно 0-0,1% сыворотки. Предпочтительно, может быть использована бессывороточная среда «определенного состава», где подлинность и концентрация каждого из компонентов в среде известна (т.е., не идентифицированный компонент, такой как экстракт гипофиза быка (BPE), не присутствует в культуральной среде).
В контексте настоящего изобретения выражения «клетка», «клеточная линия» и «клеточная культура» используются взаимозаменяемо, и все такие обозначения включают потомство. Таким образом, слова «трансформанты» и «трансформированные клетки (хозяева)» включают исходную рассматриваемую клетку и культуры, получаемые из нее, не обращая внимания на число транспозиций. Также считается, что все потомство может не быть полностью идентичным по составу ДНК вследствие искусственных или спонтанных мутаций. Мутантное потомство, которое имеет ту же функцию или биологическую активность, подвергнутую скринингу в исходно трансформированной клетке, учитывают. Где предполагаются отдельные обозначения, будет ясно из контекста.
Термин «клетка-хозяин животного», «клетка животного», «рекомбинантная клетка-хозяин животного» и т.п. охватывает клетки беспозвоночных, отличных от млекопитающих позвоночных (например, птица, рептилия и амфибия) и млекопитающих. Примеры клеток беспозвоночных включают следующие клетки насекомых: Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. См., например, Luckow et al., Bio/Technology, 6:47-55 (1988); Miller et al., in Genetic Engineering, Setlow, J. K. et al., eds., Vol. 8 (Plenum Publishing, 1986), pp. 277-279; и Maeda et al., Nature, 315:592-594 (1985).
Термины «клетка-хозяин млекопитающего», «клетка млекопитающего», «рекомбинантная клетка-хозяин млекопитающего» и т.п. относятся к клеточным линиям, полученным из млекопитающих, которые способны расти и выживать при помещении либо в монослойную культуру, либо в суспензионную культуру в среде, содержащей соответствующие питательные вещества и ростовые факторы. Необходимые питательные и ростовые факторы для конкретной клеточной линии легко определяются эмпирически без лишних экспериментов, как описано, например, в Mammalian Cell Culture (Mather, J. P. ed., Plenum Press, N. Y. (1984)), и исследователями Barnes и Sato (Cell, 22:649 (1980)). Как правило, клетки способны экспрессировать и секретировать большие количества определенного представляющего интерес белка (обычно рекомбинантного белка) в культуральную среду, и их культивируют с этой целью. Однако, клетки могут быть культивированы для целого ряда других целей, и объем данного изобретения не ограничивается культивированием клеток только для получения рекомбинантных белков. Примеры пригодных клеточных линий млекопитающих, способных расти в средах по данному изобретению, включают трансформированную SV40 линию CVI почек обезьяны (COS-7, ATCC® CRL 1651); линию 293S эмбриональной почки человека (Graham et al., J. Gen. Virolo., 36:59 (1977)); клетки почки новорожденного хомяка (BHK, ATCC® CCL 10); мышиные клетки Сертоли (TM4, Mather, Biol. Reprod., 23:243 (1980)); клетки почки обезьяны (CVI-76, ATCC® CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC® CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC® CCL 2); клетки почки собаки (MDCK, ATCC® CCL 34); клетки печени крысы buffalo (BRL 3A, ATCC® CRL 1442); клетки легкого человека (W138, ATCC® CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC® CCL 51); клетки гепатомы крысы (HTC, MI.54, Baumann et al., J. Cell Biol., 85:1 (1980)); и клетки TR-1 (Mather et al., Annals N.Y. Acad. Sci., 383:44 (1982)) и клеточные линии гибридомы. Клетки яичника китайского хомячка (Urlab and Chasin, Proc. Natl. Acad. Sci. USA, 77:4216 (1980)) являются предпочтительной клеточной линией для осуществления данного изобретения. Клетки СНО, пригодные для использования в способах настоящего изобретения, также были описаны в следующих документах: ЕР 117159, опубликованного 29 августа 1989 года; патентах США №№ 4766075; 4853330; 5185259; Lubiniecki et al., в Advances in Animal Cell Biology and Technology for Bioprocesses, Spier et al., eds. (1989), pp. 442-451. Известные производные СНО, пригодные для использования, в настоящем документе включают, например, CHO/-DHFR (Urlaub and Chasin, Proc. Natl. Acad. Sci. USA, 77: 4216 (1980)), CHO-K1 DUX B11 (Simonsen and Levinson, Proc. Natl. Acad. Sci. USA 80: 2495-2499 (1983); Urlab and Chasin, см. выше), и клетки dp 12.CHO (EP 307247, опубликованный 15 марта 1989 года). Предпочтительные клетки-хозяева включают клетки CHO-K1 DUX B11 и dp 12.CHO.
«Клетка СНО dhfr-» относится к клетке СНО, лишенной дигидрофолатредуктазы (DHFR). Получение рекомбинантных белков в клетках млекопитающих создает возможность производства целого ряда больших, сложных гликозилированных полипептидов для применения в медицинской практике. Клетки DHFR- яичника китайского хомячка (СНО) и амплифицируемый селектируемый маркер DHFR стандартно используются для выявления клеточных линий, продуцирующих клинически пригодные количества продукта. (Urlab, G. and Chasin, L.A. (1980) Proc. Natl. Acad. Sci. USA, 77, 4216-4220; Kaufman, R. J. and Sharp, P. (1982) J. Mol. Biol., 159, 601-621; Gasser, C. S., Simonsen, C. S., Schilling, J. W. and Schmike, R. T. (1982) Proc. Natl. Acad. Sci. USA, 79, 6522-6526).
«Фаза» означает определенную фазу культивирования клеток, как это принято считать специалистом-практиком.
«Фаза роста» клеточной культуры относится к периоду экспоненциального клеточного роста (log-фаза), где клетки в основном быстро делятся. Во время этой фазы клетки культивируют в течение периода времени обычно в промежутке 1-4 дней и в таких условиях, чтобы клеточный рост был максимизирован. Цикл роста для клетки-хозяина может быть определен для определенной клетки-хозяина, предусмотренный без лишних экспериментов. Во время фазы роста клетки культивируют в питательной среде, содержащей необходимые добавки, в основном, приблизительно при 30-40°С, предпочтительно приблизительно 37°С, в увлажненной, контролируемой атмосфере, такой, что оптимальный рост достигается для конкретной клеточной линии. Клетки поддерживают в фазе роста в течение периода в промежутке приблизительно от одного до четырех дней, обычно в промежутке от двух до трех дней.
«Переходная фаза» клеточной культуры относится к периоду времени, в течение которого создаются культуральные условия для фазы продукции. В течение переходной фазы факторы внешней среды, такие как температура, сдвигаются от условий роста к условиям синтеза.
«Фаза продукции» клеточной культуры относится к периоду времени, в течение которого рост клетки выходит на плато. Во время фазы продукции заканчивается логарифмический рост клеток, и синтез белка является преимущественным. Во время этого периода времени среду, как правило, дополняют для поддержания продолжающегося синтеза белка и для получения желаемого белкового продукта.
Фраза «клеточная культура с подпиткой» в том смысле, в котором она здесь используется, относится к периодической культуре, где клетки животного (например, млекопитающих) и культуральная среда изначально поставляются в емкость для культивирования, и дополнительные культуральные питательные вещества подают, непрерывно или с пошаговым количественным увеличением, к культуре во время культивирования с или без периодического забора клеток и/или продукта до завершения культивирования. Клеточная культура с подпиткой включает «полунепрерывную культуру с подпиткой», где целую культуру (включая клетки и среду) периодически удаляют и заменяют на свежую среду. Клеточная культура с подпиткой отличается от простой «периодической культуры», в которой все компоненты для культивирования клеток (включая клетки животных и все культуральные питательные вещества) поставляют в емкость для культивирования в начале процесса культивирования. Клеточная культура с подпиткой может дополнительно отличаться от перфузионного культивирования в такой степени, что супернатант не удаляют из емкости для культивирования во время процесса (при перфузионном культивировании клетки удерживают в культуре посредством, например, фильтрации, инкапсулирования, фиксации на микроносителях и т.п., и культуральную среду непрерывно или периодически вводят или удаляют из емкости для культивирования). Однако, предусмотрено взятие образцов для исследовательских целей во время культивирования культуры с подпиткой.
Термин «глутамин» в том смысле, в котором он здесь используется, относится к аминокислоте L-глутамин (также известной как «Gln» и «Q» в трехбуквенном и однобуквенном обозначении, соответственно), которая считается как аминокислотным строительным блоком для белкового синтеза, так и источником энергии в клеточной культуре. Таким образом, «глутамин» и «L-глутамин» используются в настоящем документе взаимозаменяемо.
Слово «глюкоза» относится либо к α-D-глюкозе, либо к β-D-глюкозе, по отдельности или в комбинации. Отмечают, что α и β формы глюкозы являются взаимопревращаемыми в растворе.
Выражение «осмоляльность» является мерой осмотического давления растворенных частиц раствора в водном растворе. Частицы раствора включают как ионы, так и неионизированные молекулы. Осмоляльность выражают в виде концентрации осмотически активных частиц (т.е., осмоль), растворенных в 1 кг воды (1 мосмоль/кг Н2О при 38°С эквивалентно осмотическому давлению, равному 19 мм рт.ст.). «Осмолярность» относится к числу частиц раствора, растворенных в 1 литре раствора. Осмолиты, которые могут быть добавлены в культуральную среду с тем, чтобы увеличить ее осмоляльность, включают белки, пептиды, аминокислоты, неметаболизированные полимеры, витамины, ионы, соли, сахара, метаболиты, органические кислоты, липиды и т.п. В предпочтительном варианте осуществления изобретения концентрацию аминокислот и NaCl в культуральной среде увеличивают для достижения желаемых диапазонов осмоляльности, излагаемых в данном документе. Аббревиатура «мосмоль» в том смысле, в котором она здесь используется, означает «миллиосмоль/кг Н2О».
Термин «плотность клеток» в том смысле, в котором он здесь используется, относится к числу клеток, находящихся в данном объеме среды.
Термин «жизнеспособность клеток» в том смысле, в котором он здесь используется, относится к способности клеток в культуре выживать в данной совокупности культуральных условий или в условиях экспериментальных вариаций. Термин в том смысле, в котором он здесь используется, также относится к доле клеток, которые являются живыми в определенный момент времени относительно общего числа клеток, живых или мертвых, в культуре в это время.
Термины «аминокислоты» и «аминокислота» относятся ко всем встречающимся в природе альфа-аминокислотам в обеих их стереоизомерным D или L формам, и их аналогам и производным. Аналог определяют как замену атома в аминокислоте другим атомом, который, как правило, имеет подобные свойства. Производное определено как аминокислота, которая имеет другую молекулу или атом, прикрепленные к ней. Производные включают, например, ацетилирование аминогруппы, аминирование карбоксильной группы или окисление серосодержащих остатков двух молекул цистеина с образованием цистина.
Термин «белок» предназначен для обозначения последовательности аминокислот, для которой длина цепи достаточна для образования более высоких уровней третичной и/или четвертичной структуры. Указанное следует отличать от «пептидов» или других лекарственных средств с малым молекулярным весом, которые не обладают такой структурой. Как правило, белок в настоящем документе имеет молекулярный вес величиной по меньшей мере приблизительно 15-20 кДа, предпочтительно по меньшей мере приблизительно 20 кДа. Примеры белков, подходящих под данное определение, в настоящем документе включают все белки млекопитающих, в частности, белки для терапевтических и диагностических целей, такие как терапевтические и диагностические антитела, и, в основном, белки, которые содержат одну или несколько дисульфидных связей, включая многоцепочечные полипептиды, включающие одну или несколько меж- и/или внутрицепочечные дисульфидные связи.
Термин «терапевтический белок» или «терапевтический полипептид» относится к белку, который используется в лечении заболевания, независимо от его свойств или механизма действия. Чтобы терапевтические белки были пригодными для клинического использования, они должны быть синтезированы в больших количествах. Производство терапевтических белков, или других белков, «промышленного масштаба» использует клеточные культуры объемом в диапазоне приблизительно от 400 л до приблизительно 80000 л, в зависимости от продуцируемого белка и от потребностей. Как правило, такое производство промышленного масштаба использует объемы клеточных культур величиной приблизительно от 400 л до приблизительно 25000 л. В пределах данного диапазона используются объемы специфичных клеточных культур, такие как 4000 л, приблизительно 6000 л, приблизительно 8000 л, приблизительно 10000 л, приблизительно 12000 л, приблизительно 14000 л или приблизительно 16000 л.
«Представляющий интерес полипептид» в том смысле, в котором он здесь используется, относится в основном к пептидам и белкам, имеющим приблизительно более десяти аминокислот. Полипептиды могут быть гомологичными таковым клетки-хозяина или предпочтительно могут быть экзогенными, означая, что они являются гетерологичными, т.е. чужеродными, для используемой клетки-хозяина, как, например, белок человека продуцируемый отличным от человека млекопитающим, например, клеткой яичника китайского хомячка (СНО). Предпочтительно, используют полипептиды млекопитающих (полипептиды, которые были исходно получены из организма млекопитающего), более предпочтительно используют те, которые непосредственно секретируются в питательную среду. Термин «полипептид» или «представляющий интерес полипептид», например, включает антитела, в частности, антитела, связывающиеся с полипептидами млекопитающих, такими как любые из полипептидов млекопитающих, перечисленных ниже, или их фрагменты, а также иммуноадгезины (соединение полипептида-Ig), такие, как включающие любой из полипептидов млекопитающих, перечисленных ниже, или их фрагменты.
Примеры полипептидов млекопитающих включают, помимо прочего, трансмембранные молекулы (например, рецепторы) и лиганды, такие как ростовые факторы. Иллюстративные полипептиды включают молекулы, такие как ренин; гормон роста, включая гормон роста человека и гормон роста крупного рогатого скота; фактор высвобождения гормона роста; паратиреоидный гормон; тиреотропный гормон; интерферон, такой как интерферон-α, -β и -γ; липопротеины; α-1-антитрипсин; А-цепь инсулина; В-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, такие как фактор VIIIC, фактор IX, тканевой фактор и фактор Виллебранда; противосвертывающие факторы, такие как протеин С; предсердный натрийуретический фактор; сурфактант легкого; активатор плазминогена, такой как урокиназа или мочевой или тканевой активатор плазминогена человека (t-PA), включая варианты t-PA; бомбезин; тромбин; гемопоэтический ростовой фактор; фактор некроза опухолей -альфа и -бета; энкефалиназу; RANTES (регулируемый при активации нормальных Т-клеток, его экспрессирующих и секретирующих); макрофагальный белок воспаления человека (MIP-1-α); сывороточный альбумин, такой как сывороточный альбумин человека; мюллеров ингибирующий фактор; А-цепь релаксина; В-цепь релаксина; прорелаксин; мышиный гонадотропин-ассоциированный пептид; микробный белок, такой как β-лактамаза; ДНКаза; IgE; ассоциированный с цитотоксическими Т-лимфоцитами антиген (CTLA), такой как CTLA-4; ингибин; активин; фактор роста сосудистого эндотелия (VEGF); рецепторы к гормонам или ростовым факторам; протеин А или D; ревматоидные факторы; нейротрофический фактор, такой как костный нейротрофический фактор (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT4, NT-5 или NT-6), или фактор роста нервов, такой как NGF-β; тромбоцитарный ростовой фактор (PDGF); фактор роста фибобластов, такой как aFGF и bFGF4; эпидермальный ростовой фактор (EGF); трансформирующий ростовой фактор (TGF), такой как TGF-α и TGF-β, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный ростовой фактор-I и -II (IGF-I и IGF-II); des(1-3)-IGF-I (мозговой IGF-I), связывающие инсулиноподобный ростовой фактор белки; белки CD, такие как CD3, CD4, CD8, CD19, CD20, CD34 и CD40; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-α, -β и -γ; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например, IL-1 - IL-10; супероксиддисмутазу; Т-клеточные рецепторы; поверхностные мембранные белки; комплементзависимый стимулятор гемолиза; вирусный антиген, такой как, например, часть оболочки AIDS; транспортные белки; «хоминг»-рецепторы; аддрессины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18, ICAM, VLA-4 и VCAM; опухолеассоциированный антиген, такой как рецептор HER1 (EGFR), HER2, HER3 или HER4; Apo2L/TRAIL, хеджехог, активируемую митогеном протеинкиназу (МАРК) и фрагменты любого из вышеперечисленных полипептидов. Apo2L (TRAIL) и его варианты рассмотрены, например, в опубликованной патентной заявке США № 20040186051. Антитела против VEGF рассмотрены, например, в патентах США №№ 8994879; 7060269; 7169901; и 7297334. Антитела против CD20 рассмотрены, например, в опубликованной патентной заявке США № 20060246004. Полипептид BR3, антитела против BR3 и иммуноадгезины BR3-Fc описаны, например, в опубликованной патентной заявке США № 20050070689.
Термин «иммуноадгезин» в том смысле, в котором он здесь используется, означает антителоподобные молекулы, которые сочетают в себе специфичность связывания гетерологичного белка («адгезин») с эффекторными функциями константных доменов иммуноглобулинов. В структурном плане, иммуноадгезины заключают в себе прикрепление аминокислотной последовательности с требуемой специфичностью связывания, которая отличается от узнавания антигена и сайта связывания антитела (т.е., является «гетерологичной») к последовательности константного домена иммуноглобулина. Адгезиновая часть молекулы иммуноадгезина, как правило, является непрерывной аминокислотной последовательностью, включающей по меньшей мере сайт связывания рецептора или лиганда. Последовательность константного домена иммуноглобулина в иммуноадгезине может быть получена из любого иммуноглобулина, такого как подтипы IgG-1, IgG-2, IgG-3 или IgG-4, IgA (включая IgA-1 и IgA-2), IgE, IgD или IgM.
Как отмечалось выше, в определенных вариантах осуществления изобретения, белок является антителом. «Антитела» (Ab) и «иммуноглобулины» (Ig) являются гликопротеинами, имеющими сходные структурные характеристики. В то время как антитела проявляют специфичность связывания со специфическим антигеном, иммуноглобулины включают антитела и другие антителоподобные молекулы, у которых, как правило, отсутствует антигенная специфичность. Полипептиды последней разновидности, например, продуцируются на низком уровне лимфатической системой и на повышенных уровнях миеломами.
Термин «антитело» используется в самом широком смысле и, в частности, охватывает моноклональные антитела (включая полноразмерные антитела, которые имеют область Fc иммуноглобулина, или интактные моноклональные антитела), композиции антитела с полиэпитопной специфичностью, поликлональные антитела, мультивалентные антитела, мультиспецифичные антитела (например, биспецифичные антитела), образованные по меньшей мере из двух интактных антител, диател и одноцепочечных молекул, таких как молекулы scFv, а также фрагментов антитела (например, Fab, F(ab’)2 и Fv).
Если не указано иное, выражение «мультивалентное антитело» используется повсеместно в данной спецификации для обозначения антитела, включающего три или более сайтов связывания антигена. Мультивалентное антитело, как правило, конструируют с целью содержания трех или более сайтов связывания антигена, и оно, в основном, не является нативной последовательностью антитела IgM или IgA.
Термины «полноразмерное антитело», «интактное антитело» и «целое антитело» используются в настоящем документе взаимозаменяемо, чтобы ссылаться на антитело в его по существу интактной форме, а не на фрагменты антитела, согласно приведенному ниже определению. Термины, в частности, относятся к антителу с тяжелыми цепями, которые содержат область Fc.
«Фрагменты антитела» включают только часть интактного антитела, в основном, включая сайт связывания антигена интактного антитела, и, тем самым, сохраняя способность связывать антиген. В одном варианте осуществления изобретения фрагмент антитела включает сайт связывания антигена интактного антитела и, тем самым, сохраняет способность связывать антиген. В другом варианте осуществления изобретения фрагмент антитела, например, тот, что включает область Fc, сохраняет по меньшей мере одну из биологических функций, обычно связанных с областью Fc в составе интактного антитела, таких как связывание FcRn, изменение времени полужизни антитела, функция ADCC и связывание комплемента. В одном варианте осуществления изобретения фрагмент антитела является моновалентным антителом, которое in vivo имеет время полужизни, по существу аналогичное таковому интактного антитела. Например, такой фрагмент антитела может включать антигенсвязывающее плечо, соединенное с последовательностью Fc, способной придавать in vivo стабильность фрагменту.
Расщепление антител папаином приводит к образованию двух идентичных антигенсвязывающих фрагментов, называемых фрагментами «Fab», каждый из которых имеет один антигенсвязывающий сайт, и остаточного фрагмента «Fc», название которого отражает его способность легко кристаллизоваться. Обработка пепсином приводит к образованию фрагмента F(ab’)2, который имеет два активных антигенсвязывающих сайта и все еще способен к перекрестному связыванию антигена.
Фрагмент Fab содержит вариабельные домены тяжелой и легкой цепи и также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Фрагменты Fab’ отличаются от фрагментов Fab добавлением нескольких остатков к карбоксильному концу домена СН1 тяжелой цепи, включая один или несколько цистеинов из шарнирной области антитела. Fab’-SH является обозначением в настоящем документе Fab’, в котором цистеиновый остаток(ки) константных доменов несет свободную тиоловую группу. Фрагменты антитела F(ab’)2 изначально были образованы в виде пары фрагментов Fab’, которые имеют цистеины шарнирной области между ними. Другие химические сцепления фрагментов антитела также известны. Примеры фрагментов антитела, подходящие под данное определение, включают: (i) фрагмент Fab, имеющий домены VL, CL, VH и CH1; (ii) фрагмент Fab’, который является фрагментом Fab, имеющим один или несколько цистеиновых остатков на С-конце домена СН1; (iii) фрагмент Fd, имеющий домены VH и CH1; (iv) фрагмент Fd’, имеющий домены VH и CH1 и один или несколько цистеиновых остатков на С-конце домена СН1; (v) фрагмент Fv, имеющий домены VL и VH одного плеча антитела; (vi) фрагмент dAb (Ward et al., Nature 341, 544-546 (1989)), который состоит из домена VH; (vii) изолированные области CDR; (viii) фрагменты F(ab’)2, бивалентный фрагмент, включающий два фрагмента Fab’, соединенные дисульфидным мостиком в шарнирной области; (ix) одноцепочечные молекулы антитела (например, одноцепочечные Fv; scFv) (Bird et al., Science 242:423-426 (1988); и Huston et al., PNAS (USA) 85:5879-5883 (1988)); (x) «диатела» с двумя сайтами связывания антигена, включающие вариабельный домен (VH) тяжелой цепи, соединенный с вариабельным доменом (VL) легкой цепи в одной и той же полипептидной цепи (см., например, ЕР 404097; WO 93/11161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); (xi) «линейные антитела», включающие пару тандемных сегментов Fd (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих участков (Zapata et al. Protein Eng. 8(10):1057-1062 (1995); и патент США № 5641870).
«Fv» является минимальным фрагментом антитела, который содержит антигенсвязывающий сайт целиком. В одном варианте осуществления изобретения двухцепочечные виды Fv состоят из димера вариабельного домена одной тяжелой цепи и вариабельного домена одной легкой цепи в тесной, нековалентной связи. В одноцепочечных видах Fv (scFv) вариабельный домен одной тяжелой цепи и вариабельный домен одной легкой цепи могут быть ковалентно связаны гибким пептидным линкером таким образом, чтобы легкая и тяжелая цепи могли образовывать «димерную» структуру, аналогичную таковой в двухцепочечных видах Fv. Он находится в такой конфигурации, что три CDR каждого вариабельного домена взаимодействуют с образованием антигенсвязывающего сайта на поверхности димера VH-VL. Совместно шесть CDR придают антителу антигенсвязывающую специфичность. Однако даже один вариабельный домен (или половина Fv, включающая только три CDR, специфичные для антигена) обладает способностью распознавать и связывать антиген, хотя с меньшей аффинностью, чем сайт связывания целиком.
«Одноцепочечные Fv» или «scFv» фрагменты антитела включают домены VH и VL антитела, где эти домены находятся в одной полипептидной цепи. Как правило, полипептид scFv дополнительно включает полипептидный линкер между доменами VH и VL, который дает возможность scFv образовывать необходимую структуру для связывания антигена. Обзор по scFv см. у Pluckthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994).
Термин «диатела» относится к небольшим фрагментам антитела с двумя антигенсвязывающими сайтами, где эти фрагменты включают вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL). Посредством использования линкера, который является слишком коротким, чтобы дать возможность образовать пару между двумя доменами на одной и той же цепи, домены принуждают к конъюгации с комплементарными доменами другой цепи и созданию двух антигенсвязывающих сайтов. Диатела могут быть бивалентными или биспецифичными. Диатела более подробно описаны, например, в EP 404097; WO93/1161; Hudson et al., (2003) Nat. Med. 9:129-134; и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триатела и тетратела также описаны у Hudson et al., (2003) Nat. Med. 9:129-134.
Термин «моноклональное антитело» в том смысле, в котором он здесь используется, относится к антителу, полученному из популяции в основном гомогенных антител, т.е. индивидуальные антитела, составляющие популяцию, идентичны за исключением возможных мутаций, например, естественных мутаций, которые могут присутствовать в малых количествах. Таким образом, определение «моноклональное» указывает на свойства антитела, не являясь смесью дискретных антител. Моноклональные антитела являются высокоспецифичными, направленными против одного антигена. В определенных вариантах осуществления изобретения моноклональное антитело, как правило, включает антитело, включающее полипептидную последовательность, которая связывает мишень, где мишеньсвязывающая полипептидная последовательность получена в ходе процесса, который включает отбор одной мишеньсвязывающей полипептидной последовательности из множества полипептидных последовательностей. Например, процесс отбора может представлять собой отбор уникального клона из множества клонов, таких как пул клонов гибридом, клонов фагов или клонов рекомбинантных ДНК. Следует понимать, что отобранная мишеньсвязывающая последовательность может быть дополнительно изменена, например, для улучшения аффинности к мишени, гуманизации мишеньсвязывающей последовательности, улучшения ее получения в клеточной культуре, уменьшения ее иммуногенности in vivo, создания мультиспецифичного антитела и т.д., и что антитело, включающее измененную мишеньсвязывающую последовательность, также является моноклональным антителом по данному изобретению. В отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты антигена. Помимо их специфичности, препараты моноклональных антител обладают тем преимуществом, что они, как правило, не контаминированы другими иммуноглобулинами.
Определение «моноклональное» указывает на свойства антитела, будучи полученным из по существу гомогенной популяции антител, и не должно толковаться как требующее получения антитела каким-либо специфическим способом. Например, моноклональные антитела, подлежащие использованию в соответствии с настоящим изобретением, могут быть получены разнообразными методами, включая, например, гибридомную технологию (например, Kohler and Milstein, Nature, 256:495-97 (1975); Hongo et al., Hybridoma, 14 (3): 253-260 (1995), Harlow et al., Antibodies: A Laboratory, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, NY.,1981)), методы рекомбинантной ДНК (см., например, патент США № 4816567), технологии фагового дисплея (см., например, Clackson et al., Nature, 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1991); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073- 1093 (2004); Fellouse, Proc. Natl. Acad. Sei. USA 101(34): 12467-12472 (2004); and Lee et al., J. Immunol. Methods 284(1-2): 119-132(2004), и технологии получения человеческих антител или антител, подобных человеческим, у животных, которые имеют части или все локусы иммуноглобулинов человека или гены, кодирующие последовательности иммуноглобулинов человека (см., например, WO 1998/24893; WO 1996/34096; WO 1996/33735; WO 1991/10741; Jakobovits et ai, Proc. Natl. Acad. Sei. USA 90: 2551 (1993); Jakobovits et al., Nature 362: 255-258 (1993); Bruggemann et al., Year in Immunol. 7:33 (1993); патенты США №№ 5545807; 5545806; 5569825; 5625126; 5633425; и 5661016; Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-813 (1994); Fishwild et al., Nature Biotechnol. 14: 845-851 (1996); Neuberger, Nature Biotechnol. 14: 826 (1996); и Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995).
В настоящем документе моноклональные антитела, в частности, включают «химерные» антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из определенных видов или принадлежащих определенному классу или подклассу антител, в то время как оставшаяся часть цепи(ей) идентична или гомологична соответствующим последовательностям в антителах, полученных из других видов или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител при условии, что они проявляют требуемую биологическую активность (патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
«Гуманизированные» формы отличных от человеческих (например, мышиных) антител являются химерными антителами, которые содержат минимальную последовательность, полученную из отличного от человеческого иммуноглобулина. В основном, гуманизированные антитела являются человеческими иммуноглобулинами (реципиентным антителом), в которых остатки из гипервариабельной области реципиента замещены остатками из гипервариабельной области отличных от человеческих видов (донорного антитела), таких как мышиные, крысиные, кроличьи антитела или антитела отличных от человека приматов, имеющие желаемую специфичность, аффинность и функциональная активность. В некоторых случаях, остатки каркасной области (FR) человеческого иммуноглобулина замещены соответствующими, отличными от человеческих, остатками. Более того, гуманизированные антитела могут включать остатки, которые не обнаружены в реципиентом антителе или в донорном антителе. Данные модификации создают для дополнительного совершенствования функциональной активности антитела. В основном, гуманизированное антитело включает по существу весь по меньшей мере один и, как правило, два вариабельного домена, в которых все или по существу все гипервариабельные петли соответствуют таковым отличного от человеческого иммуноглобулина, и все или по существу все FR являются таковыми последовательности иммуноглобулина человека. Гуманизированное антитело в некоторых случаях также включает по меньшей мере часть константной области иммуноглобулина (Fc), как правило, иммуноглобулина человека. Дополнительные подробности см. у Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). См. также, например, Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994); и патенты США №№ 6982321 и 7097409. См. также van Dijk and van de Winkel, Curr. Opin. Pharmacol., 5: 368-74 (2001). Человеческие антитела могут быть получены введением антигена в трансгенное животное, которое было модифицировано для получения таких антител в ответ на антигенный стимул, но чьи эндогенные локусы были дезактивированы, например, у иммунизированных мышей (см., например, патенты США №№ 6075181 и 6150584 по вопросу технологии XENOMOUSETM). См. также, например, Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006) по вопросу человеческих антител, синтезированных посредством технологии с использованием В-клеточной гибридомы человека. Гуманизированное антитело может также включать антитело PrimatizedTM, где антигенсвязывающий участок антитела получен из антитела, продуцированного иммунизацией обезьян вида макака целевым антигеном.
«Человеческое антитело» - это антитело, которое обладает аминокислотной последовательностью, соответствующей таковой антитела, синтезированного у человека и/или созданного, используя любой метод создания человеческих антител, как указано в настоящем документе. Это определение человеческого антитела, в частности, исключает гуманизированное антитело, включающее отличные от человеческих антигенсвязывающие остатки. Человеческие антитела могут быть получены, используя различные методы, известные в данной области техники. В одном варианте осуществления изобретения человеческое антитело выбрано из фаговой библиотеки, где фаговая библиотека экспрессирует человеческие антитела (Vaughan et al. Nature Biotechnology 14:309-314 (1996): Sheets et al. PNAS (USA) 95:6157-6162 (1998)); Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991)). Человеческие антитела также могут быть получены введением локусов иммуноглобулинов человека в трансгенные животные, например, мышей, у которых эндогенные иммуноглобулиновые гены были частично или полностью инактивированы. В результате введения наблюдают продукцию антитела, которая напоминает таковую, обнаруживаемую у людей во всех отношениях, включая реаранжировку генов, сборку и репертуар антител. Этот подход описан, например, в патентах США №№ 5545807; 5545806; 5569825; 5625126; 5633425; 5661016 и в нижеприведенных научных публикациях: Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368:812-13 (1994); Fishwild et al., Nature Biotechnology 14: 845-51 (1996); Neuberger, Nature Biotechnology 14: 826 (1996); Lonberg and Huszar, Intern. Rev. Immunol. 13:65-93 (1995). Альтернативно, человеческое антитело может быть получено путем иммортализации В-лимфоцитов человека, продуцирующих антитело, направленное против целевого антигена (такие В-лимфоциты могут быть извлечены из индивидуума или могут быть иммунизированы in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol., 147 (1):86-95 (1991); и патент США № 5750373.
Антитело с «созревшей аффинностью» представляет собой таковое с одним или несколькими изменениями в одной или нескольких его CDR/HVR, что приводит к улучшению аффинности антитела к антигену по сравнению с исходным антителом, которое не обладает этим(и) изменением(ями). Предпочтительные антитела с созревшей аффинностью будут иметь наномолярные или даже пикомолярные аффинности к целевому антигену. Антитела с созревшей аффинностью получают с помощью методик, известных в данной области техники. Marks et al., Bio/Technology 10:779-783 (1992) описывает созревание аффинности путем перестановки домена VH и VL. Случайный мутагенез CDR/HVR и/или остатков каркасного участка описан в:Barbas et al., Proc Nat. Acad. Sci. USA 91:3809-3813 (1994); Schier et al., Gene 169:147-155 (1995); Yelton et al., J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 10 154(7):3310-9 (1995); и Hawkins et al., J. Mol. Biol. 226:889-896 (1992).
«Вариабельная область» или «вариабельный домен» антитела относится к аминоконцевым доменам тяжелой или легкой цепи антитела. Вариабельный домен тяжелой цепи может называться «VH». Вариабельный домен легкой цепи может называться «VL». Эти домены являются, в основном, наиболее вариабельными частями антитела и содержат антигенсвязывающие сайты.
Термин «вариабельный» относится к тому, что определенные части вариабельных доменов в значительной степени отличаются по последовательности среди антител и используются для связывания и специфичности каждого конкретного антитела в отношении его конкретного антигена. Однако вариабельность распределена неравномерно в вариабельных доменах антител. Она концентрируется в трех сегментах, названных определяющими комплементарность областями (CDR) или гипервариабельными областями (HVR) как в вариабельных доменах легкой цепи, так и тяжелой цепи. Наиболее высококонсервативные участки вариабельных доменов называются каркасными областями (FR). Каждый из вариабельных доменов нативной тяжелой и легкой цепей включает четыре FR, в основном имеющие бета-складчатую конфигурацию, соединенные тремя гипервариабельными областями, которые образуют петли, соединяя, и в некоторых случаях формируя часть, бета-складчатую структуру. Гипервариабельные области в каждой цепи поддерживаются вместе в тесной пространственной близости с помощью FR и, наряду с гипервариабельными областями из другой цепи, участвуют в образовании антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Константные домены напрямую не участвуют в связывании антитела с антигеном, но выполняют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности.
Термин «гипервариабельная область», «HVR» или «HV» в том смысле, в котором он здесь используется, относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Например, термин "гипервариабельная область" относится к областям вариабельного домена антитела, которые гипервариабельны по последовательности и/или образуют определяемые структурой петли. В основном, антитела включают шесть HVR; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). В нативных антителах, H3 и L3 проявляют наибольшую вариабельность в шести HVR, и Н3, в частности, по-видимому, играет уникальную роль в придании высокой специфичности антителам. См., например, Xu et al., Immunity 13:37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, NJ, 2003). Действительно, природные антитела семейства верблюдовых, состоящие только из тяжелой цепи, функциональны и стабильны в отсутствие легкой цепи. См., например, Hamers-Casterman et al., Nature 363:446-448 (1993); Sheriff et al., Nature Struct. Biol. 3:733-736 (1996).
«Легкие цепи» антител (иммуноглобулинов) любого вида позвоночных могут быть приписаны к одному из двух четко различаемых типов, названных каппа (κ) и лямбда (λ) на основе аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотных последовательностей константных доменов тяжелых цепей, антитела (иммуноглобулины) можно причислить к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно дополнительно разделить на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называют α, δ, ε, γ и µ, соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны и описаны в общих чертах, например, в Abbas et al., Cellular and Mol. Immunology, 4th ed. (2000). Антитело может быть частью большой слитой молекулы, образованной путем ковалентной или нековалентной связи антитела с одним или несколькими другими белками или пептидами.
Термин «область Fc» используется для определения С-концевой области тяжелой цепи иммуноглобулина, которая может быть образована при расщеплении папаином интактного антитела. Область Fc может быть областью Fc с нативной последовательностью или модифицированной областью Fc. Область Fc иммуноглобулина, в основном, включает два константных домена, домен СН2 и домен СН3, и в некоторых случаях включает домен СН4.
Под термином «цепь области Fc» понимают одну из двух полипептидных цепей области Fc.
«Домен СН2» области Fc IgG человека (также называемый доменом «Cg2») уникален в том, что он не находится в тесном парном взаимодействии с другим доменом. Точнее, две N-связанные разветвленные углеводные цепи вставлены между двумя доменами СН2 интактной нативной молекулы IgG. Было предположено, что углевод может обеспечить замену парного домен-доменного взаимодействия и помочь стабилизировать домен СН2. Burton, Molec. Immunol. 22:161-206 (1985). Домен СН2 в настоящем документе может представлять собой домен СН2 с нативной последовательностью или модифицированный домен СН2.
«Домен СН3» включает фрагмент остатков, С-концевых относительно домена СН2 в области Fc. Область СН3 в настоящем документе может представлять собой домен СН3 с нативной последовательностью или модифицированный домен СН3 (например, домен СН3 с внесенным «выступом» в одной его цепи и соответствующей внесенной «впадиной» в другой его цепи; см. патент США № 5821333, специально включенный в настоящий документ в качестве ссылки). Такие модифицированные домены СН3 могут быть использованы для создания мультиспецифичных (например, биспецифичных) антител, как описано в настоящем документе.
«Шарнирная область» в настоящем документе может представлять собой шарнирную область с нативной последовательностью или модифицированную шарнирную область. Две полипептидные цепи модифицированной шарнирной области, как правило, сохраняют по меньшей мере один остаток цистеина на полипептидную цепь таким образом, что две полипептидные цепи модифицированной шарнирной области могут образовать дисульфидную связь между двумя цепями. Предпочтительная шарнирная область в настоящем документе является человеческой шарнирной областью с нативной последовательностью, например, шарнирной областью IgG1 человека с нативной последовательностью.
«Функциональная область Fc» обладает по меньшей мере одной «эффекторной функцией» области Fc с нативной последовательностью. Иллюстративные «эффекторные функции» включают связывание C1q; комплементзависимая цитотоксичность (CDC); связывание рецептора Fc; антителозависимая клеточноопосредованная цитотоксичность (ADCC); фагоцитоз; отрицательная регуляция поверхностных клеточных рецепторов (например, В-клеточный рецептор; BCR) и т.д. Такие эффекторные функции, как правило, требуют объединения области Fc с доменом связывания (например, вариабельным доменом антитела), и им может быть дана оценка, используя различные методы, известные в данной области техники для оценки таких эффекторных функций антитела.
«Область Fc с нативной последовательностью» включает аминокислотную последовательность, идентичную природной аминокислотной последовательности области Fc. Области Fc человека с нативной последовательностью включают область Fc IgG1 человека с нативной последовательностью (отличные от А и А-аллотипы); область Fc IgG2 человека с нативной последовательностью; область Fc IgG3 человека с нативной последовательностью; и область Fc IgG4 человека с нативной последовательностью, а также природные варианты вышеперечисленного.
«Интактное» антитело - это то, которое включает антигенсвязывающую вариабельную область, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи, CH1, CH2 и CH3. Константные домены могут быть константными доменами с нативной последовательностью (например, константными доменами человека с нативной последовательностью) или вариантом аминокислотной последовательности вышеперечисленного. Предпочтительно, интактное антитело обладает одной или несколькими эффекторными функциями.
«Исходное антитело» или антитело «дикого типа» является антителом, включающим аминокислотную последовательность, у которой отсутствует одно или несколько изменений аминокислотной последовательности по сравнению с вариантом антитела, как рассмотрено в настоящем документе. Таким образом, исходное антитело, как правило, имеет по меньшей мере одну гипервариабельную область, которая отличается по аминокислотной последовательности от аминокислотной последовательности соответствующей гипервариабельной области модифицированного антитела, как рассмотрено в настоящем документе. Исходный полипептид может включать антитело (включая природный аллельный вариант) с нативной последовательностью (т.е. природной) или антитело с предсуществующими модификациями аминокислотной последовательности (такими как вставки, делеции и/или другие изменения) природной последовательности. Во всем описании изобретения антитело «дикого типа», «WT» и «исходное» или «являющееся источником» используются взаимозаменяемо.
«Вариант антитела» или «модифицированное антитело» в том смысле, в котором он здесь используется, относится к антителу, которое имеет аминокислотную последовательность, которая отличается от аминокислотной последовательности исходного антитела. Предпочтительно, вариант антитела включает вариабельный домен тяжелой цепи или вариабельный домен легкой цепи, имеющий неприродную аминокислотную последовательность. Такие варианты заведомо имеют менее 100% идентичности или подобия последовательности исходного антитела. В предпочтительном варианте осуществления изобретения вариант антитела будет иметь аминокислотную последовательность, обладающую приблизительно от 75% до менее 100% идентичности или подобия аминокислотной последовательности вариабельного домена либо тяжелой, либо легкой цепи исходного антитела, более предпочтительно приблизительно от 80% до менее 100%, более предпочтительно приблизительно от 85% до менее 100%, более предпочтительно приблизительно от 90% до менее 100% и наиболее предпочтительно приблизительно от 95% до менее 100%. Вариант антитела - это вариант, который, как правило, включает одно или несколько изменений аминокислот непосредственно в или рядом с одной или несколькими гипервариабельными областями вышеперечисленного.
«Модифицированная область Fc» включает аминокислотную последовательность, которая отличается от таковой области Fc с нативной последовательностью в силу по меньшей мере одной модификации аминокислоты. В определенных вариантах осуществления изобретения модифицированная область Fc имеет по меньшей мере одну аминокислотную замену по сравнению с областью Fc с нативной последовательностью или по сравнению с областью Fc исходного полипептида, например, приблизительно от одной до приблизительно десяти аминокислотных замен, и предпочтительно приблизительно от одной до приблизительно пяти аминокислотных замен в области Fc с нативной последовательностью или в области Fc исходного полипептида, например, приблизительно от одной до приблизительно десяти аминокислотных замен, и предпочтительно приблизительно от одной до приблизительно пяти аминокислотных замен в области Fc с нативной последовательностью или в области Fc исходного полипептида. Модифицированная область Fc в настоящем документе будет, как правило, обладать, например, как минимум приблизительно 80% идентичности по последовательности с областью Fc с нативной последовательностью и/или с областью Fc исходного полипептида, или по меньшей мере приблизительно 90% идентичности по последовательности с ними или по меньшей мере приблизительно 95% идентичности по последовательности или более с ними.
«Эффекторные функции» антитела относятся к тем биологическим активностям, связанным с областью Fc (область Fc с нативной последовательностью или модифицированная область Fc аминокислотной последовательности) антитела, и варьируют в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплементзависимая цитотоксичность (CDC); связывание рецептора Fc; антителозависимая клеточноопосредованная цитотоксичность (ADCC); фагоцитоз; отрицательная регуляция поверхностных клеточных рецепторов (например, В-клеточного рецептора); и активация В-клетки.
«Антителозависимая клеточноопосредованная цитотоксичность» или «ADCC» относится к форме цитотоксичности, при которой секретированный Ig, связанный с рецепторами Fc (FcR), находится на определенных цитотоксических клетках (например, клетках естественных киллеров (NK), нейтрофилах и макрофагах), дающий возможность этим цитотоксическим эффекторным клеткам специфически связываться с несущей антиген клеткой-мишенью и впоследствии убить клетку-мишень цитотоксинами. Основные клетки для опосредования ADCC, клетки NK, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках представлена в обобщенном виде в Таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Для оценки активности ADCC у представляющей интерес молекулы может быть выполнен анализ ADCC in vitro, как описано в патенте США № 5500362 или 5821337. Пригодные эффекторные клетки для таких тестов включают мононуклеарные клетки периферической крови (PBMC) и естественные клетки-киллеры (NK). Альтернативно, или дополнительно, активность ADCC у представляющей интерес молекулы может быть оценена in vivo, например, на животной модели, как описано Clynes et al. PNAS (USA) 95:652-656 (1998).
«Эффекторные клетки человека» представляют собой лейкоциты, которые экспрессируют один или несколько FcR и выполняют эффекторные функции. В определенных вариантах осуществления изобретения эти клетки экспрессируют по меньшей мере FcγRIII и выполняют эффекторную(ые) функцию(ии) ADCC. Примеры лейкоцитов человека, опосредующих ADCC, включают мононуклеарные клетки периферической крови (PBMC), естественные клетки-киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы; при этом предпочтительными, как правило, являются PBMC и клетки NK. Эффекторные клетки могут быть выделены из их естественного источника, например, из крови или PBMC, как описано в настоящем документе.
«Рецептор Fc» или «FcR» описывает рецептор, который связывается с областью Fc антитела. В некоторых вариантах осуществления изобретения FcR является нативным FcR человека. В некоторых вариантах осуществления изобретения FcR является таковым, который связывается с антителом IgG (рецептор гамма) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы этих рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют схожие аминокислотные последовательности, отличающиеся главным образом по их цитоплазматическим доменам. Активирующий рецептор FcγRIIA содержит мотив активации иммунорецептора на основе тирозина (ITAM) в его цитоплазматическом домене. Ингибирующий рецептор FcγRIIB содержит мотив ингибирования иммунорецептора на основе тирозина (ITIM) в его цитоплазматическом домене. (см., например, Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). FcR рассмотрены в обзоре, например, Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994);и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). Другие FcR, включая таковые, которые будут идентифицированы в будущем, объединены термином «FcR» в настоящем документе.
Термин «рецептор Fc» или «FcR» также включает неонатальный рецептор, FcRn, который отвечает за передачу материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)) и регуляцию гомеостаза иммуноглобулинов. Методы измерения связывания с FcRn известны (см., например, Ghetie and Ward., Immunol. Today 18(12):592-598 (1997); Ghetie et al., Nature Biotechnology, 15(7):637-640 (1997); Hinton et al., J. Biol. Chem. 279(8):6213-6216 (2004); WO 2004/92219 (Hinton et al.).
Связывание с FcRn человека in vivoи время полужизни в сыворотке крови полипептидов высокой аффинности связывания FcRn человека могут быть исследованы, например, в трансгенных мышах или трансфицированных клеточных линиях человека, экспрессирующих FcRn человека, или в приматах, которым вводятся полипептиды с модифицированной областью Fc. WO 2000/42072 (Presta) описывает варианты антитела с улучшенным или ослабленным связыванием с FcR. См. также, например, Shields et al. J. Biol. Chem. 9(2):6591-6604 (2001).
«Комплементзависимая цитотоксичность» или «CDC» относится к лизису клетки-мишени в присутствии комплемента. Активация классического пути с участием комплемента инициируется связыванием первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связываются с их антигеном узнавания. Для оценки активации комплемента может быть выполнен анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996). Полипептидные варианты с измененными аминокислотными последовательностями области Fc (полипептиды с модифицированной областью Fc) и увеличенная или пониженная способность связывания C1q описаны, например, в патенте США № 6194551 B1 и WO 1999/51642. См. также, например, Idusogie et al. J. Immunol. 164: 4178-4184 (2000).
Антитело с «созревшей аффинностью» представляет собой таковое с одним или несколькими изменениями в одной или нескольких его CDR, что приводит к улучшению аффинности антитела к антигену по сравнению с исходным антителом, которое не обладает этим(и) изменением(ями). В одном варианте осуществления изобретения антитело с созревшей аффинностью имеет наномолярные или даже пикомолярные аффинности к целевому антигену. Антитела с созревшей аффинностью получают с помощью методик, известных в данной области техники. Marks et al., Bio/Technology 10:779-783 (1992) описывает созревание аффинности путем перестановки доменов VH и VL. Случайный мутагенез CDR и/или остатков каркасного участка описан в: Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); и Hawkins et al, J. Mol. Biol. 226:889-896 (1992).
Термин «терапевтическое антитело» относится к антителу, которое используется в лечении заболевания. Терапевтическое антитело может иметь различные механизмы действия. Терапевтическое антитело может связываться и нейтрализовать нормальную функцию мишени, ассоциированной с антигеном. Например, моноклональное антитело, которое блокирует активность белка, необходимого для выживания раковой клетки, вызывает клеточную гибель. Другое терапевтическое моноклональное антитело может связываться и активировать нормальную функцию мишени, ассоциированной с антигеном. Например, моноклональное антитело может связываться с белком на поверхности клетки и инициировать сигнал апоптоза. Еще одно моноклональное антитело может связываться с целевым антигеном, экспрессирумым только в пораженной ткани; конъюгирование токсического вещества (эффективного вещества), такого как химиотерапевтического или радиоактивного вещества, с моноклональным антителом может обусловливать создание средства для специфической доставки токсического вещества к пораженной ткани, уменьшая отрицательное воздействие на здоровую ткань. «Биологически функциональный фрагмент» терапевтического антитела будет проявлять по меньшей мере одну, если не все или некоторые из биологических функций, свойственных интактному антителу, функцию, включающую по меньшей мере специфическое связывание с целевым антигеном.
Антитело может связываться с любым белком, включая, помимо прочего, члена семейства рецепторов HER, таких как HER1 (EGFR), HER2, HER3 и HER4; белки CD, такие как CD3, CD4, CD8, CD19, CD20, CD21, CD22 и CD24; молекулы клеточной адгезии, такие как LFA-1, Mol, p150,95, VLA-4, ICAM-1, VCAM и av/p3 интегрин, включая либо α, либо β, либо субъединицы вышеперечисленного (например, антитела против CD11a, против CD18 или против CD11b); ростовые факторы, такие как фактор роста сосудистого эндотелия (VEGF); IgE; антигены группы крови; рецептор flk2/flt3; рецептор ожирения (OB); и протеин С. Другие иллюстративные белки включают гормон роста (GH), включая гормон роста человека (hGH) или гормон роста крупного рогатого скота (bGH); фактор высвобождения гормона роста; паратиреоидный гормон; тиреотропный гормон; липопротеины; α-1-антитрипсин; А-цепь инсулина; В-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, такие как фактор VIIIC, фактор, тканевой фактор и фактор Виллебранда; противосвертывающие факторы, такие как протеин С; предсердный натрийуретический фактор; сурфактант легкого; активатор плазминогена, такой как урокиназа или активатор плазминогена тканевого типа (t-PA); бомбезин; тромбин; фактор некроза опухолей α и β; энкефалиназу; RANTES (регулируемый при активации нормальных Т-клеток, его экспрессирующих и секретирующих); макрофагальный белок воспаления человека (MIP-1-α); сывороточный альбумин, такой как сывороточный альбумин человека (HSA); мюллеров ингибирующий фактор; А-цепь релаксина; В-цепь релаксина; прорелаксин; мышиный гонадотропин-ассоциированный пептид; ДНКаза; ингибин; активин; рецепторы к гормонам или ростовым факторам; интегрин; протеин А или D; ревматоидные факторы; нейротрофический фактор, такой как костный нейротрофический фактор (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6), или фактор роста нервов, такой как NGF-β; тромбоцитарный ростовой фактор (PDGF); фактор роста фибробластов, такой как aFGF и bFGF4; эпидермальный ростовой фактор (EGF); трансформирующий ростовой фактор (TGF), такой как TGF-α и TGF-β, включая TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулиноподобный ростовой фактор-I и -II (IGF-I и IGF-II); des(1-3)-IGF-I (мозговой IGF-I); связывающие инсулиноподобный ростовой фактор белки (IGFBP); эритропоэтин (EPO); тромбопоэтин (ТРО); остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-α, -β и -γ; колониестимулирующие факторы (CSF), например, M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например, IL-1 - IL-10; супероксиддисмутазу; Т-клеточные рецепторы; поверхностные мембранные белки; комплементзависимый стимулятор гемолиза (DAF); вирусный антиген, такой как, например, часть оболочки AIDS; транспортные белки; «хоминг»-рецепторы; аддрессины; регуляторные белки; иммуноадгезины; антитела; и биологически активные фрагменты или варианты любого из вышеперечисленных полипептидов. Многие другие антитела и/или другие белки могут быть использованы в соответствии с настоящим изобретением, и представленный выше список не означает, что он является ограниченным.
Терапевтические антитела, представляющие особый интерес, включают таковые, которые используются в клинической онкологической практике или развитии, такие как коммерчески доступные AVASTIN® (бевацизумаб), HERCEPTIN® (трастузумаб), LUCENTIS® (ранибизумаб), RAPTIVA® (эфализумаб), RITUXAN® (ритуксимаб), и XOLAIR® (омализумаб), а также, анти-бета-амилоид (Abeta), анти-CD4 (MTRX1011A), анти-EGFL7 (EGF-подобный домен 7), анти-IL13, Apomab (нацеленный против DR5 агонист проапоптотического рецептора (PARA), анти-BR3 (CD268, BLyS рецептор 3, BAFF-R, рецептор BAFF), анти-бета 7 субъединицы интегрина, дацетузумаб (анти-CD40), GA101 (анти-CD20 моноклональное антитело анти-CD20), MetMAb (анти-тирозинкиназный рецептор MET), анти-нейрофилин-1 (NRP1), окрелизумаб (антитело анти-CD20), анти-лиганд ОХ40, анти-LDL окисленной формы (oxLDL), пертузумаб (ингибиторы димеризации HER (HDI) и rhuMAb IFN альфа.
«Биологически функциональный фрагмент» антитела включает только часть интактного антитела, где данная часть сохраняет по меньшей мере одну и вплоть до большей части или всех функций, как правило, ассоциированных с данной частью в составе интактного антитела. В одном варианте осуществления изобретения биологически функциональный фрагмент антитела включает антигенсвязывающий сайт интактного антитела и, тем самым, сохраняет способность связывать антиген. В другом варианте осуществления изобретения биологически функциональный фрагмент антитела, например, это тот, который включает область Fc, сохраняет по меньшей мере одну из биологических функций, как правило, ассоциированных с областью Fc в составе интактного антитела, таких как связывание FcRn, модуляция времени полужизни антитела, функция ADCC и связывание комплемента. В одном варианте осуществления изобретения биологически функциональный фрагмент антитела представляет собой моновалентное антитело, которое имеет время полужизни in vivo, в основном подобное таковому интактного антитела. Например, такой биологически функциональный фрагмент антитела может включать антигенсвязывающее плечо, соединенное с последовательностью Fc, способное придавать стабильность in vivo фрагменту.
Термин «диагностический белок» относится к белку, который используется в диагностике заболевания.
Термин «диагностическое антитело» относится к антителу, которое используется в качестве диагностического реагента для заболевания. Диагностическое антитело может связываться с целевым антигеном, который специфически ассоциирован с определенным заболеванием или демонстрирует увеличенную экспрессию при данном заболевании. Диагностическое антитело может быть использовано, например, для обнаружения мишени в биологическом образце, взятом у пациента, или для диагностической визуализации пораженных участков, таких как опухоли, у пациента. «Биологически функциональный фрагмент» диагностического антитела будет проявлять по меньшей мере одну, если не все или некоторые из биологических функций, свойственных интактному антителу, функцию, включающую по меньшей мере специфическое связывание с целевым антигеном.
«Очищенная» означает, что молекула находится в образце в концентрации по меньшей мере 80-90% по весу образца, в котором она содержится. Белок, включая антитела, который является очищенным, предпочтительно является по существу беспримесным и в соответствии с требованиями по существу гомогенным (т.е. свободен от контаминирующих белков и т.п.).
Под «по существу беспримесным» белком понимают композицию белка, включающую по меньшей мере приблизительно 90% по весу белка, исходя из общего веса композиции, предпочтительно по меньшей мере приблизительно 95% по весу.
Под «по существу гомогенным» белком понимают композицию белка, включающую по меньшей мере приблизительно 99% по весу белка, исходя из общего веса композиции.
«Растворимый» в том смысле, в котором он здесь используется, относится к полипептидам, которые в водных растворах полностью растворяются с образованием прозрачного раствора с возможной незначительной опалесценцией без видимых частиц при визуальном рассмотрении. Дополнительный анализ мутности раствора (или растворимости белка) может быть выполнен путем измерения поглощения в УФ-области в диапазоне от 340 нм до 360 нм с длиной поглощающего слоя ячейки в 1 см, где мутность при 20 мг/мл составляет менее 0,05 оптических единиц.
«Изолированное» антитело или полипептид - это те, что были идентифицированы и выделены и/или извлечены из компонента его естественной окружающей среды. Контаминирующие компоненты его естественной окружающей среды представляют собой вещества, которые мешают исследованию, диагностическому или терапевтическому использованию антитела, и могут включать ферменты, гормоны и другие белковоподобные или небелковоподобные растворенные вещества. В некоторых вариантах осуществления изобретения антитело очищено до степени (1) более чем 95% по весу антитела, как определено, например, методом Лоури, и в некоторых вариантах осуществления изобретения - более чем 99% по весу; (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности путем использования, например, секвенатора с вращающимся стаканом, или (3) до гомогенности методом SDS-PAGE в восстанавливающих или невосстанавливающих условиях, используя, например, окрашивание кумасси голубым или серебром. Изолированное антитело включает антитело in situ в рекомбинантных клетках, так как, по крайней мере, один компонент естественной окружающей среды антитела не будет присутствовать. Как правило, однако, изолированное антитело получают в ходе по меньшей мере одного этапа очистки.
Термины «Протеин А» и «ProA» используются взаимозаменяемо в настоящем документе и подразумевают Протеин А, выделенный из его природного источника, Протеин А, синтезированный искусственным образом (например, путем пептидного синтеза или путем рекомбинантных технологий), и его варианты, которые сохраняют способность связываться с белками, которые имеют область CH2/CH3, такую как область Fc. Протеин А может быть приобретен коммерческим способом у Repligen, Pharmacia и Fermatech. Протеин А, как правило, иммобилизован на твердофазном материале подложки. Термин «ProA» также относится к смоле или колонке аффинной хроматографии, содержащей матрикс хроматографической твердой подложки, к которому ковалентно присоединен Протеин А.
Термин «хроматография» относится к процессу, посредством которого представляющее интерес растворенное вещество в смеси отделяют от других растворенных веществ в смеси вследствие различия скоростей, с которыми индивидуальные растворенные вещества смеси мигрируют через стационарную среду под влиянием подвижной фазы, или процессов связывания и элюирования.
Термины «аффинная хроматография» или «белковая аффинная хроматография» используются взаимозаменяемо в настоящем документе и относятся к способу разделения белков, в котором представляющий интерес белок или представляющее интерес антитело обратимо и специфически связываются с биоспецифическим лигандом. Предпочтительно, биоспецифический лиганд ковалентно связан с хроматографическим твердофазным материалом и доступен для представляющего интерес белка в растворе, поскольку раствор контактирует с хроматографическим твердофазным материалом. Представляющий интерес белок (например, антитело, фермент или рецепторный белок) сохраняет свою специфическую аффинность связывания для биоспецифического лиганда (антигена, субстрата, кофактора или гормона, например) во время этапов хроматографии, в то время как другие растворенные вещества и/или белки в смеси не связываются в значительной степени или специфически с лигандом. Связывание представляющего интерес белка с иммобилизованным лигандом позволяет контаминирующим белкам или белковым примесям проходить через хроматографическую среду, в то время как представляющий интерес белок остается специфически связанным с иммобилизованным лигандом на твердофазном материале. Специфически связанный представляющий интерес белок затем удаляется в активной форме от иммобилизованного лиганда посредством низких значений рн, высоких значений рН, высоких концентраций соли, конкурирующего лиганда и т.п., и проходит через хроматографическую колонку вместе с элюирующим буфером, свободный от контаминирующих белков или белковым примесей, которым ранее была дана возможность пройти сквозь колонку. Любой компонент может быть использован в качестве лиганда для очистки его соответствующего специфически связывающегося белка, например, антитела.
Термины «не являющаяся аффинной хроматография» или «не являющаяся аффинной очистка» относятся к процессу очистки, в котором аффинная хроматография не используется. Не являющаяся аффинной хроматография включает способ хроматографии, который основан на неспецифических взаимодействиях представляющей интерес молекулы (такой как белок, например, антитело) с твердофазной матриксом.
«Катионообменная смола» относится к твердой фазе, которая отрицательно заряжена и которая, таким образом, имеет свободные катионы для обмена с катионами в водном растворе, проходящего над твердой фазой или через нее. Отрицательно заряженный лиганд, присоединенный к твердой фазе для образования катионообменной смолы, может, например, быть карбоксилатом или сульфонатом. Имеющиеся в продаже катионообменные смолы включают карбоксиметилцеллюлозу, сульфопропил (SP), иммобилизованный на агарозе (например, SP-SEPHAROSE FAST FLOWTM или SP-SEPHAROSE HIGH PERFORMANCETM производства Pharmacia), и сульфонил, иммобилизованный на агарозе (например, S-SEPHAROSE FAST FLOWTM производства Pharmacia). «Смешанная форма ионообменной смолы» относится к твердой фазе, которая ковалентно модифицирована катионными, анионными и гидрофобными молекулами. Имеющаяся в продаже смешанная форма ионообменной смолы представляет собой BAKERBOND ABXTM (J.T. Baker, Phillipsburg, NJ), содержащая слабые катионообменные группы, низкую концентрацию анионообменных групп и гидрофобные лиганды, связанные с силикагелевым твердофазным матриксом подложки.
Термин «анионообменная смола» используется в настоящем документе для обозначения твердой фазы, которая является положительно заряженной, например, имеющая один или несколько положительно заряженных лигандов, таких как четвертичные аминогруппы, прикрепленных к ней. Имеющиеся в продаже анионообменные смолы включают DEAE-целлюлозу, QAE SEPHADEXTMиFAST Q SEPHAROSETM (Pharmacia).
«Буфер» является раствором, который препятствует изменениям рН посредством действия его кислотно-основных сопряженных компонентов. Различные буферы, которые могут быть использованы в зависимости, например, от требуемого значения рН буфера, описаны в Buffers. A Guide for the Preparation and Use of Buffers in Biological Systems, Gueffroy, D., ed. Calbiochem Corporation (1975). В одном варианте осуществления изобретения буфер имеет значение рН в диапазоне приблизительно от 2 до приблизительно 9, альтернативно приблизительно от 3 до приблизительно 8, альтернативно приблизительно от 4 до приблизительно 7, альтернативно приблизительно от 5 до приблизительно 7. Не имеющие ограничительного характера примеры буферов, которые будут контролировать рН в этом диапазоне, включают MES, MOPS, MOPSO, Tris, HEPES, фосфатный, ацетатный, цитратный, сукцинатный и аммиачный буфер, а также их комбинации.
«Загрузочный буфер» - это тот, который используется для нанесения композиции, включающей представляющую интерес молекулу полипептида и одну или несколько примесей на ионообменную смолу. Загрузочный буфер имеет такие электропроводность и/или рН, при которых представляющая интерес молекула полипептида (и, как правило, одна или несколько примесей) связывает(ют)ся с ионообменной смолой, или при которых представляющий интерес белок проходит через колонку, в то время как примеси связываются со смолой.
«Промежуточный буфер» используется для элюирования одной или нескольких примесей с ионообменной резины до элюирования представляющей интерес молекулы полипептида. Промежуточный буфер имеет такие электропроводность и/или рН, при которых происходит элюирование одной или нескольких примесей с ионообменной смолы, но не значительных количеств представляющего интерес полипептида.
Термин «промывочный буфер» в том смысле, в котором он здесь используется, относится к буферу, используемому для промывания или повторного уравновешивания ионообменной смолы до элюирования представляющей интерес молекулы полипептида. Для удобства промывочный буфер и загрузочный буфер могут быть одинаковыми, но это не требуется.
«Элюирующий буфер» используется для элюирования представляющего интерес полипептида с твердой фазы. Элюирующий буфер имеет такие электропроводность и/или рН, при которых происходит элюирование представляющего интерес полипептида с ионообменной смолы.
«Регенерирующий буфер» может быть использован для регенерации ионообменной смолы таким образом, чтобы обеспечить ее повторное использование. Регенерирующий буфер имеет такие электропроводность и/или рН, какие необходимы для удаления по существу всех примесей и представляющего интерес полипептида с ионообменной смолы.
Термин «по существу подобный» или «по существу одинаковый» в том смысле, в котором он здесь используется, означает достаточно высокую степень сходства между двумя численными величинами (например, одной величиной, имеющей отношение к антителу по изобретению, и другой, имеющей отношение к белку контроля/сравнения), такую, что специалист в данной области техники расценит различие между этими двумя величинами как незначительное или с отсутствующей биологической и/или статистической значимостью в рамках биологических характеристик, измеряемых указанными величинами (например, величинами Kd). Различие между указанными двумя величинами составляет, например, приблизительно менее 50%, приблизительно менее 40%, приблизительно менее 30%, приблизительно менее 20% и/или приблизительно менее 10% в зависимости от величины контроля/сравнения.
Фраза «значительно сниженный» или «значительно отличающийся» в том смысле, в котором она здесь используется в отношении количеств или численных величин (и не в качестве ссылки на химический процесс восстановления), означает значительно высокую степень различия между двумя численными величинами (как правило, одной величиной, имеющей отношение к молекуле, и другой величиной, имеющей отношение к молекуле контроля/сравнения), такую, что специалист в данной области техники расценит различие между этими двумя величинами как статистически значимое в рамках биологических характеристик, измеряемых указанными величинами (например, величинами Kd). Различие между указанными двумя величинами составляет, например, приблизительно более 10%, приблизительно более 20%, приблизительно более 30%, приблизительно более 40% и/или приблизительно более 50% в зависимости от величины для молекулы контроля/сравнения.
Термин «вектор» в том смысле, в котором он здесь используется, предназначен для обозначения молекулы нуклеиновой кислоты, способной переносить другую нуклеиновую кислоту, к которой она присоединена. Один тип вектора представляет собой «плазмиду», которая относится к кольцевой двухцепочечной ДНК, в которую могут быть лигированы дополнительные сегменты ДНК. Другим типом вектора является вектор на основе фага. Другим типом вектора является вирусный вектор, где дополнительные сегменты ДНК могут быть лигированы в вирусный геном. Определенные векторы способны к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы, имеющие бактериальную точку начала репликации, и эписомальные векторы млекопитающих). Другие векторы (например, отличные от эписомальных векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина в результате введения в клетку-хозяина, и вследствие этого реплицируются наряду с геномом хозяина. Более того, определенные векторы способны управлять экспрессией генов, с которыми они функционально связаны. Такие векторы относятся в настоящем документе к «рекомбинантным экспрессионным векторам» или просто к «экспрессионным векторам». В основном, используемые экспрессионные векторы в технологиях рекомбинантной ДНК часто представлены в форме плазмид. В настоящем описании изобретения «плазмида» и «вектор» могут быть использованы взаимозаменяемо, так как плазмида является наиболее часто используемой формой вектора.
«Процент (%) идентичности аминокислотной последовательности» относительно сравниваемой полипептидной последовательности определяют как процент аминокислотных остатков в кандидатной последовательности, которые идентичны аминокислотным остаткам в сравниваемой полипептидной последовательности, после выравнивания последовательностей и введения пропусков, где это необходимо, для достижения максимального процента идентичности последовательностей и не рассматривая какие-либо консервативные замены как часть идентичности последовательности. Выравнивание последовательностей с целью определения процента идентичности аминокислотной последовательности может быть осуществлено различными способами в рамках практического опыта в данной области техники, например, используя общедоступные компьютерные программы, такие как программы BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить подходящие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального совмещения при выравнивании по всей длине сравниваемых последовательностей. Для предусмотренных в настоящем документе целей, однако, величины % идентичности по аминокислотной последовательности получают, используя компьютерную программу ALIGN-2 сравнения последовательностей. Компьютерная программа ALIGN-2 сравнения последовательностей была создана Genentech, Inc., и исходный текст программы был представлен с пользовательской документацией в ведомство по охране авторского права США, Вашингтон, округ Колумбия, 20559, где он был зарегистрирован под номером регистрации авторского права США TXU510087. Программа ALIGN-2 общедоступна от Genentech, Inc., South San Francisco, California, или может быть составлена из исходного текста программы. Программу ALIGN-2 следует составлять для использования в операционной системе UNIX, предпочтительно цифровой UNIX V4.0D. Все параметры сравнения последовательностей установлены программой ALIGN-2 и не меняются.
В ситуациях, где ALIGN-2 используется для сравнений аминокислотных последовательностей, % идентичности по аминокислотной последовательности данной аминокислотной последовательности А по отношению к, с или против данной аминокислотной последовательности В (что может быть альтернативно перефразировано как данная аминокислотная последовательность А, которая имеет или включает определенный % идентичности по аминокислотной последовательности по отношению к, с или против данной аминокислотной последовательности В) вычисляют следующим образом:
100 умноженное на долю X/Y, где Х представляет собой число аминокислотных остатков, посчитанное как идентичные пары программой ALIGN-2 выравнивания последовательностей при сопоставлении программой А и В, и где Y представляет собой общее число аминокислотных остатков в В.
Следует иметь в виду, что в случае, если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, % идентичности аминокислотной последовательности А по отношению к В не будет равен % идентичности аминокислотной последовательности В по отношению к А. Если не указано иное, все величины % идентичности аминокислотных последовательностей, используемые в настоящем документе, получены, как описано в непосредственно предшествующем параграфе, используя компьютерную программу ALIGN-2.
«Процент (%) идентичности последовательностей нуклеиновых кислот» определяют как процент нуклеотидов в кандидатной последовательности, которые идентичны нуклеотидам в сравниваемой кодирующей Фактор D последовательности, после выравнивания последовательностей и введения пропусков, где это необходимо, для достижения максимального процента идентичности последовательностей. Выравнивание последовательностей с целью определения процента идентичности последовательностей нуклеиновых кислот может быть осуществлено различными способами в рамках практического опыта в данной области техники, например, используя общедоступные компьютерные программы, такие как программы BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить подходящие параметры для оценки выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального совмещения при выравнивании по всей длине сравниваемых последовательностей. Идентичность последовательностей затем вычисляется относительно более длинной последовательности, т.е. даже если более короткая последовательность демонстрирует 100% идентичность по последовательности с частью более длинной последовательности, общая идентичность по последовательность будет менее 100%.
«Лечение» относится как к терапевтическому лечению, так и профилактическим или превентивным мерам. Нуждающиеся в лечении включают тех, что уже страдают заболеванием, а также тех, у которых заболевание подлежит профилактике. «Лечение» подразумевает облегчение течения заболевания и признаков и симптомов определенного заболевания.
«Нарушением» является любое состояние, при котором наблюдают положительный результат от лечения белком. Оно включает хронические и острые нарушения или заболевания, включая те патологические состояния, предрасполагающие млекопитающих к развитию рассматриваемого нарушения. Не имеющие ограничительного характера примеры нарушений, подлежащих лечению, в настоящем документе включают карциномы и аллергии.
«Млекопитающее» для лечебных целей относится к любому животному, классифицируемому как млекопитающее, включая людей, отличных от человека высших приматов, других позвоночных, домашних и сельскохозяйственных животных, и животных зоопарка, спортивных состязаний или домашних животных, таких как собаки, лошади, кошки, коровы и т.д. Предпочтительно млекопитающим является человек.
B. Иллюстративные методы и материалы для осуществления изобретения
Для практического осуществления настоящего изобретения применяют, если не указано иное, общепринятые методы молекулярной биологии и тому подобное, которые находятся в рамках специализации в данной области техники. Такие методы подробно описаны в литературе. См., например, Molecular Cloning: A Laboratory Manual, (J. Sambrook et al., Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 1989); Current Protocols in Molecular Biology (F. Ausubel et al., eds., 1987 updated); Essential Molecular Biology (T. Brown ed., IRL Press 1991); Gene Expression Technology (Goeddel ed., Academic Press 1991); Methods for Cloning and Analysis of Eukarvotic Genes (A. Bothwell et al., eds., Bartlett Publ. 1990); Gene Transfer and Expression (M. Kriegler, Stockton Press 1990); Recombinant DNA Methodology II (R. Wu et al., eds., Academic Press 1995); PCR: A Practical Approach (M. McPherson et al., IRL Press at Oxford University Press 1991); Oligonucleotide Synthesis (M. Gait ed., 1984); Cell Culture for Biochemists (R. Adams ed., Elsevier Science Publishers 1990); Gene Transfer Vectors for Mammalian Cells (J. Miller & M. Calos eds., 1987); Mammalian Cell Biotechnology (M. Butler ed., 1991); Animal Cell Culture (J. Pollard et al., eds., Humana Press 1990); Culture of Animal Cells. 2nd Ed. (R. Freshney et al., eds., Alan R. Liss 1987); Flow Cytometry and Sorting (M. Melamed et al., eds., Wiley-Liss 1990); серии Methods in Enzvmology (Academic Press, lnc.); Wirth M. and Hauser H. (1993); Immunochemistrv in Practice. 3rd edition, A. Johnstone & R. Thorpe, Blackwell Science, Cambridge, MA, 1996; Techniques in Immunocytochemistry. (G. Bullock & P. Petrusz eds., Academic Press 1982, 1983, 1985, 1989); Handbook of Experimental Immunology, (D. Weir & C. Blackwell, eds.); Current Protocols in Immunology (J. Coligan et al., eds. 1991); Immunoassay (E. P. Diamandis & Т.К. Christopoulos, eds., Academic Press, Inc., 1996); Goding (1986) Monoclonal Antibodies: Principles and Practice (2d ed) Academic Press, New 10 York; Ed Harlow and David Lane, Antibodies A laboratory Manual. ColdSpringHarbor Laboratory, Cold Spring Harbor, New York, 1988; Antibody Engineering. 2nd edition (C. Borrebaeck, ed., Oxford University Press, 1995); и серии Annual Review of Immunology, серии Advances in Immunology.
1. Рекомбинантное получение белков в клетках-хозяевах млекопитающего, используя клеточную культуральную среду без глутамина
Настоящее изобретение затрагивает широкомасштабное рекомбинантное получение белков в клетках-хозяевах млекопитающего, используя клеточную культуральную среду без глутамина, дополненную аспарагином. Клетки млекопитающих стали доминирующей системой для получения белков млекопитающих для применения в медицинской практике, главным образом вследствие их способности продуцировать правильно уложенные и собранные гетерологичные белки и наличия у них возможности для посттрансляционных модификаций. Клетки яичника китайского хомячка (СНО) и клеточные линии, полученные из различных других источников млекопитающих, таких как, например, миелома мыши (NS0), почки новорожденного хомяка (BHK), эмбриональная почка человека (HEK-293) и клетки сетчатки глаза человека, были одобрены контролирующими органами для производства биофармацевтических продуктов, включая терапевтические антитела. Из них клетки яичника китайского хомячка (СНО) являются наиболее часто используемыми промышленными хозяевами, которые широко применяются для получения гетерологичных белков. Таким образом, методы для широкомасштабного производства антител в СНО, включая лишенные дигидрофолатредуктазы (DHFR-) клетки СНО, хорошо известны в данной области техники (см., например, Trill et al., Curr. Opin. Biotechnol. 6(5):553-60 (1995) и патент США № 6610516).
На первом этапе, нуклеиновая кислота (например, кДНК или геномная ДНК), кодирующая требуемый рекомбинантный белок, может быть вставлена в реплицируемый вектор для клонирования (амплификации ДНК) или для экспрессии. Различные векторы являются общедоступными. Компоненты вектора, как правило, включают, помимо прочего, одно или несколько из нижеприведенного: сигнальную последовательность, точку начала репликации, один или несколько маркерных генов, энхансер, промотор и последовательность терминации транскрипции, каждый из которых описан ниже. Выбираемые сигнальные последовательности, точки начала репликации, маркерные гены, энхансеры и последовательности терминации транскрипции, которые могут быть использованы, известны в данной области техники и описаны более подробно в РСТ публикации WO 97/25428.
Векторы для клонирования и экспрессии обычно содержат промотор, который распознается организмом-хозяином и функционально связан с кодирующей белок последовательностью нуклеиновой кислоты. Промоторы представляют собой нетранслируемые последовательности, расположенные выше (5’) стартового кодона структурного гена (как правило, в пределах приблизительно от 100 до 1000 п.о.), которые контролируют транскрипцию и трансляцию определенной последовательности нуклеиновой кислоты, с которой они функционально связаны. Такие промоторы обычно делятся на два класса, индуцибельные и конститутивные. Индуцибельные промоторы являются промоторами, которые инициируют повышенные уровни транскрипции ДНК под их контролем в ответ на некоторое изменение в условиях культивирования, например, наличие или отсутствие питательного вещества или изменение температуры. На данный момент огромное количество промоторов, распознаваемых целым рядом клеток-хозяев, хорошо известно. Эти промоторы функционально связаны с ДНК, кодирующей требуемый белок, путем извлечения промотора из исходной ДНК посредством расщепления ферментом рестрикции и вставки изолированной последовательности промотора в вектор.
Промоторы, пригодные для использования прокариотическими и эукариотическими хозяевами, известны в данной области техники и описаны более подробно в РСТ публикации № WO97/25428.
Для создания пригодных векторов, содержащих один или несколько из вышеперечисленных компонентов, используют стандартные методы лигирования. Изолированные плазмиды или фрагменты ДНК расщепляют, подгоняют и повторно лигируют в той форме, которая требуется для образования заданной плазмиды.
Для анализа с целью подтверждения корректности последовательностей в конструируемых плазмидах смеси реакции лигирования могут быть использованы для трансформации клеток E. coli, таких как штамм 294 E. coli K12 (ATCC® 31446) и удачные трансформанты, отобранные по устойчивости к ампициллину или тетрациклину в случае необходимости. Плазмиды из трансформантов подготавливают, анализируют расщеплением рестрикционной эндонуклеазой и/или секвенируют, используя стандартные методы, известные в данной области техники. (См., например, Messing et al., Nucleic Acids Res. 1981, 9:309; Maxam et al., Methods in Enzymology 1980, 65:499).
Могут быть использованы экспрессионные векторы, предусмотренные для временной экспрессии в клетках млекопитающих. Как правило, временная экспрессия предполагает использование экспрессионного вектора, который способен эффективно реплицироваться в клетке-хозяине таким образом, что клетка-хозяин накапливает множество копий экспрессионного вектора и, в свою очередь, синтезирует высокие уровни требуемого полипептида, кодируемого экспрессионным вектором (Sambrook et al., см.выше). Системы временной экспрессии, включающие пригодный экспрессионный вектор и клетку-хозяина, создают возможность для удобной положительной идентификации полипептидов, кодируемых клонированными кДНК, а также для быстрого скрининга таких полипептидов по требуемым биологическим или физиологическим свойствам.
Другие методы, векторы и клетки-хозяева, пригодные для приспособления к синтезу требуемого гетерологичного белка в рекомбинантной клеточной культуре позвоночных, описаны в Gething et al., Nature 1981, 293:620-625; Mantei et al., Nature 1979, 281:40-46; EP 117060; и EP 117058.
Для широкомасштабного производства в соответствии с настоящим изобретением клетки-хозяева млекопитающих трансфицируют и предпочтительно трансформируют вышеописанными экспрессионными векторами и культивируют в питательных средах, модифицированных соответствующим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих требуемые последовательности.
Трансфекция относится к захвату экспрессионного вектора клеткой-хозяином вне зависимости от того, экспрессируются ли в действительности какие-либо кодирующие последовательности или нет. Многочисленные методы трансфекции известны обычному специалисту в данной области техники, например, CaPO4 и электропорация. Трансфекцию считают удачно проведенной, как правило, когда имеет место любое указание на функционирование этого вектора в клетке-хозяине.
Трансформация означает введение ДНК в организм таким образом, что ДНК способна к репликации либо в качестве внехромосомного элемента, либо как составная часть хромосомы. В зависимости от используемой клетки-хозяина, трансформацию выполняют, используя стандартные методы, подходящие для таких клеток. Обработка кальцием, применяя хлорид кальция, как описано у Sambrook et al., см. выше, или электропорация, как правило, используется для прокариот или других клеток, которые содержат прочный барьер в виде клеточной стенки. Заражение опухолеобразующей агробактерией используется для трансформации определенных клеток растений, как описано (Shaw et al., Gene 1983, 23:315 и РСТ публикация № WO 89/05859). Кроме того, растения могут быть трансфицированы, используя обработку ультразвуком, РСТ публикация № WO 91/00358, опубликованная 10 января 1991 года.
Для клеток млекопитающих без таких клеточных стенок может быть применен метод осаждения фосфатом кальция (Graham and van der Eb, Virology 1978, 52:456-457). Основные аспекты трансформации систем клеток-хозяев млекопитающих описаны в патенте США № 4399216. Различные методики трансформации клеток млекопитающих см. также у Keown et al. Methods in Enzymology 1990, 185:527-537 и Mansour et al. Nature 1988, 336:348-352.
Во время широкомасштабного производства для начала производственного цикла, как правило, обеспечивают рост небольшого количества трансформированных рекомбинантных клеток-хозяев в культуре в течение нескольких дней. Как только клетки проходят несколько циклов репликации, их переносят в больший контейнер, где их подготавливают для культивирования. Среды, в которых клетки выращивают, и уровни кислорода, азота и углекислого газа, существующие во время производственного цикла, могут оказывать значительное влияние на способ получения. Параметры роста определяют специально для каждой клеточной линии, и неоднократно измеряют эти параметры для обеспечения оптимального роста и условий производства.
Когда число клеток достигает достаточного количества, их переносят в емкости для широкомасштабного производства, чтобы начать фазу продукции, и выращивают более длительный период времени. На этом этапе способа может быть извлечен рекомбинантный белок. Как правило, клетки проектируют для секреции полипептида в культуральные клеточные среды, таким образом, первым этапом процесса очистки является отделение клеток от среды. Сбор продуктов обычно включает центрифугирование и фильтрацию для получения собранной культуральной жидкости (HCCF). Среду затем подвергают нескольким дополнительным этапам очистки для удаления клеточного дебриса, нежелательных белков, солей, минералов или других нежелательных элементов. К концу процесса очистки рекомбинантный белок является высокоочищенным и пригоден для терапевтического использования у человека.
Хотя этот способ был предметом значительной части исследований и усовершенствований за последние несколько десятилетий, возможны дальнейшие усовершенствования широкомасштабного коммерческого получения рекомбинантных белков, таких как антитела. Таким образом, увеличение жизнеспособности клеток, продолжительности жизни клеток и специфической продуктивности культур клеток-хозяев млекопитающего и улучшения титра продуцируемых рекомбинантных белков оказывает подлинное влияние на стоимость продуцируемого рекомбинантного белка и, в случае терапевтических белков, стоимость и наличие в продаже лекарственных продуктов.
Настоящее изобретение рассматривает усовершенствованный способ получения гетерологичных белков в клеточной культуре млекопитающих, используя культуральную среду без глутамина с добавленным аспарагином в фазу продукции способа культивирования клеток. Культуральные среды, используемые в способе получения по настоящему изобретению, могут быть основаны на любой коммерчески доступной среде для рекомбинантного получения белков в клетках-хозяевах млекопитающего, в частности, в клетках СНО.
Примеры коммерчески доступных культуральных сред включают Ham’s F10 (Sigma), минимальную питательную среду («MEM», Sigma), RPMI-1640 (Sigma) и модифицированную по способу Дульбекко среду Игла («DMEM», Sigma). Любая такая среда может быть дополнена, в случае необходимости, гормонами и/или другими ростовыми факторами (такими как инсулин, трансферрин или эпидермальный ростовой фактор), солями (такими как хлорид натрия, кальций, магний и фосфат), буферами (такими как HEPES), нуклеозидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственный препарат GentamycinTM), следовыми элементами (определяемые как неорганические соединения, обычно находящиеся в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки могут быть также включены в соответствующих концентрациях, известных специалистам в данной области техники. Условия культивирования, такие как температура, рН и т.п., являются теми, что ранее были использованы для клетки-хозяина, выбранной для экспрессии, и очевидны для обычного специалиста в данной области техники. Кроме того, культуральная питательная среда по настоящему изобретению может быть основана на любой среде, описанной в Ham and McKeehan, Meth. Enz., 58: 44 (1979); Barnes and Sato, Anal. Biochem., 102: 255 (1980); патенте США № 4767704; патенте США № 4657866; патенте США № 4927762; патенте США № 5122469 или патенте США № 4560655; WO 90/03430; и WO 87/00195, при условии, что глутамин не включен в качестве ингредиента.
В безглутаминовых условиях требуется аспарагин, поскольку клетки млекопитающих могут синтезировать аспарагин только в присутствии глутамина. Аспарагин синтезируется путем переноса амида с глутамина в присутствии аспарагинсинтетазы. Аспарагин предпочтительно добавляют в культуральную среду в концентрации в диапазоне от 2,5 мМ до 15 мМ. В различных вариантах осуществления настоящего изобретения предпочтительная концентрация аспарагина должна быть по меньшей мере 2,5 мМ. В предпочтительных вариантах осуществления изобретения аспарагин добавляют в концентрации 10 мМ.
Как правило, принципы, протоколы и практические методики для максимизации продуктивности клеточных культур млекопитающих могут быть обеспечены и могут быть приспособлены для получения рекомбинантных белков, используя клеточные культуральные среды в настоящем документе.
Необходимые питательные вещества и ростовые факторы для среды, включая их концентрации, для определенной клеточной линии, подбирают эмпирически без лишнего проведения экспериментов, как описано, например, в Mammalian Cell Culture, Mather, ed. (Plenum Press: NY, 1984); Barnes and Sato, Cell, 22: 649 (1980) или Mammalian Cell Biotechnology: A Practical Approach, M. Butler, ed. (IRL Press, 1991). Пригодная среда содержит основной компонент среды, такой как основанный на DMEM/HAM F-12 состав (для композиции сред DMEM и HAM F12 и, в частности, бессывороточных сред, см. химические составы культуральных сред в каталоге Американской коллекции типовых культур клеточных линий и гибридом, шестое издание, 1988, страницы 346-349), с измененными концентрациями некоторых компонентов, таких как аминокислоты, соли, сахар и витамины, и необязательно содержащий глицин, гипоксантин и тимидин; рекомбинантный инсулин человека, гидролизованный пептон, такой как PRIMATONE HSTM или PRIMATONE RLTM (Sheffield, England), или эквивалент; защищающее клетки средство, такое как PLURONIC F68TMили эквивалентный плюрониловый полиол; GENTAMYCINTM; и следовые элементы. Особенно подходят составы среды, как описано в патенте США № 5122469, характеризуемые наличием высоких уровней определенных аминокислот, а также PS-20, как описано ниже.
Гликопротеины по настоящему изобретению могут быть продуцированы растущими клетками, которые экспрессируют требуемый гликопротеин в различных условиях культивирования клеток. Например, методики культивирования клеток для широкомасштабного и небольшого производства гликопротеинов потенциально пригодны в рамках контекста настоящего изобретения. Способы получения, включающие, помимо прочего, биореактор с кипящим слоем, биореакторы с полыми волокнами, культивирование с вращающимся флаконом или система биореактора с механическим перемешиванием, могут быть использованы, в двух последних системах, при наличии или отсутствии микроносителей, и осуществляться альтернативно в периодическом, периодическом с подпиткой или непрерывном режиме.
В частном варианте осуществления изобретения культивирование клеток по настоящему изобретению выполняют в системе биореактора с механическим перемешиванием, и применяют методику культивирования с подпиткой. В предпочтительном культивировании с подпиткой клетки-хозяева млекопитающего и культуральная среда изначально поставляются в емкость для культивирования, и дополнительные культуральные питательные вещества подают непрерывно или с пошаговым количественным увеличением к культуре во время культивирования с или без периодического забора клеток и/или продукта до завершения культивирования. Клеточная культура с подпиткой может включать, например, полунепрерывную культуру с подпиткой, где целую культуру (включая клетки и среду) периодически удаляют и заменяют на свежую среду. Клеточная культура с подпиткой отличается от простой периодической культуры, в которой все компоненты для культивирования клеток (включая клетки и все культуральные питательные вещества) поставляют в емкость для культивирования в начале процесса культивирования. Клеточная культура с подпиткой может дополнительно отличаться от перфузионного культивирования в такой степени, что супернатант не удаляют из емкости для культивирования во время способа (при перфузионном культивировании клетки удерживают в культуре посредством, например, фильтрации, инкапсулирования, фиксации на микроносителях и т.п., и культуральную среду непрерывно или периодически вводят и удаляют из емкости для культивирования).
В дальнейшем, клетки культуры могут размножаться в соответствии с любой схемой или режимом, которые могут быть пригодны для определенной клетки-хозяина и определенному намеченному плану производства. Таким образом, настоящее изобретение рассматривает одноэтапный или многоэтапный способ культивирования. В случае одноэтапного культивирования клетки-хозяева инокулируются в культуральную окружающую среду, и способы по настоящему изобретению выполняют в течение одной фазы продукции клеточной культуры. Альтернативно, предусмотрено многостадийное культивирование. В случае многостадийного культивирования, клетки можно культивировать в несколько этапов или фаз. Например, клетки могут расти на первом этапе или в культуре фазы роста, где клетки, по возможности взятые из хранилища, инокулируют в среду, пригодную для инициации роста и высокой жизнеспособности. Клетки можно поддерживать в фазе роста в течение подходящего периода времени путем добавления свежей среды к культуре клеток-хозяев.
В соответствии с частным аспектом изобретения условия для непрерывного культивирования клеток или с подпиткой разрабатываются для увеличения роста клеток млекопитающих в фазе роста клеточной культуры. В фазе роста клетки выращивают в условиях и в течение периода времени, которые максимизированы для роста. Условия культивирования, такие как температура, рН, растворенный кислород (DO2) и т.п., являются таковыми, которые используются для определенного хозяина и очевидны обычному специалисту. Как правило, рН доводят до уровня в диапазоне приблизительно от 6,5 до 7,5, используя либо кислоту (например, CO2), либо основание (например, Na2CO3 или NaOH). Подходящий температурный диапазон для культивирования клеток млекопитающих, таких как клетки СНО, равен приблизительно от 30 до 40°С, и предпочтительно приблизительно 37°С, и подходящий DO2 находится в диапазоне 5-90% насыщения воздуха.
На определенной стадии клетки могут быть использованы для инокуляции фазы продукции или этапа клеточной культуры. Альтернативно, как описано выше, фаза продукции или этап могут быть непрерывными с инокуляцией или фазой роста или этапом.
Для получения целевого белка в клетках млекопитающих, например, СНО, как правило, прибегают к полунепрерывному способу, во время которого клетки культивируют в «системе посевных ферментеров» в течение различных периодов времени и периодически переносят в посевные ферментеры для образования достаточной клеточной массы для инокуляции ферментера продукции в более широком масштабе. Таким образом, клетки, используемые для получения целевого белка, находятся в культуре в течение различных периодов времени вплоть до максимального предопределенного возраста клетки. Параметры способа культивирования клеток, такие как плотность, рН, DO2 и температура в течение культивирования, продолжительность фазы продукции культурой, технологические условия сбора клеточного урожая и т.п. зависят от определенной клеточной линии и используемой культуральной среды и могут быть подобраны эмпирически без лишнего проведения экспериментов.
По настоящему изобретению контролируются окружающие клеточную культуру условия во время фазы продукции клеточной культуры. В предпочтительном аспекте перед фазой продукции клеточной культуры происходит переходная фаза клеточной культуры, во время которой закладываются параметры для фазы продукции клеточной культуры.
Требуемый полипептид, такой как антитело, предпочтительно извлекают из культуральной среды в виде секретированного полипептида, хотя он также может быть извлечен из лизатов клеток-хозяев при непосредственном получении без секреторного сигнала. Если полипептид является мембраносвязанным, он может быть высвобожден из мембраны, используя подходящий раствор детергента (например, Тритон-Х 100), или его внеклеточный участок может быть выделен путем ферментативного расщепления.
В случае продуцирования полипептида в рекомбинантной клетке, отличной от таковой человеческого происхождения, он не имеет примеси белков или полипептидов человеческого происхождения. Однако, как правило, необходимо выделять или очищать рекомбинантные белки от рекомбинантных клеточных белков или полипептидов для получения препаратов, которые являются по существу гомогенными в отношении требуемого полипептида. На первом этапе, культуральная среда или лизат могут быть центрифугированы для удаления дисперсного дебриса. Гетерологичный полипептид затем очищают от примесных растворимых белков и полипептидов посредством использования нижеприведенных методик, иллюстрирующих подходящие методики очистки: использование фракционирования на ионообменной колонке, такой как SP-SepharoseTM или CM-SepharoseTM; гидроксиапатита; хроматографии гидрофобного взаимодействия; осаждения этанолом; хроматофокусирования; осаждения сульфатом аммония; гель-фильтрации, применяя, например, Сефадекс G-75TM; и/или диафильтрации.
Рекомбинантные полипептиды могут быть выделены, например, аффинной хроматографией.
Ингибитор протеазы, такой как фенилметилсульфонилфторид (PMSF), также может быть пригоден для ингибирования протеолитического распада во время очистки, и антибиотики могут быть включены для предотвращения роста случайных загрязняющих примесей. Специалист в данной области техники учитывает то, что методы очистки, пригодные для очистки и выделения рекомбинантных белков, включая антитела, могут быть использованы в настоящем документе и модифицированы, в случае необходимости, используя стандартные подходы.
Экспрессия требуемого гетерологичного белка может быть измерена в образце напрямую, например, общепринятым Саузерн-блоттингом, Нозерн-блоттингом для количественного определения транскрипции мРНК (Thomas, Proc. Natl. Acad. Sci. USA 1980, 77:5201-5205), дот-блоттингом (анализ ДНК) или гибридизацией in situ, используя соответствующим образом меченный зонд, руководствуясь последовательностями, представленными в настоящем документе. Могут быть использованы различные метки, наиболее часто радиоизотопы, и, в частности,32Р. Однако также могут быть использованы другие методики, такие как использование модифицированных биотином нуклеотидов для включения в полинуклеотид. Биотин затем служит в качестве сайта связывания авидина или антител, которые могут быть помечены широким ассортиментом меток, таких как радионуклеотиды, флуоресцирующие вещества или ферменты. Альтернативно, могут применяться антитела, которые могут распознавать специфические дуплексы, включая дуплексы ДНК, дуплексы РНК и гибридные дуплексы ДНК-РНК или дуплексы ДНК-белок. Антитела, в свою очередь, могут быть помечены, и анализ может быть выполнен в случае, когда дуплекс связан с поверхностью так, что при образовании дуплекса на поверхности может быть выявлено наличие антитела, связанного с дуплексом.
Экспрессия гена, альтернативно, может быть измерена иммунологическими методами, такими как иммуногистохимическое окрашивание клеток или срезов тканей и анализ клеточной культуры или биологических жидкостей, для непосредственного количественного определения экспрессии продукта гена. При иммуногистохимическом окрашивании клеточный образец обрабатывают, как правило, путем дегидратации и фиксации, с последующей реакцией в присутствии меченых антител, специфичных для продукта гена, сцепленные там, где метки обычно визуально детектируемы, такие как ферментативные метки, флуоресцентные метки, люминесцентные метки и т.п. Антитела, пригодные для иммуногистохимического окрашивания и/или анализа пробных жидкостей, могут быть либо моноклональными, либо поликлональными, и могут быть получены в любом млекопитающем.
2. Антитела
В предпочтительном варианте осуществления изобретения способы по настоящему изобретению используются для рекомбинантного получения антител, включая терапевтические и диагностические антитела. Антитела в рамках настоящего изобретения включают, помимо прочего: антитела против HER2, включая Трастузумаб (HERCEPTIN®) (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285-4289 (1992), патент США № 5725856); антитела против CD20, такие как химерные анти-CD20 «C2B8» как в патенте США № 5736137 (RITUXAN®), химерный или гуманизированный вариант антитела 2Н7 как в патенте США № 5721108В1, или Тозитумомаб (BEXXAR®); анти-IL-8 (St John et al., Chest, 103:932 (1993) и международная публикация № WO 95/23865); антитела против VEGF, включая гуманизированные и/или с созревшей аффинностью антитела против VEGF, такие как гуманизированные антитела против VEGF huA4.6.1 AVASTIN® (Kim et al., Growth Factors, 7:53-64 (1992), Международная публикация № WO 96/30046 и WO 98/45331, опубликованная 15 октября 1998 года); антитела против PSCA (WO01/40309); антитела против CD40, включая S2C6 и их гуманизированные варианты (WO00/75348); анти-CD11a (патент США № 5622700, WO 98/23761, Steppe et al., Transplant Intl. 4:3-7 (1991), и Hourmant et al., Transplantation 58:377-380 (1994)); анти-IgE (Presta et al., J. Immunol. 151:2623-2632 (1993) и Международная публикация № WO 95/19181); анти-CD18 (патент США № 5622700, выданный 22 апреля 1997 или как в WO 97/26912, опубликованный 31 июля 1997 года); анти-IgE (включая Е25, Е26 и Е27; патент США № 5714338, выданный 3 февраля 1998 года или патент США № 5091313, выданный 25 февраля 1992 года, WO 93/04173, опубликованный 4 марта 1993 года или международная заявка № PCT/US98/13410, поданная 30 июня 1998 года, патент США № 5714338); антитела против рецептора Аро-2 (WO 98/51793, опубликованный 19 ноября 1998 года); антитела против TNF-α, включая сА2 (REMICADE®), CDP571 и MAK-195 (см. патент США № 5672347, выданный 30 сентября 1997 года, Lorenz et al., J. Immunol. 156(4):1646-1653 (1996), и Dhainaut et al., Crit. Care Med. 23(9):1461-1469 (1995)); антитела против тканевого фактора (TF) (Европейский патент № 0420937В7, выданный 9 ноября 1994 года); антитела против интегрина α4β7 человека (WO 98/06248, опубликованный 19 февраля 1998 года); анти-EGFR (химерное или гуманизированное антитело 225 как в WO 96/40210, опубликованной 19 декабря 1996 года); антитела против CD3, такие как OKT3 (патент США № 4515893, выданный 7 мая 1985); анти-CD25 или анти-tac антитела, такие как CHI-621 (SIMULECT®) и (ZENAPAX®) (см. патент США № 5693762, выданный 2 декабря 1997 года); анти-CD4 антитела, такие как антитело cM-7412 (Choy et al., Arthritis Rheum 39(1):52-56 (1996)); антитела анти-CD52, такие как CAMPATH-1H (Riechmann et al., Nature 332:323-337 (1988)); антитела против рецептора Fc, такие как антитело М22, направленное против FcγRI, как в Graziano et al., J. Immunol. 155(10):4996-5002 (1995); антитела против раковоэмбрионального антигена (СЕА), такие как hMN-14 (Sharkey et al., Cancer Res. 55(23Suppl): 5935s-5945s (1995); антитела, направленные против эпителиальных клеток молочной железы, включая huBrE-3, hu-Mc 3 и CHL6 (Ceriani et al., Cancer Res. 55(23): 5852s-5856s (1995); и Richman et al., Cancer Res. 55(23 Supp): 5916s-5920s (1995)); антитела, связывающиеся с клетками карциномы толстой кишки, такие как С242 (Litton et al., Eur J. Immunol. 26(1):1-9 (1996)); антитела против CD38, например, АТ 13/5 (Ellis et al., J. Immunol. 155(2)925-937 (1995)); антитела против CD33, такие как Hu M195 (Jurcic et al., Cancer Res 55(23 Suppl):5908s-5910s (1995) и CMA-676 или CDP771; антитела против CD22, такие как LL2 или LymphoCide (Juweid et al., Cancer Res 55(23 Suppl):5899s-5907s (1995)); антитела против EpCAM, такие как 17-1А (PANOREX®); антитела против GpIIb/IIIa, такие как абциксимаб или c7E3 Fab (REOPRO®); антитела против RSV, такие как MEDI-493 (SYNAGIS®); антитела против CMV, такие как PROTOVIR®; антитела против HIV, такие как PRO542; антитела против гепатита, такие как анти-Hep B антитело OSTAVIR®; анти-CA 125 антитело OvaRex; антитело BEC2 против идиотипического эпитопа GD3; антитело VITAXIN® против avβ3; антитело против почечно-клеточной карциномы человека, такое как ch-G250; ING-1; антитело против 17-1А человека (3622W94); антитело против колоректальной опухоли человека (А33); антитело R24 по выявлению меланомы человека, направленное против ганглиозида GD3; антитело против плоскоклеточной карциномы человека (SF-25); и антитела против лейкоцитарного антигена человека (HLA), такие как Smart ID10, и антитело против HLA-DR Oncolym (Lym-1). Предпочтительными целевыми антигенами для антитела в настоящем документе являются: рецептор HER2, VEGF, IgE, CD20, CD11a и CD40.
Многие из этих антител широко используются в клинической практике для лечения различных заболеваний, включая рак.
В определенных частных вариантах осуществления изобретения методы по настоящему изобретению используются для получения нижеприведенных антител и рекомбинантных белков.
Антитела против CD20
Ритуксимаб (RITUXAN®), как правило, является созданным методами генетической инженерии химерным мышиным/человеческим моноклональным антителом, направленным против антигена CD20. Ритуксимаб является антителом под названием «С2В8» в патенте США № 5736137, выданном 7 апреля 1998 года (Anderson et al.). Ритуксимаб показан для лечения пациентов с рецидивирующей или неподдающейся лечению с низкой степенью злокачественности или фолликулярной, CD20-положительной, В-клеточной неходжкинской лимфомой. Исследования механизма действия in vitro показали, что ритуксимаб связывает человеческий комплемент и лизирует лимфоидные В-клеточные линии посредством комплемент-зависимой цитотоксичности (CDC) (Reff et al., Blood 83(2):435-445 (1994)). Кроме того, он обладает значительной активностью в анализах на антителозависимую клеточную цитотоксичность (ADCC). В последнее время было показано, что ритуксимаб оказывает антипролиферативное действие в анализах включения меченного тритием тимидина и напрямую индуцирует апоптоз, хотя другие антитела против CD19 и CD20 такими эффектами не обладают (Maloney et al., Blood 88(10):637a (1996)). Синергизм между ритуксимабом и химиотерапией и токсинами был выявлен экспериментальным путем. В частности, ритуксимаб сенсибилизирует лекарственно-устойчивые клеточные линии В-клеточной лимфомы человека к цитотоксическим воздействиям доксорубицина, CDDP, VP-1 6, дифтерийного токсина и рицина (Demidem et al., Cancer Chemotherapy & Radiopharmaceuticals 12(3):177-186 (1997)). Доклинические исследования in vivo показали, что ритуксимаб уменьшает число В-клеток в периферической крови, лимфатических узлах и костном мозге яванских макак, предпочтительно через комплемент- и клеточно-опосредованные процессы (Reff et al., Blood 83(2):435-445 (1994)).
Патенты и опубликованные патенты, рассматривающие CD20-антитела, включают патенты США №№ 5776456, 5736137, 6399061, и 5843439, а также заявка на патент США №№ US 2002/0197255A1, US 2003/0021781A1, US 2003/0082172 A1, US 2003/0095963 A1, US 2003/0147885 A1 (Anderson et al.); патент США № 6455043B1 и WO 00/09160 (Grillo-Lopez, A.); WO00/27428 (Grillo-Lopez and White); WO00/27433 (Grillo-Lopez and Leonard); WO00/44788 (Braslawsky et al.), WO01/10462 (Rastetter, W.); WO01/10461 (Rastetter and White); WO01/10460 (White and Grillo-Lopez); заявку США № US 2002/0006404 и WO02/04021 (Hanna and Hariharan); заявку США № US2002/0012665 A1 и WO01/74388 (Hanna, N.); заявку США № US 2002/0058029 A1 (Hanna, N.); заявку США № US 2003/0103971 A1 (Hariharan and Hanna); заявку США № US2002/0009444A1, и WO01/80884 (Grillo-Lopez, A.); WO01/97858 (White, C.); заявку США № US2002/0128488Al и WO02/34790 (Reff, M.); WO02/060955 (Braslawsky et al.); WO2/096948 (Braslawsky et al.); WO02/079255 (Reff and Davies); патент США № 6171586B1 и WO98/56418 (Lam et al.); WO98/58964 (Raju, S.); WO99/22764 (Raju, S.); WO99/51642, патент США № 6194551B1, патент США № 6242195B1, патент США № 6528624B1 и патент США № 6538124 (Idusogie et al.); WO00/42072 (Presta, L.); WO00/67796 (Curd et al.); WO01/03734 (Grillo-Lopez et al.); заявку США № US2002/0004587A1 и WO01/77342 (Miller and Presta); заявку США № US2002/0197256 (Grewal, I.); заявку США № US 2003/0157108 A1 (Presta, L.); патенты США №№ 6090365В1, 6287537B1, 6015542, 5843398 и 5595721, (Kaminski et al.); патенты США №№ 5500362, 5677180, 5721108 и 6120767 (Robinson et al.); патент США № 6410391B1 (Raubitschek et al.); патент США № 6224866B1 и WO00/20864 (Barbera-Guillem, E.); WO01/13945 (Barbera-Guillem, E.); WO00/67795 (Goldenberg); заявку США № US 2003/01339301 A1 и WO00/74718 (Goldenberg and Hansen); WO00/76542 (Golay et al.); WO01/72333 (Wolin and Rosenblatt); патент США № 6368596B1 (Ghetie et al.); заявку США № US2002/0041847 A1, (Goldenberg, D.); заявку США № US2003/0026801 A1 (Weiner and Hartmann); WO02/102312 (Engleman, E.); заявка на патент США № 2003/0068664 (Albitar et al.); WO03/002607 (Leung, S.); WO03/049694 и US 2003/0185796 A1 (Wolin et al.); WO03/061694 (Sing and Siegall); US 2003/0219818 A1 (Bohen et al.); US 2003/0219433 A1 и WO03/068821 (Hansen et al.), каждая из которых специально включена в настоящий документ в качестве ссылки. См., также патент США № 5849898 и заявку EP № 330191 (Seed et al.); патент США № 4861579 и EP332865A2 (Meyer and Weiss); патент США № 4861579 (Meyer et al.) и WO95/03770 (Bhat et al.).
Публикации, рассматривающие терапию ритуксимабом, включают: Perotta and Abuel "Response of chronic relapsing ITP of 10 years duration to Rituximab" Abstract # 3360 Blood 10(11) (часть 1-2): стр. 88B (1998); Stashi et al., "Rituximab chimeric anti-CD20 monoclonal antibody treatment for adults with chronic idopathic thrombocytopenic purpura" Blood 98(4):952-957 (2001); Matthews, R. "Medical Heretics" New Scientist (7 Apr., 2001); Leandro et al., "Clinical outcome in 22 patients with rheumatoid arthritis treated with В lymphocyte depletion" Ann Rheum Dis 61:833-888 (2002); Leandro et al., "Lymphocyte depletion in rheumatoid arthritis: early evidence for safety, efficacy and dose response. Arthritis & Rheumatism 44(9): S370 (2001); Leandro et al., "An open study of В lymphocyte depletion in systemic lupus erythematosus", Arthritis & Rheumatism 46(l):2673-2677 (2002); Edwards and Cambridge "Sustained improvement in rheumatoid arthritis following a protocol designed to deplete В lymphocytes" Rheumatology 40:205-211 (2001); Edwards et al., "B-lymphocyte depletion therapy in rheumatoid arthritis and other autoimmune disorders" Biochem. Soc. Trans. 30(4):824-828 (2002); Edwards et al, "Efficacy and safety of Rituximab, a B-cell targeted chimeric monoclonal antibody: A randomized, placebo controlled trial in patients with rheumatoid arthritis. Arthritis & Rheumatism 46(9): S197 (2002); Levine and Pestronk "IgM antibody-related polyneuropathies: B-cell depletion chemotherapy using Rituximab" Neurology 52: 1701-1704 (1999); DeVita et al., "Efficacy of selective В cell blockade in the treatment ofrheumatoid arthritis" Arthritis & Rheumatism 46:2029-2033 (2002); Hidashida et al., "Treatment of DMARD-Refractory rheumatoid arthritis with rituximab." Presented at the Annual Scientific Meeting of the American College of Rheumatology; October 24-29; New Orleans, La. 2002; Tuscano, J. "Successful treatment of Infliximab-refractory rheumatoid arthritis with rituximab" Presented at the Annual Scientific Meeting of the American College of Rheumatology; October 24-29; New Orleans, La. 2002.Sarwal et al., N. Eng. J. Med. 349(2):125-138 (July 10, 2003) описывает молекулярную гетерогенность при остром почечном отторжении аллотрансплантата, идентифицированную исследованием профиля экспрессии методом ДНК-микроматриц.
В различных вариантах осуществления изобретение представляет фармацевтические композиции, включающие гуманизированные антитела против CD20. В определенных вариантах осуществления композиция гуманизированного антитела по изобретению дополнительно включает аминокислотные изменения в IgG Fc и проявляет увеличенную аффинность связывания к FcRn по сравнению с антителом, имеющим IgG Fc дикого типа по меньшей мере в 60 раз, по меньшей мере в 70 раз, по меньшей мере в 80 раз, более предпочтительно по меньшей мере в 100 раз, предпочтительно по меньшей мере в 125 раз, еще более предпочтительно по меньшей мере в 150 раз вплоть до приблизительно 170 раз.
Сайт N-гликозилирования в IgG находится в Asn297 в домене CH2. Композиции гуманизированного антитела по настоящему изобретению включают композиции любых из предыдущих гуманизированных антител, имеющих область Fc, где приблизительно 80-100% (и предпочтительно, приблизительно 90-99%) антитела в композиции включают зрелую коровую углеводную структуру, в которой отсутствует фукоза, соединенной с областью Fc гликопротеина. В настоящем документе было показано, что такие композиции проявляют поразительное улучшение связывания с Fc(RIIIA(F158), которые не столь же эффективны, как Fc(RIIIA(V158) во взаимодействии с IgG человека. Fc(RIIIA(F158) более распространен, чем Fc(RIIIA(V158) среди нормальных, здоровых афроамериканцев и представителей белой европеоидной расы. См. Lehrnbecher et al., Blood 94:4220 (1999). Исторически сложилось так, что антитела, продуцируемые в клетках яичника китайского хомячка (СНО), одного из наиболее часто используемых хозяев для производственных целей, содержат в популяции приблизительно от 2 до 6%, являющихся не фукозилированными. YB2/0 и Lec13, однако, могут продуцировать антитела, среди которых от 78 до 98% составляют нефукозилированные виды. Shinkawa et al., J Bio. Chem. 278 (5), 3466-347 (2003), представил данные о том, что антитела, продуцируемые в клетках YB2/0 и Lec13, которые имеют меньшую активность FUT8, демонстрируют значительно увеличенную активность ADCC in vitro. Получение антител со сниженным содержанием фукозы также описано, например, в Li et al., (GlycoFi) "Optimization of humanized IgGs in glycoengineered Pichia pastoris", Nature Biology online publication, 22 Jan. 2006; Niwa R. et al., Cancer Res. 64(6):2127-2133 (2004); US 2003/0157108 (Presta); US 6602684 и US 2003/0175884 (Glycart Biotechnology); US 2004/0093621, US 2004/0110704, US 2004/0132140 (все от Kyowa Hakko Kogyo).
Биспецифичное гуманизированное антитело включает антитело, где одно плечо антитела имеет по меньшей мере антигенсвязывающую область H и/или L цепи гуманизированного антитела по изобретению, и другое плечо имеет V область специфического связывания для второго антигена. В частных вариантах осуществления изобретения антигены выбраны из группы, состоящей из CD-20, CD3, CD64, CD32A, CD16, NKG2D или других лигандов, активирующих NK.
Антитела против HER2
Рекомбинантная гуманизированная разновидность мышиного антитела 4D5 к HER2 (huMAb4D5-8, rhuMAb HER2, трастузумаб или HERCEPTIN®; патент США № 5821337) активно используется в клинической практике у пациентов с метастатическим раком молочной железы со сверхэкспрессией HER2, которые получали до этого экстенсивную противораковую терапию (Baselga et al., J. Clin. Oncol. 14:737-744 (1996)). Трастузумаб получил маркетинговое одобрение со стороны Управления по контролю за продуктами питания и лекарственными средствами (FDA) 25 сентября 1998 года на лечение пациентов с метастатическим раком молочной железы, у которых опухоли имеют сверхэкспрессию белка HER2. В ноябре 2006 года FDA одобрил герцептин в качестве составной части схемы лечения, включающей доксорубицин, циклофосфамид и паклитаксел, для вспомогательного лечения пациентов, имеющих положительный по HER2 раком молочной железы с поражением лимфоузлов.
В различных вариантах осуществления изобретение представляет фармацевтические композиции, включающие гуманизированные антитела против HER2. HER2-антитела с различными свойствами были описаны в Tagliabue et al., Int. J. Cancer 47:933-937 (1991); McKenzie et al., Oncogene 4:543-548 (1989); Maier et al., Cancer Res. 51:5361-5369 (1991); Bacus et al., Molecular Carcinogenesis 3:350-362 (1990); Stancovski et al., PNAS (USA) 88:8691-8695 (1991); Bacus et al., Cancer Research 52:2580-2589 (1992); Xu et al., Int. J. Cancer 53:401-408 (1993); WO94/00136; Kasprzyk etal., Cancer Research 52:2771-2776 (1992); Hancock et al., Cancer Res. 51:4575-4580 (1991); Shawver et al., Cancer Res. 54:1367-1373 (1994); Arteaga et al., Cancer Res. 54:3758-3765 (1994); Harwerth et al., J. Biol. Chem. 267:15160-15167 (1992); патент США № 5783186; и Klapper et al., Oncogene 14:2099-2109 (1997).
Антитела против VEGF
Антитела против VEGF, включая гуманизированные и/или с созревшей аффинностью антитела против VEGF, такие как гуманизированные анти-VEGF антитела huA4.6.1 AVASTIN® (Kim et al., Growth Factors, 7:53-64 (1992), Международная публикация № WO 96/30046 и WO 98/45331, опубликованная 15 октября 1998 года), одобрены FDA для лечения рака. В различных вариантах осуществления, изобретение представляет фармацевтические композиции, включающие гуманизированные антитела против VEGF.
Антитела против CD11a
Гуманизированные анти-CD11a антитела эфализумаб или Raptiva® (патент США № 6037454) получили маркетинговое одобрение со стороны Управления по контролю за продуктами питания и лекарственными средствами 27 октября 2003 года для лечения псориаза. Один вариант осуществления изобретения предоставляет фармацевтические композиции, включающие антитела против CD11a человека.
Антитела Apomab
Антитела к антителам рецептора DR5 (анти-DR5) могут быть также получены в соответствии с настоящим изобретением. Такие анти-DR5 антитела, в частности, включают все варианты антител, рассмотренных в публикации РСТ № WO 2006/083971, такие как антитела анти-DR5, названные Apomab 1.1, 2.1, 3.1, 4.1, 5.1, 5.2, 5.3, 6.1, 6.2, 6.3, 7.1, 7.2, 7.3, 8.1, 8.3, 9.1, 1.2, 2.2, 3.2, 4.2, 5.2, 6.2, 7.2, 8.2, 9.2, 1.3, 2.2, 3.3, 4.3, 5.3, 6.3, 7.3, 8.3, 9.3 и 25.3, в частности, Apomab 8.3 и Apomab 7.3, предпочтительно, Apomab 7.3. Полное содержание WO 2006/083971 специально включено в настоящий документ в качестве ссылки. Apomab является полностьтью человеческим моноклональным антителом, которое представляет собой DR5-направленным агонистом проапоптотического рецептора (PARA), специально сконструированного для индукции апоптоза. Апоптоз является естественным процессом, посредством которого поврежденные или нежелательные клетки, включая те, что являются раковыми, погибают и элиминируются из организма. Проапоптотический рецептор DR5 экспрессируется в широком спектре злокачественных новообразований.
Анти-BR3 антитела и иммуноадгезины
Антитела к BR3 антителам (анти-BR3) и иммуноадгезины BR3-Fc могут быть также получены в соответствии с настоящим изобретением. Такие анти-BR3 антитела и иммуноадгезины, в частности, включают все варианты, рассмотренные в опубликованной заявке США № 20050070689. Полное содержание опубликованной заявки США № 20050070689 специально включено в настоящий документ в качестве ссылки.
3. Основные методы рекомбинантного получения антител
Антитела и другие рекомбинантные белки в настоящем документе могут быть получены хорошо известными методиками технологии рекомбинантной ДНК. Таким образом, помимо антител, специально рассмотренных выше, квалифицированный практик сможет получить антитела, направленные против представляющего интерес антигена, например, используя методики, описанные ниже.
Выбор антигена и приготовление
Антитело в настоящем документе направлено против представляющего интерес антигена. Предпочтительно, антиген является биологически важным полипептидом, и введение антитела млекопитающему, страдающему заболеванием или нарушением, может привести к благоприятному терапевтическому эффекту у млекопитающего. Однако антитела, направленные против неполипептидных антигенов (таких как опухолеассоциированные гликолипидные антигены; см. патент США 5091178), также предусмотрены. В случае, если антиген является полипептидом, он может представлять собой трансмембранную молекулу (например, рецептор) или лиганд, такой как ростовой фактор. Иллюстративные антигены включают белки, описанные в разделе (3) ниже. Иллюстративные молекулярные мишени для антител, рассматриваемых в настоящем изобретении, включают белки CD, такие как CD3, CD4, CD8, CD19, CD20, CD22, CD34, CD40; члены семейства рецептора ErbB, такие как рецептор EGF, рецептор HER2, HER3 или HER4; молекулы клеточной адгезии, такие как LFA-1, Mac1, p150,95, VLA-4, ICAM-1, VCAM и интегрин αv/β3, включая либо α, либо β субъединицы вышеперечисленного (например, антитела против CD11a, антитела против CD18 или против CD11b); ростовые факторы, такие как VEGF; IgE; антигены группы крови; рецептор flk2/flt3; рецептор ожирения (OB); рецептор mpl; CTLA-4; протеин С или какие-либо другие антигены, упомянутые в настоящем документе. Антигены, с которыми связываются перечисленные выше антитела, специально включены в объем настоящего документа.
Растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами, могут быть использованы в качестве иммуногенов для выработки антител. В случае трансмембранных молекул, таких как рецепторы, их фрагменты (например, внеклеточный домен рецептора) могут быть использованы в качестве иммуногена. Альтернативно, клетки, экспрессирующие трансмембранную молекулу, могут быть использованы в качестве иммуногена. Такие клетки могут быть получены из естественного источника (например, раковые клеточные линии) или могут представлять собой клетки, которые были трансформированы рекомбинантными технологиями для экспрессии трансмембранной молекулы.
Другие антигены или их формы, пригодные для получения антител, очевидны специалистам в данной области техники.
Поликлональные антитела
Поликлональные антитела предпочтительно вырабатываются у животных путем подкожных (sc) или внутрибрюшинных (ip) инъекций соответствующего антигена и адъюванта. Он может быть пригоден для конъюгации антигена с белком, который является иммуногенным в видах, подлежащих иммунизации, например, гемоцианин фиссуреллы, сывороточный альбумин, бычий тиреоглобулин или соевый ингибитор трипсина, используя бифункциональный или дериватизирующий агент, например, малеимидобензоильный сложный эфир сульфосукцинимида (конъюгирование через цистеиновые остатки), N-гидроксисукцинимид (через лизиновые остатки), глутаральдегид, янтарный ангидрид, SOCl2 или R1N=C=NR, где R и R1 представляют собой различные алкильные группы.
Животных иммунизируют против антигена, иммуногенных конъюгатов или производных сочетанием, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда, и инъецированием раствора внутрикожно в многочисленных участках. Через один месяц животных стимулируют в диапазоне от 1/5 до 1/10 исходного количества антигена или конъюгата в полном адъюванте Фрейнда подкожными инъекциями в многочисленных участках. Спустя 7-14 дней животным делают забор крови и анализируют сыворотку на титр антител. Животных стимулируют до тех пор, пока титр не перестанет расти. Предпочтительно, животных стимулируют конъюгатом того же антигена, но конъюгированного с другим белком, и/или посредством другого перекрестно-сшивающего реагента. Конъюгаты также могут быть получены в рекомбинантной клеточной культуре в виде слитых белков. Также агрегирующие агенты, такие как алюм, надлежаще используются для повышения иммунного ответа.
Моноклональные антитела
Моноклональные антитела могут быть получены, используя гибридомную технологию, впервые описанную Kohler et al., Nature, 256:495 (1975), или могут быть созданы методами рекомбинантной ДНК (патент США № 4816567).
В случае гибридомного метода мышь или другое подходящее животное-хозяин, такое как хомяк или обезьяна вида макака, иммунизируют, как описано выше в настоящем документе, чтобы активировать лимфоциты, которые продуцируют или способны продуцировать антитела, которые будут специфически связываться с белком, используемым для иммунизации. Альтернативно, лимфоциты могут быть иммунизированы in vitro. Затем происходит слияние лимфоцитов с клетками миеломы, используя подходящий фактор слияния клеток, такой как полиэтиленгликоль, с образованием гибридомных клеток (Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986)).
Приготовленные таким образом гибридомные клетки высевают и выращивают в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживаемость не слившихся, исходных миеломных клеток. Например, если у исходных миеломных клеток отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (HGPRT или HPRT), культуральная среда для гибридом, как правило, будет включать гипоксантин, аминоптерин и тимидин (среда НАТ), вещества которой предотвращают рост клеток, лишенных HGPRT.
Предпочтительными миеломными клетками являются те, что эффективно сливаются, поддерживают стабильное получение антитела на высоком уровне отобранными антителопродуцирующими клетками и чувствительны к среде, такой как среда НАТ. Среди них, предпочтительными миеломными клеточными линиями являются мышиные миеломные линии, такие как те, что получают из мышиных опухолей MOPC-21 и MPC-11, имеющихся в наличии в Центре распределения клеток института Солка (Salk Institute Cell Distribution Center), San Diego, California USA, и клетки SP-2 или X63-Ag8-653, имеющиеся в наличии в Американской коллекции типовых культур, Rockville, Maryland USA. Человеческие миеломные и мышино-человеческие гетеромиеломные клеточные линии также были описаны для получения человеческих моноклональных антител (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой растут гибридомные клетки, анализируют на предмет продуцирования моноклональных антител, направленных против антигена. Предпочтительно, специфичность связывания моноклональных антител, продуцированных гибридомными клетками, определяют иммунопреципитацией или анализом связывания in vitro, таким как радиоиммунологический анализ (РИА) или ферментный иммуносорбентный анализ (ELISA).
После идентификации гибридомных клеток, которые продуцируют антитела заданной специфичности, аффинности и/или активности, клоны могут быть субклонированы методом серийных разведений и выращены стандартными методами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Пригодные культуральные среды для этой цели включают, например, среду D-MEM или RPMI-1640. Кроме того, гибридомные клетки могут быть выращены in vivo в виде асцитных опухолей в животном.
Моноклональные антитела, секретируемые субклонами, надлежащим образом отделяют от культуральной среды, асцитной жидкости или сыворотки общепринятыми методами очистки иммуноглобулинов, такими как, например, Протеин А-сефароза, гидроксиапатитная хроматография, гель-электрофорез, диализ или аффинная хроматография. Предпочтительно используется хроматография с иммобилизованным Протеином А, описанная в настоящем документе.
ДНК, кодирующую моноклональные антитела, без труда выделяют и секвенируют, используя общепринятые методики (например, путем использования олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи моноклональных антител). Гибридомные клетки служат в качестве предпочтительного источника такой ДНК. После выделения ДНК может быть вставлена в экспрессионные векторы, которыми затем трансфицируют клетки-хозяева, таких как клетки E. coli, клетки COS обезьяны, клетки яичника китайского хомячка (СНО) или миеломные клетки, которые в противном случае не продуцируют иммуноглобулиновый белок, чтобы обеспечить синтез моноклональных антител в рекомбинантных клетках-хозяевах.
ДНК также может быть модифицирована, например, используя кодирующую последовательность константных доменов тяжелой и легкой цепей человека вместо гомологичных мышиных последовательностей (патент США № 4816567; Morrison, et al., Proc. Natl Acad. Sci. USA, 81:6851 (1984)) или путем ковалентного связывания кодирующей иммуноглобулин последовательности со всей последовательностью или ее частью, кодирующей отличный от иммуноглобулина полипептид.
Как правило, такие отличные от иммуноглобулинов полипептиды замещают константные домены антитела, или они замещают вариабельные домены одного антигенсвязывающего активного центра антитела для создания химерного бивалентного антитела, включающего один антигенсвязывающий активный центр, обладающий специфичностью к антигену, и другой антигенсвязывающий активный центр, обладающий специфичностью к другому антигену.
В дополнительном варианте осуществления изобретения моноклональные антитела могут быть выделены из фаговых библиотек антител, созданных с использованием методов, описанных в McCafferty et al., Nature, 348:552-554 (1990). Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991) описывают выделение мышиных и человеческих антител, соответственно, используя фаговые библиотеки. Последующие публикации описывают получение человеческих антител высокой аффинности (нМ диапазон) путем перестановки цепей (Marks et al., Bio/Technology, 10:779-783 (1992)), а также комбинаторное заражение и рекомбинацию in vivo в качестве стратегии конструирования очень больших фаговых библиотек (Waterhouse et al., Nuc. Acids. Res., 21:2265-2266 (1993)). Таким образом, эти методы являются эффективными альтернативами традиционным гибридомным технологиям для выделения моноклональных антител.
Гуманизированные и человеческие антитела
Гуманизированное антитело имеет один или несколько аминокислотных остатков, вставленных в него из источника, который не является человеком. Эти отличные от человеческих аминокислотные остатки часто называют «импортируемыми» остатками, которых, как правило, берут из «импортируемого» вариабельного домена. Гуманизация может быть по существу выполнена, следуя методу Winter и соавторов (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), путем замены последовательностей CDR или CDR грызунов соответствующими последовательностями человеческого антитела. Соответственно, такие «гуманизированные» антитела являются химерными антителами (патент США № 4816567), где значительно меньший, чем интактный человеческий вариабельный домен был замещен соответствующей последовательностью из отличных от человеческих видов. На практике, гуманизированные антитела, как правило, представляют собой человеческие антитела, в которых некоторые остатки CDR и, возможно, некоторые остатки FR замещают остатками из аналогичных участков антител грызунов.
Выбор человеческих вариабельных доменов, как легкой, так и тяжелой цепи, подлежащих использованию в создании гуманизированных антител, очень важен для снижения антигенности. Согласно так называемому методу «наилучшего соответствия», проводится скрининг последовательности вариабельного домена антитела грызунов в сравнении со всей библиотекой известных человеческих последовательностей вариабельного домена. Человеческая последовательность, наиболее полно соответствующая таковой грызунов, затем принимается в качестве человеческой FR для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993)). Другой метод использует определенный каркасный участок, полученный из консенсусной последовательности всех человеческих антител определенной подгруппы легких или тяжелых цепей. Один и тот же каркасный участок может быть использован для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993)).
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой аффинности к антигену и других подходящих биологических свойств. Для достижения этой цели, в соответствии с предпочтительным методом, гуманизированные антитела создают в ходе процесса анализа исходных последовательностей и различных воображаемых гуманизированных продуктов, используя трехмерные модели исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов, как правило, доступны и знакомы специалистам в данной области техники. Доступны компьютерные программы, которые иллюстрируют и отображают возможные трехмерные конформационные структуры выбранных кандидатов иммуноглобулиновых последовательностей. Детальное рассмотрение этих изображений позволяет проанализировать возможную роль остатков в функционировании кандидатной иммуноглобулиновой последовательности, т.е., подвергнуть анализу остатки, которые влияют на способность кандидатного иммуноглобулина связывать его антиген. Таким способом остатки FR могут быть выбраны и скомбинированы из реципиентной и импортируемой последовательностей таким образом, чтобы получить требуемые характеристики антитела, такие как повышенная аффинность к антигену(ам)-мишени(ям). В большинстве случаев, остатки CDR напрямую и весьма существенно влияют на связывание антигена.
Альтернативно, теперь можно создавать трансгенных животных (например, мышей), которые способны, после иммунизации, продуцировать полный репертуар человеческих антител в отсутствие эндогенного продуцирования иммуноглобулинов. Например, было показано, что гомозиготная делеция гена области соединения тяжелой цепи антитела (JH) в химерных и мутантных мышах зародышевой линии приводит к полному ингибированию эндогенного продуцирования антител. Перенос генного набора иммуноглобулинов человека зародышевой линии в таких мутантных мышей зародышевой линии приведет к продуцированию человеческих антител после антигенной стимуляции. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993); и Duchosal et al., Nature 355:258 (1992). Человеческие антитела также могут быть получены из библиотек фагового дисплея (Hoogenboom et al., J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1991); Vaughan et al., Nature Biotech 14:309 (1996)).
Фрагменты антител
Различные методики были разработаны для получения фрагментов антител. Как правило, эти фрагменты были получены посредством протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако эти фрагменты теперь могут быть продуцированы непосредственно рекомбинантными клетками-хозяевами. Например, фрагменты антитела могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно, фрагменты Fab’-SH могут быть непосредственно извлечены из E. coli и химическим способом соединены в пару с образованием фрагментов (Fab’)2 (Carter et al., Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом, (Fab’)2 фрагменты могут быть выделены непосредственно из рекомбинантной клеточной культуры-хозяина. Другие методики получения фрагментов антител очевидны квалифицированному практику. В других вариантах осуществления изобретения антителом выбора является одноцепочечный фрагмент Fv (scFv) (см. WO 93/16185).
Мультиспецифичные антитела
Мультиспецифичные антитела обладают специфичностями связывания по меньшей мере к двум различным антигенам. Хотя такие молекулы обычно связывают только два антигена (т.е. биспецифичные антитела, BsAb), антитела с дополнительными специфичностями, такие как триспецифичные антитела, охвачены данным выражением при использовании в настоящем документе.
Методы создания биспецифичных антител известны в данной области техники. Общепринятое получение полноразмерных биспецифичных антител основано на совместной экспрессии двух пар тяжелой цепи-легкой цепи иммуноглобулинов, где две цепи обладают различной специфичностью (Millstein et al., Nature, 305:537-539 (1983)). Вследствие случайного ассортимента тяжелой и легкой цепей иммуноглобулинов, эти гибридомы (квадромы) продуцируют потенциальную смесь из 10 различных молекул антител, из которых только одна имеет правильную биспецифичную структуру. Очистка правильной по структуре молекулы, которую обычно выполняют поэтапной аффинной хроматографией, редко является трудоемкой, и выход продукта является низким. Похожие методики описаны в WO 93/08829 и в Traunecker et al., EMBO J., 10:3655-3659 (1991).
В соответствии с другим подходом, описанным в WO96/27011, область взаимодействия между парой молекул антител может быть сконструирована для максимизации процента гетеродимеров, извлекаемых из рекомбинантной клеточной культуры. Предпочтительная область взаимодействия включает по меньшей мере часть домена CH3 константного домена антитела. В этом методе одна или несколько небольших аминокислотных боковых цепей из области взаимодействия молекулы первого антитела заменены большими боковыми цепями (например, тирозиновыми или триптофановыми). Компенсирующие «впадины» идентичной или сходной по размеру большой боковой цепи(ей) образуются в области взаимодействия второй молекулы антитела путем замены больших аминокислотных боковых цепей более маленькими (например, аланиновыми или треониновыми). Это обеспечивает механизм увеличения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела включают перекрестно сшитые или «гетероконъюгированные» антитела. Например, одно из антител в гетероконъюгате может быть соединено с авидином, другое - с биотином. Предполагается, что такие антитела, например, обеспечивают направленное действие клеток иммунной системы на нежелательные клетки (патент США № 4676980) и в лечении ВИЧ-инфекции (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгированные антитела могут быть созданы, используя любой подходящий метод перекрестного сшивания. Пригодные перекрестно-сшивающие агенты хорошо известны в данной области техники и рассмотрены в патенте США № 4676980 наряду с целым рядом методик по перекрестному сшиванию.
Методики получения биспецифических антител из фрагментов антител также были описаны в литературе. Например, биспецифические антитела могут быть приготовлены, используя химическую связь. Brennan et al., Science, 229:81 (1985) описывают методику, где интактные антитела протеолитически расщепляют с образованием (Fab’)2 фрагментов. Эти фрагменты восстанавливаются в присутствии арсенита натрия дитиолового комплексообразующего агента для стабилизации вицинальных дитиолов и предотвращения межмолекулярного образования дисульфидов. Образованные Fab’ фрагменты затем превращают в производные тионитробензоата (TNB). Одно из производных Fab’-TNB затем возвращается в прежнее состояние с образованием Fab’-тиола путем восстановления меркаптоэтиламином и смешивается с эквимолярным количеством другого производного Fab’-TNB с образованием биспецифического антитела. Синтезированные биспецифические антитела могут быть использованы в качестве веществ для селективной иммобилизации ферментов.
Современный прогресс способствовал непосредственному выделению фрагментов Fab’-SH из E. coli, которые могут быть химически попарно связаны с образованием биспецифичных антител. Shalaby et al., J. Exp. Med., 175: 217-225 (1992) описывает получение в полной мере гуманизированной биспецифической молекулы антитела (Fab’)2. Каждый фрагмент Fab’ был по отдельности секретирован E. coli и подвергнут прямому химическому попарному связыванию in vitro с образованием биспецифического антитела. Образованное таким образом биспецифическое антитело было способно связываться с клетками, имеющими сверхэкспрессию рецептора ErbB2, и нормальными Т-клетками человека, а также инициировать литическую активность цитотоксических лимфоцитов человека по отношению к мишеням рака молочной железы человека.
Также были описаны различные методики создания и выделения фрагментов биспецифического антитела непосредственно из рекомбинантной клеточной культуры. Например, биспецифические антитела были получены, используя лейциновые молнии. Kostelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды, содержащие лейциновую молнию, из белков Fos и Jun были соединены с Fab’-участками двух различных антител путем слияния генов. Гомодимеры антитела были восстановлены в шарнирной области с образованием мономеров и затем были повторно окислены с образованием гетеродимеров антитела. Этот метод может быть также использован для получения гомодимеров антитела. Технология «диател», описанная Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993), обеспечила альтернативный механизм создания фрагментов биспецифического антитела. Фрагменты включают вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) с помощью линкера, который слишком короткий, чтобы дать возможность ассоциировать двум доменам на одной и той же цепи. Соответственно, домены VH и VL одного фрагмента вынуждают формировать пару с комплементарными доменами VL и VH другого фрагмента, тем самым образуя два антигенсвязывающего сайта. Также был опубликован другой подход в создании фрагментов биспецифического антитела путем использования димеров одноцепочечного Fv (sFv). См. Gruber et al., J. Immunol., 152:5368 (1994). Альтернативно, антитела могут быть «линейными антителами», как описано в Zapata et al., Protein Eng. 8(10):1057-1062 (1995). Вкратце, эти антитела включают тандемные сегменты Fd (VH-CH1-VH-CH1), которые образуют пару антигенсвязывающих участков. Линейные антитела могут быть биспецифичными или моноспецифичными.
Предусмотрены антитела с более чем двумя валентностями. Например, могут быть приготовлены триспецифичные антитела. Tutt et al., J. Immunol. 147:60 (1991).
Иммуноадгезины
Самая простая и наиболее эффективная структура иммуноадгезина сочетает в себе связывающий(ие) домен(ы) адгезина (например, внеклеточный домен (ECD) рецептора) и шарнирную область и область Fc тяжелой цепи иммуноглобулина. Как правило, в случае создания иммуноадгезинов по настоящему изобретению, нуклеиновая кислота, кодирующая связывающий домен адгезина, будет слита по С-концу с нуклеиновой кислотой, кодирующей N-конец последовательности константного домена иммуноглобулина, хотя N-концевые слияния также возможны.
Как правило, в такого рода слияниях кодируемый слитый полипептид сохраняет по меньшей мере функционально активную шарнирную область, домены CH2 и CH3 константной области тяжелой цепи иммуноглобулина. Слияния также проводятся с С-концом участка Fc константного домена или непосредственно N-конца с CH1 тяжелой цепи или соответствующей областью легкой цепи. Точный сайт, в котором происходит слияние, не является решающим; определенные сайты хорошо известны и могут быть выбраны с целью оптимизации биологической активности, секреции или характеристик связывания иммуноадгезина.
В предпочтительном варианте осуществления изобретения последовательность адгезина слита с N-концом домена Fc иммуноглобулина G1 (IgG1). Существует возможность слияния всего константного участка тяжелой цепи с последовательностью адгезина. Однако, более предпочтительно, когда в слиянии используется начало последовательности шарнирной области непосредственно выше сайта расщепления папаина, который определяют Fc IgG химически (т.е., остаток 216, считая первый остаток константного участка тяжелой цепи равным 114) или аналогичные сайты других иммуноглобулинов. В особенно предпочтительном варианте осуществления изобретения аминокислотная последовательность адгезина слита с (а) шарнирной областью и СН2 И СН3 или (b) СН1, шарнирной областью, доменами СН2 и СН3 тяжелой цепи IgG.
В случае биспецифичных иммуноадгезинов, иммуноадгезины образуют структуру в виде мультимеров и, в частности, в виде гетеродимеров или гетеротетрамеров. Как правило, эти собранные иммуноглобулины имеют известные единичные структуры. Основной четырехцепочечной структурной единицей является форма, в которой находятся IgG, IgD и IgE. Четырехцепочечная единица повторяется в иммуноглобулинах большего молекулярного веса; IgM, как правило, существует в виде пентамера четырех основных единиц, соединенных между собой посредством дисульфидных связей. Глобулин IgA и иногда глобулин IgG могут также существовать в мультимерной форме в сыворотке. В случае мультимера, каждая из четырех единиц может быть одинаковой или различной.
Различные иллюстративные собранные в структуру иммуноадгезины в рамках настоящего документа схематически представлены ниже:
ACL-ACL;
ACH-(ACH, ACL-ACH, ACL-VHCH или VLCL-ACH);
ACL-ACH-(ACL-ACH, ACL-VHCH, VLCL-ACH или VLCL-VHCH)
ACL-VHCH-(ACH или ACL-VHCH или VLCL-ACH);
VLCL-ACH-(ACL-VHCH или VLCL-ACH); и
(A-Y)n-(VLCL-VHCH)2,
где каждый А представляет собой идентичные или различные аминокислотные последовательности адгезина;
VL представляет собой вариабельный домен легкой цепи иммуноглобулина;
VH представляет собой вариабельный домен тяжелой цепи иммуноглобулина;
CL представляет собой константный домен легкой цепи иммуноглобулина;
CH представляет собой константный домен тяжелой цепи иммуноглобулина;
n является целым числом, превышающим 1.
Y обозначает остаток перекрестносшивающего ковалентного агента.
С целью лаконичности вышеупомянутые структуры только демонстрируют ключевые свойства; они не показывают соединительные (J) и другие домены иммуноглобулинов, не показаны дисульфидные связи. Однако там, где такие домены требуются для активности связывания, их следует конструировать так, чтобы они находились в типичных местах, которые они занимают в молекулах иммуноглобулинов.
Альтернативно, последовательности адгезина могут быть вставлены между последовательностями тяжелой и легкой цепи иммуноглобулина таким образом, чтобы был получен иммуноглобулин, включающий химерную тяжелую цепь. В этом варианте осуществления изобретения последовательности адгезина слиты с 3’-концом тяжелой цепи иммуноглобулина в каждом плече иммуноглобулина либо между шарнирной областью и доменом СН2, либо между доменами СН2 и СН3. Подобные структуры были опубликованы Hoogenboom, et al., Mol. Immunol. 28:1027-1037 (1991).
Хотя наличие легкой цепи иммуноглобулина не требуется в иммуноадгезинах по настоящему изобретению, легкая цепь иммуноглобулина может присутствовать либо ковалентно связанной с слитым полипептидом адгезина-тяжелой цепи иммуноглобулина, либо напрямую слитой с адгезином. В первом случае, ДНК, кодирующая легкую цепь иммуноглобулина, как правило, совместно экспрессируется с ДНК, кодирующей слитый полипептид адгезина-тяжелой цепи иммуноглобулина. При секреции тяжелая цепь и легкая цепь гибрида будут ковалентно связываться, образуя иммуноглобулиноподобную структуру, включающую две пары тяжелой цепи-легкой цепи иммуноглобулина, связанные дисульфидным мостиком. Методы, пригодные для получения таких структур, например, рассмотрены в патенте США № 4816567, выданном 28 марта 1989 года.
Иммуноадгезины наиболее удобно конструируют путем слияния последовательности кДНК, кодирующей часть адгезина, в рамке считывания с последовательностью кДНК иммуноглобулина. Однако слияние с геномными фрагментами иммуноглобулина также можно использовать (см., например, Aruffo et al., Cell 61:1303-1313 (1990); и Stamenkovic et al., Cell 66:1133-1144 (1991)). Последний тип слияния требует наличие регуляторных последовательностей Ig для экспрессии. кДНК, кодирующие константные участки тяжелой цепи IgG, могут быть выделены, руководствуясь опубликованными последовательностями из кДНК-библиотек, полученных из селезенки или лимфоцитов периферической крови, методами гибридизации или полимеразной цепной реакции (ПЦР). кДНК, кодирующие «адгезин» и иммуноглобулиновые части иммуноадгезина, вставлены последовательно друг за другом в плазмидный вектор, который управляет эффективной экспрессией в выбранных клетках-хозяевах.
Дополнительные подробности изобретения представлены в нижеприведенных, не имеющих ограничения, примерах.
Все патенты, патентные заявки, публикации, описания продукта и протоколы процитированы во всей данной заявке, публикуемые сведения которых включены в настоящий документ в полном объеме в качестве ссылки.
ПРИМЕРЫ
Нижеприведенные примеры представлены только для иллюстративных целей и не предполагают ограничивать объем настоящего изобретения каким-либо образом. Коммерчески доступные реагенты, на которые ссылаются в примерах, были использованы в соответствии с инструкциями изготовителя, если не указано иное. Источником клеток, рассматриваемых в нижеприведенных примерах и во всем описании изобретения, с использованием идентификационных номеров АТСС®, является американская коллекция типовых культур, Манассас, Вирджиния.
Пример 1
Получение полипептидов в среде для продукции без глутамина
Материалы и методы:
Клеточные линии. В этих исследованиях были использованы клетки-хозяева СНО, экспрессирующие антитело Apomab, антитело против VEGF и слитый белок BR3-Fc, соответственно. Клетки-хозяева были адаптированы в суспензионной и бессывороточных культурах. Замороженные клеточные запасы были приготовлены в виде главного или рабочего банка клеток в средах, описанных ниже.
Поддержание клеточной культуры выполняли, используя 250 мл или 1-литровые вентилируемые встряхиваемые колбы Corning®, содержащиеся в увлажненной камере с СО2 Thermo Scientific Forma®, поддерживаемой при 37°С и 5% СО2. Колебания колб происходило со скоростью 150 об/мин на шейкере с платформой New Brunswick Scientific Innova®-2100 с индивидуальной содержащей поликоровую подложку платформой. Клеточные культуры пассировали каждые 3 или 4 дня со свежими средами и высевали при 0,11% или 0,20% уплотненного клеточного объема (PCV). PCV был получен при использовании стеклянной 10-мл пробирки KIMAX® USA PCV.
Культуральные среды и условия. Исследования сред начинали с использования 250-мл вентилируемых встряхиваемых колб Corning, инокулированных в одном экземпляре, в двух экземплярах или трех экземплярах при 100 мл рабочего объема при 0,20% PCV для всех случаев, используя клеточную культуру из исходной 1-литровой вентилируемой встряхиваемой колбы Corning® c 500-мл рабочего объема. PCV был получен при использовании стеклянной 10-мл пробирки KIMAX® USA PCV.
До начала исследования клеточную культуру центрифугировали при 1000 об/мин в течение 5 минут в центрифуге Sorvall® RT 6000B, чтобы на 100% завершить обмен посевных сред, содержащих глутамин, с соответствующими испытуемыми средами. Различные концентрации глутамина, глутамата, аспарагина и аспартата были исследованы в различных испытуемых средах. Были исследованы следующие концентрации: глутамина 0-10 мМ, глутамата 1-10 мМ, аспарагина 0-15 мМ, аспартата 1-10 мМ. Характеристики сред оценивали в полнофакторных исследованиях DOE.
Воздействие среды без глутамина было также исследовано в коммерчески доступной среде DMEM/F12. Среда была использована при 5× концентрации (7,05 г/л) при избыточных аспарагине (10 мМ в целом), аспартате (10 мМ в целом), глутамине (10 мМ в целом для содержащей глутамин среды), глутамате (1 мМ в целом) и глюкозе (8 г/л в целом). Проводили сравнение среды без глутамина и при наличии глутамина, используя клетки, экспрессирующие Apomab и антитела против VEGF.
Встряхиваемые колбы содержали в увлажненной камере с СО2 Thermo Scientific Forma®, поддерживаемой при 37°С и 5% СО2. Колебания колб происходило со скоростью 150 об/мин на шейкере с платформой New Brunswick Scientific Innova®-2100 с индивидуальной содержащей поликоровую подложку платформой.
Используемая среда содержала следующие компоненты:
Органические соли и следовые элементы
Аммония парамолибдат, тетрагидрат
Аммониевый оксид ванадия
Хлорид кальция, безводный
Сульфат меди, пентагидрат
Сульфат железа, гептагидрат
Хлорид калия
Хлорид магния, безводный
Сульфат марганца, моногидрат
Хлорид никеля, гексагидрат
Селенистая кислота
Метасиликат натрия, нонагидрат
Фосфат натрия, одноосновный, моногидрат
Хлорид олова, дигидрат
Сульфат цинка, гептагидрат
Липиды
Линолевая кислота
Липоевая кислота (иначе называемая тиоктовая кислота)
Путресцин, дигидрохлорид
Аминокислоты
L-аланин
L-аргинин, моногидрохлорид
L-аспарагин
L-аспарагиновая кислота
L-цистеин, моногидрохлорид, моногидрат
L-глутаминовая кислота
L-глутамин
L-гистидин, моногидрохлорид, моногидрат
L-изолейцин
L-лейцин
L-лизин, моногидрохлорид
L-метионин
L-фенилаланин
L-пролин
L-серин
L-треонин
L-триптофан
L-тирозин, двунатриевая соль, дигидрат
L-валин
Витамины
Биотин
D-кальция пантотенат
Хлорид холина
Фолиевая кислота
I-инозитол
Ниацинамид
Пиридоксин, моногидрохлорид
Рибофлавин
Тиамин, моногидрохлорид
Витамин В-12
Источник углерода, ростовые факторы и прочее
Плюроник F-68
D-глюкоза
Бикарбонат натрия
Пируват натрия
Хлорид натрия
Гидроксид натрия
Инсулин
Галактоза
Коммерчески доступная культуральная среда DMEM/F-12 также была исследована, имея следующие компоненты:
Среду для посевной культуры (в отличие от фазы продукции), как правило, дополняют 5 мМ глутамином, 8 г/л глюкозы и 75-2000 нМ метотрексатом.
Для исследований было проведено регулирование значения рН по мере необходимости с целью поддержания значения рН при 7,00±0,10, используя 1 М карбонат натрия. Регулирование значения рН было выполнено путем добавления 1 мл/л 1М карбоната натрия для повышения единиц рН на 0,10.
Клеточную культуру анализировали вплоть до 14 дней путем отбора 3,5-мл образца и анализировали на предмет числа жизнеспособных клеток, жизнеспособности и размера клеток, используя цитометр Beckman Coulter ViCellTM-1.0. Анализ питательных веществ был выполнен с использованием Nova 400 Biomedical Bioprofile®. Осмоляльность измеряли путем использования многоканального осмометра Advanced® Instrument multi-sample Osmometer (модель 3900). Титр рекомбинантного продукта был получен при использовании Agilent 1100 Series HPLC.
Рекомбинантные белки. Полученными рекомбинантными белками были Apomab (TRAIL), анти-VEGF и иммуноадгезин BR3-Fc.
Анализ данных. Статистический анализ данных был выполнен, используя полнофакторный план эксперимента, который является экспериментом, чей план состоит из двух или более факторов, каждый с дискретными возможными значениями или «уровнями», и чьи экспериментальные единицы принимают все возможные комбинации этих уровней для совокупности всех таких факторов. Полнофакторный план эксперимента также может называться планом с полностью пересекающимися факторами. Такой эксперимент позволяет изучать влияние каждого фактора на переменную отклика, а также влияния взаимодействий между факторами на переменную отклика.
Результаты
Как показано на Фиг.1-5, использование среды для продукции без глутамина увеличивало конечный титр рекомбинантного белка антитела Apomab, иммуноадгезина BR3-Fc и антитела анти-VEGF. В каждом случае, анализ результатов в отношении титра с помощью кубического построения, используя полнофакторный план эксперимента, оценивающий эффект различных концентраций глутамина, глутамата, аспарагина и аспартата, прогнозирует, что наивысший титр достигается в средах без глутамина, дополненных 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой (Фиг.1-3).
Влияние аспарагина в условиях без глутамина, низкого уровня глутамата и высокого уровня аспартата на титр антитела Apomab показано на Фиг.4. В среде без глутамина титр антитела Apomab был значительно увеличен в присутствии 2,5-15 мМ аспарагина по сравнению с безглутаминовыми культурами в отсутствие аспарагина. В этих условиях, наличие или отсутствие глутамата не оказывало никакого воздействия на титр.
Титр получения антитела Apomab для всей совокупности различных концентраций аспарагина и аспартата в условиях отсутствия глутамина и низкого уровня глутамата проиллюстрирован на Фиг.5. Положительный эффект титрования наблюдали при повышении концентрации аспартата от 0 до 10 мМ в этих условиях.
Влияние среды без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, на титр показано на Фиг.6А-С, где конечный титр для антитела Apomab, антитела против VEGF и иммуноадгезина BR3-Fc (А-С, соответственно) был значительно выше в среде без глутамина по сравнению с содержащей глутамин средой.
Подобные результаты были получены, используя имеющуюся в продаже культуральную среду DMEM/F-12. Как показано на Фиг.7А и В, конечный титр для антитела Apomab и антитела против VEGF (А и В, соответственно) был значительно выше в среде DMEM/F12 без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, по сравнению с содержащей глутамин средой DMEM F12, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой.
Как показано на Фиг.8 и 9, использование среды для продукции без глутамина также увеличивало специфическое получение, измеренное как Qp (мг/мл-клетка/день). Фиг.8А-С демонстрируют, что клеточно-специфичная продуктивность (Qp) для антитела Apomab, антитела против VEGF и иммуноадгезина BR3-Fc (А-С, соответственно) была значительно выше в среде без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, по сравнению с содержащей глутамин средой. Фиг.9А и В демонстрируют, что клеточно-специфичная продуктивность для антитела Apomab и антитела против VEGF (А и В, соответственно) была значительно выше в среде DMEM/F12 без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, по сравнению с содержащей глутамин средой DMEM/F12.
Как показано на Фиг.10 и 11, использование среды для продукции без глутамина значительно улучшает жизнеспособность клеток и удлиняет продолжительность жизни культуры. Фиг.10А-С демонстрируют, что жизнеспособность клеток для антитела Apomab, антитела против VEGF и иммуноадгезина BR3-Fc (А-С, соответственно) была выше в среде без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, по сравнению с содержащей глутамин средой. Фиг.11А и В указывают на то, что в среде DMEM/F12 жизнеспособность клеток не была стабильно улучшена в питательной среде без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой. Примечательно, что жизнеспособность была выше для антитела Apomab (Фиг.11А), но ниже для антитела против VEGF (Фиг.11В) по сравнению с содержащей глутамин средой.
Как показано на Фиг.12 и 13, использование среды для продукции без глутамина значительно снижало накопление NH4+ по сравнению с содержащей глутамин средой. Фиг.12А-С демонстрируют, что уровни аммиака были, как правило, ниже в культурах клеток без глутамина, дополненных 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, по сравнению с содержащими глутамин культурами. Фиг.13А и В демонстрируют, что уровни аммиака были значительно снижены в среде DMEM/F12 без глутамина, дополненной 10 мМ аспарагином, 10 мМ аспарагиновой кислотой и 1 мМ глутаминовой кислотой, по сравнению с содержащей глутамин средой DMEM/F12.
Изобретение, наглядно описанное в настоящем документе, может надлежащим образом быть использовано на практике при отсутствии любого элемента или элементов, ограничения или ограничений, которые конкретно не рассмотрены в настоящем документе. Таким образом, например, термины «заключающий в себе», «включающий», «содержащий» и т.д. должны читаться в широком смысле и без ограничения. Кроме того, термины и выражения, применяемые в настоящем документе, были использованы как термины описания и без ограничения, и нет намерения в использовании таких терминов и выражений для исключения любого эквивалента представленного изобретения или его части, но признанно считать, что различные модификации возможны в рамках заявленного изобретения. Следует понимать, что хотя настоящее изобретение было конкретно рассмотрено посредством предпочтительных вариантов осуществления и дополнительных признаков, модификации и вариации изложенных изобретений, рассмотренных в настоящем документе, могут быть без труда внесены специалистами в данной области техники, и такие модификации и вариации подлежат рассмотрению в рамках изобретения, рассмотренного в настоящем документе.
Из описания настоящего изобретения следует, что различные эквиваленты могут быть использованы для реализации концепций настоящего изобретения, не выходя за его рамки. Более того, хотя изобретение было описано с конкретной ссылкой на определенные варианты осуществления, специалист в данной области техники примет во внимание, что изменения могут быть сделаны по форме и всесторонне без отклонения от сущности и объема изобретения. Описанные варианты осуществления изобретения рассматриваются во всех отношениях в качестве иллюстративного материала и без ограничения. Следует также понимать, что изобретение не ограничивается частными вариантами осуществления, описанными в настоящем документе, а выполнено с возможностью внесения многих эквивалентов, перестроек, модификаций и замен без отклонения от объема изобретения. Таким образом, дополнительные варианты осуществления изобретения находятся в пределах объема настоящего изобретения и в рамках нижеприведенной формулы изобретения.
Все патенты и заявки США; иностранные патенты и заявки; научные статьи; книги; и публикации, упомянутые в настоящем документе, включены в настоящий документ в качестве ссылки в полном объеме, как если бы было особым образом и индивидуально указано, чтобы каждый индивидуальный патент или публикация были включены в качестве ссылки, включая любые графические изображения, чертежи и таблицы, будто изложенные в полном объеме.
Реферат
Настоящее изобретение относится к области генной инженерии, конкретно к клеточным культуральным средам без глутамина, дополненным аспарагином, и может быть использовано для получения полипептида, выбранного из антител, фрагментов антител и иммуноадгезинов, в клетке-хозяине млекопитающего. Для получения полипептида в фазе продукции предложена готовая к использованию клеточная культуральная среда без глутамина, которая содержит аспарагин от 7,5 мМ до 15 мМ и аспарагиновую кислоту от 1 мМ до 10 мМ. Изобретение позволяет увеличить продолжительность жизни культуры клеток, специфическую продуктивность и конечный титр рекомбинантного белка. 2 н. и 40 з.п. ф-лы, 13 ил., 1 пр.

Комментарии