Варианты иммуноглобулина и их применения - RU2536937C2
Код документа: RU2536937C2
Чертежи

































































Описание
Релевантные заявки
Данная заявка является непредварительной заявкой, поданной по 37 CFR 1.53(b)(1), по которой испрашивается приоритет по 35 USC 119(e) предварительной заявки 61/105086, поданной 14 октября 2008 года, предварительной заявки 61/152131, поданной 12 февраля 2009 года, предварительной заявки 61/171768, поданной 22 апреля 2009 года, и предварительной заявки 61/220514, поданной 25 июня 2009 года, содержание которых включено в данный документ посредством ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение главным образом относится к области молекулярной биологии. Конкретнее, настоящее изобретение относится к вариантам иммуноглобулина IgG с измененными биологическими свойствами и способам их применения.
Уровень техники
С течением времени применение иммуноглобулинов в качестве лекарственных средств существенно возросло. Иммуногобулиновые молекулы (Ig), составляющие важную часть иммунной системы, представляют большой интерес, поскольку (1) они взаимодействуют с различными семействами лигандов; (2) обладают различными эффекторными функциями и (3) имеют большое биологическое значение. В настоящее время применение лекарственных средств на основе антител включает лечение рака, аутоиммунных заболеваний, а также различных системных и инфекционных заболеваний. Кроме того, иммуноглобулины являются пригодными для применения в качестве диагностических средств в условиях in vivo, например, при диагностических визуализирующих процедурах.
IgG представляет собой наиболее распространенный класс иммуноглобулинов у людей и других млекопитающих и применяется в различных типах иммунотерапии и диагностических методов. IgG1 человека представляет собой наиболее широко применяемое антитело для терапевтических целей. В настоящее время многие антитела, проходящие клинические испытания, направлены на опухолевые антигены. В частности, было показано, что многие нейтрализующие анти-VEGF антитела ингибируют рост различных клеток опухолевых линий человека у безтимусных мышей (Kim et al., Nature, 362:841-844 (1993); Warren et al., J. Clin. Invest., 95:1789-1797 (1995); Borgstrom et al., Cancer Res., 56:4032-4039 (1996) и Melnyk et al., Cancer Res., 56:921-924 (1996)) и также подавляют ангиогенез внутри глаза на моделях ишемических нарушений сетчатки (Adamis et al., Arch. Ophthalmol., 114:66-71 (1996)). Действительно, гуманизированное анти-VEGF антитело, бевацизумаб (авастин®, Genentech, South San Francisco, CA), является первым разрешенным FDA для применения лекарственным средством, предназначенным для ингибирования ангиогенеза.
Несмотря на потенциальные возможности, одной из проблем, связанных с иммунотерапией иммуноглобулинами, является персистенция иммуноглобулинов в кровотоке. Скорость клиренса иммуноглобулинов оказывает непосредственное влияние на количество и кратность дозирования иммуноглобулина. Повышенная дозировка и кратность введения могут вызвать негативные эффекты у пациента, а также привести к увеличению стоимости лечения.
Механизм катаболизма IgG в кровотоке исследовался в опытах, связанных с передачей пассивного иммунитета от матери к плоду/новорожденному через плаценту и желточный мешок, или через молозиво (передача от матери плоду IgG посредством трансцитоза) у грызунов (Brambell, Lancett, ii:1087-1093 (1966); Rodewald, J. Cell Biol., 71:666-670 (1976); Morris et al., In: Antigen Absorption by the Gut, pp. 3-22 (1978), University Park Press; Jones et al., J. Clin. Invest., 51:2916-2927 (1972)). Fc-рецептор новорожденных (FcRn) играет важную роль в трансцитозе и гомеостазе IgG у млекопитающих. В структурном отношении FcRn гомологичен молекулам главного комплекса гистосовместимости класса I (MHC) и состоит из трансмембранной цепи α и β2-микроглобулина (β2m). В предшествующих исследованиях, проведенных на нокаутных мышах, было показано, что время полужизни IgG в сыворотке крови мышей с дефицитом FcRn или β2m значительно снижено (Roopenian et al., J. Immunol., 170(7), 3528-3533 (2003); Israel et al., Immunology, 89(4), 573-578 (1996)), что свидетельствует о защитной роли FcRn в регуляции уровня циркулирующего IgG. В результате проведения экспериментов с сайт-направленным мутагенезом в Fc-области мышиных IgG идентифицировали некоторые аминокислотные остатки, принимающие участие во взаимодействии IgG и FcRn (Kim et al., Eur. J. Immunol., 24:2429-2434 (1994); Medesan et al., Eur. J. Immunol., 26:2533 (1996); Medesan et al., J. Immunol., 158:2211-2217 (1997)). Кроме того, в различных публикациях описаны способы получения физиологически активных молекул с модифицированным временем полужизни интродукцией или модификацией FcRn-связывающей области IgG (международная заявка WO 97/43316; патент США № 5869046; патент США № 5747035; международная заявка WO 96/32478; международная заявка WO 2006053301; патент США № 7083784; патент США № 7371826).
На молекулярном уровне FcRn связывается с Fc-участком IgG в домене CH2-CH3. Взаимодействие Fc-FcRn в большой степени зависит от рН; IgG связывается с FcRn с высокой аффинностью при рН 6, но по мере повышения рН до 7,4 аффинность существенно снижается. Данное зависимое от рН взаимодействие ответственно за защиту IgG от разрушения. В частности, подвергшийся пиноцитозу IgG захватывается FcRn в эндосоме с кислой средой, рециркулирует обратно на клеточную поверхность и затем вновь высвобождается в кровоток при физиологическом значении рН сыворотки, равном 7,4 (Ober et al., Proc. Natl. Acad. Sci. USA, 101(30), 11076-11081 (2004); Ober et al., J. Immunol., 172(4), 2021-2029 (2004); Prabhat et al., Proc. Natl. Acad. Sci. USA, 104(14), 5889-5894 (2007)). IgG, который не связан с FcRn, направляется в лизосому и подвергается деградации. Поскольку FcRn играет важную роль в регуляции гомеостаза IgG, то модуляция взаимодействия между Fc и FcRn посредством конструирования белка представляет способ совершенствования фармакокинетики терапевтических антител (Shields et al., J. Biol. Chem., 276(9), 6591-6604 (2001); Dall'Acqua et al., Nat. Biotechnol., 15(7), 637-640 (1997); Dall'Acqua et al., J. Immunol., 169(9), 5171-5180 (2002); Hinton et al., J. Biol. Chem., 279(8), 6213-6216 (2004); Hinton et al., J. Immunol., 176(1), 346-356 (2006); Datta-Mannan et al., Drug Metab. Dispos., 35(1), 86-94 (2007); Datta-Mannan et al., J. Biol. Chem., 282(3), 1709-1717 (2007)). Результаты исследований на мышах, резус макаках и обезьянах рода Cynomolgus показали, что повышение зависимой от рН 6 аффинности связывания IgG может пролонгировать время полужизни IgG (Dall'Acqua et al., Nat. Biotechnol., 15(7), 637-640 (1997); Dall'Acqua et al., J. Immunol., 169(9), 5171-5180 (2002); Hinton et al., J. Biol. Chem., 279(8), 6213-6216 (2004); Hinton et al., J. Immunol., 176(1), 346-356 (2006)). Кроме того, результаты других исследований показали, что аффинность связывания с FcRn при рН 7,4 представляет собой дополнительную детерминанту для фармакокинетики IgG. В частности, некоторые варианты с повышенной аффинностью связывания при рН 7,4 с мышиным FcRn имеют повышенный клиренс (т.е. уменьшенное время полужизни) у мышей (Dall'Acqua et al., J. Immunol., 169(9), 5171-5180 (2002)). Тем не менее, тесная взаимосвязь между аффинностью FcRn и временем полужизни не выяснена, поскольку все ранее проведенные исследования включали небольшое число вариантов с ограниченным рядом значений аффинности FcRn. Максимальное увеличение времени полужизни, достигаемое конструированием взаимодействия Fc:FcRn, остается неясным.
Несмотря на тот факт, что соблюдение (или следование) пациентами назначенной схемы лечения лекарственными средствами является важным, установлено, что половина из тех пациентов, которым прописаны средства, не принимают их в рекомендованном режиме. Например, результаты недавно проведенного исследования показали, что примерно треть женщин, принимающих средства по поводу рака молочной железы, разработанные в последние 10 лет, не завершают рекомендованный пятилетний курс. Некоторые причины несоблюдения схем лечения включают забывчивость, физические затруднения в соблюдении (например, путешествие или отъезд из места лечения), неудобство, побочные эффекты, сложная схема приема средств или высокая стоимость средств. Слабое соблюдение прописанных схем лечения лекарственными средствами может привести к получению более низких результатов лечения, чем полное выздоровление, которое могут обеспечить средства пациентам. Например, отсутствие завершения рекомендованного курса противоопухолевой терапии может привести к рецидиву заболевания и снижению выживаемости пациента.
Стратегии повышения строгого следования схемам терапии лекарственными средствами включают обеспечение большего удобства для пациентов для завершения рекомендованного курса лечения. Одним способом обеспечения этого для пациентов, проходящих лечение иммунотерапией, является увеличение продолжительности времени, в течение которого иммуноглобулины находятся в кровотоке. Скорость клиренса иммуноглобулина оказывает самое прямое влияние на количество и кратность введения иммуноглобулина. Следовательно, разработав иммуноглобулин с увеличенным временем полужизни в условиях in vivo, можно снизить количество и/или кратность введений, сведя до минимума возможные неудобства, а также любые дополнительные затраты.
Следовательно, будет очень преимущественным иметь модифицированные иммуноглобулины с увеличенным временем полужизни в условиях in vivo для терапевтических целей. Настоящее изобретение относится к данным и другим потребностям, как станет очевидным при знакомстве с последующим описанием.
Сущность изобретения
Изобретение относится к новым вариантам IgG и их применениям. В изобретении предлагается ряд вариантов IgG. Например, настоящее изобретение относится к новым вариантам IgG, включающим Fc-участок человеческого IgG, содержащий две или более аминокислотных замен, по сравнению с Fc-участком человеческого IgG дикого типа, в двух или более аминокислотных остатках 251, 252, 307, 308, 378, 428, 430, 434 и 436 по EU-системе нумерации по Kabat, где вариантные IgG имеют увеличенное время полужизни по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG дикого типа, и где, по меньшей мере, две аминокислотные замены находятся в аминокислотных остатках 251, 252, 307, 308, 378, 428, 430, 434 и 436, и аминокислотная замена в аминокислотном остатке 251 представляет замену на аспарагиновую кислоту или глутаминовую кислоту, аминокислотная замена в аминокислотном остатке 252 представляет замену на тирозин, аминокислотная замена в аминокислотном остатке 307 представляет замену на глутамин, аминокислотная замена в аминокислотном остатке 308 представляет замену на пролин, аминокислотная замена в аминокислотном остатке 378 представляет замену на валин, аминокислотная замена в аминокислотном остатке 428 представляет замену на лейцин, аминокислотная замена в аминокислотном остатке 430 представляет замену на аланин или лизин, аминокислотная замена в аминокислотном остатке 434 представляет замену на аланин, серин или тирозин, и аминокислотная замена в аминокислотном остатке 436 представляет замену на изолейцин.
В некоторых вариантах осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 251, где аминокислотная замена в аминокислоте 251 представляет замену на аспарагиновую кислоту или глутаминовую кислоту. В некоторых вариантах осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 307, где аминокислотная замена в аминокислоте 307 представляет замену на глутамин. В некоторых вариантах осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 308, где аминокислотная замена в аминокислоте 308 представляет замену на пролин. В некоторых вариантах осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 378, где аминокислотная замена в аминокислоте 378 представляет замену на валин. В некоторых вариантах осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 436, где аминокислотная замена в аминокислоте 436 представляет замену на изолейцин. В некоторых вариантах осуществления вариантные IgG обладают более высокой аффинностью связывания для FcRn по сравнению с IgG, имеющим Fc-участок человеческого IgG дикого типа.
В одном варианте осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 307 на глутамин и аминокислотную замену в аминокислоте 434 на аланин. В одном варианте осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 307 на глутамин и аминокислотную замену в аминокислоте 434 на серин. В одном варианте осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 308 на пролин и аминокислотную замену в аминокислоте 434 на аланин. В одном варианте осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 252 на тирозин и аминокислотную замену в аминокислоте 434 на аланин. В одном варианте осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 378 на валин и аминокислотную замену в аминокислоте 434 на аланин. В одном варианте осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 428 на лейцин и аминокислотную замену в аминокислоте 434 на аланин. В одном варианте осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 434 на аланин и аминокислотную замену в аминокислоте 436 на изолейцин. В одном варианте осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 308 на пролин и аминокислотную замену в аминокислоте 434 на тирозин. В одном варианте осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 307 на глутамин и аминокислотную замену в аминокислоте 436 на изолейцин.
Настоящее изобретение также относится к новым вариантам IgG, включающим Fc-участок человеческого IgG, содержащий три или более аминокислотных замен, по сравнению с Fc-участком человеческого IgG дикого типа, в трех или более аминокислотных остатках 251, 252, 307, 308, 378, 380, 428, 430, 434 и 436, по EU-системе нумерации по Kabat, где варианты IgG имеют увеличенное время полужизни по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG дикого типа, и где, по меньшей мере, три аминокислотные замены находятся в аминокислотных остатках 251, 252, 307, 308, 378, 380, 428, 430, 434 и 436, и аминокислотная замена в аминокислотном остатке 251 представляет замену на аспарагиновую кислоту или глутаминовую кислоту, аминокислотная замена в аминокислотном остатке 252 представляет замену на тирозин, аминокислотная замена в аминокислотном остатке 307 представляет замену на глутамин, аминокислотная замена в аминокислотном остатке 308 представляет замену на пролин, аминокислотная замена в аминокислотном остатке 378 представляет замену на валин, аминокислотная замена в аминокислотном остатке 380 представляет замену на аланин, аминокислотная замена в аминокислотном остатке 428 представляет замену на лейцин, аминокислотная замена в аминокислотном остатке 430 представляет замену на аланин или лизин, аминокислотная замена в аминокислотном остатке 434 представляет замену на аланин, серин, тирозин или гистидин, и аминокислотная замена в аминокислотном остатке 436 представляет замену на изолейцин.
В некоторых вариантах осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 251, где аминокислотная замена в аминокислоте 251 представляет замену на аспарагиновую кислоту или глутаминовую кислоту. В некоторых вариантах осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 307, где аминокислотная замена в аминокислоте 307 представляет замену на глутамин. В некоторых вариантах осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 308, где аминокислотная замена в аминокислоте 308 представляет замену на пролин. В некоторых вариантах осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 378, где аминокислотная замена в аминокислоте 378 представляет замену на валин. В некоторых вариантах осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 436, где аминокислотная замена в аминокислоте 436 представляет замену на изолейцин. В некоторых вариантах осуществления вариантные IgG обладают более высокой аффинностью связывания для FcRn по сравнению с IgG, имеющим Fc-участок человеческого IgG дикого типа.
В одном варианте осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 307 на глутамин, аминокислотную замену в аминокислоте 380 на аланин и аминокислотную замену в аминокислоте 434 на серин. В одном варианте осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 307 на глутамин, аминокислотную замену в аминокислоте 380 на аланин и аминокислотную замену в аминокислоте 434 на аланин. В одном варианте осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 252 на тирозин, аминокислотную замену в аминокислоте 308 на пролин и аминокислотную замену в аминокислоте 434 на тирозин. В одном варианте осуществления Fc-участок человеческого IgG содержит аминокислотную замену в аминокислоте 251 на аспарагиновую кислоту, аминокислотную замену в аминокислоте 307 на глутамин и аминокислотную замену в аминокислоте 434 на гистидин.
В некоторых вариантах осуществления настоящее изобретение относится к вариантным IgG или их фрагментам, дополнительно содержащим аминокислотную замену в положении 297 на аланин.
В некоторых вариантах осуществления вариантный IgG по настоящему изобретению обладает более высокой аффинностью связывания в отношении FcRn по сравнению с IgG, имеющим Fc-участок человеческого IgG дикого типа. В некоторых вариантах осуществления вариантный IgG обладает более высокой аффинностью связывания в отношении FcRn при рН 6,0, чем при рН 7,4. В некоторых вариантах осуществления вариантный IgG представляет собой человеческий или гуманизированный IgG. В некоторых вариантах осуществления вариантный IgG представляет собой IgG1, IgG2, IgG3 или IgG4. В некоторых вариантах осуществления IgG Fc-участок вариантного IgG представляет собой Fc-участок IgG1, IgG2, IgG3 или IgG4. В некоторых вариантах осуществления IgG Fc-участок вариантного IgG представляет собой Fc-участок IgG1.
В некоторых вариантах осуществления вариантный IgG представляет собой анти-VEGF антитело. В некоторых вариантах осуществления вариантный IgG представляет собой вариант бевацизумаба. В некоторых вариантах осуществления IgG, имеющий Fc-участок человеческого IgG дикого типа, представляет собой бевацизумаб. В некоторых вариантах осуществления IgG, имеющий Fc-участок человеческого IgG дикого типа, представляет собой Fc-участок бевацизумаба. В некоторых вариантах осуществления вариантный IgG содержит вариабельный домен тяжелой цепи (SEQ ID NO:1) и вариабельный домен легкой цепи (SEQ ID NO:2). В некоторых вариантах осуществления вариантный IgG содержит вариабельный домен тяжелой цепи (SEQ ID NO:3) и вариабельный домен легкой цепи (SEQ ID NO:4). В некоторых вариантах осуществления вариантный IgG содержит вариабельный домен тяжелой цепи (SEQ ID NO:7) и вариабельный домен легкой цепи (SEQ ID NO:8).
Настоящее изобретение дополнительно раскрывает фармацевтические композиции, содержащие любой из вариантных IgG, описанных в данном документе, и фармацевтически приемлемый носитель. Также в данном документе раскрывается набор, содержащий любой из вариантных IgG, описанных в данном документе, в контейнере и инструкции по применению.
В некоторых вариантах осуществления время полужизни вариантного IgG увеличивается, по меньшей мере, на 50%, 100%, 150%, 200%, 300% и более по сравнению с IgG, имеющим Fc-участок человеческого IgG дикого типа. В некоторых вариантах осуществления время полужизни вариантного IgG увеличивается, по меньшей мере, в 2 раза по сравнению с IgG, имеющим Fc-участок человеческого IgG дикого типа. В некоторых вариантах осуществления время полужизни вариантного IgG увеличивается, по меньшей мере, в 3 раза по сравнению с IgG, имеющим Fc-участок человеческого IgG дикого типа. В некоторых вариантах осуществления время полужизни вариантного IgG увеличивается, по меньшей мере, в 4 раза по сравнению с IgG, имеющим Fc-участок человеческого IgG дикого типа. В некоторых вариантах осуществления IgG, имеющий Fc-участок человеческого IgG дикого типа, представляет собой бевацизумаб. В некоторых вариантах осуществления время полужизни вариантного IgG является средним временем полужизни бевацизумаба. В некоторых вариантах осуществления среднее время полужизни бевацизумаба составляет примерно 10-12 суток у обезьян рода Cynomolgus или примерно 3 недели у человека.
В некоторых вариантах осуществления представлены вариантные IgG, содержащие Fc-участок человеческого IgG, где Fc-участок человеческого IgG содержит аминокислотные замены по сравнению с Fc-участком человеческого IgG дикого типа в аминокислотных остатках 307 и 434 по EU-системе нумерации по Kabat, где вариантный IgG имеет увеличенное время полужизни по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG дикого типа, и где аминокислотная замена в аминокислотном остатке 307 представляет замену на глутамин, и аминокислотная замена в аминокислотном остатке 434 представляет замену на аланин. В одном варианте осуществления вариантный IgG представляет собой вариантный IgG1, содержащий вариабельный домен тяжелой цепи (SEQ ID NO:1) и вариабельный домен легкой цепи (SEQ ID NO:2), и включающий Fc-участок человеческого IgG1, содержащий аминокислотные замены, по сравнению с Fc-участком человеческого IgG1 дикого типа, в аминокислотных остатках 307 и 434 по EU-системе нумерации по Kabat, где вариантный IgG1 имеет увеличенное время полужизни по сравнению с временем полужизни IgG1, имеющего Fc-участок человеческого IgG1 дикого типа, и где аминокислотная замена в аминокислотном остатке 307 представляет замену на глутамин, и аминокислотная замена в аминокислотном остатке 434 представляет замену на аланин.
В другом варианте осуществления представлены вариантные IgG, включающие Fc-участок человеческого IgG, где Fc-участок человеческого IgG содержит аминокислотные замены, по сравнению с Fc-участком человеческого IgG дикого типа, в аминокислотных остатках 307 и 434 по EU-системе нумерации по Kabat, где вариантный IgG имеет увеличенное время полужизни по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG дикого типа, и где аминокислотная замена в аминокислотном остатке 307 представляет замену на глутамин, и аминокислотная замена в аминокислотном остатке 434 представляет замену на серин.
В еще одном варианте осуществления представлены вариантные IgG, включающие Fc-участок человеческого IgG, где Fc-участок человеческого IgG содержит аминокислотные замены, по сравнению с Fc-участком человеческого IgG дикого типа, в аминокислотных остатках 308 и 434 по EU-системе нумерации по Kabat, где вариантный IgG1 имеет увеличенное время полужизни по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG дикого типа, и где аминокислотная замена в аминокислотном остатке 308 представляет замену на пролин, и аминокислотная замена в аминокислотном остатке 434 представляет замену на аланин.
В еще одном варианте осуществления представлены вариантные IgG, включающие Fc-участок человеческого IgG, где Fc-участок человеческого IgG содержит аминокислотные замены, по сравнению с Fc-участком человеческого IgG дикого типа, в аминокислотных остатках 307, 380 и 434 по EU-системе нумерации по Kabat, где вариантный IgG имеет увеличенное время полужизни по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG дикого типа, и где аминокислотная замена в аминокислотном остатке 307 представляет замену на глутамин, аминокислотная замена в аминокислотном остатке 380 представляет замену на аланин, и аминокислотная замена в аминокислотном остатке 434 представляет замену на серин.
В некоторых вариантах осуществления вариантный IgG, имеющий Fc-участок человеческого IgG, обладает более высокой аффинностью связывания в отношении FcRn по сравнению с IgG, имеющим Fc-участок человеческого IgG дикого типа. В некоторых вариантах осуществления вариантный IgG имеет более высокую аффинность связывания в отношении FcRn при рН 6,0, чем при рН 7,4. В некоторых вариантах осуществления вариантный IgG представляет собой человеческий или гуманизированный IgG. В некоторых вариантах осуществления вариантный IgG представляет собой IgG1, IgG2, IgG3 или IgG4. В некоторых вариантах осуществления IgG Fc-участок вариантного IgG представляет собой Fc-участок IgG1, IgG2, IgG3 или IgG4. В некоторых вариантах осуществления IgG Fc-участок вариантного IgG представляет собой Fc-участок IgG1. В некоторых вариантах осуществления вариантный IgG представляет собой анти-VEGF антитело. В некоторых вариантах осуществления вариантный IgG представляет собой вариант бевацизумаба. В некоторых вариантах осуществления IgG, имеющий Fc-участок человеческого IgG дикого типа, представляет собой бевацизумаб. В некоторых вариантах осуществления Fc-участок человеческого IgG дикого типа, представляет собой Fc-участок бевацизумаба. В некоторых вариантах осуществления вариантный IgG содержит вариабельный домен тяжелой цепи (SEQ ID NO:1) и вариабельный домен легкой цепи (SEQ ID NO:2). В некоторых вариантах осуществления представлена фармацевтическая композиция, содержащая любой из вариантных IgG, содержащих Fc-участок человеческого IgG, и фармацевтически приемлемый носитель. Также представлен набор, включающий любой из вариантных IgG, содержащих Fc-участок человеческого IgG, в контейнере и инструкции по применению.
В некоторых вариантах осуществления представлены вариантные IgG, включающие Fc-участок человеческого IgG1, где вариантные IgG содержат вариабельный домен тяжелой цепи (SEQ ID NO:1) и вариабельный домен легкой цепи (SEQ ID NO:2), и где Fc-участок человеческого IgG1 содержит аминокислотную замену, по сравнению с Fc-участком человеческого IgG1 дикого типа, в аминокислотном остатке 434 по EU-системе нумерации по Kabat, где вариантный IgG имеет увеличенное время полужизни по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG1 дикого типа, и где вариантный IgG имеет более высокую аффинность связывания в отношении FcRn по сравнению с IgG, имеющим Fc-участок человеческого IgG1 дикого типа, и где аминокислотная замена в аминокислотном остатке 434 представляет замену на гистидин. В некоторых вариантах осуществления вариантный IgG представляет собой вариантный IgG1.
В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению увеличивается, по меньшей мере, на 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100% по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG дикого типа. В одном варианте осуществления время полужизни вариантного IgG по настоящему изобретению увеличивается, по меньшей мере, на 50% по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG дикого типа. В еще одном варианте осуществления время полужизни вариантного IgG по настоящему изобретению увеличивается, по меньшей мере, на 75% по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG дикого типа. В еще одном варианте осуществления время полужизни вариантного IgG по настоящему изобретению увеличивается, по меньшей мере, на 100% по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG дикого типа.
В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению составляет, по меньшей мере, примерно 15, 20, 25, 30, 35 или 40 суток. В одном варианте осуществления время полужизни вариантного IgG по настоящему изобретению составляет, по меньшей мере, примерно 15 суток. В еще одном варианте осуществления время полужизни вариантного IgG по настоящему изобретению составляет, по меньшей мере, примерно 20 суток. В еще одном варианте осуществления время полужизни вариантного IgG по настоящему изобретению составляет, по меньшей мере, примерно 25 суток. В еще одном варианте осуществления время полужизни вариантного IgG по настоящему изобретению составляет, по меньшей мере, примерно 30 суток. В еще одном варианте осуществления время полужизни вариантного IgG по настоящему изобретению составляет, по меньшей мере, примерно 35 суток. В одном варианте осуществления время полужизни вариантного IgG по настоящему изобретению составляет, по меньшей мере, примерно 40 суток. В некоторых вариантах осуществления вариантный IgG представляет собой вариантный IgG1.
В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению представляет собой время полужизни, определяемое у людей. В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению представляет собой время полужизни, определенное у обезьян рода Cynomolgus. В некоторых вариантах осуществления IgG дикого типа или IgG, имеющий Fc-участок человеческого IgG дикого типа, представляет собой бевацизумаб. В некоторых вариантах осуществления время полужизни бевацизумаба составляет примерно 10-12 суток, которое определено у обезьян рода Cynomolgus, и примерно 20 суток, которое определено у людей.
Изобретение относится к ряду способов применения вариантов IgG. Представлены способы лечения опухоли у субъекта. Например, способы включают введение субъекту эффективного количества любых вариантных IgG, описанных выше и в данном документе. В некоторых вариантах осуществления вариантный IgG представляет собой анти-VEGF антитело. В некоторых вариантах осуществления вариантный IgG представляет собой вариант бевацизумаба. В некоторых вариантах осуществления способы дополнительно включают введение субъекту эффективного количества химиотерапевтического средства.
Изобретение относится к способам ингибирования активности VEGF. Например, способы включают введение указанному субъекту эффективного количества любых вариантных IgG, описанных выше и в данном документе. В некоторых вариантах осуществления активность VEGF представляет ангиогенез.
Изобретение относится к способам модуляции проницаемости сосудов. Например, способы включают введение указанному субъекту эффективного количества любых вариантных IgG, описанных выше и в данном документе.
Изобретение относится к способам лечения ненеопластического заболевания у субъекта. Например, способы включают введение указанному субъекту эффективного количества любых вариантных IgG, описанных выше и в данном документе. В некоторых вариантах осуществления ненеопластическое заболевание представляет собой аутоиммунное заболевание. В некоторых вариантах осуществления ненеопластическое заболевание представляет собой болезнь Альцгеймера. В некоторых вариантах осуществления у субъекта диагностируют возрастную дегенерацию желтого пятна.
Изобретение относится к способам лечения HER-экспрессирующей опухоли у субъекта. Например, способы включают введение указанному субъекту эффективного количества любых вариантных IgG, описанных выше и в данном документе. В некоторых вариантах осуществления вариантный IgG содержит вариабельный домен тяжелой цепи (SEQ ID NO:7) и вариабельный домен легкой цепи (SEQ ID NO:8).
Изобретение относится к способам ингибирования или предупреждения роста злокачественных клеток у субъекта. Например, способы включают введение указанному субъекту эффективного количества любых вариантных IgG, описанных выше и в данном документе.
Изобретение относится к способам введения субъекту эффективного количества вариантного IgG. Данные способы введения можно использовать в комбинации с другими способами (например, способами лечения), описанными в данном документе. В некоторых вариантах осуществления способы включают введение указанному субъекту эффективного количества любых вариантных IgG, описанных выше и в данном документе, и где вариантный IgG вводят субъекту каждые 4 недели или с большими интервалами. В некоторых вариантах осуществления вариантный IgG вводят каждые 5 недель или реже. В некоторых вариантах осуществления вариантный IgG вводят каждые 6 недель или реже. В некоторых вариантах осуществления вариантный IgG вводят каждые 7 недель или реже. В некоторых вариантах осуществления вариантный IgG вводят субъекту каждые 8 недель или реже. В некоторых вариантах осуществления вариантный IgG вводят каждые 9 недель или реже. В некоторых вариантах осуществления вариантный IgG вводят субъекту каждые 10 недель или реже. В некоторых вариантах осуществления вариантный IgG вводят каждые 11 недель или реже. В некоторых вариантах осуществления вариантный IgG вводят субъекту каждые 12 недель или реже. В некоторых вариантах осуществления способы включают введение указанному субъекту эффективного количества любых вариантных IgG, где вариантный IgG вводят реже, чем рекомендовано или прописано вводить IgG, имеющий Fc-участок человеческого IgG дикого типа. В некоторых вариантах осуществления IgG, имеющий Fc-участок человеческого IgG дикого типа, представляет собой бевацизумаб. В некоторых вариантах осуществления вариантный IgG, например вариант бевацизумаба, вводят реже, чем прописано вводить бевацизумаб.
В некоторых вариантах осуществления вариантный IgG первоначально вводят каждые 2 недели и затем вводят каждые 4 недели или реже. В некоторых вариантах осуществления вариантный IgG первоначально вводят каждые 3 недели и затем вводят каждые 6 недель или реже. В некоторых вариантах осуществления вариантный IgG первоначально вводят каждые 4 недели и затем вводят каждые 8 недель или реже. В некоторых вариантах осуществления вариантный IgG первоначально вводят каждые 5 недель и затем вводят каждые 10 недель или реже. В некоторых вариантах осуществления вариантный IgG первоначально вводят каждые 6 недель и затем вводят каждые 12 недель или реже. В некоторых вариантах осуществления вариантный IgG, например вариант бевацизумаба, первоначально вводят с кратностью, прописанной для бевацизумаба, и затем вводят реже, чем прописано для бевацизумаба.
В некоторых вариантах осуществления способов, описанных в данном документе, вариантный IgG представляет собой анти-VEGF антитело. В некоторых вариантах осуществления анти-VEGF антитело содержит вариабельный домен тяжелой цепи (SEQ ID NO:1) и вариабельный домен легкой цепи (SEQ ID NO:2). В еще одном варианте осуществления анти-VEGF антитело представляет собой вариант бевацизумаба.
В некоторых вариантах осуществления вариантные IgG по изобретению вводят субъекту внутривенно. В некоторых вариантах осуществления вариантные IgG по изобретению вводят субъекту подкожно.
В некоторых вариантах осуществления способов, описанных в данном документе, субъектом является человек. В некоторых вариантах осуществления у субъекта диагностируют злокачественную опухоль. В некоторых вариантах осуществления злокачественная опухоль выбрана из группы, состоящей из немелкоклеточного рака легких, рака органов мочевыводящих путей, рака яичника, глиобластомы, рака молочной железы и колоректального рака.
Также представлены способы лечения доброкачественной, предзлокачественной или неметастатической опухоли у субъекта, которые включают введение субъекту эффективного количества вариантного IgG. В некоторых вариантах осуществления введение вариантного IgG предупреждает превращение доброкачественной опухоли, предзлокачественной или неметастатической опухоли в инвазивную или метастатическую злокачественную опухоль. Например, доброкачественная, предзлокачественная или неметастатическая опухоль может быть опухолью на стадии 0, стадии I или стадии II развития, и в некоторых вариантах осуществления вариантный IgG предупреждает переход доброкачественной, предзлокачественной или неметастатической опухоли на следующую стадию(и), например, стадию I, стадию II, стадию III или стадию IV. В некоторых вариантах осуществления вариантный IgG вводят в течение времени и в количестве, достаточных для лечения доброкачественной, предзлокачественной или неметастатической опухоли у субъекта или для предупреждения превращения доброкачественной, предзлокачественной или неметастатической опухоли в инвазивную или метастатическую злокачественную опухоль. В некоторых вариантах осуществления введение вариантного IgG приводит к снижению размера опухоли, опухолевой нагрузки или числа доброкачественных, предзлокачественных или неметастатических опухолей. Также вариантный IgG можно вводить в количестве или в течение времени для снижения плотности сосудов в доброкачественной, предзлокачественной или неметастатической опухоли.
Как описано в данном документе, способы по изобретению можно использовать для лечения, например, злокачественной опухоли на стадии 0 (например, карциномы in situ), стадии I или стадии II. Способы неоадъювантной или адъювантной терапии можно использовать для лечения любого типа опухоли, например, доброкачественной или злокачественной опухоли. В некоторых вариантах осуществления изобретения злокачественная опухоль представляет собой солидную опухоль, включающую, не ограничиваясь этим, рак ободочной кишки, рак молочной железы, рак предстательной железы, рак органов мочевыводящих путей, рак легких (например, немелколкеточный рак легких), меланому, рак яичников, рак поджелудочной железы, рак органов желудочно-кишечного тракта, злокачественные опухоли головы и шеи, рак печени и злокачественные опухоли мягких тканей (например, В-клеточные лимфомы, такие как NHL и множественная миелома, и лейкозы, такие как хронический лимфоцитарный лейкоз). В еще одном варианте осуществления доброкачественная, предзлокачественная или неметастатическая опухоль представляет собой полип, аденому, фиброму, липому, гастриному, инсулиному, хондрому, остеому, гемангиому, лимфангиому, менингиому, лейомиому, рабдомиому, плоскоклеточную папиллому, акустические нейромы, нейрофиброму, цистаному желчного пузыря, лейомимы, мезотелиомы, тератомы, миксомы, трахомы, гранулемы, гамартому, переходноклеточную папиллому, мультиформную аденому слюнной железы, десмоидную опухоль, дермоидную цистпапиллому, цистаденому, фокальную узелковую гиперплазию или узелковую регенеративную гиперплазию. В еще одном варианте осуществления способ желательно использовать для лечения аденомы. Неограничивающие примеры аденом включают аденому печени, аденому мочевыводящих путей, метанефрическую аденому, аденому бронхов, альвеолярную аденому, аденому надпочечников, аденому гипофиза, аденому паращитовидной железы, аденому поджелудочной железы, аденому слюнной железы, гепатоцеллюлярную аденому, аденому органов желудочно-кишечного тракта, тубулярную аденому и аденому желчных протоков.
Изобретение также относится к способам, которые включают введение субъекту эффективного количества вариантного IgG для предупреждения появления или рецидива доброкачественной, предзлокачественной или неметастатической опухоли у субъекта. В некоторых вариантах осуществления субъект подвержен риску развития рака, полипов или ракового синдрома. В одном примере у субъекта имеется семейная история развития рака, полипов или наследственного ракового синдрома. В некоторых аспектах изобретения субъект подвержен риску развития доброкачественной, предзлокачественной или неметастатической опухоли. В некоторых вариантах осуществления способ предупреждает появление или рецидив доброкачественной, предзлокачественной или неметастатической опухоли у субъекта, у которого никогда не было опухоли, у субъекта, у которого никогда не было клинически детектируемой злокачественной опухоли или у субъекта, у которого была только доброкачественная опухоль.
В другом аспекте обеспечиваются способы профилактики или снижения вероятности рецидива злокачественной опухоли у субъекта, которые включают введение субъекту вариантного IgG в течение времени и в количестве, достаточных для профилактики или снижения вероятности рецидива злокачественной опухоли у субъекта. Изобретение включает способ профилактики рецидива злокачественной опухоли у субъекта, имеющего опухоль, который включает стадии удаления опухоли (например, с использованием радикальной операции) и затем введение субъекту вариантного IgG. Изобретение включает способы профилактики повторного роста опухоли у субъекта, которые включают стадии удаления опухоли (например, с использованием радикальной операции) и затем введение субъекту вариантного IgG. В близком аспекте изобретение включает способ профилактики рецидива злокачественной опухоли у субъекта или снижения вероятности рецидива злокачественной опухоли у субъекта, который необязательно включает введение субъекту эффективного количества вариантного IgG до хирургической операции, проведение радикальной операции и введение эффективного количества вариантного IgG после операции, где введение вариантного IgG после операции предупреждает рецидив злокачественной опухоли или снижает вероятность рецидива злокачественной опухоли. В другом близком аспекте изобретение включает способ профилактики рецидива злокачественной опухоли у субъекта или снижения вероятности рецидива злокачественной опухоли, который включает введение субъекту эффективного количества вариантного IgG при отсутствии любого другого противоопухолевого лекарственного средства, где введение предупреждает рецидив злокачественной опухоли у субъекта или снижает вероятность рецидива злокачественной опухоли у субъекта.
В каждом из указанных выше аспектов опухоль может представлять любой тип опухоли, включая, не ограничиваясь этим, солидные опухоли, и в частности, опухоли и аденомы, описанные в данном документе. У субъекта могут иметь место «дремлющая» опухоль или микрометастазы, которые могут детектироваться клинически или могут не детектироваться клинически. В одном варианте осуществления данного аспекта вариантный IgG вводят в течение периода времени или в количестве, достаточных для подавления неоваскуляризации «дремлющей» опухоли или микрометастазов. В другом варианте осуществления вариантный IgG вводят в течение периода времени или в количестве, достаточных для предупреждения появления клинически детектируемой опухоли или ее метастазов или повышения выживаемости субъекта.
В одном варианте осуществления вариантный IgG представляет собой монотерапию. В другом варианте осуществления субъект ранее подвергался лечению по поводу опухоли, например, с использованием противоопухолевой терапии. В одном примере противоопухолевая терапия представляет собой хирургическую операцию. В еще одном варианте осуществления субъект может подвергаться дополнительному лечению с использованием дополнительной противоопухолевой терапии до, во время (например, одновременно) или после введения вариантного IgG. Примеры противоопухолевой терапии включают, без ограничения, оперативное вмешательство, лучевую терапию (радиотерапию), биотерапию, иммунотерапию, химиотерапию или комбинацию данных видов лечения.
В вариантах осуществления, в которых субъект подвергается радикальной хирургической операции, вариантный IgG в основном вводят после периода времени, в течение которого субъект восстанавливается после операции. Данный период времени может включать период, необходимый для заживления раны или заживления хирургического разреза, период времени, необходимый для снижения риска расхождения краев раны, или период времени, необходимого для возвращения субъекта к состоянию здоровья, в основном аналогичного или лучшего по сравнению с состоянием здоровья перед хирургической операцией. Период времени между завершением радикальной хирургической операции и первым введением вариантного IgG может также включать период, необходимый для «отдыха от лекарств», где для субъекта необходим или требуется период между терапевтическими схемами. Обычно период времени между завершением радикальной операции и началом терапии вариантным IgG может составлять менее чем одну неделю, 1 неделю, 2 недели, 3 недели, 4 недели (28 суток), 5 недель, 6 недель, 7 недель, 8 недель, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 1 год, 2 года, 3 года или более. В одном варианте осуществления период времени между радикальной операцией и терапией вариантным IgG составляет более 2 недель и менее 1 года. В одном варианте осуществления период времени между радикальной операцией и терапией вариантным IgG составляет более 4 недель (28 суток).
В некоторых вариантах осуществления каждый из указанных выше аспектов может дополнительно включать мониторинг состояния субъекта в отношении рецидива злокачественной опухоли.
Также изобретение относится к способам неоадъювантной терапии до хирургического удаления функциональной злокачественной опухоли у субъекта, например, человека, включающий введение пациенту эффективного количества вариантного IgG, где пациенту поставлен диагноз опухоли или рака. Вариантный IgG можно вводить один или в комбинации, по меньшей мере, с одним химиотерапевтическим средством.
Изобретение также включает способ лечения субъекта с функциональной злокачественной опухолью, который включает введение субъекту эффективного количества вариантного IgG до хирургической операции и затем проведение операции по поводу удаления злокачественной опухоли. В одном варианте осуществления способ дополнительно включает стадию введения субъекту эффективного количества вариантного IgG после хирургической операции для предупреждения рецидива злокачественной опухоли.
В еще одном аспекте изобретение относится к способу неадъювантной терапии, включающему введение субъекту с функциональной злокачественной опухолью эффективного количества вариантного IgG и, по меньшей мере, одного химиотерапевтического средства до радикальной операции.
В еще одном аспекте изобретение относится к способу снижения размера опухоли у субъекта, имеющего неоперабельную опухоль, включающему введение субъекту эффективного количества вариантного IgG, где введение снижает размер опухоли, тем самым позволяя полностью удалить опухоль. В одном варианте осуществления способ дополнительно включает введение субъекту эффективного количества вариантного IgG после полной резекции опухоли.
В еще одном аспекте изобретение относится к способу лечения злокачественной опухоли у субъекта, включающему следующие стадии: а) первую стадию, содержащую множество циклов лечения, где каждый цикл включает введение субъекту эффективного количества вариантного IgG и, по меньшей мере, одного химиотерапевтического средства с заранее определенным интервалом; b) радикальную хирургическую операцию по удалению злокачественной опухоли и с) вторую стадию, включающую множество поддерживающих циклов, где каждый цикл включает введение субъекту эффективного количества вариантного IgG без какого-либо химиотерапевтического средства с заранее определенным интервалом. В одном варианте осуществления первая стадия включает первое множество циклов лечения, где введение вариантного IgG и первую схему химиотерапии проводят с последующим вторым множеством циклов лечения, где вводят вариантный IgG и проводят вторую схему химиотерапии.
Изобретение относится к способам, включающим введение субъекту с метастатической и неметастатической злокачественной опухолью после радикальной хирургической операции эффективного количества вариантного IgG. В некоторых вариантах осуществления способ дополнительно включает применение, по меньшей мере, одного химиотерапевтического средства.
В одном аспекте способ включает следующие стадии: а) первую стадию, содержащую множество циклов лечения, где каждый цикл включает введение субъекту эффективного количества вариантного IgG и, по меньшей мере, одного химиотерапевтического средства с заранее определенным интервалом и b) вторую стадию, включающую множество поддерживающих циклов, где каждый цикл включает введение субъекту эффективного количества вариантного IgG без какого-либо химиотерапевтического средства с заранее определенным интервалом. В одном варианте осуществления первая стадия включает первое множество циклов лечения, где введение вариантного IgG и первую схему химиотерапии проводят с последующим вторым множеством циклов лечения, где вводят вариантный IgG и проводят вторую схему химиотерапии.
В некоторых вариантах осуществления вариантный IgG представляет собой анти-VEGF антитело, которое связывается с VEGF или снижает экспрессию или биологическую активность VEGF. Анти-VEGF антитело или его антигенсвязывающий фрагмент может представлять собой моноклональное антитело, химерное антитело, полностью человеческое антитело или гуманизированное антитело. В некоторых вариантах осуществления приведенные в качестве примера антитела, пригодные для способов по изобретению, включают бевацизумаб (авастин®), G6-31, B20-4.1, B20-4.1.1 и их фрагменты.
В некоторых вариантах осуществления вариантный IgG представляет собой гуманизированное моноклональное анти-HER2 антитело герцептин®. В некоторых вариантах осуществления вариантный IgG представляет собой химерное анти-CD20 антитело ритуксан®, анти-IgE антитело ксолаир®, анти-CD20 антитело, анти-CD11 антитело раптива®, анти-HER2 антитело омнитарг®, анти-oxLDL антитело, анти-CD4 антитело MTRX1011A, анти-HCV антитело, анти-IL-17A/F антитело, анти-А-бета антитело, анти-DR6 антитело, антитело к человеческому цитомегаловирусу (HCMV), антитело к семейству рецепторов HER, антитело к тканевому фактору, антитело MLN-02, гуманизированное анти-CD18 антитело F(ab')2 или гуманизированное анти-IgE антитело IgG1 rhuMab-E25. В некоторых вариантах осуществления вариантный IgG представляет собой биспецифическое антитело, для которого антигенами-мишенями являются IL-4 и IL-13. В некоторых вариантах осуществления вариантный IgG представляет собой антитело, направленное к эпитопу антигена Staphylococcus aureus.
Несмотря на то, что субъекта можно лечить различными путями до, во время или после введения вариантного IgG, в некоторых вариантах осуществления субъекта лечат без проведения хирургической операции или химиотерапии. В других вариантах осуществления лечение вариантным IgG является монотерапией или монотерапией продолжительностью на период лечения вариантным IgG, что оценивается врачом или описывается в данном документе.
В других вариантах осуществления терапию вариантным IgG проводят в комбинации с дополнительным противоопухолевым лечением, включающим, не ограничиваясь этим, хирургическую операцию, лучевую терапию, химиотерапию, дифференцированную терапию, биотерапию, иммунотерапию, ингибитор ангиогенеза и антипролиферативное средство. Лечение вариантным IgG также может включать любую комбинацию указанных выше видов лечения. В некоторых вариантах осуществления цитотоксические средства, антиангиогенные и антипролиферативные средства можно использовать в комбинации с вариантным IgG. В одном варианте осуществления противоопухолевая терапия является химиотерапией. В некоторых вариантах осуществления химиотерапевтическое средство и вариантный IgG вводят совместно.
В некоторых вариантах осуществления способы по изобретению являются преимущественными для лечения и профилактики опухолей на ранних стадиях, с предупреждением тем самым прогрессирования опухолей до более поздних стадий, приводя к снижению заболеваемости и смертности, ассоциированных со злокачественными опухолями на поздних стадиях. Также способ по изобретению является преимущественным в отношении предупреждения рецидива опухоли или повторного роста опухоли, например, «дремлющей» опухоли, которая остается после удаления первичной опухоли, или снижения или предупреждения появления или пролиферации микрометастазов.
В способах по изобретению злокачественная опухоль может представлять собой солидную опухоль, например, рак молочной железы, колоректальный рак, рак прямой кишки, рак легких, рак мочевыводящих путей, глиому (например, анапластическую астроцитому, анапластическую олигоастроцитому, анапластическую олигодендроглиому, мульформную глиобластому), рак почек, рак предстательной железы, рак печени, рак поджелудочной железы, саркому мягких тканей, карциноидную карциному, злокачественные опухоли головы и шеи, меланому и рак яичников.
Способы по изобретению также могут включать мониторинг субъекта в отношении рецидива рака или опухоли.
Другие признаки и преимущества изобретения станут очевидными из последующего подробного описания, фигур и формулы изобретения.
Любой вариант осуществления, описанный в данном документе, или любая их комбинация относится к любому или всем вариантным IgG и способам изобретения, описанным в данном документе.
Краткое описание фигур
Фиг.1. Панели А-В: связывание анти-VEGF антитела дикого типа (WT) и вариантов анти-VEGF антитела с человеческим FcRn при рН 6,0. Было проведено две отдельных серии опытов с различными концентрациями FcRn, конъюгированными на чипах. Для каждого опыта строили график зависимости резонансных единиц в состоянии покоя от концентрации вариантов для установления значений констант диссоциации.
Фиг.2. Значения констант диссоциации анти-VEGF антитела дикого типа (WT) и вариантов анти-VEGF антитела с человеческим FcRn при рН 6,0. Значение KD было установлено по данным двух серий опытов, показанных на фиг.1.
Фиг.3. Связывание анти-VEGF антитела дикого типа (WT) и вариантов анти-VEGF антитела с человеческим FcRn при рН 7,4. Строили график зависимости резонансных единиц в состоянии покоя от концентрации вариантов анти-VEGF антитела.
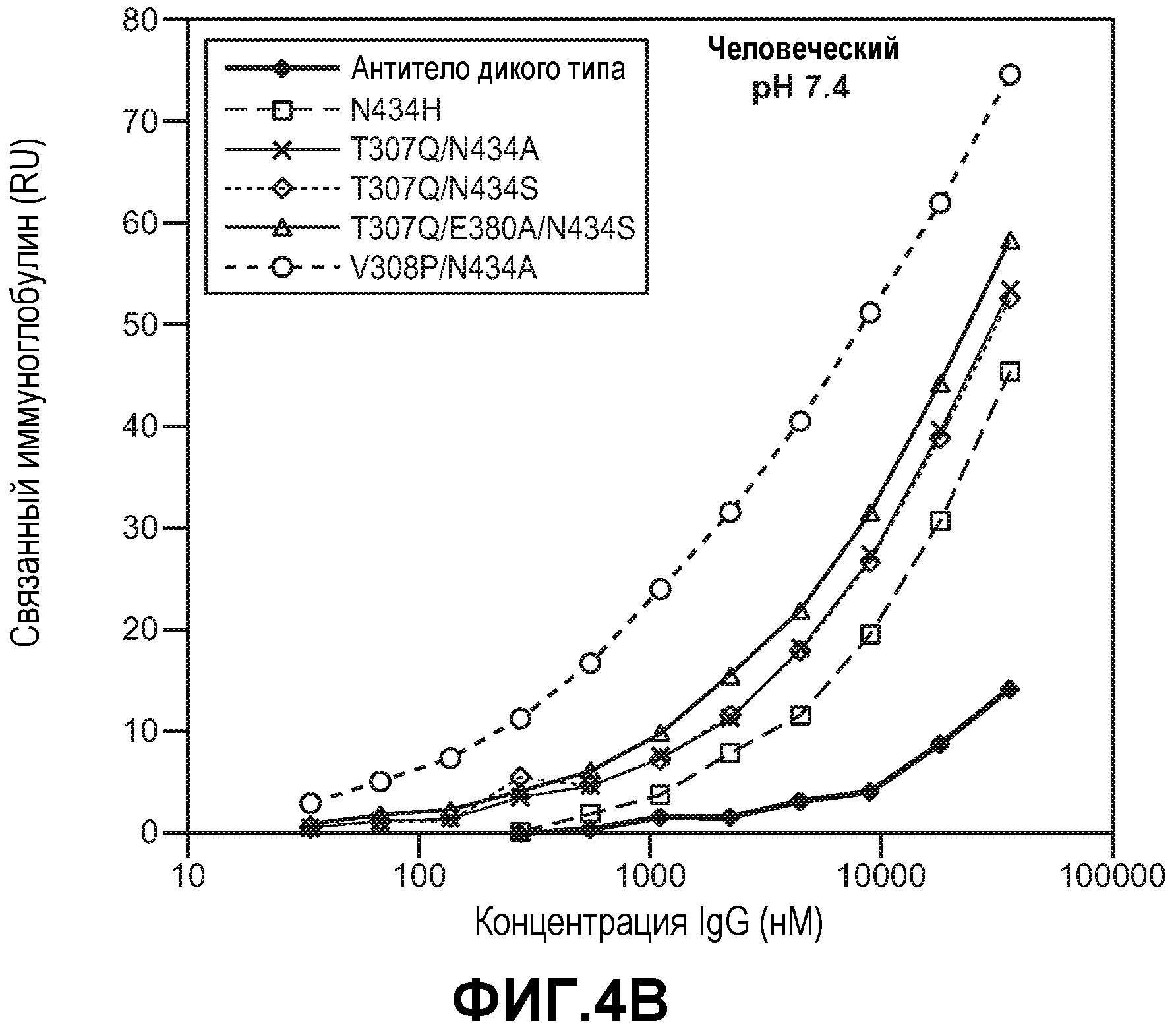
Фиг.4. Панели А-D: связывание анти-VEGF антитела дикого типа и вариантов анти-VEGF антитела (А) с человеческим FcRn при рН 6,0, (В) с человеческим FcRn при рН 7,4, (С) с FcRn обезьян рода Cynomolgus при рН 6,0 и (D) с FcRn обезьян рода Cynomolgus при рН 7,4.
Фиг.5. Параметры кинетики и значения констант моновалентной диссоциации (KD) различных вариантов анти-VEGF антитела с человеческим FcRn при рН 6,0 и 25°С. Результаты представляют данные трех независимых экспериментов.
Фиг.6. Параметры кинетики и значения констант моновалентной диссоциации (KD) различных вариантов анти-VEGF антитела с FcRn обезьян рода Cynomolgus при рН 6,0 и 25°С. Результаты представляют данные трех независимых экспериментов.
Фиг.7. Панели А-В: скорость диссоциации (koff) (А) человеческого FcRn и (В) FcRn обезьян рода Cynomolgus с различными вариантами анти-VEGF антитела при различных рН.
Фиг.8. Обобщенные данные по повышению аффинности вариантов анти-VEGF антитела для человеческого FcRn по сравнению с анти-VEGF антителом дикого типа. Данные являются обобщением фиг.4 и 5.
Фиг.9. Панели А-В: связывание (1) анти-VEGF антитела дикого типа и вариантов анти-VEGF антитела (2) N434H, (3) T307Q/N434A, (4) T307Q/N434S, (5) T307Q/E380A/N434S и (6) V308P/N434A. (А) Связывание VEGF с антителами при инжектировании анти-VEGF антитела дикого типа и вариантов анти-VEGF антитела на покрытые VEGF-А109 сенсорные чипы при 37°С с использованием BIAcore® 3000. (В) Сенсограммы для инжектирования 50 нМ и 100 нМ. Базовую линию каждой сенсограммы компенсировали 4 RU для лучшей визуализации.
Фиг.10. Ингибирование пролиферации клеток HUVEC в условиях in vitro под действием авастина®, анти-VEGF антитела дикого типа (бевацизумаба) и вариантов анти-VEGF антитела. Эндотелиальные клетки вены пупочного канатика человека (HUVEC) культивировали в присутствии VEGF и анти-VEGF антител в различных концентрациях. Через 4 суток оценивали жизнеспособность культуры.
Фиг.11. Фармакокинетические профили анти-VEGF антитела дикого типа и пяти вариантов анти-VEGF антитела у обезьян рода Cynomolgus после однократного внутривенного введения в дозе 5 мг/кг. Концентрации антител в сыворотке крови определяли с использованием ELISA. Данные выражены в виде среднего значения±стандартное отклонение от среднего (n=12 животных/группу, за исключением группы с антителом V308P/N434A, в которой было 11 животных).
Фиг.12. Фармакокинетические параметры анти-VEGF антитела дикого типа и пяти вариантов анти-VEGF антитела у обезьян рода Cynomolgus после однократного внутривенного введения в дозе 5 мг/кг.
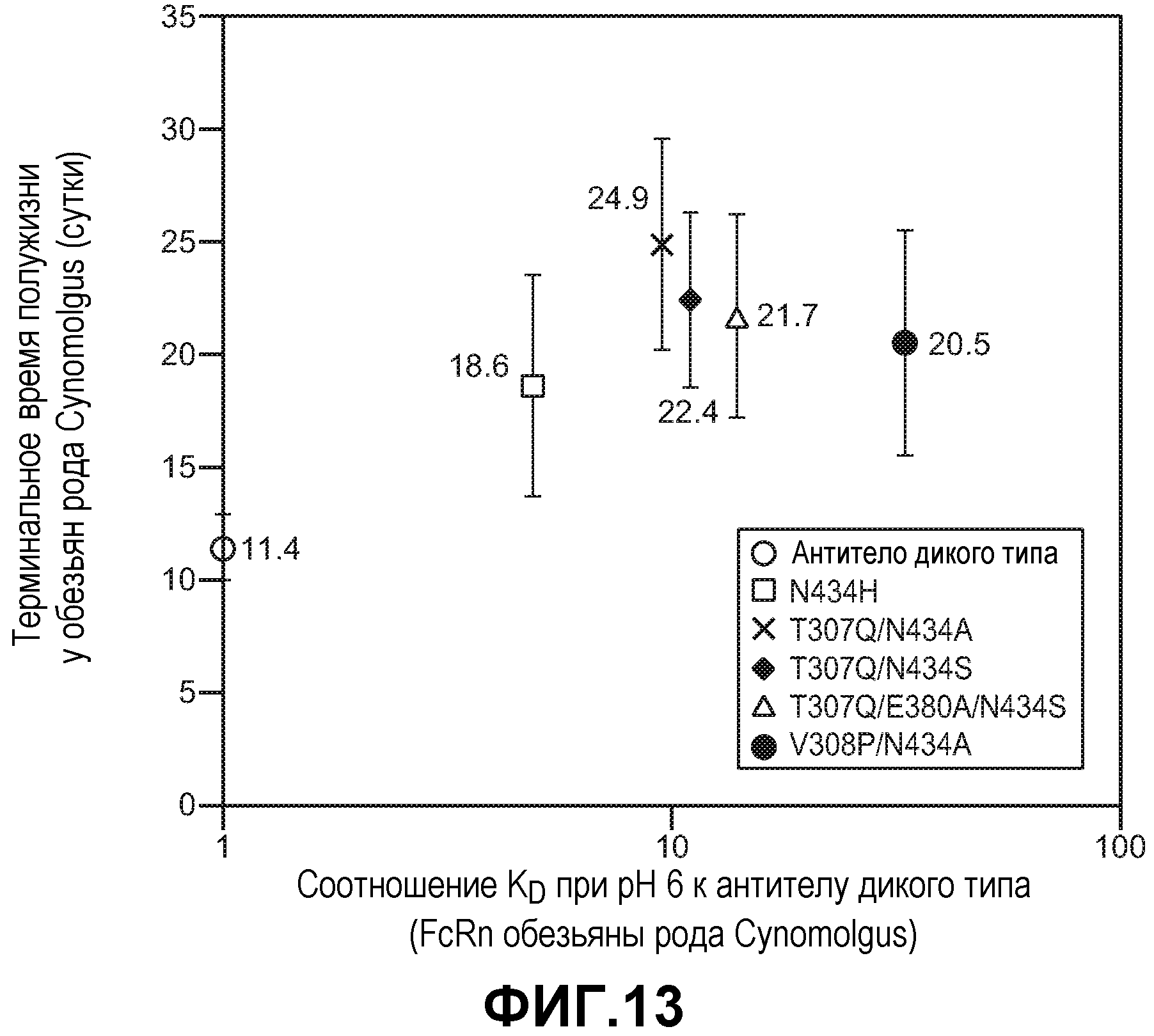
Фиг.13. График, показывающий взаимосвязь между терминальным временем полужизни у обезьян рода Cynomolgus и аффинностью в отношении FcRn при рН 6,0 для анти-VEGF антитела дикого типа и пяти вариантов анти-VEGF антитела. Столбцы с ошибками представляют стандартные отклонения от среднего для 11-12 животных на группу.
Фиг.14. Панели А-В: фармакокинетические профили анти-VEGF антитела дикого типа и варианта анти-VEGF антитела T307Q/N434A у трансгенных мышей с гуманизированным VEGF после однократного внутривенного введения в дозах 0,3 или 5 мг/кг. Концентрацию антител в сыворотке крови определяли с использованием (А) ELISA с захватом VEGF или (В) ELISA с захватом человеческого Fc. Данные выражены в виде среднего значения±стандартное отклонение от среднего.
Фиг.15. Фармакокинетические параметры анти-VEGF антитела дикого типа и варианта анти-VEGF антитела T307Q/N434A после однократного внутривенного введения в дозах 0,3 или 5 мг/кг трансгенным мышам с гуманизированным VEGF.
Фиг.16. Панели А-В: фармакокинетические профили варианта анти-VEGF антитела T307Q/N434A у трансгенных мышей с гуманизированным VEGF после многократного введения в дозах 0,3 или 5 мг/кг. Антитело вводили на 0, 3, 6 и 9 сутки. Концентрацию антител в сыворотке крови определяли с использованием (А) ELISA с захватом VEGF или (В) ELISA с захватом человеческого Fc. Данные выражены в виде среднего значения±стандартное отклонение от среднего.
Фиг.17. Фармакокинетические параметры антитела T307Q/N434A после четырехкратного внутривенного введения в дозах 0,3 или 5 мг/кг на 0, 3, 6 и 9 сутки трансгенным мышам с гуманизированным VEGF.
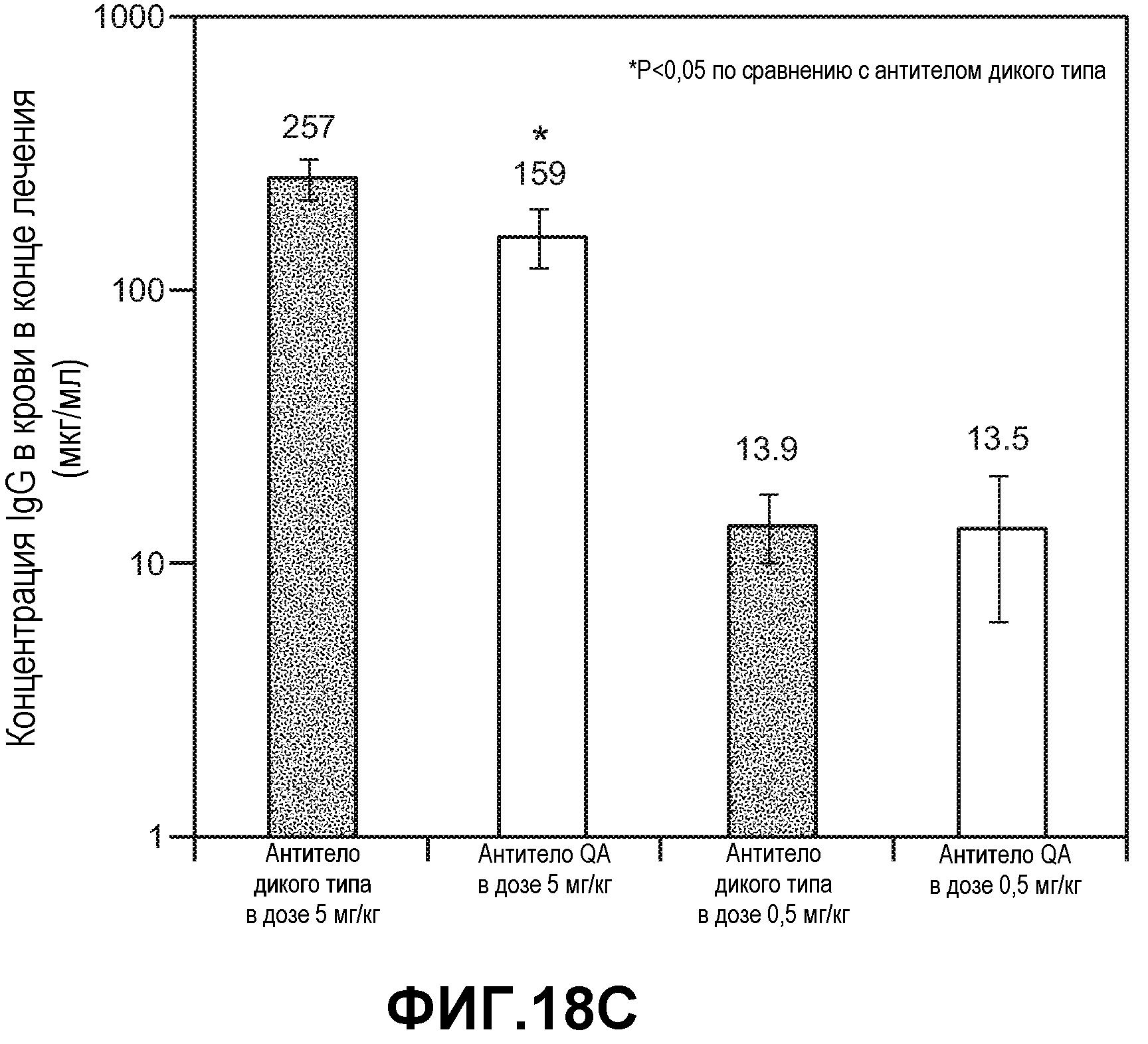
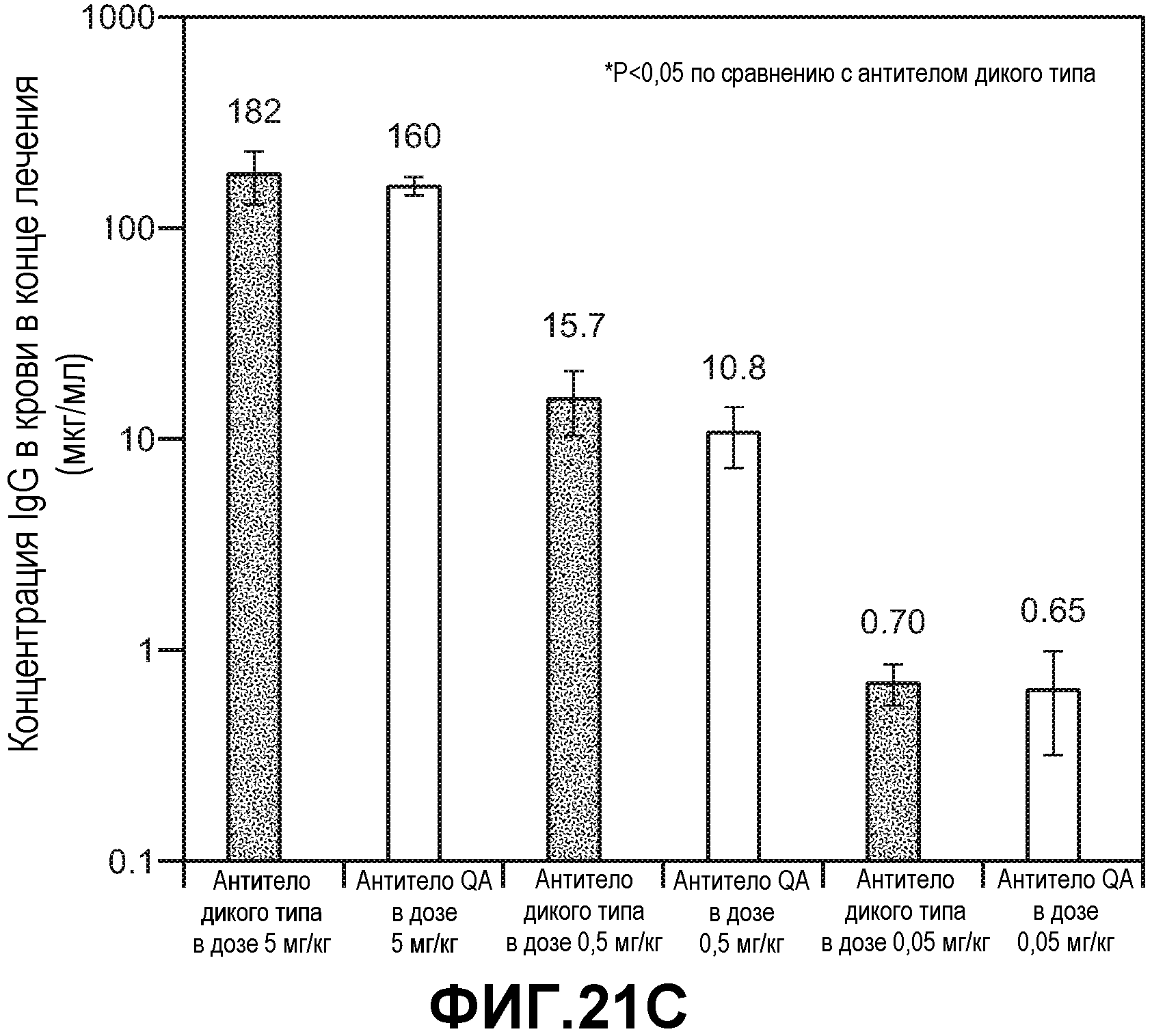
Фиг.18. Панели А-С: эффективность анти-VEGF антитела дикого типа и варианта антитела T307Q/N434A (QA) в лечении ксенотрансплантатов HM-7, имплантированных подкожно двойным гомозиготным мышам RAG2 KO; hum-X VEGF KI. Анти-VEGF антитело дикого типа и вариант T307Q/N434A вводили в дозах 5 и 0,5 мг/кг и контрольное антитело к амброзии полыннолистной вводили в дозе 5 мг/кг внутрибрюшинно дважды в неделю. (А) Кривые роста опухолей HM-7. Данные выражали в виде среднего значения±стандартная ошибка среднего. (В) Кривые роста опухолей HM-7 в группах с введением доз 0,5 и 0,05 мг/кг. (С) Концентрация в сыворотке крови анти-VEGF антитела в конце лечения (18 сутки для антитела к амброзии полыннолистной и 21 сутки для анти-VEGF антитела). Концентрацию определяли с использованием ELISA с захватом VEGF. Данные выражали в виде среднего значения±стандартное отклонение от среднего.
Фиг.19. Панели А-Е: повторный опыт по оценке эффективности анти-VEGF антитела дикого типа и варианта антитела T307Q/N434A (QA) в лечении ксенотрансплантатов HM-7, имплантированных подкожно двойным гомозиготным мышам RAG2 KO; hum-X VEGF KI. Анти-VEGF антитело дикого типа и вариант T307Q/N434A вводили в дозах 5, 0,5 и 0,05 мг/кг и контрольное антитело к амброзии полыннолистной вводили в дозе 5 мг/кг внутрибрюшинно дважды в неделю. (А) Кривые роста опухолей HM-7. Данные выражали в виде среднего значения±стандартная ошибка среднего. (В) Кривые роста опухолей HM-7 в группах с введением доз 0,5 и 0,05 мг/кг. Данные выражали в виде среднего значения±стандартная ошибка среднего. (С) Конечные массы опухолей HM-7, определенные в конце лечения (16 сутки для антитела к амброзии полыннолистной; 19 сутки для групп с дозой 0,05 мг/кг и 22 сутки для остальных групп). Данные выражали в виде среднего значения±стандартная ошибка среднего. (D) Концентрация в сыворотке крови анти-VEGF антитела в конце лечения. Концентрации определяли с использованием ELISA с захватом Fc. Данные выражали в виде среднего значения±стандартное отклонение от среднего. (Е) Соотношение концентрации антитела в опухолях к концентрации в крови. Концентрацию антитела определяли по общему количеству лизатов опухолей и количеству анти-VEGF антитела в лизатах опухолей. Данные выражали в виде среднего значения±стандартное отклонение от среднего.
Фиг.20. Панели А-D: третий опыт по оценке эффективности анти-VEGF антитела дикого типа и варианта T307Q/N434A (QA) в лечении ксенотрансплантатов HM-7, имплантированных подкожно двойным гомозиготным мышам RAG2 KO; hum-X VEGF KI. Анти-VEGF антитело дикого типа и вариант T307Q/N434A вводили в дозах 5, 0,5 и 0,05 мг/кг и контрольное антитело к амброзии полыннолистной вводили в дозе 5 мг/кг внутрибрюшинно дважды в неделю. (А) Средний объем опухолей в каждой группе в конце лечения (22 сутки). Данные выражали в виде среднего значения±стандартная ошибка среднего. (В) Конечные массы опухолей HM-7. Данные выражали в виде среднего значения±стандартная ошибка среднего. (С) Концентрация в сыворотке крови анти-VEGF антитела в конце лечения. Концентрацию определяли с использованием ELISA с захватом античеловеческого Fc. Данные выражали в виде среднего значения±стандартное отклонение от среднего. (D) Соотношение концентрации антитела в опухолях к концентрации в крови. Концентрацию антитела в опухолях определяли по общему количеству лизатов опухолей и количеству анти-VEGF антитела в лизатах опухолей. Данные выражали в виде среднего значения±стандартное отклонение от среднего.
Фиг.21. Панели A-D: эффективность анти-VEGF антитела дикого типа и варианта T307Q/N434A (QA) в лечении ксенотрансплантатов HT-55, имплантированных подкожно двойным гомозиготным мышам RAG2 KO; hum-X VEGF KI. Анти-VEGF антитело дикого типа и вариант T307Q/N434A вводили в дозах 5, 0,5 и 0,05 мг/кг и контрольное антитело к амброзии полыннолистной вводили в дозе 5 мг/кг внутрибрюшинно дважды в неделю. (А) Кривые роста опухолей HT-55. Данные выражали в виде среднего значения±стандартная ошибка среднего. (В) Конечные массы опухолей HT-55 в конце лечения (35 сутки). Данные выражали в виде среднего значения±стандартная ошибка от среднего. (С) Концентрация в сыворотке крови анти-VEGF антитела в конце лечения. Концентрацию определяли с использованием ELISA с захватом человеческого Fc. Данные выражали в виде среднего значения±стандартное отклонение от среднего. (D) Соотношение концентрации антитела в опухолях к концентрации в крови. Концентрацию антитела определяли по общему количеству лизатов опухолей и количеству анти-VEGF антитела в лизатах опухолей. Данные выражали в виде среднего значения±стандартное отклонение от среднего.
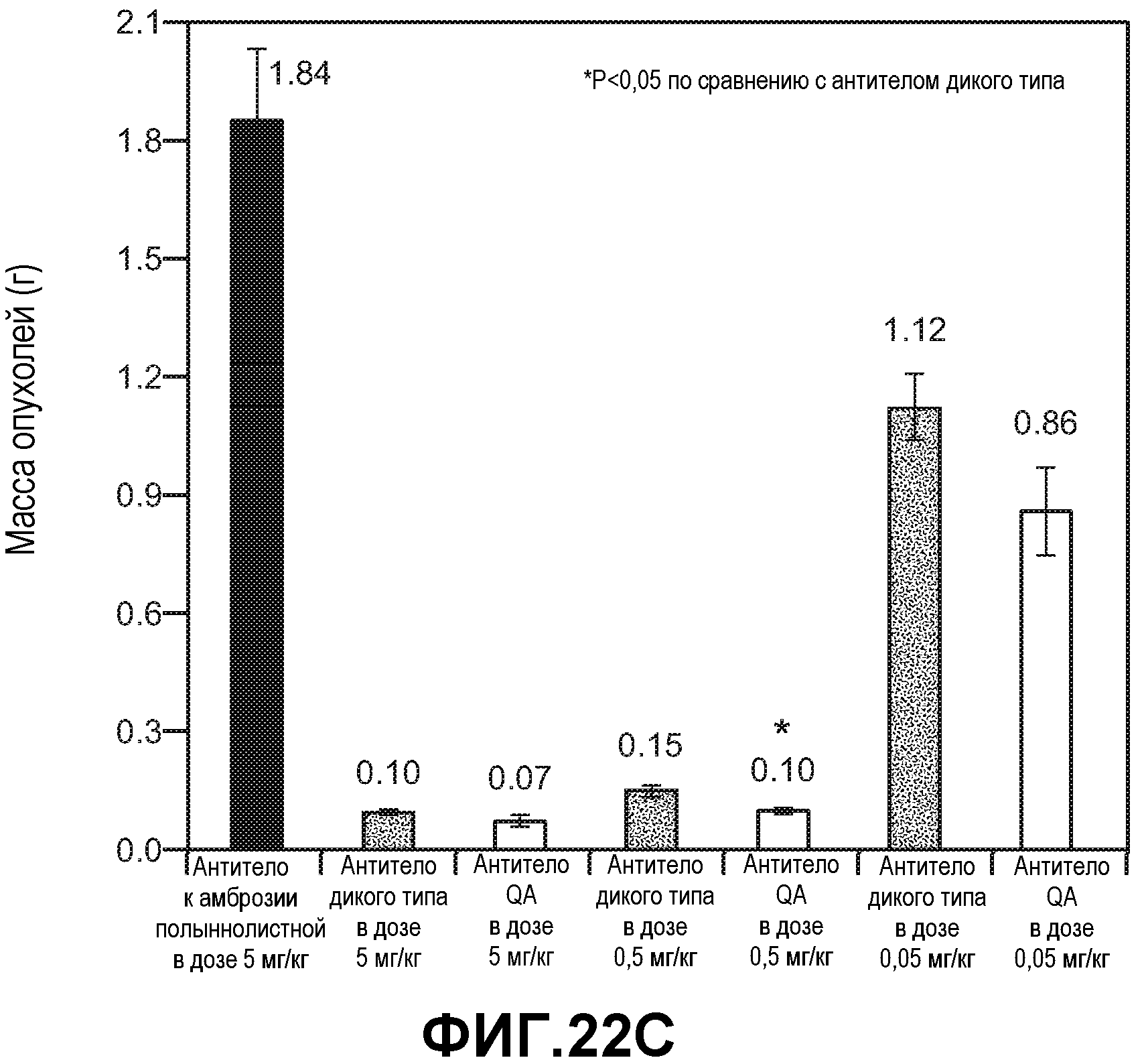
Фиг.22. Панели A-Е: эффективность анти-VEGF антитела дикого типа и варианта T307Q/N434A (QA) в лечении ксенотрансплантатов Colo-205, имплантированных подкожно двойным гомозиготным мышам RAG2 KO; hum-X VEGF KI. Анти-VEGF антитело дикого типа и вариант T307Q/N434A вводили в дозах 5, 0,5 и 0,05 мг/кг и контрольное антитело к амброзии полыннолистной вводили в дозе 5 мг/кг внутрибрюшинно дважды в неделю. (А) Кривые роста опухолей Colo-205. Данные выражали в виде среднего значения±стандартная ошибка среднего. (В) Кривые роста опухолей Colo-205 в группах с лечением в дозах 0,5 и 0,05 мг/кг. (С) Конечные массы опухолей Colo-205 в конце лечения (38 сутки). Данные выражали в виде среднего значения±стандартная ошибка среднего. (D) Концентрация в сыворотке крови анти-VEGF антитела в конце лечения. Концентрацию определяли с использованием ELISA с захватом человеческого Fc. Данные выражали в виде среднего значения±стандартное отклонение от среднего. (Е) Соотношение концентрации антитела в опухолях к концентрации в крови. Концентрацию антитела определяли по общему количеству лизатов опухолей и количеству анти-VEGF антитела в лизатах опухолей. Данные выражали в виде среднего значения±стандартное отклонение от среднего.
Фиг.23. Панели A-D: повторный опыт по оценке эффективности анти-VEGF антитела дикого типа и варианта T307Q/N434A (QA) в лечении ксенотрансплантатов Colo-205. Анти-VEGF антитело дикого типа и вариант T307Q/N434A вводили в дозах 5, 0,5 и 0,05 мг/кг и контрольное антитело к амброзии полыннолистной вводили в дозе 5 мг/кг внутрибрюшинно дважды в неделю. (А) Кривые роста опухолей Colo-205. Данные выражали в виде среднего значения±стандартная ошибка среднего. (В) Кривые роста опухолей Colo-205 в группах с лечением в дозах 0,5 и 0,05 мг/кг. (С) Конечные массы опухолей Colo-205 в конце лечения (32 сутки). Данные выражали в виде среднего значения±стандартная ошибка среднего. (D) Концентрация в сыворотке крови анти-VEGF антитела в конце лечения. Концентрацию определяли с использованием ELISA с захватом человеческого Fc. Данные выражали в виде среднего значения±стандартное отклонение от среднего.
Фиг.24. Константы моновалентной диссоциации (KD) вариантов анти-HER2 антитела IgG1 Fc (трастузумаба) с человеческим FcRn при рН 6,0 и 25°С с использованием BIAcore. Результаты представляют данные двух независимых экспериментов.
Фиг.25. Уровни экспрессии FcRn в различных клеточных линиях опухолей человека. Для эксперимента использовали пять миллионов клеток каждой клеточной линии. Клетки Raji (В-клеточная лимфома человека) использовали в качестве негативного контроля, в то время как растворимый человеческий белок FcRn, в котором отсутствуют трансмембранная 7 кДа и цитоплазматическая области, использовали в качестве позитивного контроля. Использовали разведения растворимого белка FcRn в качестве стандарта для количественного анализа уровня экспрессии FcRn. Результаты представляют данные, по меньшей мере, трех независимых экспериментов.
Фиг.26. рН-зависимое связывание вариантов анти-HER2 IgG1 Fc (трастузумаба) с человеческим FcRn. Варианты конструировали с мутациями в положениях L251, L314 и Е430. Связывание определяли при значениях рН в пределах от 6,0 до 7,2 с использованием BIAcore при 25°С. Определяли соотношение аффинности вариантов относительно анти-HER2 IgG1 дикого типа и строили график как функцию от рН.
Фиг.27. Панели А-С: связывание анти-HER2 IgG1 дикого типа (трастузумаба), варианта T307Q/N434A, варианта L251D/T307Q/N434H и варианта L251D/T307Q/M428L/N434H/Y4361 с человеческим FcRn (А) при рН 6,0, (В) рН 7,1 и (С) рН 7,4. Связывание определяли с использованием BIAcore при 25°С. Отсутствовало детектируемое связывание варианта L251D/T307Q/N434H с человеческим FcRn при рН 7,4, как показано на фиг.27С.
Фиг.28. Скорость диссоциации (koff) человеческого FcRn с различными вариантами анти-VEGF антитела и анти-HER2 антитела при различных рН. Вариантами анти-VEGF антитела были T307Q/N434A, T307Q/N434S, T307Q/E380A/N434S и V308P/N434A. Вариантом анти-HER2 антитела было антитело L251D/T307Q/M428L/N434H/Y436I. Строили график зависимости значений koff от различных рН для каждого варианта с получением наклона линии, полученной методом наилучшего приближения (уравнение: log (koff) = наклон × рН + отрезок, отсекаемый на оси y).
Подробное описание изобретения
Настоящее изобретение относится к новым вариантам Fc-участков, включая обнаруженные в антителах, слитым Fc-конструкциям и иммуноадгезинам, которые имеют увеличенное время полужизни в условиях in vivo. Данные варианты содержат Fc-участок человеческого IgG или его фрагмент, который связывается с FcRn и который содержит одну или несколько аминокислотных модификаций по сравнению с Fc-участком человеческого IgG дикого типа, где данные модификации повышают аффинность Fc-участка IgG или его фрагмента для FcRn.
Методы и методики, описанные или цитированные в данном документе, хорошо известны и обычно используются специалистами в данной области с применением обычной методологии, например, широко применяемых методологий, описанных Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd. edition (2001), Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (F.M. Ausubel et al., eds. (2003); серии METHODS IN ENZYMOLOGY (Academic Press, Inc.): PCR 2: APRACTICAL APPROACH (M.J. MacPherson, B.D. Hames and G.R. Taylor eds. (1995); Harlow and Lane, eds. (1988) ANTIBODIES, A LABORATORY MANUAL and ANIMAL CELL CULTURE (R. I. Freshney, ed. (1987)); Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney), ed. 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths and D.G. Newell, eds., 1993-8) J. Wiley and Sons; Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); PCR: The Polymerase Chain Reaction (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: A Practical Approach (D. Catty, ed., IRL Press, 1988-1989); Monoclonal Antibodies: A Practical Approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995) и Cancer: Principles and Practice of Oncology (V. T. DeVita et al., eds., J.B. Lippincott Company, 1993).
Если не указано иначе, то технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимается специалистами в области, к которой относится данное изобретение. Singleton et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J. Wiley & Sons (N.Y., 1994) и March, Advanced Organic Chemistry Reactions, Mechanisms and Structure 4th ed., J. Wiley & Sons (N.Y., 1992) обеспечивают специалистов в данной области общими указаниями для многих терминов, используемых в настоящей заявке. Все источники, цитированные в данном документе, включая заявки на патент и патентные публикации, в полном объеме включены в данный документ для сведения.
Определения
Для раскрытия данной заявки будут использоваться следующие определения, и где это приемлемо, термины, используемые в единственном числе, также включают множественные формы и тому подобное. Очевидно, понятно, что терминология, приведенная в данном документе, используется только в целях описания конкретных вариантов осуществления, и ее не следует рассматривать в качестве ограничивающей. В случае если любое описание, приведенное ниже, противоречит с любым документом, включенным в данный документ для сведения, то приведенное ниже определение будет контролировать.
По тексту настоящей заявки и в формуле изобретения система нумерации в тяжелой цепи иммуноглобулинов является EU-системой нумерации по Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), точно включенный в данный документ для сведения. «EU-система нумерации по Kabat» относится к нумерации остатков в человеческом IgG1 антителе по EU.
В том смысле, в котором в данном документе используются термины «время полужизни в условиях in vivo» или «время полужизни антитела в условиях in vivo», они относятся к биологическому времени полужизни молекулы IgG конкретного типа или ее фрагментов, содержащих FcRn-связывающие сайты, в кровотоке конкретного животного, и представляет время, необходимое для снижения концентрации молекулы в кровотоке на 50%. В некоторых вариантах осуществления, когда строят график концентрации данного IgG как функцию времени, то обычно кривая является бифазной с быстрой α-фазой, которая представляет собой равновесие введенных молекул IgG между внутри- и экстрасосудистым пространством, и более длительную β-фазу, которая представляет собой элиминацию молекул IgG из внутрисосудистого пространства. В некоторых вариантах осуществления термин «время полужизни антитела в условиях in vivo» соответствует времени полужизни молекул IgG в β-фазе. В некоторых вариантах осуществления концентрация против кривой времени для данного IgG является трехфазной с соответствующим распределением между α-фазой и β-фазой и конечной элиминацией, представленной γ-фазой. Следовательно, в некоторых вариантах осуществления время полужизни в условиях in vivo соответствует времени полужизни конечной фазы элиминации или γ-фазе. В некоторых вариантах осуществления концентрация против кривой времени данного IgG является монофазной с одной фазой элиминации. Следовательно, в некоторых вариантах осуществления время полужизни в условиях in vivo соответствует времени полужизни одной фазы элиминации.
В том смысле, в котором в данном документе используются термины «исходный полипептид» или «полипептид дикого типа», они означают немодифицированный полипептид, природный полипептид, или сконструированный вариант природного полипептида, в котором отсутствует одна или несколько аминокислотных модификаций Fc-участка, раскрытых в данном документе, и который отличается по эффекторной функции по сравнению с вариантным IgG, раскрытым в данном документе. Исходный полипептид может содержать Fc-участок с нативной последовательностью или Fc-участок с ранее имеющимися модификациями аминокислотной последовательности (такими как добавления, делеции и/или замены). Исходный полипептид также может содержать аминокислоты, отличные от природных аминокислот. Исходный полипептид может относиться к самому полипептиду, композициям, содержащим исходный полипептид, или аминокислотной последовательности, которая кодирует его. Исходный полипептид включает, не ограничиваясь этим, исходный иммуноглобулин, иммуноглобулин дикого типа, исходное антитело и антитело дикого типа.
Следовательно, в том смысле, в котором в данном документе используются термины «исходный иммуноглобулин», «исходный IgG», «иммуноглобулин дикого типа» или «IgG дикого типа», они означают немодифицированный иммуноглобулин, природный иммуноглобулин или сконструированный вариант природного иммуноглобулина, в котором отсутствует одна или несколько аминокислотных модификаций Fc-участка, раскрытых в данном документе, и который отличается по эффекторной функции по сравнению с вариантным IgG, раскрытым в данном документе. Исходный иммуноглобулин может содержать Fc-участок с нативной последовательностью или Fc-участок с ранее имеющимися модификациями аминокислотной последовательности (такими как добавления, делеции и/или замены). Исходный иммуноглобулин также может содержать аминокислоты, отличные от природных аминокислот, как описано ниже. Исходный иммуноглобулин может относиться к самому иммуноглобулину, композициям, содержащим исходный иммуноглобулин, или аминокислотной последовательности, которая кодирует его.
В том смысле, в котором в данном документе используются термины «исходное антитело» или «антитело дикого типа», они означают немодифицированное антитело, природное антитело или сконструированный вариант природного антитела, в котором отсутствует одна или несколько аминокислотных модификаций Fc-участка, раскрытых в данном документе, и которое отличается по эффекторной функции по сравнению с вариантным IgG, раскрытым в данном документе. Исходное антитело может содержать Fc-участок с нативной последовательностью или Fc-участок с ранее имеющимися модификациями аминокислотной последовательности (такими как добавления, делеции и/или замены). Исходное антитело также может содержать аминокислоты, отличные от природных аминокислот, как описано ниже. Исходное антитело может относиться к самому полипептиду, композициям, содержащим исходное антитело, или аминокислотной последовательности, которая кодирует его.
В некоторых вариантах осуществления термины «исходный IgG», «исходное антитело», «IgG дикого типа» или «антитело дикого типа» включает, не ограничиваясь этим, известные промышленно доступные, полученные рекомбинантным путем антитела, описанные в данном документе. В некоторых вариантах осуществления IgG дикого типа представляет собой IgG, имеющий Fc-участок человеческого IgG дикого типа. В некоторых вариантах осуществления Fc-участок человеческого IgG дикого типа относится к Fc-участку, в котором отсутствуют одна или несколько аминокислотных модификаций Fc-участка, раскрытых в данном документе. В некоторых вариантах осуществления Fc-участок человеческого IgG дикого типа относится к Fc-участку с одной или несколькими аминокислотными модификациями Fc-участка, не раскрытыми в данном документе. В некоторых вариантах осуществления IgG дикого типа представляет собой бевацизумаб. В некоторых вариантах осуществления антитело дикого типа представляет собой фрагмент антитела, который не содержит Fc-участок. В некоторых вариантах осуществления вариантный IgG такого антитела дикого типа представляет собой слитый Fc-белок, содержащий Fab-фрагменты антитела дикого типа, или домен или домены белка, отличного от белка антитела, и фрагмент Fc-участка, содержащий одну или несколько модификаций Fc-участка, раскрытых в данном документе. В некоторых вариантах осуществления Fc-участок человеческого IgG дикого типа относится к Fc-участку IgG с мутацией L251D L251D/434H в Fc, но в котором отсутствуют другие аминокислотные модификации Fc-участка, раскрытые в данном документе.
В том смысле, в котором в данном документе используются термины «вариант», «вариантный белок» или «вариант белка», они означают белок, который отличается от исходного белка, по меньшей мере, за счет одной аминокислотной модификации. Вариант белка может относиться к самому белку, композиции, содержащей белок, или аминокислотной последовательности, которая кодирует его. В некоторых вариантах осуществления вариант белка содержит, по меньшей мере, одну аминокислотную модификацию по сравнению с исходным полипептидом, например, от одной до примерно десяти аминокислотных модификаций. В некоторых вариантах осуществления вариант белка содержит, по меньшей мере, две аминокислотные модификации в Fc-участке IgG. В некоторых вариантах осуществления вариант белка содержит, по меньшей мере, три аминокислотные модификации в Fc-участке IgG. Последовательность вариантного белка по изобретению предпочтительно обладает, по меньшей мере, примерно 80% гомологией с последовательностью исходного белка и наиболее предпочтительно, по меньшей мере, примерно 90% гомологией, предпочтительно, по меньшей мере, примерно 95% гомологией. Варианты белка также могут содержать неприродные аминокислоты, которые определяются ниже. Термин «вариант белка» включает вариант иммуноглобулина и вариант антитела, описанные в данном документе.
В том смысле, в котором в данном документе используются термины «вариант иммуноглобулина», «вариантный иммуноглобулин», «вариантный IgG» или «вариант IgG», они означают последовательность иммуноглобулина, которая отличается от последовательности исходного иммуноглобулина или иммуноглобулина дикого типа, по меньшей мере, за счет одной аминокислотной модификации. В некоторых вариантах осуществления вариантный IgG содержит, по меньшей мере, две аминокислотные модификации в Fc-участке по сравнению с IgG дикого типа. В некоторых вариантах осуществления вариантный IgG содержит, по меньшей мере, три аминокислотные модификации в Fc-участке по сравнению с IgG дикого типа. В некоторых вариантах осуществления вариантный IgG представляет собой вариантное антитело. В некоторых вариантах осуществления вариантный IgG представляет собой анти-VEGF антитело. В некоторых вариантах осуществления вариантный IgG представляет собой вариант бевацизумаба, содержащий одну или несколько аминокислотных модификаций в Fc-участке антитела.
В том смысле, в котором в данном документе используются термины «вариант антитела» или «вариантное антитело», они означают антитело, которое отличается от последовательности исходного антитела, по меньшей мере, за счет одной аминокислотной модификации. В некоторых вариантах осуществления вариантное антитело содержит одну или несколько аминокислотных модификаций в Fc-участке по сравнению с антителом дикого типа.
В том смысле, в котором в данном документе используется термин «положение», он означает положение в последовательности белка. Положения можно последовательно пронумеровать или согласно установленному формату, например, EU-системе нумерации по Kabat.
Термины «полипептид, имеющий Fc-участок» или «Fc-полипептид» относятся к полипептиду, который содержит весь или часть Fc-участка. Например, Fc-полипептиды включают антитела, слитые Fc-белки, выделенные Fc или Fc-фрагменты.
Термин «антитело, содержащее Fc-участок» относится к антителу, которое содержит Fc-участок. С-концевой лизин (остаток 447 согласно EU-системе нумерации) Fc-участка можно удалить, например, во время очистки антитела или рекомбинантным конструированием нуклеиновой кислоты, кодирующей антитело. Следовательно, композиция, содержащая антитело, имеющее Fc-участок, может включать антитело с K447, антитело с полностью удаленным остатком K447, или смесь антител с и без остатка K447.
Термин «аминокислотная модификация» относится к изменению в аминокислотной последовательности заранее определенной аминокислотной последовательности. Приведенные в качестве примера модификации включают замену, инсерцию и/или делецию аминокислоты. В некоторых вариантах осуществления аминокислотная модификация представляет замену аминокислоты.
Термин «аминокислотная модификация в» определенном положении, например, в Fc-участке, относится к замене или делеции определенного остатка, или инсерцию, по меньшей мере, одного аминокислотного остатка, смежного к определенному остатку. Под выражением инсерция «смежного» определенного остатка понимается инсерция одного-двух его остатков. Инсерция по отношению к определенному остатку может быть N-концевой или С-концевой.
Термин «замена аминокислоты» относится к замещению, по меньшей мере, одного имеющегося аминокислотного остатка в заранее определенной аминокислотной последовательности на другой «замещающий» аминокислотный остаток. «Замещающий» остаток или остатки могут представлять «природные аминокислотные остатки» (т.е. кодированные генетическим кодом) и выбранные из группы, состоящей из аланина (Ala), аргинина (Arg), аспарагина (Asn), аспарагиновой кислоты (Asp), цистеина (Cys), глутамина (Gln), глутаминовой кислоты (Glu), глицина (Gly), гистидина (His), изолейцина (Ile), лейцина (Leu), лизина (Lys), метионина (Met), фенилаланина (Phe), пролина (Pro), серина (Ser), треонина (Thr), триптофана (Trp), тирозина (Tyr) и валина (Val). В некоторых вариантах осуществления замещающий остаток не является цистеином. Замена на один или несколько неприродных аминокислотных остатков, также входит в определение аминокислотной замены.
Выражение «неприродный аминокислотный остаток» относится к остатку, отличному от природных аминокислотных остатков, перечисленных выше, который способен ковалентно связываться со смежным аминокислотным остатком(и) в полипептидной цепи. Примеры неприродных аминокислотных остатков включают норлейцин, орнитин, норвалин, гомосерин и другие аналоги аминокислотных остатков, такие как описаны Ellman et al., Meth. Enzym., 202:301-336 (1991); патент США № 6586207; международная заявка WO 98/48032; WO 03/073238; публикация заявки на патент США № 2004-0214988А1; международные заявки WO 05/35727А2; WO 05/74524А2; J.W. Chin et al., (2002), Journal of the American Chemical Society, 124:9026-9027; J.W. Chin & P.G. Schultz, ChemBioChem., 11:1135-1137 и J. Chin et al., PICAS United States of America, 99:11020-11024 (2002), все источники в полном объеме включены в данный документ для сведения.
Термин «аминокислотная инсерция» относится к включению, по меньшей мере, одной аминокислоты в заранее определенную аминокислотную последовательность. Несмотря на то, что обычно инсерция включает инсерцию одного или двух аминокислотных остатков, в настоящей заявке предусматриваются более крупные «пептидные инсерции», например инсерция от примерно трех до примерно пяти или даже до примерно десяти аминокислотных остатков. Инсерцированный остаток(и) может представлять природный или неприродный остаток, которые были определены выше.
Термин «аминокислотная делеция» относится к удалению, по меньшей мере, одного аминокислотного остатка из заранее определенной аминокислотной последовательности.
В некоторых вариантах осуществления термины «повышение», «увеличенное время полужизни» или «увеличенное время полужизни в условиях in vivo» относятся к общему увеличению времени полужизни вариантного IgG в условиях in vivo, по меньшей мере, на примерно 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 100%, 150%, 200%, 300% или более, по данным обычных методов, известных в данной области, таких как описаны в данном документе, по сравнению с IgG дикого типа или IgG, содержащим Fc-участок человеческого IgG дикого типа. В некоторых вариантах осуществления термин «увеличение» относится к увеличенному времени полужизни в условиях in vivo вариантного IgG, где увеличение составляет, по меньшей мере, примерно 1,25×, 1,5×, 1,75×, 2×, 3×, 4×, 5× или 10× или более по сравнению с IgG дикого типа или IgG, содержащим Fc-участок человеческого IgG дикого типа. В некоторых вариантах осуществления IgG дикого типа или IgG, имеющий Fc-участок человеческого IgG дикого типа, представляет собой бевацизумаб. В некоторых вариантах осуществления среднее время полужизни бевацизумаба составляет примерно 10-12 суток у обезьян рода Cynomolgus или примерно 20 суток у людей.
«Шарнирную область» обычно определяют как участок от Glu216 до Pro230 в последовательности человеческого IgG1 (Burton, Molec. Immunol., 22:161-206 (1985)). Шарнирные области IgG других изотипов можно подвергнуть выравниванию с последовательностью IgG1 при размещении первого и последнего остатков цистеина, образующих S-S-связи между цепями тяжелых цепей, в одних и тех же положениях.
Термин «нижняя шарнирная область» Fc-участка обычно определяется как участок С-концевых остатков шарнирной области, т.е. остатков 233-239 Fc-участка. До настоящего изобретения связывание FcγR обычно относили за счет аминокислотных остатков в нижней шарнирной области Fc-участка IgG.
Термин «C1q» относится к полипептиду, который содержит сайт связывания с Fc-участком иммуноглобулина. C1q вместе с двумя сериновыми протеазами, C1r и C1s, образует комплекс С1, первый компонент комплементзависимой цитотоксичности (CDC). Человеческий C1q является промышленно доступным, например, от Quidel, San Diego, Calif.
Термин «связывающий домен» относится к области полипептида, которая связывается с другой молекулой. В случае FcR связывающий домен может содержать фрагмент его полипептидной цепи (например, его α-цепи), ответственный за связывание с Fc-участком. Одним подходящим связывающим доменом является внеклеточный домен α-цепи FcR.
Термин «антитело» используется в данном документе в самом широком смысле и конкретно включает моноклональные антитела (в том числе полноразмерные моноклональные антитела), поликлональные антитела, полиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они проявляют желаемую биологическую активность.
Термин «выделенное» антитело представляет собой антитело, которое идентифицировано и выделено и/или отделено от компонента его нативной среды. Загрязняющие компоненты его нативной среды представляют собой соединения, которые оказывают отрицательное влияние на исследовательские, диагностические или терапевтические применения антитела, и они могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В некоторых вариантах осуществления антитело очищают (1) до более 95% по массе антитела, например, по данным метода Лоури, и в некоторых вариантах осуществления до более 99% по массе; (2) до степени, достаточной для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности при использовании, например, секвенатора с вращающимся цилиндром, или (3) до гомогенности с использованием SDS-PAGE в редуцирующих или нередуцирующих условиях с использованием, например, окрашивания Кумасси синим или серебром. Выделенное антитело включает антитело in situ в рекомбинантных клетках, когда, по меньшей мере, один компонент нативной среды антитела будет отсутствовать. Однако, как правило, выделенное антитело готовят с использованием, по меньшей мере, одной стадии очистки.
«Нативные антитела» обычно представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 дальтон, состоящие из двух идентичных легких цепей (L) и двух идентичных тяжелых цепей (H). Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, в то время как число дисульфидных мостиков варьирует среди тяжелых цепей иммуноглобулинов различных изотипов. Также каждая тяжелая и легкая цепь имеет регулярно расположенные внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь имеет в одном конце вариабельный домен (VH) с последующим рядом константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом конце; константный домен легкой цепи выровнена с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. Полагают, что определенные аминокислотные остатки образуют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи.
Термин «константный домен» относится к фрагменту иммуноглобулиновой молекулы, содержащему более консервативную аминокислотную последовательность по сравнению с другим фрагментом иммуноглобулина, вариабельного домена, который содержит антигенсвязывающий сайт. Константный домен состоит из доменов CH1, СН2 и СН3 тяжелой цепи и домена CHL легкой цепи.
Термины «вариабельный домен» или «вариабельная область» антитела относится к аминоконцевым доменам тяжелой или легкой цепи антитела. Вариабельный домен тяжелой цепи может относиться к «VH». Вариабельный домен легкой цепи может относиться к «VL». Данные домены в основном представляют наиболее вариабельные участки антитела и содержат антигенсвязывающие сайты.
Термин «вариабельные» относится к тому факту, что некоторые участки вариабельных доменов существенно различаются по последовательности среди антител и определяют связывание и специфичность каждого конкретного антитела для его конкретного антигена. Однако вариабельность неравномерно распределена в вариабельных доменах антител. Она сконцентрирована в трех сегментах, называемых гипервариабельными участками (HVR) в вариабельных доменах легкой цепи и тяжелой цепи. Более консервативные участки вариабельных доменов называются каркасными участками (FR). Каждый из вариабельных доменов нативных тяжелой и легкой цепей содержит четыре FR, в основном принимающих конфигурацию бета-складок, соединенных тремя HVR, которые образуют петли, соединяющие, и в некоторых случаях образующие, часть бета-складчатой структуры. В каждой цепи HVR поддерживаются в тесной близости FR и с HVR из другой цепи, тем самым внося свой вклад в формирование антигенсвязывающего сайта антител (смотрите Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, MD (1991)). Константные домены не принимают непосредственного участия в связывании антитела с антигеном, но обладают различными эффекторными функциями, такими как участие антитела в антителозависимой клеточной токсичности.
«Легкие цепи» антител (иммуноглобулинов) от одного вида позвоночных можно отнести к одному из двух четко различающихся типов, называемых каппа (κ) и лямбда (λ), основываясь на аминокислотных последовательностях их константных доменов.
В том смысле, в котором в данном документе используется термин «изотип» или «подкласс» IgG, он означает любой из подклассов иммуноглобулинов, определяемых химическими и антигенными характеристиками их константных доменов.
В зависимости от аминокислотных последовательностей константных доменов их тяжелых цепей антитела (иммуноглобулины) можно отнести к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно подразделить на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие различным классам иммуноглобулинов, называются соответственно α, δ, ε, γ и μ. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов являются хорошо известными и в целом описаны, например, Abbas et al., Cellular and Mol. Immunology, 4th ed. (W.B. Saunders, Co., 2000). Антитело может представлять фрагмент более крупной слитой молекулы, образованной ковалентным или нековалентным связыванием антитела с одним или несколькими другими белками или пептидами.
В том смысле, в котором в данном документе используется термин «модификация подкласса IgG», он означает аминокислотную модификацию, которая превращает одну аминокислоту одного изотипа IgG в соответствующую аминокислоту в другом, выровненном изотипе IgG. Например, поскольку IgG1 содержит тирозин и IgG2 содержит фенилаланин в положении 296 EU, то замена F296Y в IgG2 рассматривается в качестве модификации подкласса IgG.
В том смысле, в котором в данном документе используется выражение «неприродная модификация», он означает аминокислотную модификацию, которая не является изотипической. Например, поскольку ни один из IgG не содержит глутаминовую кислоту в положении 332, то замена в положении 332 на глутаминовую кислоту (332Е) в IgG1, IgG2, IgG3 или IgG4 рассматривается в качестве неприродной модификации.
Термины «полноразмерное антитело», «интактное антитело» и «цельное антитело» используются в данном документе взаимозаменяемо и относятся к антителу по существу в его интактной форме. Конкретно термины относятся к антителу с тяжелыми цепями, содержащими Fc-участок.
Термин «голое антитело» в целях настоящего описания представляет собой антитело, которое не конъюгировано с цитотоксической группой или радиоактивной меткой.
«Фрагменты антитела» включают фрагмент интактного антитела, предпочтительно содержащий его антигенсвязывающий сайт. В некоторых вариантах осуществления фрагменты антитела состоят из Fc-участка или части Fc-участка, содержащего одну или несколько модификаций Fc-участка, раскрытых в данном документе. Примеры фрагментов антител включают Fab-, Fab'-, F(ab')2- и Fv-фрагменты; диатела; линейные антитела; одноцепочечные молекулы антител; и полиспецифические антитела, образованные фрагментами антител.
В результате расщепления антител папаином образуется два идентичных антигенсвязывающих фрагмента, называемых «Fab-фрагментами», каждый из которых имеет один антигенсвязывающий сайт, и остаточный «Fc-фрагмент», название которого отражает его способность легко кристаллизоваться. Обработка пепсином приводит к образованию F(ab')2-фрагмента, который имеет два антигенсвязывающих сайта, и он по-прежнему способен связываться с антигеном.
«Fv-фрагмент» представляет собой минимальный фрагмент антитела, который содержит полный антигенсвязывающий сайт. В одном варианте осуществления двухцепочечный Fv-фрагмент состоит из димера вариабельного домена одной тяжелой цепи и одной легкой цепи, находящихся в тесной нековалентной связи. В одноцепочечных Fv-фрагментах (scFv) вариабельные домены одной тяжелой цепи и одной легкой цепи могут быть связаны ковалентно гибким пептидным линкером таким образом, что легкая и тяжелая цепи образуют «димерную» структуру, аналогичную структуре, которая имеется в двухцепочечных Fv-фрагментах. Это означает, что в данной конфигурации три HVR каждого вариабельного домена взаимодействуют с ограничением антигенсвязывающего сайта на поверхности димера VH-VL. В совокупности шесть HVR придают специфичность антителу в отношении связывания с антигеном. Однако даже один вариабельная домен (или половина Fv-фрагмента, содержащая только три HVR, специфичных для антигена) обладает способностью узнавать и связываться с антигеном, хотя и с более низкой аффинностью по сравнению с целым связывающим сайтом.
Fab-фрагмент содержит вариабельные домены тяжелой и легкой цепи и также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбоксиконце домена СН1 тяжелой цепи, включающих один или несколько цистеинов из шарнирной области антитела. Fab'-SH обозначает в данном документе Fab'-фрагмент, в котором остаток(и) цистеина константных доменов содержит свободную тиоловую группу. F(ab')2-фрагменты антитела первоначально получают в виде пары Fab'-фрагментов, которые имеют цистеины шарнирной области между ними. Также известны другие химические связи между фрагментами антитела.
«Одноцепочечные Fv-фрагменты» или «scFv» содержат домены VH и VL антитела, в которых данные домены находятся в одной полипептидной цепи. Обычно полипептид scFv дополнительно содержит полипептидный линкер между доменами VH и VL, который обеспечивает образование желаемой структуры scFv для связывания антигена. Обзор по scFv смотрите, например, у Pluckthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds. (Springer-Verlag, New York, 1994), pp. 269-315.
Термин «диатела» относится к фрагментам антител с двумя антигенсвязывающими сайтами, где данные фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одной той же полипептидной цепи (VH-VL). При использовании линкера, который является слишком коротким для того, чтобы имело место спаривание двух доменов в одной и той же цепи, домены «вынуждены» спариваться с комплементарными доменами другой цепи, и в результате образуется два антигенсвязывающих сайта. Диатела могут быть бивалентными или биспецифическими. Более подробно диатела описаны, например, в EP 404097; международной заявке 1993/0116; Hudson et al., Nat. Med., 9:129-134 (2003) и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993). Также описаны триатела и тетратела, Hudson et al., Nat. Med., 9:129-134 (2003).
В том смысле, в котором в данном документе используется термин «моноклональное антитело», он относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных мутаций, например, природных мутаций, которые могут присутствовать в минорных количествах. Таким образом, определение «моноклональное» указывает на характер антитела, а не на то, что это смесь отдельных антител. В некоторых вариантах осуществления такое моноклональное антитело, как правило, включает антитело, содержащее полипептидную последовательность, которая связывается с мишенью, где полипептидная последовательность, связывающаяся с мишенью, получена способом, который включает отбор полипептидной последовательности, которая связывается с одной мишенью, из множества полипептидных последовательностей. Например, процесс отбора может представлять отбор уникального клона из множества клонов, такого как пул гибридомных клонов, фаговых клонов или клонов рекомбинантной ДНК. Очевидно, понятно, что отобранную связывающуюся с мишенью последовательность можно дополнительно изменить, например, в целях повышения аффинности для мишени, для гуманизации связывающейся с мишенью последовательности, для повышения ее продукции в клеточной культуре, для снижения ее иммуногенности в условиях in vivo, для получения полиспецифического антитела и т.д., и что антитело, содержащее измененную связывающуюся с мишенью последовательность, также является моноклональным антителом по изобретению. В противоположность средствам поликлональных антител, которые обычно включают различные антитела к различным детерминантам (эпитопам), каждое моноклональное антитело в средстве моноклонального антитела направлено к одной детерминанте на антигене. В дополнение к их специфичности средства моноклональных антител являются преимущественными в том отношении, что, как правило, они не содержат примесей других иммуноглобулинов.
Определение «моноклональное» указывает на природу антитела, как полученного по существу из гомогенной популяции антител, и при этом не предусматривается необходимость получения антитела каким-либо конкретным методом. Например, моноклональные антитела, предназначенные для применения по настоящему изобретению, можно получить различными методами, включая, например, гибридомный метод (например, Kohler and Milstein, Nature, 256:495-497 (1975); Hongo et al., Hybridoma, 14(3):253-260 (1995); Harlow et al., Antibodies: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 2nd ed., 1988); Hammerling et al., in Monoclonal Antibodies and T-cell Hybridomas, 563-681 (Elsevier, N.Y., 1981), методы рекомбинантной ДНК (смотрите, например, патент США № 4816567), технологии фагового дисплея (смотрите, например, Clackson et al., Nature, 352:624-628 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1992); Sidhu et al., J. Mol. Biol., 338(2):299-310 (2004); Lee et al., J. Mol. Biol., 340(2):1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA, 101(34):12467-12472 (2004) и Lee et al., J. Immunol. Methods, 284(1-2):119-132 (2004) и технологии получения человеческих и подобных человеческим антител у животных, которые содержат фрагменты или все локусы человеческих иммуноглобулинов, или гены, кодирующие последовательности человеческих иммуноглобулинов (смотрите, например, международные заявки WO 1998/24893, WO 1996/34096, WO 1996/33735, WO 1991/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggemann et al., Year in Immunol., 7:33 (1993); патенты США №№ 5545807, 5545806, 5569825, 5625126, 5633425 и 5661016; Marks et al., Bio/Technology, 10:779-783 (1992); Lonberg et al., Nature, 368:856-859 (1994); Morrison, Nature, 368:812-813 (1994); Fishwild et al., Nature Biotechnol., 14:845-851 (1994); Neuberger, Nature Biotechnol., 14:826 (1996); и Lonberg and Huszar, Intern. Rev. Immunol., 13:65-93 (1995).
Моноклональные антитела, описанные в данном документе, конкретно включают «химерные» антитела, в которых фрагмент тяжелой и/или легкой цепи идентичен или гомологичен соответствующим последовательностям в антителах, полученных от определенного вида или относящихся к определенному классу или подклассу антител, в то время как остальная часть цепи(й) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют желаемую биологическую активность (смотрите, например, патент США № 4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). Химерные антитела включают антитела приматизед®, в которых антигенсвязывающий участок антитела получен из антитела, продуцируемого, например, макаками, иммунизированными интересующим антигеном.
«Гуманизированные» формы антител, отличных от человеческих (например, мышиные), представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина, отличного от человеческого иммуноглобулина. В одном варианте осуществления гуманизированное антитело представляет собой человеческий иммуноглобулин (реципиентное антитело), в котором остатки HVR реципиента заменены на остатки HVR от вида, отличного от человека (донорное антитело), такого как мышь, крыса, кролик или примат, обладающее желаемой специфичностью, аффинностью и/или эффективностью. В некоторых случаях остатки FR человеческого иммуноглобулина заменены на соответствующие остатки, отличные от человеческих остатков. Кроме того, гуманизированные антитела могут содержать остатки, которые отсутствуют в реципиентном антителе или донорном антителе. Данные модификации проводят для дополнительного повышения эффективности антитела. В общем гуманизированное антитело будет содержать в основном целиком, по меньшей мере, одну и, как правило, два вариабельных домена, в которых все или по существу все гипервариабельные петли соответствуют петлям в иммуноглобулине, отличном от человеческого иммуноглобулина, и все или по существу все FR представляют собой FR из последовательности человеческого иммуноглобулина. Гуманизированное антитело необязательно также будет содержать, по меньшей мере, часть константного домена иммуноглобулина (Fc), как правило, человеческого иммуноглобулина. Дополнительные детали смотрите, например, у Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-329 (1988) и Presta, Curr. Op. Struct. Biol., 2:593-596 (1992). Также смотрите, например, Vaswani and Hamilton, Ann. Allergy, Asthma&Immunol., 1:105-115 (1998); Harris, Biochem. Soc. Transactions, 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech., 5:428-433 (1994) и патенты США №№ 6982321 и 7087409.
«Человеческое антитело» представляет собой антитело, которое имеет аминокислотную последовательность, соответствующую последовательности антитела, продуцированного человеком и/или полученное с использованием любого метода получения человеческих антител, раскрытых в данном документе. Данное определение человеческого антитела конкретно включает гуманизированное антитело, содержащее антигенсвязывающие остатки, отличные от человеческих антигенсвязывающих остатков. Человеческие антитела можно получить с использованием различных способов, известных в данной области, включая библиотеки фагового дисплея. Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991). Также для получения человеческих моноклональных антител имеются методы, описанные Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol., 147(1):86-95 (1991). Смотрите также van Dijk and van de Winkel, Curr. Opin. Pharmacol., 5:368-374 (2001). Человеческие антитела можно получить ведением антигена трансгенному животному, которое модифицировано для продукции антител в ответ на введение антигена, но чьи эндогенные локусы блокированы, например, иммунизированным xenomice (смотрите, например, патенты США №№ 6075181 и 6150584, касающиеся технологии XENOMOUSETM). Также смотрите, например, Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006), где описываются человеческие антитела, полученные с использованием гибридомной технологии с человеческими В-клетками.
«Зависимое от вида антитело» представляет собой антитело, которое обладает более высокой аффинностью связывания в отношении антигена от первого вида млекопитающих по сравнению с гомологом этого антигена от второго вида млекопитающих. Обычно зависимое от вида антитело «специфически связывается» с человеческим антигеном (т.е. имеет значение аффинности связывания (Kd), составляющее не более чем примерно 1×10-7 М, предпочтительно не более чем примерно 1×10-8 М и наиболее предпочтительно не более чем примерно 1×10-9 М), но его аффинность связывания в отношении гомолога антигена от второго вида млекопитающих, отличного от человека, по меньшей мере, примерно в 50 раз, или, по меньшей мере, примерно в 500 раз, или, по меньшей мере, примерно в 1000 раз ниже по сравнению с аффинностью связывания с человеческим антигеном. Зависимое от вида антитело может представлять любой из различных типов антител, имеющих определенные выше значения, но предпочтительно представляет собой гуманизированное или человеческое антитело.
В том смысле, в котором в данном документе используются термины «гипервариабельный участок», «HVR» или «HV», они относятся к участкам вариабельного домена антитела, которые являются гипервариабельными по последовательности и/или образуют структурно ограниченные петли. Как правило, антитела содержат шесть HVR; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). В нативных антителах H3 и L3 проявляют наибольшее разнообразие шести HVR, и в частности, полагают, что Н3 играет уникальную роль в обеспечении тонкой специфичности антител. Смотрите, например, Xu et al., Immunity, 13:37-45 (2000); Johnson and Wu, in Methods in Molecular Biology, 248:1-25 (Lo, ed., Human Press, Totowa, NJ, 2003). Действительно, природные camelid антитела, состоящие только из тяжелой цепи, являются функциональными и стабильными при отсутствии легкой цепи. Смотрите, например, Hamers-Casterman et al., Nature, 363:446-448 (1993); Sheriff et al., Nature Struct. Biol., 3:733-736 (1996).
Применяют ряд схем HVR, и они включены в данный документ. Области, определяющие комплементарность по Kabat (CDR), основаны на вариабельности последовательностей и применяются наиболее часто (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Вместо этого Chortia относит к положению структурных петель (Chorthia and Lesk, J. Mol. Biol., 196:901-917 (1987)). AbM HVR представляют собой компромисс между HVR по Kabat и структурными петлями по Chortia, и их используют в программах по моделированию Oxford Molecular's AbM antibody. «Контактные» HVR основаны на анализе доступных комплексных кристаллических структур. Ниже приводятся остатки каждого из данных HVR.
HVR могут включать следующие «распространяющиеся HVR»: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL и 26-35 (Н1), 50-65 или 49-65 (Н2) и 93-102, 94-102 или 95-102 (Н3) в VH. Остатки вариабельного домена нумеруются по системе Kabat et al., смотрите выше, для каждого из данных определений.
Остатки «каркасной области» или «FR» представляют собой остатки вариабельного домена, иные, чем остатки HVR, определенные в данном документе.
Термины «нумерация остатков вариабельного домена по Kabat» или «нумерация аминокислотных положений по Kabat» и их вариации относятся к системе нумерации, используемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи компиляции антител по Kabat et al., выше. При использовании данной системы нумерации фактическая линейная аминокислотная последовательность может содержать меньшее количество аминокислот или дополнительные аминокислоты, что соответствует укорочению или инсерции FR или HVR вариабельного домена. Например, вариабельный домен тяжелой цепи может содержать один аминокислотный инсерт (остаток 52а по системе Kabat) после остатка 52 в Н2 и инсерцированные остатки (например, остатки 82а, 82b и 82с и т.д. по системе Kabat) после остатка 82 FR тяжелой цепи. Нумерацию остатков по Kabat можно провести для данного антитела выравниванием по областям гомологии последовательности антитела со «стандартной» нумерованной последовательностью Kabat.
Как правило, систему нумерации по Kabat используют при указании остатка в вариабельном домене (приблизительно остатки 1-107 в легкой цепи и остатки 1-113 в тяжелой цепи) (например, Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)). «EU-систему нумерации» или «EU-индекс» обычно используют при указании остатка в константном домене тяжелой цепи (например, EU-индекс по Kabat et al., выше). «EU-индекс по Kabat» относится к нумерации остатков человеческого IgG1 антитела EU. Если в настоящем описании не указано иначе, то номера остатков в вариабельном домене антител означают нумерацию остатков по системе нумерации Kabat. Если в настоящем описании не указано иначе, то номера остатков в константном домене антител означают нумерацию остатков по EU-системе нумерации (смотрите, например, публикацию PCT № WO 2006/073941).
Антитело «со зрелой аффинностью» представляет собой антитело с одним или несколькими изменениями в одном или нескольких HVR, которые приводят к повышению аффинности антитела в отношении антигена по сравнению с исходным антителом, которое не содержит данное изменение(я). В одном варианте осуществления антитело со зрелой аффинностью обладает аффинностью на уровне наномоль или даже пикомоль для антигена-мишени. Антитела со зрелой аффинностью можно получить с использованием некоторых методов, известных в данной области. Например, Marks et al., Bio/Technology, 10:779-783 (1992) описывают созревание аффинности посредством перестановки областей VH и VL. Описан случайный мутагенез остатков HVR и/или каркасной области, например, Barbas et al., Proc. Natl. Acad. Sci. USA, 91:3809-3813 (1994); Schier et al., Gene, 169:147-155 (1995); Yelton et al., J. Immunol., 155:1994-2004 (1995); Jackson et al., J. Immunol., 154(7):3310-9 (1995) и Hawkins et al., J. Mol. Biol., 226:889-896 (1992).
«Блокирующее антитело» или «антитело-антагонист» представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, с которым оно связывается. Некоторые блокирующие антитела или антитела-антагонисты существенно или полностью ингибируют биологическую активность антигена.
В том смысле, в котором в данном документе используется термин «антитело-агонист», он представляет собой антитело, которое частично или полностью имитирует, по меньшей мере, одну функциональную активность интересующего полипептида.
«Ингибирующие рост антитела» представляют собой антитела, которые предупреждают или снижают пролиферацию клетки, экспрессирующей антиген, с которым антитело связывается.
Термин «эффекторные функции» антитела относится к таким биологическим активностям, за которые «отвечает» Fc-участок (Fc-участок с нативной последовательностью или Fc-участок с вариантной аминокислотной последовательностью) антитела, и они варьируют в зависимости от изотипа антитела. Примеры эффекторных функций антител включают: связывание C1q и комплемент-зависимую цитотоксичность (CDC); связывание с Fc-рецептором; антителозависимую клеточноопосредованную цитотоксичность (ADCC); фагоцитоз; негативную регуляцию рецепторов клеточной поверхности (например, рецепторов В-клеток); и активацию В-клеток.
В том смысле, в котором в данном документе используется термин «Fc-участок», он относится к С-концевой области тяжелой цепи иммуноглобулина, включая Fc-участки с нативной последовательностью и вариантные Fc-участки. Несмотря на то, что границы Fc-участка тяжелой цепи иммуноглобулина могут варьировать, Fc-участок тяжелой цепи человеческого IgG обычно определяется, как участок от аминокислотного остатка в положении Cys226 или от Pro230 до карбоксиконца. С-концевой лизин (остаток 447 по EU-системе нумерации) Fc-участка можно удалить, например, во время получения или очистки антитела или рекомбинантным конструированием нуклеиновой кислоты, кодирующей тяжелую цепь антитела. Следовательно, композиция интактных антител может содержать популяции антител с полностью удаленными остатками К447, популяции антител без удаления остатков К447 и популяции антител со смесью антител с и без остатков К447. В некоторых вариантах осуществления Fc-участок иммуноглобулина содержит два константных домена CH2 и CH3.
«CH2 домен» Fc-участка человеческого иммуноглобулина (также называемый «Сγ2» доменом) обычно простирается примерно от аминокислотного остатка 231 до примерно аминокислотного остатка 340. CH2 домен является уникальным в том отношении, что он не спарен тесно ни с одним другим доменом. Вернее, две N-связанные разветвленные углеводные цепи располагаются между двумя CH2 доменами интактной молекулы нативного IgG. Было высказано предположение, что углевод может обеспечивать замену спариванию домен-домен и помогать в стабилизации CH2 домена. Burton, Molec. Immunol., 22:161-206 (1985).
«CH3 домен» представляет собой участок остатков, расположенных на С-конце по отношению к CH2 домену в Fc-участке (т.е. примерно от аминокислотного остатка 341 до примерно аминокислотного остатка 447 IgG).
«Функциональный Fc-участок» обладает «эффекторной функцией» Fc-участка с нативной последовательностью. Примеры «эффекторных функций» включают связывание с Fc-рецептором; связывание с C1q; CDC; ADCC; фагоцитоз; негативную регуляцию рецепторов клеточной поверхности (например, рецепторов В-клеток; BCR) и т.д. Обычно для проявления таких эффекторных функций требуется, чтобы Fc-участок был соединен со связывающим доменом (например, вариабельным доменом антитела), и их можно оценить с использованием различных методов.
«Fc-участок с нативной последовательностью» содержит аминокислотную последовательность, идентичную природной аминокислотной последовательности Fc-участка. Fc-участки с нативной последовательностью человека включают Fc-участок с нативной последовательностью человеческого IgG1 (не-А и А-аллотипы); Fc-участок с нативной последовательностью человеческого IgG2, Fc-участок с нативной последовательностью человеческого IgG3 и Fc-участок с нативной последовательностью человеческого IgG4, а также их природные варианты (смотрите, например, SEQ ID NO:11-17).
«Вариантный Fc-участок» включает аминокислотную последовательность, которая отличается от Fc-участка с нативной последовательностью, по меньшей мере, за счет одной аминокислотной модификации. В некоторых вариантах осуществления вариантный Fc-участок включает аминокислотную последовательность, которая отличается от Fc-участка с нативной последовательностью, по меньшей мере, одной или несколькими аминокислотными заменами. В некоторых вариантах осуществления вариантный Fc-участок содержит, по меньшей мере, одну аминокислотную замену по сравнению с Fc-участком IgG дикого типа или антитела дикого типа. В некоторых вариантах осуществления вариантный Fc-участок содержит две или более аминокислотных замен в Fc-участке антитела дикого типа. В некоторых вариантах осуществления вариантный Fc-участок содержит три или более аминокислотных замен в Fc-участке антитела дикого типа. В некоторых вариантах осуществления вариантный Fc-участок содержит, по меньшей мере, одну, две или три, или более аминокислотных замен в Fc-участке, описанных в данном документе. В некоторых вариантах осуществления Fc-участок, описанный в данном документе, будет обладать, по меньшей мере, примерно 80% гомологией с Fc-участком с нативной последовательностью и/или с Fc-участком исходного полипептида. В некоторых вариантах осуществления вариантный Fc-участок, описанный в данном документе, будет обладать, по меньшей мере, примерно 90% гомологией с Fc-участком с нативной последовательностью и/или с Fc-участком исходного полипептида. В некоторых вариантах осуществления вариантный Fc-участок, описанный в данном документе, будет обладать, по меньшей мере, примерно 95% гомологией с Fc-участком с нативной последовательностью и/или с Fc-участком исходного полипептида.
Термины «Fc-рецептор» или «FcR» описывают рецептор, который связывается с Fc-участком антитела. В некоторых вариантах осуществления FcR представляет собой нативный человеческий FcR. В некоторых вариантах осуществления FcR представляет собой рецептор, который связывается с IgG антителом (гамма-рецептор), и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, в том числе аллельные варианты и альтернативно сплайсированные формы данных рецепторов. FcγRII рецепторы включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор») с аналогичными аминокислотными последовательностями, главным образом, различающиеся по их цитоплазматическим доменам. Активирующий FcγRIIA рецептор содержит основанный на тирозине мотив активации иммунорецептора (ITAM) в своем цитоплазматическом домене. Ингибирующий FcγRIIB рецептор содержит основанный на тирозине мотив ингибирования иммунорецептора (ITIM) в своем цитоплазматическом домене (смотрите, например, Daeron, Annu. Rev. Immunol., 15:203-234 (1997)). Обзор по FcR смотрите, например, у Ravetch and Kinet, Annu. Rev. Immunol., 9:457-492 (1991); Capel et al., Immunomethods, 4:25-34 (1994) и de Haas et al., J. Lab. Clin. Med., 126:330-41 (1995). Другие FcR, включая такие, которые будут идентифицированы в будущем, входят в понятие термина «FcR», используемого в данном документе.
Термины «Fc-рецептор» или «FcR» также включают неонатальный рецептор FcRn, который ответственен за перенос материнских IgG к плоду (Guyer et al., J. Immunol., 117:587 (1976) и Kim et al., J. Immunol., 24:249 (1994)) и регуляцию гомеостаза иммуноглобулинов. Известны методы оценки связывания с FcRn (смотрите, например, Ghetie and Ward, Immunol. Today, 18(2):592-598 (1997); Ghetie et al., Nature Biotechnology, 15(7):637-640 (1997); Hinton et al., J. Biol. Chem., 279(8):6213-6216 (2004); международная заявка WO 2004/92219 (Hinton et al.)).
Можно определить время полужизни в условиях in vivo или в сыворотке крови полипептидов, обладающих высокой аффинностью связывания с человеческим FcRn, например, у трансгенных мышей, людей или приматов, отличных от человека, которым ввели полипептиды вариантного Fc-участка. Также смотрите, например, Petkova et al., International Immunology, 18(12):1759-1769 (2006).
Термин «человеческие эффекторные клетки» относится к лейкоцитам, экспрессирующим один или несколько FcR и осуществляющим эффекторные функции. В некоторых вариантах осуществления клетки экспрессируют, по меньшей мере, FcγRIII и осуществляют ADCC-эффекторную функцию(и). Примеры человеческих лейкоцитов, опосредующих ADCC, включают мононуклеарные клетки периферической крови (PBMC), природные клетки-киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы. Эффекторные клетки можно выделить из нативного источника, например, крови.
«Антителозависимая клеточноопосредованная цитотоксичность» или «ADCC» относится к форме цитотоксичности, при которой секретированный Ig, связанный с Fc-рецепторами (FcR), находящимися на некоторых цитотоксических клетках (например, NK-клетках, нейтрофилах и макрофагах), способен обеспечивать специфическое связывание данных цитотоксических эффекторных клеток с антиген-несущими клетками-мишенями и затем приводить к гибели клеток-мишеней под действием цитотоксинов. Основными клетками, опосредующими ADCC, являются NK-клетки, которые экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Обобщенные данные по экспрессии FcR на гематопоэтических клетках приведены в таблице 3 на стр. 464 работы Ravetch and Kinet, Annu. Rev. Immunol., 9:457-92 (1991). Для оценки ADCC-активности интересующей молекулы можно провести тест ADCC в условиях in vitro, такой как описан в патентах США № 5500362 или 5821337, или патенте США № 6737056 (Presta). Подходящими эффекторными клетками для постановки таких тестов являются клетки PBMC и NK. Альтернативно или дополнительно активность ADCC интересующей молекулы можно оценить в условиях in vivo, например, на модели животных, такой как описана Clynes et al., PNAS (USA), 95:652-656 (1998).
«Комплемент-зависимая цитотоксичность» или «CDC» относится к лизису клетки-мишени в присутствии комплемента. Активация классического пути комплемента инициируется связыванием первого компонента комплементной системы (C1q) с антителами (соответствующего подкласса), которые связаны со своим антигеном. В целях оценки активации комплемента можно провести анализ CDC, например, такой как описан Gazzano-Santoro et al., J. Immunol. Methods, 202:163 (1996). Описаны полипептидные варианты с измененной аминокислотной последовательностью Fc-участка (полипептиды с вариантным Fc-участком) с повышенной или пониженной способностью связываться с C1q, например, в патенте США № 6194551 В1 и международной заявке WO 1999/51642. Смотрите также, например, Idusogie et al., J. Immunol., 164:4178-4184 (2000).
Полипептидный вариант с «измененной» аффинностью связывания с FcR или ADCC-активностью представляет собой полипептид, который обладает повышенной или пониженной связывающей активностью для FcR и/или ADCC-активностью по сравнению с исходным полипептидом или полипептидом, содержащим Fc-участок с нативной последовательностью. Вариант полипептида, который «проявляет повышенное связывание» с FcR, связывается, по меньшей мере, с одним FcR с более высокой аффинностью по сравнению с исходным полипептидом. Вариант полипептида, который «проявляет пониженное связывание» с FcR, связывается, по меньшей мере, с одним FcR с более низкой аффинностью по сравнению с исходным полипептидом. Такие варианты, которые проявляют пониженное связывание с FcR, могут обладать незначительным связыванием с FcR, или детектируемое связывание с FcR вовсе отсутствует, например, имеется 0-20% связывание с FcR по сравнению с Fc-участком с нативной последовательностью IgG.
Вариант полипептида, который «опосредует антитело-зависимую клеточноопосредованную цитотоксичность (ADCC) в присутствии человеческих эффекторных клеток более эффективно» по сравнению с исходным антителом, представляет собой полипептид, который в условиях in vitro или in vivo является значительно более эффективным в опосредовании ADCC, при том, что количества варианта полипептида и исходного антитела, используемые при анализе, практически одинаковы. В основном такие варианты идентифицируют с использованием определения активности ADCC в тесте в условиях in vitro, описанного в данном документе, но также предусматриваются другие тесты или методы для определения активности ADCC, например, на модели животных.
В общем, термин «аффинность связывания» относится к силе суммарных общих нековалентных взаимодействий между одним связывающим сайтом в молекуле (например, в антителе) и его партнером по связыванию (например, антигеном). Если не указано иначе, то в том смысле, в котором термин «аффинность связывания» используется в данном документе, он относится к присущей аффинности связывания, которая отражает взаимодействие 1:1 между членами пары связывания (например, антитела и антигена). Аффинность молекулы Х для ее партнера Y обычно выражается константой диссоциации (Kd), величиной, обратной константе ассоциации (Ka). Аффинность можно определить с использованием обычных способов, известных в данной области, включая описанные в данном документе. Как правило, низкоаффинные антитела связываются с антигеном медленно и/или имеют тенденцию к быстрой диссоциации, в то время как высокоаффинные антитела связываются с антигеном быстрее и/или имеют тенденцию оставаться связанными дольше. В данной области известны различные способы оценки аффинности связывания, любой из которых можно использовать для целей настоящего изобретения. Конкретные иллюстративные и приведенные в качестве примера варианты осуществления определения аффинности связывания описаны ниже.
В некоторых вариантах осуществления «KD», «Kd», «Kd» или «значение Kd» по данному изобретению определяют поверхностным плазмонным резонансом с использованием BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С с антигеном, иммобилизованным на чипах СМ5, примерно при 10 резонансных единицах (RU). Вкратце, биосенсорные чипы из карбоксиметилированного декстрана (CM5, BIACORE, Inc.) активируют N-этил-N'-(3-диметиламинопропил)карбодиимидом гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS), следуя инструкциям изготовителя. Антиген разводят 10 мМ ацетатом натрия, рН 4,8 до концентрации 5 мкг/мл (примерно 0,2 мкМ) перед инжектированием со скоростью потока 5 мкл/мин для достижения примерно 10 резонансных единиц (RU) конъюгированного белка. После инжектирования антигена инжектируют 1 М этаноламин для блокирования непрореагировавших групп. Для определения кинетики серийные разведения полипептида, например полноразмерного антитела, инжектируют в смеси PBS с поверхностно-активным веществом 0,05% твин-20ТМ (PBST) при 25°С со скоростью потока 25 мкл/мин. Рассчитывают скорости ассоциации (kon) и скорости диссоциации (koff) с использованием модели связывания Langmuir один-в-один (BIACORE® Evaluation Software version 3.2) при одновременной подгонке сенсограмм ассоциации и диссоциации. Константу равновесия диссоциации (Kd) рассчитывают как соотношение koff/kon. Смотрите, например, Chen et al., J. Mol. Biol., 293:865-881 (1999). В том случае, если скорость ассоциации превышает 106 М-1с-1 по данным поверхностного плазмонного резонанса, описанного выше, то скорость ассоциации можно определить с использованием методики гашения флуоресценции, с помощью которой можно определить повышение или снижение интенсивности эмиссии флуоресценции (возбуждение = 295 нм; эмиссия = 340 нм, полоса пропускания 16 нм) при 25°С 20 нМ антитела к антигену в PBS, рН 7,2 в присутствии возрастающих концентраций антигена на спектрофотометре, таком как спектрофотометр стоп-флоу (Aviv Instruments) или спектрофотометре 8000-series SLM-AMINCOTM (ThermoSpectronic) в кювете с перемешиванием.
Также можно определить «on-скорость», «скорость ассоциации», «ассоциативную скорость» или «kon» по настоящему изобретению, как описано выше, с использованием системы BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ).
В том смысле, в котором в данном документе используются термины «по существу аналогично» или «по существу одинаково», они означают достаточно высокую степень сходности между двумя цифровыми значениями, так, что специалист в данной области будет рассматривать различие между двумя значениями как незначительное или не имеющее биологической и/или статистической значимости в контексте биологических характеристик, которые выражаются указанными значениями (например, значениями Kd). В некоторых вариантах осуществления различие между двумя указанными значениями составляет, например, менее чем примерно 50%, менее чем примерно 40%, менее чем примерно 30%, менее чем примерно 20% и/или менее чем примерно 10%, как функция стандарта/сравниваемого значения.
В том смысле, в котором в данном документе используются выражения «значительно снижено» или «в значительной мере другое», они означают достаточно высокую степень различия между двумя цифровыми значениями, так, что специалист в данной области будет рассматривать различие между двумя значениями, как статистически значимое в контексте биологических характеристик, которые выражаются указанными значениями (например, значениями Kd). В некоторых вариантах осуществления различие между двумя указанными значениями составляет, например, более чем примерно 10%, более чем примерно 20%, более чем примерно 30%, более чем примерно 40% и/или более чем примерно 50%, как функция стандарта/сравниваемая молекула.
«Акцепторная человеческая каркасная область» для целей настоящей заявки представляет собой каркасную область, содержащую аминокислотную последовательность каркасной области VL или VH, полученную из каркасной области человеческого иммуноглобулина или человеческой консенсусной каркасной области. Акцепторная человеческая каркасная область, «полученная из» каркасной области человеческого иммуноглобулина или человеческой консенсусной каркасной области, может содержать такую же аминокислотную последовательность, или она может включать ранее существующие изменения аминокислотной последовательности. В некоторых вариантах осуществления число ранее существующих аминокислотных изменений составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. В том случае, когда ранее существующие аминокислотные изменения находятся в VH, предпочтительно, чтобы данные изменения имели место только в трех, двух или одном положениях 71Н, 73Н и 78Н; например, аминокислотные остатки в данных положениях могут представлять собой 71А, 73Т и/или 78А. В одном варианте осуществления акцепторная человеческая каркасная область VL идентична последовательности человеческой каркасной области VL или человеческой консенсусной каркасной области.
«Человеческая консенсусная каркасная область» представляет собой каркасную область, в которой находятся аминокислотные остатки, наиболее часто встречаемые при выборе последовательностей каркасной области VL или VH человеческого иммуноглобулина. В общем, выбирают последовательности VL или VH человеческого иммуноглобулина из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей является подгруппой по Kabat et al., выше. В одном варианте осуществления в отношении VL, подгруппа представляет собой подгруппу каппа I по Kabat et al., выше. В одном варианте осуществления в отношении VH, подгруппа представляет собой подгруппу III по Kabat et al., выше.
«Консенсусная каркасная область подгруппы III VH» включает консенсусную последовательность, полученную из аминокислотных последовательностей в подгруппе III вариабельных доменов тяжелой цепи по Kabat et al.
«Консенсусная каркасная область подгруппы I VL» включает консенсусную последовательность, полученную из аминокислотных последовательностей в подгруппе I каппа вариабельных доменов легкой цепи по Kabat et al.
Термин «очищенный» означает, что молекула находится в образце в концентрации, по меньшей мере, 95% к массе, или, по меньшей мере, 98% к массе образца, в котором она находится.
«Выделенная» молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которая отделена, по меньшей мере, от одной другой молекулы нуклеиновой кислоты, с которой она обычно ассоциирована, например, в ее природной среде. Выделенная молекула нуклеиновой кислоты дополнительно включает молекулу нуклеиновой кислоты, находящуюся в клетках, которые обычно экспрессируют молекулу нуклеиновой кислоты, но молекула нуклеиновой кислоты находится экстрахромосомально или в положении хромосомы, которое отличается от ее природного положения в хромосоме.
В том смысле, в котором в данном документе используется термин «вектор», он относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она связана. Один тип вектора представляет собой «плазмиду», которая относится к циклической двухцепочечной ДНК, в которую можно лигировать дополнительные сегменты ДНК. Другой тип вектора представляет собой фаговый вектор. Еще один тип вектора представляет собой вирусный вектор, с помощью которого дополнительные сегменты ДНК можно лигировать в вирусный геном. Некоторые векторы обладают способностью к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы, имеющие бактериальный ориджин репликации и эписомальые векторы млекопитающих). Другие векторы (например, неэписомальные векторы млекопитающих) можно интегрировать в геном клетки-хозяина при введении в клетку-хозяин, и тем самым обеспечить их репликацию вместе с геномом хозяина. Кроме того, некоторые векторы способны регулировать экспрессию генов, с которыми они оперативно связаны. Такие векторы относятся в данном документе к «рекомбинантным экспрессирующим векторам» или просто «экспрессирующим векторам». В целом экспрессирующие векторы, используемые в методах рекомбинантной ДНК, часто находятся в форме плазмид. В настоящей заявке термины «плазмида» и «вектор» можно использовать взаимозаменяемо, поскольку плазмида является наиболее часто применяемой формой вектора.
В том смысле, в котором в данном документе используются термины «полинуклеотид» или «нуклеиновая кислота», они относятся к полимерам из нуклеотидов любой длины, и они включают ДНК и РНК. Нуклеотиды могут быть дезоксирибонуклеотидами, рибонуклеотидами, модифицированными нуклеотидами или основаниями, и/или их аналогами, или любым субстратом, который может быть включен в полимер при участии ДНК- или РНК-полимеразы или в реакции синтеза. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Если они присутствуют, то модификацию нуклеотидной структуры можно включить до или после сборки полимера. Последовательность нуклеотидов можно «прерывать» ненуклеотидными компонентами. Полинуклеотид может содержать модификацию(и), сделанную после синтеза, такую как конъюгация с меткой. Другие типы модификаций включают, например, «кэпы», замену одного или нескольких природных нуклеотидов на аналог, межнуклеотидные модификации, например, с незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, содержащие боковые цепи, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации с включениями (например, акридин, псорален и т.д.), модификации, содержащие хелатообразующие агенты (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), модификации, содержащие алкилирующие агенты, с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида(ов). Кроме того, любую гидроксильную группу, обычно присутствующую в сахарах, можно заместить, например, на фосфонатные группы, фосфатные группы, защищенные обычными защитными группами, или активированные с получением дополнительных связей в дополнительных нуклеотидах, или которые можно конъюгировать с твердой или полутвердой подложкой. 5'- и 3'-концевые ОН-группы можно фосфорилировать или заместить на амины или органические кэппирующие группы из 1-20 атомов углерода. Другие гидроксильные группы также можно дериватизировать с использованием обычных защитных групп. Также полинуклеотиды могут содержать аналоги сахаров рибозы или дезоксирибозы, хорошо известные в данной области, например, такие как 2'-О-метил-, 2'-О-аллил-, 2'-фтор- или 2'-азидорибоза, карбоциклические аналоги сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозы, фуранозы, седогептулозы, ациклические аналоги, основные аналоги нуклеозидов, такие как метилрибозид. Одну или несколько фосфодиэфирных связей можно заместить на альтернативные связывающие группы. Данные альтернативные связывающие группы включают, не ограничиваясь этим, варианты осуществления, в которых фосфат заменяют на P(O)S («тиоат»), P(S)S («дитиоат»), (O)NR2 («амидат»), P(O)R, P(O)OR', CO или CH2 («формацеталь»), в которых каждый R или R' независимо представляют собой Н или замещенный или незамещенный алкил (1-20 С), необязательно содержащий эфирную связь (-О-), арил, алкенил, циклоалкил, циклоалкенил или аралдил. Не требуется, чтобы все связи в полинуклеотиде были идентичными. Приведенное выше описание относится ко всем полинуклеотидам, описанным в данном документе, включая РНК и ДНК.
В том смысле, в котором в данном документе используется термин «олигонуклеотид», в общем, он относится к коротким, как правило, одноцепочечным, как правило, синтетическим полинуклеотидам, обычно, но необязательно длиной менее чем примерно 200 нуклеотидов. Термины «олигонуклеотид» и «полинуклеотид» не являются взаимоисключающими. Приведенное выше описание для полинуклеотидов в равной и полной мере относится к олигонуклеотидам.
Выражение «регуляторные последовательности» относится к последовательностям ДНК, необходимым для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине. Регуляторные последовательности, подходящие для прокариотов, включают, например, промотор, необязательно последовательность оператора и сайт связывания рибосомы. Как известно, эукариотические клетки используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота «функционально связана», когда ее помещают в функциональную связь с другой последовательностью нуклеиновой кислоты. Например, ДНК препоследовательности или секреторного лидера функционально связана с ДНК полипептида, если она экспрессируется в виде пребелка, принимающего участие в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он оказывает влияние на транскрипцию последовательности, или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он находится в положении, которое обеспечивает его стимулирующее влияние на трансляцию. Как правило, «функционально связанный» означает, что последовательности ДНК, будучи связанными, являются непрерывными, и в случае секреторного лидера, непрерывными и в рамке считывания. Однако для энхансеров не требуется, чтобы они были непрерывными. Связывание происходит посредством лигирования в соответствующих сайтах рестрикции. Если такие сайты отсутствуют, то синтетические олигонуклеотидные адапторы или линкеры используют в соответствии с обычной практикой.
В том смысле, в котором в данном документе используются выражения «клетка», «клеточная линия» и «клеточная культура», они используются взаимозаменяемо, и все такие определения включают потомство. Таким образом, «трансформанты» и «трансформированные клетки» включают первичные конкретные клетки и культуры, полученные из них, независимо от числа пассажей. Также, очевидно, понятно, что все потомство может не быть строго идентичным по содержанию ДНК за счет преднамеренных или случайных мутаций. В изобретение также включается мутантное потомство, которое обладает аналогичной функцией или биологической активностью по данным скрининга первоначально трансформированной клетки. Из контекста становится ясным, когда имеются в виду разные определения.
В том смысле, в котором в данном документе используется термин «кодон-группа», он относится к группе различных нуклеотидных триплетных последовательностей, используемых для кодирования желаемых вариантных аминокислот. Группу олигонуклеотидов можно синтезировать, например, твердофазным синтезом, включая последовательности, которые представляют все возможные комбинации нуклеотидных триплетов, обеспеченных кодон-группой, и которые кодируют желаемую группу аминокислот. Стандартной формой обозначения кодонов является код IUB, известный в данной области и описанный в данном документе. Как правило, кодон-группа выражается тремя заглавными буквами курсивом, например, NNK, NNS, XYZ, DVK и тому подобное. В том смысле, в котором в данном документе используется термин «неслучайная кодон-группа», он относится к кодон-группе, которая кодирует выбор аминокислот, которые отвечают частично, предпочтительно полностью, критериям выбора аминокислот. В данной области хорошо известен синтез олигонуклеотидов с выбранным нуклеотидным «вырождением» в определенных положениях, например, подход TRIM (Knappek et al., J. Mol. Biol., 296:57-86 (1999); Garrard&Henner, Gene, 128:103 (1993)). Такие группы олигонуклеотидов, содержащие некоторые кодон-группы, можно синтезировать с использованием промышленно доступных синтезаторов нуклеиновых кислот (например, производства, Applied Biosystems, Foster City, CA), или можно получить промышленно доступные продукты (например, производства Life Technologies, Rockville, MD). Следовательно, синтезированная группа олигонуклеотидов, содержащая определенную кодон-группу, как правило, будет включать множество олигонуклеотидов с различными последовательностями, с различиями, установленными кодон-группой в последовательности в целом. Олигонуклеотиды по изобретению имеют последовательности, позволяющие гибридизоваться с матрицей нуклеиновой кислоты вариабельных доменов, а также могут, но не обязательно, включать сайты рестрикции, пригодные, например, для клонирования.
Термин «линейные антитела» относится к антителам, описанным Zapata et al., Protein Eng., 8(10):1057-1062 (1995). Вкратце, данные антитела содержат пару тандемных Fd-сегментов (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифическими или моноспецифическими.
В том смысле, в котором в данном документе используется термин «библиотека», он относится к множеству последовательностей антител или фрагментов антител (например, вариантных IgG по изобретению) или нуклеиновых кислот, которые кодируют данные последовательности, где последовательности различаются по комбинации вариантных аминокислот, введенных в данные последовательности согласно способам по изобретению.
«Фаговый дисплей» представляет собой метод, с помощью которого полипептиды экспонированы в виде слитых белков, по меньшей мере, с фрагментом белка оболочки на поверхности фаговых частиц, например, нитчатого фага. Применимость фагового дисплея основана на том, что крупные библиотеки рандомизированных вариантов белков можно быстро и эффективно сортировать для отбора последовательностей, которые связываются с антигеном-мишенью с высокой аффинностью. Дисплей пептидных и белковых библиотек на фаге использовали для скрининга миллионов полипептидов для отбора продуктов, обладающих свойствами специфического связывания. Методы поливалентного фагового дисплея использовали для экспонирования небольших случайных пептидов и небольших белков через слияние с геном III или геном VIII нитчатого фага. Смотрите Wells and Lowman, Curr. Opin. Struct. Biol., 3:355-362 (1992) и цитированные там источники. В моновалентном фаговом дисплее библиотеку белков или пептидов сливают с геном III или его фрагментом и экспрессируют в низких концентрациях в присутствии белка гена III дикого типа таким образом, что фаговые частицы экспонируют одну копию слитых белков, или слитые белки отсутствуют. Эффекты авидности снижаются относительно поливалентного фага так, что сортинг базируется на внутренней аффинности лиганда, и используют фагмидные векторы, которые облегчают манипуляции с ДНК. Смотрите Lowman and Wells, Methods: A companion to Methods in Enzymology, 3:205-216 (1991).
«Фагмида» представляет собой плазмидный вектор, содержащий бактериальный ориджин репликации, например, Co1E1, и копию межгенной области бактериофага. Фагмиду можно использовать на многих известных бактериофагах, включая нитчатый бактериофаг и лямбдоидный бактериофаг. Плазмида обычно содержит селектируемый маркер резистентности к антибиотикам. Сегменты ДНК, клонированные в данные векторы, можно размножить в виде плазмид. Когда получают клетки, несущие данные векторы, со всеми генами, необходимыми для получения фаговых частиц, то способ репликации плазмиды меняется на репликацию типа «разматывающегося рулона» с получением копий одной цепи плазмидной ДНК и упаковки фаговых частиц. Фагмида может образовать инфекционные или неинфекционные фаговые частицы. Данный термин включает фагмиды, содержащие ген белка оболочки фага или его фрагмент, связанный с геном гетерологичного полипептида в виде генной слитой конструкции таким образом, что гетерологичный полипептид экспонируется на поверхности фаговых частиц.
Термин «фаговый вектор» означает двухцепочечную репликативную форму бактериофага, содержащую гетерологичный ген и способную к репликации. Фаговый вектор имеет фаговый ориджин репликации, обеспечивающий репликацию фага и образование фаговых частиц. Предпочтительно фаг представляет собой нитчатый бактериофаг, такой как фаг M13, fl, fd, Pf3, или его производное, или лямбдоидный фаг, такой как лямбда, 21, phi80, phi81, 82, 424, 434 и т.д., или его производное.
В том смысле, в котором в данном документе используется термин «доступное для растворителя положение», он относится к положению аминокислотного остатка в вариабельных доменах тяжелой и легкой цепей антитела-источника или антигенсвязывающего фрагмента, которое определяется на основе структуры, множества структур и/или модельной структуры антитела или антигенсвязывающего фрагмента, в качестве потенциально доступного для растворителя и/или контакта с молекулой, такой как антитело-специфический антиген. Как правило, данные положения находятся в CDR и на внешней стороне белка. Доступные для растворителя положения антитела или антигенсвязывающего фрагмента, имеющего определенные в данном документе значения, можно определить с использованием любого из ряда алгоритмов, известных в данной области. В одном варианте осуществления доступные для растворителя положения определяют с использованием координат в 3-мерной модели антитела, предпочтительно с использованием компьютерной программы, такой как программа InsightII (Accelrys, San Diego, CA). Доступные для растворителя положения также можно определить с использованием алгоритмов, известных в данной области (смотрите, например, Lee and Richards, J. Mol. Biol., 55:379 (1971) и Connolly, J. Appl. Cryst., 16:548 (1983)). Определение доступных для растворителя положений можно определить с использованием программного обеспечения, подходящего для моделирования белков, и получения информации по 3-мерной структуре, полученной из антитела. Для данных целей можно использовать программное обеспечение, включающее SYBYL Biopolymer Module software (Tripos Associates). Как правило, когда для алгоритма (программы) требуется параметр входной размер пользователя, то «размер» зонда, используемого при расчетах, устанавливают примерно на 1,4 ангстрем или ниже в радиусе. Кроме того, описано определение доступных для растворителя положений и методы определения площадей с использованием программного обеспечения для персональных компьютеров (Pacios, Comput. Chem., 18(4):377-386 (1994)).
«Идентичность аминокислотной последовательности в процентах (%)» по отношению к стандартной полипептидной последовательности определяется, как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в стандартной полипептидной последовательности после выравнивания последовательностей и введения гэпов, при необходимости, для достижения максимальной процентной идентичности последовательностей, и без учета каких-либо возможных консервативных замен в качестве части идентичности последовательностей. Выравнивание в целях определения процентной идентичности аминокислотной последовательности можно провести различными путями, известными в данной области, например, с использованием широко известных компьютерных программ, таких как BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для подвергающихся выравниванию последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по полной длине последовательностей, которые сравниваются. Однако для целей заявки значения идентичности аминокислотной последовательности в % получают с использованием компьютерной программы ALIGN-2. Компьютерная программа ALIGN-2 для сравнения последовательностей разработана Genentech, Inc. и подана с документацией для пользователей в Бюро регистрации авторских прав США, Washington D.C., 20559, где она была зарегистрирована под регистрационным номером авторского права США TXU510087. Программа ALIGN-2 общедоступна из Genentech, Inc., South San Francisko, California, или может быть получена из другого кода источника. Программа ALIGN-2 должна быть компилирована для применения с операционной системой UNIX, предпочтительно с цифровой системой UNIX V4.0D. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не изменяются.
В тех ситуациях, когда программу ALIGN-2 используют для сравнения аминокислотных последовательностей, то идентичность аминокислотной последовательности в % для данной аминокислотной последовательности А по сравнению с или по отношению к данной аминокислотной последовательности В (что альтернативно может быть выражено, как то, что данная последовательность А имеет или содержит определенную идентичность аминокислотной последовательности в % с или по отношению к аминокислотной последовательности В) рассчитывают следующим образом:
100 раз дробь X/Y,
где Х представляет собой число аминокислотных остатков, оцененных как идентичные совпадения при использовании программы ALIGN-2 при выравнивании последовательностей А и В данной программой, и где Y представляет собой общее число аминокислотных остатков в последовательности В. Очевидно, понятно, что длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, идентичность аминокислотной последовательности А в % по отношению к последовательности В не равна идентичности аминокислотной последовательности В в % по отношению к последовательности А. Если не указано иначе, то все значения идентичности аминокислотной последовательности в %, используемые в данном документе, получены, как описано в абзаце выше, с использованием компьютерной программы ALIGN-2.
В том смысле, в котором в данном документе используются термины «VEGF» или «VEGF-A», они относятся к человеческому фактору роста эндотелия сосудов, состоящему из 165 аминокислот и близким человеческим факторам роста эндотелия сосудов из 121, 189 и 206 аминокислот, описанных Leung et al., Science, 246:1306 (1989) и Houck et al., Mol. Endocrin., 5:1806 (1991), наряду с их природными аллельными и процессированными формами. Термин «VEGF» также относится к VEGF от видов, отличных от человека, таких как мышь, крыса или примат. В некоторых случаях в названии VEGF от конкретных видов имеются обозначения, такие как hVEGF для VEGF человека, mVEGF для VEGF мыши и тому подобное. Термин «VEGF» также относится к усеченным формам полипептида, содержащим 8-109 или 1-109 из 165 аминокислотного человеческого фактора роста эндотелия сосудов. При обращении к любым таким формам VEGF они могут быть указаны в настоящей заявке, например, как «VEGF(8-109)», «VEGF(1-109)», «VEGF-A109» или «VEGF165». Аминокислотные положения в «усеченном» нативном VEGF пронумерованы аналогично тому, как указано для нативной последовательности VEGF. Например, аминокислотное положение 17 (метионин) в усеченном нативном VEGF также является положением 17 (метионином) в нативном VEGF. Усеченный нативный VEGF может обладать аффинностью связывания для рецепторов KDR и Flt-1, сравнимой с нативным VEGF.
Термин «антагонист VEGF» относится к молекуле, способной нейтрализовать, блокировать, ингибировать, отменять, снижать или отрицательно воздействовать на активность VEGF, включая, не ограничиваясь этим, связывание с одним или несколькими рецепторами VEGF. Антагонисты VEGF включают, не ограничиваясь этим, анти-VEGF антитела и их антигенсвязывающие фрагменты, молекулы рецепторов и производные, которые специфически связываются с VEGF, тем самым ингибируя его связывание с одним или несколькими рецепторами, антитела к рецепторам VEGF, антагонисты рецепторов VEGF, такие как низкомолекулярные ингибиторы VEGFR-тирозинкиназ и иммуноадгезины, связывающиеся с VEGF, такие как VEGF Trap. В том смысле, в котором в данном документе используется термин «антагонист VEGF», он конкретно включает молекулы, в том числе антитела, фрагменты антител, другие связывающие полипептиды, пептиды и небольшие молекулы, не относящиеся к пептидам, которые связываются с VEGF и способны нейтрализовать, блокировать, ингибировать, отменять, снижать или отрицательно воздействовать на активность VEGF. Таким образом, термин «активность VEGF» специфически включает биологические активности VEGF, опосредованные VEGF.
Термины «биологическая активность» и «биологически активный» по отношению к полипептиду VEGF или «активность VEGF» относятся к физическим/химическим свойствам и биологическим функциям, ассоциированным с полноразмерным и/или усеченным VEGF. В некоторых вариантах осуществления активностью VEGF является индукция, и/или стимуляция, и/или усиление ангиогенеза. В некоторых вариантах осуществления активностью VEGF является индукция, и/или стимуляция, и/или усиление неоваскуляризации. В некоторых вариантах осуществления активностью VEGF является индукция и/или модуляция проницаемости сосудов. В некоторых вариантах осуществления активностью VEGF является индукция, и/или стимуляция, и/или усиление миграции эндотелиальных клеток, и/или пролиферации эндотелиальных клеток.
Нейтрализующие анти-VEGF антитела подавляют рост различных клеток опухолевых линий человека у бестимусных мышей (Kim et al., Nature, 362:841-844 (1993); Warren et al., J. Clin. Invest., 95:1789-1797 (1995); Borgstrom et al., Cancer Res., 56:4032-4039 (1996); Melnyk et al., Cancer Res., 56:921-924 (1996)); а также ингибируют внутриглазной ангиогенез на моделях ишемических повреждений сетчатки. Смотрите Adamis et al., Arch. Ophthalmol., 114:66-71 (1996).
Термины «анти-VEGF антитело» и «антитело, которое связывается с VEGF» относятся к антителу, способному связываться с VEGF с достаточной аффинностью и специфичностью, чтобы антитело было пригодным в качестве диагностического и/или лекарственного средства для целенаправленного воздействия на VEGF. Например, анти-VEGF антитело по изобретению можно использовать в качестве лекарственного средства в целенаправленном воздействии и вмешательстве в течение заболевания или состояния, в развитие которых вовлечена активность VEGF. Смотрите, например, патенты США №№ 6582959, 6703020; международные заявки WO 98/45332, WO 96/30046, WO 94/10202, WO 2005/044853; EP 0666868B1; публикации заявок на патенты США №№ 20030206899, 20030190317, 20030203409, 20050112126, 20050186208 и 20050112126; Popkov et al., Journal of Immunological Methods, 288:149-164 (2004) и международная заявка WO2005012359. Выбранное антитело обычно должно обладать достаточно высокой аффинностью связывания для VEGF. Например, антитело может связываться с hVEGF со значением Kd в пределах 100 нМ-1 пМ. Аффинность антитела можно определить, например, с использованием теста на основе поверхностного плазменного резонанса (такого как BIAcore, описанного в публикации заявки PCT № WO 2005/012359); твердофазного иммуноферментного метода (ELISA) и конкурентных тестов (например, RIA). Антитело можно исследовать с использованием других методов оценки биологической активности, например, для оценки его эффективности в качестве лекарственного средства. Такие методы анализа известны в данной области и зависят от антигена-мишени и предполагаемого применения антитела. Примеры включают анализ ингибирования HUVEC; тесты ингибирования роста опухолевых клеток (например, описанные в международной заявке WO 89/06692); анализ антителозависимой клеточноопосредованной цитотоксичности (ADCC) и комплемент-опосредованной цитотоксичности (CDC) (патент США № 5500362) и анализ агонистической активности и гематопоэза (смотрите международную заявку WO 95/27062). Как правило, анти-VEGF антитело не должно связываться с другими гомологами VEGF, такими как VEGF-В, VEGF-С, VEGF-D или VEGF-Е, а также с другими ростовыми факторами, такими как P1GF, PDGF или bFGF. В одном варианте осуществления анти-VEGF антитела включают моноклональное антитело, которое связывается с тем же эпитопом, что и моноклональное анти-VEGF антитело А4.6.1, продуцированное гибридомой АТСС НВ 10709; рекомбинантное гуманизированное моноклональное анти-VEGF антитело (смотрите Presta et al., Cancer Res., 57:4593-4599 (1997)), включая, не ограничиваясь этим, антитело, известное, как «бевацизумаб (BV)», также известное, как «rhuMAb VEGF» или «авастин®». В настоящее время авастин® является промышленно доступным. Бевацизумаб содержит мутантные каркасные области человеческого IgG1 и антигенсвязывающие гипервариабельные области из мышиного антитела А4.6.1, которое блокирует связывание человеческого VEGF с его рецепторами. Примерно 93% аминокислотной последовательности бевацизумаба, включая большую часть каркасных областей, происходит из человеческого IgG1, и примерно 7% последовательности получено из антитела А4.6.1. Бевацизумаб имеет молекулярную массу, составляющую примерно 149000 дальтон, и антитело является гликозилированным. Бевацизумаб и другие гуманизированные анти-VEGF антитела дополнительно описаны в патенте США № 6884879 от 26 февраля 2005 года. Дополнительные анти-VEGF антитела включают антитела серий G6 или B20 (например, G6-23, G6-31, B20-4.1), как описано в РСТ публикации международной заявки WO 2005/012359. Информацию по другим предпочтительным антителам смотрите в патентах США №№ 7060269, 6582959, 6703020, 6054297; международных заявках WO 98/45332, WO 96/30046, WO 94/10202; EP 0666868B1; публикациях заявок на патенты США №№ 2006009360, 20050186208, 20030206899, 20030190317, 20030203409 и 20050112126; и Popkov et al., Journal of Immunological Methods, 288:149-164 (2004).
В том смысле, в котором в данном документе используется термин «полипептид серии В20», он относится к полипептиду, включающему антитело, которое связывается с VEGF. Полипептиды серии В20 включают, не ограничиваясь этим, антитела, полученные из последовательности антитела В20 или В20-производного антитела, описанных в публикациях заявок на патенты США №№ 20060280747, 20070141065 и/или 20070020267, содержание данных публикаций заявок точно включено в данный документ для сведения. В одном варианте осуществления полипептид серии В20 представляет собой полипептид В20-4.1, описанный в публикациях заявки на патент США № 20060280747, 20070141065 и/или 20070020267. В другом варианте осуществления полипептид серии В20 представляет собой полипептид В20-4.1.1, описанный в публикации PCT международной заявки WO 2009/073160, полное раскрытие которой точно включено в данный документ для сведения.
В том смысле, в котором в данном документе используется термин «полипептид серии G6», он относится к полипептиду, включающему антитело, которое связывается с VEGF. Полипептиды серии G6 включают, не ограничиваясь этим, антитела, полученные из последовательности антитела G6 или G6-производного антитела, описанных в публикациях заявок на патенты США №№ 20060280747, 20070141065 и/или 20070020267, содержание данных публикаций заявок точно включено в данный документ для сведения. Полипептиды серии G6, описанные в публикациях заявок на патенты США №№ 20060280747, 20070141065 и/или 20070020267, включают, не ограничиваясь этим, G6-8; G6-23 и G6-31.
«Ангиогенный фактор или средство» представляет собой ростовой фактор, стимулирующий развитие кровеносных сосудов, например, стимулирует ангионегез, рост эндотелиальных клеток, стабильность кровеносных сосудов и/или васкулогенез и т.п. Например, ангиогенные факторы включают, не ограничиваясь этим, VEGF или члены семейства VEGF (VEGF-B, VEGF-C и VEGF-D), P1GF, семейство P1GF, семейство ростового фактора фибробластов (FGF), лиганды TIE (ангиопоэтины), эфрины, дельта-подобный лиганд 4 (DLL4), Del-1, ростовые факторы фибробластов: кислый (aFGF) и основный (bFGF), фоллистатин, колониестимулирующий фактор гранулоцитов (G-CSF), ростовой фактор гепатоцитов (HGF)/рассеивающий фактор (SF), интерлейкин-8 (IL-8), лептин, мидкин, нейропилины, плацентарный ростовой фактор, тромбоцитарный фактор роста эндотелиальных клеток (PD-ECGF), тромбоцитарный ростовой фактор, в частности, PDGF-BB или PDGFR-бета, плейотрофин (PTN), програнулин, пролиферин, трансформирующий ростовой фактор-альфа (TGF-альфа), трансформирующий ростовой фактор-бета (TGF-бета), фактор некроза опухолей альфа (TNF-альфа) и т.п. Они также включают факторы, которые ускоряют заживление ран, такие как гормон роста, инсулиноподобный ростовой фактор-I (IGF-I), VIGF, эпидермальный фактор роста (EGF), CTGF и члены его семейства и TGF-альфа и TGF-бета. Смотрите, например, Klagsbrun and D'Amore, Annu. Rev. Physiol, 53:217-39 (1991); Streit and Detmar, Oncogene, 22:3172-3179 (2003); Ferrara&Alitalo, Nature Medicine, 5(12):1359-1364 (1999); Tonini et al., Oncogene, 22:6549-6556 (2003) (например, таблица 1 со списком известных ангиогенных факторов), и Sato, Int. J. Clin. Oncol., 8:200-206 (2003).
«Антиангиогенное средство» или «ингибитор ангиогенеза» относится к соединению с небольшой молекулярной массой, полинуклеотиду (включая, например, ингибирующую РНК (РНКi или siPHK)), полипептиду, выделенному полипептиду, рекомбинантному белку, антителу или их конъюгатам или слитым белкам, которые ингибируют ангиогенез, васкулогенез или нежелательную проницаемость сосудов, прямо или опосредованно. Очевидно, понятно, что антиангиогенные средства включают средства, которые связываются и блокируют ангиогенную активность ангиогенного фактора или его рецептора. Например, антиангиогенное средство представляет собой антитело или другой антагонист ангиогенного средства, имеющего значения, определенные выше, например, антитела к VEGF-A или рецептору VEGF-A (например, рецептору KDR или рецептору Flt-1), ингибиторы анти-PDGFR, такие как гливек® (иматиниб мезилат), небольшие молекулы, которые блокируют сигнальные рецепторы VEFG (например, PTK787/ZK2284, SU6668, SUTENT®/SU11248 (сунитиниб малат), AMG706 или другие продукты, описанные, например, в международной заявке WO 2004/11304). Антиангиогенные средства также включают нативные ингибиторы ангиогенеза, например, ангиостатин, эндостатин и т.п. Смотрите, например, Klagsbrun and D'Amore, Annu. Rev. Physiol., 53:217-39; Streit and Detmar, Oncogene, 22:3172-3179 (2003) (например, таблица 3 со списком антиангиогенных средств, применяемых в лечении злокачественной меланомы); Ferrara&Alitalo, Nature Medicine, 5(12):1359-1364 (1999); Tonini et al., Oncogene, 22:6549-6556 (2003) (например, таблица 2 со списком известных антиангиогенных факторов), и Sato, Int. J. Clin. dOncol., 8:200-206 (2003) (например, таблица 1 со списком антиангиогенных средств, применяемых в клинических испытаниях).
«Нарушение» представляет собой любое состояние или заболевание, на которое будет оказывать положительное влияние лечение композицией или способом по изобретению. Они включают хронические и острые нарушения или заболевания, в том числе патологические состояния, предрасполагающие млекопитающего к развитию данного нарушения. Неограничивающие примеры нарушений, которые можно лечить с использованием антител и фрагментов антител по изобретению, включают различные заболевания и нарушения, приведенные в данном документе, в разделе «Определения».
Термины «клеточнопролиферативное нарушение» и «пролиферативное нарушение» относятся к нарушениям, которые ассоциированы с определенной степенью аномальной пролиферации клеток. В одном варианте осуществления пролиферативным нарушением является рак.
В том смысле, в котором в данном документе используется термин «опухоль», он относится к росту и пролиферации всех неопластических клеток, независимо от того, являются они злокачественными или доброкачественными, а также всех предзлокачественных и злокачественных клеток и тканей. Термины «злокачественная опухоль», «злокачественный», «клеточнопролиферативное нарушение», «пролиферативное нарушение» и «опухоль» не являются взаимоисключающими при упоминании в данном документе.
Опухоль может быть солидной опухолью, или несолидной опухолью, или опухолью мягких тканей. Примеры опухолей мягких тканей включают лейкоз (например, хронический миелогенный лейкоз, острый миелогенный лейкоз, острый лимфобластный лейкоз взрослых, острый миелогенный лейкоз, зрелый В-клеточный лимфобластный лейкоз, хронический лимфоцитарный лейкоз, полимфоцитарный лейкоз или лейкоз ворсистых клеток) или лимфому (например, неходжкинскую лимфому, кожную Т-клеточную лимфому или болезнь Ходжкина). Солидная опухоль включает любую злокачественную опухоль тканей организма, иных чем кровь, костный мозг или лимфатическая система. Солидные опухоли можно дополнительно подразделить на опухоли эпителиального происхождения и неэпителиального происхождения. Примеры солидных опухолей включают рак ободочной кишки, молочной железы, предстательной железы, легких, почек, печени, поджелудочной железы, яичников, головы и шеи, ротовой полости, желудка, двенадцатиперстной кишки, тонкого кишечника, толстого кишечника, органов желудочно-кишечного тракта, ануса, желчного пузыря, губы, носоглотки, кожи, матки, полового члена, мочевыводящих путей, мочевого пузыря и кожи. Солидные опухоли неэпителиального происхождения включают саркомы, опухоли мозга и опухоли костей.
Термины «злокачественная опухоль» и «злокачественный» относятся к или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Примеры злокачественной опухоли включают, не ограничиваясь этим, карциному, лимфому, бластому, саркому и лейкозы и лимфоидные злокачественные заболевания. Более конкретные примеры таких злокачественных опухолей включают, не ограничиваясь этим, плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких, в том числе мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и плоскоклеточный рак легких, рак брюшины, гепатоцеллюлярный рак, рак желудка, включая рак органов желудочно-кишечного тракта и стромальные опухоли органов желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, рак органов мочевыводящих путей, гепатому, рак молочной железы, рак ободочной кишки, рак прямой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почек и органов мочевыводящих путей, рак вульвы, рак щитовидной железы, карциному печени, карциному заднего прохода, карциному пениса, меланому, поверхностно распространяющуюся меланому, меланому лентиго малигна, акролентигиозную меланому, узелковые меланомы, множественную миелому и В-клеточную меланому (включая фолликулярную неходжкинскую лимфому низкой степени злокачественности (NHL); малую лимфоцитарную (SL) NHL; фолликулярную NHL средней степени злокачественности; диффузную NHL средней степени злокачественности; иммунобластную NHL высокой степени злокачественности; лимфобластную NHL высокой степени злокачественности; мелкоклеточную NHL с нерасщепленными ядрами высокой степени злокачественности; NHL с массивной опухолевой массой; лимфому из клеток мантийной зоны; связанную со СПИДом лимфому и макроглобулинемию Вальденстрома); хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); лейкоз ворсистых клеток; хронический миелобластный лейкоз и посттрансплантационное лимфопролиферативное заболевание (PTLD), а также аномальную сосудистую пролиферацию, связанную с факоматозами, отеком (ассоциированным с опухолями мозга); синдром Мейгса, злокачественные опухоли головы и шеи, и связанные метастазы. В некоторых вариантах осуществления злокачественные опухоли, поддающиеся лечению вариантными IgG по изобретению, включают рак молочной железы, колоректальный рак, рак прямой кишки, немелкоклеточный рак легких, глиобластому, неходжкинскую лимфому (NHL), рак органов мочевыводящих путей, рак предстательной железы, рак печени, рак поджелудочной железы, саркому мягких тканей, саркому Капоши, карциноидную карциному, злокачественные опухоли головы и шеи, рак яичников, мезотелиому и множественную миелому. В некоторых вариантах осуществления злокачественная опухоль выбрана из группы, состоящей из мелкоклеточного рака легких, глиобластомы, нейробластомы, меланомы, рака молочной железы, рака желудка, колоректального рака (CRC) и гепатоцеллюлярной карциномы. Кроме того, в некоторых вариантах осуществления злокачественная опухоль выбрана из группы, состоящей из немелкоклеточного рака легких, колоректального рака, глиобластомы и рака молочной железы, включая метастатические формы данных злокачественных опухолей.
Термин «злокачественная опухоль» включает группу пролиферативных нарушений, в том числе, не ограничиваясь этим, предзлокачественные образования, доброкачественные опухоли, злокачественные опухоли и «дремлющие» опухоли. Доброкачественные опухоли остаются в месте первичного появления и не обладают способностью к инфильтрации, инвазированию или метастазированию в отдаленные области. Злокачественные опухоли будут инвазировать и повреждать другие ткани вокруг них. Они также могут обладать способностью распространяться из места их появления и проникать в другие части организма (метастазировать), обычно по кровяному руслу или через лимфатическую систему, где располагаются лимфатические узлы. «Дремлющие» опухоли являются бессимптомными опухолями, в которых имеются опухолевые клетки, но прогрессирование опухоли клинически не детектируется. Первичные опухоли классифицируются по типу ткани, из которой они происходят; метастатические опухоли классифицируются по типу ткани, из которой происходят злокачественные клетки. Со временем клетки злокачественной опухоли становятся все более аномальными и менее похожими на нормальные клетки. Данное изменение во внешнем виде злокачественных клеток называют злокачественностью опухоли, и злокачественные клетки описывают как высокодифференцированные, среднедифференцированные, низкодифференцированные или недифференцированные клетки. Высокодифференцированные клетки имеют практически нормальный вид и напоминают здоровые клетки, из которых они происходят. Недифференцированные клетки представляют собой клетки, которые становятся настолько аномальными, что невозможно определить их происхождение.
Эпителиальные злокачественные опухоли, обычно развивающиеся из доброкачественной опухоли до преинвазивной стадии (например, карциномы in situ) до злокачественной карциномы, которая проникает через базальную мембрану и инвазирует в субэпителиальную строму.
Под «дисплазией» понимается аномальный рост или развитие ткани, органа или клеток. В некоторых вариантах осуществления дисплазия имеет высокую стадию или является предзлокачественной.
Под «метастазированием» понимается распространение злокачественной опухоли из места ее первичного появления в другие области в организме. Злокачественные клетки могут распространиться от первичной опухоли, проникнуть в лимфатические и кровеносные сосуды, циркулировать в кровяном русле и начать рост в отдаленном месте (метастазировать) с проникновением в нормальные ткани в организме. Метастазирование может быть локальным или отдаленным. Метастазирование представляет собой последовательный процесс, в котором определенное количество опухолевых клеток выходит из первичной опухоли, проходит через кровяное русло и останавливается в отдаленном месте. В новом месте клетки обеспечивают себе снабжение кровью и могут расти с образованием угрожающей жизни массы. Оба стимулирующий и ингибирующий молекулярные пути в опухолевых клетках регулируют их поведение, кроме того, большое значение имеют взаимодействия между опухолевыми клетками и клетками хозяина в отдаленном месте.
Под «микрометастазами» понимается небольшое число клеток, которые распространяются из первичной опухоли в другие части организма. Микрометастазы могут детектироваться или могут не детектироваться в скрининге или при диагностическом обследовании.
Под термином «неметастатическая» понимается опухоль, которая является доброкачественной или которая остается в месте первичного появления и не проникает в систему лимфатических или кровеносных сосудов или другие ткани, чем место первичного появления. Как правило, неметастатическая опухоль представляет собой опухоль на стадии 0, I или II, в некоторых случаях на стадии III развития злокачественной опухоли.
При использовании терминов «опухоль» или «злокачественная опухоль», как на «стадии 0», «стадии I», «стадии II», «стадии III» или «стадии IV» указывается классификация опухоли или злокачественной опухоли по системам Overall Stage Grouping или Roman Numeral Staging, известным в данной области. Несмотря на то, что фактическая стадия злокачественной опухоли зависит от типа злокачественной опухоли, в общем 0 стадия злокачественной опухоли представляет поражение in situ, стадия I представляет небольшую локализованную опухоль, стадии II и III представляют местно развившуюся опухоль, при которой наблюдается вовлечение местных лимфатических узлов, и IV стадия злокачественной опухоли представляет метастатическую злокачественную опухоль. Клиницистам в данной области известны конкретные стадии опухоли каждого типа.
Под «первичной опухолью» или «первичной злокачественной опухолью» понимается исходная злокачественная опухоль, а не метастатический очаг поражения, находящийся в другой ткани, органе или месте в организме субъекта.
Под «доброкачественной опухолью» понимается опухоль, которая остается локализованной в месте появления и не обладает способностью к инфильтрации, инвазированию или метастазированию в отдаленное место.
В том смысле, в котором в данном документе используется выражение «рецидив злокачественной опухоли», оно относится к возвратному развитию злокачественной опухоли после лечения, и включает возвратное развитие злокачественной опухоли в первичном органе, а также отдаленное рецидивирование, при котором злокачественная опухоль вновь выходит за пределы первичного органа.
Под термином «дремлющая опухоль» понимается длительное бессимптомное состояние, при котором опухолевые клетки присутствуют, но прогрессирование опухоли не является клинически детектируемым. Дремлющая опухоль может обнаруживаться или нет в скрининге при диагностическом обследовании.
Под термином «опухолевая нагрузка» понимается количество клеток злокачественной опухоли, размер опухоли или число карцином в организме.
Под «количеством опухолей» понимается число опухолей.
Неопластические заболевания, которые поддаются лечению антителами или фрагментами антител по изобретению, включают, не ограничиваясь этим, например, нежелательную или аномальную гипертрофию, доброкачественную гипертрофию предстательной железы, артрит, ревматоидный артрит (RA), псориатический артрит, нейродегенеративные заболевания (например, болезнь Альцгеймера, связанная со СПИДом деменция, болезнь Паркинсона, амиотрофический латеральный склероз, пигментозный ретинит, спинальную мышечную атрофию и церебеллярную дегенерацию), аутоиммунное заболевание, псориаз, псориазные бляшки, саркоидоз, атеросклероз, атеросклеротические бляшки, тиреоидит Хашимото, ангиогенные нарушения, заболевание глаз, такое как синдром предполагаемого глазного гистоплазмоза, васкуляризацию сетчатки, диабетические и другие пролиферативные ретинопатии, включая ретинопатию в пожилом возрасте, диабетическую нефропатию, ретролентальную фиброплазию, неоваскулярную глаукому, возрастную дегенерацию желтого пятна, диабетический макулярный отек, неоваскуляризацию роговицы, неоваскуляризацию трансплантата роговицы, отторжение трансплантата роговицы, неоваскуляризацию сетчатки/сосудистой оболочки глаза, неоваскуляризацию радужки и угла передней камеры (рубеоз), неоваскулярное заболевание глаза, сосудистое заболевание, состояния, включающие аномальную пролиферацию сосудистых эпителиальных клеток, сосудистый рестеноз, синдром Гуллиана-Барре, полипы, такие как полипы ободочной кишки, семейный аденоматозный полипоз, полипы в носовой полости и полипы в желудочно-кишечном тракте, язвы желудочно-кишечного тракта, детский гипертрофический стеноз привратника, обструктивный синдром мочевой системы, болезнь Менетрие, секретирующие аденомы или синдром потери белка, фиброаденому, респираторное заболевание, холецистит, нейрофиброматоз, артериовенозные аномалии (AVM), менингиому, гемангиому, ангиофиброму, гиперплазию щитовидной железы (включая болезнь Граве), трансплантацию роговицы и других тканей, воспалительные заболевания, хроническое воспаление, воспаление легких, острое повреждение легких/ARDS, сепсис, хроническое окклюзивное заболевание легких, первичную пульмонарную гипертензию, злокачественные легочные выпоты, отек после ожогов, травму, облучение, инсульт, гипоксию или ишемию, отек после инфаркта миокарда, ишемическое повреждение, повреждение после церебрального ишемического события, отек мозга (например, связанный с острым инсультом/закрытой травмой головы/травмой), тромбоз, вызванный агрегацией тромбоцитов, фиброзные заболевания или заболевания с отеками, такие как цирроз печени, фиброз легких, саркоидоз, троидит, системный синдром гипервязкости, синовиальное воспаление, образование паннуса в RA, оссифицирующий миозит, гипертрофическое образование костей, патологии, ассоциированные с костями, такие как остеоартрит, рахит и остеопороз, рефракторный асцит, воспаление костей и суставов, миелодиспластический синдром, апластическую анемию, почки или печени; опосредованную Т-клетками гиперчувствительность, болезнь Педжета, поликистоз почек, болезни, связанные с потерей жидкости, в 3-е пространство (панкреатит, синдром длительного сдавления, ожоги, заболевание кишечника), хроническое воспаление, такое как IBD (болезнь Крона и язвенный колит), нарушения мочевыводящей системы, отторжение аллотрансплантата почек, синдром трансплантат против хозяина или отторжение трансплантата, воспалительное заболевание кишечника, острые и хронические нефропатии (включая пролиферативный гломерулонефрит и индуцированное диабетом заболевание почек), нефротический синдром, нежелательное или аномальное увеличение массы тела (незлокачественное), ожирение, увеличение массы жировой ткани, гемофилические артропатии, гипертрофические рубцы, замедление роста волос, синдром Ослера-Вебер-Ренду, пиогенную гранулему, ретролентальную фиброплазию, склеродерму, трахому, спайки сосудов, синовит, реакцию гиперчувствительности кожи, кожные заболевания, включая псориаз и дерматит, экзему, фотостарение (например, вызванное УФ-облучением кожи человека), образование гипертрофических рубцов, заболевания органов репродуктивной системы, такие как эндометриоз, синдром гиперстимуляции яичников, поликистоз яичников, преэклампсию, маточные кровотечения при дисфункции или менометрорагию, фиброзные опухоли матки, преждевременные роды, асцит, перикардиальный выпот (ассоциированный с перикардитом), плевральный выпот, эндотоксический шок и грибковую инфекцию, некоторые микробные инфекции, включая вызванные микробными патогенами, выбранными из аденовируса, гантавирусов, Borrelia burgdorferi, Yersinia spp., Bordetella pertussis, и психические расстройства (например, шизофрению, биполярную депрессию, аутизм и расстройство дефицита внимания).
«Респираторное заболевание» относится к заболеваниям дыхательной системы и включает хронический бронхит, астму, в том числе острую астму и аллергическую астму, цистический фиброз легких, бронхоэктаз, аллергический или другой ринит или синусит, дефицит α1-антитрипсина, кашли, эмфизему легких, фиброз легких или гиперактивные дыхательные пути, хроническая обструктивная болезнь легких и хроническое обструктивное нарушение легких.
«Аутоиммунное заболевание» в данной заявке представляет собой незлокачественное заболевание или нарушение, возникающее и направленное против собственных тканей субъекта. Примеры аутоиммунных заболеваний или нарушений включают, не ограничиваясь этим, воспалительные ответные реакции, такие как кожные воспалительные заболевания, в том числе псориаз и дерматит (например, атопический дерматит и контактный дерматит), системную склеродерму и склероз, ответные реакции, ассоциированные с воспалительным заболеванием кишечника (болезнь Крона и язвенный колит), респираторный дистресс-синдром (включая респираторный дистресс синдром взрослых; ARDS), дерматит, менингит, энцефалит, увеит, колит, гломерулонефрит, аллергические заболевания, такие как экзема и астма, и другие состояния, включающие инфильтрацию Т-клеток и хронические воспалительные реакции, атеросклероз, дефицит адгезии лейкоцитов, ревматоидный артрит, системную красную волчанку (SLE), сахарный диабет (например, сахарный диабет типа I или инсулин-зависимый сахарный диабет), рассеянный склероз, синдром Рейно, аутоиммунный тиреоидит, аллергический энцефаломиелит, синдром Шегрена, диабет, начинающийся в юношеском возрасте, и иммунные реакции, ассоциированные с немедленной и замедленной гиперчувствительностью, опосредованной цитокинами и Т-лимфоцитами, как правило имеющие место при туберкулезе, саркоидоз, полимиозит, грануломатоз и васкулит, пернициозную анемию (болезнь Аддисона), заболевания, включающие диапедез лейкоцитов, воспалительное заболевание центральной нервной системы (ЦНС), синдром множественного повреждения органов, гемолитическую анемию (включая, не ограничиваясь этим, криоглобинемию или анемию с положительной пробой Кумбса), тяжелую псевдопаралитическую миастению, заболевания, опосредованные комплексом антиген-антитело, болезнь антигломерулярных антител к базальной мембране, антифосфолипидный синдром, аллергический неврит, болезнь Граве, миастенический синдром Ламберта-Итона, буллезный пемфигоид, пемфигус, аутоиммунные полиэндокринопатии, болезнь Рейтера, синдром «ригидного человека», заболевание Бехчета, гигантоклеточный артериит, нефрит, связанный с отложением иммунных комплексов, IgA-нефропатия, IgM-полинейропатии, иммунную тромбоцитопеническую пурпуру (ITP) и аутоиммунную тромбоцитопению и т.п.
Термин «сосудистое заболевание или нарушение» в данной заявке относится к различным заболеваниям или нарушениям, которые воздействуют на сосудистую систему, включая сердечно-сосудистую систему. Примеры таких заболеваний включают атеросклероз, реобструкцию сосудов, атеросклероз, постоперационный стеноз сосудов, рестеноз, васкулярную окклюзию и обструктивное заболевание сонной артерии, заболевание коронарных сосудов, стенокардию, поражение мелких сосудов, гиперхолестеролемию, гипертензию и состояния, включающие аномальную пролиферацию или функцию сосудистых эпителиальных клеток.
В том смысле, в котором в данном документе используется, термин «лечение» (и его вариации, такие как «лечить» или «проводить лечение») относится к клиническому вмешательству с попыткой изменить естественное течение болезни у индивидуума или в клетке, подвергающихся лечению, и его можно проводить в профилактических целях или уже во время протекания клинической патологии. Желательные эффекты лечения включают предупреждение появления или рецидива заболевания, ослабление симптомов, снижение любых прямых или опосредованных патологических последствий заболевания, предупреждение метастазирования, уменьшение скорости прогрессирования заболевания, ослабление или смягчение течения заболевания и ремиссию или улучшенный прогноз исхода заболевания. В некоторых вариантах осуществления вариантные IgG по изобретению используют для подавления развития заболевания или нарушения или замедления прогрессирования заболевания или нарушения.
«Индивидуум», «субъект» или «пациент» является позвоночным. В некоторых вариантах осуществления позвоночное является млекопитающим. Млекопитающее включает, не ограничиваясь этим, сельскохозяйственных животных (таких как коровы), спортивных животных, домашних животных (таких как кошки, собаки или лошади), приматов, мышей и крыс. В некоторых вариантах осуществления млекопитающее является человеком.
Термины «фармацевтический состав» или «фармацевтическая композиция» относятся к средству, которое находится в такой форме, которая обеспечивает проявление высокой биологической активности активного ингредиента и которая не содержит дополнительных компонентов, которые были бы неприемлемо токсичными для субъекта, которому вводится композиция. Такие композиции могут быть стерильными. Также смотрите раздел под заголовком «Дозировки, составы и продолжительность лечения».
«Стерильная» композиция является асептической и не содержит никаких живых микроорганизмов или их спор.
Термины «эффективное количество» или «терапевтически эффективное количество» относятся к количеству лекарственного средства, эффективному для лечения заболевания или нарушения у субъекта. В некоторых вариантах осуществления эффективное количество относится к количеству, эффективному при дозировках и в течение периодов времени, необходимых для достижения желаемого терапевтического или профилактического результата. Терапевтически эффективное количество соединения/молекулы по изобретению может варьировать в зависимости от таких факторов, как течение заболевания, возраст, пол и масса индивидуума, и способности соединения/молекулы вызывать желаемую ответную реакцию у индивидуума. Терапевтически эффективное количество включает количество, при котором любые токсические или отрицательные эффекты соединения/молекулы перевешиваются терапевтически полезными эффектами. В случае рака эффективное количество лекарственного средства может привести к снижению количества злокачественных клеток, уменьшить размер опухоли и ингибировать (т.е. в определенной степени замедлить и обычно остановить) инфильтрацию злокачественных клеток в периферические органы, ингибировать (т.е. в определенной степени замедлить и обычно остановить) метастазирование опухоли, в определенной степени подавить рост опухоли, обеспечить возможность лечения опухоли и/или в определенной степени ослабить один или несколько симптомов, ассоциированных с нарушением. В зависимости от степени, в которой лекарственное средство может предупредить рост и/или вызвать гибель злокачественных клеток, он может быть цитостатическим и/или цитотоксическим.
Термин «профилактически эффективное количество» относится к количеству, эффективному при дозировках и в течение периодов времени, необходимых для достижения желаемого профилактического результата. Как правило, но необязательно, поскольку профилактическую дозу используют у субъектов до заболевания или на ранней стадии заболевания, то профилактически эффективное количество будет ниже терапевтически эффективного количества.
В случае предзлокачественной, доброкачественной опухоли, опухоли на ранней или поздней стадиях терапевтически эффективное количество ингибитора ангиогенеза может снизить количество злокачественных клеток, снизить размер первичной опухоли, ингибировать (т.е. в определенной степени замедлить и предпочтительно остановить) инфильтрацию злокачественных клеток в периферические органы, ингибировать (т.е. в определенной степени замедлить и предпочтительно остановить) метастазирование опухоли, ингибировать или в определенной степени замедлить рост опухоли или прогрессирование опухоли и/или в определенной степени ослабить один или несколько симптомов, ассоциированных с нарушением. В зависимости от степени, в которой лекарственное средство может предупредить рост и/или вызвать гибель злокачественных клеток, он может быть цитостатическим и/или цитотоксическим
Термин «эффективность» используется в данном документе в самом широком смысле и относится к способности иммуноглобулина, антитела или слитого Fc-белка обеспечивать желаемый эффект. В некоторых вариантах осуществления эффективность относится к максимальному наблюдаемому эффекту иммуноглобулина, антитела или слитого Fc-белка в насыщающих концентрациях. В некоторых вариантах осуществления эффективность относится к EC50 иммуноглобулина, антитела или слитого Fc-белка. В некоторых вариантах осуществления эффективность относится к силе иммуноглобулина, антитела или слитого Fc-белка. В некоторых вариантах осуществления эффективность относится к способности иммуноглобулина, антитела или слитого Fc-белка обеспечивать положительные эффекты на течение или продолжительность заболевания, включая клинические эффекты, определенных в данном документе.
Термин «EC50» относится к концентрации иммуноглобулина, антитела или слитого Fc-белка, которая индуцирует половинный ответ между базовой линией и максимумом. В некоторых вариантах осуществления EC50 представляет собой концентрацию иммуноглобулина, антитела или слитого Fc-белка, при которой обеспечивается 50% максимальный эффект. В некоторых вариантах осуществления EC50 представляет собой концентрацию в плазме или сыворотке крови, при которой обеспечивается 50% максимальный эффект в условиях in vivo.
Эффективность в лечении злокачественной опухоли можно продемонстрировать по детектированию способности антитела, слитого белка, конъюгированной молекулы или композиции по изобретению ингибировать или подавить рост или метастазирование злокачественных клеток или ослабить один или несколько симптомов, ассоциированных со злокачественной опухолью. Лечение считается терапевтическим, если имеет место, например, снижение роста и метастазирования злокачественных клеток, ослабление одного или нескольких симптомов, ассоциированных со злокачественной опухолью, или снижение заболеваемости и/или смертности после введения антитела, слитого белка, конъюгированной молекулы или композиции по изобретению. Антитела, слитые белки или композиции по изобретению можно тестировать на их способность снижать развитие опухолей в условиях in vitro, ex vivo и in vivo. В отношении лечения рака эффективность в условиях in vivo также можно оценить по выживаемости, периоду времени до начала прогрессирования заболевания (TTP), скорости ответа (RR), продолжительности ответа и/или качеству жизни. Также смотрите раздел под заголовком «Эффективность лечения».
Эффективность лечения воспалительных нарушений можно продемонстрировать по детектированию способности антитела, слитого белка, конъюгированной молекулы или композиции по изобретению ингибировать или подавлять воспаление у животного или ослаблять один или несколько симптомов, ассоциированных с воспалительным нарушением. Лечение считается терапевтическим, если имеет место, например, снижение воспаления или ослабление одного или нескольких симптомов после введения антитела, слитого белка, конъюгированной молекулы или композиции по изобретению.
Эффективность лечения или профилактики вирусных инфекций можно продемонстрировать по детектированию способности антитела, слитого белка, конъюгированной молекулы или композиции по изобретению ингибировать репликацию вируса, подавлять трансмиссию или предупреждать развитие вируса в организме хозяина, или предупреждать, ослаблять или смягчать один или несколько симптомов, ассоциированных с вирусной инфекцией. Лечение считается терапевтическим, если имеет место, например, снижение вирусной нагрузки, ослабление одного или нескольких симптомов или снижение заболеваемости и/или смертности после введения антитела, слитого белка, конъюгированной молекулы или композиции по изобретению. Антитела, слитые белки, конъюгированные молекулы или композиции по изобретению также можно оценить на их способность ингибировать репликацию вируса или снижать вирусную нагрузку с использованием тестов в условиях in vitro и in vivo.
Эффективность лечения или профилактики бактериальных инфекций можно продемонстрировать по детектированию способности антитела, слитого белка или композиции по изобретению ингибировать репликацию бактерий или ослаблять один или несколько симптомов, ассоциированных с бактериальной инфекций. Лечение считается терапевтическим, если имеет место, например, снижение числа бактерий, ослабление одного или нескольких симптомов или снижение заболеваемости и/или смертности после введения антитела, слитого белка или композиции по изобретению.
Положительный клинический эффект можно оценить по определению различных конечных точек, например, по ингибированию в определенной степени прогрессирования заболевания, включая замедление или полную остановку, снижению числа эпизодов и/или симптомов заболевания; уменьшению размера очага поражения; ингибированию (т.е. снижению, замедлению или полной остановке) инфильтрации клеток в смежные периферические органы и/или ткани; ингибированию (т.е. снижению, замедлению или полной остановке) распространения заболевания; снижению аутоиммунного ответа, что может, но необязательно, приводить к регрессии или элиминации очага поражения, возникшего в результате заболевания; ослаблению в определенной степени одного или нескольких симптомов, ассоциированных с нарушением; увеличению продолжительности периодов времени без проявления заболевания после лечения, например, выживаемости без прогрессирования заболевания; повышению выживаемости в целом; более высокой скорости ответа и/или снижению смертности в данный момент времени после лечения.
«Снижать или ингибировать» означает снижение или уменьшение активности, функции и/или количества по сравнению со стандартом. В некоторых вариантах осуществления «снижать или ингибировать» означает способность вызывать снижение в целом на 20% или более. В еще одних вариантах осуществления «снижать или ингибировать» означает способность вызывать снижение в целом на 50% или более. В еще одних вариантах осуществления «снижать или ингибировать» означает способность вызывать снижение в целом на 75%, 85%, 90%, 95% или более. Термины «снижать или ингибировать» могут относиться к симптомам нарушения, которое подвергаются лечению, наличию или размеру метастазов, размеру первичной опухоли или размеру или числу кровеносных сосудов при ангиогенных нарушениях.
«Операбельная» злокачественная опухоль означает злокачественную опухоль, которая ограничивается первичным органом и является подходящей для хирургической операции.
Термин «выживаемость» относится к пациенту, который остается живым, и включает выживаемость без проявления заболевания (DFS), выживаемость без прогрессирования (PFS) и выживаемость в целом (OS). Выживаемость можно установить с использованием метода Каплана-Мейера, и любые различия в выживаемости анализируют компьютерной программой с использованием стратифицированного теста логарифмических рангов.
«Выживаемость без проявления заболевания (DFS)» относится к пациенту, который остается живым, без рецидива рака, в течение определенного периода времени, например, примерно 1 года, примерно 2 лет, примерно 3 лет, примерно 4 лет, примерно 5 лет, примерно 10 лет и т.д., с момента начала лечения или после постановки первоначального диагноза. В одном аспекте изобретения DFS определяют по принципу назначенного лечения, т.е. состояние пациентов оценивают на основе назначенной им терапии. События, используемые при анализе DFS, могут включать местный, региональный или отдаленный рецидив злокачественного заболевания, появление вторичной злокачественной опухоли и летальный исход в результате любой причины у пациентов без предшествующего события (например, рецидива рака молочной железы или появления второй первичной опухоли).
«Выживаемость в целом (OS)» относится к пациенту, который остается живым в течение определенного периода времени, например, примерно 1 года, примерно 2 лет, примерно 3 лет, примерно 4 лет, примерно 5 лет, примерно 10 лет и т.д., с момента начала лечения или после постановки первоначального диагноза.
Под термином «повышение выживаемости» понимается увеличение DFS и/или OS у подвергшихся лечению пациентов по сравнению с пациентами без лечения, или по сравнению контрольным протоколом лечения, например, с использованием только химиотерапевтических средств. Мониторинг за выживаемостью пациентов проводят, по меньшей мере, в течение примерно шести месяцев или, по меньшей мере, примерно 1 года, или, по меньшей мере, примерно 2 лет, или, по меньшей мере, примерно 3 лет, или, по меньшей мере, примерно 4 лет, или, по меньшей мере, примерно 5 лет, или, по меньшей мере, примерно 10 лет и т.д., с момента начала лечения или после постановки первоначального диагноза.
В том смысле, в котором в данном документе используется термин «одновременно», он относится к введению двух или более лекарственных средств, когда, по меньшей мере, часть введения перекрывается во времени. Следовательно, одновременное введение включает схему дозирования, когда введение одного или нескольких лекарственного средства(в) продолжается после прекращения введения одного или нескольких других лекарственных средств.
Под термином «монотерапия» понимается терапевтическая схема, которая включает применение только одного лекарственного средства для лечения рака или опухоли во время курса терапии. В некоторых вариантах осуществления монотерапия с использованием вариантного IgG означает, что вариантный IgG вводят при отсутствии дополнительной противоопухолевой терапии во время курса лечения.
Под термином «поддерживающая терапия» понимается терапевтическая схема, которая дается для снижения вероятности рецидива или прогрессирования заболевания. Поддерживающую терапию можно проводить в течение любого периода времени, в том числе длительных периодов вплоть до периодов продолжительностью всей жизни субъекта. Поддерживающую терапию можно проводить после первоначальной терапии или в комбинации с первоначальной или дополнительной терапией. Дозировки для поддерживающей терапии могут варьировать и могут включать меньшие дозы по сравнению с дозами, используемыми для других типов терапии.
В том смысле, в котором в данном документе используются термины «неоадъювантная терапия» или «предоперационная терапия», они относятся к терапии перед хирургической операцией. Целью неоадъювантной терапии является обеспечение немедленного системного лечения, потенциально элиминирующего микрометастазы, которые иначе будут пролиферировать в случае применения стандартной последовательности лечения, т.е. хирургическая операция с последующей системной терапией. Неоадъювантная терапия также может помочь уменьшить размер опухоли, и тем самым способствовать полному удалению опухолей, первоначально считающихся неоперабельными, или сохранению части органа и его функций. Кроме того, неоадъювантная терапия позволяет оценить в условиях in vivo эффективность лекарственного средства, что может служить руководством для выбора последующего лечения.
В том смысле, в котором в данном документе используется термин «адъювантная терапия», он относится к терапии после хирургической операции, когда отсутствуют признаки остаточного заболевания, проводимой для снижения риска рецидива заболевания. Целью адъювантной терапии является предупреждение рецидива рака и, следовательно, снижение вероятности летального исхода в результате рака.
В том смысле, в котором в данном документе используется термин «стандарт ведения» химиотерапии, он относится к химиотерапевтическим средствам, обычно применяемым для лечения конкретной злокачественной опухоли.
Термин «радикальная хирургическая операция» используется в том смысле, в котором этот термин применяется в медицинском обществе. Радикальная хирургическая операция включает, например, процедуры, хирургические или другие, приводящие к удалению или резекции опухоли, в том числе мероприятия, приводящие к удалению или резекции всей отчетливо видимой опухоли. Радикальная хирургическая операция включает, например, полную или лечебную резекцию, или полную радикальную резекцию опухоли. Радикальная хирургическая операция включает процедуры, имеющие место на одной или нескольких стадиях, и включают, например, многостадийные хирургические процедуры, когда перед резекцией опухоли проводят одну или несколько хирургических и других процедур. Радикальная хирургическая операция включает вмешательства для удаления или резекции опухоли, в том числе затронутых органов, частей органов и тканей, а также окружающих органов, таких как лимфатические узлы, части органов или тканей.
Введение «в комбинации с» одним или несколькими дополнительными лекарственными средствами включает одновременное (совместное) или последовательное введение в любом порядке.
«Длительное» введение относится к введению средства(в) по длительной схеме в противоположность кратковременной схеме, в целях поддержания первоначально достигнутого терапевтического эффекта (активности) в течение продолжительного периода времени. «Периодическое» введение представляет собой лечение, которое проводят не последовательно без прерывания, а скорее по курсовой схеме.
В том смысле, в котором в данном документе используется термин «носители», он включает фармацевтически приемлемые носители, наполнители или стабилизаторы, которые являются нетоксичными для клетки или млекопитающего, подвергающихся воздействию в используемых дозах и концентрациях. Часто физиологически приемлемым носителем является водный раствор с забуференным рН. Примеры физиологически приемлемых носителей включают буферы, такие как фосфатный буфер, цитратный и другие буферы на основе органических кислот; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярные полипептиды (примерно менее 10 остатков); белки, такие как сывороточный альбумин; желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие соединения, такие как ЭДТА; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий, и/или неионогенные поверхностно-активные вещества, такие как твинТМ, полиэтиленгликоль (ПЭГ) и плуроникиТМ.
«Липосома» представляет собой небольшую везикулу, состоящую из различных типов липидов, фосфолипидов и/или поверхностно-активных веществ, которая является пригодной для доставки лекарственного средства (такого как вариантный IgG) млекопитающему. Компоненты липосомы обычно располагаются в бислойном образовании, напоминающем расположение липидов в биологических мембранах.
Термин «антинеопластическая композиция» относится к композиции, подходящей для лечения злокачественной опухоли, содержащей, по меньшей мере, одно активное лекарственное средство, например «противоопухолевое средство». Примеры лекарственных средств (противоопухолевых средств) включают, не ограничиваясь этим, химиотерапевтические средства, ингибиторы роста, цитотоксические средства, средства, применяемые в лучевой терапии, антиангиогенные средства, апоптозные средства, антитубулиновые средства и другие средства для лечения рака, такие как анти-HER2 антитела, анти-CD20 антитела, антагонист рецептора эпидермального ростового фактора (EGFR) (например, ингибитор тирозинкиназы), ингибитор HER1/EGFR (например, эрлотиниб (тарцева®)), ингибиторы тромбоцитарного ростового фактора (например, гливек® (иматиниб мезилат)), ингибитор COX-2 (например, целекоксиб), интерфероны, цитокины, антагонисты (например, нейтрализующие антитела), которые связываются с одним или несколькими следующими рецепторами-мишенями ErbB2, ErbB3, ErbB4, PDGFR-бета, BlyS, APRIL, BCMA или рецептор(ы) VEGF, TRAIL/Apo2 и другие биологически активные и органические химические агенты и т.д. В изобретение также входят комбинации указанных веществ.
В том смысле, в котором в данном документе используется термин «цитотоксическое средство», он относится к веществу, которое ингибирует или предотвращает клеточную функцию и/или вызывает гибель или разрушение клетки. Термин предназначен для включения радиоактивных изотопов (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu), химиотерапевтические средства (например, метотрексат, адриамицин, средства на основе алкалоидов борвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие средства, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины, такие как токсины с небольшой молекулой или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты, и различные противоопухолевые или противораковые средства, раскрытые ниже. Ниже описываются другие цитотоксические средства. Туморицидное средство вызывает разрушение опухолевых клеток. В некоторых вариантах осуществления вариантный IgG можно конъюгировать с цитотоксическим средством.
«Токсин» представляет собой любое соединение, способное оказывать отрицательное действие на рост или пролиферацию клетки.
«Химиотерапевтическое средство» представляет собой химическое соединение, пригодное для лечения рака. Примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид (цитоксан®); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; ацетогенины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, маринол®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; камптотецин (включая синтетический аналог топотекан (гикамтин®), СРТ-11 (иринотекан, камптосар®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамина оксид гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урацилмустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин гамма 1I и калихеамицин омега I1 (смотрите, например, Nicolaou etal., Angew. Chem. Intl. Ed. Engl., 33:183-186 (1994)); CDP323, ингибитор альфа-4-интегрина для приема внутрь; динемицин, включая динемицин А; эсперамицин; а также неокарзиностатин хромофор и близкие хромопротеиновые энедииновые антибиотики-хромофоры), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая адриамицин®, морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин, доксорубицин HCl в липосомах для инъекций (доксил®), липосомальный доксорубицин TLC D-99 (миоцет®), пэгилированный липосомальный доксорубицин (каэликс®) и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат, гемцитабин (гемзар®), тегафур (уфторал®), капецитабин (кселода®), эпотилон и 5-фторурацил (5-FU); комбрестатин; аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; средства, подавляющие функцию надпочечников, такие как аминоглютетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазикон; элфорнитин; ацетат эллиптиния; эпотилон; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; тризиквон; 2,2',2'-трихлортриэтиламин; трихотецены (в частности, токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин (элдизин®, филдезин®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ара-С»); тиотепа; таксоид, например, паклитаксел (таксол®), композиция паклитаксела на основе наночастиц генно-инженерного альбумина (абраксан®) и доцетаксел (таксотер®); хлоранбуцил; 6-тиогуанин; меркаптопурин; метотрексат; средства платины, такие как цисплатин, оксалиплатин (например, элоксатин®) и карбоплатин; средства на основе алкалоидов барвинка, которые предотвращают полимеризацию тубулина с отменой образования микротубул, включающие винбластин (велбан®), винкристин (онковин®), виндезин (элдизин®, филдезин®) и винорелбин (навелбин®); этопозид (VP-16); ифосфамид; митоксантрон; лейковорин; новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота, включая бексаротен (тагретин®); бисфосфонаты, такие как клодронат (например, бонефос® или остак®), этидронат (дидрокал®), NE-58095, золедроновую кислоту/золедронат (зомета®), алендронат (фозамакс®), памидронат (аредиа®), тилудронат (скелид®) или ризедронат (актонел®); троксацитабин (1,3-диоксолановый аналог нуклеозида цитозина); антисмысловые олигонуклеотиды, в частности, ингибирующие экспрессию генов в сигнальных путях, принимающих участие в феномене аномальной пролиферации, например, такие как PKC-альфа, Raf, H-Ras и рецептор эпидермального ростового фактора (EGF-R) (например, эрлотиниб (тарцева®) и VEGF-A, который снижает клеточную пролиферацию; вакцины, такие как вакцина тератоп® и вакцины для генной терапии, например, вакцина алловектин®, вакцина лейвектин® и вакцина ваксид®; ингибитор топоизомеразы 1 (например, луртотекан®); rmRH (например, абареликс®); BAY439006 (сорафениб; Bayer); SU-11248 (сунитиниб, сутент®, Pfizer); перифозин, ингибитор СОХ-2 (например, целекоксиб или эторикоксиб), ингибитор протеосом (например, PS341); бортезомиб (велкад®); CCI-779; типифарниб (R11577); орафениб, АВТ510; ингибитор Bcl-2, такой как облимерсен натрий (генасенс®); пиксантрон; ингибиторы EGFR; ингибиторы тирозинкиназы; ингибиторы серин-треонинкиназы, такие как рапамицин (сиролимус, рапамун®); ингибиторы фарнезилтрансферазы, такие как лонафарниб (SCH 6636, сарасарТМ); и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше средств, а также комбинации двух или более указанных выше средств, такие как CHOP, сокращенное название комбинированной терапии, включающей циклофосфамид, доксорубицин, винкристин и преднизолон; и FOLFOX, сокращенное название схемы лечения оксалиплатином (элоксатином®) в комбинации с 5-FU и лейковорином, и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше средств, а также комбинации двух или более указанных выше средств.
Химиотерапевтические средства, определенные выше, включают «антигормональные средства» или «эндокринные лекарственные средства», которые регулируют, снижают, блокируют или ингибируют действие гормонов, способствующих росту злокачественной опухоли. Они сами могут представлять собой гормоны, включая, не ограничиваясь этим, антиэстрогены и избирательные модуляторы рецепторов эстрогенов (SERM), включающие, например, тамоксифен (в том числе нолвадекс® тамоксифен), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и фарестон торемифен; ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующую продукцию эстрогенов надпочечниками, например, такие как 4(5)-имидазолы, аминоглютетимид, мегейс® мегестрол ацетат, аромазин® екземестан, форместан, фадрозол, ривисор® ворозол, фемара® летрозол и аримидекс® анастрозол; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; а также троксацитабин (1,3-диоксолановый аналог нуклеозида цитозина); антисмысловые олигонуклеотиды, в частности, ингибирующие экспрессию генов в сигнальных путях, которые принимают участие в феномене аномальной пролиферации, например, такие как PKC-альфа, Raf и H-Ras; рибозимы, такие как ингибитор экспрессии VEGF (например, рибозим ангиозим®) и ингибитор экспрессии HER2; вакцины, такие как вакцины для генной терапии, например, вакцина алловектин®, вакцина лейвектин® и вакцина ваксид®; пролейкин® rIL-2; ингибитор топоизомеразы 1 люртотекан®; абареликс® rmRH; винорелбин и эсперамицины (смотрите патент США № 4675187), и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше средств, а также комбинации двух или более указанных выше средств.
В том смысле, в котором в данном документе используется термин «ингибирующее рост средство», он относится к соединению или композиции, которые ингибируют рост клетки (клетки, экспрессирующей VEGF) в условиях in vitro или in vivo. Таким образом, ингибирующее рост средство может представлять соединение, которое в значительной степени уменьшает процентное количество клеток (клеток, экспрессирующих VEGF) в S-фазе. Примеры ингибирующих рост средств включают вещества, которые блокируют прохождение клеточного цикла (в иной фазе, чем S-фаза), такие как средства, вызывающие остановку в G1-фазе и остановку в M-фазе. Классические блокаторы M-фазы включают средства на основе алкалоидов борвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Средства, вызывающие остановку в G1-фазе, также вызывают блокирование S-фазы, например, к ним относятся ДНК-алкилирующие средства, такие как тамоксифен, преднизон, дакарбазин, меклоретамин, цисплатин, метотрексат, 5-фторурацил и ара-С. Дополнительную информацию по данному вопросу можно найти у Mendelsohn and Israel, eds., The Molecular Basis of Cancer, Chapter 1, entitled «Cell cycle regulation, oncogenes and antineoplastic drugs», Murakami et al. (W.B. Saunders, Philadelphia, 1995), например, стр. 13. Таксаны (паклитаксел и доцетаксел) являются противоопухолевыми средствами, полученными тиса. Доцетаксел (таксотер®, Rhone-Poulenc Rorer), полученный из хвои европейского тиса, является полусинтетическим аналогом паклитаксела (таксол®, Bristol-Myers Squibb). Паклитаксел и доцетаксел индуцируют сборку микротубул из димеров тубулина и блокируют микротубулы, тем самым предупреждая деполимеризацию тубулина, что приводит к ингибированию митоза клеток.
Под «лучевой терапией» понимается применение направленных гамма-лучей или бета-лучей для индукции достаточного повреждения клеток одновременно в целях ограничения их способности нормально функционировать и разрушения клеток. Очевидно, понятно, что в данной области имеется много способов определения дозы и продолжительности лечения. Типичные схемы лечения включают однократное воздействие, и обычные дозы находятся в пределах от 10 до 200 единиц (грей) в сутки.
«Патология» заболевания включает все явления, которые нарушают здоровье пациента. В отношении патологии при злокачественной опухоли она включает, без ограничения, аномальный или неконтролируемый рост клеток, метастазирование, нарушение нормального функционирования смежных клеток, высвобождение цитокинов или других секреторных продуктов на аномальном уровне, супрессию или усиление воспалительного или иммунного ответа и т.д.
«Небольшая молекула» определяется в данном документе как молекула с молекулярной массой ниже примерно 500 дальтон.
Термин «внутривенная инфузия» относится к введению лекарственного средства в вену пациента, животного или человека, в течение периода времени более чем примерно 5 минут, предпочтительно от 30 до 90 минут, хотя по изобретению альтернативно внутривенную инфузию проводят в течение 10 часов или более.
Термин «внутривенный болюс» или «внутривенная струя» относится к введению лекарственного средства в вену пациента, животного или человека, таким образом, что пациент получает лекарственное средство в течение примерно 15 минут или меньше, предпочтительно 5 минут или меньше.
Термин «подкожное введение» относится к введению лекарственного средства под кожу пациента, животного или человека, предпочтительно в «карман» между кожей и нижележащими тканями при относительно медленном, непрерывном введении из резервуара со средством. «Карман» можно получить смещением или вытягиванием кожи вверх и в сторону от нижележащей ткани.
Термин «подкожная инфузия» относится к введению лекарственного средства под кожу пациента, животного или человека, предпочтительно в «карман» между кожей и лежащими ниже тканями при относительно медленном, непрерывном введении из резервуара со средством в течение периода времени включающего, не ограничиваясь этим, 30 минут или меньше, 90 минут или меньше. Необязательно инфузию можно проводить подкожной имплантацией насоса для доставки лекарственного средства, имплантированного под кожу пациента, животного или человека, где насос доставляет заранее определенное количество средства в течение заранее определенного периода времени, например, 30 минут, 90 минут, или периода времени, составляющего продолжительность схемы лечения.
Термин «подкожный болюс» относится к введению лекарственного средства под кожу пациента, животного или человека, где продолжительность введения болюса средства предпочтительно составляет менее, чем примерно 15 минут, более предпочтительно менее, чем примерно 5 минут и наиболее предпочтительно менее, чем примерно 60 секунд. Предпочтительно введение проводят в «карман» между кожей и нижележащими тканями, где «карман» получают смещением или вытягиванием кожи вверх и в сторону от нижележащей ткани.
В том смысле, в котором в данном документе используется термин «метка», он относится к детектируемым соединению или композиции, которые конъюгированы прямо или опосредованно с полипептидом. Метка можно регистрировать как таковую (например, радиоизотопные метки или флуоресцентные метки) или, как это имеет место в случае ферментативной метки, она может катализировать химическое изменение субстрата или композиции, которые затем детектируется.
Антитела
Антитела являются белками, которые проявляют специфичность связывания в отношении специфического антигена. Как правило, «нативные антитела» обычно представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 дальтон, состоящие из двух идентичных легких цепей (L) и двух идентичных тяжелых цепей (H). Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, в то время как число дисульфидных мостиков варьирует среди тяжелых цепей иммуноглобулинов различных изотипов. Также каждая тяжелая и легкая цепь содержит регулярно расположенные внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь имеет в одном конце вариабельный домен (VH) с последующим рядом константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом конце; константный домен легкой цепи выровнена с первым константным доменом тяжелой цепи и вариабельный домен легкой цепи выровнен с вариабельным доменом тяжелой цепи. Полагают, что определенные аминокислотные остатки образуют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи.
В зависимости от аминокислотных последовательностей константных доменов их тяжелых цепей антитела (иммуноглобулины) можно отнести к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно подразделить на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4; IgA1 и IgA2. Описаны различные аллотипы IgG1, IgG2, IgG3 и IgG4человека (смотрите обзор M.-P. LeFranc and G. LeFranc in «The Human IgG Subclasses», F. Shakib (ed.), pp. 43-78, Pergamon Press, Oxford (1990)). Различные изотипы класса IgG, включая IgG1, IgG2s, IgG3 и IgG4, обладают уникальными физическими, биологическими и клиническими свойствами. IgG1 человека является наиболее широко применяемым антителом для терапевтических целей, и большинство генно-инженерных исследований проводится с ним.
Настоящее изобретение относится к вариантному IgG иммуноглобулину, который содержит аминокислотные модификации, изменяющие биологические свойства IgG. Вариантные иммуноглобулины по настоящему изобретению включают антитела, содержащие модифицированный Fc-участок, которые обладают более длительным временем полужизни в условиях in vivo по сравнению с антителами дикого типа.
В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению увеличивается, по меньшей мере, на 50% по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG дикого типа. В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению увеличивается, по меньшей мере, на 75% по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG дикого типа. В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению увеличивается, по меньшей мере, на 100% по сравнению с временем полужизни IgG, имеющего Fc-участок человеческого IgG дикого типа.
В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению составляет, по меньшей мере, примерно 15 суток. В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению составляет, по меньшей мере, примерно 20 суток. В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению составляет, по меньшей мере, примерно 25 суток. В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению составляет, по меньшей мере, примерно 30 суток. В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению составляет, по меньшей мере, примерно 35 суток. В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению составляет, по меньшей мере, примерно 40 суток. В некоторых вариантах осуществления вариантный IgG представляет собой вариантный IgG1.
В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению равняется времени полужизни IgG у человека. В некоторых вариантах осуществления время полужизни вариантного IgG по настоящему изобретению равняется времени полужизни IgG у обезьян рода Cynomolgus.
Фрагменты антител
В объем настоящего изобретения включены фрагменты антител. Особый интерес представляют антитела, содержащие Fc-участки, слитые Fc-белки и константный домен тяжелой цепи. В некоторых вариантах осуществления фрагменты антител представляют собой фрагменты вариантных иммуноглобулинов (IgG), содержащих Fc-участки. Фрагменты антител можно получить традиционными способами, такими как ферментативное расщепление или рекомбинантные методы.
Для получения фрагментов антител разработаны различные методы. Традиционно данные фрагменты получали протеолитическим расщеплением интактных антител (смотрите, например, Morimoto et al., Journal of Biochemical and Biophysical Methods, 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако в настоящее время данные фрагменты можно получить непосредственно с использованием рекомбинантных клеток-хозяев. Все Fab-, Fv- и scFv-фрагменты антител можно экспрессировать в и секретировать из E. coli, обеспечивая простое получение данных фрагментов в больших количествах. Фрагменты антител можно выделить из фаговых библиотек антител. В некоторых вариантах осуществления Fab'-SH-фрагменты можно непосредственно выделить из E. coli и химически связать с образованием F(ab')2-фрагментов (Carter et al., Bio/Technology, 10:163-167 (1992)). Согласно другому подходу F(ab')2-фрагменты можно выделить непосредственно из культуры рекомбинантных клеток-хозяев. Специалистам в данной области известны другие методы получения фрагментов антител. Фрагмент антитела также может представлять собой «линейное антитело», например, описанное в патенте США № 5641870. Такие линейные антитела могут быть моноспецифическими или биспецифическими.
Гуманизированные антитела
Изобретение включает гуманизированные антитела. В некоторых вариантах осуществления гуманизированные антитела представляют собой гуманизированные вариантные IgG с одной или несколькими аминокислотными модификациями в Fc-участке по сравнению с IgG дикого типа. В данной области известны различные методы получения гуманизированных антител, отличных от человеческих антител. Например, гуманизированное антитело может содержать один или несколько аминокислотных остатков, введенных в него из источника, который не является человеком. Такие остатки от животного, отличного от человека, часто называют «импортируемыми» остатками, которые обычно взяты из «импортируемого» вариабельного домена. Гуманизацию можно по существу провести, следуя способу Winter и соавторов (Jones et al., Nature, 321:522-525 (1986); Reichmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), заменой последовательностей гипервариабельных участков на соответствующие последовательности антитела человека. Следовательно, такие «гуманизированные» антитела являются химерными антителами (патент США № 4816567), в которых значительно меньшая часть, чем интактный человеческий вариабельный домен, заменена на соответствующую последовательность от вида, отличного от человека. Как правило, на практике гуманизированные антитела представляют собой человеческие антитела, в которых некоторые остатки гипервариабельного участка и, возможно, некоторые остатки FR замещены на остатки в аналогичных сайтах в антителах грызунов.
Выбор человеческих вариабельных доменов легкой и тяжелой цепей для использования в получении гуманизированных антител может быть важным для снижения антигенности. Согласно так называемому способу «наилучшего приближения», последовательность вариабельного домена антитела грызунов подвергают скринингу против целой библиотеки известных последовательностей человеческих вариабельных доменов. Затем человеческую последовательность, которая является наиболее близкой к последовательности грызунов, берут в качестве человеческой каркасной области для гуманизированного антитела. Смотрите, например, Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987). В другом способе используется конкретная каркасная область, полученная из консенсусной последовательности всех человеческих антител определенной подгруппы легкой и тяжелой цепей. Одну и ту же каркасную область можно использовать для нескольких различных гуманизированных антител. Смотрите, например, Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993).
Также желательно, чтобы антитела были гуманизированы с сохранением высокой аффинности для антигена и других ценных биологических свойств. Для достижения данной цели согласно одному способу гуманизированные антитела получают проводя анализ исходных последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов общедоступны и знакомы специалистам в данной области. Имеются компьютерные программы, которые иллюстрируют и представляют собой трехмерные комформационные структуры выбранных иммуноглобулиновых последовательностей-кандидатов. Исследование данных дисплеев позволяет оценить вероятную роль остатков в функционировании иммуноглобулиновой последовательности-кандидата, т.е. провести анализ остатков, оказывающих влияние на способность иммуноглобулина-кандидата связываться со своим антигеном. Таким образом можно выбрать и объединить остатки FR из реципиентных и импортируемых последовательностей, чтобы достичь желаемой характеристики антитела, такой как повышенная аффинность для антигена(в)-мишени. В общем, остатки гипервариабельного участка оказывают непосредственное и наиболее существенное влияние на связывание антигена.
Человеческие антитела
В некоторых вариантах осуществления человеческие антитела по настоящему изобретению представляют собой человеческие вариантные IgG с одной или несколькими модификациями в Fc-участке по сравнению с IgG дикого типа. Человеческие антитела можно сконструировать объединением последовательности(й) Fv-клона вариабельных доменов, выбранных из человеческих библиотек фагового дисплея, с известными человеческими константными доменами, как описано выше. Альтернативно человеческие моноклональные антитела можно получить гибридомным методом. Описаны человеческие миеломные и мышиные-человеческие гетеромиеломные клеточные линии для получения человеческих моноклональных антител, например, Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987) и Boerner et al., J. Immunol., 147:86 (1991).
В настоящее время возможно получить трансгенных животных (например, мышей), которые способны при иммунизации продуцировать полный репертуар человеческих антител при отсутствии продукции эндогенных иммуноглобулинов. Например, имеется информация, что гомозиготная делеция гена соединяющей области (JH) тяжелой цепи антитела у химерных и мутантных мышей по зародышевой линии приводит к полному подавлению продукции эндогенных антител. Перенос ряда генов иммуноглобулинов человеческой зародышевой линии таким мутантным мышам по зародышевой линии приводит к продукции человеческих антител при стимуляции антигеном. Смотрите, например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255 (1993); Bruggermann et al., Year in Immunol., 7:33 (1993).
Также можно использовать перестановку генов для получения человеческих антител из антител, отличных от человеческих, например, антител грызунов, где человеческое антитело обладает аффинностью, аналогичной аффинности исходных «нечеловеческих» антител. Согласно данному способу, который также называют, «импринтингом эпитопов», вариабельный домен тяжелой или легкой цепей фрагмента антитела, отличного от человеческого антитела, полученного методами фагового дисплея, описанными в данном документе, заменяют на репертуар генов человеческих V-доменов с получением популяции химерных scFv- или Fab-конструкций «нечеловеческая» цепь/человеческая цепь. Отбор с антигеном позволяет выделить scFv- или Fab-конструкции «нечеловеческая» цепь/человеческая цепь, в которых человеческая цепь восстанавливает антигенсвязывающий сайт, разрушенный при удалении соответствующей «нечеловеческой» цепи в первичном клоне фагового дисплея, т.е. эпитопы (импринты) направляют выбор партнера человеческой цепи. В том случае, когда способ повторяют для замещения оставшейся «нечеловеческой» цепи, получают человеческое антитело (смотрите публикацию международной заявки PCT WO 93/06213, опубликованную 1 апреля 1993 года). В отличие от традиционного способа гуманизации «нечеловеческих» антител пересадкой CDR данный способ обеспечивает получение полностью человеческих антител, в которых отсутствуют остатки FR или CDR «нечеловеческого» происхождения.
Биспецифические антитела
Биспецифические антитела представляют собой моноклональные антитела, которые обладают специфичностью связывания в отношении, по меньшей мере, двух различных антигенов. В некоторых вариантах осуществления биспецифические антитела представляют собой биспецифические антитела с одной или несколькими аминокислотными модификациями в Fc-участке по сравнению с антителом дикого типа. В некоторых вариантах осуществления биспецифические антитела представляют собой человеческие или гуманизированные антитела. В некоторых вариантах осуществления одна специфичность связывания представляет собой специфичность для VEGF, а другая - для любого другого антигена. В некоторых вариантах осуществления биспецифические антитела могут связываться с двумя различными эпитопами VEGF. Также биспецифические антитела можно использовать для доставки цитотоксических агентов к клеткам, экспрессирующим VEGF. Данные антитела обладают VEGF-связывающим плечом и плечом, которое связывается с цитотоксическим средством, таким как сапорин, анти-интерферон-α, алкалоиды борвинка, А цепь рицина, метотрексат или гаптен радиоактивный изотоп. В некоторых вариантах осуществления специфичность связывания представляет собой специфичность для IL-4 и IL-13. Биспецифические антитела можно получить в виде полноразмерных антител или фрагментов антител, содержащих Fc-участок.
В данной области известны способы получения биспецифических антител. Традиционно рекомбинантная продукция биспецифических антител основана на коэкспрессии двух пар тяжелая цепь-легкая цепь иммуноглобулина, при этом две тяжелые цепи обладают различной специфичностью (Milstein and Cuello, Nature, 305:537 (1983)). Вследствие случайного выбора тяжелой и легкой цепей иммуноглобулина данные гибридомы (квадромы) продуцируют возможную смесь 10 различных молекул антител, из которых только одна имеет правильную биспецифическую структуру. Выделение правильной молекулы, которое обычно проводят с использованием стадий аффинной хроматографии, является довольно громоздким, а выход продукта - низким. Аналогичные способы раскрываются в международной заявке WO 93/08829, опубликованной 13 мая 1993 года, и у Traunecker et al., EMBO J., 10:3655 (1991).
Согласно другому подходу вариабельные домены антитела с желаемой специфичностью связывания (сайты связывания антитело-антиген) сливают с последовательностями константных доменов иммуноглобулинов. Слияние осуществляют, например, с константным доменом тяжелой цепи иммуноглобулина, содержащей, по меньшей мере, часть шарнирной области, домены СН2 и СН3. В некоторых вариантах осуществления первый константный домен тяжелой цепи (СН1), содержащая сайт, необходимый для связывания легкой цепи, находится, по меньшей мере, в одной слитой конструкции. ДНК, кодирующие тяжелую цепь иммуноглобулиновых слитых конструкций и, если желательно, легкую цепь иммуноглобулина, встраивают в отдельные экспрессирующие векторы и котрансфицируют в подходящий организм-хозяин. Такой подход обеспечивает высокую гибкость в корректировке взаимных пропорций трех полипептидных фрагментов в вариантах осуществления, в которых используют различные относительные количества трех полипептидных цепей при конструировании, обеспечивающем высокий выход. Однако возможно встроить кодирующие последовательности двух или всех трех полипептидных цепей в один экспрессирующий вектор, когда экспрессия, по меньшей мере, двух полипептидных цепей в равных относительных количествах обеспечивает высокий выход, или когда относительные количества не имеют особого значения.
В одном варианте осуществления такого подхода биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном плече и гибридной пары тяжелая цепь-легкая цепь иммуноглобулина (обеспечивающей вторую специфичность связывания) в другом плече. Было установлено, что данная асимметричная структура облегчает отделение желаемого биспецифического соединения от нежелательных комбинаций иммуноглобулиновых цепей, поскольку присутствие легкой цепи иммуноглобулина только в половине биспецифических молекул обеспечивает простой путь их выделения. Данный способ раскрыт в международной заявке WO 94/04690. Дополнительные подробности получения биспецифических антител смотрите, например, у Suresh et al., Methods in Enzymology, 121:210 (1986).
Согласно другому подходу можно сконструировать поверхность раздела между парой молекул антител для получения максимального процентного количества гетеродимеров, которые выделяют из культуры рекомбинантных клеток. Поверхность раздела содержит, по меньшей мере, часть домена СН3 константного домена антитела. В данном способе одну или несколько небольших аминокислотных боковых цепей из поверхности раздела первой молекулы антитела заменяют на более крупные боковые цепи (например, тирозин или триптофан). Создают компенсирующие «полости» размером, аналогичным или близким размеру крупной боковой цепи(й) на поверхности раздела второго антитела, заменой крупных аминокислотных боковых цепей на меньшие (например, аланин или треонин). Такой прием увеличивает выход гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела включают поперечносшитые или «гетероконъюгированные» антитела. Например, одно из антител в гетероконъюгате может быть связано с авидином, другое - с биотином. Подобные антитела были предложены для направленного воздействия клеток иммунной системы на нежелательные клетки (патент США № 4676980) и для лечения HIV инфекции (международные заявки WO 91/00360, WO 92/00373 и ЕР 03089). Гетероконъюгатные антитела можно получить с использованием соответствующего метода поперечного связывания. Подходящие агенты для сшивания хорошо известны в данной области, и они раскрыты в патенте США № 4676980, наряду с рядом других методов поперечного сшивания.
Технология «диатела», описанная Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993), обеспечивает альтернативный механизм получения фрагментов биспецифических антител. Фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL), через линкер, который является слишком коротким для спаривания двух доменов в одной цепи. Следовательно, домены VH и VL одного фрагмента вынуждены спариваться с комплементарными доменами VL и VH другого фрагмента с образованием антигенсвязывающих участков. Также сообщалось о другой стратегии приготовления фрагментов биспецифических антител, которая заключается в применении димеров одноцепочечного Fv (sFv). Смотрите Gruber et al., J. Immunol., 152:5368 (1994).
Предусматриваются антитела с более чем одной валентностью. Например, можно получить трехспецифические антитела. Tutt et al., J. Immunol., 147:60 (1991).
Поливалентные антитела
Поливалентные антитела могут подвергаться интернализации (и/или катаболизму) быстрее по сравнению с бивалентным антителом клеткой, экспрессирующей антиген, с которым связываются антитела. Антитела по настоящему изобретению могут представлять поливалентные антитела (которые относятся к другому классу, чем IgM) с тремя или более антигенсвязывающими сайтами (например, в случае тетравалентных антител), которые легко получить экспрессией нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Поливалентное антитело может содержать домен димеризации и три или более антигенсвязывающих участков. В некоторых вариантах осуществления домен димеризации содержит (или состоит из) Fc-участок или шарнирную область. По данному сценарию антитело будет содержать Fc-участок и три или более антигенсвязывающих сайтов, аминоконцевых по отношению к Fc-участку. В некоторых вариантах осуществления поливалентное антитело содержит (или состоит из) от примерно трех до примерно восьми антигенсвязывающих сайтов. В одном таком варианте осуществления поливалентное антитело содержит (или состоит из) четыре антигенсвязывающих сайта. Поливалентное антитело содержит, по меньшей мере, одну полипептидную цепь (например, две полипептидные цепи), где полипептидная цепь(и) содержит два или более вариабельных доменов. Например, полипептидная цепь(и) может содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 представляет собой первый вариабельный домен, VD2 представляет собой второй вариабельный домен, Fc представляет собой одну полипептидную цепь Fc-участка, X1 и X2 представляют собой аминокислоту или полипептид, и n равно 0 или 1. Например, полипептидная цепь(и) может содержать: цепь VH-СН1-гибкий линкер-VH-СН1-Fc-участок или цепь VH-СН1-VH-СН1-Fc-участок. Поливалентное антитело по настоящему изобретению может дополнительно содержать, по меньшей мере, два (например, четыре) полипептида вариабельного домена легкой цепи. Поливалентное антитело по настоящему изобретению может содержать, например, примерно от двух до примерно восьми полипептидов вариабельного домена легкой цепи. Полипептиды вариабельного домена легкой цепи, предусмотренные по изобретению, содержат вариабельный домен легкой цепи и необязательно дополнительно содержат домен CL.
Однодоменные антитела
В некоторых вариантах осуществления антитело по изобретению представляет собой однодоменное антитело, содержащее Fc-участок. В некоторых вариантах осуществления однодоменное антитело содержит одну или несколько аминокислотных модификаций в Fc-участке по сравнению с IgG дикого типа. Однодоменное антитело представляет собой одну полипептидную цепь, содержащую целиком или часть вариабельного домена тяжелой цепи или целиком или часть вариабельного домена легкой цепи антитела.
Модификации антитела
В некоторых вариантах осуществления предусматривается модификация(и) аминокислотной последовательности иммуноглобулинов, описанных в данном документе. В некоторых вариантах осуществления модификации включают одну или несколько аминокислотных модификаций вариантных IgG по настоящему изобретению. В некоторых вариантах осуществления может быть желательным дополнительно изменить аффинность связывания, время полужизни в условиях in vivo и/или биологические свойства вариантных IgG по настоящему изобретению. В некоторых вариантах осуществления аминокислотные модификации включают одну или несколько аминокислотных модификаций в Fc-участке, не описанных в данном документе. Модифицированные аминокислотные последовательности вариантных IgG можно получить введением соответствующих изменений в нуклеотидную последовательность, кодирующую антитело, или пептидным синтезом. Такие модификации включают, например, делеции и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. Можно выполнить любую комбинацию, состоящую из делеции, инсерции и замены, для появления в конечной конструкции, при условии, что конечная конструкция будет обладать желаемыми характеристиками. Аминокислотные изменения можно ввести в данную аминокислотную последовательность во время получения этой последовательности.
Подходящим способом идентификации некоторых остатков или областей антитела, которые представляют собой предпочтительные положения для мутагенеза, является так называемый «аланин-сканирующий мутагенез», описанный Cunningham and Wells, Science, 244:1081-1085 (1989). В данном случае идентифицируют остаток или группу остатков-мишеней (например, заряженные остатки, такие как arg, asp, his, lys и glu) и заменяют на нейтральные или отрицательно заряженные аминокислоты (например, аланин или полиаланин) для оказания влияния на взаимодействие аминокислот с антигеном. Затем данные аминокислотные положения, проявляющие функциональную чувствительность к заменам, усовершенствуют введением дополнительных или других модификаций в или на сайты замены. Таким образом, несмотря на то, что место для введения модификации аминокислотной последовательности является заранее определенным, необязательно заранее определять природу мутации per se. Например, для анализа проведения мутации в данном сайте проводят ala-сканирующий или случайный мутагенез в кодоне-мишени или области-мишени, и экспрессированные иммуноглобулины подвергают скринингу на желаемую активность.
Инсерции аминокислотных последовательностей включают амино- и/или карбоксиконцевые слияния длиной в пределах от одного остатка до полипептидов, содержащих сотни или более остатков, а также инсерции внутри последовательности из одного или многочисленных аминокислотных остатков. Примеры концевых инсерций включают антитело с N-концевым метионильным остатком. Другие инсерционные модификации молекулы антитела включают слияние N- или C-конца антитела с ферментом (например, ADEPT) или полипептидом, который повышает время полужизни антитела.
В некоторых вариантах осуществления вариантный IgG по настоящему изобретению изменяют с целью повышения или снижения степени гликозилирования антитела. Как правило, гликозилирование полипептидов является N-связанным или О-связанным. N-связанное гликозилирование относится к присоединению углеводной группы к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, где Х представляет собой любую аминокислоту, за исключением пролина, являются последовательностями узнавания для ферментативного присоединения углеводной группы к боковой цепи аспарагина. Таким образом, присутствие данных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. О-связанное гликозилирование относится к присоединению одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиламинокислоте, чаще всего серину или треонину, хотя, также можно использовать 5-гидроксипролин или 5-гидроксилизин.
Добавление или делецию сайтов гликозилирования в антителе соответственно проводят изменением аминокислотной последовательности таким образом, что при этом вносят или удаляют одну или несколько описанных выше трипептидных последовательностей (для сайтов N-гликозилирования). Также изменение можно осуществить добавлением, делецией или заменой одного или нескольких остатков серина или треонина в последовательности исходного антитела (для сайтов О-связанного гликозилирования).
Можно изменить углевод, присоединенный к Fc-участку вариантных IgG. Нативные антитела, продуцированные клетками млекопитающих, как правило, содержат разветвленный, биантенальный олигосахарид, обычно присоединенный через N-связь к остатку Asn297 домена СН2 Fc-участка. Смотрите, например, Winter et al., TIBTECH, 15:26-32 (1997). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стебле» биантенальной олигосахаридной структуры. В некоторых вариантах осуществления модификации олигосахарида в вариантном IgG по изобретению можно провести с получением вариантного IgG с некоторыми дополнительно улучшенными свойствами. В некоторых вариантах осуществления вариантный IgG дополнительно содержит замену в положении 297 на аланин.
Например, модификации антитела обеспечивают получением структуры углевода с отсутствием фукозы, обычно присоединенной (прямо или опосредованно) к Fc-участку. Результатом таких модификаций может быть повышенная ADCC-функция. Смотрите, например, публикации патентов США №№ 2003/0157108 (Presta, L.); 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd.). Примеры публикаций, относящихся к «дефукозилированным» или «дефицитным по фукозе» модификациям антитела включают: заявку на патент США № 2003/0157018; международные заявки WO 2000/61739, WO 2001/29246; заявки на патенты США №№ 2003/29246, 2003/0115614, 2002/0164328, 2004/0093621, 2004/0132140, 2004/0110704, 2004/0110282, 2004/0109865; международные заявки WO 2003/085119, WO 2003/085570, WO 2005/035586, WO 2005/0357778, WO 2005/053742, WO 2002/031140, WO 2002/031140; Okazaki et al., J. Mol. Biol., 336:1239-1249 (2004); Yamane-Ohnuki et al., Biotech. Bioeng. 87:614 (2004). Примеры клеточных линий, способных продуцировать дефукозилированные антитела, включают клетки Lec13 СНО с дефицитом белка фукозилирования (Ripka et al., Arch. Biochem Biophys., 249:533-545 (1986); заявка на патент США № 2003/0157108 А1, Presta, L.; и международная заявка WO 2004/056312 А1; Agams et al., в частности, пример 11) и нокаутные клеточные линии, например, по гену альфа-1,6-фукозилтрансферазы FUT8, нокаутные клетки СНО (смотрите, например, Yamane-Ohnuki et al., Biotech. Bioeng., 87:614 (2004); Kanda Y. et al., Biotech. Bioeng., 94(4):680-688 (2006); и международная заявка WO 2003/085107).
Модификации антитела дополнительно получают с помощью разделенных пополам олигосахаридов, например, когда биантенальный олигосахарид, присоединенный к Fc-участку антитела, разделяется пополам с помощью GlcNAc. Такие варианты антител могут обладать низким фукозилированием и/или высокой ADCC функцией. Примеры таких модификаций антитела описаны, например, в международной заявке WO 2003/011878 (Jean-Mairet et al.); патенте США № 6602684 (Umana et al.) и заявке на патент США № 2005/0123546 (Umana et al.). Также описаны модификации антитела, по меньшей мере, с одним остатком галактозы в олигосахариде, присоединенном к Fc-участку. Подобные модификации антитела могут привести к повышению CDC функции. Такие модификации описаны, например, в международных заявках WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju S.) и WO 1999/22764 (Raju S.).
В некоторых вариантах осуществления изобретение относится к модификациям антитела, которое обладает некоторыми, но не всеми эффекторными функциями, что делает его желательным кандидатом для многих применений, для которых время полужизни антитела в условиях in vivo важен, но некоторые эффекторные функции (такие как комплемент и ADCC) являются необязательно необходимыми или даже отрицательными. В некоторых вариантах осуществления определяют связанные с Fc-участком активности антитела для гарантии того, что сохраняются только желаемые свойства. Можно провести анализ цитотоксичности в условиях in vitro и/или in vivo для подтверждения снижения/истощения CDC- и/или ADCC- активности. Например, можно провести анализ связывания с Fc-рецептором (FcR) для гарантии того, что антитело теряет способность к связыванию с FcγR (следовательно, вероятно, теряет ADCC-активность), но сохраняет способность связываться с FcRn. Основные клетки, опосредующие ADCC, NK-клетки, экспрессируют только FcRIII, в то время как моноциты экспрессируют FcRI, FcRII и FcRIII. Данные по экспрессии FcR на гематопоэтических клетках обобщены в таблице 3 на странице 464 в работе Ravetch and Kinet, Annu. Rev. Immunol., 9:457-92 (1991). Неограничивающие примеры тестов в условиях in vitro для оценки ADCC-активности интересующей молекулы описаны в патенте США № 5500362 (смотрите, например, Hellstrom I. et al., Proc. Natl. Acad. Sci. USA, 83:7059-7063 (1986) и Hellstrom I. et al., Proc. Natl. Acad. Sci. USA, 82:1499-1502 (1985)); в патенте США № 5821337 (смотрите Bruggemann M. et al., J. Exp. Med., 166:1351-1361 (1987)). Альтернативно можно использовать методы анализа без включения радиоактивной метки (смотрите, например, нерадиоактивный тест оценки цитотоксичности ACTITM с проточной цитометрией (CellTechnology, Inc. Mountain View, CA; и нерадиоактивный тест оценки цитотоксичности CytoTox 96® (Promega, Madison, WI). Подходящие эффекторные клетки для таких тестов включают мононуклеарные клетки периферической крови (PBMC) и природные клетки-киллеры (NK). Альтернативно или дополнительно ADCC-активность интересующей молекулы можно оценить в условиях in vivo, например, на модели животных, описанной Clynes et al., Proc. Natl. Acad. Sci. USA, 95:652-656 (1998). Также можно проанализировать связывание с C1q для подтверждения того, что антитело не способно связываться с C1q и, следовательно, у него отсутствует CDC-активность. Для того чтобы оценить активацию комплемента, можно провести тест оценки CDC (смотрите, например, Gazzano-Santoro et al., J. Immunol. Methods, 202:163 (1996); Cragg M.S. et al., Blood, 101:1045-1052 (2003) и Cragg M.S. and Glennie M.J., Blood, 103:2738-2743 (2004)). Также можно оценить связывание с рецептором FcRn и установить клиренс/время полужизни в условиях in vivo с использованием методов, известных в данной области (смотрите, например, Petkova S.B. et al., Int. Immunol., 18(12):1759-1769 (2006)).
Обеспечиваются другие модификации антитела, содержащие одну или несколько аминокислотных замен. Сайты, представляющие интерес для заместительного мутагенеза, включают гипервариабельные участки, но также предусматриваются изменения FR. Консервативные замены приведены в таблице 1 под заголовком «Предпочтительные замены». Более существенные изменения, обозначенные как «примерные замены», приведены в таблице 1 или дополнительно описаны при обращении к классу аминокислот. Аминокислотные замены можно ввести в интересующее антитело и продукты подвергнуть скринингу, например, на желаемую активность, такую как повышенное связывание с антигеном, пониженная иммуногенность, повышенная ADCC или CDC и т.п.
Модификации биологических свойств антитела можно осуществить, выбрав замены, оказывающие влияние на (а) структуру полипептидного скелета в области замены, например, в отношении складчатой или спиральной конформации; (b) заряд или гидрофобность молекулы в сайте-мишени или (с) объемный размер боковой цепи. Аминокислоты можно объединить на основе аналогий в свойствах их боковых цепей (Lehninger A.L., in Biochemistry, second ed., pp. 73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (A), Val (V), Leu (L), Ile (I), Pro (P), Phe (F), Trp (W), Met (M);
(2) незаряженные полярные: Gly (G), Ser (S), Thr (T), Cys (С), Tyr (Y), Asn (N), Gln (Q);
(3) кислые: Asp (D), Glu (E);
(4) основные: Lys (K), Arg (R), His (H).
Альтернативно природные остатки можно подразделить на группы, основываясь на общих свойствах боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, оказывающие влияние на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены включают обмен члена одного класса на другой. Подобные замещенные остатки также можно ввести в сайты консервативных замен или в остальные сайты (неконсервативные).
Один тип заместительной модификации включает замену одного или нескольких остатков гиперварибельных участков (например, в гуманизированном или человеческом антителе). В некоторых вариантах осуществления исходное антитело представляет собой аналог вариантного IgG дикого типа (например, вариантного IgG по изобретению без дополнительного изменения его аминокислотной последовательности). Как правило, полученные антитела, отобранные для дальнейшей разработки, будут иметь модифицированные (например, улучшенные) биологические свойства по сравнению с исходным антителом, из которого они получены. Примером заместительной модификации является антитело со зрелой аффинностью, которое можно соответственно получить с использованием методов созревания аффинности на основе фагового дисплея. Вкратце, несколько сайтов гипервариабельного участка (например, 6-7 сайтов) подвергают мутации с получением всех возможных аминокислотных замен в каждом сайте. Полученные таким образом антитела экспонируют на частицах нитчатого фага в виде слитых конструкций, по меньшей мере, с фрагментом белка оболочки фага (например, продуктом М13 гена III), упакованного в каждой частице. Затем экспонированные на фаге антитела подвергают скринингу на их биологическую активность (например, активность связывания). Для идентификации сайтов-кандидатов гипервариабельного участка для последующей модификации можно провести сканирующий мутагенез (например, аланин-сканирующий) для установления остатков гипервариабельного участка, оказывающих наиболее существенное влияние на связывание антигена. Альтернативно или дополнительно может быть полезным проанализировать кристаллическую структуру комплекса антиген-антитело для идентификации точек контактирования антитела и антигена. Такие «контактные» остатки и соседние остатки являются кандидатами для замены с использованием известных в данной области методов, включая описанные в данном документе. После получения таких модифицированных антител панель антител подвергают скринингу с использованием методов, известных в данной области, включая описанные в данном документе, и антитела с наилучшими свойствами, проявленными в соответствующих тестах, можно отобрать для дальнейшей разработки.
Нуклеиновые кислоты, кодирующие аминокислотную последовательность модифицированного антитела (например, модифицированного вариантного IgG), получают с использованием различных способов, известных в данной области. Данные методы включают, не ограничиваясь этим, выделение из природного источника (в случае природных модификаций аминокислотной последовательности) или получение олигонуклеотид-опосредованным (или сайт-направленным) мутагенезом, ПЦР-мутагенезом и кассетным мутагенезом ранее полученного модифицированного антитела или немодифицированного антитела.
Согласно данному описанию и наставлениям в данной области предусматривается, что в некоторых вариантах осуществления модификация антител по изобретению может включать одно или несколько изменений по сравнению с аналогом вариантного IgG дикого типа (например, вариантного IgG по изобретению без дополнительного изменения его аминокислотной последовательности). Данные модификации аминокислот, содержащие дополнительные изменения, тем не менее, будут сохранять в основном те же характеристики, необходимые для терапевтической применимости в сравнении с аналогом вариантного IgG дикого типа. В некоторых вариантах осуществления аналог вариантного IgG дикого типа представляет собой вариант бевацизумаба.
В другом аспекте изобретение относится к модификациям, включающим модификации поверхности раздела Fc-полипептидов, содержащих Fc-участок, где модификации облегчают и/или способствуют гетеродимеризации. Данные модификации включают введение «выступа» в первый Fc-полипептид и «впадины» во второй Fc-полипептид, где «выступ» располагается во «впадине» таким образом, чтобы способствовать комплексообразованию первого и второго Fc-полипептидов. Способы получения антител с данными модификациями известны в данной области, например, описаны в патенте США № 5731168.
В еще одном аспекте может быть желательным сконструировать антитела, содержащие цистеин, например, «тиоMAb», в которых один или несколько остатков антитела заменены на остатки цистеина. В некоторых вариантах осуществления замещенные остатки находятся в доступных сайтах антитела. Посредством замены данных остатков на цистеин реакционноспособные тиоловые группы располагаются в доступных сайтах антитела и могут быть использованы для конъюгации антитела с другими группами, такими как лекарственные средства, как описано ниже. В некоторых вариантах осуществления любой один или несколько из следующих остатков можно заместить на цистеин: V205 (система нумерации по Kabat) в легкой цепи; A118 в тяжелой цепи; и S400 (EU-система нумерация) в Fc-участке тяжелой цепи.
Производные антитела
В некоторых вариантах осуществления вариантные IgG по настоящему изобретению можно дополнительно модифицировать с целью включения дополнительных небелковых групп, которые известны в данной области и являются широко доступными. В некоторых вариантах осуществления вариантный IgG можно конъюгировать с цитотоксическим средством. В некоторых вариантах осуществления вариантный IgG, с которым связано цитотоксическое средство, интернализуется клеткой, обеспечивая высокую терапевтическую эффективность конъюгата в индукции гибели злокачественной клетки, с которой он связывается. В одном варианте осуществления цитотоксическое средство направлено или оказывает отрицательное действие на нуклеиновую кислоту в злокачественной клетке.
В некоторых вариантах осуществления группами, подходящими для дериватизации антитела, являются водорастворимые полимеры. Неограничивающие примеры водорастворимых полимеров включают, не ограничиваясь этим, полиэтиленгликоль (ПЭГ), сополимеры этиленгликоль/пропиленгликоль, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилен/малеиновый ангидрид, полиаминокислоты (гомополимеры или произвольные сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры на основе пропропиленгликоля, сополимеры пролипропиленоксид/этиленоксид, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Полиэтиленгликоль пропиональдегид обладает преимуществами для производства за счет его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может варьировать, и если присоединяется более чем один полимер, то полимеры могут представлять одинаковые или различные молекулы. В целом число и/или тип полимеров, используемых для дериватизации, можно определить с учетом, не ограничиваясь этим, конкретных свойств или функций антитела, которое подвергается совершенствованию, будет ли производное антитела использоваться в лечении в определенных условиях и т.д.
В еще одном варианте осуществления обеспечиваются конъюгаты антитела и небелковой группы, которые могут избирательно нагреваться при воздействии облучения. В одном варианте осуществления небелковая группа представляет собой углеродную нанотрубку (Kam et al., Proc. Natl. Acad. Sci. USA, 102:11600-11605 (2005)). Радиация может иметь любую длину волны, и она включает, не ограничиваясь этим, длины волн, которые не оказывают губительного действия на нормальные клетки, но которые нагревают небелковую группу до температуры, при которой клетки, находящиеся проксимальнее к комплексу антитело-небелковая группа, погибают.
Получение вариантных IgG
Вариантные IgG можно получить с использованием любого способа, известного в данной области. В некоторых вариантах осуществления последовательности вариантных IgG используют для получения нуклеиновых кислот, которые кодируют последовательности, и которые затем можно клонировать в клетки-хозяева, эспрессировать и анализировать, если желательно. Данные протоколы проводят с использованием хорошо известных способов и различных методов, которые могут найти применение, и которые описаны в Molecular Cloning - A Laboratory Manual, 3th Ed., (Maniatis, Cold Spring Harbor Laboratiry Press, New York, 2001) и Current Protocols in Molecular Biology (John Wiley & Sons), оба источника в полном объеме включены в данный документ для сведения. Нуклеиновые кислоты, которые кодируют вариантные IgG, можно включить в экспрессирующий вектор для экспрессии белка. Как правило, экспрессирующие векторы включают белок, функционально связанный, т.е. помещенный в функциональную связь с контрольными или регуляторными последовательностями, селектируемые маркеры, любые партнеры по слиянию и/или дополнительные элементы. Вариантные IgG можно получить культивированием клетки-хозяина, трансформированной нуклеиновой кислотой, предпочтительно экспрессирующим вектором, содержащим нуклеиновую кислоту, кодирующую вариантные IgG, в подходящих условиях для индукции или стимуляции экспрессии белка. Можно использовать широкий ряд подходящих клеток-хозяев, включая, не ограничиваясь этим, клетки млекопитающих, бактерий, насекомых и дрожжей. Например, в данном изобретении могут найти применение различные клеточные линии, приведенные в каталоге клеточных линий АТСС, Американской коллекции типовых культур, который в полном объеме включен в данный документ для сведения. Способы введения экзогенной нуклеиновой кислоты в клетки-хозяева являются хорошо известными в данной области, и они могут различаться в зависимости от используемой клетки-хозяина.
В некоторых вариантах осуществления вариантные IgG после экспрессии очищают или выделяют. Антитела можно очистить или выделить различными путями, известными в данной области. Стандартные способы очистки включают хроматографические, электрофоретические, иммунологические методы, преципитацию, диализ, фильтрование, концентрирование и хроматофокусирование. В данной области хорошо известно, что различные природные белки связываются с антителами, например, бактериальные белки А, G и L, и данные белки могут найти применение при очистке антител. Часто очистке может способствовать определенный партнер по слиянию. Например, белки можно очистить с использованием смолы с глютатионом, если используют слияние с GST, Ni+2 аффинную хроматографию, если используют His-метку, или иммобилизованное анти-flag антитело в случае применения flag-метки. Общие рекомендации по подходящим методам очистки смотрите в Antibody Purification: Principles and Practice, 3th Ed., Scopes, Springer-Verlag, NY, 1994; этот источник в полном объеме включен в данный документ для сведения.
Скрининг вариантных IgG
Вариантные IgG по настоящему изобретению можно подвергнуть скринингу с использованием различных способов, которые включают, не ограничиваясь этим, тесты в условиях in vitro, тесты в условиях in vivo и клеточные тесты, и технологии отбора. Для скрининга можно использовать автоматические методы скрининга и технологии скрининга с высокой пропускной способностью. В скрининге можно использовать партнера по слиянию или метку, например иммунную метку, изотопную метку или метку с небольшой молекулой, такую как флуоресцентная метка или калориметрический краситель.
В некоторых вариантах осуществления функциональные и/или биофизические свойства вариантных IgG подвергают скринингу в условиях in vitro. В некоторых вариантах осуществления белок оценивают в скрининге на функциональную активность, например, его способность катализировать реакцию или аффинность связывания с его мишенью.
Подгруппой методов скрининга являются методы, с помощью которых отбирают подходящих членов библиотеки. Способы, описанные в данном документе, называются «методами отбора», и данные методы находят применение в настоящем изобретении для скрининга вариантных IgG. В том случае, когда скринингу подвергаются библиотеки белков с использованием метода отбора, подходящими являются только те члены библиотеки, которые являются ценными, т.е. отвечают определенным критериям отбора, их размножают, выделяют и/или наблюдают. В данной области известны различные методы отбора, которые можно использовать в настоящем изобретении для скрининга белковых библиотек. Другие методы отбора, которые могут найти применение в настоящем изобретении, включают методы, не основанные на дисплее, такие как методы в условиях in vivo. Подгруппа методов отбора, относящаяся к методам «направленного выделения», представляет протоколы, включающие спаривание или обеспечение ценных последовательностей во время отбора, в некоторых случаях с включением новых мутаций.
В некоторых вариантах скрининга вариантные IgG подвергают скринингу с использованием одного или нескольких клеточных тестов или тестов, проводимых в условиях in vivo. Для таких тестов, как правило, очищенные или неочищенные белки вносят извне таким образом, что клетки подвергаются воздействию отдельных вариантов или пулов вариантов, относящихся к библиотеке. Обычно, но не всегда, данные тесты основаны на оценке функции вариантного IgG; т.е. способности вариантного IgG связываться с его мишенью и опосредовать определенное биохимическое событие, например, эфффекторную функцию, ингибирование лиганд/рецептор, апоптоз и тому подобное. Часто такие тесты включают мониторинг ответа клеток на IgG, например, в виде клеточной пролиферации, миграции клеток, ангиогенеза, выживаемости клеток, гибели клеток, изменения морфологии клеток или активации транскрипции, например, экспрессии в клетках природного гена или гена-репортера. Например, с помощью таких тестов можно оценить способность вариантов IgG проявлять ADCC, ADCP или CDC. Для постановки некоторых тестов может потребоваться добавление дополнительных клеток или компонентов, т.е. в дополнении к клеткам-мишеням, например, сывороточного комплемента или эффекторных клеток, таких как моноциты периферической крови (PBMC), NK-клетки, макрофаги и тому подобное. Такие дополнительные клетки могут происходить из любого организма, предпочтительно человека, мыши, крысы, кролика и обезьяны. В некоторых вариантах осуществления антитела могут ингибировать ангиогенез, и в данной области хорошо известны методы мониторинга такой активности. В еще одном варианте осуществления антитела могут вызвать апоптоз некоторых клеточных линий, экспрессирующих мишень, или они могут опосредовать атаку на клетки-мишени иммунных клеток, которые вносят в тест. В данной области известны способы мониторинга гибели или выживаемости клеток, и они включают применение красителей, иммунохимических, цитохимических или радиоактивных реагентов. Активация транскрипции также может служить в качестве метода оценки функции в клеточных тестах. Альтернативно скрининг на клетках проводят с использованием клеток, которые трансформированы или трансфицированы нуклеиновой кислотой, кодирующей варианты. То есть вариантные IgG не добавляют к клеткам экзогенно.
Биологические свойства вариантных IgG можно охарактеризовать в экспериментах на уровне клетки, ткани или организма в целом. Лекарственные средства часто тестируют на животных, включая, не ограничиваясь этим, мышей, крыс, кроликов, собак, кошек, свиней и обезьян, для оценки эффективности лекарственного средства в лечении заболевания или на модели заболевания, или для исследования фармакокинетики, токсичности и других свойств лекарственного средства. Животные могут представлять модели заболевания. Часто лекарственные средства тестируют на мышах, включая, не ограничиваясь этим, бестимусных мышей, мышей SCID, мышей с ксенотрансплантатами и трансгенных мышей (в том числе нокин и нокаут). Результаты таких экспериментов могут иметь большое значение для определения потенциальной возможности применения белка в качестве лекарственного средства. Для тестирования можно использовать любой организм, предпочтительно млекопитающих. Например, обезьяны являются подходящими моделями для терапевтических испытаний за счет их генетической близости к людям, и таким образом, их можно использовать для оценки эффективности, токсичности, фармакокинетики или других свойств вариантных IgG. Клиническое изучение средств у людей в конечном итоге необходимо для получения официального разрешения к применению, и таким образом, предусматривается проведение этих испытаний. Таким образом, можно провести клинические испытания вариантных IgG у людей в целях определения их терапевтической эффективности, токсичности, иммуногенности, фармакокинетики и/или других клинических свойств.
Терапевтические применения вариантных IgG
Вариантные IgG могут найти применение в широком ряду продуктов. В некоторых вариантах осуществления вариант IgG является терапевтическим, диагностическим средством или исследовательским реагентом. Вариантный IgG может найти применение в композиции антитела, которое представляет собой моноклональное или поликлональное. В некоторых вариантах осуществления вариантные IgG используют для блокирования, антагонистического или агонистического действия в отношении антигена-мишени, такого как VEGF. В некоторых вариантах осуществления вариантные IgG используют для блокирования или нейтрализации активности VEGF. В одном варианте осуществления активность VEGF представляет собой ангиогенез.
Вариантные IgG можно использовать для различных терапевтических целей, включая, не ограничиваясь этим, лечение пациентов с неопластическими и/или доброкачественными заболеваниями, описанными в данном документе в разделе «Определения». В некоторых вариантах осуществления пациентов вначале лечат IgG дикого типа, и затем они проходят лечение вариантным IgG. В одном варианте осуществления пациентов вначале лечат бевацизумабом, и затем лечат вариантным IgG, например, вариантом бевацизумаба. В некоторых вариантах осуществления пациенты проходят лечение бевацизумабом в течение примерно 6 месяцев, и затем их лечат вариантным IgG, например, вариантом бевацизумаба.
Ряд антител и слитых Fc-белков разрешен для применения в клинических испытаниях, или находится на стадии разработки, эти продукты в данном документе называются «клиническими продуктами и кандидатами». В некоторых вариантах осуществления вариантные IgG по настоящему изобретению могут найти применение в ряде клинических продуктов и кандидатов. Примеры антител, которые можно модифицировать, включают, не ограничиваясь этим, антитело, которое может связываться с антигеном-мишенью, таким как VEGF, EGFR (ErbB-1), Her2/neu (ErbB-2), Her3 (ErbB-3), Her4 (ErbB-4), CD20, IgE, CD11, липопротеин низкой плотности (LDL), интерлейкин-4 (IL-4), интерлейкин-13 (IL-13), эпитоп антигена вируса гепатита С, А-бета, IL-17А, IL-17F, DR6, DR5, эпитоп антигена антигена цитомегаловируса человека, эпитоп антигена Staphylococcus aureus, тканевой фактор, альфа4бета7 интегрин, альфа5бета1 интегрин, CTLA4, CD3, эпитоп RSV, NFальфа, CD147, IL-8, MUC18, MUC1, альфа4бета1 (VLA-4) интегрин, рецептор лимфотоксина альфа, рецептор лимфотоксина бета (LTBR), TGF-β2, IL-12, TGFβ1, эотаксин1, BAFF, TRAIL-R1, IL-15, гепараназа I, CD40, CD154, CD80, CD23, фактор миграции макрофагов (MIF), KDR, flk-1, кадгерин VE, карциноэмбриональный антиген (CEA), CD22, CTLA4, CD30, межклеточная молекула-1 адгезии, рецептор 3 антифибробластного ростового фактора (FGFR-3), гамма-интерферон, IL-12, антитело Ep-CAM и интегрин бета2.
Примеры клинических продуктов и кандидатов, которые можно модифицировать, включают, не ограничиваясь этим, анти-VEGF антитело авастин® (бевацизумаб, Genentech) (смотрите, например, патент США № 7169901, в полном объеме включенный в данный документ для сведения); гуманизированное моноклональное анти-HER2 антитело герцептин® (трастузумаб, Genentech) (смотрите, например, патент США № 7169901, в полном объеме включенный в данный документ для сведения); химерное анти-CD20 антитело ритуксан® (ритуксимаб, IDEC/Genentech/Roche); анти-IgE антитело ксолаир® (омализумаб, Genentech); другие анти-CD20 антитела; анти-CD11a антитело раптива® (эфализумаб®, Genentech/Xoma); анти-HER2 антитело омнитарг® (пертузумаб, Genentech); анти-oxLDL антитело (смотрите, например, публикацию заявки на патент США № 2004202653 и международную заявку WO 2004030607, оба источника в полном объеме включены в данный документ для сведения); анти-CD4 антитело MTRX1011A (смотрите, например, международную заявку WO 02/102853, содержание которой в полном объеме включено в данный документ для сведения); биспецифические антитела, антигенами которых являются IL-4 и IL-13; анти-HCV антитело; анти-IL-17A/F антитело; анти-А-бета антитело; анти-DR6 антитело; антитело к человеческому цитомегаловирусу (HCMV); антитела к семейству рецепторов HER; антитело к тканевому фактору; антитело MLN-02; гуманизированное IgG1 моноклональное антитело к интегрину α4β7 (ранее оно называлось LDP-02, Genentech/Millenium Pharmaceuticals); гуманизированное анти-CD18 антитело F(ab')2; и гуманизированное анти-IgE антитело IgG1 rhuMab-E25 (Genentech/Novartis/Tanox Biosystems).
Дополнительные клинические продукты и кандидаты, которые можно модифицировать, включают, не ограничиваясь этим, химерное анти-CD20 антитело, официально разрешенное для лечения неходжкинской лимфомы; анти-CD20 антитело HuMax-CD20 (Genmab); анти-CD20 антитело AME-133 (смотрите, например, патент США № 5500362, в полном объеме включенный в данный документ для сведения, Applied Molecular Evolution); hA20 (Immunomedics, Inc.); HumaLYM (Intracel) и PRO70769 (PCT/US2003/04426, в полном объеме включенная в данный документ для сведения). Модификации Fc-участка, описанные в данном документе, могут быть полезными для ряда антител к членам семейства рецепторов эпидермального ростового фактора, включающим EGFR (ErbB-1), Her2/neu (ErbB-2), Her3 (ErbB-3), Her4 (ErbB-4). Например, варианты IgG могут найти применение для ряда продуктов, таких как антитело, которое по существу аналогично эрбитуксу® (цетуксимабу, Imclone) (патент США № 4943533; международная заявка WO 96/40210, оба источника в полном объеме включены в данный документ для сведения); химерное анти-EGFR антитело, находящееся на стадии клинических испытаний для лечения различных видов злокачественных опухолей; ABX-EGF (патент США № 6235883; включенный в полном объеме в данный документ для сведения; Abgenix/Immunex/Amgen); HuMax-EGFr (патент США № 10/172317; включенный в полном объеме включены в данный документ для сведения); 425, EMD55900, EMD62000 и EMD72000 (Merck KGaA) (патент США № 5558864; Murthy et al., Arch. Bioche. Biophys., 252(2):549-560 (1987); Rodeck et al., Cell Biochem., 35(4):315-20 (1987); Kettle et al., Protein Eng., 4(7):773-83 (1991); все источники в полном объеме включены в данный документ для сведения); ICR62 (Institute of Cancer Research) (международная заявка WO 95/20045; Modjtahedi et al., Cell Biophys., 22(1-3):129-146 (1993); Modjtahedi et al., Brit. J. Cancer, 73(2):228-235 (1996); Modjtahedi et al., Int. J. Cancer, 105(2):273-280 (2003); все источники в полном объеме включены в данный документ для сведения); TheraCIM hR3 (YM Bioscinces, Canada and Centro de Immunologia Molecular, Cuba (патенты США № 5891996; 6506883; Mateo et al., Immunotechnology, 3(1):71-81 (1997), все источники в полном объеме включены в данный документ для сведения); mAb-806 (Ludwig Institute for Cancer Research, Memorial Kettering) (Jungbluth et al., Proc. Natl. Acad. Sci. USA, 100(2):639-644 (2003); KSB-102 (KS Biomedix, в полном объеме включенный в данный документ для сведения); MR1-1 (IVAX, National Cancer Institute) (WO 0162931F2, в полном объеме включенная в данный документ для сведения); и SC100 (Scancel) (WO 01/88138, в полном объеме включенная в данный документ для сведения). В некоторых вариантах осуществления варианты IgG по настоящему изобретению могут найти применение для ряда продуктов, таких как кампат® (алемтузумаб, Genzyme Corporation), гуманизированное моноклональное антитело, официально разрешенное в настоящее время для лечения В-клеточного лимфоцитарного лейкоза. Варианты IgG по настоящему изобретению могут найти применение для различных антител или слитых Fc-конструкций, которые по существу аналогичны другим клиническим продуктам и кандидатам, включая, не ограничиваясь этим, VEGF-Trap (Regeneron); муромонаб-CD3 (Orthclone OKT3); анти-CD3 антитело (Ortho Biotech/Johnson&Johnson); анти-CD20 антитело зевалин® (ибритумомаб тиуксетан, IDEC/Schering AG); анти-CD33 антитело милотарг® (белок р67) антитело гемтузумаб озогамицин (Celltech/Wyeth); анти-LFA-3 антитело слитый Fc-белок амевив® (алефацепт, Biogen); реопро® (абциксимаб, Centocor/Lilly); симулект® (басиликсимаб, Novartis); синагис® (паливизумаб, MedImmune); анти-TNFальфа антитело ремикад® (инфликсимаб, Centocor); анти-TNFальфа антитело гумира® (адалимумаб, Abbott); гуманизированное IgG4 анти-TNF антитело гумикад® (Celltech); анти-TNFальфа слытый Fc-белок энбрел® (этанерцепт, Immunex/Amgen); анти-CD147 антитело ABX-CBL (Abgenix); анти-IL-8 антитело ABX-IL8 (Abgenix); анти-MUC18 антитело ABX-MA1 (Abgenix); анти-MUC1 антитело пемтумомаб (R1549, 90Y-muHMG1) (Antisoma); анти-MUC1 антитело терекс (R1550) (Antisoma); AngioMab (AS1405) (Antisoma); HuBC-1 (Antisoma); тиоплатин (AS1407) (Antisoma); тисабри® (формалли антегрен®, натализумаб); анти-альфа-4-бета-1 (VLA-4) и альфа-4-бета-7 антитело (Biogen); анти-VLA-1 интегрин антитело VLA-1 mAb (Biogen); антитело к рецептору лимфотоксина бета (LTBR) LTBR mAb (Biogen); анти-TGF-β2 антитело CAT-152 (Cambridge Antibody Technology); J695, анти-IL-12 антитело (Cambridge Antibody Technology/Abbott); CAT-192, анти-TGFβ1 антитело (Cambridge Antibody Technology/Genzyme); CAT-213, анти-эотаксин1 антитело (Cambridge Antibody Technology); лимфостат-В®, анти-Blys антитело (Cambridge Antibody Technology/Human Genome Sciences Inc.); TRAIL-R1mAb, анти-TRAIL-R1 антитело (Cambridge Antibody Technology/Human Genome Sciences Inc.); HUMAX-CD4, анти-CD4 антитело (Genmab); HuMax-IL15, анти-IL15 антитело (Genmab/Amgen); HuMax-Inflam (Genmab/Medarex); HuMax-Cancer, анти-гепараназа I антитело (Genmab/Medarex/Oxford GlycoSciences); HuMax-Lymphoma (Genmab/Amgen); HuMax-TAC (Genmab); IDEC-131, анти-CD40L антитело (IDEC Pharmaceutials); IDEC-151 (кленоликсимаб), анти-CD4 антитело (IDEC Pharmaceutials); IDEC-114, анти-CD80 антитело (IDEC Pharmaceutials); IDEC-152, анти-CD23 антитело (IDEC Pharmaceutials); антитела к фактору миграции макрофагов (MIF) (IDEC Pharmaceutials); BEC2, антиидиотипическое антитело (Imclone); IMC-1C11, анти-KDR антитело (Imclone); DC101, анти-flk-1 антитело (Imclone); анти-VE кадгерин-антитело (Imclone); CEA-CIDE®, антитело к карциноэмбриональному антигену (СЕА) (Immunomedics); лимфоцид® (эпратузумаб); анти-CD22 антитело (Immunomedics); AFP-Cide (Immunomedics); MyelomaCide (Immunomedics); AFP-LkoCide (Immunomedics); ProstaCide (Immunomedics); MDX-010, анти-CTLA4 антитело (Medarex); MDX-060, анти-CD30 антитело (Medarex); MDX-070 (Medarex); MDX-018 (Medarex); осидем® (IDM-1), анти-Her2 антитело (Medarex/Immuno-Designed Molecules); CNTO 148, анти-TNFα антитело (Medarex/Centocor/J&J); CNTO 1275, анти-цитокин антитело (Centocor/J&J); MOR101 и MOR102, антитело к межклеточной молекуле 1 адгезии (ICAM-1, также известное как CD54) (MorphoSys); MOR201, антитело к рецептору 3 ростового фактора фибробластов (FGFR-3) (MorphoSys); нувион® (визилизумаб), анти-CD3 антитело (Protein Design Labs); HuZAF®, анти-интерферон гамма антитело (Protein Design Labs); антитело к интегрину α5β1 (Protein Design Labs); анти-IL-12 (Protein Design Labs); ING-1, анти-Ep-CAM антитело (Xoma); и MLN01, анти-бета2 интегрин антитело (Xoma), все источники, цитированные в данной абзаце, в полном объеме приведены в данном документе для сведения.
Вариантные IgG с модификациями в Fc-участке IgG по настоящему изобретению можно включить в приведенные выше кандидаты для клинического применения и используемые в клинике продукты, или в антитела и слитые Fc-белки, по существу аналогичные им. Вариантные IgG по настоящему изобретению также можно включить в варианты приведенных выше кандидатов для клинического применения и используемые в клинике продукты, которые представляют собой гуманизированные, со зрелой аффинностью, генно-инженерные или модифицированные иным путем.
В некоторых вариантах осуществления вариантные IgG по настоящему изобретению могут найти применение для лечения доброкачественных, предзлокачественных или неметастатических опухолей; для лечения «дремлющих» опухолей или микрометастазов; для профилактики рецидива опухолей или вторичного роста; или для лечения или профилактики злокачественной опухоли у субъекта с риском развития злокачественной опухоли. Например, вариантные Fc-модификации, описанные в данном документе, можно использовать для адъювантной терапии в целях лечения субъекта с неметастатической злокачественной опухолью после радикальной хирургической операции или для неоадъювантной терапии для лечения субъекта с функциональной злокачественной опухолью, когда терапию проводят до хирургического удаления злокачественной опухоли у субъекта. Несмотря на то, что терапевтические применения отделены ниже от профилактики, неоадъювантной терапии и адъювантной терапии, специалистам в данной области, очевидно, понятно, что данные категории необязательно являются взаимоисключающими.
Классификация опухолей
Системы классификации злокачественных опухолей по стадиям дают представление о том, насколько далеко анатомически распространилась злокачественная опухоль, и дают основание поместить пациентов с одинаковым прогнозом и лечением в одну группу согласно стадии заболевания. Можно провести несколько анализов для определения стадии злокачественной опухоли, включающих биопсию и некоторые визуализирующие методы обследования, такие как рентгеновское обследование грудной клетки, маммограмма, сканирование СТ и сканирование МРТ. Также используют анализ крови и клиническое обследование для оценки состояния здоровья пациента в целом и установления того, насколько злокачественная опухоль проникла в другие органы.
Для определения стадии злокачественной опухоли Американский Объединенный Комитет по раку вначале размещает злокачественные опухоли, в частности, солидные опухоли, по буквенным категориям с использованием системы стадий TNM. Злокачественные опухоли обозначаются буквой Т (размер опухолей), N (пальпируемые лимфатические узлы) и/или М (метастазы). Т1, Т2, Т3 и Т4 описывают увеличивающийся размер первичного поражения; N0, N1, N2, N3 указывают на прогрессивно возрастающее вовлечение лимфатических узлов; и М0 и М1 отражают отсутствие или наличие отдаленных метастазов.
Во втором методе определения стадии злокачественной опухоли, также известной как Overall Stage Grouping или Roman Numeral Staging, злокачественные опухоли подразделяются на стадиях 0-IV, включая размер первичных поражений, а также наличие распространения в лимфатические узлы или отдаленных метастазов. В данной системе случаи подразделяются на четыре стадии, обозначаемые римскими цифрами I-IV, или классифицируются, как «рецидивы». Для некоторых злокачественных опухолей 0 относится к опухоли «in situ» или «Tis», например, проточная карцинома in situ или лобулярная карцинома in situ для рака молочной железы. Аденомы высокой злокачественности также можно классифицировать как стадию 0. В целом злокачественные опухоли стадии I представляют собой небольшие локализованные опухоли, которые обычно поддаются лечению, в то время как стадия IV является нефункциональной или метастатической злокачественной опухолью. Как правило, стадии II и III являются локально распространенными опухолями и/или сопровождаются вовлечением местных лимфатических узлов. В целом более высокие номера стадий указывают на более распространенный характер заболевания, в том числе размер опухоли и/или распространение злокачественной опухоли в лимфатические узлы и/или органы, смежные с первичной опухолью. Данные стадии определяются точно, но определение стадии является различным для каждого вида злокачественной опухоли, и это известно специалистам в данной области.
Во многих системах регистрации злокачественных опухолей, таких как NCI's Surveillance, Epidemiology and End Results Program (SEER), используется краткое изложение определения стадии опухолей. Данную систему применяют для всех типов злокачественных опухолей. Она подразделяет случаи рака на пять основных категорий:
Опухоль in situ представляет собой злокачественную опухоль на ранней стадии, которая находится только в слое клеток, в котором она начала свое развитие.
Локализованная опухоль представляет собой злокачественную опухоль, которая ограничена органом, в котором она начала свое развитие, без признаков распространения.
Региональная опухоль представляет собой злокачественную опухоль, которая распространяется из первоначального (первичного) места развития в ближайшие лимфатические узлы или органы и ткани.
Отдаленная опухоль представляет собой злокачественную опухоль, которая распространяется из первичного места развития в отдаленные органы и отдаленные лимфатические узлы.
Неизвестно используется для описания случаев, для которых отсутствует достаточная информация, необходимая для определения стадии опухоли.
Кроме того, часто наблюдают рецидив злокачественной опухоли через месяцы или годы после удаления первичной опухоли. Злокачественную опухоль, которая рецидивирует после удаления всей видимой опухоли, называют рецидивирующим заболеванием. Заболевание, рецидив которого происходит в области первичной опухоли, является местно рецидивирующим, и заболевание, которое рецидивирует в виде метастазов, относят к отделенному рецидивирующему заболеванию. «Дремлющая» опухоль представляет собой опухоль, находящуюся в состоянии покоя, в которой опухолевые клетки присутствуют, но прогрессирование опухоли клинически не детектируется. «Микрометастазы» представляют собой небольшие метастазы или клетки, которые распространяются от первичной опухоли в другие части тела. Микрометастазы могут детектироваться или не детектироваться при проведении скрининговых тестов или диагностическом обследовании. Способы по изобретению являются пригодными для предупреждения рецидивирования дремлющих опухолей или микрометастазов, или рецидивирования опухолей, например, в случае, когда дремлющая опухоль или микрометастазы имеют место, но они могут детектироваться или не детектироваться клинически.
Способы по изобретению также являются пригодными для лечения злокачественных опухолей на ранних стадиях, включая, не ограничиваясь этим, доброкачественные, предзлокачественные или неметастатические опухоли. Такие опухоли включают любую опухоль стадии 0, I или II; любую неметастатическую опухоль стадии II; любое состояние, которое, как правило, предшествует или переходит в рак, включая, не ограничиваясь этим, дисплазию; и любую опухоль, которая остается локализованной в месте появления и не инфильтрирует, инвазирует или метастазирует в отдаленные места. Примеры доброкачественных, предзлокачественных или неметастатических опухолей включают полип, аденому, фиброму, липому, гастриному, инсулиному, хондрому, остеому, гемангиому, лимфангиому, менингиому, лейомиому, рабдомиому, плоскоклеточную папиллому, акустические нейромы, нейрофиброму, цистаному желчных протоков, лейомиомы, мезотелиомы, тератомы, миксомы, трахомы, грануломы, гамартому, переходноклеточную папиллому, мультиморфную аденому слюнной железы, десмоидную опухоль, кожную цистпапиллому, цистаденому, фокальную узелковую гиперплазию и узелковую регенеративную гиперплазию.
Поскольку ангиогенез принимает участие в росте первичной опухоли и метастазировании, то антиангиогенное лечение по изобретению способно ингибировать неопластический рост опухоли в первичном месте, а также предупредить метастазирование опухолей во вторичные места, и следовательно, позволит воздействовать на опухоли другими лекарственными средствами.
Дополнительная информация, касающаяся адъювантной и неоадъювантной терапии и лечения опухолей на ранних стадиях, приводится в заявке на патент США 12/002605 и РСТ заявки PCT/US2007/088000, содержание данных патентных заявок точно включено в данный документ для сведения.
Профилактика
В некоторых вариантах осуществления вариантные IgG можно использовать для лечения доброкачественных, предзлокачественных опухолей или опухолей на ранних стадиях, или для лечения или профилактики рецидива опухолей. В некоторых вариантах осуществления вариантный IgG представляет собой анти-VEGF антитело. В одном варианте осуществления вариантный IgG представляет собой вариант бевацизумаба. В одном варианте осуществления вариантный IgG содержит гипервариабельные области бевацизумаба. В еще одном варианте осуществления вариантный IgG содержит вариабельный домен тяжелой цепи (SEQ ID NO:1) и вариабельный домен легкой цепи (SEQ ID NO:2). В еще одном варианте осуществления вариантный IgG содержит вариабельный домен тяжелой цепи (SEQ ID NO:7) и вариабельный домен легкой цепи (SEQ ID NO:8).
Способы можно использовать для лечения самой злокачественной опухоли или предупреждения прогрессирования опухоли и перехода в метастатическую или инвазивную стадию, а также перехода в опухоль с более высокой злокачественностью или на более высокую стадию. Например, способы по изобретению можно использовать для лечения субъекта со злокачественной опухолью стадии 0 или полипов для предупреждения перехода на стадию I или более высокую стадию. Аналогично у пациента со злокачественной опухолью II стадии способы можно использовать для предупреждения прогрессирования злокачественной опухоли до стадии III или стадии IV.
Вариантные IgG также можно использовать для профилактики рецидива опухоли. Например, если опухоль идентифицирована и подверглась лечению (например, химиотерапии или хирургическому удалению), то вариантный IgG можно использовать для профилактики рецидива колоректального рака локально или метастазирования колоректального рака. Для предупреждения рецидива опухоли вариантные IgG можно использовать, например, для лечения «дремлющей» опухоли или микрометастазов, или профилактики роста или повторного роста «дремлющей» опухоли или микрометастазов, которые могут детектироваться или могут не детектироваться клинически.
В некоторых вариантах осуществления вариантные IgG можно использовать для профилактики злокачественной опухоли у субъекта, у которого никогда не было рака, или у которого имеется риск развития рака. Существуют различные факторы риска, о которых известно, что они ассоциированы с развитием рака, и многие из них описаны в данном документе. Кроме того, субъекта с наличием наследственного ракового синдрома рассматривают в качестве субъекта с риском развития рака.
Неоадъювантная терапия
Изобретение относится к способам неоадъювантной терапии до хирургического удаления функциональной злокачественной опухоли у субъекта, например, человека, включающим введение пациенту (например, когда у пациента диагностируют опухоль и/или рак) эффективного количества вариантного IgG. В некоторых вариантах осуществления вариантный IgG представляет собой анти-VEGF антитело. В одном варианте осуществления вариантный IgG представляет собой вариант бевицизумаба. В одном варианте осуществления вариантный IgG содержит гипервариабельные области бевацизумаба. В еще одном варианте осуществления вариантный IgG содержит вариабельный домен тяжелой цепи (SEQ ID NO:1) и вариабельный домен легкой цепи (SEQ ID NO:2). В еще одном варианте осуществления вариантный IgG содержит вариабельный домен тяжелой цепи (SEQ ID NO:7) и вариабельный домен легкой цепи (SEQ ID NO:8).
В некоторых вариантах осуществления вариантный IgG вводят в комбинации, по меньшей мере, с одним химиотерапевтическим средством. Можно также использовать дополнительную стадию введения субъекту эффективного количества вариантного IgG после хирургической операции для предупреждения рецидива злокачественной опухоли вместе с неоадъювантной терапий, описанной в данном документе. Для способов, которые включают дополнительную стадию введения субъекту эффективного количества вариантного IgG после хирургической операции, можно использовать любой из адъювантных способов, описанных в данном документе.
Например, один способ включает лечение злокачественной опухоли у субъекта, включающий следующие стадии: а) первую стадию, содержащую множество циклов лечения, где каждый цикл включает введение субъекту эффективного количества вариантного IgG и, по меньшей мере, одного химиотерапевтического средства с заранее определенным интервалом; b) радикальную хирургическую операцию по удалению злокачественной опухоли и с) вторую стадию, включающую множество поддерживающих циклов, где каждый цикл включает введение субъекту эффективного количества вариантного IgG без какого-либо химиотерапевтического средства с заранее определенным интервалом.
В одном варианте осуществления схемы введения неоадъювантная терапия включает первую стадию, на которой вариантный IgG и один или несколько химиотерапевтических средств вводят пациентам во множестве неоадъювантных циклов с последующей хирургической операцией для радикального удаления опухоли. В некоторых вариантах осуществления неоадъювантная терапия продолжается в течение менее одного года, в одном варианте осуществления в течение менее шести месяцев перед хирургической операцией.
Адъювантная терапия
Изобретение относится к способам адъювантной терапии, включающим введение вариантного IgG субъекту с неметастатической злокачественной опухолью после радикальной операции. В некоторых вариантах осуществления вариантный IgG представляет собой анти-VEGF антитело. В одном варианте осуществления вариантный IgG представляет собой вариант бевицизумаба. В одном варианте осуществления вариантный IgG содержит гипервариабельные области бевацизумаба. В еще одном варианте осуществления вариантный IgG содержит вариабельный домен тяжелой цепи (SEQ ID NO:1) и вариабельный домен легкой цепи (SEQ ID NO:2). В еще одном варианте осуществления вариантный IgG содержит вариабельный домен тяжелой цепи (SEQ ID NO:7) и вариабельный домен легкой цепи (SEQ ID NO:8).
Например, способ может включать следующие стадии: а) первую стадию, содержащую множество циклов лечения, где каждый цикл включает введение субъекту эффективного количества вариантного IgG и, по меньшей мере, одного химиотерапевтического средства с заранее определенным интервалом и b) вторую стадию, включающую множество поддерживающих циклов, где каждый цикл включает введение субъекту эффективного количества вариантного IgG без какого-либо химиотерапевтического средства с заранее определенным интервалом; где продолжительность комбинированных первой и второй стадий составляет, по меньшей мере, один год после первоначального послеоперационного лечения. В одном варианте осуществления первая стадия включает первое множество циклов лечения, где введение вариантного IgG и первую схему химиотерапии проводят с последующим вторым множеством циклов лечения, где вводят вариантный IgG и проводят вторую схему химиотерапии.
Как правило, вариантный IgG вводят в течение периода времени, когда субъект восстанавливается после хирургической операции. Данный период времени может включать период, необходимый для заживления раны или заживления хирургического разреза, период, необходимый для снижения риска расхождения краев раны, или период времени, необходимый для того, чтобы субъект вернулся к состоянию здоровья, по существу аналогичного или лучшего, по сравнению с состоянием здоровья, имевшего место до хирургической операции. Период между радикальной операцией и первым введением вариантного IgG также может включать период, необходимый для «отдыха от лекарств», когда субъекту необходим или требуется период времени между терапевтическими курсами. Как правило, период времени между радикальной операцией и началом лечения вариантным IgG может составлять менее одной недели, 1 неделю, 2 недели, 3 недели, 4 недели (28 суток), 5 недель, 6 недель, 7 недель, 8 недель, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 1 год, 2 года, 3 года или более. В одном варианте осуществления период времени между радикальной операцией и введением вариантного IgG составляет более 4 недель (28 суток) и менее 1 года.
В одной схеме введения адъювантная терапия включает первую стадию, на которой вариантный IgG и один или несколько химиотерапевтических средств вводят пациентам во множестве циклов лечения; и вторую стадию, на которой вариантный IgG используют в качестве единственного средства во множестве поддерживающих циклов. В некоторых вариантах осуществления вариантный IgG представляет собой вариант бевацизумаба, и цикл лечения может составлять восемь недель, что означает, что пациенты получают одну дозу химиотерапии и одну дозу вариантного бевацизумаба каждые восемь недель. В некоторых вариантах осуществления цикл лечения может составлять двенадцать недель, что означает, что пациенты получают одну дозу химиотерапии и одну дозу вариантного бевацизумаба каждые двенадцать недель. В некоторых вариантах осуществления адъювантная терапия продолжается, по меньшей мере, в течение одного года с момента начала лечения, и успех лечения субъекта оценивают после данного периода времени. Результативность лечения легко оценить с использованием обычных методов и тестов.
Дозы, составы и продолжительность лечения
Композицию вариантного IgG необходимо приготавливать, дозировать и вводить в соответствие с надлежащей медицинской практикой. Факторы, которые следует учитывать в данном контексте, включают, не ограничиваясь этим, конкретное нарушение, которое подвергается лечению, конкретное млекопитающее, которое лечат, клиническое состояние отдельного пациента, причину нарушения, место введения лекарственного средства, способ введения, схему введения и другие факторы, известные практикующим специалистам в области медицины. Для профилактики и лечения заболевания подходящая доза вариантного IgG, например, антитела, по изобретению (при самостоятельном применении или в комбинации с одним или несколькими другими дополнительными лекарственными средствами) будет зависеть от типа заболевания, которое подвергается лечению, типа антитела, тяжести и течения заболевания, от того, применяется антитело в профилактических или терапевтических целях, истории болезни пациента и ответа на введение антитела, а также мнения лечащего врача. Вариантный IgG соответственно вводят пациенту однократно или многократно.
Фармацевтические композиции, описанные в данном документе, также могут содержать более одного активного вещества, если это требуется для лечения конкретного заболевания, предпочтительно с дополняющими активностями, которые не оказывают отрицательного влияния друг на друга. Такие молекулы соответственно находятся в комбинации в количествах, которые эффективны для предназначенной цели.
«Терапевтически эффективное количество» вариантного IgG, например, антитела, предназначенного для введения, должно определяться с учетом приведенных выше факторов, и оно является минимальным количеством, необходимым для профилактики, ослабления или лечения заболевания или нарушения. В некоторых вариантах осуществления «терапевтически эффективное количество» вариантного IgG для введения является минимальным количеством, необходимым для профилактики, ослабления или лечения, или стабилизации доброкачественной, предзлокачественной опухоли или злокачественной опухоли на ранней стадии; или для лечения или профилактики появления или рецидива опухоли, «дремлющей» опухоли или микрометастазов, например, при неоадъювантной или адъювантной терапии. Для вариантного IgG не требуется, но необязательно его формулируют с одним или несколькими лекарственными средствами, применяемыми в настоящее время для профилактики или лечения данного нарушения. Эффективное количество таких других лекарственных средств зависит от количества вариантного IgG в композиции, типа нарушения или лечения, и других факторов, которые обсуждались выше. Как правило, их используют в тех же дозировках и при тех же путях введения, которые применялись ранее, или примерно от 1 до 99% от используемых доз. Обычно облегчение или лечение заболевания или нарушения включает ослабление одного или нескольких симптомов или медицинских проблем, ассоциированных с заболеванием или нарушением. В случае злокачественного заболевания терапевтически эффективное количество лекарственного средства может обеспечить одно или комбинацию следующего: снизить количество злокачественных клеток; снизить размер опухоли; ингибировать (т.е. в определенной степени снизить и/или остановить) инфильтрацию злокачественных клеток в периферические органы; подавить метастазирование опухоли; в определенной степени ингибировать рост опухоли; и/или в определенной степени ослабить один или несколько симптомов, ассоциированных со злокачественной опухолью. В зависимости от степени, в которой лекарственное средство может предупредить рост и/или вызвать гибель злокачественных клеток, он может быть цитостатическим и/или цитотоксическим. В некоторых вариантах осуществления композицию по данному изобретению можно использовать для предупреждения начала развития или рецидива заболевания или нарушения у субъекта или млекопитающего.
В некоторых вариантах осуществления продолжительность лечения будет составлять период времени, необходимый по медицинским показаниям, или пока не будет достигнут желаемый терапевтический эффект (например, описанный в данном документе). В некоторых вариантах осуществления продолжительность лечения вариантным IgG составляет 2 месяца, 4 месяца, 6 месяцев, 8 месяцев, 10 месяцев, 1 год, 2 года, 3 года, 4 года, 5 лет, 10 лет или в течение всей жизни субъекта.
Обычно облегчение или лечение доброкачественной, предзлокачественной опухоли или злокачественной опухоли на ранней стадии, или неоадъювантная или адъювантная терапия злокачественной опухоли (доброкачественной или злокачественной) включает ослабление одного или нескольких симптомов или медицинских проблем, ассоциированных с заболеванием или нарушением. Терапевтически эффективное количество лекарственного средства может обеспечить одно или комбинацию следующего: снизить (например, на 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% или более) количество злокачественных клеток в опухоли; снизить размер опухоли; снизить опухолевую нагрузку; ингибировать (т.е. в определенной степени снизить и/или остановить) инфильтрацию злокачественных клеток в периферические органы; уменьшить плотность сосудов в опухоли; снизить или ингибировать рост или пролиферацию опухолевых клеток; снизить или предупредить рост «дремлющей опухоли»; подавить или предупредить рост или пролиферацию микрометастазов; снизить или предупредить повторный рост опухоли после лечения или удаления (например, в адъювантной терапии); повысить или увеличить DFS или OS у субъекта, имеющего риск развития, или с диагнозом доброкачественной, предзлокачественной или неметастатической опухоли или злокачественной опухоли; уменьшить размер опухоли для последующего проведения хирургической операции (например, в неоадъювантной терапии); и/или в определенной степени ослабить один или несколько симптомов, ассоциированных со злокачественной опухолью. В некоторых дополнительных вариантах осуществления вариантный IgG можно использовать для предупреждения появления или рецидива злокачественной опухоли у субъекта.
Для профилактики и лечения заболевания подходящая доза вариантного IgG по изобретению (при самостоятельном применении или в комбинации с одним или несколькими другими дополнительными лекарственными средствами) будет зависеть от типа заболевания, которое подвергается лечению, типа антитела, тяжести и течения заболевания, от того, применяется антитело в профилактических или терапевтических целях, истории болезни пациента и ответа на введение вариантного IgG, а также мнения лечащего врача. В некоторых вариантах осуществления вариантный IgG соответственно вводят пациенту однократно или многократно. В зависимости от типа и тяжести заболевания доза вариантного IgG в пределах примерно от 1 мкг/кг до 20 мг/кг (например, 0,1-15 мг/кг) может быть начальной дозой-кандидатом для введения пациенту, независимо от того, вводится средство один или несколько раз, или в виде продолжительной инфузии. Одна типичная суточная доза может находиться в пределах примерно от 1 мкг/кг до 100 мг/кг или выше в зависимости от факторов, указанных выше. Для повторных введений в течение нескольких суток или более, в зависимости от состояния пациента, обычно лечение продолжают до наступления желаемого подавления заболевания. В одном варианте осуществления, в зависимости от состояния пациента, лечение продолжают до излечения злокачественной опухоли, что оценивают методами, описанными в данном документе, или известными в данной области. Одна приведенная в качестве примера доза вариантного IgG будет находиться в пределах от примерно 0,05 мг/кг до примерно 20 мг/кг. Таким образом, пациенту можно вводить дозы примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг, 7,5 мг/кг, 10 мг/кг или 15 мг/кг (или любую их комбинацию). Такие дозы можно вводить c интервалом, например, каждые три, каждые восемь или каждые двенадцать недель (например, так, чтобы пациент получал от примерно двух до примерно двадцати, или, например, примерно шесть доз антитела). В некоторых вариантах осуществления начальная доза может быть более высокой нагрузочной дозой с последующим введением средства в более низких дозах. В некоторых вариантах осуществления схема дозирования включает введение начальной нагрузочной дозы, составляющей примерно 4 мг/кг, с последующим введением еженедельной поддерживающей дозы примерно 2 мг/кг антитела. Результативность данной терапии легко проследить с использованием обычных методов и тестов.
В некоторых вариантах осуществления вариантный IgG представляет собой анти-VEGF антитело. В некоторых вариантах осуществления вариантный IgG представляет собой вариант бевацизумаба.
В некоторых вариантах осуществления кратность введения вариантного IgG уменьшена по сравнению с IgG дикого типа за счет увеличенного времени полужизни вариантного IgG. В некоторых вариантах осуществления вариантный IgG вводят реже по сравнению с рекомендованной или назначенной кратностью введения IgG дикого типа.
В некоторых вариантах осуществления, когда вариантный IgG представляет собой вариант бевацизумаба, вариантный IgG можно вводить каждые 4 недели или с большими интервалами. В еще одном варианте осуществления вариантный IgG можно вводить каждые 6 недель или реже. В еще одном варианте осуществления вариантный IgG можно вводить каждые 8 недель или реже. В еще одном варианте осуществления вариантный IgG можно вводить каждые 10 недель или реже. В еще одном варианте осуществления вариантный IgG можно вводить каждые 12 недель или реже.
В некоторых вариантах осуществления вариантный IgG можно вводить первоначально каждые 2 недели и затем каждые 4 недели или с большими интервалами. В еще одном варианте осуществления вариантный IgG можно вводить первоначально каждые 2-3 недели и затем каждые 6 недели или реже. В еще одном варианте осуществления вариантный IgG можно вводить первоначально каждые 2-4 недели и затем каждые 8 недель или реже. В еще одном варианте осуществления вариантный IgG можно вводить первоначально каждые 2-5 недель и затем каждые 10 недель или реже. В еще одном варианте осуществления вариантный IgG можно вводить первоначально каждые 2-6 недель и затем каждые 12 недель или реже. В некоторых вариантах осуществления вариантный IgG представляет собой вариант бевацизумаба, и первоначально его вводят с рекомендованной для бевацизума кратностью, и затем вводят реже по сравнению с рекомендованной для бевацизума кратностью. В некоторых вариантах осуществления первоначально вводят бевацизумаб с рекомендованной кратностью и затем вариантный бевацизумаб вводят реже по сравнению с рекомендованной для бевацизума кратностью.
В некоторых вариантах осуществления вариантный IgG вводят каждые 14 суток или с большими интервалами. В некоторых вариантах осуществления вариантный IgG вводят каждые 21 сутки или реже. В некоторых вариантах осуществления вариантный IgG вводят каждые 28 суток или реже. В некоторых вариантах осуществления вариантный IgG вводят каждые 60 суток или реже. В некоторых вариантах осуществления вариантный IgG вводят каждый месяц или с большими интервалами. В некоторых вариантах осуществления вариантный IgG вводят каждые два месяца или реже. В некоторых вариантах осуществления вариантный IgG вводят каждые три месяца или реже.
В некоторых вариантах осуществления пациента лечат комбинацией вариантного IgG и одного или нескольких других лекарственных средств. Комбинированное введение включает совместное или одновременное введение средств с использованием отдельных композиций или одной фармацевтической композиции и последовательное введение в любом порядке, где необязательно имеется период времени, необходимый для того, чтобы оба (или все) активные вещества одновременно проявляли свою биологическую активность. Эффективные количества лекарственных средств, введенных в комбинации с вариантным IgG, будет определять медицинский или ветеринарный врач. Введение и корректировка дозировок проводится с целью достижения максимального контроля заболеваний, которые подвергаются лечению. Кроме того, доза будет зависеть от таких факторов, как тип используемого лекарственного средства и конкретного пациента, который лечится. В некоторых вариантах осуществления подходящие дозировки вариантного IgG являются дозами, которые используются в настоящее время для IgG дикого типа, и они могут быть ниже за счет повышенного времени полужизни, и/или комбинированного действия (синергического действия) вариантного IgG и дополнительного лекарственного средства. В некоторых вариантах осуществления комбинация ингибиторов потенцирует эффективность одного ингибитора. Термин «потенцировать» относится к повышению эффективности лекарственного средства в его обычной или рекомендованной дозе.
В некоторых вариантах осуществления схемы введения, описанные в данном документе, используют в комбинации со схемой химиотерапии. В некоторых вариантах осуществления химиотерапевтическая схема включает обычное введение средств в высоких дозах с интервалами. В некоторых вариантах осуществления химиотерапевтические средства вводят с использованием более низких и более частых доз без запланированных прерываний («метрономная химиотерапия»).
В некоторых вариантах осуществления пациент подвергается лечению комбинацией вариантного IgG и одного или нескольких химиотерапевтических средств. В некоторых вариантах осуществления химиотерапевтическое средство можно вводить до или после введения вариантного IgG. В одном варианте осуществления период времени, по меньшей мере, между одним введением химиотерапевтического средства и, по меньшей мере, одним введением вариантного IgG составляет примерно 1 месяц или менее. В одном варианте осуществления период времени, по меньшей мере, между одним введением химиотерапевтического средства и, по меньшей мере, одним введением вариантного IgG составляет примерно 2 недели или менее. Альтернативно химиотерапевтическое средство и вариантный IgG вводят пациенту одновременно в одной лекарственной форме или раздельных лекарственных формах. Лечение комбинацией химиотерапевтического средства и вариантного IgG может привести к обеспечению синергического терапевтического, более высокого эффекта по сравнению с аддитивным действием.
Химиотерапевтическое средство, если его применяют, обычно вводят в известных для него дозах, или необязательно дозы снижают за счет комбинированного действия средств или негативных побочных эффектов, возникающих при введении химиотерапевтического средства, представляющего собой антиметаболит. Подготовку и режим введения таких химиотерапевтических средств проводят согласно инструкциям организации-производителя, или как это определит специалист в данной области.
В данном документе раскрываются различные химиотерапевтические средства, например, в разделе «Определения». Примеры химиотерапевтических средств для комбинирования с вариантным IgG включают, не ограничиваясь этим, например, таксоиды (такие как доцетаксел и паклитаксел), алкалоиды барвинка (такие как винорелбин или винбластин), средства платины (такие как карбоплатин или цисплатин), ингибиторы ароматазы (такие как летрозол, анастразол или эксеместан), антиэстрогены (например, фулвестрант или тамоксифен), этопозид, тиотепа, циклофосфамид, метотрексат, липосомальный доксорубицин, пэгилированный липосомальный доксорубицин, капецитабин, гемцитабин, ингибитор COX-2 (например, целекоксиб) или ингибитор протеосом (например, PS342). Можно вводить «смеси» различных химиотерапевтических средств.
Результативность терапии легко проследить с использованием обычных методов и тестов.
В некоторых вариантах осуществления лечение или профилактика появления или рецидива опухоли, «дремлющей» опухоли или микрометастазов включает предупреждение образования опухоли или метастазов в основном после первоначального лечения или удаления опухоли (например, с использованием противоопухолевого лечения, такого как хирургическая операция, химиотерапия или лучевая терапия). После хирургической операции могут остаться остаточные опухолевые клетки или «дремлющие» узелки микрометастазов, которые обладают потенциальной способностью реактивировать «ангиогенную программу» и вызывают более экспоненциальный рост опухоли. Несмотря на то, что наличие «дремлющей» опухоли или микрометастазов необязательно детектируется при использовании клинических методов или скрининговых тестов, терапевтически эффективное количество является количеством, которое достаточно для предупреждения или снижения детектирования «дремлющей» опухоли, микрометастазов, метастазов или рецидива опухоли с использованием методов, известных клиницистам. В одном примере субъект, который подвергается хирургическому вмешательству по поводу резекции опухоли, затем получает лечение вариантным IgG и в течение времени проходит наблюдение в отношении обнаружения «дремлющей» опухоли, микрометастазов или рецидива опухоли. Вариантный IgG, например анти-VEGF антитело, можно вводить в комбинации с другим противоопухолевым средством (например, до, вместе или после терапии вариантным IgG), и введение одного или обоих средств можно продолжать, но уже в качестве поддерживающей терапии.
Дополнительные методы оценки терапевтической эффективности лечения злокачественных опухолей описаны в публикации заявки на патент США № 20050186208.
Вариантный IgG по изобретению (и любое дополнительное лекарственное средство) можно вводить любыми подходящими путями, которые включают парентеральный, подкожный, внутрибрюшинный, интрацереброспинальный, интрапульмонарный и интраназальный и, если желательно, его можно применять для местного лечения при введении в область поражения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. В некоторых вариантах осуществления вариантный IgG, например, антитело, соответственно вводят пульсирующей инфузией, в частности, со снижающимися дозами вариантного IgG. Введение можно проводить любым подходящим способом, например, с помощью инъекцией, таких как внутривенные или подкожные инъекции, отчасти в зависимости от того, должно быть введение быстрым или длительным. В некоторых вариантах осуществления вариантный IgG вводят субъекту внутривенно, например, в виде болюса или продолжительной инфузии в течение определенного периода времени.
При приготовлении и введении вариантного IgG следует учитывать локализацию мишени, связывающейся с вариантным IgG, например антителом по изобретению. В том случае, когда мишень, связывающаяся с вариантным IgG, располагается в мозге, некоторые варианты осуществления изобретения должны обеспечивать прохождение вариантного IgG через гематоэнцефалический барьер. В данной области существуют некоторые известные подходы для транспорта молекул через гематоэнцефалический барьер, включая, не ограничиваясь этим, физические способы, основанные на липидах способы, основанные на стволовых клетках способы и основанные на рецепторах и каналах способы.
Физические способы транспорта вариантного IgG, например, антитела, через гематоэнцефалический барьер включают, не ограничиваясь этим, обхождение гематоэнцефалического барьера цельком или создание отверстий в гематоэнцефалическом барьере. Способы обхождения включают, не ограничиваясь этим, прямую инъекцию в мозг (смотрите, например, Papanastassiou et al., Gene Therapy, 9:398-406 (2002)), интерстициальную инфузию/доставку с повышенной конвекцией (смотрите, например, Bobo et al., Proc. Natl. Acad. Sci. USA, 91:2076-2080 (1994)) и имплантацию устройства для доставки в мозг (смотрите, например, Gill et al., Nature Med., 9:589-595 (2003) и Gliadel WafersTM, Guildford Pharmaceuticals). Способы создания отверстий в барьере включают, не ограничиваясь этим, ультразвук (смотрите, например, публикацию заявки на патент США № 2002/0038086), осмотическое давление (например, обеспеченное введением гипертонического раствора маннита (Neuwelt E.A., Implication of the Blood-Brain Barrier and its Manipulation, Vols 1&2, Plenum Press, N.Y. (1989)), повышение проницаемости, например, под действием брадикинина или средства A-7 (смотрите, например, патенты США №№ 5112596, 5268164, 5506206 и 5686416) и трансфекцию нейронов, которые составляют гематоэнцефалический барьер, векторами, содержащими гены, кодирующие вариантный IgG (смотрите, например, публикацию патента США № 2003/0083299).
Основанные на липидах способы транспорта вариантного IgG, например, антитела, через гематоэнцефалический барьер включают, не ограничиваясь этим, инкапсулирование вариантного IgG в липосомы, которые соединяются со связывающими фрагментами антител, и затем связываются с рецепторами на эндотелии сосудов гематоэнцефалического барьера (смотрите, например, публикацию заявки на патент США № 20020025323) и покрытие вариантного IgG частицами липопротеина низкой плотности (смотрите, например, публикацию заявки на патент США № 20040204354) или аполипопротеина Е (смотрите, например, публикацию заявки на патент США № 20040131692).
В основанных на стволовых клетках способах транспорта вариантного IgG, например, антитела, через гематоэнцефалический барьер проводят стимуляцию экспрессии интересующего антитела сконструированными клетками-предшественниками нейронов (NPC) и затем имплантируют стволовые клетки в мозг индивидуума, который подвергается лечению. Смотрите Behrstock et al. (2005), Gene Ther., 15 декабря 2005 года (в этом источнике сообщается, что сконструированные NPC экспрессируют нейротрофический фактор GDNF, подавляющий симптомы болезни Паркинсона при имплантации в мозг грызунов и приматов, моделей заболевания).
Основанные на рецепторах и каналах способы транспорта вариантного IgG, например, антитела, через гематоэнцефалический барьер включают, не ограничиваясь этим, применение глюкокортикоидных блокаторов для повышения проницаемости гематоэнцефалического барьера (смотрите, например, публикации заявок на патент США № 2002/0065259, 2003/0162695 и 2005/0124533); активацию калиевых каналов (смотрите, например, публикацию заявки на патент США № 2005/0089473), ингибирование транспортеров лекарственных средств ABC (смотрите, например, публикацию заявки на патент США № 2003/0073713), покрытие антител трансферином и модуляцию активности одного или нескольких рецепторов трансферина (смотрите, например, публикацию заявки на патент США № 2003/0129186) и катионизацию антител (смотрите, например, патент США № 5004697).
Фармацевтические композиции, содержащие вариантный IgG, например, антитело, по изобретению готовят для хранения смешением вариантного IgG, имеющего желаемую степень чистоты, с необязательными физиологически приемлемыми носителями, наполнителями или стабилизаторами (Remington: The Science and Practice of Pharmacy 20th edition (2000), в форме водных растворов, лиофилизованных или других высушенных композиций. Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях, и они включают буферы, такие как фосфатный, цитратный, гистидиновый и на основе других органических кислот; антиоксиданты, такие как аскорбиновая кислота и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид, гексаметоний хлорид, бензалконий хлорид, бензетоний хлорид, феноловый, бутиловый или бензиловый спирт, алкилпарабены, такие как метил- или пропилпарабен, катехол, резорцин, циклогексанол, 3-пентанол и м-крезол); низкомолекулярные полипептиды (размером примерно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие средства, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, Zn-протеиновые комплексы); и/или неионогенные поверхностно-активные вещества, такие как твинТМ, плуроникиТМ или полиэтиленгликоль (ПЭГ).
Активные фармацевтические ингредиенты также можно включить в микрокапсулы, приготовленные, например, коацервацией или межфазной полимеризацией, например, микрокапсулы соответственно из гидроксиметилцеллюлозы или желатина и поли(метилметакрилата), в коллоидные системы для доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в Remington: The Science and Practice of Pharmacy 20th edition (2000).
Композиции, используемые для введения in vivo, должны быть стерильными. Такую стерилизацию легко провести фильтрованием через стерильные мембранные фильтры.
Можно приготовить средства с замедленным высвобождением. Подходящие примеры средств с замедленным высвобождением включают полупроницаемые матриксы из твердых гидрофобных полимеров, содержащие иммуноглобулин по изобретению, где данные матриксы имеют форму фигурных изделий, например, пленок или микрокапсул. Примеры матриксов с замедленным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт, полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, недеградируемый этилен-винилацетат, деградируемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOTTM(инъекционные микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и лейпролида ацетата) и поли-D-(-)-3-гидроксимасляную кислоту. Несмотря на то, что этилен-винилацетат и сополимер молочной кислоты-гликолевой кислоты способны высвобождать молекулы в течение более 100 суток, некоторые гидрогели высвобождают белки в более короткий период времени. Когда инкапсулированные иммуноглобулины остаются в организме в течение длительного периода времени, то они могут денатурировать или агрегировать в результате воздействия влаги при 37°С, что приводит к потере биологической активности и возможным изменениям в иммуногенности. Можно разработать рациональные стратегии для стабилизации в зависимости от вовлекаемого механизма. Например, если установлено, что механизм агрегации связан с образованием межмолекулярных S-S-связей посредством тио-дисульфидного обмена, то стабилизации можно достичь модификацией сульфгидрильных остатков, лиофилизацией из кислых растворов, контролем содержания влаги, использованием соответствующих добавок и разработкой специфических композиций на основе полимерных матриксов.
Эффективность лечения
Эффективность вариантных IgG можно определить различными путями, включая, не ограничиваясь этим, методы, описанные в данном документе, в разделе «Определения». Например, эффективность лечения опухоли можно определить по способности вариантного IgG подавлять или снижать рост или метастазирование опухоли. В некоторых вариантах осуществления вариантный IgG обладает более высокой эффективностью по сравнению с IgG дикого типа, если вариантный IgG способен снижать скорость роста опухоли по сравнению с ростом опухоли, достигаемым при лечении IgG дикого типа. В некоторых вариантах осуществления вариантный IgG обладает более высокой эффективностью по сравнению с IgG дикого типа, если вариантный IgG может обеспечить максимальное ингибирование роста опухоли в более низкой дозе IgG по сравнению с дозой, необходимой для достижения максимального ингибирования роста опухоли под действием IgG дикого типа. В некоторых вариантах осуществления вариантный IgG обладает более высокой эффективностью по сравнению с IgG дикого типа, если вариантный IgG может ингибировать или снизить рост или метастазирование злокачественных клеток в более низкой дозе IgG по сравнению с дозой, необходимой для IgG дикого типа. В некоторых вариантах осуществления вариантные IgG по настоящему изобретению обладают равной или более высокой эффективностью по сравнению с IgG дикого типа. В некоторых вариантах осуществления вариантные IgG по настоящему изобретению не обладают более низкой эффективностью по сравнению с IgG дикого типа.
Эффективность лечения по изобретению также можно определить по различным конечным точкам, обычно используемым при оценке неопластических или ненеопластических заболеваний. Например, лечение рака можно оценить, в том числе, не ограничиваясь этим, по регрессии опухоли, массе опухоли или уменьшению размера опухоли, периоду времени до прогрессирования заболевания, выживаемости, выживаемости без прогрессирования, скорости ответа в целом, продолжительности ответа, качеству жизни, экспрессии белка и/или активности. Поскольку некоторые лекарственные средства, описанные в данном документе, такие как антиангиогенные средства, направлены на сосудистую сеть, а не на сами злокачественные клетки, то они представляют уникальную группу противоопухолевых средств и, следовательно, для них могут потребоваться уникальные методы анализа и критерии оценки клинического ответа на действие средств. Например, уменьшение размера опухоли более чем на 50% при 2-мерном анализе представляет стандартный порог для констатации наличия ответа. Однако ингибиторы по изобретению могут вызывать подавление метастатического распространения без уменьшения первичной опухоли, или просто оказывать туморостатическое действие. Следовательно, подходы для определения эффективности терапии, которые можно использовать, включают, например, определение маркеров ангиогенеза в плазме крови или моче и определение ответа на лечение с применением радиологических методов визуализации.
Комбинированные средства
Лекарственные средства, описанные в данном документе, можно вводить вместе с другими лекарственными средствами одновременно, т.е. лекарственные средства, описанные в данном документе, можно вводить с другими видами лечения и лекарственными средствами, включая, например, небольшие молекулы, другие биологические вещества, лучевую терапию, хирургическую операцию и т.д.
В некоторых вариантах осуществления вариант IgG является единственным терапевтически активным веществом, которое вводится пациенту. В некоторых вариантах осуществления вариант IgG вводят в комбинации с одним или несколькими лекарственными средствами, включая, не ограничиваясь этим, антиангиогенные средства, химиотерапевтические средства, цитокины, ингибирующие рост средства, антигормональные средства, ингибиторы киназы, цитотоксические средства, кардиопротекторы или другие лекарственные средства. Варианты IgG можно вводить одновременно с проведением одной или нескольких терапевтических схем. В некоторых вариантах осуществления вариант IgG можно вводить в комбинации с одним или несколькими антителами, которые могут быть или могут не быть вариантом IgG. В некоторых вариантах осуществления варианты IgG можно использовать в сочетании с другими методами лечения, такими как хирургическая операция.
В некоторых вариантах осуществления дополнительные средства, например, противоопухолевые средства или лекарственные средства, или средства против ангиогенеза, также можно вводить в комбинации с вариантным IgG для лечения различных неопластических или ненеопластических состояний. В одном варианта осуществления неопластическое или ненеопластическое состояние характеризуется патологическим нарушением, ассоциированным с аномальным или нежелательным ангиогенезом. Вариантные IgG по изобретению можно вводить периодически или в комбинации с другим средством, которое является эффективным для данных целей, в одной композиции или разных композициях с использованием одного и того же или различных путей введения.
Антиангиогенная терапия в отношении рака является стратегией лечения злокачественных опухолей, направленной на подавление развития кровеносных сосудов, необходимых для обеспечения опухоли питательными веществами для ее роста. В некоторых вариантах осуществления с учетом того, что ангиогенез принимает участие в росте первичной опухоли и метастазировании, антиангиогенная терапия по изобретению способна подавлять неопластический рост опухоли в первичном месте, а также предупреждать метастазирование опухолей во вторичных местах, что, следовательно, позволяет воздействовать на опухоли другими лекарственными средствами. В одном варианте осуществления противоопухолевое средство или лекарственное средство является антиангиогенным средством. В еще одном варианте осуществления противоопухолевое средство представляет собой химиотерапевтическое средство.
Существует много антиангиогенных средств, и они известны в данной области, включая перечисленные в данном документе, например, в разделе «Определения», и описанные, например, Carmeliet and Jain, Nature, 407:249-257 (2000); Ferrara et al., Nature Reviewes: Drug Discovery, 3:391-400 (2004) и Sato, Int. J. Clin. Oncol., 8:200-206 (2003). Смотрите также публикацию патента США № 20030055006. В некоторых вариантах осуществления необязательно пациенту можно совместно вводить два или более ингибиторов ангиогенеза в дополнение к вариантному IgG по изобретению.
В некоторых вариантах осуществления другие лекарственные средства, которые можно комбинировать с вариантным IgG, представляют собой антагонист VEGF или антагонисты рецептора VEGF. В некоторых вариантах осуществления другие лекарственные средства, пригодные для комбинированной терапии опухолей с вариантным IgG, включают антагонист других факторов, которые участвуют в росте опухоли, такие как EGFR, ErbB2 (также известный как Her2), ErbB3, ErbB4 или TNF. В некоторых вариантах осуществления вариантный IgG можно использовать в комбинации с низкомолекулярными ингибиторами тирозинкиназы (RTKI), направленные на один или несколько рецепторов тирозинкиназы, таких как VEGF-рецепторы, FGF-рецепторы, EGF-рецепторы и PDGF-рецепторы. В данной области известны многие лекарственные средства с небольшой молекулой, включающие, не ограничиваясь этим, ваталаниб (PTK787), эрлотиниб (тарцева®), OSI-7904, ZD6474 (зактима®), ZD6126 (ANG453), ZD1839, сунитиниб (сутент®), семаксаниб (SU5416), AMG706, AG013736, иматиниб (гливек®), MLN-518, CEP-701, PKC-412, лапатиниб (GSK572016), велкаде®, AZD2171, сорафениб (нексавар®), XL880 и CHIR-265.
Изобретение также относится к применению комбинации двух или более вариантных IgG с одним или несколькими дополнительных видов противоопухолевого лечения. Примеры лечения опухолей включают, не ограничиваясь этим, хирургическую операцию, лучевую терапию (радиотерапию), биотерапию, иммунотерапию, химиотерапию или комбинацию данных видов лечения. В одном варианте осуществления противоопухолевая терапия для рака предстательной железы, рака яичников и рака молочной железы может представлять гормональную терапию. Кроме того, в комбинации с вариантным IgG можно использовать цитотоксические средства, антиангиогенные и антипролиферативные средства. В некоторых вариантах осуществления вариант IgG вводят пациенту вместе с проведением химиотерапии, лучевой терапии или комбинацией химиотерапии и лучевой терапии.
В некоторых вариантах осуществления вариантный IgG применяют в адъювантной терапии для лечения неметастатической злокачественной опухоли после радикальной операции. В одном примере вариантный IgG можно обеспечить с или без, по меньшей мере, одного дополнительного химиотерапевтического средства.
В некоторых вариантах осуществления вариантный IgG используют в качестве неадъювантной терапии для лечения функциональной злокачественной опухоли до операции. В данном примере вариантный IgG можно обеспечить с или без, по меньшей мере, одного дополнительного химиотерапевтического средства.
В некоторых вариантах осуществления вариантный IgG и одно или несколько лекарственных средств можно вводить одновременно или последовательно в количестве и в течение времени, достаточных для подавления или элиминации появления или рецидива опухоли, «дремлющей» опухоли или микрометастазов. Вариантный IgG и одно или несколько лекарственных средств можно вводить в качестве поддерживающей терапии для предупреждения или снижения вероятности рецидива опухоли.
В некоторых вариантах осуществления изобретение относится к применению вариантного IgG и одного или нескольких химиотерапевтических средств (например, их смеси). Неограничивающие примеры химиотерапевтических средств приводятся в разделе «Определения». Подготовку и режим введения таких химиотерапевтических средств проводят согласно инструкции организации-производителя, или это эмпирически определит специалист в данной области, например, смотрите раздел «Дозы, составы и продолжительность лечения».
Изделия
В другом аспекте изобретения представлено изделие, содержащее вещества, пригодные для лечения, профилактики и/или диагностики нарушений, описанных выше. Изделие включает контейнер и этикетку или вкладыш в упаковке, на или связанный с контейнером. Подходящие контейнеры включают, например, бутыли, флаконы, шприцы и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер может содержать композицию, которая сама по себе или в комбинации с другой композицией является эффективной для лечения, профилактики и/или диагностики заболевания, и он может иметь стерильное входное отверстие (например, контейнер может представлять мешок с раствором для внутривенного введения или флакон с пробкой, проткнутой иглой для внутрикожных инъекций). На этикетке или вкладыше в упаковке указывается, что композиция используется для лечения состояния выбора. В некоторых вариантах осуществления изделие содержит (а) первый контейнер с композицией в нем, где композиция содержит вариантный IgG по изобретению; и (b) второй контейнер с композицией в нем, где композиция содержит дополнительное цитотоксическое или другое лекарственное средство. Изделие может дополнительно содержать вкладыш в упаковке, на котором указывается, что композицию можно использовать для лечения конкретного нарушения. Альтернативно или дополнительно изделие может также содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Дополнительно он может содержать другие вещества, желательные с коммерческой точки зрения и с точки зрения потребителя, включая буферы, разбавители, фильтры, иглы и шприцы.
В некоторых вариантах осуществления вариантный IgG можно упаковать один или в комбинации с другими лекарственными средствами в виде набора. В одном варианте осуществления лекарственное соединение является противоопухолевым средством. Набор может содержать необязательные компоненты, который помогают введению разовой дозы пациентам, такие как флаконы для восстановления порошковых форм, шприцы для инъекций, системы для доставки средства, ингаляторы и т.д. Дополнительно набор может содержать инструкции по приготовлению и введению композиций. Набор можно изготовить в виде разовой дозы для одного применения одному пациенту, многократных применений для конкретного пациента (в постоянной дозе или где отдельные вещества могут варьировать по силе по мере протекания терапии) или набор может содержать множественные дозы, подходящие для введения многим пациентам («объемная упаковка»). Компоненты набора можно компоновать в картоне, блистерных упаковках, бутылях, пробирках и тому подобное.
Примеры
Далее представлены примеры способов и композиций по изобретению. Очевидно, понятно, что различные другие варианты осуществления можно использовать на практике, руководствуясь общим описанием, приведенным выше.
Пример 1. Получение вариантов анти-VEGF антитела (бевацизумаба)
Fv-области тяжелой и легкой цепей анти-VEGF IgG1 дикого типа (бевацизумаба) клонировали по отдельности в две pRK-основанные плазмиды для временной трансфекции, содержащие константные домены человеческого IgG1. Затем использовали сайт-направленный мутагенез по Кункелю для получения всех вариантов анти-VEGF IgG1, в котором были мутированы остатки в доменах СН2 и СН3. Варианты анти-VEGF антитела, полученные в данном исследовании, обобщены в таблице 2 ниже. Каждый вариант содержит одну, две или три мутации в доменах СН2 и СН3. Варианты пронумерованы по EU-системе по Kabat.
Плазмиды, содержащие тяжелую цепь варианта и легкую цепь дикого типа, котрансфицировали в линию трансформированных аденовирусом человеческих почечных эмбриональных клеток 293 с использованием FUGENE® (Roche, Basel, Швейцария) согласно протоколу изготовителя. Через 24 часа инкубации с трансфицирующими комплексами трансфицированные клетки культивировали в бессывороточной среде PSO4 с добавлением инсулина в концентрации 10 мг/л и микроэлементов в течение 5 суток или в среде 1,3× GEM N с 5 мМ глутамина. Собирали супернатант и кондиционировали 1 М Трис-буфером рН 8,0 и 5 М хлоридом натрия (NaCl) с получением конечной концентрации 30 мМ Трис-буфера и 50 мМ NaCl. Затем кондиционированный супернатант очищали при помощи хроматографии с белком А. Связанный IgG1 элюировали с колонки с протеином А 0,1 М глициновым буфером рН 3,0. Затем очищенный IgG1 концентрировали и наносили на колонку для эксклюзионной хроматографии с Superdex-200 для удаления любых агрегатов. Фракции мономерного IgG1 объединяли и затем использовали для экспериментов по оценке связывания. Рассчитывали концентрации анти-VEGF антитела дикого типа и вариантов анти-VEGF-IgG1по поглощению при длине волны 280 нм, и было установлено, что поглощение 1,5 соответствует 1 мг/мл IgG1.
Пример 2. Получение FcRn человека и обезьян рода Cynomolgus
Человеческий FcRn представляет собой гетеродимер альфа-цепи и субъединицы β2-микроглобулина. Данные две субъединицы клонировали по отдельности в две pRK-основанные плазмиды для временной трансфекции. Плазмиды, одновременно содержащие альфа-цепь и β2-микроглобулин, котрансфицировали в клетки 293 с использованием FUGENE® (Roche, Basel, Швейцария) согласно протоколу изготовителя. Через 24 часа инкубации с трансфицирующими комплексами трансфицированные клетки культивировали в бессывороточной среде PSO4 с добавлением инсулина в концентрации 10 мг/л и микроэлементов в течение 5 суток. Собранный супернатант фильтровали и кондиционировали 1 М соляной кислотой и 5 М NaCl с получением конечных рН 6,0 и концентрации 50 мМ NaCl. Кондиционированный супернатант очищали с использованием хроматографии на IgG-сефарозе. Связанный FcRn элюировали с колонки, используя буфер с рН 8,0, содержащий 30 мМ Трис и 150 мМ NaCl. Элюированный FcRn дополнительно очищали с использованием эксклюзионной хроматографии на Superdex-75 для удаления любых агрегатов. Рассчитывали концентрацию FcRn по поглощению при длине волны 280 нМ, и было установлено, что поглощение 1,9 соответствует 1 мг/мл FcRn. Получали FcRn обезьян рода Cynomolgus и очищали по протоколу, аналогичному для человеческого FcRn, за исключением того, что для трансфекции использовали плазмиды, содержащие альфа-цепь и β2-микроглобулин обезьян рода Cynomolgus.
Пример 3. Опыты по оценке связывания с FcRn: инжектирование вариантов IgG1на FcRn
Связывание вариантов анти-VEGF c человеческим FcRn исследовали поверхностным плазменным резонансом с использованием прибора BIAcore 3000 (GE Healthcare, Piscataway, NJ). Человеческий FcRn конъюгировали с сенсорным чипом, используя набор для конъюгации. Конкретно, сенсорный чип СМ5 активировали EDC/NHS в течение 7 минут при 5 мкл/мин. 100 мкг/мл человеческого FcRn инжектировали в течение 30 секунд - 2 минут со скоростью потока 10 мкл/мин на активированный чип с получением максимальных резонансных единиц связывания (RU), равных 50-200. После конъюгации связанный с FcRn чип блокировали инжектированием 35 мкл 1 М этаноламина гидрохлорида при 5 мкл/мин.
Оценивали связывание анти-VEGF антитела дикого типа (WT) и вариантов анти-VEGF антитела с человеческим FcRn при рН 6,0 или рН 7,4. Буфером для анализа в опытах по оценке связывания был PBS рН 6,0 или рН 7,4, содержащий 0,01% Р20 и 0,02% азида натрия. Анти-VEGF антитела дикого типа (бевацизумаб) WT и варианты анти-VEGF антитела обменивали на буфер для анализа с рН 6,0 или 7,4. Все эксперименты проводили при 25°С. Для буфера с рН 6,0 варианты с концентрацией в пределах от 15 мкМ до 0,7 нМ пропускали над покрытым FcRn чипом со скоростью 30 мкл/мин в течение различных периодов времени с достижением стационарного состояния и затем давали возможность диссоциироваться от чипа в течение 5 минут. Для буфера с рН 7,4 варианты с концентрацией в пределах от 30 мкМ до 30 нМ пропускали над покрытым FcRn чипом со скоростью 20 мкл/мин в течение различных периодов времени с достижением стационарного состояния и затем давали возможность высвободиться в течение 2 минут. Также варианты пропускали над неконъюгированным пятном на сенсорном чипе для вычитания фонового неспецифического связывания из значения связывания с FcRn-конъюгированным чипом. Чип регенерировали в течение 30 секунд импульсом 0,1 М Трис-буфера рН 8,3 между инжектированием. Регистрировали RU в стационарном состоянии для каждого инжектирования в конце каждой фазы инжектирования и затем устанавливали кажущиеся константы диссоциации (кажущиеся KD) в виде концентраций IgG, которые достигали 50% максимальных RU.
Результаты двух различных опытов, приведенные на фиг.1А и 1B, свидетельствуют о том, что все варианты обладали повышенной аффинностью связывания с FcRn по сравнению с антителом дикого типа при рН 6,0. Установленные значения кажущихся констант диссоциации (KD) приведены на фиг.2. Поскольку плотность конъюгации FcRn различалась между двумя опытами, то уровень авидности был разным, что привело к несколько различающимся значениям KD для одного и того же варианта. Однако ранжирование аффинности для данных вариантов оставалось одинаковым для различных опытов. На фиг.3 показано, что все варианты анти-VEGF антител проявляли более высокое связывание при нейтральных значениях рН с человеческим FcRn по сравнению с антителами дикого типа. Ранжирование аффинности связывания для вариантов при рН 7,4 соответствовало ранжированию аффинности, установленному для связывания при рН 6.
Дополнительно оценивали связывание анти-VEGF антитела дикого типа (WT) и вариантов анти-VEGF антитела, приведенных в таблице 3, с человеческим FcRn и FcRn обезьян рода Cynomolgus, с использованием данного форма теста. Человеческий FcRn и FcRn обезьян рода Cynomolgus инжектировали на сенсорные чипы. Анти-VEGF антитело дикого типа (WT) и варианты анти-VEGF антитела инжектировали сверху покрытых FcRn чипов при 25°С в буфере с рН 6,0 или 7,4. Регистрировали резонансные единицы в стационарном состоянии и строили график зависимости от инжектированных концентраций. Все варианты анти-VEGF антитела обладали повышенной аффинностью связывания с человеческим FcRn и FcRn обезьян рода Cynomolgus по сравнению с анти-VEGF антитела дикого типа при обоих значениях рН 6,0 и рН 7,4 (смотрите фиг.4A-4D). Ранжирование аффинности связывания для вариантов анти-VEGF антитела, установленное в данном опыте, было аналогичным для ранжирования аффинности, определенного с использованием моновалентной KD.
Также в формате настоящего анализа было оценено связывание анти-HER2 антитела дикого типа (WT) и вариантов анти-HER2 антитела, приведенных на фиг.26, с человеческим FcRn. Варианты, приведенные на фиг.26, представляют собой L251A, L314A, L314D, L314K, E430A, E430K, L251D/N434H и L314D/N434H. Сенсорные чипы покрывали человеческим FcRn. Анти-HER2 антитело дикого типа и варианты анти-HER2 антитела инжектировали сверху покрытых FcRn чипов при 25°С в буферах с рН в пределах от 6,0 до 7,2. Регистрировали резонансные единицы в стационарном состоянии и строили график зависимости от инжектированных концентраций для каждого рН. Затем определяли аффинность для антитела дикого типа и каждого варианта при каждом значении рН и строили график зависимости отношения аффинности вариантного антитела к антителу дикого типа, как функцию рН, как представлено на фиг.26. Отношения аффинности для вариантов E430A, E430K и L251D/N434H снижались с увеличением рН; в то время как значения отношения аффинности для всех других вариантов повышалось с увеличением рН.
Также в формате аналогичного опыта оценивали связывание анти-HER2 IgG1 дикого типа (трастузумаба), вариантного антитела T307Q/N434A, вариантного антитела L251D/T307Q/N434H и вариантного антитела L251D/T307Q/M428L/N434H/Y436I с человеческим FcRn при рН 6,0 (фиг.27А), рН 7,1 (фиг.27В) и рН 7,4 (фиг.27С). Анти-HER2 антитело дикого типа и варианты анти-HER2 антитела инжектировали сверху покрытых FcRn чипов при 25°С в буферах с рН 6,0, рН 7,1 или рН 7,4. Регистрировали резонансные единицы в стационарном состоянии и строили график зависимости от инжектированных концентраций для каждого варианта. Полученные результаты свидетельствуют, что при рН 6,0 (фиг.27А) вариант L251D/T307Q/N434H показывает аффинность в отношении FcRn, аналогичную с антителом дикого типа, и вариант L251D/T307Q/M428L/N434H/Y436I имеет одинаковую аффинность в отношении FcRn с вариантом T307Q/N434A. При рН 7,1 (фиг.27В) вариант L251D/T307Q/N434H имеет значительно более низкую аффинность в отношении FcRn по сравнению с антителом дикого типа; и вариант L251D/T307Q/M428L/N434H/Y436I имеет одинаковую аффинность в отношении FcRn с антителом дикого типа и значительно более низкую аффинность в отношении FcRn по сравнению с вариантом T307Q/N434A. При рН 7,4 (фиг.27С) вариант L251D/T307Q/M428L/N434H/Y436I имеет более низкую аффинность в отношении FcRn по сравнению с антителом дикого типа и вариантным антителом T307Q/N434A.
Пример 4. Опыты по оценке связывания с FcRn: инжектирование вариантов IgG1на человеческий FcRn и FcRn обезьян рода Cynomolgus
В формате анализа связывания с использованием прибора BIAcore 3000 (GE healthcare, Piscataway, NJ) анти-VEGF антитело дикого типа (бевацизумаб) и варианты анти-VEGF антитела конъюгировали с различными проточными ячейками сенсорного чипа с использованием набора для конъюгации аминов. Конкретно, сенсорный чип СМ5 активировали с EDC/NHC в течение 7 минут со скоростью потока 5 мкл/мин. Антитела в концентрации 10-50 мкг/мл инжектировали в течение времени от 30 секунд до 2 минут со скоростью потока 10 мкл/мин сверху активированного чипа с получением максимальных резонансных единиц связывания (RU), равных 50-200. После конъюгации связанный с FcRn чип блокировали инжектированием 35 мкл 1 М этаноламина гидрохлорида при 5 мкл/мин.
Буфером для анализа в опытах по оценке связывания был буфер, содержащий PBS с рН 6,0/0,01% Р20/0,02% азида натрия (NaN3). Разведения растворимого человеческого FcRn или FcRn обезьян рода Cynomolgus от 20 мкМ до 0,15 нМ инжектировали со скоростью потока 30 мкл/мин в течение 10 минут сверху покрытого антителом сенсорного чипа при 25°С. В конце инжектирования определяли RU в состоянии покоя. Чип регенерировали в течение 30 секунд импульсом 0,1 М Трис-буфера с рН 8,5/0,15 М NaCl. FcRn также инжектировали на неконъюгированную поверхность для вычитания фонового значения. Рассчитывали кинетические параметры и константны равновесия моновалентного связывания (KD) с использованием программного обеспечения BIAevaluation (GE healthcare, Piscataway, NJ).
Результаты опыта, приведенные на фиг.5 и фиг.6, показывают, что все варианты анти-VEGF антитела имеют повышенную аффинность в отношении FcRn по сравнению с антителом дикого типа в отношении обоих рецепторов человеческого FcRn и FcRn обезьян рода Cynomolgus при рН 6,0. Повышение аффинности было результатом увеличения констант скорости ассоциации и снижения констант скорости диссоциации. В целом данные по повышению аффинности в отношении FcRn вариантов анти-VEGF антитела по сравнению с антителом дикого типа с использованием различных тестов оценки связывания обобщены на фиг.8. На фиг.8 показано, что вариант V308P/N434A обладает наиболее высокой аффинностью в отношении FcRn среди вариантов антитела, приведенных в таблице 3, затем следуют варианты T307Q/E380A/N434S, T307Q/N434S и T307Q/N434A. Вариант N434H демонстрирует наименьшее повышение аффинности в отношении FcRn по сравнению с антителом дикого типа.
Пример 5. Значения скорости диссоциации для вариантов анти-VEGF антитела и вариантов анти-HER2 антитела при различных рН
Для определения значений скорости диссоциации при различных рН от 200 нМ до 2 мкМ человеческий FcRn или FcRn обезьян рода Cynomolgus вначале инжектировали поверх конъюгированной с антителом проточной ячейки со скоростью потока 30 мкл/мин в буфере, содержащем PBS с рН 6,0/0,01% Р20/0,02% NaN3 в течение 5 минут,до достижения стационарного состояния. Затем инжектировали буфер PBS с рН в пределах от 6,0 до 7,4 со скоростью 30 мкл/мин поверх проточной ячейки в течение 8 минут для обеспечения полной диссоциации. FcRn также инжектировали поверх неконъюгированной поверхности для вычитания фона. Константы скорости диссоциации определяли «пригонкой» фазы диссоциации сенсограммы с использованием программного обеспечения BIAevaluation (GE healthcare, Piscataway, NJ). Результаты, приведенные на фиг.7, свидетельствуют, что значения koff вариантов повышались с повышением рН для обоих рецепторов человеческого FcRn (фиг.7А) и FcRn обезьян рода Cynomolgus (фиг.7В) и скорость увеличения koffдля каждого варианта была аналогичной.
Аналогично определяли скорость диссоциации (koff) для варианта анти-HER2 антитела L251D/T307Q/M428L/N434H/Y436I с человеческим FcRn при различных рН. Строили график зависимости значений koff варианта анти-HER2 антитела L251D/T307Q/M428L/N434H/Y436I с человеческим FcRn, как функцию рН, как представлено на фиг.28. Кроме того, строили график зависимости koff для вариантов анти-VEGF антитела T307Q/N434A, T307Q/N434S, T307Q/E380A/N434S и V308P/N434A с человеческим FcRn по данным фиг.7, который приведен на фиг.28 для сравнения. Значения koff при различных рН сопоставляли с рН для каждого варианта с получением наклона линии, полученной методом наилучшего приближения (уравнение: log (koff) = наклон × рН + отрезок, отсекаемый на оси y). Наклоны для вариантов анти-VEGF антитела находились в пределах от 0,75 до 0,84; в то время как наклон для варианта анти-HER2 антитела L251D/T307Q/M428L/N434H/Y436I составлял примерно 1,2.
Пример 6. Связывание с человеческим VEGF
Рекомбинантную форму VEGF-А109 конъюгировали с чипом СМ5 с использованием набора для конъюгации аминов. Конкретно, сенсорный чип СМ5 активировали с EDC/NHS в течение 7 минут со скоростью потока 5 мкл/мин. VEGF-А109в концентрации от 1 до 2 мкг/мл инжектировали в течение 30 секунд со скоростью потока 10 мкл/мин сверху активированного чипа с получением максимальных резонансных единиц связывания (RU), равных 100-400. После конъюгации связанный с FcRn чип блокировали инжектированием 35 мкл 1 М этаноламина гидрохлорида при 5 мкл/мин. Двукратные разведения антител в концентрации от 100 нМ до 6 нМ инжектировали поверх конъюгированного с VEGF чипа в течение 4 минут в буфере из PBS/0,05% твин/0,02% NaN3 при 37°С. Комплексам давали возможность диссоциировать в течение 18 минут. Чип регенерировали в течение 30 секунд импульсом 20 мМ соляной кислоты. Антитела также инжектировали поверх неконъюгированной поверхности для вычитания фона. Результаты, приведенные на фиг.9, показывают, что мутации Fc не приводят к изменению связывания с VEGF и что все варианты имели одинаковый с антителом дикого типа характер связывания.
Пример 7. Ингибирование клеточной пролиферации в условиях in vitro
Анти-VEGF антитело дикого типа (бевацизумаб) и варианты анти-VEGF антитела предварительно инкубировали с рекомбинантным человеческим VEGF при комнатной температуре в течение 1 часа. Концентрации анти-VEGF антитела дикого типа (бевацизумаб) и вариантов анти-VEGF антитела находились в пределах от 33 нМ до 0,05 нМ. Концентрация рекомбинантного человеческого VEGF составляла 0,26 нМ. Затем комплексы вносили в культуру эндотелиальных клеток вены пупочного канатика человека (HUVEC) при 37°С и в атмосфере 5% СО2. Через 4 суток оценивали жизнеспособность HUVEC при инкубировании клеток с красителем 20% аламаром синим® (Trec Diagnostic Systems, Cleveland, OH) в течение 6 часов при 37°С и в атмосфере 5% СО2. Затем определяли флуоресценцию аламара синего® с использованием ридера для микропланшетов Molecular Devices (Sunnyvale, CA). Как показано на фиг.10, все варианты имели одинаковый уровень ингибирования пролиферации, сравнимый с антителом дикого типа и авастином®, вновь подтверждая, что мутации Fc не оказывают влияния на способность вариантов антитела нейтрализовать VEGF.
Пример 8. Фармакокинетические исследования на обезьянах рода Cynomolgus
36 самцов и 36 самок клинически здоровых обезьян рода Cynomolgus массой 2-5 кг и в возрасте 2-7 лет после обследования физического состояния здоровья, предшествовавшего опыту, распределяли на шесть опытных групп, каждая состоящая из шести самцов и шести самок. Животных распределяли на опытные группы с использованием компьютерной блокирующей процедуры, предназначенной для достижения баланса массы тела животных в опытных группах. В опыт включали обезьян, которые были здоровы, и у которых не обнаруживали явных аномалий. Все животные на сутки 1 получали одну внутривенную болюсную инъекцию в малую подкожную вену конечности на 0,9% физиологическом растворе. Во всех группах доза составляла 5 мг/кг. Пробы крови (примерно 1,0 мл) отбирали из бедренной вены до и после введения антитела на 0,5, 2, 4, 8 часов, 1, 2, 4, 7, 10, 14, 21, 28, 35, 42, 49, 56 и 70 сутки. Кривые концентрация в сыворотке крови-время для всех групп строили с использованием средней концентрации в сыворотке крови 11-12 животных в группе. Пробы сыворотки крови, отобранные в данном опыте, анализировали с использованием протокола ELISA, описанного в примере 9.
Пример 9. Определение концентрации антитела в сыворотке крови обезьян рода Cynomolgus с использованием ELISA
Планшеты для постановки ELISA (Thermo Fisher Scientific, Rochester, NY) покрывали рекомбинантным человеческим VEGF в концентрации 0,5 мкг/мл в 50 мМ карбонатном буфере, рН 9,6 при 4°С в течение ночи. Планшеты блокировали PBS, 0,5% BSA, 10 ч/млн проклина, рН 7,2 в течение 1 часа при комнатной температуре и затем промывали буфером (PBS/0,05% твина 20/рН 7,2). После блокирования планшетов добавляли двукратные серийные разведения стандартов (анти-VEGF IgG1 дикого типа (бевацизумаба), а также трехкратные серийные разведения сыворотки крови обезьян рода Cynomolgus (начиная с 1:10) в буфере PBS, содержащем 0,5% бычьего сывороточного альбумина, 0,05% твина 20, 5 мМ ЭДТА, рН 8,0, 0,25% CHAPS, 0,2% бычьего гамма-глобулина, 10 ч/млн проклина и 0,35 М NaCl и инкубировали в течение 2 часов при комнатной температуре при встряхивании. Планшеты промывали 6 раз, и связанное лекарственное средство детектировали с использованием овечьего антитела против человеческого IgG (Fc-специфического)-HRP (Jackson ImmunoResearch, West Grove, PA) в разведении 1:10К в буфере для постановки анализа (PBS, рН 7,4, 0,5% BSA, 0,05% твина 20, 10 ч/млн проклина) в течение 1 часа при комнатной температуре при встряхивании. Затем планшеты вновь промывали 6 раз с последующим добавлением субстрата тетраметилбензидина (Moss, Pasadena, MD) для развития окраски. Реакцию останавливали добавлением через 20 минут 1 М фосфорной кислоты (H3PO4). Показания снимали на ридере для микропланшетов Molecular Devices при длине волны 450-620 нм. Фармакокинетические профили антитела дикого типа и пяти вариантов анти-VEGF антитела в сыворотке крови обезьян рода Cynomolgus после однократной внутривенной инъекции в дозе 5 мг/кг приведены на фиг.11. Для всех пяти вариантов был характерен пониженный клиренс и пролонгированное время полужизни по сравнению с антителом дикого типа.
Пример 10. Анализ фармакокинетических данных
Фармакокинетические параметры определяли с использованием программы WinNonLin-Enterprise, версия 5.1.1 (Pharsight Corporation; Mountain View, CA). Для описания полученных данных использовали двухкамерную модель с внутривенным введением с элиминацией первого порядка и константы микровеличин (модель 7). Значения концентрации определяли с использованием итеративного анализа (прогнозированного до силы n=-1) и алгоритма минимизации Gauss-Newton в модификации Levenberg и Hartley. Определяли следующие фармакокинетические параметры с использованием программы WinNonLin Model 7: AUC∞ = общее количество средства, определенное в виде площади под кривой концентрация-время, экстраполированной в бесконечность; t1/2,α= время полужизни альфа-фазы (альфа-время полужизни); t1/2,β= время полужизни бета-фазы (бета-время полужизни); Cmax= максимальная концентрация; CL = клиренс; V1= объем центрального компартмента; Vss= объем распределения в стационарном состоянии.
Для групп со всеми дозами модель отбора была основана на хорошем качестве подгонки по визуальному исследованию наблюдаемого против прогнозированного профиля концентрация в сыворотке крови-время для каждого животного, исследования анализированной суммы остатков площадей и определения стандартной ошибки и коэффициента вариации для каждого параметра. Фармакокинетические параметры выражали в виде среднего значения±стандартное отклонение от среднего (SD) для каждой группы.
На фиг.12 приведены в виде таблицы фармакокинетические параметры анти-VEGF антитела дикого типа и пяти вариантов N434H, T307Q/N434A, T307Q/N434S, T307Q/E380A/N434S и V308P/N434A после внутривенного введения в однократной дозе 5 мг/кг обезьянам рода Cynomolgus. Значения β-периодов (терминальных) полураспада вариантов были примерно в 1,6-2,2 раза выше по сравнению с временем полужизни антитела дикого типа, при том, что вариант T307Q/N434A имеет наиболее длительное время полужизни, составляющее 24,9 суток. Согласно имеющейся информации время полужизни варианта T307Q/N434A, составляющий примерно 25 суток, представляет собой наиболее длительное время полужизни человеческого IgG у обезьян рода Cynomolgus, о котором сообщалось ранее.
Взаимосвязь между временем полужизни и аффинностью в отношении FcRn показана на фиг.13. Наиболее среднее повышение аффинности в отношении FcRn при рН 6,0 приводит к повышению терминального времени полужизни для вариантов N434H и T307Q/N434A. Однако дополнительное увеличение аффинности в отношении FcRn при рН 6,0 (варианты T307Q/N434S, T307Q/E380A/N434A и V308P/N434A) не повышает время полужизни, поскольку более низкая скорость диссоциации и повышенная афиннность при нейтральном значении рН может компенсировать полезный эффект, возникающий в результате повышения аффинности при кислом рН. Вместо этого, имеется тенденция к снижению времени полужизни при более высокой аффинности в отношении FcRn при рН 6,0.
Пример 11. Фармакокинетические исследования на трансгенных мышах
В опыте использовали линию мышей Mu.VEGFhuX.KI.B6.129. Мыши Mu.VEGFhuX.KI.B6.129 (+/+) нокин, RAG2 (-/-) нокаут содержат две аллели гуманизированных форм VEGF, которые можно нейтрализовать анти-VEGF антителом дикого типа (бевацизумабом). Мыши RAG2 (-/-) являются иммунодефицитными и не продуцируют Т- и В-клеток. У данных мышей могут расти человеческие опухоли, экспрессирующие гуманизированные формы VEGF, в отсутствие явного ответа на опухолевые клетки. Таким образом, VEGF, полученный из человеческой опухоли, и мышиные стромальные клетки будут нейтрализоваться анти-VEGF антителом дикого типа (бевацизумабом), которое не нейтрализует мышиный VEGF. Определяли фармакокинетические параметры анти-VEGF антитела дикого типа и варианта анти-VEGF антитела T307Q/N434A у данных трансгенных мышей без опухолей мышей.
Проводили два различных опыта по определению фармакокинетических параметров. В первом опыте определяли фармакокинетические параметры при однократном введении. Формировали 4 группы по 8-9 животных в каждой группе, мышам каждой группы однократно внутривенно вводили анти-VEGF антитело дикого типа и вариант анти-VEGF антитела T307Q/N434A в дозе 5 мг/кг на PBS. Объем введения составлял от 5 до 15 мл/кг в зависимости от концентрации раствора для введения и массы каждого животного. Антитела вводили в хвостовую вену. На каждую временную точку от 3 мышей отбирали пробы крови и примерно 125 мкл проб крови отбирали для анализа фармакокинетических параметров на 15 минут, 8 часов, 24 часа, 2, 4, 7, 10, 14, 21 и 28 сутки после введения. Образцы крови отбирали под анестезией из периорбитального синуса. В указанные временные точки у мышей отбирали пробы крови пункцией сердца под анестезией изофлураном.
Во втором опыте фармакокинетические параметры определяли при многократном введении. В группе было по 9 животных. Каждому животному вводили вариант T307Q/N434A в дозе 0,3 или 5 мг/кг на PBS на 0, 3, 6 и 9 сутки. Способы введения и отбора проб были аналогичны для опыта по оценке фармакокинетических параметров при однократном введении. Однако пробы крови отбирали через 15 минут после первого введения, на 3 сутки (предоза), 6 сутки (предоза), 9 сутки (предоза), через 15 минут после дозы на 9 сутки, 11 сутки, 14 сутки, 21 сутки, 28 сутки и 35 сутки.
Пробы крови, отобранные для определения фармакокинетических параметров, анализировали с использованием ELISA, описанной в примере 13. На фиг.14А и 14В приведены фармакокинетические профили антитела дикого типа и варианта T307Q/N434A с использованием соответственно ELISA с захватом VEGF (фиг.14А) или захватом человеческого Fc (фиг.14В). Вариант T307Q/N434A имеет аналогичные фармакокинетические профили с антителом дикого типа после однократного внутривенного введения в дозе 0,3 или 5 мг/кг. Данные фиг.15 подтверждают, что время полужизни антитела дикого типа и варианта T307Q/N434A сравнимы у трансгенных мышей. Однако наблюдали отсутствие линейной зависимости для фармакокинетических параметров, поскольку антитела при введении в дозе 0,3 мг/кг имели более короткое время полужизни по сравнению с введением в дозе 5 мг/кг, возможно за счет антигензависимого клиренса. На фиг.16 приведены фармакокинетические профили варианта T307Q/N434A у трансгенных мышей с гуманизированным VEGF после многократного введения в дозах 0,3 или 5 мг/кг, и фармакокинетические параметры обобщены на фиг.17. Результаты свидетельствуют, что концентрации антител в сыворотке крови, определенные экспериментально, соответствовали концентрациям, прогнозированным при моделировании с использованием фармакокинетических параметров при однократном введении.
Пример 12. Опыты по оценке эффективности в условиях in vivo
Человеческие клетки HT-55, Colo-205 (колоректальной карциномы) и Calu-6 (карциномы легких) получали из Американской коллекции типовых культур (Manassas, VA). Клеточная линия колоректальной карциномы человека НМ-7 является производной линией LS 174T. Calu-6 и НМ-7 культивировали в среде Ham's F12, DMEM с низким содержанием глюкозы 1:1. Colo-205 и HT-55 культивировали в среде RPMI 1640. В обе среды добавляли 10% FBS об./об., 1% об./об. пенициллина/стрептомицина (Invitrogen, Carlsbad, CA), 2 мМ L-глутамина (Invitrogen, Carlsbad, CA) и 1 мкг/мл фунгизонаТМ(Invitrogen, Carlsbad, CA). Клетки культивировали при 37°С в атмосфере 5% СО2 до слияния, собирали и ресуспендировали в стерильном матригеле с титром 50×106 клеток на мл. Ксенотрансплантаты прививали 6-8-недельным мышам RAG2; двойным гомозиготным мышам hum-X VEGF KI (Genentech, South San Franciskp, CA) подкожным введением в дорсальную боковую область 5×106 клеток на мышь и давали расти. Через 24 часа после прививки опухолевых клеток начинали обработку мышей антителом при внутрибрюшинном введении в дозе 5, 0,5 и 0,05 мг/кг дважды в неделю. Размер трансплантированных опухолей определяли дважды в неделю замером по самой длинной оси и перпендикулярной оси, как описано. На каждый день замера опухолей рассчитывали объем опухоли для каждой мыши, и сравнивали со средними значениями объемов опухолей в контрольной группе (антитело к амброзии полыннолистной) и в группе с анти-VEGF антителом с использованием t-теста Стьюдента при уровне Р<0,05. Мышей умерщвляли, когда размер опухолей достигал 2000 мм3.
Результаты первого опыта с ксенотрансплантатами HM-7 приведены на фиг.18. На фиг.18А и 18В показано, что вариант T307Q/N434A был способен обеспечивать максимальное ингибирование роста опухоли в обеих опытных группах с дозами 0,5 и 5 мг/кг. Несмотря на то, что антитело дикого типа подавляло рост опухоли в обеих дозах, оно не демонстрировало максимального ингибирования роста опухоли в дозе 0,5 мг/кг. На основании данных результатов было высказано предположение, что вариант T307Q/N434A является более эффективным по сравнению с антителом дикого типа в дозе 0,5 мг/кг в лечении ксенотрансплантатов HM-7, несмотря на аналогичные значения концентраций IgG в сыворотке крови (фиг.18С). Результаты повторного опыта по оценке эффективности антител в отношении ксенотрансплантатов HM-7, приведенные на фиг.19, подтверждают, что вариант T307Q/N434A является более эффективным по сравнению с антителом дикого типа в опытных группах мышей, получавших средство в обеих дозах 0,5 и 0,05 мг/кг. Действительно вариант T307Q/N434A проявлял более высокое ингибирование роста опухоли во всех опытных группах по сравнению с антителом дикого типа (фиг.19А и 19В). Более высокая эффективность может быть результатом более высокой нормализованной концентрации антитела в опухолях у мышей в опытной группе с вариантом T307Q/N434A по сравнению с антителом дикого типа (фиг.19Е). Данные, полученные в третьем опыте по оценке эффективности антител в отношении роста ксенотрансплантатов HM-7, представленные на фиг.20, подтверждают более высокую эффективность вариантного антитела T307Q/N434A по сравнению с антителом дикого типа в опытных группах с дозами 0,5 и 0,05 мг/кг.
В опыте с ксенотрансплантатами НТ-55 вариант T307Q/N434A демонстрировал более высокое ингибирование роста опухоли по сравнению с антителом дикого типа в дозе 0,05 мг/кг (фиг.21), на основании этих данных можно предположить, что вариант T307Q/N434A является более эффективным в сравнении с антителом дикого типа в группах мышей, получавших средства в дозе 0,05 мг/кг. Данные опыта с ксенотрансплантатами Colo-205 приведены на фиг.22В; они показывают достоверное различие в кривых роста между антителом дикого типа в дозе 0,5 мг/кг и вариантом T307Q/N434A в дозе 0,5 мг/кг. Также фиг.22А и 22В демонстрируют повышение подавления роста опухоли под действием варианта T307Q/N434A в опытных группах с дозами 0,5 и 0,05 мг/кг, на основании чего можно высказать предположение о наличии более высокой эффективности варианта T307Q/N434A в дозах 0,5 и 0,05 мг/кг. Результаты повторного опыта с ксенотрансплантатами Colo-205 на фиг.23 указывают на то, что вариант T307Q/N434A является несколько более эффективным по сравнению с антителом дикого типа по своему действию на рост ксенотрансплантатов Colo-205. Наконец, эффективность варианта T307Q/N434A и антитела дикого типа на рост ксенотрансплантатов Calu-6 была аналогичной.
Существует несколько возможных причин повышенной эффективности Fc-вариантов. Например, более высокая эффективность варианта может быть следствием более длительного удерживания и/или рециркуляции вариантного антитела, опосредованных человеческим FcRn, экспрессируемым в некоторых опухолях (например, HM-7). Это может привести к повышенному эффекту масса-действие в блокировании локально продуцированного VEGF, или может обеспечить механизм повышенной деградации VEGF в опухоли. Однако заявители установили, что повышенная концентрация варианта в опухолях HM-7 по сравнению с опухолями HT-55 и Calu-6 не коррелирует прямо с уровнем экспрессии FcRn в клетках, поскольку клетки HM-7 экспрессируют FcRn в более низких количествах по сравнению с клетками HT-55 и Calu-6 (фиг.25). Кроме того, другие факторы в микросреде опухоли, такие как рН опухоли, скорость роста и другие опухолевые составляющие могут играть совместную роль с FcRn в определении распределения IgG. Например, микросреда опухолей в основном является кислой с рН в пределах от 6,0 до 7,6 (среднее значение 7,1), в то время, как нормальные ткани имеют рН в пределах от 7,3 до 7,8 (среднее значение 7,55), смотрите Song C.W. et al., «Influence of Tumor pH on Therapeutic Response» в Cancer Drug Resistance, 21-42 (2007). Кроме того, различные типы опухолей могут иметь широкие пределы рН в зависимости от различий в сосудистом снабжении и перфузии крови, смотрите Song C.W. et al., Cancer Drug Resistance, 21-42 (2007), выше; Gillies R.J., J. Magn. Reson. Imaging, 16: 430-459 (2002). Результаты многочисленных опытов в условиях in vitro указывают, что количество Fc/IgG, ассоциированных с клетками, возрастает при инкубации при кислых значениях рН, смотрите Praetor A. et al., Journal of Cell Science, 112 (Pt 14), 2291-2299 (1999); MaCarthy K.M., Yoong Y.&Simister N.E., Bidirectional transcytosis of IgG by rat neonatal Fc receptor expressed in a rat kidney cell line: a system to stdy protein transport across epithelia. Journal of Cell Science, 113 (Pt 7), 1277-1285 (2000); Tesar D.B. et al., Traffic, 7:1127-1142 (2006). Следовательно, является возможным, что различия в рН среди тестированных опухолевых линий могут оказывать влияние на уровень накопления антитела в каждой опухоли. Кроме того, кислая микросреда опухоли также активирует экспрессию VEGF (смотрите Song C.W. et al., Cancer Drug Resistance, 21-42 (2007), выше), который может специфически опосредовать удерживание данных анти-VEGF антител. Также ранее было показано, что опухоли HM-7 у мышей имеют неплотную строму (смотрите Liang W.C. et al., J. Biol. Chem., 281:951-961 (2006)), в то время как опухоли Calu-6 индуцируют сильный стромальный ответ у хозяина и являются относительно «богатыми» стромой (смотрите Tejada M.L. et al., Clin. Cancer Res., 12:2676-2688 (2006)). Присутствие стромальных клеток, экспрессирующих мышиный FcRn, может маскировать повышенную рециркуляцию вариантного IgG человеческими опухолевыми клетками. Это может привести к более низкому концентрационному эффекту в человеческих ксенотрансплантатах, содержащих более высокий компонент мышиной стромы, например, Calu-6.
Пример 13. Определение концентрации антител в сыворотке крови и опухолях у трансгенных мышей с использованием ELISA
Для определения концентрации антитела у трансгенных мышей использовали два различных формата ELISA, каждый с двумя различными реагентами захвата антитела (VEGF или Fc IgG1). Планшеты для постановки ELISA Maxisorp (Thermo Fisher Scientific, Rochester, NY) покрывали рекомбинантным человеческим VEGF в концентрации 0,5 мкг/мл или кроличьим (Fab')2 в концентрации 0,25 мкг/мл против человеческого Fc IgG1 (Jackson ImmunoResearch, West Grove, PA) в 50 мМ карбонатном буфере с рН 9,6 при 4°С в течение ночи. Планшеты блокировали PBS, 0,5% BSA, 10 ч/млн проклина, рН 7,2 в течение 1 часа при комнатной температуре и затем промывали буфером для отмывки (PBS/0,05% твина 20/рН 7,2). К блокированным планшетам добавляли двукратные серийные разведения стандартов (бевацизумаб для формата с VEGF или человеческий IgG1 для формата с Fc) до концентрации 12,5 нг/мл, а также трехкратные серийные разведения сыворотки крови обезьян рода Cynomolgus (начиная с 1:10) в буфере PBS, содержащем 0,5% бычьего сывороточного альбумина, 0,05% твина 20, 5 мМ ЭДТА, рН 8,0, 0,25% CHAPS, 0,2% бычьего гамма-глобулина, 10 ч/млн проклина и 0,35 М NaCl и инкубировали в течение 2 часов при комнатной температуре при встряхивании. Планшеты промывали 6 раз, и связанное лекарственное средство детектировали с использованием козьего (Fab'2) против человеческого IgG (Fc-специфического)-HRP коньюгата (Jackson) в разведении от 1:20К до 1:60К в буфере для постановки анализа (PBS, рН 7,4, 0,5% BSA, 0,05% твина 20, 10 ч/млн проклина) в течение 1 часа при комнатной температуре при встряхивании. Затем планшеты вновь промывали 6 раз с последующим добавлением субстрата тетраметилбензидина (Moss, Pasadena, MD) для развития окраски. Реакцию останавливали добавлением через 20 минут 1 М фосфорной кислоты (H3PO4). Показания снимали на ридере для микропланшетов Molecular Devices при длине волны 450-620 нм.
Пример 14. Fc-варианты IgG1 с различным повышением аффинности по сравнению с антителом дикого типа и их фармакокинетические параметры в условиях in vivo
Дополнительные комбинации Fc-мутаций, приведенные на фиг.24, включали в человеческое анти-HER2 антитело (трастузумаб) для конструирования вариантов IgG. Варианты IgG1 экспресссировали с использованием методов, описанных в примере 1. Определяли константы диссоциации антитела анти-HER2-IgG1 дикого типа и вариантов анти-HER2-IgG1, как описано в примере 4, и результаты приведены на фиг.24. Результаты свидетельствуют, что посредством комбинирования различных мутаций можно было сконструировать вариант IgG, такой как M252Y/V308P/N434Y, способный связываться с человеческим FcRn с наномолярной однозначной аффинностью, что примерно в 450 раз выше по сравнению с IgG1 дикого типа.
Однако варианты с высокой аффинностью необязательно обладают улучшенными фармакокинетическими параметрами в условиях in vivo. Например, две Fc-мутации N434A и N434W включали в различные человеческие антитела для конструирования двух различных вариантов IgG1. Два варианта IgG1, вариант N434A и вариант N434W, имели соответственно примерно в 3 и 40 раз более высокую аффинность в отношении FcRn при рН 6,0 по сравнению с антителом дикого типа, как показано на фиг.24. Их фармакокинетические профили оценивали на обезьянах рода Cynomolgus, как описано в примерах 8 и 9, и сравнивали с аналогичными показателями для антитела дикого типа (примерно от 6 до 9 суток). Время полужизни антитела N434W (примерно 9,7±2,4 суток) в меньшей степени подвергался увеличению по сравнению с вариантом N434A, имевшим среднюю аффинность (примерно 14,5±2,2 суток). Полученные результаты дают основание предположить, что слишком значительное повышение аффинности в отношении FcRn может оказывать отрицательное действие на значение времени полужизни Fc-варианта, и трудно прогнозировать заранее, будет ли Fc-вариант с повышенной аффинностью для FcRn иметь увеличенное время полужизни или нет.
Пример 15. Иммунопреципитация FcRn с использованием высокоаффинного варианта IgG1
5 миллионов клеток из каждой линии HM-7, HT-55, Calu-6 или Raji (В-клеточная лимфома) лизировали при инкубации в 25 мМ натриевом фосфатном буфере с рН 6,0, содержащем 1% нонидета Р-40, 0,5% дезоксихолата натрия, 0,1% SDS, 2 мМ ЭДТА, 150 мМ NaCl и ингибитора протеазы 1× (Pierce, Rockland, IL) в течение 1 часа при 4°С. Лизированные клетки центрифугировали при 12000 g в течение 30 минут при 4°С и затем к супернатанту добавляли 50 нМ Fc-варианта трастузумаба M252Y/V308P/N434Y (Yeung et al., подана к публикации) для захвата FcRn. После инкубации в течение ночи при 4°С добавляли смолу c протеином-L (Promega) и давали связаться с комплексом в течение 4 часов при 4°С. Затем смолу отмывали пять раз буфером для лизиса и связанные белки элюировали 2× буфером для нанесения (Invitrogen, Carlsbad, CA). Белки разделяли в 4-12% геле BIS-TRIS (Invitrogen) и переносили на нитроцеллюлозную мембрану (Invitrogen). Мембрану блокировали 3% нежирным молоком в PBS и зондировали 1 нг/мл кроличьего антитела к человеческому FcRn (Santa Cruz, Santa Cruz, CA) при комнатной температуре в течение 1 часа, затем с козьим антителом против конъюгата кроличий IgG-пероксидаза при разведении 1:104(Pierce) в течение 1 часа при комнатной температуре. Мембрану промывали смесью PBS/0,05% твин между стадиями блокирования и инкубации антитела. Белок FcRn визуализировали с использованием набора для детектирования ECL (GE Healthcare, Piscataway, NJ). Смотрите фиг.25.
Результаты и обсуждение
Проводили два отдельных эксперимента по оценке связывания с различными вариантами анти-VEGF антитела при каждом значении рН 6,0 и 7,4. На фиг.1 и 2 соответственно приведены резонансные единицы связывания в стационарном состоянии (RU) как функция концентрации при рН 6,0 и рН 7,4. Установленные константы диссоциации (KD) при рН 6,0 приведены на фиг.1 и данные обобщены на фиг.2. Константы диссоциации одного и того же варианта, рассчитанные по данным двух различных опытов, несколько различались. Например, вариант N434A имел KD, равное 550 нМ в одном опыте, но его значение во втором опыте составляло 250 нМ. Различие относилось за счет влияния эффекта авидности в формате анализа, который включает растекаемость бивалентного антитела поверх FcRn-конъюгированного чипа. Влияние авидности на константу диссоциации зависело от уровня FcRn, конъюгированного на чипах, с наличием следующей зависимости: более высокий уровень конъюгирования приводит к более высокой авидности. Это может объяснить более высокую аффинность, наблюдаемую во втором опыте, в котором получали в два раза более высокие RU в сравнении с первым опытом. Несмотря на то, что при анализе имел место эффект авидности, данный формат в большей степени напоминает природный процесс связывания внутри клеток, когда подвергающиеся пиноцитозу бивалентные антитела связываются с FcRn, в свою очередь, связанного с мембраной. Хотя абсолютное значение KD может различаться от опыта к опыту, ранжирование аффинности данных вариантов было постоянным, даже при различном уровне связанного FcRn. На обеих фиг.1 и 2 показано, что вариант V308P/N434A имел наиболее высокую аффинность среди испытанных вариантов, и все испытанные варианты обладали повышенной способностью к связыванию с FcRn при рН 6,0.
Аффинность вариантов анти-VEGF антитела в отношении FcRn при рН 7,4 была значительно ниже по сравнению со значениями при рН 6,0. Поскольку аффинность связывания при рН 7,4 была очень низкой, константы диссоциации вариантов при рН 7,4 не определяли. Однако на фиг.3 показано, что ранжирование аффинности данных вариантов при рН 7,4 было аналогичным ранжированию при рН 6,0, указывая, что связывание вариантов с FcRn при рН 6,0 и рН 7,4 было сопряженным. Поскольку связывание вариантов при рН 6,0 было повышено, как и связывание при рН 7,4, то имеется тонкий баланс, каким образом связывание при рН 6,0 и 7,4 с FcRn оказывает влияние на время полужизни варианта. На основании повышенного связывания при рН 6,0 можно предположить, что оно оказывает положительное влияние на время полужизни варианта в условиях in vivo, поскольку варианты с более высокой аффинностью могут связываться с FcRn лучше и, следовательно, в большей степени подвергаться рециркуляции FcRn. С другой стороны, предположительно, что существенно высокое связывание при рН 7,4 оказывает неблагоприятное влияние на время полужизни, поскольку связанные с FcRn антитела не могут легко высвобождаться обратно в кровоток, если они связаны очень прочно.
Повышенная аффинность при высоком рН может негативно отразиться на полезных эффектах повышенной аффинности при низких рН. Например, Dall'Acqua et al., J. Immunol., 169(9):5171-518 (2002) показали, что варианты человеческого IgG1, такие как M252Y/S254T/T256E и G385D/Q386P/N389S, не обладают увеличенным временем полужизни у мышей, вероятно, за счет высокой аффинности связывания с мышиным FcRn при высоких значениях рН. Следовательно, остается неясным, какой имеется запас прочности для повышения связывания для вариантов IgG1при высоком рН, чтобы еще имелась возможность повысить время их полужизни.
Несмотря на то, что вышеупомянутое изобретение подробно описано посредством иллюстрации и примеров для ясности понимания, описание и примеры не следует рассматривать в качестве ограничивающих объем изобретения. Раскрытие всех патентов и научной литературы точно в полном объеме включено для сведения.
Реферат
Изобретение относится к области биотехнологии и иммунологии. Представлены вариантные иммуноглобулины с одной или несколькими аминокислотными модификациями в Fc-участке, которые имеют увеличенное время полужизни, и способы их применения. Изобретение может быть использовано в медицине. 8 н. и 13 з.п. ф-лы, 57 ил., 3 табл., 15 пр.
Формула
аминокислотную замену аминокислотного остатка 251 аспарагиновой кислотой и аминокислотную замену аминокислотного остатка 434 гистидином;
аминокислотную замену аминокислотного остатка 252 тирозином и аминокислотную замену аминокислотного остатка 434 аланином;
аминокислотную замену аминокислотного остатка 307 глутамином и аминокислотную замену аминокислотного остатка 434 аланином;
аминокислотную замену аминокислотного остатка 307 глутамином и аминокислотную замену аминокислотного остатка 434 серином;
аминокислотную замену аминокислотного остатка 307 глутамином и аминокислотную замену аминокислотного остатка 378 валином;
аминокислотную замену аминокислотного остатка 307 глутамином и аминокислотную замену аминокислотного остатка 436 изолейцином;
аминокислотную замену аминокислотного остатка 308 пролином и аминокислотную замену аминокислотного остатка 434 аланином;
аминокислотную замену аминокислотного остатка 308 пролином и аминокислотную замену аминокислотного остатка 434 тирозином;
аминокислотную замену аминокислотного остатка 378 валином и аминокислотную замену аминокислотного остатка 434 аланином;
аминокислотную замену аминокислотного остатка 428 лейцином и аминокислотную замену аминокислотного остатка 434 аланином;
аминокислотную замену аминокислотного остатка 434 аланином и аминокислотную замену аминокислотного остатка 436 изолейцином;
аминокислотную замену аминокислотного остатка 251 аспарагиновой кислотой, аминокислотную замену аминокислотного остатка 307 глутамином и аминокислотную замену аминокислотного остатка 434 гистидином;
аминокислотную замену аминокислотного остатка 252 тирозином, аминокислотную замену аминокислотного остатка 308 пролином и аминокислотную замену аминокислотного остатка 434 тирозином;
аминокислотную замену аминокислотного остатка 307 глутамином, аминокислотную замену аминокислотного остатка 380 аланином и аминокислотную замену аминокислотного остатка 434 серином;
аминокислотную замену аминокислотного остатка 307 глутамином, аминокислотную замену аминокислотного остатка 380 аланином и аминокислотную замену аминокислотного остатка 434 аланином;
аминокислотную замену аминокислотного остатка 307 глутамином, аминокислотную замену аминокислотного остатка 378 валином и аминокислотную замену аминокислотного остатка 436 изолейцином; или
аминокислотную замену аминокислотного остатка 251 аспарагиновой кислотой, аминокислотную замену аминокислотного остатка 307 глутамином, аминокислотную замену аминокислотного остатка 428 лейцином, аминокислотную замену аминокислотного остатка 434 гистидином и аминокислотную замену аминокислотного остатка 436 изолейцином.

Комментарии