Антитела против ох40 и способы их применения - RU2562874C1
Код документа: RU2562874C1
Чертежи






































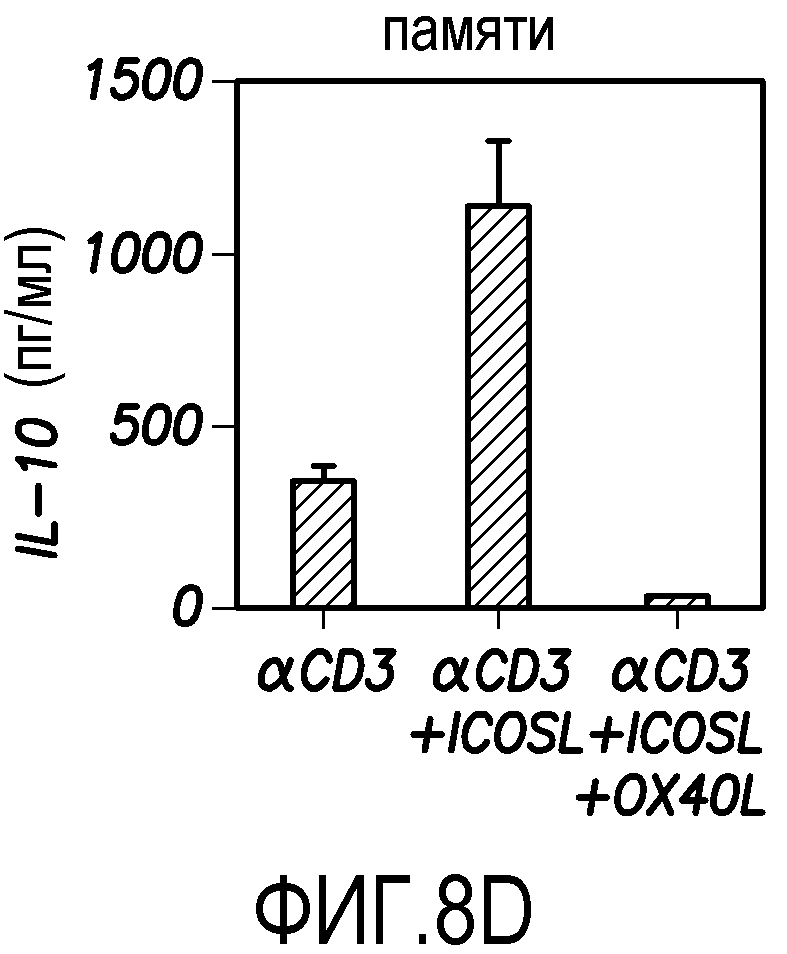
















































Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение, в целом, относится к модулированию активации рецептора OX40, и более конкретно, к модулированию ингибирования рецептором OX40 иммуносупрессорной функции продуцирующих интерлейкин 10 (IL-10) регуляторных T-клеток типа 1 CD4+ («клеток Tr1») и экспрессирующих Foxp3+ регуляторных T-клеток (также иногда называемых в настоящем описании клетками «Foxp3+ T-reg»), и образования клеток Tr1 из клеток CD4+ или наивных клеток и продукции IL-10.
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка является частичным продолжением предыдущей заявки PCT № PCT/US11/48752, поданной 23 августа 2011, по которой испрашивается приоритет предварительной заявки на выдачу патента США № 61/375999, поданной 23 августа 2010, и предварительной заявки на выдачу патента США № 61/380827, поданной 8 сентября 2010. Указанные заявки включены в настоящее описание в качестве ссылки.
ИНФОРМАЦИЯ О ФИНАНСИРУЕМОМ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА ИССЛЕДОВАНИИ ИЛИ РАЗРАБОТКЕ
Настоящее изобретение было создано при поддержке правительства по грантам номер R01 AI061645-01, R01 AI062888-01, и U19 AI071130-01, присужденным национальными институтами здравоохранения. Правительство обладает определенными правами на изобретение.
НАИМЕНОВАНИЯ СТОРОН СОГЛАШЕНИЯ О СОВМЕСТНОМ ИССЛЕДОВАНИИ
Нет.
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
В настоящее описание включен список последовательностей, поданный в виде текстового файла согласно 37 C.F.R. § 1.52(e)(v), названного sequence listing.txt, созданного 1 февраля 2012, размером 32796 байт, который включен в настоящее описание в качестве ссылки. Прилагаемое описание последовательностей и список последовательностей соответствуют правилам, установленным для описания нуклеотидных и/или аминокислотных последовательностей в заявках на выдачу патента, которые указаны в 37 C.F.R. §§ 1.821-1.825. Список последовательностей содержит однобуквенный код для записи нуклеотидных последовательностей и трехбуквенный код для аминокислот, которые определены в соответствии со стандартами ИЮПАК-МСБМБ, описанными в Nucleic Acids Res. 13: 3021-3030 (1985) и в Biochemical J. 219 (№2): 345-373 (1984). Символы и формат, используемые для представления данных о нуклеотидных и аминокислотных последовательностях соответствуют правилам, указанным в 37 C.F.R. § 1.822.
УРОВЕНЬ ТЕХНИКИ
Клетки Tr1 играют решающую роль в периферической толерантности. Клетки Tr1 особенно важны для ограничения повреждения тканей хозяина во время воспалительных иммунных ответов. Образование клеток Tr1 сопровождает как TH1-, так и TH2-иммунные ответы in vivo и in vitro.
Клетки Tr1 образуются из наивных T-клеток CD4+ во время запускаемого антигеном T-клеточного иммунного ответа. Клетки Tr1 являются анергическими в случае ответа на передачу сигнала через рецепторы TCR, CD28 и IL-2 и обладают способностью супрессировать запускаемую антигеном пролиферацию наивных T-клеток CD4+in vivo и in vitro. Клетки Tr1 обладают способностью ингибировать развитие аутоиммунных заболеваний и ограничивают величину иммунных ответов на микробные патогены.
Хотя молекулярные сигналы, которые приводят к появлению клеток Tr1, были изучены, мало известно о молекулярных сигналах, которые отрицательно регулируют образование таких клеток. Хотя было показано, что иммунодепрессивные лекарственные средства, цитокины, костимулирующие молекулы и ДК вовлечены в индукцию клеток Tr1, сигналы, которые отрицательно регулируют образование клеток Tr1, остаются неясными.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Активация рецептора OX40 блокирует образование Tr1 из наивных T-клеток CD4+или T-клеток памяти CD4+, а также продукцию IL-10 клетками Tr1 и иммуносупрессорную функцию клеток Tr1. Активация рецептора OX40 также блокирует продукцию IL-10 клетками Foxp3+ T-reg и иммуносупрессорную функцию. В связи с этим в настоящем описании представлены агонистические антитела, которые связываются с рецептором OX40, при этом агонист модулирует активацию рецептора OX40, блокируя секрецию цитокина IL-10 и/или общую иммуносупрессорную функцию клеток Tr1 и Foxp3+ T-reg. По существу, антитела могут имитировать лиганд OX40 и запускать рецептор OX40 на клетках Tr1 и/или на природных регуляторных T-клетках («nTreg»), также называемых «Foxp3+ T-reg».
Как было показано авторами в одновременно находящихся на рассмотрении заявках на выдачу патента США с регистрационными номерами 11/659266 и 12/861135, OX40L ингибирует образование и функцию IL-10-продуцирующих клеток Tr1 из наивных T-клеток и T-клеток памяти CD4+, которые индуцировали иммунодепрессивными лекарственными средствами дексаметазоном и витамином D3. Авторы изобретения обнаружили, что OX40L ингибирует образование и функцию IL-10-продуцирующих регуляторных T-клеток. Такие открытия демонстрируют, что передача сигнала OX40 при действии OX40L подавляет образование IL-10-продуцирующих иммуносупрессорных T-клеток человека в культуре. Такая уникальная функция OX40L не свойственна двум другим костимулирующим представителям TNF-семейства, GITR-лиганду и 4-1BB-лиганду. OX40L также сильно ингибирует образование и функцию IL-10-продуцирующих клеток Tr1, индуцируемых двумя физиологическими стимулами, обеспечиваемыми индуцируемым костимулирующим лигандом и незрелыми ДК. Передача сигнала через рецептор OX40 на T-клетках человека при действии моноклональных антител, малых молекул или OX40L или белком, который по меньшей мере на 90 процентов гомологичен ими, модулирует и регулирует образование и функцию IL-10-продуцирующих иммуносупрессорных T-клеток.
Такое обнаружение дает возможность многочисленным вариантам использования при лечении. Например, агонистические антитела, малые молекулы или OX40L можно использовать для подавления образования и функции IL-10-продуцирующих иммуносупрессорных T-клеток и, следовательно, их можно использовать для усиления иммунных ответов для лечения злокачественной опухоли и инфекционных болезней, или в качестве адъюванта противораковых вакцин. Антагонистические антитела против OX40 или против OX40L или антагонистические малые молекулы можно использовать для усиления образования и функции IL-10-продуцирующих иммуносупрессорных T-клеток и, следовательно, их можно использовать для создания способов терапии аутоиммунных заболеваний и заболеваний «трансплантат против хозяина». Обнаружение, сделанное авторами изобретения также обеспечивает возможность осуществления способов высокопроизводительного скрининга антител или малых молекул, либо активирующих рецептор OX40 (либо наоборот блокирующих передачу сигнала OX40) на T-клетках для создания способов лечения злокачественной опухоли, или альтернативно, аутоиммунных заболеваний и болезней «трансплантат против хозяина».
Настоящее изобретение относится к моноклональным антителам и антителам человека (иногда называемым в настоящем описании «антителом против OX40» и/или другими вариантами такого названия), которые связывают рецептор OX40 человека. Такие антитела могут использоваться для лечения или профилактики острых или хронических заболеваний или состояний, патология которых связана с OX40. В одном из аспектов раскрыто выделенное антитело человека или его антигенсвязывающая часть, которые связываются с OX40 человека и являются эффективными в качестве средства лечения злокачественной опухоли или лечения, направленного против аутоиммунного заболевания. Любое из антител против OX40, описанных в настоящем описании, можно использовать в качестве лекарственного средства. Любое, одно или несколько, антител против OX40 можно использовать для лечения одной или нескольких различных злокачественных опухолей или аутоиммунного заболевания, описанных в настоящем описании.
Настоящее изобретение относится к выделенным гуманизированным антителам, которые связываются с OX40. Выделенные антитела, которые описаны в настоящем описании, связываются с OX40 и могут связываться с OX40, кодируемым следующими генами: с номером доступа в NCBI NP_003317, с номером доступа в Genpept Accession P23510, или генами, которые на 90 процентов гомологичны им. Выделенное антитело, предлагаемое в настоящем описании, может дополнительно связываться с рецептором OX40, имеющим один из следующих номером доступа в GenBank: AAB39944, CAE11757 или AAI05071.
Как указано в настоящем описании, примером является выделенное антитело, которое связывается с OX40, содержащее: (a) вариабельную область тяжелой цепи CDR1, содержащую аминокислотную последовательность SEQ ID NO:1; (b) вариабельную область тяжелой цепи CDR2, содержащую аминокислотную последовательность SEQ ID NO:2; (c) вариабельную область тяжелой цепи CDR3, содержащую аминокислотную последовательность SEQ ID NO:3; (d) вариабельную область легкой цепи CDR1, содержащую аминокислотную последовательность SEQ ID NO:7; (e) вариабельную область легкой цепи CDR2, содержащую аминокислотную последовательность SEQ ID NO:8; и (f) вариабельную область легкой цепи CDR3, содержащую аминокислотную последовательность SEQ ID NO:9.
Кроме того, другим примером является выделенное антитело, которое связывается с OX40, содержащее: (a) вариабельную область тяжелой цепи CDR1, содержащую аминокислотную последовательность SEQ ID NO:13; (b) вариабельную область тяжелой цепи CDR2, содержащую аминокислотную последовательность SEQ ID NO:14; (c) вариабельную область тяжелой цепи CDR3, содержащую аминокислотную последовательность SEQ ID NO:15; (d) вариабельную область легкой цепи CDR1, содержащую аминокислотную последовательность SEQ ID NO:19; (e) вариабельную область легкой цепи CDR2, содержащую аминокислотную последовательность SEQ ID NO:20; и (f) вариабельную область легкой цепи CDR3, содержащую аминокислотную последовательность SEQ ID NO:21.
Кроме того, другим примером является выделенное антитело, которое связывается с OX40, содержащее: (a) вариабельную область тяжелой цепи CDR1, содержащую аминокислотную последовательность SEQ ID NO:25; (b) вариабельную область тяжелой цепи CDR2, содержащую аминокислотную последовательность SEQ ID NO:26; (c) вариабельную область тяжелой цепи CDR3, содержащую аминокислотную последовательность SEQ ID NO:27; (d) вариабельную область легкой цепи CDR1, содержащую аминокислотную последовательность SEQ ID NO:32; (e) вариабельную область легкой цепи CDR2, содержащую аминокислотную последовательность SEQ ID NO:33; и (f) вариабельную область легкой цепи CDR3, содержащую аминокислотную последовательность SEQ ID NO:34.
Альтернативно, выделенное антитело может иметь вариабельную область тяжелой цепи CDR1, содержащую аминокислотную последовательность SEQ ID NO:1 или 13; вариабельную область тяжелой цепи CDR2, содержащую аминокислотную последовательность SEQ ID NO:2 или 14; и/или вариабельную область тяжелой цепи CDR3, содержащую аминокислотную последовательность SEQ ID NO:3 или 15, или вариабельную область тяжелой цепи CDR, которая на 90 процентов гомологична указанным последовательностям.
Кроме того, выделенное антитело может иметь вариабельную область легкой цепи CDR1, содержащую аминокислотную последовательность SEQ ID NO:7 или 19; вариабельную область легкой цепи CDR2, содержащую аминокислотную последовательность SEQ ID NO:8 или 20, и/или вариабельную область легкой цепи CDR3, содержащую аминокислотную последовательность SEQ ID NO:9 или 21, или вариабельную область тяжелой цепи, которая на 90 процентов гомологична указанным последовательностям.
Выделенное антитело может иметь вариабельную область легкой цепи («VL»), содержащую аминокислотную последовательность SEQ ID NO:10, 11, 22 или 23, или аминокислотную последовательность, которая по меньшей мере на 90 процентов идентична аминокислотным последовательностям SEQ ID NO:10, 11, 22 или 23. Выделенное антитело может иметь вариабельную область тяжелой цепи («VH»), содержащую аминокислотную последовательность SEQ ID NO:4, 5, 16 и 17 или аминокислотную последовательность, которая по меньшей мере на 90 процентов идентична аминокислотным последовательностям SEQ ID NO:4, 5, 16 и 17. По существу, в качестве примера выделенное антитело может содержать вариабельную последовательность тяжелой цепи SEQ ID NO:5 и вариабельную последовательность легкой цепи SEQ ID NO:11 или последовательность, которая на 90 процентов гомологична указанным последовательностям. Подобным образом, выделенное антитело может иметь вариабельную последовательность тяжелой цепи SEQ ID NO:17 и вариабельную последовательность легкой цепи SEQ ID NO:23 или последовательность, которая на 90 процентов гомологична указанным последовательностям.
Выделенное антитело может иметь вариабельную легкую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO:12 или 24 или последовательностью нуклеиновой кислоты, которая по меньшей мере на 90 процентов идентична нуклеотидным последовательностям SEQ ID NO:12 или 24. Выделенное антитело может иметь вариабельную тяжелую цепь, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO:6 или 18 или последовательностью нуклеиновой кислоты, которая по меньшей мере на 90 процентов идентична нуклеотидными последовательностями SEQ ID NO:6 или 18.
Также настоящее изобретение относится к моноклональному антителу. Моноклональные антитела могут иметь вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:10 или 22, или аминокислотную последовательность, которая по меньшей мере на 90 процентов идентична аминокислотным последовательностям SEQ ID NO:10 или 22. Кроме того, изобретение отнросится к моноклональным антителам с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность SEQ ID NO:4 или 16 или аминокислотную последовательность, которая по меньшей мере на 90 процентов идентична аминокислотным последовательностям SEQ ID NO:4 или 16.
Также настоящее описание относится к выделенной нуклеиновой кислоте, кодирующей антитело против OX40, описанной в настоящем описании. Кроме того, настоящее изобретение относится к клеткам-хозяевам, которые содержат нуклеиновую кислоту, кодирующую любое из антител против OX40, описанных в настоящем описании. Кроме того, изобретение относится к способам получения антитела (например, клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую любое из антител против OX40, описанных в настоящем описании), включающим культивирование клетки-хозяина так, чтобы она продуцировала антитело, и/или извлечение антитела из клетки-хозяина.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Для того, чтобы перечисленные выше признаки, аспекты и преимущества изобретения, а также другое, которое будет очевидно, были достигнуты и могли быть понятны в деталях, может быть приведено более конкретное описание изобретения, кратко суммированного выше, при обращении к его вариантам, которые проиллюстрированы на чертежах, которые составляют часть настоящего описания. Однако следует отметить, что прилагаемые чертежи иллюстрируют некоторые варианты осуществления изобретения, и поэтому их не следует рассматривать как ограничивающие объем изобретения, так как изобретение может допускать другие эквивалентно эффективные варианты осуществления.
На фиг. 1 показано, что FOXP3+Treg инфильтруют ткани фолликулярной лимфомы (FL) человека и локализованы вместе с опухолевыми B-клетками и моноцитами. Слева: двойное иммуноокрашивание клеток FOXP3+ Treg (красные) и B-клеток лимфомы CD20+ (зеленые); Справа: FOXP3+ Treg (красные) и CD11c+ моноциты/макрофаги/ДК (зеленые).
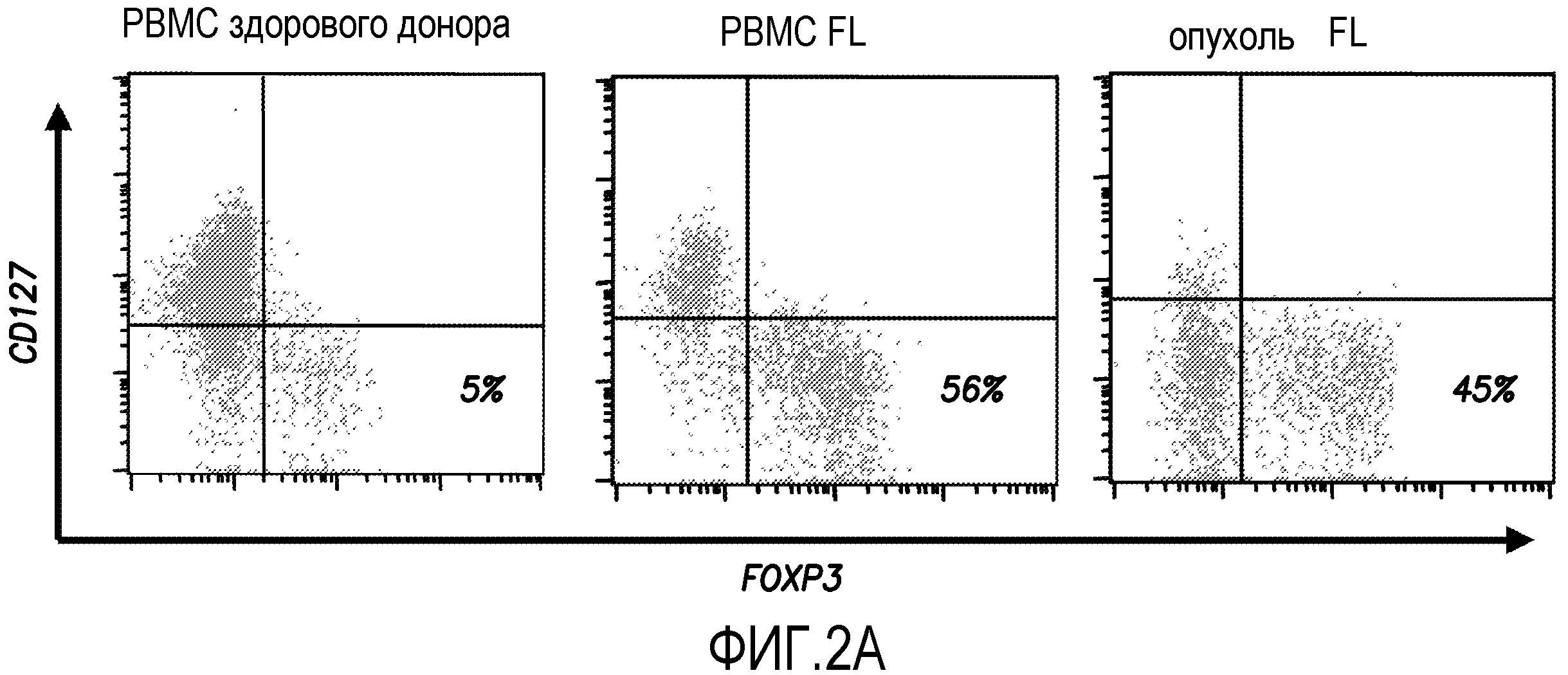
На фиг. 2A и 2B показаны увеличенные количества CD4+FOXP3+ Treg у пациентов с FL. Опухолевые клетки и PBMC получали от шести пациентов с FL при первичном диагнозе перед терапией. PBMC также получали от шести здоровых доноров для сравнения. Процентное содержание регуляторных T-клеток среди суммарных T-клеток CD4+ определяли в проточно-цитометрическом анализе CD4+CD25+CD127lowFOXP3+ Treg. На фиг. 2A показан типичный FACS-анализ клеток Treg. FL PBMC и опухолевые клетки FL были получены от одного и того же пациенты и разделены. На фиг. 2B показано процентное содержание Treg у всех доноров. Горизонтальные полоски показывают средние значения.
На фиг. 3 показано выделение ICOS+FOXP3+ Treg или ICOS-FOXP3+ Treg из FL. Суспензию отдельных клеток получали из образца селезенки перед любой обработкой. Клетки размораживали в день анализа. Обогащенные T-клетки CD4+CD8-CD14-CD16-CD56-CD11c-TCRγδ- делили на подгруппы CD25low и CD25high. CD4+CD25highFOXP3+ Treg дополнительно сортировали на подгруппы ICOShigh и ICOSlow на основании поверхностной экспрессии ICOS. Внутриклеточную экспрессию FOXP3 определяли во всех подгруппах.
На фиг. 4 показано, что внутриопухолевые Treg ингибируют пролиферацию инфильтрующих T-клеток CD4+CD25- в FL, и ингибирование может быть частично блокировано нейтрализующими антителами против IL-10. CFSE-меченые инфильтрующие опухоль T-клетки CD4+CD25- культивировали с аутологичными опухолевыми клетками, предварительно активированными рекомбинантным CD40L в присутствии или отсутствии аутологичных ICOS+FOXP3+ Treg или ICOS-FOXP3+ Treg, или анти-IL-10 (10 мкг/мл). Через 72 часа культивирования определяли пролиферацию клеток CD4+CD25- в проточно-цитометрическом анализе разбавления CFSE.
На фиг. 5A показан внутриклеточный анализ продукции цитокинов наивными T-клетками CD4+, которую определяли с использованием проточной цитометрии согласно варианту осуществления способа по настоящему изобретению.
На фиг. 5B показана продукция цитокинов наивными T-клетками CD4+, которую определяли в ELISA согласно варианту осуществления способа по настоящему изобретению.
На фиг. 5C показана супрессорная функция IL-10-продуцирующих клеток Tr1, которую определяли по включению [3H]-тимидина согласно варианту осуществления способа по настоящему изобретению.
На фиг. 6A показан внутриклеточный анализ продукции цитокинов T-клетками памяти CD4+, которую определяли с использованием проточной цитометрии согласно осуществления способа по настоящему изобретению.
На фиг. 6B показана продукция IL-10 T-клетками памяти CD4+, которую определяли в ELISA согласно варианту осуществления способа по настоящему изобретению.
На фиг. 7A показан внутриклеточный анализ продукции цитокинов наивными T-клетками CD4+, которую определяли с использованием проточной цитометрии согласно варианту осуществления способа по настоящему изобретению.
На фиг. 7B показана продукция IL-10 наивными T-клетками CD4+, которую определяли в ELISA согласно варианту осуществления способа по настоящему изобретению.
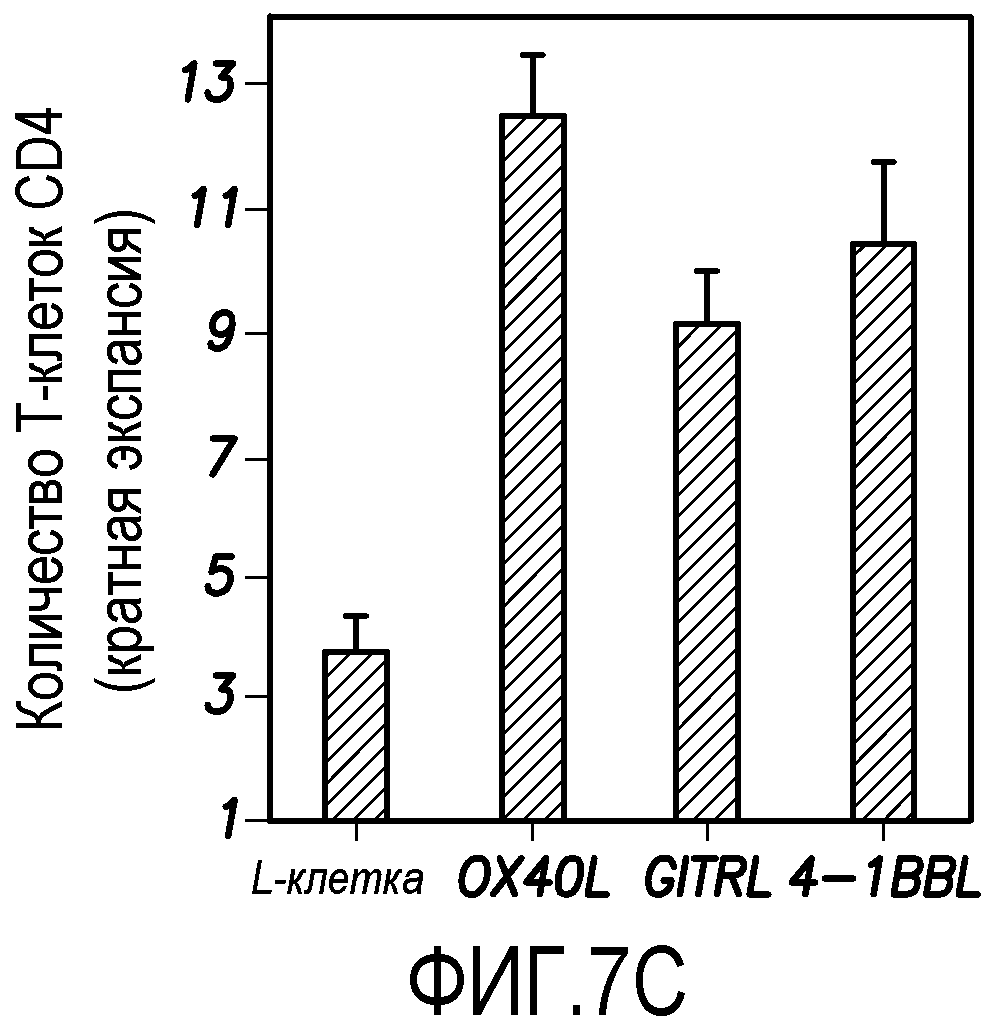
На фиг. 7C показано количество живых T-клеток, подсчитанное согласно варианту осуществления способа по настоящему изобретению.
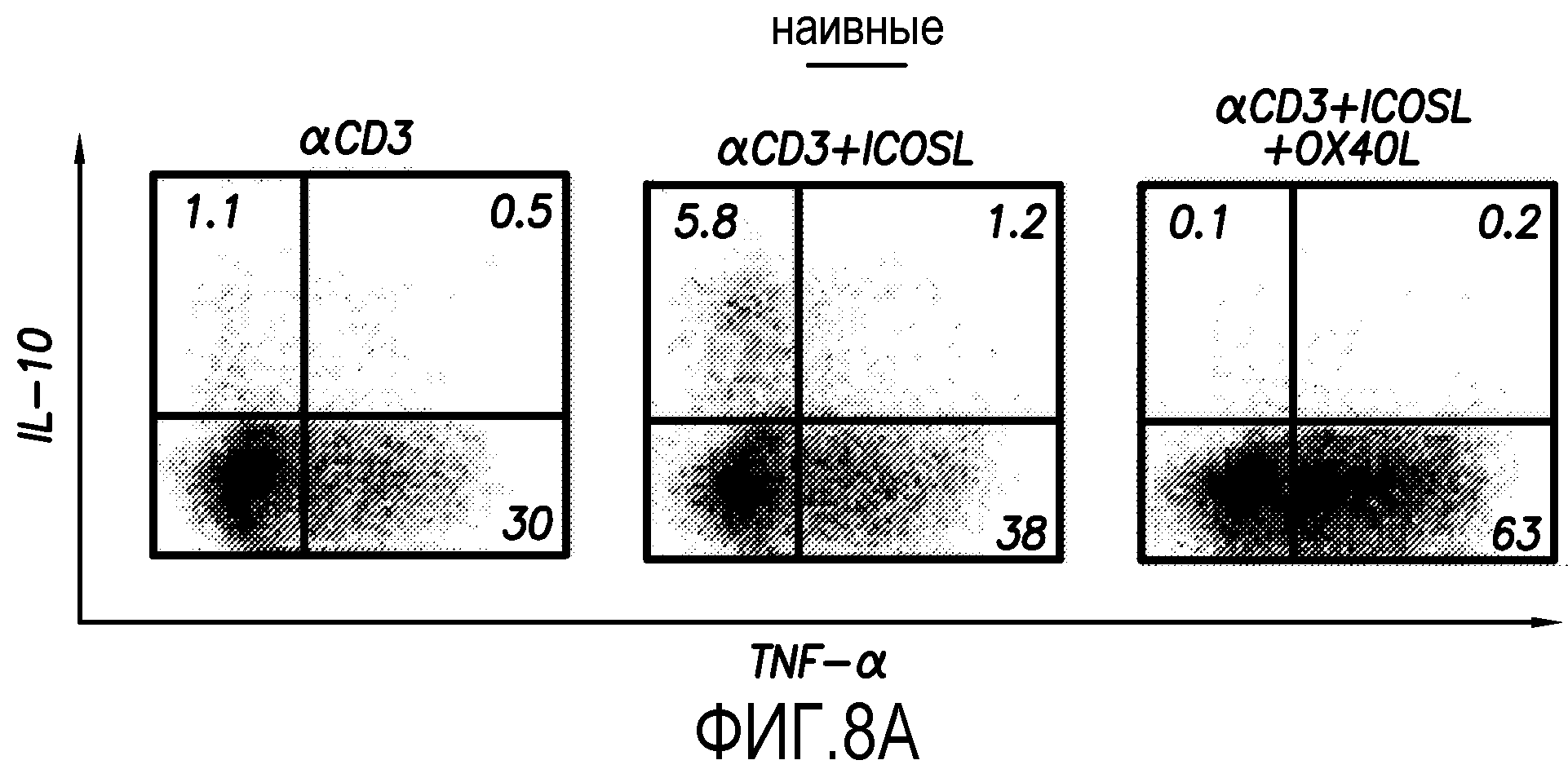
На фиг. 8A показан внутриклеточный анализ продукции цитокинов наивными T-клетками CD4+, которую определяли с использованием проточной цитометрии согласно варианту осуществления способа по настоящему изобретению.
На фиг. 8B показана продукция IL-10 наивными T-клетками CD4+, которую определяли в ELISA согласно варианту осуществления способа по настоящему изобретению.
На фиг. 8C показан внутриклеточный анализ продукции цитокинов T-клетками памяти CD4+, которую определяли с использованием проточной цитометрии согласно варианту осуществления способа по настоящему изобретению.
На фиг. 8D показана продукция IL-10 T-клетками памяти CD4+, которую определяли в ELISA согласно варианту осуществления способа по настоящему изобретению.
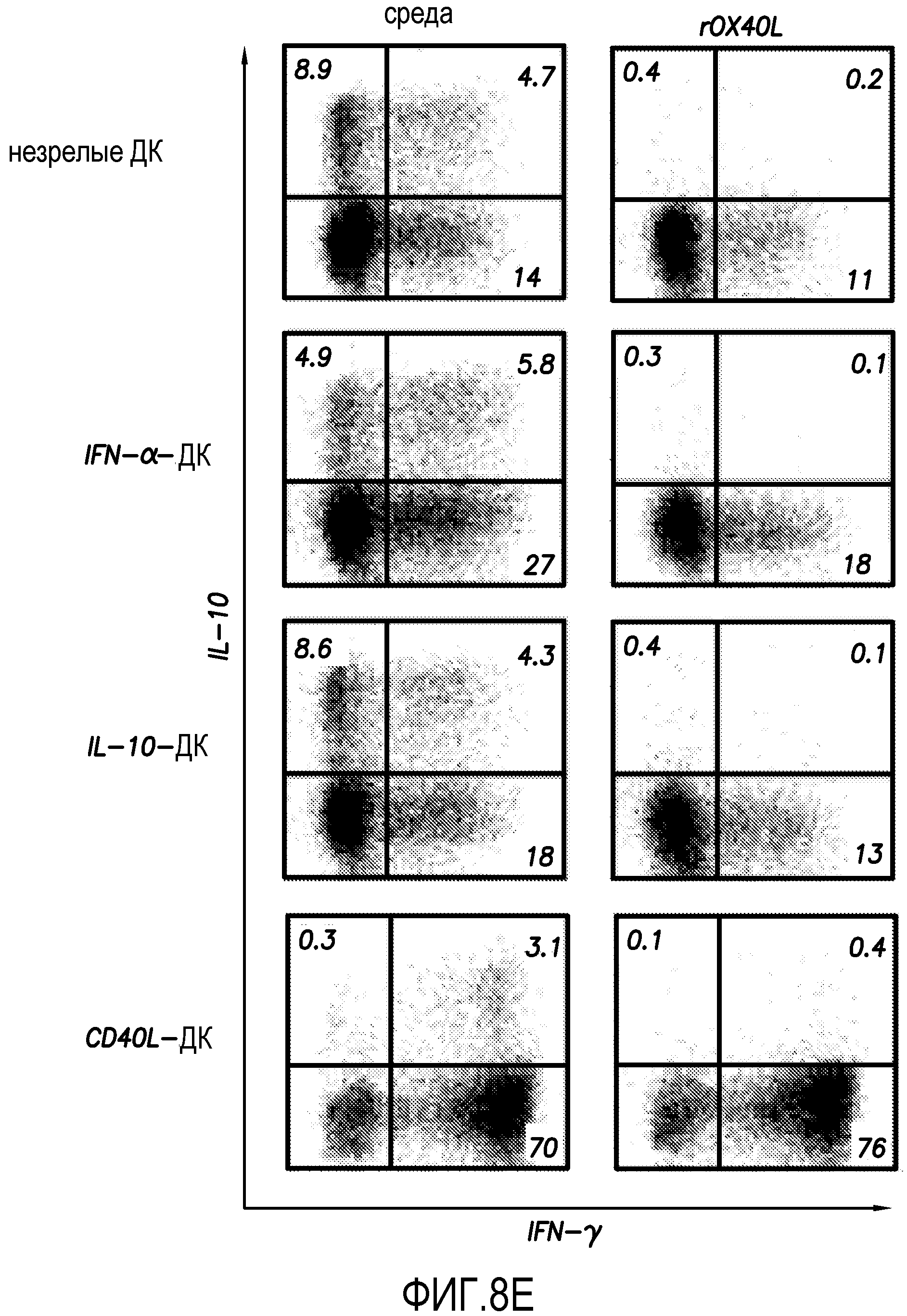
На фиг. 8E показан внутриклеточный анализ продукции цитокинов наивными T-клетками CD4+, которую определяли с использованием проточной цитометрии согласно варианту осуществления способа по настоящему изобретению.
На фиг. 8F показана продукция IL-10 наивными T-клетками CD4+, которую определяли в ELISA согласно варианту осуществления способа по настоящему изобретению.
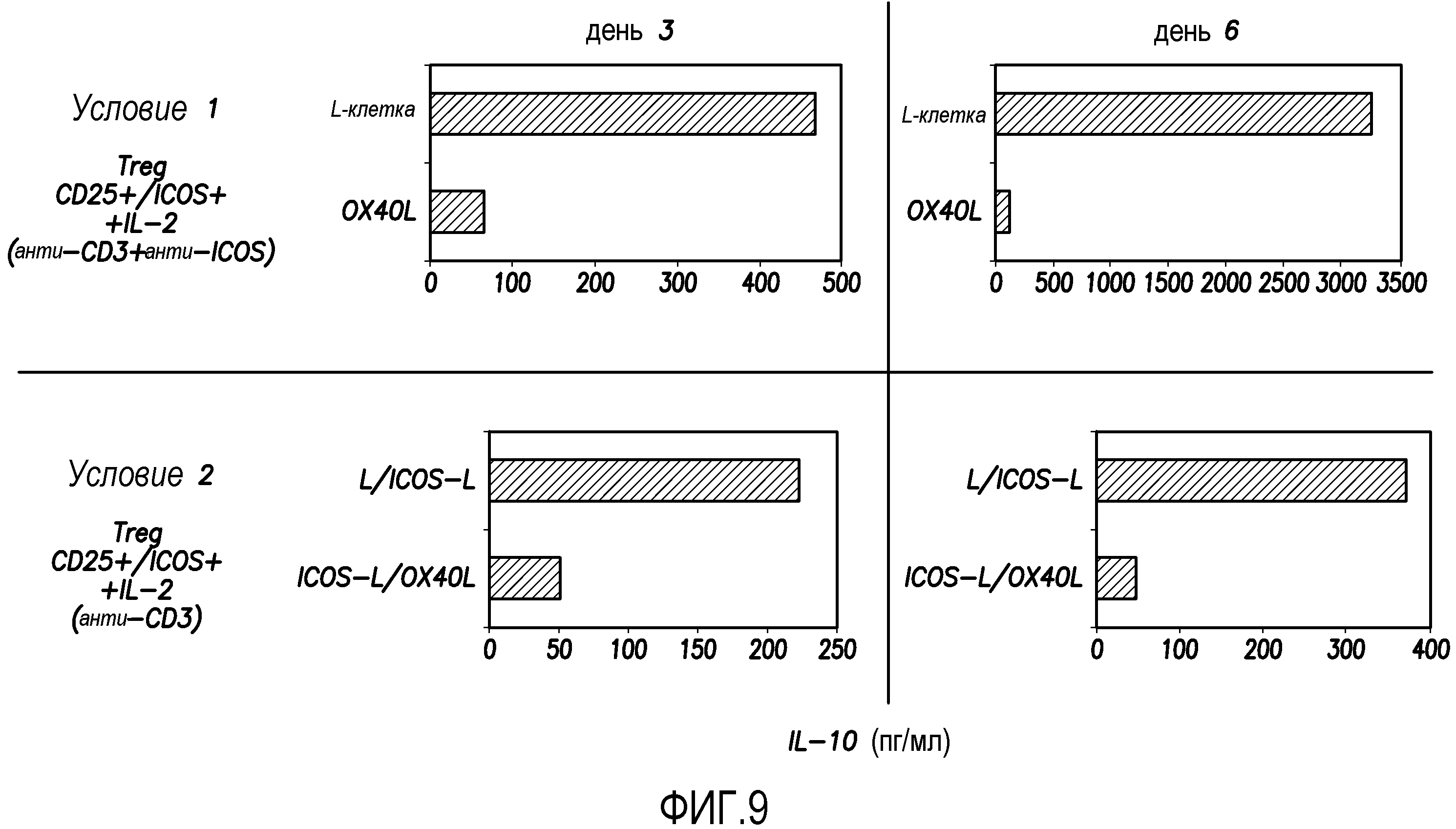
На фиг. 9 показана продукция IL-10 регуляторными T-клетками, которую определяли в ELISA согласно варианту осуществления способа по настоящему изобретению.
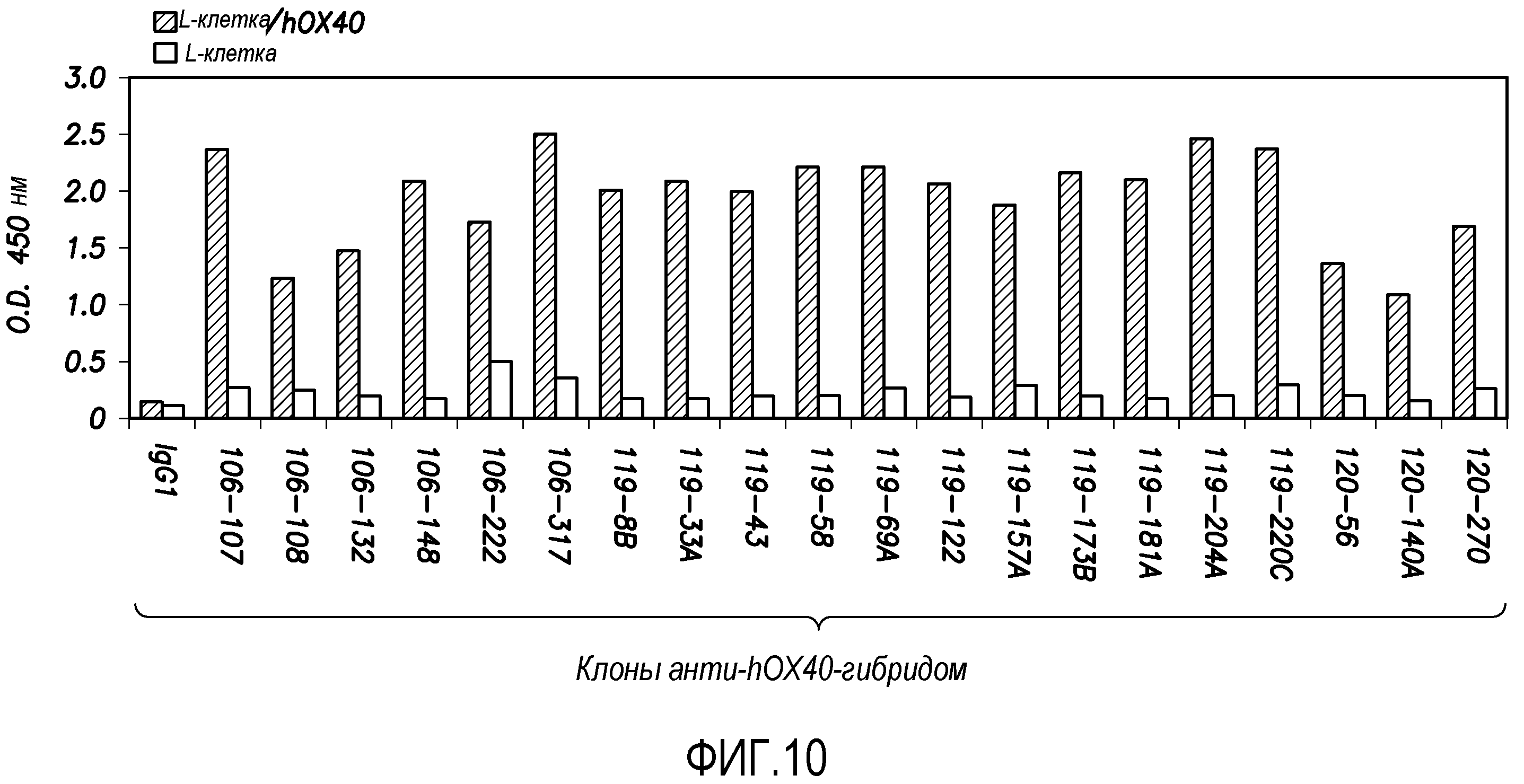
На фиг. 10 показаны результаты скрининга супернатантов гибридом, продуцирующих антитела против OX40 человека, против L-OX40 по сравнению с исходными L-клетками, которые были получены в ELISA.
На фиг. 11 показан скрининг специфичных моноклональных антител против OX40 человека, который осуществляли с использованием проточно-цитометрического анализа согласно варианту осуществления способа по настоящему изобретению.
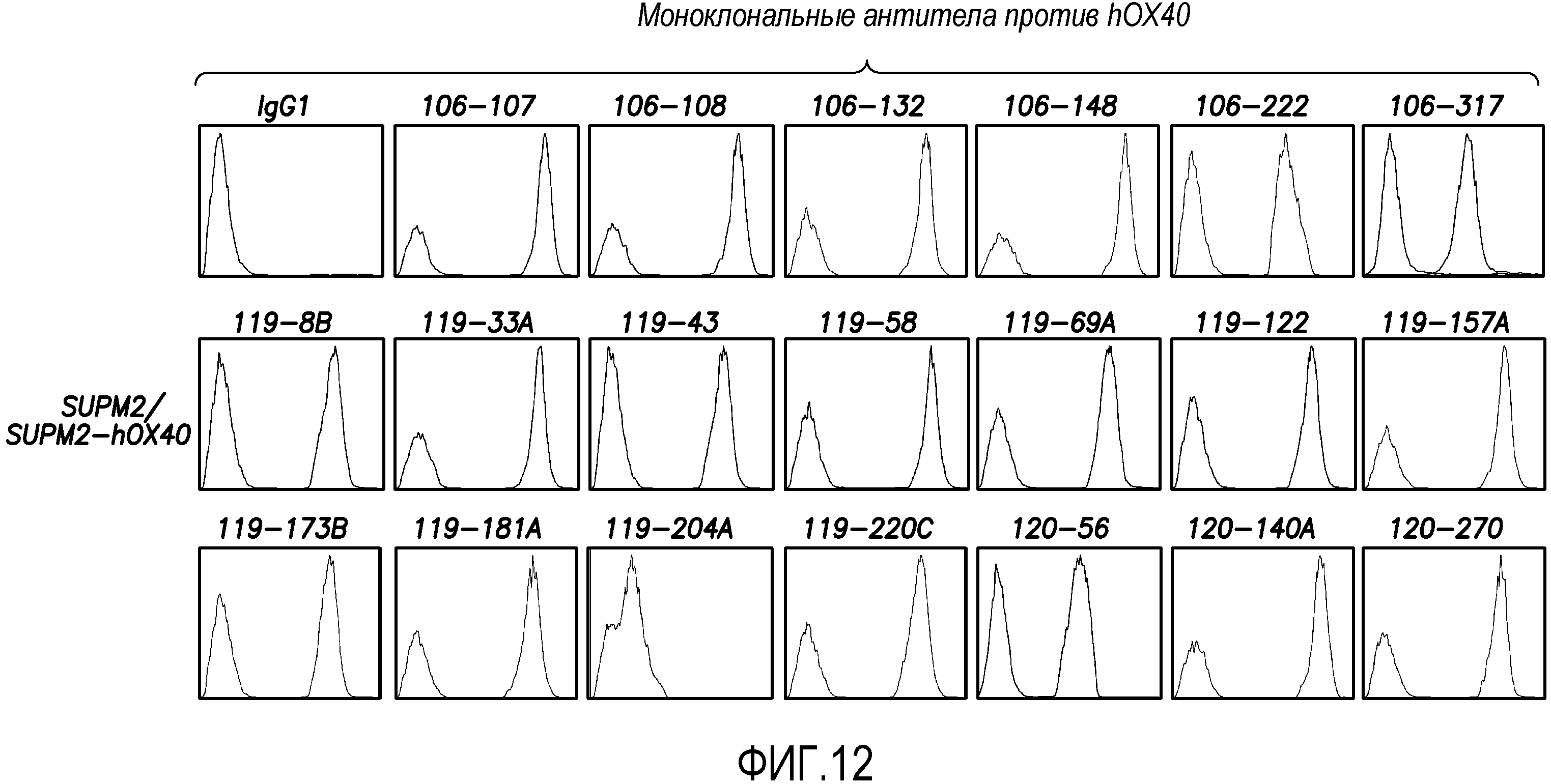
На фиг. 12 показано подтверждение специфичности моноклональных антител против hOX40 с использованием клеток SUPM2, экспрессирующих OX40 (SUPM2-OX40) согласно варианту осуществления способа по настоящему изобретению.
На фиг. 13 показаны OX40-специфичные моноклональные антитела, которые могут ингибировать образование IL-10-продуцирующих клеток (Tr1) из T-клеток CD4+, стимулированных витамином D3 (0,1 мкМ)/Dex (50 нм), CD32L/ICOSL и анти-CD3/CD28 (0,2 мкг/мл) согласно варианту осуществления способа по настоящему изобретению. Типичные данные, полученные с использованием активируемой флуоресценцией сортировки клеток (FACS), показаны на фиг. A, и процент IL-10-продуцирующих клеток в случае всех обработок моноклональными OX40-антителами показан на фиг. B.
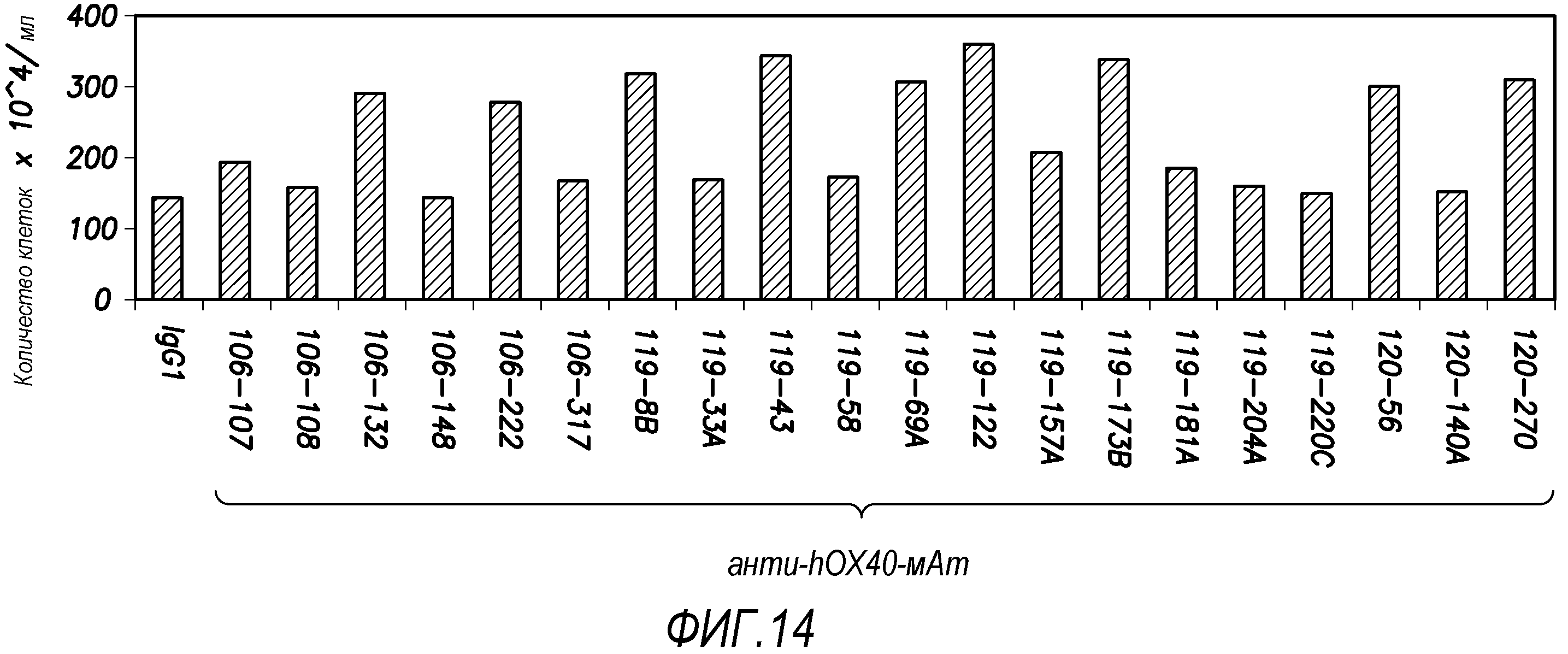
На фиг. 14 показаны результаты, свидетельствующие, что hOX40-специфичные моноклональные антитела, которые ингибируют образование клеток Tr1, также стимулируют пролиферацию T-клеток CD4+ согласно варианту осуществления способа по настоящему изобретению.
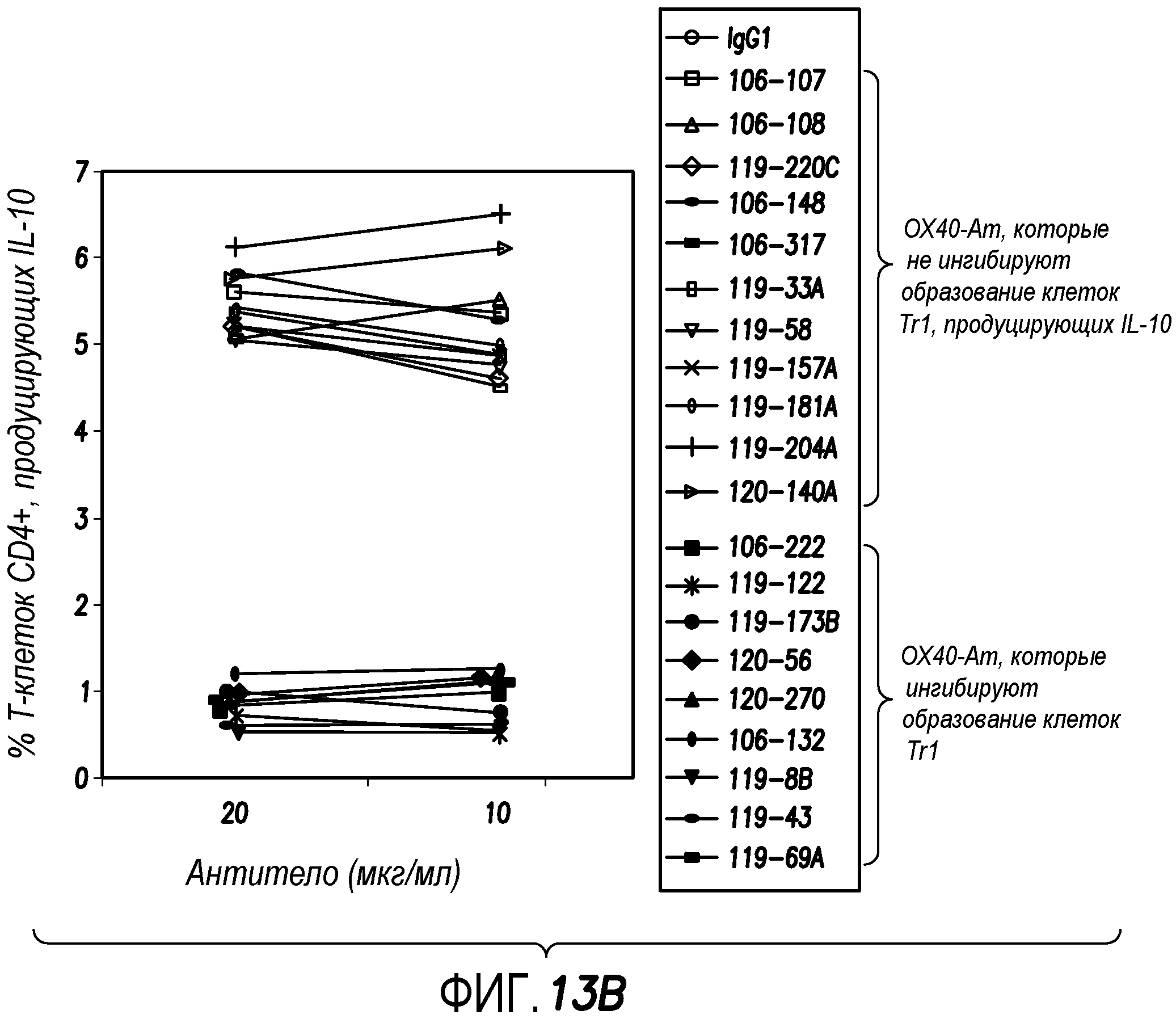
На фиг. 15A, 15B и 15C подробно показано титрование моноклональных OX40-антител в отношении их способности ингибировать образование клеток Tr1 из T-клеток CD4+ согласно варианту осуществления способа по настоящему изобретению. Типичные данные FACS показаны на фиг. 15A, и процентное содержание клеток Tr1 после обработки девятью моноклональными OX40-антителами показано на фиг. 15B.
На фиг. 16A, 16B и 16C показаны OX40-специфичные моноклональные антитела, которые ингибируют образование IL-10-продуцирующих клеток Tr1 из T-клеток CD4+, а также ингибируют продукцию IL-10 и иммуносупрессорную функцию ICOS+CD4+CD25highCD127- Treg. Свежие отсортированные ICOS+CD4+CD25highCD127- Treg (ICOS+Treg) стимулировали анти-CD3 (0,2 мкг/мл) в присутствии клеток CD32L/ICOSL и клеток CD32L/OX40L (фиг. 16A) или моноклональными OX40-антителами или контрольным антителом (фиг. 16B) в течение пяти дней. Затем клетки повторно стимулировали анти-CD3/CD28 в течение 24 часов и супенатанты анализировали в отношении IL-10 в твердофазном иммуноферментном анализе (ELISA). На фиг. 16C представлен основанный на моноцитах анализ пролиферации, показывающий, что два антитела блокировали функцию ICOS+Treg.
На фиг. 17A и 17B показана идентификация моноклональных анти-hOX40-антител, которые ингибируют образование клеток Tr1 и блокируют функцию FOXP3+CD4+CD25high Treg, согласно варианту осуществления способа по настоящему изобретению. Типичные проточно-цитометрические анализы показаны на фиг. 17A. Данные для шести моноклональных антител показаны на фиг. 17B.
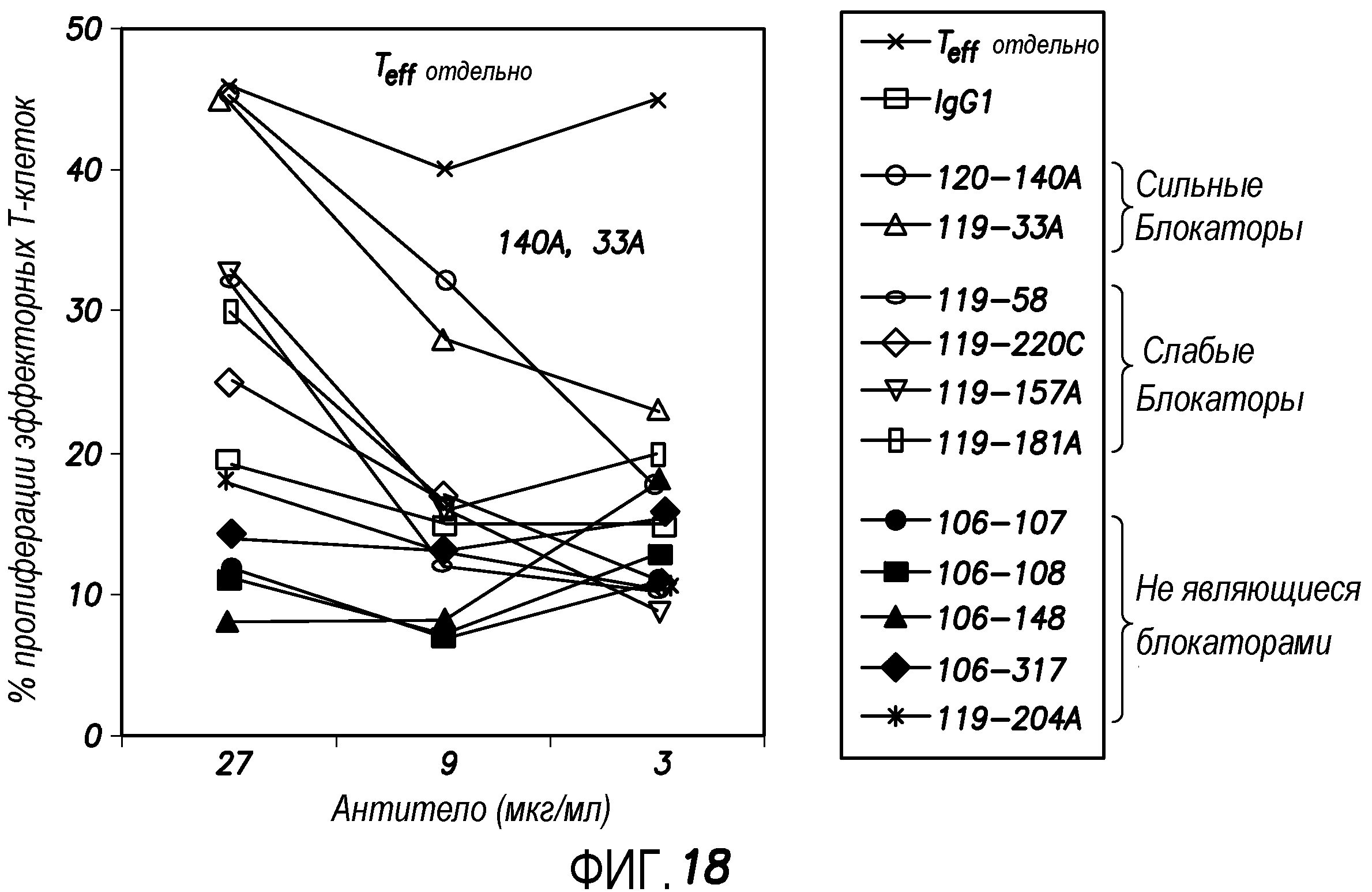
На фиг. 18 показана идентификация анти-hOX40 моноклональных антител, которые не ингибируют образование клеток Tr1, но блокируют функцию FOXP3+CD4+CD25high Treg, согласно варианту осуществления способа по настоящему изобретению.
На фиг. 19A и 19B показано блокирование агонистическими анти-hOX40-антителами функции полученных из лимфомы CD4+CD25high Treg, согласно варианту осуществления способа по настоящему изобретению. Типичные анализы FACS показаны на фиг. 19A, и данные всех экспериментов показаны на фиг. 19B.
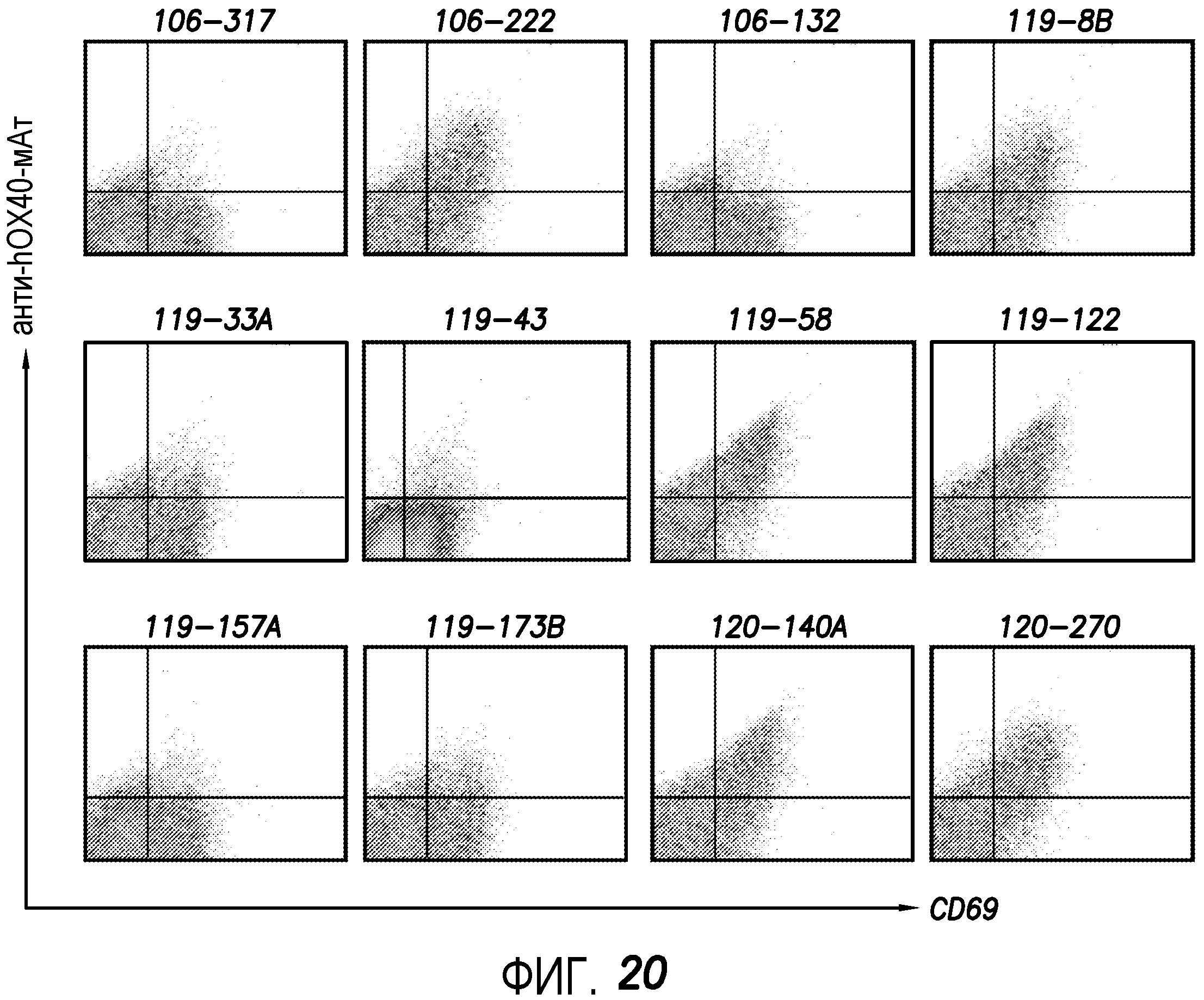
На фиг. 20 показано, что моноклональные анти-hOX40- антитела могут связываться с T-клетками CD4+ резус. Как показано, шесть анти-hOX40-мАт могут связываться с активированными T-клетками CD4+ резус, и будут связываться с OX40 резус и активировать передачу сигнала OX40.
На фиг. 21 показано, что каждое из антител Hu106-222 партии I и II из примера I состоит из тяжелой цепи с молекулярной массой примерно 50 кД и легкой цепи с молекулярной массой примерно 25 кД. Чистота антител Hu106-222 партии I и II, по-видимому, составляет более 95%.
На фиг. 22 показан анализ антител мыши 106-122, Ch106 и Hu106-222 (партия II) в отношении связывания с клетками L/OX40 (пример I).
На фиг. 23 изображена схематичная структура вектора экспрессии для IgG1/каппа-антитела Hu106 (вектор экспрессии). В направлении по часовой стрелке от сайта SalI сверху плазмида содержит единицу транскрипции тяжелой цепи, начинающуюся основным немедленным ранним промотором цитомегаловируса (CMV) человека и энхансером (промотор CMV) для инициации транскрипции гена тяжелой цепи антитела. За промотором следует экзон VH, геномная последовательность, содержащая константную область тяжелой цепи гамма-1 человека, включая экзоны CH1, шарнирный, CH2 и CH3 с находящимися между ними интронами, и сайт полиаденилирования, следующий за экзоном CH3. Вслед за последовательностью гена тяжелой цепи единица транскрипции легкой цепи начинается промотором CMV, за которым следует экзон VL и геномная последовательность, содержащая экзон константной области цепи каппа человека (CL) с предшествующей ему частью интрона, и сайт полиаденилирования, следующий за экзоном CL. После гена легкой цепи следует ранний промотор SV40 (промотор SV40), ген ксантингуанинфосфорибозилтрансферазы (gpt) E. coli и участок, содержащий сайт полиаденилирования SV40 (сайт поли(A) SV40). Наконец, плазмида содержит часть плазмиды pUC19, включающую бактериальное начало репликации (pUC ori) и ген бета-лактамазы (бета-лактамаза). На фигуре показаны положения соответствующих сайтов рестрикции.
На фиг.24 показано сравнение между антителами Hu 106-222 партии I и II в отношении связывания с клетками L/OX40 (пример I ниже).
На фиг. 25 показано, что Hu119-122 состоит из тяжелой цепи с молекулярной массой примерно 50 кД и легкой цепи с молекулярной массой примерно 25 кД. Чистота Hu119, по-видимому, составляет более 95% (пример II ниже).
На фиг. 26 показан результат FACS-анализа антител Ch119-122 и Hu119-122, описанных в настоящем описании (пример II ниже).
На фиг. 27 показано, что клон 119-122 гуманизированных мАт против OX40 человека (Hu119) и соответствующее ему FcR-связывающее мутантное антитело (Hu1l9-AA) усиливали пролиферацию наивных T-клеток CD4+. Hu119-122 обладало более высокой стимулирующей T-клетки активностью по сравнению с исходным мАт мыши против OX40 человека (119-122 мыши). Однако химерное мАт против OX40 человека (Ch119, VH и VL мыши, но константные области гамма-1 и каппа человека) не могло усиливать пролиферацию T-клеток.
На фиг. 28 показано, что клон FcR-связывающих мутантных гуманизированных мАт против OX40 человека 106-222 (Hu222AA) и клон химерных мАт против OX40 человека 106-222 (Ch222) усиливали стимулированную анти-CD3 пролиферацию наивных T-клеток CD4+. Указанные антитела обладали стимулирующей активностью, сходной с активностью исходного мАт мыши против OX40 человека (222 мыши). Однако полностью гуманизированное антитело против OX40 человека, Hu222, не усиливало пролиферацию T-клеток по сравнению с IgG1 человека.
На фиг. 29A и B показано, что гуманизированный и мышиный клоны мАт против OX40 человека 119-122 блокируют супрессорную функцию CD4+ Treg.
На фиг. 30 представлены данные, показывающие, что антитела против OX40 человека усиливают пролиферацию T-клеток CD4+ и CD8+ в случае использования связанных с планшетом антител.
На фиг. 31 показано, что гуманизированные антитела и антитела мыши против OX40 человека требуют перекрестного связывания для того, чтобы усилить пролиферацию T-клеток.
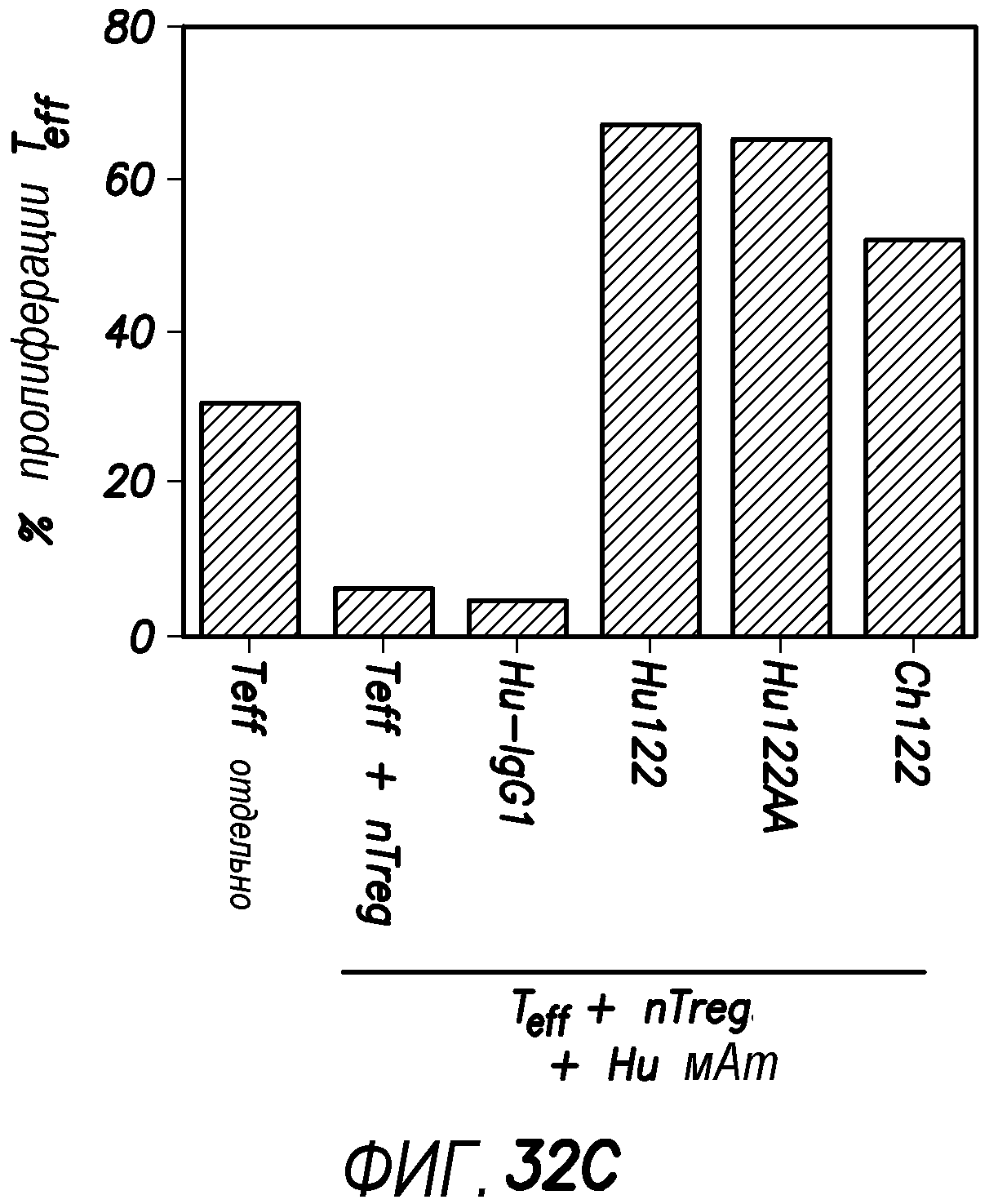
На фиг. 32 показано, что антитела против OX40 человека блокируют активность CD4+FOXP3+nTreg при использовании связанных с планшетом антител.
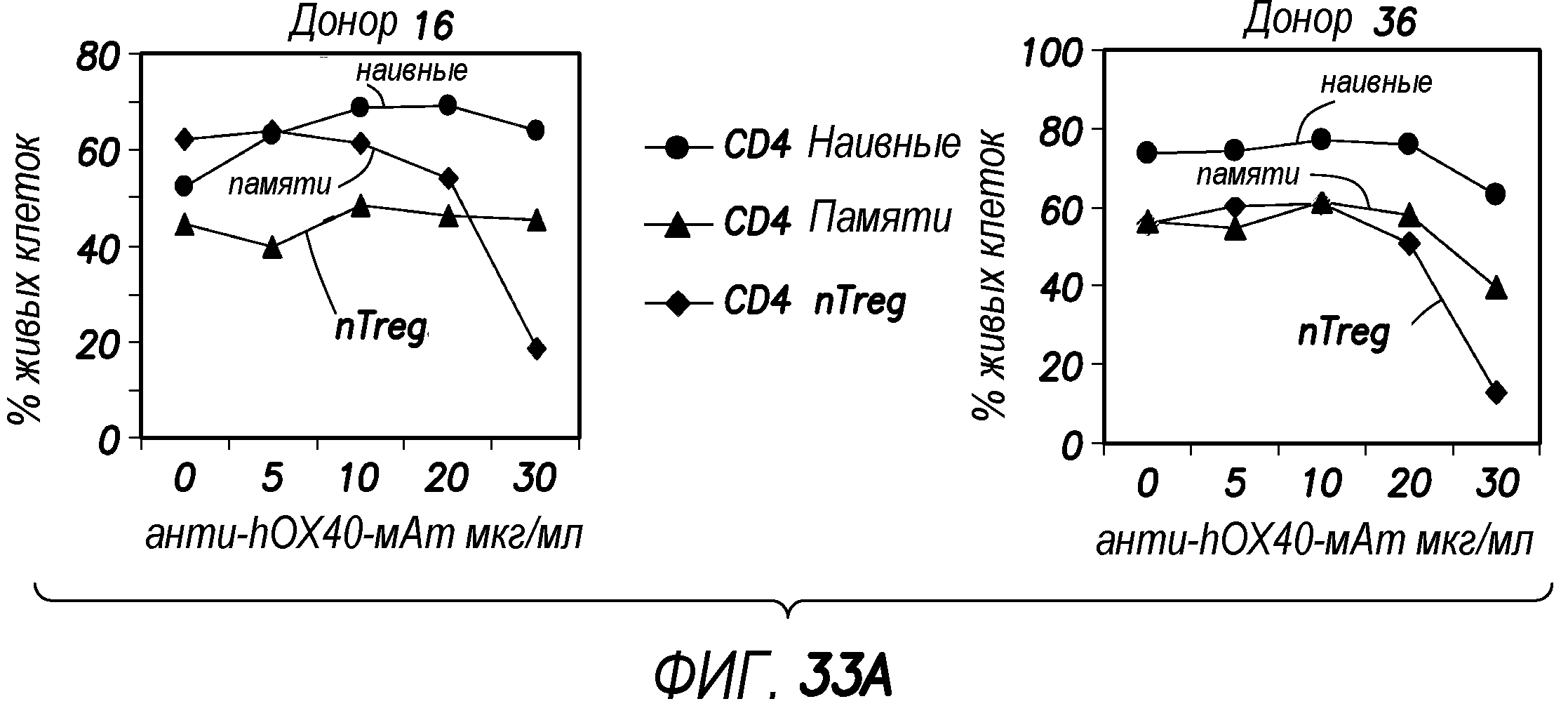
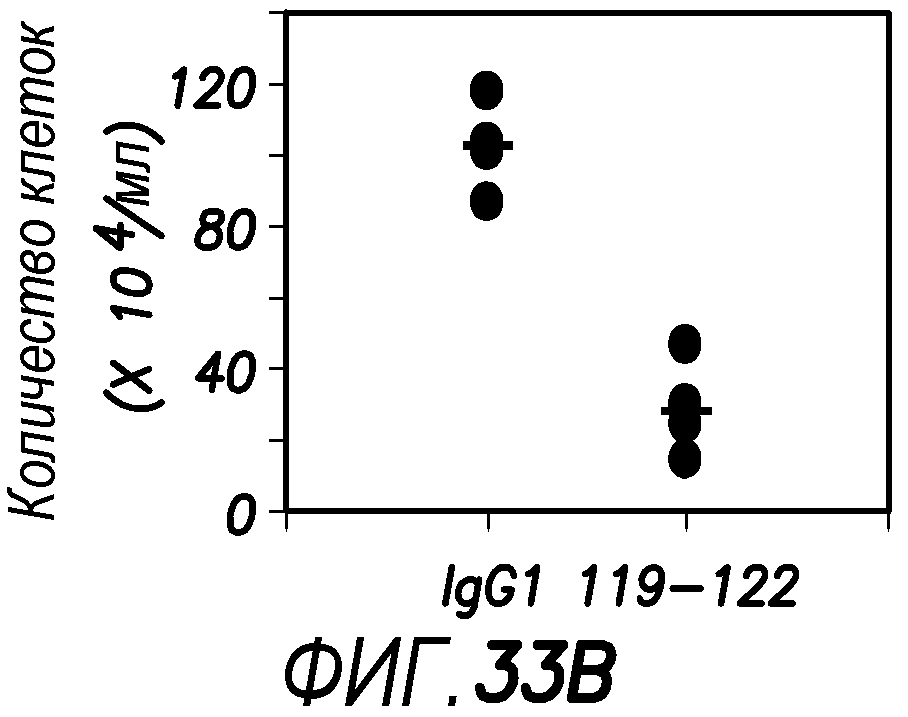
На фиг. 33 показано, что высокая концентрация антител мыши против OX40 человека преимущественно убивает FOXP3+ Treg.
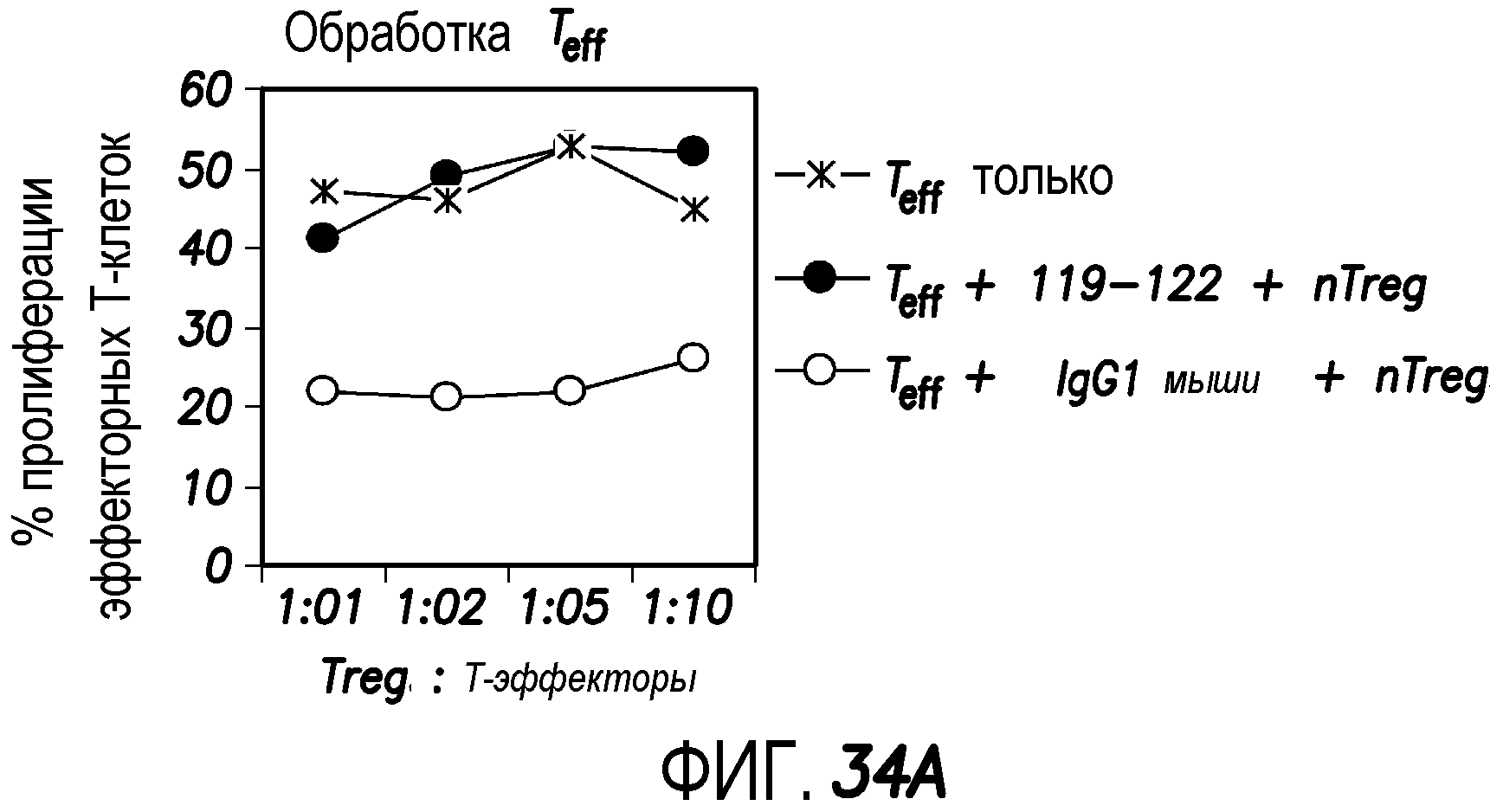
На фиг. 34 показано, что мАт мыши против OX40 человека непосредственно действуют либо на эффекторные T-клетки, либо на nTreg, блокируя супрессорную функцию Treg.
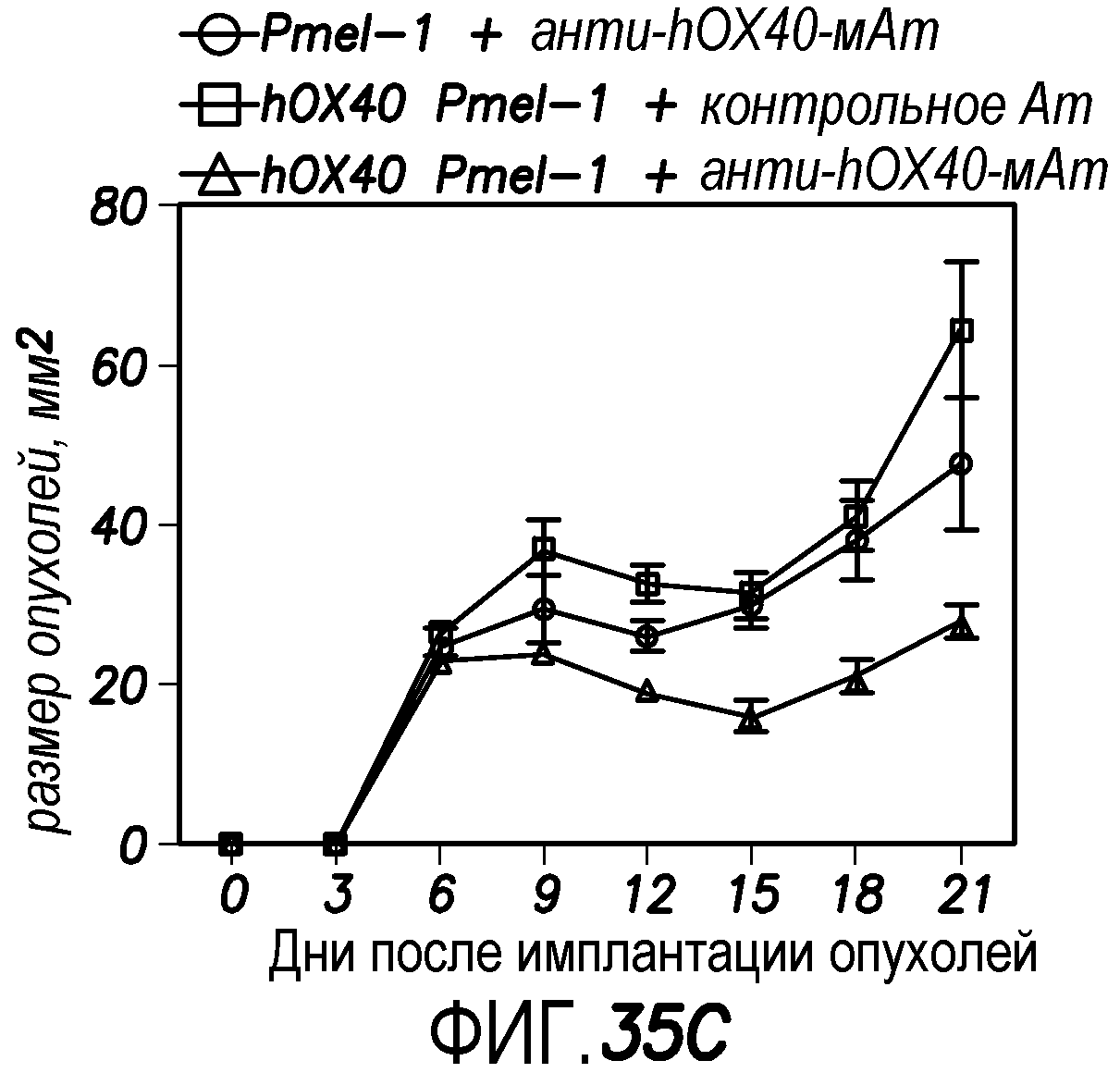
На фиг. 35A, 35B и 35C показаны результаты лечения с использованием анти-hOX40-мАт у мышей, у которых был осуществлен адоптивный перенос T-клеток hOX40+CD8+. мАт против OX40 человека стимулирует экспансию и выживаемость T-клеток in vivo. Схема терапевтической вакцинации показана на фиг. 35A. Типичные изображения биолюминесценции in vivo показаны на фиг. 35B. Результаты лечения опухолей антителами показаны на фиг. 35C.
На фиг. 36 показано выравнивание аминокислотных последовательностей VH 106-222, гуманизированного 106-222 (Hu106) и последовательности VH акцептора человека X61012 (номер доступа в GenBank). Аминокислотные остатки показаны с использованием однобуквенного кода. Числа над последовательностями указывают положения согласно системе Kabat et al. (Sequences of Proteins of Immunological Interests, Fifth edition, NIH Publication No. 91-3242, U.S. Department of Health and Human Services, 1991). Такие же последовательности, как и последовательности, заявленные в настоящем описании, также представлены в списке последовательностей, но номера положений могут отличаться. На фигуре 36, последовательности CDR, определенные согласно системе Kabat et al. (1991), подчеркнуты в VH 106-222. Остатки CDR в VH X61012 на фигуре пропущены. Проводили поиск последовательностей VH человека, гомологичных каркасам VH 106-222, в базе данных GenBank, и последовательность VH, кодируемая кДНК X61012 человека (X61012 VH) была выбрана в качестве акцептора для гуманизации. Последовательности CDR VH 106-222 сначала переносили в соответствующие положения VH X61012. Затем в положениях каркаса, в которых, как свидетельствовала трехмерная модель вариабельных областей 106-222, происходит значимый контакт с CDR, аминокислотными остатками VH 106-222 мыши заменяли соответствующие остатки человека. Такие замены осуществляли в положениях 46 и 94 (подчеркнуты в VH Hu106). Кроме того, остаток каркаса человека, который, как было обнаружено, является нетипичным в соответствующей подгруппе V-областей, заменяли наиболее типичным остатком, чтобы снизить потенциальную иммуногенность. Такую замену осуществляли в положении 105 (подчеркнуто двумя чертами в VH Hu106).
На фиг. 37 показано выравнивание аминокислотных последовательностей VL 106-222, гуманизированного 106-222 (Hu106) и последовательности VL акцептора AJ388641 человека (номер доступа в GenBank). Аминокислотные остатки показаны с использованием однобуквенного кода. Числа над последовательностями указывают положения согласно системе Kabat et al. (1991). Такие же последовательности, как и последовательности, заявленные в настоящем описании, также представлены в списке последовательностей, хотя номера положений могут отличаться. Последовательности CDR, определенные согласно системе Kabat et al. (1), подчеркнуты в VH 106-222. Остатки CDR в VL AJ388641 на фигуре пропущены. Проводили поиск последовательностей VL человека, гомологичных каркасам VL 106-222, в базе данных GenBank, и последовательность VL, кодируемая кДНК AJ388641 человека (VL AJ388641 VL) была выбрана в качестве акцептора для гуманизации. Последовательности CDR VL 106-222 переносили в соответствующие положения VL AJ388641. В гуманизированной форме не проводили замен в каркасе.
На фиг. 38 показана нуклеотидная последовательность гена VH Hu106, фланкированная сайтами SpeI и HindIII (подчеркнуты) вместе с рассчитанной аминокислотной последовательностью. Аминокислотные остатки показаны с использованием однобуквенного кода. Последовательность сигнального пептида показана курсивом. N-концевой аминокислотный остаток (Q) зрелой VH подчеркнут двойной чертой. Последовательности CDR согласно определению Kabat et al. (1991) подчеркнуты. Такие же последовательности, как и последовательности, заявленные в настоящем описании, также представлены в списке последовательностей, но номера положений в списке последовательностей могут отличаться. Последовательность интрона показана курсивом. Фрагмент гена VH Hu106, расщепленного SpeI и HindIII, клонировали между соответствующими сайтами в векторе экспрессии, показанном на фиг. 23.
На фиг. 39 показана нуклеотидная последовательность гена VL Hu106-222, фланкированная сайтами NheI и EcoRI (подчеркнуты), вместе с рассчитанной аминокислотной последовательностью. Аминокислотные остатки показаны с использованием однобуквенного кода. Последовательность сигнального пептида показана курсивом. N-концевой аминокислотный остаток (D) зрелой VL подчеркнут двумя чертами. Последовательности CDR согласно определению Kabat et al. (1991) подчеркнуты. Последовательность интрона указана курсивом. Фрагмент гена VL Hu106, расщепленного NheI и EcoRI, клонировали между соответствующими сайтами в векторе экспрессии, показанном на фиг. 23. Такие же последовательности, как и последовательности, заявленные в настоящем описании, также представлены в списке последовательностей, но номера положений в списке последовательностей могут отличаться.
На фиг. 40 показано выравнивание аминокислотных последовательностей VH 119-122, гуманизированного 119-122 (Hu1l9) и последовательности акцептора Z14189 человека (номер доступа в GenBank). Аминокислотные остатки показаны с использованием однобуквенного кода. Числа над последовательностями указывают положения согласно системе Kabat et al. (Sequences of Proteins of Immunological Interests, Fifth edition, NIH Publication No. 91-3242, U.S. Department of Health and Human Services, 1991). Последовательности CDR, определенные согласно системе Kabat et al. (1991), подчеркнуты в VH 119-122. Остатки CDR в VH Z14189 пропущены на фигуре. Осуществляли поиск последовательностей VH человека, гомологичных каркасам VH 119-122, в базе данных GenBank, и была выбрана последовательность VH, кодируемая кДНК Z14189 человека (Z14189 VH) в качестве акцептора для гуманизации. Последовательности CDR VH 119-122 сначала переносили в соответствующие положения VH Z14189. Затем положения в каркасе, в случае которых трехмерная модель вариабельных областей 119-122 свидетельствовала о значимом контакте с CDR, аминокислотными остатками VH 119-122 мыши заменяли соответствующие остатки человека. Такие замены осуществляли в положениях 26, 27, 28, 30 и 47 (подчеркнуты в последовательности VH Hu119), которые показаны на фигуре. Такие же последовательности, как и последовательности, заявленные в настоящем описании, также представлены в списке последовательностей, но номера положений в списке последовательностей могут отличаться.
На фиг. 41 показано выравнивание аминокислотных последовательностей VL 119-122, гуманизированного 119-122 (Hu119) и последовательности VL акцептора M29469 человека (номер доступа GenBank). Аминокислотные остатки показаны с использованием однобуквенного кода. Числа над последовательностями указывают положения согласно системе Kabat et al. (1991). Последовательности CDR, определенные согласно Kabat et al. (1), подчеркнуты в VL 119-122. Остатки CDR в VL M29469 пропущены в последовательности. Осуществляли поиск последовательностей VL человека, гомологичных каркасам VL 119-122, в базе данных GenBank, и последовательность VL, кодируемая кДНК M29469 человека (M29469 VL), была выбрана в качестве акцептора для гуманизации. Последовательности CDR VL 119-122 переносили в соответствующие положения VL M29469. Замены в каркасе в гуманизированной форме не требовались. Такие же последовательности, как и последовательности, заявленные в настоящем описании, также представлены в списке последовательностей, но номера положений в списке последовательностей могут отличаться.
На фиг. 42 показана нуклеотидная последовательность гена VH Hu119, фланкированная сайтами SpeI и HindIII (подчеркнуты) вместе с рассчитанной аминокислотной последовательностью. Аминокислотные остатки показаны с использованием однобуквенного кода. Последовательность сигнального пептида показана курсивом. N-концевой аминокислотный остаток (E) зрелой VH подчеркнут двумя чертами. Последовательности CDR согласно определению Kabat et al. (1991) подчеркнуты. Последовательность интрона указана курсивом. Фрагмент гена VH Hu119, расщепленного SpeI и HindIII, клонировали между соответствующими сайтами в векторе экспрессии, показанном на фиг. 23. Такие же последовательности, как и последовательности, заявленные в настоящем описании, также представлены в списке последовательностей, но номера положений в списке последовательностей могут отличаться.
На фиг. 43 показана нуклеотидная последовательность гена VL Hu119, фланкированная сайтами NheI и EcoRI (подчеркнуты) вместе с рассчитанной аминокислотной последовательностью. Аминокислотные остатки показаны с использованием однобуквенного кода. Последовательность сигнального пептида показана курсивом. N-концевой аминокислотный остаток (E) зрелой VL подчеркнут двумя чертами. Последовательности CDR согласно определению Kabat et al. (1991) подчеркнуты. Последовательность интрона указана курсивом. Фрагмент гена VL Hu1119, расщепленного NheI и EcoRI, клонировали между соответствующими сайтами в векторе экспрессии, показанном на фиг. 23. Такие же последовательности, как и последовательности, заявленные в настоящем описании, также представлены в списке последовательностей, но номера положений в списке последовательностей могут отличаться.
На фиг. 44 показана нуклеотидная последовательность кДНК VH 119-43-1 мыши вместе с рассчитанной аминокислотной последовательностью. Аминокислотные остатки показаны с использованием однобуквенного кода. Последовательность сигнального пептида показана курсивом. N-концевой аминокислотный остаток (E) зрелой VH подчеркнут двумя чертами. Последовательности CDR согласно определению Kabat et al. (Sequences of Proteins of Immunological Interests, Fifth edition, NIH Publication No. 91-3242, U.S. Department of Health and Human Services, 1991) подчеркнуты.
На фиг. 45 показана нуклеотидная последовательность кДНК VL 119-43-1 мыши и рассчитанная аминокислотная последовательность. Аминокислотные остатки показаны с использованием однобуквенного кода. Последовательность сигнального пептида показана курсивом. N-концевой аминокислотный остаток (D) зрелой VL подчеркнут двумя чертами. Последовательности CDR согласно определению Kabat et al. (1991) подчеркнуты.
На фиг. 46 показана нуклеотидная последовательность сконструированного гена VH 119-43-1, фланкированная сайтами SpeI и HindIII (подчеркнуты), вместе с рассчитанной аминокислотной последовательностью. Аминокислотные остатки показаны с использованием однобуквенного кода. Последовательность сигнального пептида показана курсивом. N-концевой аминокислотный остаток (E) зрелой VH подчеркнут двумя чертами. Последовательности CDR согласно определению Kabat et al. (1991) подчеркнуты. Последовательность интрона указана курсивом.
На фиг. 47 показана нуклеотидная последовательность сконструированного гена VL 119-43-1, фланкированная сайтами NheI и EcoRI (подчеркнуты) вместе с рассчитанной аминокислотной последовательностью. Аминокислотные остатки показаны с использованием однобуквенного кода. Последовательность сигнального пептида показана курсивом. N-концевой аминокислотный остаток (D) зрелой VL подчеркнут двумя чертами. Последовательности CDR согласно определению Kabat et al. (1991) подчеркнуты. Последовательность интрона указана курсивом.
На фиг. 48 показана схематичная структура pCh119-43-1 (называемая вектором экспрессии на фигуре). В направлении по часовой стрелке от сайта SalI наверху плазмида содержит единицу транскрипции тяжелой цепи, начиная с основного немедленного раннего промотора цитомегаловируса (CMV) человека и энхансера (промотор CMV) для инициации транскрипции гена тяжелой цепи антитела. За промотором CMV следует экзон VH, геномная последовательность, содержащая константную область тяжелой цепи гамма-1 человека, включающая экзоны CH1, шарнирный, CH2 и CH3 с расположенными между ними интронами, и сайт полиаденилирования после экзона CH3. После последовательности гена тяжелой цепи начинается единица транскрипции легкой цепи промотором CMV, за которым следует экзон VL и геномная последовательность, содержащая экзон константной области цепи каппа человека (CL), с предшествующей ей частью интрона и сайтом полиаденилирования после экзона CL. За геном легкой цепи следует ранний промотор SV40 (промотор SV40), ген ксантингуанинфосфорибозилтрансферазы (gpt) и участок, содержащий сайт полиаденилирования SV40 (сайт поли(A) SV40). Наконец плазмида содержит часть плазмиды pUC19, содержащую бактериальное начало репликации (pUC ori) и гена бета-лактамазы (бета-лактамаза).
На фиг. 49 показаны последовательности олигонуклеотидов, используемых для ПЦР-амплификации и секвенирования кДНК тяжелой и легкой цепей Ch119-43-1.
На фиг. 50 показана нуклеотидная последовательность кодирующей области тяжелой цепи гамма-1 в pCh119-43-1 с использованием однобуквенного кода. Кодон терминации обозначен «•».
На фиг. 51 показана нуклеотидная последовательность кодирующей области легкой цепи каппа в pCh119-43-1 вместе с рассчитанной аминокислотной последовательностью. Аминокислотные остатки показаны с использованием однобуквенного кода. Кодон терминации обозначен «•».
На фиг. 52 показан анализ в SDS-ПААГ Ch119-43-1. Пять микрограмм Ch119-43-1 разгоняли в 4-20% SDS-ПААГ-геле в восстанавливающих условиях (дорожка 1). Предварительно окрашенный стандарт SeeBluePlus2 Invitrogen (№ в каталоге LC5925) использовали в качестве стандартов молекулярной массы (дорожка 2).
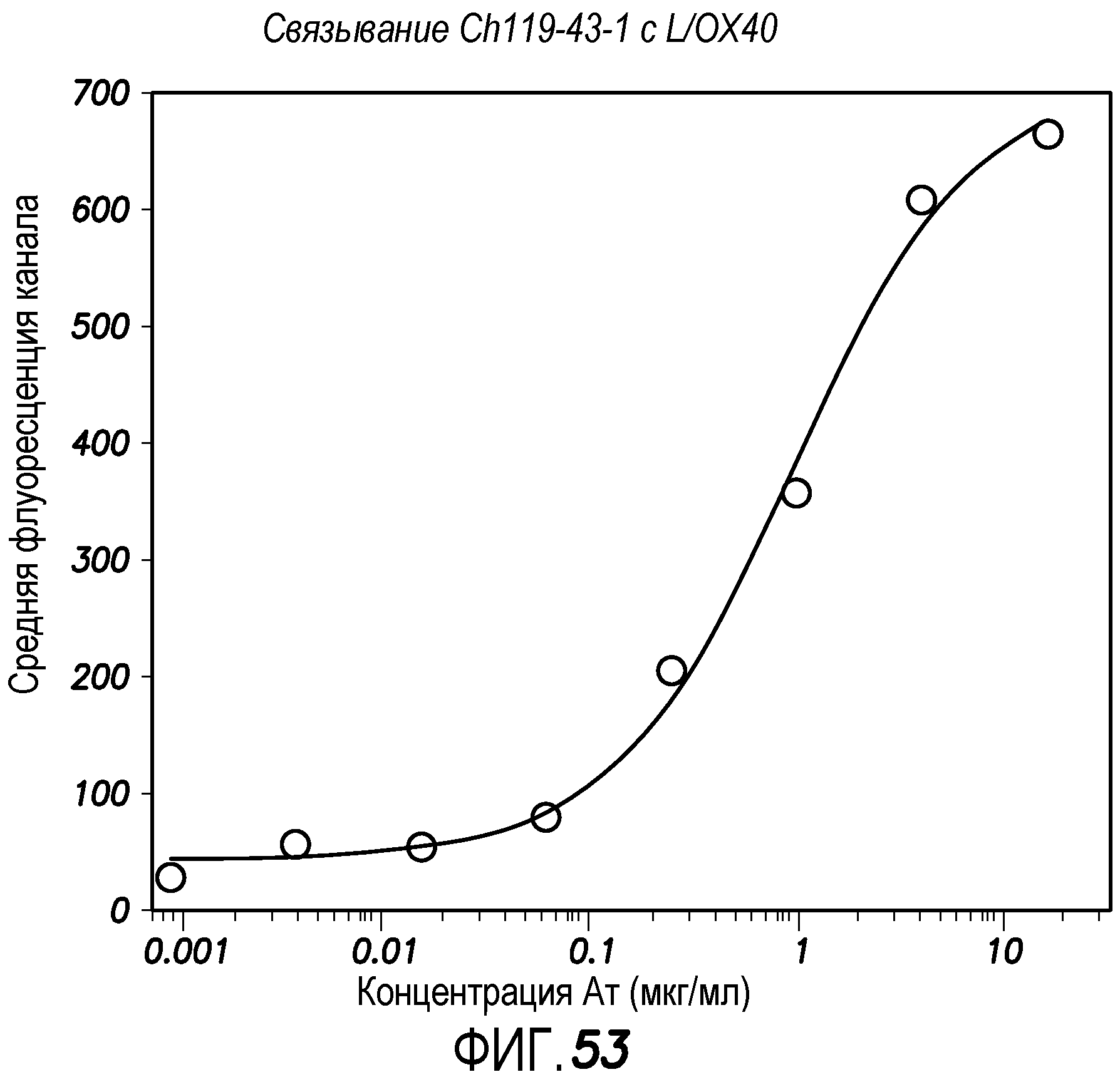
На фиг. 53 показан FACS-анализ связывания Ch119-43-1 с клетками L/OX40. Ch119-43-1 тестировали в разных концентрациях, начиная с 16 мкг/мл и используя серийные 4-кратные разведения, в отношении связывания с клетками L/OX40. Значение EC50 вычисляли, используя GraphPad Prism (компьютерную программу GraphPad, San Diego, CA).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРТЕНИЯ
Термин «антитело» включает молекулу иммуноглобулина, состоящую из четырех полипептидных цепей, двух тяжелых (H) цепей и двух легких (L) цепей, взаимосвязанных дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно называемой в настоящем описании HCVR или VH) и константной области тяжелой цепи. Константная область тяжелой цепи содержит три домена, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно называемой в настоящем описании LCVR или VL) и константной области легкой цепи. Константная область легкой цепи содержит один домен (CL1). Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), между которыми находятся более консервативные области, называемые каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, которые распределены от амино-конца до карбоксильного конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Термин «антигенсвязывающая часть» антитела (или просто «часть антитела») охватывает фрагменты антитела, которые сохраняют способность специфично связываться с антигеном (например, hOX40). Было показано, что антигенсвязывающая функция антитела может осуществляться фрагментами полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином «антигенсвязывающая часть» антитела, включают (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL1 и CH1; (ii) F(ab')2-фрагмент, бивалентный фрагмент, содержащий два F(ab)'-фрагмента, связанных дисульфидной связью в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) dAb-фрагмент (Ward et al. (1989) Nature 241: 544-546), который состоит из домена VH; и (vi) выделенную область, определяющую комплементарность (CDR). Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, они могут быть связаны с использованием способов рекомбинации синтетическим линкером, который позволяет получать их в виде одной белковой цепи, в которой области VL и VH составляют пару с образованием моновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, Bird et al., (1988) Science 242: 423-426; и Huston et al., (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Также подразумевается, что такие одноцепочечные антитела охватывает термин «антигенсвязывающая часть» антитела. Другие формы одноцепочечных антител, такие как диантитела, также подпадают под такой термин. Диантитела представляют собой бивалентные, биспецифичные антитела, в которых домены VH и VL экспрессированы в одной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы обеспечить спаривание между двумя доменами на одной и той же цепи, что вынуждает домены спариваться с комплементарными доменами другой цепи и приводит к созданию двух антигенсвязывающих участков (см., например, Holliger, P. et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448; Poljak, R.J., et al. (1994) Structure 2: 1121-1123). Кроме того, антитело или его антигенсвязывающая часть может быть частью более крупной молекулы иммуноадгезии, образованной в результате ковалентной или нековалентной ассоциации антитела или части антитела с одним или несколькими другими белками или пептидами. Примеры таких молекул иммуноадгезии включают использование центральной области стрептавидина для получения тетрамерной молекулы scFv (Kipriyanov, S. M. et al. (1995) Human Antibodies and Hybridomas 6: 93-101) и использование остатка цистеина, маркерного пептида и C-концевой полигистидиновой метки для получения бивалентных и биотинилированных молекул scFv (Kipriyanov, S. M. et al. (1994) Mol. Immunol. 31: 1047-1058). Части антитела, такие как Fab- и F(ab')2-фрагменты, могут быть получены из целых антител обычными способами, такими как расщепление целых антител папаином или пепсином, соответственно. Кроме того, антитела, части антител и молекулы иммуноадгезии могут быть получены с использованием стандартных способов получения рекомбинантной ДНК, которые описаны в настоящем описании. Предпочтительными антигенсвязывающими частями являются полные домены или части полных доменов.
Лиганд OX40/OX40 (рецептор OX40)/(OX40L) представляют собой пару костимулирующих молекул, которые важны для T-клеточной пролиферации, жизнеспособности, продукции цитокинов и образования клеток памяти. Ранее в экспериментах in vitro было показано, что передача сигналов через OX40 на T-клетках CD4+ приводит к развитию TH2, но не TH1. Такие результаты были подтверждены в исследованиях in vivo, показавших, что блокирование взаимодействия OX40/OX40L предотвращало индукцию и поддержание TH2-опосредованных аллергических иммунных ответов. Однако блокирование взаимодействия OX40/OX40L ослабляет или предотвращает TH1-опосредованные заболевания. Кроме того, показано, что введение растворимого OX40L или генный перенос OX40L в опухоли сильно повышает противоопухолевый иммунитет у мышей. Недавние исследования также свидетельствуют о том, что OX40/OX40L может играть роль в стимулировании иммунных ответов, опосредованных T-клетками CD8. Как обсуждается в настоящем описании, передача сигнала OX40 блокирует ингибирующую функцию встречающихся в природе регуляторных T-клеток CD4+CD25+, и пара OX40/OX40L играют важнейшую роль в глобальной регуляции периферической иммунотолерантности.
Термин «нумерация по Kabat», «определения по Kabat» и «маркировка по Kabat» используют в настоящем описании взаимозаменяемо. Такие термины, которые известны в данной области, относятся к системе нумерации аминокислотных остатков, которые являются более вариабельными (т.е., гипервариабельными), чем другие аминокислотные остатки в вариабельных областях тяжелой и легкой цепей антитела или его антигенсвязывающей части (Kabat et al. (1971) Ann. NY Acad., Sci. 190: 382-391, и Kabat, E. A. et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242).
Фраза «рекомбинантное антитело человека» охватывает антитела человека, которые получены, экспрессированы, созданы или выделены основанными на рекомбинации способами, такие как антитела, экспрессированные с использованием рекомбинантного вектора экспрессии, которым трансфицировали клетку-хозяина, антитела, выделенные из рекомбинантной комбинаторной библиотеки антител человека, антитела, выделенные из организма животного (например, мыши), которое является трансгенным по генам иммуноглобулина человека (см., например, Taylor, L. D. et al. (1992) Nucl. Acids Res. 20: 6287-6295), или антитела, полученные, экспрессированные, созданные или выделенные любым другим способом, который включает сплайсинг последовательностей генов иммуноглобулина человека с другими последовательностями ДНК. Такие рекомбинантные антитела человека имеют вариабельные и константные области, полученные из последовательностей иммуноглобулина зародышевой линии человека (см. Kabat E.A. et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242).
«Выделенное антитело» включает антитело, которое по существу не содержит других антител, обладающих другими антигенными специфичностями (например, выделенное антитело, которое специфично связывает hOX40, по существу не содержит антител, которые специфично связывают другие антигены, отличные от hOX40). Выделенное антитело, которое специфично связывает hOX40, может связывать молекулы OX40 из других видов. Кроме того, выделенное антитело может по существу не содержать другого материала и/или химических веществ.
Термин «активность» включает такие активности, как специфичность/аффинность связывания антитела с антигеном, например, антитела против OX40 человека, которое связывается с антигеном OX40, и/или эффективность антитела в активации, например, антитела против OX40, связывание которого с рецептором hOX40 активирует биологическую активность hOX40, или активация связывания рецептора в анализе в клетках L/OX40 человека.
Термин «Koff» в используемом в настоящем описании смысле предназначен для обозначения константы скорости распада в случае диссоциации антитела из комплекса антитело/антиген. Термин «Kd» в используемом в настоящем описании смысле предназначен для обозначения константы диссоциации для конкретного взаимодействия антитело-антиген.
Фраза «резонанс поверхностного плазмона» включает оптическое явление, которое позволяет проводить анализ биоспецифичных взаимодействий в режиме реального времени посредством регистрации изменений в концентрациях белков на биосенсорной матрице, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden и Piscataway, N.J.). Дополнительно описание смотри в примере 5 и Jonsson, U., et al. (1993) Ann. Biol. Clin. 51: 19-26; Jonsson, U., et al. (1991) Biotechniques 11:620-627; Johnsson, B., et al. (1995) J. Mol. Recognit. 8: 125-131; и Johnnson, B., et al. (1991) Anal. Biochem. 198:268-277.
Термин «вектор» включает молекулу нуклеиновой кислоты, способную транспортировать другую нуклеиновую кислоту, с которой она была связана. Одним из типов векторов является «плазмида», которая представляет собой кольцевую двунитевую петлю ДНК, в которую могут быть лигированы дополнительные фрагменты ДНК. Другим типом вектора является вирусный вектор, в котором дополнительные фрагменты ДНК могут быть лигированы в вирусный геном. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы, имеющие бактериальное начало репликации, и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина при введении в клетку-хозяина, и при этом реплицируются вместе с геномом хозяина. Кроме того, некоторые векторы способны управлять экспрессией генов, с которыми они оперативно связаны. Такие векторы называют в настоящем описании «рекомбинантными векторами экспрессии» (или просто «рекомбинантными векторами»). В общем, векторы экспрессии, применимые в способах рекомбинантной ДНК, часто имеют форму плазмид. В настоящем описании термины «плазмида» и «вектор» могут быть использованы взаимозаменяемо, так как плазмида представляет собой наиболее широко используемую форму вектора. Однако подразумевается, что изобретение охватывает другие формы векторов экспрессии, такие как вирусные векторы (например, дефектные по репликации ретровирусы, аденовирусы и аденосвязанные вирусы), которые выполняют эквивалентные функции.
Фраза «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин») относится к клетке, в которую был введен рекомбинантный вектор экспрессии. Следует понимать, что такие термины предназначены для обозначения не только конкретной клетки индивида, но также к потомству такой клетки. Так как в последующих поколениях могут иметь место некоторые модификации либо вследствие мутации, либо вследствие влияния окружающей среды, такое потомство в действительности может быть не идентичным исходной клетке, но все еще будет входить в объем термина «клетка-хозяин» в используемом в настоящем описании смысле.
Термин «моноклональное антитело» (моноклональные антитела) относится к антителу или популяции подобных антител, получаемой из популяции по существу гомогенных антител, и его не следует толковать как требование получения антитела каким-либо конкретным способом, включая, без ограничения, моноклональные антитела, которые могут быть получены способом, основанном на гибридомах, впервые описанным Kohler и Milstein (Nature 256: 495-497, 1975), или могут быть получены способами, основанными на рекомбинантной ДНК.
Термин «химерное антитело» (или «химерный иммуноглобулин») относится к молекуле, содержащей тяжелую и/или легкую цепь, которая идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретного вида или относящихся к конкретному классу или подклассу антител, в то время как остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (Cabilly et al. (1984), ниже; Morrison et al., Proc. Natl. Acad. Sci. U.S.A. 81: 6851).
Термин «гуманизированное антитело» относится к формам антител, которые содержат последовательности антител животных, отличных от человека (например, мыши), а также антител человека. Гуманизированное антитело может содержать консервативные аминокислотные замены или неприродные остатки из одного и того же или разных видов, которые значимо не изменяют его связывание и/или биологическую активность. Такие антитела представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулинов животного, отличного от человека. Главным образом, гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из определяющей комплементарность области (CDR) реципиента заменены остатками из CDR вида, отличного от человека (донорное антитело), такого как мышь, крыса, верблюд, корова, коза или кролик, обладающей требуемыми свойствами. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются ни в реципиентном антителе, ни в импортированной CDR или каркасных последовательностях. Такие модификации осуществляют для того, чтобы дополнительно улучшить и максимизировать эффективность антитела. Таким образом, в общем, гуманизированное антитело будет содержать все или по существу все из по меньшей мере одного и в одном аспекте двух вариабельных доменов, в которых все или в основном все гипервариабельные петли соответствуют петлям иммуноглобулина животного, отличного от человека, и все или в основном все области FR являются областями FR из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), или константной области иммуноглобулина человека (см., например, Cabilly et al., патент США № 4816567; Cabilly et al., европейский патент № 0125023 B1; Boss et al., патент США № 4816397; Boss et al., европейский патент № 0120694 B1; Neuberger, M. S. et al., WO 86/01533; Neuberger, M. S. et al., европейский патент № 0194276 B1; Winter, патент США № 5225539; Winter, европейский патент № 0239400 B1; Padlan, E. A. et al., заявка на выдачу европейского патента № 0519596 A1; Queen et al. (1989) Proc. Natl. Acad. Sci. USA, Vol. 86: 10029-10033).
Каждое из антител, описанных и заявленных в настоящем описании, могут быть упомянуты в единственной или множественной форме, например: «антитело против OX40», «антитело против hOX40», «моноклональное антитело против hOX40», «антитело против OX40 человека», «мАт против OX40 человека», «анти-hOX40-мАт», «hOX40-специфичное моноклональное антитело», «антитело против OX40L», «антитело против hOX40L», «антитело против OX40L человека», «антитело, специфичное по отношению к OX40 человека», «моноклональное антитело, специфичное по отношению к OX40 человека», «антитело, специфичное по отношению к OX40 человека», «специфичное антитело против OX40 человека», «специфичное моноклональное антитело против OX40 человека», «h-OX40-специфичное антитело», «h-OX40-специфичное моноклональное антитело», «hOX40-агонистическое антитело», «антагонист hOX40» и/или другие сходные варианты таких названий антител.
Как описано в заявке на выдачу патента США № 11/659266, озаглавленной «Methods to Treat Disease States by Influencing the Signaling of OX-40-Receptors and High Throughput Screening Methods and Identifying Substrates Thereof», которая включена в настоящее описание в качестве ссылки, было обнаружено, что функция OX40L заключается в отрицательной регуляции образования клеток Tr1, индуцированного иммунодепрессантами дексаметазоном (Dex) и витамином D3, ICOSL или незрелыми ДК. Такое открытие демонстрирует общий механизм, благодаря которому OX40L усиливает иммунитет и нарушает иммунологическую толерантность.
С использованием иммуногистологического анализа (фиг. 1), внутриклеточного окрашивания (фиг. 2) и сортировки клеток (фиг. 3), авторы показали, что и ICOS+IL-10-продуцирующие и ICOS-TGF-β-продуцирующие Treg инфильтруют ткани FL человека. Такие полученные из FL FOXP3+ Treg могут в значительной степени ингибировать пролиферацию инфильтрующих опухоли T-клеток FOXP3-CD4+CD25- в ответ на предварительно активированные лигандом аутологичные клетки лимфомы CD40- (фиг.4). Супрессорная активность ICOS+ Treg может быть частично блокирована нейтрализующим антителом против IL-10, что подтверждает роль ICOS+IL-10-продуцирующих Treg в FL (фиг.4). В эксперименте, показанном на фиг.2, опухолевые клетки и PBMCS получали от 7 пациентов, имеющих первичный диагноз, до терапии. PBMC также получали от 7 здоровых доноров для сравнения. Процент регуляторных T-клеток среди суммарных T-клеток CD4+ определяли, используя проточно-цитометрический анализ CD4+CD25+CD127lowFOXP3+ Treg. На фиг. 2A представлен типичный FACS-анализ Treg, тогда как на фиг. 2B показан процент Treg у всех доноров.
Также было обнаружено, что OX40L ингибирует образование клеток Tr1 из T-клеток CD4+, индуцированных Dex и витамином D3. Известно, что сочетание иммунодепрессантов Dex и витамина D3 соответственно индуцирует дифференцировку наивных T-клеток CD4+ в клетки Tr1. Чтобы исследовать, может ли OX40L ингибировать образование и функцию клеток Tr1, наивные T-клетки CD4+ культивировали с моноклональными антителами анти-CD3 плюс анти-CD28 в присутствии или в отсутствие OX40L-трансфицированных L-клеток в четырех разных условиях культивирования, включая: (1) Tr1 (Dex и вит. D3); (2) TH1 (IL-12); (3) TH2 (IL-4); или (4) нейтральные (только среда) в течение 7 суток (фиг. 5A). Продукцию IL-10 примированными T-клетками анализировали, используя внутриклеточное окрашивание цитокинов и ELISA.
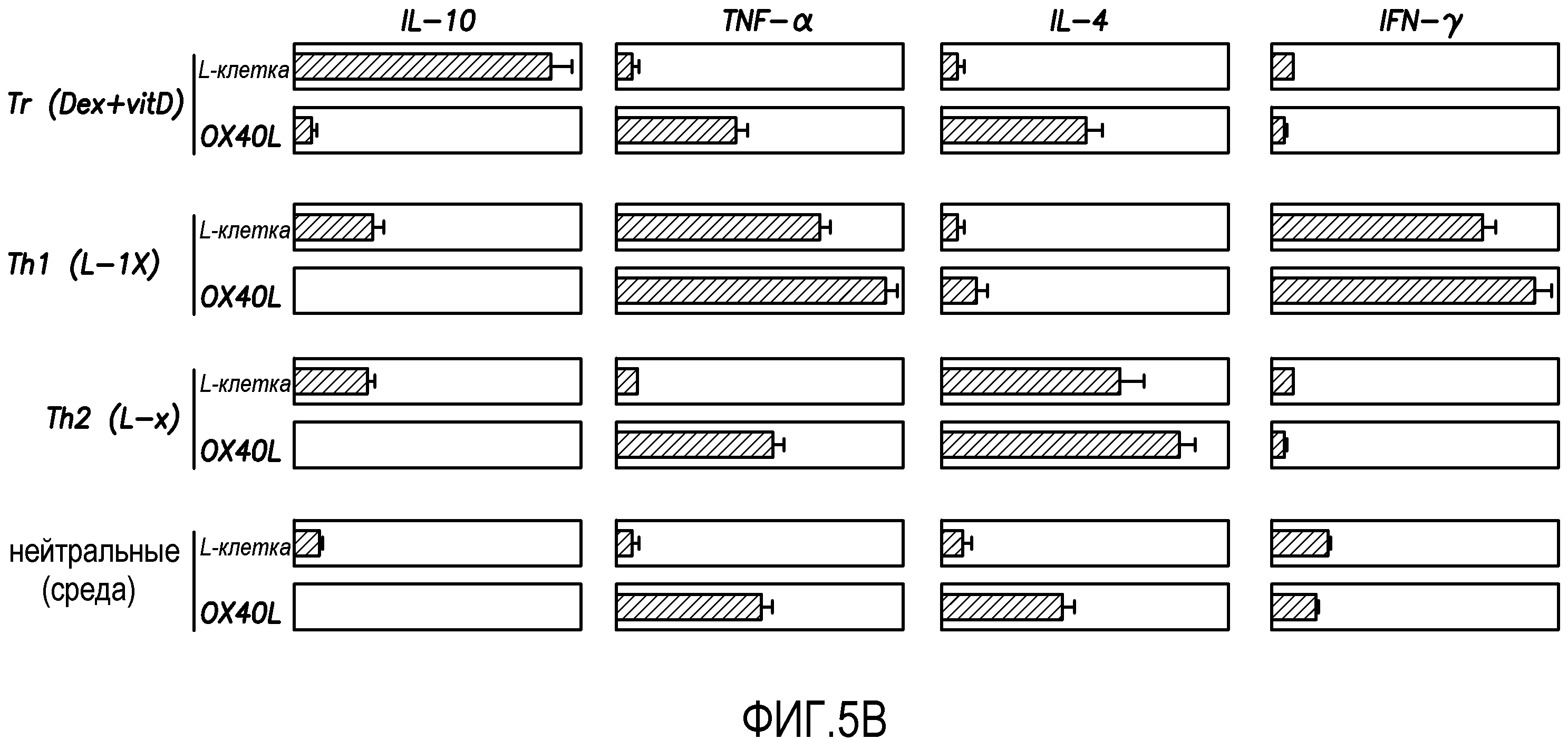
В экспериментах, показанных на фиг. 5A, внутриклеточный анализ продукции цитокинов наивными T-клетками CD4+ проводили с использованием проточной цитометрии. Наивные T-клетки CD4+ культивировали с моноклональными антителами анти-CD3 и анти-CD28 в присутствии IL-2 на исходных L-клетках или клетках OX40L-L с указанными рекомбинантными цитокинами или реагентами в течение 7 суток. Процент соответствующих цитокин-продуцирующих T-клеток указан на каждом дот-блот-профиле. Результаты показывают, что OX40L ингибирует образование клеток Tr1 из наивных T-клеток CD4+, индуцированных разными поляризующими сигналами. Как показано на фиг. 5A, было образовано от 2% до 4% клеток Tr1 из наивных T-клеток CD4+, культивируемых в нейтральных условиях или условиях TH1 или TH2. Более 15% клеток Tr1 было образовано к культуре с Dex плюс витамин D3. Добавление OX40L полностью блокировало образование клеток Tr1, при этом стимулируя образование TNF-α-продуцирующих T-клеток в случае всех условий культивирования.
Полученные данные были подтверждены данными ELISA (фиг. 5B). В экспериментах, показанных на фиг. 5B, продукцию цитокинов наивными клетками CD4+ в супенатантах после повторной стимуляции моноклональными антителами анти-CD3 и анти-CD28 в течение 24 часов измеряли с использованием ELISA. Наивные T-клетки CD4+ культивировали с моноклональными антителами анти-CD3 и анти-CD28 в присутствии IL-2 на исходных L-клетках или OX40L-L-клетках с указанными рекомбинантными цитокинами или реагентами в течение 7 суток. Данные показаны в виде среднего ± стандартная ошибка среднего (SEM) из четырех независимых экспериментов. Результаты показывают, что OX40L ингибирует образование клеток Tr1 из наивных T-клеток CD4+, индуцированных разными поляризующими сигналами.
Наивные T-клетки CD4+, примированные в условиях Tr1 (Dex плюс витамин D3), были анергическими и обладали способностью подавлять пролиферацию наивных T-клеток CD4+ в ответ на моноклональные антитела анти-CD3 плюс анти-CD28 (фиг. 5C). В экспериментах, показанных на фиг. 5C, супрессорную функцию в T-клетках измеряли по включению [3H]-тимидина. Смеси указанных популяций T-клеток рестимулировали моноклональными анти-CD3- и анти-CD28-антителами. Планками ошибок представлены SEM для лунок в трех повторах. Было обнаружено, что наивные T-клетки CD4+, примированные в таких же условиях Tr1 в присутствии OX40L, энергично пролиферировали, и не удавалось ингибировать пролиферацию наивных T-клеток CD4+ в ответ на моноклональные антитела анти-CD3 плюс анти-CD28. Полученные данные свидетельствуют, что OX40L блокирует образование функциональных клеток Tr1 из наивных T-клеток CD4+, индуцированных Dex и витамином D3.
Было обнаружено, что клетки Tr1 могут быть образованы из T-клеток памяти CD4+CD45RA-CD45RO+, и что OX40L может ингибировать образование клеток Tr1 из T-клеток памяти CD4+. T-клетки памяти CD4+CD45RA-CD45RO+ культивировали в течение 7 суток с моноклональными антителами анти-CD3 плюс анти-CD28 в присутствии или в отсутствии OX40L-трансфицированных L-клеток и условия Tr1 (Dex плюс витамин D3). В экспериментах, показанных на фиг. 6A, внутриклеточный анализ продукции цитокинов T-клетками памяти CD4+ проводили с использованием проточной цитометрии. T-клетки памяти CD4+CD45RO+CD25- культивировали с моноклональными антителами анти-CD3, анти-CD28 и IL-2 на исходных L-клетках или клетках OX40L-L в присутствии или в отсутствии Dex плюс витамин D3 в течение 7 суток. Процент соответствующих цитокин-продуцирующих T-клеток указан на каждом дот-блот-профиле. Результаты показывают, что OX40L ингибирует образование клеток Tr1 из T-клеток памяти CD4+ в условиях присутствия Dex плюс витамин D3. На фиг. 6A показано, что большие количества клеток Tr1 (>20%) были образованы из T-клеток памяти CD4+ в культуре с Dex плюс витамин D3. Добавление OX40L полностью блокировало образование клеток Tr1 и стимулировало образование TNF-α-продуцирующих клеток из T-клеток памяти CD4+.
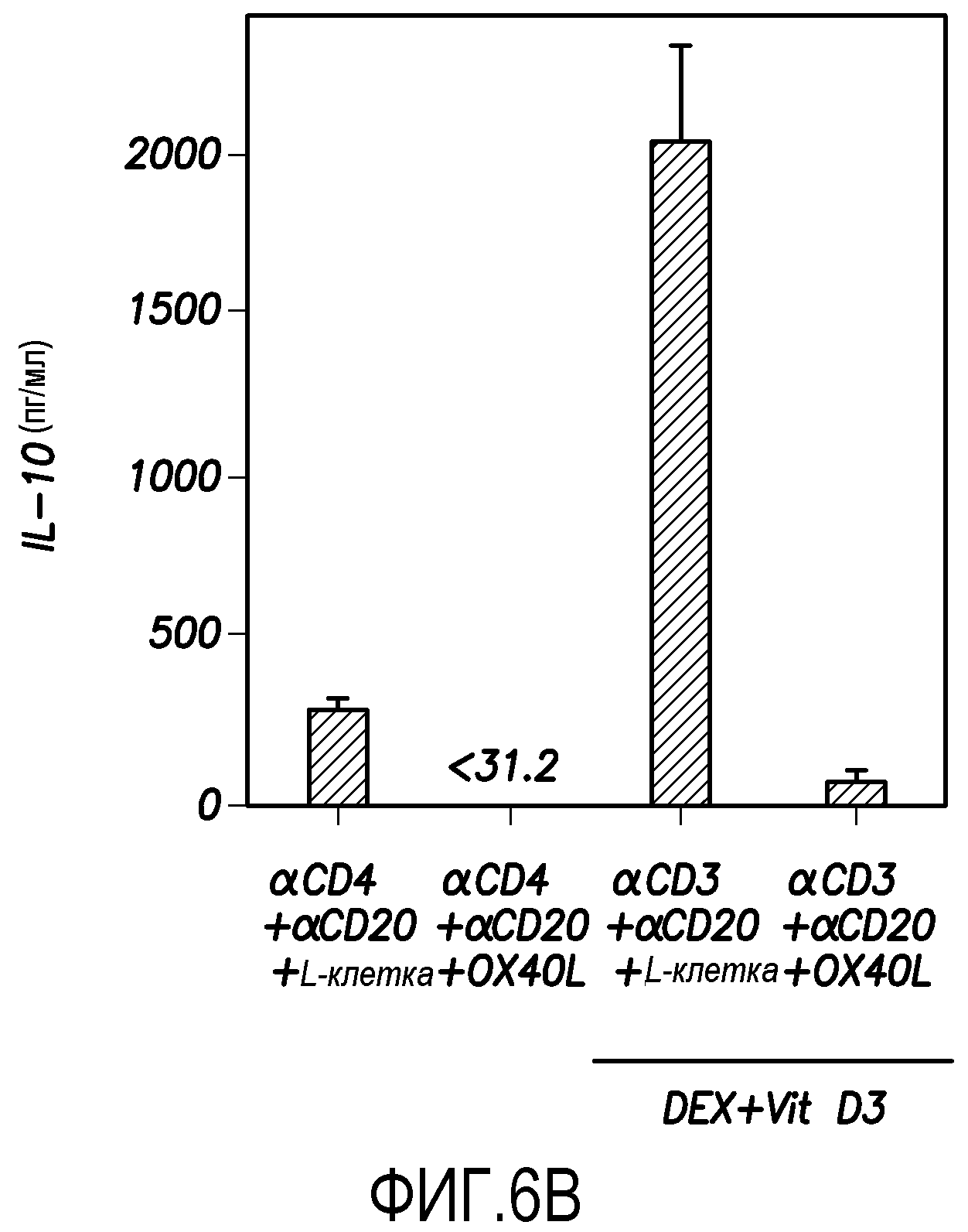
Способность Dex плюс витамин D3 стимулировать продукцию IL-10 из T-клеток памяти CD4+, и тот факт, что такая способность может быть ингибирована OX40L, были подтверждены в анализах ELISA IL-10 (фиг. 6B). В экспериментах, показанных на фиг. 6B, продукцию IL-10 T-клетками памяти CD4+ измеряли в супернатантах после рестимуляции моноклональными анти-CD3- и анти-CD28-антителами в течение 24 часов, используя ELISA. Данные показаны в виде среднего ± SEM из четырех независимых экспериментов. Результаты показывают, что OX40L ингибирует образование клеток Tr1 из T-клеток памяти CD4+ в условиях присутствия Dex плюс витамин D3.
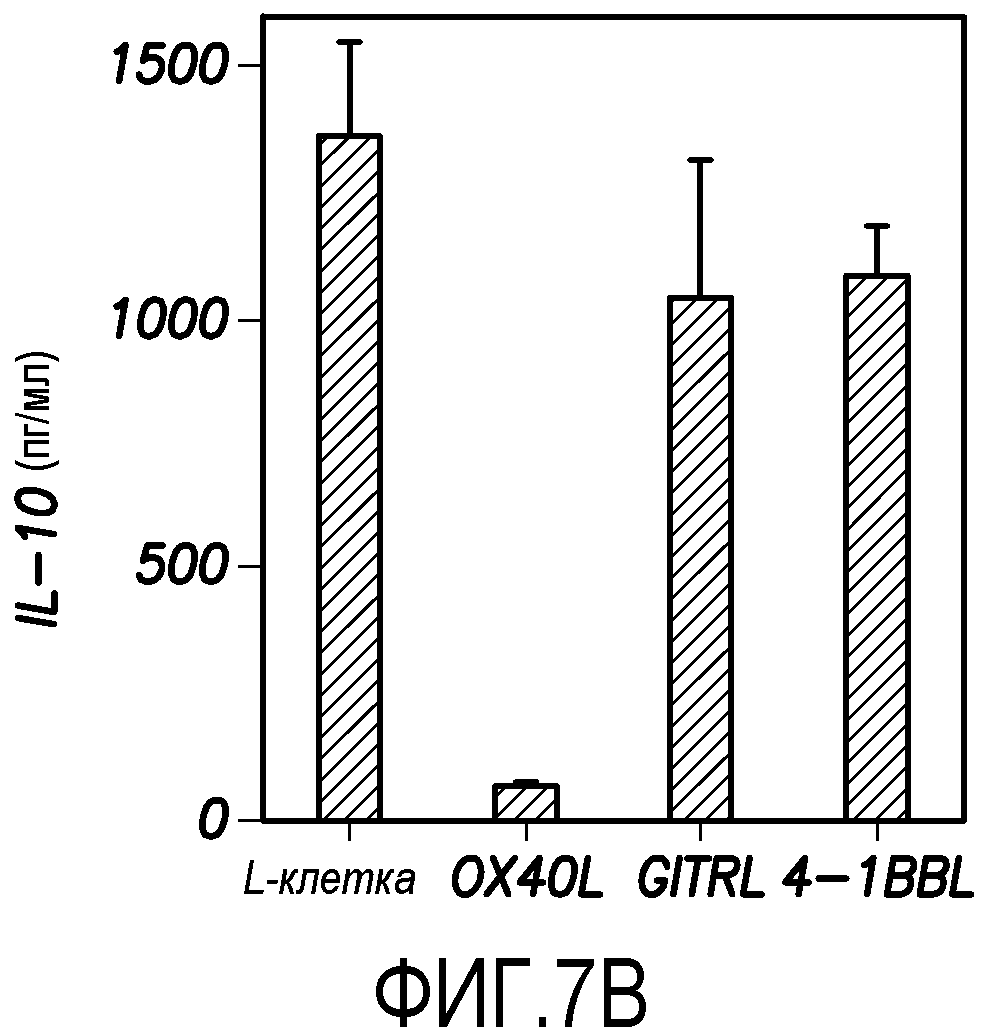
Кроме того, было обнаружено, что OX40L ингибирует образование клеток Tr1, тогда как другие представители семейства TNF (GITRL и 4-1BBL) не обладают таким действием. В надсемействе TNF OX40L, лиганд индуцируемого глюкокортикоидами рецептора TNF (GITRL) и 4-1BB-лиганд (4-1BBL) обладают костимулирующей функцией в отношении T-клеток. Чтобы исследовать, является ли OX40L уникальным в ингибировании клеток Tr1, наивные T-клетки CD4+ культивировали с моноклональными антителами анти-CD3 плюс анти-CD28 с Dex плюс витамин D3, используя исходные L-клетки или L-клетки, трансфицированные OX40L, GITRL или 4-1BBL, в течение 7 суток. В то время как OX40L, GITRL и 4-1BBL стимулировали образование TNF-α-продуцирующих клеток, только OX40L ингибировал образование клеток Tr1 (фиг. 7A и 7B).
В экспериментах, показанных на фиг. 7A, внутриклеточный анализ продукции цитокинов наивными T-клетками CD4+ проводили с использованием проточной цитометрии. Наивные T-клетки CD4+ культивировали с моноклональными антителами анти-CD3, анти-CD28 и IL-2 на исходных L-клетках, OX40L-L-клетках, GITRL-L-клетках или 4-1BBL-L-клетках в присутствии Dex плюс витамин D3 в течение 7 суток. Процент продуцирующих соответствующие цитокины T-клеток указан на каждом дот-блот-профиле. Результат показывают, что OX40L ингибирует образование клеток Tr1, но ни GITRL, ни 4-1BBL не оказывают такого действия.
В экспериментах, показанных на фиг. 7B, продукцию IL-10 наивными клетками CD4+ измеряли в супернатантах после рестимуляции моноклональными анти-CD3- и анти-CD28-антителами в течение 24 часов, используя ELISA. Данные показаны в виде среднего ± SEM из четырех независимых экспериментов. Результаты показывают, что OX40L ингибирует образование клеток Tr1, но ни GITRL, ни 4-1BBL не оказывают такого действия.
OX40L, GITRL и 4-1BBL стимулировали увеличение количества суммарных T-клеток (фиг. 7C). В экспериментах, показанных на фиг. 7C, подсчитывали количество жизнеспособных T-клеток. Данные показаны в виде среднего ± SEM из четырех независимых экспериментов.
Как понятно специалистам в данной области, результаты, представленные на фиг. 7A, 7B и 7C, показывают, что OX40L ингибирует образование клеток Tr1, но ни GITRL, ни 4-1BBL не оказывают такого действия. Полученные данные свидетельствуют, что из трех представителей надсемейства TNF, которые, как известно, костимулируют T-клетки, OX40L обладает новой и уникальной функцией в ингибировании образования клеток Tr1.
Кроме того, было обнаружено, что OX40L ингибирует образование клеток Tr1, индуцированное ICOSL или незрелыми ДК. ICOS и CD28 представляют собой два позитивных костимулирующих рецептора в семействе CD28, экспрессируемых на T-клетках. Было показано, что передача сигнала через ICOS агонистическими антителами или ICOSL стимулирует T-клетки CD4+ к продукции IL-10. Чтобы исследовать, может ли OX40L ингибировать способность ICOS индуцировать продукцию IL-10 T-клетками CD4+, наивные T-клетки и T-клетки памяти CD4+ культивировали с анти-CD3 в присутствии ICOSL-трансфицированных L-клеток или ICOSL-трансфицированных L-клеток в присутствии OX40L в течение 7 суток.
В экспериментах, показанных на фиг. 8A, внутриклеточный анализ продукции цитокинов наивными T-клетками CD4+ осуществляли с использованием проточной цитометрии. Наивные T-клетки CD4+ культивировали в течение 7 суток на исходных L-клетках, на смеси ICOSL-L-клеток и L-клеток или на смеси ICOSL-L-клеток и OX40L-L-клеток, которые были предварительно покрыты моноклональными антителами против CD3. Процент T-клеток, продуцирующих соответствующие цитокины, показан на каждом дот-блот-профиле. Результаты показывают, что OX40L ингибирует образование клеток Tr1 из наивных T-клеток CD4+, индуцированных ICOSL.
В экспериментах, показанных на фиг. 8B, продукцию IL-10 наивными клетками CD4+ измеряли в супернатантах после рестимуляции моноклональными анти-CD3- и анти-CD28-антителами в течение 24 часов, используя ELISA. Наивные T-клетки CD4+ культивировали в течение 7 суток на исходных L-клетках, на смеси ICOSL-L-клеток и L-клеток или на смеси ICOSL-L-клеток и OX40L-L-клеток, которые были предварительно покрыты моноклональными антителами против CD3. Данные показаны в виде среднего ± SEM из трех независимых экспериментов. Результаты показывают, что OX40L ингибирует образование клеток Tr1 из наивных T-клеток CD4+, индуцированных ICOSL.
В экспериментах, показанных на фиг. 8C, внутриклеточный анализ продукции цитокинов T-клетками памяти CD4+ проводили с использованием проточной цитометрии. T-клетки памяти CD4+ культивировали в течение 7 суток на исходных L-клетках, на смеси ICOSL-L-клеток и L-клеток или на смеси ICOSL-L-клеток и OX40L-L-клеток, которые были предварительно покрыты моноклональным антителом против CD3. Процент T-клеток, продуцирующих соответствующие цитокины, показан на каждом дот-блот-профиле. Результаты показывают, что OX40L ингибирует образование клеток Tr1 из T-клеток памяти CD4+, индуцированных ICOSL.
В экспериментах, показанных на фиг. 8D, продукцию IL-10 T-клетками памяти CD4+ в супернатантах после рестимуляции моноклональными антителами против CD3 и против CD28 в течение 24 часов измеряли с использованием ELISA. T-клетки памяти CD4+ культивировали в течение 7 суток на исходных L-клетках, на смеси ICOSL-L-клеток и L-клеток, или на смеси ICOSL-L-клеток и OX40L-L-клеток, которые предварительно покрывали моноклональным антителом против CD3. Данные показаны в виде среднего ± SEM из трех независимых экспериментов. Результаты показывают, что OX40L ингибирует образование клеток Tr1 из T-клеток памяти CD4+, индуцированных ICOSL.
Результаты экспериментов, представленные на фиг. 8A, 8B, 8C и 8D, показывают, что ICOSL значимо стимулировал образование клеток Tr1 как из наивных T-клеток, так и из T-клеток памяти CD4+. Добавление OX40L полностью ингибировало образование клеток Tr1 как из наивных T-клеток, так и из T-клеток памяти CD4+, при этом сильно стимулируя образование клеток, продуцирующих TNF-α.
Известно, что незрелые ДК или ДК, обработанные IFN-α или IL-10, могут индуцировать наивные T-клетки CD4+ к дифференцировке в клетки Tr1. Было исследовано, может ли OX40L ингибировать образование клеток Tr1, индуцированных ДК. Как показано на фиг. 8E, незрелые ДК или ДК, обработанные IL-10 или IFN-α, индуцировали образование более чем 10% клеток Tr1 из наивных T-клеток CD4+. Напротив, ДК, активированные CD40L, индуцируют сильный TH1-ответ, сопровождаемый образованием примерно 3% клеток Tr1. Добавление рекомбинантного OX40L в культуры клеток ДК-T полностью ингибировало образование клеток Tr1, индуцированных незрелыми ДК и ДК, обработанными IL-10 и IFN-α. Кроме того, OX40L также ингибировал образование остального количества клеток Tr1, индуцированное активированными CD40L зрелыми ДК. В экспериментах, показанных на фиг. 8E, внутриклеточный анализ продукции цитокинов наивными T-клетками CD4+, проводили с использованием проточной цитометрии. Наивные T-клетки CD4+ совместно культивировали в присутствии или в отсутствие рекомбинантного OX40L в течение 7 суток с незрелыми ДК или ДК, культивированными с IFN-α, IL-10 и CD40L. Процент T-клеток, продуцирующих соответствующие цитокины, показан на каждом дот-блот-профиле. Результаты показывают, что OX40L ингибирует образование клеток Tr1 из T-клеток CD4+, индуцированных ДК.
Способность OX40L ингибировать образование клеток Tr1, индуцированное ДК, подтверждали данными, полученными в ELISA (фиг. 8F). В экспериментах, показанных на фиг. 8F, продукцию IL-10 наивными клетками CD4+ измеряли в супернатантах после рестимуляции моноклональными антителами против CD3 и против CD28 в течение 24 часов, используя ELISA. Наивные T-клетки CD4+ совместно культивировали в присутствии или в отсутствие растворимого рекомбинантного OX40L в течение 7 суток с незрелыми ДК или ДК, культивированными с IFN-α, IL-10 и CD40L. Данные показаны в виде среднего ± SEM из трех независимых экспериментов. Результаты показывают, что OX40L ингибирует образование клеток Tr1 из T-клеток CD4+, индуцированных ДК. Таким образом, полученные данные демонстрируют, что OX40L может ингибировать образование клеток Tr1, индуцированных более физиологичными сигналами, создаваемыми ICOSL и ДК.
Ранее предполагали, что регуляторные T-клетки широко представлены в области B-клеточной неходжкинской лимфомы, и что B-клетки вовлечены в рекрутинг регуляторных T-клеток в область лимфомы. Было исследовано может ли воздействие на передачу сигнала рецепторов OX40, такое как воздействие OX40L, обеспечить терапию, направленную против B-клеточной лимфомы. Криоконсервированные образцы от пациентов с B-клеточной лимфомой использовали для оценки способности OX40L отключать клетки Tr1. Используемые образцы представляли собой образцы фолликулярной лимфомы, полученные из образца селезенки перед лечением. Клетки размораживали, при этом 400×106 замороженных клеток давали 127×106 живых клеток и 33,9×106 мертвых клеток (выживаемость 79%). Достаточное количество клеток CD25+ идентифицировали при FACS-окрашивании. В экспериментах, показанных на фиг. 9, секрецию IL-10 ICOS+IL-10-продуцирующими Treg определяли в ELISA. Клетки Treg культивировали в двух разных условиях. В случае условия 1 клетки CD25+/ICOS+ культивировали с анти-CD3 в присутствии IL-2 (900 мкл/мл) на исходных L-клетках или OX40L-L-клетках с антителом против ICOS в течение 3-6 суток. В случае условия 2 клетки CD25+/ICOS+ культивировали с анти-CD3 в присутствии IL-2 (900 мкл/мл) на ICOS-L-L-клетках или смеси клеток OX40L-L и ICOS-L-L в течение 3-6 суток. Продукцию цитокинов в супернатантах измеряли в ELISA. Результаты показывают, что OX40L значительно ингибировал продукцию IL-10 клетками Treg.
Полученные данные, свидетельствующие о том, что OX40L обладает способностью ингибировать образование и функцию клеток Tr1, индуцированных иммунодепрессантами Dex плюс витамин D3, ICOSL или ДК, иллюстрируют новый механизм, посредством которого OX40L стимулирует иммунитет и нарушает толерантность во время разных форм CD4- или CD8-опосредованных иммунных ответов, как будет понятно специалисту в данной области. Способность OX40L ингибировать образование клеток Tr1 как во время IL-12-индуцированного TH1-ответа, так и во время IL-4-индуцированного TH2-ответа свидетельствует о том, что OX40L может контролировать величину TH1- или TH2-опосредованных иммунных ответов. Кроме того, способность OX40L ингибировать образование клеток Tr1, по-видимому, является уникальным свойством OX40L, так как два других представителя TNF-семейства GITRL и 4-1BBL не обладают таким функциональным свойством. Кроме того, способность OX40L ингибировать продукцию IL-10 клетками Treg характеризует OX40L как эффективное средство лечения B-клеточной лимфомы и других злокачественных опухолей.
Было идентифицировано множество молекул, которые стимулируют образование клеток Tr1, включая IL-10, IFN-α, ICOSL и иммуносупрессорные соединения, такие как Dex плюс витамин D3. OX40L представляет собой эффективный ингибитор образования клеток Tr1, но не только из наивных T-клеток CD4+, а также из T-клеток памяти CD4+ и регуляторных T-клеток. Такое новое свойство OX40/OX40L может объяснить недавнее сообщение, показывающее, что передача сигнала OX40 обеспечивает возможность приобретения анергическими аутореактивными T-клетками функций эффекторных клеток. Таким образом, целенаправленное воздействие на OX40/OX40L обеспечивает возможность лечения аллергических и аутоиммунных заболеваний человека, а также разработки способов лечения инфекционных болезней человека и злокачественной опухоли, включая без ограничения меланому, рак головного мозга, рак костей, лейкоз, лимфому, происходящую из эпителиальных клеток неоплазию (эпителиальную карциному), такую как базальноклеточная карцинома, аденокарцинома, рак желудочно-кишечного тракта, такой как рак губы, рак ротовой полости, рак пищевода, рак тонкого кишечника и рак желудка, рак ободочной кишки, рак печени, рак мочевого пузыря, рак поджелудочной железы, рак яичника, рак шейки матки, рак легкого, рак молочной железы и рак кожи, такой как плоскоклеточный и базальноклеточный рак, рак простаты, почечноклеточная карцинома и другие известные злокачественные опухоли.
Расстройства и состояния, которые можно предотвращать или лечить антителами и способами, описанными в настоящем описании, включают профилактику или лечение злокачественной опухоли, такой как кожный T-клеточный лейкоз, опухоли головы и шеи, рак поджелудочной железы, рак мочевого пузыря, глиомы высокой степени злокачественности, метастазы головного мозга, меланому, рак кожи, рак легкого, рак молочной железы, рак простаты, рак ободочной кишки, лейкоз, миелодиспластический синдром (предлейкозное состояние) и множественную миелому. В общем, метастазирование любой злокачественной опухоли можно предотвратить или лечить соединениями и способами, описанными в настоящем описании. Также можно применять антитела для профилактики или лечения пролиферативных ангиогенных состояний, включая телеангиэктазию, венозные ангиомы, гемангиобластому. Другие расстройства, заболевания или состояния включают вирусные заболевания, некоторые из которых можно традиционного считать «неизлечимыми». Антитела, например, также можно применять для классификации штаммов одного патогена. Исследователи могут применять антитела, описанные в настоящем описании, для идентификации и выявления конкретных клеток или молекул в организме.
В общем, термины «злокачественная опухоль» и «злокачественный» относится или описывает физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом. Более конкретно, злокачественной опухоли, которые можно лечить или предотвращать, применяя одно или несколько антител, описанных в настоящем описании или их вариант, включают без ограничения карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких злокачественных опухолей включают без ограничения плоскоклеточный рак, рак легкого (включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого), рак брюшины, гепатоклеточный рак, рак желудка (включая рак желудочно-кишечного тракта и стромальные злокачественные опухоли желудочно-кишечного тракта), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, рак прямой и ободочной кишки, карциному эндометрия или матки, карциному слюнных желез, рак почек, рак печени, рак простаты, рак вульвы, рак щитовидной железы, карциному печени и различные типы рака головы и шеи, меланому, поверхностно распространяющуюся меланому, меланому типа злокачественного лентиго, акральные лентигинозные меланомы, нодулярную меланому, а также B-клеточную лимфому (включая низкой степени злокачественности/фолликулярную неходжкинскую лимфому (NHL); мелкоклеточную лимфоцитарную (SL) NHL; средней степени злокачественности/фолликулярную NHL; диффузную NHL промежуточной степени злокачественности; иммунобластную NHL высокой степени злокачественности; лимфобластную NHL высокой степени злокачественности; мелкоклеточную NHL с нерасщепленными ядрами высокой степени злокачественности; NHL с массивной опухолевой массой; лимфому из клеток мантийной зоны; связанную со СПИДом лимфому; и макроглобулинемию Вальденстрома; хронический лимфоцитарный лейкоз (CLL); острый лимфобластный лейкоз (ALL); лейкоз ворсистых клеток; хронический миелобластный лейкоз; и посттрансплантационное лимфопролиферативное заболевание (PTLD), а также аномальную пролиферацию сосудов, связанную с факоматозом, эдемой (такой как эдема, связанная с опухолями головного мозга) и синдромом Мейгса.
Настоящее изобретение также относится к способам лечения или профилактики иммунного расстройства. Такие способы включают введение эффективного количества антитела индивиду, нуждающемуся в таком лечении. В некоторых вариантах осуществления иммунным расстройством является иммунное расстройство или аутоиммунное расстройство. Расстройством является астма, атопический дерматит, аллергический ринит, воспалительное заболевание кишечника, рассеянный склероз, GVHD и/или системная красная волчанка. В некоторых вариантах осуществления расстройством является расстройство, связанное с вирусом, бактерией или другим инфекционным агентом.
Кроме того, антитела и способы, которые описаны в настоящем описании, можно применять для профилактики или лечения воспалительных заболеваний и состояний, таких как остеоартрит, ревматоидный артрит, болезнь Крона, язвенный колит, и аутоиммунных заболеваний, таких как волчанка и смешанное аутоиммунное заболевание. Например, антитела, описанные в настоящем описании, могут быть применимы для лечения множества аутоиммунных и воспалительных заболеваний, включающего стадию введения терапевтически эффективного количества антитела индивиду, нуждающемуся в таком лечении, при этом аутоиммунным заболеванием или воспалительным заболеванием является любое одно или несколько из следующих заболеваний: инсулинозависимый сахарный диабет (IDDM), сахарный диабет, рассеянный склероз, экспериментальный аутоиммунный энцефаломиелит, острый диссеминированный энцефаломиелит, артрит, ревматоидный артрит, экспериментальный аутоиммунный артрит, тяжелую псевдопаралитическую миастению, тиреоидит, болезнь Хашимото, первичную микседему, тиреотоксикоз, пернициозную анемию, аутоиммунный атрофический гастрит, Аддисонову болезнь, преждевременную менопаузу, мужское бесплодие, ювенильный диабет, синдром Гудпасчера, вульгарный пемфигус, пемфигоид, симпатическую офтальмию, факогенный увеит, аутоиммунную гемолитическую анемию, идиопатическую лейкопению, первичный биллиарный цирроз, активный хронический гепатит Hbs-ve, криптогенный цирроз, язвенный колит, синдром Шегрена, склеродермию, гранулематоз Вегенера, поли/дерматомиозит, дискоидную красную волчанку, системную красную волчанку, болезнь Крона, псориаз, анкилозирующий спонидилит, синдром антифосфолипидных антител, апластическую анемию, аутоиммунный гепатит, целиакию, диффузный токсический зоб, синдром Гийена-Барре (GBS), идиопатическую тромбоцитопеническую пурпуру, синдром опсоклонуса-миоклонуса (OMS), неврит зрительного нерва, тиреоидит Орда, пемфигус, полиартрит, первичный биллиарный цирроз, синдром Рейтера, артериит Такаясу, темпоральный артериит, аутоиммунная гемолитическая анемия с синдромом тепловых агглютининов, гранулематоз Вегенера, универсальную алопецию, болезнь Бехчета, болезнь Шагаса, синдром хронической усталости, дисавтономию, эндометриоз, гнойный гидраденит, интерстициальный цистит, нейромиотонию, саркоидоз, склеродермию, язвенный колит, витилиго, вульводинию, воспалительные заболевания кожи, аллергический контактный дерматит, гастрит, вызванный H. pylory, хроническое воспалительное заболевание носа, артериосклероз и болезнь «трансплантат против хозяина».
Более конкретно, «аутоиммунное заболевание», которое упоминается в настоящем описании, представляет собой заболевание или расстройство, возникающее и направленное против собственных тканей или органов индивидуума, или его косегрегацию или проявление или возникающее в результате состояние. Аутоиммунное заболевание может относиться к состоянию, которое возникает или усиливается в результате продукции B-клетками антител, которые реактивны по отношению к нормальным тканям и антигенам организма. Также аутоиммунное заболевание представляет собой заболевание, в которое может быть вовлечена секреция аутоантитела, которое специфично по отношению к эпитопу собственного антигена (например, ядерного антигена).
Аутоиммунные заболевания или расстройства, которые можно лечить и/или предотвращать с использованием любого одного или нескольких антител, описанных в настоящем описании, включают без ограничения артрит (ревматоидный артрит, такой как острый артрит, хронический ревматоидный артрит, падагрический артрит, острый падагрический артрит, острый иммнуологический артрит, хронический воспалительный артрит, дегенеративный артрит, инлуцированный коллагеном типа II артрит, инфекционный артрит, артрит Лайма, пролиферативный артрит, псориатический артрит, болезнь Стилла, вертебральный артрит и ювенильный ревматоидный артрит, остеоартрит, хронический прогредиентный артрит, деформирующий артрит, первичный хронический полиартрит, реактивный артрит и анкилозирующий спондилит), воспалительные гиперпролиферативные заболевания кожи, псориаз, такой как бляшечный псориаз, каплевидный псориаз, пустулезный псориаз и псориаз ногтей, атопию, включая атопические заболевания, такие как сенная лихорадка и синдром Джоба, дерматит, включая контактный дерматит, хронический контактный дерматит, эксфолиативный дерматит, аллергический дерматит, аллергический контактный дерматит, герпетиформный дерматит, нуммулярный дерматит, себорейный дерматит, неспецифический дерматит, контактный дерматит при первичном раздражении и атопический дерматит, X-сцепленный синдром гипер-IgM, аллергические внутриглазные воспалительные заболевания, крапивницу, такую как хроническая аллергическая крапивница и хроническая идиопатическая крапивница, включая хроническую аутоиммунную крапивницу, миозит, полимиозит/дерматомиозит, ювенильный дерматомиозит, токсический эпидермический некролиз, склеродермию (включая системную склеродермию), склероз, такой как системный склероз, рассеянный склероз (MS), такой как MS с поражением спинного мозга и зрительного нерва, первичный прогрессирующий MS (PPMS) и релапсирующий ремиттирующий MS (PPMS), прогрессирующий системный склероз, атеросклероз, артериосклероз, диссеминирующий склероз, атаксический склероз, нейромиелит зрительного нерва (NMO), воспалительное заболевание кишечника (IBD) (например болезнь Крона, опосредованные аутоиммунными реакциями желудочно-кишечные заболевания, колит, такой как язвенный колит, микроскопический колит, коллагеновый колит, полипозный колит, некротизирующий энтероколит и трансмуральный колит, и аутоиммунное воспалительное заболевание кишечника), воспаление кишечника, гангренозную пиодерму, узловатую эритему, первичный склерозирующий холангит, респираторный дистресс-синдром, включая респираторный дистресс-синдром взрослых или острый респираторный дистресс-синдром (ARDS), менингит, воспаление всей или части сосудистой оболочки глазного яблока, ирит, хориоидит, аутоиммунное гематологическое расстройство, ревматоидный спондилит, ревматоидный синовит, наследственный ангионевротический отек, повреждение черепно-мозговых нервов, как при менингите, гестационный герпес, пемфигоид беременных, зуд мошонки, аутоиммунную преждевременную недостаточность функции яичников, внезапную потерю слуха вследствие аутоиммунного состояния, IgE-опосредованные заболевания, такие как анафилаксия и аллергический или атопический ринит, энцефалит, такой как энцефалит Расмуссена и лимбический энцефалит и/или энцефалит ствола головного мозга, увеит, такой как передний увеит, острый передний увеит, гранулематозный увеит, негранулематозный увеит, факоантигенный увеит, задний увеит или аутоиммунный увеит, гломерулонефрит (GN) с нефротическим синдромом или без нефротического синдрома, такой как хронический или острый гломерулонефрит, такой как первичный GN, иммунно-опосредованный GN, мембранный GN (мембранная нефропатия), идиопатический мембранный GN или идиопатическая мембранная нефропатия, мембрано-пролиферативный или мембранный пролиферативный GN (MPGN), включая тип I и тип II, и быстро прогрессирующий GN, пролиферативный нефрит, аутоиммунную полигландулярную эндокринную недостаточность, баланит, включая ограниченный плазмоцитарный баланит, баланопостит, кольцевидную центробежную эритему, пепельный дерматоз, мультиформную эритему, кольцевидную гранулему, лишай блестящий, лишай склерозирующий и атрофический, простой хронический лишай, лишай шиловидный, красный плоский лишай, ламеллярный ихтиоз, эпидермолитический гиперкератоз, предзлокачественный кератоз, гангренозную пиодермию, аллергические состояния и реакции, аллергическую реакцию, экзему, включая аллергическую или атопическую экзему, астеатозную экзему, дисгидротическую экзему и везикулярную экзему ладоней и подошв, астму, такую как бронхиальная астма и аутоиммунная астма, состояния, в которые вовлечена инфильтрация T-клеток и хронические воспалительные реакции, иммунные реакции против чужеродных антигенов, таких как группы крови A-B-O плода во время беременности, хроническое воспалительное заболевание легких, аутоиммунный миокардит, недостаточность адгезии лейкоцитов, волчанку, включая волчаночный нефрит, волчаночный церебрит, волчанку в детском возрасте, непочечную волчанку, внепочечную волчанку, дискоидную волчанку и дискоидную красную волчанку, алопецию при волчанке, системную красную волчанку (СКВ), такую как кожная СКВ или подострая кожная СКВ, неонатальный волчаночный синдром (NLE) и диссеминированная красная волчанка, юношеский сахарный диабет (типа I), включая инсулинозависимый сахарный диабет у детей (IDDM), сахарный диабет у взрослых (диабет типа II), аутоиммунный диабет, идиопатический несахарный диабет, диабетическую ретинопатию, диабетическую нефропатию, диабетическое расстройство крупных артерий, иммунные реакции, связанные с острой и отсроченной гиперчувствительностью, опосредованной цитокинами и T-лимфоцитами, туберкулез, саркоидоз, гранулематоз, включая лимфоматоидный гранулематоз, гранулематоз Вегенера, агранулоцитоз, васкулитиды, включая васкулит, включая васкулит крупных сосудов (включая ревматическую полимиалгию и гигантоклеточный артериит (артериит Такаясу)), васкулит средних сосудов (включая болезнь Кавасаки и нодозный полиартериит/нодозный периартериит), микроскопический полиартериит, иммуноваскулит, васкулит ЦНС, кожный васкулит, гиперчувствительный васкулит, некротизирующий васкулит, такой как системный некротизирующий васкулит, и ANCA-связанный васкулит, такой как синдром Чарга-Штрауса (CSS) и ANCA-связанный васкулит мелких сосудов, темпоральный артериит, апластическую анемию, аутоиммунную апластическую анемию, Кумбс-позитивную анемию, анемию Диамонда-Блэкфанда, гемолитическую анемию или иммунную гемолитическую анемию, включая аутоиммунную гемолитическую анемию (AIHA), пернициозную анемию (anemia perniciosa), Аддисонову болезнь, истинную эритроцитарную анемию или аплазию (PRCA), недостаточность фактора VIII, гемофилию A, аутоиммунную нейтропению, панцитопению, лейкопению, заболевания, в которые вовлечен диапедез лейкоцитов, воспалительные заболевания ЦНС, болезнь Альцгеймера, болезнь Паркинсона, синдром множественного органного повреждения, такой как вторичные синдромы при септицемии, травме или геморрагии, заболевания, опосредованные комплексами антиген-антитело, заболевание, вызванное антителами к клубочковой базальной мембране, синдром антифосфолипидных антител, аллергический неврит, болезнь/синдром Бехчета, синдром Кастлемана, синдром Гудпасчера, синдром Рейно, синдром Шегрена, синдром Стевенса-Джонсона, пемфигоид, такой как буллезный пемфигоид и кожный пемфигоид, пемфигус (включая вульгарный пемфигус, листовидный пемфигус, пемфигоид слизистой оболочки и эриматозный пемфигоид), аутоиммунные полиэндокринопатии, болезнь или синдром Рейтера, термическое повреждение, преэклампсию, расстройство, обусловленное иммунными комплексами, такое как иммунокомплексный нефрит, опосредованный антителами нефрит, полиневропатии, хроническую невропатию, такую как IgM-полиневропатии или опосредованная IgM невропатия, тромбоцитопению (которая развивается например у пациентов с инфарктом миокарда), включая тромботическую тромбоцитопеническую пурпуру (TTP), пост-трансфузионную пурпуру (PTP), индуцированную гепарином тромбоцитопению и аутоиммунную или опосредованную иммунитетом тромбоцитопению, такую как идиопатическая тромбоцитопеническая пурпура (ITP), включая хроническую и острую ITP, склерит, такой как идиопатический кератосклерит, эписклерит, аутоиммунное заболевание семенников и яичника, включая аутоиммунный орхит и оофорит, первичный гипотиреоидизм, гипопаратиреоидизм, аутоиммунные эндокринные заболевания, включая тиреоидит, такой как аутоиммунный тиреоидит, болезнь Хашимото, хронический тиреоидит (тиреоидит Хашимото) или подострый тиреоидит, аутоиммунное заболевание щитовидной железы, идиопатический гипотиреоидизм, диффузный токсический зоб, полигландулярные синдромы, такие как аутоиммунные полигландулярные синдромы (или полигландулярные эндокринопатические синдромы), паранеопластические синдромы, включая неврологические паранеопластические синдромы, такие как миастенический синдром Ламберта-Итона или синдром Итона-Ламберта, синдром обездвиженности «stiff-man»-синдром или «stiff-person»-синдром, энцефаломиелит, такой как аллергический энцефаломиелит и экспериментальный аллергический энцефаломиелит (EAE), бульбоспинальный паралич, такой как связанный с тимомой бульбоспинальный паралич, дегенерацию мозжечка, нейромиотонию, синдром опсоклонуса или синдром опсоклонуса-миоклонуса (OMS) и сенсорную невропатию, многофокальную моторную невропатию, синдром Шихана, аутоиммунный гепатит, хронический гепатит, липоидный гепатит, гигантоклеточный гепатит, хронический активный гепатит или аутоиммунный хронический активный гепатит, лимфоидный интерстициальный пневмонит (LIP), облитерирующий брохиолит (не трансплантационный) вариант NSIP, синдром Гийена-Барре, болезнь Бергера (IgA-невропатию), идиопатическую IgA-невропатию, линейный IgA-зависимый дерматоз, острый фебрильный нейтрофильный дерматоз, субкорнеальный пустулезный дерматоз, транзиторный акантолитический дерматоз, цирроз, такой как первичный билиарный цирроз и цирроз легких, синдром аутоиммунной энтеропатии, целиакию или глютеновую болезнь, брюшной спру (глютеновую энтеропатию), рефрактерный спру, идиопатический спру, криоглобулинемию, боковой амиотрофический склероз (ALS; болезнь Лу Геринга), болезнь коронарных артерий, аутоиммунное заболевание уха, такое как аутоиммунное заболевание внутреннего уха (AIED), аутоиммунная потеря слуха, полихондрию, такую как рефрактерная или рецидивирующая полихондрия, легочный альвеолярный протеиноз, синдром Когана/несифилитический интерстициальный кератит, паралич Белла, болезнь/синдром Свита, аутоиммунную розацею, связанную с опоясывающим лишаем боль, амилоидоз, склерит, незлокачественный лимфоцитоз, первичный лимфоцитоз, который включает моноклональный B-клеточный лимфоцитоз (например, доброкачественную моноклональную гаммапатию и моноклональную гаммапатию неопределенного значения, MGUS), периферическую невропатию, паранеопластический синдром, каналопатии, такие как эпилепсия, мигрень, аритмия, мышечные заболевания, глухота, слепота, периодический паралич и каналопатии ЦНС, аутизм, воспалительную миопатию, фокальный или сегментарный или фокальный сегментарный гломерулосклероз (FSGS), эндокринную офтальмопатию, увеоретинит, хориоретинит, аутоиммунное гепатологическое расстройство, фибромиалгию, множественную эндокринную недостаточность, синдром Шмидта, адреналит, атрофию желудка, пресенильную деменцию, демиелинизирующие заболевания, такие как аутоиммунные демиелинизирующие заболевания и хроническая воспалительная демиелинизирующая полиневропатия, синдром Дресслера, очаговую алопецию, генерализованную алопецию, CREST-синдром (кальциноз, феномен Рейно, нарушение моторики пищевода, склеродактилия и телеангиэктазия), аутоиммунное бесплодие у мужчин и женщин, например, вследствие антител против сперматозоидов, смешанное заболевание соединительной ткани, болезнь Шагаса, ревматический полиартрит, привычный выкидыш, аллергический альвеолит у сельскохозяйственных рабочих, полиморфную эритему, посткардиотомический синдром, синдром Кушинга, легочную аллергию птицеводов, аллергический гранулематозный ангиит, доброкачественный лимфоцитарный ангиит, синдром Алпорта, альвеолит, такой как аллергический альвеолит и фиброзирующий альвеолит, интерстициальное легочное заболевание, трансфузионную реакцию, проказу, малярию, паразитарные болезни, такие как лейшманиоз, трипаносомоз, шистосомоз, аскаридоз, аспергиллез, синдром Самптера, синдром Каплана, денге, эндокардит, эндомиокардиальный фиброз, диффузный интерстициальный легочный фиброз, интерстициальный легочный фиброз, легочный фиброз, идиопатический легочный фиброз, кистозный фиброз, эндофтальмит, возвышенную стойкую эритему, эритробластоз плода, эозинофильный фасциит, синдром Шульмана, синдром Фелти, филяриоз, циклит, такой как хронический циклит, гетерохронный циклит, иридоциклит (острый или хронический) или циклит Фуча, пурпуру Шенлейн-Геноха, инфекцию вирусом иммунодефицита человека (ВИЧ), SCID, синдром приобретенного иммунодефицита (СПИД), эховирусную инфекцию, сепсис, эндотоксикоз, панкреатит, тироксикоз, парвовирусную инфекцию, инфекцию вирусом краснухи, синдромы пост-вакцинации, инфекцию, вызывающую рубеолярную эмбриопатию, инфекцию вирусом Эпштейн-Барр, эпидемический паротит, синдром Эвана, аутоиммунную гонадную недостаточность, хорею Сиденгама, постстрептококковый нефрит, облитерирующий тромбоангиит, тиротоксикоз, сухотку спинного мозга, хориоидит, гигантоклеточную полимиалгию, хронический гиперчувствительный пневмонит, сухой кератоконъюнктивит, эпидемический кератоконъюнктивит, идиопатический нефритический синдром, нефропатия с минимальными изменениями, семейное доброкачественное и ишишемическое-реперфузионное повреждение, реперфузию трансплантированного органа, аутоиммунное заболевание сетчатки, воспаление суставов, бронхит, хроническое обструктивное заболевание дыхательных/легочных путей, силикоз, афты, афтозный стоматит, артериосклеротические заболевания, нарушения спермиогенеза, аутоиммунный гемолиз, болезнь Бека, криоглобулинемию, контрактуру Дюпюитрена, факоанафилактический эндофтальмит, аллергический энтерит, нодозную эритему, идиопатический паралич лицевого нерва, синдром хронической усталости, ревматизм, болезнь Хаммена-Рича, сенсоневральную потерю слуха, пароксизмальную гемоглобинурию, гипогонадизм, региональный илеит, лейкопению, инфекционный мононуклеоз, поперечный миелит, первичную идиопатическую микседему, нефроз, симпатическую офтальмию, гранулематозный орхит, панкреатит, острый полирадикулит, гангренозную пиодермию, тиреоидит Кервена, приобретенную атрофию селезенки, незлокачественную тимому, витилиго, синдром токсического шока, пищевое отравление, состояния, в которые вовлечена инфильтрация T-клеток, недостаточность адгезии лейкоцитов, иммунные ответы, связанные с острой и замедленной гиперчувствительностью, опосредованной цитокинами и T-лимфоцитами, заболевания, в которые вовлечен диапедез лейкоцитов, синдром множественного органного повреждения, заболевания, опосредованные комплексом антиген-антитело, заболевание, вызванное антителами к клубочковой базальной мембране, аллергический неврит, аутоиммунные полиэндокринопатии, оофорит, первичную микседему, аутоиммунный атрофический гастрит, симпатическую офтальмию, ревматические заболевания, смешанное заболевание соединительной ткани, нефротический синдром, инсулит, полиэндокринную недостаточность, аутоиммунный полигландулярный синдром типа I, идиопатический гипопаратиреоидизм взрослых (AOIH), кардиомиопатию, такую как дилатационная кардиомиопатия, приобретенный буллезный эпидермолиз (EBA), гемохроматоз, миокардит, нефротический синдром, первичный склерозирующий холангит, гнойный или негнойный синусит, острый или хронический синусит, этмоидальный, фронтальный, верхнечелюстной или сфеноидальный синусит, связанное с эозинофилами расстройство, такое как эозинофилия, эозинофильная инфильтрация легких, синдром эозинофилии-миалгии, синдром Леффлера, хроническую эозинофильную пневмонию, тропическую легочную эозинофилию, бронхолегочный аспергиллез, аспергиллема или гранулемы, содержащие эозинофилы, анафилаксию, серонегативные спондилоартриты, полиэндокринное аутоиммунное заболевание, склерозирующий холангит, склеру, эписклеру, хронический слизисто-кожный кандидамикоз, синдром Брутона, трансзиторную гипогаммаглобулинемию новорожденных, синдром Вискотта-Олдриджа, синдром атаксии-телеангиэктазии, ангиэктазию, аутоиммунные расстройства, связанные с коллагеновой болезнью, ревматизм, неврологическое заболевание, лимфаденит, снижение реакции кровяного давления, дисфункцию сосудов, повреждение тканей, сердечно-сосудистую ишемию, гипералгезию, ишемию почек, ишемию головного мозга и заболевания, сопровождаемые васкуляризацией, аллергические гиперчувствительные расстройства, гломерулонефриты, реперфузионное повреждение, ишемическое реперфузионное расстройство, реперфузионное повреждение миокарда или других тканей, лимфоматозный трахеобронхит, воспалительные дерматозы, дерматозы с острым воспалительными компонентами, множественную органную недостаточность, буллезные заболевания, почечный кортикальный некроз, острый гнойный менингит или другие воспалительные заболевания центральной нервной системы, глазные и глазничные воспалительные расстройства, синдромы, связанные с трансфузией гранулоцитов, индуцированную цитокинами токсичность, нарколепсию, острое тяжелое воспаление, хроническое стойкое воспаление, пиелит, внутриартериальную гиперплазию, пептическую язву, вальвулит и эндометриоз.
Антитела, описанные в настоящем описании, могут иметь различные академические, медицинские и коммерческие применения. Антитела можно применять в диагностических тестах разных типов, например, для того, чтобы выявить широкое множество заболеваний или присутствие лекарственных средств (фармацевтических средств), токсинов или других белков, включая гормоны, либо in vitro, либо in vivo. Антитела, описанные в настоящем описании, могут быть применимы в тестировании заболевания, например, с использованием сыворотки или крови пациентов. Заболевание могут включать связанные с OX40 заболевания или заболевания или показания, не связанные с OX40, включая различные злокачественные опухоли, воспалительное или аутоиммунное заболевание. Антитела также можно применять для радиоиммунологической детекции и радиоиммунологической терапии злокачественной опухоли, и в некоторых новых способах тестирования можно использовать такие описанные антитела для целенаправленного воздействия только на клеточные мембраны конкретных типов клеток, т.е., злокачественных клеток.
Антитела, описанные в настоящем описании, могут быть частью набора или другой упаковки для диагностики. В связи с этим в настоящем описании предлагается диагностический набор или изделие для применения в предлагаемом в настоящем изобретении способе предварительной обработки. Диагностический набор может содержать любой один или несколько из следующих компонентов: эталонный материал антагонист/антитело/лекарственное средство; нейтрализующее антитело для положительного контроля (предпочтительно, козы или макака-крабоеда); колонку с белком A+G (например, колонку с белком A/G); реагент для обезжиривания; буфер (буферы) для аффинной очистки иммуноглобулинов (например, буферы для связывания, элюирования и нейтрализации); сыворотка с комплементом; разбавитель клеток для анализа; инструкцию или литературу для пользователя; флакон с замороженными клетками (например, клетками WIL2); реагент для мечения клеток (такой как CELL TITER GLO.RTM.) и т.д. В качестве примера диагностический набор может содержать без ограничения: (a) реагент для обезжиривания; (b) буферы (например, буферы для связывания и элюирования) для аффинной очистки иммуноглобулинов; и (c) руководство с инструкциями для пользователя диагностическим набором по применению набора для предварительной обработки биологического образца от индивида, имеющего аутоиммунное заболевание или злокачественную опухоль, перед проведением основанного на клетках биологического анализа (такого как анализ нейтрализующих антител) на образце (например, чтобы избежать проблемы, обусловленной помехами, связанными с присутствием сыворотки). Диагностический набор необязательно дополнительно содержит любой один или несколько из следующих компонентов: эталонное лекарственное средство, нейтрализующее антитело для положительного контроля, сыворотку с комплементом, разбавитель клеток для анализа и реагент для мечения клеток и т.д.
Антитела и другие объекты изобретения, описанные в настоящем описании, также обеспечивают высокопроизводительные способы скрининга. Более конкретно и как будет понятно специалистам в данной области стали возможными высокопроизводительные способы скрининга антагонистических или агонистических моноклональных антител или малых молекул, которые связываются с рецепторами OX40 и которые могут ингибировать образование и функцию клеток Tr1 или стимулировать образование и функцию клеток Tr1. В одном таком способе линию T-клеток человека (SU-DHL-1), обладающую способностью продуцировать IL-10, трансфицировали геном OX40 человека (SUOX40). 100000 клеток SUOX40e культивировали либо со 100000 фибробластов мыши (L-клетками), либо со 100000 фибробластов мыши, экспрессирующих лиганд OX40 человека (L-клетки с OX40-лигандом), в 96-луночных планшетах. Через 48 часов культивирования супернатанты культур собирали для измерения IL-10 в IL-10-специфичном ELISA. В типичном эксперименте 100000 клеток SUOX40 продуцировали до 6000 пг/мл IL-10 в случае культивирования в отсутствие OX40-лиганда. В присутствии OX40-лиганда 100000 клеток SUOX40 продуцировали менее 1000 пг/мл IL-10. Такой способ культивирования можно использовать, наряду с прочим, для скрининга антагонистических моноклональных антител или малых молекул, которые блокируют способность OX40-лиганда ингибировать продукцию IL-10 клетками SUOX40. Альтернативно, такой способ культивирования можно модифицировать заменой L-клеток, экспрессирующих OX40-лиганд, потенциально агонистическими моноклональными антителами или малыми молекулами, специфичными по отношению к OX40, чтобы определить, наряду с прочим, их способность ингибировать продукцию IL-10 клетками SUOX40.
Антитела против OX40, описанные в настоящем описании, можно использовать в качестве анализирующего средства или в анализе для тестирования или измерения активности лекарственного средства или другой молекулы, выявляемой в организме или в органическом образце. Антитела также можно применять в количественном анализе для измерения количества вещества в образце. Биологические анализы и иммунологические анализы могут быть выбраны среди множества различных специальных биохимических анализов, в которых можно применять такие антитела. Антитела против OX40, описанные в настоящем описании, можно применять в других анализах для измерения таких процессов, как ферментативная активность, улавливание антигена, активность стволовых клеток и конкурентное связывание белков.
L-клетки, экспрессирующие GITRL, OX40L, 4-1BBL, ICOSL человека, создавали, используя опосредованную ретровирусами трансдукцию, как понятно специалистам в данной области. Вкратце, полноразмерную кодирующую последовательность GITRL человека (номер доступа NM_005092), OX40L (номер доступа NM_003326), 4-1BBL (номер доступа NM_003811), ICOSL (номер доступа NM_015259) амплифицировали в ОТ-ПЦР с использованием РНК, полученной из HSV-1-стимулированных PBMC. Затем кДНК клонировали в основанном на MSCV ретровирусном векторе pMIGW2 и получение плазмид подтверждали расщеплением ферментами рестрикции и секвенированием ДНК. Чтобы получить рекомбинантный ретровирус, каждый вектор котрансфицировали с пакующими конструкциями pCL-gp (gag/pol) и pHCMV-VSVg (гликопротеин оболочки VSV) в клетки HEK293T. Через два дня супернатанты культур, содержащие вирусы, собирали и использовали для инфицирования L-клеток CD32 при множественности заражения MOI 100. В таких условиях >95% клеток были эффективно трансдуцированы.
Выделенные моноциты CD14+ (чистота >94%) культивировали в присутствии 100 нг/мл GM-CSF и 50 нг/мл IL-4 (оба из R&D) в течение 5 суток, как понятно специалистам в данной области. Полученные незрелые ДК промывали и культивировали в течение 24 часов с IFN-α (1000 ед./мл, PBL Biomedical Laboratories), IL-10 (10 нг/мл, R&D) и облученными CD40L-трансфицированными L-клетками (отношение ДК к L-клеткам 4:1), чтобы получить зрелые ДК, как понятно специалистам в данной области.
Наивные T-клетки CD4+ и T-клетки памяти CD4+ (и те и другие с чистотой >99%) выделяли из PBMC, используя набор II для выделения T-клеток CD4+ (Miltenyi Biotec), с последующей сортировкой клеток (фракция CD4+CD45RA+CD45RO-CD25- в качестве наивных T-клеток и фракция CD4+CD45RA-CD45RO+CD25- в качестве T-клеток памяти), как понятно специалистам в данной области. 4×104 свежеочищенных аллогенных наивных T-клеток CD4+ культивировали совместно с незрелыми или культивированными ДК (отношение ДК к T 1:10) в присутствии или отсутствие рекомбинантного OX40L человека (R&D, 100 нг/мл) в 96-луночных культуральных планшетах с круглым дном в течение 7 суток, как понятно специалистам в данной области. Очищенные T-клетки CD4+ также культивировали с IL-12 (10 нг/мл, R&D), IL-4 (25 нг/мл, R&D) или сочетанием дексаметазона (5×10-8 М, Life Technologies) и 1-альфа,25-дигидроксивитамина D3 (10-7 М) в течение 7 суток в присутствии растворимого моноклонального антитела против CD28 (CD28.2, 1 мкг/мл) и IL-2 (50 ед./мл, R&D) на облученных клетках CD32/OX40L-L, клетках CD32/GITRL-L, клетках CD32/4-1BBL-L или исходных клетках CD32-L, которые были предварительно покрыты моноклональным антителом против CD3 (OKT3, 0,2 мкг/мл) в 48-луночных культуральных планшетах (отношение T-клеток к L-клеткам 2,5:1), как понятно специалистам в данной области. В некоторых экспериментах T-клетки CD4+ культивировали в течение 7 суток на клетках CD32-L, смеси клеток CD32-L и клеток CD32/ICOSL-L (отношение 1:1) или смеси клеток CD32/ICOSL-L и клеток CD32/OX40L-L (отношение 1:1), предварительно покрытых моноклональным антителом против CD3 (0,2 мкг/мл) в 48-луночных культуральных планшетах, как понятно специалистам в данной области. Использовали RPMI 1640 и добавляли 10% FCS, 2 мМ L-глутамина, 1 мМ пирувата натрия, пенициллин G и стрептомицин для культур, как понятно специалистам в данной области.
Культивированные T-клетки собирали и промывали, и затем рестимулировали связанным с планшетом анти-CD3 (5 мкг/мл) и растворимым анти-CD28 (2 мкг/мл) в концентрации 1×106 клеток/мл в течение 24 часов, как понятно специалистам в данной области. Уровни IL-4, IL-10, TNF-α и IFN-α в супернатантах измеряли в ELISA (все наборы из R&D), как понятно специалистам в данной области. Для внутриклеточной продукции цитокинов культивированные T-клетки рестимулировали 50 нг/мл PMA плюс 2 мкг/мл иономицина в течение 6 часов. Брефелдин A (10 мкг/мл) добавляли в последний 2-часовой период, как понятно специалистам в данной области. Клетки красили сочетанием PE-меченых моноклональных антител к IL-4 или ФИТЦ-меченых моноклональных антител к IFN-α и APC-меченых анти-IL-10 (все из BD), используя наборы FIX и PERM (CALTAG), как понятно специалистам в данной области.
T-клетки собирали и ресуспендировали в EDTA-содержащей среде, чтобы разделить кластеры, как понятно специалистам в данной области. Живые клетки подсчитывали, используя исключение мертвых клеток по окраске трипановым синим, как понятно специалистам в данной области. Для анализа супрессорной функции использовали наивные T-клетки CD4+ (A) и клетки Tr1, образованные из наивных T-клеток CD4+ при действии моноклонального антитела против CD3, моноклонального антитела против CD28, IL-2, Dex и витамина D3 в присутствии исходных L-клеток (B) или OX40L-L-клеток (C), затем указанные три типа клеток и их смеси в соотношении 1:1 рестимулировали в течение 5 суток благодаря культивированию в присутствии 5 мкг/мл моноклонального антитела против CD3 и 1 мкг/мл моноклонального антитела против CD28, после указанного периода времени анализировали клеточную пролиферацию по включению [3H]-тимидина, как понятно специалистам в данной области.
Образование специфичных моноклональных антител против OX40 человека.
Авторы изобретения создавали множество агонистических моноклональных антител мыши против OX40 человека. Специфичность связывания антигена антителами подтверждали, используя проточную цитометрию (фиг.10-12). Агонистическую активность антител подтверждали в функциональных анализах. Авторы обнаружили, что девять из 20 OX40-специфичных антител могут блокировать опосредованное витамином D3/дексаметазоном образование клеток Tr1 из T-клеток CD4+ (фиг. 13), усиливать пролиферацию T-клеток CD4+ (фиг. 14) и подавлять продукцию IL-10 клетками ICOS+CD4+CD25highFOXP3+ Treg (фиг. 16). Авторы титровали антитела и обнаружили, что пять из них обладали высокой активностью в подавлении образования клеток Tr1 в концентрациях уже при такой низкой концентрации, как 4 нг/мл (фиг. 15).
Антитела против OX40 ингибируют функцию CD4+CD25highFOXP3+ Treg
Некоторые из моноклональных OX40-антител ингибируют супрессорную функцию FOXP3+ Treg (фиг. 17). Из пяти антител (119-8B, 119-43, 119-122, 119-173B и 106-222), которые потенциально ингибируют продукцию IL-10 клетками Tr1 и CD4+CD25highCD127-FOXP3+ Treg, три (119-43, 119-122 и 106-222) были эффективными в блокировании функции CD4+CD25highCD127-FOXP3+ Treg (фиг. 17). Однако два (119-33 и 120-140A) из 11 антител, которые не обладают активностью, направленной против продукции IL-10, но блокируют функцию CD4+CD25highFOXP3+ Treg (фиг. 18).
Моноклональные антитела против OX40 человека
Получение моноклональных антител против OX40 человека осуществляли, например, иммунизацией мышей BALB/c 6-8-недельного возраста линией клеток мышей, трансфицированных OX40 человека, следуя общепринятым протоколам. Получали и затем анализировали гибридомные клоны, секретирующие моноклональное антитело, которое специфично окрашивало клетки OX40+.
Авторы изобретения разработали всесторонний скрининг для выявления таких клонов, которые запускают передачу сигнала OX40 (т.е., агонистических антител) посредством ингибирования образования и функции клеток Tr1. Затем такие клоны очищали. Агонистические антитела против hOX40 могут быть гуманизированы и использованы в протоколах противоопухолевый терапии человека либо отдельно, либо в сочетании с противоопухолевой вакцинацией и другими адъювантами. Мишенью таких антител могут быть опухоли нескольких разных типов, включая меланому, лимфому и рак легкого.
В другом варианте осуществления использовали самок мышей BALB/c 6-8-недельного возраста для иммунизации в подушечку лап или подкожной иммунизации. Каждой мыши инъецировали 5 миллионов L-клеток мышей, трансфицированных OX40 человека (L-OX40), 6 раз с 3-дневными интервалами. Через три дня после шестой инъекции мышей умерщвляли и извлекали подколенные лимфатические узлы (в случае иммунизации в подушечки лап) или селезенку (в случае подкожной иммунизации) и клетки сливали с клетками миеломы SP2.0 или клетками миеломы NSО в соотношении 1:1, чтобы получить гибридомные клоны, используя общепринятые протоколы. Затем осуществляли скрининг гибридомных клонов, секретирующих моноклональное антитело, в отношении их специфичности связывания с клетками L-hOX40 в анализах ELISA. Супернатанты гибридом, которые связываются с клетками L-hOX40 и не связываются с исходными L-клетками, дополнительно оценивали, подтверждая связывание на клетках L-hOX40 и SUPM2-hOX40, с использованием проточно-цитометрического анализа.
В эксперименте, показанном на фиг. 10, супернатанты гибридом hOX40 подвергали скринингу в отношении их действия против L-hOX40 по сравнению с исходными L-клетками в ELISA. Было отобрано двадцать hOX40-специфичных моноклональных антител. Двадцатью миллионами L-клеток или L-клеток, экспрессирующих OX40 человека (L-hOX40), покрывали 96-луночный планшет, смешивая клетки с 0,01% хлоридом магния и кальция в PBS и давая им возможность подсохнуть в течение ночи в ламинарном боксе. Затем планшеты замораживали при -20°C, по меньшей мере, за один день до использования. В случае анализов связывания антител замороженные клетки регидратировали PBS и промывали буфером для промывки, содержащим PBS плюс 0,05% Twin 20, и блокировали 2% БСА в буфере для промывки. Затем использовали кондиционированные клетки для связывания с супернатантами, содержащими OX40-антитела. Затем выявляли связывание антител с клетками, используя второе антитело против FC IgG мыши - HRP. Супернатанты hOX40-специфичных гибридом распознают L-клетки, экспрессирующие OX40, но не исходные L-клетки.
В эксперименте, показанном на фиг. 11, hOX40-специфичные моноклональные антитела подвергали скринингу с использованием проточно-цитометрического анализа. Равные количества (100k) L-клеток и L-hOX40 смешивали в FACS-буфере (1% FCS/2 мМ EDTA/PBS) и инкубировали с 0,5 мкг антител, очищенных с использованием FPLC (белок A-HiTrap/слабый буфер для элюирования Аг/Ат). Затем клетки промывали и красили вторым антителом, конъюгированным с PE антителом против IgG мыши. Два пика показывают положительное и отрицательное окрашивание моноклональным антителом против hOX40. Один пик свидетельствует об отсутствии связывания или неспецифичном связывании антител. В проточно-цитометрическом анализе было подтверждено наличие двадцати hOX40-специфичных моноклональных антител.
В эксперименте, показанном на фиг. 12, специфичность моноклональных hOX40-антител подтверждали, используя клетки SUPM2, экспрессирующие hOX40 (SUPM2-hOX40). Равные количества (100k) клеток SUPM2 и SUPM2-hOX40 смешивали в FACS-буфере (1% FCS/2 мМ EDTA/PBS) и использовали для связывания моноклональных hOX40-антител, как показано на фиг. 11. Специфичность связывания каждого антитела анализировали проточной цитометрией. Два пика указывают положительное и отрицательное окрашивание моноклональным антителом против hOX40, тогда как один пик свидетельствует об отсутствии связывания или неспецифичном связывании антителами. Повторно подтвердили наличие двадцати hOX40-специфичных моноклональных антител.
В эксперименте, показанном на фиг. 13, авторы пытались идентифицировать специфичные по отношению к OX40 человека моноклональные антитела, которые могут ингибировать образование клеток Tr1 из T-клеток CD4+, стимулированных витамином D3 (10 микромоль, мМ)/Dex (50 наномоль, нМ), CD32L/ICOSL и анти-CD3/CD28 (0,2 микрограмма/мл). Моноклональные антитело против hOX40 добавляли в 0 день культивирования клеток и T-клетки CD4+ после 7-дневного стимулирования подвергали окрашиванию в отношении внутриклеточного IL-10 с последующим проточно-цитометрическим анализом. Типичные данные, полученные с использованием активируемой флуоресценцией сортировки клеток (FACS), показаны на фиг. A и процент клеток Tr1 в случае всех обработок моноклональными антителами против hOX40 показан на фиг. B. Используя клетки, полученные в таком эксперименте, авторы попытались идентифицировать hOX40-специфичные моноклональные антитела, которые стимулируют пролиферацию T-клеток CD4+ (фиг. 14, клетки подсчитывали на 7 день после стимуляции) и ингибируют образование Tr1 из CD4+ (фиг. 13).
Чтобы идентифицировать такие моноклональные hOX40-антитела по их способности ингибировать образование клеток Tr1 из T-клеток CD4+, получали Tr1-клетки и культивировали, как описано в экспериментах, показанных на фиг. 13 выше. Типичные данные FACS показаны на фиг. A, и процент клеток Tr1 после обработки девятью моноклональными антителами против hOX40 показаны на фиг. B. Пять hOX40-специфичных моноклональных антител в значительной степени ингибировали образование клеток Tr1 в концентрации 4 нг/мл (фиг. 15).
В эксперименте, показанном на фиг. 16A, 16B и 16C, вновь отсортированные T-клетки ICOS+CD4+CD127-CD25high стимулировали, используя анти-CD3 (0,2 мкг/мл), в присутствии CD32L/ICOSL-клеток и CD32L/hOX40L-клеток или моноклональных антител против hOX40 или контрольного антитела, в течение 5 суток. Затем клетки подсчитывали и 5×104 клеток рестимулировали анти-CD3/CD28 в течение 24 часов, и супернатанты анализировали в отношении секреции IL-10, используя набор для ELISA. Авторы обнаружили, что hOX40-специфичные моноклональные антитела, которые ингибируют образование Tr1 из T-клеток CD4+, также ингибируют продукцию IL-10 природными T-клетками ICOS+CD4+CD25high. Свежеотсортированные ICOS+ICOS-CD4+CD127-CD25high Treg культивировали с CFSE-мечеными клетками CD4+CD25low в присутствии облученных моноцитов и анти-CD3 (0,3 мкг/мл) и анти-hOX40-мАт. Через 3,5 дня культивирования оценивали пролиферацию клеток по разбавлению CFSE в клетках, используя FACS (фиг. 16C).
На фиг. 17A и 17B показана идентификация моноклональных антител против hOX40, которые ингибируют образование клеток Tr1 и блокируют функцию FOXP3+CD4+CD25high Treg. Свежеотсортированные T-клетки FOXP3+CD4+CD127-CD25high (3,5×104) культивировали с CFSE-мечеными клетками CD4+CD25low (7×104) в присутствии облученных моноцитов (7×104, 6000 рад) и 0,3 мкг/мл анти-CD3 и различных концентраций моноклонального антитела против hOX40. После 3-4 дней культивирования оценивали пролиферацию клеток по разбавлению CFSE в клетках, используя проточно-цитометрический анализ. Показан процент делящихся клеток. Типичные проточно-цитометрические анализы показаны на фиг.17A. Данные для 6 моноклональных антител показаны на фиг.17B.
В эксперименте, показанном на фиг.18, свежеотсортированные T-клетки FOXP3+CD4+CD127-CD25high (3,5×104) культивировали с CFSE-мечеными клетками CD4+CD25low (7×104) в присутствии облученных моноцитов (7×104, 6000 рад) и 0,3 мкг/мл анти-CD3 и различных концентраций моноклонального OX40-антитела. После 3-4-дневного культивирования оценивали пролиферацию клеток по разбавлению красителя CFSE в клетках с использованием FACS. Представлены данные из двух экспериментов. Авторы идентифицировали моноклональные антитела против hOX40, которые не ингибируют образование Tr1, но блокируют функцию FOXP3+CD4+CD25high Treg.
В эксперименте, показанном на фиг. 19A и 19B, полученные из лимфомы T-клетки CD4+CD25high культивировали с CFSE-мечеными клетками CD4+CD25low (7×104), выделенными от здорового донора, в присутствии облученных аллогенных моноцитов (7×104, 6000 рад) и 0,3 микрограмм/мл анти-CD3 и 25 мкг/мл моноклонального антитела против hOX40. После 3-4-дневного культивирования оценивали пролиферацию клеток по разбавлению CFSE, используя FACS. Типичные FACS-анализы показаны на фиг. 19A, и данные для всех экспериментов показаны на фиг. 19B. Авторы обнаружили, что агонистические hOX40-антитела блокируют функцию полученных из лимфомы CD4+CD25high Treg.
На фиг. 20 показана идентификация агонистических антител против OX40, которые специфично связываются с OX40 человека и макак-резус. Мононуклеарные клетки периферической крови макака-резус получали центрифугированием в фиколе. T-клетки CD4+ получали с использованием микрошариков CD4. T-клетки CD4+ стимулировали, используя 10 мкг/мл лектина Phaseolus vulgaris (ФГА). Через два дня после стимуляции клетки красили анти-hOX40-мАт, а затем антителом козы против IgG мыши-APC и CD69-PE. 106-317 служило в качестве отрицательного контроля. Показаны шесть анти-hOX40-мАт, которые сильно активируют пролиферацию T-клеток и могут связывать активированные T-клетки CD4+ макака-резус. Полученные результаты показывают, что токсичность указанных шести моноклональных антител против hOX40 можно тестировать на обезьянах.
Только семь из 500 положительных клонов против OX40 человека, полученных с использованием обычных протоколов слияния, проявляли свойства, вызывающие запуск OX40, включая без ограничения способность блокировать образование Tr1, продуцирующих IL-10, и супрессорную функцию nTreg, как описано в таблице 1.
Гибридомные клоны 106-222 и 119-122 были выбраны на основе трех критериев
1. Они ингибируют образование клеток Tr1 из T-клеток CD4+ (индуцируемые Treg).
2. Они реверсируют супрессорную функцию клеток FOXP3+nTreg.
3. Они вызывают зависимое от дозы ингибирование клеток Tr1, отключение и реверсирование функции FOXP3+Treg.
Химерные и гуманизированные антитела
Гуманизация (также называемая реконструкцией или CDR-прививкой) представляет собой общепринятый способ, предназначенный для снижения иммуногенности моноклональных антител из ксеногенных источников (включая без ограничения грызунов) и для улучшения активации иммунной системы человека. Хотя известна техника получения сконструированного моноклонального антитела с использованием способов молекулярной биологии, простая прививка определяющих комплементарность областей (CDR) грызунов в каркасы человека не всегда позволяет реконструировать аффинность и специфичность связывания исходного моноклонального антитела.
В случае гуманизации антитела дизайн гуманизированного антитела становится важнейшей стадией в воспроизведении функции исходной молекулы. Такой дизайн включает различные варианты выбора: протяженность CDR, используемые каркасы человека и замену остатков из моноклонального антитела грызунов в каркасные области человека (обратные мутации). Положения таких обратных мутаций, главным образом, были идентифицированы с помощью анализа последовательности/структуры или анализа модели гомологии 3D-структуры вариабельных областей.
Недавно были использованы фаговые библиотеки для варьирования аминокислот в выбранных положениях. Подобным образом, было использовано множество способов выбора наиболее подходящих каркасов человека, в которые нужно привить CDR грызунов. В ранних экспериментах использовали ограниченную подгруппу хорошо охарактеризованных моноклональных антител человека (часто, но не всегда, таких, для которых была доступна структура), независимо от идентичности последовательности таких антител последовательности моноклонального антитела грызуна (так называемый способ фиксированных каркасов). Некоторые группы используют вариабельные области с высокой идентичностью аминокислотной последовательности вариабельным областям грызунов (совпадение с точки зрения гомологии или наилучшее соответствие); другие используют консенсусные последовательности или последовательности зародышевой линии, тогда как другие отбирают фрагменты каркасных последовательностей в каждой вариабельной области легкой или тяжелой цепи из нескольких разных моноклональных антител человека. Также существуют разработанные способы гуманизации, в которых заменяют поверхностные остатки грызунов наиболее распространенными остатками, встречающимися в моноклональных антителах человека («изменение поверхности» или «виниринг»), и способы, в которых используют установление разных границ протяженности CDR. Гуманизированные антитела описаны ниже. Однако химерное антитело, содержащее вариабельные области тяжелой и легкой цепей SEQ ID NO:4 и 10 или SEQ ID NO:16 и 22, также описаны в настоящем описании.
Гуманизированные моноклональные антитела получали из антитела мыши против OX40.
Выделенное гуманизированное антитело против OX40 может иметь вариабельную область тяжелой цепи CDR1, содержащую аминокислотную последовательность SEQ ID NO:1 или 13. Выделенное гуманизированное антитело против OX40 может иметь вариабельную область тяжелой цепи CDR2, содержащую аминокислотную последовательность SEQ ID NO:2 или 14. Выделенное гуманизированное антитело против OX40 может иметь вариабельную область тяжелой цепи CDR3, содержащую аминокислотную последовательность SEQ ID NO:3 или 15.
Выделенное гуманизированное антитело против OX40 может иметь вариабельную область легкой цепи CDR1, содержащую аминокислотную последовательность SEQ ID NO:7 или 19. Выделенное гуманизированное антитело против OX40 может иметь вариабельную область легкой цепи CDR2, содержащую аминокислотную последовательность SEQ ID NO:8 или 20. Выделенное гуманизированное антитело против OX40 может иметь вариабельную область легкой цепи CDR3, содержащую аминокислотную последовательность SEQ ID NO:9 или 21.
Выделенное гуманизированное антитело против OX40 может иметь вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO:11 или 23, или аминокислотную последовательность, которая по меньшей мере на 90 процентов идентична аминокислотным последовательностям SEQ ID NO:11 или 23. Выделенное гуманизированное антитело против OX40 может иметь вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:5 или 17, или аминокислотную последовательность, которая по меньшей мере на 90 процентов идентична аминокислотным последовательностям SEQ ID NO:5 или 17.
Выделенное гуманизированное антитело против OX40 может иметь вариабельную область легкой цепи, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO:12 или 24 или последовательностью нуклеиновой кислоты, имеющей по меньшей мере 90-процентную идентичность с аминокислотными последовательностями SEQ ID NO:12 или 24. Выделенное гуманизированное антитело против OX40 может иметь вариабельную область тяжелой цепи, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO:6 или 18 или последовательностью нуклеиновой кислоты, которая по меньшей мере на 90 процентов идентична аминокислотным последовательностям SEQ ID NO:6 или 18.
Экспрессия гуманизированных антител против OX40
Антитело или часть антитела согласно изобретению могут быть получены в результате рекомбинантной экспрессии генов легкой и тяжелой цепи иммуноглобулина в клетке-хозяине. Чтобы рекомбинантно экспрессировать антитело, клетку-хозяина трансфицируют одним или несколькими рекомбинантными векторами экспрессии, несущими фрагменты ДНК, кодирующие легкую и тяжелую иммуноглобулиновые цепи антитела, так что легкая и тяжелая цепи экспрессируются в клетке-хозяине и, предпочтительно, секретируются в среду, в которой культивируют клетки-хозяева, и из такой среды антитела могут быть извлечены. Используют стандартные способами получения рекомбинантной ДНК для получения генов тяжелой и легкой цепей антитела, включения таких генов в рекомбинантные векторы экспрессии и введения векторов в клетки-хозяева, такие как клетки-хозяева, описанные в Sambrook, Fritsch and Maniatis (eds), Molecular Cloning; A Laboratory Manual, Second Edition, Cold Spring Harbor, N.Y., (1989), Ausubel, F. M. et al. (eds.) Current Protocols in Molecular Biology, Greene Publishing Associates, (1989) и в патенте США № 4816397, Boss et al.
Антитела и фрагменты и варианты антител могут быть получены из различных клеток животных, предпочтительно, из клеток млекопитающих, при этом особенно предпочтительны клетки мышей и человека. Также системы экспрессии рекомбинантной ДНК могут включать такие системы, в которых используют клетки-хозяева и экспрессирующие конструкции, которые были сконструированы так, чтобы получить высокие уровни конкретного белка. Такие клетки-хозяева и экспрессирующие конструкции могут включать клетки Escherichia coli, несущие экспрессирующие конструкции, полученные из плазмид или вирусов (бактериофага); дрожжи, такие как Saccharomyces cerevisieae или Pichia pastoras, несущие эписомные или интегрированные в хромосому экспрессирующие конструкции; клетки насекомых и вирусы, такие как клетки Sf9 и бакуловирус; и клетки млекопитающих, несущие эписомные или интегрированные в хромосому (включая без ограничения ретровирусные) экспрессирующие конструкции (такие способы, например, можно найти в рукописи Verma et al., J. Immunol. Methods 216: 165-181, 1998). Антитела также могут быть получены в растениях (такие способы можно найти, например, в патенте США № 6046037; Ma et al., Science 268: 716-719, 1995) или с использованием способов фагового дисплея (такие способы можно найти, например, в Winter et al., Annu. Rev. Immunol. 12: 433-455, 1994).
Антитела против OX40 человека, которые имели высокий уровень активности и специфичности/аффинности связывания, которые необходимы, могут быть дополнительно обработаны стандартными способами получения рекомбинантной ДНК, например, чтобы превратить гены вариабельных областей в гены полноразмерных цепей антитела, в гены Fab-фрагментов или в ген scFv. При таких обработках VL- или VH-кодирующий фрагмент ДНК оперативно связывают с другим фрагментом ДНК, кодирующим другой белок, такой как константная область антитела или гибкий линкер. Подразумевают, что термин «оперативно связывают», который использован в данном контексте, означает, что два фрагмента ДНК соединяют так, что аминокислотные последовательности, кодируемые двумя фрагментами ДНК, остаются в рамке.
В другом аспекте, выделенная ДНК, кодирующая область VH, может быть превращена в ген полноразмерный тяжелой цепи благодаря оперативному связыванию VH-кодирующей ДНК с другой молекулой ДНК, кодирующей константные области тяжелой цепи (CH1, CH2 и CH3). Последовательности генов константных областей тяжелой цепи человека известны в данной области (см., например, Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242 и фрагменты ДНК, охватывающие такие области, могут быть получены в результате стандартной ПЦР-амплификации. Константная область тяжелой цепи может представлять собой константную область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD и любой аллотипический вариант, как описано в Kabat et al. (Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), но наиболее предпочтительно, является константной областью IgG1 или IgG4. В случае гена тяжелой цепи Fab-фрагмента VH-кодирующая ДНК может быть оперативно связана с другой молекулой ДНК, кодирующей только константную область CH1 тяжелой цепи.
Также гуманизированное антитело, связанное с поверхностным антигеном, может взаимодействовать с клетками, несущими FcR. Такое взаимодействие может вызывать эффекторную функцию, такую как ADCC, и/или усиливать передачу сигнала вследствие Fc-опосредованного перекрестного связывания. Взаимодействие может быть полезным или вредным для терапии. Такие вредные побочные эффекты включают озноб, лихорадку, гипотензию и в некоторых случаях затрудненное дыхание (Thistlethwaite JR Jr., Cosimi AB, Delmonico FL, et al.).
Некоторые опасные эффекты могут возникать в белковом комплексе, находящемся на поверхности T-клетки. При активации T-клетки белковый комплекс оказывается вовлеченным в трансдукцию сигналов, генерируемых посредством рецептора антигена. Вкратце, активация T-клетки запускает каскад событий, которые включают усиленное перекрестное связывание рецептора антигена. Перекрестное связывание рецептора может вносить вклад в передачу сильных митогенных сигналов, что приводит к стимуляции некоторых цитокинов, таких как фактор некроза опухолей альфа (TNF-α), интерлейкин-2 (IL-2) и интерферон-гамма (IFN-γ). Известно, что такие цитокины являются токсичными, если образуются в больших количествах.
Например, анти-CD3-мАт в настоящее время применяют для лечения аутоиммунного заболевания, включая сахарный диабет типа I, при котором T-клетки опосредуют атаку, направленную против островков поджелудочной железы, продуцентов инсулина (Kaufman A and Herold K. Anti-CD3 mAbs for treatment of type 1 diabetes. Diabetes Metab. Res. Rev. 2009; 25: 302-306). Известно, что антитела против CD3 ингибируют лизис мишеней T-клетками и усиливают перекрестное связывание рецептора антигена CD3. Кроме того, известно, что наряду с высокой митогенной активностью анти-CD3-антитело является сильным индуктором цитокинов, в частности, фактора некроза опухолей альфа (TNF-α), интерлейкина-2 (IL-2) и интерферона-гамма (IFN-γ). Высвобождение огромного количества цитокинов, особенно TNF-α, из T-клеток в ответ на лекарственное средство (Chatenoud L.) вызывает токсические эффекты. Такие нежелательные побочные эффекты были объяснены перекрестным связыванием T-клеток, несущих молекулы CD3, и клеток, несущих FcR, которые связываются с Fc-частью антител. Перекрестное связывание активирует как T-клетку, так и FcR-несущие клетки, что приводит к массивному высвобождению цитокинов, как указано выше.
Подобным образом возможные нежелательные побочные эффекты могут возникать при использовании антител против OX40. Например, антитела против OX40, которые связываются с T-клетками, экспрессирующими OX40, также могут связываться с клетками, несущими FcR, и запускать продукцию цитокинов, которые могут быть полезными или вредными для пациентов, которых лечат антителом. Для преодоления такой потенциальной проблемы авторы сконструировали и предложили в настоящем описании способы осуществления мутаций FcR-части антител против OX40, чтобы избежать токсических эффектов и получить мутации в FcR-части, которые могут быть желательны.
Известен участок IgG1 человека, который взаимодействует с FcR (CD16, CD32 и CD64). Он картирован в верхней части домена CH2. Наиболее важными аминокислотами являются два остатка Leu в положениях 234 и 235. В результате мутаций указанных двух остатков с получением двух остатков Ala взаимодействия IgG1 со всеми FcR прекращаются. Гуманизированное антитело против CD3, содержащее такие мутации (HuOKT3AA), является намного более безопасным лекарственным средством и обладает механизмом действия, который отличается от механизма действия HuOKT3. См., например, патент США № 6491916, включенный в настоящее описание в качестве ссылки в полном объеме.
Положения AA-мутанта показаны ниже:
234 235
---A---P---E---L---L---G---G---P--- верх CH2 IgG1 дикого типа
---A---P---E---A---A---G---G---P--- верх CH2 AA-мутанта IgG1
Hu222AA и Hu122AA, описанные в настоящем описании, могут содержать такие мутации. Если система анализа содержит клетки, несущие FcR, можно видеть различие между диким типом и AA-мутантом. Во всем остальном два антитела должны вести себя одинаково.
Выделенная ДНК, кодирующая область VL, может быть превращена в ген полноразмерной легкой цепи (а также ген легкой цепи Fab) в результате оперативного связывания ДНК, кодирующей VL, с другой молекулой ДНК, кодирующей константную область легкой цепи CL. Последовательности генов константных областей легкой цепи человека известны в данной области (см., например, Kabat, E. A. et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242), и фрагменты ДНК, охватывающие такие области, могут быть получены с использованием стандартной ПЦР-амплификации. Константная область легкой цепи может представлять собой константную область каппа или лямбда.
Чтобы создать ген scFv, VH- и VL-кодирующие фрагменты ДНК оперативно связывают с другим фрагментом, кодирующим гибкий линкер, например, кодирующим аминокислотную последовательность (Gly4-Ser)3, так что последовательности VH и VL могут быть экспрессированы в виде непрерывного одноцепочечного белка, при этом области VL и VH связаны гибким линкером (см., например, Bird et al. (1988) Science 242:423-426; Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; McCafferty et al., Nature (1990) 348:552-554.
Предусмотрены модификация(ии) аминокислотных последовательностей антител, описанных в настоящем описании. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела получают введением соответствующих изменений нуклеотидов в нуклеиновую кислоту антитела или в результате пептидного синтеза. Такие модификации включают, например, делеции и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. Осуществляют любое сочетание делеции, инсерции и замены, чтобы получить конечную конструкцию, при условии, что конечная конструкция обладает требуемыми характеристиками. Изменения аминокислот могут быть введены в данную аминокислотную последовательность антитела одновременно с получением последовательности.
Применимый способ идентификации некоторых остатков или областей антитела, которые являются предпочтительными положениями для мутагенеза, называют «мутагенезом на основе сканирования аланином», который описан Cunningham and Wells (1989) Science 244: 1081-1085. В данном случае идентифицируют остаток или группу остатков-мишеней (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) и заменяют нейтральной или отрицательно заряженной аминокислотой (наиболее предпочтительно, аланином или полиаланином), чтобы оказать влияние на взаимодействие аминокислот с антигеном. Затем те положения аминокислот, которые проявляют функциональную чувствительность к заменам, улучшают введением дополнительных или других вариантов в участки или вместо участков замены. Таким образом, хотя участок введения варианта аминокислотной последовательности предварительно определяют, нет необходимости в предварительном определении природы мутации как таковой. Например, чтобы проанализировать эффективность мутации в данном участке, проводят Ala-сканирование или случайный мутагенез в кодоне-мишени или области-мишени и экспрессированные иммуноглобулины подвергают скринингу в отношении требуемой активности.
Инсерции в аминокислотных последовательностях включают слияния с амино- и/или карбоксильным концом длиной в диапазоне от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции внутри последовательности одного или нескольких аминокислотных остатков. Примеры концевых инсерций включают антитело с N-концевым остатком метионила или антитело, слитое с цитотоксическим полипептидом. Другие инсерционные варианты молекулы антитела включают слияние N- или C-конца антитела с ферментом (например, ADEPT) или полипептидом, который увеличивает время полужизни антитела в сыворотке. Другой тип аминокислотного варианта антитела изменяет исходный характер гликозилирования антитела. Такое изменение включает делецию одного или нескольких остатков углеводов, встречающихся в антителе, и/или добавление одного или нескольких сайтов гликозилирования, которые не присутствуют в антителе.
Другой тип варианта представляет собой вариант осуществления с аминокислотной заменой. В таких вариантах осуществления по меньшей мере, один аминокислотный остаток в молекуле антитела заменен другим остатком. Участки, представляющие наибольший интерес для мутагенеза путем замен, включают гипервариабельные области, но также предполагаются изменения и в FR. Консервативные замены показаны в таблице 1 патента США № 7812133, колонка 43, 1. 55 - колонка 44, 1. 49, включенного в настоящее описание в качестве ссылки, под заголовком «предпочтительные замены». Если такие замены приводят к изменению биологической активности, то могут быть введены дополнительные изменения в существенные изменения, названные «примерными заменами» в таблице 1, или изменения, которые описаны ниже при указании классов аминокислот, и продукты могут быть подвергнуты скринингу.
Кроме того, существенные модификации биологических свойств антитела осуществляют посредством отбора замен, которые значительно отличаются по их влиянию на поддержание (a) структуры остова полипептида в области замены, например, конформации в виде листа или спирали, (b) заряда или гидрофобности молекулы в сайте-мишени или (c) размера боковой цепи. Природные остатки делят на группы на основании общих свойств боковых цепей: (1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile; (2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln; (3) кислые: Asp, Glu; (4) основные: His, Lys, Arg; (5) остатки, которые влияют на ориентацию цепи: Gly, Pro; и (6) ароматические: Trp, Tyr, Phe. Неконсервативные замены повлекут за собой обмен представителя одного из указанных классов представителем другого класса.
Чтобы экспрессировать антитела или части антител, описанные в настоящем описании, ДНК, кодирующие неполные или полноразмерные легкие и тяжелые цепи, полученные как описано выше, встраивают в векторы экспрессии, так чтобы гены были оперативно связаны с последовательностями регуляции транскрипции и трансляции. Подразумевают, что в данном контексте термин «оперативно связанный» означает, что ген антитела лигирован в вектор так, что последовательности регуляции транскрипции и трансляции в векторе выполняют предназначенную им функцию регуляции транскрипции и трансляции гена антитела. Вектор экспрессии и последовательности регуляции экспрессии выбирают так, чтобы они были совместимы с используемой для экспрессии клеткой-хозяином. Ген легкой цепи антитела и ген тяжелой цепи антитела могут быть встроены в отдельные векторы, или более часто оба гена встраивают в один и тот же вектор экспрессии. Гены антител встраивают в вектор экспрессии стандартными способами (например, лигированием комплементарных сайтов рестрикции на фрагменте гена антитела и векторе, или лигированием тупых концов, если нет сайтов рестрикции).
На фиг. 23 показана одна такая схематичная структура вектора экспрессии для IgG1/каппа-антитела H106-222. В направлении по часовой стрелке от сайта SalI сверху плазмида содержит единицу транскрипции тяжелой цепи, начинающуюся основным немедленным ранним промотором цитомегаловируса (CMV) человека и энхансером (промотор CMV) для инициации транскрипции гена тяжелой цепи антитела. За промотором следует экзон VH, геномная последовательность, содержащая константную область тяжелой цепи гамма-1 человека, включая экзоны CH1, шарнирный, CH2 и CH3 с находящимися между ними интронами, и сайт полиаденилирования, следующий за экзоном CH3. Вслед за последовательностью гена тяжелой цепи единица транскрипции легкой цепи начинается промотором CMV, за которым следует экзон VL и геномная последовательность, содержащая экзон константной области цепи каппа человека (CL) с предшествующей ему частью интрона, и сайт полиаденилирования, следующий за экзоном CL. После гена легкой цепи следует ранний промотор SV40 (промотор SV40), ген ксантингуанинфосфорибозилтрансферазы (gpt) E. coli и участок, содержащий сайт полиаденилирования SV40 (сайт поли(A) SV40). Наконец, плазмида содержит часть плазмиды pUC19, включающую бактериальное начало репликации (pUC ori) и ген бета-лактамазы (бета-лактамаза). На фигуре показаны положения соответствующих сайтов рестрикции.
Рекомбинантный вектор экспрессии может кодировать сигнальный пептид, который способствует секреции цепи антитела из клетки-хозяина. Ген цепи антитела может быть клонирован в векторе так, чтобы сигнальный пептид был связан в рамке с амино-концом гена цепи антитела. Сигнальный пептид может представлять собой сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (т.е. сигнальный пептид из белка, отличного от иммуноглобулина).
Как указано выше кроме генов цепей антитела рекомбинантные векторы экспрессии согласно изобретению несут регуляторные последовательности, которые контролируют экспрессии генов цепей антитела в клетке-хозяине. Подразумевается, что термин «регуляторная последовательность» включает промоторы, энхансеры и другие элементы регуляции экспрессии (например, сигналы полиаденилирования), которые регулируют транскрипцию или трансляцию генов цепей антител. Такие регуляторные последовательности описаны, например, Goeddel; Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif. (1990). Будет понятно, что конструирование вектора экспрессии, включая подбор регуляторных последовательностей, может зависеть от таких факторов, как выбор клетки-хозяина, которую необходимо трансформировать, уровень экспрессии требуемого белка и т.п. Предпочтительные регуляторные последовательности для экспрессии в клетке-хозяине млекопитающего включают вирусные элементы, которые обеспечивают высокие уровни экспрессии белка в клетках млекопитающих, такие как промоторы и/или энхансеры, полученные из цитомегаловируса (CMV) (такие как промотор/энхансер CMV), вируса 40 обезьяны (SV40) (такие как промотор/энхансер SV40), аденовируса (например, главный поздний промотор аденовируса (AdMLP)) и полиомы. Для дальнейшего знакомства с описанием вирусных регуляторных элементов и их последовательностей, смотрите, например, патент США № 5168062, Stinski; патент США № 4510245, Bell et al.; патент США № 4968615, Schaffner et al., патент США № 5464758, Bujard et al., и патент США № 5654168, Bujard et al.
Кроме генов цепей антител и регуляторных последовательностей рекомбинантные векторы экспрессии согласно изобретению могут нести дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетке-хозяине (например, начала репликации) и гены селективных маркеров. Ген селективного маркера облегчает селекцию клеток-хозяев, в которые был введен вектор (см., например, патенты США № 4399216, 4634665 и 5179017, все патенты Axel et al.). Например, ген селективного маркера обычно придает клетке-хозяину, в которую был введен вектор, резистентность к лекарственным средствам, таким как G418, гигромицин или метотрексат. Предпочтительные гены селективных маркеров включают ген дигидрофолатредуктазы (DHFR) (для применения в клетках-хозяевах dhfr- при селекции/амплификации с метотрексатом) и ген neo (для селекции с помощью G418).
Для экспрессии легких и тяжелых цепей вектором (векторами) экспрессии, кодирующим тяжелые и легкие цепи трансфицируют клетку-хозяина стандартными способами. Подразумевается, что различные формы термина «трансфекция» охватывают широкое множество способов, обычно применяемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяина, например, электропорацию, преципитацию фосфатом кальция, трансфекцию с использованием DEAE-декстрана и тому подобные. Хотя теоретически можно экспрессировать антитела согласно изобретению в любых прокариотических или эукариотических клетках-хозяевах, наиболее предпочтительна экспрессия антител в эукариотических клетках, и, наиболее предпочтительно, в клетках-хозяевах млекопитающих, поскольку такие эукариотические клетки, и, в частности, клетки млекопитающих, более вероятно, чем прокариотические клетки осуществляют сборку и секретируют подвергнутое правильному фолдингу и иммунологически активное антитело. Клетки-хозяева млекопитающих для экспрессии рекомбинантных антител, описанных в настоящем описании, включают клетки яичника китайского хомячка (клетки CHO) (такие как клетки dhfr-CHO, описанные Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci. USA 77: 4216-4220, используемые с селектируемым маркером DHFR, например, как описано R. J. Kaufman and P. A. Sharp (1982) Mol. Biol. 159: 601-621), клетки миеломы NS0, клетки COS и клетки SP2. Когда рекомбинантные векторы экспрессии, кодирующие гены антител, вводят в клетки-хозяева млекопитающих, антитела получают посредством культивирования клеток-хозяев в течение периода времени, достаточного для того, чтобы обеспечить экспрессию антитела в клетках-хозяевах или секрецию антитела в культуральную среду, в которой клетки-хозяева выращивают. Антитела могут быть извлечены из культуральной среды с использованием стандартных способов очистки белка.
Клетки-хозяева также можно использовать для получения частей интактных антител, таких как Fab-фрагменты или молекулы scFv. Будет понятно, что изменения указанного выше способа входят в объем настоящего изобретения. Например, может быть желательна трансфекция клетки-хозяина с использованием ДНК, кодирующей либо легкую цепь, либо тяжелую цепь (но не обе цепи) антитела согласно настоящему изобретению. Также можно использовать методику рекомбинантной ДНК для удаления некоторых или всех ДНК, кодирующих любую или обе легкую и тяжелую цепи, которые не являются необходимыми для связывания OX40. Молекулы, экспрессированные с таких укороченных молекул ДНК, также относятся к антителам согласно изобретению. Кроме того, могут быть получены бифункциональные антитела, в которых одна тяжелая и одна легкая цепь представляют антитело согласно изобретению, а другие тяжелая и легкая цепи специфичны для другого антигена, отличного от OX40, посредством поперечного сшивания антитела согласно изобретению со вторым антителом стандартными химическими способами поперечного сшивания.
Фармацевтические композиции и введение фармацевтических средств
Антитела и части антител согласно изобретению могут быть включены в фармацевтические композиции, подходящие для введения индивиду. Обычно фармацевтическая композиция содержит антитело или часть антитела согласно изобретению и фармацевтически приемлемый носитель. В используемом в настоящем изобретении смысле «фармацевтически приемлемый носитель» включает любой или все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, средства для изотоничности и замедления всасывания и тому подобные, которые являются физиологически совместимыми. Примерами фармацевтически приемлемых носителей являются один или несколько из следующих носителей: вода, физиологический раствор соли, фосфатно-солевой буфер, декстроза, глицерин, этанол и тому подобные, а также их сочетания. Во многих случаях, предпочтительно, включение в композицию изотонических средств, например, сахаров, полиспиртов, таких как маннит, сорбит или хлорид натрия. Фармацевтически приемлемые носители дополнительно могут содержать минорные количества вспомогательных веществ, таких как увлажнители или эмульгаторы, консерванты или буферы, которые увеличивают срок хранения или эффективность антитела или части антитела.
Антитела и части антител согласно изобретению могут быть включены в фармацевтическую композицию, подходящую для парентерального введения (например, внутривенного, подкожного, внутрибрюшинного, внутримышечного). Композиции согласно настоящему изобретению могут быть в разных формах. Такие формы включают, например, жидкие, полутвердые и твердые дозированные формы, такие как жидкие растворы (например, инъекционные и инфузионные растворы), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Предпочтительная форма зависит от предполагаемого способа введения и терапевтического применения. Типичные композиции имеют форму инъекционных или инфузионных растворов, такие как композиции, сходные с композициями, используемыми для пассивной иммунизация человека другими антителами. Антитело может быть введено путем внутривенной инфузии или инъекции или путем внутримышечной или подкожной инъекции.
Путь и/или способ введения будет варьировать в зависимости от требуемых результатов. В некоторых вариантах осуществления активное соединение может быть получено с носителем, который будет защищать соединение от быстрого высвобождения, например, в виде препарата контролируемого высвобождения, включая имплантаты, трансдермальные пластыри и микроинкапсулированные системы доставки. Можно использовать биологически разрушаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. Многие способы получения таких препаратов запатентованы или, как правило, известны специалистам в данной области. См., например, Sustained and Controlled Release Drug Delivery Systems, J. R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
В композиции также могут быть включены вспомогательные активные соединения. В некоторых вариантах осуществления антитело или часть антитела согласно изобретению получают совместно и/или вводят совместно с одним или несколькими дополнительными терапевтическими средствами, которые применимы для лечения расстройств, при которых инактивация OX40 является вредной. Например, антитело против OX40 или часть антитела согласно изобретению можно получить вместе и/или совместно ввести с одним или несколькими дополнительными антителами, которые связывают другие мишени (например, антителами, которые связывают другие цитокины или которые связывают молекулы на клеточной поверхности). Кроме того, одно или несколько антител согласно изобретению можно применять в сочетании с двумя или более вышеуказанными терапевтическими средствами. При такой комбинированной терапии можно преимущественно использовать более низкие дозы вводимых терапевтических средств, таким образом позволяя избегать возможной токсичности или осложнений, связанных с различными средствами, применяемыми в виде монотерапии. Специалисту будет понятно, что когда антитела согласно изобретению применяют в виде части комбинированной терапии, может требоваться более низкая доза антитела, чем в том случае, когда антитело вводят индивиду отдельно (например, в результате применения комбинированной терапии может быть достигнут синергетический терапевтический эффект, который, в свою очередь, позволяет использовать более низкую дозу антитела для достижения требуемого терапевтического эффекта.
Антитела, описанные в настоящем описании, или их антигенсвязывающие части можно применять отдельно или в сочетании для лечения таких заболеваний. Следует понимать, что такие антитела или их антигенсвязывающую часть можно применять отдельно или в сочетании с дополнительным средством, например, терапевтическим средством, при этом указанное дополнительное средство выбирает специалист в данной области в зависимости от предполагаемой цели. Например, дополнительное средство может представлять собой терапевтическое средство, известное в данной области как применимое для лечения заболевания или состояния, которое лечат антителом согласно настоящему изобретению. Дополнительное средство также может представлять собой средство, которое придает полезное свойство терапевтической композиции, например, средство, которое влияет на вязкость композиции.
Фармацевтические композиции, описанные в настоящем описании, могут включать «терапевтически эффективное количество» или «профилактически эффективное количество» антитела или части антитела согласно изобретению. «Терапевтически эффективное количество» относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения требуемого терапевтического результата. Терапевтически эффективное количество антитела или части антитела может варьировать в зависимости от таких факторов, как состояние болезни, возраст, пол и масса пациента, и способность антитела или части антитела вызывать требуемый ответ у пациента. Терапевтически эффективное количество также представляет собой количество, при котором любые токсические или вредные эффекты антитела или части антитела перевешиваются терапевтически полезными эффектами. «Профилактически эффективное количество» относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения требуемого профилактического результата.
Схемы дозирования могут быть скорректированы, чтобы обеспечить оптимальный требуемый ответ (например, терапевтический или профилактический ответ). Например, можно вводить один болюс, можно вводить несколько дробных доз в течение определенного периода времени, или доза может быть пропорционально снижена или увеличена в зависимости от того, что требует терапевтическая ситуация. Особенно предпочтительно, получение парентеральных композиций в стандартной лекарственной форме для простоты введения и единообразия дозирования. Стандартная лекарственная форма в используемом в настоящем изобретении смысле относится к физически дискретным единицам, подходящим в качестве единичных доз для млекопитающих, подвергаемых лечению; при этом каждая единица содержит предварительно определяемое количество активного соединения, вычисляемое для получения требуемого терапевтического эффекта, в связи с требуемым фармацевтическим носителем. Технические характеристики стандартных лекарственных форм продиктованы и напрямую зависят от (a) уникальных свойств активного соединения и конкретного терапевтического или профилактического эффекта, который необходимо достичь, и (b) ограничений, имеющих место в области получения препаратов такого активного соединения для лечения чувствительности пациентов.
ПРИМЕР I
Химерные и гуманизированные моноклональные IgG1/каппа-антитела 106-222 (Ch222 и Hu222, соответственно) очищали из супернатантов культур соответствующих стабильных трансфектантов NS0 с использованием колонки с белком A, как описано в приложениях A и B. Hu222 элюировали с колонки двумя разными путями. Вкратце, партию I Hu222 элюировали буфером с низким значением pH, а партию II слабым буфером для элюирования Аг/Ат Pierce. Выход Hu222 был лучше в том случае, когда для элюирования использовали буфер с низким значением pH. Ch222 элюировали с колонки слабым буфером для элюировании Аг/Ат.
Очищенные антитела Hu222 партий I и II характеризовали в SDS-ПААГ одновременно с 106-222 мыши согласно стандартным способам. Пять микрограмм каждого антитела анализировали в восстанавливающих условиях. Как показано на фиг. 21, каждое из антител Hu222 партии I и II состояли из тяжелой цепи с молекулярной массой примерно 50 кД и легкой цепи с молекулярной массой примерно 25 кД. Чистота антител Hu222 из партий I и II, по-видимому, составляла более 95%.
Примеси эндотоксина в гуманизированных антителах анализировали с использованием набора для теста на лизате амебоцитов Limulus (LAL) Lonza QCL-1000. Уровень эндотоксина был меньше 0,5 ед. эндотоксина/мг белка в случае антител Hu222 из партий I и II.
Характеристика Hu106-222 в отношении связывания с клетками L/OX40
Связывание антитела мыши 106-222, антител Ch106-222 и Hu106-222 с OX40 исследовали в анализе связывания FACS с клетками L/hOX40 по существу согласно протоколу, предоставленному доктором Laura Bover. Антитела, связанные с клетками L/hOX40, выявляли с использованием PE-меченого антитела козы против IgG мыши (в случае 106-222 мыши) или PE-меченого антитела козы против IgG человека (в случае Ch106 и Hu106).
На фиг. 22 показан анализ антитела мыши 106-222, антител Ch106 и Hu106-222 (партия II) в отношении связывания с клетками L/OX40. Кривая титрования Hu106-222 (партия II) была почти идентична кривой титрования Ch106-222, что свидетельствует о том, что аффинность связывания антигена 106-222 мыши сохраняется у Hu106-222. Кривая титрования 106-222 мыши была сходной с кривыми титрования Ch106 и Hu106; однако из-за различия вторых антител данные только указывают, что аффинность 106-222 мыши сходна с аффинностью Hu106-222.
На фиг. 24 показано сравнение между антителами Hu106-222 из партий I и II в отношении связывания с клетками L/hOX40. Хотя необходим дополнительный анализ, аффинности двух партий Hu106-222, по-видимому, сходны, если не идентичны, друг другу. Следовательно, кислотное элюирование Hu106-222 с колонки, содержащей белок A, по-видимому, не влияет на его аффинность.
Очистка Ch106-222
Стабильный NS0-трансфектант C8 выращивали в 500 мл среды для гибридом Invitrogen SFM во вращающемся флаконе до истощения. Культуру осаждали центрифугированием в центрифужной пробирке Corning объемом 250 мл (№ в каталоге 430776) в центрифуге Beckman Coulter's Allegra X-12R (2000 об./мин в течение 15 минут). Супернатант культуры наносили на колонку GE Healthcare HiTrap MabSelect SuRe объемом 1 мл (№ в каталоге 11-034-95), используя насос Pharmacia P1. Колонку промывали раствором соли, забуференным Tris (Pierce, № в каталоге 28379), и элюировали слабым буфером для элюирования Аг/Ат Pierce (№ в каталоге 21027). Фракции (примерно 1 мл) собирали и регистрировали их OD при 280 нм.
Фракции 3-6 объединяли (объем = 3,0 мл, OD при 280 нм = 0,14). Объединенные фракции обессоливали на колонке Sephadex G25 medium объемом 10 мл в PBS. Собирали фракции по 1 мл.
Фракции 6-9 объединяли (объем = 3,0 мл, OD при 280 нм = 0,11). Объединенные фракции диализовали в течение ночи в PBS. После диализа объем составлял 3,0 мл и OD при 280 нм составляла 0,19. Полученный препарат назван Ch106, партия 8/31/09, с концентрацией 0,13 мг/мл.
Очистка Hu106-222
Стабильный NS0-трансфектант 1-C6 выращивали в 500 мл среды для гибридом Invitrogen SFM во вращающемся флаконе до истощения. Культуру осаждали центрифугированием в центрифужной пробирке Corning объемом 250 мл (№ в каталоге 430776) в центрифуге Beckman Coulter's Allegra X-12R (2000 об./мин в течение 15 минут).
Партия I: 150 мл супернатанта культуры наносили на колонку GE Healthcare HiTrap MabSelect SuRe объемом 1 мл (№ в каталоге 11-034-95), используя насос Pharmacia P1. Колонку промывали PBS и связанное антитело элюировали 0,1 М глицин-HCl, 0,1 М NaCl (pH 3,0). Элюированные фракции (1 мл каждая) собирали в пробирки, содержащие 50 мкл 1 М три-HCl (pH 8,0).
Фракции 2-5 объединяли (объем = 4,2 мл, OD при 280 нм = 1,59). Объединенные фракции диализовали в течение ночи в PBS. После диализа объем составлял 4,2 мл и OD при 280 нм составляла 1,54. Раствор антител (партия 9/18/09 I; 1,1 мг/мл) стерилизовали фильтрованием.
Партия II:
Оставшийся супернатант культуры (350 мл) наносили на колонку GE Healthcare HiTrap MabSelect SuRe объемом 1 мл, используя насос Pharmacia P1. Колонку промывали Tris-забуференным физиологическим раствором и элюировали слабым буфером для элюирования Аг/Ат. Фракции (примерно 1 мл) собирали и регистрировали их OD при 280 нм.
Фракции 3-7 объединяли (объем = 4,2 мл, OD при 280 нм = 1,22). Колонку снова промывали Tris-забуференным физиологическим раствором и антитело элюировали 0,1 М глицин-HCl, 0,1 М NaCl (pH 3,0), чтобы исследовать было ли эффективным элюирование слабым буфером для элюирования Аг/Ат.
Фракции 3-7, элюированные слабым буфером для элюирования Аг/Ат, объединяли и обессоливали на колонке с Sephadex G25 medium объемом 10 мл в PBS. Собирали фракции по 1 мл.
Фракции 5-8 объединяли (объем = 4,0 мл, OD при 280 нм = 1,12). Объединенные фракции диализовали в течение ночи в PBS. После диализа объем составлял 4,0 мл и OD при 280 нм составляла 1,12. Раствор антител (партия 9/18/09 II; 0,8 мг/мл) стерилизовали фильтрованием.
Способ элюирования в условиях высокой концентрации соли с использованием слабого буфера для элюирования Аг/Ат Pierce был не так эффективен, как способ элюирования в условиях низкого значения pH, для элюирования связанного IgG1-антитела человека с колонки, содержащей белок A. Так как антитела не были элюированы в виде острого пика слабым буфером для элюирования Аг/Ат, было необходимо объединять много фракций для сбора элюированного IgG и подвергать объединенные фракции обессоливанию перед диализом. Плохой профиль элюирования с использованием слабого буфера для элюирования Аг/Ат и дополнительная стадия очистки влияли на выход антитела. Рекомендуется применение способа элюирования с высоким содержанием сои только в том случае, если очищаемый IgG является кислотонеустойчивым.
ПРИМЕР II
Очистка антител Ch119-122 и Hu119-122
Химерное моноклональное IgG1/каппа антитело 119-122 (Ch119) очищали из супернатанта культуры соответствующего стабильного трансфектанта NS0 (клон G11), выращенного в среде для гибридом SFM (Invitrogen), с использованием колонки, содержащей белок A. После элюирования слабым буфером для элюирования Аг/Ат Pierce буфер Ch119 заменяли на PBS, используя гель-фильтрацию и затем диализ. Концентрация Ch119 составляла 0,21 мг/мл.
Гуманизированное моноклональное IgG1/каппа-антитело 119-122 (Hu122) очищали из супернатанта культуры соответствующего стабильного трансфектанта NS0 (клон 2F5), выращенного в среде для гибридом SFM, с использованием колонки, содержащей белок A. Hu106-222 элюировали с колонки, используя буфер с низким значением pH, нейтрализовали 1 М Tris-HCl (pH 8,0) и диализовали в PBS. Концентрация Hu122 составляла 1,6 мг/мл.
Очищенное Hu106-222 характеризовали в SDS-ПААГ вместе с 119-122 мыши согласно стандартным способам. Пять микрограмм каждого антитела анализировали в восстанавливающих условиях. Как показано на фиг. 25, Hu119-122 состояло из тяжелой цепи с молекулярной массой примерно 50 кД и легкой цепи с молекулярной массой примерно 25 кД. Чистота Hu119, по-видимому, составляла более 95%.
Характеристика Hu119-122 в отношении связывания с клетками L/hOX40
Связывание антитела 119-122 мыши, антител Ch119-122 и Hu119-122 с OX40 исследовали в анализе связывания FACS с клетками L/OX40 по существу согласно протоколу, предоставленному доктором Laura Bover. Антитела, связанные с клетками L/OX40, выявляли с использованием PE-меченого антитела козы против IgG мыши (в случае 119-122 мыши) или PE-меченого антитела козы против IgG человека (в случае Ch119-122 и Hu119-122).
На фиг. 26 показан результат FACS-анализа. Кривая титрования Hu119-122 была сходна с кривой титрования Ch119-122, что свидетельствует о том, что аффинность связывания антигена 119-122 мыши сохраняется у Hu119-122. Однако значения MCF при более высоких концентрациях антител Ch109-122 и Hu119-122 не совпадали правильно с соответствующими кривыми. После корректировки экспериментальных условий FACS-анализ следует повторить.
ПРИМЕР III
Чтобы оценить способность полученных авторами гуманизированных антител против OX40 человека усиливать пролиферацию T-клеток, авторы осуществили анализы пролиферации, используя покрытые анти-CD3 клетки CD32-L и свежеотсортированные наивные T-клетки CD4+. На фиг. 27 показано, что гуманизированный клон мАт против OX40 человека 119-122 (Hu122) и его FcR-связывающее мутантное антитело (Hu122-AA) усиливали пролиферацию наивных T-клеток CD4+. Hu122 обладало более высокой стимулирующей T-клетки активностью по сравнению с исходным мАт мыши против OX40 человека (122 мыши) (фиг. 27).
FcR-связывающий клон мутантных гуманизированных мАт против OX40 человека 106-222 (Hu222-AA) и клон химерных мАт против OX40 человека 106-222 (Ch222) усиливали стимулированную анти-CD3 пролиферацию наивных T-клеток CD4+. Такие антитела обладают стимулирующей активностью, сходной с активностью исходного мАт мыши против OX40 человека (106-222 мыши). Однако полностью гуманизированное Ат против OX40 человека, Hu106, не усиливало пролиферацию T-клеток (фиг. 28).
Чтобы оценить способность гуманизированного антитела против OX40 человека блокировать супрессорную функцию регуляторных T-клеток (Treg) CD4+, авторы осуществляли анализы пролиферации с использованием свежеотсортированных наивных T-клеток CD4+ и CD4+CD25highCD127low Treg. Авторы обнаружили, что химерное антитело Ch122 и Fc-связывающее мутантное гуманизированное антитело (Hu122-AA) проявляли более высокую эффективность, чем исходное мАт мыши против OX40 человека (122 мыши), в блокировании супрессорной функции Treg CD4+ Treg (фиг.29 A-B).
В эксперименте, показанном на фиг. 27, свежеотсортированные наивные T-клетки CD4+CD25lowCD127+CD45RO-CD45RA+ стимулировали, используя L-клетки, экспрессирующие CD32 (CD32-L), покрытые 4 концентрациями антител против CD3 плюс 2 мкг/мл антител клона антител против OX40 человека 119 или контрольных антител. Через три дня после стимуляции добавляли радиоактивный изотоп тритий и культивировали еще в течение 16-18 часов до сбора клеток. Данные представляют эксперименты, проводимые на двух донорах. CD32-L-клетки, экспрессирующие лиганд hOX40 лиганд (CD32-L/hOX40L), служили в качестве положительного контроля, тогда как IgG1 человека и мыши служили в качестве отрицательных контролей.
В эксперименте, показанном на фиг. 28, свежеотсортированные наивные T-клетки CD4+ стимулировали CD32-L-клетками, покрытыми 4 концентрациями антител против CD3 плюс 2 мкг/мл антител клона мАт против OX40 человека 106-222 (Hu222) или контрольных антител. Через три дня после стимуляции добавляли радиоактивный изотоп тритий и культивировали еще в течение 16-18 часов до сбора клеток. Данные представляют эксперименты, проводимые на двух донорах. CD32-L/hOX40L служит в качестве положительного контроля, тогда как IgG1 человека и мыши служат в качестве отрицательных контролей.
В эксперименте, показанном на фиг. 29, свежеотсортированные наивные T-клетки CD4+ культивировали в присутствии CD4+CD25highCD127lowTreg, используя три соотношения Treg:T-эффекторы, и стимулировали CD32-L-клетками, покрытыми 0,2 мкг/мл антител против CD3 плюс 10 мкг/мл антител клона мАт против OX40 человека 119-122 или контрольных антител. Через три дня после стимуляции добавляли радиоактивный изотоп тритий и культивировали еще в течение 16-18 часов до сбора клеток. Данные представляют три эксперимента. CD32-L/hOX40L служит в качестве положительного контроля, тогда как IgG1 человека и мыши служат в качестве отрицательных контролей.
ПРИМЕР IV
Так как антитела будут встречаться со всеми мононуклеарными клетками периферической крови (PBMC) при их введении пациентам посредством внутривенной инъекции, авторы тестировали способность антител против OX40 человека согласно изобретению стимулировать пролиферацию T-клеток, используя PBMC в качестве антигенпрезентирующих клеток (APC) в анализах пролиферации, проводимых авторами изобретения. Однако авторы получили сильно варьирующие данные при использовании мАт мыши против OX40 человека при использовании PBMC в качестве APC, что не наблюдалось в случае использования моноцитов в качестве APC, что свидетельствует о том, что полученные авторами антитела требуют для своей активности определенного вида перекрестного связывания. Чтобы проверить такую возможность, планшеты покрывали полученными авторами мАт против OX40 человека и анти-CD3, промывали и использовали для стимуляции пролиферации T-клеток CD4+ или CD8+ в отсутствие вспомогательных клеток. На фиг. 30 показаны результаты, свидетельствующие, что антитела против OX40 человека усиливают пролиферацию T-клеток CD4+ и CD8+.
Свежеотсортированные наивные T-клетки CD4+CD25lowCD45RO-CD45RA+ (фиг. 30A) или T-клетки CD3+CD8+ (фиг. 30B) в количестве 1×105 стимулировали связанными с планшетом анти-CD3 (3 мкг/мл) и мАт мыши против OX40 человека (2 мкг/мл). Меченый тритием тимидин добавляли на третий день культивирования и клетки собирали после дополнительной инкубации в течение 15 часов. Пролиферацию T-клеток оценивали по включению тимидина. мАт против OX40 человека получали из трех слияний гибридом. Числа, указанные после номера слияния, означают конкретное антитело. IgG1 мыши и 119-42 служили в качестве отрицательных контролей. Каждую обработку осуществляли в трех повторах. Показаны типичные данные, полученные для 4 доноров T-клеток (фиг. 30C). Все три варианта гуманизированных мАт против OX40 человека [Hu106-222 и Hu119-122; Hu106-222AA и Hu1l9-122AA (AA означает, что два Fc-связывающих остатка были подвергнуты мутации с получением аминокислоты аланина); и Ch119-122 (сходно с гуманизированным 119-122, за исключением того, что сохранена вариабельная область «паратоп» мыши)] стимулировали пролиферацию наивных T-клеток CD4+. Анти-CD28 служило в качестве положительного контроля.
Как видно на фиг. 30, на панелях A и B показано, что связанные с планшетом мАт против OX40 человека потенциально стимулировали пролиферацию наивных T-клеток CD4+ и T-клеток CD8+в диапазоне от 10 до 40 раз. Авторы расширили свои исследования, используя полученные ими гуманизированные мАт против OX40 человека, и обнаружили, что три варианта гуманизированных антител, либо полностью гуманизированное либо химерное, либо имеющее мутации AA, в котором остатки, ответственные за связывание с Fc-рецептором, были заменены на аланин, были эффективными стимуляторами пролиферации наивных T-клеток CD4+ (фиг. 30C).
На фиг. 31 показано, что антитела мыши и гуманизированные антитела против OX40 человека требуют перекрестного связывания для усиления пролиферации T-клеток. Свежеотсортированные наивные T-клетки CD4+ стимулировали связанным с планшетами анти-CD3 (3 мкг/мл) плюс связанными с планшетами или растворимыми гуманизированными мАт против OX40 человека (2 мкг/мл) в отсутствие вспомогательных клеток. Меченый тритием тимидин добавляли на третий день культивирования и клетки собирали после дополнительной инкубации в течение 15 часов. Пролиферацию T-клеток оценивали по включению тимидина. IgG1 мыши и анти-CD28 служили в качестве отрицательных и положительных контролей, соответственно. Показаны типичные данные для двух доноров. Наивные T-клетки CD4+ повергались стимуляции связанным с планшетом анти-CD3 в отсутствие вспомогательных клеток. На следующий день добавляли мАт против OX40 человека 119-122 (2 мкг/мл) отдельно или в сочетании с равным количеством второго антитела против Fc. Пролиферацию клеток оценивали, как описано на панели A.
Эффективность полученных авторами гуманизированных мАт против OX40 человека Hu106-222 и Hu119-122 была сравнима с эффективностью анти-CD28. Напротив, когда растворимое антитело против OX40 человека добавляли к культуре T-клеток, стимулирующий эффект исчезал (фиг. 31A). Однако в том случае, когда растворимое мАт против OX40 человека 119-122 добавляли вместе с F(ab')2-фрагментом антитела козы против IgG мыши, специфичным для Fc-фрагмента вторым антителом, стимулирующий эффект восстанавливался (фиг. 31B). Полученные результаты демонстрируют, что мАт против OX40 человека требуют перекрестного связывания для своей биологической активности.
Чтобы оценить способность полученных авторами агонистических мАт против OX40 человека блокировать супрессорную функцию CD4+CD25highCD12T nTreg, авторы осуществляли анализы пролиферации в присутствии эффекторных T-клеток CD4+CD25lowCD127+CD45RO+ (Teff) и CD4+ nTreg. При использовании разработанной авторами связанной с планшетом системы, в которой планшет покрывали мАт против OX40 человека вместе с анти-CD3 в отсутствие вспомогательных клеток, двенадцать полученных авторами мАт мыши против OX40 человека (222, 132, 8B, 33A, 43, 58B, 122, 157A, 173B, 220C, 140A, 270) эффективно ингибировали супрессию nTreg (фиг. 32A и 32B). Хотя соотношение nTreg и эффекторных T-клеток, используемое в таких анализах составляло 1:1, такие антитела были способны стимулировать эффекторные T-клетки к пролиферации на 10-35 процентов более высокой, чем пролиферация в процентах, достигаемая эффекторными T-клетками в отсутствие nTreg. Гуманизированные мАт против OX40 человека согласно изобретению также реверсировали супрессорную функцию nTreg на сходном уровне (фиг. 32C). Полученные результаты вместе взятые свидетельствуют, что мАт мыши против OX40 человека согласно изобретению являются мощными стимуляторами OX40, приводящими к значимому усилению пролиферации T-клеток и ингибированию супрессорной функции nTreg. Кроме того, гуманизированные мАт против OX40 человека согласно изобретению сохраняли высокие биологические активности их исходных антител мыши.
На фиг. 32 показано, что мАт против OX20 человека блокирует активность CD4+FOXP3+ nTreg. CFSE-меченые эффекторные T-клетки CD4+CD25-CD45RO+ и CD4+FOXP3+ Treg получали от одного и того же здорового донора. T-клетки стимулировали растворимым анти-CD28 (0,5 мкг/мл) и связанным с планшетом анти-CD3 (3 мкг/мл) и мАт против OX40 человека (2 мкг/мл). Пролиферацию эффекторных T-клеток оценивали проточной цитометрией по разбавлению CFSE. Отношение nTreg к эффекторным T-клеткам составляло 1:1. IgG1 мыши служил в качестве отрицательного контроля. Наивные T-клетки CD4+ служили в качестве контрольных T-клеток для демонстрации специфичного ингибирования пролиферации эффекторных T-клеток клетками nTreg. На фиг. 32A представлены данные FACS, показывающие пролиферацию эффекторных T-клеток в присутствии наивных T-клеток CD4+, nTreg или nTreg плюс мАт против OX40 человека 119-33A. На фиг. 32B показана пролиферация эффекторных T-клеток в процентах в присутствии nTreg после обработки мАт мыши против OX40 человека (20 тестов). На фиг. 32C показано, что все три варианта гуманизированных мАт против OX40 человека восстанавливали пролиферацию эффекторных T-клеток.
Недавнее сообщение свидетельствует о том, что инициирование OX40 может индуцировать апоптоз линии T-клеток человека, экспрессирующих OX40 (Yoshiaki Takahashi et al., 200B, Aids Research and human Retroviruses, 24). Поэтому авторы тестировали влияние возрастающих концентраций мАт против OX40 человека 106-222 плюс фиксированной низкой дозы анти-CD3 на жизнеспособность трех подгрупп T-клеток в присутствии моноцитов. На фиг. 33A показано, что высокие концентрации мАт против OX40 человека 106-222 (20-30 мкг/мл), предпочтительно, убивали активированные FOXP3+ nTreg, тогда как активированные наивные и T-клетки памяти CD4+были либо резистентными, либо менее чувствительными к такому действию. Чтобы проверить, действуют ли мАт против OX40 человека непосредственно на Treg, индуцируя гибель клеток, авторы осуществляли новые эксперименты в отсутствие вспомогательных клеток. На фиг. 33B показано, что эффективная передача сигнала OX40 в сочетании с анти-CD3 специфично убивали nTreg в отсутствие вспомогательных клеток. Чтобы подтвердить, имитируют ли вызывающие гибель эффекты, опосредованные мАт против OX40 человека, инициирование OX40 природным лигандом OX40, авторы использовали линию фибробластов L, которые сверхэкспрессировали hOX40L, и использовали ее для стимуляции nTreg в присутствии низкой дозы анти-CD3 и получали сходные вызывающие гибель nTreg эффекты (фиг. 33C). Полученные результаты свидетельствуют, что высокая степень инициации OX40 приводит к гибели OX40-экспрессирующих Treg-клеток.
В частности, на фиг. 33 показано, что высокая концентрация мАт против OX40 человека, предпочтительно, убивает FOXP3+ Treg. Как показано на фиг. 33A, каждую из подгрупп T-клеток (наивные, CD4+CD25lowCD127+CD45RO-CD45RA+; памяти, CD4+CD25lowCD127+CD45RA-CD45RO+; и nTreg, CD4+CD25highCD127low) культивировали с моноцитами CD14+ в равных количествах в присутствии растворимого анти-CD3 (0,3 мкг/мл) и возрастающих концентраций мАт мыши против OX40 человека 106-222. Выживаемости клеток определял после 3 дней культивирования в проточно-цитометрическом анализе, в котором пропускали живые лимфоциты. Показаны данные для двух доноров T-клеток. На фиг. 33B и 33C показано, что инициирование OX40 в высокой степени приводит к гибели CD4+FOXP3+ Treg. На фиг. 33B показано, что CD4+FOXP3+ Treg были стимулированы связанным с планшетом анти-CD3 (2 мкг/мл) плюс растворимым мАт 119-122 (30 мкг на миллион клеток) или мышиным контрольным IgG1-антителом. Отрицательные по окрашиванию трипановым синим живые клетки после культивирования в течение одних суток подсчитывали, используя гемацитометр. На фиг. 33C показано, что CD4+FOXP3+ Treg были стимулированы растворимым анти-CD3 (0,2 мкг/мл) плюс L-клетками или L-клетками, экспрессирующими лиганд hOX40 (L/hOX40L). Живые клетки подсчитывали через день после стимуляции.
Затем авторы пытались определить, действует ли мАт против OX40 человека непосредственно на T-клетки, блокируя супрессорную функцию nTreg. Свежеотсортированные эффекторые T-клетки CD4+ или nTreg предварительно активировали в течение ночи, используя анти-CD3, и затем импульсно действовали мАт против OX40 человека в течение 4 часов. Затем эффекторные T-клетки промывали, метили CFSE и культивировали совместно с nTreg в присутствии равного количества моноцитов CD14+ и анти-CD3. Подобным образом, предварительно стимулированные nTreg промывали и культивировали с необработанными CFSE-мечеными эффекторными T-клетками.
На фиг. 34 показано, что мАт против OX40 человека действуют непосредственно на T-клетки, блокируя супрессорную функцию Treg. На фиг. 34A показано, что мАт против OX40 человека действуют непосредственно на эффекторные T-клетки памяти, придавая им резистентность к супрессии клетками nTreg. T-клетки памяти CD4+CD25lowCD127+CD45RA-CD45RO+ стимулировали связанным с планшетом анти-CD3 (0,8 мкг/мл) в культуральной среде (RPMI/10% FCS/ P/S плюс IL-2, 30 межд. единиц/мл) в течение 12 часов, затем импульсно действовали мАт против OX40 человека (119-122, 22 мкг на 0,5 миллионов клеток) в культуральной среде в течение 4 часов, промывали 3 раза, и 8×104 CFSE-меченых эффекторных T-клеток культивировали, используя снижающиеся доли nTreg в соотношении. Пролиферацию эффекторных T-клеток оценивали, используя проточную цитометрию, по разбавлению CFSE. МАт против OX40 человека действует на Treg, делая их неспособными супрессировать пролиферацию эффекторных T-клеток (фиг. 34B). CD4+CD25highCD127low nTreg предварительно стимулировали связанным с планшетом анти-CD3 (2 мкг/мл) в культуральной среде в течение 12 часов, затем импульсно действовали мАт против OX40 человека, 119-122 или 106-222, или контрольным антителом, анти-ICOS или IgG1 мыши, как описано на панели A, промывали и культивировали с CFSE-мечеными эффекторными T-клетками памяти. Пролиферацию эффекторных T-клеток оценивали с использованием проточной цитометрии по разбавлению CFSE.
Эффекторные T-клетки, обработанные мАт против OX40 человека, становятся резистентными к супрессии клетками nTreg (фиг. 34A). Напротив, пролиферация эффекторных T-клеток, обработанных контрольным IgG1-антителом мыши, оставалась чувствительным к супрессии клетками nTreg. На фиг. 34B показано, что nTreg, обработанные мАт против OX40 человека, неспособны супрессировать пролиферацию эффекторных T-клеток. Напротив, nTreg, обработанные контрольными антителами, такими как анти-ICOS или IgG1 мыши, оставались супрессорными. Полученные результаты свидетельствуют, что мАт против OX40 человека согласно изобретению непосредственно действуют как на эффекторные T-клетки, так и на nTreg, восстанавливая пролиферацию эффекторных T-клеток.
ПРИМЕР V
Дополнительно полученные предварительные данные in vivo показали, что антитело против OX40 человека работает у мышей, усиливая экспансию T-клеток и отторжение опухолей у мышей. Ранее было показано, что мАт против OX40 человека может специфично активировать каскад NF-kB в T-клетках мыши CD8+, трансдуцированных OX40 человека. Чтобы определить, может ли анти-hOX40-мАт усиливать отторжение опухолей благодаря стимуляции жизнеспособности и клональной экспансии эффекторных T-клеток CD8+in vivo, трансгенные T-клетки Pmel CD8+, трансдуцированные геном люциферазы и hOX40, адоптивно переносили мышам альбиносам C57BL/6, несущим непигментированные опухоли MC38. После адоптивного переноса трансдуцированных T-клеток мышей обрабатывали антителами. Было обнаружено, что значительно больше T-клеток человека OX40+люцифераза+ Pmel мигрировало в легкие на 4 день у мышей, обработанных анти-hOX40-мАт, по сравнению с мышью, обработанной контрольным IgG1-антителом (фиг. 35B), что свидетельствует о том, что инициация hOX40 у мышей стимулировала экспансию T-клеток CD8+. На 8 день (данные не показаны) и на 12 день после обработки было обнаружено, что в такой же группе мышей, обработанных анти-hOX40-мАт, оставалось значимо больше T-клеток люцифераза+Pmel в месте опухоли, по сравнению с контрольной группой мышей, обработанных IgG1 (фиг. 35B), что снова свидетельствует о том, что инициация hOX40 у мышей стимулировала жизнеспособность T-клеток CD8+. Наконец, размеры опухолей у мышей, которые получали T-клетки hOX40+PmelCD8+ и затем были обработаны анти-hOX40-мАт, были значимо меньше, чем размеры опухолей у мышей, которые получали нетрансдуцированные T-клетки Pmel и были обработаны анти-hOX40-мАт или T-клетки hOX40+Pmel с последующей обработкой контрольным мышиным совпадающим в IgG1 антителом. Полученные результаты показывают, что инициация OX40 человека у мышей приводит к биологическим эффектам, сходным с эффектами OX40 мыши (Gough MJ et al., 2008). Таким образом, данные демонстрируют способность мАт против OX40 человека стимулировать экспансию и жизнеспособность T-клеток CD+in vivo и усиливать отторжение опухолей.
мАт против OX40 человека стимулирует экспансию и жизнеспособность T-клеток in vivo.
Используемая авторами схема терапевтической вакцинации показана на фиг. 35A. Мышам альбиносам C57BL/6 в группах по 5 мышей подкожно (п/к) имплантировали 5×105 непигментированных опухолевых клеток MC38/gp100 (0 день). На 6 день индуцировали лимфопению облучением в дозе 350 сГр. На 7 день 1×106 трансдуцированных люциферазой T-клеток Pmel-1 с экспрессией или без экспрессии OX40 человека адоптивно переносили несущим опухоли мышам (n=5 на группу) с последующей внутривенной инъекцией 5×105 ДК, импульсно обработанных пептидом Gp100. Рекомбинантный IL-2 человека вводили внутрибрюшинно в течение 3 дней после переноса T-клеток. Антитела вводили на 7, 9 и 11 день по 100, 50 и 50 мкг, соответственно, на инъекцию на одну мышь (фиг. 35B). Биолюминисцентные изображения, полученные in vivo, показали накопление экспрессирующих люциферазу T-клеток CD8+ pmel-1 в легком и в местах опухолей на 4 и 12 день. Показаны две из пяти мышей на группу на 4 день и 12 день (фиг. 35C). Опухоли реагировали на обработки с использованием анти-hOX40-мАт. Размер опухолей измеряли каждые 3 дня. Pmel-1 и Pmel-1 плюс IgG1 мыши служили в качестве контролей.
ПРИМЕР VI
Клонирование и секвенирование генов вариабельных областей 119-43-1 мыши
Клетки гибридомы 119-43-1 мыши выращивали в среде DME, содержащей 20% фетальную сыворотку теленка (FBS; HyClone, Logan, UT), 10 мМ HEPES (Sigma, St. Louis, MO), 2 мМ глутамин (Mediatech, Herndon, VA), 1 мМ пируват (Mediatech), 1xMEM заменимых аминокислот (Sigma), 1x смесь HT (Sigma), 1x смесь пенициллина-стрептомицина (Mediatech) и 50 мкМ β-меркаптоэтанол (bio WORLD, Dublin, OH) при 37°C в инкубаторе с 7,5% CO2. Общую РНК экстрагировали примерно из 107 клеток гибридом, используя реагент TRIzol (Invitrogen, Carlsbad, CA) согласно протоколу поставщика. Олиго-dT-праймированную кДНК для 5'-RACE синтезировали, используя набор для амплификации кДНК SMARTer RACE (Clontech, Mountain View, CA), следуя протоколу поставщика. кДНК вариабельных областей тяжелой и легкой цепей 119-43-1 амплифицировали в полимеразной цепной реакции (ПЦР) ДНК-полимеразой Phusion (New England Biolabs, Beverly, MA) с использованием 3'-праймеров, которые, соответственно, отжигались с константными областями гамма-1 и каппа мыши, и 5'-RACE-праймера (смесь универсальных праймеров A или универсальный праймер A для гнездовой ПЦР), поставляемых в наборе для амплификации кДНК SMARTer RACE. В случае ПЦР-амплификации вариабельной области тяжелой цепи (VH), 3'-праймер имеет последовательность 5'-GCCAGTGGATAGACAGATGG-3'. В случае ПЦР-амплификации вариабельной области легкой цепи (VL) 3'-праймер имеет последовательность 5'-GATGGATACAGTTGGTGCAGC-3'. Амплифицированные кДНК VH и VL субклонировали в векторе pCR4Blunt-TOPO (Invitrogen) для определения последовательности. Секвенирование ДНК осуществляли на Tocore (Menlo Park, CA). Несколько клонов тяжелой и легкой цепей секвенировали и идентифицировали уникальные последовательности, гомологичные типичным вариабельным областям тяжелой и легкой цепей мыши. Консенсусные последовательности кДНК вместе с рассчитанными аминокислотными последовательностями VH и VL 119-43-1 показаны на фиг.44 и 45, соответственно. Не отмечали необычных признаков в аминокислотных последовательностях VH и VL зрелого 119-43-1. Последовательность кДНК и рассчитанная аминокислотная последовательность VH 119-43-1 представлены в виде SEQ ID NO:28 и 29, соответственно. Последовательность кДНК и рассчитанная аминокислотная последовательность VL 119-43-1 представлены в виде SEQ ID NO:35 и 36, соответственно.
Конструирование химерного IgG1/k-антитела 119-43-1
Ген, кодирующий VH 119-43-1, создавали в виде экзона, содержащего донорный сигнал сплайсинга и соответствующие фланкирующие сайты ферментов рестрикции, в ПЦР, используя кДНК VH 119-43-1 в качестве матрицы, 5'-GCTACTAGTACCACCATGTACTTGGGACTGAACTATG-3' (сайт SpeI подчеркнут) в качестве 5'-праймера и 5'-GGGAAGCTTGTTTTAAGGACTCACCTGAGGAGACTGTGAGAGTGGTGCC-3' (сайт HindIII подчеркнут) в качестве 3'-праймера (фиг. 46). Сайт HindIII в гене VH устраняли с помощью сайт-специфичного мутагенеза. Последовательность кДНК и рассчитанная аминокислотная последовательность конструируемой VH 119-41-1 представлены в виде SEQ ID NO:30 и 31, соответственно. Ген, кодирующий VL 119-43-1 также создавали в виде экзона, содержащего донорный сигнал сплайсинга и соответствующие сайты ферментов рестрикции, в ПЦР с использованием кДНК VL 119-43-1 в качестве матрицы, 5'-GCAGCTAGCACCACCATGAGACCGTCTATTCAGTTC-3' (сайт NheI подчеркнут) в качестве 5'-праймера и 5'-GCAGAATTCAGAAAAGTGTACTTACGTTTCAGCTCCAGCTTGGTCC-3' (сайт EcoRI подчеркнут) в качестве 3'-праймера (фиг. 47). Последовательность кДНК и рассчитанная аминокислотная последовательность конструируемой VL 119-41-1 представлены в виде SEQ ID NO:37 и 38, соответственно. Донорные сигналы сплайсинга экзонов VH и VL 119-43-1 получали из последовательностей зародышевой линии JH2 и JK5 мышей, соответственно. ПЦР-амплифицированные фрагменты очищали из геля, используя набор для экстракции NucleoSpin II (Macherey-Nagel, Bethlehem PA), и клонировали в векторе pCR4Blunt-TOPO (Invitrogen) для подтверждения последовательности. Правильные V-фрагменты расщепляли SpeI и HindIII (в случае VH) или NheI и EcoRI (в случае VL), очищали из геля и клонировали в векторе экспрессии млекопитающих, несущем константные области гамма-1 и каппа человека, для получения химерного IgG1/k-антитела 119-43-1. Схематичная структура полученного в результате вектора экспрессии, pCh119-43-1, показана на фиг. 48.
Создание стабильных NS0-трансфектантов, продуцирующих химерное IgG1/k-антитело 119-43-1
Чтобы получить линию клеток, стабильно продуцирующих антитело Ch119-43-1, вектор экспрессии pCh119-43-1 вводили в хромосому линии клеток миеломы мышей NS0 (European Collection of Animal Cell Cultures, Salisbury, Wiltshire, UK). Клетки NS0 выращивали в среде DME, содержащей 10% FBS, при 37°C в инкубаторе с 7,5% CO2. Стабильную трансфекцию в NS0 осуществляли путем электропорации, как описано Bebbington et al. (Bio/Technology 10: 169-175, 1992). Перед трансфекцией вектор pCh119-43-1 линеаризовали, используя FspI. Примерно 107 клеток трансфицировали 20 мкг линеаризованной плазмиды, суспендировали в среде DME, содержащей 10% FBS, и высевали в несколько 96-луночных планшетов. Через 48 часов использовали селективную среду (среда DME, содержащая 10% FBS, добавку к среде HT (Sigma), 0,25 мг/мл ксантина и 1 мкг/мл микофеноловой кислоты). Примерно через 10 дней после инициации селекции супернатанты культуры анализировали в отношении продукции антител.
Экспрессию антитела Ch119-43-1 измеряли в ELISA типа «сэндвича». В типичном эксперименте планшет для ELISA покрывали в течение ночи при 4°C 100 мкл/лунку специфичного для Fcγ-цепи поликлонального антитела козы против IgG человека (Sigma) в разведении 1/2000 в PBS, промывали буфером для промывки (PBS, содержащий 0,05% Twin 20) и блокировали в течение 30 минут при комнатной температуре 300 мкл/лунку блокирующего буфера (PBS, содержащий 2% обезжиренного молока и 0,05% Twin 20). После промывки буфером для промывки в планшет для ELISA вносили 100 мкл/лунку образцов, соответствующих образом разбавленных в буфере для ELISA (PBS, содержащий 1% обезжиренного молока и 0,025% Twin 20). Соответствующее гуманизированное IgG1/k-антитело использовали в качестве стандарта. После инкубации планшета для ELISA в течение 1 часа при комнатной температуре и промывки буфером для промывки связанные антитела выявляли, используя 100 мкл/лунку HRP-конъюгированное поликлональное антитело козы против каппа-цепи человека (SouthemBiotech, Birmingham, AL) в разведении 1/2000. После инкубации в течение 30 минут при комнатной температуре и промывки буфером для промывки осуществляли развитие окраски в результате добавления 100 мкл/лунку субстрата ABTS (bioWORLD). Развитие окраски останавливали добавлением 100 мкл/лунку 2% щавелевой кислоты. Оптическую плотность регистрировали при 405 нм. Стабильный NS0-трансфектант, продуцирующий высокий уровень антитела Ch119-43-1, NS0-Ch119-43-11-C6, адаптировали к росту в бессывороточной среде, используя Hybridoma SFM (Invitrogen).
Аутентичность тяжелой и легкой цепей, продуцированных в NSO-Ch119-43-11-C6, подтверждали в результате секвенирования кДНК. Общую РНК экстрагировали из клеток, используя реагент TRIzol (Invitrogen), и синтезировали олиго-dT-праймированную кДНК, используя систему синтеза первой нити Superscript III для ОТ-ПЦР (Invitrogen), следуя протоколам поставщика. Кодирующую область тяжелой цепи гамма-1 амплифицировали в двух ПЦР-реакциях с использованием CMV3 и JNT082 и JNT097 и JNT098 в качестве наборов праймеров (фиг. 48) и ДНК-полимеразу Phusion. ПЦР-фрагменты очищали из геля и подвергали секвенированию с использованием в качестве праймеров CMV3 (SEQ ID NO:39), JNT082 (SEQ ID NO:41), JNT097 (SEQ ID NO:42) и JNT098 (SEQ ID NO:43). Подобным образом, кодирующую область легкой цепи каппа амплифицировали, используя CMV3 и JNT026 (SEQ ID NO:40) (фиг. 49). Очищенные из геля фрагменты ДНК подвергали секвенированию с использованием CMV3 и JNT026 в качестве праймеров. Полученная нуклеотидная последовательность кодирующей области для каждой тяжелой и легкой цепи Ch119-43-1 превосходно совпадала с соответствующей последовательностью в pCh119-43-1 (фиг. 50 и 51). Нуклеотидная и аминокислотная последовательности кодирующей области тяжелой цепи в pCH119-43-1 представлены последовательностями SEQ ID NO:44 и 45, соответственно. Нуклеотидная и аминокислотная последовательности кодирующей области легкой цепи в pCH119-43-1 представлены последовательностями SEQ ID NO:46 и 47, соответственно.
Очистка антитела Ch119-43-1
Клетки NS0-Ch119-43-11-C6 выращивали в 450 мл Hybridoma-SFM во вращающемся флаконе до плотности примерно 106/мл, подпитывали 50 мл подвергнутого ультрафильтрации гидролизата сои в концентрации 60 мг/мл (Irvine Scientific, Santa Ana, CA), растворенного в среде SFM4MAb (HyClone) и дополнительно выращивали вплоть до момента, когда жизнеспособность клеток становилась менее 50%. После центрифугирования и фильтрации супернатант культуры наносили на колонку, содержащую белок-A-сефарозу (HiTrap MABSelect SuRe, GE Healthcare, Piscataway, NJ). Колонку промывали PBS перед элюированием антитела с использованием 0,1 М глицин-HCl (pH 3,0). После нейтрализации 1 М Tris-HCl (pH 8) буфер, в котором находилось элюированное антитело, заменяли на PBS диализом. Концентрацию антитела определяли, измеряя оптическую плотность при 280 нм (1 мг/мл = 1,4 OD). Выход составлял 5 мг.
Очищенное Ch119-43-1 характеризовали в SDS-ПААГ согласно стандартным способам. Анализ в восстанавливающих условиях показал, что Ch119-43-1 состоит из тяжелой цепи с молекулярной массой примерно 50 кД и легкой цепи с молекулярной массой примерно 25 кД (фиг. 52). Чистота антитела, по-видимому, составляла более 95%.
Характеристика антитела Ch119-43-1
Связывание антитела Ch119-43-1 с OX40 исследовали проточной цитометрией, используя линию фибробластов мышей L, экспрессирующих OX40 человека (L/OX40). В типичном эксперименте различные концентрации Ch119-43-1 инкубировали с 105 клеток L/OX40 в PBS, содержащем 0,5% БСА и 0,05% NaN3 (FACS-буфер) в течение 1 часа при 4°C. Затем клетки промывали охлажденным на льду FACS-буфером и подвергали инкубации с ФИТЦ-меченым антителом козы против IgG человека в течение 30 минут при 4°C. После промывки FACS-буфером окрашенные клетки анализировали, используя проточный цитометр FACScan (BD Biosciences, San Jose, CA). Результат показан на фиг. 53. Значение EC50 для Ch119-43-1, вычисленное с использованием GraphPad Prism (компьютерная программа GraphPad, San Diego, CA) составляло 0,96 мкг/мл.
Реферат
Изобретение относится к биохимии. Раскрыто антитело человека, которое специфично связывается с OX40 человека. Предпочтительно антитело имеет высокую аффинность по отношению к рецептору OX40 и активирует рецептори. Антитело может представлять собой полноразмерное антитело или его антигенсвязывающую часть. Представлены нуклеиновые кислоты, векторы и клетки-хозяева для экспрессии рекомбинантных антител человека, а также предлагаются способы синтеза рекомбинантных антител человека. Изобретение применимо для модулирования активности рецептора, например, у человека, страдающего от расстройства, при котором активность OX40 является вредной. 5 н. и 7 з.п. ф-лы, 53 ил., 1 табл., 6 пр.
Формула
(a) вариабельную область тяжелой цепи CDR1, содержащую аминокислотную последовательность SEQ ID NO: 25;
(b) вариабельную область тяжелой цепи CDR2, содержащую аминокислотную последовательность SEQ ID NO: 26;
(c) вариабельную область тяжелой цепи CDR3, содержащую аминокислотную последовательность SEQ ID NO: 27;
(d) вариабельную область легкой цепи CDR1, содержащую аминокислотную последовательность SEQ ID NO: 32;
(e) вариабельную область легкой цепи CDR2, содержащую аминокислотную последовательность SEQ ID NO: 33; и
(f) вариабельную область легкой цепи CDR3, содержащую аминокислотную последовательность SEQ ID NO: 34.
Документы, цитированные в отчёте о поиске
Антитела-антагонисты против ох40 и их применение в лечении воспалительных и аутоиммунных заболеваний

Комментарии