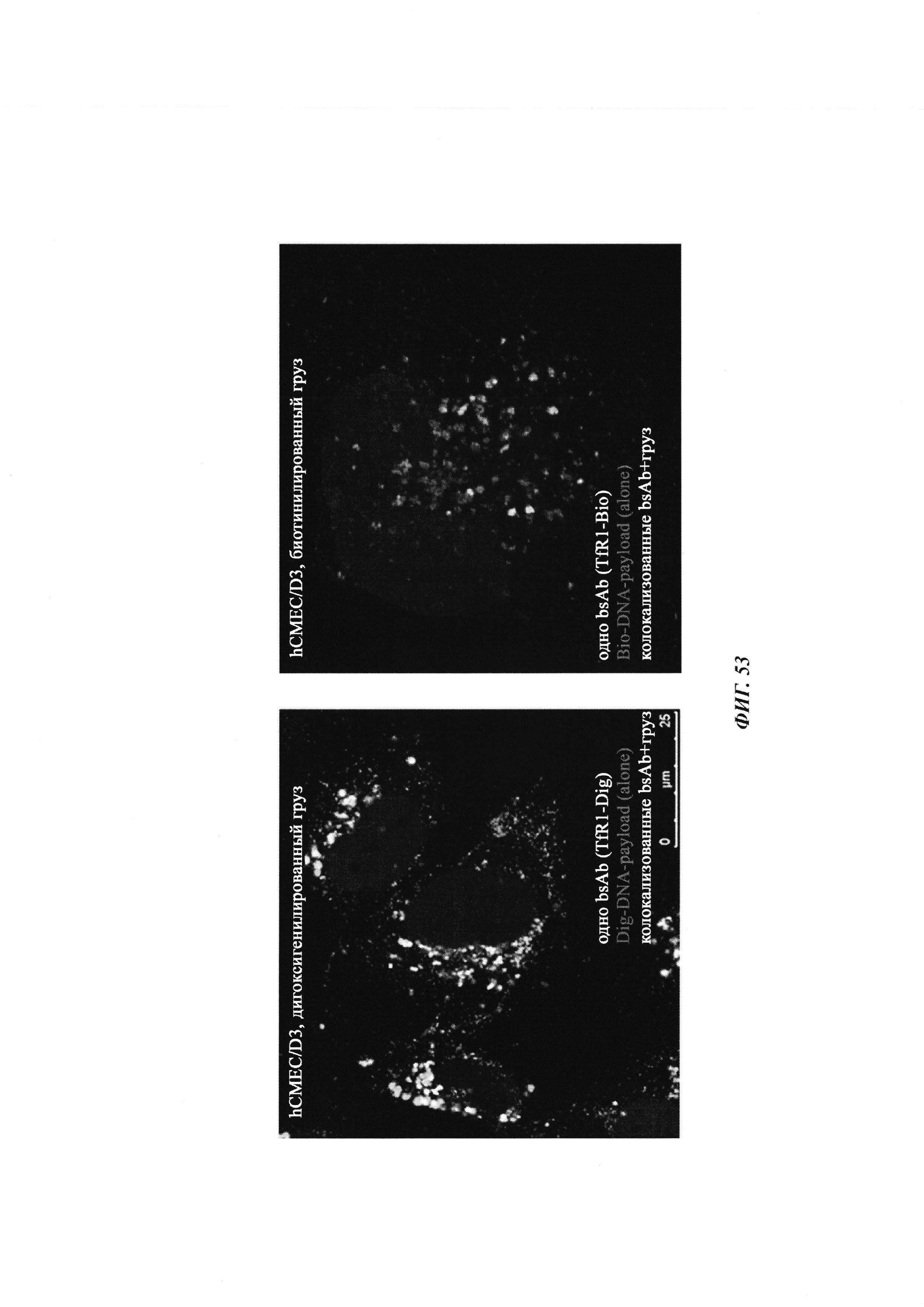
Биспецифичные антитела против гаптена/против рецептора гематоэнцефалического барьера, их комплексы и их применение в качестве челноков гематоэнцефалического барьера - RU2693438C2
Код документа: RU2693438C2
Чертежи










































































































































Описание
В данном документе описаны биспецифичные антитела против гаптена/против рецептора гематоэнцефалического барьера, их нековалентные, а также ковалентные комплексы с гаптенилированными грузами и применение антител, а также их комплексов в качестве челноков гематоэнцефалического барьера.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Главным препятствием для терапевтического применения полипептидов является их ограниченная растворимость, стабильность in vivo, короткий период полувыведения в сыворотке и быстрый клиренс из кровотока.
Описаны разные подходы для решения данной проблемы. Одним подходом для улучшения PK (фармакокинетика)/стабильности и биофизических характеристик терапевтических полипептидов является их слияние с веществами, которые стабилизируют полипептид, поддерживают его в растворе и продлевают его период полувыведения. Примерами таких соединений являются человеческий сывороточный альбумин или области Fc человеческого иммуноглобулина. Другим подходом для улучшения PK/стабильности и биофизических характеристик терапевтических полипептидов является химическое или ферментативное конъюгирование с полимерами, например, посредством ПЭГ(полиэтиленгликоль)илирования или ГЭК(гидроксиэтилкрахмал)илирования.
В US 5804371 описаны пептиды, меченные гаптеном, и их применение в иммунологическом способе выявления. Decarie A., et al. (Peptides 15 (1994) 511-518) описаны пептид, меченный дигоксигенином (брадикинин), и его применение для хемилюминоферментативного иммуноанализа брадикинина в воспаленных тканях.
В WO 2004/065569 описаны мультифункциональные антитела.
В WO 2011/003780 описаны биспецифичные антитела, связывающиеся с дигоксигенином.
В WO 2012/093068 описана фармацевтическая композиция комплекса антитела против DIG (дигоксигенин) и дигоксигенина, который конъюгирован с пептидом.
В WO 2014/006124 описаны ковалентные комплексы антител против гаптена и гаптенилированного груза.
Моноклональные антитела имеют огромный терапевтический потенциал для лечения неврологических заболеваний или заболеваний центральной нервной системы (ЦНС), но их прохождение в мозг ограничивается гематоэнцефалическим барьером (ГЭБ). Прошлые исследования показали, что очень малая процентная доля (приблизительно 0,1%) IgG, циркулирующего в кровотоке, проходит через ГЭБ в ЦНС (Felgenhauer, K., Klin. Wschr. 52 (1974) 1158-1164), где концентрация антитела в ЦНС может быть недостаточной для обеспечения надежного эффекта.
Было описано, что посредством определения одновалентного способа связывания антитела или фрагмента антитела, которое специфично связывается с рецептором гематоэнцефалического барьера (РГЭБ), может быть получен челночный модуль ГЭБ со свойствами трансцитоза через ГЭБ - WO 2014/033074.
Было описано, что посредством применения антитела или фрагмента антитела, которое специфично связывается с РГЭБ со средней аффинностью может быть получен челночный модуль ГЭБ со свойствами трансцитоза через ГЭБ - WO 2012/075037.
Было описано, что посредством применения антитела или фрагмента антитела, которое имеет конкретное отношение значений ЕС50 (полумаксимальная эффективная концентрация), определенное при разных значениях рН, может быть получен челночный модуль ГЭБ со свойствами трансцитоза через ГЭБ - WO 2012/143379.
Pardridge W.М. описывает перестройку биофармацевтических средств для доставки в мозг с использованием молекулярных троянских коней (Bioconjug. Chem. 19 (2008) 1327-1338). Опосредованный рецептором транспорт лекарственных средств через ГЭБ описыается Feng Ji-Ming et al. (Neurometh. 45 (2010) 15-34). Zhou, Q-H., et al. описывают доставку пептидного радиоактивного фармацевтического средства в мозг с использованием слитого белка IgG-авидин (Bioconjug. Chem. 22 (2011) 1611-1618). Исследование трансцитоза антитела против рецептора трансферрина с грузом Fab' через гематоэнцефалический барьер у мышей описывается Manich, G., et al. (Eur. J. Pharm. Sci. 49 (2013) 556-564).
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В данном документе описан челночный модуль гематоэнцефалического барьера (челночный модуль ГЭБ), который представляет собой биспецифичное антитело с первой специфичностью связывания в отношении гаптена и второй специфичностью связывания в отношении рецептора гематоэнцефалического барьера (РГЭБ). Такой челночный модуль ГЭБ распознает способную к трансцитозу мишень поверхности клетки на гематоэнцефалическом барьере (такую как TfR (рецептор трансферрина), LRP или другие мишени, РГЭБ) и одновременно связывается с гаптенилированными грузами.
Обнаружили, что не должны удовлетворяться дополнительные требования в отношении валентности связывания, формата антитела, аффинностей связывания с РГЭБ.
Дополнительно обнаружили, что не требуется, чтобы челночный модуль на основе биспецифичного антитела, как описано в данном документе, высвобождался из эндотелиальных клеток гематоэнцефалического барьера для того, чтобы опосредовать трансцитоз гаптенилированного груза. Вместо этого при связывании с РГЭБ гаптенилированный груз, который образует комплекс/связывается с челночным модулем на основе биспецифичного антитела, высвобождается из челночного модуля на основе биспецифичного антитела в клетке ГЭБ, т.е. во внутриклеточной везикулярной системе, отделяется от челночного модуля и затем экзоцитируется из клетки ГЭБ в мозг, оставляя биспецифичное антитело позади в клетке ГЭБ. Это также применимо при использовании ковалентного комплекса.
Челночный модуль на основе биспецифичного антитела, как описано в данном документе, является очень варьирующим в показателях валентности функционала связывания, а также аффинности функционала связывания с РГЭБ. Одновременно он обеспечивает высвобождение груза из челночного модуля.
Один аспект, как описано в данном документе, представляет собой биспецифичное антитело, содержащее первый функционал (специфичность) связывания, который специфично связывается с гаптенилированным грузом, и второй функционал (специфичность) связывания, который специфично связывается с рецептором гематоэнцефалического барьера.
Один аспект, как описано в данном документе, представляет собой нековалентный комплекс, содержащий биспецифичное антитело, которое имеет первый функционал связывания, который специфично связывается с гаптенилированным грузом, и второй функционал связывания, который специфично связывается с рецептором гематоэнцефалического барьера, и гаптенилированный груз, в котором гаптенилированный груз специфично связывается посредством первого функционала связывания.
Один аспект, как описано в данном документе, представляет собой ковалентный конъюгат, содержащий 1) биспецифичное антитело, которое имеет первый функционал связывания, который специфично связывается с гаптенилированным грузом, и второй функционал связывания, который специфично связывается с рецептором гематоэнцефалического барьера, и 2) гаптенилированный груз, в котором гаптенилированный груз специфично связывается посредством первого функционала связывания, и который имеет ковалентную связь между гаптенилированным грузом и первым функционалом связывания, который специфично связывается с гаптенилированным грузом.
В одном воплощении гаптенилированный груз выбран из группы, содержащей биотинилированные грузы, теофиллинированные грузы, дигоксигенилированные грузы, карборанилированные грузы, флуоресцеинилированные грузы, хеликарилированные грузы и бромдезоксиуридинилированные грузы.
Одним аспектом, как описано в данном документе, является ковалентный конъюгат, содержащий
i) биспецифичное антитело, которое имеет первый функционал связывания, который специфично связывается с гаптенилированным грузом, и второй функционал связывания, который специфично связывается с рецептором гематоэнцефалического барьера, и
ii) гаптенилированный груз,
в котором гаптенилированный груз специфично связывается посредством первого функционала связывания,
где ковалентный конъюгат имеет ковалентную связь между гаптенилированным грузом и первым функционалом связывания, который специфично связывается с гаптенилированным грузом, и
где гаптенилированный груз выбран из группы, состоящей из биотинилированных грузов, теофиллинированных грузов, дигоксигенилированных грузов, карборанилированных грузов, флуоресцеинилированных грузов, хеликарилированных грузов и бромдезоксиуридинилированных грузов.
В одном воплощении всех аспектов ковалентный конъюгат представляет собой непостоянный ковалентный конъюгат. В одном воплощении ковалентный конъюгат представляет собой внутриклеточно расщепляемый ковалентный конъюгат.
В одном воплощении рецептор гематоэнцефалического барьера выбран из группы, состоящей из рецептора трансферрина (TfR), рецептора инсулина, рецептора инсулиноподобного фактора роста (рецептор IGF), белка 8, родственного рецептору липопротеина низкой плотности (LRP8), белка 1, родственного рецептору липопротеина низкой плотности (LRP1), и фактора роста, подобного гепаринсвязывающему эпидермальному фактору роста (HB-EGF).
В одном воплощении биспецифичное антитело не имеет эффекторной функции.
В одном воплощении биспецифичное антитело содержит
а) один сайт связывания для гаптенилированного груза и один сайт связывания для рецептора гематоэнцефалического барьера или
б) два сайта связывания для гаптенилированного груза и один сайт связывания для рецептора гематоэнцефалического барьера или
в) один сайт связывания для гаптенилированного груза и два сайта связывания для рецептора гематоэнцефалического барьера или
г) два сайта связывания для гаптенилированного груза и два сайта связывания для рецептора гематоэнцефалического барьера.
В одном воплощении биспецифичное антитело содержит остаток цистеина в положении аминокислотного остатка в CDR2 (гипервариабельная область 2) антитела, при этом CDR2 определяется согласно Kabat.
В одном воплощении ковалентная связь образуется между остатком цистеина в CDR2 антитела и тиольной группой в гаптенилированном грузе.
Одним аспектом, как описано в данном документе, является ковалентный конъюгат, содержащий
1) биспецифичное антитело, которое имеет первый функционал связывания, который специфично связывается с гаптенилированным грузом, и второй функционал связывания, который специфичное связывается с рецептором трансферрина и
2) гаптенилированный груз,
где гаптенилированный груз специфчно связывается посредством первого функционала связывания,
где ковалентный конъюгат имеет дисульфидную связь между гаптенилированным грузом и остатком цистеина в положении 52b или 53 в CDR2 тяжелой цепи первого функционала связывания, при этом нумерация осуществляется согласно Kabat,
где гаптенилированный груз выбран из группы, состоящей из биотинилированных грузов, теофиллинированных грузов, дигоксигенилированных грузов, карборанилированных грузов, флуоресцеинилированных грузов, хеликарилированных грузов и бромдезоксиуридинилированных грузов, и
где биспецифичное антитело содержит:
а) один сайт связывания для гаптенилированного груза и один сайт связывания для рецептора трансферрина или
б) два сайта связывания для гаптенилированного груза и один сайт связывания для рецептора трансферрина, или
в) один сайт связывания для гаптенилированного груза и два сайта связывания для рецептора трансферрина, или
г) два сайта связывания для гаптенилированного груза и два сайта связывания для рецептора трансферрина.
В одном воплощении гаптен представляет собой производное или аналог нуклеотида или нуклеозида. В одном воплощении гаптен представляет собой производное или аналоги аминокислоты.
В одном воплощении рецептор гематоэнцефалического барьера выбран из группы, состоящей из рецептора трансферрина (TfR), рецептора инсулина, рецептора инсулиноподобного фактора роста (рецептор IGF), белка 8, родственного рецептору липопротеина низкой плотности (LRP8), белка 1, родственного рецептору липопротеина низкой плотности (LRP1), и фактора роста, подобного гепаринсвязывающему эпидермальному фактору роста (HB-EGF).
В одном воплощении биспецифичное антитело представляет собой полноразмерное антитело, содержащее два сайта связывания.
В одном воплощении биспецифичное антитело представляет собой полноразмерное антитело, с которым были слиты один или два scFv или scFab, и которое содержит три или четыре сайта связывания.
В одном воплощении биспецифичное антитело представляет собой фрагмент антитела. В одном воплощении фрагмент антитела выбран из F(ab')2 и диател.
В одном воплощении биспецифичное антитело представляет собой гуманизированное или человеческое антитело.
В одном воплощении биспецифичное антитело не имеет эффекторной функции. В одном воплощении биспецифичное антитело не имеет функциональной области Fc. В одном воплощении биспецифичное антитело не имеет области Fc. В одном воплощении биспецифичное антитело имеет область Fc человеческого подкласса IgG1 с мутациями L234A, L235A и P329G, где положения определяются согласно нумерации области Fc по Kabat (индекс ЕС по Kabat). В одном воплощении биспецифичное антитело имеет область Fc человеческого подкласса IgG4 с мутациями S228P, L235E и P329G, где положения определяются согласно нумерации области Fc по Kabat (индекс ЕС по Kabat).
В одном воплощении биспецифичное антитело содержит:
а) один сайт связывания для гаптенилированного груза и один сайт связывания для рецептора гематоэнцефалического барьера или
б) два сайта связывания для гаптенилированного груза и один сайт связывания для рецептора гематоэнцефалического барьера, или
в) один сайт связывания для гаптенилированного груза и два сайта связывания для рецептора гематоэнцефалического барьера, или
г) два сайта связывания для гаптенилированного груза и два сайта связывания для рецептора гематоэнцефалического барьера.
В случаях б) и в) предыдущего воплощения одна тяжелая цепь биспецифичного антитела содержит мутацию, создающую впадину, и соответствующая другая цепь содержит мутацию, создающую выступ.
В одном предпочтительном воплощении биспецифичное антитело содержит два сайта связывания для гаптенилированного груза и два сайта связывания для рецептора гематоэнцефалического барьера.
В одном воплощении гаптенилированный груз содержит линкер между гаптеном и грузом. В одном воплощении линкер представляет собой пептидный линкер. В одном воплощении линкер представляет собой химический линкер (непептидный линкер).
Обнаружили, что посредством ковалентного связывания гаптенилированного груза с антителом против гаптена может достигаться стабилизация и улучшение PK свойств груза.
Одним аспектом, как описано в данном документе, является применение ковалентного конъюгата, содержащего:
1) биспецифичное антитело, которое имеет первый функционал связывания, который специфично связывается с гаптенилированным грузом, и второй функционал связывания, который специфично связывается с рецептором гематоэнцефалического барьера, и
2) гаптенилированный груз,
где гаптенилированный груз специфично связывается первым функционалом связывания,
где ковалентный конъюгат имеет ковалентную связь между гаптенилированным грузом и первым функционалом связывания, который специфично связывается с гаптенилированным грузом, и
где гаптенилированный груз выбран из группы, состоящей из биотинилированных грузов, теофиллинированных грузов, дигоксигенилированных грузов, карборанилированных грузов, флуоресцеинилированных грузов, хеликарилированных грузов и бромдезоксиуридинилированных грузов,
для целевой доставки гаптенилированного груза через гематоэнцефалический барьер.
В одном воплощении применением является целевая доставка свободного (т.е. выделенного) гаптенилированного груза через гематоэнцефалический барьер.
В одном воплощении рецептор гематоэнцефалического барьера выбран из группы, состоящей из рецептора трансферрина (TfR), рецептора инсулина, рецептора инсулиноподобного фактора роста (рецептор IGF), белка 8, родственного рецептору липопротеина низкой плотности (LRP8), белка 1, родственного рецептору липопротеина низкой плотности (LRP1), и фактора роста, подобного гепаринсвязывающему эпидермальному фактору роста (HB-EGF).
В одном воплощении рецептор гематоэнцефалического барьера представляет собой рецептор трансферрина или белок 8, родственный рецептору липопротеина низкой плотности.
В одном воплощении биспецифичное антитело не имеет эффекторной функции.
В одном воплощении биспецифичное антитело содержит:
а) один сайт связывания для гаптенилированного груза и один сайт связывания для рецептора гематоэнцефалического барьера или
б) два сайта связывания для гаптенилированного груза и один сайт связывания для рецептора гематоэнцефалического барьера, или
в) один сайт связывания для гаптенилированного груза и два сайта связывания для рецептора гематоэнцефалического барьера, или
г) два сайта связывания для гаптенилированного груза и два сайта связывания для рецептора гематоэнцефалического барьера.
В одном воплощении биспецифичное антитело содержит остаток цистеина в качестве остатка аминокислоты в CDR2 антитела, при этом CDR2 определяется согласно Kabat.
В одном воплощении ковалентная связь образуется между остатком цистеина в CDR2 антитела и тиольной группой в гаптенилированном грузе.
В одном воплощении всех аспектов каждый из биспецифичного антитела и гаптенилированного груза содержит функциональную группу, посредством которой при связывании гаптенилированного груза биспецифичным антителом образуется ковалентная связь между гаптенилированным грузом и биспецифичным антителом.
В одном воплощении всех аспектов биспецифичное антитело содержит функциональную группу на аминокислотном остатке в CDR2 антитела, при этом CDR2 определяется согласно Kabat. В одном воплощении функциональная группа на аминокислотном остатке в CDR2 антитела представляет собой тиольную группу. В одном воплощении биспецифичное антитело содержит аминокислотный остаток цистеина в CDR2 антитела.
В одном воплощении всех аспектов гаптенилированный груз содержит функциональную группу в гаптене или, при его наличии, в линкере между гаптеном и грузом. В одном воплощении функциональная группа представляет собой тиол или малеимид, или галогенацетил. В одном воплощении функциональная группа в гаптене или, при его наличии, в линкере представляет собой тиольную группу.
В одном воплощении всех аспектов ковалентная связь образуется между остатком цистеина в CDR2 антитела и тиольной группой в гаптенилированном грузе. В одном воплощении ковалентная связь представляет собой дисульфидную связь. В одном воплощении ковалентная связь представляет собой дисульфидную связь, и она образуется без добавления окислительно-восстановительно активных агентов.
В одном воплощении всех аспектов CDR2 представляет собой CDR2 тяжелой цепи в случае гаптенилированного груза, выбранного из группы, состоящей из биотинилированных грузов, теофиллинированных грузов, дигоксигенилированных грузов и флуоресцеинилированных грузов. В одном воплощении остаток цистеина в CDR2 тяжелой цепи антитела находится в положении 52, или в положении 52а, или в положении 52b, или в положении 52с, или в положении 52d, или в положении 53 согласно нумерации вариабельного домена тяжелой цепи по Kabat. В одном воплощении остаток цистеина в CDR2 тяжелой цепи антитела находится в положении 52а, или в положении 52b, или в положении 52с, или в положении 53 согласно нумерации вариабельного домена тяжелой цепи по Kabat. В одном предпочтительном воплощении остаток цистеина в CDR2 тяжелой цепи антитела находится в положении 52b, или в положении 53 согласно нумерации вариабельного домена тяжелой цепи по Kabat.
Обнаружили, что можно использовать любой груз в гаптенилированном грузе при дериватизации с использованием универсального линкера, который содержит функциональную группу для образования ковалентной связи между гаптенилированным грузом и аминокислотным остатком в CDR2 тяжелой цепи антитела. Нахождение функциональной группы в универсальном линкере имеет то преимущество, что отсутствует необходимость реконструировать синтез и положение функциональной группы в CDR2 тяжелой цепи антитела при изменении груза.
В одном воплощении всех аспектов CDR2 представляет собой CDR2 легкой цепи в случае хеликарилированного груза. В одном воплощении остаток цистеина в CDR2 легкой цепи антитела находится в положении 51 или в положении 55 согласно нумерации вариабельного домена легкой цепи по Kabat. В одном предпочтительном воплощении остаток цистеина в CDR2 легкой цепи антитела находится в положении 55 согласно нумерации вариабельного домена легкой цепи по Kabat.
Обнаружили, что в хеликарилированном грузе можно использовать любой груз при дериватизации аминокислотной последовательности хеликара цистеином, содержащим функциональную группу для образования ковалентной дисульфидной связи между хеликарилированным грузом и остатком цистеина в CDR2 легкой цепи антитела. Нахождение остатка цистеина (тиольной функциональной группы) в аминокислотной последовательности мотива хеликар имеет то преимущество, что отсутствует необходимость реконструировать синтез и положение остатка цистеина в CDR2 легкой цепи антитела при изменении груза.
В одном воплощении всех аспектов образуется точно одна ковалентная связь на CDR2.
В одном воплощении всех аспектов груз выбран из связывающей группировки, метящей группировки и биологически активной группировки.
В одном воплощении всех аспектов биологически активная группировка выбрана из группы, содержащей антитела, полипептиды, природные лиганды одной или более чем одной мишени ЦНС, модифицированные версии природных лигандов одной или более чем одной мишени ЦНС, аптамеры, ингибирующие нуклеиновые кислоты (т.е. малые интерферирующие РНК (миРНК) и короткие шпилечные РНК (кшРНК)), запертые нуклеиновые кислоты (ЗНК), рибозимы и маленькие молекулы или активные фрагменты любого из вышеупомянутых.
В одном воплощении всех аспектов груз представляет собой нуклеиновую кислоту или производное нуклеиновой кислоты. В одном воплощении нуклеиновая кислота представляет собой иРНК (интерферирующая РНК) или ЗНК.
В одном воплощении всех аспектов груз представляет собой полипептид.
В одном воплощении всех аспектов груз представляет собой полноразмерное антитело или фрагмент антитела.
В одном воплощении всех аспектов гаптенилированный груз представляет собой гаптенилированное полноразмерное антитело против альфа-синуклеина.
В одном воплощении всех аспектов гаптенилированный груз представляет собой гаптенилированный фрагмент антитела против альфа-синуклеина, который специфично связывается с альфа-синуклеином.
В одном воплощении всех аспектов гаптен представляет собой биотин.
В одном воплощении всех аспектов антитело содержит в вариабельном домене тяжелой цепи HVR (гипервариабельная область) SEQ ID NO: 243-245, и в вариабельном домене легкой цепи - HVR SEQ ID NO: 246-248.
В одном воплощении всех аспектов антитело содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 249, 250 и 245 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 251-253.
В одном воплощении всех аспектов антитело содержит вариабельный домен тяжелой цепи, состоящий из SEQ ID NO: 254, и вариабельный домен легкой цепи, состоящий из SEQ ID NO: 255.
В одном воплощении всех аспектов антитело было получено гуманизацией антитела, содержащего вариабельный домен тяжелой цепи, состоящий из SEQ ID NO: 254, и вариабельный домен легкой цепи, состоящий из SEQ ID NO: 255.
В одном воплощении всех аспектов антитело представляет собой гуманизированное антитело и содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 243-245, и в вариабельном домене легкой цепи - HVR SEQ ID NO: 246-248, где в каждой HVR может быть заменено вплоть до 3 аминокислотных остатков.
В одном воплощении всех аспектов антитело представляет собой гуманизированное антитело и содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 249, 250 и 245, и в вариабельном домене легкой цепи HVR SEQ ID NO: 251-253, где в каждой HVR может быть заменено вплоть до 3 аминокислотных остатков.
В одном воплощении всех аспектов антитело представляет собой гуманизированное антитело, и вариабельный домен тяжелой цепи происходит из вариабельного домена тяжелой цепи, состоящего из SEQ ID NO: 254, и вариабельный домен легкой цепи происходит из вариабельного домена легкой цепи, состоящего из SEQ ID NO: 255.
В одном воплощении всех аспектов антитело связывается с тем же самым эпитопом, что и антитело, содержащее в тяжелой цепи HVR SEQ ID NO: 256-258, и в легкой цепи - HVR SEQ ID NO: 259-261.
В одном воплощении всех аспектов антитело связывается с тем же самым эпитопом, что и антитело, содержащее в тяжелой цепи HVR SEQ ID NO: 262, 263 и 258, и в легкой цепи - HVR SEQ ID NO: 264-266.
В одном воплощении всех аспектов антитело содержит вариабельный домен тяжелой цепи, состоящий из SEQ ID NO: 267, и в легкой цепи -вариабельный домен, состоящий из SEQ ID NO: 268.
В одном воплощении всех аспектов антитело было получено гуманизацией антитела, содержащего вариабельный домен тяжелой цепи, состоящий из SEQ ID NO: 267, и вариабельный домен легкой цепи, состоящий из SEQ ID NO: 268.
В одном воплощении всех аспектов антитело представляет собой гуманизированное антитело и содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 256-258, и в вариабельном домене легкой цепи - HVR SEQ ID NO: 259-261, где в каждой HVR могут быть заменены вплоть до 3 аминокислотных остатков.
В одном воплощении всех аспектов антитело представляет собой гуманизированное антитело и содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 262, 263 и 258, и в вариабельном домене легкой цепи - HVR SEQ ID NO: 264-266, где в каждой HVR могут быть заменены вплоть до 3 аминокислотных остатков.
В одном воплощении всех аспектов антитело представляет собой гуманизированное антитело, и вариабельный домен тяжелой цепи происходит из вариабельного домена тяжелой цепи, состоящего из SEQ ID NO: 267, и вариабельный домен легкой цепи происходит из вариабельного домена легкой цепи, состоящего из SEQ ID NO: 268.
В одном воплощении всех аспектов антитело связывается с тем же самым эпитопом, что и антитело, содержащее в тяжелой цепи HVR SEQ ID NO: 269-271 и в легкой цепи - HVR SEQ ID NO: 272-274.
В одном воплощении всех аспектов антитело связывается с тем же самым эпитопом, что и антитело, содержащее в тяжелой цепи HVR SEQ ID NO: 269, 275 и 271, и в легкой цепи - HVR SEQ ID NO: 276-278.
В одном воплощении всех аспектов антитело содержит вариабельный домен тяжелой цепи, состоящий из SEQ ID NO: 279, и вариабельный домен легкой цепи, состоящий из SEQ ID NO: 280.
В одном воплощении всех аспектов антитело было получено гуманизацией антитела, содержащего вариабельный домен тяжелой цепи, состоящий из SEQ ID NO: 279, и вариабельный домен легкой цепи, состоящий из SEQ ID NO: 280.
В одном воплощении всех аспектов антитело представляет собой гуманизированное антитело и содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 269-271 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 272-274, где в каждой HVR могут быть заменены вплоть до 3 аминокислотных остатков.
В одном воплощении всех аспектов антитело представляет собой гуманизированное антитело и содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 269, 275 и 271, и в вариабельном домене легкой цепи - HVR SEQ ID NO: 276-278, где в каждой HVR могут быть заменены вплоть до 3 аминокислотных остатков.
В одном воплощении всех аспектов антитело представляет собой гуманизированное антитело, и вариабельный домен тяжелой цепи происходит из вариабельного домена тяжелой цепи, состоящего из SEQ ID NO: 279, и вариабельный домен легкой цепи происходит из вариабельного домена легкой цепи, состоящего из SEQ ID NO: 280.
В одном воплощении всех аспектов гаптенилированный груз представляет собой гаптенилированное полноразмерное антитело против человеческого Tau(pS422).
В одном воплощении всех аспектов гаптенилированный груз представляет собой гаптенилированный фрагмент антитела против человеческого Tau(pS422), который специфично связывается с человеческим Tau, фосфорилированным по серину в положении 422.
В одном воплощении всех аспектов гаптен представляет собой биотин.
В одном воплощении всех аспектов антитело против человеческого Tau(pS422) содержит:
а) в вариабельном домене тяжелой цепи - HVR SEQ ID NO: 230, 239 и 232 или
б) в вариабельном домене тяжелой цепи - HVR SEQ ID NO: 230, 231 и 232.
В одном воплощении всех аспектов антитело дополнительно содержит:
а) в вариабельном домене легкой цепи - HVR SEQ ID NO: 234, 235 и 236 или
б) в вариабельном домене легкой цепи - HVR SEQ ID NO: 233, 229 и 236.
В одном воплощении всех аспектов антитело содержит:
а) в вариабельном домене тяжелой цепи - HVR SEQ ID NO: 230, 239 и 232 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 234, 235 и 236 или
б) в вариабельном домене тяжелой цепи - HVR SEQ ID NO: 230, 231 и 232 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 233, 229 и 236, или
в) в вариабельном домене тяжелой цепи - HVR SEQ ID NO: 230, 231 и 232 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 234, 235 и 236.
В одном воплощении всех аспектов антитело содержит:
а) вариабельный домен тяжелой цепи SEQ ID NO: 241 и вариабельный домен легкой цепи SEQ ID NO: 238, или
б) вариабельный домен тяжелой цепи SEQ ID NO: 240 и вариабельный домен легкой цепи SEQ ID NO: 237, или
в) вариабельный домен тяжелой цепи SEQ ID NO: 240 и вариабельный домен легкой цепи SEQ ID NO: 238, или
г) вариабельный домен тяжелой цепи SEQ ID NO: 242 и вариабельный домен легкой цепи SEQ ID NO: 238.
В одном воплощении всех аспектов гаптенилированный груз представляет собой гаптенилированное полноразмерное антитело против Абета.
В одном воплощении всех аспектов гаптенилированный груз представляет собой гаптенилированный фрагмент антитела против Абета, который специфично связывается с человеческим Абета.
В одном воплощении всех аспектов гаптен представляет собой биотин.
В одном воплощении всех аспектов антитело против Абета содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 281, 282 и 283.
В одном воплощении всех аспектов антитело дополнительно содержит в вариабельном домене легкой цепи HVR SEQ ID NO: 284, 285 и 286.
В одном воплощении всех аспектов антитело содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 281, 282 и 283, и в вариабельном домене легкой цепи HVR SEQ ID NO: 284, 285 и 286.
В одном воплощении всех аспектов антитело содержит:
а) вариабельный домен тяжелой цепи SEQ ID NO: 287 и вариабельный домен легкой цепи SEQ ID NO: 290, или
б) вариабельный домен тяжелой цепи SEQ ID NO: 288 и вариабельный домен легкой цепи SEQ ID NO: 291, или
в) вариабельный домен тяжелой цепи SEQ ID NO: 289 и вариабельный домен легкой цепи SEQ ID NO: 292.
В одном воплощении всех аспектов груз представляет собой маленькую молекулу (неполипептидную биологически активную группировку).
В одном воплощении всех аспектов биологически активная группировка представляет собой полипептид. В одном воплощении полипептид состоит из 5-500 аминокислотных остатков. В одном воплощении полипептид содержит 10-450 аминокислотных остатков. В одном воплощении полипептид содержит 15-400 аминокислотных остатков. В одном воплощении полипептид содержит 18-350 аминокислотных остатков.
В одном воплощении всех аспектов биспецифичное антитело содержит первый функционал связывания, который специфично связывается с дигоксигенилированным грузом (функционал связывания против дигоксигенина; функционал связывания против DIG), и второй функционал связывания, который специфично связывается с (человеческим) рецептором трансферрина (функционал связывания против (человеческого) рецептора трансферрина; функционал связывания против (h)TfR), или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности; функционал связывания против LRP8).
В одном воплощении всех аспектов биспецифичное антитело имеет два функционала связывания, которые специфично связываются с дигоксигенилированным грузом (два функционала связывания против дигоксигенина), и два функционала связывания, которые специфично связываются с (человеческим) рецептором трансферрина (два функционала связывания против (человеческого) рецептора трансферрина), или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности).
В одном воплощении всех аспектов функционал связывания, который специфично связывается с дигоксигенилированным грузом, представляет собой пару вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую: (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 01, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 02, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 03, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 05, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 06, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 07.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с дигоксигенилированным грузом, представляет собой гуманизированный функционал связывания.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с дигоксигенилированным грузом, содержит такие же CDR, как и в любом из приведенных выше воплощений, и акцепторный человеческий каркас (например, каркас человеческого иммуноглобулина или человеческий консенсусный каркас).
В одном воплощении всех аспектов функционал связывания, который специфично связывается с дигоксигенилированным грузом, представляет собой пару вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую: (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 09 или 25, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 10 или 26, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 11 или 27, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 13 или 29, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 14 или 30 и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 15 или 31.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с дигоксигенилированным грузом, представляет собой пару вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 04 или 12, или 20, или 28. В некоторых воплощениях последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции по отношению к контрольной последовательности, но антитело против дигоксигенина, содержащее данную последовательность, сохраняет способность к связыванию с дигоксигенином. В некоторых воплощениях в SEQ ID NO: 01 или 09, или 17, или 25 всего от 1 до 10 аминокислот были заменены, вставлены и/или подвергнуты делеции. В некоторых воплощениях замены, вставки или делеции происходят в областях вне CDR (т.е. в FR). Возможно антитело против дигоксигенина содержит последовательность VH SEQ ID NO: 01 или 09, или 17, или 25, включая посттрансляционные модификации данной последовательности.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с дигоксигенилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, дополнительно содержущую вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 08 или 16, или 24, или 32. В некоторых воплощениях последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции по отношению к эталонной последовательности, но антитело против дигоксигенина, содержащее данную последовательность, сохраняет способность к связыванию с дигоксигенином. В некоторых воплощениях в SEQ ID NO: 08 или 16, или 24, или 32 всего от 1 до 10 аминокислот было заменено, вставлено и/или подвергнуто делеции. В некоторых воплощениях замены, вставки или делеции происходят в областях вне CDR (т.е., в FR). Возможно антитело против дигоксигенина содержит последовательность VL SEQ ID NO: 08 или 16, или 24, или 32, включающую посттрансляционные модификации данной последовательности.
В одном воплощении всех аспектов биспецифичное антитело имеет первый функционал связывания, который специфично связывается с биотинилированным грузом (функционал связывания против биотина; функционал связывания против BI), и второй функционал связывания, который специфично связывается с (человеческим) рецептором трансферрина (функционал связывания против (человеческого) рецептора трансферрина; функционал связывания против (h)TfR) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности; функционал связывания против LRP8).
В одном воплощении всех аспектов биспецифичное антитело имеет два функционала связывания, которые специфично связываются с биотинилированным грузом (два функционала связывания против биотина), и два функционала связывания, которые специфично связываются с (человеческим) рецептором трансферрина (два функционала связывания против (человеческого) рецептора трансферрина) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности).
В одном воплощении всех аспектов функционал связывания, который специфично связывается с биотинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую: (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 33, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 34, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 35, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 37, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 38, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 39.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с биотинилированным грузом, представляет собой гуманизированный функционал связывания.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с биотинилированным грузом, содержит такие же CDR, как и в любом из приведенных выше воплощений, и акцепторный человеческий каркас (например, каркас человеческого иммуноглобулина или человеческий консенсусный каркас).
В одном воплощении всех аспектов функционал связывания, который специфично связывается с биотинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую: (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 41 или 57, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 42 или 58, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 43 или 59, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 45 или 61, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 46 или 62, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 47 или 63.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с биотинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 36, или 44, или 52, или 60. В некоторых воплощениях последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции по отношению к эталонной последовательности, но антитело против биотина, содержащее данную последовательность, сохраняет способность к связыванию с биотином. В некоторых воплощениях в SEQ ID NO: 36 или 44, или 52, или 60 всего от 1 до 10 аминокислот были заменены, вставлены и/или подвергнуты делеции. В некоторых воплощениях замены, вставки или делеции происходят в областях вне CDR (т.е. в FR). Возможно антитело против биотина содержит последовательность VH в SEQ ID NO: 36 или 44, или 52, или 60, включая посттрансляционные модификации данной последовательности.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с биотинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, дополнительно содержущую вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 40 или 48, или 56, или 64. В некоторых воплощениях последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции по отношению к эталонной последовательности, но антитело против биотина, содержащее данную последовательность, сохраняет способность к связыванию с биотином. В некоторых воплощениях в SEQ ID NO: 40 или 48, или 56, или 64 всего от 1 до 10 аминокислот было заменено, вставлено и/или подвергнуто делеции. В некоторых воплощениях замены, вставки или делеции происходят в областях вне CDR (т.е., в FR). Возможно антитело против биотина содержит последовательность VL в SEQ ID NO: 40 или 48, или 56, или 64, включающую посттрансляционные модификации данной последовательности.
В одном воплощении всех аспектов биспецифичное антитело содержит первый функционал связывания, который специфично связывается с теофиллинилированным грузом (функционал связывания против теофиллина; функционал связывания против ТНЕО), и второй функционал связывания, который специфично связывается с (человеческим) рецептором трансферрина (функционал связывания против (человеческого) рецептора трансферрина; функционал связывания против (h)TfR) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности; функционал связывания против LRP8).
В одном воплощении всех аспектов биспецифичное антитело имеет два функционала связывания, которые специфично связываются с теофиллинилированным грузом (два функционала связывания против теофиллина), и два функционала связывания, которые специфично связываются с (человеческим) рецептором трансферрина (два функционала связывания против (человеческого) рецептора трансферрина) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности).
В одном воплощении всех аспектов функционал связывания, который специфично связывается с теофиллинированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую: (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 65, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 66, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 67, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 69, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 70, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 71.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с теофиллинированным грузом, представляет собой гуманизированный функционал связывания.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с теофиллинированным грузом, содержит такие же CDR, как и в любом из приведенных выше воплощений, и акцепторный человеческий каркас (например, каркас человеческого иммуноглобулина или человеческий консенсусный каркас).
В одном воплощении всех аспектов функционал связывания, который специфично связывается с теофиллинированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую: (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 73 или 89, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 74 или 90, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 75 или 91, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 77 или 93, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 78 или 94, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 79 или 95.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с теофиллинированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 68, или 76, или 84, или 92. В некоторых воплощениях последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции по отношению к эталонной последовательности, но антитело против теофиллина, содержащее данную последовательность, сохраняет способность к связыванию с теофиллином. В некоторых воплощениях в SEQ ID NO: 68 или 76, или 84, или 92 всего от 1 до 10 аминокислот были заменены, вставлены и/или подвергнуты делеции. В некоторых воплощениях замены, вставки или делеции происходят в областях вне CDR (т.е. в FR). Возможно антитело против теофиллина содержит последовательность VH в SEQ ID NO: 68 или 76, или 84, или 92, включающую посттрансляционные модификации данной последовательности.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с теофиллинированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, дополнительно содержущую вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 72 или 80, или 88, или 96. В некоторых воплощениях последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции по отношению к эталонной последовательности, но антитело против теофиллина, содержащее данную последовательность, сохраняет способность к связыванию с теофиллином. В некоторых воплощениях в SEQ ID NO: 72 или 80, или 88, или 96 всего от 1 до 10 аминокислот было заменено, вставлено и/или подвергнуто делеции. В некоторых воплощениях замены, вставки или делеции встречаются в областях вне CDR (т.е., в FR). Возможно антитело против теофиллина содержит последовательность VL в SEQ ID NO: 72 или 80, или 88, или 96, включающую посттрансляционные модификации данной последовательности.
В одном воплощении всех аспектов биспецифичное антитело содержит первый функционал связывания, который специфично связывается с флуоресцеинилированным грузом (функционал связывания против флуоресцеина; функционал связывания против FLUO), и второй функционал связывания, который специфично связывается с (человеческим) рецептором трансферрина (функционал связывания против (человеческого) рецептора трансферрина; функционал связывания против (h)TfR) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности; функционал связывания против LRP8).
В одном воплощении всех аспектов биспецифичное антитело имеет два функционала связывания, которые специфично связываются с флуоресцеинилированным грузом (два функционала связывания против флуоресцеина), и два функционала связывания, которые специфично связываются с (человеческим) рецептором трансферрина (два функционала связывания против (человеческого) рецептора трансферрина) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности).
В одном воплощении всех аспектов функционал связывания, который специфично связывается с флуоресцеинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую: (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 97, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 98, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 99, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 101, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 102, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 103.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с флуоресцеинилированным грузом, представляет собой гуманизированный функционал связывания.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с флуоресцеинилированным грузом, содержит такие же CDR, как и в любом из приведенных выше воплощений, и акцепторный человеческий каркас (например, каркас человеческого иммуноглобулина или человеческий консенсусный каркас).
В одном воплощении всех аспектов функционал связывания, который специфично связывается с флуоресцеинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую: (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 105 или 113, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 106 или 114, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 107 или 115, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 109 или 117, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 110 или 118 и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 111 или 119.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с флуоресцеинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 108 или 116. В некоторых воплощениях последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции по отношению к эталонной последовательности, но антитело против флуоресцеина, содержащее данную последовательность, сохраняет способность к связыванию с флуоресцеином. В некоторых воплощениях в SEQ ID NO: 108 или 116 всего от 1 до 10 аминокислот были заменены, вставлены и/или подвергнуты делеции. В некоторых воплощениях замены, вставки или делеции происходят в областях вне CDR (т.е. в FR). Возможно антитело против флуоресцеина содержит последовательность VH в SEQ ID NO: 108 или 116, включающую посттрансляционные модификации данной последовательности.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с флуоресцеинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, дополнительно содержащую вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 112 или 120. В некоторых воплощениях последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции по отношению к эталонной последовательности, но антитело против флуоресцеина, содержащее данную последовательность, сохраняет способность к связыванию с флуоресцеином. В некоторых воплощениях в SEQ ID NO: 112 или 120 всего от 1 до 10 аминокислот было заменено, вставлено и/или подвергнуто делеции. В некоторых воплощениях замены, вставки или делеции происходят в областях вне CDR (т.е., в FR). Возможно антитело против флуоресцеина содержит последовательность VL в SEQ ID NO: 112 или 120, включающую посттрансляционные модификации данной последовательности.
В одном воплощении всех аспектов биспецифичное антитело содержит первый функционал связывания, которая специфично связывается с бромдезоксиуридинилированным грузом (функционал связывания против бромдезоксиуридина; функционал связывания против BrdU), и второй функционал связывания, который специфично связывается с (человеческим) рецептором трансферрина (функционал связывания против (человеческого) рецептора трансферрина; функционал связывания против (h)TfR) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности; функционал связывания против LRP8).
В одном воплощении всех аспектов биспецифичное антитело имеет два функционала связывания, которые специфично связываются с бромдезоксиуридинилированным грузом (два функционала связывания против бромдезоксиуридина), и два функционала связывания, которые специфично связываются с (человеческим) рецептором трансферрина (два функционала связывания против (человеческого) рецептора трансферрина) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности).
В одном воплощении всех аспектов функционал связывания, который специфично связывается с бромдезоксиуридинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую: (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 214, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 216, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 218, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 219, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 220, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 221.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с бромдезоксиуридинилированным грузом, представляет собой гуманизированный функционал связывания.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с бромдезоксиуридинилированным грузом, содержит такие же CDR, как и в любом из приведенных выше воплощений, и акцепторный человеческий каркас (например, каркас человеческого иммуноглобулина или человеческий консенсусный каркас).
В одном воплощении всех аспектов функционал связывания, который специфично связывается с бромдезоксиуридинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую: (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 214 или 215, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 216 или 217, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 218, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 219, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 220, и (e) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 221.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с бромдезоксиуридинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 222 или 224. В некоторых воплощениях последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции по отношению к эталонной последовательности, но антитело против бромдезоксиуридина, содержащее данную последовательность, сохраняет способность к связыванию с бромдезоксиуридином. В некоторых воплощениях в SEQ ID NO: 222 или 224 всего от 1 до 10 аминокислот были заменены, вставлены и/или подвергнуты делеции. В некоторых воплощениях замены, вставки или делеции происходят в областях вне CDR (т.е. в FR). Возможно антитело против бромдезоксиуридина содержит последовательность VH в SEQ ID NO: 222 или 224, включающую посттрансляционные модификации данной последовательности.
В одном воплощении всех аспектов функционал связывания, который специфично связывается с бромдезоксиуридинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, дополнительно содержащую вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 223 или 225. В некоторых воплощениях последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции по отношению к эталонной последовательности, но антитело против бромдезоксиуридина, содержащее данную последовательность, сохраняет способность к связыванию с бромдезоксиуридином. В некоторых воплощениях в SEQ ID NO: 223 или 225 всего от 1 до 10 аминокислот было заменено, вставлено и/или подвергнуто делеции. В некоторых воплощениях замены, вставки или делеции происходят в областях вне CDR (т.е., в FR). Возможно антитело против бромдезоксиуридина содержит последовательность VL в SEQ ID NO: 223 или 225, включающую посттрансляционные модификации данной последовательности.
Одним аспектом, как описано в данном документе, является фармацевтическая композиция, содержащая биспецифичное антитело, как описано в данном документе, и фармацевтически приемлемый носитель.
Одним аспектом, как описано в данном документе, является фармацевтическая композиция, содержащая нековалентный комплекс, как описано в данном документе, и фармацевтически приемлемый носитель.
Одним аспектом, как описано в данном документе, является фармацевтическая композиция, содержащая ковалентный конъюгат, как описано в данном документе, и фармацевтически приемлемый носитель.
Одним аспектом, как описано в данном документе, является биспецифичное антитело, как описано в данном документе, для применения в качестве лекарственного средства.
Одним аспектом, как описано в данном документе, является нековалентный комплекс, как описано в данном документе, для применения в качестве лекарственного средства.
Одним аспектом, как описано в данном документе, является ковалентный конъюгат, как описано в данном документе, для применения в качестве лекарственного средства.
Одним аспектом, как описано в данном документе, является биспецифичное антитело, как описано в данном документе, для лечения рака или неврологического расстройства.
Одним аспектом, как описано в данном документе, является нековалентный комплекс, как описано в данном документе, для лечения рака или неврологического расстройства.
Одним аспектом, как описано в данном документе, является ковалентный конъюгат, как описано в данном документе, для лечения рака или неврологического расстройства.
Одним аспектом, как описано в данном документе, является применение биспецифичного антитела, как описано в данном документе, в изготовлении лекарственного средства.
Одним аспектом, как описано в данном документе, является применение нековалентного комплекса, как описано в данном документе, в изготовлении лекарственного средства.
Одним аспектом, как описано в данном документе, является применение ковалентного конъюгата, как описано в данном документе, в изготовлении лекарственного средства.
В одном воплощении лекарственное средство предназначено для лечения рака.
В одном воплощении лекарственное средство предназначено для лечения неврологического расстройства.
В одном воплощении неврологическое расстройство выбрано из следующих: болезнь Альцгеймера (AD) (включающая умеренное когнитивное нарушение и продромальную AD, но не ограничивающаяся ими), инсульт, деменция, мышечная дистрофия (MD), рассеянный склероз (MS), боковой амиотрофический склероз (ALS), кистозный фиброз, синдром Ангельмана, синдром Лиддла, болезнь Паркинсона, болезнь Пика, болезнь Пэджета, рак (например, рак, поражающий ЦНС или мозг) и травматическое поражение мозга.
Одним аспектом, как описано в данном документе, является применение биспецифичного антитела, как описано в данном документе, в качестве диагностического агента.
Одним аспектом, как описано в данном документе, является применение нековалентного комплекса, как описано в данном документе, в качестве диагностического агента.
Одним аспектом, как описано в данном документе, является применение ковалентного конъюгата, как описано в данном документе, в качестве диагностического агента.
Одним аспектом, как описано в данном документе, является применение нековалентного комплекса, как описано в данном документе, для увеличения стабильности груза.
Одним аспектом, как описано в данном документе, является применение ковалентного конъюгата, как описано в данном документе, для увеличения стабильности груза.
Одним аспектом, как описано в данном документе, является применение нековалентного комплекса, как описано в данном документе, для увеличения активности груза.
Одним аспектом, как описано в данном документе, является применение ковалентного конъюгата, как описано в данном документе, для увеличения активности груза.
Одним аспектом, как описано в данном документе, является применение нековалентного комплекса, как описано в данном документе, для увеличения периода полувыведения груза in vivo.
Одним аспектом, как описано в данном документе, является применение ковалентного конъюгата, как описано в данном документе, для увеличения периода полувыведения груза in vivo.
Одним аспектом, как описано в данном документе, является применение биспецифичного антитела, как описано в данном документе, в лечении заболевания.
Одним аспектом, как описано в данном документе, является применение нековалентного комплекса, как описано в данном документе, в лечении заболевания.
Одним аспектом, как описано в данном документе, является применение ковалентного конъюгата, как описано в данном документе, в лечении заболевания.
Одним аспектом, как описано в данном документе, является способ лечения индивида, имеющего заболевания, включающий введение индивиду эффективного количества нековалентного комплекса, как описано в данном документе.
Одним аспектом, как описано в данном документе, является способ лечения индивида, имеющего заболевание, включающий введение индивиду эффективного количества ковалентного конъюгата, как описано в данном документе.
Одним аспектом, как описано в данном документе, является способ лечения заболевания у индивида, включающий введение индивиду эффективного количества нековалентного комплекса, как описано в данном документе.
Одним аспектом, как описано в данном документе, является способ лечения заболевания у индивида, включающий введение индивиду эффективного количества ковалентного конъюгата, как описано в данном документе.
В одном воплощении заболевание представляет собой рак.
В одном воплощении заболевание представляет собой неврологическое расстройство.
В одном воплощении неврологическое расстройство выбрано из следующих: болезнь Альцгеймера (AD) (включающая умеренное когнитивное нарушение и продромальную AD, но не ограничивающаяся ими), инсульт, деменция, мышечная дистрофия (MD), рассеянный склероз (MS), боковой амиотрофический склероз (ALS), кистозный фиброз, синдром Ангельмана, синдром Лиддла, болезнь Паркинсона, болезнь Пика, болезнь Пэджета, рак (например, рак, поражающий ЦНС или мозг) и травматическое поражение мозга.
Одним аспектом, как описано в данном документе, является применение биспецифичного антитела, как описано в данном документе, для направленной доставки гаптенилированного груза через гематоэнцефалический барьер.
Одним аспектом, как описано в данном документе, является применение нековалентного комплекса, как описано в данном документе, для направленной доставки гаптенилированного груза через гематоэнцефалический барьер.
Одним аспектом, как описано в данном документе, является применение ковалентного комплекса, как описано в данном документе, для направленной доставки гаптенилированного груза через гематоэнцефалический барьер.
Одним аспектом, как описано в данном документе, является применение биспецифичного антитела, как описано в данном документе, для направленной доставки гаптенилированного груза через гематоэнцефалический барьер и высвобождения гаптенилированного груза в гематоэнцефалическом барьере или в мозге.
Одним аспектом, как описано в данном документе, является применение нековалентного комплекса, как описано в данном документе, для направленной доставки гаптенилированного груза через гематоэнцефалический барьер и высвобождения гаптенилированного груза в гематоэнцефалическом барьере или в мозге.
В одном воплощении доставка гаптенилированного груза больше, по сравнению с доставкой в отсутствие биспецифиного антитела. В одном воплощении доставка в два раза больше. В одном воплощении доставка в 10 раз больше.
В одном воплощении гаптенилированный груз имеет большую биологическую активность в отсутствие биспецифичного антитела, как описано в данном документе, чем в присутствии биспецифичного антитела, как описано в данном документе. В одном воплощении биологическая активность в два раза выше в отсутствие биспецифичного антитела. В одном воплощении биологическая активность в десять раз выше в отсутствие биспецифичного антитела.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
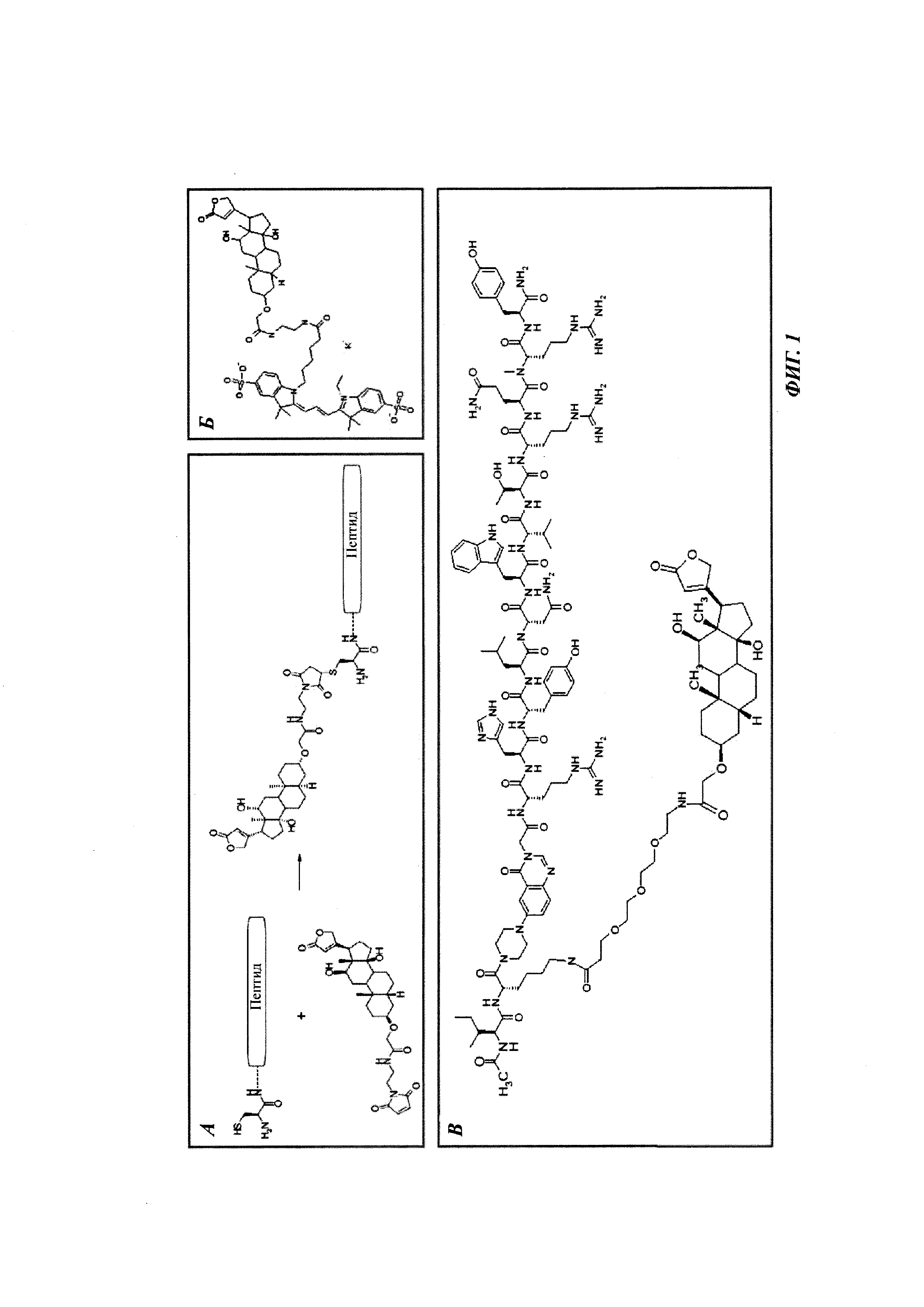
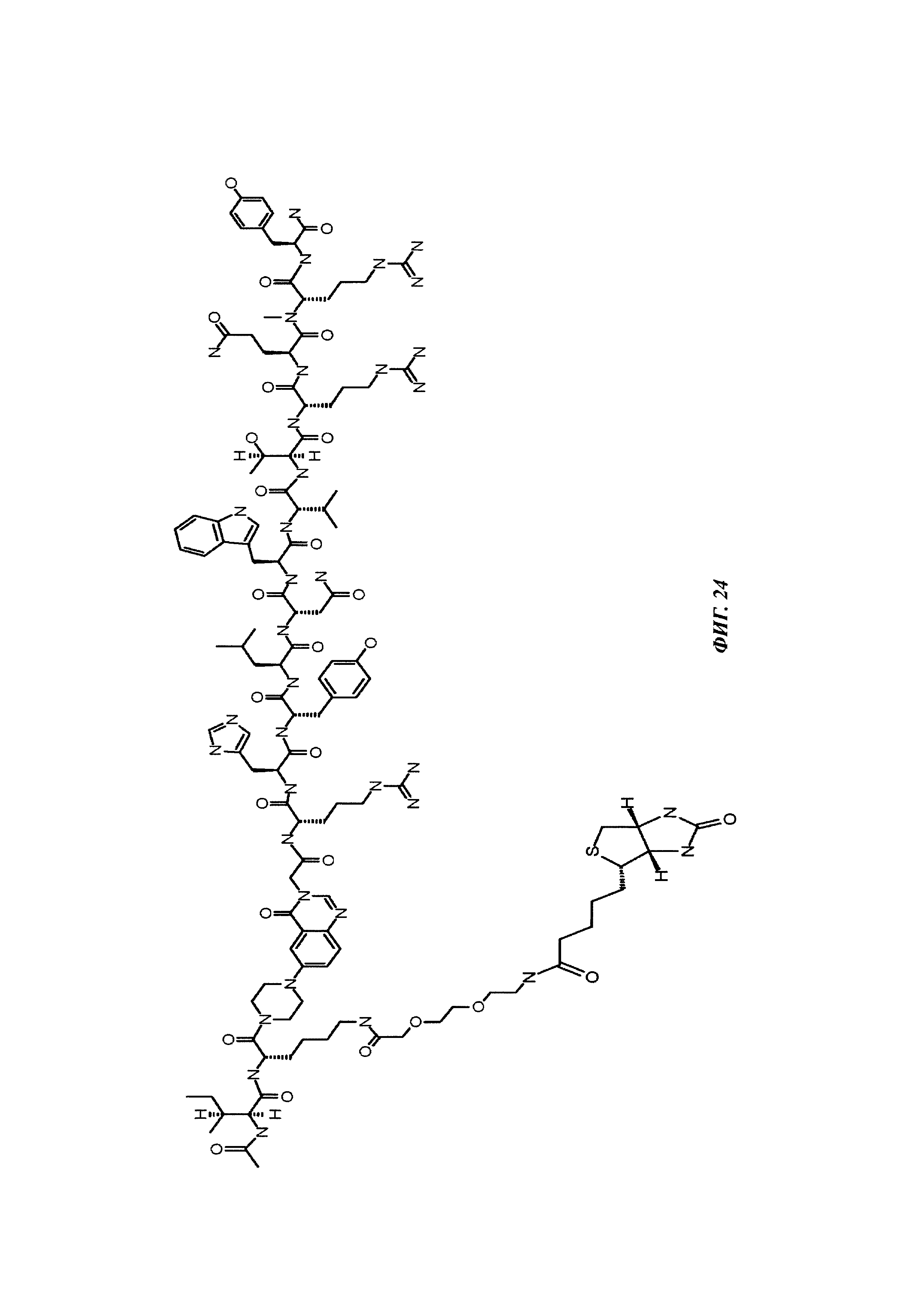
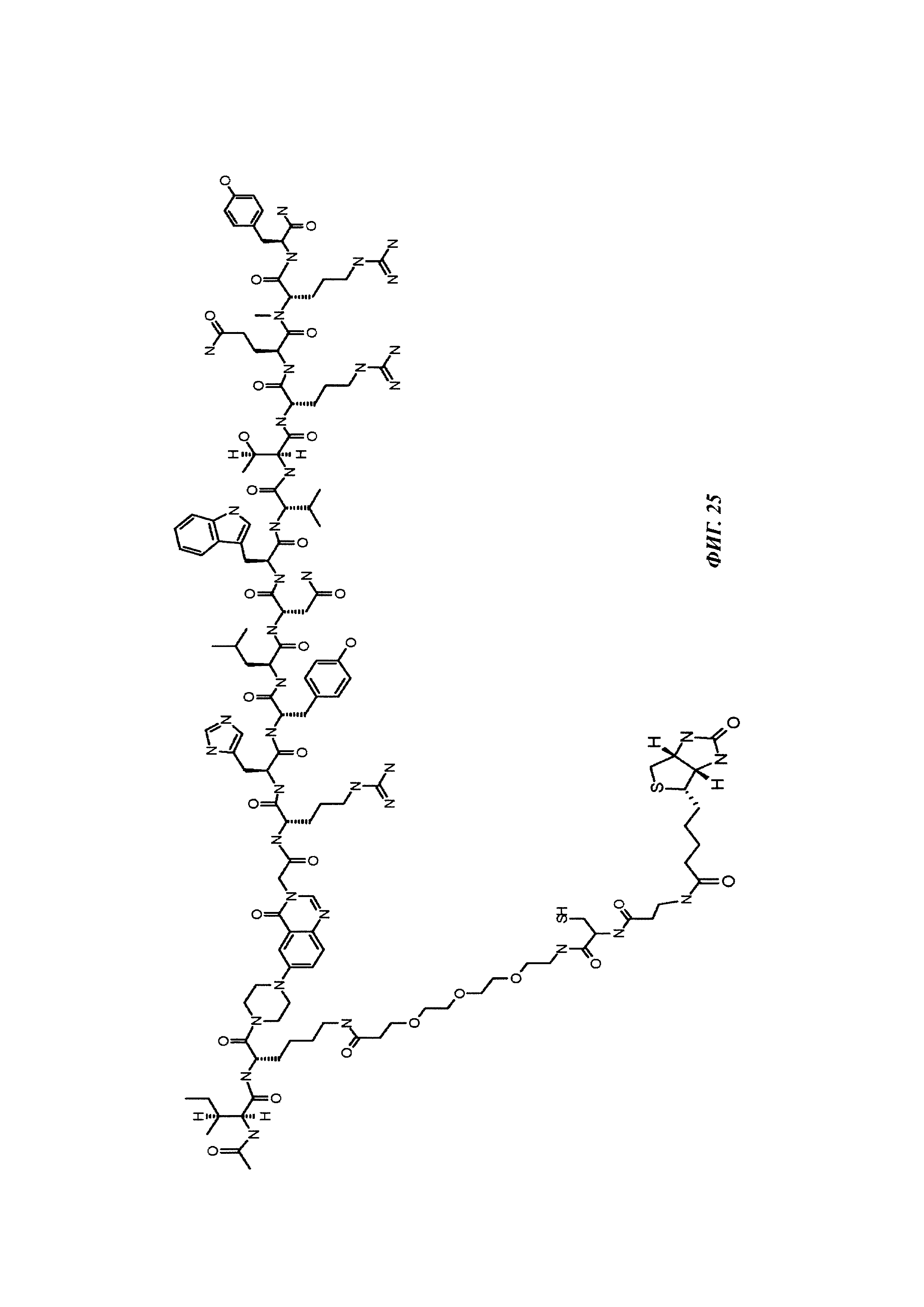
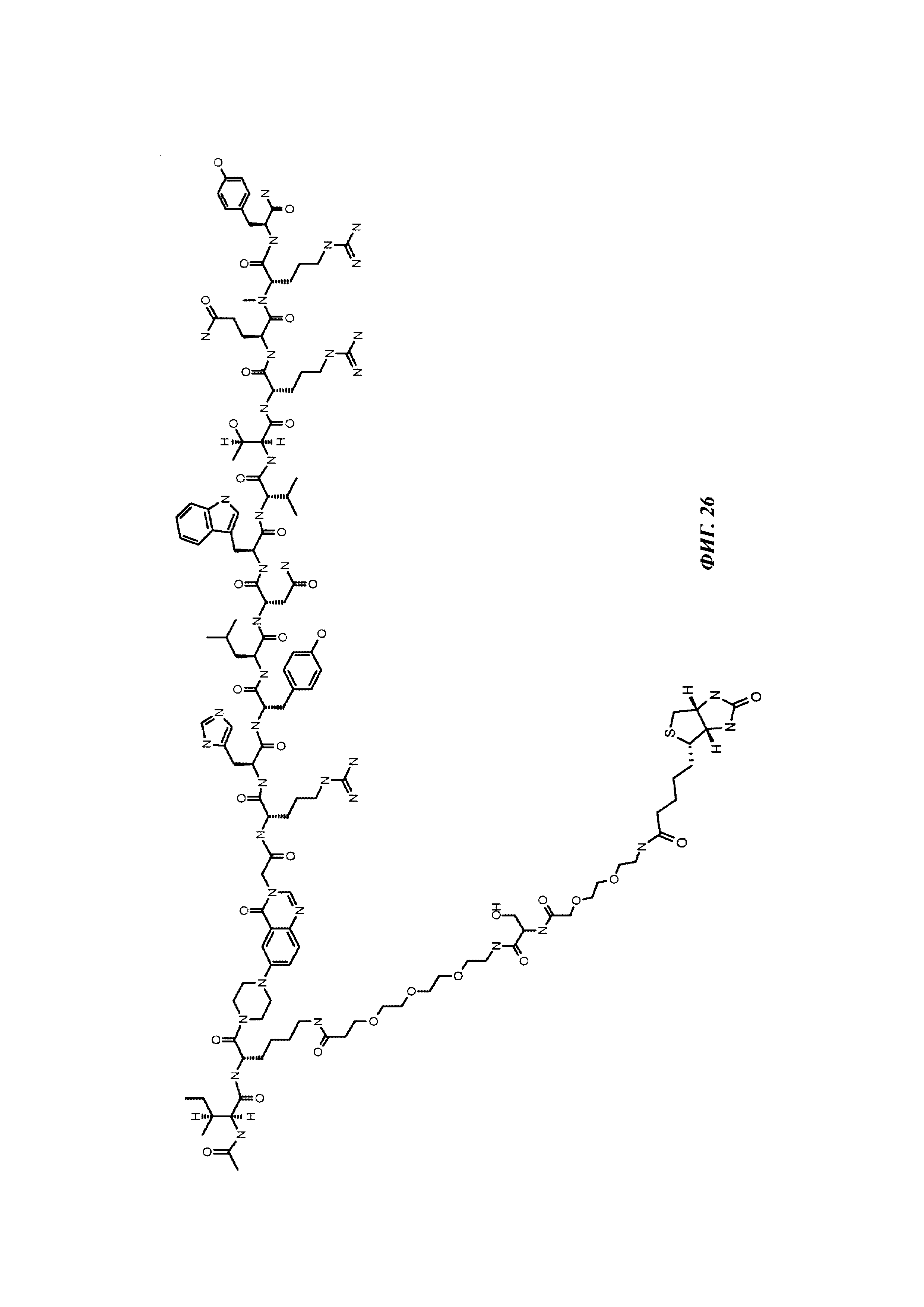
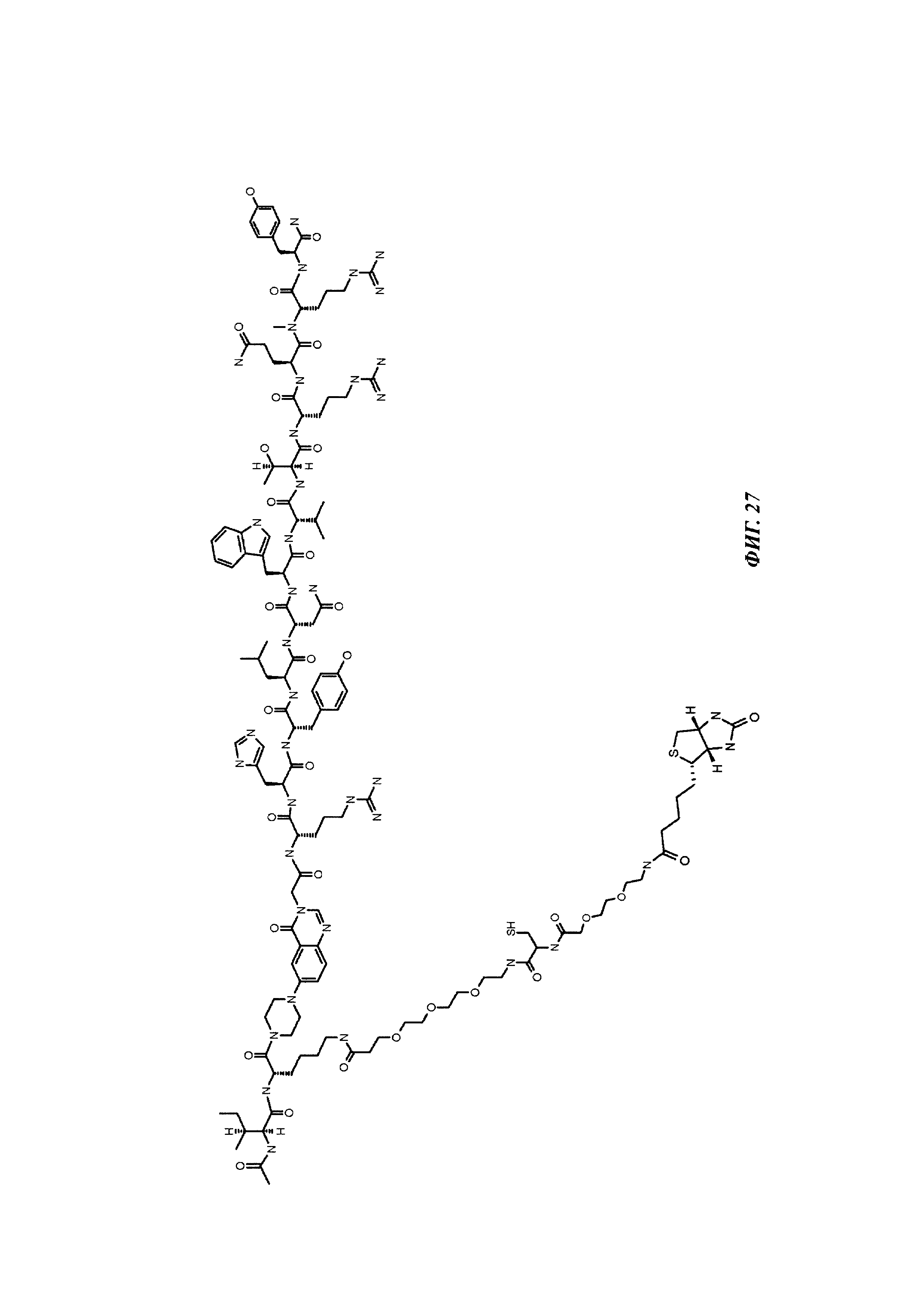
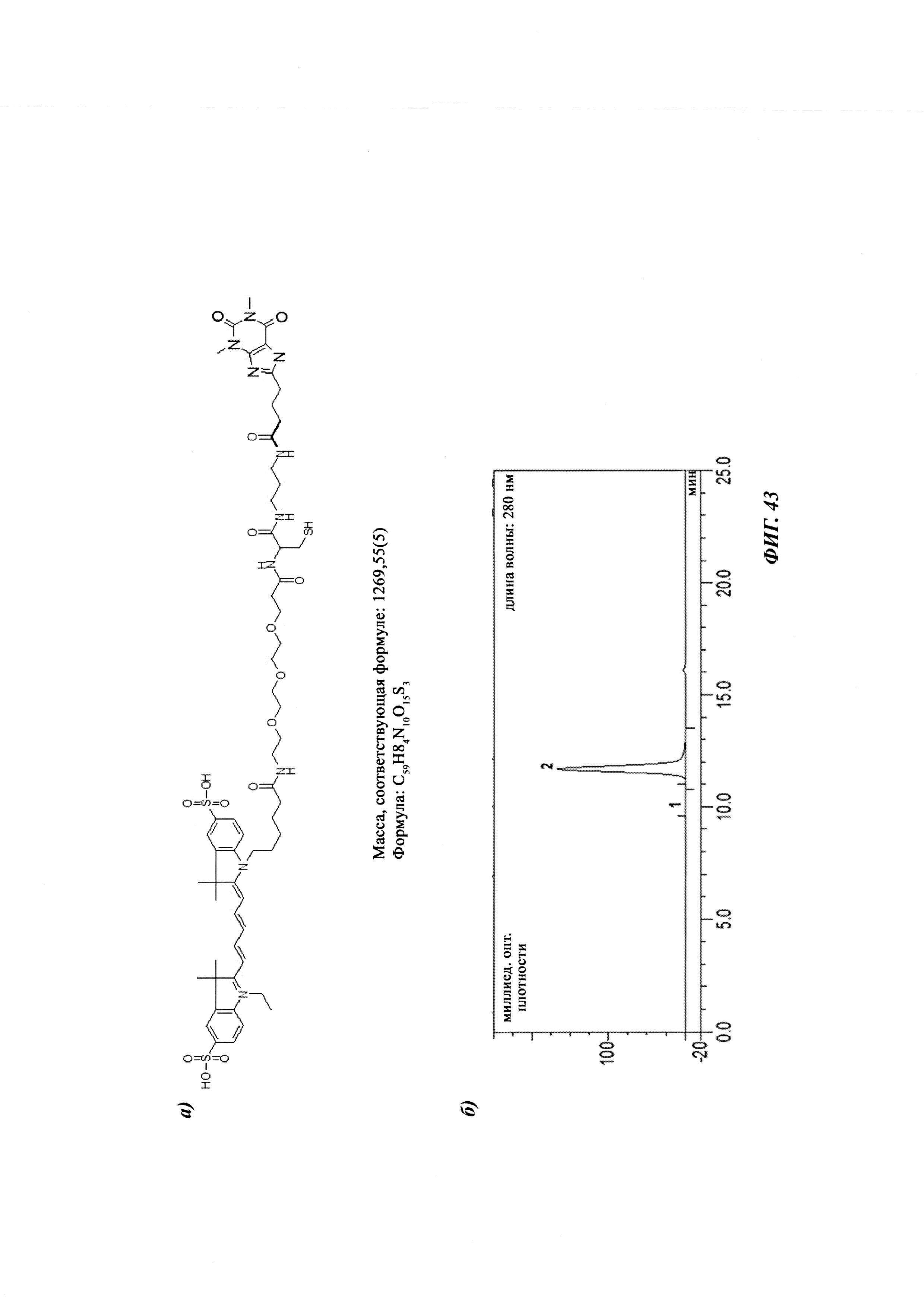
Фиг. 1: методика дигоксигенилирования (конъюгирования дигоксигенина с) пептидов (Фиг. 1А). Примеры дигоксигенилированной метки (флуорофор Dig-Cy5; Фиг. 1Б) и дигоксигенилированного полипептида (PYY-производное (DIG-PYY); Фиг. 1В).
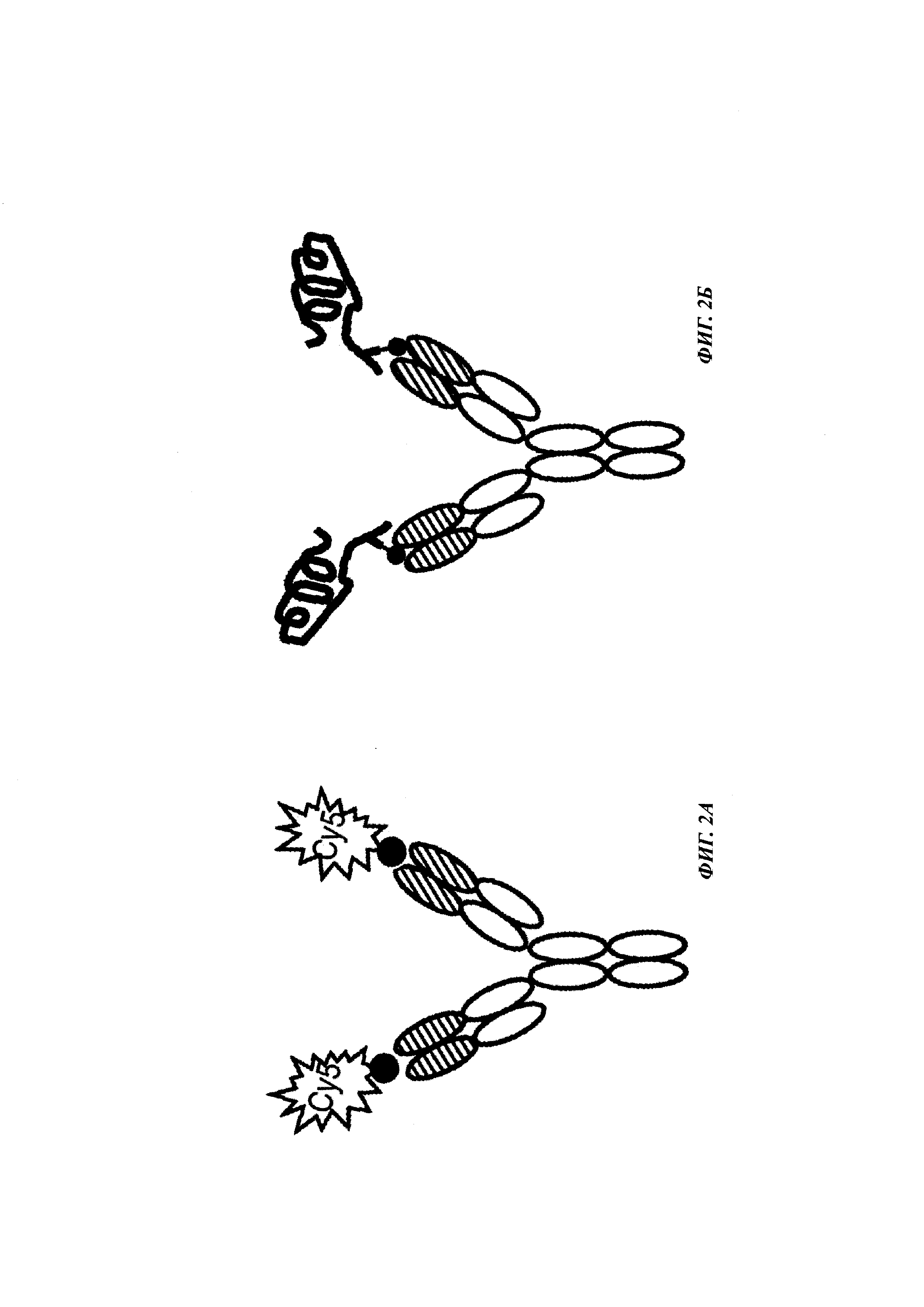
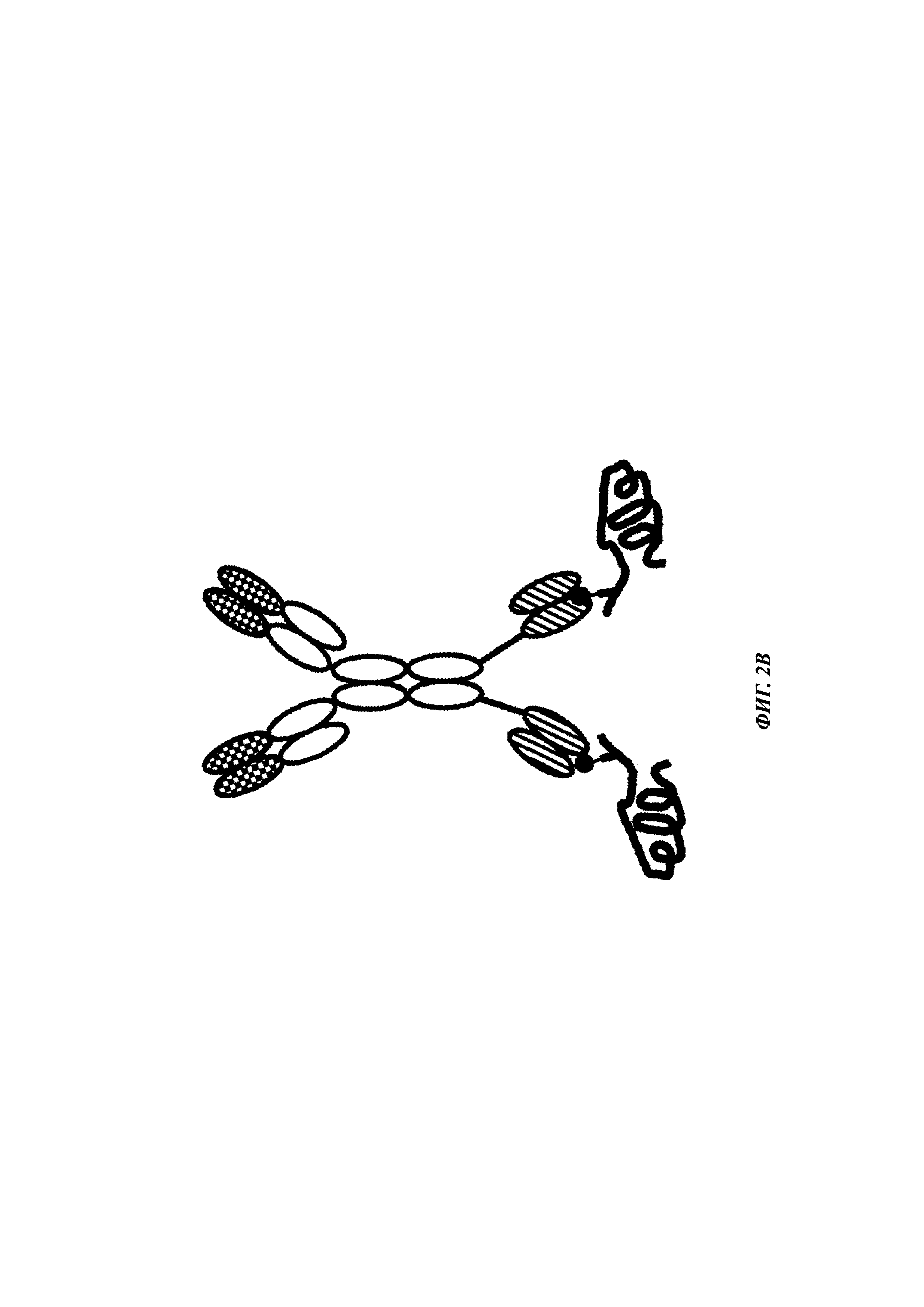
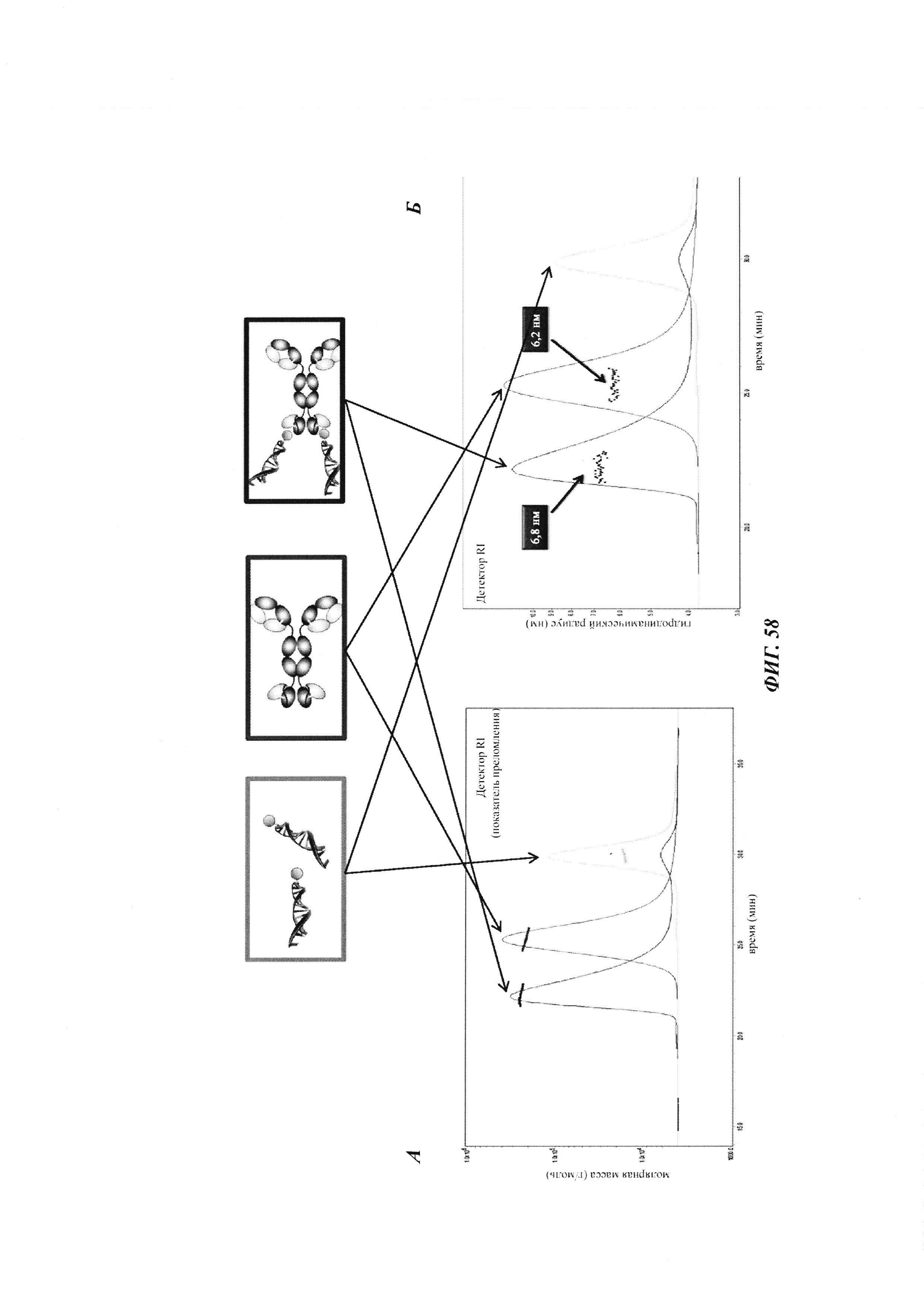
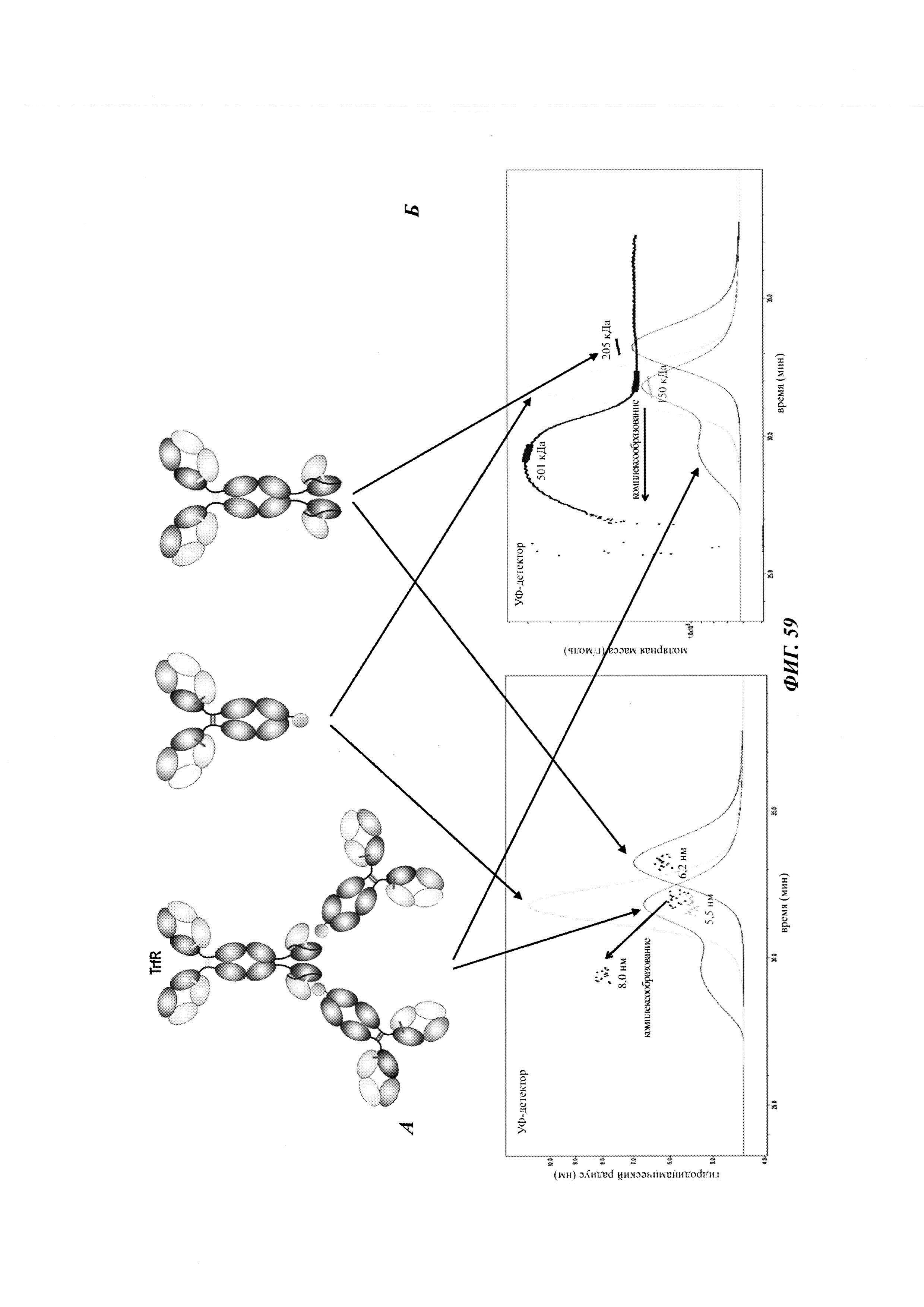
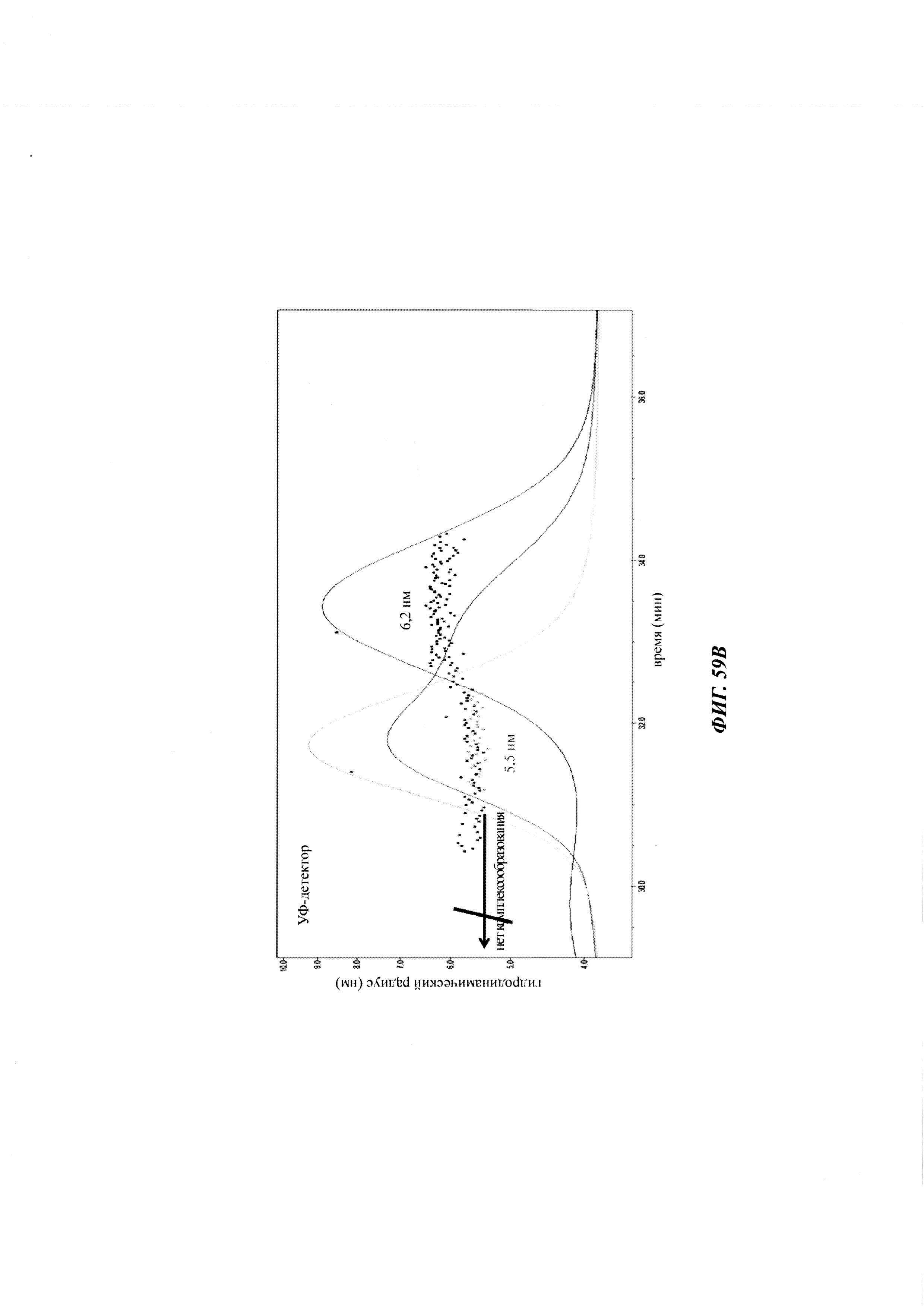
Фиг. 2: схема комплекса моноспецифичного двухвалентного антитела против дигоксигенина и конъюгата дигоксигенин-Cy5 (Фиг. 2А) и комплекса моноспецифичного двухвалентного антитела против дигоксигенина и конъюгата дигоксигенин-полипептид (Фиг. 2Б). Схема комплекса биспецифичного четырехвалентного антитела против дигоксигенина и конъюгата дигоксигенин-полипептид (Фиг. 2В).
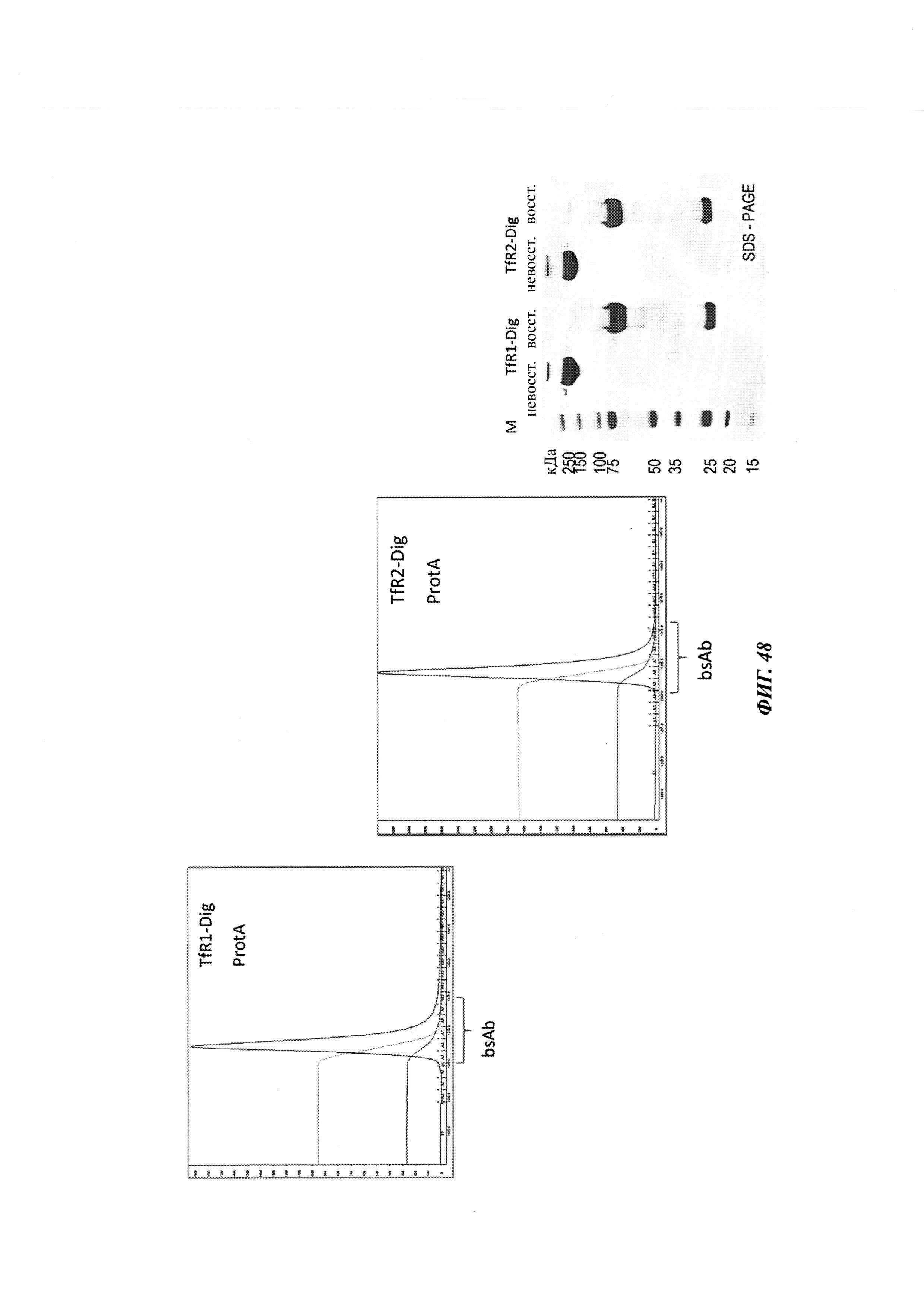
Фиг. 3: хроматограмма гель-фильтрации (записанная при 280 нм) комплекса, содержащего антитело против дигоксигенина и дигоксигенин, который конъюгирован с пептидом (DIG-PYY), демонстрирующая один пик комплекса определенного размера.
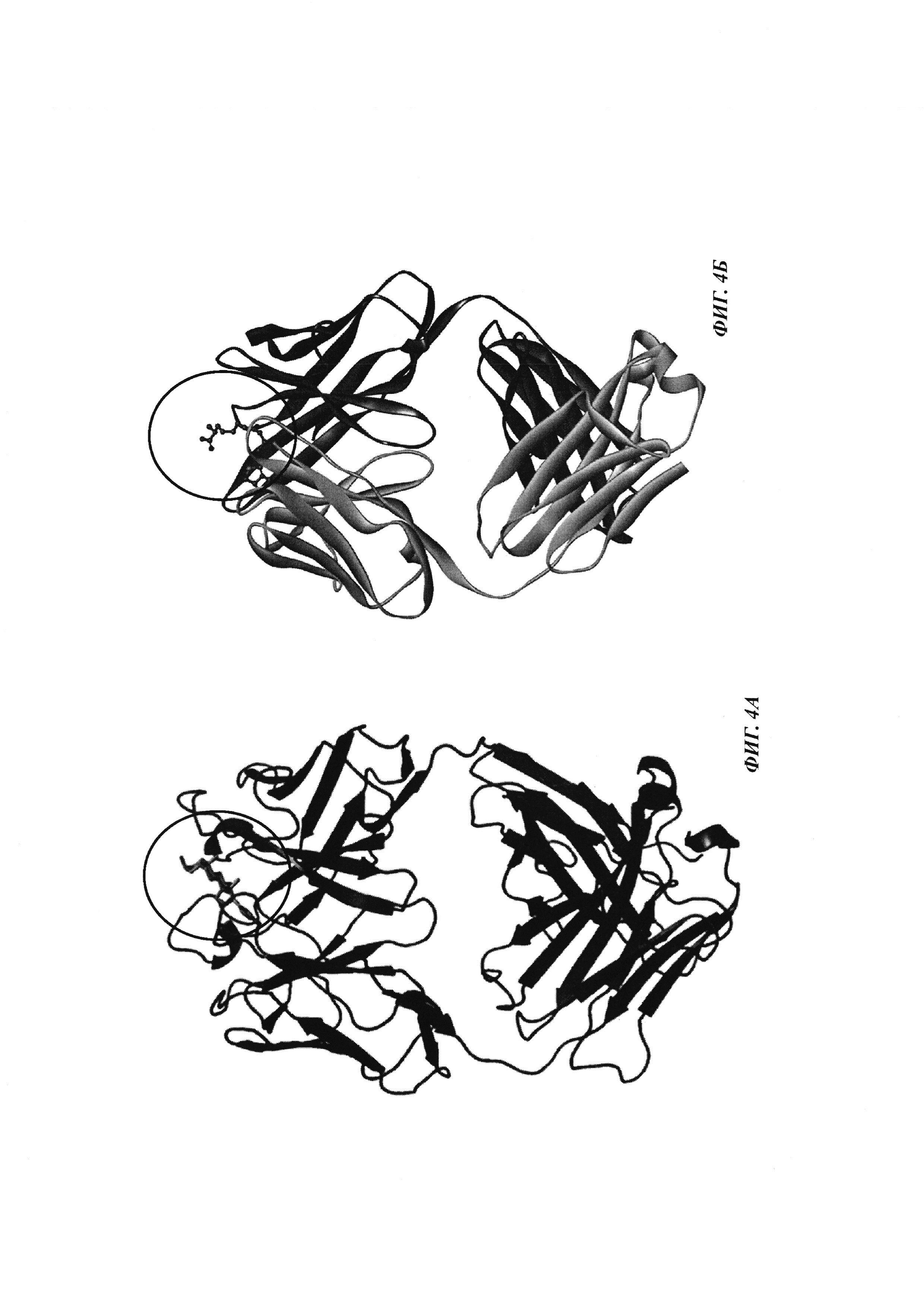
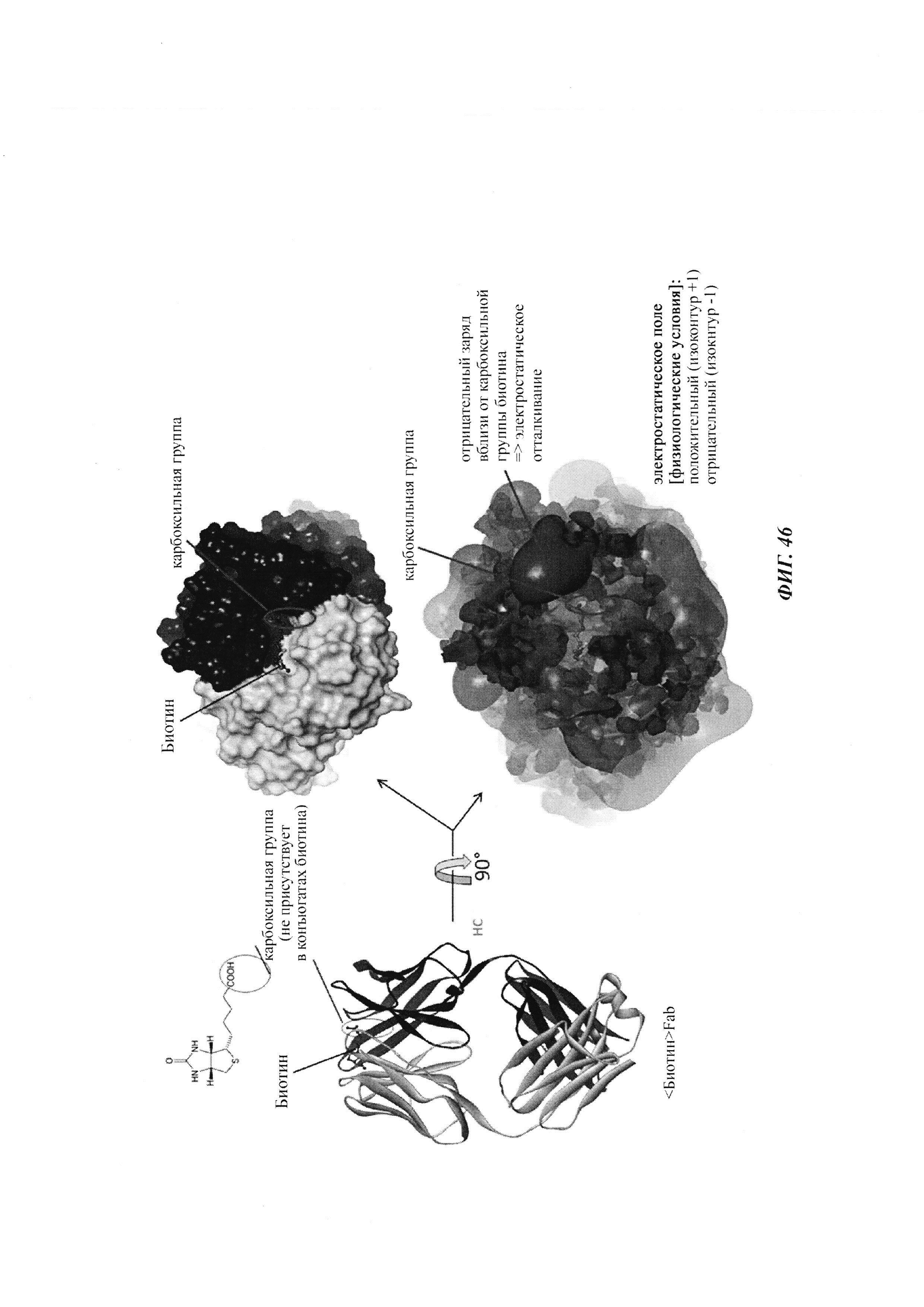
Фиг. 4: А: структурная модель Fab против дигоксигенина (слева), показывающая то, что дигоксигенин (заключен в круг) захватывается в глубоком кармане, который образован CDR областей VH и VL. Б: структурная модель Fab против биотина (справа), показывающая то, что биоцитинамид (заключен в круг) захватывается в глубоком кармане, который образован CDR областей VH и VL.
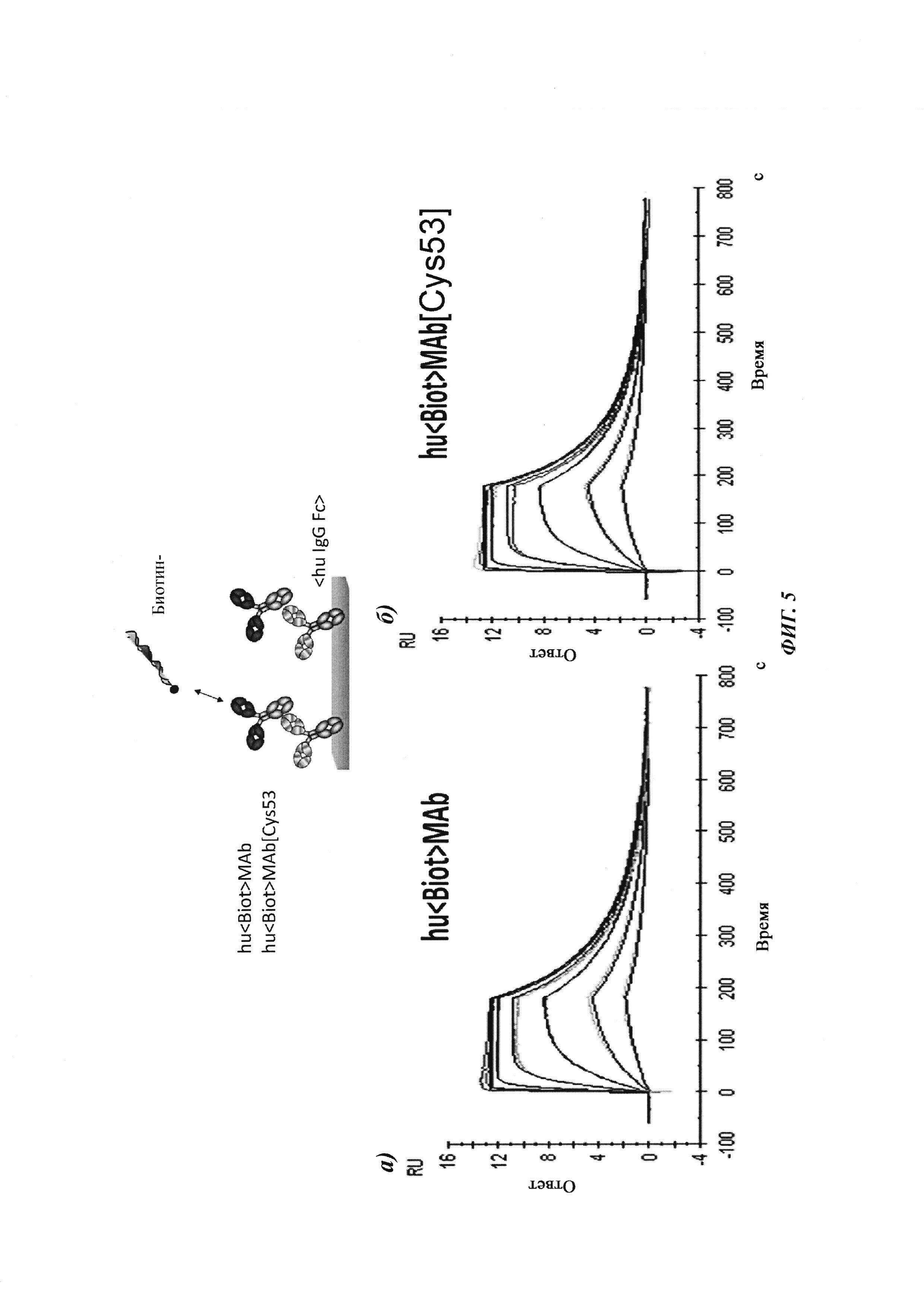
Фиг. 5: сравнение связывания рекомбинантных гуманизированных антител против биотина с введенной мутацией VH53C или без нее. Свойства связывания анализировали методикой поверхностного плазмонного резонанса (SPR) с использованием установки BIAcore Т100 или BIAcore 3000. а) гуманизированное антитело против биотина. Связывание биотинилированной миРНК с гуманизированным антителом против биотина, KD равна 624 пМ; б) гуманизированное антитело против биотина с мутацией Cys53. Связывание биотинилированной миРНК, KD равна 643 пМ; концентрации миРНК: 0,14; 0,41; 1,23; 3,70; 11,1; 33,3 и 100 нМ; концентрация антитела против биотина: 2 нМ; сенсорный чип СМ3; связывание антитела посредством антитела против Fc человеческого IgG.
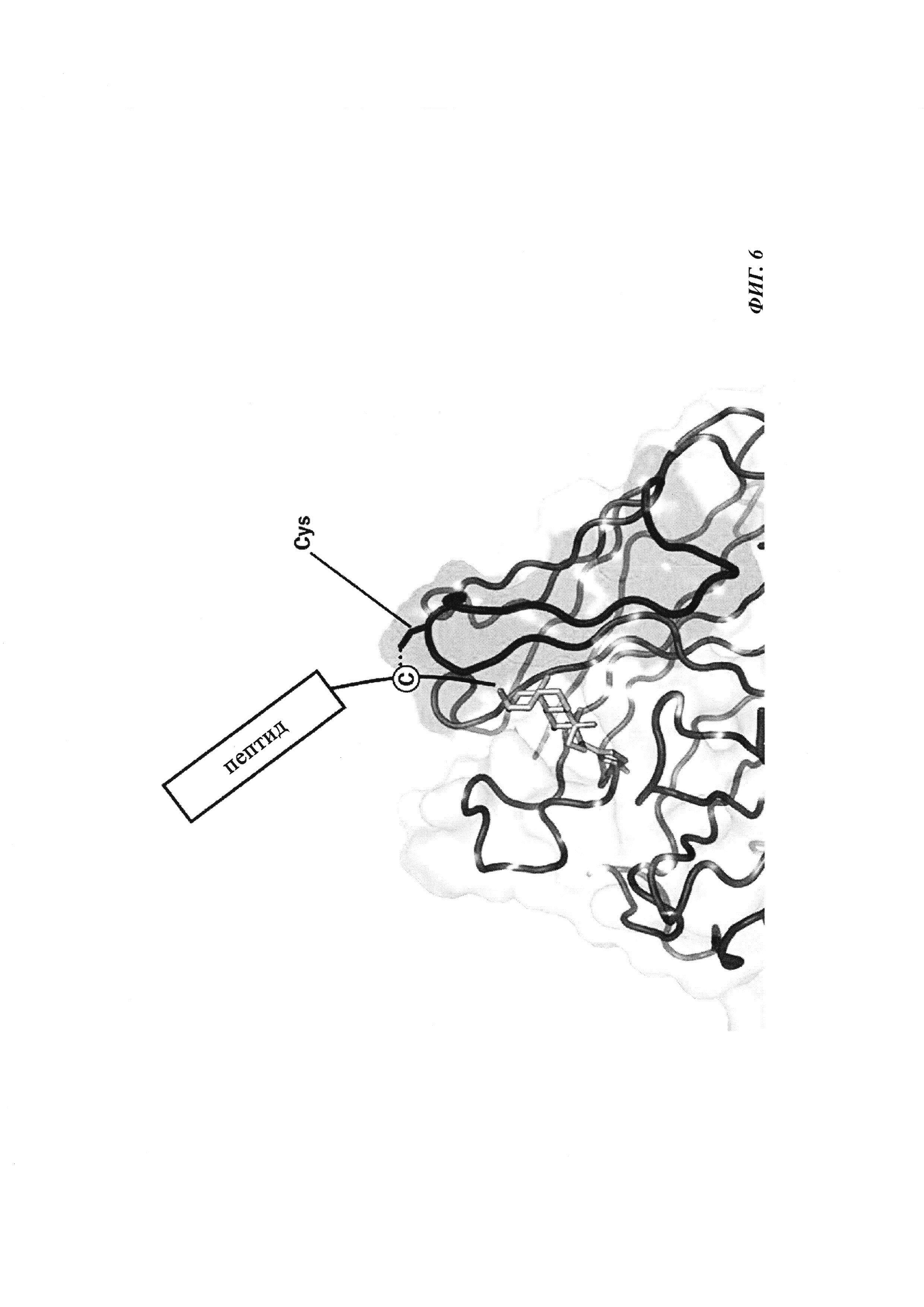
Фиг. 6: введение SH функциональных групп в гаптен, а также в антитело в подходящих положениях обеспечивает то, что антитело и гаптен образуют ковалентную связь, приводящую к конъюгату.
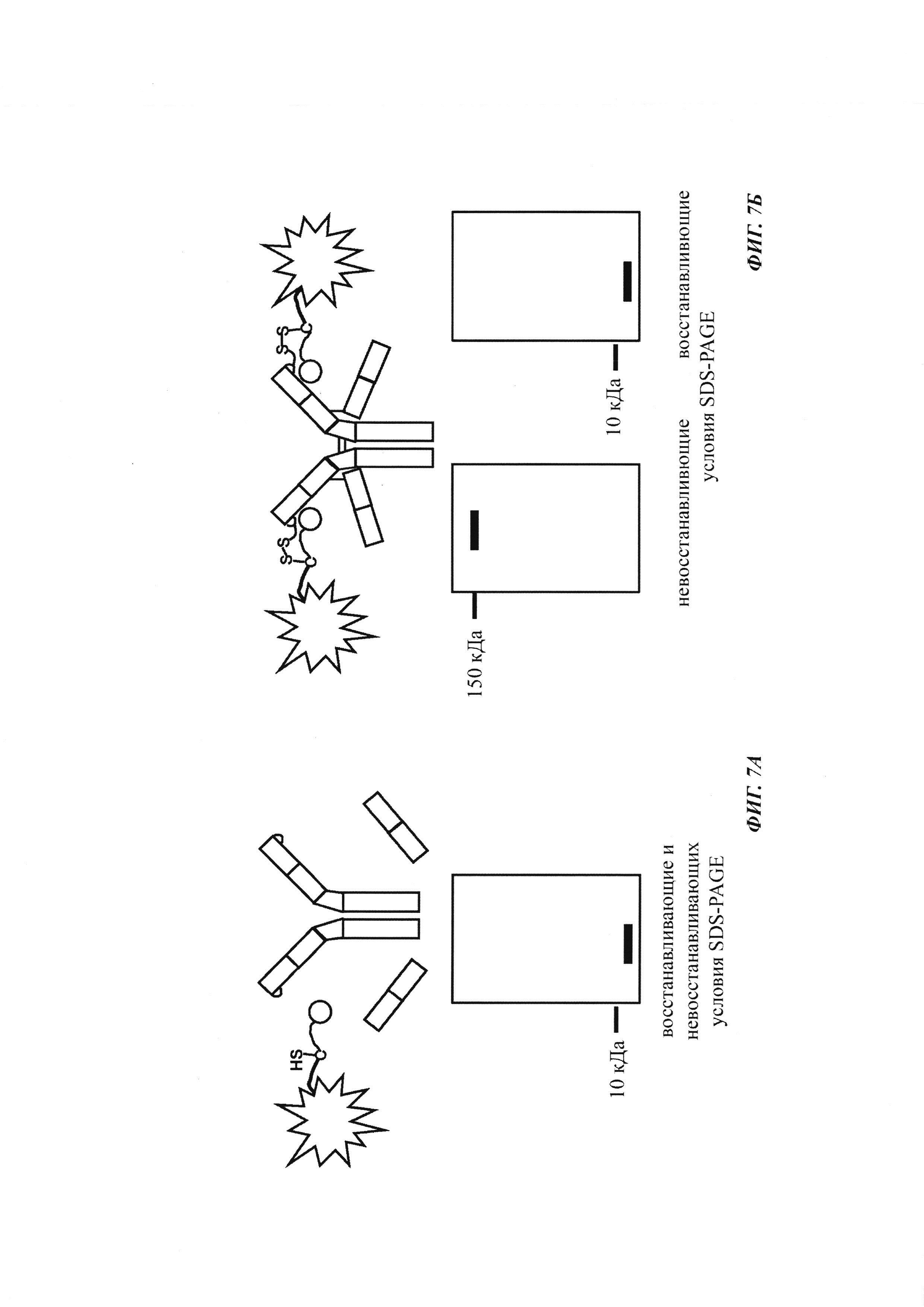
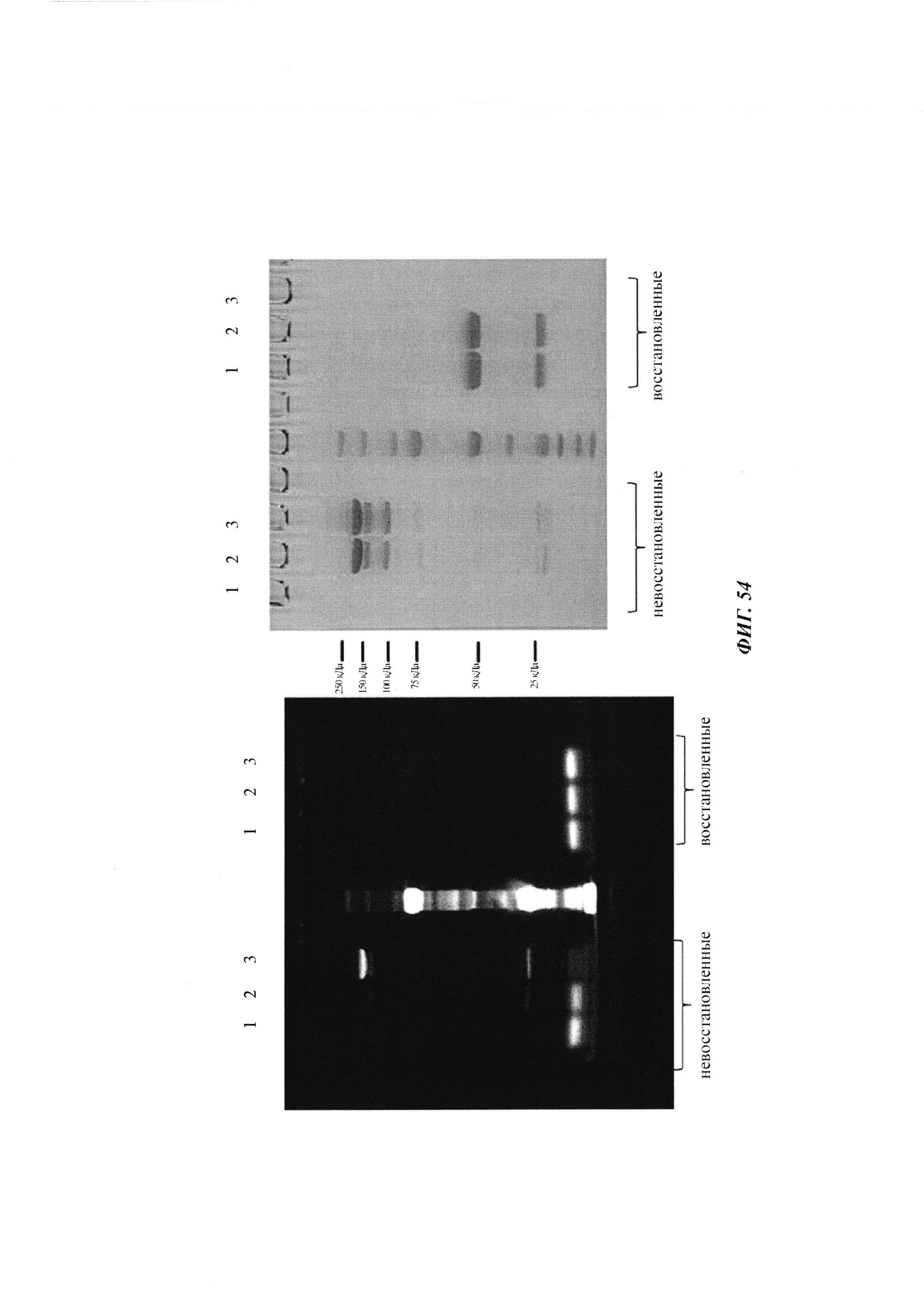
Фиг. 7: схема картины полос автофлуоресценции на SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия (без дополнительного окрашивания геля SDS-PAGE):
А: если между антителом и конъюгатом гаптен-флуорофор не образуется ковалентная связь, и при восстанавливающих, и при невосстанавливающих условиях может быть выявлена одна автофлуоресцирующая полоса с молекулярной массой свободного конъюгата гаптен-флуорофор.
Б: если между антителом и конъюгатом гаптен-флуорофор образуется ковалентная связь при невосстанавливающих условиях, может быть выявлена одна автофлуоресцирующая полоса с объединенной молекулярной массой антитела и конъюгата гаптен-флуорофор. При восстанавливающих условиях дисульфидные мостики в конъюгате антитела и конъюгата гаптен-флуорофор (гаптенилированное соединение) расщепляются, и может быть выявлена одна автофлуоресцирующая полоса с молекулярной массой свободного конъюгата гаптен-флуорофор.
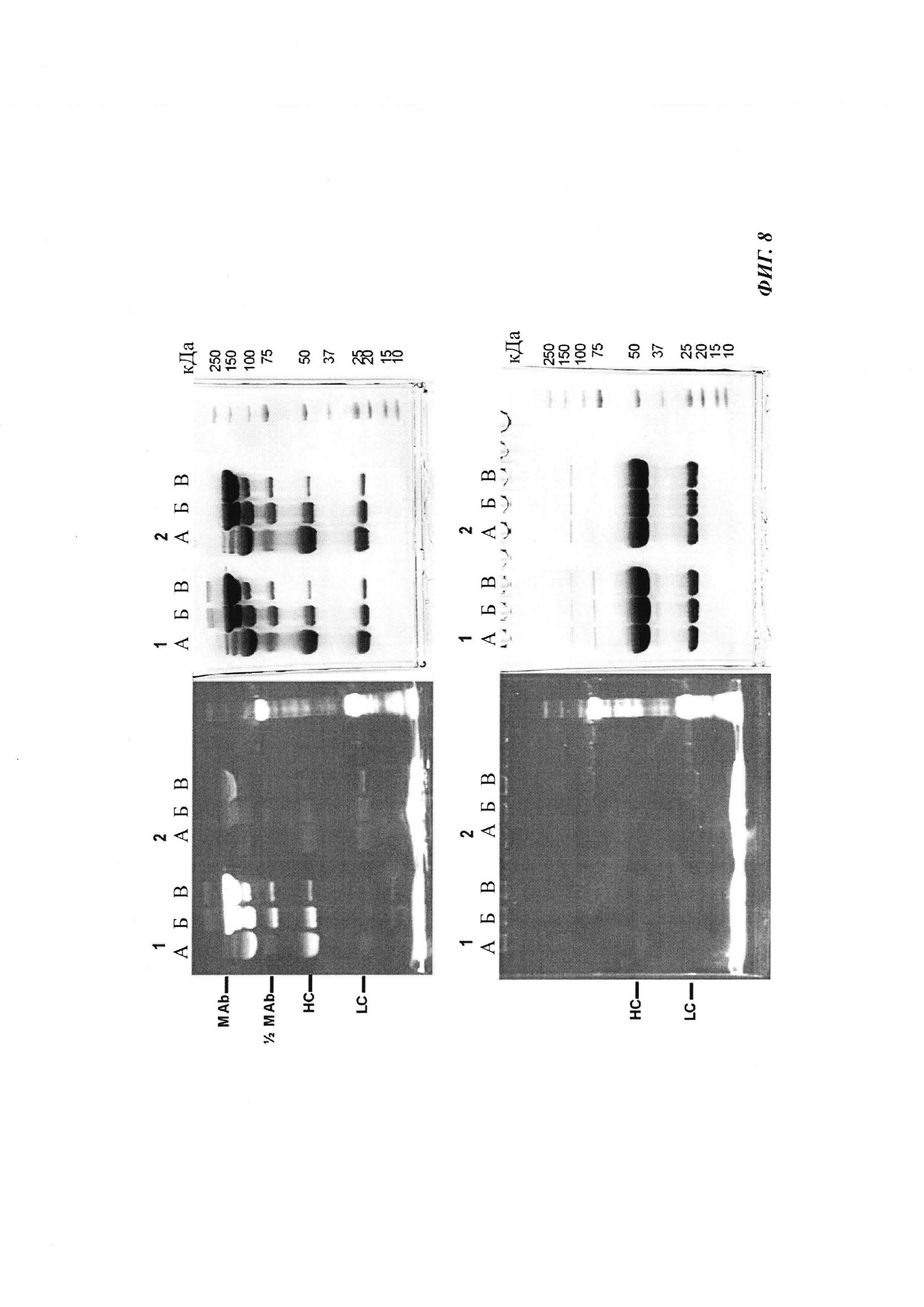
Фиг. 8: образование конъюгата гаптенсвязывающих антител с мутацией Cys с конъюгатами гаптен-Cys-флуоресцентная метка (гаптенилированное соединение) в присутствии редокс-активных агентов: окисляющего агента (глутатиона дисульфид, GSSG) и восстанавливающего агента (дитиотрейтол, DTE): образование комплекса антителом и последующее ковалентное связывание в определенных положениях выявляется посредством флуоресцентных сигналов в анализах SDS-PAGE. Анализы SDS-PAGE при невосстанавливающих (верхние изображения) и восстанавливающих (нижние изображения) условиях проводили, как описано в Примере 11. Ковалентно связанные с антителом гаптены выявляются при невосстанавливающих условиях в виде связанных с белком в подходящих положениях сигналов большего размера. Данные сигналы отделяются от белка при восстановлении и видны при восстанавливающих условиях в виде маленьких соединений.
Слева: флуоресцентное изображение
Справа: окрашивание кумасси синим
Ряд 1: антитело против дигоксигенина с мутацией 52bC
Ряд 2: антитело против дигоксигенина с остатком дикого типа в положении 52b
(A) ковалентное связывание с использованием 3 мМ DTE и 10 мМ GSSG;
(Б) ковалентное связывание с использованием 0,3 мМ DTE и 1 мМ GSSG;
(B) ковалентное связывание с использованием 0,03 мМ DTE и 0,1 мМ GSSG.
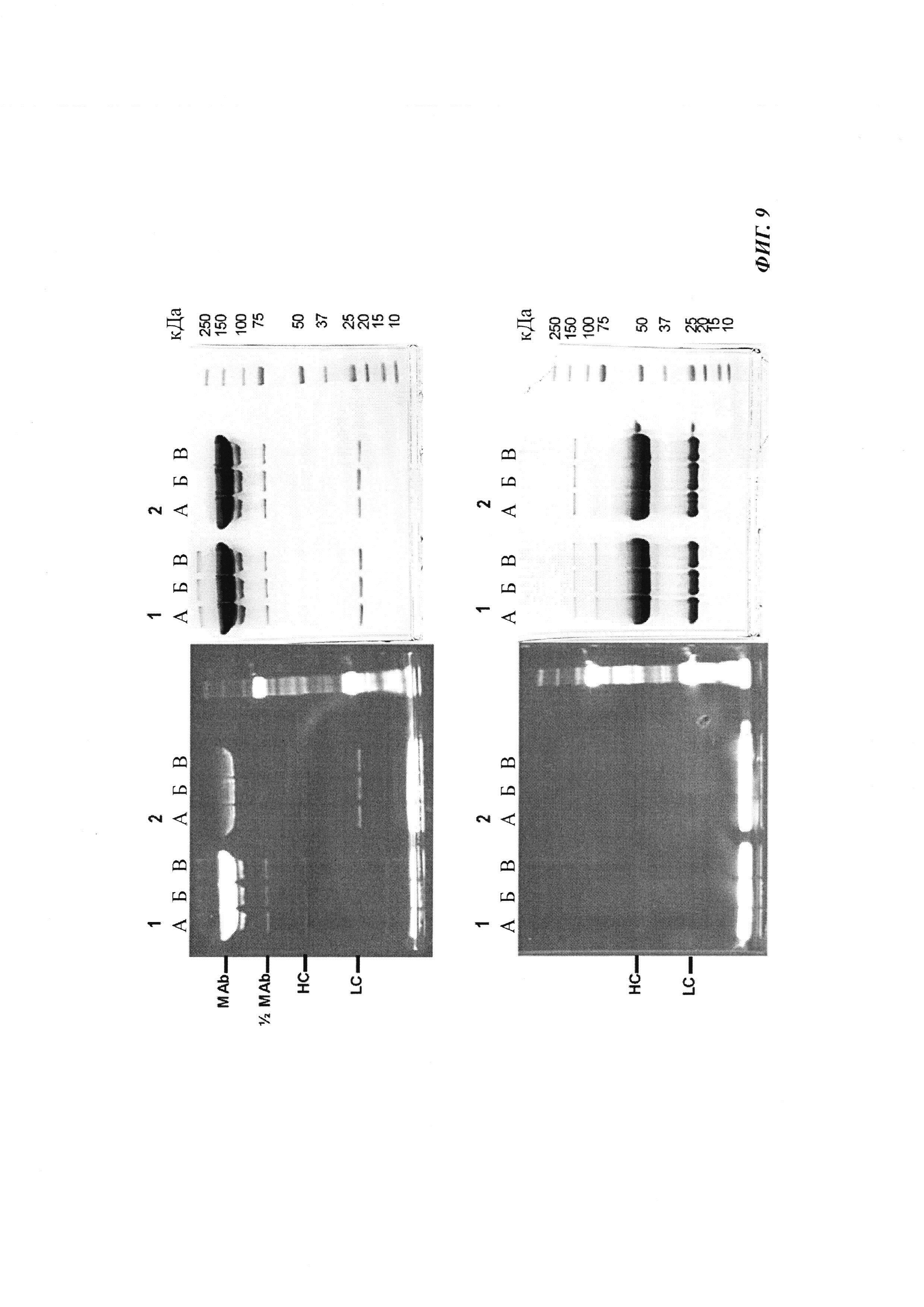
Фиг. 9: образование комплекса гаптенсвязывающих антител с мутацией Cys с конъюгатами гаптен-Cys-флуоресцентная метка в присутствии только окислительного агента (глутатиона дисульфид, GSSG), но в отсутствие восстановительных агентов или в отсутствие обоих: образование комплекса антителом и последующее ковалентное связывание в определенных положениях выявляется в анализах SDS-PAGE по флуоресцентным сигналам. Анализы SDS-PAGE при невосстанавливающих (верхние изображения) и восстанавливающих (нижние изображения) условиях проводили, как описано в Примере 12. Ковалентно связанные с антителом гаптены выявляются при невосстанавливающих условиях в виде связанных с белком в подходящих положениях сигналов большего размера. Данные сигналы отделяются от белка при восстановлении и видны при восстанавливающих условиях в виде маленьких соединений.
Слева: флуоресцентное изображение
Справа: окрашивание кумасси синим
Ряд 1: антитело против дигоксигенина с мутацией 52bC
Ряд 2: антитело против дигоксигенина с остатком дикого типа в положении 52b
(A) без добавок
(Б) ковалентное связывание с 1 мМ GSSG;
(B) ковалентное связывание с 0,1 мМ GSSG.
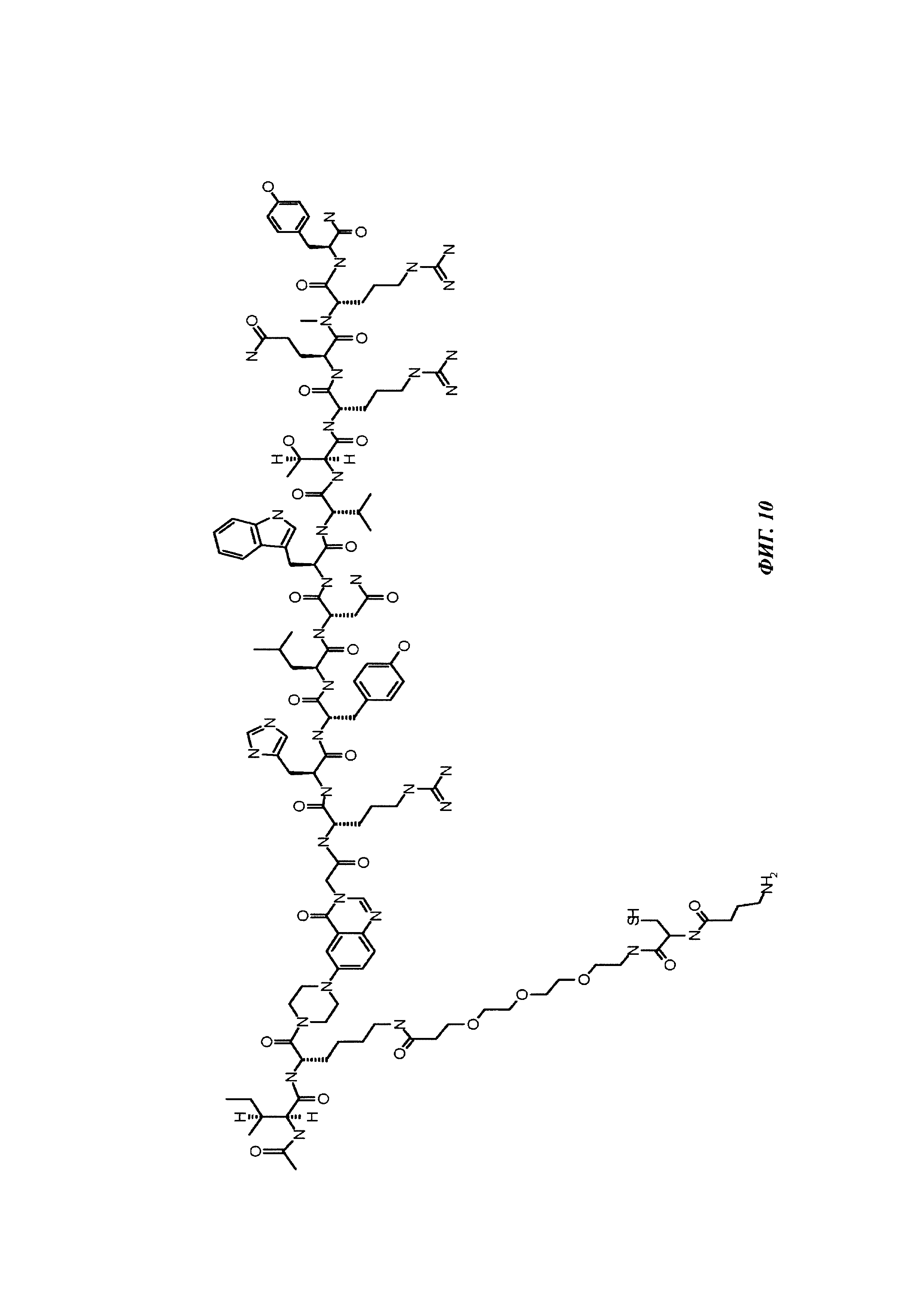
Фиг. 10: структура Ac-PYY(PEG3-Cys-4Abu-NH2).
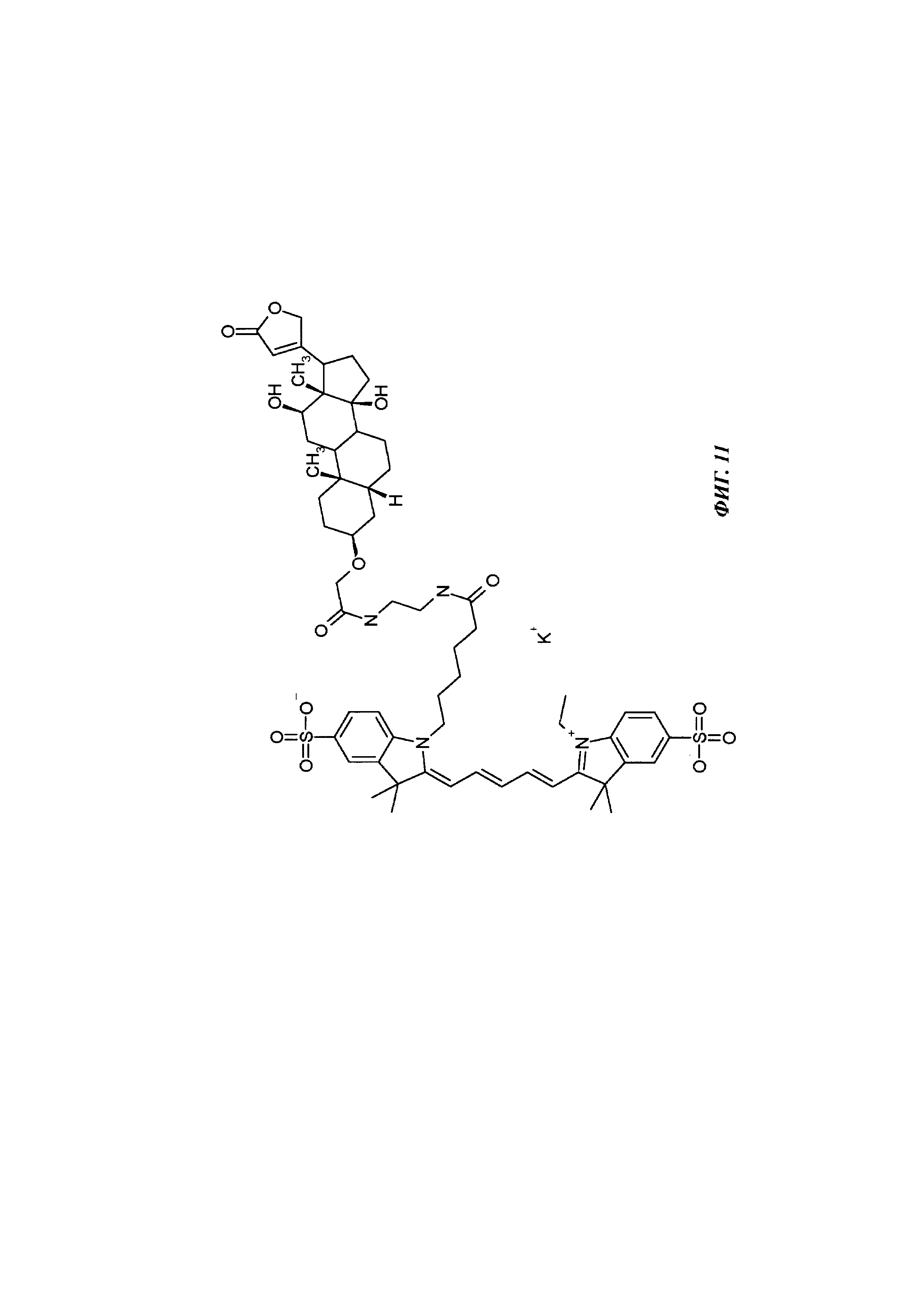
Фиг. 11: структура DIG-3-cme-eda-Cy5.
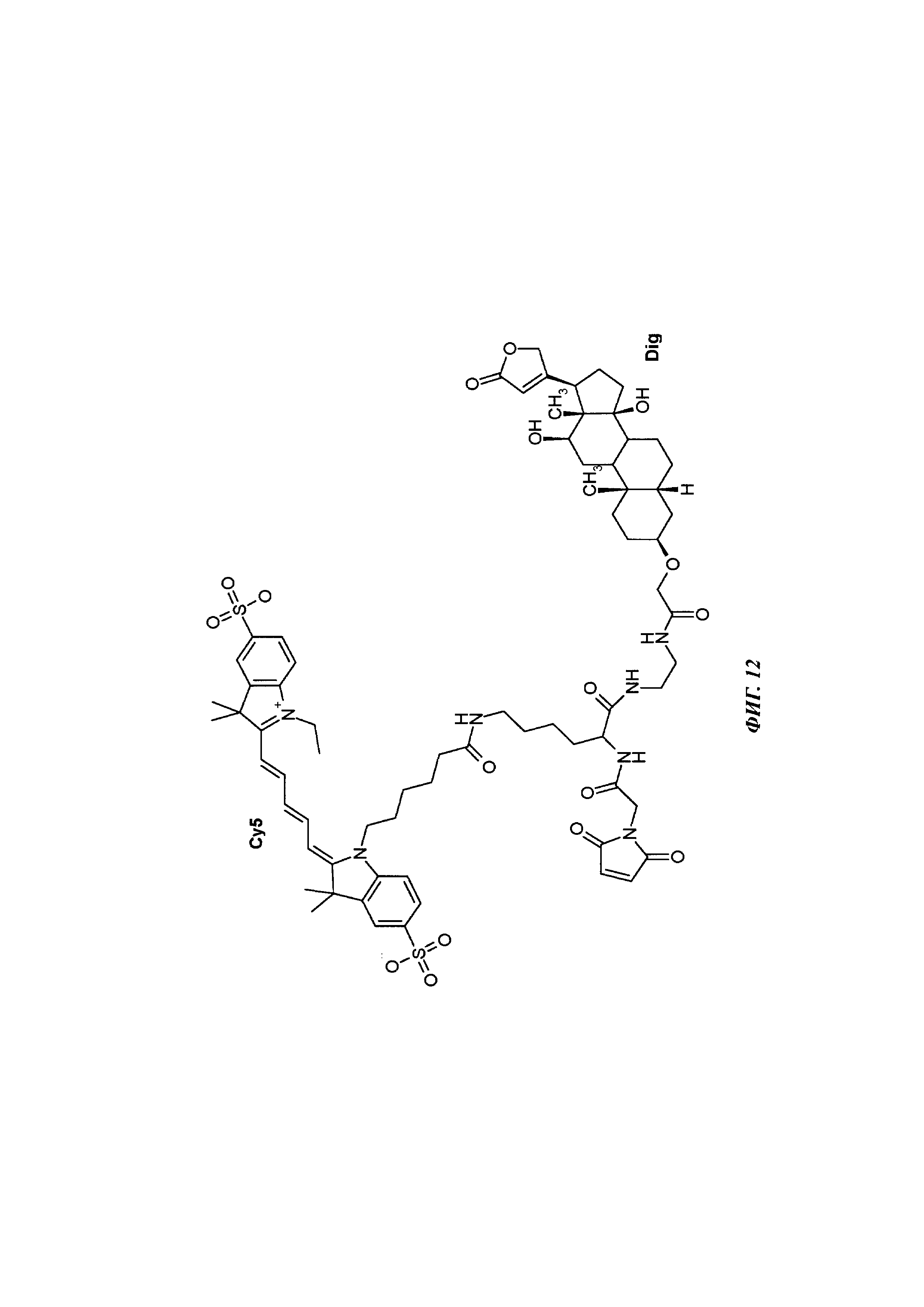
Фиг. 12: структура DIG-малеимид-Cy5.
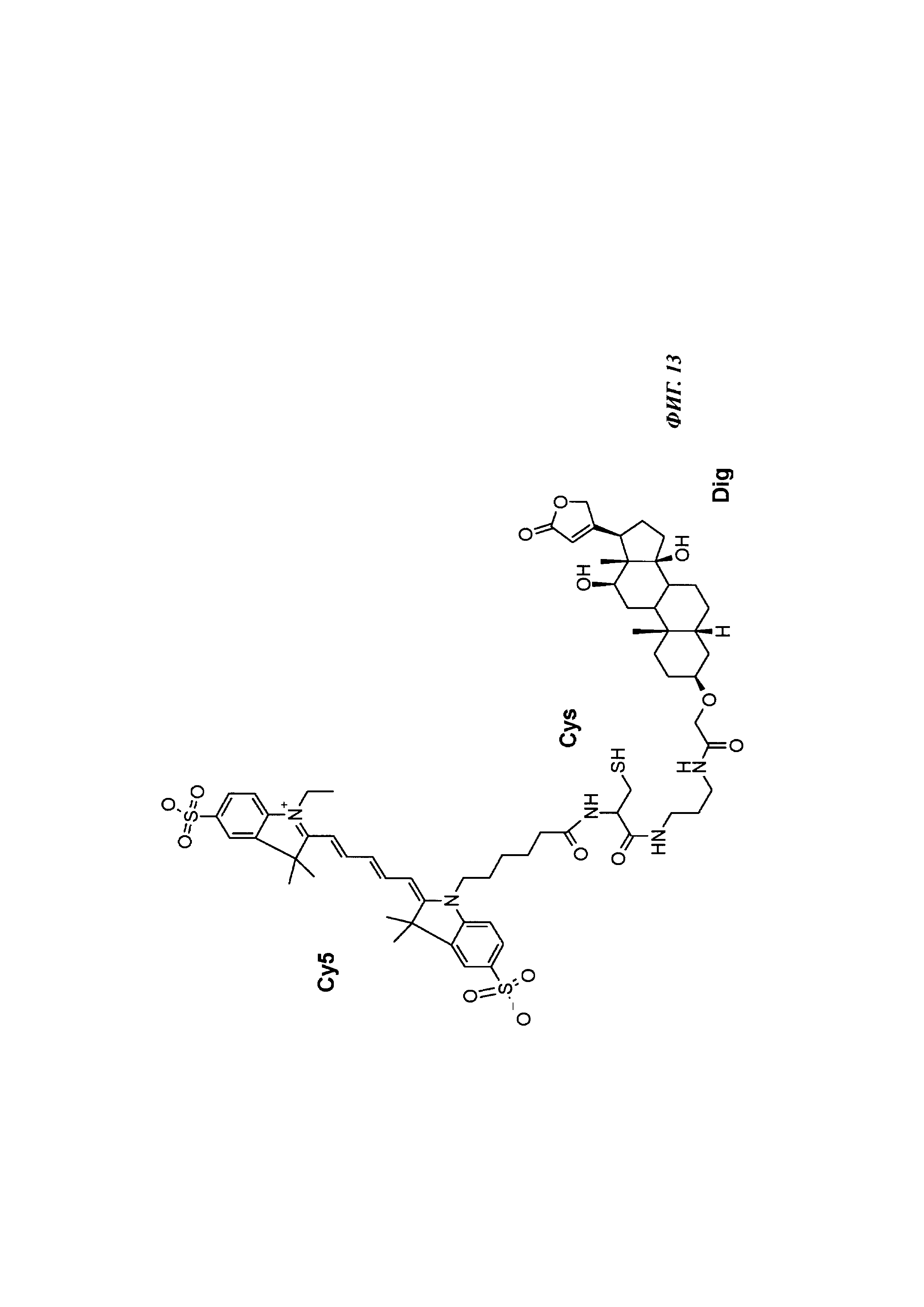
Фиг. 13: структура DIG-eda-Cys-Cy5.
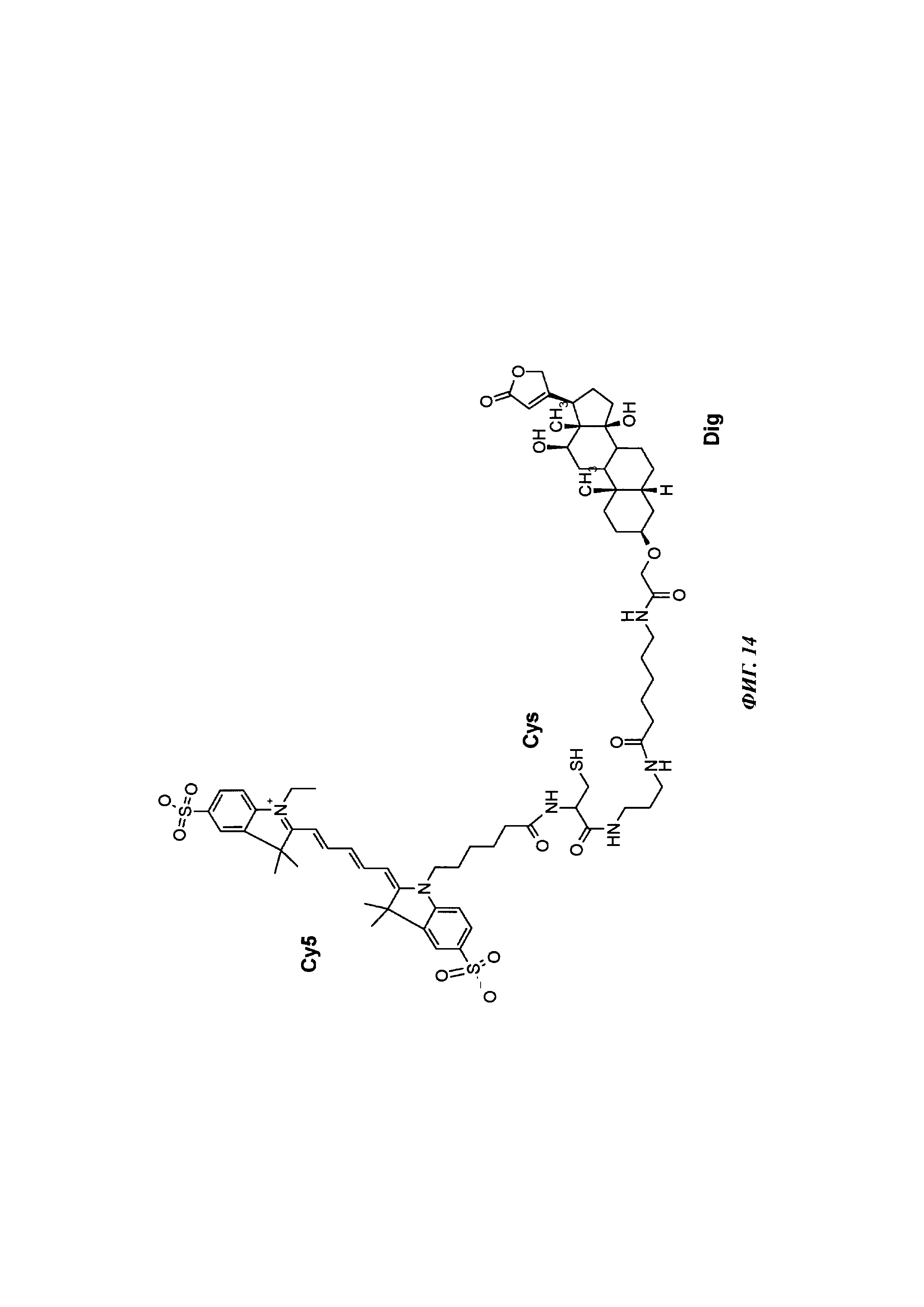
Фиг. 14: структура DIG-Ahx-Cys-Cy5.
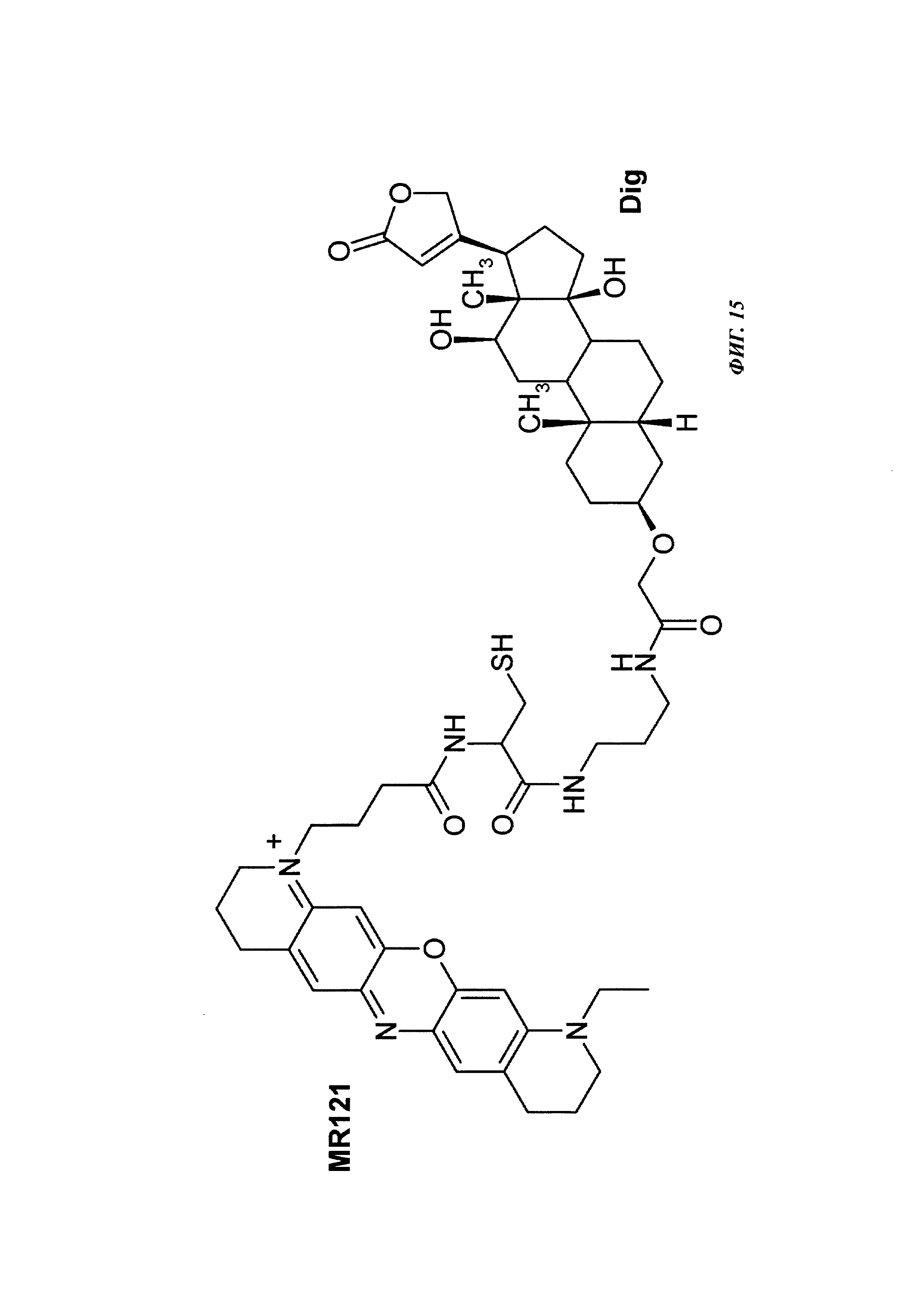
Фиг. 15: структура DIG-Cys-MR121.
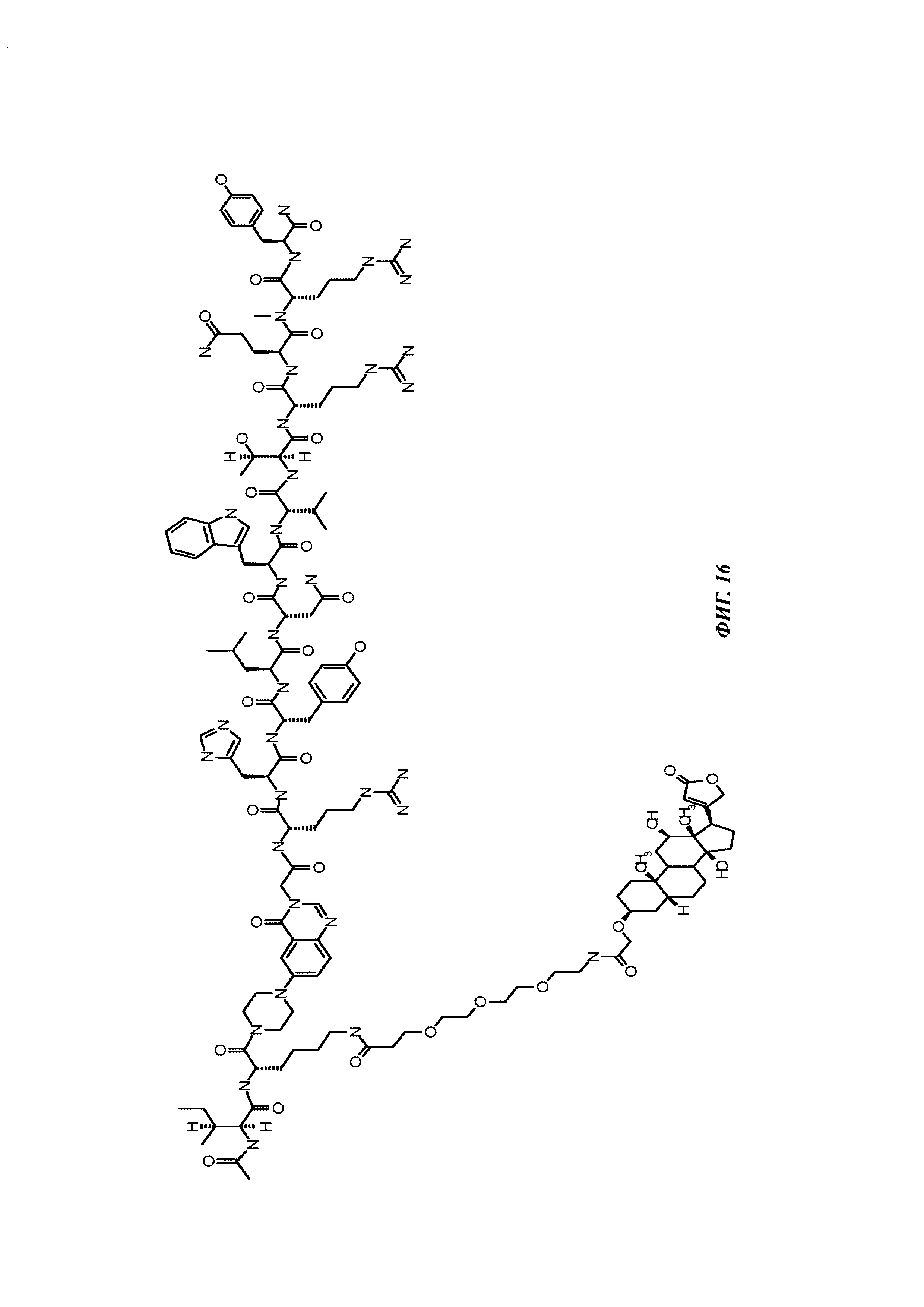
Фиг. 16: структура Ac-PYY(PEG3-Dig).
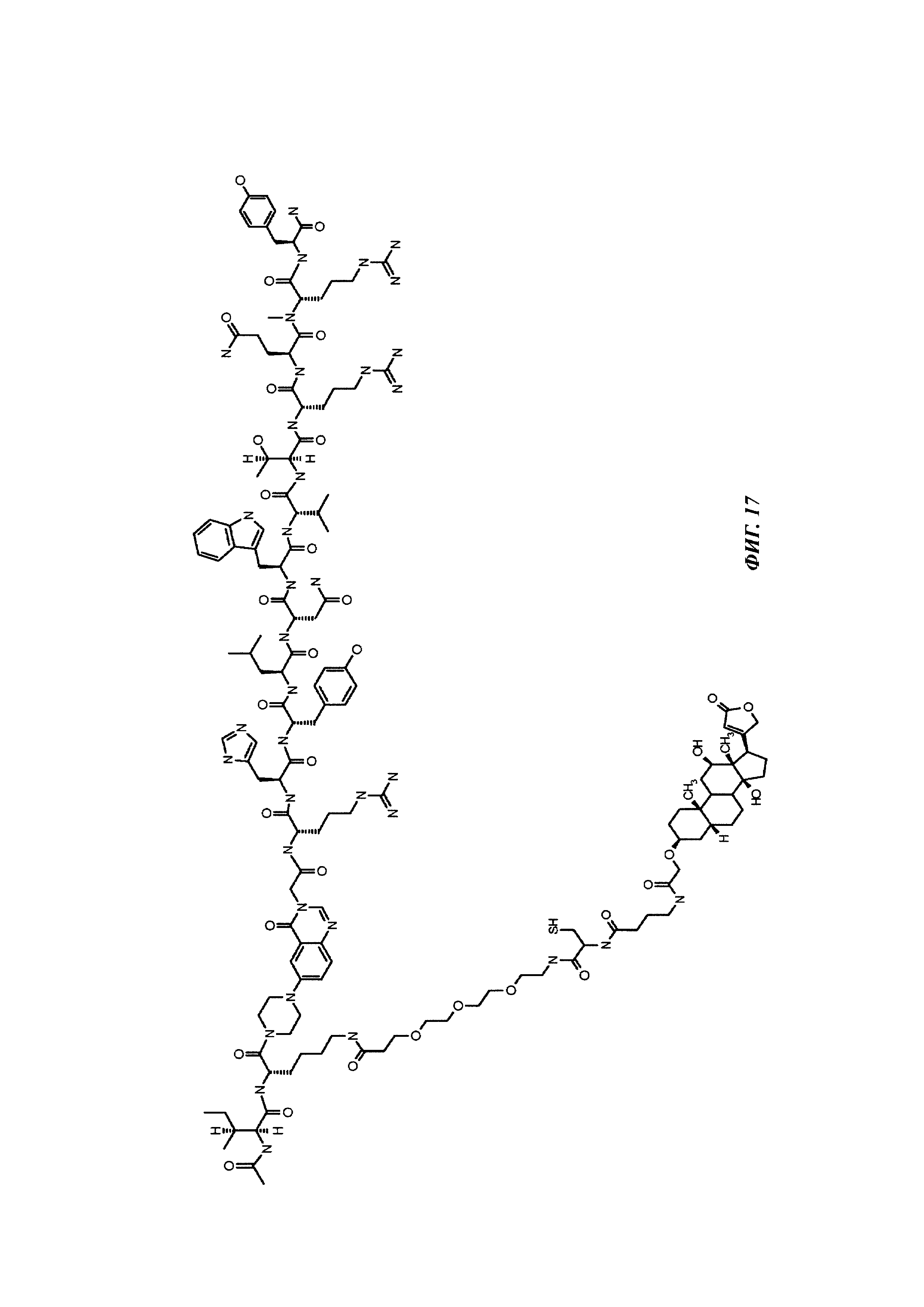
Фиг. 17: структура Ac-PYY(PEG3-Cys-4Abu-Dig).
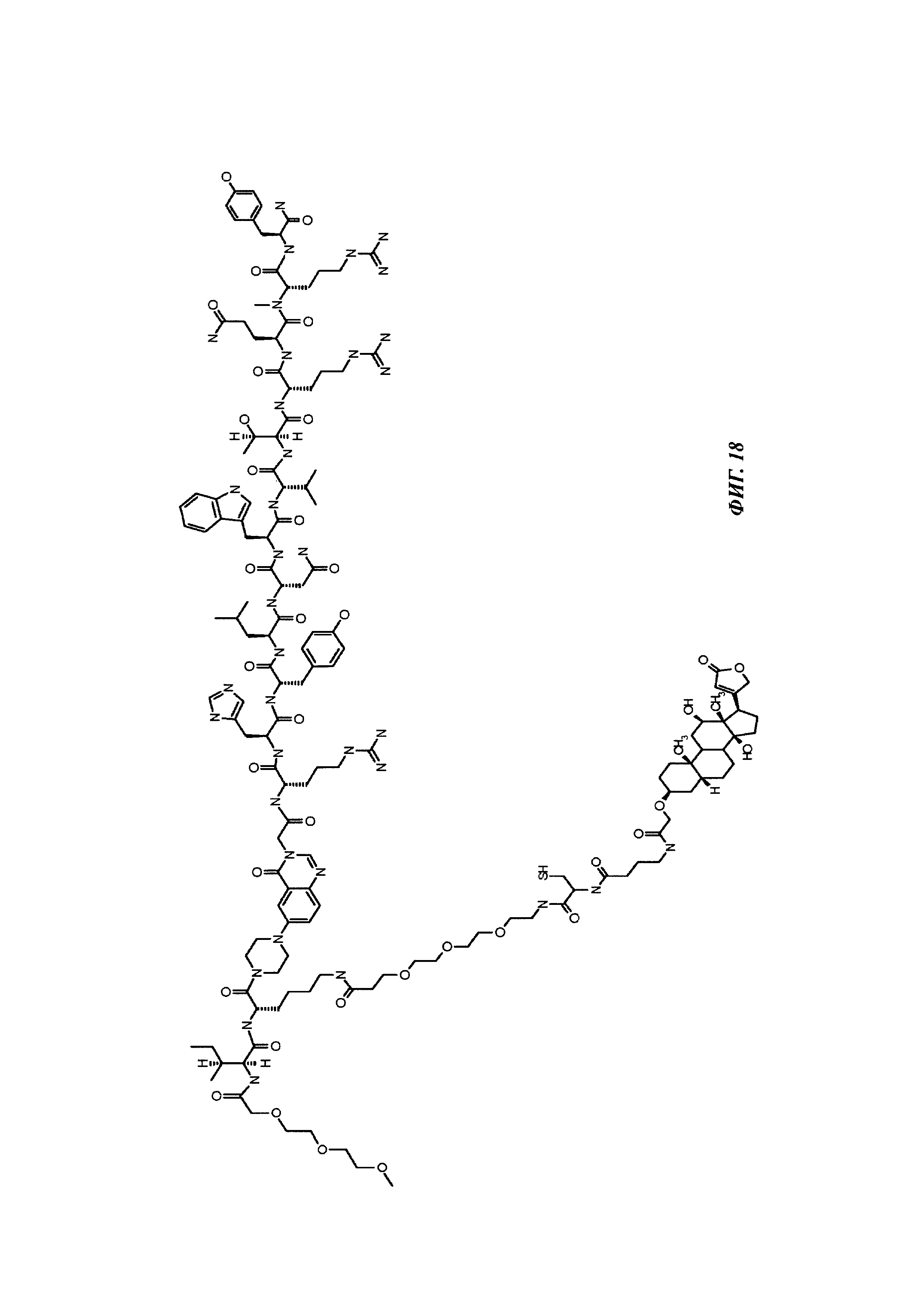
Фиг. 18: структура PEG3-PYY(PEG3-Cys-4Abu-Dig).
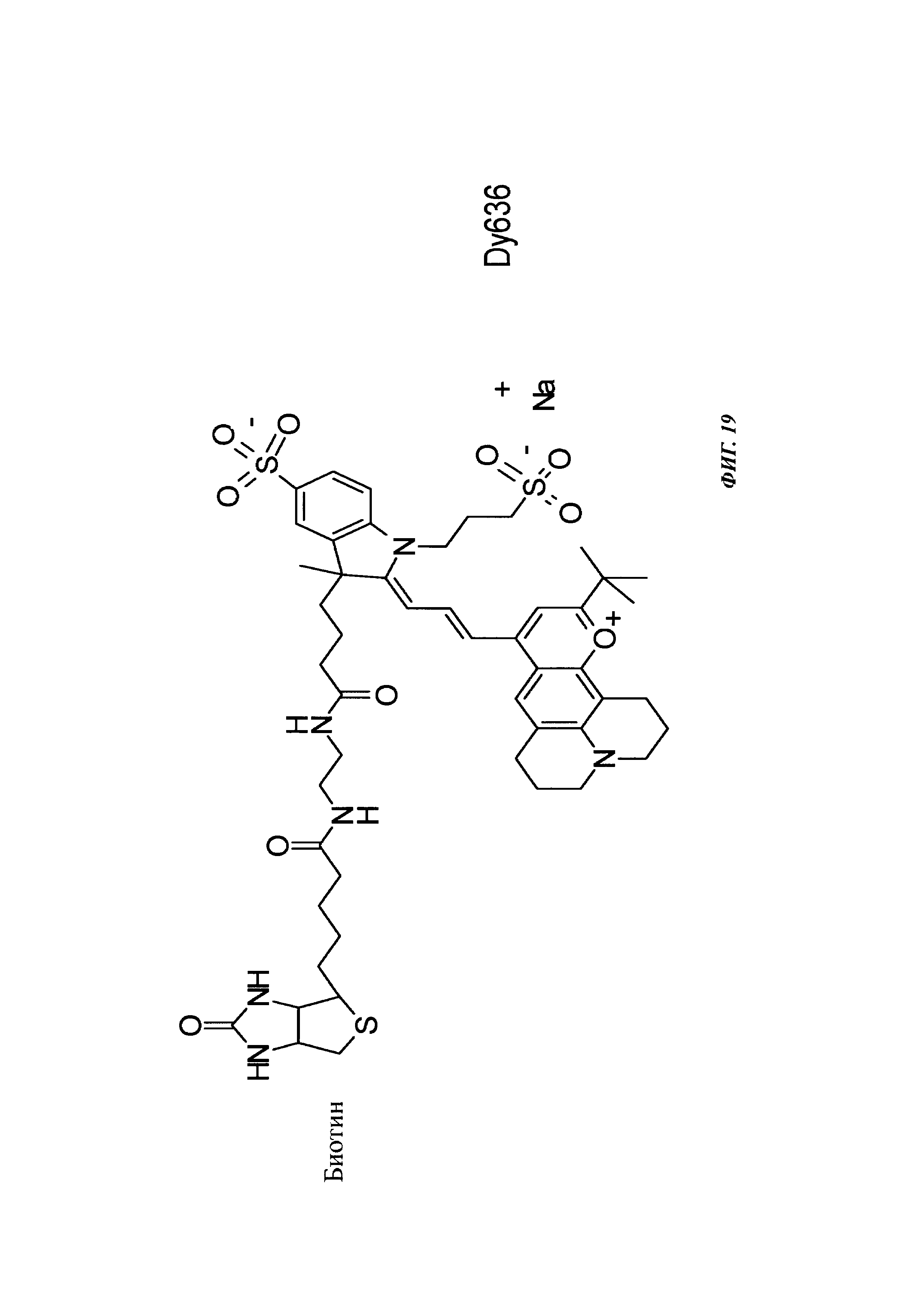
Фиг. 19: структура Dy636-eda-Btn.
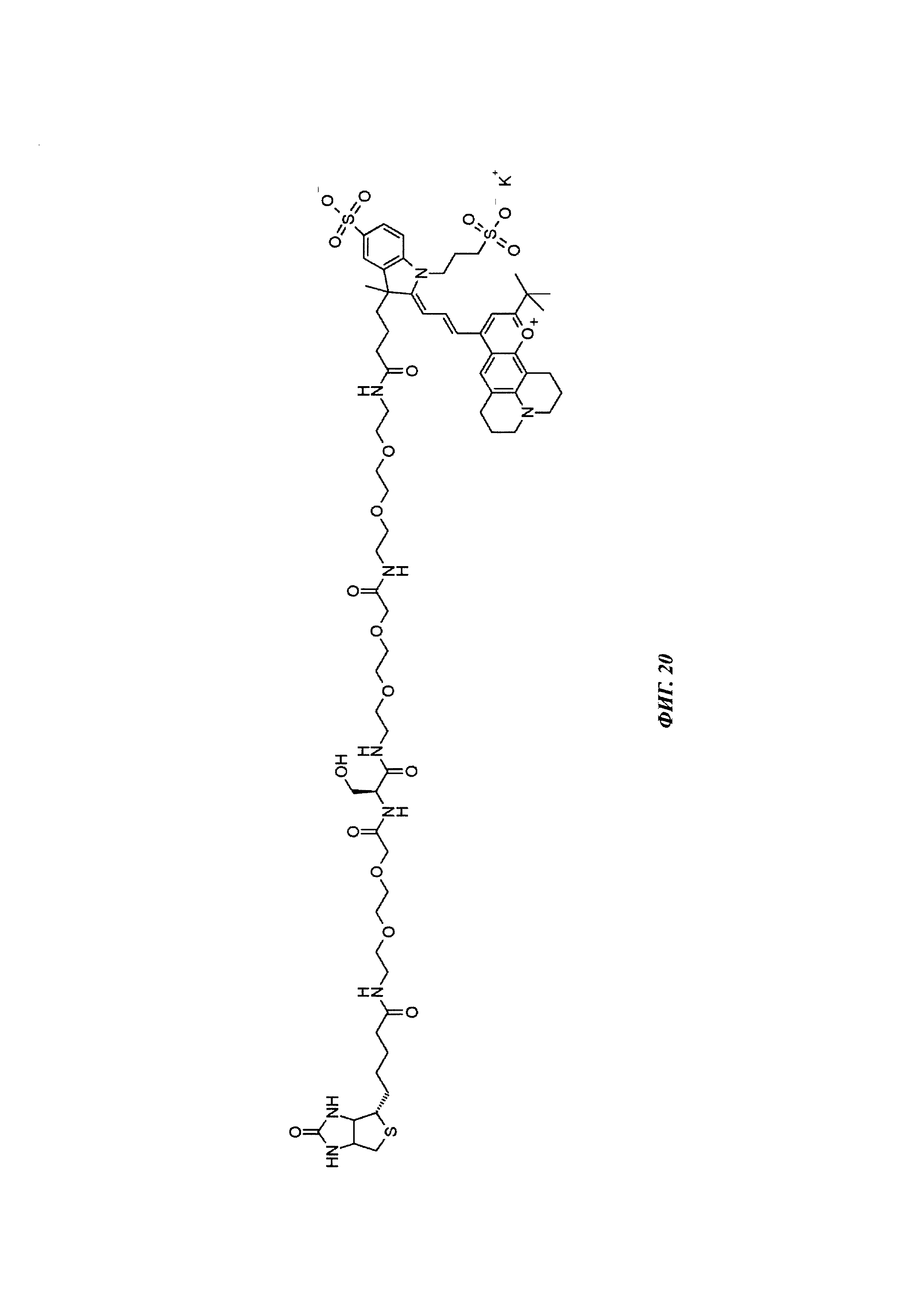
Фиг. 20: структура Dy636-Ser-Btn.
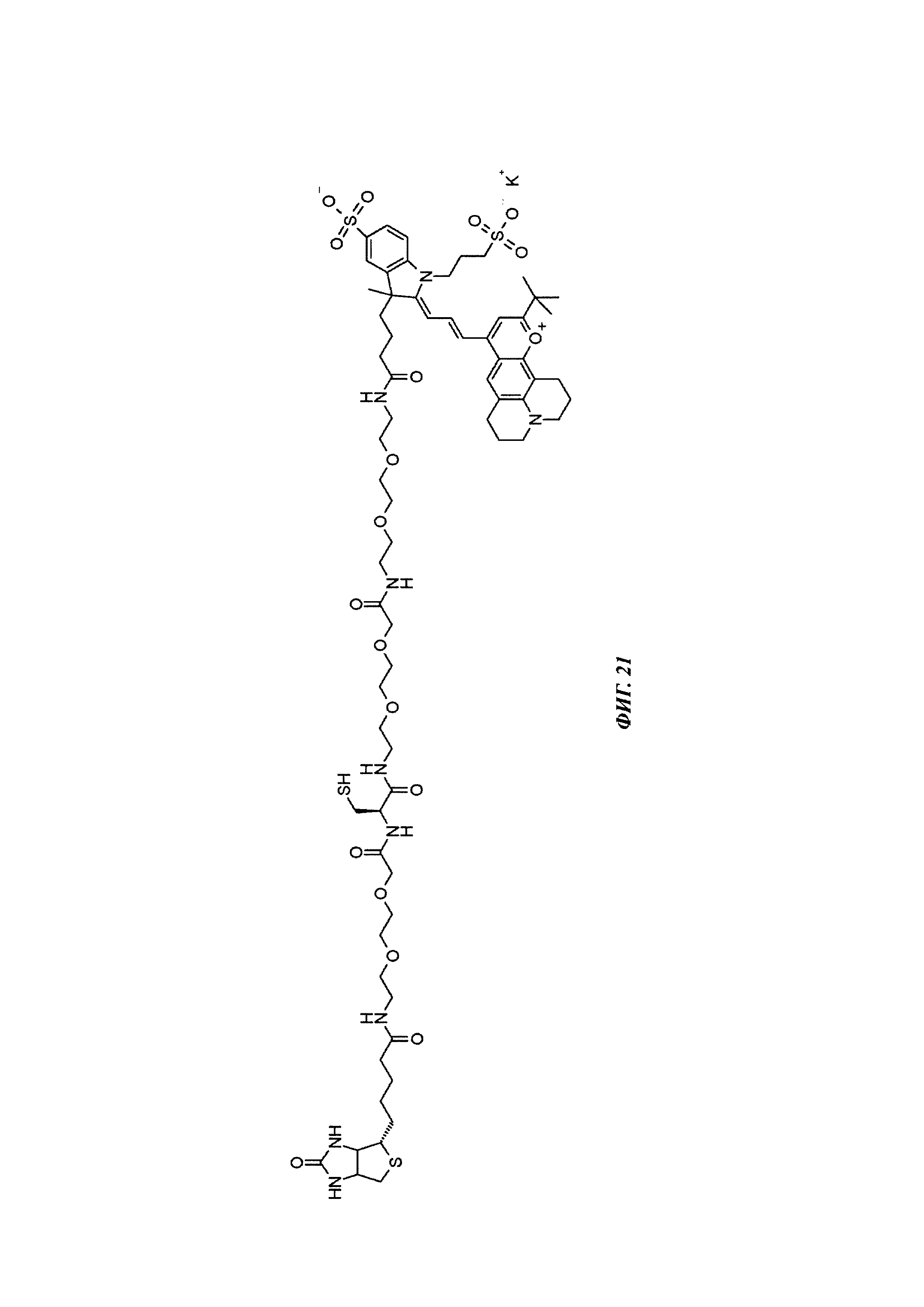
Фиг. 21: структура Dy636-Cys-Btn.
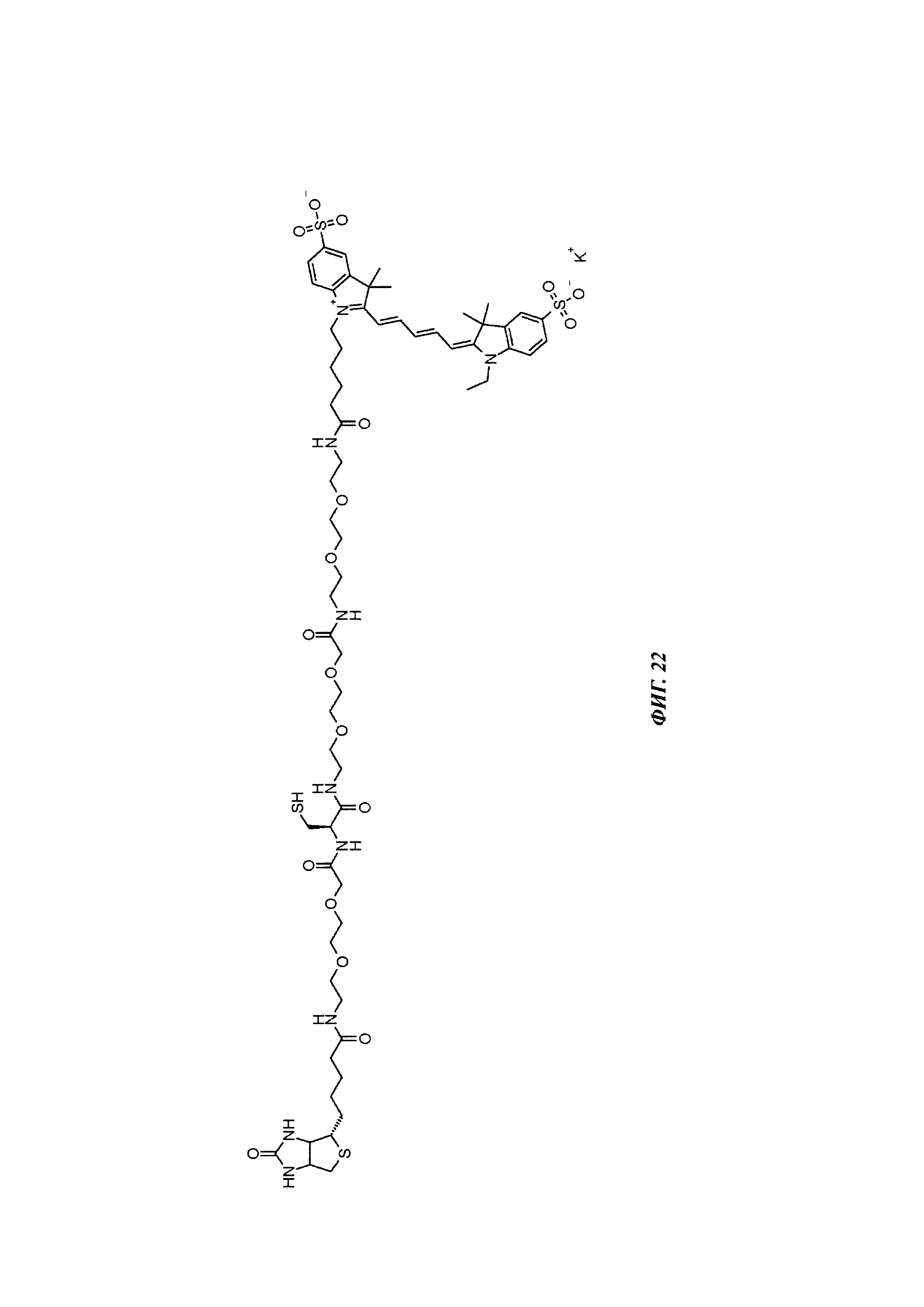
Фиг. 22: структура Cy5-Cys-Btn.
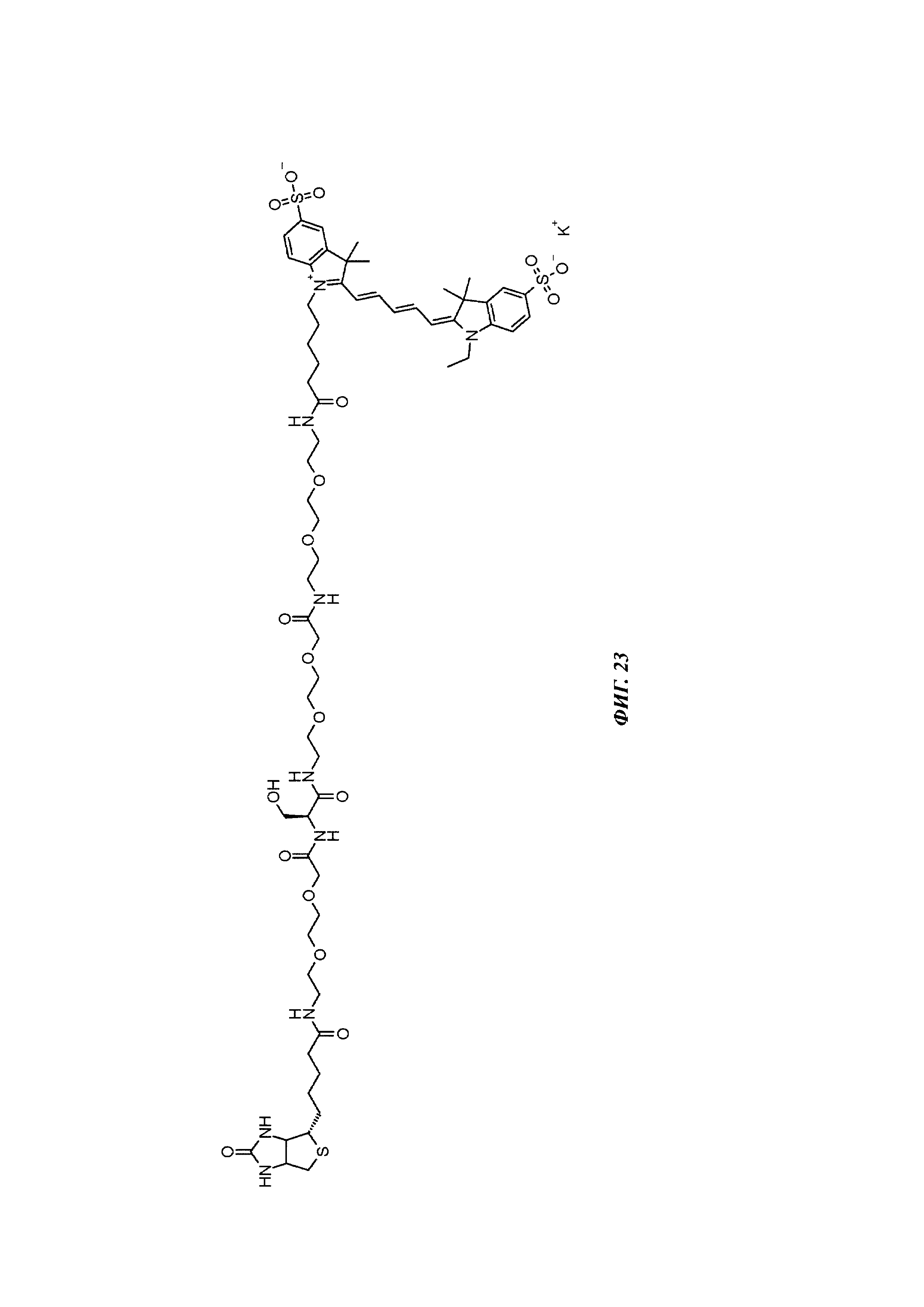
Фиг. 23: структура Cy5-Ser-Btn.
Фиг. 24: структура Ac-PYY(PEG2-Btn).
Фиг. 25: структура Ac-PYY-PEG3-Cys-β-Ala-Btn.
Фиг. 26: структура Ac-PYY-PEG3-Ser-PEG2-Btn.
Фиг. 27: структура Ac-PYY-PEG3-Cys-PEG2-Btn.
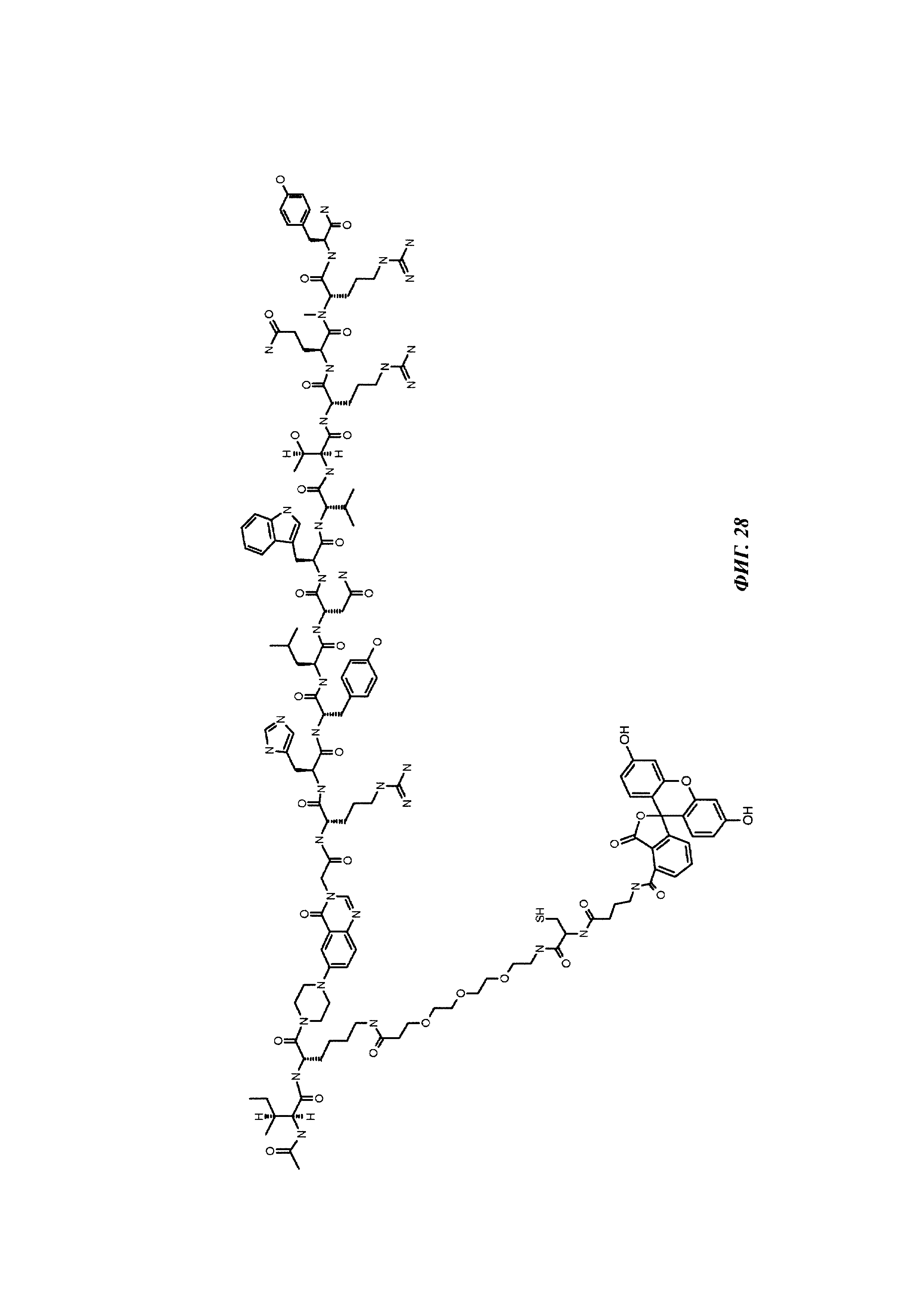
Фиг. 28: структура Ac-PYY(PEG3-Cys-4-Abu-5-Fluo).
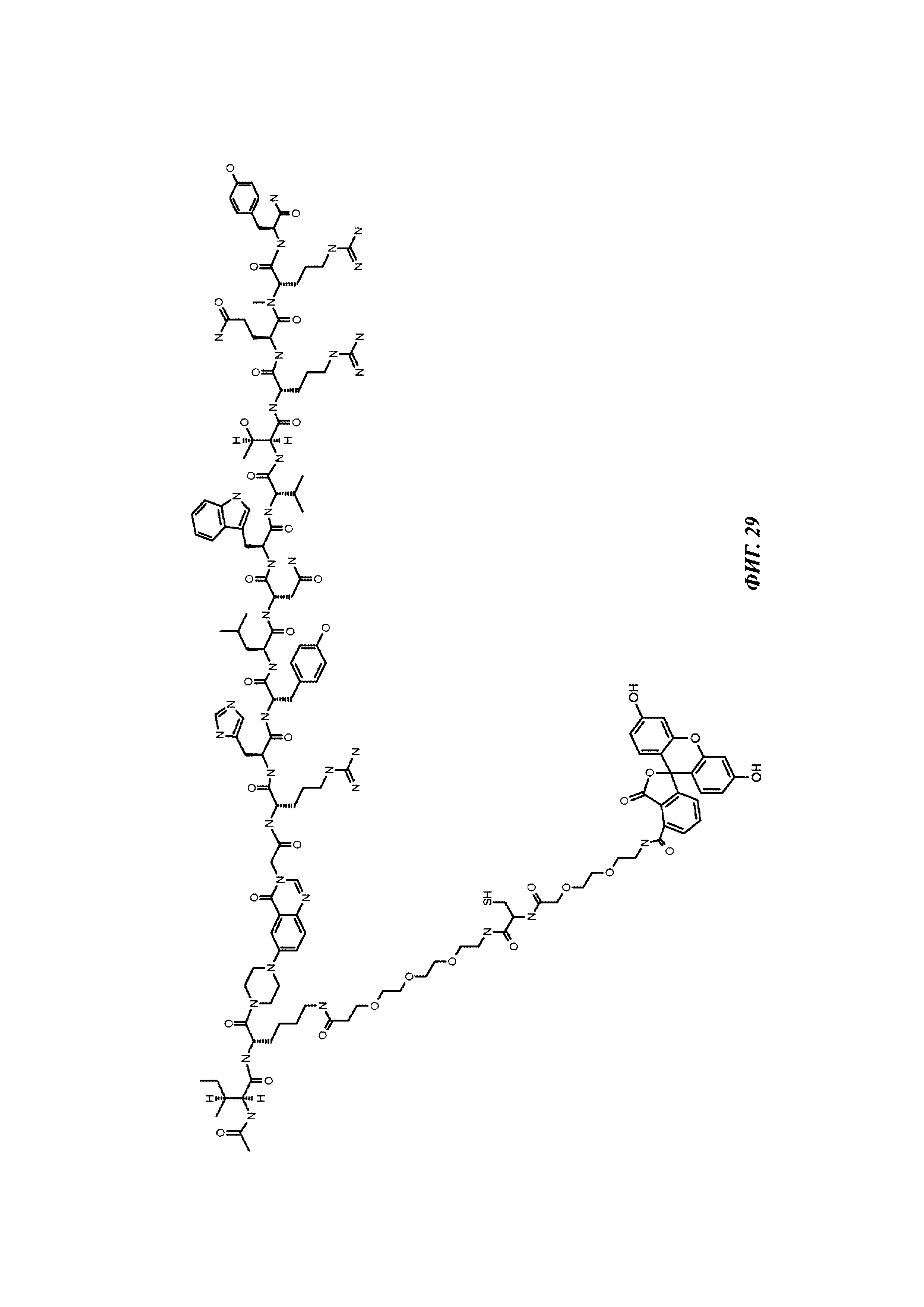
Фиг. 29: структура Ac-PYY(PEG3-Cys-PEG2-5-Fluo).
Фиг. 30: схема получения Ac-PYY(PEG2-Btn).
Фиг. 31: схема получения Ac-PYY(PEG3-Cys-β-Ala-Btn).
Фиг. 32: схема получения Ac-PYY(PEG3-Cys-4-Abu-Dig).
Фиг. 33: полученная рентгеноструктурным анализом структура мышиного антитела против биотина в комплексе с биоцитинамидом. Аминокислотные остатки, которые взаимодействуют с биоцитинамидом, показаны в виде палочек.
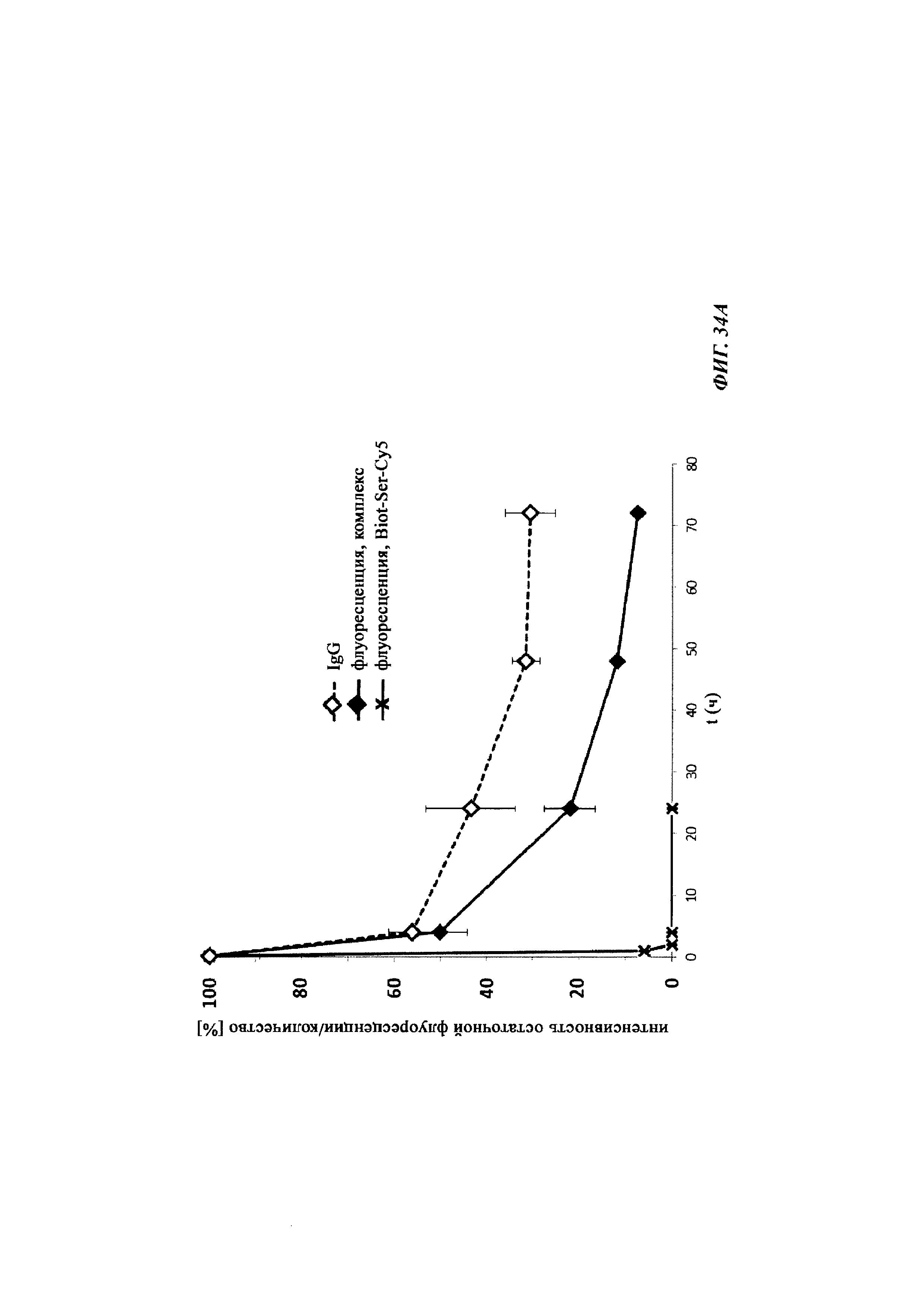
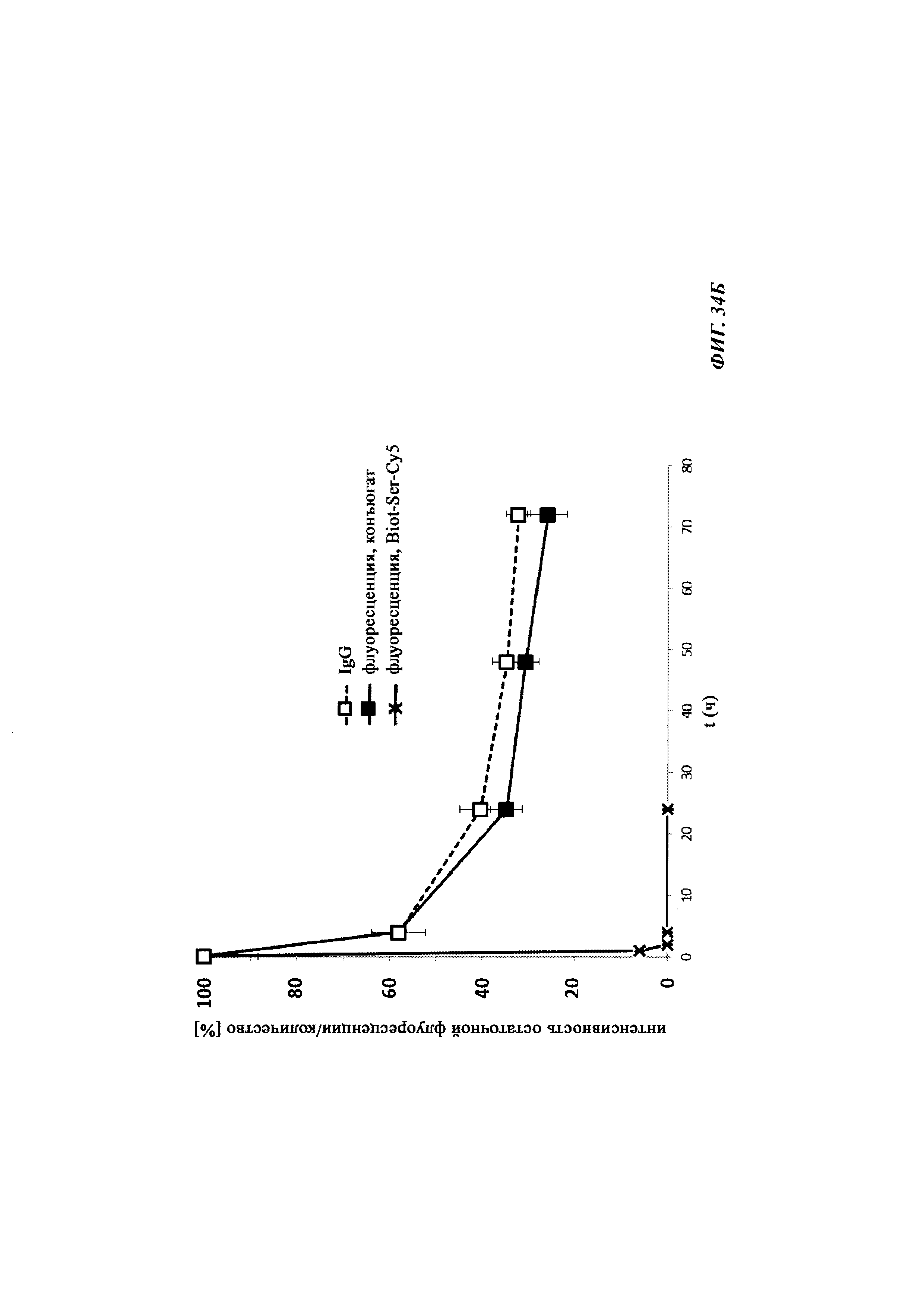
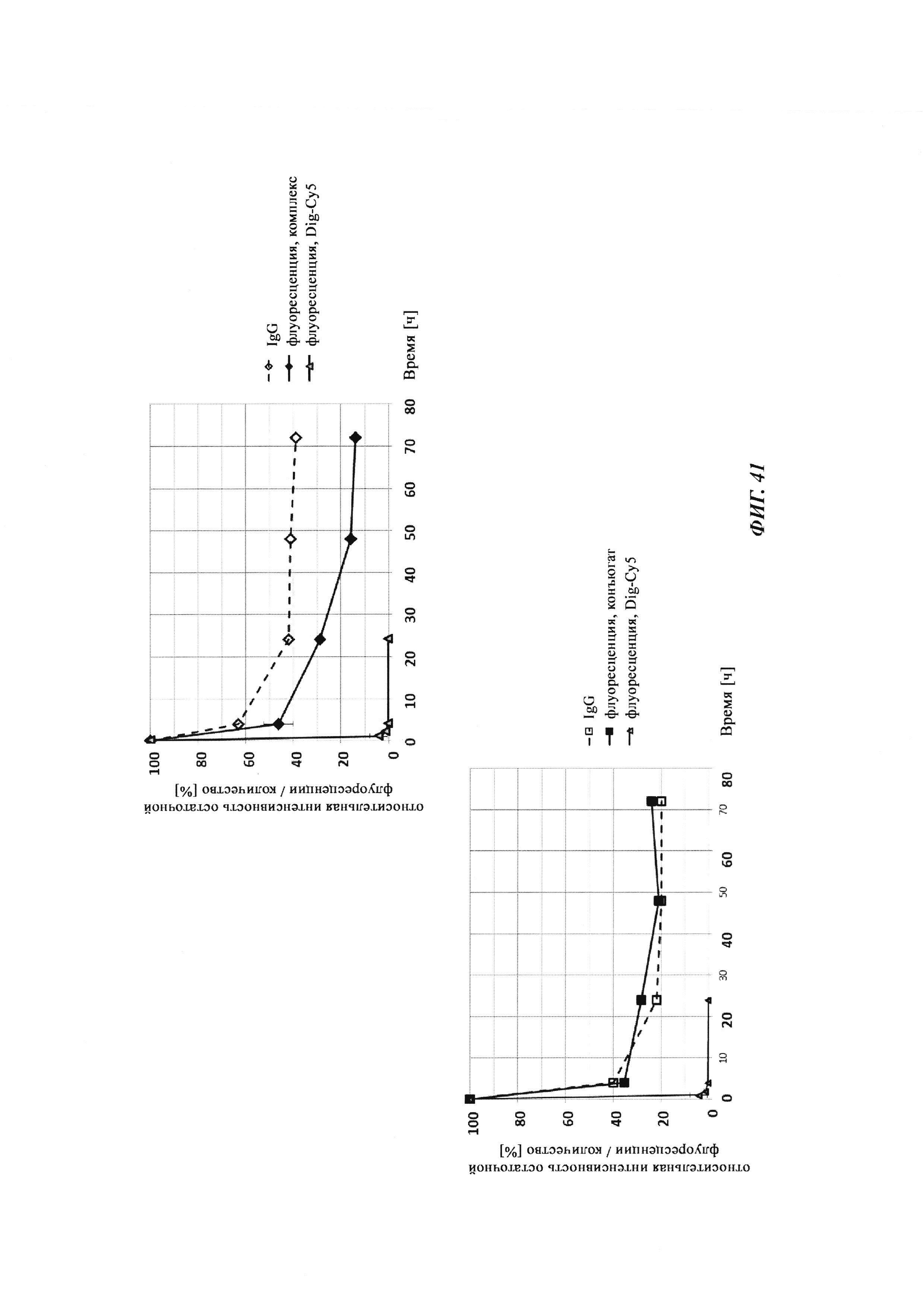
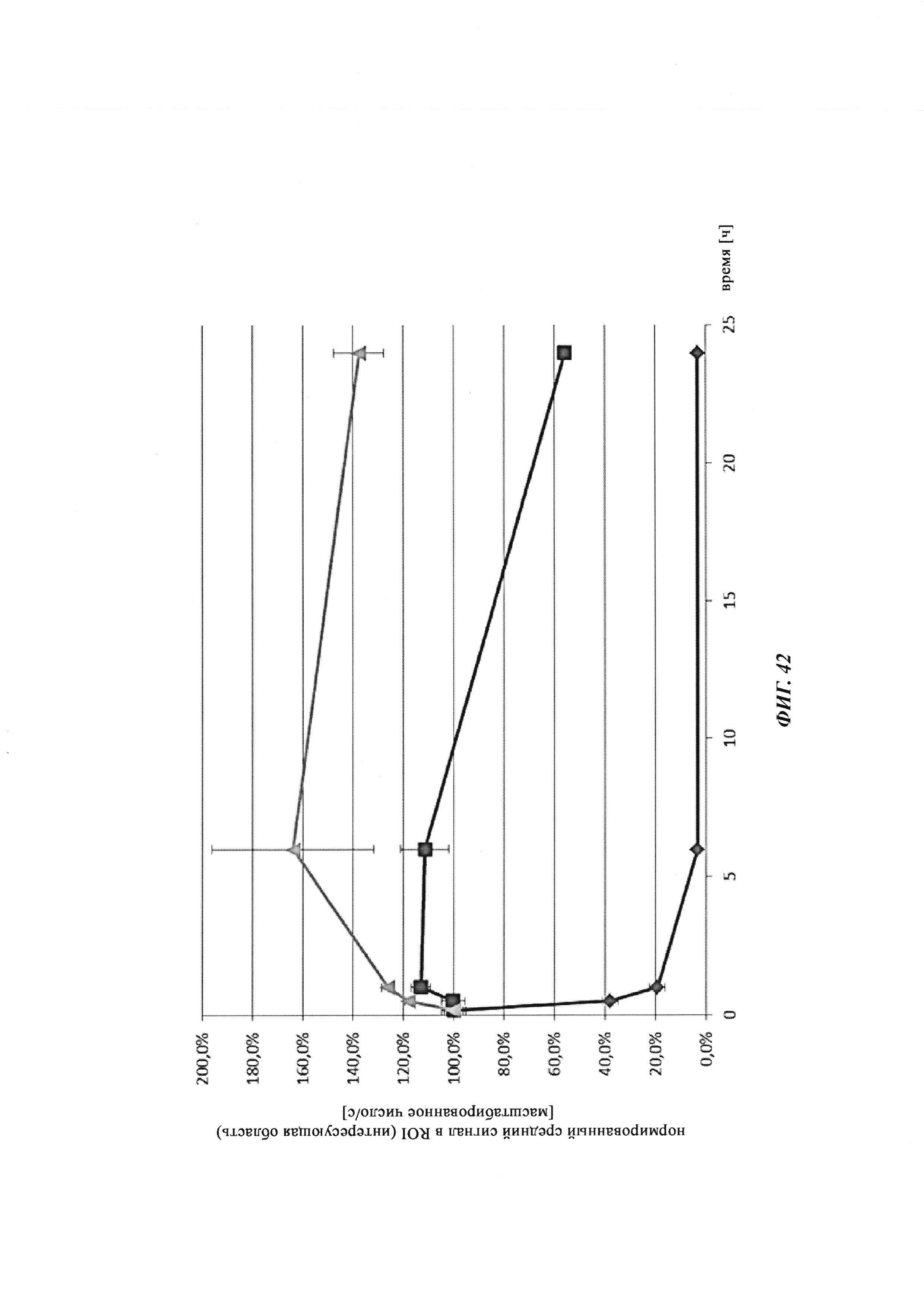
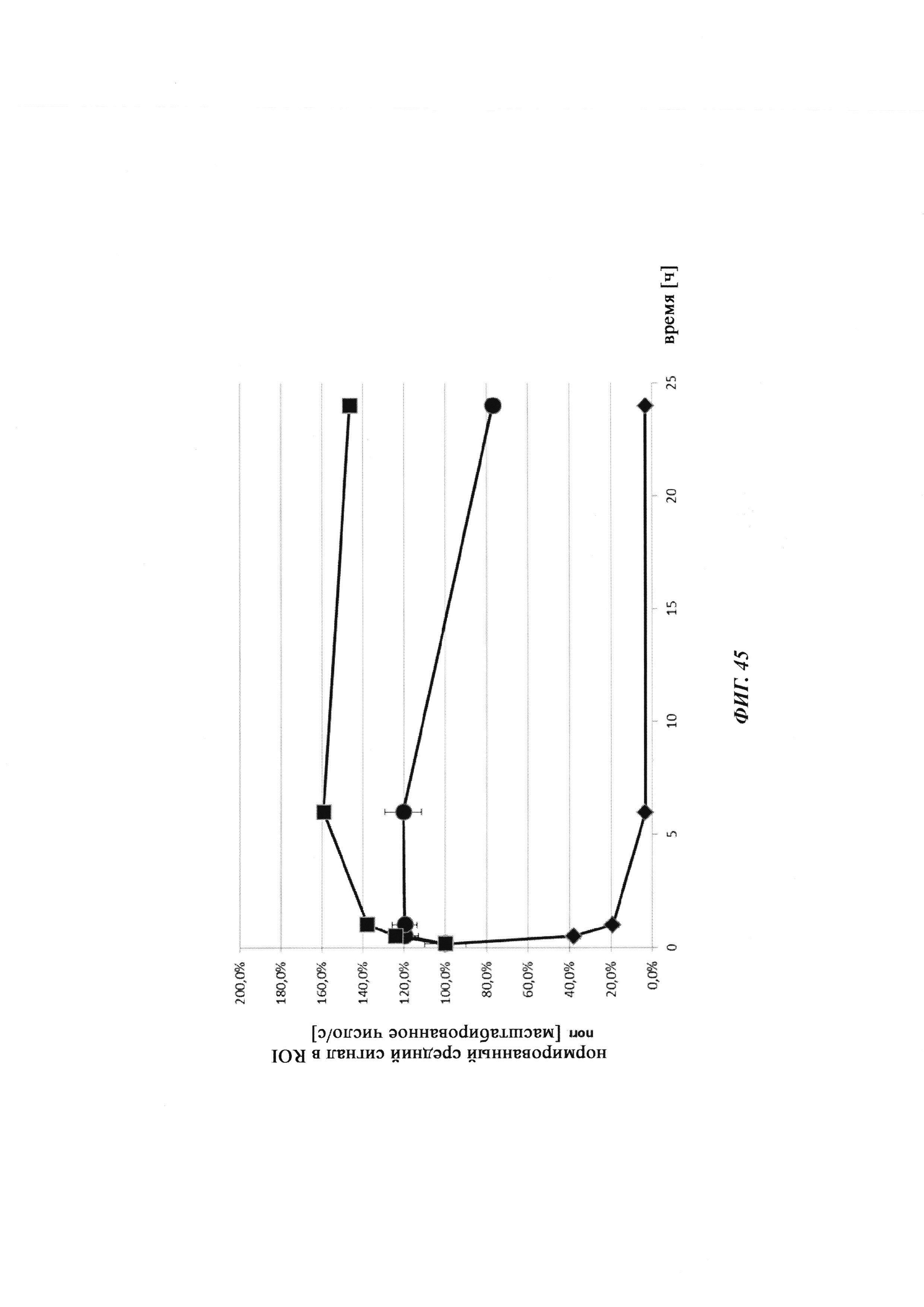
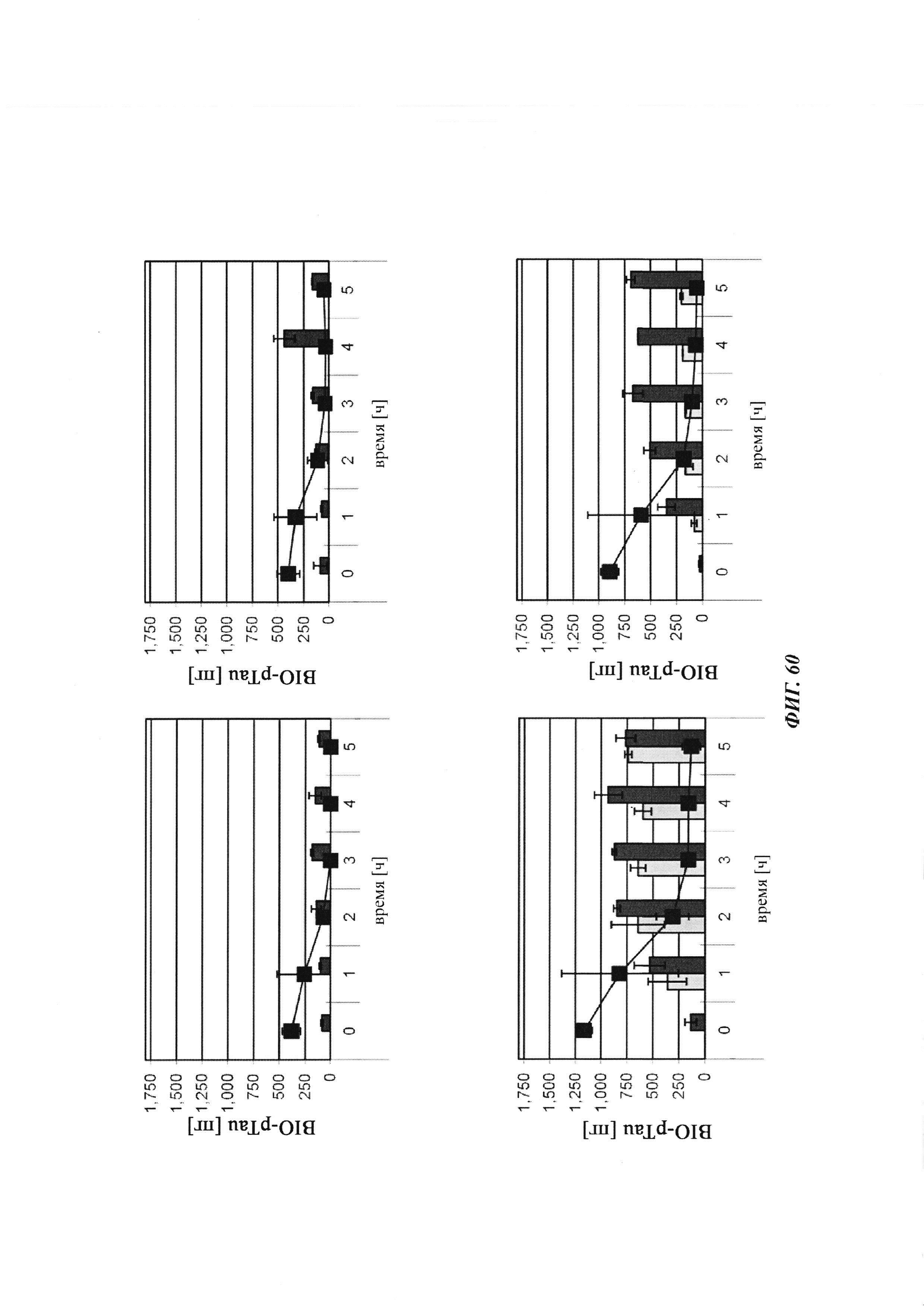
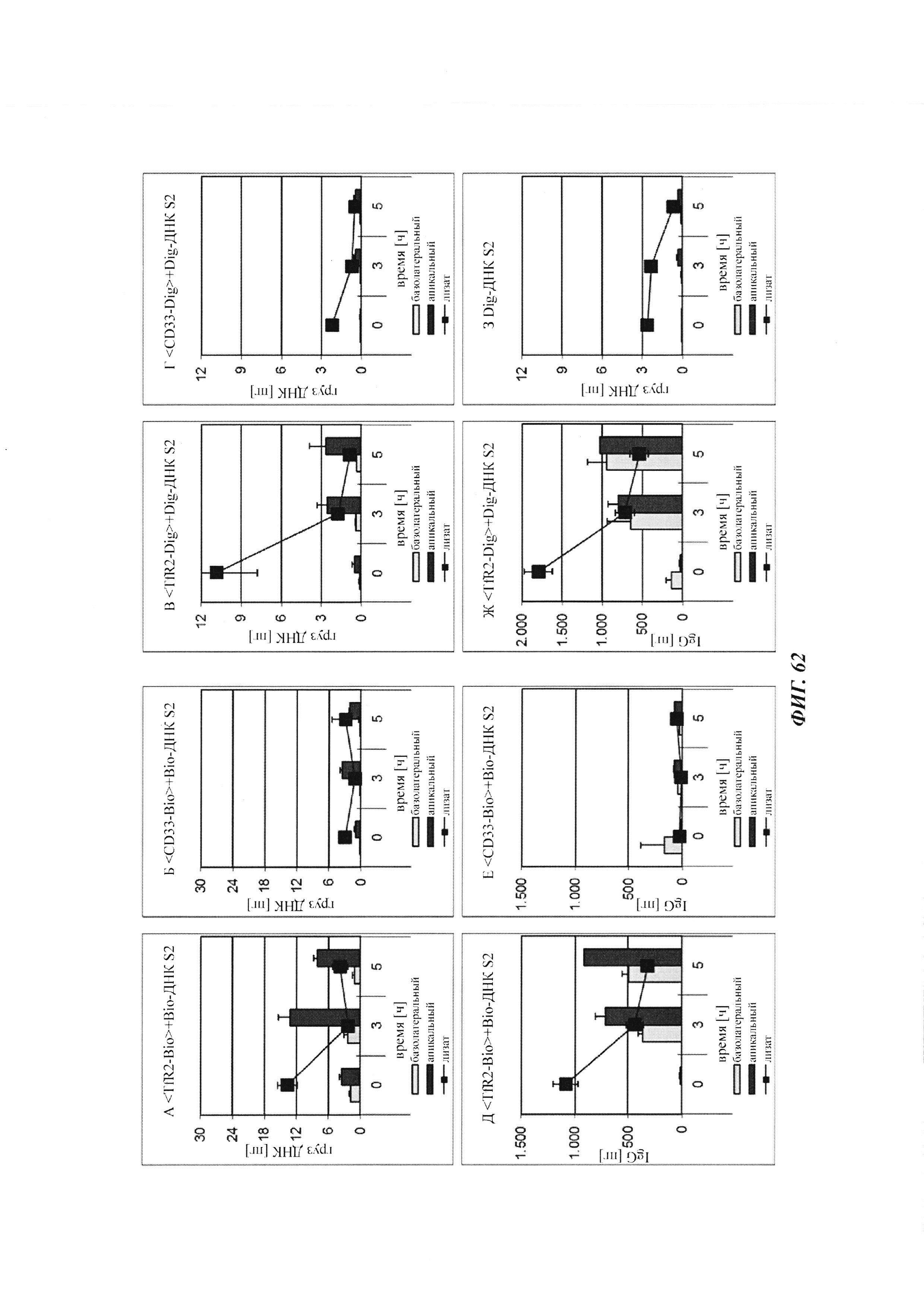
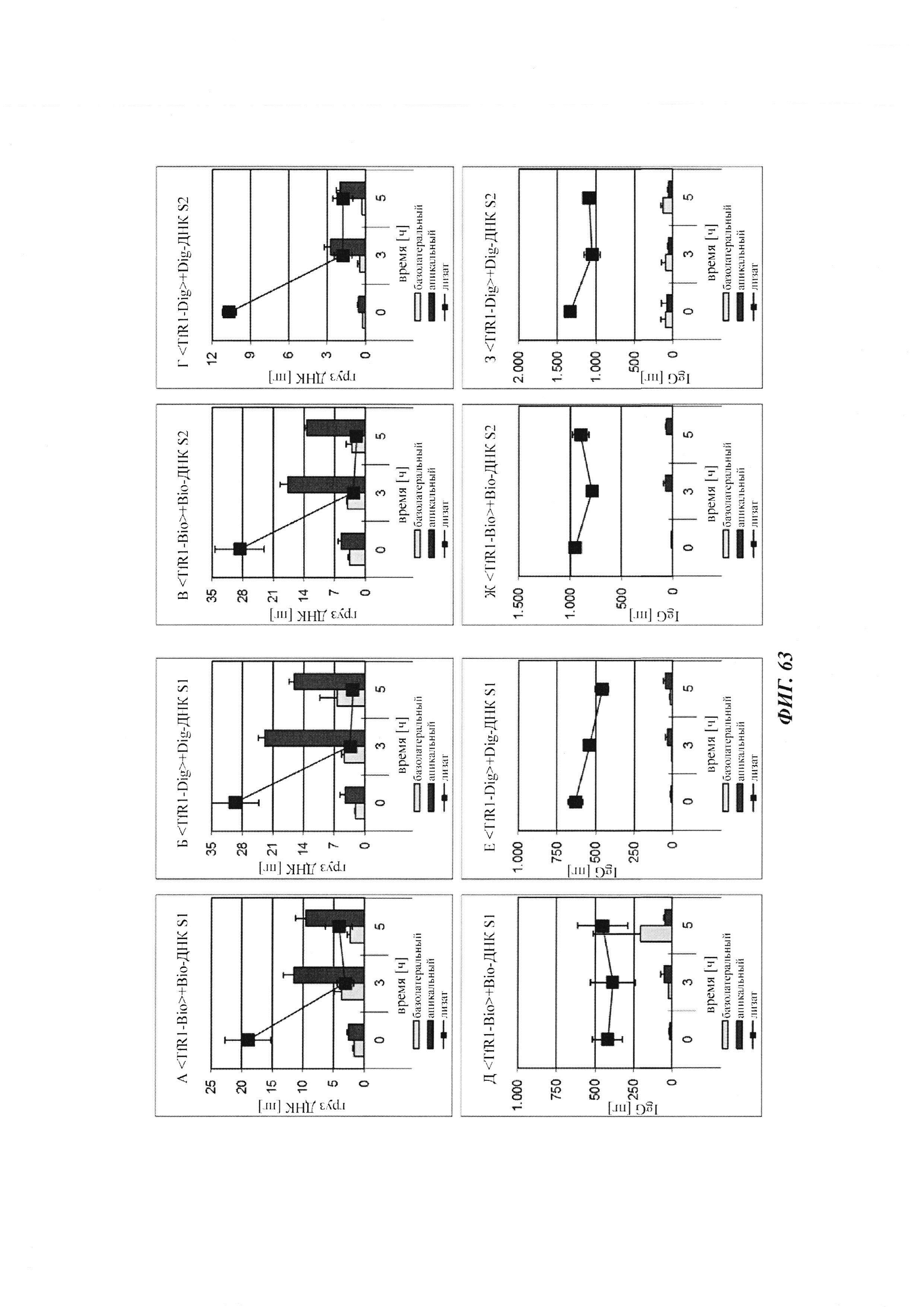
Фиг. 34: результаты PK исследования в крови in vivo с ковалентными конъюгатами и нековалентными комплексами по сравнению с не образующим комплекс антигеном/гаптеном; показаны относительная остаточная интенсивность флуоресценции (%, закрашенные метки) опосредованной Су-5 флуоресценции нековалентных комплексов биотин-Cy5 (Фиг. 34А) и ковалентных (связанных дисульфидным мостиком) конъюгатов (Фиг. 35Б), а также не образующего комплекс биотин-Ser-Cy5 (звездочка); флуоресцентный сигнал в момент времени t, равный 0,08 ч, был принят за 100%; дополнительно показано относительное остаточное количество человеческого IgG в образцах мышиной сыворотки (незакрашенные метки); концентрация IgG в сыворотке (мг/мл) в t, равное 0,08 ч, была принята за 100%.
Фиг. 35: определение посредством вестерн-блоттинга количества дигоксигенилированного полипептида PYY в сыворотке мышей.
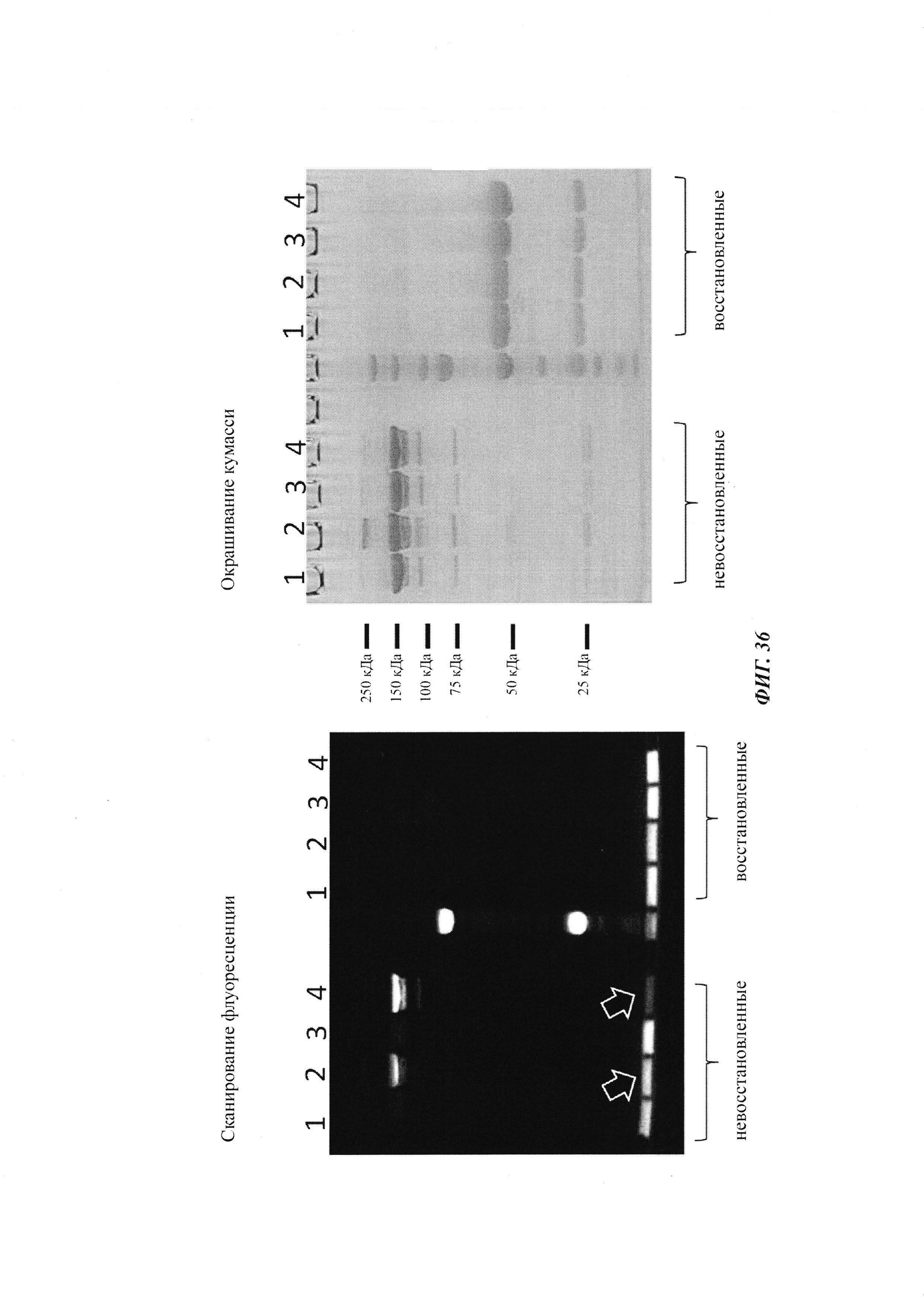
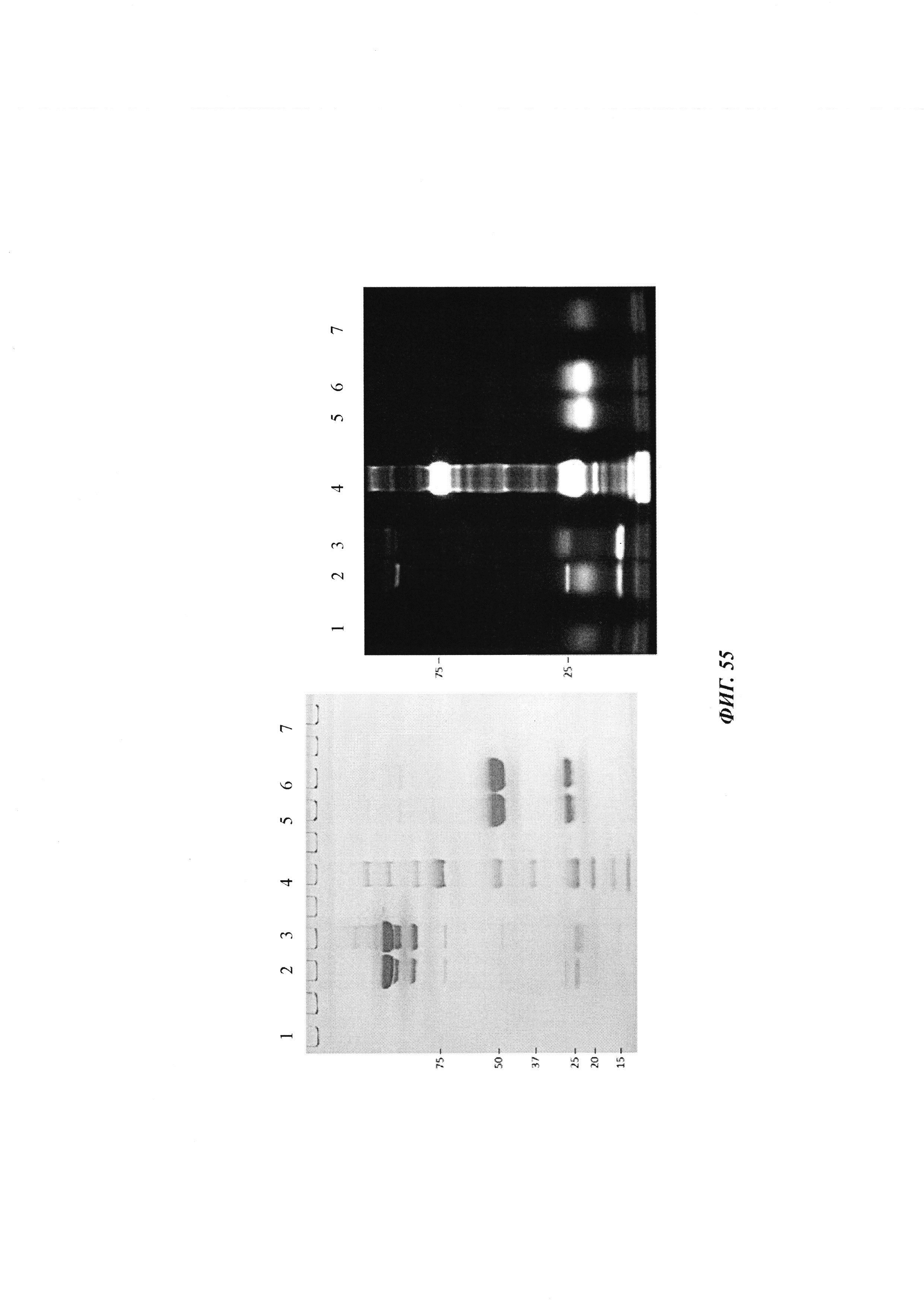
Фиг. 36: анализ управляемого аффинностью комплексообразования гаптенилированных соединений с антителами против гаптена.
На образование комплекса антителом и последующее ковалентное связывание в определенных положениях указывают флуоресцентные сигналы в анализах SDS-PAGE, которые проводили, как описано в Примере 20.
Слева: флуоресцентное изображение с невосстановленными (левая сторона геля) и восстановленными (правая сторона геля) образцами.
Справа: окрашивание кумасси синим.
1: гуманизированное антитело против дигоксигенина плюс биотин-Cys-Cy5
2: гуманизированное антитело против дигоксигенина VH52bC плюс биотин-Cys-Cy5
3: гуманизированное антитело против биотина плюс биотин-Cys-Cy5
4: гуманизированное антитело против биотина VH53C плюс биотин-Cys-Cy5
Белые стрелки отмечают избыток (несвязанного) биотин-Cys-Cy5, который значительно выше при использовании антитела против дигоксигенина VH52bC, так как движущей силой реакции конъюгирования в данном случае не является аффинность.
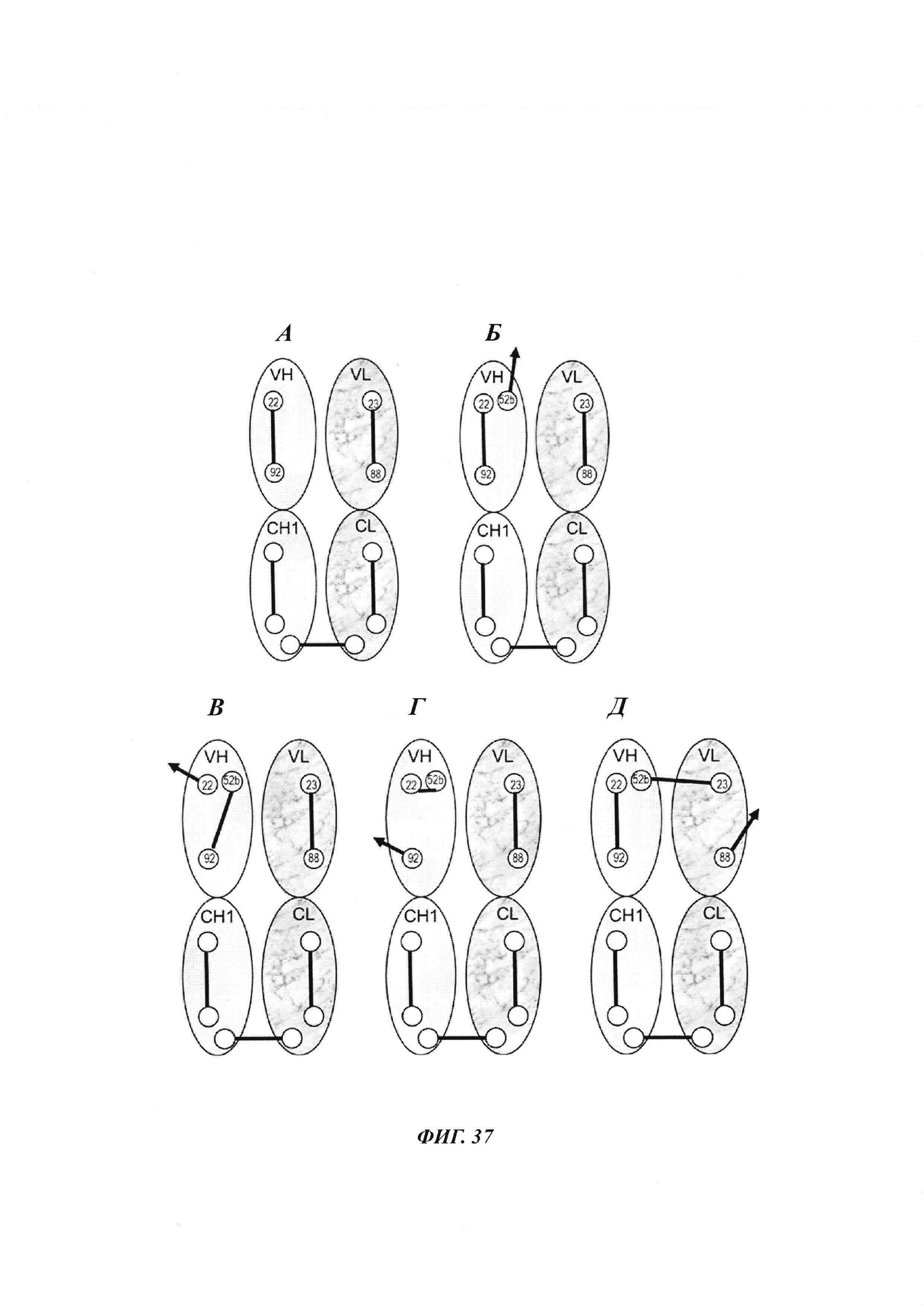
Фиг. 37: положения цистеинов и картины дисульфидных связей в пределах области Fab, требующиеся для образования антитела, связывающегося с Dig, с дополнительным цистеином в положении 52b для опосредованного гаптеном сайт-направленного направленного ковалентного связывания груза. (А) Цистеины и картина дисульфидных связей в доменах VH и СН1, и в доменах VL и CL, которые требуются для образования функциональных фрагментов Fab. (Б) Цистеины и картина дисульфидных связей в доменах VH и СН1, и в доменах VL и CL, которые требуются для образования функциональных фрагментов Fab с дополнительным цистеином в положении 52b для опосредованного гаптеном сайт-направленного направленного ковалентного связывания груза. (В и Г) Потенциал к образованию неправильных дисульфидных связей в пределах домена VH варианта VH52b, которые приводили бы к неправильно свернутым нефункциональным антителам. (Д) Пример потенциальной неправильной междоменной дисульфидной связи в пределах области Fv варианта VH52b, которая приводила бы к неправильно свернутым нефункциональным антителам.
Фиг. 38: положения цистеинов и картины дисульфидных связей, требующихся для образования связывающейся с Dig стабилизированной дисульфидом одноцепочечной Fv с дополнительным цистеином в положении 52b для опосредованного гаптеном сайт-направленного направленного ковалентного связывания груза. (А) Цистеины в доменах VH и VL, которые требуются для образования функциональных scFv, dsscFv и dsscFv с мутацией 52b. (Б) Правильная картина дисульфидных связей, которые должны образоваться для получения функциональных scFv, dsscFv и dsscFv с мутацией 52b. (В) Потенциал к образованию неправильных дисульфидных связей, которые приводили бы к неправильно свернутым нефункциональным scFv. (Г) Потенциал к образованию неправильных дисульфидных связей, которые приводили бы к неправильно свернутым нефункциональным dsscFv. (Д) Потенциал к образованию неправильных дисульфидных связей, которые приводили бы к неправильно свернутым нефункциональным dsscFv с мутацией 52b.
Фиг. 39: состав производного биспецифичного антитела LeY-Dig в качестве носителя для доставки ковалентно связанных грузов.
Фиг. 40: экспрессия и очистка производных биспецифичного антитела против гаптена для целевой доставки ковалентно связанных грузов.
(A) Для анализов вестерн-блоттингом супернатанты культуры клеток подвергали SDS-PAGE (NuPAGE 4-12%-ный бис-Tris гель (1,0 мм × 12 лунок) (Invitrogen; кат. № NP0322), и белки затем переносили на мембраны для переноса Immobilon (Immobilon-P) (Millipore; кат. № IPVH07850), PVDF (поливинилиденфторид) с размером пор: 0,45 мкм. Производные антител выявляли посредством антитела против человеческой легкой цепи каппа, конъюгированного со щелочной фосфатазой, продуцированного в козе, (аффинно очищенное), Sigma (кат. № А3813), в разведении 1:1000, и антитела против человеческого IgG (Fc-специфичного), конъюгированного со щелочной фосфатазой, продуцированного в козе, Sigma (кат. № А9544), в разведении 1:1000. Для проявления вестерн-блота применяли субстрат BCIP/NBT-Blue Liquid Substrate (Sigma, кат. № B3804). Полоса 1 - маркер молекулярной массы; полосы 2 и 3 - контрольное антитело с немодифицированной тяжелой цепью; полоса 4 - биспецифичное антитело LeY-Dig(52bC) с увеличенной Н-цепью (тяжелой цепью).
(Б) Анализы SDS-PAGE (NuPAGE 4-12%-ный бис-Tris гель [Invitrogen] и последующее окрашивание кумасси бриллиантовым синим демонстрируют чистоту белковых препаратов и визуализируют полипептидные цепи, имеющие отношение к IgG, с кажущимися молекулярными размерами, которые соответствуют их расчетным молекулярным массам. Полоса 1 - маркер молекулярной массы; полоса 2 - восстановленное биспецифичное антитело LeY-Dig(52bC) с увеличенной Н-цепью; полоса 3 - невосстановленное биспецифичное антитело LeY-Dig(52bC) с увеличенной тяжелой цепью;
(B) Гель-фильтрация (Superdex 200) демонстрирует гомогенность и отсутствие агрегатов в белковых препаратах производного биспецифичного антитела LeY-Dig(52bC) после очистки на белке А.
Фиг. 41: результаты фармакокинетического исследования в крови in vivo с ковалентными конъюгатами и нековалентными комплексами по сравнению с некомплексированным соединением гаптена Dig-Cy5; показана относительная интенсивность остаточной флуоресценции (%) нековалентных комплексов Dig-Cy5 (верхняя панель), ковалентных (связанных дисульфидными мостиками) конъюгатов Dig-Cys-Cy5, а также некомплексированного Dig-Cy5 (серые треугольники); флуоресцентный сигнал в момент времени t, равный 0,08 ч, принимали за 100%; дополнительно, показано относительное остаточное количество человеческого IgG в образцах мышиной сыворотки; концентрация IgG в сыворотке (мг/мл) в t, равное 0,08 ч, была принята за 100%.
Фиг. 42: фармакокинетику флуоресценции Cy5 in vivo определяли посредством неинвазивной визуализации глаза после инъекции нековалентных комплексов или ковалентных (связанных дисульфидными мостиками) конъюгатов, содержащих биотин-Cy5 или биотин-Cys-Cy5 соответственно, или некомплексированного биотин-Cy5; закрашенный ромб: биотин-Cy5; закрашенный квадрат: комплекс биотин-Cy5 с антителом против биотина; треугольник: конъюгат биотин-Cy5 с антителом против биотина.
Фиг. 43: а) состав, структура и молекулярная масса теофиллин-Cys-Cy5; б) гель-фильтрация демонстрирует чистоту и гомогенность очищенных вариантов антитела, связывающихся с теофиллином; пик №2 показывает очищенный продукт, отсутствие пика №1 указывает на то, что такие препараты не содержат агрегатов; в) образование ковалентных комплексов между антителами, связывающимися с теофиллином, и теофиллин-Cys-Cy5, продемонстрированное посредством SDS-PAGE при невосстанавливающих (левые полосы) и восстанавливающих (правые полосы) условиях; Cy5 является связанным с Н-цепью только при невосстанавливающих условиях в образцах, которые содержали теофиллин-Cys-Cy5 и антитело с мутацией Cys, данные ковалентные конъюгаты разрушаются при восстановлении (правые полосы); Полосы 1: маркер молекулярной массы; 2-4 - невосстанавливающие - 2: антитело против теофиллина (без мутации Cys) плюс теофиллин-Cys-Cy5 (комплекс); 3: антитело против теофиллина-cys_55 плюс теофиллин-Cys-Cy5 (конъюгат); 4: антитело против теофиллина-cys_54 плюс теофиллин-Cys-Cy5 (конъюгат); 5-7 - восстанавливающие - 5: антитело против теофиллина (без мутации Cys) плюс теофиллин-Cys-Cy5 (комплекс); 6: антитело против теофиллина-cys_55 плюс теофиллин-Cys-Cy5 (конъюгат); 7: антитело против теофиллина-cys_54 плюс теофиллин-Cys-Cy5 (конъюгат).
Фиг. 44: образование ковалентных комплексов между антителами, связывающимися с биотином, и биотин-Cys-Cy5 продемонстрировано посредством SDS-PAGE при невосстанавливающих и восстанавливающих условиях; реакцию связывания проводили в мышиной сыворотке при 37°С в течение 1 ч. Cy5 является связанным с Н-цепью только при невосстанавливающих условиях в образцах, которые содержали биотин-Cys-Cy5 и антитело с мутацией Cys; данные ковалентные конъюгаты разрушаются при восстановлении (правые полосы); полосы 1: маркер молекулярной массы; 2-3 - невосстанавливающие - 2: антитело против биотина (без мутации Cys) плюс биотин-Cys-Cy5 (комплекс); 3: антитело против биотина-Cy5 плюс биотин-Cys-Cy5 (конъюгат); 4-5 - восстанавливающие - 5: антитело против биотина (без мутации Cys) плюс биотин-Cys-Cy5 (комплекс); 6: антитело против биотина-Cys плюс биотин-Cys-Cy5 (конъюгат).
Фиг. 45: фармакокинетику in vivo флуоресценции Cy5 определяли посредством неинвазивной визуализации глаза после инъекции антител, образующих нековалентный комплекс, или антител, образующих ковалентный (связанный дисульфидным мостиком) конъюгат, с последующей инъекцией биотин-Cy5; закрашенный ромб: только введенный биотин-Cy5, закрашенный круг: биотин-Cy5, введенный через 24 часа после введения антитела против биотина (образование комплекса in vivo); закрашенный квадрат: биотин-Cys-Cy5, введенный через 24 часа после введения антитела против биотина-Cy5 (образование конъюгата in vivo).
Фиг. 46: структуру белка мышиное антитело против биотина-фрагмент Fab определяли в комплексе с биоцитинамидом: комплексированный гаптен располагается в непосредственной близости от отрицательно заряженного кластера аминокислот; биотин, который, в качестве гаптена, дериватизирован для связывания груза на его карбоксильной группе, связывается с хорошей эффективностью, поскольку в данном положении нет отталкивания зарядов (из-за отсутствия группы СООН); в отличие от этого, свободный (нормальный) биотин не может эффективно связываться с антителом, так как его карбоксильная группа находилась бы в непосредственной близости от данного отрицательно заряженного кластера и, следовательно, отталкивалась бы.
Фиг. 47: схема состава челночного модуля гематоэнцефалического барьера.
Фиг. 48: профили SEC (гель-фильтрация) и SDS-PAGE челночных модулей гематоэнцефалического барьера, полученных в Примере 27.
Фиг. 49: результаты анализа FACS (флуоресцентная сортировка клеток) с использованием клеток hCMEC/D3 в качестве линии клеток, происходящей из ГЭБ, экспрессирующей TfR, и Dig-Cy5 в качестве флуоресцентного груза.
Фиг. 50: трансцитоз и высвобождение из эндотелиальных клеток челночных модулей гематоэнцефалического барьера на основе гаптенсвязывающего биспецифичного антитела; А: анализ в трансвелах антитела против CD33-dig, ELISA на huFc; Б: анализ в трансвелах антитела против TfR1, ELISA на huFc; В: анализ в трансвелах антитела против TfR1-Dig, ELISA на huFc; Г: анализ в трансвелах антитела против TfR2, ELISA на huFc; Д: анализ в трансвелах антитела против TfR2-Dig, ELISA на huFc.
Фиг. 51: А: состав и количественное измерение нековалентных комплексов биспецифичное антитело-гаптенилированный груз; Б: трансцитоз и высвобождение из эндотелиальных клеток гаптенилированных грузов с использованием биспецифичных антител с пониженной аффинностью в отношении TfR (А: анализ в трансвелах антитела против CD33-Dig плюс Dig-ДНК, кПЦР (количественная полимеразная цепная реакция); анализ в трансвелах антитела против CD33-Bio плюс Bio-ДНК, кПЦР, В: анализ в трансвелах антитела против TfR2-Dig плюс Dig-ДНК, кПЦР, Г: анализ в трансвелах антитела против TfR2-Bio плюс Bio-ДНК, кПЦР).
Фиг. 52: трансцитоз и высвобождение из эндотелиальных клеток гаптенилированных грузов с применением невысвобождаемых челночных модулей гематоэнцефалического барьера с высокой аффинностью к TfR; А: анализ в трансвелах антитела против TfR1-Dig плюс Dig-ДНК, кПЦР, Б: анализ в трансвелах антитела против TfR1-Bio плюс Bio-ДНК, кПЦР).
Фиг. 53: связывание, поглощение и внутриклеточное разделение гаптенилированных грузов из невысвобождаемых челночных модулей гематоэнцефалического барьера с высокой аффинностью к TfR; показано субклеточное разделение комплексированных с биспецифичным антителом гаптенилированных флуоресцентных грузов в клетках hCMEC/D3 после трех часов инкубации при 37°С. DIG-ДНК-CY5 или Bio-ДНК-Cy5 (темно-серый) появляются в отличных внутриклеточных везикулах, не перекрываясь с интернализованным биспецифичным связывающимся антителом против дигоксигенина или против биотина (серый средней насыщенности).
Фиг. 54: гель SDS-PAGE связывания антитела 0155 с вариантом 2 с цистеином аминокислотной последовательности мотива хеликар с использованием 2,5-кратного молярного избытка аминокислотной последовательности мотива хеликар, содержащего форму соединения ковалентного комплекса 0156; 1 - вариант 2 с цистеином аминокислотной последовательности мотива хеликар; 2 - антитело 0019; 3 - антитело 0155.
Фиг. 55: гель SDS-PAGE связывания антитела 0157 с вариантом 1 с цистеином аминокислотной последовательности мотива хеликар; 1 - вариант 1 с цистеином аминокислотной последовательности мотива хеликар (окисленный); 2 - контрольное связывание (окисленный); 3 - ковалентный конъюгат (окисленный); 4 - маркер молекулярной массы; 5 - ковалентный конъюгат (восстановленный); 6 - контрольное связывание (восстановленный); 7 - вариант 1 с цистеином аминокислотной последовательности мотива хеликар (восстановленный).
Фиг. 56: хроматограмма SEC антитела 0155, варианта 1 с цистеином аминокислотной последовательности мотива хеликар, содержащего молекулу экзотоксина LR8M Pseudomonas с С-концевым остатком лизина, удаленным из SEQ ID NO: 28, и их ковалентного конъюгата.
Фиг. 57: анализ эффективности конъюгирования посредством SDS-CE (капиллярный электрофорез с додецилсульфатом натрия), Caliper, для невосстановленных образцов.
Фиг. 58: А: анализ SEC-MALLS (гель-фильтрация с детектированием рассеивания лазерного излучения с кратными углами) проводили для идентификации и характеризации комплексов биспецифичных антител против TfR/BRDU (бромдезоксиуридин) с ДНК, меченной BRDU, а также свободного биспецифичного антитела и свободного BRDU-ДНК. Комплексы элюируются из колонки при MW (молекулярная масса) 244,9 кДа, свободное биспецифичное антитело выявляется при MW 215,4 кДа, и свободный BRDU-ДНК выявляется при MW16,4 кДа.
Б: анализ SEC-MALLS проводили для идентификации и характеризации комплексов биспецифичных антител против TfR/BRDU с ДНК, меченной BRDU, а также свободного биспецифичного антитела и свободного BRDU-ДНК. Комплексы демонстрируют гидродинамический радиус 6,8 нм, тогда как свободное биспецифичное антитело демонстрирует гидродинамический радиус 6,2 нм.
Фиг. 59: А: анализ SEC-MALLS проводили для идентификации и характеризации комплексов биспецифичных антител против TfR/биотина с антителом против pTau, меченным биотином, а также свободного биспецифичного антитела и свободного антитела против pTau, меченного биотином. Комплексы демонстрируют гидродинамический радиус 8,0 нм, тогда как свободное биспецифичное антитело демонстрирует гидродинамический радиус 6,2 нм, и свободное антитело против pTau, меченное биотином, демонстрирует гидродинамический радиус 5,5 нм.
Б: анализ SEC-MALLS проводили для идентификации и характеризации комплексов биспецифичных антител против TfR/биотина с антителом против pTau, меченным биотином, а также свободного биспецифичного антитела и свободного антитела против pTau, меченного биотином. Комплексы элюируются из колонки при MW 501 кДа, свободное биспецифичное антитело выявляется при MW 205 кДа, и свободное антитело против pTau, меченное биотином, выявляется при MW 150 кДа.
В: при использовании неправильной комбинации гаптена и антитела против гаптена комплексы не образуются.
Фиг. 60: Комплексы антитела против pTau, меченного биотином, и биспецифичного антитела против CD33/биотина (верхняя левая панель) и свободное антитело против pTau, меченное биотином (верхняя правая панель) не подвергаются эффективному эндоцитозу (лизат клеток, линия) и не транспортируются в базолатеральный (левая колонка, светло-серый) или апикальный (правая колонка, черный) компартменты (загрузка 3,8 мкг/мл).
Образование комплекса антитела против pTau, меченного биотином, либо с биспецифичным антителом 1 против TfR/биотина (нижняя левая панель), либо с биспецифичным антителом 2 против TfR/биотина (нижняя правая панель) опосредует эффективный эндоцитоз (лизат клеток, линия) и последующий транспорт антитела против pTau, меченного биотином, в базолатеральный (левая колонка, светло-серый), а также обратно в апикальный (правая колонка, черный) компартмент (загрузка 3,8 мкг/мл).
Фиг. 61: анализ с трансвелами трансцитоза и высвобождения из эндотелиальных клеток гаптенилированных грузов и челночных модулей гематоэнцефалического барьера на основе гаптенсвязывающего биспецифичного антитела; применение биспецифичных антител с пониженной аффинностью к TfR (TfR2) и несвязывающихся биспецифичных антител (антитела против CD33) и применение груза - 34-мерного олигонуклеотида (олигонуклеотид S1).
А, Б, В, Г: количественное измерение груза - ДНК посредством кПЦР;
Д, Е, Ж, З: количественное измерение челночного модуля гематоэнцефалического барьера (биспецифичное антитело) посредством ELISA;
A, Д: антитело против TfR2-Bio плюс Bio-ДНК олигонуклеотид S1;
Б, Е: антитело против CD33-Bio плюс Bio-ДНК олигонуклеотид S1;
B, Ж: антитело против TfR2-Dig плюс Dig-ДНК олигонуклеотид S1;
Г, З: антитело против CD33-Dig плюс Dig-ДНК олигонуклеотид S1;
Фиг. 62: анализ с трансвелами трансцитоза и высвобождения из эндотелиальных клеток гаптенилированных грузов и челночных модулей гематоэнцефалического барьера на основе гаптенсвязывающего биспецифичного антитела; применение биспецифичных антител с пониженной аффинностью к TfR (TfR2) и несвязывающихся биспецифичных антител (антитело против CD33) и применение груза - 28-мерного олигонуклеотида (олигонуклеотид S2).
А, Б, В, Г, З: количественное измерение олигонуклеотидного груза посредством кПЦР;
Д, Е, Ж: количественное измерение челночного модуля гематоэнцефалического барьера (биспецифичное антитело) посредством ELISA;
A, Д: антитело против TfR2-Bio плюс Bio-ДНК олигонуклеотид S2;
Б, Е: антитело против CD33-Bio плюс Bio-ДНК олигонуклеотид S2;
B, Ж: антитело против TfR2-Dig плюс Dig-ДНК олигонуклеотид S2;
Г: антитело против CD33-Dig плюс Dig-ДНК олигонуклеотид S2;
З: только груз - Dig-ДНК олигонуклеотид S2.
Фиг. 63: анализ с трансвелами трансцитоза и высвобождения из эндотелиальных клеток гаптенилированных грузов и челночных модулей гематоэнцефалического барьера на основе гаптенсвязывающего биспецифичного антитела; применение биспецифичных антител с высокой аффинностью к TfR (TfR1) и применение груза - 34-мерного олигонуклеотида (олигонуклеотид S1) или груза - 28-мерного олигонуклеотида (олигонуклеотид S2).
А, Б, В, Г: количественное измерение груза - ДНК посредством кПЦР;
Д, Е, Ж, З: количественное измерение челночного модуля гематоэнцефалического барьера (биспецифичное антитело) посредством ELISA;
A, Д: антитело против TfR1-Bio плюс Bio-ДНК олигонуклеотид S1;
Б, Е: антитело против TfR1-Dig плюс Dig-ДНК олигонуклеотид S1;
B, Ж: антитело против TfR1-Bio плюс Bio-ДНК олигонуклеотид S2;
Г, З: антитело против TfR1-Dig плюс Dig-ДНК олигонуклеотид S2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
Положения аминокислот всех константных областей и доменов тяжелой и легкой цепи в том виде в котором, они используются в данном документе, пронумерованы согласно системе нумерации Kabat, описанной в Kabat, et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991) и именуемой в данном документе «нумерация согласно Kabat». Конкретно, система нумерации по Kabat (см. страницы 647-660) Kabat, et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991) используется для константного домена легкой цепи CL изотипа каппа и лямбда, и система нумерации согласно индексу EU (Европейский Союз) по Kabat (см. страницы 661-723) используется для константных доменов тяжелой цепи (СН1, шарнир, СН2 и СН3).
Термин «акцепторный человеческий каркас» для целей данного документа представляет собой каркас, содержащий аминокислотную последовательность каркаса вариабельного домена легкой цепи (VL) или каркаса вариабельного домена тяжелой цепи (VH), происходящий из каркаса человеческого иммуноглобулина или человеческого консенсусного каркаса, как определено ниже. Акцепторный человеческий каркас, «происходящий из» каркаса человеческого иммуноглобулина или человеческого консенсусного каркаса, может содержать одинаковую аминокислотную последовательность, или он может содержать замены аминокислотной последовательности. В некоторых воплощениях число аминокислотных замен составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. В некоторых воплощениях акцепторный человеческий каркас VL является идентичным по последовательности последовательности каркаса VL человеческого иммуноглобулина или последовательности человеческого консенсусного каркаса.
Термин «аминокислота» обозначает группу карбокси-α-аминокислот либо встречающихся в природе, т.е. которые непосредственно или в виде предшественника могут кодироваться нуклеиновой кислотой, либо не встречающихся в природе. Индивидуальные встречающиеся в природе аминокислоты кодируются нуклеиновыми кислотами, состоящими из трех нуклеотидов - так называемых кодонов или триплетов оснований. Каждая аминокислота кодируется по меньшей мере одним кодоном. Это известно как «вырожденность генетического кода». Термин «аминокислота» в том виде, в котором он используется в пределах данной заявки, обозначает встречающиеся в природе карбокси-α-аминокислоты, включающие следующие: аланин (трехбуквенный код: Ala, однобуквенный код: А), аргинин (Arg, R), аспарагин (Asn, N), аспарагиновая кислота (Asp, D), цистеин (Cys, С), глутамин (Gln, Q), глутаминовая кислота (Glu, Е), глицин (Gly, G), гистидин (His, Н), изолейцин (Ile, I), лейцин (Leu, L), лизин (Lys, K), метионин (Met, М), фенилаланин (Phe, F), пролин (Pro, Р), серии (Ser, S), треонин (Thr, Т), триптофан (Trp, W), тирозин (Tyr, Y) и валин (Val, V). Примеры аминокислот, не встречающихся в природе, включают Aad (альфа-аминоадипиновая кислота), Abu (аминомасляная кислота), Ach (альфа-аминоциклогексан-карбоновая кислота), Аср (альфа-аминоциклопентан-карбоновая кислота), Асрс (1-аминоциклопропан-1-карбоновая кислота), Aib (альфа-аминоизомасляная кислота), Aic (2-аминоиндан-2-карбоновая кислота; также именуемая 2-2-Aic), 1-1-Aic (1-аминоиндан-1-карбоновая кислота), (2-аминоиндан-2-карбоновая кислота), аллилглицин (аллилGly), аллоизолейцин (allo-Ile), Asu (альфа-аминосубериновая кислота, 2-аминооктандиовая кислота), Bip (4-фенил-фенилаланин-карбоновая кислота), BnHP ((2S,4R)-4-гидроксипролин), Cha (бета-циклогексилаланин), Cit (цитруллин), циклогексилглицин (Chg), циклопентилаланин, бета-циклопропилаланин, Dab (1,4-диаминомасляная кислота), Dap (1,3-диаминопропионовая кислота), п-(3,3-дифенилаланин-карбоновая кислота), 3,3-дифенилаланин, ди-н-пропилглицин (Dpg), 2-фурилаланин, гомоциклогексилаланин (HoCha), гомоцитруллин (HoCit), гомоциклолейцин, гомолейцин (HoLeu), гомоаргинин (HoArg), гомосерин (HoSer), гидроксипролин, Lys(Ac), (1) Nal (1-нафтилаланин), (2) Nal (2-нафтилаланин), 4-МеО-Арс (1-амино-4-(4-метоксифенил)-циклогексан-1-карбоновая кислота), нор-лейцин (Nle), Nva (норвалин), оматин, 3-Pal (альфа-амино-3-пиридилаланин-карбоновая кислота), 4-Pal (альфа-амино-4-пиридилаланин-карбоновая кислота), 3,4,5,F3-Phe (3,4,5-трифтор-фенилаланин), 2,3,4,5,6,F5-Phe (2,3,4,5,6-пентафтор-фенилаланин), Pqa (4-оксо-6-(1-пиперазинил)-3(4Н)-хиназолин-уксусная кислота (CAS 889958-08-1)), пиридилаланин, хинолилаланин, саркозин (Sar), тиазолилаланин, тиенилаланин, Tic (альфа-амино-1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота), Tic(OH), Tle (трет-бутилглицин) и Tyr(Ме), но не ограничиваются ими.
Термин «вариант аминокислотной последовательности» относится к полипептидам, имеющим аминокислотные последовательности, которые в некоторой степени отличаются от нативной/родительской/дикого типа аминокислотной последовательности. Обычно варианты аминокислотной последовательности будут обладать по меньшей мере примерно 70%-ной идентичностью последовательности с нативной/родительской/дикого типа аминокислотной последовательностью. В одном воплощении вариант имеет примерно 80% или более идентичности последовательности с нативной/родительской/дикого типа аминокислотной последовательностью. В одном воплощении вариант имеет примерно 90% или более идентичности последовательности с нативной/родительской/дикого типа аминокислотной последовательностью. В одном воплощении вариант имеет примерно 95% или более идентичности последовательности с нативной/родительской/дикого типа аминокислотной последовательностью. В одном воплощении вариант имеет примерно 98% или более идентичности последовательности с нативной/родительской/дикого типа аминокислотной последовательностью. Варианты аминокислотной последовательности обладают заменами, делециями и/или вставками в определенных положениях в пределах аминокислотной последовательности нативной/родительской/дикого типа аминокислотной последовательности. Аминокислоты могут быть обозначены традиционными названиями, однобуквенными и трехбуквенными кодами.
Термин «антитело» используется в данном документе в самом широком смысле и охватывает разные структуры антител, включая моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, но не ограничивается ими, при условии, что они демонстрируют желательную антигенсвязывающую активность и специфичность.
Термин «фрагмент антитела» обозначает молекулу, отличную от интактного антитела, которая содержит часть интактного антитела, которая специфично связывается с антигеном, с которым также специфично связывается интактное антитело. Примеры фрагментов антитела включают Fv, Fab, Fab', Fab'-SH, F(ab')2, диатела, линейные антитела, молекулы одноцепочечных антител (например, scFv), одноцепочечные фрагменты Fab (scFab), антитела на основе одной тяжелой цепи (VHH) и мультиспецифичные антитела, образованные из фрагментов антител, но не ограничиваются ими.
Расщепление антител папаином продуцирует два идентичных антигенсвязывающим фрагмента, именуемых фрагментами «Fab», причем каждый имеет один антигенсвязывающий сайт, и остаточный фрагмент «Fc», название которого отражает его способность легко кристаллизоваться. Обработка пепсином дает фрагмент F(ab')2, который имеет два антигенсвязывающих сайта и все еще способен к поперечному связыванию антигена.
Фрагмент Fab также содержит константный домен легкй цепи и первый константный домен (СН1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab добавлением нескольких остатков на карбокси конце домена СН1 тяжелой цепи, включая один или более чем один цистеин из шарнирной области антитела. Fab'-SH представляет собой используемое в данном документе обозначение для Fab', в котором остаток(тки) цистеина константных доменов несет(сут) по меньшей мере одну свободную тиольную группу. Фрагменты антитела F(ab')2 исходно продуцировались в виде пар фрагментов Fab', которые имеют между ними цистеины шарнирной области. Также известны другие продукты химического связывания фрагментов антитела.
«Fv» представляет собой минимальный фрагмент антитела, который содержит полные сайт распознавания антигена и антигенсвязывающий сайт. Данная область состоит из димера вариабельного домена одной тяжелой цепи и одной легкой цепи в тесной, нековалентной ассоциации. Именно в данной конфигурации три гипервариабельные области каждого вариабельного домена взаимодействуют с определением антигенсвязывающего сайта на поверхности димера VH-VL. В совокупности шесть гипервариабельных областей придают антителу специфичность связывания антигена. Однако даже один вариабельный домен (или половина Fv, содержащая только три гипервариабельные области, специфичные в отношении антигена) имеет способность распознавать и связываться с антигеном, хотя и с меньшей аффинностью, чем полный связывающий сайт.
Термин «биотин», сокращенно «В1», обозначает 5-[(3aS,4S,6aR)-2-оксогексагидро-1Н-тиено[3,4-d]имидазол-4-ил]пентановую кислоту. Биотин также известен как витамин Н или кофермент R.
Термин «биотинилированный груз» означает конъюгированное соединение, содержащее биотиновую группировку, возможно линкер и груз. Линкер может представлять собой любой линкер, такой как, например, пептидный линкер или химический линкер.
Термин «биспецифичные антитела» обозначает антитела, которые имеют две разные специфичности связывания (антигена/гаптена). В одном воплощении биспецифичные антитела, как описано в данном документе, являются специфичными в отношении двух разных антигенов, т.е. гаптена и антигена, не являющегося гаптеном.
Термин «бромдезоксиуридин», кратко «BrdU», обозначает 5-бром-2'-дезоксиуридин. Бромдезоксиуридин также известен как броксуридин, BudR, BrdUrd.
Термин «бромдезоксиуридинилированный груз» обозначает конъюгированное соединение, содержащее бромдезоксиуридиновую группировку, возможно линкер и груз. Линкер может представлять собой любой линкер, такой как, например, пептидный линкер или химический линкер.
Термин «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи происходит из конкретного источника или вида, тогда как остальная тяжелая и/или легкая цепь происходит из другого источника или вида.
«Класс» антитела относится к типу константного домена или константной области, которыми обладает его тяжелая цепь. Существуют пять главных классов антител: IgA, IgD, IgE, IgG и IgM, и несколько из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называются α, δ, ε, γ и μ соответственно.
Термин «цитотоксический агент» в том виде, как он используется в данном документе, относится к веществу, которое ингибирует или предотвращает клеточную функцию и/или вызывает гибель или разрушение клетки. Цитотоксический агент представляет собой специфический груз. Цитотоксические агенты включают радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); агенты, ингибирующие рост; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты; и разные противоопухолевые или противораковые агенты, раскрытые ниже, но не ограничиваются ими.
Термин «дигоксигенин», кратко «DIG», обозначает 3-[(3S,5R,8R,9S,10S,12R,13S,14S,17R)-3,12,14-тригидрокси-10,13-диметил-1,2,3,4,5,6,7,8,9,11,12,15,16,17-тетрадекагидро-циклопента[а]-фенантрен-17-ил]-2Н-фуран-5-он (номер CAS 1672-46-4). Дигоксигенин (DIG) представляет собой стероид, обнаруженный исключительно в цветках и листьях растений Digitalis purpurea, Digitalis orientalis и Digitalis lanata (наперстянка) (Polya, G., Biochemical targets of plant bioactive compounds, CRC Press, New York (2003) p. 847).
Термин «дигоксигенилированный груз» обозначает конъюгированное соединение, содержащее дигоксигениновую группировку, возможно линкер и груз. Линкер может представлять собой любой линкер, такой как, например, пептидный линкер или химический линкер.
Термин «эффекторные функции» обозначает те биологические активности, которые приписывают области Fc антитела, которые варьируют в зависимости от класса антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплементзависимую цитотоксичность (CDC); связывание с рецептором Fc; антителозависимую клеточную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов поверхности клетки (например, рецептора В-клеток) и активацию В-клеток. Область Fc без эффекторной функции (безэффекторная область Fc) содержит мутации в аминокислотной последовательности, которые устраняют связывание области Fc с C1q или рецепторами Fcγ.
Термин «эффективное количество» агента, например, фармацевтической композиции, обозначает количество, эффективное в дозировках и в течение периодов времени, необходимых для достижения желательного терапевтического или профилактического результата.
Термин «область Fc» в данном документе используется для определения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Данный термин включает области Fc с нативной последовательностью и варианты областей Fc. В одном воплощении область Fc тяжелой цепи человеческого IgG простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) области Fc может присутствовать или может отсутствовать. Если в данном документе не определено иначе, нумерация аминокислотных остатков в области Fc или в константной области осуществляется согласно системе нумерации ЕС, также именуемой индекс ЕС, как описано в Kabat, Е.А. et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242.
Термин «флуоресцеин», кратко «FLUO», обозначает 6-гидрокси-9-(2-карбоксифенил)-(3Н)-ксантен-3-он, альтернативно - 2-(6-гидрокси-3-оксо-(3Н)-ксантен-9-ил)-бензойную кислоту. Флуоресцеин также известен как резорцинолфталеин, C.I. 45350, растворитель желтый 94, D & С желтый №7, ангиофлур, японский желтый 201 или мыльный желтый.
Термин «флуоресцеинилированный груз» обозначает конъюгированное соединение, содержащее флуоресцеиновую группировку, возможно линкер и груз. Линкер может представлять собой любой линкер, такой как, например, пептидный линкер или химический линкер.
Термин «каркас», кратко «FR», обозначает аминокислотные остатки вариабельного дмена тяжелой и легкой цепи, отличные от остатков гипервариабельной области (HVR). FR вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR обычно появляются в следующей последовательности в VH (или в VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Термин «искусственный остаток цистеина» обозначает остаток аминокислоты цистеин, который был создан путем генетической модификации в (родительском) антителе или (родительском) полипептиде, который имеет тиольную функциональную группу (SH), и который не образует пару в виде внутримолекулярного дисульфидного мостика. Тем не менее, искусственный остаток цистеина может образовать пару в виде межмолекулярного дисульфидного мостика, например, с глутатионом.
Термин «полноразмерное антитело» обозначает антитело, имеющее структуру, по существу аналогичную структуре нативного антитела, или имеющее тяжелые цепи, которые содержат область Fc, как определено в данном документе. Нативные антитела IgG представляют собой гетеротетрамерные гликопротеины массой примерно 150000 Дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, которые связаны дисульфидным мостиком. От N-до С-конца каждая тяжелая цепь имеет вариабельную область (VH), также именуемую вариабельный тяжелый домен или вариабельный домен тяжелой цепи, с последующими тремя константными доменами (СН1, СН2 и СН3). Аналогично, от N- до С-конца каждая легкая цепь имеет вариабельную область (VL), также именуемую вариабельный легкий домен или вариабельный домен легкой цепи, с последующим константным легким (CL) доменом. Легкая цепь антитела может быть приписана к одному из двух типов, именуемых каппа (κ) и лямбда (λ), на основе аминокислотной последовательности ее константного домена.
«Полноразмерное антитело» представляет собой антитело, содержащее домен VL и VH, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи - СН1, СН2 и СН3. Константные домены могут представлять собой константные домены с нативной последовательностью (например, человеческие константные домены с нативной последовательностью) или вариантом его аминокислотной последовательности. Полноразмерное антитело может иметь одну или более чем одну «эффекторную функцию», которая относится к тем биологическим активностям, которые присущи константной области Fc (области Fc с нативной последовательностью или варианту аминокислотной последовательности области Fc) антитела. Примеры эффекторных функций антитела включают связывание C1q; комплементзависимую цитотоксичность; связывание с рецептором Fc; антителозависимую клеточную цитотоксичность (ADCC); фагоцитоз и понижающую регуляцию рецепторов поверхности клетки, таких как рецептор В-клеток и BCR.
Термин «гаптен» обозначает маленькую молекулу, которая может вызывать иммунный ответ только при присоединении к большому носителю, такому как белок. Типичными гаптенами являются анилин, о-, м- и п-аминобензойная кислота, хинон, гистамин-сукцинил-глицин (HSG), гидралазин, галотан, иридий-DTPA (диэтилентриаминпентауксусная кислота), флуоресцеин, биотин, дигоксигенин, теофиллин, бромдезоксиуридин и динитрофенол. В одном воплощении гаптен представляет собой биотин или дигоксигенин, или теофиллин, или флуоресцеин, или бромдезоксиуридин.
Термин «гаптенилированный груз» обозначает гаптен, который (ковалентно) конъюгирован с грузом. Активированные производные гаптена можно использовать в качестве исходных веществ для образования таких конъюгатов. В одном воплощении гаптен конъюгирован (в одном воплощении через его 3-гидрокси группу) с грузом через линкер. В одном воплощении линкер содержит: а) одну или более чем одну (в одном воплощении - от трех до шести) метилен-карбокси-метильную группу (-СН2-С(O)-) и/или б) от 1 до 10 (в одном воплощении - от 1 до 5) аминокислотных остатков (в одном воплощении выбранных из глицина, серина, глутамата, β-аланина, γ-аминомасляной кислоты, ε-аминокапроновой кислоты или лизина), и/или в) одно или более чем одно (в одном воплощении - одно или два) соединение, имеющее структурную формулу NH2-[(CH2)nO]xCH2-CH2-COOH, в котором n равно 2 или 3, и х равен 1-10, в одном воплощении - 1-7. Последний элемент приводит (по меньшей мере частично) к образованию линкера (части) формулы -NH-[(CH2)nO]xCH2-CH2-C(O)-. Одним примером такого соединения является, например, 12-амино-4,7,10-триоксадодекановая кислота (приводит к образованию TEG (триэтиленгликоль) линкера). В одном воплощении линкер дополнительно содержит малеимидную группу. Линкер имеет стабилизирующий и солюбилизирующий эффект, так как он содержит заряды и/или может образовать водородные мостики. Кроме того, он может стерически облегчать связывание антитела против гаптена с гаптенилированным грузом. В одном воплощении линкер конъюгирован с боковой цепью аминокислоты груза (в одном воплощении - полипептида) (например, конъюгирован с боковой цепью лизина или цистеина через амино или тиольную группу). В одном воплощении линкер конъюгирован с аминоконцом или карбоксильным концом груза (в одном воплощении -полипептида). Положение конъюгирования линкера с грузом типично выбрано так, чтобы оно находилось в области, в которой конъюгирование с линкером не влияет на биологическую активность груза. Следовательно, положение присоединения линкера зависит от природы груза и релевантных структурных элементов, которые отвечают за биологическую активность груза. Биологическую активность груза, к которому присоединен гаптен, можно тестировать до и после конъюгирования в анализе in vitro.
Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо и относятся к клеткам, в которые была введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают «трансформантов» и «трансформированные клетки», которые включают первичную трансформированную клетку и потомство, происходящее от нее, безотносительно от числа пассажей. Потомство может не быть полностью идентичным по составу нуклеиновых кислот родительской клетке, но может содержать мутации. В данный документ включено мутантное потомство, которое имеет такую же функцию или биологическую активность, что и полученная в результате скрининга или отбора на них исходно трансформированная клетка.
«Человеческое антитело» представляет собой антитело, которое обладает аминокислотной последовательностью, которая соответствует аминокислотной последовательности антитела, продуцируемого человеком или человеческой клеткой, или полученного из источника, не являющегося человеческим, в котором используются репертуары человеческих антител или другие последовательности, кодирующие человеческие антитела. Данное определение человеческого антитела конкретно исключает гуманизированное антитело, содержащее антигенсвязывающие остатки, не являющиеся человеческими.
Термин «гуманизированное» антитело относится к химерному антителу, содержащему аминокислотные остатки из HVR, не являющихся человеческими, и аминокислотные остатки из человеческих FR. В некоторых воплощениях гуманизированное антитело будет по существу содержать все или по меньшей мере один и типично два вариабельных домена, в которых все или по существу все HVR (например, CDR) соответствуют HVR антитела, не являющегося человеческим, и все или по существу все FR соответствуют FR человеческого антитела. Гуманизированное антитело возможно может содержать по меньшей мере часть константной области антитела, происходящей из человеческого антитела. Термин «гуманизированная форма» антитела, например, антитела, не являющегося человеческим, относится к антителу, которое подверглось гуманизации.
Термин «гипервариабельная область» или «HVR» в том виде, в котором он используется в данном документе, относится к каждой из областей вариабельного домена антитела, которая является гипервариабельной по последовательности («области, определяющие комплементарность», или CDR) и/или образует структурно определенные петли («гипервариабельные петли»), и/или содержит остатки, контактирующие с антигеном («контакты с антигеном»). В общем, антитела содержат шесть HVR: три в VH (Н1, Н2, Н3) и три в VL (L1, L2, L3).
Описанные в данном документе HVR включают:
(а) гипервариабельные петли, встречающиеся в области аминокислотных остатков 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) (Chothia, С. and Lesk, A.M., J. Mol. Biol. 196 (1987) 901-917);
(б) CDR, встречающиеся в области аминокислотных остатков 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (Н1), 50-65 (Н2) и 95-102 (Н3) (Kabat, Е.А. et al., Sequences of Proteins of Immunological Interest, 5th ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242);
(в) контакты с антигеном, встречающиеся в области аминокислотных остатков 27с-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (Н1), 47-58 (Н2) и 93-101 (Н3) (MacCallum et al. J. Mol. Biol. 262: 732-745 (1996)); и
(г) комбинации (а), (б) и/или (в), включающие аминокислотные остатки HVR 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (Н1), 26-35b (Н1), 49-65 (Н2), 93-102 (Н3) и 94-102 (Н3).
«Индивид» или «субъект» представляет собой млекопитающее. Млекопитающие включают домашних животных (например, коровы, овцы, кошки, собаки и лошади), приматов (например, человек и приматы, не являющиеся человеком, такие как обезьяны), кроликов и грызунов (например, мыши и крысы), но не ограничиваются ими. В некоторых воплощениях индивид или субъект представляет собой человека.
«Выделенное» антитело представляет собой антитело, которое было отделено от компонента его природного окружения. В некоторых воплощениях антитело очищено до более чем 95%-ной или 99%-ной чистоты при определении, например, электрофоретическими (например, SDS-PAGE, изоэлектрофокусировка (IEF), капиллярный электрофорез) или хроматографическими (например, ионообменная ВЭЖХ (высокоэффективная жидкостная хроматография) или ВЭЖХ с обращенной фазой) способами. Относительно обзора способов оценки чистоты антитела, см., например, Flatman, S. et al., J. Chrom. В 848 (2007) 79-87.
«Выделенная» нуклеиновая кислота относится к молекуле нуклеиновой кислоты, которую отделили от компонента ее природного окружения. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат молекулу нуклеиновой кислоты, но данная молекула нуклеиновой кислоты присутствует внехромосомно или в участке хромосомы, который отличается от ее природной хромосомной локализации.
Термин «моноклональное антитело» в том виде, в котором он используется в данном документе, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальные антитела, содержащиеся в популяции, являются идентичными и/или связываются с тем же самым эпитопом, за исключением возможных вариантов антител, например, содержащих встречающиеся в природе мутации или возникающие во время получения препарата моноклонального антитела, причем такие варианты обычно присутствуют в минорных количествах. В отличие от препаратов поликлональных антител, которые типично включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело препарата моноклонального антитела направлено против одной детерминанты на антигене. Таким образом, модификатор «моноклональное» указывает характер антитела, как полученного из по существу гомогенной популяции антител, и его не следует истолковывать как требующий получения антитела каким-либо конкретным способом. Например, моноклональные антитела, подлежащие применению согласно настоящему изобретению, можно получать целым рядом способов, включающих способ гибридомы, способы генной инженерии, способы фагового дисплея и способы с использованием трансгенных животных, содержащих все или часть локусов человеческих иммуноглобулинов, но не ограничивающихся ими, причем такие способы и другие типичные способы получения моноклональных антител описыаются в данном документе.
Термин «моноспецифичное антитело» обозначает антитело, которое имеет один или более чем один сайт связывания, каждый из которых имеет одинаковую специфичность связывания, т.е. связывается с тем же самым антигеном или гаптеном.
Термин «голое антитело» относится к антителу, которое не конъюгировано с гетерологичной группировкой (например, с цитотоксической группировкой) или радиоактивной меткой. Голое антитело может присутствовать в фармацевтической композиции.
Термин «листок-вкладыш в упаковке» используется для названия инструкций, традиционно включаемых в имеющиеся в продаже упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждения относительно применения таких терапевтических продуктов.
Термин «груз» обозначает любую молекулу или комбинацию молекул, которую можно конъюгировать с гаптеном. Термин «груз» дополнительно обозначает группировку, биологическая активность которой является желательной для доставки в(к) и/или для локализации в клетке или ткани. Грузы включают метки, химиотерапевтические агенты, антиангиогенные агенты, цитотоксины (например, экзотоксин Pseudomonas, рицин, абрин, дифтерийный токсин и тому подобное), цитокины, пролекарства, ферменты, факторы роста, транскрипционные факторы, лекарственные средства, радиоактивные изотопы, лиганды, антитела или их фрагменты, липосомы, наночастицы, вирусные частицы, цитокины и тому подобное, но не ограничваются ими.
«Химиотерапевтический агент» представляет собой химическое соединение, полезное в лечении ракового заболевания. Примеры химиотерапевтических агентов включают следующие: алкилирующие агенты, такие как тиотепа и циклофосфамид (CYTOXAN™); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламиламины, включающие алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин; нитромочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; противоадреналиновые средства, такие как аминоглутетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновая кислота; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; ацетат эллиптиния; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK®; разоксан; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2''-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Аrа-С"); циклофосфамид; тиотепа; таксаны, например, паклитаксел (TAXOL®, Bristol-Myers Squibb Oncology, Princeton, NJ) и доцетаксел (TAXOTERE®, Rh6ne-Poulenc Rorer, Antony, Франция); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; СРТ-II; ингибитор топоизомеразы 35 - RFS 2000; дифторметилорнитин (DMFO); ретиноевая кислота, эсперамицины; капецитабин и фармацевтически приемлемые соли, кислоты или производные любого из приведенных выше. Также в данное определение включены противогормональные агенты, которые действуют, регулируя или ингибируя действие гормона на опухоли, такие как антиэстрогены, включая, например, тамоксифен, ралоксифен, 4(5)-имидазолы, ингибирующие ароматазу, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (фарестон); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; и фармацевтически приемлемые соли, кислоты или производные любого из приведенных выше.
Термин «антиангиогенный агент» относится к соединению, которое блокирует, или в некоторой степени препятствует развитию кровеносных сосудов. Антиангиогенный агент может, например, представлять собой маленькую молекулу или антитело, которое связывается с фактором роста или рецептором фактора роста, участвующих в стимуляции ангиогенеза. В одном воплощении антиангиогенный фактор представляет собой антитело, которое связывается с фактором роста эндотелия сосудов (VEGF).
Термин «цитокин» является общим термином для белков, высвобождаемых одной популяцией клеток, которые действуют на другую клетку в качестве межклеточных медиаторов. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. Включенными среди цитокинов являются гормон роста, такой как человеческий гормон роста, N-метионил-человеческий гормон роста и коровий гормон роста; паратгормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреотропный гормон (TSH) и лютеинизирующий гормон (LH); фактор роста гепатоцитов; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей-а и -Р; мюллерова ингибирующая субстанция; мышиный пептид, ассоциированный с гонадотропином; ингибин; активин; фактор роста эндотелия сосудов; интегрин; тромбопоэтин (ТРО); факторы роста нервов, такие как NGF-p; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-a и TGF-p; инсулиноподобный фактор роста-I и -II; эритропоэтин (ЕРО); остеоиндуктивные факторы; интерфероны, такие как интерферон-а, -Р и -y; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагальный CSF (GM-CSF) и гранулоцитарный CSF (GCSF); интерлейкины (IL), такие как IL-I, IL-1a, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; фактор некроза опухоли, такой как TNF-α или TNF-P; и другие полипептидные факторы, включающие LIF (фактор, ингибирующий лейкоз) и наборный лиганд (KL). Термин «цитокин» в том виде, в котором он используется в данном документе, включает белки из природных источников или из культуры рекомбинантных клеток и биологически активные эквиваленты цитокинов с природной последовательностью.
Термин «fMLP» обозначает трипептид, состоящий из N-формилметионина, лейцина и фенилаланина. В одном воплощении эффекторная группировка представляет собой fMLP или его производное.
Термин «пролекарство» относится к предшественнику или форме производного фармацевтически активного вещества, которые являются менее цитотоксичными для опухолевых клеток по сравнению с родительским лекарственным средством и способными к ферментативной активации или превращению в более активную родительскую форму. См., например, Wilman, "Prodrugs in Cancer Chemotherapy" Biochemical Society Transactions, Vol. 14, 615th Meeting Belfast (1986) pp. 375-382 и Stella, et al., "Prodrugs: A Chemical Approach to Targeted Drug Delivery", Directed Drug Delivery, Borchardt, et al., (eds.), pp. 247-267, Humana Press (1985). Пролекарства, которые могут быть использованы в качестве эффекторной группировки, включают фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептид-содержащие пролекарства, пролекарства, модифицированные D-аминокислотой, гликозилированные пролекарства, b-лактам-содержащие пролекарства, возможно замещенные феноксиацетамид-содержащие пролекарства или возможно замещенные фенилацетамид-содержащие пролекарства, 5-фторцитозин и другие пролекарства на основе 5-фторуридина, которые могут быть превращены в более активное нецитотоксическое лекарственное средство, но не ограничиваются ими. Примеры цитотоксических лекарственных средств, которые могут быть дериватизированы до формы пролекарства для применения в данном изобретении, включают те химиотерапевтические агенты, которые описаны в данном документе, но не ограничиваются ими.
Термин «цитотоксин» относится к веществу, которое ингибирует или предотвращает клеточную функцию и/или вызывает гибель или разрушение клетки. Цитотоксины включают радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); агенты, ингибирующие рост; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты; и разные противоопухолевые или противораковые агенты, раскрытые в данном документе, но не ограничиваются ими.
«Процент (%) идентичности аминокислотной последовательности» по отношению к эталонной полипептидной последовательности определяется как процентная доля аминокислотных остатков в последовательности-кандидате, которые являются идентичными аминокислотным остаткам в эталонной полипептидной последовательности, после выравнивания данных последовательностей и введения, при необходимости, пробелов для достижения максимального процента идентичности последовательностей, и не рассматривая какие-либо консервативные замены как часть идентичности последовательности. Выравнивание в целях определения процента идентичности аминокислотных последовательностей может достигаться разными способами, которые находятся в пределах квалификации в данной области, например, с использованием общедоступных компьютерных программ, таких как BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определять подходящие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для указанных в данном документе целей значения % идентичности аминокислотных последовательностей получают с использованием компьютерной программы для сравнения последовательностей ALIGN-2. Автором компьютерной программы для сравнения последовательностей ALIGN-2 является Genentech, Inc., и исходный код с пользовательской документацией был подан в Бюро регистрации авторских прав США, Washington D.C., 20559, где он зарегестрирован под регистрационным № авторских прав США TXU510087. Программа ALIGN-2 является общедоступной от Genentech, Inc., Южный Сан-Франциско, Калифорния, или может быть компилирована из исходного кода. Программа ALIGN-2 должна быть компилирована для применения на операционной системе UNIX, включая цифровую UNIX V4.0D. Все параметры сравнения последовательностей заданы программой ALIGN-2 и не изменяются.
В ситуациях, когда ALIGN-2 используется для сравнений аминокислотных последовательностей, % идентичности аминокислотной последовательности данной аминокислотной последовательности А относительно, при сравнении или против данной аминокислотной последовательности Б (что, в качестве альтернативы, может быть выражено как данная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности относительно, при сравнении или против данной аминокислотной последовательности Б) рассчитывется следующим образом:
100 умножить на отношение X/Y,
где X равен числу аминокислотных остатков, подсчитанных программой выравнивания последовательностей ALIGN-2 как идентичные соответствия, в выравнивании данной программой А и Б, и где Y равен общему числу аминокислотных остатков в Б. Будет понятно, что когда длина аминокислотной последовательности А не равна длине аминокислотной последовательности Б, % идентичности аминокислотной последовательности А с Б не будет равен % идентичности аминокислотной последовательности Б с А. Если конкретно не утверждается иное, все значения % идентичности аминокислотных последовательностей, использованные в данном документе, получают, как описано в непосредственно предшествующем абзаце, с использованием компьютерной программы ALIGN-2.
Термин «фармацевтическая композиция» относится к препарату, который находится в такой форме, чтобы обеспечивать эффективную биологическую активность содержащегося в нем активного ингредиента, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому вводилась бы композиция.
Термин «фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтической композиции, отличному от активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает буфер, эксципиент, стабилизатор или консервант, но не ограничивается ими.
«Полипептид» представляет собой полимер, состоящий из аминокислот, связанных пептидными связями, независимо от того, продуцируется ли он в природе или синтетически. Полипептиды из менее чем примерно 20 аминокислотных остатков могут называться «пептидами», тогда как молекулы, состоящие из двух или более чем двух полипептидов или содержащие один полипептид из более чем 100 аминокислотных остатков могут называться «белками». Полипептид также может содержать неаминокислотные компоненты, такие как углеводные группы, ионы металлов или сложные эфиры карбоновой кислоты. Неаминокислотные компоненты могут быть добавлены клеткой, в которой экспрессируется полипептид, и могут варьировать, в зависимости от типа клетки. Полипептиды определяются в данном документе в терминах структуры их аминокислотного остова или кодирующей их нуклеиновой кислоты. Присоединения, такие как углеводные группы, обычно не определяются, но, тем не менее, могут присутствовать.
Все полипептидные последовательности написаны согласно общепринятому соглашению, при этом альфа-N-концевой аминокислотный остаток находится слева, и альфа-С-концевой аминокислотный остаток находится справа. Термин «N-конец» в том виде, как он используется в данном документе, относится к свободной альфа-аминогруппе аминокислоты в полипептиде, и термин «С-конец» относится к свободному концу в виде α-карбоксильной группы аминокислоты в полипептиде. Фраза «полипептид, который N-терминирован группой», относится к полипептиду, несущему группу на азоте альфа-аминогруппы N-концевого аминокислотного остатка. Фраза «аминокислота, которая N-терминирована группой», относится к аминокислоте, несущей группу на азоте альфа-аминогруппы.
Если не указано иное посредством префикса «D», например, D-Ala или N-Me-D-Ile, или не написано в формате строчных букв, например, a, i, l (D версии Ala, Ile, Leu), стереохимией альфа-углерода аминокислот и аминоацильных остатков в полипептидах, описанных в данном описании изобретения и приложенной формуле изобретения, является природная «L» конфигурация. Обозначения Кана-Ингольда-Прелога «R» и «S» используются для определения стереохимии хиральных центров в определенных ацильных заместителях на N-конце полипептидов. Подразумевается, что обозначение «R, S» указывает рацемическую смесь двух энантиомерных форм. Данная номенклатура следует номенклатуре, описанной в Cahn, R.S., et al., Angew. Chem. Int. Ed. Engl. 5 (1966) 385-415.
Термин «одноцепочечный Fv», кратко «scFv», обозначает фрагмент антитела, который содержит домены VH и VL антитела, где данные домены присутствуют в одной полипептидной цепи. В одном воплощении полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который обеспечивает образование scFv желательной структуры для связывания антигена. Относительно обзора scFv, см. Plueckthun, в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore (Eds), Springer-Verlag, New York, pp. 269-315(1994).
Термин «теофиллин», кратко «ТНЕО», обозначает 1,3-диметил-7Н-пурин-2,6-дион. Теофиллин также известен как диметилксантин.
Термин «теофиллинированный груз» обозначает конъюгированное соединение, содержащее теофиллиновую группировку, возможно линкер, и груз. Линкер может представлять собой любой линкер, такой как, например, пептидный линкер или химический линкер.
Термин «лечение» (и его грамматические вариации, такие как «лечить» или «проведение лечения») обозначает клиническое вмешательство в попытке изменить естественный ход заболеания у индивида, которого лечат, и его можно проводить либо для профилактики, либо на протяжении хода клинической патологии. Желательные эффекты лечения включают предупреждение появления или рецидива заболевания, облегчение симптомов, уменьшение каких-либо прямых или опосредованных патологических последствий заболевания, предупреждение метастазов, уменьшение скорости прогрессирования заболевания, уменьшение интенсивности или временное облегчение болезненного состояния и ремиссию или улучшенный прогноз, но не органичиваются ими. В некоторых воплощениях антитела по изобретению используют для задержки развития заболевания или для замедления прогрессирования заболевания.
Термин «х-валентное», например, «одновалентное» или «двухвалентное», или «трехвалентное», или «четырехвалентное», обозначает присутствие определенного числа сайтов связывания, т.е. «х», в молекуле антитела. Термины «двухвалентное», «четырехвалентное» или «шестивалентное», как таковые, обозначают присутствие в молекуле антитела двух сайтов связывания, четырех сайтов связывания и шести сайтов связывания соответственно. Биспецифичные антитела, как описано в данном документе, являются по меньшей мере «двухвалентными» и могут быть «трехвалентными» или «многовалентными» (например, «четырехвалентными» или «шестивалентными»). В одном воплощении биспецифичное антитело, как описано в данном документе, является двухвалентным, трехвалентным или четырехвалентным. В одном воплощении биспецифичное антитело является двухвалентным. В одном воплощении биспецифичное антитело является трехвалентным. В одном воплощении биспецифичное антитело является четырехвалентным.
В некоторых аспектах и воплощениях антитела, как описано в данном документе, имеют два или более чем два сайта связывания и являются биспецифичными. То есть, антитела могут быть биспецифичными даже в случаях, когда имеются более чем два сайта связывания (т.е., данное антитело является трехвалентным или многовалентным). Термин «биспецифичные антитела» включает, например, многовалентные одноцепочечные антитела, диатела и триатела, а также антитела, имеющие структуру константного домена полноразмерных антител, с которыми связаны дополнительные антигенсвязывающие сайты (например, одноцепочечный Fv, домен VH и/или домен VL, Fab или (Fab)2) через один или более чем один пептидный линкер. Антитела могут быть полноразмерными из одного вида или химерными, или гуманизированными. Для антитела с более чем двумя антигенсвязывающими сайтами некоторые сайты связывания могут быть идентичными, при условии, что данный белок имеет сайты связывания в отношении двух разных антигенов. То есть, в то время как первый сайт связывания является специфичным в отношении гаптена, второй сайт связывания является специфичным в отношении негаптенового антигена и наоборот.
Термин «вариабельная область» обозначает домен тяжелой или легкой цепи антитела, который участвует в связывании антитела с его антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) нативного антитела обычно имеют аналогичные структуры, причем каждый домен содержит четыре консервативные каркасные области (FR) и три гипервариабельные области (HVR). (См., например, Kindt, T.J. et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., N.Y. (2007), страница 91). Один домен VH или VL может быть достаточным для придания специфичности связывания антигена. Кроме того, антитела, которые связываются с конкретным антигеном, могут быть выделены с использованием домена VH или VL из антитела, который связывается с антигеном, для скрининга библиотеки комплементарных доменов VL или VH соответственно. См., например, Portolano, S. et al., J. Immunol. 150 (1993) 880-887; Clackson, T. et al., Nature 352 (1991) 624-628).
Термин «вектор» обозначает молекулу нуклеиновой кислоты, способную размножать другую нуклеиновую кислоту, с которой он связан. Данный термин включает вектор в виде самореплицируемой структуры нуклеиновой кислоты, а также вектор, включенный в геном клетки-хозяина, в кторую он был введен. Некоторые векторы способны управлять экспрессией нуклеиновых кислот, с которыми они связаны функциональным образом. Такие векторы называются в данном документе «экспрессионные векторы».
II. Конъюгаты, описанные в данном документе
В данном документе описан модуль гематоэнцефалического барьера (челночный модуль ГЭБ), который представляет собой биспецифичное антитело с первой специфичностью связывания в отношении гаптена и второй специфичностью связывания в отношении рецептора гематоэнцефалического барьера (РГЭБ). Такой челночный модуль ГЭБ распознает способную к трансцитозу мишень клеточной поверхности на гематоэнцефалическом барьере (такую как TfR, LRP или другие мишени, РГЭБ) и одновременно связывается с гаптенилированными грузами.
Обнаружили, что не должны удовлетворяться дополнительные требования в отношении валентности связывания, формата антитела, аффинностей связывания с РГЭБ.
Кроме того, обнаружили, что не требуется, чтобы челночный модуль на основе биспецифичного антитела, как описано в данном документе, высвобождался из эндотелиальных клеток гематоэнцефалического барьера для того, чтобы опосредовать трансцитоз гаптенилированного груза. Вместо этого, гаптенилированный груз, который образует комплекс/связывается с челночным модулем на основе биспецифичного антитела, при связывании с РГЭБ высвобождается из челночного модуля на основе биспецифичного антитела в клетке ГЭБ, т.е. во внутриклеточной везикулярной системе, отделяется от челночного модуля и затем экзоцитируется из клетки ГЭБ в мозг, оставляя биспецифичное антитело за клеткой ГЭБ.
Челночный модуль на основе биспецифичного антитела, как описано в данном документе, является очень вариабельным в показателях валентности функционала связывания, а также аффинности функционала связывания в отношении РГЭБ. Одновременно он обеспечивает высвобождение груза из челночного модуля.
Нековалентные комплексы
Биспецифичное антитело, как описано в данном документе, используется в качестве носителя для доставки гаптенилированного груза для терапевтического или диагностического груза. Терапевтический или диагностический груз конъюгируют с гаптеном и, таким образом, комплексируют посредством гаптенсвязывающего сайта биспецифичного антитела, как описано в данном документе. Данный комплекс является определенным и стабильным и специфично доставляет гаптенилированный груз в клетку- или ткань-мишень. Поскольку гаптенилированный терапевтический или диагностический груз нековалентно комплексируется биспецифичным антителом, гаптенилированный груз, с одной стороны, связывается с его носителем для доставки (биспецифичным антителом) во время его нахождения в системе кровообращения, но, с другой стороны, также может эффективно высвобождаться после интернализации или трансцитоза. Конъюгирование с гаптеном может осуществляться без препятствования активности терапевтического или диагностического груза. Биспецифичное антитело не содержит необычное ковалентное присоединение и, следовательно, избегает какого-либо риска иммуногенности. Следовательно, данную простую методику комплексообразования можно использвать для любого груза в комбинации только с одним антителом против гаптена; например, пептидов, белков, маленьких молекул, реактивов для визуализации и нуклеиновых кислот. Комплексы гаптенилированных диагностических или терапевтических грузов с биспецифичным антителом, как описано в данном документе, содержащим гаптен-специфичные сайты связывания, придают доброкачественные биофизические характеристики и улучшенные ФК параметры диагностическому или терапевтическому грузу, например, диагностическому или терапевтическому полипептиду или маленьким молекулам. Кроме того, такие комплексы способны нацеливать доставляемый груз на клетки и ткани, которые демонстрируют антиген, который распознается посредством второй специфичности связывания биспецифичного антитела.
Специфичное нацеливание и доставка нуклеиновых кислот к и в ткани-мишени и клетки-мишени является важной задачей. Для терапевтических применений желательными являются гомогенные определенные соединения. В некоторых примерах была показана доставка нуклеиновой кислоты, опосредованная антителом или фрагментом антитела (например, Lieberman et al., Nat. Biotechnol. 23 (2005) 709). Особый интерес представляет специфичное нацеливание и доставка молекул двухцепочечной РНК (дцРНК) к и в ткани-мишени и клетки-мишени. Было показано, что молекулы двухцепочечной рибонуклеиновой кислоты (дцРНК) блокируют экспрессию генов в высококонсервативном регуляторном механизме, известном как РНК-интерференция (РНКи). дцРНК можно конъюгировать с антителами с хорошей стабильностью для обеспечения специфичного нацеливания и избежания системного неспецифичного высвобождения. С другой стороны, дцРНК должна высвобождаться у или в пределах клеток-мишеней для обеспечения поступления в клетку.
Биспецифичное антитело, как описано в данном документе, можно использовать в качестве носителя для доставки нуклеиновых кислот (ДНК или РНК). Таким образом, в данном изобретении предложена специфичная платформа для доставки для таргетной генотерапии, целевой доставки РНКи и целевой доставки ЗНК.
В одном воплощении комплекс гаптенилированной нуклеиновой кислоты и биспецифичного антитела, как описано в данном документе, используется для специфичной целевой доставки нуклеиновых кислот в клетки или ткань. Данная нуклеиновая кислота сохраняет ее функциональность, несмотря на гаптенилирование, а также при образовании комплекса с антителом. Кроме того, сайт связывания с рецептором гематоэнцефалического барьера на биспецифичном антителе сохраняет его специфичность связывания и аффинность в присутствии образующей комплекс гаптенилированной нуклеиновой кислоты. Комплексы гаптенилированных нуклеиновых кислот с биспецифичным антителом, как описано в данном доументе, можно использовать для специфичного нацеливания нуклеиновых кислот на клетки, которые экспрессируют рецептор гематоэнцефалического барьера. Посредством этого в клетки, которые распознаются по рецептору гематоэнцефалического барьера или в мозг после трансцитоза селективно адресуются нуклеиновые кислоты, следовательно, в клетках, экспрессирующих рецептор гематоэнцефалического барьера, или в мозге усиливаются активности, вызванные нуклеиновыми кислотами (например, РНКи или цитотоксичность, опосредованная нуклеиновой кислотой). В одном воплощении данные активности дополнительно усиливаются посредством дополнительного применения агентов направленного действия, модулирующих эндосомы. Нуклеиновые кислоты не только специфично доставляются в клетки, экспрессирующие антиген, но также становятся интернализованными в клетки-мишени. Поскольку гаптенилированные нуклеиновые кислоты нековалентно связываются с биспецифичным антителом, как описано в данном документе, груз (т.е. нуклеиновые кислоты) может высвобождаться после интернализации или трансцитоза.
В одном предпочтительном воплощении нуклеиновая кислота представляет собой ДНК. В одном предпочтительном воплощении нуклеиновая кислота представляет собой дцРНК. В одном предпочтительном воплощении нуклеиновая кислота представляет собой ЗНК.
Терапевтические или диагностические нуклеиновые кислоты для опосредования их активности (например, специфичного разрушения мРНК (матричная РНК) посредством миРНК (малая интерферирующая РНК)) должны иметь доступ в цитоплазму их клеток-мишеней. Одним важным фактором для доставки специфичной активности нуклеиновой кислоты является то, что молекулы не только доставляются в клетки, но также то, что в цитоплазму данных клеток должно переноситься достаточное количество нуклеиновых кислот. Для этого данные молекулы должны проникать через биологическую мембрану по меньшей мере один раз. Посколько биологические соединения не проходят легко через мембраны, данный процесс является бутылочным горлышком, которое необходимо преодолеть для эффективной доставки активности нуклеиновой кислоты. Способами преодоления данного бутылочного горлышка может быть проникновение через мембрану, транслокация белка через мембраны или механизмы побега из эндосом или побега из везикул, в которые могут включать процессы разрушения мембран.
В одном воплощении биспецифичные антитела, как описано в данном документе, или нековалентные комплексы биспецифичного антитела с гаптенилированными нуклеиновыми кислотами, как описано в данном документе, используются в виде модуля для доставки нуклеиновой кислоты, с которым связан модулятор функциональности эндосом или модули побега из/разрушения эндосом. В одном воплощении модуль побега из эндосом содержит пептид.
В одном воплощении модуль побега из эндосом содержит динамические поликонъюгаты (DPC). DPC представляют собой химические соединения, которые при связывании с клетками и интернализации вызывают побег миРНК из эндосом (Rozema, D.B., et. al., Proc. Natl. Acad. Sci. USA 104(2007) 12982-12987). Такие DPS состоят из PBAVE (полимеры бутил-аминовиниловых эфиров) каркасов, к которым обратимо присоединяются молекулы ПЭГ с использованием бифункциональной малеаматной связи. Для последней можно применять карбоксилированную диметилмалеиновую кислоту (CDM). Звенья ПЭГ используются для экранирования эндосомолитических положительных зарядов PBAVE. Также связанным с PBAVE является груз в виде миРНК (например, посредством обратимой дисульфидной связи). Образующиеся везикулы для доставки называются динамическими поликонъюгатами миРНК, так как миРНК, экранирующие группы (и дополнительные нацеливающие лиганды) обратимо конъюгированы с полимером. Эндосомолитические свойства таких DPC, которые вызывают цитоплазматическую доставку миРНК, индуцируются их химическим окружением: уменьшение рН в созревающих эндолизосомах индуцирует высвобождение CDM-ПЭГ, экспонируя положительные заряды PBAVE, что, в свою очередь, опосредует эндосомолизис.
Следовательно, в одном воплощении объединяются эндосомолитические характеристики DPC со специфическими нацеливающими свойствами биспецифичной системы доставки гаптенилированного груза.
В одном воплощении нековалентный комплекс биспецифичного антитела, как описано в данном документе, и гаптенилированной нуклеиновой кислоты используется для визуализаций. В данном воплощении нуклеиновые кислоты одновременно конъюгированы с гаптеном и с детектируемой меткой. Посредством этого возможно визуализировать локализацию нуклеиновых кислот, нацеленных в клетки, экспрессирующие рецептор гематоэнцефалического барьера, посредством микроскопии или других методик визуализации. В одном воплощении детектируемая метка представляет собой флуоресцентную метку. В одном воплощении локализация нуклеиновых кислот визуализируется в клетках, т.е. in vitro. В другом воплощении локализация нуклеиновых кислот визуализируется in vivo.
Из-за их химических и физических свойств, таких как молекулярная масса и доменная архитектура, включая вторичные модификации, последующий процессинг антител является очень сложным. Например, для достижения малых объемов для экономически оправданных манипуляций и хранения при применении требуются концентрированные растворы не только приготовленных в виде препаратов лекарственных средств, но также и промежуточных соединений в последующей переработке (DSP).
Однако с увеличением концентрации антитела можно наблюдать тенденцию к образованию агрегатов. Данные агрегировавшие антитела имеют ухудшенные характеристики по сравнению с выделенным антителом. Агрегацию антител, как описано в данном документе, можно уменьшать введением дисульфидных связей между вариабельными доменами тяжелой и легкой цепи одноцепочечных антител, соединенных с моноспецифичным двухвалентным родительским антителом. Эта улучшенная стабильность не только полезна во время процесса получения, но также и в течение хранения антител. В одном воплощении дисульфидная связь между вариабельными доменами одноцепочечных антител, содержащихся в биспецифичном антителе, как описано в данном документе, независимо для каждого одноцепочечного антитела, выбрана из следующих:
i) от положения 44 вариабельного домена тяжелой цепи до положения 100 вариабельного домена легкой цепи,
ii) от положения 105 вариабельного домена тяжелой цепи до положения 43 вариабельного домена легкой цепи, или
iii) от положения 101 вариабельного домена тяжелой цепи до положения 100 вариабельного домена легкой цепи.
В одном воплощении дисульфидная связь между вариабельными доменами одноцепочечных антител, содержащихся в биспецифичном антителе, как описано в данном документе, находится между положением 44 вариабельного домена тяжелой цепи и положением 100 вариабельного домена легкой цепи.
В одном воплощении дисульфидная связь между вариабельными доменами одноцепочечных антител, содержащихся в биспецифичном антителе, как описано в данном документе, находится между положением 105 вариабельного домена тяжелой цепи и положением 43 вариабельного домена легкой цепи.
Ковалентные конъюгаты
Обнаружили, что посредством ковалентного связывания гаптенилированного груза с антителом против гаптена можно добиваться стабилизации и улучшения PK свойств груза.
Ковалентные конъюгаты гаптенилированного груза и антитела против гаптена могут придавать данному полипептиду благоприятные биофизические характеристики и улучшенные PK свойства. Кроме того, в случае применения биспецифичного антитела, данные конъюгаты можно использовать для нацеливания полипептида на клетки, которые демонстрируют антиген, котрорый распознается посредством второй специфичности связывания биспецифичного антитела. Такие конъюгаты состоят из одного функционала связывания против гаптена и одного функционала связывания против антигена (не являющегося гаптеном). Стехиометрическое отношение антитела к гаптенилированному грузу зависит от формата биспецифичного антитела и может составлять 1:1, 1:2, 2:1, 2:2, 2:4 и 4:2 (антитело: гаптен-полипептид).
Желательно, чтобы грузы сохраняли хорошую биологическую активность, несмотря на конъюгирование с гаптеном, а также конъюгирование с антителом. Также желательно (в случае биспецифичных нацеливающих модулей), чтобы сайт связывания мишени на поверхности клетки биспецифичного антитела сохранял его специфичность связывания и аффинность в присутствии ковалентно конъюгированного гаптенилированного груза.
Реакционноспособная группа в гаптенилированном грузе может представлять собой любую реакционноспособную группу, такую как, например, малеимид, например, N-этилмалеимид (NEM), йодацетамид, пиридилдисульфид или другой реакционноспособный партнер по конъюгированию (см., например, Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3: 2; Garman, 1997, Non-Radioactive Labeling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1: 2; Hermanson, G. in Bioconjugate Techniques (1996) Academic Press, San Diego, pp. 40-55 и 643-671).
Реакционноспособная группа на антителе ограничивается группами, которые могут быть получены селективно, т.е. специфично в отношении положения. Следовательно, она ограничивается группами боковой цепи аминокислотных остатков цистеина, серина, аспарагина, глутамина, тирозина, лизина, аргинина, аспарагиновой кислоты и глутаминовой кислоты.
Для образования ковалентного конъюгата между антителом и гаптенилированным грузом оба соединения должны быть модифицированы введением реакционноспособной группы. При связывании гаптенилированного груза антителом две реакционноспособные группы оказываются совсем рядом друг с другом, обеспечивая образование ковалентной связи. В одном воплощении модификация представляет собой введение в каждое из соединений тиольной функциональной группы. В одном воплощении тиольное соединение представляет собой остаток цистеина.
Положение, содержащее функциональную группу, должно одновременно удовлетворять двум требованиям: (i) связываемые положения должны находится поблизости от связывающей области функционала связывания антитела против гаптена для использования эффекта расположения гаптена для непосредственного связывания, (ii) мутация и связываемое положение должны располагаться таким образом, чтобы не было влияния на само связывание гаптена. Данные требования для нахождения подходящего положения являются фактически «противоречащими» друг другу, так как требование (i) лучше всего выполняется положением, близким к сайту связывания, тогда как требование (ii) наиболее безопасно достигается удаленными положениями от сайта связывания.
Несмотря на эти фактически взаимоисключающие требования, были идентифицированы положения, в которых можно осуществлять мутацию без воздействия на расположение гаптена, и которые, тем не менее, одновременно обеспечивают непосредственное ковалентное связывание.
Первое положение расположено в положении VH52b или в положении VH53 соответственно согласно нумерации вариабельного домена тяжелой цепи по Kabat. Если антитело имеет короткую CDR2 VH, которая не имеет перемежающихся остатков, таких как 52а, 52b, 52с и 52d, данным положением является 53 (нумерация и выравнивание согласно схеме нумерации и правилам Kabat для вариабельного домена тяжелой цепи антитела). Если антитело имеет длинную CDR2 VH, содержащую остатки 52а и 52b и, возможно, дополнительные остатки, такие как 52с и 52d и т.д., данным положением является 52b (нумерация и выравнивание согласно схеме нумерации и правилам Kabat для вариабельного домена тяжелой цепи антитела).
Обнаружили, что в гаптенилированном грузе можно использовать любой груз (в случае гаптенилированного груза, выбранного из группы, состоящей из биотинилированных грузов, теофиллинированных грузов, дигоксигенилированных грузов и флуоресцеинилированных грузов) при дериватизации с использованием универсального линкера, который содержит функциональную группу для образования ковалентной связи между гаптенилированным грузом и аминокислотным остатком в CDR2 тяжелой цепи антитела. Расположение функциональной группы в универсальном линкере имеет то преимущество, что отсутствует необходимость в переделке синтеза и положения функциональной группы в CDR2 тяжелой цепи антитела при замене груза.
Кроме того, обнаружили, что в хеликарилированном грузе можно использовать любой груз при дериватизации аминокислотной последовательности хеликара цистеином, содержащим функциональную группу для образования ковалентной дисульфидной связи между хеликарилированным грузом и остатком цистеина в CDR2 легкой цепи антитела. Расположение остатка цистеина (тиольной функциональной группы) в аминокислотной последовательности мотива хеликар имеет то преимущество, что отсутствует необходимость в переделке синтеза и положения остатка цистеина в CDR2 легкой цепи антитела при замене груза.
Второе положение расположено в положении VH28 согласно нумерации по Kabat.
Например, в структуре антитела против дигоксигенина гаптен связывается в глубоком кармане, образованном гидрофобными остатками. Флуоресцентный конъюгат дигоксигенин-Cy5 использовали в данном кристаллографическом исследовании, где флуорофор, а также линкер между дигоксигенином и Cy5 не были видны в структуре из-за высокой гибкости и возникающего в результате беспорядка в кристалле. Однако линкер и Cy5 присоединяются к O32 дигоксигенина, который направлен в сторону CDR2 тяжелой цепи. Расстояние между O32 дигоксигенина до Сα аминокислотного остатка в положении 52b согласно Kabat составляет примерно 10,5
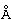
Обнаружили, что данное положение является «универсальным» положением, т.е. данное положение применимо к любому антителу (против гаптена) или к любому хеликарилированному грузу соответственно и, таким образом, каждый раз не требуется начинать с нуля получение нового ковалентного комплекса, например, путем предоставления кристаллической структуры и определения подходящего положения, которое делает возможным ковалентное связывание с правильно размещенным гаптеном.
Антитела, модифицированные, как описано в данном документе, сохраняют гаптен(антиген)связывающую способность их аналогов - родительских антител (т.е. антител дикого типа). Таким образом, модифицированное антитело способно к связыванию, в одном воплощении оно способно к специфичному связыванию с гаптенами (антигенами).
Термины «сайт связывания, который специфично связывается с» или «антитело, которое специфично связывается с» обозначают то, что молекула, содержащая сайт связывания, или антитело могут специфично образовать комплекс с другой молекулой. Связывание может быть выявлено анализом in vitro, как, например, в анализе плазмонного резонанса (BIAcore, GE-Healthcare, Уппсала, Швеция). Аффинность образования комплекса определяется по показателям ka (константа скорости для ассоциации соединений с образованием комплекса), kD(константа диссоциации, диссоциации комплекса) и KD (kD/ka). Связывание или специфичное связывание означает аффинность связывания (KD) примерно 10-7 М или менее.
Обнаружили, что образование ковалентной связи между антителом, модифицированным цистеином, и гаптенилированным грузом, модифицированным цистеином, несущим остаток цистеина в линкере между гаптеном и грузом или в пределах гаптена, или в пределах груза, происходит при связывании антитела с гаптенилированным грузом без необходимости добавления восстановителей и/или окислителей, если образующаяся связь представляет собой дисульфидную связь. Таким образом, дисульфидный мостик между двумя соединениями образуется спонтанно при образовании нековалентного комплекса. Следовательно, для способа образования ковалентного комплекса, как описано в данном документе, просто требуется смешивание двух соединений. Единственной предпосылкой для образования дисульфидной связи является правильная ориентация двух соединений по отношению друг к другу.
Замена аминокислотного остатка в положении VH52b и VH53 соответственно (согласно схеме нумерации по Kabat) на остаток Cys приводила к производным антитела с последовательностями вариабельной области тяжелой цепи, которые перечислены в SEQ ID NO: 20 и 28 для антитела против дигоксигенина-VH52bC, в SEQ ID NO: 84 и 92 для антитела против теофиллина-VH53C, в SEQ ID NO: 52 и 60 для антитела против биотина-VH53C, в SEQ ID NO: 108 для антитела против флуоресцеина-VH52bC и в SEQ ID NO: 226 для антитела против бромдезоксиуридина-VH53C.
Замена аминокислотного остатка вариабельного домена тяжелой цепи в положении VH28 (согласно схеме нумерации по Kabat) на остаток Cys приводила к производным антитела с последовательностями вариабельной области тяжелой цепи, которые перечислены в SEQ ID NO: 116, 124, 132, 140, 148, 156 и 164 соответственно.
Дополнительным положением, которое было идентифицировано в качестве точки модификации, является положение VH28 согласно нумерации по Kabat.
Замена аминокислоты в положении VH28 согласно Kabat на Cys генерировала производные антитела с последовательностями вариабельной области тяжелой цепи, которые перечислены в SEQ ID NO: 124 и 132 для антитела против дигоксигенина-VH28C, в SEQ ID NO: 156 и 164 для антитела против теофиллина-VH28C, в SEQ ID NO: 140 и 148 для антитела против биотина-VH28C, в SEQ ID NO: 116 для антитела против флуоресцеина-VH28C и в SEQ ID NO: 227 для антитела против бромдезоксиуридина-VH28C.
Анализы МС-ЭРИ (масс-спектрометрия с электрораспылительной ионизацией) демонстрируют то, что ковалентное конъюгирование антитела с гаптенилированным грузом (груз представляет собой терапевтический пептид) приводит к конъюгату определенного размера, который больше, чем не образующее комплекс антитело или не образующий комплекс пептид.
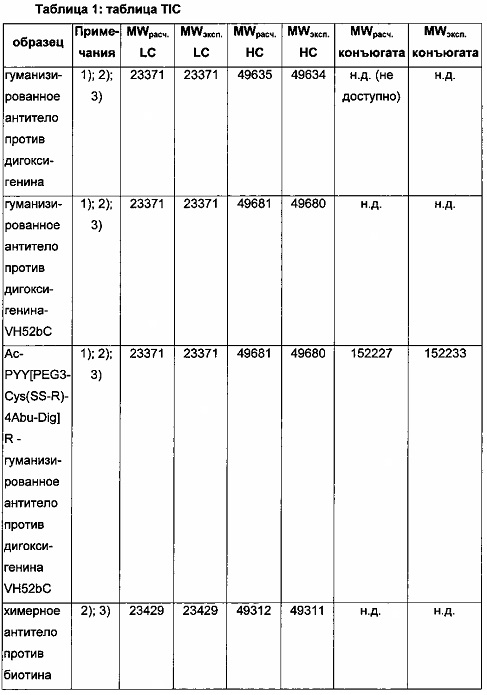
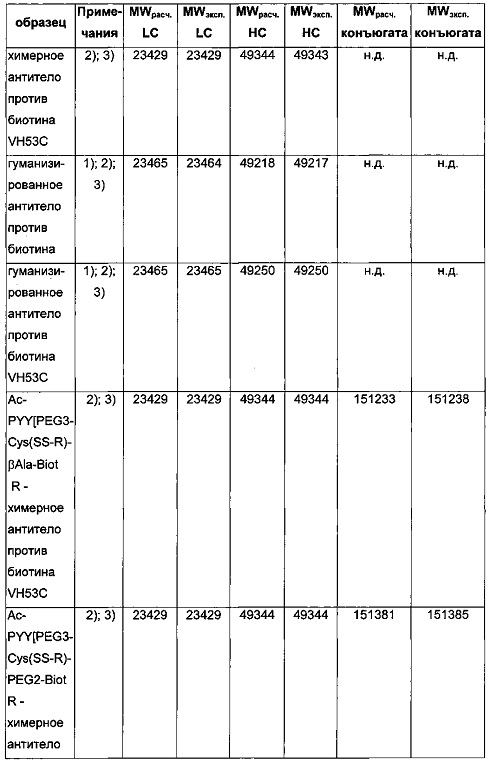
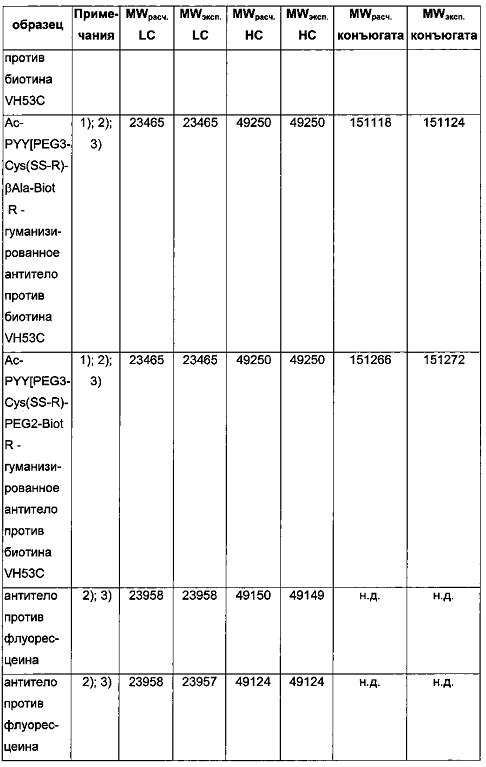
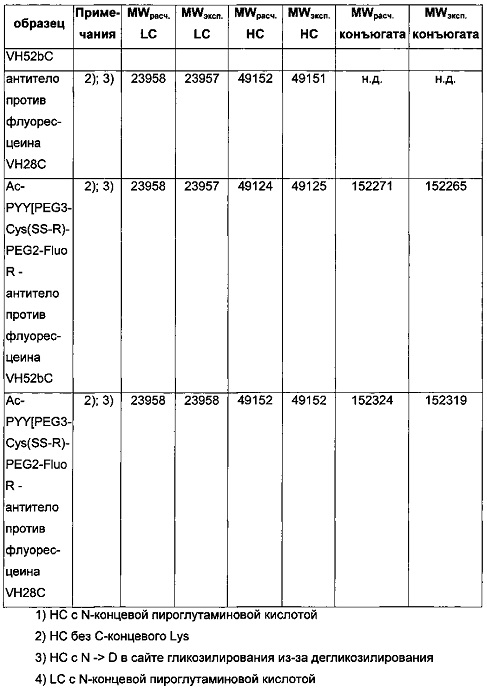
Результаты экспериментов in vivo демонстрируют то, что гаптен- и TfR-связывающие биспецифичные челночные носители ГЭБ связываются с антителом с гаптенилированным грузом и обеспечивают транспорт груза через ГЭБ. Результаты данных экспериментов также показывают то, что груз может высвобождаться из челночного носителя и затем связываться с и накапливаться на его мишени в мозге.
Аффинность антитела
В некоторых воплощениях само антитело, как описано в данном документе, или антитело в комплексе, как описано в данном документе, имеет константу диссоциации (Kd) меньшую или равную 10 нМ, меньшую или равную 1 нМ, меньшую или равную 0,1 нМ, меньшую или равную 0,01 нМ или меньшую или равную 0,001 нМ (например, примерно 10-8 М или менее, например, от примерно 10-8 М до примерно 10-13 М, например, от примерно 10-9 М до примерно 10-13 М).
В одном воплощении Kd измеряется посредством анализа связывания радиоактивно меченого антигена (RIA), проведенного с Fab версией интересующего антитела и его антигеном, как описано в следующем анализе. Аффинность Fab в отношении антигена при связывании в растворе измеряется путем уравновешивания Fab с минимальной концентрацией антигена, меченного125I, в присутствии серии титрования немеченого антигена, затем захвата связанного антигена с использованием планшета, покрытого антителом против Fab (см., например, Chen, Y. et al., J. Mol. Biol. 293 (1999) 865-881). Для создания условий для данного анализа многолуночные планшеты MICROTITER® (Thermo Scientific) покрывают в течение ночи 5 мкг/мл захватывающего антитела против Fab (Cappel Labs) в 50 мМ карбонате натрия (рН 9,6) и затем блокируют 2% (масс./об.) бычьего сывороточного альбумина в PBS (фосфатно-солевой буферный раствор) в течение двух-пяти часов при комнатной температуре (приблизительно 23°С). В неадсорбирующем планшете (Nunc #269620) 100 пМ или 26 пМ [125I]-антиген смешивают с серийными разведениями интересующего Fab (например, согласно с оценкой антитела против VEGF, Fab-12 в Presta, L.G. et al., Cancer Res. 57 (1997) 4593-4599). Интересующий Fab затем инкубируют в течение ночи; однако, инкубация может продолжаться в течение более длительного периода (например, примерно 65 часов) для обеспечения того, что достигается равновесие. Затем смеси переносят в планшет для захвата для инкубации при комнатной температуре (например, в течение одного часа). Раствор затем удаляют, и планшет восемь раз промывают 0,1%-ным полисорбатом 20 (TWEEN-20®) в PBS. При высыхании планшетов добавляют 150 мкл/лунку сцинтиллянта (MICROSCINT-20™; Packard), и осуществляют счет на планшетах на гамма-счетчике TOPCOUNT™ (Packard) в течение десяти минут. Для применения в конкурентных анализах связывания выбирают концентрации каждого Fab, которые дают меньшее чем или равное 20% от максимального связывания.
Согласно другому воплощению Kd измеряют с использованием анализов поверхностного плазмонного резонанса, используя BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с применением чипов СМ5 с иммобилизированным антигеном при ~10 единицах ответа (RU). Вкратце, биосенсорные чипы с карбоксиметилированным декстраном (СМ5, BIACORE, Inc.) активируют N-этил-N'-(3-диметиламинопропил)-карбодиимида гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разводят 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (примерно 0,2 мкМ) до инъекции при скорости тока 5 мкл/минуту с достижением приблизительно 10 единиц ответа (RU) связанного белка. После инъекции антигена инъецируют 1 М этаноламин для блокирования непрореагировавших групп. Для измерений кинетики инъецируют двухкратные серийные разведения Fab (от 0,78 нМ до 500 нМ) в PBS с поверхностно-активным веществом (PBST) - 0,05%-ный полисорбат 20 (TWEEN-20™) при 25°С при скорости тока приблизительно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают с использованием простой модели связывания Лангмюра один к одному (BIACORE® Evaluation Software, версия 3.2) путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Равновесная константа диссоциации (Kd) рассчитывается как отношение koff/kon. См., например, Chen, Y. et al., J. Mol. Biol. 293 (1999) 865-881. Если скорость ассоциации превышает 106 М-1 с-1 при определении приведенным выше анализом повехностного плазмонного резонанса, тогда скорость ассоциации может быть определена с использованием методики гашения флуоресценции, в которой измеряется увеличение или уменьшение интенсивности испускания флуоресценции (возбуждение - 295 нм; испускание - 340 нм, 16 нм полоса пропускания) 20 нМ антитела против антигена (в форме Fab) в PBS, рН 7,2, при 25°С в присутствии возрастающих концентраций антигена при измерении на спектрофотометре, таком как спектрофотометр, оснащенный устройством для остановки струи (Aviv Instruments) или спектрофотометр SLM-AMINCO™ (ThermoSpectronic) серии 8000 с кюветой с перемешиванием.
Фрагменты антитела
В некоторых воплощениях предложенное в данном документе антитело или находящееся в конъюгате, как описано в данном документе, представляет собой фрагмент антитела. Фрагменты антитела включают фрагменты Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv и их конъюгаты, и другие фрагменты, описанные ниже, при условии, что данные фрагменты являются двухвалентными и биспецифичными или объединенными с образованием двухвалентного биспецифичного слитого полипептида из фрагментов антител, но не ограничиваются ими. Для обзора определенных фрагментов антител, см. Hudson, P.J. et al., Nat. Med. 9 (2003) 129-134. Для обзора фрагментов scFv, см., например, Plueckthun, A., In; The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore (eds.), Springer-Verlag, New York (1994), pp. 269-315; см. также WO 93/16185 и патенты США №5571894 и 5587458. Для обсуждения фрагментов Fab и F(ab')2, содержащих остатки эпитопа связывания рецептора спасения и имеющих повышенный период полувыведения in vivo, см. US 5869046.
Диатела представляют собой фрагменты антител с двумя антигенсвязывающими сайтами, которые могут быть двухвалентными или биспецифичными. См., например, ЕР 0 404 097; WO 1993/01161; Hudson, P.J. et al., Nat. Med. 9 (2003) 129-134 и Holliger, P. et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448. Триатела и тетратела также описаны в Hudson, P.J. et al., Nat. Med. 9 (20039 129-134).
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи антитела или его часть, или весь вариабельный домен легкой цепи антитела или его часть. В некоторых воплощениях однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Waltham, MA; см., например, US 6248516).
Фрагменты антител можно получать разными методиками, включающими протеолитическое расщепление интактного антитела, а также продукцию рекомбинантными клетками-хозяевами (например, Е.coli или фагом), как описано в данном документе, но не ограничивающимися ими.
Химерные и гуманизированные антитела
В некоторых воплощениях антитело, предложенное в данном документе, или антитело в конъюгате, как описано в данном документе, представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в US 4816567 и Morrison, S.L. et al., Proc. Natl. Acad. Sci. USA 81 (1984) 6851-6855). В одном примере химерное антитело содержит вариабельную область, не являющуюся человеческой (например, вариабельную область, происходящую от мыши, крысы, хомяка, кролика или примата, не являющегося человеком, такого как обезьяна), и человеческую константную область. В другом примере химерное антитело представляет собой антитело с «переключением класса», в котором был изменен класс или подкласс от класса или подласса родительского антитела. Химерные антитела включают их антигенсвязывающие фрагменты.
В некоторых воплощениях химерное антитело представляет собой гуманизированное антитело. Типично антитело, не являющееся человеческим, гуманизируют для уменьшения иммуногенности у людей при сохранении специфичности и аффинности родительского антитела, не являющегося человеческим. Обычно гуманизированное антитело содержит один или более чем один вариабельный домен, в котором HVR, например, CDR (или их части), происходят из антитела, не являющегося человеческим, и FR (или их части) происходят из последовательностей человеческого антитела. Гуманизированное антитело возможно также будет содержать по меньшей мере часть человеческой константной области. В некоторых воплощениях некоторые остатки FR в гуманизированном антителе заменены соответствующими остатками из антитела, не являющегося человеческим (например, антитела, из которого происходят остатки HVR), например, для восстановления или улучшения специфичности или аффинности антитела.
Обзор гуманизированных антител и способов их получения приводится, например, в Almagro, J.C. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633, и они дополнительно описываются, например, в Riechmann, I. et al., Nature 332 (1988) 323-329; Queen, С. et al., Proc. Natl. Acad. Sci. USA 86 (1989) 10029-10033; патентах США №5821337, 7527791, 6982321 и 7087409; Kashmiri, S.V. et al., Methods 36 (2005) 25-34 (описывающей пересадку SDR (a-CDR)); Padlan, E.A., Mol. Immunol. 28 (1991) 489-498 (описывающей изменение поверхности вариабельного домена); Dall'Acqua, W.F. et al., Methods 36 (2005) 43-60 (описывающей «перетасовку FR»), Osbourn, J. et al., Methods 36 (2005) 61-68 и Klimka, A. et al., Br. J. Cancer 83 (2000) 252-260 (описывающих подход «управляемой селекции» в отношении перетасовки FR).
Человеческие константные области, которые можно использовать для гуманизации, включают каркасные области, выбранные с использованием способа «наилучшей аппроксимации» (см., например, Sims, M.J. et al., J. Immunol. 151 (1993) 2296-2308; каркасные области, происходящие из консенсусной последовательности человеческих антител конкретной подгруппы вариабельных областей легкой или тяжелой цепи (см., например, Carter, P. et al., Proc. Natl. Acad. Sci. USA 89 (1992) 4285-4289 и Presta, L.G. et al., J. Immunol. 151 (1993) 2623-2632); человеческие зрелые (подвергнувшиеся соматическому мутагенезу) каркасные области или человеческие каркасные области зародышевой линии (см., например, Almagro, J.C. and Fransson, J., Front. Biosci. 13 (2008) 1619-1633) и каркасные области, полученные в результате скрининга библиотек FR (см., например, Васа, М. et al., J. Biol. Chem. 272 (1997) 10678-10684 и Rosok, M.J. et al., J. Biol. Chem. 271 (19969 22611-22618), но не ограничиваются ими.
Человеческие антитела
В некоторых воплощениях антитело, предложенное в данном документе, или антитело в конъюгате, как описано в данном документе, представляет собой человеческое антитело. Человеческие антитела могут быть получены с использованием разных методик, известных в данной области. Человеческие антитела в общем описаны в van Dijk, М.А. and van de Winkel, J.G., Curr. Opin. Pharmacol. 5 (2001) 368-374 и Lonberg, N., Curr. Opin. Immunol. 20 (2008) 450-459.
Человеческие антитела могут быть получены путем введения иммуногена трансгенному животному, которое было модифицировано для получения интактных человеческих антител или интактных антител с человеческими вариабельными областями в ответ на антигенный стимул. Такие животные типично содержат все человеческие локусы иммуноглобулинов или их часть, которые заменяют эндогенные локусы иммуноглобулинов, или которые присутствуют внехромосомно или случайным образом интегрированы в хромосомы животного. В таких трансгенных мышах локусы эндогенных иммуноглобулинов обычно были инактивированы. Для обзора способов получения человеческих антител из трансгенных животных, см. Lonberg, N., Nat. Biotech. 23 (2005) 1117-1125. См. также, например, US 6075181 и US 6150584, описывающие технологию XENOMOUSE™; US 5770429, описывающий технологию HUMAB®; US 7041870, описывающий технологию K-М MOUSE®, и US 2007/0061900, описывающий технологию VELOCIMOUSE®. Человеческие вариабельные области из интактных антител, полученные посредством таких животных, могут быть дополнительно модифицированы, например, путем объединения с другой человеческой константной областью.
Человеческие антитела также могут быть получены способами на основе гибридомы. Были описаны линии клеток человеческой миеломы и мышино-человеческой гетеромиеломы для продукции человеческих моноклональных антител. (См., например, Kozbor, D., J. Immunol. 133 (1984) 3001-3005; Brodeur, B.R. et al., Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc., New York (1987), pp. 51-63 и Boerner, P. et al., J. Immunol. 147 (1991) 86-95). Человеческие антитела, полученные посредством технологии человеческой В-клеточной гибридомы, также описаны в Li, J. et al., Proc. Natl. Acad. Sci. USA 103 (2006) 3557-3562. Дополнительные способы включают способы, описанные, например, в патенте США №7189826 (описывающем продукцию моноклональных человеческих антител IgM из гибридомных линий клеток) и Ni, J., Xiandai Mianyixue 26 (2006) 265-268 (описывающей человеческие-человеческие гибридомы). Технология человеческой гибридомы (технология триомы) также описана в Vollmers, Н.Р. and Brandlein, S., Histology and Histopathology 20 (2005) 927-937 и Vollmers, H.P. and Brandlein, S., Methods and Findings in Experimental and Clinical Pharmacology 27 (2005) 185-191.
Человеческие антитела также можно получать путем выделения последовательностей вариабельного домена клона Fv, отобранных из библиотек фагового дисплея последовательностей человеческого происхождения. Такие последовательности вариабельного домена затем можно объединять с желательным человеческим константным доменом. Методики отбора человеческих антител из библиотек антител описаны ниже.
Антитела, происходящие из библиотеки
Антитела по изобретению или антитела в конъюгате, как описано в данном документе, могут быть выделены посредством скрининга комбинаторных библиотек на антитела с желательной активностью или активностями. Например, в данной области известно множество способов получения библиотек фагового дисплея и скрининга таких библиотек на антитела, обладающие желательными характеристиками связывания. Обзор таких способов приводится, например, в Hoogenboom, H.R. et al., Methods in Molecular Biology 178 (2001) 1-37, и они дополнительно описаны, например, в McCafferty, J. et al., Nature 348 (1990) 552-554; Clackson, T. et al., Nature 352 (1991) 624-628; Marks, J.D. et al., J. Mol. Biol. 222 (1992) 581-597; Marks, J.D. and Bradbury, A., Methods in Molecular Biology 248 (2003) 161-175; Sidhu, S.S. et al., J. Mol. Biol. 338 (2004) 299-310; Lee, C.V. et al., J. Mol. Biol. 340 (2004) 1073-1093; Fellouse, F.A., Proc. Natl. Acad. Sci. USA 101 (2004) 12467-12472 и Lee, C.V. et al., J. Immunol. Methods 284 (2004) 119-132.
В некоторых способах фагового дисплея репертуары генов VH и VL по отдельности клонируют полимеразной цепной реакцией (ПЦР) и случайным образом рекомбинируют в фаговые библиотеки, которые затем можно подвергать скринингу на антигенсвязывающий фаг, как описано в Winter, G. et al., Ann. Rev. Immunol. 12 (1994) 433-455. Фаг типично подвергает дисплею фрагменты антитела либо в виде одноцепочечных фрагментов Fv (scFv), либо в виде фрагментов Fab. Библиотеки из иммунизированных источников дают высокоаффинные антитела к иммуногену без необходимости конструирования гибридом. В качестве альтернативы, может быть клонирован нативный репертуар (например, от человека) с предоставлением одного источника антител к широкому диапазону не своих, а также своих антигенов без какой-либо иммунизации, как описано Griffiths, A.D. et al., EMBO J. 12 (1993) 725-734. Наконец, библиотеки наивных также можно получать синтетически посредством клонирования не подвергавшихся реаранжировке сегментов V-гена из стволовых клеток, и используя ПЦР-праймеры, содержащие случайную последовательность, для кодирования сильно вариабельных областей CDR3 и для осуществления реаранжировки in vitro, как описано Hoogenboom, H.R. and Winter, G., J. Mol. Biol. 227 (1992) 381-388. Патентные публикации, описывающие фаговые библиотеки человеческих антител, включают, например: патент США №5750373 и публикации патентов США №2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, считаются в данном документе человеческими антителами или фрагментами человеческих антител.
Форматы антител
Описанные выше антитела и фрагменты антител можно объединять разными способами с получением разных форматов антител.
Например, один или более чем один фрагмент scFv антитела можно сливать с С-концом одной или более чем одной полипептидной цепи полного антитела. Фрагмент scFv антитела в особенности может быть слит с С-концом каждой тяжелой цепи или с С-концом каждой легкой цепи.
Например, один или более чем один фрагмент Fab антитела может быть слит с С-концом одной или более чем одной полипептидной цепи полного антитела. Фрагмент Fab антитела в особенности может быть слит с С-концом каждой тяжелой цепи или с С-концом каждой легкой цепи.
Например, один scFv и один фрагмент Fab антитела может быть слит с N-концами области Fc антитела.
Например, один scFv или фрагмент Fab антитела может быть слит с N-концом области Fc антитела, и один scFv или фрагмент Fab антитела может быть слит с С-концом соответствующей другой цепи области Fc антитела.
Мультиспецифичные антитела
Разработали широкий спектр форматов рекомбинантных антител, например, четырехвалентные биспецифичные антитела, посредством слияния, например, формата антитела IgG и доменов одной цепи (см., например, Coloma, M.J., et al., Nature Biotech 15 (1997) 159-163; WO 2001/077342 и Morrison, S.L., Nature Biotech 25 (2007) 1233-1234).
Также были разработаны несколько других форматов, в которых больше не сохраняется базовая структура антитела (IgA, IgD, IgE, IgG или IgM), такие как диа-, триа- или тетратела, минитела, несколько одноцепочечных форматов (scFv, бис-scFv), которые способны к связыванию с двумя или более чем двумя антигенами (Holliger, P., et al., Nature Biotech 23 (2005) 1126-1136; Fischer, N.,
Во всех таких форматах используются линкеры либо для слияния базовой структуры антитела (IgA, IgD, IgE, IgG или IgM) с другим связывающим белком (например, с scFv), либо для слияния, например, двух фрагментов Fab или scFv (Fischer, N. and
В WO 2007/024715 описаны иммуноглобулины с двойным вариабельным доменом в виде генетически модифицированных многовалентных и мультиспецифичных белков. Способ получения биологически активных димеров антител описан в US 6897044. Многовалентная конструкция на основе FV антитела, имеющая по меньшей мере четыре вариабельных домена, которые связаны друг с другом посредством пептидных линкеров, описана в US 7129330. Димерные и мультимерные антигенсвязывающие структуры описаны в US 2005/0079170. Трех- или четырехвалентный моноспецифичный антигенсвязывающий белок, содержащий три или четыре фрагмента Fab, ковалентно связанных друг с другом посредством соединительной структуры, который не является природным иммуноглобулином, описан в US 6511663. В WO 2006/020258 описаны четырехвалентные биспецифичные антитела, которые могут эффективно экспрессироваться в прокариотических и эукариотических клетках, и которые являются полезными в терапевтических и диагностических способах. Способ разделения или предпочтительного проведения синтеза димеров, которые связаны посредством по меньшей мере одной межцепочечной дисульфидной связи, из димеров, которые не связаны посредством по меньшей мере одной межцепочечной дисульфидной связи, из смеси, содержащей два типа полипептидных димеров, описан в US 2005/0163782. Биспецифичные четырехвалентные рецепторы описаны в US 5959083. Генетически модифицированные антитела с тремя или более чем тремя функциональными антигенсвязывающими сайтами описаны в WO 2001/077342.
Мультиспецифичные и многовалентные антигенсвязывающие полипептиды описаны в WO 1997/001580. В WO 1992/004053 описаны гомоконъюгаты, типично полученные из моноклональных антител класса IgG, которые связываются с одинаковой антигенной детерминантой и являются ковалентно связанными посредством синтетического поперечного связывания. Олигомерные моноклональные антитела с высокой авидностью в отношении антигена описаны в WO 1991/06305, при этом секретируются олигомеры, типично класса IgG, имеющие два или более чем два мономера иммуноглобулина, совместно ассоциированные с образованием четырехвалентных или шестивалентных молекул IgG. В US 6350860 описаны антитела, происходящие от овцы, и конструкции генетически модифицированных антител, которые можно использовать для лечения заболеваний, при которых активность интерферона-гамма является патогенной. В US 2005/0100543 описаны нацеливаемые конструкции, которые представляют собой многовалентные носители биспецифичных антител, т.е. каждая молекула нацеливаемой конструкции может служить в качестве носителя двух или более чем двух биспецифичных антител. Генетически модифицированные биспецифичные четырехвалентные антитела описаы в WO 1995/009917. В WO 2007/109254 описаны стабилизированные связывающие молекулы, которые состоят из или содержат стабилизированный scFv.
В некоторых воплощениях предложенное в данном документе антитело или антитела в конъюгате, как описано в данном документе, представляет собой мультиспецифичное антитело, например, биспецифичное антитело. Мультиспецифичные антитела представляют собой моноклональные антитела, которые имеют специфичности связывания в отношении по меньшей мере двух разных сайтов. В некоторых воплощениях одна из специфичностей связывания направлена на гаптен, а другая - на любой другой (не являющийся гаптеном) антиген. Биспецифичные антитела также можно использовать для помещения цитотоксических агентов в клетки. Биспецифичные антитела можно получать в виде полноразмерных антител или фрагментов антител.
Методики получения мультиспецифичных антител включают рекомбинантную соэкспрессию двух пар тяжелая цепь-легкая цепь иммуноглобулина, имеющих разные специфичности (см. Milstein, С. and Cuello, А.С., Nature 305 (1983) 537-540, WO 93/08829 и Traunecker, A. et al., EMBO J. 10 (1991) 3655-3659), и инженерию «выступ во впадину» (см., например, патент США №5731168), но не ограничиваются ими. Мультиспецифичные антитела также можно получать посредством инженерии эффектов электростатического наведения для получения гетеродимерных молекул на основе Fc антитела (WO 2009/089004); поперечного связывания двух или более чем двух антител или фрагментов (см., например, патент США №4676980 и Brennan, М. et al., Science 229 (1985) 81-83); с использованием лейциновых молний для получения биспецифичных антител (см., например, Kostelny, S.A. et al., J. Immunol. 148 (1992) 1547-1553; с использованием технологии «диатела» для получения биспецифичных фрагментов антитела (см., например, Holliger, P. et al., Proc. Natl. Acad. Sci. USA 90 (1993) 6444-6448); с использованием димеров на основе одноцепочечной Fv (scFv) (см., например, Gruber, М et al., J. Immunol. 152 (1994) 5368-5374) и получения триспецифичных антител, как описано, например, в Tutt, А. et al., J. Immunol. 147 (1991) 60-69).
В одном воплощении домены СН3 тяжелых цепей биспецифичного антитела изменяют посредством технологии «выступ во впадину», которая подробно описана с использованием нескольких примеров, например, в WO 96/027011, WO 98/050431, Ridgway J.B., et al., Protein Eng. 9 (1996) 617-621, Merchant, A.M., et al., Nat Biotechnol 16 (1998) 677-681. В данном способе взаимодействующие поверхности двух доменов CH3 изменяют для усиления гетеродимеризации обеих тяжелых цепей, содержащих эти два домена CH3. Каждый из двух доменов CH3 (из двух тяжелых цепей) может представлять собой «выступ», тогда как другой представляет собой «впадину». Введение дисульфидного мостика стабилизирует гетеродимеры (Merchant, A.M. et al., Nature Biotech 16 (1998) 677-681, Atwell, S., et al. J. Mol. Biol. 270 (1997) 26-35) и увеличивает выход.
В одном воплощении всех аспектов биспецифичное антитело характеризуется тем, что:
- каждый из домена CH3 одной тяжелой цепи и домена CH3 другой тяжелой цепи встречаются на поверхности контакта, которая содержит исходную поверхность контакта между доменами CH3 антитела,
где указанную поверхность контакта изменяют для стимуляции образования биспецифичного антитела, где данное изменение характеризуется тем, что
а) домен CH3 тяжелой цепи изменен,
таким образом, что в пределах исходной поверхности контакта домена CH3 одной тяжелой цепи, которая встречается с исходной поверхностью контакта домена CH3 другой тяжелой цепи в пределах биспецифичного антитела
аминокислотный остаток заменяется аминокислотным остатком, имеющим больший объем боковой цепи, генерируя, посредством этого, выступ в пределах поверхности контакта домена CH3 одной тяжелой цепи, который позиционируется во впадину в пределах поверхности контакта домена CH3 другой тяжелой цепи
и
б) домен CH3 другой тяжелой цепи изменен,
таким образом, что в пределах исходной поверхности контакта второго домена CH3, которая встречается с исходной поверхностью контакта первого домена CH3 в пределах биспецифичного антитела
аминокислотный остаток заменяется аминокислотным остатком, имеющим меньший объем боковой цепи, генерируя, посредством этого, впадину в пределах поверхности контакта второго домена CH3, в пределах которой позиционируется выступ в пределах поверхности контакта первого домена CH3.
Таким образом, антитела, как описано в данном документе, в одном воплощении характеризуются тем, что
- каждый из домена CH3 первой тяжелой цепи полноразмерного антитела и домена CH3 второй тяжелой цепи полноразмерного антитела встречаются на поверхности контакта, которая содержит изменение исходной поверхности контакта между доменами CH3 антитела,
где i) в домене CH3 первой тяжелой цепи
аминокислотный остаток заменяется аминокислотным остатком, имеющим больший объем боковой цепи, генерируя, посредством этого, выступ в пределах поверхности контакта домена CH3 одной тяжелой цепи, который позиционируется во впадине в пределах поверхности контакта домена CH3 другой тяжелой цепи,
и где ii) в домене CH3 второй тяжелой цепи
аминокислотный остаток заменяется аминокислотным остатком, имеющим меньший объем боковой цепи, генерируя, посредством этого, впадину в пределах поверхности контакта второго домена CH3, в пределах которой позиционируется выступ в пределах поверхности контакта первого домена CH3.
В одном воплощении аминокислотный остаток, имеющий больший объем боковой цепи, выбран из группы, состоящей из аргинина (R), фенилаланина (F), тирозина (Y), триптофана (W).
В одном воплощении аминокислотный остаток, имеющий меньший объем боковой цепи, выбран из группы, состоящей из аланина (А), серина (S), треонина (Т), валина (V).
В одном воплощении оба домена CH3 дополнительно изменяются путем введения цистеина (С) в качестве аминокислоты в соответствующих положениях каждого домена CH3 таким образом, что может быть образован дисульфидный мостик между обеими доменами CH3.
В одном предпочтительном воплощении мультиспецифичное антитело содержит мутацию аминокислоты T366W в первом домене CH3 «цепи с выступом» и мутации аминокислот T366S, L368A, Y407V во втором домене CH3 «цепи со впадиной». Также можно использовать дополнительный межцепочечный дисульфидный мостик между доменами CH3 (Merchant, A.M., et al., Nature Biotech. 16 (1998) 677-681), например, путем введения в домен CH3 «цепи со впадиной» мутации аминокислоты Y349C и в домен CH3 «цепи с выступом» мутации аминокислоты Е356С или мутации аминокислоты S354C.
В одном воплощении биспецифичное антитело содержит мутации Y349C, T366W в одном из двух доменов CH3 и мутации Е356С, T366S, L368A, Y407V в другом из двух доменов CH3. В одном воплощении биспецифичное антитело содержит мутации Y349C, T366W в одном из двух доменов CH3 и мутации S354C, T366S, L368A, Y407V в другом из двух доменов CH3 (дополнительную мутацию Y349C в одном домене CH3 и дополнительную мутацию Е356С или S354C в другом домене CH3, образующую межцепочечный диульфидный мостик) (нумерация согласно индексу ЕС по Kabat); (Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991))). Альтернативно или дополнительно можно использовать другие технологии «выступ во впадину», как описано в ЕР 1870459 А1. Таким образом, другим примером биспецифичного антитела является антитело с мутациями R409D, K370E в домене CH3 «цепи с выступом» и с мутациями D399K, E357K в домене CH3 «цепи со впадиной» (нумерация согласно индексу ЕС по Kabat; (Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991)).
В одном воплощении биспецифичное антитело содержит мутацию T366W в домене CH3 «цепи с выступом» и мутации T366S, L368A, Y407V в домене CH3 «цепи со впадиной», и дополнительно мутации R409D, K370E в домене CH3 «цепи с выступом» и мутации D399K, E357K в домене CH3 «цепи со впадиной».
В одном воплощении биспецифичное антитело содержит мутации Y349C, T366W в одном из двух доменов CH3 и мутации S354C, T366S, L368A, Y407V в других двух доменах CH3, или биспецифичное антитело содержит мутации Y349C, T366W в одном из двух доменов CH3 и мутации S354C, T366S, L368A, Y407V в другом из двух доменов CH3, и дополнительно мутации R409D, K370E в домене CH3 «цепи с выступом» и мутации D399K, E357K в домене CH3 «цепи со впадиной». Такие мутации, дяющие выступ и впадину в домене CH3, типично используются константных областях человеческой тяжелой цепи SEQ ID NO: 169, SEQ ID NO: 170, SEQ ID NO: 171 или SEQ ID NO: 172 (аллотипы человеческого подкласса IgG1 (кавказский и афроамериканский или мутанты L234A/L235A и L234A/L235A/P329G), SEQ ID NO: 173, SEQ ID NO: 174 или SEQ ID NO: 175 (человеческий подкласс IgG4 или мутанты S228P, L235E и S228P/L235E/P329G) (нумерация согласно индексу ЕС по Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991).
В одном воплощении биспецифичное антитело содержит константные области человеческой тяжелой цепи SEQ ID NO: 169, SEQ ID NO: 170, SEQ ID NO: 171 или SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174 или SEQ ID NO: 175, дополнительно включающие такие мутации, дающие «выступ» и «впадину» в домене CH3 (например, мутации Y349C, T366W в одном из двух доменов CH3 и мутации S354C, T366S, L368A, Y407V в другом из двух доменов СН3) (нумерация согласно индексу ЕС по Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991).
В данный документ также включены генетически модифицированные антитела с тремя или более чем тремя функциональными антигенсвязывающими сайтами, включая «антитела-осьминоги» (см., например, US 2006/0025576).
Описанное в данном документе антитело или фрагмент также включает "Fab двойного действия» или «DAF», содержащий антигенсвязывающий сайт, который связывается с гаптеном, а также с другим, отличным антигеном (см., например, US 2008/0069820).
Описанное в данном документе антитело или фрагмент также включает мультиспецифичные антитела, описанные в WO 2009/080251, WO 2009/080252, WO 2009/080253, WO 2009/080254, WO 2010/112193, WO 2010/115589, WO 2010/136172, WO 2010/145792 и WO 2010/145793.
В одном предпочтительном воплощении мультиспецифичное антитело (которое содержит домен CH3 в каждой тяжелой цепи) содержит мутации аминокислот S354C, T366W в одном из двух доменов CH3, и мутации аминокислот Y349C, T366S, L368A, Y407V в другом из двух доменов CH3 (дополнительную мутацию аминокислоты S354C в одном домене CH3 и дополнительную мутацию аминокислоты Y349C в другом домене CH3, образующую межцепочечный дисульфидный мостик) (нумерация согласно Kabat).
Другие методики для модификаций CH3 для усиления гетеродимеризации рассматриваются в качестве альтернатив и описаны, например, в WO 96/27011, WO 98/050431, ЕР 1870459, WO 2007/110205, WO 2007/147901, WO 2009/089004, WO 2010/129304, WO 2011/90754, WO 2011/143545, WO 2012/058768, WO 2013/157954, WO 2013/096291.
В одном воплощении используется подход гетеродимеризации, описанный в ЕР 1870459 А1. Данный подход основан на введении замен/мутаций заряженных аминокислот с противоположным зарядом в конкретных положениях аминокислот в поверхности контакта доменов СН3/СН3 между обеими тяжелыми цепями. В одном предпочтительном воплощении мультиспецифичное антитело содержит мутации аминокислот R409D, K370E в домене CH3 первой тяжелой цепи (мультиспецифичного антитела) и мутации аминокислот D399K, E357K во втором домене CH3 второй тяжелой цепи (мультиспецифичного антитела) (нумерация согласно Kabat).
В другом воплощении мультиспецифичное антитело содержит мутацию аминокислоты T366W в домене CH3 «цепи с выступом» и мутации аминокислот T366S, L368A, Y407V в домене CH3 «цепи с впадиной», и дополнительно мутации аминокислот R409D, K370E в домене CH3 «цепи с выступом» и мутации аминокислот D399K, E357K в домене CH3 «цепи с впадиной».
В другом воплощении мультиспецифичное антитело содержит мутации аминокислот S354C, T366W в одном из двух доменов CH3 и мутации аминокислот Y349C, T366S, L368A, Y407V в другом из двух доменов CH3, или мультиспецифичное антитело содержит мутации аминокислот Y349C, T366W в одном из двух доменов CH3 и мутации аминокислот S354C, T366S, L368A, Y407V в другом из двух доменов CH3, и дополнительно мутации аминокислот R409D, K370E в домене CH3 «цепи с выступом» и мутации аминокислот D399K, E357K в домене CH3 «цепи с впадиной».
В одном воплощении используется подход гетеродимеризации, описанный в WO 2013/157953. В одном воплощении первый домен CH3 содержит мутацию аминокислоты T366K, и второй домен CH3 содержит мутацию аминокислоты L351D. В другом воплощении первый домен CH3 дополнительно содержит мутацию аминокислоты L351K. В другом воплощении второй домен CH3 дополнительно содержит мутацию аминокислоты, выбранную из Y349E, Y349D и L368E (предпочтительно L368E).
В одном воплощении используется подход гетеродимеризации, описанный в WO 2012/058768. В одном воплощении первый домен CH3 содержит мутации аминокислот L351Y, Y407A, и второй домен CH3 содержит мутации аминокислот Т366А, K409F. В другом воплощении второй домен CH3 содержит дополнительную мутацию аминокислоты в положении Т411, D399, S400, F405, N390 или K392, например, выбранную из a) T411N, T411R, T411Q, T411K, T411D, Т411Е или T411W, б) D399R, D399W, D399Y или D399K, в) S400E, S400D, S400R или S400K, F405I, F405M, F405T, F405S, F405V или F405W, N390R, N390K или N390D, K392V, K392M, K392R, K392L, K392F или K392E. В другом воплощении первый домен CH3 содержит мутации аминокислот L351Y, Y407A, и второй домен CH3 содержит мутации аминокислот T366V, K409F. В другом воплощении первый домен CH3 содержит мутацию аминокислоты Y407A, и второй домен CH3 содержит мутации аминокислот Т366А, K409F. В другом воплощении второй домен CH3 дополнительно содержит мутации аминокислот К392Е, Т411Е, D399R и S400R.
В одном воплощении используется подход гетеродимеризации, описанный в WO 2011/143545, например, с модификацией аминокислоты в положении, выбранном из группы, состоящей из положений 368 и 409.
В одном воплощении используется подход гетеродимеризации, описанный в WO 2011/090762, в котором также используется описанная выше технология выступов во впадины. В одном воплощении первый домен CH3 содержит мутацию аминокислоты T366W, и второй домен CH3 содержит мутацию аминокислоты Y407A. В одном воплощении первый домен CH3 содержит мутацию аминокислоты T366Y, и второй домен CH3 содержит мутацию аминокислоты Y407T.
В одном воплощении мультиспецифичное антитело принадлежит к изотипу IgG2, и используется подход гетеродимеризации, описанный в WO 2010/129304.
В одном воплощении используется подход гетеродимеризации, описанный в WO 2009/089004. В одном воплощении первый домен CH3 содержит замену аминокислотного остатка K392 или N392 на отрицательно заряженную аминокислоту (например, глутаминовую кислоту (Е) или аспарагиновую кислоту (D), предпочтительно K392D или N392D), и второй домен CH3 содержит замену аминокислотного остатка D399, Е356, D356 или Е357 на положительно заряженную аминокислоту (например, лизин (K) или аргинин (R), предпочтительно D399K, E356K, D356K или E357K, и наиболее предпочтительно D399K и E356K). В другом воплощении первый домен CH3 дополнительно содержит замену аминокислотного остатка K409 или R409 на отрицательно заряженную аминокислоту (например, глутаминовую кислоту (Е) или аспарагиновую кислоту (D), предпочтительно K409D или R409D). В другом воплощении первый домен CH3 дополнительно или альтернативно содержит замену аминокислотного остатка K439 и/или K370 на отрицательно заряженную аминокислоту (например, глутаминовую кислоту (Е) или аспарагиновую кислоту (D)).
В одном воплощении используется подход гетеродимеризации, описанный в WO 2007/147901. В одном воплощении первый домен CH3 содержит мутации аминокислот K253E, D282K и K322D, и второй домен CH3 содержит мутации аминокислот D239K, E240K и K292D.
В одном воплощении используется подход гетеродимеризации, описанный в WO 2007/110205.
В одном воплощении первая специфичность связывания биспецифичного антитела направлена на гаптен, и вторая специфичность связывания - на антиген, не являющийся гаптеном. В одном воплощении антиген, не являющийся гаптеном, выбран из следующих: маркеры лейкоцитов - CD2, CD3, CD4, CD5, CD6, CD7, CD8, CD11a,b,c, CD13, CD14, CD18, CD19, CD22, CD23, CD27 и его лиганд, CD28 и его лиганды В7.1, В7.2, В7.3, CD29 и его лиганд, CD30 и его лиганд, CD40 и его лиганд gp39, CD44, CD45 и изоформы, CD56, CD58, CD69, CD72, CTLA-4, LFA-1 и TCR; антигены гистосовместимости, МНС (главный комплекс гистосовместимости) класса I или II, антигены Льюиса Y, SLex, SLey, SLea и SLeb; интегрины, VLA-1, VLA-2, VLA-3, VLA-4, VLA-5, VLA-6, αVβ3 и LFA-1, Мас-1, и pl50,95, αVβ1, gpIIbIIIa, αR β3, α6β4, αVβ5, αVβ6 и αV 62 7; селектины, L-селектин, Р-селектин и E-селектин, и их противорецепторы VCAM-1, ICAM-1, ICAM-2 и LFA-3; интерлейкины -IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14 и IL-15; рецептор интерлейкина, выбранный из группы, состоящей из IL-1R, IL-2R, IL-3R, IL-4R, IL-5R, IL-6R, IL-7R, IL-8R, IL-9R, IL-10R, IL-11R, IL-12R, IL-13R, IL-14R и IL-15R; хемокин, выбранный из группы, состоящей из PF4, RANTES, MIP1α, МСР1, NAP-2, Groα, Groβ, and IL-8; фактор роста, выбранный из группы, состоящей из TNF-альфа (фактор некроза опухолей-альфа), TGF-бета (трансформирующий фактор роста-бета), TSH (тиреотропный гормон), VEGF (фактор роста эндотелия сосудов)/VPF (фактор сосудистой проницаемости), VEGFA, VEGFB, VEGF111, VEGF121, VEGF165, VEGF189, VEGF206, PTHrP, семейство EGF (эпидермальный фактор роста), семейство PDGF (фактор роста тромбоцитов), эндотелин, фиброзин (FSF-1), человеческий ламинин и гастринвысвобождающий пептид (GRP), PLGF (плацентарный фактор роста), HGH (гормон роста человека), HGHR (рецептор гормона роста человека); рецептор фактора роста, выбранный из группы, состоящей из следующих: TNFальфаR, RGFбетаR, TSHR, VEGFR/VPFR, EGFR, PTHrPR, семейство PDGFR, EPO-R, GCSF-R (рецептор гранулоцитарного колониестимулирующего фактора) и другие гематопоэтические рецепторы; рецептор интерферона, выбранный из группы, состоящей из IFNCαR, IFNβR и IFNλR; Ig и его рецептор, выбранный из группы, состоящей из IgE, FcγRI и FcγRII; антиген опухоли, выбранный из группы, состоящей из her2-neu, муцина, СЕА (карцино-эмбриональный антиген) и эндостатина; аллерген, выбранный из группы, состоящей из антигена пылевых клещей, антигенов Iol р1 (злака) и урушиола; вирусный полипептид, выбранный из группы, состоящей из гликопротеинов В, Н и gCIII CMV (цитомегаловирус), гликопротеинов оболочки HIV-1 (вирус иммунодефицита человека-1), гликопротеинов оболочки RSV (вирус саркомы Рауса), гликопротеинов оболочки HSV (вирус простого герпеса), гликопротеинов оболочки HPV (вирус папилломы человека), антигенов поверхности вирусов из семейства вируса гепатита; токсин, выбранный из группы, состоящей из эндотоксина псевдомонады и остеопонтина/уропонтина, змеиного яда, яда паука и пчелиного яда конотоксина; фактор крови, выбранный из группы, состоящей из C3b комплемента, С4а комплемента, C4b-9 комплемента, фактора Rh, фибриногена, фибрина и ингибитора роста, ассоциированного с миелином; и фермент, выбранный из группы, состоящей из полипептида переноса сложного эфира холестерина, мембраносвязанных металлопротеаз матрикса и декарбоксилазы глутаминовой кислоты (GAD).
Варианты антитела
В некоторых воплощениях рассматриваются варианты аминокислотных последовательностей антител, предложенных в данном документе. Например, может быть желательным улучшение аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотной последовательности антитела могут быть получены посредством введения подходящих модификаций в нуклеотидную последовательность, кодирующую антитело, или посредством пептидного синтеза. Такие модификации включают, например, делеции из и/или вставки в, и/или замены остатков в пределах аминокислотных последовательностей антитела. Можно делать любую комбинацию делеции, вставки и замены для получения конечной конструкции, при условии, что конечная конструкция обладает желательными характеристиками, например, связыванием антигена.
а) Варианты с заменой, вставкой и делецией
В некоторых воплощениях предложены варианты антитела, имеющие одну или более чем одну аминокислотную замену. Интересующие сайты для мутагенеза путем замен включают HVR и FR. В интересующее антитело можно вводить аминокислотные замены и продукты подвергать скринингу на желательную активность, например, сохраненное/улучшенное связывание антигена, пониженную иммуногенность или улучшенные ADCC или CDC.
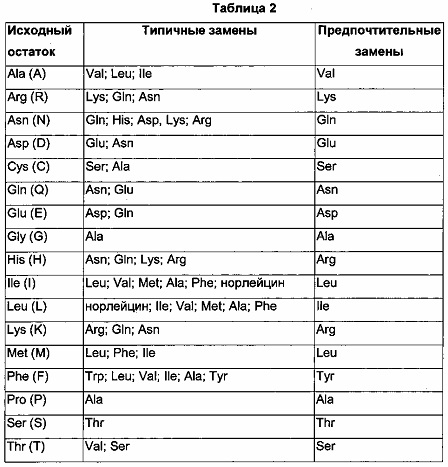
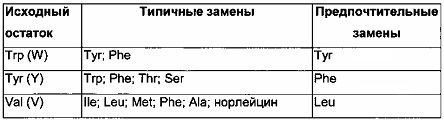
Аминокислоты можно группировать согласно общим свойствам боковой цепи:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены будут влечь за собой замену члена одного из данных классов на другой класс.
Один тип варианта с заменой включает замену одного или более чем одного остатка гипервариабельной области родительского антитела (например, гуманизированного или человеческого антитела). В общем, образующийся вариант(ты), отобранный для дальнейшего исследования, будет иметь модификации (например, улучшения) определенных биологических свойств (например, повышенная аффинность, пониженная иммуногенность) относительно родительского антитела и/или будет иметь по существу сохраненные определенные биологические свойства родительского антитела. Типичным вариантом с заменой является антитело с созревшей аффинностью, которое можно с удобством получать, например, с использованием методик созревания аффинности на основе фагового дисплея, таких как методики, описанные в данном документе. Вкратце, один или более чем один остаток HVR мутируют, и варианты антител подвергают фаговому дисплею и скринингу на конкретную биологическую активность (например, аффинность связывания).
В HVR можно делать изменения (например, замены), например, для улучшения аффинности антитела. Такие изменения можно делать в «горячих точках» HVR, т.е. остатках, кодируемых кодонами, которые на протяжении процесса соматического созревания подвергаются мутации с высокой частотой (см., например, Chowdhury, P.S., Methods Mol. Biol. 207 (2008) 179-196), и/или SDR (a-CDR), причем образующийся вариант VH или VL тестируется на аффинность связывания. Созревание аффинности путем конструирования и повторного отбора из вторичных библиотек выло описано, например, в Hoogenboom, H.R. et al. в Methods in Molecular Biology 178 (2002) 1-37. В некоторых воплощениях созревания аффинности разнообразие вводится в вариабельные гены, выбранные для созревания, любым из целого ряда способов (например, ПЦР, склонная к ошибкам, перетасовка цепи или мутагенез, управляемый олигонуклеотидом). Затем создают вторичную библиотеку. Данную библиотеку затем подверают скринингу для идентификации любых вариантов антитела с желательной аффинностью. Другой способ введения разнообразия включает подходы, направленные на HVR, в которых рандомизируются несколько остатков HVR (например, 4-6 остатков за один раз). Остатки HVR, участвующие в связывании антигена, можно специфично идентифицировать, например, с использованием мутагенеза на основе аланинового сканирования или моделирования. Мишенью часто являются, в частности, CDR3 тяжелой цепи и CDR3 легкой цепи.
В некоторых воплощениях замены, вставки или делеции могут встречаться в пределах одной или более чем одной HVR, при условии, что такие изменения по существу не уменьшают способности антитела к связыванию антигена. Например, в HVR можно делать консервативные изменения (например, консервативные замены, как приведено в данном документе), которые по существу не уменьшают аффинность связывания. Такие изменения могут находиться вне «горячих точек» HVR или SDR. В некоторых воплощениях предложеных выше вариантов последовательностей VH и VL каждая HVR является либо неизменной, либо содержит не более чем одну, две или три аминокислотные замены.
Полезный способ идентификации остатков или областей антитела, которые могут служить мишенью для мутагенеза, называется «мутагенез на основе аланинового сканирования», как описано Cunningham, B.C. and Wells, J.A., Science 244 (1989) 1081-1085. В данном способе идентифицируют остаток или группу остатков-мишеней (например, заряженных остатков, таких как Arg, Asp, His, Lys и Glu) и заменяют нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином) для определения того, подвергается ли влиянию взаимодействие антитела с антигеном. Дополнительные замены можно вводить в положениях аминокислот, демонстрирующих функциональную чувствительность к исходным заменам. В качестве альтернативы или дополнительно, определяют кристаллическую структуру комплекса антиген-антитело для идентификации точек контакта между антителом и антигеном. Такие контактные остатки и соседние остатки могут служить в качестве мишени или упраздняться в качестве кандидатов для замены. Варианты можно подвергать скринингу для определения того, имеют ли они желательные свойства.
Вставки аминокислотной последовательности включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сто или более чем сто остатков, а также вставки внутри последовательности одного или многих аминокислотных остатков. Примеры концевых вставок включают антитело с N-концевым метионильным остатком. Другие варианты молекулы антитела со вставкой включают слияние с N- или С-концом антитела фермента (например, для ADEPT (опосредованная антителами терапия с использованием ферментов и пролекарств)) или полипептида, который увеличивает период полувыведения антитела в сыворотке.
б) Варианты по гликозилированию
В некоторых воплощениях антитело, предложенное в данном документе, или содержащееся в конъюгате, как описано в данном документе, изменяют для увеличения или уменьшения степени, в которой гликозилировано антитело. Добавление или удаление сайтов гликозилирования к антителу можно с удобством осуществлять путем изменения аминокислотной последовательности таким образом, что один или более чем один сайт гликозилирования создается или удаляется.
Когда антитело содержит область Fc, может быть изменен углевод, присоединенный к ней. Нативные антитела, продуцируемые клетками млекопитающих, типично содержат разветвленный двухантенный олигосахарид, который обычно присоединен N-связью к Asn297 домена СН2 области Fc. См., например, Wright, A. and Morrison, S.L., TIBTECH 15 (1997) 26-32. Данный олигосахарид может включать разные углеводы, например, маннозу, N-ацетилглюкозамин (ClcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стволе» двухантенной олигосахаридной структуры. В некоторых воплощениях в антителе по изобретению могут быть сделаны модификации олигосахарида для того, чтобы создать варианты антитела с определенными улучшенными свойствами.
В одном воплощении предложены варианты антитела, имеющие структуру углевода, в которой отсутствует фукоза, присоединенная (прямо или опосредованно) к области Fc. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяется посредством расчета среднего количества фукозы в сахарной цепи на Asn297 по отношению к сумме всех гликоструктур, присоединенных к Asn297 (например, сложных, гибридных структур и структур с высоким содержанием маннозы), при измерении посредством масс-спектрометрии MALDI-TOF (времяпролетная масс-спектрометрия с лазерной ионизацией и десорбцией из матрицы), как описано, например, в WO 2008/077546. Asn297 относится к остатку аспарагина, расположенному примерно в положении 297 области Fc (нумерация ЕС остатков области Fc); однако, Asn297 также может находиться примено в плюс/минус 3 аминокислотах выше или ниже положения 297, т.е. между положениями 294 и 300, из-за небольших вариаций последовательности в антителах. Такие варианты по фукозилированию могут иметь улучшенную функцию ADCC. См., например, US 2003/0157108; US 2004/0093621. Примеры публикаций, относящихся к «дефукозилированным» или «дефицитным по фукозе» вариантам антител включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki, A. et al., J. Mol. Biol. 336 (2004) 1239-1249; Yamane-Ohnuki, N. et al., Biotech. Bioeng. 87 (2004) 614-622. Примеры линий клеток, способных продуцировать дефукозилированные антитела, включают клетки СНО (яичники китайского хомяка) Lec13 СНО, дефицитные по фукозилированию белка (Ripka, J. et al., Arch. Biochem. Biophys. 249 (1986) 533-545; US 2003/0157108 и WO 2004/056312, особенно в Примере 11), и нокаутные линии клеток, такие как нокаутные клетки СНО по гену альфа-1,6-фукозилтрансферазы, FUT8 (см., например, Yamane-Ohnuki, N. et al., Biotech. Bioeng. 87 (2004) 614-622; Kanda, Y. et al., Biotechnol. Bioeng. 94 (2006) 680-688 и WO 2003/085107).
Дополнительно предложены варианты антител с разделенными надвое олигосахаридами, например, в которых двухантенный олигосахарид, присоединенный к области Fc антитела, разделен надвое ClcNAc. Такие варианты антител могут иметь пониженное фукозилирование и/или улучшенную функцию ADCC. Примеры таких вариантов антител описаны, например, в WO 2003/011878; патенте США №6602684 и US 2005/0123546. Также предложены варианты антител с по меньшей мере одним галактозным остатком в олигосахариде, присоединенном к области Fc. Такие варианты антител могут иметь улучшенную функцию CDC. Такие варианты антител описаны, например, в WO 1997/30087; WO 1998/58964 и WO 1999/22764.
в) Варианты по области Fc
В некоторых воплощениях в область Fc антитела, предложенного в данном документе, могут быть введены одна или более чем одна аминокислотная модификация, генерируя, посредством этого, вариант области Fc. Вариант области Fc может содержать последовательность человеческой области Fc (например, области Fc человеческого IgG1, IgG2, IgG3 или IgG4), содержащую аминокислотную модификацию (например, замену) в одном или более чем одном положении аминокислоты.
В некоторых воплощениях в данном изобретении рассматривается вариант антитела, который обладает некоторыми, но не всеми эффекторными функциями, что делает его желательным кандидатом для применений, в которых важным является период полувыведения антитела in vivo, тем не менее, определенные эффекторные функции (такие как опосредованные комплементом и ADCC) не требуются или являются вредными. Можно проводить анализы цитотоксичности in vitro и/или in vivo для подтверждения уменьшения/устранения антивностей CDC и/или ADCC. Например, для того, чтобы убедиться, что антитело не имеет связывания с FcγR (следовательно, вероятно, не имеет активности ADCC), но сохраняет способность к связыванию с FcRn, можно проводить анализы связывания с рецептором Fc (FcR). Первичные клетки, опосредующие ADCC - клетки NK (природный киллер), экспрессируют только FcRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гематопоэтических клетках обобщена в Таблице 3 на странице 464 Ravetch, J.V. and Kinet, J.P., Annu. Rev. Immunol. 9 (1991) 457-492. Неограничивающие примеры анализов in vitro для оценки активности ADCC интересующей молекулы описаны в патенте США №5500362 (см., например, Hellstrom, I. et al., Proc. Natl. Acad. Sci. USA 83 (1986) 7059-7063 и Hellstrom, I. et al., Proc. Natl. Acad. Sci. USA 82 (1985) 1499-1502); патент США №5821337 (см. Bruggemann, M. et al., J. Exp.Med. 166 (1987) 1351-1361). В качестве альтернативы, можно использовать нерадиоактивные способы анализа (см., например, нерадиоактивный анализ цитотоксичности ACTI™ для проточной цитометрии (CellTechnology, Inc. Mountain View, CA и нерадиоактивный анализ цитотоксичности CytoTox 96® (Promega, Madison, WI). Полезные эффекторные клетки для таких анализов включают одноядерные клетки периферической крови (РВМС) и клетки-природные киллеры (NK). В качестве альтернативы или дополнительно, активность ADCC интересующей молекулы можно оценивать in vivo, например, в такой животной модели, как модель, раскрытая в Clynes, R. et al., Proc. Natl. Acad. Sci. USA 95 (1998) 652-656. Также можно проводить анализы связывания C1q для подтверждения того, что антитело не способно связываться с C1q и, следовательно, не имеет активности CDC. См., например, ELISA связывания C1q и С3с в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента можно проводить анализ CDC (см., например, Gazzano-Santoro, Н. et al., J. Immunol. Methods 202 (1996) 163-171; Cragg, M.S. et al., Blood 101 (2003) 1045-1052 и Cragg, M.S. and M.J. Glennie, Blood 103 (2004) 2738-2743). Определения связывания с FcRn и клиренса/периода полувыведения in vivo также можно проводить с использованием способов, известных в данной области (см., например, Petkova, S.B. et al., Int. Immunol. 18 2006: 1759-1769).
Антитела с ослабленной эффекторной функцией включают антитела с заменой одного или более чем одного остатка области Fc 238, 265, 269, 270, 297, 327 и 329 (патент США №6737056). Такие мутанты Fc включают мутантов Fc с заменами в двух или более чем двух положениях аминокислот 265, 269, 270, 297 и 327, включая так называемый мутант Fc «DANA» с заменой остатков 265 и 297 на аланин (патент США №7332581).
Описаны определенные варианты антител с улучшенным или ослабленным связыванием с FcR. (См., например, патент США №6737056; WO 2004/056312 и Shields, R.L. et al., J. Biol. Chem. 276 (2001) 6591-6604).
В некоторых воплощениях вариант антитела содержит область Fc с одной или более чем одной аминокислотной заменой, которая улучшает ADCC, например, с заменами в положениях 298, 333 и/или 334 области Fc (нумерация остатков ЕС).
В некоторых воплощениях в области Fc делают изменения, которые приводят к измененным (т.е. либо улучшенному, либо ослабленному) связыванию C1q и/или комплементзависимой цитотоксичности (CDC), например, как описано в патенте США №6194551, WO 99/51642 и Idusogie, Е.Е. et al., J. Immunol. 164 (2000) 4178-4184.
Антитела с повышенными периодами полувыведения и улучшенным связыванием с неонатальным рецептором Fc (FcRn), который отвечает за перенос материнских IgG в плод (Guyer, R.L. et al., J. Immunol. 117 (1976) 587-593 и Kim, J.K. et al., J. Immunol. 24 (1994) 2429-2434), описаны в US 2005/0014934. Данные антитела содержат область Fc с одной или более чем одной заменой в них, которая улучшает связывание области Fc с FcRn. Такие варианты Fc включают варианты с заменами в одном или более чем одном остатке области Fc: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, с заменой остатка 434 области Fc (патент США №7371826).
См. также Duncan, A.R. and Winter, G., Nature 322 (1988) 738-740; US 5648260; US 5624821; и WO 94/29351 относительно других примеров вариантов области Fc.
В одном предпочтительном воплощении антитело содержит в обеих тяжелых цепях мутации L234A, L235A и P329G (нумерация согласно индексу ЕС).
г) Варианты антител с модификацией цистеином
В некоторых воплощениях может быть желательным создание антител с модификацией цистеином, например, «тиоMAb», в которых один или более чем один остаток антитела заменен остатками цистеина. В конкретных воплощениях замещенные остатки встречаются в доступных сайтах антитела. Посредством замены данных остатков цистеином в доступных сайтах антитела, посредством этого, размещаются реакционноспособные тиольные группы, и их можно использовать для конъюгирования антитела с другими группировками, такими как лекарственные группировки или группировки линкер-лекарственное средство, для создания иммуноконъюгата, как дополнительно описано в данном документе. В некоторых воплощениях любой один или более чем один из следующих остатков может быть заменен цистеином: V205 (нумерация по Kabat) легкой цепи; А118 (нумерация ЕС) тяжелой цепи и S400 (нумерация ЕС) тяжелой цепи области Fc. Антитела с модификацией цистеином можно получать, как описано, например, в патенте США №7521541.
д) Производные антител
В некоторых воплощениях предложенное в данном документе антитело может быть дополнительно модифицировано для содержания дополнительных небелковых группировок, которые известны в данной области и легко доступны. Группировки, подходящие для дериватизации антитела включают водорастворимые полимеры, но не ограничиваются ими. Неограничивающие примеры водорастворимых полимеров включают полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1, 3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо случайные сополимеры), декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры полипропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси, но не ограничиваются ими. Полиэтиленгликоля пропиональдегид может иметь преимущества в изготовлении из-за его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может варьировать и, если присоединен более чем один полимер, они могут быть одинаковыми или разными молекулами. В общем, число и/или тип полимеров, используемых для дериватизации, может быть определено на основе соображений, включающих конкретные свойства или функции антитела, подлежающие улучшению, того, будет ли производное антитела использоваться в терапии при определенных условиях и т.д., но не ограничиваясь ими.
В другом воплощении предложены конъюгаты антитела и небелковой группировки, которые можно селективно нагревать посредством воздействия радиации. В одном воплощении небелковая группировка представляет собой углеродную нанотрубку (Kam, N.W. et al., Proc. Natl. Acad. Sci. USA 102 (2005) 11600-11605). Радиация может иметь любую длину волны и включает длины волн, которые не причиняют вреда обычным клеткам, но которые нагревают небелковую группировку до температуры, при которой умерщвляются клетки, расположенные рядом с конъюгатом антитело-небелковая группировка, но не ограничивается ими.
Гаптенилированные соединения
Гаптен в конъюгате, как описано в данном документе, может быть конъюгирован, если он сам по себе не является одной из молекул, с терапевтическим агентом (лекарственным средством), цитотоксическим агентом (например, токсином, таким как доксорубицин или коклюшный токсин), флуорофорами, такими как флуоресцентный краситель, подобный флуоресцеину или родамину, хелатирующим агентом для визуализации или радиотерапевтическим металлом, пептидильной или непептидильной меткой или детектируемой меткой или агентом, модифицирующим клиренс, таким как разные изомеры полиэтиленгликоля, пептидом, который связывается с третьим компонентом или другим углеводом, или липофильным агентом. Такой конъюгат обозначают как гаптенилированное соединение. Конъюгирование может осуществляться либо непосредственно, либо через промежуточный линкер.
а) Терапевтические группировки
Лекарственной группировкой (D) конъюгата гаптен-лекарственное средство (ADC, гаптенилированное лекарственное средство) может быть любое соединение, группировка или группа, которая имеет цитотоксический или цитостатический эффект. Лекарственные группировки включают: (i) химиотерапевтические агенты, которые могут функционировать в качестве ингибиторов микротрубочек, ингибиторов митоза, ингибиторов топоизомеразы или интеркаляторов ДНК; (ii) белковые токсины, которые могут функционировать ферментативно; и (iii) радиоизотопы.
Типичные лекарственные группировки включают майтансиноид, ауристатин, доластатин, трихотецен, СС1065, калихеамицин и другие энедииновые антибиотики, таксан, антрациклин и стереоизомеры, изостеры, их аналоги и производные, но не ограничиваются ими.
Белковые токсины включают цепь А дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина (Vitetta et al (1987) Science, 238: 1098), цепь А абрина, цепь А модессина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-5), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены (WO 93/21232).
Терапевтические радиоизотопы включают32Р,33Р,90Y,125I,131I,131In,153Sm,186Re,188Re,211At,212B,212Pb и радиоактивные изотопы Lu.
Радиоизотопные или другие метки могут быть включены известными способами (Fraker et al (1978) Biochem. Biophys. Res. Commun. 80: 49-57; "Monoclonal Antibodies in Immunoscintigraphy" Chatal, CRC Press 1989). Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой типичный хелатирующий агент для конъюгирования радионуклида с комплексом (WO 94/11026).
б) Метки
Гаптенилированное соединение может представлять собой гаптенилированную метку. Можно использовать любую группировку метки, которую можно ковалентно присоединять к гаптену (см., например, Singh et al (2002) Anal. Biochem. 304: 147-15; Harlow E. and Lane, D. (1999) Using Antibodies: A Laboratory Manual, Cold Springs Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Lundblad R.L. (1991) Chemical Reagents for Protein Modification, 2nd ed. CRC Press, Boca Raton, Fla.). Метка может функционировать для: (i) предоставления выявляемого сигнала; (ii) взаимодействия со второй меткой для модификации выявляемого сигнала, предоставленного первой или второй меткой, например, для получения FRET (резонансный перенос энергии флуоресценции); (iii) воздействия на подвижность, например, электрофоретическую подвижность или проницаемость клетки посредством заряда, гидрофобности, формы и других физических параметров, или (iv) предоставления захватывающей группировки, например, для модуляции ионного комплексообразования.
Конъюгаты, содержащие гептенилированную метку, как описано в данном документе, могут быть полезными в диагностических анализах, например, для выявления экспрессии интересующего антигена в конкретных клетках, тканях или сыворотке. Для диагностических применений будет использоваться биспецифичное антитело, в котором первый функционал связывания связывается с мишенью, и второй функционал связывания связывается с гаптенилированной меткой. Гаптен типично будет помечен выявляемой группировкой. Доступны многочисленные метки, которые обычно можно группировать в следующие категории:
(а) радиоизотопы (радионуклиды), такие как3Н,11С,14С,18F,32Р,35S,64Cu,68Gn,86Y,89Zr,99Tc,111In,123I,124I,125I,131I,133Xe,177Lu,211At, или131Bi. Конъюгаты меченные радиоизотопом, являются полезными в экспериментах по визуализации, нацеленной на рецептор. Антиген (гаптен) можно метить реактивами-лигандами, которые связываются, хелатируют или иным образом формируют комплекс с радиоизотопным металлом с использованием методик, описанных в Current Protocols in Immunology, (1991) Тома 1 и 2, Coligen et al, Ed. Wiley-lnterscience, New York, N.Y., Pubs. Хелатирующие лиганды, которые могут формировать комплекс с ионом металла, включают DOTA, DOTP, DOTMA, DTPA и ТЕТА (Macrocyclics, Dallas, Тех.). Радионуклиды могут быть нацелены через комплексообразование с комплексом, описанным в данном документе (Wu et al, Nature Biotechnology 23(9) (2005) 1137-1146). Визуализация рецептора-мишени с использованием комплексов, меченных радионуклидом, может давать маркер активации пути посредством выявления и количественного измерения постепенного накопления комплексов или соответствующих терапевтических антител в опухолевой ткани (Albert et al (1998) Bioorg. Med. Chem. Lett. 8: 1207-1210).
Комплексы металл-хелат подходят в качестве меток для экспериментов по визуализации (US 2010/0111856; US 5342606; US 5428155; US 5316757; US 5480990; US 5462725; US 5428139; US 5385893; US 5739294; US 5750660; US 5834456; Hnatowich et al, J. Immunol. Methods 65 (1983) 147-157; Meares et al, Anal. Biochem. 142 (1984) 68-78; Mirzadeh et al, Bioconjugate Chem. 1 (1990) 59-65; Meares et al, J. Cancer (1990), Suppl. 10: 21-26; Izard et al, Bioconjugate Chem. 3 (1992) 346-350; Nikula et al, Nucl. Med. Biol. 22 (1995) 387-90; Camera et al, Nucl. Med. Biol. 20 (1993) 955-62; Kukis et al, J. Nucl. Med. 39 (1998) 2105-2110; Verel et al., J. Nucl. Med. 44 (2003) 1663-1670; Camera et al, J. Nucl. Med. 21 (1994) 640-646; Ruegg et al, Cancer Res. 50 (1990) 4221-4226; Verel et al, J. Nucl. Med. 44 (2003) 1663-1670; Lee et al, Cancer Res. 61 (2001) 4474-4482; Mitchell, et al, J. Nucl. Med. 44 (2003) 1105-1112; Kobayashi et al Bioconjugate Chem. 10 (1999) 103-111; Miederer et al, J. Nucl. Med. 45 (2004) 129-137; DeNardo et al, Clinical Cancer Research 4 (1998) 2483-90; Blend et al, Cancer Biotherapy & Radiopharmaceuticals 18 (2003) 355-363; Nikula et al J. Nucl. Med. 40 (1999) 166-76; Kobayashi et al, J. Nucl. Med. 39 (1998) 829-36; Mardirossian et al, Nucl. Med. Biol. 20 (1993) 65-74; Roselli et al, Cancer Biotherapy & Radiopharmaceuticals, 14 (1999) 209-20).
(б) Флуоресцентные метки, такие как хелаты редкоземельных металлов (хелаты европия), разные типы флуоресцеина, включающие FITC (флуоресцеинизотиоцианат), 5-карбоксифлуоресцеин, 6-карбоксифлуоресцеин; разные типы родамина, включающие TAMRA; дансил; лиссамин; цианины; фикоэритрины; техасский красный и их аналоги. Флуоресцентные метки могут быть конъюгированы с антигеном (гаптеном) с использованием методик, раскрытых, например, выше в Current Protocols in Immunology. Флуоресцентные красители и реактивы на основе флуоресцентной метки включают красители и реактивы, которые имеются в продаже у Invitrogen/Molecular Probes (Eugene, Oregon, США) и Pierce Biotechnology, Inc. (Rockford, III.).
Выявляемые метки, такие как флуоресцентные красители и хемилюминисцентные красители (Briggs et al "Synthesis of Functionalised Fluorescent Dyes and Their Coupling to Amines and Amino Acids," J. Chem. Soc., Perkin-Trans. 1 (1997) 1051-1058), дают выявляемый сигнал и обычно являются применимыми для мечения, особенно со следующими свойствами: (i) меченый конъюгат должен давать очень сильный сигнал со слабым фоном таким образом, что могут быть чувствительно выявлены маленькие количества конъюгата как в бесклеточных анализах, так и в анализах на основе клеток; и (ii) меченый конъюгат должен быть фотостабильным так, что флуоресцентный сигнал можно наблюдать, отслеживать и записывать без значимого фотообесцвечивания. Для применений, включающих связывание на поверхности клетки меченых конъюгатов с мембранами или поверхностями клеток, особенно живых клеток, метки должны (iii) иметь хорошую растворимость в воде для достижения эффективной концентрации конъюгата и чувствительности выявления и (iv) быть нетоксчными для живых клеток так, чтобы не нарушать нормальные метаболические процессы клеток или вызывать преждевременную гибель клеток.
(в) Доступны или раскрыты разные ферментативно-субстратные метки (см., например, US 4275149). Фермент обычно катализирует химическое изменение хромогенного субстрата, которое может быть измерено с использованием разных методик. Например, фермент может катализировать изменение окрашивания субстрата, которое можно измерять спектрофотометрически. В качестве альтернативы, фермент может изменять флуоресценцию или хемилюминисценцию субстрата. Хемилюминисцентный субстрат становится элетронно возбужденным посредством химической реакции и может затем испускать свет, который можно измерять (например, с использованием хемилюминометра), или передает энергию флуоресцентному акцептору. Примеры ферментативных меток включают люциферазы (например, люцифераза светляка и бактериальная люцифераза; US 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, такую как пероксидаза хрена (HRP), щелочную фосфатазу (АР), 3-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы (например, глюкозооксидаза, галактозооксидаза и глюкозо-6-фосфатдегидрогеназа), оксидазы гетероциклических соединений (такие как уриказа и ксантиноксидаза), лактопероксидазу, микропероксидазу и тому подобные. Методики конъюгирования ферментов с полипептидами описаны в O'Sullivan et al "Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay", in Methods in Enzym. (ed. by J. Langone & IT Van Vunakis), Academic Press, New York, 73 (1981) 147-166.
Примеры фермент-субстратных комбинаций (US 4275149; US 4318980) включают, например:
(i) пероксидазу хрена (HRP) с пероксидом водорода в качестве субстрата, где пероксидаза окисляет предшественник красителя (например, ортофенилендиамин (OPD) или 3,3',5,5'-тетраметилбензидина гидрохлорид (ТМВ));
(ii) щелочную фосфатазу (АР) с пара-нитрофенилфосфатом в качестве хромогенного субстрата; и
(iii) 3-D-галактозидазу (3-D-Gal) с хромогенным субстратом (например, п-нитрофенил-(3-D-галактозидом) или флуорогенным субстратом 4-метилумбеллиферил-(3-D-галактозидом).
Меченый конъюгат, как описано в данном документе, может использоваться в любом известном способе анализа, таком как ELISA, анализы конкурентного связывания, прямые и непрямые сэндвич-анализы и анализы иммунопреципитации (Zola, Monoclonal Antibodies: A Manual of Techniques (1987) pp. 147-158, CRC Press, Inc.).
Меченые конъюгаты, как описано в данном документе, являются полезными в качестве биомаркеров для визуализации и зондов при использовании в разных способах и методиках биомедицинской и молекулярной визуализации, таких как: (i) MPT (магнитно-резонансная томография); (ii) микроКТ (компьютерная томография); (iii) SPECT (однофотонная эмиссионная компьютерная томография); (iv) PET (позитронная эмиссионная томография) Tinianow, J. et al Nuclear Medicine and Biology, 37(3) (2010) 289-297; Chen et al, Bioconjugate Chem. 15 (2004) 41-49; US 2010/0111856; (v) биолюминисценция; (vi) флуоресценция и (vii) ультразвук. Иммуносцинтиграфия представляет собой методику визуализации, в которой конъюгаты, меченные радиоактивными веществами, вводятся пациенту-животному или человеку, и получают изображение сайтов в организме, где локализуется конъюгат (US 6528624). Биомаркеры для визуализации можно объективно измерять и оценивать в качестве индикатора нормальных биологических процессов, патогенных процессов или фармакологических ответов на терапевтическое вмешательство. Биомаркеры могут быть нескольких типов: маркеры типа 0 представляют собой маркеры естественной истории заболевания, и они линейно коррелируют с известными клиническими показателями, например, оценка посредством МРТ синовиального воспаления при ревматоидном артрите; маркеры типа I запечатлевают эффект вмешательства в соответствии с механизмом действия, даже если данный механизм может быть не связан с ожидаемым клиническим результатом; маркеры типа II функционируют как имитация ожидаемых результатов, когда изменение в или сигнал от биомаркера прогнозирует клиническую пользу для «подтверждения» целевого ответа, как, например, измеренная эрозия кости при ревматоидном артрите, определенная КТ.
Биомаркеры для визуализации, таким образом, могут давать фармакодинамическую (PD) терапевтическую информацию по: (i) экспрессии белка-мишени, (ii) связыванию терапевтического средства с белком-мишенью, т.е. селективности, и (iii) фармакодинамическим данным - клиренсу и периоду полувыведения. Преимущества биомаркеров для визуализации in vivo по отношению к лабораторным биомаркерам включают: неинвазивную обработку, поддающуюся количественному измерению оценку всего организма, повторное дозирование и оценку, т.е. во многие моменты времени, и потенциально переносимые эффекты от доклинических (на маленьких животных) на клинические (на человеке) результаты. Для некоторых применений биовизуализация подменяет или минимизирует число экспериментов на животных в доклинических исследованиях.
Способы мечения пептидов хорошо известны. См. Haugland (2003) Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley (1992) Bioconjugate Chem. 3: 2; Garman, (1997) Non-Radioactive Labeling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1: 2; Glazer et al Chemical Modification of Proteins. Laboratory Techniques in Biochemistry and Molecular Biology (T.S. Work and E. Work, Eds.) American Elsevier Publishing Co., New York; Lundblad, R.L. and Noyes, С.M. (1984) Chemical Reagents for Protein Modification, Vols. I and II, CRC Press, New York; Pfleiderer, G. (1985) "Chemical Modification of Proteins", Modern Methods in Protein Chemistry, H. Tschesche, Ed., Walter DeGruyter, Berlin and New York и Wong (1991) Chemistry of Protein Conjugation and Cross-linking, CRC Press, Boca Raton, Fla.); DeLeon-Rodriguez et al, Chem. Eur. J. 10 (2004) 1149-1155; Lewis et al, Bioconjugate Chem. 12 (2001) 320-324; Li et al, Bioconjugate Chem. 13 (2002) 110-115; Mier et al Bioconjugate Chem. 16 (2005) 240-237.
Конъюгаты антител
Антитело в конъюгате, как описано в данном документе, может быть дополнительно конъюгировано, если оно само по себе не является одной из молекул, с терапевтическим агентом (лекарственным средством), цитотоксическим агентом (например, токсином, таким как доксорубицин или коклюшный токсин), флуорофорами, такими как флуоресцентный краситель, подобный флуоресцеину или родамину, хелатирующим агентом для визуализации или радиотерапевтическим металлом, пептидильной или непептидильной меткой или выявляемой меткой или агентом, модифицирующим клиренс, таким как разные изомеры полиэтиленгликоля, пептидом, который связывается с третьим компонентом, или другим углеводным или липофильным агентом.
Иммуноконъюгаты
Согласно изобретению также предложены иммуноконъюгаты, содержащие антитело, как описано в данном документе, или конъюгат, как описано в данном документе, конъюгированные с одним или более чем одним цитотоксическим агентом, таким как химиотерапевтические агенты или лекарственные средства, агенты, ингибирующие рост, токсины (например, белковые токсины, ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, или их фрагменты) или радиоактивные изотопы.
В одном воплощении иммуноконъюгат представляет собой конъюгат антитело-лекарственное средство (ADC), в котором антитело конъюгировано с одним или более чем одним лекарственным средством, включающим майтансиноид (см. US 5208020, US 5416064 и ЕР 0 425 235 В1); ауристатин, такой как монометилауристатиновые лекарственные группировки DE и DF (ММАЕ и MMAF) (см. US 5635483, US 5780588 и US 7498298); доластатин; калихеамицин или его производное (см. US 5712374, US 5714586, US 5739116, US 5767285, US 5770701, US 5770710, US 5773001 и US 5877296; Hinman, LM. et al., Cancer Res. 53 (1993) 3336-3342 и Lode, H.N. et al., Cancer Res. 58 (1998) 2925-2928); антрациклин, такой как дауномицин или доксорубицин (см. Kratz, F. et al., Curr. Med. Chem. 13 (2006) 477-523; Jeffrey, S.C. et al., Bioorg. Med. Chem. Lett. 16 (2006) 358-362; Torgov, M.Y. et al., Bioconjug. Chem. 16 (2005) 717-721; Nagy, A. et al., Proc. Natl. Acad. Sci. USA 97 (2000) 829-834; Dubowchik, G.M. et al., Bioorg. & Med. Chem. Letters 12 (2002) 1529-1532; King, H.D. et al., J. Med. Chem. 45 (2002) 4336-4343 и патент США №6630579); метотрексат; виндезин; таксан, такой как доцетаксел, паклитаксел, ларотаксел, тезетаксел и ортатаксел; трихотецен и СС1065, но не ограничивающимся ими.
В другом воплощении иммуноконъюгат содержит антитело, как описано в данном документе, конъюгированное с ферментативно активным токсином или его фрагментом, включающим цепь А дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модессина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены, но не ограничивающимся ими.
В другом воплощении иммуноконъюгат содержит антитело, как описано в данном документе, или комплекс, как описано в данном документе, конъюгированные с радиоактивным атомом с образованием радиоконъюгата. Для получения радиоконъюгатов доступно множество радиоактивных изотопов. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. При использовании радиоконъюгата для выявления он может содержать радиоактивный атом для сцинтиграфических исследований, например, Tc99m или I123, или спиновую метку для визуализации посредством ядерного магнитного резонанса (ЯМР) (также известного как магнитно-резонансная томография, МРТ), такую как опять-таки йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела и цитотоксического агента можно получать с использованием целого ряда связывающих агентов для бифункциональных белков, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)-циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцинимидил суберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис-(п-азидобензоил)-гександиамин), производные бис-диазония (такие как бис-(п-диазониябензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta, E.S. et al., Science 238 (1987) 1098-1104. Меченная углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) представляет собой типичный хелатирующий агент для конъюгирования радиоактивного нуклеотида с антителом. См. WO 94/11026. Линкер может быть «расщепляемым линкером», облегчающим высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать кислотолабильный линкер, пептидазочувствительный линкер, фотолабильный линкер, диметильный линкер или дисульфидсодержащий линкер (Chari, R.V. et al., Cancer Res. 52 (1992) 127-131; патент США №5208020).
Иммуноконъюгаты или ADC, прямо рассматриваемые в данном документе, включают, но не ограничиваются такими конъюгатами, которые получены с поперечно связывающими реактивами, включающими BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые имеются в продаже (например, у Pierce Biotechnology, Inc., Rockford, IL, США), но не ограничивающимися ими.
Линкер
Термин «линкер» обозначает бифункциональную или мультифункциональную группировку, которую можно использовать для конъюгирования (связывания) антигена (например, гаптена) с другими группировками, такими как детектируемые метки или лекарственные средства. Конъюгаты антигена (гаптена) могут быть с удобством получены с использованием линкера, имеющего реакционноспособную функциональную группу для связывания с лекарственным средством, с антигеном (гаптеном) и с антителом против гаптена.
В одном воплощении линкер имеет реакционноспособный сайт, который имеет электрофильную группу, которая реагирует с нуклеофильной группой, присутствующей на антителе против гаптена. Тиольная группа цистеина на антителе, например, реагирует с электрофильной группой на линкере и образует ковалентную связь с линкером. Полезные электрофильные группы включают другую тиольную, малеимидную и галогенацетамидную группы (см., например, способ конъюгирования на стр.766 Klussman et al, Bioconjugate Chemistry 15(4) (2004) 765-773), но не ограничиваются ими.
Примеры функциональных групп, реагирующих с тиолом, включают тиол, малеимид, альфа-галогенацетил, активированные сложные эфиры, такие как сложные эфиры сукцинимида, 4-нитрофениловые сложные эфиры, пентафторфениловые сложные эфиры, тетрафторфениловые сложные эфиры, ангидриды, хлорангидриды, сульфонилхлориды, изоцианаты и изотиоцианаты, но не ограничиваются ими.
Линкер может содержать аминокислотные остатки, которые связывают антиген (гаптен) с грузом. Аминокислотные остатки могут образовать дипептидное, трипептидное, тетрапептидное, пентапептидное, гексапептидное, гептапептидное, октапептидное, нонапептидное, декапептидное, ундекапептидное или додекапептидное звено. Аминокислотные остатки включают аминокислотные остатки, встречающиеся в природе, а также не встречающиеся в природе аминокислотные аналоги, такие как, например, цитруллин или β-аминокислоты, такие как, например, β-аланин, или ϖ-аминокислоты, такие как 4-аминомасляная кислота.
В другом воплощении линкер имеет реакционноспособную функциональную группу, которая имеет нуклеофильную группу, которая реагирует с электрофильной группой, присутствующей на антигене (гаптене) или на антителе (антителе против гаптена). Полезные электрофильные группы включают карбонильные группы альдегидов и кетонов, но не ограничиваются ими. Гетероатом нуклеофильной группы линкера может реагировать с электрофильной группой на гаптене или антителе с образованием ковалентной связи с антигеном (гаптеном) или антителом. Полезные нуклеофильные группы на линкере включают гидразидную, оксимовую, амино, гидразиновую, тиосемикарбазоновую, гидразинкарбоксилатную и арилгидразидную, но не ограничиваются ими. Электрофильная группа на антигене (гаптене) дает удобный сайт для присоединения к линкеру.
Типично линкеры пептидного типа можно получать путем образования пептидной связи между двумя или более чем двумя аминокислотами и/или пептидными фрагментами. Такие пептидные связи можно получать, например, согласно способу синтеза в жидкой фазе (Е. Schroder and K. Lubke "The Peptides", volume 1 (1965) 76-136, Academic Press), который хорошо известен в области пептидной химии.
В другом воплощении линкер может быть замещен группами, которые модулируют растворимость или реакционную способность. Например, заряженный заместитель, такой как сульфонат (SO3-) или аммоний, или полимер, такой как ПЭГ, может увеличивать растворимость реактива в воде и облегчать реакцию связывания линкерного реактива с антигеном (гаптеном) или лекарственной группировкой, или облегчать реакцию связывания, в зависимости от используемого пути синтеза.
Конъюгаты, содержащие лекарственное средство или метку, как описано в данном документе, прямо предусматривают комплексы, полученные со следующими линкерными реактивами: ВМРЕО, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), и включая бис-малеимидные реактивы: DTME, ВМВ, BMDB, ВМН, ВМОЕ, ВМ(РЕО)3 и ВМ(РЕО)4, которые имеются в продаже у Pierce Biotechnology, Inc., но не ограничиваются ими. Бис-малеимидные реактивы обеспечивают последовательное или одновременное присоединение, например, тиольной группы к тиолсодержащей лекарственной группировке, метке или линкерному промежуточному соединению. Другие функциональные группы, помимо малеимида, которые реагируют, например, с тиольной группой, включают йодацетамид, бромацетамид, винилпиридин, дисульфид, пиридилдисульфид, изоцианат и изотилцианат.
Типичный линкер включает валин-цитруллиновый (val-cit или vc) дипептидный линкерный реактив, имеющий малеимидную ширилку и пара-аминобензилкарбамоильный (РАВ) самораспадающийся спейсер, и phe-lys(Mtr) дипептидный линкерный реактив, имеющий малеимидную ширилку и п-аминобензильный самораспадающийся спейсер.
Тиольные группы цистеина являются нуклеофильными и способными к реакции с образованием ковалентных связей с электрофильными группами на линкерных реактивах и гаптенилированных соединениях, включающих: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и хлорангидриды; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы; и (iv) дисульфиды, включающие пиридилдисульфиды, образующиеся посредством сульфидного обмена. Нуклеофильные группы на гаптенилированном соединении включают аминогруппу, тиольную, гидроксильную, гидразидную, оксимовую, гидразиновую, тиосемикарбазоновую, гидразинкарбоксилатную и арилгидразидную группы, способные к реакции с образованием ковалентных связей с электрофильными группами на линкерных группировках и линкерных реактивах.
III. Нуклеиновая кислота
ДНК, кодирующую вариант аминокислотной последовательности антитела, как описано в данном документе, или содержащегося в конъюгате, как описано в данном документе, можно получать множеством способов, известных в данной области. Данные способы включают получение сайтнаправленным (или опосредованным олигонуклеотидом) мутагенезом, ПЦР-мутагенезом и кассетным мутагенезом полученной ранее ДНК, кодирующей полипептид, но не ограничиваются ими. Варианты рекомбинантных антител также можно конструировать посредством манипулирования с рестрикционным фрагментом или посредством ПЦР с перекрывающимися праймерами с использованием синтетических олигонуклеотидов. Мутагенные праймеры кодируют замену(ны) на кодоны цистеина. Для получения ДНК, кодирующей такие генетически модифицированные антитела, можно использовать стандартные методики мутагенеза. Общее руководство можно найти в Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989 и Ausubel et al Current Protocols in Molecular Biology, Greene Publishing and Wiley-lnterscience, New York, N.Y., 1993.
IV. Экспрессия и очистка
Антитела можно получать с использованием способов и композиций генной инженерии, например, как описано в US 4816567. В одном воплощении предоставляется выделенная нуклеиновая кислота, кодирующая антитело, описанное в данном документе. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). В другом воплощении предложен один или более чем один вектор (например, экспрессионные векторы), содержащий такую нуклеиновую кислоту. В другом воплощении предложена клетка-хозяин, содержащая такую нуклеиновую кислоту. В одном таком воплощении клетка-хозяин содержит (например, была трансформирована): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном воплощении клетка-хозяин является эукариотической, например, клеткой яичника китайского хомяка (СНО) или лимфоидной клеткой (например, клетка Y0, NS0, Sp20). В одном воплощении предложен способ получения антитела, как описано в данном документе, где данный способ влючает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, как приведено выше, при подходящих условиях для экспрессии антитела, и возможно выделение антитела из клетки-хозяина (или культуральной среды клетки-хозяина).
Для рекомбинантной продукции антитела, как описано в данном документе, выделяют нуклеиновую кислоту, кодирующую антитело, например, как описано выше, и вставляют в один или более чем один вектор для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такую нуклеиновую кислоту можно легко выделять и секвенировать с использованием традиционных методик (например, посредством применения олигонуклеотидных зондов, которые способны к специфичному связыванию с генами, кодирующими тяжелые и легкие цепи антитела).
Подходящие клетки-хозяева для клонирования или экспрессии векторов, кодирующих антитело, включают прокариотические или эукариотические клетки, описанные в данном документе. Например, антитела можно продуцировать в бактериях, в частности, когда не нужны гликозилирование и эффекторная функция Fc. Относительно экспрессии фрагментов и полипептидов антитела в бактериях см., например, US 5648237, US 5789199 и US 5840523. (См. также Charlton, K.А., In: Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2003), pp. 245-254, описывающую экспрессию фрагментов антитела в Е.coli.). После экспрессии антитело можно выделять из пасты бактериальных клеток в растворимой фракции и можно дополнительно очищать.
Помимо прокариот, подходящими хозяевами для клонирования или экспрессии векторов, кодирующих антитело, являются эукариотические микробы, такие как нитчатые грибки или дрожжи, включая штаммы грибков и дрожжей, пути гликозилирования которых были «гуманизированы», приводя к получению антитела с частично или полностью человеческой картиной гликозилирования. См. Gerngross, T.U., Nat. Biotech. 22 (2004) 1409-1414 и Li, Н. et al., Nat. Biotech. 24 (2006) 210-215.
Подходящие клетки-хозяева для экспрессии гликозилированного антитела также происходят из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, котрые можно использовать в сочетании с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
Культуры растительных клеток также можно использовать в качестве хозяев. См., например, патенты США №5959177, 6040498, 6420548, 7125978 и 6417429 (описывающие технологию PLANTIBODIES™ для продуцирования антител в трансгенных растениях).
Клетки позвоночных также можно использовать в качестве хозяев. Например, могут быть полезными линии клеток млекопитающих, которые адаптированы для роста в суспензии. Другими примерами полезных линий клеток-хозяев млекопитающих являются линия CV1 почки обезьяны, трнсформированная SV40 (COS-7); линия эмбриональной почки человека (293 или клетки 293, как описано, например, Graham, F.L. et al., J. Gen Virol. 36 (1977) 59-74); клетки почки новорожденного хомяка (BHK); мышиные клетки Сертоли (клетки ТМ4, как описано, например, в Mather, J.P., Biol. Reprod. 23 (1980) 243-252); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клеки почки собаки (MDCK); клетки печени серой крысы (BRL 3А); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, как описано, например, в Mather, J.P. et al., Annals N.Y. Acad. Sci. 383 (1982) 44-68; клетки MRC 5 и клетки FS4. Другие полезные линии клеток-хозяев млекопитающих включают клетки яичника китайского хомяка (СНО), включая клеки СНО DHFR- (негативные по дегидрофолатредуктазе) (Urlaub, G. et al., Proc. Natl. Acad. Sci. USA 77 (1980) 4216-4220); и линии клеток миеломы, такие как Y0, NS0 и Sp2/0. Для обзора определенных линий клеток-хозяев млекопитающих, полезных для продукции антител, см., например, Yazaki, P. and Wu, A.M., Methods in Molecular Biology, Vol. 248, Lo, B.K.C. (ed.), Humana Press, Totowa, NJ (2004), pp. 255-268.
V. Способы и композиции для диагностики и выявления
В некоторых воплощениях любое из антител, особенно биспецифичных антител и конъюгатов, как описано в данном документе, является полезным для выявления присутствия одной или более чем одной молекулы-мишени в биологическом образце. Термин «выявление» в том виде, в котором он используется в данном документе, охватывает количественное или качественное выявление. В одном воплощении биологический образец содержит клетку или ткань.
В одном воплощении предложено антитело или конъюгат, как описано в данном документе, для применения в способе диагностики или выявления. В некоторых воплощениях способ включает приведение в контакт биологического образца с антителом или конъюгатом, как описано в данном документе, при пермиссивных условиях для связывания антитела или конъюгата с мишенью и выявление того, образуется ли комплекс между антителом или конъюгатом и мишенью. Такое способ может представлять собой способ in vitro или in vivo.
В некоторых воплощениях предложены меченые антитела или конъюгаты. Метки включают метки или группировки, которые выявляются непосредственно (такие как флуоресцентные, хромофорные, электроноплотные, хемилюминисцентные и радиоактивные метки), а также такие группировки, как ферменты или лиганды, которые выявляются опосредованно, например, посредством ферментативной реакции или молекулярного взаимодействия, но не ограничиваются ими. Типичные метки включают радиоизотопы32Р,14С,125I,3Н и131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люциферазу светляка и бактериальную люциферазу (US 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфат дегидрогеназу, окисдазы гетероциклических соединений, такие как уриказа и ксантиноксидаза, связанные с ферментом, который использует пероксид водорода для окисления предшественника красителя, таким как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и тому подобное, но не ограничиваются ими.
VI. Фармацевтические композиции
Фармацевтические композиции антитела или конъюгата, как описано в данном документе, получают смешиванием такого антитела или конъюгата, имеющего желательную степень чистоты, с одним или более чем одним возможным фармацевтически приемлемым носителем (Remington's Pharmaceutical Sciences, 16th edition, Osol, A. (ed.) (1980)) в форме лиофилизированных композиций или водных растворов. Фармацевтически приемлемые носители обычно являются нетоксичными для реципиентов при используемых дозировках и концентрациях и включают: буферы, такие как фосфатный, цитратный или на основе других органических кислот; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид; бензэтония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (меньше, чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поли(винилпирролидон); аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA (этилендиаминтетрауксусная кислота); сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок) и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ), но не ограничиваются ими. Типичные фармацевтически приемлемые носители в данном документе дополнительно включают агенты для диспергирования лекарственного средства в интерстициальном пространстве, такие как растворимые нейтрально-активные гиалуронидазные гликопротеины (sHASEGP), например, человеческие растворимые гиалуронидазные гликопротеины РН-20, такие как rhuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые типичные sHASEGPs и способы применения, включающие rhuPH20, описаны в публикациях патентов США №2005/0260186 и 2006/0104968. В одном аспекте sHASEGP объединяют с одной или более чем одной дополнительной гликозаминогликаназой, такой как хондроитиназа.
Типичные лиофилизированные композиции антитела описаны в US 6267958. Водные композиции антитела включают композиции, описанные в US 6171586 и WO 2006/044908, причем последние композиции включают гистидин-ацетатаный буфер.
Описанная в данном документе композиция также может содержать более чем один активный ингредиент, по мере необходимости для конкретного показания, которое лечат, предпочтительно активные ингредиенты с дополнительными активностями, которые не оказывают неблагоприятного влияния друг на друга. Такие активные ингредиенты подходящим образм присутствуют в комбинации в количествах, которые являются эффективными для намеченной цели.
Активные ингредиенты могут быть захвачены в микрокапсулы, полученные, например, посредством методик коацервации или полимеризации на границе раздела фаз, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы доставки лекарственного средства (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики раскрыты в Remington's Pharmaceutical Sciences, 16th edition, Osol, A. (ed.) (1980).
Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело или конъюгат, которые находятся в виде формованных предметов, например, пленок или микрокапсул.
Композиции, подлежащие для применения для введения in vivo, обычно являются стерильными. Стерильность может легко достигаться, например, фильтрованием через мембраны для стерилизующей фильтрации.
VII. Терапевтичекие способы и композиции
Любое из описанных в данном документе антител или конъюгатов можно использовать в терапевтических способах.
В одном аспекте предложено антитело или конъюгат, как описано в данном документе, для применения в качестве лекарственного средства. В других аспектах предложено антитело или конъюгат, как описано в данном документе, для применения в лечении заболевания. В некоторых воплощениях предложено антитело или конъюгат, как описано в данном документе, для применения в способе лечения. В некоторых воплощениях согласно изобретению предложено антитело или конъюгат, как описано в данном документе, для применения в способе лечения индивида, включающем введение индивиду эффективного количества антитела или конъюгата, как описано в данном документе. В одном таком воплощении способ дополнительно включает введение индивиду эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, как описано ниже. «Индивид» согласно любому из приведенных выше воплощений может представлять собой человека.
В другом аспекте согласно изобретению предложено применение антитела или конъюгата, как описано в данном документе, в изготовлении или получении лекарственного средства. В одном воплощении лекарственное средство служит для лечения заболевания. В другом воплощении лекарственное средство служит для применения в способе лечения заболевания, включающем введение индивиду, имеющему заболевание, эффективного количества лекарственного средства. В одном таком воплощении данный способ дополнительно включает введение индивиду эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, как описано ниже. «Индивид» согласно любому из приведенных выше воплощений может быть человеком.
В другом аспекте согласно изобретению предложен способ лечения заболевания. В одном воплощении данный способ включает введение индивиду, имеющему такое заболевание, эффективного количества антитела или конъюгата, как описано в данном документе. В одном таком воплощении данный способ дополнительно включает введение индивиду эффективного количества по меньшей мере одного дополнительного терапевтического агента, как описано ниже. «Индивид» согласно любому из приведенных выше воплощений может быть человеком.
В другом аспекте согласно изобретению предложены фармацевтические композиции, содержащие любое из антител или конъюгатов, как описано в данном документе, например, для применения в любом из приведенных выше терпевтических способов. В одном воплощении фармацевтическая композиция содержит любое из антител или конъюгатов, как описано в данном документе, и фармацевтически приемлемый носитель. В другом воплощении фармацевтическая композиция содержит любое из антител или конъюгатов, как описано в данном документе, и по меньшей мере один дополнительный терапевтический агент, например, как описано ниже.
Антитела и конъюгаты, как описано в данном документе, можно использовать в терапии либо одни, либо в комбинации с другими агентами. Например, антитело и конъюгат, как описано в данном документе, можно вводить совместно с по меньшей мере одним дополнительным терапевтическим агентом.
Такие комбинированные терапии, отмеченные выше, охватывают комбинированное введение (когда два или более чем два терапевтических агента включают в ту же самую или в отдельные композиции) и раздельное введение, причем в данном случае введение антитела по изобретению может происходить до, одновременно и/или после введения дополнительного терапевтического агента и/или адъюванта. Антитела и конъюгаты, как описано в данном документе, также можно использовать в комбинации с лучевой терапией.
Антитело или конъюгат, как описано в данном документе (и любой дополнительный терапевтический агент), можно вводить любыми подходящими способами, включая парентеральное, внутрилегочное и интраназальное введение, и, если это желательно для местного лечения, введение в область поражения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование может осуществляться любым подходящим путем, например, посредством инъекций, таких как внутривенные или подкожные инъекции, отчасти в зависимости от того, является ли введение кратковременным или хроническим. В данном документе рассматриваются разные схемы дозирования, включающие однократные или многократные введения на протяжении разных моментов времени, болюсное введение и импульсную инфузию, но не ограничивающиеся ими.
Антитела или конъюгаты, как описано в данном документе, были бы приготовлены, дозированы и введены способом, согласующимся с надлежащей медицинской практикой. В данном контексте факторы для рассмотрения включают конкретное расстройство, которое лечат, конкретное млекопитающее, которое лечат, клиническое состояние индивидуального пациента, причину расстройства, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам. Антитело или конъюгат не должны, но возможно готовятся с одним или более чем одним агентом, используемым в настоящее время для предупреждения или лечения рассматриваемого расстройства. Эффективное количество таких других агентов зависит от количетва антитела или конъюгата, присутствующих в композиции, типа расстройства или лечения и других факторов, обсуждавшихся выше. Их обычно используют в таких же дозировках и с использованием таких же путей введения, которые описаны в данном документе, или примерно от 1 до 99% от дозировок, описанных в данном документе, или в любой дозировке и любым путем, который эмпирически/клинически определен как подходящий.
Для предупреждения или лечения заболевания подходящая дозировка антитела или конъюгата, как описано в данном документе (при использовании одного или в комбинации с одним или более чем одним другим дополнительным терапевтическим агентом), будет зависеть от типа заболевания, подлежащего лечению, типа антитела или конъюгата, тяжести и хода заболевания, того, вводится ли антитело или конъюгат для предупредительных или терапевтических целей, предыдущей терапии, клинической истории пациента, ответа на антитело или конъюгат и решения лечащего врача. Антитело или конъюгат подходящим образом вводятся пациенту за один раз или на протяжении серии обработок. В зависимости от типа и тяжести заболевания примерно от 1 мкг/кг до 15 мг/кг (например, 0,5 мг/кг - 10 мг/кг) антитела или конъюгата могут составлять исходную подходящую дозировку для введения пациенту, например, независимо от того, посредством одного или более чем одного раздельного введения или посредством непрерывной инфузии. Одна типичная ежесуточная дозировка может варьировать от примерно 1 мкг/кг до 100 мг/кг или более, в зависимости от факторов, упомянутых выше. Для повторных введений на протяжении некольких суток или более, в зависимости от состояния, лечение обычно сохраняли бы, пока не происходило бы желательное подавление симптомов заболевания. Одна типичная дозировка антитела или конъюгата находилась бы в интервале от примерно 0,05 мг/кг до примерно 10 мг/кг.Таким образом, пациенту можно вводить одну или более чем одну дозу примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или их любую комбинацию). Такие дозы можно вводить периодически, например, каждую неделю или каждые три недели (например, таким образом, что пациент получает от примерно двух до примерно двадцати или, например, примерно шесть доз антитела). Может вводиться исходная более высокая ударная доза, с последующей одной или более чем одной меньшей дозой. Однако могут быть полезными другие схемы дозировки. Прогресс данной терапии легко отслеживать традиционными методиками и анализами.
Понятно, что любые из приведенных выше композиций или терапевтических способов можно получать(осуществлять) с использованием иммуноконъюгата по изобретению вместо или помимо антитела или конъюгата, как описано в данном документе.
VIII. Изделия
В другом аспекте изобретения предложено изделие, содержащее полезные материалы для лечения, предупреждения и/или диагностики расстройств, описанных выше. Данное изделие содержит контейнер и этикетку или листок-вкладыш в упаковке на или ассоциированный с контейнером. Подходящие контейнеры включают, например, бутыли, флаконы, шприцы, мешки с в.в. (внутривенный) раствором и т.д. Контейнеры могут быть образованы из целого ряда материалов, таких как стекло или пластмасса. Данный контейнер содержит композицию, которая сама по себе или объединенная с другой композицией является эффективной для лечения, предупреждения и/или диагностики состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой мешок с внутривенным раствором или флакон, имеющий пробку, проницаемую подкожной инъекционной иглой). По меньшей мере один активный агент в композиции представляет собой антитело или комплекс, как описано в данном документе. На этикетке или листке-вкладыше в упаковке указано то, что композиция используется для лечения выбранного состояния. Кроме того, изделие может содержать (а) первый контейнер с композицией, содержащейся в нем, где данная композиция содержит антитело или комплекс, как описано в данном документе; и (б) второй контейнер с композицией, содержащейся в нем, где данная композиция содержит дополнительный цитотоксический или иной терапевтический агент. Изделие в данном воплощении изобретения может дополнительно содержать листок-вкладыш в упаковке, указывающий, что композиции можно использовать для лечения конкретного состояния. Альтернативно или дополнительно изделие может дополнительно содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекции (BWFI), фосфатно-солевой буферный раствор, раствор Рингера и раствор декстрозы. Оно может дополнительно включать другие материалы, желательные с коммерческой или пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Понятно, что любое из приведенных выше изделий может включать иммуноконъюгат по изобретению вместо или помимо антитела или конъюгата, как описано в данном документе.
IX. Конкретные воплощения
1. Ковалентный конъюгат, содержащий
i) биспецифичное антитело, которое имеет первый функционал связывания, который специфично связывается с гаптенилированным грузом, и второй функционал связывания, который специфично связывается с рецептором гематоэнцефалического барьера, и
ii) гаптенилированный груз,
в котором гаптенилированный груз специфично связывается первым функционалом связывания,
в котором ковалентный конъюгат имеет ковалентную связь между гаптенилированным грузом и первым функционалом связывания, который специфично связывается с гаптенилированным грузом, и
в котором гаптенилированный груз выбран из группы, состоящей из биотинилированных грузов, теофиллинированных грузов, дигоксигенилированных грузов, карборанилированных грузов, флуоресцеинилированных грузов, хеликарилированных грузов и бромдезоксиуридинилированных грузов.
2. Нековалентный комплекс, содержащий биспецифичное антитело, которое имеет первый функционал связывания, который специфично связывается с гаптенилированным грузом, и второй функционал связывания, который специфично связывается с рецептором гематоэнцефалического барьера, и гаптенилированный груз, в котором гаптенилированный груз специфично связывается первым функционалом связывания.
3. Ковалентный конъюгат, содержащий биспецифичное антитело, которое имеет первый функционал связывания, который специфично связывается с гаптенилированным грузом, и второй функционал связывания, который специфично связывается с рецептором гематоэнцефалического барьера, и гаптенилированный груз, в котором гаптенилированный груз специфично связывается первым функционалом связывания, и который имеет ковалентную связь между гаптенилированным грузом и первым функционалом связывания, который специфично связывается с гаптенилированным грузом.
4. Комплекс или конъюгат по любому из пп. 1-3, в котором гаптенилированный груз выбран из группы, состоящей из биотинилированных грузов, теофиллинированных грузов, дигоксигенилированных грузов, карборанилированных грузов, флуоресцеинилированных грузов, хеликарилированных грузов и бромдезоксиуридинилированных грузов.
5. Комплекс или конъюгат по любому из пп. 1-4, в котором гаптен представляет собой производное или аналог нуклеотида или нуклеозида. В одном воплощении гаптен представляет собой производное или аналог аминокислоты.
6. Комплекс или конъюгат по любому из пп. 1-5, в котором рецептор гематоэнцефалического барьера выбран из группы, состоящей из рецептора трансферрина (TfR), рецептора инсулина, рецептора инсулиноподобного фактора роста (рецептор IGF), белка 8, родственного рецептору липопротеина низкой плотности (LRP8), белка 1, родственного рецептору липопротеина низкой плотности (LRP1), и фактора роста, подобного гепаринсвязывающему эпидермальному фактору роста (HB-EGF).
7. Комплекс или конъюгат по любому из пп. 1-6, в котором биспецифичное антитело представляет собой полноразмерное антитело, содержащее два сайта связывания.
8. Комплекс или конъюгат по любому из пп. 1-7, в котором биспецифичное антитело представляет собой полноразмерное антитело, с которым были слиты один или два scFv или scFab, и который содержит три или четыре сайта связывания.
9. Комплекс или конъюгат по любому из пп. 1-8, в котором биспецифичное антитело представляет собой фрагмент антитела. В одном воплощении фрагмент антитела выбран из F(ab')2 и диател.
10. Комплекс или конъюгат по любому из пп. 1-9, в котором биспецифичное антитело представляет собой гуманизированное или человеческое антитело.
11. Комплекс или конъюгат по любому из пп. 1-10, в котором биспецифичное антитело не имеет эффекторной функции.
12. Комплекс или конъюгат по любому из пп. 1-11, в котором биспецифичное антитело не имеет функциональной области Fc.
13. Комплекс или конъюгат по любому из пп. 1-12, в котором биспецифичное антитело не имеет области Fc.
14. Комплекс или конъюгат по любому из пп. 1-13, в котором биспецифичное антитело имеет область Fc человеческого подкласса IgG1 с мутациями L234A, L235A и P329G, в котором положения определяются согласно нумерации области Fc по Kabat (индекс ЕС по Kabat).
15. Комплекс или конъюгат по любому из пп. 1-14, в котором биспецифичное антитело имеет область Fc человеческого подкласса IgG4 с мутациями S228P, L235E и P329G, где положения определяются согласно нумерации области Fc по Kabat (индекс ЕС по Kabat).
16. Комплекс или конъюгат по любому из пп. 1-15, в котором биспецифичное антитело содержит:
а) один сайт связывания для гаптенилированного груза и один сайт связывания для рецептора гематоэнцефалического барьера или
б) два сайта связывания для гаптенилированного груза и один сайт связывания для рецептора гематоэнцефалического барьера, или
в) один сайт связывания для гаптенилированного груза и два сайта связывания для рецептора гематоэнцефалического барьера, или
г) два сайта связывания для гаптенилированного груза и два сайта связывания для рецептора гематоэнцефалического барьера.
17. Комплекс или конъюгат по любому из пп. 1-16, в котором биспецифичное антитело содержит два сайта связывания для гаптенилированного груза и два сайта связывания для рецептора гематоэнцефалического барьера.
18. Комплекс или конъюгат по любому из пп. 1-17, в котором гаптенилированный груз содержит линкер между гаптеном и грузом.
19. Комплекс или конъюгат по п. 18, в котором линкер представляет собой пептидный линкер.
20. Комплекс или конъюгат по п. 18, в котором линкер представляет собой химический линкер (непептидный линкер).
21. Комплекс или конъюгат по любому из пп. 1-20, в котором каждый из биспецифичного антитела и гаптенилированного груза содержит функциональную группу, посредством которых при связывании гаптенилированного груза биспецифичным антителом образуется ковалентная связь между гаптенилированным грузом и биспецифичным антителом.
22. Комплекс или конъюгат по любому из пп. 1-21, в котором биспецифичное антитело содержит функциональную группу на аминокислотном остатке в CDR2 антитела, при этом CDR2 определяется согласно Kabat.
23. Комплекс или конъюгат по п. 22, в котором функциональная группа на аминокислотном остатке в CDR2 антитела представляет собой тиольную группу.
24. Комплекс или конъюгат по любому из пп. 1-23, в котором биспецифичное антитело содержит аминокислотный остаток цистеина в CDR2 антитела.
25. Комплекс или конъюгат по любому из пп. 1-24, в котором гаптенилированный груз содержит функциональную группу в гаптене или, при его наличии, в линкере между гаптеом и грузом.
26. Комплекс или конъюгат по п. 25, в котором функциональная группа представляет собой тиол или малеимид, или галогенацетил.
27. Комплекс или конъюгат по любому из пп. 25-26, в котором функциональная группа в гаптене или, при его наличии, в линкере представляет собой тиольную группу.
28. Комплекс или конъюгат по любому из пп. 1-27, в котором ковалентная связь образуется между остатком цистеина в CDR2 антитела и тиольной группой в гаптенилированном грузе.
29. Комплекс или конъюгат по п. 28, в котором ковалентная связь представляет собой дисульфидную связь.
30. Комплекс или конъюгат по любому из пп. 28-29, в котором ковалентная связь представляет собой дисульфидную связь, и она образуется без добавления окислительно-восстановительно активных агентов.
31. Комплекс или конъюгат по любому из пп. 1-30, в котором CDR2 представляет собой CDR2 тяжелой цепи, в случае гаптенилированного груза, выбранного из группы, состоящей из биотинилированных грузов, теофиллинированных грузов, дигоксигенилированных грузов и флуоресцеинилированных грузов.
32. Комплекс или конъюгат по п. 31, в котором остаток цистеина в CDR2 тяжелой цепи антитела находится в положении 52 или в положении 52а, или в положении 52b, или в положении 52с, или в положении 52d, или в положении 53 согласно нумерации вариабельного домена тяжелой цепи по Kabat.
33. Комплекс или конъюгат по любому из пп. 31-32, в котором остаток цистеина в CDR2 тяжелой цепи антитела находится в положении 52а или в положении 52b, или в положении 52с, или в положении 53 согласно нумерации вариабельного домена тяжелой цепи по Kabat.
34. Комплекс или конъюгат по любому из пп. 31-33, в котором остаток цистеина в CDR2 тяжелой цепи антитела находится в положении 52b или в положении 53 согласно нумерации вариабельного домена тяжелой цепи по Kabat.
35. Комплекс или конъюгат по любому из пп. 1-30, в котором CDR2 представляет собой CDR2 легкой цепи, в случае хеликарилированного груза.
36. Комплекс или конъюгат по п. 35, в котором остаток цистеина в CDR2 легкой цепи антитела находится в положении 51 или в положении 55 согласно нумерации вариабельного домена легкой цепи по Kabat.
37. Комплекс или конъюгат по любому из пп. 35-36, в котором остаток цистеина в CDR2 легкой цепи антитела находится в положении 55 согласно нумерации вариабельного домена легкой цепи по Kabat.
38. Комплекс или конъюгат по любому из пп. 1-37, в котором образуется точно одна ковалентная связь на CDR2.
39. Комплекс или конъюгат по любому из пп. 1-38, в котором груз выбран из связывающей группировки, метящей группировки и биологически активной группировки.
40. Комплекс или конъюгат по любому из пп. 1-39, в котором биологически активная группировка выбрана из группы, содержащей антитела, фрагменты антител, полипептиды конъюгатов антител, природные лиганды одной или более чем одной мишени ЦНС, модифицированные версии природных лигандов одной или более чем одной мишени ЦНС, аптамеры, ингибирующие нуклеиновые кислоты (т.е. малые интерферирующие РНК (миРНК) и короткие шпилечные РНК (кшРНК)), запертые нуклеиновые кислоты (ЗНК), рибозимы и маленькие молекулы или активные фрагменты любого из вышеупомянутых.
41. Комплекс или конъюгат по любому из пп. 1-40, в котором груз представляет собой нуклеиновую кислоту или производное нуклеиновой кислоты.
42. Комплекс или конъюгат по любому из пп. 1-41, в котором нуклеиновая кислота представляет собой иРНК или ЗНК.
43. Комплекс или конъюгат по любому из пп. 1-42, в котором груз представляет собой полипептид.
44. Комплекс или конъюгат по любому из пп. 1-43, в котором груз представляет собой маленькую молекулу (неполипептидную биологически активную группировку).
45. Комплекс или конъюгат по любому из пп. 1-44, в котором биологически активная группировка представляет собой полипептид.
46. Комплекс или конъюгат по п. 45, в котором полипептид состоит из 5-500 аминокислотных остатков.
47. Комплекс или конъюгат по любому из пп. 45-46, в котором полипептид содержит 10-450 аминокислотных остатков.
48. Комплекс или конъюгат по любому из пп. 45-47, в котором полипептид содержит 15-400 аминокислотных остатков.
49. Комплекс или конъюгат по любому из пп. 45-48, в котором полипептид содержит 18-350 аминокислотных остатков.
50. Комплекс или конъюгат по любому из пп. 1-49, в котором биспецифичное антитело содержит первый функционал связывания, который специфично связывается с дигоксигенилированным грузом (функционал связывания против дигоксигенина, функционал связывания против DIG), и второй функционал связывания, который специфично связывается с (человеческим) рецептором трансферрина (функционал связывания против (человеческого) рецептора трансферрина; функционал связывания против (h)TfR) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности; функционал связывания против LRP8).
51. Комплекс или конъюгат по любому из пп. 1-50, в котором биспецифичное антитело имеет два функционала связывания, которые специфично связываются с дигоксигенилированным грузом (два функционала связывания против дигоксигенина), и два функционала связывания, которые специфично связываются с (человеческим) рецептором трансферрина (два функционала связывания против (человеческого) рецептора трансферрина) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности).
52. Комплекс или конъюгат по любому из пп. 1-51, в котором функционал связывания, который специфично связывается с дигоксигенилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 01, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 02, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 03, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 05, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 06, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 07.
53. Комплекс или конъюгат по любому из пп. 1-52, в котором функционал связывания, который специфично связывается с дигоксигенилированным грузом, представляет собой гуманизированный функционал связывания.
54. Комплекс или конъюгат по любому из пп. 1-53, в котором функционал связывания, который специфично связывается с дигоксигенилированным грузом, содержит такие же CDR, как и в любом из приведенных выше воплощений, и акцепторный человеческий каркас (например, каркас человеческого иммуноглобулина или человеческий консенсусный каркас).
55. Комплекс или конъюгат по любому из пп. 1-54, в котором функционал связывания, который специфично связывается с дигоксигенилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 09 или 25, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 10 или 26, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 11 или 27, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 13 или 29, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 14 или 30, (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 15 или 31.
56. Комплекс или конъюгат по любому из пп. 1-55, в котором функционал связывания, который специфично связывается с дигоксигенилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 04 или 12, или 20, или 28.
57. Комплекс или конъюгат по любому из пп. 1-56, в котором последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно контрольной последовательности, но антитело против дигоксигенина, содержащее данную последовательность, сохраняет способность к связыванию с дигоксигенином.
58. Комплекс или конъюгат по любому из пп. 1-57, в котором в SEQ ID NO: 01 или 09, или 17, или 25 было заменено, вставлено и/или подвергнуто делеции всего от 1 до 10 аминокислот.
59. Комплекс или конъюгат по любому из пп. 1-58, в котором замены, вставки или делеции происходят в областях вне CDR (т.е., в FR).
60. Комплекс или конъюгат по любому из пп. 1-59, в котором антитело против дигоксигенина содержит последовательность VH SEQ ID NO: 01 или 09, или 17, или 25, включая посттрансляционные модификации данной последовательности.
61. Комплекс или конъюгат по любому из пп. 1-60, в котором функционал связывания, который специфично связывается с дигоксигенилированным грузом, представляет собой пару вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, дополнительно содержащую вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 08 или 16, или 24, или 32.
62. Комплекс или конъюгат по любому из пп. 1-61, в котором последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно контрольной последовательности, но антитело против дигоксигенина, содержащее данную последовательность, сохраняет способность к связыванию с дигоксигенином.
63. Комплекс или конъюгат по любому из пп. 1-62, в котором в SEQ ID NO: 08 или 16, или 24, или 32 всего от 1 до 10 аминокислот были заменены, вставлены и/или подвергнуты делеции, возможно замены, вставки или делеции происходят в областях вне CDR (т.е. в FR).
64. Комплекс или конъюгат по любому из пп. 1-63, в котором антитело против дигоксигенина содержит последовательность VL в SEQ ID NO: 08 или 16, или 24, или 32, включая посттрансляционные модификации данной последовательности.
65. Комплекс или конъюгат по любому из пп. 1-49, в котором биспецифичное антитело содержит первый функционал связывания, который специфично связывается с биотинилированным грузом (функционал связывания против биотина, функционал связывания против BI), и второй функционал связывания, который специфично связывается с (человеческим) рецептором трансферрина (функционал связывания против (человеческого) рецептора трансферрина; функционал связывания против (h)TfR) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности; функционал связывания против LRP8).
66. Комплекс или конъюгат по любому из пп. 1-49 и 65, в котором биспецифичное антитело имеет два функционала связывания, которые специфично связываются с биотинилированным грузом (два функционала связывания против биотина), и два функционала связывания, которые специфично связываются с (человеческим) рецептором трансферрина (два функционала связывания против (человеческого) рецептора трансферрина) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности).
67. Комплекс или конъюгат по любому из пп. 1-49 и 65-66, в котором функционал связывания, который специфично связывается с биотинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 33, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 34, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 35, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 37, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 38, (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 39.
68. Комплекс или конъюгат по любому из пп. 1-49 и 65-67, в котором функционал связывания, который специфично связывается с биотинилированным грузом, представляет собой гуманизированный функционал связывания.
69. Комплекс или конъюгат по любому из пп. 1-49 и 65-68, в котором функционал связывания, который специфично связывается с биотинилированным грузом, содержит такие же CDR, как и в любом из приведенных выше воплощений, и акцепторный человеческий каркас (например, каркас человеческого иммуноглобулина или человеческий консенсусный каркас).
70. Комплекс или конъюгат по любому из пп. 1-49 и 65-69, в котором функционал связывания, который специфично связывается с биотинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 41 или 57, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 42 или 58, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 43 или 59, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 45 или 61, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 46 или 62, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 47 или 64.
71. Комплекс или конъюгат по любому из пп. 1-49 и 65-70, в котором функционал связывания, который специфично связывается с биотинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 36 или 44, или 52, или 60.
72. Комплекс или конъюгат по любому из пп. 1-49 и 65-71, в котором последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно контрольной последовательности, но антитело против биотина, содержащее данную последовательность, сохраняет способность к связыванию с биотином.
73. Комплекс или конъюгат по любому из пп. 1-49 и 65-72, в котором в SEQ ID NO: 36 или 44, или 52, или 60 было заменено, вставлено и/или подвергнуто делеции всего от 1 до 10 аминокислот, возможно замены, вставки или делеции происходят в областях вне CDR (т.е. в FR).
74. Комплекс или конъюгат по любому из пп. 1-49 и 65-73, в котором антитело против биотина содержит последовательность VH в SEQ ID NO: 36 или 44, или 52, или 60, включая посттрансляционные модификации данной последовательности.
75. Комплекс или конъюгат по любому из пп. 1-49 и 65-74, в котором функционал связывания, который специфично связывается с биотинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, дополнительно содержащую вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 40 или 48, или 56, или 64.
76. Комплекс или конъюгат по любому из пп. 1-49 и 65-75, в котором последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно контрольной последовательности, но антитело против биотина, содержащее данную последовательность, сохраняет способность к связыванию с биотином.
77. Комплекс или конъюгат по любому из пп. 1-49 и 65-76, в котором в SEQ ID NO: 40 или 48, или 56, или 64 всего от 1 до 10 аминокислот были заменены, вставлены и/или подвергнуты делеции, возможно замены, вставки или делеции происходят в областях вне CDR (т.е. в FR).
78. Комплекс или конъюгат по любому из пп. 1-49 и 65-77, в котором антитело против биотина содержит последовательность VL в SEQ ID NO: 40 или 48, или 56, или 64, включая посттрансляционные модификации данной последовательности.
79. Комплекс или конъюгат по любому из пп. 1-49, в котором биспецифичное антитело содержит первый функционал связывания, который специфично связывается с теофиллинированным грузом (функционал связывания против теофиллина, функционал связывания против ТНЕО), и второй функционал связывания, который специфично связывается с (человеческим) рецептором трансферрина (функционал связывания против (человеческого) рецептора трансферрина; функционал связывания против (h)TfR) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности; функционал связывания против LRP8).
80. Комплекс или конъюгат по любому из пп. 1-49 и 79, в котором биспецифичное антитело имеет два функционала связывания, которые специфично связываются с теофиллинированным грузом (два функционала связывания против теофиллина), и два функционала связывания, которые специфично связываются с (человеческим) рецептором трансферрина (два функционала связывания против (человеческого) рецептора трансферрина) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности).
81. Комплекс или конъюгат по любому из пп. 1-49 и 79-80, в котором функционал связывания, который специфично связывается с теофиллинированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 65, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 66, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 67, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 69, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 70, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 71.
82. Комплекс или конъюгат по любому из пп. 1-49 и 79-81, в котором функционал связывания, который специфично связывается с теофиллинированным грузом, представляет собой гуманизированный функционал связывания.
83. Комплекс или конъюгат по любому из пп. 1-49 и 79-82, в котором функционал связывания, который специфично связывается с теофиллинированным грузом, содержит такие же CDR, как и в любом из приведенных выше воплощений, и акцепторный человеческий каркас (например, каркас человеческого иммуноглобулина или человеческий консенсусный каркас).
84. Комплекс или конъюгат по любому из пп. 1-49 и 79-83, в котором функционал связывания, который специфично связывается с теофиллинированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 73 или 89, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 74 или 90, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 75 или 91, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 77 или 93, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 78 или 94, (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 79 или 95.
85. Комплекс или конъюгат по любому из пп. 1-49 и 79-84, в котором функционал связывания, который специфично связывается с теофиллинированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 68 или 76, или 84, или 92.
86. Комплекс или конъюгат по любому из пп. 1-49 и 79-85, в котором последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно контрольной последовательности, но антитело против теофиллина, содержащее данную последовательность, сохраняет способность к связыванию с теофиллином.
87. Комплекс или конъюгат по любому из пп. 1-49 и 79-86, в котором в SEQ ID NO: 68 или 76, или 84, или 92 было заменено, вставлено и/или подвергнуто делеции всего от 1 до 10 аминокислот, возможно замены, вставки или делеции встречаются в областях вне CDR (т.е. в FR).
88. Комплекс или конъюгат по любому из пп. 1-49 и 79-87, в котором антитело против теофиллина содержит последовательность VH в SEQ ID NO: 68 или 76, или 84, или 92, включая посттрансляционные модификации данной последовательности.
89. Комплекс или конъюгат по любому из пп. 1-49 и 79-88, в котором функционал связывания, который специфично связывается с теофиллинированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, дополнительно содержащую вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 72 или 80, или 88, или 96.
90. Комплекс или конъюгат по любому из пп. 1-49 и 79-89, в котором последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно контрольной последовательности, но антитело против теофиллина, содержащее данную последовательность, сохраняет способность к связыванию с теофиллином.
91. Комплекс или конъюгат по любому из пп. 1-49 и 79-90, в котором в SEQ ID NO: 72 или 80, или 88, или 96 всего от 1 до 10 аминокислот были заменены, вставлены и/или подвергнуты делеции, возможно замены, вставки или делеции происходят в областях вне CDR (т.е. в FR).
92. Комплекс или конъюгат по любому из пп. 1-49 и 79-91, в котором антитело против теофиллина содержит последовательность VL в SEQ ID NO: 72 или 80, или 88, или 96, включая посттрансляционные модификации данной последовательности.
93. Комплекс или конъюгат по любому из пп. 1-49, в котором биспецифичное антитело содержит первый функционал связывания, который специфично связывается с флуоресцеинилированным грузом (функционал связывания против флуоресцеина, функционал связывания против FLUO), и второй функционал связывания, который специфично связывается с (человеческим) рецептором трансферрина (функционал связывания против (человеческого) рецептора трансферрина; функционал связывания против (h)TfR) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности; функционал связывания против LRP8).
94. Комплекс или конъюгат по любому из пп. 1-49 и 93, в котором биспецифичное антитело имеет два функционала связывания, которые специфично связываются с флуоресцеинилированным грузом (два функционала связывания против флуоресцеина), и два функционала связывания, которые специфично связываются с (человеческим) рецептором трансферрина (два функционала связывания против (человеческого) рецептора трансферрина) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности).
95. Комплекс или конъюгат по любому из пп. 1-49 и 93-94, в котором функционал связывания, который специфично связывается с флуоресцеинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 97, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 98, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 99, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 101, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 102, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 103.
96. Комплекс или конъюгат по любому из пп. 1-49 и 93-95, в котором функционал связывания, который специфично связывается с флуоресцеинилированным грузом, представляет собой гуманизированный функционал связывания.
97. Комплекс или конъюгат по любому из пп. 1-49 и 93-96, в котором функционал связывания, который специфично связывается с флуоресцеинилированным грузом, содержит такие же CDR, как и в любом из приведенных выше воплощений, и акцепторный человеческий каркас (например, каркас человеческого иммуноглобулина или человеческий консенсусный каркас).
98. Комплекс или конъюгат по любому из пп. 1-49 и 93-97, в котором функционал связывания, который специфично связывается с флуоресцеинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 105 или 113, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 106 или 114, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 107 или 115, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 109 или 117, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 110 или 118, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 111 или 119.
99. Комплекс или конъюгат по любому из пп. 1-49 и 93-98, в котором функционал связывания, который специфично связывается с флуоресцеинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 108 или 116.
100. Комплекс или конъюгат по любому из пп. 1-49 и 93-99, в котором последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно контрольной последовательности, но антитело против флуоресцеина, содержащее данную последовательность, сохраняет способность к связыванию с флуоресцеином.
101. Комплекс или конъюгат по любому из пп. 1-49 и 93-100, в котором в SEQ ID NO: 108 или 116 было заменено, вставлено и/или подвергнуто делеции всего от 1 до 10 аминокислот, возможно замены, вставки или делеции происходят в областях вне CDR (т.е. в FR).
102. Комплекс или конъюгат по любому из пп. 1-49 и 93-101, в котором антитело против флуоресцеина содержит последовательность VH в SEQ ID NO: 108 или 116, включая посттрансляционные модификации данной последовательности.
103. Комплекс или конъюгат по любому из пп. 1-49 и 93-102, в котором функционал связывания, который специфично связывается с флуоресцеинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, дополнительно содержащую вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID N0: 112 или 120.
104. Комплекс или конъюгат по любому из пп. 1-49 и 93-103, в котором последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно контрольной последовательности, но антитело против флуоресцеина, содержащее данную последовательность, сохраняет способность к связыванию с флуоресцеином.
105. Комплекс или конъюгат по любому из пп. 1-49 и 93-104, в котором в SEQ ID NO: 112 или 120 всего от 1 до 10 аминокислот были заменены, вставлены и/или подвергнуты делеции, возможно замены, вставки или делеции происходят в областях вне CDR (т.е. в FR).
106. Комплекс или конъюгат по любому из пп. 1-49 и 93-105, в котором антитело против флуоресцеина содержит последовательность VL в SEQ ID NO: 112 или 120, включая посттрансляционные модификации данной последовательности.
107. Комплекс или конъюгат по любому из пп. 1-49, в котором биспецифичное антитело содержит первый функционал связывания, который специфично связывается с бромдезоксиуридинилированным грузом (функционал связывания против бромдезоксиуридина, функционал связывания против BrdU), и второй функционал связывания, который специфично связывается с (человеческим) рецептором трансферрина (функционал связывания против (человеческого) рецептора трансферрина; функционал связывания против (h)TfR) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности; функционал связывания против LRP8).
108. Комплекс или конъюгат по любому из пп. 1-49 и 107, в котором биспецифичное антитело имеет два функционала связывания, которые специфично связываются с бромдезоксиуридинилированным грузом (два функционала связывания против бромдезоксиуридина), и два функционала связывания, которые специфично связываются с (человеческим) рецептором трансферрина (два функционала связывания против (человеческого) рецептора трансферрина) или с белком 8, родственным рецептору липопротеина низкой плотности (функционал связывания против белка 8, родственного рецептору липопротеина низкой плотности).
109. Комплекс или конъюгат по любому из пп. 1-49 и 107-108, в котором функционал связывания, который специфично связывается с бромдезоксиуридинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 214, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 216, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 218, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 219, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 220, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 221.
110. Комплекс или конъюгат по любому из пп. 1-49 и 107-109, в котором функционал связывания, который специфично связывается с бромдезоксиуридинилированным грузом, представляет собой гуманизированный функционал связывания.
111. Комплекс или конъюгат по любому из пп. 1-49 и 107-110, в котором функционал связывания, который специфично связывается с бромдезоксиуридинилированным грузом, содержит CDR из антитела, не являющегося человеческим, и акцепторный человеческий каркас (например, каркас человеческого иммуноглобулина или человеческий консенсусный каркас).
112. Комплекс или конъюгат по любому из пп. 1-49 и 107-111, в котором функционал связывания, который специфично связывается с бромдезоксиуридинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую (a) CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 214 или 215, (б) CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 216 или 217, (в) CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 218, (г) CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 219, (д) CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 220, и (е) CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 221.
113. Комплекс или конъюгат по любому из пп. 1-49 и 107-112, в котором функционал связывания, который специфично связывается с бромдезоксиуридинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, содержащую последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 222 или 224.
114. Комплекс или конъюгат по любому из пп. 1-49 и 107-113, в котором последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно контрольной последовательности, но антитело против бромдезоксиуридина, содержащее данную последовательность, сохраняет способность к связыванию с бромдезоксиуридином.
115. Комплекс или конъюгат по любому из пп. 1-49 и 107-114, в котором в SEQ ID NO: 222 или 224 было заменено, вставлено и/или подвергнуто делеции всего от 1 до 10 аминокислот, возможно замены, вставки или делеции происходят в областях вне CDR (т.е. в FR).
116. Комплекс или конъюгат по любому из пп. 1-49 и 107-115, в котором антитело против бромдезоксиуридина содержит последовательность VH в SEQ ID NO: 223 или 225, включая посттрансляционные модификации данной последовательности.
117. Комплекс или конъюгат по любому из пп. 1-49 и 107-116, в котором функционал связывания, который специфично связывается с бромдезоксиуридинилированным грузом, представляет собой пару из вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела, дополнительно содержащую вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с аминокислотной последовательностью SEQ ID NO: 223 или 225.
118. Комплекс или конъюгат по любому из пп. 1-49 и 107-117, в котором последовательность VL, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности, содержит замены (например, консервативные замены), вставки или делеции относительно контрольной последовательности, но антитело против бромдезоксиуридина, содержащее данную последовательность, сохраняет способность к связыванию с бромдезоксиуридином.
119. Комплекс или конъюгат по любому из пп. 1-49 и 107-118, в котором в SEQ ID NO: 223 или 225 всего от 1 до 10 аминокислот были заменены, вставлены и/или подвергнуты делеции, возможно замены, вставки или делеции происходят в областях вне CDR (т.е. в FR).
120. Комплекс или конъюгат по любому из пп. 1-49 и 107-119, в котором антитело против бромдезоксиуридина содержит последовательность VL в SEQ ID NO: 223 или 225, включая посттрансляционные модификации данной последовательности.
121. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-120, в котором груз представляет собой гаптенилированное полноразмерное антитело или гаптенилированный фрагмент антитела.
122. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-121, в котором гаптенилированный груз представляет собой гаптенилированное полноразмерное антитело против альфа-синуклеина.
123. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-121, в котором гаптенилированный груз представляет собой гаптенилированный фрагмент антитела против альфа-синуклеина, который специфично связывается с альфа-синуклеином.
124. Комплекс или конъюгат по любому из пп. 121-123, в котором гаптен представляет собой биотин.
125. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-124, в котором антитело содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 243-245 и в вариабельном домене легкой цепи HVR SEQ ID NO: 246-248.
126. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-125, в котором антитело содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 249, 250 и 245 и в вариабельном домене легкой цепи HVR SEQ ID NO: 251-253.
127. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-126, в котором антитело содержит вариабельный домен тяжелой цепи, состоящий из SEQ ID NO: 254, и вариабельный домен легкой цепи, состоящий из SEQ ID NO: 255.
128. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-127, где антитело было получено гуманизацией антитела, содержащего вариабельный домен тяжелой цепи, состоящий из SEQ ID NO: 254, и вариабельный домен легкой цепи, состоящий из SEQ ID NO: 255.
129. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-128, в котором антитело представляет собой гуманизированное антитело и содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 243-245 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 246-248, где в каждой HVR было заменено вплоть до 3 аминокислотных остатков.
130. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-129, в котором антитело представляет собой гуманизированное антитело и содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 249, 250 и 245 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 251-253, где в каждой HVR было заменено вплоть до 3 аминокислотных остатков.
131. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-130, в котором антитело представляет собой гуманизированное антитело, и вариабельный домен тяжелой цепи происходит из вариабельного домена тяжелой цепи, состоящего из SEQ ID NO: 254, и вариабельный домен легкой цепи происходит из вариабельного домена легкой цепи, состоящего из SEQ ID NO: 255.
132. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-131, в котором антитело связывается с тем же самым эпитопом, что и антитело, содержащее в тяжелой цепи HVR SEQ ID NO: 256-258 и в легкой цепи - HVR SEQ ID NO: 259-261.
133. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-131, в котором антитело связывается с тем же самым эпитопом, что и антитело, содержащее в тяжелой цепи HVR SEQ ID NO: 262, 263 и 258 и в легкой цепи - HVR SEQ ID NO: 264-266.
134. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-133, в котором антитело содержит вариабельный домен тяжелой цепи, состоящий из SEQ ID NO: 267, и вариабельный домен легкой цепи, состоящий из SEQ ID NO: 268.
135. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-134, где антитело было получено посредством гуманизации антитела, содержащего вариабельный домен тяжелой цепи, состоящий из SEQ ID NO: 267, и вариабельный домен легкой цепи, состоящий из SEQ ID NO: 268.
136. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-135, в котором антитело представляет собой гуманизированное антитело и содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 256-258 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 259-261, где в каждой HVR может быть заменено вплоть до 3 аминокислотных остатков.
137. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-136, в котором антитело представляет собой гуманизированное антитело и содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 262, 263 и 258 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 264-266, где в каждой HVR может быть заменено вплоть до 3 аминокислотных остатков.
138. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-137, в котором антитело представляет собой гуманизированное антитело, и вариабельный домен тяжелой цепи происходит из вариабельного домена тяжелой цепи, состоящего из SEQ ID NO: 267, и вариабельный домен легкой цепи происходит из вариабельного домена легкой цепи, состоящего из SEQ ID NO: 268.
139. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-138, в котором антитело связывается с тем же самым эпитопом, что и антитело, содержащее в тяжелой цепи HVR SEQ ID NO: 269-271 и в легкой цепи HVR SEQ ID NO: 272-274.
140. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-139, в котором антитело связывается с тем же самым эпитопом, что и антитело, содержащее в тяжелой цепи HVR SEQ ID NO: 269, 275 и 271 и в легкой цепи HVR SEQ ID NO: 276-278.
141. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-140, в котором антитело содержит вариабельный домен тяжелой цепи, состоящий из SEQ ID NO: 279, и вариабельный домен легкой цепи, состоящий из SEQ ID NO: 280.
142. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-141, где антитело было получено посредством гуманизации антитела, содержащего вариабельный домен тяжелой цепи, состоящий из SEQ ID NO: 279, и вариабельный домен легкой цепи, состоящий из SEQ ID NO: 280.
143. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-142, в котором антитело представляет собой гуманизированное антитело и содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 269-271 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 272-274, где в каждой HVR может быть заменено вплоть до 3 аминокислотных остатков.
144. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-143, в котором антитело представляет собой гуманизированное антитело и содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 269, 275 и 271 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 276-278, где в каждой HVR может быть заменено вплоть до 3 аминокислотных остатков.
145. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-144, в котором антитело представляет собой гуманизированное антитело, и вариабельный домен тяжелой цепи происходит из вариабельного домена тяжелой цепи, состоящего из SEQ ID NO: 279, и вариабельный домен легкой цепи происходит из вариабельного домена легкой цепи, состоящего из SEQ ID NO: 280.
146. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-121, в котором гаптенилированный груз представляет собой гаптенилированное полноразмерное антитело против человеческого Tau(pS422).
147. Комплекс или конъюгат по любому из пп. 1-38, 40, 43, 45-121 и 146, в котором гаптенилированный груз представляет собой гаптенилированный фрагмент антитела против человеческого Tau(pS422), который специфично связывается с человеческим Tau, фосфорилированным по серину в положении 422.
148. Комплекс или конъюгат по любому из пп. 146-147, в котором гаптен представляет собой биотин.
149. Комплекс или конъюгат по любому из пп. 1-38, 40, 43, 45-121 и 146-148, в котором антитело против человеческого Tau(pS422) содержит:
а) в вариабельном домене тяжелой цепи - HVR SEQ ID NO: 230, 239 и 232 или
б) в вариабельном домене тяжелой цепи - HVR SEQ ID NO: 230, 231 и 232.
150. Комплекс или конъюгат по любому из пп. 1-38, 40, 43, 45-121 и 146-149, в котором антитело дополнительно содержит:
а) в вариабельном домене легкой цепи - HVR SEQ ID NO: 234, 235 и 236 или
б) в вариабельном домене легкой цепи - HVR SEQ ID NO: 233, 229 и 236.
151. Комплекс или конъюгат по любому из пп. 1-38, 40, 43, 45-121 и 146-150, в котором антитело содержит:
а) в вариабельном домене тяжелой цепи - HVR SEQ ID NO: 230, 239 и 232 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 234, 235 и 236 или
б) в вариабельном домене тяжелой цепи - HVR SEQ ID NO: 230, 231 и 232 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 233, 229 и 236, или
в) в вариабельном домене тяжелой цепи - HVR SEQ ID NO: 230, 231 и 232 и в вариабельном домене легкой цепи - HVR SEQ ID NO: 234, 235 и 236.
152. Комплекс или конъюгат по любому из пп. 1-38, 40, 43, 45-121 и 146-151, в котором антитело содержит:
а) вариабельный домен тяжелой цепи SEQ ID NO: 241 и вариабельный домен легкой цепи SEQ ID NO: 238 или
б) вариабельный домен тяжелой цепи SEQ ID NO: 240 и вариабельный домен легкой цепи SEQ ID NO: 237, или
в) вариабельный домен тяжелой цепи SEQ ID NO: 240 и вариабельный домен легкой цепи SEQ ID NO: 238, или
г) вариабельный домен тяжелой цепи SEQ ID NO: 242 и вариабельный домен легкой цепи SEQ ID NO: 238.
153. Комплекс или конъюгат по любому из пп. 1-38, 40, 43 и 45-121, в котором гаптенилированный груз представляет собой гаптенилированное полноразмерное антитело против Абета.
154. Комплекс или конъюгат по любому из пп. 1-38, 40, 43, 45-121 и 154, в котором гаптенилированный груз представляет собой гаптенилированный фрагмент антитела против Абета, который специфично связывается с человеческим Абета.
155. Комплекс или конъюгат по любому из пп. 153-154, в котором гаптен представляет собой биотин.
156. Комплекс или конъюгат по любому из пп. 1-38, 40, 43, 45-121 и 153-155, в котором антитело против Абета содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 281, 282 и 283.
157. Комплекс или конъюгат по любому из пп. 1-38, 40, 43, 45-121 и 153-156, в котором антитело дополнительно содержит в вариабельном домене легкой цепи HVR SEQ ID NO: 284, 285 и 286.
158. Комплекс или конъюгат по любому из пп. 1-38, 40, 43, 45-121 и 153-157, в котором антитело содержит в вариабельном домене тяжелой цепи HVR SEQ ID NO: 281, 282 и 283, и в вариабельном домене легкой цепи HVR SEQ ID NO: 284, 285 и 286.
159. Комплекс или конъюгат по любому из пп. 1-38, 40, 43, 45-121 и 153-158, в котором антитело содержит:
а) вариабельный домен тяжелой цепи SEQ ID NO: 287 и вариабельный домен легкой цепи SEQ ID NO: 290 или
б) вариабельный домен тяжелой цепи SEQ ID NO: 288 и вариабельный домен легкой цепи SEQ ID NO: 291, или
в) вариабельный домен тяжелой цепи SEQ ID NO: 289 и вариабельный домен легкой цепи SEQ ID NO: 292.
160. Фармацевтическая композиция, содержащая комплекс или конъюгат по любому из пп. 1-159 и фармацевтически приемлемый носитель.
161. Комплекс или конъюгат по любому из пп. 1-159 для применения в качестве лекарственного средства.
162. Конъюгат по любому из пп. 1-159 для лечения рака или неврологического расстройства.
163. Применение комплекса или конъюгата по любому из пп. 1-159 в изготовлении лекарственного средства.
164. Применение по п. 163, где лекарственное средство предназначено для лечения рака.
165. Применение по п. 163, где лекарственное средство предназначено для лечения неврологического расстройства.
166. Применение по п. 165, где неврологическое расстройство выбрано из следующих: болезнь Альцгеймера (AD) (включающая умеренное когнитивное нарушение и продромальную AD, но не ограничивающаяся ими), инсульт, деменция, мышечная дистрофия (MD), рассеянный склероз (MS), боковой амиотрофический склероз (ALS), кистозный фиброз, синдром Ангельмана, синдром Лиддла, болезнь Паркинсона, болезнь Пика, болезнь Пэджета, рак (например, рак, поражающий ЦНС или мозг) и травматическое поражение мозга.
167. Применение комплекса или конъюгата по любому из пп. 1-159 в качестве диагностического агента.
168. Применение комплекса или конъюгата по любому из пп. 1-159 для увеличения стабильности груза.
169. Применение комплекса или конъюгата по любому из пп. 1-159 для увеличения активности груза.
170. Применение комплекса или конъюгата по любому из пп. 1-159 для увеличения периода полувыведения груза in vivo.
171. Применение комплекса или конъюгата по любому из пп. 1-159 в лечении заболевания.
172. Способ лечения индивида, имеющего заболевание, включающий введение индивиду эффективного количества комплекса или конъюгата по любому из пп. 1-159.
173. Способ лечения заболевания у индивида, включающий введение индивиду эффективного количества комплекса или конъюгата по любому из пп. 1-159.
174. Применение или способ по любому из пп. 171-173, где заболевание представляет собой рак.
175. Применение или способ по любому из пп. 171-173, где заболевание представляет собой неврологическое расстройство.
176. Применение или способ по п. 175, где неврологическое расстройство выбрано из следующих: болезнь Альцгеймера (AD) (включающая умеренное когнитивное нарушение и продромальную AD, но не ограничивающаяся ими), инсульт, деменция, мышечная дистрофия (MD), рассеянный склероз (MS), боковой амиотрофический склероз (ALS), кистозный фиброз, синдром Ангельмана, синдром Лиддла, болезнь Паркинсона, болезнь Пика, болезнь Пэджета, рак (например, рак, поражающий ЦНС или мозг) и травматическое поражение мозга.
177. Применение комплекса или конъюгата по любому из пп. 1-159 для целевой доставки гаптенилированного груза через гематоэнцефалический барьер.
178. Применение по п. 177, где данное применение предназначено для целевой доставки свободного (т.е. выделенного) гаптенилированного груза через гематоэнцефалический барьер.
179. Применение комплекса по любому из пп. 1-2 и 4-159 для целевой доставки гаптенилированного груза через гематоэнцефалический барьер и высвобождения гаптенилированного груза в гематоэнцефалическом барьере или мозге.
180. Применение по п. 179, где доставка гаптенилированного груза больше по сравнению с доставкой в отсутствие биспецифичного антитела или комплекса.
181. Применение по п. 180, где доставка больше в два раза.
182. Применение по любому из пп. 180-181, где доставка больше в 10 раз.
183. Применение по любому из пп. 179-182, где гаптенилированный груз имеет большую биологическую активность в отсутствие биспецифичного антитела или комплекса, чем в присутствии биспецифичного антитела или комплекса.
184. Применение по п. 183, где биологическая активность в два раза выше в отсутствие биспецифичного антитела или комплекса.
185. Применение по любому из пп. 183-184, где биологическая активность в десять раза выше в отсутствие биспецифичного антитела или комплекса.
Раскрытие всех ссылок, процитированных в данном документе, включено посредством этого при помощи ссылки.
Следующие примеры, графические материалы и последовательности приведены для помощи в понимании настоящего изобретения, истинный объем которого изложен в приложенной формуле изобретения. Понятно, что в изложенных методиках могут быть сделаны модификации без отступления от сущности изобретения.
ПРИМЕРЫ
Пример 1
Выделение и характеризация кДНК, кодирующих домены VH и VL мышиного антитела против дигоксигенина и мышиного антитела против биотина класса IgG1 с легкой цепью каппа, из мышиной гибридомы
Выделение и характеризация кДНК, кодирующих домены VH и VL антител против дигоксигенина, получение РНК, получение фрагментов ДНК, клонирование фрагментов ДНК в плазмиды и определение последовательностей ДНК и аминокислотных последовательностей описаны в WO 2011/003557 и WO 2011/003780 соответственно.
Информация о последовательности белка и (ДНК) доменов VH и VL мышиных гаптенасвязывающих антител была получена непосредственно из клонов гибридомы. Проведенные затем экспериментальные этапы были следующими: (i) выделение РНК из клеток гибридомы, продуцирующих антитело, (ii) превращение этой РНК в кДНК, перенос в ПЦР-фрагменты, содержащие VH и VL, и (iii) интеграция данных ПЦР-фрагментов в плазмидные векторы для размножения в Е.coli и определение их последовательностей ДНК (и выведенных последовательностей белка).
Получение РНК из клеток гибридомы:
РНК получали из 5×106 клеток гидридомы, экспрессирующих антитело, применяя набор RNAeasy (Qiagen). Вкратце, осажденные клетки один раз промывали в PBS (фосфатно-солевой буферный раствор), осаждали и затем ресуспендировали для лизиса в 500 мкл буфера RLT (плюс β-МЕ). Клетки полностью лизировали путем пропускания через Qiashredder (Qiagen) и затем подвергали методике очистки, опосредованной матрицей (ЕТОН, колонки RNAeasy), как описано в руководстве изготовителя. После последней стадии промывки РНК выделяли из колонок в 50 мкл воды, не содержащей РНКазы. Концентрацию выделенной РНК определяли путем количественного измерения А260 (поглощение при длине волны 260 нм) и А280 (поглощение при длине волны 280 нм) образцов, разведенных 1:20. Целостность (качество, степень деградации) образцов выделенной РНК анализировали посредством гель-электрофореза РНК в денатурирующих условиях на формамид-агарозных гелях (см. руководство Maniatis). Получали дискретные полосы, представляющие интактные 18s и 28s рибосомальные РНК, и интактность (и отношения интенсивности приблизительно 2:1) данных полос показывала хорошее качество препаратов РНК. Выделенные РНК из гибридомы замораживали и хранили при -80°С в аликвотах.
Получение фрагментов ДНК, кодирующих VH и VL посредством RACE ПЦР, клонирование данных фрагментов ДНК в плазмиды и определение их последовательностей ДНК и аминокислотных последовательностей
кДНК для последующих (RACE-) ПЦР-реакций (ПЦР с быстрой амплификацией концов кДНК) получали из препаратов РНК путем применения методик, описанных в международной патентной заявке WO 2012/093068. Затем ПЦР-фрагменты, кодирующие VH и VL, выделяли посредством экстракции из агарозного геля и последующей очистки стандартными методиками молекулярной биологии. Генерированные PWO очищенные ПЦР-фрагменты вставляли в вектор pCR bluntll topo посредством применения набора pCR bluntll topo (Invitrogen), точно следуя инструкциям изготовителя. Продукты реакций Торо-лигирования трансформировали в компетентные клетки Е.coli Торо10-one-shot. Затем идентифицировали клоны Е.coli, которые содержали векторы, содержащие вставки либо VL, либо VH, в виде колоний на чашках с агаром и средой LB с канамицином. Из данных колоний получали плазмиды, и присутствие желательной вставки в векторе подтверждали рестрикционным расщеплением с использованием EcoRI. Поскольку остов вектора содержит рестрикционные сайты, распознаваемые EcoRI, фланкирующие каждую сторону вставки, плазмиды, имеющие вставки, определяли посредством наличия вставок из приблизительно 800 п.о. (для VL) или 600 п.о. (для VH), высвобождаемых EcoRI. Последовательность ДНК и выведенную последовательность белка VL и VH определяли посредством автоматического секвенирования ДНК на многих клонах для VH и VL.
Последовательность мышиной VL антитела против биотина показана в SEQ ID NO: 40. Последовательность мышиной VH антитела против биотина показана в SEQ ID NO: 36.
Последовательность мышиной VL антитела против дигоксигенина показана в SEQ ID NO: 08. Последовательность мышиной VH антитела против дигоксигенина показана в SEQ ID NO: 04.
Пример 2
Выделение и характеризация кДНК, кодирующих домены VH и VL мышиного антитела против теофиллина класса IgG1 с легкой цепью каппа, из мышиной гибридомы
Последовательности антитела против теофиллина были получены, как описано в Примере 1.
Последовательность мышиной VL антитела против теофиллина показана в SEQ ID NO: 72. Последовательность мышиной VH антитела против теофиллина показана в SEQ ID NO: 68.
Пример 3
Гуманизация доменов VH и VL мышиных антитела против дигоксигенина и антитела против биотина
Получение гуманизированных вариантов антитела против дигоксигенина было подробно описано в WO 2011/003557 и WO 2011/003780. Мышиное антитело muM33, связывающееся с биотином, гуманизировали аналогично следующему способу.
Получение и характеризация кодирующих последовательностей и аминокислотных последовательностей, которые содержат домены VH и VL мышиного антитела против биотина класса IgG1 с легкой цепью каппа из мышиной гибридомы описываются в WO 2011/003557 и WO 2011/003780. На основании данной информации было получено соответствующее гуманизированное антитело против биотина (huM33) на основе комбинации человеческого каркаса зародышевой линии IGHV1-69-02 и IGKV1-27-01. Для VL не было необходимости интегрировать какую-либо обратную мутацию в каркас человеческого IGKV1-27-01 и в человеческий J-элемент IGKJ2-01 зародышевой линии. Гуманизированная VH основана на человеческом IGHV1-69-02 зародышевой линии и человеческом J-элементе IGHJ4-01-3 зародышевой линии. Две обратные мутации вводили в каркасную область 1 в положении 24 (A24S) и в каркасную область 3 в положении 73 (K73T). Аминокислотная последовательность гуманизированного VH показана в SEQ ID NO: 44, и аминокислотная последовательность гуманизированного VL показана в SEQ ID NO: 48.
Пример 4
Гуманизация доменов VH и VL мышиного антитела против теофиллина
Мышиное антитело, связывающееся с теофиллином, гуманизировали следующим образом: гуманизированное антитело против теофиллина получали на основе комбинации человеческой каркасной области зародышевой линии IGHV4-31-02 и IGKV2-30-01. Гуманизированная VH основывается на человеческом IGHV4-31-02 зародышевой линии и человеческом J-элементе IGHJ4-01-3 зародышевой линии. Одну обратную мутацию вводили в каркасную область 3 в положении 71 (V71R). Гуманизированная VL основывается на человеческом IGHV2-30-01 зародышевой линии и человеческом J-элементе IGKJ2-01 зародышевой линии. Вводили одну обратную мутацию в каркасную область 2 в положении 46 (R46L). Аминокислотная последовательность гуманизированного VH показана в SEQ ID NO: 76, и аминокислотная последовательность гуманизированного VL показана в SEQ ID NO: 80.
Пример 5
Кристаллизация и определение посредством рентгеноструктурного анализа структуры связывающей области мышиной области Fv против дигоксигенина в присутствии дигоксигенина и связывающей области мышиной области Fv против биотина в присутствии биотина
Определение структуры фрагмента Fab антитела, связывающегося дигоксигенином, было подробно описано в WO 2011/003557 и WO 2011/003780, и также опубликовано (3RA7) в Metz, S. et al., Proc. Natl. Acad. Sci. USA 108 (2011) 8194-8199.
Была определена структура мышиного антитела против биотина. Следовательно, получали фрагменты Fab посредством протеазного расщепления очищенных IgG и последующей очистки, применяя хорошо известные в данной области способы (расщепление папаином).
Для кристаллизации апофрагмент Fab (очищенные Fab) в 20 мМ His-HCl, 140 мМ NaCl, рН 6,0, концентрировали до 13 мг/мл. В экспериментах по диффузии из паровой фазы с использованием сидячих капель кристаллизационные капельки доводили до 21°С посредством смешивания 0,2 мкл белкового раствора с 0,2 мкл резервуарного раствора. Кристаллы появлялись из 0,1 М Tris, рН 8,5, 0,01 М хлорида кобальта, 20% поливинилпирролидона K15 в пределах 5 суток и вырастали до конечного размера 0,3 мм × 0,06 мм × 0,03 мм в пределах 8 суток.
Кристаллы собирали с использованием 15%-ного глицерина в качестве криопротектора и затем быстро замораживали в жидком N2. Картины дифракции получали с использованием детектора Pilatus 6М при температуре 100K в пучке X10SA Swiss Light Source и обрабатывали с использованием программ XDS (Kabsch, W., J. Appl. Cryst. 26 (1993) 795-800) и масштабировали с использованием SCALA (приобретенных у BRUKER AXS), получая данные при разрешении 2,22
Для определения структуры посредством молекулярного замещения использовали стандартные кристаллографические программы из программного пакета ССР4 с использованием ввода PDB 3PQP в качестве поисковой модели для расчета электронной плотности и для уточнения рентгеновской структуры (ССР4, Collaborative Computational Project, Acta Crystallogr. D, 760-763 (1994)). Структурные модели перестраивали в электронную плотность с использованием COOT (Emsley, P., et al. Acta Crystallogr. D Biol. Crystallogr. 60 (2010) 486-501). Координаты уточняли с использованием REFMAC5 (Murshudov, G.N., et al. Acta Crystallogr. D Biol. Crystallogr. 53 (1997) 240-55) и с использованием autoBUSTER (Global Phasing Ltd.).
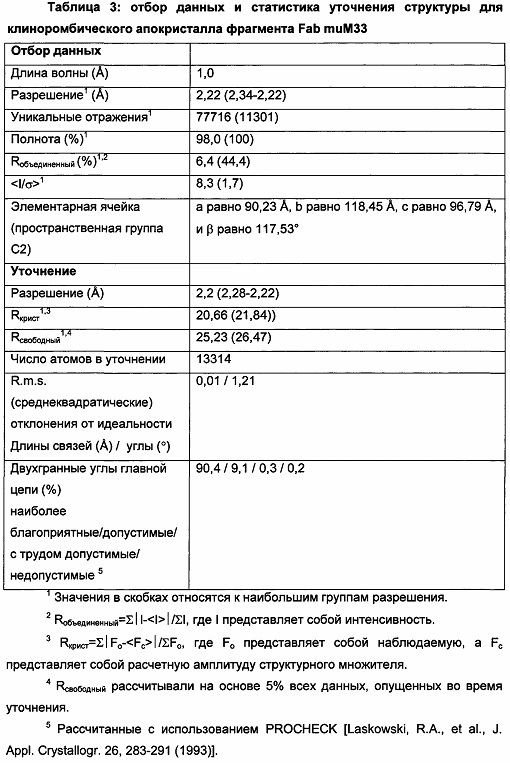
Для кристаллизации фрагмента Fab в комплексе с производным биотина апокристаллы фрагмента Fab, использованные для экспериментов по намоканию, получали из 0,8 М янтарной кислоты в пределах 3 суток после просеивания и выращивали до конечного размера 0,25 мм × 0,04 мм × 0,04 мм в пределах 5 суток. Биоцитинамид растворяли в концентрации 100 мМ в воде. Затем соединение разводили до 10 мМ рабочей концентрации в кристаллизационном растворе и наносили на кристаллы в кристаллизационной капле. Кристаллы промывали три раза 2 мкл 10 мМ раствора соединения и, наконец, инкубировали в течение 16 ч с биоцитинамидом при 21°С.
Кристаллы собирали с использованием 15%-ного глицерина в качестве криопротектора и затем быстро замораживали в жидком N2. Картины дифракции получали с использованием детектора Pilatus 6М при температуре 100K в пучке X10SA Swiss Light Source и обрабатывали с использованием программ XDS (Kabsch, W., J. Appl. Cryst. 26 (1993) 795-800) и масштабировали с использованием SCALA (приобретенных у BRUKER AXS), получая данные при разрешении 2,35
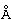
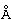
Для определения структуры посредством молекулярного замещения использовали стандартные кристаллографические программы из программного пакета ССР4 с использованием координат апо Fab фрагмента в качестве поисковой модели для расчета электронной плотности и для уточнения рентгеновской структуры до разрешения 2,5
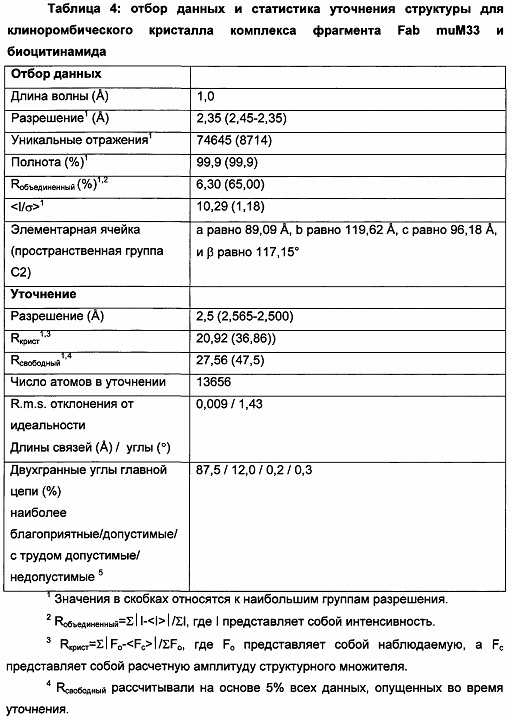

Результат определения экспериментальной структуры показан на Фиг. 33. Кристаллическая форма комплекса содержала в асимметричной ячейке четыре независимых комплекса биоцитинамид:Fab против биотина с биоцитинамидом, связанным всеми молекулами Fab аналогичным образом. Биоцитинамид связывается в кармане, образованном CDR1 и 3 тяжелой цепи и всеми 3 CDR легкой цепи. Карман связывания лиганда определяется остатками ASN29, ASP31, THR32, РНЕ33, GLN35, TRP99 и TRP106 из тяжелой цепи и ASN31, TYR32, LEU33, SER34, TYR49, SER50, РНЕ91 и TYR96 из легкой цепи. Группа головки биотина образует водородные связи с остатками CDR2 и CDR1 на одном конце кармана: N3 биоцитинамида взаимодействует с кислородом гидроксила Ser50, тогда как O22 находится в контакте с амидным азотом основной цепи того же самого остатка. Кроме того, O22 биоцитинамида также связывается водородными связями с кислородом гидроксильной группы Ser34. Помимо этого, наблюдаются гидрофобные взаимодействия между биоцитинамидом и ароматическими боковыми цепями, выстилающими пакет связывания. Амидная связь на конце (СН2)4 алифатического хвоста биотина накладывается на РНЕ33 CDR1 тяжелой цепи и стабилизируется дополнительной водородной связью с амидным азотом основной цепи РНЕЗЗ и с Asp31. Это располагает амидный азот, который является сайтом связи с активной группировкой, таким образом, что атомы, которые следуют за азотом, направлены от кармана связывания к растворителю.
Результаты экспериментального определения участка связывания при разрешении 2,5
Пример 6
Определение и получение антитела против гаптена с введенными функционалами для ковалентного конъюгирования
Дериватизацию гуманизированных последовательностей VH и VL антитела против гаптена, описанного выше, осуществляли для получения соединений, которые обеспечивают ковалентное связывание антигенов/гаптенов с антителом в определенном положении.
Экспериментально определенную структуру фрагмента Fab против дигоксигенина, связанного с дигоксигенином (3RA7) (Metz, S. et al., Proc. Natl. Acad. Sci. USA 108 (2011) 8194-8199), использовали для идентификации положений, изменения в которых обеспечивают реацию сайтнаправленного связывания между антителом и комплексированным с ним антигеном/гаптеном. Структуру фрагмента Fab против биотина, связанного с биоцитинамидом (см. Пример 5), использовали для подтверждения правильного положения введенного остатка цистеина для биотинсвязывающего фрагмента антитела и получения доказательства общей применимости идентифицированного(ных) положения(ний).
Положения, подлежащие мутированию, должны одновременно удовлетворять двум требованиям: (i) связываемые положения должны находиться близко к связывающей области для использования эффекта позиционирования антигена/гаптена для направленного связывания, и (ii) мутация и связываемое положение должны располагаться таким образом, чтобы связывание антигена/гаптена само по себе не подвергалось влиянию. Данные требования для обнаружения подходящего положения фактически «противоречат» друг другу, так как требование (i) лучше всего удовлетворяется положением, близким к сайту связывания, тогда как требование (ii) безопаснее всего достигается положениями, которые удалены от сайта связывания.
Несмотря на эти фактически взаимоисключающие требования, авторы изобретения смогли идентифицировать положения, в которых можно осуществлять мутацию без влияния на расположение гаптена, и которые, тем не менее, одновременно обеспечивают направленное ковалентное связывание гаптенилированного соединения.
Первое положение располагается в положении VH52b или VH53 согласно нумерации по Kabat, в зависимости от реальной длины CDR2 соответствующего антитела. В структуре антитела против дигоксигенина гаптен связывается в глубоком кармане, образованном гидрофобными остатками. В данном кристаллографическом исследовании использовали флуоресцентный конъюгат дигоксигенин-Cy5, в котором флуорофор, а также линкер между дигоксигенином и Cy5 не были видны в структуре из-за высокой гибкости и возникающего в результате беспорядка в кристалле. Однако линкер и Cy5 присоединяются к O32 дигоксигенина, который смотрит в направлении CDR2 тяжелой цепи. Расстояние между O32 (см. выше) дигоксигенина до Сα аминокислотного остатка в положении 52b согласно нумерации по Kabat составляет 10,5
Замена аминокислоты в положении VH52b/VH53 на Cys генерировала производные антитела с последовательностями вариабельной области тяжелой цепи, которые перечислены как SEQ ID NO: 20 и 28 для антитела против дигоксигенина-VH52bC, SEQ ID NO: 84 и 92 для антитела против теофиллина-VH53C, SEQ ID NO: 52 и 60 для антитела против биотина-VH53C и SEQ ID NO: 108 для антитела против флуоресцеина-VH52bC.
Дополнительное положение, которое было идентифицировано как точка модификации, представляет собой положение VH28 согласно нумерации по Kabat.
Следовательно, авторы изобретения ввели цистеин в положение VH28 по Kabat. Замена аминокислоты в положение VH28 на Cys генерировала производные антитела с последовательностями вариабельной области тяжелой цепи, которые перечислены как SEQ ID NO: 124 и 132 для антитела против дигоксигенина-VH28C, SEQ ID NO: 156 и 164 для антитела против теофиллина-VH28C, SEQ ID NO: 140 и 148 для антитела против биотина-VH28C и SEQ ID NO: 116 для антитела против флуоресцеина-VH28C.
Обнаружили, что одно из этих положений представляет собой «универсальное» положение, т.е. данное положение применимо к любому антителу и, таких образом, не требуется каждый раз модифицировать новое антитело с нуля путем предоставления кристаллической структуры и определения подходящего положения, которое обеспечивает ковалентное связывание посредством позиционирования гаптена.
Мутация VH52bC или VH53C соответственно согласно нумерации вариабельной области тяжелой цепи по Kabat могла бы использоваться для каждого гаптенсвязывающего антитела (антитела против гаптена). Даже если антитела и структуры их связывающих карманов являются довольно разнообразными, было показано, что мутация VH52bC/VH53C может использоваться для ковалентного присоединения антигенов/гаптенов к антителам, которые связываются с дигоксигенином, биотином, флуоресцеином, а также с теофиллином.
Связывающие группировки, которые состоят из данных последовательностей, могли быть экспрессированы и очищены с использованием стандартной хроматографии на белке А и гель-фильтрации (см. Пример 7). Образующиеся молекулы были полностью функциональными и сохраняли аффинность по отношению к их когнатным гаптенам таким же образом, как и их немодифицированные родительские молекулы. Это было продемонстрировано посредством экспериментов с использованием поверхностного плазмонного резонанса (SPR) (см. Пример 9).
Пример 7
Состав, экспрессия и очистка рекомбинантных антител против гаптена
Вариабельные области мышиных и гуманизированных антител против гаптена объединяли с константными областями человеческого происхождения с получением моно- или биспецифичных химерных или гуманизированных антител.
Получение моноспецифичных гуманизированных антител против гаптена и биспецифичных гуманизированных антител против гаптена, которые специфично связываются с гаптеном, а также с другой мишенью, не являющейся гаптеном (например, с рецепторными тирозинкиназами или с IGF-1R) требовало (i) конструирования и определения аминокислотных и нуклеотидных последовательностей таких молекул, (ii) экспрессии данных молекул в трансфицированных культивируемых клетках млекопитающих и (iii) очистки данных молекул из супернатантов трансфицированных клеток. Данные этапы проводили, как описано ранее в WO 2012/093068.
В общем, для получения гуманизированного антитела класса IgG, которое имеет специфичность связывания (исходного) мышиного антитела против гаптена, гуманизированную последовательность VH сливали в рамке считывания с N-концом СН1-шарнир-СН2-СН3 человеческой области Fc полкласса IgG1. Аналогичным образом, гуманизированную последовательность VL сливали в рамке считывания с N-концом человеческой константной области CLкаппа.
Для получения производных биспецифичных антител, которые содержат гаптенсвязывающий функционал, а также функционалы к другим мишеням, антитело против гаптена, фрагмент scFv или Fab сливали в рамке считывания с С-концом тяжелой цепи описанных ранее антител. Во многих случаях применяемый scFv против гаптена был дополнительно стабилизирован введением дисульфидной связи VH44-VL100, которая была описана ранее (например, Reiter Y et al., Nature Biotechnology 14 (1996) 1239-1245).
Экспрессионные плазмиды
Экспрессионные плазмиды, содержащие экспрессионные кассеты для экспрессии тяжелых и легких цепей, по отдельности собирали в экспрессионные векторы для клеток млекопитающих.
Посредством этого отрезки генов, кодирующие индивидуальные элементы, были соединены, как описано выше.
Общая информация относительно нуклеотидных последовательностей человеческих легких и тяжелых цепей, из которых может быть выведена частота использования кодонов, приведена в: Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication No 91-3242.
Транскрипционная единица легкой цепи κ состоит из следующих элементов:
- немедленный ранний энхансер и промотор из человеческого цитомегаловируса (hCMV),
- синтетическая 5'-UT (5'-нетранслируемая область), включающая последовательность Козака,
- сигнальная последовательность тяжелой цепи мышиного иммуноглобулина, включающая интрон сигнальной последовательности,
- клонированная кДНК вариабельной области легкой цепи, размещенная с уникальным рестрикционным сайтом Bsml на 5-конце и сайтом донора сплайсированного фрагмента и уникальным рестрикционным сайтом Notl на 3'-конце,
- геномный человеческий κ-ген константной области, включающий интрон 2 мышиного Ig-κ энхансера (Picard, D., and Schaffner, W. Nature 307 (1984) 80-82),
и
- сигнальная последовательность κ-полиаденилирования («поли А») человеческого иммуноглобулина.
Транскрипционная единица γI-тяжелой цепи состоит из следующих элементов:
- немедленный ранний энхансер и промотор из человеческого цитомегаловируса (hCMV),
- синтетическая 5'-UT, включающая последовательность Козака,
- модифицированная сигнальная последовательность тяжелой цепи мышиного иммуноглобулина, включающая интрон сигнальной последовательности,
- клонированная кДНК моноспецифичной вариабельной области тяжелой цепи или клонированная кДНК биспецифичного слияния scFv-вариабельная область тяжелой цепи, размещенная с уникальным рестрикционным сайтом Bsml на 5'-конце и сайтом донора сплайсированного фрагмента и уникальным рестрикционным сайтом Notl на 3'-конце,
- геномный человеческий ген константной области тяжелой цепи γI, включающий μ-энхансер мышиного Ig (Neuberger, M.S., EMBO J. 2 (1983) 1373-1378), и
- сигнальная последовательность полиаденилирования («поли А») человеческого γI-иммуноглобулина.
Помимо легкой цепи κ или тяжелой цепи γI, экспрессионная кассета данных плазмид содержит
- ген устойчивости к гигромицину,
- oriP - репликатор вируса Эпштейна-Барр (EBV),
- репликатор из вектора pUC18, который обеспечивает репликацию данной плазмиды в Е.coli, и
- ген β-лактамазы, который придает Е.coli устойчивость к ампициллину.
Методики генной инженерии
Клонирование проводили с использованием стандартных методик клонирования, как описано в Sambrook et al., 1999 (выше). Все молекулярно-биологические реактивы были доступными в продаже (если не указано иное) и были использованы согласно инструкциям изготовителя.
ДНК, которая содержит кодирующие последовательности, мутации или дополнительные генетические элементы, была синтезирована Geneart AG, Регенсбург.
Последовательности ДНК были определены двухнитевым секвенированием, проведенным в SequiServe (SequiServe GmbH, Германия).
Анализ последовательностей ДНК и белка и управление данными по последовательностям
Для создания последовательностей, картирования, анализа, аннотации и иллюстрации использовали версию 9.0 пакета Vector NTI Advance.
Экспрессия антител против гаптена и производных
Антитела против гаптена экспрессировали посредством временной трансфекции клеток человеческой эмбриональной печени 293 (HEK293) в суспензии. Для этого конструировали легкие и тяжелые цепи соответствующих моно- или биспецифичных антител в экспрессионных векторах, несущих прокариотические и эукариотические селективные маркеры, как описано выше. Данные плазмиды амплифицировали в Е.coli, очищали и затем применяли для временных трансфекций. Для обращения с клетками использовали стандартные методики культуры клеток, как описано в Current Protocols in Cell Biology (2000), Bonifacino, J.S., Dasso, M., Harford, J.В., Lippincott-Schwartz, J. and Yamada, K.M. (eds.), John Wiley & Sons, Inc.
Клетки культивировали в подходящей экспрессионной среде при 37°С/8% СО2. В сутки трансфекций клетки высевали в свежую среду при плотности 1-2×106 жизнеспособных клеток/мл. Комплексы ДНК с трансфекционными реактивами готовили в среде Opti-MEM I (Invitrogen, США), содержащей 250 мкг плазмидной ДНК тяжелой и легкой цепи в молярном отношении 1:1 для конечного трансфекционного объема 250 мл. Супернатанты культуры клеток, содержащие моноспецифичное или биспецифичное антитело, осветляли через 7 суток после трансфекции посредством центрифугирования при 14000 g в течение 30 минут и фильтрования через стерилизующий фильтр (0,22 мкм). Супернатанты хранили до очистки при -20°С.
Для определения концентрации антител и производных в супернатантах культуры клеток применяли аффинную ВЭЖХ (высокоэффективная жидкостная хроматография). Для этого супернатант культуры клеток, содержащий моно- или биспецифичное антитело или их производные, которые связываются с белком А, наносили на колонку Poros А/20 от Applied Biosystems в растворе, содержащем 200 мМ KH2PO4, 100 мМ цитрат натрия, рН 7,4. Элюцию из хроматографического вещества проводили посредством применения раствора, содержащего 200 мМ NaCl, 100 мМ лимонную кислоту, рН 2,5. Использовали систему ВЭЖХ UltiMate 3000 (Dionex). Элюированный белок количественно измеряли по поглощению в УФ (ультрафиолетовая область) и посредством интегрирования площадей пиков. Очищенное антитело IgG1 служило в качестве стандарта.
Очистка антител против гаптена, которые связываются с дигоксигенином, флуоресцеином, теофиллином или биотином
Через семь суток после трансфекций клеток HEK 293 отбирали супернатанты. Рекомбинантное антитело (или производные), содержащееся в них, очищали из супернатанта в два этапа посредством аффинной хроматографии с использованием аффинной хроматографии на основе белка A-Sepharose™ (GE Healthcare, Швеция) и гель-фильтрации на Superdex200. Вкратце, осветленные супернатанты культуры, содержащие антитело, наносили на колонку с белком А MabSelectSuRe (5-50 мл), уравновешенную буфером PBS (10 мМ Na2HPO4, 1 мМ KH2PO4, 137 мМ NaCl и 2,7 мМ KCl, рН 7,4). Несвязавшиеся белки вымывали с использованием уравновешивающего буфера. Антитела (или производные) элюировали 50 мМ цитратным буфером, рН 3,2. Фракции, содержащие белок, нейтрализовали 0,1 мл 2 М Tris буфера, рН 9,0. Затем фракции элюированного белка объединяли, концентрировали с использованием центрифужного фильтрующего устройства Amicon Ultra (MWCO (порог отсечения молекулярной массы): 30 кДа, Millipore) и загружали на гель-фильтрационную колонку Superdex200 HiLoad 26/60 (GE Healthcare, Швеция), уравновешенную 20 мМ гистидином, 140 мМ NaCl, рН 6,0. Концентрацию белка очищенных антител и производных определяли посредством определения оптической плотности (ОП) при 280 нм с использованием ОП при 320 нм в качестве корректировки фона, используя коэффициент молярной экстинкции, рассчитанный на основе аминокислотной последовательности, согласно Расе et. al., Protein Science 4 (1995) 2411-2423. Фракции мономерного антитела объединяли, быстро замораживали и хранили при -80°С. Часть образцов была предоставлена для последующих аналитики и характеризации белка.
Гомогенность антител подтверждали посредством SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) в присутствии и в отсутствие восстановителя (5 мМ 1,4-дитиотрейтол) и окрашивания кумасси бриллиантовым синим. Использовали систему предварительно отлитого геля NuPAGE® (Invitrogen, США) согласно инструкции изготовителя (4-20%-ные Tris-глициновые гели).
Полипептидные цепи, относящиеся к IgG, идентифицировали после SDS-PAGE при восстанавливающих условиях при кажущихся молекулярных размерах, аналогичных расчетным молекулярным массам. Уровни экспрессии всех конструкций анализировали посредством белка А. Средние выходы белка в таких неоптимизированных экспериментах по временной экспрессии составляли от 6 мг до 35 мг очищенного белка на литр супернатанта культуры клеток.
Пример 8
Получение гаптенилированных соединений
Для получения соединений для нековалентного комплексообразования, а также для конъюгирования (ковалентное комплексообразование) необходимо (i) связать гаптен через подходящие линкеры с соединением (груз) и (ii) убедиться в том, что связывание осуществляется способом, который обеспечивает сохранение соединением его функциональности,
а) конъюгаты гаптен-полипептид
Любой полипептид может быть дериватизирован на N- или С-конце, или в положении боковой цепи линкером, несущим гаптен, при условии, что в линкер между полипептидом и гаптеном может быть введен реакционноспособный остаток, такой как остаток цистеина. В особенности, полипептид может содержать неприродные аминокислотные остатки.
Типичные гаптенилированные соединения перечислены в следующей Таблице 5.


Сокращения: 4Abu - 4-аминомасляная кислота
Ahx - аминогексановая кислота
Btn - биотинил
cme - карбоксиметил
Cy5 - индодикарбоцианин, цианин-5
Dadoo - 1,8-диамино-3,6-диоксооктан
DCM - дихлорметан
Dig(OSu) - дигоксигенин-3-карбосиметил-N-гидроксисукцинимид
Dy636 - флуорофор
eda - этилендиамин
Fluo - 5-карбоксифлуоресцеин
HATU - 0-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат
HFIP - 1,1,1,3,3,3-гексафтор-2-пропанол
Mmt - 4-метокситритил
MR121 - оксазиновый флуорофор
МТВЕ - трет-бутилметиловый эфир
NMM - N-метилморфолин
NMP - N-метил-2-пирролидон
PEG2 - 8-амино-3,6-диоксаоктановая кислота
PEG3 - 12-амино-4,7,10-триоксадодекановая кислота
O2Oc - 8-амино-3,6-диоксаоктановая кислота
Pip - пиперидин
Pqa - 4-оксо-6-пиперазин-1-ил-4Н-хиназолин-3-ил)-уксусная кислота
TBTU - 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторборат
ТСЕР - Tris(2-хлорэтил)фосфат
TFE - 2,2,2-трифторэтанол
TIS - триизопропилсилан
Схема методики связывания и используемые реактивы показаны на Фиг. 30, 31 и 32.
Типичным полипептидом, который использовали в данном документе, было производное агониста рецептора нейропептида-2. Данный полипептид представляет собой пептид-тирозин-тирозин или аналог панкреатического пептида YY с коротким PYY(3-36), как описано в WO 2007/065808. Он был дигоксигенилирован через аминокислотный остаток лизина в положении 2. В последующем тексте дигоксигенилированный полипептид PYY называется DIG-PYY, независимо от боковой цепи, связывающей полипептид с остатком дигоксигенина.
Другие типичные соединения представляют собой непептидные флуоресцентные красители Cy5, Dy636 и MR121. Данные соединения могут быть связаны с дигоксигенином или биотином, содержащими линкерные системы, посредством химии NHS-сложного эфира.
i) Общий способ получения происходящего из PYY(3-36) полипептидного предшественника для конъюгирования
Стандартный протокол для производных PYY на автоматическом множественном синтезаторе:
Маточные растворы:
Связывание:
Fmoc-деблокирование:
Промывка:
Конечное расщепление:
Ac-IK-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-TentaGel S RAM смола (SEQ ID NO: 176)
PYY(3-36)-полипептидное производное (названное PYY) получали автоматическим твердофазным синтезом связанной со смолой пептидной последовательности Ac-IK(Mmt)-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(tBu)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-TentaGel-RAM смола. Пептидный синтез проводили в множественном синтезаторе SYRO I (MultiSynTech GmbH, Witten) с вихревой перемешивающей системой с использованием химии Fmoc. Используя смолу TentaGel RAM (загрузка: 0,25 ммоль/г; Rapp Polymers, Германия), собирали пептидную последовательность в повторных циклах посредством последовательного связывания соответствующих Fmoc-аминокислот (масштаб: 0,05 ммоль). На каждом этапе связывания N-концевую Fmoc-группу удаляли посредством обработки смолы (5 мин плюс 12 мин) 30%-ным пиперидином в диметилформамиде (DMF). Связывания проводили с использованием Fmoc-защищенных аминокислот (0,25 ммоль), активированных TBTU (0,25 ммоль) в положениях 1, 13, 14 и 15 и NMM 50% в NMP (двухкратное связывание 2×30 мин с вихревым перемешиванием). Во всех других положениях в качестве активатора использовали HATU (0,25 ммоль) и NMM 50% в NMP. Между каждым из этапов связывания смолу промывали DMF 5×1 мин. После синтеза линейного предшественника проводили ацетилирование посредством реакции с DMF/DIPEA/Ac2O за 15 мин и промывки DMF, получая Ac-IK(Mmt)-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-TentaGel S RAM смолу.
Для удаления группы Mmt пептид обрабатывали DCM/HFIP/TFE/TIS (6,5:2:1:0,5), 2×1 ч, получая, после промывки DMF, родительский деблокированный предшественник Ac-IK-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-TentaGel S RAM смола.
Ac-PYY(PEG3-Dig)/Ac-IK(PEG3-Dig)-Pga-RHYLNWVTRQ-MeArg-Y-NH2 (SEQ ID NO: 177)
Относительно синтезов также см. WO 2012/093068.
К раствору пептида Ac-IK(H2N-TEG)-Pqa-RHYLNWVTRQ(N-метил)RY (100 мг, 40,6 мкмоль) в воде (5 мл) добавляли дигоксигенин-3-карбокси-метил-N-гидроксисукцинимид (26,6 мг, 48,8 мкмоль), растворенный в NMP (1 мл). Добавляли триэтиламин (13,6 л, 97,6 мкмоль), и смесь перемешивали переворачиванием в течение 2 ч при комнатной температуре. Затем добавляли дополнительное количество дигоксигенин-3-карбокси-метил-N-гидроксисукцинимида (13,3 мг, 24,4 мкмоль), растворенного в NMP (0,5 мл) и триэтиламине (6,8 мкл, 48,8 мкмоль), и раствор перемешивали переворачиванием в течение 15 ч. Неочищенный продукт очищали препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм) с получением пептида Dig-PYY (29 мг, 10,0 мкмоль, 25%) в виде бесцветного твердого вещества. Для аналитической характеризации пептидного производного авторы изобретения применяли следующие условия и получили следующие данные: аналитическая ВЭЖХ: tR равно 11,3 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода плюс 0,1% TFA → ацетонитрил/вода плюс 0,1% TFA 80: 20, 25 мин); МС-ЭРИ (масс-спектрометрия с электрораспылительной ионизацией) (режим положительных ионов): m/z: расчетное для C140H207N35O32: 2892,4; обнаруженное: 964,9 [М+2Н]2+, расчетное: 965,1. До момента комплексообразования с антителом авторы изобретения хранили дигоксигенилированный пептид в виде лиофилизата при 4°С. На Фиг. 2В показана структура DIG-moPYY.
ii) Получение дигоксигенилированных полипептидов, происходящих от PYY(3-36), с линкером, содержащим цистеин
Ac-IK(PEG3-Cys-4Abu-NH2)-Pga-RHYLNWVTRQ-MeArg-Y-NH2 (SEQ ID NO: 178)
Начиная с предшественника Ac-IK-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-TentaGel S RAM смола (SEQ ID NO: 176), пептидный синтез продолжали с использованием следующих этапов:
Проводили двойное связывание вручную с использованием 66,5 мг (3 экв.) Fmoc-12-амино-4,7,10-триоксадодекановой кислоты (PEG3-спейсер), 57,0 мг (3 экв.) HATU и 16,7 мкл (3 экв.) NMM в 1,2 мл DMF 2 раза в течение 30 мин. После промывок DMF (5×1 мин) Fmoc-группу отщепляли 30% Pip/DMF, и смолу промывали DMF, используя стандартный протокол.
Следующие двойные связывания Fmoc-Cys(Trt)-OH и Fmoc-4-Abu-OH проводили автоматически в синтезаторе SYRO 1 посредством протокола, описанного в стандартном протоколе для производных PYY на автоматическом множественном синтезаторе. Наконец, смолу промывали DMF, EtOH, МТВЕ и сушили.
Отщепление от смолы проводили с использованием 8 мл ТРА/тиоанизола/тиокрезола/TIS (95:2,5:2,5:3) в течение 4 ч. Раствор, полученный в результате отщепления, фильтровали и концентрировали до 1-2 мл, и пептид осаждали добавлением МТВЕ. Белое твердое вещество собирали центрифугированием, промывали 2 раза МТВЕ и сушили.
Неочищенный продукт очищали препаративной ВЭЖХ с обращенной фазой, получая бесцветное твердое вещество. Выход: 28,0 мг.
Протокол очистки
Аналитические данные:
m/z: расчетное для C122H185N37O28S: 2650,13; обнаруженное: 2650,3.
Ac-IK(PEG3-Cys-4Abu-Dig)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2 (SEQ ID NO: 179)
К раствору 15 мг пептида Ac-IK(PEG3-Cys-4Abu-NH2)-Pqa-RHYLNWVTRQ-MeArg-Y-амид (SEQ ID NO: 180) в 50 мкл DMSO добавляли 250 мкл буфера PBS, рН 7,4, и раствор перемешивали в течение ночи. Образование димера контролировали посредством ВЭЖХ. Через 18 ч образовалось приблизительно 90% димера.
К данному раствору добавляли 7,3 мг дигоксигенин-3-карбокси-метил-N-гидроксисукцинимида (Dig-OSu), растворенного в 100 мкл DMF, и данную смесь перемешивали в течение 5 ч при комнатной температуре. Затем добавляли дополнительные 16,9 мг Dig-OSu, растворенного в 100 мкл DMF, и перемешивали в течение 2 ч. Добавляли дополнительное количество 6,9 мг в 100 мкл DMF и перемешивали в течение 18 ч. Для восстановления димера добавляли ТСЕР, перемешивали в течение 3 ч, и данный раствор непосредственно использовали для очистки посредством препаративной ВЭЖХ с обращенной фазой.
Аналитические данные:
Условия были такими же, как описано для SEQ ID NO: 178.
Градиент для препаративной ВЭЖХ: 38-58% Б за 30 мин.
Выход: 5,3 мг.
m/z: расчетное для C147H219N37O34S: 3080,7; обнаруженное: 3079,8.
PEG3-IK(PEG3-Cys-4Abu-Dig)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2 (SEQ ID NO: 180)
Автоматический твердофазный синтез последовательности PYY, связанной со смолой
PEG2-IK(ivDde)-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(tBu)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-TentaGel-RAM смола (SEQ ID NO: 181)
Пептидный синтез проводили согласно устоявшимся протоколам (FastMoc 0,25 ммоль) в автоматическом синтезаторе пептидов ABI 433А от Applied Biosystems с использованием химии Fmoc. Пептидную последовательность собирали с использованием смолы TentaGel RAM (загрузка: 0,18 ммоль/г; Rapp Polymers, Германия) в повторяющихся циклах посредством последовательного связывания соответствующих Fmoc-аминокислот (масштаб: 0,25 ммоль). На каждом этапе связывания N-концевую Fmoc-группу удаляли посредством обработки смолы (3×2,5 мин) 20%-ным пиперидином в N-метилпирролидоне (NMP). Связывания проводили с использованием Fmoc-защищенных аминокислот (1 ммоль), активированных HBTU/HOBt (1 ммоль каждого) и DIPEA (2 ммоль) в DMF (45-60 мин вихревого перемешивания). В синтезируемую последовательность в положения 2, 3 и 14 включали аминокислотные производные Fmoc-Lys(ivDde)-OH, Fmoc-Pqa-OH и Fmoc-N-Me-Arg(Mtr)-OH соответственно. После каждого этапа связывания непрореагировавшие аминогруппы кэппировали посредством обработки смесью Ac2O (0,5 М), DIPEA (0,125 М) и HOBt (0,015 М) в NMP (10 мин вихревого перемешивания). Между каждым из этапов смолу тщательно промывали N-метилпирролидоном и DMF. Включение стерически затрудненных аминокислот осуществляли в автоматических двойных связываниях. С этой целью смолу дважды обрабатывали 1 ммоль активированного строительного блока без этапа кэппирования между циклами связывания. После завершения целевой последовательности N-концевую Fmoc-группу удаляли с использованием 20%-ного пиперидина в NMP, и 2-[2-(метоксиэтокси)-этокси]уксусную кислоту (4 ммоль) связывали после активации HBTU/HOBt (по 2 ммоль каждого) и DIPEA (4 ммоль). Затем смолу переносили в твердофазный реактор на основе фритты для дальнейших манипуляций.
PEG2-IK(PEG3-Cys-Abu-NH2)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2 (SEQ ID NO: 182)
Для удаления группы ivDde обеспечивали набухание смолы с пептидом (PEG2-IK(ivDde)-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(tBu)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-TentaGel-RAM смола; SEQ ID NO: 181) с использованием DMF в течение 30 мин и затем проводили обработку 2%-ным раствором гидразина гидрата в DMF (60 мл) в течение 2 ч. После тщательной промывки смолы изопропанолом и DMF добавляли раствор Fmoc-12-амино-4,7,10-триоксадодекановой кислоты (PEG3-спейсер) (887 мг, 2 ммоль), HBTU (2 ммоль), HOBt (2 ммоль) и 2 М диизопропилэтиламина (2 мл, 4 ммоль) в DMF (3 мл), и встряхивали смесь в течение 3 ч. Смолу промывали DMF, и Fmoc-группу отщепляли смесью 20%-ного пиридина в DMF. Затем смолу обрабатывали смесью Fmoc-Cys(Trt)-OH (1,2 г; 2 ммоль), HBTU/HOBt (по 2 ммоль каждого) и DIPEA (4 ммоль) в течение 2 ч. Смолу промывали DMF, и Fmoc-группу отщепляли смесью 20%-ного пиридина в DMF, и связывали Fmoc-4-аминомасляную кислоту (0,65 г, 2 ммоль), активированную HBTU/HOBt (по 2 ммоль каждого) и DIPEA (4 ммоль) (2 ч). N-концевую Fmoc-группу удаляли с использованием 20%-ного пиперидина в NMP, и смолу многократно промывали DMF. Затем смолу обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (19 мл: 0,5 мл: 0,5 мл) в течение 2,5 ч. Раствор, полученный в результате отщепления, фильтровали, и пептид осаждали добавлением холодного (0°С) диизопропилового эфира (300 мл) с получением бесцветного твердого вещества, которое многократно промывали диизопропиловым эфиром. Неочищенный продукт повторно растворяли в смеси уксусная кислота/вода, лиофилизировали и очищали препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм).
Аналитическая ВЭЖХ: tR равно 8,6 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода плюс 0,1% TFA → ацетонитрил/вода плюс 0,1% TFA 80: 20, 25 мин); МС-ЭРИ (режим положительных ионов): m/z: расчетный для C127H195N37O31S: 2768,3; обнаруженный: 1385,0 [М+2Н]2+, расчетный: 1385,1; 923,7 [М+3Н]3+, расчетный: 923,8; 693,1 [М+4Н]4+, расчетный: 693,1.
PEG2-IK(PEG3-Cys-4Abu-Dig)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2 (PEG2-PYY(PEG3-Cys-4Abu-Dig) (SEQ ID NO: 183)
К раствору пептида PEG2-IK(PEG3-Cys-Abu-NH2)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2 (SEQ ID NO: 182, 4,1 мг, 1,48 мкмоль) в DMF (3 мл) добавляли дигоксигенин-3-карбокси-метил-N-гидроксисукцинимид (0,81 мг, 1,48 мкмоль), растворенный в NMP (1 мл). Добавляли триэтиламин (0,41 мкл, 97,6 мкмоль) в DMF, и данную смесь перемешивали переворачиванием в течение 2 ч при комнатной температуре. Неочищенный продукт очищали препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), с получением пептида PEG3-Cys-4Abu-Dig (1,2 мг, 0,375 мкмоль, 25%) в виде бесцветного твердого вещества.
Аналитическая ВЭЖХ: tR равно 10,2 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода плюс 0,1% TFA → ацетонитрил/вода плюс 0,1% TFA 80: 20, 25 мин); МС-ЭРИ (режим положительных ионов): m/z: расчетный для C152H229N37O37S: 3198,8; обнаруженный: 1067,3 [М+3Н]3+, расчетный: 1067,3.
iii) Получение полипептидов, происходящих из PYY(3-36), с биотином или с биотином и цистеинсодержащим линкером:
Ac-IK(PEG2-биотин)-Pqa-RHYLNWVTRQ-MeArg-Y-амид/Ac-PYY(PEG2-Biot) (SEQ ID NO: 184)
Начиная с обычной смолы с предшественником пептида (SEQ ID NO: 176), пептид 2 раза вручную связывали с 57,8 мг (3 экв.) Fmoc-8-амино-диоксаоктановой кислоты (PEG2 спейсер), 48,2 мг (3 экв.) TBTU и 33,3 мкл (6 экв.) NMM в 1,2 мл DMF, 30 мин для каждого этапа, и промывали DMF. Fmoc-группу отщепляли 30% Pip/DMF, используя стандартный протокол, описанный для SEQ ID NO: 176, смолу промывали DMF и обрабатывали в течение 2 ч раствором биотин-OBt в NMP (48,9 мг биотина (4 экв.), 64,2 мг TBTU (4 экв.) и 44,4 мкл NMM (8 экв.) в 1,2 мл NMP, предактивация в течение 3 мин). Смолу с пептидом сушили после промывки DMF, EtOH и МТВЕ.
Конечное отщепление проводили, как описано выше. Неочищенный продукт очищали препаративной ВЭЖХ с обращенной фазой, используя градиент 22-52% Б за 30 мин, с получением твердого вещества. Выход: 42 мг.
Протокол очистки
Аналитические данные:
m/z: расчетное для C122H181N37O27S равно 2630,10; обнаруженное: 2631,5
Ac-IK(PEG3-Cys-β-Ala-биотин)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2/Ac-PYY(PEG3-Cys-β-Ala-Biot) (SEQ ID NO: 185)
Начиная с предшественника - Ac-IK-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-TentaGel S RAM смола (SEQ ID NO: 176), связывали пептид вручную 2 раза по 30 мин с 66,5 мг (3 экв.) Fmoc-12-амино-4,7,10-триоксадодекановой кислоты (PEG3-спейсер), 57,0 мг (3 экв.) HATU и 16,7 мкл (3 экв.) NMM в 1,2 мл DMF. После промывки DMF Fmoc-группу отщепляли 30% Pip/DMF, и смолу промывали DMF с использованием стандартного протокола.
После двойных связываний Fmoc-Cys(Trt)-OH и Fmoc-β-Ala-OH, проведенных автоматически в синтезаторе SYRO 1 посредством стандартного протокола, добавляли вручную раствор биотин-OBt в NMP (полученный из 48,9 мг биотина (4 экв.), 64,2 мг TBTU (4 экв.) и 44,4 мкл NMM (8 экв.) в 1,2 мл NMP, предактивация 3 мин) и перемешивали при комнатной температуре. После 2 ч смолу промывали DMF, ЕtOН, МТВЕ и сушили.
Конечное отщепление проводили, как описано выше. Неочищенный продукт очищали препаративной ВЭЖХ с обращенной фазой, как описано для SEQ ID NO: 184, с получением бесцветного твердого вещества. Выход: 41,4 мг.
Аналитические данные:
Градиент для препаративной ВЭЖХ: 28-58% Б за 30 мин.
m/z: расчетное для C131H197N39O30S2 - 2862,4; обнаруженное: 2862,4
Ac-IK(PEG3-Cys-PEG2-биотин)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2/Ac-PYY(PEG3-Cys-PEG2-Biot) (SEQ ID NO: 186)
Начиная с предшественника - R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-TentaGel S RAM смола (SEQ ID NO: 176), пептидный синтез продолжали с использованием следующих этапов:
двойное связывание с использованием Fmoc-PEG3-OH (посредством стандартного протокола),
двойное связывание Fmoc-Cys(Trt)-OH (посредством стандартного протокола),
двойное связывание Fmoc-PEG2-OH с 57,8 мг (3 экв.) Fmoc-8-амино-диоксаоктановой кислоты (PEG2 спейсер), 48,2 мг (3 экв.) TBTU и 33,3 мкл (6 экв.) NMM в 1,2 мл DMF, 2×30 мин, и биотинилирование с использованием раствора 48,9 мг биотина (4 экв.), 64,2 мг TBTU (4 экв.) и 44,4 мкл NMM (8 экв.) в 1,2 мл NMP, (предактивация 3 мин), одиночное связывание в течение 2 ч.
Отщепление от смолы, очистку и анализ проводили, как описано для SEQ ID NO: 184. Выход: 47,7 мг.
Аналитические данные:
Те же самые условия, что и для SEQ ID NO: 184. Градиент для препаративной ВЭЖХ: 25-45% Б за 30 мин.
m/z: расчетное для C134H203N39O32S2 - 2936,5; обнаруженное: 2937,8
iv) Получение происходящих из PYY(3-36) полипептидов с флуоресцеином или с флуоресцеином и цистеинсодержащим линкером
Ac-IK(PEG3-Cys-4-Abu-5-Fluo)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2/Ac-PYY(PEG3-Cys-4-Abu-5-Fluo) (SEQ ID NO: 187)
Начиная с предшественника - Ac-IK-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)W(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-TentaGel S RAM смола (SEQ ID NO: 176), пептидный синтез продолжали по аналогии с SEQ ID NO: 179. Для мечения добавляли раствор 54,2 мг 5-карбоксифлуоресцеина, 33,1 мг HOBt и 35,6 мкл DIC в DMF и перемешивали в течение 18 ч при комнатной температуре.
Отщепление от смолы, очистку и анализ проводили, как описано для SEQ ID NO: 179. Выход: 41,6 мг.
Аналитические данные:
Градиент для препаративной ВЭЖХ: 29-49% Б за 30 мин.
m/z: расчетное для C143H195N37O34S - 3008,44; обнаруженное: 3007,2
Ac-IK(PEG3-Cys-PEG2-5-Fluo)-Pqa-RHYLNWVTRQ-MeArg-Y-NH2/Ac-PYY(PEG3-Cys-PEG2-5-Fluo) (SEQ ID NO: 188)
Начиная с предшественника - Ac-IK-Pqa-R(Pbf)H(Trt)Y(tBu)LN(Trt)W(Boc)VT(But)R(Pbf)Q(Trt)-MeArg(Mtr)-Y(tBu)-TentaGel S RAM смола (SEQ ID NO: 176), пептидный синтез продолжали с использованием следующих этапов:
двойное связывание с использованием Fmoc-PEG3-OH (посредством стандартного протокола),
двойное связывание Fmoc-Cys(Trt)-OH (посредством стандартного протокола),
двойное связывание Fmoc-PEG2-OH (см. SEQ ID NO: 186).
Для мечения смолу с пептидом перемешивали в течение 18 ч с раствором 56,7 мг 5-карбоксифлуоресцеина, 34,6 мг HOBt и 37,3 мкл DIC в DMF. Отщепление от смолы, очистку и анализ проводили, как описано в SEQ ID NO: 185. Выход: 41,7 мг.
Аналитические данные:
Градиент для препаративной ВЭЖХ: 34-64% Б за 30 мин.
m/z: расчетное для C145H199N37O36S1 - 3068,5; обнаруженное: 3069,2
б) флуоресцентные красители, меченные гаптеном:
i) Получение дигоксигенилированного Cy5
Относительно синтезов см. WO 2012/093068.
ii) Получение Dig-Cys-MR121
Осуществляли набухание 1,2-диамино-пропантритильной смолы (250 мг, 0,225 ммоль, загрузка 0,9 ммоль/г) в колбе Эрленмейера с DMF (5 мл) в течение 30 мин. Затем добавляли к смоле раствор Fmoc-Cys(Trt)-OH (395 мг, 0,675 ммоль) в DMF (2 мл) и раствор HATU (433 мг, 1,2375 ммоль) и HOAt (164 мг, 1,2375 ммоль) в DMF (8 мл). К данной суспензии добавляли DIPEA (385 мкл, 2,25 ммоль), и смесь перемешивали вращением в течение 16 ч при температуре окружающей среды, фильтровали и многократно промывали DMF. После стадии связывания непрореагировавшие аминогруппы кэппировали посредством обработки смесью Ac2O (20%) в DMF, с последующей стадией промывки DMF. Удаление N-концевой Fmoc группы осуществляли посредством обработки смолы пиперидином (20%) в DMF в течение 2 ч. Затем смолу тщательно промывали DMF и изопропанолом, и вновь DMF, и затем обрабатывали раствором MR121 (25 мг, 0,05 ммоль) в 1% DIPEA в DMF (10 мл) в течение 16 ч. После фильтрования и промывки DMF смолу обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (9 мл : 9 мл : 1 мл) в течение 3 ч. Раствор, полученный в результате отщепления, фильтровали, концентрировали при пониженном давлении, и образующееся твердое вещество очищали посредством препаративной ВЭЖХ с обращенной фазой с использованием градиента ацетонитрил/вода, содержащего 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм) и лиофилизировали. Аналитическая ВЭЖХ: tR равно 7,7 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода плюс 0,1% TFA → ацетонитрил/вода плюс 0,1% TFA 80: 20, 25 мин. Затем часть данного промежуточного соединения (10,0 мг, 17,6 мкмоль) растворяли в DMF (1 мл), и добавляли раствор дигоксигенин-3-карбокси-метил-N-гидроксисукцинимида (9,6 мг, 17,6 мкмоль) в DMF (1 мл) и 1% триэтиламина в DMF (2 мл), и данную смесь перемешивали переворачиванием в течение 16 ч. Затем раствор концентрировали, и целевое соединение очищали препаративной ВЭЖХ с обращенной фазой с использованием градиента ацетонитрил/вода, содержащего 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм). Выход: 1,0 мг. Аналитическая ВЭЖХ: tR равно 10,1 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода плюс 0,1% TFA → ацетонитрил/вода плюс 0,1% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов): m/z: расчетное для [М]: 996,3; обнаруженное: 995,8 [М]1+.
iii) Получение DIG-Cys-Ahx-Cy5
Осуществляли набухание 1,2-диамино-пропантритильной смолы (250 мг, 0,225 ммоль, загрузка 0,9 ммоль/г) в колбе Эрленмейера с DMF (5 мл) в течение 30 мин. Затем добавляли к смоле раствор Fmoc-Cys(Trt)-OH (395 мг, 0,675 ммоль) в DMF (2 мл) и раствор HATU (433 мг, 1,2375 ммоль) и HOAt (164 мг, 1,2375 ммоль) в DMF (8 мл). К данной суспензии добавляли DIPEA (385 мкл, 2,25 ммоль), и смесь перемешивали вращением в течение 16 ч при температуре окружающей среды, фильтровали и многократно промывали DMF. После стадии связывания непрореагировавшие аминогруппы кэппировали посредством обработки смесью Ac2O (20%) в DMF, с последующей стадией промывки DMF. Удаление N-концевой Fmoc группы осуществляли посредством обработки смолы пиперидином (20%) в DMF. Затем смолу тщательно промывали DMF и изопропанолом, и вновь DMF, и затем обрабатывали раствором Cy5-моно-NHS-сложного эфира (25 мг, 0,0316 ммоль) в 1% DIPEA в DMF (10 мл) в течение 16 ч. После фильтрования и промывки DMF смолу обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (9 мл : 9 мл : 1 мл) в течение 3 ч. Раствор, полученный в результате отщепления, фильтровали, концентрировали при пониженном давлении, и образующееся твердое вещество повторно растворяли в воде и лиофилизировали. Очистку промежуточного соединения осуществляли препаративной ВЭЖХ с обращенной фазой с использованием градиента ацетонитрил/вода, содержащего 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), что приводило к образованию после лиофилизации синего твердого вещества. Аналитическая ВЭЖХ: tR равно 6,2 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода плюс 0,1% TFA → ацетонитрил/вода плюс 0,1% TFA 80: 20, 25 мин. Затем часть данного промежуточного соединения (6,5 мг, 7,9 мкмоль) растворяли в DMF (1 мл), и добавляли раствор Dig-Amcap-OSu (5,2 мг, 7,9 мкмоль) в DMF (1 мл) и 1% триэтиламина в DMF (2 мл), и данную смесь перемешивали переворачиванием в течение 16 ч. Затем раствор концентрировали, и целевое соединение очищали препаративной ВЭЖХ с обращенной фазой с использованием градиента ацетонитрил/вода, содержащего 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм). Выход: 3 мг. Аналитическая ВЭЖХ: tR равно 8,7 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода плюс 0,1% TFA → ацетонитрил/вода плюс 0,1% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов); m/z: расчетное для [М]: 1360,0; обнаруженное: 1360,7 [М+Н]1+.
iv) Получение биотин-eda-Dy636
К раствору биотин-этилендиамина гидробромида (2,14 мг, 5,83 мкмоль) в 0,1 М буфере K3PO4 (рН 8,0, 500 мкл) добавляли раствор Dy636-OSu (5 мг, 5,83 мкмоль) в 0,1 М буфере K3PO4 (рН 8,0, 500 мкл), и образующуюся смесь перемешивали переворачиванием в течение 2 ч при температуре окружающей среды, фильтровали, и целевое соединение выделяли препаративной ВЭЖХ с обращенной фазой с использованием градиента ацетонитрил/вода, содержащего 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм). После лиофилизации конъюгат Dy636-этилендиамин-Вi был получен в виде бесцветного твердого вещества (2,8 мг, 48%). Аналитическая ВЭЖХ: tR равно 8,5 мин (Merck Chromolith Performance RP-18e, 100×4,6 мм, вода плюс 0,1% TFA → ацетонитрил/вода плюс 0,1% TFA 80: 20, 25 мин); МС-ЭРИ (режим положительных ионов): m/z: расчетное для C50H65N6O10S3: 1006,3; обнаруженное: 1007,3 [М+Н]1+.
v) Получение биотин-Ser-Dy636
Стадия 1: биотин-O2Oc-Ser-O2Oc-DADOO-NH2
На O-бис-(аминоэтил)этиленгликольтритильной смоле (176 мг, 0,125 ммоль, загрузка 0,71 ммоль/г, Novabiochem) последовательно связывали Fmoc-O2Oc-OH, Fmoc-Ser(tBu)-OH, Fmoc-O2Oc-OH (все от Iris Biotech) и DMTr-D-биотин (Roche). Пептидный синтез проводили согласно устоявшимся протоколам (FastMoc 0,25 ммоль) в автоматическом синтезаторе пептидов ABI 433А от Applied Biosystems с использованием химии Fmoc (как описано для SEQ ID NO: 180).
После синтеза смолу тщательно промывали DMF, метанолом, дихлорметаном и сушили под вакуумом. Затем смолу помещали в колбу Эрленмейера и обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (9,5 мл : 250 мкл : 250 мкл) в течение 2 ч при комнатной температуре. Раствор, полученный в результате отщепления, фильтровали, и пептид осаждали добавлением холодного (0°С) диизопропилового эфира (80 мл) с получением бесцветного твердого вещества, которое многократно промывали диизопропиловым эфиром. Неочищенный продукт повторно растворяли в воде, лиофилизировали и затем очищали препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), что приводило к образованию после лиофилизации бесцветного твердого вещества. Выход: 56 мг (60%). Аналитическая ВЭЖХ: tR равно 4,5 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода плюс 0,1% TFA → ацетонитрил/вода плюс 0,1% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов): m/z: расчетное для [М]: 751,9; обнаруженное: 752,4 [М+Н]+; 376,9 [М+2Н]2+.
Стадия 2: биотин-O2Oc-Ser-O2Oc-DADOO-Dy-636 (Bi-Ser-Dy-636)
Пептид (5,3 мг, 7,0 мкмоль) растворяли в 200 мМ калий-фосфатном буфере, рН 7,5 (583 мкл). Сложный NHS-эфир Dy-636 (4 мг, 4,7 мкмоль, Dyomics) растворяли в воде (583 мкл) и добавляли к раствору пептида. Реакционный раствор перемешивали в течение 2 часов при комнатной температуре и затем очищали препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), что приводило к образованию после лиофилизации синего твердого вещества. Выход: 3,9 мг (55%). Аналитическая ВЭЖХ: tR равно 8,3 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода плюс 0,025% TFA → ацетонитрил/вода плюс 0,023% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов): m/z: расчетное для [М]: 1472,8; обнаруженное: 1472,8 [М+Н]+; 737,0 [М+2Н]2+.
vi) Получение биотин-Cys-Dy636
Стадия 1: биотин-O2Oc-Cys-O2Oc-DADOO-NH2
На O-бис-(аминоэтил)этиленгликольтритильной смоле (325 мг, 0,25 ммоль, загрузка 0,71 ммоль/г, Novabiochem) последовательно связывали Fmoc-O2Oc-OH, Fmoc-Cys(Trt)-OH, Fmoc-O2Oc-OH (все от Iris Biotech) и DMTr-D-биотин (Roche). Пептидный синтез проводили согласно устоявшимся протоколам (FastMoc 0,25 ммоль) в автоматическом синтезаторе пептидов ABI 433А от Applied Biosystems с использованием химии Fmoc (как описано для SEQ ID NO: 180).
После синтеза смолу тщательно промывали DMF, метанолом, дихлорметаном и сушили под вакуумом. Затем смолу помещали в колбу Эрленмейера и обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (9,5 мл : 250 мкл : 250 мкл) в течение 2 ч при комнатной температуре. Раствор, образующийся в результате отщепления, фильтровали, и пептид осаждали добавлением холодного (0°С) диизопропилового эфира (100 мл) с получением бесцветного твердого вещества, которое многократно промывали диизопропиловым эфиром. Неочищенный продукт повторно растворяли в воде, лиофилизировали и затем очищали препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), что приводило к образованию после лиофилизации бесцветного твердого вещества. Выход: 79 мг (41%). Аналитическая ВЭЖХ: tR равно 5,3 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода плюс 0,1% TFA → ацетонитрил/вода плюс 0,1% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов); m/z: расчетное для [М]: 767,9; обнаруженное: 768,4 [М+Н]+; 384,8 [М+2Н]2+.
Стадия 2: биотин-O2Oc-Cys(TNB)-O2Oc-DADOO-NH2
Пептид (30 мг, 39 мкмоль) растворяли в 100 мМ калий-фосфатном буфере, рН 7,5 (4 мл), и добавляли 5,5'-дитиобис(2-нитробензойную кислоту) (77 мг, 195 мкмоль). Данную смесь перемешивали в течение 30 минут при комнатной температуре и затем очищали препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), что приводило к образованию после лиофилизации желтого твердого вещества. Выход: 31 мг (83%). Аналитическая ВЭЖХ: tR равно 5,4 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода плюс 0,025% TFA → ацетонитрил/вода плюс 0,023% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов); m/z: расчетное для [М]: 965,1; обнаруженное: 965,4 [М+Н]+; 483,3 [М+2Н]2+.
Стадия 3: биотин-O2Oc-Cys(TNB)-O2Oc-DADOO-Dy-636
Пептид, защищенный TNB (1,35 мг, 1,4 мкмоль), растворяли в 200 мМ калий-фосфатном буфере, рН 7,5 (291 мкл). Сложный NHS-эфир Dy-636 (1 мг, 1,2 мкмоль, Dyomics) растворяли в воде (291 мкл) и добавляли в раствор пептида. Реакционный раствор перемешивали в течение 1 часа при комнатной температуре и затем очищали препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), что приводило к образованию после лиофилизации синего твердого вещества. Выход: 1 мг (50%). Аналитическая ВЭЖХ: tR равно 9,0 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода плюс 0,025% TFA → ацетонитрил/вода плюс 0,023% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов); m/z: расчетное для [М]: 1686,0; обнаруженное: 1686,7 [М+Н]+; 844,2 [М+2Н]2+.
Стадия 4: биотин-O2Oc-Cys-O2Oc-DADOO-Dy-636 (Bi-Cys-Dy-636)
Пептид, защищенный TNB и меченный красителем (1 мг, 0,6 мкмоль) растворяли в смеси 200 мМ калий-фосфатного буфера, рН 7,5 (250 мкл) и воды (192 мкл). Добавляли 100 мМ раствор tris(2-карбоксиэтил)фосфина гидрохлорида (58 мкл), и перемешивали реакционную смесь в течение 30 минут при комнатной температуре. Очистку проводили препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), что приводило к образованию после лиофилизации синего твердого вещества. Выход: 0,7 мг (79%). Аналитическая ВЭЖХ: tR равно 8,6 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода плюс 0,025% TFA → ацетонитрил/вода плюс 0,023% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов); m/z: расчетное для [М]: 1488,9; обнаруженное: 1488,6 [М+Н]+; 745,1 [М+2Н]2+.
vii) Получение биотин-Суs-Cy5
Стадия 1: биотин-O2Oc-Cys-O2Oc-DADOO-NH2
На O-бис-(аминоэтил)зтиленгликольтритильной смоле (352 мг, 0,25 ммоль, загрузка 0,71 ммоль/г, Novabiochem) последовательно связывали Fmoc-О2Ос-ОН, Fmoc-Cys(Trt)-OH, Fmoc-O2Oc-OH (все от Iris Biotech) и DMTr-D-биотин (Roche). Пептидный синтез проводили согласно устоявшимся протоколам (FastMoc 0,25 ммоль) в автоматическом синтезаторе пептидов ABI 433А от Applied Biosystems с использованием химии Fmoc (как описано для SEQ ID NO: 180).
После синтеза смолу тщательно промывали DMF, метанолом, дихлорметаном и сушили под вакуумом. Затем смолу помещали в колбу Эрленмейера и обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (9,5 мл : 250 мкл : 250 мкл) в течение 2 ч при комнатной температуре. Раствор, образующийся в результате отщепления, фильтровали, и пептид осаждали добавлением холодного (0°С) диизопропилового эфира (100 мл) с получением бесцветного твердого вещества, которое многократно промывали диизопропиловым эфиром. Неочищенный продукт повторно растворяли в воде, лиофилизировали и затем очищали препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), что приводило к образованию после лиофилизации бесцветного твердого вещества. Выход: 79 мг (41%). Аналитическая ВЭЖХ: tR равно 5,3 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода плюс 0,1% TFA → ацетонитрил/вода плюс 0,1% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов); m/z: расчетное для [М]: 767,9; обнаруженное: 768,4 [М+Н]+; 384,8 [М+2Н]2+.
Стадия 2: биотин-O2Oc-Cys(TNB)-O2Oc-DADOO-NH2
Пептид (30 мг, 39 мкмоль) растворяли в 100 мМ калий-фосфатном буфере, рН 7,5 (4 мл), и добавляли 5,5'-дитиобис(2-нитробензойную кислоту) (77 мг, 195 мкмоль). Данную смесь перемешивали в течение 30 минут при комнатной температуре и затем очищали препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), что приводило к образованию после лиофилизации желтого твердого вещества. Выход: 31 мг (83%). Аналитическая ВЭЖХ: tR равно 5,4 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода плюс 0,025% TFA → ацетонитрил/вода плюс 0,023% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов); m/z: расчетное для [М]: 965,1; обнаруженное: 965,4 [М+Н]+; 483,3 [М+2Н]2+.
Стадия 3: биотин-O2Oc-Cys(TNB)-O2Oc-DADOO-Cy
Пептид, защищенный TNB (9,9 мг, 10,3 мкмоль), растворяли в 200 мМ калий-фосфатном буфере, рН 7,5 (1026 мкл). Сложный NHS-эфир Cy5 (6,5 мг, 8,2 мкмоль, GE Healthcare) растворяли в воде (1026 мкл) и добавляли к раствору пептида. Реакционный раствор перемешивали в течение 2 часов при комнатной температуре и затем очищали препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), что приводило к образованию после лиофилизации синего твердого вещества. Выход: 10 мг (80%). Аналитическая ВЭЖХ: tR равно 7,2 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода плюс 0,025% TFA → ацетонитрил/вода плюс 0,023% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов); m/z: расчетное для [М]: 1603,9; обнаруженное: 1604,9 [М+Н]+; 803,1 [М+2Н]2+.
Стадия 4: биотин-O2Oc-Cys-O2Oc-DADOO-Cy5 (Bi-Cys-Cy5)
Пептид, защищенный TNB и меченный красителем (10 мг, 6,1 мкмоль) растворяли в смеси 200 мМ калий-фосфатного буфера, рН 7,5 (1522 мкл), и воды (1218 мкл). Добавляли 100 мМ раствор tris(2-карбоксиэтил)фосфина гидрохлорида (304 мкл), и перемешивали реакционную смесь в течение 30 минут при комнатной температуре. Очистку проводили препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), что приводило к образованию после лиофилизации синего твердого вещества. Выход: 7,6 мг (86%). Аналитическая ВЭЖХ: tR равно 6,4 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода плюс 0,025% TFA → ацетонитрил/вода плюс 0,023% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов); m/z: расчетное для [М]: 1406,8; обнаруженное: 1406,8 [М+Н]+; 704,0 [М+2Н]2+.
viii) Получение биотин-Ser-Cy5
Стадия 1: биотин-O2Oc-Ser-O2Oc-DADOO-NH2
На O-бис-(аминоэтил)этиленгликольтритильной смоле (176 мг, 0,125 ммоль, загрузка 0,71 ммоль/г, Novabiochem) последовательно связывали Fmoc-O2Oc-OH, Fmoc-Ser(tBu)-OH, Fmoc-O2Oc-OH (все от Iris Biotech) и DMTr-D-биотин (Roche). Пептидный синтез проводили согласно устоявшимся протоколам (FastMoc 0,25 ммоль) в автоматическом синтезаторе пептидов ABI 433А от Applied Biosystems с использованием химии Fmoc (как описано для SEQ ID NO: 180).
После синтеза смолу тщательно промывали DMF, метанолом, дихлорметаном и сушили под вакуумом. Затем смолу помещали в колбу Эрленмейера и обрабатывали смесью трифторуксусной кислоты, воды и триизопропилсилана (9,5 мл : 250 мкл : 250 мкл) в течение 2 ч при комнатной температуре. Раствор, образующийся в результате отщепления, фильтровали, и пептид осаждали добавлением холодного (0°С) диизопропилового эфира (80 мл) с получением бесцветного твердого вещества, которое многократно промывали диизопропиловым эфиром. Неочищенный продукт повторно растворяли в воде, лиофилизировали и затем очищали препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), что приводило к образованию после лиофилизации бесцветного твердого вещества. Выход: 56 мг (60%). Аналитическая ВЭЖХ: tR равно 4,5 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода плюс 0,1% TFA → ацетонитрил/вода плюс 0,1% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов); m/z: расчетное для [М]: 751,9; обнаруженное: 752,4 [М+Н]+; 376,9 [М+2Н]2+.
Стадия 2: биотин-O2Oc-Ser-O2Oc-DADOO-Cy5 (Bi-Ser-Cy5)
Пептид (5,7 мг, 7,6 мкмоль) растворяли в 200 мМ калий-фосфатном буфере, рН 7,5 (789 мкл). Сложный NHS-эфир Cy5-Mono (5 мг, 6,3 мкмоль, GE Healthcare) растворяли в воде (789 мкл) и добавляли в раствор пептида. Реакционный раствор перемешивали в течение 2 часов при комнатной температуре и затем очищали препаративной ВЭЖХ с обращенной фазой, используя градиент ацетонитрил/вода, содержащий 0,1% TFA (колонка Merck Chromolith prep RP-18e, 100×25 мм), что приводило к образованию после лиофилизации синего твердого вещества. Выход: 6 мг (58%). Аналитическая ВЭЖХ: tR равно 6,1 мин (Merck Chromolith Performance RP-18e, 100×3 мм, вода плюс 0,025% TFA → ацетонитрил/вода плюс 0,023% TFA 80: 20, 25 мин. МС-ЭРИ (режим положительных ионов); m/z: расчетное для [М]: 1390,72; обнаруженное: 1391,2 [М+Н]+.
Пример 9
Связывание рекомбинантного гуманизированного антитела против биотина с соединением, меченным биотином (гаптенилированным соединением)
Для того чтобы определить, приводили ли процедура гуманизации и последующее введение цистеиновых мутаций к производным, которые сохраняли полную активность связывания, проводили следующие эксперименты.
Свойства связывания производных рекомбинантного антитела против биотина анализировали методикой биослойной интерферометрии (BLI) с использованием прибора Octet QK (Fortebio Inc.). Данная система хорошо устоялась для исследования взаимодействий молекул. Методика BLI основана на измерении картины интерференции белого света, отраженного от поверхности кончика биосенсора и внутреннего эталона. Связывание молекул с кончиком биосенсора приводит к сдвигу картины интерференции, который можно измерить. Для анализа того, уменьшила ли процедура гуманизации, описанная выше, способность антитела против биотина связываться с биотином, непосредственно сравнивали свойства химерных и гуманизированных версий антитела в их способности к связыванию с биотинилированным белком. Исследования связывания проводили путем захвата антитела против биотина на биосенсорах для захвата с антителом против Fc человеческого IgG (АНС) (Fortebio Inc.). Сначала биосенсоры инкубировали в растворе антитела с концентрацией 0,5 мг/мл в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, в течение 1 мин. Затем биосенсоры инкубировали в течение 1 мин в 1× PBS, рН 7,4, для достижения стабильного фона. Связывание измеряли путем инкубирования биосенсоров, покрытых антителом, в растворе, содержащем биотинилированный белок с концентрацией 0,06 мг/мл в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, в течение 5 мин. Диссоциацию отслеживали в течение 5 мин в 1× PBS, рН 7,4. Полученные в результате кривые связывания для химерного и гуманизированного антител против биотина сравнивали непосредственно.
Гуманизированная версия антитела демонстрировала равное или даже лучшее связывание биотинилированного антигена, чем химерное антитело. То же самое верно для гуманизированного антитела с мутацией Cys в положении VH53 по Kabat. Биотинилированный белок демонстрировал остаточное неспецифичное связывание с биосенсорами, которое уменьшалось при покрытии биосенсоров герцептином, который не связывается с биотином. Таким образом, функциональность антитела против биотина сохранялась у его гуманизированного варианта (который определяется последовательностями, описанными в SEQ ID NO: 44 и 48, SEQ ID NO: 60 и 64).
Поверхностный плазмонный резонанс
Измерение поверхностного плазмонного резонанса проводили на приборе BIAcore® Т200 (GE Healthcare Biosciences АВ, Швеция) при 25°С. Примерно 4300 резонансных единиц (RU) захватывающей системы (10 мкг/мл захватывающего антитела против человеческого антитела (Fc IgG) из набора для захвата человеческого антитела, BR-1008-39, GE Healthcare Biosciences АВ, Швеция) связывали на чипе СМЗ (GE Healthcare, BR-1005-36) при рН 5,0 посредством применения стандартного набора для аминного связывания, поставленного GE Healthcare (BR-1000-50). Подвижным буфером для аминного связывания был HBS-N (10 мМ HEPES, рН 7,4, 150 мМ NaCl, GE Healthcare, BR-1006-70). Подвижным буфером и буфером для разведения для следующего анализа связывания был PBS-T (10 мМ фосфатно-солевой буферный раствор, включающий 0,05% Tween 20), рН 7,4. Гуманизированное антитело против биотина захватывали путем инъецирования 2 нМ раствора в течение 60 с при скорости тока 5 мкл/мин. Биотинилированную миРНК разводили PBS-T в концентрациях 0,14-100 нМ (серии разведения 1:3). Связывание измеряли путем инъецирования каждой концентрации в течение 180 с при скорости тока 30 мкл/мин, время диссоциации - 600 с. Поверхность регенерировали 30 с промывкой 3 М раствором MgCl2 при скорости тока 5 мкл/мин. Данные оценивали с использованием программы BIAevaluation (GE Healthcare Biosciences АВ, Швеция). Общие различия индекса преломления корректировали посредством вычитания ответа, полученного от поверхности с антителом против Fc человеческого IgG. Также вычитали пустые инъекции (двойной контроль). Для расчета KD и кинетических параметров использовали модель Лангмюра 1:1.
Анализ кинетики связывания посредством поверхностного плазмонного резонанса (SPR) проводили для гуманизированного антитела против биотина SEQ ID NO: 44 и 48 и гуманизированного антитела против биотина VH53C SEQ ID NO: 60 и 64. Антитела против биотина в концентрации 2 нМ захватывали антителом против Fc человеческого IgG, которое было связано с сенсорным чипом СМ3. Записывали связывание биотинилированных миРНК (Mw: 13868 Да) в концентрациях 0,41; 1,23; 3,7; 11,1; 33,3; 100 и 300 нМ. Измерения проводили в двойных повторностях. Расчетная KD для гуманизированного антитела против биотина и гуманизированного антитела против биотина VH53C составляла 0,633 нМ и 0,654 нМ соответственно.
Пример 10
Получение нековалентных комплексов гаптенилированных соединений с антителами против гаптена
Общий способ:
Получение комплексов антител против гаптена с гаптенилированными соединениями (гаптены, конъюгированные с грузом) должно приводить к определенным комплексам, и следует убедиться, что соединение (груз) в данных комплексах сохраняет его активность. Для получения комплексов гаптенилированных соединений с соответствущим антителом против гаптена гаптенилированное соединение растворяли в H2O до конечной концентрации 1 мг/мл. Антитело концентрировали до конечной концентрации 1 мг/мл (4,85 мкМ) в 20 мМ гистидиновом буфере, 140 мМ NaCl, рН 6,0. Гаптенилированный груз и антитело смешивали в молярном отношении 2:1 (соединение к антителу) посредством всасывания и выпускания из пипетки и инкубировали в течение 15 минут при RT (комнатная температура).
В качестве альтернативы, гаптенилированное соединение растворяли в 100% DMF до конечной концентрации 10 мг/мл. Антитело концентрировали до конечной концентрации 10 мг/мл в 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Гаптенилированное соединение и антитело смешивали в молярном отношении 2,5:1 (соединение к антителу) посредством всасывания и выпускания из пипетки и инкубировали в течение 60 минут при RT и 350 об./мин.
Типичный способ образования комплексов гаптенилированных флуоресцентных красителей и антител против гаптена - нековалентный комплекс дигоксигенин-Cy5
В качестве компонентов - антител использовали гуманизированное и мышиное антитело против дигоксигенина или биспецифичные производные антитела против дигоксигенина. Для получения комплексов дигоксигенилированного Cy5 с антителами против дигоксигенина конъюгат Cy5-дигоксигенин растворяли в PBS до конечной концентрации 0,5 мг/мл. Антитело использовали в концентрации 1 мг/мл (примерно 5 мкМ) в буфере, состоящем из 20 мМ гистидина и 140 мМ NaCl, рН 6. Дигоксигенилированный Cy5 и антитело смешивали в молярном отношении 2:1 (дигоксигенилированный Cy5 к антителу). Данная процедура приводила к гомогенному препарату комплексов определенного состава.
Реакцию комплексообразования можно отслеживать путем определения флуоресценции (650/667 нм) флуорофора, ассоциированного с антителом, на гель-фильтрационной колонке. Результаты данных экспериментов демонстрируют то, что комплексообразование происходит только если антитело содержит функционалы связывания с дигоксигенином. Антитела без функционалов связывания с дигоксигенином не связываются с конъюгатом дигоксигенин-Cy5. Усиленный сигнал можно наблюдать для двухвалентных антител против дигоксигенина, пока не достигается отношение конъюгата дигоксигенин-Cy5 к антителу 2:1. Затем флуоресцентные сигналы, зависимые от состава, достигают плато.
Типичный способ образования комплексов гаптенилированных флуоресцентных красителей и антител против гаптена - комплекс биотин-Cy5/химерное антитело против биотина (человеческого подкласса IgG)
Для получения комплексов Cy5, дериватизированного биотином (биотин-Cys-Cy5), содержащих цистеинилированный линкер, 0,16 мг биотин-Cys-Cy5 растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антитела использовали в концентрации 10,1 мг/мл (примерно 69 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Cys-Cy5 и антитело смешивали в молярном отношении 2,5:1 (биотин-Cys-Cy5 к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали посредством SDS-PAGE, как описано в Примере 11а. Выявление флуоресценции проводили, как описано в Примере 11а.
Типичный способ образования конъюгатов биотинилированных флуоресцентных красителей и антител против биотина - биотин-Ser-Cy5/гуманизированное антитело против биотина:
Для получения комплексов Cy5, дериватизированного биотином (биотин-Ser-Cy5), содержащих остаток серина в линкере, 0,61 мг биотин-Ser-Cy5 растворяли в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, до концентрации 10 мг/мл. 18,5 мг гуманизированного антитела против биотина использовали в концентрации 10 мг/мл (примерно 69 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Ser-Cy5 и антитело смешивали в молярном отношении 2,5:1 (биотин-Ser-Cy5 к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образец затем подвергали гель-фильтрации с использованием колонки препаративного класса для высокой загрузки Superdex 200 16/60 (GE Healthcare) со скоростью тока 1,5 мл/мин и 20 мМ гистидином, 140 мМ NaCl, рН 6,0, в качестве подвижной фазы. Фракции пика отбирали и анализировали SDS-PAGE на чистоту. Отношение красителя к антителу рассчитывали посредством (1) измерения поглощения образцов при длине волны 280 нм (белок) и 650 нм (Cy5); (2) с использованием формулы: А650 меченного белка/ε(Cy5)*концентрация белка (М) = моли красителя на моль белка, где ε(Cy5) равно 25000 М-1см-1, A650 комплекса равно 47,0, и концентрация белка составляет 86,67 мкМ. Полученное в результате отношение красителя к молекуле антитела составляло 2,17, что указывает на то, что все паратопы антитела насыщаются молекулами биотин-Cy5.
Типичный способ образования комплексов гаптенилированных полипептидов и антител против гаптена - комплекс дигоксигенин-РYY(3-36)/антитело против дигоксигенина
Для получения нековалентных комплексов дигоксигенилированных полипептидов с антителом против дигоксигенина антитело, полученное из мышиной гибридомы (лиофилизат из 10 мМ KPO4, 70 мМ NaCl; рН 7,5), растворяли в 12 мл воды и диализировали против раствора, содержащего 20 мМ гистидин, 140 мМ NaCl, рН 6,0, с получением 300 мг (2×10-6 моль) в 11 мл буфера (концентрация составляет 27,3 мг/мл). Конъюгат дигоксигенин-PYY(3-36) (11,57 мг, 4×10-6 моль, 2 экв.) добавляли 4 порциями по 2,85 мг в пределах 1 ч и инкубировали в течение еще одного часа при комнатной температуре. После завершения реакции комплексообразования комплексы очищали гель-фильтрацией посредством колонки Superdex 200 26/60 GL (320 мл) в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, при скорости тока 2,5 мл/мин. Элюированный комплекс собирали в 4 мл фракциях, объединяли и стерилизовали через 0,2 мкм фильтр с получением 234 мг комплекса в концентрации 14,3 мг/мл. Аналогичным образом для получения комплексов гуманизированного антитела против дигоксигенина антитело доводили до концентрации 10,6 мг/мл (9,81 мг, 6,5×10-8 моль в 0,93 мл) в 20 мМ гистидине, 140 мМ NaCl, рН 6,0. 0,57 мг, составляющих 1,97×10-7, составляющих 3,03 экв. дигоксигенилированного полипептида (DIG-PYY) добавляли в раствор антитела в виде лиофилизата. Полипептид и антитело инкубировали в течение 1,5 ч при комнатной температуре. Избыток полипептида удаляли гель-фильтрацией посредством колонки Superose 6 10/300 GL в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, при скорости тока 0,5 мл/мин. Элюированный комплекс собирали в 0,5 мл фракциях, объединяли и стерилизовали через 0,2 мкм фильтр с получением 4,7 мг комплекса в концентрации 1,86 мг/мл.
Образующийся комплекс гаптенилированный полипептид-антитело против гаптена определяли как мономерную IgG-подобную молекулы через появление одиночного пика в гель-фильтрации. Образующийся комплекс определяли как мономерную IgG-подобную молекулу, несущую два дигоксигенин-PYY производных на молекулу антитела. Определенный состав данных пептидных комплексов был подтвержден гель-фильтрацией, которая также показала отсутствие агрегатов белка. Определенный состав (и отношение полипептида к белку 2:1) данных биспецифичных пептидных комплексов был дополнительно подтвержден SEC-MALLS (гель-фильтрация с детектированием рассеивания лазерного излучения с кратными углами). Для анализа SEC-MALLS 100-500 мкг соответствующего образца наносили на гель-фильтрационную колонку Superdex 200 10/300 GL со скоростью тока 0,25-0,5 мл/мин с 1×PBS, рН 7,4, в качестве подвижной фазы. Рассеяние света детектировали с использованием детектора Wyatt MiniDawn TREOS/QELS, индекс преломления измеряли с использованием детектора Wyatt Optilab rEX. Полученные данные анализировали с использованием программы ASTRA (версия 5.3.4.14). Результаты анализов SEC-MALLS дают информацию о массе, радиусе и размере комплекса. Эти данные затем сравнивали с данными для соответствующего некомплексированного антитела. Результаты данных экспериментов демонстрируют то, что экспонирование дигоксигенилированного PYY с антителом против дигоксигенина приводит к образованию комплексов, которые содержат два производных дигоксигенин-PYY на одну молекулу антитела. Таким образом, дигоксигенилированный PYY может образовать комплекс с антителом против дигоксигенина в определенных сайтах (область связывания) и с определенной стехиометрией.
Характеризация данного комплекса посредством исследований поверхностного плазмонного резонанса дала дополнительное доказательство того, что реакция комплексообразования генерировала определенные и полностью комплектованные молекулы. Антитело против дигоксигенина может связываться с чипом SPR, что приводит к усилениям сигнала. Последующее добавление конъюгата дигоксигенин-PYY приводит к дополнительным усилениям сигнала, пока все сайты связывания не оказываются полностью занятыми. При данных условиях добавление дополнительного дигоксигенин-PYY дополнительно не усиливает сигнал. Это указывает на то, что реакция комплексообразования является специфичной, и что сигналы не вызваны неспецифичным прилипанием дигоксигенилированного полипептида.
Типичный способ образования комплексов гаптенилированных полипептидов и антител против гаптена - комплекс Ac-PYY-PEG3-Cys-β-Ala-Biot/химерное антитело против биотина
Для получения нековалентных комплексов биотинилированный-PYY-полипептид, содержащих цистеинилированный линкер, 0,19 мг Ac-PYY-PEG3-Cys-β-Ala-Biot растворяли в 100% DMF до концентрации 10 мг/мл. Антитело использовали в концентрации 10,7 мг/мл (примерно 73 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY-PEG3-Cys-β-Ala-Biot и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY-PEG3-Cys-β-Ala-Biot к антителу) и инкубировали в течение 60 мин при RT и 350 об./мин. Образующийся комплекс определяли как мономерную IgG-подобную молекулу посредством появления одного пика в гель-фильтрации (95% мономера). Образующийся комплекс дополнительно анализировали SDS-PAGE и последующим анализом вестерн-блоттингом. 10 мкг комплекса смешивали с 4× буфера для образца LDS (Invitrogen) и инкубировали при 95°С в течение 5 мин. Образец наносили на 4-12% Bis-Tris полиакриламидный гель (NuPAGE, Invitrogen), разделение на котором осуществляли в течение 35 мин при 200 В и 120 мА. Молекулы, которые были разделены на полиакриламидном геле, переносили на PVDF мембрану (размер пор 0,2 мкм, Invitrogen) в течение 40 мин при 25В и 160 мА. Мембрану блокировали в 1% (масс./об.) обезжиренном молоке в 1× PBST (1× PBS плюс 0,1% Tween 20) в течение 1 ч при RT. Мембрану промывали 3× в течение 5 мин в 1× PBST и затем инкубировали с конъюгатом стрептавидин-POD (пероксидаза) (2900 U/мл, Roche), который использовали в разведении 1:2000. Выявление стрептавидин-POD, связавшегося с биотином на мембране, проводили с использованием субстрата для вестерн-блоттинга Lumi-Light (Roche).
Типичный способ образования комплексов гаптенилированных полипептидов и антител против гаптена - комплекс Ac-PYY-PEG3-Cys-PEG2-Biot/химерное антитело против биотина
Для получения нековалентных комплексов биотинилированный-PYY-полипептид, содержащих цистеинилированный линкер, 0,16 мг Ac-PYY-PEG3-Cys-PEG2-Biot растворяли в 100% DMF до концентрации 10 мг/мл. Антитело использовали в концентрации 10,7 мг/мл (примерно 73 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY-PEG3-Cys-PEG2-Biot и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY-PEG3-Cys-PEG2-Biot к антителу) и инкубировали в течение 60 мин при RT и 350 об./мин. Полученный в результате комплекс определяли посредством гель-фильтрации как 63% мономерной IgG-подобной молекулы и 37% димерных растворимых агрегетов. Полученный в результате комплекс дополнительно анализировали SDS-PAGE и последующим анализом вестерн-блоттингом. 10 мкг комплекса смешивали с 4× буфера для образца LDS (Invitrogen) и инкубировали при 95°С в течение 5 мин. Образец наносили на 4-12% Bis-Tris полиакриламидный гель (NuPAGE, Invitrogen), разделение на котором осуществляли в течение 35 мин при 200 В и 120 мА. Молекулы, которые были разделены на полиакриламидном геле, переносили на PVDF мембрану (размер пор 0,2 мкм, Invitrogen) в течение 40 мин при 25В и 160 мА. Мембрану блокировали в 1% (масс./об.) обезжиренном молоке в 1× PBST (1× PBS плюс 0,1% Tween 20) в течение 1 ч при RT. Мембрану промывали 3× в течение 5 мин в 1× PBST и затем инкубировали с конъюгатом стрептавидин-POD (2900 U/мл, Roche), который использовали в разведении 1:2000. Выявление стрептавидин-POD, связавшегося с биотином на мембране, проводили с использованием субстрата для вестерн-блоттинга Lumi-Light (Roche).
Типичный способ образования комплексов гаптенилированных полипептидов и антител против гаптена - комплекс Ac-PYY(PEG3-Cys-PEG2-5-Fluo)/химерное антитело против флуоресцеина
Для получения нековалентных комплексов полипептида PYY, конъюгированного с флуоресцеином, содержащих цистеинилированный линкер, 0,33 мг Ac-PYY(PEG3-Cys-PEG2-5-Fluo) растворяли в 100% DMF до концентрации 10 мг/мл. Антитело использовали в концентрации 9,99 мг/мл (примерно 68 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-PEG2-5-Fluo) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-PEG2-5-Fluo) к антителу) и инкубировали в течение 60 мин при RT и 350 об./мин. Полученный в результате комплекс определяли посредством гель-фильтрации как 76% мономерной IgG-подобной молекулы и 24% димерных растворимых агрегетов. Полученный в результате комплекс дополнительно анализировали SDS-PAGE и последующим выявлением флуоресценции, связанной с флуоресцеином, в полиакриламидном геле. 8 мкг комплекса смешивали с 4× буфера для образца LDS (Invitrogen) и инкубировали при 95°С в течение 5 мин. Флуоресценцию, связанную с флуоресцеином, записывали с использованием прибора Lumilmager F1 (Roche) при длине волны возбуждения 645 нм.
Пример 11
Получение определенных ковалентных конъюгатов гаптенилированных красителей или полипептидов с антителом против гаптена VH52bC/VH53C в присутствии окислительно-восстановительных агентов
Типичный способ образования конъюгатов гаптенилированных флуоресцентных красителей и антител против гаптена - Dig-Cys-Ahx-Cy5/антитело против дигоксигенина VH52bC
Получение ковалентных конъюгатов антител против гаптена и гаптенилированных флуоресцентных красителей, содержащих линкер с цистеином, приводит к определенным конъюгатам, где дисульфидный мостик образуется в специфическом положении между VH52bC в CDR2 антитела против гаптена и цистеином в линкере между гаптеном и флуоресцентным красителем. Реакцию конъюгирования проводили в присутствии окислительно-восстановительных реактивов. Dig-Cys-Ahx-Cy5 растворяли в 20 мМ гистидине, 140 мМ NaCl, рН 6,0. Солюбилизацию облегчали добавлением по каплям 10% (об./об.) уксусной кислоты. Конечную концентрацию доводили до 0,4 мг/мл. Антитело против дигоксигенина VH52bC в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, доводили до концентрации 10 мг/мл. Антитело против дигоксигенина использовали в качестве контроля и обрабатывали тем же самым способом, что и антитело против дигоксигенина VH52bC. 4,7 нмоль каждого антитела смешивали с 2,5 молярными эквивалентами Dig-Cys-Ahx-Cy5. Это достигалось добавлением 11,7 нмоль данного вещества 4 порциями (по 2,9 нмоль каждая) каждые 15 мин. Между этими добавлениями образцы инкубировали при 25°С при легком встряхивании. После добавления последней порции 0,64 нмоль каждого комплекса антитело-Dig-Cys-Ahx-Cy5 переносили в буфер, содержащий следующие окислительно-восстановительные реактивы: 3 мМ DTE (дитиотрейтол) плюс 10 мМ GSSG (окисленный глутатион), 3 мМ DTE плюс 1 мМ GSSG и 0,03 мМ DTE плюс 0,1 мМ GSSG. Все образцы инкубировали в данных условиях в течение 15 мин. После инкубации образцы делили пополам (по 0,34 нмоль каждый) и готовили для гель-электрофореза с SDS. Для этого добавляли 4× буфер для образца LDS (Invitrogen). Для каждого образца также получали восстановленную версию посредством добавления 10× агента NuPAGE, восстанавливающего образец (Invitrogen). Все образцы инкубировали при 70°С в течение 5 мин перед электрофорезом на 4-12% Bis-Tris полиакриламидном геле (NuPAGE, Invitrogen) с 1× буфером MOPS (Invitrogen). Флуоресценцию в геле, связанную с Cy5, выявляли с использованием прибора Lumilmager F1 (Roche) при длине волны возбуждения 645 нм. После выявления флуоресценции гель окрашивали SimplyBlue SafeStain (Invitrogen). Гели показаны на Фиг. 8.
Сайт-специфичное образование дисульфидной связи было показано для антитела против дигоксигенина VH52bC (Фиг. 8, гели сверху, полосы 1 А-В) с низким сигналом фоновой флуоресценции при использовании антитела против дигоксигенина без цистеина в CDR2 (полосы 2 А-В). Фоновые сигналы в контрольных реакциях можно объяснить связыванием Dig-Cys-Ahx-Cy5 с цистеинами, которые обычно участвуют в образовании межцепочечных дисульфидных связей антитела. Увеличение количества окислительно-восстановительных реактивов значительно уменьшает число дисульфидных мостиков, которые соединяют тяжелые и легкие цепи антитела, продуцируя, главным образом,
Типичный способ образования конъюгатов гаптенилированных флуоресцентных красителей и антител против гаптена - Dig-Cys-Cy5/антитело против дигоксигенина VH52bC
Dig-Cys-Cy5 растворяли в 8,3 мМ HCl, 10% (об./об.) DMF до конечной концентрации 3,25 мг/мл. Антитело против дигоксигенина VH52bC в 20 мМ гистидине, 140 мМ NaCl, рН 6,0, доводили до концентрации 15 мг/мл. Антитело против дигоксигенина использовали в качестве контроля и обрабатывали таким же способом, что и антитело против дигоксигенина VH52bC. 13,3 нмоль каждого антитела смешивали с 2 молярными эквивалентами Dig-Cys-Cy5 при конечной концентрации антитела 10 мг/мл в присутствии 1 мМ GSH (восстановленный глутатион) и 5 мМ GSSG (окисленный глутатион). Это достигалось добавлением 26,6 нмоль данного вещества 2 порциями каждые 5 мин. Между этими добавлениями образцы инкубировали при RT при аккуратном перемешивании. После добавления последней порции образцы инкубировали в течение 1 ч при RT. Эффективность реакции связывания оценивали посредством SDS-PAGE и последующей записи флуоресцентного сигнала, связанного с Cy5. 5, 10 и 20 мкг каждого образца готовили для SDS-PAGE. Для этого добавляли 4× буфер для образца LDS (Invitrogen). Все образцы инкубировали при 70°С в течение 5 мин перед электрофорезом на 4-12% Bis-Tris полиакриламидном геле (NuPAGE, Invitrogen) с 1× буфером MOPS (Invitrogen). Флуоресценцию в геле, связанную с Cy5, выявляли с использованием прибора Lumilmager F1 (Roche) при длине волны возбуждения 645 нм. После выявления флуоресценции гель окрашивали SimplyBlue SafeStain (Invitrogen).
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - PEG3-PYY(PEG3-Cys-4Abu-Dig)/гуманизированное антитело против дигоксигенина VH52bC
Для получения конъюгатов дериватизированного дигоксигенином полипептида PYY, содержащих цистеинилированный линкер, 1,4 мг PEG3-PYY(PEG3-Cys-4Abu-Dig) растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антитела использовали в концентрации 10 мг/мл (примерно 68 мкМ) в буфере, состоящем из 5 мМ Tris-HCl, 1 мМ EDTA, 1 мМ GSH, 5 мМ GSSG, рН 8,2. PEG3-PYY(PEG3-Cys-4Abu-Dig) и антитело смешивали в молярном отношении 2:1 (PEG3-PYY(PEG3-Cys-4Abu-Dig) к антителу) и инкубировали в течение 60 мин при RT, перемешивали при 100 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 43% детектированного соединения идентифицировали как антитело, связанное с 2 полипептидными млекулами, 46% представляло собой антитело, связанное с 1 полипептидной молекулой, и 11% было идентифицировано как несвязанное антитело.
Пример 12
Получение определенных ковалентных конъюгатов гаптенилированных красителей и полипептидов с антителом против гаптена VH52bC/VH53C в отсутствие окислительно-восстановительных агентов
Для получения ковалентных, связанных дисульфидом конъюгатов антитело против гаптена/гаптенилированный полипептид или гаптенилированный краситель, необходимо (i) связать гаптен (например, дигоксигенин, флуоресцеин, биотин или теофиллин) с полипептидом или красителем через подходящие линкеры, содержащие реакционноспособную группу (такую как, например, цистеин, малеимид), которые позволяют экспонировать полипептид над поверхностью антитела и, следовательно, сохранять его активность, и (ii) создать специфичные в отношении сайта ковалентного связывания конъюгаты гаптенилированных полипептидов с антителом против гаптена с цистеиновой мутацией (антитело VH52bC/VH53C), в которых сохраняется биологическая активность полипептида, и (iii) провести реакцию в отсутствие восстановителя для того, чтобы избежать восстановления межцепочечных дисульфидных мостиков антитела.
Общий способ:
Получение конъюгатов антител против гаптена с гаптенилированными соединениями должно приводить к конъюгатам с определенной стехиометрией, и следует убедиться, что соединение в данных коньюгатах сохраняет его активность. Для получения конъюгатов гаптенилированных соединений с соответствущим антителом против гаптена гаптенилированное соединение растворяли в 100% DMF до конечной концентрации 10 мг/мл. Антитело против гаптена VH52bC/VH53C доводили до концентрации 10 мг/мл в 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Гаптенилированное соединение и антитело против гаптена VH52bC/VH53C смешивали в молярном отношении 2,5:1 (соединение к антителу) посредством всасывания и выпускания из пипетки и инкубировали в течение 60 минут при RT и 350 об./мин.
Полипептид, конъюгированный с гаптеном через линкер, содержащий цистеин, далее называется гаптен-Cys-полипептид или полипептид-Cys-гаптен. Данный полипептид может иметь либо свободный N-конец, либо кэппированный N-конец, например, посредством ацетильной группы (Ас-полипептид-Cys-гаптен) или остатка PEG (РЕС-полипептид-Cys-гаптен).
Флуоресцентный краситель, конъюгированный с гаптеном через линкер, содержащий цистеин, далее называется краситель-Cys-гаптен или гаптен-Cys-краситель.
Типичный способ образования конъюгатов гаптенилированных флуоресцентных красителей и антител против гаптена - Dig-Cys-Ahs-Cy5/антитело против дигоксигенина VH52bC
Образцы готовили точно так же, как описано в Примере 11а, с тем отличием, что комплексы антитело-Dig-Cys-Ahs-Cy5 переносили в буфер, либо не содержащий окислительно-восстановительных соединений, либо содержащий 0,1 мМ GSSG (окисленный глутатион) или 1 мМ GSSG. Полученные в результате сканированные на флуоресценцию и окрашенные кумасси полиакриламидные гели показаны на Фиг. 9. При всех трех условиях продемонстрирована аналогичная специфичность в отношении сайтспецифичного образования дисульфидных связей (Фиг. 9, верхние гели, полосы 1 А-В) с низким уровнем фоновых реакций (Фиг. 9, полосы 2 А-В). Это подтверждает то, что образование дисульфидной связи может осуществляться без необходимости восстановителей. Это значительно стабилизирует антитело/уменьшает разрушение антитела, так как по сравнению с Примером 11 выявляются только остаточные количества
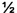
Типичный способ образования конъюгатов гаптенилированных флуоресцентных красителей и антител против гаптена - Dig-Cys-Cy5/антитело против дигоксигенина VH52bC
Образцы готовили точно так же, как описано в Примере 11b, с тем отличием, что 13,3 нмоль антитела смешивали с 2 молярными эквивалентами Dig-Cys-Cy5 при конечной концентрации антитела 10 мг/мл в отсутствие окислительно-восстановительных реактивов.
Типичный способ образования конъюгатов гаптенилированных флуоресцентных красителей и антител против гаптена - биотин-Cys-Cy5/химерное антитело против биотина VH53C
Для получения конъюгатов дериватизированного биотином Cy5, содержащих цистеинилированный линкер, 0,16 мг биотин-Cys-Cy5 растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антитела против биотина VH53C использовали в концентрации 9,7 мг/мл (примерно 68 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Cys-Cy5 и антитело смешивали в молярном отношении 2,5:1 (Ас-биотин-Cys-Cy5 к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Полученный в результате конъюгат анализировали SDS-PAGE, как описано в Примере 11а. Определение флуоресценции проводили, как описано в Примере 11а.
Типичный способ образования конъюгатов гаптенилированных флуоресцентных красителей и антител против гаптена - биотин-Cys-Cy5/гуманизированное антитело против биотина VH53C
Для получения конъюгатов дериватизированного биотином Cy5, содержащих цистеинилированный линкер, 0,16 мг биотин-Cys-Cy5 растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг гуманизированного антитела против биотина VH53C использовали в концентрации 7,4 мг/мл (примерно 51 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Cys-Cy5 и антитело смешивали в молярном отношении 2,5:1 (Ас-биотин-Cys-Cy5 к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Полученный в результате конъюгат анализировали SDS-PAGE, как описано в Примере 11а. Выявление флуоресценции проводили, как описано в Примере 11а.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ac-PYY(PEG3-Cys-4Abu-Dig)/гуманизированное антитело против дигоксигенина VH52bC
Для получения конъюгатов дериватизированного дигоксигенином полипептида PYY, содержащих цистеинилированный линкер, 2,4 мг Ac-PYY(PEG3-Cys-4Abu-Dig) растворяли в 20% ацетате до концентрации 5 мг/мл. 10 мг гуманизированного антитела против дигоксигенина VH52bC (68,4 нмоль) использовали в концентрации 19,5 мг/мл (примерно 133 мкМ) в буфере, состоящем из 20 мМ гистидина, 140 мМ NaCl, рН 6,0. Ac-PYY(PEG3-Cys-4Abu-Dig) и антитело смешивали в молярном отношении 2:1 (Ac-PYY(PEG3-Cys-4Abu-Dig) к антителу) и инкубировали в течение 60 мин при RT, перемешивая при 100 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 7,4% выявленного соединения было идентифицировано как антитело, связанное с 2 пептидными молекулами, 40% представляло собой антитело, связанное с 1 пептидной молекулой, и 52% было идентифицировано как несвязанное антитело.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ac-PYY(PEG3-Cys-βAla-Biot)/химерное антитело против биотина VH53C
Для получения конъюгатов дериватизированного биотином полипептида PYY, содержащих цистеинилированный линкер, 0,19 мг Ac-PYY(PEG3-Cys-βAla-Biot) растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг химерного антитела против биотина VH53C использовали в концентрации 9,7 мг/мл (примерно 67 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-βAla-Biot) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-βAla-Biot) к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 87,7% выявленного соединения было идентифицировано как антитело, связанное с 2 молекулами пептида, 12,3% было идентифицировано как антитело, связанное с 1 молекулой пептида.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ac-PYY(PEG3-Cys-PEG2-Biot)/химерное антитело против биотина VH53C
Для получения конъюгатов дериватизированного биотином полипептида PYY, содержащих цистеинилированный линкер, 0,16 мг Ac-PYY(PEG3-Cys-PEG2-Biot) растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг химерного антитела против биотина VH53C использовали в концентрации 9,9 мг/мл (примерно 68 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-PEG2-Biot) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-PEG2-Biot) к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 100% выявленного соединения было идентифицировано как антитело, связанное с 2 молекулами пептида.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ac-PYY(PEG3-Cys-βAla-Biot)/гуманизированное антитело против биотина VH53C
Для получения конъюгатов дериватизированного биотином полипептида PYY, содержащих цистеинилированный линкер, 0,06 мг Ac-PYY(PEG3-Cys-βAla-Biot) растворяли в 100% DMF до концентрации 10 мг/мл. 0,8 мг гуманизированного антитела против биотина VH53C использовали в концентрации 9 мг/мл (примерно 62 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-βAla-Biot) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-βAla-Biot) к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 62,2% выявленного соединения было идентифицировано как антитело, связанное с 2 пептидными молекулами, 33,9% было идентифицировано как антитело, связанное с 1 пептидной молекулой, и 3,9% было идентифицировано как несвязанное антитело.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ac-PYY(PEG3-Cys-PEG2-Biot)/гуманизированное антитело против биотина VH53C
Для получения конъюгатов дериватизированного биотином полипептида PYY, содержащих цистеинилированный линкер, 0,08 мг Ac-PYY(PEG3-Cys-PEG2-Biot) растворяли в 100% DMF до концентрации 10 мг/мл. 0,8 мг гуманизированного антитела против биотина VH53C использовали в концентрации 9 мг/мл (примерно 62 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-PEG2-Biot) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-PEG2-Biot) к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 71,4% выявленного соединения было идентифицировано как антитело, связанное с 2 пептидными молекулами, 26% было идентифицировано как антитело, связанное с 1 пептидной молекулой, и 2,5% было идентифицировано как несвязанное антитело.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ас-PYY(PEG3-Cys-PEG2-Fluo)/антитело против флуоресцеина VH52bC
Для получения конъюгатов дериватизированного биотином полипептида PYY, содержащих цистеинилированный линкер, 0,33 мг Ac-PYY(PEG3-Cys-PEG2-Fluo) растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антитела против флуоресцеина VH52bC использовали в концентрации 9,3 мг/мл (примерно 63 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-PEG2-Fluo) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-PEG2-Fluo) к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 95% выявленного соединения было идентифицировано как антитело, связанное с 2 молекулами пептида, 5% было идентифицировано как антитело, связанное с 1 молекулой пептида.
Типичный способ образования конъюгатов гаптенилированных полипептидов и антител против гаптена - Ac-PYY(PEG3-Cys-PEG2-Fluo)/антитело против флуоресцеина VH28C
Для получения конъюгатов дериватизированного биотином полипептида PYY, содержащих цистеинилированный линкер, 0,33 мг Ac-PYY(PEG3-Cys-PEG2-Fluo) растворяли в 100% DMF до концентрации 10 мг/мл. 1 мг антитела против флуоресцеина VH28C использовали в концентрации 9,5 мг/мл (примерно 63 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ac-PYY(PEG3-Cys-PEG2-Fluo) и антитело смешивали в молярном отношении 2,5:1 (Ac-PYY(PEG3-Cys-PEG2-Fluo) к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся конъюгат анализировали масс-спектрометрией. 100% выявленного соединения было идентифицировано как антитело, связанное с двумя молекулами пептида.
Пример 13
Получение ковалентных комплексов теофиллин-антитело против теофиллина
Для оценки образования ковалентных комплексов антитела, в которых используется теофиллин и антитела, связывающиеся с теофилином, в качестве системы распознавания гаптена, получали теофиллин-Cys-Cy5 в качестве флуоресцентного груза, в общем, применяя методики синтеза и очистки, которые были описаны для дигоксигенин-Cys-Cy5 или биотин-Cys-Cy5, за исключением того, что гаптен был заменен, по сравнению с теофиллином (см. Пример 8 и Фиг. 13, 14 и 22). Состав производного теофиллин-Cys-Cy5, которое было синтезировано, показан на Фиг. 43а). Для демонстрации образования ковалентного дисульфида, получали антитела, связывающиеся с теофиллином, которые содержали сконструированный Cys в положении 54 или 55 вариабельной области тяжелой цепи (антитело против теофиллина-Cys). Чистота данных антител демонстрируется в качестве примера для варианта Y54C на Фиг. 43б). Данные производные антител комплексировали с теофиллин-Cys-Cy5 и затем подвергали SDS-PAGE при невосстанавливающих и восстанавливающих условиях, как описано в Примере 12. При невосстанавливающих условиях связанное с дисульфидом антитело против теофиллина, комплексированное с Cy5, выявляли в геле по его флуоресценции, ассоциированной с Н-цепью, таким же образом, как описано в Примере 12. Это показано на Фиг. 43в), которая демонстрирует то, что ковалентные комплексы между антителом сформировались как следствие простой реакции загрузки, таким же образом, как и дисульфиды, конорые наблюдали при использовании дигоксигенина, флуоресцеина или биотина в качестве гаптена. Данные комплексы диссоциировали, как и ожидалось, при восстановлении, т.е высвобождали груз из Н-цепи только при восстановлении дисульфида (Фиг. 43в)).
Пример 14
Получение ковалентных комплексов гаптен-антитело при условиях, подобных условиям in vivo, и доказательство направленного образования дисульфида in vivo
Для оценки образования ковалентных комплексов гаптен-антитело при условиях, подобных условиям in vivo, антитела против биотина-Cys инкубировали при 37°С в мышиной сыворотке с биотин-Cys-Cy5 в течение 60 мин. Затем захватывали антитело из мышиной сыворотки посредством белка А. Затем захваченные антитела подвергали SDS-PAGE при невосстанавливающих и восстанавливающих условиях, как описано в Примере 12. Связанное с дисульфидом антитело, комплексированное с Cy5, выявляли в геле по его флуоресценции, ассоциированной с Н-цепью, таким же образом, как описано в Примере 12. Фиг. 44 демонстрирует то, что в сыворотке при 37°С образуются ковалентные комплексы между антителом, т.е. при условиях, которые имеют сходство с условиями in vivo. Данные комплексы диссоциируют, как и ожидалось, при восстановлении, т.е. груз высвобождается от Н-цепи только при восстановлении дисульфида (Фиг. 44). Наблюдение того, что при позиционировании гаптена, даже в присутствии сыворотки, может образоваться направленная дисульфидная связь между антителом и грузом является неожиданным, так как сыворотка содержит большое количество белков, пептидов и других соединений (которые могут препятствовать реакциям образования дисульфида). Наблюдение того, что при позиционировании гаптена может образоваться направленная дисульфидная связь между антителом и грузом в сыворотке при 37°С также открывает возможность применения данной системы модуляции PK в преднацеливающей ситуации: раздельное применение антитела и гаптен-груза, с последующей сборкой комплексов антитела и последующим образованием дисульфида in vivo.
Для дальнейшей оценки потенциала применений «преднацеливания» in vivo определяли фармакокинетику биотин-Cy5 при условиях преднацеливания посредством неинвазивной оптической методики визуализации глаза животных, как описано в Примере 19. В данных экспериментах присутствие Cy5 определяли неинвазивно посредством оптической визуализации глаза животных, что выявляло флуоресценцию Cy5 в капиллярах. Значения опосредованной Cy5 флуоресценции, которая была выявлена в глазе мышей через 10 мин после инъекции биотин-Cy5, были приняты за значение 100%, и значения флуоресценции, измеренные в последующие моменты времени, были выражены относительно него. В данном эксперименте 1 мг антитела (либо антитела против биотина, либо антитела против биотина-Cys (Cys мутант антитела против биотина)) применяли за 24 часа до инъекции биотин-Cy5 и начала визуализации глаза. Контрольной группе не давали предварительную инъекцию антитела против биотина.
Результаты данных экспериментов показаны на Фиг. 45: инъекция биотин-Cy5 животным, которые не получали предварительно инъецированного антитела, устранялась с низким периодом полувыведения в сыворотке и низкими уровнями воздействия (ромбы). Сывороточные уровни и период полувыведения биотин-Cy5, который инъецировали животным с 24-часовой предварительной инъекцией антитела против биотина (без мутации Cys) был значительно увеличен. Это показывает то, что антитело захватывает его антиген (без груза) в системе кровообращения и продлевает период полувыведения антигена (и, подобным образом, конъюгированного груза) в сыворотке. Относительный уровень и период полувыведения в сыворотке биотин-Cys-Cy5, который инъецировали животным, которым за 24 часа была сделана предварительная инъекция антитела против биотина-Cys (т.е. антитела, содержащего мутацию Cys, как описано в данном документе, для ковалентного связывания груза), был еще больше увеличен. В данных примерах относительные уровни Cy5 были не только выше, чем уровни некомплексированного соединения, но также выше, чем уровни комплексированного (но не связанного дисульфидной связью) Cy5. Таким образом, комплектованные с гаптеном, связанные дисульфидом грузы (которые образуются при условиях преднацеливания in vivo) являются более стабильными в системе кровообращения и могут достигать более высоких уровней воздействия, чем нековалентно комплектованные грузы.
Пример 15
Полипептиды в конъюгатах и в комплексах с антителом против гаптена сохраняют функциональность
Авторы изобретения ранее показали, что полипептиды, которые являются частью нековалентных конъюгатов гаптен-полипептид и находятся в комплексах с антителами против гаптена, сохраняют функциональность (WO 2011/003557, WO 2011/003780 и WO 2012/093068). Для демонстрации того, что связанные пептиды сохраняют функциональность также при ковалентном связывании дисульфидом, сравнили биологическую активность полипептидов, комплектованных антителом против дигоксигенина, и их конъюгатов с антителом против дигоксигенина VH52bC, связанных дисульфидом.
Желательной с терапевтической точки зрения функциональностью пептидов, происходящих из PYY, является связывание с и препятствование сигнализации его когнатного рецептора NPY2. Сигнализация через рецептор NPY2 участвует в и/или регулирует метаболические процессы.
Для оценки того, влияет ли комплексообразование или SS-конъюгирование полипептида Dig-PYY с антителом против дигоксигенина или конъюгирование полипептида Dig-Cys-PYY с антителом против дигоксигенина VH52bC соответственно на его активность, авторы изобретения оценили его способность к ингибированию накопления цАМФ, стимулированного форсколином, в клетках HEK293, экспрессирующих рецептор NPY2 (анализ цАМФ).
В следующей Таблице 6 показаны результаты анализов цАМФ, которые проводили для оценки биологической активности PYY(3-36), его модифицированного аналога moPYY, специфичного в отношении рецептора Y2, его комплексированного с антителом Dig-варианта и его конъюгированного посредством дисульфида Dig-Cys-производного.
Для агонистического анализа цАМФ использовали следующие материалы: 384-луночный планшет; набор Tropix cAMP-Screen; систему ELISA для цАМФ (Applied Biosystems, кат. № Т1505; CS 20000); форсколин (кат. №344270 от Calbiochem); клетки: HEK293/hNPY2R; ростовая среда: среда Игла, модифицированная по Дульбекко (D-MEM, Gibco); 10% фетальная телячья сыворотка (FBS, Gibco), инактивированная нагреванием; 1% пенициллин/стрептомицин (Pen 10000 единиц/мл; Strep 10000 мг/мл, Gibco); 500 мкг/мл G418 (генетицин, кат. №11811-031 от Gibco) и среда для посева: DMEM/F12 без фенолового красного (Gibco); 10% FBS (Gibco, кат. №10082-147), инактивированная нагреванием; 1% пенициллин/стрептомицин (Gibco, кат. №15140-122); 500 мкг/мл G418 (генетицин, Gibco, кат. №11811-031).
Для проведения анализа в первые сутки среду отбрасывали, и монослой клеток промывали 10 мл PBS на колбу (Т225). После декантации с PBS использовали 5 мл VERSENE (Gibco, кат. №1504006) для перемещения клеток (5 мин при 37°С). Содержимое колбы аккуратно откачивали, и объединяли суспензию клеток. Каждую колбу промывали 10 мл среды для посева и центрифугировали при 1000 об./мин в течение 5 мин. Суспензию объединяли и осуществляли подсчет клеток. Суспендию ресуспендировали в среде для посева при плотности 2,0×105 клеток/мл для HEK293/hNPY2R. 50 микролитров клеток (HEK293/hNPY2R - 10000 клеток/лунку) переносили в 384-луночный планшет с использованием дозатора Multi-drop. Планшеты инкубировали при 37°С в течение ночи. На вторые сутки клетки проверяли на 75-85%-ную конфлюентность. Давали средам и реактивам достичь комнатной температуры. Перед приготовлением разведений давали маточному раствору стимулирующего соединения в диметилсульфоксиде (DMSO, Sigma, кат. № D2650) нагреться до 32°С в течение 5-10 мин. Разведения готовили в DMEM/F12 с 0,5 мМ 3-изобутил-1-метилксантином (IBMX, Calbiochem, кат. №410957) и 0,5 мг/мл BSA. Конечная концентрация DMSO в стимулирующей среде составляла 1,1% с концентрацией форсколина - 5 мкМ. Клеточную среду сливали аккуратным переворачиванием чашки с клетками на бумажное полотенце. Помещали 50 мкл стимулирующей среды на лунку (каждую концентрацию готовили в четырех повторностях). Планшеты инкубировали при комнатной температуре в течение 30 мин, и клетки проверяли под микроскопом на токсичность. После 30 мин обработки стимулирующие среды отбрасывали, и добавляли 50 мкл/лунку лизисного буфера для анализа (предоставленного в наборе Tropix). Планшеты инкубировали в течение 45 мин при 37°С. 20 мкл лизата переносили из стимулирующих планшетов в планшеты, предварительно покрытые антителом (384-луночные) из набора Tropix. Добавляли 10 мкл конъюгата АР и 20 мкл антитела против цАМФ. Планшеты инкубировали при комнатной температуре со встряхиванием в течение 1 часа. Затем планшеты 5 раз промывали промывочным буфером, по 70 мкл на лунку для каждой промывки. Осуществляли отсасывание из планшетов досуха. Добавляли 30 мкл/лунку раствора субстрата/усилителя CSPD/Sapphire-II RTU и инкубировали в течение 45 мин при RT (встряхивание). Измеряли сигнал в течение 1 с/лунку на люминометре (VICTOR-V).
Результаты данных анализов (Таблица 6) демонстрируют то, что модифицированное производное пептида moPYY имеет пренебрежимо меньшую активность, чем PYY дикого типа. Значение IC50 анализа на цАМФ составляло 0,09 нМ для PYY дикого типа и 0,14 нМ для модифицированного аналога. Ковалентное конъюгирование посредством дисульфида приводило к небольшому уменьшению биологической активности. Значение IC50 составляло 5-36 нМ для конъюгата. Неожиданно ковалентный дисульфидный конъюгат является в 2 раза более активным, чем нековалентный комплекс со значением IC50 10,91 нМ.
Пример 16
Стабильность в сыворотке комплексов биотинилированного Cy5 с гуманизированным антителом против биотина по сравнению с ковалентными конъюгатами биотинилированного Cy5 с гуманизированным антителом против биотина VH53C
Целью описанной технологии модификации пептида является улучшение терапевтической применимости пептидов. Главными препятствиями для терапевтического применения пептидов в настоящее время являются ограниченная стабильность in vivo и/или короткий период полувыведения в сыворотке и быстрый клиренс. PK параметры конъюгатов флуорофоров с антителом определяли in vivo и сравнивали с PK нековалентных комплексов антитело-флуорофор. Следовательно, (i) антитело против биотина VH53C ковалентно конъюгировали с биотинилированным флуорофором Biot-Cys-Cy5, (ii) получали нековалентный комплекс антитела против биотина с биотинилированным флуорофором Biot-Cy5, (iii) вводили животным ковалентно конъюгированные и образующие нековалентный комплекс соединения, и (iv) у данных животных измеряли сывороточные концентрации соединений с течением времени посредством определения флуоресценции Cy5 (А650) и флуоресценции соответствующего антитела способом ELISA, в котором специфично выявляется гуманизированное антитело.
Экспериментальная методика
Для анализа влияния на PK параметры комплексообразования с антителом или конъюгирования с антителом маленького флуоресцентного субстрата вводили 13 нмоль конъюгата Cy5-биотин/гуманизированное антитело против биотина VH53C или соединения, образующего нековалентный комплекс с соответствующим антителом, или одно флуоресцентное соединение в 20 мМ гистидине / 140 мМ NaCl, рН 6,0, шести самкам мышей (линия NMRI) для каждого вещества. Отбирали примерно 0,1 мл образцы крови в следующие моменты времени: 0,08 ч, 4 ч и 48 ч для мыши 1, 2 и 3 в первой группе, и 0,08 ч, 24 ч и 72 ч для мыши 1, 2 и 3 во второй группе. Образцы сыворотки - примерно 50 мкл получали через 1 ч при RT посредством центрифугирования (9300 g, 3 мин, 4°С). Образцы сыворотки хранили при -80°С.
Для определения количества соединения (флуорофора) в сыворотке в данные моменты времени использовали флуоресцентные свойства Cy5: флуоресценцию Cy5 в образцах сыворотки измеряли в 120 мкл кварцевых кюветах при комнатной температуре с использованием флуоресцентного спектрофотометра Сагу Eclipse (Varian). Длина волны возбуждения составляла 640 нм, испускание измеряли при 667 нм. Образцы сыворотки разводили в 1× PBS до достижения подходящего диапазона интенсивности испускания. Сыворотку крови необработанной мыши в том же самом разведении в 1× PBS, что и в соответствующем образце, использовали в качестве пустой пробы, и она не демонстрировала какого-либо флуоресцентного сигнала.
Для определения количества человеческого антитела IgG в сыворотке в данные моменты времени использовали следующий принцип анализа: человеческие антитела IgG1 в образцах сыворотки захватывали на твердой фазе (планшет для микротитрования Maxisorb®, NUNC-Immuno™), покрытой моноклональным антителом IgG против человеческой цепи каппа. Образцы сыворотки разводили 1:105 и 1:106, и 100 мкл данных разведений добавляли в лунки. После инкубации каждую лунку 3 раза промывали 300 мкл PBS/0,05% Tween 20. Выявление человеческих антител IgG проводили, добавляя сначала 100 мкл антитела против CH1 домена человеческого IgG, которое является дигоксигенилированным на С-конце, в концентрации 0,25 мкг/мл. После промывки 3 раза, каждый раз 300 мкл 1× PBS/0,05% Tween 20, добавляли 100 мкл фрагмента Fab антитела против дигоксигенина, конъюгированного с пероксидазой хрена (HRP) в концентрации 25 мU/мл. Наконец, добавляли 100 мкл ABTS® на лунку. После 30 мин инкубации при температуре окружающей среды измеряли экстинкцию (ОП) при 405 нм и 492 нм [405/492] на имеющемся в продаже ридере планшетов ELISA для микротитрования (например, Tecan Sunrise).
На Фиг. 34 показаны сывороточные уровни Bio-Cy5, а также сывороточные уровни человеческого IgG у мышей, обработанных комплексами и конъюгатами антитело-биотин-Cy5. Данные показаны как относительный (%) человеческого IgG или уровней флуоресценции, нормированных к (пиковым) сывороточным уровням через 5 мин после инъекции. Относительные сывороточные уровни человеческого IgG и комплексов, и конъюгатов антитело-гаптен согласуются с относительной флуоресценцией, измеренной для конъюгатов антитело-гаптен. Таким образом, соединение биотин-Cys-Cy5 демонстрирует аналогичную стабильность in vivo, что и антитело, с которым оно конъюгировано, что означает, что конъюгаты антитело-гаптен остаются интактными in vivo. Это очевидно не так для комплексов антитело-гаптен, для которых относительная флуоресценция, опосредованная Cy5, уменьшается быстрее, чем относительные сывороточные уровни человеческого IgG. Это означает то, что комплексы высвобождают груз с течением времени in vivo.
В заключение, стабильность in vivo гаптенилированных соединений значительно увеличивается при связывании антителом против гаптена. Однако комплексы антитело-гаптен не являются полностью стабильными in vivo, так как уменьшение сывороточных уровней гаптен-Cy5 быстрее, чем уменьшение сывороточных уровней антитела. Это не так для конъюгатов антитело-гаптен-Cy5, которые демонстрируют характеристики in vivo, аналогичные нормальным антителам IgG.
Пример 17
Стабильность в сыворотке комплексов дигоксигенин-Cy5 с гуманизированным антителом против дигоксигенина по сравнению с ковалентными конъюгатами дигоксигенин-Cys-Cy5 с гуманизированным антителом против дигоксигенина
Для анализа влияния разных гаптенов на фармакокинетику комплексов антитела или конъюгатов антитела определяли PK параметры in vivo антитела против дигоксигенина, комплексированного с дигоксигенин-Cy5 или ковалентно конъюгированного с дигоксигенин-Cys-Cy5. Таким же образом, как описано для биотин-Cy5 или биотин-Cys-Cy5 (см. Пример 16), дигоксигенин-Cy5 или дигоксигенин-(Cys)-Cy5, комплексированный с антителом или связанный с антителом посредством Cys, вводили самкам мышей NMRI, с последующим отбором крови в 0,08 ч, 2 ч, 4 ч и 24 ч. Уровни дигоксигенин-(Cys)-Cy5 определяли посредством измерения его флуоресценции, и концентрацию соответствующего антитела определяли посредством ELISA, как описано в Примере 16. Данные демонстрируются на Фиг. 41 как относительный (%) человеческого IgG или уровней флуоресценции, нормированных к (пиковым) сывороточным уровням через 5 мин после инъекции.
Результаты данных экспериментов демонстрируют то, что для дигоксигенин-Cy5 через 2 часа после инъекции выявллось менее чем 10% флуоресценции, которую вводили (значение через 5 мин). В более поздние моменты времени, 4 ч и 24 ч соответственно после инъекции, не выявлялись сигналы некомплексированного дигоксигенин-Cy5 (см. Фиг. 41, серые треугольники на обоих графиках). В отличие от некомплексированного соединения, соединение в комплексе с антителом выявлялось со значительно большими уровнями и в более поздние моменты времени (Фиг. 41, верхний график). Это указывает на то, что комплексообразование антитела значительно увеличивает период полувыведения в сыворотке маленького соединения дигоксигенин-Cy5. Кроме того, ковалентно связанные грузы демонстрируют большую стабильность в сыворотке по сравнению с нековалентно связанными комплексами. Прямое сравнение уровней дигоксигенин-Cy5 и уровней антитела указывает на потерю комплексированного груза от антитела с течением времени, причем уровни Cy5 уменьшаются быстрее, чем уровни антитела. В отличие от этого, ковалентно связанные конъюгаты дигоксигенина демонстрировали почти идентичные периоды полувыведения в сыворотке Cy5 и IgG (Фиг. 41, нижний график). Это указывает на то, что грузы, связанные дисульфидом, остаются стабильно присоединенными к антителам, тогда как нековалентные комплексы диссоциируют с течением времени.
Пример 18
Стабильность в сыворотке дигоксигенилированного полипептида в комплексе с гуманизированным антителом против дигоксигенина
Для анализа влияния на PK параметры комплексообразования дигоксигенилированного полипептида с антителом каждый из 32,1 нмоль полипептида или 32,1 нмоль нековалентного комплекса между дигоксигенилированным полипептидом и соответствующим антителом против дигоксигенина в 20 мМ гистидине / 140 мМ NaCl, рН 6,0, вводили 2 самкам мышей (линия NMRI). Отбирали примерно 0,1 мл образцы крови в следующие моменты времени: 0,08 ч, 2 ч и 24 ч для мыши 1 и 0,08 ч, 4 ч и 24 ч для мыши 2. Образцы сыворотки - примерно 50 мкл получали через 1 ч при RT посредством центрифугирования (9300 g, 3 мин, 4°С). Образцы сыворотки хранили при -80°С.
Определение количества дигоксигенилированного пептида в сыворотке в данные моменты времени было затруднительным по сравнению с выявлением Dig-Cy5, так как прямые способы выявления полипептида в образцах сыворотки не были доступны. Следовательно, для выявления дигоксигенилированного пептида в сыворотке был налажен анализ, связанный с вестерн-блоттингом. На первом этапе образцы сыворотки разделяли на SDS-PAGE при восстанавливающих условиях. Поскольку приготовление образца включало воздействие на сыворотку высоких концентраций SDS и восстанавителей, комплексированные конъюгаты Dig-полипептид могут высвобождаться от (полностью денатурировавшего/развернутого) антитела против дигоксигенина, тогда как ковалентные конъюгаты оставались связанными. Для опосредования высвобождения полипептида из нековалентного комплекса с антителом и разделения индивидуальных компонентов посредством SDS-PAGE 2 мкл каждого образца сыворотки разводили в 18 мкл 20 мМ гистидина / 140 мМ NaCl, рН 6,0, смешивали с 6,7 мкл 4× буфера для образца LDS и 3 мкл 10× восстановителя для образца (NuPAGE, Invitrogen) в течение 5 мин при 95°С. В качестве контроля использовали 2 мкл сыворотки от необработанной мыши той же самой линии. Образцы наносили на 4-12% Bis-Tris гель (NuPAGE, Invitrogen), разделение на котором осуществляли в течение 20 мин при 200 В/120 мА с использованием 1× MES (Invitrogen) в качестве подвижного буфера. Затем осуществляли блоттинг разделенных полипептидов на PVDF мембрану (размер пор 0,22 мкм, Invitrogen) с использованием системы миниячейки XCell Sure Lock® (Invitrogen) в течение 40 мин при 25В/130 мА. Мембраны блокировали в 1% обезжиренном молоке в 1× PBS плюс 0,1% Tween 20 (PBST) в течение 1 ч при RT. Дигоксигенилированные полипептиды затем выявляли на мембране с использованием антитела против дигоксигенина. Для этого антитело против дигоксигенина наносили на мембраны в концентрации 13 мкг/мл в 10 мл 1% обезжиренного молока/PBST в течение 2 ч при RT. Мембраны промывали 3 раза по 5 мин в 1× PBST. Фрагменты Fab против мышиного IgG, связанные с POD (пероксидаза), из набора для вестерн-блоттинга LumiLightPLUS (Roche) наносили в разведении 1:25 в 10 мл 1% обезжиренного молока/PBST в течение 1 ч при RT. Мембраны промывали 3 раза по 5 мин 1× PBST. Выявление проводили путем инкубирования мембран в 4 мл субстрата для вестерн-блоттинга LumiLight в течение 5 мин при RT. Хемилюминисценцию выявляли с использованием Lumilmager F1 (Roche) со временем экспозиции 20 мин.
Результаты данных анализов показаны на Фиг. 35А и Б. Было определено присутствие/количество дигоксигенилированного полипептида в мышиной сыворотке в разные моменты времени. Мыши, которые получили пептиды в комплексе с антителом (Фиг. 35 слева), демонстрировали сильные сигналы в самый ранний момент времени (5 мин после введения). Данные сигналы были четко приписываемыми, что демонстрируется по размеру и расположению на блоте контролей. В сыворотках мышей, которые были обработаны пептидом в комплексе с антителом, сигналы, ассоциированные с полипептидом, были самыми сильными в ранние моменты времени и снижались с течением времени. Тем не менее, полипептид все еще был детектируемым с хорошими сигналами во все моменты времени и даже через 24 ч после введения.
У мышей, которые получали некомплексированный полипептид, любой сигнал, ассоциируемый с маленьким полипептидом, был едва выявляемым даже в самый ранний момент времени. На Фиг. 35 справа показано, что при нормальных условиях экспозиции на блоте не виден свободный полипептид. Усиление контраста блота выявило присутствие некоторого полипептида через 5 мин после введения, однако, только в следовых количествах. В более поздние моменты времени не выявлялась определенная полипептидная полоса.
Можно видеть, что аналогично некомплексированному гаптен-Cy5, некомплексированный полипептид имеет очень короткий период полувыведения в сыворотке мышей. Мыши, которые получали такие же полипептиды, но в форме комплекса с антителом, демонстрируют присутствие данных полипептидов в сыворотке в течение увеличенного периода времени. Через двадцать четыре часа после инъекции полипептид все еще может быть определен в сыворотке данных мышей.
Пример 19
Измерение в реальном времени in vivo периода полувыведения в сыворотке и уровней воздействия ковалентно связанных конъюгатов гаптен-антитело и нековалентных комплексов
Для дальнейшего анализа фармакокинетических свойств нековалентно комплексированных гаптенилированных соединений по сравнению с ковалентно связанными гаптенилированными соединениями определяли кинетику in vivo инъецированного комплекса или конъюгата между биотин-Cy5 или биотин-Cys-Cy5 и соответствующим антителом против биотина посредством неинвазивной методики оптической визуализации, которая выявляла флуоресценцию Cy5 в капиллярах глаза животных. Значения нормировали к значению в 10 мин, которое было принято за 100%. Результаты данных экспериментов показаны на Фиг. 42: некомплексированный биотин-Cy5 сам по себе имеет короткий период полувыведения в сыворотке и низкий уровень воздействия. Биотин-Cy5 в комплексе с антителом, который не был ковалентно связан, выявлялся со значительно большими уровнями и с увеличенным периодом полувыведения. Ковалентно связанный груз демонстрировал даже большую стабильность в сыворотке, на которую указывали большие сывороточные уровни, по сравнению с комплексами, связанными нековалентно. Данные эксперименты подтверждают то, что ковалентно связанные дисульфидом грузы являются более стабильными в системе кровообращения и могут достигать более высоких уровней воздействия, чем нековалентно комплексированные грузы.
Пример 20
Комплексирование пептида и ковалентное конъюгирование с антителами, которые связываются с разными гаптенами
Применение гаптенсвязывающих модулей для связывания гаптенилированных соединений (грузов) с нацеливающими носителями представляет собой одну техническую возможность, посредством которой может осуществляться доставка, опосредованная гаптеном. Данную идею можно расширить на дополнительные гаптены или другие соединения, которые захватывают соединения и соединяют их с нацеливающим модулем. Например, для доставки или стабилизации полипептида можно применять моно- или биспецифичные антитела, которые связываются с дигоксигенином или другими гаптенами, для стабилизации и оптимизации PK терапевтических полипептидов.
Предпосылками для применения в качестве модулей захвата полипептида является то, что (i) связывание соединений с гаптеном не оказывает серьезного мешающего влияния на активность полипептида и (ii) возможность эффективного связывания/комплексообразования антитела с гаптенилированными соединениями.
Направляемое гаптеном связывание является предпосылкой для эффективного ковалентного связывания гаптенилированных красителей или полипептидов с цистеинилированным антителом против гаптена.
Для демонстрации того, что управляемое аффинностью комплексообразование гаптенилированных соединений с антителами против гаптена является предпосылкой для эффективного образования дисульфидной связи биотин-Cys-Cy5 инкубировали с гуманизированным антителом против дигоксигенина и гуманизированным антителом против дигоксигенина VH53C. Инкубацию биотин-Cys-Cy5 с гуманизированным антителом против биотина и гуманизированным антителом против биотина VH53C проводили в качестве контрольной реакции.
0,13 мг биотин-Cys-Cy5 растворяли в 100% DMF до концентрации 10 мг/мл. 0,7 мг каждого антитела использовали в концентрации 6,7 мг/мл (примерно 46 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Биотин-Cys-Cy5 и антитела смешивали в молярном отношении 2,5:1 (Ас-биотин-Cys-Cy5 к антителу) и инкубировали в течение 60 мин при RT, встряхивая при 350 об./мин. Образующийся комплекс/конъюгат далее анализировали посредством SDS-PAGE и последующего выявления в полиакриламидном геле флуоресценции, относящейся к Cy5. 15 мкг комплекса/конъюгата смешивали с 4× буфером для образца LDS (Invitrogen) и инкубировали при 95°С в течение 5 мин. Относящуюся к Cy5 флуоресценцию записывали с использованием прибора Lumilmager F1 (Roche Diagnostics GmbH, Мангейм, Германия) при длине волны возбуждения 645 нм.
Невосстановленные образцы демонстрируют ковалентное сайт-специфичное образование дисульфидной связи для гуманизированного антитела против биотина VH53C (Фиг. 36, полоса 4) с очень низким фоновым флуоресцентным сигналом при использовании гуманизированного антитела против биотина без цистеина в CDR2 (Фиг. 36, полоса 3). Биотин-Cys-Cy5 был также ковалентно связан с гуманизированным антителом против дигоксигенина VH52bC (Фиг. 36, полоса 2) с низким фоновым сигналом при использовании гуманизированного антитела против дигоксигенина (Фиг. 36, полоса 1), но со значительно меньшей эффективностью. Это может быть выведено из избытка биотин-Cys-Cy5, который выявляется внизу геля (стрелки). В случае гуманизированного антитела против дигоксигенина VH52bC можно выявить значительно больше несвязанного биотин-Cys-Cy5 (полоса 2), чем при использовании гуманизированного антитела против биотина VH53C (полоса 4). При восстановлении образцов относящаяся к Cy5 флуоресценция не выявляется около тяжелой и легкой цепей антитела, указывая на то, что ковалентная связь действительно образовалась посредством дисульфидного мостика. Окрашивания каждого геля кумасси показывают то, что общее количество белка в каждой полосе было равным.
Пример 21
Направляемое гаптеном связывание является предпосылкой для эффктивного ковалентного связывания гаптенилированных красителей или полипептидов с цистеинилированным антителом против гаптена
Для демонстрации того, что управляемое аффинностью комплексообразование гаптенилированных соединений с антителами против гаптенов является предпосылкой для эффективного образования дисульфидной связи негаптенилированный пептид Ac-PYY(PEG3-Cys-4Abu-NH2) (Biosynthan 1763.1, SEQ ID NO: 178) инкубировали с гуманизированным антителом против дигоксигенина VH52bC и гуманизированным антителом против дигоксигенина. 1,4 мг Ac-PYY(PEG3-Cys-4Abu-NH2) растворяли в 100% DMF до концентрации 10 мг/мл. 2 мг каждого антитела использовали в концентрации 11-13 мг/мл (примерно 75-89 мкМ) в буфере, состоящем из 50 мМ Tris-HCl, 1 мМ EDTA, рН 8,2. Ас-PYY(PEG3-Cys-4Abu-NH2) и антитела смешивали в молярном отношении 2,1:1 (Ас-PYY(PEG3-Cys-4Abu-NH2) к антителу). Пептид добавляли 3 порциями при перемешивании раствора при 500 об./мин с использованием бруска для перемешивания. Между каждым добавлением образцы инкубировали в течение 5 мин при 200 об./мин. После добавления последней порции образцы инкубировали в течение 1 ч при RT и 200 об./мин.
Образующийся комплекс/конъюгат определяли посредством гель-фильтрации как 97% мономерной IgG-подобной молекулы и 3% димерных раствормых агрегатов для конъюгата Ac-PYY(PEG3-Cys-4Abu-NH2) : гуманизированное антитело против дигоксигенина VH52C и как 100% мономера для комплекса Ac-PYY(PEG3-Cys-4Abu-NH2) : гуманизированное антитело против дигоксигенина. Кроме того, образующийся комплекс/конъюгат анализировали посредством масс-спектрометрии. Для конъюгата Ac-PYY(PEG3-Cys-4Abu-NH2) : гуманизированное антитело против дигоксигенина VH52C 17% выявленных соединений было идентифицировано как антитело, связанное с 2 молекулами пептида, 51% был идентифицирован как антитело, связанное с 1 молекулой пептида, и 32% было идентифицировано как антитело без связанного пептида. Для комплекса Ac-PYY(PEG3-Cys-4Abu-NH2) : гуманизированное антитело против дигоксигенина 100% антитела не было связанным.
Пример 22
Картины дисульфидов, которые требуются для образования правильно свернутых функциональных гаптенсвязывающих антител с цистеиновой мутацией для ковалентного связывания груза
Гаптенсвязывающие модули для ковалентного связывания соединения/груза могут состоять из «стандартных» антител, таких как IgG, которые содержат дополнительные цистеины, которые обеспечивают ковалентное присоединение гаптенилированных соединений/грузов. В способе, описанном в данном документе, в пределах свернутых доменов, структура и последовательность которых обеспечивают основу для функциональности антитела, вводятся требующиеся функционалы (цистеины). Правильное образование определенных дисульфидных связей в пределах, а также между доменами антител является важным для образования и поддержания правильной структуры и функциональности. На Фиг. 37(A) показана картина дисульфидов, которая требуется для образования функциональных связывающих плеч, таких как Fab немодифицированных антител, и на Фиг. 37(Б) показана картина дисульфидов, которая необходима для поддержания структуры и функциональности производного антитела с мутацией VH52bC/VH53C. Для поддержания правильной картины дисульфидов дополнительный цистеин, который был введен в домен VH, не должен быть занят и не должен мешать или реагировать с соседними цистаинами. На Фиг. 37(B) и 37(Г) показано, что добавления дополнительных цистеинов создает возможности для образования неправильных дисульфидов в пределах доменов VH во время биосинтеза таких молекул. Факт того, что положение VH52bC/VH53C расположено в пределах домена VH (и довольно близко к другим цистеинам) усугубляет риск того, что во время биосинтеза тяжелой цепи могут образоваться неправильные дисульфиды. Другой потенциальной проблемой является то, что домены VH и VL собираются до одного фрагмента Fv в пределах секреторного пути. Секреторный путь включает перемену окислительно-восстановительных условий и ферметы образования и перетасовки дисульфидов. Следовательно, потенциал введения неправильных дисульфидов посредством добавления мутации VH52bC/VH53C также может «распространяться» на дисульфиды легкой цепи (пример показан на Фиг 37(Д)). Это в самом деле дополнительно увеличивает риск получения/генерации неправильно свернутых нефункциональных молекул. Следовательно, довольно неожиданно то, что, несмотря на эти риски, могли быть экспрессированы и получены хорошие количества гомогенных функциональных производных антитела, которые содержат мутацию VH52bC/VH53C, и которые способны ковалентно связываться с гаптенилированными соединениями/грузами.
Пример 23
Состав и получение одноцепочечных фрагментов Fv против гаптена, стабилизированных дисульфидом, с цистеиновой мутацией для ковалентного связывания
Гаптенсвязывающие модули для ковалентного связывания соединения/груза могут состоять из «стандартных» антител, таких как IgG. В качестве альтернативы, они могут представлять собой модифицированные соединения, такие как рекомбинантные фрагменты Fv или Fab, или их производные. Одноцепочечные фрагменты Fv часто применяют в качестве альтернативы полноразмерным антителам, особенно в применениях, когда требуется маленький размер модуля, или когда желательными являются дополнительные связывающие модули для получения би- или мультиспецифичных производных антител. Одним примером происходящих из Fv соединений против гаптена, которые были получены, является стабилизированный дисульфидом одноцепочечный Fv, который связывается с и ковалентно присоединяется к дигоксигенилированным соединениям/грузам. Стабилизированный дисульфидом одноцепочечный Fv со специфичностью связывания с Dig был получен посредством соединения друг с другом доменов VH и VL антитела против дигоксигенина через гибкий линкер, обогащенный Gly и Ser. Данные домены VH и VL дополнительно содержат цистеиновые мутации в положении 44 VH и в положении 100 VL (положения согласно Kabat et al.). Эти дополнительные цистеины образуют стабильную межмолекулярную дисульфидную связь между VH и VL. Это стабилизирует scFv, как было описано ранее (например, Reiter, Y., et al., Nature Biotechnology 14 (1996) 1239-1245).
Помимо этого, другой цистеин был введен в VH в положении 52b или 53 соответственно согласно нумерации по Kabat для того, чтобы добавить во фрагмент Fv функционал для образования ковалентной связи.
Однако введение такой мутации во фрагменты Fv, стабилизированные дисульфидом, является значительно большим вызовом, чем ее помещение в полноразмерные антитела. Одноцепочечные фрагменты Fv по своей природе менее стабильны, чем полноразмерные IgG или фрагменты Fab из-за того, что у них отсутствуют константные домены в качестве стабилизирующих и принуждающих к гетеродимеризации структурных единиц. Стабильность может придаваться помещением дополнительных цистеиновых мутаций в Fv, таких как мутации, приводящие к образованию дисульфида VH44-VL100. Однако данное стабилизирующее начало работает только при образовании дисульфида в правильных положениях между правильными цистеинами. Таким образом, помимо определенных внутридоменных дисульфидов (одного в VH и одного в VL), должен образоваться один определенный правильный междоменный дисульфид. Дисульфидные соединения между несоответствующими цистеинами будут генерировать неправильно свернутые, нестабильные и нефункциональные соединения. Учитывая то, что стабилизированный дисульфидом фрагмент Fv содержит 6 цистеинов, теоретически может образоваться 21 разное дисульфидное соединение, но только правильная комбинация из 3 определенных дисульфидов будет формировать функциональный стабилизированный dsscFv. Этот вызов усугубляется при добавлении в домен VH другого свободного цистеина. Стабилизированный dsscFv, который является желательным, содержит два определенных внутридоменных диульфида (один в VH и один в VL), один определенный междоменный дисульфид (между VH и VL) и, кроме того, один свободный цистеин для связывания гаптенилированного соединения/груза (в VH в положении 52b/53). Учитывая то, что стабилизированный дисульфидом фрагмент Fv с дополнительной цистеиновой мутацией для ковалентного связывания содержит 7 цистеинов, теоретически могут образоваться многие разные дисульфидные соединения, но только правильная комбинация из 3 определенных дисульфидов с точным положением свободного цистеина в VH52b/VH53 будет приводить к функциональному стабилизированному dsscFv, компетентному к ковалентному связыванию. Одним дополнительным вызовом является тот факт, что дополнительный свободный цистеин (VH52b/VH53) располагается в непосредственной близости к цистеину VH44, который не является встречающимся в природе цистеином, но мутацией, введенной для стабилизации дисульфидом. VH44C является необходимым для образования правильной междоменной дисульфидной связи, и данный дисульфид, наиболее вероятно, не будучи связанными этой теорией, образуется после независимого сворачивания и сборки VH и VL. Близость VH44C и VH52bC/VH53C усугубляет риск того, что внутридоменный дисульфид не образуется правильным образом. Но обнаружили, что могут быть получены функциональные стабилизированные дисульфидом одноцепочечные Fv модули, которые связываются с дигоксигенином, и которые одновременно способны ковалентно присоединяться к дигоксигенилированным грузам. Состав стабилизированной дисульфидом одноцепочечной молекулы Fv, которая содержит правильные дисульфиды и свободный цистеин в правильном положении, и ее сравнение с нежелательными, неправильно свернутыми молекулами показаны на Фиг. 38. Последовательности, которые кодируют вариабельные области легкой цепи и модифицированные вариабельные области тяжелой цепи данного связывающегося с Dig dsscFv с мутацией VH52bC производного Fv антитела, перечислены под SEQ ID NO: 190 (VH), и соответствующая VL - под SEQ ID NO: 189. Успешное получение таких dsscFv в виде модулей для получения производных биспецифичного антитела описано в Примере 24 (ниже), а также на Фиг. 40(A), Фиг. 40(Б) и Фиг. 40(B).
Пример 24
Состав, экспрессия и очистка биспецифичных производных антитела против гаптена для целевой доставки ковалентно связанных соединений/грузов
Были получены биспецифичные антитела, которые содержат модули гаптенсвязывающего антитела для ковалентного связывания соединения/груза. Данные антитела дополнительно содержат связывающие модули, которые обеспечивают нацеливание на другие антигены. Применения таких биспецифичных антител включают специфичное нацеливание гаптенилированных соединений/грузов на клетки или ткани, которые несут нацеливающий антиген. Один пример таких молекул, которые были получены, представляет собой биспецифичное антитело со связывающими областями, которые распознают ассоциированный с опухолью углеводный антиген LeY, и одновременно с Fv, стабилизированными дисульфидом, которые связываются и ковалентно присоединяются к дигоксигенилированным соединениям/грузам. Следовательно, стабилизированные дисульфидом одноцепочечные Fv присоединялись через гибкие, обогащенные Gly и Ser соединительные пептиды к С-концам доменов CH3 антитела против LeY, что приводило к четырехвалентным молекулам с двумя плечами, связывающимися с LeY, и доплнительно двумя дигоксигенинсвязывающими структурными единицами. Данные дигоксигенинсвязывающие структурные единицы содержали дисульфидную связь VH44-VL100, которая была описана ранее (например, Reiter, Y., et al., Nature Biotechnology 14 (1996) 1239-1245). Дигоксигенинсвязывающая структурная единица, кроме того, содержала мутацию VH52bC для ковалентного связывания. Последовательности, которые кодируют легкую цепь и модифицированную тяжелую цепь данного производного антитела против LeY-Dig, перечислены под SEQ ID NO: 191 и SEQ ID NO: 192. Состав биспецифичного производного антитела против LeY-Dig в качестве носителя для доставки для ковалентно связанных соединений/грузов схематически показан на Фиг. 39.
Биспецифичные молекулы получали методиками молекулярной биологии, экспрессировали посредством секреции из культивируемых клеток, затем очищали из супернатантов культуры таким же образом, как описано выше. На Фиг. 40(A) показано присутствие данного биспецифичного антитела против LeY-Dig (52bC) с модифицированной Н-цепью и L-цепью в супернатантах культуры клеток, визуализированного в анализах вестерн-блоттингом, в которых выявляются L-цепи и Н-цепи антитела. На Фиг. 40(Б) продемонстрирована гомогенность данных антител после очистки посредством SDS-PAGE в присутствии восстановителя. Окрашивание геля SDS-PAGE кумасси бриллиантовым синим визуализирует полипептидные цепи, относящиеся к IgG, с кажущимися молекулярными размерами, аналогичными их расчетным молекулярным массам. На Фиг. 40(B) показан профиль SEC биспецифичного антитела (52bC) против LeY-Dig после очистки на белке А, демонстрирующий гомогенность и отсутствие агрегатов в белковых препаратах. Таким образом, могут быть получены и очищены до гомогенности биспецифичные антитела, которые содержат нацеливающие модули, а также модули для ковалентного связывания гаптенилированных соединений/грузов.
Пример 25
Определение структуры фрагментов Fab мышиного антитела против биотина в комплексе с биоцитинамидом посредством рентгеноструктурного анализа
Структуру белка фрагмента Fab мышиного антитела против биотина определяли в комплексе с биоцитинамидом. В связи с этим, кристаллы фрагмента Fab выращивали в 0,8 М янтарной кислоте, с последующей загрузкой кристаллов антитела биоцитинамидом (разведенный до 10 мМ рабочей концентрации в кристаллизационном растворе, нанесенный на кристаллы в кристаллизационной капле). Кристаллы три раза промывали 2 мкл 10 мМ раствора биоцитинамида и, наконец, инкубировали в течение 16 ч с биоцитинамидом при 21°С, отбирали с использованием 15%-ного глицерина в качестве криопротектора и быстро замораживали в жидком азоте. Обработанные картины дифракции давали структуру белка при разрешении 2,5
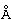
Пример 26
Конструирование модулей гематоэнцефалического барьера
Гаптенсвязывающие биспецифичные челночные модули гематоэнцефалического барьера получали посредством слияния стабилизированных дисульфидом гаптенсвязывающих одноцепочечных Fv с С-концами доменов CH3 антител против TfR. Аналогичные конструкции и технологии применялись, как описано ранее (см., например, РСТ/ЕР2013/064100). Пример состава данных челночных модулей гематоэнцефалического барьера показан на Фиг. 47.
Челночные модули гематоэнцефалического барьера распознают способные к трансцитозу мишени клеточой поверхности на эндотелиальных клетках гематоэнцефалического барьера (рецептор гематоэнцефалического барьера). В качестве примера, авторы изобретения использовали два разных антитела, которые связываются с рецептором трансферрина с разными аффинностями. Антитело против TfR1 связывается с рецептором тансферрина с высокой аффинностью, и антитело против TfR2 связывается с рецептором тансферрина с пониженной аффинностью (см., например, WO 2012/075037). Сайты связывания TfR, происходящие из данных антител против TfR, устанавливали в качестве неизмененных плеч Fab в биспецифичное антитело для получения двухвалентного полноразмерного модуля на основе IgG. Стабилизированные дисульфидом гаптенсвязывающие одноцепочечные Fv сливали через короткий GS-линкер с С-концами домена CH3 полученного биспецифичного антитела. В качестве примера использовали сайты связывания против гаптена описанных ранее соединений, которые связываются с производными дигоксигенина (Dig) или биотина (Bio) (относительно последовательностей, см. выше).
Примеры состава последовательности данных челгочных носителей перечислены как SEQ ID NO: 193 (LC антитела против TfR1), SEQ ID NO: 194 (НС антитела против TfR1, конъюгированная с фрагментом антитела scFv против дигоксигенина), SEQ ID NO: 195 (НС антитела против TfR1, конъюгированная с фрагментом антитела scFv против биотина), SEQ ID NO: 196 (LC антитела против TfR2), SEQ ID NO: 197 (НС антитела против TfR2, конъюгированная с фрагментом антитела scFv против дигоксигенина), SEQ ID NO: 198 (НС антитела против TfR2, конъюгированная с фрагментом антитела scFv против биотина).
Пример 27
Экспрессия и очистка биспецифичных антител (челночных модулей гематоэнцефалического барьера)
Биспецифичные антитела челночных модулей гематоэнцефалического барьера продуцировали в клетках млекопитающих в определенных бессывороточных средах, как описано ранее (см. выше). Суспензию клеток HEK293 временно трансфицировали экспрессионными плазмидами, кодирующими L- и Н-цепь для получения культур, которые экспрессируют биспецифичное антитело челночного модуля гематоэнцефалического барьера.
Для получения челночных модулей гематоэнцефалического барьера, связывающихся с дигоксигенилированным грузом, которые связываются с TfR с высокой аффинностью, экспрессионные плазмиды, содержащие нуклеиновую кислоту/экспрессионную кассету, кодирующую SEQ ID NO: 193, сотрансфицировали с экспрессионными плазмидами, содержащими нуклеиновую кислоту/экспрессионную кассету, кодирующую SEQ ID NO: 194.
Для получения челночных модулей гематоэнцефалического барьера, связывающихся с биотинилированным грузом, которые связываются с TfR с высокой аффинностью, экспрессионные плазмиды, содержащие нуклеиновую кислоту/экспрессионную кассету, кодирующую SEQ ID NO: 193, сотрансфицировали с экспрессионными плазмидами, содержащими нуклеиновую кислоту/экспрессионную кассету, кодирующую SEQ ID NO: 195.
Для получения челночных модулей гематоэнцефалического барьера, связывающихся с дигоксигенилированным грузом, которые связываются с TfR с пониженной аффинностью, экспрессионные плазмиды, содержащие нуклеиновую кислоту/экспрессионную кассету, кодирующую SEQ ID NO: 196, сотрансфицировали с экспрессионными плазмидами, содержащими нуклеиновую кислоту/экспрессионную кассету, кодирующую SEQ ID NO: 197.
Для получения челночных модулей гематоэнцефалического барьера, связывающихся с биотинилированным грузом, которые связываются с TfR с пониженной аффинностью, экспрессионные плазмиды, содержащие нуклеиновую кислоту/экспрессионную кассету, кодирующую SEQ ID NO: 196, сотрансфицировали с экспрессионными плазмидами, содержащими нуклеиновую кислоту/экспрессионную кассету, кодирующую SEQ ID NO: 198.
Биспецифичные антитела очищали из супернатантов суспензионных клеток HEK293, которые временно трансфицировали экспрессионными плазмидами, кодирующими L- и Н-цепь, посредством хроматографии на белке А (см. выше). Затем применяли гель-фильтрацию (SEC) для получения биспецифичных антител, не содержащих агрегатов или примесей. Примеры чистоты и состава очищенных челночных модулей гематоэнцефалического барьера показаны в виде профилей SEC и геля SDS-PAGE на Фиг. 48.
Пример 28
Биспецифичные гаптенсвязывающие челночные модули гематоэнцефалического барьера одновременно связываются с гаптенилированными грузами и рецептором гематоэнцефалического барьера
Для обеспечения функциональности биспецифичных антител челнока гематоэнцефалического барьера они должны одновременно связываться с рецептором гематоэнцефалического барьера на эндотелиальных клетках гематоэнцефалического барьера и с гаптенилированными грузами, подлежащими челночному переносу. Для оценки этой функциональности гаптенсвязывающих биспецифичных антител, как описано в данном документе, одновременное связывание с поверхностью клетки и с грузом рассматривалось посредством анализов FACS. Для этих анализов связывание с клетками челночного модуля гематоэнцефалического барьера (биспецифичное антитело) выявляли посредством вторичных антител, распознающих IgG, меченных фикоэритрином. Одновременное связывание груза выявляли посредством применения гаптенилированного флуоресцентного груза (дигоксигенилированный Cy5; DIG-Cy5 (см. выше)). Результаты анализа FACS с использованием клеток hCMEC/D3 в качестве линии клеток, происходящей из ГЭБ, экспрессирующей TfR, и Dig-Cy5 в качестве флуоресцентного груза показаны на Фиг. 49: оба биспецифичных антитела, связывающихся с рецептором трансферрина, связываются с hCMEC/D3, как показано посредством сигналов, ассоциированных с антителом против IgG, конъюгированного с РЕ. Аналогично оба биспецифичных антитела также и одновременно связываются с Dig-Cy5, как показано посредством сигналов, ассоциированных с клетками, приписываемых Cy5. Сравнение интенсивностей сигналов между биспецифичным антителом против TfR1 (высокоаффинное) и биспецифичным антителом против TfR2 (с пониженной аффинностью) показывает (как и ожидалось) более высокую интенсивность сигнала на клетках с использованием высокоаффинного биспецифичного антитела по сравнению с биспецифичным антителом со средней аффинностью. Контрольное биспецифичное антитело, которое распознает антиген, который не присутствует в выявляемых количествах на hCMEC/D3 (CD33-Dig) не генерирует (как и ожидалось) релевантные сигналы ни с антителом против IgG, ни с Dig-Cy5.
Данные результаты показывают то, что биспецифичные гаптенсвязывающие челночные модули гематоэнцефалического барьера специфично связываются с их мишенями на поверхности эндотелиальных клеток. Кроме того, данные биспецифичные антитела одновременно связываются с гаптенилированными грузами и, посредством этого, могут направлять их к эндотелиальным клеткам гематоэнцефалического барьера.
Пример 29
Способ связывания челночного модуля гематоэнцефалического барьера с рецептором влияет на высвобождение из эндотелиальных клеток мозга
Авторы изобретения использовали эндотелиальные клетки мозга (hCMEC/D3) для исследования связывания с клетками и трансцитоза челночных модулей, описанных в данном документе. В предыдущих исследованиях (Crepin et al., 2010; Lesley et al., 1989, WO 2012/075037, WO 2014/033074) описано то, что валентность и аффинность антител, связывающихся с TfR, влияет на эффективность связывания с, трансцитоз через и высвобождение из эндотелиальных клеток гематоэнцефалического барьера. Для исследования связывания с клетками и трансцитоза в hCMEC/D3 клетки hCMEC/D3, культивируемые на вставках из фильтра, инкубировали апикально с биспецифичным антителом или родительским антителом (без гаптенсвязывающих scFv в качестве контролей) в течение 1 ч при 37°С. Монослои клеток промывали при RT в бессывороточной среде апикально (400 мкл) и базолатерально (1600 мкл) три раза, каждый раз в течение 3-5 мин. Все объемы промывок отбирали для отслеживания эффективности удаления несвязавшегося лиганда или антитела. В апикальную камеру добавляли предварительно нагретую среду, и фильтры переносили в свежий 12-луночный планшет (блокированный в течение ночи PBS, содержащим 1% BSA), содержащий 1600 мкл предварительно нагретой среды. В данный момент клетки на некоторых фильтрах лизировали в 500 мкл буфера RIPA (Sigma, Мюнхен, Германия, № R0278) для того, чтобы определить специфичные поглощения. Остальные фильтры инкубировали при 37°С, и образцы клеток и базолатеральных, и апикальных сред отбирали в разные моменты времени для определения апикального и/или базолатерального высвобождения. Содержание антитела в образцах количественно измеряли с использованием высокочувствительного ELISA на IgG. Результаты данных анализов показаны на Фиг. 50: высокоаффинные двухвалентные антитела против TfR (TfR1) эффективно связываются с клетками, но не высвобождаются в апикальный или базолатеральный компартменты. Таким же образом биспецифичные антитела, которые содержат высокоаффинные сайты связывания TfR (TfR1-Dig, TfR1-Bio), становятся эффективно связанными с клетками, но не высвобождаются в апикальный или базолатеральный компартменты. В отличие от этого, двухвалентные антитела против TfR с пониженной аффинностью (TfR2) становятся эффективно связанными с клетками и затем высвобождаются с течением времени в апикальный или базолатеральный компартменты. Биспецифичные антитела, которые содержат двухвалентные сайты связывания с TfR пониженной аффинности (TfR2-Dig, TfR2-Bio), также становятся эффективно связанными с клетками и высвобождаются в апикальный или базолатеральный компартменты в той же самой степени, что и родительское антитело. Контрольные биспецифичные антитела (CD33-Dig, CD33-Bio), которые связываются с антигеном, который не присутствует на hCMEC/D3, не связываются с данными клетками и, следовательно, также не высвобождаются с течением времени в апикальный или базолатеральный компартменты.
Пример 30
Челночные модули гематоэнцефалического барьера с пониженной аффинностью к TfR обеспечивают челночный перенос через эндотелиальные клетки и поддерживают трансцитоз и высвобождение гаптенилированного груза
Для исследования связывания с клетками и трансцитоза гаптенилированных грузов, которые образуют нековалентные комплексы с гаптенсвязывающими челночными модулями гематоэнцефалического барьера, использовали эндотелиальные клетки мозга (hCMEC/D3). Для оценки того, может ли трансцитоз груза достигаться посредством гаптенсвязывающих челночных модулей гематоэнцефалического барьера (биспецифичные антитела), как описано в данном документе для грузов, образующих нековалентный комплекс, клетки hCMEC/D3 в системе трансвел подвергали воздействию гаптенилированного груза, комплексированного биспецифичным антителом, как описано в данном документе (см. предыдущие примеры относительно типичных конструкций), в течение одно часа для обеспечения связывания с TfR. После удаления челнока и грузов посредством промывки (см. Пример 28) отслеживали с течение времени связавшиеся молекулы, интернализацию, внутриклеточную сортировку, трансцитоз и высвобождение груза (от 0 до 5 часов после начала эксперимента - стадия промывки) аналогично тому, как описано в Примере 28 для челночных модулей. Груз, который использовали в настоящем примере, представлял собой моногаптенилированную ДНК, которая становилась нековалентно комплексированной при инкубации с биспецифичными антителами, как описано в данном документе, в (молярном) отношении 2:1, как показано на Фиг. 51А. Присутствие груза можно выявлять и количественно измерять в клеточных экстрактах, апикальном и базолатеральном компартментах посредством кПЦР. В качестве примера, количественное измерение на Roche LightCycler терминально монобиотинилированного или монодигоксигенилированного 50-мера одноцепочечной ДНК (SEQ ID NO: 199) в качестве груза с использованием двух ПЦР-праймеров PrFor (SEQ ID NO: 200) и PrRev (SEQ ID NO: 201) показано на Фиг. 51А. Результаты данных анализов (Фиг. 51Б) демонстрируют то, что нековалентно присоединенные гаптенилированные грузы связываются с клетками, интернализуются и затем высвобождаются в апикальный и базолатеральный компартменты. Связывание и последующее высвобождение опосредуется челночным модулем гематоэнцефалического барьера, связывающимся с TfR, так как ни связывание с клетками, ни высвобождение не выявляется при применении контрольного биспецифичного антитела, связывающегося с CD33. Кроме того, ни связывание с клетками, ни высвобождение не выявляется в случаях, когда применяется гаптенилированный груз без биспецифичного антитела. Трансцитоз груза, образующего нековалентный комплекс, наблюдали для биспецифичных антител, содержащих сайты связывания дигоксигенина, а также сайты связывания биотина, и для соответствующих гаптенилированных грузов. Это показывает то, что можно использовать разные гаптены для конструирования челночного модуля гематоэнцефалического барьера на основе нековалентного связывания биспецифичным антителом. Таким образом, трансцитоз груза через гематоэнцефалический барьер может достигаться с использованием гаптенсвязывающих биспецифичных антител для образования нековалентного комплекса с гаптенилированными грузами.
Пример 31
Челночные модули гематоэнцефалического барьера с сайтами связывания с высокой аффинностью в отношении TfR связываются, но не высвобождаются из эндотелиальных клеток, но, тем не менее, поддерживают трансцитоз и высвобождение гаптенилированного груза
Для исследования связывания с клетками и трансцитоза гаптенилированных грузов, которые могут образовать нековалентные комплексы с гаптенсвязывающими челночными модулями гематоэнцефалического барьера, использовали эндотелиальные клетки мозга (hCMEC/D3) таким же образом, как описано в предыдущем Примере 30. Клетки hCMEC/D3 в системе трансвела подвергали воздействию гаптенилированного груза, комплексированного челночным модулем гематоэнцефалического барьера (биспецифичное антитело) в течение 1 часа для обеспечения связывания с TfR, интернализации, внутриклеточной сортировки и трансцитоза. Груз представлял собой моногаптенилированную ДНК, которая становилась нековалентно комплексированной при инкубации с биспецифичным антителом в (молярном) отношении 2:1, как показано на Фиг. 51А. Присутствие груза в виде монобиотинилированного или монодигоксигенилированного 50-мера одноцепочечной ДНК (SEQ ID NO: 199) количественно измеряли кПЦР в клеточных экстрактах, апикальном и базолатеральном компартментах, как описано в предыдущем Примере 30.
Результаты данных анализов (Фиг. 52) демонстрируют то, что гаптенилированные грузы, образующие нековалентный комплекс, связываются с клетками, интернализуются и затем высвобождаются в апикальный и базолатеральный компартменты. Это было неожиданным открытием, так как двухвалентный высокоаффинный челночный модуль сам по себе не высвобождается из клеток. Связывание и последующее высвобождение груза опосредуется челночным модулем гематоэнцефалического барьера на основе биспецифичного антитела, связывающегося с TfR, так как ни связывание с клетками, ни высвобождение не выявляются при применении контрольного биспецифичного антитела, связывающегося с CD33. Кроме того, ни связывание с клетками, ни высвобождение не выявляется в случаях, когда применяется гаптенилированный груз без челночного модуля гематоэнцефалического барьера на основе биспецифичного антитела. Трансцитоз и высвобождение груза, образующего нековалентный комплекс, наблюдали для биспецифичных антител, содержащих сайты связывания дигоксигенина, а также сайты связывания биотина, и для соответствующих гаптенилированных грузов. Это показывает то, что можно использовать разные гаптены для конструирования нековалентных комплексов гаптенилированного груза с челночным модулем гематоэнцефалического барьера на основе биспецифичного антитела. Трансцитоз груза через клетки, которые составляют гематоэнцефалический барьер, может достигаться посредством гаптенилированных грузов, нековалентно комплексированных челночными модулями гематоэнцефалического барьера (биспецифичное антитело). Неожиданным является то, что трансцитоз не основается на высвобождении самого челночного носителя, так как груз высвобождается, даже когда применяемые челночные модули не высвобождаются.
Пример 32
Гаптенилированные грузы отделяются от челночных модулей гематоэнцефалического барьера в пределах везикулярных компартментов
Анализы трансцитоза с использованием челночных модулей гематоэнцефалического барьера, содержащих высокоаффинный сайт связывания с TfR, которые связываются с эндотелиальными клетками, но сами не высвобождаются из данных клеток (TfR1), продемонстрировали неожиданный результат: гаптенилированные грузы подвергались челночному переносу через клетки и высвобождались в апикальный и базолатеральный компартменты, даже несмотря на то, что сами челночные модули оставались присоединенными к клеткам/содержались в клетке. Опосредованное биспецифичным антителом связывание с клеткой, поглощение и распределение грузов анализировали конфокальной микроскопией. В связи с этим, эндотелиальные клетки мозга (hCMEC/D3) подвергали воздействию гаптенилированных флуоресцентных грузов (гаптен-Cy5 или гаптен-ДНК-Cy5), комплексированных с биспецифичным антителом, и анализировали конфокальной флуоресцентной микроскопией. В связи с этим, клетки hCMEC/D3 высевали на стеклянные покровные стекла микроскопического уровня качества и инкубировали в среде для культуры клеток с 50 нМ гаптенилированными флуоресцентными грузами, комплексированными с биспецифичным антителом, в течение трех часов при 37°С. Клетки затем промывали, фиксировали (4%-ный параформальдегид), и часть челночного модуля, представленную IgG, выявляли посредством контрастного окрашивания антителами, специфичными в отношении легкой цепи каппа, с последующим связыванием вторичными антителами, конъюгированными с ALEXA Fluor 488. Изображения получали на конфокальном микроскопе LEICA SP5x с использованием линзы объектива 100×/1,46NA, используя подходящие установки полосового фильтра для ALEXAFluor488 (IgG) и CY5 (груз гаптен-ДНК-Cy5). Результаты данных анализов показаны на Фиг. 53. Комплексы высокоаффинных биспецифичных антител с флуоресцентно меченными гаптенилированными грузами (ДНК-Cy5) связываются с TfR и исходно локализуются на поверхностях клеток. Затем они становятся соинтернализованными с их когнатными рецепторами и появляются в клетках в везикулярных компартментах, т.е. в эндосомах и лизосомах. Вскоре (через три часа) после интернализации авторы изобретения наблюдали существенное отделение флуоресцентных сигналов, приписываемых челночному модулю, от сигналов, приписываемых гаптенилированным грузам. Таким образом, нековалентные комплексы челночных модулей гематоэнцефалического барьера, как описано в данном документе, и гаптенилированных грузов могут диссоциировать в разные везикулярные компартменты внутри клетки. Посредством этого груз высвобождается из челночного модуля и может выходить из эндотелиальных клеток посредством трансцитоза, даже когда челночный модуль остается связанным с клетками/удерживается в клетке. Внутриклеточное отделение гаптенилированного груза, образующего нековалентный комплекс, наблюдали для связывающихся с дигоксигенином, а также для связывающихся с биотином челночных модулей гематоэнцефалического барьера (биспецифичные антитела) и соответствующих гаптенилированных грузов. Таким образом, для конструирования нековалентных комплексов гаптенилированных грузов и челночных модулей гематоэнцефалического барьера, которые обеспечивают трансцитоз, можно использовать разные гаптены.
Пример 33
Пептид YY, содержащий аминокислотную последовательность мотива хеликар
Пептид YY представляет собой короткий (36-аминокислотный) пептид, высвобождаемый клетками в подвздошной и толстой кишке в ответ на получение пищи. У людей он, по-видимому, уменьшает аппетит.Самой обычной формой находящегося в системе кровообращения PYY является PYY3-36, который связывается с рецептором Y2 (Y2R) семейства рецепторов Y. PYY находится в L клетках в слизистой желудочно-кишечного тракта, особенно в подвздошной и толстой кишке. Также маленькое количество PYY, примерно 1-10%, находится в пищеводе, желудке, двенадцатиперстной кишке и тощей кишке. В системе кровообращения концентрация PYY возрастает после приема пищи и снижается во время голодания. PYY оказывает его действие через рецепторы NPY; он ингибирует перистальтику желудка и увеличивает поглощение воды и электролитов в толстой кишке. PYY и миметики PYY использовали для воздействия на ожирение.
PYY модифицировали так, чтобы он содержал аминокислотную последоваельность мотива хеликар и комплексировался антителом против аминокислотной последовательности мотива хеликар для того, чтобы получить преимущество фармакокинетических свойств антитела и избежать собственной нестабильности PYY.
Образование нековалентного комплекса
Структурное исследование пептида PYY3-36 (Nygaard, R., et al., Biochem. 45 (2006) 8350-8357; SEQ ID NO: 211) выявляет спиральный мотив (аминокислотная последовательность хеликар-подобного мотива) для центральных аминокислот. Поскольку N-концевой изолейцин и модифицированный С-конец были описаны как важные для функциональной активности пептида, центральную спираль модифицировали для того, чтобы она отображала аминокислоты в аминокислотной последовательности мотива хеликар.

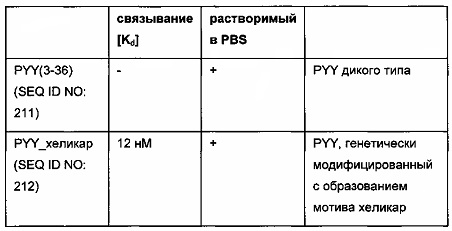
Полное антитело IgG1 против аминокислотной последовательности мотива хеликар продуцировали в клетках HEK293 путем трансфицирования двух плазмид, содержащих вариабельные области тяжелой и легкой цепи, вставленные в вектор, содержащий константную область тяжелой цепи человеческого IgG1 и константный человеческий домен лямбда соответственно. Антитело против аминокислотной последовательности мотива хеликар (0019) очищали стандартными методиками с использованием хроматографии на белке А. Эксперимент с использованием масс-спектрометрии подтвердил идентичность антитела 0019.
Комплекс между антителом 0019 и модифицированным пептидом PYY - PYY_хеликар был получен in vitro посредством применения небольшого избытка пептида к раствору антитела. Формировался комплекс 0052. Стехиометрия данного комплекса, определенная посредством аналитических экспериментов SEC-MALLS, составляет 1,6 пептидов, комплексированных на одном двухвалентном антителе.
Антитело 0019, PYY(3-36) дикого типа, PYY_хеликар и комплекс 0052 тестировали на их эффект на семейство рецептора Y2.
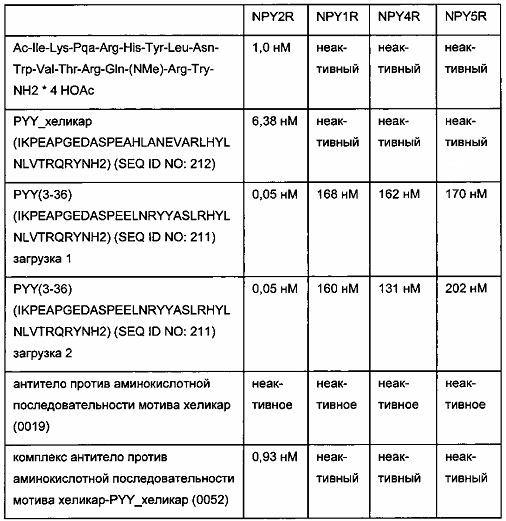
Как было продемонстрировано (Hoffmann, Е., et al., J. Cont. Rel. 171 (2013) 48-56.), пептиды, комплексированные антителом, имеют пролонгированный период полувыведения in vivo. Кроме того и неожиданно, данный комплекс демонстрирует немного лучшую аффинность в отношении рецептора NPY2R по сравнению с некомплексированным пептидом; антитело стабилизирует полипептид и презентирует пептид в его фиксированной биологически активной конформации.
Образование ковалентного комплекса (ковалентная дисульфидная связь)
Для того чтобы увеличить стабильность комплекса между антителом против аминокислотной последовательности мотива хеликар и соединением, содержащим аминокислотную последовательность мотива хеликар in vitro и in vivo, использовали образование дисульфидного мостика при связывании.
Первой стадией является стадия специфичного распознавания (высокоаффинное взаимодействие), т.е. образование комплекса соединение, содержащее аминокислотную последовательность мотива хеликар-антитело против аминокислотной последовательности мотива хеликар. После этого на второй стадии следует спонтанная перетасовка дисульфидного мостика с образованием ковалентного комплекса с улучшенной стабильностью.
Поскольку 12-мерный пептид (аминокислотная последовательность мотива хеликар) является относительно жестким соединением (по меньшей мере при комплексировании специфичным антителом против аминокислотной последовательности мотива хеликар), обнаружили, что необходимо использовать специфичную для структуры конструкцию дисульфидного мостика. Поскольку образование комплекса и осуществляемое позднее ковалентное связывание происходят между двумя соединениями, продуцированными рекомбинантно, искусственные остатки цистеина, введенные для образования ковалентной дисульфидной связи, не обязательно продуцируются в виде свободных остатков цистеина, но экспрессируются в восстановленной форме, т.е. конъюгированными со свободной аминокислотой цистеином или гомоцистеином.
Критически важным является положение в аминокислотной последовательности вариабельного домена антитела против аминокислотной последовательности мотива хеликар, куда вводится искусственный свободный остаток цистеина. Неэкспонированный цистеин в аминокислотной последовательности вариабельного домена антитела имеет большую вероятность экспрессии в форме свободного цистеина (не конъюгированного), тогда как экспонированный остаток цистеина, близкий к карману связывания, может отменить связывание 12-мерного пептида (аминокислотная последовательность мотива хеликар) из-за стерического препятствия, индуцированного конъюгированием цистеина с дополнительной группировкой, подобной свободному цистеину.
а) комплексы с аминокислотной последовательностью мотива хеликар, содержащие флуоресцентное соединение
Для того чтобы идентифицировать подходящее положение, которое создает минимальный риск стерического препятствия и сильного уменьшения аффинности, тестировали разные положения для введения искусственного остатка цистеина в аминокислотную последовательность мотива хеликар. Остаток цистеина был введен на С-конце 12мера (аминокислотная последовательность мотива хеликар) для того, чтобы иметь главную часть паратопа неизменной. Пептиды синтезировали и сливали с флуоресцентным мотивом.
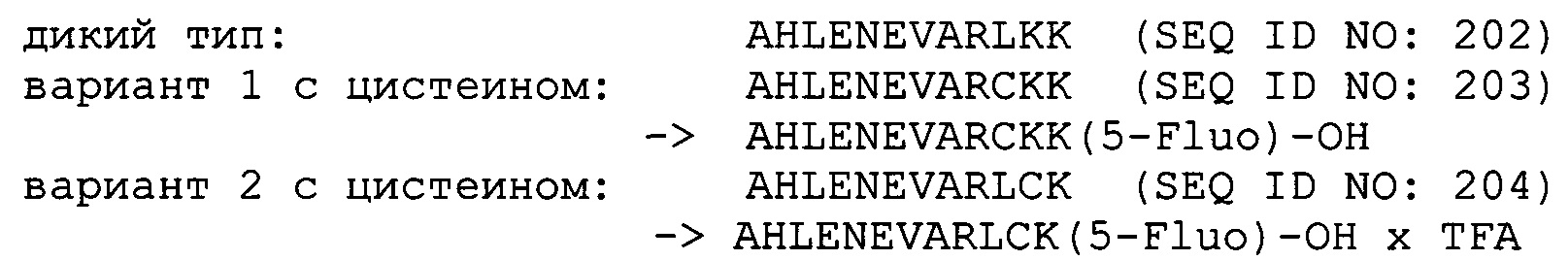
На антителе делали структурную конструкцию для обеспечения образования дисульфидного для обоих сконструированных пептидов, включающих каждый цистеин в отличном 3D (трехмерном) окружении.
12-мерный спиральный пептид AHLENEVARLKK (аминокислотная последовательность мотива хеликар) моделируется в VH и доменах VH. Остатки L10 и K11 идентифицируются как возможное положение на С-конце пептида, а в вариабельном домене легкой цепи идентифицируются положения N55 и G51 согласно нумерации легкой цепи по Kabat.
Вариабельный домен тяжелой цепи антитела против аминокислотной последовательности мотива хеликар (0019) имеет следующую аминокислотную последовательность:

(SEQ ID NO: 205).
Вариабельный домен легкой цепи антитела против аминокислотной последовательности мотива хеликар (0019) имеет следующую аминокислотную последовательность:
(SEQ ID NO: 206).
Вариабельный домен легкой цепи варианта N55C антитела против аминокислотной последовательности мотива хеликар (0155) имеет следующую аминокислотную последовательность:
(SEQ ID NO: 207).
Вариабельный домен легкой цепи варианта N51C антитела против аминокислотной последовательности мотива хеликар (0157) имеет следующую аминокислотную последовательность:
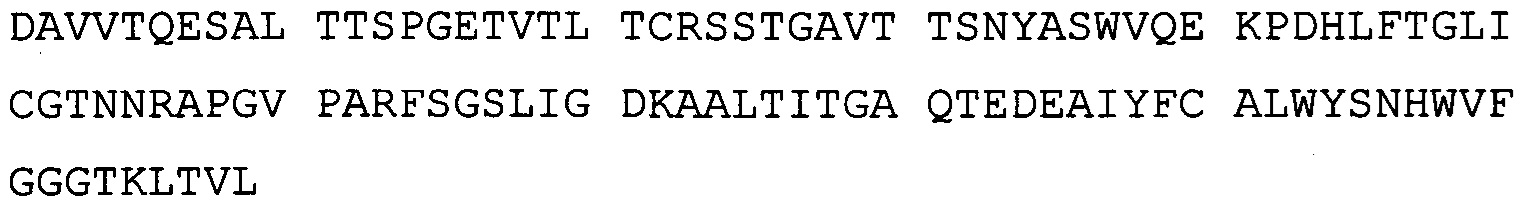
(SEQ ID NO: 208).
i) Ковалентный конъюгат соединения, содержащего аминокислотную последовательность мотива хеликар, с антителом 0155
Двухвалентное антитело 0155 экспрессируется в клетках HEK293 аналогично его родительской молекуле Y2R(bck)-0019 без свободного цистеина. Модифицированное антитело очищают с использованием того же самого протокола, который используется для антитела 0019. Анализ масс-спектрометрией демонстрирует то, что экспериментально определенная масса дегликозилированного антитела составляет 142001 Да. Это превышает расчетную массу на 259 Да. Восстановленные цепи имеют экспериментально определенную массу 48167 Да (полная тяжелая цепь, расчетная - 48168 Да, Cys - SH, С-конец - -K) и 22720 Да (полная легкая цепь, N55C, расчетная - 22720 Да, Cys - SH). Последовательности данных цепей были подтверждены после восстановления.
Антитело 0155 связывали с вариантом 2 аминокислотной последовательности мотива хеликар с цистеином, используя 2,5-молярный избыток соединения, содержащего аминокислотную последовательность мотива хеликар, в 100% DMF с образованием ковалентного комплекса 0156.
На геле SDS-PAGE (денатурирующие условия, см. Фиг. 54) флуоресценция видна только на антителе 0155; при восстанавливающих условиях виден только маленький пептид.
Результаты:
Ковалентное конъюгирование флуоресцентного соединения, содержащего аминокислотную последовательность мотива хеликар, с антителом против аминокислотной последовательности мотива хеликар было успешным. Всего примерно 43% антитела против аминокислотной последовательности мотива хеликар было ковалентно конъюгировано с двумя аминокислотными последовательностями мотива хеликар, примерно 40% антитела против аминокислотной последовательности мотива хеликар было ковалентно конъюгировано с одной аминокислотной последовательностью мотива хеликар, и примерно 17% антитела против аминокислотной последовательности мотива хеликар не было конъюгировано.
Примерно 50% конъюгата, содержащего две аминокислотные последовательности мотива хеликар, модифицируется. Это соединение не принимали во внимание для количественного измерения. Как уже было определено для исходного вещества, антитело без аминокислотной последовательности мотива хеликар содержит две модификации примерно по 128 Да. Антитело, конъюгированное с одной аминокислотной последовательностью мотива хеликар, имеет только одну примерно 128 Да модификацию.
ii) Ковалентный конъюгат соединения, содержащего аминокислотную последовательность мотива хеликар, с антителом 0157
Аналогично антителу 0155, антитело 0157 экспрессируется, главным образом, как цистеинилированная форма. Анализ масс-спектрометрией демонстрирует то, что экспериментально определенная масса дегликозилированного антитела составляет 141863 Да. Это превышает расчетную массу на 3 Да. Антитело, главным образом, присутствует в виде одиночной или двойной гомоцистеинилированной формы. Восстановленные цепи имеют экспериментально определенную массу 48168 Да (полная тяжелая цепь, расчетная - 48168 Да, Cys - SH, С-конец - -K) и 22777 Да (полная легкая цепь, N51C, расчетная - 22777 Да, Cys - SH). Последовательности данных цепей были подтверждены после восстановления.
Связывание антитела 0157 с вариантом 1 аминокислотной последовательности мотива хеликар с цистеином не приводило к ожидаемому ковалентному комплексу. Флуоресценция не видна в ожидаемой полосе, но видна на контроле, который должен быть негативным в данном эксперименте (см. Фиг. 55).
Антитело 0157 инкубировали с вариантом 1 аминокислотной последовательности мотива хеликар с цистеином. В качестве контрольного антитела, с таким же вариантом 1 аминокислотной последовательности мотива хеликар с цистеином инкубировали 0019.
Результаты:
Ковалентное конъюгирование флуоресцентного соединения, содержащего аминокислотную последовательность мотива хеликар, с антителом против аминокислотной последовательности мотива хеликар не было успешным. Не желая быть связанными данной теорией, предполагается, что в этом случае цистеинилирование антитела происходит слишком глубоко в кармане связывания для того, чтобы обеспечивать эффективное связывание флуоресцентного соединения, содержащего аминокислотную последовательность мотива хеликар, и доставлять нуклеофильную тиольную группу в подходящее положение для атаки С51.
б) комплексы с рекомбинантным полипептидом, содержащим аминокислотную последовательность мотива хеликар
Методология на основе хеликара становится особенно привлекательной при рассмотрении образования ковалентного комплекса с рекомбинантно продуцированным полипептидом, содержащим аминокислотную последовательность мотива хеликар.
Поскольку конъюгирование антитела 0155, содержащего мутацию VL-N55C, с вариантом 1 аминокислотной последовательности мотива хеликар с цистеином (AHLENEVARLCK; SEQ ID NO: 203) работало значительно лучше по сравнению с альтернативой (G51C на VL с вариантом 2 аминокислотной последовательности мотива хеликар с цистеином (AHLENEVARCKK; SEQ ID NO: 204)), дополнительно исследовали конъюгирование 0155 с полипептидом, содержащим вариант 1 аминокислотной последовательности мотива хеликар с цистеином. Данный полипептид содержал вариант 1 аминокислотной последовательности мотива хеликар с цистеином (AHLENEVARLCK; SEQ ID NO: 203), слитой с N-концом.
Молекула экзотоксина Pseudomonas LR8M с делецией С-концевого остатка лизина, содержащая вариант 1 аминокислотной последовательности мотива хеликар с цистеином (0236; SEQ ID NO: 213), была продуцирована в Е.coli и очищена с использованием комбинации анионообменной хроматографии и SEC (см., например, WO 2011/032022).
Антитело 0155 ковалентно конъюгируют с молекулой экзотоксина Pseudomonas LR8M с делецией С-концевого остатка лизина SEQ ID NO: 213, содержащей вариант 1 аминокислотной последовательности мотива хеликар с цистеином. Хроматограмма SEC показана на Фиг. 56. Эффективность конъюгирования анализируется посредством SDS-CE (капиллярный электрофорез с додецилсульфатом натрия), Caliper, для невосстановленных образцов (см. Фиг. 57).
Всего примерно 4% антитела против аминокислотной последовательности мотива хеликар было ковалентно конъюгировано с двумя полипептидами SEQ ID NO: 213, примерно 41% антитела против аминокислотной последовательности мотива хеликар было ковалентно конъюгировано с одним полипептидом SEQ ID NO: 213, и примерно 55% антитела против аминокислотной последовательности мотива хеликар не было конъюгировано.
В заключение, моноклональное антитело против аминокислотной последовательности мотива хеликар может быть использовано для комплексирования пептидов, маленьких молекул с пептидным линкером и рекомбинантных белков посредством высокоаффинного распознавания аминокислотной последовательности 12-мерного мотива хеликар. Пептиды с предрасположенностью к сворачиванию в виде спирали могут быть модифицированы для имитации исходной аминокислотной последовательности AHLENEVARLKK (SEQ ID NO: 202) 12-мерного мотива хеликар, и затем становятся способными к комплексообразованию с моноклональным антителом против аминокислотной последовательности мотива хеликар. Помимо высокоаффинного комплексообразования, создается возможность ковалентного конъюгирования с цистеиновым вариантом SEQ ID NO: 202, содержащим цистеин, и модифицированным антителом против аминокислотной последовательности мотива хеликар, содержащим цистеин в CDR, посредством образования стабильной дисульфидной связи. Рекомбинантные белки, экспрессируемые другой системой, могут быть конъюгированы in vitro позднее без участия конкретных условий реакции, но посредством спонтанной перетасовки дисульфидных мостиков.
Пример 34
Биспецифичные антитела, связывающиеся с BrdU, образуют комплексы с грузами, содержащими BrdU
Анализы SEC-MALLS применяли для оценки того, способно ли и в какой степени биспецифичное антитело (bsAb), связывающееся с рецептором трансферрина (TfR) и бромдезоксиуридином (BRDU), способно связываться с грузами, содержащими BRDU. В связи с этим, BRDU-ДНК добавляли к bsAb против TfR-BRDU в стехиометрическом отношении 2:1 (350 мкг; 2,5 мг/мл) и инкубировали в течение 30 мин при комнатной температуре для образования комплексов bsAb/груз. В качестве контрольных реактивов авторы изобретения получали свободное биспецифичное антитело (2,5 мг/мл) и свободный BRDU-ДНК (3,2 мг/мл). BRDU-ДНК (BRDU-ACC AAG ССТ AGA GAG GAG САА ТАС AAC AGT АСА TAT CGC GTG GTA AGС GT; SEQ ID NO: 228) содержал один BRDU на молекулу ДНК на 5'-конце ДНК. Комплексы и контрольные реактивы хранили при -80°С до анализа.
Полученные таким образом комплексы и контрольные реактивы подвергали анализу SEC-MALLS для идентификации и характеризации свободного биспецифичного антитела, свободного груза и комплексов обоих. Анализ SEC-MALLS проводили на ВЭЖХ Dionex Ultimate 3000, оснащенном детекторами miniDawnTREOS/QELS и Optilab rEX от Wyatt. Аналиты растворяли в концентрации 1 мг/мл в буфере PBS, рН 7,4, наносили на колонку Superdex200 10/300GL при скорости тока 0,5 мл/мин и элюировали буфером PBS, рН 7,4, в течение 60 мин.
Результаты данных анализов (показанные на Фиг. 58) показывают, что ДНК, содержащая BRDU, образует определенные комплексы с биспецифичным антителом. Данные комплексы элюируются из колонки при MW 244,9 кДа (Фиг. 58А) и демонстрируют гидродинамический радиус 6,8 нм (Фиг. 58Б), обеспечивая расчет стехиометрического отношения, составляющего приблизительно две (1,8) молекулы ДНК на молекулу биспецифичного антитела. По сравнению с этим, свободное биспецифичное антитело было выявлено при MW 215,4 кДа, и было определено, что его гидродинамический радиус составляет 6,2 нм. Свободный BRDU-ДНК был выявлен при MW 16,4 кДа.
Таким образом, было показано, что ДНК, содержащая BRDU, эффективно и стехиометрически связывается биспецифичным антителом против TfR/BRDU, приводя к образованию комплексов с молярным отношением 2:1.
Пример 35
Биспецифичные антитела, связывающиеся с биотином, связываются с IgG, содержащими биотин
Для анализа того, связывается ли и в какой степени биспецифичное антитело против TfR/биотина способно связываться с монобиотинилированным полноразмерным IgG, монобиотинилированное антитело изотипа IgG, специфично связывающееся с pTau (меченное биотином антитело против pTau, BIO-pTau), добавляли к биспецифичному антителу против TfR/биотина в стехиометрическом отношении 2:1 (300 мкг, 1,3 мг/мл), и данную смесь инкубировали в течение 30 мин при комнатной температуре (образование комплексов биспецифичное антитело-груз). Монобиотинилированный IgG получали путем продуцирования производных IgG с Avi-меткой на С-конце одной цепи гетеродимерного антитела изотипа IgG, модифицированного по принципу выступ во впадину. Avi-метка становится ферментативно конъюгированной с одним биотином определенным образом.
В качестве контроля специфичности образования комплекса, биспецифичное антитело против TfR/дигоксигенина смешивали с BIO-pTau. В качестве дополнительных контрольных реактивов готовили аликвоты и свободного биспецифичного антитела, и свободного BIO-pTau. Комплексы и контрольные реактивы хранили при -80°С до анализа.
Полученные комплексы подвергали анализу SEC-MALLS для идентификации и характеризации свободного биспецифичного антитела, свободного BIO-pTau и их комплексов. Анализ SEC-MALLS проводили на ВЭЖХ Dionex Ultimate 3000, оснащенном детекторами miniDawnTREOS/QELS и Optilab rEX от Wyatt. Аналиты растворяли в концентрации 1-2 мг/мл в буфере PBS, рН 7,4, наносили на колонку Superose 6 10/300GL при скорости тока 0,5 мл/мин и элюировали буфером PBS, рН 7,4, в течение 60 мин.
Результаты данных анализов (показанные на Фиг. 59) показывают то, что BIO-pTau образует определенные комплексы с биспецифичным антителом. Данные комплексы элюируются из колонки при MW 501 кДа (Фиг. 59А) и демонстрируют гидродинамический радиус 8,0 нм (Фиг. 59Б). По сравнению с этим, свободное биспецифичное антитело было выявлено при MW 205 кДа, и было определено, что его гидродинамический радиус составляет 6,2 нм. Свободное BIO-pTau было выявлено при MW 150 кДа, и было измерено, что его гидродинамический радиус составляет 5,5 нм.
Данные комплексы специфично образуются посредством взаимодействия между биотином и связывающейся с биотином группировкой биспецифичного антитела, так как связывающееся с дигоксигенином биспецифичное антитело не образует комплексы с BIO-pTau (Фиг. 59В).
Пример 36
Трансцитоз антитела против pTau, меченного биотином
Для анализа того, облегчают ли и в какой степени биспецифичные антитела против TfR/биотина облегчают трансцитоз грузов в виде полноразмерного антитела, образовали комплексы биспецифичного антитела против TfR/биотина (bsAb-1 против TfR/биотина и bsAb-2 против TfR/биотина) и BIO-pTau, как описано в Примере 35, и подвергли анализу трансцитоза, как описано выше, например, в Примере 31. В качестве контроля неспецифичного трансцитоза параллельно тестировали комплексы биспецифичного антитела против CD33/биотина и BIO-pTau, а также свободный BIO-pTau. Образцы из апикальных и базолатеральных компартментов, и образцы клеточных лизатов отбирали в 0, 1, 2, 3, 4 и 5 часов после загрузки клнток. Загрузочная концентрация всегда составляла 3,8 мкг/мл.
Количество антитела против pTau, меченного биотином, измеряли посредством ELISA. В связи с этим, белком pTau в концентрации 500 нг/мл покрывали 384-луночные планшеты Maxisorb White от NUNC в течение ночи при 2-8°С или в течение одного часа при комнатной температуре. Планшеты блокировали PBS, содержащим 2% BSA и 0,05% Tween 20 в течение по меньшей мере одного часа. Разведения образцов вплоть до 1/729 в PBS, содержащем 0,5% BSA и 0,05% Tween 20, наносили на 1,5-2 часа, с последующим нанесением поли-НRР40-стрептавидина (Fitzgerald) на 30 мин и субстрата Super Signal ELISA Pico (Thermo Scientific) на 10 мин, все при комнатной температуре. Стандартные разведения антитела BIO-pTau (100 нг/мл - 0,5 пг/мл) анализировали на том же самом планшете. Между последовательными стадиями инкубации планшеты промывали PBS, содержащим 0,1% Tween 20.
Результаты данных анализов трансцитоза (Фиг. 60) демонстрируют то, что комплексирование BIO-pTau либо с bsAb-1 против TfR/биотина, либо с bsAb-2 против TfR/биотина опосредует эффективный эндоцитоз и последующий транспорт BIO-pTau в базолатеральный, а также обратно в апикальный компартмент. В отличие от этого, ни комплексы BIO-pTau с биспецифичным антителом против CD33/биотина, ни свободный BIO-pTau не подвергаются эффективному эндоцитозу или трансцитозу, указывая на то, что наблюдаемый трансцитоз вызван специфичным связыванием биспецифичного антитела против TfR/биотина с TfR на поверхности клеток.
Пример 37
Гаптенсвязывающий челнок гематоэнцефалического барьера обеспечивает трансцитоз и высвобождение коротких олигонуклеотидов
В данном примере показано, что трансцитоз нуклеиновых кислот через эндотелиальные клетки, которые образуют гематоэнцефалический барьер, может достигаться для маленьких нуклеиновых кислот, таких как антисмысловые олигонуклеотиды или модифицированные производные нуклеиновых кислот, таких как «запертые» нуклеиновые кислоты. Были получены грузы в виде одноцепочечных нуклеиновых кислот, которые меньше, чем фрагменты ДНК, описанные в Примерах 30 и 31. Данные грузы, которые были получены в связанной с гаптеном форме, имеют близкое сходство с терапевтическими антисмысловыми олигонуклеотидами или запертыми нуклеиновыми кислотами, и, посредством этого, могут служить в качестве имитации указанных соединений. Точное выявление гаптенилированных (например, монобиотинилированных или монодигоксигенилированных) одноцепочечных 34-мерных или 28-мерных олигонуклеотидов (последовательность S1 или S2 соответственно) достигалось посредством кПЦР анализов, аналогичных анализам, описанным в Примере 30. Специфичное выявление подтверждали проведением анализа серийных разведений ДНК S1 и S2 в средах hCMEM/D3 и в клеточных экстрактах с использованием ПЦР-праймеров PrFor (SEQ ID NO: 200) и PrRev (SEQ ID NO: 201). Условия для кПЦР анализа для выявления присутствия олигонуклеотидов S1 или S2 в апикальном или базолатеральном компартментах с супернатантом клеток или в клеточных экстрактах были следующими: денатурация при 95°С в течение 10 мин; 45 циклов при 95°С в течение 10 с, 54°С в течение 15 с, 72°С в течение 10 с; с последующим плавлением и охлаждением при высоком разрешении. Анализы проводили на Roche Light Cycler 480 II.
Эндотелиальные клетки мозга (hCMEM/D3) использовали для исследования связывания с клетками и трансцитоза гаптенилированных грузов, которые могут образовать нековалентные комплексы с гаптенсвязывающими челночными модулями гематоэнцефалического барьера таким же образом, как описано в Примерах 30 и 31. Клетки hCMEM/D3 в системе трансвела подвергали воздействию гаптенилированного груза, комплексированного челночным модулем гематоэнцефалического барьера (биспецифичное антитело), в течение 1 часа для обеспечения связывания с TfR, интернализации, внутриклеточной сортировки и трансцитоза. Грузы представляли собой моногаптенилированные олигонуклеотиды S1 или S2, которые, при инкубации с биспецифичным антителом, образуют нековалентный комплекс в (молярном) отношении 2:1, как показано на Фиг. 51А. Присутствие монобиотинилированного или монодигоксигенилированного олигонуклеотида S1 или S2 количественно измеряли посредством кПЦР в клеточных экстрактах, апикальном и базолатеральном компартментах, как описано в предыдущих Примерах 30 и 31. Присутствие челночного модуля гематоэнцефалического барьера (биспецифичное антитело) в тех же самых экстрактах, апикальном и базолатеральном компартментах количественно измеряли посредством ELISA, специфичного в отношении человеческого IgG, как описано в Примере 29.
Результаты данных анализов (Фиг. 61-63) демонстрируют то, что нековалентно присоединенные гаптенилированные грузы S1 и S2 связываются с клетками, интернализуются и затем высвобождаются в апикальный и базолатеральный компартменты. Как происходило для груза в виде 50-мерной ДНК в Примере 31, наблюдали, что двухвалентный высокоаффинный челночный модуль, который сам не высвобождается из клеток, тем не менее, облегчает трансцитоз обоих грузов - S1 и S2. Связывание и последующее высвобождение опосредуется связывающимся с TfR челночным модулем гематоэнцефалического барьера, так как ни связывание с клетками, ни высвобождение не выявляется при применении контрольного биспецифичного антитела, связывающегося с CD33. Трансцитоз грузов S1 и S2, образующих нековалентный комплекс, наблюдали для дигоксигенинсвязывающих челноков, а также для биотинсвязывающих челноков, содержащих биспецифичные антитела и соответствующие гаптенилированные грузы. С другой стороны, ни значимое специфичное связывание с клетками, ни значимое высвобождение не выявляются в случаях, когда применяется гаптенилированный груз без биспецифичного антитела, или когда гаптенилированный груз применяется совместно с биспецифичным антителом, которое распознает несоответствующий гаптен. Это показывает, что грузы, происходящие из коротких олигонуклеотидов, доставляются через эндотелиальные клетки мозга посредством нековалентного связывания челночным модулем гематоэнцефалического барьера на основе биспецифичного антитела. Таким образом, трансцитоз коротких нуклеиновых кислот, таких как антисмысловые олигонуклеотиды или «запертые» нуклеиновые кислоты через клетки, которые образуют гематоэнцефалический барьер, может достигаться посредством гаптенилированных грузов, нековалентно комплексированных челночными модулями гематоэнцефалического барьера (биспецифичное антитело). Таким же образом, как описано в Примере 31, трансцитоз коротких производных нуклеиновых кислот не полагается на всвобождение самого челнока, так как груз высвобождается из челночного элемента, даже при применении челночных модулей, которые не высвобождаются.
Пример 38
Оценка функциональности in vivo челночных носителей, связывающихся с гаптеном и рецептором трансферрина, для доставки груза через гематоэнцефалический барьер
Для оценки того, в какой степени биспецифичные челночные носители, связывающиеся с гаптеном и рецептором трансферрина, обеспечивают доставку груза через гематоэнцефалический барьер (ГЭБ) in vivo применяли эксперименты на животных. Груз, подлежащий транспортировке и выявлению в мозге, представляет собой монобиотинилированное производное антитела, связывающегося с фосфо-тау. Мишень данного антитела (белок тау) локализуется в мозге. Из-за этого для достижения его мишени антитело должно пройти через гематоэнцефалический барьер. Данное антитело, следовательно, применяется для эксперимента in vivo в качестве груза. Челночные носители, которые объединяются с грузом, составлены таким же или аналогичным образом, что и описанные и применяемые для эксперимента in vitro в представленных выше Примерах, но имеют связывающие области, которые связываются с мышиным рецептором трансферрина вместо человеческого аналога. Причиной для переключения специфичности является то, что в культивируемой системе анализа трансцитоза через ГЭБ (анализы в трансвелах, см. выше) применяются человеческие клетки с человеческим TfR, тогда как эксперименты с животными проводятся на мышах, которые обладают мышиным TfR на ГЭБ.
Мышиные распознающие TfR связывающиеся с гаптеном (например, с биотином) челночные носители комплексируются с биотинилированными антителами, связывающимися с pTau, и затем вводятся мышам TauPS2APP. В качестве альтернативы, мышиные распознающие TfR связывающиеся с гаптеном (например, с биотином) челночные носители также могут быть инъецированы мышам TauPS2APP, с последующей инъекцией биотинилированных антител, связывающихся с pTau, в более поздние моменты времени (ситуация преднацеливания).
Группы мышей обрабатывают в сутки -1 одной дозой антитела против CD4 для индукции иммунотолерантности, с последующей еженедельной в.в. (внутривенная) инъекцией тестируемых веществ в течение 10-12 недель:
Группа А: без обработки
Группа Б: только (биотинилированное) антитело, связывающееся с р-Tau
Группа В: биотинилированное антитело, связывающееся с р-Tau, комплексированное с биспецифичным антителом против TfR/биотина (челночный носитель)
Группа Г: антитело, связывающееся с р-Tau, ковалентно связанное с антителом против TfR
Мыши группы А умерщвляются в сутки 0 для получения группы исходного уровня. Остальные группы получают еженедельные в.в. введения соответствующего соединения всего в течение 12 недель и умерщвляются через одну неделю после последнего введения.
Для определения переноса груза - антитела через ГЭБ мозг каждой мыши саггитально разрезается на два полушария и используется следующим образом:
(1) правое полушарие: иммуногистохимия агрегатов, содержащих pTau;
(2) левое полушарие: получение гомогената мозга для измерения белка фосфо-тау и общего белка тау посредством специфичного AlphaLISA.
Реферат
Настоящее изобретение относится к биотехнологии. Предложен конъюгат и его применение для целевой доставки гаптенилированного фармацевтически активного груза через гематоэнцефалический барьер. Также представлена фармацевтическая композиция, содержащая упомянутый конъюгат, для лечения заболевания головного мозга. Конъюгат по настоящему изобретению содержит гаптенилированный груз и биспецифическое антитело, которое имеет первый антигенсвязывающий фрагмент, специфично связывающийся с гаптенилированным грузом, и второй антигенсвязывающий фрагмент, специфично связывающийся с рецептором гематоэнцефалического барьера, где первый антигенсвязывающий фрагмент ковалентно связан с гаптенилированным грузом с помощью остатка цистеина в положении 52b или 53 тяжелой цепи согласно нумерации по Kabat. Ковалентная связь с гаптеном обеспечивает стабилизацию фармацевтически активного груза, а наличие второго антигенсвязывающего фрагмента – его транспортировку через гематоэнцефалический барьер. В этой связи данное изобретение может найти применение в терапии. 3 н. и 11 з.п. ф-лы, 63 ил., 8 табл., 38 пр.

Комментарии