Штамм гибридных культивируемых клеток homo sapiens/mus musculus 1b9c7 - продуцент человеческих моноклональных антител, специфичных к протеолитическому домену ботулинического токсина типа a - RU2783897C1
Код документа: RU2783897C1
Чертежи




Описание
Изобретение относится к области биотехнологии, биоинженерии, биохимии, лабораторных медицинских исследований и может быть использовано для получения моноклональных антител к протеолитическому домену (легкой цепи, LC) ботулинического токсина типа A (BoNT/A).
Ботулизм - это тяжелое нейропаралитическое заболевание, которое обусловлено воздействием ботулинических нейротоксинов, секретируемых анаэробными почвенными бактериями Clostridium botulinum. Известно 7 типов ботулотоксинов (BoNT/A-BoNT/G) и множество их подтипов, отличающихся токсичностью и распространением, но именно типы А, В и Е в основном вызывают заболевание у человека. Ботулизм характеризуется более как пищевая интоксикация, нежели инфекция, потому что его возбудитель является строгим анаэробом и не способен производить токсин внутри желудочно-кишечного тракта человека. Исключением считается раневой ботулизм и детский (младенческий) ботулизм. Наибольшим источником рисков является продукция домашнего и фабричного консервирования с нарушением технологий производства [Redel H. Foodborne infections and intoxications // Emerging Infectious Diseases. - 2013. - V. 19. - №12. - P. 371-377.], а также соленая и копченая рыба кустарного производства [Санин Б.И. Ботулизм. В кн.: Избранные лекции по инфекционным болезням и эпидемиологии. Учебно-методическое пособие под ред. Лучшева В.И. и Жарова С.Н. М. ГОУ ВПО РГМУ, МИМСР. 2004; 219-239.]. Также источником инфекции в случае детского ботулизма является мёд, контаминированный спорами C. botulinum.
На территории Российской Федерации в среднем в год регистрируется около 200-300 случаев ботулизма с летальностью в 7-9% [Никифоров В.В. Ботулизм. В кн.: Инфекционные болезни: национальное руководство под ред. Ющука Н.Д., Венгерова Ю.Я. 2-е изд., перераб. и доп. М. ГЭОТАР-Медиа. 2018; 558-568].
Лечение ботулинической токсикоинфекции заключается в симптоматической терапии (подключение к аппарату ИВЛ, поддержание витальных функций организма) до момента ослабления токсического эффекта из-за разрушения ботулотоксина в местах его воздействия, также применяется специфическая терапия - иммуноглобулины, блокирующие токсин еще в кровяном русле и препятствующие проникновению его в нейроны. В РФ специфическая терапия ботулизма предусматривает применение поликлональных лошадиных сывороток к токсинам типов А, В и Е (сыворотка противоботулиническая очищенная концентрированная жидкая типов A, B, E производства АО НПО Микроген, Россия). В США FDA зарегистрированы поливалентный антитоксин (F(ab')2-фрагменты лошадиных антител против семи типов токсина) [https://www.fda.gov/vaccines-blood-biologics/approved-blood-products/bat-botulism-antitoxin-heptavalent-b-c-d-e-f-g-equine] и препарат BabyBIG, представляющий собой очищенные человеческие иммуноглобулины [https://www.fda.gov/vaccines-blood-biologics/approved-blood-products/babybig].
Иммуноглобулины являются стандартным и эффективным средством для предотвращения дальнейшего развития ботулинической интоксикации. Однако применение гетерологичных антител (лошадиных) связано с рядом проблем и ограничений: такие препараты нельзя вводить дважды, но даже при однократном введении велика вероятность развития анафилаксии и сывороточной болезни. Применение гомологичных человеческих антител позволит снизить эти риски.
На территории РФ известны мышиные гибридомы, продуцирующие моноклональные антитела к BoNT/B, пригодные для конструирования на их основе тест-систем для выявления возбудителя ботулизма [Патенты RU 2566553 C1, RU 2571208 C1]. Также известны рекомбинантные гуманизированные антигенсвязывающие фрагменты антител против BoNT/C, полученные с целью применения в экспресс-тестах для определения ботулотоксина типа C в объектах окружающей среды и продуктах питания [Патент RU 2623157 C1]. За рубежом известны мышиные гибридомы и продуцируемые ими моноклональные антитела к эпитопам BoNT/А. Описанные антитела рекомендуют для обнаружения BoNT/А, для пассивной иммунизации против ботулинической интоксикации или в качестве терапии ботулизма [Патент US 7879330 B2].
Известны мышиные антитела против BoNT/A, BoNT/B и BoNT/E, полученные посредством технологии фагового дисплея. Изобретение предназначено для нейтрализации ботулотоксинов типов A, B и E. [Патент US 9902780 B2].
Известны человеческие антитела против BoNT/A и BoNT/B, полученные с помощью гетерогибридомы человек/мышь. Изобретение также включает в себя метод детекции и разделения BoNT/A и BoNT/B и способ лечения ботулизма [Патент US 2010/0222555 A1].
В качестве терапевтических средств против BoNT/A рассматривают как антитела, связывающиеся с тяжелой цепью (HC) BoNT/A и способные ингибировать взаимодействие BoNT/A с рецепторами нейронов [Nowakowski A. et al. Potent neutralization of botulinum neurotoxin by recombinant oligoclonal antibody // Proceedings of the National Academy of Sciences. - 2002. - Т. 99. - №. 17. - С. 11346-11350. - doi:10.1073 / pnas. 172229899; Smith T. J. et al. Sequence variation within botulinum neurotoxin serotypes impacts antibody binding and neutralization // Infection and immunity. - 2005. - Т. 73. - №. 9. - С. 5450-5457. - doi:10.1128/IAI.73.9.5450-5457.2005], так и антитела, специфичные к LC BoNT/A и ингибирующие ее протеолитическую активность [Adekar S.P. et al. Neutralization of botulinum neurotoxin by a human monoclonal antibody specific for the catalytic light chain // Plos one. - 2008. - Т. 3. - №. 8. - С. e3023. - doi: 10.1371/journal.pone.0003023].
Техническим результатом предлагаемого изобретения является перевиваемая линия гетерогибридных клеток 1B9C7, производящая человеческие моноклональные антитела (чМКА) 1B9C7, специфичные к LC BoNT/А, способные ингибировать протеолитическую активность LC BoNT/A, которые могут использоваться для накопления моноклонального иммуноглобулинового сырья с целью последующего изготовления терапевтического препарата.
Технический результат достигается тем, что предложен штамм гибридных культивируемых клеток H. sapiens/Mus. musculus1B9C7 - продуцент чМКА против LC BoNT/A. Штамм депонирован в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск», коллекционный номер H-96.
Характеристика штамма гетерогибридной клеточной линии 1B9C7.
Видовая принадлежность: гетерогибридома мышь-человек-человек. Материал, используемый для получения гибридомы: плазмобластная фракция из периферической крови донора, иммунизированного коммерческим препаратом BoNT/А (комплексом ботулинический токсин типа А - гемагглютинин). Партнер для гибридизации - клетки гетерогибридомы K6H6/B5 (ATCC® CRL-1823™), полученные слиянием клеток мышиной миеломы P3/NSI/1-Ag4-1 с малигнизированными клетками человека, больного нодулярной лимфомой.
Система селекции гибридных клеток - гипоксантин-аминоптерин-тимидин (HAT). Кратность клонирования - однократно.
Морфологическая характеристика. Культура гетерогибридных клеток 1B9C7 представлена слабо прикрепленными к подложке округлыми клетками размером с исходную гетерогибридому K6H6/B5.
Характер роста на питательных средах: рост суспензионный, культивирование стационарное.
Культуральные свойства. Культивирование в питательной среде Hybridoma-SFM (Gibco, UK) при температуре 37°С, 5% СО2 и влажности 80%. Кратность рассева 1:2 - 1:3, время субкультивирования от 3 до 4 суток, посевная доза 5-10×104 клеток/мл.
Продуктивность гибридной клеточной линии in vitro. Титр иммуноглобулинов в культуральной жидкости после культивации в инкубаторе в колбах 1.6L Optimum Growth™ Flasks (Thomson, США), анализированный с использованием непрямого твердофазного иммуноферментного анализа (ИФА) - не менее 1:160. Концентрация иммуноглобулинов составляет в среднем 0,4-0,8 мг/л.
Контаминация штамма гибридных клеток. Проведено исследование методом полимеразной цепной реакции (ПЦР) в реальном времени на выявление микоплазмы - не обнаружено; бактериологический посев на выявление бактерий и грибов - не обнаружены; проверка на вирусы - не проводилась.
Способ, условия и состав сред для криоконсервации:
А) среда для криоконсервации - 90% ФБС, 10% диметилсульфоксида;
Б) режим замораживания - пластиковые флаконы (виалы) с культурой клеток, по 2×108 клеток/мл среды для криоконсервации в каждом флаконе. Замораживают в заданном режиме:
1) со скоростью 1°С/мин до -70°С.
2) через сутки виалы перемещают в хранилище с жидким азотом.
В) режим размораживания - выполняют на водяной бане при 37°С в течение 2-3 минут. Виалы асептически вскрывают, содержимое переносят в центрифужную пробирку с 7-8 мл бессывороточной среды, центрифугируют 5 минут при 200×g, супернатант отбрасывают, клетки ресуспендируют в среде культивирования и переносят в лунки 6-луночного планшета или культуральный флакон с суточным фидерным слоем клеток. Жизнеспособность восстанавливаемых гибридом после криоконсервации составляет 75-85%.
Характеристика полезного продукта. Полученный штамм гетерогибридных клеток 1В9С7 производит чМКА, специфичные к белку LC BoNT/A, проявляющие активность в непрямом твердофазном ИФА не менее 1:160. чМКА из культуральной жидкости выделяют путем аффинной хроматографии на колонке с Protein G-сефарозой (HiTrapTM Protein G, Швеция), с последующей гель-фильтрацией на колонке Superdex™ 75 10/300 GL (GE Healthcare Bio-Sciences, Швеция). Чистоту полученных иммуноглобулиновых фракций оценивают методом электрофореза в денатурирующих условиях. Концентрацию иммуноглобулинов определяют методом спектрофотометрии при длине волны 280 нм на спектрофотометре Smart Spec Plus (Bio-Rad, США), а также с использованием инфракрасного спектрометра Direct Detect (Merck, Германия).
Изобретение осуществляют следующим образом:
Из периферической крови людей-доноров, многократно использовавших инъекции препарата BoNT/A - BOTOX® Cosmetic (Allergan Pharmaceuticals Ireland a subsidiary of: Allergan, США) в целях эстетической ботулинотерапии, осуществляют забор сыворотки крови, которую затем тестируют в непрямом твердофазном ИФА в отношении специфичности к LC BoNT/A. Забор периферической крови для последующего выделения субпопуляции плазмобластов и гибридизации с миеломной линией клеток осуществляют на 7 сутки после последней инъекции у доноров, сыворотки крови которых показали наибольшие титры в ИФА в отношении LC BoNT/A.
Для увеличения количества выделенных плазмобластов из периферической крови доноров проводят предварительное обогащение В-клеток с помощью коммерческого набора RosetteSep™ Human B Cell Enrichment Cocktail (Stemcell Technologies, Канада). Последующее фенотипирование плазмобластов и их сортинг осуществляют с использованием панели коммерческих МКА, конъюгированных с флуорохромами, против CD-антигенов (BD Biosciences, США). С помощью настольной системы для клеточного сортинга FACSAria III (Becton Dickinson, США) с использованием программного обеспечения BD FACSDiva (версия 8.0) методом многократного гейтирования выделяют субпопуляцию плазмобластов с фенотипом CD19+CD20loCD27hiCD38hi. Далее по заданному гейту осуществляют сортинг данной субпопуляции в стерильные полипропиленовые пробирки, содержащие 500 мкл ФБС, для последующего элекстрослияния с клетками-партнерами и получения гибридом.
В качестве партнера для гибридизации используют клеточную линию K6H6/B5 (ATCC® CRL-1823™). Плазмобласты с фенотипом CD19+CD20loCD27hiCD38hi и клетки K6H6/B5 смешивают в соотношении 1:2, отмывают чистой культуральной средой RPMI-1640, затем буфером для электрослияния BTXpress Cytofusion Medium C (BTX, Harvard Bioscience, США), в котором впоследствии ресуспендируют клетки. Электрослияние проводят в мультипораторе ECM2001 (BTX, США) с использованием микрослайда для слияния Model 453 (BTX, Harvard Bioscience, США) в режиме, включающем три стадии: выравнивание, импульс, пост-выравнивание.
По окончании процедуры слияния суспензию клеток выдерживают 30 минут в микрослайде при комнатной температуре и далее переносят в питательную среду Hybri-Care (ATCC® 46-X™) с 20% ФБС, однократным раствором HAT (Gibco 21060-017, Thermo Fisher, США) и вносят по 100 мкл полученной суспензии в лунки 96-луночных культуральных планшетов. Инкубируют клетки с заменой селективной культуральной среды раз в трое суток до появления видимого роста гибридных клеток в лунках, а затем и монослоя гибридных клеток.
Культуральную жидкость из лунок, в которых наблюдается рост гибридных клеток, тестируют в ИФА в отношении специфического взаимодействия с рекомбинантной LC BoNT/A. Клетки из лунок, показавших наилучшую активность в отношении антигена, подвергают клонированию методом предельных разведений. Единичные клоны гетерогибридом наращивают в увеличивающихся объемах среды в культуральных флаконах, перманентно тестируя культуральную жидкость на наличие антител, специфически взаимодействующих с рекомбинантными LC BoNT/A.
Для последующего выделения и очистки чМКА стабильные гетерогибридомы адаптировали к бессывороточной среде Hybridoma-SFM (Gibco, UK). Полученные клоны гетерогибридом наращивают с масштабированием: в культуральных флаконах Corning® T-25 и T-75, затем в качалочных колбах 1.6L Optimum Growth™ Flasks (Thomson, США), после чего выделяют из культуральной жидкости фракцию человеческих иммуноглобулинов G (IgG), применяя аффинную хроматографию на сорбенте с Protein G-сефарозой (HiTrapTM Protein G, Швеция), с последующей гель-фильтрацией на колонке Superdex™ 75 10/300 GL (GE Healthcare Bio-Sciences, Швеция).
Выделенные чМКА тестируют на предмет специфической активности в отношении рекомбинантной LC BoNT/A и нативного BoNT/A.
Проверяют отобранные чМКА во FRET анализе по способности ингибировать протеолитическую активность LC BoNT/A с применением коммерческого FRET-субстрата SNAPtide® Botulinum Toxin A Substrate, Fluorogenic (Sigma-Aldrich, США).
Изобретение иллюстрируют следующие графические материалы:
Фиг. 1. Результаты тестирования специфической активности сывороток людей-доноров, многократно получавших инъекции препарата BoNT/A в отношении рекомбинантной LC BoNT/A методом ИФА.
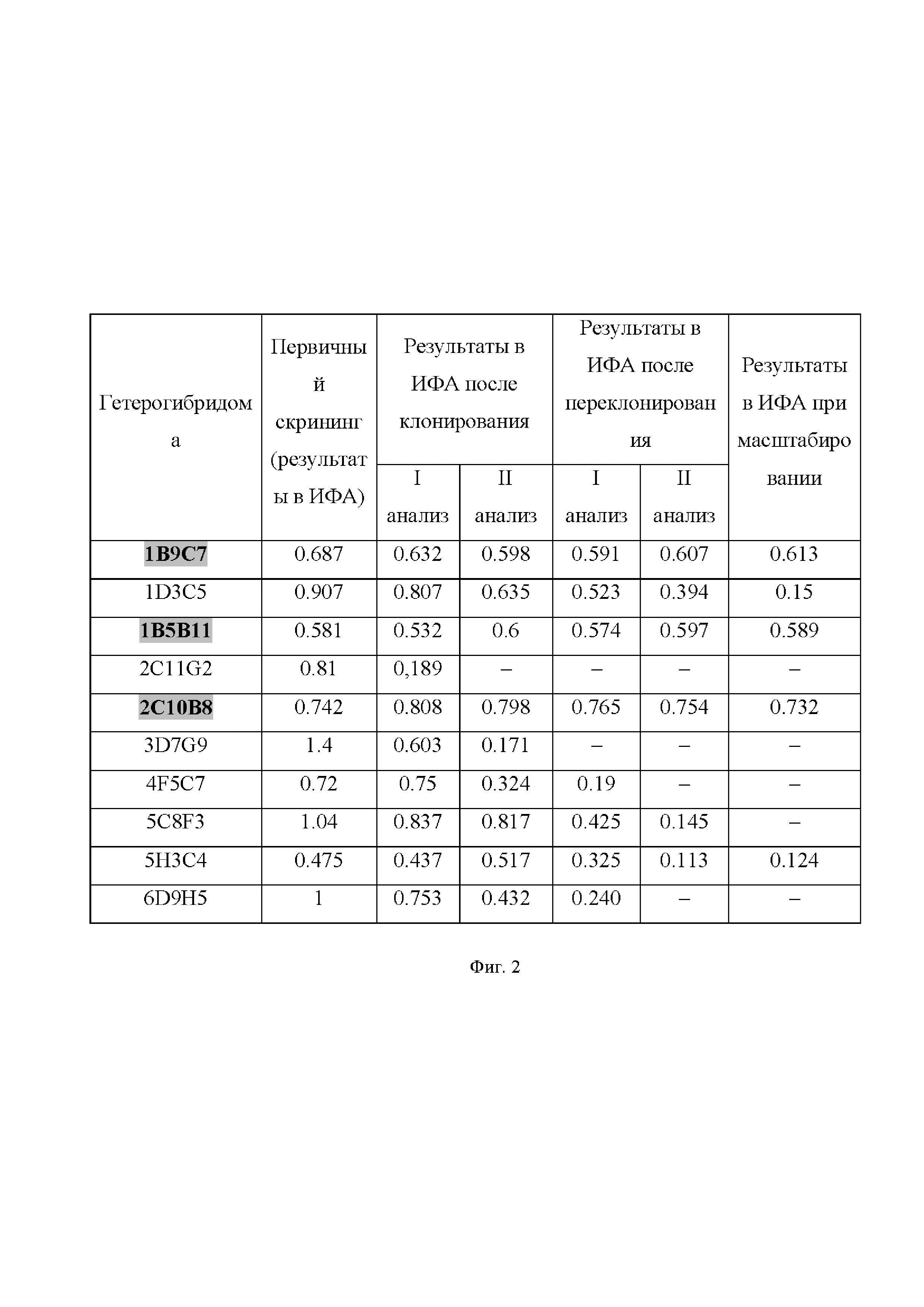
Фиг. 2. Результаты отбора наиболее перспективных клонов гибридом-продуцентов чМКА, специфичных к рекомбинантной LC BoNT/A.
Цветом выделены результаты образцов, показавших наилучший результат и выбранные для дальнейшей работы.
Фиг. 3. Результаты электрофореза в 10%-ом полиакриламидном геле (ПААГ) в денатурирующих условиях образца чМКА 1В9С7, выделенных из культуральной жидкости одноименной гетерогибридомы-продуцента 1В9С7.
Дорожка 1. Маркер молекулярных масс PageRuler™ Prestained Protein Ladder SM0671 (Fermentas, США). Дорожка 2 - образец чМКА в неденатурирующих (без 2-меркаптоэтанола) условиях. Дорожка 3 - образец чМКА в денатурирующих (с 2-меркаптоэтанолом) условиях.
Фиг. 4. Результаты вестерн-блот анализа чМКА 1В9С7 в отношении BoNT/A (А) и BoNT/В (Б).
А. Дорожка М - маркер молекулярных масс Page Ruler™ Prestained Protein Ladder SM0671 (Fermentas, США); Дорожка 1 - нативный BoNT/A, детектированный чМКА 1В9С7; Дорожка 2 - рекомбинантная LC BoNT/A, детектированная чМКА 1В9С7; Дорожка 3 - рекомбинантная HC50 BoNT/A.
Б. Дорожка М - маркер молекулярных масс Page Ruler™ Prestained Protein Ladder SM0671 (Fermentas, США); Дорожка 1 - рекомбинантная LC BoNT/В; Дорожка 2 - рекомбинантная HC50 BoNT/В.
Фиг. 5. Определение способности исследуемых чМКА 1В9С7 ингибировать протеолитическую активность рекомбинантного белка LC BoNT/A.
Примечание: отрицательный контроль 1 - проба, содержащая буфер и белок SNAPtide; отрицательный контроль 2 - проба, содержащая только буфер; отрицательный контроль 3 - проба, содержащая белок SNAPtide и чМКА 1В9С7; положительный контроль - проба, содержащая рекомбинантную LC BoNT/A и белок SNAPtide; чМКА 1B5B11 - проба, содержащая рекомбинатную LC BoNT/A предварительно инкубированную с чМКА 1B5B11 в эквимолярном соотношение 1:3, и белок SNAPtide; чМКА 1В9С7 - проба, содержащая рекомбинатную LC BoNT/A предварительно инкубированную с чМКА 1В9С7 в эквимолярном соотношение 1:3, и белок SNAPtide; чМКА 2C10B8 - проба, содержащая рекомбинатную LC BoNT/A предварительно инкубированную с чМКА 2C10B8 в эквимолярном соотношение 1:3, и белок SNAPtide.
Примеры получения и использования чМКА, синтезируемых штаммом гетерогибридной клеточной линии 1В9С7.
Пример 1. Получение сывороток крови людей-доноров, многократно использующих инъекции препарата BoNT/А.
От 3 людей-доноров, многократно (не менее 5 раз) использующих инъекции препарата BoNT/A в целях эстетической ботулинотерапии методом венозной пункции получают образцы крови. Образцы объемом 20 мл собирают в центрифужные пробирки и отстаивают при комнатной температуре в течение 30 мин до полного образования тромба. Центрифугируют пробирки при 1200×g в течение 10 минут, после чего отбирают сыворотку крови в чистые пробирки. При необходимости повторяют центрифугирование.
Пример 2. Тестирование специфической активности сывороток людей-доноров, в отношении рекомбинантной LC BoNT/A методом непрямого твердофазного ИФА.
На поверхности лунок поликарбонатного планшета для иммуноферментного анализа иммобилизуют рекомбинантную LC BoNT/A в количестве 1 мкг/лунку в объеме 100 мкл фосфатно-солевого буфера (ФСБ) и инкубируют в течение 2 часов при температуре 37°С и перемешивании на орбитальном шейкере на скорости 300 об/мин. По окончании инкубации проводят трехкратную отмывку лунок планшета ФСБ с добавлением 0,05% Tween-20 (ФСБ-Tw). Свободные валентности пластика блокируют обезжиренным (м.д.ж. не более 0,5%) молоком, внося его в объеме 200 мкл в лунку. Блокировку проводят в течение 40 мин при температуре 37°С и перемешивании, после чего трехкратно отмывают с использованием ФСБ-Tw. Сыворотки доноров разводят в ФСБ в соотношениях от 1:5 до 1:640 с двукратным шагом разведения по вертикали и инкубируют в течение 1 ч на шейкере при температуре 37°C, затем трехкратно промывают ФСБ-Tw. В качестве отрицательного контроля выступают лунки с чистым ФСБ; в качестве положительного лунки с коммерчески доступными кроличьими поликлональными антителами к LC BoNT/A C. botulinum (Clostridium botulinum Type A Neurotoxin Light Chain polyclonal antibody, PAB13914, Abnova, Тайвань) в концентрации 0,1 мкг/лунку. В лунки планшета добавляют по 100 мкл конъюгата: в лунки, инкубированные с чМКА, вносят кроличьи антитела против цельной молекулы IgG человека, конъюгированные с пероксидазой хрена (Sigma, США) в разведении 1:20000; в лунки, инкубированные с кроличьими антителами, вносят козьи антитела против цельной молекулы IgG кролика, конъюгированные с пероксидазой хрена (Sigma, США) в разведении 1:10000. После часовой инкубации и четырехкратной отмывки планшета во все лунки вносят по 100 мкл субстратной смеси - готового раствора 3,3′,5,5′-тетраметилбензидина (Termo Fisher Scientific, США). Планшет помещают на 3-5 минут в темное место, затем останавливают реакцию 4N серной кислотой (50 мкл/лунку). Учет результатов проводят с помощью планшетного спектрофотометра xMark (Bio-Rad, США) при длине волны 450 нм. Положительным считают результат, превышающий показатели оптической плотности отрицательного контроля не менее, чем в 2 раза.
По результатам ИФА на основании полученных данных о специфической активности образцов сывороток людей-доноров, многократно получавших инъекции препарата BoNT/A, для дальнейшей работы отобрали образец крови донора 3, сыворотка которого демонстрировала наивысший титр антител к рекомбинантной LC BoNT/А. Результаты представлены на Фиг. 1.
Пример. 3. Получение и подготовка плазмобластной фракции из цельной венозной крови донора, многократно получавшего инъекции препарата BoNT/A.
Для получения плазмобластной фракции крови у избранных доноров отбирают свежую порцию периферической крови на 7 день после последней инъекции препарата BoNT/A, полученной донором.
Для увеличения количества выделенных плазмобластов из периферической крови доноров проводят предварительное обогащение В-клеток с помощью коммерческого набора RosetteSep™ Human B Cell Enrichment Cocktail (Stemcell Technologies, Канада) путем негативной селекции В-лимфоцитов с помощью комплекса тетрамерных антител, распознающих мембранные маркеры моноцитов и Т-клеток. Для этого гепаринизированную кровь инкубируют в пробирках в течение 20 мин с RosetteSep™ Human B Cell Enrichment Cocktail из расчета 50 мкл реактива на 1 мл цельной крови. Затем кровь разводят в 2 раза ФСБ с 2% ФБС, наслаивают на градиент плотности RosetteSep™ DM-L Density (Stemcell Technologies, Канада) в соотношении 1:1, и центрифугируют в течение 30 мин при 1200×g с выключенным тормозом при комнатной температуре. Полученное опалесцирующее кольцо на границе раздела двух сред отбирают и дважды отмывают в среде RPMI 1640 при 300×g в течение 10 мин, а затем ресуспендируют в полной питательной среде RPMI 1640, содержащей 2 мМ глутамина («ПанЭко»,Россия), 10 мМ HEPES (Sigma, США), 25 мкМ 2-меркаптоэтанола (Sigma, США) и 2% ФБС (TermoFisher Scientific, США). Жизнеспособность клеток оценивают на автоматическом счетчике ТС-20 (Bio-Rad, США) после окрашивания клеток трипановым синим (Invitrogen, США).
Для выявления субпопуляции плазмобластов выделенные В-лимфоциты окрашивают следующей комбинацией МКА, конъюгированных с флуорохромами: anti-CD19 APC (клон HIB19), anti-CD20 BV421 (клон 2H7), anti-CD38 PE-cy7 (клон HIT2), anti-CD27 BB515 (клон M-T271). Для этого В-лимфоциты (5×106 клеток/мл) инкубируют с МКА в темноте в течение 20 мин при температуре 20°С в соответствии с инструкцией производителя. Затем клетки дважды отмывают избытком ФСБ с 2% ФБС и осаждают центрифугированием 10 мин при 200×g.
С помощью системы для клеточного сортинга FACSAria III (Becton Dickinson, США), оснащенной тремя лазерами с длинами волн излучения 405, 488 и 633 нм и с использованием программного обеспечения BD FACSDiva (версия 8.0) методом многократного гейтирования выделяют фракцию плазмобластов с фенотипом CD19+CD20loCD27hiCD38hi. Далее по заданному гейту осуществляют сортинг данной субпопуляции в пробирку с 500 мкл ФБС.
Выделенные плазмобласты отмывают ФСБ с 2% ФБС двукратно в течение 10 мин при 300×g. Отмытый клеточный осадок ресуспендируют в 1 мл среды RPMI-1640, проводят подсчет концентрации клеток с применением автоматического счетчика клеток TC-20 (Bio-Rad, США), доводят концентрацию чистой культуральной средой до 1×106 кл/мл.
Пример. 4. Получение гетерогибридом-продуцентов чМКА, специфичных к LC BoNT/A.
В качестве партнера для гибридизации с плазмобластами используют линейную культуру гетерогибридомы K6H6/B5 (ATCC® CRL-1823™), полученную слиянием клеток мышиной миеломы P3/NSI/1-Ag4-1 с малигнизированными клетками человека, больного нодулярной лимфомой. Клетки K6H6/B5 культивируют в среде RPMI-1640 с содержанием 2 мМ L-глутамина и ФБС 10 %. Выращивание клеточной линии осуществляют в культуральных флаконах Corning® T-150 с поверхностью роста 150 см2 при температуре 37°С во влажной атмосфере с 5% СО2. Для процедуры электрослияния данную клеточную линию используют в экспоненциальной фазе роста.
Гибридизацию плазмобластов и клеток партнеров K6H6/B5 осуществляют в соотношении 1:2, соответственно, с помощью системы для электрослияния клеток, состоящей из генератора электрических импульсов BTX ECM 2001 и микрослайда Model 453 (BTX, Harvard Bioscience, США). Полученные коктейли клеток дважды отмывают центрифугированием при 400×g в течение 5 мин в избытке буфера для электрослияния BTXpress Cytofusion Medium C (BTX, Harvard Bioscience, США). После отмывки клетки подсчитывают на автоматическом счетчике клеток ТС-20 (Bio-Rad, США), одновременно определяя жизнеспособность с помощью 0,4 % раствора трипанового синего. Далее коктейль клеток ресуспендируют в 500 мкл буфера BTXpress Cytofusion Medium C, вносят в кювету для электрослияния и подвергают электропорации при следующих значения электрических параметров: напряженность поля - 1560 V/см, длительность диэлектрофореза клеток - 60 с; параметры электрического импульса - двукратный импульс амплитудой 500 V и длительностью 30 мкс. После электрослияния содержимое микрослайда оставляют на 30 мин при комнатной температуре, а затем переносят в 60 мл среды Hybri-Care (ATCC® 46-X™), содержащей 20% ФБС, однократным раствором HAT (Gibco2, ThermoFisher, США) и вносят по 100 мкл полученной суспензии в лунки 96-луночных культуральных планшетов.
Таким образом, в результате гибридизации получают десять 96-луночных планшетов, содержащих по 60 лунок с клетками.
Пример 5. Культивирование гетерогибридных клеток и получение клонов гетерогибридом, продуцирующих чМКА, специфичных к рекомбинантной LC BoNT/A.
Слитые клетки, распределенные по лункам культурального планшета, культивируют при 37°C в 5% CO2. Через 3-4 дня проводят замену питательной среды в каждой лунке. Контролируют рост колоний клеток визуально с использованием светового микроскопа. Селекцию гетерогибридных колоний проводят с помощью селективных добавок HAT и HT (Thermo Fisher, США). На 14 день HAT среду заменяют на среду с HT, на 20 сутки - на обычную питательную среду.
После образования монослоя гибридных клеток при замене среды в лунках культуральную жидкость в объеме 100 мкл отбирают для анализа специфической активности антител, наработанных гетерогибридомами, в отношении рекомбинантной легкой цепи BoNT/A методом ИФА. Для этого используют планшет с иммобилизованным рекомбинантным белком легкой цепи BoNT/A (методика подготовки планшета соответствует описанной выше, в примере 2), в который вносят культуральную жидкость по 100 мкл на лунку. В качестве отрицательного контроля используют лунку А1, в которую вносят чистый ФСБ. Коммерческие антитела к LC BoNT/A (Clostridium botulinum Type A Neurotoxin Light Chain polyclonal antibody, PAB13914, Abnova, Тайвань) в концентрации 0,1 мкг/лунку используют как положительный контроль. Методика проведения ИФА описана в примере 2.
На основании полученных данных для дальнейшей работы выделяют те лунки планшета, культуральная жидкость из которых в ИФА показывает стабильный результат, превышающий значения отрицательного контроля не менее чем в 2 раза.
Клонирование гетерогибридных клеток-продуцентов специфических чМКА проводят методом предельных разведений. Для этого клетки в лунке ресуспендируют, подсчитывают концентрацию клеток в суспензии на счетчике клеток TC-20, затем делают разведения суспензии в среде Hybri-Care из расчета 2 кл. на лунку (в 100 мкл), 1 кл. на лунку и 0,5 кл. на лунку. Каждым вариантом разведенной суспензии заполняют 60 лунок 96-луночного планшета. Культивируют до образования визуально различимых колоний. Для тестирования в ИФА (аналогично описанному выше) отбирают культуральную жидкость из лунок, в которых наблюдают единичные сформированные хорошо растущие колонии гетерогибридных клеток.
Колонии, показывающие хороший рост и стабильные высокие показатели оптической плотности в ИФА, при наработке монослоя подвергают пересеву в 24-луночные планшеты. Полученные клоны гетерогибридом адаптируют к бессывороточной среде Hybridoma-SFM (Gibco, UK) и наращивают с маштабированием в культуральных флаконах Corning® T-25 и T-75, затем в качалочных колбах 1.6L Optimum Growth™ Flasks (Thomson, США) при температуре 37°C в атмосфере, содержащей 5% углекислого газа. Результаты представлены на Фиг. 2. Количество клеток при субкультивировании в культуральных флаконах поддерживают в диапазоне между 1×105 и 1×106 кл/мл культуральной среды. Замену культуральной среды производят каждые 2-3 дня.
Антитела выделяют из культуральной жидкости путем аффинной хроматографии на колонке с Protein G-сефарозой (HiTrapTM Protein G, Швеция). Колонку, упакованную сорбентом Protein G-сефарозой (HiTrapTM Protein G, Швеция) уравновешивают буфером нанесения (50 мМ Трис-HCl, 100 мМ NaCl, pH 7.4), промывают элюирующим буфером (50 мМ Трис-HCl, 100 мМ NaCl, 50 мМ глицина, pH 2,4) и вновь уравновешивают буфером нанесения. Наносят образец на колонку со скоростью 1 мл/мин при постоянном охлаждении колонки и образца. Отмывают колонку буфером нанесения до достижения состояния равновесия. Элюируют белок, нанося буфер для элюции на скорости 1 мл/мин. Собирают очищенный образец IgG в пробирку и немедленно доводят pH раствора до 7.4-7.6 добавлением 1М раствора Трис, pH 11.0.
Выделенные IgG переводят в ФСБ и доочищают методом гель-фильтрации на сорбенте Superdex 200 10/300 GL (GE Healthcare, Великобритания). Хранят раствор иммуноглобулинов в ФСБ с добавлением 0,1% NaN3при температуре 4-8°С.
Чистоту полученных иммуноглобулиновых фракций оценивают в SDS-PAGE-электрофорезе в денатурирующих условиях по методу Лэммли (Фиг. 3). Концентрацию иммуноглобулинов определяют спектрофотометрически при длине волны 280 нм (спектрофотометр Smart Spec Plus, Bio-Rad, США).
Пример 5. Тестирование специфической и ингибирующей активности выделенных чМКА 1В9С7 в отношении рекомбинантного белка LC BoNT/A.
Специфическую активность определяют в отношении рекомбинантных белков LC и рецептор связывающего домена тяжелой цепи (HC50) BoNT/A и BoNT/В, а также в отношении нативного BoNT/A. Для этого используют метод вестерн-блот анализа. Рекомбинантные белки: HC50 BoNT/A (аминокислоты R861 - L1296 белка-предшественника ботулотоксина А) и домен HC50 BoNT/B (аминокислоты N853 - E1291 белка-предшественника ботулотоксина А (были получены из базы данных GenBank)), а также протеазы LC BoNT/A (аминокислоты P2 - N418 белка-предшественника ботулотоксина А; UniProtKB - P0DPI1 (BXA1_CLOBH)) и LC BoNT/В (аминокислоты P2 - K441 белка-предшественника ботулотоксина B; UniProtKB - B1INP5 (BXB_CLOBK)), нарабатывают в плазмидах pET-HCA, pET-HCB, pET-LCA и pET-LCB, соответственно. Плазмиды были сконструированы на основе модифицированного коммерческого вектора pET-22b(+) (Invitrogen). Все четыре рекомбинантных белка, полученных в результате экспрессии с вышеупомянутых плазмид, содержат полигистидиновый (6×His) тэг на N-конце, за которым следует тандем из двух c-myc эпитопов. Рекомбинантные белки экспрессируют в штамме E. coli BL21(DE3) (NEB). Компетентные клетки E. coli BL21(DE3) трансформируют в одной из экспрессионных плазмид. Очистку осветленного центрифугированием лизата проводят на колонке с сорбентом cOmplete His-Tag (Roche, Germany) на высокоэффективном жидкостном хроматографе AKTA Pure (Cytiva, Sweden). Полученные белки подвергают последующей доочистке на гель-фильтрационной колонке Superdex 75 10/300 GL (GE Healthcare, USA).
Нативный токсин выделяют из осадка, содержащего концентрированный комплекс белков, включая BoNT/A, полученный путем кислотного осаждения культуральной жидкости после культивирования Clostridium botulinum ATCC 19397 в токсинпродуцирующих условиях. Токсинокомплекс извлекают из осадка ренатурацией в натрий-фосфатном буфере (0,2М; pH6.0) с последующим концентрированием полученных белков при помощи высаливания насыщенным раствором сульфата аммония. В качестве отрицательного контроля по той же схеме культивировали непатогенный штамм Clostridium difficile ATCC 43255. Полученный после применения сульфата аммония осадок отделяют центрифугированием в течение 10 минут при 10000×g, затем растворяют в натрий-цитратном буфере (0,05М; pH5.5) в объеме, составляющем 1/10 от исходного объема культуральной токсинсодержащей жидкости, взятой в работу. Выдерживают при комнатной температуре в течение 10 минут. После этого доводят объем до исходного, соответствующего начальному объему, взятому в работу, при помощи ФСБ.
Рекомбинантные LC и HC50 BoNT/A и BoNT/В в количестве 0,5 мкг на дорожку и 10 мкл раствора нативного BoNT/A подвергают ПААГ электрофорезу в денатурирующих условиях, после чего осуществляют горизонтальный перенос белка из геля на нитроцеллюлозную мембрану Hybond-C Extra (GE Healthcare, Великобритания) методом полусухого переноса на приборе Trans-Blot Turbo Transfer System (Bio-Rad, США). Мембрану по окончании переноса погружают в обезжиренное (м.д.ж. не более 0,5 %) молоко для блокировки свободных валентностей нитроцеллюлозы, инкубируют в течение часа при покачивании и температуре 37°С. Промывают мембрану ФСБ-Тв трижды, после чего погружают в раствор чМКА с концентрацией 10 мкг/мл в ФСБ. Инкубируют час при 37°С с орбитальным перемешиванием, затем отмывают трижды ФСБ-Тв. Детектируют антитела на мембране козьими антителами против IgG человека, конъюгированными с пероксидазой хрена. Для этого конъюгат с пероксидазой хрена (Sigma, США) разводят в ФСБ 1:10000, погружают в него нитроцеллюлозную мембрану и инкубируют 40 мин при покачивании и температуре 37°С. Мембрану отмывают ФСБ-Тв не менее шести раз и проявляют 1% раствором диаминобензидина в ФСБ с добавлением хлоридов никеля и кобальта, а также 33 % перекиси водорода в количестве 1 мкл на 1 мл красящего раствора. После развития окраски реакцию останавливают, ополаскивая мембрану водой и высушивая (Фиг. 4.).
Тестирование способности чМКА ингибировать протеолитическую активность рекомбинантного белка LC BoNT/A проводят с помощью FRET-анализа с применением коммерческого FRET-субстрата SNAPtide® Botulinum Toxin A Substrate, Fluorogenic (Calbiochem 567333 Sigma-Aldrich, Millipore). Для этого готовят стоковый 5 мМ раствор субстрата в диметилсульфоксиде. Затем из стока получают 250 мкМ раствора с использованием рабочего буферного раствора состава 20 мМ HEPES pH 8.0, 5 мМ ДТТ, 0,3 мМ ZnSO4, 0,1% полисорбата-20. Реакцию проводят в 96-луночном планшете OptiPlate-96 (Perkin Elmer). Общий объем раствора в каждой лунке составляет 250 мкл. Рабочая концентрация FRET-субстрата в лунке 10 мкМ. В лунки планшета помещают по 10 мкг рекомбинантного белка LC BoNT/A и по 60 мкг чМКА, объем доводят до 240 мкл рабочим буфером и инкубируют на термостатируемом шейкере при 37°С в течении 60 мин. Непосредственно перед помещением планшета в анализатор EnSpire (Perkin Elmer) в лунки добавляют по 10 мкл 250 мкМ раствора FRET-субстрата. В качестве отрицательного контроля используют лунки: 1) содержащие только буфер; 2) содержащие буфер и белок SNAPtide; 3) содержащие буфер и чМКА 1B9C7. Считывание флуоресцентного сигнала проводят раз в 10 мин при Ex/Em = 320 нм/420 нм. Ингибирующую способность исследуемых чМКА 1В9С7 рассчитывают по формуле:
Ингибирующая активность (%) =

где ОЕФ (исследуемого чМКА) - относительные единицы флуоресценции пробы с исследуемым чМКА; ОЕФ (отрицательного контроля 1) - относительные единицы флуоресценции пробы, содержащие буфер и белок SNAPtide; ОЕФ (LC BoNT/А+ SNAPtide) - относительные единицы флуоресценции пробы, содержащей фрагмент LC BoNT/A и белок SNAPtide.
По результатам тестирования определили наиболее эффективное для ингибирования протеолитической активности рекомбинантного белка LC BoNT/A чМКА - 1В9С7, ингибирующая активность которого составила 48,6%. Результаты тестирования чМКА 1В9С7 представлены на Фиг. 5.
Реферат
Изобретение относится к области биотехнологии. Описан штамм гибридных культивируемых клеток Homo sapiens/Mus musculus 1B9C7, продуцирующий человеческие моноклональные антитела, специфичные к домену ботулиническому токсину типа A (LC BoNT/A) Clostridium botulinum. Штамм депонирован в государственной коллекции патогенных микроорганизмов и клеточных культур “ГКПМ-Оболенск”, коллекционный номер Н-96. Изобретение расширяет арсенал средств для получения моноклональных антител, способных нейтрализовать протеолитическую активность LC BoNT/A, что может быть использовано для последующего изготовления терапевтического препарата. 5 ил., 5 пр.

Комментарии