Способ идентификации, выделения и получения антигенов определенного патогена - RU2289817C2
Код документа: RU2289817C2
Чертежи






































































































































































































Описание
Область техники, к которой относится изобретение
Изобретение касается способа идентификации, выделения и получения антигенов определенного патогена, а также новых антигенов, пригодных для применения в вакцине, предпочтительной для определенного вида животных или для человека.
Уровень техники
Вакцины могут спасти больше жизней (и ресурсов), чем любое другое медицинское вмешательство. Благодаря всемирным программам вакцинации резко снизилась частота многих смертельных заболеваний. Хотя это верно в отношении целого ряда заболеваний, к примеру, дифтерии, коклюша, кори и столбняка, однако не существует эффективных вакцин против многих инфекционных заболеваний, включая большинство вирусных инфекций, таких как HIV, HCV, CMV и многих других. Также не существует эффективных вакцин и против других болезней, причем не только инфекционных, которые уносят жизни миллионов больных в год, включая малярию или рак. Кроме того, быстрое появление устойчивых к антибиотикам бактерий и микроорганизмов требует альтернативных методов, из которых вакцины представляют логический выбор. Наконец, большая потребность в вакцинах также иллюстрируется тем, что именно инфекционные заболевания, а не сердечно-сосудистые, раковые или травматические повреждения остаются самой большой причиной смертности и инвалидности в мире.
Некоторые признанные вакцины состоят из живых аттенуированных организмов, у которых существует опасность реверсии к вирулентному дикому типу. В частности, при иммунодефицитных состояниях это может представлять опасность для жизни. С другой стороны, вакцины можно вводить в виде комбинации антигенов, происходящих из патогена, вместе с соединениями, индуцирующими или усиливающими иммунные ответы на эти антигены (такие соединения обычно называют адъювантами), поскольку такие субъединичные вакцины в общем не эффективны сами по себе.
Хотя несомненно, что указанные выше вакцины являются ценными средствами лечения, однако есть и недостаток, а именно то, что вследствие их сложности они могут вызывать тяжелые побочные эффекты, к примеру, на антигены, входящие в состав вакцины и проявляющие перекрестную реактивность с молекулами, которые экспрессируются в клетках вакцинируемых лиц. Кроме того, существующие правила, исходящие из контролирующих органов, к примеру, Всемирной Организации Здравоохранения (ВОЗ), Управления по контролю за продуктами и лекарствами (FDA) и их аналогов в Европе, требуют точного указания состава вакцины и механизма индукции иммунитета, что трудновыполнимо.
Некоторые распространенные вакцины представляют собой вакцины из целых клеток - аттенуированных бактерий или вирусов, например, бацилл Calmette-Guerin (БЦЖ) (против туберкулеза), вакцины против кори, свинки, краснухи, пероральная вакцина против полиомиелита (Sabin); убитых бактерий или вирусов, например, вакцина против коклюша, инактивированная вакцина против полиомиелита (Salk); субъединичные вакцины, например, из токсоида (против дифтерии, столбняка), капсульного полисахарида (Н.influenzae типа В), дрожжевой рекомбинантной субъединицы (поверхностный белок гепатита В).
Вакцина может содержать целый ряд различных антигенов. Примерами антигенов являются целые убитые организмы, такие как инактивированные вирусы или бактерии, простейшие, грибы и даже раковые клетки. Антигены также могут состоять из субклеточных фракций этих организмов/тканей, из белков или, в простейшем виде, из пептидов. Антигены могут распознаваться иммунной системой и в виде гликозилированных белков или пептидов, а также могут представлять собой или содержать полисахариды или липиды. Могут использоваться короткие пептиды, так как, например, цитотоксические Т-клетки (CTL) распознают антигены в виде коротких пептидов, обычно из 8-11 аминокислот, в сочетании с главным комплексом гистосовместимости (МНС). В-клетки могут распознавать линейные эпитопы длиной всего лишь в 4-5 аминокислот, а также 3-мерные структуры (конформационные эпитопы). Для того, чтобы вызвать продолжительный антиген-специфичный иммунный ответ, адъювант должен запустить иммунный каскад, в котором должны участвовать все клетки иммунной системы. Главным образом адъюванты действуют, не ограничиваясь этим механизмом, на так называемые антигенпрезентирующие клетки (АРС). Эти клетки обычно первыми сталкиваются с антигенами, после чего следует предъявление (презентация) процессированного либо необработанного антигена иммуноэффекторным клеткам. Могут также принимать участие промежуточные типы клеток. При продуктивном иммунном ответе активируются лишь те эффекторные клетки, которые обладают надлежащей специфичностью. Адъюванты также могут удерживать на месте антигены и другие введенные вместе с ними факторы. Кроме того, адъювант может действовать в качестве хемоаттрактанта для других иммунных клеток или оказывать местное и/или системное действие как стимулятор иммунной системы.
Антигенпрезентирующие клетки принадлежат к системе врожденного иммунитета, которая возникла как первая линия защиты организма, ограничивающая инфекцию сразу после контакта с микроорганизмами. Клетки системы врожденного иммунитета распознают шаблоны или сравнительно неспецифичные структуры, экспрессированные на их мишенях, тогда как система адаптивного иммунитета распознает более сложные, специфичные структуры. Примерами клеток системы врожденного иммунитета являются макрофаги и дендритные клетки, а также гранулоциты (например, нейтрофилы), естественные клетки-киллеры и другие. В отличие от них, клетки системы адаптивной иммунной системы распознают специфические антигенные структуры, включая пептиды в случае Т-клеток и пептиды наряду с 3-мерными структурами в случае В-клеток. Система приобретенного иммунитета намного более специфична и сложна, чем система врожденного иммунитета, и совершенствуется при повторном воздействии данного патогена/антигена. В эволюционном отношении система врожденного иммунитета намного более древняя и обнаруживается даже у очень примитивных организмов. Тем не менее, система врожденного иммунитета играет решающую роль в начальной фазе антигенного воздействия, так как, наряду со сдерживанием распространения патогенов, клетки системы врожденного иммунитета, то есть АРС, примируют клетки системы приобретенного иммунитета и тем самым запускают специфические имунные ответы, ведущие к устранению "незванных гостей". Таким образом, клетки системы врожденного иммунитета, в особенности АРС, играют решающую роль в индукционной фазе иммунных ответов тем, что они: а) сдерживают распространение инфекций посредством примитивной системы распознавания простых структур и б) примируют клетки системы приобретенного иммунитета, что ведет к специфическим иммунным ответам и запоминанию, приводящим к устранению вторгающихся патогенов или других мишеней. Эти механизмы также могут иметь значение в устранении или сдерживании раковых клеток.
Используемые для таких вакцин антигены зачастую выбирают случайным образом или по доступности. Существует потребность в идентификации эффективных антигенов данного патогена или - предпочтительно - почти полного набора всех антигенов данного патогена, имеющих практическое (клиническое) значение. Такие антигены могут быть предпочтительными кандидатами на антигены для вакцин.
Сущность изобретения
Таким образом, предметом настоящего изобретения является удовлетворение этих потребностей и обеспечение способа, с помощью которого такие антигены могут быть получены и с помощью которого практически полный набор антигенов определенного патогена может быть идентифицирован с применением данной сыворотки как источника антител. Такой способ должен подходить и для очень изменчивых патогенов, у которых быстро развивается устойчивость к обычным препаратам или вакцинам. Способ также должен быть применимым для идентификации и выделения опухолевых антигенов, аллергенов, аутоиммунных антигенов.
Итак, настоящее изобретение обеспечивает способ идентификации, выделения и получения реагирующих с гипериммунной сывороткой антигенов из определенного патогена, причем указанные антигены подходят для применения в качестве вакцины, предназначенной для определенного типа животных или для человека, характеризующийся следующими стадиями:
- получение препарата антител из пула плазмы данного типа животных или пула плазмы человека или индивидуальных сывороток с антителами против данного определенного патогена,
- получение по меньшей мере одной экспрессионной библиотеки дисплея на бактериальной поверхности данного определенного патогена,
- скрининг данной по меньшей мере одной экспрессионной библиотеки дисплея на бактериальной поверхности с помощью указанного препарата антител,
- идентификация антигенов, связывающихся при скрининге с антителами в указанном препарате антител,
- скрининг идентифицированных антигенов с помощью индивидуальных препаратов антител из индивидуальных сывороток от лиц с антителами против указанного определенного патогена,
- идентификация реагирующей с гипериммунной сывороткой антигенной части идентифицированных антигенов, где указанные реагирующие с гипериммунной сывороткой антигены связываются с релевантной частью индивидуальных препаратов антител из индивидуальных сывороток, и
- при необходимости выделение реагирующих с гипериммунной сывороткой антигенов и их получение химическими или рекомбинантными способами при условии, что указанные индивидуальные сыворотки получают от пациентов, имеющих титр антител к указанному определенному патогену, превышающий 90-процентиль, и титр IgG выше 10000 ед.
Этот способ также подходит вообще для идентификации практически полного набора реагирующих с гипериммунной сывороткой антигенов определенного патогена с помощью данных сывороток как источников антител, если проводить скрининг по меньшей мере трех разных экспрессионных библиотек по программе идентификации патогенов/антигенов способом настоящего изобретения. Следовательно, настоящее изобретение также касается способа идентификации, выделения и получения практически полного набора реагирующих с гипериммунной сывороткой антигенов определенного патогена, причем указанные антигены подходят для применения в качестве вакцины, предназначенной для определенного типа животных или для человека, характеризующегося следующими стадиями:
- получение препарата антител из пула плазмы данного типа животных или пула плазмы человека или индивидуальных сывороток с антителами против данного конкретного патогена,
- получение по меньшей мере трех разных экспрессионных библиотек указанного определенного патогена, причем по меньшей мере одна является экспрессионной библиотекой дисплея на бактериальной поверхности,
- скрининг данных по меньшей мере трех экспрессионных библиотек с помощью указанного препарата антител,
- идентификация антигенов, связывающихся хотя бы при одном из по крайней мере трех скринингов с антителами в указанном препарате антител,
- скрининг идентифицированных антигенов с помощью индивидуальных препаратов антител из индивидуальных сывороток от лиц с антителами против данного конкретного патогена,
- идентификация реагирующей с гипериммунной сывороткой антигенной части идентифицированных антигенов, где указанные реагирующие с гипериммунной сывороткой антигены связываются с релевантной частью индивидуальных препаратов антител из индивидуальных сывороток,
- повторение стадий скрининга и идентификации по меньшей мере еще один раз,
- сравнение реагирующих с гипериммунной сывороткой антигенов, идентифицированных при повторении стадий скрининга и идентификации, с реагирующими с гипериммунной сывороткой антигенами, идентифицированными на стадиях первоначального скрининга и идентификации,
- дальнейшее повторение стадий скрининга и идентификации, если только на стадиях повторного скрининга и идентификации было идентифицировано по меньшей мере 5% реагирующих с гипериммунной сывороткой антигенов, до тех пор, пока при следующем повторении стадий будет идентифицировано менее 5% реагирующих с гипериммунной сывороткой антигенов для получения полного набора реагирующих с гипериммунной сывороткой антигенов данного патогена,
- при необходимости выделение реагирующих с гипериммунной сывороткой антигенов и их получение химическими или рекомбинантными способами при условии, что указанные индивидуальные сыворотки получают от пациентов, имеющих титр антител к указанному определенному патогену, превышающий 90-процентиль, и титр IgG выше 10000 ед.
Перечень чертежей
На фиг.1 представлен предварительный отбор сывороток на основе титров антител против стафилококков, измеренных методом ELISA.
На фиг.2 представлено распределение по размеру фрагментов ДНК в библиотеке LSA50/6 в векторе pMAL4.1.
На фиг.3 представлена селекция методом магнитной сортировки клеток (MACS) с помощью биотинилированной сыворотки человека. Библиотеку LSA50/6 в векторе pMAL4.1 подвергали скринингу с помощью 10 мкг биотинилированной сыворотки человека в первом (А) и 1 мкг во втором (В) цикле скрининга. Сыворотка Р - сыворотка больных, сыворотка В - детская сыворотка. Показано число отобранных клеток после 2-й и 3-й элюции для каждого цикла селекции.
На фиг.4 представлена иммунореактивность специфических клонов, полученных путем дисплея на бактериальной поверхности по результатам анализа методом Вестерн-блоттинга с помощью сыворотки больного в разведении 1:5000.
На фиг.5 представлен анализ методом ELISA с помощью сыворотки больных и здоровых лиц пептида с эпитопом, идентифицированным способом рибосомного дисплея.
На фиг.6 представлен репрезентативный двухмерный иммуноблот поверхностных белков S.aureus, детектированных с помощью сыворотки человека. 800 мкг белка из S. aureus/COL, культивированного на BHI, разделяли методами ИЭФ (рI 4-7) и ДДС-Na-ПАГ-электрофореза (9-16%), а затем переносили на мембрану из PVDF. После блокирования мембрану инкубировали с сывороткой IC35 (1:20000). Связывание сывороточного IgG визуализировали при помощи конъюгата HRPO с антителом к IgG человека и проявления с помощью усиленной хемилюминесценции ECL.
На фиг.7 представлен репрезентативный двумерный гель, показывающий поверхностные белки S.aureus при окрашивании Кумасси голубым. 1 мг белка из S.aureus/COL разделяли методами ИЭФ (рI 4-7) и ДДС-Na-ПАГ-электрофореза (9-16%). Отмечены пятна, выбранные для секвенирования после серологического протеомного анализа.
На фиг.8А и 8В представлена структура белков клеточной стенки LPXTG.
На фиг.9 представлен IgG-ответ у неинфицированных (N, С) и инфицированных (Р) пациентов на LPXTGV, новый антиген и вероятный поверхностный адгезин S.aureus, открытый согласно изобретению с помощью дисплея на бактериальной поверхности и протеомного подхода.
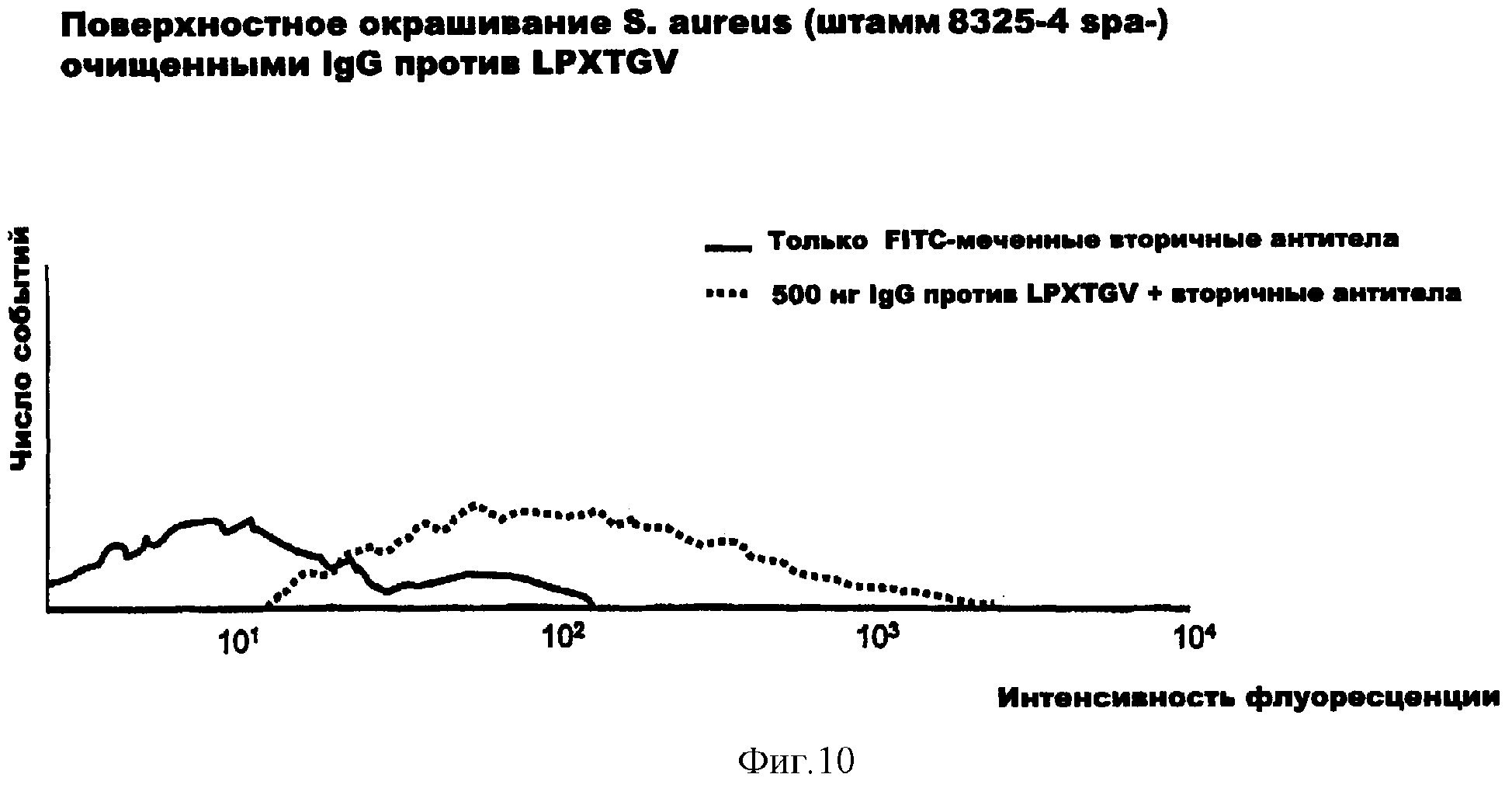
На фиг.10 представлено окрашивание поверхности S.aureus очищенными IgG против LPXTGV.
На фиг.11 представлен двухмерный гель, на котором поверхностные белки S.aureus окрашивали Кумасси голубым (слева). 1 мг белка из S. aureus/agr, культивированного до ранней логарифмической фазы, разделяли методами ИЭФ (рI 4-7) и ДДС-Na-ПАГ-электрофорезе (9-16%). Отмечены пятна, выбранные для секвенирования после серологического протеомного анализа. Соответствующий двухмерный иммуноблот (справа). 800 мкг белка из того же препарата разделяли параллельно методом двухмерного электрофореза, а затем переносили на мембрану из PVDF. После блокирования мембрану инкубировали с пулом Р (1:10000). Связывание сывороточного IgG визуализировали при помощи конъюгата HRPO с антителом к IgG человека и проявления с помощью усиленной хемилюминесценции ECL.
Сведения, подтверждающие возможность осуществления изобретения
Способ по настоящему изобретению в основном состоит из трех основных частей, а именно: 1) идентификация источников гипериммунной сыворотки, содержащих специфические антитела против определенного патогена, 2) скрининг подходящих экспрессионных библиотек с помощью соответствующего препарата антител, при котором отбираются антигены-кандидаты (или антигенные фрагменты таких антигенов), и 3) второй цикл скрининга, в котором реагирующие с гипериммунной сывороткой антигены идентифицируют по их способности к связыванию с релевантной частью индивидуальных препаратов антител из индивидуальных сывороток для того, чтобы убедиться, что эти антигены практически значимы и не только реагируют с гипериммунной сывороткой, но и обладают широкой иммуногенностью (то есть что множество индивидуальных сывороток реагирует с данным антигеном). Настоящий способ дает возможность получить набор антигенов определенного патогена, который будет практически полным в отношении данного патогена и данной сыворотки. Таким образом, в настоящем способе исключается перекос в сторону "плохих" антигенов-кандидатов или неполного набора антигенов данного патогена.
Полнота набора антигенов данного патогена в контексте настоящего изобретения, конечно, зависит от полноты экспрессионных библиотек, используемых в настоящем способе, и от качества и размера тестируемых коллекций сыворотки (числа индивидуальных плазм/сывороток), как в отношении репрезентативности библиотеки, так и пригодности экспрессионной системы. Поэтому предпочтительные воплощения настоящего способа отличаются тем, что по меньшей мере одна из экспрессионных библиотек выбрана из библиотеки рибосомного дисплея (ribosome display library), библиотеки дисплея на бактериальной поверхности (bacterial surface library) и протеома.
Коллекция сыворотки, используемая в настоящем изобретении, должна быть проверена против набора известных антигенных соединений данного патогена, таких как полисахариды, липиды и белковые компоненты клеточной стенки, клеточных мембран и цитоплазмы, а также секретируемые продукты. Предпочтительно используют три отдельные коллекции сывороток: 1) с очень стабильным репертуаром антител: от нормальных взрослых, клинически здоровых людей, перенесших прежние случаи контакта, или от носителей данного патогена без острых проявлений и симптомов заболевания; 2) с антителами, индуцированными острым присутствием патогенного организма: от пациентов с острым заболеванием в различных проявлениях (к примеру, сепсис или заражение раны S.aureus и т.д.); 3) без каких-либо специфических антител вообще (в качестве отрицательного контроля): от грудных детей в возрасте 5-8 месяцев, утративших материнские иммуноглобулины через 5-6 месяцев после рождения. Сыворотка должна реагировать с множеством патоген-специфичных антигенов, тогда ее можно считать гипериммунной для данного патогена (бактерии, грибка, червя или др.), благодаря чему она будет релевантной для скрининга способом настоящего изобретения.
В программе идентификации антигенов для выявления полного набора антигенов согласно настоящему изобретению предпочтительно, чтобы указанные по меньшей мере три экспрессионные библиотеки были представлены по крайней мере библиотекой рибосомного дисплея, библиотекой дисплея на бактериальной поверхности и протеомом. Было отмечено, что хотя все экспрессионные библиотеки могут быть полными, однако использование только одной или двух экспрессионных библиотек в программе идентификации антигенов не приводит к полному набору антигенов вследствие присущих каждой из различных экспрессионных библиотек свойств предпочтительной экспрессии. Таким образом, хотя и можно получить реагирующие с гипериммунной сывороткой антигены при помощи только одной или двух различных экспрессионных библиотек, однако во многих случаях это может и не привести в конце концов к идентификации полного набора реагирующих с гипериммунной сывороткой антигенов. Конечно, термин "полный" согласно настоящему изобретению означает не теоретический максимум, а лишь практическую полноту, то есть что у данного патогена идентифицировано по меньшей мере 95% практически значимых антигенов или антигенных детерминант. При этом практическая значимость определяется распространенностью антител к данному патогену в популяции пациентов.
Согласно настоящему изобретению, пулы сыворотки или фракции плазмы или другие пулы внутренних сред организма, содержащих антитела, также представляют собой "пулы плазмы".
Экспрессионная библиотека, используемая в настоящем изобретении, должна по крайней мере обеспечивать экспрессию всех потенциальных антигенов, например, всех поверхностных белков данного патогена. Экспрессионная библиотека по настоящему изобретению обеспечивает по меньшей мере один набор потенциальных антигенов данного патогена, и предпочтительно этот набор представляет собой полный теоретический набор (поли)пептидов, кодируемых геномом патогена (то есть геномные библиотеки, как описано в Примере 2) и экспрессируемых либо в рекомбинантном хозяине (см. Пример 3), либо in vitro (см. Пример 4). Этот набор возможных антигенов может представлять собой и белковый препарат, в случае внеклеточных патогенов - белковый препарат, содержащий поверхностные белки патогена, полученные из патогена, культивированного в определенных физиологических условиях (см. Пример 5). В то время, как геномный подход способен обеспечить полный набор антигенов, последний подход обладает тем преимуществом, что он дает белки в природном состоянии, то есть включая, к примеру, пост-трансляционные модификации или подвергнутые процессингу формы этих белков, которые не очевидны из последовательности ДНК. Эти и любые другие наборы потенциальных антигенов из патогена, опухоли, аллергена, либо ткани или организма, подверженного аутоиммунным реакциям, в дальнейшем именуются как "экспрессионная библиотека". Совершенно различные экспрессионные библиотеки могут применяться при осуществлении настоящего изобретения. Соответствующие примеры приведены, к примеру, в Ausubel et al., 1994. Особенно предпочтительны экспрессионные библиотеки, представляющие собой дисплей генетического набора патогена в рекомбинантном виде типа методов трансляции in vitro, например, рибосомный дисплей, или прокариотической системы экспрессии, например, экспрессионные библиотеки дисплея на бактериальной поверхности, или такие, которые близки к специфическим состояниям физиологической экспрессии данного патогена в данном физиологическом состоянии типа протеома.
Рибосомный дисплей является признанным методом технологии рекомбинантной ДНК, который применим к любому определенному патогену в интересах настоящего изобретения (Schaffitzel et al., 1999). Библиотеки дисплея на бактериальной поверхности представлены рекомбинантной библиотекой бактериального хозяина, представляющей (полный) набор пептидных последовательностей данного патогена, экспрессируемых, к примеру, на выбранном наружном мембранном белке на мембране бактериального хозяина (Georgiou et al., 1997). Помимо представления пептидных или белковых последовательностей на наружном мембранном белке, для экспрессионной библиотеки дисплея на бактериальной поверхности предпочтительны и другие методы бактериального дисплея, такие как технологии дисплея на бактериофагах и экспрессия через секретируемые белки (Forrer et al., 1999; Rodi and Makowski, 1993; Georgiou et al., 1997).
Препарат антигена для первого цикла скрининга способом настоящего изобретения может происходить из любого источника, содержащего антитела к данному патогену. Предпочтительно, если в качестве источника препарата антител используют пул плазмы, то выбирают пул плазмы человека, включающий доноров, перенесших или находящихся в состоянии инфицирования данным патогеном. Хотя такой выбор плазмы или пулов плазмы в принципе является стандартным методом, например, при получении гипериммунных препаратов иммуноглобулина, однако неожиданно оказалось, что эти методы оказывают такие эффекты, особенно как показывают предпочтительные воплощения настоящего изобретения.
Предпочтительно экспрессионные библиотеки представляют собой геномные экспрессионные библиотеки данного патогена, или же, альтернативно, библиотеки мРНК. Предпочтительно эти геномные или мРНК-библиотеки являются полными геномными или мРНК-библиотеками, что означает, что они содержат как минимум по одной копии всех возможных белков, пептидов или пептидных фрагментов, которые может экспрессировать патоген. Предпочтительно геномные экспрессионные библиотеки проявляют избыточность не менее 2-кратной, более предпочтительно не менее 5-кратной, в особенности не менее 10-кратной.
Предпочтительно способ настоящего изобретения включает скрининг по меньшей мере библиотеки рибосомного дисплея, библиотеки дисплея на бактериальной поверхности и протеома с помощью препарата антител и идентификацию антигенов, связывающихся по меньшей мере при двух, а предпочтительно при всех скринингах с антителами в препарате антител. Тогда такие антигены можно считать чрезвычайно подходящими в качестве гипериммуногенных антигенов, независимо от способа их экспрессии. Предпочтительно эти по меньшей мере два скрининга должны как минимум включать протеом, так как в протеоме антигены всегда представлены в виде экспрессируемых естественным образом белков, включая пост-трансляционные модификации, процессинг и т.п., которые не очевидны из последовательности ДНК.
Способ настоящего изобретения может применяться к любому патогену. Следовательно, патогены предпочтительно выбирают из числа бактериальных, вирусных, грибковых и протозойных патогенов. Способ настоящего изобретения также применим к раку, то есть для идентификации опухолевых антигенов, а также для идентификации аллергенов или антигенов, участвующих в аутоиммунных заболеваниях. Конечно, рекомбинантные методы будут особенно простыми для патогенов, имеющих небольшой геном или сравнительно небольшое число экспрессируемых белков (например, бактериальных или вирусных патогенов), и более трудными для сложных (эукариотических) организмов с большими геномами. Однако, даже такие большие геномные библиотеки патогенов из числа высших организмов можно анализировать способом настоящего изобретения, по крайней мере быстрее и более надежно, чем известными методами идентификации соответствующих антигенов.
Предпочтительные патогены, предназначенные для анализа или экстракции антигенов, соответственно, включают вирус иммунодефицита человека (HIV), вирус гепатита A (HAV), вирус гепатита В (HBV), вирус гепатита С (HCV), вирус саркомы Рауса (RSV), вирус Эпштейна-Барра (EBV), вирус гриппа (IV), ротавирус (RV), Staphylococcus aureus (S.aureus), Staphylococcus epidermidis (S.epidermidis), Chlamydia pneumoniae (C.pneumoniae), Chlamydia trachomatis (C.trachomatis), Mycobacterium tuberculosis (M.tuberculosis), Mycobacterium leprae (M.leprae), Streptococcus pneumoniae (S.pneumoniae), Streptococcus pyogenes (S.pyogenes), Streptococcus agalactiae (S.agalactiae), Enterococcus faecalis (E.faecalis), Bacillus anthracis (В.anthracis), Vibrio cholerae (V.cholerae), Borrelia burgdorferi (B.burgdorferi), Plasmodium sp., грибковые патогены, такие как Pneumocystis carinii, Aspergillus sp., Cryptococcus sp., Candida albicans, или паразитарные патогены, такие как аскариды (Ascaris lumbricoides) и ленточные черви (Taenia saginata). Способ настоящего изобретения наиболее применим к бактериям, червям или Candida.
В качестве модельного организма для настоящей заявки выбран Staphylococcus aureus, чтобы показать применимость и эффективность способа настоящего изобретения. В особенности из примеров становится ясно, что изобретение легко переносится на все возможные патогены, особенно те, что перечислены выше.
Неожиданно оказалось, что способ настоящего изобретения обеспечивает эффективный и быстрый биологический скрининг определенного патогена, особенно ввиду того, что лишь малая доля репертуара антител пациента направлена на данный патоген, даже в том случае, когда против этого патогена вырабатывается эффективная защита. В ходе настоящего изобретения, особенно при выполнении примера с S.aureus, было сделано открытие, что лишь 1-2% репертуара антител пациента с высоким титром антител к S.aureus в действительности представляют антитела, направленные против S.aureus. Более того, свыше 70% из этой специфической доли в 1% направлено против небелковых антигенов, таких как тейхоевая кислота, так что лишь 0,1% или меньше антител направлено против белковых антигенов.
Одно из преимуществ использования рекомбинантных экспрессионных библиотек, особенно библиотек рибосомного дисплея и библиотек дисплея на бактериальной поверхности, состоит в том, что идентифицированные антигены, реагирующие с гипериммунной сывороткой, могут быть незамедлительно получены путем экспрессии кодирующих последовательностей прошедших скрининг и отобранных клонов, экспрессирующих антигены, реагирующие с гипериммунной сывороткой, причем дальнейшие стадии технологии рекомбинантной ДНК или клонирования становятся ненужными.
Поэтому реагирующие с гипериммунной сывороткой антигены, получаемые способом настоящего изобретения, могут быть незамедлительно заключены в фармацевтический состав, предпочтительно путем добавления фармацевтически приемлемого носителя и/или наполнителя, сразу после получения (в ходе второй стадии селекции), например, при экспрессии из экспрессионной библиотеки.
Предпочтительно фармацевтический состав, содержащий антиген, реагирующий с гипериммунной сывороткой, представляет собой вакцину для профилактики или лечения инфекции, вызванной определенным патогеном, из которого были отобраны антигены.
Фармацевтический состав может содержать любые подходящие вспомогательные вещества, такие как буферные вещества, стабилизаторы или дополнительные активные ингредиенты, в особенности известные ингредиенты, связанные с получением вакцин.
Предпочтительно носитель и/или наполнитель для реагирующих с гипериммунной сывороткой антигенов по настоящему изобретению представляет собой соединение-иммуностимулятор для дополнительной стимуляции иммунного ответа на данный реагирующий с гипериммунной сывороткой антиген. Предпочтительно соединение-иммуностимулятор в фармацевтическом составе по настоящему изобретению выбирают из числа поликатионных веществ, особенно поликатионных пептидов, иммуностимуляторных дезоксинуклеотидов, квасцов, полного адъюванта Фрейнда, неполного адъюванта Фрейнда, нейроактивных соединений, особенно гормона роста человека, или их комбинаций.
Поликатионные соединения для применения по настоящему изобретению могут представлять собой любые поликатионные соединения, проявляющие характерные эффекты согласно WO 97/30721. Предпочтительные поликатионные соединения выбирают из основных полипептидов, органических поликатионов, основных полиаминокислот или их смесей. Длина цепи у таких полиаминокислот должна составлять не менее 4 аминокислотных остатков (см. Tuftsin, как описано в Goldman et al., 1983). Особенно предпочтительны вещества типа полилизина, полиаргинина и полипептидов, содержащие более 20%, предпочтительно более 50% основных аминокислот в пределах от более 8, предпочтительно более 20 аминокислотных остатков, или их смеси. Другие предпочтительные поликатионы и их фармацевтические композиции описаны в WO 97/30721 (к примеру, полиэтиленимин) и WO 99/38528. Предпочтительно такие полипептиды содержат от 20 до 500 аминокислотных остатков, более предпочтительно от 30 до 200 остатков.
Такие поликатионные соединения могут быть получены химическим путем или рекомбинантными методами, либо происходить из природных источников.
Катионные (поли)пептиды также могут обладать антимикробными свойствами, как описано в обзорах: Ganz et al., 1999; Hancock, 1999. Такие (поли)пептиды могут происходить из прокариот, животных или растений, либо могут быть получены химическим путем или рекомбинантными методами (Andreu et al., 1998; Ganz et al., 1999; Simmaco et al., 1998). Пептиды также могут принадлежать к классу дефензинов (Ganz, 1999; Ganz et al., 1999). Последовательности таких пептидов, к примеру, можно найти в Базе данных по антимикробным последовательностям по следующему адресу Интернета: http://www.bbcm.univ.trieste.it/˜tossi/pag2.html.
Такие защитные пептиды организма-хозяина или дефензины также являются предпочтительной формой поликатионных полимеров согласно настоящему изобретению. В общем, в качестве поликатионных полимеров используют соединения, обеспечивающие в конечном счете активацию (или понижающую регуляцию) системы адаптивного иммунитета, предпочтительно опосредованную АРС (включая дендритные клетки).
Особенно предпочтительны для применения в качестве поликатионных веществ в настоящем изобретении антимикробные пептиды, происходящие из кателицидина, или их производные (международная патентная заявка РСТ/ЕР01/09529, включенная в описание в качестве ссылки), особенно антимикробные пептиды, происходящие из кателицидина млекопитающих, предпочтительно человека, быка или мыши.
К поликатионным соединениям природного происхождения относятся HIV-REV и HIV-TAT (производные катионные пептиды, пептиды antennapedia, хитозан и другие производные хитина) и другие пептиды, полученные из этих пептидов или белков биохимическим или рекомбинантным способом. Другие предпочтительные поликатионные соединения - кателин и родственные ему или производные вещества. Например, кателин мыши - это пептид, имеющий аминокислотную последовательность NH2-RLAGLLRKGGEKIGEKLKKIGOKIKNFFQKLVPQPE-COOH. Родственные кателину или производные вещества содержат полную или частичную последовательность кателина, включающую по меньшей мере 15-20 аминокислотных остатков. Производные могут включать замещение или модификацию природных аминокислот такими аминокислотами, которые не входят в число стандартных 20 аминокислот. Кроме того, в такие молекулы кателина могут вводиться дополнительные катионные остатки. Такие молекулы кателина являются предпочтительными для комбинирования с антигеном. Неожиданно эти молекулы кателина также оказались эффективными как адъюванты для антигена без добавления других адъювантов. Поэтому такие молекулы кателина можно использовать в качестве эффективных адъювантов в составе вакцин вместе с другими иммуноактивирующими веществами или без них.
Другим предпочтительным поликатионным веществом для применения согласно настоящему изобретению является синтетический пептид, содержащий по меньшей мере 2 мотива KLK, разделенные линкером из 3-7 гидрофобных аминокислот (международная патентная заявка РСТ/ЕР01/12041, включена в описание в качестве ссылки).
К иммуностимуляторным дезоксинуклеотидам относятся природные или искусственные CpG-содержащие ДНК, короткие отрезки ДНК из беспозвоночных или короткие олигонуклеотиды (ODNs), содержащие неметилированные динуклеотиды цитозин-гуанин (CpG) в определенном контексте (см. Krieg et al., 1995), а также содержащие инозин ODNs (I-ODNs), как описано в WO 01/93905.
Нейроактивные соединения, к примеру, комбинируемые с поликатионными веществами, описаны в WO 01/24822.
Согласно предпочтительному воплощению, индивидуальные препараты антител для второго цикла скрининга получают от больных острой инфекцией, вызванную данным патогеном, особенно от больных, у которых титр антител к этому патогену превышает определенный минимальный уровень, например, титр антител, превышающий 80-процентиль, предпочтительно превышающий 90-процентиль, более предпочтительно превышающий 95-процентиль для протестированных образцов сыворотки человека (больных или носителей). Использование индивидуальных препаратов антител с таким высоким титром во втором цикле скрининга обеспечивает высокую избирательность при идентификации реагирующих с гипериммунной сывороткой антигенов данного патогена.
Важно то, что второй скрининг с помощью индивидуальных препаратов антител (которыми могут служить и отобранные сыворотки) обеспечивает избирательную идентификацию реагирующих с гипериммунной сывороткой антигенов из всех перспективных кандидатов, полученных в первом цикле. Поэтому при идентификации таких антигенов во втором цикле скрининга предпочтительно следует использовать по меньшей мере 10 индивидуальных препаратов антител (то есть препаратов антител, к примеру, сывороток, полученных как минимум от 10 различных лиц, перенесших инфекцию, вызванной данным патогеном). Конечно, можно использовать и меньше 10 индивидуальных препаратов, однако при малом числе индивидуальных препаратов антител избирательность на этой стадии может оказаться неоптимальной. С другой стороны, если данный реагирующий с гипериммунной сывороткой антиген (или его антигенный фрагмент) распознается по меньшей мере 10 индивидуальными препаратами антител, предпочтительно по меньшей мере 30, особенно предпочтительно по меньшей мере 50 индивидуальными препаратами антител, то идентификация реагирующего с гипериммунной сывороткой антигена будет достаточно избирательной для надлежащей идентификации. Конечно, для тестирования способности к реакции с гипериммунной сывороткой можно использовать и такое количество индивидуальных препаратов, какое только возможно (к примеру, более 100 и даже более 1000).
Таким образом, релевантная часть реагирующих с гипериммунной сывороткой препаратов антител в соответствии со способом настоящего изобретения должна предпочтительно составлять по меньшей мере 10, более предпочтительно по меньшей мере 30, особенно предпочтительно по меньшей мере 50 индивидуальных препаратов антител. В качестве альтернативы (или в дополнение), реагирующий с гипериммунной сывороткой антиген можно предпочтительно идентифицировать при помощи по меньшей мере 20%, предпочтительно по меньшей мере 30%, особенно предпочтительно по меньшей мере 40% от всех индивидуальных препаратов антител, используемых во втором цикле скрининга.
Согласно предпочтительному воплощению настоящего изобретения сыворотки, из которых получают индивидуальные препараты антител для второго цикла скрининга (или используют в качестве препаратов антител), отбирают по их титрам против определенного патогена (то есть против препарата этого патогена, например, лизата, компонентов клеточной стенки или рекомбинантных белков). Предпочтительно их отбирают при общем титре IgA более 4000 ед., особенно более 6000 ед., и/или при титре IgG более 10000 ед., особенно более 12000 ед. (ед. = единицы, рассчитанные по величине CD405нм при соответствующем разведении), когда в качестве антигена для ELISA используют целый организм (тотальный лизат или целые клетки). Индивидуальные белки с титрами Ig более 800-1000 ед. особенно предпочтительны для селекции антигенов, реагирующих с гипериммунной сывороткой, только по общему титру. Отчет по индивидуальным белкам можно получить из фиг.9.
В показательном примере, также представляющем предпочтительное воплощение настоящего изобретения, патогеном являются стафилококки, особенно Staphylococcus aureus и Staphylococcus epidermidis. Стафилококки являются условными патогенами, которые могут вызывать ряд заболеваний, от легких инфекций до опасных для жизни болезней. Из большого числа стафилококков по крайней мере 3 обычно связывают с заболеваниями человека: S.aureus, S.epidermidis и изредка S.saprophyticus (Crossley and Archer, 1997). В ходе настоящего изобретения S.aureus был использован как показательный пример того, как работает настоящее изобретение. Кроме того, он также является важным организмом в плане его сильного патогенного влияния на человека. Стафилококковые инфекции представляют все большую опасность в больницах по всему миру. Распространение стафилококков и их способность вызывать инфекции связаны с широким применением антибиотиков, которые индуцировали и продолжают индуцировать множественную устойчивость к лекарственным препаратам. По этой причине лечение стафилококковых инфекций не может больше полагаться только на антибиотики. Поэтому крайне необходимо менять тактику лечения этих заболеваний, с прицелом на профилактику инфекций. Выработка высокоаффинных антител опсонического и нейтрализующего типа при вакцинации способствует элиминации бактерий и токсинов системой врожденного иммунитета. Вследствие этого способ настоящего изобретения становится оптимальным инструментом для идентификации антигенных белков стафилококков.
Каждый человек колонизирован S.epidermidis. В норме S.epidermidis обитает на коже и слизистых оболочках. Наиболее патогенный вид, S.aureus, в основном обитает в ноздрях и промежности. Некоторые лица становятся постоянными носителями S.aureus, часто одного и того же штамма. Стадия носительства имеет клиническое значение, так как при операциях инфекции чаще всего случаются именно у носителей. В общем случае, закрепившаяся в носу флора препятствует приобретению новых штаммов. Однако колонизация другими штаммами может произойти при лечении антибиотиками, которое ведет к элиминации чувствительного присущего носителю штамма. Поскольку такая ситуация встречается в больницах, у пациентов может произойти колонизация устойчивыми нозокомиальными стафилококками. Эти бактерии обладают врожденной приспособляемостью, которая дополняется широким и не всегда правильным применением антимикробных средств. Поэтому больницы представляют благоприятную среду для развития устойчивости к лекарственным препаратам (тесные контакты между больными, широкое применение антимикробных средств, нозокомиальные инфекции). S.aureus и S.epidermidis приобрели устойчивость ко многим распространенным антибиотикам, из которых особенно важны метициллин (MRSA) и ванкомицин (VISA). Устойчивость к лекарствам представляет все возрастающую опасность в здравоохранении, и вскоре многие инфекции, вызываемые стафилококками, станет невозможно лечить антибиотиками. Наряду с неблагоприятным воздействием на здоровье населения, устойчивость к антимикробным средствам способствует повышению стоимости лечения, поскольку лечение устойчивых инфекций зачастую требует применения более токсичных и более дорогих препаратов и может привести к более длительному пребыванию в больнице инфицированных пациентов.
Более того, даже с применением эффективных антибиотиков смертность при наиболее серьезных стафилококковых инфекциях составляет 30-50%.
Стафилококки становятся потенциально патогенными, как только нарушается естественный баланс между микроорганизмами и иммунной системой, при повреждении естественных барьеров (кожи, слизистых оболочек). Положительный по коагулазе S.aureus является наиболее патогенным видом стафилококка, которого уже давно боятся хирурги. Чаще всего он вызывает раневые инфекции и вызывает образование абсцессов. Такая местная инфекция может превратиться в системную, вызывая бактеремию и сепсис. Особенно после вирусных инфекций и у пожилых людей он может вызвать тяжелую пневмонию. S.aureus часто является причиной инфекций, связанных с медицинскими приспособлениями типа сосудистых и подкожных катетеров (эндокардит, сепсис, перитонит), протезов (септический артрит, остеомиелит). S.epidermidis чаще всего вызывает заболевания, связанные с присутствием инородных тел и применением приспособлений: инфекции, связанные с катетерами, инфекции при шунтировании спинномозговой жидкости, перитонит у пациентов на диализе (в основном CAPD), эндокардит у лиц с искусственными клапанами сердца. В качестве примера можно привести иммунокомпрометированных лиц, таких как онкологические больные и недоношенные дети, у которых часто встречаются инфекции, вызванные отрицательными по коагулазе стафилококками в связи с применением сосудистых катетеров. Увеличение числа случаев заболевания связано со все возрастающим применением таких приспособлений и повышением числа иммунокомпрометированных пациентов.
Значительно меньше известно о другом отрицательном по коагулазе стафилококке, S.saprophyticus, вызывающем острые инфекции мочевых путей у прежде здоровых людей. За малым исключением, ими являются женщины в возрасте 16-25 лет.
Патогенез стафилококковых инфекций многофакторный. Для того чтобы вызвать инфекцию, патоген должен получить доступ к клеткам и тканям хозяина, то есть прикрепиться. S.aureus экспрессирует поверхностные белки, которые способствуют прикреплению к таким белкам хозяина, как ламинин, фибронектин, эластин, витронектин, фибриноген и многие другие молекулы, входящие в состав внеклеточного матрикса (связывающиеся с внеклеточным матриксом белки, ЕСМВР). S.epidermidis обладает молекулами клеточной поверхности, которые способствуют прикреплению к чужеродному материалу и посредством этого механизма вызывают инфекции у хозяина. Другое мощное оружие, которое используют стафилококки, - это секретируемые продукты, такие как энтеротоксины, экзотоксины и ферменты, повреждающие ткани. Токсины убивают или обманывают иммунные клетки, важные для защиты хозяина. Несколько различных типов токсинов несут ответственность за большинство симптомов при инфекциях.
Защита организма-хозяина от S.aureus в основном зависит от механизмов врожденного иммунитета. Кожа и слизистые оболочки являются мощными барьерами против проникновения стафилококков. Однако, как только кожа или слизистая оболочка подвергается повреждению (ранки, подкожные катетеры и т.п.), первая линия защиты клеток, не относящаяся к системе приобретенного иммунитета, согласованно вступает в действие через комплемент и фагоциты, в особенности полиморфноядерные лейкоциты (PMNs). Эти клетки можно рассматривать как краеугольные камни в элиминации проникающих бактерий. Поскольку стафилококки прежде всего являются внеклеточными патогенами, основная адаптивная реакция против стафилококков исходит от гуморальной ветви иммунной системы и опосредуется тремя главными механизмами: запуском опсонизации, нейтрализацией токсинов и ингибированием прикрепления. Полагают, что особенно важна опсонизация, так как для нее необходим действенный фагоцитоз. Для эффективной опсонизации поверхность микроба должна быть покрыта антителами и факторами комплемента для узнавания клетками PMNs через рецепторы к фрагменту Fc молекулы IgG или к активированному С3b. После опсонизации стафилококки подвергаются фагоцитозу и погибают. Кроме того, S.aureus может прикрепляться к клеткам эндотелия и подвергаться интернализации посредством подобного фагоцитозу процесса. Антитела, связавшиеся со специфическими антигенами на поверхности бактериальной клетки, служат лигандами для прикрепления к PMNs и способствуют фагоцитозу. Те же самые антитела, связавшиеся с адгезинами и другими белками клеточной поверхности, должны противодействовать прикреплению и предотвращать колонизацию.
Клинических данных о том, что клеточный иммунитет играет значительную роль в защите от стафилококков, слишком мало, однако следует признать, что этот вопрос еще не достаточно разработан. Тем не менее известно, что Staphylococcus aureus использует широкий набор молекулярных контрмер для воздействия на защитное микроокружение инфицированного хозяина путем секреции полипептидов, называемых суперантигенами, которые берут на прицел мультирецепторные связи между Т-клетками и антигенпрезентирующими клетками, которые играют фундаментальную роль в запуске патоген-специфичного иммунного обезвреживания. Суперантигены играют решающую роль в синдроме токсического шока и пищевом отравлении, однако их функция при обычных инфекциях еще не совсем ясна. Кроме того, невозможно ожидать продолжительного антительного ответа (памяти) без участия Т-клеток. К тому же известно, что большинство антител против стафилококков направлено на Т-независимые антигены (капсульные полисахариды, липотейхоевую кислоту, пептидогликаны), не вызывающие памяти. Зависимые от Т-клеток белковые антигены могут вызывать продолжительные защитные антительные ответы. Но такие белки и пептиды стафилококков еще не установлены.
По всем этим причинам, указанным выше, крайне необходимо изменение тактики на поле битвы со стафилококковыми инфекциями. Один из способов борьбы с инфекциями заключается в их профилактике путем активной иммунизации. Разработку вакцины против S.aureus предпринимали различные исследовательские группы и национальные институты во всем мире, однако эффективная вакцина пока еще не появилась. Было показано, что состояние иммунодефицита способствует перенстированию стафилококков, свидетельствуя, что антистафилококковые антитела имеют важное значение в защите хозяина. Направленные против поверхностных компонентов антитела - внесенные при пассивной иммунизации или индуцированные при активной вакцинации - могли бы предотвратить прикрепление бактерий, нейтрализовать токсины и стимулировать фагоцитоз. Вакцина на основе фибронектин-связывающего белка индуцирует защитный иммунитет против мастита у коров, свидетельствуя, что такой подход может сработать и у человека (ссылки). С учетом всего этого можно предположить, что эффективная вакцина должна состоять из тех белков или полипептидов, которые экспрессируются всеми штаммами и способны индуцировать высокоаффинные, массовые антитела против компонентов клеточной поверхности S.aureus. Антитела должны быть типа IgG1 и/или IgG3 для опсонизации и любого субтипа IgG и IgA для подавления прикрепления и нейтрализации действия токсинов. Вакцина определенного химического состава явно должна превосходить вакцины на основе целых клеток (аттенуированных или мертвых), так как можно устранить те компоненты S.aureus, которые парализуют ТН-клетки (суперантигены) или ингибируют опсонизацию (белок А), и отобрать индивидуальные белки, индуцирующие защитные антитела. Идентификация релевантных антигенов поможет обеспечить эффективную пассивную иммунизацию (терапия гуманизированными моноклональными антителами), которая может заменить введение иммуноглобулина человека со всеми его опасными побочными эффектами. Стафилококковые инфекции новорожденных, тяжелая септицемия и другие опасные для жизни острые состояния являются главной мишенью пассивной иммунизации. Эффективная вакцина представляет большой потенциал для пациентов, ожидающих хирургической операции вообще, и тех, кому вводят сосудистые катетеры, в частности. Кроме того, такая вакцина должна принести пользу и больным хроническими заболеваниями, при которых снижаются иммунные ответы, и тем, кто подвергается непрерывному перитонеальному диализу амбулаторно.
Для показательного примера в отношении Staphylococcus aureus использовали параллельно три различных подхода. Все эти три способа основаны на взаимодействии белков или пептидов стафилококка с антителами в сыворотке человека в соответствии со способом настоящего изобретения. Это взаимодействие зависит от узнавания эпитопов на белках, которые могут представлять собой короткие пептиды (линейные эпитопы) или полипептидные домены (структурные эпитопы). Антигенные белки идентифицируют различными методами, используя пулы предварительно отобранных сывороток и - во втором цикле скрининга - отдельные индивидуальные сыворотки.
После высопроизводительного скрининга отобранные антигенные белки экспрессируют как рекомбинантные белки или продукты трансляции in vitro (в том случае, если они не могут быть экспрессированы в прокариотической системе экспрессии) и тестируют в серии анализов методом ELISA или Western-гибридизации для оценки иммуногенности с большой коллекцией сывороток человека (>100 неинфицированных, >50 больных). Предпочтительные антигены находятся на поверхности клетки или секретируются, то есть они доступны внеклеточно. Следует ожидать, что антитела против белков клеточной стенки (типа связывающихся с внеклеточным матриксом белков) будут иметь двойное назначение: ингибировать адгезию и стимулировать фагоцитоз. Антитела против секретируемых белков полезны для нейтрализации токсинов. К тому же известно, что бактерии общаются друг с другом посредством секретируемых белков. Нейтрализующие антитела против этих белков будут прерывать стимулирующие рост межвидовые или внутривидовые "переговоры" стафилококков. Биоинформатика (сигнальные последовательности, сигналы локализации на клеточной поверхности, трансмембранные домены) оказалась очень полезной при анализе локализации на клеточной поверхности или секреции. Экспериментальный подход включает выделение антител к соответствующим эпигонам и белкам из сыворотки человека и применение их в качестве реагентов в следующих испытаниях: окрашивание клеточной поверхности стафилококков, культивированных в различных условиях (FACS, микроскопия), определение нейтрализующей способности (токсин, прикрепление) и индукция опсонизации и фагоцитоза (анализ фагоцитоза in vitro).
Антитела могут распознавать линейные эпитопы с последовательностями всего лишь из 4-5 аминокислот. Конечно, это не значит, что такие короткие пептиды способны индуцировать образование определенного антитела in vivo. По этой причине определенные эпитопы, полипептиды и белки могут подвергаться дальнейшему тестированию на животных (главным образом мышах) в отношении их способности индуцировать антитела к отобранным белкам in vivo. Антигены с проверенной способностью к индукции антител подвергают тестированию на животных моделях на их способность к предотвращению инфекций.
Продукция антитела против стафилококков иммунной системой человека и их присутствие в сыворотке человека свидетельствуют об экспрессии антигенных белков in vivo и их иммуногенности.
Соответственно, были получены новые реагирующие с гипериммунной сывороткой антигены из Staphylococcus aureus или Staphylococcus epidermidis способом настоящего изобретения. Согласно следующему аспекту настоящего изобретения, изобретение касается реагирующих с гипериммунной сывороткой антигенов, выбранных из группы, состоящей из последовательностей, перечисленных в любой из табл.2а, 2b, 2c, 2d, 3, 4 и 5, в особенности выбираемых из группы, состоящей из Seq.ID No.56, 57, 59, 60, 67, 70, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 85, 87, 88, 89, 90, 92, 95, 96, 97, 99, 100, 101, 102, 103, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 126, 128, 130, 132, 134, 138, 140, 142, 151, 152, 154, 155 и их гипериммунных фрагментов. Соответственно, настоящее изобретение также касается реагирующих с гипериммунной сывороткой антигенов, получаемых способом настоящего изобретения и выбираемых из группы, состоящей из последовательностей, перечисленных в любой из табл.2а, 2b, 2c, 2d, 3, 4 и 5, в особенности выбираемых из группы, состоящей из Seq.ID No.56, 57, 59, 60, 67, 70, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 85, 87, 88, 89, 90, 92, 95, 96, 97, 99, 100, 101, 102, 103, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 126, 128, 130, 132, 134, 138, 140, 142, 151, 152, 154, 155 и их гипериммунных фрагментов.
Антигены из Staphylococcus aureus и Staphylococcus epidermidis были получены способом настоящего изобретения, который может применяться для изготовления лекарственных препаратов, в особенности для изготовления вакцин против инфекций, вызываемых Staphylococcus aureus и Staphylococcus epidermidis. Примеры таких реагирующих с гипериммунной сывороткой антигенов Staphylococcus aureus и Staphylococcus epidermidis для применения в лекарственных препаратах выбирают из группы, состоящей из последовательностей, перечисленных в любой из табл.2а, 2b, 2с, 2d, 3, 4 и 5, в особенности выбирают из группы, состоящей из Seq.ID No.55, 56, 57, 58, 59, 60, 62, 66, 67, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 87, 88, 89, 90, 92, 94, 95, 96, 97, 99, 100, 101, 102, 103, 104, 106, 108, 110, 112, 114, 116, 118, 120, 122, 126, 128, 130, 132, 134, 138, 140, 142, 151, 152, 154, 155, 158 и их гипериммунных фрагментов, для изготовления лекарственного препарата, в особенности для изготовления вакцин против инфекций, вызываемых Staphylococcus aureus и Staphylococcus epidermidis.
Гипериммунный фрагмент определяется как фрагмент идентифицированного антигена, который сам по себе антигенен или может стать антигенным в сочетании с гаптеном. Следовательно, настоящее изобретение также предусматривает антигены или антигенные фрагменты с одной или (для длинных фрагментов) несколькими заменами аминокислот при условии, что антигенные свойства таких фрагментов с заменами аминокислот не ухудшаются сильно при замене(ах), то есть они пригодны для индукции надлежащего иммунного ответа у лиц, вакцинируемых этим антигеном, и идентифицируются индивидуальными препаратами антител из индивидуальных сывороток.
Предпочтительные примеры таких гипериммунных фрагментов реагирующих с гипериммунной сывороткой антигенов выбирают из группы, состоящей из пептидов, содержащих аминокислотные последовательности из столбцов "Предсказанные иммуногенные аминокислоты", "Локализация идентифицированного иммуногенного участка" и "Реактивность сыворотки с релевантным участком" в табл.2а, 2b, 2с и 2d и аминокислотные последовательности из столбца "Предполагаемые области антигенной поверхности" в табл.4 и 5, в особенности пептиды, содержащие аминокислоты №№12-29, 34-40, 63-71, 101-110, 114-122, 130-138, 140-195, 197-209, 215-229, 239-253, 255-274 и 39-94 из Seq.ID No.55,
аминокислоты №№5-39, 111-117, 125-132, 134-141, 167-191, 196-202, 214-232, 236-241, 244-249, 292-297, 319-328, 336-341, 365-380, 385-391, 407-416, 420-429, 435-441, 452-461, 477-488, 491-498, 518-532, 545-556, 569-576, 581-587, 595-602, 604-609, 617-640, 643-651, 702-715, 723-731, 786-793, 805-811, 826-839, 874-889, 37-49, 63-77 и 274-334 из Seq.ID No.56,
аминокислоты №№28-55, 82-100, 105-111, 125-131, 137-143, 1-49 из Seq.ID No.57,
аминокислоты №№33-43, 45-51, 57-63, 65-72, 80-96, 99-110, 123-129, 161-171, 173-179, 185-191, 193-200, 208-224, 227-246, 252-258, 294-308, 321-329, 344-352, 691-707, 358-411 и 588-606 из Seq.ID No.58,
аминокислоты №№16-38, 71-77, 87-94, 105-112, 124-144, 158-164, 169-177, 180-186, 194-204, 221-228, 236-245, 250-267, 336-343, 363-378, 385-394, 406-412, 423-440, 443-449, 401-494 из Seq.ID No.59,
аминокислоты №№18-23, 42-55, 69-77, 85-98, 129-136, 182-188, 214-220, 229-235, 242-248, 251-258, 281-292, 309-316, 333-343, 348-354, 361-367, 393-407, 441-447, 481-488, 493-505, 510-515, 517-527, 530-535, 540-549, 564-583, 593-599, 608-621, 636-645, 656-670, 674-687, 697-708, 726-734, 755-760, 765-772, 785-792, 798-815, 819-824, 826-838, 846-852, 889-904, 907-913, 932-939, 956-964, 982-1000, 1008-1015, 1017-1024, 1028-1034, 1059-1065, 1078-1084, 1122-1129, 1134-1143, 1180-1186, 1188-1194, 1205-1215, 1224-1230, 1276-1283, 1333-1339, 1377-1382, 1415-1421, 1448-1459, 1467-1472, 1537-1545, 1556-1566, 1647-1654, 1666-1675, 1683-1689, 1722-1737, 1740-1754, 1756-1762, 1764-1773, 1775-1783, 1800-1809, 1811-1819, 1839-1851, 1859-1866, 1876-1882, 1930-1939, 1947-1954, 1978-1985, 1999-2007, 2015-2029, 2080-2086, 2094-2100, 2112-2118, 2196-2205, 2232-2243, 198-258, 646-727 и 2104-2206 из Seq.ID No.60,
аминокислоты №№10-29, 46-56, 63-74, 83-105, 107-114, 138-145, 170-184, 186-193, 216-221, 242-248, 277-289, 303-311, 346-360, 379-389, 422-428, 446-453, 459-469, 479-489, 496-501, 83-156 из Seq.ID No.62,
аминокислоты №№14-22, 32-40, 52-58, 61-77, 81-93, 111-117, 124-138, 151-190, 193-214, 224-244, 253-277, 287-295, 307-324, 326-332, 348-355, 357-362, 384-394, 397-434, 437-460, 489-496, 503-510, 516-522, 528-539, 541-547, 552-558, 563-573, 589-595, 602-624, 626-632, 651-667, 673-689, 694-706, 712-739, 756-790, 403-462 из Seq.ID No.66,
аминокислоты №№49-56, 62-68, 83-89, 92-98, 109-115, 124-131, 142-159, 161-167, 169-175, 177-188, 196-224, 230-243, 246-252, 34-46 из Seq.ID No.67,
аминокислоты №№11-20, 26-47, 69-75, 84-92, 102-109, 119-136, 139-147, 160-170, 178-185, 190-196, 208-215, 225-233, 245-250, 265-272, 277-284, 300-306, 346-357, 373-379, 384-390, 429-435, 471-481, 502-507, 536-561, 663-688, 791-816, 905-910, 919-933, 977-985, 1001-1010, 1052-1057, 1070-1077, 1082-1087, 1094-1112, 493-587, 633-715 и 704-760 из Seq.ID No.70,
аминокислоты №№6-20, 53-63, 83-90, 135-146, 195-208, 244-259, 263-314, 319-327, 337-349, 353-362, 365-374, 380-390, 397-405, 407-415, 208-287 и 286-314 из Seq.ID No.71,
аминокислоты №№ 10-26, 31-43, 46-58, 61-66, 69-79, 85-92, 100-115, 120-126, 128-135, 149-155, 167-173, 178-187, 189-196, 202-222, 225-231, 233-240, 245-251, 257-263, 271-292, 314-322, 325-334, 339-345, 59-74 из Seq.ID No.72,
аминокислоты №№4-9, 15-26, 65-76, 108-115, 119-128, 144-153, 38-52 и 66-114 из Seq.ID No.73,
аминокислоты №№5-22, 42-50, 74-81, 139-145, 167-178, 220-230, 246-253, 255-264, 137-237 и 250-267 из Seq.ID No.74,
аминокислоты №№10-26, 31-44, 60-66, 99-104, 146-153, 163-169, 197-205, 216-223, 226-238, 241-258, 271-280, 295-315, 346-351, 371-385, 396-407, 440-446, 452-457, 460-466, 492-510, 537-543, 546-551, 565-582, 590-595, 635-650, 672-678, 686-701, 705-712, 714-721, 725-731, 762-768, 800-805, 672-727 из Seq.ID No.75.
аминокислоты №№5-32, 35-48, 55-76 из Seq.ID No.76,
аминокислоты №№7-35, 54-59, 247-261, 263-272, 302-320, 330-339, 368-374, 382-411, 126-143 и 168-186 из Seq.ID No.77,
аминокислоты №№5-24, 88-94, 102-113, 132-143, 163-173, 216-224, 254-269, 273-278, 305-313, 321-327, 334-341, 31-61 и 58-74 из Seq.ID No.78,
аминокислоты №№16-24, 32-39, 43-49, 64-71, 93-99, 126-141, 144-156, 210-218, 226-233, 265-273, 276-284, 158-220 из Seq.ID No.79,
аминокислоты №№49-72, 76-83, 95-105, 135-146, 148-164, 183-205, 57-128 из Seq.ID No.80,
аминокислоты №№6-15, 22-32, 58-73, 82-88, 97-109, 120-131, 134-140, 151-163, 179-185, 219-230, 242-255, 271-277, 288-293, 305-319, 345-356, 368-381, 397-406, 408-420, 427-437, 448-454, 473-482, 498-505, 529-535, 550-563, 573-580, 582-590, 600-605, 618-627, 677-685, 718-725, 729-735, 744-759, 773-784, 789-794, 820-837, 902-908, 916-921, 929-935, 949-955, 1001-1008, 1026-1032, 1074-1083, 1088-1094, 1108-1117, 1137-1142, 1159-1177, 1183-1194, 1214-1220, 1236-1252, 1261-1269, 1289-1294, 1311-1329, 1336-1341, 1406-1413, 1419-1432, 1437-1457, 1464-1503, 1519-1525, 1531-1537, 1539-1557, 1560-1567, 1611-1618, 1620-1629, 1697-1704, 1712-1719, 1726-1736, 1781-1786, 1797-1817, 1848-1854, 1879-1890, 1919-1925, 1946-1953, 1974-1979, 5-134 из Seq.ID No.81,
аминокислоты №№6-33, 40-46, 51-59, 61-77, 84-104, 112-118, 124-187, 194-248, 252-296, 308-325, 327-361, 367-393, 396-437, 452-479, 484-520, 535-545, 558-574, 582-614, 627-633, 656-663, 671-678, 698-704, 713-722, 725-742, 744-755, 770-784, 786-800, 816-822, 827-837, 483-511 из Seq.ID No.82,
аминокислоты №№4-19, 57-70, 79-88, 126-132, 144-159, 161-167, 180-198, 200-212, 233-240, 248-255, 276-286, 298-304, 309-323, 332-346, 357-366, 374-391, 394-406, 450-456, 466-473, 479-487, 498-505, 507-519, 521-530, 532-540, 555-565, 571-581, 600-611, 619-625, 634-642, 650-656, 658-665, 676-682, 690-699, 724-733, 740-771, 774-784, 791-797, 808-815, 821-828, 832-838, 876-881, 893-906, 922-929, 938-943, 948-953, 969-976, 1002-1008, 1015-1035, 1056-1069, 1105-1116, 1124-1135, 1144-1151, 1173-1181, 1186-1191, 1206-1215, 1225-1230, 1235-1242, 6-66, 65-124 и 590-604 из Seq.ID No.83,
аминокислоты №№5-32, 66-72, 87-98, 104-112, 116-124, 128-137, 162-168, 174-183, 248-254, 261-266, 289-303, 312-331, 174-249 из Seq.ID No.84,
аминокислоты №№4-21, 28-40, 45-52, 59-71, 92-107, 123-137, 159-174, 190-202, 220-229, 232-241, 282-296, 302-308, 312-331, 21-118 из Seq.ID No.85,
аминокислоты №№9-28, 43-48, 56-75, 109-126, 128-141, 143-162, 164-195, 197-216, 234-242, 244-251, 168-181 из Seq.ID No.87,
аминокислоты №№4-10, 20-42, 50-86, 88-98, 102-171, 176-182, 189-221, 223-244, 246-268, 276-284, 296-329, 112-188 из Seq.ID No.88,
аминокислоты №№4-9, 13-24, 26-34, 37-43, 45-51, 59-73, 90-96, 99-113, 160-173, 178-184, 218-228, 233-238, 255-262, 45-105, 103-166 и 66-153 из Seq.ID No.89,
аминокислоты №№13-27, 42-63, 107-191, 198-215, 218-225, 233-250, 474-367 из Seq.ID No.90,
аминокислоты №№26-53, 95-123, 164-176, 189-199, 8-48 из Seq.ID No.92,
аминокислоты №№7-13, 15-23, 26-33, 68-81, 84-90, 106-117, 129-137, 140-159, 165-172, 177-230, 234-240, 258-278, 295-319, 22-56, 23-99, 97-115, 233-250 и 245-265 из Seq.ID No.94,
аминокислоты №№13-36, 40-49, 111-118, 134-140, 159-164, 173-183, 208-220, 232-241, 245-254, 262-271, 280-286, 295-301, 303-310, 319-324, 332-339, 1-85, 54-121 и 103-185 из Seq.ID No.95,
аминокислоты №№39-44, 46-80, 92-98, 105-113, 118-123, 133-165, 176-208, 226-238, 240-255, 279-285, 298-330, 338-345, 350-357, 365-372, 397-402, 409-415, 465-473, 488-515, 517-535, 542-550, 554-590, 593-601, 603-620, 627-653, 660-665, 674-687, 698-718, 726-739, 386-402 из Seq.ID No.96,
аминокислоты №№5-32, 34-49, 1-43 из Seq.ID No.97,
аминокислоты №№10-27, 37-56, 64-99, 106-119, 121-136, 139-145, 148-178, 190-216, 225-249, 251-276, 292-297, 312-321, 332-399, 403-458, 183-200 из Seq.ID No.99,
аминокислоты №№5-12, 15-20, 43-49, 94-106, 110-116, 119-128, 153-163, 175-180, 185-191, 198-209, 244-252, 254-264, 266-273, 280-288, 290-297, 63-126 из Seq.ID No.100,
аминокислоты №№5-44, 47-55, 62-68, 70-78, 93-100, 128-151, 166-171, 176-308, 1-59 из Seq.ID No.101,
аминокислоты №№18-28, 36-49, 56-62, 67-84, 86-95, 102-153, 180-195, 198-218, 254-280, 284-296, 301-325, 327-348, 353-390, 397-402, 407-414, 431-455, 328-394 из Seq.ID No.102,
аминокислоты №№7-37, 56-71, 74-150, 155-162, 183-203, 211-222, 224-234, 242-272, 77-128 из Seq.ID No.103,
аминокислоты №№34-58, 63-69, 74-86, 92-101, 130-138, 142-150, 158-191, 199-207, 210-221, 234-249, 252-271, 5-48 из Seq.ID No.104,
аминокислоты №№12-36, 43-50, 58-65, 73-78, 80-87, 108-139, 147-153, 159-172, 190-203, 211-216, 224-232, 234-246, 256-261, 273-279, 286-293, 299-306, 340-346, 354-366, 167-181 из Seq.ID No.106,
аминокислоты №№61-75, 82-87, 97-104, 113-123, 128-133, 203-216, 224-229, 236-246, 251-258, 271-286, 288-294, 301-310, 316-329, 337-346, 348-371, 394-406, 418-435, 440-452 из Seq.ID No.112,
аминокислоты №№30-37, 44-55, 83-91, 101-118, 121-128, 136-149, 175-183, 185-193, 206-212, 222-229, 235-242 из Seq.ID No.114,
аминокислоты №№28-38, 76-91, 102-109, 118-141, 146-153, 155-161, 165-179, 186-202, 215-221, 234-249, 262-269, 276-282, 289-302, 306-314, 321-326, 338-345, 360-369, 385-391 из Seq.ID No.116,
аминокислоты №№9-33, 56-62, 75-84, 99-105, 122-127, 163-180, 186-192, 206-228, 233-240, 254-262, 275-283, 289-296, 322-330, 348-355, 416-424, 426-438, 441-452, 484-491, 522-528, 541-549, 563-569, 578-584, 624-641, 527-544 из Seq.ID No.142,
аминокислоты №№37-42, 57-62, 121-135, 139-145, 183-190, 204-212, 220-227, 242-248, 278-288, 295-300, 304-309, 335-341, 396-404, 412-433, 443-449, 497-503, 505-513, 539-545, 552-558, 601-617, 629-649, 702-711, 736-745, 793-804, 814-829, 843-858, 864-885, 889-895, 905-913, 919-929, 937-943, 957-965, 970-986, 990-1030, 1038-1049, 1063-1072, 1080-1091, 1093-1116, 1126-1136, 1145-1157, 1163-1171, 1177-1183, 1189-1196, 1211-1218, 1225-1235, 1242-1256, 1261-1269, 624-684 из Seq.ID No.151,
аминокислоты №№8-23, 31-38, 42-49, 61-77, 83-90, 99-108, 110-119, 140-147, 149-155, 159-171, 180-185, 189-209, 228-234, 245-262, 264-275, 280-302, 304-330, 343-360, 391-409, 432-437, 454-463, 467-474, 478-485, 515-528, 532-539, 553-567, 569-581, 586-592, 605-612, 627-635, 639-656, 671-682, 700-714, 731-747, 754-770, 775-791, 797-834, 838-848, 872-891, 927-933, 935-942, 948-968, 976-986, 1000-1007, 1029-1037, 630-700 из Seq.ID No.152,
аминокислоты №№17-25, 27-55, 84-90, 95-101, 115-121, 55-101 из Seq.ID No.154,
аминокислоты №№13-28, 40-46, 69-75, 86-92, 114-120, 126-137, 155-172, 182-193, 199-206, 213-221, 232-238, 243-253, 270-276, 284-290, 22-100 из Seq.ID No.155,
аминокислоты №№7-19, 46-57, 85-91, 110-117, 125-133, 140-149, 156-163, 198-204, 236-251, 269-275, 283-290, 318-323, 347-363, 9-42 и 158-174 из Seq.ID No.158,
аминокислоты №№7-14, 21-30, 34-50, 52-63, 65-72, 77-84, 109-124, 129-152, 158-163, 175-190, 193-216, 219-234 из Seq.ID No.168,
аминокислоты №№5-24, 38-44, 100-106, 118-130, 144-154, 204-210, 218-223, 228-243, 257-264, 266-286, 292-299 из Seq.ID No.174,
аминокислоты №№29-44, 74-83, 105-113, 119-125, 130-148, 155-175, 182-190, 198-211, 238-245 из Seq.ID No.176,
и фрагменты, содержащие не менее 6, предпочтительно более 8, в особенности более 10 аминокислот из указанных последовательностей. Все эти фрагменты поодиночке и каждый из них независимо образуют предпочтительный отдельный аспект настоящего изобретения.
Из этих антигенов также могут происходить особенно пригодные Т-хелперные эпитопы. Особенно предпочтительными Т-хелперными эпитопами являются пептиды, содержащие фрагменты, выбранные из пептидов, указанных в столбце "Предполагаемые области антигенной поверхности" в табл.4 и 5, а также из группы аминокислот №№6-40, 583-598, 620-646 и 871-896 из Seq.ID No.56, аминокислот №№24-53 из Seq.ID No.70, аминокислот №№240-260 из Seq.ID No.74, аминокислот №№1660-1682 и 1746-1790 из Seq.ID No.81, аминокислот №№1-29, 680-709 и 878-902 из Seq.ID No.83, аминокислот №№96-136 из Seq.ID No.89, аминокислот №№1-29, 226-269 и 275-326 из Seq.ID No.94, аминокислот №№23-47 и 107-156 из Seq.ID No.114, аминокислот №№24-53 из Seq.ID No.142 и их фрагментов, являющихся Т-клеточными эпитопами.
В соответствии с другим аспектом, настоящее изобретение касается вакцин, содержащих такой реагирующий с гипериммунной сывороткой антиген или его фрагмент, указанный выше для Staphylococcus aureus и Staphylococcus epidermidis. Такая вакцина может включать один или несколько антигенов S.aureus и S.epidermidis. При необходимости такие антигены S.aureus и S.epidermidis можно комбинировать с антигенами других патогенов в комбинированной вакцине. Предпочтительно такая вакцина дополнительно включает иммуностимулирующее вещество, предпочтительно выбранное из группы, содержащей поликатионные полимеры, в особенности поликатионные пептиды, иммуностимуляторные дезоксинуклеотиды (ODNs), нейроактивные соединения, особенно гормон роста человека, квасцы, полный или неполный адъюванты Фрейнда или их комбинации. Такая вакцина может также содержать антиген, полученный по технологии поверхностного дисплея белков, представленный на поверхности генетически измененного микроорганизма типа Е.coli.
В соответствии со следующим аспектом, настоящее изобретение касается специфических препаратов, содержащих антитела, полученные по меньшей мере против одного из антигенов или антигенных фрагментов Staphylococcus aureus и Staphylococcus epidermidis, определенных выше. Эти антитела предпочтительно являются моноклональными антителами.
Способы получения таких препаратов антител, поликлональных или моноклональных, вполне доступны специалисту в этой области и хорошо описаны ранее. Предпочтительный способ получения такого препарата моноклональных антител характеризуется следующими стадиями:
- индукция иммунного ответа у животного (не человека) введением антигена стафилококка или его фрагмента, определенного выше, данному животному,
- изъятие селезенки или клеток селезенки у животного,
- получение клеток гибридомы из селезенки или клеток селезенки,
- селекция и клонирование клеток гибридомы, специфичных к этому антигену,
- получение препарата антител путем культивирования клонированных клеток гибридомы и при необходимости дополнительные стадии очистки.
Предпочтительно изъятие селезенки или клеток селезенки связано с забоем животного.
Моноклональные антитела и их фрагменты можно сделать химерными или гуманизированными (Graziano et al., 1995), что делает возможным их повторное введение. В качестве альтернативы моноклональные антитела человека и их фрагменты можно получить из библиотеки фагового дисплея (McGuinnes et al., 1996) или из трансгенных животных (Brüggemann et al., 1996).
Предпочтительный способ получения препаратов поликлональных антител против антигенов Staphylococcus aureus или Staphylococcus epidermidis, идентифицированных в настоящем изобретении, характеризуется следующими стадиями:
- индукция иммунного ответа у животного (не человека) введением антигена стафилококка или его фрагмента, определенного выше, данному животному,
- изъятие содержащей антитела внутренней среды организма у животного,
- получение препарата антител, подвергая содержащую антитела внутреннюю среду организма дополнительным стадиям очистки.
Эти препараты моноклональных или поликлональных антител можно применять для изготовления лекарственного средства для лечения или профилактики заболеваний, вызванных стафилококковой инфекцией. Кроме того, их можно применять для диагностики и интраскопии.
Далее способ описывается на следующих примерах и фигурах, но не должен ограничиваться ими.
ПРИМЕРЫ
Открытие новых антигенов Staphylococcus aureus
Пример 1. Получение антител из сывороток человека
Антитела, вырабатываемые иммунной системой человека против стафилококков и находящиеся в сыворотке человека, свидетельствуют об экспрессии антигенных белков и их иммуногенности. Эти молекулы необходимы для идентификации индивидуальных антигенов способом настоящего изобретения, который основывается на взаимодействии специфических антител против стафилококков с соответствующими пептидами или белками S.aureus. Чтобы получить доступ к релевантному репертуару антител, собирали человеческие сыворотки у: I) пациентов с острыми инфекциями S.aureus, такими как бактериемия, сепсис, инфекции от сосудистых и подкожных катетеров и устройств, раневые инфекции, инфекции поверхностных и глубоких мягких тканей. Медико-микробиологические анализы показали, что возбудителем является S.aureus; II) коллекцию сывороток от неинфицированных взрослых также использовали для анализа, поскольку стафилококковые инфекции нередки и наличие антител является следствием естественной иммунизации от предыдущих контактов со стафилококками при инфекциях кожи и мягких тканей (фурункулы, раневые инфекции, периодонтит и т.п.).
Сыворотки исследовали на антитела против S.aureus серией анализов ELISA. Использовали несколько стафилококковых антигенов, чтобы подтвердить, что измеряемые титры не являются следствием суммирования антител с перекрестной реактивностью. С этой целью в методе ELISA использовали не только экстракты (лишенные белка А) целых клеток S.aureus (культивированных в различных условиях) или целые бактерии, но также индивидуальные компоненты клеточной стенки, такие как липотейхоевая кислота и пептидогликаны, выделенные из S.aureus. Еще более важно то, что была создана коллекция рекомбинантных белков, представляющих известные белки клеточной поверхности стафилококков, для лучшей характеристики данной коллекции сывороток человека.
Недавно сообщалось, что в сыворотке не только антитела класса IgG, но и IgA могут распознаваться рецепторами FcRIII клеток PMNs и вызывать опсонизацию (Phillips-Quagliata et al., 2000; Shibuya et al., 2000). Основная роль антител класса IgA состоит в нейтрализации, главным образом на поверхности слизистых оболочек. Уровень IgA в сыворотке отражает качество, количество и специфичность димерных секреторных IgA. По этой причине коллекцию сывороток анализировали не только на антитела против стафилококков класса IgG, но и на уровень IgA. В методе ELISA использовали высокоспецифичные вторичные реагенты, чтобы обнаружить антитела высокоаффинных типов, такие как IgG и IgA, и избежать IgM. Продукция антител IgM происходит при первичном гуморальном адаптивном ответе и ведет к образованию низкоаффинных антител, тогда как антитела классов IgG и IgA уже подвергались созреванию аффинности и они представляют большую ценность в борьбе с заболеваниями или их профилактике.
Экспериментальная часть
Твердофазный иммуноферментный анализ (ELISA). Чашки для ELISA покрывали различными антигенами (2-10 мкг/мл) в покровном буфере (карбонат натрия, рН 9,2).
Серийные разведения сывороток (100-100000) делали в буфере TBS-BSA. Высокоспецифичные (подвергнутые перекрестному адсорбированию) вторичные антитела против IgG или IgA человека, меченые пероксидазой хрена (HRP), использовали согласно рекомендациям изготовителя (Southern Biotech, ˜2000×). Комплексы антиген-антитело количественно определяли, измеряя превращение субстрата (ABTS) в окрашенный продукт по значениям OD450нм на автоматическом считывающем приборе для ELISA (Wallace Victor 1420). Титры сравнивали при таких разведениях, при которых сохраняется линейность ответа (табл.1). Около 100 образцов сыворотки ранжировали по реактивности ко множественным компонентам стафилококков и имевшие наивысший ранг (процентиль свыше 90%) отбирали для дальнейшего анализа по идентификации антигенов. Важно то, что антитела против стафилококков из сывороток клинически здоровых лиц оказались очень стабильными, давая одинаково высокие титры методом ELISA ко всем стафилококковым антигенам при измерении через 3, 6 и 9 месяцев (данные не приводятся). Напротив, антитела против S.aureus у больных снижаются, а затем пропадают через пару недель после заражения (Coloque-Navarro et al., 1998). Однако антитела от больных очень важны, так как они являются прямым доказательством экспрессии in vivo бактериальных антигенов, тестируемых методом ELISA или идентифицированных как иммуногенные при скрининге согласно настоящему изобретению.
Такой комплексный подход, которого придерживались при анализе антител, является уникальным, и он привел к однозначной идентификации гипериммунных антистафилококковых сывороток.
Очистка антител для геномного скрининга. Было отобрано 5 сывороток из группы больных и группы неинфицированных лиц на основании общего титра против стафилококков. Антитела против белков Е.coli удаляли либо путем инкубации инактивированных нагреванием сывороток с целыми клетками Е.coli (DH5a, трансформированные pHIE11, культивированные в тех же условиях, что и для бактериального дисплея), либо путем аффинной хроматографии лизатов Е.coli для рибосомного дисплея. Сильно обогащенные препараты IgG получали из пула истощенных сывороток получали методом аффинной хроматографии на белке G согласно инструкциям изготовителя (UltraLink Immobilized Protein G фирмы Pierce). Антитела IgA также получали методом аффинной хроматографии, используя меченные биотином антитела к IgA человека (Southern Biotech), иммобилизованные на стрептавидин-агарозе (Gibco BRL). Эффективность истощения и очистки проверяли методами ДДС-Na-ПАГ-электрофореза, Вестерн-блоттинга, ELISA и измерения концентрации белка. Для протеомного анализа не требовалось истощения препаратов IgG и IgA, так как вторичный реагент обеспечивал специфичность.
Пример 2. Создание в высокой степени случайных, отобранных по рамке, библиотек малых фрагментов геномной ДНК Staphylococcus aureus
Экспериментальная часть
Получение геномной ДНК стафилококков. Этот метод был разработан как модификация двух ранее опубликованных методик (Sohail, 1998; Batley et al., 1984) и первоначально был адаптирован для метициллин-резистентного штамма COL S.aureus с целью получения геномной ДНК высокого качества и в большом количестве. 500 мл среды BHI (Brain Heart Infusion) с добавлением тетрациклина (5 мкг/мл) инокулировали бактериями с замороженного косяка и культивировали с аэрированием и встряхиванием в течение 18 ч при 37°С. После этого культуру собирали двумя порциями по 250 мл, центрифугировали при 1600 g в течение 15 мин и удаляли супернатант. Осадки бактерий тщательно ресуспендировали в 26 мл 0,1 М трис-HCl, рН 7,6, и снова центрифугировали при 1600 g в течение 15 мин. Осадки ресуспендировали в 20 мл 1 мМ трис-HCl, рН 7,6, 0,1 мМ ЭДТА, и переносили в стерильные полипропиленовые пробирки на 50 мл. В каждую пробирку добавляли 1 мл обработанной нагреванием РНКазы А (10 мг/мл) и 200 ед. РНКазы Т1 и тщательно перемешивали. Затем в пробирки вносили по 250 мкл лизостафина (концентрат 10 мг/мл, свежеприготовленный раствор в б/д Н2О), тщательно перемешивали и инкубировали 10 мин при 40°С на водяной бане с постоянным встряхиванием. После добавления 1 мл 10% ДДС-Na, 40 мкл протеиназы К (концентрат 25 мг/мл) и 100 мкл проназы (10 мг/мл) пробирки несколько раз переворачивали и инкубировали 5 мин при 40°С на водяной бане со встряхиванием. Затем добавляли 3,75 мл 5 М NaCl и 2,5 мл раствора цетилтриметиламмонийбромида (СТАВ) (10% вес/об., 4% вес/об. NaCl) и опять инкубировали пробирки 10 мин при 65°С на водяной бане со встряхиванием. Образцы охлаждали до комнатной температуры и экстрагировали смесью PhOH/CHCl3/IAA (25:24:1) и смесью CHCl3/IAA (24:1). Водные фазы тщательно собирали и переносили в новые стерильные пробирки на 50 мл. В каждую пробирку добавляли 1,5 мл смолы Strataclean™, осторожно, но тщательно перемешивали и инкубировали 1 мин при комнатной температуре. Образцы центрифугировали и собирали верхние слои, содержащие ДНК, в новые пробирки на 50 мл. ДНК осаждали при комнатной температуре добавлением 0,6 объема изопропанола, вытягивали из раствора стерильной пастеровской пипеткой и переносили в пробирки, содержащие охлажденный во льду 80% этанол. ДНК собирали центрифугированием осадков при 10-12000 g, высушивали на воздухе и растворяли в б/д Н2O.
Получение малых фрагментов геномной ДНК. Фрагменты геномной ДНК расщепляли механически на фрагменты размером от 150 до 300 п.о. путем обработки ультразвуком (ультразвуковой дефинтегратор типа стаканчик-зонд Bandelin Sonoplus UV 2200, снабженный зондом ВВ5, пульсы по 10 сек при 100% мощности) или на фрагменты размером от 50 до 70 п.о. путем мягкой обработки ДНКазой I (Novagen). Оказалось, что обработка ультразвуком давала значительно более узкое распределение фрагментов по размеру при разрушении ДНК на фрагменты в пределах 150-300 п.о. Однако, даже подвергая ДНК исчерпывающему воздействию гидромеханического срезывающего усилия, индуцируемого ультразвуковой волной, не удавалось достичь эффективного и воспроизводимого уменьшения размера фрагментов. Поэтому фрагменты ДНК размером от 50 до 70 п.о. получали путем мягкой обработки ДНКазой I, используя набор для расщепления для метода «shotgun» фирмы Novagen. ДНКазу I из набора разводили 1:20 и проводили расщепление в присутствии MnCl2 в объеме 60 мкл при 20°С в течение 5 мин, обеспечивая расщепление двойной нити ферментом. Реакции останавливали добавлением 2 мкл 0,5 М ЭДТА и оценивали эффективность расщепления на 2% ТАЕ-агарозном геле. Такая обработка приводила к полному расщеплению геномной ДНК на фрагменты около 50-70 п.о. Затем концы фрагментов дважды "затупляли" с помощью ДНК-полимеразы Т4 в присутствии 100 мкМ каждого из dNTPs, обеспечивая эффективное заполнение выступающих концов. Фрагменты сразу использовали для реакций лигирования либо замораживали при -20°С для последующего использования.
Описание векторов. Вектор pMAL4.1 был сконструирован на основе рЕН1 (Hashemzadeh-Bonehi et al., 1998) с геном устойчивости к канамицину. Кроме того, он несет ген β-лактамазы (bla), встроенный в сайт множественного клонирования. Гену bla предшествует последовательность лидерного пептида оmрА, обеспечивая эффективную секрецию через цитоплазматическую мембрану. Сайт рестрикции SmaI служит для инсерции библиотеки. Впереди (upstream) от сайта SmaI находится сайт FseI, а позади (downstream) - сайт NotI, которые использовались для извлечения отобранных фрагментов. Эти три сайта рестрикции вставлены после лидерной последовательности оmрА таким образом, что ген bla транскрибируется в рамке считывания -1, вследствие чего стоп-кодон находится на расстоянии 15 п.о. после сайта NotI. Вставка +1 п.о. восстанавливает открытую рамку считывания (ORF) для bla так, что вырабатывается белок β-лактамазы вместе с последующим приобретением устойчивости к ампициллину.
Вектор pMAL4.31 был сконструирован на основе pASK-IBA (Skerra, 1994) с заменой гена р-лактамазы геном устойчивости к канамицину. Кроме того, он несет ген β-лактамазы (bla), встроенный в сайт множественного клонирования. Перед последовательностью, кодирующей зрелую β-лактамазу, находится последовательность лидерного пептида оmрА, обеспечивая эффективную секрецию через цитоплазматическую мембрану. Кроме того, за последовательностью лидерного пептида ompA следует последовательность, кодирующая первые 12 аминокислот (спейсер) зрелой β-лактамазы, чтобы избежать слияния последовательностей сразу после сайта расщепления сигнальной пептидазой, так как, например, кластеры положительно заряженных аминокислот в этой области могли бы уменьшить или устранить транслокацию через цитоплазматическую мембрану (Kajava et al, 2000). Сайт рестрикции Smal служит для вставки библиотеки. Впереди (upstream) от сайта Smal находится сайт Fsel, а позади (downstream) - сайт NotI, которые использовались для извлечения отобранных фрагментов. Эти три сайта рестрикции вставлены после последовательности, кодирующей спейсер из 12 аминокислог таким образом, что ген bla транскрибируется в рамке считывания -1, вследствие чего стоп-кодон на расстоянии 15 п.о. находится после сайта NotI. Вставка +1 п.о. восстанавливает ORF для bla так, что вырабатывается белок β-лактамазы вместе с закономерным приобретением устойчивости к ампициллину.
Вектор pMAL9.1 был сконструирован путем клонирования гена lamB в сайт множественного клонирования рЕН1. После этого в lamB после аминокислоты 154 вставили последовательность, содержащую сайты рестрикции Fsel, Smal и NotI. При этом рамку считывания выбирали таким образом, чтобы при переносе в плазмиду pMAL9.1 отобранных по рамке фрагментов ДНК, вырезанных при расщеплении с помощью Fsel и NotI из плазмиды pMAL4.1 или pMAL4.31, получалась непрерывная рамка считывания для lamB и соответствующей вставки.
Вектор pHIE11 был сконструирован путем клонирования гена fhuA в сайт множественного клонирования рЕН1. После этого в fhuA после аминокислоты 405 вставили последовательность, содержащую сайты рестрикции FseI, XbaI и NotI. При этом рамку считывания выбирали таким образом, чтобы при переносе в плазмиду pHIE11 отобранных по рамке фрагментов ДНК, вырезанных при расщеплении с помощью FseI и NotI из плазмиды pMAL4.1 или pMAL4.31, получалась непрерывная рамка считывания для fhuA и соответствующей вставки. 7
Клонирование и анализ библиотеки для селекции по рамке считывания. Фрагменты геномной ДНК S.aureus лигировали в сайт SmaI вектора pMAL4.1 или pMAL4.31. Рекомбинатную ДНК вводили путем электропорации в электрокомпетентные клетки Е.coli DH10B (Gibco BRL), и высевали трансформанты на LB-агар с канамицином (50 мкг/мл) и ампициллином (50 мкг/мл). Чашки инкубировали в течение ночи при 37°С и собирали колонии для выделения большого количества ДНК. Отбирали репрезентативную чашку и сохраняли для сбора колоний для ПЦР-анализа колоний и масштабного секвенирования. Использовали простой ПЦР-анализ одиночных колоний для предварительного грубого определения размера фрагментов, а также эффективности встраивания. По результатам секвенирования определяли точный размер фрагментов, целостность соединения по месту встраивания и правильность выбора рамки (правило 3n+1).
Клонирование и анализ библиотеки для дисплея на бактериальной поверхности. Фрагменты геномной ДНК вырезали из векторов pMAL4.1 или pMAL4.31, содержащих библиотеку S.aureus, с помощью рестрикционных ферментов Fsel и NotI. Затем всю популяцию фрагментов переносили в плазмиды pMAL9.1 (LamB) или pHIE11 (FhuA), предварительно расщепленные FseI и NotI. Применение этих двух рестрикционных ферментов, распознающих богатые GC последовательности в 8 п.о., позволяет сохранить в каждом из несущих векторов те рамки считывания, которые были отобраны в векторе pMAL4.1 или pMAL4.31. Затем плазмидную библиотеку трансформировали в клетки Е.coli DH5a с помощью электропорации. Клетки засевали на большие чашки с LB-агаром и канамицином (50 мкг/мл) и культивировали в течение ночи при 37°С при плотности, позволяющей получить четко различимые одиночные колонии. Затем клетки соскабливали с поверхности этих чашек, промывали свежей средой LB и хранили порциями при -80°С для скрининга библиотеки.
Результаты
Библиотеки для селекции по рамке считывания. Были созданы две библиотеки (LSA50/6 и LSA250/1) в векторе pMLA4.1 с размерами вставок примерно 50 и 250 п.о., соответственно. Из обеих библиотек после селекции по рамке в целом было получено 1-2×106 клонов при использовании примерно 1 мкг ДНК плазмиды pMAL4.1 и 50 нг фрагментированной геномной ДНК S.aureus. Для оценки случайного характера библиотеки LSA50/6 просеквенировали 672 выбранных по случайной схеме клонов. Биоинформатический анализ показал, что ни один из этих клонов не был представлен более одного раза. Кроме того, было показано, что 90% клонов попадают в диапазон размеров от 19 до 70 п.о. при среднем размере 25 п.о. (фиг.2). У всех 672 клонов выполнялось правило 3n+1, свидетельствуя, что у всех клонов произошел правильный выбор рамки.
Библиотеки дисплея на бактериальной поверхности. Для дисплея пептидов на поверхности Е.coli нужно было перенести вставки из библиотеки LSA50/6 из вектора для селекции по рамке pMAL4.1 в дисплейные плазмиды pMAL9.1 (LamB) или pHIE11 (FhuA). Фрагменты геномной ДНК вырезали рестрикционными ферментами Fsel и NotI и после лигирования 5 нг вставок с 0,1 мкг плазмидной ДНК получили 2-5·106 клонов. Клоны соскабливали с LB-чашек и замораживали без дополнительной амплификации.
Пример 3. Идентификация последовательностей сильно иммуногенных пептидов S.aureus при помощи геномных библиотек дисплея на бактериальной поверхности и сыворотки человека
Экспериментальная часть
Скрининг методом магнитной сортировки клеток (MACS). Приблизительно 2,5×108клеток из определенной библиотеки культивировали в 5 мл среды LB с канамицином (50 мкг/мл) в течение 2 ч при 37°С. Экспрессию индуцировали добавлением 1 мМ IPTG в течение 30 мин. Клетки промывали 2 раза свежей средой LB и примерно 2×107 клеток ресуспендировали в 100 мкл среды LB и переносили в микропробирку (Eppendorf).
К клеткам добавляли 10 мкг биотинилированной сыворотки человека и суспензию инкубировали в течение ночи при 4°С со слабым встряхиванием. Добавляли 900 мкл среды LB, суспензию перемешивали, а затем центрифугировали 10 мин при 6000 об/мин при 4°С. Клетки промывали один раз 1 мл LB, а затем ресуспендировали в 100 мкл среды LB. Добавляли 10 мкл микрошариков для MACS, конъюгированных со стрептавидином (Miltenyi Biotech, Германия), и проводили инкубацию в течение 20 мин при 4°С. После этого добавляли 900 мкл среды LB и суспензию микрошариков для MACS с клетками наносили на уравновешенную колонку MS (Miltenyi Biotech, Германия) с прикрепленным к ней магнитом. Колонку MS уравновешивали пропусканием 1 мл 70% EtOH и два раза по 2 мл среды LB.
Колонку затем промывали три раза по 3 мл среды LB. Элюирование проводили, убирая магнит и пропуская 2 мл среды LB. После промывки колонки 3 мл среды LB повторно наносили 2 мл элюата на ту же колонку и повторяли процесс промывки и элюирования. Процесс нанесения, промывки и элюирования повторяли и третий раз, получая 2 мл конечного элюата.
Второй цикл скрининга проводили следующим образом. Клетки из конечного элюата собирали центрифугированием и ресуспендировали в 1 мл среды LB с канамицином (50 мкг/мл). Культуру инкубировали 90 мин при 37°С, а затем индуцировали с помощью 1 мМ IPTG в течение 30 мин. После этого клетки промывали 1 мл среды LB и суспендировали в 10 мкл среды LB. Поскольку объем уменьшился, то добавляли 1 мкг биотинилированной сыворотки человека и суспензию инкубировали в течение ночи при 4°С со слабым встряхиванием. Все дальнейшие операции были точно такими же, как в первом цикле селекции. Прошедшие два цикла селекции клетки высевали на чашки с LB-агаром с канамицином (50 мкг/мл) и культивировали в течение ночи при 37°С.
Анализ отобранных клонов путем секвенирования и Вестерн-блоттинга. Прошедшие селекцию клоны культивировали в течение ночи при 37°С в 3 мл среды LB с канамицином (50 мкг/мл) для получения плазмидной ДНК стандартными методами. Секвенирование проводили в MWG (Германия) или совместно с TIGR (США).
Для Вестерн-блоттинга приблизительно от 10 до 20 мкг общего клеточного белка разделяли методом ДДС-Na-ПАГ-электрофореза в 10%-м геле и переносили на мембрану HybondC (Amersham Pharmacia Biotech, Англия). Слитые с LamB или FhuA белки детектирвали, используя сыворотку человека в качестве первичного антитела при разведении 1:5000 и конъюгированные с HRP антитела против IgG человека в качестве вторичного антитела. Детектирование проводили с помощью набора для детекции на основе усиленной хемилюминесценции ECL (Amersham Pharmacia Biotech, Англия). В качестве альтернативы использовали кроличьи антитела к FhuA или мышиные антитела к LamB в качестве первичного антитела в сочетании с соответствующими вторичными антителами, конъюгированными с HRP, для детекции слитых белков.
Результаты
Скрининг библиотек дисплея на бактериальной поверхности методом магнитной сортировки клеток (MACS) с помощью биотинилированной сыворотки человека. Библиотеки LSA50/6 в pMAL9.1 и LSA250/1 в рHIЕ11 подвергали скринингу при помощи пула биотинилированных сывороток больных (см. Пример 1 - Получение антител из сыворотки человека). Процесс селекции проводили, как описано в разделе "Экспериментальная часть". В качестве контроля использовали пул детских сывороток, взятых у младенцев, которые вряд ли могли подвергаться инфекции S.aureus. В описанных условиях обычно отбирали в 10-50 раз больше клеток с использованием сыворотки больных, чем детской сыворотки (фиг.3). Для оценки эффективности скрининга выбрали по случайной схеме около 100 прошедших селекцию клонов и подвергли их Вестерн-блоттингу с тем же пулом сывороток больных. Такой анализ показал, что от 30 до 50% прошедших селекцию клонов реагировали с антителами, присутствующими в сыворотке больных, тогда как контрольный штамм, экспрессирующий LamB или FhuA без S.aureus - специфичной вставки, не реагировал с этой сывороткой. ПЦР-анализ одиночных колоний показал, что все прошедшие селекцию клоны содержали вставку в ожидаемом диапазоне размеров.
Последующее секвенирование большего числа выбранных по случайной схеме клонов (от 500 до 800 на один скрининг) привело к идентификации гена и соответствующей последовательности пептида или белка, специфически узнаваемого используемой для скрининга сывороткой больных. Частота, с которой определенный клон отбирается при селекции, отражает, по крайней мере частично, распространенность и/или аффинность специфических антител в сыворотке, используемых для селекции и распознающих эпитоп, представленный этим клоном. В этом отношении удивительно, что некоторые клоны (ORF2264, ORF1951, ORF0222, липаза и IsaA) встречались до 90 раз, что указывает на их высокую иммуногенность. Все клоны, представленные в табл.2, были проверены методом Вестерн-блоттинга с использованием экстрактов целых клеток из одиночных клонов для подтверждения указанной реактивности с пулом сывороток человека, использовавшимся при скрининге.
Кроме того, следует отметить, что большинство генов, идентифицированных при скрининге дисплея на бактериальной поверхности, кодируют белки, которые прикрепляются к поверхности S.aureus и/или секретируются. Это согласуется с ожидаемой ролью прикрепленных к поверхности и секретируемых белков в вирулентности S.aureus.
Оценка реактивности сильно иммуногенных пептидных последовательностей с различными сыворотками человека. Использовали от 10 до 30 различных сывороток больных для оценки присутствия антител против отобранных иммуногенных пептидных последовательностей, обнаруженных при скрининге согласно настоящему изобретению. Для устранения возможной перекрестной реакции с белками, экспрессируемыми Е.coli, все сыворотки были предварительно адсорбированы с помощью тотального лизата клеток Е.coli DHa, экспрессирующих белок FhuA.
Проведенный анализ суммирован в табл.2 и представлен в качестве примера на фиг.4, свидетельствуя об адекватности настоящего скрининга. Он также показывает, что уже отдельные короткие эпитопы могли вызывать образование антител у большого числа пациентов (ORF1618, ORF1632, IsaA, Empbp, белок А). А те пептидные последовательности, которые не распознаются большим набором сывороток больных, все же могут входить в состав сильно иммуногенных белков, однако это можно проверить на самих рекомбинантных белках в каждом конкретном случае.
Пример 4. Идентификация сильно иммуногенных пептидных последовательностей из геномных фрагментов S.aureus при помощи рибосомного дисплея и сыворотки человека
Экспериментальная часть
Скрининг рибосомного дисплея. Методом ПЦР амплифицировали 2,4 нг геномной библиотеки S.aureus LSA250/1 в pMAL4.1 (описанной выше) с помощью олигонуклеотидов ICC277 и Iсс202 для рибосомного дисплея. Олигонуклеотиды ICC277 (CGAATAATACGACTCACTATAGGGAGACCACAACGGTTTCCCACTAGTAATAATTT TGTTTAACTTTAAGAAGGAGATATATCCATGCAGACCTTGGCCGGCCTCCC) и ICC202 (GGCCCACCCGTGAAGGTGAGCCGGCGTAAGATGCTTTTCTGTGACTGG) гибридизуются в 5'- и 3'-направлении от FseI-NotI инсерционного сайта плазмиды pMAL4.1, соответственно. ICC277 вводит промотор РНК-полимеразы фага Т7, палиндромную последовательность, образующую структуру петли-с-ножкой (stem-loop) на уровне РНК, сайт связывания рибосомы (RBS) и начало трансляции гена 10 фага Т7, включая стартовый кодон ATG. Олигонуклеотид ICC202 гибридизуется в положении нуклеотида 668 открытой рамки считывания β-лактамазы и также вводит структуру петли-с-ножкой на 3'-конце образующейся РНК. ПЦР осуществляли с помощью набора High fidelity PCR kit (Roche Diagnostics), проводя 25 циклов при температуре гибридизации 50°С и прочих стандартных условиях.
Полученную библиотеку ПЦР-продуктов использовали в 5 последовательных циклах селекции и амплификации методом рибосомного дисплея, как описано ранее (Hanes et al., 1997), но с модификациями, описанными ниже.
Один цикл рибосомного дисплея состоял из следующих стадий. При транскрипции in vitro 2 мкг продукта ПЦР при помощи набора RiboMax (Promega) получали около 50 мкг РНК. Трансляцию in vitro проводили в течение 9 мин при 37°С в объеме 22 мкл с добавлением 4,4 мкл смеси Premix Z (250 мМ трис-ацетат, рН 7,5, по 1,75 мМ каждой аминокислоты, 10 мМ АТФ, 2,5 мМ ГТФ, 5 мМ цАМФ, 150 мМ ацетилфосфат, 2,5 мг/мл тРНК Е.coli, 0,1 мг/мл фолиевой кислоты, 7,5% ПЭГ 8000, 200 мМ глутамата калия, 13,8 мМ Mg(Ac)2), 8 мкл экстракта S30 (× мг/мл) и около 2 мкг пула транскрибированной РНК. Экстракт S30 получали, как описано (Chen et al., 1983). Затем образец переносили в охлажденную во льду пробирку, содержащую 35,2 мкл смеси 10% молоко-WBT (трис-ацетат, рН 7,5, 150 мМ NaCl, 50 мМ Mg(Ac)2, 0,1% Tween-20, 10% сухого молока) и 52,8 мкл смеси WBTH (как перед этим +2,5 мг/мл гепарина). После этого проводили иммунопреципитацию, добавляя 10 мкг очищенных IgG, инкубируя в течение 90 мин на льду, а затем добавляя 30 мкл содержащих белок G бусин MAGmol (Miltenyi Biotech, 90 мин на льду). Образец наносили на предварительно уравновешенную колонку, μ (Miltenyi Biotech) и пропускали 5 объемов ледяного буфера WBT. Затем на колонку наносили 20 мкл элюционного буфера ЕВ20 (50 мМ трис-ацетат, 150 мМ NaCl, 20 мМ ЭДТА, 50 мкг/мл РНК S.cerevisiae) и инкубировали 5 мин при 4°С. Элюирование завершали добавлением 2×50 мкл ЕВ20. мРНК из элюированного образца очищали с помощью набора High pure RNA isolation kit (Roche Diagnostics). После этого проводили обратную транскрипцию с помощью содержащего обратную транскриптазу набора Superscript II (Roche Diagnostics) согласно инструкциям изготовителя в присутствии 60 пмоль олигонуклеотида ICC202 в течение 1 ч при 50°С в объеме 50 мкл. Отбирали 5 мкл этой смеси и использовали для последующей реакции ПЦР с праймерами ICC202 и ICC277, как описано выше.
Проводили три цикла рибосомного дисплея, после чего полученный пул прошедших селекцию продуктов ПЦР клонировали в плазмиду рHIЕ11 (описанную выше) после расщепления рестрикционными эндонуклеазами NotI и Fsel.
Анализ прошедших селекцию клонов путем секвенирования и анализа пептидов методом ELISA. Прошедшие селекцию клоны культивировали в течение ночи при 37°С в 3 мл среды LB с канамицином (50 мкг/мл) для получения плазмидной ДНК стандартными методами. Секвенирование проводили в MWG (Германия) или в Институте исследований генома (TIGR, Rockville, MD, США). Синтезировали пептиды, соответствующие вставкам, и покрывали ими 96-луночные планшеты (Nunc) в 10 мМ NaHCO3, pH 9,3, при концентрации 10 мкг/мл (50 мкл). После блокирования 1% раствором БСА в PBS при 37°С в лунки вносили разведения 1:200 и 1:1000 указанных сывороток в 1% БСА/PBS. После отмывки PBS/0,1% Tween-20 добавляли меченные биотином вторичные антитела против IgG человека (SBA), которые детектировали последующим добавлением конъюгированного с пероксидазой хрена стрептавидина согласно стандартным методам.
Результаты
Описанную выше геномную библиотеку в 250 п.о. (LSA250/1) использовали для скрининга. Для селекции антигенных пептидов использовали очищенные IgG от неинфицированных взрослых, но с высоким титром против S.aureus, как описано выше.
Проводили три цикла селекции рибосомного дисплея и амплификации согласно "Экспериментальной части", которые завершались клонированием и секвенированием получаемых продуктов ПЦР.
Анализ последовательностей большого числа (700) взятых по случайной схеме клонов привел к идентификации гена и соответствующей последовательности пептида или белка, специфически узнаваемого используемой для скрининга сывороткой с высоким титром. Частота, с которой определенный клон отбирается при селекции, отражает, по крайней мере частично, распространенность и/или аффинность специфических антител в сыворотке, используемых для селекции и распознающих эпитоп, представленный этим клоном. Замечательно, что некоторые клоны (ORFs) встречались до 50 раз, что указывает на их высокую иммуногенность. В табл.2 приведено наименование ORF, Seq.ID No.и сколько раз этот клон встречался при скрининге согласно изобретению.
Для ряда отобранных при иммуноселекции ORFs были синтезированы пептиды, соответствующие идентифицированному иммуногенному участку, и протестированы методом ELISA на реактивность в отношении того пула сывороток, с помощью которого они были идентифицированы, а также ряда дополнительных сывороток от больных, страдающих инфекцией, вызванной S.aureus. Два примера на графике фиг.5 показывают титры для пептидов из ауреолизина и Pls. Они не только гипериммунореактивны в отношении пула сывороток с высоким титром, но также ряда индивидуальных сывороток больных. Все синтезированные пептиды, соответствующие отобранным иммуногенным участкам, проявляли реактивность в отношении пула сывороток с высоким титром, и в табл.2 показано, сколько раз пептиды реагировали с индивидуальными сыворотками больных, подобно тому, как описано выше.
Кроме того, замечательно, что для тех ORF, которые были идентифицированы путем дисплея на бактериальной поверхности, как описано выше, очень часто иммуногенная область в данном ORF была идентична или перекрывалась с той, которая была идентифицирована путем рибосомного дисплея. Такое сравнение представлено в табл.2.
Пример 5. Идентификация сильно иммуногенных антигенов из S.aureus при помощи серологического протеомного анализа
Экспериментальная часть
Препараты поверхностных белков S.aureus. содержащие сильно иммуногенные антигены. Штаммы S.aureus COL (Shafer and landolo, 1979) и agr- (Recsei et al., 1986) хранили в глицерине при -80°С или на чашках со средой BHI (Difco) при 4°С. Одиночные колонии использовали для инокуляции ночных культур в среду BHI ("стандартные условия") или среду RPMI 1640 (Gibco BRL), лишенную железа ("стрессовые условия") путем обработки в течение ночи иминодиуксусной кислотой (Sigma). На следующий день инокулировали свежую среду 1:100 и культивировали бактерии до значения CD600 между 0,3 и 0,7. Бактерии собирали центрифугированием и промывали ледяным PBS. Поверхностные белки получали обработкой лизостафином в изотонических условиях (Lim et al., 1998). Вкратце, около 3×109 бактерий (принимая, что OD600=1 соответствует приблизительно 5×107 бактерий) ресуспендировали в 1 мл буфера для расщепления, содержащего 35% раффинозы (Aldrich Chemical Company), ингибиторы протеаз (Roche) и 5 ед. лизостафина (Sigma). После инкубации 30 мин при 37°С протопласты осторожно осаждали центрифугированием при низкой скорости. При такой обработке в супернатант высвобождаются поверхностные белки, ковалентно связанные с пентаглициновым мостиком пептидогликана клеточной стенки (см. Crossley, 1997). Белки клеточной поверхности либо высаживали смесью метанол/хлороформ (Wessel, 1984), либо концентрировали в центрифужных пробирках с фильтрами (Millipore). Белковые образцы замораживали и хранили при -80°С или растворяли в буфере для образцов и сразу использовали для изоэлектрического фокусирования (IEF) (Pasquali et al., 1997).
Серологический протеомный анализ препаратов поверхностных белков S.aureus. Образцы получали из: a) S.aureus/agr, выращенных в "стрессовых условиях", b) S.aureus/COL, выращенных в "стандартных условиях", и с) S.aureus/COL, выращенных в "стрессовых условиях". Нанесение на полоски длиной 17 см, содержащие иммобилизованные градиенты рН, осуществляли согласно "in-gel reswelling procedure" (Pasquali et al., 1997). На гели для блоттинга наносили 100-800 мкг белка, на препаративные гели - 400-1000 мкг белка. Изоэлектрическое фокусирование и ДДС-Na-ПАГ-электрофорез (градиентные гели 9-16%) проводили, как описано (Pasquali et al., 1997). Для Вестерн-блоттинга белки переносили на мембраны из PVDF (BioRad) методом полусухого блоттинга. Эффективность переноса проверяли по окрашиванию амидочерным. После блокирования (PBS/ 0,1% Tween-20/ 10% сухого молока, 16 ч при 4°С) блоты инкубировали в течение 2 часов с сывороткой (1:2500-1:100000 в блокирующем растворе, см. табл.3). После отмывки специфическое связывание IgG сыворотки визуализировали с помощью конъюгата пероксидазы с козьими антителами к IgG человека (1:25 000, Southern Biotech) в качестве вторичного антитела и проявления с помощью хемилюминесцентного субстрата (ECL™, Amersham). Репрезентативный результат представлен на фиг.6. Мембраны отмывали от антител обработкой в буфере Леммли с 2% β-меркаптоэтанолом в течение 30 мин при 50-65°С, незамедлительно подвергали реакции с другой сывороткой и проявляли, как описано выше. Эту процедуру повторяли до 5 раз. Сигналы, проявляющиеся при реакции с сыворотками больных и/или здоровых контрольных доноров, но не с детским пулом, сопоставляли с окрашенными Кумасси (BioRad) препаративными гелями (пример приведен на фиг.7). Результаты этого серологического протеомного анализа препаратов поверхностных белков S.aureus приведены в табл.3.
Секвенирование белковых зон методом "пептидных отпечатков пальцев" MALDI-TOF-масс-спектрометрии и тандемного MS/MS. Кусочки гелей поочередно промывали 3 раза по 10 мкл буфера для расщепления (10 мМ NH4 HCO3/CAN, 1:1). После этого кусочки гелей сначала ужимали в 10 мкл ACN, а затем подвергали повторному набуханию добавлением 2 мкл протеазного раствора (0,05 мкг/мкл трипсина, Promega, Madison, США). Расщепление проводили в течение 10-12 ч при 37°С. Для MALDI-TOF-масс-спектрометрии пептиды экстрагировали из кусочков геля 10 мкл буфера для расщепления. Супернатант концентрировали с помощью ZipTip™ (Millipore, Bedford, США), пептиды элюировали на мишень для MALDI с помощью 0,5 мкл экстракционного буфера (0,1% TFA/CAN, 1:1) и добавляли 0,5 мкл раствора матрицы (НССА в ACN/0,1% TFA, 1:1). MALDI-TOF-масс-спектрометрию проводили на приборе REFLEX III (Bruker Daltonik, Бремен, Германия), оснащенном ионным источником SCOUT384. Устанавливали напряжение ускорения 25 кВ и напряжение отражения 28,7 кВ. Диапазон масс устанавливали от 700 до 4000 Да. Сбор данных осуществляли на компьютере SUN Ultra с помощью программы XACQ, версия 4.0. Обработку данных после анализа проводили с помощью программы XMASS, версия 4.02 (Bruker Daltonik, Бремен, Германия). Результаты приведены в табл.3 и 4.
Пример 6. Характеризация сильно иммуногенных белков S.aureus
Антигены, идентифицированные различными методами скрининга с помощью препаратов IgG и IgA из предварительно отобранных сывороток, подвергали дальнейшей характеризации следующими способами.
1. Очищали белки, наиболее предпочтительно в виде рекомбинантных белков, экспрессированных в Е.coli, в системе экспрессии грам-положительных бактерий или в системе трансляции in vitro, и исследовали их антигенность с помощью серии сывороток человека. Белки подвергали модификации на основе биоинформационного анализа: удаляли N-концевые последовательности, представляющие сигнальные пептиды, также удаляли С-концевые участки, следующие за якорной последовательностью для клеточной стенки, и вводили дополнительные аминокислоты в качестве меток для облегчения очистки (к примеру, Strep-tagII, His-tag и т.п.). Затем при помощи большого числа сывороток методом ELISA оценивали, какие сыворотки человека содержат специфические антитела против определенного белка (см. фиг.9 в качестве примера). Один из отобранных антигенов представляет собой белок из 895 аминокислот, который назвали LPXTGV (см. табл.2 и 4), так как он содержит якорную последовательность LPXTG для клеточной стенки грам-положительных бактерий. Было показано, что этот мотив служит сайтом расщепления для сортазы - транспептидазы, ковалентно соединяющей содержащие мотив LPXTG белки с пептидогликаном клеточной стенки. LPXTGV также снабжен типичным сигнальным пептидом (фиг.8). Данные, полученные методом ELISA при использовании этого белка в виде рекомбинантного белка с меткой Strep, показывают, что он обладает высокой иммуногенностью (высокие титры по сравнению с другими рекомбинантными белками) с большим процентом сывороток (фиг.9). Важно и то, что больные с острыми инфекциями S.aureus вырабатывают значительно больше антител против LPXTGV, чем здоровые лица, что свидетельствует, что этот белок экспрессируется во время инфекции in vivo. Сравнивали общие титры (ELISA) индивидуальных антигенных белков и отбирали те из них, которые индуцируют самые высокие уровни антител (сильно иммуногенные) у большинства лиц (белок экспрессируется большинством штаммов). Поскольку антигенная специфичность и качество (класс, субтип, функциональность или ее отсутствие) антител против S.aureus, вырабатываемых индивидуальными больными, может варьировать в зависимости от места инфекции, сопутствующих хронических заболеваний (к примеру, диабет) и хронических состояний (к примеру, сосудистый катетер), а также выраженности иммунного ответа индивида, то особое внимание уделяли отличиям между различными группами больных, так как имелись истории болезней по каждой сыворотке. Кроме того, получение каждого образца сыворотки больных сопровождалось выделением патогенного штамма у больного в момент получения сыворотки.
2. Очищали специфические антитела для функционального исследования. Проверяли чистоту и целостность рекомбинантных белков (например, выявление N-концевой Strep-метки при Вестерн-блоттинге и по сравнению с окрашиванием серебром при ДДС-Na-ПАГ-электрофорезе). Антигены иммобилизовали через метки для получения аффинного матрикса, используемого для очистки специфических антител из сывороток с высокой реактивностью. Например, используя LPXTGV с меткой Strep в качестве улавливающего антигена, получали 20 мкг очищенного антитела из 125 мг IgG. По данным ELISA, был получен чистый препарат, не проявляющий активности, к примеру, против LTA и против пептидогликана (которые преобладают в нефракционированном IgG). Затем антитела использовали для тестирования локализации на клеточной поверхности методами FACS и флуоресцентной микроскопии (фиг.10).
3. Распространенность генов в клинических изолятах. Идеальный антиген для вакцины должен присутствовать во всех или в громадном большинстве штаммов того организма, против которого направлена вакцина. Для того, чтобы установить, насколько широко распространены гены, кодирующие идентифицированные антигены S.aureus, в различных штаммах S.aureus, проводили ПЦР на серии независимых изолятов S.aureus с праймерами, специфичными для искомого гена. Изоляты S.aureus получали от больных различными инфекциями, вызванными S.aureus. Кроме того, собирали и анализировали несколько изолятов из носовой полости здоровых носителей и несколько лабораторных штаммов. Эти штаммы типировали по полиморфизму длин рестрикционных фрагментов (RFLP) генов spa и соа (Goh et al., 1992; Frenay et al., 1994; vanden Bergh et al., 1999). По этим результатам было идентифицировано 30 различных штаммов - 24 изолята от больных, 3 изолята из носовой полости и 3 лабораторных штамма. Чтобы установить распределение генов выбранных антигенов, геномную ДНК из этих 30 штаммов подвергали ПЦР с геноспецифичными праймерами, фланкирующими выбранные эпитопы (ORF1361: Seq.ID No.187 и 188; ORF2268: Seq.ID No.193 и 194; ORF1951: Seq.ID No.195 и 196; ORF1632: Seq.ID No.181 и 182; ORF0766: Seq.ID No.183 и 184; ORF0576: Seq.ID No.185 и 186; ORF0222: Seq.ID No.189 и 190; ORF0360: Seq.ID No.191 и 192). Продукты ПЦР анализировали методом гель-электрофореза для идентификации продуктов правильного расчетного размера. ORF 1361, 2268, 1951, 1632, 0766 и 0222 обнаружены у 100% протестированных штаммов и ORF0576 у 97%. Однако ORF0360 встречалось лишь у 71% штаммов. Таким образом, ORFs 1361, 2268, 1951, 1632, 0766, 0576 и 0222 удовлетворяют требованию повсеместного распространения среди изолятов S.aureus.
Эти антигены (или их антигенные фрагменты, в особенности идентифицированные фрагменты) особенно предпочтительны для применения в программе вакцинации против S.aureus.
4. Идентификация «неразборчивых» (promiscuous) Т-хелперных эпитопов для HLA класса II в ORF выбранных антигенов
Открытые рамки считывания (ORF), соответствующие антигенам, идентифицированным по их распознаванию антителами в сыворотке человека, по всей вероятности также содержат и линейные Т-клеточные эпитопы. В особенности неожиданное открытие в ходе изобретения того, что даже здоровые, неинфицированные, неколонизированные лица проявляют чрезвычайно высокие титры антител (>100000 по некоторым антигенам, см. Пример 5), которые устойчивы на протяжении >1 года (см. Пример 1), свидетельствует о существовании Т-зависимой памяти, которая по всей вероятности опосредована Т-хелперными клетками CD4+. Определение молекул, несущих соответствующие Т-хелперные эпитопы для HLA класса II, полезно для разработки синтетических вакцин против стафилококков, которые могли бы индуцировать иммунологическую память. В этом плане Т-хелперные эпитопы из стафилококковых антигенов обеспечивают "родственную помощь" В-клеточному ответу к этим антигенам или их фрагментам. Более того, возможно использовать такие Т-хелперные эпитопы для индукции памяти к Т-независимым антигенам, например, углеводам (комбинированные вакцины). С другой стороны, находящиеся внутри клеток стафилококки могут элиминироваться цитотоксическими Т-клетками CD8+, распознающими эпитопы, рестриктируемые в ассоциации с HLA класса I.
Т-клеточные эпитопы можно предсказать с помощью разнообразных алгоритмов, находящихся в публичных доменах: http://bimas.dcrt.nih.gov/molbio/hla.bind/ (Parker et al. 1994), http://134.2.96.221/script/MHCServer.dll/home.htm (Rammensee at al. 1999), http://mypage.ihost.com/usinet.hamme76/ (Sturniolo et al. 1999). Последний из этих предсказательных алгоритмов дает возможность идентифицировать «неразборчивые» Т-хелперные эпитопы, то есть пептиды, связывающиеся с несколькими молекулами HLA класса II. Для того, чтобы идентифицировать очень «неразборчивые» Т-хелперные эпитопы в стафилококковых антигенах, анализировали ORF, соответствующие Seq ID 64 (IsaA), Seq ID 114 (POV2), Seq ID 89 (ORF0222), Seq ID 70 (LPXTGIV), Seq ID 56 (LPXTGV), Seq ID 142 (LPXTGVI), Seq ID 81 (ORF3200), Seq ID 74 (ORF 1951), Seq ID 94 (Empbp), Seq ID 83 (аутолизин) и Seq ID 58 (ORF2498) с помощью пакета программ TEPITOPE http://mypage.ihost.com/usi-net.hamme76/ (Sturniolo et al. 1999). Анализ проводили по 25 основным DR-аллелям и пептиды отбирали, если по расчетам их связывание было: а) сильным (1%-й порог) как минимум по 10 из 25 аллелей или b) промежуточным (3%-й порог) как минимум по 17 из 25 аллелей.
Были отобраны (и патентуются) следующие пептиды, содержащие один или несколько «неразборчивых» Т-хелперных эпитопов:
Seq ID 56: полож. 6-40, 583-598, 620-646, 871-896
Seq ID 58: ни один пептид не удовлетворяет критериям отбора
Seq ID 64: ни один пептид не удовлетворяет критериям отбора
Seq ID 70: полож. 24-53
Seq ID 74: полож. 240-260
Seq ID 81: полож. 1660-1682, 1746-1790
Seq ID 83: полож. 1-29, 680-709, 878-902
Seq ID 89: полож. 96-136
Seq ID 94: полож. 1-29, 226-269, 275-326
Seq ID 114: полож. 23-47, 107-156
Seq ID 142: полож. 24-53
Соответствующие пептиды или их фрагменты (например, перекрывающиеся 15-меры) могут быть синтезированы и протестированы на их способность к связыванию с различными молекулами HLA in vitro. Иммуногенность можно тестировать, определяя индуцируемую пептидом (антигеном) пролиферацию Т-клеток (по включению Br-dU или3 H-тимидина) или секрецию ими цитокинов (ELIspot, внутриклеточное окрашивание на цитокины) in vitro (Mayer et al., 1996, Schmittel et al., 2000, Sester et al., 2000). В этом отношении представляет интерес определение количественных и качественных отличий в Т-клеточных ответах на антигены стафилококков или отобранные «неразборчивые» пептиды или их фрагменты в популяциях больных различными стафилококковыми инфекциями, а также сравнение колонизированных со здоровыми лицами, не подвергавшимися в последнее время ни инфекции, ни колонизации. Более того, следует ожидать кореляции между титром антител и величиной и качеством Т-клеточных ответов в этих популяциях. С другой стороны, иммуногенность предполагаемых пептидов можно тестировать на трансгенных по HLA мышах (Sonderstrup et al., 1999).
Сходные подходы могут быть предприняты для идентификации рестриктируемых в ассоциации с HLA класса I эпитопов в антигенах стафилококков.
Синтетические пептиды, соответствующие одному или нескольким «неразборчивым» Т-хелперным эпитопам S.aureus
Были синтезированы частично перекрывающиеся пептиды, охватывающие указанные участки Seq ID 56 (LPXTGV), Seq ID 70 (LPXTGIV), Seq ID 74 (ORF1hom1), Seq ID 81 (EM_BP), Seq ID 83 (аутолизин), Seq ID 89 (ORF1hom2), Seq ID 94 (EMPBP), Seq ID 114 (POV2) и Seq ID 142 (LPXTGVI). Последовательности индивидуальных пептидов приведены в табл.5. Все пептиды синтезировали методом Fmoc, очищали методом ВЭЖХ и анализировали методом масс-спектрометрии. Лиофилизованные пептиды растворяли в ДМСО и хранили при -20°С в концентрации 5-10 мМ.
Связывание синтетических пептидов, соответствующих «неразборчивых» Т-хелперным эпитопам, с молекулами HLA in vitro
Связывание пептидов с молекулами HLA является необходимым условием активации Т-клеток. Связывание определяли in vitro двумя независимыми биохимическими методами с помощью рекомбинантных растворимых вариантов молекул HLA класса II. В одном методе измеряли зависимое от концентрации конкурентное вытеснение меченого контрольного пептида тестируемыми пептидами. В основе второго метода лежит образование устойчивых к ДДС-Na комплексов при связывании высоко- и среднеаффинных лигандов. Результаты, полученные двумя методами, суммированы в табл.5.
Растворимые молекулы HLA (DRA1*0101/DRB 1*0101 и DRA1*0101/DRB1*0401) экспрессировали в клетках SC-2 и очищали, как описано в Aichinger et al, 1997. Для конкурентного связывания (Hammer et al., 1995) молекулы HLA вносили в количестве от 50 до 200 нг/лунку. Для DRB1*0101 использовали биотинилированный индикаторный пептид НА (PKYVKQNTLKLAT, Valli et al., 1993) в концентрации 0,008 мкМ. Для DRB 1*0401 использовали биотинилированный индикаторный пептид UD4 (YPKFVKQNTLKAA, Valli et al., 1993) в концентрации от 0,03 до 0,06 мкМ. Тестируемые пептиды использовали в серийных разведениях от 0,02 нМ до 200 мкМ. Молекулы, индикаторные и тестируемые пептиды инкубировали в течение ночи при 37°С, рН 7. Комплексы HLA: пептид, образовавшиеся после инкубации с серийными разведениями тестируемых и контрольных пептидов (в качестве положительного контроля использовали известные своей высокой аффинностью пептиды НА и UD4), фиксировали на чашках для ELISA, покрытых антителом L243, которое распознает конформационный эпитоп, образуемый только правильно соединенными гетеродимерами. Связанный биотин измеряли стандартным колориметрическим методом с помощью конъюгата стрептавидин-щелочная фосфатаза (Dako), используя в качестве субстрата таблетки NBT/BCIP (Sigma) и измеряя значения OD на автоматическом считывающем приборе Victor (Wallac).
Оценка Т-клеточного ответа на «неразборчивые» Т-хелперные эпитопы по определению IFNg методом ELIspot
После антигенной стимуляции начинается пролиферация Т-клеток и секреция ими цитокинов, таких как γ-интерферон (IFNg). Т-клетки человека, специфически распознающие эпитопы в антигенах S.aureus, выявляли по определению IFNg методом ELIspot (Schmittel et al., 2000). Клетки РВМС выделяли от здоровых лиц с сильным IgG-ответом против S.aureus из 50-100 мл венозной крови путем центрифугирования в градиенте плотности фиколла и использовали после замораживания и оттаивания. Клетки высевали на 96-луночные планшеты (200000 клеток/лунку). Пептиды добавляли в виде смесей, соответствующих индивидуальным антигенам, во всех случаях по 10 мкг/мл. Конканавалин A (Amersham) и PPD (очищенный белковый продукт туберкулина, Statens Serum Institute) служили положительными контролями, а среда без пептидов - отрицательным контролем. После инкубации в течение ночи в 96-луночных фильтрационных планшетах Multi Screen (Millipore), покрытых моноклональным антителом В 140 против IFNg человека (Bender Med Systems), результаты анализа ELIspot проявляли с помощью биотинилированного моноклонального антитела В308-ВТ2 против IFNg человека (Bender Med Systems), конъюгата стрептавидин-щелочная фосфатаза (Daco) и субстрата щелочной фосфатазы BCIP/NBT (Sigma). Пятна просчитывали на автоматическом считывающем приборе Bioreader (BioSys). Количество пятен в лунках с клетками, инкубированными только со средой (отрицательный контроль, обычно менее 10 пятен на 100000 клеток), принимали за фон и вычитали из количества пятен в лунках с пептидами.


5. Антигены можно ввести мышам и измерить антитела против этих белков.
6. Защитную способность антител, индуцируемых антигенами при вакцинации, можно оценить на животных моделях.
Методы 5 и 6 хорошо доступны специалистам в этой области.
Пример 7. Применения
А) Эффективная вакцина представляет большой потенциал для пациентов, сталкивающихся с избирательным хирургическим вмешательством вообще, и тех, кому вводят сосудистые катетеры, в частности. Больные хроническими заболеваниями, при которых снижаются иммунные ответы, и те, кто подвергается непрерывному перитонеальному диализу амбулаторно, также должны получить пользу от вакцины против S.aureus с применением иммуногенных антигенов по настоящему изобретению. Идентификация релевантных антигенов поможет обеспечить эффективную пассивную иммунизацию (терапия гуманизированными моноклональными антителами), которая может заменить введение иммуноглобулина человека со всеми его опасными побочными эффектами. Так что эффективная вакцина представляет большой потенциал для пациентов, сталкивающихся с избирательным хирургическим вмешательством вообще, и тех, кому вводят сосудистые катетеры, в частности.
S.aureus может вызывать много различных заболеваний:
1) сепсис, бактериемия,
2) у тех, кто подвергается гемодиализу - бактериемия, сепсис,
3) у тех, кто подвергается перитонеальному диализу - перитонит,
4) у пациентов с сосудистыми катетерами (при операции на сердце и т.п.) - эндокардит, бактериемия, сепсис,
5) у ортопедических больных с протезами - септический артрит,
6) профилактическая вакцинация всего населения.
B) Профилактическая и лечебная вакцинация, с уделением особого внимания Т-клеткам при последней. Ее целью является индукция сильного Т-хелперного ответа при вакцинации для достижения эффективного гуморального ответа, а также иммунологической памяти. В настоящее время нет прямых данных о том, что Т-клетки играют важную роль в ликвидации вызванных S.aureus инфекций, однако этот вопрос еще не был адекватно исследован. В эффективном гуморальном ответе к белковым антигенам должны участвовать Т-хелперы, и они необходимы для возникновения памяти. "Наивные" клетки CD4+ подвергаются дифференцировке в клетки Тh1 или Th2. Поскольку врожденные имунологические реакции (цитокины) влияют на этот выбор, то участие Т-клеток может быть разным во время острых, серьезных инфекций по сравнению с иммунизацией здоровых лиц субъединичными вакцинами, не содержащими компонентов, нарушающих иммунный ответ при естественном течении инфекции. Выбор между индукцией Тh1 или Th2 имеет глубокие последствия. Клетки Тh1 вызывают клеточный иммунитет, тогда как клетки Th2 обеспечивают гуморальный иммунитет.
C) Профилактические и лечебные вакцины
Профилактические: активная вакцинация/ пассивная иммунизация людей в группах высокого риска, до заражения
Лечебные: пассивная вакцинация уже заболевших
Активная вакцинация для устранения внутриносового носительства
Конкретный пример применения
Устранение носительства устойчивых к метициллину S.aureus (MRSA) и профилактика колонизации медицинского персонала
Носительство S.aureus в ноздрях у людей вне больницы колеблется от 10 до 40%. У пациентов больниц и персонала носительство еще выше. Оно особенно высоко у больных, подвергающихся гемодиализу, и у диабетиков, наркоманов и больных целым рядом дерматологических заболеваний. Наибольшему риску заражения MRSA подвергаются пациенты больших госпиталей третьей ступени, особенно пожилые и иммунокомпрометрированные, находящиеся в блоке интенсивной терапии, больные с ожогами, с операционными ранами и пациенты с внутривенными катетерами.
Полученные методом ELISA данные явно свидетельствуют о существовании выраженного IgA-ответа к S.aureus, который не обнаружен или неизвестен в литературе. Поскольку преобладающий иммунный ответ слизистых оболочек заключается в продукции IgA с нейтрализующей активностью, ясно, что стафилококковые эпитопы и антигены, идентифицированные с помощью высокоочищенных препаратов IgA, ведут к получению эффективной вакцины для слизистых оболочек.
Прямые показания: все подвергаются опасности в тех отделениях, где проводятся операции (особенно ортопедических, травматологических, общей хирургии).
- Четко определенная группа населения для вакцинации (врачи и медсестры).
- Работников здравоохранения, идентифицированных как внутриносовых носителей эпидемического штамма S.aureus, в настоящее время лечат мупироцином и рифампицином до элиминации бактерий. Иногда лечение неэффективно, и оно требует времени.
- Наличие животной модели: существуют мышиные модели внутриносового носительства.
Таблица 1. Титры сывороток от неинфицированных лиц по данным ELISA к нескольким стафилококковым белкам
Уровни антител против стафилококков измеряли по отдельности стандартным методом ELISA с помощью тотального лизата клеток S.aureus, культивированных в среде BHI, липотейхоевой кислоты (LTA), пептидогликана (PG), 13 рекомбинантных белков, представляющих белки клеточной поверхности и секретируемые белки, такие как факторы слипания А и В (ClfA, ClfB), фибронектин-связывающий белок (FnBPA), белки SD-повторов (sdrC, sdrE), белок-аналог МНС класса II (Map-w), эластин-связывающий белок (ЕВР), енолаза (сообщалось о ее локализации на клеточной поверхности и иммуногенности), липопротеины транспорта железа (LP309, LP342), сортаза (srtA), коагулаза (coagul), внеклеточный фибриноген-связывающий белок (fib). В качестве антигенов были включены и два коротких синтетических пептида, представляющие 2 из 5 иммунодоминантных доменов D-повторов FnBPA (D1+D3). Индивидуальные сыворотки ранжировали в соответствии с титром IgG по 9-балльной шкале. При этом 1 соответствует сыворотке с наибольшим титром, а 8 и 9 соответствуют сывороткам, получившим 8-е и 9-е места из всех сывороток, протестированных по данному антигену. Это привело к отбору сывороток из верхней 20-процентили (8-9 из 40). На основании количества баллов от 1 до 8 было отобрано 5 "наилучших сывороток", то есть самых гиперреактивных в отношении антител к стафилококкам. Звездочки (***) означают, что реактивность антител к данному антигену была особенно высокой, превышая более чем в 2 раза число ELISA-единиц относительно 2-й по реактивности сыворотки.
Таблица 2а. Иммуногенные белки S.aureus, идентифицированные методами дисплея на бактериальной поверхности и рибосомного дисплея
Дисплей на бактериальной поверхности: А, библиотека LSA250/1 в fhuA с сыворотками больных 1 (655); В, библиотека LSA50/6 в lamB с сыворотками больных 1 (484); С, библиотека LSA250/1 в fhuA с сыворотками иммунокомпрометированных 1 (571); Е, библиотека LSA50/6 в lamB с сыворотками иммунокомпрометированных 2 (454); F, библиотека LSA50/6 в lamB с сыворотками больных Р1 (1105); G, библиотека LSA50/6 в lamB с сыворотками иммунокомпрометированных 1 (471); Н, библиотека LSA250/1 в fhuA с сыворотками больных 1 (IgA, 708). Рибосомный дисплей: D, библиотека LSA250/1 в fhuA с сыворотками иммунокомпрометированных (1686). *, идентифицирован в 18 из 33 скринингов и поэтому изъят из скрининга С; **, предсказание антигенных последовательностей длиной более 5 аминокислот проводили с помощью программы ANTIGENIC (Kolaskar and Tongaonkar, 1990); #, идентичная последовательность присутствует 2 раза в ORF; ##, клон не представлен в базе данных (последовательность не из TIGR).







Таблица 2b. Дополнительные иммуногенные белки S.aureus, идентифицированные методами дисплея на бактериальной поверхности и рибосомного дисплея
Дисплей на бактериальной поверхности: А, библиотека LSA250/1 в fhuA с сыворотками больных 1 (655); В, библиотека LSA50/6 в lamB с сыворотками больных 1 (484); С, библиотека LSA250/1 в fhuA с сыворотками иммунокомпрометированных 1 (571); Е, библиотека LSA50/6 в lamB с сыворотками иммунокомпрометированных 2 (454); F, библиотека LSA50/6 в lamB с сыворотками больных Р1 (1105); G, библиотека LSA50/6 в lamB с сыворотками иммунокомпрометированных 1 (471); Н, библиотека LSA250/1 в fhuA с сыворотками больных 1 (IgA, 708). Рибосомный дисплей: D, библиотека LSA250/1 в fhuA с сыворотками иммунокомпрометированных (1686). **, предсказание антигенных последовательностей длиной более 5 аминокислот проводили с помощью программы ANTIGENIC (Kolaskar and Tongaonkar, 1990). ORF, открытая рамка считывания; CRF, рамка считывания на комплементарной цепи; ARF, альтернативная рамка считывания.
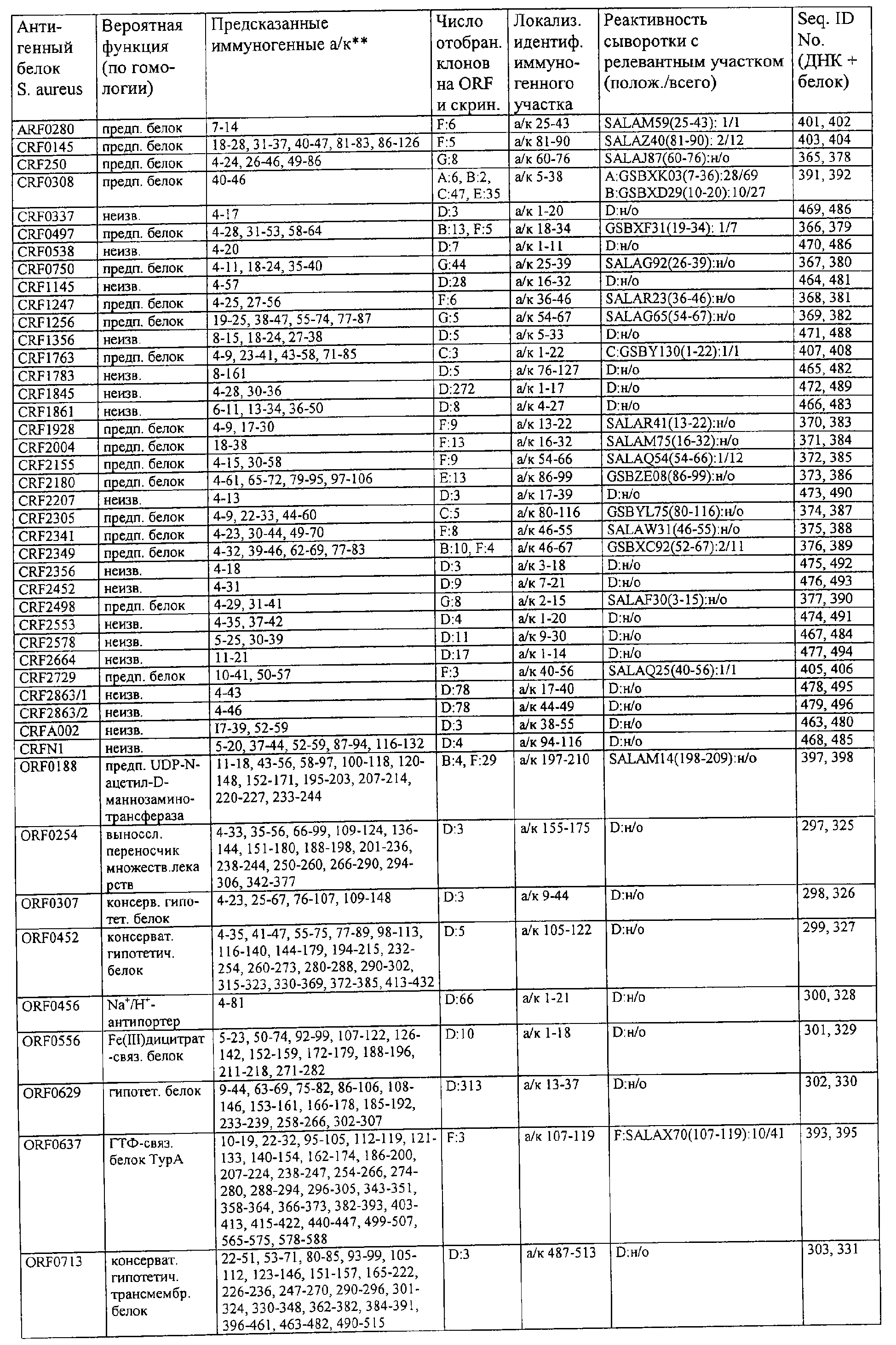


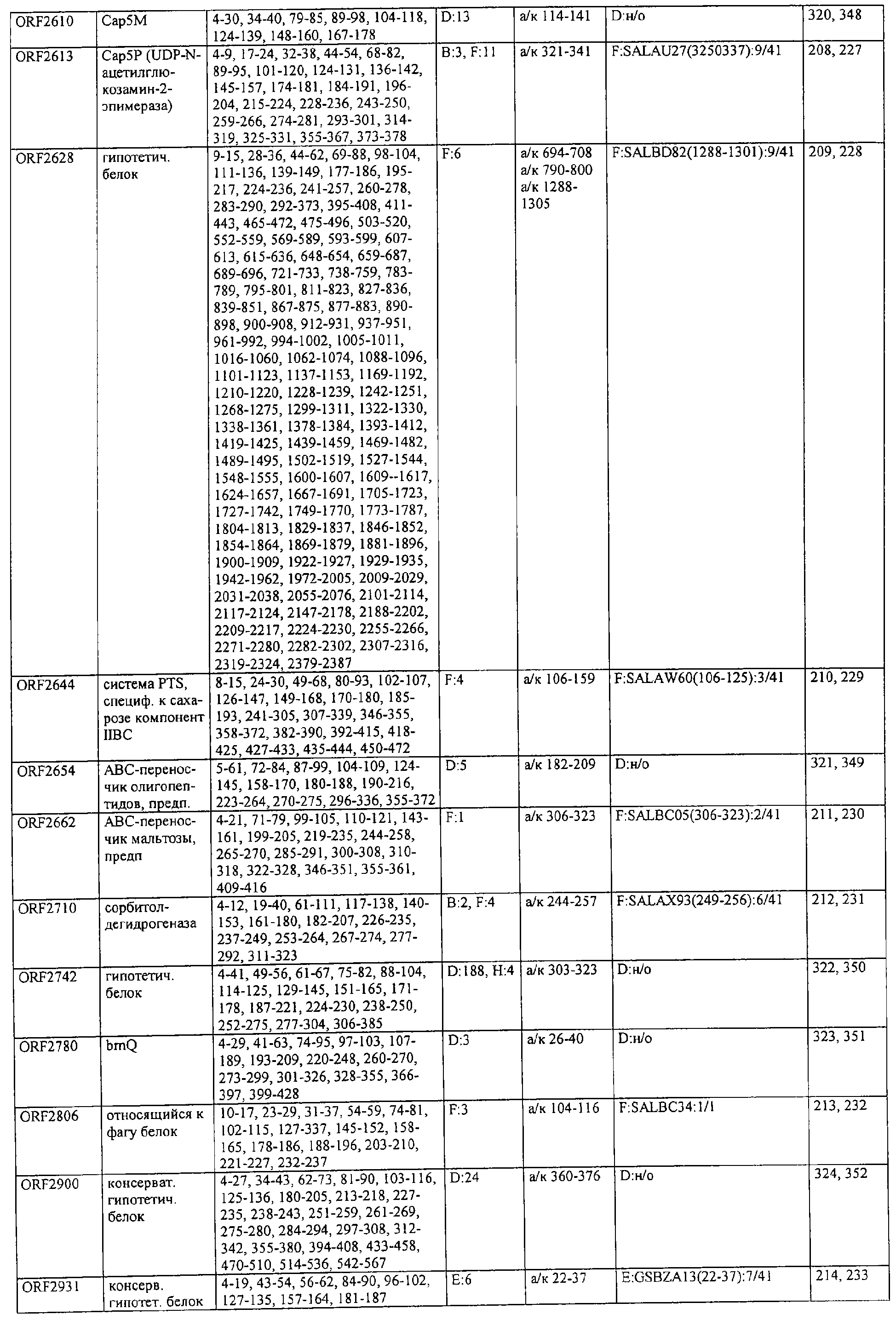

Таблица 2с. Иммуногенные белки S.epidermidis, идентифицированные методами дисплея на бактериальной поверхности и рибосомного дисплея
Дисплей на бактериальной поверхности: А, библиотека LSE150 в fhuA с сыворотками больных 2 (957); В, библиотека LSE70 в lamB с сыворотками больных 2 (1420); С, библиотека LSE70 в lamB с сыворотками больных 1 (551). Рибосомный дисплей: D, библиотека LSE150 в pMAL4.31 с сыворотками Р2 (1235). **, предсказание антигенных последовательностей длиной более 5 аминокислот проводили с помощью программы ANTIGENIC (Kolaskar and Tongaonkar, 1990). ORF, открытая рамка считывания; ARF, альтернативная рамка считывания; CRF, рамка считывания на комплементарной цепи.
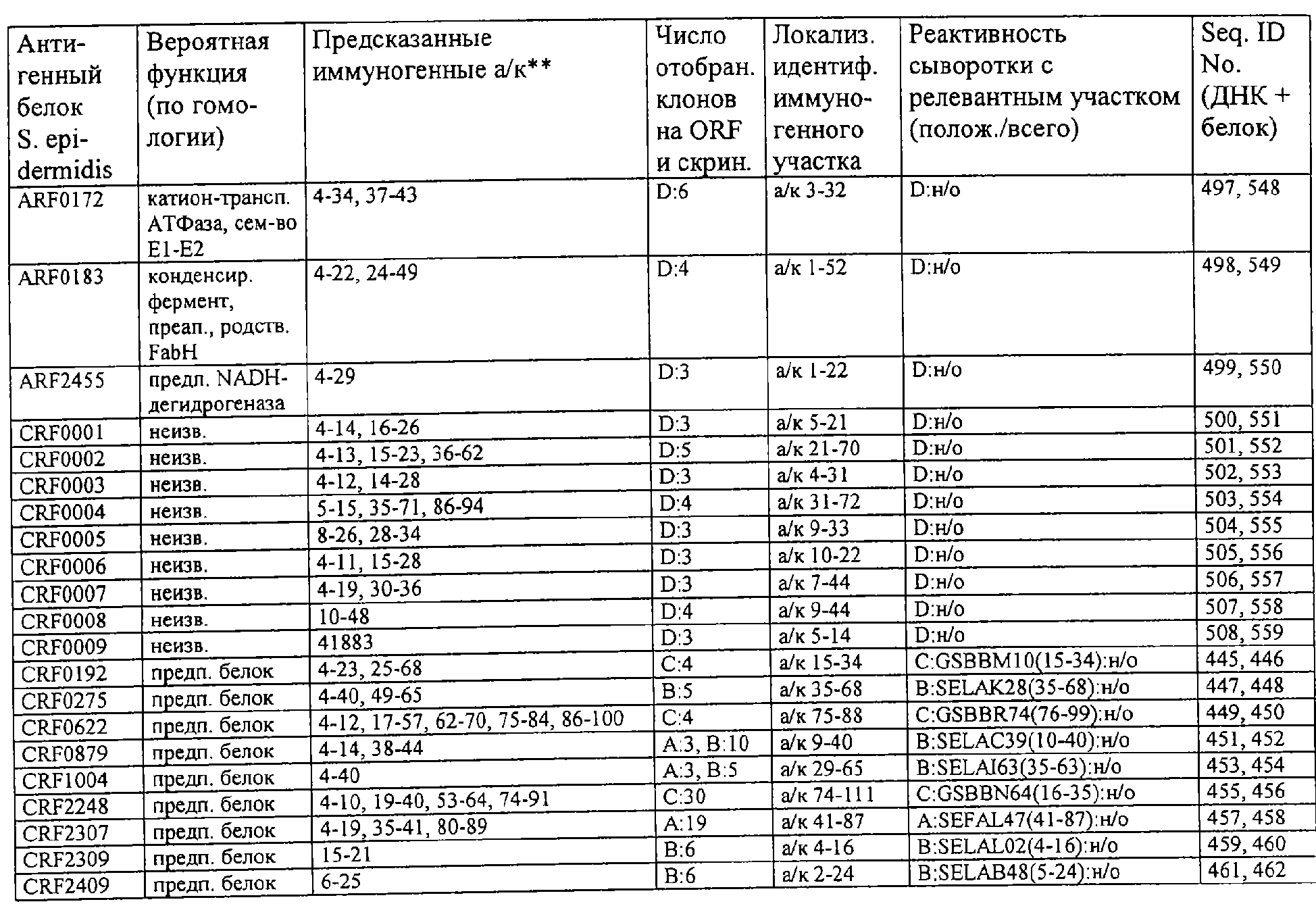





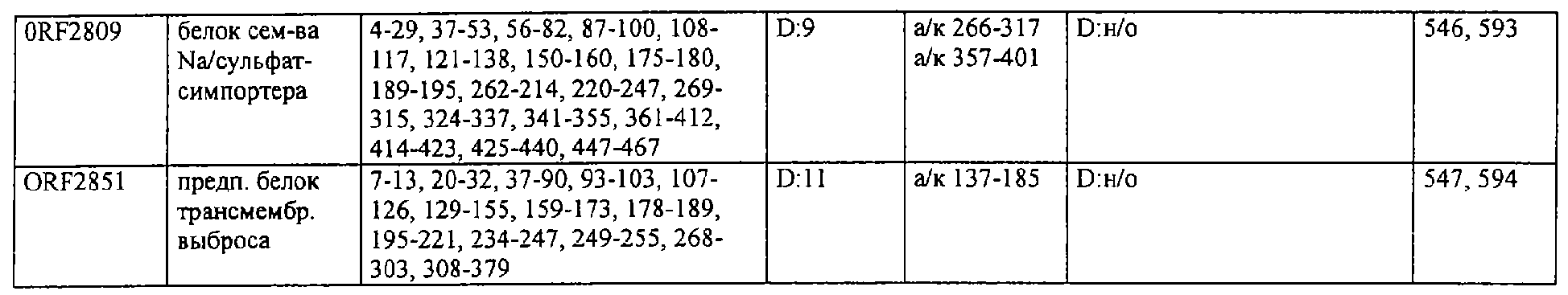
Таблица 2d. Иммуногенные белки S.aureus, идентифицированные методами дисплея на бактериальной поверхности и рибосомного дисплея (новая аннотация)
Дисплей на бактериальной поверхности: А, библиотека LSA250/1 в fhuA с сыворотками больных 1 (655); В, библиотека LSA50/6 в lamB с сыворотками больных 1 (484); С, библиотека LSA250/1 в fhuA с сыворотками иммунокомпрометированных 1 (571); Е, библиотека LSA50/6 в lamB с сыворотками иммунокомпрометированных 2 (454);
F, библиотека LSA50/6 в lamB с сыворотками больных Р1 (1105); G, библиотека LSA50/6 в lamB с сыворотками иммунокомпрометированных 1 (471). Рибосомный дисплей: D, библиотека LSA250/1 в fhuA с сыворотками иммунокомпрометированных (1686). **, предсказание антигенных последовательностей длиной более 5 аминокислот проводили с помощью программы ANTIGENIC (Kolaskar and Tongaonkar, 1990); #, идентичная последовательность присутствует 2 раза в ORF.

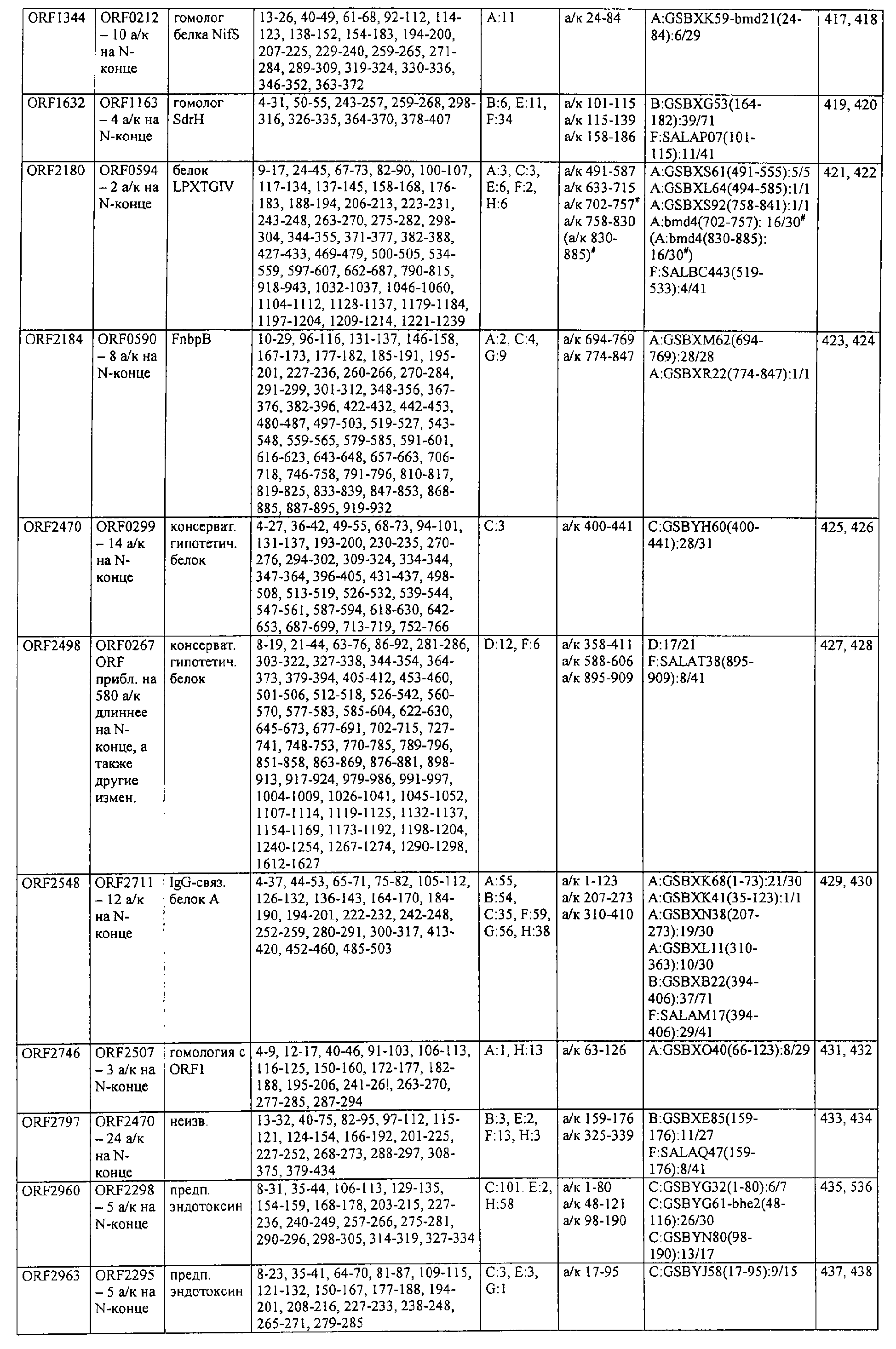


b) S.aureus/COL, "стандартные условия"
c) S.aureus/COL, "стрессовые условия"



Список литературы
Aichinger G., Karlsson L., Jackson M.R., Vestberg M., Vaughau J.H., Teyton L., Lechler R.I.
and Peterson P A. Major Histocompatibility Complex classll-dependent unfolding, transport and degradation of endogenous proteins. J. Biol. Chem., v.272, 1997, pp. 29127-29136.
Ausubel, F.M., Brent, R., Kingston, R.E., Moore, D.D., Seidman, J.G., Smith, J.A. and Struhl, K. Eds. (1994). Current protocols in molecular biology. John Wiley & Sons, Inc. Betley, M.J., Lofdahl, S., Kreiswirth, B.N., Bergdoll, M.S. and Novick, R.P. (1984).
Staphylococcal enterotoxin A gene is associated with a variable genetic element. Proc. Hatl. Acad. Sci. U.S.A. 81:5179-5183.
Bruggemann M, Heuberger MS (1996) Immunol. Today 17:391-397/
Burnie, J.P., Matthews, R.C., Carter, Т., Beaulieu, E., Donohoe, M., Chapman, C., Williamson, P. and Hodgetts, S.J. (2000). Identification of an immunodominant ABC transporter in methicillinresistant Staphylococcus aureus infections. Infect. Immun. 68:3200-3209.
Chen, H.Z. and Zubay, G. (1983). Methods Enzymol. 101:674-690.
Coloque-Navarro, P., Söderquist, В., Holmberg, H., Blomqvist, L., Olcen, P., and Möllby, R.
(1998) Antibody response in Staphylococcus aureus septicaemia - a prospective study. J. Med. Microbiol.47, 217-25.
Crossley, K.B. and Archer G.L., eds. (1997). The Staphylococci in Human Disease. Churchill Livingston Inc.
Flock, J.-I. (1999). Extracellular-matrix-binding proteins as targets for the prevention of Staphylococcus aureus infections. Molecular Medicine Today 5:532-537.
Forrer, P., Jung, S. and Pluckthun, A. (1999). Beyond binding: using phage display to select for structure, folding and enzymatic activity in proteins. Curr. Opin. Struct. Biol. 9:514-520.
Foster, T.J. and Hook, M. (1998). Surface protein adhesins of Staphylococcus aureus. Trends Microbiol. 6:484-488.
Frenay, H.M.E., Theelen, J.P.G., Schouls, L.M., Vandenbroucke-Grauls, C.M.J.E., Vernoef, J., van Leeuwen, W.J., and Mooi, F.R. (1994). Discrimination of epidemic and nonepidemic methicillin-resistant Staphylococcus aureus on the basis of protein A gene polymorphism. J. Clin. Microbiol. 32:846-847.
Georgiou, G., Stathopoulos, C., Daugherty, P.S., Nayak, A.R., Iverson, B.L. and Curtiss III, R. (1997). Display of heterologous proteins on the surface of microorganisms: From the screening of combinatorial libraries to live recombinant vaccines. Nature Biotechnology 15:29-34.
Goh, S.-H., Byrne, S.K., Zhang, J.L., and Chow, A.W. (1992). Molecular typing of Staphylococcus aureus on the basis of coagulase gene polymorphisms. J. Clin. Microbiol. 30:1642-1645.
Graziano et al. (1995) J. Immunol. 155:4996-5002.
Hammer et al. J. Exp. Med (1995) 181: 1847-1855.
Hanes, J. and Pluckthun, A. (1997). In vitro selection and evolution of functional proteins by using ribosome display. PNAS 94:4937-4942.
Hashemzadeh-Bonehi, L., Mehraein-Ghomi, F., Mitsopoulos, C., Jacob, J.P., Hennessey, E.S. and Broome-Smith, J.K., (1998). Importance of using lac rather than ara promoter vectors for modulating the levels of toxic gene products in Escherichia coli. Mol. Microbiol. 30:676-678.
Hryniewicz, W. (1999). Epidemiology of MRSA. Infection 27:S13-16.
Immler, D., Gremm, D., Kirsch, D., Spengler, В., Presek, P., Meyer, H.E. (1998). Electrophoresis 19:1015-1023.
Kajava, A.V., Zolov, S.H., Kalinin, A.E. and Hesmeyanova, M.A. (2000). The net charge of the first 18 residues of the mature sequence affects protein translocation across the cytoplasmic membrane of Gram-negative bacteria. J. Bacteriol. 182:2163-2169.
Kluytmans, J., van Belkum, A. and Verbrugh, H. (1997). Nasal carriage of Staphylococcus aureus: epidemiology, underlying mechanisms, and associated risks. Clin. Microbiol. Rev. 10:505-520.
Kolaskar, A.S. and Tongaonkar, P.C. (1990}. A semi-empirical method for prediction of antigenic determinants on protein antigens. FEBS Lett. 276:172-174.
Lim, Y., Shin, S.H., Jang, I.Y., Rhee, J.H. and Kirn, I.S. (1998). Human transferring-binding protein of Staphylococcus aureus is immunogenic in vivo and has an epitope in common with human transferring receptor. FEMS Microbiol. Letters 166:225-230.
Lorenz, U., Ohlsen, K., Karch, H., Hecker, M., Thiede, A. and Hacker, J. (2000). Human antibody response during sepsis against targets expressed by methicillin resistant Staphylococcus aureus. FEMS Immunol. Med. Microbiol. 29:145-153.
Mamo, W., Jonsson, P. and Muller, H.P. (1995). Opsonization of Staphylococcus aureus with a fibronectin-binding protein antiserum induces protection in mice. Microb. Pathog. 19:49-55.
McGuiness ВТ et al. (1996) Nature Biotech. 14:1149.
Modun, В., Evans, R.W., Joannou, C.L. and Williams, P. (1998). Receptor-mediated recognition and uptake of iron from human transferring by Staphylococcus aureus and Staphylococcus epidermidis. Infect. Immun. 66:3591-3596.
Hilsson, I., Patti, J.M., Bremell, Т., Höök, M. and Tarkowski, A. (1998). Vaccination with a Recombinant Fragment of Collagen Adhesin provides Protection against Staphylococcus aureus-mediated Septic Death. J. Clin. Invest. 101:2640-2649.
Parker, K.C., M.A. Bednarek, and J.E. Coligan (1994) Scheme for ranking potential HLA-A2 binding peptides based on independent binding of individual peptide side-chains. J. Immunol. 152:163.
Pasquali, C., Fialka, I. & Huber, L.A. (1997). Electrophoresis 18:2573-2581.
Phillips-Quagliata, J.M, Patel, S., Han, J.K., Arakelov, S., Rao, T.D., Shulman, M.J., Fazel, S., Corley, R.B., Everett, M., Klein, M.H., Underdown, B.J. and Corthesy, B. (2000). The IgA/IgM receptor expressed on a murine В cell lymphoma is poly-Ig receptor. J. Immunol. 165:2544-2555.
Rammensee, Hans-Georg, Jutta Bachmann, Niels Nikolaus Ernmerich., Oskar Alexander Bachor, Stefan Stevanovic (1999) SYFPEITHI: database for MHC ligands and peptide motifs. Immunogenetics 50:213-219.
Recsei P., Kreiswirth, В., O'Reilly, M., Schlievert, P., Gruss, A. and Novick, R.P. (1986).
Regulation of exoprotein gene expression in. Staphylococcus aureus by agr. Mol. Gen. Genet.
202:58-61.
Rodi, D.J. and Makowski, L. (1999). Phage-display technology-finding a needle in a vast molecular haystack. Curr. Opin. Biotechnol. 10:87-93.
Schaffitzel et al., Ribosome display: an in vitro method for selection and evolution of antibodies from libraries; Journal of lmmunological Methods 231, 119-135 (1999).
Sanchez-Campillo, M., Bini, L., Comanducci, M., Raggiaschi, R., Marzocchi, В., Pallini, V. and Ratti, G. (1999). Electrophoresis 20:2269-2279.
Schmittel A., Keilholz U., Thiel E., Scheibenbogen C. (2000) Quantification of tumor-specific Т lymphocytes with the ELISPOT assay. J Immunother 23(3):289-95.
Sester M., Sester U., Kohler H., Schneider Т., Deml L., Wagner R., Mueller-Lantzsch N., Pees HW, Meyerhans A. (2000) Rapid whole blood analysis of virus-specific CD4 and CD8 Т cell responses in persistent HIV infection. AIDS 14(17):2653-60.
Shafer, W.M. and landolo, J.J. (1979). Genetics of staphylococcal enterotoxin В in methicillin-resistant isolates of Staphylococcus aureus. Infect. Immun. 25:902-911.
Shibuya, A., Sakamoto, N., Shimizu, Y., Shibuya K., Osawa, M., Hiroyama Т., Eyre, H.J., Sutherland G.R., Endo Y., Fujita, Т., Miyabayashi Т., Sakano S., Tsuji, Т., Nakayama, E., Phillips, J.H., Lanier, L.L. and Nakauchi, H. (2000). Fca/q receptor mediates endocytosis of IgM-coated microbes. Nature Immunology 1:441-446.
Skerra, A. (1994). Use of the tetracycline promoter for the tightly regulated production of a murine antibody fragment in Escherichia coli. Gene 151:131-135. Sohail, M. (1993). A simple and rapid method for preparing genomic DNA from Gram-positive bacteria. Mol. Biotech. 10:191-193.
Sonderstrup G, Cope AP, Patel S, Congia M, Hain N, Hall FC, Parry SL, Fugger LH, Michie S, McDevitt HO (1999) HLA class II transgenic mice: models of the human CD4+ T-cell immune response. Immunol Rev 172:335-43.
Stumiolo, T. et al., E Bono, J Ding, L Raddrizzani, 0. Tuereci, U Sahin, M Braxenthaler, F Gallazzi, MP Protti, F Sinigaglia, and J Hammer (1999) Generation of tissue-specific and promiscuous HLA ligand databases using DNA chips and virtual HLA class II matrices. Nature Biotechnology 17:555-562.
Valli et al. J. Clin. Invest. (1993) 91: 616-62.
Vandenbergh M.F.Q., Yzerman E.P.F., van Belkum, A., Boelens, H.A. M., Sijmons, M., and Verbrugh, H.A. (1999). Follow-up of Staphylococcus aureus nasal carriage after 8 years: redining the persistent carrier state. J. Clin. Microbiol. 37:3133-3140.
Wessel, D. and Fluegge, U.I. (1984). Anal. Biochem. 138:141-143.
Реферат
Описан способ идентификации, выделения и получения реагирующих с гипериммунной сывороткой антигенов из определенного патогена, причем указанные антигены подходят для применения в вакцине, предназначенной для определенного типа животных или для человека. Способ характеризуется следующими стадиями: получение препарата антител из пула плазмы данного типа животных или пула плазмы человека или индивидуальных сывороток с антителами против данного конкретного патогена; получение по меньшей мере одной экспрессионной библиотеки данного конкретного патогена; скрининг данной по меньшей мере одной экспрессионной библиотеки с помощью указанного препарата антител; идентификация антигенов, связывающихся при скрининге с антителами в препарате антител; скрининг идентифицированных антигенов с помощью индивидуальных препаратов антител из индивидуальных сывороток от лиц с антителами против данного конкретного патогена; идентификация реагирующей с гипериммунной сывороткой антигенной части идентифицированных антигенов, которые связываются с релевантной частью индивидуальных препаратов антител из индивидуальных сывороток; при необходимости выделение реагирующих с гипериммунной сывороткой антигенов и их получение химическими или рекомбинантными методами. Использование способа позволяет идентифицировать эффективные антигены данного патогена, которые могут быть использованы как предпочтительные кандидаты в антигенные вакцины. 2 н. и 18 з.п. ф-лы, 11 ил., 10 табл.


Комментарии