Перекрестно-нейтрализующее антитело (варианты), способ его получения, фармацевтический и диагностический препараты, способы диагностики и лечения инфекций staphylococcus aureus, выделенная нуклеиновая кислота, рекомбинантная экспрессионная кассета или пла - RU2016119052A
Код документа: RU2016119052A
Формула
1. Перекрестно-нейтрализующее антитело, характеризующееся отличием от антитела АВ-24, продуцированного клеткой-хозяином, содержащим легкую цепь антитела, обозначенную AB-24-LC, кодирующая последовательность которой содержится в клетке-хозяине, депонированной под номером DSM 26748, и тяжелую цепь антитела, обозначенную АВ-24-НС, кодирующая последовательность которой содержится в клетке-хозяине, депонированной под номером DSM 26747, и включающее по крайней мере один полиспецифический участок связывания, который связывается с альфа-токсином (HIa) и по крайней мере одним из двухкомпонентных токсинов Staphylococcus aureus, и по крайней мере три определяющих комплементарность области (CDR1-CDR3) вариабельной области тяжелой цепи антитела (VH), при этом CDR1 содержит или состоит из аминокислотной последовательности YSISSGMGWG (SEQ ID 1), CDR2 содержит или состоит из аминокислотной последовательности SIDQRGSTYYNPSLKS (SEQ ID 2), и CDR3 содержит или состоит из аминокислотной последовательности ARDAGHGVDMDV (SEQ ID 3), или CDR является по крайней мере одним функционально активным вариантом, в котором CDR1 является родительской и состоящей из аминокислотной последовательности с SEQ ID 1, или CDR2 является родительской и состоящей из аминокислотной последовательности с SEQ ID 2, или CDR3 является родительской и состоящей из аминокислотной последовательности с SEQ ID 3, причем функционально активный вариант CDR содержит по крайней мере одну точковую мутацию в родительской последовательности CDR и содержит или состоит из аминокислотной
последовательности, которая обладает по крайней мере 60% идентичностью последовательности с родительской последовательностью CDR.
2. Антитело по п. 1, в котором в положении 5 VH CDR1 аминокислотный остаток выбран из группы, включающей S, A, D, Е, F, G, Н, I, К, L, М, N, Q, R, Т V, W и Y, предпочтительно любой из Н, R и W, в положении 7 VH CDR1 аминокислотный остаток выбран из группы, включающей М, Н, К, Q, R и W, предпочтительно любой из К, R и W, в положении 3 VH CDR2 аминокислотный остаток выбран из группы, включающей D и R, в положении 7 VH CDR2 аминокислотный остаток выбран из группы, включающей S, A, D, Е, F, Н, К, М, N, Q, R, Т, W и Y, предпочтительно любой из D, Н, К, N или Q и более предпочтительно Q; в положении 9 VH CDR2 аминокислотный остаток выбран из группы, включающей Y, F, К, L, Q и R и предпочтительно R, в положении 5 VH CDR3 аминокислотный остаток выбран из группы, включающей G, A, D, F, Н, I, М, N, R, S, Т, V и Y, предпочтительно любой из D, F, Н, I, М, N, R, Т, V или Y, в положении 6 VH CDR3 аминокислотный остаток выбран из группы, включающей Н, Е, Q и S, предпочтительно любой из Е или Q, в положении 7 VH CDR3 аминокислотный остаток выбран из группы, включающей G, A, D, Е, Н, I, М, N, Q, S, Т, V и W и предпочтительно Q, и/или в положении 8 VH CDR3 аминокислотный остаток выбран из группы, включающей V, A, D, Е, G, I, К, L, М, Q, R, S и Т и предпочтительно любой из М или R.
3. Антитело по п. 1, в котором функционально активный вариант CDR включает по крайней мере или 1, 2 или 3 точковые мутации в родительской последовательности CDR, или 1 или 2 точковые мутации в любом из четырех С-концевых или четырех N-концевых, или четырех центральных положений
аминокислот родительской последовательности CDR.
4. Антитело по п. 1, в котором функционально активный вариант CDR является или последовательностью CDR1, выбранной из группы, включающей YPISSGMGWG (SEQ ID 4) и YSISSGMGWD (SEQ ID 5), или последовательностью CDR2, выбранной из группы, включающей SVDQRGSTYYNPSLKS (SEQ ID 6), RIDQRGSTYYNPSLKS (SEQ ID 7), RVDQRGSTYYNPSLKS (SEQ ID 8), SIDQRGSTYYNPSLEG (SEQ ID 9) и SIDQRGSTYYNPPLES (SEQ ID 10) или последовательностью CDR3, выбранной из группы, включающей ARDAGHGADMDV (SEQ ID 11) и ARDAGHAVDMDV (SEQ ID 12).
5. Антитело по п. 1, которое включает или последовательность CDR1 с SEQ ID 1, последовательность CDR2 с SEQ ID 6, и последовательность CDR3 с SEQ ID 11, или последовательность CDR1 с SEQ ID 4, последовательность CDR2 с SEQ ID 7 и последовательность CDR3 с SEQ ID 3, или последовательность CDR1 с SEQ ID 1, последовательность CDR2 с SEQ ID 8 и последовательность CDR3 с SEQ ID 3, или последовательность CDR1 с SEQ ID 1, последовательность CDR2 с SEQ ID 2 и последовательность CDR3 с SEQ ID 12, или последовательность CDR1 с SEQ ID 5, последовательность CDR2 с SEQ ID 9 и последовательность CDR3 с SEQ ID 3 или последовательность CDR1 с SEQ ID 5, последовательность CDR2 с SEQ ID 10 и последовательность CDR3 с SEQ ID 3.
6. Антитело по п. 1, которое включает аминокислотную последовательность VH, выбранную из группы, включающей SEQ ID 20-31, предпочтительно содержащее аминокислотную последовательность тяжелой цепи (ТЦ) антитела, выбранную из группы, включающей SEQ ID 40-51 или
любую из аминокислотных последовательностей с SEQ ID 40-51 с делецией С-концевой аминокислоты.
7. Антитело по п. 1, которое дополнительно включает по крайней мере три определяющих комплементарность области (CDR4-CDR6) вариабельной области легкой цепи антитела (VL), при этом предпочтительно CDR4 содержит или состоит из аминокислотной последовательности RASQGISRWLA (SEQ ID 32), CDR5 содержит или состоит из аминокислотной последовательности AASSLQS (SEQ ID 33), и CDR6 содержит или состоит из аминокислотной последовательности QQGYVFPLT (SEQ ID 34), или CDR является по крайней мере одним функционально активным вариантом, в котором CDR4 является родительской и содержит аминокислотную последовательность с SEQ ID 32, или CDR5 является родительской и содержит аминокислотную последовательность с SEQ ID 33, или CDR6 является родительской и содержит аминокислотную последовательность с SEQ ID 34, причем функционально активный вариант CDR содержит по крайней мере одну точковую мутацию в родительской последовательности CDR и содержит или состоит из аминокислотной последовательности, которая обладает по крайней мере 60% идентичностью последовательности с родительской последовательностью CDR.
8. Антитело по п. 7, в котором в положении 7 VL CDR4 аминокислотный остаток выбран из группы, включающей S, А, Е, F, G, К, L, М, N, Q, R, W и Y, предпочтительно любой из L, М, R или W и более предпочтительно R, в положении 1 VL CDR5 аминокислотный остаток выбран из группы, включающей А и G, в положении 3 VL CDR5 аминокислотный остаток выбран
из группы, включающей S, A, D, G, Н, I, К, L, N, Q, R, Т, V и W, в положении 4 VL CDR5 аминокислотный остаток выбран из группы, включающей S, D, Е, Н, I, К, М, N, Q, R, Т и V, предпочтительно любой из К, N, Q и R, в положении 3 VL CDR6 аминокислотный остаток выбран из группы, включающей G, A, D, E, F, Н, I, К, L, N, Q, R, S, Т, V, W и Y, в положении 4 VL CDR6 аминокислотный остаток выбран из группы, включающей Y, D, F, Н, М, R и W, в положении 5 VL CDR6 аминокислотный остаток выбран из группы, включающей V, A, D, Е, F, G, Н, I, К, L, М, N, Q, R, S, Т, и W, и/или в положении 6 VL CDR6 аминокислотный остаток выбран из группы, включающей F и W.
9. Антитело по п. 7, которое включает аминокислотную последовательность VL с SEQ ID 39 или аминокислоту легкой цепи (ЛЦ) антитела с SEQ ID 52.
10. Антитело по п. 1, которое обладает перекрестной специфичностью к связыванию с HIa и по крайней мере одним из компонентов F двухкомпонентных токсинов, предпочтительно двумя или тремя из них, при этом предпочтительно компоненты F выбраны из группы, включающей HIgB, LukF и LukD или любой компонент F родственных и неродственных пар компонентов F и S гамма-гемолизинов, токсинов PVL и PVL-подобных токсинов, предпочтительно HIgAB, HIgCB, LukSF, LukED, LukS-HIgB, LukSD, HIgA-LukD, HIgA-LukF, LukEF, LukE-HIgB, HIgC-LukD или HIgC-LukF.
11. Антитело по любому из пп. 1-10, которое является полноразмерным моноклональным, при этом его фрагмент включает по крайней мере один домен, содержащий участок связывания, или гибридный белок, включающий по крайней мере один домен, содержащий участок связывания.
12. Перекрестно-нейтрализующее антитело, включающее по крайней мере один полиспецифический участок связывания, который связывается с альфа-токсином (HIa) и по крайней мере одним из двухкомпонентных токсинов Staphylococcus aureus, являющееся функционально активным вариантом родительского антитела, которое включает полиспецифический участок связывания аминокислотной последовательности VH с SEQ ID 20 и аминокислотной последовательности VL с SEQ ID 39 и по крайней мере одну точковую мутацию в любой из каркасной областей (FR), или константных доменов или определяющих комплементарность областей (CDR1-CDR6) в любой из SEQ ID 20 или SEQ 39 и имеющее аффинность к связыванию каждого из токсинов с Kd меньше 10-8 М, предпочтительно меньше 10-9 М.
13. Антитело по п. 12, в котором в положении 5 VH CDR1 аминокислотный остаток выбран из группы, включающей S, A, D, Е, F, G, Н, I, К, L, М, N, Q, R, Т V, W и Y, предпочтительно любой из Н, R и W, в положении 7 VH CDR1 аминокислотный остаток выбран из группы, включающей М, Н, К, Q, R и W, предпочтительно любой из К, R и W, в положении 3 VH CDR2 аминокислотный остаток выбран из группы, включающей D и R, в положении 7 VH CDR2 аминокислотный остаток выбран из группы, включающей S, A, D, Е, F, Н, К, М, N, Q, R, Т, W и Y, предпочтительно любой из D, Н, К, N или Q и более предпочтительно Q, в положении 9 VH CDR2 аминокислотный остаток выбран из группы, включающей Y, F, К, L, Q и R, и предпочтительно R, в положении 5 VH CDR3 аминокислотный остаток выбран из группы, включающей G, A, D, F, Н, I, М, N, R, S, Т, V и Y, предпочтительно любой из D, F, Н, I, М, N, R, Т, V или Y, в
положении 6 VH CDR3 аминокислотный остаток выбран из группы, включающей Н, Е, Q и S, предпочтительно любой из Е или Q, в положении 7 VH CDR3 аминокислотный остаток выбран из группы, включающей G, A, D, Е, Н, I, М, N, Q, S, Т, V и W и предпочтительно Q, и/или в положении 8 VH CDR3 аминокислотный остаток выбран из группы, включающей V, A, D, Е, G, I, К, L, М, Q, R, S и Т и предпочтительно любой из М или R.
14. Антитело по п. 12, в котором в положении 7 VL CDR4 аминокислотный остаток выбран из группы, включающей S, А, Е, F, G, К, L, М, N, Q, R, W и Y, предпочтительно любой из L, М, R или W и более предпочтительно R, в положении 1 VL CDR5 аминокислотный остаток выбран из группы, включающей А и G, в положении 3 VL CDR5 аминокислотный остаток выбран из группы, включающей S, A, D, G, Н, I, К, L, N, Q, R, Т, V и W, в положении 4 VL CDR5 аминокислотный остаток выбран из группы, включающей S, D, Е, Н, I, К, М, N, Q, R, Т и V, предпочтительно любой из К, N, Q и R, в положении 3 VL CDR6 аминокислотный остаток выбран из группы, включающей G, A, D, Е, F, Н, I, К, L, N, Q, R, S, Т, V, W и Y, в положении 4 VL CDR6 аминокислотный остаток выбран из группы, включающей Y, D, F, Н, М, R и W, в положении 5 VL CDR6 аминокислотный остаток выбран из группы, включающей V, A, D, Е, F, G, Н, I, К, L, М, N, Q, R, S, Т, и W, и/или в положении 6 VL CDR6 аминокислотный остаток выбран из группы, включающей F и W.
15. Антитело по п. 12, которое обладает перекрестной специфичностью к связыванию с HIa и по крайней мере одним из компонентов F двухкомпонентных токсинов, предпочтительно двумя или тремя из них, при
этом предпочтительно компоненты F выбраны из группы, включающей HIgB, LukF и LukD или любой компонент F родственных и неродственных пар компонентов F и S гамма-гемолизинов, токсинов PVL и PVL-подобных токсинов, предпочтительно HIgAB, HIgCB, LukSF, LukED, LukS-HIgB, LukSD, HIgA-LukD, HIgA-LukF, LukEF, LukE-HIgB, HIgC-LukD или HIgC-LukF.
16. Антитело по любому из пп. 12-15, которое является полноразмерным моноклональным, при этом его фрагмент включает по крайней мере один домен, содержащий участок связывания, или гибридный белок, включающий по крайней мере один домен, содержащий участок связывания.
17. Применение антитела по любому из пп. 1-16 при лечении больного, подверженного риску или страдающего от инфекции S. aureus, включающем введение больному эффективного количества антитела для ограничения инфекции у больного, улучшения состояния заболевания, связанного с указанной инфекцией, или ингибирования патогенеза заболевания S. aureus, такого как пневмония, сепсис, бактериемия, раневая инфекция, абсцессы, инфекция послеоперационной раны, эндофтальмит, фурункулез, карбункулез, эндокардит, перитонит, остеомиелит или суставная инфекция.
18. Фармацевтический препарат, включающий антитело по любому из пп. 1-16, предпочтительно выполненный в виде лекарственной формы для парентерального применения или нанесения на слизистую оболочку, необязательно содержащий фармацевтически приемлемый носитель или наполнитель.
19. Применение антитела по любому из пп. 1 -16 при диагностике любых
инфекций S. aureus, в том числе метициллин-резистентными золотистыми стафилококками с высоким токсинообразованием, такими как некротическая пневмония и токсинообразование при фурункулезе и карбункулезе.
20. Диагностический препарат антитела по любому из пп. 1-16, необязательно включающий метку антитела и/или дополнительный диагностический реактив с меткой.
21. Выделенная нуклеиновая кислота, кодирующая антитело по любому из пп. 1-16.
22. Рекомбинантная экспрессионная кассета или плазмида, включающая кодирующую последовательность для экспрессии легкой цепи и/или тяжелой цепи антитела по любому из пп. 1-16.
23. Клетка-хозяин, содержащая экспрессионную кассету или плазмиду по п. 22.
24. Способ получения антитела по любому из пп. 1-16, включающий культивирование или поддержание в условиях получения указанного антитела клетки-хозяина по п. 23.
25. Способ получения функционально активных вариантов родительского антитела, которое является любым из антител, содержащим полиспецифический участок связывания аминокислотной последовательности VH любой из SEQ ID 20-31 и аминокислотной последовательности VL с SEQ ID 39, включающий конструирование по крайней мере одной точковой мутации в любой из каркасных областей (FR) или константных доменов или определяющих комплементарность областей (CDR1-CDR6) в любой из SEQ ID 20-31 или SEQ 39 для получения варианта антитела и определение
функциональной активности варианта антитела или по аффинности к связыванию с HIa и по крайней мере одним из двухкомпонентных токсинов S. aureus с Kd меньше 10-8 М, предпочтительно меньше 10-9 М и/или по связыванию варианта антитела с HIa и/или по крайней мере с одним из двухкомпонентных токсинов в конкуренции с родительским антителом, при этом после определения функциональной активности функционально активные варианты выбирают для производства с применением рекомбинантного метода.
26. Кристалл, образованный из мономера HIa, который преломляет рентгеновское излучение для получения дифракционной картины, представляющей трехмерную структуру краевого домена HIa в контакте с антителом по любому из пп. 1-16 или его фрагментом связывания, предпочтительно фрагментом Fab, характеризующийся константами ячейки, выбранными из группы, включающей 285,05
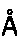 , 150,94
, 150,94
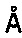 , 115,25
, 115,25
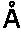 и пространственную группу Р21212, необязательно с отклонением от 0,00
и пространственную группу Р21212, необязательно с отклонением от 0,00
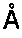 до 2,00
до 2,00
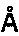 .
.
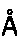
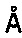
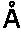
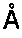
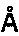
27. Кристалл, образованный из мономера LukD, который преломляет рентгеновское излучение для получения дифракционной картины, представляющей трехмерную структуру краевого домена LukD в контакте с антителом по любому из пп. 1-16 или его фрагментом связывания, предпочтительно фрагментом Fab, характеризующийся константами ячейки, выбранными из группы, включающей 112,0
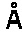 , 112,0
, 112,0
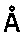 , 409,3
, 409,3
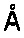 и пространственную группу Н32, необязательно с отклонением от 0,00
и пространственную группу Н32, необязательно с отклонением от 0,00
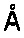 до 2,00
до 2,00

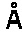
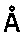
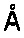
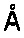

28. Выделенный паратоп антитела по любому из пп. 1-16 или связывающая молекула, включающую указанный паратоп.
29. Выделенный конформационный антигенный эпитоп, распознаваемый антителом по любому из пп. 1-16, характеризующийся трехмерной структурой краевого домена HIa, LukD, LukF или HIgB.
30. Эпитоп по п. 29, который имеет трехмерную структуру, выбранную из группы, включающей трехмерную структуру HIa, характеризующуюся структурными координатами контактных аминокислотных остатков 179-191, 194, 200, 269 и 271 с SEQ ID 54, трехмерную структуру LukF, характеризующуюся структурными координатами контактных аминокислотных остатков 176-188, 191, 197 и 267 с SEQ ID 55, предпочтительно с аминокислотными остатками 176-179, 181-184, 186-188, 191, 197 и 267 с SEC-ID 58, трехмерную структуру LukD, характеризующуюся структурными координатами контактных аминокислотных остатков 176-188, 191, 197 и 267 с SEQ ID 54, предпочтительно с аминокислотными остатками 176-179, 181-184, 186-188, 191, 197 и 267 с SEQ ID 62, трехмерную структуру HIgB, характеризующуюся структурными координатами контактных аминокислотных остатков 177-189, 192, 198 и 268 с SEQ ID 56, предпочтительно с аминокислотными остатками 177-180, 182-185, 187-189, 192, 198 и 268 c SEQ ID 68, трехмерную структуру краевого домена HIa кристалла по определению 26, трехмерную структуру краевого домена LukD кристалла по определению 27 и трехмерную структуру, которая является гомологом любой из вышеуказанных структур, при этом указанный гомолог включает участок связывания, который имеет среднеквадратичное отклонение от атомов
основной цепи контактных аминокислотных остатков от 0,00
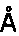 до 2,00
до 2,00
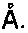
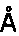
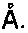
31. Эпитоп по п. 29 или 30, которая связывается связывающей молекулой.
32. Связывающая молекула, которая специфически связывается с антигенным эпитопом по любому из пп. 29-31, предпочтительно выбранная из группы, включающей белок, пептид, пептидомиметик, нуклеиновую кислоту, углевод, липид, олигопептид, аптамер и низкомолекулярное соединение, предпочтительно антитело, фрагмент этого антитела, включающее по крайней мере один домен антитела, содержащий участок связывания, или гибридный белок, включающий по крайней мере один домен антитела, содержащий участок связывания, характеризующаяся полиспецифическим связыванием с HIa и по крайней мере с одним из двухкомпонентных токсинов S. aureus.
33. Способ скрининга или анализа для определения связывающего соединения, которое специфически связывается с антигенным эпитопом по любому из пп. 29-31, включающий введение рассматриваемого соединения в контакт с трехмерной структурой эпитопа по п. 30 и оценку связывания между рассматриваемым соединением и трехмерной структурой, при этом фактом связывания между рассматриваемым соединением и трехмерной структурой определяют рассматриваемое соединение как полиспецифическое связывающее соединение, которое связывается с HIa и по крайней мере одним из двухкомпонентных токсинов S. aureus.
34. Иммуноген, включающий эпитоп по любому из пп. 29-31, необязательно дополнительные эпитопы, свободные от природной связи с
вышеназванным эпитопом, и носитель, предпочтительно фармацевтически приемлемый носитель, предпочтительно включающий буфер и/или адъювантные вещества.
35. Иммуноген по п. 34, который выполнен в лекарственной форме вакцины, предпочтительно для парентерального применения.
36. Применение иммуногена по любому из пп. 34-35 при лечении больного от инфекции S. aureus, профилактики состояния заболевания, связанного с указанной инфекцией, или ингибирования патогенеза пневмонии S. aureus, путем введения эффективного количества указанного иммуногена для защиты больного.
37. Применение по п. 36, которое включает стимулирование защитного иммунного ответа.

Комментарии