Внешний коровой эпитоп липополисахарида н. pylori - RU2558257C2
Код документа: RU2558257C2
Чертежи

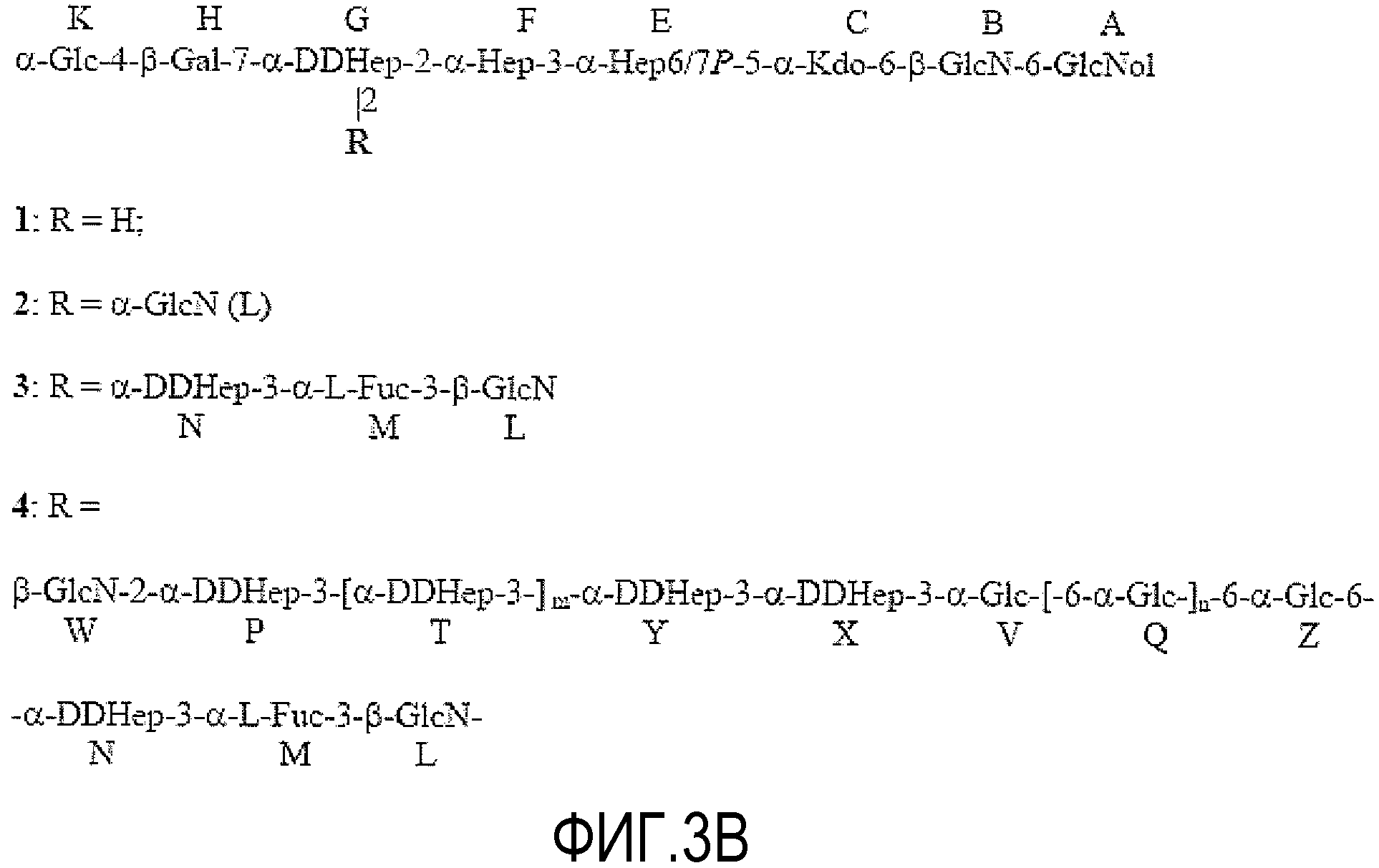
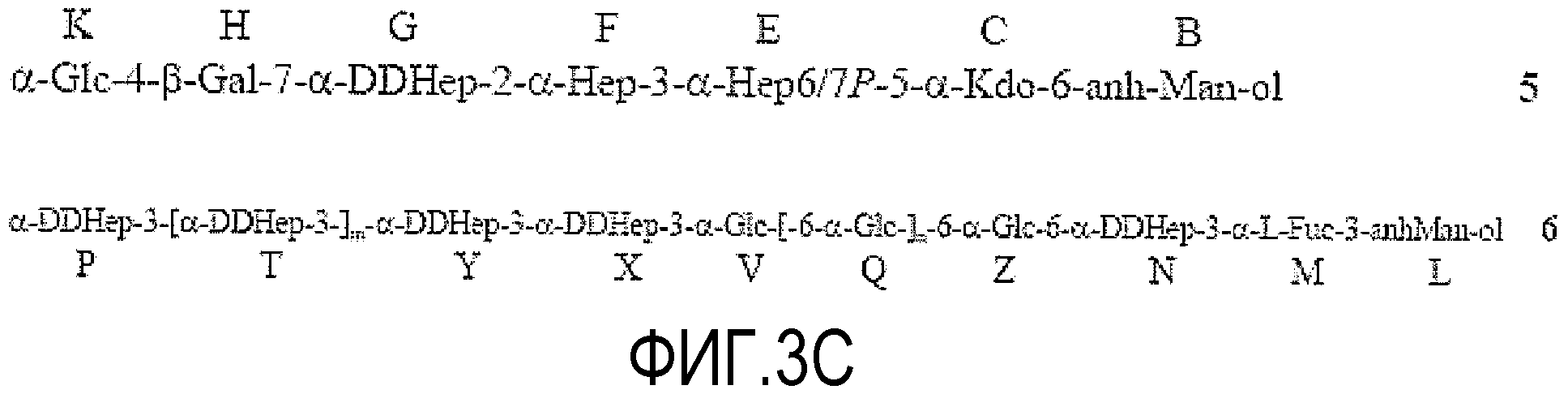
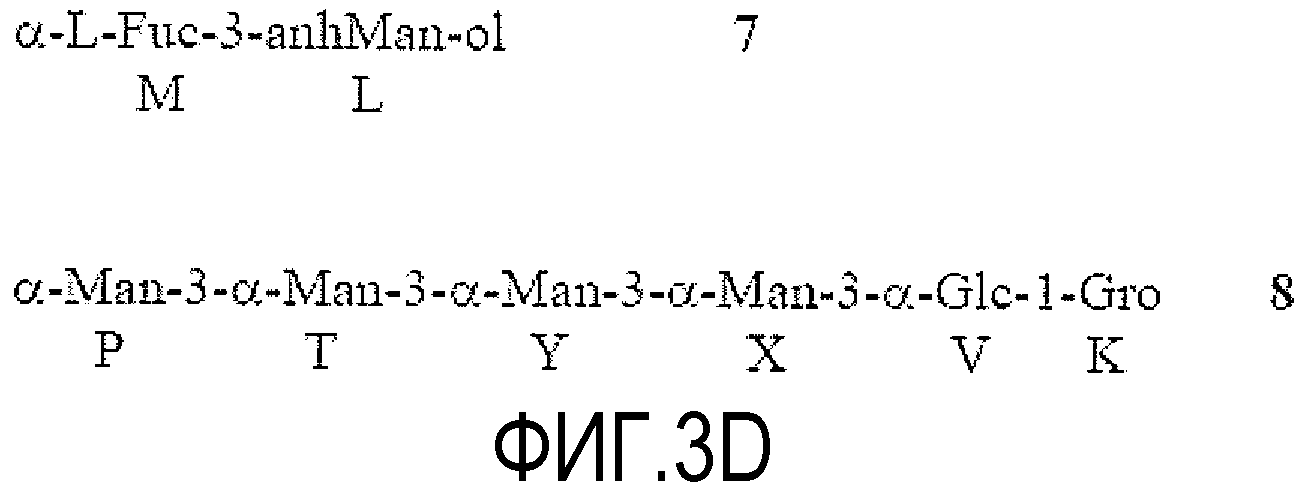
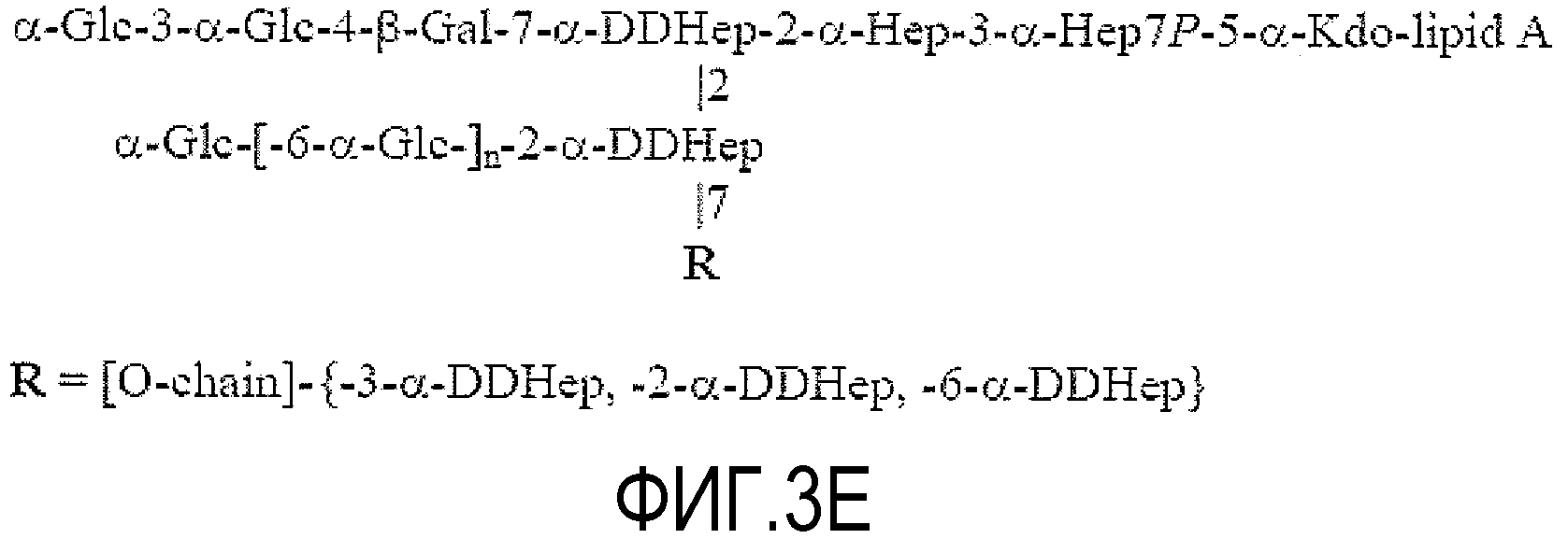
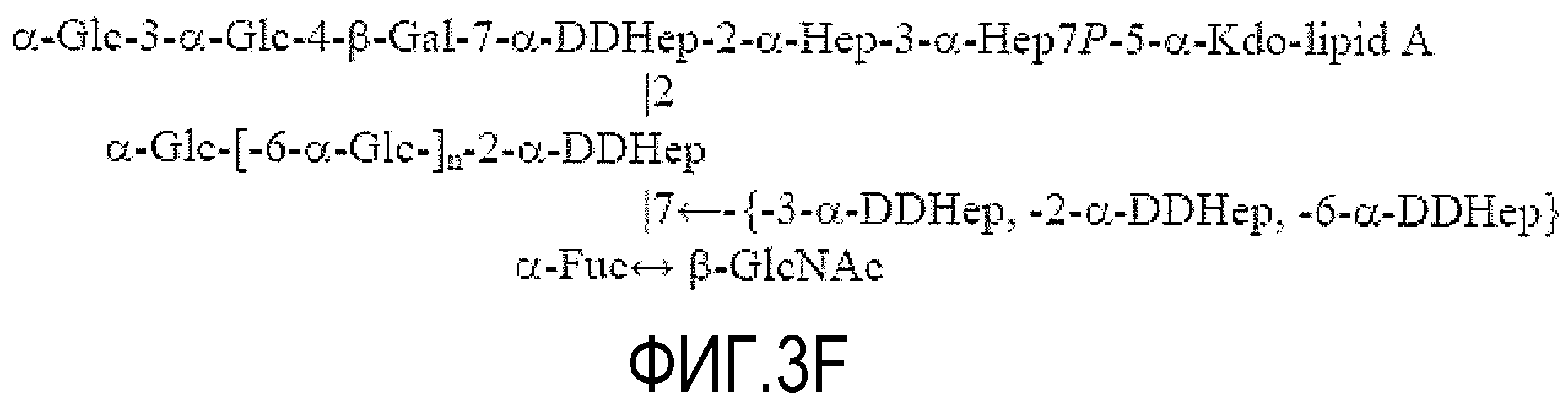

Описание
ИНФОРМАЦИЯ О ПРЕДШЕСТВУЮЩЕЙ ЗАЯВКЕ
По настоящей заявке испрашивается приоритет предварительной заявки на патент США 61/230315, поданной 31 июля 2009, которая включена в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новому внешнему коровому эпитопу LPS Helicobacter pylori. Более конкретно, настоящее изобретение относится к новому внешнему коровому эпитопу H. pylori, к его синтезу, описанию и конъюгированию.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Helicobacter pylori считается наиболее распространенной бактериальной инфекцией, связанной с хроническим гастритом, пептической язвой и карциномой желудка у человека. Распространенность инфекции H. pylori оценивается как приблизительно половина популяции всего мира, достигая до 70% в развивающихся странах и 20-30% в промышленно развитых странах (Dunn et al., 1997). Подавляющее большинство индивидов приобретает H. pylori в детстве; распространенность инфекции среди детей в развивающихся странах связывают с низким социально-экономическим статусом и плохим санитарным состоянием (Castillo-Rojas et al., 2004). H. pylori определяется Всемирной Организацией Здравоохранения (WHO) как канцероген класса I, поскольку она повышает относительный риск возникновения рака желудка по меньшей мере в шесть раз. Рак желудка является второй наиболее частой причиной смертности во всем мире и составляет 700000 случаев в год (Parkin et al., 2002).
Современные стратегии уничтожения H. pylori основаны на использовании ингибиторов протонной помпы и антибиотиков. Однако эффективность химиотерапевтического воздействия ограничена устойчивостью к антибиотикам, что часто встречается среди изолятов H. pylori и недостаточностью иммунного ответа при повторной инфекции. Таким образом, необходимы новые виды терапевтических средств, обеспечивающих глобальную стратегию профилактики и устранения инфекций H. pylori.
Несмотря на то, что в недавно проведенных исследованиях внимание было сосредоточено на роли белковых компонентов в патогенезе H. pylori и их роли в защитном иммунитете (Ruggiero et al., 2003; Rossi et al., 2004), сравнительно небольшое число исследований было осуществлено для оценки возможности включения антигенов, отличных от белков, в составы вакцин (Angelakopoulos and Hohmann, 2000). Например, известно, что конъюгированные вакцины на основе полисахаридов препятствуют развитию системной инфекции и ингибируют колонизацию хозяина (Anderson et al., 1986; Chu et al., 1991; Pon et al., 1997; Passwell et al., 2001; Passwell et al., 2003). В недавних исследованиях кишечных патогенов были изучены подходы, основанные на конъюгатах LPS, в качестве вакцин-кандидатов человека (Gu et al., 1996; Mieszala et al., 2003; Cox et al., 2005; Yu and Gu, 2007).
Липополисахарид (LPS) является главным компонентом клеточной поверхности H. pylori. Исследования структуры, проведенные на ряде изолятов H. pylori (Monteiro, 2001), привели в результате к созданию структурной модели LPS, состоящей из O-цепи и корового олигосахарида, который прикреплен к молекуле липида A. Структура полисахаридного остова O-цепи большинства штаммов H. pylori являетсяуникальной и отражает детерминанты группы крови по Льюису (Le) типа 2 и/или типа 1, которые имитируют детерминанты, присутствующие на поверхности клеток желудка и опухолевых клеток человека (Wirth et al., 1996); указанные детерминанты могут быть вовлечены в нежелательные аутоиммунные реакции, приводящие к атрофическому гастриту (Appelmelk et al., 1996). Кроме того, внешний участок кора LPS H. pylori содержит два необычных полимерных компонента: DD-гептогликан и α1,6-глюкан (Monteiro, 2001). Полимер α1,6-глюкана внешнего корового участка LPS изолятов H. pylori синтезируется продуктом гена HP0159 с открытой рамкой считывания. Наличие и экспрессия гена HP0159 в H. pylori являются обычными.
Описано несколько биосинтетических генов LPS H. pylori и определена их роль в патогенезе и колонизации (Logan et al., 2000; Logan et al., 2005; Hiratsuka et al., 2005; Chandan et al., 2007; Altman et al., 2008). Были созданы мутанты HP0826 H. Pylori, и было показано, что указанная мутация приводит к образованию усеченных LPS, лишенных антигена Le (Logan et al., 2000). Однако не была проведена полная характеристика структуры LPS.
Несмотря на успехи в данной области, иммуногенные эпитопы, эффективные во многих типах H. Pylori остаются неясными.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому эпитопу внешнего участка кора LPS Helicobacter pylori. Более подробно, настоящее изобретение относится к новому эпитопу внешнего участка кора LPS H. pylori, его синтезу, описанию и конъюгированию.
Настоящее изобретение относится к α1,6-глюкан-содержащему соединению Helicobacter pylori, содержащему структуру формулы I:
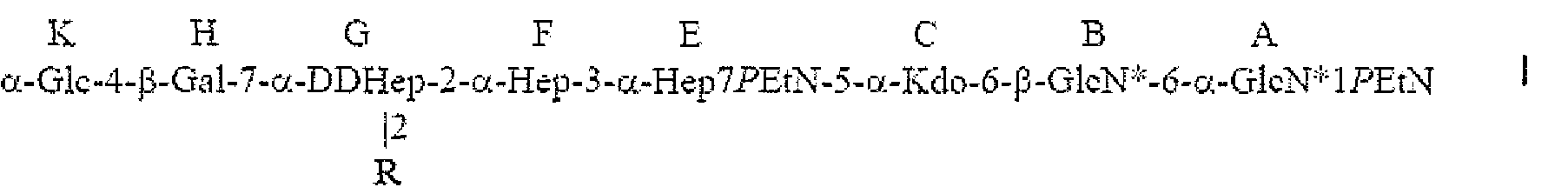
R представляет собой трисахарид α-DDHep-3-α-L-Fuc-3-β-GlcNAc, замещенный α1,6-глюканом, связанным с α1,3-DD-гептаном, и последний остаток DD-Hep α1,3-DD-гептана кэпирован остатком β-GlcNAc. В описанном соединении α1,6-глюкан может содержать приблизительно от 3 до 12 α1,6-связанных остатков глюкозы, и α1,3-DD-гептан может содержать приблизительно от 2 до 6 α1,3-связанных остатков гептозы.
Группа R соединения, которое описано выше, может представлять собой
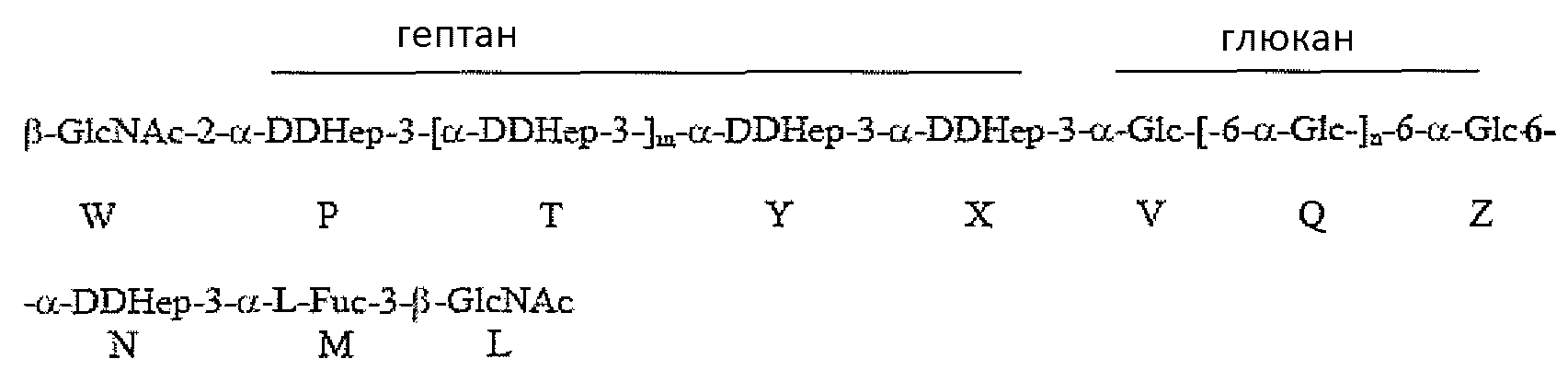
где остаток L β-GlcNAc связан с О-2 Hep G. В соединении, которое описано выше, остатки Q и Z глюкана представляют собой α1,6-связанные остатки глюкозы, и n может иметь любое значение от 1 до 11; остатки T, Y и X представляют собой α1,3-связанные остатки гептозы, и m может иметь любое значение приблизительно от 0 до 4.
Соединение, которое описано выше, может быть выделено или очищено из штамма HP0826::Kan H. pylori.
В соединениях, описанных выше, структура формулы I может, кроме того, содержать молекулу липида A, ковалентно связанную с остатком Kdo С. Молекула липида A может быть O-деацилирована или может быть отщеплена путем гидролиза кетозидной связи от остатка Kdo.
Настоящее изобретение также относится к конъюгату, содержащему по существу линейное α1,6-глюкан-содержащее соединение, конъюгированное с линкерной молекулой, белком-носителем или их комбинацией. По существу линейное α1,6-глюкан-содержащее соединение может представлять собой соединение, описанное в настоящей заявке, отличающееся тем, что структура формулы I конъюгирована с линкерной молекулой, белком-носителем или их комбинацией. По существу линейное α1,6-глюкан-содержащее соединение альтернативно может представлять собой Декстран, такой как Декстран T5. Белок-носитель может представлять собой столбнячный анатоксин или бычий сывороточный альбумин.
Настоящее изобретение также включает композицию, содержащую одно или более чем одно соединения или конъюгаты, которые описаны выше.
Настоящее изобретение дополнительно относится к антителу, направленному против соединения, содержащего α1,6-глюкановый эпитоп, описанный в настоящем описании. Антитело может быть моноклональным антителом 1C4F9. Изобретение, кроме того, относится к гибридомной клеточной линии 1C4F9, которая продуцирует моноклональное антитело 1C4F9.
Моноклональное антитело, описанное выше, может быть использовано для индукции комплемент-опосредованного бактериолиза α1,6-глюкан-экспрессирующих штаммов H. pylori у индивида, при необходимости.
Настоящее изобретение также относится к применению эффективного количества композиции, описанной выше, для индукции иммунного ответа против H. pylori у индивида. Соединение(я) в композиции может быть конъюгировано с подходящим белком-носителем; кроме того, соединение(я) в композиции может быть конъюгировано с подходящим белком-носителем с помощью 2-кето-3-деокси-октулозоновой кислоты (Kdo) липополисахарида.
Настоящее изобретение, кроме того, относится к иммунной антисыворотке, полученной иммунизацией млекопитающего иммуногенной композицией, описанной в настоящей заявке. Иммунная антисыворотка может содержать IgG, распознающий α1,6-связанный глюкановый эпитоп в гомологичных и гетерологичных типируемых и нетипируемых штаммах H. pylori мутантного и дикого типа. IgG может вызывать комплемент-опосредованный бактериолиз штаммов H. pylori мутантного и дикого типа, экспрессирующих α1,6-глюкан.
Дополнительные аспекты и преимущества настоящего изобретения будут понятны с учетом нижеследующего описания. Подробное описание и примеры, в которых приведены предпочтительные варианты осуществления изобретения, показаны только в качестве иллюстрации, поскольку различные изменения и модификации в рамках изобретения будут очевидны специалистам в данной области в свете описания настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Указанные и другие признаки изобретения будут описаны в настоящей заявке в форме примера со ссылкой на прилагаемые чертежи, где:
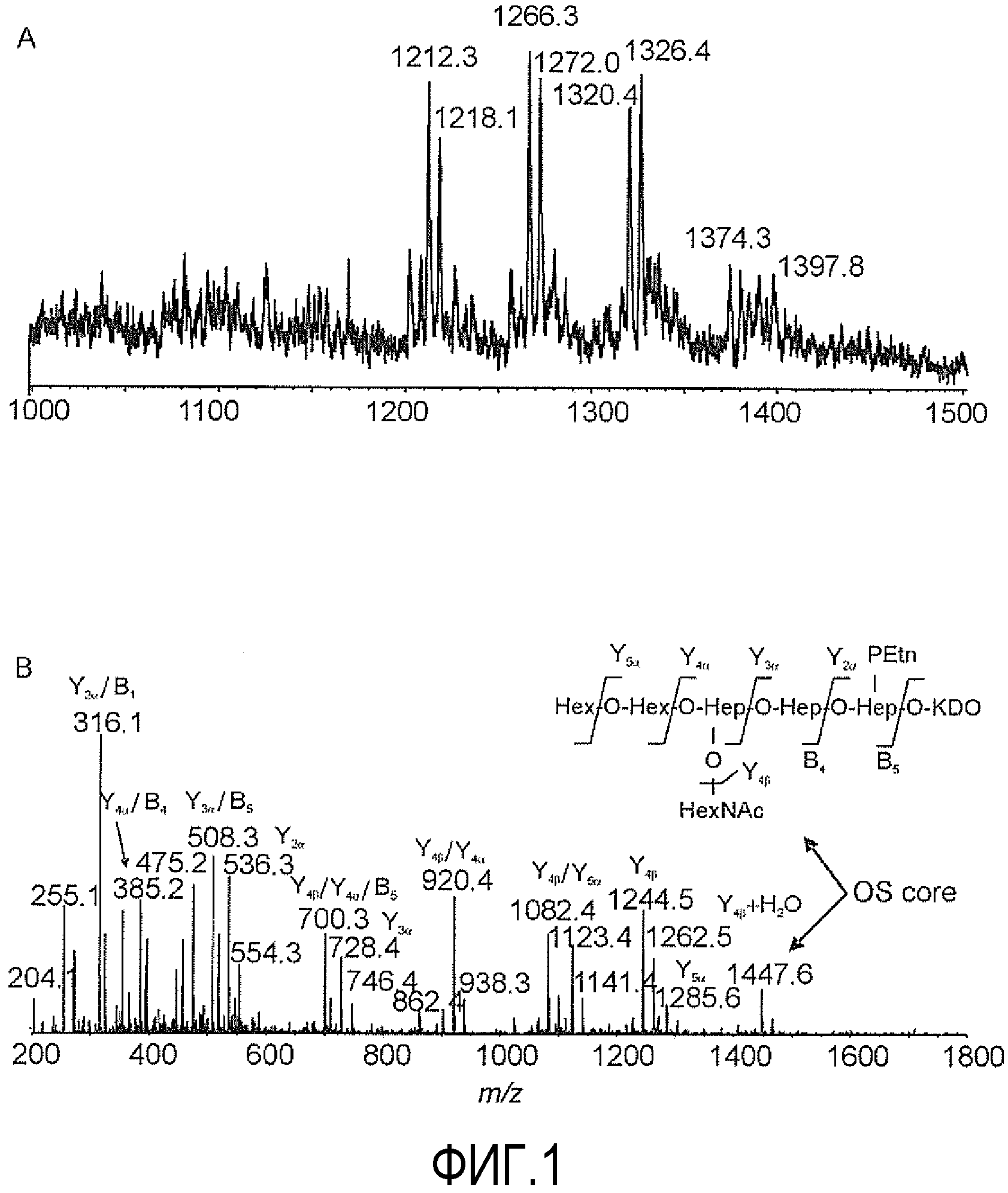
на ФИГУРЕ 1 показан анализ CE-MS гликоформ LPS фракции 1 делипидизированного LPS штамма 26695 HP0826::Kan H. pylori в режиме определения положительных ионов. На фигуре 1A показан выделенный масс-спектр (m/z 1000-1500), тогда как на фигуре 1 B показан спектр ионов-продуктов ионов при m/z 1266,3.
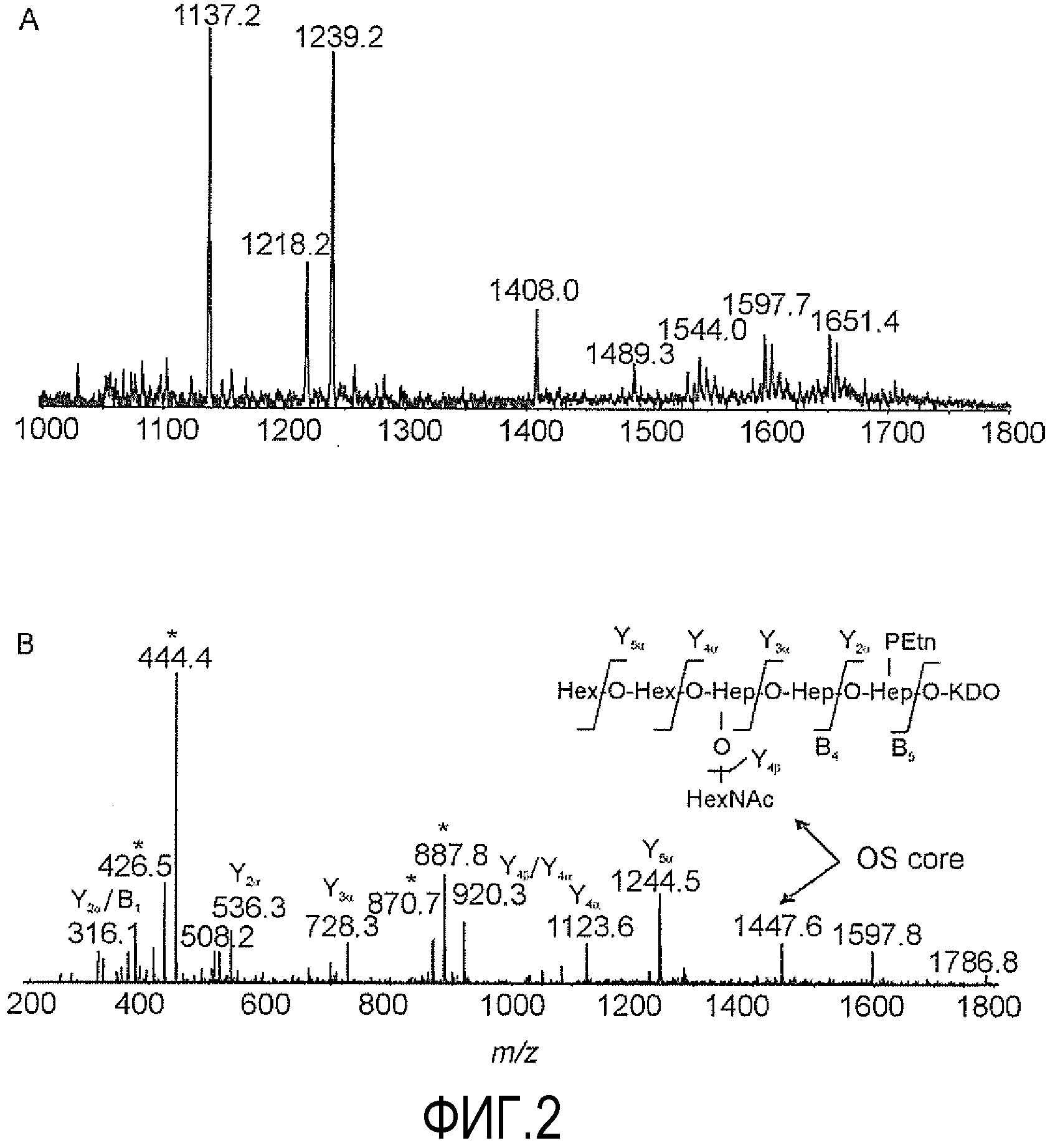
На ФИГУРЕ 2 показан анализ CE-MS гликоформ LPS O-деацилированного LPS штамма 26695 HP0826::Kan H. pylori в режиме определения отрицательных ионов. На фигуре 2A показан выделенный масс-спектр (m/z 600-2000), тогда как на фигуре 2B показан спектр ионов-продуктов ионов при m/z 1597,7. Заряженные фрагменты, соответствующие группировке липида А, помечены звездочкой.
На ФИГУРЕ 3A показана структура основной гликоформы LPS штамма 26695 HP0826::Kan H. pylori; ацилирование не показано. Продукты KOH-деацилирования LPS фигуры 3A показаны на фигуре 3B (соединения 1-4). Продукты дезаминирования соединения 4 показаны на фигуре 3C (соединения 5 и 6). Продукты окисления периодатом соединения 6 показаны на фигуре 3D (соединения 7 и 8). Структуры, ранее предложенные в данной области для LPS H. pylori штамма 26695 (фигура 3E) и LPS H. pylori мутантного штамма 26695 HP0826::Kan (фигура 3F), также показаны (адаптировано из Logan et al., 2000). PEtn = фосфоэтаноламин; Glc = D-глюкопираноза; Gal = D-галактопираноза; Kdo = 2-кето-3-деокси-октулозоновая кислота; LDHep = L-глицеро-D-манногептоза; DDHep = D-глицеро-D-манногептоза; GlcNAc - 2-ацетамидо-2-деокси-D-глюкоза; GlcN=2-амино-2-деокси-D-глюкоза; Fuc=L-фукоза; P=фосфат; и Gro=глицерин.
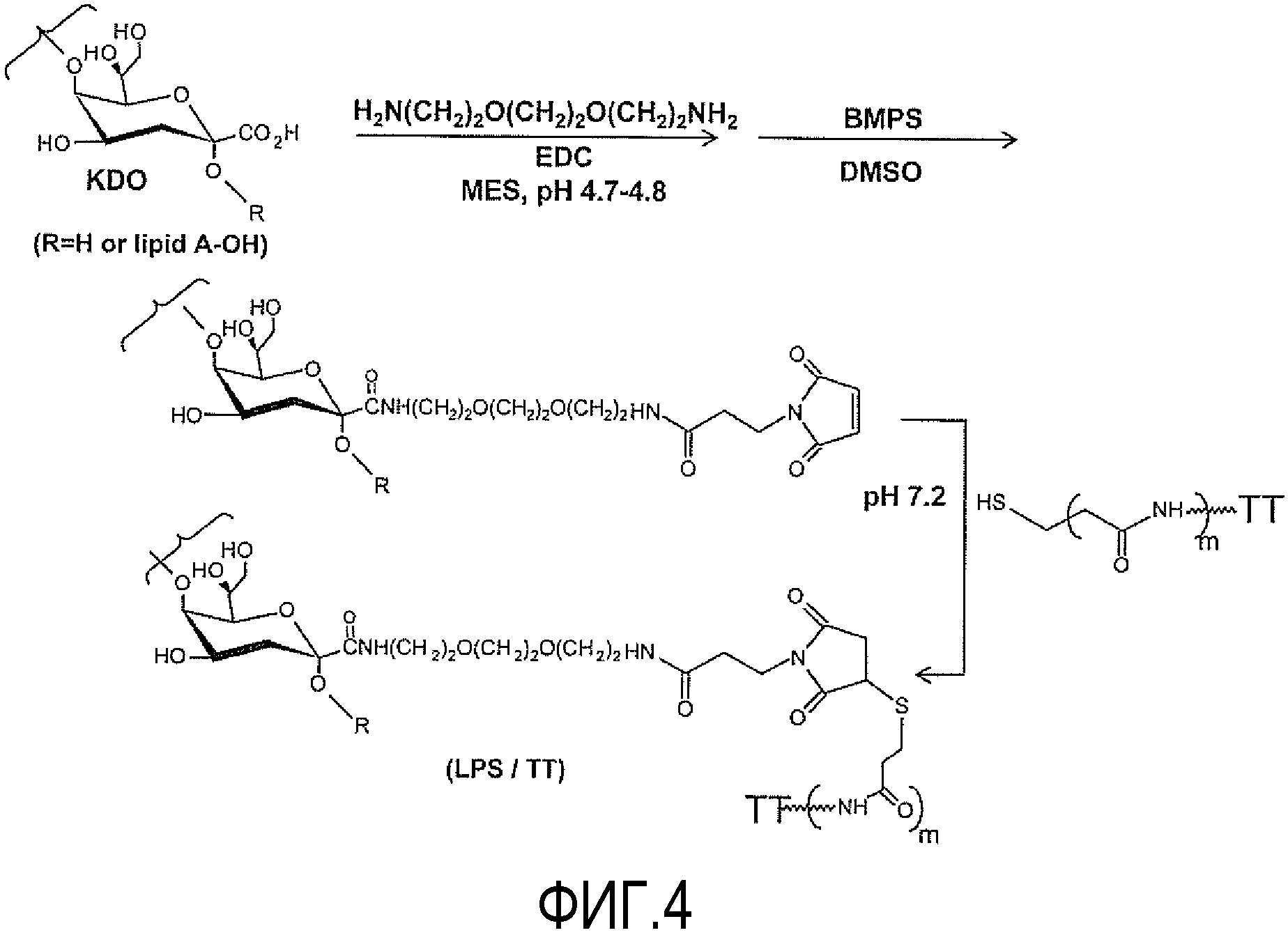
На ФИГУРЕ 4 показана схема реакции получения конъюгатов на основе LPS настоящего изобретения.
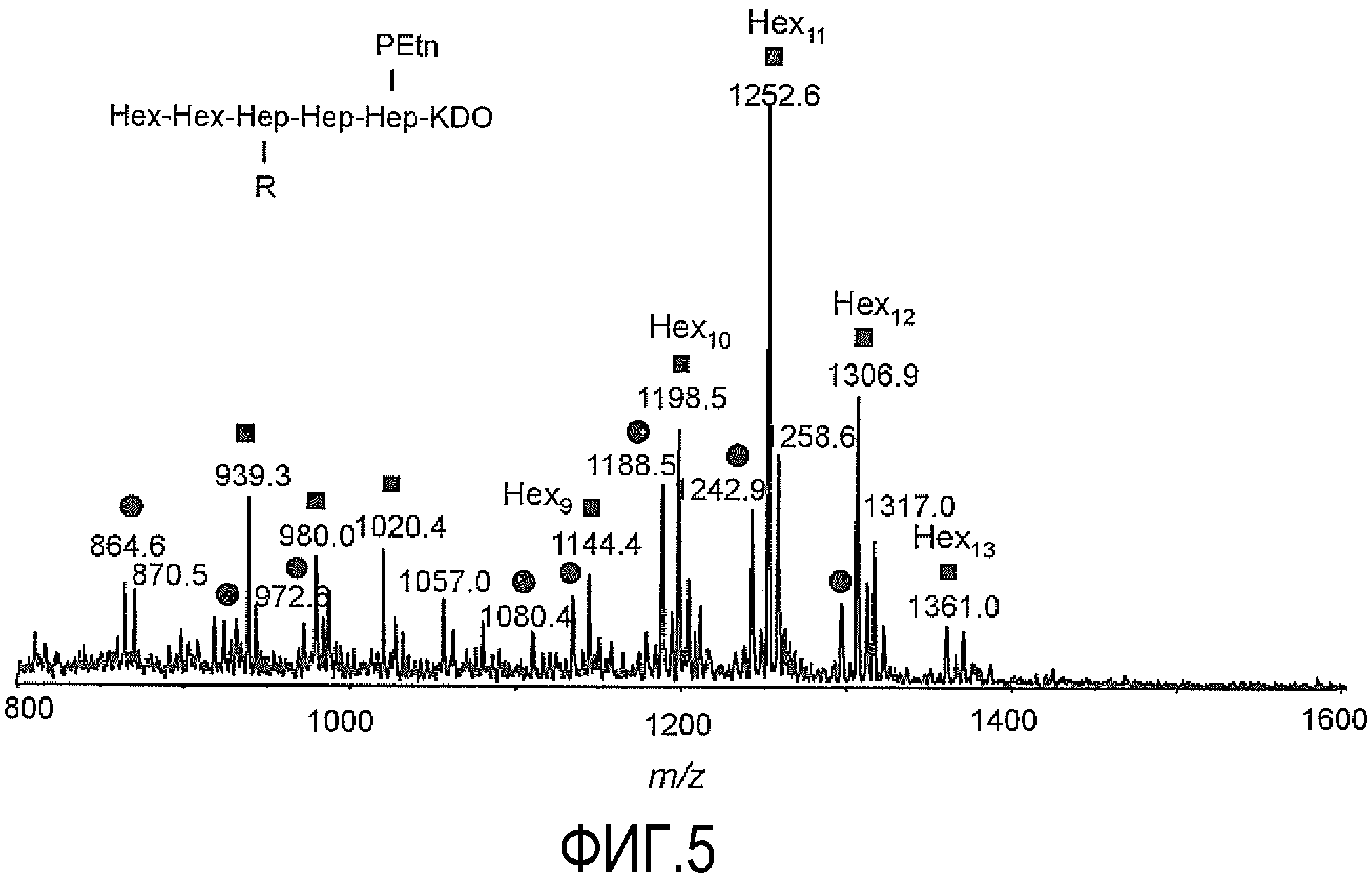
На ФИГУРЕ 5 показан анализ CE-MS основной фракции делипидизированного LPS H. pylori O:3HP0826::Kan в режиме определения отрицательных ионов. ●: гликоформы LPS, содержащие один остаток Hep в боковой цепи, R=Hex5-13, Hep, HexNAc, Fuc; ■: гликоформы LPS, содержащие два остатка Hep в боковой цепи, R=Hex8-13, Hep, Hep, HexNAc, Fuc.
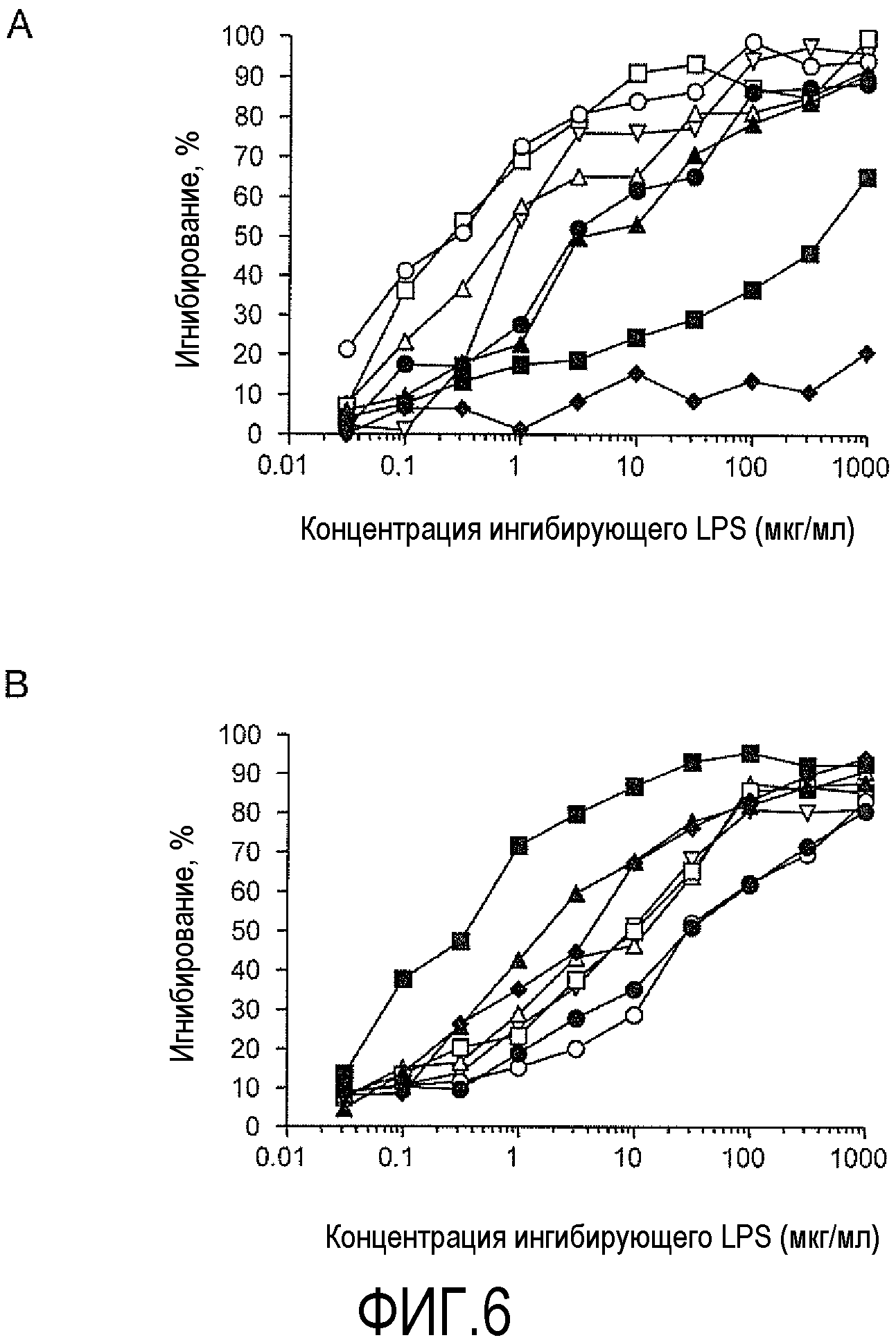
На ФИГУРЕ 6 представлены графики определения специфичности кроличьих антител, вызываемых конъюгатом dLPS-TT, с помощью ингибирования ELISA с помощью LPS H. pylori 26695 HP0479::Kan (фигура 6A) и 26695 HP0826::Kan (фигура 6B). Нанесение LPS изображено следующим образом: закрашенные квадраты - 26695; закрашенные ромбы - 26695 HP0826::Kan; закрашенный круг - 26695 HP0159::Kan; закрашенные треугольники - 26695 HP0479::Kan; незакрашенные круги - SS1; незакрашенные квадраты - SS1 HP0826::Kan; незакрашенные треугольники - SS1 HP0159::Kan; незакрашенные перевернутые треугольники - SS1 HP0479::Kan.
На ФИГУРЕ 7 представлены графики, иллюстрирующие образование H. pylori-специфичных антител у мышей CD-1. Мышей вакцинировали четыре раза с недельными интервалами 25 мкг/мышь конъюгата dLPS-TT с добавленным в качестве адъюванта 1 мкг/мышь холерного токсина (закрашенные столбики), бесклеточного сониката PJ2 с добавленным в качестве адъюванта 1 мкг/мышь холерного токсина (заштрихованные столбики) или физиологического раствора (незакрашенные столбики). Через четыре недели после первой иммунизации собирали образцы сыворотки, фекалий и вагинальных смывов и тестировали на H. pylori-специфичные IgG и IgA. Показания отдельных мышей нанесены на графики с горизонтальной чертой, указывающей среднее значение в группе (n=5/группа).*p<0,05,**p<0,01 согласно одностороннему критерию Манна-Уитни.
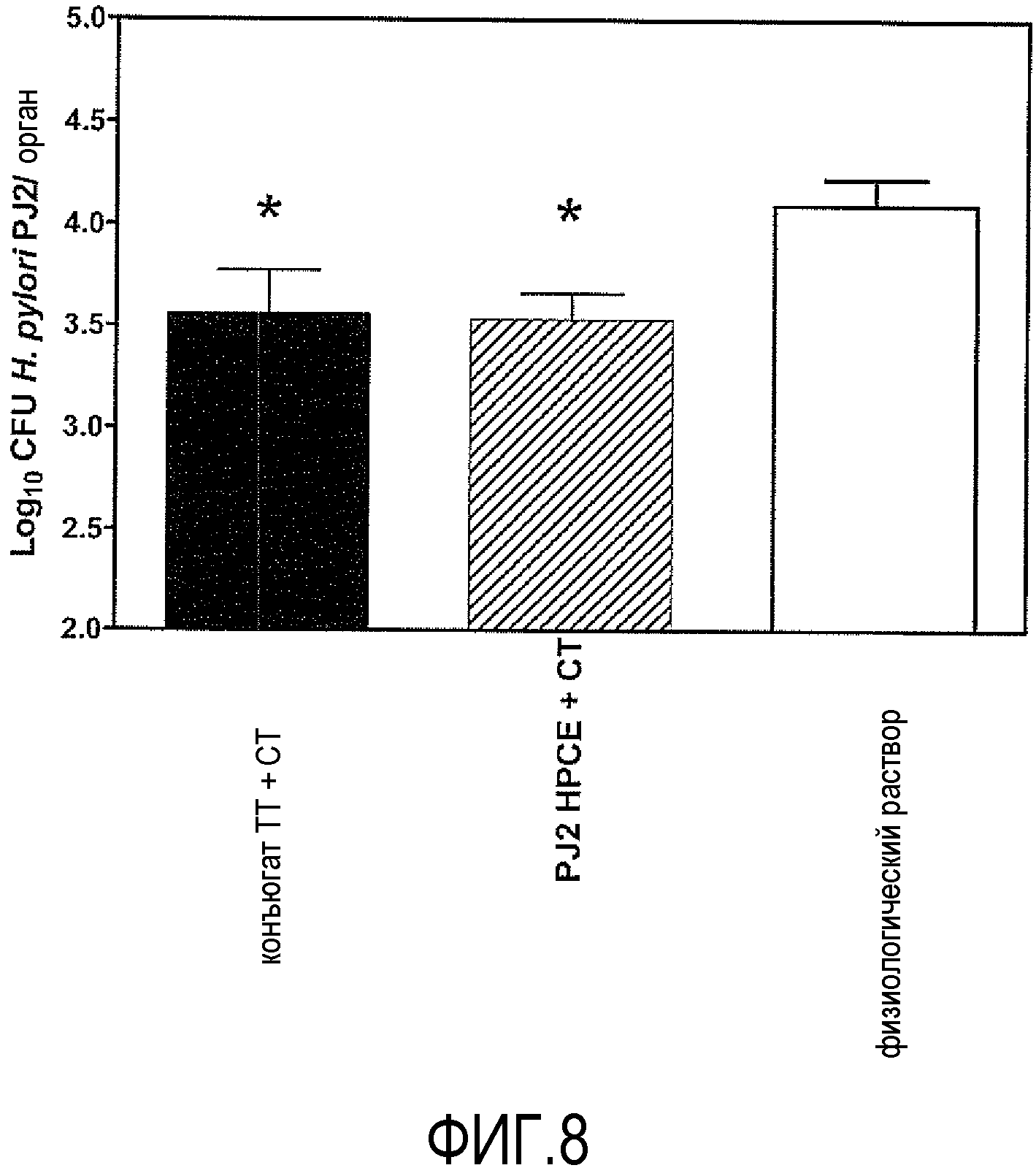
ФИГУРА 8 представляет собой столбчатый график, изображающий нагрузки H. pylori в желудках мышей CD-1. Мышей вакцинировали четыре раза с недельными интервалами 25 мкг/мышь конъюгатом dLPS-TT с добавленным в качестве адъюванта 1 мкг/мышь холерного токсина (заштрихованные столбики), бесклеточного сониката PJ2 с добавленным в качестве адъюванта 1 мкг/мышь холерного токсина (заштрихованные столбики) или физиологического раствора (незакрашенные столбики). Через пять недель после первой иммунизации мышам вводили перорально с помощью зонда три раза через день по -108 КОЕ H. pylori, штамм PJ2. Через четыре недели мышей умерщвляли и подсчитывали живые бактерии в желудках. Столбики представляют собой группы из 4-5 мышей ±SEM. *p<0,05, односторонний критерий Манна-Уитни.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к новому эпитопу внешнего участка кора LPS Helicobacter pylori. Более подробно, настоящее изобретение относится к новому эпитопу внешнего участка кора LPS H. pylori, его синтезу, описанию и конъюгации.
Если не указано иного, то все технические и научные термины, используемые в настоящей заявке, имеют значение, понятное специалисту в данной области, к которой относится изобретение. Хотя любые способы и материалы, сходные или эквивалентные с описанными в настоящей заявке способами и материалами, могут быть использованы на практике или при тестировании настоящего изобретения, ниже описаны предпочтительные способы и материалы. Все упомянутые в настоящей заявке публикации включены в качестве ссылки.
В данном контексте “очищенный” не обязательно означает абсолютную чистоту, но, скорее, предназначен как относительное определение. Аналогичным образом, в данном контексте “выделенный” относится к удалению чего-либо из его естественной среды.
Helicobacter pylori представляет собой бактериальный патоген, обычно связанный у человека с хроническим гастритом, пептической язвой и раком желудка; в результате того, что риск рака желудка повышается при наличии инфекции H. pylori, этот патоген был классифицирован как канцероген класса I. Липополисахарид (LPS) является главным компонентом клеточной поверхности H. pylori. Существующие до настоящего момента публикации, относящиеся к исследованиям структуры LPS H. Pylori, привели к созданию модели, в которой полисахарид O-цепи ковалентно связан с олигосахаридом кора, который, в свою очередь, присоединен к молекуле липида А. Полисахаридный остов О-цепи большинства штаммов H. pylori является уникальным и может проявлять детерминанты группы крови по Льюису (Le) типа 2 и/или типа 1; указанный полисахаридный компонент является антигенным. "Типируемые" штаммы H. pylori имеют эпитопы Льюиса (антигены Le X и/или Le Y), которые могут быть распознаны антителами анти-Льюис (anti-Le); такие антитела коммерчески доступны и помогают при типировании. "Нетипируемые" штаммы не содержат структур Льюиса.
Другие исследования структуры показали, что внешний участок кора LPS H. pylori содержит два необычных полимерных компонента: DD-гептогликан и α1,6-глюкановые боковые цепи (Monteiro, 2001). Logan et al. (2000) также дали представление о структуре LPS. В частности, предложенные структуры (см. фиг. 3E и 3F) предусматривали, что DD-гептоза (DD-Hep) боковой цепи присоединена к DD-Hep основной цепи, тогда как α1,6-глюкан присоединен к указанной DD-Hep боковой цепи и образует другую ветвь. В частности, Logan et al. (2000) определили длину гликановой цепи LPS мутанта 0826, которая составляет от одной до трех молекул глюкозы, на основании спектров FAB-MS (масс-спектрометрия с бомбардировкой ускоренными атомами). Наличие α1,6-связанной глюкозы в LPSштамма 26695 H. pylori также было описано и основано на данных анализа метилирования, но длина глюкана не была установлена. Кроме того, было сделано предположение, что в LPS штамма 26695, 3-замещенная Hep образует связь между элементом GlcNAc O-цепи и кором. Также было установлено наличие 3-связанной гептозы в LPS H. pylori HP0826::Kan, но наличие α1,3-гептана или его длина не были описаны. Другой информации о структуре или длине гептановых или глюкановых боковых цепей не существует. Структура LPS H. pylori в настоящее время устанавливается.
Настоящее изобретение относится к новому α1,6-глюкан-содержащему соединению Helicobacter pylori, содержащему структуру формулы I:
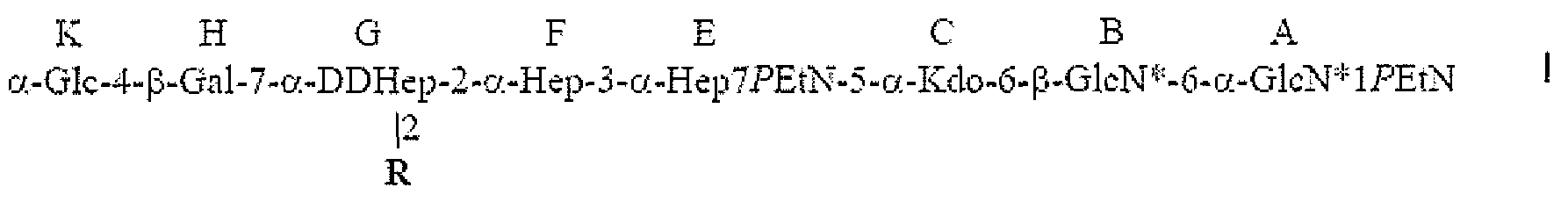
в которой R представляет собой трисахарид α-DDHep-3-α-L-Fuc-3-β-GlcNAc, замещенный α1,6-глюканом за которым следует α1,3-DD-гептан, где последний остаток DD-Hep α1,3-DD-гептана кэпирован остатком β-GlcNAc.
В структуре, которая описана выше, β-GlcNAc трисахарида (α-DDHep-3-α-L-Fuc-3-β-GlcNAc), связан с α-DDHep G. α-DDHep трисахарида связан с α1,6-глюканом, который в свою очередь связан с α1,3-DD-гептаном. Затем α1,3-DD-гептан соединяется с остатком β-GlcNAc; последний может предоставлять точку прикрепления для полисахарида O-цепи. Термин "связанный" или "замещенный" обозначает, что две группировки соединены ковалентной связью.
Термин "α1,6-глюкан", используемый в настоящей заявке, также может взаимозаменяемо употребляться как "глюкан", "α1,6-глюкановая боковая цепь", "глюкановая боковая цепь", "α1,6-глюкановый фрагмент" и/или "глюкановый фрагмент". α1,6-Глюкан представляет собой линейную полисахаридную цепь, состоящую из мономеров глюкозы, связанных α1,6 O-гликозидными связями. В одном неограничивающем примере α1,6-глюкан может представлять собой линейный полисахарид. α1,6-Глюкан может содержать любое подходящее количество α1,6-глюкозных остатков. Например, глюкан может содержать без ограничения приблизительно от 3 до 12 α1,6-связанных остатков глюкозы; в частности, фрагмент глюкана может содержать приблизительно 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 α1,6-связанных остатков глюкозы, или число остатков может находиться в любом диапазоне, задаваемом любыми двумя из перечисленных значений. В неограничивающем примере α1,6-глюкан может содержать 9-12 остатков α1,6-глюкозы; в другом неограничивающем примере α1,6-глюкан может содержать 10 α1,6-глюкозных остатков.
Термин "гликоформа", как используется в настоящем описании, обозначает различные формы или типы соединения с одинаковой структурой LPS, но отличающиеся числом остатков α1,6-глюкозы или α1,3-гептозы. Например, и без связи с какой-либо теорией, каждая гликоформа может содержать глюкановый и/или гептановый фрагмент определенной длины или их комбинацию.
Термин "α1,3-гептан", используемый в настоящей заявке, также может взаимозаменяемо упоминаться как "α1,3-DD-гептан", "гептан", "α1,3-гептановая боковая цепь", "гептановая боковая цепь", "α1,3-гептановый фрагмент", "гептановый фрагмент" и/или "DD-гептогликан". α1,3-Гептан представляет собой полисахаридную цепь, состоящую из мономеров гептозы, связанных α1,3 O-гликозидными связями. В одном из примеров, которые не предназначены для ограничения каким-либо образом, α1,3-гептан может представлять собой линейный полисахарид. α1,3-Гептан может содержать любое подходящее количество остатков α1,3-гептозы. Например, гептан может содержать без ограничения приблизительно 2-6 α1,3-связанных остатков гептозы; в частности, гептановый фрагмент может содержать приблизительно 2, 3, 4, 5 или 6 α1,3-связанных остатков гептозы или количество остатков гептозы может находиться в диапазоне, задаваемом любыми двумя из перечисленных выше значений.
Последний остаток DD-Hep α1,3-DD-гептана, описанного выше, кэпирован остатком β-GlcNAc. Термин "кэпированный" означает, что остаток β-GlcNAc является последним остатком боковой цепи; также может быть использован термин "концевой". β-GlcNAc может быть связан с DD-Hep через положение О-2 гептозы. Вне связи с какой-либо теорией, остаток β-GlcNAc может предоставлять точку прикрепления для полисахарида O-цепи.
В неограничивающем примере R может представлять собой
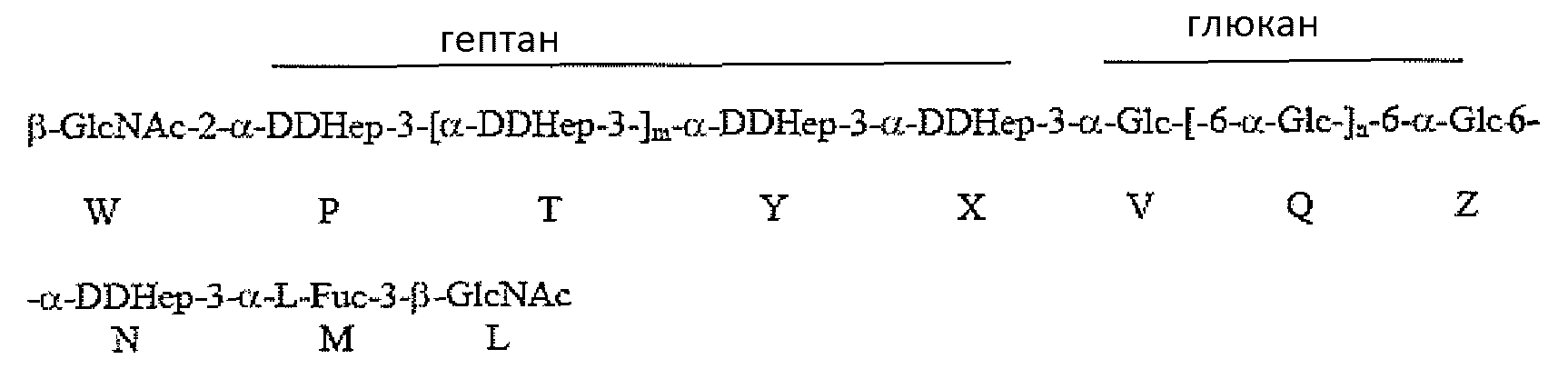
где остаток L β-GlcNAc связан с O-2 Hep остатка G. В данном примере остаток W β-GlcNAc может предоставлять точку прикрепления для полисахарида O-цепи. В соединении, которое описано, остатки Q и Z глюкана представляют собой α1,6-связанные остатки глюкозы, и n может иметь любое значение от 1 до 11, так что глюкан содержит приблизительно 3-12 остатков глюкозы в α1,6-соединении; в одном конкретном не ограничивающем примере основная гликоформа содержит 10 последовательных α1,6-связанных остатков глюкозы (n=9). В соединении, которое описано, остатки T, Y и X представляют собой α1,3-связанные остатки гептозы, и m может иметь любое значение от 0 до 4, так что гептан содержит приблизительно от 2 до 6 остатков гептозы в α1,3-соединении; в одном конкретном не ограничивающем примере основная гликоформа содержит 4 последовательных α1,3-связанных остатков гептозы (m=2).
Структура может быть выделена и/или очищена из любого подходящего штамма H. pylori; в качестве примера и без намерения ограничить каким-либо образом, усеченная молекула LPS H. pylori может быть выделена из нетипируемого штамма H. pylori (т.е. штамма, лишенного антигенов Льюиса), такого, но без ограничения, как штамм H. Pylori, имеющий мутацию в гене HP0826, приводящую к изогенному мутанту, лишенному полисахарида O-цепи. В неограничивающем примере соединение, описанное в настоящем описании, может быть выделено и/или очищено из штамма 26695 HP0826::Kan или штамма PJ2 H. pylori.
Структура формулы I, также обозначаемая в настоящем описании как "молекула внутреннего участка кора", может, кроме того, включать молекулу липида A, ковалентно присоединенную к остатку Kdo, например, к остатку Kdo С. В других вариантах осуществления молекула липида A может быть O-деацилирована или может быть полностью деацилирована. В других вариантах осуществления молекула липида A отщеплена путем гидролиза кетозидной связи от остатка Kdo. Вне связи с какой-либо теорией, отщепление липида А можно осуществить для устранения токсичности LPS и во избежание возможной агрегации и нерастворимости конъюгата. Специалистам в данной области известны способы O-деацилирования, деацилирования, или гидролиза кетозидной связи молекулы липида A (см., например, Hoist et al., 1991; Altman et al., 2003).
Настоящее изобретение также относится к конъюгату, содержащему по существу линейное α1,6-глюкан-содержащее соединение, конъюгированное с белком-носителем. По существу линейное α1,6-глюкан-содержащее соединение может представлять собой любой подходящий по существу линейный полисахарид, состоящий из α1,6-связанных остатков глюкозы. Термин "по существу линейный" обозначает, что α1,6-глюкан содержит несколько ветвей; например, α1,6-глюкан может без ограничения содержать приблизительно от 0 до 5% разветвления в α1,6-глюкане. В частности, α1,6-глюкан может включать приблизительно 0, 0,5, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5 или 5% разветвления, или любое количество между указанными значениями; соединение также может представлять собой смесь, в которой степень разветвления в смеси изменяется от одного соединения к другому. В неограничивающем примере α1,6-глюкан-содержащее соединение может представлять собой структуру, которая описана выше, и в настоящем описании в другом примере α1,6-глюкан-содержащее соединение может представлять собой Декстран. Декстран может быть любым подходящим Декстраном, который соответствует требованиям, описанным выше, и имеет молекулярный вес от 1 до 10 кДа; например, Декстран может иметь без ограничения молекулярный вес 1, 3,5, 5, 6,5, 8 или 10 кДа, или любой молекулярный вес между указанными значениями. В конкретном неограничивающем примере Декстран может представлять собой Декстран T5. В еще одном примере α1,6-глюкан-содержащее соединение может представлять собой линейную цепь из 5-8 α1,6-связанных остатков глюкозы; например, α1,6-глюкан-содержащее соединение может представлять собой без ограничения линейную цепь из 5, 6, 7 или 8 α1,6-связанных остатков глюкозы.
α1,6-Глюкан-содержащее соединение конъюгируют с линкерной молекулой и/или белком-носителем; специалисту в данной области очевидно, что структуру, описанную в настоящем описании, можно конъюгировать непосредственно с белком-носителем или можно конъюгировать с линкерной молекулой (также обозначаемой в настоящей заявке как "линкер"), которая, в свою очередь, конъюгируется с белком-носителем. Термин "конъюгированный" обозначает, что структура ковалентно присоединена или связана с линкерной молекулой и/или белком-носителем. Способы ковалентного присоединения линкера и/или белка-носителя хорошо известны специалистам в данной области; и как будет понятно специалисту в данной области, способ ковалентного присоединения (и независимо от того, представлен ли линкер) может изменяться с учетом применяемого белка-носителя. Без намерения ограничить каким-либо образом, на фигуре 4 представлен один из таких способов, который адаптирован из Fernandez-Santana et al. (1998); в указанном способе деацилированный или делипидизированный LPS активируется ковалентным присоединением карбоксильной группы остатка Kdo к линкерной молекуле с последующим введением малеимидной функциональной группы. Активированный LPS смешивают с тиолированным белком-носителем для получения конъюгированной структуры. Как оценят специалисты в данной области, способ, описанный в настоящей заявке, является общим и соответственно может быть использован любой другой подходящий способ (например, но, не ограничиваясь способами, описанными Chu et al., 1991; Cox et al., 2005; Gu et al., 1996; Mieszala et al., 2003; Yu and Gu, 2007). α1,6-Глюкан-содержащее соединение можно присоединить к линкеру/белку-носителю с помощью карбоксильной группы любого подходящего углеводного остатка структуры. В конкретном неограничивающем примере α1,6-глюкан-содержащее соединение может иметь структуру настоящего изобретения и может быть присоединено с помощью остатка С, Kdo внутреннего участка кора.
Белок-носитель может представлять собой любой подходящий носитель, известный в данной области, включая иммуногенные носители. Например, белок-носитель может представлять собой, но без ограничения, столбнячный анатоксин, бычий сывороточный альбумин (BSA), дифтерийный анатоксин, мутантный дифтерийный анатоксин, CRM, белок CRM197, белок А Pseudomonas, белок холерного токсина (CT), белок холерного токсина мутанта CT-E29H, и другие белки-носители, известные в данной области, например, но без ограничения части жгутиков, пили и другие токсины.
Как указывалось ранее, конъюгаты могут быть получены либо непосредственно соединением белка-носителя и структуры настоящего изобретения через естественные группы, либо соединением с помощью введения спейсера или линкерных молекул, включая, но без ограничения простейшие аминогруппы, гидразиды, тиолы, карбоксильные группы и другие.
Настоящее изобретение, кроме того, относится к композиции, содержащей одно или более соединения, которые описаны выше, один или более конъюгаты, как описано выше, или их комбинацию. В одном из вариантов осуществления композиция может содержать смесь гликоформ соединения, описанного выше; в качестве примера и без намерения ограничить каким-либо образом, композиция может содержать основную гликоформу, включающую 10 последовательных α1,6-связанных остатков глюкозы (n=9) во фрагменте глюкана. Аналогичным образом, композиция может содержать без ограничения конъюгаты, полученные из более чем одной гликоформы, описанной в настоящей заявке. Как показано в примерах, структура LPS, вырабатываемого штаммом H. pylori 26695 HP0826::Kan, который использовали при получении конъюгатов, представляла собой смесь трех гликоформ: олигосахарид основной цепи I, олигосахарид основной цепи I, кэпированный GlcNAc и [GlcNAc, Fuc, Hep], и олигосахарид, содержащий α1,6-связанный глюкан, с наиболее длинной глюкановой цепью, соответствующей приблизительно двенадцати α-1,6-связанным остаткам, как определили с помощью анализа CE-MS (таблица 2, фиг. 2).
Композиция, которая описана выше, может быть иммуногенной. Термин "иммуногенный" обозначает, что композиция может вызывать иммунный ответ против H. pylori диких и/или мутантных штаммов. Иммунный ответ может обеспечить широкую иммуногенную реакцию против типируемых и нетипируемых штаммов H. pylori.
Настоящее изобретение также относится к применению эффективного количества композиции, которая описана в настоящей заявке, для индукции иммунного ответа против H. pylori у индивида. Как описано ранее, композиция может содержать одно или более чем одно соединение по настоящему изобретению. Одно или более чем одно соединение может быть конъюгировано с линкером и/или подходящей молекулой-носителем.
Настоящее изобретение, кроме того, относится к иммунной антисыворотке, полученной иммунизацией млекопитающего иммуногенной композицией, как описано выше. Иммунная антисыворотка может содержать или предоставлять постиммунный сывороточный IgG, распознающий α1,6-связанный глюкановый эпитоп в гомологичных и гетерологичных типируемых и нетипируемых мутантных и диких штаммах H. pylori. IgG может вызывать комплемент-опосредованный бактериолиз мутантных и диких α1,6-глюкан-экспрессирующих штаммов H. pylori.
Настоящее изобретение, кроме того, относится к анти-α1,6-глюкановым антителам. Антитела могут быть индуцированы против соединения изобретения, которое описано в настоящей заявке, или могут быть индуцированы против других α1,6-глюкан-содержащих молекул, таких как Декстран (или конъюгаты Декстрана, например, но без ограничения конъюгаты BSA-Декстран). В одном из неограничивающих примеров антитело может быть моноклональным антителом, полученным способом, известным в данной области (см. Пример 10; Altman et al., 2005). Например, антитело может быть без ограничения моноклональным антителом, индуцированным против α1,6-глюканового эпитопа, представленного во внешнем коровом участке LPS мутанта HP0826 H. pylori; более подробно, антитело может быть индуцировано против соединения, представленного на фигуре 5. В более конкретном примере моноклональное антитело может представлять собой IgM 1C4F9, продуцируемый гибридомной клеточной линией 1C4F9. Указанная клеточная линия зарегистрирована Международным депозитарным органом Канады (National Microbiology Laboratory, Public Health Agency of Canada, 1015 Arlington Street, Winnipeg, Manitoba, CANADA) 30 июля 2009 и с присвоением учетного номера 300709-01. Как показано в примерах, антитело 1C4F9 распознавало α1,6-глюкановый эпитоп в LPS и в целых клетках типируемых и нетипируемых штаммов H. pylori, являлось легко доступным на поверхности живых бактерий и реагировало одинаково хорошо с конъюгатами LPS-OH-TT и dLPS-BSA или dLPS-TT.
Настоящее изобретение относится к применению антитела 1C4F9, для осуществления комплемент-опосредованного бактериолиза мутантных и диких типируемых и нетипируемых α1,6-глюкан-экспрессирующих штаммов H. pylori у индивида, при необходимости. Как описано ранее, типируемые штаммы H. pylori имеют антигены Льюиса, распознаваемые антителами анти-Le, тогда как нетипируемые штаммы их не имеют. Однако, поскольку типируемые и нетипируемые штаммы содержат α1,6-глюкан, оба типа штаммов будут распознаваться антителом 1C4F9.
В настоящее время в данной области, штаммы H. pylori могут быть типированы с помощью коммерчески доступных антител против антигенов Льюиса; однако, поскольку нетипируемые штаммы не содержат структур Льюиса, они не могут быть классифицированы с применением указанного подхода. Поскольку большинство типируемых и нетипируемых штаммов H. pylori имеют α1,6-глюкановые эпитопы, анти-α1,6-глюкановые антитела (такие как mAb 1C4F9) могут предоставить дополнительный способ скрининга и описания изолятов H. pylori.
LPS штамма 26695 HP0826::Kan H. pylori очищали и его химическую структуру определяли с помощью композиции, метилирования, углубленного анализа ядерного магнитного резонанса (ЯМР) и данных анализа CE-MS. Наличие α1,6-связанного глюкана во внешнем коровом участке LPS мутанта HP0826 H. pylori также было показано; указанная структура распознавалась моноклональным антителом 1C4F9, специфичным к α1,6-глюкану. Последнее антитело было получено с использованием фиксированных формалином клеток мутантного штамма О:3 HP0826::Kan H. pylori. Указанные антитела были доступны на клеточной поверхности и являлись бактерицидными. Ранее считалось, что только структуры Льюиса являются антигенными; таким образом, получение антител против α1,6-глюкана стало неожиданным.
Для изучения вакцинного потенциала LPS H. pylori, модифицированный LPS мутанта 26695 HP0826::Kan H. pylori конъюгировали со столбнячным анатоксином (TT) или бычьим сывороточным альбумином (BSA). Применяли два подхода для получения частично делипидизированного или делипидизированного LPS: O-деацилирование LPS с помощью мягкого гидразинолиза (LPS-OH) или делипидизация LPS мягкой обработкой кислотой (dLPS). Дополнительные способы делипидизации и/или частичной делипидизации хорошо известны в данной области, и такие подходящие способы можно использовать в объеме настоящего изобретения. LPS-OH и dLPS ковалентно связывали через остаток 2-кето-3-деокси-октулозоновой кислоты (Kdo) со спейсером, содержащим диаминогруппу, с последующим введением малеимидной функциональной группы и конъюгированием с тиолированным TT или BSA для получения конъюгатов LPS-OH-TT, dLPS-BSA и dLPS-TT, соответственно. В отдельном эксперименте LPS нетипируемого штамма PJ2 делипидизировали и использовали для конъюгации с получением конъюгата dLPS(PJ2)-TT.
Конъюгаты LPS-OH-TT, dLPS-BSA, dLPS-TT и dLPS(PJ2)-TT сохраняли антигенность поверхностной доступной α1,6-глюкановой детерминанты, которую оценивали в непрямом тесте ELISA с IgM 1C4F9. Антитело, как было показано, обладало высокой специфичностью к α1,6-глюкановой детерминанте и характеристики связывания определяли в тесте ингибирования ELISA олигосахаридами из изомальто-серий и очищенным LPS типируемых и нетипируемых штаммов H. pylori. Указанные исследования подтвердили, что антителу 1C4F9 необходимы 5-6 последовательных α1,6-связанных остатков глюкозы, модель согласуется с размером участков связывания анти-α-(1→6)декстрана, постулированным Kabat (1993).
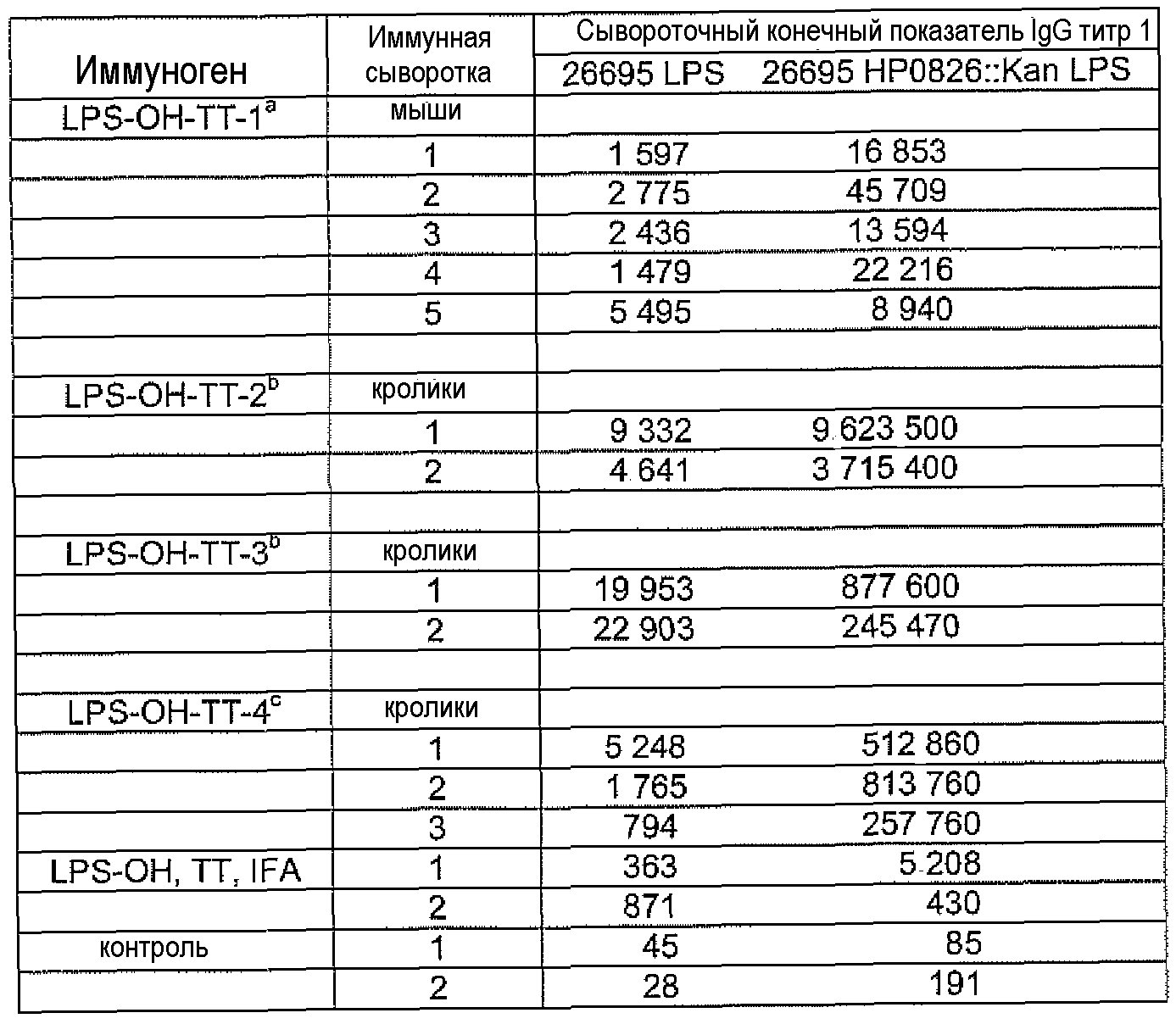
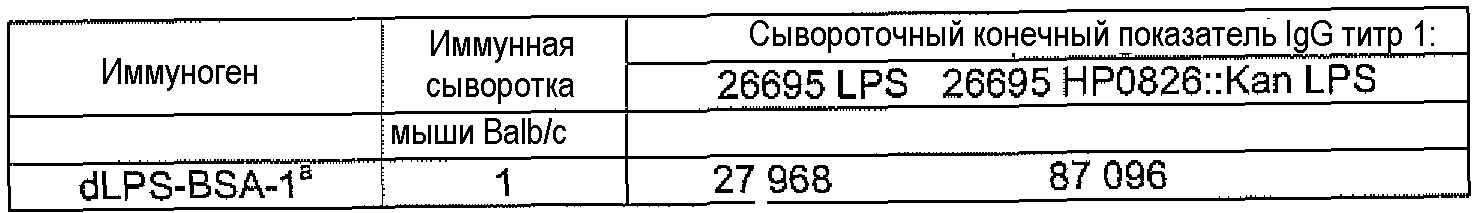
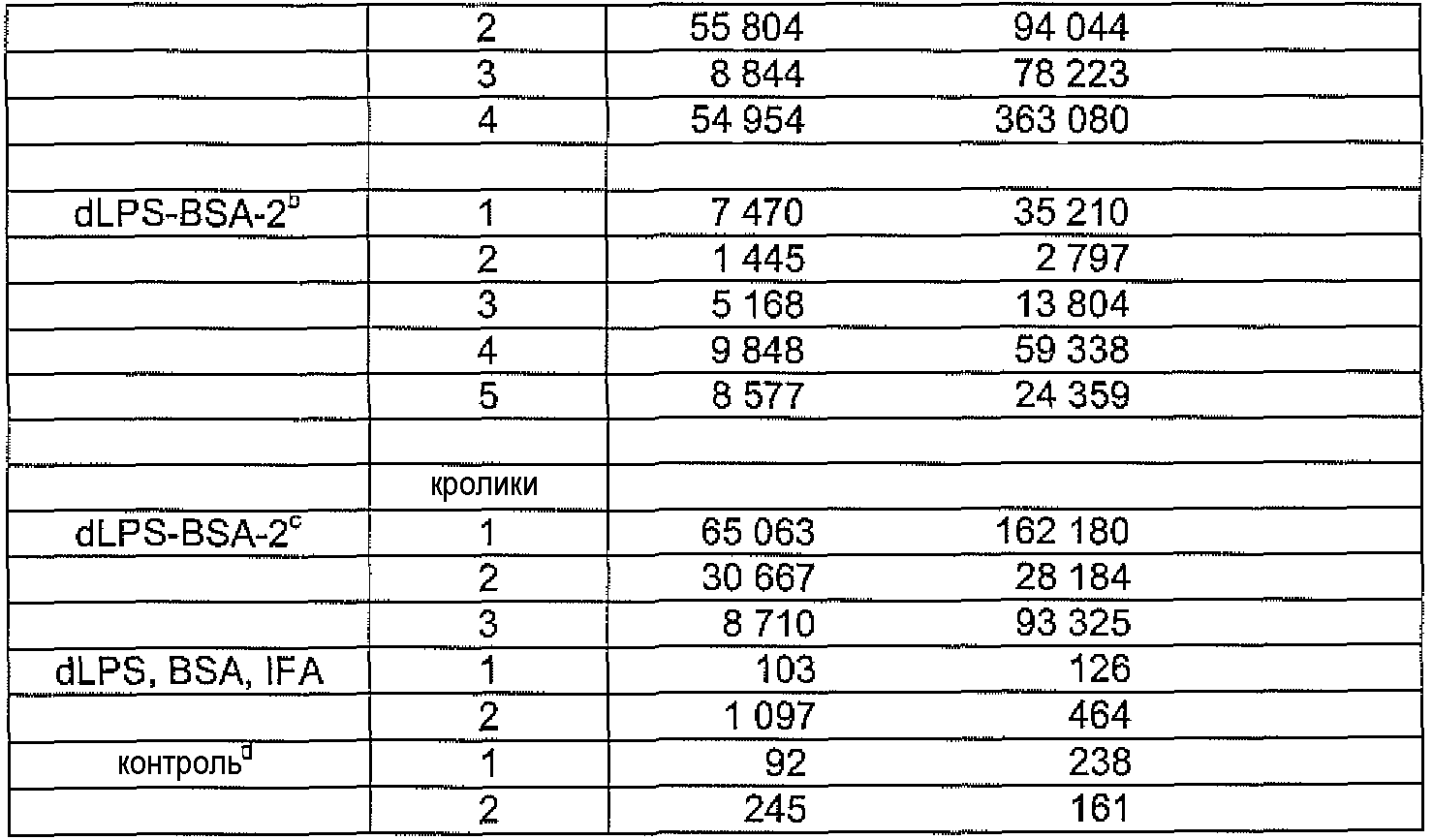
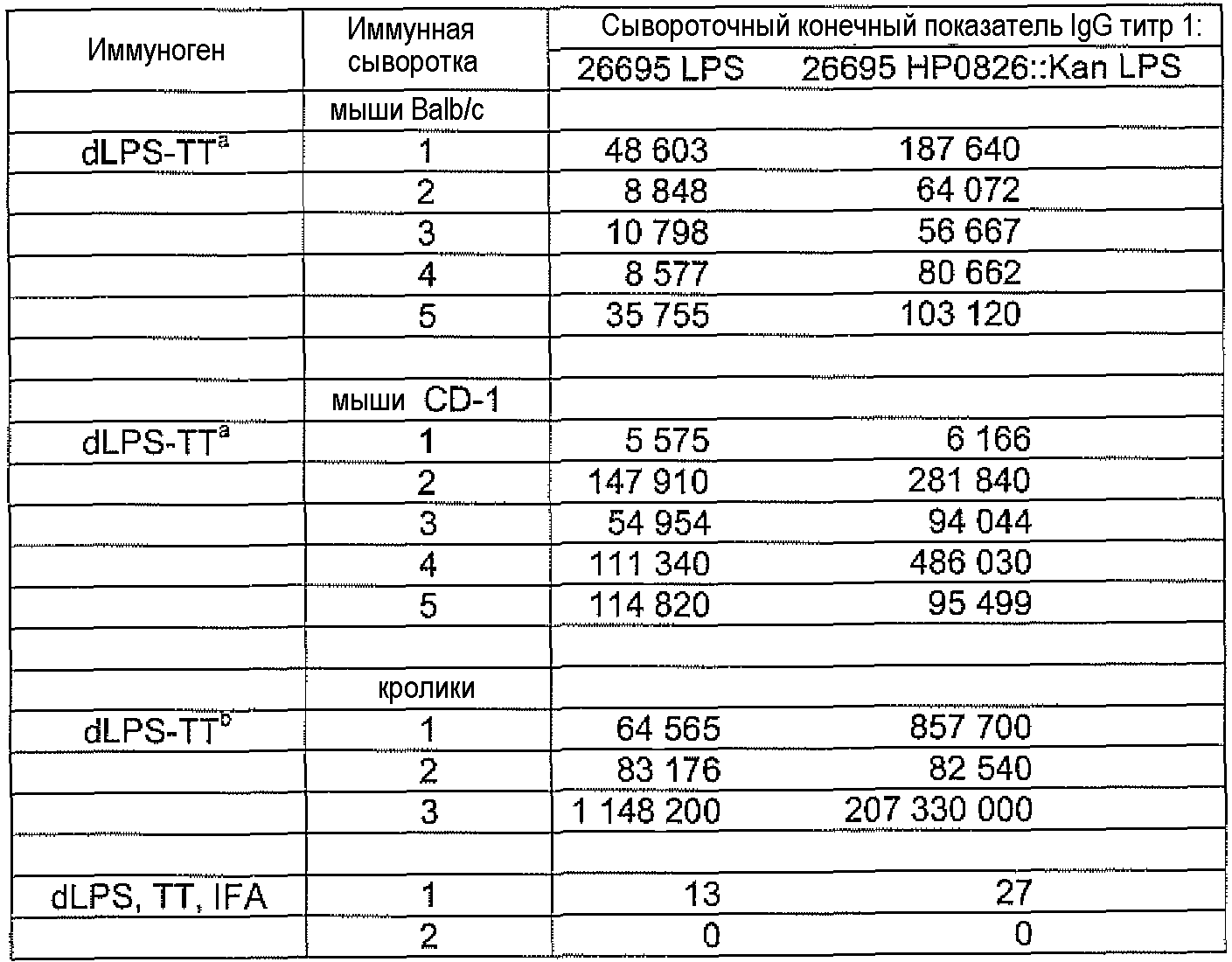
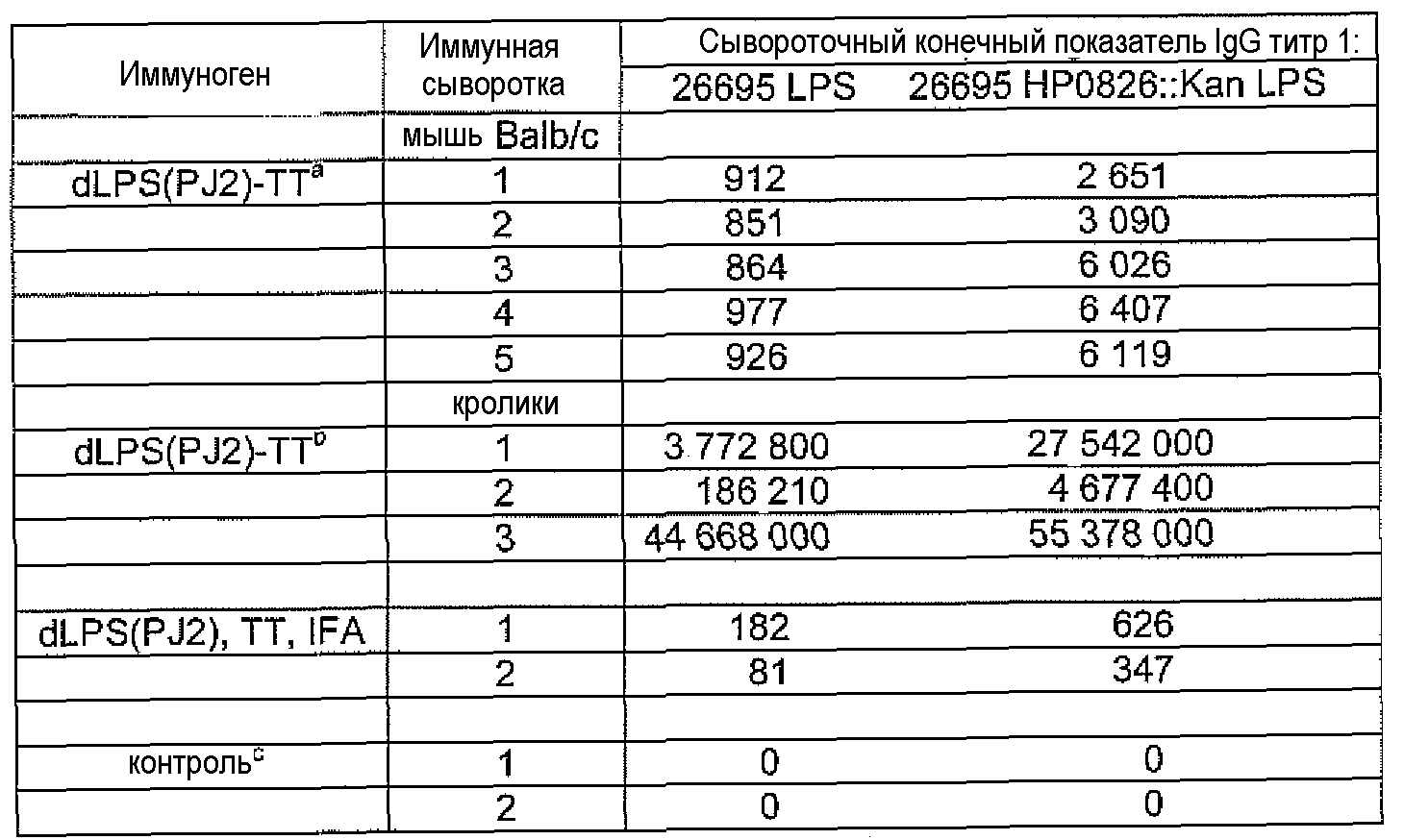
Конъюгаты LPS-OH-TT, dLPS-BSA, dLPS-TT или dLPS(PJ2)-TT являлись иммунногенными у мышей и кроликов и вызывали статистически значимое образование антител IgG в ответ на LPS гомологичных, гетерологичных и диких штаммов H. pylori. У мышей и кроликов, которые получали dLPS-содержащий конъюгат, развивался в десять раз более сильный иммунный ответ IgG на иммунизирующий антиген. Постиммунные сыворотки кроликов, иммунизированных либо LPS-OH-TT, dLPS-BSA, dLPS-TT, либо dLPS(PJ2)-TT демонстрировали бактерицидную активность против мутантного 26695 HP0826::Kan и дикого 26695 штаммов H. pylori.
Таким образом, указанные результаты показывают, что белковые конъюгаты на основе делипидизированного или частично делипидизированного на основе LPS H. pylori, лишенного антигена Le и несущего длинную α1,6-глюкановую цепь являются иммуногенными для мышей и кроликов и индуцируют образование бактерицидных антител. Важно отметить, что указанный эпитоп был идентифицирован как иммуногенный. Данный факт не был установлен ранее, поскольку было известно, что только структуры Льюиса являются антигенными и вызывают образование специфических антител.
Настоящее изобретение далее будет проиллюстрировано в следующих примерах. Однако следует понимать, что указанные примеры являются только иллюстративными и не должны использоваться для ограничения объема настоящего изобретения каким-либо образом.
Пример 1. Выделение и структурный анализ LPS H. pylori 26696 HP0826::Kan
Штамм 26695 Helicobacter pylori был получен от Dr. R. Aim (Astra Zeneca, Boston, MA), изолят H. pylori О:3 был получен от Dr. J. Penner, J99 был получен от Dr. D. Taylor (University of Alberta, Edmonton, Canada), SS1 был получен от Dr. A. Lee (The University of New South Wales, Sydney, Australia), клинические изоляты PJ1 и PJ2 представляли собой свежие клинические изоляты от Dr. W. Conlan (IBS, NRC) и M6 был получен от Dr. K. Eaton (Michigan State University, MI).
Культивирование бактериальных штаммов осуществляли, как описано Hiratsuka et al. (2005). Кратко, клетки выращивали при 37°C на чашках с кровяным агаром Columbia (Difco) и с добавлением антибиотиков, содержащим 7% крови лошади в микроаэрофильных условиях в течение 48 часов (Kan 20 мкг/мл), как описано ранее (Hiratsuka et al., 2005). Для роста в суспензионной культуре с добавлением антибиотиков жидкую среду Brucella, содержащую 10% фетальной бычьей сыворотки, инокулировали клетками H. pylori, собранными через 48 часов со слоя питательной среды кровяной агар Columbia/лошадиная кровь, и инкубировали в течение 48 часов в шейкере в микроаэрофильных условиях (85% N2, 10% CO2, 5% O2), как описано ранее (Hiratsuka et al., 2005).
Штаммы H. pylori культивировали в жидкой культуре, как описано выше, и влажную клеточную массу, полученную при центрифугировании бактериальной культуры, дважды последовательно отмывали этанолом, ацетоном и светлым петролейным эфиром и высушивали на воздухе. LPS экстрагировали из высушенной на воздухе клеточной массы с помощью процедуры экстракции смесью горячий фенол-вода, описанной Westphal and Jann (1965). LPS получали из водной фазы после протяженного диализа и лиофилизации. Затем LPS H. pylori очищали ультрацентрифугированием (105000 x g, 4°C, 12 часов), и осадок суспендировали в дистиллированной воде и лиофилизировали.
Анализ состава сахаров проводили альдит-ацетатным методом (Sawardeker et al., 1967). Гидролиз выполняли в 4 M трифторуксусной кислоте при 100°C в течение 4 часов или в 2 M трифторуксусной кислоте при 100°C в течение 16 часов с последующим восстановлением в H2O NaBH4 и последующим ацетилированием уксусным ангидридом/пиридином. Альдит-ацетатные производные анализировали, как описано ранее (Altman et al., 2003). Анализ метилирования осуществляли по методу Ciucanu & Kerek (1984) и с описанием перметилированных альдит-ацетатных производных с помощью газо-жидкостной хроматографии - масс-спектрометрии (GLC-MS), как описано ранее (Altman et al., 2003).
Анализ сахаров очищенного LPS из штамма 26695 HP0826::Kan H. pylori в виде альдит-ацетатов выявил присутствие L-фукозы (L-Fuc), D-глюкозы (D-Glc), D-галактозы (D-Gal), N-ацетил-D-глюкозамина (D-GlcNAc), D-глицеро-D-манно-гептозы (DD-Hep) и L-глицеро-D-манно-гептозы (LD-Hep) приблизительно в молярном отношении 0,4:5,0:1,5:4,3:6,4:1,4, указывая на наличие структуры, лишенной O-цепи (Logan et al., 2000). Анализ метилирования, проведенный на интактном LPS штамма 26695 HP0826::Kan, соответствовал указанным результатам и показал наличие терминальной L-Fuc, 3-замещенной L-Fuc, терминальной D-Glc, терминальной D-Gal, 3-замещенной глюкозы, 4-замещенной D-Gal, 6-замещенной глюкозы, терминальной DD-Hep, 2-замещенной DD-Hep, 6-замещенной DD-Hep, 3-замещенной DD-Hep, 7-замещенной DD-Hep, 2,7-замещенной DD-Hep, 2-замещенной LD-Hep, 3-замещенной LD-Hep, терминальной D-GlcNAc и 3-замещенной D-GlcNAc в приблизительном молярном отношении 0,1:1,0:1,1:0,1:1,2:1,0:6,0:0,4:1,2:1,1:3,1:0,5:1,6:1,2:0,1:0,3:0,4. Не обнаружили 3,4-замещенной D-GlcNAc и 2-связанной D-Gal, характерных для O-цепи, содержащей антигены Le. Чистоту LPS подтверждали отсутствием рибита, получаемого из РНК.
Анализы с помощью композиции и метилирования LPS штамма 26695 представлены в другом месте (Logan et al., 2005). Все сахара присутствовали в пиранозной форме.
Пример 2. Описание делипидизированного LPS H. pylori 26695 HP0826::Kan с помощью системы капиллярный электрофорез - масс-спектрометрия(CE-MS)
Очищенный LPS 26695 HP0826::Kan (20 мг), полученный в Примере 1, гидролизовали в 0,1 M натрий-ацетатном буфере, pH 4,2, в течение 2 часов при 100°C и фракционировали с помощью гель-фильтрации на колонке Bio-Gel P-2, как описано ранее (Altman et al., 2003) для получения делипидизированного LPS (dLPS). Собирали три фракции (фракции 1-3) и анализировали с помощью комбинации капиллярного электрофореза и масс-спектрометрии (CE-MS; таблица 1).
Для CE-MS систему Prince CE (Prince Technologies, The Netherlands) соединяли с масс-спектрометром 4000 QTRAP (Applied Biosystems/MDS Sciex, Canada). Проточный раствор (изопропанол-метанол, 2:1) пропускали со скоростью потока 1,0 мкл/мин.
Разделение получали приблизительно на немодифицированном кварцевом капилляре длиной 90 см с применением 15 мМ ацетата аммония в деионизированной воде, pH 9,0. Использовали напряжение ионизации электрораспылением 5 kV для режима определения положительных ионов. Тандемные масс-спектры получали с помощью усиленного режима сканирования продукции ионов (EPI) со скоростью сканирования 4000 Да/с. Азот использовали в качестве “газовой завесы” (при величине 12) и газа для соударений (установить на шкале "высокий").
Анализ CE-MS основной фракции 1 в режиме определения положительных ионов подтвердил присутствие серии трижды заряженных ионов при m/z 1212,3, m/z 1266,3 и m/z 1320,4 в соответствии с последовательным добавлением остатков Hex, наиболее длинная глюкановая цепь соответствовала приблизительно одиннадцати α-1,6-связанным остаткам. Исходя из интенсивности сигнала ионов, наиболее часто встречающаяся гликоформа при m/z 1266,3 содержала десять α-1,6-связанных Hex (фиг. 1). Спектр ионных продуктов для ионов при m/z 1266,3 в режиме определения положительных ионов подтвердил присутствие диагностических ионов при m/z 1244,5 и m/z 1447,6 в соответствии с ранее наблюдаемыми фрагментами основной цепи кора Hex2Hep3(PEtn)Kdo и HexNAcHex2Hep3(PEtn)Kdo, соответственно (фиг. 1). Фракции 1 и 2, несущие α1,6-глюкан в коре LPS, соединяли и использовали для конъюгации.
Пример 3. Описание O-деацилированного LPS 26695 HP0826::Kan с помощью CE-MS
O-деацилирование LPS 26695 HP0826::Kan (Примера 1) осуществляли согласно Holst et al. (1991) с некоторыми модификациями. Кратко, LPS (4 мг) перемешивали в безводном гидразине (0,2 мл) при 37°C в течение 4 часов. Охлаждали реакционную смесь и медленно добавляли холодный ацетон (2 мл), чтобы разложить избыток гидразина. Через 30 мин, осажденный O-деацилированный LPS (LPS-OH) собирали центрифугированием (4°C, 9300 x g, 10 мин). Осадок дважды отмывали холодным ацетоном, растворяли в воде и лиофилизировали с получением LPS-OH (3,5 мг).
Анализ CE-MS O-деацилированного LPS 26695 HP0826::Kan (LPS-OH) в режиме определения положительных ионов осуществляли, как описано в Примере 2. Результаты CE-MS соответствовали данным MS, полученным для делипидизированного LPS и представляли три главных дважды заряженных иона при m/z 1137,2, m/z 1239,2 и m/z 1408,0, соответствовавших присутствию олигосахарида основной цепи и олигосахарида основной цепи, кэпированного HexNAc и [HexAc, Fuc, Hep], соответственно (Таблица 2), тогда как трижды заряженные ионы при m/z 1597,7, m/z 1651,4 и m/z 1705,5 соответствовали присутствию глюкана, наиболее длинная глюкановая цепь соответствовала приблизительно двенадцати α-1,6-связанным остаткам (Таблица 2, фиг. 2). Спектр MS/MS при m/z 1597,7 показал присутствие диагностических ионов при m/z 1447,6 и m/z 1244,5, что согласуется с последовательным удалением [Fuc,Hep] и [Fuc,Hep,HexNAc], соответственно (фиг. 2) и, дополнительно, давал слабо заряженный ион при m/z 1786,8, соответствующий коровому фрагменту FucHex2HexNAcHep4(PEtn)Kdo, связанному через остаток Kdo с O-деацилированным липидом A (липид A-OH), тогда как ионы при m/z 444,4 и m/z 887,8 соответствовали молекуле липида A-OH, состоящей из диглюкозаминовой основной цепи, замещенной двумя связанными амидной связью цепями 3-гидроксиоктадеканоевой [C18:0(3-OH)] жирной кислоты (фиг. 2).
Пример 4. Анализ ЯМР LPS штамма 26695 HP0826::Kan H. pylori
Деградацию LPS штамма 26695 HP0826::Kan (Примера 1) H. pylori начинали с полного деацилирования 4 M KOH в присутствии NaBH4 для быстрого восстановления GlcN липида A, поскольку щелочной гидролиз заместителя PEtN оставляет восстанавливающий конец GlcN без агликона (Holst et al., 1991). Разделение продуктов гель-хроматографией давало две фракции, элюированные в области олигосахарида хроматограммы. Дальнейший анализ показал, что указанные фракции содержали сходные соединения, очевидно отличающиеся длиной глюкановой цепи. Фракция с более низкой молекулярной массой содержала соединения 1-3, идентифицированные масс-спектрометрией, и обе фракции содержали соединение 4 с глюкановой частью другой длины (фиг. 3).
Спектры ЯМР (DQCOSY, TOCSY, NOESY,1H-13C HSQC и HMBC) записывали на спектрометре Varian 500 или 600 МГц с использованием стандартного программного обеспечения, как описано ранее (Brisson et al., 2002). Все эксперименты ЯМР проводили при 25°C с использованием ацетона в качестве внутреннего стандарта δ 2,225 м.д. для1H спектров и 31,45 м.д. для13C спектров.
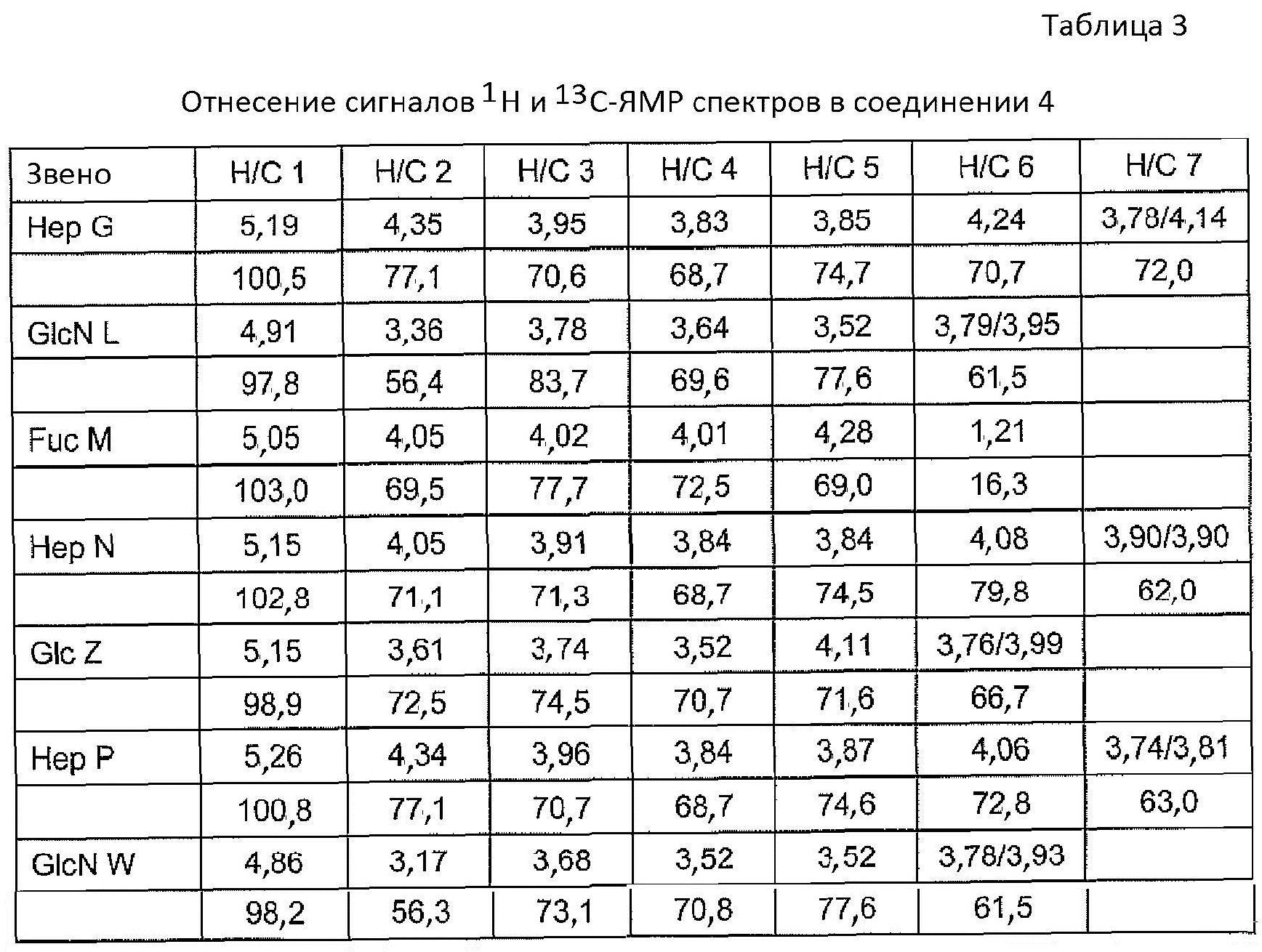
Спектры ЯМР обеих фракций соответствовали соединению 4, хотя спектры не могли быть полностью интерпретированы из-за их сложности. Протоны H-1 концевых остатков α-1,6-глюкана и DD-гептана не перекрываются с остальными H-1 глюкана и гептана, что позволяет идентифицировать положение указанных гомополимеров в пределах целой структуры, как показано на фиг. 3. Однако, положение связи восстанавливающего концевого остатка Glc Z α-1,6-глюкановой цепи не установлено. Он показал сильную корреляцию NOE с неидентифицированным протоном (позднее отнесен к H-6 Hep N). Результаты ЯМР соединения 4 отчетливо показали, что α-1,6-глюкан расположен между DD-гептаном и внутренним участком кора, поскольку первый остаток Hep фрагмента гептана (X) связан с O-3 невосстанавливающего концевого остатка Glc V, принадлежащего α-1,6-глюкану. Невосстанавливающий конец DD-гептана замещен в O-3 β-GlcN W. Соединения, идентичные небольшим олигосахаридам 1-3 ранее обнаружены в качестве главных компонентов LPS H. pylori мутанта, лишенного α-1,6-глюкана, HP0159::Kan, и опубликованы результаты ЯМР (Altman et al., 2008). Некоторые результаты ЯМР соединения 4 представлены в таблице 3. Хорошо видно, что ранее предложенная последовательность из четырех последовательных остатков гептозы, связанных с Kdo, не представлена ни в одном из рассматриваемых соединений (фиг. 3). Остаток L β-GlcN был связан непосредственно с O-2 Hep G, и не было GlcN, соединенного с O-7 Hep в какой-либо части структуры LPS.
Для дальнейшего анализа структуры LPS соединения 1-4 дезаминировали. Вкратце, образцы растворяли в 10% AcOH и добавляли избыток NaNO2; через 3 часа продукт выделяли гель-хроматографией на колонке Sephadex G-15. Некоторые соединения затем восстанавливали NaBD4 и обессоливали. Конечные продукты представляли собой соединения 5 и 6. Спектры ЯМР соединения 5 (выполненные, как описано выше) показали два изомера с фосфатом в положении 6 или 7 Hep E (вследствие перегруппировки фосфата в щелочных условиях). И в этом случае, были представлены три последовательных остатка Hep, но не четыре, как можно было бы ожидать, если бы ранее предложенная структура была правильной. Удаление всей боковой цепи с помощью метода дезаминирования (описано выше) подтверждало, что GlcN L образует связь между сахарами 5OS и остатком молекулы.
Соединение 6 содержало DD-гептан, α-1,6-глюкан и трисахарид DDHep-Fuc-anh-Man-ol (N-M-L, anh-Man L, полученные из GlcN L) на восстанавливающем конце. Спектры данного продукта являлись менее перегруженными и стало возможно определить точку присоединения α-1,6-глюкана к O-6 DDHep N (из TOCSY между H-1 и H-6 DDHep N). Структура являлась линейной, что подтверждалось анализом метилирования, который не показал разветвленных сахаров; все ожидаемые продукты были идентифицированы в соответствии с предполагаемой структурой (Таблица 4).
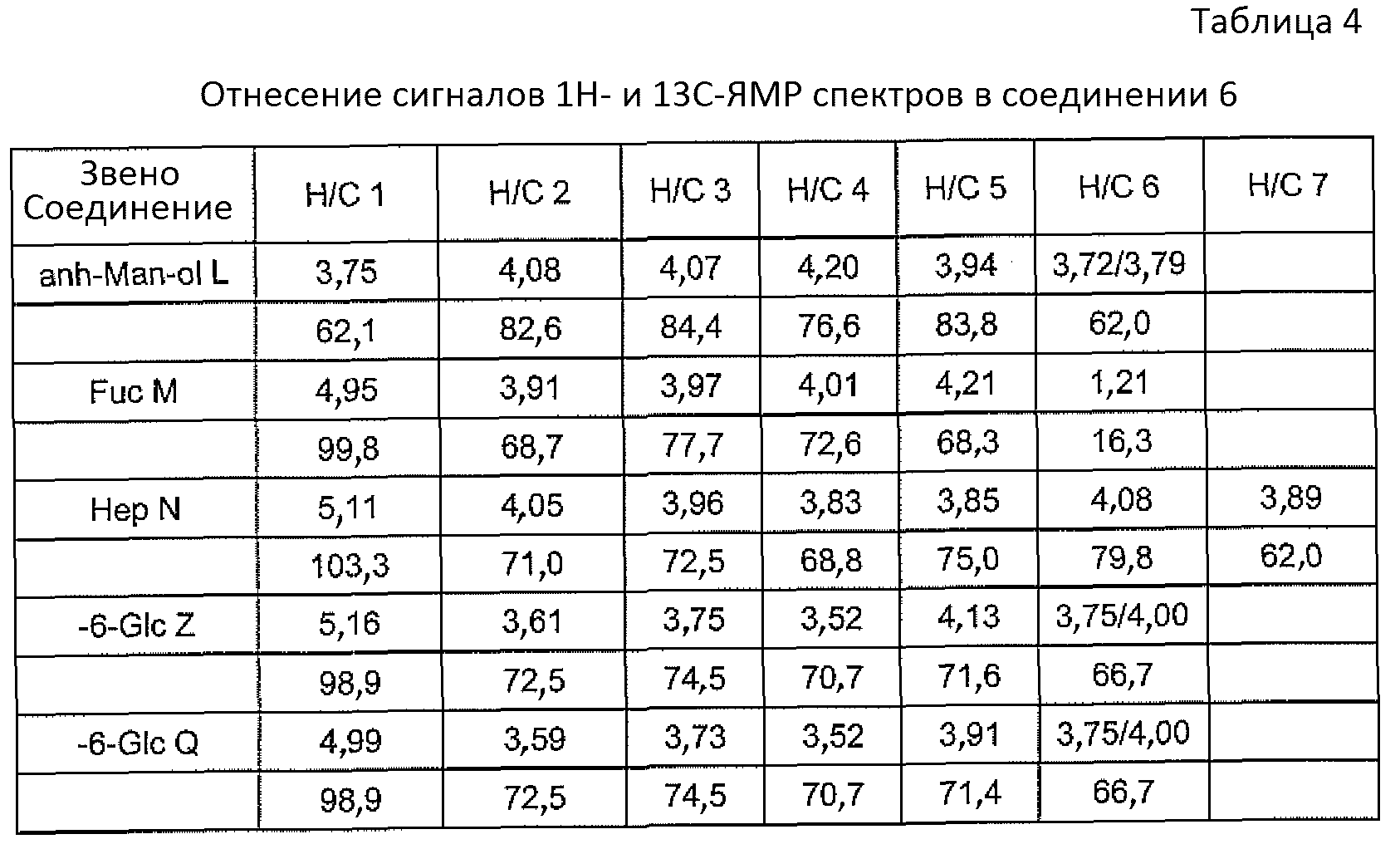
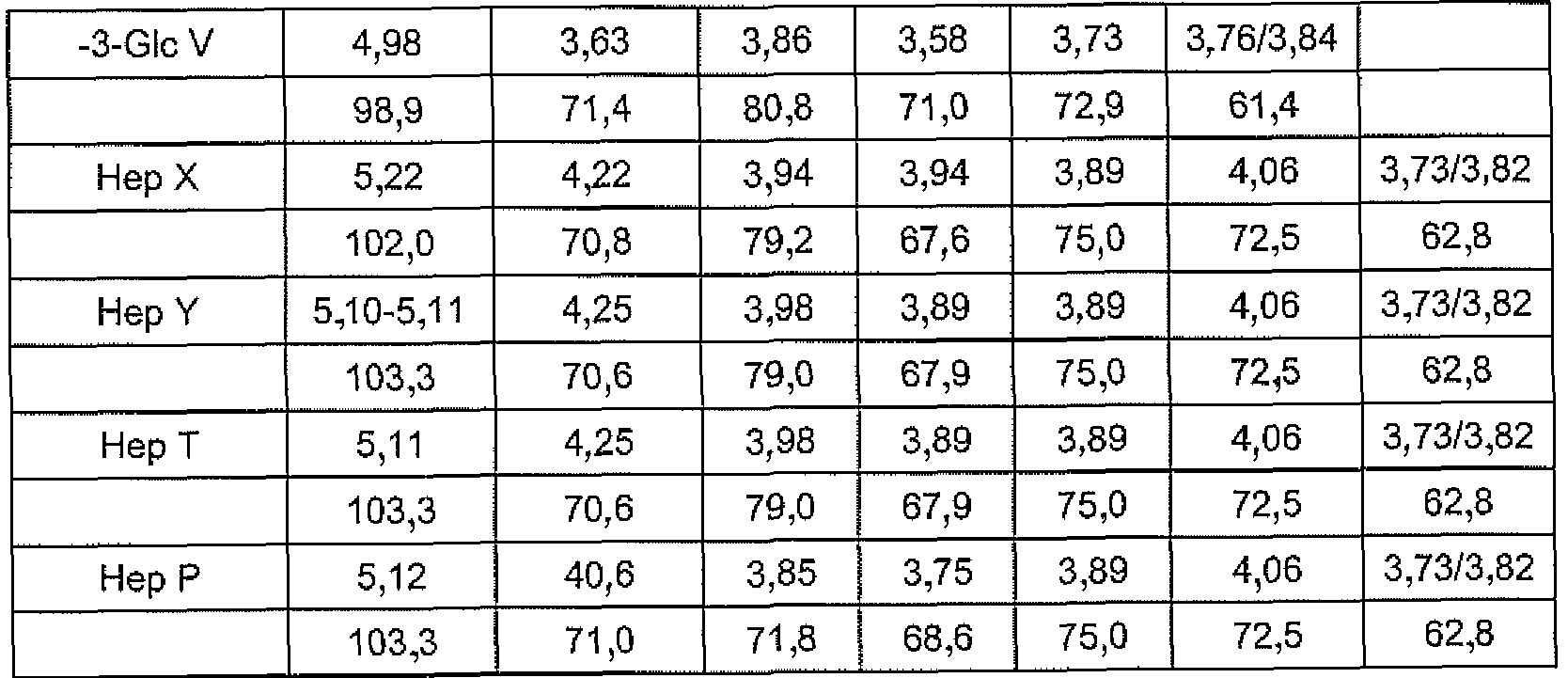
Кроме того, конформацию структуры в области DD-гептан-α-1,6-глюкана получали из результатов периодатного окисления соединения 6. Периодатное окисление осуществляли с избытком 0,1M NaIO4 в течение 24 часов; добавляли этиленгликоль и выделяли продукт с помощью гель-хроматографии на колонке Sephadex G-15. Продукт восстанавливали NaBD4, обессоливали и гидролизовали 2% AcOH в течение 3 часов при 100°C. Получали два основных продукта 7 и 8, и выделяли с помощью гель-хроматографии на колонке Sephadex G-15.
Восстановление окисленного олигосахарида NaBD4 позволяло идентифицировать окисленные атомы углерода в спектрах ЯМР (обращенная фаза сигналов CHDOH в сравнении с сигналами CH2OH в APT-HSQC). Структуру соединений 7 и 8 определяли с помощью ЯМР-спектроскопии и анализа метилирования. Образование соединения 7 доказывало, что DDHep N был не замещен в положении 3. Поскольку метилирование соединения 6 показало только концевой, 3- и 6-замещенный DD-Hep, DD-Hep N был замещен в положении 6, как предположили, исходя из результатов ЯМР соединения 6. Образование соединения 8 с глицерином (Gro) на восстанавливающем конце подтвердило, что Glc V в 6 OS гликозилировала следующий остаток Glc в положении 6, поскольку не было других компонентов олигосахарида 6, которые могли бы образовать глицерин после окисления-восстановления. Данный факт также доказывает присоединение фрагмента DD-гептана к невосстанавливающему концу α-1,6-глюкана в положении 3 концевого остатка глюкозы.
Можно оценить размер DD-гептанового домена: соединение 8 содержало четыре остатка маннозы, полученных из DD-гептозы. Спектры соединения 8 имели хорошее разрешение и интеграция сигналов H-1 давала почти эквимолярное отношение и указывала на присутствие четырех остатков маннозы. Таким образом, интактный DD-гептановый домен в соединении 6 состоял преимущественно из 5 звеньев DD-гептозы, один из которых (концевой) удаляли периодатным окислением. Вывод подтвержден результатами масс-спектрометрии. Структура основной гликоформы LPS, продуцируемой штаммом 26695 HP0826::Kan H. Pylori, проиллюстрирована на Фигуре 3.
Пример 5. Получение и описание конъюгатов LPS-OH-TT, dLPS-BSA, dLPS-TT и dLPS(PJ2)-TT
Получали Kdo-связанные конъюгаты LPS-OH (см. Пример 3) и dLPS (см. Пример 2) с бычьим сывороточным альбумином (BSA) и/или столбнячным анатоксином (TT).
LPS-OH (4 мг, 0,8 мкмоль, на основе предполагаемой средней молекулярной массы 4789 Да) или dLPS (4 мг, 1 мкмоль, на основе предполагаемой средней молекулярной массы 3779 Да) растворяли в 0,1 M буфере 2-(N-морфолин)этансульфоновой кислоты (MES; Sigma-Aldrich, St. Louis, Mo), pH 4,8, содержащем 0,1 M NaCl (0,4 мл); добавляли 1-этил-3-диметиламинопропил карбодиимид (EDC; 34,38 мг, молярное отношение 100:1; Sigma-Aldrich) с последующим добавлением 1,8-диамино-3,6-диоксаоктана (15 мкл, 103 мкмоль; Sigma-Aldrich), и проводили реакцию при pH 4,8 в течение 4 часов при 22°C. Раствор доводили до значения pH 7,0 и диализовали против дистиллированной воды или обессоливали с применением центрифужного устройства Microsep, пороговое значение 1000 Да (Pall Life Sciences, Ann Arbor, MI) и лиофилизировали.
Процедуру конъюгации осуществляли, главным образом, как описано для олигосахаридов Fernandez-Santana et al. (1998). Вкратце, проводили реакцию содержащего спейсер LPS-OH (2 мг, 0,4 мкмоль) или dLPS (2 мг, 0,5 мкмоль) с N-гидроксисукцинимидным эфиром 3-малеимидпропионовой кислоты (BMPS; 2 мг, 7,5 мкмоль; Sigma-Aldrich) в сухом DMSO в течение 24 часов при 22°C. Раствор диализовали против дистиллированной воды и лиофилизировали.
Для активации BSA добавляли 3,3-дитиодипропионовой кислоты ди(N-гидроксисукцинимидный эфир) (DTSP; 0,63 мг, 1,6 мкмоль; Sigma-Aldrich) в сухом DMSO, в атмосфере N2, к раствору бычьего сывороточного альбумина (BSA) (молекулярная масса 66320 Да) (8 мг, 0,12 мкмоль) предварительно растворенном в 10 мМ буфере PBS, pH 8,0, содержащем 6 мМ EDTA (конечная концентрация 4 мг/мл), и перемешивали смесь в течение 2 часов при 22°C. Затем добавляли дитиотреитол (DTT; 7,12 мг, 46 мкмоль; Sigma-Aldrich), в атмосфере N2, и перемешивали смесь в течение 1 часа при 4°C. Полученный раствор диализировали против 10 мМ буфера PBS, pH 7,2, содержащего 5 мМ EDTA в ячейке для ультрафильтрации (Millipore, Billerica, MA), с применением N2 в качестве источника давления, на мембране из регенерированной целлюлозы, пороговое значение 30000 Да (YM30, Millipore), при 4°C. Содержание белка и SH определяли с помощью аналитического набора с бицинхониновой кислотой (BCA; Pierce, Rockford, IL) и по методу Ellman (1959), соответственно. Достигали молярного замещения 20-22 SH-группами.
Для активации столбнячного анатоксина (TT) (молекулярная масса, 150000 Да), DTSP (0,316 мг, 0,8 мкмоль) в сухом DMSO (25 мкл) добавляли, в атмосфере N2, к раствору TT (4 мг, 0,03 мкмоль) в 10 мМ буфере PBS, pH 8,0, содержащему 6 мМ EDTA (конечная концентрация 4 мг/мл), и проводили реакцию как описано для BSA. Затем добавляли дитиотреитол (DTT; 3,56 мг, 23 мкмоль; Sigma-Aldrich), в атмосфере N2, и перемешивали смесь 1 час при 4°C. Активированный TT переносили в ячейке для ультрафильтрации (Millipore) и диализовали против 10 мМ буфера PBS, pH 7,2, содержащего 5 мМ EDTA на мембране из регенерированной целлюлозы, пороговое значение 100000 Да (YM100, Millipore), при 4°C.
К раствору BSA-SH21-22 или TT-SH21-22 в 10 мМ буфере PBS, pH 7,2, содержащему 5 мМ EDTA, добавляли раствор производного малеимидо-функционализированного LPS-OH или dLPS в 10 мМ буфере PBS, pH 7,2, содержащем 5 мМ EDTA (конечная концентрация 4 мг/мл) (молярное отношение 3:1) в атмосфере N2. Реакционную смесь перемешивали в течение 24 часов при 4°C. Затем добавляли N-этилмалеимид (1 мг; Sigma-Aldrich). Реакцию проводили в течение 30 мин при 22°C, и полученный конъюгат диализовали против 10 мМ буфера PBS, pH 7,2, в течение 4 дней при 4°C и стерилизовали посредством фильтрации с применением 0,22 мкм мембрана из поливинилиденфторида (PVDF) (Millex-GV, Millipore, Cork, Ireland). Конъюгаты проверяли на содержание углевода и белка методом определения нейтральных сахаров фенолом и серной кислотой (Dubois et al., 1956) и с помощью стандартного набора для определения белка с помощью BCA (Pierce), соответственно, с LPS-OH или dLPS и BSA в качестве стандартов. Эффективность конъюгирования подтверждали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ; Agilent 1200 series, Agilent Technologies, Waldbronn, Germany) с использованием колонки Superose 12 10/300 GL (Amersham Biosciences, Uppsala, Sweden), уравновешенной 10 мМ буфером PBS pH 7,2. Хроматографию проводили при комнатной температуре и со скоростью потока 0,5 мл/мин. Элюцию отслеживали при 210 нм и 280 нм с помощью детектора на диодной матрице (Agilent Technologies).
Наличие спейсера подтверждали с помощью1H-ЯМР спектроскопии по появлению нового протонового резонанса при 3,22 м.д., соответствующего группе CH2NH2. Затем получали производное аминогруппы молекулы спейсера с помощью реакции с N-гидроксисукцинимидным эфиром 3-малеимидпропионовой кислоты для образования малеимидо-функционизированного LPS-OH или dLPS, что подтверждали наличием протоновых резонансов при 2,55 м.д. и 6,9 м.д., соответствующих группам CH2α и CH=CH β-малеимидпропионата, соответственно (фиг. 4). Получение производных фосфоэтаноламина внутреннего участка кора LD-Hep сохраняли на минимальном уровне при использовании стехиометрических количеств реагента. Гликоконъюгат получали путем тиолирования белка-носителя и добавления тиолированного белка к малеимидо-функционализированному LPS-OH или dLPS (фиг. 4). Эффективность конъюгирования контролировали с помощью ВЭЖХ. Полученный конъюгат проверяли на содержание углевода и белка.
Молярное отношение LPS-OH к TT в трех конъюгатах изменялось от 10:1 до 20:1, и выход изменялся от 13% до 22%, из расчета содержания углевода (Таблица 5). В результате конъюгирования dLPS с BSA или TT получали конъюгаты dLPS-BSA-2, dLPS-TT или dLPS(PJ2)-TT со значительно боле высоким содержанием углеводов (Таблица 5). Конъюгаты LPS-OH-TT и dLPS-BSA или dLPS-TT одинаково хорошо реагировали с α1,6-глюкан-специфическими mAb при проведении ELISA, что позволяет предположить, что конформация глюканового эпитопа не изменялась.
Пример 6. Иммуногенность конъюгатов LPS-OH-TT, dLPS-BSA, dLPS-TT и конъюгатов dLPS(PJ2)-TT у мышей и кроликов
Иммуногенность конъюгатов (LPS-OH-TT, dLPS-BSA, dLPS-TT, и dLPS(PJ2)-TT) Примера 5 тестировали на мышах и кроликах.
Пять самок мышей BALB/c в возрасте 6-8 недель иммунизировали внутрибрюшинно соответствующими конъюгатами. Каждая мышь получала 2 мкг или 10 мкг углевода в 0,2 млм адъюванта Ribi на инъекцию. Мышам вводили бустерные инъекции на 21-й и 42-й день и получали сыворотки после терминальной сердечной пункции на 51-й день.
Трех белых кроликов New Zealand иммунизировали подкожно соответствующими конъюгатами. Каждый кролик получал 10 мкг или 50 мкг углевода в 0,5 мл неполного адъюванта Фрейнда. Мышам вводили бустерные инъекции на 28-й и 56-й день и получали сыворотки после кровопускания на 65-й день.
Уровень антитела анти-LPS в сыворотке измеряли с помощью теста ELISA, в котором очищенный LPS использовали в качестве антигена, покрывающего лунку (1 мкг/лунку). После отмывки PBS планшеты блокировали 1% (масс/об) раствором бычьего сывороточного альбумина (BSA) в PBS или дилюентом/блокирующим раствором, содержащим молоко (MDB) (KPL, Gaithersburg, MD) в течение 1 часа при 37°C. Добавляли разведенные мышиные или кроличьи пре- или постимунные сыворотки и инкубировали планшеты в течение 2 часов при 37°C. Для ингибирования ELISA серийные разведения ингибирующего LPS штамма 26695 HP0479::Kan или LPS штамма 26695 HP0826::Kan смешивали с заранее установленным разведением кроличьих сывороток, которому соответствовало значение OD450=0,6-0,8. Указанную смесь инкубировали в течение 15 мин при 22°C и затем переносили в исходный микротитрационный планшет, блокированный адсорбированным антигеном LPS, где смесь инкубировали в течение 2 часов при 37°C. После указанной стадии проводили непрямой тест ELISA. Коротко, планшеты отмывали PBS и второе антитело, конъюгат пероксидазы хрена с козьими антимышиными IgG+IgM (Caltag, So. San Francisco, CA) добавляли на 1 час при комнатной температуре. После стадии заключительной отмывки добавляли субстрат 3,3',5,5'-тетраметилбензидин (TMB) (KPL, Gaithersburg, MD) и останавливали реакцию 1 M фосфорной кислотой. Абсорбцию определяли при 450 нм с применением спектрофотометра для микротитрационных планшетов (Dynatech, Chantilly, VA).
Процент ингибирования рассчитывали по следующей формуле:
% ингибирование = 100×[(OD с ингибитором-OD без ингибитора)/OD без ингибитора]
Строили кривые зависимости ингибирования от log концентрации для каждого ингибитора, и определяли концентрации, необходимые для полумаксимальной подавляющей концентрации (IC50) в результате экстраполяции кривых.
Все конъюгаты вызывали ответ IgG против LPS гомологичного (26695 HP0826::Kan) и соответствующего дикого (26695) штаммов у кроликов и у мышей после трех инъекций (таблицы 6-9), хотя ответ был обычно слабее у мышей и кроликов, иммунизированных LPS-OH-TT, чем у животных, иммунизированных dLPS-BSA, dLPS-TT или dLPS(PJ2)-TT. Контрольные кролики, иммунизированные смесью LPS-OH, dLPS или dLPS(PJ2) и белка-носителя (с адъювантом) не проявляли или проявляли низкий уровень специфического ответа на LPS гомологичного штамма (мутант 26695 HP0826::Kan) или соответствующего дикого штамма 26695 H. pylori после трех иммунизаций.
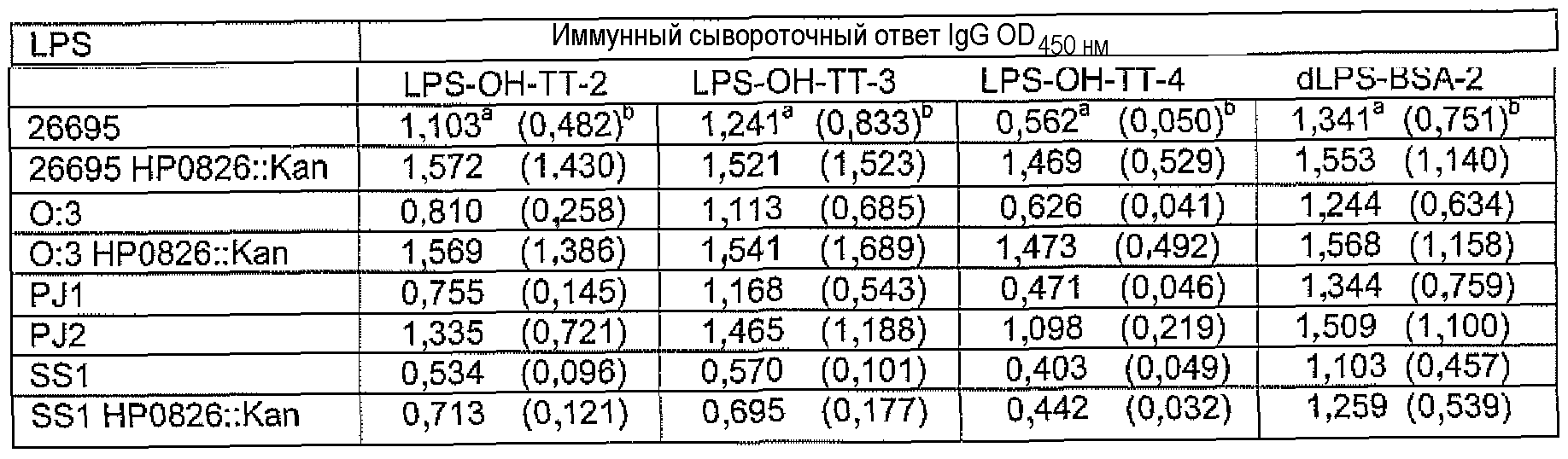
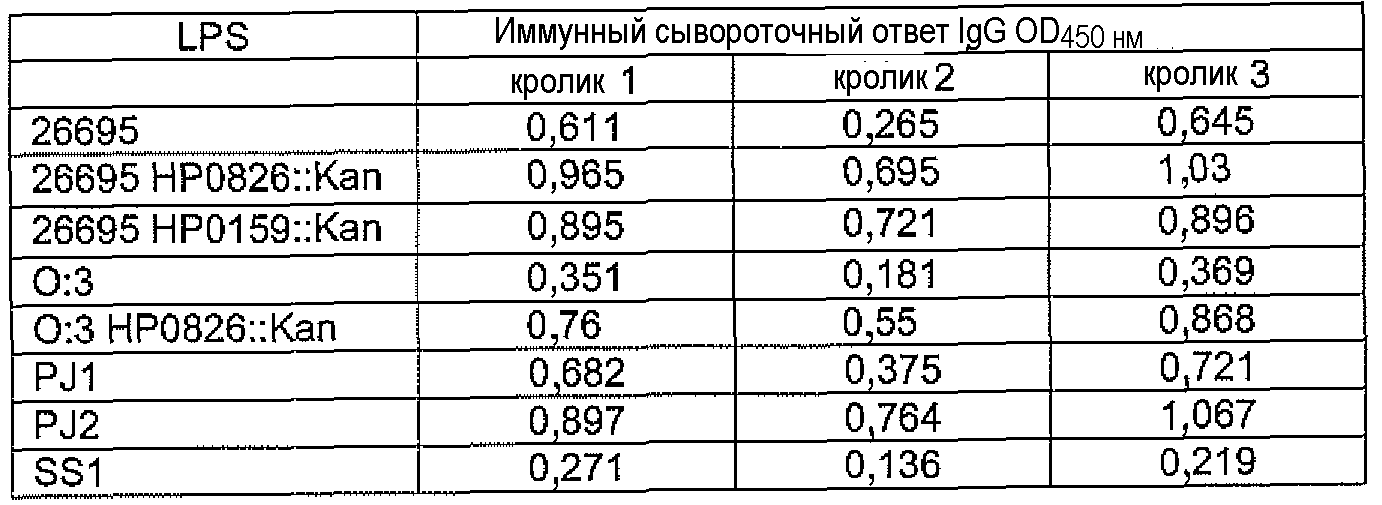
Исследования перекрестной реактивности проводили с постиммунными сыворотками кроликов, иммунизированых LPS-OH-TT-2, LPS-OH-TT-3, LPS-OH-TT-4, dLPS-BSA-2, dLPS-TT, или dLPS(PJ2) против LPS из штаммов H. Pylori, представляющих различные гликотипы LPS (Monteiro, 2001) и отобранных мутантных штаммов. Результаты представлены в таблицах 10, 11 и 12.
Реактивность постиммунных сывороток, полученных от кроликов, которых иммунизировали LPS-OH-TT-2, LPS-OH-TT-3 или LPS-OH-TT-4 показала необходимость присутствия α1,6-глюкана, поскольку получали только слабую перекрестную реактивность с LPS штаммов SS1 и SS1 HP0826::Kan, которые являются представителями штаммов H. pylori неспособных присоединить α1,6-глюкан (Logan et al., 2005) (таблица 10). Как ни удивительно, сыворотки, полученные от кроликов, которых иммунизировали dLPS-TT, также распознавали коровые эпитопы LPS, которые не содержали α1,6-глюкана, а именно LPS штаммов SS1, SS1 HP0826::Kan, M6 и J99 (Таблица 11), что показывает широкое коровое распознавание и предполагает, что конъюгат dLPS-TT являлся более иммуногенным, возможно, благодаря присутствию белка-носителя TT (Таблица 11). Альтернативно, поскольку конъюгаты получали из смеси 3 гликоформ, иммунный ответ мог вырабатываться на другие минорные компоненты LPS; что может объяснить наблюдаемые перекрестные реакции.
Чтобы изучить специфичность связывания кроличьих сывороток, вызванную конъюгатом dLPS-TT, проводили ингибирование теста ELISA, очищенным LPS штамма 26695 HP0479::Kan, состоящим из двух гликоформ (приблизительное соотношение 1:1), линейной структуры олигосахарида основной цепи и линейного олигосахарида основной цепи, кэпированного [GlcNAc, Fuc] (Hiratsuka et al., 2005), и LPS штамма 26695 HP0826::Kan. Связывание кроличьих сывороток с глюкан-отрицательным LPS штаммов SS1, SS1 HP0826::Kan HP0159::Kan и SS1 HP0479::Kan (фиг. 6) существенно ингибировалось, когда LPS 26695 HP0479::Kan использовали в качестве ингибитора, в то время как LPS 26695 HP0826::Kan являлся наиболее эффективным ингибитором, если LPS 26695 использовали в качестве покрывающего антигена (фиг. 6).
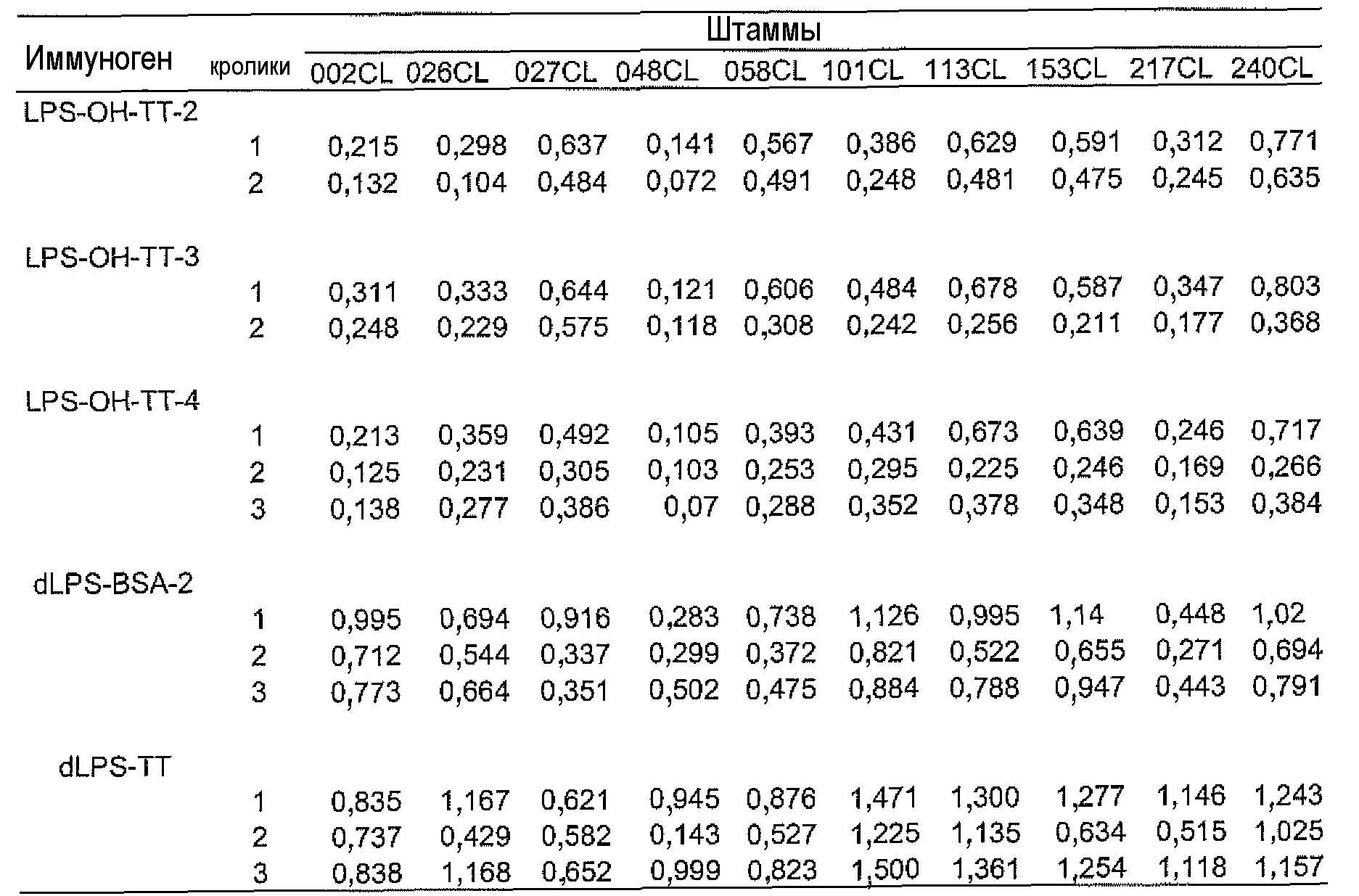
Способность кроличьих постиммунных сывороток распознавать гетерологичные типируемые и нетипируемые штаммы также проверяли в непрямом тесте ELISA с целыми клетками (WCE) против отобранных клинических изолятов H. Pylori, представителей типируемых и нетипируемых штаммов H. pylori. Непрямой тест ELISA с целыми клетками (WCE) проводили, как описано ранее (Altman et al., 2008). Вкратце, лунки микротитрационного планшета покрывали 100 мкл бактериальной суспензии, 108 клеток/мл, оставляли на ночь при 4°C. Затем лунки фиксировали метанолом и блокировали 200 мкл дилюента/блокирующего раствора, содержащего молоко, (MDB) (KPL, Gaithersburg, MD) в течение 2 часов при 37°C. Затем, лунки инкубировали в течение 2 часов при 37°C с 100 мкл асцитических жидкостей 1C4F9, разведенных 1:500 в MDB, с последующим инкубированием с конъюгатом антимышиных IgG+IgM с пероксидазой хрена (Caltag), разведенным 1:1000 в MDB, в течение 1 часа при комнатной температуре. Добавляли субстрат, как описано для непрямого теста ELISA. Неспецифические фоновые значения определяли как OD450 лунок отрицательного контроля, содержащих бактериальные клетки, конъюгат вторичных антител и субстрат. Указанные значения OD450 являлись ≤0,2. Значения оптической плотности при OD450 <0,2 классифицировали как отрицательные реакции и значения OD450 ≥0,2 классифицировали как положительные реакции. Для обеспечения сопоставимости между планшетами клетки штамма 26695 H. pylori использовали в качестве положительного контроля. Результаты тестов отличались не более чем на 10%.
Сыворотки, полученные от кроликов, которых иммунизировали конъюгатом dLPS-TT, проявили наиболее сильную перекрестную реактивность со всеми тестируемыми штаммами (Таблица 13) при использовании целых клеток в непрямом тесте ELISA.
Пример 7. Бактерицидная активность кроличьих антисывороток
Бактерицидный тест проводили с применением сывороток пре- или поствакцинированных кроликов (Пример 6).
Выращенные на чашках клетки H. pylori собирали и отмывали 5 мл PBS на чашку. После центрифугирования суспендировали осадки в 25 мл PBS. Конечную бактериальную суспензию разводили в физиологическом растворе, забуференном фосфатом Дульбекко (DPBS) (Invitrogen, Grand Island, NY) в концентрации 4×106 КОЕ/мл. Бактерицидный тест проводили в титрационном микропланшете с плоским дном (ICN). Десятикратное серийное разведение декомплементированных пре- или постиммунных сывороток (50 мкл) добавляли в каждую лунку. Затем добавляли бактериальную суспензию (25 мкл) и предварительно инкубировали в течение 15 мин при 37°C. Препарат комплемента крольчат (Cedarlane Laboratories, Hornby, ON) разводили 1:50 и 25 мкл добавляли в соответствующие лунки. Планшет инкубировали в течение 45 мин при 37°C и затем помещали на лед. Аликвоту 10 мкл наносили в трипликате на кровяной агар Columbia, выращивали в течение 4 дней, и затем производили подсчет на чашке для измерения числа колониеобразующих единиц (КОЕ). Контрольную чашку для посева с бактериями и комплементом, но без сывороток использовали для подсчета процентного значения лизиса. Бактерицидную активность определяли как наибольшее разведение сывороток, которое вызывало 50% лизиса.
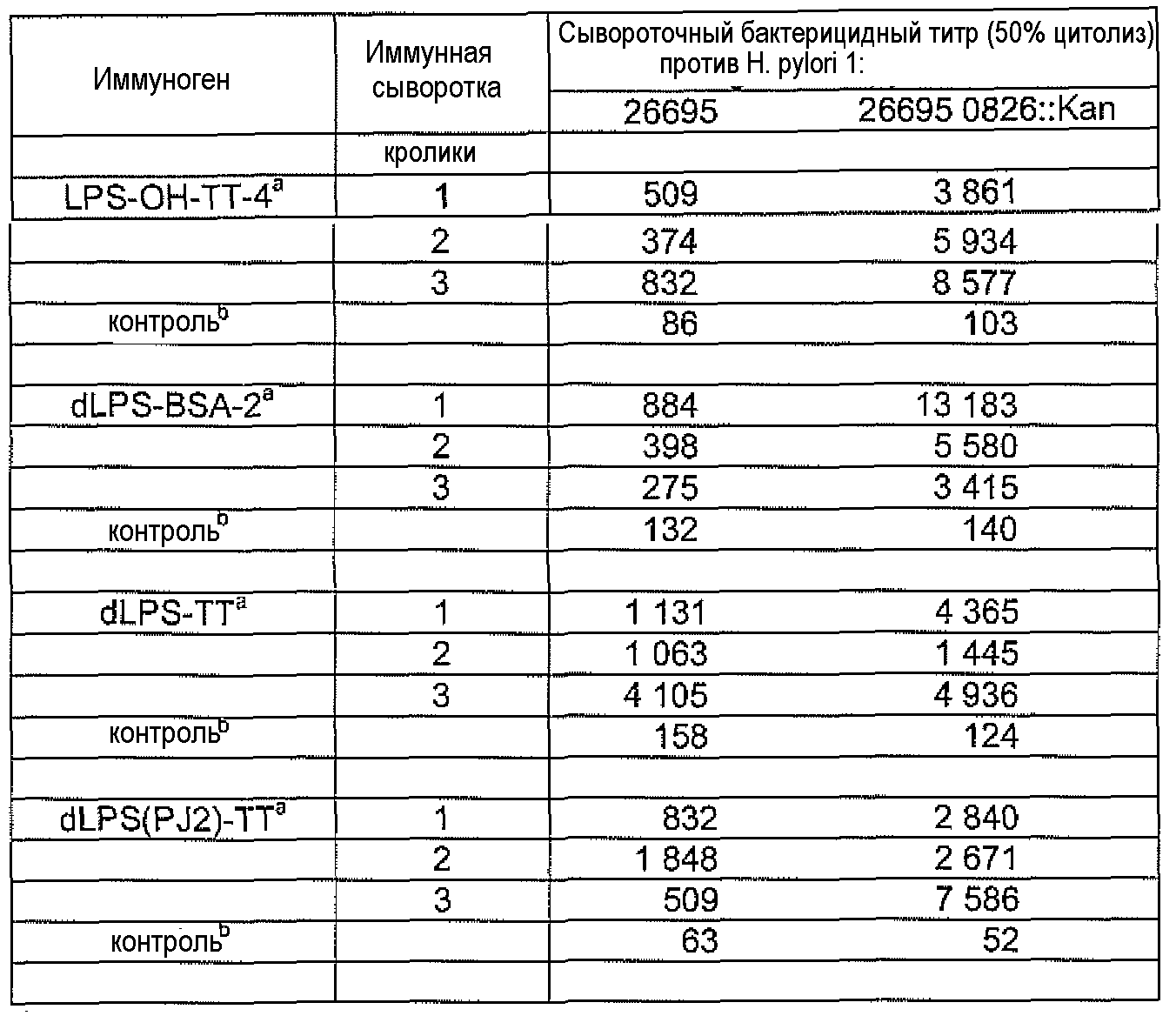
Сыворотки, взятые перед вакцинацией, или сыворотки, полученные от кроликов, иммунизированных смесью белка-носителя и либо LPS-OH, dLPS, либо dLPS(PJ2) (с адъювантом) не показали или показали низкие уровни бактерицидной активности против гомологичного штамма H. pylori 26695 HP0826::Kan или штамма дикого типа 26695. Постиммунные сыворотки, полученные от кроликов, иммунизированных LPS-OH-TT-4, dLPS-BSA-2, dLPS-TT и dLPS(PJ2)-TT, проявляли статистически значимую функциональную активность против мутанта 26695 HP0826::Kan и соответствующих штаммов дикого типа (Таблица 14), причем сыворотки после вакцинации, полученные от кроликов, иммунизированных конъюгатом dLPS-TT, демонстрировали наиболее высокую функциональную активность против дикого штамма 26695 (Таблица 14).
Кроме того, бактерицидную активность кроличьих сывороток также проверяли в отношении выбранных клинических изолятов H. pylori, а именно штаммов 002CL, 0153CL и 058CL (Altman et al., 2008). Указанные изоляты были выбраны как представители сильных, умеренных и слабых связывающих агентов, исходя из их значений OD450 в тестах WCE с mAb анти-α1,6-глюкан: штамм 002CL - OD450 1,361, сильный связывающий агент; штамм 153CL - OD450 0,29, умеренный связывающий агент; и штамм 058CL - OD450 0,162, слабый связывающий агент. Важно отметить, что только постиммунные сыворотки кроликов, иммунизированных конъюгатом dLPS-TT или dLPS(PJ2)-TT, проявляли функциональную активность со всеми тремя тестированными клиническими изолятами (Таблица 15).
Пример 8. Исследования защиты с помощью конъюгата dLPS-TT у мышей
Потенциал конъюгата dLPS-TT в качестве вакцины-кандидата оценивали у беспородных мышей CD-1.
Группы из 5 мышей CD-1 вакцинировали четыре раза интраназально с недельными интервалами 25 мкг/мышь конъюгата dLPS-TT, с добавленным в качестве адъюванта 1 мкг/мышь холерным токсином (CT; Sigma), 31,5 мкг/мышь бесклеточным соникатом PJ2 с добавленным в качестве адъюванта 1 мкг/мышь холерным токсином (контроль), или физиологическим раствором (контроль). Через неделю после последней иммунизации собирали образцы сыворотки, экскрементов и вагинальных смывов и проверяли на H. pylori-специфические IgG и IgA. Уровни антител сывороточного IgG и сывороточного, фекального и вагинального IgA определяли с помощью стандартного теста ELISA. Планшеты покрывали 1 мкг/лунку LPS штамма 26695 HP0826::Kan H. pylori, как описано в настоящей заявке. Образцы сыворотки разводили 1:100 для теста с IgG и 1:50 для теста с IgA. Образцы экскрементов разводили 1:2 и вагинальные образцы разводили 1:20. Определяли уровни антител, специфичных к H. pylori и анализировали данные с помощью критерия Манна-Уитни с применением программного обеспечения GraphPad, версия 5.0.
Через пять недель после первой иммунизации мышам перорально через зонд вводили три раза через день ~108 КОЕ H. pylori штамма PJ2 (Altman et al., 2003). Через четыре недели мышей умерщвляли, подсчитывали живые бактерии, выделенные из их желудков, и анализировали данные с помощью критерия Манна-Уитни с использованием программного обеспечения GraphPad, версия 5.0.
Интраназальная иммунизация конъюгатом dLPS-TT плюс CT вызывала очень сильный ответ IgG, специфичный к LPS H. pylori 26695 HP0826::Kan, который измеряли с помощью ELISA, и также обнаруживали умеренный ответ сывороточного IgA, специфического к H. pylori 26695 HP0826::Kan (таблицы 16 и 17, фиг. 7). Кроме того, образование IgA, специфического к LPS H. pylori 26695 HP0826::Kan, также обнаруживали в вагинальных или фекальных образцах (p<0,01) (Таблица 17, фиг. 7).
Все группы мышей затем орогастрально инокулировали нетипируемым колонизирующим мышей штаммом PJ2 H. pylori, который, как показано ранее, содержит длинный α1,6-глюкан (Altman et al., 2003). Защитное действие определяют как статистически значимое снижение бактериальной нагрузки в вакцинированных группах по сравнению с контрольными группами. Результаты колонизации для групп мышей, иммунизированных интраназально конъюгатом dLPS-TT плюс CT, являлись статистически значимыми (p <0,05) (фиг. 8). Кроме того, указанные результаты позволяют предположить, что образование только сывороточных антител IgA, специфичных к LPS 26695 HP0826::Kan H. pylori не может быть достаточным для защиты против бактериального заражения и что образование сывороточных антител IgG, специфичных к LPS, также может вносить свой вклад в усиление защиты.
Пример 9. Получение и описание конъюгата Декстран-BSA и исследования иммуногенности и функциональной активности
Конъюгат Декстран-BSA получали путем растворения 10 мг Декстрана T5 (MW 5 KDa, Pharmacosmos A/S, Holbaek, Denmark) в 250 мкл 0,2 M боратного буфера, pH 9,0; указанный раствор добавляли к раствору (250 мкл), содержащему 1,8-диамино-3,6-диоксаоктан (25 мкл) и цианоборогидрид натрия (10 мг) в 0,2 M боратном буфере, pH 9,0 (как описано Roy et al., 1984). Реакцию проводили в течение 5 дней при 55°C. Продукт реакции очищали, как описано выше, для получения конъюгатов на основе LPS.
Указанная реакция приводила к введению спейсера. Затем получали производное аминогруппы молекулы-спейсера с помощью реакции с N-гидроксисукцинимидным эфиром 3-малеимидопропионовой кислоты, как описано для конъюгатов на основе LPS (см. Пример 5). Гликоконъюгат получали тиолированием белка-носителя и добавлением тиолированного белка к малеимидофункционализированному Декстрану T5. Молярное отношение Декстрана к BSA в конъюгате составляло 20:1, и выход составлял 32%, на основании содержания углеводов.
Исследования перекрестной реактивности проводили с постиммунными сыворотками кроликов, иммунизированных Декстран-BSA против LPS штаммов H. Pylori, характерных для различных гликотипов LPS, и LPS отобранных мутантных штаммов (Таблица 18).
Реактивность постимунных сывороток, полученных от кроликов, которые были иммунизированы Декстраном-БСА, свидетельствовала о необходимости присутствия α1,6-глюкана, поскольку не получали перекрестной реактивности с глюкан-отрицательными штаммами SS1 и SS1 HP0826::Kan.
Постиммунные сыворотки, полученные от кроликов, иммунизированных Декстраном-БСА, проявляют функциональную активность против мутанта 26695 HP0826::Kan и соответствующего штамма дикого типа (Таблица 19).
Способность кроличьих постиммунных сывороток распознавать геторологичные типируемые и нетипируемые штаммы и индуцировать бактерицидные антитела отражает возможность того, что конъюгат, состоящий из Декстрана, полимера, содержащего линейную основную цепь из α1,6-связанных повторяющихся глюкозных остатков, или конъюгат, содержащий оптимизированные линейные олигосахариды, состоящие из последовательных α1,6-связанных остатков глюкозы, и подходящий белок-носитель, могут быть достаточными для обеспечения защиты против инфекции H. pylori.
Пример 10. Исследования специфичности анти-глюкановых mAb
Получали моноклональные антитела, специфичные к штамму O:3 HP0826::Kan H. pylori и изучали их специфичность.
Создавали гибридомы, как описано ранее (Altman et al., 2005). Шести мышам BALB/c (Charles River Laboratories, St Constant, QC) вводили внутрибрюшинно (i.p.) 108 (200 мкл) фиксированных в формалине клеток штамма O:3 HP0826::Kan H. pylori 5 раз на протяжении 82 дней для достижения значимого титра. Вводили заключительную внутривенную (i.v.) инъекцию и через 3 дня выполняли слияние клеток. Клетки селезенки двух мышей соединяли с клетками плазмацитомы линии Sp2/O по Kohler and Milstein (1975). Проводили скрининг супернатантов исходных слитых клеток из 368 лунок с помощью непрямого твердофазного иммуноферментного анализа (ELISA). Для скрининга гибридом с помощью ELISA титрационные микропланшеты (ICN, Costa Mesa, CA) покрывали 10 мкг/мл соответствующего LPS H. pylori O:3 HP0826::Kan в 50 мМ карбонатном буфере, pH 9,8, в течение 3 часов при 37°C. После отмывки PBS планшеты блокировали 5% (масс/об) раствором бычьего сывороточного альбумина (BSA) в PBS. Добавляли истощенные супернатанты, и инкубировали планшеты в течение 3 часов при комнатной температуре. Планшеты отмывали PBS и добавляли второе антитело, конъюгат пероксидазы хрена с козьими антимышиными IgG+IgM (Caitag, So. San Francisco, CA) на 1 час при комнатной температуре. После стадии заключительной отмывки добавляли субстрат 3,3',5,5'-тетраметилбензиден (TMB) (KPL, Gaithersburg, MD) и останавливали реакцию 1 M фосфорной кислотой. Абсорбцию определяли при 450 нм с помощью спектрофотометра для титрационных микропланшетов (Dynatech, Chantilly, VA). После указанной стадии проводили непрямой тест ELISA, как описано в Примере 6.
Две подходящие гибридомы получали в результате клонирования методом серийных разведений. Один клон, 1C4F9, IgM, был выбран для дальнейшего описания. Асцитическую жидкость получали в мышах BALB/c, и моноклональное антитело 1C4F9 (mAb) выделяли из асцитической жидкости с применением IgM-специфичной колонки для аффинной хроматографии (Pierce, Rockford, IL) согласно инструкции производителя.
Исследования специфичности глюкан-специфического антитела осуществляли с применением серии линейных олигосахаридов, состоящих из последовательных α1,6-связанных остатков глюкозы Glc→[α(1→6)Glc]n=1-6 и селективно очищенного LPS H. pylori. Для ингибирования ELISA, готовили серийные разведения ингибиторов, линейных α1,6-связанных глюкозосодержащих олигосахаридов изомальто-серий [Glcα1→(6Glcα1→)n=1-6] (USBiologicals, Swampscott, MS) или LPS H. pylori 26695, O:3 и PJ2, и смешивали с заранее приготовленными разведениями очищенного антитела 1C4F9, которые давали значение OD450=1. После инкубирования (22°C, 15 мин) смесь переносили в исходно блокированный микротитрационный планшет с адсорбированным антигеном LPS, где смесь инкубировали в течение 2 часов при 37°C. После указанной стадии следовал непрямой тест ELISA, как описано в Примере 6. Процент ингибирования рассчитывали по следующей формуле:
% ингибирования = 100×[(OD с ингибитором - OD без ингибитора)/ OD без ингибитора]
Для каждого ингибитора строили кривую ингибирования в виде функции log концентрации и определяли концентрации, требуемые для полумаксимальной ингибиторной концентрации (IC50) из экстраполяции кривых.
Ингибиторные свойства имели оптимальные значения при использовании изомальтогексаозы (n=5) и изомальтопентаозы (n=6) (таблица 20). LPS штамма PJ2 H. Pylori, как показано ранее, содержащий в среднем от шести до восьми остатков в глюкановой цепи (Altman et al., 2003), являлся наиболее эффективным ингибитором (Таблица 20).
Пример 11. Исследования доступности и бактерицидные тесты с использованием антиглюкановых mAb
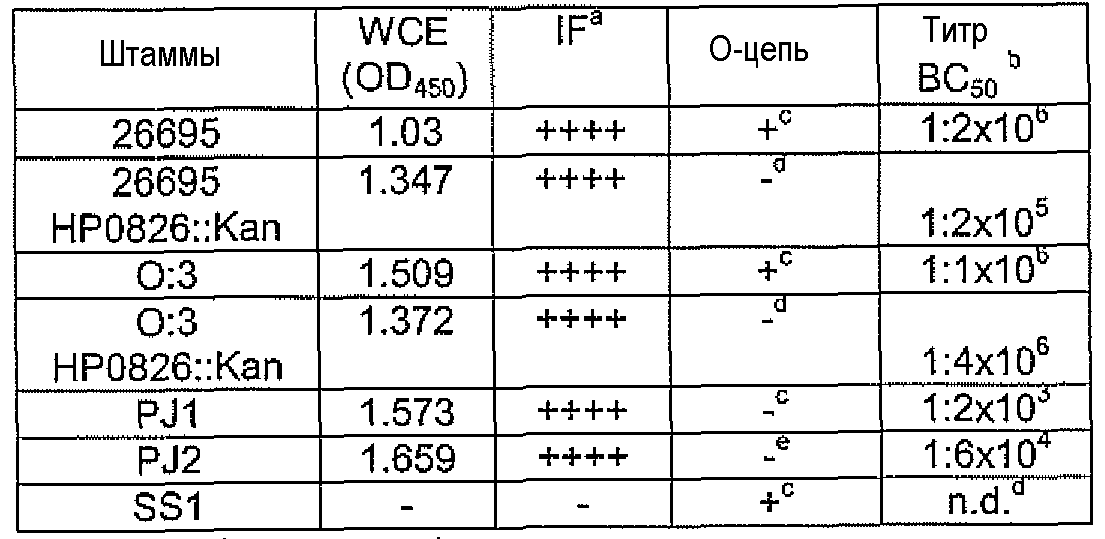
Антиглюкановые mAb были легко доступны на поверхности живых бактерий репрезентативных штаммов H. Pylori, как показано исследованиями непрямой ИФ-микроскопией (Таблица 21). α1,6-глюкан и CagA можно одновременно различать на бактериальной поверхности.
Для определения бактерицидной активности моноклонального антитела, десятикратное серийное разведение mAb 1C4F9 из лишенной комплемента асцитической жидкости (50 мкл) добавляли в каждую лунку с последующим добавлением бактериальной суспензии (25 мкл) и преинкубировали в течение 15 мин при 37°C. После указанной стадии тест проводили, как описано в Примере 7. Связывание клеточной поверхностью 1C4F9 коррелировало с функциональной активностью, которую определяли с помощью бактерицидных тестов против диких и мутантных штаммов H. pylori (Таблица 21).
Несмотря на то, что предпочтительные варианты осуществления изобретения были описаны выше, следует учитывать и понимать, что в нем могут быть произведены различные модификации, и предполагается, что прилагаемая формула изобретения охватывает все такие модификации, которые могут соответствовать сущности и объему изобретения.
ССЫЛКИ
Все патенты, патентные заявки, и публикации, упоминаемые в настоящей заявке и во всей заявке, включены, таким образом, в качестве ссылки.




Реферат
Настоящее изобретение относится к биотехнологии и представляет собой α1,6-глюкан-содержащее соединениеНастоящее изобретение также раскрывает конъюгат для индукции иммунного ответа против, содержащий указанное соединение, конъюгированное с белком-носителем. Также настоящее изобретение раскрывает иммуногенную композицию, применение указанной композиции и способ индукции иммунного ответа противс использованием указанной композиции. Настоящее изобретение раскрывает также иммунную антисыворотку для нейтрализацииу млекопитающего, которую получают путем иммунизации указанного млекопитающего иммуногенной композицией, содержащей указанную иммуногенную композицию.Настоящее изобретение раскрывает антитело, распознающее указанное α1,6-глюкан-содержащее соединениеприменение указанного антитела и способ индукции комплемент-опосредованного бактериолиза штаммовэкспрессирующихα1,6-глюкан с использованием указанного антитела. Настоящее изобретение позволяет повысить эффективность иммуногенных композиций против9 н. и 18 з.п. ф-лы, 8 ил., 21 табл., 11 пр.
Формула
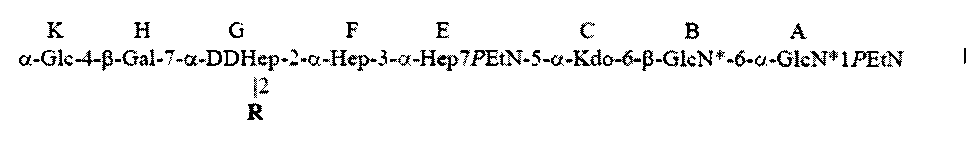
в которой R представляет собой трисахарид α-DDHep-3-α-L-Fuc-3-β-GlcNAc, замещенный α1,6-глюканом, содержащим от 4 до 12 α1,6-связанных остатков глюкозы, соединенным с α1,3-DD-гептаном, в котором последний остаток DD-Hep α1,3-DD-гептана кэпирован остатком β-GlcNAc.
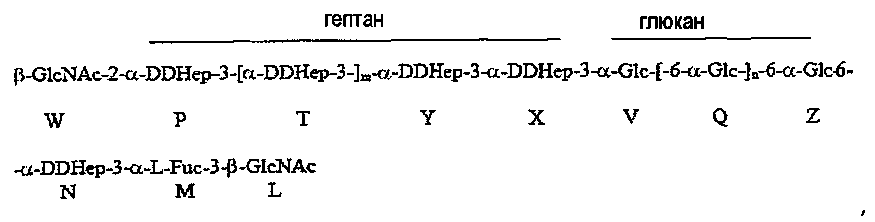
где остаток L β-GlcNAc соединен с 0-2 Hep G, n равно 1-11, и m равно 0-4.




Комментарии