Композиции для предупреждения и/или лечения инфекции, вызванной вирусом вич-1 - RU2603262C2
Код документа: RU2603262C2
Чертежи






















Описание
Область техники
Настоящее изобретение относится к предупреждению и к лечению инфекции индивидуумов, вызванной вирусом ВИЧ-1 (вирус иммунодефицита человека).
Предшествующий уровень техники
Примерно 90% ВИЧ-инфекций человека вызвано вирусом ВИЧ-1. Вирус иммунодефицита человека типа 1 (ВИЧ-1) характеризуется сильной генетической изменчивостью, вызванной накоплением мутаций, возникающих в течение репликации вируса, и также вызванной явлениями рекомбинации. Отсутствие результата в течение длительного периода химиотерапевтических методов лечения ВИЧ в значительной степени объясняется высокой мутагенной активностью вирусных штаммов ВИЧ-1. Ранее было показано, что устойчивые разновидности вируса быстро возникали у пациентов после разных курсов антиретровирусной терапии и даже после терапии с использованием многих лекарственных средств (HAART-высокоактивная антиретровирусная терапия). Эти устойчивые вирусы несут определенные изменения в конформации и структуре своих белков. Обычно такие мутации, ответственные за уклонение ВИЧ-1 от современных способов лечения, сохраняются в последующих поколениях вируса и накапливаются как результат селекции в условиях лечения.
Лечение лекарственными средствами против ВИЧ-1 полностью не блокирует репликацию вируса, что делает возможным отбор и накопление заранее существующих мутаций, ассоциированных с устойчивостью, а также вновь возникающих мутаций, таким образом, давая возможность вирусу продолжать распространяться. Существующие антиретровирусные лекарственные средства (NRTI (нуклеозидный ингибитор обратной транскриптазы), NNRTI (ненуклеозидный ингибитор обратной транскриптазы) ингибиторы протеаз, ингибиторы слияния и их смеси, подобно HAART) могут только замедлить репликацию ВИЧ-1 в течение более или менее продолжительного периода времени, до возникновения и репродукции устойчивых вирусных штаммов. Широкое распространение устойчивых разновидностей ВИЧ-1 вызывает серьезные опасения и требует наличия дополнительных терапевтических средств против ВИЧ-1.
Были рассмотрены разные терапевтические стратегии против ВИЧ, отличающиеся от терапевтических стратегий против ВИЧ с применением химических антиретровирусных веществ, которые включают (i) применение антител против ВИЧ, (ii) вакцины на основе частиц разрушенного вируса ВИЧ, (iii) вакцины на основе пептидов ВИЧ и (iv) вакцины на основе ДНК плазмиды или вирусного вектора, причем каждая имеет свои конкретные недостатки.
Так как пандемия ВИЧ продолжает инфицировать миллионы людей каждый год, возрастает потребность в эффективной вакцине. Развитие вакцин против ВИЧ было сильно замедлено вследствие сложности, возникающей при разработке иммуногенного продукта, способного вызывать образование нейтрализующих антител против ВИЧ широкого спектра действия.
Индуцирование образования нейтрализующих антител широкого спектра действия (bNAb) против первичных изолятов вируса иммунодефицита человека (ВИЧ) остается главной и нереализованной задачей при исследовании вакцины против СПИДа (синдром приобретенного иммунодефицита). Ранние попытки использования вакцин на основе капсул приводили к образованию антител, которые являются эффективными только против изолятов, адаптированных для использования в лаборатории. В этих примерах защита коррелировала с высоким титром bNAb, направленных на гипервариабельную область V3 gp120. Однако образованное нейтрализующее действие является главным образом специфичным по отношению к изоляту и является минимально эффективным по отношению к большинству первичных изолятов ВИЧ-1. Неспособность вакцин на основе субъединицы gp120 защищать от инфицирования ВИЧ-1 на Фазе III клинических испытаний подчеркивает сложность задачи.
Тем не менее, bNAb может быть часто обнаружено у ВИЧ-инфицированных индивидуумов. Ответы, вызванные рано при инфицировании, обычно являются узкоспецифичными, нейтрализуя распространяющиеся в хозяине вирусы, но не совпадающими во времени. Такие ответы распространяются в течение инфицирования у некоторых долгожителей, которые способны контролировать свою инфекцию в отсутствие антивирусного лечения. Однако, природа ответа, заключающегося в образовании перекрестно-нейтрализующих антител, и механизмы, приводящие к его возникновению, не поняты.
В естественных условиях NAb против Env (ген белка оболочки) образуются в пределах недель после инфицирования, но данный ранний ответ является эффективным только против определенного вирусного подтипа; однако bNAb (перекрестно-реагирующие нейтрализующие антитела) могут вырабатываться в течение развития ВИЧ. Недавно в нескольких масштабных исследованиях было показано, что приблизительно 25% ВИЧ-инфицированных пациентов (инфицированных в течение по меньшей мере 1 года) имеют ответ в виде образования bNAb, и 1% «элитных нейтрализующих агентов» с очень высокой активностью против большинства клад. Важно отметить, данные результаты демонстрируют способность иммунной системы инфицированных индивидуумов к образованию Nab in vivo против ВИЧ-1, в течение развития заболевания. Они также наводят на мысль о том, что активность Nab, реагирующих в широкой области, по-видимому, развивается со временем, и ей благоприятствует продолжительная антигенная стимуляция, в отсутствие знания о титре bNAb, который был бы защитным.
Постоянная репликация вируса с низким уровнем помех приводит к постоянной эволюции Env для уклонения от NAb. Такая антигенная эволюция может сосредотачивать внимание на новой стратегии вакцинации на основе более консервативной области белка Env и наводит на мысль о том, что иммуногены вакцины могли бы быть предназначены для имитации ключевых, высококонсервативных эпитопов.
Одной из главных проблем разработки эффективных вакцин против ВИЧ было то, что мишенью bNAb является белок вирусной оболочки (Env), который является высоковариабельным, тогда как консервативные элементы, по-видимому, являются слабоиммунногенными. Это означает, что кинетические и пространственные ограничения затрудняют доступ bNAb к потенциально чувствительным сайтам во время связывания с рецептором и процессов слияния. На самом деле было описано небольшое количество NAb. Например, первым идентифицированным bNAb был b12, который закрывает сайт связывания CD4 на gp120 и предотвращает прикрепление CD4. Субъединица gp41 является гораздо более консервативной, чем gp120, включая конформационные перестройки, характерна для всех штаммов. Очень низкую bNAb активность выявляют по отношению к консервативным структурным элементам gp41, которые защищены, труднодоступны или являются неустойчивыми; данные bNAb, включая 2F5 и 4Е10, нацелены на ближайшую к мембране эктодоменную область (MPER) gp41. Однако иммунизация данными ключевыми эпитопами не приводила в результате к образованию активности bNAb. Данное раздвоение между антигенными и иммунологическими характеристиками все еще не понято.
В данной области все еще существует необходимость в терапевтических средствах, нацеленных на предупреждение или лечение инфекции, вызванной вирусом ВИЧ-1.
Краткое описание изобретения
Настоящее изобретение относится к иммуногенной композиции, содержащей антигенный пептид нижеприведенной формулы (I):
[Nt-SEQ ID №1-Ct], где
- Nt состоит из пептида, имеющего от 0 до 100 аминокислот в длину,
- Ct состоит из пептида, имеющего от 0 до 100 аминокислот в длину,
- каждый из Х1-Х4 состоит из аминокислотного остатка, где:
- (i) X1 обозначает конкретную аминокислоту W, или (ii) X1 обозначает любой аминокислотный остаток, за исключением W,
- (i) X2 обозначает конкретную аминокислоту S, или (ii) X2 обозначает любой аминокислотный остаток, за исключением S,
- (i) Х3 обозначает конкретную аминокислоту N, или (ii) X3 обозначает любой аминокислотный остаток, за исключением N,
- (i) X4 обозначает конкретную аминокислоту S, или (ii) X4 обозначает любой аминокислотный остаток, за исключением S,
при условии, что
- три из четырех аминокислотных остатков X1, X2, Х3 и X4 обозначают конкретную аминокислоту, определенную выше в их соответствующем значении (i), и
- оставшийся аминокислотный остаток среди Х1-Х4 обозначает любой аминокислотный остаток, за исключением конкретного аминокислотного остатка, определенного в своем значении (i),
при условии, что пептид формулы (I) не обозначает пептид SEQ ID №18, раскрытый в заявке РСТ, поданной 22 июня 2010 года под №PCT/US2010/001784 и опубликованной 13 января 2011 года под № WO 2011/005289 от имени Президента и Членов совета Гарвардского колледжа.
Данное изобретение также относится к иммуногенной композиции, содержащей антигенный пептид формулы (I), как описано выше, для применения в качестве лекарственного средства.
Настоящее изобретение также относится к иммуногенной композиции, содержащей антигенный пептид формулы (I), как описано выше, для применения в способе предупреждения и/или лечения инфекции индивидуума, вызванной вирусом ВИЧ-1.
Данное изобретение также относится к применению иммуногенной композиции, содержащей антигенный пептид формулы (I), как описано выше, для изготовления лекарственного средства для предупреждения и/или лечения инфекции индивидуума, вызванной вирусом ВИЧ-1.
В определенных воплощениях значение (ii) одного или более чем одного из Х1, Х2, Х3 и Х4 независимо друг от друга выбрано из группы аминокислотных остатков, состоящей из цистеина (Cys или С), аланина (Ala или А), глицина (Gly или G) и валина (Val или V), пролина (Pro или Р) и, наиболее предпочтительно, аланина.
В определенных воплощениях только один из Х1-Х4 обозначает аминокислотный остаток, отличающийся от W (для Х1), S (для Х2), N (для Х3) и S (для Х4) соответственно.
В определенных воплощениях антигенный пептид формулы (I) выбран из группы, состоящей из:
- PWNASASNKSLDDIW (SEQ ID №12),
- PWNASWANKSLDDIW (SEQ ID №13),
- PWNASWSAKSLDDIW (SEQ ID №14), и
- PWNASWSNKALDDIW (SEQ ID №15).
Данное изобретение также относится к иммуногенной композиции, содержащей антигенный пептид формулы (I).
В определенных воплощениях антигенный пептид формулы (I) ковалентно связан с молекулой-носителем.
В определенных воплощениях указанной иммуногенной композиции антигенный пептид формулы (I), возможно связанный с молекулой-носителем, объединен с одним или более чем одним иммуноадъювантом.
Настоящее изобретение также относится к пептиду формулы (I), как описано в настоящем описании.
Изобретение также относится к применению антител, действие которых направлено против пептида формулы (I), при изготовлении лекарственного средства для предупреждения и/или лечения индивидуума, инфицированного вирусом ВИЧ-1.
Данное изобретение также относится к антителам, действие которых направлено против пептида вышеуказанной формулы (I).
Данное изобретение также относится к способам диагностики ВИЧ-1, а также наборам для диагностики ВИЧ-1, в которых применяется пептид формулы (I).
Данное изобретение также относится к способам прогнозирования ВИЧ-1, а также наборам для прогнозирования ВИЧ-1, в которых применяется пептид формулы (I).
Оно также относится к способам мониторинга состояния ВИЧ-1 инфекции, при которых применяется пептид формулы (I), особенно у пациентов, которые находятся на терапевтическом лечении ВИЧ-1 инфекции, а также наборам для осуществления таких способов мониторинга.
Описание графических материалов
Фиг.1. Выравнивание аминокислотных последовательностей нескольких пептидов формулы (I).
Дикий тип: аминокислотная последовательность, содержащаяся в белке gp41 штамма НХВ2 ВИЧ-1, которая может также называться «3S».
S613A (М1) и K617A (М5): аминокислотные последовательности, имеющие высокую аминокислотную идентичность с указанным выше «Диким типом».
W614A, S615A, N616A и S618A: конкретные воплощения пептида формулы (I).
Фиг.2. Инфицирующая способность ВИЧ-1 вируса NL4.3, содержащего аланиновую замену в мотиве 3S/gp41.
Клетки МТ-2 инфицировали 100 нг/мл р24 эквивалентного антигена из дикого типа (WT, белые столбики на диаграмме) или мутированных по аланину 3S/gp41 (черные столбики на диаграмме) вирусов NL4.3.
(A) р24 антиген количественно определяли на день-6 после инфицирования. Результаты, выраженные в относительных единицах по отношению к дикому типу, представляют среднее ±SD (стандартное отклонение) от трех до семи независимых препаратов клона плазмиды, в зависимости от мутантов.
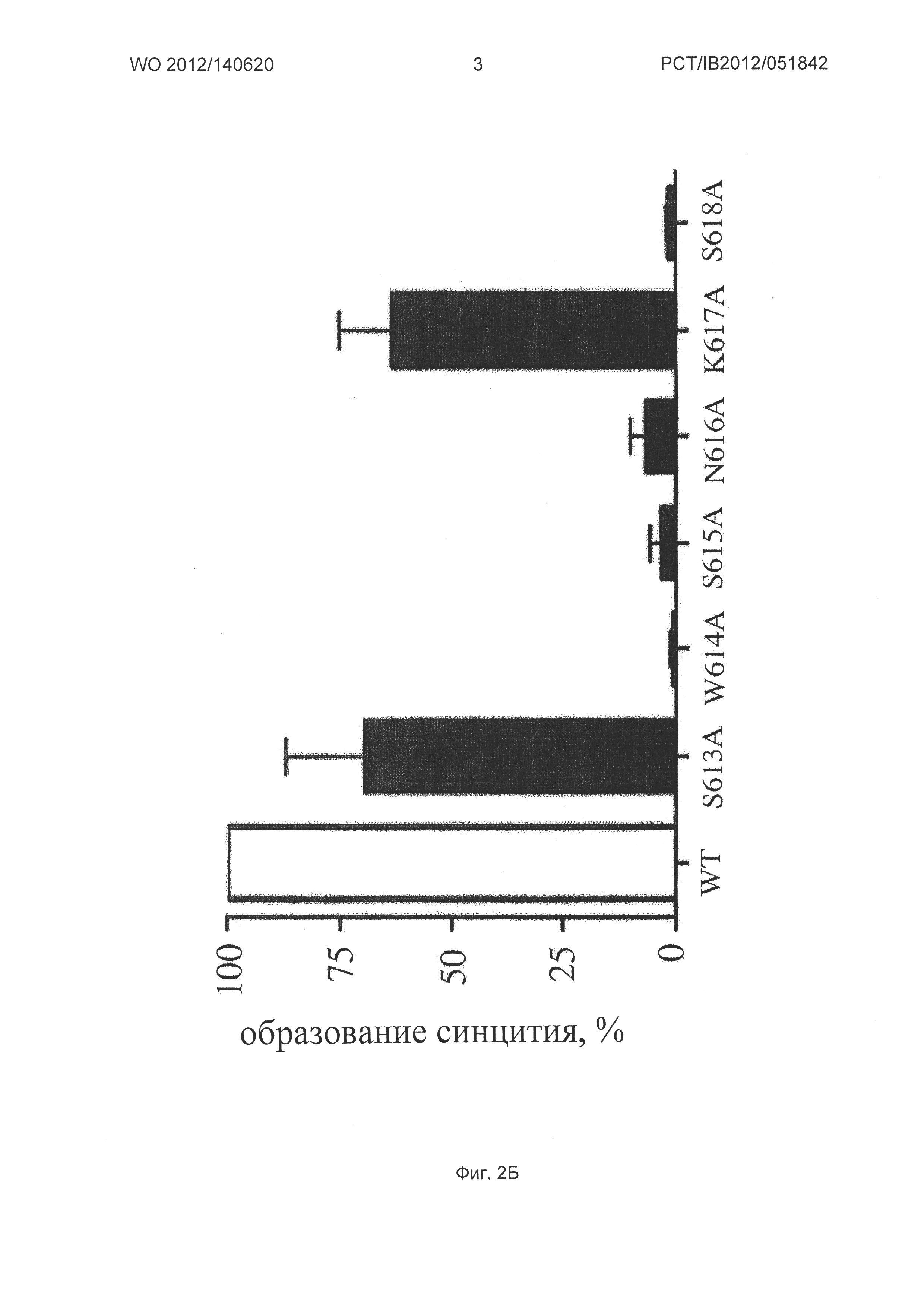
(Б) Образование синцития количественно определяли на день-4 после инфицирования посредством стандартной фазово-контрастной микроскопии. Результаты, выраженные в относительных единицах по отношению к дикому типу, представляют среднее ±SD (стандартное отклонение) от двух до четырех отдельных препаратов клона плазмиды, в зависимости от мутантов.
(B) Изучение кинетики продукции р24 антигена в клеточном супернатанте первичных CD4+ Т клеток, инфицированных диким типом (WT, ×), или мутированным по аланину 3S/gp41 NL4.3 вирусом, включая S613A (■), W614A (Δ), S615A (◇), N616A (Ο), K617A (•) и S618A (□). Данный эксперимент соответствует 2 независимым экспериментам, проведенным с отдельными препаратами клона плазмиды на очищенных клетках CD4+ Т от двух независимых здоровых доноров.
(Г) Инфицирующая способность Hela клеток Р4С5 диким типом (WT, белые столбики на диаграмме) или мутированным по аланину 3S/gp41 (черные столбики на диаграмме) NL4.3 вирусом. Клетки инфицировали в трех параллельных повторностях 4 нг/15000 клеток эквивалентного антигена р24 в течение 48 ч, а активность β-галактозидазы определяли в клеточных экстрактах. Результаты, выраженные в относительных единицах относительно дикого типа, представляют среднее ±SD от трех до четырех независимых препаратов клона плазмиды. Мутированные по аланину вирусы NL4.3 называются: S613A, W614A, S615A, N616A, K617A и S618A.
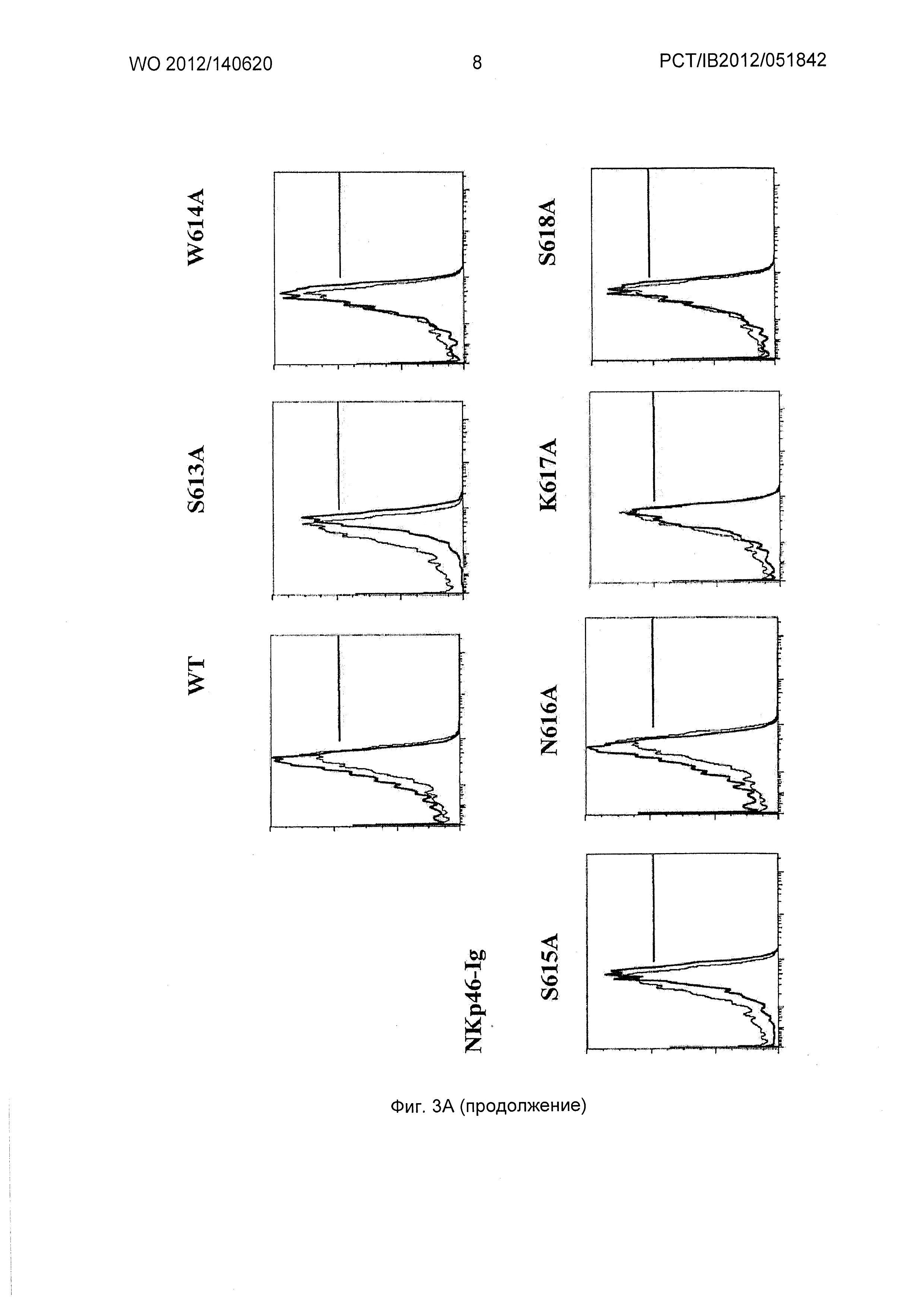
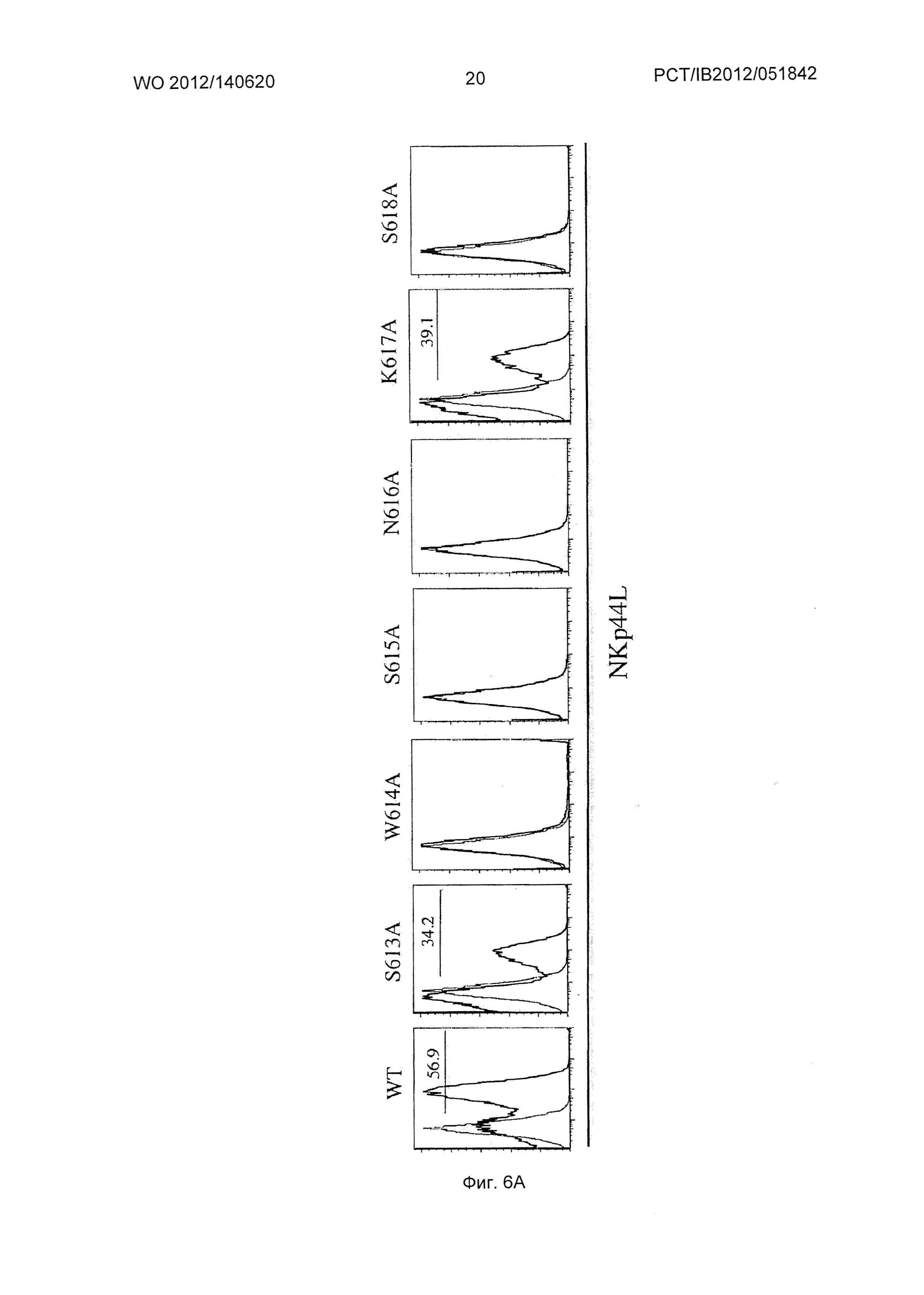
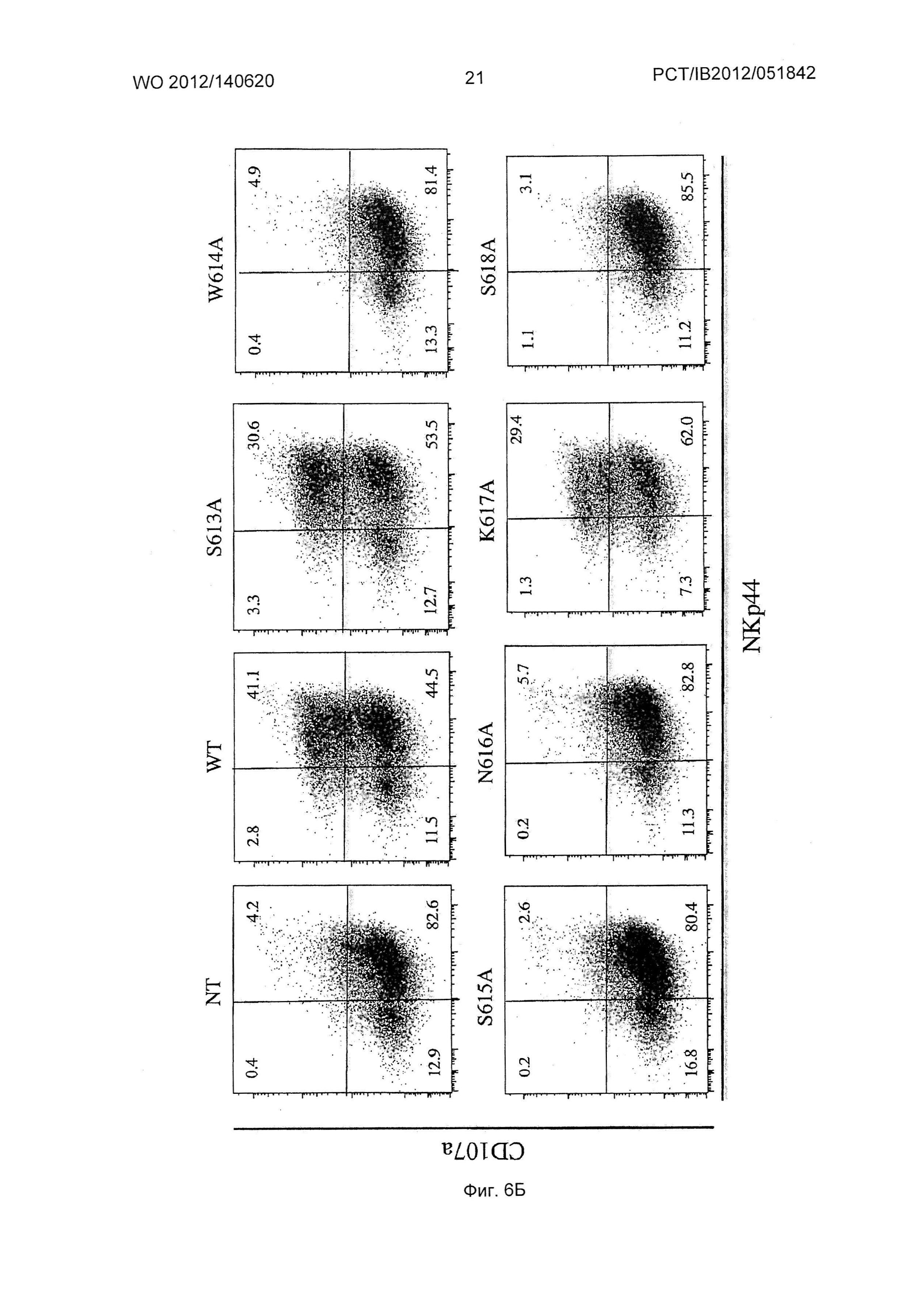
Фиг.3. Экспрессия NKp44L в CD4+ Т клетках и дегрануляция NK (естественный киллер) клеток, опосредованная 3S/gp41 мутантами по аланину.
(А) Очищенные клетки CD4+ Т не инфицировали (пунктирные линии), инфицировали на протяжении ночи диким типом (WT) (черные линии) или разным мутированным по аланину вирусом NL4.3. Клетки окрашивали лигандами для NCR (естественный рецептор цитотоксичности) (NKp30-Ig, NKp44-Ig или NKp46-Ig белки слияния). Пороговое значение на гистограммах устанавливали по CD4+ Т-клеткам. Наложение показывает экспрессию лигандов NCR на ВИЧ-инфицированных клетках по сравнению с неинфицированными клетками. Числа соответствуют доле CD4+ Т-клеток, экспрессирующих лиганды NCR.
(Б) Экспрессия NKp44L на очищенных CD4+ Т клетках, которых не обрабатывали (UT) или обрабатывали пептидами из дикого типа (WT) или с мутированными по аланину синтетическими пептидами 3S/gp41 мотива 3S/gp41. Клетки или окрашивали или mAb (моноклональное антитело) против NKp44L или изотипическим контролем IgM (иммуноглобулин) (пунктирные линии). Пороговое значение на гистограммах устанавливали по подгруппе CD4+. Наложение показывает экспрессию NKp44L по сравнению с изотипическим контролем. Числа соответствуют доле CD4+ Т-клеток, экспрессирующих NKp44L.
(В) Активность дегрануляции оценивали на активированных IL (интерлейкин 2) клетках NK (естественная клетка-киллер) против аутологических клеток CD4+ Т, при Е/Т соотношении: 1/1, в присутствии mAb против CD107a. Очищенные клетки CD4+ Т не инфицировали (NI) или инфицировали ночью диким типом (WT) или мутированными по аланину 3S/gp41 вирусами NL4.3. На точечном графике откладывали число NK клеток CD3-CD56+ в зависимости от экспрессии NKp44 и CD107a. Число на каждой панели соответствует доле позитивных NK клеток.
(Г) Эффективность дегрануляции NK клеток против аутологических очищенных CD4+ Т клеток при соотношении Е/Т: 1/1, в присутствии mAb против CD107a. CD4+ Т клетки не обрабатывали (UT) или обрабатывали пептидами от дикого типа (WT) или мутированными по аланину синтетическими пептидами мотива 3S/gp41. CD4+ Т клетки инкубировали с аутологическими NK клетками, активированными IL2. Пороговое значение на гистограммах устанавливали по клеткам NK CD3-CD56+, экспрессирующим NKp44. Наложение показывает экспрессию CD107a клетками NK, анализируемыми в присутствии аутологических клеток CD4+ Т, обработанных либо диким типом (WT), либо синтетическими пептидами 3S/gp41 с мутацией по аланину, по сравнению с необработанными клетками. Числа соответствуют доле клеток NK, экспрессирующих CD107a. Мутированные по аланину вирусы NL4.3 вирусы или пептиды 3S/gp41 называются S613A, W614A, S615A, N616A, K617A и S618A.
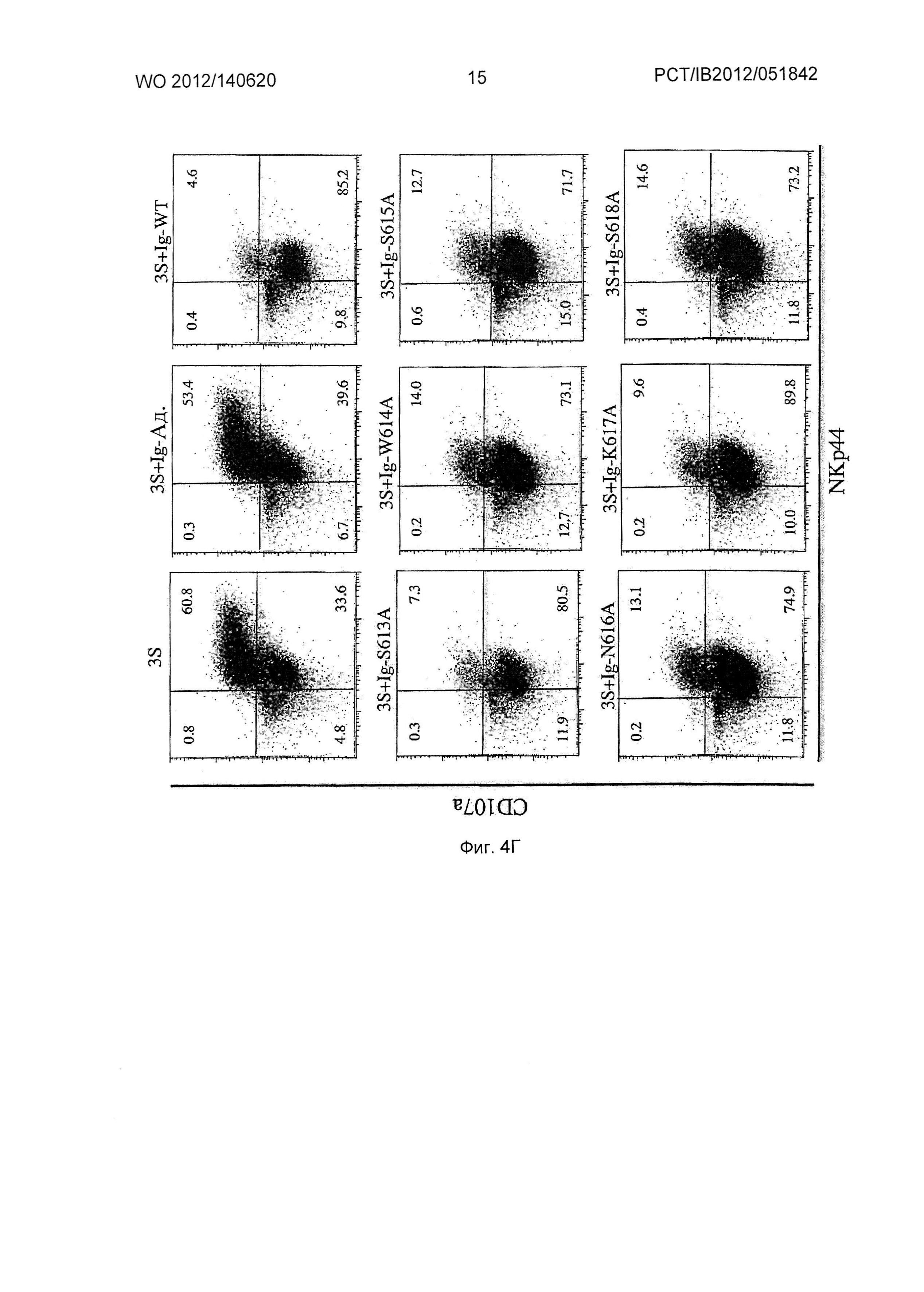
Фиг.4. Нейтрализация вирусной инфекции и ингибирование NKp44L на CD4+ Т клетках и дегрануляции клеток NK с помощью мышиных Ig, образующихся в определенных мутантах 3S/gp41 по аланину.
Очищенные клетки CD4+ Т инфицировали NL4.3 (левая панель) или NDK (правая панель) компетентными вирусами, предварительно инкубированными в течение 30 мин с очищенным Ig, полученным из мышей, иммунизированных только адъювантом (Ig-Adj,

(A) Компетентные вирусы (200TCID50) инкубировали с очищенным Ig в разной концентрации, находящейся в интервале от 0 до 20 мкг/мл, в течение 30 мин с последующим добавлением РНА (фитогемагглютинин)-активированных очищенных CD4+ Т клеток. На 6 день после инфицирования р24 антиген определяли количественно в клеточном супернатанте.
(Б) Воздействие, зависящее от времени. Компетентные вирусы (200TCID50) инкубировали с 10 мкг/мл Ig в течение 30 мин с последующим добавлением РНА-активированных очищенных CD4+ Т клеток. Уровень р24 анализировали в клеточном супернатанте каждые 2 дня в течение 10 дней после инфицирования.
(B) Экспрессию NKp44L на CD4+ Т определяли через 17 ч после инфицирования. На гистограммах откладывали подгруппу клеток CD4+. Показанная методом наложения экспрессия NKp44L по сравнению с изотипическим контролем IgM. Числа соответствуют доле позитивных клеток.
(Г) Дегрануляция аутологических NK клеток. CD4+ Т клетки инкубировали с аутологическими NK клетками при соотношении Е/T: 1/1 в присутствии mAb против CD107a. На точечном графике откладывали число клеток NK CD3-CD56+ в зависимости от экспрессии NKp44 и CD107a. Число на каждой панели соответствует доли позитивных клеток. Мутированные по аланину вирусы NL4.3 или пептиды 3S/gp41 называют S613A, W614A, S615A, N616A, K617A и S618A.
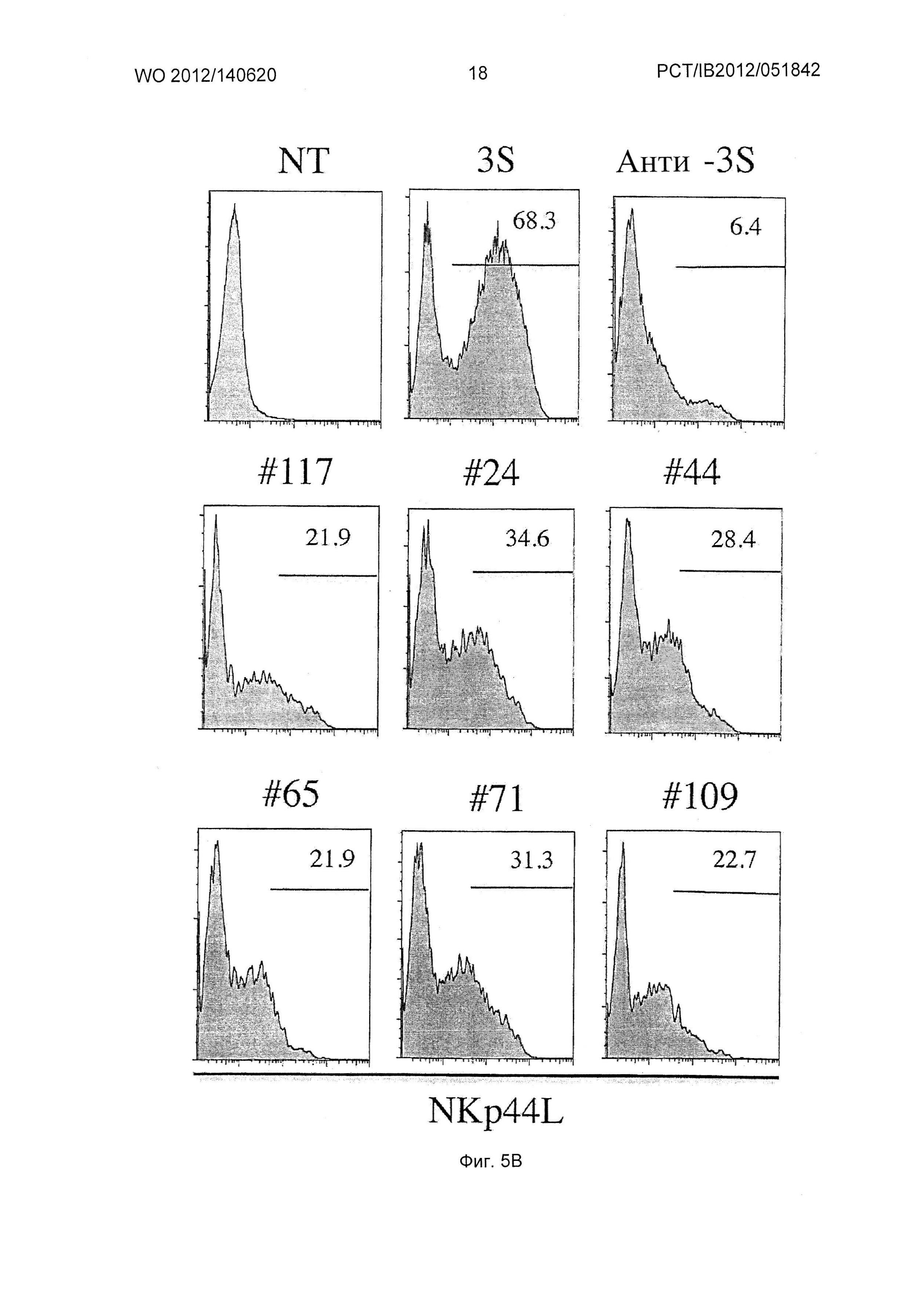
Фиг.5. Нейтрализация вирусной инфекции и ингибирование NKp44L на CD4+ клетках и дегрануляции клеток NK посредством иммунопреципитированного антитела к W614A, выделенного из ВИЧ-инфицированных пациентов.
РНА-активированные CD4+ Т клетки инфицировали NL4.3 (левая панель) или NDK (правая панель) компетентными вирусами, предварительно инкубированными в течение 30 мин с моноклональным антителом к 3-S-WT (Anti-3S, Ο), с очищенным иммуносорбционным методом антителом к 3S-WT, полученным от 1 ВИЧ-инфицированного пациента (#117, □) или с очищенным иммуносорбционным методом антителом к 3S-W614A, полученным от 5 ВИЧ-инфицированных пациентов: #24 (•), #44 (■), #65 (▲), #71 (▼) и #109 (♦).
(A) Компетентные вирусы (200TCID50) инкубировали с очищенным иммуносорбционным методом антителом в разной концентрации, находящейся в интервале от 0 до 2 мкг/мл, в течение 30 мин с последующим добавлением CD4+ Т клеток. На День 6 после инфицирования антиген р24 определяли количественно в клеточном супернатанте.
(Б) Воздействие, зависящее от времени. Компетентные вирусы (200TCID50) инкубировали с 1 мкг/мл очищенного иммуносорбционным методом Ab в течение 30 мин с последующим добавлением РНА-активированных очищенных CD4+ Т клеток. Уровень р24 анализировали в клеточном супернатанте каждые 2 дня в течение 10 дней после инфицирования.
(B) Экспрессию NKp44L на клетках CD4+ Т определяли через 17 ч после инфицирования. На гистограммах откладывали подгруппу клеток CD4+ Т. Показанная методом наложения экспрессия NKp44L по сравнению с изотипическим контролем IgM. Числа соответствуют доле позитивных клеток.
(Г) Дегрануляция аутологических NK клеток. CD4+ Т клетки инкубировали с аутологическими NK клетками при соотношении Е/Т: 1/1 в присутствии mAb против CD107a. На точечном графике отложено число клеток NK CD3-CD56+ в зависимости от экспрессии NKp44 и CD107a. Число на каждой панели соответствует доле позитивных клеток NK. Мутированные по аланину вирусы NL4.3 или пептиды 3S/gp41 называют S613A, W614A, S615A, N616A, K617A и S618A.
Фиг.6. Экспрессия NKp44L и дегрануляция аутологических клеток NK, опосредованная инактивированными нагреванием мутантами по аланину 3S/gp41 на клетках CD4+ Т.
Очищенные клетки CD4+ Т не обрабатывали или обрабатывали на протяжении ночи 100 нг р24 эквивалентного антигена на 1 мл инактивированного нагреванием вируса дикого типа (WT) NL4.3 или с разными мутантами по аланину вирусов 3S/gp41.
(А) Экспрессию NKp44L на CD4+ Т определяли через 17 ч после инфицирования. Пороговое значение на гистограммах устанавливали по подгруппе клеток CD4+ Т. Наложение показывает экспрессию NKp44L по сравнению с изотипическим контролем IgM. Числа соответствуют доле позитивных клеток.
(Б) Дегрануляция аутологических NK клеток. CD4+ Т клетки инкубировали с аутологическими NK клетками при соотношении Е/T: 1/1 в присутствии mAb против CD107a. На точечном графике отложено число клеток NK CD3-CD56+ в зависимости от экспрессии NKp44 и CD107a. Число на каждой панели соответствует доле позитивных клеток NK. Мутированные по аланину вирусы NL4.3 или пептиды 3S/gp41 называют S613A, W614A, S615A, N616A, K617A и S618A.
Подробное описание изобретения
Согласно настоящему изобретению главным образом предложены иммуногенные композиции или вакцинные композиции против ВИЧ-1, где иммуногенные композиции или композиции вакцины содержат конкретные антигенные пептиды, делающие, в частности, возможной индукцию образования нейтрализующих антител против ВИЧ-1 широкого спектра действия.
В идеальном случае эффективная ВИЧ-1 вакцина полностью блокирует инфекцию. В действительности может быть более реалистичным разработать близкую к оптимальной безопасную и эффективную вакцину, которая как значительно снижает инфицирование, так и предотвращает элиминацию CD4+ Т клеток. Главная цель данной стратегии связана со способностью генерировать образование нейтрализующих антител широкого спектра действия (bNAb), обладающих также способностью действовать на элиминацию CD4+ Т клеток, что казалось непреодолимым на предшествующем уровне техники.
Таким образом, согласно настоящему изобретению предложены новые вещества и композиции для предупреждения и/или лечения инфекции организма млекопитающего, предпочтительно человека, вызванной вирусом ВИЧ-1.
Согласно изобретению обнаружили, что семейство конкретных пептидов, которые разделяют высокую идентичность последовательности с известным gp41-производным пептидом под названием «3S», вызывают in vivo продукцию bNAb против ВИЧ-1.
В данном документе показано, что данные конкретные пептиды вызывают высокую нейтрализующую активность и нейтрализующую активность широкого спектра действия против разных клинических изолятов вируса ВИЧ-1 по сравнению с известными пептидами, происходящими от gp41 белка ВИЧ-1, включая известный пептид «3S», приведенный выше.
Очень важным является то, что согласно изобретению было также обнаружено, что данные конкретные пептиды не инициируют чувствительность CD4+ Т клеток к лизису, осуществляемому клетками NK, несмотря на то, что полная функциональность клеток NK, включая дегрануляцию, остается неизменной.
Кроме того, показали, что антитела к данным конкретным пептидам блокируют чувствительность CD4+ Т клеток к лизису, осуществляемому NK клетками, который стимулируется при развитии инфекции, вызванной вирусом ВИЧ-1.
Настоящее изобретение относится к иммуногенной композиции, содержащей антигенный пептид нижеприведенной формулы (I):

- Nt состоит из пептида, имеющего от 0 до 100 аминокислот в длину,
- Ct состоит из пептида, имеющего от 0 до 100 аминокислот в длину,
- каждый из Х1-Х4 состоит из аминокислотного остатка, где:
- (i) X1 обозначает конкретную аминокислоту W, или (ii) X1 обозначает любой аминокислотный остаток, за исключением W,
- (i) X2 обозначает конкретную аминокислоту S, или (ii) X2 обозначает любой аминокислотный остаток, за исключением S,
- (i) Х3 обозначает конкретную аминокислоту N, или (ii) X3 обозначает любой аминокислотный остаток, за исключением N,
- (i) X4 обозначает конкретную аминокислоту S, или (ii) X4 обозначает любой аминокислотный остаток, за исключением S,
при условии, что
- три из четырех аминокислотных остатков Х1, Х2, Х3 и Х4 обозначают конкретную аминокислоту, определенную в их соответствующем значении (i) выше, и
- оставшийся аминокислотный остаток среди Х1-Х4 обозначает любой аминокислотный остаток, за исключением конкретного аминокислотного остатка, определенного в своем значении (i),
при условии, что пептид формулы (I) не обозначает пептид SEQ ID №18, раскрытый в заявке РСТ, опубликованной как WO 2011/005289.
Пептид SEQ ID №18, описанный в заявке РСТ, опубликованной как WO 2011/005289, имеет следующую аминокислотную последовательность: "Ас-NHNHRIRTNPAIVK(Ac)TENSWSNKAKSICQQQ-NH2" (SEQ ID №16 настоящей заявки на патент).
Nt пептид, имеющий от 0 до 100 аминокислотных остатков в длину, охватывает пептиды, имеющие 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 и 100 аминокислотных остатков в длину.
Ct пептид, имеющий от 0 до 100 аминокислотных остатков в длину, охватывает пептиды, имеющие 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59,60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 и 100 аминокислотных остатков в длину.
Как уже упоминалось выше, пептид формулы (I) при применении в иммуногенной композиции, предпочтительно в комбинации с одним или более чем одним иммуноадъювантом, вызывает продукцию антител, которые блокируют инфицирование CD4+ Т клеток вирусами ВИЧ-1 и/или блокируют распространение вируса ВИЧ-1 на неинфицированные CD4+ Т клетки, как показано, почти необнаруживаемой продукцией р24 CD4+ Т клетками, приведенными в контакт как с вирусами ВИЧ-1, так и антителами, направленными против пептида формулы (I).
Дополнительно, в отличие от других ВИЧ-производных пептидов, которые применяли в данной области в качестве ВИЧ антигенов, включая «3S» пептид (показано на фиг.1), пептид формулы (I) не инициирует экспрессию NKp44L на поверхности CD4+ Т клеток и таким образом не инициирует разрушение CD4+ Т клеток клетками NK.
Более того, антитела, образованные у индивидуума, иммунизированного пептидом формулы (I), способны блокировать опосредованный NKp44L лизис CD4+ Т клеток, осуществляемый NK клетками, без нарушения любой другой функции NK клеток, которая включает дегрануляцию.
Таким образом, согласно настоящему изобретению предложено высокоэффективное терапевтическое средство, которое можно применять для профилактики и для лечения инфекции, вызванной вирусом ВИЧ-1.
Иммуногенная композиция, которую применяют согласно изобретению, содержит антигенный пептид формулы (I), который при введении указанной иммуногенной композиции индивидууму увеличивает продукцию антител, направленных против указанного пептида формулы (I), которые наделены нейтрализующими свойствами по отношению к множеству клинических изолятов ВИЧ-1, как показано в примерах в данном документе. Как проиллюстрировано дополнительно в настоящем описании, антигенный пептид формулы (I) может быть переведен в иммуногенное состояние посредством соединения с молекулой-носителем и/или посредством комбинации с одним или более чем одним иммунным адъювантом.
Иммуногенную композицию, содержащую полипептид формулы (I), можно применять профилактически против инфекции, вызванной вирусом ВИЧ-1, вызывая образование антител, которые сильно снижают или даже блокируют инфицирование CD4 клеток указанным вирусом ВИЧ-1.
Иммуногенную композицию, содержащую полипептид формулы (I), можно применять в целях лечения инфицированного ВИЧ-1 индивидуума, вызывая образование антител, которые сильно снижают или даже блокируют инфицирование CD4+ Т клеток вирусами ВИЧ-1, которые уже реплицировались в инфицированном индивидууме.
Как показано в примерах в данном документе, антитела против ВИЧ-1, которые получают после иммунизации млекопитающего иммуногенной композицией, содержащей антигенный пептид формулы (I), состоят из нейтрализующих антител, которые могут обладать IC50 (полумаксимальная ингибирующая концентрация) менее чем 20 мкг/мл, в анализе CD4+ Т клеток-р24.
Обычно анализ CD4+ Т клеток-р24 включает стадии:
а) получения тестируемой смеси посредством приведения компетентного по отношению к репликации вируса ВИЧ-1 в контакт с известным количеством антител, подлежащих тестированию,
б) инкубирования РНА-активированных CD4+ Т клеток с тестируемой смесью, полученной в конце стадии а), в присутствии IL-2 и
в) определения активности р24 в клеточных культурах CD4+ Т, полученных в конце стадии б), и
г) определения значения IC50 тестируемых антител посредством сравнения активности р24, определенной на стадии в), для известного количества антител, добавленных на стадии а), с активностью р24, обнаруженной в том же самом тесте, где стадию а) проводят в отсутствие антител против ВИЧ.
Как правило, для выполнения анализа нейтрализации, описанного выше, проводят серию испытаний, когда на стадии а) применяют возрастающее известное количество тестируемых антител. Полностью подробное описание анализа нейтрализации дано в примерах в данном документе.
Полученные авторами изобретения результаты показывают, что иммуногенную композицию, содержащую антигенный пептид формулы (I), можно применять с высокой степенью безопасности для индивидуума, нуждающегося в ней, так как указанная иммуногенная композиция не вызывает нежелательных побочных эффектов, а именно не влияет на функциональность клеток CD4+ Т, по сравнению с известными антигенными пептидами против ВИЧ (например, «3S» пептид, показанный на фиг.1).
Дополнительно, иммуногенная композиция, содержащая антигенный пептид формулы (I), является очень мощным терапевтическим средством против ВИЧ благодаря своему плейотропному действию против ВИЧ-1 инфекции, включая (i) образование антител, наделенных нейтрализующей активностью широкого спектра действия против целого ряда клинических изолятов ВИЧ-1, и (ii) блокирование лизиса CD4+ Т клеток, осуществляемого клетками NK.
Более того, иммуногенная композиция, содержащая антигенный пептид формулы (I), наделена высокой селективностью действия, так как для иллюстрации она нарушает исключительно активность NK клеток, направленную против CD4, в то же самое время не оказывая воздействия на важную функцию антимикробного иммунитета клеток NK, подобно дегрануляции.
Таким образом, иммуногенная композиция, содержащая антигенный пептид формулы (I), (i) имеет активность, направленную против ВИЧ-1, посредством индукции образования нейтрализующих антител против ВИЧ-1 широкого спектра действия, и (ii) защищает функциональность иммунной системы ВИЧ-1-инфицированного индивидуума, (а) защищая CD4+ Т клетки от разрушения и (б) следя за тем, чтобы неспецифичные антимикробные функции иммунной системы оставались полностью функциональными.
Иллюстративные воплощения пептидов формулы (I) раскрыты на фиг.1, которые включают "W614A" или "М2" (SEQ ID №12 в данном документе), (ii) "S615A" или "М3" (SEQ ID №13 в данном документе), (iii) "N616A" или "М4" (SEQ ID №14 в данном документе) и (iv) "S618A" или "М6" (SEQ ID №15 в данном документе).
Важным является то, что, как показано в примерах данного документа, другие конкретные пептиды, имеющие высокую уровень аминокислотной идентичности с пептидами формулы (I), подобно конкретным пептидам, названным S613A (или "М1") и K617A (или "М5"), представленным на фиг.1, не наделены каким-либо свойством против ВИЧ пептидов формулы (I). Для иллюстрации пептиды S613A и K617A (i) не вызывают образования нейтрализующих антител против ВИЧ, (ii) инициируют экспрессию NKp44L клетками CD4 и таким образом также чувствительность CD4+ Т клеток к лизису, осуществляемому NK клетками, и (iii) не вызывают продукции антител, способных снижать или блокировать чувствительность CD4+ Т клеток к лизису, осуществляемому NK клетками.
Очень неожиданно, как показали авторы изобретения, что пептиды S613A и K617A, обсуждаемые выше, вызывают образование антител, которые хорошо распознают последовательности дикого типа, экспрессируемые вирусами ВИЧ-1, несмотря на то, что данные пептиды не способны вызывать образование нейтрализующих антител против ВИЧ-1 вирусов.
Также очень неожиданно, как показано в примерах данного документа, что пептиды формулы (I) вызывают образование антител, которые не взаимодействуют с последовательностями дикого типа, экспрессируемыми ВИЧ-1 вирусами, как показано в Таблице 4. Эти неожиданные результаты говорят о том, что пептиды формулы (I) структурно отличаются от соответствующих последовательностей ВИЧ-1 дикого типа, хотя они вызывают образование нейтрализующих антител против ВИЧ-1 широкого спектра действия. Данные результаты явно противоречат тому, что ожидал бы специалист в данной области при поиске антигенных соединений для индукции эффективного иммунного ответа на инфекцию, вызванную вирусами ВИЧ-1.
С другой стороны, пептиды, имеющие последовательности, близкие к пептиду формулы (I), подобно приведенным выше S613A и K617A пептидам, по-видимому, структурно тесно связаны с последовательностями ВИЧ-1 дикого типа и способны вызывать образование антител, распознающих данные последовательности дикого типа, хотя данные антитела не обладают каким-либо свойством антител против ВИЧ-1.
Результаты, изложенные в данном документе, показывают, что специалист в данной области не мог ожидать (i) ни безопасности пептида формулы (I), ни (ii) разных, направленных против ВИЧ свойств антител к пептиду формулы (I).
Дополнительно ожидают, что пептид формулы (I) обладает линейной пространственной структурой.
Авторы изобретения также показали, что антитела, направленные против пептида формулы (I), могут быть обнаружены у небольшого числа индивидуумов, инфицированных ВИЧ-1 вирусом. Обнаружили сильную корреляцию между (i) наличием антител, направленных против пептида формулы (I) у данных ВИЧ-1-инфицированных индивидуумов, и (ii) низкой ВИЧ-1 вирусной нагрузкой, а также большим количеством CD4+ Т клеток. Данные результаты явно показывают высокую эффективность in vivo антител, направленных против пептида формулы (I), для предупреждения и/или лечения инфекции индивидуума, вызванной вирусом ВИЧ-1.
Примеры данного документа также иллюстрируют, что мутировавшие вирусы ВИЧ-1, кодирующие мутантный белок gp41, несущий одну из мутаций W614A и S618A, которые представлены в воплощениях пептидов формулы (I), имеют сильно сниженную способность инфицировать человеческую лимфобластную клеточную линию и не инициируют экспрессию NKp44L CD4+ Т клетками. Данные результаты говорят о том, что неспособность пептида формулы (I) инициировать экспрессию NKp44L CD4+ Т клетками также обнаруживают в цельных вирусах, экспрессирующих конкретные варианты gp41 белков.
В данном контексте предупреждение или лечение инфекции индивидуума, вызванной ВИЧ-1 вирусом, охватывает (I) предупреждение или лечение заболевания, связанного с инфекцией указанного индивидуума, вызванной вирусом ВИЧ-1, включая СПИД, и (ii) предупреждение развития ВИЧ-1 заболевания.
В данном контексте термин «ВИЧ инфекция» главным образом охватывает инфицирование животного-хозяина, в частности человека, вирусом иммунодефицита человека (ВИЧ-1) типа 1. «ВИЧ-1» можно использовать в данном документе для того, чтобы ссылаться на любые штаммы, формы, подтипы, клады и разновидности в семействе ВИЧ-1. Таким образом, лечение ВИЧ-1 инфекции будет охватывать лечение субъекта, который является носителем любого из семейства ВИЧ-1 ретровирусов, или субъекта, у которого диагностирован активный СПИД, а также лечение или профилактику состояний, связанных со СПИДом, у таких субъектов. Носителя ВИЧ-1 можно идентифицировать любыми способами, известными из уровня техники. Например, субъект может быть идентифицирован в качестве носителя ВИЧ-1 на основе того, что субъект является позитивным относительно антител против ВИЧ-1 или ВИЧ-1-позитивным, или имеет симптомы СПИДа. То есть под «лечением ВИЧ-1 инфекции» следует понимать лечение пациента, который находится на любой одной из нескольких стадий развития инфекции ВИЧ-1, которые, например, включают синдром острой первичной инфекции (который может быть бессимптомным или связан с гриппоподобным заболеванием с лихорадками, плохим самочувствием, диареей и неврологической симптоматикой, такой как головная боль), бессимптомную инфекцию (которая представляет собой длительный латентный период с постепенным снижением числа циркулирующих в крови CD4+ Т клеток) и СПИД (который характеризуется более серьезными заболеваниями, определяющими СПИД, и/или снижением числа циркулирующих в крови CD4 клеток ниже уровня, который совместим с эффективной иммунной функцией). Дополнительно, «лечение или предупреждение ВИЧ-1 инфекции» будет также охватывать лечение пациента с подозрением на инфекцию, вызванную ВИЧ-1, после воздействия на подозреваемого ВИЧ-1, вследствие, например, контакта с зараженной ВИЧ-1 кровью, переливания крови, замены жидкостей организма, «небезопасного» секса с инфицированным субъектом, случайного укола иглой, нанесения татуировки или иглоукалывания зараженными инструментами, или передачи вируса от матери к ребенку в течение беременности, родов или вскоре после этого.
Термин «лечение ВИЧ-1 инфекции» также следует понимать в контексте антиретровирусной терапии, являются ли пациенты полностью восприимчивыми или частично восприимчивыми к такой терапии с точки зрения вирусной загрузки и/или числа CD4+ Т клеток.
Термин «предупреждение ВИЧ-1 инфекции» может охватывать лечение субъекта, который не инфицирован ВИЧ-1, но, как полагают, подвергается риску инфицирования ВИЧ-1, рано или поздно.
Под термином «лечение СПИДа» подразумевается лечение пациента, у которого проявляются более серьезные заболевания, определяющие СПИД, и/или снижение числа циркулирующих в крови клеток CD4+ Т ниже уровня, который совместим с эффективной иммунной функцией. Термин «лечение СПИДа» также охватывает лечение связанных со СПИДом состояний, под которыми подразумеваются расстройства и заболевания, свойственные или связанные со СПИДом или ВИЧ-1 инфекцией, такие как СПИД-ассоциированный комплекс (ARC), прогрессирующая генерализованная лимфаденопатия (PGL), заболевания, позитивные по отношению к антителам против ВИЧ, и ВИЧ-позитивные заболевания, неврологические заболевания, связанные со СПИДом, (такие как деменция или тропический парапарез), саркома Калоши, тромбоцитопения пурпурная и связанные оппортунистические инфекции, такие как интерстициальная плазмоклеточная пневмония, микробактериальный туберкулез, кандидоз пищевода, токсоплазмоз мозга, CMV (цитомегаловирусный) ретинит, энцефалопатия, связанная с БИЧ, синдром истощения при ВИЧ-1-инфекции и т.д.
Таким образом, под термином «предупреждение СПИДа» в данном контексте подразумевается предупреждение у пациента, у которого есть ВИЧ-1 инфекция, или пациента с подозрением на ВИЧ-1 инфекцию, или пациента, который подвергается риску инфицирования ВИЧ-1, развития СПИДа (который характеризуется более серьезными заболеваниями, определяющими СПИД, и/или снижением числа циркулирующих в крови CD4+ Т клеток ниже уровня, который совместим с эффективной иммунной функцией) и/или заболеваний, связанных со СПИДом.
Таким образом, под термином «предупреждение развития ВИЧ-1» в данном контексте подразумевается предупреждение у пациента, у которого есть ВИЧ-1 инфекция, снижения его числа CD4+ Т клеток и/или предупреждение увеличения вирусной нагрузки, двух главных маркеров, связанных с осложнением заболевания и увеличением тяжести заболевания.
В данном контексте аминокислотные остатки охватывают аланин (также называемый "А" или "Ala"), аргинин (также называемый ("R" или "Arg"), аспарагин (также называемый "N" или "Asn"), аспарагиновая кислота (также называемая "D" или "Asp"), цистеин (также называемый "С" или "Cys"), глутамин (также называемый "Q" или Gln"), глутаминовая кислота (также называемая ("Е" или "Glu), глицин (также называемый "G" или "Gly"), гистидин (также называемый "Н" или "His"), изолейцин (также называемый "I" или "Ile"), лейцин (также называемый "L" или "Leu"), лизин (также называемый "K" или "Lys"), метионин (также называемый "М" или "Met"), фенилаланин (также называемый "F" или "Phe"), пролин (также называемый "Р" или "Pro"), серин (также называемый "S" или "Ser"), треонин (также называемый "Т" или "Thr"), триптофан (также называемый "W" или "Trp"), тирозин (также называемый "Y" или "Tyr") и валин (также называемый "V" или "Val").
Все аминокислоты в пептидах по изобретению могут находиться как в D-, так и L-форме, хотя в природе встречаемость L-формы предпочтительна.
Таким образом, в пептиде вышеприведенной формулы (I), когда аминокислотный остаток Х1 обозначает (ii) любой аминокислотный остаток, за исключением W, тогда аминокислотный остаток Х1 может обозначать любой из аминокислотных остатков А, R, N, D, С, Q, Е, G, Н, I, L, K, М, F, Р, Т, S, Y или V. Такое же объяснение применяют для обозначений любого из Х1, Х2, Х3 и Х4 аминокислотных остатков антигенного пептида формулы (I).
Не желая быть связанными какой-либо определенной теорией, авторы изобретения полагают, что пептид формулы (I) является пространственно линейным, будучи суспендированным в физиологически совместимом солевом растворе (например, 0,15 М раствор NaCl).
Таким образом, в некоторых воплощениях пептида формулы (I) значение (ii) каждого из аминокислотных остатков Х1, Х2, Х3 и Х4 включает в себя аминокислотный остаток, который не генерирует изменение пространственной конформации, по сравнению с аминокислотным остатком обозначения (i) X1, Х2, Х3 и Х4 соответственно.
В некоторых воплощениях пептида формулы (I) значение (ii) каждого из аминокислотных остатков Х1, Х2, Х3 и Х4 включает в себя незаряженный аминокислотный остаток небольшого размера.
В некоторых воплощениях пептида формулы (I) значение (ii) каждого из аминокислотных остатков Х1, Х2, Х3 и Х4 выбрано из группы, состоящей из аланина (Ala или А), цистеина (Cys или С), глицина (Gly или G) и валина (Val или V).
В некоторых воплощениях пептида формулы (I) значение (ii) каждого из аминокислотных остатков Х1, Х2, Х3 и Х4 выбрано из группы, состоящей из аланина (Ala или А), цистеина (Cys или С), глицина (Gly или G), валина (Val или V) и пролина (Pro или Р).
В некоторых предпочтительных воплощениях пептида формулы (I) значение (ii) каждого из аминокислотных остатков Х1, Х2, Х3 и Х4 включает незаряженный аминокислотный остаток небольшого размера, имеющий неполярную боковую цепь. Некоторые предпочтительные незаряженные аминокислотные остатки небольшого размера выбраны из группы, состоящей из глицина (Gly или G), аланина (Ala или А), валина (Val или V), лейцина (Leu или L), изолейцина (Ile или I), метионина (Met или М), фенилаланина (Phe или F), пролина (Pro или Р) и триптофана (Trp или W). Более предпочтительно незаряженные аминокислотные остатки небольшого размера, имеющие неполярную боковую цепь, выбраны из группы, состоящей из глицина (Gly или G), аланина (Ala или А), валина (Val или V), лейцина (Leu или L), изолейцина (Ile или I), пролина (Pro или Р) и метионина (Met или М). В других предпочтительных воплощениях незаряженные аминокислотные остатки небольшого размера, имеющие неполярную боковую цепь, выбраны из группы, состоящей из глицина (Gly или G), аланина (Ala или А), валина (Val или V), лейцина (Leu или L), изолейцина (Ile или I) и метионина (Met или М).
В некоторых данных предпочтительных воплощениях значение (ii) каждого из аминокислотных остатков Х1, Х2, Х3 и Х4 выбрано из группы, состоящей из аланина (Ala или А), глицина (Gly или G) и валина (Val или V).
В некоторых предпочтительных воплощениях пептида формулы (I) значение (ii) каждого из аминокислотных остатков Х1, Х2, Х3 и Х4 включает остаток аланина (Ala или А).
В некоторых воплощениях пептида формулы (I) каждый из четырех аминокислотных остатков Х1, Х2, X3 и Х4 обозначает свое значение (ii).
В некоторых воплощениях пептида формулы (I) три аминокислотных остатка среди Х1, Х2, X3 и Х4 обозначают, один независимо от двух других, свое значение (ii), а четвертый аминокислотный остаток среди Х1, Х2, X3 и Х4 обозначает свое значение (i).
В некоторых воплощениях пептида формулы (I) два аминокислотных остатка среди Х1, Х2, X3 и Х4 обозначают, один независимо от другого, свое значение (ii), а два других аминокислотных остатка среди Х1, Х2, X3 и Х4 обозначают, один независимо от другого, свое значение (i).
В некоторых предпочтительных воплощениях пептида формулы (I) только один аминокислотный остаток среди Х1, Х2, X3 и Х4 обозначает значение (ii), a каждый из других аминокислотных остатков среди Х1, Х2, X3 и Х4 обозначает свое значение (i).
Таким образом, в некоторых предпочтительных воплощениях пептида вышеприведенной формулы (I):
- Х1 обозначает вышеприведенное значение (ii), а каждый из Х2, X3 и Х4 обозначает свое соответствующее вышеприведенное значение (i), или
- Х2 обозначает вышеприведенное значение (ii), а каждый из Х1, X3 и Х4 обозначает свое соответствующее вышеприведенное значение (i), или
- X3 обозначает вышеприведенное значение (ii), а каждый из Х1, Х2 и Х4 обозначает свое соответствующее вышеприведенное значение (i), или
- Х4 обозначает вышеприведенное значение (ii), а каждый из Х1, Х2 и X3 обозначает свое соответствующее вышеприведенное значение (i).
Вышеприведенные воплощения являются наиболее предпочтительными, так как полагают, что одна замена аминокислоты (т.е. один аминокислотный остаток, обозначающий значение (ii)) среди Х1, Х2, X3 и Х4 минимизирует риск изменения пространственной конформации по сравнению с пептидом, где все из Х1, Х2, X3 и Х4 остатков обозначают свое соответствующее значение (I), и таким образом, увеличит шансы того, чтобы обуславливать хорошие свойства, направленные против ВИЧ, т.е. вызвать образование нейтрализующих антител против ВИЧ.
В еще одних воплощениях антигенного пептида формулы (I) указанный антигенный пептид имеет аминокислотную длину, составляющую не более чем 200 аминокислотных остатков. Данные воплощения охватывают пептиды формулы (I), имеющие 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108,109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199 и 200 аминокислотных остатков в длину. В некоторых из данных предпочтительных воплощений пептид формулы (I) имеет от 10 до 26 аминокислотных остатков в длину, который включает от 15 до 20 аминокислотных остатков в длину.
Пептид формулы (I) в данном контексте можно получать известным методом клонирования или путем химического синтеза.
Например, ДНК, кодирующую пептид формулы (I), получают путем применения метода клонирования и вставляют в автономно реплицирующийся вектор с получением рекомбинантной ДНК. Рекомбинантную ДНК вводят в соответствующего хозяина, такого как Escherichia coli, Bacillus subtilis, Actinomyces, дрожжи, нитчатый гриб, растительная клетка, клетка насекомого и животная клетка, с получением трансформанта. Из культивируемого продукта трансформанта можно получать пептид, содержащий пептид формулы (I). В качестве альтернативы получают ДНК, кодирующую пептид формулы (I), и помещают ее в бесклеточную белоксинтезирующую систему с использованием зародышей пшеницы и клеточного экстракта из Escherichia coli для синтеза пептида по изобретению. В некоторых воплощениях, когда пептид формулы (I) связан с белком-носителем, тогда иммуногенный продукт, состоящий из белка слияния, содержащего как пептид формулы (I), так и необходимый белок-носитель, может быть синтезирован с помощью технологии рекомбинантных ДНК.
Более того, применяя общепринятый способ химического синтеза для пептида формулы (I), такой как «твердофазный метод» или «жидкофазный метод», аминокислоты удачно связывают и удлиняют посредством дегидратации/конденсации.
Кроме того, когда пептид формулы (I) связан с необходимым пептидом или полипептидом, например белковой молекулой-переносчиком, можно синтезировать иммуногенный продукт, содержащий антигенный пептид формулы (I).
Пептид формулы (I) охватывает следующие антигенные пептиды:
- 
- 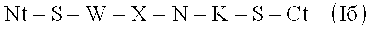
- 
- 
- Nt и Ct имеют одно и то же значение, как для пептида формулы (I), определенного выше, и
- Х представляет собой любой аминокислотный остаток, за исключением: W для (Iа), S для (Iб), N для (Iв) и S для (Iг).
В конкретных воплощениях пептида формулы (I) указанный «любой аминокислотный остаток» представляет собой остаток аланина (также называемый «А»). В данных воплощениях аминокислотный остаток «X» каждого из пептидов формул (Iа)-(Iг) означает «А».
В предпочтительных воплощениях пептид формулы (I) выбран из группы, состоящей из:
- Nt-SASNKS-Ct (Nt-SEQ ID №6-Ct),
- Nt-SWANKS-Ct (Nt-SEQ ID №7-Ct),
- Nt-SWSAKS-Ct (Nt-SEQ ID №8-Ct), и
- Nt-SWSNKA-Ct (Nt-SEQ ID №9-Ct).
В конкретных воплощениях антигенного пептида формулы (I) Nt (для «N-концевой области») состоит из пептида, имеющего от 1 до 10 аминокислотных остатков в длину, который включает от 1 до 5 аминокислотных остатков в длину. Таким образом, согласно данным воплощениям Nt представляет собой пептид, имеющий 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных остатков в длину. В некоторых воплощениях Nt имеет 5 или 6 аминокислотных остатков в длину.
В конкретных воплощениях пептида формулы (I) Nt содержит или в качестве альтернативы состоит из аминокислотной последовательности NH2-PWNA-COOH [SEQ ID №10].
В конкретных воплощениях антигенного пептида формулы (I) Ct (для «C-концевой» области) состоит из пептида, имеющего от 1 до 10 аминокислотных остатков в длину, который включает от 1 до 5 аминокислотных остатков в длину. Таким образом, согласно данным воплощениям Ct представляет собой пептид, имеющий 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных остатков в длину. В некоторых воплощениях Ct имеет 5 или 6 аминокислотных остатков в длину.
В конкретных воплощениях пептида формулы (I) Ct содержит или в качестве альтернативы состоит из аминокислотной последовательности NH2-LDDIW-COOH [SEQ ID №11].
Каждый из Nt и Ct пептидов непосредственно связан ковалентной связью с соответствующим концом пептида S-X1-X2-X3-K-X4, предпочтительно ковалентной пептидной связью.
В иммуногенной композиции согласно изобретению один из Nt или Ct пептидов или оба из них могут содержать или состоять из полимера одной аминокислоты в качестве мономера. Для иллюстрации указанный аминокислотный полимер может состоять из полимера полиаланина, полиглутамина или полилизина.
С- и/или N-концевая области пептида формулы (I) могли бы отличаться от естественных последовательностей, точно описанных в данном документе, вследствие модификации концевой NH2-группы и/или СООН-группы, и/или модификации NH2-группы и/или СООН-группы боковой цепи аминокислотного остатка, содержащегося в ней. Эти группы могут, например, быть ацилированы, ацетилированы, амидированы или модифицированы для обеспечения сайта связывания для молекулы носителя.
В конкретных воплощениях антигенный пептид выбран из группы, состоящей из:
- PWNASASNKSLDDIW (SEQ ID №12),
- PWNASWANKSLDDIW (SEQ ID №13),
- PWNASWSAKSLDDIW (SEQ ID №14), и
- PWNASWSNKALDDIW (SEQ ID №15).
В конкретных воплощениях иммуногенной композиции согласно изобретению антигенный пептид формулы (I) ковалентно связан с молекулой-носителем.
Типы молекул-носителей, применяемые для образования иммуногенного продукта, содержащего полипептид формулы (I), связанный с молекулой-носителем, хорошо известны специалисту в данной области. Функция молекулы-носителя заключается в том, чтобы обеспечить помощь цитокину (или помощь Т-клетке) для того, чтобы усилить иммунный ответ, направленный против ВИЧ-1.
Молекула-носитель, с которой возможно связан пептид, может быть выбрана из широкого разнообразия известных носителей. Примеры молекул-носителей в целях вакцины охватывают белки, такие как человеческий или бычий сывороточный альбумин, и гемоцианин моллюска Megathura crenulata (KLH) и жирные кислоты. Другие воплощения молекул-носителей, с которыми антигенный пептид формулы (I) может быть ковалентно связан, включают бактериальные токсины или анатоксины, такие как дифтерийные, холерные, E.coli термолабильные и столбнячные анатоксины, наружный белок мембран N.meninigitidis (европейская патентная заявка № ЕР 0372501), синтетические пептиды (европейская патентная заявка № ЕР 0378881 и № ЕР 0427347), белки теплового шока (заявка РСТ № WO 93/17712), белки Pertussis (заявка РСТ № WO 98/58668), белок D из Н. influenzae (РСТ заявка № WO 00/56360) и токсин А или В из С. difficile (Международная патентная заявка WO 00/61761).
Любая подходящая реакция конъюгации может быть использована с любым подходящим линкером, при необходимости. Примеры в данном документе иллюстрируют воплощения иммуногенной композиции, где пептиды формулы (I) ковалентно связаны с молекулой-носителем KLH.
Настоящее изобретение также относится к антигенному пептиду формулы (I), как описано в данном документе, возможно ковалентно связанному с молекулой-носителем, для применения в качестве лекарственного средства, в том числе для применения в качестве иммуногенного активного ингредиента лекарственного средства.
Данное изобретение также относится к антигенному пептиду формулы (I), как описано в данном документе, возможно связанному с молекулой-носителем, для применения в способе предупреждения и/или лечения инфекции индивидуума, вызванной вирусом ВИЧ-1.
Настоящее изобретение также относится к применению антигенного полипептида формулы (I), возможно ковалентно связанному с молекулой-носителем, для изготовления лекарственного средства для предупреждения и/или лечения ВИЧ-1-инфицированного индивидуума, т.е. для предупреждения и/или лечения инфекции индивидуума, вызванной вирусом ВИЧ-1.
Настоящее изобретение также относится к способу предупреждения и/или лечения индивидуума, инфицированного вирусом ВИЧ-1, т.е. предупреждения и/или лечения инфекции индивидуума, вызванной вирусом ВИЧ-1, включающему стадию введения указанному индивидууму иммуногенной композиции, содержащей антигенный пептид формулы (I), предпочтительно связанный с молекулой-носителем.
В конкретных воплощениях иммуногенная композиция, применяемая согласно изобретению, содержит антигенный пептид формулы (I) в количестве от 10 нг до 1 мг пептида формулы (I), которое адаптировано для введения индивидууму, нуждающемуся в этом, для профилактической или терапевтической цели.
Количество антигенного пептида формулы (I), составляющее от 10 нг до 10 мг, охватывает количество пептида формулы (I), составляющее примерно 20 нг, 30 нг, 40 нг, 50 нг, 60 нг, 70 нг, 80 нг, 90 нг, 100 нг, 150 нг, 200 нг, 250 нг, 300 нг, 350 нг, 400 нг, 450 нг, 500 нг, 550 нг, 600 нг, 700 нг, 800 нг, 900 нг, 1 мкг, 2 мкг, 3 мкг, 4 мкг, 5 мкг, 6 мкг, 7 мкг, 8 мкг, 9 мкг, 10 мкг, 20 мкг, 30 мкг, 40 мкг, 50 мкг, 60 мкг, 70 мкг, 80 мкг, 90 мкг, 100 мкг, 110 мкг, 120 мкг, 130 мкг, 140 мкг, 150 мкг, 160 мкг, 170 мкг, 180 мкг, 190 мкг, 200 мкг, 250 мкг, 300 мкг, 350 мкг, 400 мкг, 450 мкг, 500 мкг, 550 мкг, 600 мкг, 650 мкг, 700 мкг, 750 мкг, 800 мкг, 850 мкг, 900 мкг, 950 мкг и 1 мг.
Количество пептида формулы (I), выбранного из группы пептидов SEQ ID №12, 13, 14 или 15, может составлять, в частности, примерно 200 мкг, 500 мкг или 1 мг.
Специалист в данной области может легко адаптировать количество пептида формулы (I) посредством проведения рутинных анализов и определения диапазона количества пептида, который при введении in vivo вызывает антительный ответ, что блокирует инфицирование CD4+ Т клеток вирусом ВИЧ-1 и/или блокирует распространение вируса ВИЧ-1 на неинфицированные CD4+ Т клетки, используя известные анализы, включая один или более чем один анализ, описанный в примерах данного документа.
Причем количество пептида формулы (I) можно варьировать в зависимости от его аминокислотной длины и, таким образом, в зависимости от его молекулярной массы, при этом принимается во внимание, что отношение числа последовательностей "S-X1-X2-X3-K-X4" к массе пептида формулы (I) варьируется с длиной Ct и Nt пептидов, содержащихся в указанном пептиде формулы (I), и таким образом, варьируется с молекулярной массой указанного пептида.
Также в предпочтительных воплощениях, где антигенный пептид формулы (I) связан с молекулой-носителем и где пациенту вводят иммуногенную композицию, содержащую или состоящую из указанного пептида формулы (I), связанного с указанной молекулой-носителем, количество иммуногенного пептида, подлежащее введению, может варьироваться как в зависимости от (i) молекулярной массы пептида формулы (I), так и (ii) молекулярной массы молекулы-носителя, которую применяют.
Количество иммуногенного соединения, подлежащее введению индивидууму, легко определяется или адаптируется специалистом в данной области, который в первую очередь руководствуется диапазоном эффективного количества пептида формулы (I), который включает диапазон эффективного количества пептида формулы (I), выбранного из группы, состоящей из SEQ ID №12-15, и затем молекулярной массой иммуногенного соединения, которое он собирается вводить.
В некоторых воплощениях количество иммуногенного пептида, подлежащее введению, может составлять примерно 0,1 мкг, 0,5 мкг, 1 мкг, 5 мкг, 10 мкг или 20 мкг указанного иммуногенного соединения.
Количество пептида формулы (I) может составлять не больше 10000 мг пептида формулы (I).
Количество пептида формулы (I), описанное выше, также применяется, когда указанный пептид формулы (I) конъюгирован с молекулой-носителем, в иммуногенной композиции согласно изобретению.
Для иллюстрации, при применении для людей иммуногенная композиция, содержащая пептид формулы (I), конъюгированный с молекулой-носителем KLH, может содержать от 0,1 мкг до 50 мкг конъюгата - иммуногенного продукта KLH-пептид формулы (I).
В конкретных воплощениях иммуногенную композицию вводят по меньшей мере дважды индивидууму, нуждающемуся в этом. В данных воплощениях вторую стадию введения иммуногенной композиции согласно изобретению проводят в период времени, составляющий от 2 недель до 6 месяцев после стадии первого введения.
В конкретных воплощениях иммуногенную композицию вводят по меньшей мере три раза индивидууму, нуждающемуся в этом. В данных воплощениях вторую стадию введения указанной иммуногенной композиции согласно изобретению проводят в период времени, составляющий от 2 недель до 6 месяцев после первой стадии введения. В данных воплощениях третью стадию введения указанной иммуногенной композиции проводят в период времени, составляющий от более 6 месяцев до примерно одного года после первой стадии введения.
В некоторых воплощениях указанную иммуногенную композицию затем опять вводят иммунизированному индивидууму, например, в период времени каждые 5 лет или в период времени каждые 10 лет.
Настоящее изобретение также относится к иммуногенным композициям, содержащим антигенный полипептид формулы (I), как описано в данном документе.
В конкретных воплощениях антигенный пептид формулы (I) ковалентно связан с молекулой-носителем.
В конкретных воплощениях иммуногенная композиция согласно изобретению дополнительно содержит один или более чем один иммуноадъювант.
Иммуногенную композицию, как определено в данном документе, которая содержит иммуногенный продукт, содержащий пептид формулы (I), предпочтительно иммуногенный продукт, состоящий из конъюгата, образованного между указанным пептидом формулы (I) и молекулой-носителем, и которая дополнительно содержит одно или более чем одно соединение иммуноадъюванта, в настоящем описании можно также назвать «вакцинной композицией».
В некоторых воплощениях не существует конкретного отличия, которое можно было бы сделать между иммуногенной композицией согласно изобретению и вакцинной композицией согласно изобретению, помимо терминов, используемых для определения таких композиций.
Точнее, иммуногенная композиция нацелена на образование антител, направленных против пептида формулы (I), когда ее вводят млекопитающему организму, например мыши, кролику, овце, лошади или козе, в ситуациях, когда не предполагают, что образующиеся антитела оказывают предупредительное или терапевтическое действие в иммунизированном млекопитающем организме. Иммуногенные композиции согласно изобретению можно использовать для получения антител, направленных против пептида формулы (I), для дополнительного нетерапевтического применения данных антител, например, в качестве реагента для обнаружения вируса ВИЧ-1 или реагента для обнаружения ВИЧ-производного пептида.
С другой стороны, вакцинная композиция согласно изобретению нацелена на образование антител, направленных против пептида формулы (I) в организме млекопитающего, которому вводят указанную вакцинную композицию, в ситуациях, когда не предполагают, что образующиеся антитела оказывают предупредительное или терапевтическое действие в иммунизированном организме млекопитающего.
Иммуноадъюванты охватывают, но не ограничиваются Stimulon™, QS-21 (Aquila Biopharmaceuticals, Inc., Framingham, Mass.); MPL™ (3-O-деацилированный монофосфориллипид A; Corixa, Hamilton, Mont.), 529 (соединение аминоалкилглюкозаминфосфат, Corixa, Hamilton, Mont), IL-12 (Genetics Institute, Cambridge, Mass.); GM-CSF (Immunex Corp., Seattle, Wash.); N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP); N-ацетил-нормурамил-L-аланил-D-изоглутамин (CGP 11637, называется nor-MDP); N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси-этиламин) (CGP 19835A, называется МТР-РЕ); и холерный токсин. Другие иммуноадъюванты или соединения, которые можно применять, охватывают нетоксичные производные холерного токсина, включая его субъединицу А и/или конъюгаты, или генетически сконструированные слияния полипептида N. Meningitides с холерным токсином или его субъединицей В («СТВ»), термоинактивированный агрегат холерного энтеротоксина, полисахариды грибов, включая шизофилан, мурамилдипептид, производные мурамилдипептида («MDP»), сложные форболовые эфиры, термолабильный токсин Е.coli, блокполимеры или сапонины.
Для иллюстрации примеры в данном документе иллюстрируют вакцинную композицию, содержащую (i) конъюгат, образованный между KLH и пептидом формулы (I), в качестве иммуногенного продукта и (ii) неполный адъювант Фрейнда в качестве иммуноадъюванта.
Состав таких иммуногенных композиций хорошо известен специалистам в данной области. Иммуногенные композиции по изобретению предпочтительно включают фармацевтически приемлемый носитель. Подходящие фармацевтически приемлемые носители и/или разбавители включают любой и все традиционные растворители, диспергирующую среду, наполнители, твердые носители, водные растворы, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие абсорбцию агенты и тому подобное. Подходящие фармацевтически приемлемые носители включают, например, один или более чем один носитель, выбранный из воды, физиологического раствора, фосфатно-солевого буферного раствора, декстрозы, глицерина, этанола и тому подобное, а также их комбинации. Фармацевтически приемлемые носители могут дополнительно содержать малые количества вспомогательных веществ, таких как увлажняющие или эмульгирующие агенты, консерванты или буферы, которые увеличивают срок годности при хранении или эффективность антитела. Получение и применение фармацевтически приемлемых носителей хорошо известно из уровня техники. За исключением случаев, когда любая обычная среда или агент является несовместимым с активным ингредиентом, предполагается их применение в иммуногенных композициях по настоящему изобретению.
Такие иммуногенные композиции можно вводить парентерально, например посредством инъекции, или под кожу, или внутримышечно, а также перорально или интраназально. При других способах введения, например, помимо прочего, используют пероральные композиции, ингаляционные композиции, суппозитории и трансдермальное применение. Пероральные композиции, например, включают такие обычно используемые эксципиенты, как, например, фармацевтической степени чистоты маннит, лактоза, крахмал, стеарат магния, натрия сахарин, целлюлоза, карбонат магния и тому подобное, помимо прочего.
Настоящее изобретение также относится к вакцинной композиции, содержащей антигенный пептид формулы (I), описанный в данном документе, в комбинации с одним или более чем одним соединением иммуноадъюванта.
Настоящее изобретение также относится к вакцинной композиции, содержащей (i) иммуногенный продукт, содержащий пептид формулы (I), который объединен с (ii) одним или более чем одним соединением иммуноадъюванта.
Как правило, иммуногенная или вакцинная композиция согласно изобретению содержит 1, 2, 3, 4 или самое большое 5 различных соединений иммуноадъюванта.
В предпочтительных воплощениях иммуногенная или вакцинная композиция согласно изобретению содержит 1 или 2 различных соединения иммуноадъюванта.
В некоторых предпочтительных воплощениях иммуногенной или вакцинной композиции пептид формулы (I) выбран из группы, состоящей из:
- Nt-SASNKS-Ct (Nt-SEQ ID №6-Ct),
- Nt-SWANKS-Ct (Nt-SEQ ID №7-Ct),
- Nt-SWSAKS-Ct (Nt-SEQ ID №8-Ct), и
- Nt-SWSNKA-Ct (Nt-SEQ ID №9-Ct).
В некоторых предпочтительных воплощениях иммуногенной или вакцинной композиции антигенный пептид формулы (I) выбран из группы, состоящей из:
- PWNASASNKSLDDIW (SEQ ID №12),
- PWNASWANKSLDDIW (SEQ ID №13),
- PWNASWSAKSLDDIW (SEQ ID №14), и
- PWNASWSNKALDDIW (SEQ ID №15).
В некоторых предпочтительных воплощениях антигенный полипептид формулы (I) ковалентно связан с молекулой-носителем.
Настоящее изобретение также относится к антигенному пептиду формулы (I), как подробно описано в настоящем описании, в качестве активного агента вакцинной композиции, направленной на предупреждение и/или лечение ВИЧ-1-инфицированного индивидуума.
В общем, настоящее изобретение также относится к пептиду формулы (I) perse, как подробно описано в настоящем описании.
Антитела, направленные против пептида формулы (I)
Как подробно обсуждали и экспериментально проиллюстрировали в данном документе, иммунизация индивидуума иммуногенной композицией, содержащей пептид формулы (I), вызывает продукцию нейтрализующих антител против ВИЧ-1 широкого спектра действия. Данные нейтрализующие антитела против ВИЧ-1 широкого спектра действия можно применять сами по себе в качестве активных агентов против ВИЧ-1.
Антитела, направленные против пептида формулы (I), можно применять для предупреждения ВИЧ-1 или в терапевтических целях относительно ВИЧ-1, а также в целях диагностики ВИЧ-1.
В некоторых воплощениях антитела, направленные против пептида формулы (I), состоят из антител, образованных после иммунизации млекопитающего, включая человека, иммуногенной композицией, содержащей пептид формулы (I), как описано в данном документе.
В некоторых воплощениях антитела, направленные против пептида формулы (I), получают из ВИЧ-1 инфицированных индивидуумов, у которых был вызван иммунный ответ на ВИЧ-1.
В обоих воплощениях, приведенных выше, указанные антитела можно получать посредством очистки из образца, главным образом образца крови, взятого у указанного млекопитающего, в том числе у указанного человека.
В обоих воплощениях, приведенных выше, указанные антитела можно также получать посредством клонирования соответствующей ДНК в качестве материала, кодирующей их, например, начиная с В-клеток, полученных из указанного млекопитающего, в том числе из указанного человека.
В обоих воплощениях, приведенных выше, указанные антитела можно также получать посредством определения последовательностей аминокислотных остатков указанных антител, отобранных у указанного млекопитающего, в том числе из указанного человека, и затем синтеза молекулы ДНК, кодирующей указанное антитело или его часть, содержащую его CDR (гипервариабельная область), для получения соответствующих рекомбинантных антител, направленных против пептида формулы (I).
Настоящее изобретение также относится к антителам, направленным против пептида формулы (I), как описано в данном документе.
В некоторых предпочтительных воплощениях указанные антитела направлены против пептида формулы (I), выбранного из группы, состоящей из:
- Nt-SASNKS-Ct (Nt-SEQ ID №6-Ct),
- Nt-SWANKS-Ct (Nt-SEQ ID №7-Ct),
- Nt-SWSAKS-Ct (Nt-SEQ ID №8-Ct), и
- Nt-SWSNKA-Ct (Nt-SEQ ID №9-Ct.
В некоторых других предпочтительных воплощениях указанные антитела направлены против пептида формулы (I), выбранного из группы, состоящей из:
- PWNASASNKSLDDIW (SEQ ID №12),
- PWNASWANKSLDDIW (SEQ ID №13),
- PWNASWSAKSLDDIW (SEQ ID №14), и
- PWNASWSNKALDDIW (SEQ ID №15.
Получение антител, направленных против пептида формулы (I), посредством иммунизации иммуногенной композицией, содержащей пептид формулы (I), в частности, описано в примерах данного документа. В качестве альтернативы антитела, направленные против пептида формулы (I), можно отбирать от ВИЧ-1 инфицированный пациентов, уже имеющих в норме такие антитела; их можно также получать после иммортализации человеческих В-лимфоцитов, продуцирующих их; их кДНК (комплементарная ДНК) можно также клонировать и применять дополнительно для их продуцирования или их производных посредством технологии рекомбинантных ДНК.
Настоящее изобретение также относится к применению антител против ВИЧ-1, полученных из индивидуума, иммунизированного иммуногенной композицией, описанной в данном документе, для изготовления лекарственного средства для предупреждения и/или лечения ВИЧ-1 инфицированного индивидуума.
Термин «антитело» в данном документе применяется для того, чтобы ссылаться на молекулу, имеющую подходящую специфичность связывания антигена. Специалисты в данной области быстро поймут, что данный термин может также охватывать полипептиды, которые являются фрагментами или производными антител, которые еще могут показывать такую же или сильно похожую функциональность. Такие фрагменты антител или производные, как подразумевается, в данном контексте охвачены термином антитело. Под «антителом» или «молекулой антитела» для цели пассивной иммунотерапии в данном документе подразумевается не только целые молекулы иммуноглобулина, но также его фрагменты, такие как Fab, F(ab')2, Fv и другие его фрагменты, которые сохраняют нейтрализующую активность против ВИЧ-1 вирусов. Похожим образом термин антитело включает генетически сконструированные производные антител, такие как молекулы одноцепочечного Fv (scFv) и доменные антитела (dAb).
Изготовление композиций, содержащих очищенные антитела к пептиду формулы (I), описано в данном документе в примерах.
В некоторых воплощениях антитело к пептиду формулы (I) включает поликлональное антитело. Получение композиции, содержащей очищенные поликлональные антитела к пептиду формулы (I), описано в данном документе в примерах.
Термин «моноклональное антитело» применяется в данном документе для того, чтобы охватить любые выделенные антитела, такие как традиционное моноклональное антитело, продуцируемое гибридомами, а также для того, чтобы охватить выделенные моноспецифичные антитела, продуцируемые любой клеткой, такие как, например, образец идентичных человеческих иммуноглобулинов, экспрессируемых в клеточной линии млекопитающих.
Вариабельные тяжелые (VH) и вариабельные легкие (VL) домены антитела вовлечены в распознавание антигена, факт впервые признанный вследствие ранних экспериментов по протеолитическому расщеплению. Дополнительное подтверждение обнаружили посредством «гуманизации» антител грызунов. Вариабельные домены грызунов по происхождению могут быть слиты с константными доменами человеческого происхождения, так что получающееся в результате антитело сохраняет специфичность относительно антигена антитела, происходящего из грызуна (Morrison et al. (1984) Proc. Natl. Acad. Sci. USA 81, 6851-6855). To, что специфичность по отношению к антигену предоставляется вариабельными доменами и не зависит от константных доменов, известно из экспериментов, включающих бактериальную экспрессию фрагментов антител, причем все содержат один или более чем один вариабельный домен. Данные молекулы включают Fab-подобные молекулы (Better et al (1988) Science 240, 1041); Fv молекулы (Skerra et al (1988) Science 240, 1038); молекулы одноцепочечного Fv (ScFv), где VH и VL домены-партнеры связаны посредством гибкого олигопептида (Bird et al (1988) Science 242, 423; Huston et al (1988) Proc. Natl. Acad. Sci. USA 85, 5879), и однодоменные антитела (dab), содержащие единичные V домены (Ward et al (1989) Nature 341, 544). Общий обзор способов, вовлеченных в синтез фрагментов антител, которые сохраняют свои специфичные сайты связывания, можно найти в Winter & Milstein (1991, Nature 349, 293-299).
Под «молекулами ScFv» подразумеваются молекулы, где VH и VL домены-партнеры связаны посредством гибкого олигопептида. Сконструированные антитела, такие как антитела ScFv, можно получать, используя методики и подходы, описанные в J. Huston et al, (1988) "Protein engineering of antibody binding sites: recovery of specific activity in an anti-digoxin single chain Fv analogue produced in E.coli", Proc. Natl. Acad. Sci. USA, 85, pp.5879-5883, и в A. Pluckthun, (1991) "Antibody engineering; Advances from use of E.coli expression systems", Bio/technology 9(6):545-51, включенных в данный документ путем ссылки.
Подходящие моноклональные антитела, которые являются реактивными, как описано в данном документе, можно получать посредством известных методик, например методик, описанных в "Monoclonal Antibodies; A manual of techniques", H Zola (CRC Press, 1988) и в "Monoclonal Hybridoma Antibodies: Techniques and Application", S G R Hurrell (CRC Press, 1982).
Дополнительное воплощение охватывает гуманизированные антитела, где области мышиного антитела, которые контактировали с антигеном, гипервариабельные области (CDR), переносили в каркас человеческого антитела. Такие антитела почти полностью человеческие и редко вызывают какие-либо вредные антительные ответы при введении пациентам. Несколько химерных или гуманизированных антител было зарегистрировано как терапевтические лекарственные средства и сейчас широко используются при разных показаниях (Borrebaeck & Carlsson, 2001, Curr. Opin. Pharmacol. 1:404-408).
Предпочтительно, когда антитело представляет собой гуманизированное антитело. Надлежащим образом полученные нечеловеческие антитела могут быть «гуманизированными» известными способами, например посредством вставки CDR областей мышиных антител в каркас человеческих антител. Гуманизированные антитела можно создавать, используя методики и подходы, описанные в Verhoeyen et al (1988) Science, 239, 1534-1536 и в Kettleborough et al, (1991) Protein Engineering, 14 (7), 773-783.
Другие воплощения антител охватывают полностью человеческие антитела, которые можно получать, используя технологии рекомбинантных ДНК. Обычно применяют большие библиотеки, содержащие миллиарды разных антител. В отличие от прежних методик, использующих химеризацию или гуманизацию, например, мышиных антител, данная технология не основывается на иммунизации животных для получения специфичного антитела. Вместо этого рекомбинантные библиотеки содержат огромное число предварительно созданных вариантов антител, где вероятно, что библиотека будет иметь по меньшей мере одно антитело, специфичное для любого антигена.
При пассивном лечении ВИЧ-1 инфекции, как приведено в данном документе, антитела по настоящему изобретению будут вводить, предпочтительно, внутривенно пациентам, нуждающимся в этом. Частота введения может быть определена клинически посредством нижеописанного уменьшения титров антител в сыворотке пациентов со временем, но в любом случае может происходить с частотой от 1 до 52 раз в год, и наиболее предпочтительно между 1 и 12 раз в год. Количества антитела могут варьировать согласно тяжести заболевания или времени полужизни антитела в сыворотке, но предпочтительно будет находиться в интервале от 1 до 10 мг/кг пациента и предпочтительно в интервале от 1 до 5 мг/кг пациента и наиболее предпочтительно от 1 до 2 мг/кг пациента.
Способы и наборы для диагностики, прогнозирования, осуществления контроля за ВИЧ-1
Как описано в примерах в данном документе, антитела, направленные против пептида формулы (I), можно обнаружить у пациентов, инфицированных ВИЧ-1.
Вследствие этого пептид формулы (I) можно применять в качестве реагента для выявления для определения наличия и, возможно, количества антител, направленных против указанного пептида, у обследуемого индивидуума.
Данное изобретение относится к способу детектирования и/или количественного определения антител, направленных против пептида формулы (I), в образце, включающему следующие стадии:
а) приведение образца, подлежащего тестированию, в контакт с одним или более чем одним пептидом формулы (I), и
б) детектирование и/или количественное определение образования комплексов между указанными пептидами формулы (I) и антителами, находящимися в указанном образце.
Настоящее изобретение также относится к набору для детектирования и/или количественного определения антител, направленных против пептида формулы (I), в образце, содержащему:
а) один или более чем один пептид формулы (I) и
б) один или более чем один реагент для детектирования комплексов, образованных между указанными пептидами и антителами, присутствующими в указанном образце.
В некоторых воплощениях образец, подлежащий тестированию, состоит из образца, прежде отобранного у индивидуума, который включает (i) индивидуум с подозрением на инфекцию, вызванную вирусом ВИЧ-1, и (ii) индивидуум, который был инфицирован вирусом ВИЧ-1.
В некоторых воплощениях указанный образец состоит из препарата, который предположительно содержит антитела, направленные против пептида формулы (I), такого как (i) препарат антител, очищенных из образцов, отобранных у млекопитающего, иммунизированного иммуногенной композицией, содержащей пептид формулы (I), и (ii) препарат моноклональных антител или рекомбинантных антител, направленных против пептида формулы (I).
В некоторых воплощениях приведенного выше способа детекции пептид(ы) формулы (I) иммобилизован(ы) на подложке.
В некоторых воплощениях пептид формулы (I) можно применять в качестве реагента для диагностирования инфекции индивидуума, вызванной вирусом ВИЧ-1.
Таким образом, настоящее изобретение также относится к способу диагностики инфекции, вызванной вирусом ВИЧ-1, у индивидуума, включающему следующие стадии:
а) приведение образца, отобранного у указанного индивидуума, в контакт с одним или более чем одним пептидом формулы (I), и
б) детектирование образования комплексов между указанными пептидами формулы (I) и антителами, находящимися в указанном образце.
В некоторых воплощениях стадии б) способа комплексы, образованные указанными пептидами формулы (I) и антителами, в случае присутствия, определяют количественно.
Данное изобретение также относится к набору для диагностики инфекции, вызванной вирусом ВИЧ-1, у индивидуума, содержащему:
а) один или более чем один пептид формулы (I) и
б) один или более чем один реагент для детектирования комплексов, образованных указанными пептидами формулы (I) и антителами, присутствующими в образце, отобранном у указанного индивидуума.
В некоторых воплощениях способа диагностики или вышеописанного набора для диагностики указанный пептид(ы) формулы (I) иммобилизован(ы) на подложке, как это описано дополнительно в настоящем описании.
Согласно вышеописанному способу ВИЧ-1 инфекцию определяют, если детектируют образование комплексов, образованных между пептидом(ми) формулы (I) и антителами, содержащимися в образце, отобранном ранее у обследуемого индивидуума.
Согласно вышеописанному способу диагностики уровень иммунного ответа ВИЧ-1-инфицированного индивидуума на вирус ВИЧ-1 определяют посредством количественного определения комплексов, образованных между пептидом(ми) формулы (I) и антителами, содержащимися в образце, обобранном ранее у обследуемого индивидуума.
В некоторых воплощениях пептид формулы (I) можно применять в качестве реагента для осуществления прогнозирования развития инфекции индивидуума, вызванной вирусом ВИЧ-1.
Таким образом, настоящее изобретение также относится к способу прогнозирования развития инфекции, вызванной вирусом ВИЧ-1, у индивидуума, включающему следующие стадии:
а) приведение образца, отобранного у указанного индивидуума, в контакт с одним или более чем одним пептидом формулы (I), и
б) детектирование и количественного определение образования комплексов между указанными пептидами формулы (I) и антителами, находящимися в указанном образце.
Данное изобретение также относится к набору для прогнозирования у индивидуума развития инфекции, вызванной вирусом ВИЧ-1, содержащему:
а) один или более чем один пептид формулы (I) и
б) один или более чем один реагент для детектирования комплексов, образованных между указанными пептидами формулы (I) и антителами, присутствующими в образце, отобранном у указанного индивидуума.
Согласно вышеописанному способу ВИЧ-1 инфекцию определяют, если детектируют образование комплексов между пептидом(ми) формулы (I) и антителами, содержащимися в образце, взятом ранее у обследуемого индивидуума.
Согласно вышеописанному способу прогнозирования, уровень иммунного ответа ВИЧ-1 инфицированного индивидуума на ВИЧ-1 вирус определяют на стадии б).
При осуществлении вышеописанного способа прогнозирования благоприятный исход ожидают, когда на стадии б) определяют высокий уровень антител к полипептиду формулы (I). Напротив, неблагоприятный исход ожидают, когда на стадии б) определяют низкий уровень антител к полипептиду формулы (I).
В данном контексте «высокий» уровень антител к пептиду формулы (I) определяют посредством сравнения с одним или более чем одним эталонным значением.
В некоторых воплощениях вышеописанного способа прогнозирования благоприятный исход может быть определен, если в образце, ранее взятом у указанного ВИЧ-1 инфицированного индивидуума, детектируют наличие антител к полипептиду формулы (I), так как, как показано в примерах в данном документе, индивидуумы, имеющие сывороточные антитела к пептиду формулы (I), как обнаружили, имеют хорошие клинические показатели, такие как низкая вирусная нагрузка и высокое число клеток CD4+ Т.
Вышеописанный способ диагностики, вышеописанный способ прогнозирования, а также наборы для осуществления указанных способов можно применять для осуществления контроля за эффективностью направленного против ВИЧ-1 терапевтического лечения индивидуума, инфицированного ВИЧ-1.
Данное изобретение также относится к способу осуществления контроля за направленным против ВИЧ-1 терапевтическим лечением ВИЧ-1 инфицированного индивидуума, включающему стадии:
а) проведения курса лечения против ВИЧ-1 для указанного ВИЧ-1-инфицированного индивидуума и
б) определения уровня антител к пептиду формулы (I) в образце, взятом у указанного пациента.
В некоторых воплощениях способа осуществления контроля уровень антител к пептиду формулы (I) определяют перед проведением курса лечения, направленного против ВИЧ-1, для указанного индивидуума, таким образом, перед стадией а) способа.
В некоторых воплощениях способа осуществления контроля, особенно когда лечение, направленное против ВИЧ-1, включает множество стадий введения указанному индивидууму фармацевтической композиции против ВИЧ-1, вышеописанный способ осуществления контроля выполняют на каждой стадии введения или только на одной или более чем одной стадии введения, или после последней стадии введения.
В данном документе описано, что воплощения терапевтического лечения ВИЧ-1 инфекции, за которым можно осуществлять контроль, согласно способу, описанному выше, охватывают иммунизацию ВИЧ-1-инфицированного индивидуума вакцинной композицией, содержащей пептид формулы (I), как описано в данном документе.
Фразы, такие как «образец, содержащий антитело» или «детектирование антитела в образце», не предназначены для исключения образцов или определений (попыток детекции), где не содержится или не детектируется антитело. В общем смысле, данное изобретение включает анализы для определения того, присутствует ли в образце антитело, образующееся в ответ на инфицирование и в течение протекания заболевания, вызванного вирусом ВИЧ-1, независимо от того, детектируют его или нет.
Условия для взаимодействия пептидов и антител, так что они взаимодействуют специфично, хорошо известны специалистам в данной области. См., например, Current Protocols in Immunology (Coligan et al., editors, John Wiley & Sons, Inc) или Примеры в данном документе.
Способ диагностики включает взятие образца жидкости или ткани организма, которые, вероятно, содержат антитела. Антитела могут представлять собой, например, тип IgG, IgE, IgD, IgM или IgA. Обычно обнаруживают IgM и/или IgA антитела, например, при выявлении ранней инфекции. IgG антитела могут детектировать, когда некоторые из дополнительных пептидов, обсуждаемых выше, применяют в способе (например, пептиды для детекции белков жгутиков). Образец предпочтительно таков, что не представляет затруднений для его получения, и он может представлять собой сыворотку или плазму, полученную из образца венозной крови или даже при взятии крови из пальца. Ткань из других частей организма или другие жидкости организма, такие как спинномозговая жидкость (CSF), слюна, желудочная секреция, слизь и т.д., как известно, содержат антитела и могут быть использованы в качестве источника образца.
Как только пептидный антиген и антитело образца получают возможность взаимодействовать в подходящей среде, для определения наличия или отсутствия взаимодействия антитело-пептид проводят анализ. Среди многих типов подходящих анализов, которые будут очевидными для специалиста, есть анализы иммунопреципитации и агглютинации.
В воплощениях изобретения анализ может включать (1) иммобилизацию антител(а) в образце, добавление пептида по изобретению и затем детектирование уровня антитела, связанного с пептидом, например, посредством мечения пептида или посредством добавления меченного вещества (конъюгат, партнер по связыванию), такого как меченное антитело, которое специфично распознает пептид; (2) иммобилизацию пептида по изобретению, добавление образца, содержащего антитело(ла) и затем детектирование количества антитела, связанного с пептидом, например, посредством добавления меченого вещества (конъюгат, партнер по связыванию), такого как меченое антитело, которое специфично распознает антитело; или (3) взаимодействие пептида и образца, содержащего антитело(а) без какого-либо из иммобилизованных реагентов, и затем детектирование количества комплексов антитела с пептидом, например, с помощью мечения пептида или посредством добавления меченого вещества (конъюгат, партнер по связыванию), такого как меченое антитело, которое специфично распознает пептид.
Иммобилизация пептида по изобретению может быть или ковалентной, или нековалентной, а нековалентная иммобилизация может быть неспецифичной (например, неспецифичное связывание с поверхностью полистирола, например, в лунке планшета для микротитрования). Специфичного или полуспецифичного связывания с твердым или полутвердым носителем, подложкой или поверхностью можно достигать с помощью пептида, имеющего связанную с ним группировку, которая позволяет ему ковалентно или нековалентно связываться с твердым или полутвердым носителем, подложкой или поверхностью. Например, группировка может обладать аффинностью по отношению к компоненту, прикрепленному к носителю, подложке или поверхности. В этом случае группировка может представлять собой, например, биотин или биотинил группу или их аналог, связанный с аминокислотной группой пептида, такой как 6-аминогексановая кислота, а компонентом тогда является авидин, стрептавидин или их аналог. Альтернативным вариантом является ситуация, в которой группировка имеет аминокислотную последовательность His-His-His-His-His-His (SEQ ID NO: 17), a носитель содержит производное нитрилотриуксусной кислоты (NTA), заряженное ионами Ni++. Среди подходящих носителей, подложек или поверхности можно назвать, например, магнитные шарики или латекс сополимеров, таких как стирол-дивинилбензол, гидроксилированный стирол-дивинилбензол, полистирол, карбоксилированный полистирол, частицы углеродной сажи, неактивированное или активированное стекло на основе полистирола или поливинилхлорида, эпокси-активированное пористое магнитное стекло, желатин или частицы полисахарида или другие белковые частицы, эритроциты, моно- или поликлональные антитела или Fab фрагменты таких антител.
Протоколы для иммуноанализов с использованием антигенов для детекции специфичных антител хорошо известны из уровня техники. Например, можно применять традиционный анализ «сэндвич»-типа или можно применять традиционный конкурентный анализ. Для обсуждения некоторых подходящих типов анализов, см. Current Protocols in Immunology (выше). В предпочтительном анализе пептид по изобретению иммобилизован на твердой или полутвердой поверхности или носителе посредством ковалентного или нековалентного связывания, или до или после добавления образца, содержащего антитело.
Устройства для выполнения анализов специфичного связывания, главным образом иммуноанализов, известны и могут быть быстро приспособлены для применения в настоящих способах. Твердофазные анализы, в общем, легче выполнять, чем методы гетерогенного анализа, которые требуют стадии разделения, такой как преципитация, центрифугирование, фильтрация, хроматография или магнетизм, поскольку разделение реагентов быстрее и проще. Устройства для твердофазного анализа включают планшеты для микротитрования, устройства для проточного анализа, тест-полоски и устройства для иммунокапиллярного или иммунохроматографического иммуноанализа.
В воплощениях изобретения твердая или полутвердая поверхность или носитель представляет собой дно или стенку в лунке планшета для микротитрования; фильтрующую поверхность или мембрану (например, нитроцеллюлозная мембрана или мембрана PVDF (поливинилиденфторид), такая как мембрана Immobilion); полое волокно; гранулированную хроматографическую среду (например, агарозный или полиакриламидный гель); магнитный микроноситель; волокнистую целлюлозную матрицу; ВЭЖХ матрицу (высокоэффективная жидкостная хроматография); FPLC матрицу (жидкостная экспресс-хроматография белков); вещество, имеющее молекулы такого размера, что молекулы с пептидной связью, будучи растворенными или рассеянными в жидкой фазе, могут быть удержаны посредством фильтра; вещество, способное образовывать мицеллы или принимать участие в образовании мицелл, давая возможность жидкой фазе меняться и обмениваться без захватывания мицелл; водорастворимый полимер; или любой другой подходящий носитель, подложку или поверхность.
В некоторых воплощениях изобретения пептид обеспечен подходящей меткой, которая делает возможной детекцию. Можно применять традиционные метки, которые способны сами по себе или совместно с другими композициями или соединениями обеспечивать детектируемый сигнал. Подходящие способы детекции включают, например, детекцию агента, который является меченным, прямо или косвенно, флуоресцентной меткой посредством иммунофлуоресцентной микроскопии, включая конфокальную микроскопию или проточную цитометрию (FACscan); детекцию радиоактивно меченного агента посредством авторадиографии; электронную микроскопию; иммуноокрашивание; субклеточное фракционирование или тому подобное. В одном воплощении радиоактивный элемент (например, радиоактивная аминокислота) вводят непосредственно в пептидную цепь; в другом воплощении флуоресцентная метка ассоциирована с пептидом через взаимодействие биотин/авидин, связь с антителом, конъюгированным с флуоресцеином, или тому подобное. В одном воплощении детектируемый специфичный партнер связывания для антитела добавляют в смесь. Например, партнер связывания может представлять собой детектируемое вторичное антитело, которое связывается с первичным антителом. Данное вторичное антитело может быть мечено, например, радиоактивной, ферментативной, флуоресцентной, люминесцентной или другой детектируемой меткой, такой как система авидин/биотин.
В воплощениях изобретения способ детектирования включает наблюдение за видимым комплексом антитело-пептид при изменении окраски или наблюдение за комплексом антитело-пептид при физико-химическом изменении. Физико-химические изменения могут происходить с реакциями окисления или другими химическими реакциями. Их можно детектировать на глаз, используя спектрофотометр или тому подобное.
В одном воплощении способа пептид или смесь пептидов подвергают электроблоттингу или дот-блоттингу на нитроцеллюлозную бумагу. После этого биологическую жидкость (например, сыворотка или плазма) инкубируют с антигеном, подвергнутым блоттингу, и антителу в биологической жидкости дается возможность связываться с антигеном(ами). Связанное антитело можно затем детектировать, например, стандартными иммуноферментными методами.
В другом воплощении способа латексные шарики конъюгируют с антигеном(ми) по изобретению. Далее биологическую жидкость инкубируют с конъюгатом шарик/пептид, с образованием, таким образом, реакционной смеси. Реакционную смесь затем анализируют для определения наличия антител.
Один предпочтительный анализ для скрининга продуктов крови или других физиологических или биологических жидкостей представляет собой твердофазный иммуноферментный анализ, т.е. ELISA. Обычно в ELISA выделенный антиген(ны) по изобретению адсорбируется на поверхности лунки планшета для микротитрования прямо или посредством матрицы для захвата (например, антитело). Остаточные неспецифичные сайты связывания белка на поверхности затем блокируют соответствующим агентом, таким как бычий сывороточный альбумин (BSA), инактивированная нагреванием нормальная сыворотка козы (NGS) или BLOTTO (забуференный раствор обезжиренного сухого молока, который также содержит консервант, соли и пеногаситель). Затем лунку инкубируют с биологическим образцом, потенциально содержащим антитела против ВИЧ-1. Образец можно применять неразбавленным, или чаще он может быть разбавлен, обычно в забуференном растворе, который содержит небольшое количество (0,1-5,0 масс.%) белка, такого как BSA, NGS или BLOTTO. После инкубирования в течение достаточного периода времени для того чтобы позволить произойти специфичному связыванию, лунку промывают для удаления несвязанного белка и затем инкубируют с оптимальной концентрацией соответствующего антитела к иммуноглобулину (например, в случае субъектов, являющихся людьми, антитело к человеческому иммуноглобулину из другого животного, такого как собака, мышь, корова и т.д.), которое конъюгировано с ферментом или другой меткой с помощью стандартных способов, и растворено в блокирующем буфере. Метку можно выбрать из множества ферментов, включая пероксидазу хрена (HRP), бета-галактозидазу, щелочную фосфатазу, глюкозооксидазу и т.д. Предоставляют достаточно времени для того, чтобы снова произошло специфичное связывание, затем лунку снова промывают для удаления несвязанного конъюгата и добавляют подходящий субстрат для фермента. Позволяют развиться окраске и определяют оптическую плотность содержимого лунки визуально или инструментально (измеряют при соответствующей длине волны). Предельное значение OD (оптическая плотность) можно определять как среднюю OD ± стандартное отклонение (SDs) по меньшей мере 50 образцов сыворотки, отобранных у индивидуумов, которые не инфицированы вирусом ВИЧ-1, или посредством других таких традиционных определений. В случае очень специфичного анализа, в качестве предельного значения можно использовать OD+2SD.
В одном воплощении ELISA пептид по изобретению иммобилизуют на поверхности, такой как 96-луночный планшет ELISA или эквивалентная твердая фаза, которая покрыта стрептавидином или эквивалентным биотинсвязывающим соединением в оптимальной концентрации в щелочном покрывающем буфере, и инкубируют при 4°С всю ночь. После подходящего числа промывок стандартными отмывочными буферами в каждой лунке используют оптимальную концентрацию биотинилированной формы композиции/антигена по данному изобретению, растворенной в традиционном блокирующем буфере; добавляют образец; и анализ продолжается, как описано выше.
Другим полезным форматом анализа является формат латерального тока. Антитело к человеческому или животному антителу или антителам к стафилококковым белкам А и G метят генератором сигнала или репортером (т.е. коллоидным золотом), которое сушат и помещают на подложку из стекловолокна (подложка для нанесения образца). Диагностический пептид иммобилизуют на мембране, такой как мембрана PVDF (поливинилиденфторид), (например, мембрана Immobilon (Millipore)) или нитроцеллюлозной мембране. Когда раствор образца (кровь, сыворотка и т.д.) наносят на подложку для нанесения образца, он растворяет меченный коллоидным золотом репортер и он связывается со всеми антителами в образце. Данную смесь переносят на следующую мембрану (PVDF или нитроцеллюлозу, содержащую диагностический пептид) посредством капиллярного действия. Если антитела к диагностическому пептиду присутствуют, они связываются с диагностическим пептидом, нанесенным на мембрану, генерируя сигнал. Для получения контрольного сигнала используют дополнительное антитело, специфичное к антителу, меченному коллоидным золотом (такое как антитело козы против мышиного IgG).
Специалисту в данной области следует понимать, что можно спланировать любое число форматов традиционного анализа белков, в частности форматов иммуноанализа, с использованием выделенных пептидов по данному изобретению для детекции у субъекта инфекции ВИЧ-1. Данное изобретение, таким образом, не ограничивается отбором определенного формата анализа и, как полагают, охватывает форматы анализа, которые известны специалистам в данной области.
Реагенты для ELISA или других анализов согласно данному изобретению могут быть предоставлены в форме наборов. Такие наборы полезны для диагностирования инфекции, вызванной ВИЧ-1 вирусом, с использованием образца, отобранного у субъекта (например, человека или другого животного). Такой набор для диагностики может содержать пептид по изобретению (и, при необходимости, дополнительные пептиды, как обсуждается выше) и, возможно, систему (средства, позволяющие) для детекции пептида по изобретению, связанного с антителом, направленным против пептида формулы (I), и/или поверхность, с которой пептид может быть связан. В одном воплощении набор содержит смесь подходящих пептидов или средства для получения таких смесей, и/или реагенты для детектирования комплексов пептид-антитело.
Набор может включать планшеты для микротитрования, на которых пептид(ы) по изобретению были заранее адсорбированы, другое устройство для соответствующего анализа, различные разбавители и буферы, меченные конъюгаты или другие агенты для детекции специфично связанных антигенов или антител, и другие генерирующие сигнал реагенты, такие как субстраты ферментов, кофакторы и хромогены. Другие компоненты набора могут быть легко определены специалистом в данной области. Такие компоненты могут включать реагенты для покрытия, поликлональные или моноклональные иммобилизованные антитела, специфичные для пептида по изобретению, или смесь двух или более чем двух антител, очищенные или полуочищенные экстракты данных антигенов в качестве стандартов, идентифицирующие MAb антитела, антитело к мышиному и человеческому антителу с молекулой-индикатором, конъюгированным с ним, планшет ELISA, приготовленный для абсорбции, индикаторные графики для калориметрических сравнений, одноразовые перчатки, инструкции по деконтаминации, полоски-аппликаторы или контейнеры, сосуд для приготовления образца и т.д. В одном воплощении набор содержит буферы или другие реагенты, подходящие для составления реакционной смеси, делая возможным образование комплекса пептид-антитело. Такие наборы обеспечивают для клинической лаборатории удобный, эффективный путь для диагностики инфекции, вызванной вирусом ВИЧ-1.
В некоторых воплощениях способы диагностики и наборы, описанные в данном документе, можно применять в основном для детектирования наличия антител против ВИЧ в образце, отобранном ранее у индивидуума. В некоторых других воплощениях способы диагностики и наборы, описанные в данном документе, можно применять для идентификации подсемейства вируса ВИЧ-1, которым был инфицирован индивидуум, который в настоящее время обследуется.
В некоторых воплощениях в способах диагностики и наборах, описанных в данном документе, используется только один пептид, отобранный из пептидов, принадлежащих семейству пептидов формулы (I).
В других воплощениях в способах диагностики и наборах, описанных в данном документе, используется множество пептидов, отобранных из пептидов, принадлежащих семейству пептидов формулы (I).
Для иллюстрации, в воплощениях способов диагностики и наборов, описанных в данном документе, используется множество пептидов формулы (I), выбранных из группы, состоящей из:
- PWNASASNKSLDDIW (SEQ ID №12),
- PWNASWANKSLDDIW (SEQ ID №13),
- PWNASWSAKSLDDIW (SEQ ID №14), и
- PWNASWSNKALDDIW (SEQ ID №15),
Ниже настоящее изобретение дополнительно проиллюстрировано примерами, но не ограничивается ими.
Примеры
Материал и Методы
1. Получение вируса
Мутантов получали из плазмиды pNL4.3 с использованием набора QuickChange II XL для сайт-направленного мутагенеза (Stratagene) с последующей проверкой посредством ДНК. Плазмиды pNL4.3 дикого типа и мутированные по аланину 38/gp41 трансфецировали посредством липофектамина (Invitrogen) в клетки 293Т в среде Optima. После 48-часовой трансфекции собирали супернатант, не содержащий клеток, и определяли концентрацию главного коревого белка ВИЧ р24 с использованием набора Vidas Ag р24 II (Biomerieux). Вирусные супернатанты хранили при -80°С.
2. Пептиды и антитела
Очищенные неконъюгированные и KLH-конъюгированные синтетические пептиды дикого типа и мутированные по аланину 3S/gp41 (Фиг.1) получали из Covalabs (Villeurbanne, Франция). Мышам дважды внутривенно вводили, с примерно 2-недельным интервалом между каждой инъекцией, 20 мг пептида, связанного с KLH, в присутствии неполного адъюванта Фрейнда. Сыворотки титровали посредством твердофазного иммуноферментного анализа (ELISA) с использованием планшетов Maxisorp (Nunc), покрытых на ночь при 4°С, 100 нг пептидов дикого типа или мутированных по аланину 3S/gp41, как описано (Vieillard et al AIDS 2006).
3. Очистка исходных здоровых клеток CD4+ Т
Лейкоциты из образцов цельной крови, взятых у здоровых доноров, получали посредством центрифугирования с образованием лейкоцитарной пленки из "Etablissement Francais du sang" (Hôpital Pitié-Salpêtrière, Париж, Франция). Клетки CD4+ Т очищали с помощью CD4 магнитных микрогранул (Miltenyi). Проточный цитометрический анализ показал чистоту CD4 клеток, составляющую более 95%. Клетки активировали в течение 3 дней 1 мкг/мл PHA-L (Murex) в RPMI-1640 Glutamax среде (Invitrogen) с добавлением 10% фетальной телячьей сыворотки (FCS) и затем культивировали с 100 ME (международные единицы)/мл пролейкина-2 (Chiron), добавляемого каждые 3 дня.
4. Анализ инфицирования
Очищенные активированные клетки CD4+ Т, МТ2 и клетки Jurkat (107клеток) инкубировали со 100 нг эквивалентов антигена р24 в течение 17 ч и 2 ч при 37°С соответственно. Клетки затем промывали дважды в PBS (фосфатно-солевой буферный раствор)/EDTA (этилендиаминтетрауксусная кислота) и ресуспендировали до 106/мл. За продукцией вируса следили каждые 2 дня после инфицирования посредством ELISA с измерением концентрации р24 с помощью набора Vidas Ag р24 II (Biomerieux). Образование синцития на инфицированных МТ2 клетках оценивали после 96 ч с помощью стандартной фазово-контрастной микроскопии.
5. Одноэтапный анализ инфекционности ВИЧ-1
Hela P4C4, любезно подаренные A. Morris и О. Schwartz (Институт Пастера, Париж, Франция), совместно трансфицировали с CD4+ и CCR5+ и содержали интегрированную копию HIV-1 длинного концевого повтора (LTR), связанного с геном люциферазы и β-галактозидазы (Amara et al J. Exp. Med. 1997). Клетки высевали за один день накануне и инфицировали 4 нг р24/мл дикого типа или мутированных по аланину 3S/gp41 вирусов NL4.3. Через 48 ч после инфицирования измеряли активность β-галактозидазы в клеточных лизатах Hela-P4C5 с использованием набора CPRG Beta-Galactosidase (OZ biosciences).
6. Анализ нейтрализации
Фракцию поликлональных IgG из антисывороток мышей выделяли с использованием набора Nab Protein A/G Spin и затем высаливали с использованием колонок для высаливания Zeba spin, оба из Thermo Scientific, согласно инструкциям изготовителя. Фракции иммуноглобулина концентрировали с использованием Centricon Centrifugal Filter Units (Millipore) и затем количественно определяли с использованием набора ВСА protein assay (Thermo Scientific). Очищенные Ab тестировали при начальных концентрациях 20 мкг/мл с последующими пятью 2-кратными разведениями.
Человеческие антитела к WT или к W614A 3S/gp41 очищали посредством иммунопреципитации из инактивированной нагреванием плазмы инфицированного HIV-1 пациента с использованием набора Pierce Direct IP посредством прямой иммунобилизации синтетического пептида на агарозной подложке с реакционноспособными аминогруппами. Очищенные антитела затем подвергали диализу против PBS (Silde-A-Lyser Dialysis cassette, Pierce) и количественно определяли. Очищенные антитела тестировали при начальных концентрациях 2 мкг/мл с последующими пятью 2-кратными разведениями.
Два анализа с использованием инфекционных вирусов проводили для анализа нейтрализации очищенных антител (Fenyo et la PLoS one 2009):
(1) Для сравнения действенности (концентрации, требующиеся для достижения 50% [IC50] и 90% [IC90] ингибирования) антитела, сначала использовали анализ «CD4+ Т клетки-р24». Инфекционные реплицирующиеся компетентные вирусы (200TCID50) инкубировали с разными концентрациями Ig в течение 30 мин с последующим добавлением РНА-активированных очищенных CD4+ Т клеток в присутствии IL2. Семь дней после инициации инфекции образцы в двух повторностях отбирали для измерения р24 (набор Vidas Ag р24 II, Biomerieux).
(2) Для оценки возможности при различающейся нейтрализующей активности разных очищенных Ab измеряли их способность ингибировать проникновение ВИЧ-1 у разных штаммов Х4 (NL4.3, BRU, NDK) и R5 (JR-CSF, YU-2) или ROD HIV-2 с использованием клеток Hela-P4C5 и/или TZM-bl (NIH AIDS Research and Reference Reagent Program), любезно предоставленных Clarisse Berlioz-Torrent (Institut Cochin, Париж, Франция). Инфекционные реплицирующиеся компетентные вирусы (200TCID50) инкубировали с Ig в разных концентрациях в течение 30 мин с последующим добавлением клеток Hela P4C5. Через 48 ч после инфицирования измеряют β-галактозидазную активность в лизатах Hela-P4C5 с использованием набора CPRG Beta-Galactosidaset (OZ biosciences), а активность люциферазы измеряют в лизатах TZM-bl с использованием Britelite Plus Reagent (Perkin Elmer). Пороговое значение 2,5-кратного фона применяли для определения положительных значений в анализах TCID (доза, инфицирующая культуру ткани). Данные выражали в TCID50 и TCID95.
7. Проточная цитометрия
FACS анализ (сортировка флуоресцентно-активированных клеток) проводили на очищенных CD4+ Т клетках в присутствии жизнеспособного или инактивированного нагреванием вируса в течение 17 часов или обработанных пептидами 3S/gp41 в течение 4 ч при 37°С. Образцы инкубировали с 1 мкг каждого антитела: антитела к NKp44L или с белками слияния (NKp30-Ig, NKp44-Ig или NKp46-Ig) в течение 2 ч при 4°С в присутствии PBS/BSA1%. Затем клетки промывали в PBS/BSA1% и инкубировали в течение 30 мин при 4°С со специфичными вторичными антителами (разведенными 1:100 в PBS/BSA1%), и, наконец, окрашивали непосредственно mAb против CD4 и фиксировали с использованием раствора BD CellFix (BD Bioscience), как описано (Vieillard et al PNAS 2005). На FACSCanto (BD Biosciences) или Navios (Coulter) детектировали по меньшей мере 10000 событий клеток CD4+.
8. Анализ дегрануляции
Неинфицированные CD4+ Т клетки или CD4+ Т клетки, инфицированные диким типом или мутированными по аланину 3S/gp41 вирусами NL4.3, ресуспендировали в соотношении 1:1 в присутствии аутологических РВМС (мононуклеарные клетки периферической крови), активированных аутологическими IL2, и mAb против CD107a (H4A3; Becton Dickinson). После 1 ч инкубации добавляли 3 мМ монензин для дополнительных 3 ч инкубации, как описано ранее (Bèziat et al PLoS One 2010). NK клетки окрашивали mAb против CD3, против CD56 и против NKp44 и анализировали на FACSCanto (BD Biosciences) или Navios (Coulter). По меньшей мере анализировали 5000 событий CD3-CD56+.
Пример 1: Целостность 3S/gp41 CD4 при инфицировании CD4+ Т клеток
Чтобы определить роль мотива 3S/gp41 в жизненном цикле вируса, в остатки, расположенные между положением S613 и S618 в пределах 3S мотива белка gp41 из штамма ВИЧ-1 NL4.3, индивидуально вводили единичные точечные замены. Для изучения того, оказывают ли единичные замены влияние на вирусную инфекционность, клетки МТ-2 стимулировали 100 нг эквивалентного р24 антигена из каждого вирусного препарата. На Фиг.2А показано, что воздействия, оказываемые заменами мотива 3S/gp41, варьируют от почти полной отмены вирусной продукции до отсутствия воздействия относительно вируса, экспрессирующего мотив дикого типа. Действительно, S613A мутированный вирус сохранял свою абсолютную способность инфицировать МТ-2, в то время как K617A все еще демонстрировал 66±10% от уровня, наблюдаемого для дикого типа, а другие мутанты - менее чем 22%. По-видимому, W614A и S618A не способны устанавливать инфекцию в МТ-2 клетках (Фиг.2А). Эти данные подтверждали способностью данных мутантов осуществлять образование синцития с абсолютным отсутствием данных гигантских клеточных структур в клетках МТ-2, инфицированных либо W614A и S618A мутированных вирусов, по сравнению с диким типом (Фиг.2Б). Эти данные наводят на мысль о том, что оба положения, W614A и S618A, мотива 3S/gp41 могут играть критическую роль при вирусной инфекции.
Изучение кинетики инфицирования в очищенных CD4+ Т клетках показало, что дикий тип и S613A и K617A мутанты показали очень продуктивную репликацию вируса (вплоть до 187 пкг/мл р24) с пиком продукции р24, соответствующим 8 дням после инфицирования (Фиг.2В). Наоборот, независимо от периода времени инфекционный уровень S615A и N616A мутированных вирусов остается очень низким, с 13,5 и 17,3 пкг/мл на пике вирусной нагрузки соответственно, и остается неопределяемым в случае W614A и S618A (Фиг.2В). Похожие результаты наблюдали в присутствии инфицированных клеток Jurkat (данные не показаны).
Далее пытались определить, на какую стадию вирусного цикла влияла мутация в мотиве 3S/gp41. Для оценки инфекционности мутантов 3S/gp41 вирусные супернатанты из трансфицированных клеток 293Т тестировали на индикаторных клетках Hela P4C5, причем производная клеточная линия Hela содержала ВИЧ-LTR Lac-Z кассету, активируемую Tat при ВИЧ-1 инфицировании (Amara et al J Exp Med 1997). Как показано на Фиг.2Г, как у S613A, так и K617A мутантов сохраняется способность инфицировать клетки подобно дикому типу. Наоборот, в присутствии S615A, N616A и S618A мутантов уровень инфекционности по меньшей мере в 10 раз ниже, чем в случае дикого типа, и абсолютно неопределяемый в случае W614A мутанта. Это указывает на то, что специфичные замены в конкретных положениях в мотиве 3S/gp41 ингибируют поступление вируса в клетки CD4+ Т.
Пример 2: Точечные мутации в мотиве 3S/gp41 прекращают экспрессию NKp44L
Как показано ранее другими и авторами изобретения, ВИЧ-1 инфекция индуцирует экспрессию определенных NKR лигандов, включая NKp44L (Vieillard et al 2005; Ward et al 2007). Хотелось определить, способен ли вирус, содержащий 3S/gp41 замены, также вызывать экспрессию NKp44L на очищенных клетках CD4+ Т. После инфицирования вирусом дикого типа клетки с высокой частотой экспрессировали NKp44L (56,2%). Похожие результаты были получены на клетках CD4+ Т, инфицированных мутантами S613A или K617A, с 61,0 и 67,6% клеток, экспрессирующих NKp44L, соответственно. Более любопытен тот факт, что экспрессию не детектировали в случае других мутантов; W614A, S615A, N616A и S618A. В соответствии с прежними данными (Vieillard et al 2005; Ward et al 2007) экспрессия лигандов NKp30 и NKp46 не индуцировалась в клетках, инфицированных или диким типом, или мутированными по аланину 3S/gp41 вирусами независимо от положения замены (Фиг.3А).
Далее исследовали возможность того, что экспрессия NKp44L по-разному регулируется в отсутствие инфекционных частиц. Таким образом, в присутствии инактивированного нагреванием вируса (Фиг.6А) или после стимуляции синтетическими 38-пептидами, включая разные замены на аланин в мотиве 3S/gp41 (Фиг.3Б), были получены результаты, похожие с результатами, полученными в случае компетентного вируса, при сохранении замены их конкретного остатка. Действительно, экспрессия NKp44L индуцируется только в присутствии S613A и K617A мутированных элементов на уровне, близком с уровнем, наблюдаемым в случае дикого типа, тогда как другие неинфекционные частицы или пептиды-мутанты не способны индуцировать NKp44L.
Пример 3: Модуляция дегрануляции NK клеток в присутствии аутологических CD4+ Т клеток, инфицированных 3S/gp41 мутантами вируса
Поскольку обнаружили NKp44L на CD4+ Т клетках, инфицированных NL4.3 вирусом, содержащим конкретные 3S/gp41 мутации (Фиг.2А), исследовали возможность того, что клетки-мишени, экспрессирующие данный лиганд, являются более чувствительными к NK цитотоксичности. Очищенные CD4+ Т клетки, инфицированные или диким типом, или разными мутированными вирусами, инкубировали с аутологическими IL2-активированными NK клетками для определения их способности к дегрануляции. На Фиг.3В показано, что высокий уровень экспрессии CD107a в NKp44L+ NK клетках детектировали в присутствии вируса дикого типа (28,8%) или S613A (29,5%) и K617A (29,9%) мутантов по сравнению с неинфицированными клетками (4,2%) в соответствии с данными, показывающими высокий уровень экспрессии NKp44L в CD4+ Т клетках-мишенях (Фиг.3А). В отличие от других мутантов, для которых не наблюдают индукции NKp44L в клетках CD4+ Т, уровень дегрануляции остается почти близким к уровню дегрануляции, наблюдаемому в случае неинфицированных клеток (Фиг.3В). Похожие результаты получали в присутствии инактивированных нагреванием вирусных частиц (Фиг.6Б) и синтетических пептидов (Фиг.4Г).
В целом, данные результаты строго указывают на то, что замены специфичных остатков в пределах высококонсервативного 3S/gp41 мотива вызывают большие последствия, касающиеся модуляции чувствительности клеток-мишеней CD4+ к NK клеткам.
Пример 4: Элиситация 3S-подобных нейтрализующих антител широкого спектра действия в мышах
В связи с вышеизложенным проводили иммунизацию мышей диким типом и каждым мутированным по аланину 3S/gp41 пептидом для выработки специфичных антител. Для каждого из них наблюдали устойчивые иммунные ответы на свою специфичную последовательность 3S/gp41 при использовании ELISA с захватом свободных пептидов (данные не показаны). Любопытен тот факт, что величина перекрестной серологической реакции зависит от пептидного компонента; причем антисыворотка взаимодействует с каждым синтетическим пептидом прямо пропорционально своей способности индуцировать экспрессию NKp44L Таким образом, сильную перекрестную серологическую реакцию наблюдали между диким типом и S613A и K617A мутантами, тогда как данный эффект сильно снижается с другими мутантами, в соответствии с предполагаемыми конформационными модификациями, вызываемыми специфичными заменами.
Более того, целые иммуноглобулины (Ig) элюировали из каждой сыворотки для оценки их эффективности и широты действия нейтрализации на кладе R5 и Х4 ВИЧ-1 штаммах. Используя разные классические анализы нейтрализации с использованием клеток TZM-bl и Hela-P4C5, подтвердили присутствие значительной нейтрализующей активности антител к 3S дикого типа против ВИЧ-1 (Таблица 2 и 3), как ранее описано (Vieillard AIDS 2006). Похожие результаты наблюдали в присутствии очищенного Ig из иммунизированных S613A и K617A мутантных мышей. Неожиданно, высокую нейтрализующую активность широкого спектра действия детектировали для мутантов W614A, S615A, N616A и S618A. Действительно, значительные ответы были вызваны каждым из данных мутантов на разные Х4 (NL4.3, BRU, и NDK) и R5 (JR-CSF и YU-2) ВИЧ-1 штаммы со значением IC50, находящимся между 3,3 и 17,7 мг Ig/мл (Таблица 2). Более того, Ig из W614A способны нейтрализовать все тестируемые Х4 и R5 ВИЧ-1 штаммы со значением IC95, находящимся между 6,7 и 19,5 мкг/мл в клетках Hela-P4C5 (Таблица 2) и между 3,9 и 10,3 мкг/мл в клетках TZM-bl (Таблица 3), в зависимости от вирусов. Как и ожидалось, в присутствии штамма ВИЧ-2 (ROD) нейтрализующую активность не детектировали независимо от состояния (Таблица 3), что согласуется со специфичной делецией мотива 3S/gp41 в последовательностях штамма ВИЧ-2 (Vieillard PNAS 2005).
Для окончательного подтверждения этих данных определяли эффективность вирусной нейтрализации посредством детекции продукции р24 очищенных клеток CD4+ Т, инфицированных NL4.3 или NDK штаммами ВИЧ-1. На Фиг.4А подтверждается отсутствие нейтрализующей активности против NL4.3, вызываемой Ig из WT или мутантов S613A и K617A, независимо от их концентрации. Наоборот, значительное снижение продукции р24 наблюдали в присутствии Ig из мутантов W614A, S615A, N616A и S618A. Интересно то, что при концентрации, превосходящей 10 мкг/мл Ig из W614A, антиген р24 остается неопределяемым. Похожие результаты наблюдали после инфицирования NDK (Фиг.4А). Кроме того, изучение кинетики показало, что продукция р24 полностью прекращается при 10 мкг/мл Ig из мутанта W614A независимо от времени после инфицирования и значительно задерживается в случае Ig из S615A, N616A и S618A мутантов по сравнению с диким типом и мутантами S613A и K617A (Фиг.4Б). В общем, эти данные всецело подтверждают, что замена в конкретных положениях в высококонсервативном мотиве 3S/gp41 вызывала образование нейтрализующей активности широкого спектра действия в мышах.
Для дополнительной оценки эффективности ингибирования NKp44L, осуществляемого Ig, очищенным из мутантов 3S/gp41 по аланину, очищенные клетки CD4+ Т от здоровых доноров инкубировали с пептидом 3S/gp41 дикого типа, предварительно обработанным очищенным Ig из иммунизированных мышей. На Фиг.4В показано, что 3S-индуцируемая экспрессия NKp44L значительно снижается в присутствии Ig из 3S-WT (9,4%) по сравнению с контрольными клетками (35,5%), что соответствует прежним данным, полученным с mAb против 3S дикого типа (Vieillard et al PNAS 2005). Кроме того, сильное ингибирование экспрессии NKp44L также наблюдали в присутствии 3S/gp41 мутантов по аланину, но чуть более выраженное в случае Ig из S613A и K617A, чем W614A, S615A, N616A и S618A мутантов (Фиг.4В). Эти результаты согласуются с данными по дегрануляции IL-2-активированных NK клеток относительно аутологических клеток CD4+ Т, обработанных 3S-пептидом в присутствии антител из WT или мутантов 3S/gp41 по аланину. Таким образом, дегрануляция ингибировалась как в WT на 91,4%, так и в мутантах 3S/gp41 по аланину на 78,3±4,8%, независимо от положения замены (Фиг.4Г). Это показало, что Ig, образованные в ответ на 3S/gp41 пептид со специфичными заменами, приобретают нейтрализующую способность широкого спектра действия при защите, делая возможным ингибирование экспрессии NKp44L в CD4+ Т клетках.
Пример 5: NAb широкого спектра действия против W614A 3S мутанта в плазме от ВИЧ-1-инфицированных пациентов
Недавно показали, что активность реакционноспособных Nab широкого спектра действия, по-видимому, развивается со временем у ВИЧ-1-инфицированных пациентов. Для получения информации по частоте, с которой индуцируется образование bNAb к замещенному 3S/gp41 мотиву, при ВИЧ инфекции, проанализировали нейтрализующую активность в 106 образцах плазмы, полученных от ВИЧ-1-инфицированных пациентов с различным клиническим состоянием. Из 106 оцененных образцов 55/106 (52%) имели обнаруживаемый уровень антител к 3S-WT со значениями, находящимися в интервале между 15 и 325 AU (оптическая единица)/мл. Тест Спирмена показывает высокозначимую взаимосвязь между количеством антител к 3S и числом CD4 клеток (p<0,0001) (данные не показаны), как описано (Vieillard et al AIDS 2006). Неожиданно, антитела, специфично направленные против W614A мутированного мотива 3S/gp41, детектировали в 5 из 106 образцах плазмы (4,7%) с помощью ELISA. Для каждого из них высокий уровень антител был детектируемым (находящийся между 120 и 250 AU/мл). Данные специфичные антитела представляли собой изотипы IgG (данные не показаны), и их исключительно детектировали у пациентов с высоким числом CD4 (822±89 CD4/мм3) и недетектируемой вирусной нагрузкой (ниже, чем 20 копий/мл) (Таблица 3). Следует отметить, что данные антитела, специфично направленные против W614A мутированного 3S/gp41 мотива, не являются детектируемыми в плазме здоровых доноров (данные не показаны), а также антитела к мотиву дикого типа (Vieillard et al AIDS 2006).
Образцы плазмы от данных 5 необычных пациентов исследовали, и уровни нейтрализации, выраженные как кратность разбавления плазмы, показали нейтрализующую активность против ВИЧ кросс-клады для всех данных образцов плазмы, с IC50>100 для всех из них, в присутствии Х4 NL4.3 и R5 YU-2 вирусов. Интересно, что плазма из 1 из данных пациентов (#109) нейтрализовала по меньшей мере 95% ВИЧ частиц (Таблица 3). Для подтверждения того, что нейтрализующая активность связана с антителом, специфично направленным против W614A 3S/gp41 мутированного мотива, антитела из сывороток 5 ВИЧ-инфицированных пациентов очищали иммуносорбционным методом с соответствующим синтетическим пептидом. Данные элюированные антитела показывают значительную нейтрализующую активность с IC50 значениями, находящимися в интервале между <0,2 и 1,9 мкг/мл, или <0,2 и 1,9 мкг/мл, в клетках Hela-P4C5 и TZM-bl соответственно, для по меньшей мере двух разных ВИЧ-1 штаммов (Таблица 3). Поразительно, очищенные антитела от 1 из 5 пациентов (#109) показывают похожую широту нейтрализующей активности против всех Х4 и R5 ВИЧ штаммов с IC95, находящейся между 0,6 и 1,9 мкг/мл, независимо от анализа нейтрализации (Таблица 3). Эти данные подтверждали продукцией р24 на очищенных CD4+ Т клетках, показывающих сильную нейтрализующую активность, варьирующую между 0,2 и 1,0 мкг/мл и 0,11 и 1,8 мкг/мл после инфицирования NL4.3 и NDK соответственно (Фиг 5А). Кроме того, изучение кинетики показывает, что продукция р24 в супернатанте, не содержащем клеток, очень значительно снижается в случае 1 мкг/мл очищенных иммуносорбционным методом антитела от ВИЧ-1-инфицированных пациентов, независимо от времени после инфицирования, по сравнению с контролями (Фиг.5Б).
Далее, хотели определить эффект ингибирования NKp44L, осуществляемого данными нейтрализующими bNAb, которые специфично распознают W614A 3S/gp41 мутированный мотив, очищенный из ВИЧ-1-инфицированных пациентов. На Фиг.5В показано, что все NAb против W614A сохраняли свои способности ингибировать NKp44L по сравнению с 3S-сенсибилизированными контрольными клетками; однако по сравнению с антителом к 3S-gp41 дикого типа из мышей или очищенными из ВИЧ-1 пациента (#117) эффективность немного снижена. Действительно, 21,9% клеток экспрессировали NKp44L в присутствии очищенного Ab против 3S-WT, тогда как от 21,9 до 34,6% клеток остаются NKp44L+ после обработки bNAb против W614A мутированного 3S/gp41 от ВИЧ-1-инфицированных пациентов. Важно, что совместно культивируемые аутологические CD4+ Т клетки, обработанные диким типом или очищенным антителом к W614A 3S/gp41, с аутологическими IL2-активированными NK клетками показали, что экспрессия CD107a значительно снижена или прекращена со значениями, варьирующими между 1,8 и 7,8% CD107a+NKp44+NK клеток, по сравнению с 28,6% в случае NK клеток, совместно культивированных с 3S-сенсибилизированными клетками мишенями CD4+ Т в отсутствие Ab (Фиг.5Г). В общей сложности эти данные показывают, что элиситация естественных bNAb против специфичной мутированной формы мотива 3S/gp41 наблюдается у некоторых инфицированных ВИЧ-1, обладая дихотомическими эффектами, объединяя как нейтрализацию вируса, так и ингибирование истощения популяции CD4.
Реферат
Настоящее изобретение относится к биохимии, в частности к иммуногенным композициям против ВИЧ-1, содержащим фармацевтически приемлемый носитель и антигенный пептид, выбранный из группы, состоящей из PWNASASNKSLDDIW, PWNASWANKSLDDIW, PWNASWSAKSLDDIW и PWNASWSNKALDDIW. Указанный антигенный пептид может быть ковалентно связан с молекулой-носителем. Настоящее изобретение также раскрывает способ с использованием указанных антигенных пептидов для детектирования антител к указанным антигенным пептидам в образце, и набор, содержащий указанные антигенные пептиды, для осуществления указанного способа. Способ предусматривает контактирование антигенных пептидов согласно изобретению с образцом и детектирование образования комплексов между указанными антигенными пептидами и антителами. Настоящее изобретение также раскрывает способ и набор для количественного определения антител к антигенным пептидам согласно изобретению. Настоящее изобретение позволяет расширить арсенал средств для лечения или предупреждения инфекции, вызванной ВИЧ-1. 8 н. и 4 з.п. ф-лы, 6 ил., 4 табл., 5 пр.
Формула
- PWNASASNKSLDDIW (SEQ ID №12),
- PWNASWANKSLDDIW (SEQ ID №13),
- PWNASWSAKSLDDIW (SEQ ID №14), и
- PWNASWSNKALDDIW (SEQ ID №15).
- PWNASASNKSLDDIW (SEQ ID №12),
- PWNASWANKSLDDIW (SEQ ID №13),
- PWNASWSAKSLDDIW (SEQ ID №14), и
- PWNASWSNKALDDIW (SEQ ID №15),
где указанный антигенный пептид ковалентно связан с молекулой-носителем.
- PWNASASNKSLDDIW (SEQ ID №12),
- PWNASWANKSLDDIW (SEQ ID №13),
- PWNASWSAKSLDDIW (SEQ ID №14), и
- PWNASWSNKALDDIW (SEQ ID №15).
а) приведение образца, подлежащего тестированию, в контакт с одним или более чем одним антигенным пептидом, как определено в любом из пп. 7 или 8, и
б) детектирование образования комплексов между указанными антигенными пептидами и антителами, присутствующими в указанном образце.
а) один или более чем один антигенный пептид, как определено в любом из пп. 7 или 8, и
б) один или более чем один реагент для детектирования комплексов, образованных между указанными антигенными пептидами и антителами, присутствующими в указанном образце.
а) приведение образца, подлежащего тестированию, в контакт с одним или более чем одним антигенным пептидом, как определено в любом из пп. 7 или 8, и
б) количественное определение образования комплексов между указанными пептидами и антителами, присутствующими в указанном образце.
а) один или более чем один антигенный пептид, как определено в любом из пп. 7 или 8, и
б) один или более чем один реагент для детектирования комплексов, образованных между указанными антигенными пептидами и антителами, присутствующими в указанном образце.

Комментарии