Композиция вакцины и способ применения - RU2015146762A
Код документа: RU2015146762A
Формула
1. Композиция вакцины, содержащая: по меньшей мере от приблизительно 1 мкг до приблизительно 200 мкг растворимого белка F RSV и по меньшей мере от приблизительно 1 мкг до приблизительно 20 мкг адъюванта, содержащего липидный агонист toll-подобного рецептора (TLR).
2. Композиция вакцины по п. 1, в которой у растворимого белка F RSV отсутствует C-концевой трансмембранный домен.
3. Композиция вакцины по п. 1 или 2, в которой у растворимого белка F RSV отсутствует цитоплазматический хвостовой домен.
4. Композиция вакцины по любому из пп. 1-3, в которой растворимый белок F RSV содержит аминокислоты 1-524 растворимого белка F RSV из штамма А2, патогенного для человека (SEQ ID NO: 2).
5. Композиция вакцины по любому из пп. 1-4, в которой растворимый белок F RSV содержит SEQ ID NO: 7.
6. Композиция вакцины по любому из пп. 1-5, в которой адъювант содержит агонист (TLR)4.
7. Композиция вакцины по любому из пп. 1-6, в которой адъювант содержит синтетическое гексилированное производное липида A.
8. Композиция вакцины по любому из пп. 1-7, в которой адъювант содержит глюкопиранозил-липид A (GLA).
9. Композиция вакцины по любому из пп. 1-8, в которой адъювант содержит соединение, имеющее формулу:
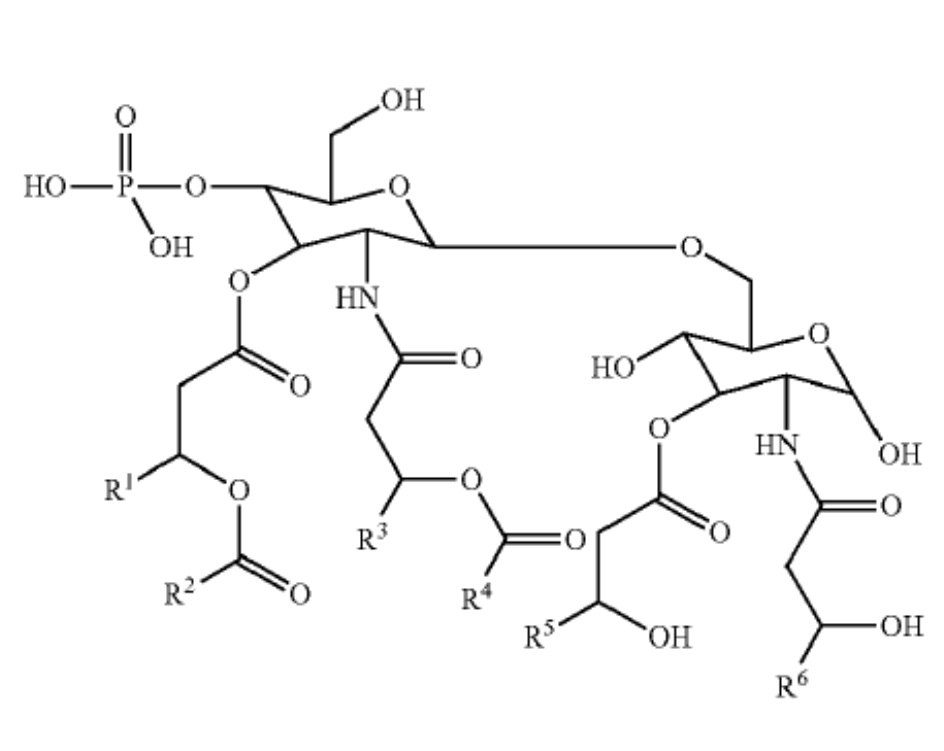
где R1, R3, R5 и R6 представляют собой C11-C20алкил; и R2 и R4 представляют собой C12-C20алкил.
10. Композиция вакцины по любому из пп. 1-9, в которой адъювант содержит GLA в стабильной эмульсии типа масло в воде (GLA-SE).
11. Композиция вакцины по любому из пп. 1-10, в которой адъювант содержит GLA в стабилизированной эмульсии на основе сквалена.
12. Композиция вакцины по любому из пп. 1-11, в которой адъювант содержит GLA в стабилизированной эмульсии типа масло в воде, имеющей концентрацию по меньшей мере от приблизительно 1% до приблизительно 5%.
13. Композиция вакцины по любому из пп. 1-12, в которой адъювант содержит GLA в стабилизированной эмульсии типа масло в воде, имеющей средний размер частиц по меньшей мере от приблизительно 50 нм до приблизительно 200 нм.
14. Композиция вакцины по любому из пп. 1-13, содержащая по меньшей мере приблизительно 5 мкг растворимого белка F RSV.
15. Композиция вакцины по любому из пп. 1-14, содержащая по меньшей мере приблизительно 10 мкг растворимого белка F RSV.
16. Композиция вакцины по любому из пп. 1-15, содержащая по меньшей мере приблизительно 20 мкг растворимого белка F RSV.
17. Композиция вакцины по любому из пп. 1-16, содержащая по меньшей мере приблизительно 30 мкг растворимого белка F RSV.
18. Композиция вакцины по любому из пп. 1-17, содержащая по меньшей мере приблизительно 50 мкг растворимого белка F RSV.
19. Композиция вакцины по любому из пп. 1-18, содержащая по меньшей мере приблизительно 100 мкг растворимого белка F RSV.
20. Композиция вакцины по любому из пп. 1-19, содержащая по меньшей мере приблизительно 2,5 мкг адъюванта.
21. Композиция вакцины по любому из пп. 1-20, содержащая по меньшей мере приблизительно 5 мкг адъюванта.
22. Композиция вакцины по любому из пп. 1-21, содержащая от приблизительно 10 мкг до приблизительно 100 мкг растворимого белка F RSV и от приблизительно 1 мкг до приблизительно 5 мкг GLA-SE.
23. Композиция вакцины по п. 1, содержащая от приблизительно 10 мкг до приблизительно 100 мкг растворимого белка F RSV, в которой растворимый белок F RSV содержит аминокислоты 1-524 растворимого белка F RSV из штамма A2, патогенного для человека (SEQ ID NO: 2), и от приблизительно 1 мкг до приблизительно 5 мкг GLA в стабилизированной эмульсии типа масло в воде, имеющей концентрацию от приблизительно 1% до 5%.
24. Композиция вакцины по любому из пп. 1-23, дополнительно содержащая фармацевтически приемлемый носитель, разбавитель, эксципиент или их комбинацию.
25. Композиция вакцины по любому из пп. 1-24, составленная для парентерального введения.
26. Композиция вакцины по любому из пп. 1-25, составленная для внутримышечного введения.
27. Композиция вакцины по любому из пп. 1-26, составленная для подкожного введения.
28. Композиция вакцины по любому из пп. 1-27, характеризующаяся объемом от приблизительно 50 мкл до приблизительно 500 мкл.
29. Способ профилактики инфекции респираторного синцитального вируса (RSV) у млекопитающего, включающий: введение млекопитающему терапевтически эффективного количества композиции вакцины, содержащей: по меньшей мере от приблизительно 1 мкг до приблизительно 200 мкг растворимого белка F RSV при некоторой его концентрации и по меньшей мере от приблизительно 1 мкг до приблизительно 20 мкг адъюванта, содержащего липидный агонист toll-подобного рецептора (TLR), достаточного для предупреждения инфекции RSV у млекопитающего.
30. Способ индуцирования иммунного ответа у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества композиции вакцины, содержащей: по меньшей мере от приблизительно 1 мкг до приблизительно 200 мкг растворимого белка F RSV при некоторой его концентрации и по меньшей мере от приблизительно 1 мкг до приблизительно 20 мкг адъюванта, содержащего липидный агонист toll-подобного рецептора (TLR), достаточного для выработки защитного иммунного ответа у млекопитающего.
31. Способ усиления Th1-смещенного клеточного иммунного ответа у млекопитающего, который ранее подвергался воздействию RSV, включающий: введение млекопитающему терапевтически эффективного количества композиции вакцины, содержащей: по меньшей мере от приблизительно 1 мкг до приблизительно 200 мкг растворимого белка F RSV при некоторой его концентрации и по меньшей мере от приблизительно 1 мкг до приблизительно 20 мкг адъюванта, содержащего липидный агонист toll-подобного рецептора (TLR), достаточного для усиления Th1-смещенного клеточного иммунного ответа у млекопитающего.
32. Способ по п. 31, в котором клеточный иммунный ответ млекопитающего включает Th1-клеточный иммунный ответ и Th2-клеточный иммунный ответ при соотношении по меньшей мере приблизительно 1,2:1.
33. Способ по п. 31, в котором при клеточном иммунном ответе у млекопитающего преобладает IFNγ.
34. Способ реверсии Th2-смещенного иммунного ответа у млекопитающего, включающий: введение млекопитающему терапевтически эффективного количества композиции вакцины, содержащей: по меньшей мере от приблизительно 1 мкг до приблизительно 200 мкг растворимого белка F RSV при некоторой его концентрации и по меньшей мере от приблизительно 1 мкг до приблизительно 20 мкг адъюванта, содержащего липидный агонист toll-подобного рецептора (TLR), достаточного для реверсии Th2-смещенного иммунного ответа у млекопитающего.
35. Способ индуцирования нейтрализующих антител к RSV у млекопитающего, включающий: введение млекопитающему терапевтически эффективного количества композиции вакцины, содержащей: по меньшей мере от приблизительно 1 мкг до приблизительно 200 мкг растворимого белка F RSV при некоторой его концентрации и по меньшей мере от приблизительно 1 мкг до приблизительно 20 мкг адъюванта, содержащего липидный агонист toll-подобного рецептора (TLR), достаточного для индуцирования нейтрализующих антител к RSV у млекопитающего.
36. Способ по п. 35, в котором титры нейтрализующих антител к RSV составляют более 10,0 Log2.
37. Способ по п. 35, в котором титры нейтрализующих антител к RSV после введения композиции вакцины включают сывороточные титры IgG, которые превышают сывороточные титры IgG до введения по меньшей мере в от приблизительно 10 раз до приблизительно 200 раз.
38. Способ снижения титров вируса RSV у млекопитающего, включающий: введение млекопитающему терапевтически эффективного количества композиции вакцины, содержащей: по меньшей мере от приблизительно 1 мкг до приблизительно 200 мкг растворимого белка F RSV при некоторой его концентрации и по меньшей мере от приблизительно 1 мкг до приблизительно 20 мкг адъюванта, содержащего липидный агонист toll-подобного рецептора (TLR), достаточного для индуцирования нейтрализующих антител к RSV у млекопитающего.
39. Способ по п. 38, в котором титры вируса RSV снижаются в от приблизительно 50 до приблизительно 1000 раз.
40. Способ по п. 38, в котором титры вируса RSV составляют менее 2 log 10 БОЕ/г после введения композиции вакцины.
41. Способ по п. 38, в котором титры вируса RSV составляют менее 2 log 10 БОЕ/г через от приблизительно 1 недели до 1 года после введения композиции вакцины.
42. Способ по любому из пп. 29-41, в котором млекопитающим является человек.
43. Способ по любому из пп. 29-42, в котором млекопитающим является пожилой человек.
44. Способ по любому из пп. 29-43, в котором млекопитающим является пожилой человек, который достиг календарного возраста по меньшей мере приблизительно 50 лет.
45. Способ по любому из пп. 29-43, в котором млекопитающим является пожилой человек, который достиг календарного возраста по меньшей мере приблизительно 55 лет.
46. Способ по любому из пп. 29-43, в котором млекопитающим является пожилой человек, который достиг календарного возраста по меньшей мере приблизительно 60 лет.
47. Способ по любому из пп. 29-43, в котором млекопитающим является пожилой человек, который достиг календарного возраста по меньшей мере приблизительно 65 лет.
48. Способ по любому из пп. 29-47, в котором млекопитающее является RSV-серопозитивным.
49. Способ по любому из пп. 29-48, включающий однократный режим введения.
50. Способ по любому из пп. 29-48, включающий двукратный режим введения, который включает первую и вторую дозы.
51. Способ по п. 50, в котором вторую дозу вводят по меньшей мере через приблизительно 1 неделю после первой дозы.
52. Способ по п. 50, в котором вторую дозу вводят по меньшей мере через приблизительно 1 месяц после первой дозы.
53. Способ по п. 50, в котором вторую дозу вводят по меньшей мере через приблизительно 1 год после первой дозы.
54. Способ по любому из пп. 29-53, в котором композицию вакцины вводят парентерального.
55. Способ по любому из пп. 29-54, в котором композицию вакцины вводят внутримышечно.
56. Способ по любому из пп. 29-54, в котором композицию вакцины вводят подкожно.
57. Способ по любому из пп. 29-56, в котором у растворимого белка F RSV отсутствует C-концевой трансмембранный домен.
58. Способ по любому из пп. 29-57, в котором у растворимого белка F RSV отсутствует цитоплазматический хвостовой домен.
59. Способ по любому из пп. 29-58, в котором растворимый белок F RSV содержит аминокислоты 1-524 растворимого белка F RSV из штамма A2, патогенного для человека (SEQ ID NO: 2).
60. Способ по любому из пп. 29-59, в котором растворимый белок F RSV содержит SEQ ID NO: 7.
61. Способ по любому из пп. 29-60, в котором адъювант содержит агонист (TLR)4.
62. Способ по любому из пп. 29-61, в котором адъювант содержит синтетическое гексилированное производное липида A.
63. Способ по любому из пп. 29-62, в котором адъювант содержит глюкопиранозил-липид A (GLA).
64. Способ по любому из пп. 29-63, в котором адъювант содержит соединение, имеющее формулу:

где R1, R3, R5 и R6 представляют собой C11-C20алкил; и R2 и R4 представляют собой C12-C20алкил.
65. Способ по любому из пп. 29-64, в котором адъювант содержит GLA в стабильной эмульсии типа масло в воде (GLA-SE).
66. Способ по любому из пп. 29-65, в котором адъювант содержит GLA в стабилизированной эмульсии на основе сквалена.
67. Способ по любому из пп. 29-66, в котором адъювант содержит GLA в стабилизированной эмульсии типа масло в воде, имеющей концентрацию по меньшей мере от приблизительно 1% до приблизительно 5%.
68. Способ по любому из пп. 29-67, в котором адъювант содержит GLA в стабилизированной эмульсии типа масло в воде, имеющей средний размер частиц по меньшей мере от приблизительно 50 нм до приблизительно 200 нм (100 нм).
69. Способ по любому из пп. 29-68, включающий по меньшей мере приблизительно 5 мкг растворимого белка F RSV.
70. Способ по любому из пп. 29-69, включающий по меньшей мере приблизительно 10 мкг растворимого белка F RSV.
71. Способ по любому из пп. 29-70, включающий по меньшей мере приблизительно 20 мкг растворимого белка F RSV.
72. Способ по любому из пп. 29-71, включающий по меньшей мере приблизительно 30 мкг растворимого белка F RSV.
73. Способ по любому из пп. 29-72, включающий по меньшей мере приблизительно 50 мкг растворимого белка F RSV.
74. Способ по любому из пп. 29-73, включающий по меньшей мере приблизительно 100 мкг растворимого белка F RSV.
75. Способ по любому из пп. 29-74, включающий по меньшей мере приблизительно 2,5 мкг адъюванта.
76. Способ по любому из пп. 29-75, включающий по меньшей мере приблизительно 5 мкг адъюванта.
77. Способ по любому из пп. 29-76, включающий от приблизительно 10 мкг до приблизительно 100 мкг растворимого белка F RSV и от приблизительно 1 мкг до приблизительно 5 мкг GLA-SE.
78. Способ по любому из пп. 29-77, включающий от приблизительно 10 мкг до приблизительно 100 мкг растворимого белка F RSV, в котором растворимый белок F RSV содержит аминокислоты 1-524 растворимого белка F RSV из штамма A2, патогенного для человека (SEQ ID NO: 2), и от приблизительно 1 мкг до приблизительно 5 мкг GLA в стабилизированной эмульсии типа масло в воде, имеющей концентрацию по меньшей мере от приблизительно 1% до 5%.
79. Способ по любому из пп. 29-78, в котором композиция вакцины дополнительно содержит фармацевтически приемлемый носитель, разбавитель, эксципиент или их комбинацию.
80. Способ по любому из пп. 29-79, в котором композиция вакцины составлена для парентерального введения.
81. Способ по любому из пп. 29-80, в котором композиция вакцины составлена для внутримышечного введения.
82. Способ по любому из пп. 29-80, в котором композиция вакцины составлена для подкожного введения.
83. Способ по любому из пп. 29-82, в котором композиция вакцины включает объем от приблизительно 50 мкл до приблизительно 500 мкл.

Комментарии