Слитые клетки-партнеры - RU2431667C9
Код документа: RU2431667C9
Чертежи







Описание
Область техники
Настоящее изобретение относится к слитым клеткам и гибридомам.
Предпосылки изобретения
Гибридомы (слитые клетки) используются для получения веществ с помощью культур клеток. Существует много животных клеток, которые продуцируют коммерчески или академически полезные вещества. Однако обычно трудно культивировать животные клетки, и не существует способа стабильного культивирования животных клеток в течение длительного периода с сохранением их способности продуцировать вещества. В таких обстоятельствах был предложен способ создания клеток, имеющих оба признака - способность к росту в культуре и способность продуцировать вещества. Этим способом созданы гибридомы посредством слияния клеток, продуцирующих биологически активное вещество, а в качестве клеток-партнеров слияния миеломных клеток, которые можно неограниченно и стабильно пересевать in vitro.
Когда моноклональные антитела продуцируют посредством слияния клеток, гибридомы проверяют по таким характеристикам как производительность антител и связывающая способность, и отобранные клетки клонируют до гомогенности. Тогда клетки вырастают в гомогенную клеточную популяцию и продуцируют моноклональные антитела. Такие гибридомы выращивают в культурах in vitro или in vivo (в асците) и развивают до продукции антител в большом масштабе. Способ создания моноклональных антител с использованием слияния клеток уже известен (см. непатентный документ 1). Предполагается, что моноклональные антитела являются более специфичными по сравнению с поликлональными антителами, очищенными из антисывороток. Таким образом, моноклональные антитела используют в качестве мощного инструмента в различных иммунологических исследованиях.
Когда слитые клетки принадлежат одному виду, их просто называют «гибридомами». В основном этим способом получают мышиные моноклональные антитела и т.п. С другой стороны, антителопродуцирующие клетки, полученные при слиянии клеток, выделенных из особых видов с бессмертными клетками, полученными от разных видов, называют «гетерогибридомами». Термин «гетерогибрид» является синонимом гетерологичного слияния, и полученные клетки называют «гетерогибридомами». Кроме того, антителопродуцирующие клетки, полученные путем слияния клеток, полученных из трех видов животных, называют «триомами». Полученные этим способом моноклональные антитела представляют собой антитела крыс и хомяков. Гетерогибридомы между мышью и крысой или между мышью и хомяком получены путем слияния мышиных миеломных клеток с лимфоцитами, полученными из крыс или хомяков, которым был введен представляющий интерес антиген. Полученные таким образом гетерогибридомы клонируют, обеспечивая производство моноклональных антител, полученных из каждого иммунизированного животного.
До настоящего времени публиковались сообщения о гетерогибридомах, продуцирующих моноклональные антитела человека, кролика, коровы и овцы (см. непатентные документы 2-5 и патентные документы 1 и 2).
Однако продукция моноклональных антител гетерогибридомами считается более затрудненной, так как филогенетическое расстояние между клетками биологических видов, подвергаемыми слиянию, увеличивается. Например, крайне трудно продуцировать антитела с использованием гибридом между мышью и кроликом или между мышью и человеком. Так как гибридомы имеют аберрантное число хромосом, при сегрегации дочерним клеткам не всегда достаются одинаковые пары хромосом, и некоторые хромосомы могут быть потеряны.
Непатентный документ 1: Waldman, T., Science 252:1657-1662 1991
Непатентный документ 2: Proc. Natl. Acad. Sci. USA 80:7308-7312, 1983
Непатентный документ 3: Raybould et al., Science 240:1788-1790, 1988
Непатентный документ 4: Kennedy et al., J. Gen. Virol. 69:3023-3032, 1988
Непатентный документ 5: Flynn et al., J. Immunol. Methods 121:237-246, 1989
Патентный документ 1: патент США № 4634664 specification
Патентный документ 2: патент США № 4977081 specification
Описание изобретения
Решаемые в данном изобретении проблемы
Целью настоящего изобретения является предоставление способов, которые обеспечили бы стабильное и несложное продуцирование веществ с использованием гибридом в широком диапазоне видов животных. В частности, целью настоящего изобретения является получение новых партнеров слияния, эффективных для получения гибридом, и способов получения партнеров слияния. Другой целью настоящего изобретения является обеспечение продукции гибридом, полученных путем слияния клеток, продуцирующих вещество, и партнеров слияния, полученных согласно настоящему изобретению, способы получения гибридом и способы получения веществ с использованием таких гибридом.
Способы решения проблем
В производстве веществ с использованием техник слияния клеток существуют различные проблемы, не касающиеся клеток некоторых животных, таких как мышь. Например, не существует пригодной клетки, которую можно использовать в качестве партнера слияния при слиянии клеток, и это является существенной проблемой, которая должна быть преодолена в техниках слияния клеток других животных. Авторы настоящего изобретения обнаружили, что клетка, пригодная в качестве партнера слияния, может быть получена путем слияния особых типов клеток. Стабильные гибридомы предоставлены путем слияния немышиных клеток с клетками-партнерами слияния, созданными авторами настоящего изобретения. Авторы изобретения показали, что полученные таким образом гибридомы стабильно сохраняли фенотип в течение всего процесса клонирования и были так же пригодны, как и клетки, продуцирующие вещество. Таким образом авторы настоящего изобретения его и осуществили. Кроме того, они показали, что антитела, специфически распознающие антигены, могут быть получены с использованием гибридом согласно изобретению.
В частности, настоящее изобретение относится к описанным ниже клеткам-партнерам слияния и гибридомам между клетками-партнерами слияния и продуцирующими вещество клетками. Настоящее изобретение относится также к способам получения этих клеток и способам производства веществ с использованием гибридом.
[1] Клетка-партнер слияния, которая может быть получена путем слияния:
(а) миеломной клетки, полученной из животного первого биологического вида, и
(б) лейкозной клетки, полученной из животного второго биологического вида, в клеточном цикле которой есть дополнительная S-фаза;
[2] клетка-партнер слияния по п. [1], где животное первого биологического вида представляет собой мышь, и миеломная клетка выбрана из группы, состоящей из линий мышиных миеломных клеток MOPC21, P3X63AG8, SP2/0, NS-1, P3.X63AG8.653, F0, S194/5.XXO.BU-1, FOX-NY, и SP2/0-Ag14 и клеточных линий, полученных из этих клеточных линий;
[3] клетка-партнер слияния по п. [1], где животное второго биологического вида представляет собой человека, и лейкозная клетка выбрана из группы, состоящей из лейкозных клеточных линий MEG-01, HEL, UT-7, M07e, MEG-A2, и DAMI и клеточных линий, полученных из этих клеточных линий;
[4] клетка-партнер слияния по п. [1], где миеломная клетка, полученная из животного первого биологического вида, представляет собой SP2/0-Ag14, и лейкозная клетка, полученная из животного второго биологического вида, представляет собой MEG-01;
[5] клетка-партнер слияния SPYMEG, депонированная под инвентарным номером FERM BP-10761;
[6] гибридома, которую можно получить путем слияния
(1) клетки-партнера слияния, которая может быть получена путем слияния
(а) миеломной клетки, полученной из животного первого биологического вида, и
(б) лейкозной клетки, полученной из животного второго биологического вида, в клеточном цикле которой имеется дополнительная S-фаза, и
(2) третьей клетки;
[7] гибридома по п. [6], где животное первого биологического вида представляет собой мышь, и миеломная клетка выбрана из группы, состоящей из линий мышиных миеломных клеток MOPC21, P3X63AG8, SP2/0, NS-1, P3.X63AG8.653, F0, S194/5.XXO.BU-1, FOX-NY, и SP2/0-Ag14 и клеточных линий, полученных из этих клеточных линий;
[8] гибридома по п. [6], где животное второго биологического вида представляет собой человека, и лейкозная клетка выбрана из группы, состоящей из лейкозных клеточных линий MEG-01, HEL, UT-7, M07e, MEG-A2, и DAMI и клеточных линий, полученных из этих клеточных линий;
[9] гибридома по п. [6], где миеломная клетка, полученная из животного первого биологического вида, представляет собой SP2/0-Ag14, и лейкозная клетка, полученная из животного второго биологического вида, представляет собой MEG-01;
[10] гибридома по п. [6], где клетка-партнер слияния представляет собой SPYMEG, депонированную под инвентарным номером FERM BP-10761;
[11] гибридома по п. [6], где третья клетка представляет собой клетку, полученную из животного того же биологического вида, из которого была получена лейкозная клетка;
[12] гибридома по п. [11], где третья клетка представляет собой антителопродуцирующую клетку;
[13] способ получения клетки-партнера слияния, предусматривающий следующие стадии:
(1) слияние
(а) миеломной клетки, полученной из животного первого биологического вида, и
(б) лейкозной клетки, полученной из животного второго биологического вида, жизненный цикл которой содержит дополнительную S-фазу, и
(2) культивирование клеток, слитых на стадии (1), и сбор клеток-партнеров слияния из культуры;
[14] способ получения гибридомы, предусматривающий следующие стадии:
(1) слияние антителопродуцирующей клетки с клеткой-партнером слияния, полученной способом по п. [13], и
(2) культивирование клеток, слитых на стадии (1), и сбор гибридомы из культуры;
[15] способ получения антителопродуцирующей клетки, предусматривающий следующие стадии:
(1) получение гибридомы путем слияния антителопродуцирующей клетки с клеткой-партнером слияния, полученной способом по п. [13], и
(2) сбор полученной на стадии (1) гибридомы в качестве антителопродуцирующей клетки;
[16] способ по п. [15], дополнительно предусматривающий стадию клонирования гибридомы, полученной на стадии (1);
[17] способ производства антител, предусматривающий следующие стадии:
(1) получение гибридомы путем слияния антителопродуцирующей клетки с клеткой-партнером слияния, полученной способом по п. [13], и
(2) культивирование гибридомы, полученной на стадии (1), и сбор антител из культуры;
[18] способ по п. [17], дополнительно предусматривающий стадию клонирования гибридомы, полученной на стадии (1);
[19] способ производства антител против инфекционного заболевания, предусматривающий следующие стадии:
(1) получение гибридомы путем слияния клетки-партнера слияния, полученной способом по п. [13], с антителопродуцирующей клеткой, полученной из субъекта, который подвергался воздействию патогенетического антигена инфекционного заболевания, и
(2) культивирование гибридомы, полученной на стадии (1), и сбор антител против инфекционного заболевания из культуры, и
[20] способ по п. [19], где инфекционное заболевание представляет собой грипп, СПИД или вирусный гепатит.
Альтернативно, настоящее изобретение относится к применению слитых клеток в качестве клеток-партнеров слияния, которые могут быть получены путем слияния клеток (а) и (б), описанных ниже. В частности, настоящее изобретение относится к применению слитых клеток в качестве клеток-партнеров слияния, которые должны быть слиты с антителопродуцирующими клетками:
(а) миеломные клетки, полученные из животного первого биологического вида, и
(б) лейкозные клетки, полученные из животного второго биологического вида, клеточный цикл которых содержит дополнительную S-фазу.
Эффекты изобретения
Настоящее изобретение относится к клеткам-партнерам слияния, которые при слиянии с гетерологичными клетками дают возможность получения стабильных гибридом. Гибридомы, полученные путем слияния клеток с клетками-партнерами слияния согласно изобретению, стабильно продуцируют вещества. В частности, слияние между антителопродуцирующими клетками и клетками-партнерами слияния согласно изобретению приводит к тому, что полученные гибридомы продуцируют антитела, полученные из антителопродуцирующих клеток. В предпочтительном варианте осуществления слияние между клетками-партнерами слияния согласно изобретению и человеческими или мышиными антителопродуцирующими клетками приводит к тому, что полученные гибридомы продуцируют, соответственно, человеческие или мышиные антитела. Ранее полагали, что сложно поддерживать человеческие антителопродуцирующие клетки. Таким образом, настоящее изобретение связано с достоверным эффектом в виде предоставления клеток, которые стабильно продуцируют антитела человека.
Стабильное сохранение фенотипов в гибридомах представляет собой важную особенность не только для продукции веществ, но также и для клонирования клеток. Например, для получения моноклональных антител в качестве антителопродуцирующих клеток были клонированы гибридомы. Клонирование клеток означает получение клеточной популяции из одной клетки. Таким образом, очень сложно клонировать представляющие интерес клетки, если клеточные фенотипы не стабильны в циклах деления отдельных клеток. Так как гибридомы, предоставленные согласно изобретению, стабильно поддерживают свои клеточные фенотипы, они действительно могут быть клонированы.
Краткое описание рисунков
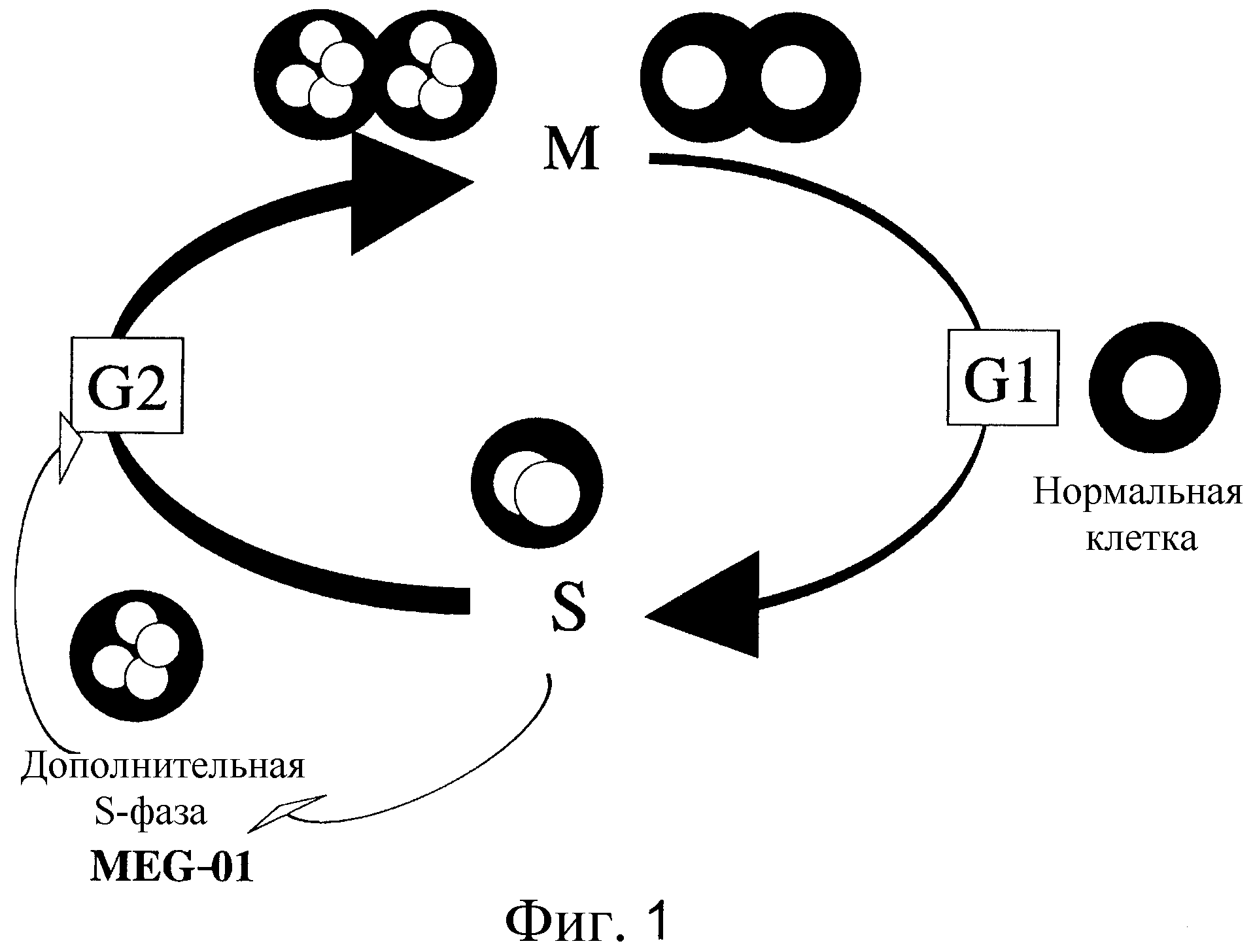
На Фиг. 1 представлена диаграмма клеточного цикла MEG-01.
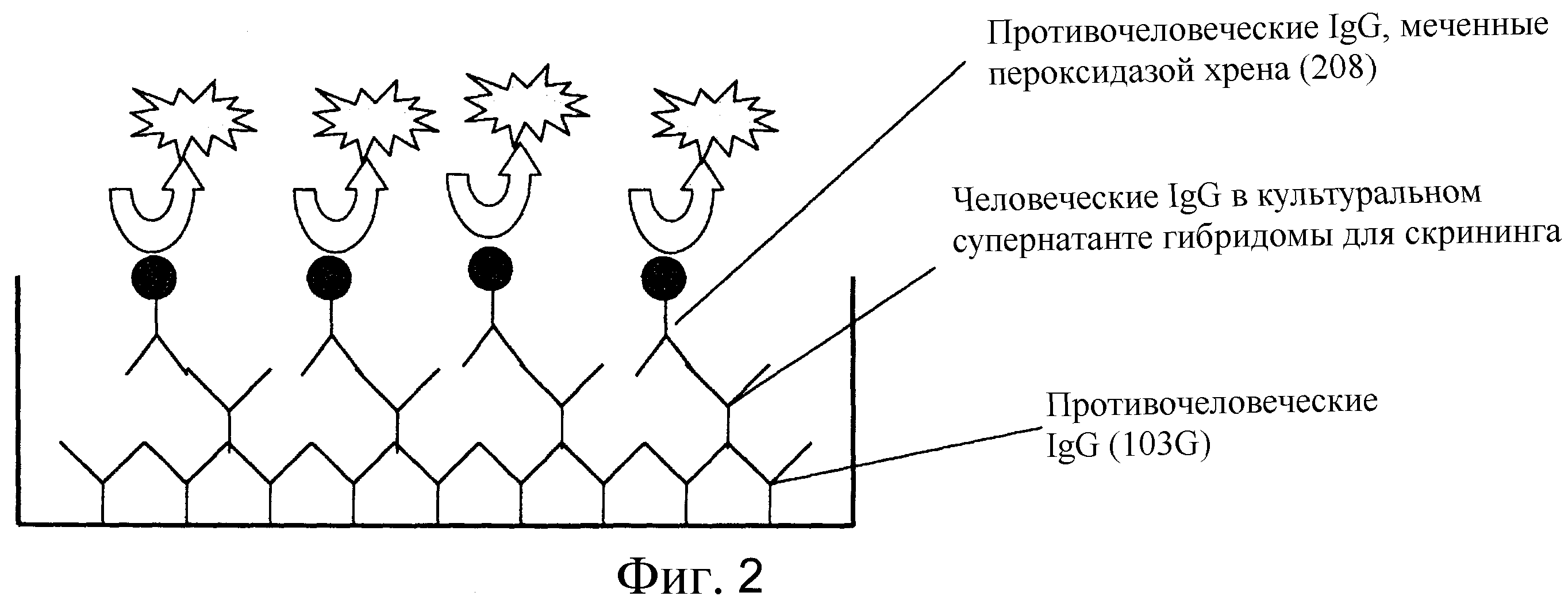
Фиг. 2 представляет собой диаграмму схемы ELISA-скрининга человеческих IgG-продуцирующих гибридом.
На Фиг. 3 приведены фотографии, на которых приведено морфологическое сравнение между клетками-партнерами слияния согласно изобретению SPYMEG и известной клеткой-партнером слияния Karpas.
На Фиг. 4 показаны фотографии, на которых приведено подтверждение IgG в каждой элюционной фракции клонов KO142(+), MK16(+) и MK99(+). На этих фотографиях (+) и (-) означают, соответственно, ELISA-положительные и -отрицательные клоны.
На Фиг. 5 показаны фотографии, на которых приведено подтверждение IgG в образце после диализа и концентрация элюционной фракции каждого клона.
Фиг. 6 представляет собой диаграмму, показывающую каждую стадию улучшенного способа слияния клеток с использованием SPYMEG.
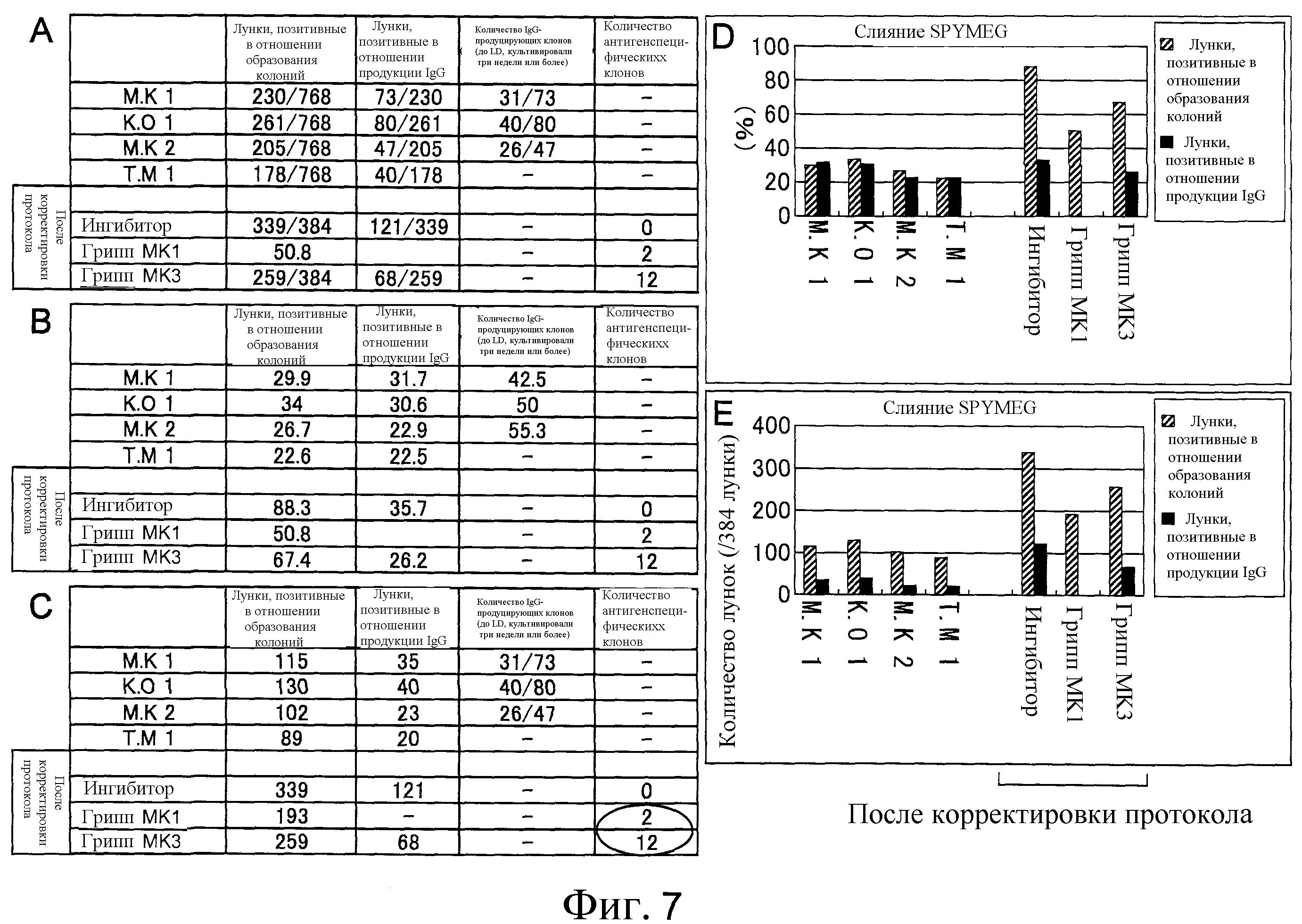
Фиг. 7 представляет собой диаграмму, на которой показано сравнение количества образованных клонов и продуцирующих IgG клонов до и после улучшения способа слияния клеток. Показано количество лунок, положительных в отношении образования колоний, и количество лунок, положительных в отношении продукции IgG в четырех 96-луночных планшетах. При усовершенствовании стадии клеточного слияния было значительно увеличено как количество лунок, положительных в отношении образования колоний, так и положительных в отношении продукции IgG. С помощью гриппозного скрининга из лунок было выделено множество антител, которые специфически распознают гриппозную вакцину. Таким образом, впервые успешно были установлены антитела, которые специфически распознавали антиген.
Фиг. 8 представляет собой диаграмму реактивности IgG-продуцирующих клонов к гриппу с помощью ELISA.
Фиг. 9 представляет собой фотографию Вестерн-блоттинга для оценки реактивности к гриппозной вакцине.
Фиг. 10 представляет собой фотографию SDS-PAGE очищенного человеческого IgG (6-19) в подтверждение его реактивности. Приведенные в таблице значения представляют собой оптическую плотность при длине волны 450 нм в ELISA с использованием планшетов, сенсибилизированных гемагглютининовой гриппозной вакциной.
Лучший вариант осуществления изобретения
Здесь «гибридома» относится к клетке, полученной путем клеточного слияния. В основном гибридомы получены путем слияния гетерологических клеток или клеток, которые гомологичны, но получены из различных животных или тканей. Гибридомы также включают клетки, полученные в результате слияния гомологических клеток, относящихся к одному типу клеток. Кроме того, гибридомы согласно изобретению также включают в себя слитые клетки, полученные путем слияния двух или более клеток. В частности, гибридомы согласно изобретению включают в себя также слитые клетки β, полученные путем слияния клетки В с гибридомой α, полученной в результате слияния клеток А и Б.
(клетка А)×(клетка Б)=[гибридома α]
[гибридома α]×(клетка В)=[гибридома β]
где три типа клеток, а именно клетка А, клетка Б и клетка В, которые были слиты для получения гибридомы β, могут быть получены из животных любых видов. Таким образом, в настоящем изобретении биологические виды, из которых получают клетки, могут быть одинаковыми или различными. В частности, гибридомы, полученные слиянием трех типов клеток, иногда обозначают как «триомы».
В предпочтительном варианте осуществления настоящего изобретения биологические виды клетки А (первая клетка) и клетки Б (вторая клетка) отличаются друг от друга, тогда как биологические виды клетки Б и клетки В (третья клетка) одинаковы. Гибридомы согласно изобретению также включают в себя слитые клетки, полученные когда биологические виды клетки А и клетки В одинаковы или биологические виды клетки А, клетки Б и клетки В отличаются друг от друга.
В основном клетки, полученные путем клеточного слияния и в течение длительного периода легко пересеваемые in vitro, в частности, называют «гибридомами». Таким образом, предпочтительными гибридомами согласно изобретению являются клетки, которые легко пересеваются in vitro в течение длительного периода после клеточного слияния. Альтернативно, предпочтительными гибридомами согласно изобретению являются клетки, которые продолжают расти после предельного разведения. Другими словами, клетки, которые могут продолжать расти после предельного разведения, включены в клетки, которые могут быть легко пересеяны in vitro в течение длительного периода после клеточного слияния.
Кроме того, предпочтительные гибридомы согласно изобретению представляют собой клетки, которые сохраняют фенотип клеток, использованных при клеточном слиянии. В настоящем изобретении клеточные фенотипы, подлежащие сохранению в гибридомах, включают способность клеток продуцировать вещества. Например, когда клетки, использованные при слиянии клеток, продуцируют антитела или цитокины, предпочтительные гибридомы согласно изобретению сохраняют способность продуцировать эти вещества.
Однако гибридомы согласно изобретению необязательно сохраняют полный фенотип клеток, использованных при слиянии клеток. Таким образом, когда сохранение фенотипов, например, продукции антигенов клеточной поверхности или ферментов и факторов транскрипции, которые накапливаются в клетке, желательно, в дополнение к продукции описанных выше антител, эти фенотипы также включаются в фенотип, подлежащий сохранению в гибридомах. Однако когда продукция этих веществ не является необходимой, гибридомы, лишенные способности продуцировать эти вещества, также включаются в гибридомы согласно изобретению, пока они продолжают продуцировать необходимые вещества.
Здесь «клетки-партнеры слияния» относится к клеткам, которые при слиянии с другими клетками дают возможность получить гибридомы. Предпочтительные клетки-партнеры слияния согласно изобретению дают возможность клеткам выживать in vitro в течение длительного периода после слияния клеток.
Кроме того, клетки-партнеры слияния предпочтительно имеют подходящие селекционные маркеры для скрининга. Селекционный маркер относится к фенотипу, который позволяет (или не позволяет) выживать в особых культуральных условиях.
Известные селективные маркеры животных клеток включают в себя гипоксантин-аминоптерин-тимидиновую чувствительность (в дальнейшем сокращается как «ГАТ-чувствительность»), являющуюся результатом гипоксантин-гуанин-фосфорибозилтрансферазной недостаточности (в дальнейшем сокращается как «ГГФРТ-недостаточность») или тимидинкиназная недостаточность (в дальнейшем сокращается как «ТК-недостаточность»). В ГАТ-селективной среде ГАТ-чувствительные клетки не могут синтезировать ДНК и, таким образом, будут погибать. Однако при слиянии с нормальными клетками полученные клетки могут продолжать синтезировать ДНК «реутилизационным» путем, характерным для нормальных клеток, и, таким образом, способны расти даже в ГАТ-селективной среде.
ГГФРТ- или ТК-недостаточные клетки могут быть отобраны с использованием среды, содержащей 6-тиогуанин, 8-азагуанин (в дальнейшем сокращается как «8АГ»), или 5'-бромодезоксиуридин. Нормальные клетки погибают при встраивании этих аналогов пиримидина в ДНК. В отличие от этого, клетки, страдающие от недостатка этих ферментов, могут выживать в селективной среде, потому что они не способны встраивать эти аналоги пиримидина. Другой селективный маркер называется устойчивостью к G418 и обеспечивает устойчивость к 2-дезоксистрептаминовым антибиотикам (аналогам гентамицина) благодаря гену резистентности к неомицину.
Настоящее изобретение относится к клеткам-партнерам слияния, которые могут быть получены путем слияния
(а) миеломных клеток, полученных из животного первого биологического вида, и
(б) лейкозных клеток, полученных из животного второго биологического вида, клеточный цикл которых имеет дополнительную S-фазу.
Настоящее изобретение относится также к способам производства клеток-партнеров слияния, предусматривающим следующие стадии:
(1) слияние
(а) миеломных клеток, полученных из животного первого биологического вида, и
(b) лейкозных клеток, полученных из животного второго биологического вида, клеточный цикл которых имеет дополнительную S-фазу, и
(2) культивирование клеток, слитых на стадии (1), и сбор клеток-партнеров слияния из культуры.
Здесь подразумевается, что миеломные клетки, полученные из животного первого биологического вида, получены из миелом, которые могут быть клонированы независимо. Фраза «могут быть клонированы независимо» означает, что рост может быть начат даже из одной клетки, и пересев можно проводить постоянно в условиях искусственной среды.
В настоящем изобретении миеломные клетки, полученные из животного первого биологического вида, могут быть любыми клетками, пока они обеспечивают клетки-партнеры слияния при слиянии с лейкозными клетками. Известные клетки, которые можно использовать в качестве миеломных клеток согласно изобретению, включают в себя, например, описанные ниже клетки. В списке клеточных линий, приведенном ниже, «ATCC» означает инвентарный номер в American Tissue and Culture Collection, тогда как «JCRB» означает инвентарный номер в банке клеток JCRB (Japanese Collection of Research Bioresources). Таким образом, все клеточные линии доступны в этих клеточных банках. Клеточные линии в банке клеток JCRB распространяются через Health Science Research Resources Bank (HSRRB).
MOPC21 (ATCC номер: HB-8411)
P3X63AG8 (ATCC номер: T1B9)
SP2/0 (ATCC номер: CRL 1581)
NS-1 (ATCC номер: TIB18)
P3.X63AG8.653 (ATCC номер: CRL 1580)
F0 (ATCC номер: CRL 1646)
S194/5.XXO.BU-1 (ATCC номер: CRL 1580)
FOX-NY (ATCC номер: CRL 1732)
SP2/0-Ag14 (JCRB номер: 0029)
Среди этих клеточных линий предпочтительными свойствами, описанными выше, обладает группа линий мышиных миеломных клеток и клеточные линии, полученные из этих линий мышиных миеломных клеток. Под полученными клеточными линиями подразумеваются клеточные линии, которые переклонированы после введения дополнительных фенотипов, таких как устойчивость к лекарственным средствам.
В настоящем изобретении лейкозные клетки, полученные из животного второго биологического вида, представляют собой лейкозные клетки, клеточный цикл которых имеет дополнительную S-фазу. Обычный клеточных цикл эукариотической клетки приведен ниже. Растущие клетки продолжают делиться, в то время как повторяется цикл с G1-фазы до M-фазы. Рост клетки останавливается, когда клеточный цикл достигает стабильного состояния, называемого G0-фазой, после M-фазы.
-[G1-фаза]-[S-фаза]-[G2-фаза]-[M-фаза]-
В каждом клеточном цикле S-фаза представляет собой период синтеза нуклеиновых кислот. В этот период полагают, что геномная ДНК образует хромосомы после репликации, и клетка готовится к клеточному делению. Удвоившаяся в M-фазе геномная ДНК распределяется по двум клеткам в ходе митоза. Однако в некоторых клетках наблюдали феномен, когда клеточный цикл не проходит стадию клеточного деления после репликации геномной ДНК. Период после синтеза ДНК, в котором клеточный цикл не приводит к делению клетки в М-фазе, был назван «дополнительной S-фазой». Было обнаружено, что не поделившиеся клетки накапливают синтезированную геномную ДНК и, таким образом, содержат повышенное количество ДНК. Например, среднее число хромосом у MEG-01, которая является лейкозной клеточной линией, предпочтительной в настоящем изобретении, составляет 2n=104. Это значительно больше, чем количество хромосом в нормальных клетках (2n=46). Причиной наличия у MEG-01 дополнительной S-фазы является то, что в ее клеточном цикле увеличивается количество геномной ДНК, и, таким образом, имеется свойство диплоидизации (Oncogene 13:695-703, 1996) (Фиг. 1).
Таким образом, ожидается, что настоящее изобретение имеет эффект предупреждения потери хромосом, полученных гетерогибридомами от антителопродуцирующих клеток за счет использования лейкозных клеток, которые имеют дополнительную S-фазу в своем клеточном цикле и свойство диплоидизации.
В настоящем изобретении лейкозные клетки, чей клеточный цикл имеет дополнительную S-фазу, получены от биологического вида, отличающегося от другого биологического вида, от которого получены описанные выше миеломы, и, предпочтительно, от того же биологического вида, от которого получена третья клетка, описанная ниже. Такие лейкозные клетки могут быть получены из гематопоэтических тканей или периферической крови животного с лейкемией. Гематопоэтические ткани включают в себя костный мозг, селезенку, лимфатические узлы и т.п. Лейкемия включает в себя, например, мегакариотическую лейкемию. Лейкоциты, мононуклеарные клетки или им подобные могут быть выделены, например, путем центрифугирования периферической крови и сбора клеточных фракций с определенным удельным весом способом с фиколлом.
Кроме того, если выделенные лейкозные клетки обладают дополнительной S-фазой в их клеточном цикле, они могут быть оценены с использованием в качестве индикатора увеличения хромосом в клетках. Увеличение хромосом может быть подтверждено, например, на основе увеличения плоидности (общего числа хромосом) клеток, обработанных 12-O-тетрадеканоил-форбол-13-ацетатом (ТФА). Такое увеличение плоидности может быть обнаружено с помощью проточного цитометра или анализатора плоидности.
Альтернативно, известные лейкозные клетки также могут быть использованы в настоящем изобретении. Известные клетки, которые можно использовать в качестве лейкозных, полученных из животного второго биологического вида, в настоящем изобретении включают в себя, например, указанные ниже клеточные линии. MEG-01 и HEL представляют собой линии человеческих мегакариотических лейкозных клеток (Blood 66:1384-1392, 1985; J. Clin. Invest. 85:1072-1084).
MEG-01 (ATCC № CRL-2021)
HEL (JCRB № 0062)
UT-7 (N. Komatsu et al., Cancer Res. 51: 341-348, 1991)
M07e (Avanzi GC et al., J. Cell Physiol. 1990 Dec; 145(3):458-64)
MEG-A2 (JCRB № IFO50478)
DAMI (Blood 89:4238, 1997)
В частности, MEG-01 проявляет устойчивость к 8АГ, которая полезна в качестве селективного маркера. Кроме того, когда MEG-01 не продуцирует иммуноглобулин, она является предпочтительной в качестве партнера для слияния с антителопродуцирующими клетками для получения гибридом.
Клетки-партнеры слияния согласно изобретению могут быть получены путем слияния миеломных клеток, полученных из животного первого биологического вида, с лейкозными клетками, полученными из животного второго биологического вида, чей клеточный цикл имеет дополнительную S-фазу. Известные способы слияния клеток, такие как способ с полиэтиленгликолем (PEG) и электрослияние, можно использовать для достижения слияния клеток.
Способ с полиэтиленгликолем проводят в соответствии со следующей процедурой. Сначала оптимизируют соотношение между миеломными и лейкозными клетками для каждых отдельных условий слияния. Специалисты в данной области могут выбрать оптимальную концентрацию полиэтиленгликоля (PEG), на основе молекулярной массы PEG или ему подобного. Например, 35% PEG1500 (Aldrich, Milwaukee, Wisconsin) является одним из требований к обычному слиянию клеток. 1 мл 35%-ного PEG1500 медленно добавляют к клеточному осадку/смеси клеток на протяжении 1,5 минут. Затем клеточную суспензию понемногу разбавляют средой, не содержащей сыворотку, а затем средой, содержащей сыворотку, для достижения слияния клеток.
Другие подходящие способы, которые также могут быть использованы для достижения слияния клеток, включают электрослияние. В этом способе клетки помещают в специальный буфер и затем выравнивают посредством подачи напряжения. Выровненные клетки могут быть эффективно слиты друг с другом благодаря тому, что шанс контакта друг с другом повышается.
Смесь для слияния суспендируется, например, при плотности клеток 8×105 клеток/мл в 150 мл среды HB-GRO (Irvine Scientific, Santa Ana, California), содержащей 15% фетальной телячьей сыворотки. Затем клетки разделяют на равные порции по 2,0×105 клеток/на лунку в 96-луночные планшеты. Клетки можно инкубировать в атмосфере с 5%-10% CO2 при 37°C для получения 8АГ-резистентных клеток-партнеров слияния. Полученные клетки-партнеры слияния могут быть клонированы, если потребуется. Клонированные клетки-партнеры слияния способствуют поддержанию репродуктивности в полученных гибридомах.
Например, SP2/0-Ag14 можно использовать в качестве миеломной клетки, полученной из животного первого биологического вида, в то время как MEG-01 можно использовать в качестве лейкозной клетки, полученной из животного второго биологического вида, клеточный цикл которой имеет дополнительную S-фазу.
Клетки-партнеры слияния, подготовленные, как описано выше, сами могут быть пересеяны в течение длительного периода и, таким образом, могут быть использованы в качестве обычных клеток-партнеров слияния для получения моноклональных антител из антителопродуцирующих клеток. В частности, подобно тому, как линии мышиной миеломы признаны для производства мышиных гомогибридом, клетки можно использовать в качестве слитых клеток, которые дают возможность получения стабильных гибридом с использованием антителопродуцирующих клеток, полученных из биологических видов, отличающихся от мыши. Среди клеток-партнеров слияния, полученных согласно изобретению, клетка-партнер слияния SPYMEG, полученная путем слияния мышиной миеломной клетки линии SP2/0-Ag14 с клеточной линией человеческой миеломы MEG-01, депонирована под инвентарным номером FERM BP-10761 в International Patent Organism Depositary.
(а) Название и адрес депозитарного учреждения
Название: National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary.
Адрес: (Почтовый индекс: 305-8566) Central 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki-ken, Japan.
(б) Дата размещения: 24 февраля 2006.
(в) Входной номер: FERM BP-10761
(перенесен из FERM P-20816 размещен 24 февраля 2006).
Настоящее изобретение относится к гибридомам, которые могут быть получены с использованием клеток-партнеров слияния, описанных выше. В частности, настоящее изобретение относится к гибридомам, которые могут быть получены путем слияния
(1) клетки-партнера слияния, которая может быть получена путем слияния
(а) миеломных клеток, полученных из животного первого биологического вида, и
(б) лейкозных клеток, полученных из животного второго биологического вида, в клеточном цикле которых имеется дополнительная S-фаза, и
(2) третьей клетки.
Настоящее изобретение относится также к способам получения гибридом, которые содержат следующие стадии:
(1) слияние
(а) миеломных клеток, полученных из животного первого биологического вида, и
(б) лейкозных клеток, полученных из животного второго биологического вида, в клеточном цикле которых имеется дополнительная S-фаза;
(2) культивирование клеток, слитых на стадии (1), и сбор клеток-партнеров слияния из культуры;
(3) слияние третьей клетки с клеткой-партнером слияния, собранных на стадии (2), и
(4) культивирование клеток, слитых на стадии (3), и сбор гибридомы из культуры.
Биологический вид третьей клетки согласно изобретению является сходным или отличающимся от биологического вида первой клетки и второй клетки. В частности, можно использовать клетки человека, кролика, мыши, крысы, коровы, козы, овцы или подобных. Более конкретно, при использовании слитых клеток, полученных из мышиной миеломы (первая клетка) и человеческих лейкозных клеток (вторая клетка), третью клетку предпочтительно получают из человека или мыши. В частности, тот факт, что человеческие клетки можно использовать в качестве третьей клетки, представляет собой большое преимущество клеток-партнеров слияния согласно изобретению.
Третья клетка согласно изобретению представляет собой клетку, которая предположительно в конечном счете дает долгоживущую культуру. Более конкретно, например, клетки, обладающие способностью продуцировать представляющие интерес вещества, можно использовать в качестве третьей клетки. Гибридомы, которые способны к долговременному поддержанию клеток, обладающих представляющим интерес фенотипом, могут быть получены посредством клеточного слияния между описанными выше клетками и слитыми клетками согласно изобретению. Образование гибридом, дающих возможность длительного поддержания клеток, как правило, называется «иммортализацией».
В настоящем изобретении любую клетку, продуцирующую представляющее интерес биологически активное вещество, можно использовать в качестве третьей клетки. Предпочтительные биологически активные вещества согласно изобретению включают в себя антитела. Другими словами, антителопродуцирующие клетки являются предпочтительными в качестве третьей клетки согласно изобретению. Антителопродуцирующие клетки включают в себя, например, лейкоциты (периферические лимфоциты) и клетки селезенки. Способы сбора таких клеток из живого тела известны. Более специфические примеры третьей клетки включают антителопродуцирующие клетки, полученные из животных, подвергавшихся воздействию патогенного антигена инфекционного заболевания. Животные, подвергавшиеся воздействию патогенного антигена инфекционного заболевания, включают в себя животных, вакцинированных патогенным антигеном (вакциной) инфекционного заболевания, и животных, которые пережили инфекцию. Здесь инфекционное заболевание не ограничено частностями; однако к предпочтительным примерам относятся грипп, СПИД и вирусные гепатиты, такие как HCV и HBV.
В частности, лимфоциты периферической крови являются предпочтительными в качестве антителопродуцирующих клеток согласно изобретению. Лимфоциты периферической крови могут быть легко получены через забор крови. Гибридомы, продуцирующие мышиные антитела, могут быть легко получены путем приготовления гибридом из лимфоцитов периферической крови мыши согласно изобретению. Альтернативно, гибридомы, продуцирующие антитела человека, могут быть быстро получены путем приготовления гибридом из лимфоцитов периферической крови человека согласно изобретению.
В настоящем изобретении слитая клетка может быть слита с третьей клеткой тем же способом, который использовался при клеточном слиянии описанных выше первой и второй клеток. Слияние клеток может быть достигнуто при использовании способа с PEG или электрослияния. Например, когда лимфоциты периферической крови человека слились с SPYMEG в качестве партнеров слияния согласно изобретению, предпочтительные условия включают в себя следующие условия.
Во-первых, количество лейкоцитов периферической крови (PBL), подлежащих слиянию, предпочтительно составляет от 1×107до 108 клеток. SPYMEG и PBL смешивают вместе в соотношении от 2:1 до 10:1. Клетки осаждают посредством центрифугирования, и полученный супернатант удаляют. Для слияния клеток к фракции собранных клеток добавляют полиэтиленгликоль (PEG). Концентрация PEG, используемого при слиянии клеток, составляет от 30% до 70%, предпочтительно, от 40% до 60%, и более предпочтительно, 50%. В зависимости от количества клеток, к клеткам добавляют от 0,1 до 2,0 мл, предпочтительно, от 0,6 до 1,0 мл раствора PEG в течение 60-90 секунд, помешивая с помощью пипетки. После добавления раствора PEG клеточную суспензию постоянно помешивают пипеткой в течение 2-3 минут. Затем при помешивании постепенно, в течение 30-60 секунд, добавляют от 10 до 14 мл среды, не содержащей сыворотку. После добавления среды, не содержащей сыворотку, смесь центрифугируют. После центрифугирования супернатант удаляют, и клетки однократно промывают средой, не содержащей сыворотку. Промытые клетки суспендируют в ГАТ-среде (RPMI содержит 15% ЭТС и ГАТ (x 50)) и помещают в 96-луночные планшеты.
Среда, не содержащая сыворотку, и PEG, которые, как правило, используются специалистами в данной области при слиянии клеток, могут быть соответствующим образом использованы. Например, перечисленные ниже среду и PEG можно использовать при слиянии клеток согласно изобретению.
PEG: PEG1500 (Aldrich, Milwaukee, Wisconsin).
ГАТ: ГАТ-добавка (50x) (GIBCO; Cat. No. 21060-017).
Среда, не содержащая сыворотку: RPMI1640 (SIGMA; Cat. No. R8758).
Альтернативно, антителопродуцирующие клетки также могут быть получены от иммунизированных животных. Животные были заранее иммунизированы случайным антигеном вместе с подходящим адъювантом. Антиген может быть конъюгирован с белком-носителем и затем использован как иммуноген. К таким белкам-носителям для получения иммуногена относятся гемоцианин морского блюдца (KLH) и бычий сывороточный альбумин (BSA). В основном к животным, подлежащим иммунизации, относят кроликов, мышей, крыс, коз и овец. Подходящие адъюванты включают в себя полный адъювант Фрейнда (FCA) (Adv. Tubercl. Res. 1:130-148, 1956). Титр антител отслеживают с помощью ELISA или анализа по Оухтерлони. Антителопродуцирующие клетки собирают после того, как подтверждается увеличение титра до удовлетворительного уровня. Суспендированные антителопродуцирующие клетки используют при слиянии клеток. Антителопродуцирующие клетки могут быть получены путем сбора клеток селезенки или лимфоцитов периферической крови тем же способом, какой используется для человеческих клеток. Полученные таким образом антителопродуцирующие клетки можно сливать со слитыми клетками согласно изобретению для получения гибридомы согласно изобретению.
Как описано выше, антитела могут продуцироваться с использованием антителопродуцирующих клеток в способах согласно изобретению в качестве третьей клетки для получения гибридом. В частности, настоящее изобретение относится к способам получения антител, предусматривающим следующие стадии:
(1) получение клеток-партнеров слияния согласно следующим стадиям:
(А) слияние
(а) миеломных клеток, полученных из животного первого биологического вида, и
(б) лейкозных клеток, полученных из животного второго биологического вида, в клеточном цикле которых имеется дополнительная S-фаза, и
(Б) культивирование клеток, слитых на стадии (A), и сбор клеток-партнеров слияния из культуры;
(2) получение гибридомы путем слияния антителопродуцирующих клеток с клетками-партнерами слияния, полученными на стадии (1), и
(3) культивирование гибридом, полученных на стадии (2), и сбор антител из культуры.
Альтернативно, настоящее изобретение относится к способам приготовления описанных выше антителопродуцирующих клеток, которые пригодны для продукции антител. В частности, настоящее изобретение относится к способам приготовления антителопродуцирующих клеток, предусматривающим следующие стадии:
(1) получение клеток-партнеров слияния согласно следующим стадиям:
(А) слияние
(а) миеломных клеток, полученных из животного первого биологического вида, и
(б) лейкозных клеток, полученных из животного второго биологического вида, в клеточном цикле которых содержится дополнительная S-фаза, и
(Б) культивирование клеток, слитых на стадии (А), и сбор клеток-партнеров слияния из культуры;
(2) приготовление гибридомы путем повторного слияния антителопродуцирующих клеток с клетками-партнерами слияния, полученными на стадии (1), и
(3) сбор гибридом, полученных на стадии (2), в качестве антителопродуцирующих клеток.
Гибридомы, которые стабильно продуцируют антитела, могут быть получены при использовании клеток-партнеров слияния согласно изобретению. Успешно слитые клетки могут предпочтительно пролиферировать при культивировании гибридомы в подходящей селективной среде. Например, ГАТ-содержащую селективную среду можно использовать, когда SPYMEG согласно изобретению используются в качестве клеток-партнеров слияния.
Способы согласно изобретению для производства антител или антителопродуцирующих клеток могут включать в себя клонирование гибридом. Способы для клонирования гибридом известны. В частности, гибридомы могут быть клонированы способом лимитирующих разведений. Теоретически, гибридомы, разведенные лимитирующими разведениями, образуют клеточные популяции, каждая из которых выросла из отдельной клетки. Такая клеточная популяция имеет гомогенные генетические характеристики и таким образом является клоном. Антитела, полученные от клонированной гибридомы, называются моноклональными антителами. Моноклональные антитела обладают крайне постоянными антигенсвязывающими свойствами.
В частности, настоящее изобретение относится к способам производства моноклональных антител, которые содержат следующие стадии:
(1) приготовление клеток-партнеров слияния согласно следующим стадиям:
(А) слияние
(а) миеломных клеток, полученных из животного первого биологического вида, и
(б) лейкозных клеток, полученных из животного второго биологического вида, в клеточном цикле которых содержится дополнительная S-фаза, и
(Б) культивирование клеток, слитых на стадии (А), и сбор клеток-партнеров слияния из культуры;
(2) приготовление гибридом слиянием антителопродуцирующих клеток с клетками-партнерами слияния, приготовленными на стадии (1), и клонирование гибридом, продуцирующих представляющие интерес антитела, и
(3) культивирование гибридом, клонированных на стадии (2), и сбор моноклональных антител из культуры.
Настоящее изобретение также относится способам производства антителопродуцирующих клеток, которые полезны в производстве антител, описанных выше. В частности, настоящее изобретение относится к способам производства антителопродуцирующих клеток, которые содержат следующие стадии:
(1) приготовление клеток-партнеров слияния согласно следующим стадии:
(А) слияние
(а) миеломных клеток, полученных из животных первого биологического вида, и
(б) лейкозных клеток, полученных из животного второго биологического вида, в клеточном цикле которых имеется дополнительная S-фаза, и
(Б) культивирование клеток, слитых на стадии (А), и сбор клеток-партнеров слияния из культуры;
(2) приготовление гибридомы путем повторного слияния антителопродуцирующих клеток с клетками-партнерами слияния, приготовленными на стадии (1), и
(3) получение антителопродуцирующих клеток из гибридом, приготовленных на стадии (2).
В настоящем изобретении антителопродуцирующие клетки могут быть клонированы. Моноклональные антителопродуцирующие клетки могут быть получены клонированием антителопродуцирующих клеток, продуцирующих представляющие интерес антитела. В частности, настоящее изобретение относится к способам производства гибридом, которые продуцируют моноклональные антитела, которые содержат следующие стадии:
(1) приготовление клеток-партнеров слияния согласно следующим стадиям:
(А) слияние
(а) миеломных клеток, полученных из животного первого биологического вида, и
(б) лейкозных клеток, полученных из животного второго биологического вида, в клеточном цикле которых содержится дополнительная S-фаза, и
(Б) культивирование клеток, слитых на стадии (А) и сбор клеток-партнеров слияния из культуры;
(2) приготовление гибридомы путем повторного слияния антителопродуцирующих клеток с клетками-партнерами слияния, приготовленными на стадии (1), и клонирование гибридом, продуцирующих представляющие интерес антитела и
(3) сбор клонированных на стадии (2) гибридом в качестве антителопродуцирующих клеток.
Гибридомы согласно изобретению представляют собой антителопродуцирующие клетки, обладающие стабильной способностью к продукции антител in vitro. Таким образом, клетки можно выращивать в подходящей среде, пока сохраняется способность к продукции антител, несмотря на то, что они являются гетерогибридомами. Поэтому потеря живых клонов в ходе процесса клонирования является менее вероятной. Кроме того, установленные клоны гибридом могут устойчиво сохраняться.
Антитела или моноклональные антитела могут продуцироваться при культивировании гибридомы или ее клонов, полученных согласно изобретению. Среда, не содержащая сыворотку, или среда, содержащая низкую концентрацию сыворотки, является предпочтительной для использования, исходя из удобства очистки антител. Основная среда для культуры животных клеток включает DMEM, RPMI1640, и ASF 103. Альтернативно, гибридомы или ее клоны могут быть инокулированы в перитонеальные полости голых мышей или СКИД-мышей для сбора моноклональных антител в виде асцита.
Культуральные среды могут быть дополнены от 5% до 10% по объему эмбриональной телячьей сыворотки (в дальнейшем сокращается как «ЭТС»). Когда гибридомы согласно изобретению культивируют в таких средах для культивирования, преимущественно к среде добавляют известные факторы, которые улучшают продукцию антител. Средства, которые улучшают продукцию антител in vitro, включают, например, D-пеницилламин, ацетоуксусную кислоту, бигуанидные средства, витамин K5, N-ацетилглютаминовую кислоту (японская патентная заявка Kokai публикация номер (JP-A) H8-70858 (нерассмотренная, опубликованная японская патентная заявка), интерлейкин 6 (Nature 324(6092):73-6, 1986), сахарный спирт (JP-A (Kokai) H2-200177), липополисахариды (JP-A (Kokai) H4-20294), форболовый эфир(JP-A (Kokai) H1-171494) и масляную кислоту (гибридома 4(1):63, 1985). Полученные таким образом моноклональные антитела могут быть очищены высаливанием, таким как с использованием сульфата аммония или сульфата натрия, ионообменной хроматографии, гель-фильтрации, аффинной хроматографии и подобных.
Настоящее изобретение более точно проиллюстрировано ниже со ссылкой на примеры, которые не должны пониматься как ограничение.
Все предшествующие цитируемые здесь документальные источники, относящиеся к отрасли знаний, включены в настоящий документ в качестве ссылки.
ПРИМЕРЫ
Пример 1
Приготовление слитых клеток-партнеров
Клетки SP2/0-Ag-14 (3×107 клеток) и MEG-01 (от 3 до 6×107 клеток) культивировали в RPMI с добавлением 5% ЭТС (стандартная среда) и затем сливались вместе в соответствии с обычным способом с использованием PEG. Слитые клетки культивировали в стандартной среде (RPMI с добавлением 5% ЭТС) в течение 3 дней. На 3 день среду заменили на не содержащую ЭТС RPMI и затем клетки культивировали в течение 19 дней. На 19 день с помощью серийных разведений клетки разбавили стандартной средой, содержащей 8 АГ, и затем культивировали в течение пяти дней. Пролиферировавшие слитые клетки были собраны и названы «клетка-партнер слияния SPYMEG». SPYMEG была размещена под инвентарным номером FERM BP-10761 (перенесен с FERM P-20816) 24 февраля 2006 в National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary. SPYMEG была устойчива к 8AG, и погибала, когда культивировалась в ГАТ-среде.
Пример 2
Приготовление гетерогибридомы с использованием способа с PEG
(а) Сбор лейкоцитов периферической крови человека (плотностное центрифугирование)
С применением гепарина забрали периферическую кровь человека (40 мл) и разделили на равные части (10 мл) в 50 мл пробирки. В каждую пробирку добавили 25 мл стерильной PBC. После смешивания кровь наслоили на 15-мл аликвоту HISTOPAQUE (SIGMA H8889) в 50 мл пробирках. Эти пробирки центрифугировали при 800 об/мин и комнатной температуре в течение 30 минут. После центрифугирования собрали слои лейкоцитов.
(б) Сбор клеток-партнеров слияния (SPYMEG)
Клетки SPYMEG вырастили в 75-см2 культуральных колбах (среда: RPMI, содержащая 10% ЭТС) и собрали.
(в) Слияние клеток
Собранные лейкоциты периферической крови человека и SPYMEG клетки смешивали в соотношениях от 2:1 до 10:1 и затем центрифугировали. От 4 до 8×107 клеток было получено из 40 мл периферической крови. SPYMEG культивировали с использованием 75-см2 колб. Для выполнения слияния клеток к осадку добавляли от 0,6 до 1,0 мл 50% PEG (PEG4000; MERCK, Cat. No. 1097270100 был разбавлен равным объемом RPMI (RPMI1640; SIGMA, Cat. No. R8758)). После отмывки с помощью не содержащей сыворотку RPMI клетки суспендировали в 160 мл 1% BM, содержащей 15% ЭТС (EQUITECH-BIO INC., Lot. SFB30-1548) и ГАТ (ГАТ-добавка (BM-condimed; Roche, Cat. No. 663573) (50x), GIBCO Cat. No. 21060-017) и поместили в восемь 96-луночных планшетов. Среду заменили через три дня после помещения. Когда решили, что колонии гибридом сформировались (после 2-3 недель), взяли образцы культуральных супернатантов из 96-луночных планшетов для первого скрининга.
Пример 3
Протокол очистки IgG
Образцы (культуральные супернатанты) элюировались при скорости потока 1 капля/с. Собрали проточные фракции. Колонки промыли с PBS, содержащим 0,1% NaN3, при максимальной скорости потока (промывали до тех пор, пока оптическая плотность при 280 не стала 0,05 или меньше при контроле на спектрофотометре). Колонки элюировались с 2-5 объемами слоя колонки 0,17 M глицин-HCl буфером (pH 2,3) при максимальной скорости потока. С использованием сборника фракций элюат был собран в тестовые пробирки, содержащие 1 M трис-HCl буфер (pH 8,0) объемом одна пятая или больше от объема элюированной фракции (мл). Элюированные фракции как можно скорее смешали с нейтрализующим трис-буфером (1 M трис-HCl буфер (pH 8,0)). После измерения A280 в каждой фракции, фракции проверяли на белки. Фракции при значении A280, равном 0,1 или более, объединяли.
После объединения, с использованием тестовой полоски на pH был подтвержден pH, равный 8,0. Чистоту объединенного раствора оценивали с помощью SDS-PAGE с использованием 12,5% геля и буфера для образца (2ME+). Каждая дорожка содержала 5 мкг образца. Такое же количество из предыдущей пробы также подвергали электрофорезу для сравнения. Объединенный раствор упаковали в диализную пробирку и диализировали против PBS или PBS, содержащего 0,1% NaN3, объемом в сто или более раз превышающего объем объединенного раствора. Диализ повторяли три или более раза и каждый диализ проводили в течение 6 часов или более. После концентрации, диализная пробирка была тщательно промыта деионизированной водой. После того как диализную пробирку осторожно потерли, достаточно для растворения белков, прилипших к стенке пробирки, концентрированный раствор был удален из пробирки. Затем измеряли концентрацию.
Альтернативно, без использования сборника фракций, элюированный раствор при встряхивании может быть собран в измерительный цилиндр, стакан или им подобное. Даже в этом случае нейтрализующий трис-буфер (1 M трис-HCl буфер (pH 8,0)) используется в объеме одной пятой или более от объема элюированной фракции (мл). После сбора с использованием тестовой полоски на pH был подтвержден pH, равный 8,0. При pH менее 8,0 его немедленно доводят до 8,0 путем добавления нейтрализующего буфера.
Пример 4
Измерение человеческого IgG с помощью ELISA
(а) Подготовка сенсибилизированных планшетов
Противочеловеческие IgG поликлональные антитела кролика были разбавлены сенсибилизирующим буфером (PBS) до 10 мкг/мл разделены на равные части (50 мкл/лунка) в микропланшеты (Nunc MaxiSorp). Планшеты оставили на ночь при 4°C. Сенсибилизирующий буфер удалили и оставшуюся жидкость из планшетов удалили тэппингом. Блокирующий буфер (PBS, содержащий 1% БСА и 0,1% NaN3) добавили (100 мкл/лунка) и планшеты оставили на ночь при 4°C.
(б) ELISA
Супернатанты культур гибридом разделили на равные части (50 мкл/лунка) в сенсибилизированные микропланшеты (подготовленные как описано в (а)). Планшеты инкубировали и оставили на один час при комнатной температуре. Реакционный раствор удалили и планшеты три раза промыли отмывочным буфером (PBS, содержащий 0,05% Tween20). Оставшуюся жидкость удалили из планшетов тэппингом. Меченые антитела разбавили (меченные пероксидазой; развели в 5000 раз и затем использовали; меченные POD противочеловеческие поликлональные антитела IgG) и разделили на равные части (50 мкл/лунка) в планшеты. Затем планшеты оставили при комнатной температуре на один час. Приготовили раствор субстрата (тетраметилбензидин). Раствор меченых антител удалили из планшетов. После трехкратной отмывки отмывочным буфером, оставшуюся жидкость удалили из планшетов тэппингом. Раствор субстрата разделили на равные части (50 мкл/лунка). Планшеты инкубировали при комнатной температуре в течение примерно 15 минут. Раствор для терминации реакции (2N H2SO4) разделили на равные части (50 мкг/лунка) в планшеты. Оптическую плотность (основная длина волны 450 нм; дополнительная длина волны 620 нм) измеряли с помощью спектрофотометра для прочтения планшетов. Схематическая диаграмма ELISA, использованного в эксперименте, показана на фиг. 2.
Пример 5
Подтверждение человеческих IgG с помощью Вестерн-блоттинга
Раствор антител 1 мг/мл смешали с равным объемом буфера для образца. Полученную смесь кипятили в течение пяти минут. 10 мкл смеси (5 мкг антител) загрузили в 12,5% гель. Провели SDS-PAGE и перенесли образец на ПВДФ мембрану (Immobilon-P Cat. No. IPVH00010). Мембрану блокировали PBS, содержащим 2% обезжиренного молока, при 4°C в течение ночи и затем обработали PBS, содержащим 10% BlockAce и противокрысиные IgG POD x 2500 в качестве антитела для детектирования при комнатной температуре в течение одного часа. Мембрану три раза промыли буфером (PBS, содержащий 0,05% Tween20). Использованным субстратом был PIERCE (super signal West Pico Chemiluminescent Substrate, code 34080). После экспозиции в течение минуты пленку (Hyperfilm ECL; Amersham Bioscience, Cat. No. RPN3103K) проявили с использованием RENDOL (Fuji Film) в качестве проявителя. Использованным и стоп-реагентом и фиксатором были 3% уксусная кислота и RENFIX (Fuji Film) соответственно.
Пример 6
Результаты
(а) Подготовка слитых клеток-партнеров
Оценили подготовленную клеточную линию слитых клеток SPYMEG (Фиг. 3) с помощью сравнения ее с известной клеточной линией человеческих слитых клеток, Karpas (Abraham Karpas et al., Proc. Natl. Acad. Sci. USA 2001 Feb 13; 98(4):1799-1804). Как и другие стандартные мышиные миеломные клетки, клетки SPYMEG были сферическими. Адгезия была слабее, чем у Karpas. Активность роста была сильнее (данные не приведены). Эти сведения подсказывают то, что эффективность SPYMEG в качестве слитой клетки-партнера выше, чем у Karpas. Кроме того, созданная клеточная линия слитых клеток SPYMEG была жизнеспособной даже после заморозки и стабильной без потери способности к продукции даже после 100 мл scale culture в течение одного месяца (данные не приведены).
(б) Приготовление гибридомы (антителопродуцирующих клеток) слиянием клеток SPYMEG и лейкоцитов из периферической крови человека
Таблица 1 показывает продукцию IgG гибридомами (антителопродуцирующими клетками), полученными слиянием клеток SPYMEG и лейкоцитов из периферической крови человека. Гибридомы поместили в восемь 96-луночных микропланшетов (768 лунок). В таблице 1 показано количество лунок, позитивных в отношении образования колоний, количество лунок, среди них позитивных на продукцию IgG, и среди них количество лунок, позитивных на длительную продукцию IgG в течение трех недель или более. Контроль проводили с помощью ELISA.
Результаты показывают, что в этом эксперименте были подготовлены IgG-продуцирующие гибридомы. Кроме того, с использованием известной клеточной линии слитых клеток Karpas не может быть получен IgG-продуцирующий клон. Эта находка подсказывает, что SPYMEG представляет собой клеточную линию слитых клеток, которые делают возможной более эффективную продукцию гибридом, чем Karpas.
IgG-продуцирующие клоны поместили в колонку с протеином G. Элюированные из колонки фракции оценивали с помощью SDS-PAGE и Вестерн-блоттинга (фиг. 4). На этом чертеже (+) и (-) обозначают ELISA-позитивные и -негативные клоны соответственно. KO142 фракция 2 была позитивна в ELISA и SDS-PAGE показал присутствие человеческих IgG в этой фракции; однако сигнал нельзя было определить с помощью Вестерн-блоттинга. Было допущено, что детекция не удалась по некоторым причинам.
Кроме того, элюированные фракции от каждого клона были диализированы и концентрированы и полученные образцы были протестированы (фиг. 5). В SDS-PAGE полосы, предположительно соответствовавшие H и L цепям IgG, были обнаружены даже для ELISA-негативных клонов; однако полосы не поддавались обнаружению с помощью Вестерн-блоттинга с использованием антител к IgG человека, и, таким образом, было решено, что они относятся к IgG, полученным из ЭТС. На дорожке 5 обнаружена полоса для ELISA-негативного клона. Подумали, что этот клон продуцирует IgG в очень малых количествах, учитывая то, что он был расценен как негативный, основываясь на результатах ELISA для культурального супернатанта. Кроме того, описанный выше результат показывает, что SPYMEG сам по себе не продуцирует человеческие IgG.
Таблица 2 показывает выход IgG, очищенного из культурального супернатанта для каждого позитивного клона. Исходя из количества IgG, очищенного из 100 мл культурального супернатанта, концентрация человеческого IgG в каждом культуральном супернатанте составляла от 2 до 11 мкг/мл. Таким образом, было подтверждено, что концентрация сравнима с концентрацией для стандартной мышиной гибридомы.
Пример 7
Улучшение способа подготовки гетерогибридом
В примере 2 периферическую кровь, разбавленную PBS, наслаивали на HISTOPAQUE, с последующим центрифугированием. Однако для получения лейкоцитов (B-клеток) высокой чистоты, лейкоциты периферической крови человека собирали путем удаления эритроцитов в качестве предобработки с помощью смешивания периферической крови с HetaSep (HETASTARCH) и затем наслаивали кровь на HISTOPAQUE (фиг. 6).
Точнее, около 10 мл периферической крови, полученной у пациента, инокулировали с гриппозной гемагглютининовой вакциной и переносили в 15 мл пробирку и добавляли туда от 2 до 3 мл HetaSep (StemCell Technologies Inc., CAT#07906). Кровь перемешивали перевертыванием и затем оставили при комнатной температуре на один час. Полученный супернатант (оранжевого цвета) собирали и в 15 мл пробирке медленно наслаивали на него HISTOPAQUE пастеровской пипеткой, не повреждая границу раздела. Пробирку центрифугировали при 1800 об/мин и комнатной температуре в течение 30 минут. После центрифугирования образовавшийся в середине раствора белый, похожий на полоску, слой (слой лейкоцитов) с помощью пастеровской пипетки собрали в 50 мл пробирку. Чтобы отмыть клетки, добавили около 30 мл не содержащей сыворотки DMEM и центрифугировали полученную смесь при 1600 об/мин в течение восьми минут.
В качестве слитых клеток клетки SPYMEG были слиты с лейкоцитами периферической крови человека, собранными способом, описанным в примере 2. Вместо RPMI использовали не содержащую сыворотку DMEM в качестве минимальной среды для слияния клеток.
IgG были очищены от подготовленных гетерогибридом и человеческие IgG оценивали с помощью ELISA способами, описанными в примерах 3 и 4. Результат показал, что как колонии, образовавшиеся после слияния клеток, так и IgG-продуцирующие колонии, увеличились в результате улучшения способа создания гетерогибридом (фиг. 7).
Пример 8
Подтверждение реактивности к гриппозной вакцине
Было подтверждено, что IgG-продуцирующие клоны, подготовленные в примере 7, реактивны к гриппозной вакцине. Более точно, продукция IgG в каждом клоне оценивали с помощью сэндвич-ELISA, как описано ниже, с использованием сенсибилизированных гриппозной вакциной планшетов и не сенсибилизированных планшетов, которые были просто блокированы для удаления клонов, проявляющих неспецифическую реакцию.
Гриппозная вакцина была разбавлена PBS в 30 раз и разделена на равные порции (50 мкл/лунка) в планшеты для ELISA. Планшеты оставили на ночь (сенсибилизация). В качестве гриппозной вакцины использовали гриппозную гемагглютининовую вакцину (The Chemo-Sero-Therapeutic Research Institute, Japan). Штаммы вируса гриппа A и B отдельно культивировались в куриных яйцах с зародышем. Аллантоидная жидкость, содержащая выращиваемый вирус, была очищена и концентрирована путем центрифугирования в градиенте плотности сахарозы или ему подобным. Вирусные частицы были обработаны эфиром или ему подобным, чтобы подготовить суспензионные фракции гемагглютинина (в дальнейшем сокращается как «ГА»). После инактивации формалином препарат разбавили с использованием забуференного фосфатом раствора хлорида натрия, так что он содержал заранее определенное количество ГА каждого вирусного штамма.
После удаления раствора 200 мкл блокирующего буфера добавили в каждую лунку. Планшеты оставили на ночь (блокирование). Удалили блокирующий буфер и добавили в планшеты культуральные супернатанты гибридом (50 мкл/лунка). Планшеты инкубировали при комнатной температуре в течение одного часа. Супернатанты удалили и лунки промыли три раза с PBS, содержащим 0,05% Tween.
Меченные пероксидазой хрена антитела к человеческому IgG (MBL: 206) разбавили в 5000 раз и добавили в планшеты. Планшеты инкубировали при комнатной температуре в течение одного часа. После трехкратной промывки в каждую лунку добавили 50 мкл хромогенного субстрата. После инкубации в течение 15 минут для развития окраски, добавили стоп-реагент и измерили оптическую плотность (OD450) с помощью спектрофотометра для прочтения планшетов.
В результате, было обнаружено около десяти клонов, реактивных к гриппозной вакцине (фиг. 8). Антиген-специфические антитела человека были успешно созданы с использованием гетерогибридомы согласно изобретению.
Пример 9
Подтверждение человеческого IgG с помощью Вестерн-блоттинга
Реактивность культуральных супернатантов гибридомы, продуцирующей человеческие IgG, оценивали с помощью Вестерн-блоттинга с использованием гриппозной ГА вакцины в качестве образца.
Гриппозную ГА вакцину смешали с равным объемом буфера для образцов. Смесь прокипятили в течение пяти минут. 20 мкл смеси (10 мкл вакцины) загрузили в 12,5% gel. Провели SDS-PAGE и образцы перенесли на ПВДФ мембрану (Immobilon-P Cat. No. IPVH00010). Мембрану блокировали с PBS, содержащим 2% обезжиренного молока, при 4°C в течение ночи и затем обработали PBS, содержащим 10% BlockAce и противочеловеческие IgG, меченные пероксидазой хрена (MBL code 206) x 3000 в качестве детектирующих антител, при комнатной температуре в течение одного часа. Мембрану промыли три раза буфером (PBS, содержащий 0,05% Tween20). В качестве субстрата использовали PIERCE (super signal West Pico Chemiluminescent Substrate, code 34080). После экспозиции в течение одной минуты пленку (Hyperfilm ECL; Amersham Bioscience, Cat. No. RPN3103K) проявили с использованием RENDOL (Fuji Film) в качестве проявителя. В качестве стоп-реагента и фиксатора использовали 3% уксусную кислоту и RENFIX (Fuji Film) соответственно.
В результате была обнаружена специфическая полоска для клона (6-19) (фиг. 9).
Пример 10
SDS-PAGE очищенных человеческих IgG (6-19) и подтверждение их реактивности
В начале, используя процедуру, описанную ниже, человеческие IgG, реактивные к гриппозной ГА вакцине, были очищены от культуральных супернатантов человеческих IgG-продуцирующих гибридом, которые показали реактивность с помощью Вестерн-блоттинга, как описано в примере 9.
Культуральные супернатанты были элюированы при скорости потока 1 капля/с. Собрали протекавшие фракции. Колонку (Protein G Sepharose (Protein G Sepharose 4 Fast Flow, Cat. No. 17-0618-03)) промыли с PBS, содержащим 0,1% NaN3, при максимальной скорости потока (промывали, пока оптическая плотность при 280 не стала 0,05 или ниже под контролем с помощью спектрофотометра). Колонку элюировали 2-5 объемами слоя колонки 0,17 M глицин-HCl буфера (pH 2,3) при максимальной скорости потока. Используя сборник фракций, элюат был собран в тестовые пробирки, содержащие 1 M трис-HCl буфер (pH 8,0) объемом одна пятая или более от объема элюируемой фракции (мл). Элюированные фракции смешивали с буфером как можно быстрее. После измерения A280 каждой фракции фракции были проверены на белки. Фракции с A280, равным 0,1 или более, были объединены. После объединения, с использованием тестовой полоски на pH был подтвержден pH, равный 8,0. Чистоту объединенного раствора оценивали с помощью SDS-PAGE, с использованием 12,5% геля и буфера для образцов (2ME+) (фиг. 10). Объединенный раствор фракций упаковали в диализную пробирку и диализировали против PBS или PBS, содержащего 0,1% NaN3, объемом в сто или более раз превышающего объем объединенного раствора. Диализ повторяли три или более раз, и каждый диализ проводили в течение шести часов или более. После концентрации диализную пробирку тщательно промывали деионизированной водой. После того как диализную пробирку осторожно потерли, достаточно для растворения белков, прилипших к стенке пробирки, концентрированный раствор был удален из пробирки. Затем измеряли концентрацию концентрированного раствора.
Результат показал, что из 200 мл культурального супернатанта было получено 2,5 мг очищенного IgG (фиг. 10) и IgG сохранял связывающую активность.
Применяемость в производственных условиях
Настоящее изобретение полезно в производстве веществ с использованием животных клеток. В частности, гибридомы, которые могут быть легко культивированы in vitro, могут быть получены слиянием слитых клеток согласно изобретению с клетками, продуцирующими полезные вещества. Такие клетки, продуцирующие полезные вещества, включают антителопродуцирующие клетки.
В частности, настоящее изобретение полезно в качестве способа производства антител. В частности, настоящее изобретение делает возможной получение гибридомы, используя человеческие антителопродуцирующие клетки в качестве материала. Гибридомы, полученные согласно изобретению, стабильно продуцируют антитела человека. Например, кровь от пациентов, перенесших инфекционные заболевания вероятно содержит клетки, продуцирующие антитела, которые нейтрализуют возбудителей заболевания или токсины, продуцируемые возбудителями. Антитела, полезные в лечении инфекционных заболеваний, могут продуцироваться путем подготовки гибридом согласно изобретению из антителопродуцирующих клеток таких пациентов.
Инфекционные заболевания, для которых могут быть получены терапевтические антитела согласно изобретению, включают, например, грипп, СПИД и вирусный гепатит, такой как HCV и HBV.
Кроме того, антителопродуцирующие клетки раковых пациентов, вероятно, содержат клетки, продуцирующие антитела, обладающие повреждающим действием на злокачественные клетки. Антитела, эффективные при лечении рака, могут быть получены путем производства гибридом согласно изобретению из таких антителопродуцирующих клеток.
Антитела человека могут быть получены от человеческих антителопродуцирующих клеток при использовании способов продукции антител согласно изобретению. Так как антитела человека могут безопасно вводиться человеку, они пригодны в качестве терапевтических антител. Модификации, такие как химеризация и гуманизация, требуются при лечении людей антителами, полученными от мышей, которые являются общеупотребительным инструментом для производства моноклональных антител. При сравнении с такими модификациями способы продукции антител согласно изобретению очевидно являются полезными в качестве способов продукции терапевтических антител.
Реферат
В изобретении описаны клетки-партнеры слияния, дающие возможность получения гетерогибридом из клеток биологических видов, отличающихся от мыши. Гетерогибридомы получают путем слияния миеломных клеток, полученных из животного первого биологического вида, с лейкозными клетками, полученными из животного второго биологического вида, которые имеют дополнительную S-фазу в клеточном цикле и обладают свойством диплоидизации. Клетка-партнер слияния SPYMEG депонирована под номером FERM ВР-10761 и может быть использована для получения гибридомы. Описана гибридома, продуцирующая антитела, полученная слиянием клетки-партнера слияния и третьей клетки с антителопродуцирующей способностью. В изобретении описаны способы получения клетки-партнера слияния, гибридомы и антителопродуцирующей клетки, а также способы получения антител. Использование изобретения обеспечивает стабильное и несложное продуцирование веществ с использованием гибридом в широком диапазоне видов животных. Полученные по изобретению гибридомы стабильно сохраняют фенотип в течение всего процесса клонирования. 8 н. и 12 з.п. ф-лы, 10 ил., 2 табл.
Формула
(а) миеломной клетки, полученной из животного первого биологического вида, и
(б) лейкозной клетки, полученной из животного второго биологического вида, в клеточном цикле которых содержится дополнительная S-фаза.
(а) миеломной клетки, полученной из животного первого биологического вида, и
(б) лейкозной клетки, полученной из животного второго биологического вида, чей клеточный цикл содержит дополнительную S-фазу, и
(2) третьей клетки, обладающей антителопродуцирующей способностью.
(1) слияние
(а) миеломной клетки, полученной из животного первого биологического вида, и
(б) лейкозной клетки, полученной из животного второго биологического вида, в клеточном цикле которых содержится дополнительная S-фаза; и
(2) культивирование клеток, слитых на стадии (1), и сбор этих клеток-партнеров слияния из культуры.
(1) слияние антителопродуцирующей клетки с клеткой-партнером слияния, полученной способом по п.13, и
(2) культивирование клеток, слитых на стадии (1), и сбор гибридом из культуры.
(1) получение гибридомы путем слияния антителопродуцирующей клетки с клеткой-партнером слияния, полученной способом по п.13, и
(2) сбор гибридом, полученных на стадии (1), в качестве антителопродуцирующих клеток.
(1) получение гибридомы путем слияния антителопродуцирующей клетки с клеткой-партнером слияния, полученной способом по п.13, и
(2) культивирование гибридом, полученных на стадии (1), и сбор антител из культуры.
(1) получение гибридомы путем слияния клетки-партнера слияния, полученной способом по п.13, с антителопродуцирующей клеткой, полученной от субъекта, который подвергался действию патогенного агента инфекционного заболевания, и
(2) культивирование гибридом, полученных на стадии (1), и сбор из культуры антител против инфекционного заболевания.

Комментарии