Моноклональное антитело, способное связываться со специфическим прерывистым эпитопом, расположенным в области ad1 гликопротеина gb цитомегаловируса человека, и его антигенсвязывающий фрагмент - RU2542472C2
Код документа: RU2542472C2
Чертежи



























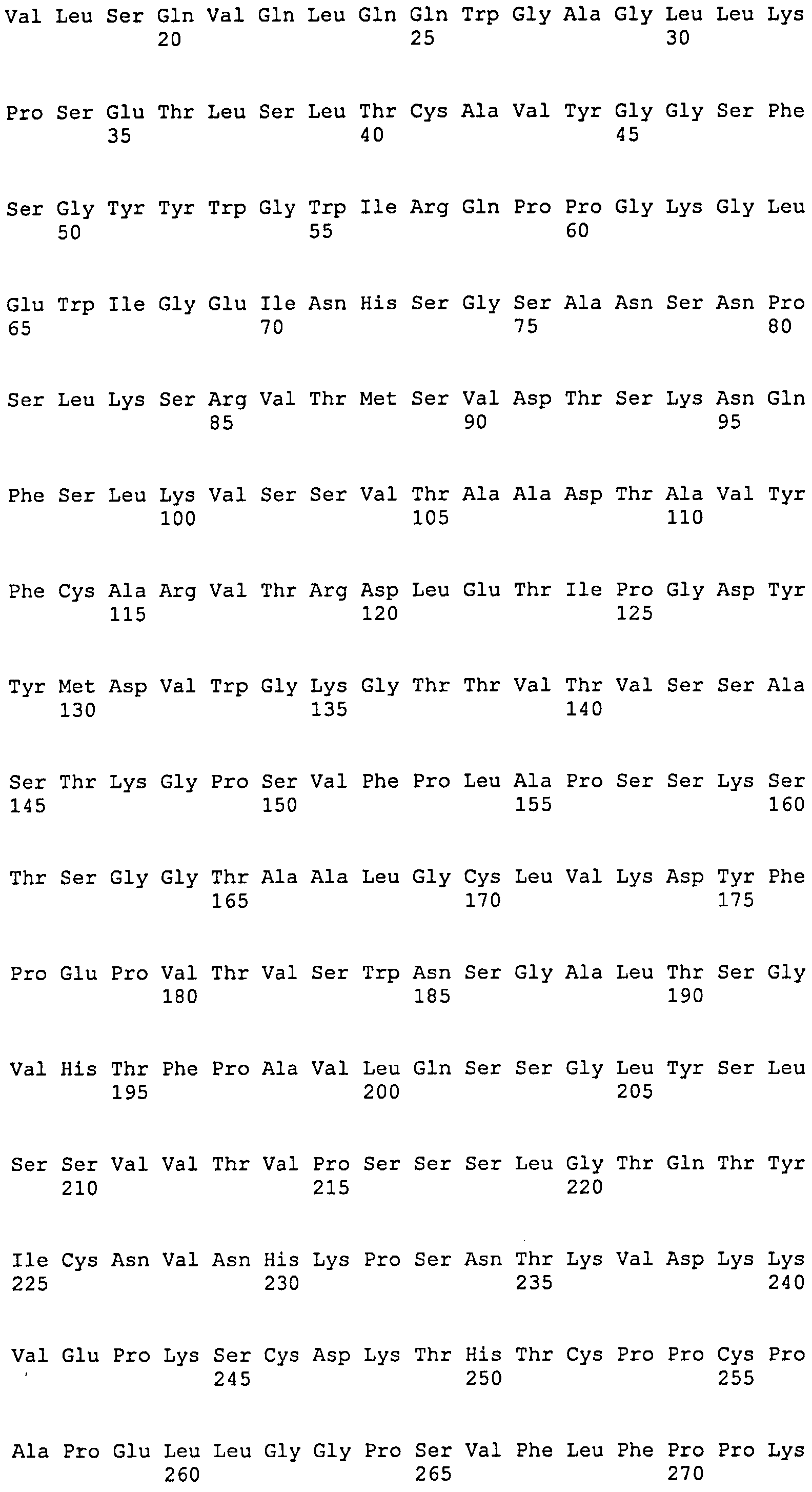






































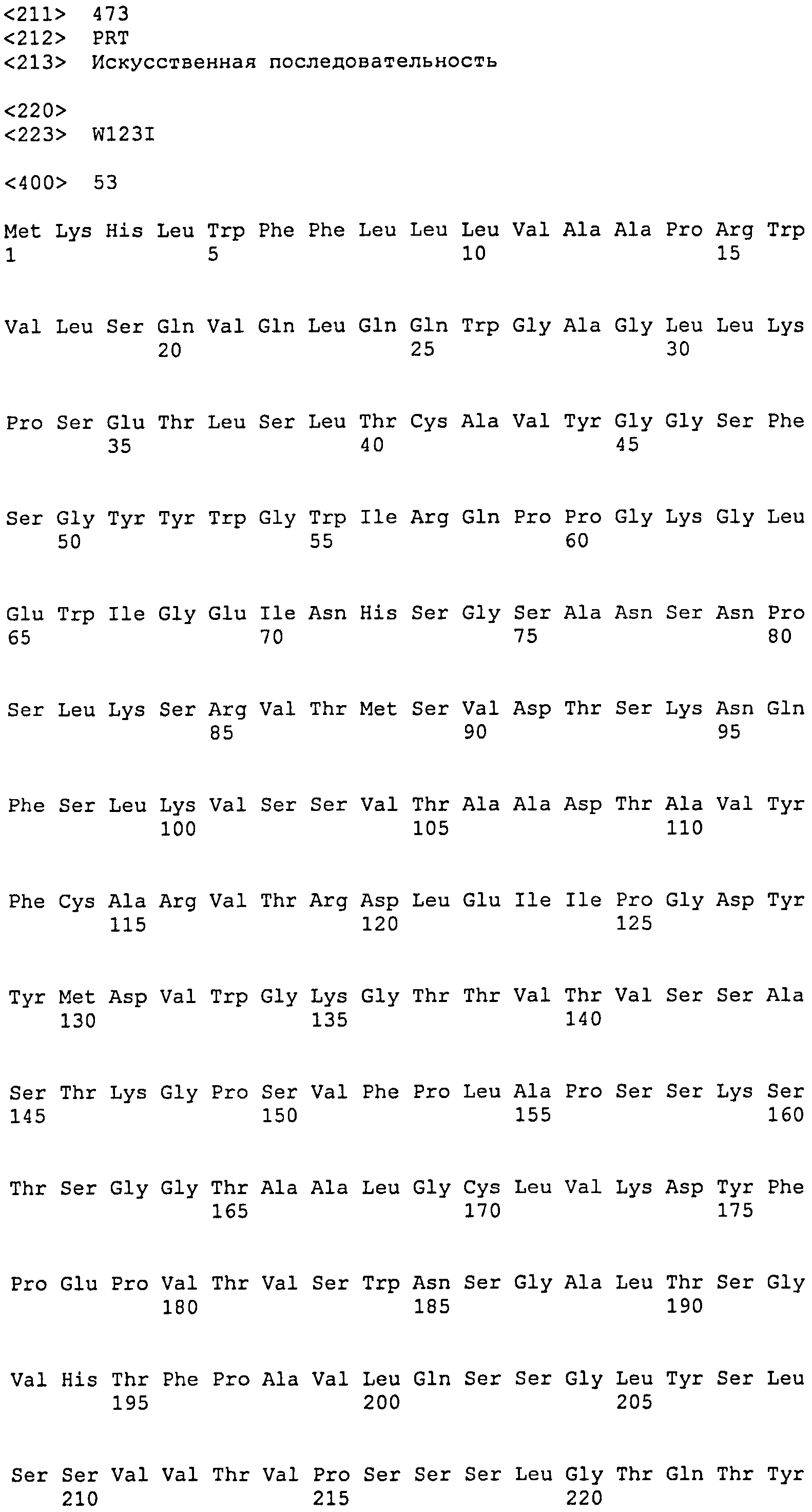

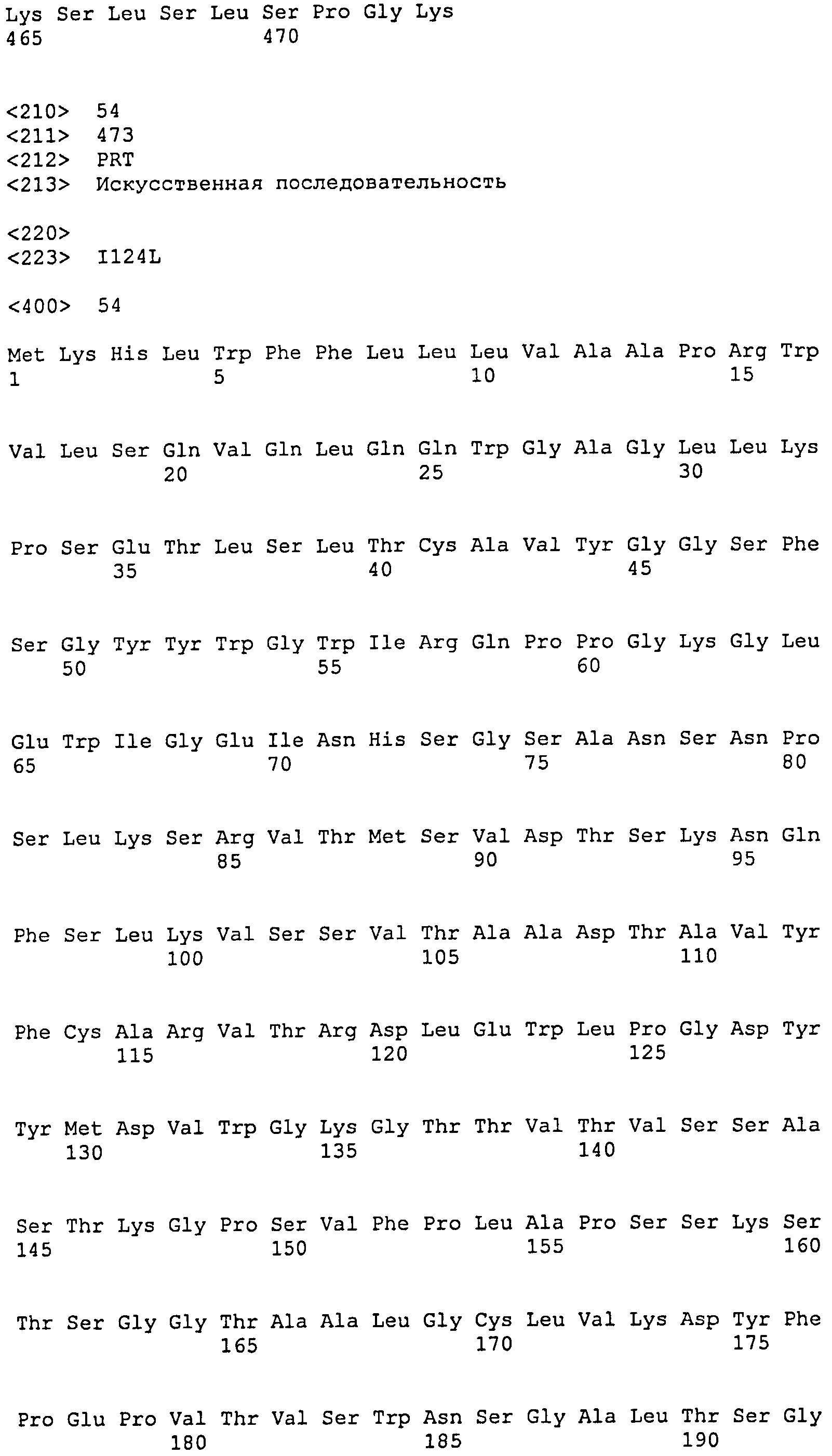








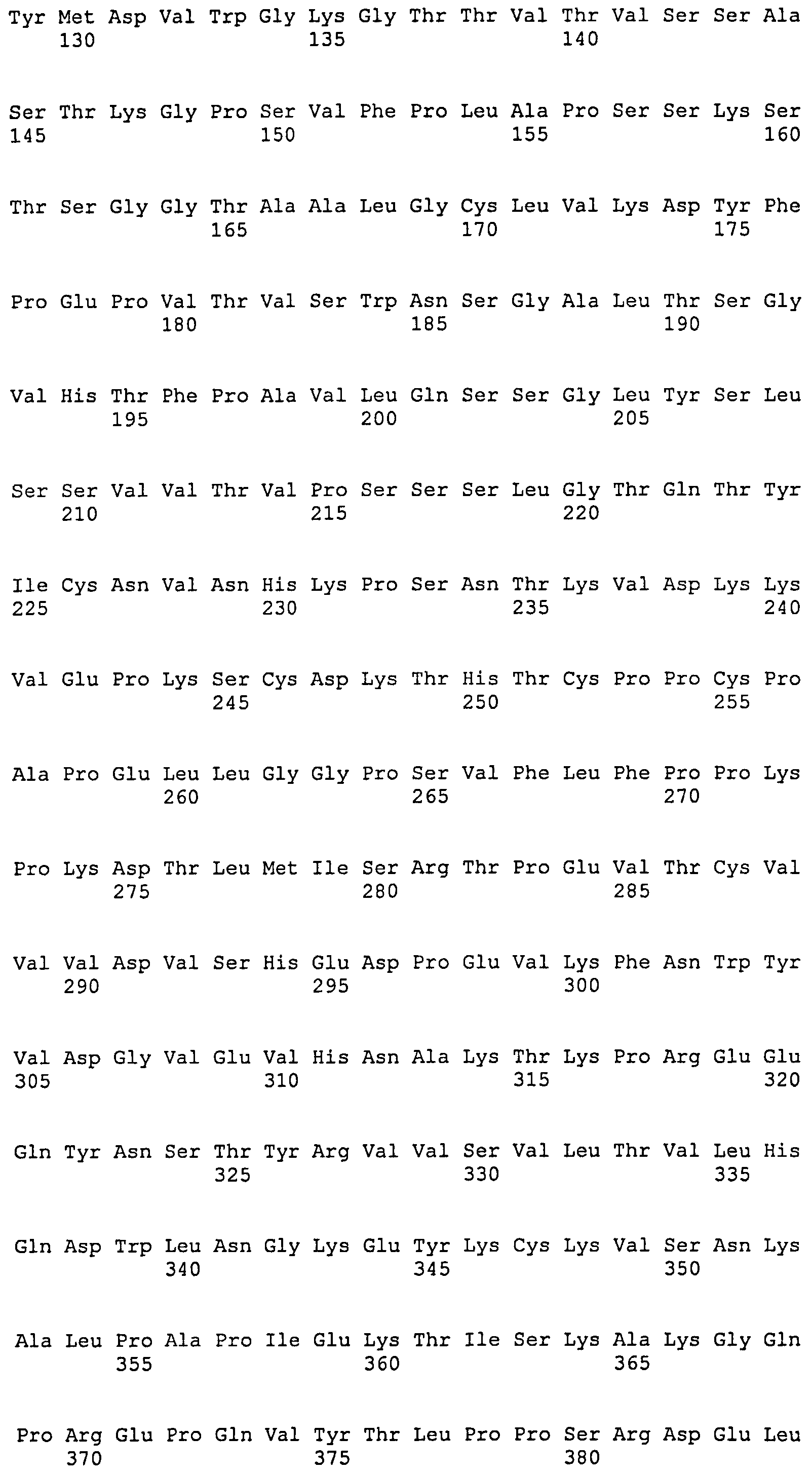


































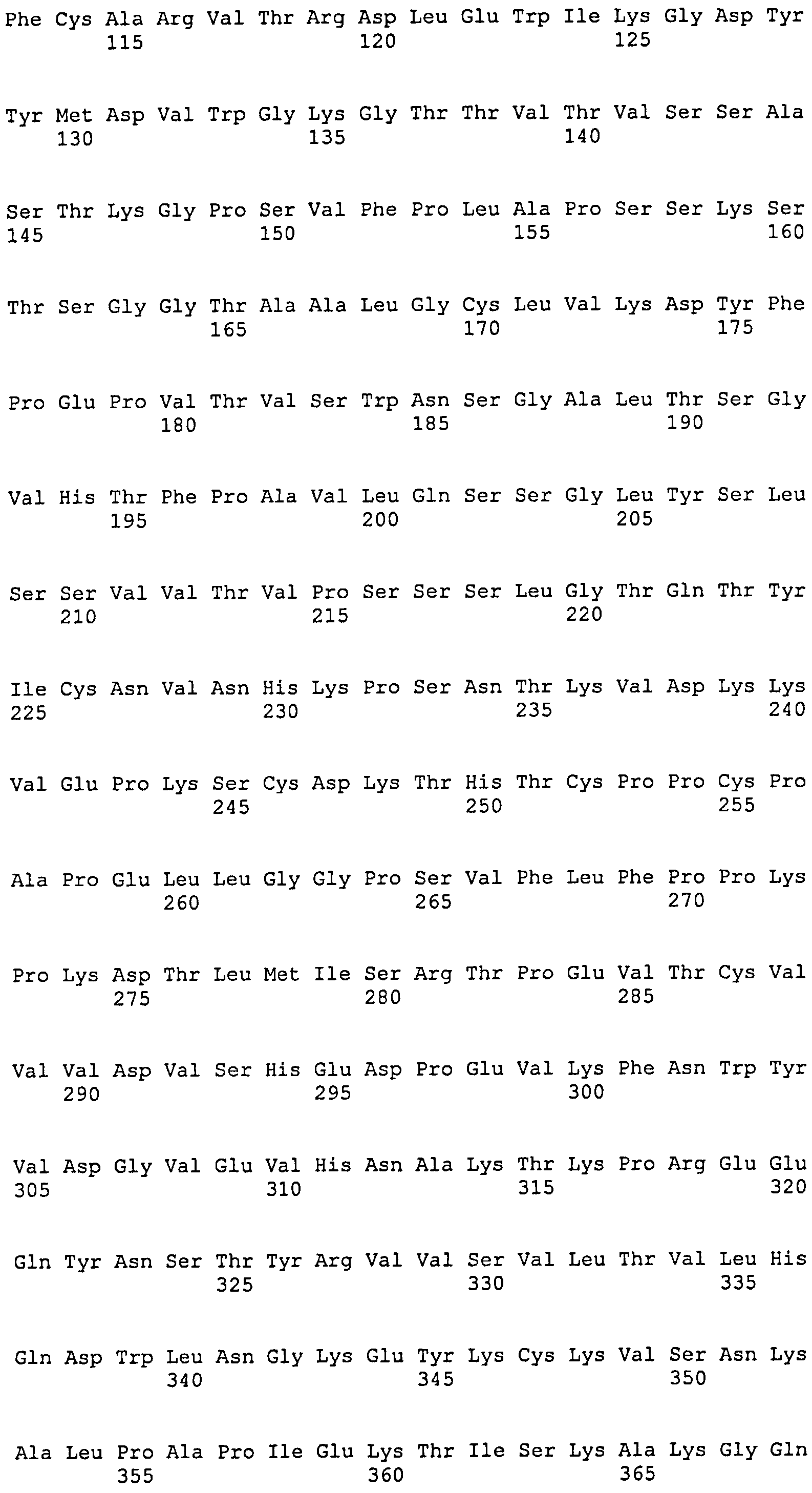






















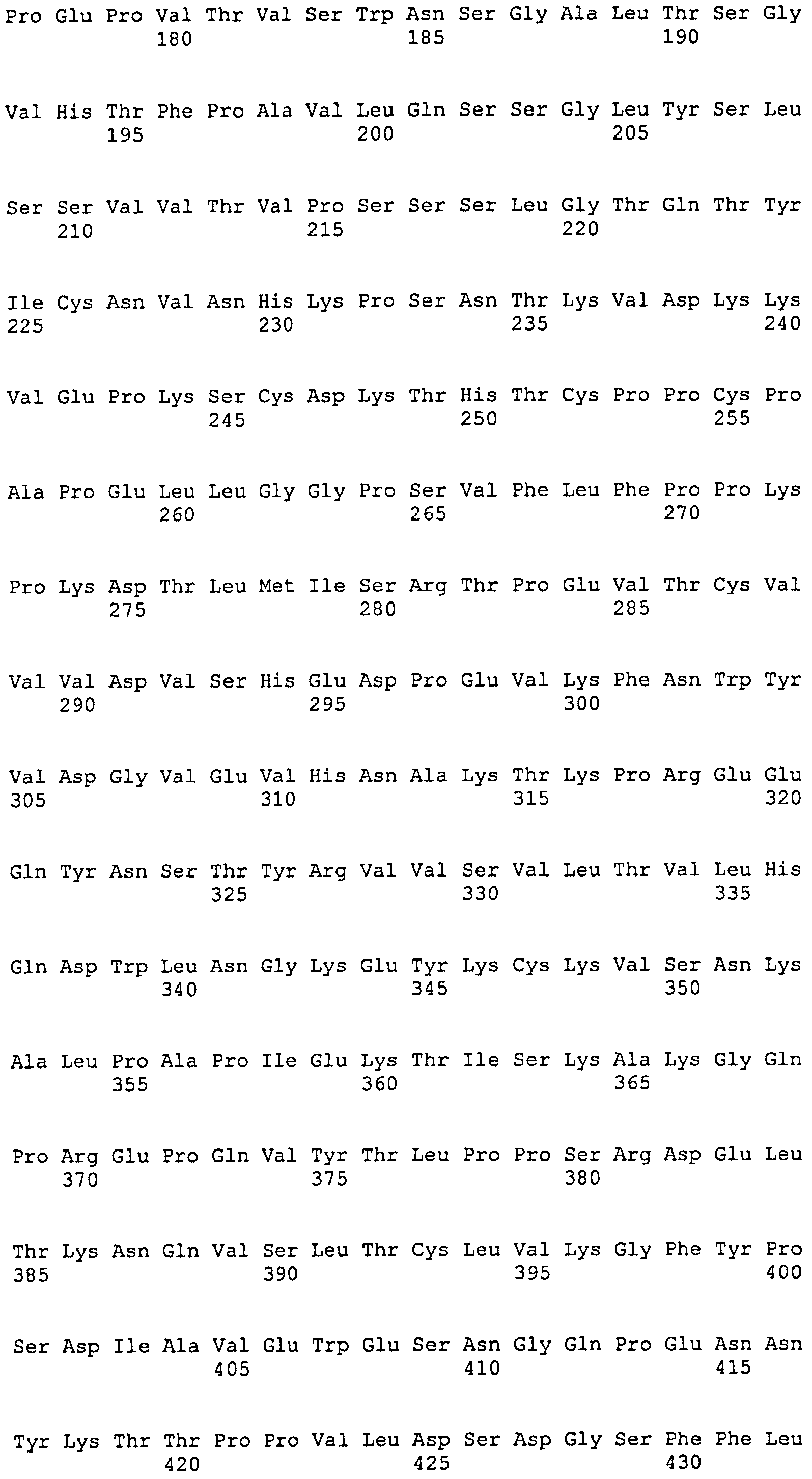







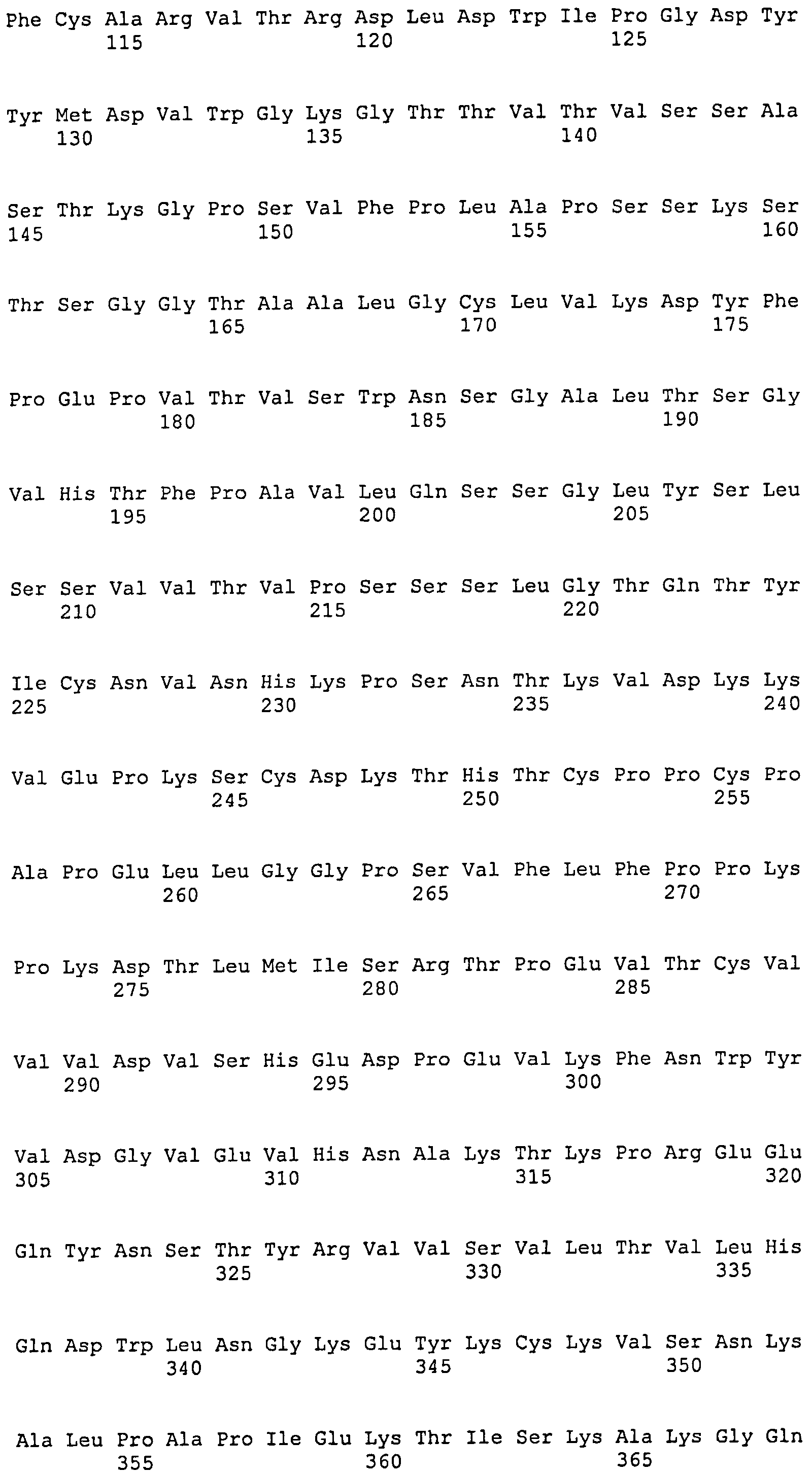





















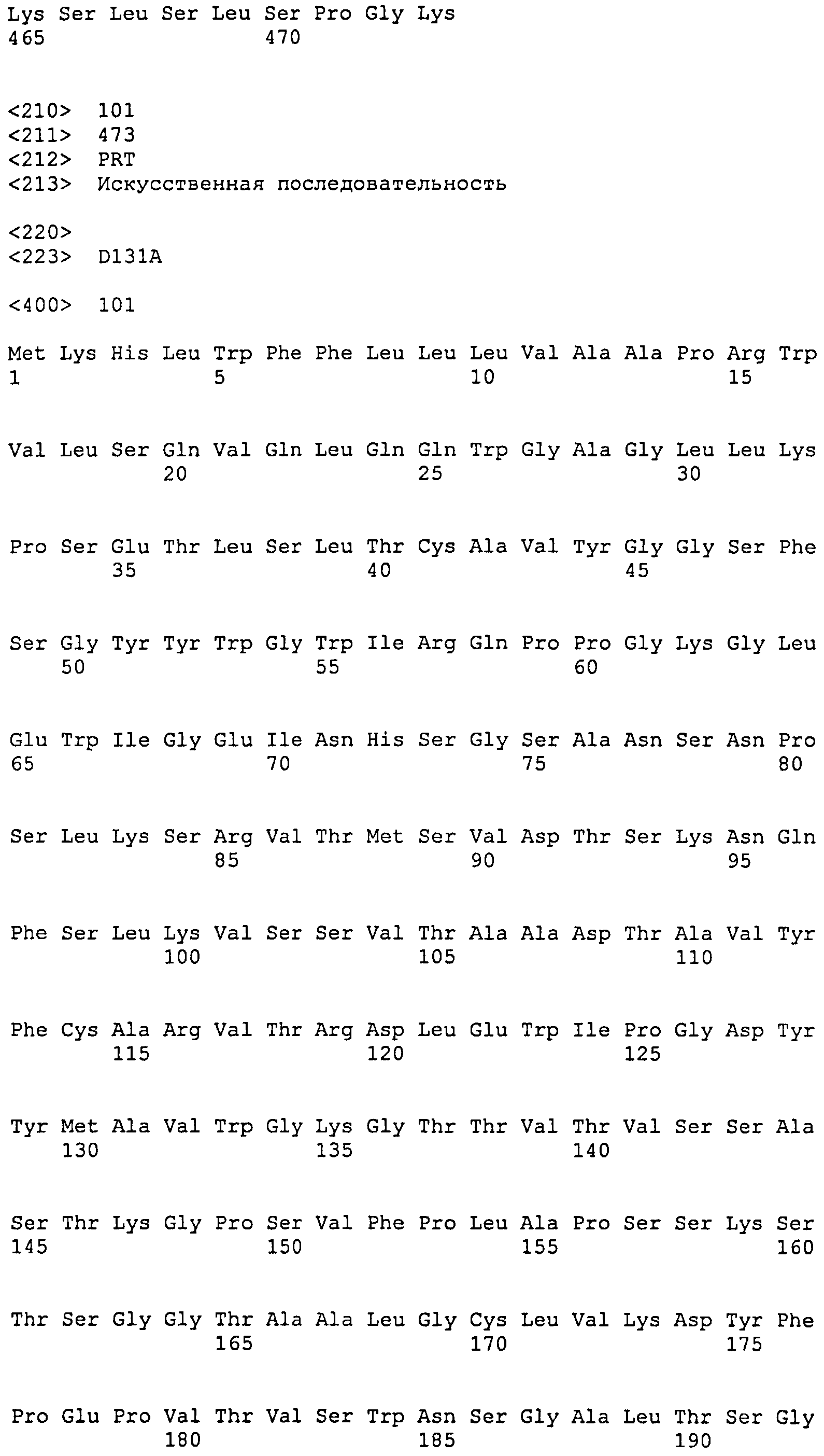





































Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к моноклональному антителу, которое связывается с цитомегаловирусом (в настоящем описании в дальнейшем обозначаемый иногда как «HCMV»), и к его антигенсвязывающему фрагменту. Более конкретно, настоящее изобретение относится к моноклональному антителу человека, которое способно связываться с областью AD1 гликопротеина gB, и к его антигенсвязывающему фрагменту.
Уровень техники
Наряду с вирусом герпеса человека 6 типа (HHV-6) и вирусом герпеса человека 7 типа (HHV-7), цитомегаловирус человека (HCMV) принадлежит к бета-герпесвирусам семейства Herpesviridae. HCMV представляет собой вирус, содержащий двухцепочечную ДНК, который является самым крупным в семействе Herpesviridae с диаметром приблизительно 180 нм, причем его дикий штамм кодирует 165 генов с размером генома приблизительно 235 т.п.н. (непатентный документ 1 и 2).
HCMV является весьма видоспецифичным и не инфицирует животных, отличных от человека, но в высокой степени инфицирует человека и обладает аффинностью в отношении разнообразных типов тканей в организме человека.
Более того, после первичного инфицирования HCMV не элиминируется даже после выработки иммунитета у хозяина и остается пожизненно.
После первичного инфицирования HCMV остается латентным в течение жизни. Более 90% взрослых японцев уже являются инфицированными и носителями вируса, хотя вирус редко активируется и редко вызывает заболевания у здоровых людей.
Однако состояние иммунодефицита, обусловленное СПИДом, обусловленное раком, трансплантацией органа, трансплантацией костного мозга, гемодиализом или подобным, может вызвать реактивацию латентного HCMV, которая может быть причиной серьезной инфекции HCMV, которая может быть фатальной, такой как интерстициальная пневмония, ретинит, гастроэнтерит, энцефалит или тому подобное (непатентные документы 3 и 4).
Более того, когда у беременной женщины возникает первичная HCMV инфекция в течение эмбрионального периода, HCMV инфекция может передаться от беременной женщины плоду через плаценту, в этом случае у плода может развиться врожденная CMV инфекция (врожденное цитомегаловирусное заболевание: также называемое цитомегалией или врожденной цитомегалией), и она может привести к невынашиванию беременности, мертворождению или смерти вскоре после рождения. Даже в случае выживания она может приводить к низкой массе при рождении, гепатоспленомегалии, желтухе, тромбоцитопенической пурпуре, микроцефалии, нарушению умственного развития, задержке интеллектуального развития, хориоретиниту, нарушению слуха или подобному. Кроме того, даже в течение периода новорожденности или младенчества, если недостаточно антител против HCMV, передаваемых от матери, HCMV инфекция через родовой путь, молоко, поступающее из молочной железы, мочу, слюну или тому подобное может вызвать развитие аномалий функции печении, интерстициальную пневмонию, мононуклеоз или тому подобное (непатентные документы 3, 4 и 5).
HCMV инфекция стала широко распространенной, и профилактические и терапевтические лекарственные средства, которые способны подавлять возникновение различных патологических состояний, обусловленных описанным выше HCMV, или которые способны облегчать такие патологические состояния, в настоящее время находятся в состоянии разработки. Недавно в качестве противовирусных лекарственных средств были разработаны ганцикловир (непатентные документы 6 и 7), фоскарнет (непатентный документ 8), валганцикловир (непатентный документ 9) и тому подобное для подавления пролиферации HCMV.
Ганцикловир представляет собой противовирусное лекарственное средство, блокирующее синтез вирусной ДНК, который в клетках активируется до ганцикловиртрифосфата и является конкурентным антагонистом дезоксигуанозинтрифосфата (dGTP), т.е. субстрата ДНК-полимеразы, тем самым ингибируя ДНК-полимеразу. В связи с этим, он используется для лечения цитомегаловирусного ретинита при состоянии иммунодефицита, главным образом СПИДа, или используется для подавления возникновения цитомегаловирусного ретинита при прогрессирующей инфекции ВИЧ со 100 или менее CD4 лимфоцитами/мм3, и одобрен как фармацевтический продукт.
Однако, как сообщалось, противовирусные агенты, такие как ганцикловир, имеют различные побочные эффекты, такие как гематопоэтическое нарушение, и их режим использования очень ограничен, как описано выше.
Среди побочных эффектов ганцикловира наиболее часто встречающимися и требующими внимания побочными эффектами являются нарушения крови, связанные с подавлением работы костного мозга, когда количество лейкоцитов, эритроцитов и тромбоцитов аномально снижено. Ранние симптомы включают лихорадку, ангину, аномальную медлительность и склонность к кровотечению, такому как подкожное кровотечение. В некоторых случаях он может вызывать отклонение в психоневротической системе, приводящее к головной боли, головокружению, бессоннице, затруднению мышления, ощущению тревоги или подобному.
Кроме того, в экспериментах на животных сообщалось о тератогенности, мутагенности и канцерогенности, и, следовательно, он не может использоваться при беременности.
Далее, хотя использование ганцикловира в тяжелых случаях врожденной HCMV инфекции, как считается, является эффективным для снижения возникновения неврологических последствий и улучшения в отношении прогрессии потери слуха (непатентный документ 10), проблемы подавления работы костного мозга, тератогенности или канцерогенности в качестве побочных эффектов ганцикловира все еще требуют обоснованного и внимательного рассмотрения.
Валганцикловир представляет собой сложный эфир L-валина и ганцикловира, который превращается в ганцикловир с помощью кишечных и печеночных эстераз после перорального введения. Соответственно, механизм его действия и побочные эффекты являются такими же, как и у ганцикловира, и, следовательно, связаны с подавлением работы костного мозга, тератогенностью и канцерогенностью. В Японии валганцикловир одобрен в качестве терапевтического лекарственного средства для цитомегаловирусного ретинита при иммунодефицитных состояниях, главным образом при СПИДе.
Между тем фоскарнет представляет собой аналог пирофосфорной кислоты и подавляет пролиферацию HCMV, действуя прямо на связывающий сайт пирофосфорной кислоты ДНК-полимеразы и ингибируя ДНК-полимеразу. Он также эффективен против HCMV, устойчивого к ганцикловиру. Главные побочные эффекты включают ощущение тошноты, анемию, повышение сывороточного креатинина, рвоту, снижение содержания магния в крови, гипокалиемию, аномальное ощущение и тому подобное. В частности, часто наступают шок и повреждение почек и, следовательно, требуется осторожное введение. В Японии использование фоскарнета разрешено только у пациентов с установленным диагнозом HCMV ретинита или у пациентов с серьезным клиническим подозрением на HCMV ретинит среди пациентов со СПИДом, и он не используется в целях профилактики инфекции (непатентный документ 8).
Таким образом, крайне желательна разработка лекарственного средства, способного предотвращать возникновение различных заболеваний, обусловленных описанным выше HCMV, или облегчать их симптомы без какого-либо побочного эффекта. Под влиянием этих обстоятельств были осуществлены клинические разработки двух антител против HCMV, где одно представляет собой антитело против HCMV «C23 (также названное во время разработки TI-23)», описанное в патентном документе 3, которое представляет собой антитело, распознающее область AD2 гликопротеина gB, а другое представляет собой антитело против HCMV «SDZ MSL 109», описанное в патентном документе 4, которое представляет собой моноклональное антитело, которое распознает гликопротеин gH на поверхности HCMV. В частности, разработка C23 была заброшена на полпути, несмотря на его высокую нейтрализующую активность, т.е. концентрацию 0,5 мкг/мл при 50% ингибировании, как определено методом локального гемолиза в геле (непатентный документ 11).
С течением времени была активно проведена разработка вакцины против HCMV, но вакцина, которая может выдержать клиническое использование, до сих пор недоступна. Недавно был разработан состав гамма-глобулина, происходящего от человека, с высоким титром против CMV, который одобрен в Соединенных Штатах для его использования при профилактике возникновения HCMV инфекции, связанной с трансплантацией почки. Однако так как состав гамма-глобулина с высоким титром против CMV является препаратом, происходящим из крови человека, это создает различные проблемы. Например, смесь гамма-глобулинов, происходящих от человека, ведет к существенной вариабельности активности от лота к лоту, к низкой активности и ограниченному применению, а также к постоянным рискам, таким как загрязнение неизвестным патогенным вирусом или патогеном.
Соответственно, так как моноклональное антитело (иногда обозначаемое в настоящем описании как «антитело против HCMV»), которое связывается с HCMV и нейтрализует его инфекционность (т.е. уничтожает его биологическую активность), как ожидается, может являться профилактическим или терапевтическим лекарственным средством для различных патологических состояний, вызываемых HCMV, оно пригодно, например, в плане стратегии профилактики или лечения различных заболеваний, вызываемых HCMV у пациента в состоянии иммунодефицита.
В частности, антитело против HCMV, происходящее от человека, которое обладает высокой аффинностью и сильной нейтрализующей способностью против HCMV для уничтожения активности HCMV, предотвращения возникновения заболеваний или облегчения симптомов и которое не вызывает аллергической реакции, очевидно является эффективным для введения в качестве так называемого «лекарственного средства на основе антител».
Однако антитела, ингибирующие HCMV, о которых сообщалось до настоящего времени (например, в патентных документах 1, 2, 3, 4 и 5), были неудовлетворительны в плане аффинности, нейтрализующей способности против HCMV и подобного, и, следовательно, они не отвечали ожиданиям удовлетворительного блокирования биологической активности HCMV для предотвращения возникновения различных заболеваний, вызываемых HCMV, или облегчения их симптомов.
Следовательно, крайне желательно создание антитела против HCMV или его антигенсвязывающего фрагмента, которое является моноклональным антителом человека, которое не распознает или не реагирует на другое чужеродное вещество, которое обладает прекрасными аффинностью, специфичностью и нейтрализующей способностью в отношении HCMV, и которое, как можно ожидать, может использоваться в качестве профилактического или терапевтического лекарственного средства.
Недавно для того, чтобы подавить пролиферацию HCMV in vivo, приводилась не только нейтрализующая активность, но также важность блокирования передачи инфекции от клетки к клетке (непатентные документы 12 и 13), и, таким образом, крайне необходимо антитело против HCMV, которое также обладает активностью в отношении ингибирования передачи инфекции от клетки к клетке.
Документы предшествующего уровня техники
Патентные документы
Патентный документ 1: публикация японской патентной заявки № 8-502403
Патентный документ 2: публикация японской патентной заявки № 8-506325
Патентный документ 3: WO87/03602
Патентный документ 4: WO93/021952
Патентный документ 5: WO2007/094423
Непатентные документы
Непатентный документ 1: Davidson, A.J. et al., The human cytomegalovirus genome revisited: comparison with the chimpanzee cytomegalovirus genome. J. Gen.Virol., 2003; 84: p17-28
Непатентный документ 2: Dolan, A. et al., Genetic content of wild-type human cytomegalovirus. J. Gen. Virol., 2004; 85: p1301-1312
Непатентный документ 3: Keiko TAYA, Discussion of Infection: Cytomegalovirus infection, Infectious Diseases Weekly Report Japan. 2003; Week 15: 10-14
Непатентный документ 4: Griffiths P.D., The treatment of cytomegalovirus infection. J. Anti. Chemo., 2002; 49: p243-253
Непатентный документ 5: Demmler, G.J., Congenital cytomegalovirus infection and diseases. Seminars in Pediatric Infection Diseases. Seminars in Pediatric Infection Diseases, 1999; 10: p195-200
Непатентный документ 6: Freitas, V.R. et al., Activity of 9-(1,3-dihydroxy-2-Propoxymethel)guanine compared with that of acyclovir against human, monkey, and rodent cytomegalovirus. Anti. Agent Chemo., 1985; 28: p240-245
Непатентный документ 7: Package insert for anti-cytomegalovirus chemotherapeutic agent, Denosine for intravenous infusion, 500 mg, ganciclovir formulation, Mitsubishi Tanabe Pharma (переработано в октябре 2007 г.)
Непатентный документ 8: Package insert for antiviral agent for drip injection, Foscavir, 24 mg/ml. foscarnet sodium hydrate injection, AstraZeneca (переработано в июне 2007 г.)
Непатентный документ 9: Package insert for anti-cytomegalovirus chemotherapeutic agent, Valixa tablet (4500 mg), valganciclovir hydrochloride formulation, Mitsubishi Tanabe Pharma (переработано в октябре 2007 г.)
Непатентный документ 10: Kimberlin, D.W. et al., Effect of ganciclovir therapy on hearing in symptomatic congenital cytomegalovirus disease involving the central nervous system; controlled trial. J. Pediatr., 2003; 143: 16-25
Непатентный документ 11: Masuho, T., et al., Human monoclonal antibodies neutralizing human cytomegalovirus, J. Gen. Virol, 1987; 68: p1457-1461
Непатентный документ 12: Navarro, D. et al., Glycoprotein B of human cytomegalovirus promotes virion penetration into cells, transmission of infection from cell to cell, and fusion of infected cells. Virology, 1993: p143-158
Непатентный документ 13: Ohizumi, Y., Neutralizing mechanism of two human monoclonal antibodies against human cytomegalovirus glycoprotein 130/55. J. Gan. Virol., 1992; 73: p2705-2707
Сущность изобретения
Задачи, решаемые изобретением
Таким образом, антитело или антигенсвязывающий фрагмент, которые специфически связываются с HCMV и которые в достаточной мере ингибируют его биологическую активность, очевидно, являются полезными в борьбе с различными заболеваниями, вызываемыми HCMV, в плане перспектив стратегии лечения или профилактики.
В настоящий момент большинство лекарственных средств на основе антител, которые одобрены в качестве фармацевтических продуктов, нуждаются во введении в большом количестве от нескольких мг или нескольких сотен мг в день и являются дорогими. Многие из биофармацевтических продуктов, которые являются из коммерчески доступными до настоящего времени, отличных от фармацевтических продуктов на основе антител, нуждаются во введении в количестве от нескольких десятков мкг до 1 мг в день. По сравнению с традиционным биофармацевтическим продуктом суточные дозы фармацевтических продуктов на основе антител существенно варьируют, являясь более высокими приблизительно в 10-1000 раз. HCMV вызывает различные заболевания, и лечение этих заболеваний связано с важными характеристиками антитела, такими как более высокая активность, меньшая терапевтическая доза и поддержание низкой стоимости лечения, рассмотрение возможного влияния на новорожденных, младенцев и беременных женщин. Другими словами, желательно не какое-либо лекарственное средство на основе антител, а лекарственное средство с высокой биологической активностью, которое более пригодно в плане улучшенной аффинности и более высокой нейтрализующей способности в качестве фармацевтического продукта, исходя из расходов на здравоохранение.
Хотя количество получаемых необходимых фармацевтических продуктов на основе антител существенно возрастает, возможностей для получения в глобальном масштабе недостаточно. В таких условиях желательно моноклональное антитело человека против HCMV с более высокой аффинностью и нейтрализующей способностью, так как антитело с прекрасной аффинностью и нейтрализующей способностью может оказывать эффекты в меньшем количестве. Более того, так как HCMV по существу является инфекционным для разнообразных типов тканей и клеток в организме (Singer, C. Et al., Curr Top Microbiol Immunol., 2008; 325: p63-83), для антитела против HCMV важно проявлять клинические эффекты, обладая эффективной нейтрализующей активностью в отношении любой из подвергаемых инфицированию клеток-хозяина - фибробласта, эпителиальной клетки и эндотелиальной клетки.
Учитывая способ распространения HCMV инфекции in vivo, крайне необходимо антитело против HCMV, которое не только обладает нейтрализующей способностью, но обладает также способностью блокировать передачу инфекции от клетки к клетке. Более того, в плане эффективности и безопасности в качестве фармацевтического продукта желательно обеспечение фармацевтической композицией против HCMV, вызывающего различные заболевания, содержащей происходящее от человека моноклональное антитело или его антигенсвязывающий фрагмент, которые обладают высокой нейтрализующей способностью и способностью блокировать передачу инфекции от клетки к клетке.
Средства решения задач изобретения
Для получения описанного выше антитела авторы настоящего изобретения провели интенсивные исследования и достигли успеха в плане получения моноклонального антитела человека, которое специфически распознает ранее не описанный прерывистый эпитоп, присутствующий в области AD1 гликопротеина gB HCMV, которое также обладает высокой нейтрализующей способностью и высокой способностью блокировать передачу инфекции от клетки к клетке, тем самым осуществив настоящее изобретение.
Таким образом, настоящее изобретение относится к моноклональному антителу против HCMV или к его связывающему фрагменту, к ДНК (полинуклеотиду), кодирующей антитело или связывающий фрагмент, к вектору, содержащему ДНК, и к клетке-хозяина, содержащей вектор, описанным ниже.
[1] Антитело или его антигенсвязывающий фрагмент, которые связываются с областью AD1 гликопротеина gB цитомегаловируса человека (HCMV), и которые распознают в качестве эпитопа прерывистую последовательность, включающую аминокислотную последовательность SEQ ID NO:25, аминокислотную последовательность SEQ ID NO:26 и аминокислотную последовательность SEQ ID NO:27, присутствующие в области AD1.
[2] Моноклональное антитело, которое специфически связывается с областью AD1 гликопротеина gB цитомегаловируса человека (HCMV), и которое способно нейтрализовать его биологическую активность, где
(i) вариабельная область тяжелой цепи включает:
(a) аминокислотную последовательность CDR1 тяжелой цепи, выбранную из группы, состоящей из аминокислотной последовательности SEQ ID NO:13 и аминокислотной последовательности, имеющей делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:13;
(b) аминокислотную последовательность CDR2 тяжелой цепи, выбранную из группы, состоящей из аминокислотной последовательности SEQ ID NO:14 и аминокислотной последовательности, имеющей делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:14, и
(c) аминокислотную последовательность CDR3 тяжелой цепи, выбранную из группы, состоящей из аминокислотной последовательности SEQ ID NO:15, аминокислотной последовательности, имеющей делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:15 и аминокислотной последовательности SEQ ID NO:22, и
(ii) вариабельная область легкой цепи включает:
(a) аминокислотную последовательность CDR1 легкой цепи, выбранную из группы, состоящей из аминокислотной последовательности SEQ ID NO:16 и аминокислотной последовательности, имеющей делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16;
(b) аминокислотную последовательность CDR2 легкой цепи, выбранную из группы, состоящей из аминокислотной последовательности SEQ ID NO:17 и аминокислотной последовательности, имеющей делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:17, и
(c) аминокислотную последовательность CDR3 легкой цепи, выбранную из группы, состоящей из аминокислотной последовательности SEQ ID NO:18 и аминокислотной последовательности, имеющей делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:18;
или его антигенсвязывающий фрагмент.
[3] Антитело или его антигенсвязывающий фрагмент по пункту [2] выше, которые специфически связываются с эпитопом, включающим две или более прерывистые последовательности, присутствующие в областях аминокислотной последовательности (SEQ ID NO:23), состоящей из непрерывных аминокислотных остатков в положениях 549-580, и аминокислотной последовательности (SEQ ID NO:24), состоящей из непрерывных аминокислотных остатков в положениях 596-640 гликопротеина gB HCMV.
[4] Антитело или его антигенсвязывающий фрагмент по пункту [2] выше, которые распознают в качестве эпитопа прерывистую последовательность, включающую аминокислотную последовательность SEQ ID NO:25, аминокислотную последовательность SEQ ID NO:26 и аминокислотную последовательность SEQ ID NO:27 в области AD1 гликопротеина gB HCMV.
[5] Антитело или его антигенсвязывающий фрагмент по любому из пунктов [3] или [4] выше, где антитело включает:
(i)
(a) аминокислотную последовательность CDR1 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO:13;
(b) аминокислотную последовательность CDR2 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO:14, и
(c) аминокислотную последовательность CDR3 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO:22, и
(ii)
(a) аминокислотную последовательность CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO:16;
(b) аминокислотную последовательность CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO:17, и
(c) аминокислотную последовательность CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO:18.
[6] Антитело или его антигенсвязывающий фрагмент по пункту [5] выше, где антитело включает:
(i)
(a) аминокислотную последовательность CDR1 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO:13;
(b) аминокислотную последовательность CDR2 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO:14, и
(c) аминокислотную последовательность CDR3 тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO:15; и
(ii)
(a) аминокислотную последовательность CDR1 легкой цепи, включающую аминокислотную последовательность SEQ ID NO:16;
(b) аминокислотную последовательность CDR2 легкой цепи, включающую аминокислотную последовательность SEQ ID NO:17, и
(c) аминокислотную последовательность CDR3 легкой цепи, включающую аминокислотную последовательность SEQ ID NO:18.
[7] Антитело или его антигенсвязывающий фрагмент по пункту [2] выше, включающие:
(a) вариабельную область тяжелой цепи (HCVR), состоящую из аминокислотной последовательности SEQ ID NO:10, аминокислотной последовательности, имеющей делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:10, или аминокислотной последовательности, идентичной на 95% или более аминокислотной последовательности SEQ ID NO:10, и
(b) вариабельную область легкой цепи (LCVR), состоящую из аминокислотной последовательности SEQ ID NO:12, аминокислотной последовательности, имеющей делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:12, или аминокислотной последовательности, идентичной на 95% или более аминокислотной последовательности SEQ ID NO:12.
[8] Антитело или его антигенсвязывающий фрагмент по пункту [7] выше, включающие:
(a) вариабельную область тяжелой цепи (HCVR), включающую аминокислотную последовательность SEQ ID NO:10, и
(b) вариабельную область легкой цепи (LCVR), включающую аминокислотную последовательность SEQ ID NO:12.
[9] Антитело или его антигенсвязывающий фрагмент по пункту [2] выше, включающие:
(a) тяжелую цепь (H-цепь), имеющую аминокислотную последовательность SEQ ID NO:2 или 6, аминокислотную последовательность, имеющую делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или 6, или аминокислотную последовательность, идентичную на 95% или более аминокислотной последовательности SEQ ID NO:2 или 6, и
(b) легкую цепь (L-цепь), имеющую аминокислотную последовательность SEQ ID NO:4 или 8, аминокислотную последовательность, имеющую делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:4 или 8, или аминокислотную последовательность, идентичную на 95% или более аминокислотной последовательности SEQ ID NO:4 или 8.
[10] Антитело или его антигенсвязывающий фрагмент по пункту [9] выше, включающие:
(a) тяжелую цепь (H-цепь), включающую аминокислотную последовательность SEQ ID NO:2 или 6, и
(b) легкую цепь (L-цепь), включающую аминокислотную последовательность SEQ ID NO:4 или 8.
[11] Антитело или антигенсвязывающий фрагмент по любому из пунктов [1]-[10] выше, где антитело представляет собой моноклональное антитело человека.
[12] Антитело или антигенсвязывающий фрагмент по любому из пунктов [1]-[11] выше, где антитело принадлежит к классу (подклассу) IgG1 (λ).
[13] Антитело или антигенсвязывающий фрагмент по любому из пунктов [1]-[12] выше, чья концентрация при 50% ингибировании образования бляшек составляет 0,05 мкг/мл (приблизительно 0,3 нМ) или менее для лабораторного штамма HCMV (AD169) в присутствии фибробластов человека.
[14] Антитело или антигенсвязывающий фрагмент по любому из пунктов [1]-[13] выше, которые обладают способностью блокировать передачу инфекции от клетки к клетке на 50% или более при 0,2 мкг/мл (приблизительно 1,3 нМ) или менее в клеточной линии фибробластов человека (MRC-5), инфицированных лабораторным штаммом HCMV (AD169).
[15] Фармацевтическая композиция для профилактики или лечения заболевания, связанного с цитомегаловирусом человека (HCMV), содержащая антитело или антигенсвязывающий фрагмент по любому из пунктов [1]-[14] выше и фармацевтически приемлемый носитель.
[16] Фармацевтическая композиция по пункту [15] выше, где заболевание, связанное с HCMV, представляет собой (a) интерстициальную пневмонию, ретинит, гастроэнтерит или энцефалит, вызываемые реактивацией HCMV при состоянии иммунодефицита, (b) врожденную CMV инфекцию, обусловленную передачей инфекции HCMV от беременной женщины плоду, (c) невынашивание беременности, мертворождение или смерть вскоре после рождения, обусловленные описанной выше врожденной CMV инфекцией, (d) низкую массу при рождении, гепатоспленомегалию, желтуху, тромбоцитопеническую пурпуру, микроцефалию, нарушение умственного развития, задержку интеллектуального развития, хориоретинит или нарушение слуха в случае выживания при описанной выше врожденной CMV инфекции; или (e) патологию функции печени, интерстициальную пневмонию или мононуклеоз, который вызван HCMV инфекцией при рождении или в младенчестве.
[17] Нуклеиновая кислота, кодирующая моноклональное антитело против HCMV или его антигенсвязывающий фрагмент, которые специфически связываются с областью AD1 гликопротеина gB HCMV и которые способны нейтрализовать его биологическую активность, где выделенная нуклеиновая кислота выбрана из нуклеиновых кислот, кодирующих аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO:2, 4, 6, 8, 10, 12, 13-18 и 22, и нуклеиновых кислот, которые гибридизуются с ними в очень жестких условиях.
[18] Вектор, включающий нуклеиновую кислоту по пункту [17] выше.
[19] Клетка-хозяина, включающая вектор по пункту [18] выше.
[20] Способ получения антитела или антигенсвязывающего фрагмента по любому из пунктов [1]-[14] выше, включающий стадию культивирования клетки-хозяина по пункту [19] выше.
Эффекты изобретения
Антитело против HCMV по настоящему изобретению, в частности антитело, которое специфически связывается с областью AD1 гликопротеина gB HCMV, или его антигенсвязывающий фрагмент могут специфически связываться с HCMV, который является причиной различных заболеваний, например, при состоянии иммунодефицита, и уничтожать (нейтрализовать) биологическую активность HCMV, тем самым проявляя прекрасную нейтрализующую способность против HCMV. Кроме того, вариант осуществления, в котором антитело против AD1 гликопротеина gB HCMV по настоящему изобретению представляет собой моноклональное антитело человека, является преимущественным в том, что оно не является иммуногенным, и в том, что оно не вызывает иммунного ответа.
В одном варианте осуществления антитело против HCMV по настоящему изобретению обладает высокой способностью к блокированию передачи инфекции от клетки к клетке или ингибирующей активностью против HCMV в отношении передачи инфекции от клетки к клетке. Учитывая способ распространения инфекции HCMV in vivo, преимущественным является то, что антитело против HCMV не только обладает нейтрализующей способностью, но также обладает способностью к блокированию передачи инфекции от клетки к клетке.
Антитело против HCMV или его антигенсвязывающий фрагмент по настоящему изобретению обладает высокой нейтрализующей способностью и ингибирующей активностью против HCMV в отношении распространения инфекции. Так как моноклональное антитело человека не является иммуногенным, оно, очевидно, является полезным в качестве профилактического или терапевтического лекарственного средства для лечения различных заболеваний, вызываемых HCMV, например: (a) таких заболеваний, как интерстициальная пневмония, ретинит, гастроэнтерит, энцефалит и тому подобное, обусловленных реактивацией HCMV при состояниях иммунодефицита, таких как СПИД, рак, состояния после трансплантации органа, после трансплантации костного мозга и после гемодиализа; (b) врожденной CMV инфекции, обусловленной передачей инфекции HCMV от беременной женщины плоду; (c) невынашивания беременности, мертворождения и смерти вскоре после рождения, обусловленных описанной выше врожденной CMV инфекцией; (d) низкой массы при рождении, гепатоспленомегалии, желтухи, тромбоцитопенической пурпуры, микроцефалии, нарушения умственного развития, задержки интеллектуального развития, хориоретинита и нарушения слуха в случае выживания при описанной выше врожденной CMV инфекции; и (e) патологии функции печени, интерстициальной пневмонии и мононуклеоза, который вызван HCMV инфекцией при рождении или в младенчестве (непатентные документы 3, 4 и 5).
Более того, фармацевтическая композиция, содержащая особенно предпочтительное моноклональное антитело человека по настоящему изобретению, эффективна в крайне малом количестве.
В последнее время проводятся исследования антитела против HCMV в плане работы против различных поверхностных антигенов, отличных от гликопротеина gB, например, gH, gL или подобного. Однако исходя из условий, указанных в (1)-(3) ниже, антитело, которое специфически связывается с гликопротеином gB, особенно с его областью AD1, и обладающее высокой нейтрализующей активностью, подобно антителу по настоящему изобретению, весьма полезно в качестве профилактического или терапевтического лекарственного средства для HCMV инфекции.
(1) Указывается (непатентные документы 12 и 13) важность для подавления пролиферации вируса, такого как HCMV, in vivo не только нейтрализующей активности, но также блокирования передачи инфекции от клетки к клетке. Между тем, недавние исследования гликопротеина gB показывают, что gB играет важную роль во входе вирусных частиц в клетки и передаче инфекции от клетки к клетке (Isaacson, M.K. et al., Human cytomegalovirus glycoprotein B is required for virus entry and cell-to-cell spread but not for virion attachment, assembly, or egress. J. Virology, 2009; 83: p3891-3903). Следовательно, антитело против gB, очень вероятно, вносит вклад также в ингибирование передачи инфекции от клетки к клетке.
(2) Среди областей гликопротеина gB, существенных для HCMV инфекции, область AD1 необходима для функционирования и создания конформации gB (Qadri, I. et al., Assembly of conformational-dependent neutralizing domains on glycoprotein B of human cytomegalovirus. J. Gen. Virol, 1992; 73; p2913-2921; и Britt, W.J. et al., Antigenic domain is required for oligomerization of human cytomegalovirus glycoprotein B. L. Virol., 2005; 79: p4066-4079), и она также известна как часть с меньшим количеством мутаций клинически выделенного штамма вируса. Таким образом, антитело против AD1, вероятно, имеет широкий спектр действия.
(3) Антитело против AD1, которое распознает прерывистые эпитопы на протяжении более длинной области на gB по сравнению с антителом против области AD2, обладает более высокой специфичностью и, тем самым, как представляется, имеет меньшую возможность оказывать нежелательные побочные эффекты в результате перекрестного взаимодействия с другой биологической молекулой.
Краткое описание фигур
На фиг.1 представлена схема последовательности операций, демонстрирующая метод выделения клона клеток, продуцирующих антитело, для продукции антитела против HCMV по настоящему изобретению.
На фиг.2 представлена оценка способности последовательностей из 16 аминокислотных остатков, образующих CDR-H3 EV2038, связываться с AD1, когда у них проводят неконсервативные аминокислотные замены.
На фиг.3 представлена оценка способности последовательности связываться с AD1, когда у нее проводят консервативные аминокислотные замены в положениях 121, 123, 124 и 126 H-цепи EV2038.
На фиг.4 представлена оценка способности последовательности связываться с AD1, когда пролин в положении 125 H-цепи EV2038 заменен всеми аминокислотами, отличными от пролина и аргинина.
На фиг.5 представлена оценка способности последовательности связываться с AD1, когда у нее проводят консервативные аминокислотные замены у аминокислотных остатков среди аминокислот, образующих CDR-H3 EV2038, чья способность связывания в отношении AD1 не снижалась, когда проводили неконсервативные аминокислотные замены, представленные на фиг.2.
На фиг.6 представлена оценка способности связывания вариантов в отношении AD1. Суммарно было приготовлено четыре типа вариантов с помощью одновременной замены двух или четырех аминокислотных остатков, которые, как показано, снижали способность связывания в отношении AD1, путем неконсервативных аминокислотных замен среди аминокислот, образующих CDR-H3 EV2038, отличных от пролина в положении 125 (а именно, суммарно четырех остатков в положениях 121, 123, 124 и 126) (продукты с двумя аминокислотными заменами: I124V/G126A и I124V/G126S, продукты с четырьмя аминокислотными заменами: L121I/W123Y/I124V/G126A и L121I/W123Y/I124V/G126S).
На фиг.7 представлена оценка способности связывания вариантов в отношении AD1. Получали и подвергали оценке один из каждых вариантов с делецией и вставкой (E122del и G126_D127insE) для аминокислотных остатков в положениях 121, 123, 124 и 126 (пролин в положении 125 был исключен), т.е. суммарно для четырех остатков среди аминокислот, образующих CDR-H3 EV2038, неконсервативная аминокислотная замена которых вызывала сниженную способность связывания в отношении AD1.
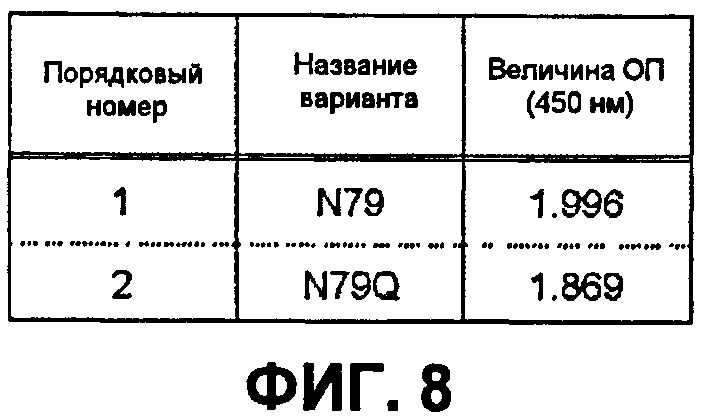
На фиг.8 представлена оценка способности связывания в отношении AD1 варианта, имеющего мутацию в 79-ом аминокислотном остатке области CDR-H2 EV2038.
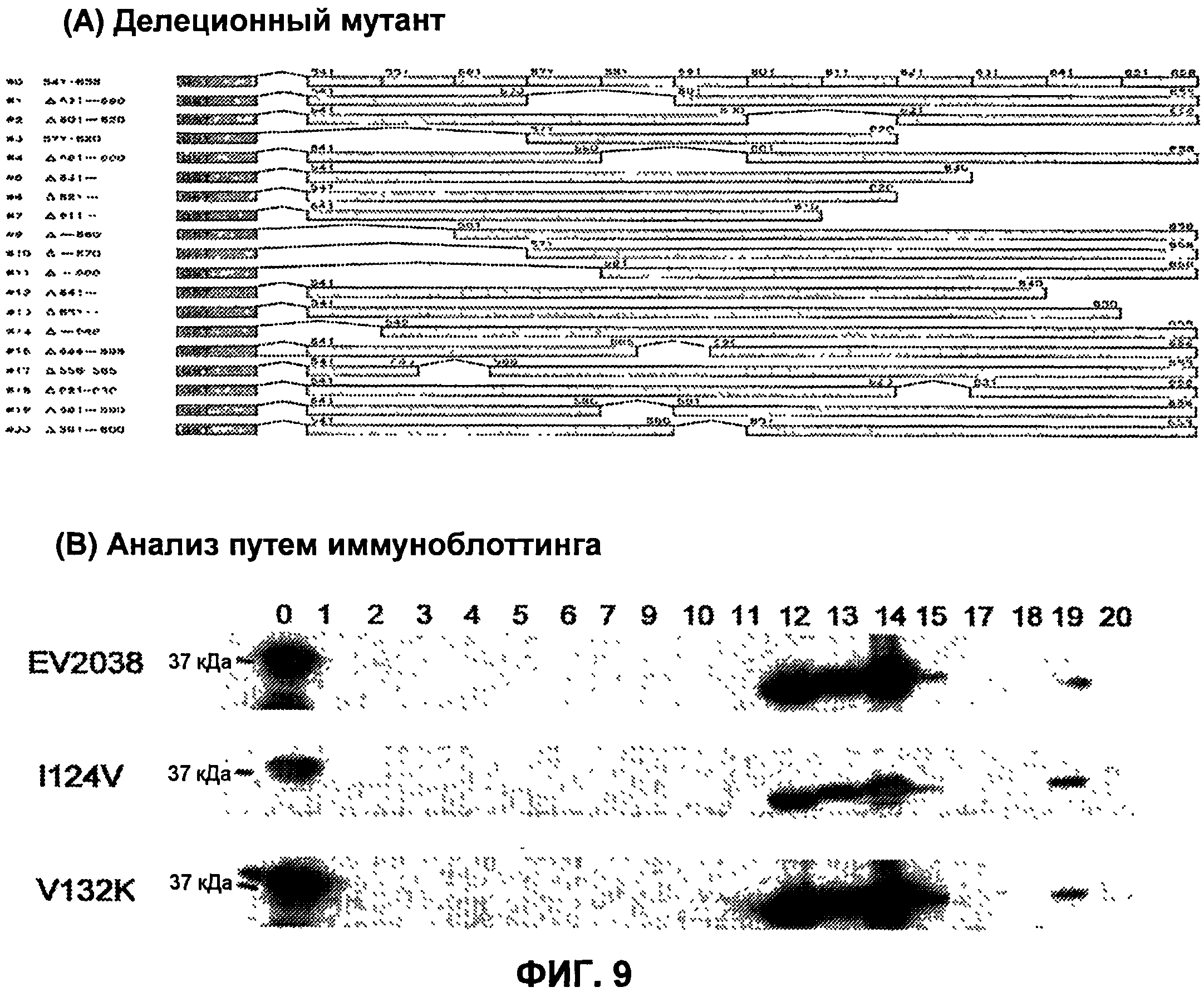
На фиг.9(A) представлен вид клонов мутантных гликопротеинов gB с делециями в области AD1, используемых для анализа областей эпитопов, тогда как на фиг.9(B) представлено изображение, показывающее результаты анализа с помощью иммуноблоттинга с использованием этих делеционных мутантов.
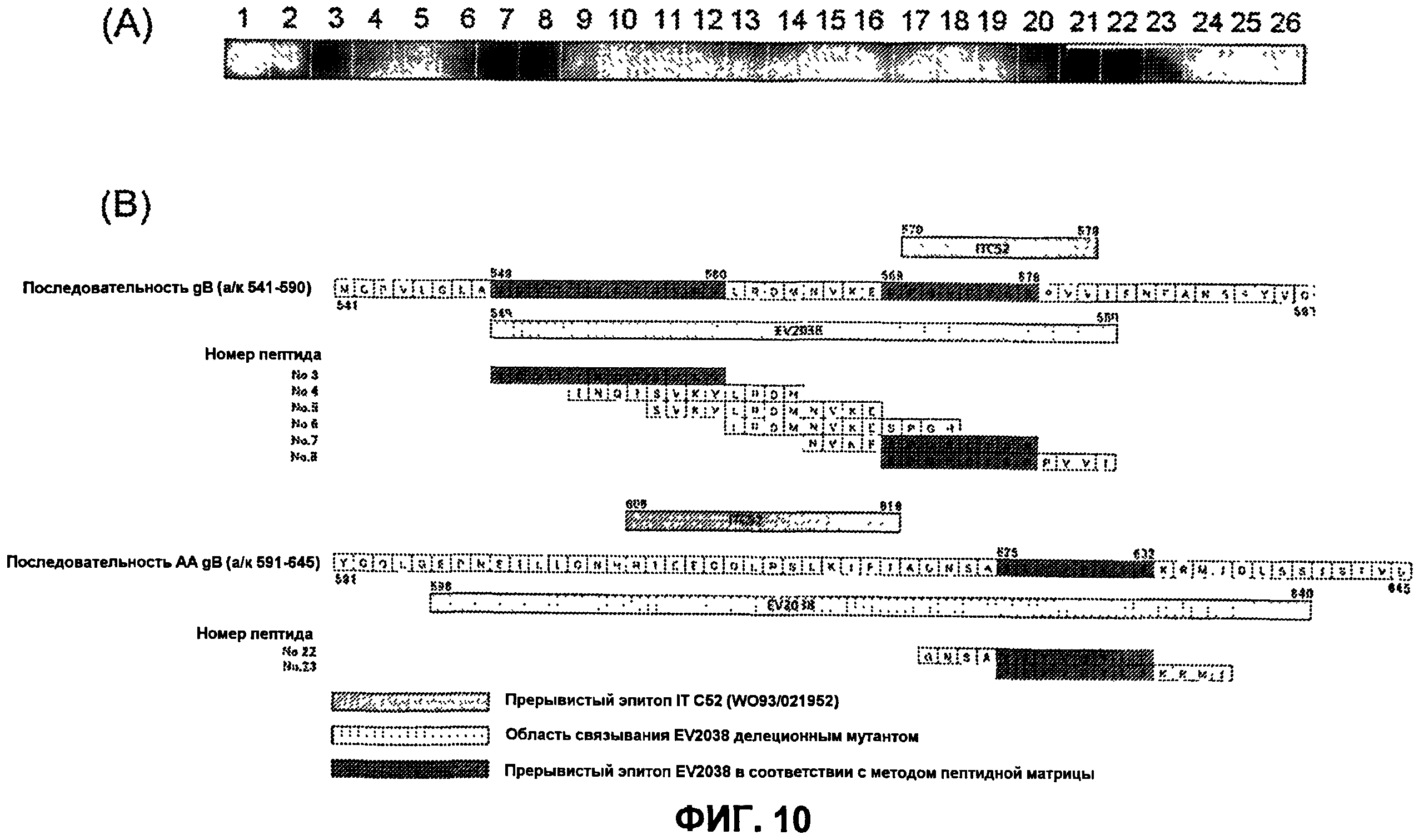
На фиг.10(A) представлены результаты картирования эпитопов EV2038 с использованием пептидной матрицы. На фиг.10(B) представлены указанные выше результаты анализа вместе с аминокислотной последовательностью гликопротеина gB, а также результаты анализа с использованием делеционного мутанта EV2038 и ранее описанной последовательности эпитопа ITC52.
Фиг.11 представляет собой гистограмму, демонстрирующую результаты оценки нейтрализующей активности антитела против HCMV по настоящему изобретению. Фиг.11(A) представляет собой гистограмму, демонстрирующую нейтрализующую активность моноклонального антитела человека (hIgG), используемого в качестве негативного контроля, которое не обладает специфичностью в отношении HCMV, и EV2001 в качестве антитела против AD1 (раскрытого в патентном документе 5) против цитомегаловируса человека (штамма AD169) в присутствии комплемента; фиг.11(B) представляет собой гистограмму, демонстрирующую нейтрализующую активность hIgG и моноклональных антител против HCMV (EV2038 и HCMV16) против цитомегаловируса человека (штамма AD169) в присутствии комплемента; фиг.11(C) представляет собой гистограмму, демонстрирующую нейтрализующую активность hIgG в качестве негативного контроля и EV2001 против цитомегаловируса человека (штамма AD169) в отсутствие комплемента; и фиг.11(D) демонстрирует нейтрализующую активность hIgG и моноклональных антител против HCMV (EV2038 и HCMV16) против цитомегаловируса человека (штамма AD169) в отсутствие комплемента.
Вариант осуществления изобретения
1. Антитело или его антигенсвязывающий фрагмент по настоящему изобретению
В соответствии с одним вариантом осуществления настоящего изобретения предлагается антитело или его антигенсвязывающий фрагмент, которые специфически связываются с гликопротеином gB цитомегаловируса человека (HCMV) и способны нейтрализовать его биологическую активность. В соответствии с более конкретным вариантом осуществления предлагается антитело или его антигенсвязывающий фрагмент, которые специфически связываются с прерывистым эпитопом, присутствующим в области AD1 гликопротеина gB HCMV, и способны нейтрализовать биологическую активность белка.
«Гликопротеин gB цитомегаловируса человека (HCMV)» (или «гликопротеин gB HCMV» или «HCMV-гликопротеин gB») представляет собой один из главных гликопротеинов, который образует оболочку HCMV, который, как известно, вносит вклад во вход вирусных частиц в клетки, слияние клеток и передачу вирусом инфекции от клетки к клетке. Аминокислотная последовательность гликопротеина gB HCMV (аминокислотная последовательность штамма AD169 как репрезентативного штамма вируса HCMV) доступна в виде аминокислотной последовательности (SEQ ID NO:137) белка с номером доступа P06473 из базы данных последовательностей, доступной общественности (Swiss-Prot).
«Область AD1 гликопротеина gB цитомегаловируса человека (HCMV)» или «область AD1 гликопротеина gB HCMV» относится к области, состоящей из непрерывных аминокислотных остатков в положениях 552-635 аминокислотной последовательности гликопротеина gB (Wagner et al., Journal of Virology, Vol.66, №9, Sept. 1992, p.5290-5297).
В настоящем описании термин «эпитоп» используется в обычном в данной области значении и обозначает небольшую часть структуры молекулы антигена, являющуюся партнером по связыванию молекулы антитела (Iwanami Biological Dictionary, 4th Ed. (1st Ed. Published in 1996)).
В соответствии с еще более конкретным вариантом осуществления изобретения прерывистый эпитоп, присутствующий в области AD1, существует в виде аминокислотной последовательности из непрерывных аминокислотных остатков в положениях 549-580 (SEQ ID NO:23) и аминокислотной последовательности из непрерывных аминокислотных остатков в положениях 596-640 (SEQ ID NO:24) гликопротеина gB цитомегаловируса человека (HCMV). Еще более конкретно, прерывистый эпитоп состоит из аминокислотной последовательности SEQ ID NO:25, аминокислотной последовательности SEQ ID NO:26 и аминокислотной последовательности SEQ ID NO:27.
В соответствии с одним вариантом осуществления антитело или его антигенсвязывающий фрагмент по настоящему изобретению включает:
(a) тяжелую цепь (H-цепь), содержащую аминокислотную последовательность SEQ ID NO:2 или 6, и
(b) легкую цепь (L-цепь), содержащую аминокислотную последовательность SEQ ID NO:4 или 8,
где антитело или антигенсвязывающий фрагмент специфически связываются с гликопротеином gB цитомегаловируса человека и способны нейтрализовать его биологическую активность.
Альтернативно, антитело или его антигенсвязывающий фрагмент по настоящему изобретению включает:
(a) вариабельную область тяжелой цепи (HCVR), содержащую аминокислотную последовательность SEQ ID NO:10, и
(b) вариабельную область легкой цепи (LCVR), содержащую аминокислотную последовательность SEQ ID NO:12,
где они специфически связываются с гликопротеином gB цитомегаловируса человека и способны нейтрализовать его биологическую активность.
Альтернативно, антитело или антигенсвязывающий фрагмент по настоящему изобретению специфически связывается с гликопротеином gB цитомегаловируса человека и способен нейтрализовать его биологическую активность, где:
(i) аминокислотные последовательности CDR (области, определяющей комплементарность) 1, CDR2 и CDR3 вариабельной области тяжелой цепи включают:
(a) аминокислотную последовательность SEQ ID NO:13;
(b) аминокислотную последовательность SEQ ID NO:14 и
(c) аминокислотную последовательность SEQ ID NO:15, соответственно, и
(ii) аминокислотные последовательности CDR1, CDR2 и CDR3 вариабельной области легкой цепи включают:
(a) аминокислотную последовательность SEQ ID NO:16;
(b) аминокислотную последовательность SEQ ID NO:17 и
(c) аминокислотную последовательность SEQ ID NO:18, соответственно.
Антитело или его антигенсвязывающий фрагмент также включает функциональный эквивалент описанного выше антитела или антигенсвязывающего фрагмента, который специфически связывается с гликопротеином gB цитомегаловируса человека и способен нейтрализовать его биологическую активность. Это включает, например:
(a) тяжелую цепь (H-цепь), представленную аминокислотной последовательностью, имеющей делецию, замену, вставку, добавление или комбинацию двух или более любых таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2 или 6, или аминокислотной последовательности, идентичной на 95% или более аминокислотной последовательности SEQ ID NO:2 или 6, и
(b) легкую цепь (L-цепь), представленную аминокислотной последовательностью, имеющей делецию, замену, вставку, добавление или комбинацию двух или более любых таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:4 или 8, или аминокислотной последовательности, идентичной на 95% или более аминокислотной последовательности SEQ ID NO:4 или 8.
Альтернативно, функциональный эквивалент описанного выше антитела или антигенсвязывающего фрагмента также включает:
(a) вариабельную область тяжелой цепи (HCVR), включающую аминокислотную последовательность, имеющую делецию, замену, вставку, добавление или комбинацию двух или более любых таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:10 или аминокислотной последовательности, идентичной на 95% или более аминокислотной последовательности SEQ ID NO:10, и
(b) вариабельную область легкой цепи (LCVR), включающую аминокислотную последовательность, имеющую делецию, замену, вставку, добавление или комбинацию двух или более любых таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:12, или аминокислотной последовательности, идентичной на 95% или более аминокислотной последовательности SEQ ID NO:12.
Альтернативно, функциональный эквивалент описанного выше антитела или антигенсвязывающего фрагмента дополнительно включает:
(i)
(a) CDR1 тяжелой цепи, выбранную из группы, состоящей из аминокислотных последовательностей, имеющих делецию, замену, вставку, добавление или комбинацию двух или более любых таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:13,
(b) CDR2 тяжелой цепи, выбранную из группы, состоящей из аминокислотных последовательностей, имеющих делецию, замену, вставку, добавление или комбинацию двух или более любых таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:14, и
(c) CDR3 тяжелой цепи, выбранную из группы, состоящей из аминокислотных последовательностей, имеющих делецию, замену, вставку, добавление или комбинацию двух или более любых таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:15, и аминокислотной последовательности SEQ ID NO:22, и
(ii)
(a) CDR1 легкой цепи, выбранную из группы, состоящей из аминокислотных последовательностей, имеющих делецию, замену, вставку, добавление или комбинацию двух или более любых таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:16,
(b) CDR2 легкой цепи, выбранную из группы, состоящей из аминокислотных последовательностей, имеющих делецию, замену, вставку, добавление или комбинацию двух или более любых таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:17, и
(c) CDR3 легкой цепи, выбранную из группы, состоящей из аминокислотных последовательностей, имеющих делецию, замену, вставку, добавление или комбинацию двух или более любых таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO:18.
Верхний предел количества мутаций, содержащихся в аминокислотной последовательности описанного выше функционального эквивалента, может быть определен исходя из того, может ли эквивалент специфически связываться с гликопротеином gB HCMV и способен ли он нейтрализовать его биологическую активность. Нейтрализующая активность в отношении HCMV может быть оценена, например, согласно способам, описанным в примерах 9 и 10 ниже. Способность блокировать передачу инфекции от клетки к клетке может быть оценена согласно способу, описанному в примере 11 ниже.
Применяемый в настоящем описании термин «антитело» означает молекулу иммуноглобулина, состоящую из четырех полипептидных цепей, а именно двух тяжелых (H) цепей и двух легких (L) цепей, которые взаимно соединены дисульфидными связями. Моноклональное антитело по настоящему изобретению также состоит из молекулы иммуноглобулина, содержащей две из каждых легких цепей (L-цепей) и тяжелых цепей (H-цепей). Каждая из H-цепей состоит из вариабельной области H-цепи (иногда обозначаемой как «HCVR» или «VH») и константной области H-цепи (константная область H-цепи состоит из трех доменов, которые иногда могут обозначаться как «CH1», «CH2» и «CH3» (совместно называемые CH)). Каждая из L-цепей состоит из вариабельной области L-цепи (иногда обозначаемой как «LCVR» или «VL») и константной области L-цепи (константная область L-цепи состоит из одного домена, который иногда может обозначаться как «CL»).
В частности HCVR и LCVR важны потому, что они отвечают за специфичность связывания антитела. Так как антитело взаимодействует с антигеном-мишенью, главным образом через аминокислотные остатки LCVR и HCVR, аминокислотная последовательность в пределах вариабельной области существенно варьирует среди различных антител по сравнению с последовательностью вне вариабельной области. HCVR и LCVR могут дополнительно подразделяться на область, называемую областью каркаса (FR), и гипервариабельную область, называемую областью, определяющей комплементарность (CDR), которые более постоянны среди различных антител. HCVR и LCVR, каждая состоит из трех CDR и четырех FR, которые последовательно выстроены от аминоконца к карбоксиконцу в порядке FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4.
Термин «антигенсвязывающий фрагмент» антитела (или просто «фрагмент антитела») означает фрагмент одного или более антител, способных специфически связываться с антигеном (например, HCMV). В этом случае, данный фрагмент должен содержать пептид, имеющий минимальную аминокислотную последовательность, которая специфически связывается с антигеном. Кроме того, одноцепочечное антитело (scFV), биспецифический антиген, полиспецифический антиген и тому подобное, имеющие вариабельную область или область, определяющую комплементарность антитела, которые специфически связываются с антигеном, также включены в «антигенсвязывающие фрагменты». В настоящем описании ради простоты «антитело или антигенсвязывающий фрагмент» может просто обозначаться как «антитело».
«Антитело, способное нейтрализовать биологическую активность HCMV», относится к антителу, которое ингибирует биологическую активность HCMV в результате связывания с HCMV или с инфицированной HCMV клеткой.
Конкретная «биологическая активность HCMV» включает, но, не ограничиваясь ими, активность HCMV, которая вызывает следующие заболевания (a)-(e), проиллюстрированные ниже, и включает активность HCMV, которая индуцирует различные заболевания, вызываемые действием активированного HCMV:
(a) различные заболевания, такие как интерстициальная пневмония, ретинит, гастроэнтерит или энцефалит, вызываемые реактивацией HCMV при состоянии иммунодефицита, такого как СПИД, рак, состояние после трансплантации органа, после трансплантации костного мозга или после гемодиализа;
(b) врожденную CMV инфекцию, обусловленную передачей HCMV инфекции от беременной женщины плоду;
(c) невынашивание беременности, мертворождение или смерть вскоре после рождения, обусловленные описанной выше врожденной CMV инфекцией;
(d) низкую массу при рождении, гепатоспленомегалию, желтуху, тромбоцитопеническую пурпуру, микроцефалию, нарушение умственного развития, задержку интеллектуального развития, хориоретинит или нарушение слуха в случае выживания при описанной выше врожденной CMV инфекции; или
(e) патологию функции печени, интерстициальную пневмонию или мононуклеоз, который вызван HCMV инфекцией при рождении или в младенчестве (непатентные документы 3, 4 и 5).
Применяемый в настоящем описании термин «заболевание, вызываемое HCMV», включает, также как и другие заболевания, заболевание, которое, как обнаружено, вызывается или которое, очевидно, вызывается, потому что у подверженного индивидуума, страдающего заболеванием, имеется HCMV в качестве причины патологических состояний этого заболевания или в качестве причины ухудшения этого заболевания. Следовательно, заболевания, вызываемые биологической активностью HCMV, представляют собой заболевания, симптомы и/или прогрессия которых, как ожидается, будут облегчаться с помощью ингибирования биологической активности HCMV. Симптомы таких заболеваний можно облегчить или лечить, например, путем использования описанного выше антитела против HCMV. Конкретно, указанное выше заболевание может быть подтверждено по увеличению уровня антитела против HCMV в биологической жидкости у индивидуума-мишени, страдающего этим заболеванием, (например, по увеличению уровня антитела против HCMV в сыворотке, плазме или синовиальной жидкости у индивидуума-мишени).
Термины, такие как «ингибирующий эффект», «ингибирование», «подавление» и «способность ингибирования» при использовании в настоящем описании, относятся к снижению биологической активности, возникающей в результате действия антигена (HCMV), приблизительно на 5-100%, предпочтительно на 10-100%, более предпочтительно на 20-100%, более предпочтительно на 30-100%, более предпочтительно на 40-100%, более предпочтительно на 50-100%, более предпочтительно на 60-100%, более предпочтительно на 70-100% и еще более предпочтительно на 80-100%.
Так как аминокислотная последовательность вариабельной области ответственна за основную часть взаимодействия антитело-антиген, с помощью конструирования экспрессионного вектора может быть экспрессировано рекомбинантное антитело, копирующее свойство конкретного природного антитела, которое содержит последовательность вариабельной области или последовательность части CDR, происходящей от конкретного природного антитела, соединенную с константной областью или областью каркаса, происходящей от отличного антитела, имеющего отличающееся свойство.
Соответственно, для того чтобы воссоздать интактное рекомбинантное антитело, имеющее такие же связывающие характеристики, как и исходное антитело, нет необходимости получать полную последовательность конкретного антитела. Для этой цели может быть достаточно последовательности вариабельной области или части CDR тяжелой и легкой цепей антитела.
SEQ ID NO:13, 14 и 15 представляют собой аминокислотные последовательности, соответствующие CDR1, CDR2 и CDR3 тяжелой цепи, соответственно. SEQ ID NO:16, 17 и 18 представляют собой аминокислотные последовательности, соответствующие CDR1, CDR2 и CDR3 легкой цепи, соответственно. Следовательно, предпочтительное антитело по настоящему изобретению имеет CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи, соответствующие SEQ ID NO:13, 14, 15, 16, 17 и 18, соответственно. Однако CDR1, CDR2 и CDR3 тяжелой цепи и CDR1, CDR2 и CDR3 легкой цепи могут необязательно соответствовать SEQ ID NO:13, 14, 15, 16, 17 и 18, соответственно, до тех пор, пока моноклональное антитело специфически связывается с HCMV и способно нейтрализовать его биологическую активность. CDR-3 тяжелой цепи, в частности, может представлять собой аминокислотную последовательность, выбранную из группы аминокислотной последовательности SEQ ID NO:22. Более того, последовательность CDR может представлять собой аминокислотную последовательность, имеющую делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких (конкретно 1-9, 1-8, 1-7, 1-6, 1-5, 1-4, 1-3, 1-2 или 1) аминокислотных остатков в аминокислотной последовательности, выбранной из группы, состоящей из аминокислотных последовательностей SEQ ID NO:13, 14, 15, 16, 17 и 18, до тех пор, пока она обладает описанной выше нейтрализующей активностью.
Аминокислотная последовательность, отличная от CDR, особенно не ограничивается, и так называемое антитело с пересаженной CDR, в котором аминокислотная последовательность, отличная от CDR, происходит от другого антитела, в частности от антитела из других видов, также охватывается настоящим изобретением. Аминокислотная последовательность, отличная от CDR, предпочтительно представляет собой антитело, происходящее от человека, но, если это необходимо, область каркаса (FR) может включать делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких (конкретное количество является таким, как указано выше) аминокислотных остатков. Такие антитела могут быть получены согласно известному способу (Reichmann L, et al., Reshaping human antibodies for therapy. Nature, 332:323-327, 1988). В соответствии с настоящим изобретением антитело полностью от человека, конечно, является подходящим.
Делеция, замена, вставка, добавление или комбинация двух или более таких мутаций для одного-нескольких аминокислотных остатков в аминокислотной последовательности белка по настоящему изобретению обозначают, что делеция, замена, вставка и добавление одного или нескольких аминокислотных остатков присутствуют в любом одном или более положениях одной и той же аминокислотной последовательности, где две или более делеций, замен, вставок и добавлений могут присутствовать одновременно.
Аминокислоты, образующие природные белки, могут быть классифицированы по свойствам их боковых цепей. Например, примеры групп аминокислот, имеющих сходные свойства, включают ароматические аминокислоты (тирозин, фенилаланин, триптофан), основные аминокислоты (лизин, аргинин, гистидин), кислые аминокислоты (аспарагиновая кислота, глутаминовая кислота), нейтральные аминокислоты (серин, треонин, аспарагин, глутамин), аминокислоты, имеющие углеводородную цепь (аланин, валин, лейцин, изолейцин, пролин) и еще (глицин, метионин, цистеин).
Взаимозаменяемые аминокислотные остатки, включая неприродные аминокислоты, также могут быть классифицированы, например, таким образом, когда аминокислотные остатки одной и той же группы могут быть взаимно заменены друг другом. Группа A: лейцин, изолейцин, норлейцин, валин, норвалин, аланин, 2-аминомасляная кислота, метионин, o-метилсерин, трет-бутилглицин, трет-бутилаланин, циклогексилаланин; группа B: аспарагиновая кислота, глутаминовая кислота, изоаспарагиновая кислота, изоглутаминовая кислота, 2-аминоадипиновая кислота, 2-аминопробковая кислота; группа С: аспарагин, глутамин; группа D: лизин, аргинин, орнитин, 2,4-диаминомасляная кислота, 2,3-диаминопропионовая кислота; группа E: пролин, 3-гидроксипролин, 4-гидроксипролин; группа F: серин, треонин, гомосерин; и группа G: фенилаланин, тирозин, триптофан.
Согласно настоящему изобретению более предпочтительные антитела включают (a) вариабельную область тяжелой цепи (HCVR), представленную: аминокислотной последовательностью SEQ ID NO:10; аминокислотной последовательностью, имеющей делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких (конкретно 1-9, 1-8, 1-7, 1-6, 1-5, 1-4, 1-3, 1-2 или 1) аминокислотных остатков в аминокислотной последовательности SEQ ID NO:10; или аминокислотной последовательностью, идентичной на 95% или выше (предпочтительно на 96% или выше; на 97% или выше, на 98% или выше, на 99% или выше или на 99,5% или выше) аминокислотной последовательности SEQ ID NO:10, и (b) вариабельную область легкой цепи (LCVR), представленную: аминокислотной последовательностью SEQ ID NO:12; аминокислотной последовательностью, имеющей делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких (конкретное количество является таким, как указано выше) аминокислотных остатков в аминокислотной последовательности SEQ ID NO:12; или аминокислотной последовательностью, идентичной на 95% или выше (конкретный процент является таким, как указано выше) аминокислотной последовательности SEQ ID NO:12.
В настоящем описании идентичность аминокислотной последовательности или нуклеотидной последовательности может быть определена с помощью применения алгоритма BLAST от Karin and Altschul (Proc. Natl. Acad. Sci. USA 872264-2268, 1990; Proc. Natl. Acad. Sci. USA 90: 5873, 1993). На основе алгоритма BLAST разработаны программы, называемые BLASTN и BLASTX, (Altschul SF, et al: J Mol Biol 215: 403, 1990). Для того чтобы проанализировать нуклеотидную последовательность с использованием BLASTN, устанавливают параметры, например, сумма баллов = 100 и длина слова = 12. Для того чтобы проанализировать аминокислотную последовательность с использованием BLASTX, устанавливают параметры, например, сумма баллов = 50 и длина слова = 3. В случае использования программ BLAST и Gapped BLAST используют параметры по умолчанию для каждой программы.
Согласно настоящему изобретению даже более предпочтительное антитело включает (a) тяжелую цепь (H-цепь), представленную: аминокислотной последовательностью SEQ ID NO:6; аминокислотной последовательностью, имеющей делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких (конкретное количество является таким, как указано выше) аминокислотных остатков в аминокислотной последовательности SEQ ID NO:6; или аминокислотной последовательностью, идентичной на 95% или выше (конкретный процент является таким, как указано выше) аминокислотной последовательности SEQ ID NO:6, и (b) легкую цепь (L-цепь), представленную: аминокислотной последовательностью SEQ ID NO:8; аминокислотной последовательностью, имеющей делецию, замену, вставку, добавление или комбинацию двух или более таких мутаций для одного-нескольких (конкретное количество является таким, как указано выше) аминокислотных остатков в аминокислотной последовательности SEQ ID NO:8; или аминокислотной последовательностью, идентичной на 95% или выше (конкретный процент является таким, как указано выше) аминокислотной последовательности SEQ ID NO:8.
Наиболее предпочтительное антитело по настоящему изобретению представляет собой моноклональное антитело полностью от человека, включающее тяжелую цепь (H-цепь), представленную аминокислотной последовательностью SEQ ID NO:6, и легкую цепь (L-цепь), представленную аминокислотной последовательностью SEQ ID NO:8. Более того, классом (подклассом) предпочтительного антитела по изобретению является IgG1 (λ).
Описанное выше антитело против HCMV или его антигенсвязывающий фрагмент по настоящему изобретению специфически связывается с HCMV, являющимся причиной различных заболеваний, нейтрализует его биологическую активность и обладает намного более высокой нейтрализующей способностью по сравнению с обычным антителом против HCMV.
Выражение «специфически связывается с», применяемое в настоящем описании, означает распознавание предварительно определенного антигена и связывание с ним.
Обычно константа диссоциации (величина Kd) при связывании HCMV (особенно HCMV человека) и антитела по изобретению составляет предпочтительно 1×10-7М или менее, более предпочтительно 1×10-8М или менее, еще более предпочтительно 1×10-9М или менее и наиболее предпочтительно 1×10-10М или менее. Константа диссоциации антитела и HCMV может быть определена согласно известному способу. Например, для определения может быть использовано антитело против HCMV, иммобилизованное на чипе, с использованием анализатора белкового взаимодействия, такого как BIACORET100 (зарегистрированная торговая марка).
Нейтрализующая способность антитела против HCMV может быть оценена путем определения скорости блокирования инфекции или скорости блокирования образования бляшек иммуноокрашиванием. Конкретно, обычный штамм HCMV, такой как штамм AD169 и штамм Towne, вводят в контакт с различными уровнями антител против HCMV в течение предварительно определенного времени перед его инокуляцией в инфицируемую клеточную культуральную систему. Впоследствии они инокулируются в клетки. Через двадцать четыре часа после инфицирования количество инфицированных HCMV клеток может быть подсчитано с помощью иммуноокрашивания для определения скорости блокирования инфекции, или может быть подсчитано количество бляшек, образованных через 5-6 дней после инфицирования, для определения скорости их блокирования, тем самым, определяя нейтрализующую активность антитела против HCMV.
Антитело против HCMV или его антигенсвязывающий фрагмент по настоящему изобретению обладают способностью блокировать образование бляшек приблизительно на 50%, т.е. нейтрализующей активностью против штамма AD169, предпочтительно при 1 мкг/мл (приблизительно 7 нМ) или ниже, более предпочтительно при 0,1 мкг/мл (приблизительно 0,7 нМ) или ниже, еще более предпочтительно при 0,05 мкг/мл (приблизительно 0,3 нМ) или ниже и наиболее предпочтительно при 0,03 мкг/мл (приблизительно 0,2 нМ) или ниже.
Кроме того, в качестве способности блокировать передачу инфекции от клетки к клетке, может быть оценен ингибирующий эффект в отношении передачи инфекции от клетки к клетке с помощью культивирования инфицированной HCMV клетки в течение предварительно определенного времени и последующего добавления различных уровней антител против HCMV к этой клеточной культуральной системе.
Антитело против HCMV или его антигенсвязывающий фрагмент по настоящему изобретению обладает способностью блокировать передачу инфекции от клетки к клетке на 50% или более при конечной концентрации предпочтительно 2 мкг/мл (приблизительно 13 нМ) или ниже, более предпочтительно 0,5 мкг/мл (приблизительно 3 нМ) или ниже и еще более предпочтительно 0,2 мкг/мл (приблизительно 0,13 нМ) или ниже.
Антитело по настоящему изобретению может представлять собой рекомбинантное моноклональное антитело человека, моноклональное антитело (включая гибридное антитело и гуманизированное антитело) или его антигенсвязывающий фрагмент, которые могут специфически связываться с HCMV и способны нейтрализовать его биологическую активность, и которые могут быть получены согласно способу, хорошо известному в данной области, на основе полноразмерного антитела, его антигенсвязывающего фрагмента или аминокислотной последовательности вариабельной области SEQ ID NO:6, 8, 10 или 12 и аминокислотной последовательности области, определяющей комплементарность (CDR), представленной любой из SEQ ID NO:13-18. Эти антитела входят в объем настоящего изобретения.
Например, сигнальные последовательности тяжелой и легкой цепей отщепляются в ходе созревания белка и, следовательно, они не вносят вклад в свойство окончательного антитела. Для того чтобы добавить отсутствующую последовательность, клонированная последовательность кДНК может быть соединена с синтетическим олигонуклеотидом путем лигирования или ПЦР-амплификации.
Альтернативно, может быть синтезирована полная вариабельная область путем сочетания набора коротких перекрывающихся олигонуклеотидов с помощью ПЦР-амплификации, тем самым, получая полностью искусственный клон вариабельной области.
2. Нуклеиновая кислота, кодирующая антитело или подобное по настоящему изобретению
В соответствии с другим вариантом осуществления настоящего изобретения предлагается выделенная нуклеиновая кислота, кодирующая моноклональное антитело против HCMV или его антигенсвязывающий фрагмент, которые специфически связываются с HCMV и которые способны нейтрализовать его биологическую активность, где нуклеиновая кислота выбрана из нуклеиновых кислот, кодирующих аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:2, 4, 6, 8, 10, 12, 13-18 и 22, и нуклеиновых кислот, которые гибридизуются с этими нуклеиновыми кислотами в очень жестких условиях.
Предпочтительно описанная выше нуклеиновая кислота представляет собой либо ДНК, либо РНК, и более предпочтительно ДНК.
Выделенная нуклеиновая кислота, кодирующая моноклональное антитело против HCMV или его антигенсвязывающий фрагмент, которые связываются с HCMV и которые способны нейтрализовать его биологическую активность, имеющая высокую идентичность с нуклеиновой кислотой, кодирующей аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:2, 4, 6, 8, 10, 12, 13-18 и 22, также охватывается настоящем изобретением. Выражение «имеющая высокую идентичность», применяемое в настоящем описании, означает идентичность последовательности, которая достаточна для гибридизации с предварительно определенной последовательностью нуклеиновой кислоты в очень жестких условиях, подразумевающее, например, идентичность на 60%, 70%, 80%, 90%, 95% или выше.
«Очень жесткие условия» обозначают, например, условия 5× SSC, 5× раствор Денхардта, 0,5% SDS и 50% формамид при 50°С (см., например, J.Sambrook et al., Molecular Cloning, A Laboratory Manual 2nd ed., Cold Spring Harbor Laboratory Press (1989), в частности, раздел 11.45 “Conditions for Hybridization of Oligonucleotide Probes”). В этих условиях более высокая температура, как ожидается, эффективно дает полинуклеотид (например, ДНК) с более высокой идентичностью. Существуют, однако, очевидно, множественные факторы, которые влияют на жесткость гибридизации, такие как температура, концентрация зонда, длина зонда, ионная сила, время и концентрация соли, и специалисты в данной области могут подходящим образом выбрать эти факторы, для создания сходной жесткости.
Примеры нуклеиновых кислот, подвергаемых гибридизации в описанных выше очень жестких условиях, включают нуклеиновые кислоты, которые идентичны, например, на 70% или выше, на 80% или выше, на 90% или выше, на 95% или выше, на 97% или выше или на 99% или выше, нуклеиновой кислоте, кодирующей аминокислотную последовательность любой из SEQ ID NO:2, 4, 6, 8, 10, 12, 13-18 и 22.
Идентичность нуклеотидной последовательности может быть определена с использованием описанного выше алгоритма поиска идентичности (Proc. Natl. Acad. Sci. USA 872264-2268, 1990; Proc Natl Acad Sci USA 90: 5873, 1993).
Предпочтительная нуклеиновая кислота по настоящему изобретению представляет собой ДНК, кодирующую обе аминокислотные последовательности SEQ ID NO:10 и 12, и более предпочтительно ДНК, кодирующую обе аминокислотные последовательности SEQ ID NO:6 и 8. Еще более предпочтительная нуклеиновая кислота представляет собой ДНК, кодирующую обе аминокислотные последовательности SEQ ID NO:2 и 4.
Еще более предпочтительная нуклеиновая кислота представляет собой нуклеиновую кислоту, содержащую обе нуклеиновые кислоты SEQ ID NO:5 и 7, и еще более предпочтительная нуклеиновая кислота представляет собой нуклеиновую кислоту, содержащую обе нуклеиновые кислоты SEQ ID NO:1 и 3.
3. Вектор, клетка-хозяина и способ получения антитела изобретения
Настоящее изобретение также относится к вектору, включающему описанную выше нуклеиновую кислоту, к клетке-хозяина, в которую введен вектор, и к способу получения антитела с их использованием.
Антитело по настоящему изобретению может быть также получено в виде рекомбинантного антитела человека согласно известному способу (см., Nature, 312:643, 1984, Nature, 321:522, 1986 и т.д.). Например, антитело по настоящему изобретению может быть получено путем культивирования клетки-хозяина, в которую введен вектор по изобретению, и очистки продуцируемого антитела из культурального супернатанта или подобного. Более конкретно, антитело может быть получено путем вставки кДНК, кодирующих VH и VL, в экспрессионные векторы для животных клеток, содержащие гены, кодирующие CH антитела человека и/или CL антитела человека, полученные из той же самой клетки или отличных клеток человека, для конструирования вектора, экспрессирующего антитело человека, и введения вектора в животную клетку для экспрессии.
Векторы, в которые включают нуклеиновые кислоты, кодирующие VH или VL антитела по настоящему изобретению, специально не ограничиваются, но они предпочтительно представляют собой векторы, обычно используемые для экспрессии гена белка или подобного, и, в частности, вектор или вектор с высокой экспрессией, который подходит для экспрессии гена антитела. Предпочтительные примеры включают векторы, содержащие промотор EF и/или энхансер CMV. Обычно, экспрессионные векторы, каждый из которых включает нуклеиновую кислоту, кодирующую VH или VL, получают и используют для котрансфекции клетки-хозяина, но нуклеиновые кислоты можно включать также в один экспрессионный вектор.
Клетка-хозяина для введения экспрессионного вектора специально не ограничивается, но она предпочтительно представляет собой клетку, которую обычно используют для экспрессии гена белка или подобного, и конкретно клетку, которая подходит для экспрессии гена антитела. Примеры включают бактерию (E. coli и т.д.), актиномицетов, дрожжи, клетку насекомых (SF9 и т.д.) и клетку млекопитающих (COS-1, CHO, клетку миеломы или тому подобное).
Для того чтобы получить рекомбинантное антитело промышленным способом, обычно используют линию рекомбинантных животных клеток, такую как линия клеток CHO, которая в высокой степени и стабильно продуцирует антитело. Для получения и клонирования такой высоко экспрессирующей рекомбинантной клеточной линии могут быть применены известные методы амплификации и скрининга генов (например, см. Omasa T.: J. Biosci. Bioeng., 94, 600-605, 2002 и т.д.).
Кроме антитела, состоящего из двух тяжелых цепей и двух легких цепей, настоящее изобретение также включает антигенсвязывающий фрагмент антитела по настоящему изобретению. Примеры антигенсвязывающих фрагментов включают Fab (фрагмент, связывающий антиген), Fab' и F(ab')2. Примеры фрагментов, полученных путем соединения активных фрагментов антитела через линкер или тому подобное, включают одноцепочечное антитело (одноцепочечный Fv: scFv) и антитело, стабилизированное дисульфидной связью (Fv, стабилизированный дисульфидной связью: dsFv). Пример пептида, содержащего активный фрагмент антитела, включает пептид, содержащий CDR. Все это может быть получено согласно известному способу, такому как метод, в котором антитело по настоящему изобретению обрабатывают подходящим протеолитическим ферментом, или метод генной рекомбинации.
Очистка антитела может быть осуществлена с использованием известного метода очистки, такого как метод высаливания, гель-фильтрации, ионообменной хроматографии или аффинной хроматографии.
Кроме того, гены VH и VL могут быть искусственно перетасованы для экспрессии измененного scFv (одноцепочечного фрагмента вариабельной области) антитела в виде гибридного белка фага с помощью недавно разработанного метода фагового дисплея антител, в котором рекомбинантное антитело экспрессируется на поверхности фага методом генной инженерии, в результате чего получают конкретное антитело. Этот метод крайне ценен из-за способности избегать ответа иммунной системы и дополнительно в качестве метода получения гуманизированного антитела как альтернативы методу слияния клеток. Конкретное антитело или его антигенсвязывающий фрагмент, полученные с использованием такого метода, с аминокислотными последовательностями SEQ ID NO:2, 4, 6, 8, 10, 12, 13-18 и 22, описанными в данном описании, входят в объем настоящего изобретения.
Более того, антитело, полученное с помощью применения недавно разработанного метода Potelligent, в котором активность ADCC антитела существенно улучшена с помощью модификации части антитела из цепей сахаров, может быть использовано в качестве антитела по настоящему изобретению (см., Niwa R., et al, Clin. Cancer Res., 10, 6248-6255 (2004)), и антитело, полученное с применением метода Complegnant, который улучшает активность CDC у антитела настоящего изобретения (см. Kanda S., et al., Glycobiology, 17, 104-108 (2007)), также входит в объем настоящего изобретения.
Антитело обычно получают, приобретением поликлонального антитела или моноклонального антитела с использованием экспериментального животного, такого как мышь, кролик, коза или тому подобное. Так как такое антитело имеет последовательность, которая характерна для видов используемых животных, при непосредственном введении оно должно распознаваться иммунной системой человека как чужеродное вещество, что может приводить к ответу антител человека против антитела животного (другими словами продуцируется антитело против антитела).
Моноклональное антитело против HCMV, которое является полностью антителом человека, или его антигенсвязывающий фрагмент по настоящему изобретению могут быть получены из клетки, продуцирующей антитело, происходящей из крови здорового человека. Когда данное антитело, являющееся антителом полностью от человека, вводят человеку в качестве лекарственного средства в виде антитела, оно не является иммуногенным и, следовательно, не должно вызывать иммунного ответа.
Так как моноклональное антитело против HCMV по настоящему изобретению имеет более высокую нейтрализующую способность по сравнению с обычным моноклональным антителом против HCMV, сходный уровень терапевтического эффекта можно ожидать при меньшей дозе.
Далее будет описан способ получения моноклонального антитела против HCMV и антигенсвязывающего фрагмента по настоящему изобретению, но способ получения антитела или подобного по настоящему изобретению не должен ограничиваться этими описаниями, и, само собой разумеется, что может быть осуществлена любая модификация, обычно проводимая в данной области техники.
Моноклональное антитело против HCMV и его антигенсвязывающий фрагмент по настоящему изобретению могут быть получены с помощью: выделения клеточного клона, который продуцирует антитело, из крови здорового человека путем нескольких стадий; выделения антитела из культурального супернатанта клона клеток, продуцирующих антитело; и осуществления аффинной очистки полученного антитела.
1. Выделение клеточного клона, который продуцирует полностью человеческое антитело против HCMV
B-лимфоциты выделяют из крови здорового человека для индукции пролиферации B-лимфоцитов. Метод индукции пролиферации известен как таковой и может быть осуществлен, например, методом трансформации с использованием «вируса Эпштейна-Барра (вируса EB)» (далее в настоящем описании обозначаемого как EBV) в качестве индуцирующего рак фактора (D. Kozbor et al.).
Конкретно, указанные выше B-лимфоциты инфицируют EBV для индукции пролиферации, и пролиферировавшие клетки используют в качестве продуцирующей антитело клеточной библиотеки.
2. Сбор моноклонального антитела из продуцирующей антитело клеточной библиотеки
Моноклональное антитело может быть собрано из индуцированных к пролиферации клеток согласно хорошо известному способу, обычно используемому для получения моноклонального антитела.
Из описанной выше продуцирующей антитело клеточной библиотеки отсортировывают клон лимфоцитов, который продуцирует антитело, связывающееся с HCMV, и антитело удаляют из культурального супернатанта клона. Конкретно, клеточную популяцию (клон), которая продуцирует связывающее HCMV антитело, отбирают из описанной выше продуцирующей антитело клеточной библиотеки методом ограниченного разведения.
Для выявления клона, который связывается с HCMV, особенно предпочтительно использование ELISA с использованием антигена из HCMV и меченого антитела мыши против IgG человека.
Путем повторения культивирования и скрининга отобранной клеточной популяции, позитивной в отношении антитела, может быть получена клеточная популяция (клон), которая продуцирует только представляющее интерес антитело.
Блок-схема, на которой указаны стадии до выделения клона продуцирующей антитело клетки, показана на фигуре 1.
3. Аффинная очистка с использованием протеина A или G
Для очистки антитела против HCMV отобранные клетки могут быть подвергнуты пролиферации во вращающейся бутыли, вращающемся 2-л сосуде или другой системе культивирования.
Полученный культуральный супернатант фильтруют для концентрирования и затем подвергают аффинной хроматографии на протеин A- или протеин G-сефарозе (GE Healthcare) или подобном, очищая, таким образом, белок. Буфер может быть заменен PBS для определения концентрации по OD280 или предпочтительно с помощью нефелометрического анализа.
Изотип может быть проверен с помощью метода, специфичного в отношении антигена изотипа.
Поскольку полученное таким образом антитело против HCMV является полностью человеческим антителом, полученным из B-лимфоцита, сенсибилизированного в организме человека, риск индукции иммунного ответа против антитела является низким.
Такое получение продуцирующего антитело клеточного клона также отличается использованием вируса EB, являющегося активным в инфицировании и индукции пролиферации B-лимфоцитов.
Преимущества метода с использованием вируса EB заключаются в том, что может быть получено природное антитело в организме человека и что может быть получено антитело с высокой аффинностью. Например, обнаружено, что человеческое антитело против HCMV обладает аффинностью, которая приблизительно в 10-100 раз превышает аффинность антитела, произведенного искусственно иммунизированной мышью.
Популяция B-лимфоцитов, пролиферировавших в результате инфекции вируса EB, может служить библиотекой продуцирующих антитело клеток.
Специфичный продуцирующий антитело клон клеток может быть выделен из указанной библиотеки для получения человеческого антитела.
4. Фармацевтическая композиция, содержащая антитело изобретения
Далее, настоящее изобретение предоставляет фармацевтическую композицию для профилактики или лечения заболевания, связанного с цитомегаловирусом человека (HCMV), которая содержит описанное выше антитело или его сайт связывания антигена и фармацевтически приемлемый носитель.
Поскольку антитело против HCMV или его антигенсвязывающий фрагмент по настоящему изобретению обладает более высокой нейтрализующей способностью в отношении HCMV по сравнению с традиционным антителом против HCMV, оно пригодно в качестве профилактического или терапевтического лекарственного средства для связанного с HCMV заболевания (различных заболеваний, вызываемых HCMV). Заболевание, вызываемое HCMV, представляет собой заболевание, симптомы и/или развитие которого, как ожидается, смягчаются ингибированием активности HCMV.
Используемый в настоящем описании термин «связанное с HCMV заболевание» включает, как и другие заболевания, заболевание, которое, как установлено, вызывается или, по-видимому, вызывается благодаря наличию у рассматриваемого индивидуума, страдающего данным заболеванием, HCMV в качестве причины патологических проявлений данного заболевания или в качестве причины усиления данного заболевания. Другими словами, поскольку антитело против HCMV или его антигенсвязывающий фрагмент по настоящему изобретению обладает высокой нейтрализующей способностью в отношении HCMV, можно ожидать, что оно является профилактическим или терапевтическим лекарственным средством для различных заболеваний, вызываемых HCMV, например: (a) таких заболеваний, как интерстициальная пневмония, ретинит, гастроэнтерит, энцефалит и тому подобное, из-за реактивации HCMV при состояниях иммунодефицита, таких как СПИД, рак, после трансплантации органа, после трансплантации костного мозга, после гемодиализа; (b) врожденной инфекции CMV благодаря передаче инфекции HCMV от беременной женщины плоду; (c) невынашивания беременности, рождения мертвого плода или гибели вскоре после рождения, вызываемых описанной выше врожденной инфекцией CMV; (d) малой массы тела при рождении, гепатоспленомегалии, желтухи, тромбоцитопенической пурпуры, микроцефалии, нарушения умственного развития, отставания в интеллектуальном развитии, хориоретинита и нарушения слуха в случае выживания при описанной выше врожденной инфекции CMV; и (e) нарушении функции печени, интерстициальной пневмонии и мононуклеоза из-за инфекции сразу после рождения или в раннем детстве (непатентные документы 3, 4 и 5).
Используемый в настоящем описании термин «носитель, приемлемый в качестве фармацевтического продукта», включает любой физиологически пригодный или любой растворитель, дисперсионную среду, покрытие, изотонический агент, замедлитель всасывания и тому подобное.
Примеры носителей, приемлемых в качестве фармацевтических продуктов, включают одно или более, или комбинацию воды, физиологического раствора, забуференного фосфатом физиологического раствора, декстрозы, глицерина, этанола и подобного. Для использования в качестве агента для инъекций и подобного в композиции предпочтительно включают регулятор pH или изотонический агент, например, сахар или многоатомный спирт, такой как маннит и сорбит, или хлорид натрия. Носитель, приемлемый в качестве фармацевтического продукта, может дополнительно содержать небольшое количество вспомогательного вещества для повышения сохранности или эффективности антитела или части антитела, такого как смачивающее вещество, эмульгатор, антисептик, буфер, стабилизатор или тому подобное.
Композиция настоящего изобретения может быть изготовлена в разных дозированных формах. Примеры таких композиций включают жидкую, полутвердую и твердую дозированные формы, такие как раствор (например, раствор для инъекций или инфузии), дисперсия, суспензия, таблетка, капсула, лепешка, пилюля, порошок, липосома, суппозиторий и тому подобное. Предпочтительная форма варьирует в зависимости от назначенного способа введения и применяемого лечения. Обычно предпочтительная композиция находится в форме раствора для инъекций или инфузии, такой как форма композиции, сходная с формами композиций, используемых для пассивной иммунизации человека другим антителом. Предпочтительным способом введения является парентеральное введение (например, внутривенное, подкожное, внутрибрюшинное или внутримышечное). По предпочтительному варианту осуществления антитело вводят посредством внутривенной инфузии или внутривенной инъекции. По другому предпочтительному варианту осуществления антитело вводят внутримышечной инъекцией или подкожной инъекцией.
Антитело и фрагмент антитела по настоящему изобретению могут быть включены в фармацевтическую композицию, пригодную для парентерального введения. При использовании одного антитела или части антитела его предпочтительно готовить в виде состава для инъекций, содержащего антитело в концентрации 0,1-250 мг/мл. С другой стороны, когда используют антитела многих типов в смеси, их предпочтительно готовить в виде состава для инъекций, содержащего антитело в концентрации 0,001-100 мг/мл. Соответственно, может быть определено соотношение антител многих типов в смеси.
Состав для инъекций может представлять собой продукт эффективного компонента, который помещен в прозрачный или коричневый сосуд, ампулу или заранее наполняемый шприц. Буфер может представлять собой L-гистидин (1-50 мМ) с pH 5,0-7,0 (предпочтительно pH 6,0) и предпочтительно 5-10 мМ L-гистидин. Примеры других подходящих буферов включают, но не ограничиваются ими, сукцинат натрия, цитрат натрия, фосфат натрия или фосфат калия. Для изменения осмотического давления раствора может быть использован хлорид натрия в концентрации 0-300 мМ (предпочтительно 150 мМ в случае жидкой формы дозы). Лиофилизированная форма дозы может содержать криозащитное вещество, главным образом 0-10% (предпочтительно 0,5-5,0%) сахарозы. Другие подходящие криозащитные вещества включают маннит, трегалозу и лактозу. Лиофилизированная форма дозы может содержать наполнитель, главным образом 1-10% (предпочтительно 2-4%) маннита. Как для жидкой, так и для лиофилизированной форм дозы может быть использован стабилизатор, главным образом 1-50 мМ (предпочтительно 5-10 мМ) L-метионин. Другие подходящие стабилизаторы включают глицин, аргинин и полисорбат 80 и тому подобное. В случае полисорбата 80 он может содержаться в концентрации 0-0,05% (предпочтительно 0,005-0,01%). Другие поверхностно-активные вещества включают, но не ограничиваются ими, полисорбат 20 и поверхностно-активное вещество BRIJ.
Такая фармацевтическая композиция обычно должна быть стерильной и стабильной в условиях производства и хранения. Данная композиция может быть составлена в другую упорядоченную структуру, которая пригодна для раствора, микроэмульсии, дисперсии, липосомы или лекарственного средства с высокой концентрацией. Стерильный раствор для инъекций может быть получен смешиванием необходимого количества активного соединения (то есть, антитела или части антитела) с подходящим растворителем и, если это необходимо, с любым из описанных выше компонентов или их комбинацией и последующей стерилизацией полученной смеси фильтрованием. В общем случае, дисперсию получают смешиванием активного соединения с основной дисперсионной средой и стерильным носителем, содержащим другие необходимые компоненты, выбранные из перечисленных выше компонентов. Предпочтительный способ получения стерильного состава порошка для получения стерильного раствора для инъекций включает обработку описанного выше стерильно отфильтрованного раствора сушкой сублимацией и сушкой распылением с получением, таким образом, композиции, содержащей любой другой желаемый компонент, а также порошок активного компонента. Подходящую текучесть раствора можно поддерживать с помощью, например, покрывающего агента, такого как лецитин, сохраняя необходимый размер частиц в случае дисперсии, или с помощью поверхностно-активного вещества. Продолжительная абсорбция композиции для инъекций может быть обеспечена добавлением к композиции агента, который может задерживать абсорбцию, например, моностеарата или желатина.
Фармацевтическая композиция по изобретению может также содержать дополнительное активное соединение. По одному варианту осуществления антитело или часть антитела по настоящему изобретению составляют вместе с одним или более другими терапевтическими средствами, которые пригодны для лечения заболевания, вызываемого HCMV, или вводят с таким другим терапевтическим средством. Например, антитело против HCMV или часть антитела по настоящему изобретению может быть составлено вместе с одним или более другими антителами, которые связываются с другой мишенью (например, антителом, которое связывается с другим сайтом связывания HCMV), или одновременно введено с таким другим антителом. Кроме того, одно или более антител по настоящему изобретению может быть использовано путем объединения двух или более типов описанных выше терапевтических средств. При такой комбинированной терапии можно преимущественно использовать более низкие дозы вводимых терапевтических средств, и тем самым можно избежать возможной токсичности или осложнения, связанных с разными раздельными терапиями.
Ниже приведены следующие соответствия нуклеотидных или аминокислотных последовательностей номерам последовательностей, приведенным в настоящем описании.
SEQ ID NO:1 представляет собой нуклеотидную последовательность, кодирующую H-цепь антитела против области AD1 гликопротеина gB HCMV (далее в настоящем описании «антитело против AD1») (EV2038) с сигнальной последовательностью.
SEQ ID NO:2 представляет собой аминокислотную последовательность H-цепи антитела против AD1 (EV2038) с сигнальной последовательностью.
SEQ ID NO:3 представляет собой нуклеотидную последовательность, кодирующую L-цепь антитела против AD1 (EV2038) с сигнальной последовательностью.
SEQ ID NO:4 представляет собой аминокислотную последовательность L-цепи антитела против AD1 (EV2038) с сигнальной последовательностью.
SEQ ID NO:5 представляет собой нуклеотидную последовательность, кодирующую H-цепь антитела против AD1 (EV2038) без сигнальной последовательности.
SEQ ID NO:6 представляет собой аминокислотную последовательность H-цепи антитела против AD1 (EV2038) без сигнальной последовательности.
SEQ ID NO:7 представляет собой нуклеотидную последовательность, кодирующую L-цепь антитела против AD1 (EV2038) без сигнальной последовательности.
SEQ ID NO:8 представляет собой аминокислотную последовательность L-цепи антитела против AD1 (EV2038) без сигнальной последовательности.
SEQ ID NO:9 представляет собой нуклеотидную последовательность, кодирующую вариабельную область H-цепи антитела против AD1 (EV2038).
SEQ ID NO:10 представляет собой аминокислотную последовательность вариабельной области H-цепи антитела против AD1 (EV2038).
SEQ ID NO:11 представляет собой нуклеотидную последовательность, кодирующую вариабельную область L-цепи антитела против AD1 (EV2038).
SEQ ID NO:12 представляет собой аминокислотную последовательность вариабельной области L-цепи антитела против AD1 (EV2038).
SEQ ID NO:13 представляет собой аминокислотную последовательность CDR1 H-цепи антитела против AD1 (EV2038).
SEQ ID NO:14 представляет собой аминокислотную последовательность CDR2 H-цепи антитела против AD1 (EV2038).
SEQ ID NO:15 представляет собой аминокислотную последовательность CDR3 H-цепи антитела против AD1 (EV2038).
SEQ ID NO:16 представляет собой аминокислотную последовательность CDR1 L-цепи антитела против AD1 (EV2038).
SEQ ID NO:17 представляет собой аминокислотную последовательность CDR2 L-цепи антитела против AD1 (EV2038).
SEQ ID NO:18 представляет собой аминокислотную последовательность CDR3 L-цепи антитела против AD1 (EV2038).
SEQ ID NO:19 представляет собой нуклеотидную последовательность праймера 38 Hind-S, используемого для получения варианта CDR-H3 EV2038 в рабочем примере.
SEQ ID NO:20 представляет собой нуклеотидную последовательность праймера 38 Not-A, используемого для получения варианта CDR-H3 EV2038 в рабочем примере.
SEQ ID NO:21 представляет собой нуклеотидную последовательность праймера для подтверждения нуклеотидной последовательности, используемой для получения варианта CDR-H3 EV2038 в рабочем примере.
SEQ ID NO:22 представляет собой консенсусную аминокислотную последовательность аминокислотной последовательности CDR-H3 антитела против AD1.
SEQ ID NO:23 представляет собой аминокислотную последовательность, содержащую аминокислотные остатки в положениях 549-580 области AD1 гликопротеина gB HCMV, которая ранее была идентифицирована в качестве области существующего эпитопа с помощью описанного в примере метода делеционной мутации.
SEQ ID NO:24 представляет собой аминокислотную последовательность, содержащую аминокислотные остатки в положениях 596-640 области AD1 гликопротеина gB HCMV, которая ранее была идентифицирована в качестве области существующего эпитопа с помощью описанного в примере метода делеционной мутации.
SEQ ID NO:25 представляет собой аминокислотную последовательность, содержащую аминокислотные остатки в положениях 549-560 области AD1 гликопротеина gB HCMV, которая ранее была идентифицирована в качестве области эпитопа с помощью описанного в примере метода пептидной матрицы.
SEQ ID NO:26 представляет собой аминокислотную последовательность, содержащую аминокислотные остатки в положениях 569-576 области AD1 гликопротеина gB HCMV, которая ранее была идентифицирована в качестве области эпитопа с помощью описанного в примере метода пептидной матрицы.
SEQ ID NO:27 представляет собой аминокислотную последовательность, содержащую аминокислотные остатки в положениях 625-632 области AD1 гликопротеина gB HCMV, которая ранее была идентифицирована в качестве области эпитопа с помощью описанного в примере метода пептидной матрицы.
SEQ ID NO:28 представляет собой аминокислотную последовательность мутанта, где валин (V) был заменен лизином (K) в положении 117 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:29 представляет собой аминокислотную последовательность мутанта, где треонин (T) был заменен триптофаном (W) в положении 118 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:30 представляет собой аминокислотную последовательность мутанта, где аргинин (R) был заменен валином (V) в положении 119 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:31 представляет собой аминокислотную последовательность мутанта, где аспарагиновая кислота (D) была заменена изолейцином (I) в положении 120 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:32 представляет собой аминокислотную последовательность мутанта, где лейцин (L) был заменен глутаминовой кислотой (E) в положении 121 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:33 представляет собой аминокислотную последовательность мутанта, где глутаминовая кислота (E) была заменена лейцином (L) в положении 122 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:34 представляет собой аминокислотную последовательность мутанта, где триптофан (W) был заменен треонином (T) в положении 123 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:35 представляет собой аминокислотную последовательность мутанта, где изолейцин (I) был заменен аспарагиновой кислотой (D) в положении 124 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:36 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен аргинином (R) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:37 представляет собой аминокислотную последовательность мутанта, где глицин (G) был заменен фенилаланином (F) в положении 126 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:38 представляет собой аминокислотную последовательность мутанта, где аспарагиновая кислота (D) была заменена изолейцином (I) в положении 127 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:39 представляет собой аминокислотную последовательность мутанта, где тирозин (Y) был заменен аспарагином (N) в положении 128 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:40 представляет собой аминокислотную последовательность мутанта, где тирозин (Y) был заменен аспарагином (N) в положении 129 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:41 представляет собой аминокислотную последовательность мутанта, где метионин (M) был заменен глутамином (Q) в положении 130 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:42 представляет собой аминокислотную последовательность мутанта, где аспарагиновая кислота (D) была заменена изолейцином (I) в положении 131 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:43 представляет собой аминокислотную последовательность мутанта, где валин (V) был заменен лизином (K) в положении 132 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:44 представляет собой аминокислотную последовательность мутанта, где лейцин (L) был заменен изолейцином (I) в положении 121 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:45 представляет собой аминокислотную последовательность мутанта, где лейцин (L) был заменен валином (V) в положении 121 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:46 представляет собой аминокислотную последовательность мутанта, где лейцин (L) был заменен аланином (A) в положении 121 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:47 представляет собой аминокислотную последовательность мутанта, где лейцин (L) был заменен фенилаланином (F) в положении 121 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:48 представляет собой аминокислотную последовательность мутанта, где лейцин (L) был заменен пролином (P) в положении 121 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:49 представляет собой аминокислотную последовательность мутанта, где триптофан (W) был заменен тирозином (Y) в положении 123 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:50 представляет собой аминокислотную последовательность мутанта, где триптофан (W) был заменен фенилаланином (F) в положении 123 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:51 представляет собой аминокислотную последовательность мутанта, где триптофан (W) был заменен пролином (P) в положении 123 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:52 представляет собой аминокислотную последовательность мутанта, где триптофан (W) был заменен лейцином (L) в положении 123 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:53 представляет собой аминокислотную последовательность мутанта, где триптофан (W) был заменен изолейцином (I) в положении 123 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:54 представляет собой аминокислотную последовательность мутанта, где изолейцин (I) был заменен лейцином (L) в положении 124 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:55 представляет собой аминокислотную последовательность мутанта, где изолейцин (I) был заменен метионином (M) в положении 124 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:56 представляет собой аминокислотную последовательность мутанта, где изолейцин (I) был заменен пролином (P) в положении 124 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:57 представляет собой аминокислотную последовательность мутанта, где изолейцин (I) был заменен валином (V) в положении 124 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:58 представляет собой аминокислотную последовательность мутанта, где изолейцин (I) был заменен аланином (A) в положении 124 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:59 представляет собой аминокислотную последовательность мутанта, где глицин (G) был заменен пролином (P) в положении 126 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:60 представляет собой аминокислотную последовательность мутанта, где глицин (G) был заменен аланином (A) в положении 126 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:61 представляет собой аминокислотную последовательность мутанта, где глицин (G) был заменен серином (S) в положении 126 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:62 представляет собой аминокислотную последовательность мутанта, где глицин (G) был заменен аспарагином (N) в положении 126 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:63 представляет собой аминокислотную последовательность мутанта, где глицин (G) был заменен треонином (T) в положении 126 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:64 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен глицином (G) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:65 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен изолейцином (I) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:66 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен аланином (G) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:67 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен лейцином (L) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:68 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен валином (V) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:69 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен серином (S) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:70 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен треонином (T) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:71 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен аспарагином (N) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:72 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен глутамином (Q) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:73 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен аспарагиновой кислотой (D) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:74 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен глутаминовой кислотой (E) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:75 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен лизином (K) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:76 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен гистидином (H) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:77 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен цистеином (C) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:78 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен метионином (M) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:79 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен тирозином (Y) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:80 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен триптофаном (W) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:81 представляет собой аминокислотную последовательность мутанта, где пролин (P) был заменен фенилаланином (F) в положении 125 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:82 представляет собой аминокислотную последовательность мутанта, где валин (V) был заменен лейцином (L) в положении 117 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:83 представляет собой аминокислотную последовательность мутанта, где валин (V) был заменен изолейцином (I) в положении 117 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:84 представляет собой аминокислотную последовательность мутанта, где треонин (T) был заменен серином (S) в положении 118 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:85 представляет собой аминокислотную последовательность мутанта, где треонин (T) был заменен лизином (K) в положении 118 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:86 представляет собой аминокислотную последовательность мутанта, где аргинин (R) был заменен лизином (K) в положении 119 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:87 представляет собой аминокислотную последовательность мутанта, где аргинин (R) был заменен треонином (T) в положении 119 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:88 представляет собой аминокислотную последовательность мутанта, где аспарагиновая кислота (D) была заменена глутаминовой кислотой (E) в положении 120 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:89 представляет собой аминокислотную последовательность мутанта, где аспарагиновая кислота (D) была заменена аланином (A) в положении 120 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:90 представляет собой аминокислотную последовательность мутанта, где глутаминовая кислота (E) была заменена аспарагиновой кислотой (D) в положении 122 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:91 представляет собой аминокислотную последовательность мутанта, где глутаминовая кислота (E) была заменена аланином (A) в положении 122 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:92 представляет собой аминокислотную последовательность мутанта, где аспарагиновая кислота (D) была заменена глутаминовой кислотой (E) в положении 127 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:93 представляет собой аминокислотную последовательность мутанта, где аспарагиновая кислота (D) была заменена аланином (A) в положении 127 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:94 представляет собой аминокислотную последовательность мутанта, где тирозин (Y) был заменен фенилаланином (F) в положении 128 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:95 представляет собой аминокислотную последовательность мутанта, где тирозин (Y) был заменен триптофаном (W) в положении 128 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:96 представляет собой аминокислотную последовательность мутанта, где тирозин (Y) был заменен фенилаланином (F) в положении 129 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:97 представляет собой аминокислотную последовательность мутанта, где тирозин (Y) был заменен триптофаном (W) в положении 129 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:98 представляет собой аминокислотную последовательность мутанта, где метионин (M) был заменен фенилаланином (F) в положении 130 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:99 представляет собой аминокислотную последовательность мутанта, где метионин (M) был заменен изолейцином (I) в положении 130 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:100 представляет собой аминокислотную последовательность мутанта, где аспарагиновая кислота (D) была заменена глутаминовой кислотой (E) в положении 131 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:101 представляет собой аминокислотную последовательность мутанта, где аспарагиновая кислота (D) была заменена аланином (A) в положении 131 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:102 представляет собой аминокислотную последовательность мутанта, где валин (V) был заменен тирозином (Y) в положении 132 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:103 представляет собой аминокислотную последовательность мутанта, где валин (V) был заменен серином (S) в положении 132 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:104 представляет собой аминокислотную последовательность мутанта, где изолейцин (I) был заменен валином (V) в положении 124, и глицин (G) был заменен аланином (A) в положении 126 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:105 представляет собой аминокислотную последовательность мутанта, где изолейцин (I) был заменен валином (V) в положении 124, и глицин (G) был заменен серином (S) в положении 126 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:106 представляет собой аминокислотную последовательность мутанта, где лейцин (L) был заменен изолейцином (I) в положении 121, триптофан (W) был заменен тирозином (Y) в положении 123, изолейцин (I) был заменен валином (V) в положении 124, и глицин (G) был заменен аланином (A) в положении 126 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:107 представляет собой аминокислотную последовательность мутанта, где лейцин (L) был заменен изолейцином (I) в положении 121, триптофан (W) был заменен тирозином (Y) в положении 123, изолейцин (I) был заменен валином (V) в положении 124, и глицин (G) был заменен серином (S) в положении 126 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:108 представляет собой аминокислотную последовательность мутанта, где глутаминовая кислота (E) в положении 122 была удалена из аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:109 представляет собой аминокислотную последовательность мутанта, где глутаминовая кислота (E) была вставлена между глицином (G) в положении 126 и аспарагиновой кислотой (D) в положении 127 аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:110 представляет собой аминокислотную последовательность мутанта, где аспарагин (N) в положении 79 был заменен глутамином (Q) в аминокислотной последовательности H-цепи антитела против AD1 (EV2038) по настоящему изобретению.
SEQ ID NO:111 представляет собой аминокислотную последовательность синтетического пептида (пептида 1 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:112 представляет собой аминокислотную последовательность синтетического пептида (пептида 2 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:113 представляет собой аминокислотную последовательность синтетического пептида (пептида 3 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:114 представляет собой аминокислотную последовательность синтетического пептида (пептида 4 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:115 представляет собой аминокислотную последовательность синтетического пептида (пептида 5 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:116 представляет собой аминокислотную последовательность синтетического пептида (пептида 6 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:117 представляет собой аминокислотную последовательность синтетического пептида (пептида 7 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:118 представляет собой аминокислотную последовательность синтетического пептида (пептида 8 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:119 представляет собой аминокислотную последовательность синтетического пептида (пептида 9 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:120 представляет собой аминокислотную последовательность синтетического пептида (пептида 10 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:121 представляет собой аминокислотную последовательность синтетического пептида (пептида 11 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:122 представляет собой аминокислотную последовательность синтетического пептида (пептида 12 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:123 представляет собой аминокислотную последовательность синтетического пептида (пептида 13 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:124 представляет собой аминокислотную последовательность синтетического пептида (пептида 14 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:125 представляет собой аминокислотную последовательность синтетического пептида (пептида 15 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:126 представляет собой аминокислотную последовательность синтетического пептида (пептида 16 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:127 представляет собой аминокислотную последовательность синтетического пептида (пептида 17 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:128 представляет собой аминокислотную последовательность синтетического пептида (пептида 18 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:129 представляет собой аминокислотную последовательность синтетического пептида (пептида 19 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:130 представляет собой аминокислотную последовательность синтетического пептида (пептида 20 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:131 представляет собой аминокислотную последовательность синтетического пептида (пептида 21 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:132 представляет собой аминокислотную последовательность синтетического пептида (пептида 22 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:133 представляет собой аминокислотную последовательность синтетического пептида (пептида 23 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:134 представляет собой аминокислотную последовательность синтетического пептида (пептида 24 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:135 представляет собой аминокислотную последовательность синтетического пептида (пептида 25 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:136 представляет собой аминокислотную последовательность синтетического пептида (пептида 26 в таблице 5), полученного и использованного в примере 8.
SEQ ID NO:137 представляет собой аминокислотную последовательность гликопротеина gB цитомегаловируса человека (HCMV) (Swiss-Prot: P06473).
В настоящем описании в таблице 1 ниже показаны соответствия нуклеотидных последовательностей или аминокислотных последовательностей, фигурирующих в примерах 1-6 настоящей заявки, номерам последовательностей.
Ниже настоящее изобретение будет описано более конкретно с помощью примеров, хотя настоящее изобретение, никоим образом, не следует ограничивать этими примерами.
Если не указано иное, методики, использованные в примерах, можно найти в Molecular Cloning: A Laboratory Manual (Third Edition) (Sambrook et al., Cold Spring Harbour Laboratory Press, 2001).
ПРИМЕРЫ
Пример 1. Выделение клеточного клона, который продуцирует полностью человеческое антитело против HCMV
Блок-схема стадий выделения продуцирующего антитело клеточного клона показана на фиг.1.
B-лимфоциты выделяли из периферической крови человека, уровень антитела против HCMV в сыворотке которого высок, и который был инфицирован EBV. Инфицированные клетки высевали в 96-луночный планшет. После приблизительно 3 недель культивирования производили скрининг на антитело против HCMV в культуральном супернатанте (первичный скрининг). Скрининг проводили методом ELISA с использованием 96-луночного планшета, покрытого соединенного с GST HCMV-AD1 или соединенного с GST HCMV-AD2, служащими мишенями для антител против главных нейтрализующих эпитопов AD1 и AD2 HCMV (J. Virol., 65, 138-146 (1991), J. Gen. Virol., 73, 2375-2383 (1992), J. Virol., 66, 5290-5297 (1992), J. Virol., 67, 703-710 (1993). Клетки из каждой лунки с подтвержденной продукцией антитела против HCMV высевали в новый 96-луночный планшет. После приблизительно 3 недель культивирования производили вторичный скрининг на продукцию антитела против HCMV. Клетки из полученных позитивных в отношении антитела лунок высевали в новый 96-луночный планшет в количестве 1-30 клеток/лунка. В результате такой клонирующей обработки путем культивирования после ограниченного разведения получали клеточный клон, продуцирующий представляющее интерес антитело.
Пример 2. Идентификация изотипа и подкласса антитела
Культуральный супернатант выделенного продуцирующего антитело клона использовали для определения изотипа продуцируемого антитела методом ELISA (литературная ссылка: см. Curr Protoc Immunol. 2001 May; Chapter 2: Unit 2.2) Для ELISA использовали 96-луночный планшет, покрытый соединенным с GST HCMV-AD1 или AD2, и антитело, специфичное в отношении каждого из изотипов и подклассов, в качестве второго антитела. Результаты определения изотипа и подкласса полученного антитела против HCMV показаны в таблице 2.
Пример 3. Клонирование ДНК, кодирующей антитело против HCMV
кДНК получали на суммарной РНК продуцирующих антитело клеток путем обратной транскрипции с использованием олиго-dT праймеров и использовали в качестве матрицы в методе ПЦР для амплификации гена антитела. Использованные для ПЦР праймеры конструировали на основе базы данных о кДНК, кодирующих H- и L-цепи IgG антитела человека. Для амплификации полноразмерной кДНК H-цепи и кДНК L-цепи 5'- и 3'-концевые праймеры содержали сайт инициации трансляции и сайт терминации трансляции, соответственно.
Пример 4. Определение аминокислотной последовательности на основании нуклеотидной последовательности
кДНК H- и L-цепей антитела, амплифицированные методом ПЦР, вставляли в плазмидный вектор для идентификации каждой нуклеотидной последовательности с помощью секвенатора ABI. На основании полученных нуклеотидных последовательностей определяли сигнальную последовательность и аминокислотные последовательности H- и L-цепей антитела.
Кроме того, область, определяющую комплементарность (CDR) антитела, анализировали по методу Kabat (www.bioinf.org.uk:Dr.Andrew C.R. Martin's Group, Antibodies: General Information). Последовательности CDR полученного антитела против HCMV (EV2038) представлены SEQ ID NO:13-18. Конкретно, аминокислотные последовательности CDR1 H-цепи, CDR2 H-цепи, CDR3 H-цепи, CDR1 L-цепи, CDR2 L-цепи и CDR3 L-цепи EV2038 представлены SEQ ID NO:13, 14, 15, 16, 17 и 18, соответственно.
Для проверки сходства с моноклональными антителами, о которых ранее сообщалось как об антителах против AD1, последовательности CDR EV2038 сравнивали с антителами, аминокислотные последовательности вариабельных областей которых были ранее зарегистрированы в GenBank или тому подобное. Каждый тип последовательностей CDR известных антител человека или мыши против AD1 идентифицировали методом Kabat и сравнивали с идентифицированной по сходству последовательностью CDR EV2038. В таблице 3 гомологию (%) отдельного CDR определяли на основании количества аминокислотных остатков объекта сравнения (знаменатель) и количества аминокислотных остатков, положения и типы которых соответствовали аминокислотным остаткам в части CDR EV2038 (числитель). Суммарный % определяли сложением количества аминокислотных остатков в знаменателе и количества аминокислотных остатков в числителе, полученных путем сравнения отдельных CDR, то есть, получая общую гомологию (%) из суммарного количества аминокислотных остатков знаменателя и числителя. Как можно понять из таблицы 3, EV2038 не имеет высокой гомологии с известными антителами против AD1, что указывает на наличие большого отличия от последовательностей CDR из антител против AD1, о которых сообщалось ранее.
Пример 5. Определение того, кодирует ли полученный ген антитела антитело против HCMV
Каждую из полученных кДНК H-цепи и L-цепи вставляли в экспрессионные векторы и затем одновременно вводили в клетки 293T. Генный перенос производили с помощью липофектамина (Invitrogen) и реагента PLUS (каталог Invitrogen: Cat.No.18324-111, Cat.No.18324-012 или Cat.No.18324-020). Через два дня культуральный супернатант собирали и подвергали анализу методом ELISA с использованием 96-луночного планшета, покрытого антителом против IgG человека и соединенным с GST HCMV-AD1 для определения того, является ли антитело в культуральном супернатанте человеческим IgG антителом и связывается ли оно с HCMV-AD1.
Пример 6. Получение белка антитела
Полученную плазмиду, экспрессирующую антитело против HCMV, вводили в клетки CHO. Генный перенос производили методом, аналогично описанному для клеток 293T. Культивирование осуществляли в присутствии маркера селекции для получения клона клеток CHO, который постоянно продуцирует антитело.
Те же самые клетки CHO, которые стабильно продуцировали антитело, культивировали в бессывороточной среде и собирали культуральный супернатант. Полученный культуральный супернатант наносили на колонку протеина A и подвергали аффинной очистке, с получением очищенного антитела. Использованная колонка представляла собой заранее набитую колонку HiTrap rProtein A FF (GE Healthcare), и условия очистки соответствовали рекомендованным производителем колонки. После очистки HCMV-AD1- или HCMV-AD2-способность связывания антитела проверяли с помощью ELISA. Кроме того, с помощью SDS-PAGE проверяли H-цепь антитела размером приблизительно 50 кДа и L-цепь антитела размером приблизительно 25 кДа.
Пример 7. Получение вариантов и оценка их связывающей активности
Для изучения аминокислотных последовательностей, которые оказывают влияние на свойства антитела по настоящему изобретению или его связывающего фрагмента, подробно исследовали область CDR3 (аминокислоты 117-132). В настоящем описании положения аминокислотных остатков CDR-H3 последовательно нумеровали, начиная с N-конца (метионина) аминокислотной последовательности тяжелой цепи, включая сигнальную последовательность, SEQ ID NO:2.
Тем временем, аминокислоты, из которых состоят природные белки, могут быть сгруппированы в соответствии со свойствами их боковых цепей. Примеры групп аминокислот, обладающих сходными свойствами, включают ароматические аминокислоты (тирозин, фенилаланин, триптофан), основные аминокислоты (лизин, аргинин, гистидин), кислые аминокислоты (аспарагиновая кислота, глутаминовая кислота), нейтральные аминокислоты (серин, треонин, аспарагин, глутамин), аминокислоты, содержащие углеводородную цепь (аланин, валин, лейцин, изолейцин, пролин) и прочие (глицин, метионин, цистеин).
В данном разделе термин «консервативная аминокислотная замена» относится к замене аминокислотами со сходными свойствами, то есть, аминокислотной замене главным образом аминокислотами, относящимися к одной и той же группе, приведенной выше. Как полагают, такая замена не должна оказывать существенного влияния на свойства исходного белка или изменять их. С другой стороны, термин «неконсервативная аминокислотная замена» отличается от указанной выше замены тем, что он относится к замене аминокислотой, свойства которой сильно отличаются от свойств исходной аминокислоты.
(1) Получение вариантов CDR-H3 EV2038
Каждый из 16 аминокислотных остатков, составляющих CDR-H3 EV2038, подвергали неконсервативной аминокислотной замене методом 2-стадийной ПЦР для получения вариантов (V117K, T118W, R119V, D120I, L121E, E122L, W123T, I124D, P125R, G126F, D127I, Y128N, Y129N, M130Q, D131I и V132K). Сначала получали первую половину фрагмента гена с помощью пары 38Hind-S (CACCAAGCTTTGTGCAAGAACATGAAGCATC: SEQ ID NO:19) и обратного праймера для сайта замены, и оставшуюся половину фрагмента гена получали с помощью пары прямого праймера для сайта замены и 38Not-A (ATAAGAATGCGGCCGCGCCGTCGCACTCATTTACC: SEQ ID NO:20). Вторую ПЦР проводили с использованием этих фрагментов в качестве матриц, с получением полноразмерного варианта гена антитела. Затем ген антитела обрабатывали ферментом рестрикции NotI для получения липких концов, и после этого вставляли в продуцирующую антитело плазмиду. Нуклеотидную последовательность каждого варианта проверяли с использованием праймера для проверки нуклеотидной последовательности (ACCAGACATAATAGCTGACAG: SEQ ID NO:21) с помощью 3130 Genetic Analyzer (ABI) в соответствии с предлагаемым протоколом.
(2) Демонстрация экспрессии вариантов CDR-H3 EV2038
Полученный вариант плазмиды (H-цепь) и исходную плазмиду L-цепи совместно трансфицировали в клетки CHO согласно предлагаемому протоколу Lipofectamine LTX (Invitrogen). Через сорок восемь часов собирали культуральный супернатант. Последовательно разведенные культуральные супернатанты подвергали взаимодействию с антителами против IgG человека на твердой фазе (0,25 мкг/лунка) в иммуно-планшете (Maxi sorp, Nunc) при комнатной температуре в течение часа. В качестве второго антитела взаимодействию подвергали антитело против иммуноглобулина G гамма человека и антитело против иммуноглобулина G лямбда (MBL) человека при комнатной температуре в течение 11 часов. Добавляли пятьдесят мкл/мл Sure Blue (MPL), содержащего субстрат TMB в качестве продуцирующего окраску агента, оставляли при комнатной температуре на 30 минут и затем добавляли равное количество 1,5М фосфорной кислоты для определения поглощения при длине волны 450 нм с использованием микропланшет-ридера (680XR, BIO-RAD). Проверку наличия или отсутствия и количественное определение антитела проводили на основании поглощения гамма- и лямбда-цепей.
(3) Оценка способности связывания вариантов EV2038 CDR-H3 в отношении AD1 с помощью ELISA
Концентрацию антитела доводили до 1 мкг/мл по лямбда-цепи, и последовательные разведения подвергали взаимодействию с 5 мкг/мл AD1 на твердой фазе в иммуно-планшете (Poly sorp, Nunc). Затем проводили ELISA, как описано выше. Способность связывания вариантов в отношении антигена AD1 оценивали по поглощению при 450 нм полученных вариантов и EV2038 (исходного). Как результат, неконсервативные аминокислотные замены остатков 121-126 EV2038 CDR-H3 за исключением остатка 122 значительно снижали способность связывания в отношении AD1, и, таким образом, было предположено, что эти остатки важны в качестве паратопов AD1 (фиг.2).
(4) Получение вариантов EV2038 CDR-H3 (2)
Из пяти аминокислотных остатков, связывающая активность которых в отношении AD1 снижалась после неконсервативной аминокислотной замены, четыре аминокислотных остатка 121, 123, 124 и 126 заменяли аминокислотами со сходными свойствами. Для каждого остатка использовали пять типов аминокислот. Конкретно, были получены варианты, показанные на фиг.3. Пролин в положении 125 заменяли всеми природными аминокислотами, отличными от исходной аминокислоты (фиг.4). Варианты получали, как описано выше.
(5) Оценка способности связывания вариантов EV2038 CDR-H3 в отношении AD1 с помощью ELISA
Концентрацию антитела доводили до 1 мкг/мл по лямбда-цепи, и последовательные разведения подвергали взаимодействию с 5 мкг/мл AD1 на твердой фазе в иммуно-планшете (Poly sorp, Nunc). Затем проводили ELISA, как описано выше для оценки способности связывания вариантов в отношении AD1. Что касается аминокислот в положениях 121, 123, 124 и 126, то большинство консервативных аминокислотных замен сохраняло способность связывания в отношении AD1 (фиг.3). Однако после замены пролина в положении 125 любой другой природной аминокислотой (19 типов) способность связывать AD1 терялась (фиг.4). Следовательно, было показано, что пролин в положении 125 CDR-H3 EV2038 по настоящему изобретению является аминокислотой, необходимой для способности антитела связывать AD1.
(6) Получение вариантов CDR-H3 EV2038 (3)
Консервативные аминокислотные замены производили также для аминокислотных остатков, способность связывания которых в отношении AD1 не снижалась после неконсервативной аминокислотной замены (всего 11 остатков в положениях 117-120, 122 и 127-132), согласно методу, аналогично приведенному для осуществления оценки способности связывания в отношении AD1. В результате было обнаружено, что варианты с консервативными аминокислотными заменами в этой области (V117L, V117I, T118S, T118K, R119K, R119T, D120E, D120A, E122D, E122A, D127E, D127A, Y127F, Y128W, Y129F, Y129W, M130F, M130I, D131E, D131A, V132Y и V132S) сохраняют способность связывания в отношении AD1, как и варианты с неконсервативными аминокислотными заменами (фиг.5).
(7) Получение вариантов CDR-H3 EV2038 (4)
В общей сложности получали четыре типа вариантов путем одновременной замены двух или четырех аминокислотных остатков среди аминокислотных остатков, способность связывания которых в отношении AD1 снижалась после неконсервативной аминокислотной замены и которые были отличны от пролина в положении 125 (всего четырех аминокислотных остатков в положениях 121, 123, 124 и 126) (продукты с двумя аминокислотными заменами: I124V/G126A и I124V/G126S, продукты с четырьмя аминокислотными заменами: L121I/W123Y/I124V/G126A и L121I/W123Y/I124V/G126S), для оценки их способности связывания в отношении AD1. В результате было обнаружено, что все варианты с множественными заменами сохраняют способность связывания в отношении AD1 (фиг.6).
(8) Получение вариантов CDR-H3 EV2038 (5)
Получали каждый из вариантов с делецией и вставкой (E122del и G126_D127insE), направленных на аминокислотные остатки, способность связывания которых в отношении AD1 снижалась после неконсервативной аминокислотной замены и которые были отличны от пролина в положении 125 (всего четыре аминокислотных остатка в положениях 121, 123, 124 и 126), для оценки их способности связывания в отношении AD1. В результате способность связывания в отношении AD1 была полностью утрачена как у E122del, так и у G126_D127insE. В связи с этим было предположено, что для связывания с AD1 важно количество аминокислотных остатков в данном сайте (положения 121-126) (6 остатков) (фиг.7).
В итоге аминокислотная последовательность CDR-H3 EV2038 может быть следующей консенсусной последовательностью:
XnXnXnXnX1XnX2X3PX4XnXnXnXnXnXn (SEQ ID NO:22),
где Xn означает любую природную аминокислоту,
X1 представляет собой L, I, V, F или A,
X2 представляет собой W, Y или F,
X3 представляет собой I, V, L или M,
X4 представляет собой G, S, A или T.
(9) Получение вариантов CDR-H2 EV2038
Для выяснения того, влияет ли консервативная замена, отличная от CDR-H3, на способность связывания в отношении AD1 с помощью метода, аналогично использованному для получения других вариантов, получали вариант, в котором N79, находящийся в CDR-H2 EV2038, был заменен N79Q, для оценки способности связывания в отношении AD1. В результате было доказано, что способность связывания в отношении AD1 также не снимается в варианте, содержащем замену N79 в CDR-H2 на N79Q (фиг.8).
Номера последовательностей аминокислотных последовательностей H-цепей (включая сигнальную последовательность) вариантов, полученных в данном разделе, перечислены в таблице 4.
Пример 8. Эпитопное картирование антитела против HCMV AD1
Для определения сайта гликопротеина gB, с которым связываются антитела против AD1, в экспрессионный вектор с клонированным AD1 HCMV gB вводили делеционную мутацию методом ПЦР с получением серии мутантов E.coli, которые экспрессируют белки, содержащие делеции в различных сайтах AD1. Мутанты E.coli культивировали и индуцировали к экспрессии. Затем производили стандартный анализ иммуноблоттингом с использованием клеточного лизата в качестве антигена. В качестве контролей выбирали EV2038 и два типа вариантов с разными сайтами замены, которые обладали способностью связывания в отношении AD1. Один из отобранных вариантов представлял собой форму с консервативной аминокислотной заменой I124V, которая появилась в результате замены части изолейцина в положении 124 (одном из сайтов, связывающая активность которых в отношении AD1 не проявлялась после неконсервативной аминокислотной замены), расположенном выше петлевой структуры CDR-H3 (Shirai, H., et al., FEBS Letters, 1996; 399:p1-8). Другой вариант представлял собой форму с неконсервативной аминокислотной заменой V132K, которая появилась в результате замены валина в положении 132 у основания петлевой структуры CDR-H3.
EV2038, I124V и V132K, все связываются с клонами с номерами #0, #12, #13, #14, #15 и #19 наряду с тем, что EV2038 и его варианты - все, как было обнаружено, содержат эпитопы между аминокислотными остатками 549-580 (SCVTINQTSVKVLRDMNVKESPGRCYSPVVI:SEQ ID NO:23) и 596-460 (EDNEILLGNHRTEECQLPSLKIFIAGNSAYEYVDYLFKRMIDLSS: SEQ ID NO:24) (фиг.9 и 10). В настоящем описании нумерация аминокислотной последовательности gB штамма HCMV AD169 в качестве антигена начинается с кодона инициации, т.е. метионина, со ссылкой на последовательность с номером регистрации P06473.
Более того, эпитоп определяли более конкретно для EV2038 с помощью пептидной матрицы. Синтезировали двадцать шесть типов пептидов путем сдвига за один раз на четыре остатка в пептиде из 12 остатков внутри диапазона аминокислотных остатков 548-641 (таблица 5). C-конец каждого пептида присоединяли к поверхности дериватизированной целлюлозной мембраны для твердофазного синтеза в виде отдельного пятна размером 3,7×3,7 мм (метод SPOT, Sigma Genosys). Пептид, связанный EV2038, определяли стандартным дот-блот синтезом. EV2038 связывался с пептидами с номерами 3, 7, 8, 21 и 22 (фиг.10), и было определено, что эпитопы представляют собой аминокислотные остатки 549-560 (SCVTINQTSVKV: SEQ ID NO:25), аминокислотные остатки 569-576 (SPGRCYSR: SEQ ID NO:26) и аминокислотные остатки 625-632 (YEYVDYLF: SEQ ID NO:27).
Ранее сообщалось (WO93/21952 и J. Virol, 67; p703-710 (1993)), что в качестве антител, которые распознают область AD1, ITC52 и подобные, распознают прерывистый эпитоп из аминокислотных остатков 570-579 и 606-619. Однако ранее не сообщалось, по меньшей мере, о двух частях с эпитопными последовательностями, отличными от аминокислотных остатков 569-576 (SPGRCYSR: SEQ ID NO:26), что свидетельствует о том, что EV2038 представляет собой антитело, которое распознает прерывистую последовательность, которая отличается от последовательностей, о которых сообщалось для антител против AD1 (фиг.10).
Пример 9. Оценка нейтрализующей активности
(1) Иммуноокрашивание
Для оценки эффективности антитела против HCMV (EV2038) определяли нейтрализующую активность. Нейтрализующую активность оценивали по степени блокады антителом инфекции HCMV (штамм AD169) в клеточной линии нормальных фибробластов из легкого плода человека (MRC-5: Ricken BRC No.RBC0211). Методика соответствовала методу Abai et al. (Journal of Immunological Methods 322 2007 82-93). Кратко, методика была следующей. Комплемент (5%) добавляли к раствору вируса и очищенного антитела и оставляли на час. Затем содержимое использовали для инокуляции клеток MRC-5 (37°С, 1 час). Клетки дважды промывали, культивировали в течение 20 часов, и затем в них определяли немедленный-ранний белок HCMV с помощью иммунофлуоресцентного окрашивания. Инфицированные HCMV клетки подсчитывали с помощью программы анализа изображений Image J (http://rsbweb.hih.gov/ij/).
На фиг.11 показаны результаты оценки нейтрализующей активности антитела против HCMV. В качестве отрицательного контроля использовали человеческое моноклональное антитело (hIgG), не обладающее специфичностью в отношении HCMV, и в качестве положительного контроля использовали мышиное моноклональное антитело (название клона HCMV16, AbD serotec: 2470-5437), которое связывается с гликопротеином H (gH), т.е. одним из нейтрализующих эпитопов HCMV. Степень блокирования инфекции HCMV каждым антителом представляли в виде процента по отношению к степени блокирования инфекции, полученной после добавления равной концентрации hIgG. Концентрация, вызывающая 50% ингибирование (IC50) после добавления комплемента, для EV2038 составляла 0,58 мкг/мл, что показывает, что оно обладает эффективной нейтрализующей активностью при меньшей концентрации по сравнению с EV2001. В отсутствие комплемента эффективная нейтрализующая активность не была получена для EV2001, тогда как IC50 EV2038 составляла 0,57 мкг/мл, что показывает, что оно обладает такой же нейтрализующей активностью, как и в случае наличия комплемента (таблица 6).
(2) Метод бляшек
EV2038, проявившее высокую нейтрализующую активность при описанной выше оценке, дополнительно оценивали на предмет его блокирующей инфекцию активности методом бляшек (Masuho, Y. et al., J. Gen. Virol., 1987; 68: p1457-1461). В качестве штаммов вируса использовали обычные лабораторные штаммы HCMV AD169, Towne, Davis и Merlin, а также клинически выделенные штаммы HCMV T-137 и MDU-1. Кратко, метод осуществляли следующим образом. Смешивали раствор вируса с 50-100 PFU и последовательно разбавленное очищенное антитело с заранее определенной концентрацией, инкубировали при 37°С в течение часа и использовали для инокуляции фибробластных клеток (MCR-5) или пигментных эпителиальных клеток сетчатки (ARPE-19), которые высаживали в один слой в 48-луночные планшеты. После инокуляции содержимое инкубировали при 37°С в течение 2 часов, и затем культуральный супернатант удаляли. После двойной промывки содержимое культивировали при 37°С в стандартной среде, содержащей 2% FCS. Культивирование продолжали в течение 5-6 дней с лабораторным штаммом или в течение 10-12 дней с клиническим штаммом до образования бляшки с четко подтвержденной гибелью инфицированных вирусом клеток. Затем добавляли 5% формалин для иммобилизации клеток и проводили окрашивание 0,025% кристаллическим фиолетовым. После окрашивания подсчитывали количество бляшек на лунку для расчета степени блокирования инфекции антителом против HCMV.
В таблице 7 представлены результаты оценки нейтрализующей активности EV2038 методом бляшек. В качестве отрицательного контроля использовали моноклональное антитело человека (hIgG), которое не обладает специфичностью в отношении HCMV, и в качестве положительного контроля использовали иммуноглобулиновый состав с высоким титром против CMV CytoGam (CSL Behring, CytoGam Cytomegalovirus immune globulin intravenous, Prescribing information. (Revised July 2008)), одобренный в Соединенных Штатах для применения при профилактике развития инфекции HCMV, связанной с трансплантацией почки.
Сообщалось, что механизм вхождения HCMV отличается от способа инфекции клеток фибробластов и способов инфекции эпителиальных и эндотелиальных клеток (Sinzger, C. et al., Curr Top Microbiol Immunol., 2008; 325: p63-83). Для многих лабораторных штаммов, конкретными представителями которых являются штаммы AD169 и Towne, инфективность в отношении эпителиальных и эндотелиальных клеток, как полагают, утрачивается после нескольких пассажей с фибробластными клетками (Dai Wang, et al., J. Virol., 2005; 79: p10330-10338). С другой стороны, в действительности, HCMV обладает инфективностью в отношении широкого спектра тканей и клеточных типов in vivo (Sinzger, C. et al., Curr Top Microbiol Immunol., 2008; 325: p63-83). Следовательно, для проявления антителом против HCMV клинического действия может быть важным, чтобы антитело обладало эффективной нейтрализующей активностью как для клеточного типа фибробластов, так и для клеточного типа эпителиальных/эндотелиальных клеток, которые используют в качестве инфицированных клеток-хозяина.
Было показано, что антитела против HCMV (EV2038) по настоящему изобретению имеют IC50 0,012-0,037 мкг/мл в отношении инфекции фибробластных клеток лабораторным штаммом. В случае клинически выделенного штамма (MDU-1), который сохраняет инфективность в отношении эпителиальных/эндотелиальных клеток, IC50 составляла 0,044 мкг/мл для инфекции фибробластных клеток и 0,040 мкг/мл для инфекции фибробластных и эпителиальных клеток, что подтверждает, что антитело обладает прекрасной нейтрализующей активностью в равной мере в отношении как клеточного типа фибробластов, так и клеточных типов эпителиальных/эндотелиальных клеток. Более того, EV2038 проявляло очень высокую активность против штамма AD169, которая приблизительно в 2000 раз превышала активность коммерчески доступного иммуноглобулинового состава с высоким титром против CMV CytoGam, и очень высокую активность, которая приблизительно в 20 раз превышала сообщавшиеся величины для внедренного в клинику и одобренного C23 (Masuho, Y. et al., J. Gen. Virol., 1987; 68: p.1457-1461).
Пример 10. Оценка нейтрализующей активности вариантов антитела EV2038
Из вариантов EV2038 выбирали два типа вариантов с заменами в разных сайтах для оценки их нейтрализующей активности. Один вариант представлял собой форму с консервативной аминокислотной заменой I124V, которая появилась в результате замены изолейциновой части в положении 124 (расположенном выше петлевой структуры CDR-H3), AD1-связывающая активность которой не обнаруживалась после неконсервативной аминокислотной замены. Другой вариант представлял собой форму с неконсервативной аминокислотной заменой V132K, которая появилась в результате замены валина в положении 124 (расположенном в основании петлевой структуры CDR-H3) и которая после неконсервативной аминокислотной замены обладала AD1-связывающей активностью, равной активности исходной формы. Методика соответствовала описанному выше методу Abai et al. (Journal of Immunological Methods 322 2007 82-93). В качестве отрицательного контроля использовали человеческое моноклональное антитело (hIgG), не обладающее специфичностью в отношении HCMV, и в качестве положительного контроля использовали мышиное моноклональное антитело (название клона HCMV16, AbD serotec: 2470-5437), которое связывается с гликопротеином H (gH), т.е. одним из нейтрализующих эпитопов CMV. Степень блокирования инфекции HCMV каждым антителом представляли в виде процента по отношению к степени блокирования инфекции, полученной после добавления равной концентрации hIgG. Концентрация, вызывающая 50% ингибирование (IC50), составляла 0,45 мкг/мл для I124V и 1,20 мкг/мл для V132K, и было показано, что оба варианта обладают активностью, почти равной активности EV2038.
Пример 11. Оценка способности блокировать распространение инфекции от клетки к клетке
Далее в качестве одного из показателей эффективности EV2038 оценивали блокирующую активность EV2038 в отношении распространения инфекции от клетки к клетке с использованием инфицированных HCMV нормальных фибробластных клеток из легкого плода человека (MRC-5). Метод оценки основывался на методе Navarro et al. (Virology. 1993; 197: p143-158). Конкретно, использовали MRC-5, которые предварительно инфицировали HCMV (AD169) в течение 24 часов, к которым добавляли антитело в последовательных 4-кратных разведениях, начиная с 10 мг/мл (приблизительно 67 нМ). Через 6 дней после инфекции клетки иммобилизовали, и с помощью иммуноокрашивания определяли белок IE1 ранней инфекционной экспрессии. Инфицированные HCMV клетки подсчитывали с помощью программы анализа изображений Image J. В результате было обнаружено, что добавление антитела EV2038 против AD1 к инфицированным клеткам может значительно подавлять распространение вирусной инфекции от клетки к клетке (таблица 8).
В таблице (1)+++, (2)++, (3)+, (4)± и (5)- соответствуют ингибированию на 100-75%, ингибированию на 75-50%, ингибированию на 50-25%, ингибированию на 25-0% и отсутствию ингибирующего действия в отношении распространения инфекции, соответственно.
В сообщении Navarro et al. (Virology. 1993; 197: p143-158) показан иллюстративный случай, когда антитела с наибольшей активностью (CH177-3, CH244-4 и т.д.) вызывали 100-75% ингибирование в концентрации 10 мг/мл. В случае EV2038, однако, 100-75% ингибирование инфекции клеток можно наблюдать в диапазоне концентраций 10-0,63 мкг/мл и дополнительно 75-50% ингибирующее действие на распространение инфекции от клетки к клетке при 0,16 мкг/мл (1,07 нМ).
На основании описанных выше свойств антитело против HCMV или его антигенсвязывающий фрагмент по настоящему изобретению, по-видимому, служит новой точкой отсчета в качестве профилактического или терапевтического средства для различных заболеваний, вызываемых HCMV, например, таких заболеваний, как интерстициальная пневмония, ретинит, гастроэнтерит или энцефалит у пациента с иммунодефицитом, или нарушения функции печени, интерстициальной пневмонии или мононуклеоза, которые возникают в результате инфекции HCMV в период сразу после рождения или младенчества.
До сих пор настоящее изобретение было конкретно описано в соответствии с конкретными вариантами осуществления. Эти варианты осуществления, однако, представлены исключительно с целью описания и не являются ограничивающими. Объем настоящего изобретения может быть изменен или модифицирован любым образом в пределах ограничений, налагаемых формулой изобретения, которая соответствует объему настоящего изобретения.
Промышленная применимость
Ожидается, что антитело против HCMV по настоящему изобретению и фармацевтическая композиция, содержащая антитело, будут использоваться в качестве профилактического или терапевтического средства для различных заболеваний, вызываемых HCMV, например: (a) таких заболеваний, как интерстициальная пневмония, ретинит, гастроэнтерит, энцефалит и тому подобное, вызванных реактивацией HCMV при состояниях иммунодефицита, таких как СПИД, рак, после трансплантации органа, после трансплантации костного мозга и после гемодиализа; (b) врожденной инфекции CMV из-за передачи инфекции HCMV от беременной женщины плоду; (c) невынашивания беременности, рождения мертвого плода и гибели вскоре после рождения, вызванных описанной выше врожденной инфекцией CMV; (d) малой массы тела при рождении, гепатоспленомегалии, желтухи, тромбоцитопенической пурпуры, микроцефалии, нарушения умственного развития, отставания в интеллектуальном развитии, хориоретинита и нарушения слуха в случае выживания при описанной выше врожденной инфекции CMV; и (e) нарушении функции печени, интерстициальной пневмонии и мононуклеоза из-за инфекции сразу после рождения или в раннем детстве.
Реферат
Изобретение относится к области биохимии, в частности к моноклональному антителу или его антигенсвязывающему фрагменту, которое специфически связывается с областью AD1 гликопротеина gB цитомегаловируса человека (HCMV), а также к нуклеиновой кислоте, его кодирующей. Раскрыта фармацевтическая композиция для профилактики или лечения заболевания, вызванного HCMV, содержащая эффективное количество вышеуказанного антитела или его антигенсвязывающего фрагмента. Описан вектор экспрессии, включающий вышеуказанную нуклеиновую кислоту, а также клетка-хозяин, содержащая указанный вектор. Также описан способ получения указанного антитела или антигенсвязывающего фрагмента, включающий стадии 1) культивирования вышеуказанной клетки-хозяина и 2) очистки продуцируемого антитела из культурального супернатанта. Изобретение позволяет эффективно лечить заболевания, вызванные HCMV. 6 н. и 4 з.п. ф-лы, 11 ил., 8 табл., 11 пр.
Формула
(i)
(a) аминокислотную последовательность CDR1 тяжелой цепи SEQ ID NO:13,
(b) аминокислотную последовательность CDR2 тяжелой цепи SEQ ID NO:14 и
(c) аминокислотную последовательность CDR3 тяжелой цепи SEQ ID NO:15 и
(ii)
(а) аминокислотную последовательность CDR1 легкой цепи SEQ ID NO:16,
(b) аминокислотную последовательность CDR2 легкой цепи SEQ ID NO:17 и
(c) аминокислотную последовательность CDR3 легкой цепи SEQ ID NO:18.
(a) вариабельную область тяжелой цепи (HCVR), включающую аминокислотную последовательность SEQ ID NO:10, и
(b) вариабельную область легкой цепи (LCVR), включающую аминокислотную последовательность SEQ ID NO:12.
(a) тяжелую цепь (H-цепь), включающую аминокислотную последовательность SEQ ID NO:6, и
(b) легкую цепь (L-цепь), включающую аминокислотную последовательность SEQ ID NO:8.

Комментарии