Серологический тест для терапевтического контроля впч16-положительной карциномы - RU2757629C2
Код документа: RU2757629C2
Чертежи
Описание
Настоящее изобретение относится к способу терапевтического контроля ВПЧ16-положительной карциномы, антителу для применения в соответствующем способе диагностики, а также к тесту на осуществление способа. В частности, настоящее изобретение относится к серологическому способу контроля развития количества антител в образцах, которые взяты у пациентов до и после лечения ВПЧ16-положительной карциномы за заданный заранее период времени. Кроме того, настоящее изобретение обеспечивает иммунологический тест в форме набора, с помощью которого осуществляют способ согласно настоящему изобретению.
Между тем известно более 100 типов вирусов папилломы человека (ВПЧ), которые могут инфицировать эпителиальные клетки кожи или различных слизистых оболочек. ВПЧ инфекции широко распространены, и различные типы ВПЧ относятся к разным клиническим картинам. ВПЧ типа 1 и ВПЧ типа 2 вызывают бородавки на руках и ногах, тогда как ВПЧ типа 6 и ВПЧ типа 11 вызывают остроконечные бородавки. Во многих случаях такая инфекция не имеет клинических симптомов, но она также может привести к опухолеподобному росту пораженных эпителиальных клеток. Хотя такие опухоли в основном являются доброкачественными и, как уже упоминалось выше, приводят только к образованию бородавок, было установлено, что некоторые ВПЧ могут также вызывать злокачественные изменения и, следовательно, отвечать за развитие рака, например, в область половых органов, а также во рту или горле.
Методом лечения этих злокачественных опухолей является хирургическое вмешательство, лучевая терапия, химиотерапия, иммунотерапия или комбинация этих способов. В контексте терапевтического контроля после лечения ВПЧ-положительной карциномы желательно выявлять опухолевые клетки, остающиеся в организме, а также рецидив или метастазы на ранних стадиях, так чтобы можно было возобновить лечение, например, посредством химиотерапии или иммунотерапии прежде, чем образуются видимые вторичные опухоли.
Различные публикации посвящены определению ВПЧ -специфических антител в сыворотке крови пациентов и диагностическому и прогностическому значению полученных данных в отношении возникновения или рецидива ВПЧ -положительной карциномы.
Особенно полезными для определения диагностических или прогностических значений являются, так называемые, опухолевые антигены, то есть конкретные антигенные структуры, которые являются частью опухолевой клетки и специфичны для нее, и которые распознаются иммунной системой и могут вызывать иммунный ответ. Так называемые опухолевые антигены ВПЧ Е6 и ВПЧ Е7 являются подходящими только в ограниченной степени, однако, поскольку эти белковые антигены встречаются во всех типах ВПЧ, они в значительной степени гомологичны и, следовательно, не позволяют проводить оценку конкретного типа, даже когда, например, специфичные для ВПЧ 16 E6 или E7 белки используются для серологического обнаружения. Это типоспецифическое обнаружение серологического ответа необходимо, однако, для определения реакции иммунной системы на тип ВПЧ, который вызвал опухоль, а не, например, иммунного ответа на доброкачественную бородавку на ноге, что должно рассматриваться как ложноположительный результат и может иметь фатальные последствия для пациента.
ВПЧ представляет собой вирусы двухспиральной ДНК. Неинкапсулированные вирионы состоят из икосаэдрических капсид. L1 (поздний белок 1) определяет, среди прочего, образование капсиды ВПЧ и в первую очередь отвечает за иммуногенность типов ВПЧ.
Af Geijerstam et al. описывает Journal of Infectious Diseases, 177, 1998, 1710-1714 исследование, в котором были определены сывороточные уровни капсид-специфических антител против ВПЧ у первородящих женщин за период времени до второй беременности. Из этого исследования можно сделать вывод, что количество капсид-специфических антител против ВПЧ16 в сыворотке остается стабильным в течение нескольких лет, а количество антител коррелирует с количеством половых партнеров, но не с состоянием здоровья.
Другое исследование посвящено вопросу представляют ли инфекции ВПЧ 16 фактор риска для более позднего возникновения рака шейки матки (Shah et al., Cancer Epidemiology, Biomarkers & Preventions, 6, 1997, 233-237). Наличие большего количества антител против капсидного ВПЧ16 в сыворотке связано с более высоким риском возникновения рака шейки матки. В ходе испытаний также было обнаружено, что антитела против капсидного ВПЧ16 заметно не убывают в течение 7-13 лет.
Koslabova et al. раскрыли в International Journal of Cancer, 133, 2013, 1832-1839, что после лечения опухолевых пациентов наблюдается длительная серопозитивность в отношении вирусоподобных частиц (VLP) ВПЧ16, то есть капсид. Это означает, что уменьшение количества L1-специфических антител после терапии не представляется подходящим для контроля успеха терапии. В аннотации упоминается, что титр антител, которые являются специфическими для капсидных антигенов ВПЧ16, не изменяется в течение периода наблюдения после лечения. L1, следовательно, не представляет собой маркер, который может быть пригоден для мониторинга развития или даже для обнаружения рецидива.
Другой проблемой является - как уже упоминалось выше - отсутствие типовой специфичности обычных тестов на антитела. L1 или также основной капсидный белок ВПЧ может быть в мономерной или мультимерной форме. Пять одиночных белков L1 ассоциируются для образования так называемых капсомеров (или пентамеров). 72 капсомера, как субъединицы капсид, объединяются, образуя капсиды вирусов, в которые упакован генетический материал в ходе инфекции природного происхождения. Различия в последовательности нуклеиновой кислоты в 10% в гене L1 определены как требование для описания нового типа ВПЧ. Это означает, что даже разные типы ВПЧ могут быть идентичны почти на 90% гена и белка L1. Помимо основного капсидного белка (L1), существует также минорный капсидный белок L2. Белок L2 также является высококонсервативным, то есть в значи тельной степени идентичным белком. Следовательно, белок L2 также не специфичен для конкретных типов ВПЧ.
Тем не менее, в обоих белках могут присутствовать части, которые специфичны для определенных типов ВПЧ (смотрите, например, Christensen). Это означает, что типоспецифичные и нетипоспецифичные (специфичные для группы - например, для типов высокого риска или также специфичные для рода) эпитопы (сайты связывания для антител) могут встречаться рядом друг с другом.
Поскольку антитела образца пациента имеют поликлональное происхождение, то есть направлены против многих разных антигенов или разных частей антигена, типоспецифичные и нетипоспецифичные антитела L1 нельзя различить при использовании мономерных белков L1 при «традиционной» организации теста ELISA с пероксидазно- или флуоресцентно-меченными анти-IgG-специфическими конъюгатами. Обнаружено только присутствие антител против L1 более чем 100 различных ВПЧ, даже если белок L1 происходит из ВПЧ типа 16. Из-за очень высокой гомологии белка в группе ВПЧ кажущаяся типоспецифичность используемого антигена L1 является очень обманчивой.
В результате серология ВПЧ не подходит для терапевтического контроля ВПЧ16-положительной карциномы, поскольку в данной области техники принято, что количество антител остается стабильным в течение многих лет и не обязательно уменьшается после терапии, так что этот параметр не подходит для мониторинга состояния. Кроме того, различные типы ВПЧ нельзя различить с помощью обычных тестов на антитела.
Однако неожиданно было обнаружено, что для конкретных специфических для капсиды L1 антител против ВПЧ 16, которые связываются по меньшей мере с одним конформационным эпитопом капсиды L1 ВПЧ 16, который не присутствует в мономерных и/или денатурированных белках L1 ВПЧ 16, наблюдается снижение и уменьшение количества антител. Таким образом, впервые возможно не только диагностическое определение специального количества специфических для капсиды L1 антител против ВПЧ 16, но и обнаружение рецидива.
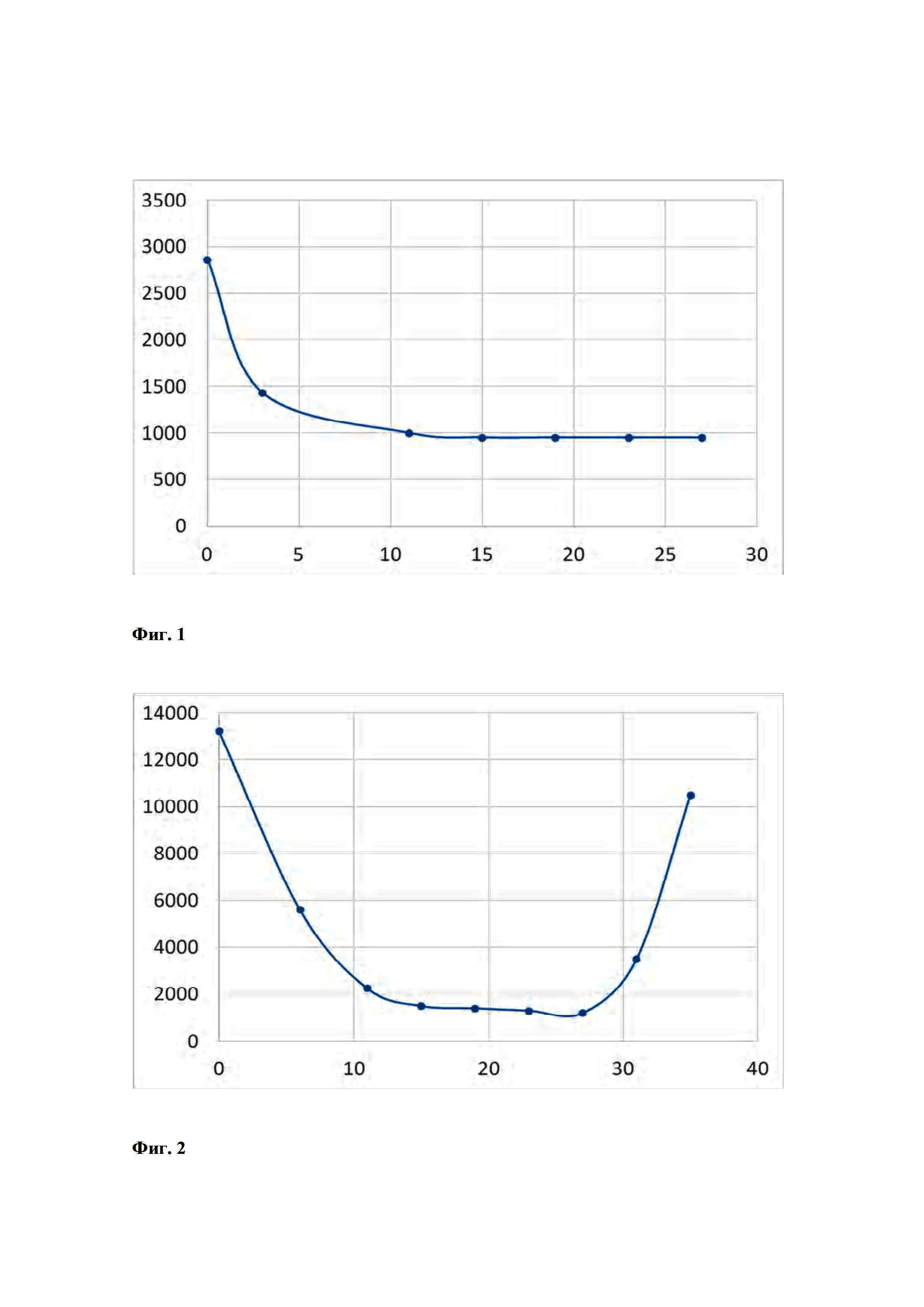
При лечении первичной ВПЧ 16-положительной опухоли в течение нескольких недель (например, двух недель), как правило, в контексте мониторинга, может наблюдаться уменьшение количества специфичных к L1 антител против ВПЧ 16. Количество неуклонно уменьшается, но выравнивается по базовой линии, так что образуется плато (Фиг. 1). Если ВПЧ 16-положительные клетки первичной опухоли, оставшиеся в организме, начинают снова расти (рецидив или метастазирование), наблюдается быстрое увеличение количества антител (Фиг. 2).
Это изменение (уменьшение) количества антител наблюдается уже в случае микроскопически небольшой, для клинициста не видной, вторичной опухоли, так что при уменьшении терапевтические меры могут быть начаты гораздо раньше, чем это обычно делается сегодня, и вероятность исцеления для пациента значительно увеличивается.
Задача, решаемая настоящим изобретением, заключается в обеспечении серологического теста, который позволяет проводить высокочувствительный и специфичный для конкретного типа терапевтический контроль ВПЧ16-положительной карциномы и облегчает обнаружение повторного возникновения заболевания, такого как рецидив или метастазирование, на ранней стадии.
Эта задача решается согласно настоящему изобретению посредством in vitro способа терапевтического контроля после лечения ВПЧ16-положительной карциномы, включающего стадии
(a) приведение в контакт образца, взятого у пациента с ВПЧ16-положительной карциномой, причем в отношении указанного пациента проводилась противораковая терапия, с множеством антигенов, содержащих конформационный эпитоп капсиды или капсомера L1 ВПЧ16, где указанный эпитоп не присутствует в мономерном и/или денатурированном L1 ВПЧ16, в условиях, при которых антитела, присутствующие в образце, могут связываться с антигенами, и
(b) обнаружение связывания антител в образце, связанном с антигеном,
где связывание указанных антител имеет отрицательную корреляцию с успехом противораковой терапии у пациента.
Образец может быть взят у пациента до лечения или в момент начала противораковой терапии, чтобы получить эталонное значение количества антител в образце, с которым можно сравнивать более поздние образцы. В это время у пациента могут наблюдаться уровни антител вплоть до 50 000 нг/мл.
Предпочтительно связывание антител в образце, связанном с антигеном, обнаруживают путем контактирования образца с мечеными антителами, которые специфически связываются с конформационным эпитопом капсиды или капсомера L1 ВПЧ16, предпочтительно с мечеными антителами, полученными из клеточной линии гибридомы с номер депонирования DSM ACC3306.
Кроме того, предпочтительно сравнивать связывание указанных антител с контрольным уровнем связывания, предпочтительно, когда связывание указанных антител сравнивают со связыванием указанных антител в одном или более образцах, взятых у указанного пациента в заданные заранее интервалы времени, где уменьшение указанного связывания в течение заданного заранее времени указывает на успешную противораковую терапию, и где увеличение указанного связывания во времени указывает на рецидив ВПЧ16-положительной карциномы у указанного пациента.
Меченые антитела могут присутствовать в мобильной форме на тест-полоске, и комплексы антигена и меченого антитела обнаруживают путем связывания с другим антителом, предпочтительно другие антитела также являются антителами, которые получены из клеточной линии гибридомы с номером депонирования DSM ACC3306.
В способе согласно настоящему изобретению в отношении пациента, у которого выявлен рецидив ВПЧ16-положительной карциномы, может проводиться противораковая терапия.
Согласно предпочтительному варианту выполнения настоящего изобретения, способ терапевтического контроля после лечения ВПЧ16-положительной карциномы включает или состоит из следующих стадий:
i) смешивание образца, взятого у пациента, с множеством антигенов, где антигены представляют капсидные или капсомерные структуры L1 ВПЧ16, которые имеют конформационные эпитопы, не присутствующие в мономерном и/или денатурированном L1 ВПЧ16, в условиях, при которых антитела, присутствующие в образце, могут связываться с антигенами L1 ВПЧ16,
ii) приведение в контакт смеси со стадии i) с меченными антителами, которые специфически связываются с конформационными эпитопами антигенов, представляющих капсидные или капсомерные структуры L1 ВПЧ16, в частности с меченными антителами, которые получены из клеточной линии гибридомы с номером депонирования DSM ACC3306,
iii) количественное определение меченных антител и/или антител образца, которые связались с антигенами, представляющими капсидные или капсомерные структуры L1 ВПЧ16, соответственно,
iv) повторение стадий i) - iii) один или более раз с образцами, взятыми у того же пациента в заданные заранее интервалы времени, так чтобы тенденция количества антител, которые связаны с антигенами, представляющими капсидные или капсомерные структуры L1 ВПЧ16, у пациента прослеживалась на основе образцов за заданный заранее период времени, и
v) определение количества антител, которые связаны с антигенами, представляющими капсидные или капсомерные структуры L1 ВПЧ16, в образцах, с наблюдением уменьшения количества после успешной терапии, и/или
vi) определение количества антител, которые связаны с антигенами, представляющими капсидные или капсомерные структуры L1 ВПЧ16, в образцах, наблюдая рецидив ВПЧ16-положительной карциномы, если количество антител, которые связаны с антигенами, представляющими капсидные или капсомерные структуры L1 ВПЧ16, снова увеличивается в образце за заданный заранее период времени.
Способ согласно настоящему изобретению позволяет количественно определять количество антител в образце, взятом у пациента, за период времени и, таким образом, отслеживать развитие состояния после терапии. Например, стадии i) - iii) могут повторяться каждые 1-4 недели в течение периода времени от одного до десяти лет.
В случае успешной терапии количество антител, обнаруженных в образце, взятом у пациента, может уменьшиться более чем на 50% в течение пары недель, по сравнению с количеством антител, обнаруженных до или в начале лечения.
В способе согласно настоящему изобретению могут применяться антигены или вирусоподобные частицы, которые представляют капсидные или капсомерные структуры L1 ВПЧ16, имеющие конформационные эпитопы. Предпочтительно, конформационные эпитопы специфически связываются с антителами, которые получены из клеточной линии гибридомы с номером депонирования DSM ACC3306.
В качестве образца пригодна жидкость организма, например, цельная кровь или производные цельной крови, такие как, например, сыворотка или плазма, а также капиллярная кровь или цельная кровь из подушечки пальца пациента. Для выполнения способа достаточно одной капли (около 25 мкл).
На стадии i), образец, взятый у пациента, может быть инкубирован в течение времени от 1 до 15 минут, предпочтительно, от 3 до 10 минут. Таким образом, обеспечивают специфические взаимодействия.
Терапия, в частности, является первичной терапией с помощью хирургии, лучевой терапии, химиотерапии или иммунотерапии или комбинации этих методов.
Как правило, у пациентов женского пола 93% ВПЧ16-положительной карциномы обнаруживаются в аногенитальной области и только 7% во рту или глотке, в то время как у мужчин около 80% локализуются во рту или горле и только 20% в аногенитальной области.
В контексте настоящего изобретения структура капсидная или капсомерная структура белка L1 ВПЧ16 представляет собой агрегат или мультимер белка L1ВПЧ16, который посредством взаимодействия нескольких белков L1 образует на своей поверхности конформационные эпитопы, которые не присутствуют в мономерах или денатурированных белках L1. В частности, вирусоподобные частицы (VLP) используются в соответствии с настоящим изобретением, которые представляют капсидные или капсомерные структуры L1 ВПЧ16. Некоторые VLP могут нести несколько конформационных эпитопов, то есть конкретные сайты связывания.
Вирусоподобная частица (VLP) в контексте настоящего изобретения представляет собой вирусную частицу, которая состоит из вирусных капсид, но не содержит нуклеиновых кислот. Поэтому VLP пригодны для представления вышеупомянутых конформационных эпитопов без возможности репликации.
Меченные антитела представляют собой антитела, направленные против L1 ВПЧ16, которые специфически связываются с конформационными эпитопами капсидных или капсомерных структур L1 белка HPV, и таким образом, не связываются с мономерными и/или денатурированными белками L1 ВПЧ16. Предпочтительное антитело согласно настоящему изобретению может быть получено из клеточной линии гибридомы, которая была задепонирована согласно Budapest Treaty at the Deutsche Sammlung für Mikroorganismen und Zellkulturen (DSMZ), Inhoffenstraße 7B, 38124 Braunschweig, Germany, 14 сентября 2016 компанией Abviris Deutschland GmbH, Ammersbeck, под номером депонирования DSM ACC3306. Для внесения метки в антитело специалисту в данной области известны подходящие способы из уровня техники, которые позволяют количественно определить количество связанных и несвязанных антител. В частности, предпочтительно антитело помечено частицами золота.
Для обнаружения коммерчески доступны ридеры для тест-полосок, например можно использовать EseQuant от QIAGEN. Измерение может быть выполнено фотооптически или путем определения проводимости. Альтернативно, можно использовать окрашенные или радиоактивно меченые частицы (везикулы).
Способ абсолютно специфичен для ВПЧ типа 16, и перекрестная реакция с другими антителами отсутствует. Причина этого заключается, в частности, в том, что капсомерные структуры присутствуют в виде агрегатов L1, благодаря чему конформационные эпитопы представлены на поверхности.
Когда белок L1 образует агрегаты (синонимами являются мультимеры, пентамеры или также капсомеры), структуры (конформационные эпитопы - сайты связывания для антител) образуются на поверхности (области капсид, которые ориентированы наружу) этих агрегатов посредством взаимодействия нескольких белков L1, которые специфичны для определенных типов ВПЧ (т.е. специфичны для конкретного типа).
С другой стороны, высокогомологичные участки белка L1 ориентированы так, что они находятся не на поверхности, а внутри. Эти области необходимы для интеграции вирусного генетического материала. Это означает, что для вирусов или неинфекционных вирусоподобных частиц (VLP), используемых при тестировании, описанные выше области, которые полностью соответствуют семейству вирусов папилломы, скрыты внутри частиц. Таким образом, эти области больше не доступны в VLP для группоспецифичных антител в образцах человека, благодаря чему обеспечивается, что антитела, специфичные только для исключительного типа, могут быть обнаружены.
Однако мономерный белок не может быть удален на 100% в ходе очистки VLP. Следовательно, очищенные VLP всегда содержат также капсомеры. Это означает, что если эти очищенные белки L1 непосредственно иммобилизованы на среде-носителе (например, на классических планшетах для ELISA), то для тестирования будут доступны как типоспецифичные VLP, так и мономерный белок L1 и капсомеры с нетипоспецифичными областями.
Это загрязнение L1 типоспецифичных VLP мономерным или денатурированным белком приводит к тому, что типоспецифичные антитела в смеси антител, таких как образцы, взятые у человека, больше не могут (надежно) идентифицироваться, поскольку невозможно определить, можно ли приписать результат теста к специфическим сайтам связывания конкретного типа или группы.
То же самое справедливо для VLP, которые состоят из L1 и L2 белка.
При использовании подхода конкуренции между антителами пациента и L1 специфическими антителами против ВПЧ16 согласно настоящему изобретению, эту проблему загрязнения можно решить, поскольку тест-система может измерять исключительно L1специфические антитела против ВПЧ16, которые конкурируют с антителом согласно настоящему изобретению.
Поэтому предпочтительно антигены не иммобилизованы, но обеспечены в жидкой фазе, в которую добавляют образец, взятый у пациента.
Это имеет основные преимущества или, соответственно, следующие предпосылки: при иммобилизации и последующей консервации (при сушке - потеря гидратной оболочки вызывает конформационные изменения белка), необходимой для продажи планшетов для ELISA, антигены (VLP) изменяются, т.е. они теряют свои типоспецифичные эпитопы и, таким образом, становятся бесполезными для тестирования. При добавлении образца, взятого у пациента, в раствор VLP антитела образца, взятого у пациента, и антиген оказываются в непосредственной близости. Таким образом, кинетика реакции связывания становится значительно быстрее, что чрезвычайно полезно для быстрого теста. Кроме того, аналитическая чувствительность повышается, потому что все антитела в образце, взятом у пациента, «быстро» доступны для тестирования.
При иммобилизации на материале-носителе, например микротитровальном планшете, с другой стороны, в качестве реагирующих веществ доступны только антитела, находящиеся в непосредственной близости к поверхности. Антитела в просвете реакционного сосуда практически «никогда» не достигнут поверхности реакционного сосуда, потому что они должны пересекать расстояние 1-2 мм до поверхности исключительно броуновским движением, что занимает «много» времени.
Предпочтительным также является способ, как описано выше, где образец, взятый у пациента, одновременно смешивают с антигенами и вводят в контакт с меченными антигенами.
Предпочтительно также можно одновременно смешивать образец, взятый у пациента, с антигенами и вводить его в контакт с антителами. Таким образом, достигается прямая конкуренция между антителами из образца, взятого у пациента, и мечеными антителами за сайты связывания, что - благодаря быстрой кинетике связывания, как описано выше - приводит к более точным результатам испытаний в способе в соответствии с настоящим изобретение. Соответственно, метод испытания может быть выполнен за один шаг.
Кроме того, настоящее изобретение относится к способу, как описано выше,, где на стадии ii) смесь проходит через тест-полоску, на которой присутствуют меченные антитела в мобильной форме, и где на стадии iii) комплексы антигена и меченного антитела обнаруживают посредством связывания с другим антителом, где предпочтительно другие антитела также представляют собой антитела, которые получены из клеточной линии гибридомы с номером депонирования DSM ACC3306.
Этот вариант выполнения настоящего изобретения позволяет обеспечить быстрый тест, в котором в зоне реакции быстро читаемая тест-линия результата становится видимой.
Смесь со стадии i) наносится на область нанесения на тест-полоску, а затем, например с помощью капиллярных сил, проходит через мембрану, во время чего она вступает в контакт с мечеными антителами на протяжении всей зоны реакции. Меченые антитела концентрируются так, что не все антигены или сайты связыва ния заполнены. В зоне реакции иммобилизуются другие антитела, которые также специфичны для антигенов или сайтов связывания согласно настоящему изобретению и связывают меченые комплексы антитело-антиген, поскольку свободные сайты связывания все еще доступны. Таким образом, меченые комплексы антитело-антиген сохраняются в зоне реакции, благодаря чему тест-линия становится видимой. В случае, если антигены или сайты связывания, соответственно, уже заняты антителами из образца, взятого у пациента, благодаря конкурентному подходу, образуется меньше комплексов антитело-антиген с мечеными антителами, и тест-линия менее интенсивна или не видна, то есть, если все сайты связывания уже были заняты антителами из образца, взятого у пациента, на момент нанесения. В этом контексте важна правильная регулировка количества антигенов или сайтов связывания, соответственно, на стадии i) и меченых антител на стадии ii), так что изменение количества антител в образце, взятом у пациента, по отношению к предыдущему измерению может быть обнаружено.
Настоящее изобретение также относится к способу лечения пациента, в отношении которого ранее проводилась по меньшей мере одна противораковая терапия, нацеленная на ВПЧ16-положительную карциному, включающему (A) запрос теста, обеспечивающего результаты анализа, чтобы определить увеличиваются ли у пациента антитела, которые связываются с конформационным эпитопом капсиды или капсомера L1 ВПЧ16 за заданный заранее период времени, и (B) применение дополнительной противораковой терапии, нацеленной на ВПЧ16-положительную карциному, если у пациента обнаружено увеличения антител.
Другим объектом настоящего изобретения являются антитела, которые специфически связываются с конформационными эпитопами антигенов, представляющих капсидные или капсомерные структуры L1 ВПЧ16, предпочтительно антитело, которое получено из клеточной линии гибридомы с номером депонирования DSM ACC3306.
Настоящее изобретение также относится к антителу, как описано выше, для применения в диагностическом способе, в частности в способе определения рецидива ВПЧ16-положительной карциномы после лечения.
Более того, настоящее изобретение также относится к антигену, который представляет капсидные или капсомерные структуры L1 ВПЧ16, или вирусоподобной частице, которая представляет капсидные или капсомерные структуры L1 ВПЧ16.
Предпочтительным является антиген или вирусоподобные частицы, которые представляют капсидные или капсомерные структуры L1 ВПЧ16, имеющие конформационные эпитопы которые специфически связываются с антителом, полученным из клеточной линии гибридомы с номером депонирования DSM ACC3306.
Настоящее изобретение также относится к антигену или вирусоподобной частице, как описано выше, для применения в диагностическом способе, в частности в способе определения рецидива ВПЧ16-положительной карциномы после лечения. Настоящее изобретение также относится к набору для определения количества антител в образце, который взят у пациента, содержащему или состоящему из:
I) композиции, содержащей антигены, представляющие конформационные эпитопы капсидных или капсомерных структур белка L1 ВПЧ16, и
II) композиции, содержащей меченные антитела, которые специфически связываются с конформационными эпитопами антигенов, представляющих капсидные или капсомерные структуры L1 ВПЧ16, где предпочтительно меченные антитела получают из клеточной линии гибридомы с номером депонирования DSM ACC3306.
Композиция i) предпочтительно представляет собой композицию, которая содержит вирусоподобные частицы, которые представляют конформационные эпитопы капсидных или капсомерных структур белка L1 ВПЧ16.
Набор в соответствии с настоящим изобретением также может содержать тест-полоску, которая необязательно обеспечена в тест-кассете, которая имеет отверстия для нанесения смеси согласно стадии i), а также для наблюдения за тест-линией и предпочтительно контрольной линией. Тест-полоска содержит на одном конце зону нанесения смеси согласно стадии i), прокладку, на которой обеспечены меченые антитела и которая соединяется с зоной нанесения, а также зону реакции, которая соединяется на другой стороне прокладки, если смотреть со стороны зоны нанесения, и предпочтительно зону контроля, далее за пределами зоны реакции. В зоне реакции обеспечивается дополнительное антитело, которое специфически связывается с эпитопом в соответствии с настоящим изобретением, и благодаря связыванию меченых комплексов антитело-антиген делает тест-линию видимой. Другая независимая реакция антитела в зоне контроля показывает, что испытание прошло корректно. Появление линии в зоне контроля подтверждает, что объем образца был достаточным, и испытание прошло должным образом.
Краткое описание чертежей:
Фиг. 1 показывает развитие количества антител в сыворотке крови пациента с положительным ходом терапии через 27 недель после первичной терапии ВПЧ16-положительной карциномы. На оси X показаны недели, начиная с 0 в момент времени первичной терапии, на оси Y показана концентрация антитела согласно настоящему изобретению показана в нг/мл.
Фиг. 2 показывает развитие количества антител в сыворотке крови пациента, у которого через около 35 недель после первичной терапии ВПЧ16-положительной карциномы произошел рецидив. До 27 недели наблюдалось постоянное снижение количества антител. Начиная с 31 недели количество антител снова увеличилось. Увеличение продолжалось до 35 недели, когда была обнаружена клиническая корреляция. На оси X показаны недели, начиная с 0 в момент времени первичной терапии, на оси Y показана концентрация антитела согласно настоящему изобретению показана в нг/мл.
Пример 1: Скрининг антител и антигенов согласно настоящему изобретению
Получение вирусоподобных частиц вируса папилломы (VLP): Ген L1 ВПЧ16 (GenBank: K02718.1) был амплифицирован с помощью ПЦР и клонирован в вектор переноса pVL1392. Рекомбинантные векторы вводили в клетки Sf9 вместе с ДНК BaculoGold (Pharmingen) с использованием осаждения фосфатом кальция. Рекомбинантные вирусы были амплифицированы и очищены с помощью анализа бляшкообразования в соответствии с инструкциями производителя.
Вирусоподобные частицы (VLP) были очищены согласно Volpers et al.. (Volpers, C., P. Schirmacher, R. E. Streeck, and M. Sapp. 1994. Assembly of the major and the minor Kapsid protein of human papilloma virus type 33 into virus-like particles and tubular structures in insect cells. Virology 200:504-512).
Получение, скрининг и клонирование моноклональных антител. Мышей BALB/c подкожно иммунизировали 20 мкг интактных VLP ВПЧ16, растворенных в фосфатно-буферизированном солевом растворе (PBS), после того как они были смешаны с полным адъювантом Фрейнда. Иммунизацию повторяли через один месяц и через три месяца.
Через три дня после третьей иммунизации селезенку вынимали и получали суспензию отдельных клеток. Клетки селезенки сливали с мышиной клеточной линией миеломы X63Ag8.653 с использованием полиэтиленгликоля 2500 (Boehringer Mannheim) и культивировали в Iscoves, модифицированной среде Eagle (IMDM), в присутствии 10% эмбриональной телячьей сыворотки в 96-ти луночных планшетах. Слитые клетки отбирали азазерином и гипоксантином. Через 6-8 дней супернатант клеток тестировали на секрецию специфичных к L1 антител против ВПЧ16 с применением ELISA. Денатурированный белок L1, а также VLP ВПЧ -6, ВПЧ -11, ВПЧ -18, ВПЧ -31, ВПЧ -33 и ВПЧ -39 служили в качестве контролей для исключения неспецифической реактивностей.
Пример 2: Наблюдение уменьшения количества антител у пациента после успешного лечения
Пациент мужского пола, 53 года, с комбинированной онкологической терапией (хирургия/радиохимиотерапия) в отношении ВПЧ16- положительной тонзиллярной карциномы. За день до начала терапии у пациента было взято 5 мл крови для получения сыворотки пациента. Тестирование сыворотки в начале лечения дало концентрацию антител 13200 нг/мл.
Через шесть недель после первичной терапии у пациента снова отбирали 5 мл крови для получения сыворотки. Была измерена концентрация антител 5600 нг/мл. Это соответствует уменьшению концентрации антител на более 50% в течение 6 недель.
При уменьшении количества антител можно контролировать успешное лечение, поскольку опухолевые клетки, образующие опухолевый антиген ВПЧ16 L1, были успешно удален, и опухолевый антиген (белок L1ВПЧ16) больше не побуждает иммунную систему образовывать L1 специфические антитела против ВПЧ16.
Реферат
Группа изобретений относится к области медицины, а именно к способам терапевтического контроля ВПЧ16-положительной карциномы, антителу и его применению в способе определения рецидива ВПЧ16-положительной карциномы после лечения, а также набору, содержащему данное антитело. In vitro способ терапевтического контроля после лечения ВПЧ16-положительной карциномы включает стадии: (a) приведение в контакт образца, взятого у пациента, с ВПЧ16-положительной карциномой, причем в отношении указанного пациента проводилась противораковая терапия, с множеством антигенов, содержащих конформационный эпитоп капсиды или капсомера L1 ВПЧ16, где указанный эпитоп не присутствует в мономерном и/или денатурированном L1 ВПЧ16, в условиях, при которых антитела, присутствующие в образце, могут связываться с антигенами, и (b) обнаружение связывания антител в образце, связанном с антигеном, где связывание указанных антител имеет отрицательную корреляцию с успехом противораковой терапии у пациента. Для реализации способа используется антитело, которое специфически связывается с конформационными эпитопами антигенов, представляющих капсидные или капсомерные структуры L1 ВПЧ16, и которое получено из клеточной линии гибридомы с номером депонирования DSM АСС3306. Группа изобретений обеспечивает серологический тест, который позволяет проводить высокочувствительный и специфичный для конкретного типа терапевтический контроль ВПЧ16-положительной карциномы и облегчает обнаружение повторного возникновения заболевания, такого как рецидив или метастазирование, на ранней стадии. 7 н. и 7 з.п. ф-лы, 2 ил., 2 пр.

Комментарии