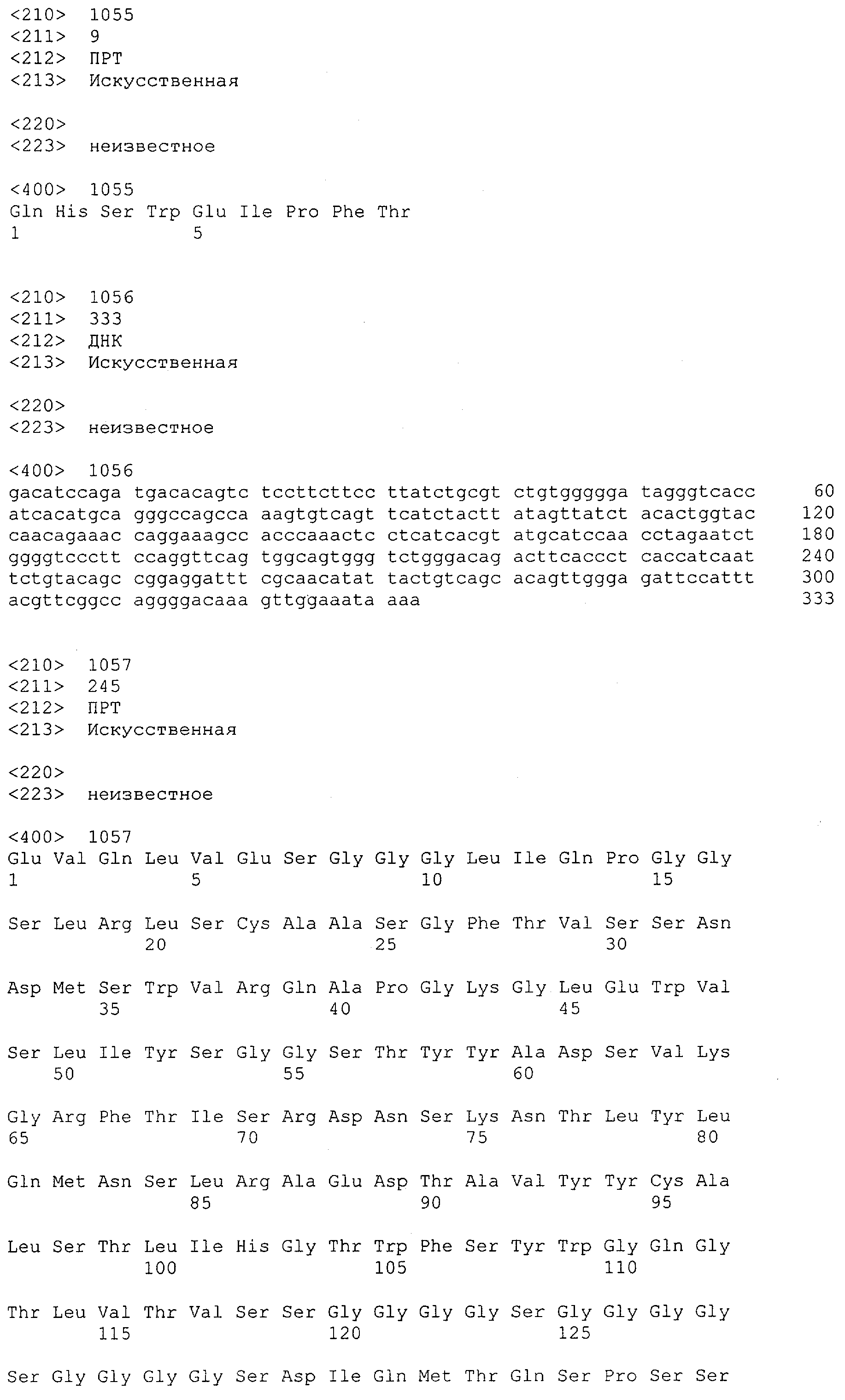
Cd3-эпсилон-связывающий домен с межвидовой специфичностью - RU2561457C2
Код документа: RU2561457C2
Чертежи
































































































































































































































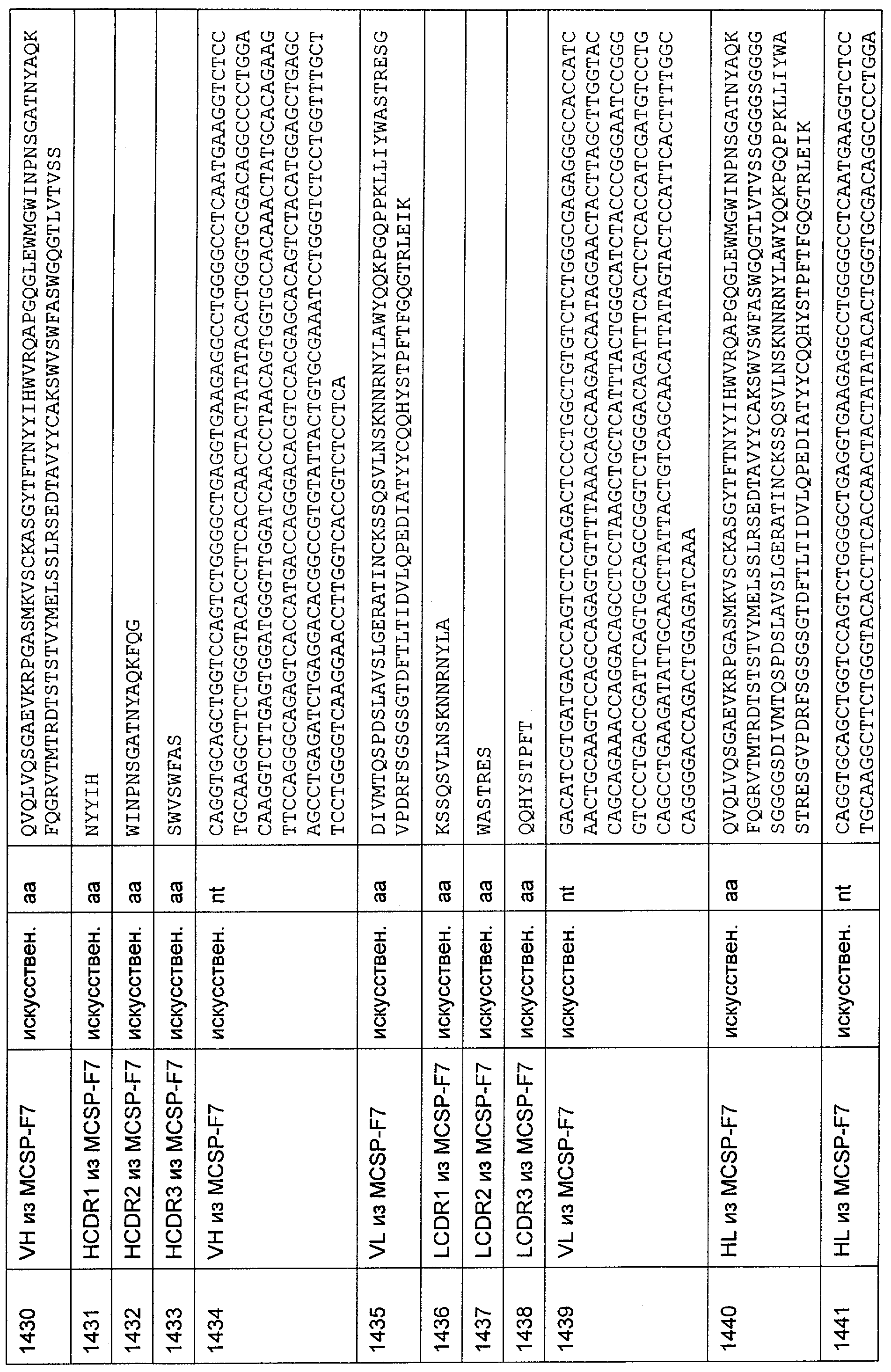

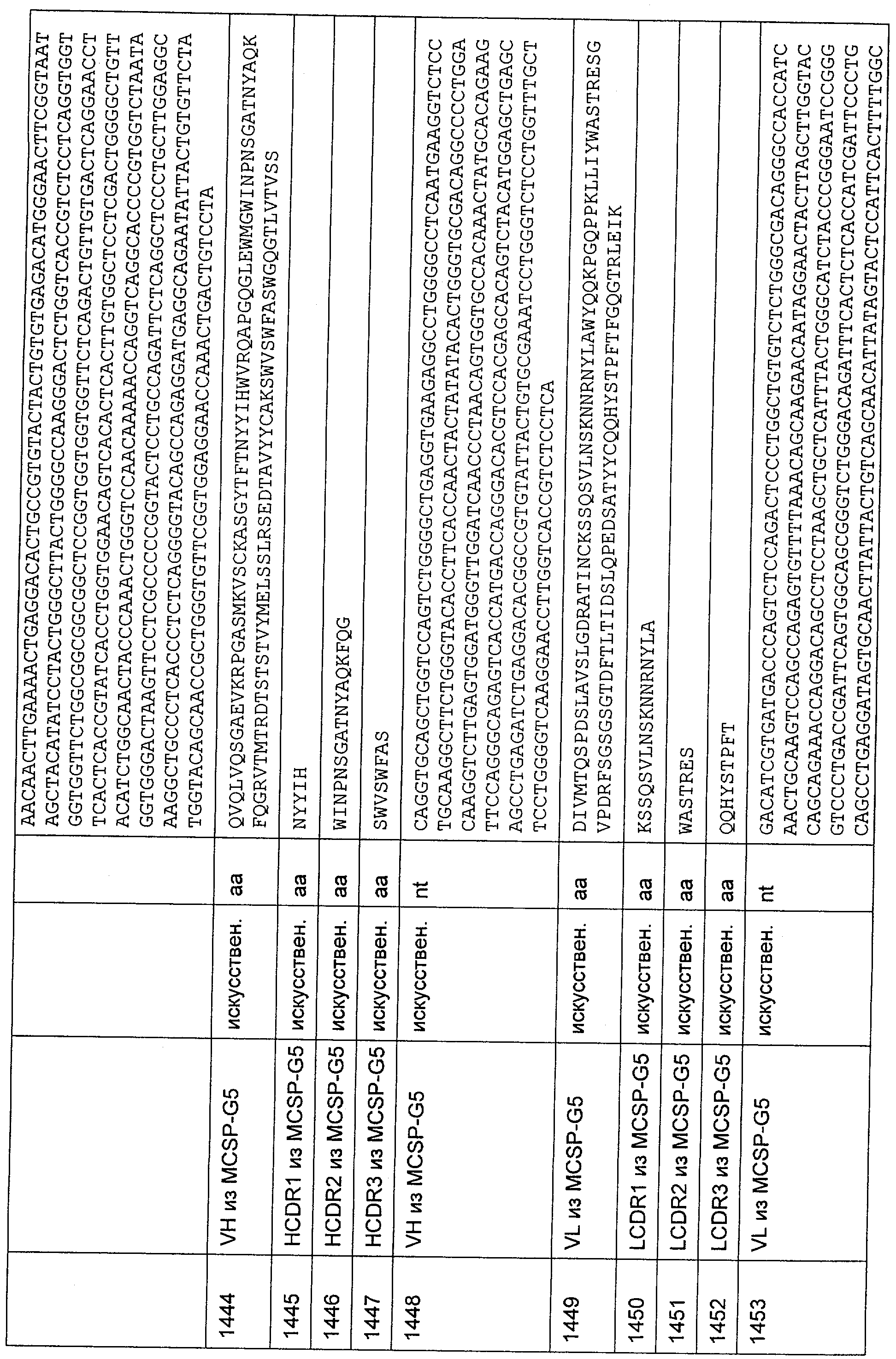




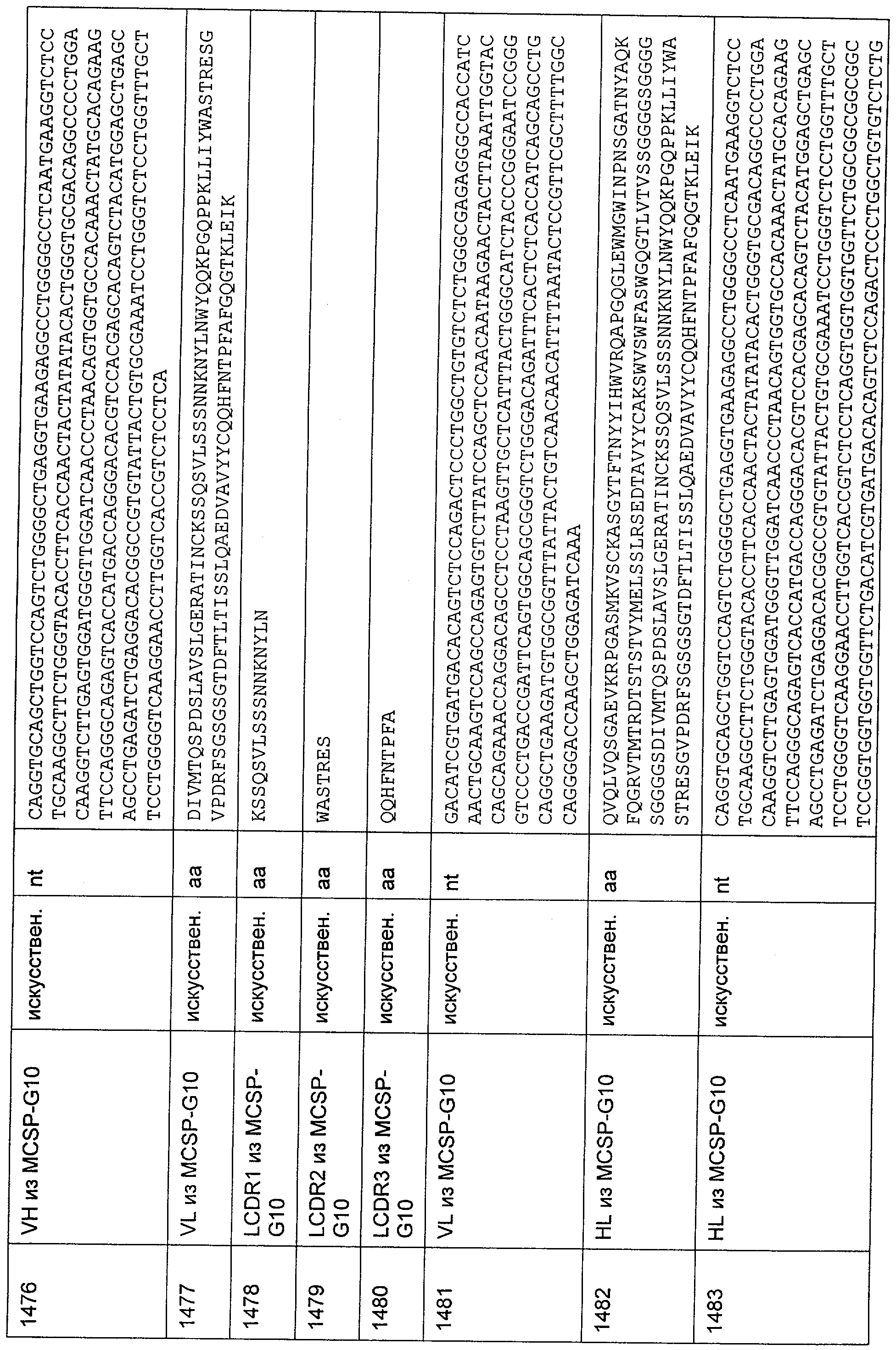

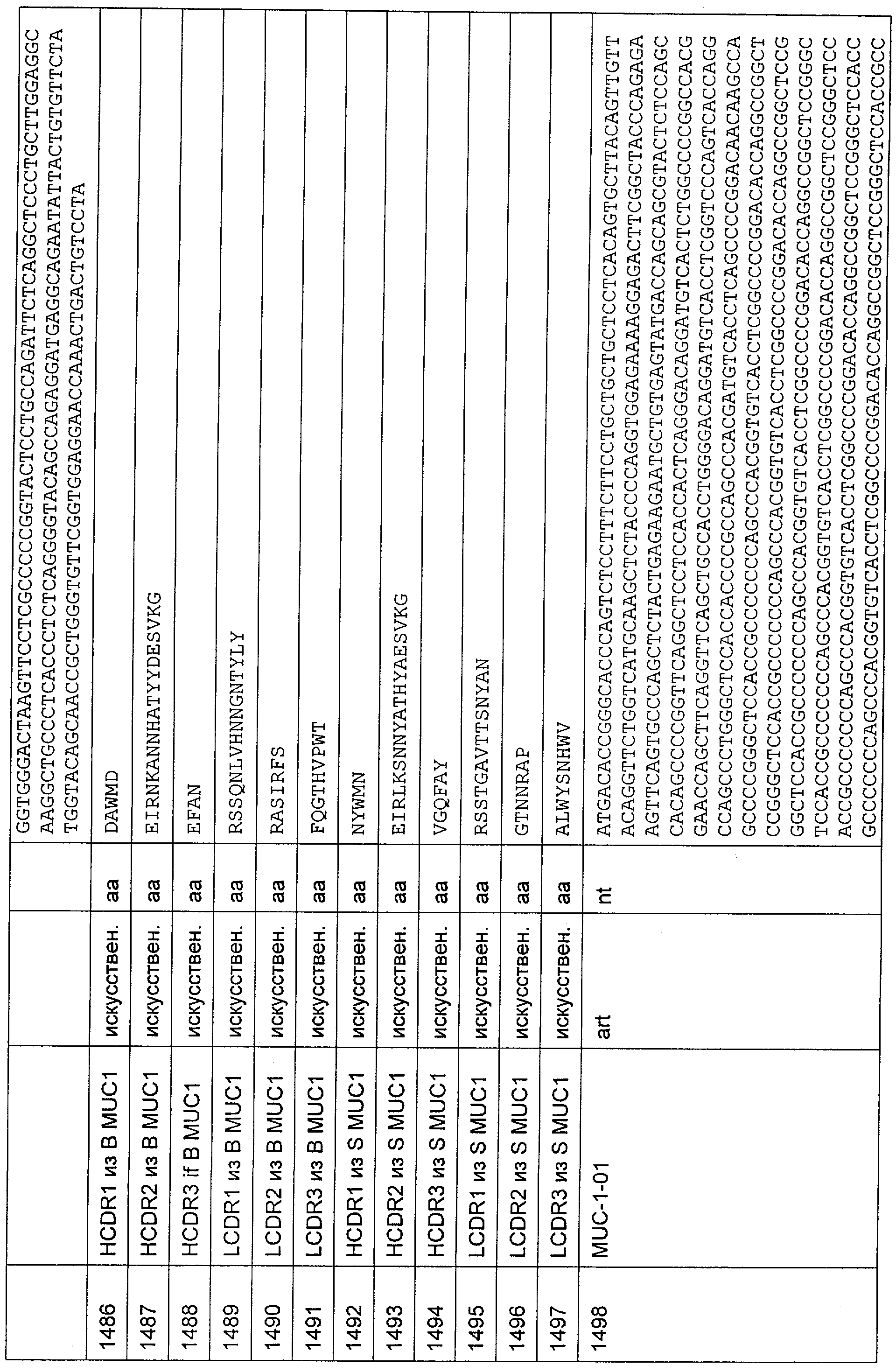




















































































































































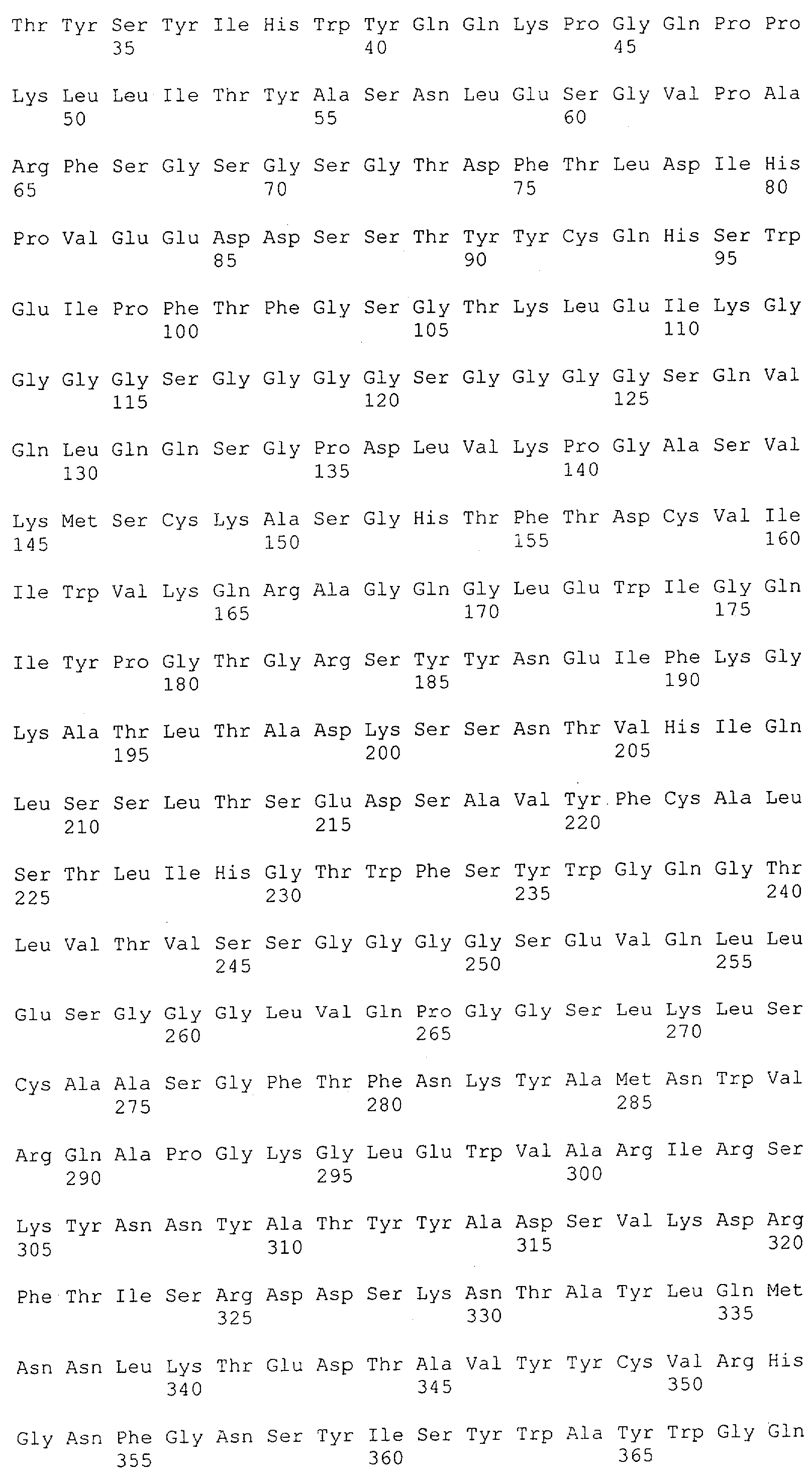

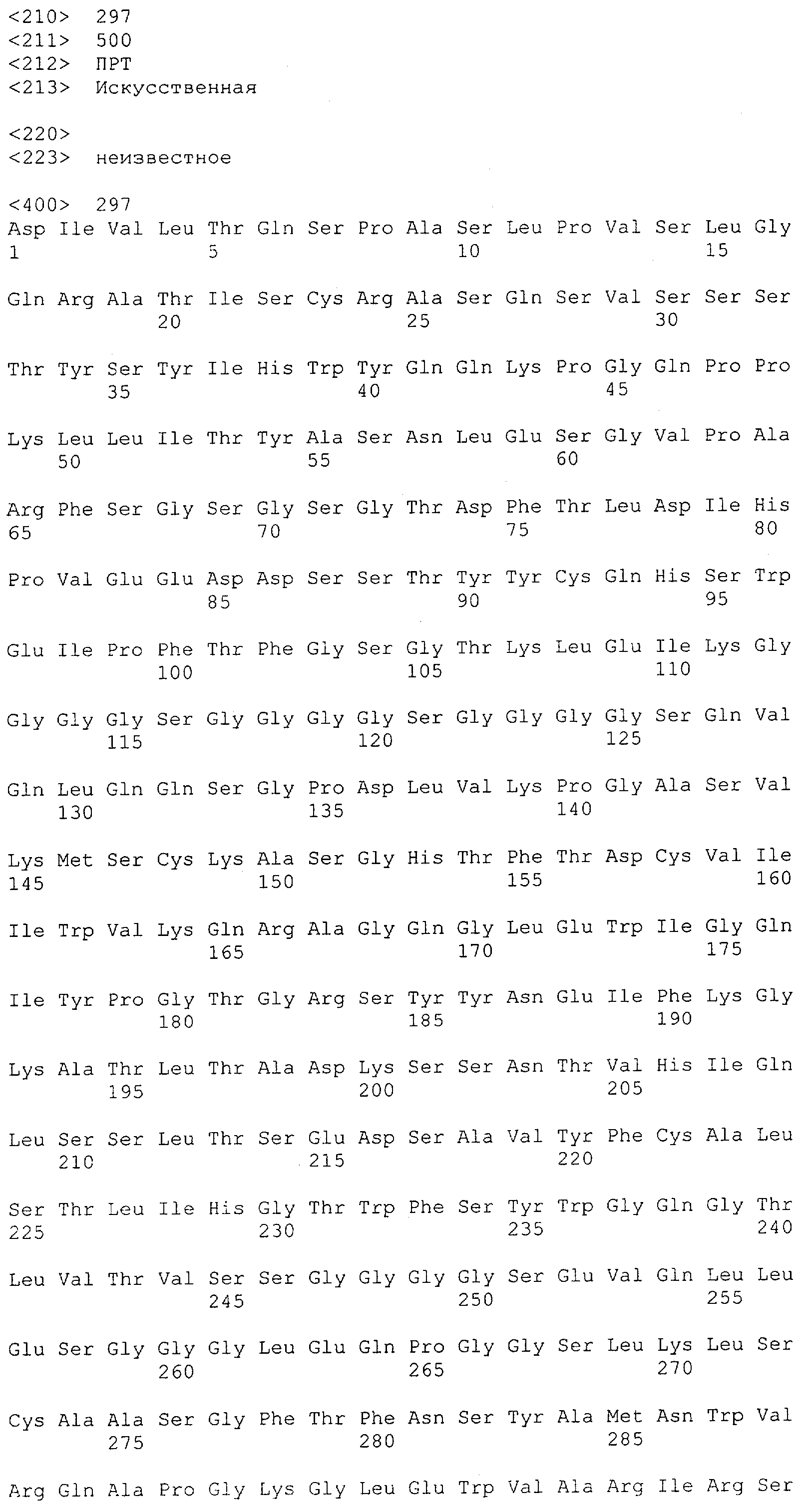
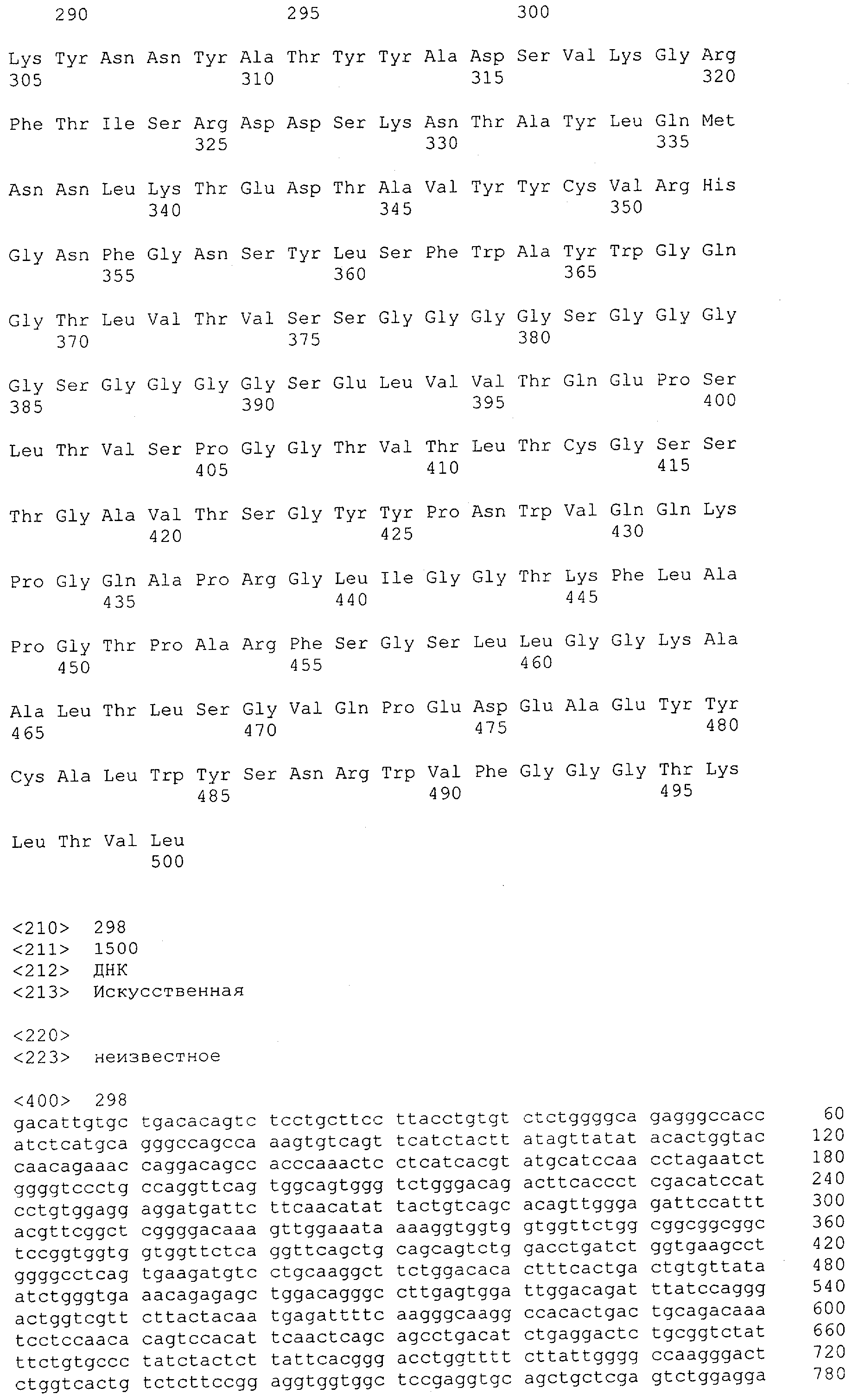


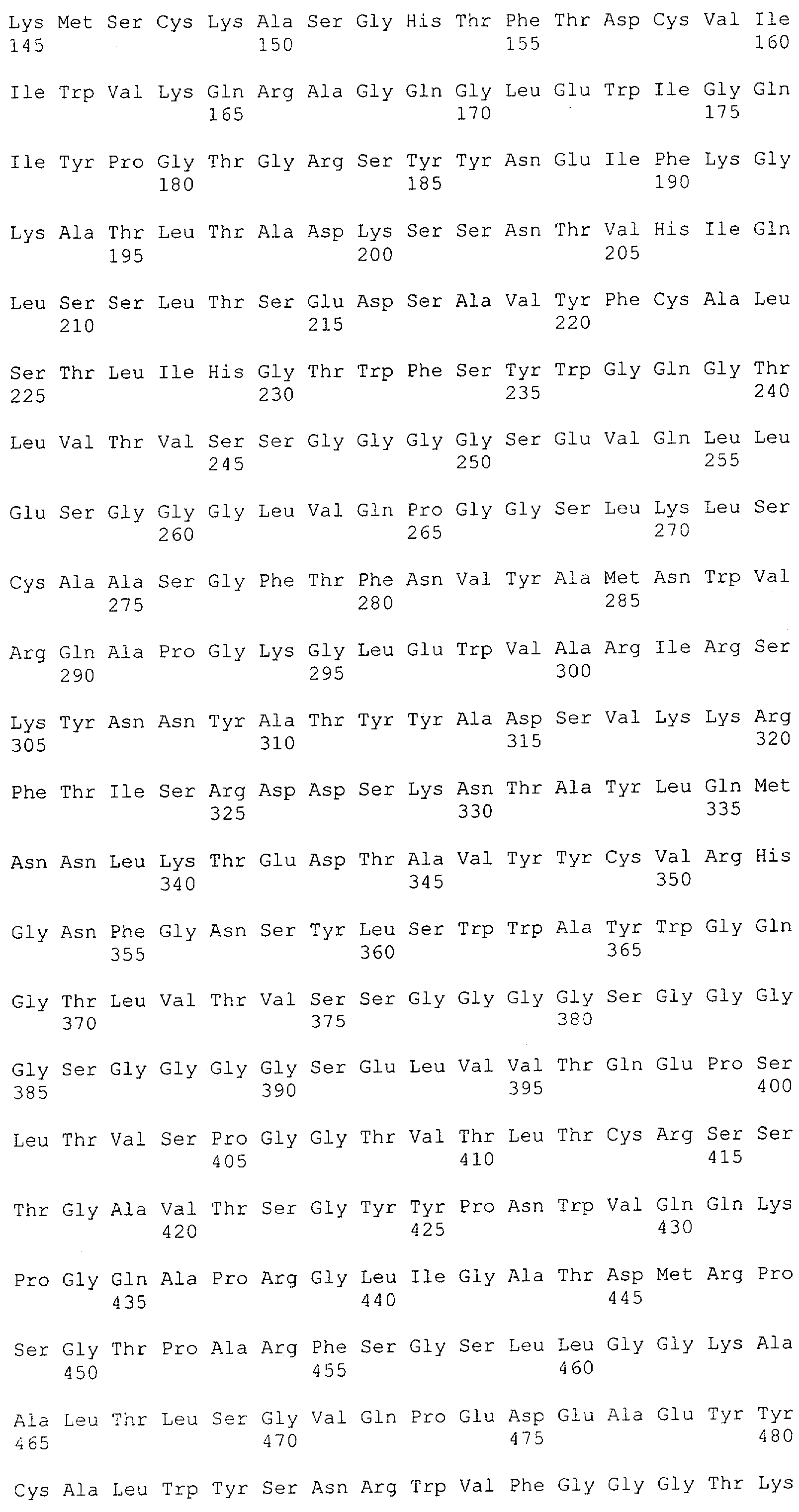



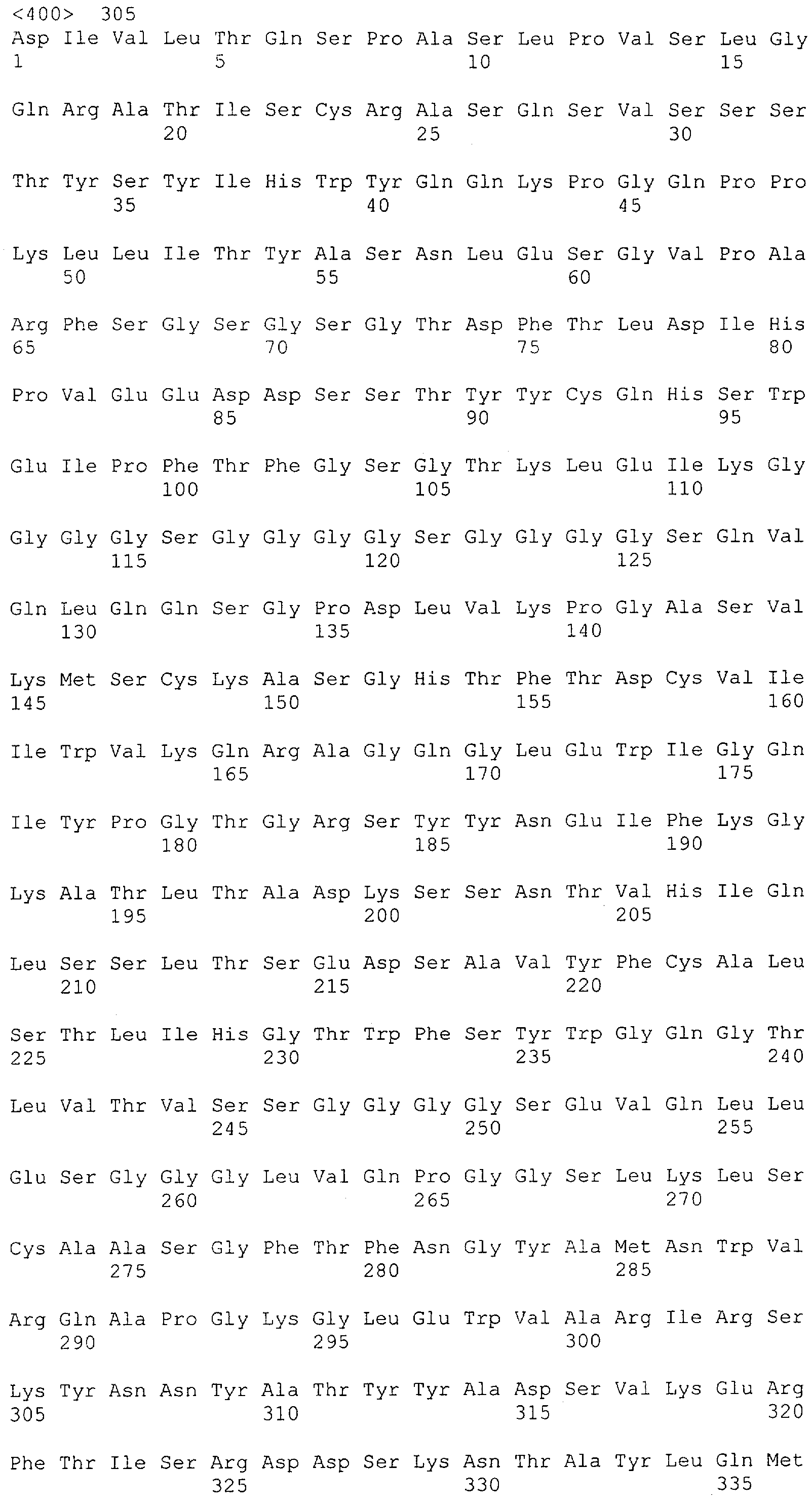



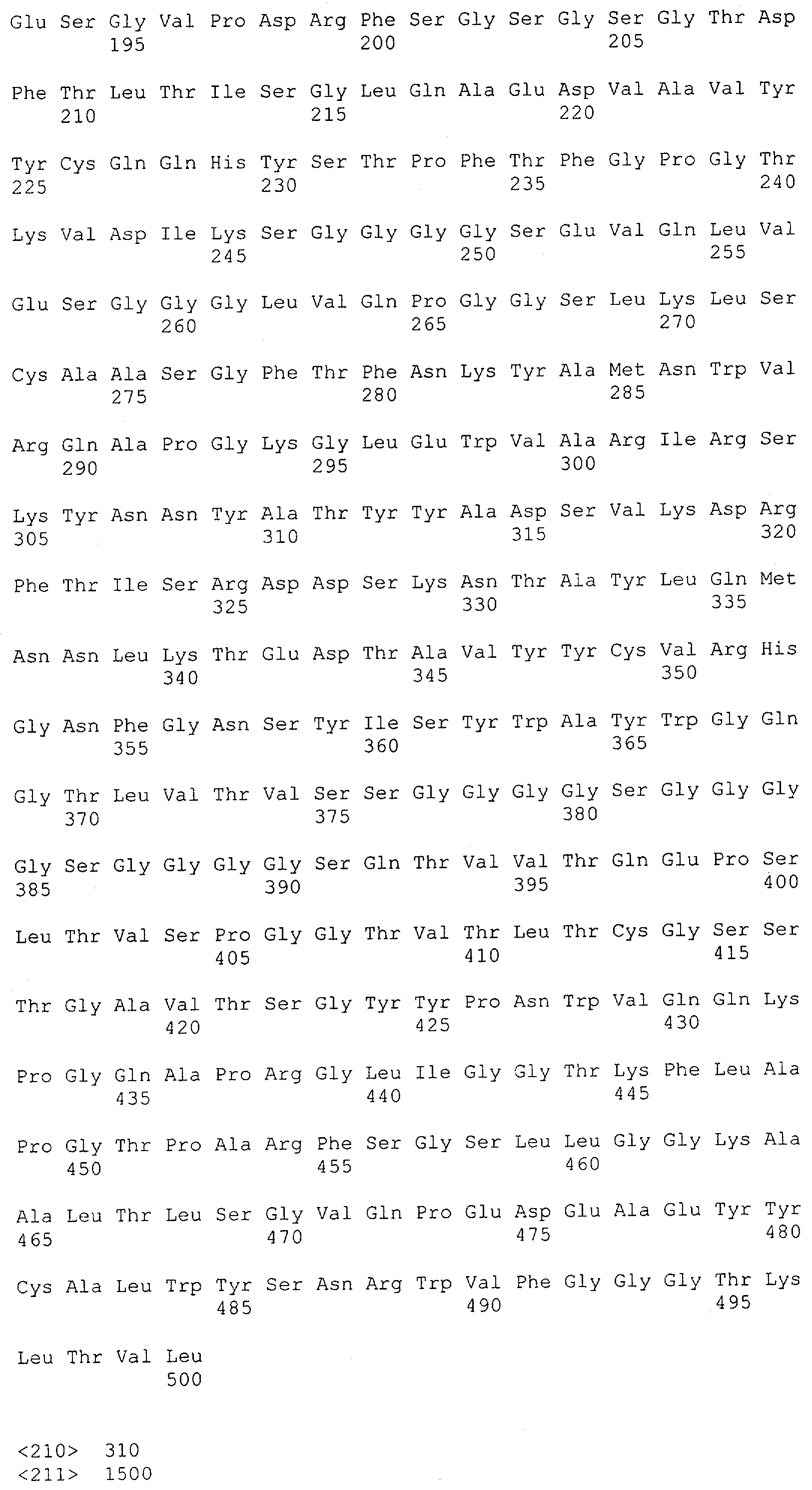



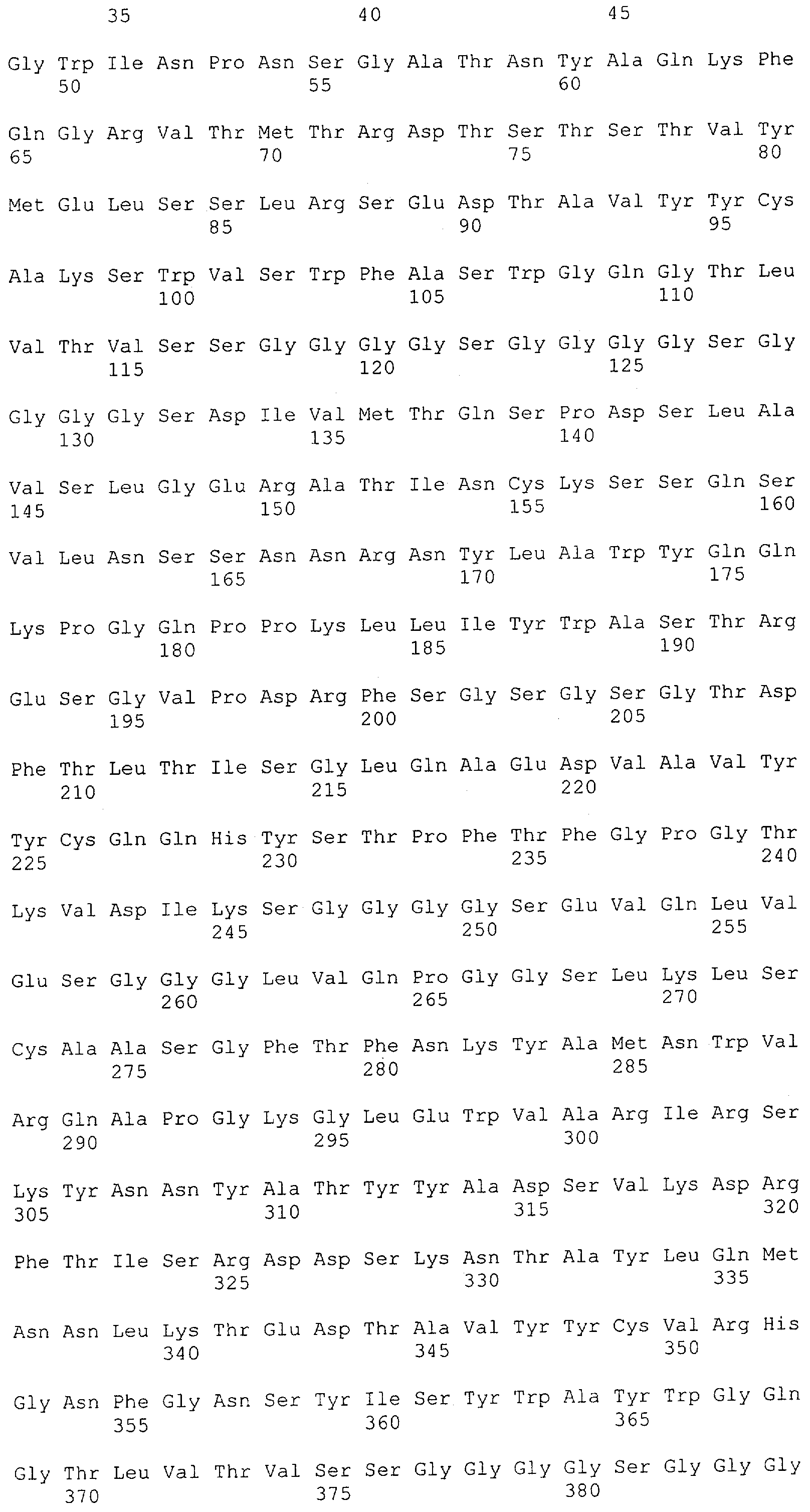

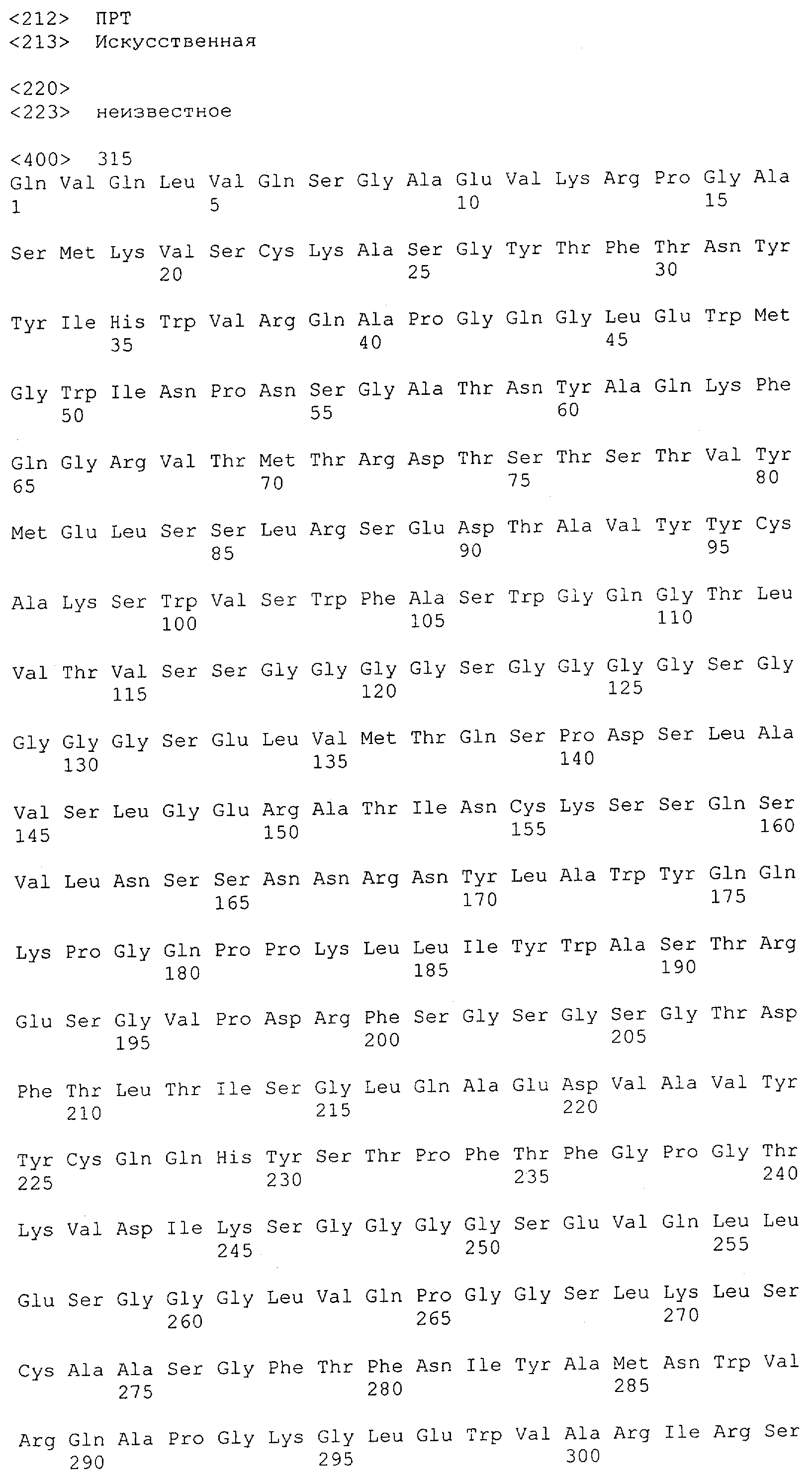






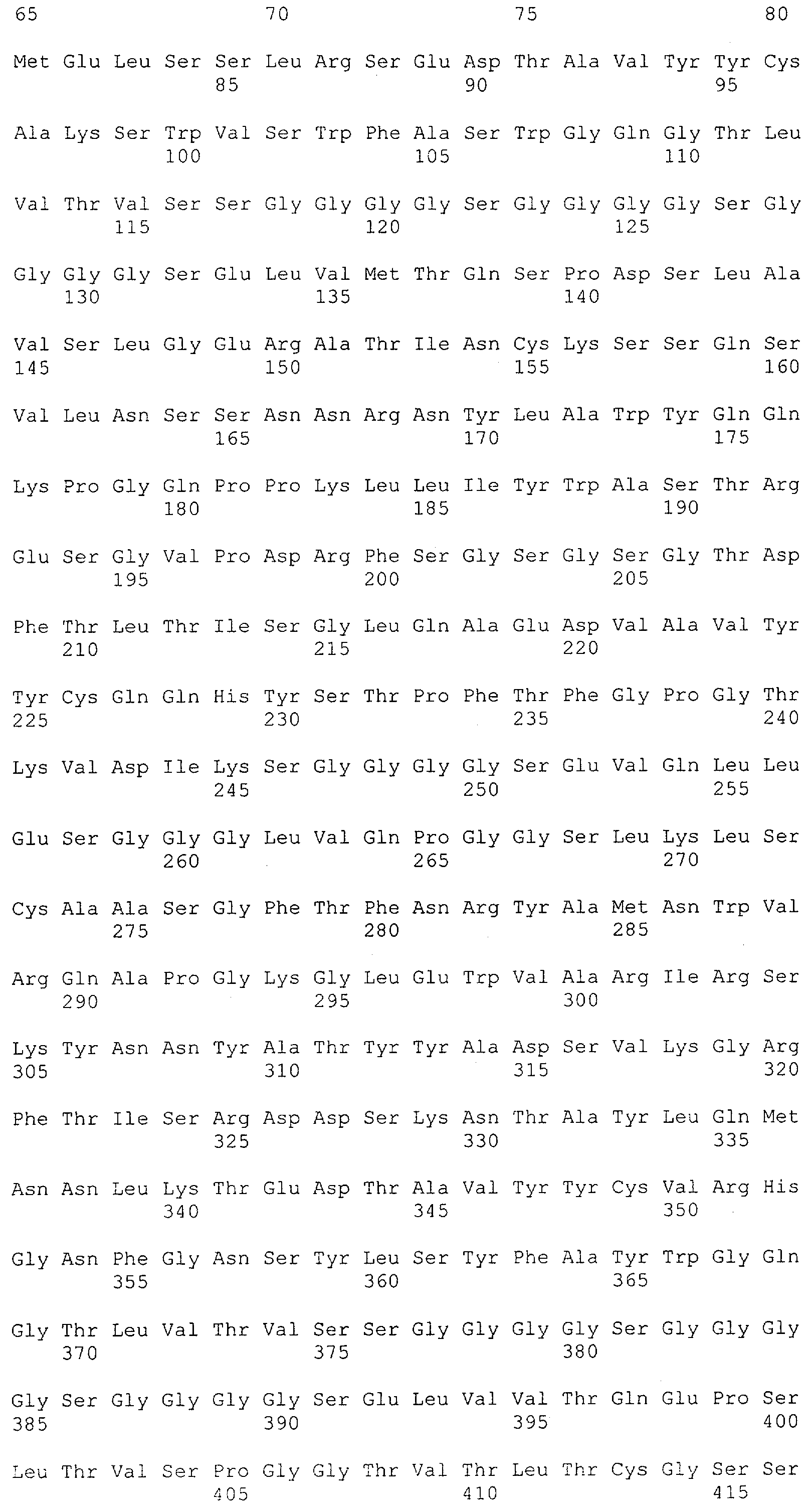

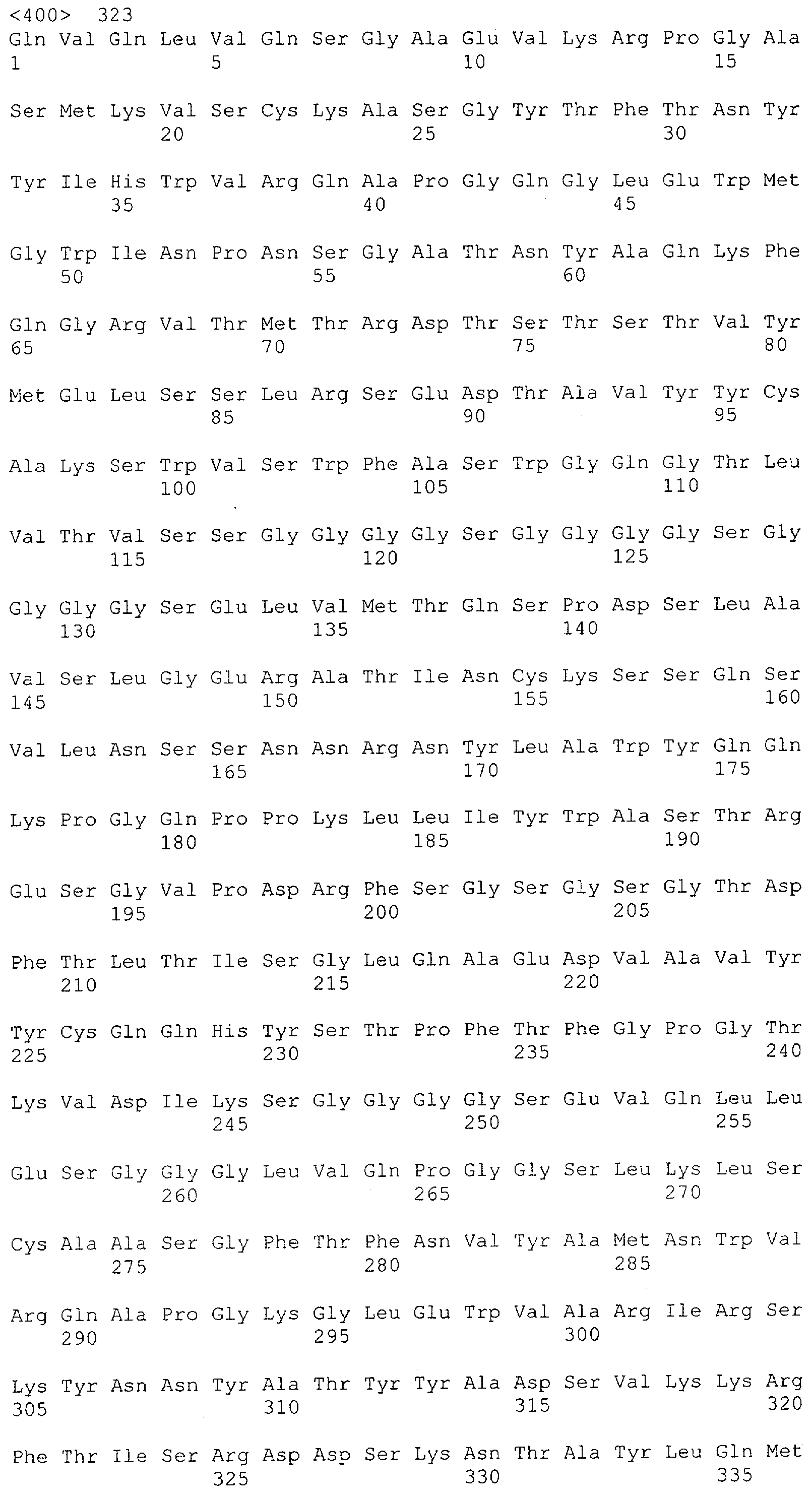
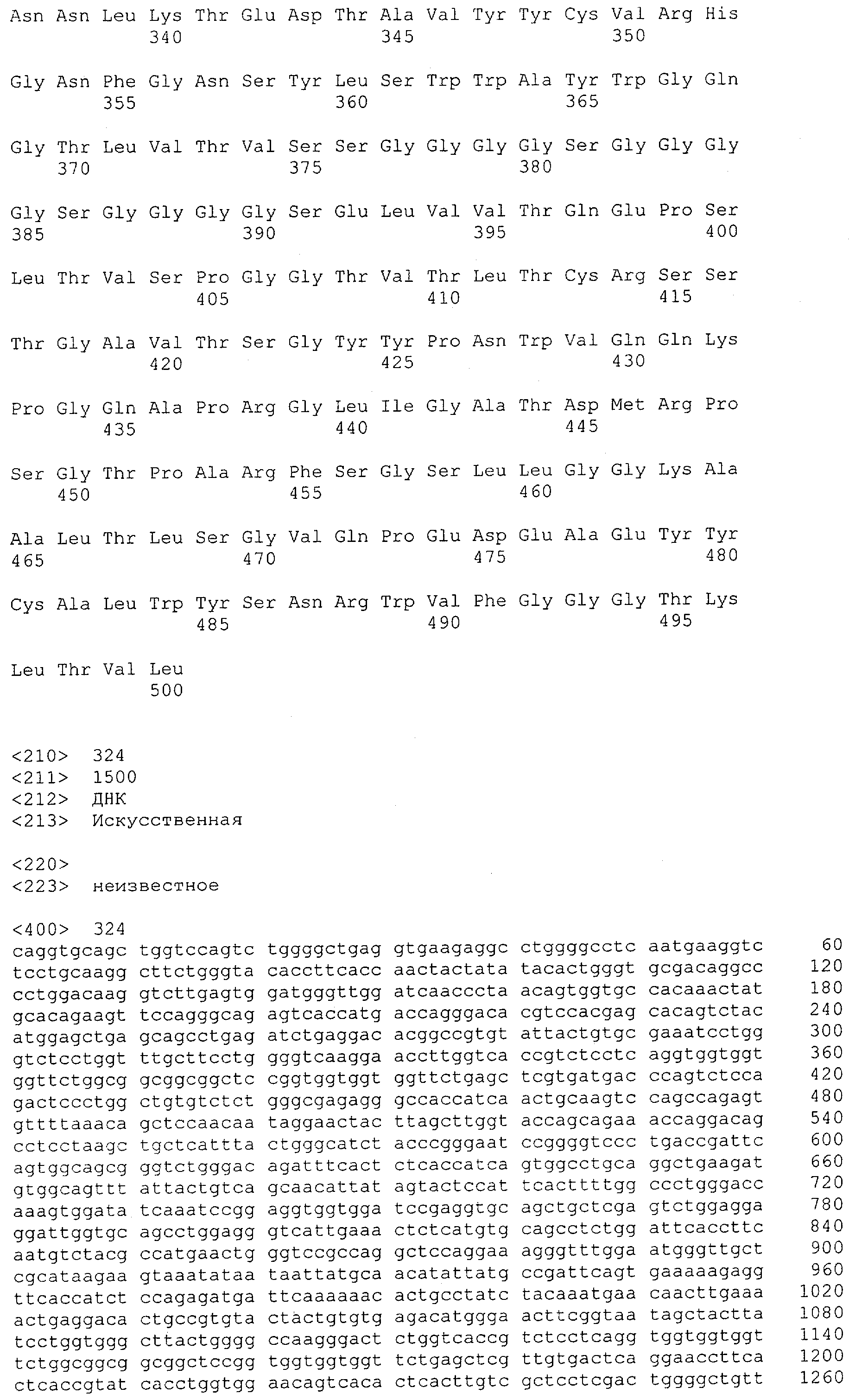



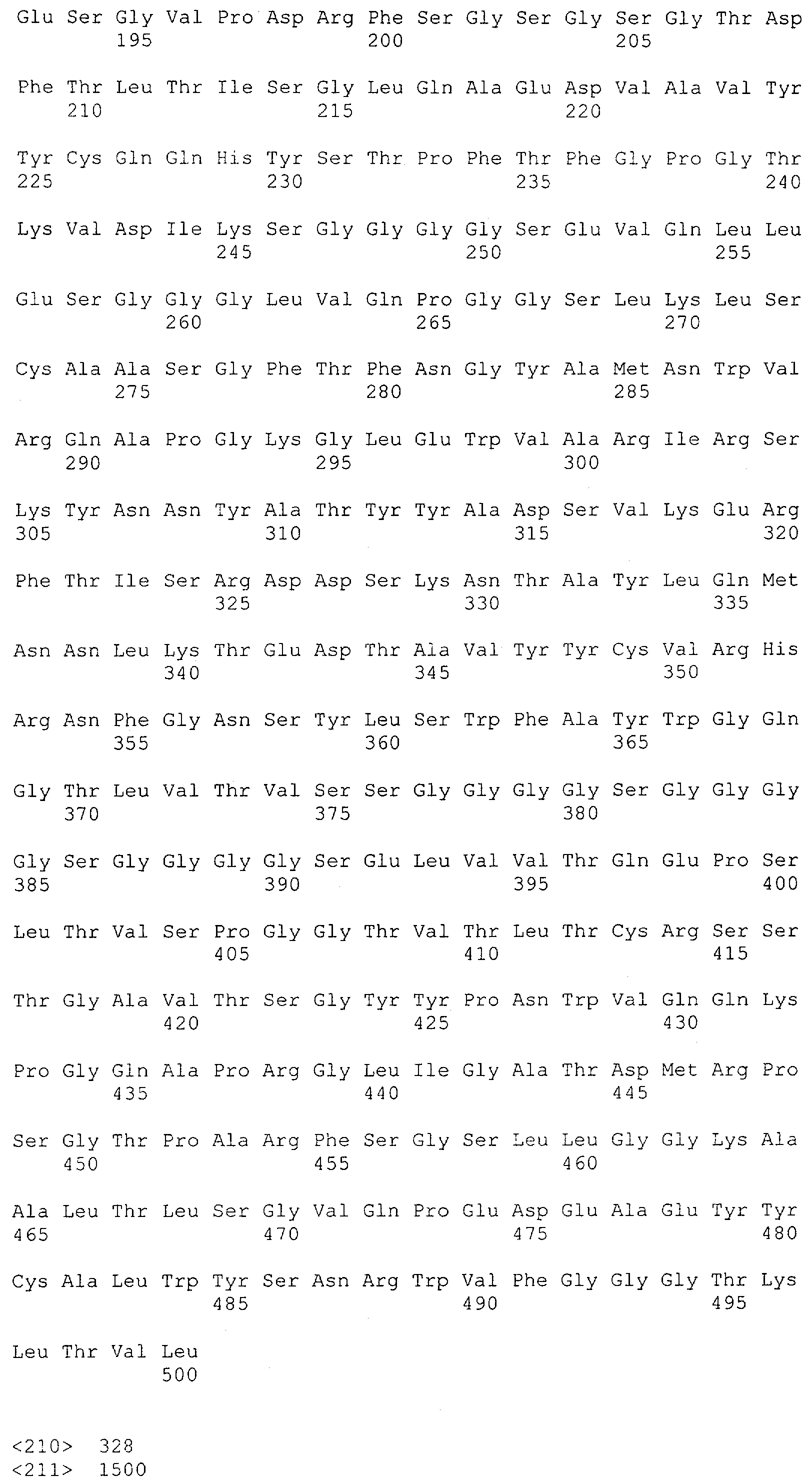

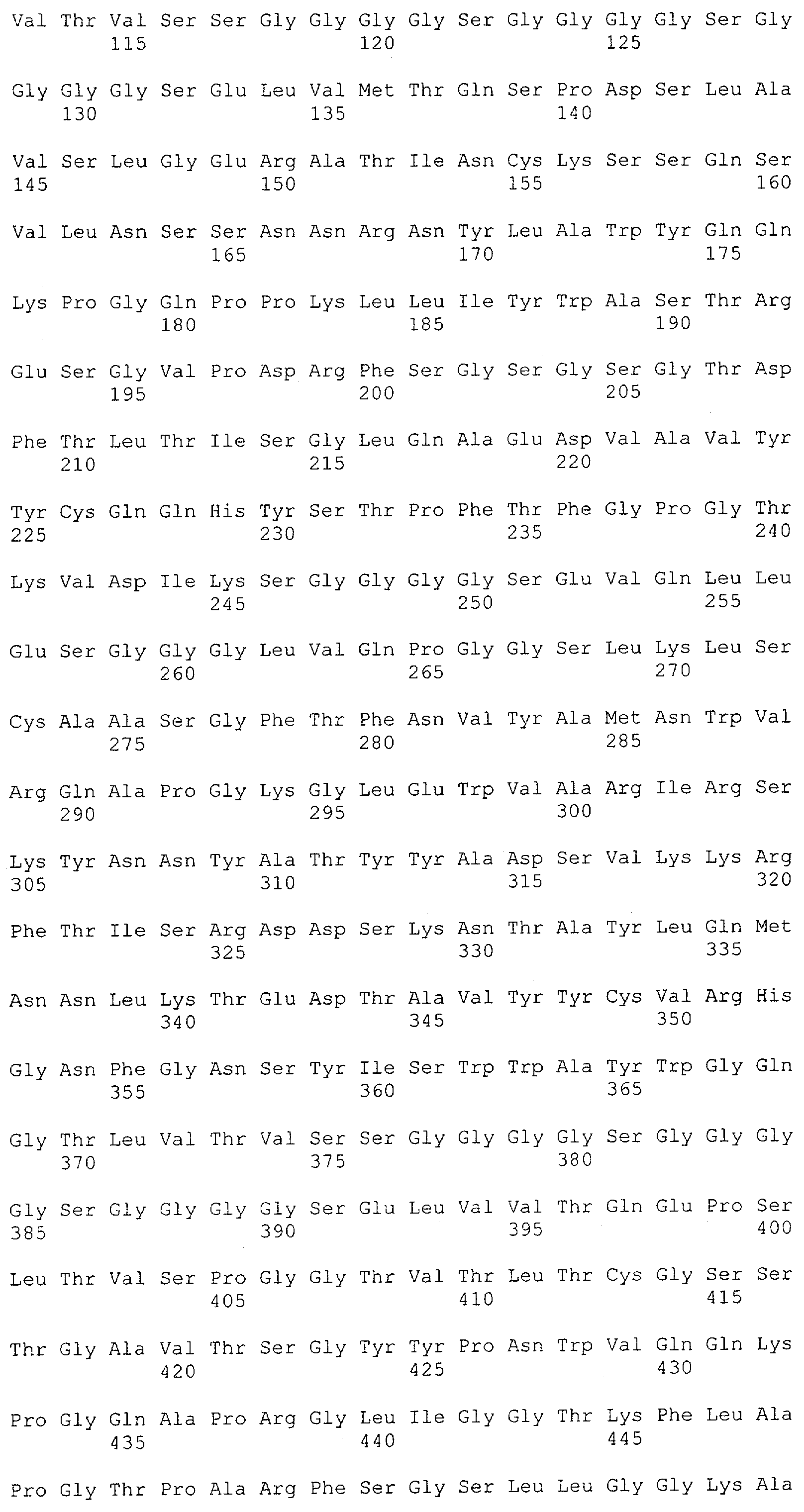

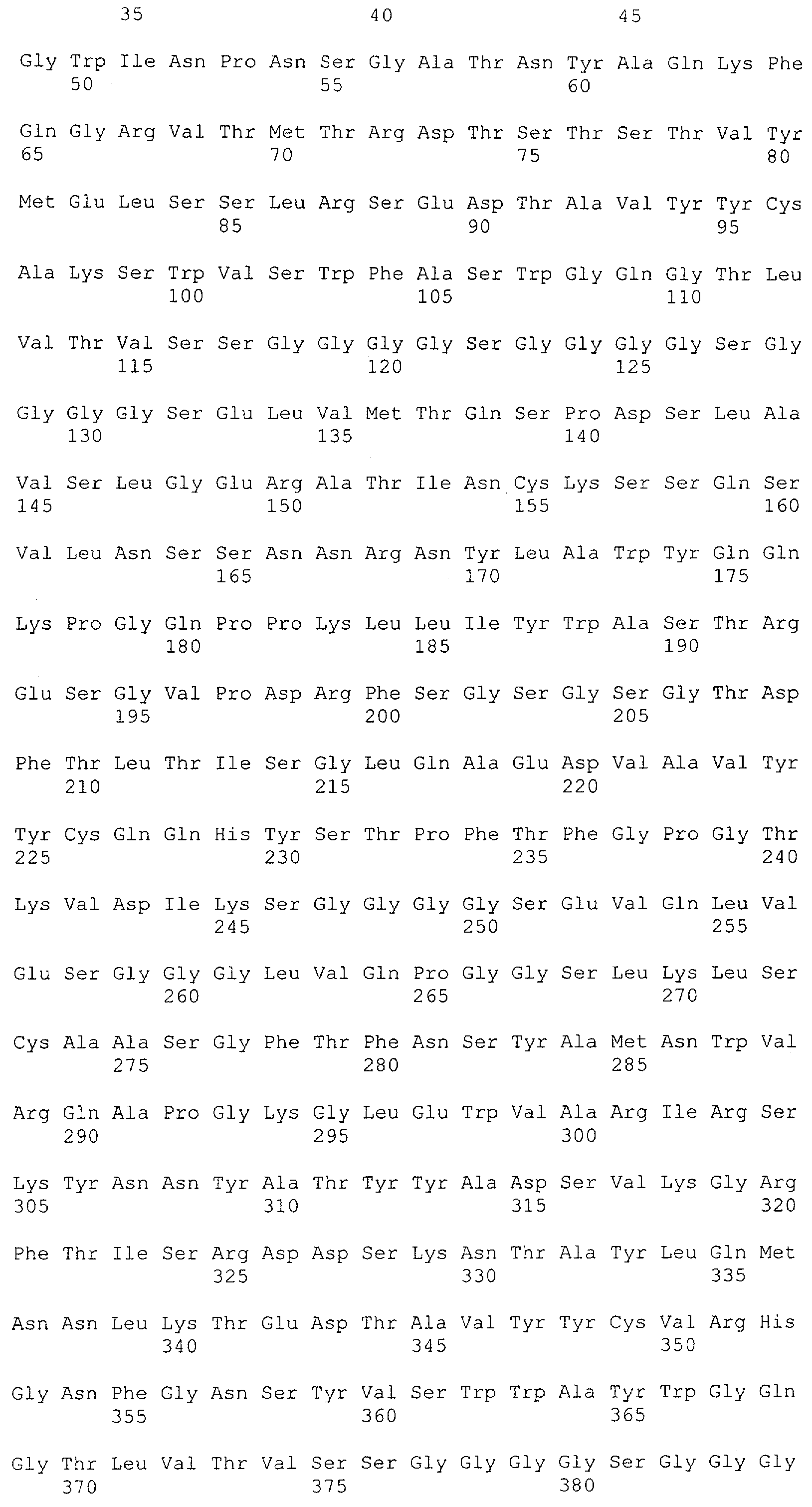






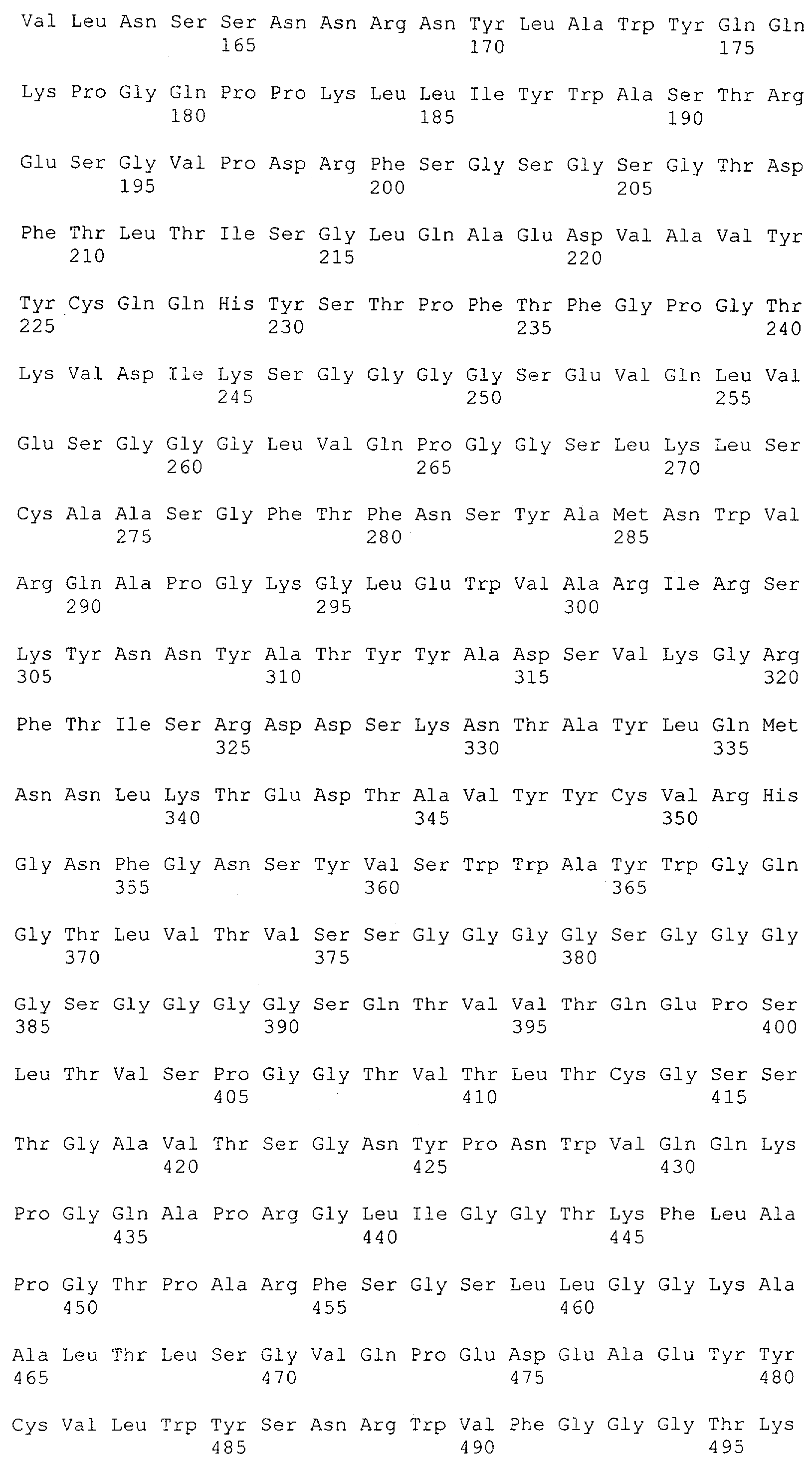



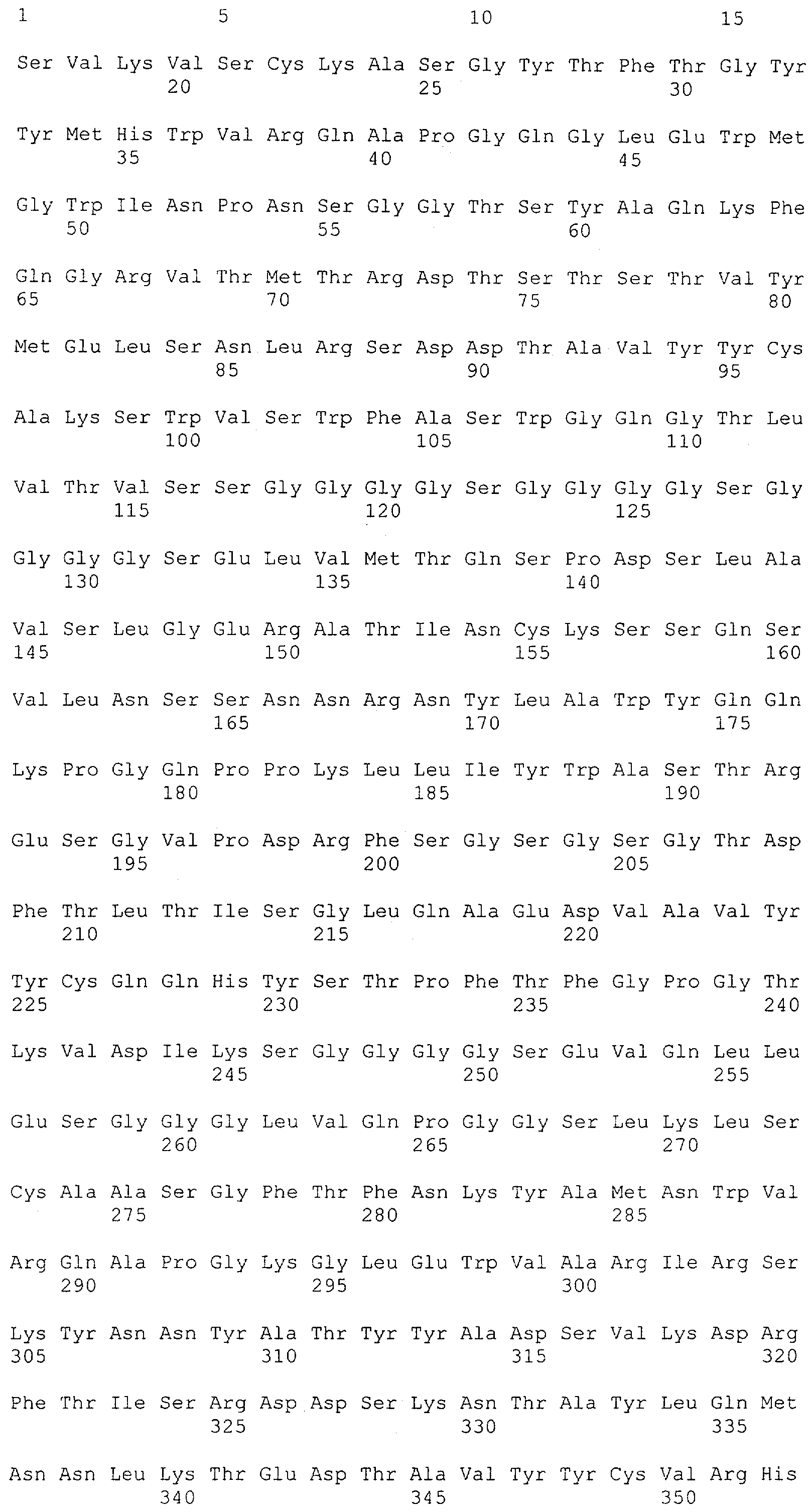

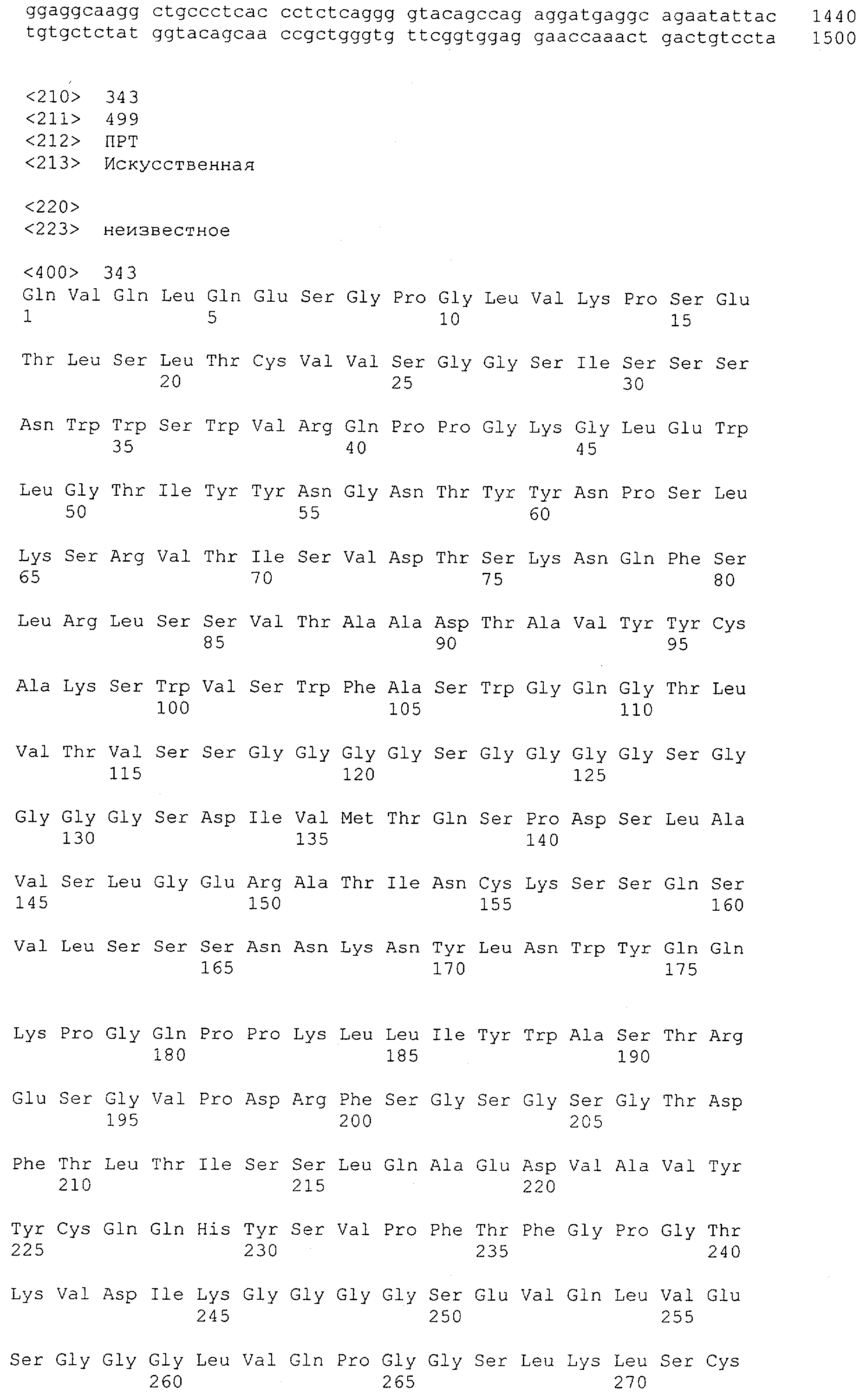


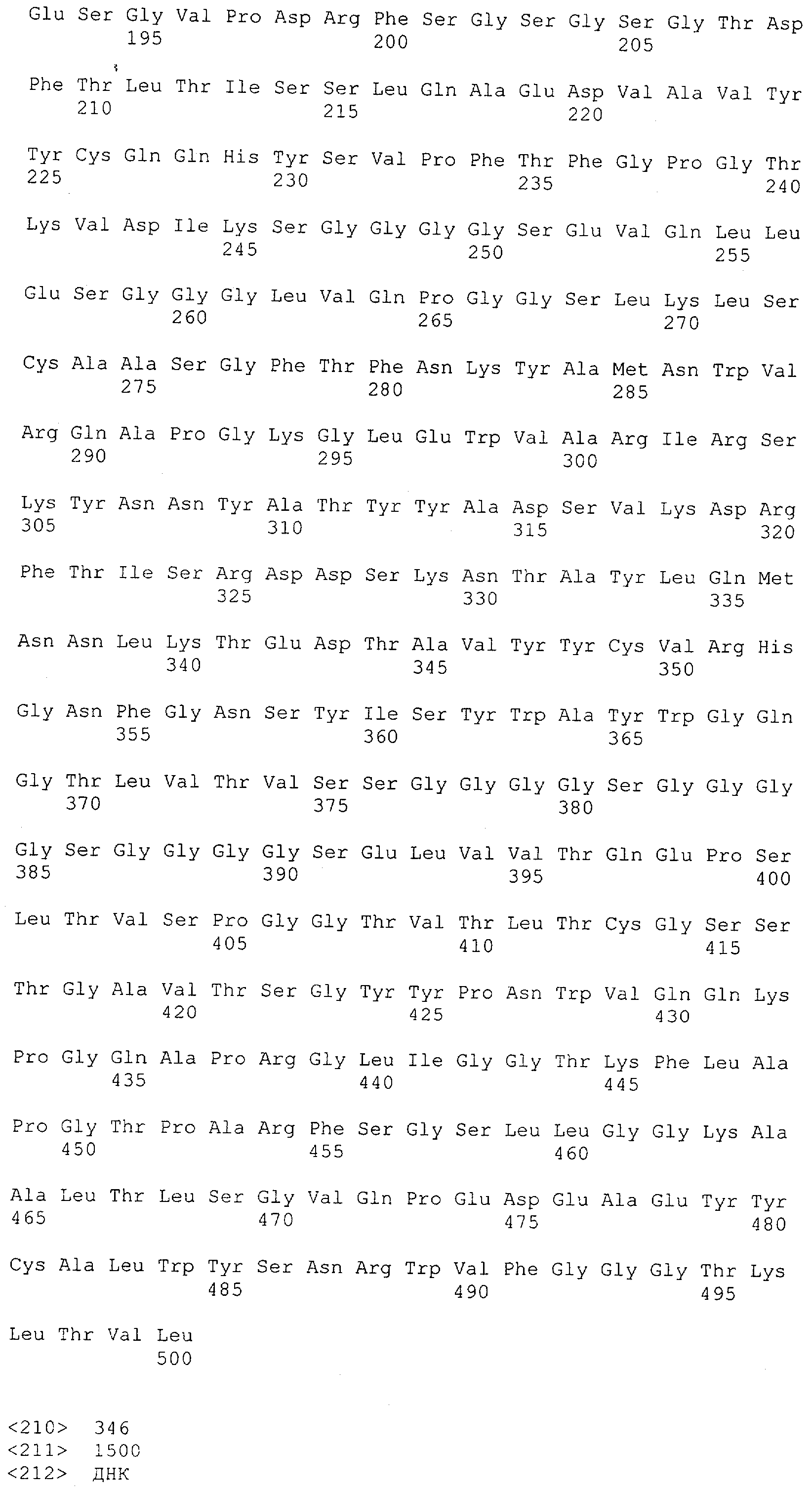

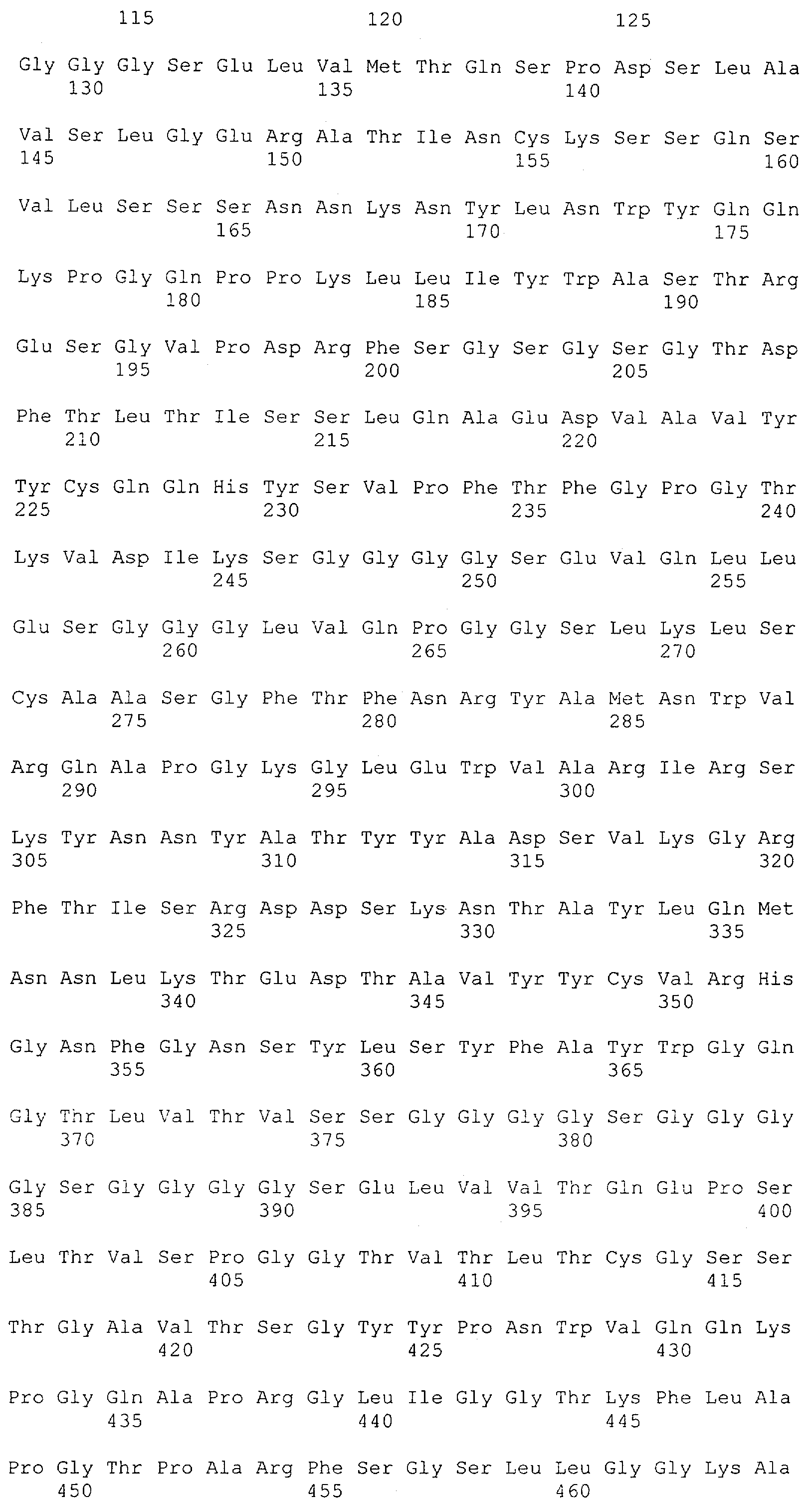




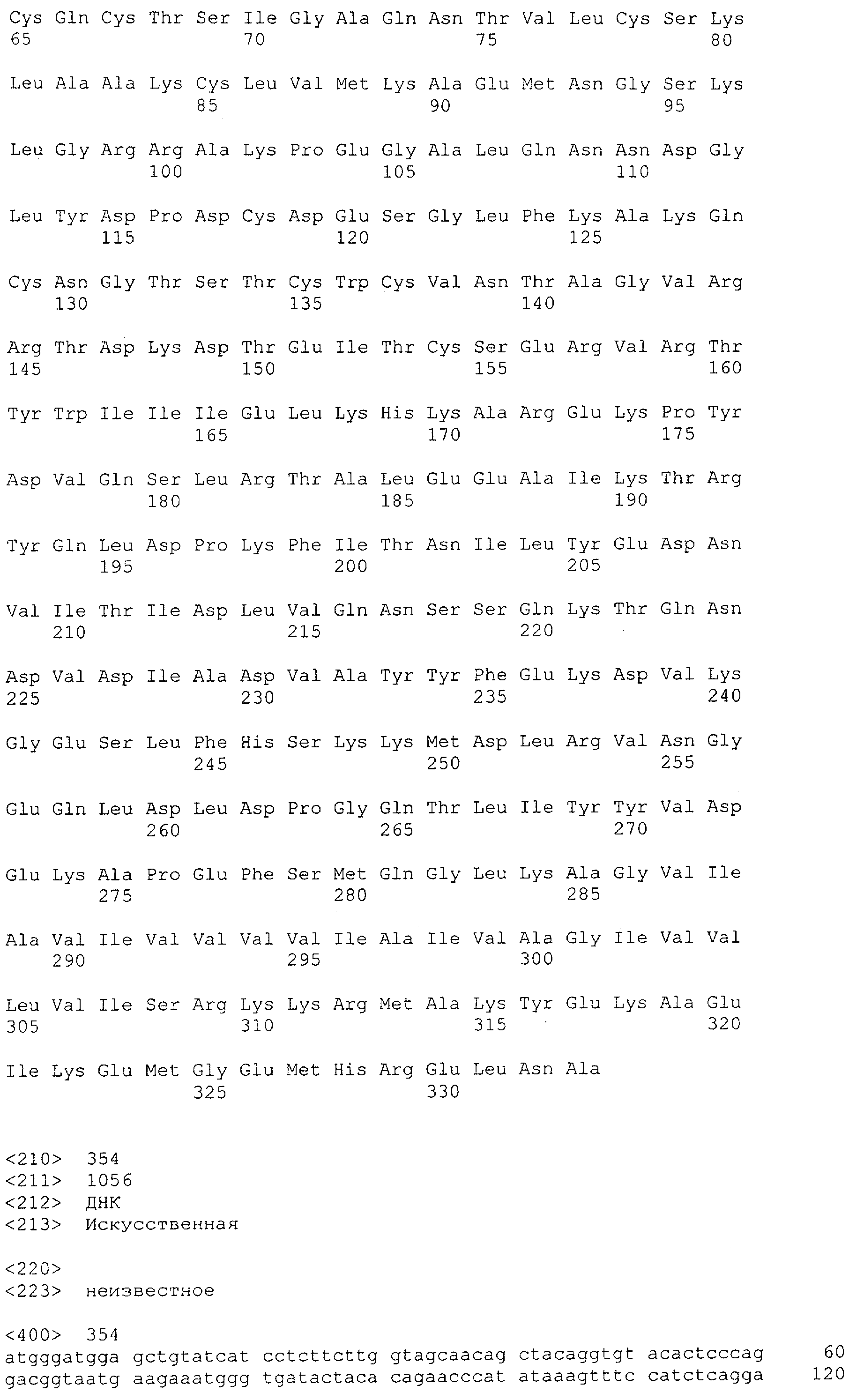

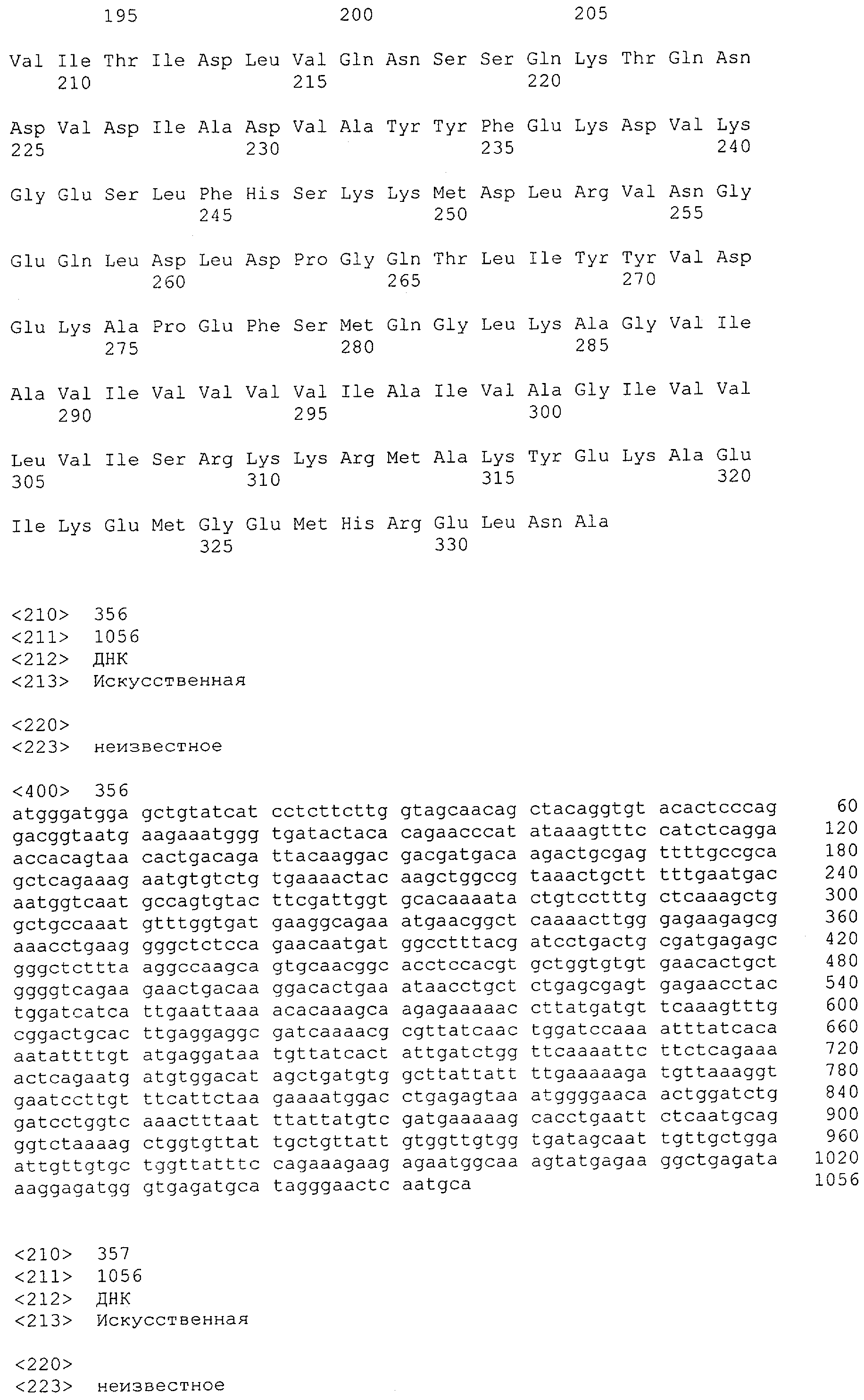

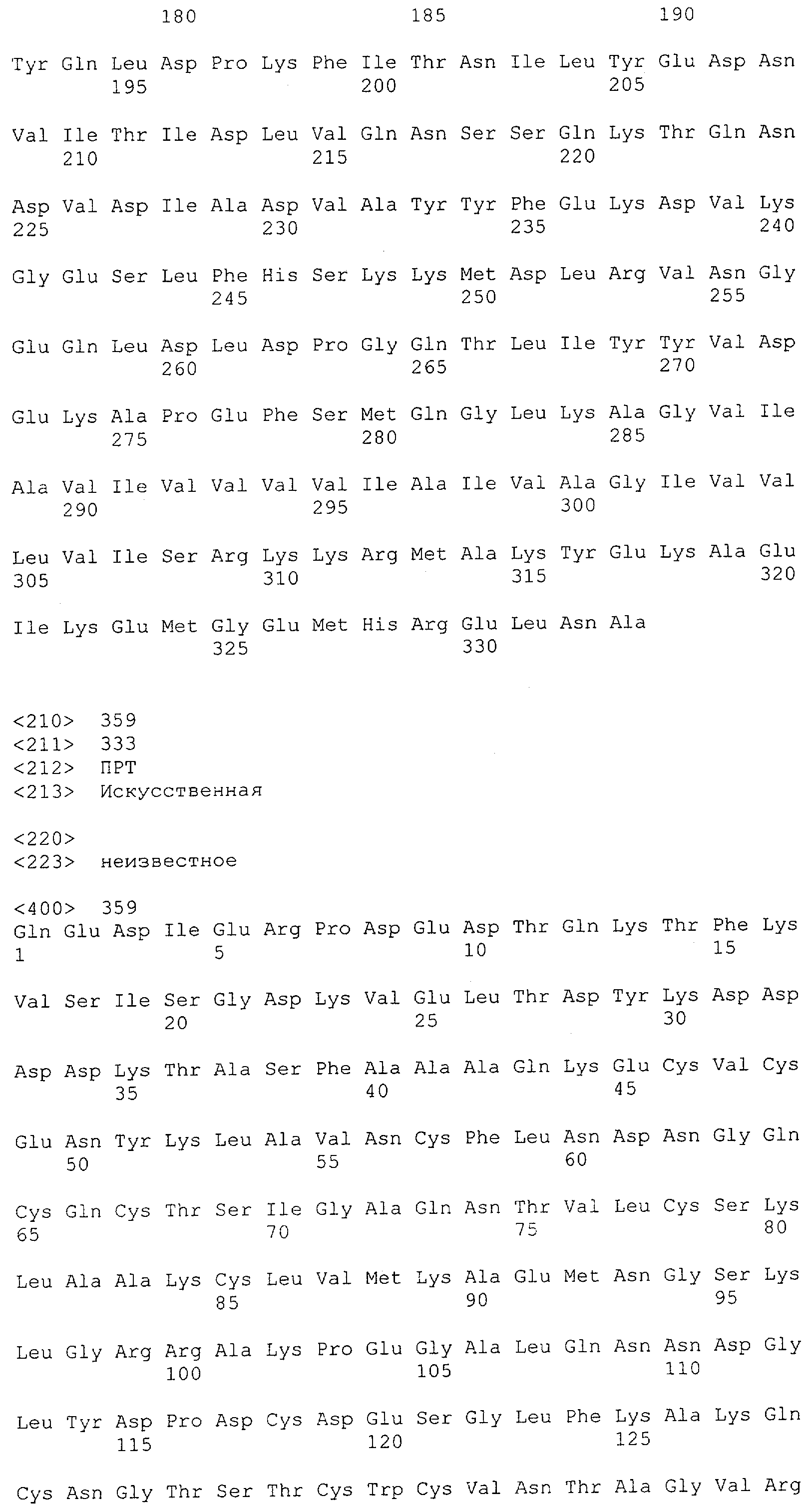






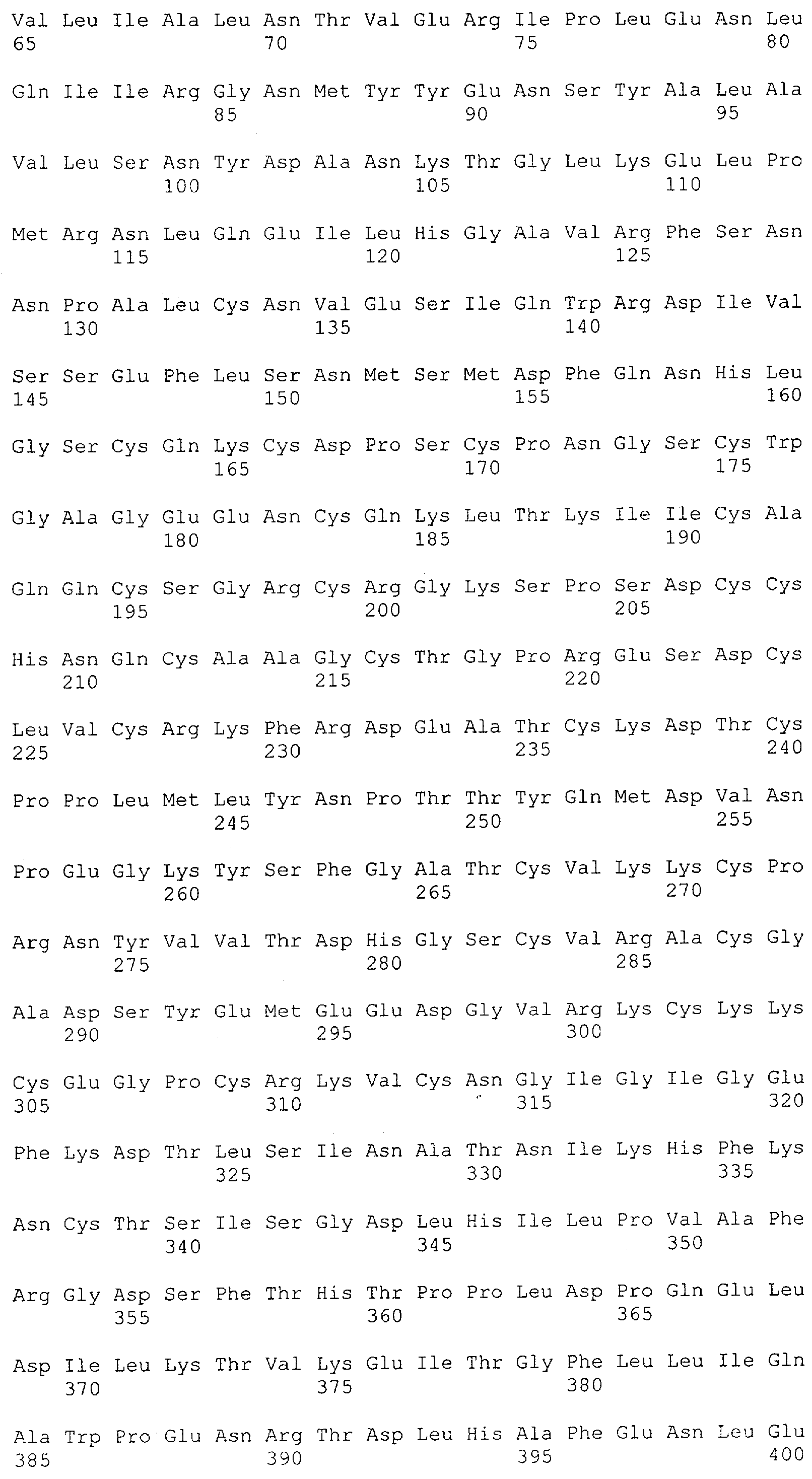

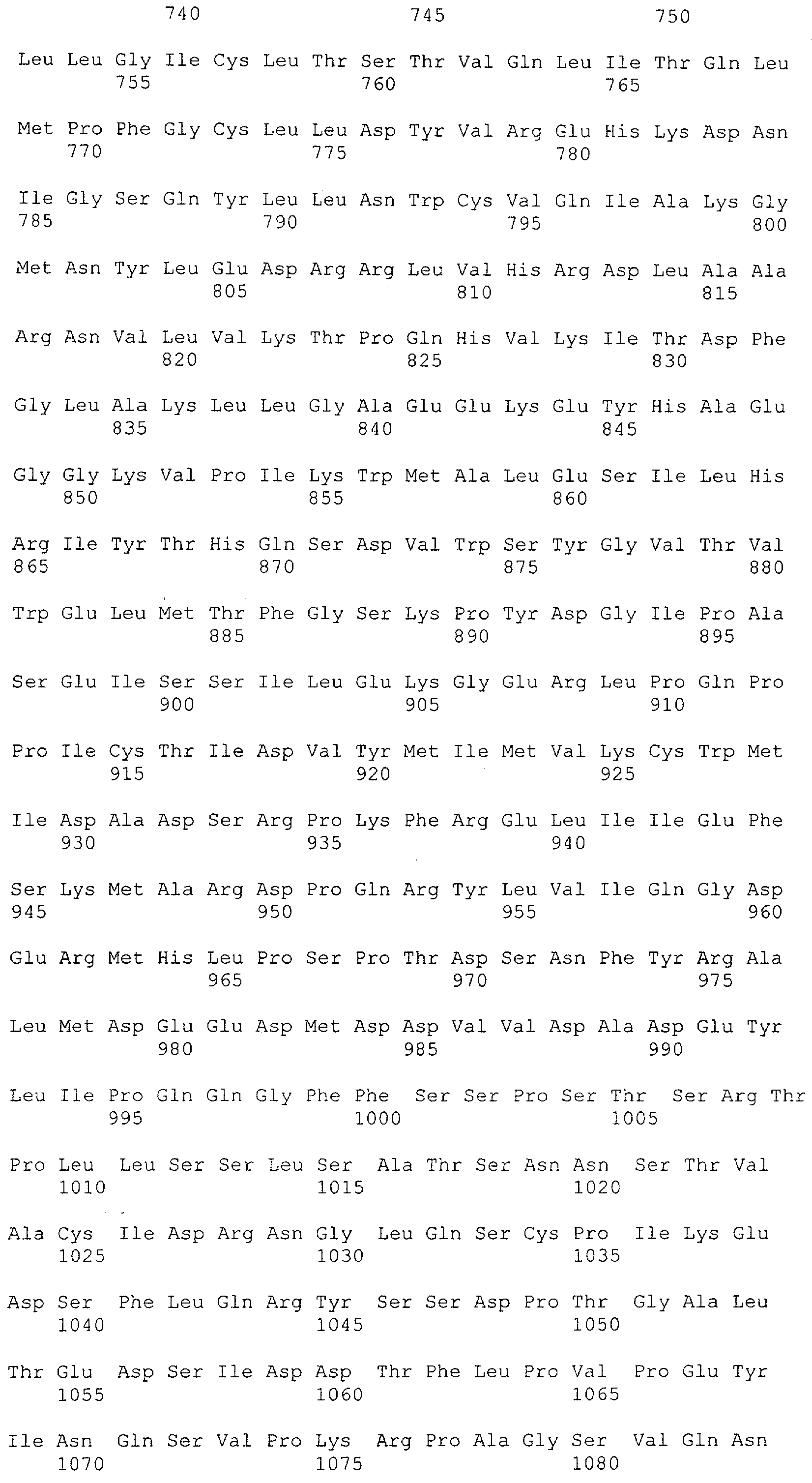


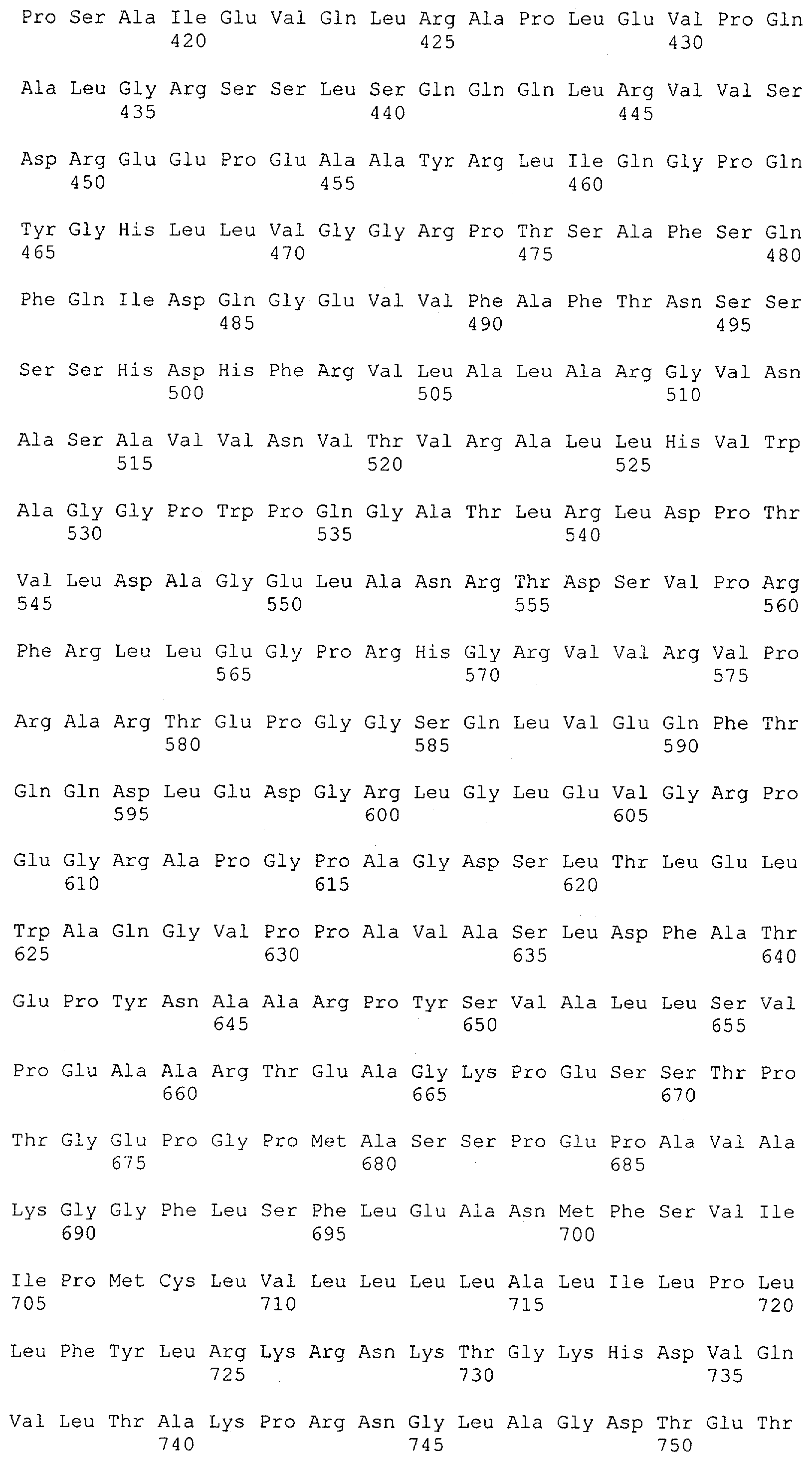


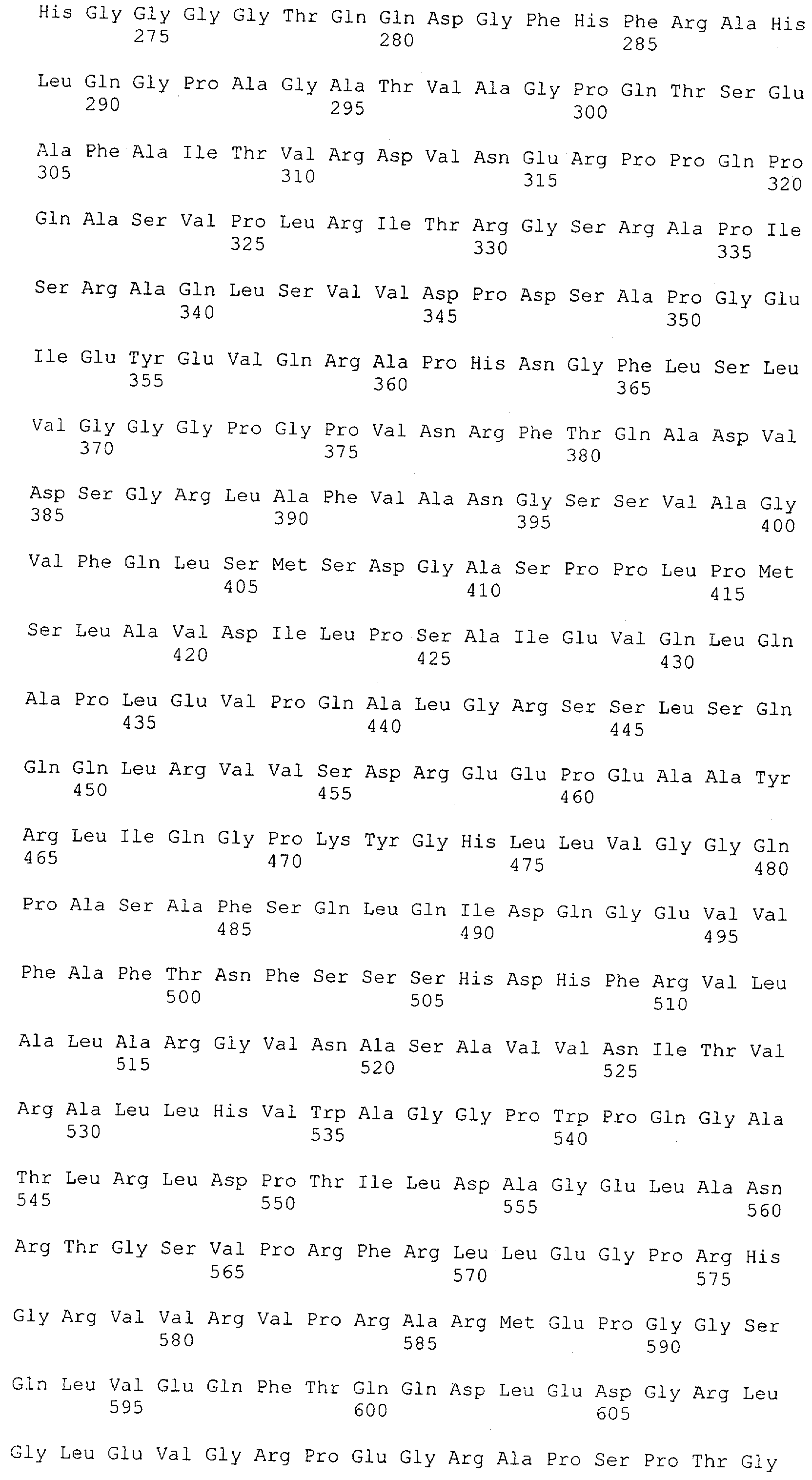






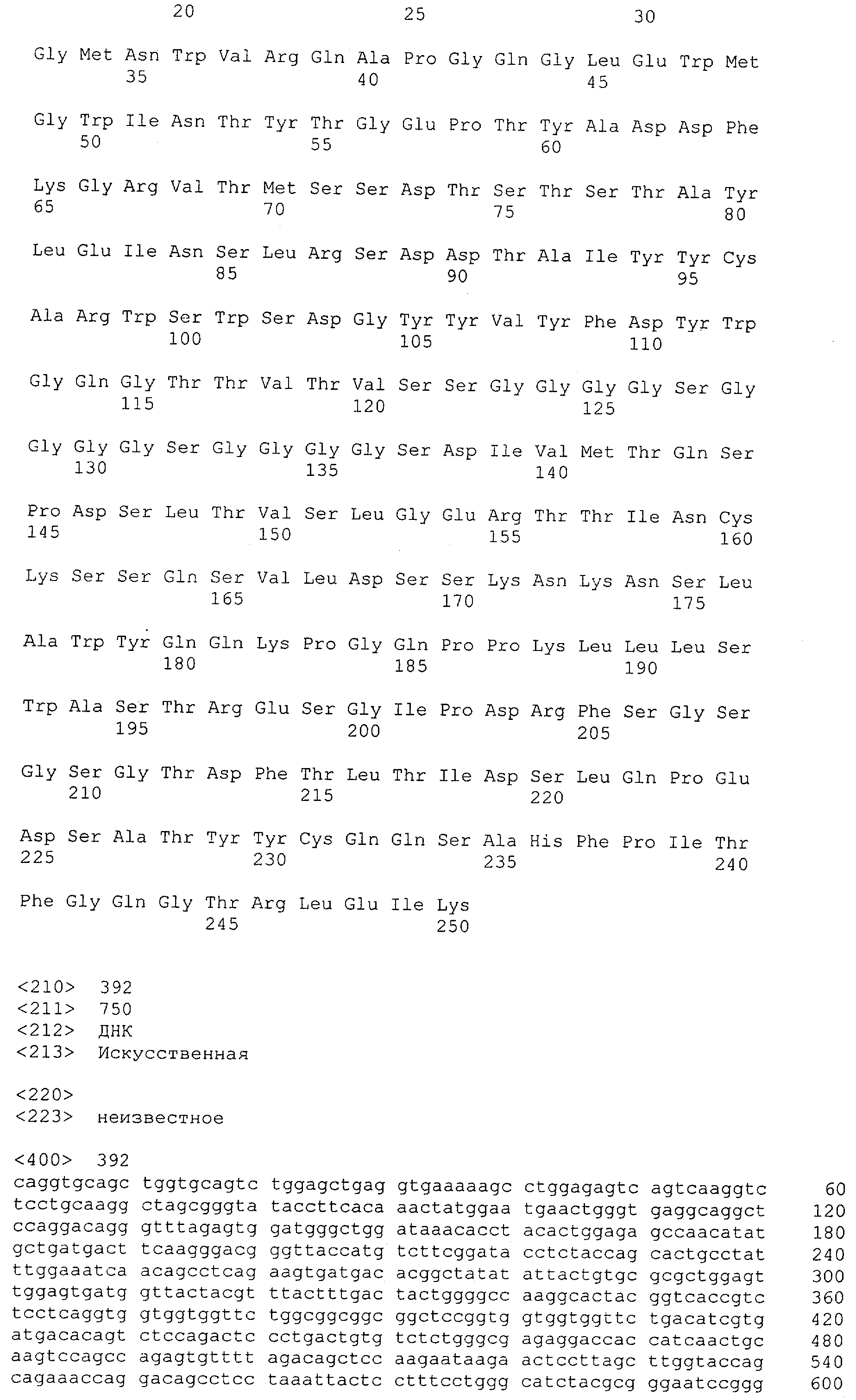
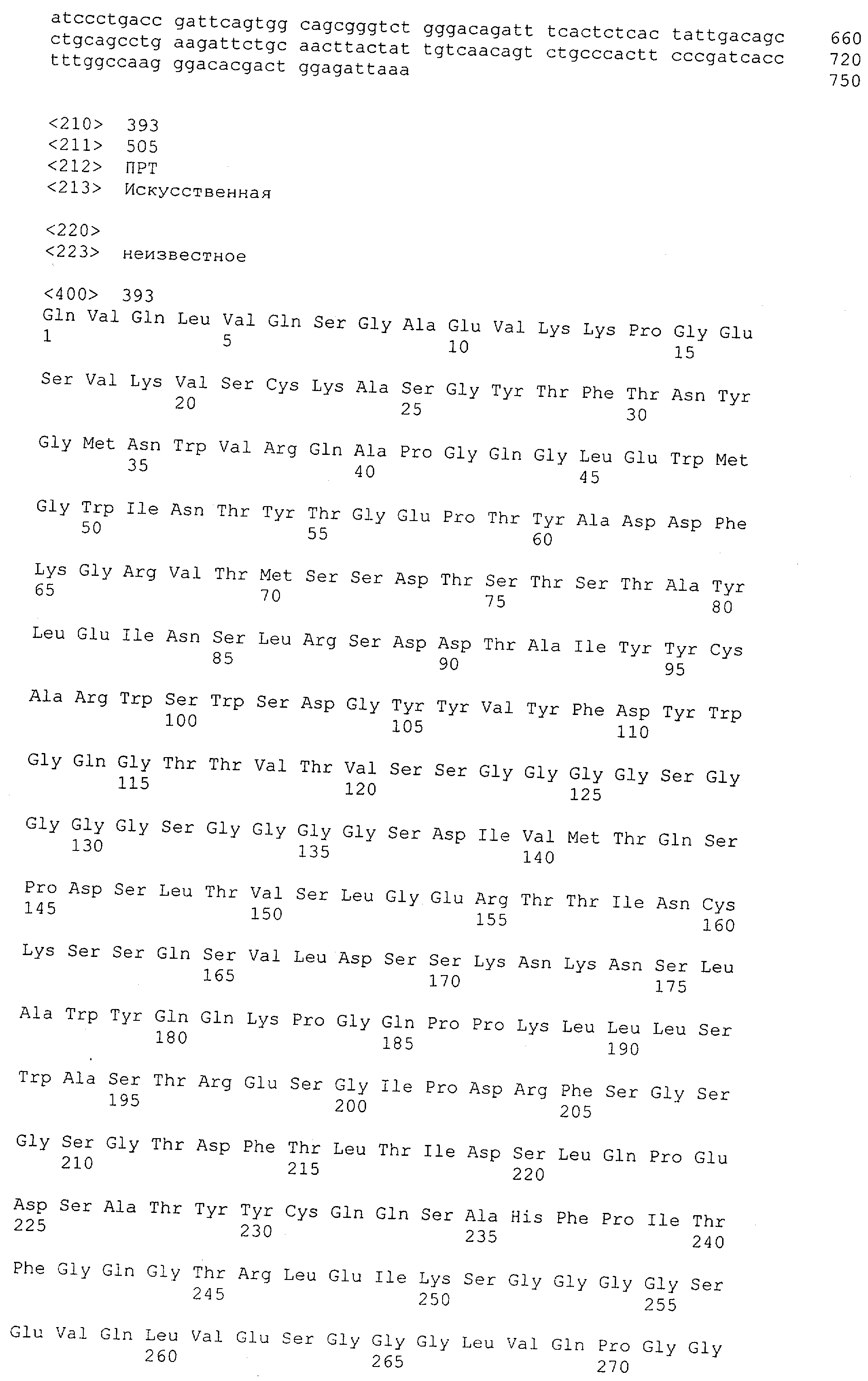


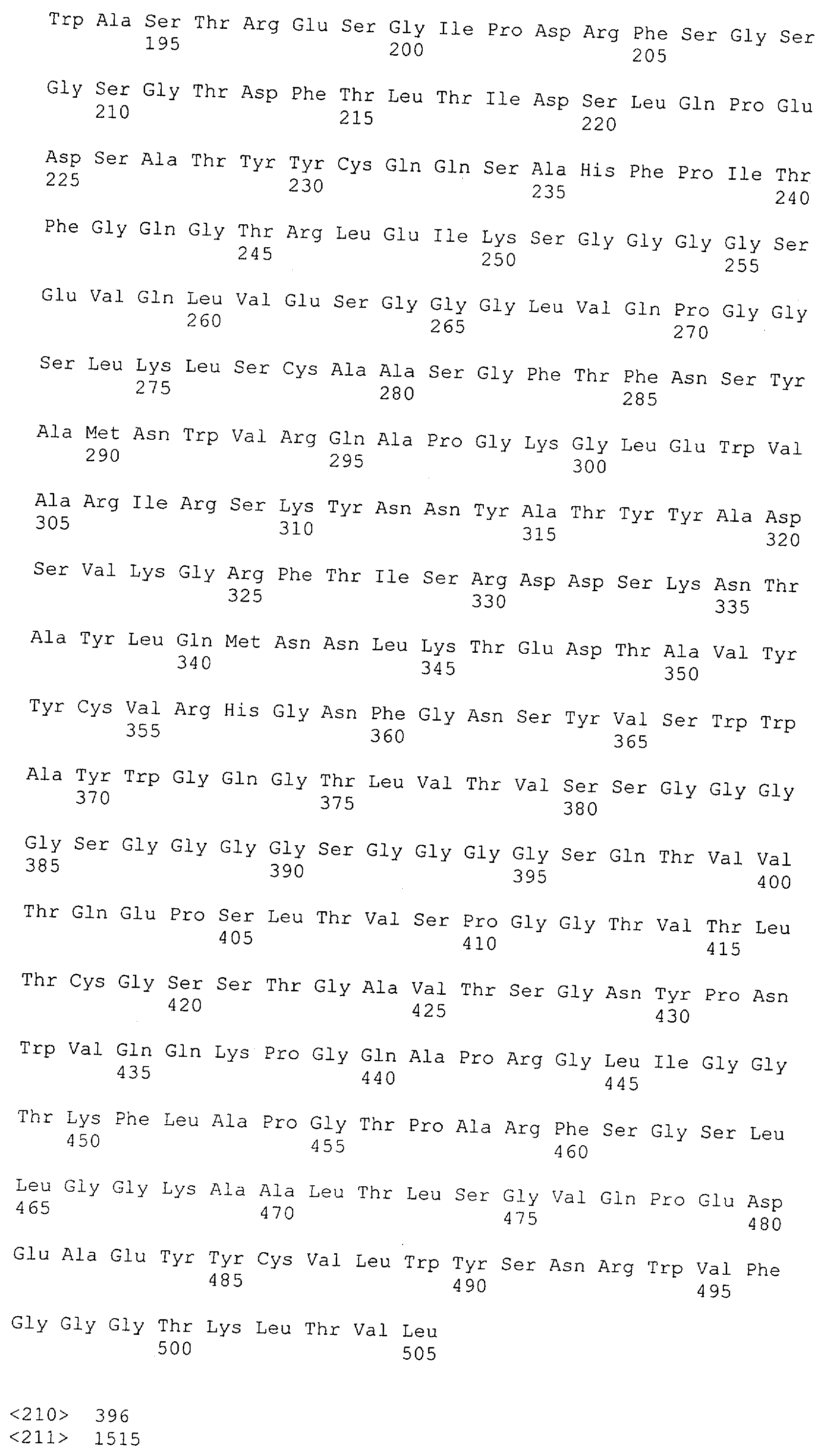

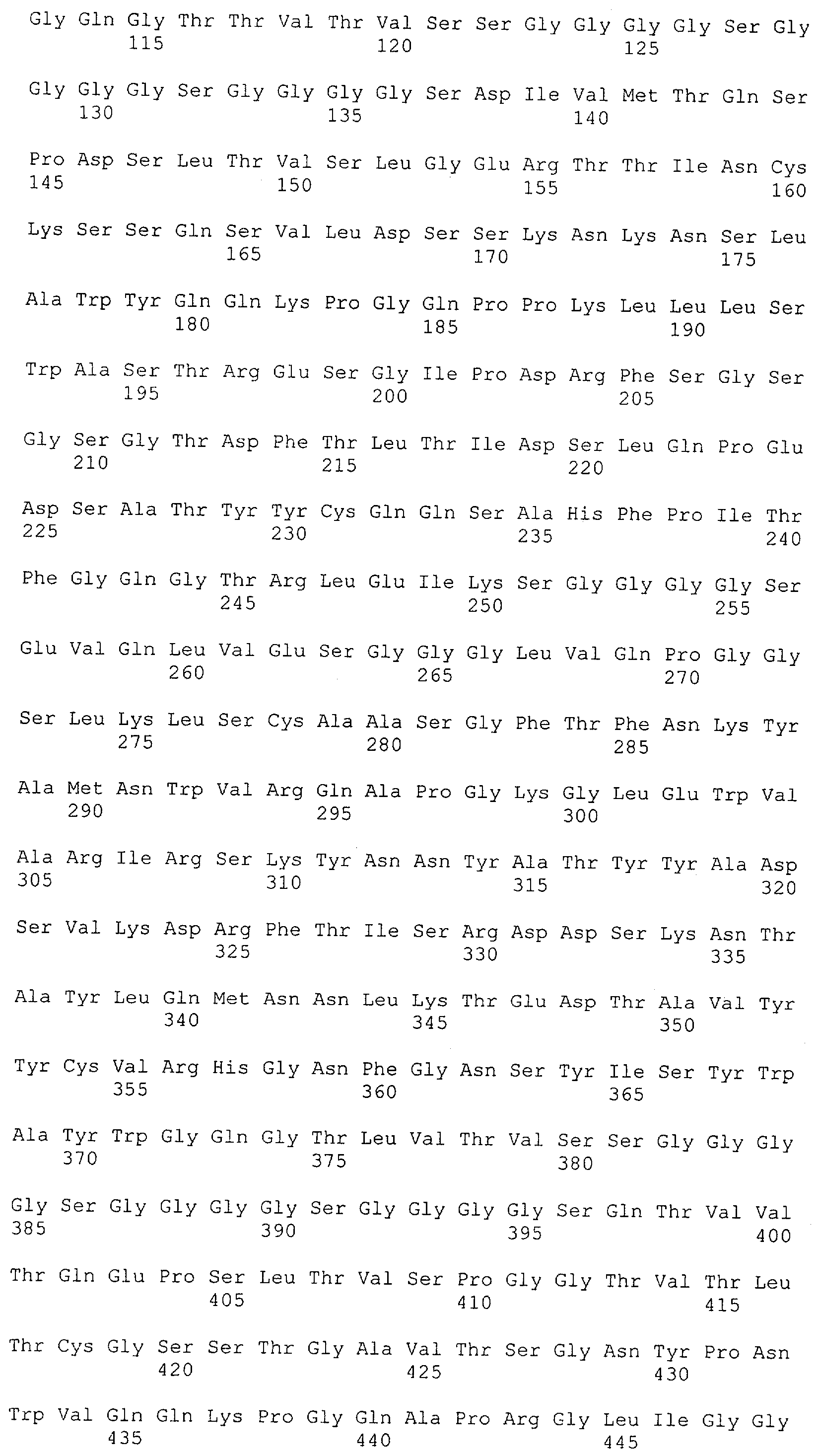




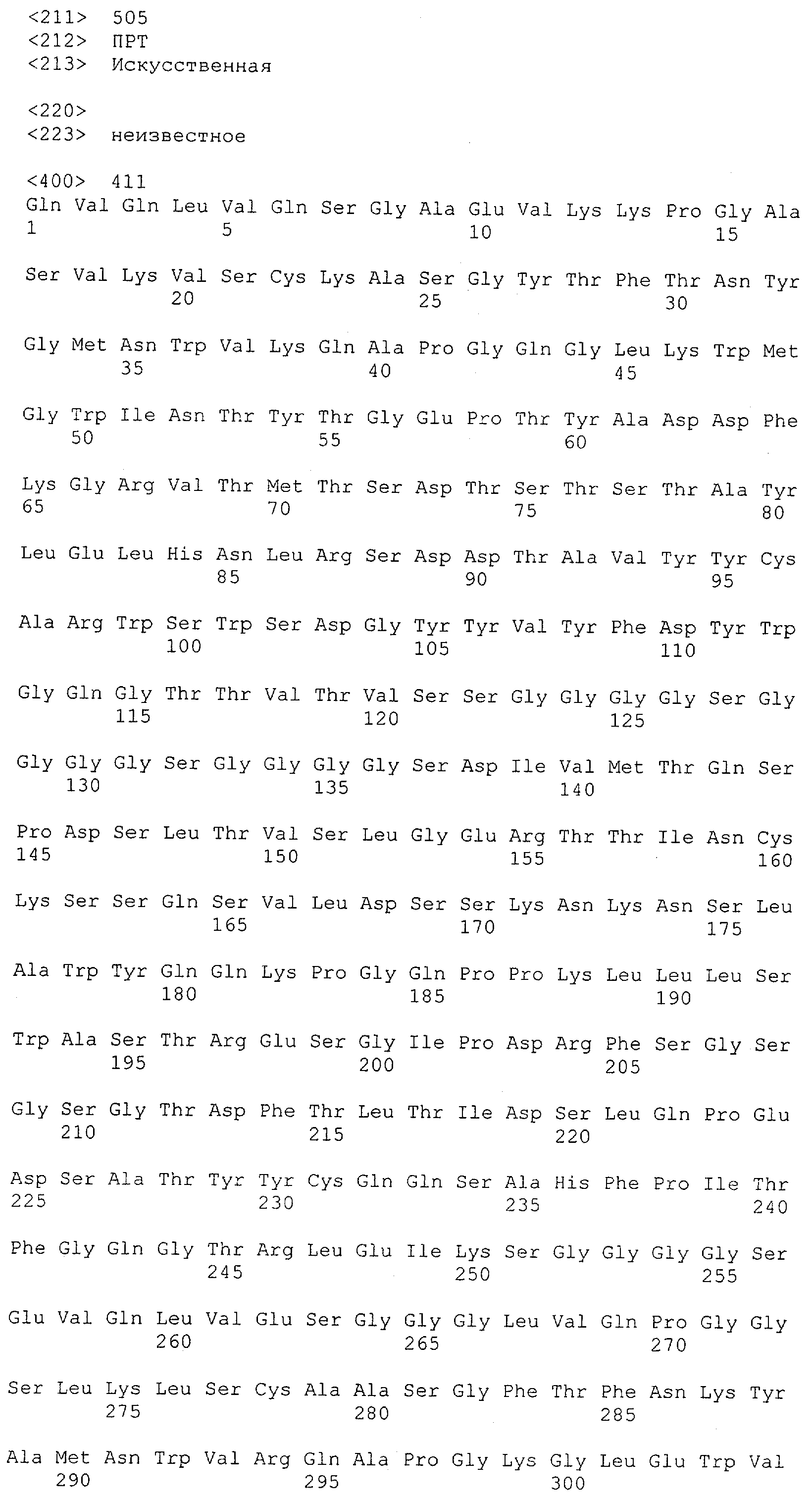


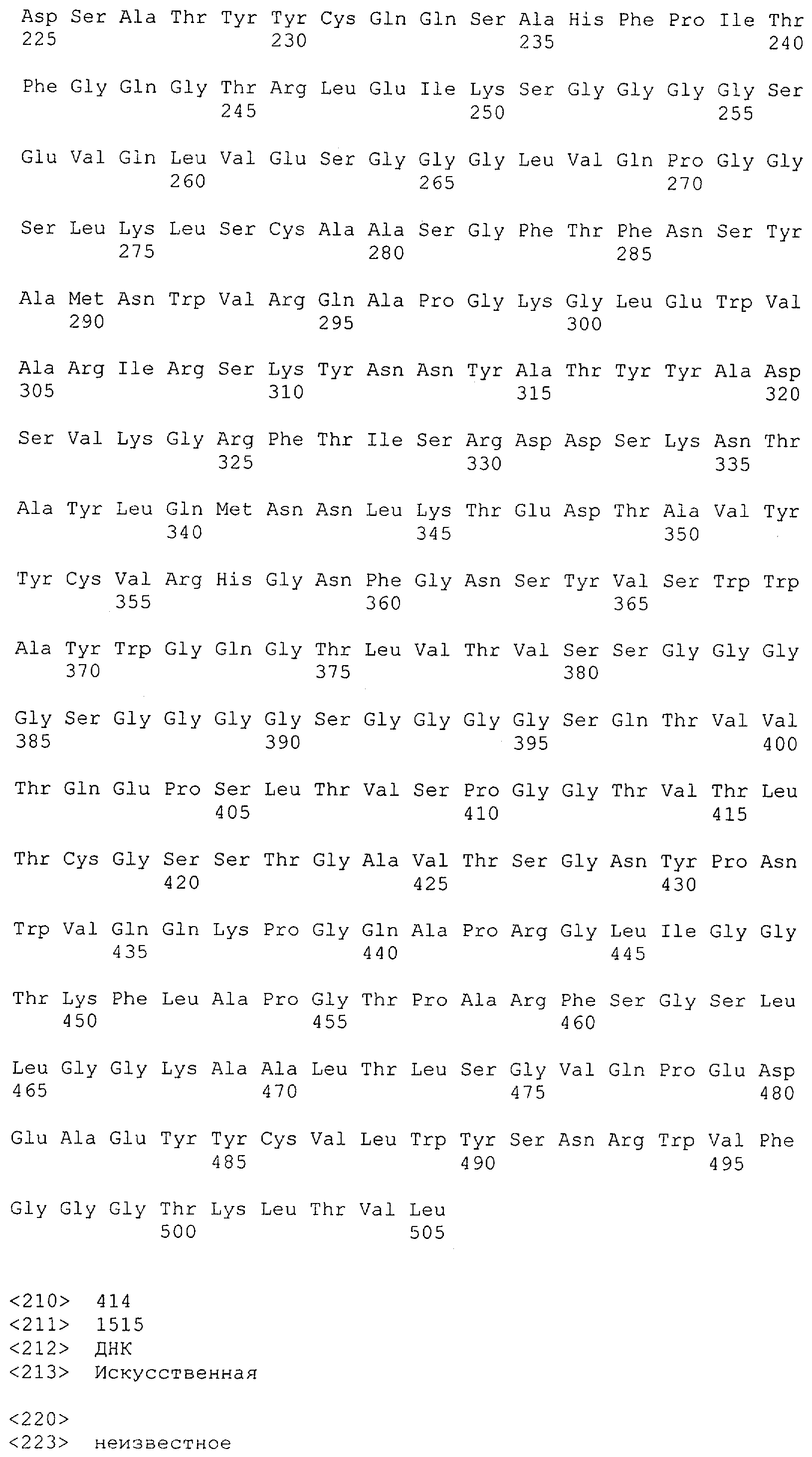










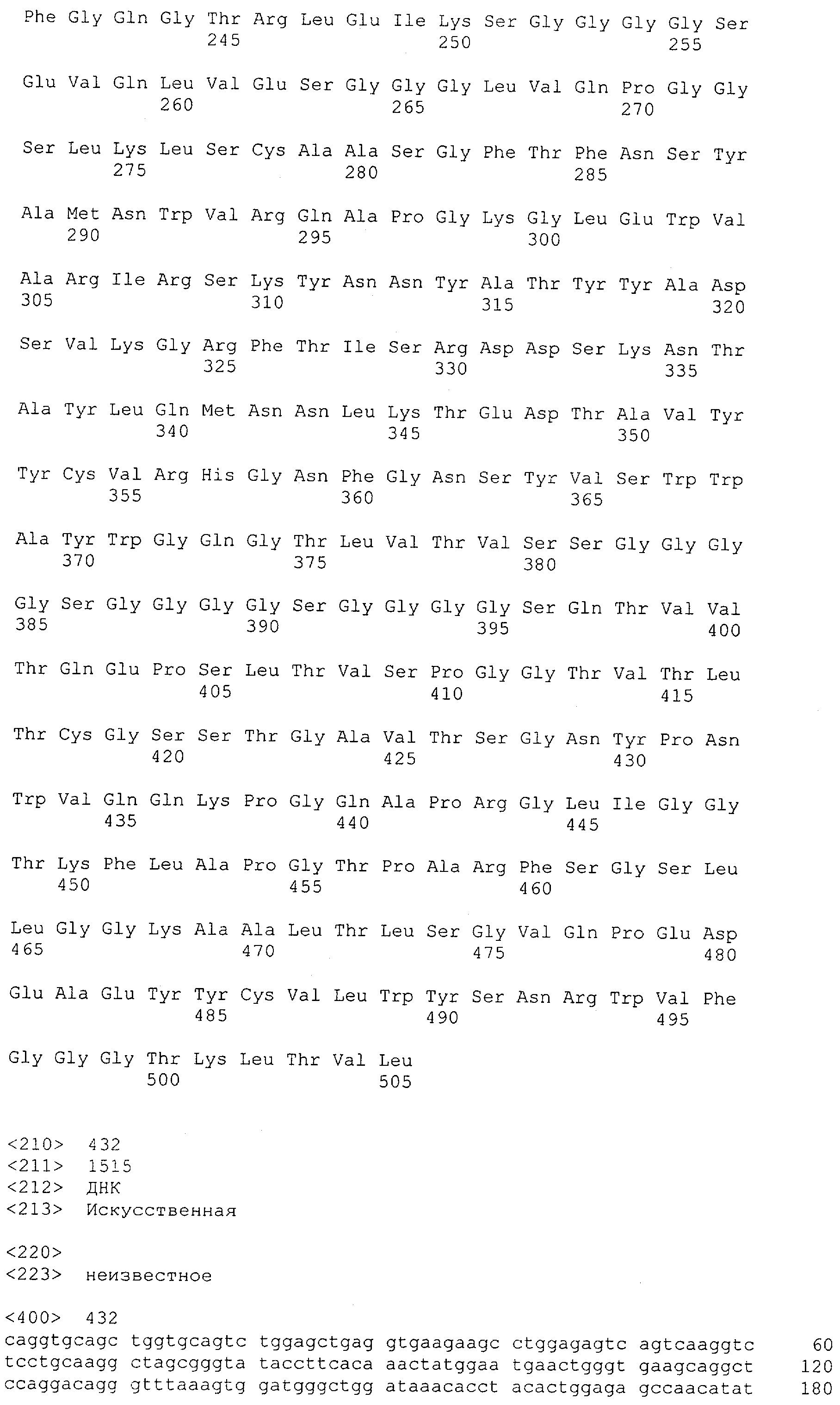






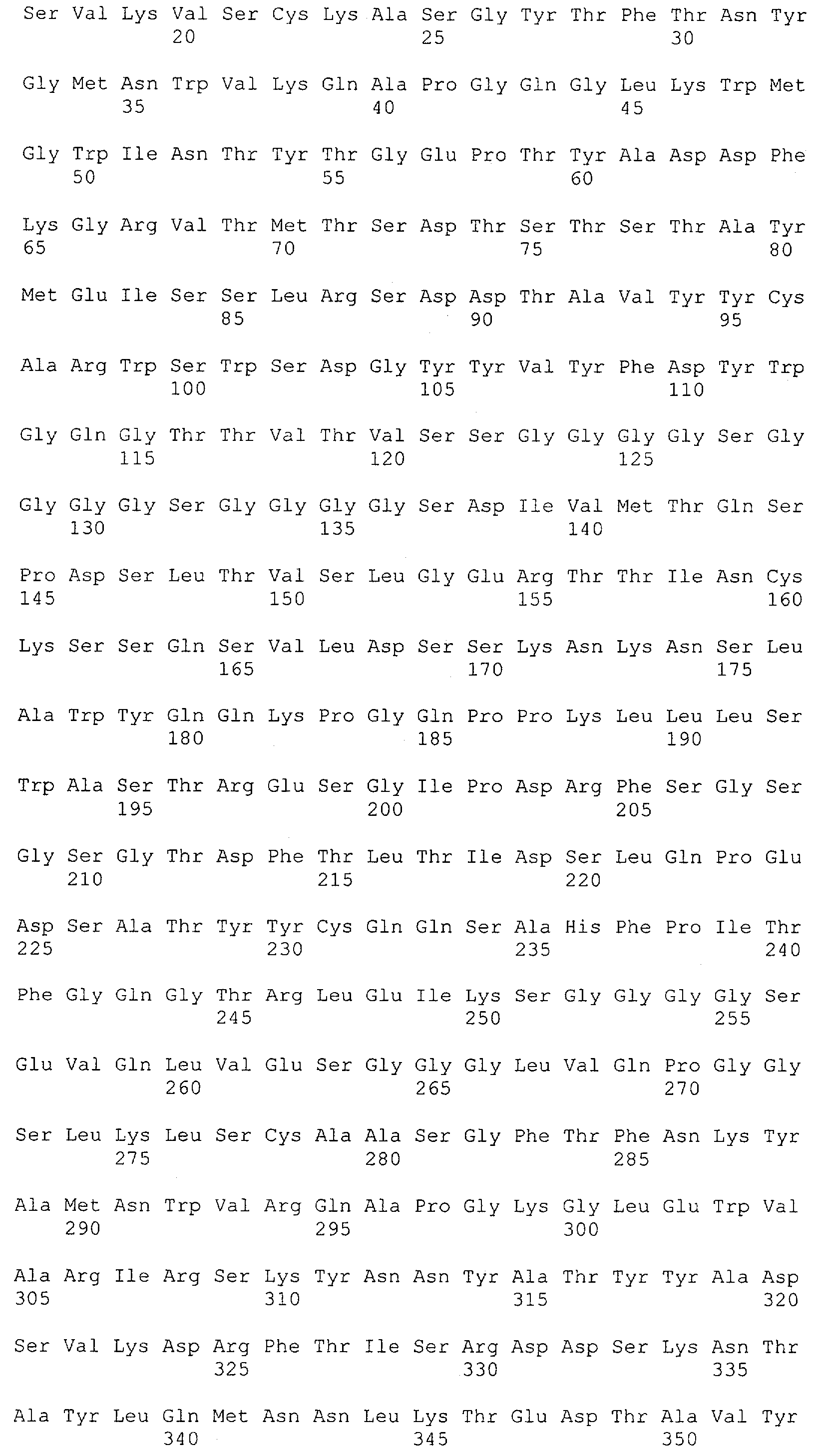

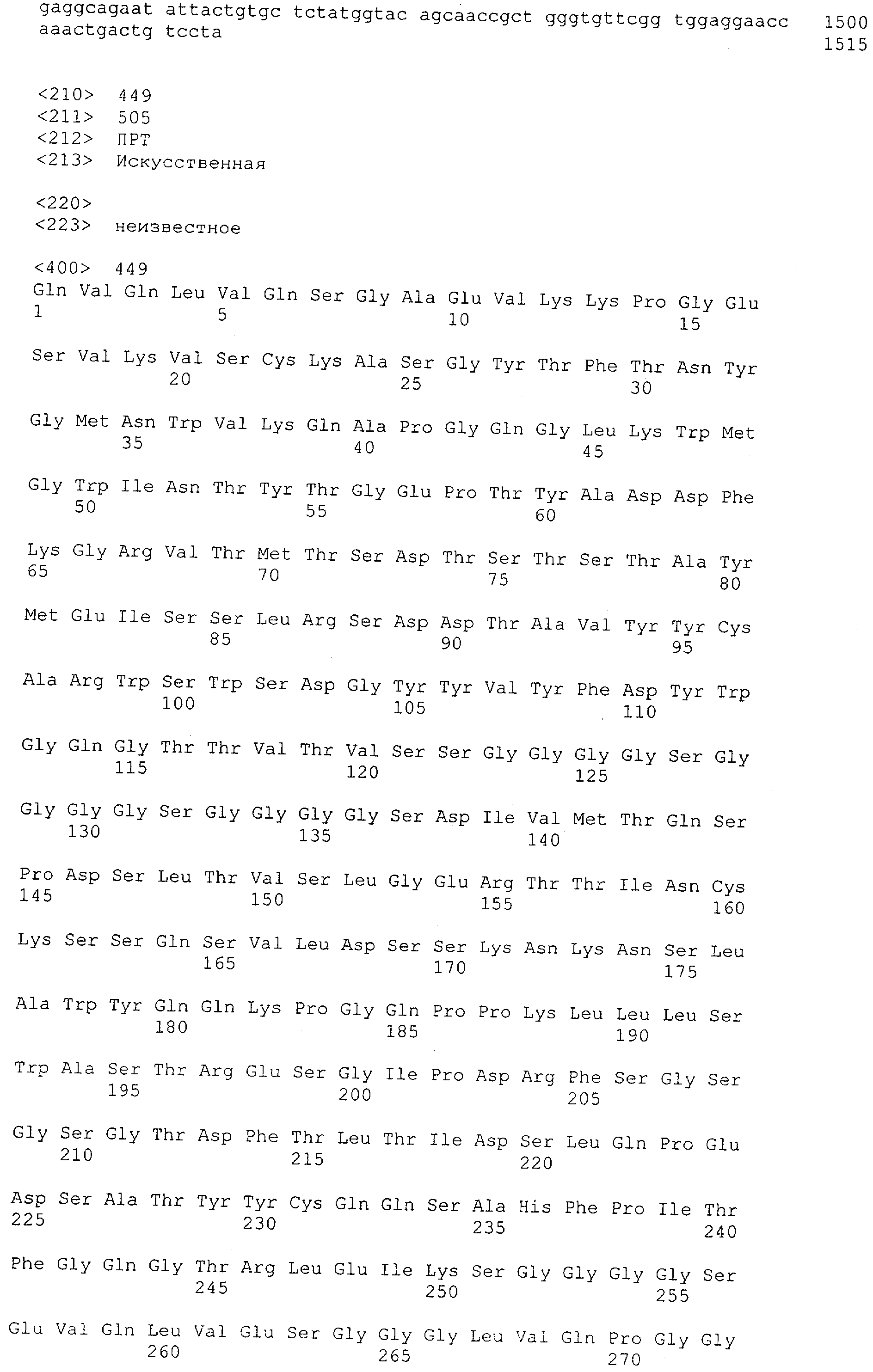


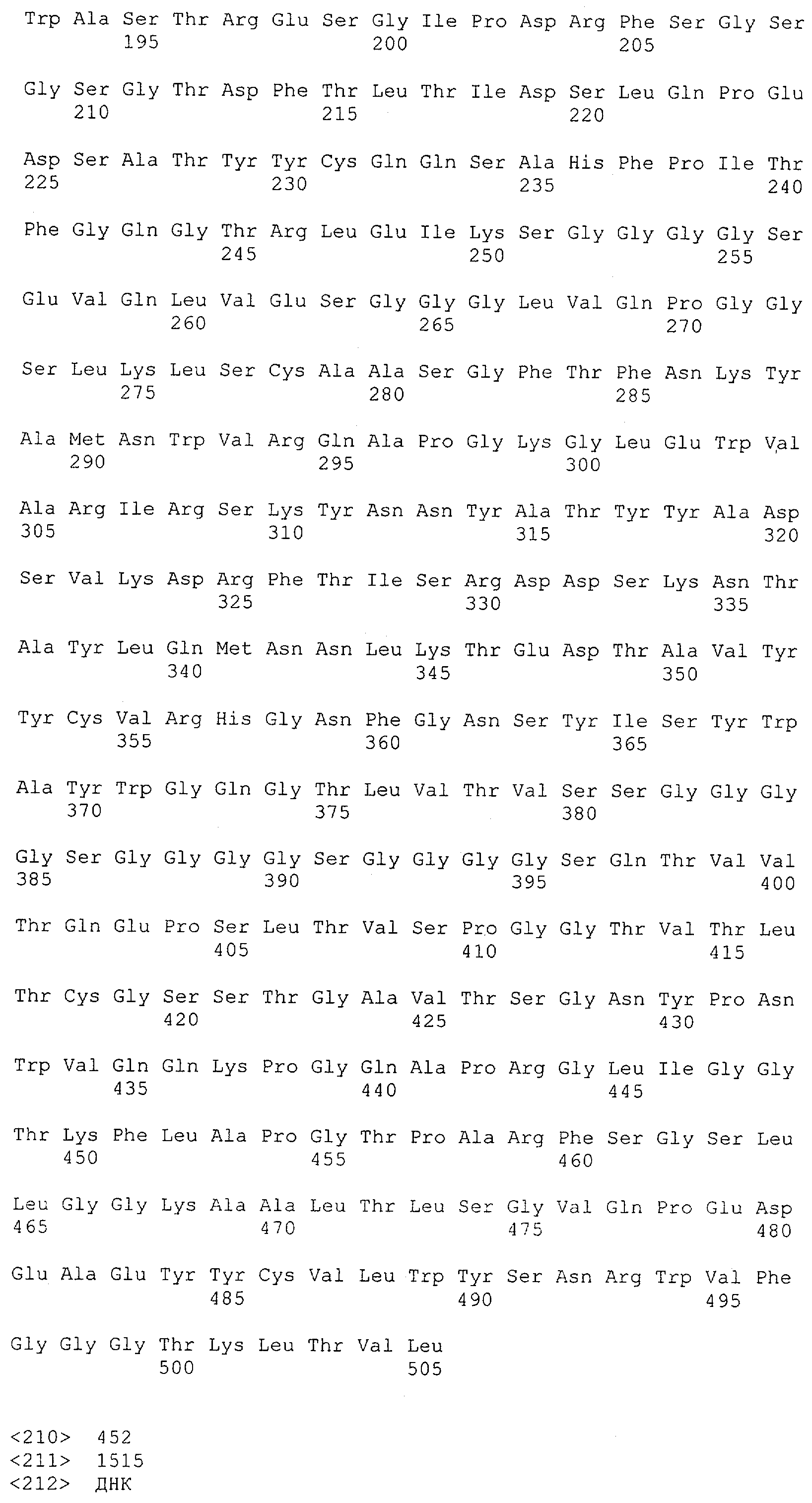





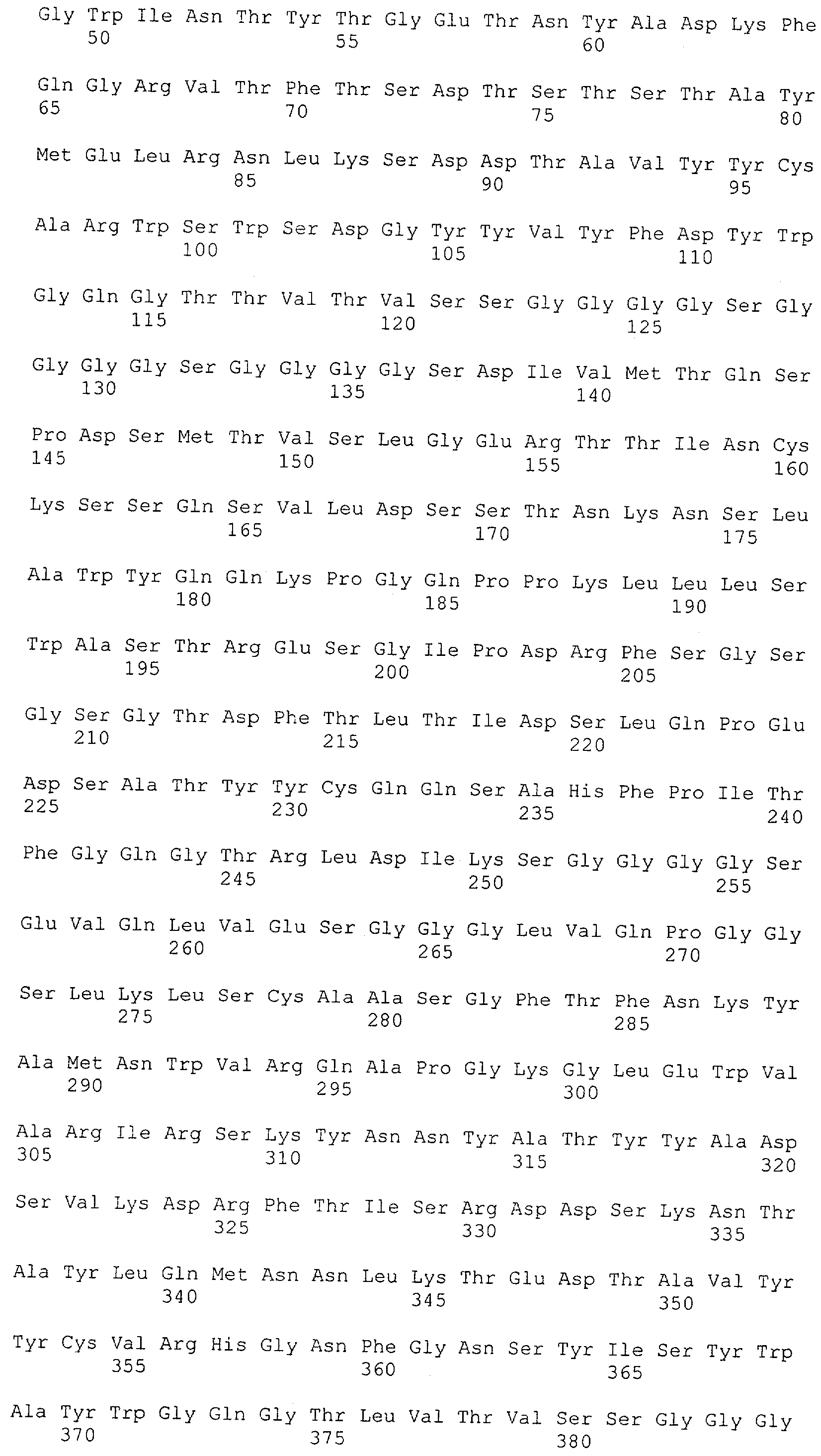




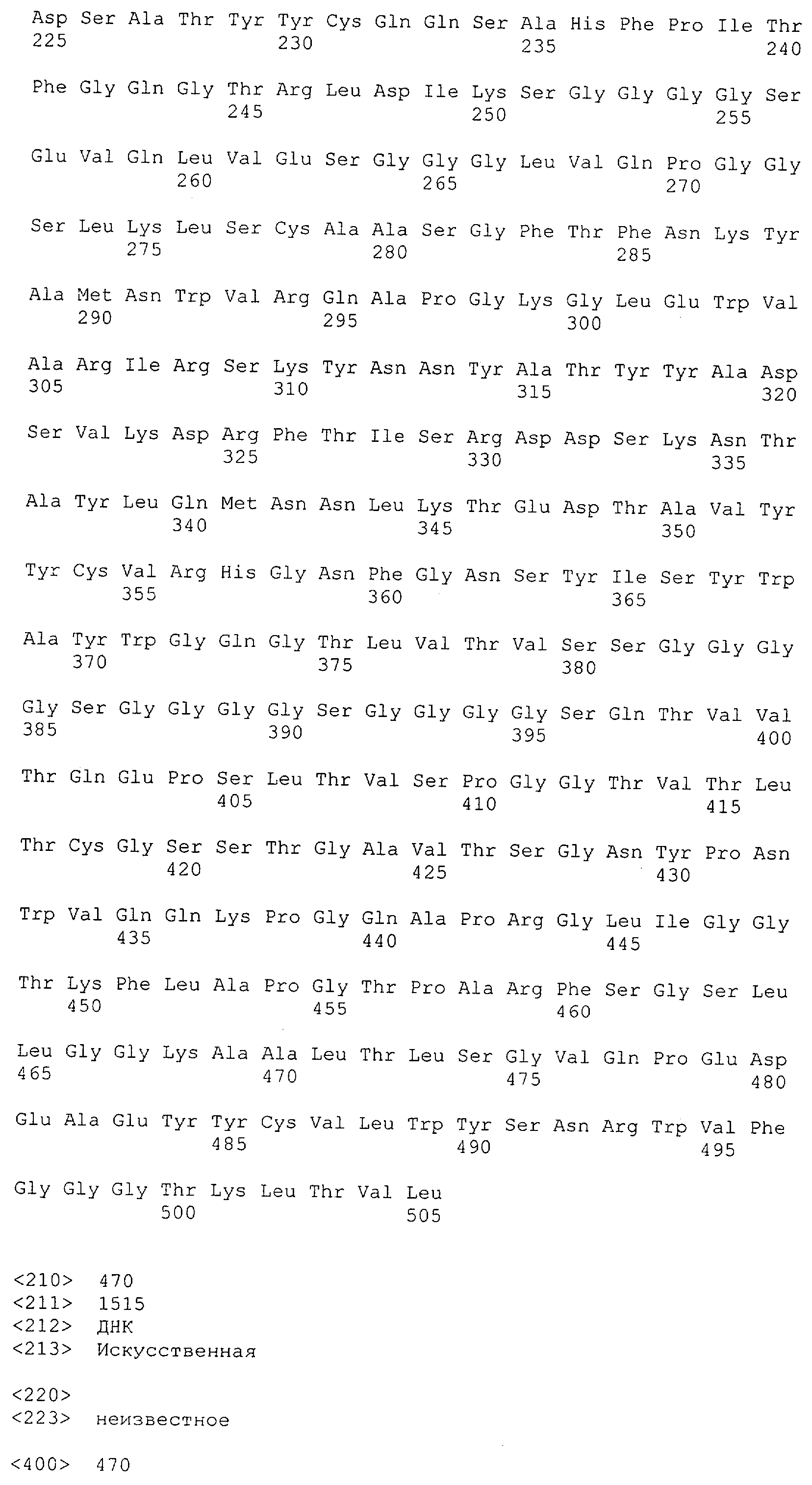






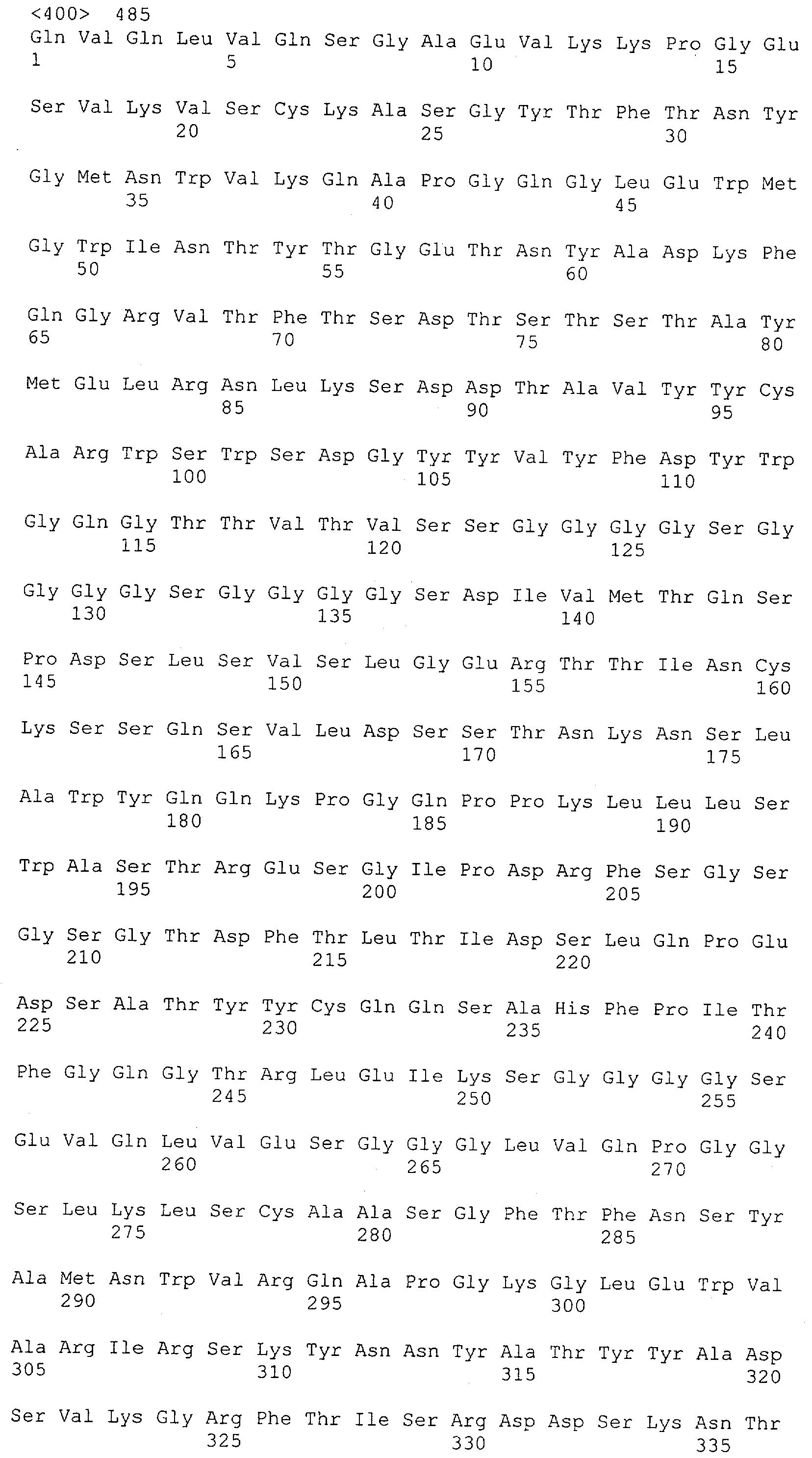








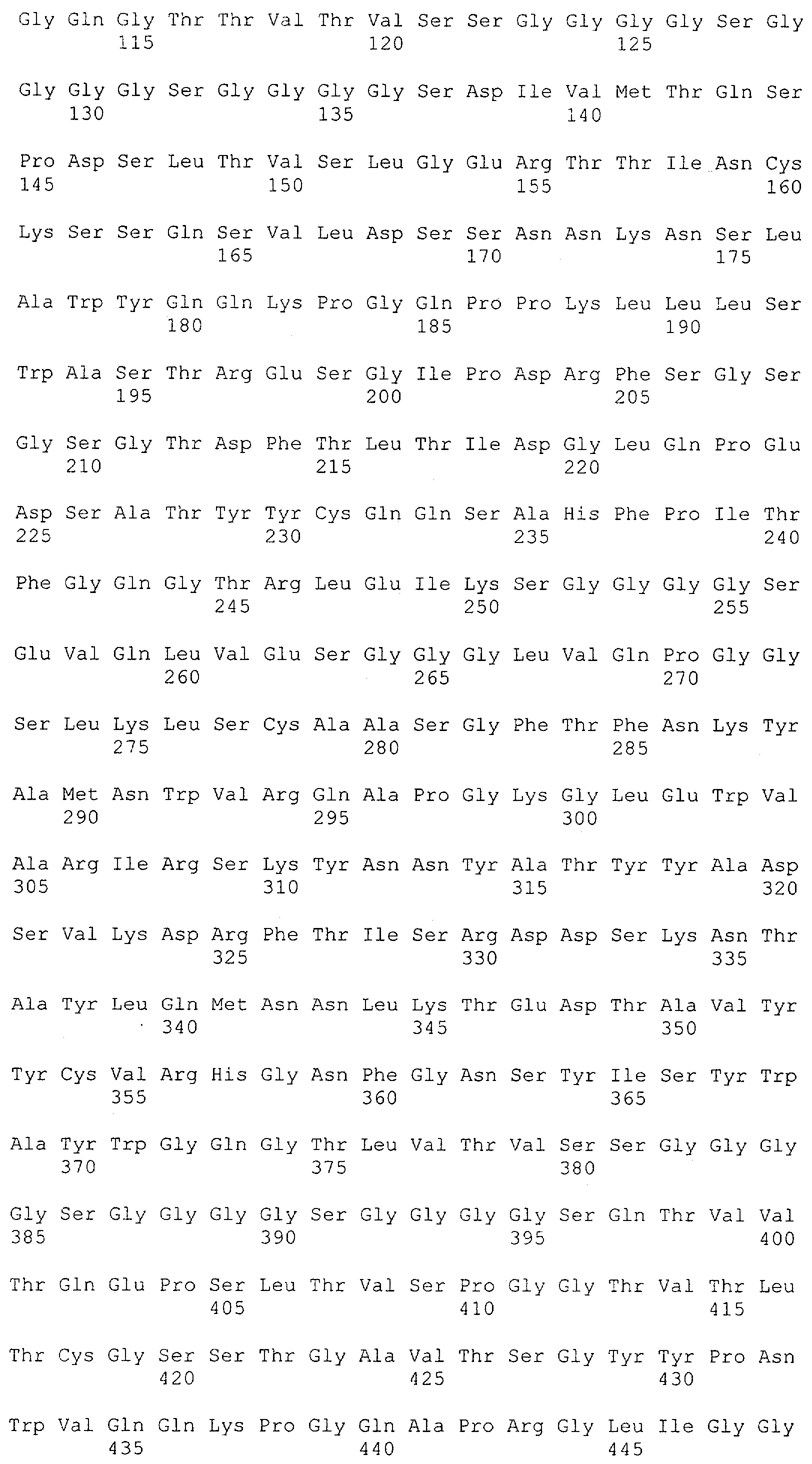

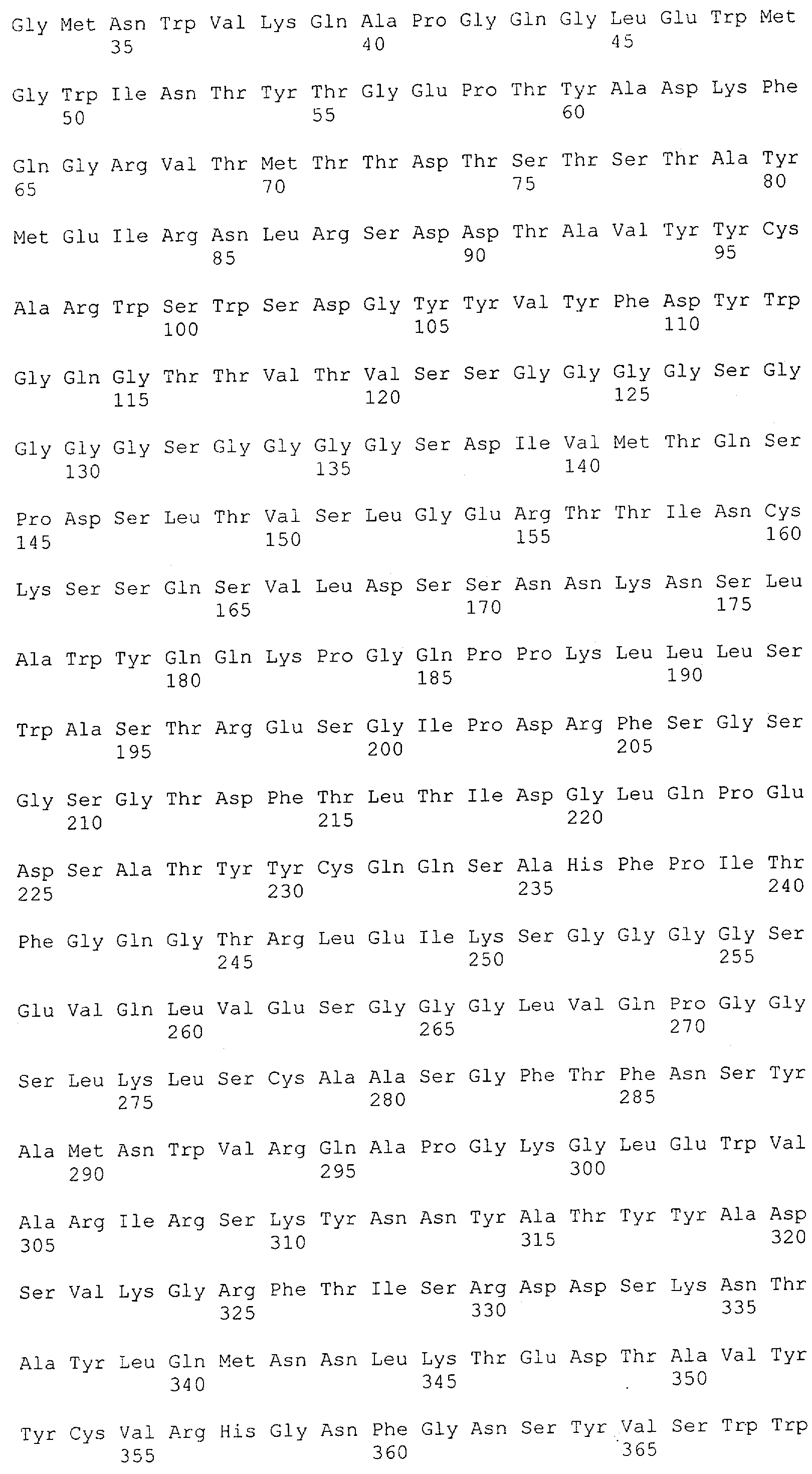

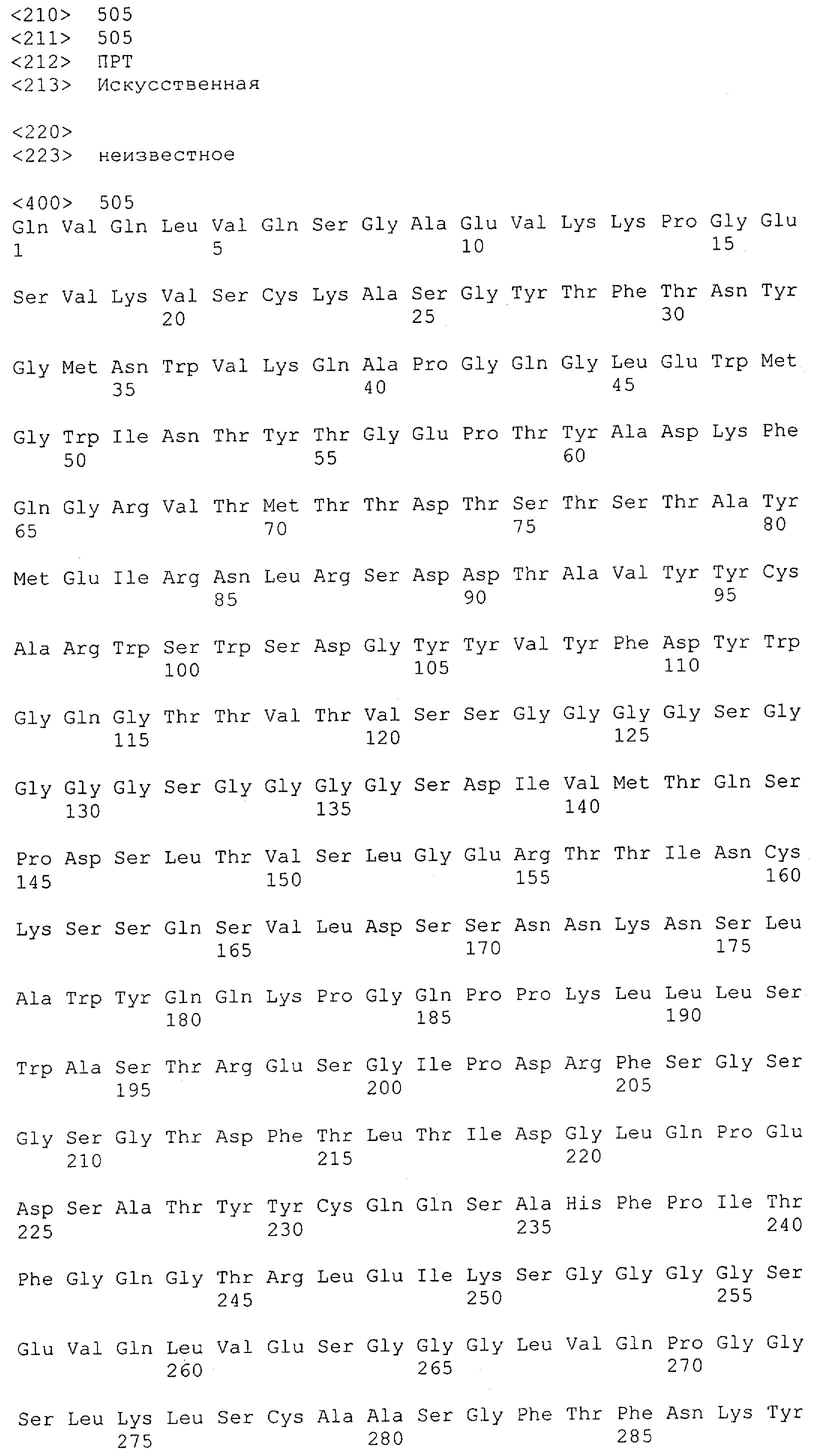




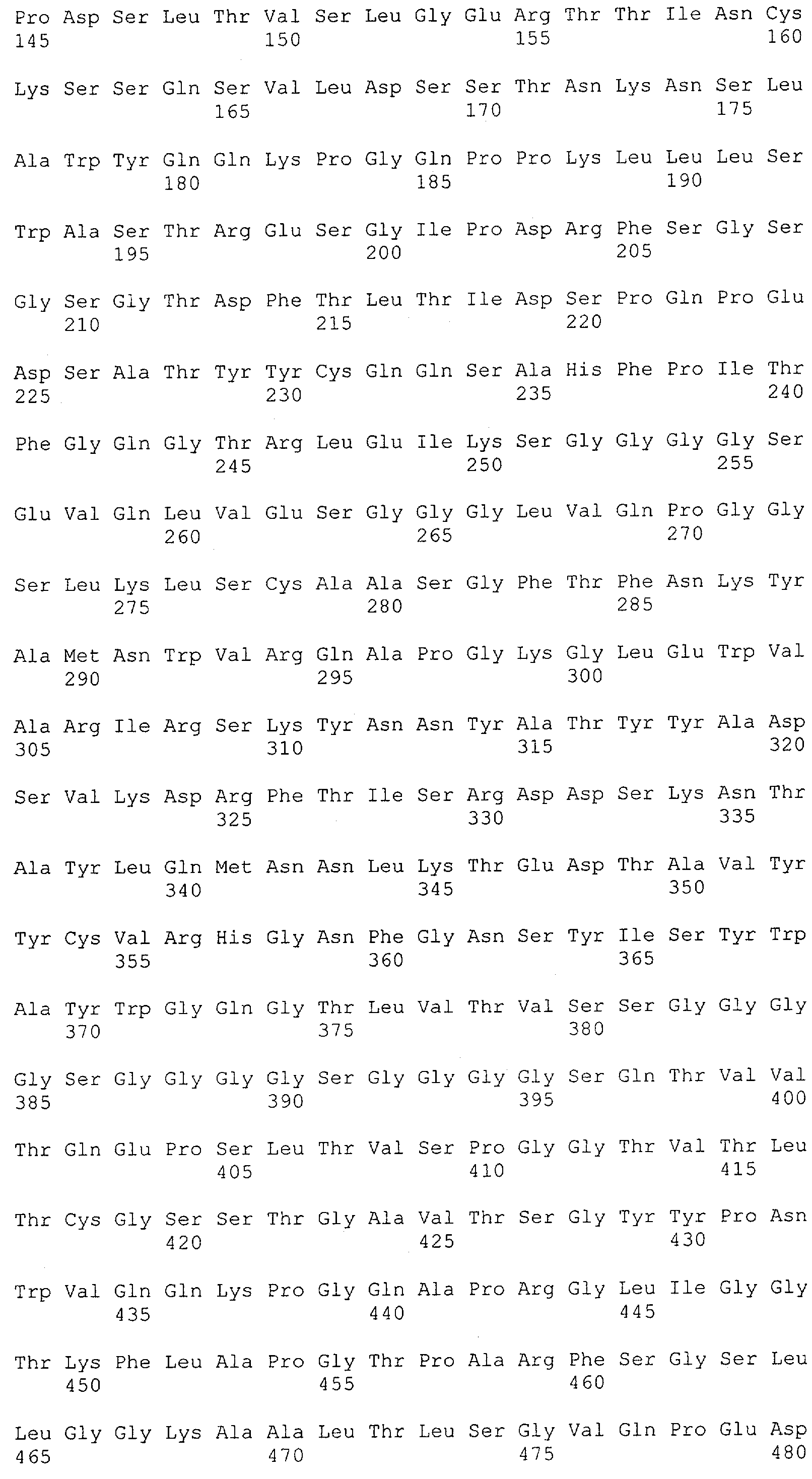

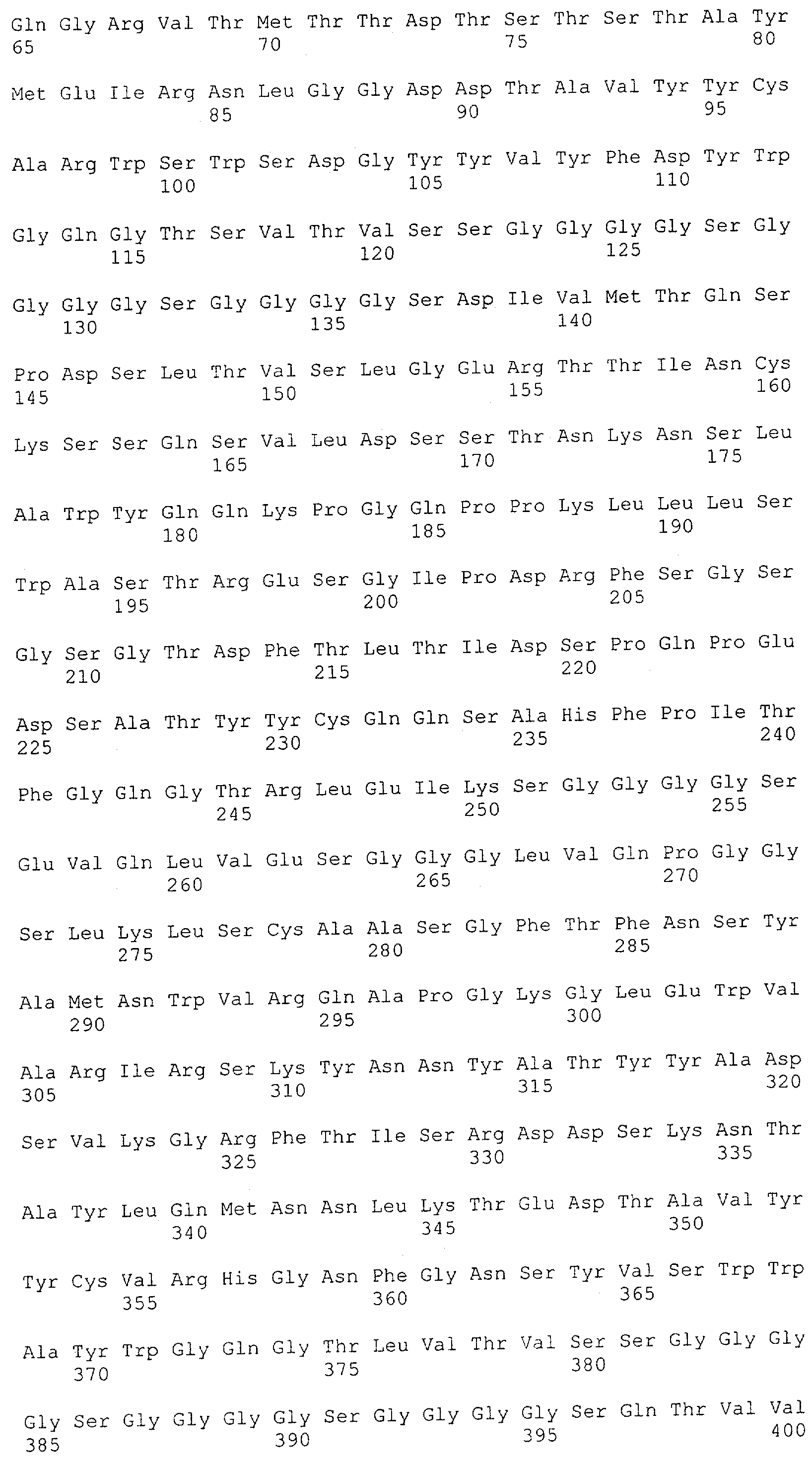

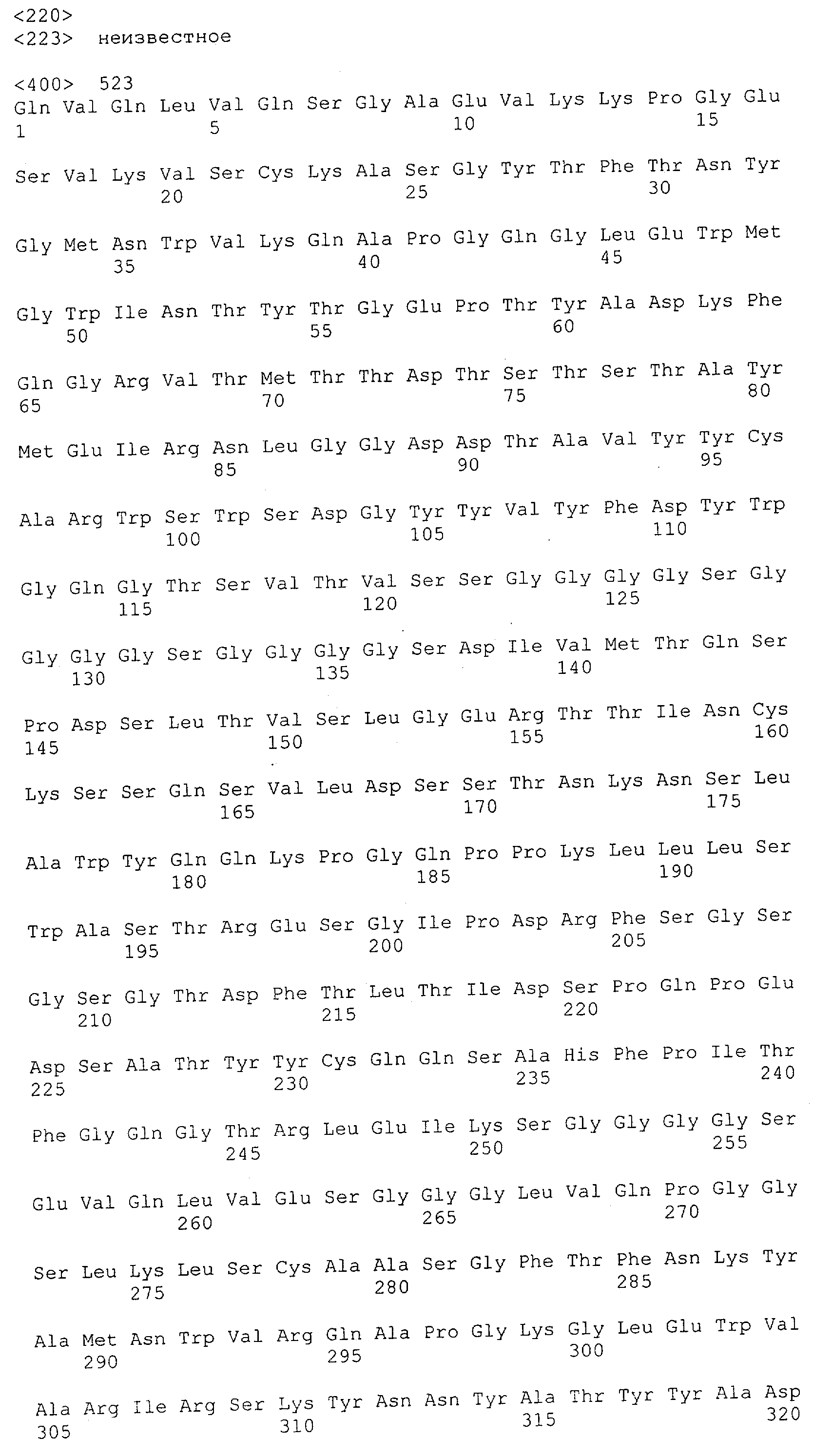


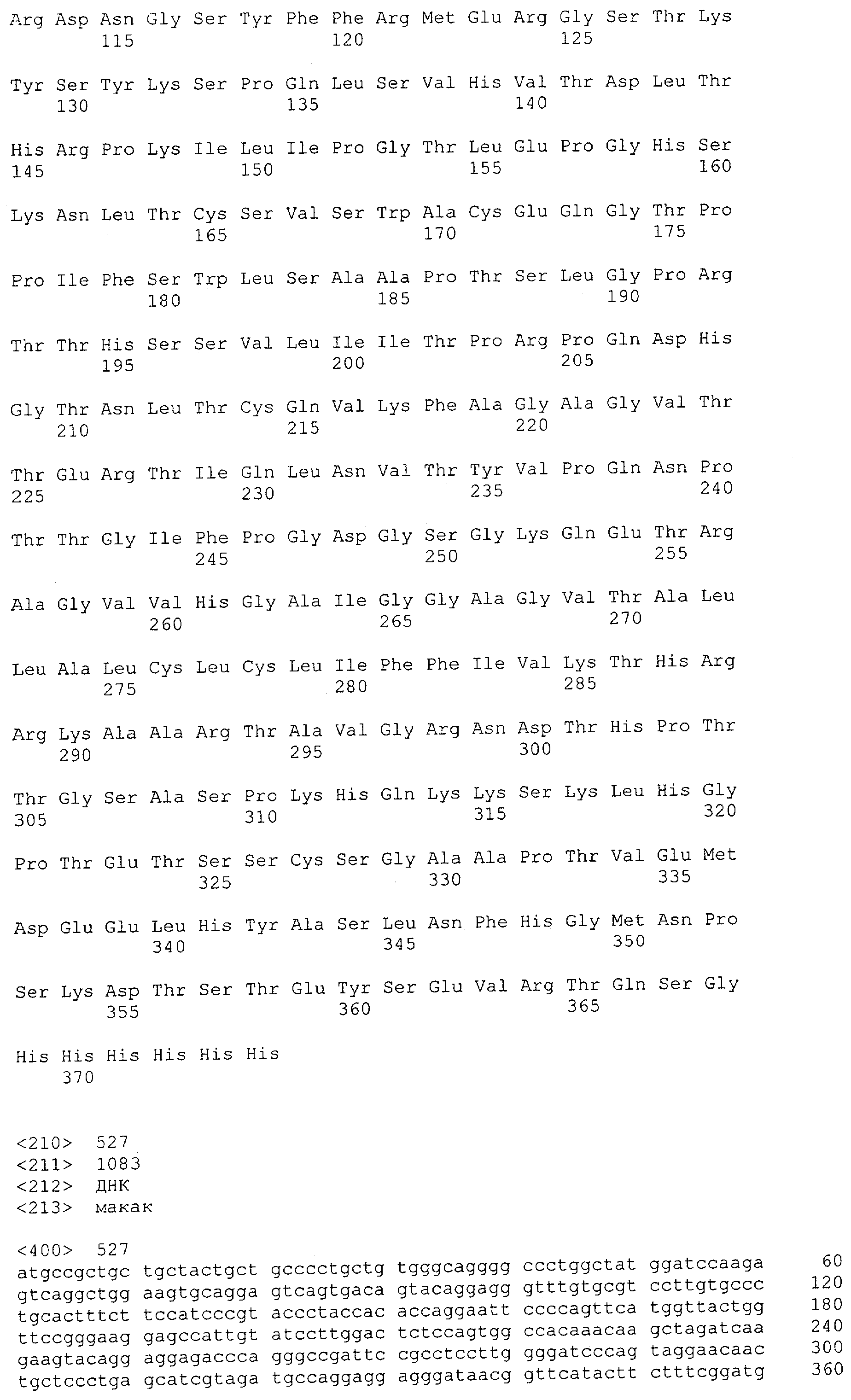
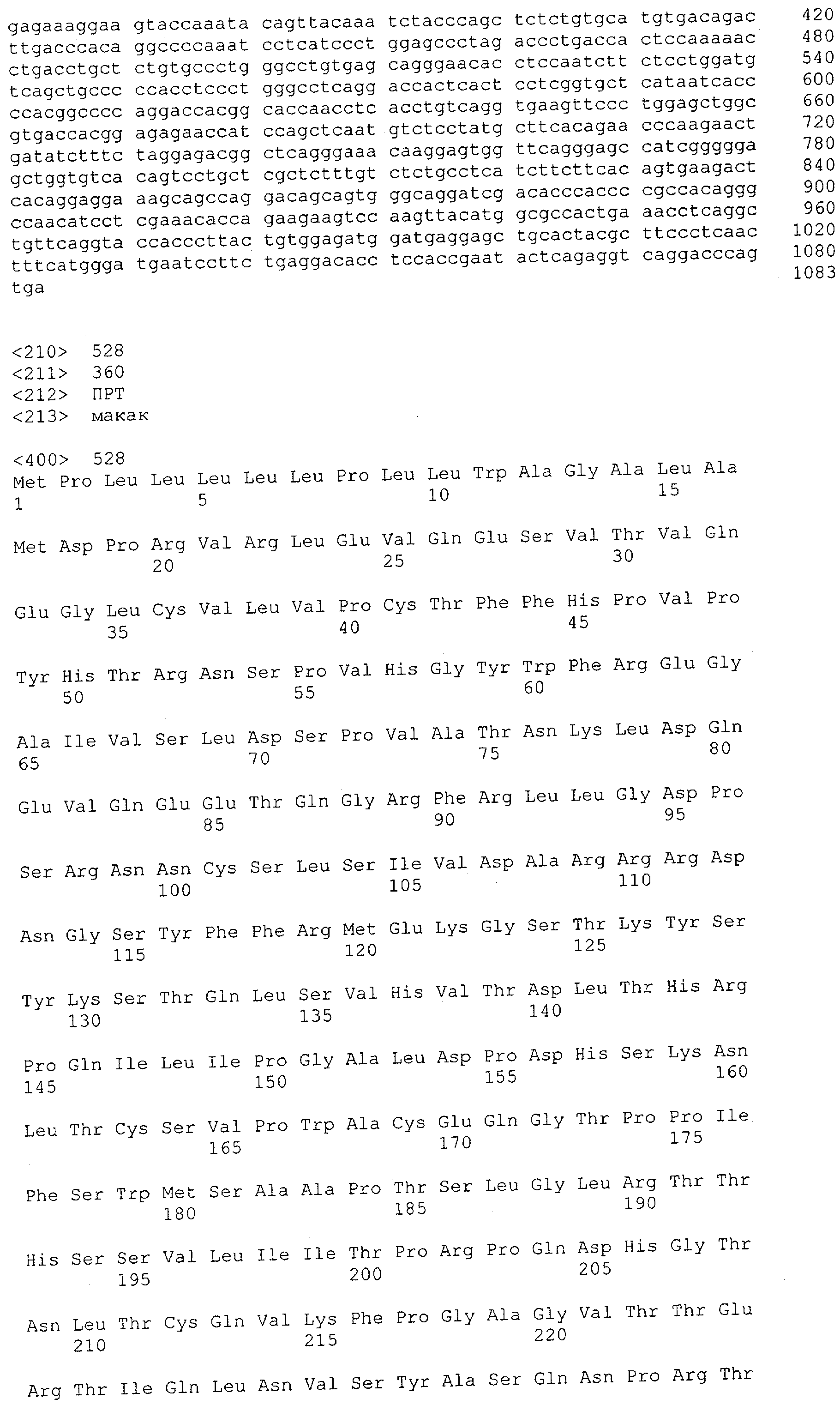
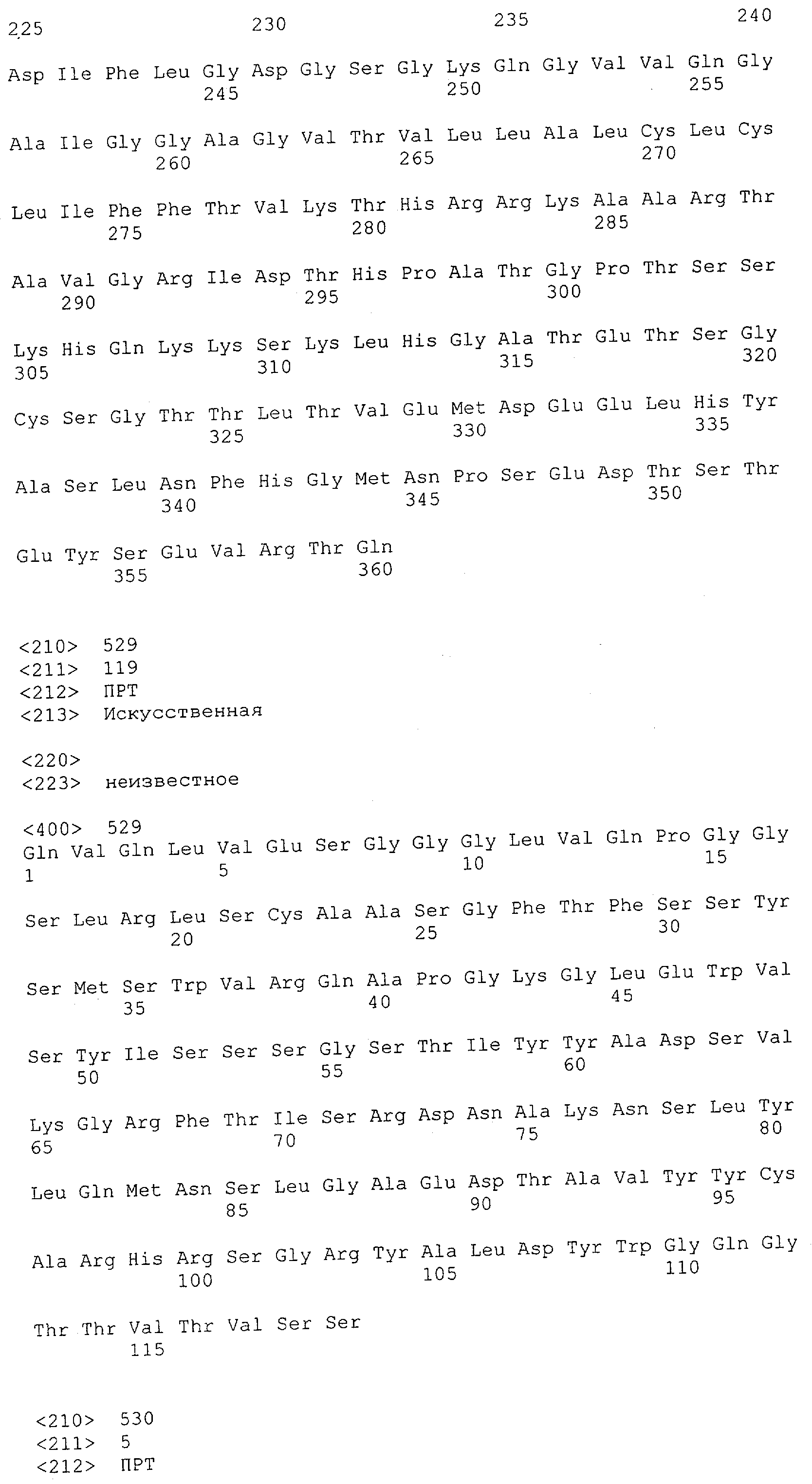


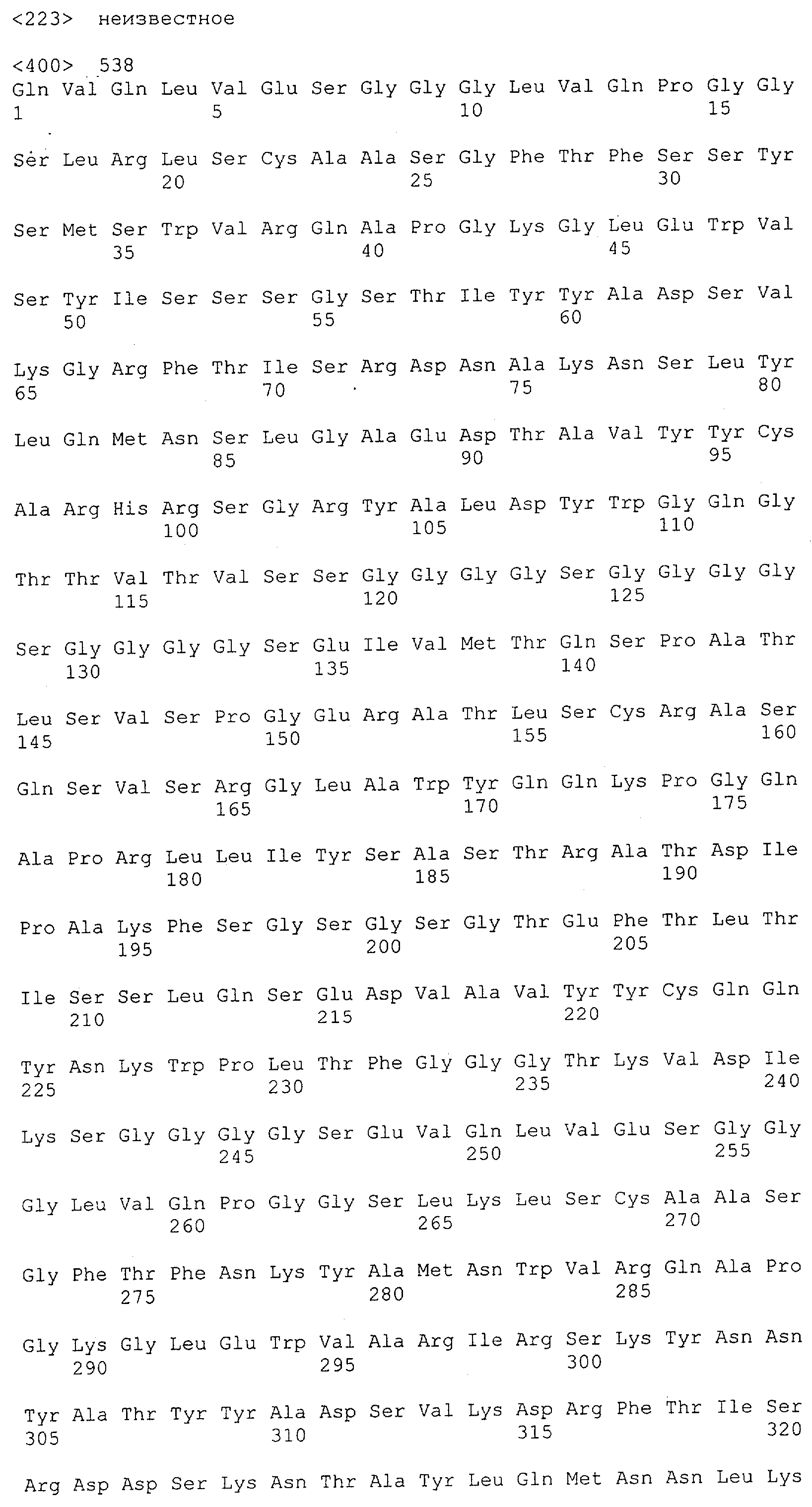

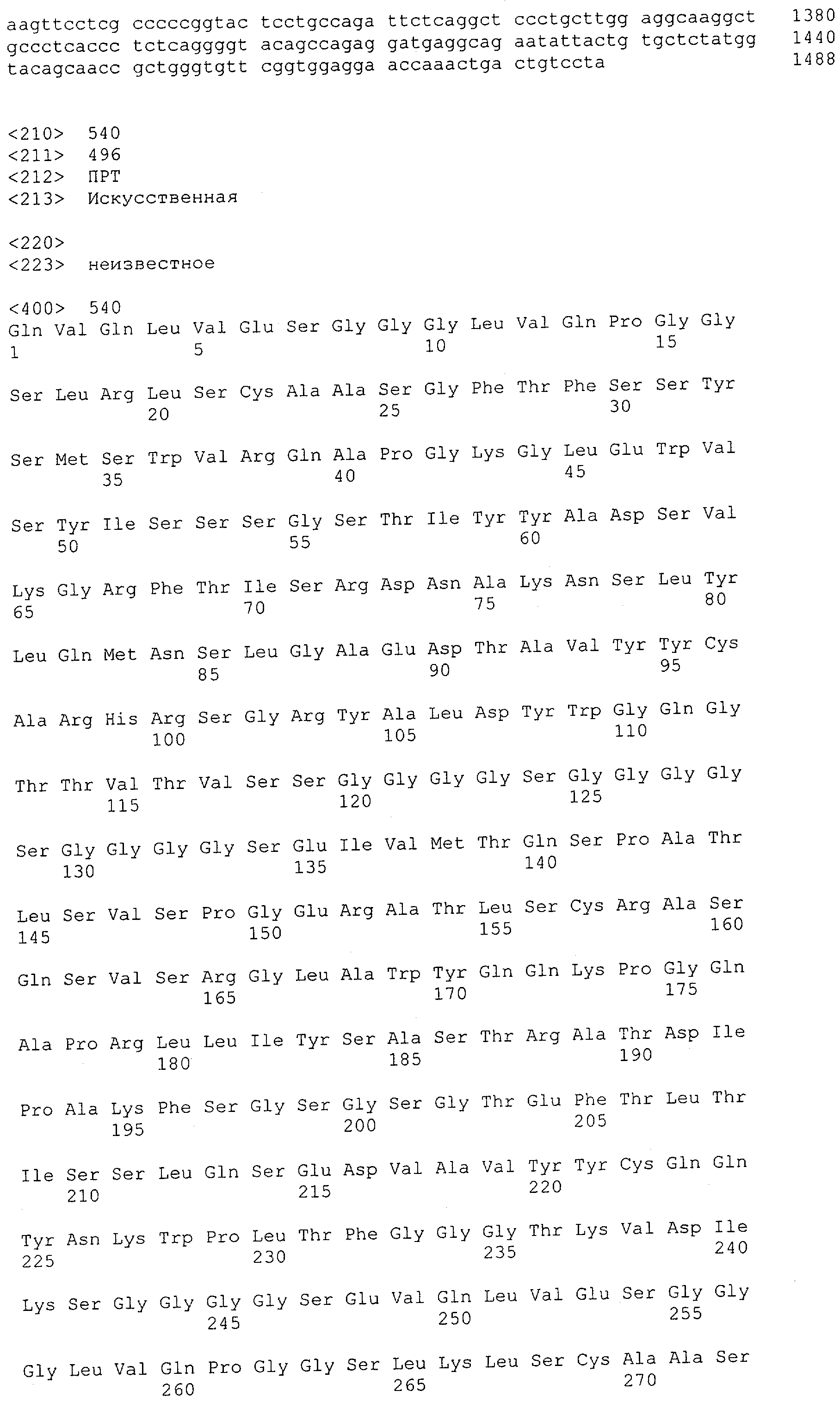






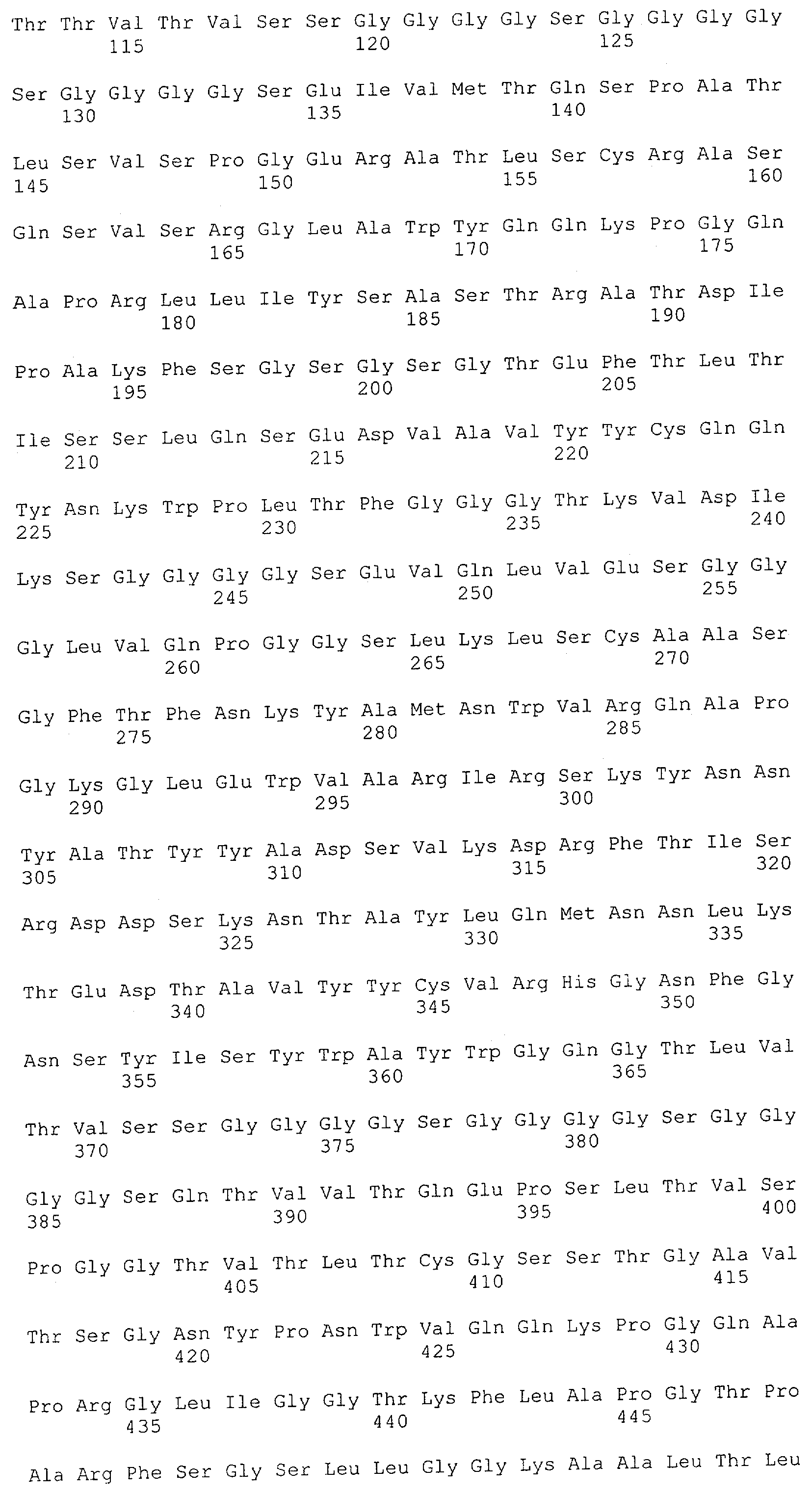





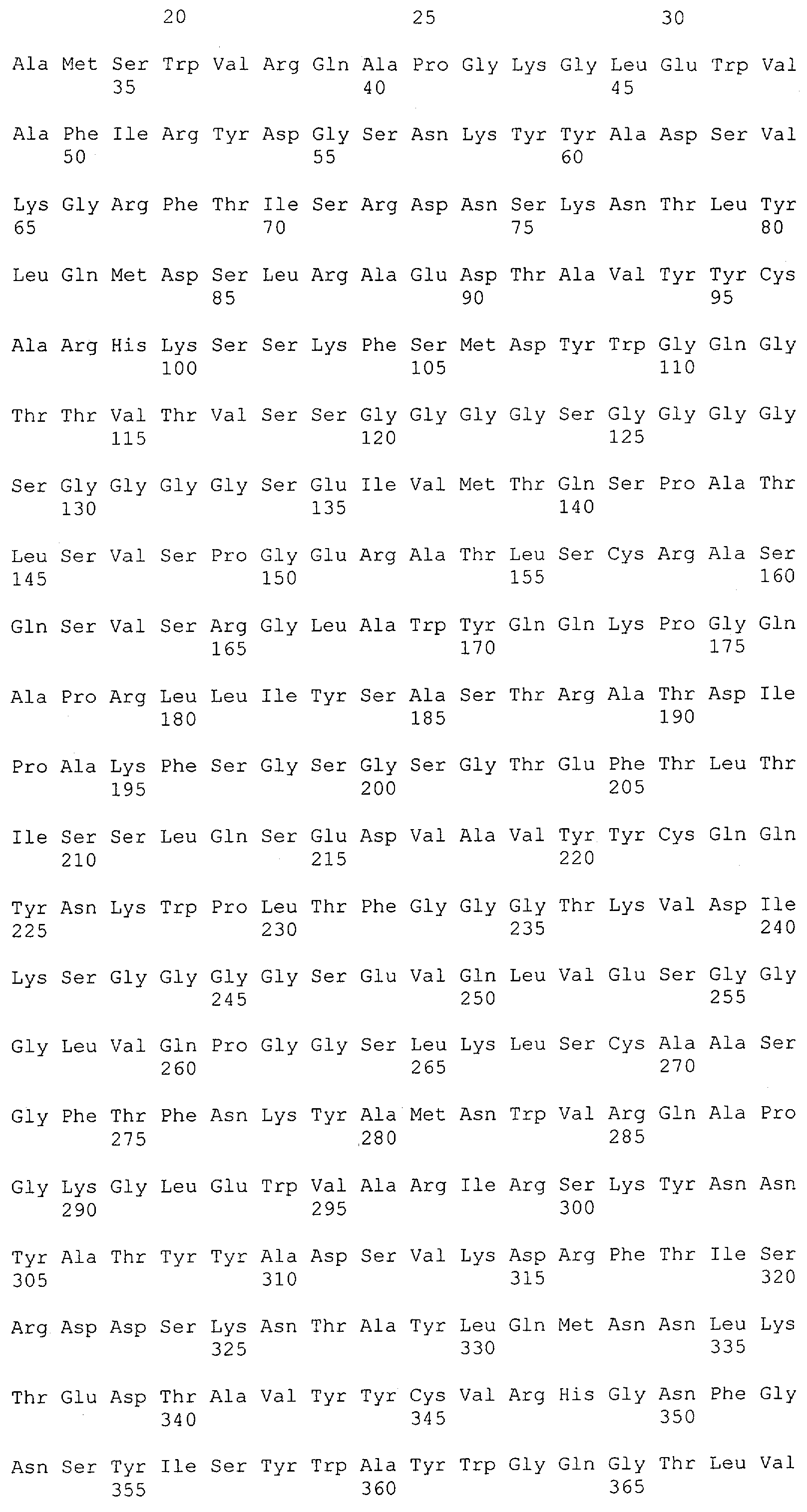

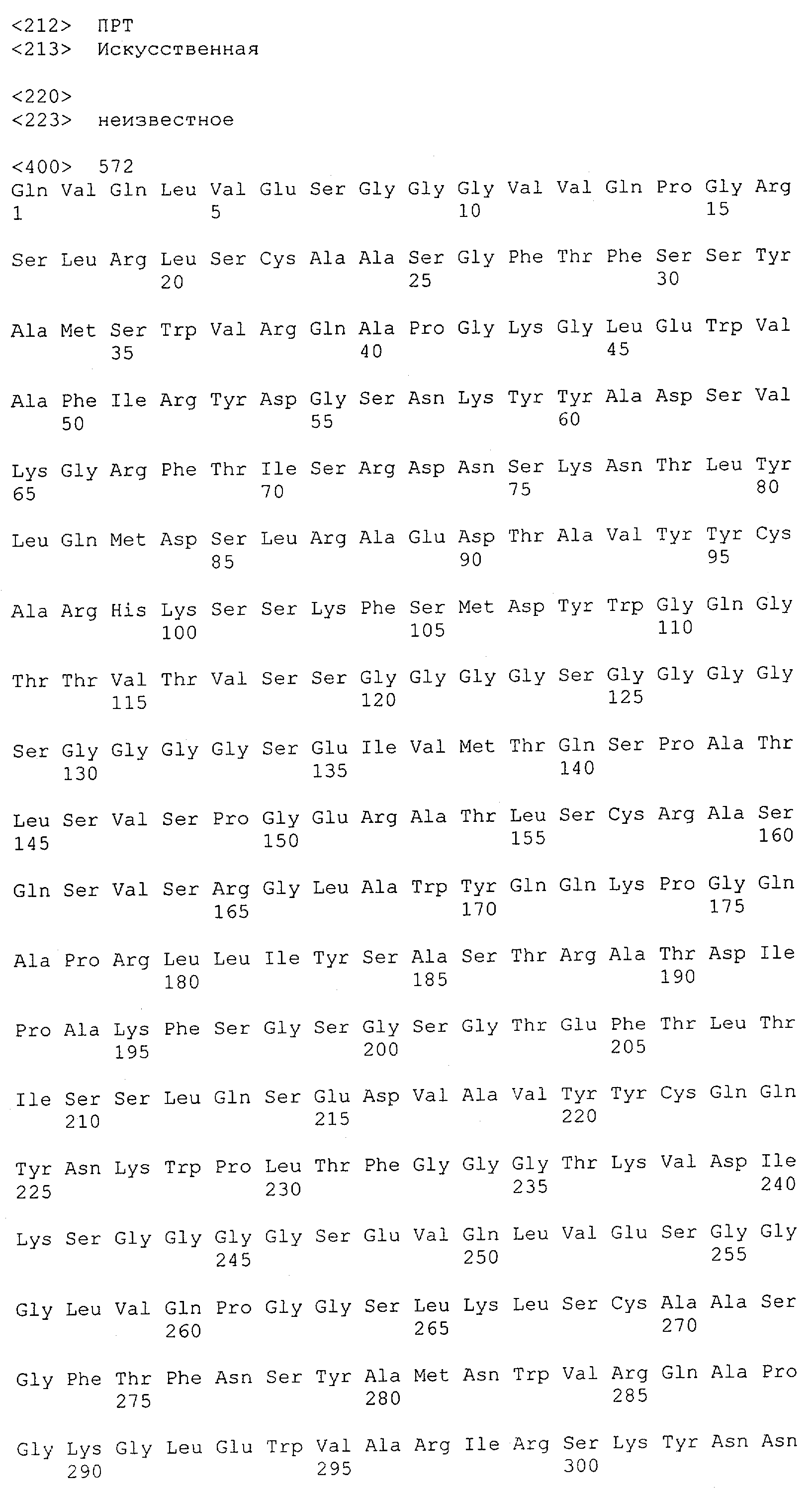














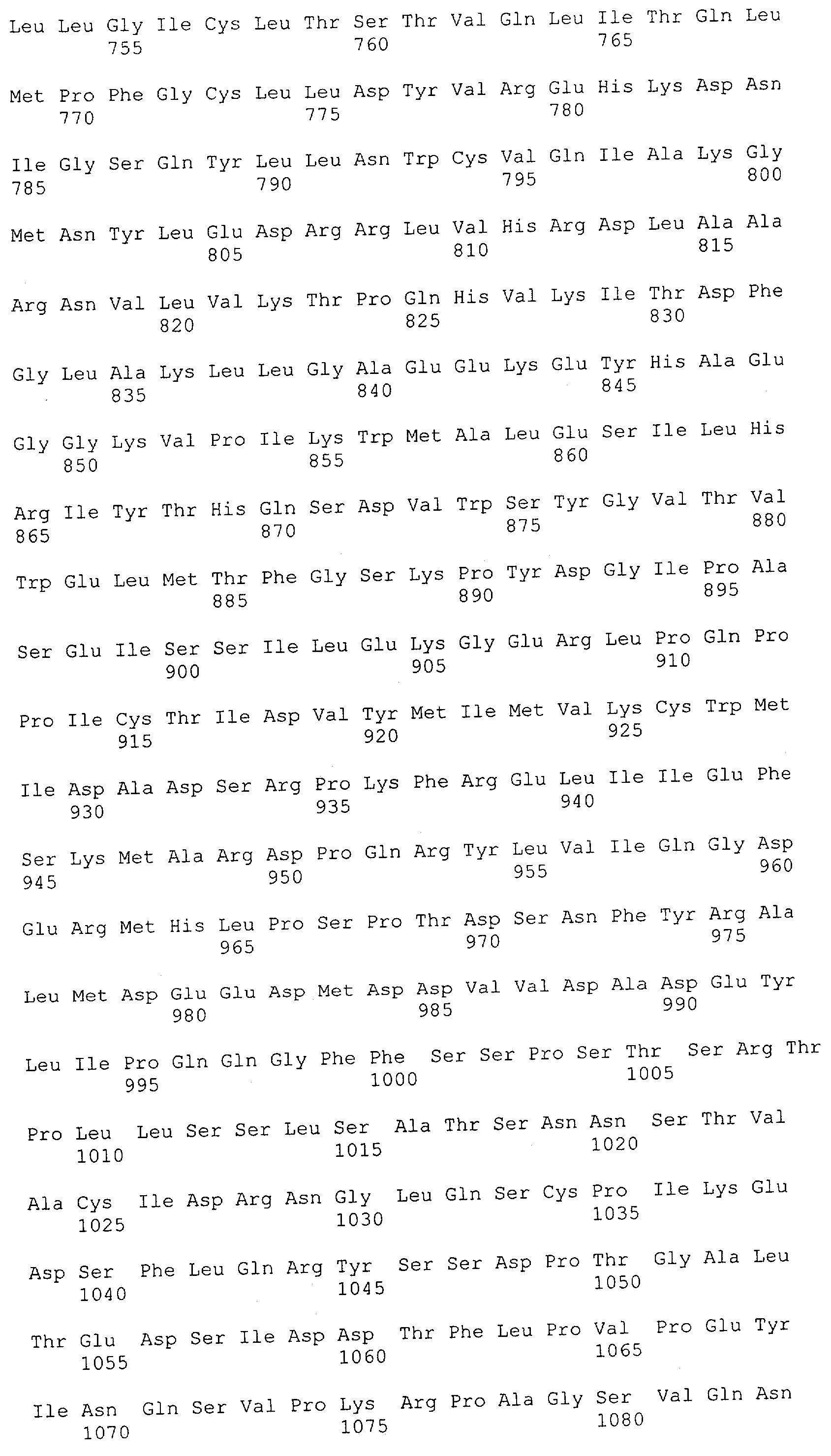


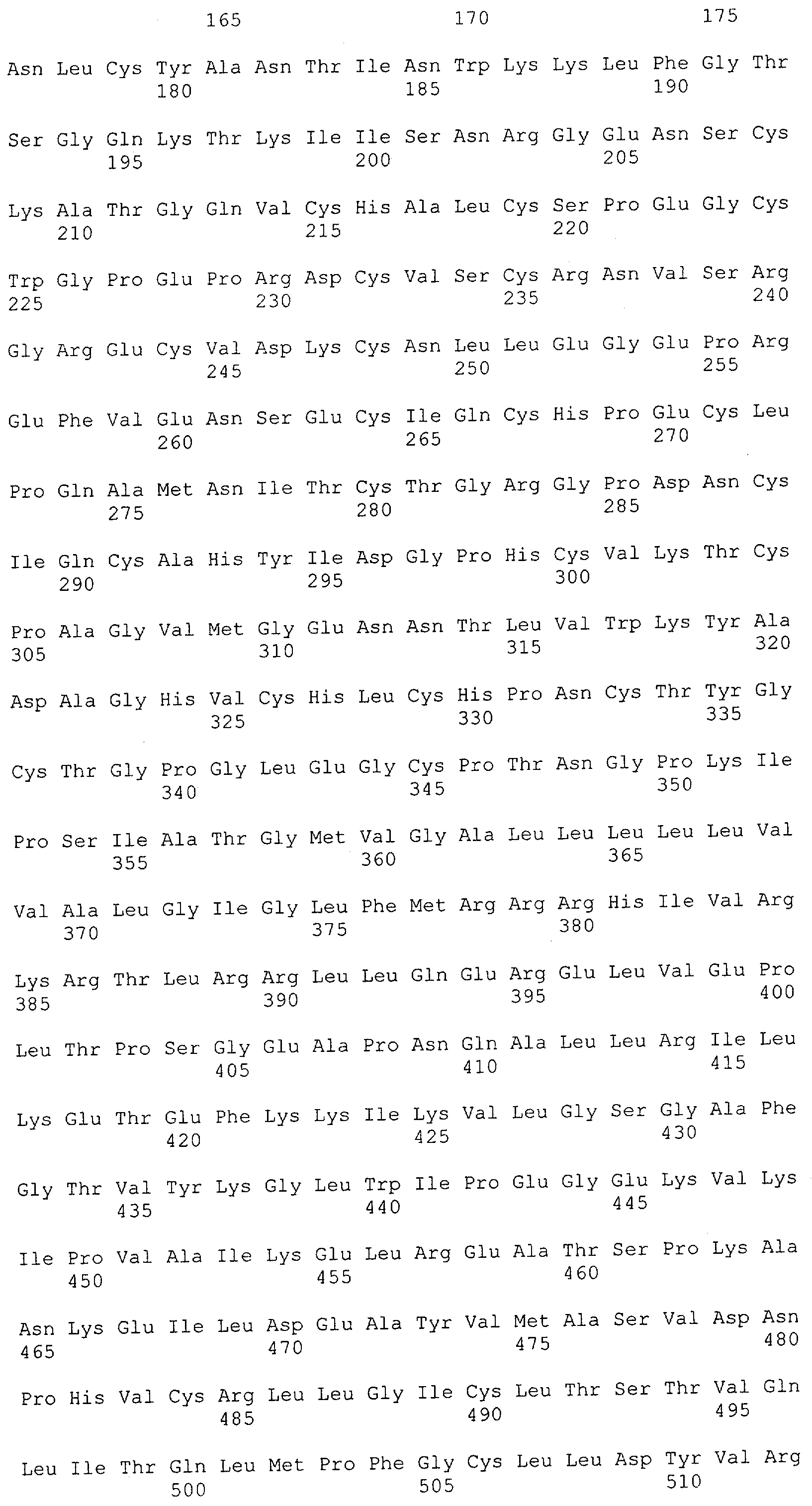
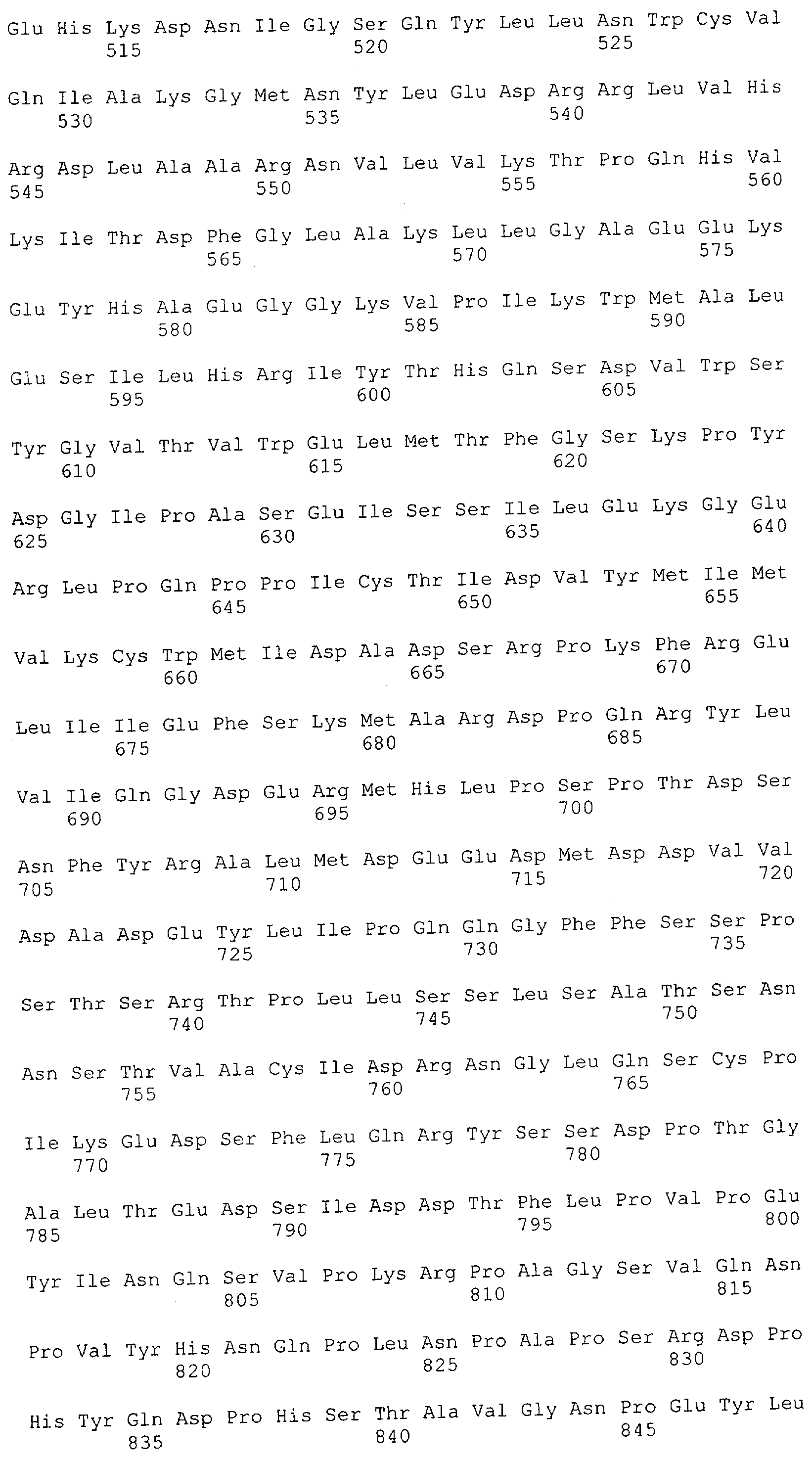

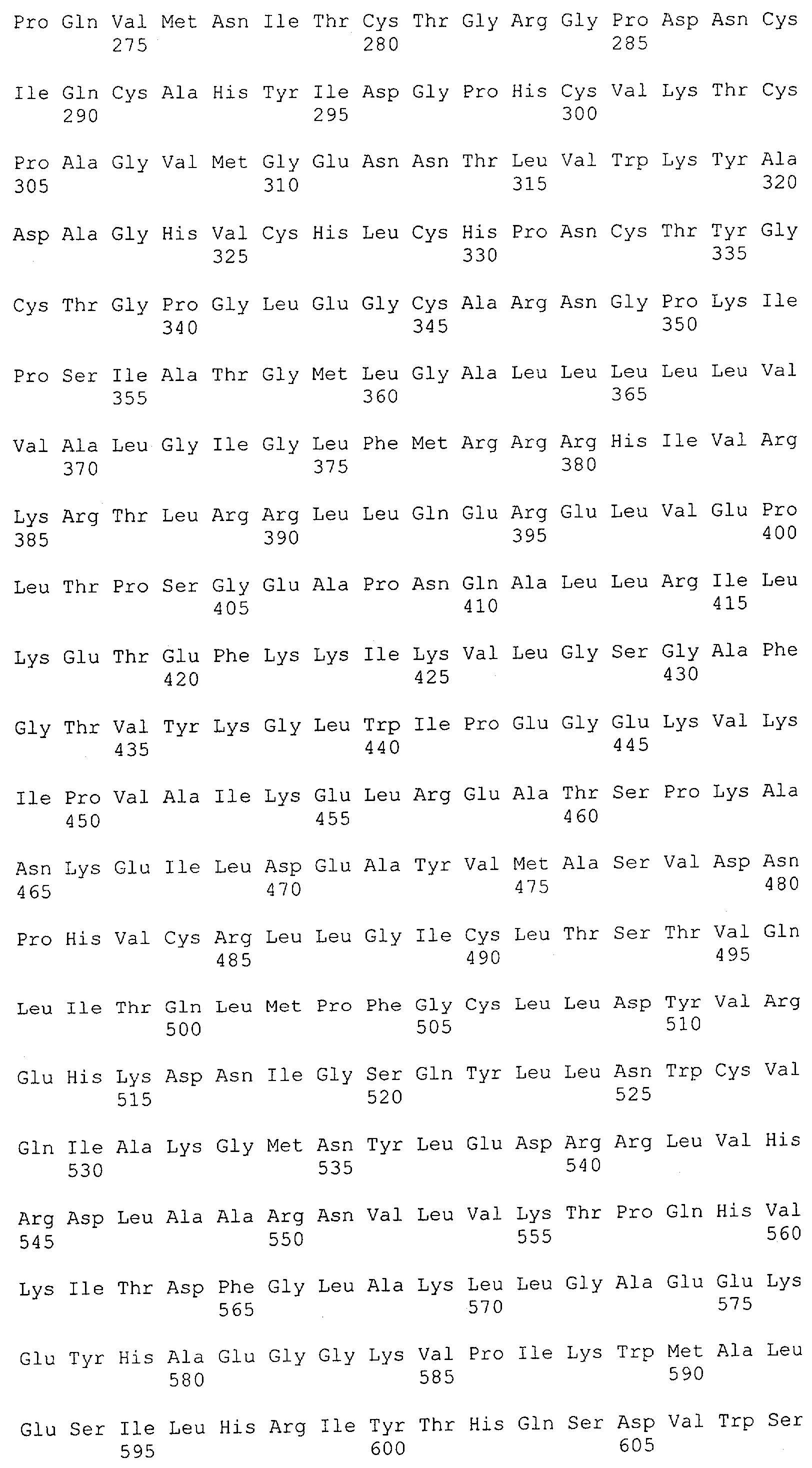
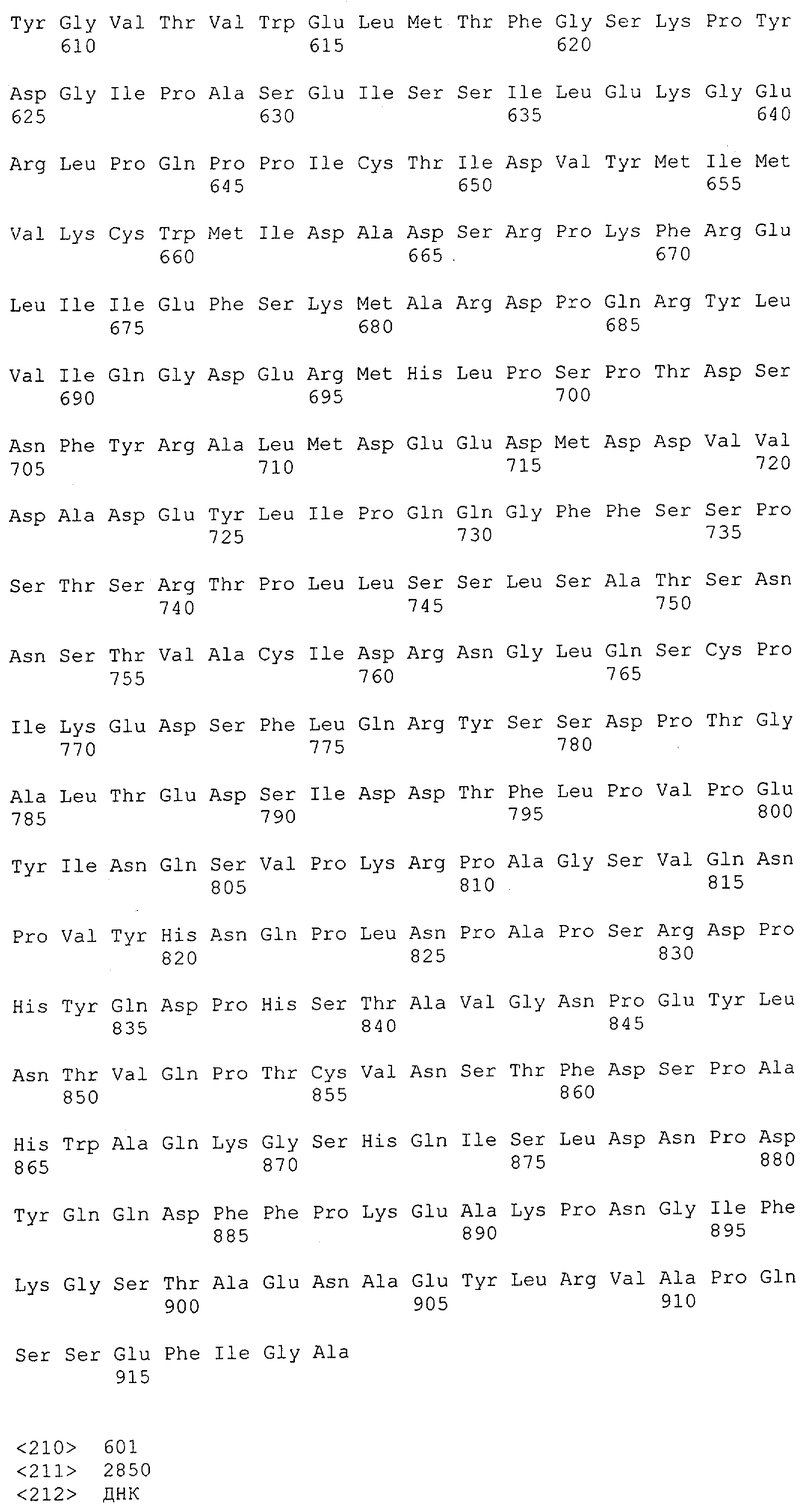

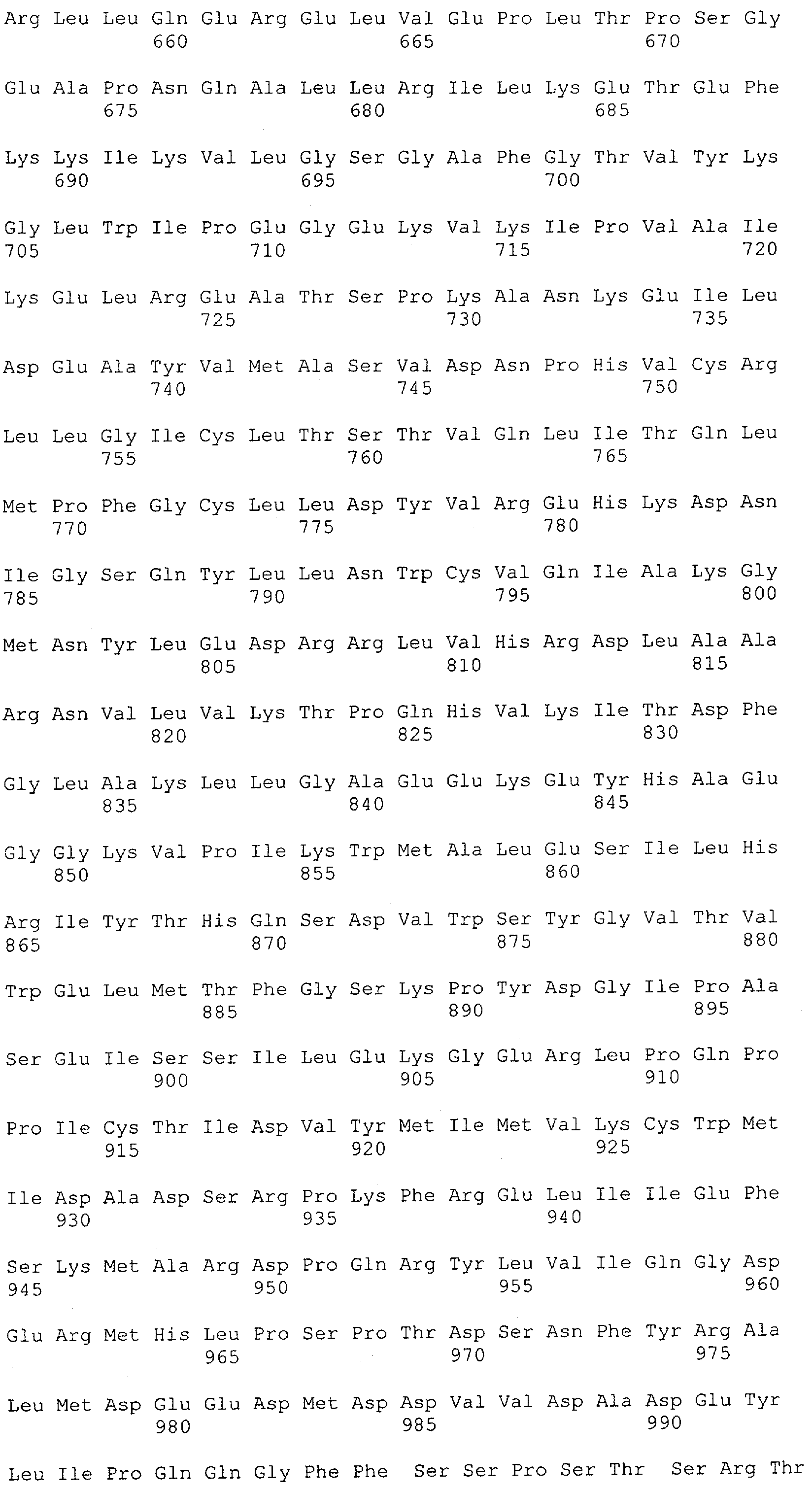



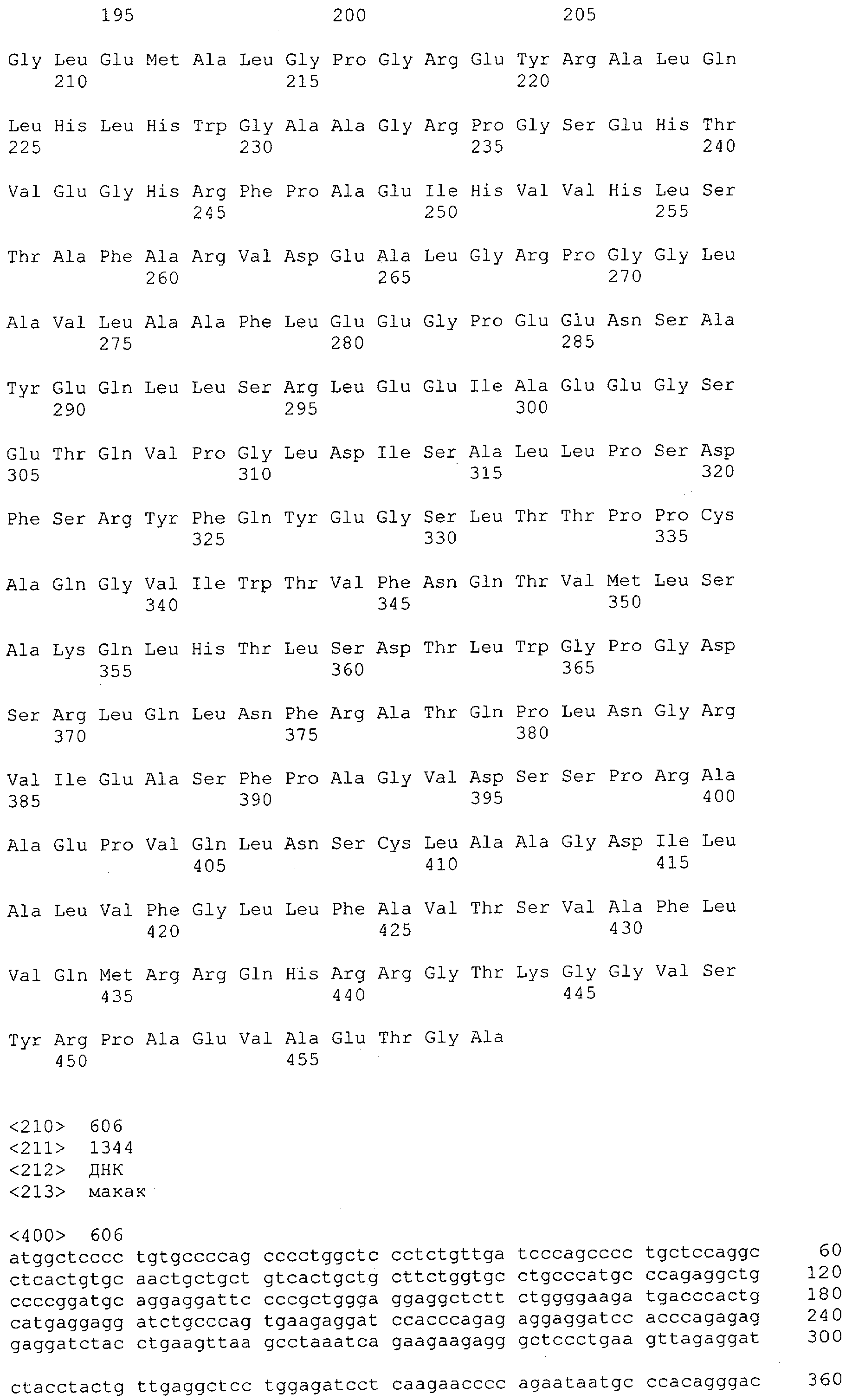




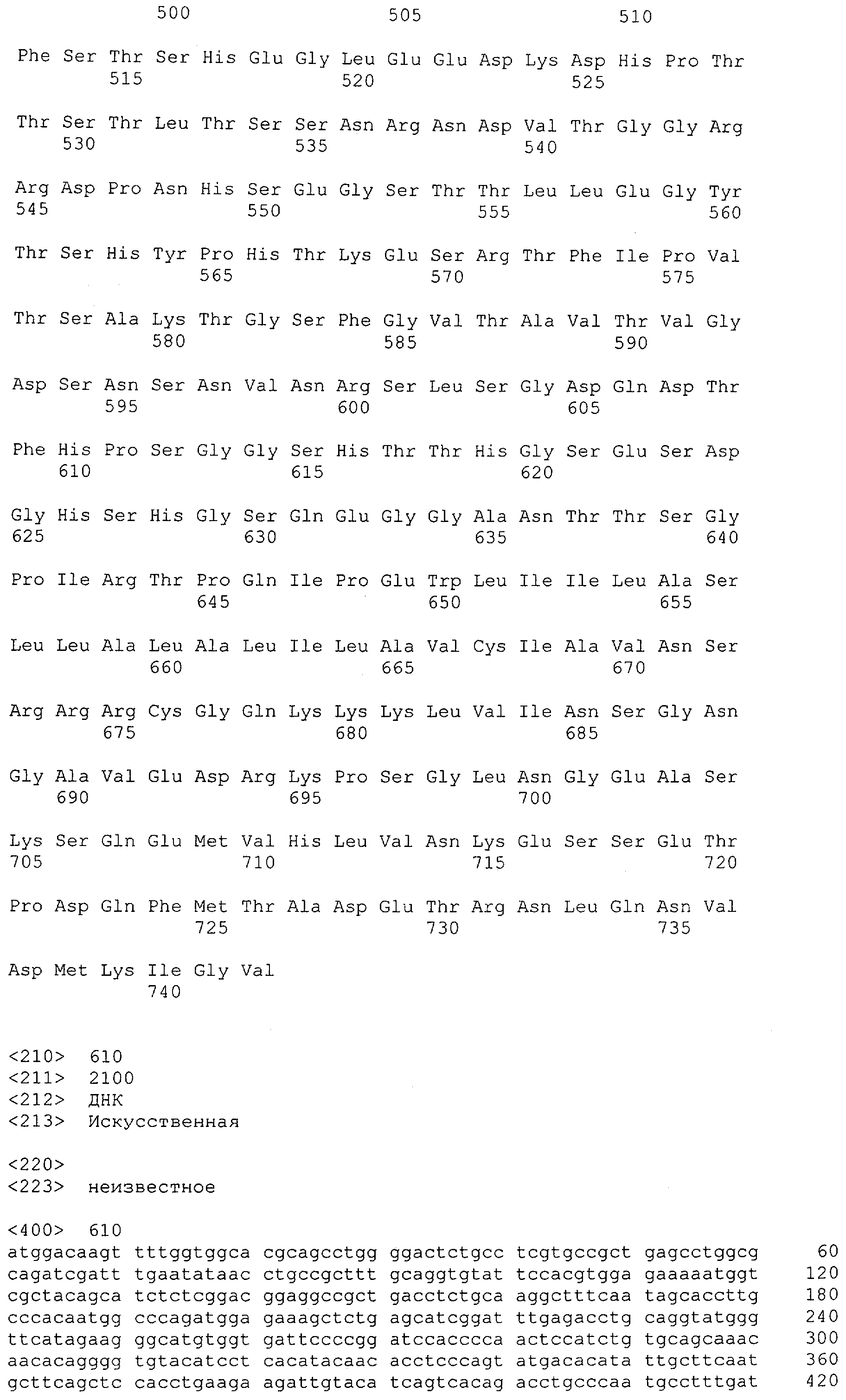


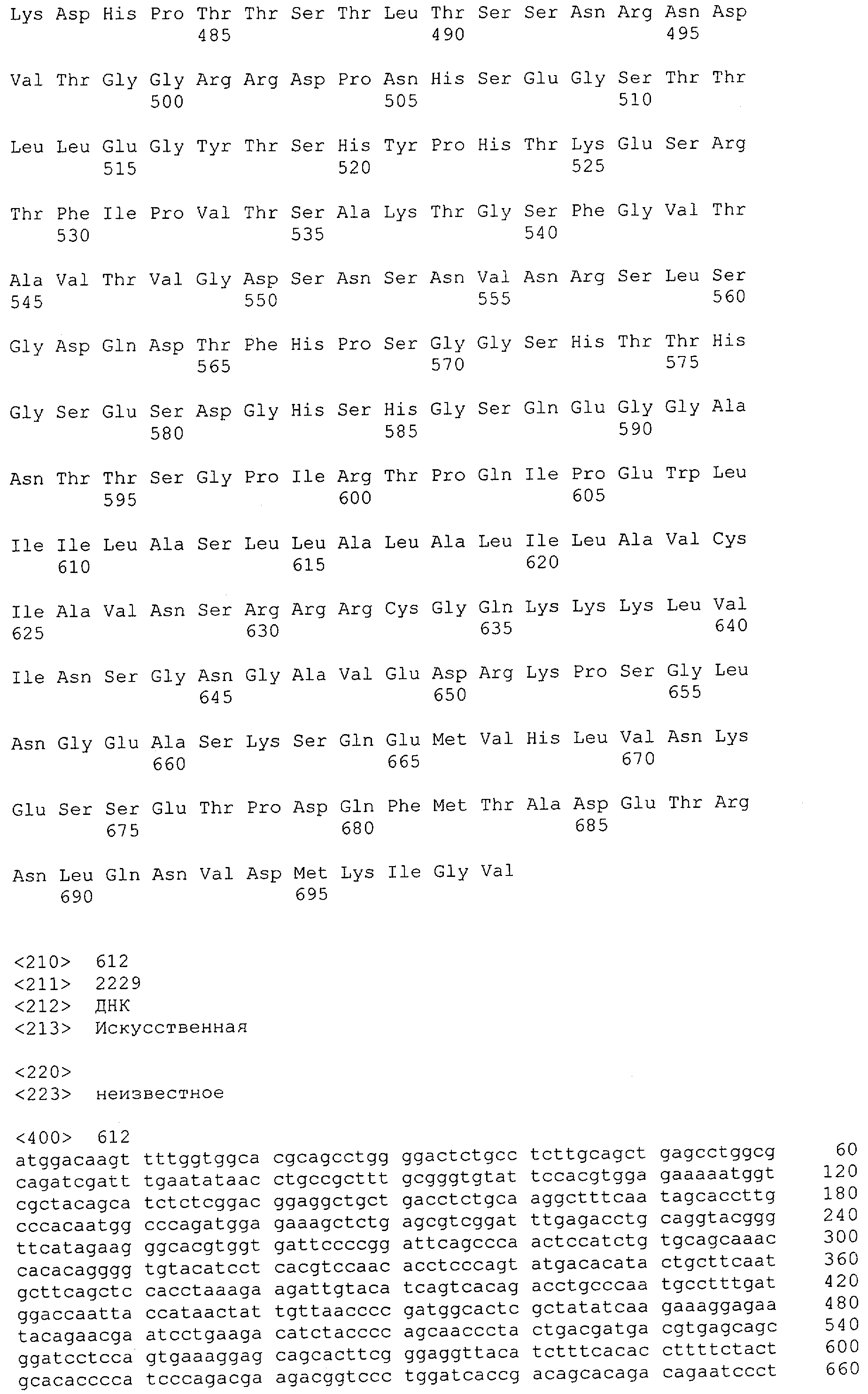





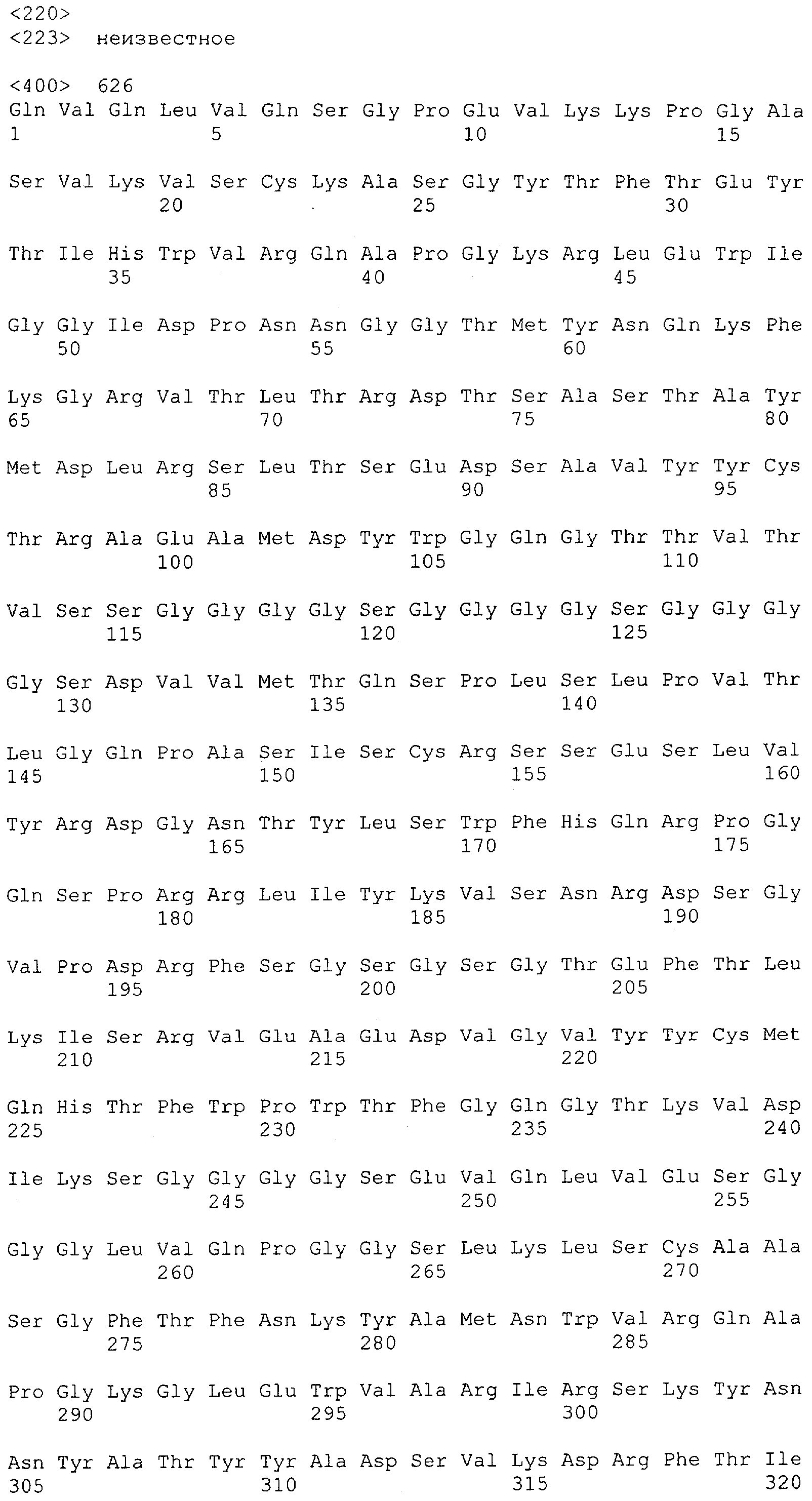


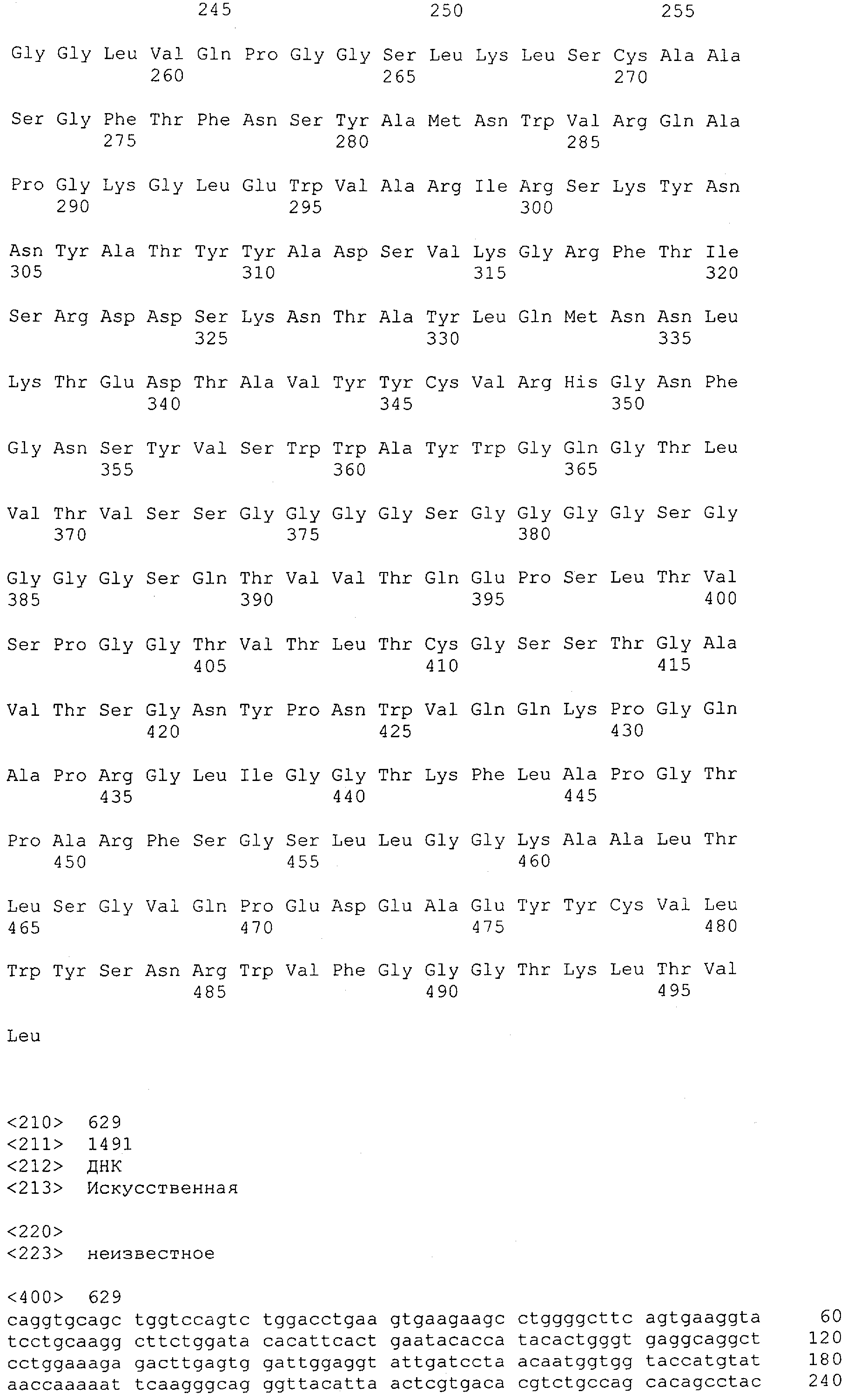

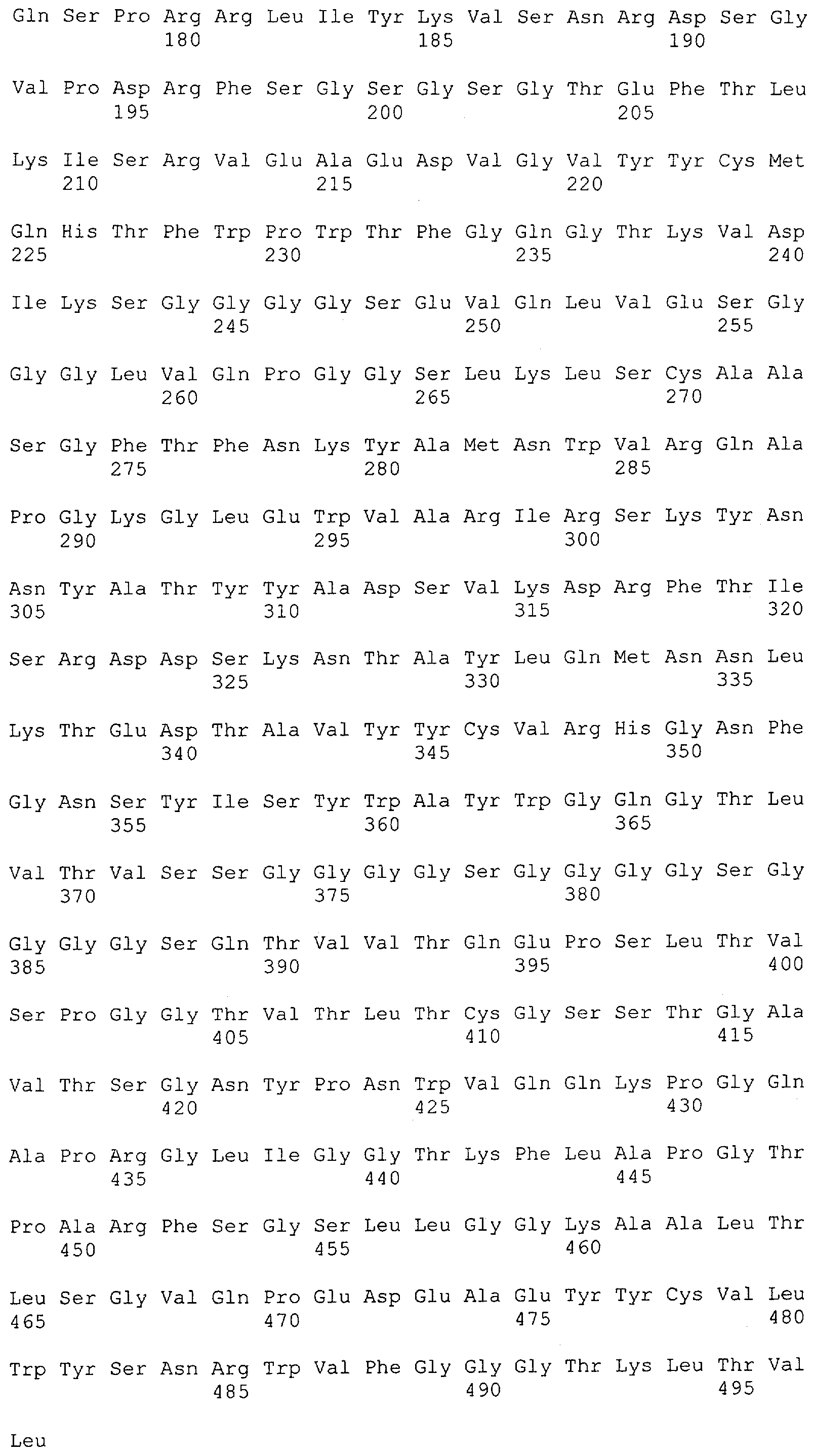




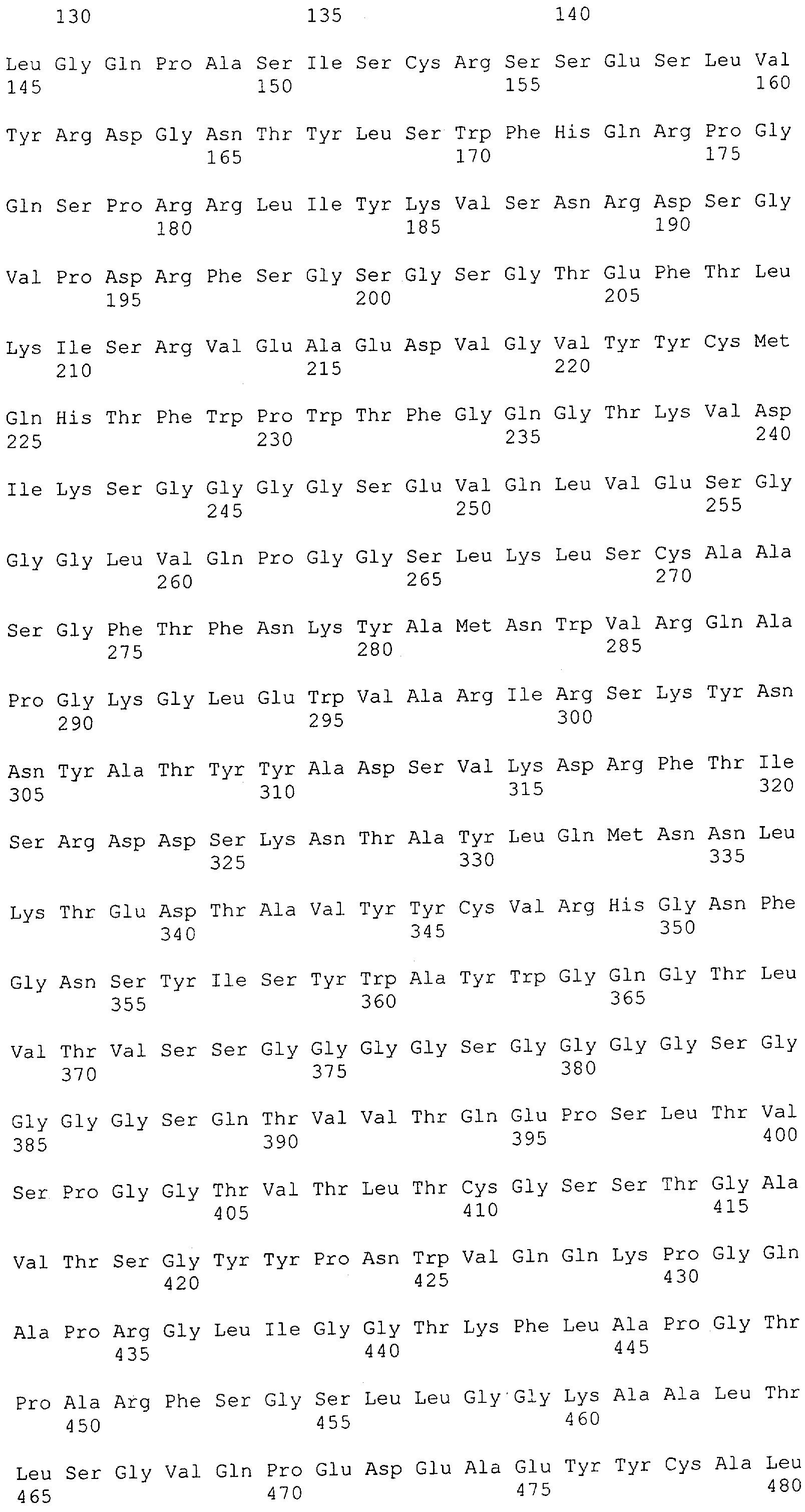

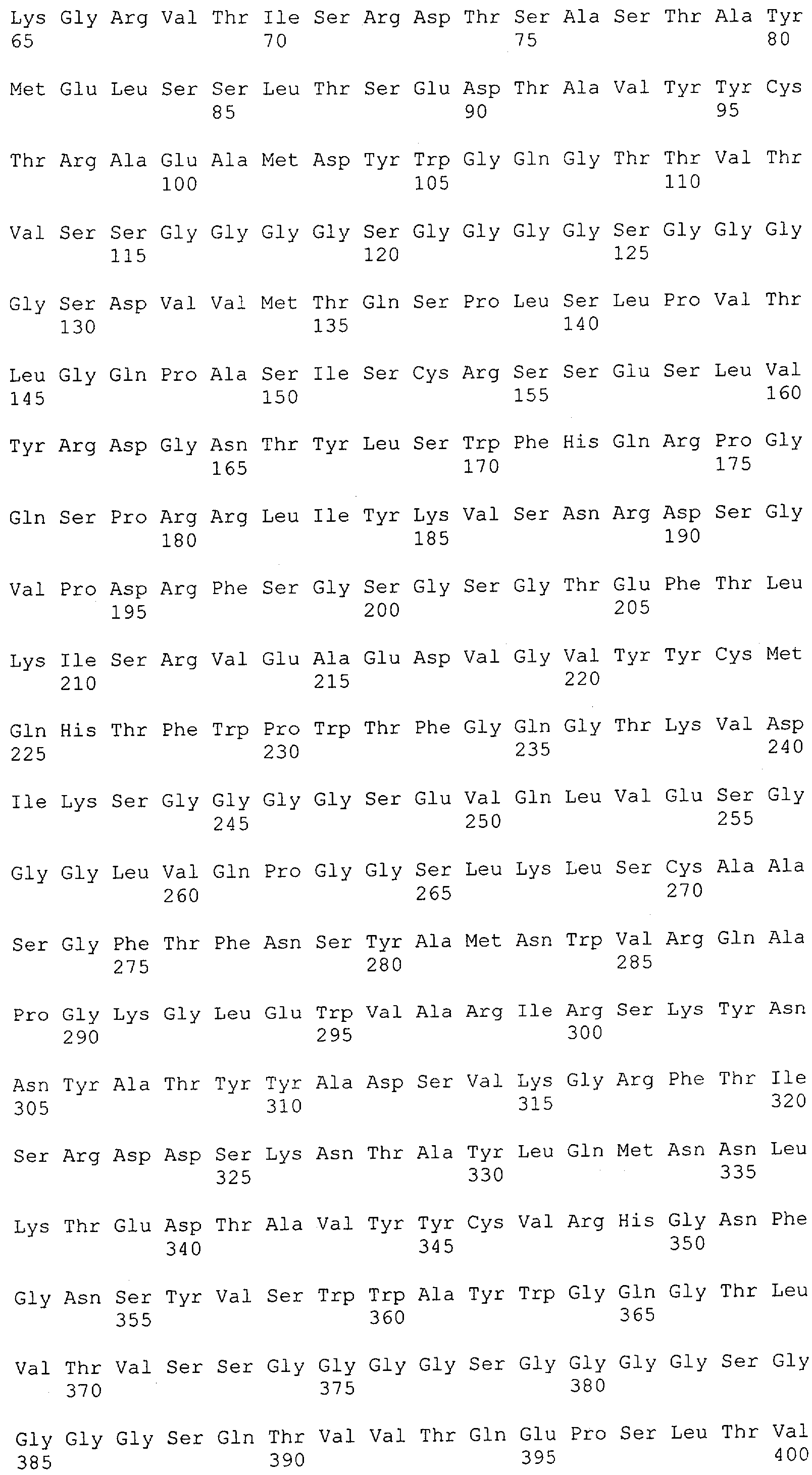






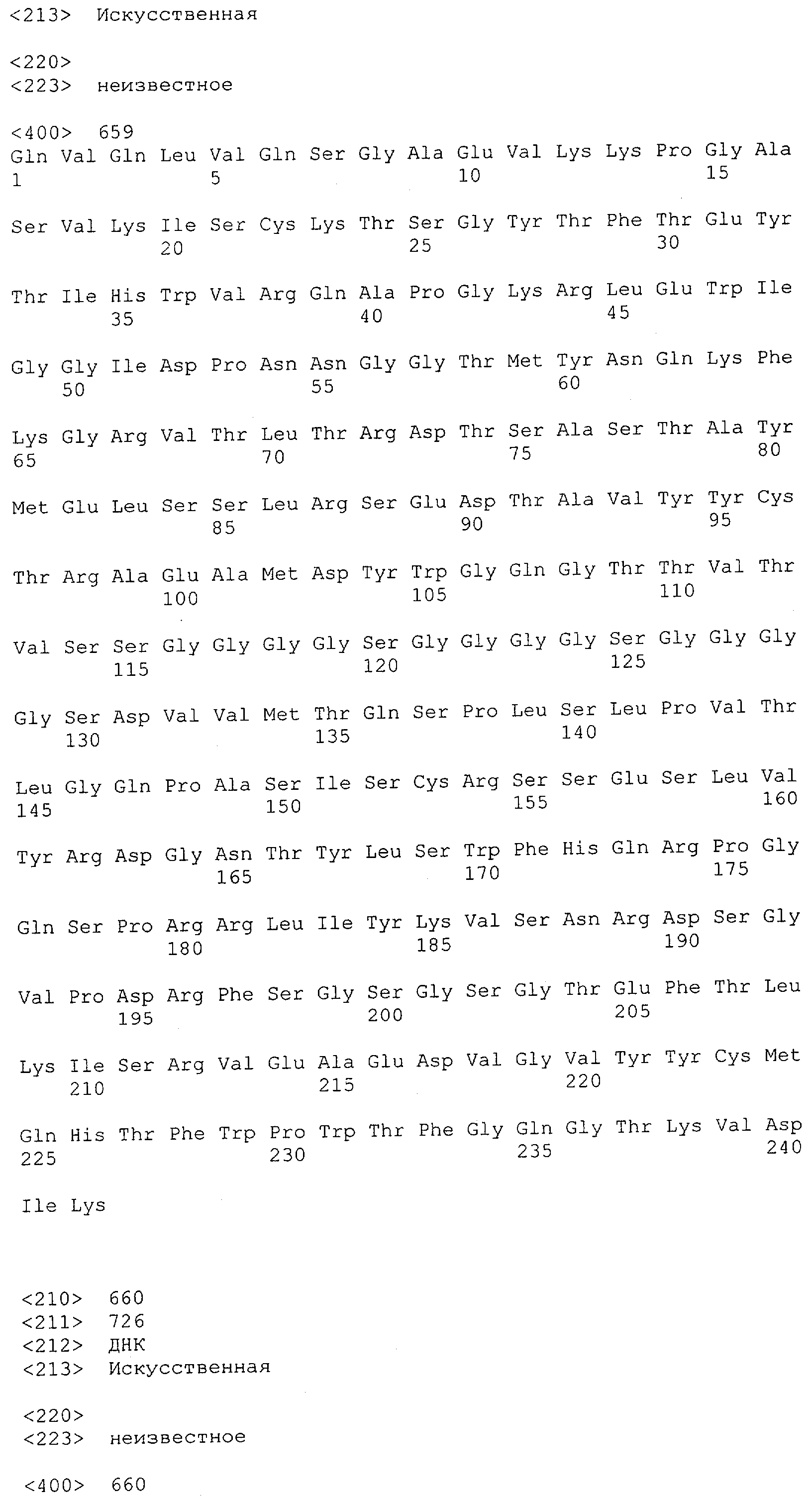

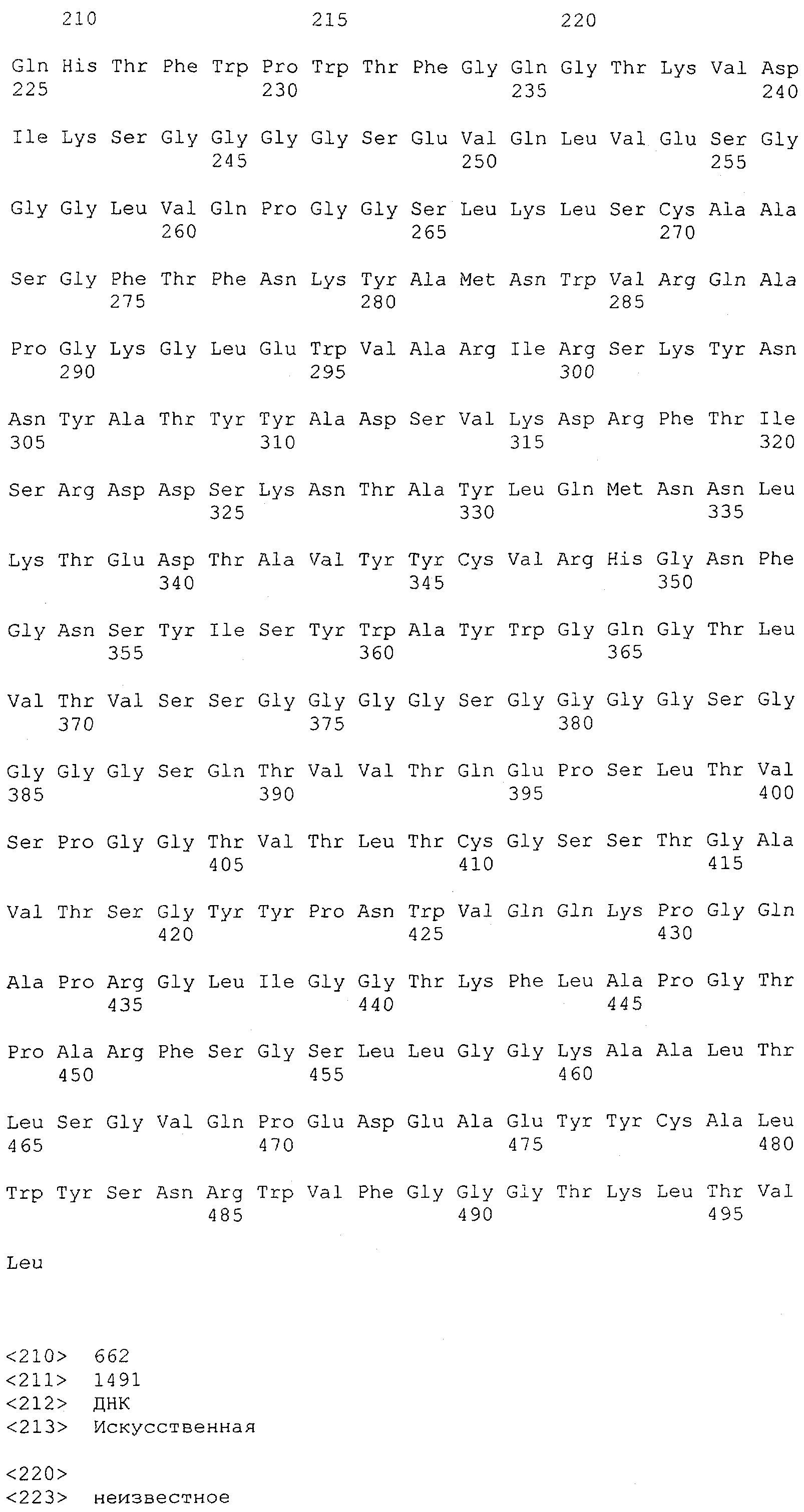

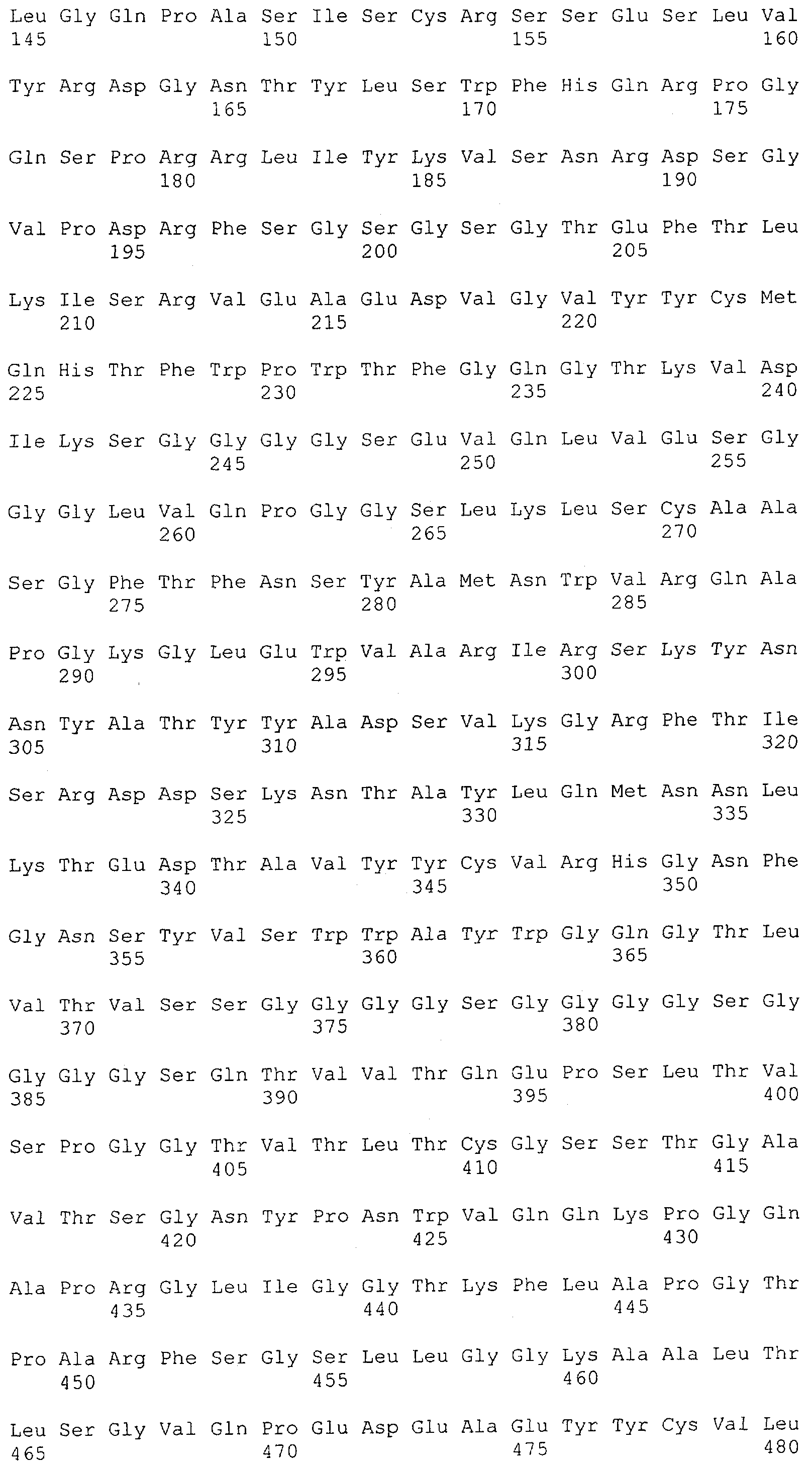

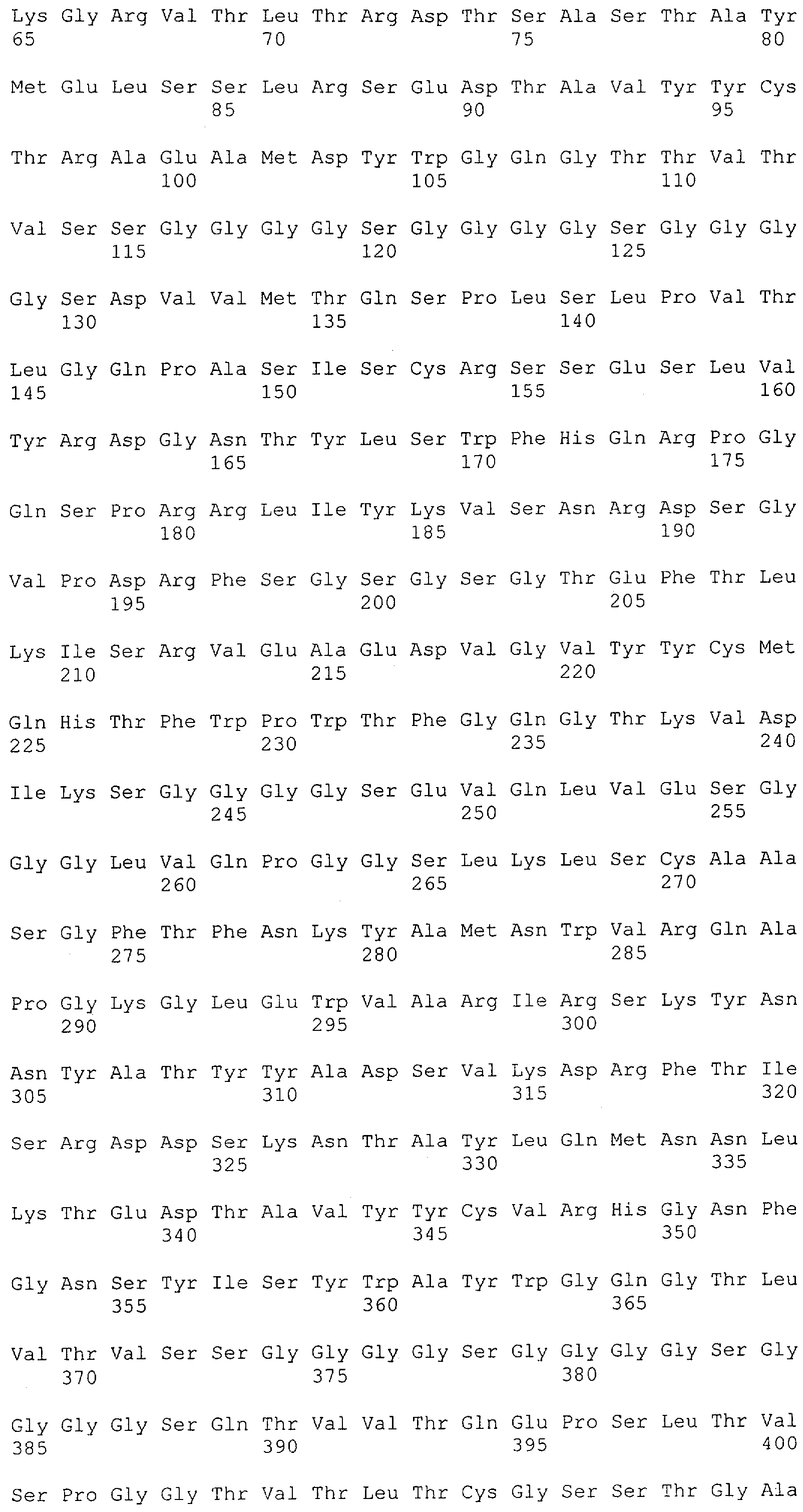




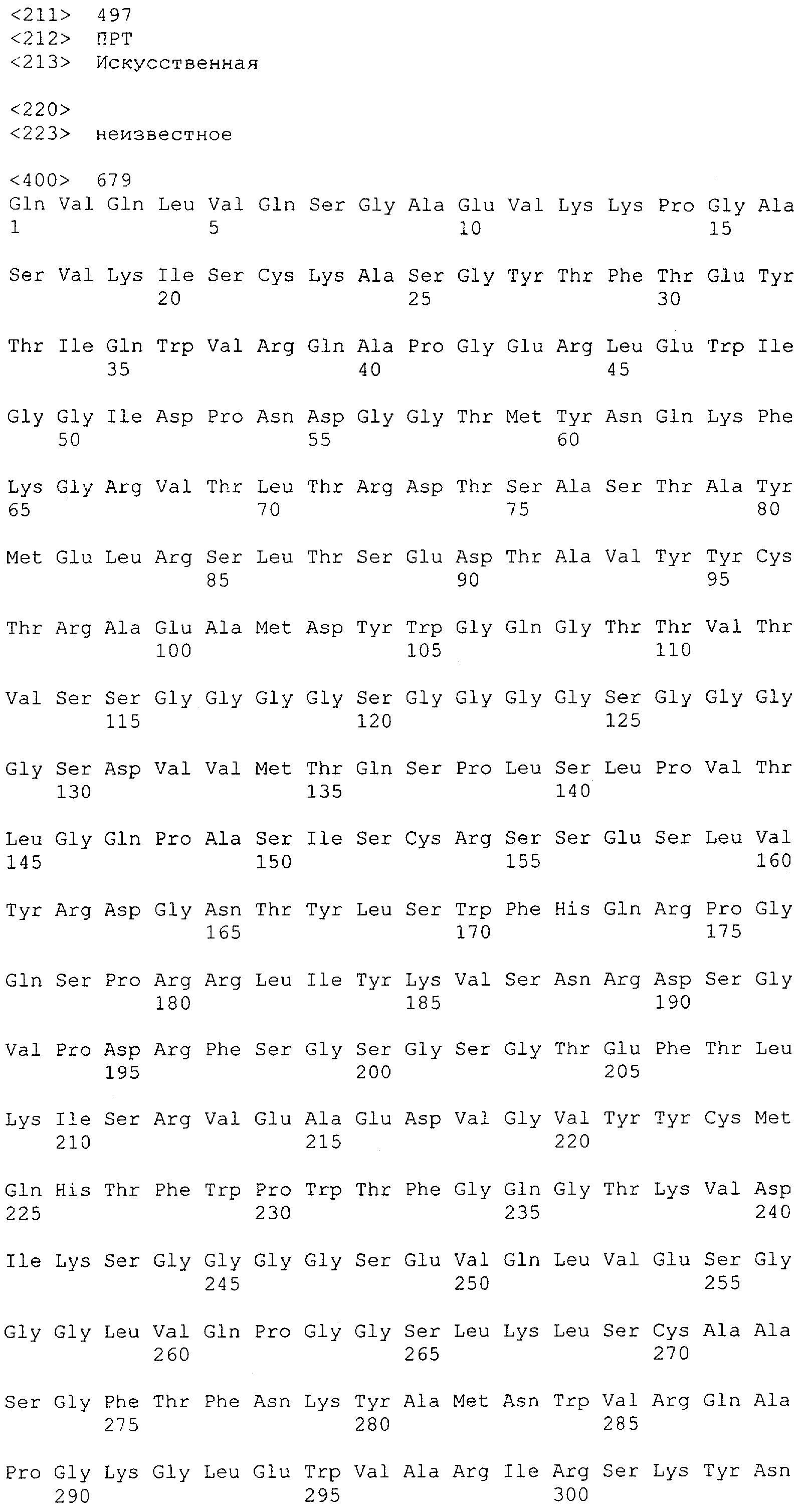




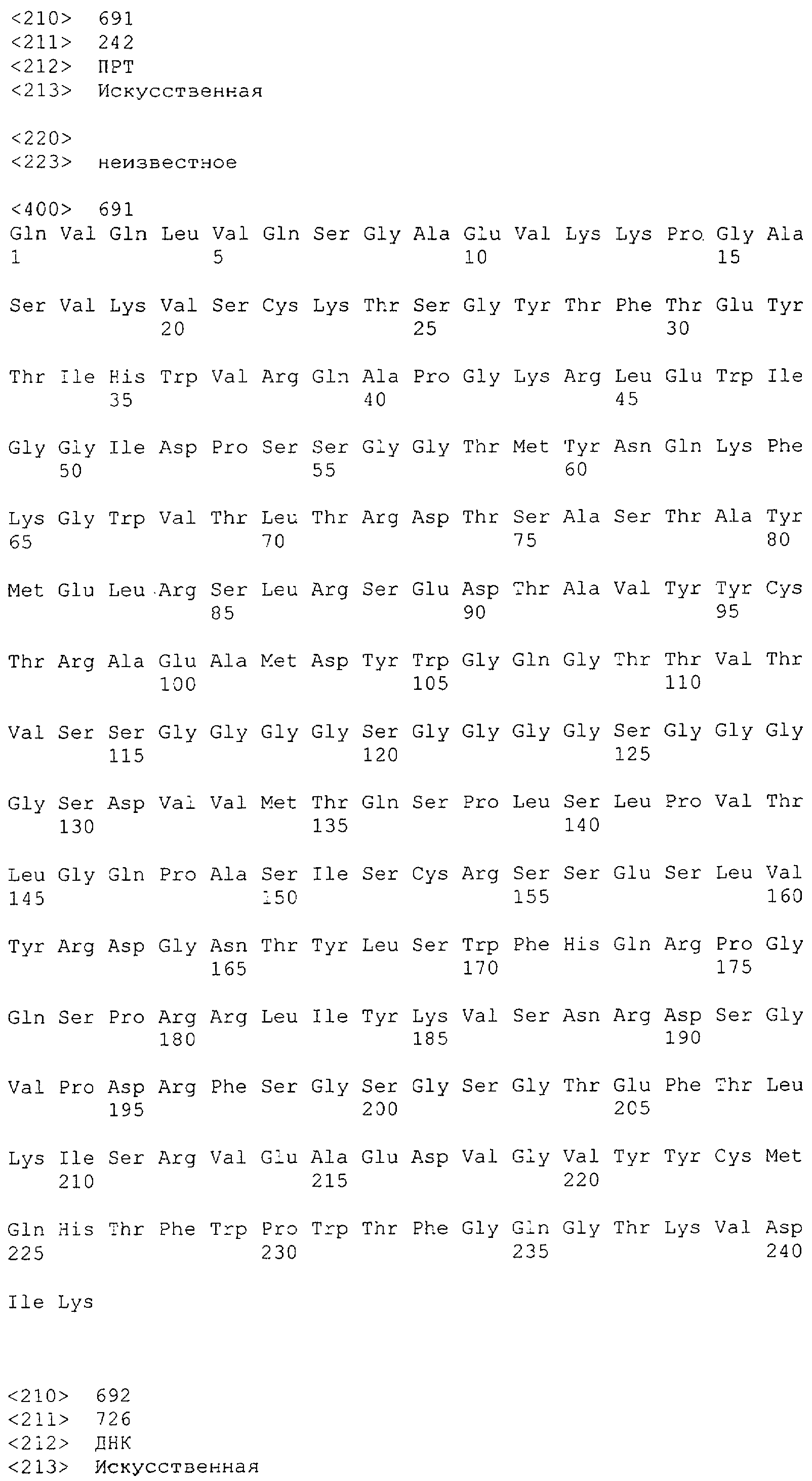

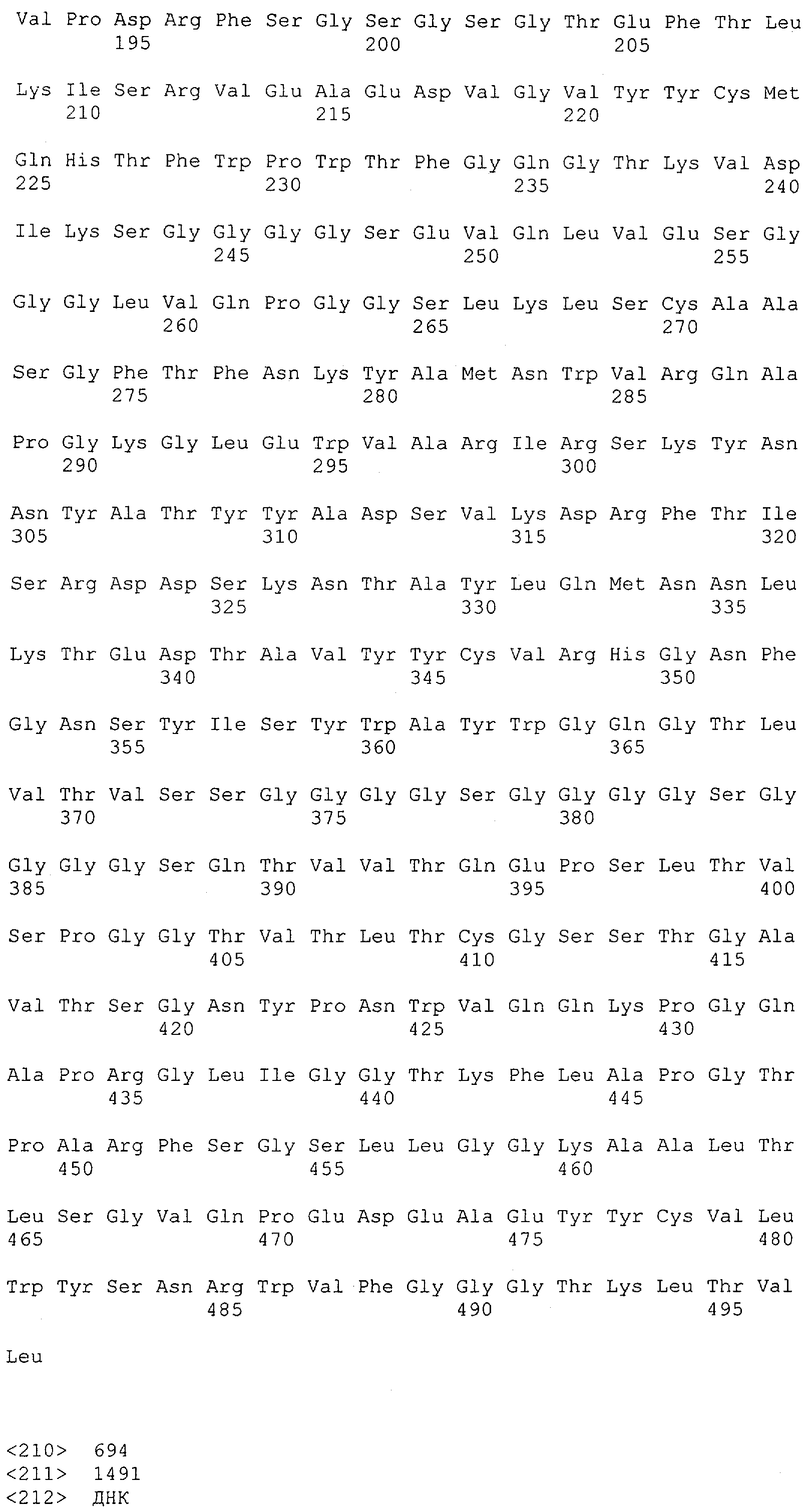





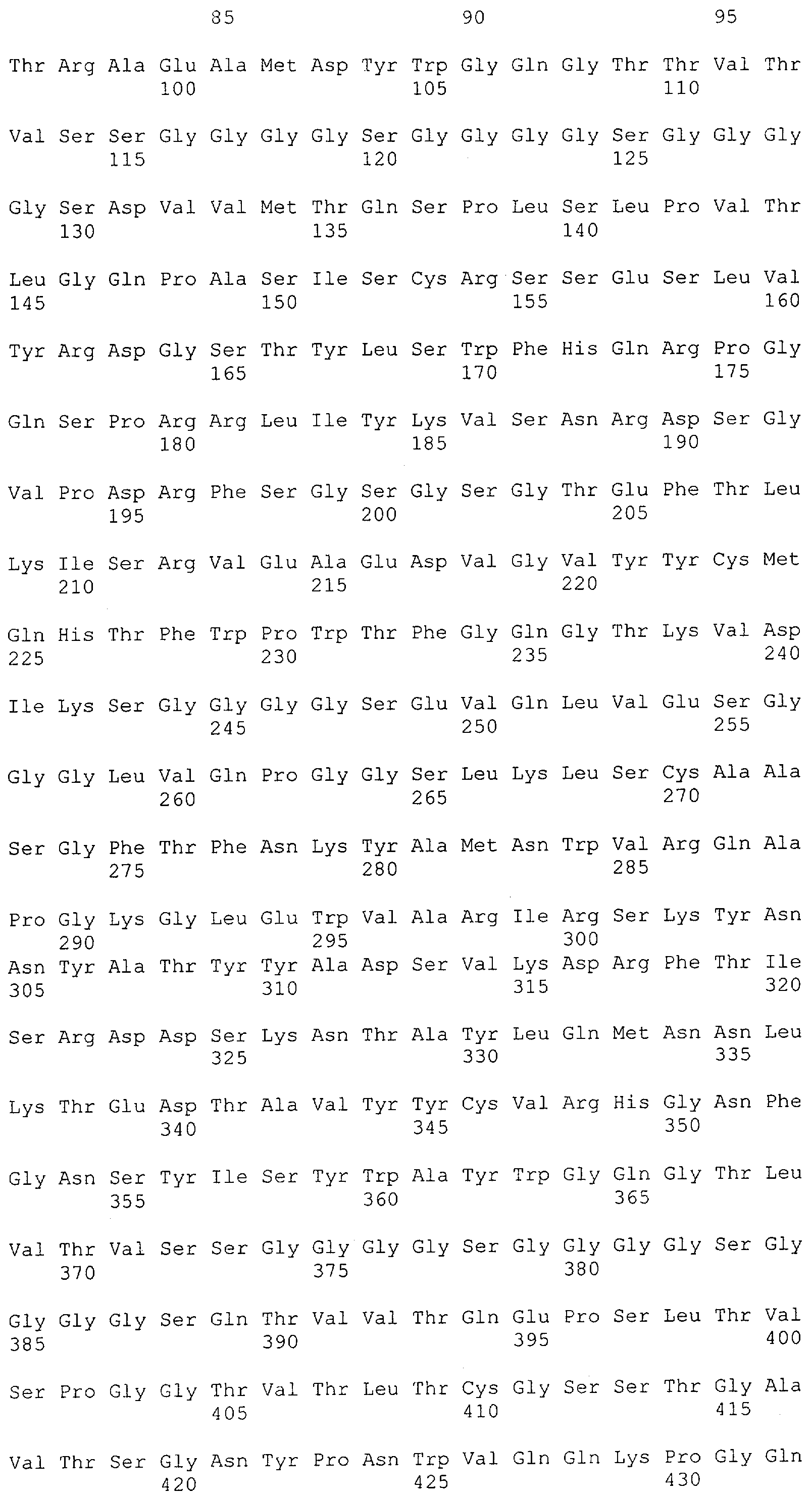





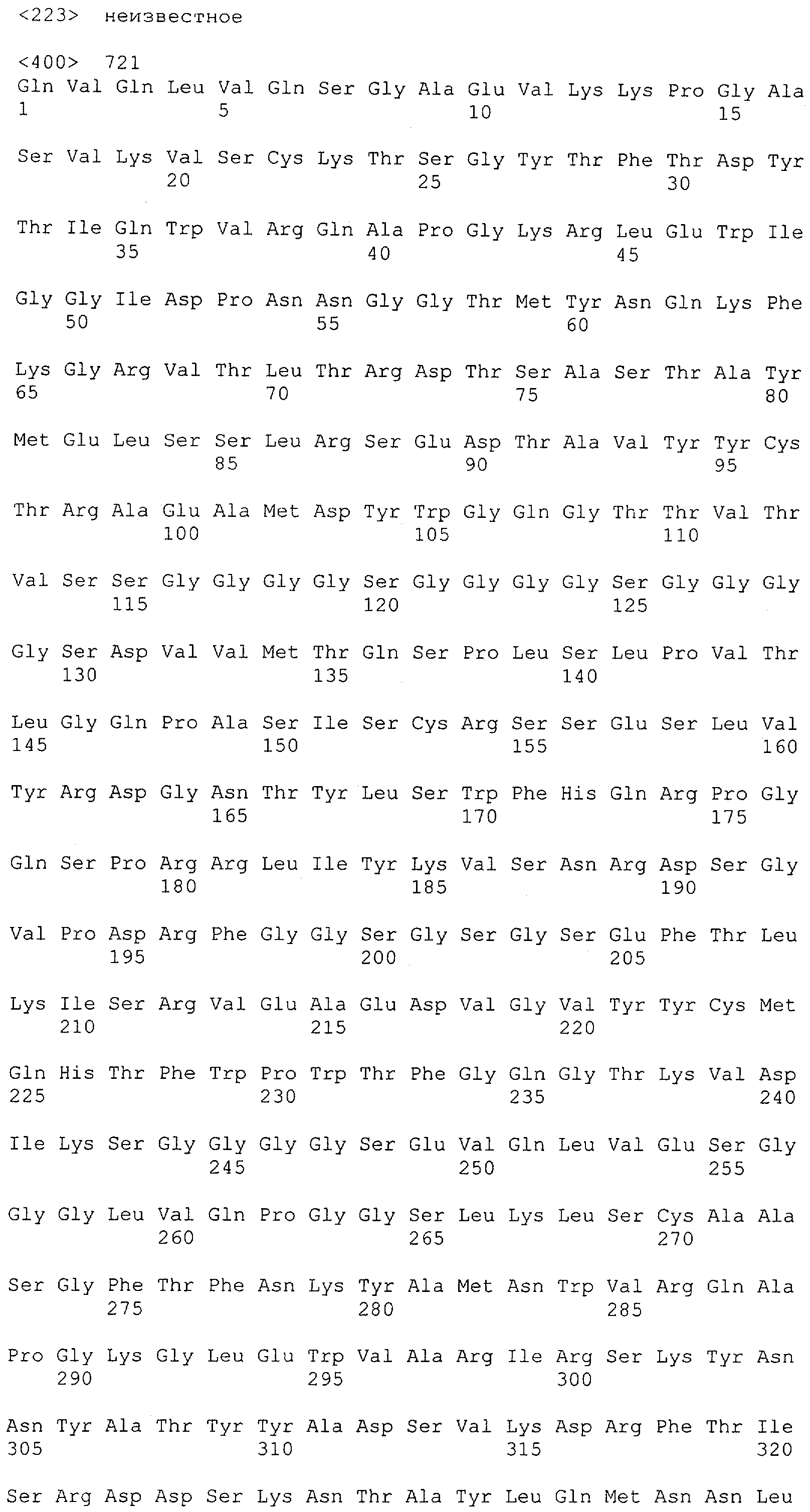











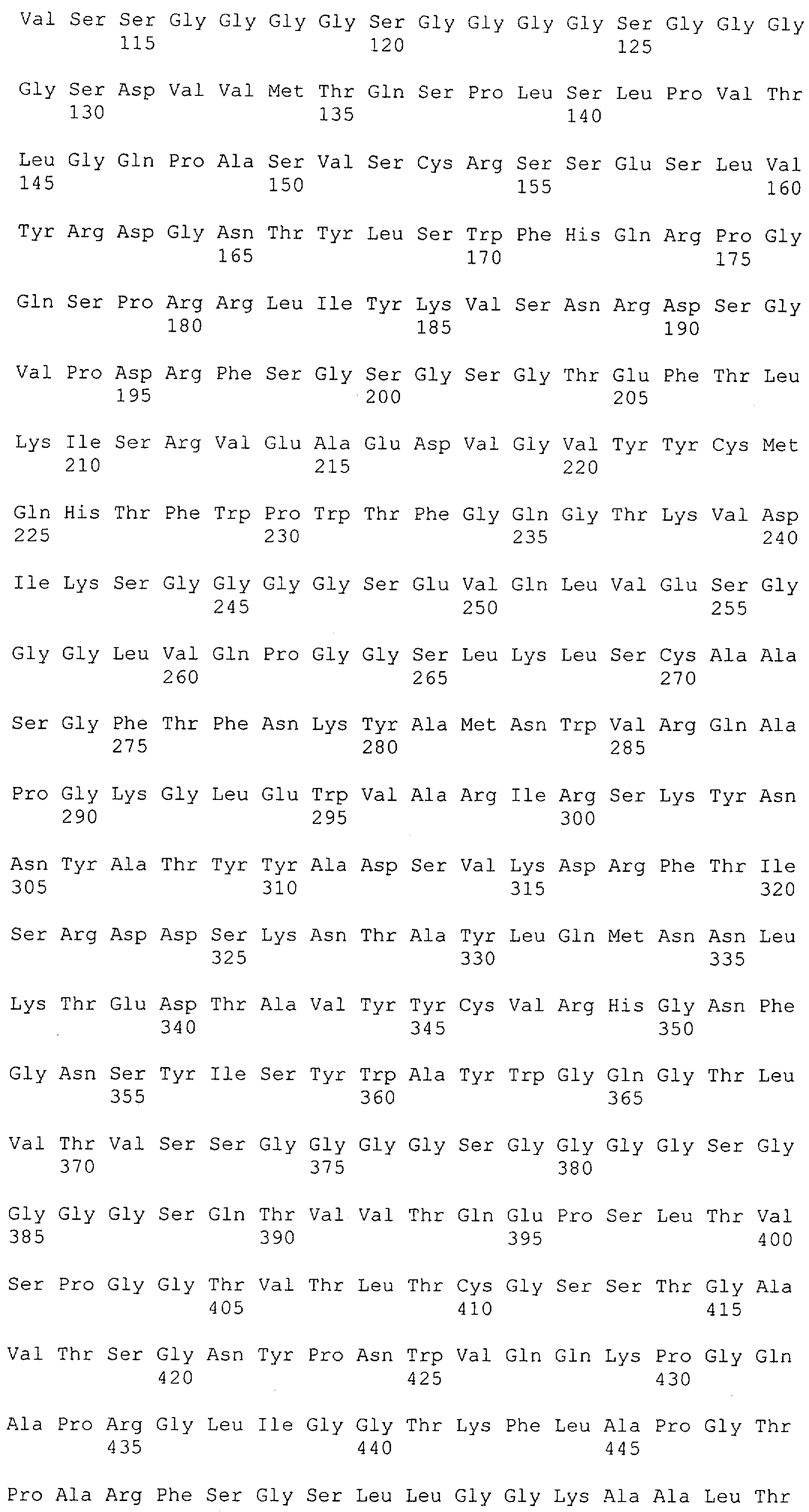







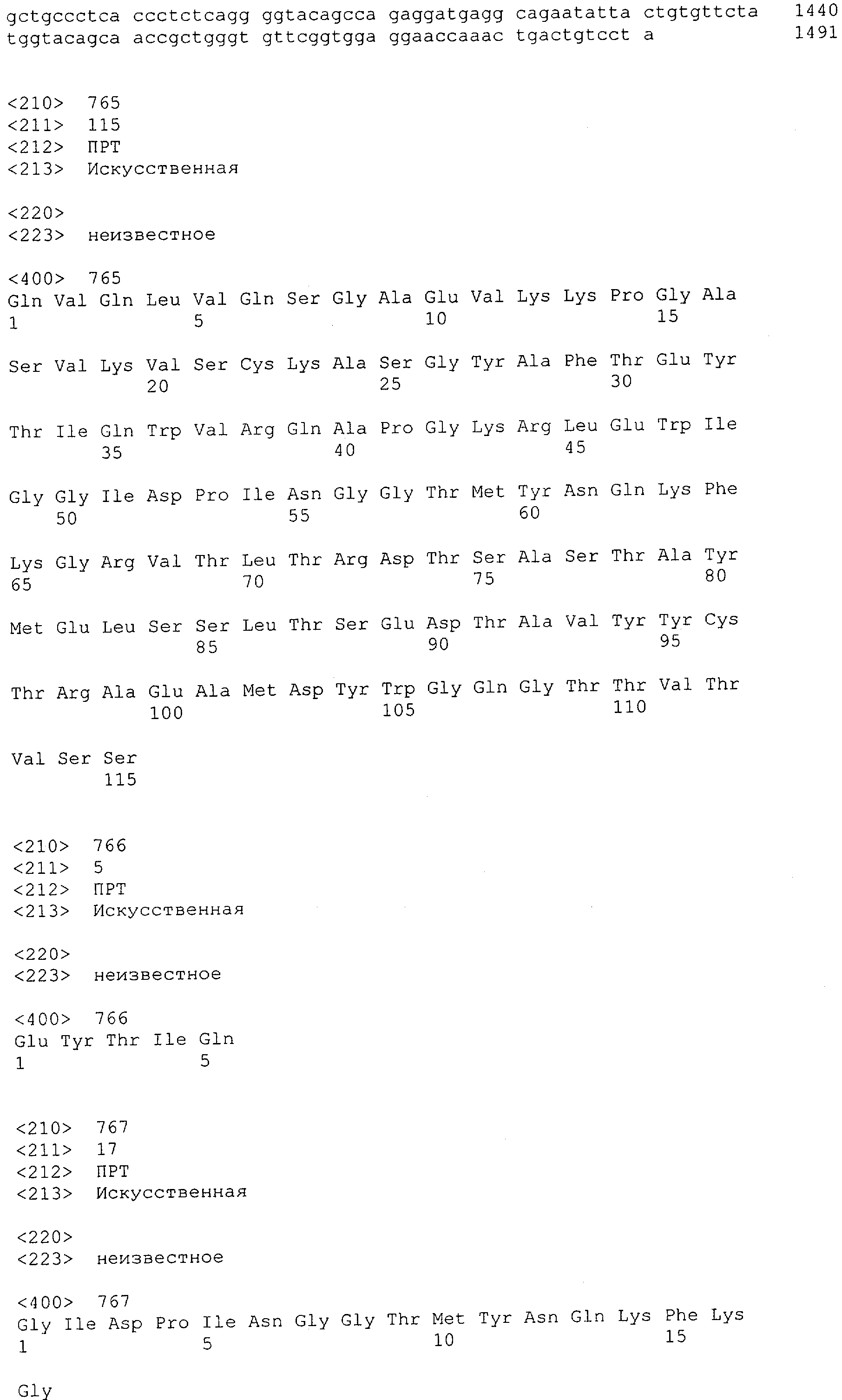

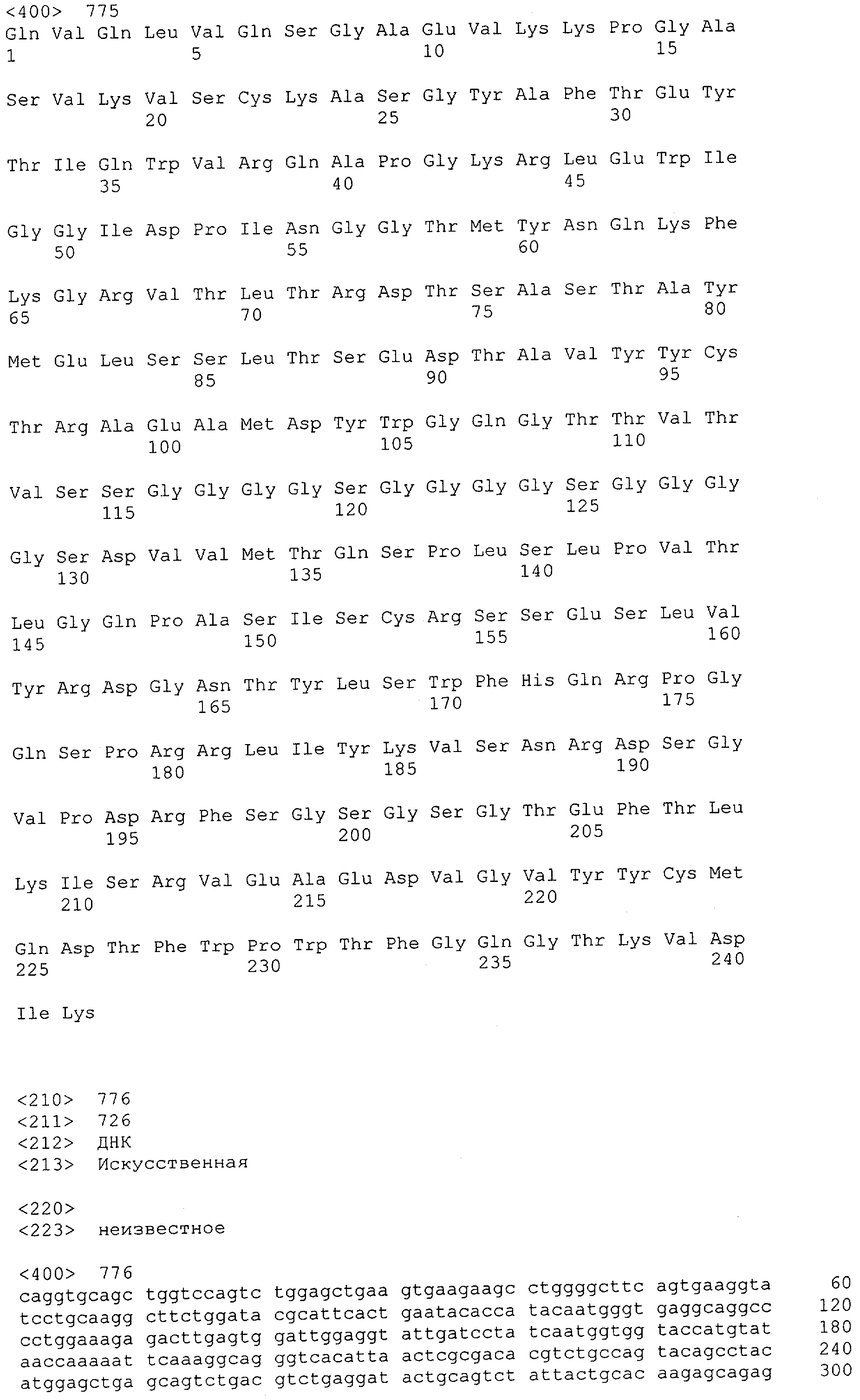
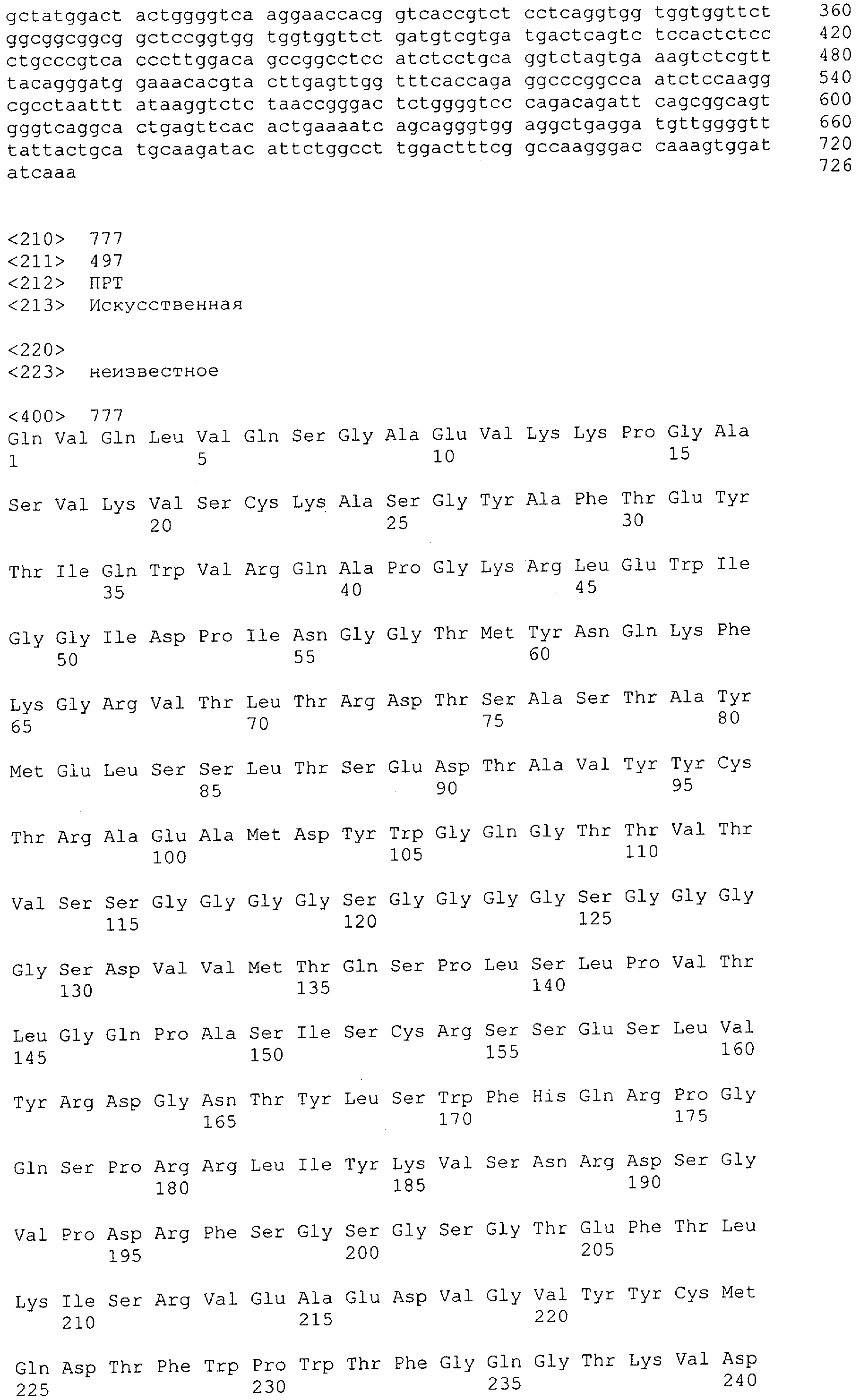
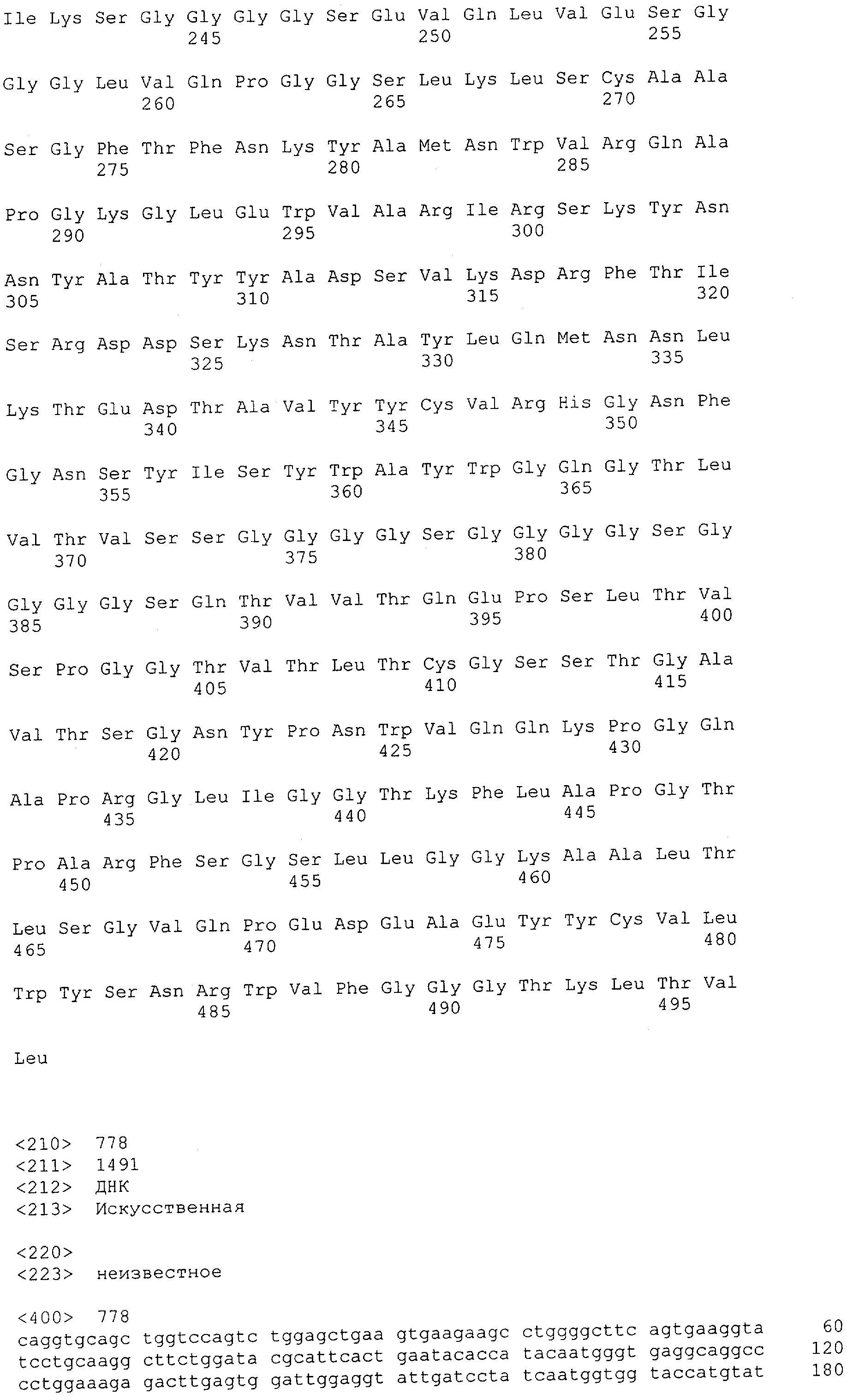





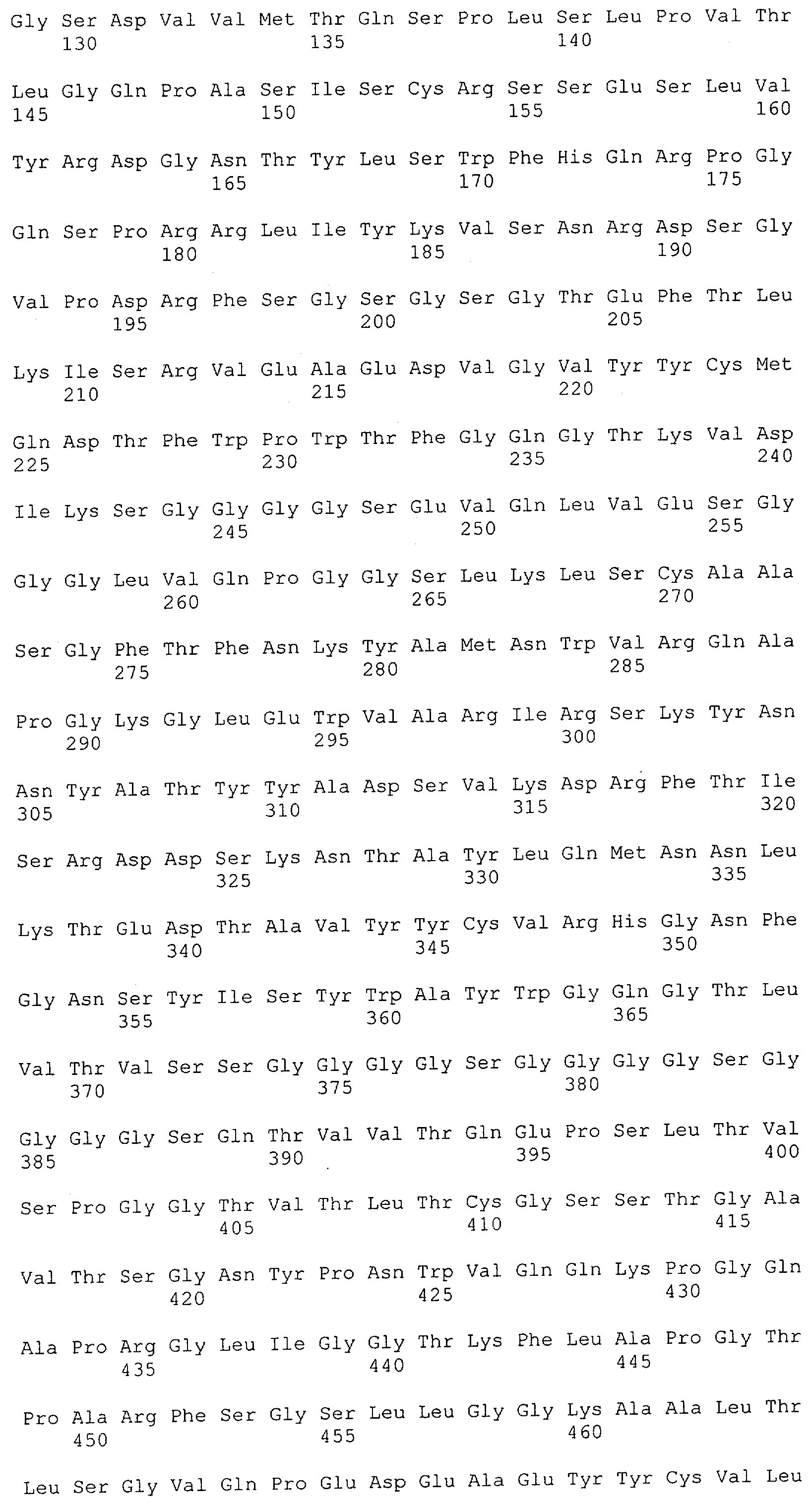





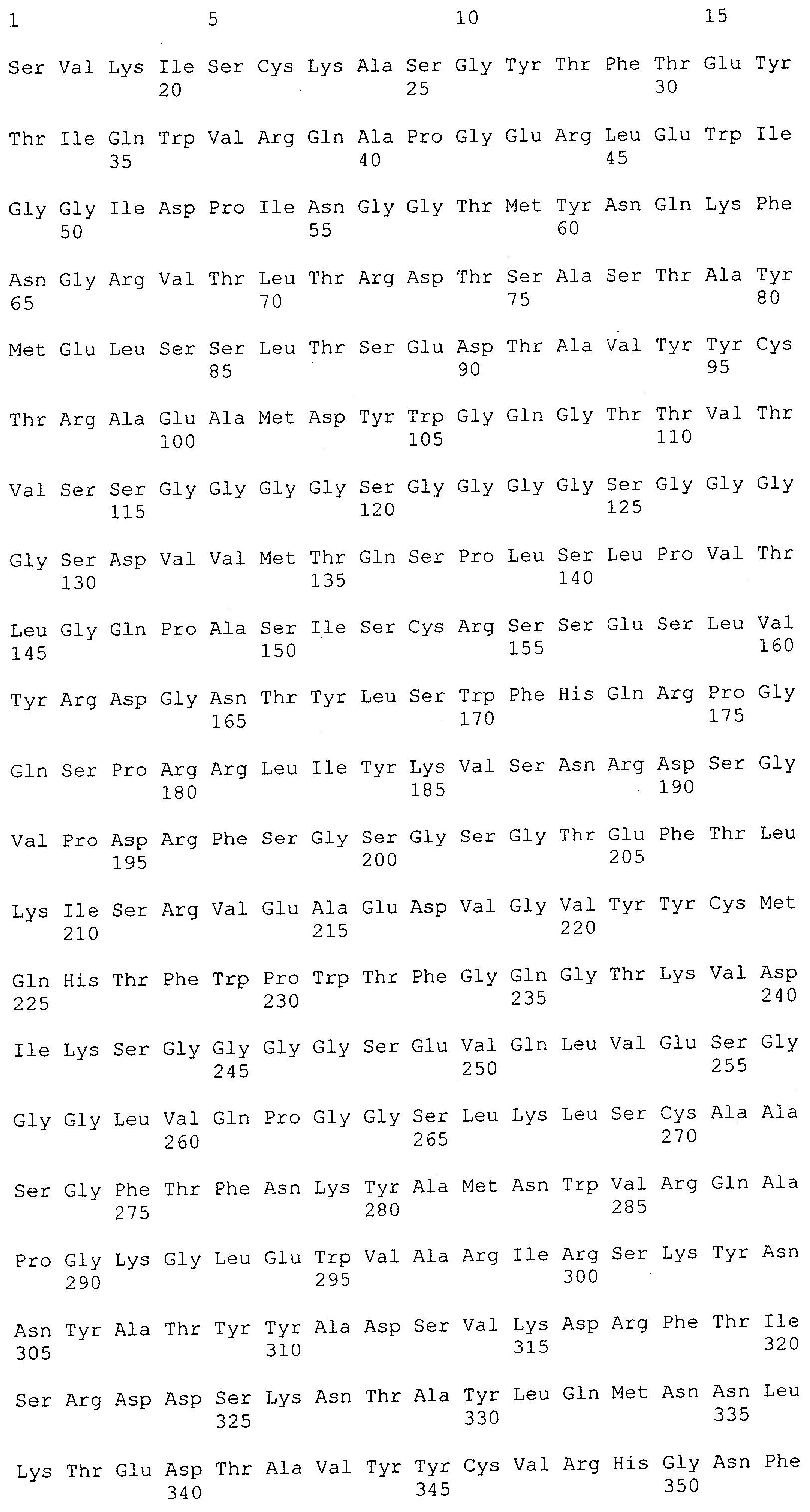




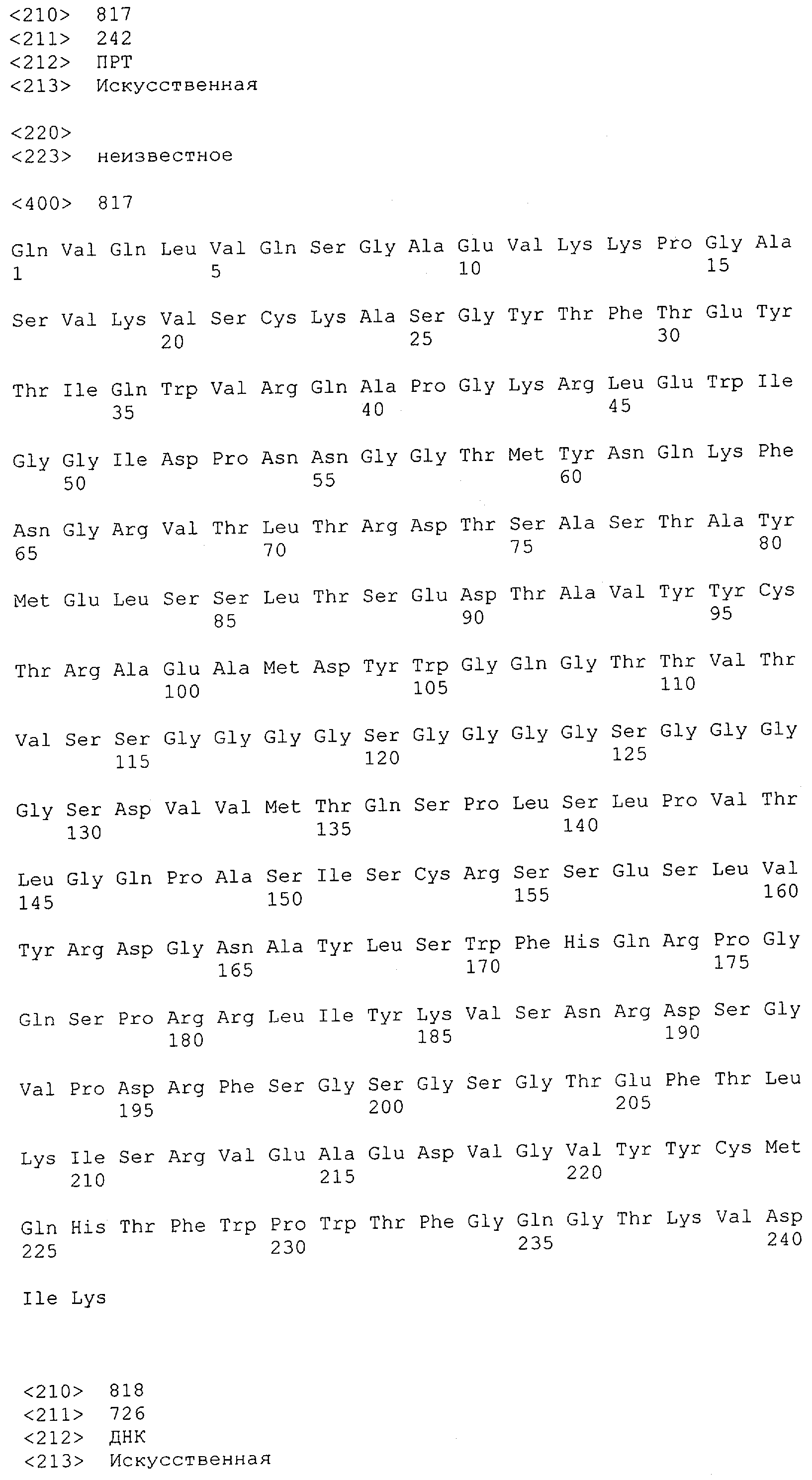

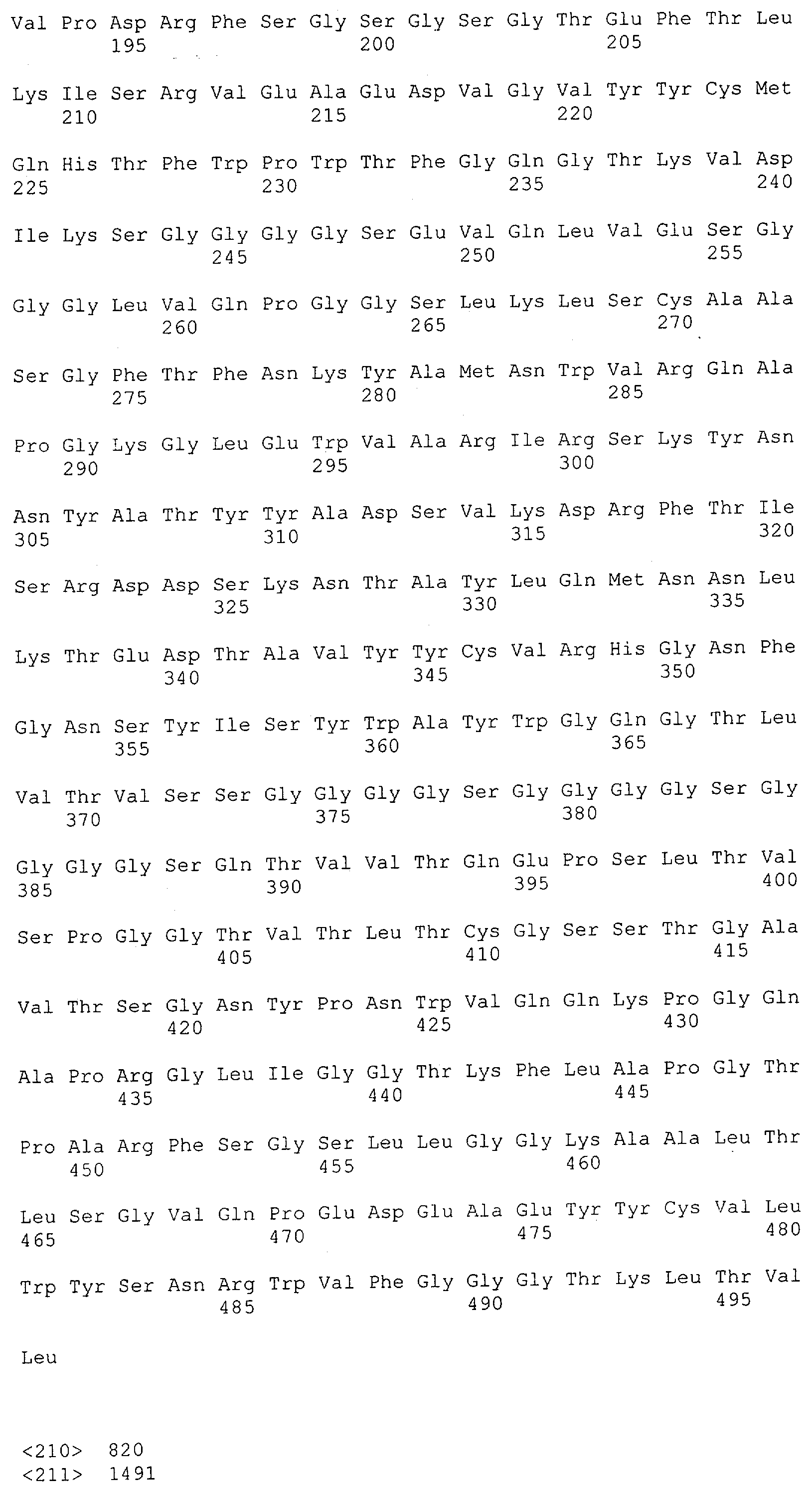





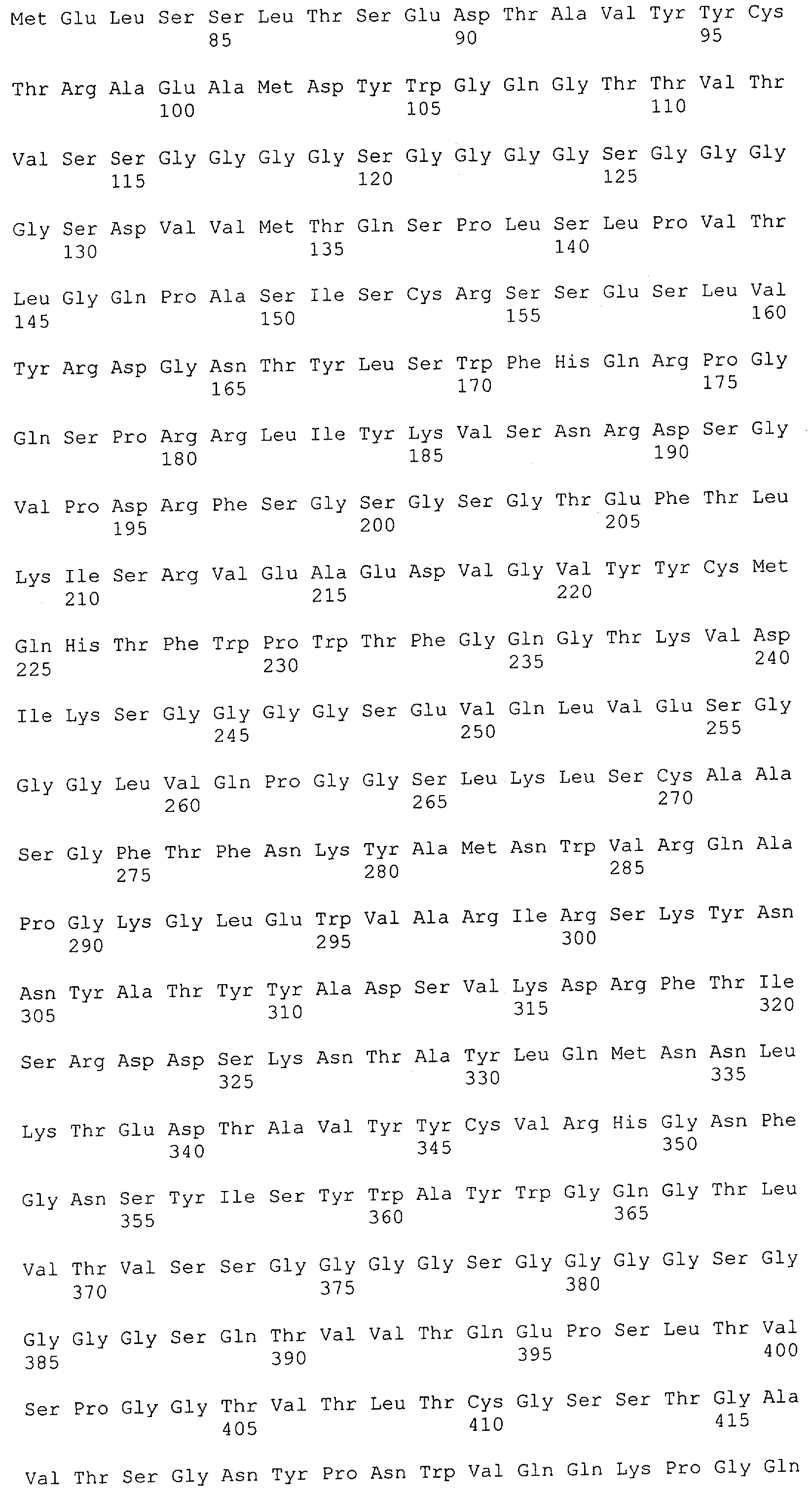





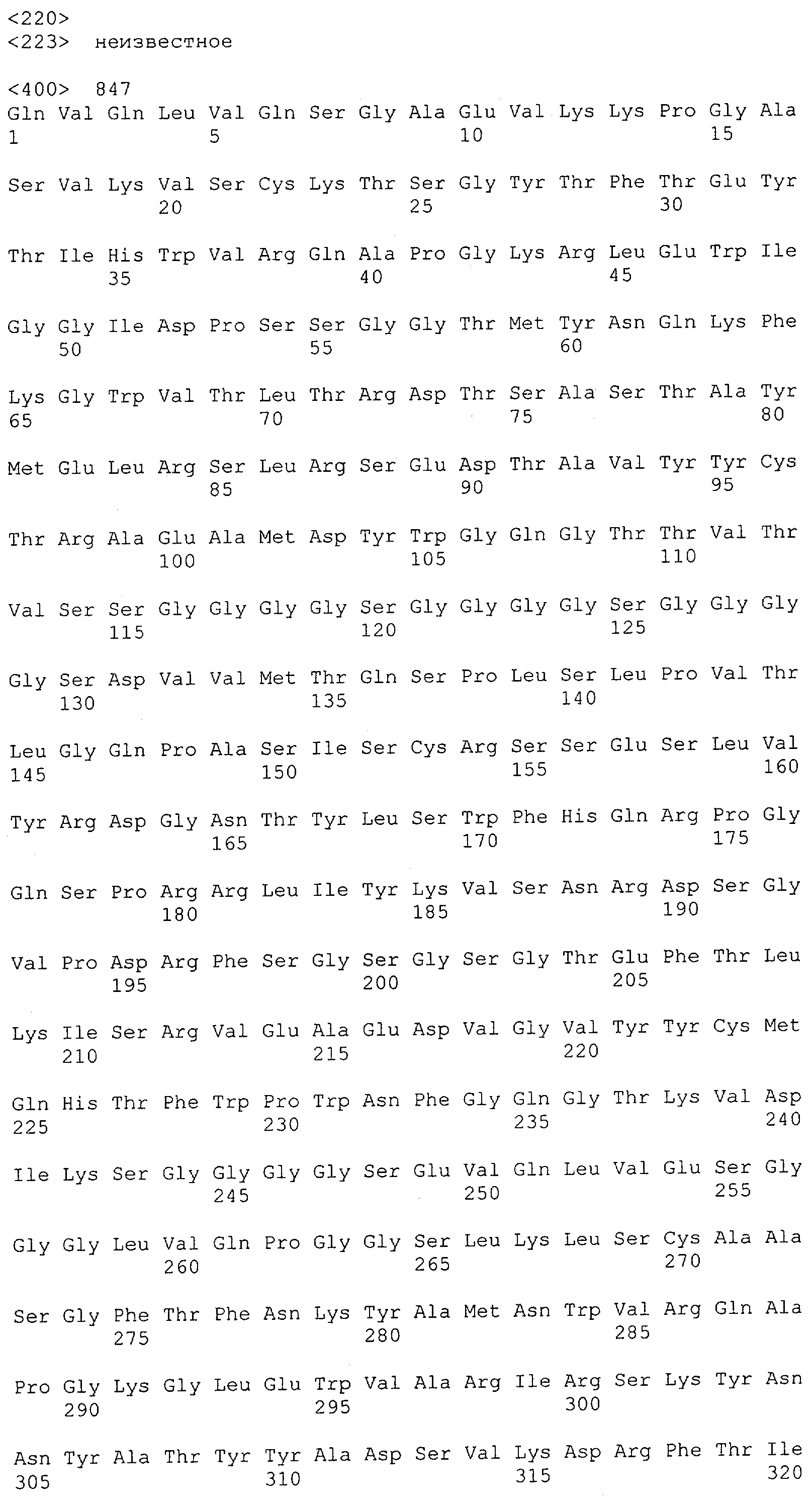



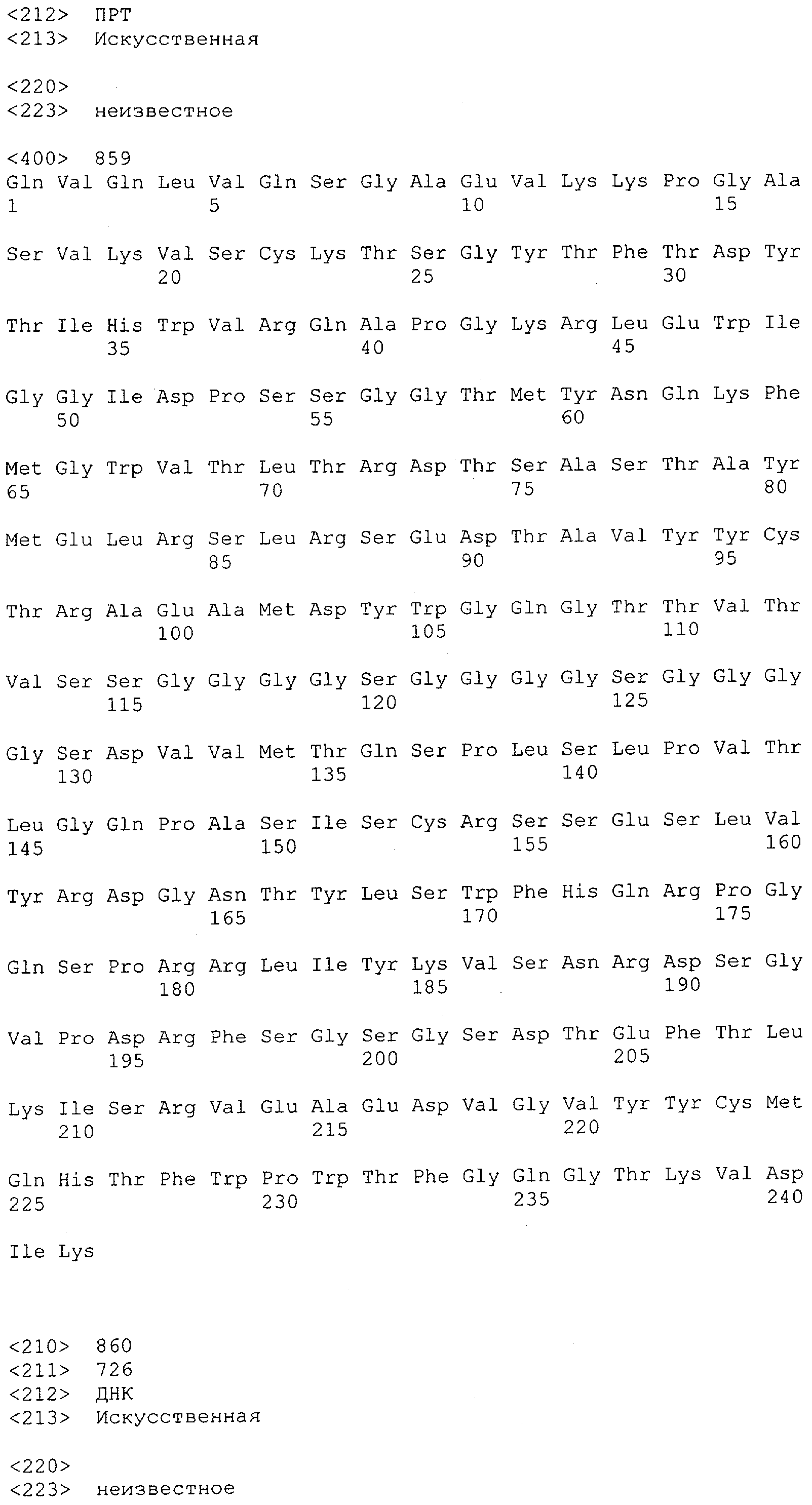



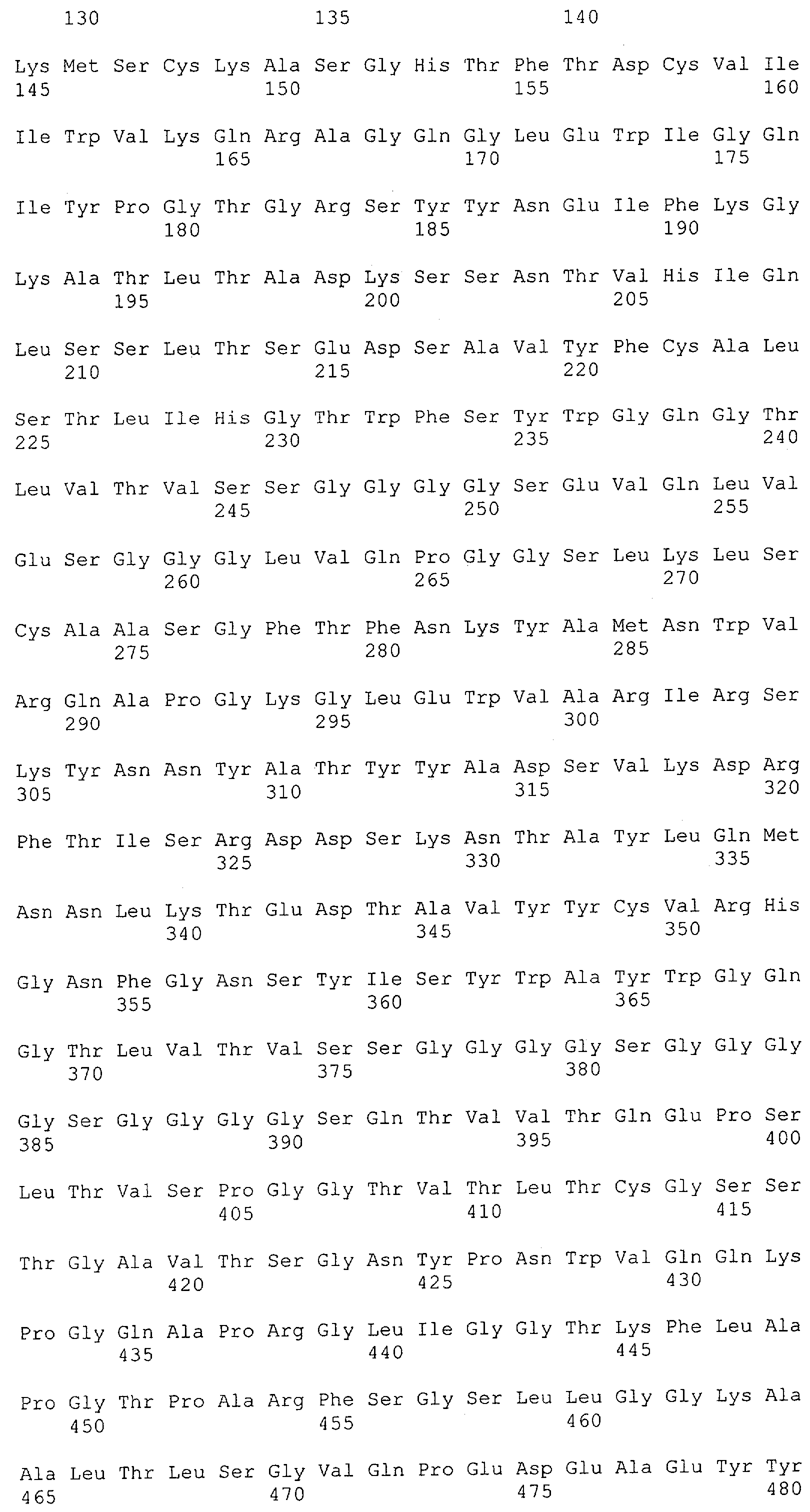





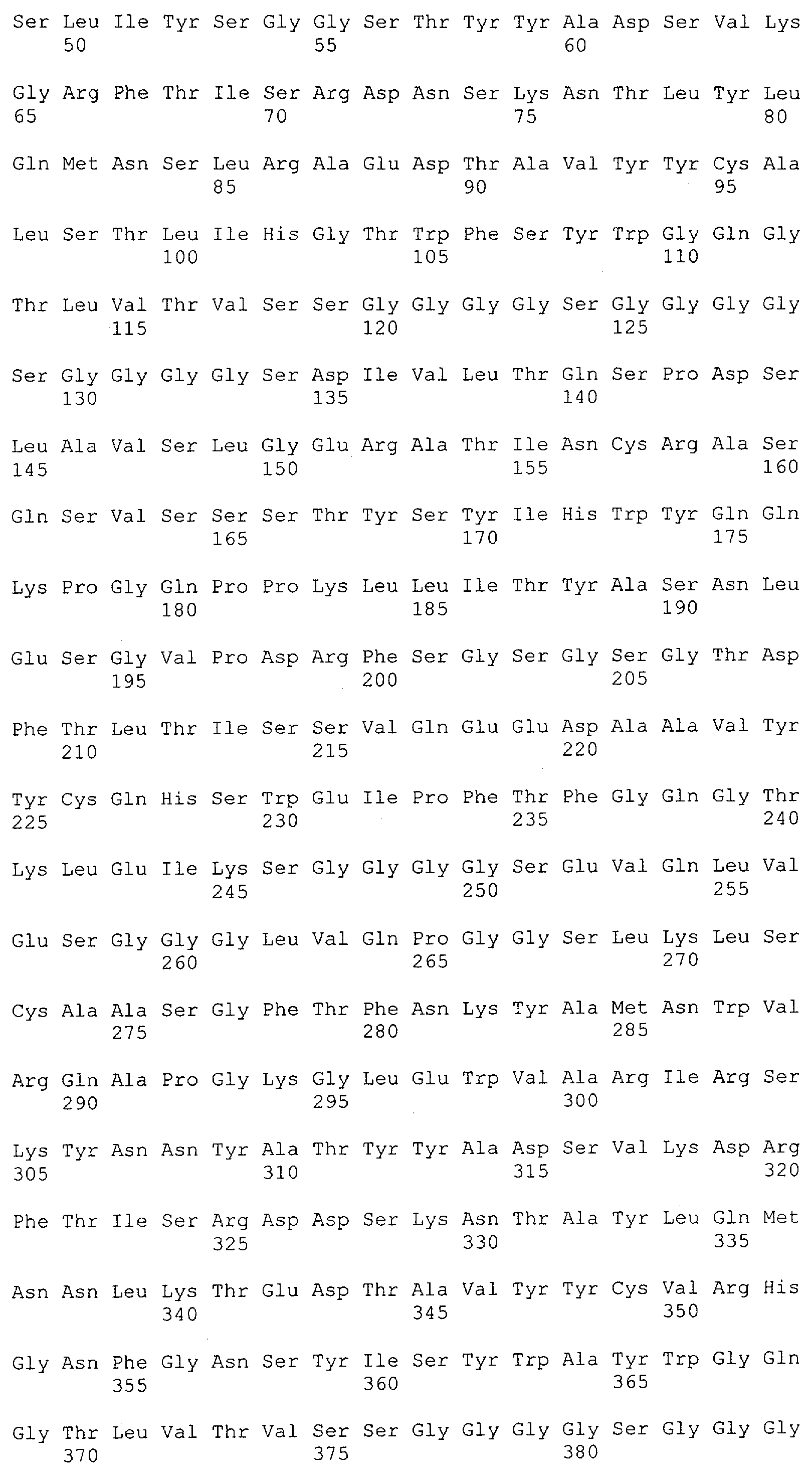

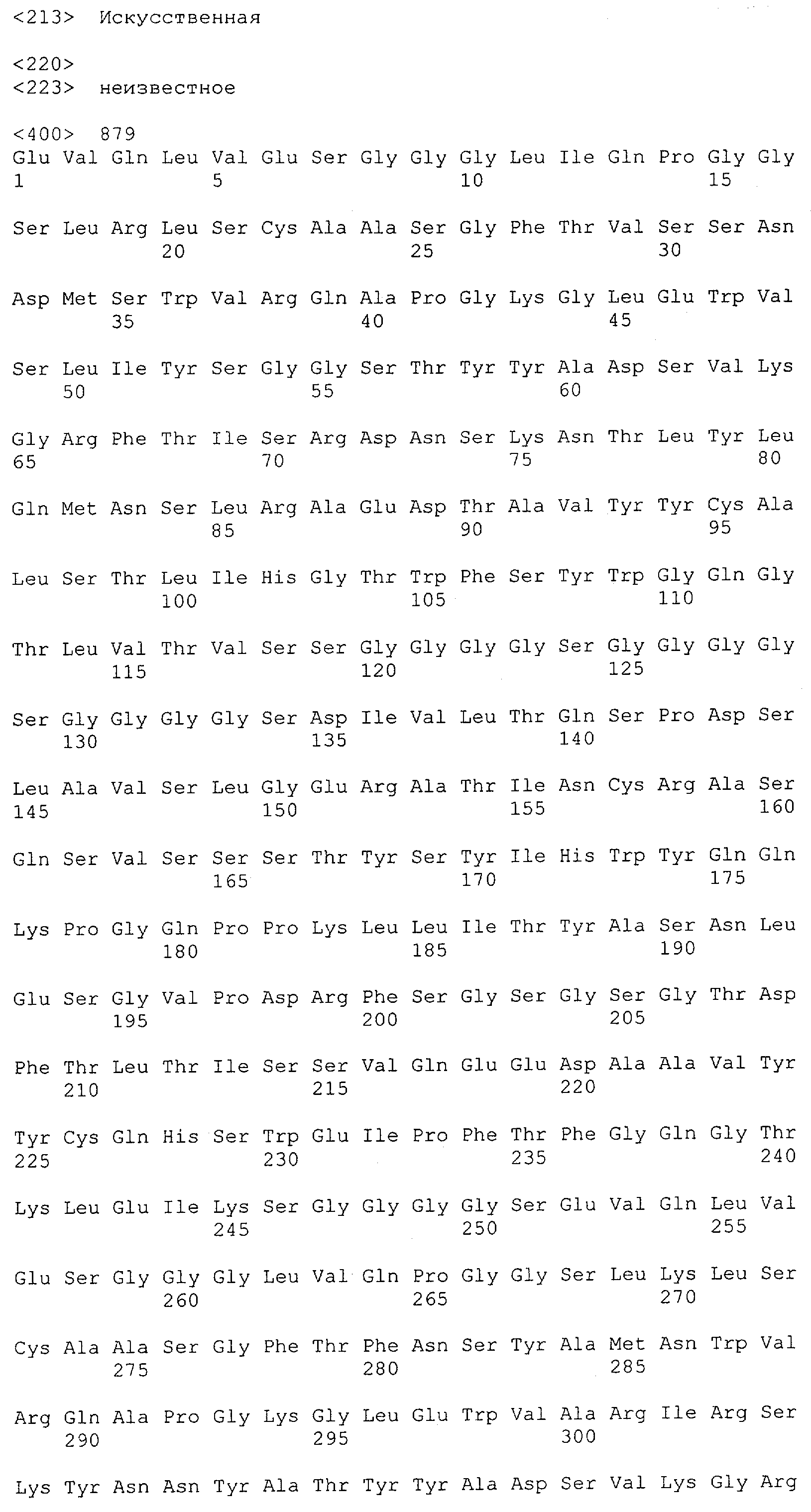

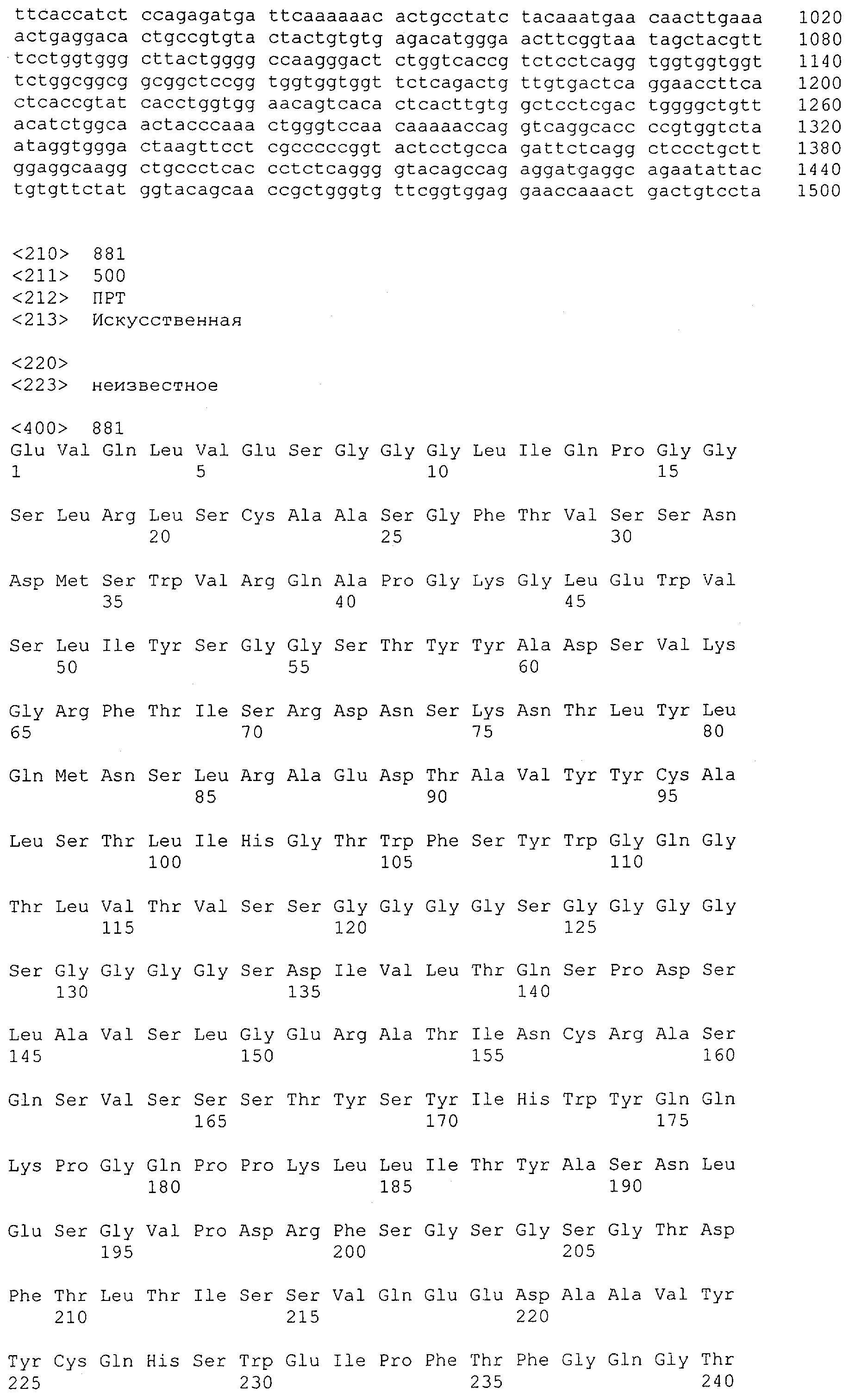
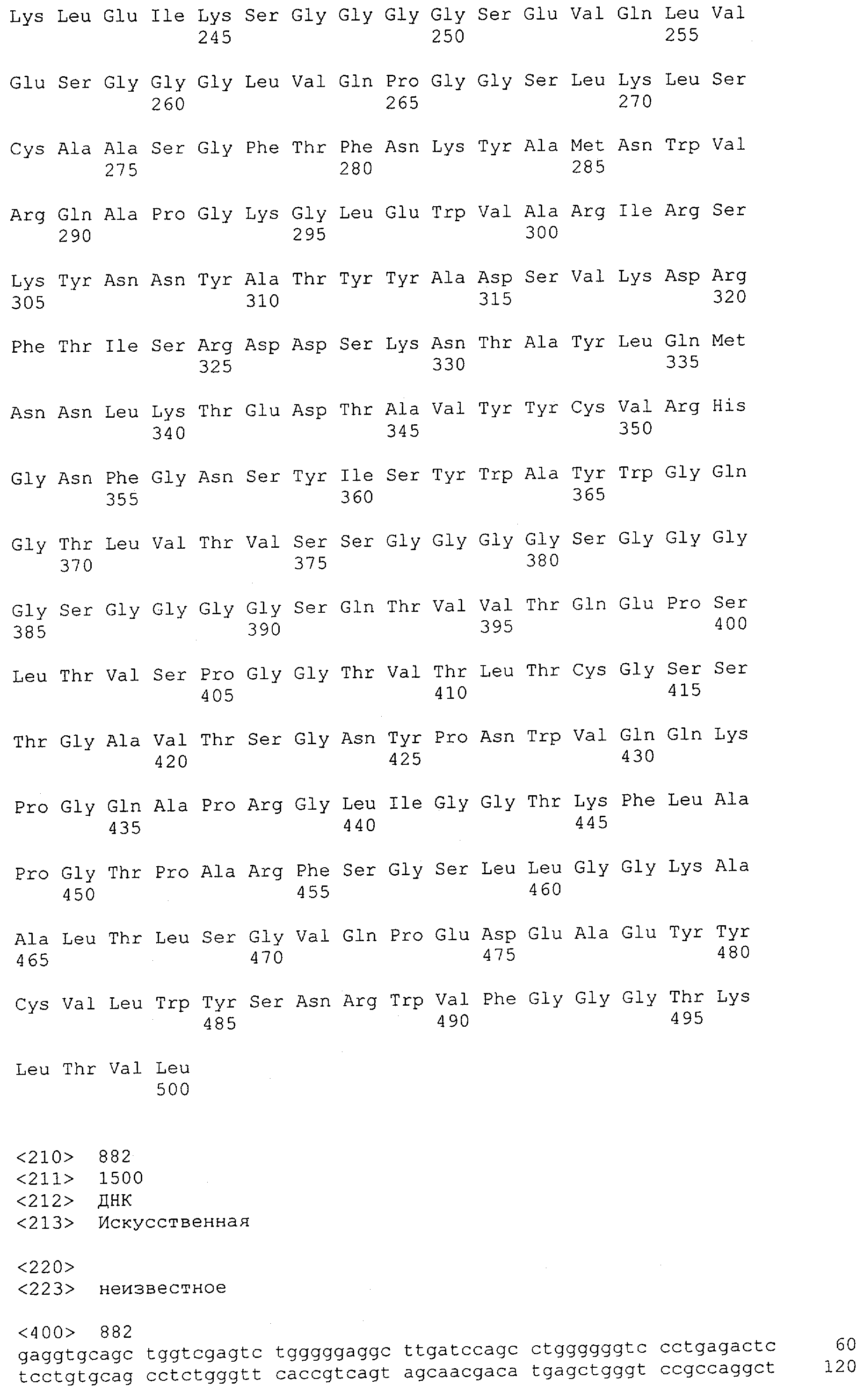








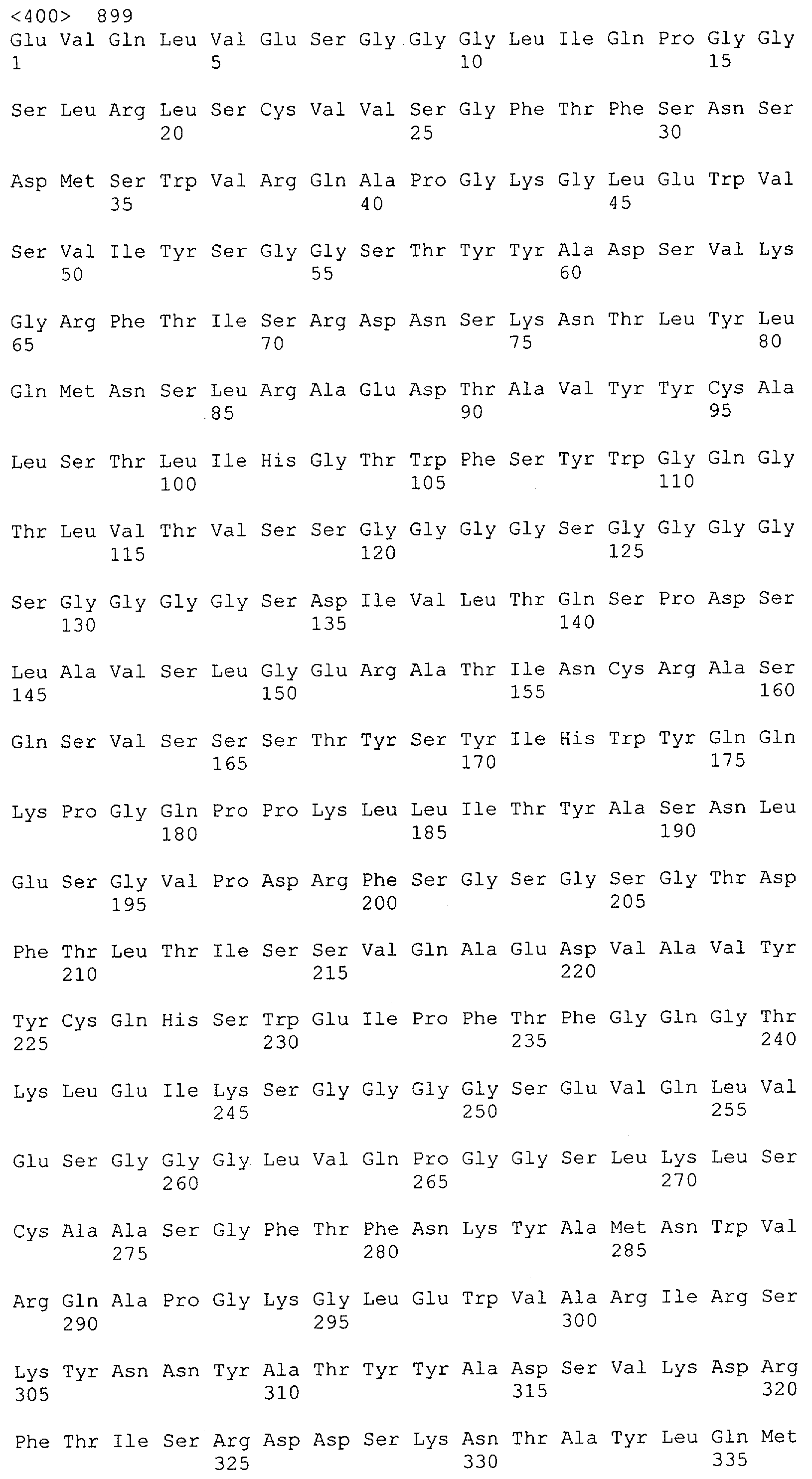














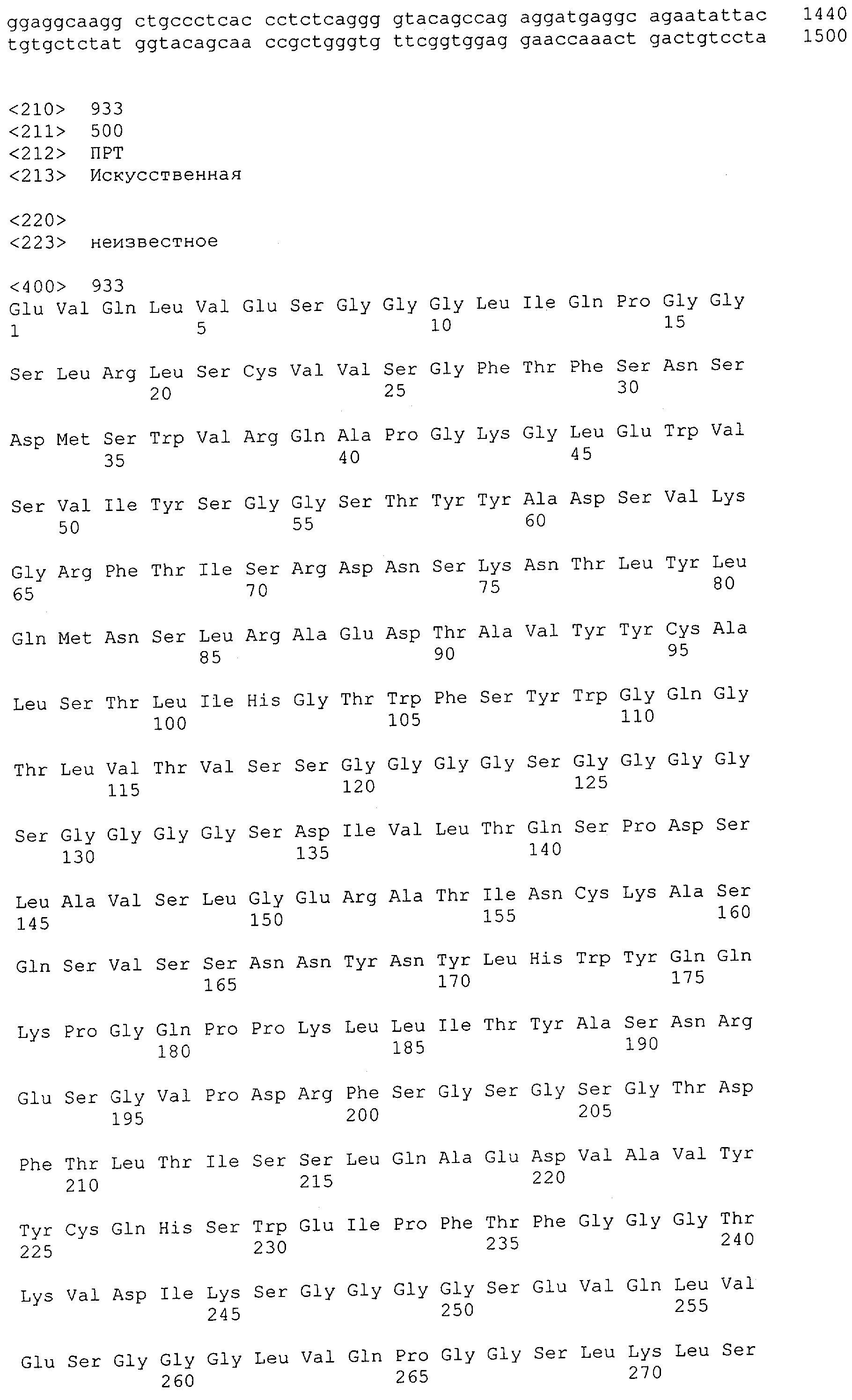








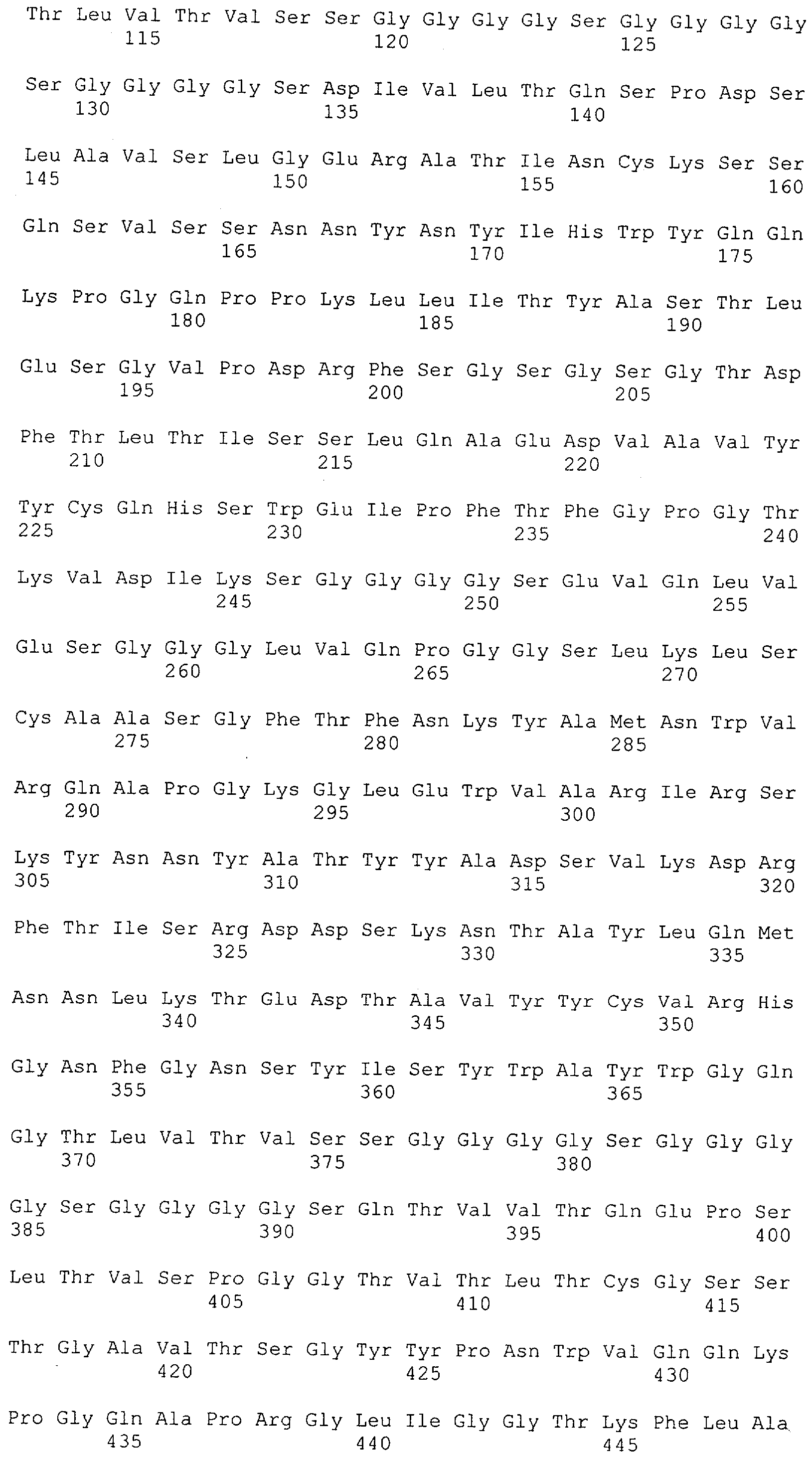

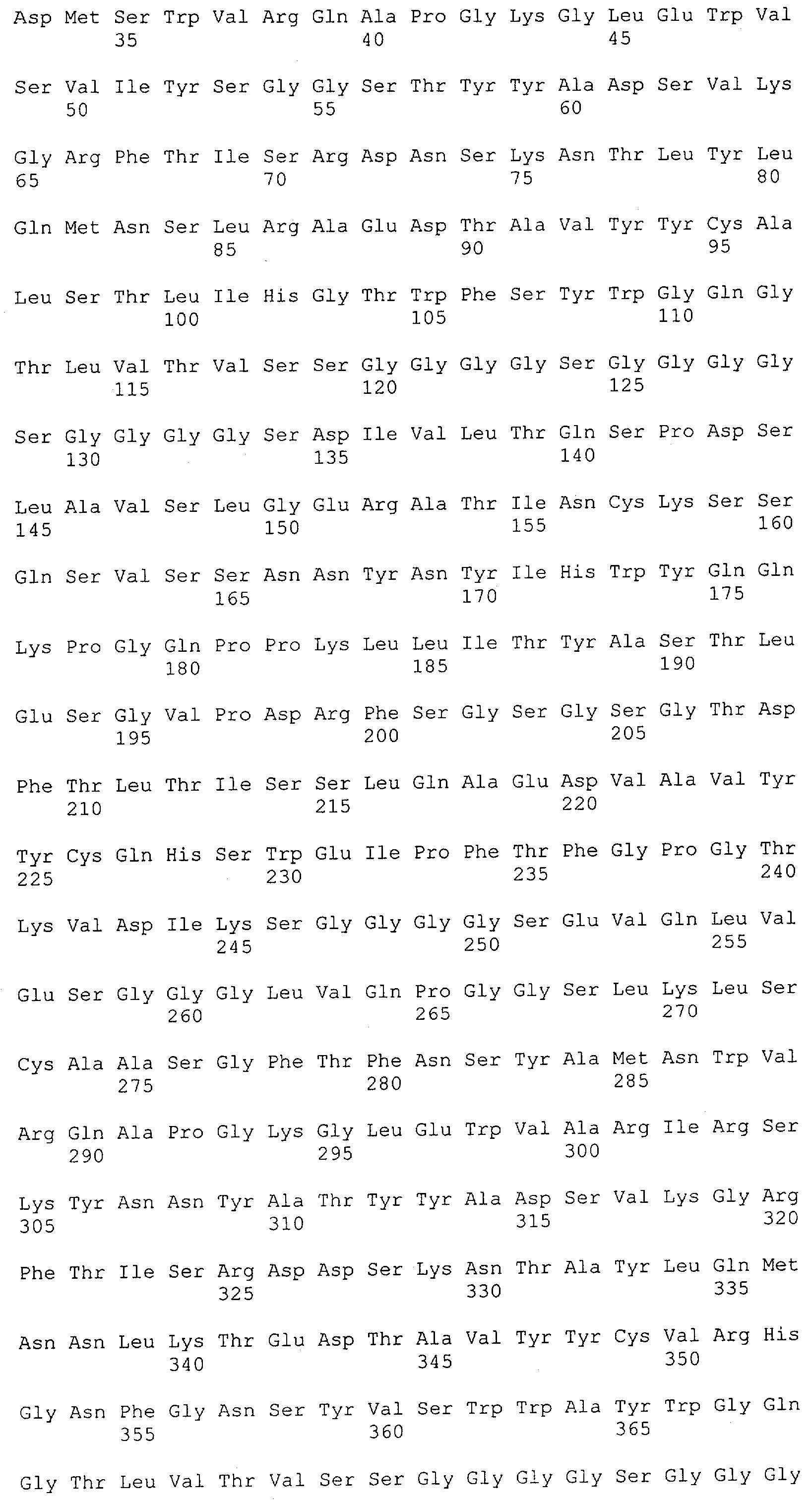

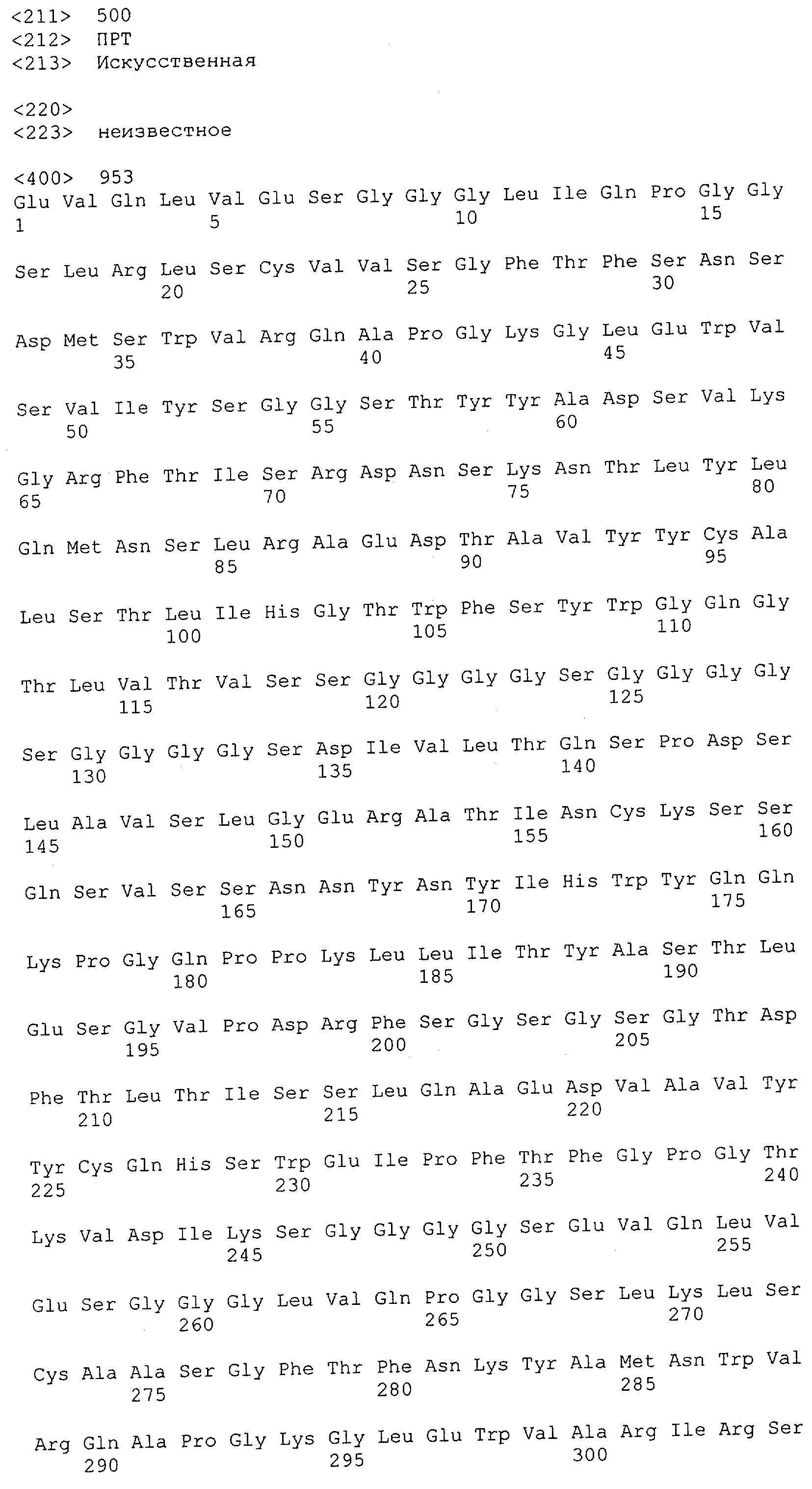




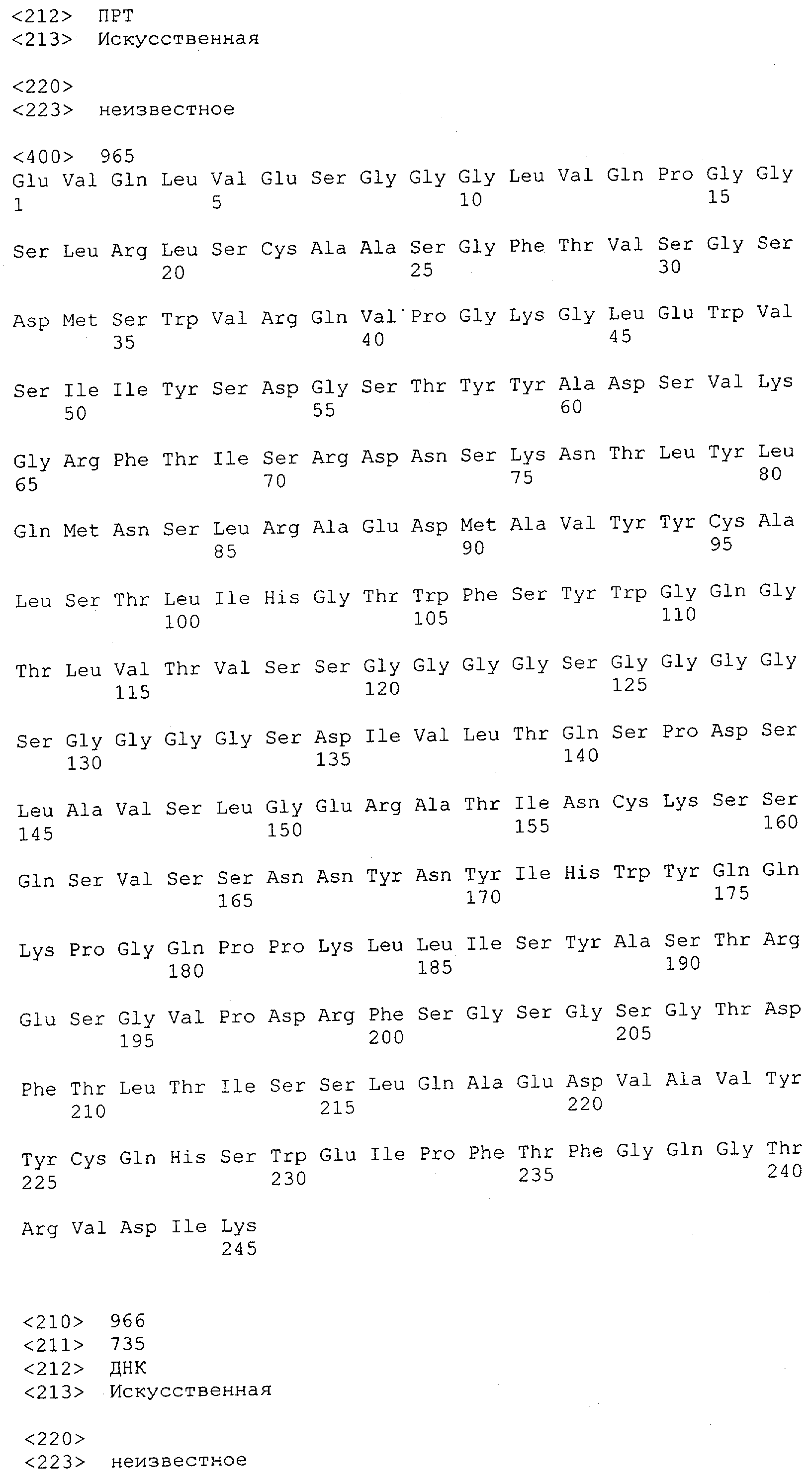



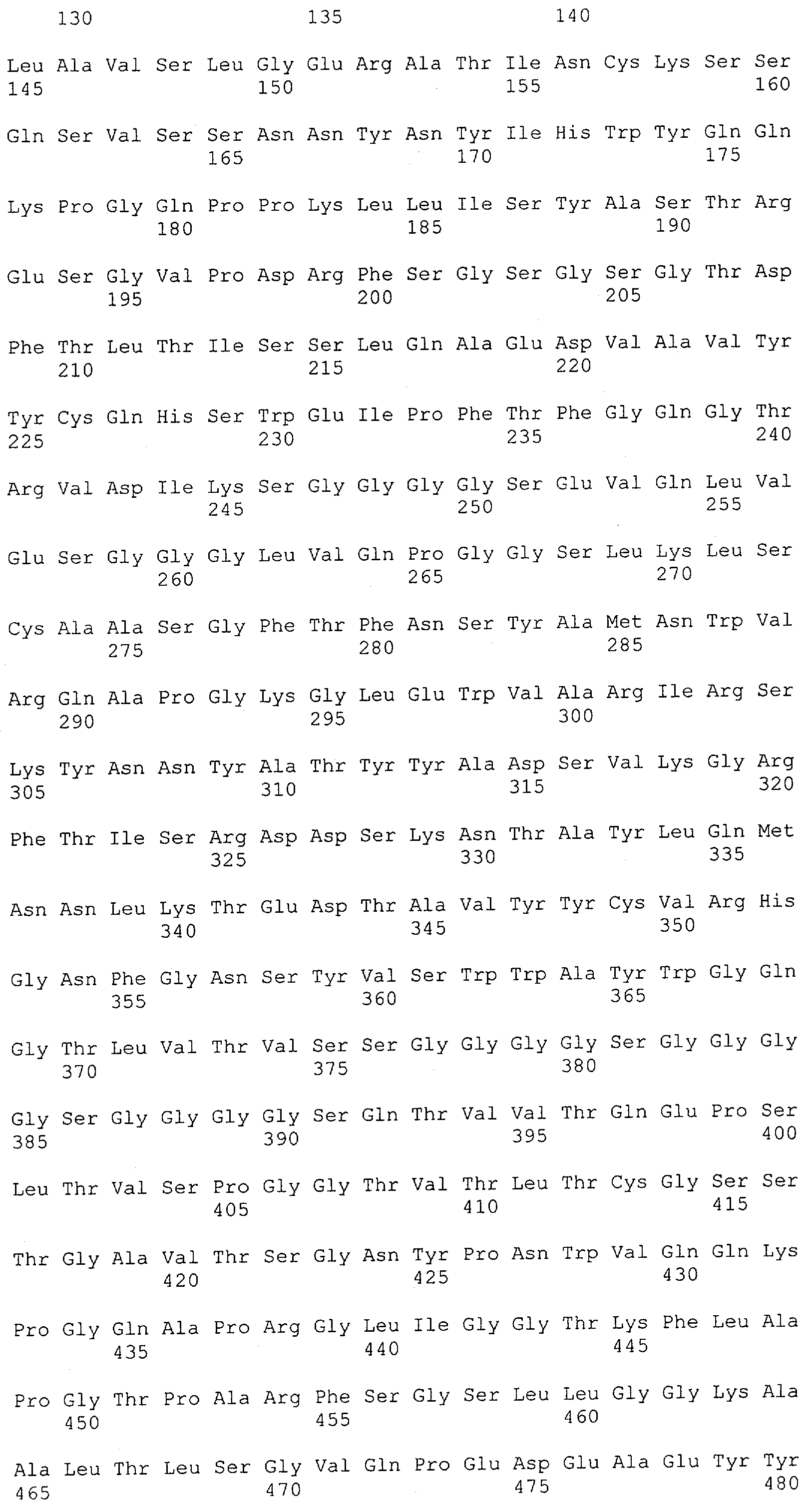

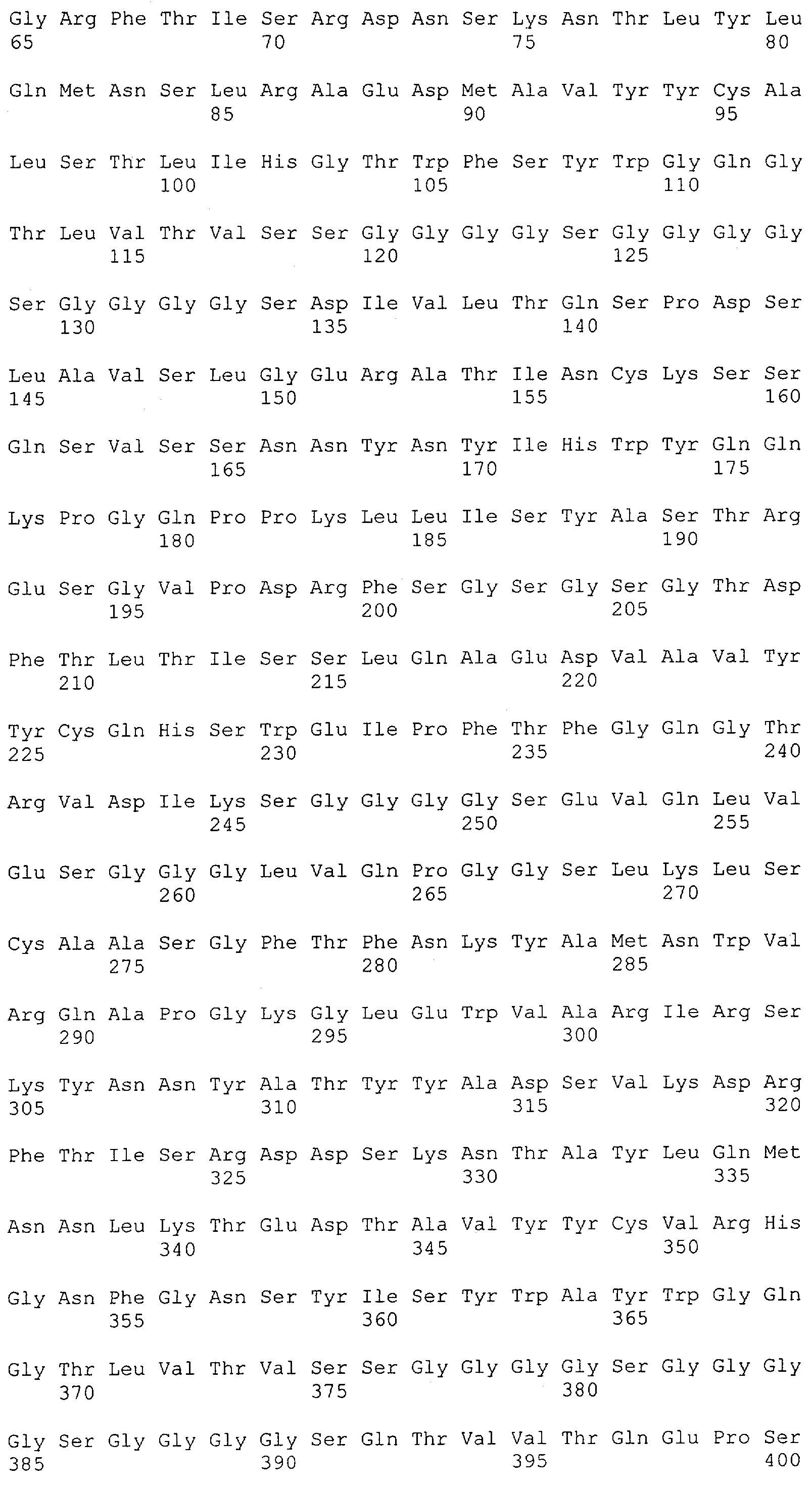





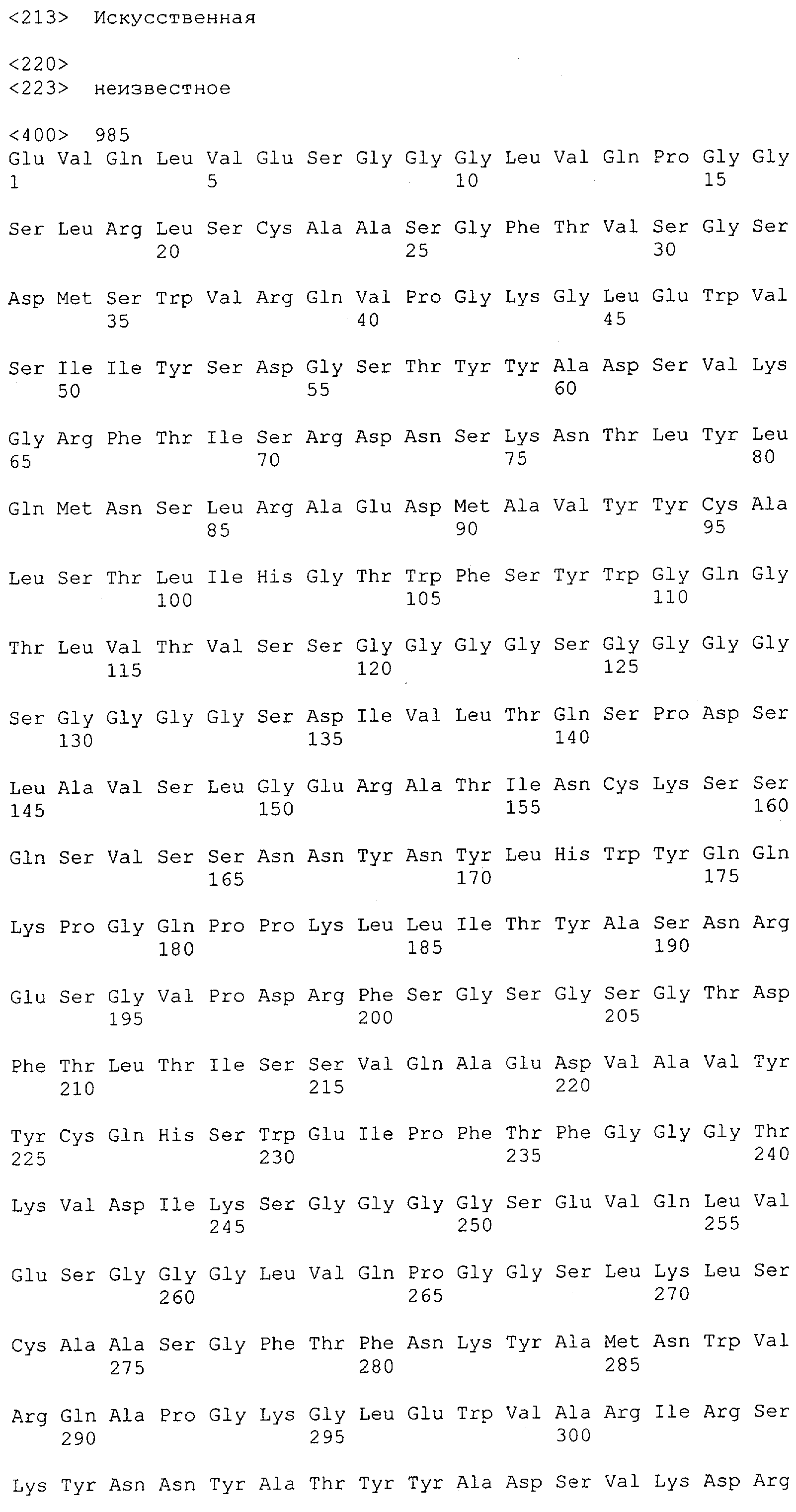


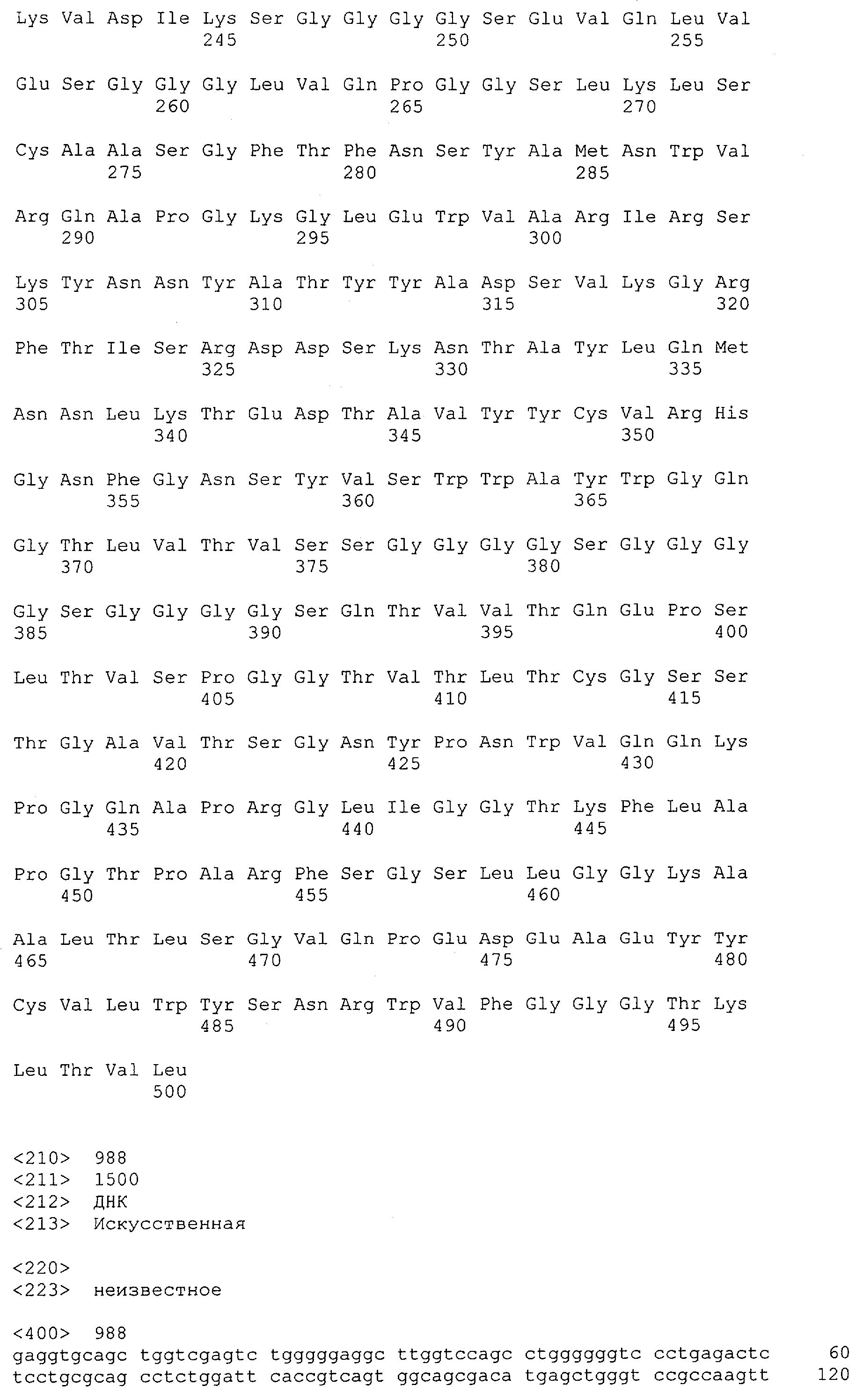

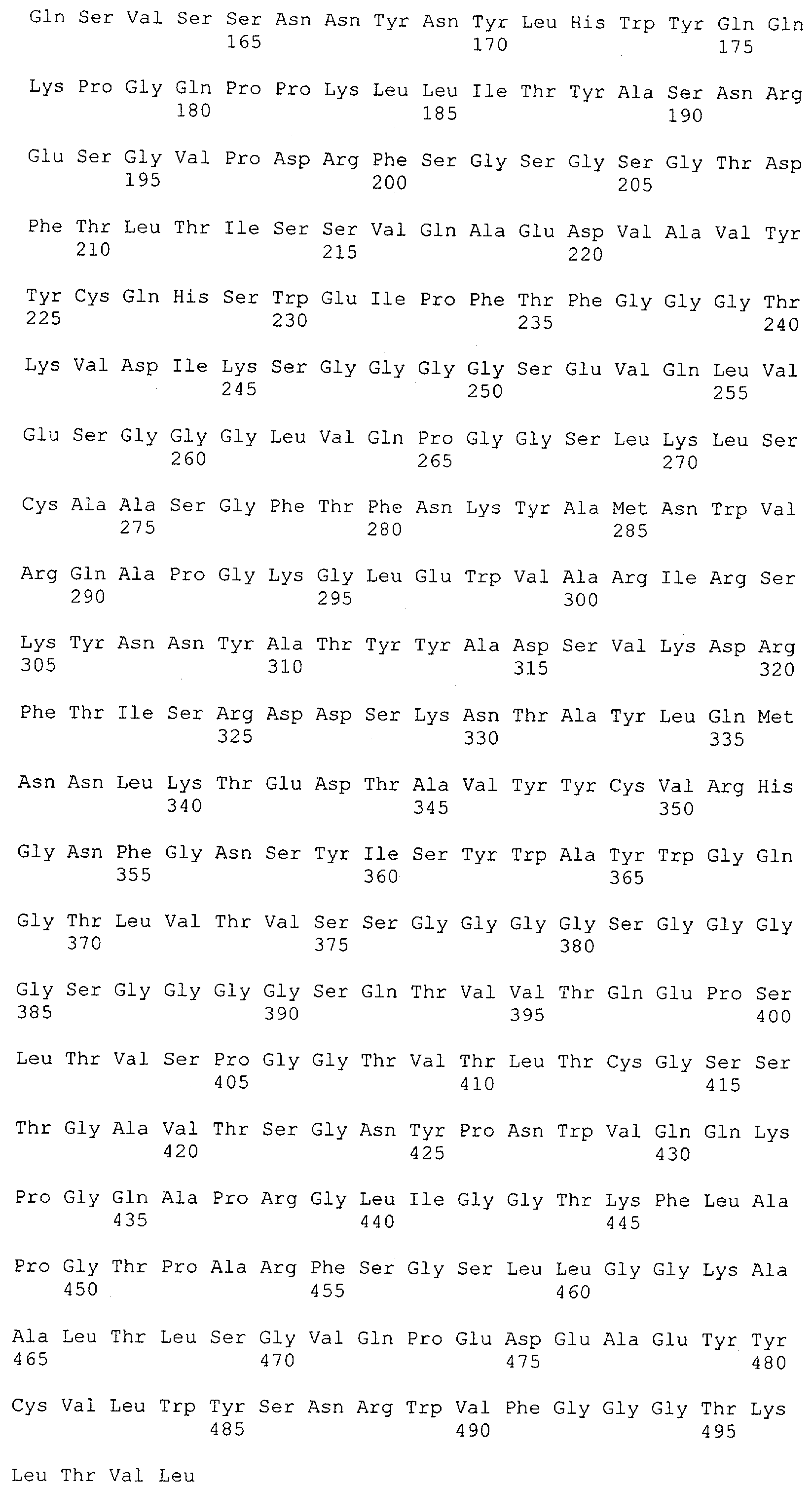




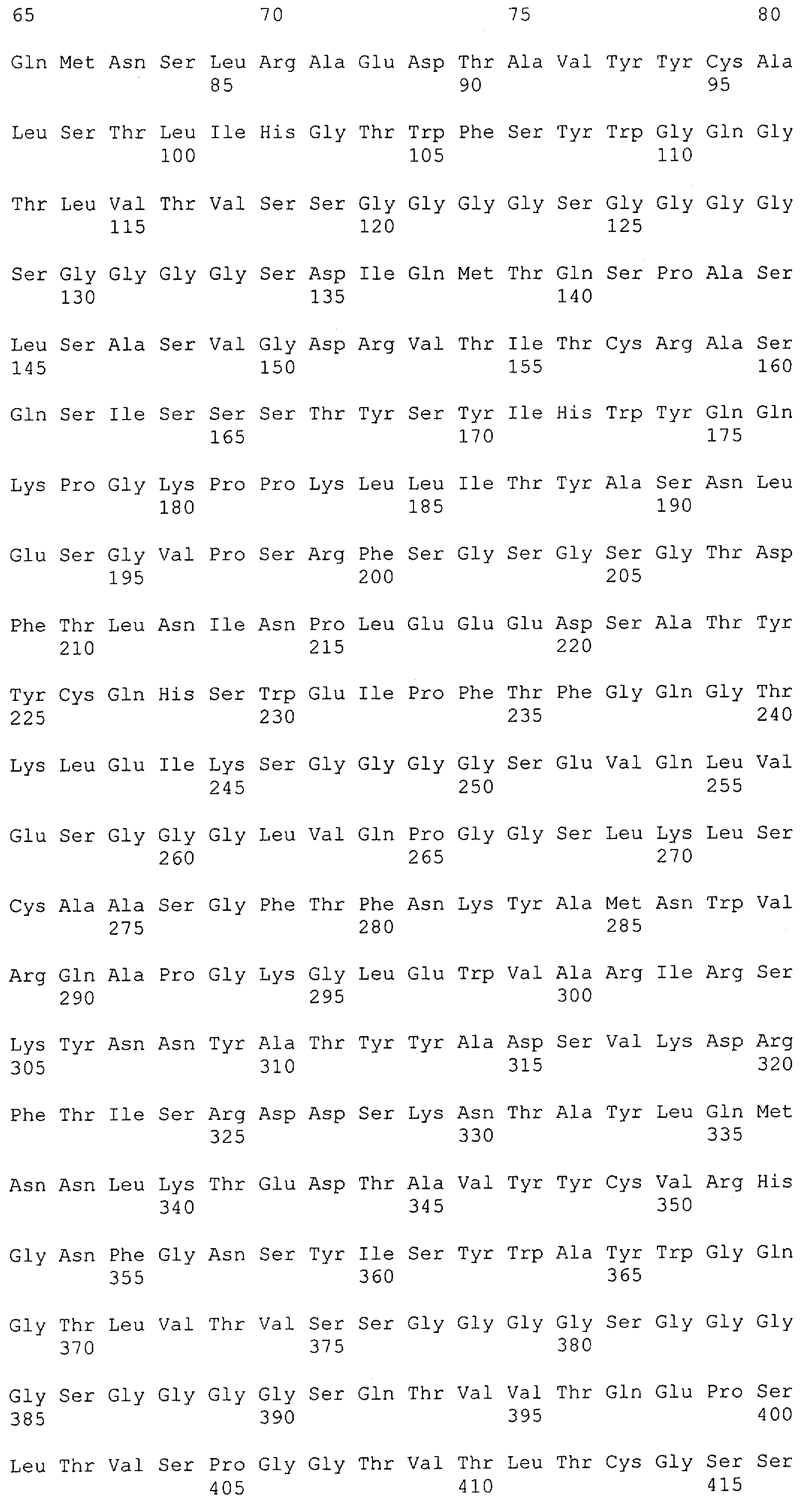










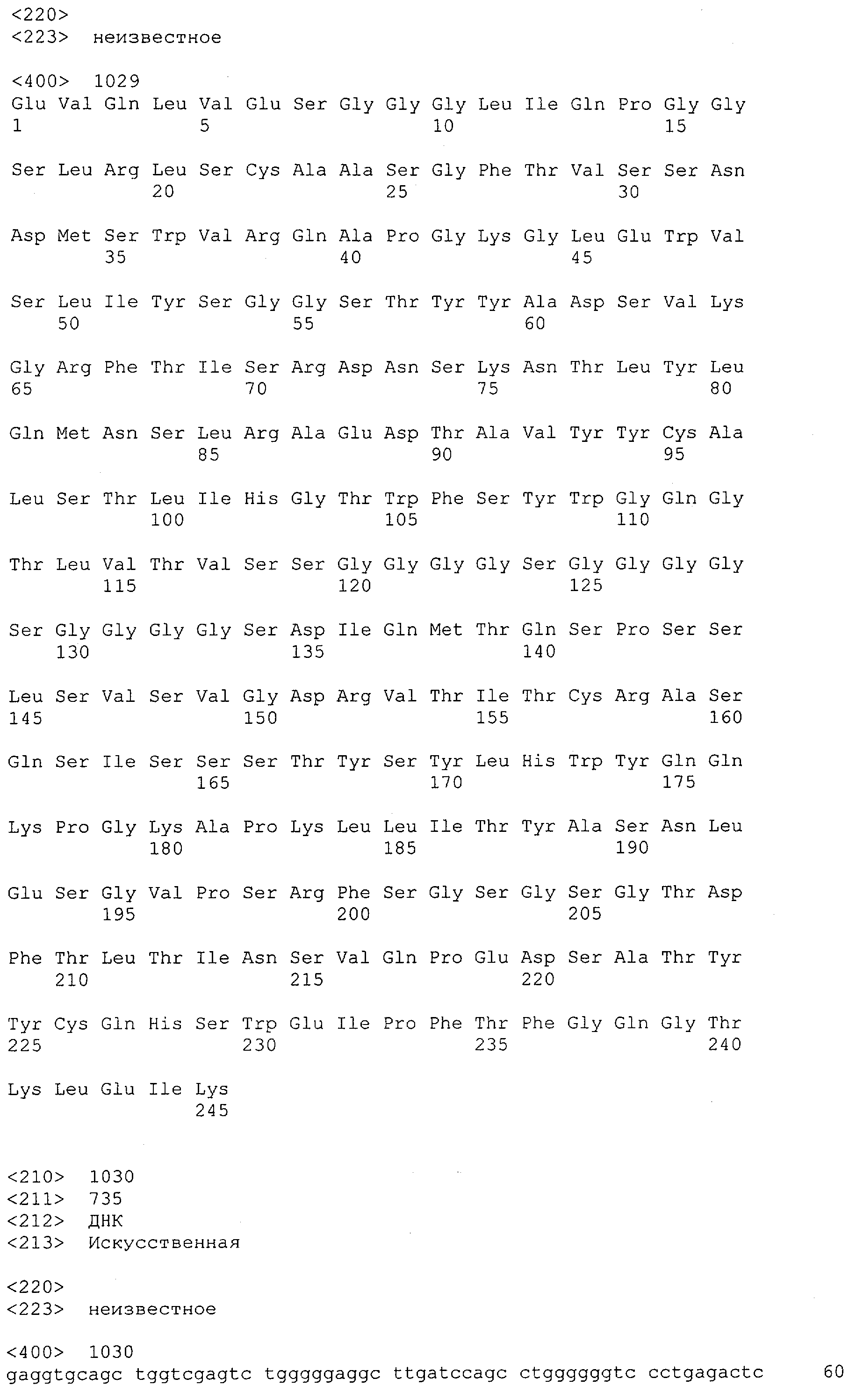










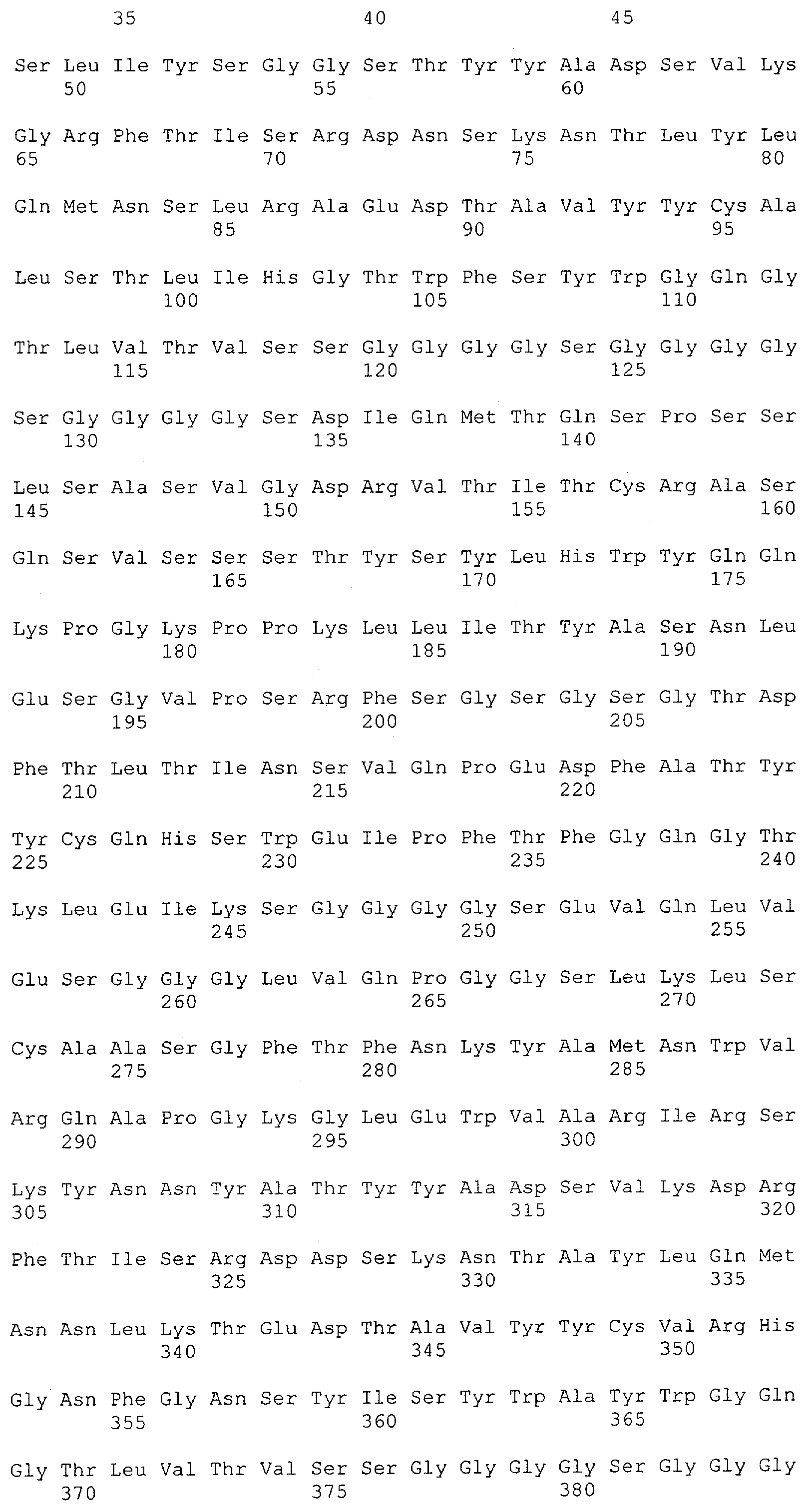




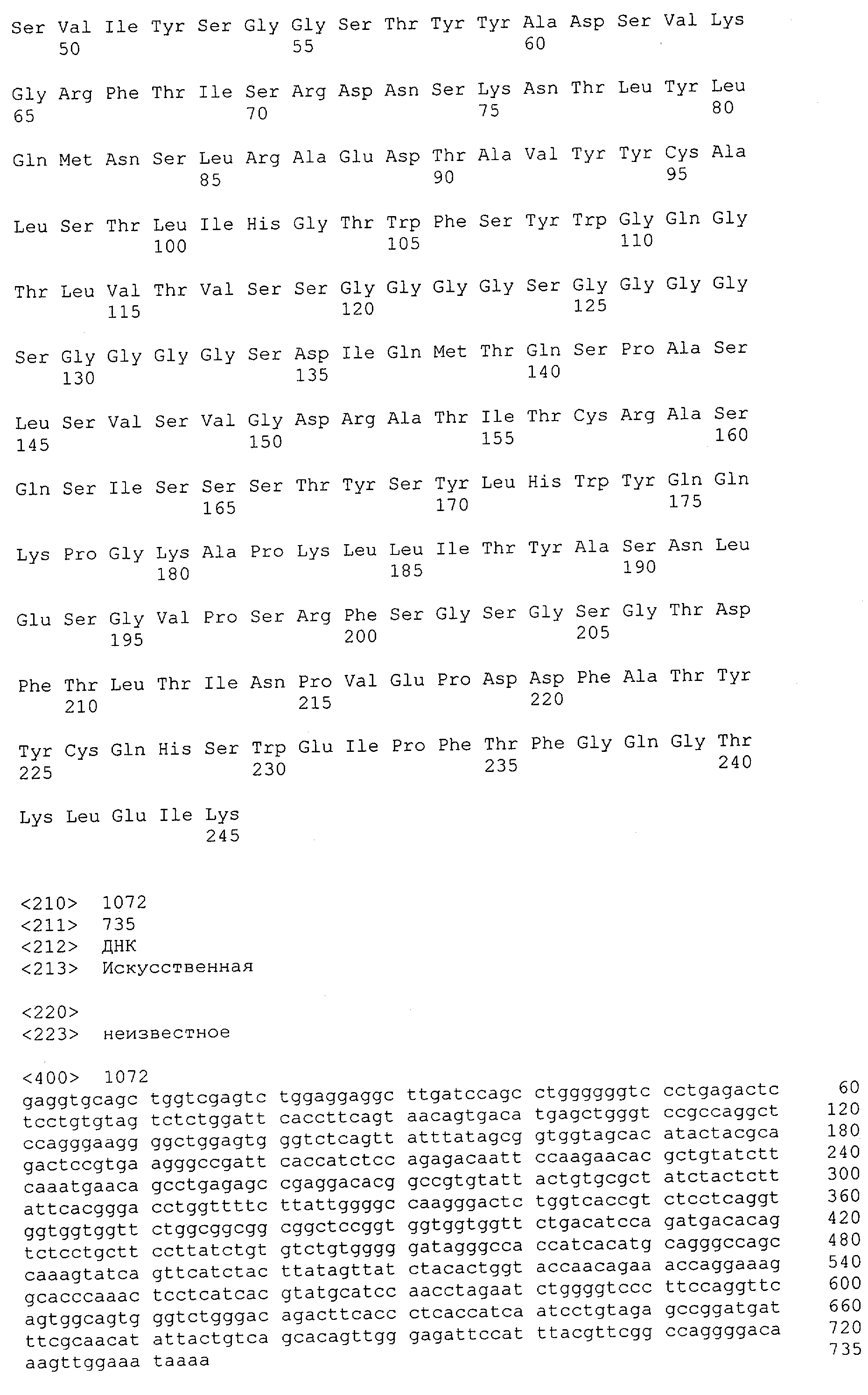
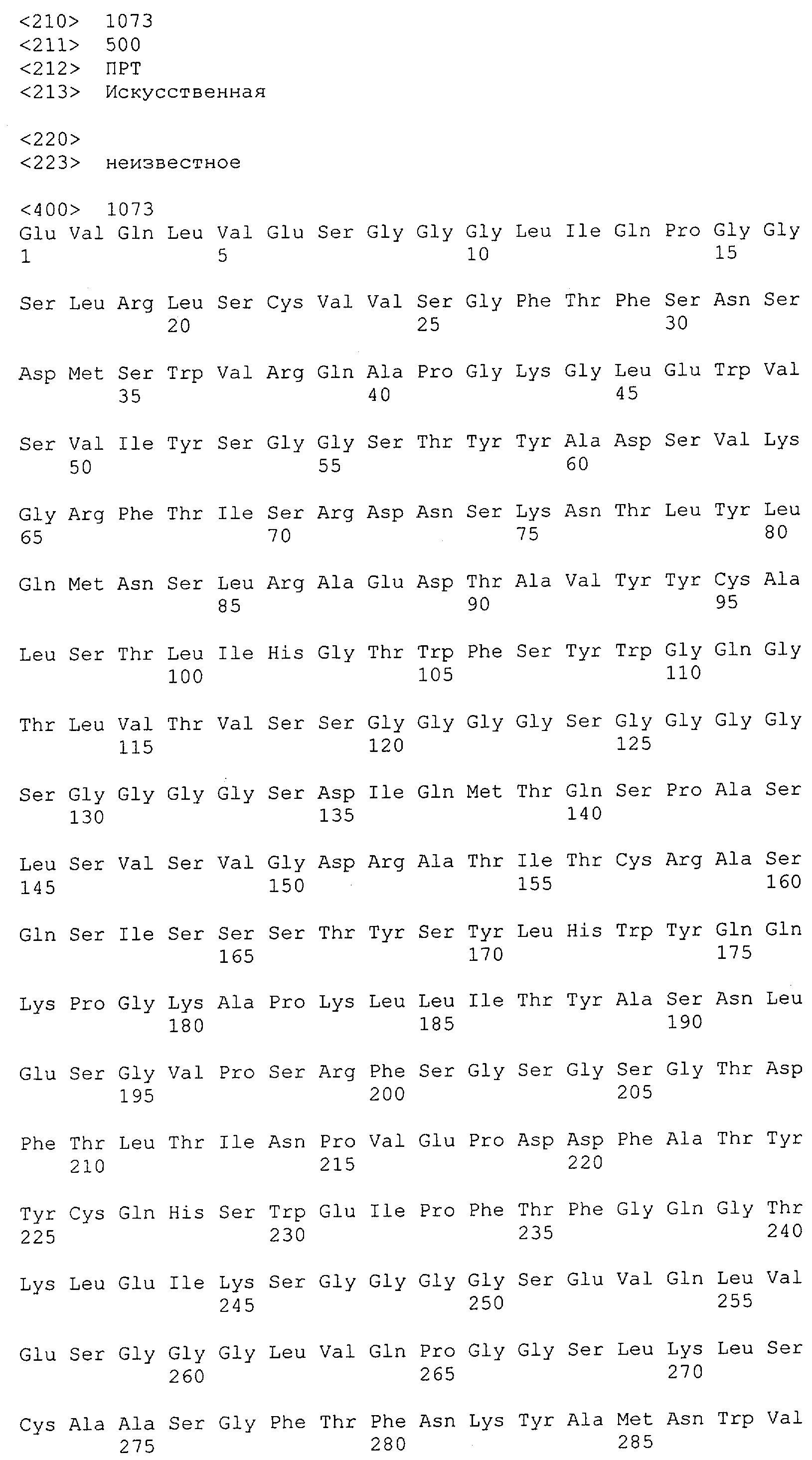




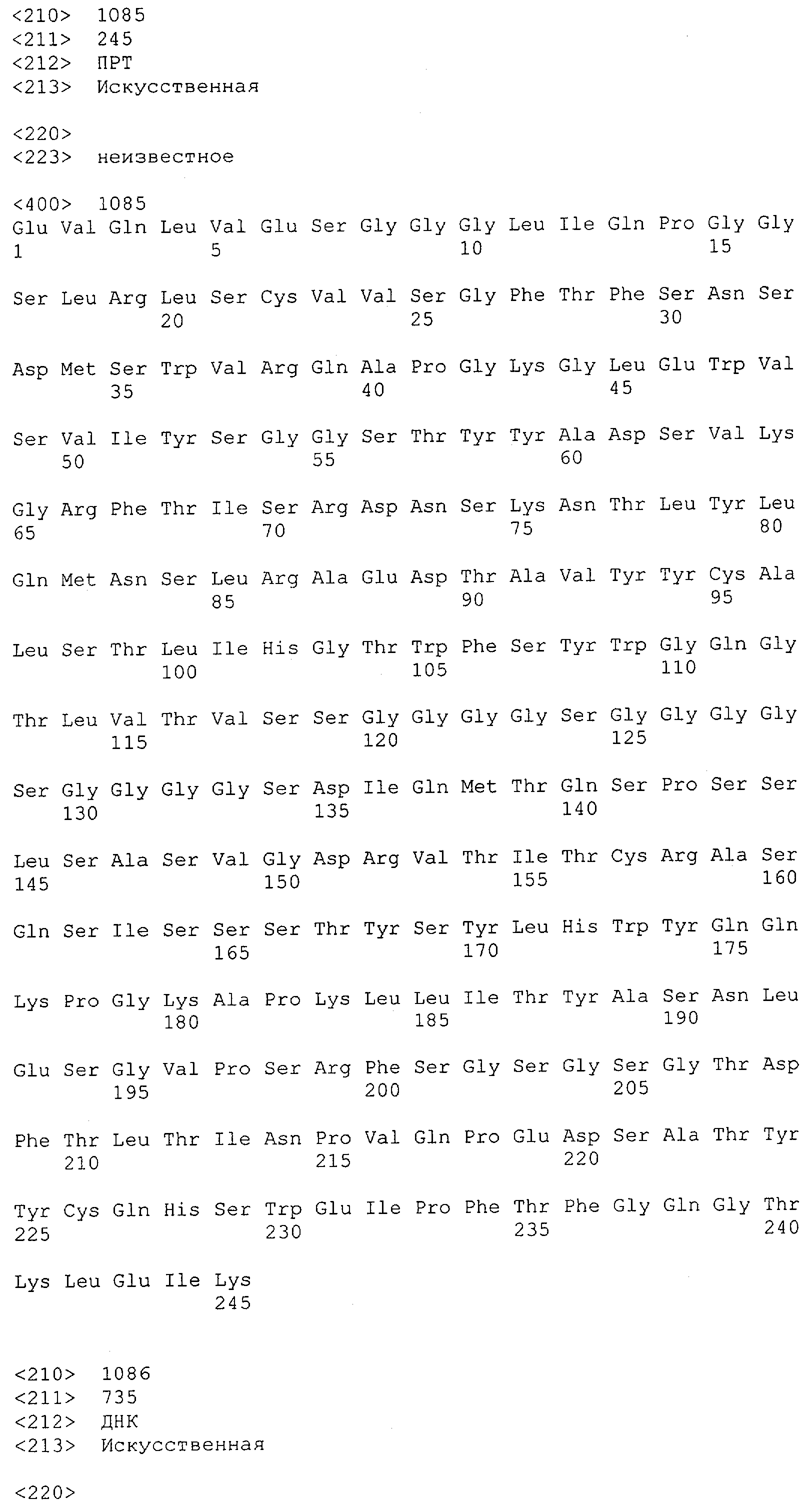

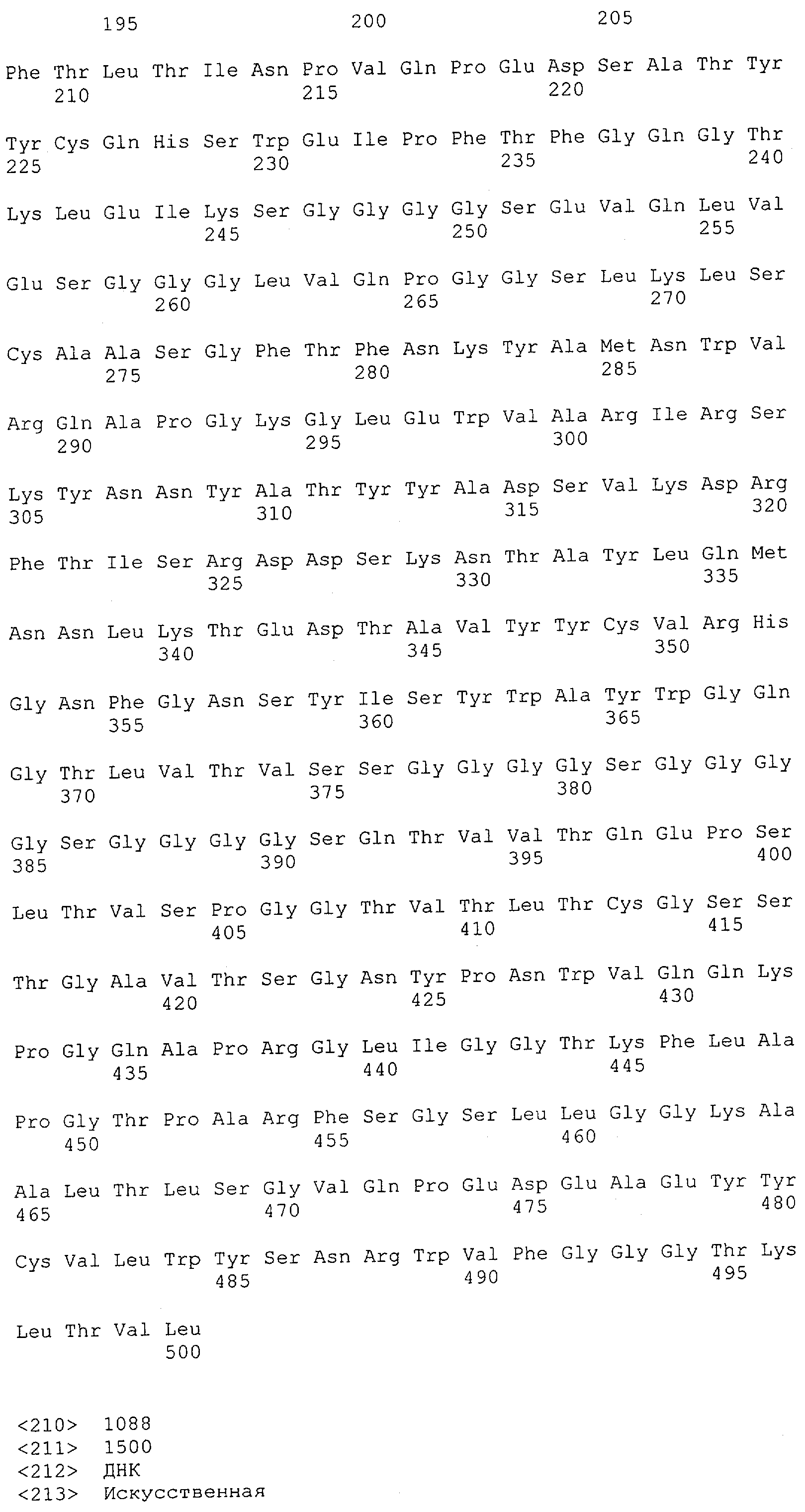





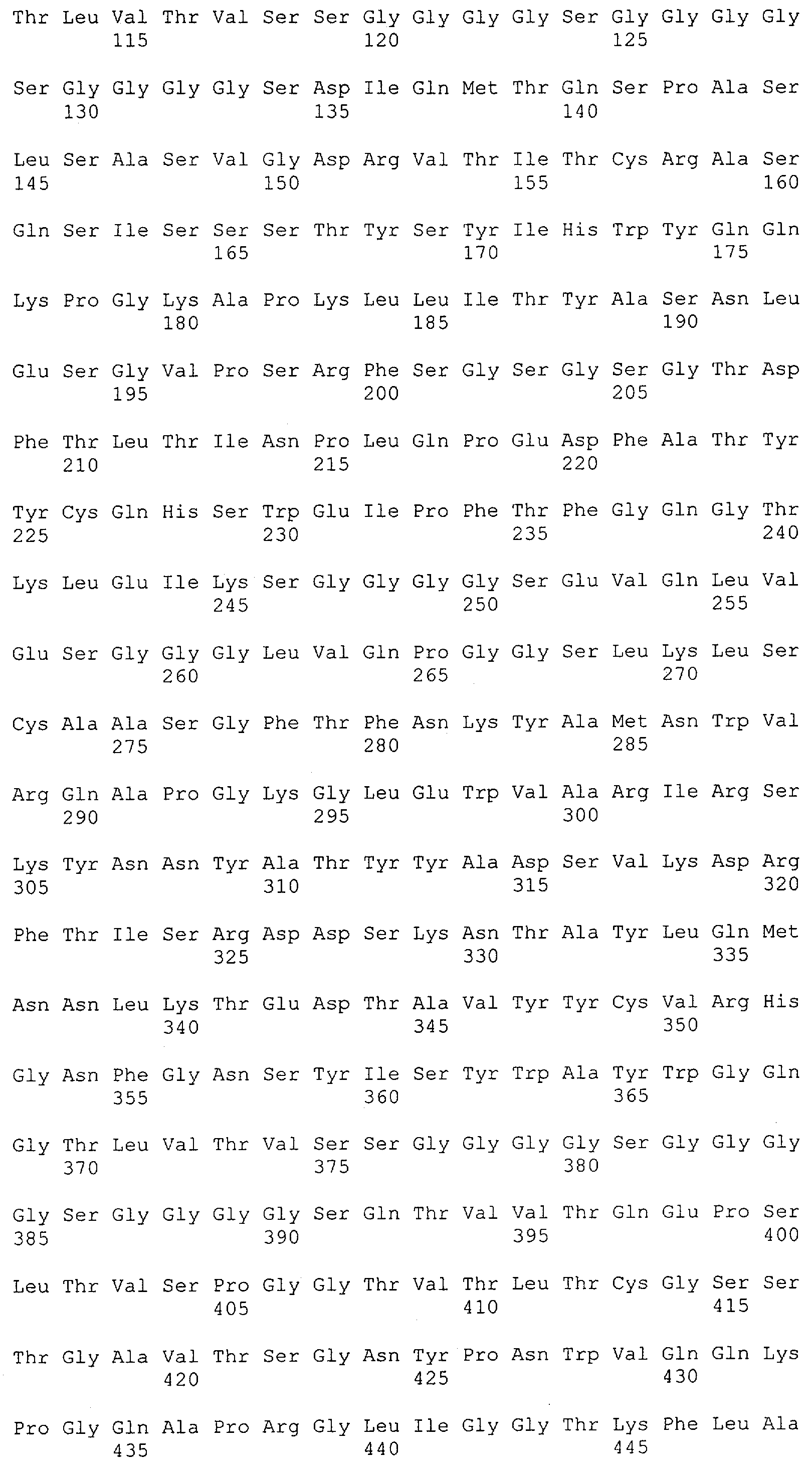


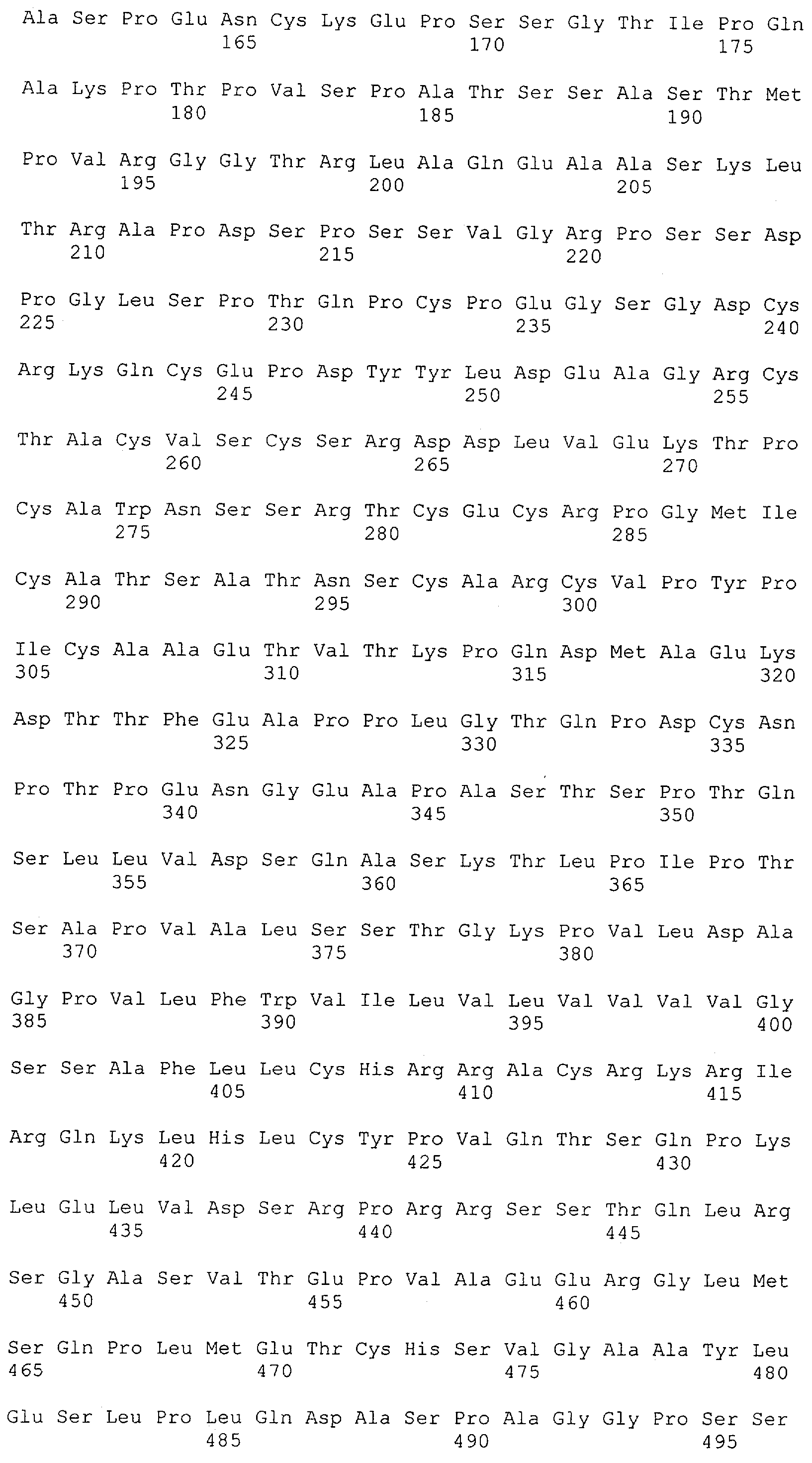

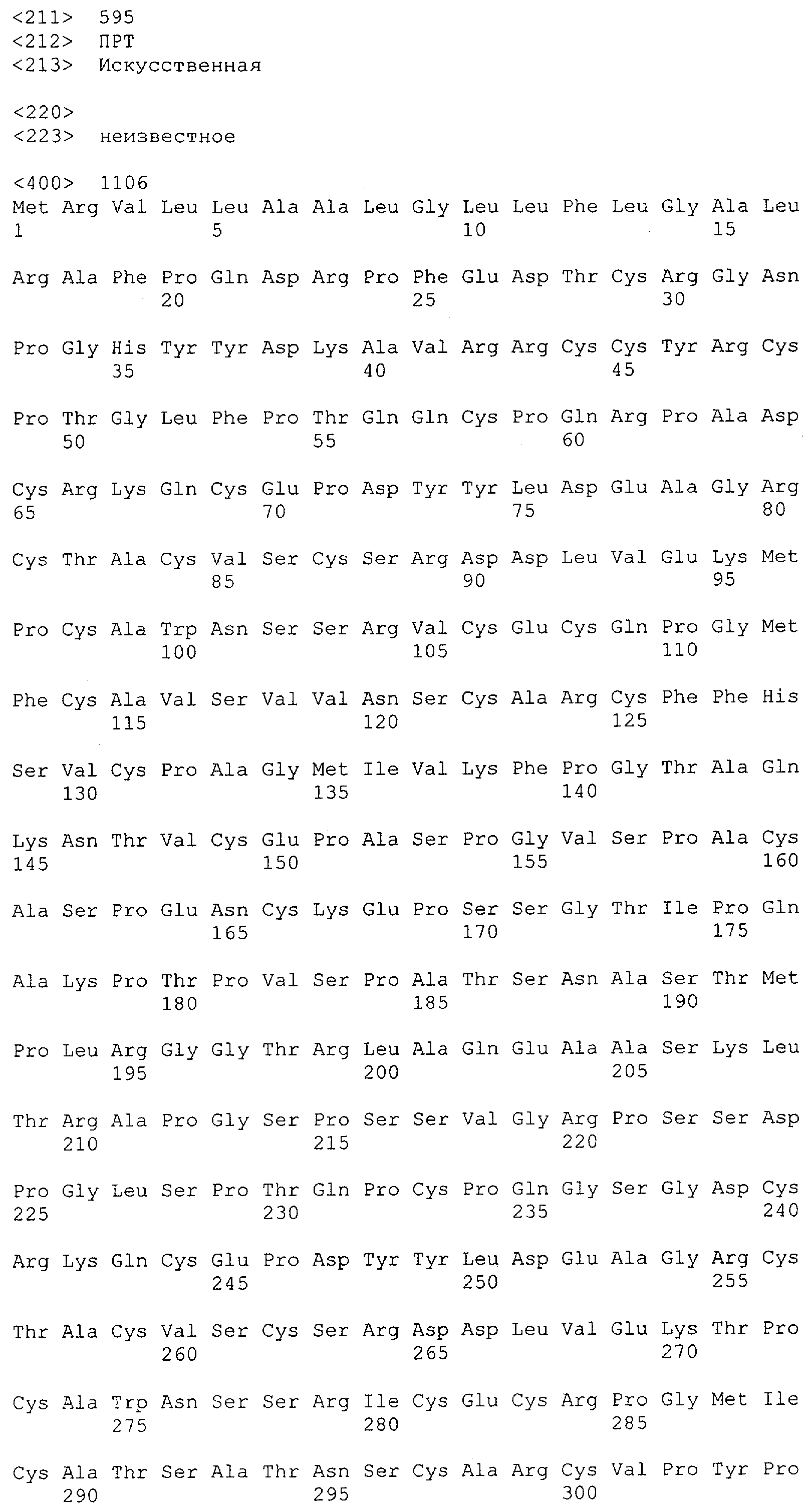


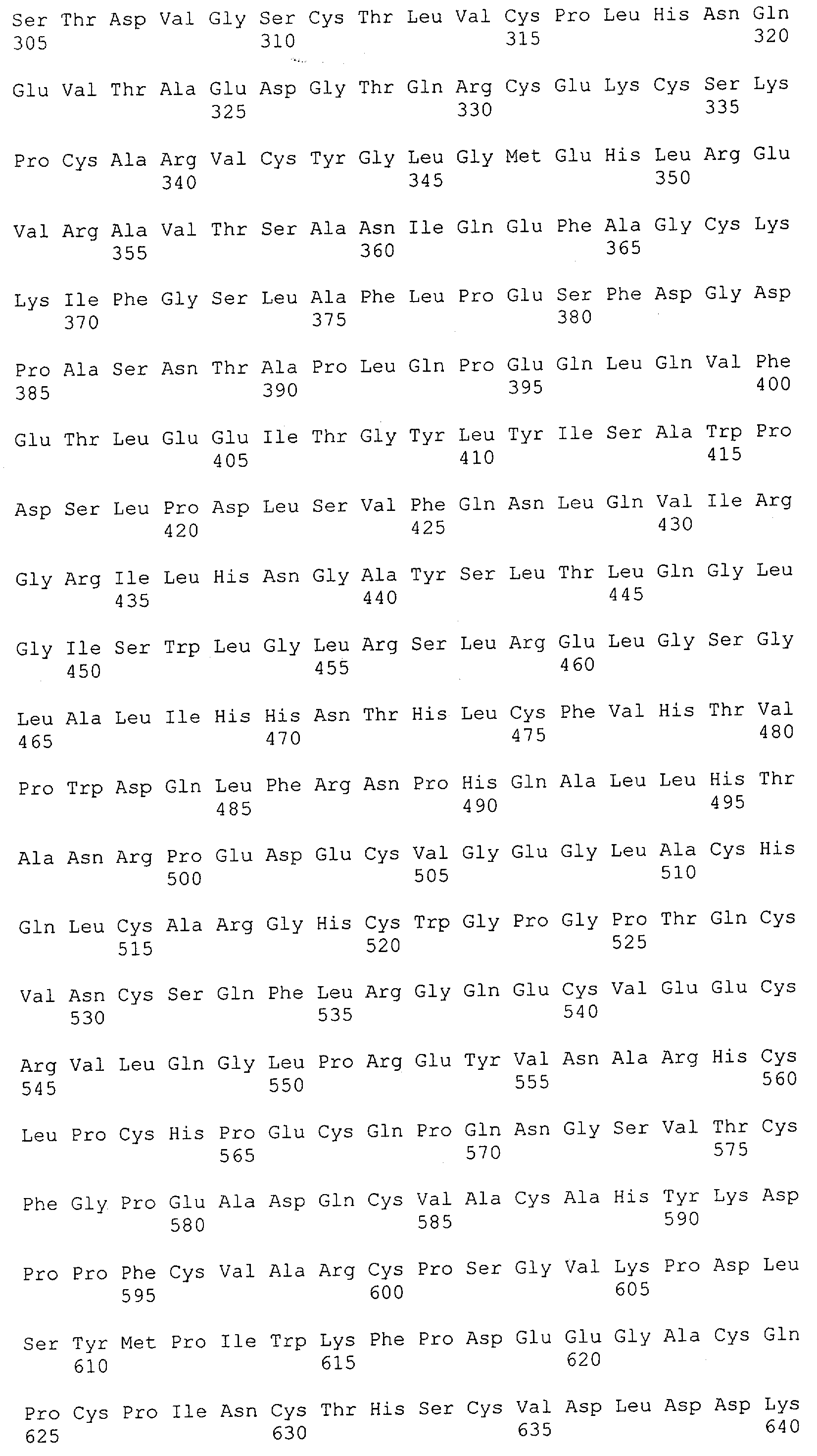
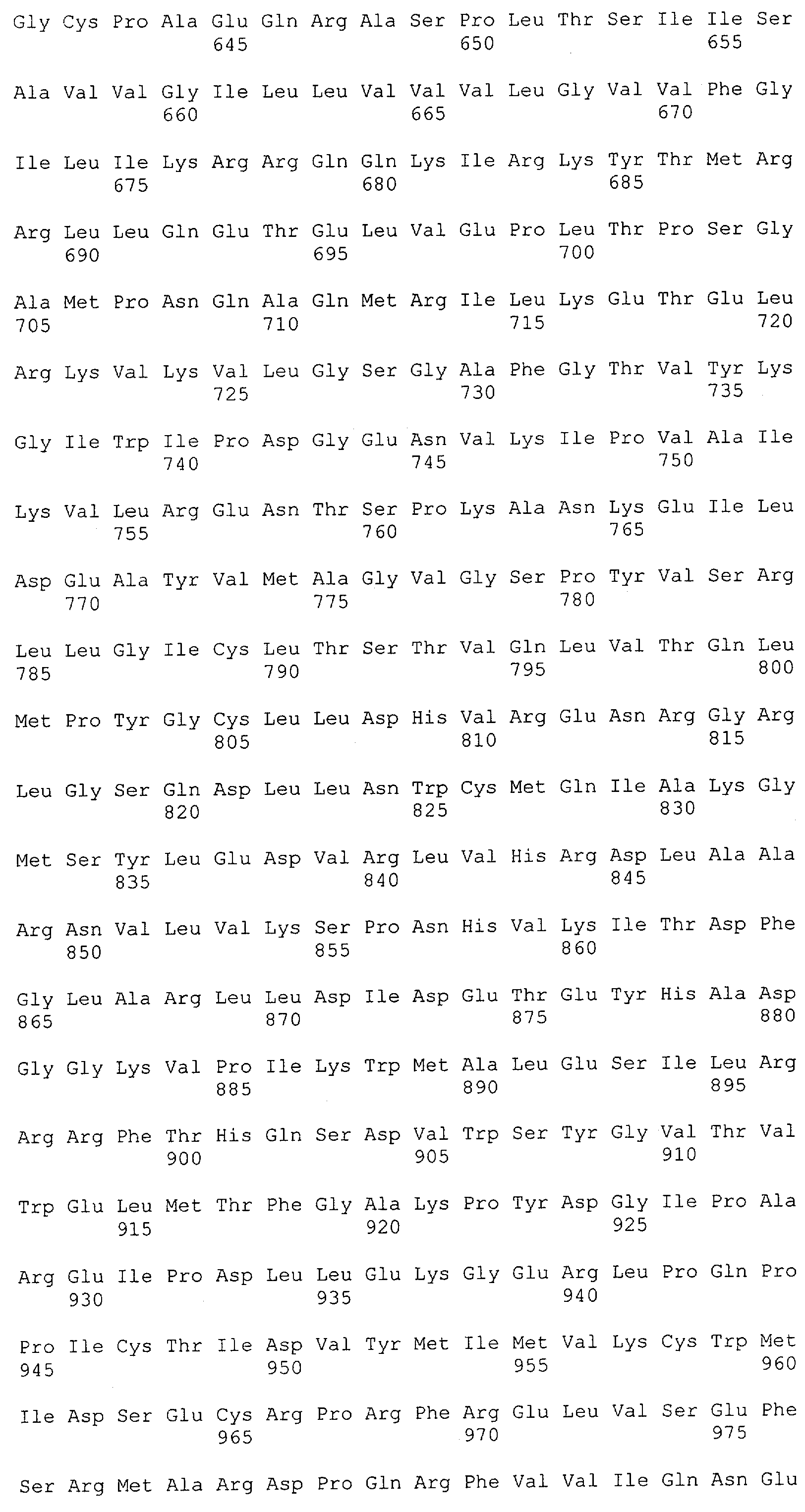

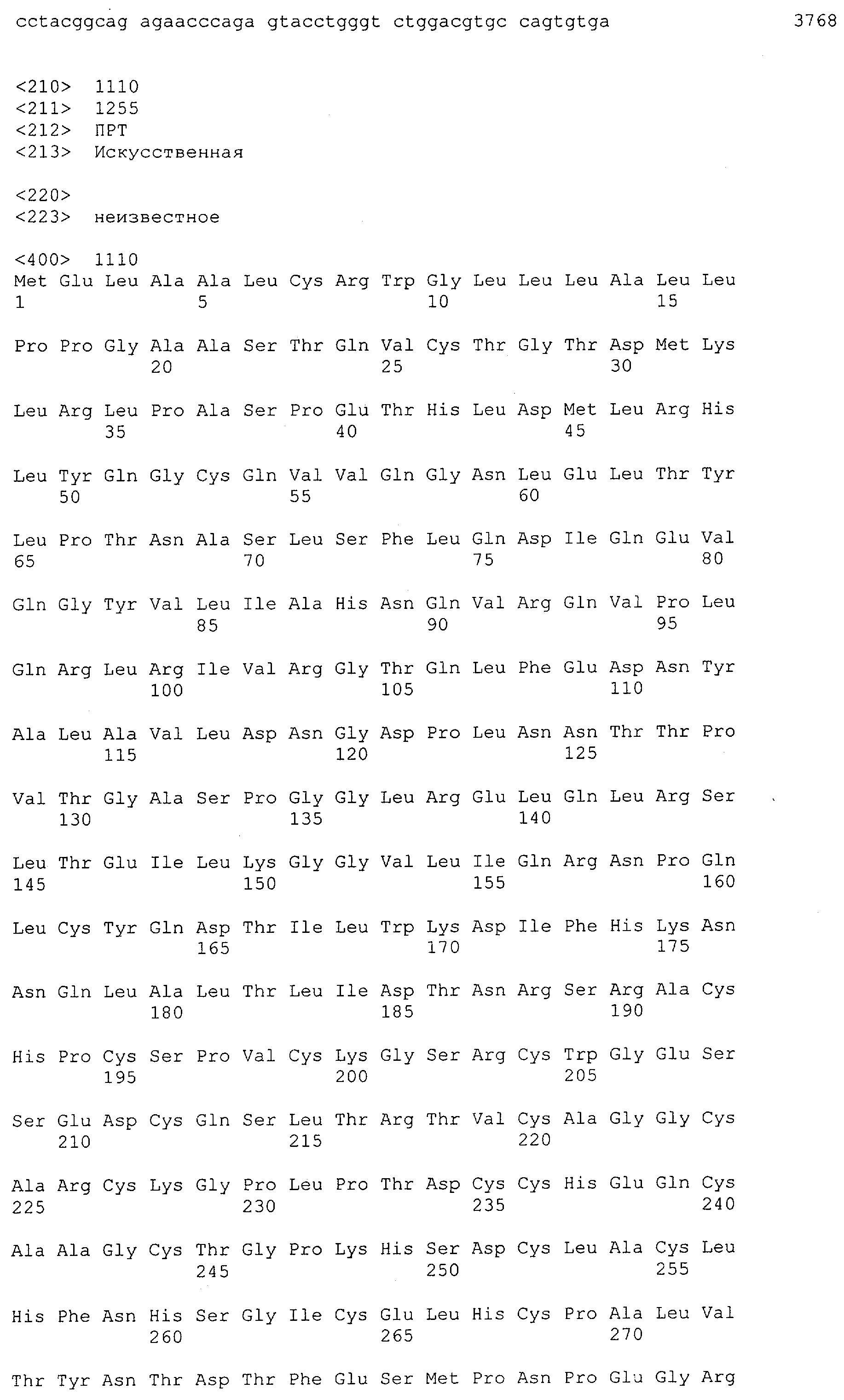
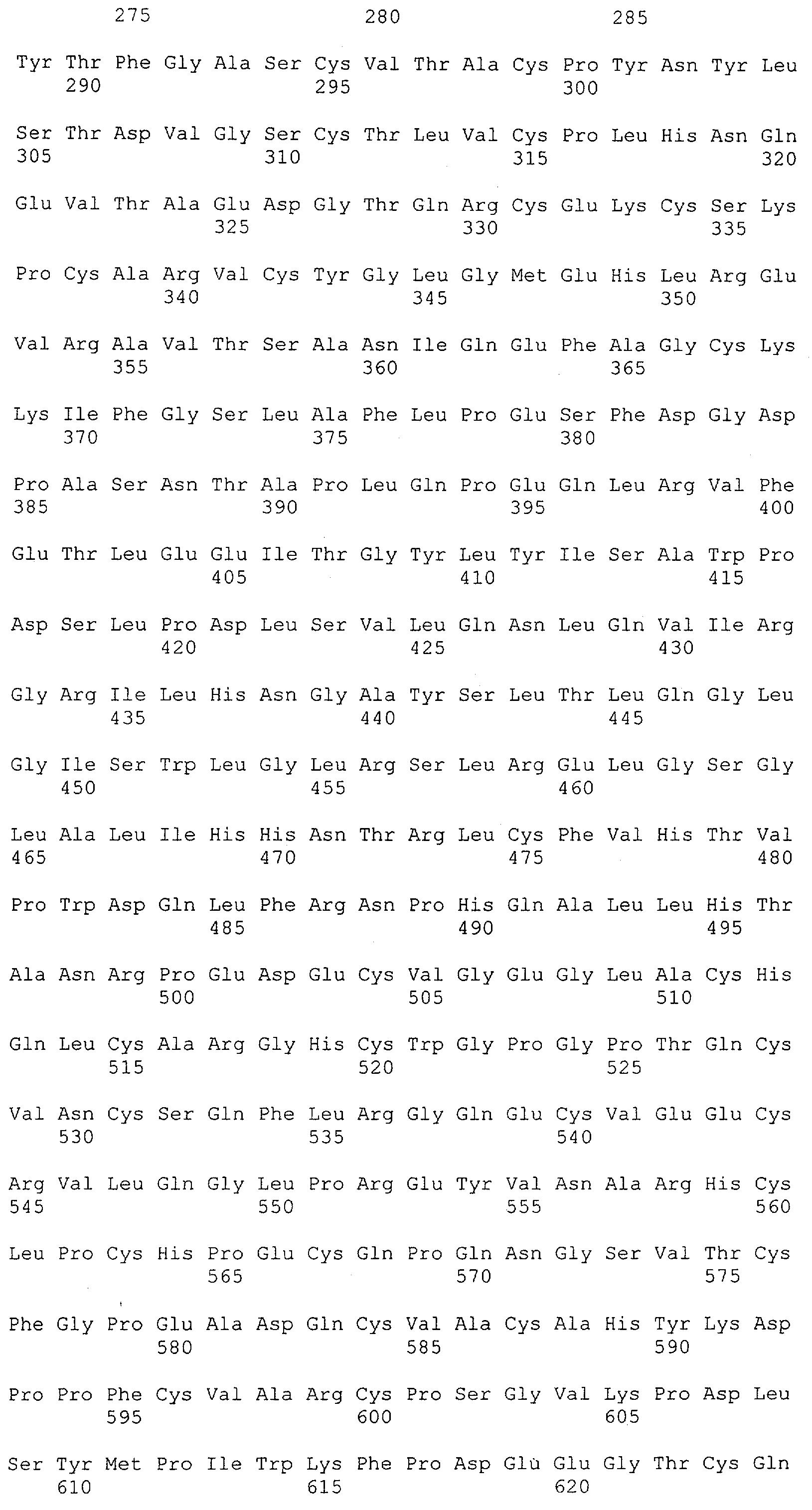






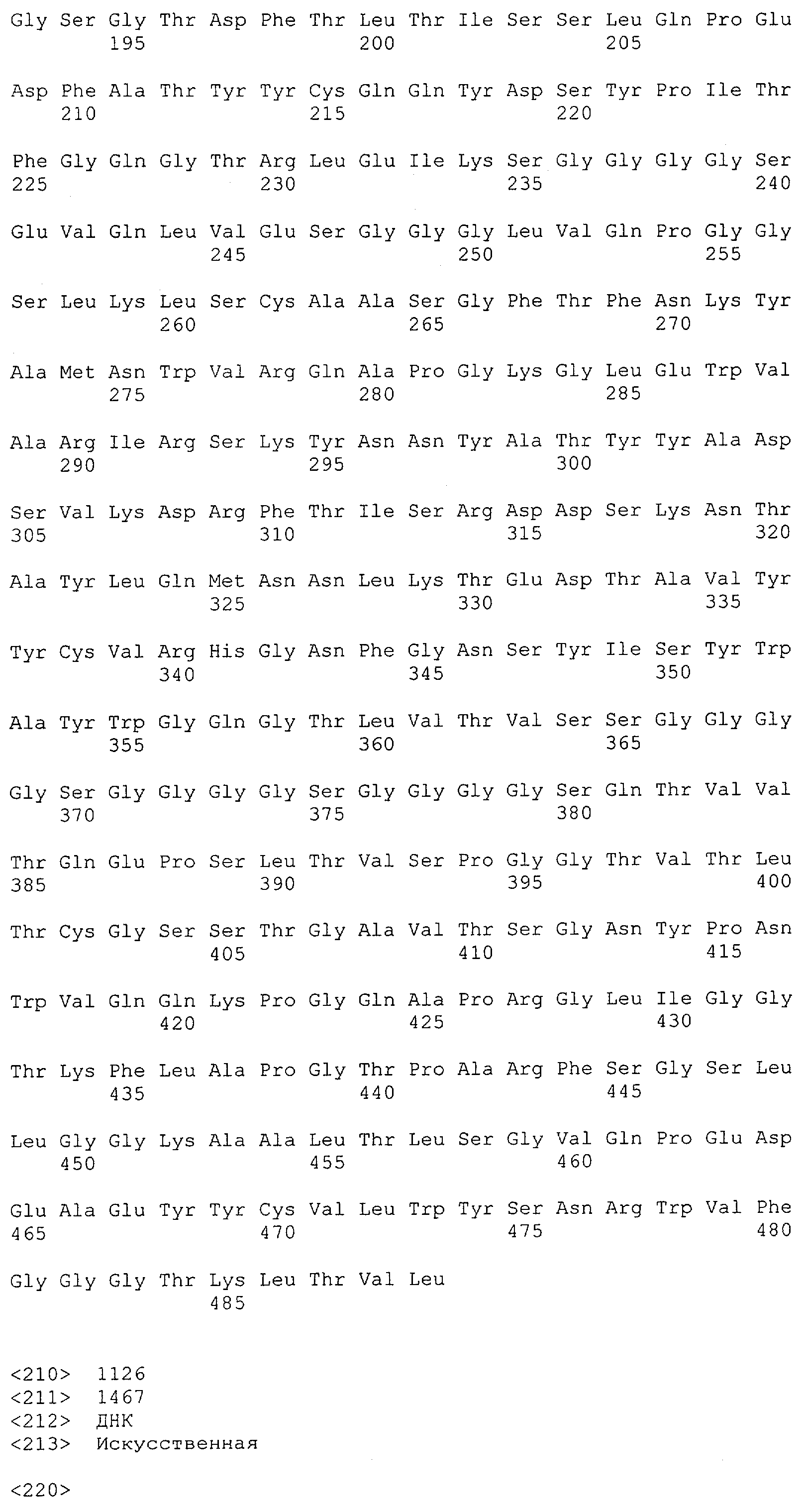










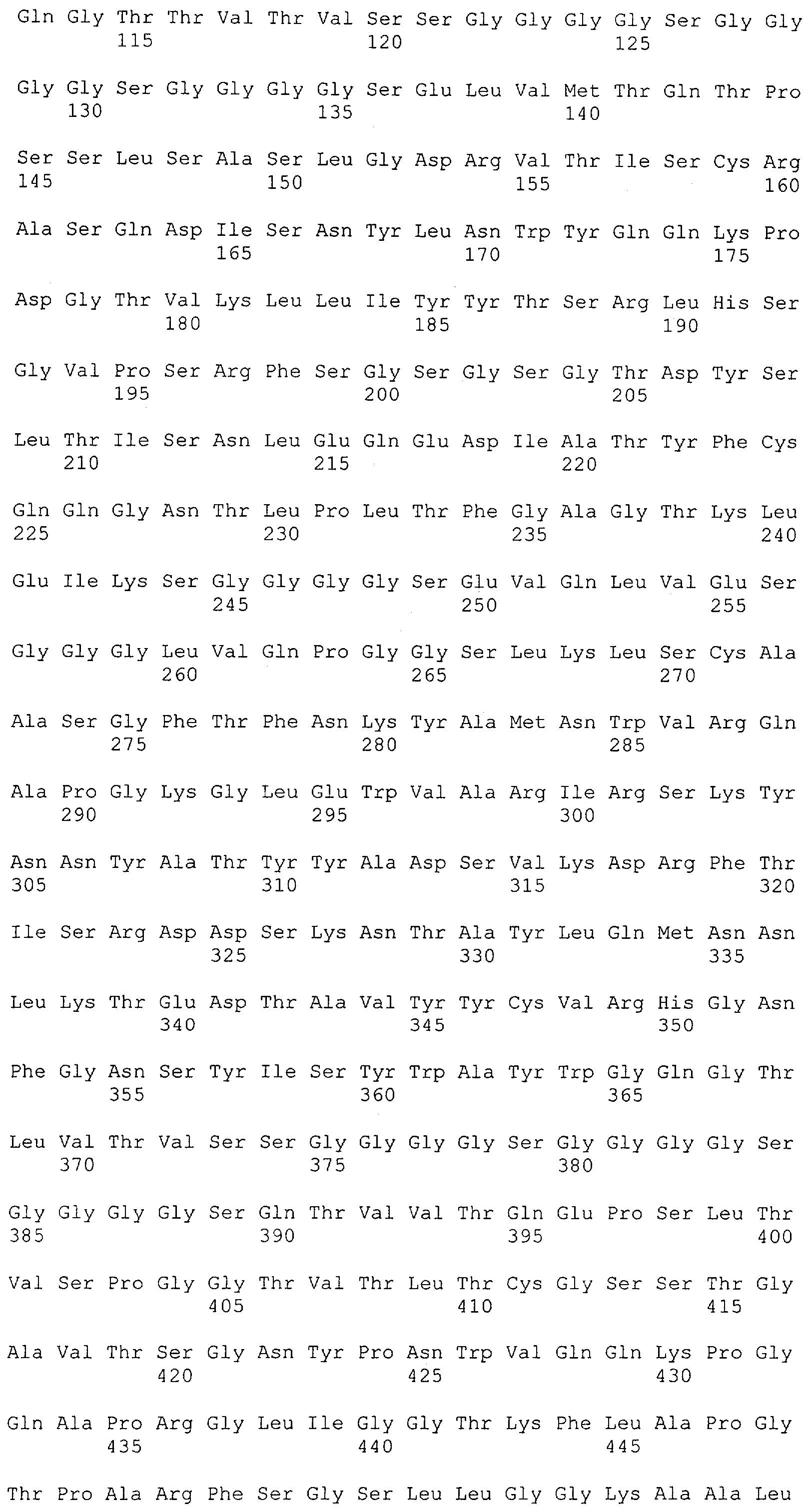




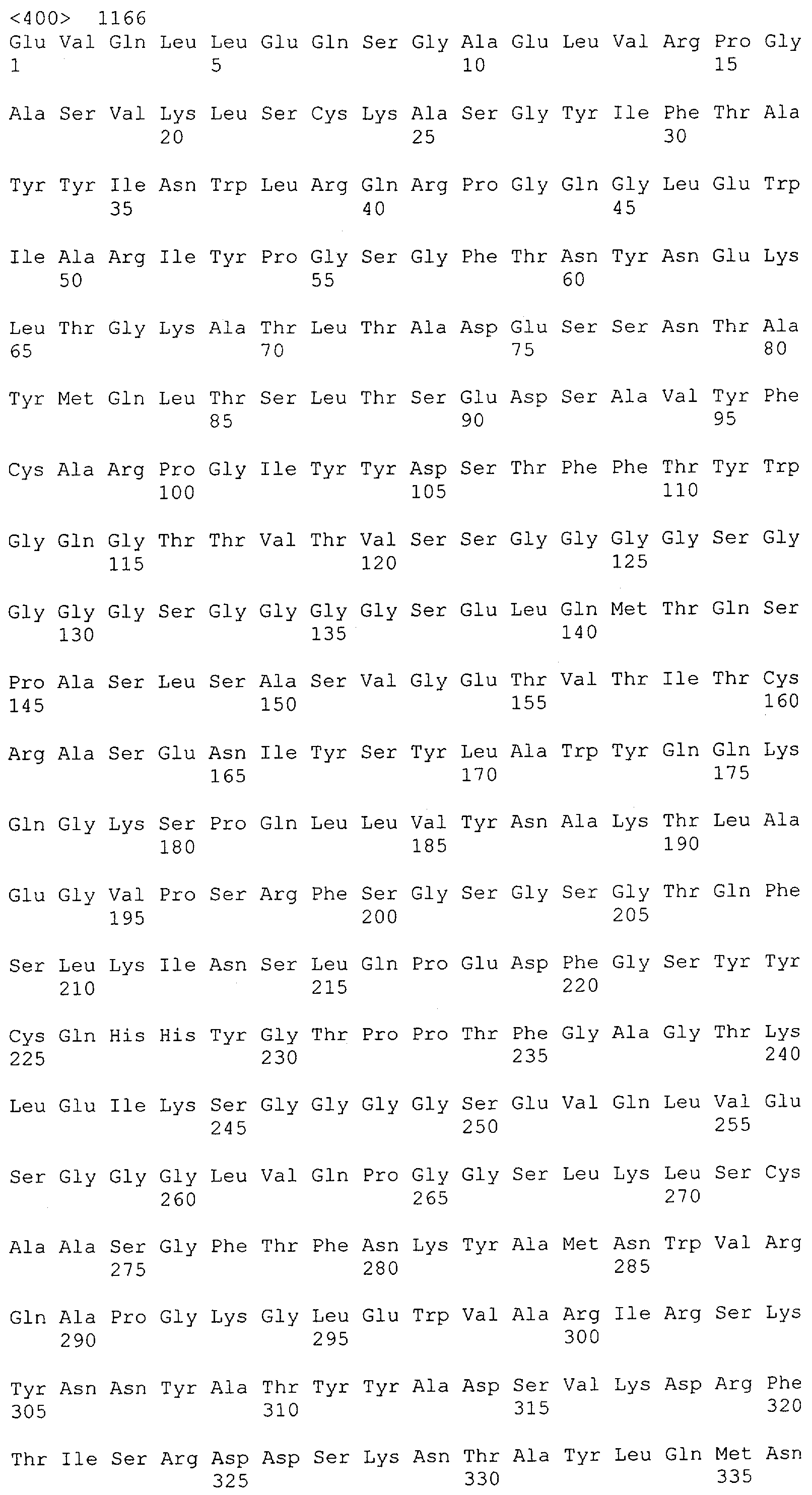




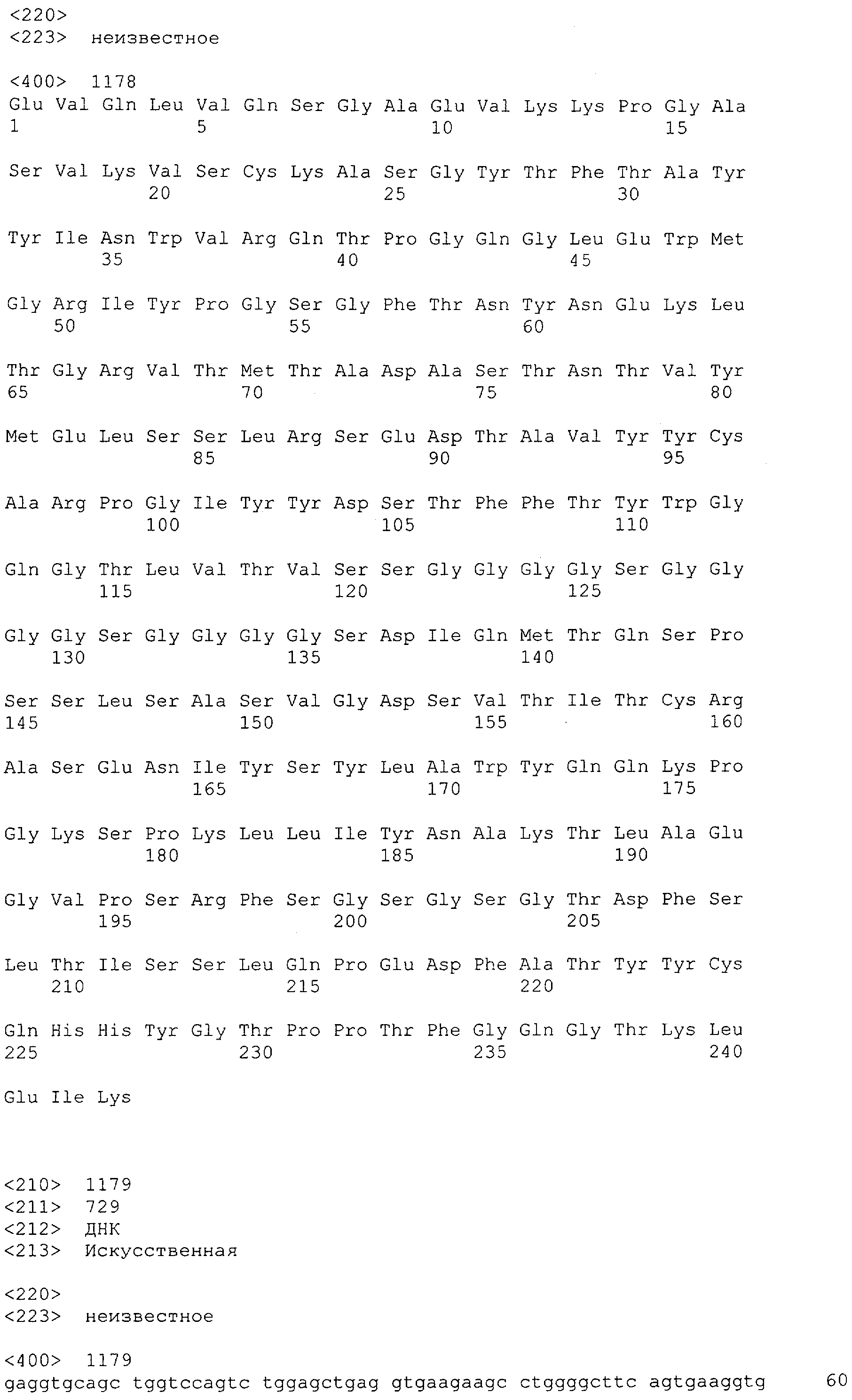

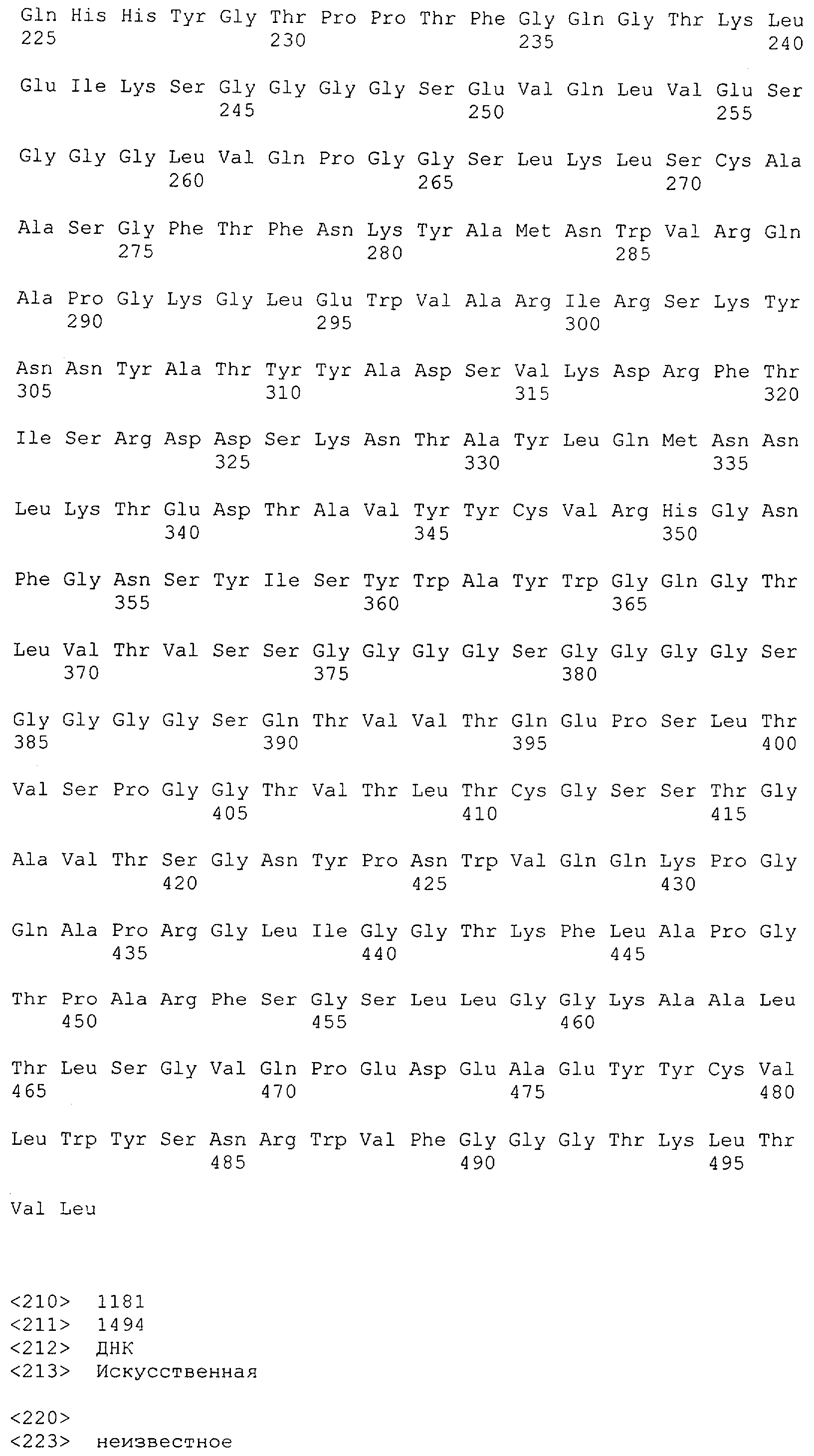





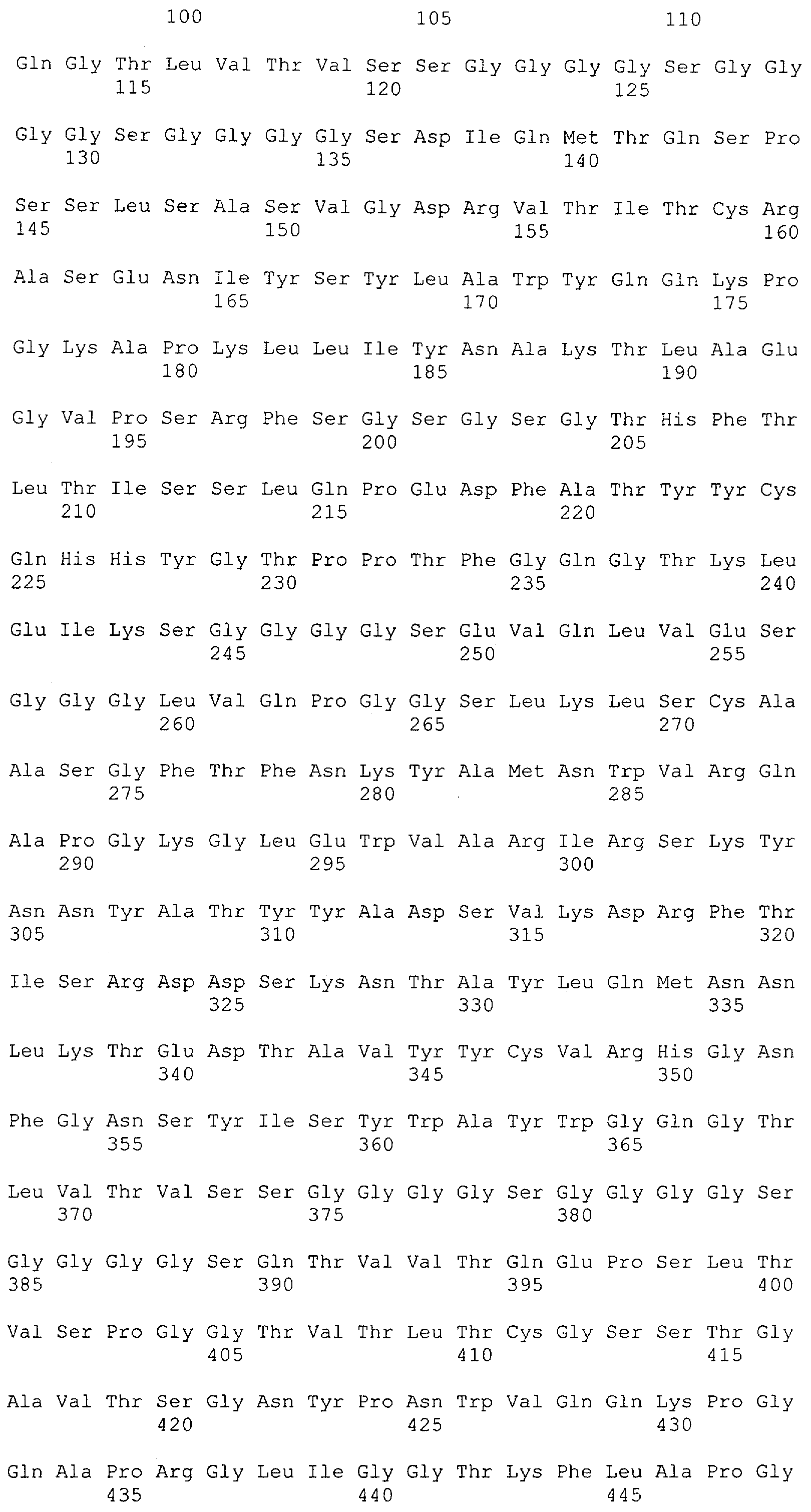





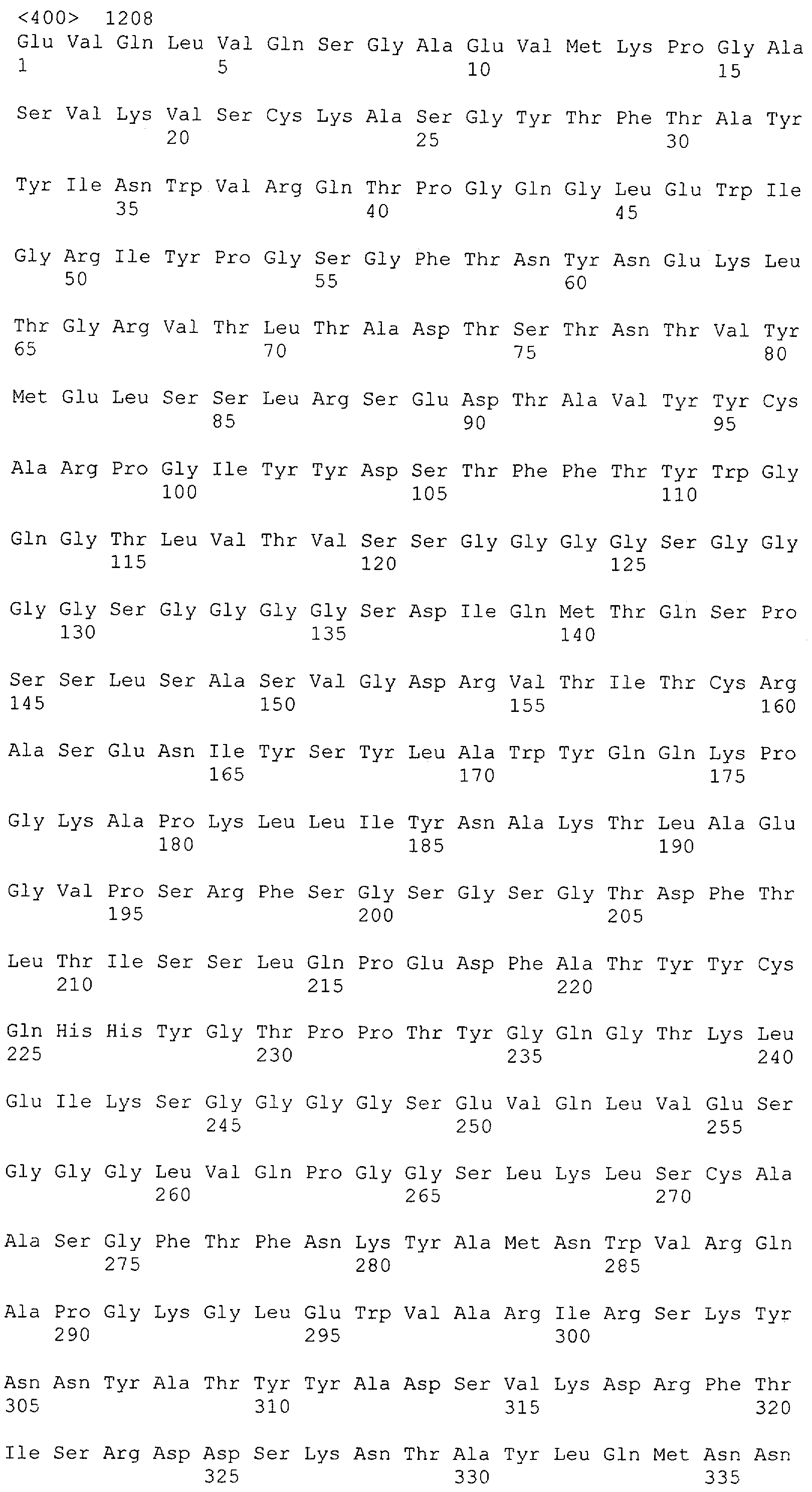












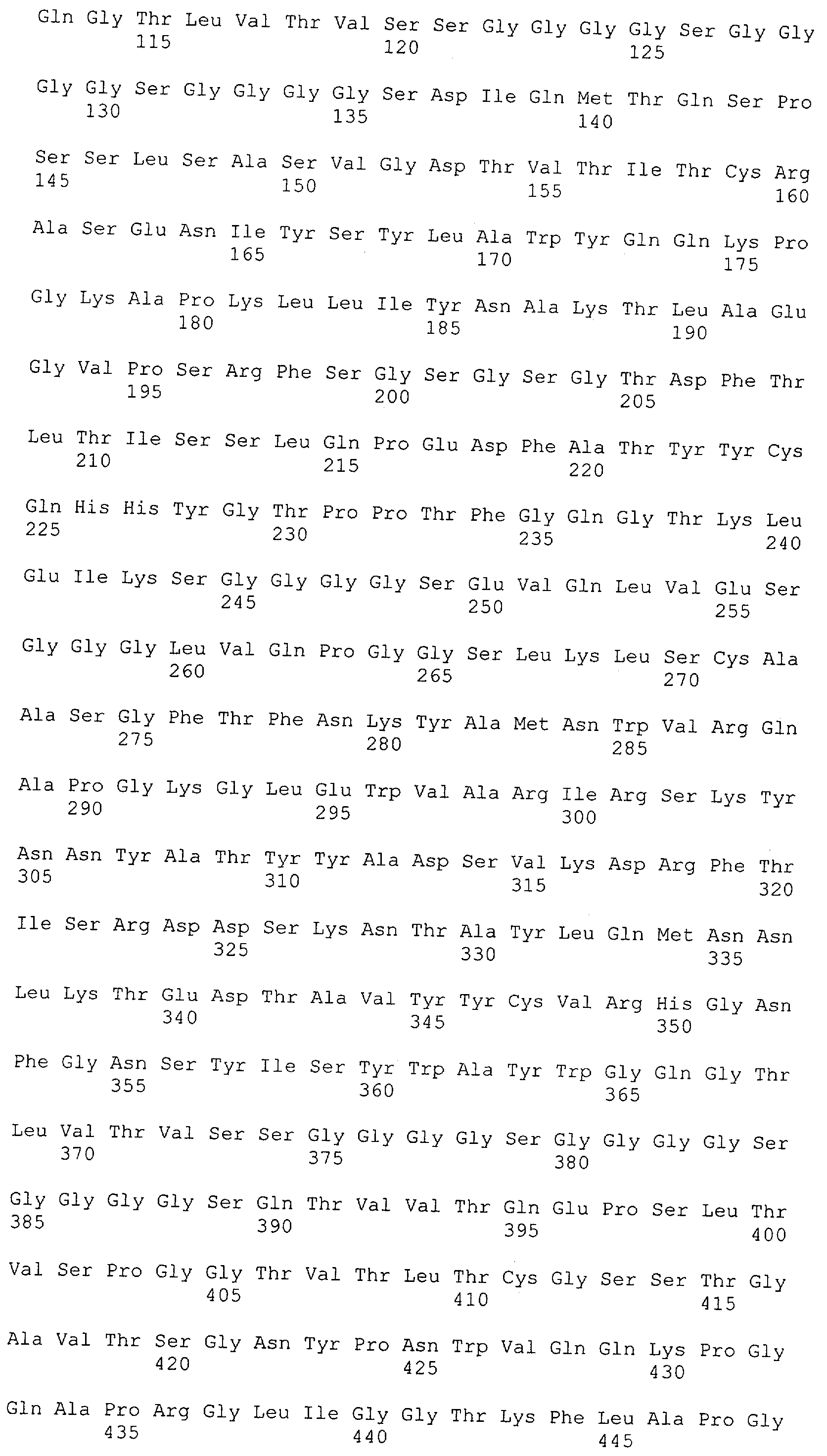





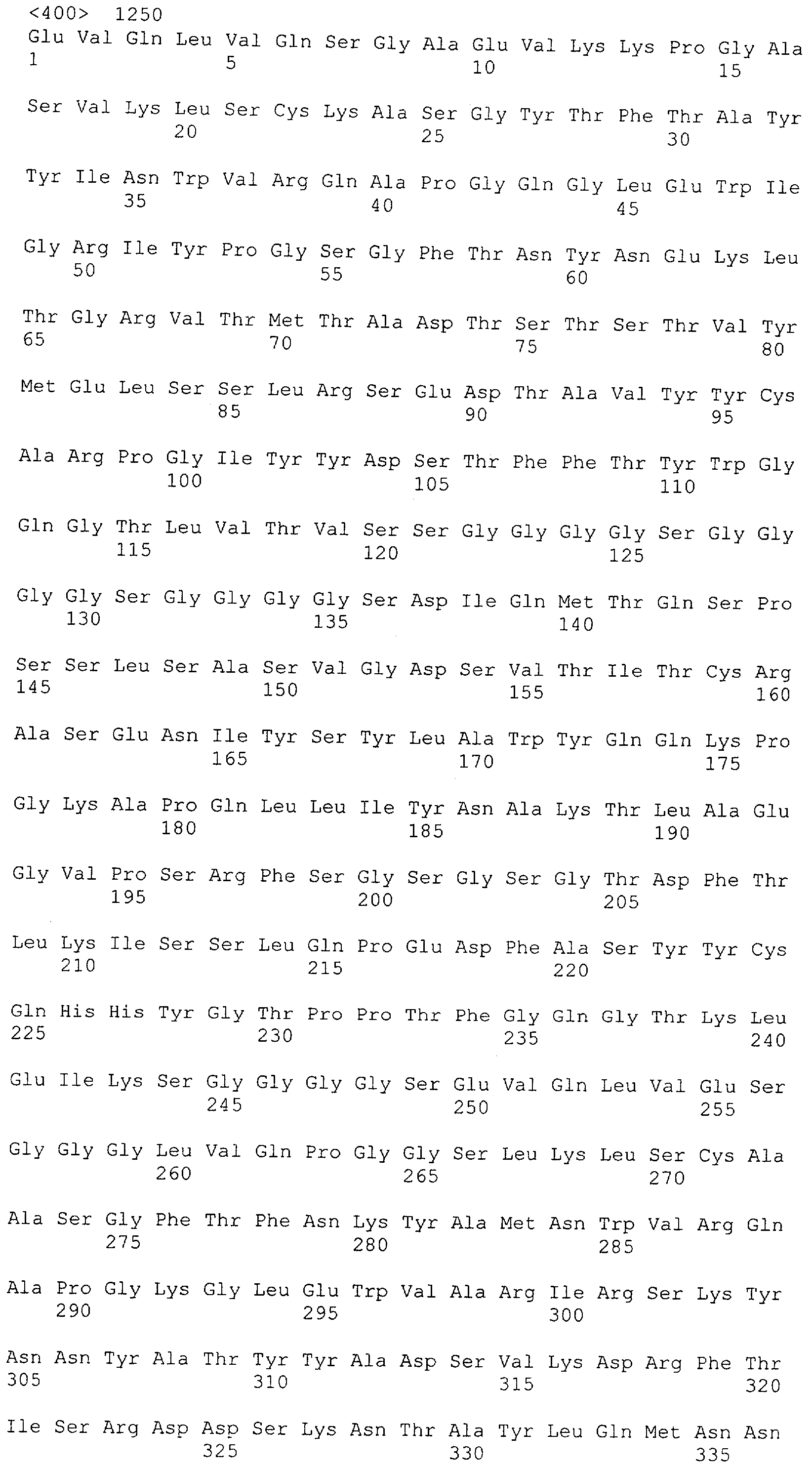



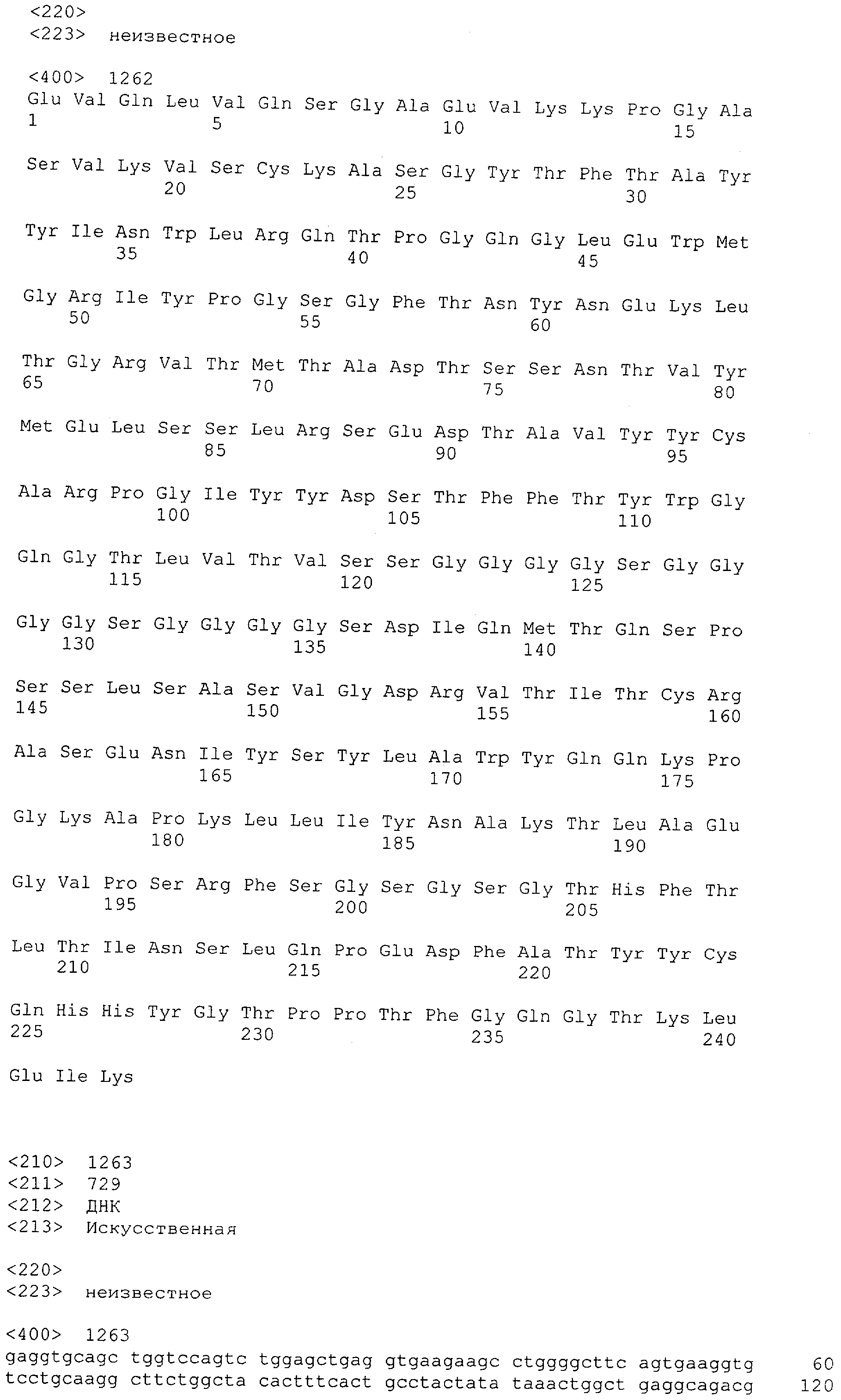



















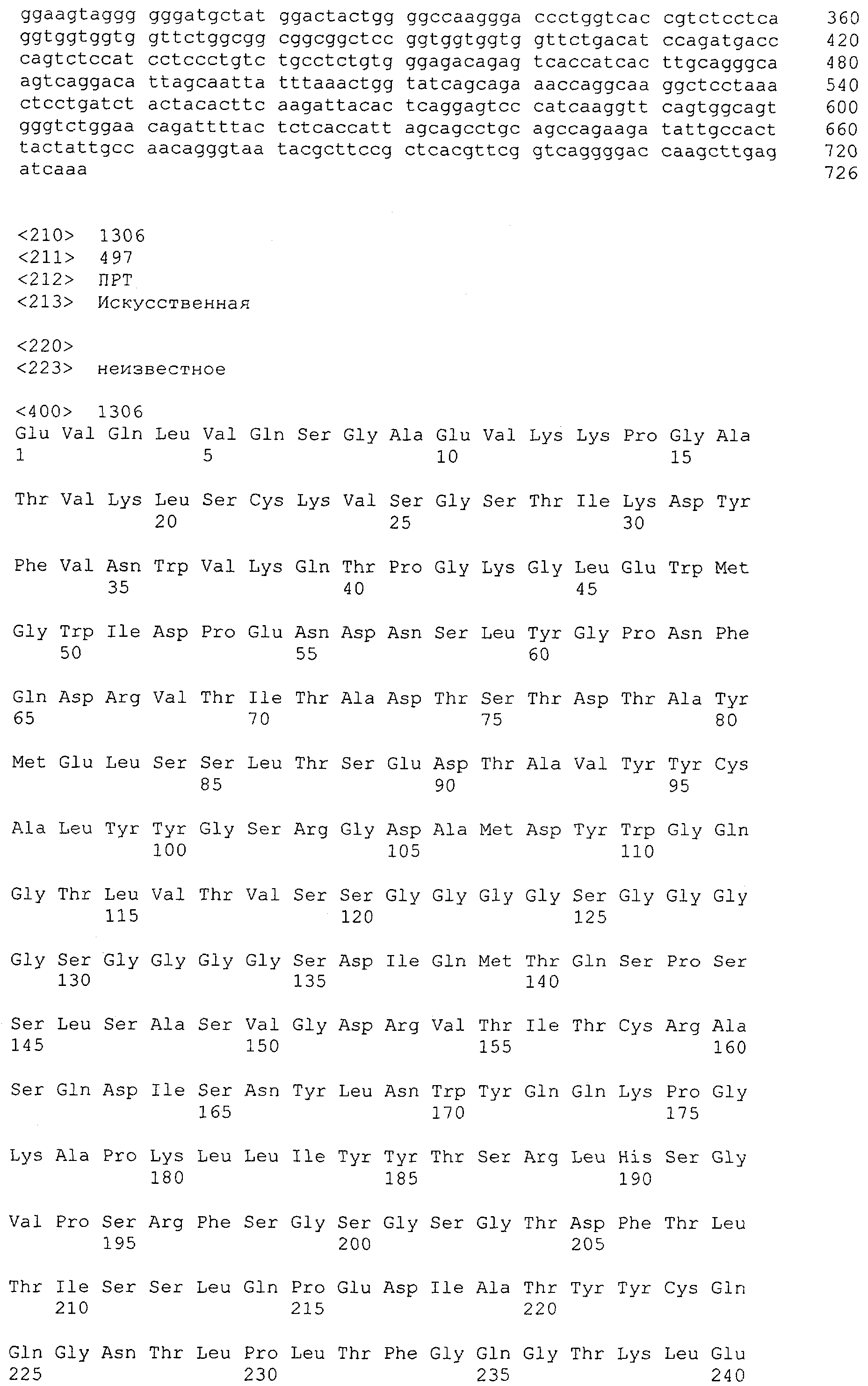






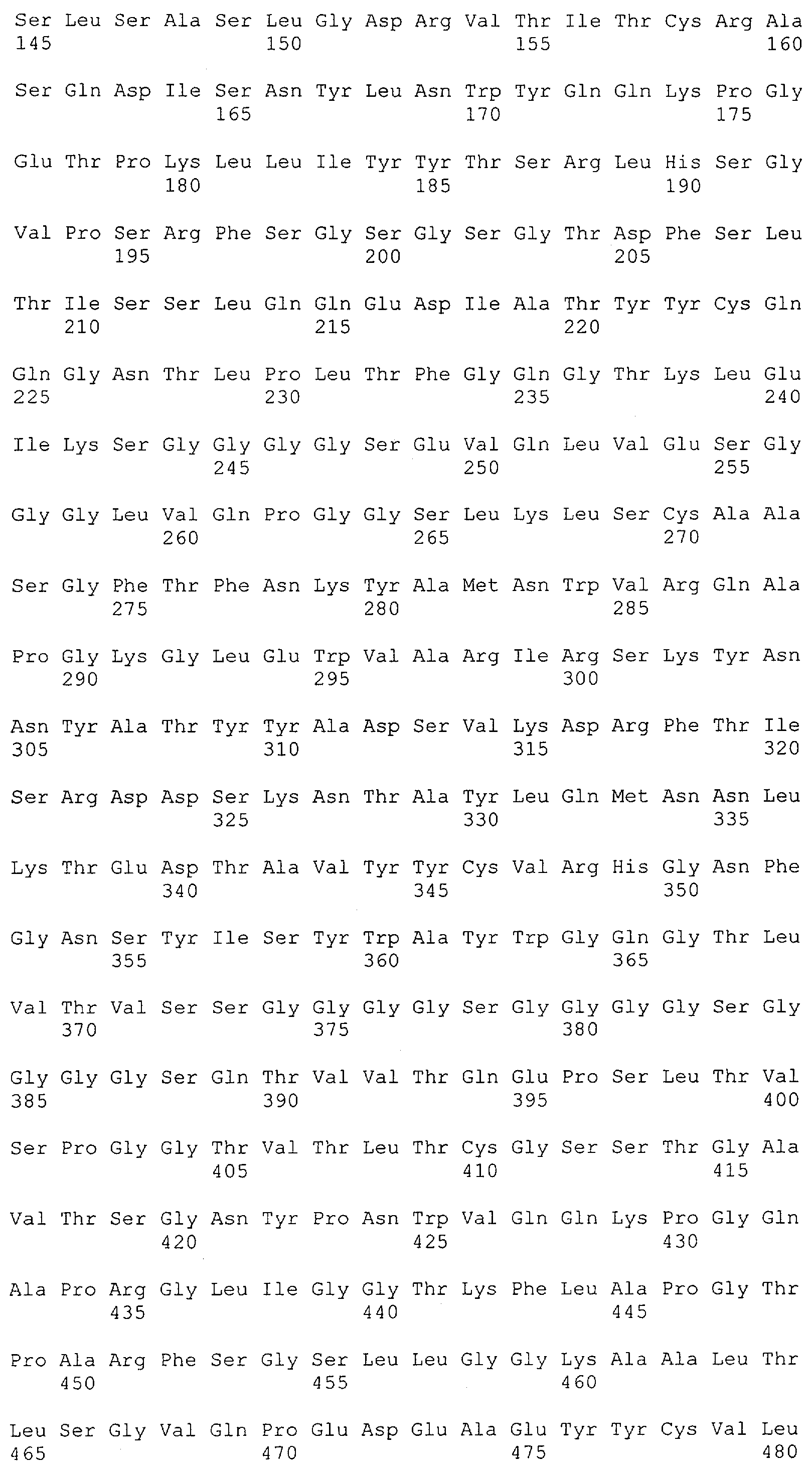





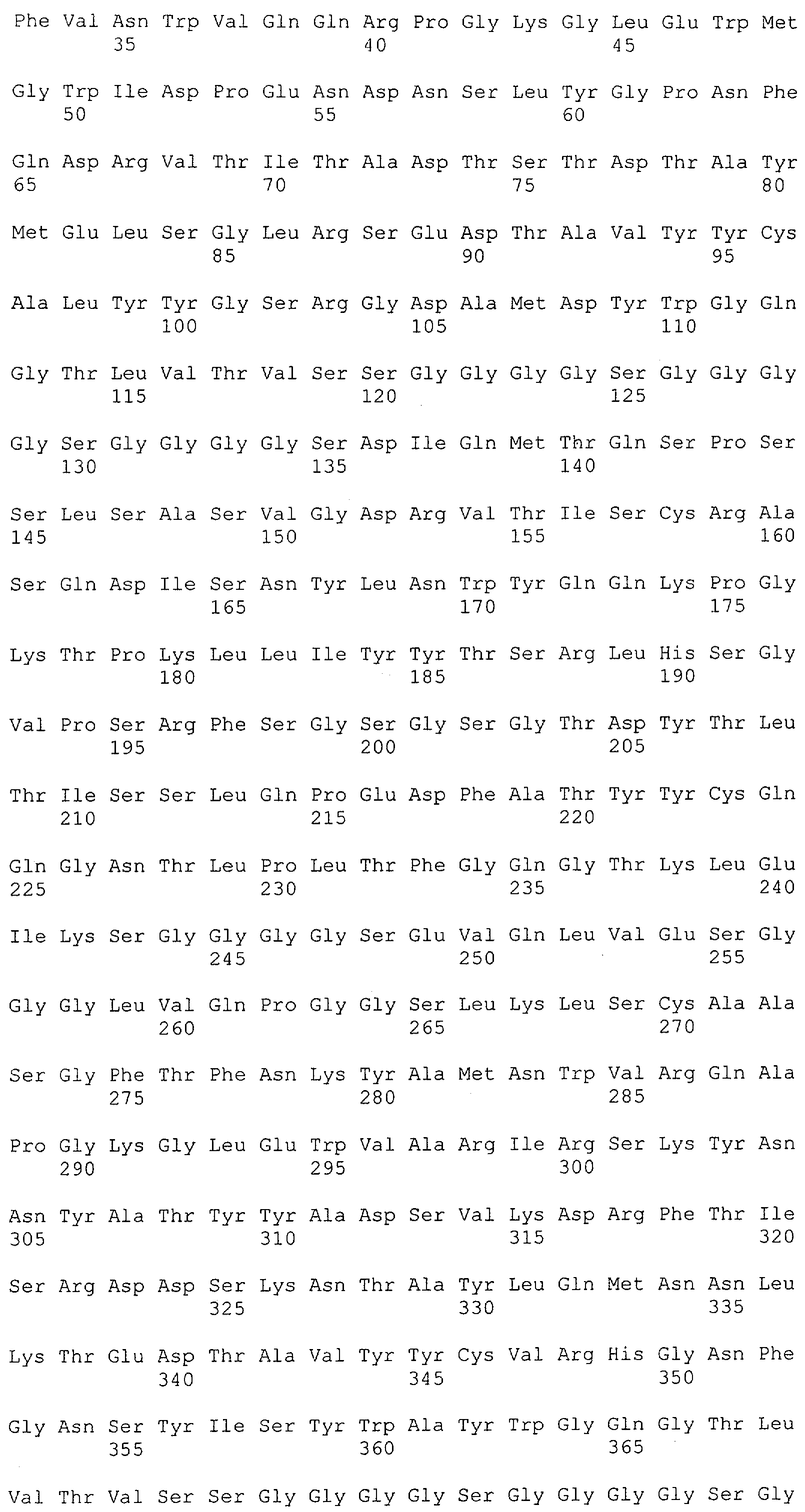
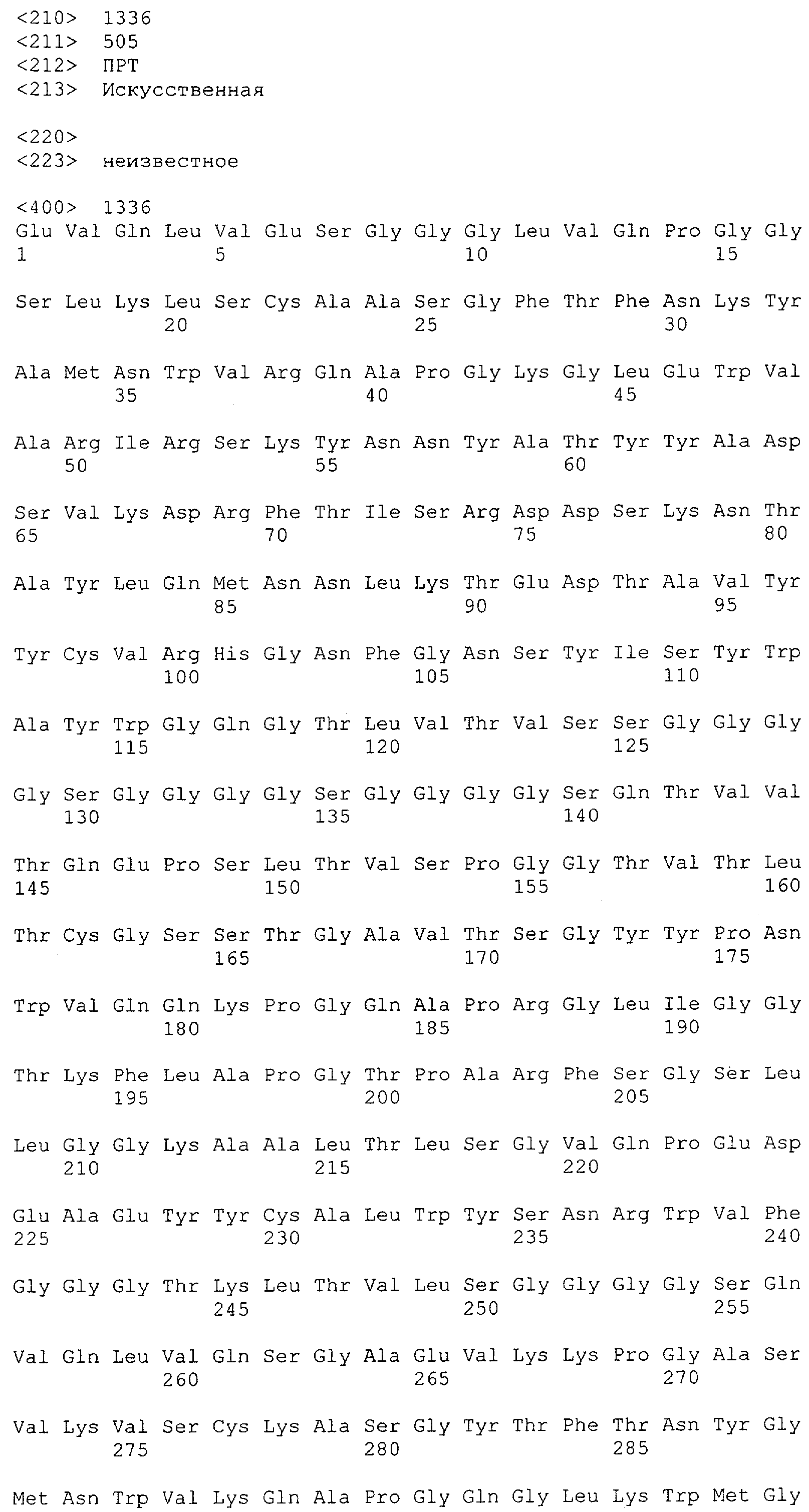


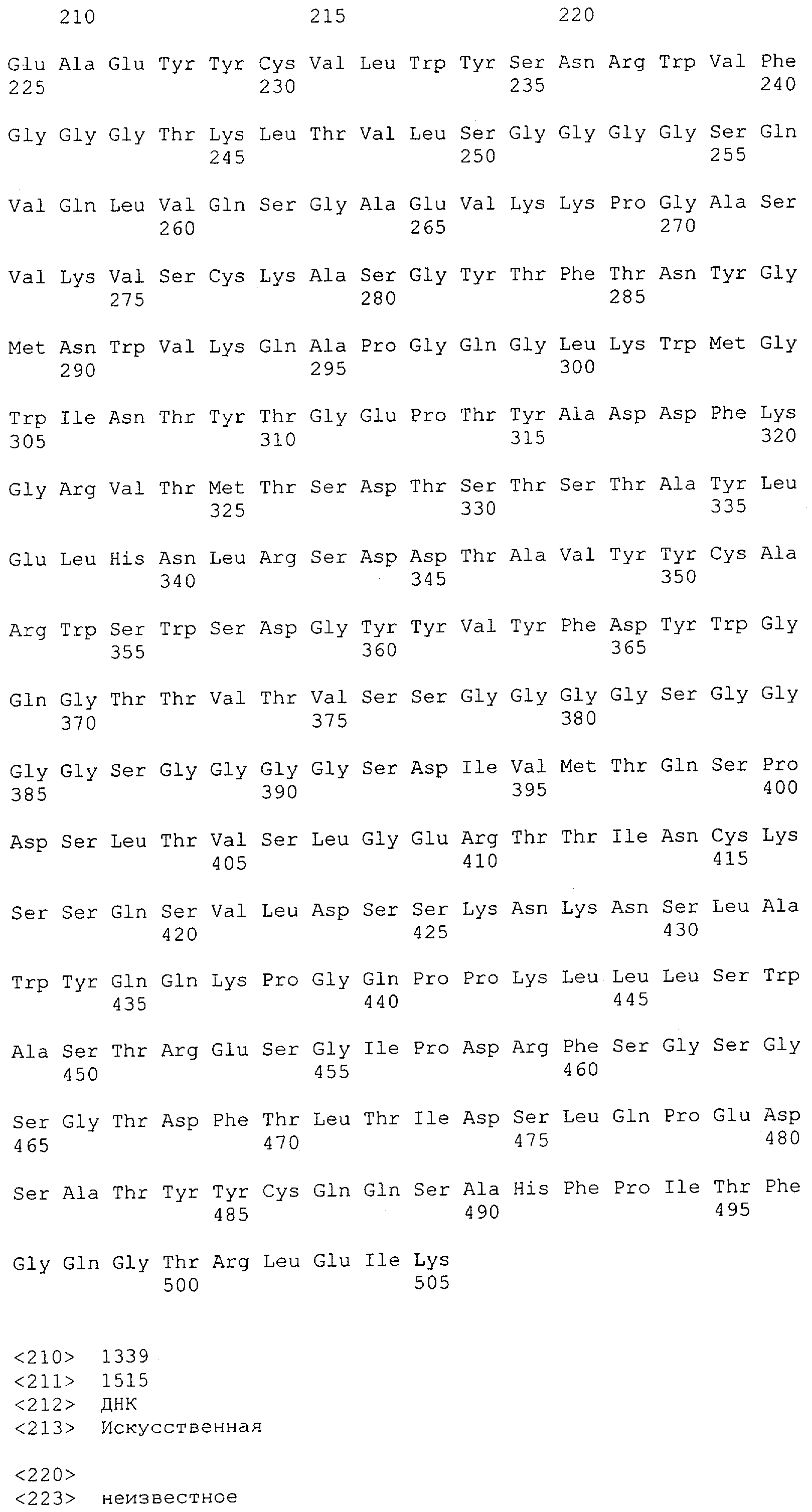

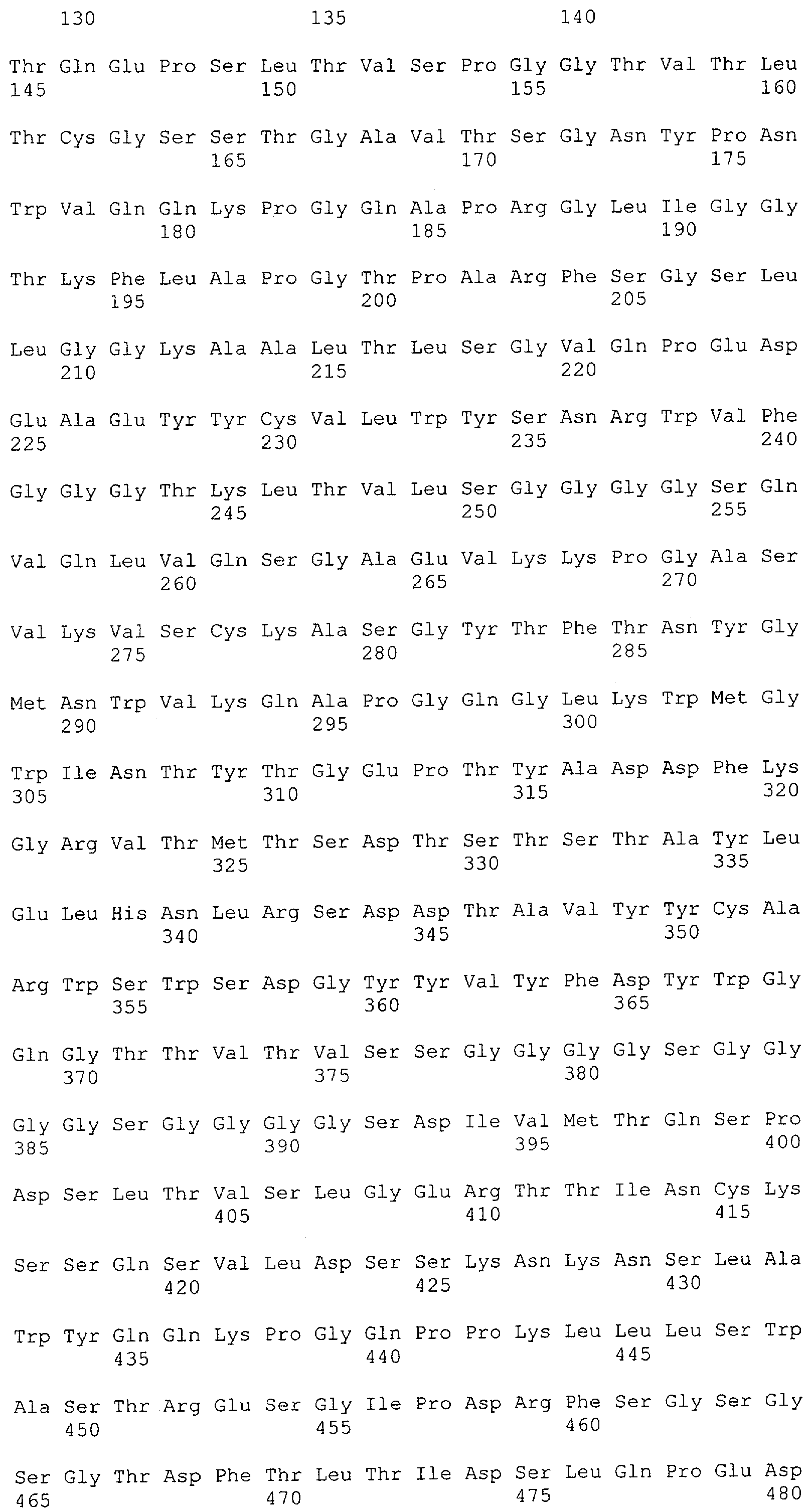






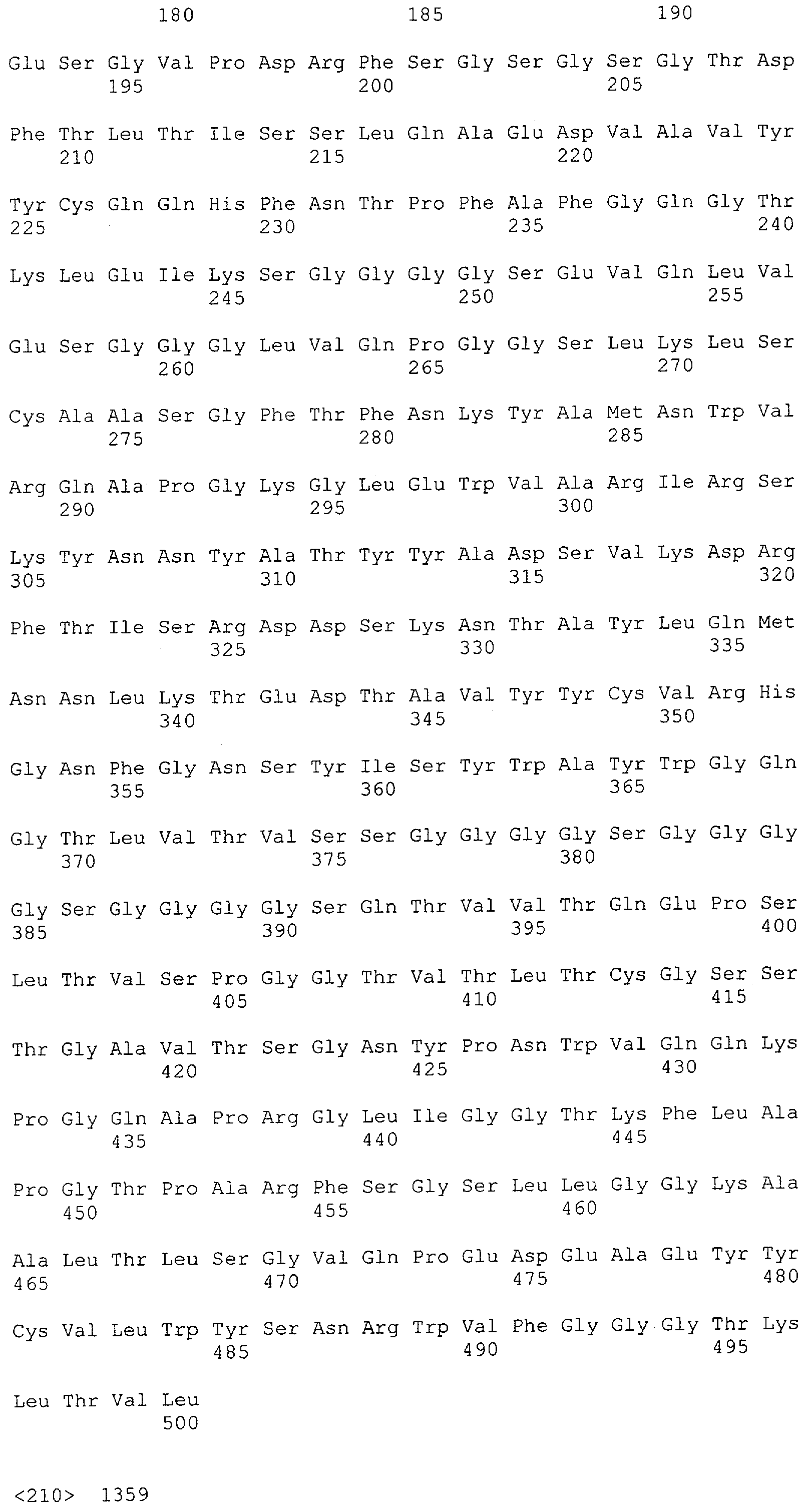










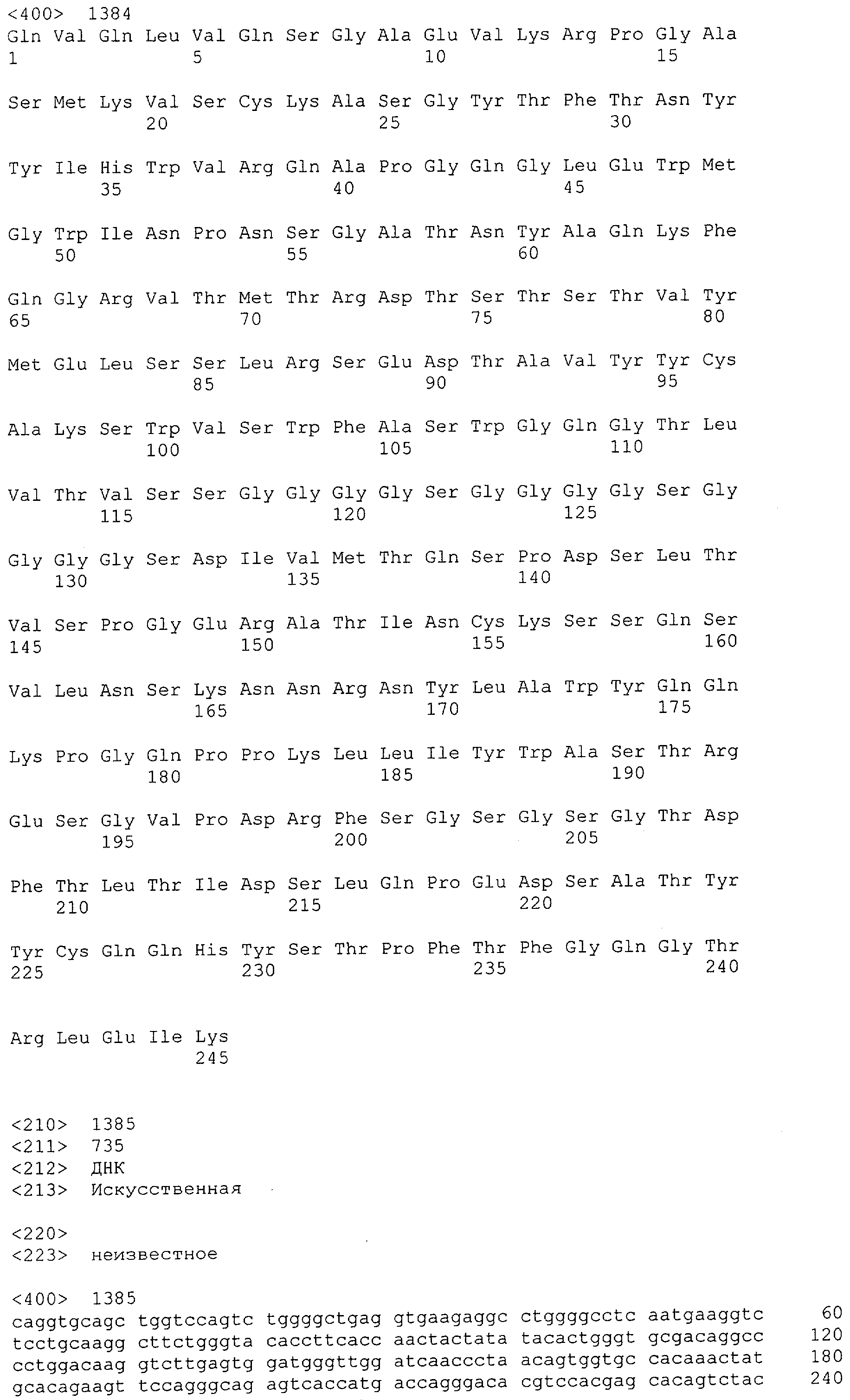





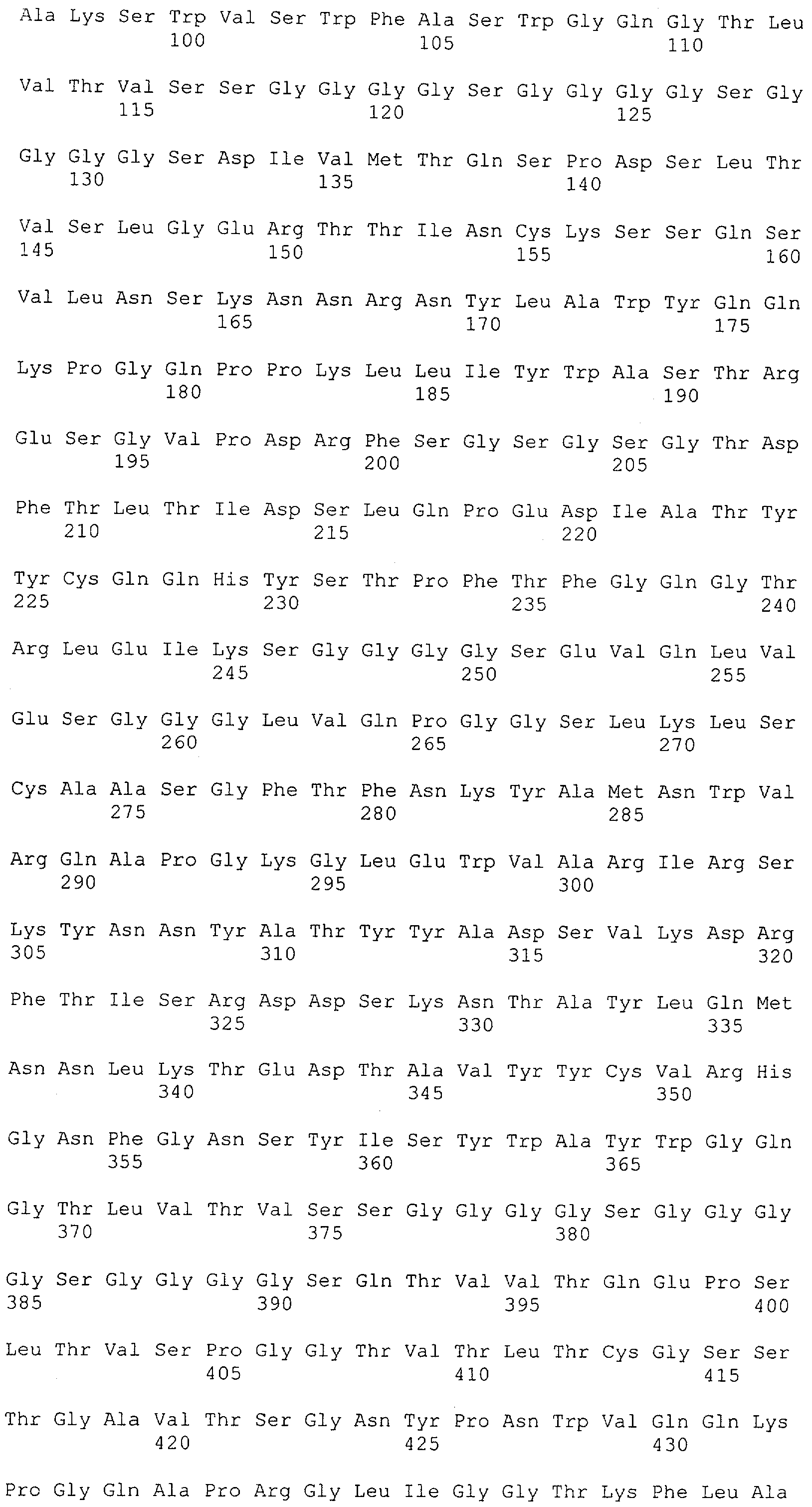





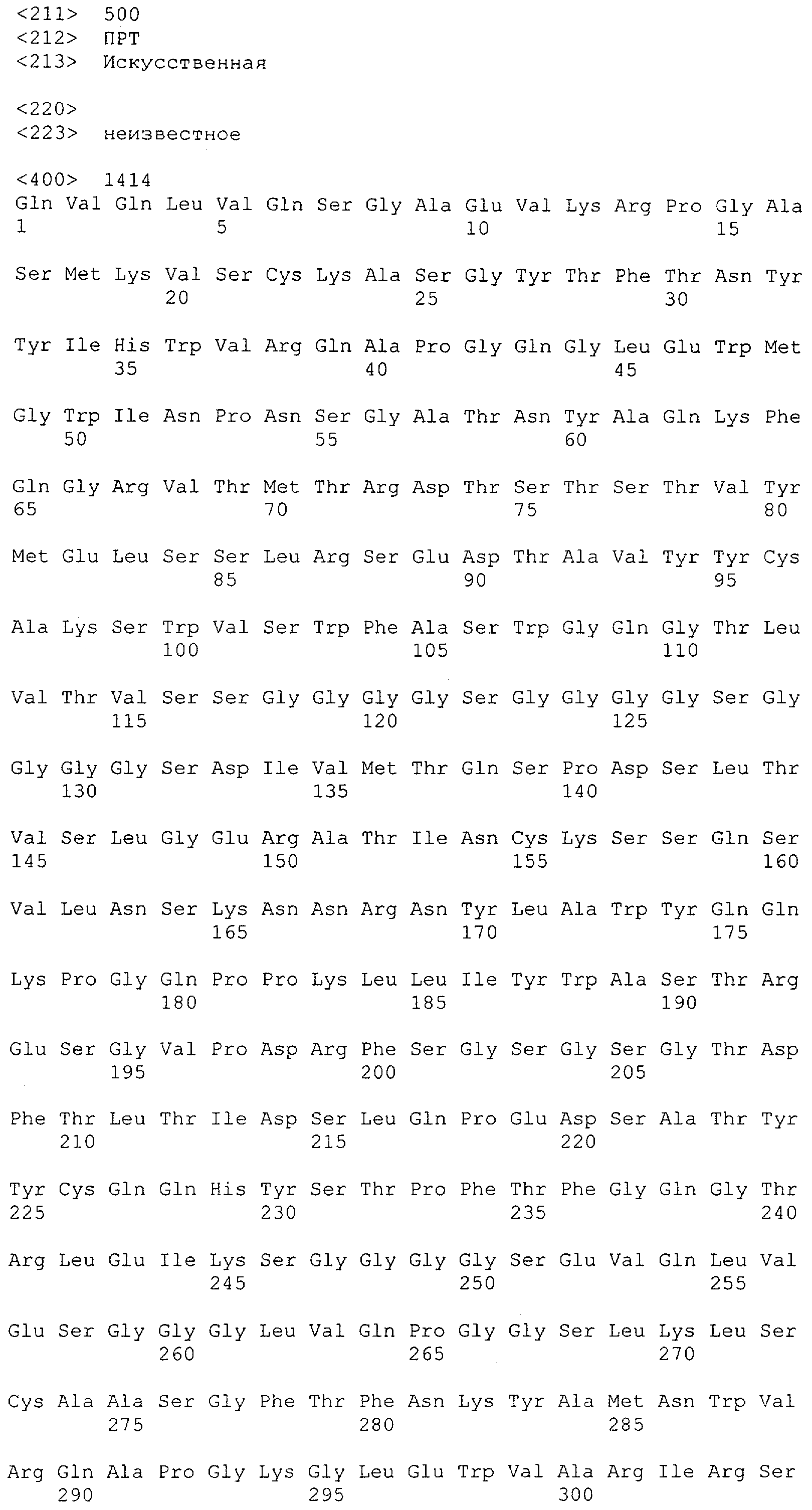






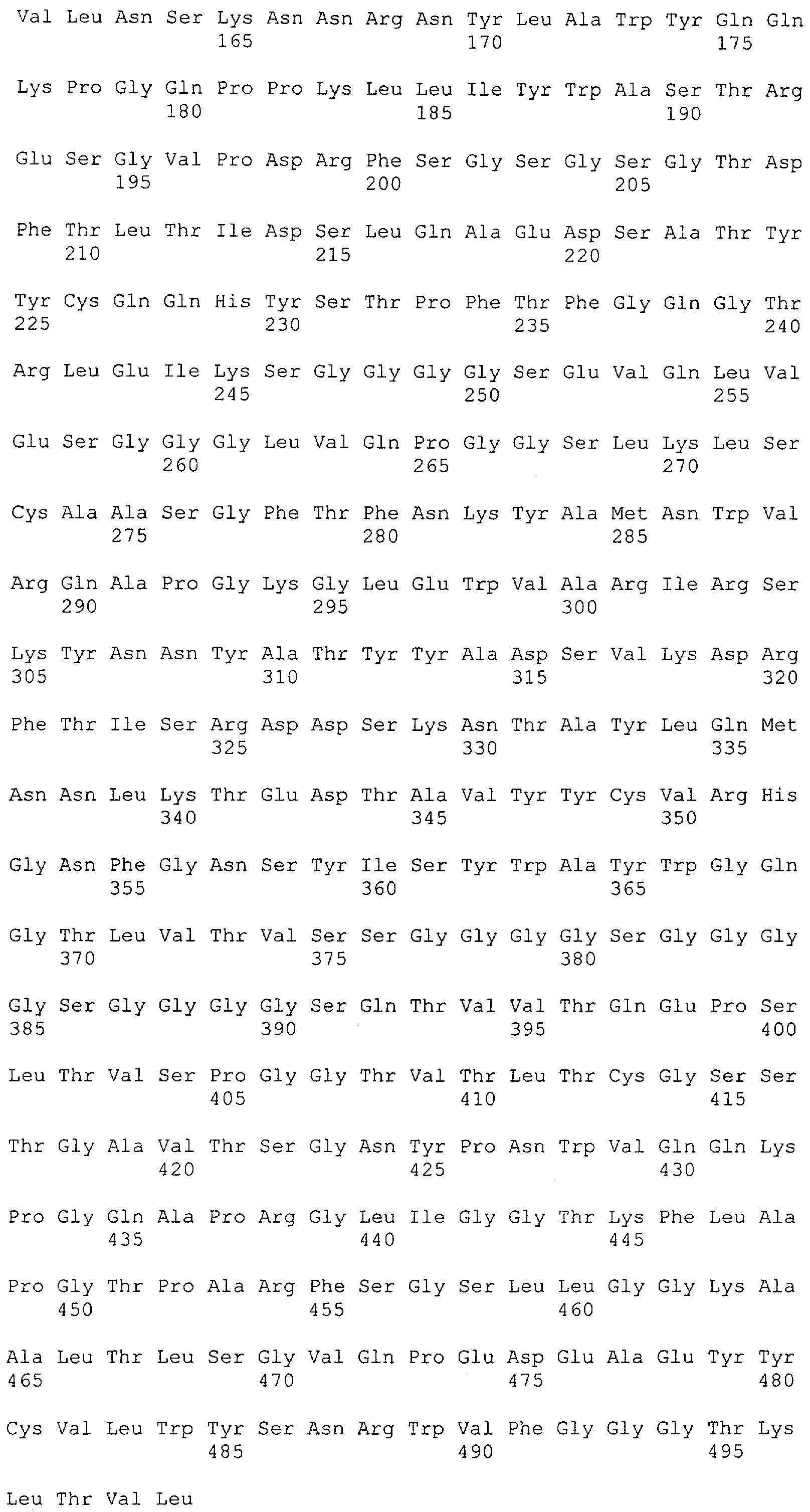


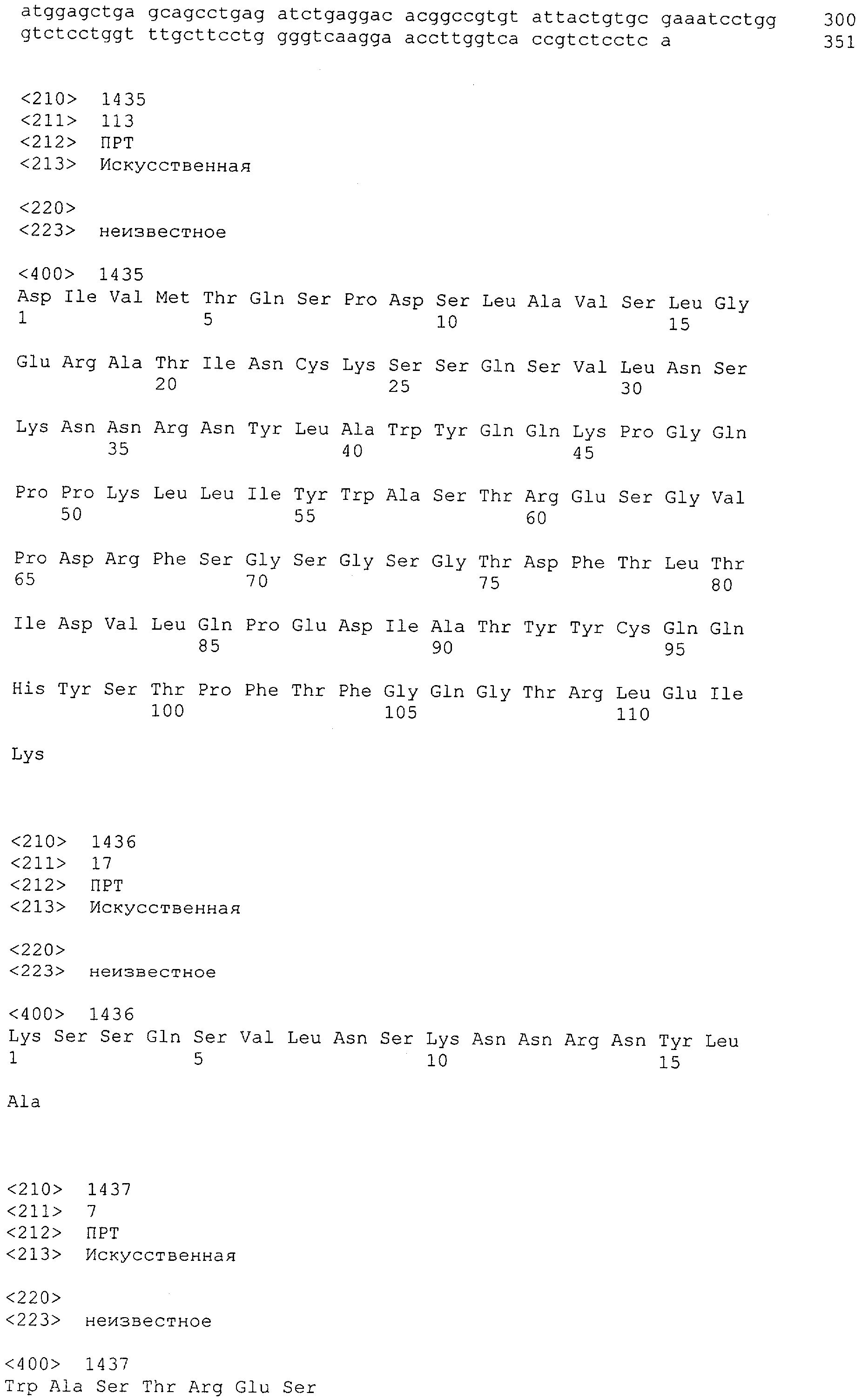






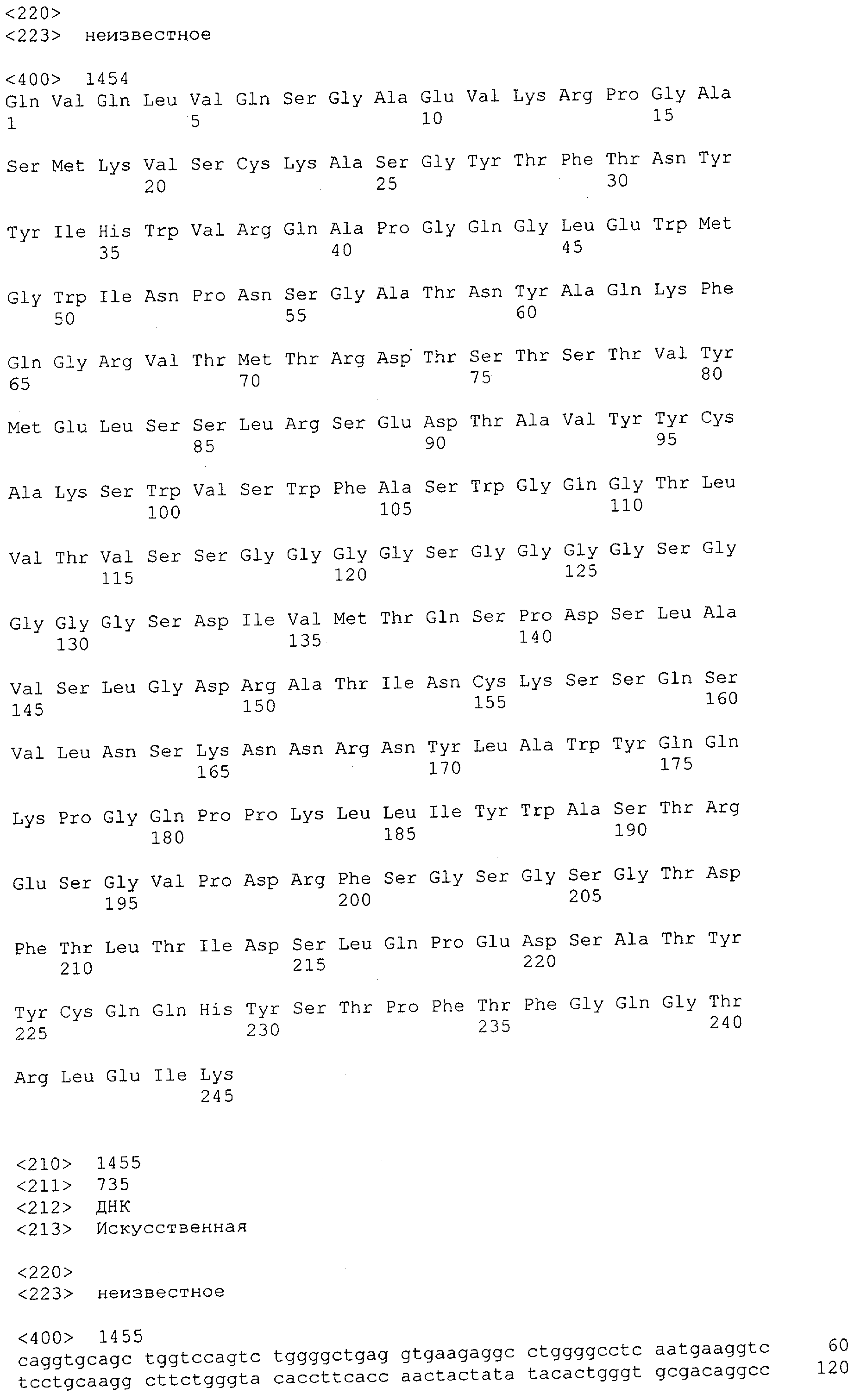















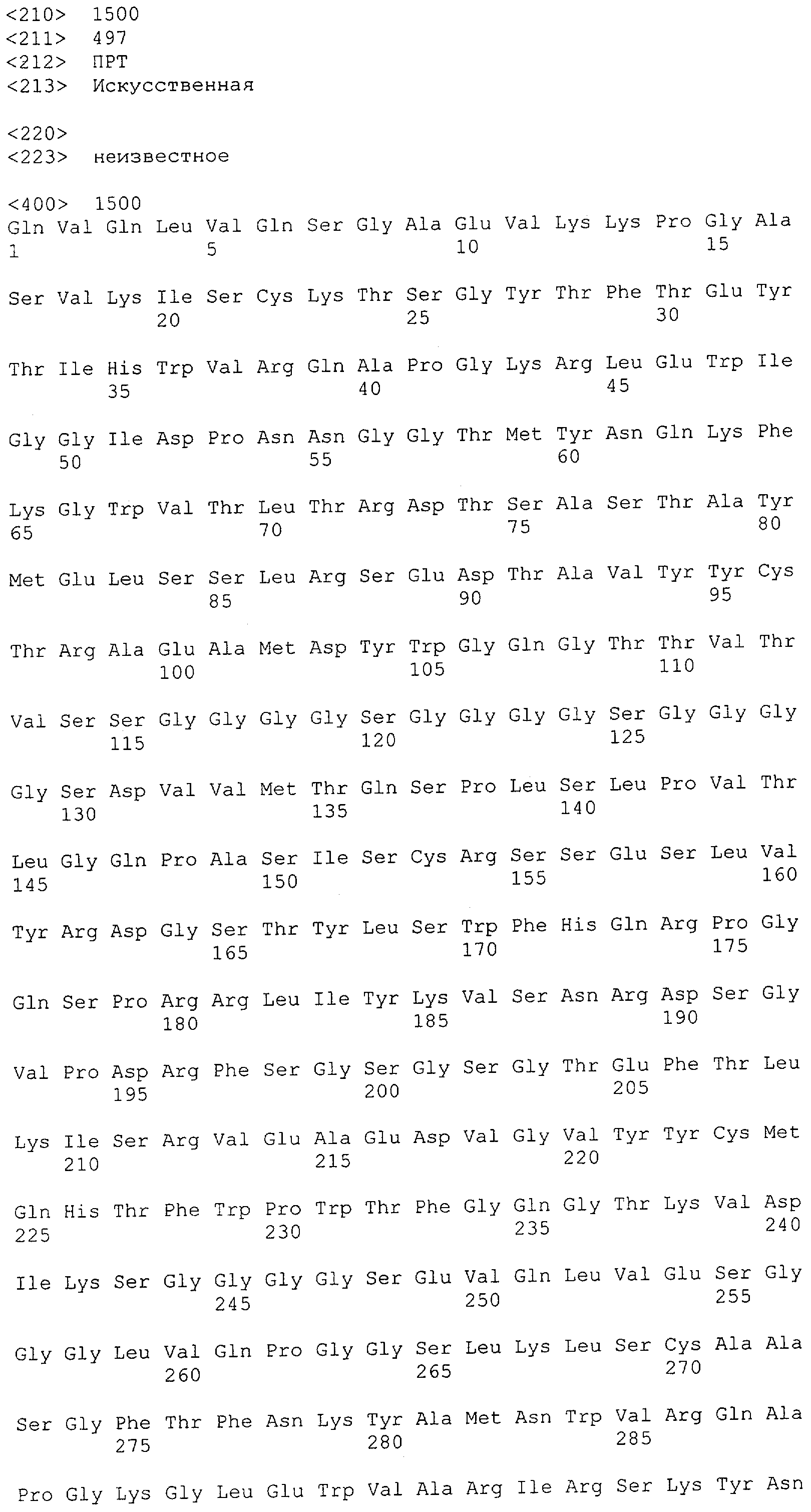


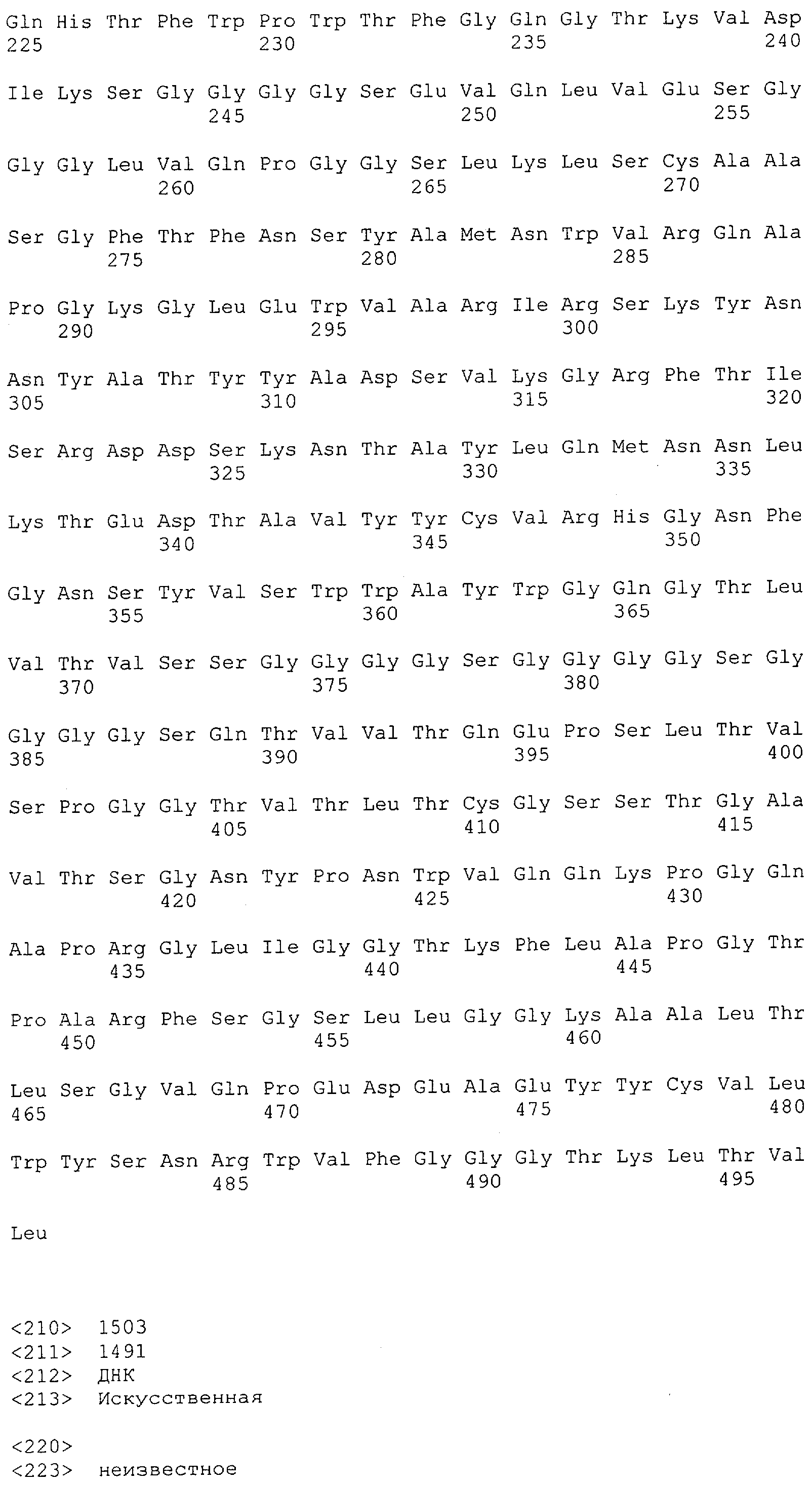


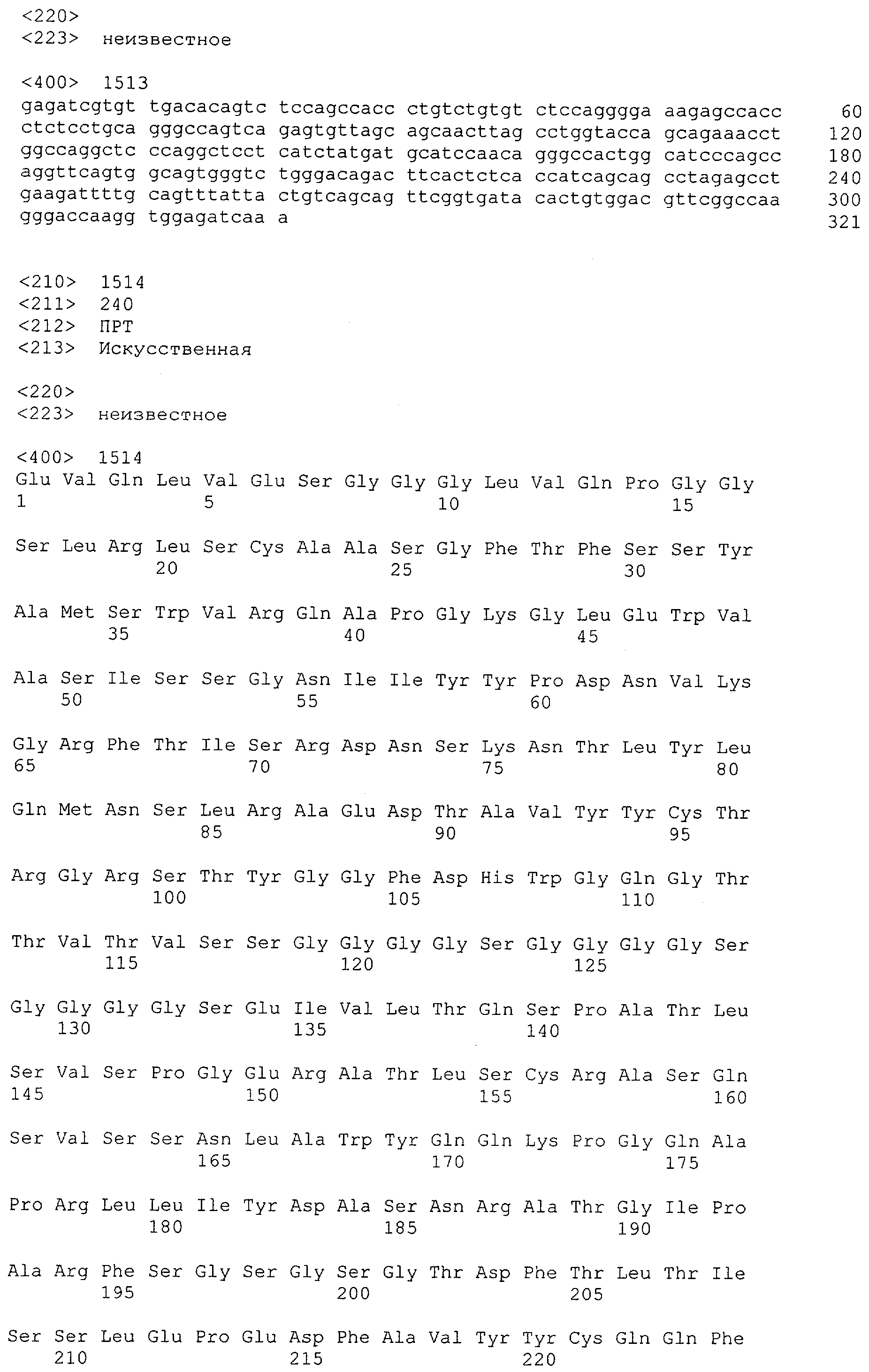


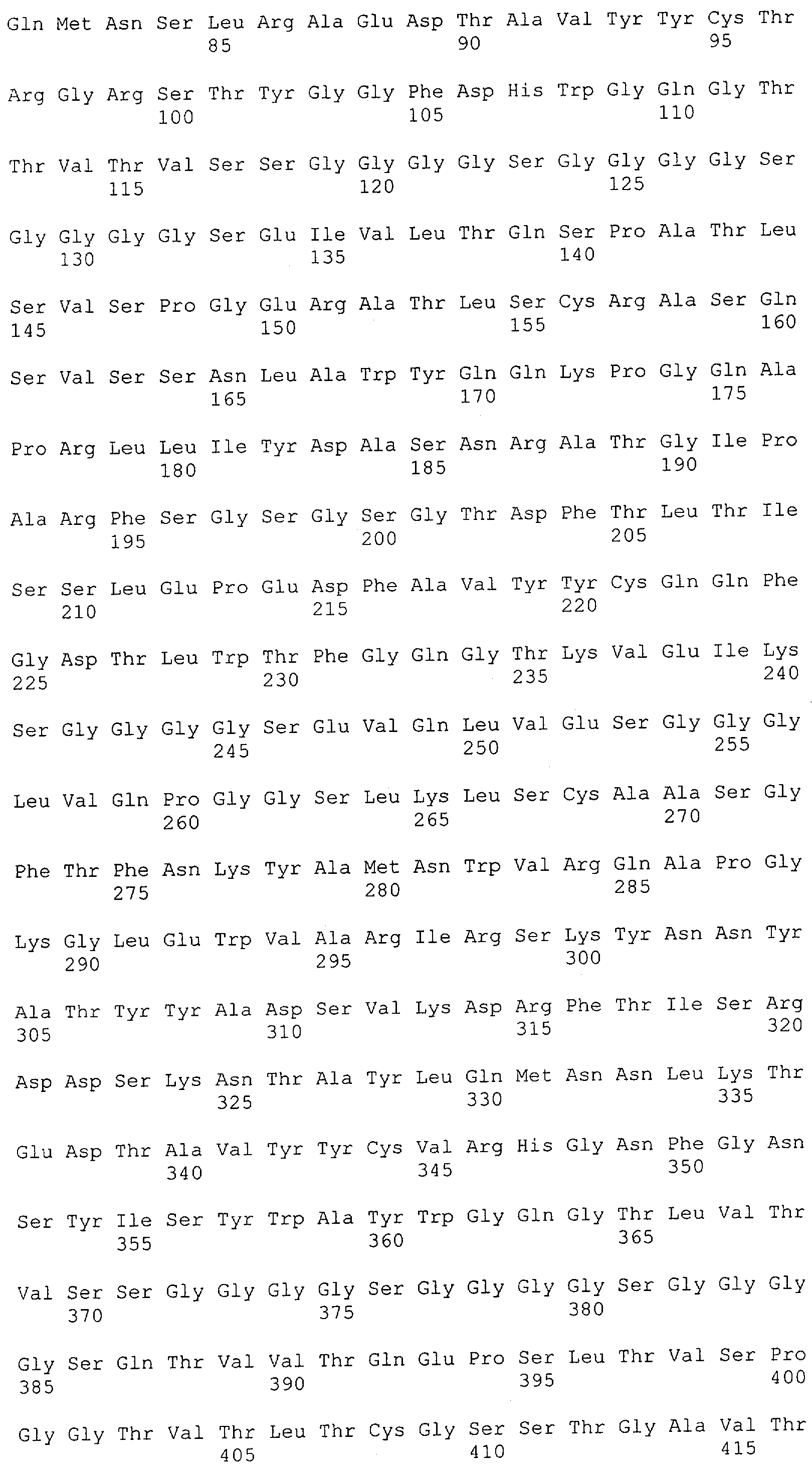

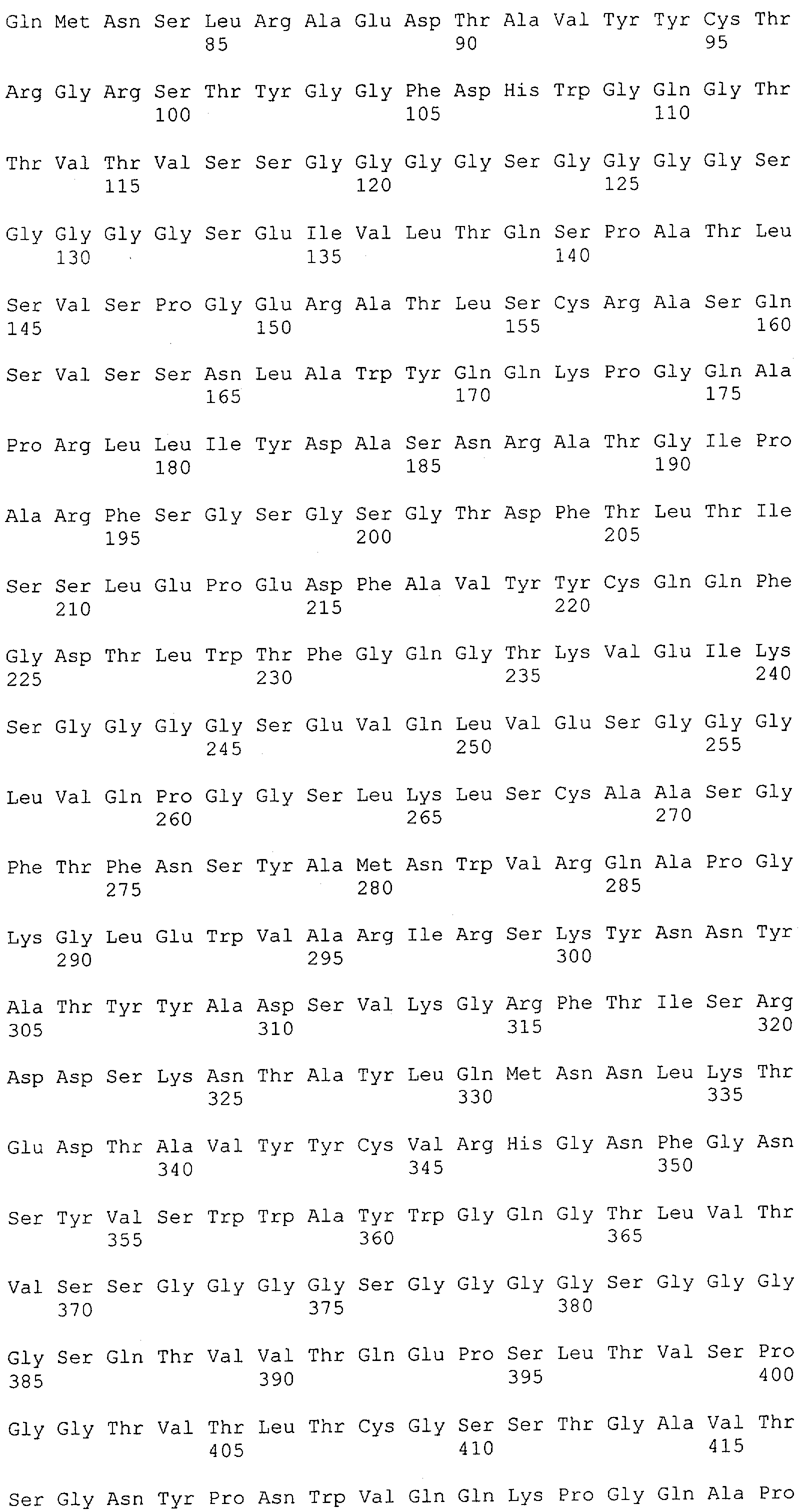

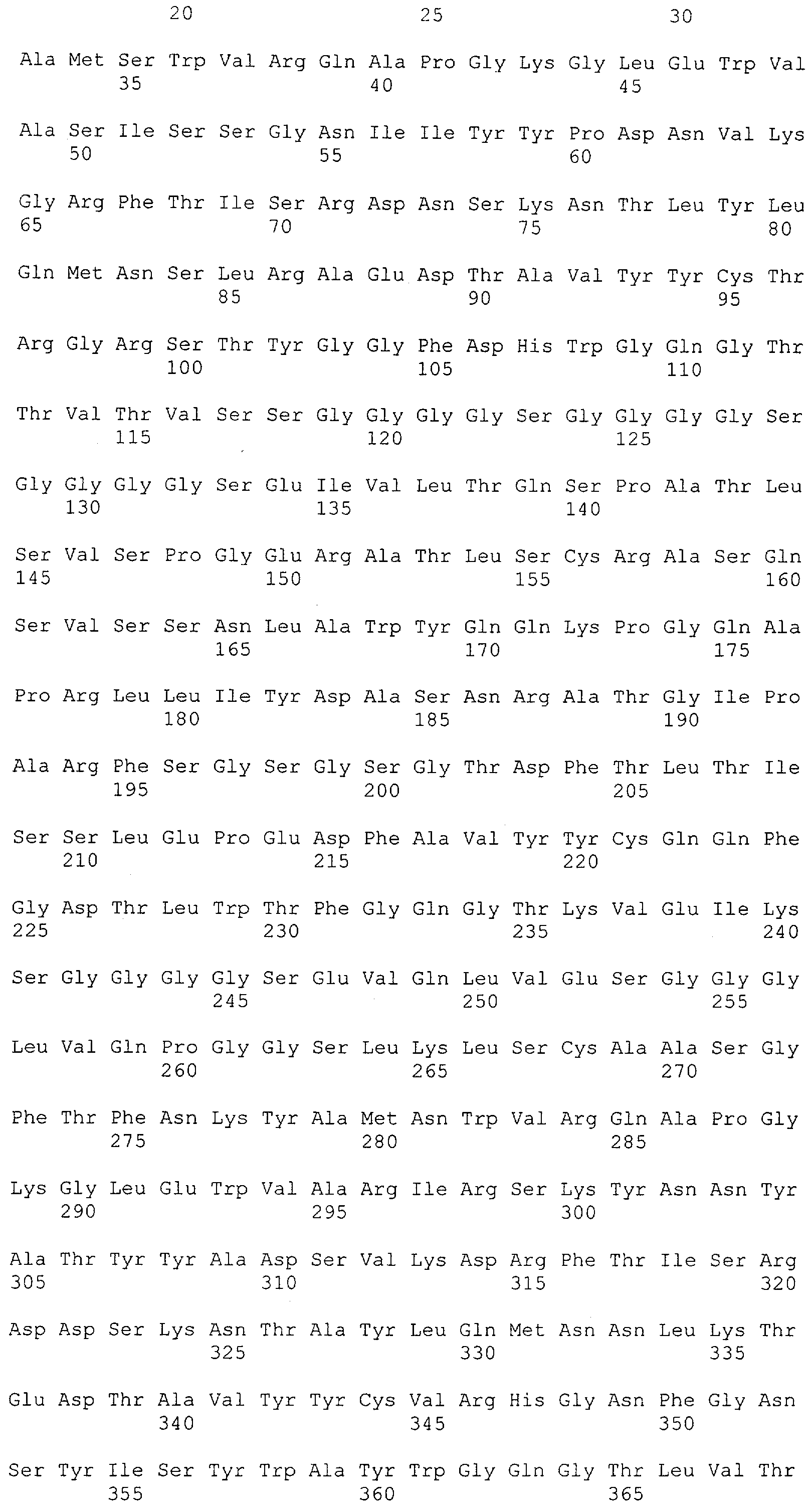

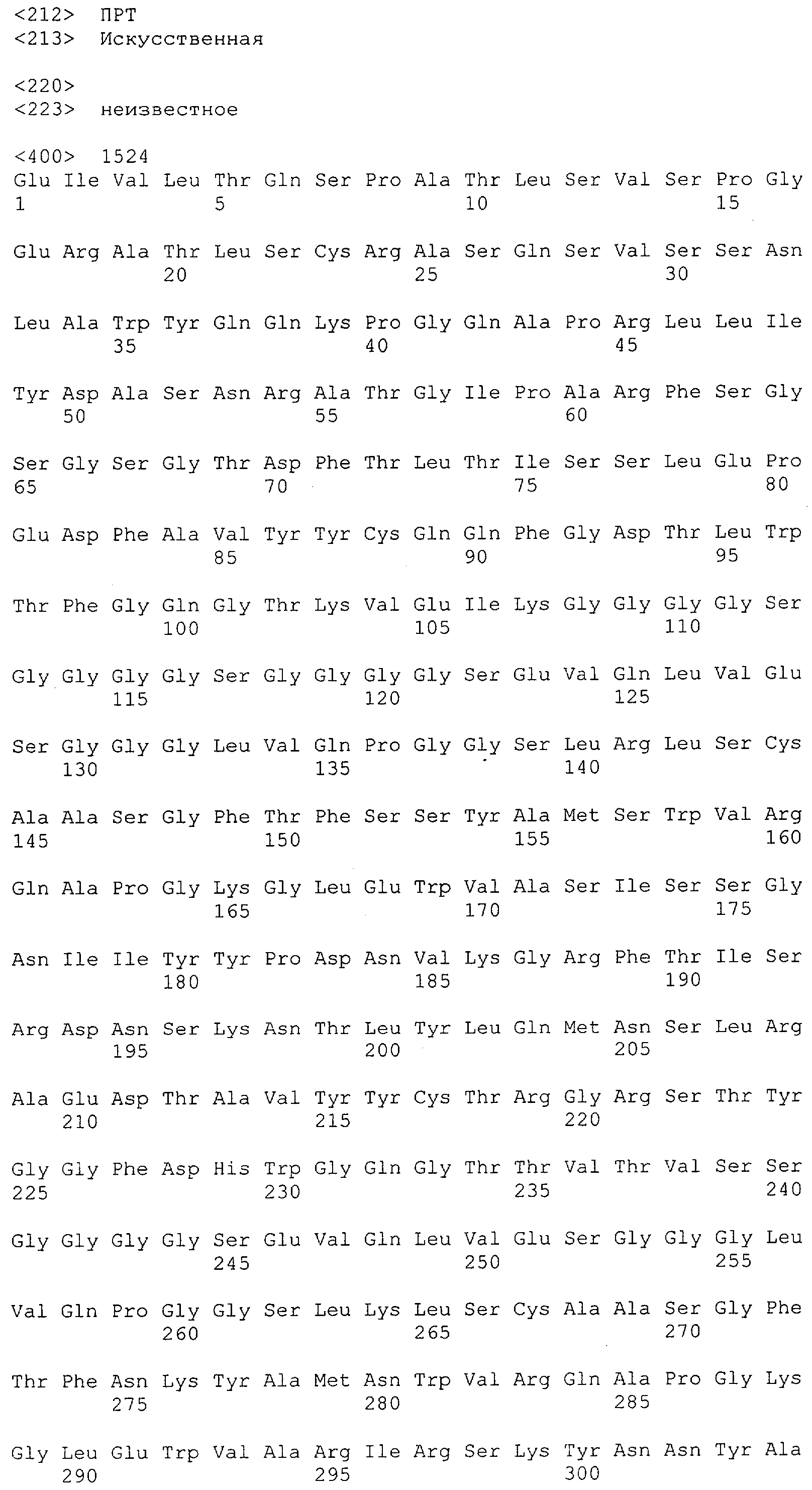


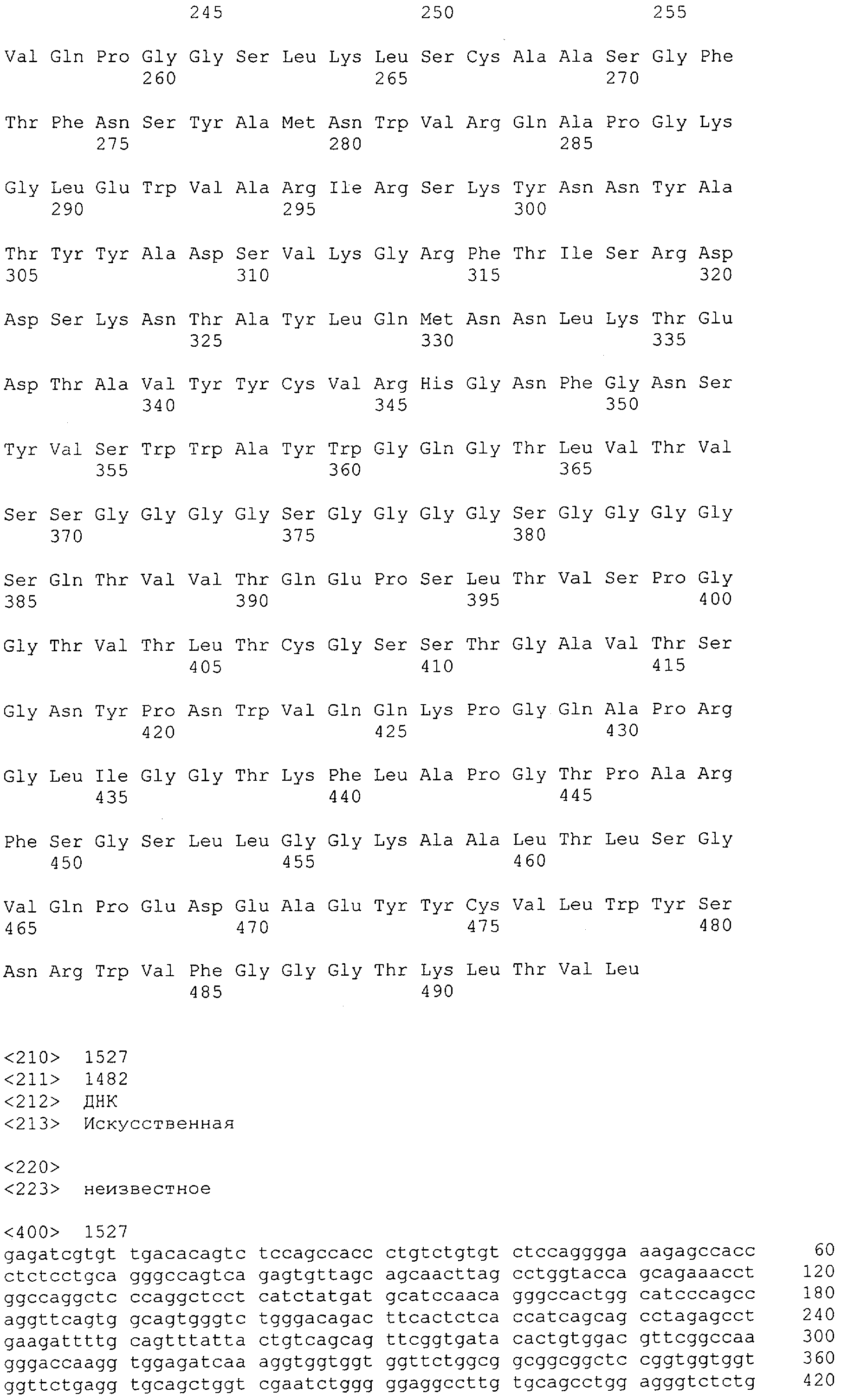










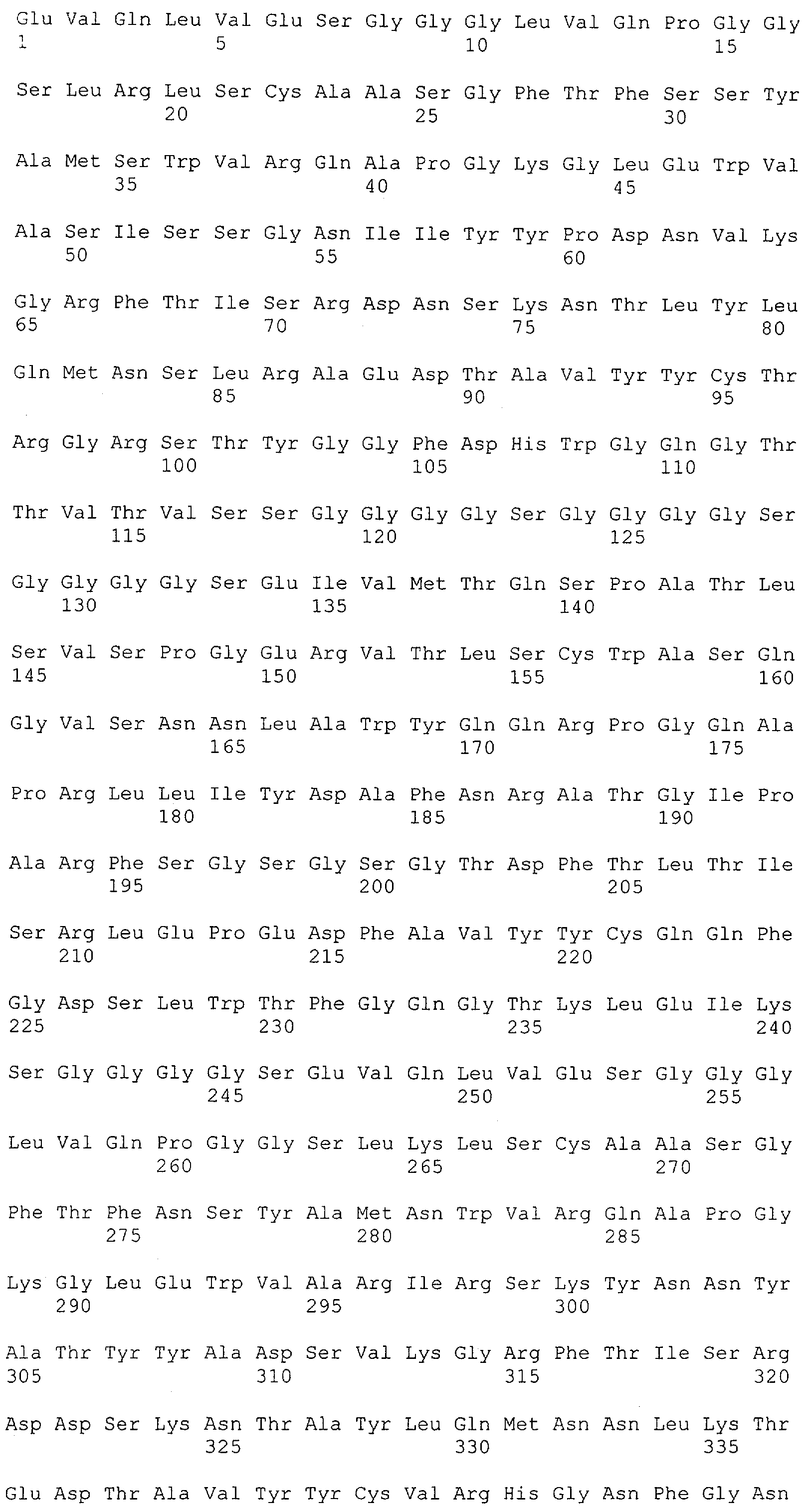




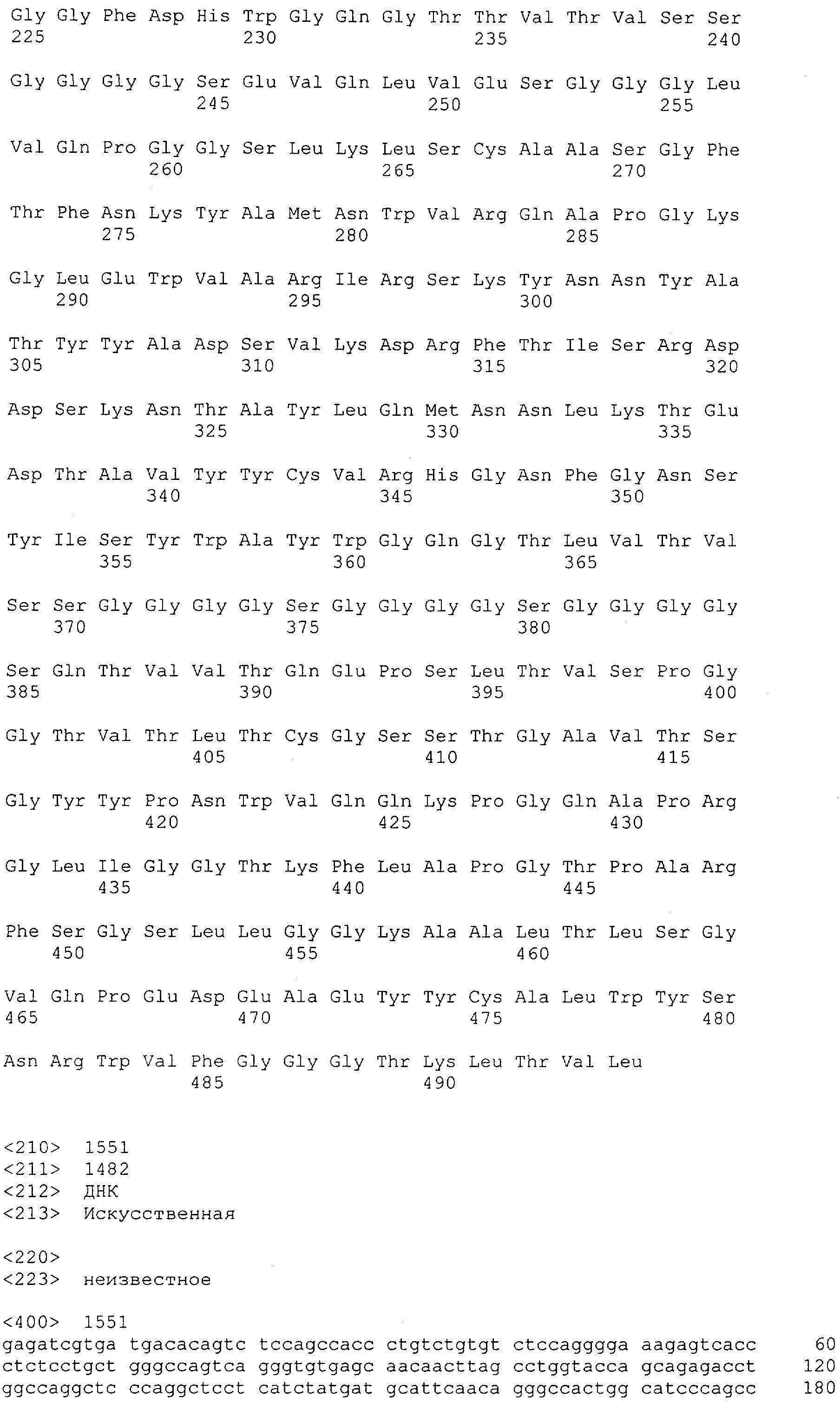

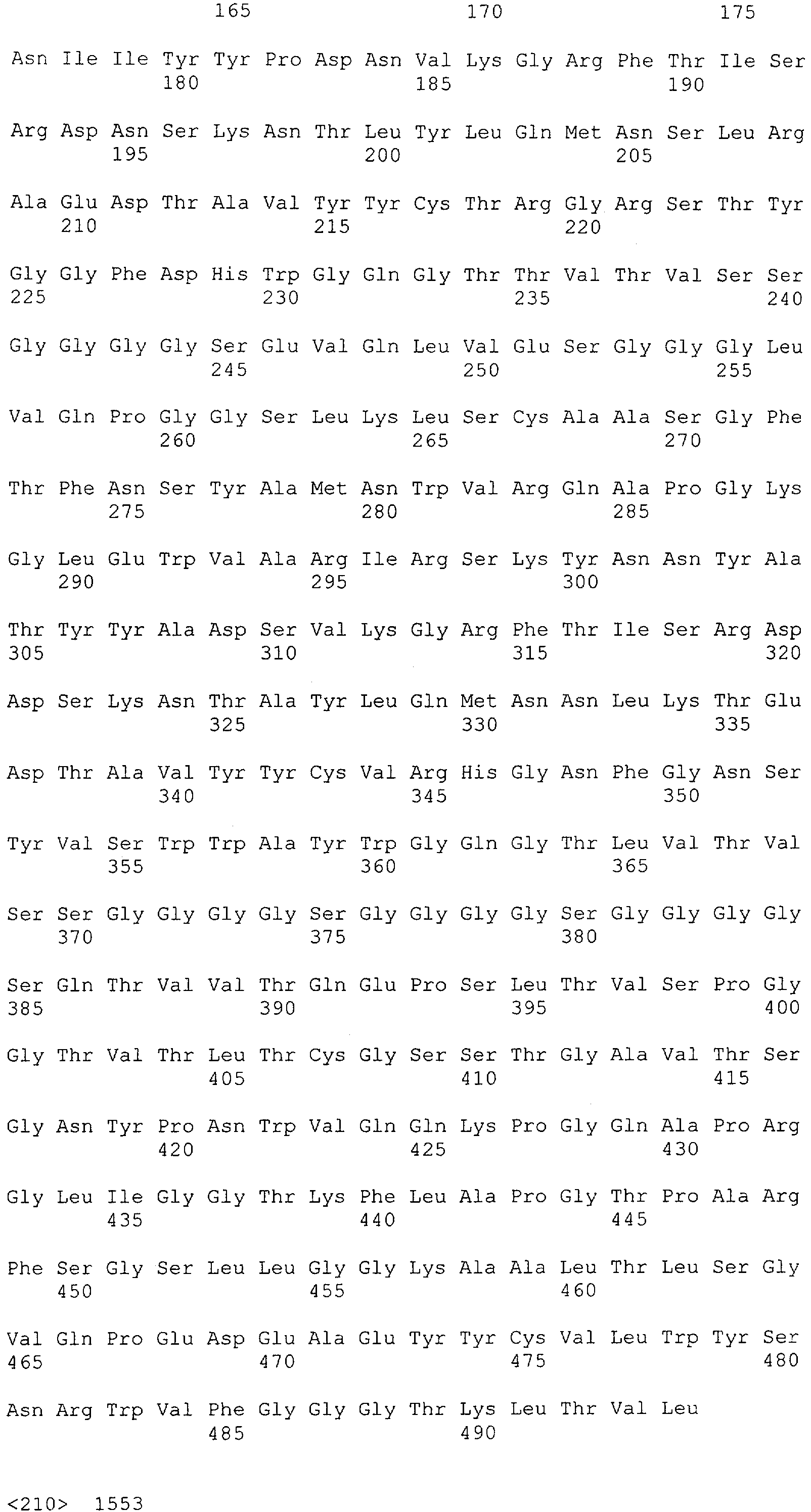

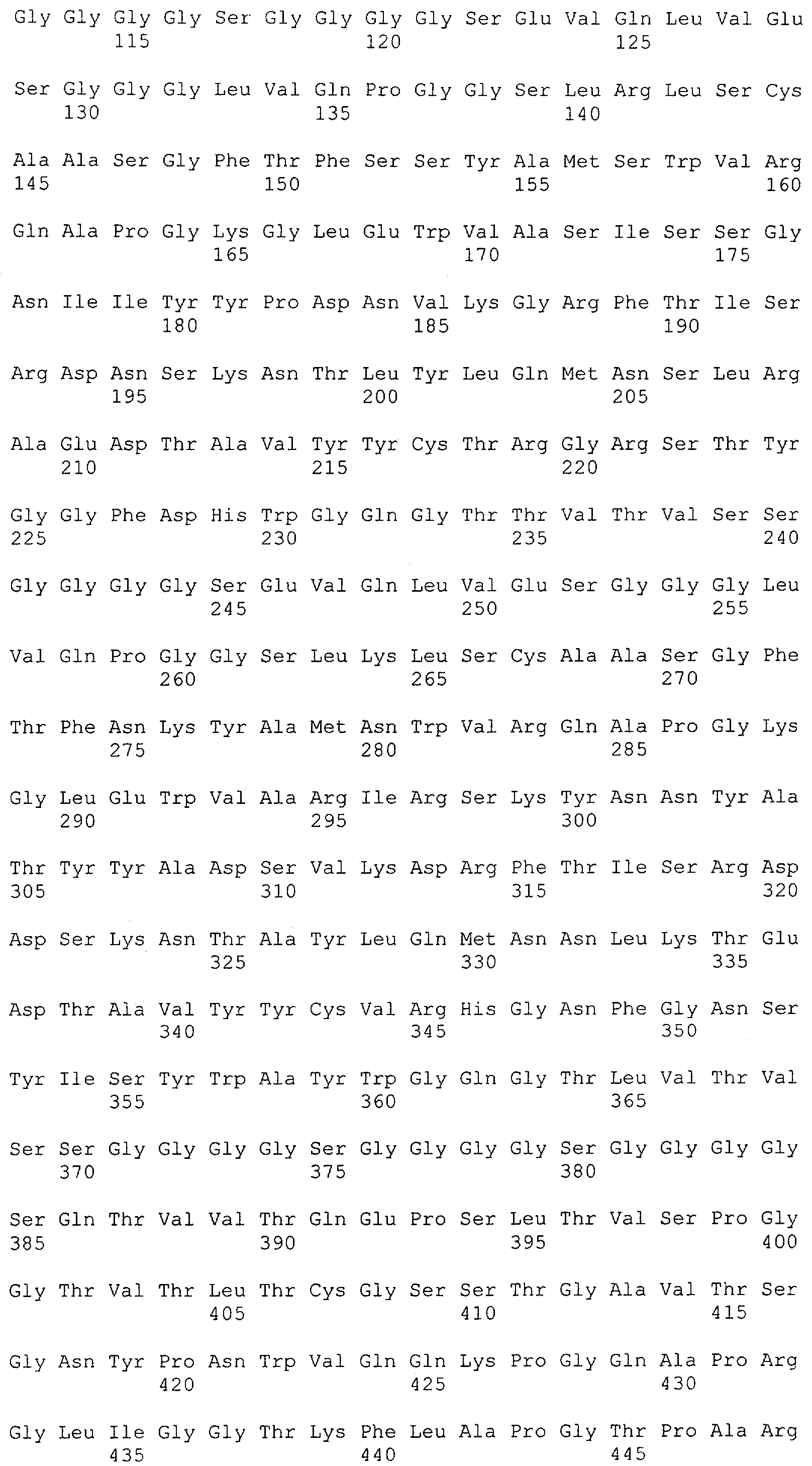

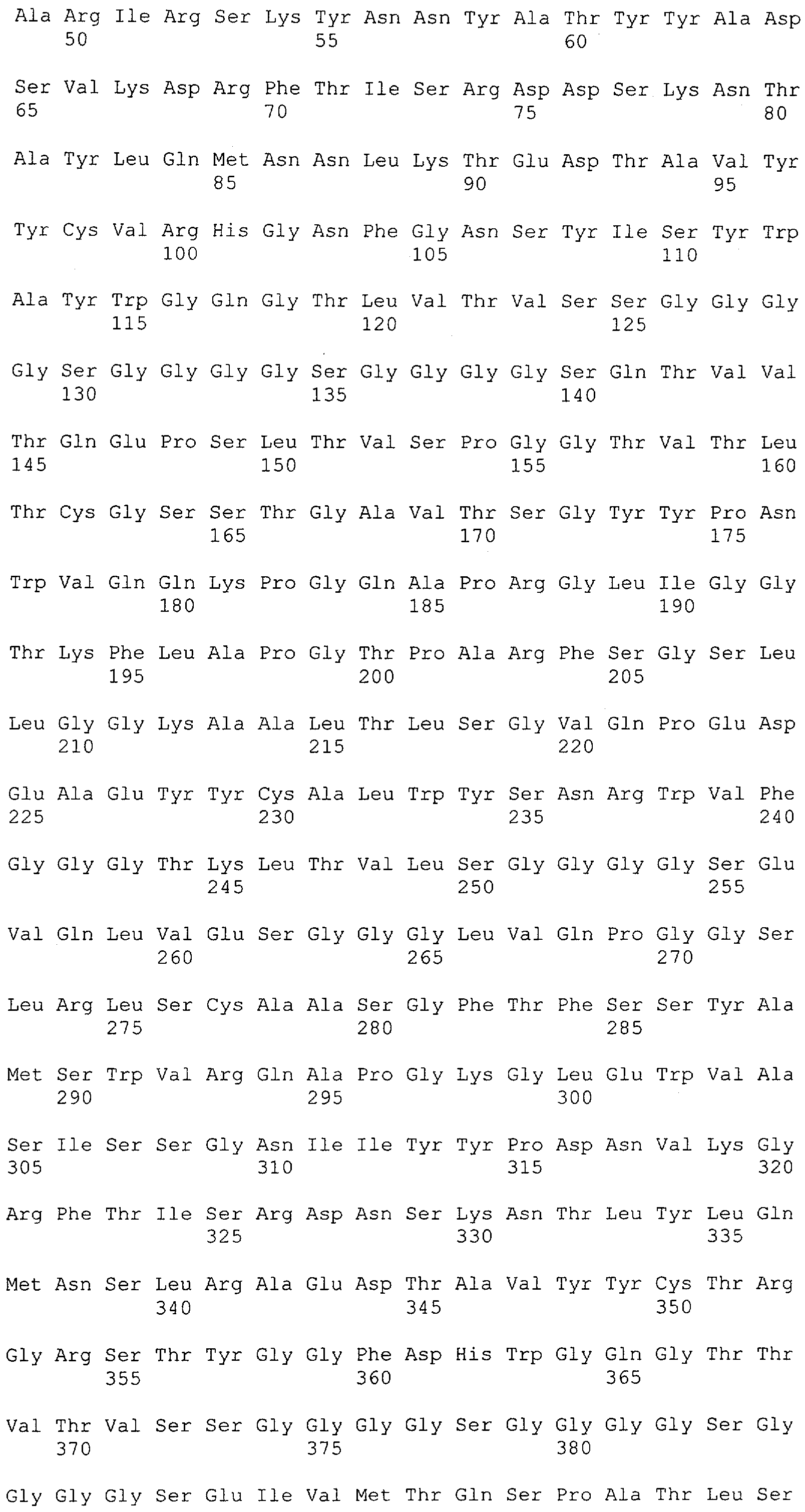


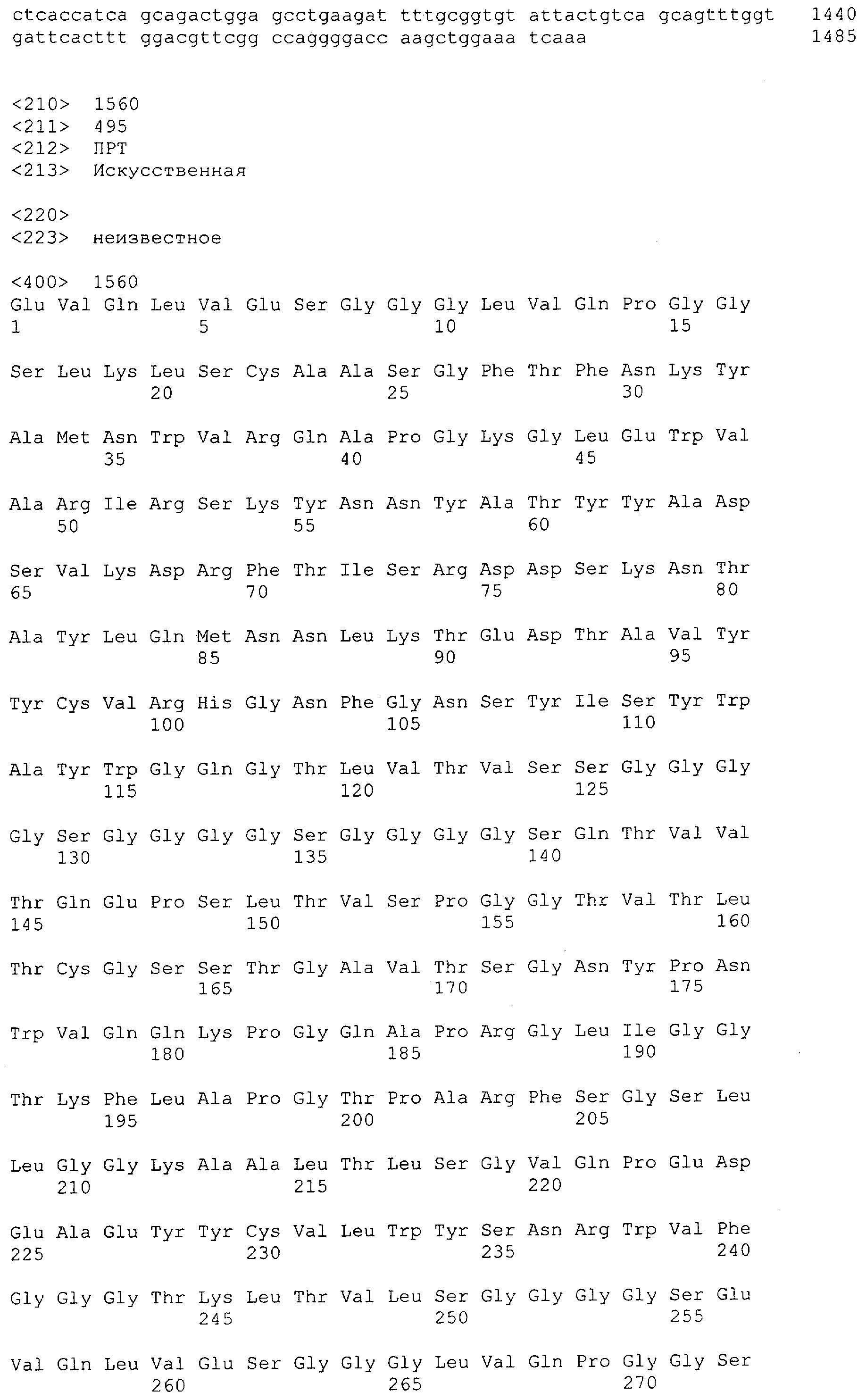
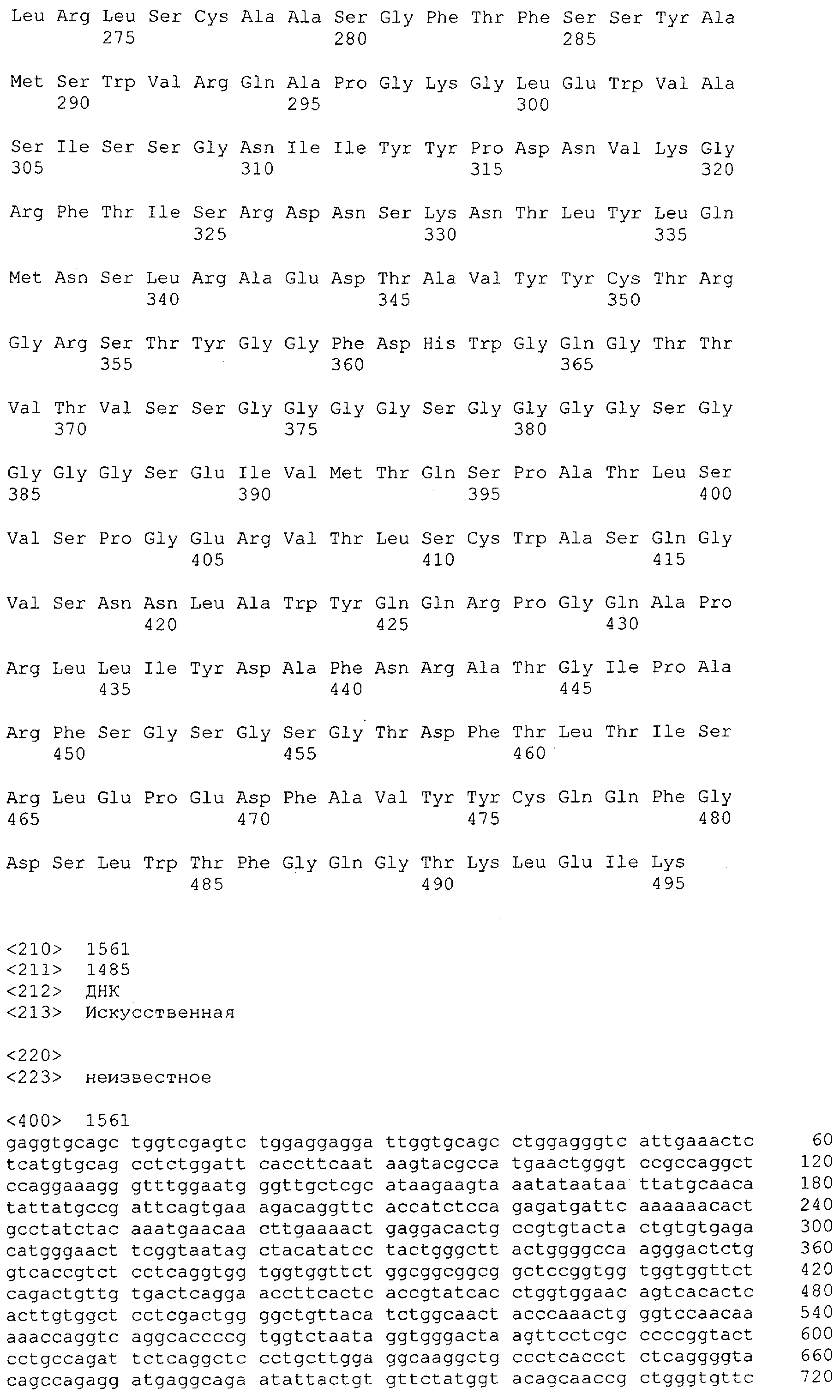

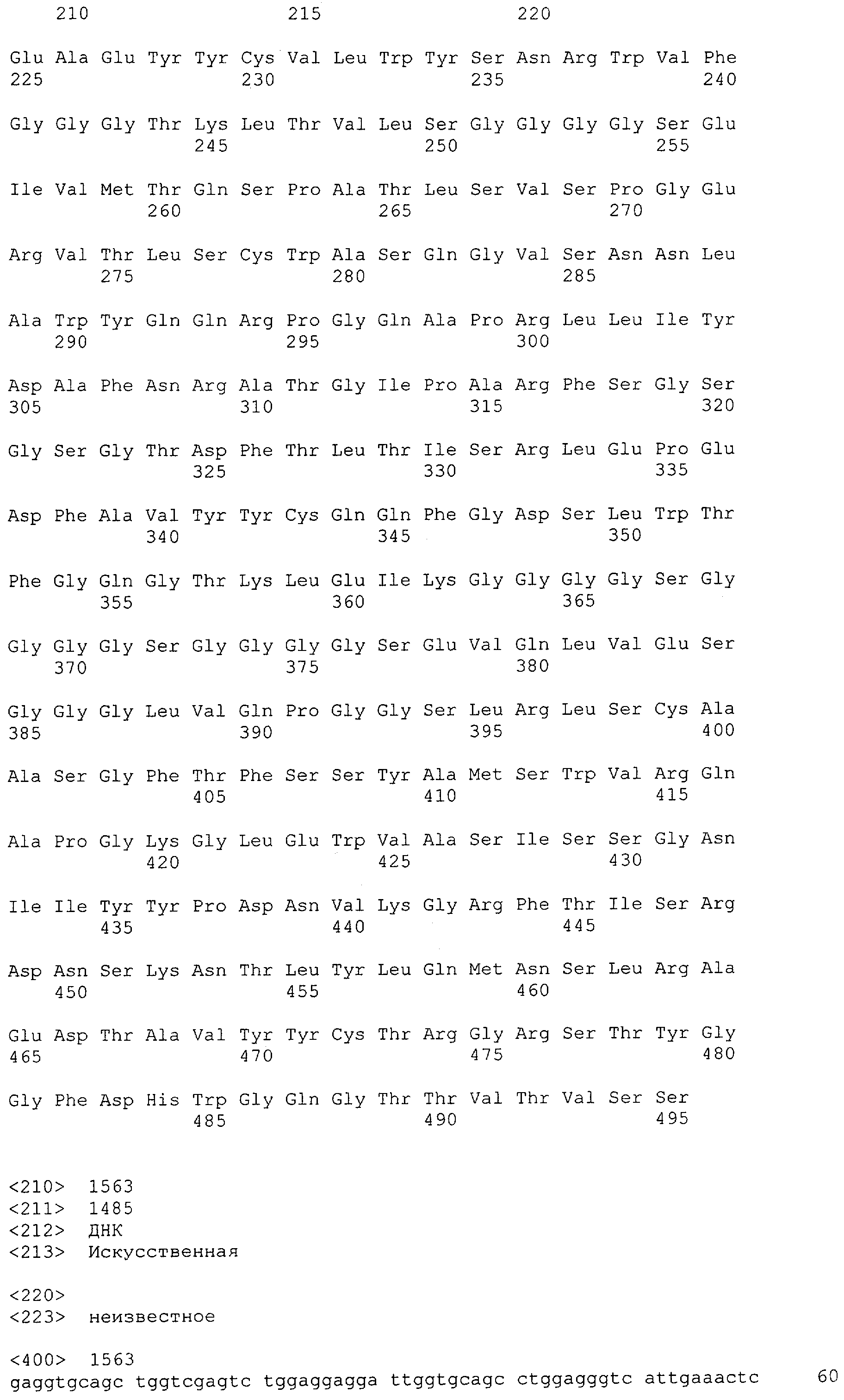

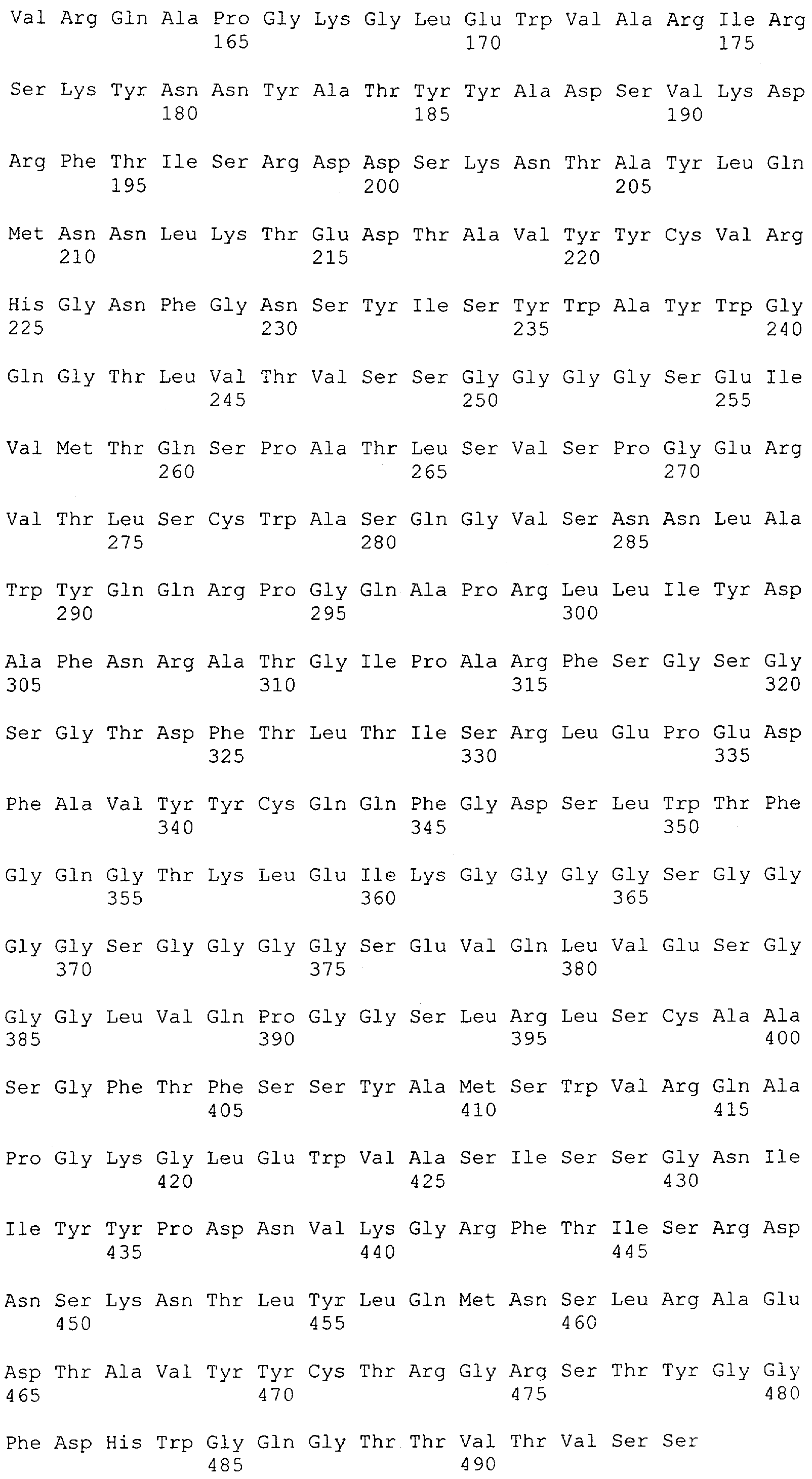

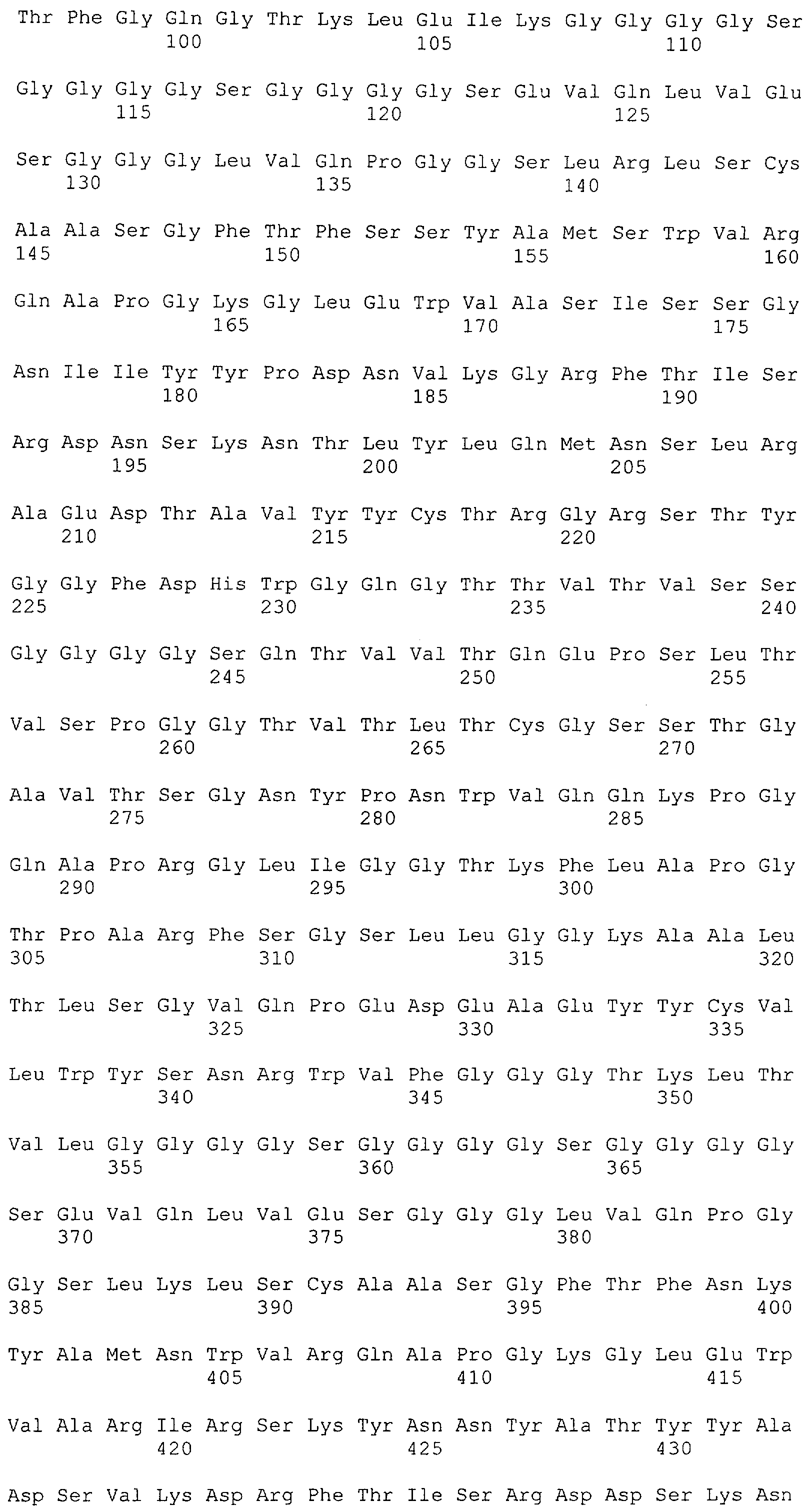








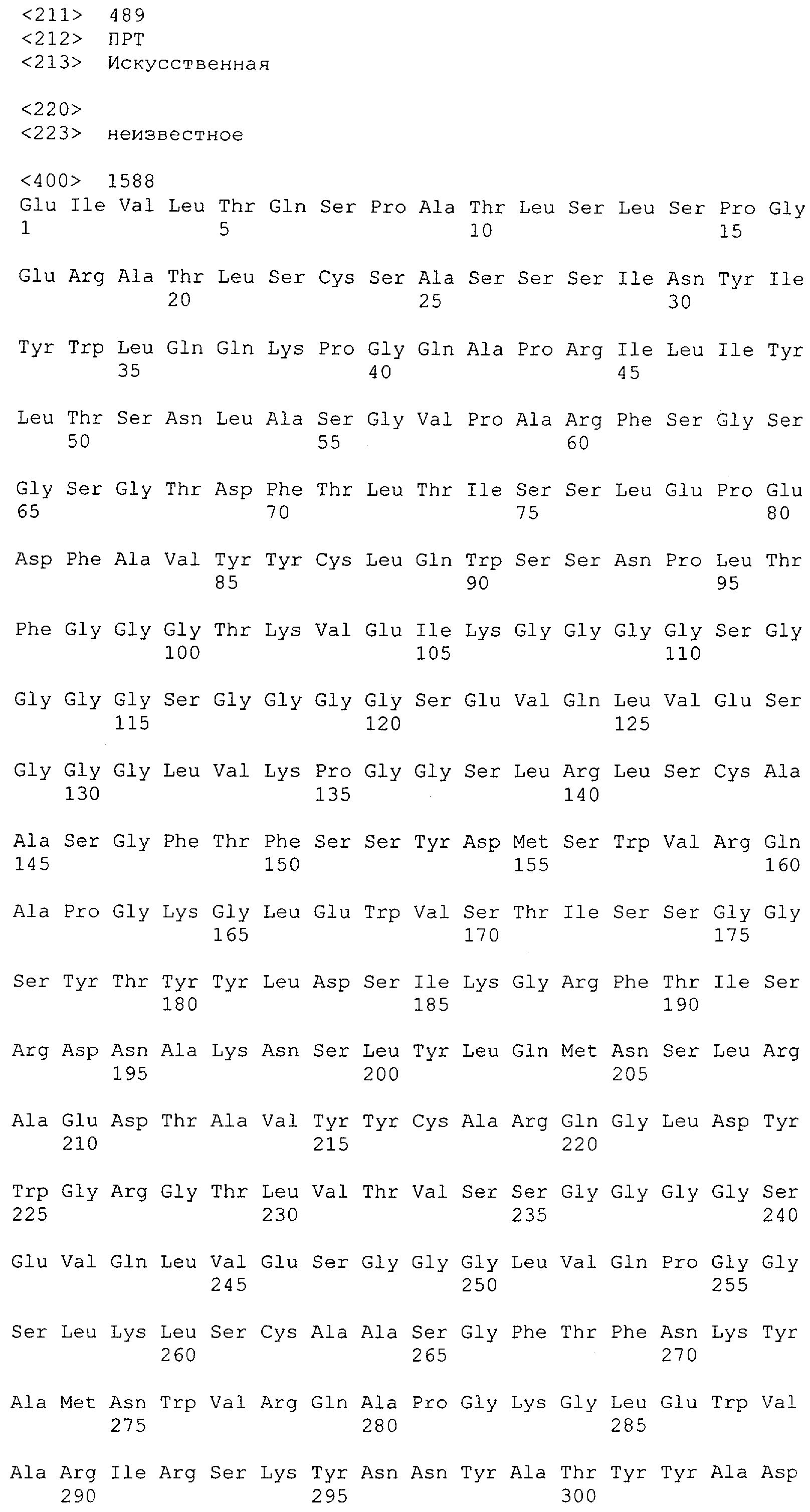




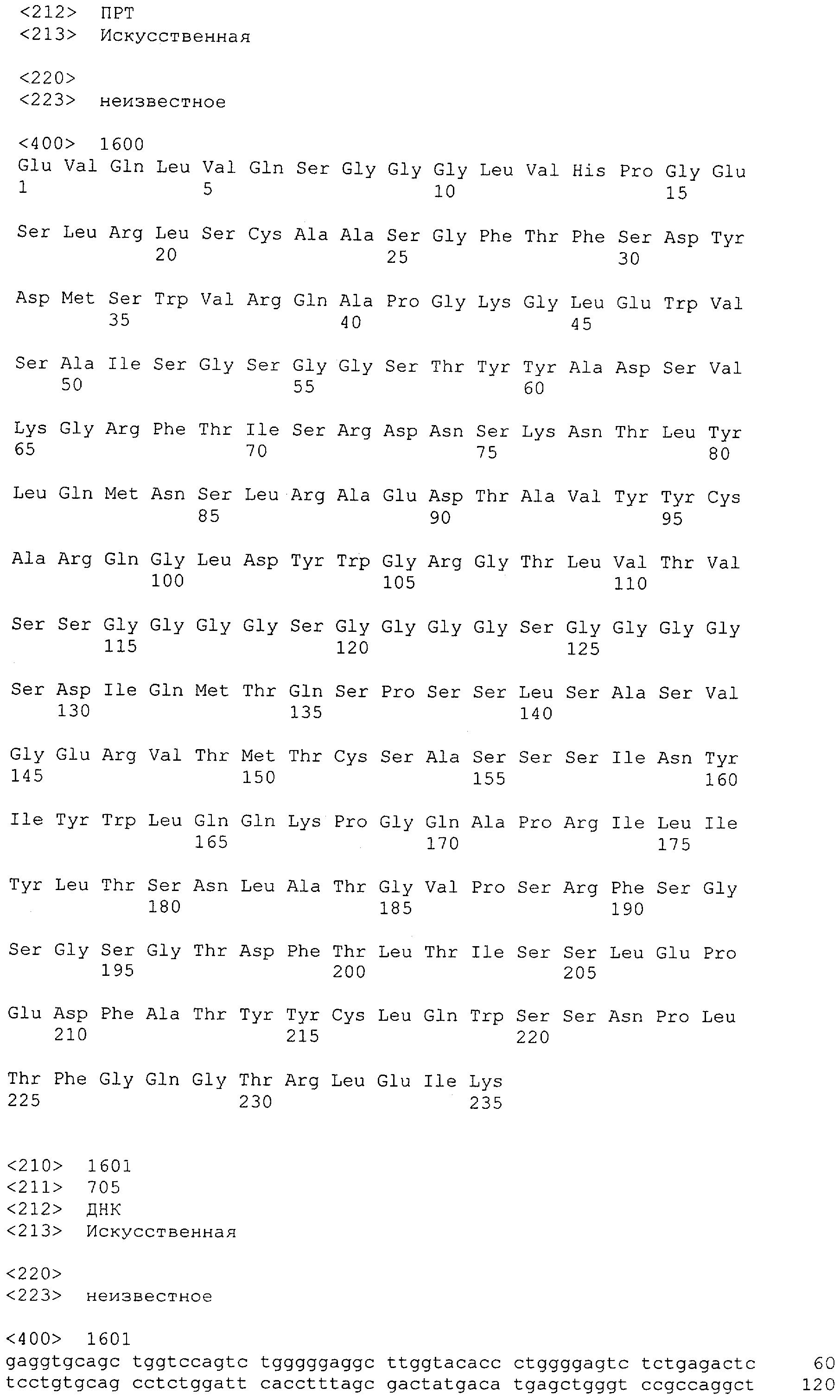













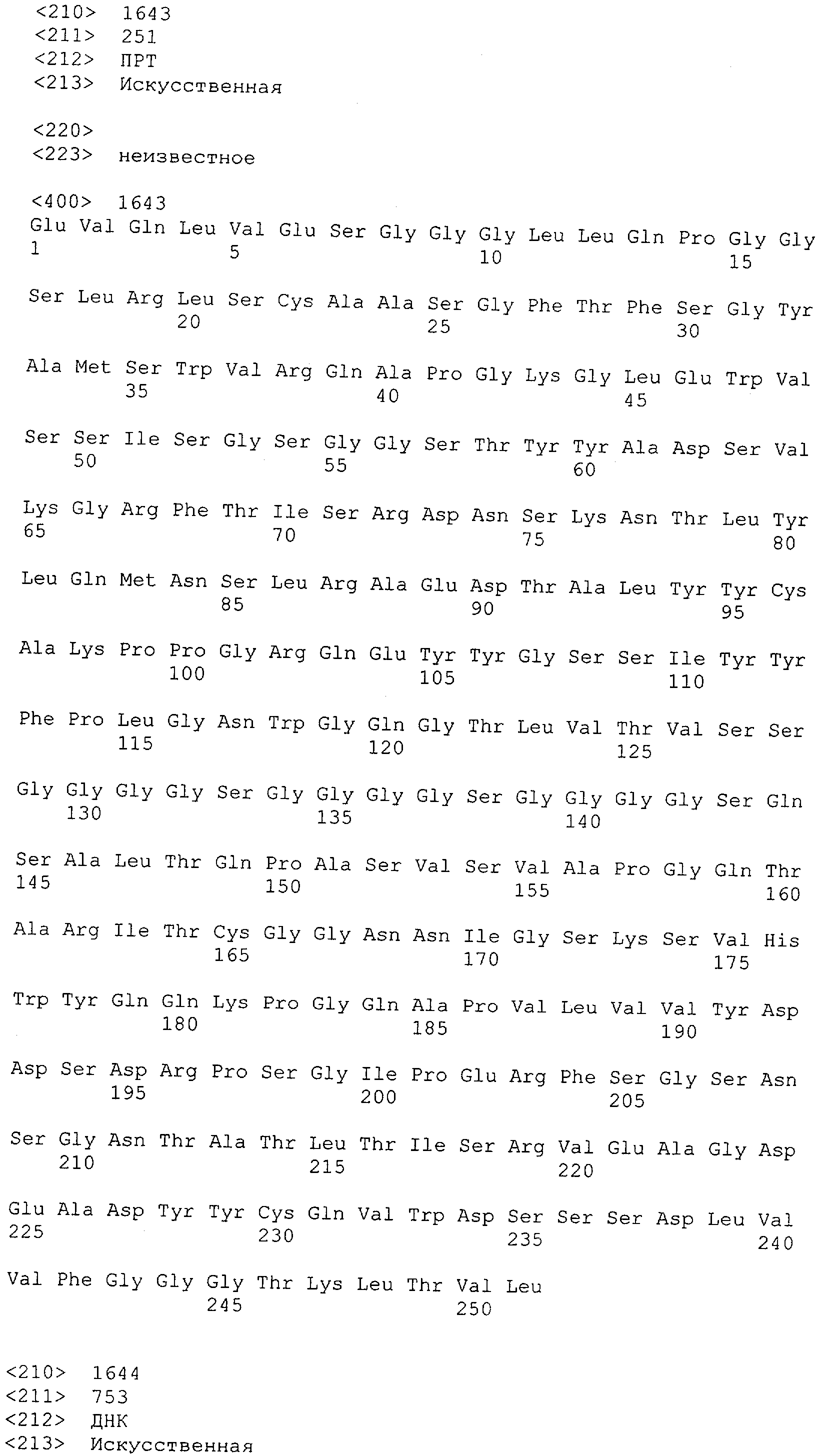


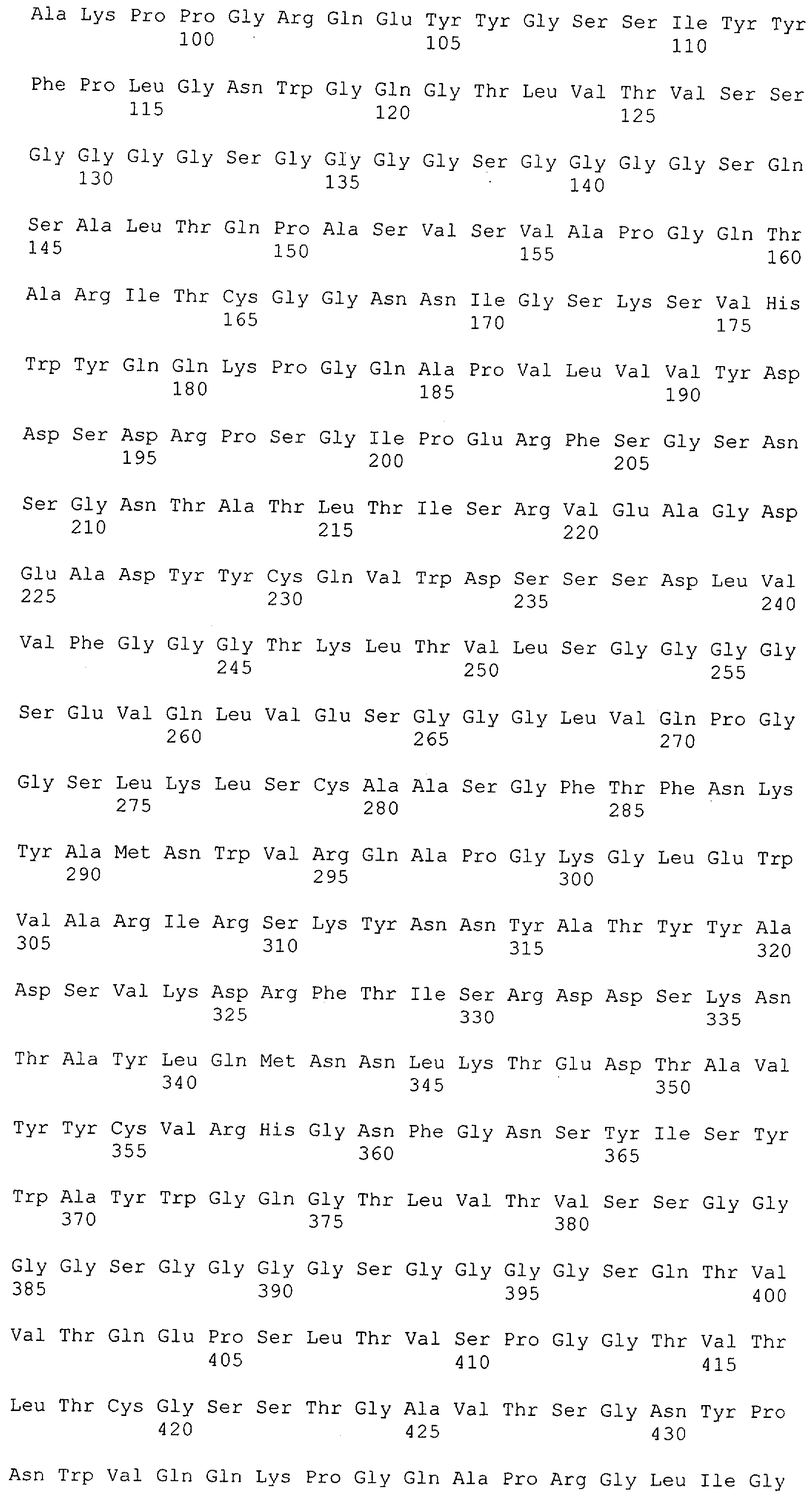






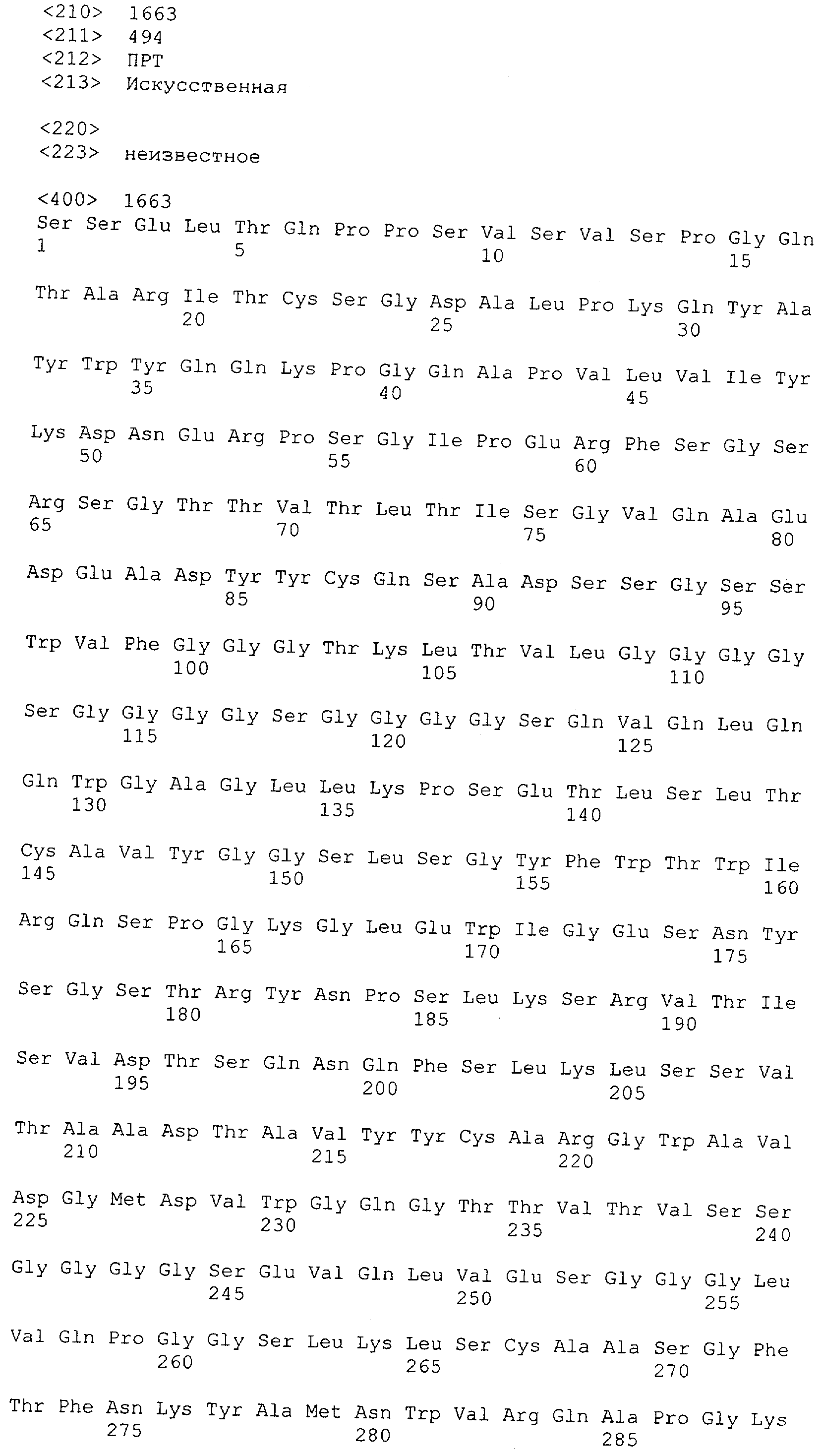














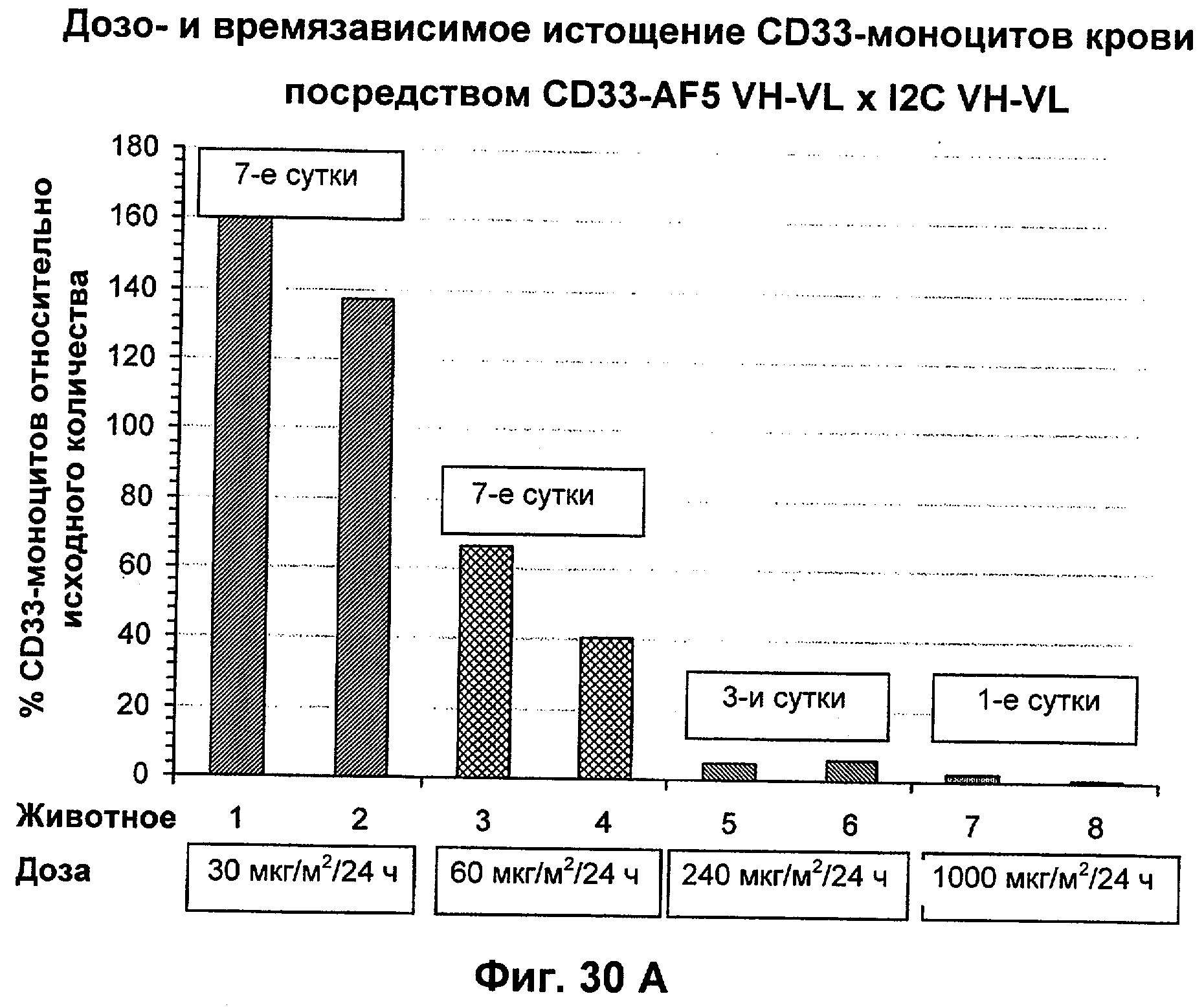
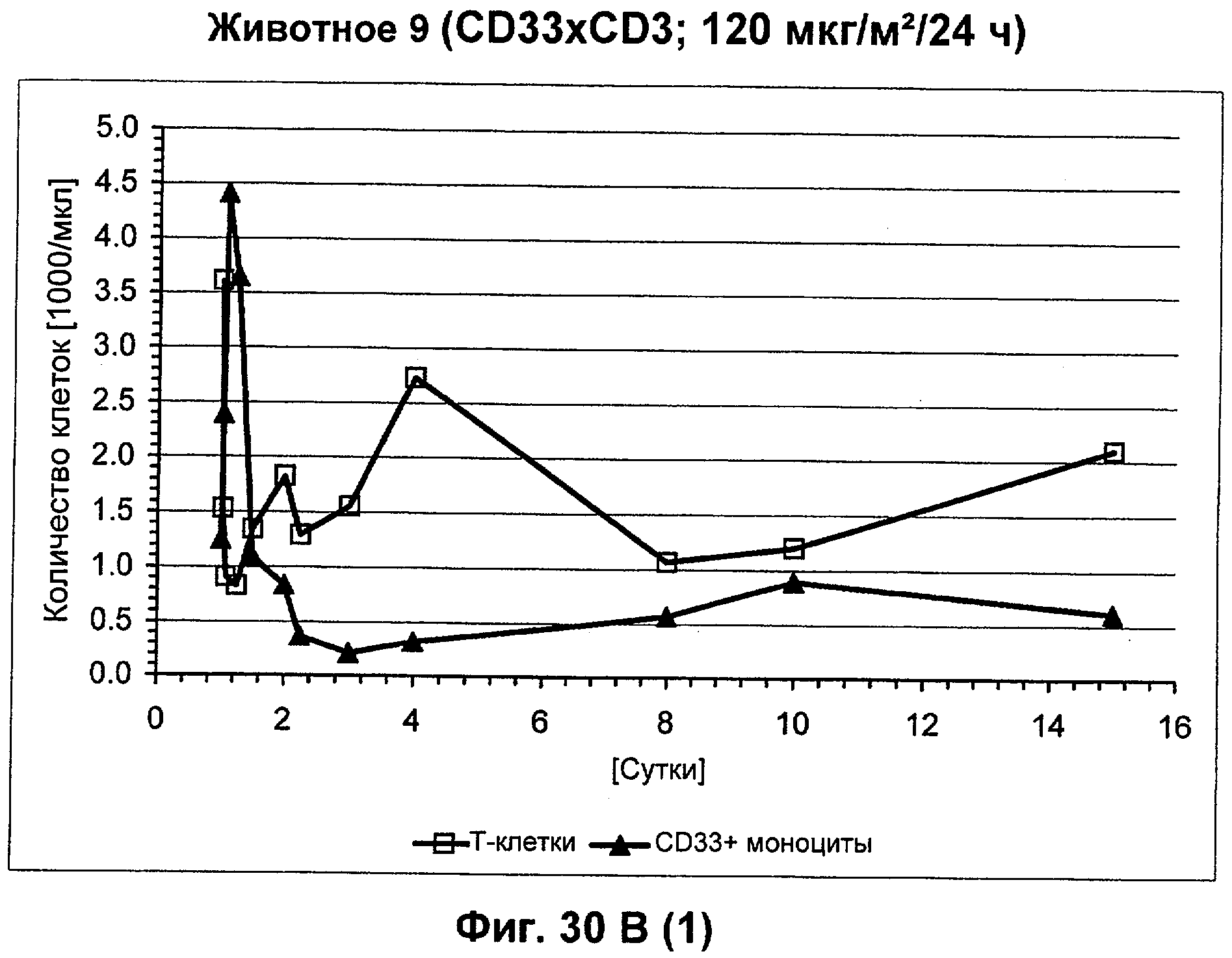
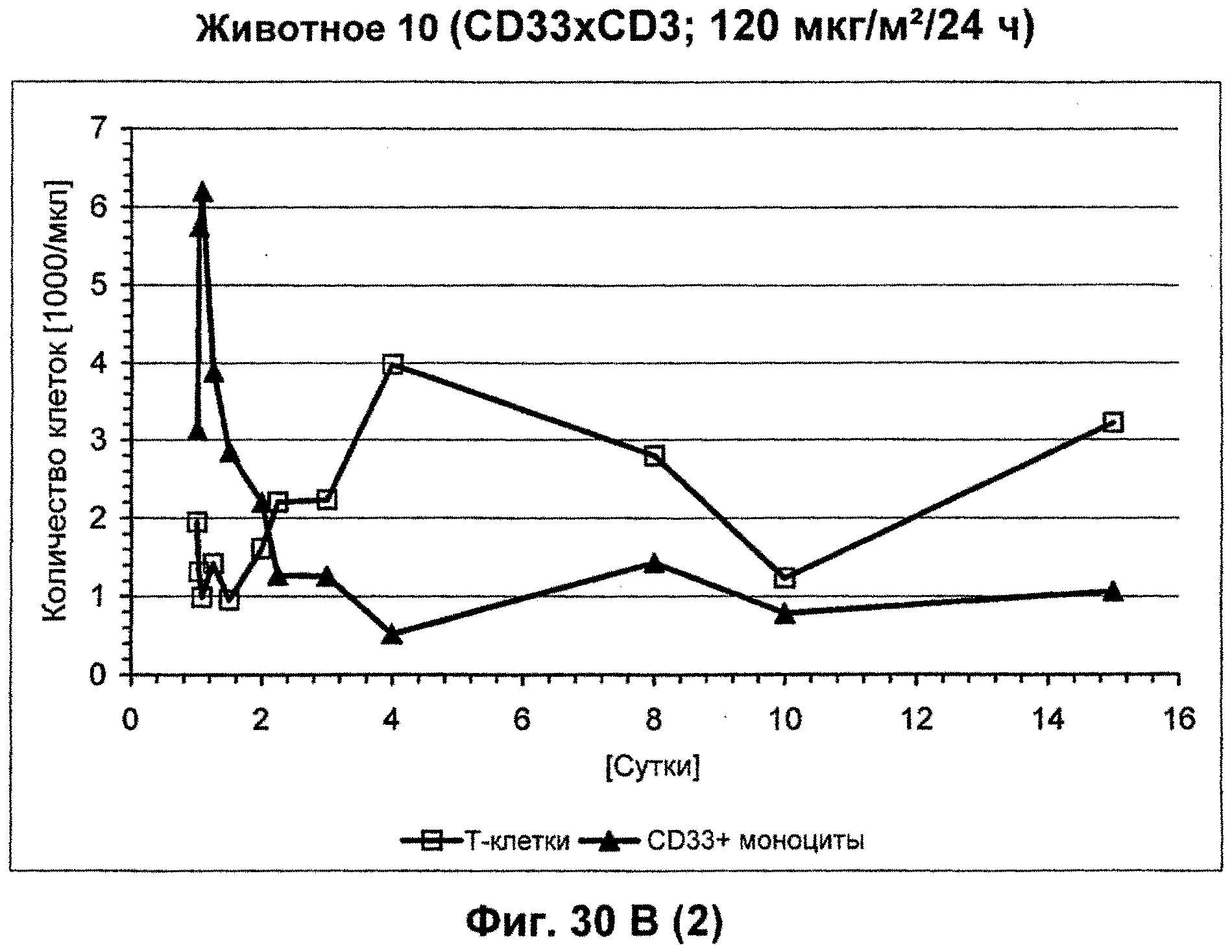

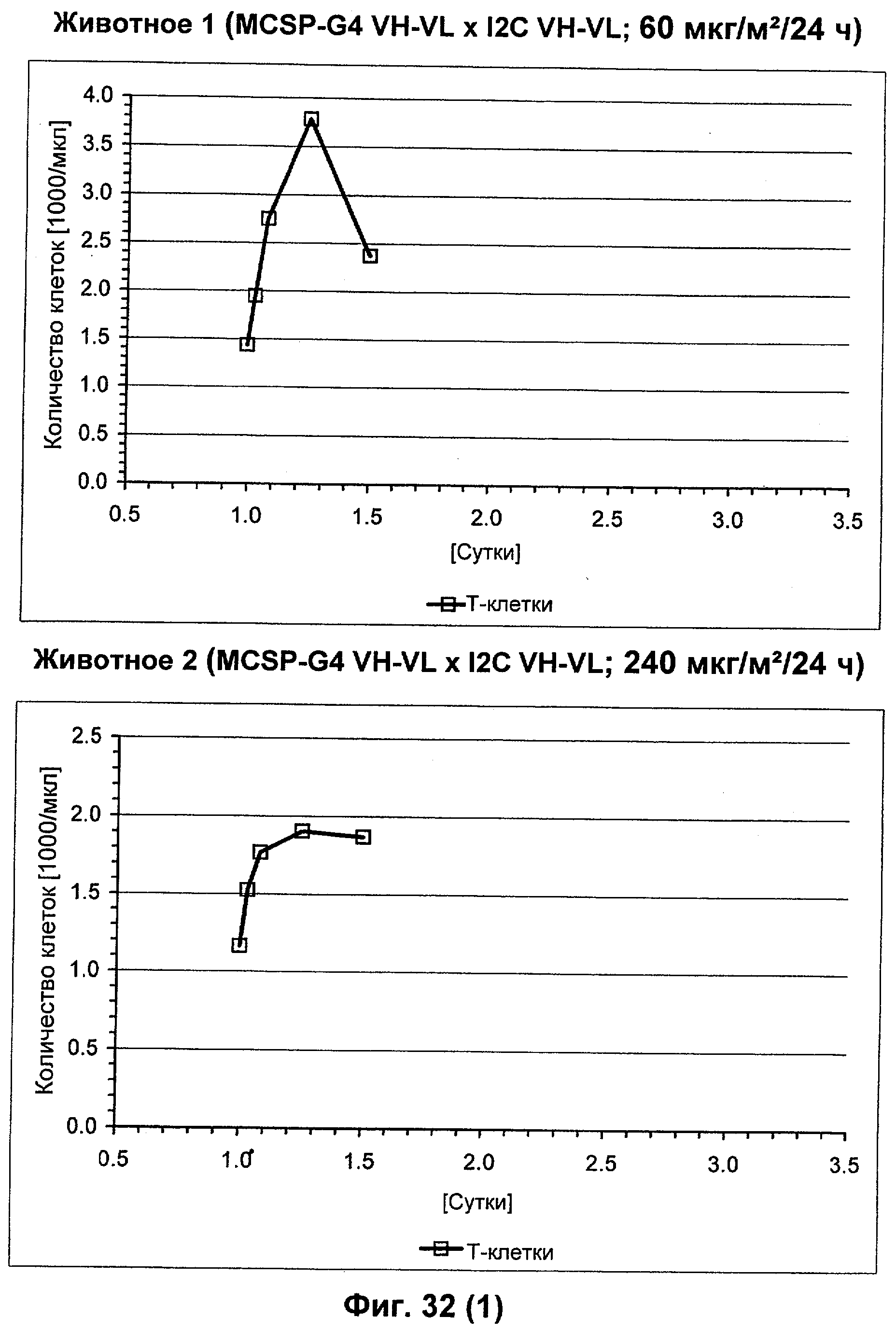














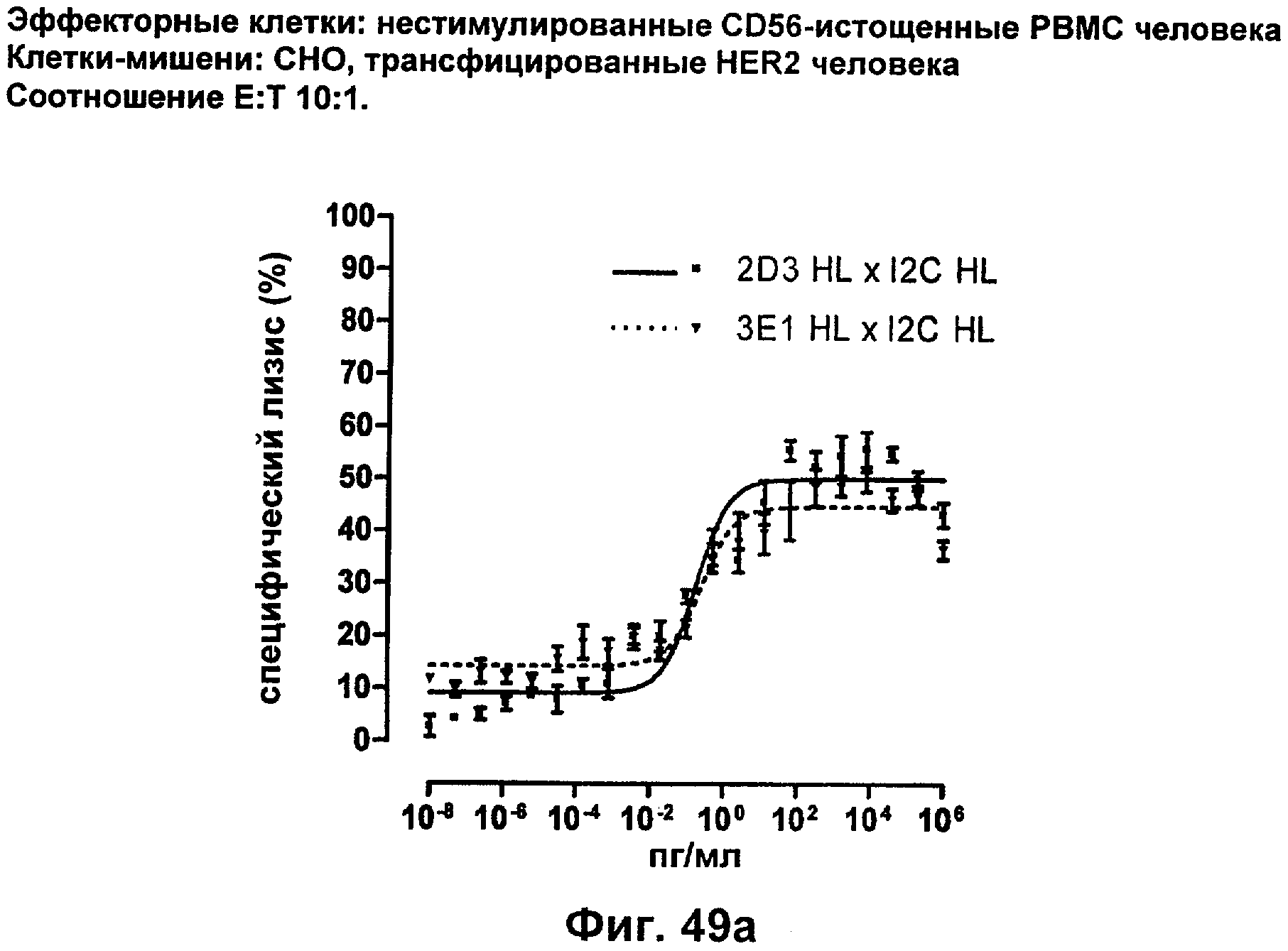
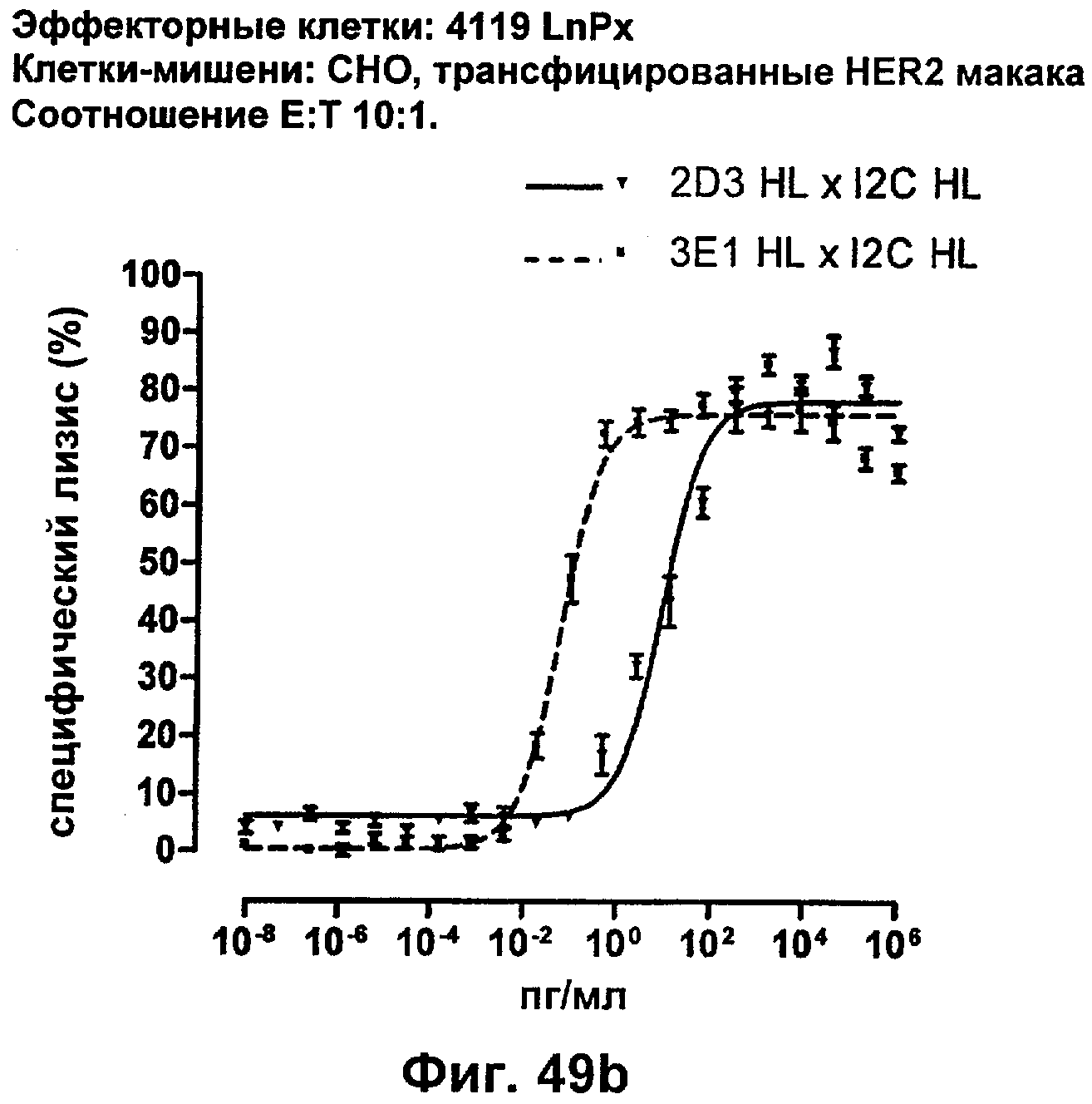
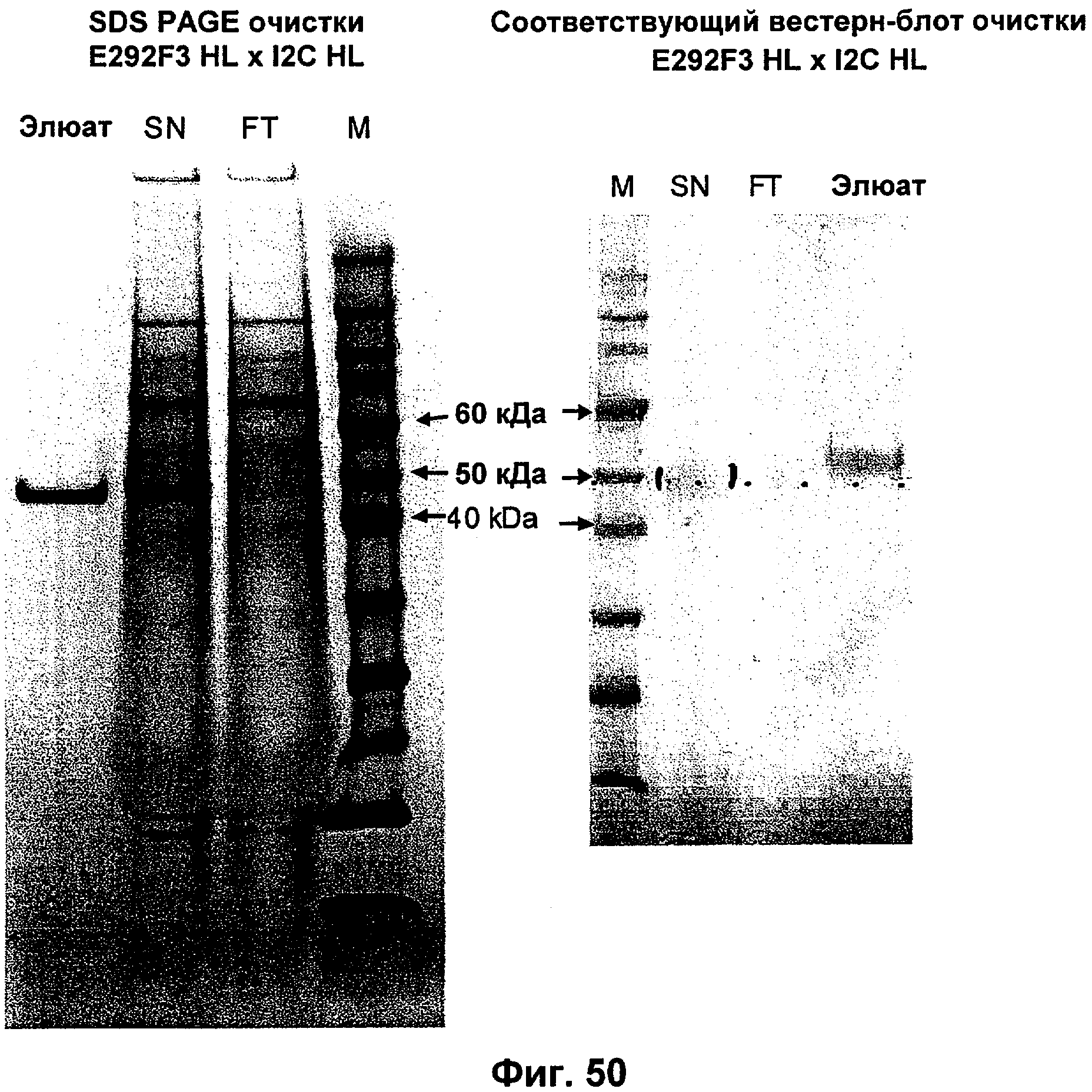
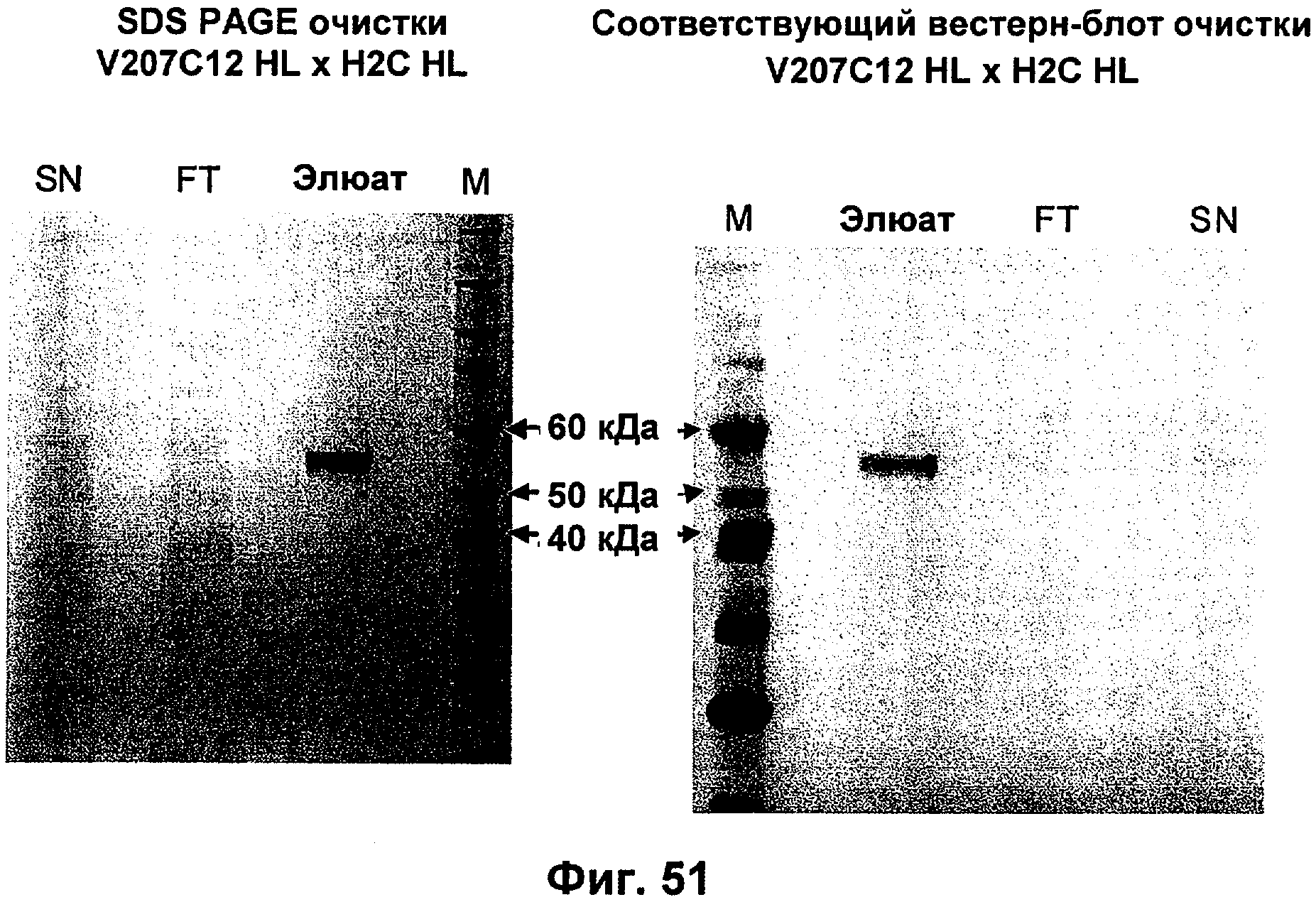
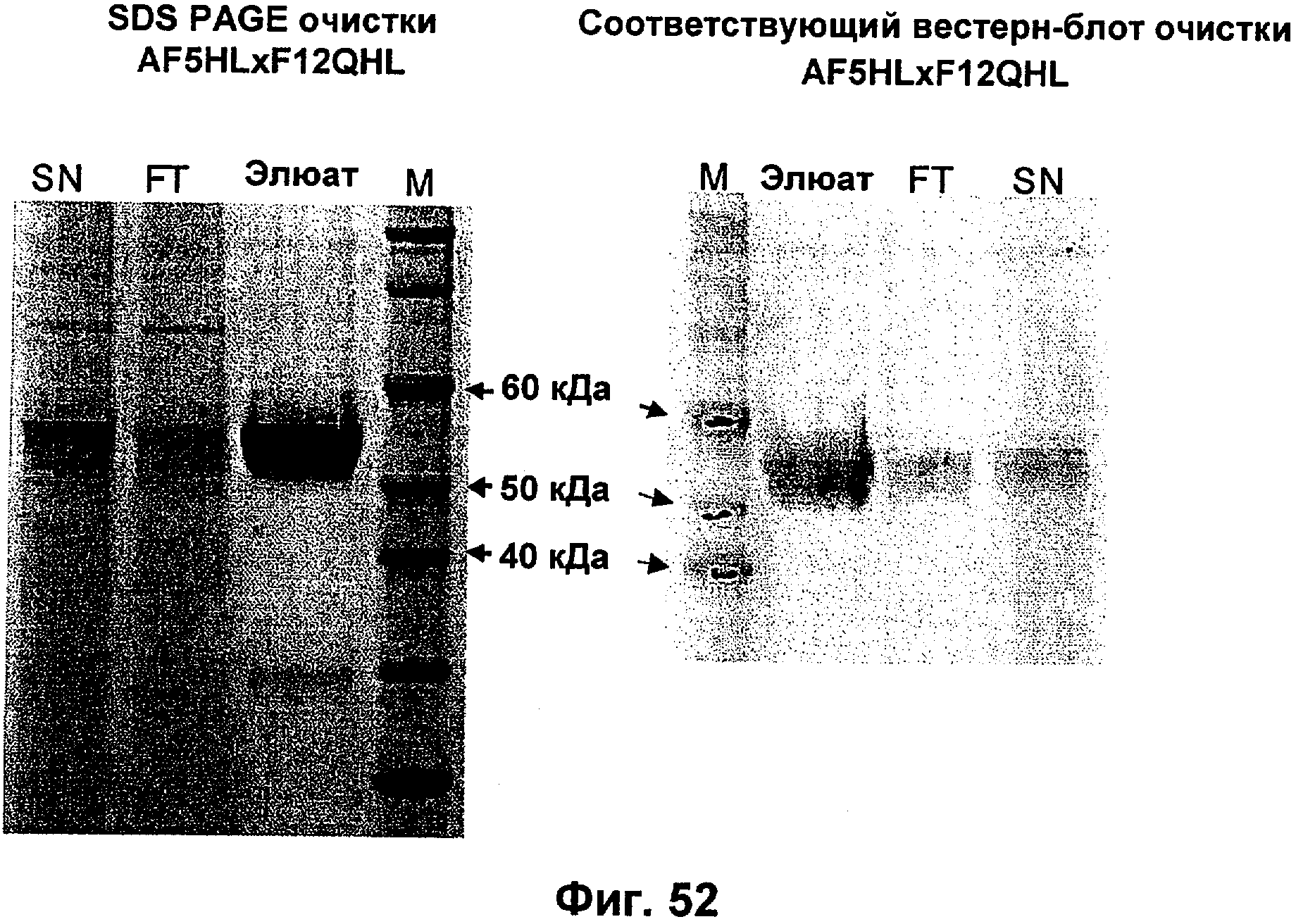
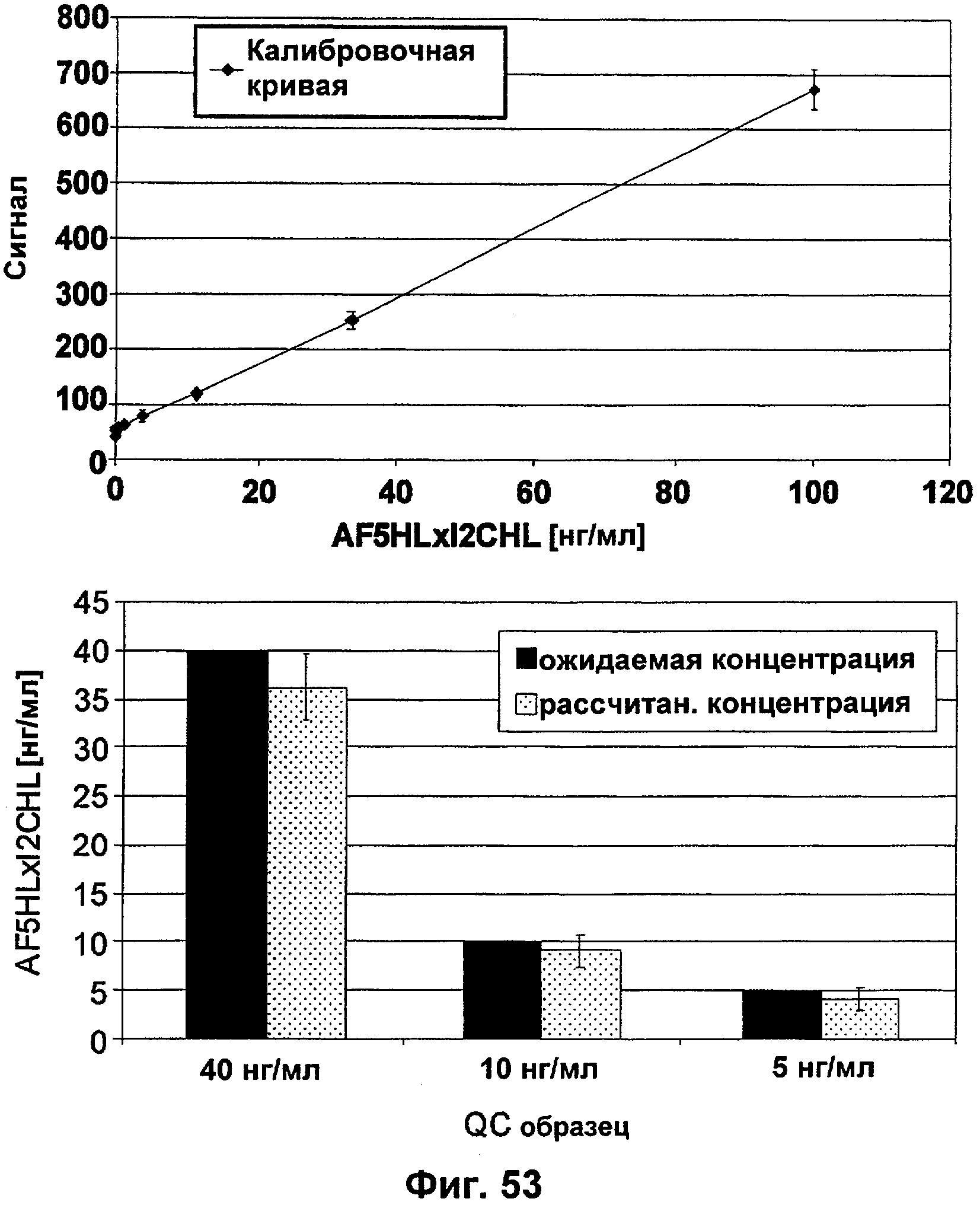
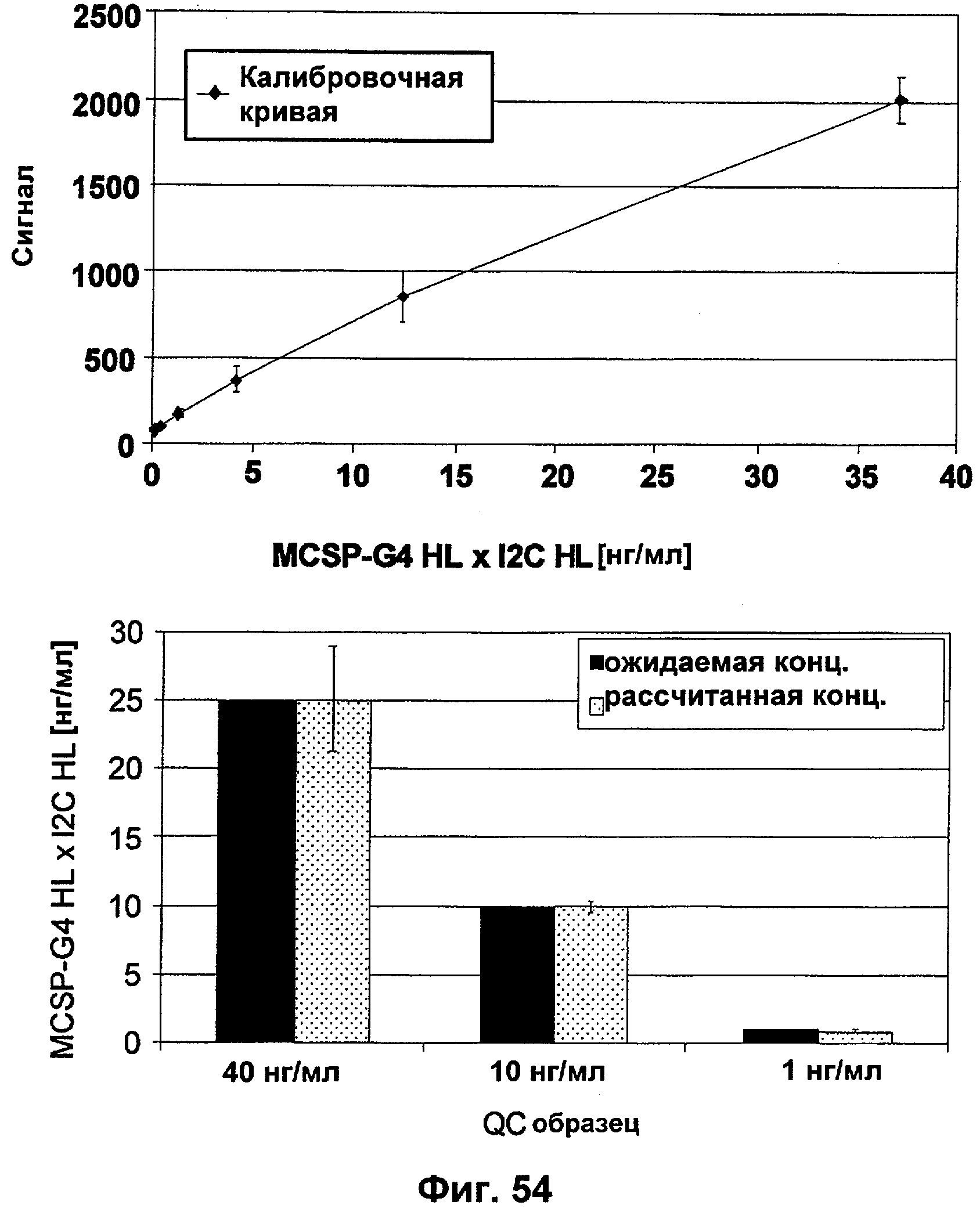
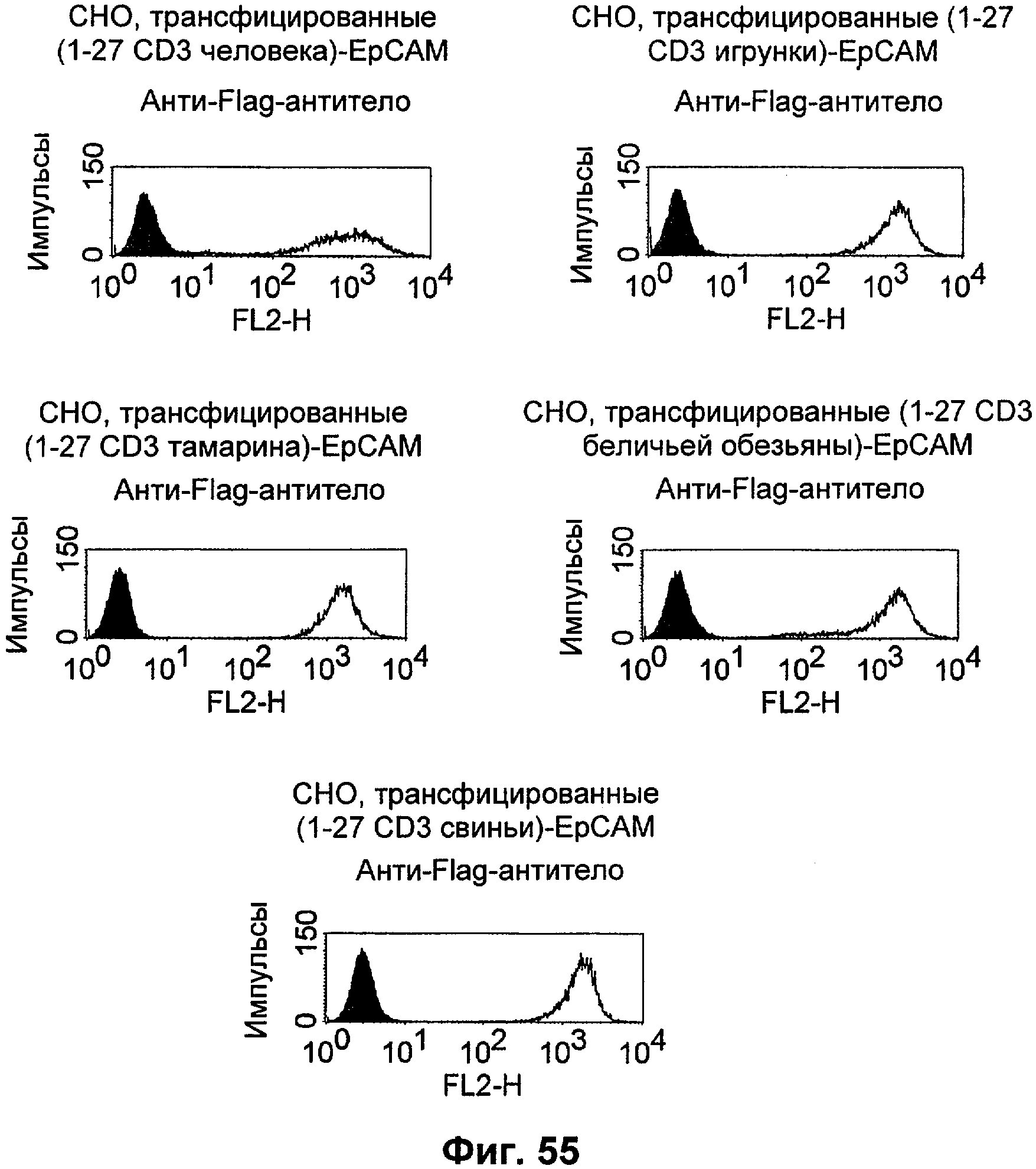


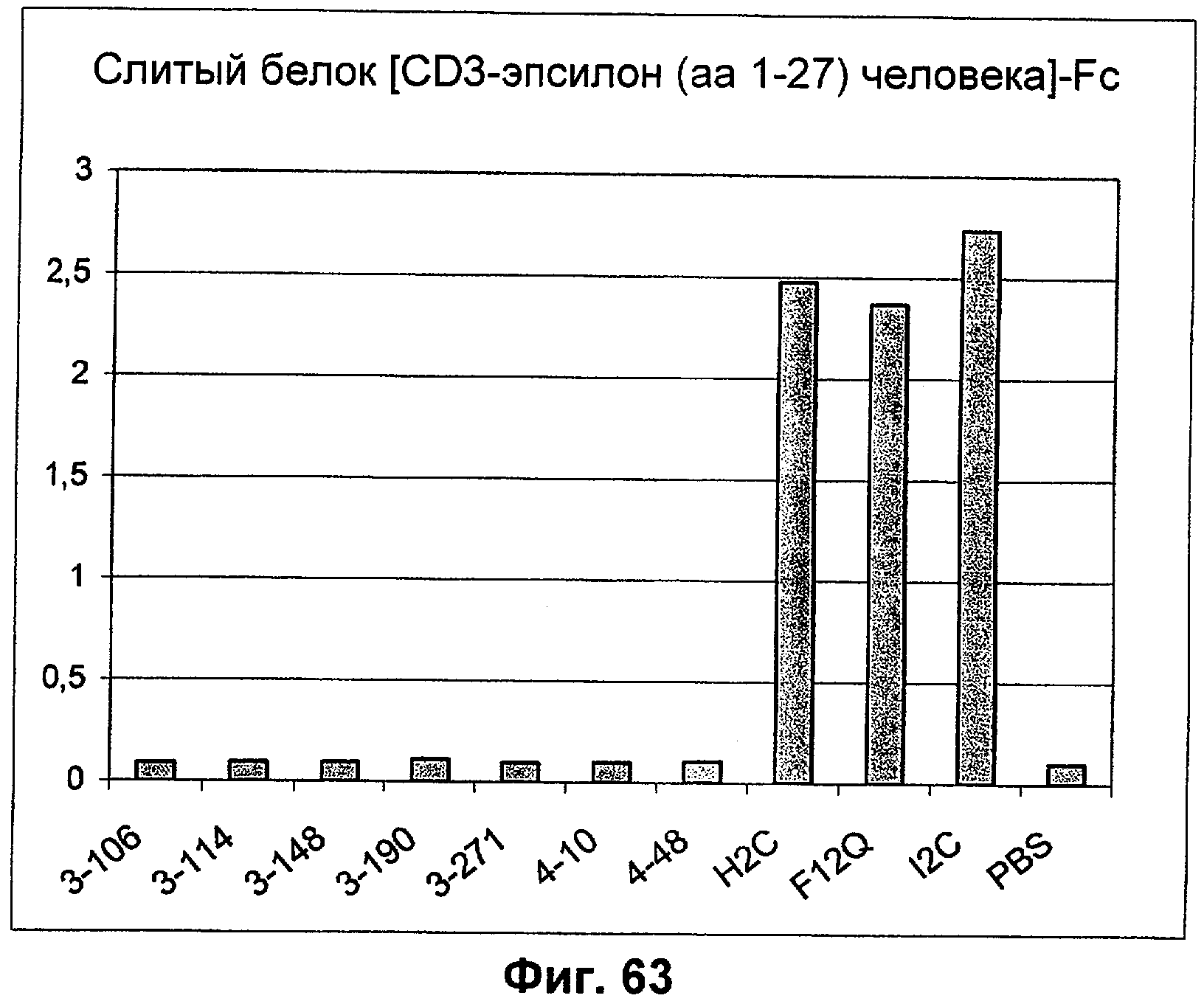
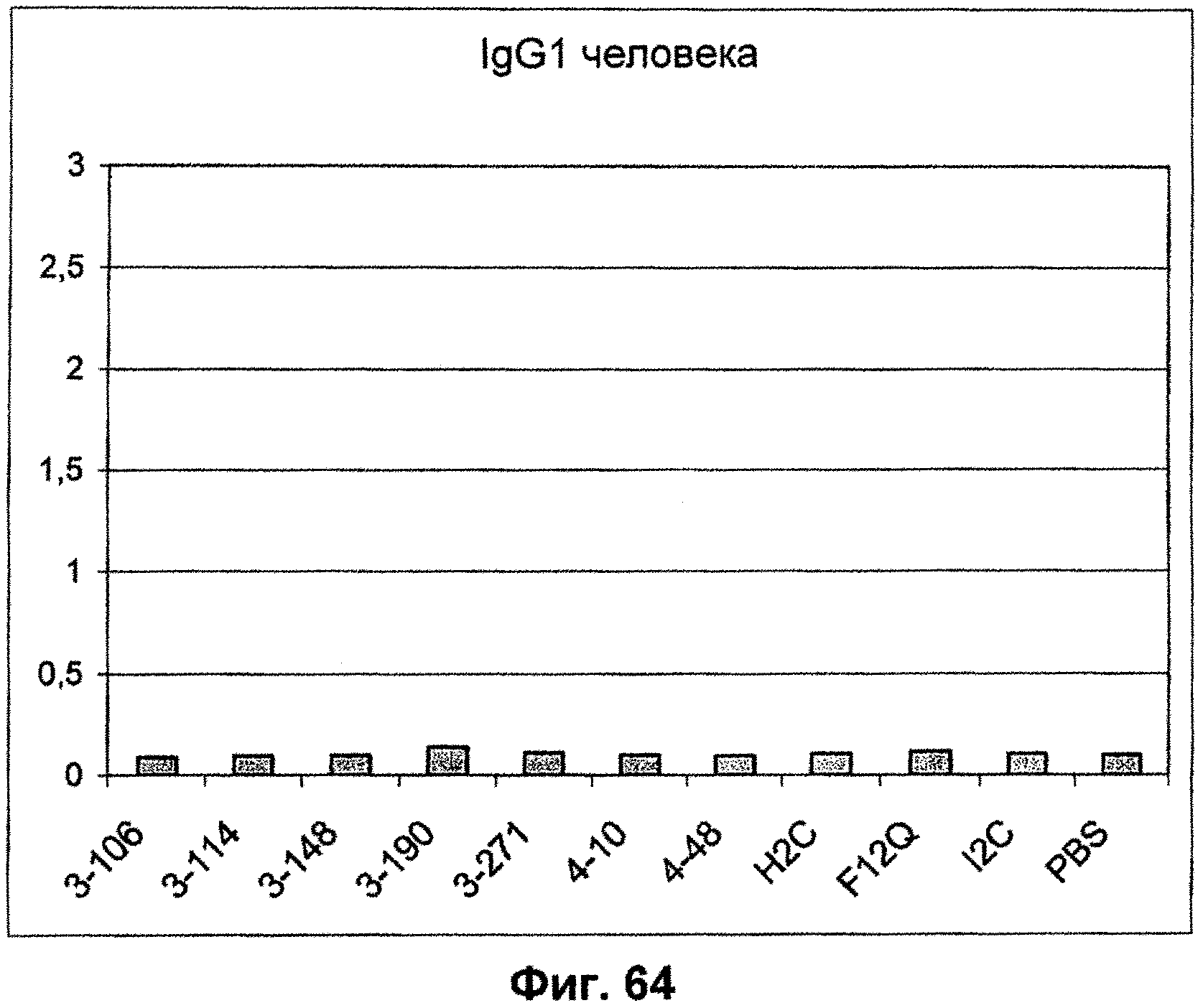
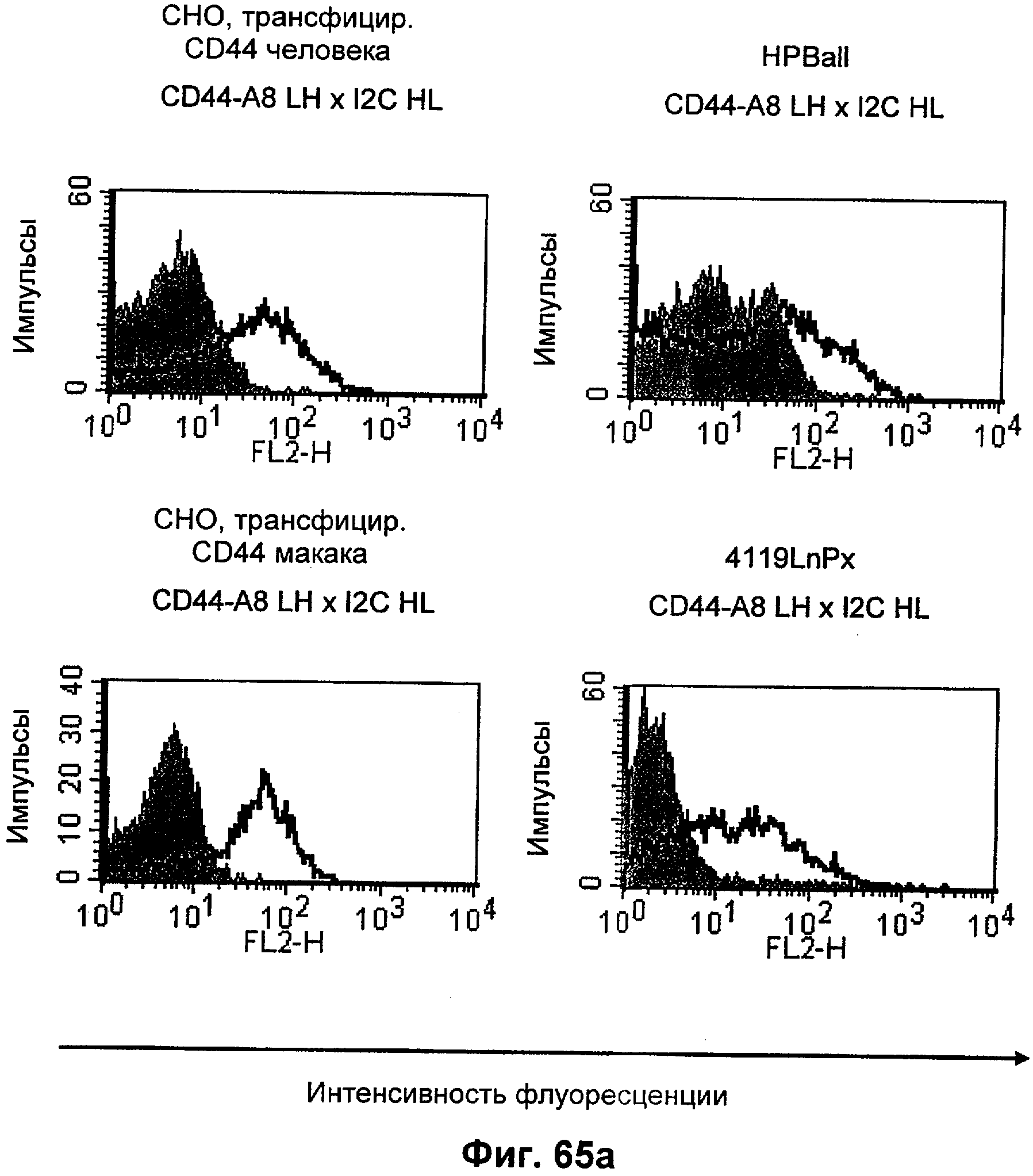
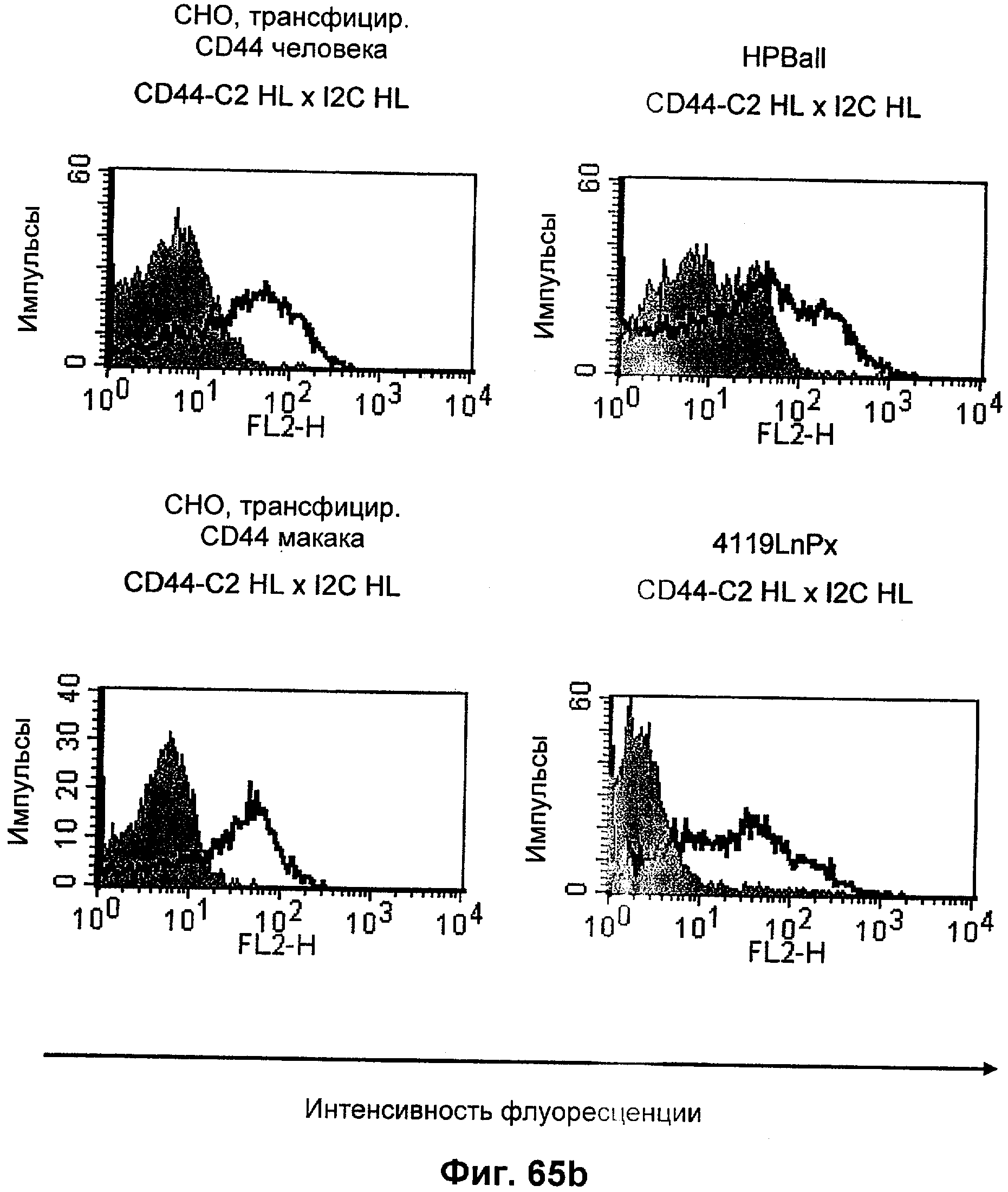



Описание
Настоящее изобретение относится к полипептиду, содержащему первый связывающий домен человека, способный связываться с эпитопом CD3 (от англ. cluster of differentiation - кластер дифференцировки) (эпсилон) человека и примата, не являющегося шимпанзе, а также к способу получения упомянутого полипептида. Кроме того, изобретение относится к нуклеиновым кислотам, кодирующим данный полипептид, к векторам, содержащим данные нуклеиновые кислоты, и к клеткам-хозяевам, содержащим данный вектор. В другом аспекте согласно изобретению предложены фармацевтическая композиция, содержащая упомянутый полипептид, и медицинские применения данного полипептида.
Т-клеточное распознавание опосредуется клонотипически распределенными альфа-бета и гамма-дельта Т-клеточными рецепторами (TcR), которые взаимодействуют с пептид-нагруженными молекулами (комплекса) пептид-МНС (главный комплекс гистосовместимости) (рМНС) (Davis & Bjorkman, Nature 334 (1988), 395-402). Антиген-специфические цепи TcR не содержат доменов сигналинга, а вместо этого связываются с консервативным многосубъединичным комплексом передачи сигнала CD3 (Call, Cell 111 (2002), 967-979, Alarcon, Immunol. Rev. 191 (2003), 38-46, Malissen, Immunol. Rev. 191 (2003), 7-27). Механизм, посредством которого TcR-лигирование непосредственно связано с аппаратом передачи сигнала, остается фундаментальным вопросом Т-клеточной биологии (Alarcon, выше; Davis, Cell 110 (2002), 285-287). Кажется очевидным, что в устойчивые Т-клеточные ответы вовлечены контактирование с корецептором, олигомеризация TcR и организация комплексов TcR-pMHC более высокого порядка в иммунологическом синапсе (Davis & van der Merwe, Curr. Biol. 11 (2001), R289-R291, Davis, Nat. Immunol. 4 (2003), 217-224). Однако самая ранняя передача сигнала посредством TcR происходит в отсутствие этих событий и может вовлекать лиганд-индуцированное конформационное изменение в CD3-эпсилон (Alarcon, выше, Davis (2002), выше, Gil, J. Biol. Chem. 276 (2001), 11174-11179, Gil, Cell, 109 (2002), 901-912). Эпсилон-, гамма-, дельта- и зета-субъединицы сигнального комплекса ассоциированы друг с другом с образованием CD3 эпсилон-гамма гетеродимера, CD3 эпсилон-дельта гетеродимера и CD3 зета-зета гомодимера (Call, выше). В различных исследованиях обнаружили, что присутствие молекул CD3 является важным для надлежащей экспрессии на клеточной поверхности альфа-бета TcR и нормального развития Т-клеток (Berkhout, J. Biol. Chem. 263 (1988), 8528-8536, Wang, J. Exp. Med. 188 (1998), 1375-1380, Kappes, Curr. Opin. Immunol. 7 (1995), 441-447). На основании разрешенной структуры фрагментов эктодоменов мышиного CD3 эпсилон-гамма гетеродимера показано, что обе эпсилон-гамма-субъединицы представляют собой С2-подобные (C2-set) Ig-домены, которые взаимодействуют друг с другом с образованием необычной димерной конфигурации по типу "side-to-side" (Sun, Cell 105 (2001), 913-923). Хотя обогащенный цистеиновыми остатками "стебель" (stalk), по-видимому, играет важную роль в запуске димеризации CD3 (Su, выше, Borroto, J. Biol. Chem. 273 (1998), 12807-12816), взаимодействие посредством внеклеточных доменов CD3-эпсилон и CD3-гамма является достаточным для образования комплекса этих белков с TcR-бета (Manolios, Eur. J. Immunol. 24 (1994), 84-92, Manolios & Li, Immunol. Cell Biol. 73 (1995), 532-536). Хотя этот пункт все еще является спорным, преобладающая стехиометрия TcR, наиболее вероятно, содержит один альфа-бета TcR, один CD3 эпсилон-гамма гетеродимер, один CD3 эпсилон-дельта гетеродимер и один CD3 зета-зета гомодимер (Call, выше). Центральная роль CD3 эпсилон-гамма гетеродимера человека в иммунном ответе стала понятна в связи с недавним установлением кристаллической структуры этого комплекса, связанного с терапевтическим антителом ОКТ3 (Kjer-Nielsen, PNAS, 101 (2004), 7675-7680).
Многие терапевтические стратегии модулируют Т-клеточный иммунитет путем направленного воздействия на TcR-сигналинг, в частности моноклональные антитела (mAb) против CD3 человека, которые широко используются в клинике в схемах приема иммуносупрессивных средств. CD3-специфическое мышиное mAb ОКТ3 было первым mAb, разрешенным для применения у людей" (Sgro, Toxicology 105 (1995), 23-29), и оно широко используется в клинике в качестве иммуносупрессивного агента при трансплантации (Chatenoud, Clin. Transplant. 7 (1993), 422-430, Chatenoud, Nat. Rev. Immunol. 3 (2003), 123-132, Kumar, Transplant. Proc. 30 (1998), 1351-1352), диабете 1 типа (Chatenoud (2003), выше) и псориазе (Utset, J. Rheumatol. 29 (2002), 1907-1913). Более того, анти-CD3 mAb могут индуцировать частичный Т-клеточный сигналинг и клональную толерантность (Smith, J. Exp. Med. 185 (1997), 1413-1422). ОКТ3 было описано в литературе в качестве мощного Т-клеточного митогена (Van Wauve, J. Immunol. 124 (1980), 2708-18), а также в качестве мощного Т-клеточного киллера (Wong, Transplantation 50 (1990), 683-9). ОКТ3 демонстрирует время-зависимое изменение обеих этих активностей:
после ранней активации Т-клеток, приводящей к высвобождению цитокинов, последующее введение ОКТ3 блокирует все известные Т-клеточные функции. Благодаря этому более позднему блокированию Т-клеточной функции для ОКТ3 было показано такое широкое применение в качестве иммуносупрессанта в схемах лечения для снижения или даже устранения отторжения тканевого аллотрансплантата.
ОКТ3 обращает отторжение тканевого аллотрансплантата наиболее вероятно путем блокирования функции всех Т-клеток, которые играют основную роль в остром отторжении. ОКТ3 взаимодействует с CD3-комплексом и блокирует функцию CD3-комплекса в мембране Т-клеток человека, который ассоциирован с антиген-распознающей структурой Т-клеток (TCR) и является важным для трансдукции сигнала. Многочисленные исследования касались того, какая из субъединиц TCR/CD3 связывается с ОКТ3. Однако некоторые факты указывают на специфичность ОКТ3 в отношении эпсилон-субъединицы комплекса TCR/CD3 (Tunnacliffe, Int. Immunol. 1 (1989), 546-50; Kjer-Nielsen, PNAS 101 (2004), 7675-7680). Согласно другим данным показано, что для связывания ОКТ3 с комплексом TCR/CD3 необходимо присутствие других субъединиц этого комплекса (Salmeron, J. Immunol. 147 (1991), 3047-52).
Другие общеизвестные антитела, обладающие специфичностью к молекуле CD3, перечислены в Tunnacliffe, Int. Immunol. 1 (1989), 546-50. Как указано выше, такие CD3-специфические антитела способны индуцировать различные Т-клеточные ответы, такие как продукция лимфокинов (Von Wussow, J. Immunol. 127 (1981), 1197; Palacious, J. Immunol. 128 (1982), 337), пролиферация (Van Wauve, J. Immunol. 124 (1980), 2708-18) и индукция Т-клеточных супрессоров (Kunicka, в "Limphociting Typing II" 1 (1986), 223). To есть, в зависимости от экспериментальных условий CD3-специфическое моноклональное антитело может либо ингибировать, либо индуцировать цитотоксичность (Leewenberg, J. Immunol. 134 (1985), 3770; Phillips, J. Immunol. 136 (1986) 1579; Platsoucas, Proc. Natl. Acad. Sci. USA 78 (1981), 4500; Itoh, Cell Immunol. 108 (1987), 283-96; Mentzer, J. Immunol. 135 (1985), 34; Landegren, J. Exp. Med. 155 (1982), 1579; Choi (2001), Eur. J. Immunol. 31, 94-106; Xu (2000), Cell Immunol. 200, 16-26; Kimball (1995), Transpl. Immunol. 3, 212-221).
Хотя многие антитела против CD3, описанные в данной области техники, по сообщениям, распознают CD3-эпсилон-субъединицу CD3-комплекса, большинство из них в действительности связывается с конформационными эпитопами и, таким образом, распознает CD3-эпсилон только в нативном окружении TCR. Конформационные эпитопы характеризуются наличием двух или более отдельных аминокислотных остатков, которые разнесены в первичной последовательности, но сближаются на поверхности молекулы, когда полипептид сворачивается в нативный белок/антиген (Sela (1969) Science 166, 1365 и Laver (1990) Cell 61, 553-6). Конформационные эпитопы, связывающиеся с антителами против CD3-эпсилон, описанными в данной области техники, можно разделить на две группы. В основной группе указанные эпитопы образуются двумя субъединицами CD3, например CD3-эпсилон цепью и CD3-гамма или CD3-дельта цепью. Например, в нескольких исследованиях обнаружено, что наиболее широко используемые моноклональные антитела против CD3-эпсилон, а именно ОКТ3, WT31, UCHT1, 7D6 и Leu-4, не связывались с клетками, трансфицированными одной CD3-эпсилон цепью. Однако эти антитела окрашивали клетки, трансфицированные двойной комбинацией CD3-эпсилон плюс или CD3-гамма, или CD3-дельта (Tunnacliffe, выше; Law, Int. Immunol. 14 (2002), 389-400; Salmeron, J. Immunol. 147 (1991), 3047-52; Coulie, Eur. J. Immunol. 21 (1991), 1703-9). Во второй менее многочисленной группе конформационный эпитоп образуется в самой CD3-эпсилон субъединице. Членом этой группы является, например mAb АРА 1/1, которое получено против денатурированной CD3-эпсилон цепи (Risueno, Blood 106 (2005), 601-8). В совокупности большинство антител против CD3-эпсилон, описанных в данной области техники, распознает Конформационные эпитопы, расположенные на двух или более субъединицах CD3. Отдельные аминокислотные остатки, образующие трехмерную структуру этих эпитопов, при этом могут быть локализованы либо на самой CD3-эпсилон субъединице, либо на CD3-эпсилон субъединице и других субъединицах CD3, таких как CD3-гамма или CD3-дельта.
Другая проблема, связанная с антителами против CD3, состоит в том, что антитела против CD3, как было обнаружено, являются видоспецифическими. Анти-CD3 моноклональные антитела, что, как правило, справедливо для любых других моноклональных антител, функционируют путем высокоспецифического распознавания своих молекул-мишеней. Они распознают только один сайт, или эпитоп, на их целевой молекуле CD3. Например, одним из наиболее широко используемых и наилучшим образом охарактеризованных моноклональных антител, специфичных к CD3-KOMnneKcy, является ОКТ-3. Это антитело взаимодействует с CD3 шимпанзе, но не с гомологом CD3 других приматов, таких как макаки, или с CD3 собаки (Sandusky et al., J. Med. Primatol. 15 (1986), 441-451). Анти-CD3 моноклональное антитело UCHT-1 также взаимодействует с CD3 от шимпанзе, но не с CD3 от макака (собственные данные). С другой стороны, также существуют примеры моноклональных антител, которые распознают антигены макака, но не их человеческие копии. Одним из примеров этой группы является моноклональное антитело FN-18, направленное на CD3 макака (Uda et al., J. Med. Primatol. 30 (2001), 141-147). Интересен обнаруженный факт, что периферические лимфоциты от примерно 12% яванских макаков не взаимодействуют с моноклональным антителом против CD3 макака резуса (FN-18) вследствие полиморфизма антигена CD3 у макаков. Uda и др. описали замену двух аминокислот в последовательности CD3 яванских макаков, в результате чего отсутствовало взаимодействие с антителами FN-18, по сравнению с CD3 других животных, которые взаимодействуют с антителами FN-18 (Uda et al., J Med. Primatol. 32 (2003), 105-10; Uda et al., J. Med. Primatol. 33 (2004), 34-7).
Эта избирательная способность, т.е. видовая специфичность, свойственная моноклональным антителам против CD3 и их фрагментам, является существенным препятствием для их разработки в качестве терапевтических агентов для лечения заболеваний человека. Для того чтобы получить разрешение на продажу, любое новое лекарственное средство-кандидат должно пройти строгое тестирование. Это тестирование можно подразделить на доклиническую и клиническую фазы: в то время как последнюю, дополнительно подразделяемую на общеизвестные клинические фазы I, II и III, проводят на пациентах людях, предшествующую проводят на животных. Цель доклинического тестирования заключается в доказательстве того, что лекарственное средство-кандидат обладает желаемой активностью и, что наиболее важно, является безопасным. Только после установления на животных безопасности и возможной эффективности лекарственного средства-кандидата в доклиническом тестировании это лекарственное средство-кандидат получит одобрение соответствующего регуляторного органа на проведение клинического тестирования на людях. Лекарственные средства-кандидаты могут быть протестированы на предмет безопасности на животных следующими тремя путями: (1) на релевантном виде, т.е. виде, в котором лекарственные средства-кандидаты могут распознавать ортологические антигены, (2) на трансгенном животном, содержащем человеческие антигены, и (3) путем использования имитатора лекарственного средства-кандидата, который может связываться с ортологическими антигенами, присутствующими в животном. Ограничения по трансгенным животным заключаются в том, что эта технология обычно ограничивается грызунами. Между грызунами и человеком имеются значительные различия в физиологии, и результаты по безопасности нельзя с легкостью экстраполировать на людей. Ограничения, обусловленные имитатором лекарственного средства-кандидата, заключаются в иной композиции веществ по сравнению с реальным лекарственным средством-кандидатом, и часто используемыми животными являются грызуны с тем ограничением, которое рассмотрено выше. Таким образом, доклинические данные, полученные на грызунах, обладают ограниченной прогностической способностью в отношении лекарственного средства-кандидата. Подход в отношении выбора тестирования безопасности состоит в использовании релевантного вида, предпочтительно низшего примата. В настоящее время ограничение, касающееся CD3-связывающих молекул, подходящих для терапевтического вмешательства у людей и описанных в данной области техники, заключается в том, что релевантными видами являются высшие приматы, в частности, шимпанзе. Шимпанзе считаются вымирающим видом, и вследствие их человекоподобной природы использование таких животных для тестирования безопасности лекарственного средства запрещено в Европе и весьма ограничено где-либо еще.
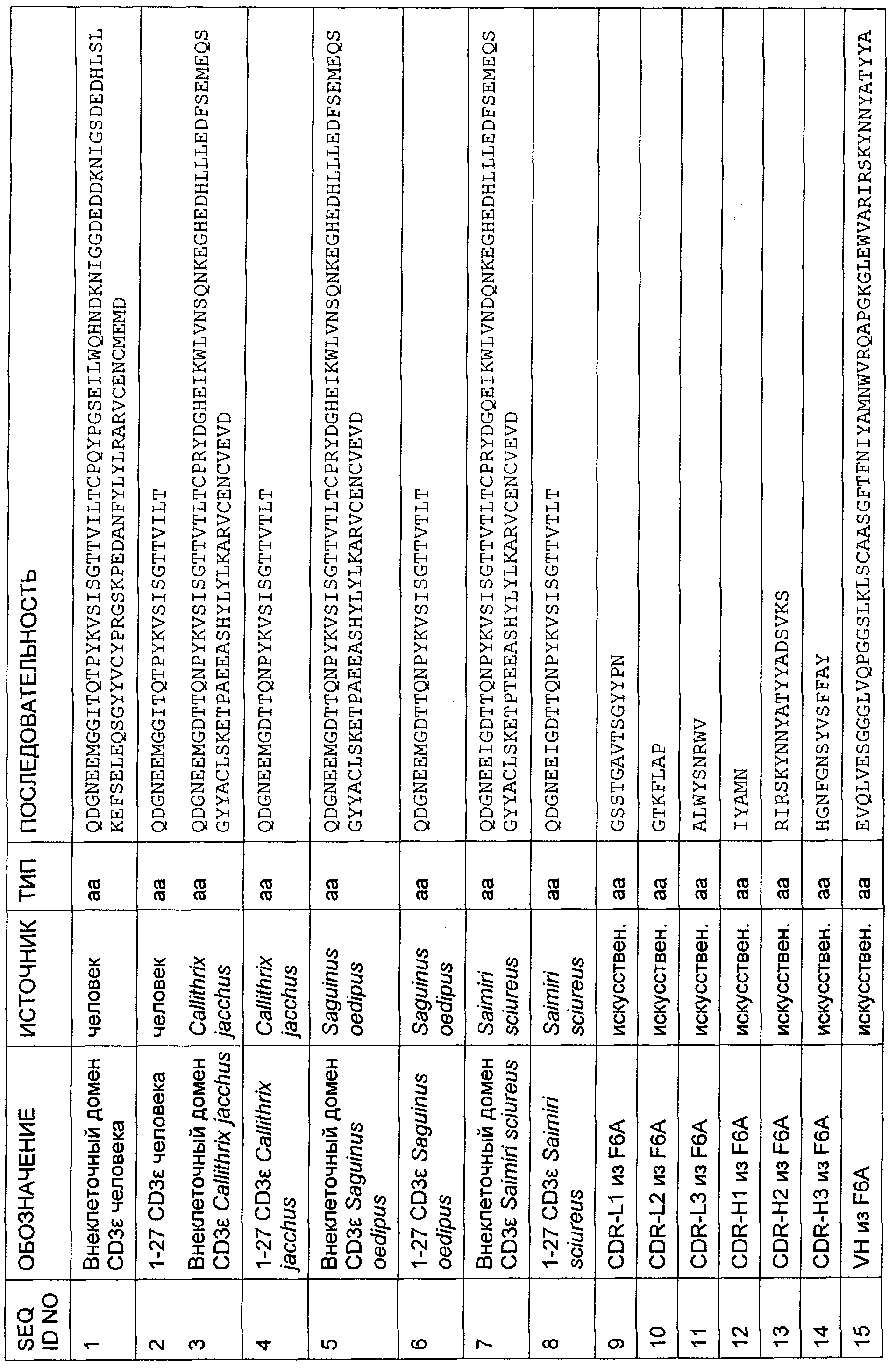
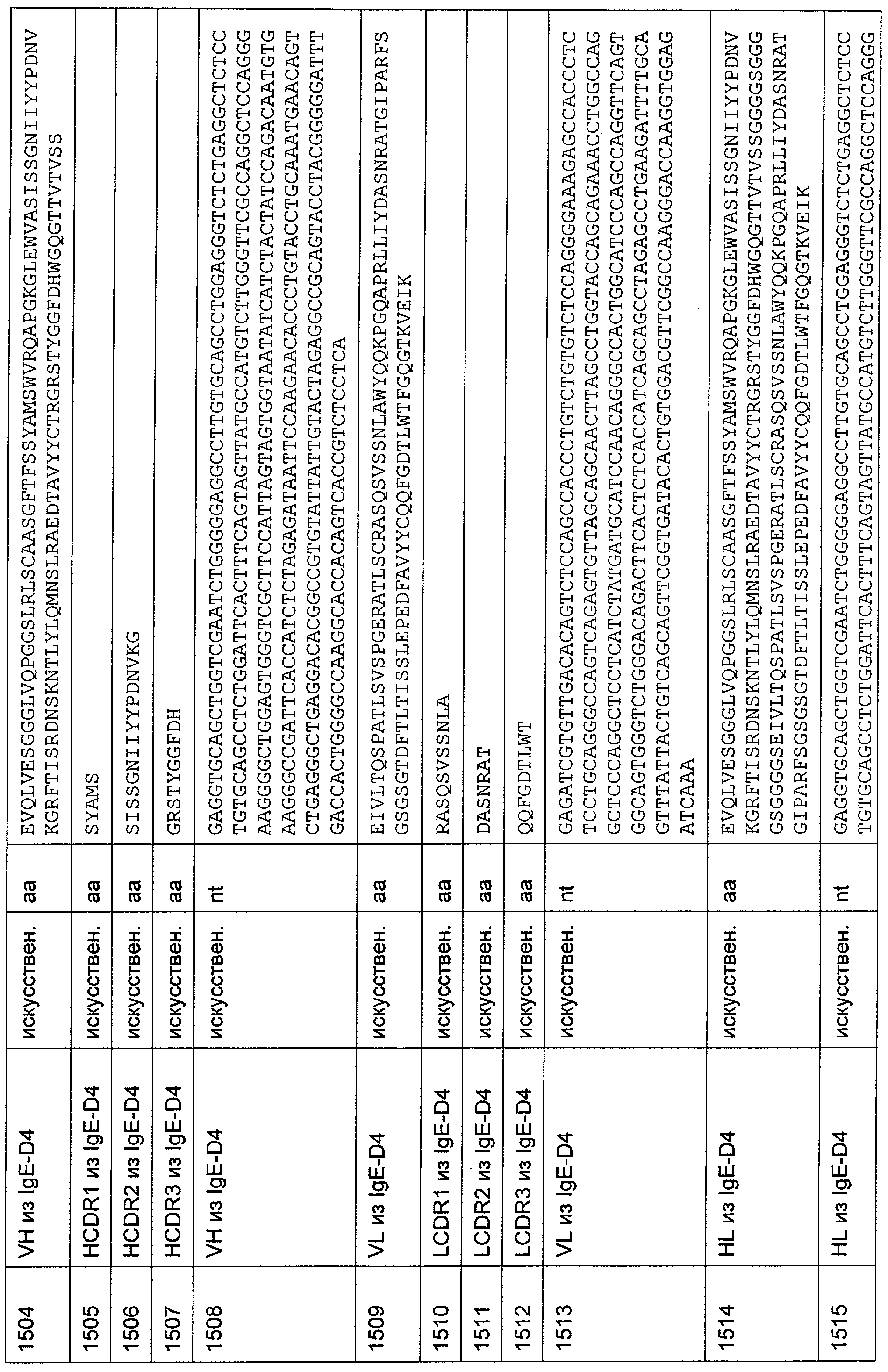
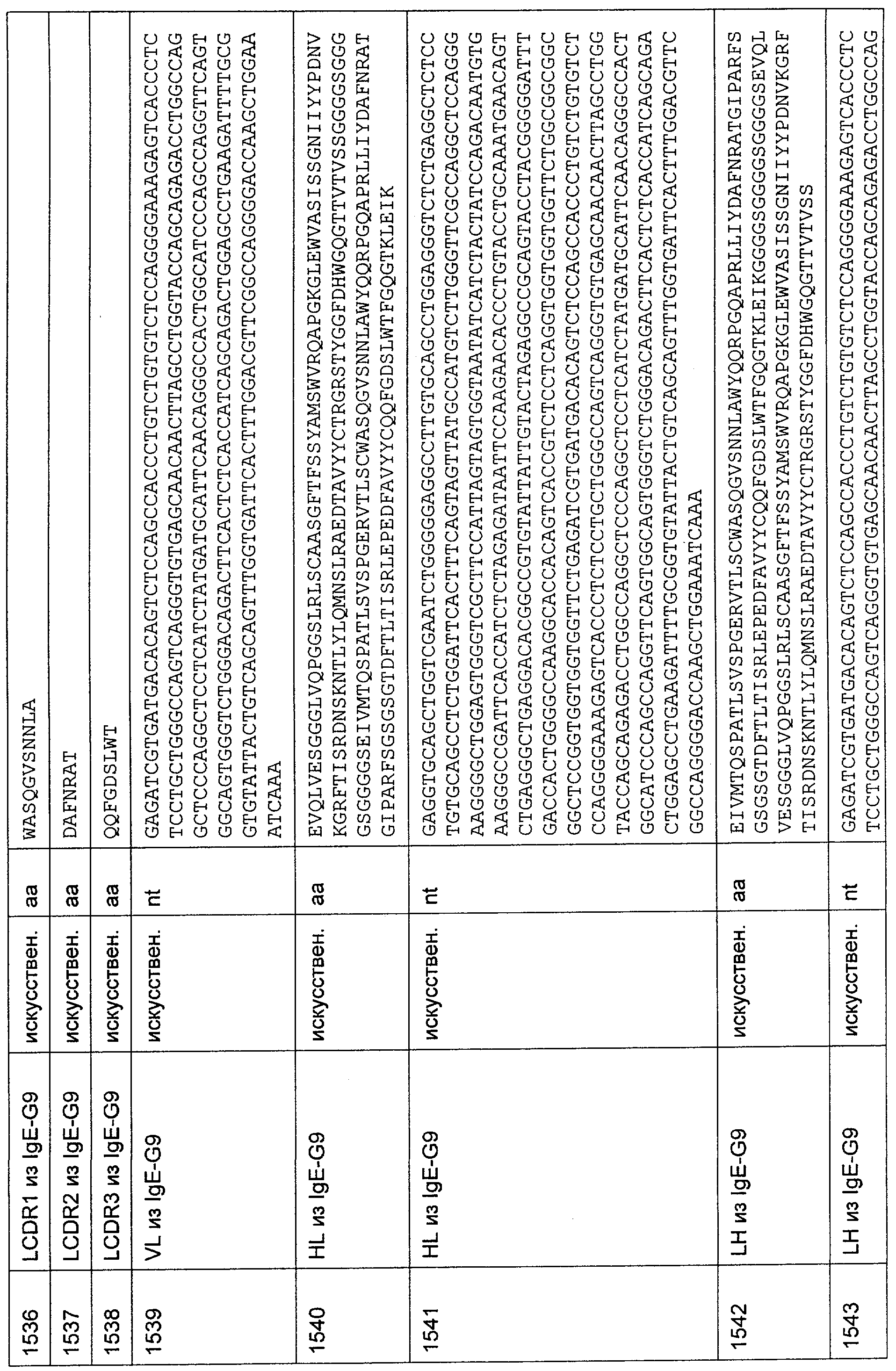
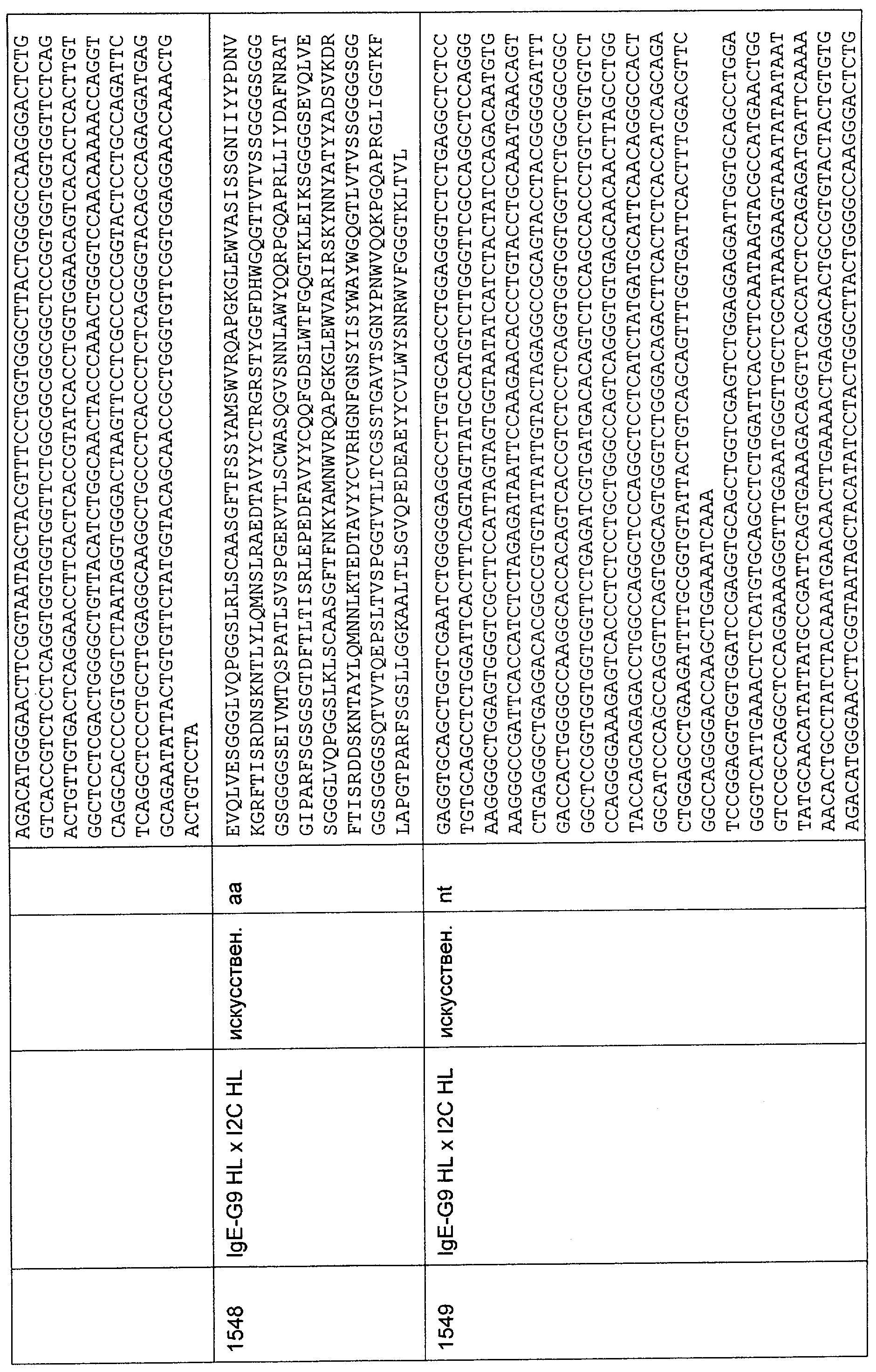
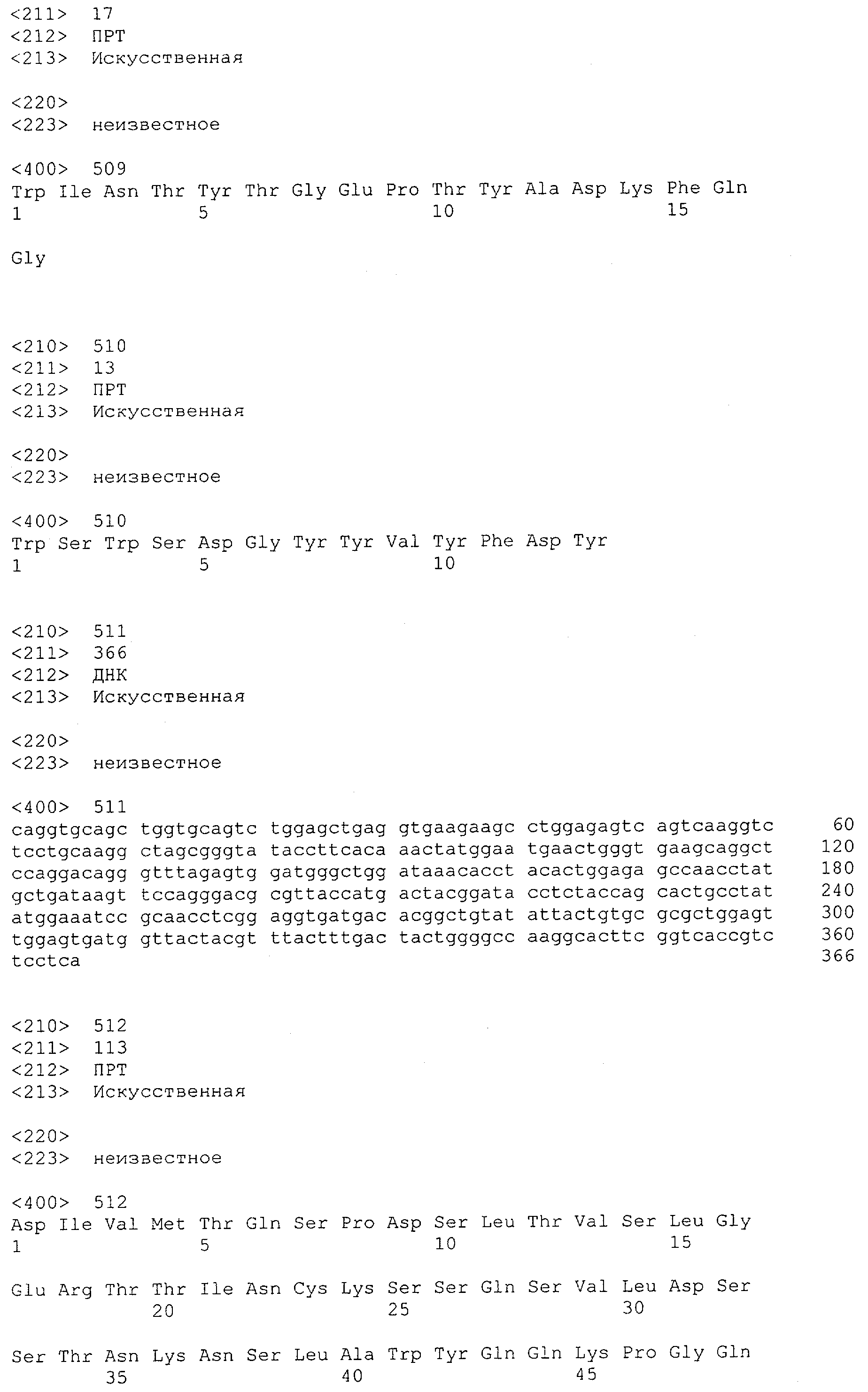
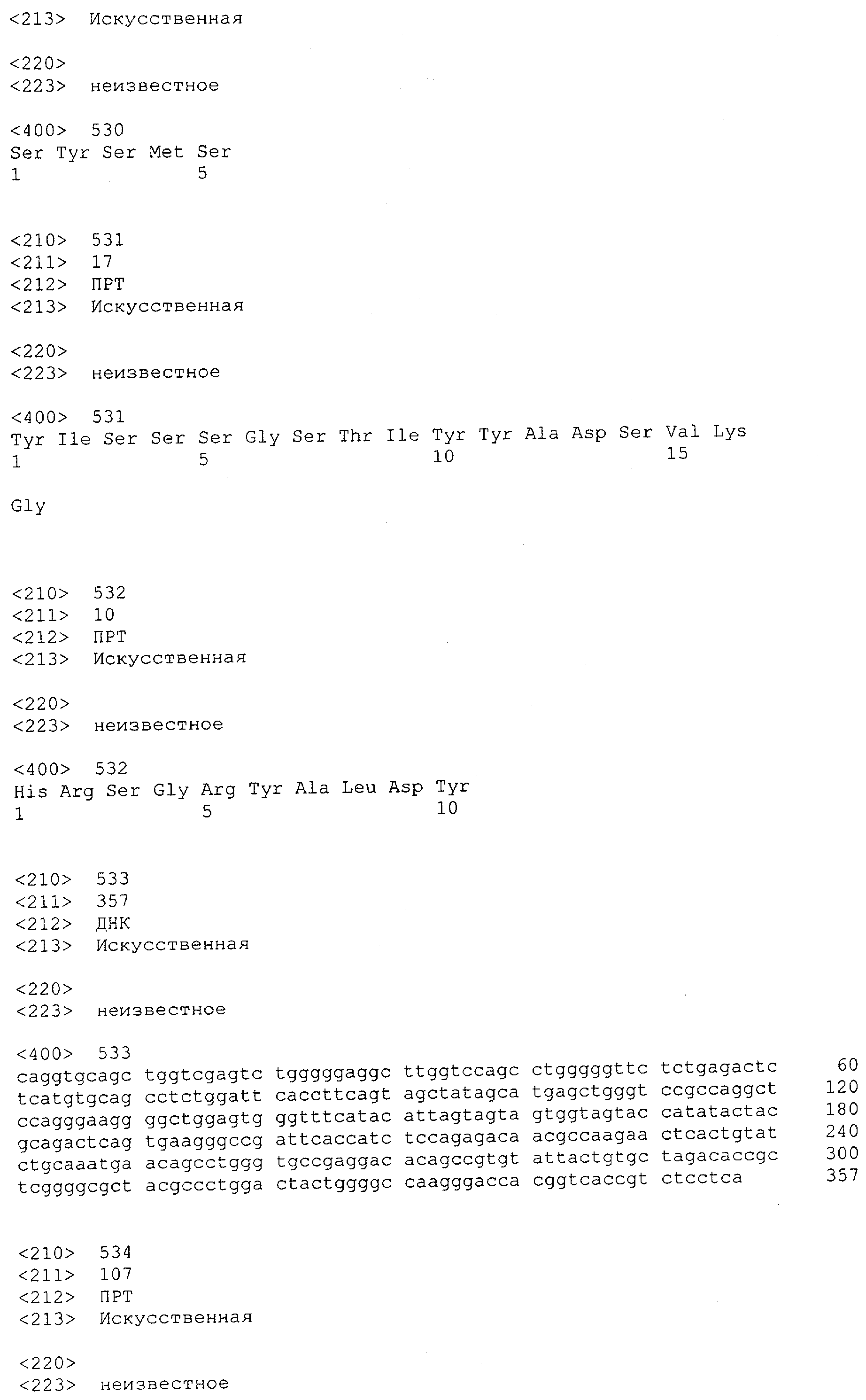
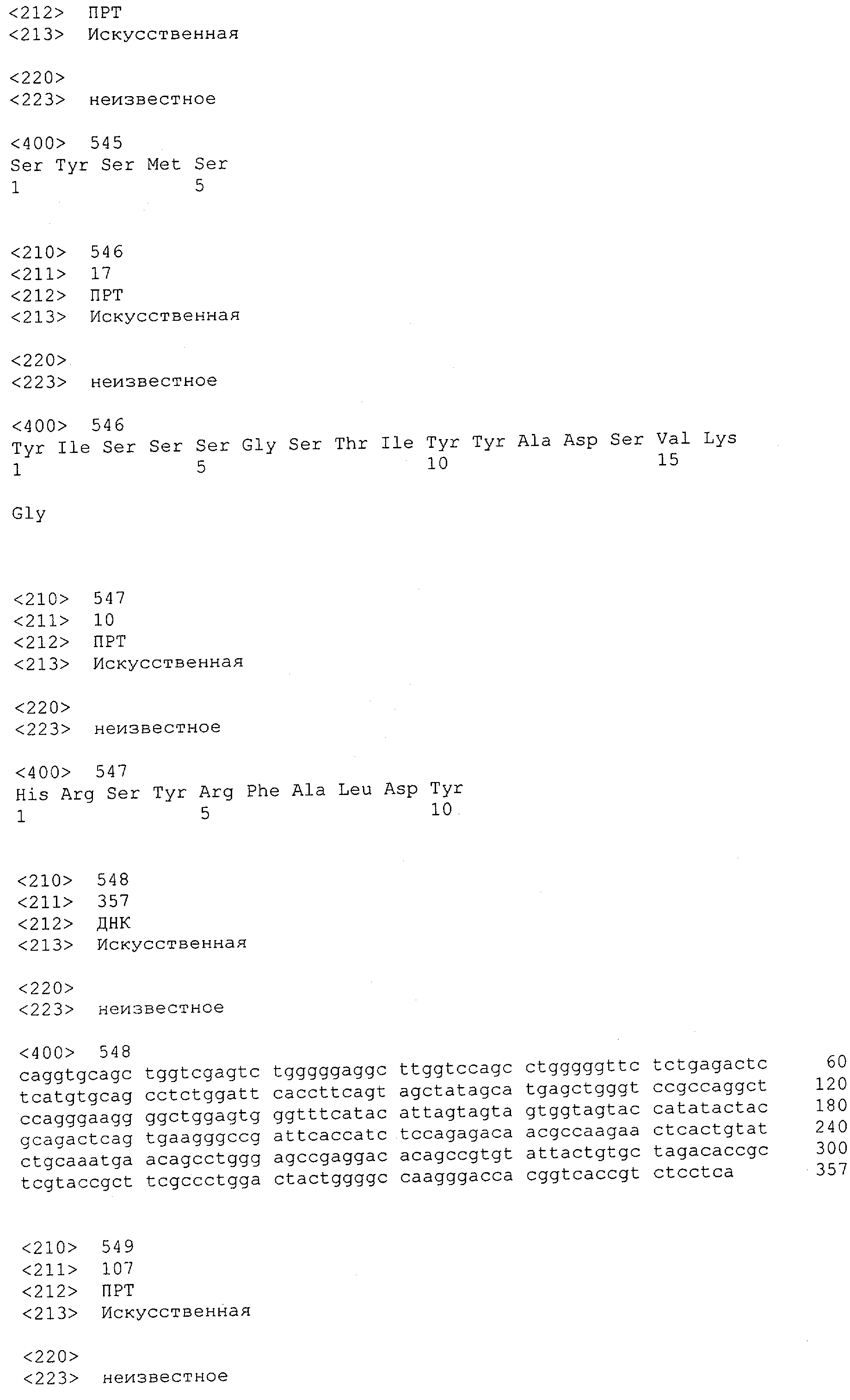
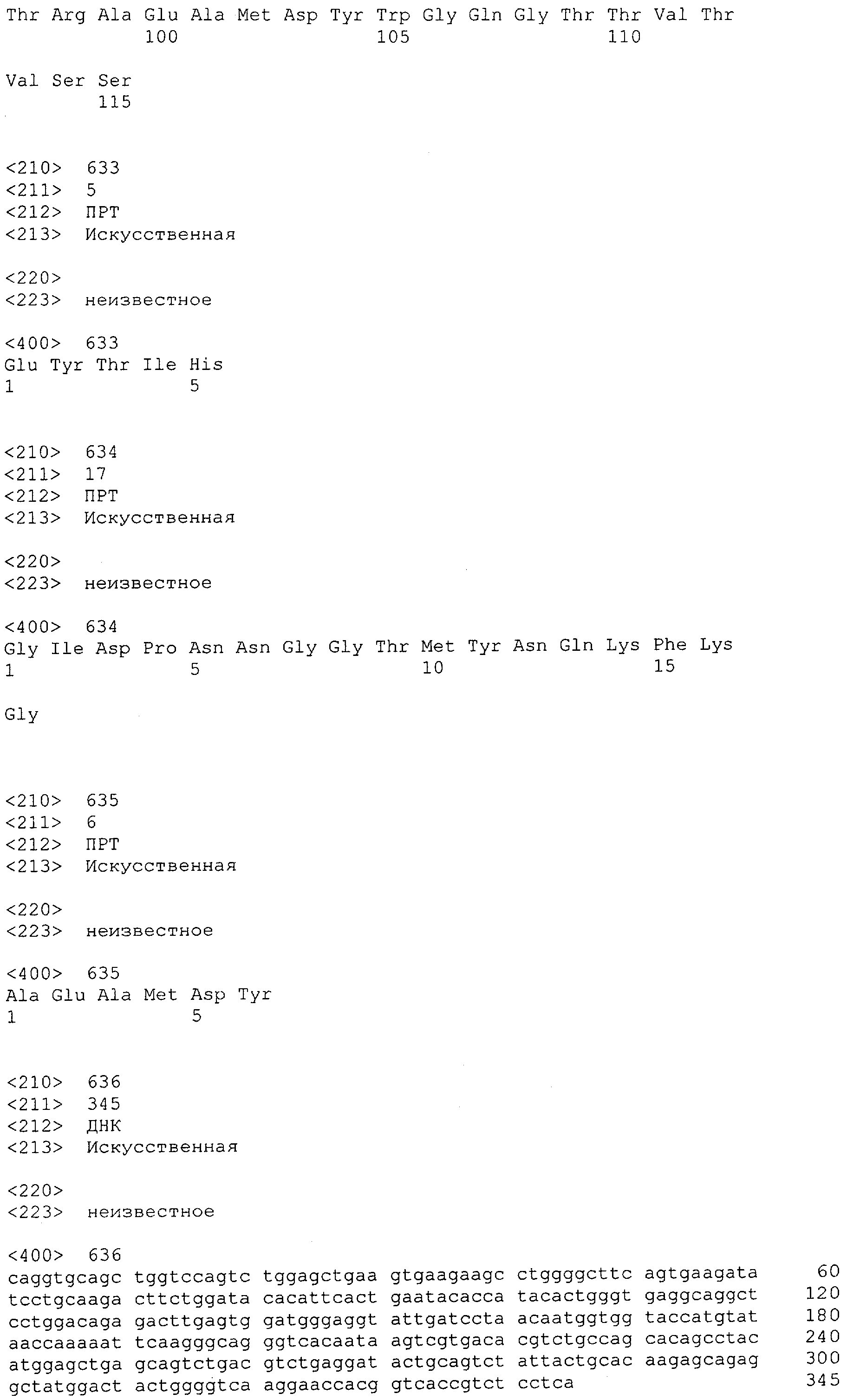
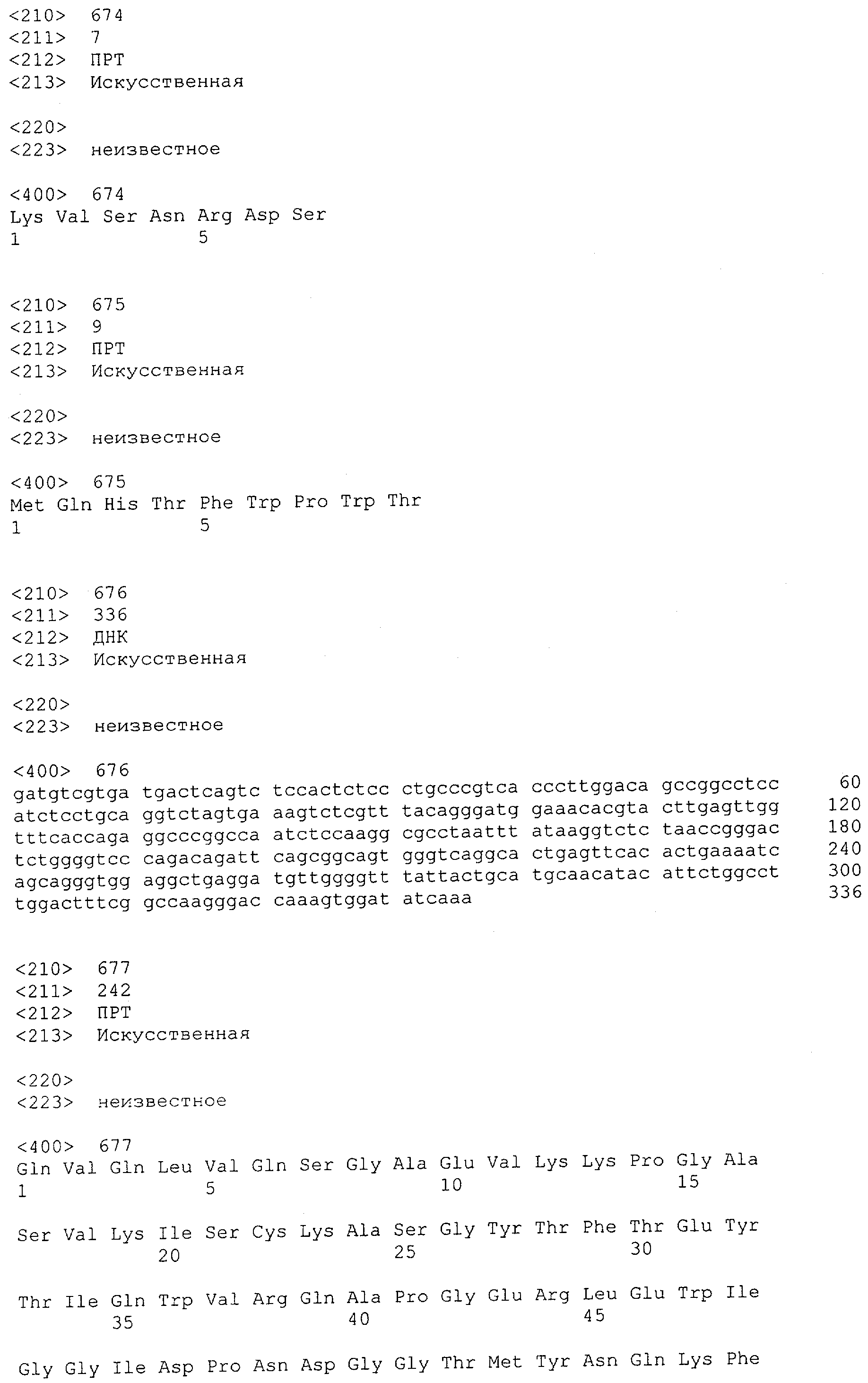
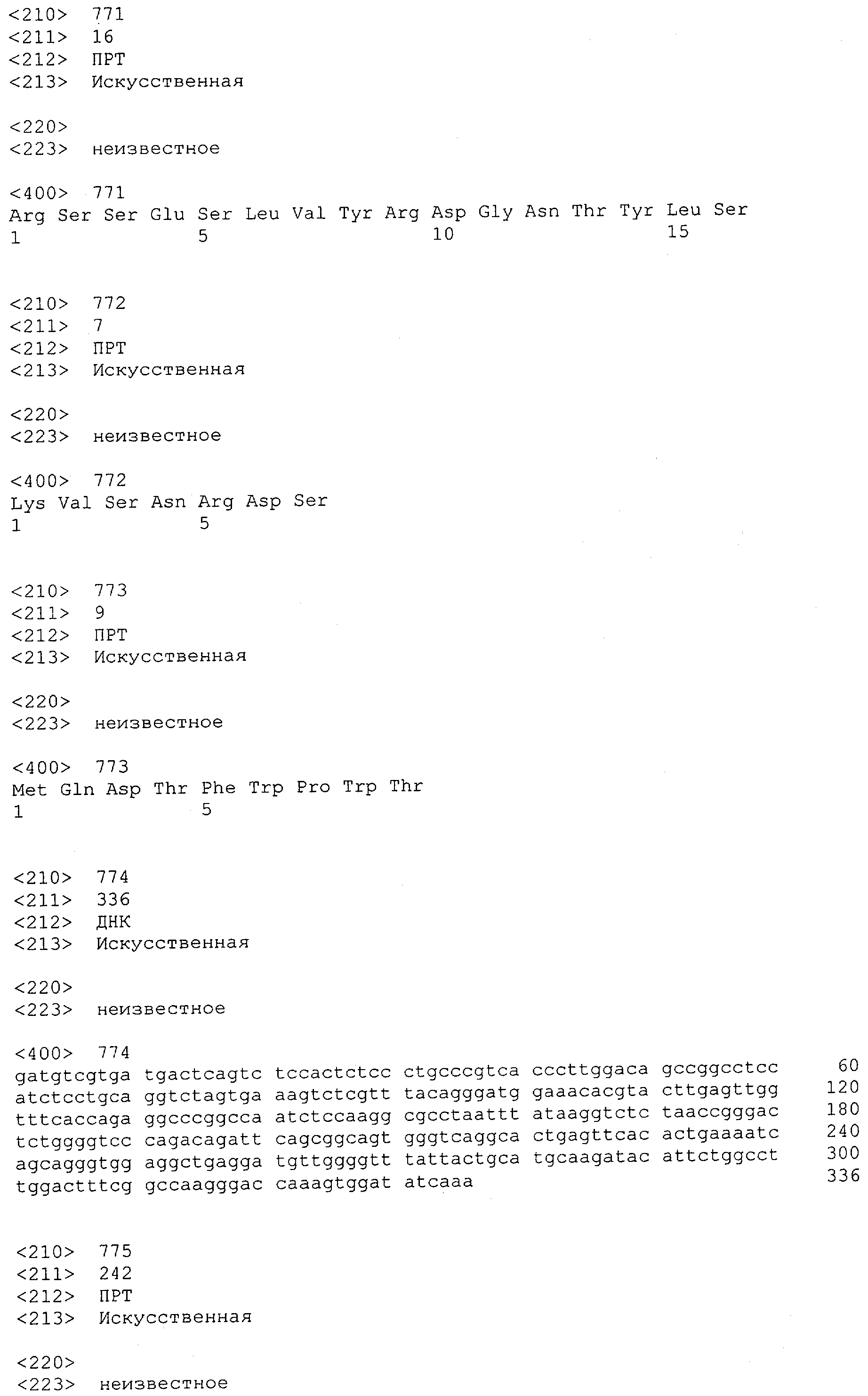
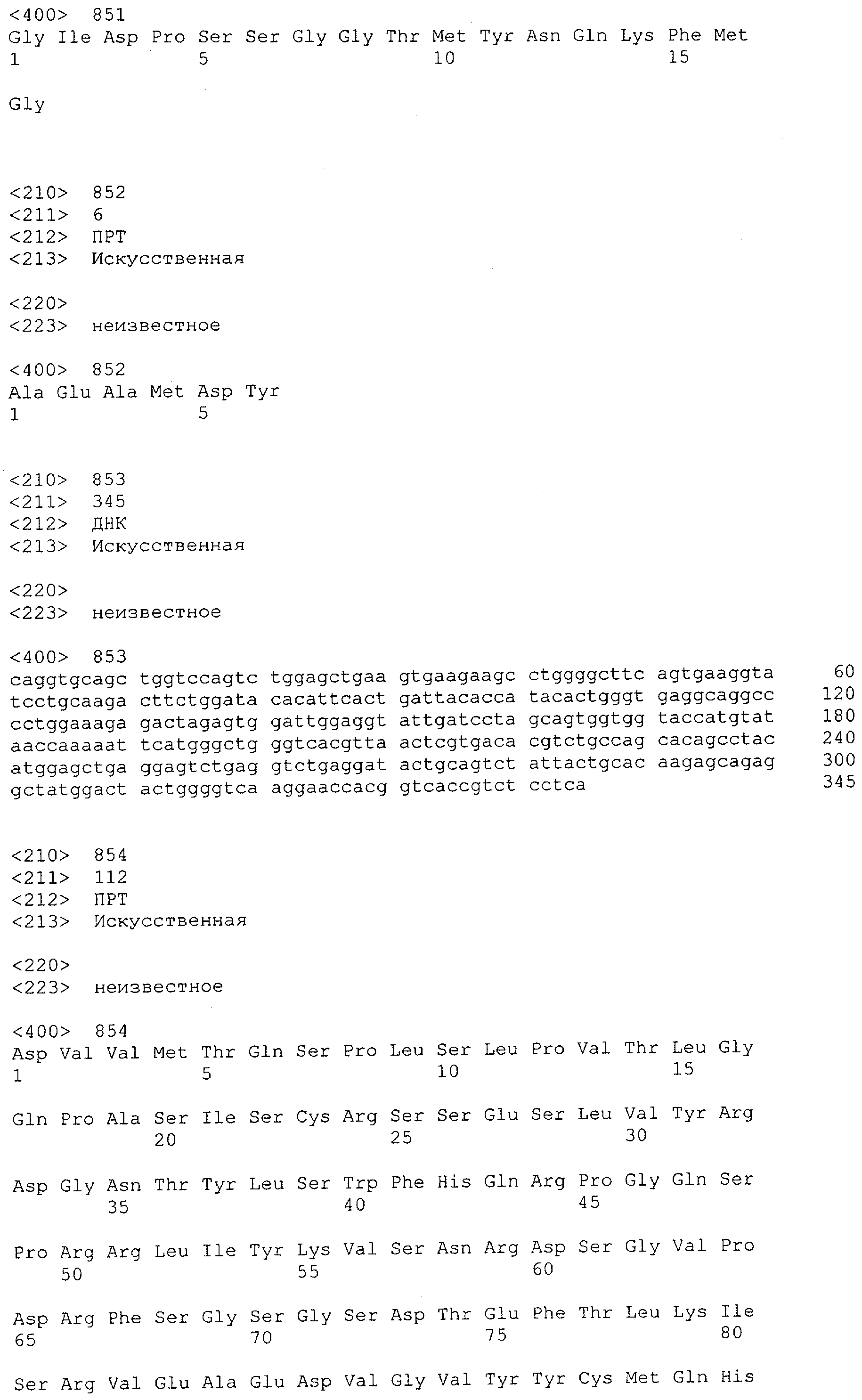
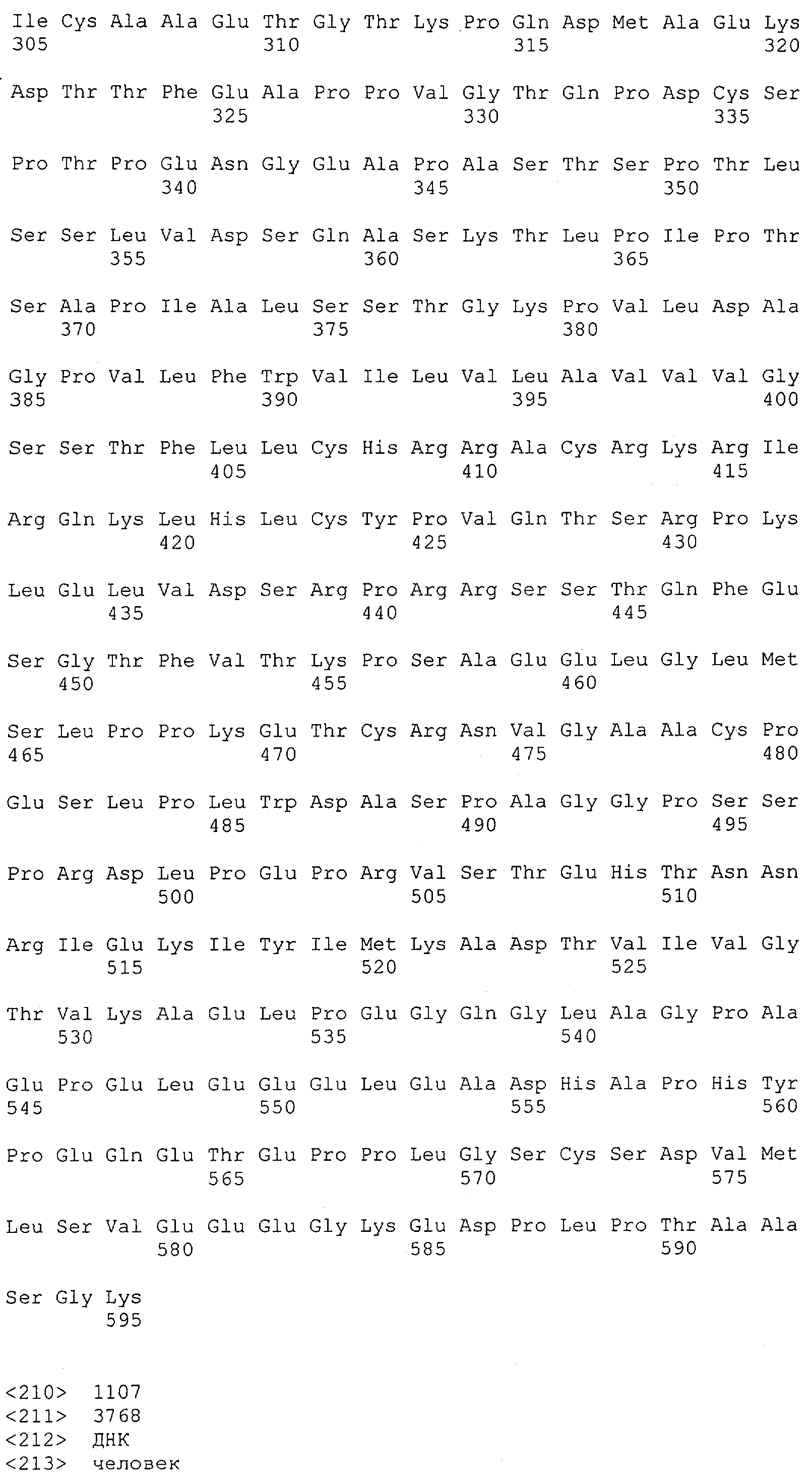
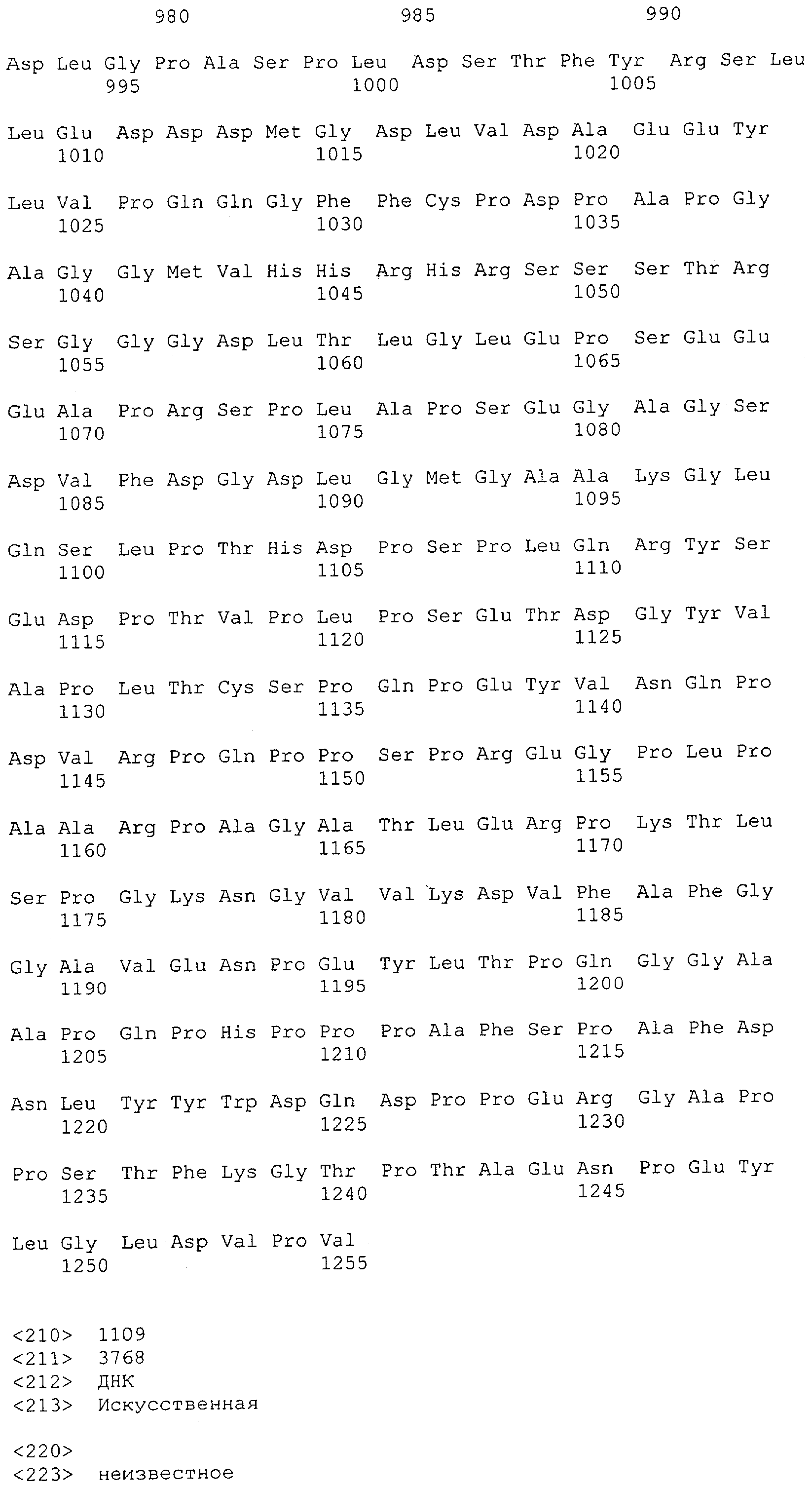
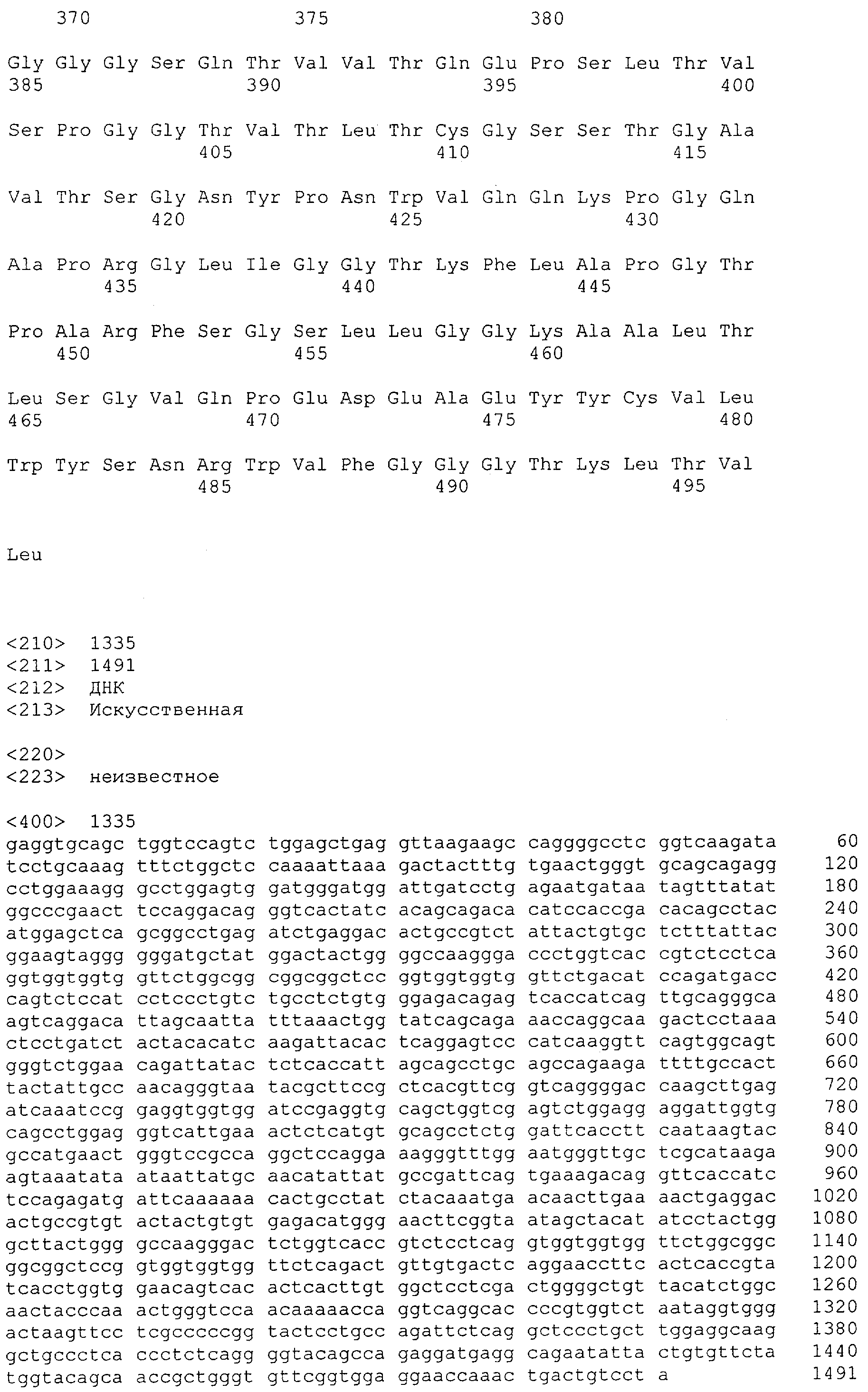
Настоящее изобретение относится к полипептиду, содержащему связывающий домен, предпочтительно человека, способный связываться с эпитопом CD3ε(эпсилон)-цепи человека и примата, не являющегося шимпанзе, причем указанный эпитоп представляет собой часть аминокислотной последовательности, входящей в группу, состоящую из SEQ ID NO; 2, 4, 6 или 8. Последовательности, которые показаны в SEQ ID NO: 2, 4, 6 и 8, и их фрагменты представляют собой независимые от окружения (context independent) эпитопы CD3.
Преимущество настоящего изобретения заключается в предложении полипептида, содержащего связывающий домен, демонстрирующий межвидовую специфичность в отношении CD3ε(эпсилон)-цепи человека и примата, не являющегося шимпанзе, который может быть использован как для доклинической оценки безопасности, активности и/или фармакокинетического профиля этих связывающих доменов на приматах, так и, в идентичной форме, в качестве лекарственного средства у людей. В доклинических исследованиях на животных, а также в клинических исследованиях на людях может быть использована одна и та же молекула. Это приводит к получению весьма сопоставимых результатов и значительной прогностической способности исследований на животных по сравнению с видоспецифическими молекулами имитатора. В настоящем изобретении неожиданно был идентифицирован N-концевой, содержащий аминокислотные остатки 1-27, полипептидный фрагмент внеклеточного домена CD3-эпсипон, который в противоположность всем другим известным эпитопам CD3-эпсилон, описанным в данной области техники, сохраняет свою трехмерную структурную целостность при удалении из его нативного окружения в CD3-комплексе (и слиянии с гетерологической аминокислотной последовательностью, такой как ЕрСАМ (молекула адгезии эпителиальных клеток) или Fc-область иммуноглобулина).
Фраза "независимость от окружения" эпитопа CD3, предложенного в этом изобретении, соответствует первым 27 N-концевым аминокислотам CD3-эпсилон или функциональным фрагментам этого участка из 27 аминокислот. Фраза "независимый от окружения", как использовано в данной заявке в отношении эпитопа CD3, означает, что связывание рассмотренных в данной заявке связывающих молекул/молекул антител по изобретению не приводит к изменению или модификации конформации, последовательности или структуры, окружающей антигенную детерминанту или эпитоп. В противоположность этому, эпитоп CD3, распознаваемый традиционной CD3-связывающей молекулой (например, описанной в WO 99/54440 или WO 04/106380), локализован в С-концевой области CD3 эпсилон-цепи относительно N-концевых 1-27 аминокислот независимого от окружения эпитопа, причем он принимает надлежащую конформацию, только если погружен в остальную часть эпсилон-цепи и удерживается в правильном положении посредством гетеродимеризации эпсилон-цепи либо с гамма-, либо с дельта-цепью CD3.
Анти-CD3-связывающие молекулы как часть биспецифической связывающей молекулы, которая предложена в данной заявке и создана (и направлена) против независимого от окружения эпитопа CD3, обеспечивают неожиданное клиническое улучшение в отношении перераспределения Т-клеток и, следовательно, более подходящий профиль безопасности. Без связи с теорией полагают, что поскольку эпитоп CD3 не зависит от окружения, образуя автономный самодостаточный субдомен без большого влияния на остальную часть CD3-KOMnneKca, CD3-связывающие молекулы, предложенные в данной заявке, в меньшей степени индуцируют аллостерические изменения конформации CD3, чем традиционные CD3-связывающие молекулы (аналогичные молекулам, предложенным в WO 99/54440), которые распознают зависимые от окружения эпитопы CD3.
Независимость от окружения эпитопа CD3 CD3-связывающих молекул по изобретению как части биспецифической связывающей молекулы ассоциирована с меньшим перераспределением Т-клеток в течение начальной фазы лечения CD3-связывающими молекулами по изобретению, в результате чего получают лучший профиль безопасности CD3-связывающих молекул по изобретению по сравнению с традиционными CD3-связывающими молекулами, известными в данной области техники, которые распознают зависимые от окружения эпитопы CD3. В частности, поскольку перераспределение Т-клеток в течение начальной фазы лечения СD3-связывающими молекулами представляет собой основной фактор риска для неблагоприятных в отношении ЦНС событий, CD3-связывающие молекулы по изобретению благодаря распознаванию скорее независимого от окружения, чем зависимого от окружения эпитопа CD3 обладают значительным преимуществом в отношении безопасности по сравнению с CD3-связывающими молекулами, известными в данной области техники. Пациенты с такими неблагоприятными в отношении ЦНС событиями, связанными с перераспределением Т-клеток в течение начальной фазы лечения традиционными CD3-связывающими молекулами, обычно страдают от спутанности сознания и дезориентации, в некоторых случаях также от недержания мочи. Спутанность сознания представляет собой изменение в психическом состоянии, при котором пациент не способен думать с его или ее обычным уровнем ясности. Обычно пациент имеет трудности с концентрацией, и процесс мышления становится не только расплывчатым и неясным, но часто значительно замедляется. Пациенты с неблагоприятными в отношении ЦНС событиями, связанными с перераспределением Т-клеток в течение начальной фазы лечения традиционными CD3-связывающими молекулами, могут страдать также от потери памяти. Зачастую, спутанность сознания приводит к потере способности различать людей и/или места, или называть время и дату. Ощущения дезориентации обычно имеют место при спутанности сознания, и нарушается способность принятия решений. Неблагоприятные в отношении ЦНС события, связанные с перераспределением Т-клеток в течение начальной фазы лечения традиционными CD3-связывающими молекулами, могут также включать спутанную речь и/или трудности в подборе слов. Это расстройство может ухудшить как выразительность, так и восприятие речи, а также процесс чтения и письма. Кроме недержания мочи, вертиго и головокружение также могут сопровождать неблагоприятные в отношении ЦНС события, связанные с перераспределением Т-клеток в течение начальной фазы лечения традиционными CD3-связывающими молекулами, у некоторых пациентов.
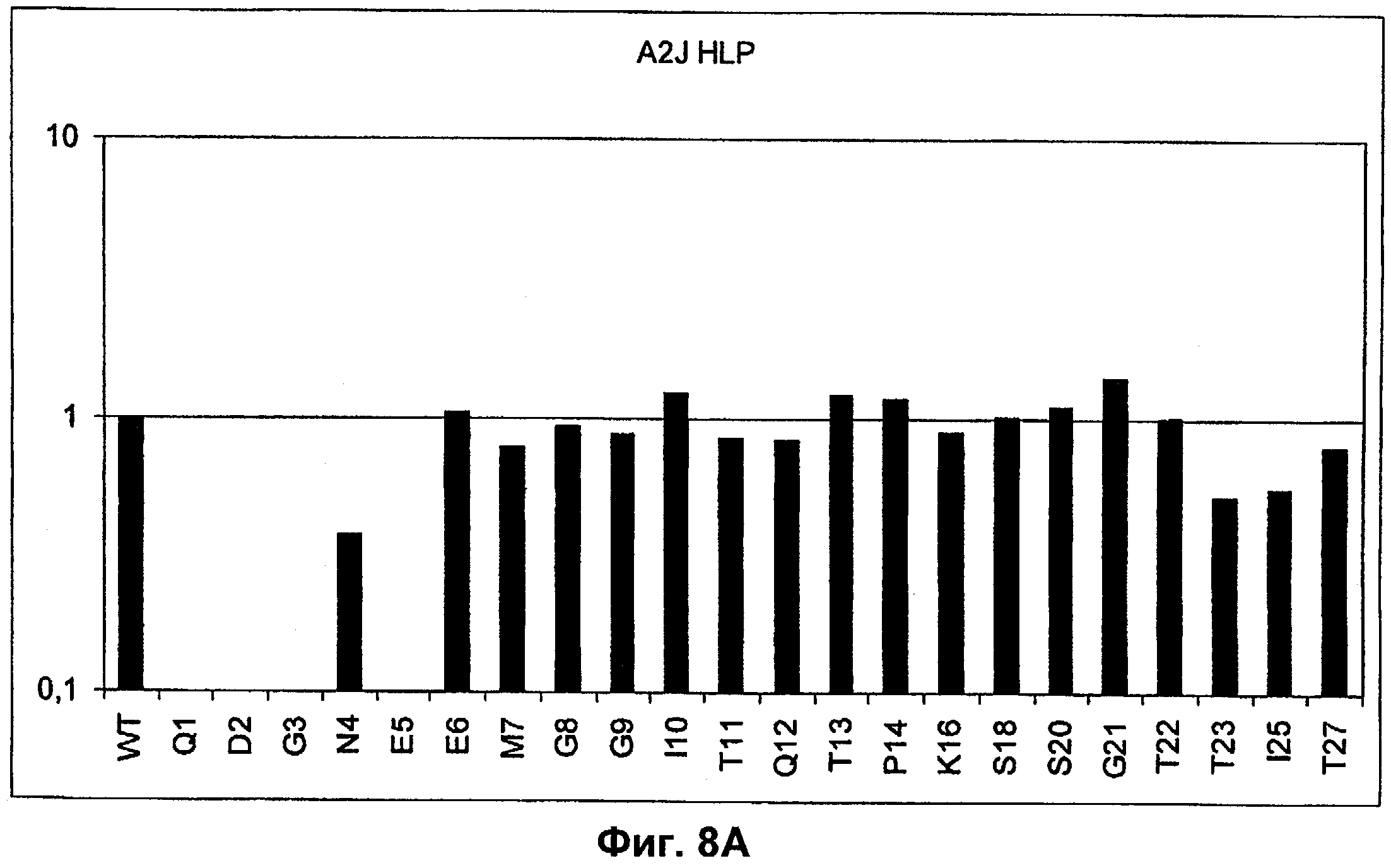
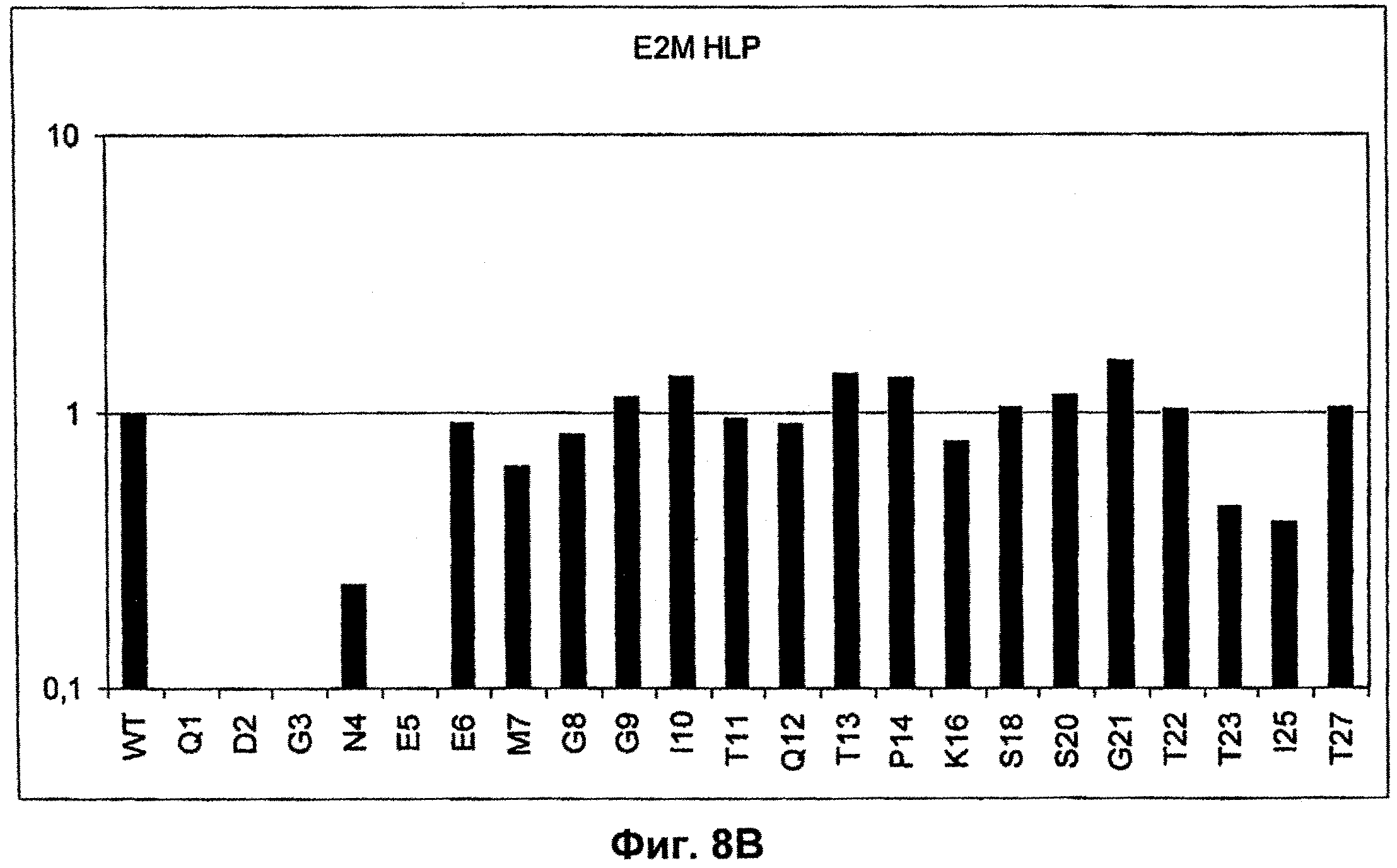
Поддержание трехмерной структуры в пределах упомянутого 27-аминокислотного N-концевого полипептидного фрагмента CD3-эпсилон может быть использовано для создания связывающих доменов, предпочтительно человека, которые способны связываться с N-концевым полипептидным фрагментом CD3-эпсилон in vitro и с нативным CD3-комплексом (CD3-эпсилон-субъединицей CD3-комплекса) на Т-клетках in vivo с такой же аффинностью связывания. Эти данные строго указывают на то, что N-концевой фрагмент, как он описан в данном изобретении, образует третичную конформацию, которая аналогична его структуре, в норме существующей in vivo. Был проведен очень чувствительный тест на предмет важности структурной целостности аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон. Индивидуальные аминокислоты из аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон заменяли на аланин (аланиновое сканирование), чтобы протестировать чувствительность аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон к минорным нарушениям. CD3-специфические молекулы антител как часть биспецифической связывающей молекулы по изобретению использовали для тестирования связывания с аланиновыми мутантами аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон (см. прилагаемый Пример 5). Индивидуальные замены первых пяти аминокислотных остатков в том же N-терминальном конце фрагмента и двух аминокислот в положениях 23 и 25 среди аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон были критичными для связывания молекул антител. Замена аминокислотных остатков в области положений 1-5, содержащей остатки Q (глутамин в положении 1), D (аспарагиновая кислота в положении 2), G (глицин в положении 3), N (аспарагин в положении 4) и Е (глутаминовая кислота в положении 5), на аланин отменяла связывание связывающих молекул, предпочтительно человека, по изобретению с указанным фрагментом. В то время как, по меньшей мере для некоторых связывающих молекул, предпочтительно человека, по изобретению, два аминокислотных остатка на С-конце упомянутого фрагмента Т (треонин в положении 23) и I (изолейцин в положении 25) уменьшали энергию связывания со связывающими молекулами, предпочтительно человека, по изобретению.
Неожиданно обнаружили, что выделенные таким образом связывающие молекулы, предпочтительно человека, не только распознают N-концевой фрагмент CD3-эпсилон человека, но также соответствующие гомологичные фрагменты CD3-эпсилон различных приматов, включая обезьян Нового Света (игрунковые, обыкновенная игрунка (Callithrix jacchus); эдипов тамарин (Saguinus oedipus); обыкновенная беличья обезьяна (Saimili sciureus)) и обезьян Старого Света (длиннохвостый макак (Масаса fascicularis), также известный как яванский макак; или Масаса mulatta, также известный как макак резус). Таким образом, была установлена специфичность CD3-связывающих молекул по изобретению в отношении многих приматов (multi-primate specificity). Последующие анализы последовательностей подтвердили, что человек и приматы имеют общий участок с высоко гомологичной последовательностью на N-конце внеклеточного домена CD3-эпсилон.
В настоящем изобретении обнаружили, что можно создать связывающие молекулы, предпочтительно человека, специфичные к CD3-эпсилон, при этом в доклиническом тестировании на животных, а также в клинических исследованиях на людях и даже в терапии человека может быть использована одна и та же молекула. Это обусловлено неожиданной идентификацией связывающих молекул, предпочтительно человека, которые в дополнение к связыванию с CD3-эпсилон человека (и вследствие вероятного генетического сходства с эквивалентом шимпанзе), также связываются с гомологами указанных антигенов приматов, не являющихся шимпанзе, включая обезьян Нового Света и обезьян Старого Света. Как показано в следующих ниже Примерах, указанные CD3-эпсилон-специфические связывающие молекулы, предпочтительно человека, могут быть интегрированы в биспецифические одноцепочечные антитела с целью создания терапевтических средств против различных заболеваний, включая, но не ограничиваясь этим, рак или иммунологические расстройства. Таким образом, необходимость в конструировании CD3-эпсилон-связывающего домена-имитатора или биспецифического одноцепочечного антитела, включающего его же, для тестирования на филогенетически отдаленном (от людей) виде, отпадает. В результате, в доклиническом тестировании на животных может быть использована та же молекула, которая предназначена для введения людям в клиническом тестировании, а также для последующего получения разрешения на продажу и введения в качестве терапевтического лекарственного средства. Возможность использовать ту же самую молекулу для доклинического тестирования на животных, как и при более позднем введении людям, фактически исключает или по меньшей мере значительно уменьшает опасность того, что данные, полученные в доклиническом тестировании на животных, будут иметь ограниченную применимость в случае человека. Кратко, получение доклинических данных по безопасности на животных с использованием той же молекулы, которую фактически будут вводить людям, в значительной степени гарантирует применимость этих данных для сценария, подходящего для людей.
И наоборот, в традиционных подходах с использованием молекул-имитаторов, указанные молекулы-имитаторы должны быть адаптированы на молекулярном уровне к животной тест-системе, используемой для доклинической оценки безопасности. Таким образом, молекула, которая подлежит использованию в терапии людей, в действительности отличается по последовательности и также, вероятно, по структуре от молекулы-имитатора, используемой в доклиническом тестировании, по фармакокинетическим параметрам и/или биологической активности, вследствие чего данные, полученные в доклиническом тестировании на животных, имеют ограниченную применимость /пригодность в случае людей. Использование молекул-имитаторов требует конструирования, получения, очистки и характеристики полностью новой конструкции. Это ведет к дополнительным затратам средств и времени на разработку, необходимым для получения такой молекулы. В целом, имитаторы должны разрабатываться отдельно в дополнение к реальному лекарственному средству, которое будет использоваться в терапии людей, таким образом, должны проводиться две линии разработки для двух молекул. Следовательно, главное преимущество связывающей молекулы человека или конструкций на основе антител, демонстрирующих межвидовую специфичность, описанных в данном изобретении, заключается в том, что одна и та же молекула может быть использована для терапии людей и в доклиническом тестировании на животных.
Предпочтительно, чтобы связывающие молекулы по изобретению, способные связываться с эпитопом CD3-эпсилон цепи человека и примата, не являющегося шимпанзе, имели человеческое происхождение.
Кроме того, вследствие человеческого происхождения связывающих молекул человека по изобретению, развитие иммунной реакции против указанных связывающих молекул исключается с максимально возможной степенью после введения этих связывающих молекул пациентам-людям.
Другим главным преимуществом CD3-эпсилон-специфических связывающих молекул, предпочтительно человека, как части биспецифической связывающей молекулы по изобретению является их применимость для доклинического тестирования на различных приматах. Поведение лекарственного средства-кандидата в организме животных в идеальном случае будет показателем ожидаемого поведения этого лекарственного средства-кандидата после введения людям. В итоге данные, полученные на основании такого доклинического тестирования, таким образом обычно будут иметь высокую прогностическую способность в случае человека. Однако, как стало ясно из трагических результатов недавнего клинического испытания, фаза I, на TGN1412 (моноклональное антитело CD28), лекарственное средство-кандидат может по-разному действовать на вид приматов и на людей: Несмотря на то, что при доклиническом тестировании указанного антитела не наблюдаются никакие или наблюдаются только ограниченные неблагоприятные эффекты в исследованиях на животных, проводимых с яванскими макаками, у 6 пациентов-людей развилась полиорганная недостаточность после введения указанного антитела (Lancet 368 (2006), 2206-7). Результаты этих нежелательных негативных событий позволяют предположить, что ограничение доклинического тестирования только одним видом (приматов) может быть недостаточным. Тот факт, что молекулы по изобретению, специфически связывающиеся с CD3-эпсилон человека, связываются с CD3 ряда обезьян Нового Света и Старого Света, может помочь преодолеть проблемы, возникшие в упомянутом выше случае. В соответствии с этим, согласно настоящему изобретению предложены средства и способы минимизации видовых различий в эффектах при разработке и тестировании лекарственных средств для терапии человека.
Кроме того, при использовании CD3-эпсилон-связывающего домена, предпочтительно человека, с межвидовой специфичностью как части биспецифической связывающей молекулы по изобретению более нет необходимости в адаптации тестируемого животного к лекарственному средству-кандидату, предназначенному для введения людям, как, например, при создании трансгенных животных. CD3-эпсилон-специфические связывающие молекулы (или содержащие их биспецифические одноцепочечные антитела), предпочтительно человека, демонстрирующие межвидовую специфичность согласно применениям и способам по изобретению, могут быть непосредственно использованы в доклиническом тестировании на приматах, не являющихся шимпанзе, без какой-либо генетической манипуляции на животных. Как хорошо известно специалистам в данной области техники, подходы, при которых тестируемое животное адаптируют к лекарственному средству-кандидату, всегда несут риск того, что результаты, полученные в доклиническом тестировании безопасности, будут менее репрезентативными и обладать меньшей прогностической ценностью для людей вследствие модификации животного. Например, у трансгенных животных белки, кодируемые трансгенами, часто являются сверхэкспрессирующимися в высокой степени. Таким образом, данные, полученные для биологической активности антитела против этого белкового антигена, могут быть ограничены в своей прогностической ценности для людей, у которых этот белок экспрессируется на гораздо более низких, более физиологических уровнях.
Следующим преимуществом применений CD3-эпсилон-специфических связывающих молекул (или содержащих их биспецифических одноцепочечных антител), предпочтительно человека, демонстрирующих межвидовую специфичность, является тот факт, что шимпанзе, как вымирающий вид животных, исключают из проводимого на животных тестирования. Шимпанзе являются ближайшими родственниками людей и недавно были сгруппированы в семейство гоминид на основе данных по секвенированию генома (Wildman et al., PNAS 100 (2003), 7181). Поэтому в общем случае считается, что данные, полученные с использованием шимпанзе, обладают высокой прогностической ценностью для людей. Однако, благодаря своему статусу вымирающего вида количество шимпанзе, которое может быть использовано для медицинских экспериментов, сильно ограничено. Поэтому, как указано выше, обеспечение шимпанзе для тестирования на животных представляет собой как дорогостоящую, так и этическую проблему. Применения CD3-эпсилон-специфических связывающих молекул, предпочтительно человека, по изобретению (или содержащих их биспецифических одноцепочечных антител) снимает как этические возражения, так и финансовые затруднения в процессе доклинического тестирования без нанесения вреда качеству, т.е. применимости полученных на животных результатов тестирования. В свете этого, применение CD3-эпсилон-специфических связывающих молекул (или содержащих их биспецифических одноцепочечных антител), предпочтительно человека, обеспечивает разумную альтернативу исследованиям на шимпанзе.
Следующим преимуществом CD3-эпсилон-специфических связывающих молекул, предпочтительно человека, по изобретению (или содержащих их биспецифических одноцепочечных антител) является возможность отбора множества образцов крови при их использовании как части доклинического тестирования на животных, например в ходе фармакокинетических исследований на животных. Многократные отборы крови можно получить значительно легче с использованием примата, не являющегося шимпанзе, чем более с использованием низших животных, например мышей. Отбор множества образцов крови позволяет проводить непрерывное тестирование параметров крови для определения биологических эффектов, индуцируемых связывающей молекулой (или биспецифическим одноцепочечным антителом), предпочтительно человека, по изобретению. Кроме того, отбор множества образцов крови позволяет исследователю оценить фармакокинетический профиль связывающей молекулы (или биспецифического одноцепочечного антитела, содержащего данную связывающую молекулу), предпочтительно человека, как определено в данной заявке. К тому же, возможные побочные эффекты, которые могут быть индуцированы указанной связывающей молекулой (или биспецифическим одноцепочечным антителом, содержащим данную связывающую молекулу), предпочтительно человека, отражаемые в параметрах крови, могут быть измерены в различных образцах крови, отобранных в ходе введения указанного антитела. Это позволяет определить возможный профиль токсичности связывающей молекулы (или биспецифического одноцепочечного антитела, содержащего данную связывающую молекулу), предпочтительно человека, как определено в данной заявке.
Преимущества связывающих молекул (или биспецифических одноцепочечных антител), предпочтительно человека, как они определены в данной заявке, демонстрирующих межвидовую специфичность, кратко можно суммировать, как изложено ниже.
Во-первых, связывающие молекулы (или биспецифические одноцепочечные антитела), предпочтительно человека, как они определены в данной заявке, используемые в доклиническом тестировании, те же самые, что используются в терапии людей. Таким образом, больше нет необходимости в разработке двух независимых молекул, которые могут отличаться по своим фармакокинетическим свойствам и биологической активности. Огромное преимущество заключается в том, что, например, фармакокинетические результаты можно более непосредственно переносить на человеческое окружение (human setting) и применять к нему, чем, например, в традиционных подходах с использованием имитаторов.
Во-вторых, применение связывающих молекул (или биспецифических одноцепочечных антител), предпочтительно человека, как они определены в данной заявке, с целью изготовления терапевтических средств для людей является менее дорогостоящим и трудоемким процессом, чем подходы с использованием имитаторов.
В-третьих, связывающие молекулы (или биспецифические одноцепочечные антитела), предпочтительно человека, как они определены в данной заявке, могут быть использованы для доклинического тестирования не только на одном виде приматов, но и на ряде других видов приматов, что тем самым ограничивает риск возможного видового различия между приматами и человеком.
В-четвертых, шимпанзе, как вымирающий вид животных, исключен из тестирования.
В-пятых, для проведения интенсивных фармакокинетических исследований можно проводить отбор множества образцов крови.
В-шестых, благодаря тому, что связывающие молекулы, предпочтительно человека, согласно предпочтительному воплощению изобретения имеют человеческое происхождение, развитие иммунной реакции против указанных связывающих молекул минимизировано при введении пациентам-людям. Индукция иммунного ответа антителами, специфическими к лекарственному средству-кандидату, происходящему из вида, не являющегося человеком, например мыши, приводящая к выработке человеческих антимышиных антител (МАМА) против терапевтических молекул мышиного происхождения, исключена.
Термин "белок" хорошо известен в данной области техники и описывает биологические соединения. Белки содержат одну или более аминокислотных цепей (полипептидов), в которых аминокислоты связаны друг с другом посредством пептидной связи. Термин "полипептид", как он использован в данной заявке, описывает группу молекул, которые состоят более чем из 30 аминокислот. В соответствии с изобретением эта группа полипептидов содержит "белки" при условии, что белки состоят из одного полипептида. Кроме того, в соответствии с определением термин "полипептид" описывает фрагменты белков при условии, что эти фрагменты состоят более чем из 30 аминокислот. Полипептиды также могут образовывать мультимеры, такие как димеры, тримеры и высшие олигомеры, т.е. состоящие из более чем одной полипептидной молекулы. Полипептидные молекулы, образующие такие димеры, тримеры и т.д., могут быть одинаковыми или не одинаковыми. Соответствующие более высокого порядка структуры таких мультимеров обозначаются, следовательно, гомо- или гетеродимеры, гомо- или гетеротримеры и т.д. Примером гетеромультимера является молекула антитела, которая, в ее существующей в природе форме, состоит из двух одинаковых легких полипептидных цепей и двух одинаковых тяжелых полипептидных цепей. Термины "полипептид" и "белок" также относятся к природномодифицированным полипептидам/белкам, в которых модификация осуществляется, например, в результате посттрансляционных модификаций типа гликозилирования, ацетилирования, фосфорилирования и тому подобного. Такие модификации хорошо известны в данной области техники.
Как использовано в данной заявке, "человеческий" и "человек" относится к виду Homo sapiens. Поскольку говорится о медицинских применениях данных конструкций, описанных в данном изобретении, то пациенты-люди должны быть подвергнуты лечению той же самой молекулой.
Термин "человеческое происхождение", как он использован в контексте с молекулами по изобретению, описывает молекулы, получаемые из человеческих библиотек или имеющие структуру/последовательность, соответствующие человеческому эквиваленту. Соответственно, белки, имеющие аминокислотную последовательность, соответствующую аналогичной последовательности у человека, например фрагмент антитела, имеющий аминокислотные последовательности в каркасе, соответствующие последовательностям зародышевой линии человека, понимаются как молекулы, имеющие человеческое происхождение.
Как использовано в данной заявке, термин "примат, не являющийся шимпанзе" или "примат, не являющийся шимп." либо его грамматические варианты относятся к любому примату, отличающемуся от шимпанзе, т.е. отличающемуся от животного, принадлежащего роду Pan и включающего виды Pan paniscus (карликовый шимпанзе, бонобо) и Pan troglodytes (обыкновенный шимпанзе), также известные как Anthropopithecus troglodytes (обыкновенный шимпанзе) или Simla satyrus (орангутан). Термины "примат", "вид приматов", "приматы" или их грамматические варианты обозначают отряд плацентарных млекопитающих, разделенный на два подотряда полуобезьян и антропоидов и включающий в себя человека, человекообразных обезьян, обезьян и лемуров. Конкретно, термин "приматы", как он использован в данной заявке, содержит подотряд Strepsirrhini (мокроносые обезьяны) (полуобезьяны, не являющиеся долгопятами (non-tarsier prosimians)), включая инфраотряд Lemuriformes (лемурообразные) (включающий в себя надсемейства Cheirogaleoidea (карликовые лемуры) и Lemuroidea (лемуриды)), инфраотряд Chiromyiformes (руконожкообразные) (включающий в себя семейство Daubentoniidae (руконожковые)) и инфраотряд Lorisiformes (лориобразные) (включающий в себя семейства Lorisidae (лориевые) и Galagidae (галаговые)). Термин "приматы", как он использован в данной заявке, также содержит подотряд Haplorrhini (сухоносые обезьяны), включая инфраотряд Tarsiiformes (долгопятообразные) (включающий в себя семейство Tarsiidae (долгопятовые)), инфраотряд Simiiformes (обезьянообразные) (включающий в себя Platyrrhini (широконосые обезьяны) или обезьян Нового Света, и Catarrhini (узконосые обезьяны), включая Cercopithecidea (мартышкообразные) или обезьян Старого Света)).
В рамках изобретения вид приматов, не являющийся шимпанзе, можно понимать как представляющий собой лемура, долгопята, гиббона, игрунку (принадлежащую обезьянам Нового Света семейства Cebidae (цепкохвостые)) или обезьяну Старого Света (принадлежащую надсемейству Cercopithecoidea (собакоподобные)).
Как использовано в данной заявке, термин "обезьяна Старого Света" включает в себя любую обезьяну, попадающую в надсемейство Cercopithecoidea, которое само разделено на семейства: Cercopithecinae (мартышковые обезьяны), которые встречаются главным образом в Африке, но включают в себя другой род макаков, встречающихся в Азии и Северной Африке; и Colobinae (тонкотелые), которые включают в себя большинство встречающихся в Азии родов, а также африканских представителей толстотелых обезьян.
Конкретно, в пределах подсемейства Cercopithecinae предпочтительный примат, не являющийся шимпанзе, может происходить из трибы мартышковых (Cercopithecini), в пределах рода Atlenopithecus (болотная обезьяна Аллена, Allenopithecus nigroviridis); в пределах рода Miopithecus (мартышка карликовая талапойн, Miopithecus talapoin; габонский талапойн, Miopithecus ogouensis); в пределах рода Erythrocebus (мартышка обыкновенная гусар, Erythrocebus patas); в пределах рода Chlorocebus (мартышка зеленая, Chlorocebus sabaceus; мартышка зеленая гривет, Chlorocebus aethiops; мартышка горнобейлская вервет, Chlorocebus djamdjamensis; мартышка танталусская, Chlorocebus tantalus; верветка, Chlorocebus pygerythrus; малбрук, Chlorocebus cynosuros); или в пределах рода Cercopithecus (мартышка dryas или мартышка салонгойская, Cercopithecus dryas; мартышка Диана, Cercopithecus diana; мартышка роловейская, Cercopithecus roloway; большая белоносая мартышка, Cercopithecus nictitans; мартышка голубая, Cercopithecus mitis; мартышка серебряная, Cercopithecus doggetti; мартышка золотистая, Cercopithecus kandti; мартышка Сикса, Cercopithecus albogularis; мартышка мона, Cercopithecus топа; мартышка мона Кэмпбелла, Cercopithecus campbelli; мартышка мона Лоуи, Cercopithecus lower, мартышка мона хохлатая, Cercopithecus pogonias; мартышка мона Вольфа, Cercopithecus wolfi; мартышка мона Дента, Cercopithecus denti; мартышка малая белоносая, Cercopithecus petaurista; мартышка белогорлая, Cercopithecus erythrogaster, мартышка Склатера, Cercopithecus sclaten; мартышка красноухая, Cercopithecus erythrotis; мартышка голуболицая [усатая], Cercopithecus cephus; мартышка краснохвостая, Cercopithecus ascanius; мартышка Л′Хоеста, Cercopithecus Ihoesti; мартышка Преусса, Cercopithecus preussi; мартышка солнцехвостая, Cercopithecus solatus; мартышка совинолицая, Cercopithecus hamlyni; мартышка де Брасса, Cercopithecus neglectus).
Альтернативно, предпочтительный примат, не являющийся шимпанзе, также в пределах подсемейства Cercopithecinae, но в пределах трибы павиановых (Papionini), может происходить из рода макаков (Масаса) (обезьяна варварийская, Масаса sylvanus; макак львинохвостый, Масаса silenus; южный свинохвостый макак или берук (Beruk), Масаса nemesthna; макак северный свинохвостый, Масаса leonina; макак пагайский или Bokkoi, Масаса pagensis; макак сиберу, Масаса siberu; макак Моора, Масаса тайга; макак обутый, Масаса ochreata; макак тонкинский, Масаса tonkeana; макак Гека, Масаса hecki; макак горонталский, Масаса nigriscens; макак целебесский хохлатый или черная обезьяна, Масаса nigra; макак яванский или макак-крабоед, или макак длиннохвостый или кера (Kera), Macaca fasciculatis; макак короткохвостый или макак медвежий, Macaca arctoides; макак резус, Macaca mulatta; макак формозский горный, Macaca cyclopis; макак японский, Macaca fuscata; макак цейлонский, Macaca sinica; макак индийский, Macaca radiata; макак бесхвостый, Macaca sylvanmus; макак ассамский, Macaca assamensis; макак тибетский или макак Милна-Эдвардса, Macaca thibetana; макак аруначалский или "обезьяна из глубины леса", Macaca munzala); в пределах рода Lophocebus (мангобей серо щеки и, Lophocebus albigena; Lophocebus albigena albigena; Lophocebus albigena osmani; Lophocebus albigena johnstoni; мангобей чернохохлый, Lophocebus aterrimus; мангобей Опденбоха, Lophocebus opdenboschi; мангобей высокогорный, Lophocebus kipunji); в пределах рода Papio (павиан гамадрил, Papio hamadryas; сфинкс, или гвинейский павиан, Papio papio; павиан анубис, Papio anubis; павиан бабуин, или желтый павиан, Papio cynocephalus; чакма, или павиан медвежий, Papio ursinus); в пределах рода Theropithecus (гелада, Theropithecus gelada); в пределах рода Cercocebus (мангобей дымчатый, Cercocebus atys; Cercocebus atys atys; Cercocebus atys lunulatus; мангобей красноголовый, Cercocebus torquatus; мангобей проворный, Cercocebus agilis; мангобей золотистобрюхий, Cercocebus chrysogaster, мангобей речной (танский), Cercocebus galeritus; мангобей Санье, Cercocebus sanjei); или в пределах рода Mandrillus (мандрил, Mandrillus sphinx; дрил, Mandrillus leucophaeus).
Наиболее предпочтительным является Macaca fascicularis (также известный как макак яванский, или крабоед (CynomoIgus monkey) и поэтому обозначенный в Примерах как "яванский") и Macaca mulatta (макак резус, обозначенный как "резус").
В пределах подсемейства Colobinae предпочтительный примат, не являющийся шимпанзе, может происходить из африканской группы, в пределах рода Colobus (колобус черный, Colobus satanas; колобус ангольский, Colobus angolensis, колобус королевский, Colobus polykomos; колобус медвежий, Colobus vellerosus; черно-белая гвереца, Colobus guereza); в пределах рода Piliocolobus (колобус красный западный, Piliocolobus badius; Piliocolobus badius badius; Piliocolobus badius temminckii; Piliocolobus badius waldronae; колобус Пеннанта, Piliocolobus pennantii; Piliocolobus pennantii pennantii; Piliocolobus pennantii epieni; Piliocolobus pennantii bouvieri; колобус красный Преусса, Piliocolobus preussi; колобус красный Фолона, Piliocolobus tholloni; колобус красный центрально-африканский, Piliocolobus foai; Pitiocolobus foai foai; Piliocolobus foai ellioti; Piliocolobus foai oustaleti; Piliocolobus foai semlikiensis; Piliocolobus foai parmentierorum; колобус красный угандийский, Piliocolobus tephrosceles; колобус красный узунгвайский, Piliocolobus gordonorum; колобус красный занзибарский, Piliocolobus kirkii; колобус красный речной (танский), Piliocotobus rufomitratus); или в пределах рода Procolobus (колобус оливковый, Procolobus verus).
В пределах подсемейства Colobinae предпочтительный примат, не являющийся шимпанзе, альтернативно может быть из группы лангуров (тонкотелов), в пределах рода Semnopithecus (лангур серый непальский, Semnopithecus schistaceus; лангур серый кашмирский, Semnopithecus ajax; лангур серый тарайский, Semnopithecus hector, лангур североравнинный серый, Semnopithecus entellus; лангур серый черностопый, Semnopithecus hypoleucos; лангур южноравнинный серый, Semnopithecus dussumieri; лангур серый опушенный, Semnopithecus priam); в пределах группы T. vetulus рода Trachypithecus (лангур пурпуролицый, Trachypithecus vetulus; лангур Нилгири, Trachypithecus johnii); в пределах группы T. cristatus рода Trachypithecus (лангур яванский, Trachypithecus auratus; тонкотел серебристый, или лангур серебристый, Trachypithecus cristatus; лангур индокитайский, Trachypithecus germaini; лангур тенассерский, Trachypithecus barbel); в пределах группы Т. obscurus рода Trachypithecus (лангур дымчатый, или очковый, Trachypithecus obscurus; лангур Фейра Фейра, Trachypithecus phayrei); в пределах группы Т. pileatus вида Trachypithecus (лангур шапочниковый, Trachypithecus pileatus; лангур Шортриджа, Trachypithecus shortridgei; лангур золотой, или трахипитек Гее, Trachypithecus geei); в пределах группы T. francoisi рода Trachypithecus (лангур Франсуа, Trachypithecus francoisi; лангур хатинхенский, Trachypithecus hatinhensis; лангур белоголовый, Trachypithecus potiocephalus; лангур лаотийский, Trachypithecus laotum; лангур Делакура, Trachypithecus delacouri; лангур черный индокитайский, Trachypithecus ebenus); или в пределах рода Presbytis (сюрили суматранский, Presbytis melalophos; тонкотел полосатый, Presbytis femoralis; тонкотел саравакский, Presbytis chrysomelas; тонкотел белобедрый, Presbytis siamensis; тонкотел белолобый, Presbytis frontata; тонкотел яванский, Presbytis comata; тонкотел Томаса, Presbytis thomasi; тонкотел Хоуза, Presbytis hosei; тонкотел каштановый, Presbytis rubicunda; лангур ментавайский или Joja, Presbytis potenziani; тонкотел натунский, Presbytis natunae).
В пределах подсемейства Colobinae предпочтительный примат, не являющийся шимпанзе, альтернативно может быть из группы курносых (odd-nosed) обезьян, в пределах рода Pygathrix (пигатрикс красноплюсный, Pygathrix nemaeus; пигатрикс черноплюсный, Pygathrix nigripes; пигатрикс сероплюсный, Pygathrix cinerea); в пределах рода Rhinopithecus (обезьяна курносая золотистая, Rhinopithecus roxellana; обезьяна курносая черная, Rhinopithecus bieti; обезьяна курносая серая, Rhinopithecus brelichi; лангур тонкинский курносый, Rhinopithecus avuncufus); в пределах рода Nasalis (носач обыкновенный, Nasalis larvatus); или в пределах рода Simias (лангур свинохвостый, Simias concolor).
Как использовано в данной заявке, термин "игрунка, или мармозетка" означает любых обезьян Нового Света рода Callithrix, например, принадлежащих к мармозеткам Атлантического побережья подрода Callithrix (игрунка обыкновенная, или мармозетка, Callithrix (Callithrix) jacchus; мармозетка черноухая, Callithrix (Callithrix) penicillata; мармозетка Вайеда (Wied's marmoset), Calfithrix (Callithrix) kuhlii; мармозетка белоголовая, Callithrix (Callithrix) geoffroyi; игрунка желтоголовая, Callithrix (Callithrix) flaviceps; игрунка белоухая, Callithrix (Callithrix) aurita); принадлежащих к мармозеткам лесов Амазонии подрода Mico (шелковые игрунки) (игрунка Рио-Акари, Callithrix (Mico) acariensis; игрунка Manicore, Callithrix (Mico) manicorensis; игрунка серебристая, Callithrix (Mico) argentata; игрунка белая, Callithrix (Mico) leucippe; игрунка Эмилия (Emilia's marmoset), Callithrix (Mico) emiliae; мармозетка чернокисточная, Callithrix (Mico) nigriceps; игрунка Марка (Marca's marmoset), Callithrix (Mico) marcai; мармозетка чернохвостая, Callithrix (Mico) melanura; игрунка белоплечая, Callithrix (Mico) humeralifera; мармозетка Maues, Callithrix (Mico) mauesi; мармозетка золотистая (gold-and-white marmoset), Callithrix (Mico) chrysoteuca', мармозетка Гершковица (Hershkovitz's marmoset), Callithrix (Mico) intermedia; мармозетка Satere, Callithrix (Mico) saterei); мармозетку Roosmalens' Dwarf, принадлежащую к подроду Callibella (Caflithrix (Callibella) humilis); или карликовую игрунку, принадлежащую к подроду Cebuella (Callithrix (Cebuella) pygmaea).
Другие роды обезьян Нового Света включают тамаринов (или сагуинов) рода Saguinus (включающего группу S. oedipus, группу S. midas, группу S. nigricollis, группу S. mystax, группу S. bicolor и группу S. inustus) и беличьих обезьян рода Saimiri (например Saimiri sciureus, Saimiri oerstedii, Saimiri ustus, Saimiri boliviensis, Saimin vanzolini).
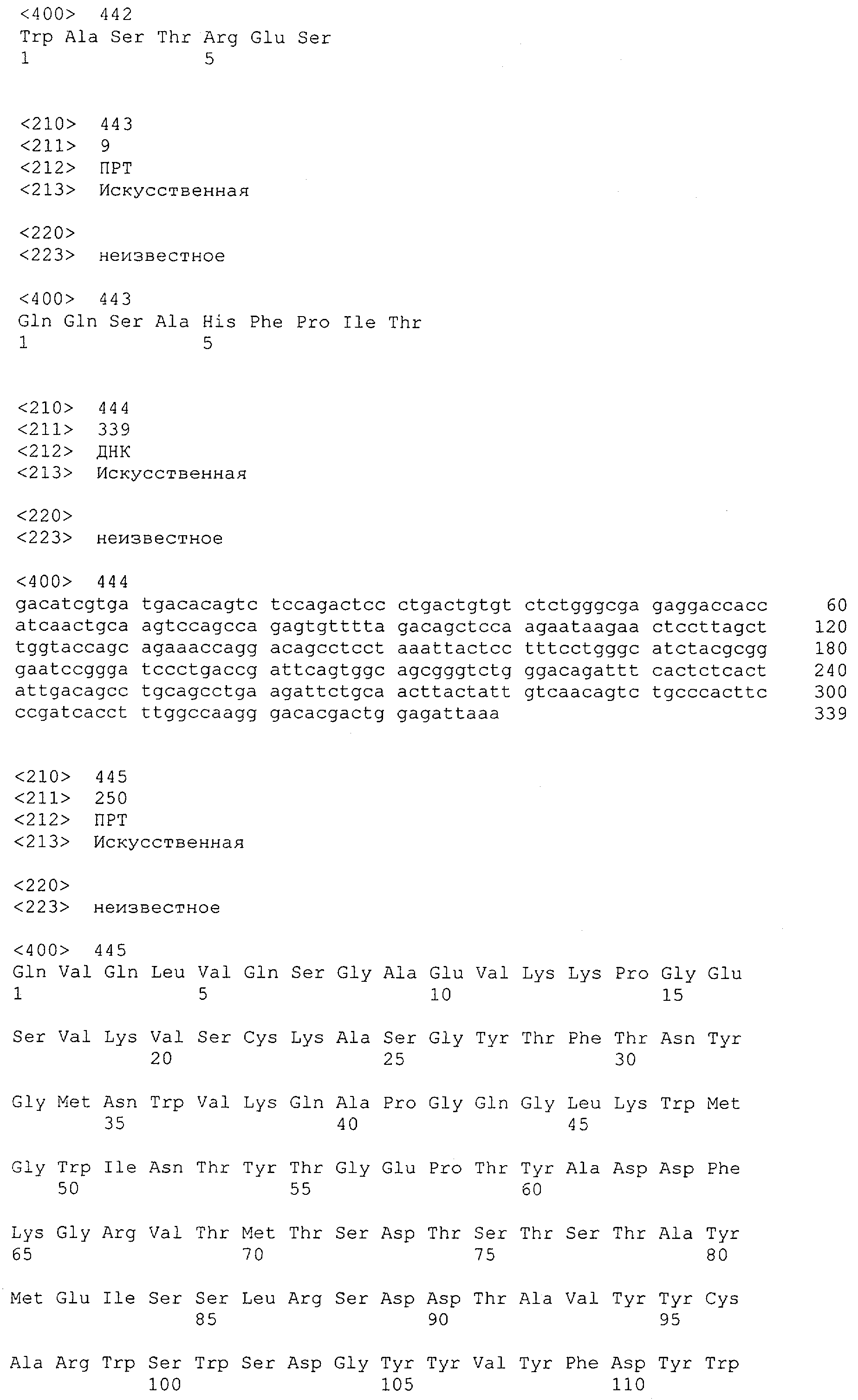
Термин "связывающий домен" характеризует в соответствии с настоящим изобретением домен полипептида, который специфически связывается/взаимодействует с данной(ым) целевой(ым) структурой/антигеном/эпитопом. Таким образом, связывающий домен представляет собой "сайт взаимодействия с антигеном". Термин "сайт взаимодействия с антигеном" определяет, в соответствии с настоящим изобретением, мотив полипептида, который способен специфически взаимодействовать с конкретным антигеном или конкретной группой антигенов, например одним и тем же антигеном у разных видов. Также понятно, что указанное связывание/взаимодействие определяет "специфическое распознавание". Термин "специфически распознающий" означает в соответствии с этим изобретением то, что молекула антитела способна специфически взаимодействовать и/или связывать по меньшей мере два, предпочтительно по меньшей мере три, более предпочтительно по меньшей мере четыре аминокислоты антигена, например антигена CD3 человека, определенного в данной заявке. Такое связывание может быть проиллюстрировано специфичностью в соответствии с "принципом замка и ключа". Таким образом, специфические мотивы в аминокислотной последовательности связывающего домена и антигена связываются друг с другом вследствие их первичной, вторичной или третичной структуры, а также вследствие вторичных модификаций указанной структуры. Специфическое взаимодействие данного "сайта взаимодействия с антигеном" с его специфическим антигеном также может приводить просто к связыванию указанного сайта с антигеном. Кроме того, специфическое взаимодействие данного "сайта взаимодействия с антигеном" с его специфическим антигеном альтернативно может вызывать инициацию сигнала, например вследствие индукции изменения конформации антигена, олигомеризации антигена и т.д. Предпочтительным примером связывающего домена в соответствии с настоящим изобретением является антитело. Связывающий домен может представлять собой моноклональное или поликлональное антитело или происходить из моноклонального или поликлонального антитела.
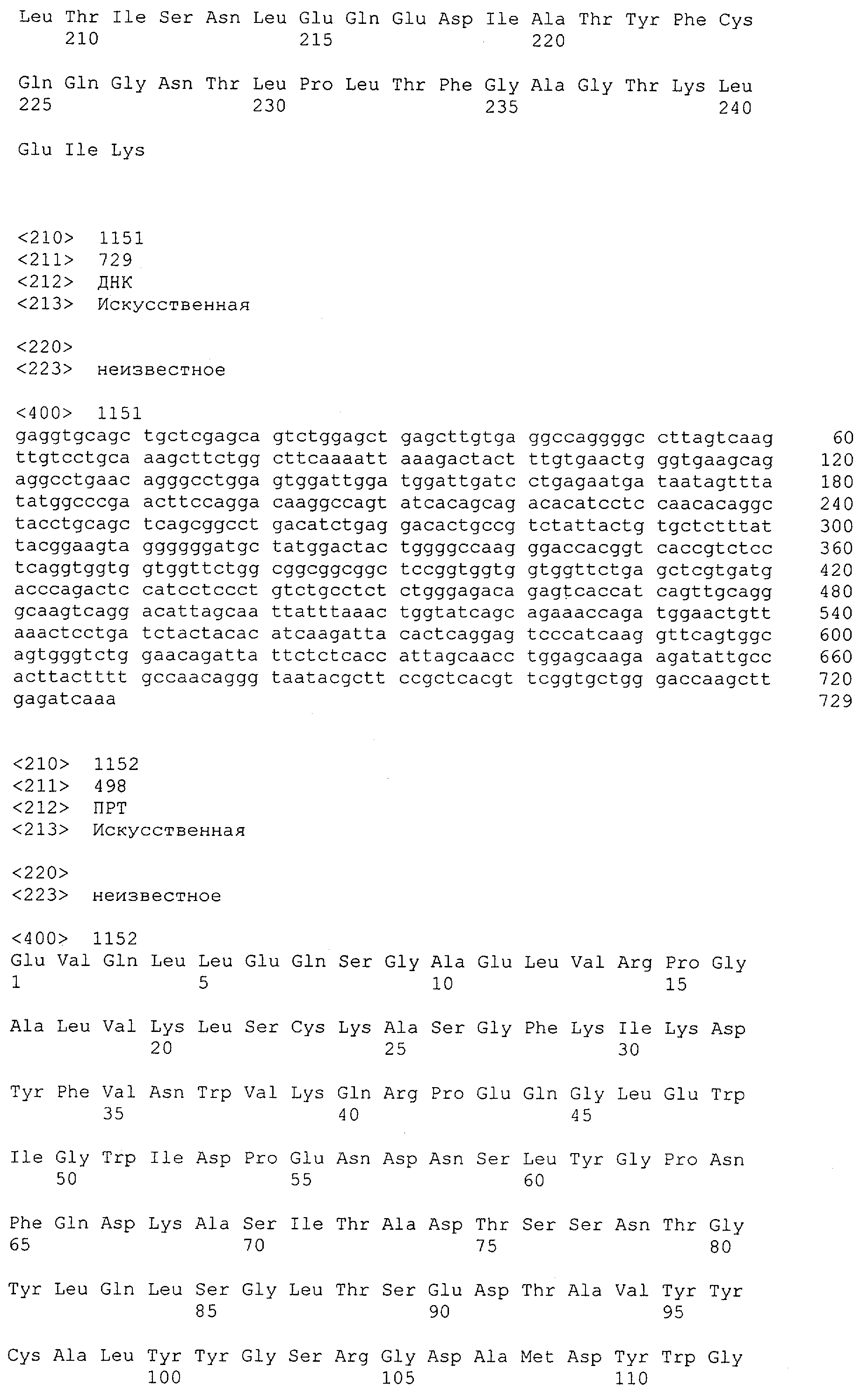
Термин "антитело" включает в себя производные или их функциональные фрагменты, которые все еще сохраняют специфичность связывания. Методики получения антител хорошо известны в данной области техники и описаны, например в Harlow and Lane "Antibodies, A Laboratory Manual", Cold Spring Harbor Laboratory Press, 1988 и Harlow and Lane "Using Antibodies: A Laboratory Manual" Cold Spring Harbor Laboratory Press, 1999. Термин "антитело" также включает в себя иммуноглобулины (Ig) разных классов (т.е. IgA, IgG, IgM, IgD и IgE) и подклассов (такие как IgG1, IgG2 и т.д.). Эти антитела могут быть использованы, например для иммунопреципитации, аффинной очистки и иммунолокализации полипептидов или слитых белков по изобретению, а также для мониторинга присутствия и количества таких полипептидов, например в культурах рекомбинантных прокариот или эукариотических клетках или организмах.
Определение термина "антитело" также включает такие воплощения, как химерные, одноцепочечные и гуманизированные антитела, а также фрагменты антител, подобные, среди прочего, Fab-фрагментам. Фрагменты или производные антител кроме этого содержат фрагменты F(ab')2, Fv, scFv (одноцепочечный Fv) или однодоменные антитела, антитела, состоящие из единичного вариабельного домена, или иммуноглобулиновый единичный вариабельный домен, содержащий только один вариабельный домен, который может представлять собой VH или VL, которые специфически связываются с антигеном или эпитопом независимо от других V-областей или -доменов; см., например Harlow и Lane (1988) и (1999), выше. Такой иммуноглобулиновый единичный вариабельный домен охватывает не только выделенный полипептид единичного вариабельного домена антитела, но также более крупные полипептиды, которые содержат один или более мономеров полипептидной последовательности единичного вариабельного домена антитела.
В данной области техники известны различные методики, которые можно использовать для получения таких антител и/или фрагментов. Так, данные производные (антител) могут быть получены с использованием пептидомиметиков. Далее, методики, описанные для получения одноцепочечных антител (см., среди прочего, патент США 4946778), могут быть адаптированы для получения одноцепочечных антител, обладающих специфичностью к выбранному(ым) полипептиду(ам). Кроме того, для экспрессии гуманизированных антител, специфичных к полипептидам и слитым белкам по данному изобретению, можно использовать трансгенных животных. Для получения моноклональных антител можно использовать любую методику, обеспечивающую получение антител, продуцируемых культурами стабильных клеточных линий. Примеры таких методик включают гибридомную методику (Kohler and Milstein, Nature, 256 (1975), 495-497), триомную методику, гибридомную методику с использованием В-клеток человека (Kozbor, Immunology Today, 4 (1983), 72) и EBV-гибридомную методику (EBV - вирус Эпштейна-Барр) для продуцирования человеческих моноклональных антител (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc. (1985), 77-96). Поверхностный плазменный резонанс, который применен в системе BIAcore, может быть использован для увеличения эффективности фаговых антител, которые связываются с эпитопом целевого полипептида, таким как CD3-эпсилон (Schier, Human Antibodies Hybridomas, 7 (1996), 97-105; Malmborg, J. Immunol. Methods, 183 (1995), 7-13). В контексте данного изобретения также предусматривается, что термин "антитело" включает в себя антительные конструкции, которые могут быть экспрессированы в хозяине, описанном в данном изобретении ниже, например антительные конструкции, которые могут быть трансфицированы и/или трансдуцированы с использованием, среди прочего, вирусных или плазмидных векторов.
Термин "специфическое взаимодействие", как он использован в соответствии с настоящим изобретением, означает, что связывающ(ий)ая (домен) молекула не обладает перекрестной реактивностью или не обладает значительной перекрестной реактивностью с полипептидами, имеющими похожую структуру, что и полипептиды, с которыми образует связь связывающая молекула, и которые могли бы экспрессироваться теми же клетками, как и представляющий интерес полипептид. Перекрестную реактивность панели исследуемых связывающих молекул можно протестировать, например, путем оценки связывания указанной панели связывающих молекул в стандартных условиях (см., например, Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1988 и Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1999). Примеры специфического взаимодействия связывающего домена с конкретным антигеном включают в себя специфичность лиганда к его рецептору. Указанное определение, в частности, включает в себя взаимодействие лигандов, которые индуцируют сигнал после связывания с его специфическим рецептором. Примером указанного взаимодействия, которое, в частности, также охватывается указанным определением, является взаимодействие антигенной детерминанты (эпитопа) со связывающим доменом (антигенсвязывающим сайтом) антитела.
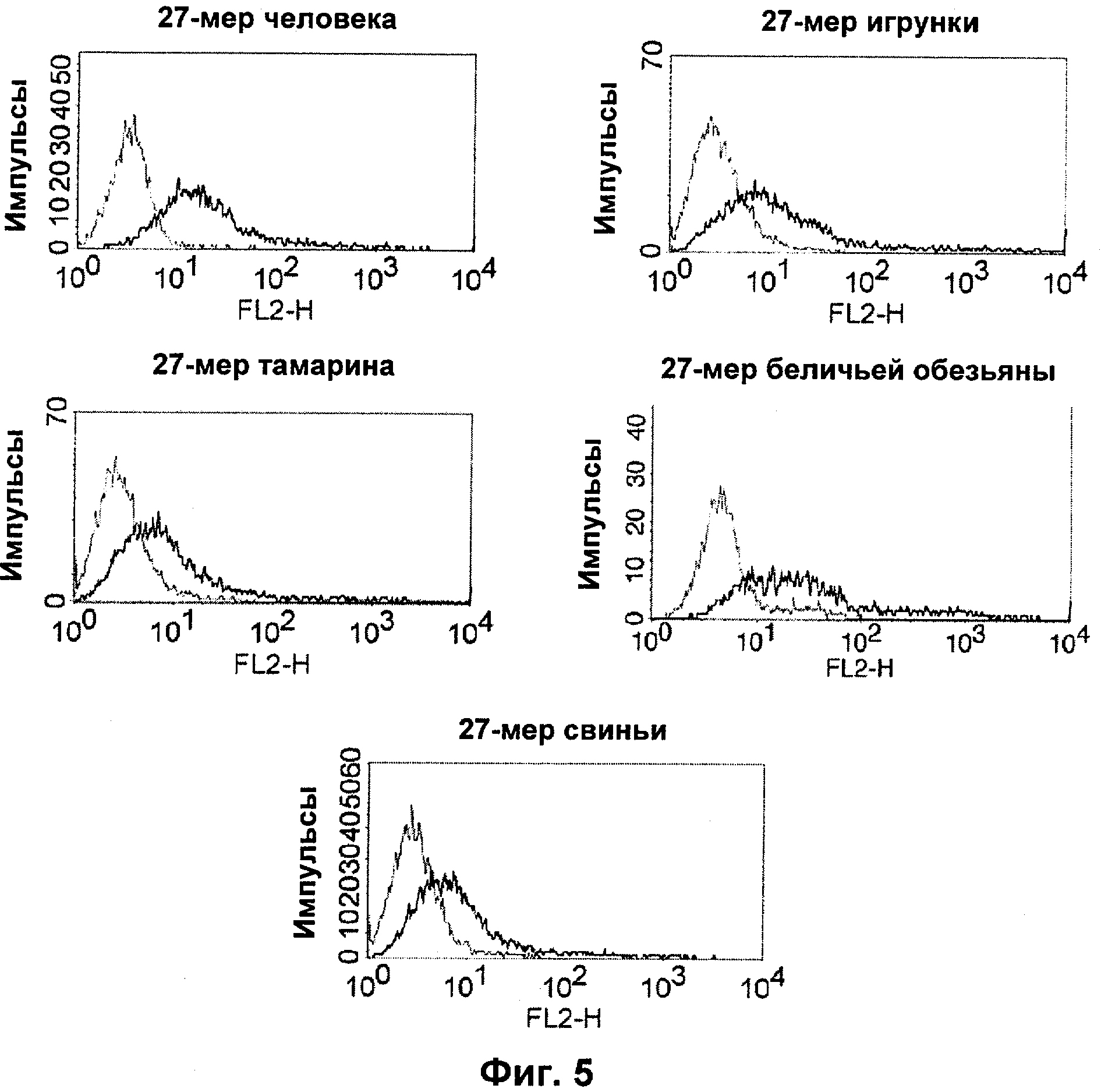
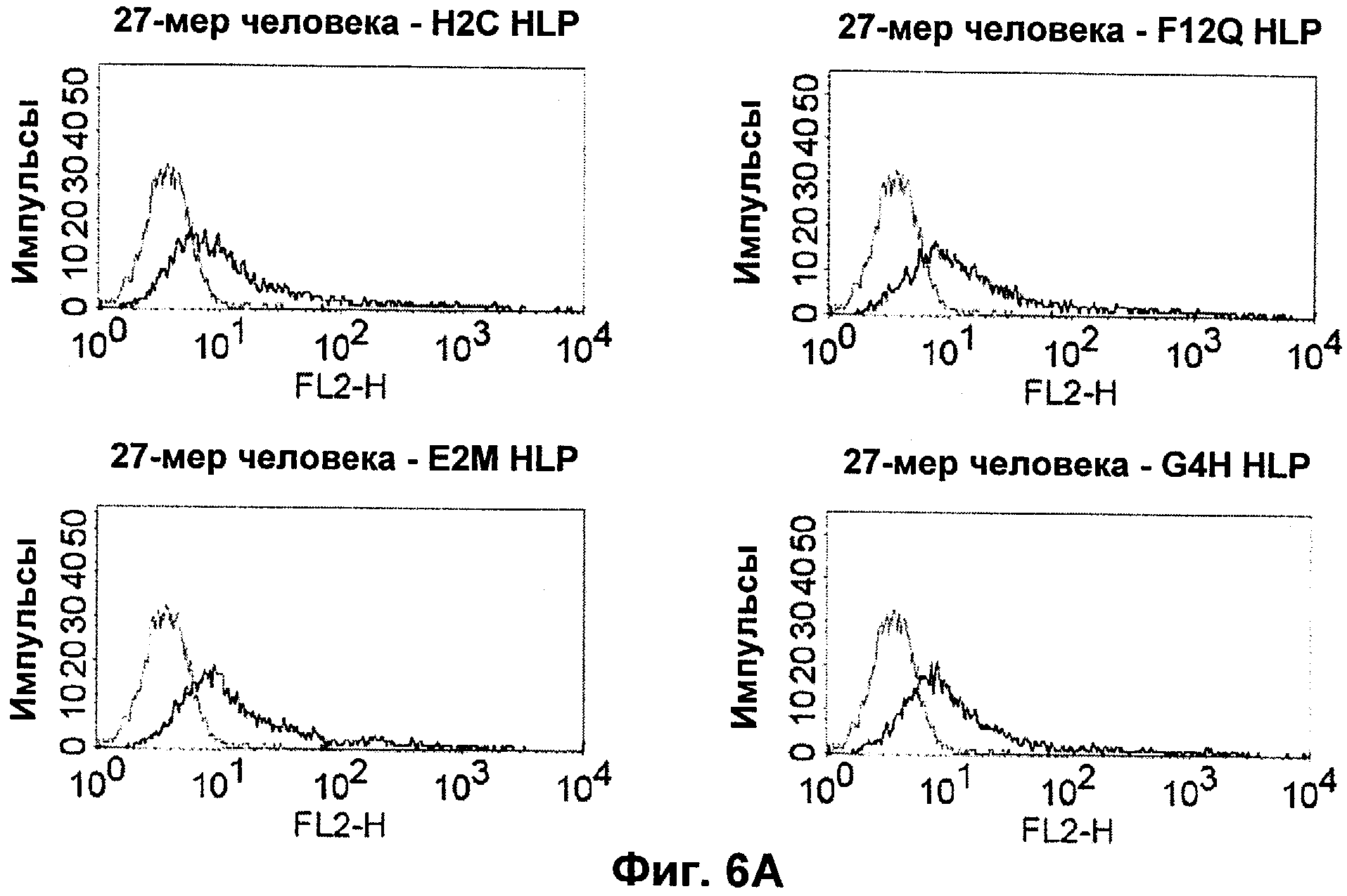
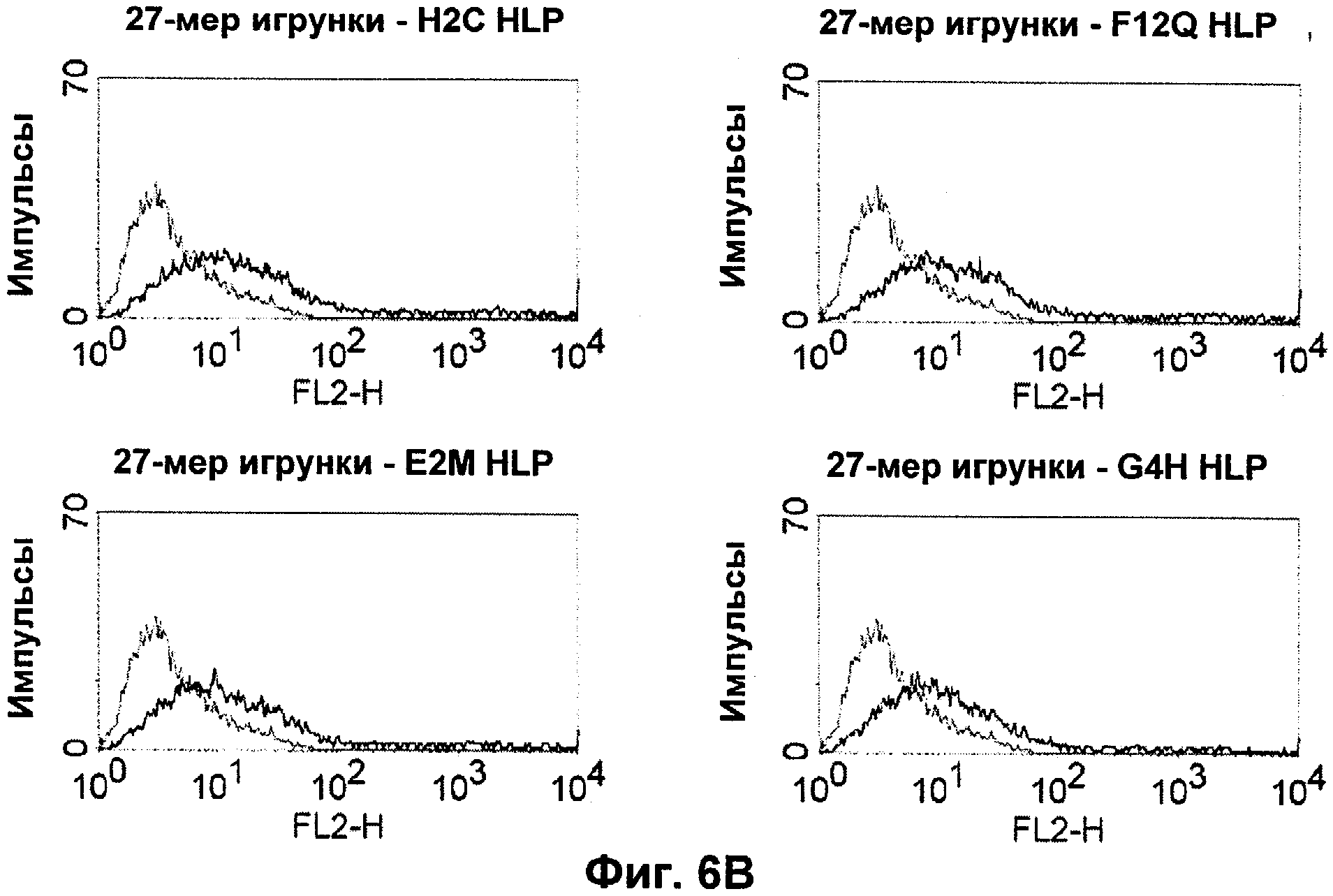
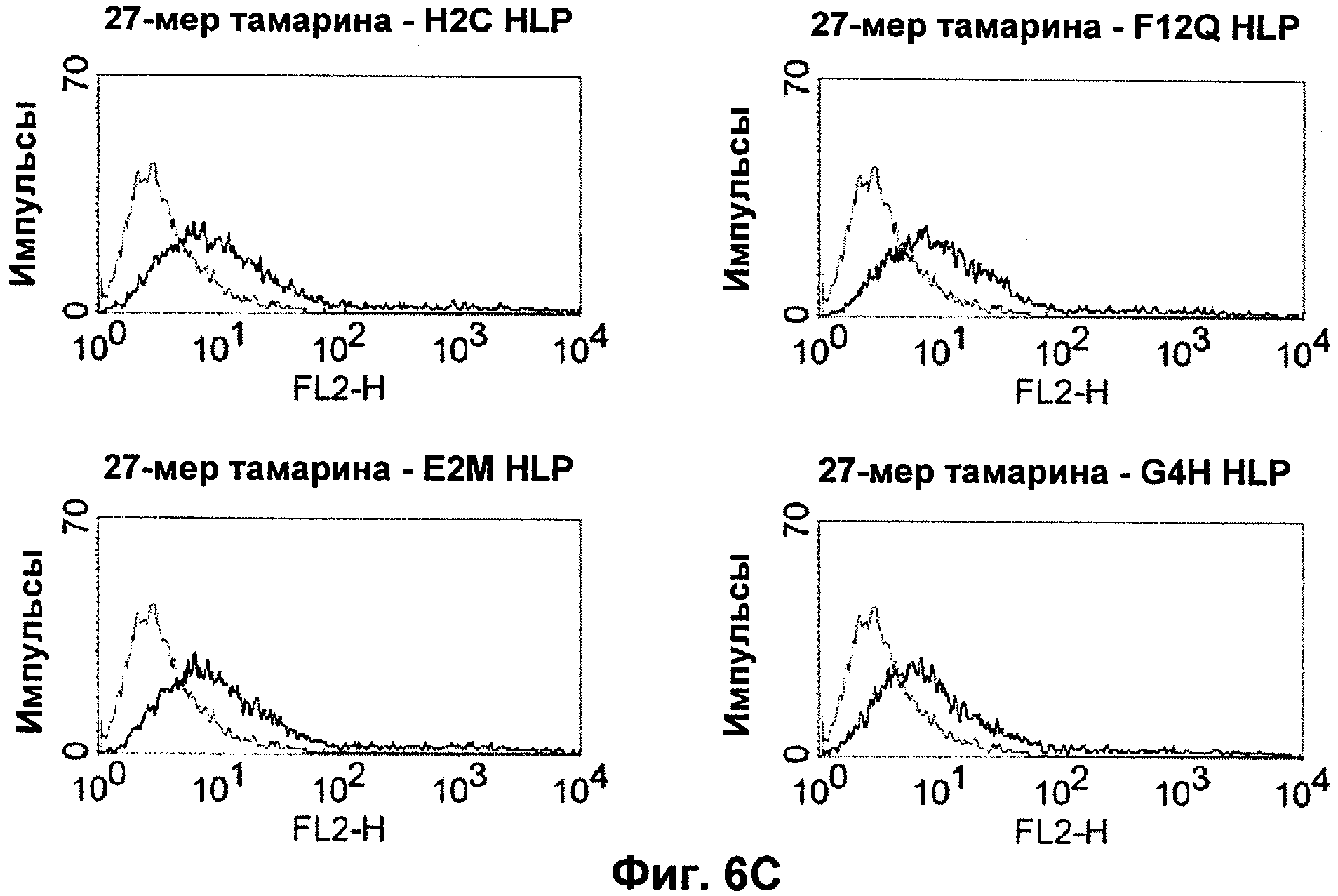
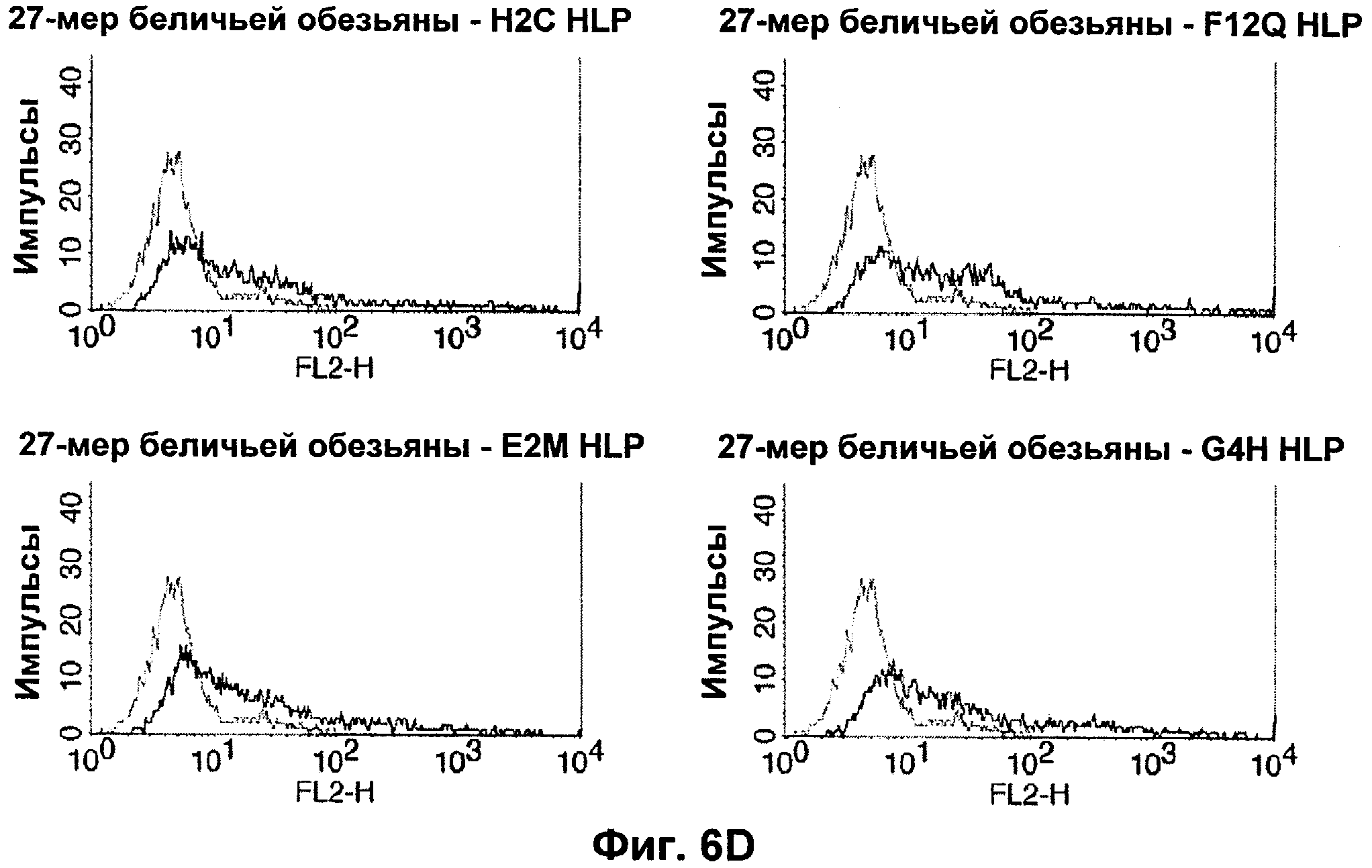
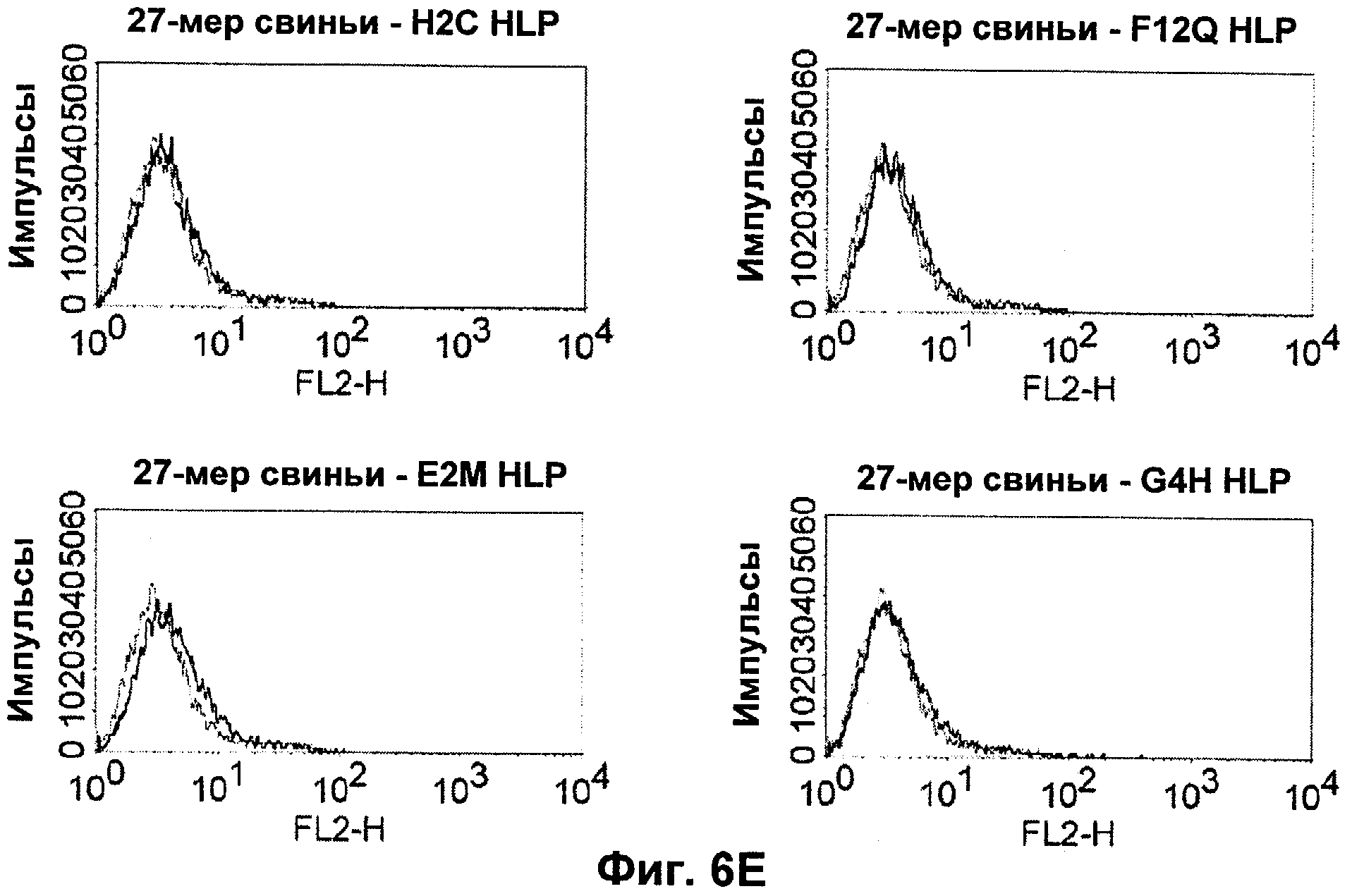
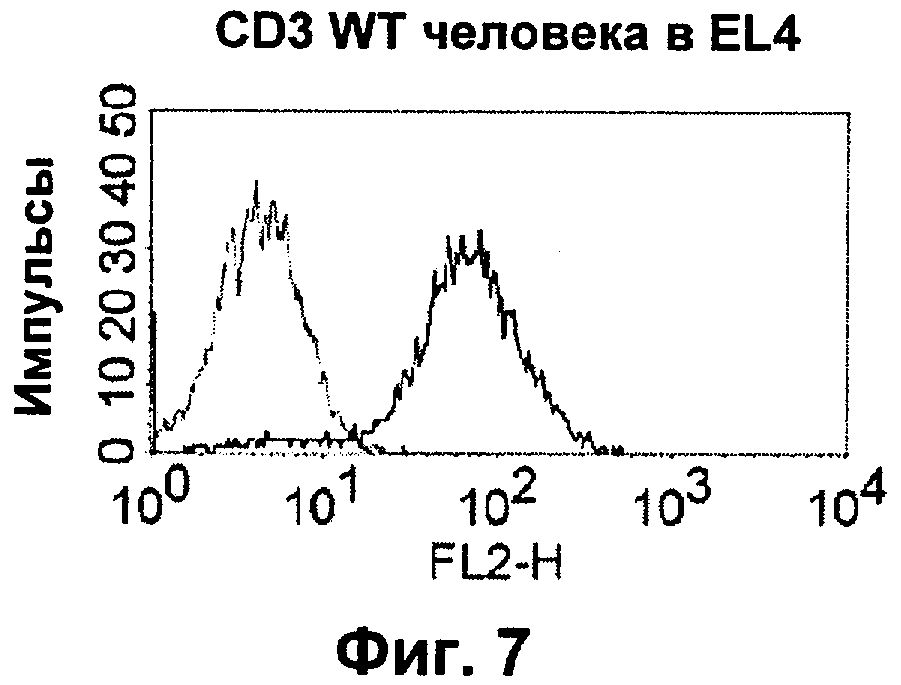
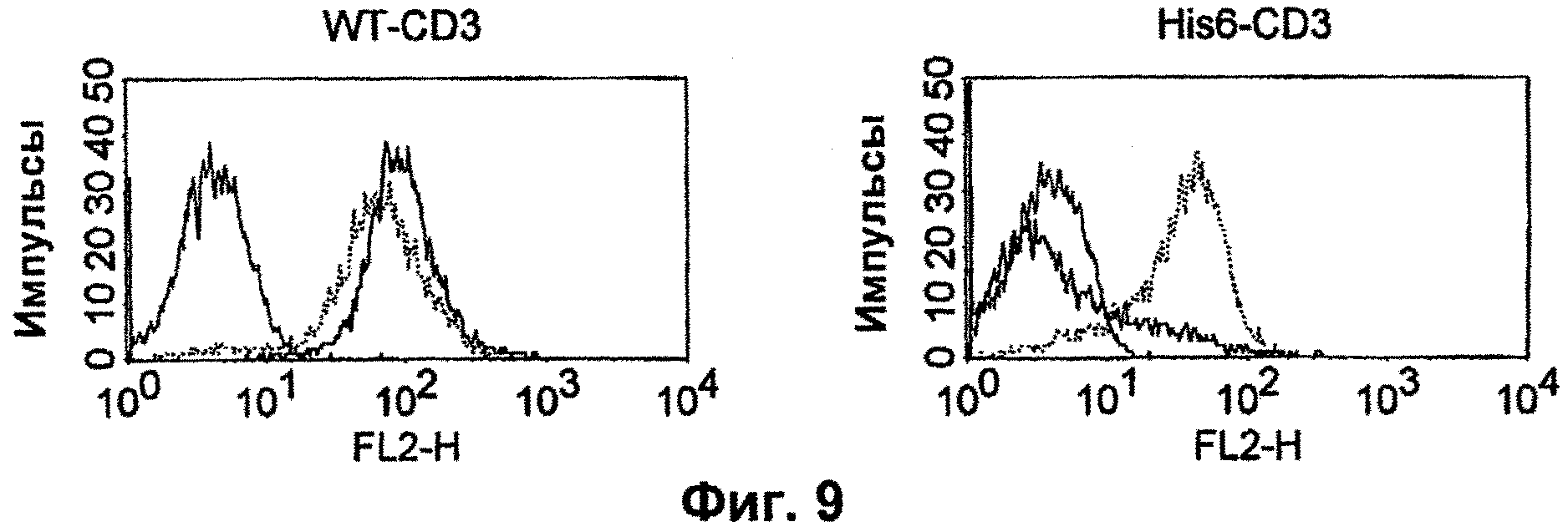
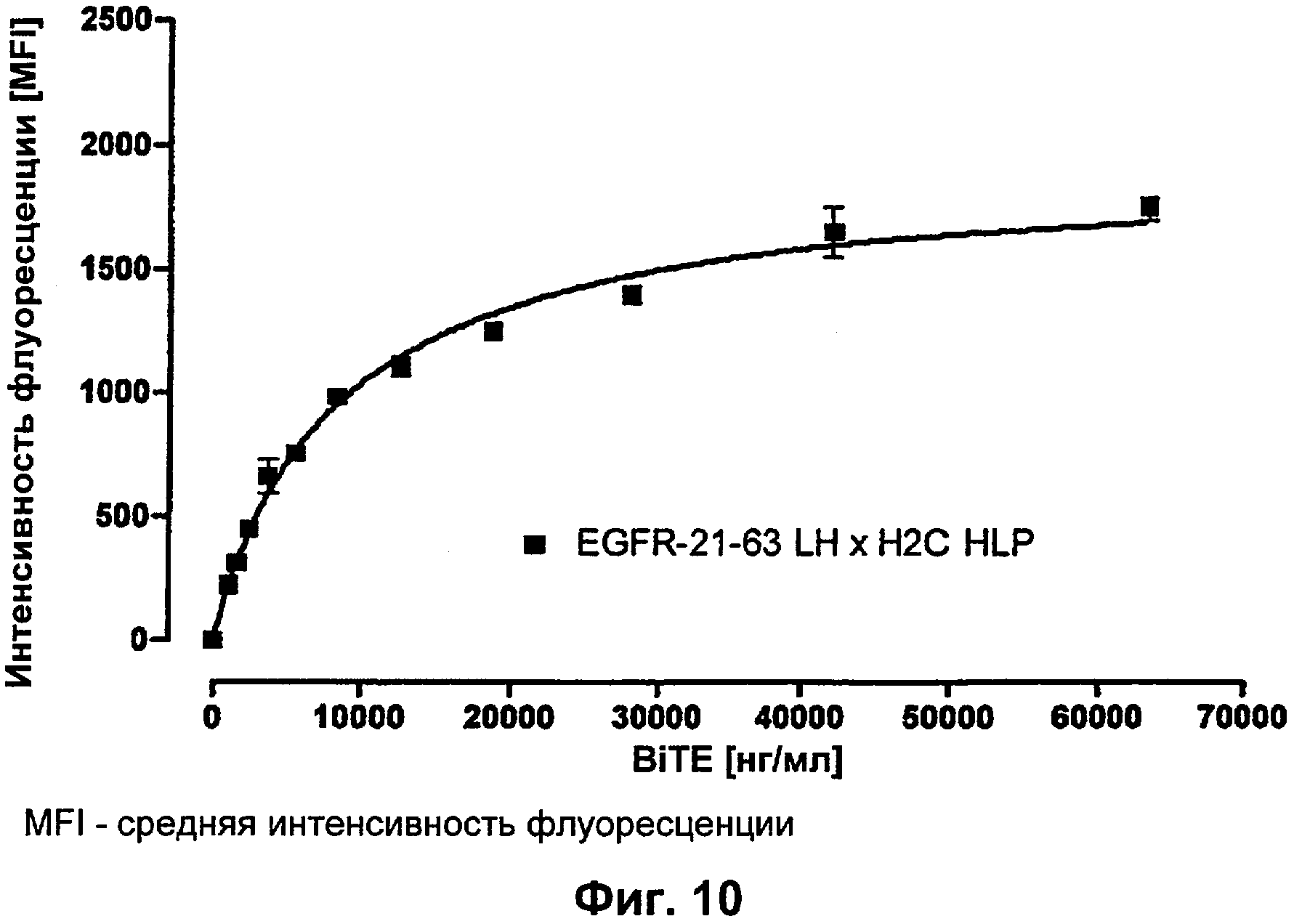
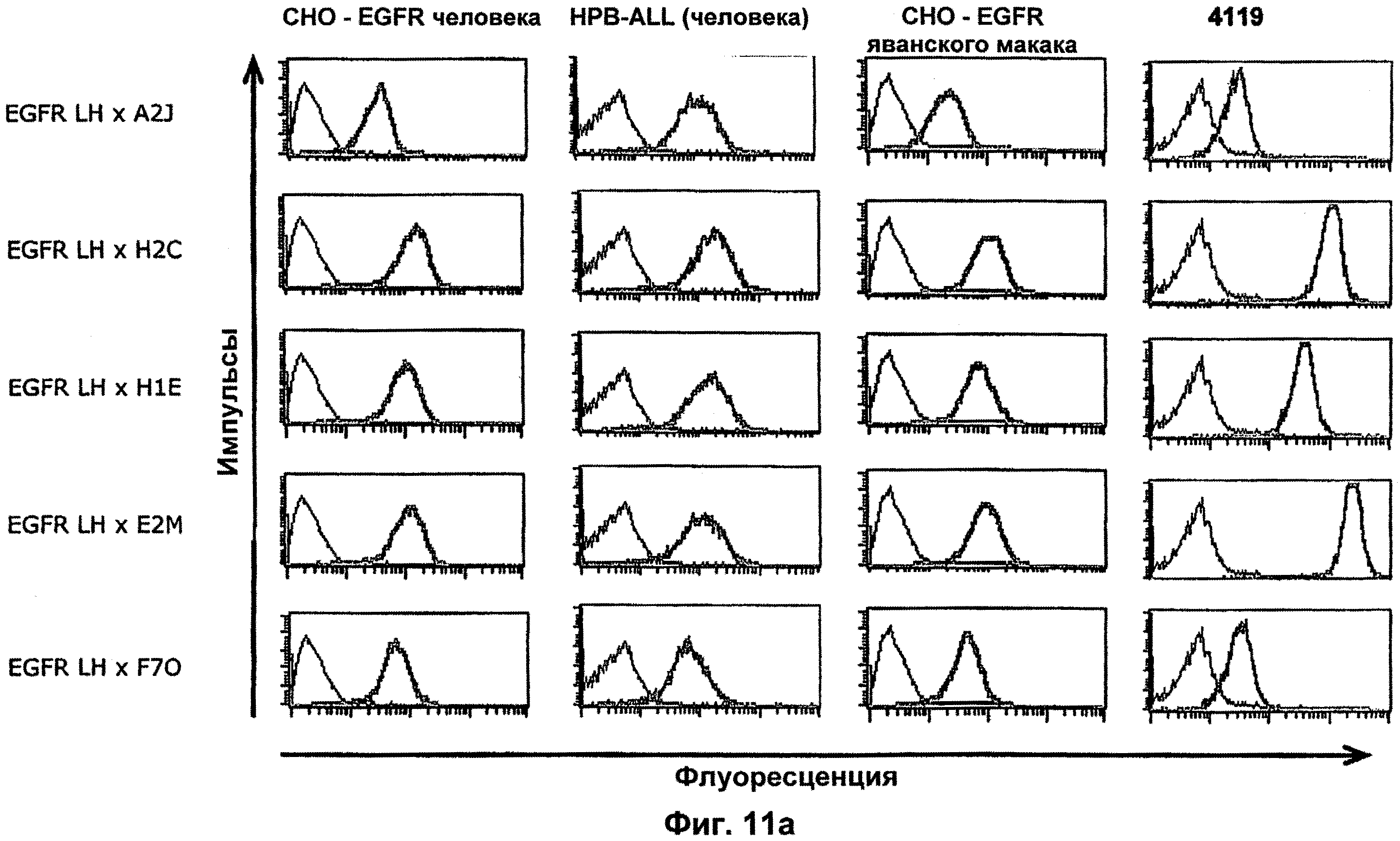
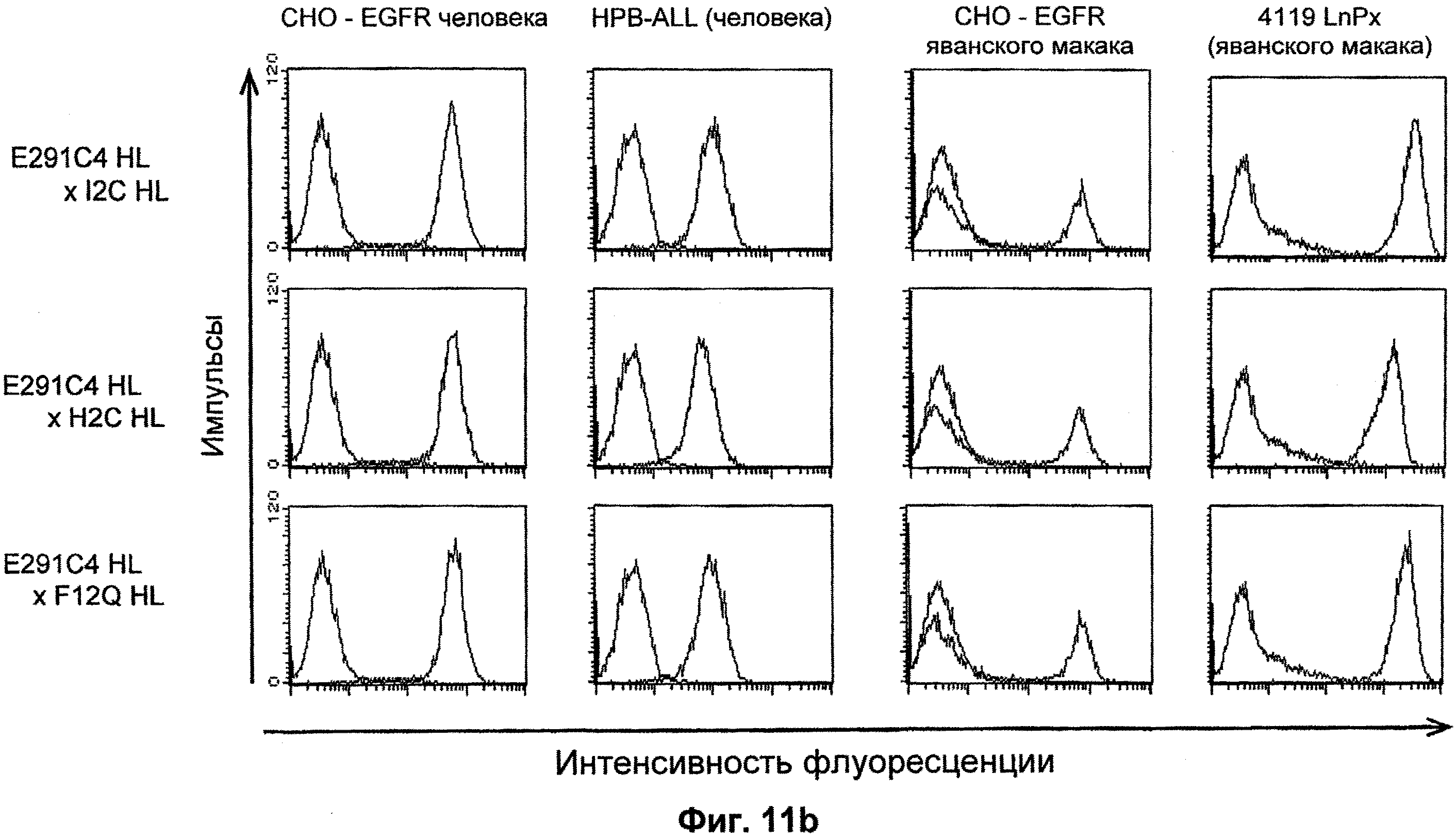
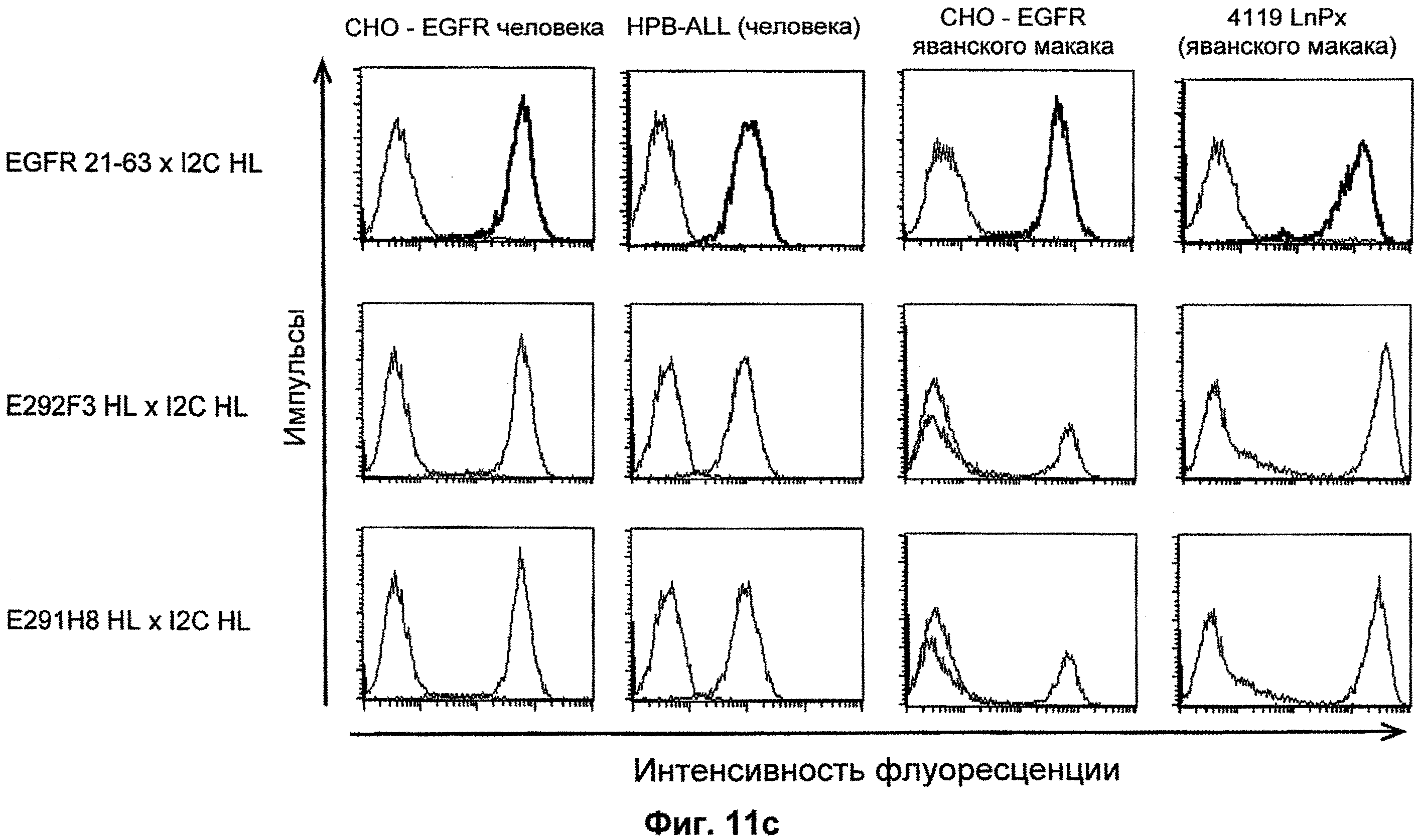
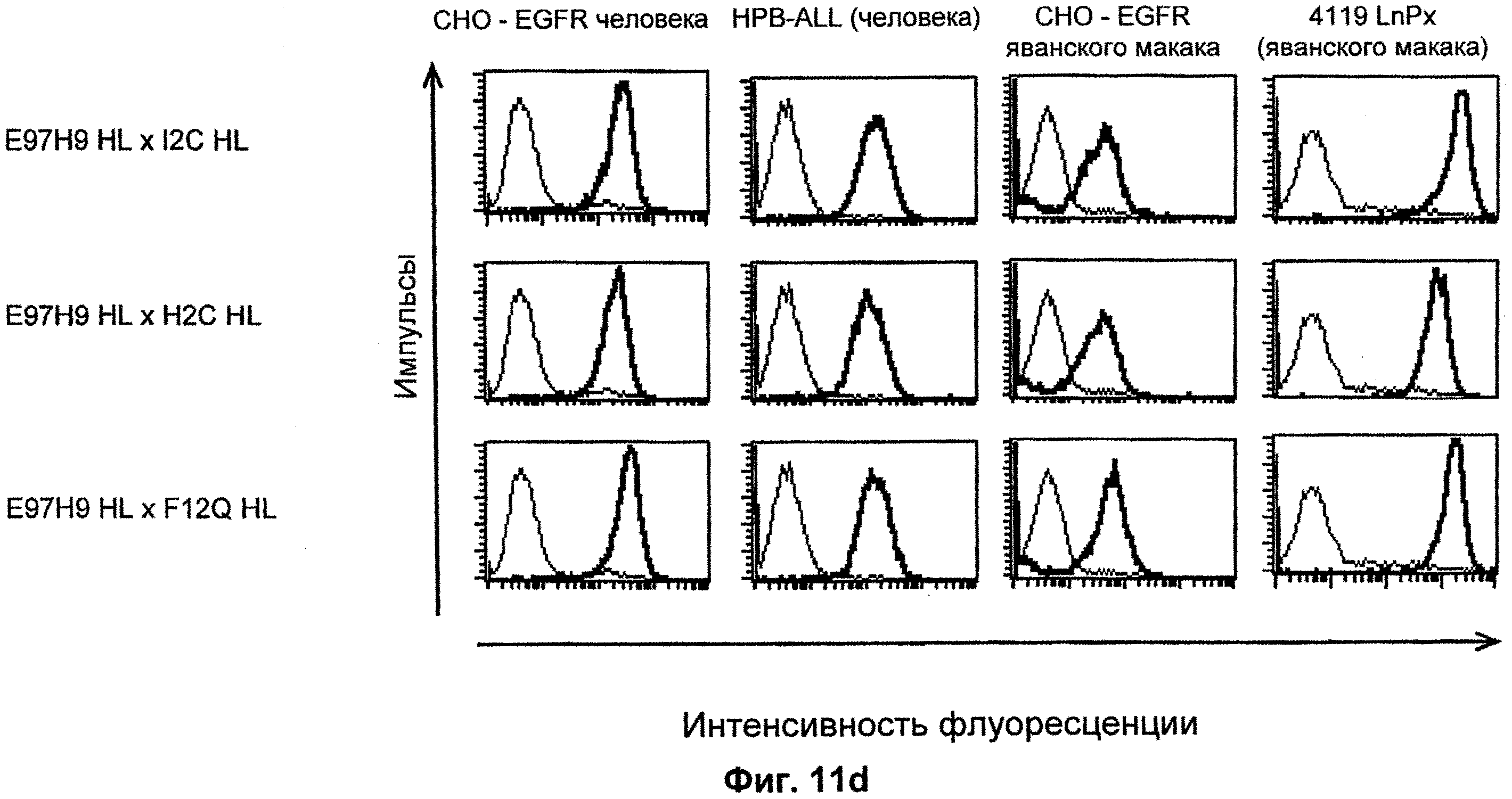
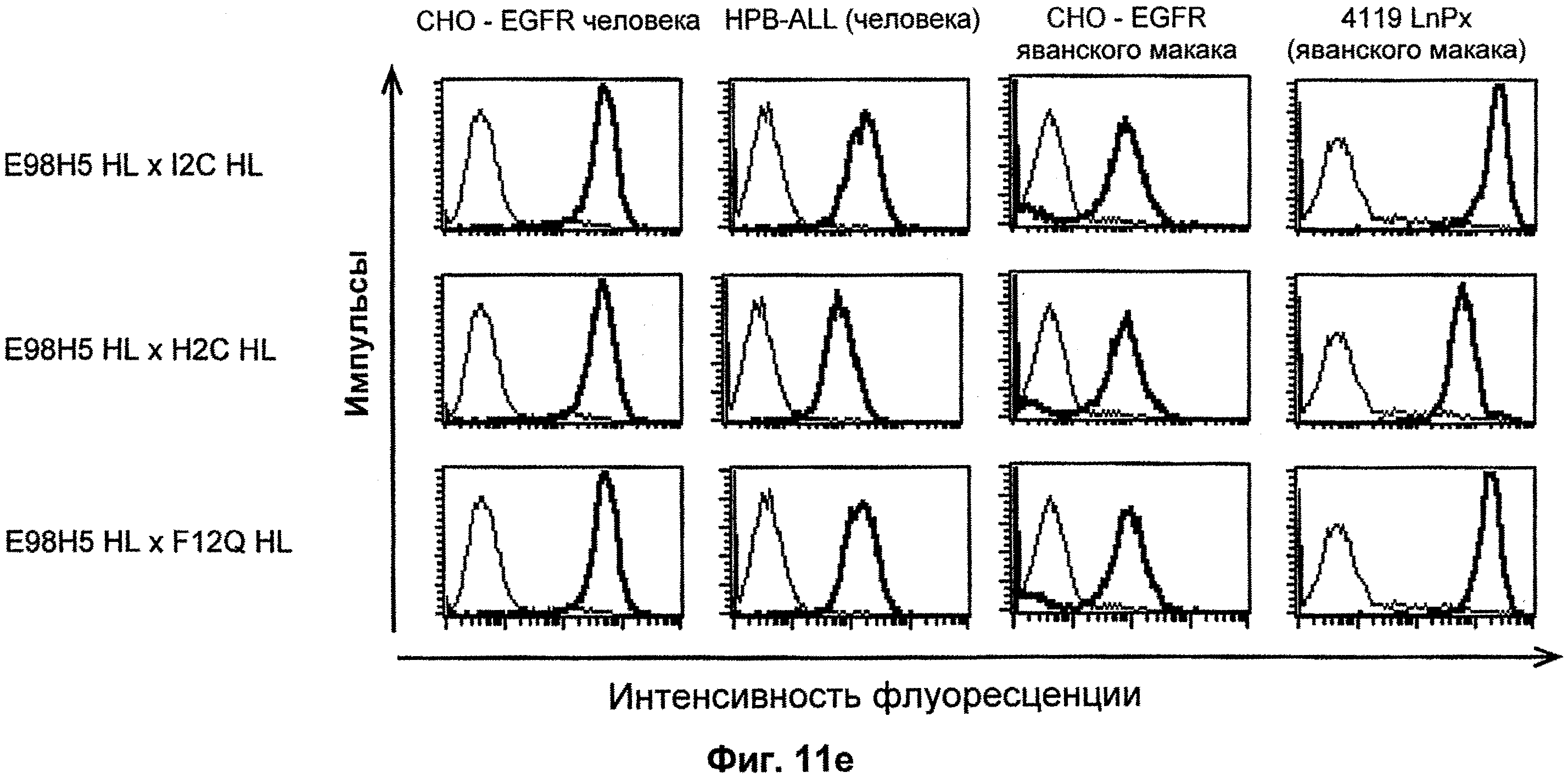
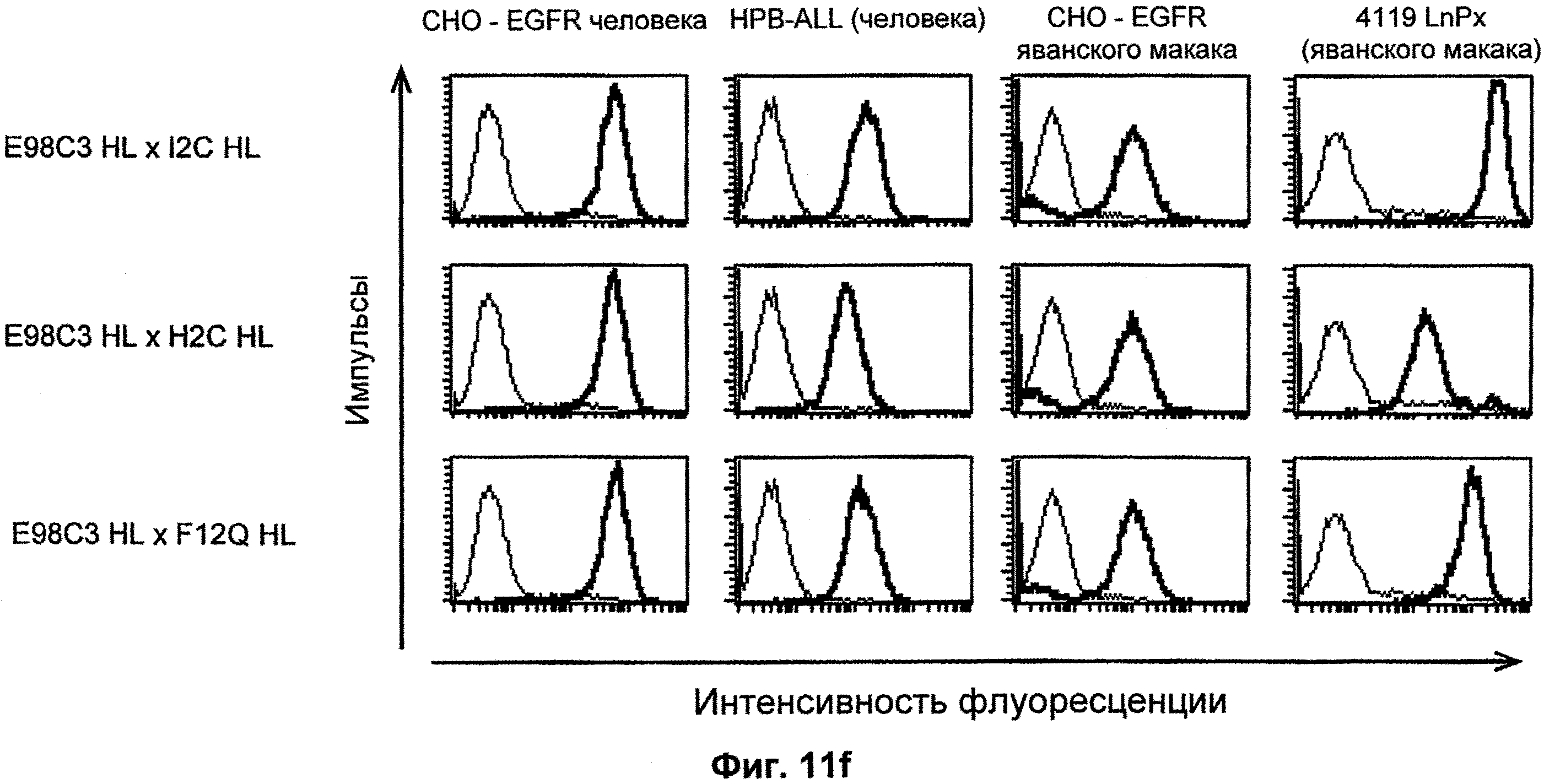
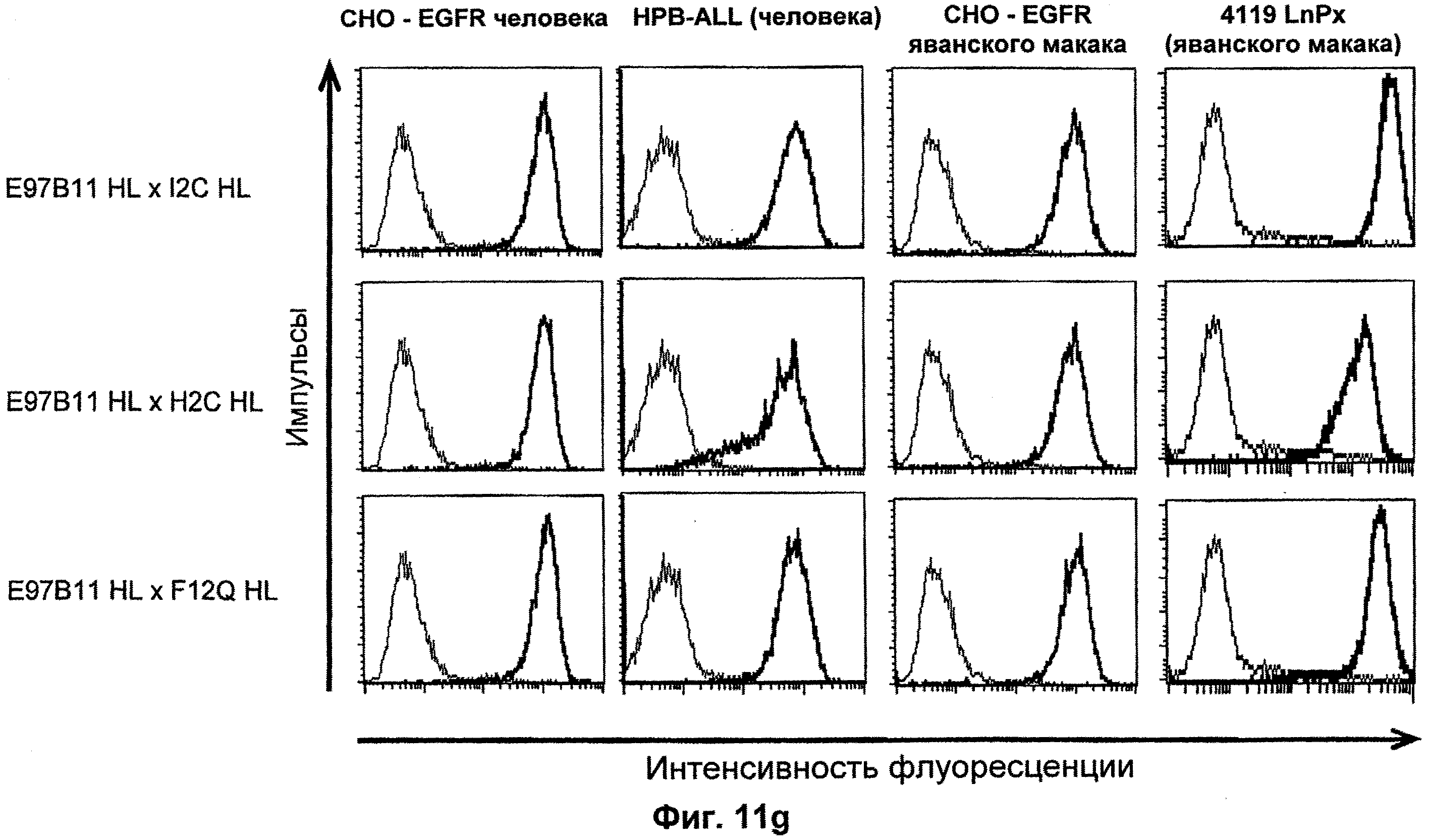
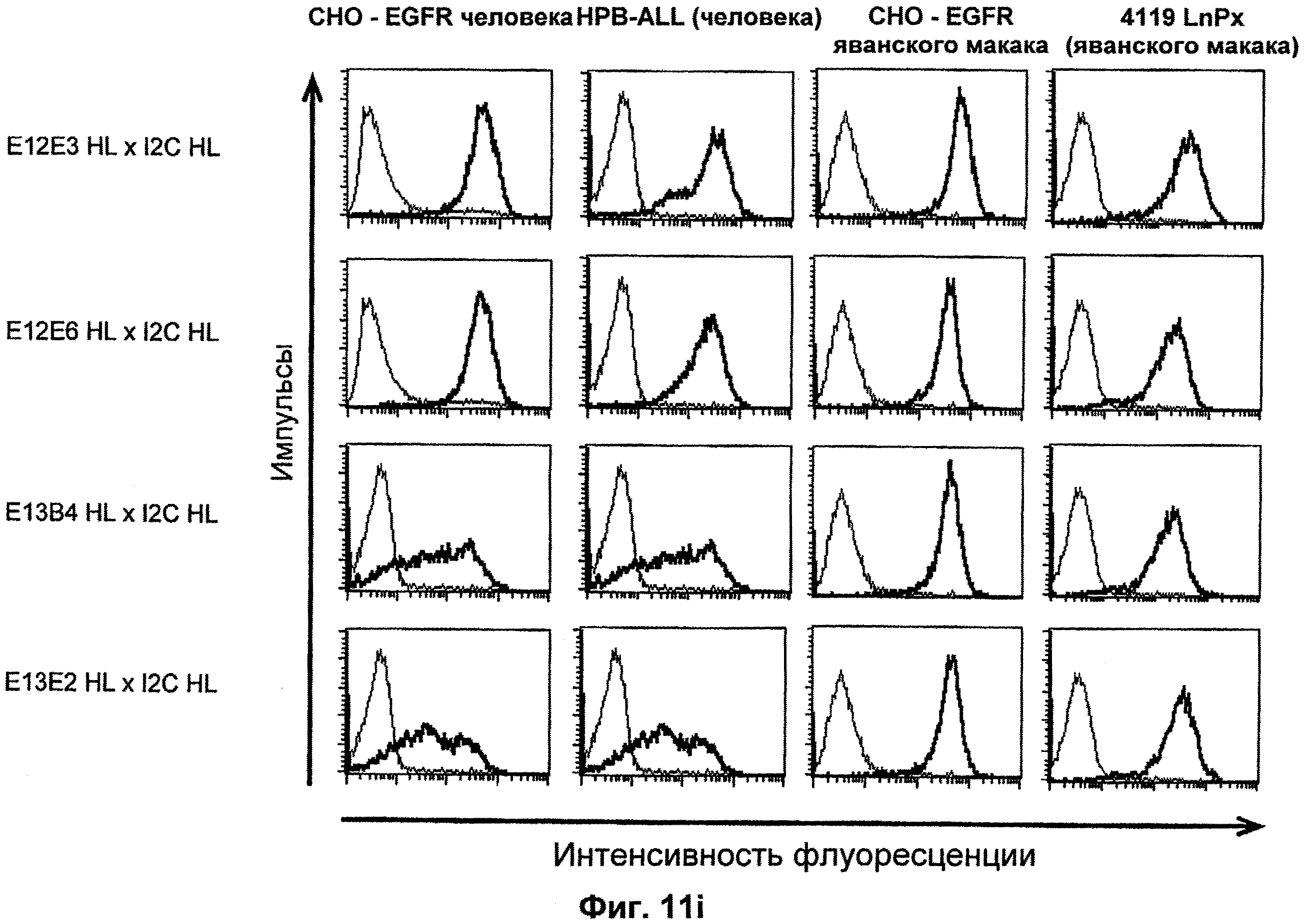
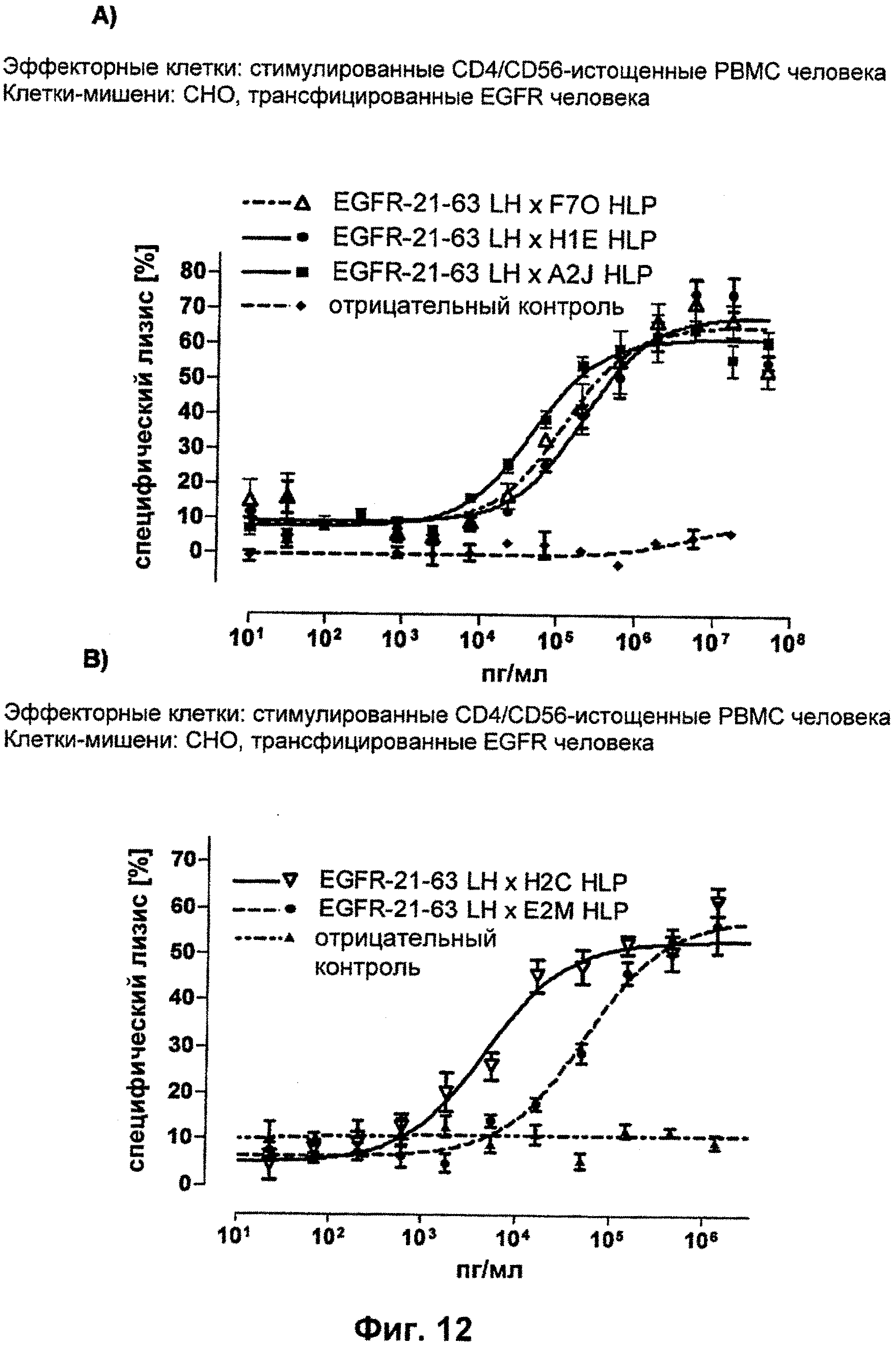
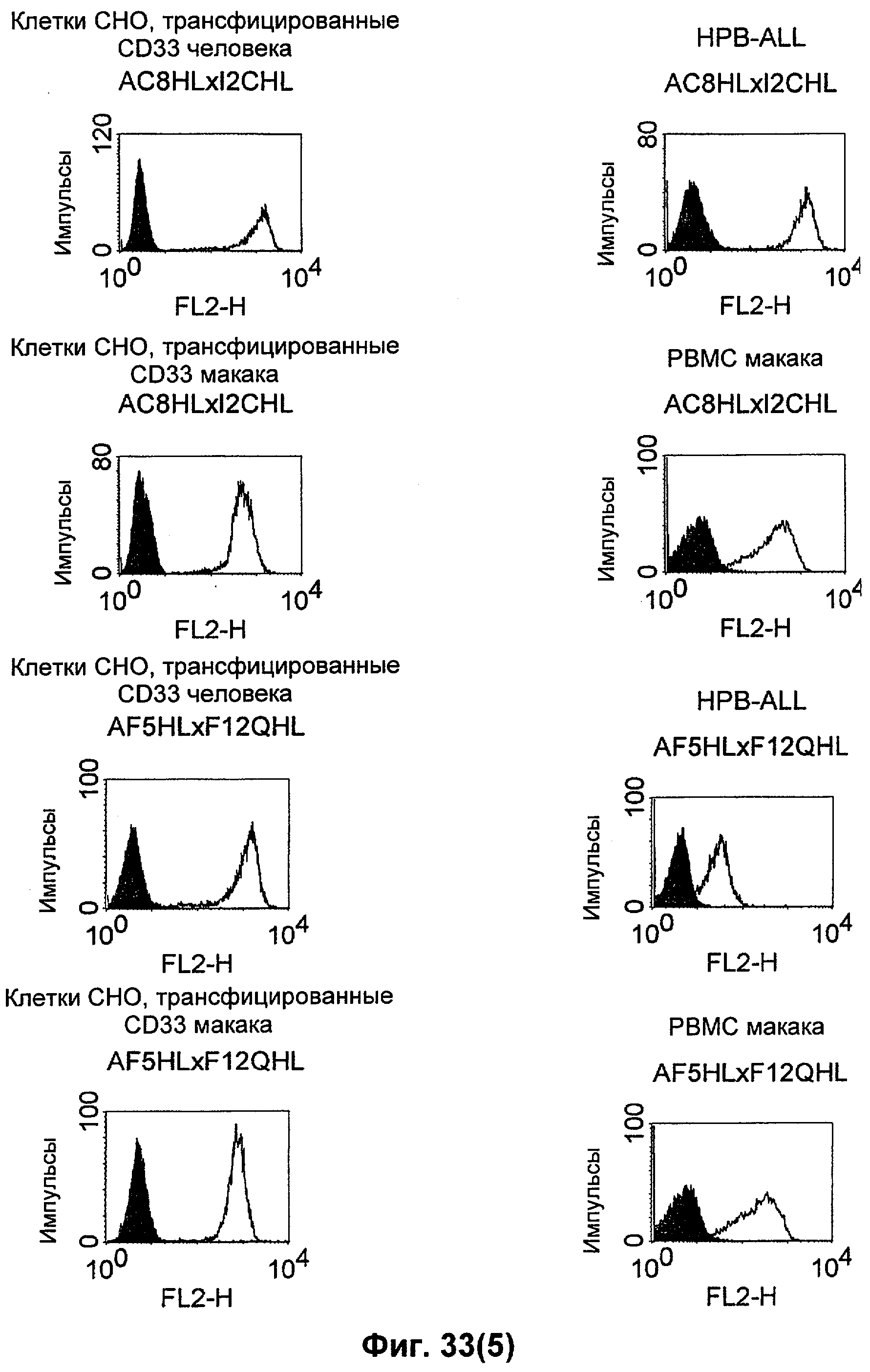
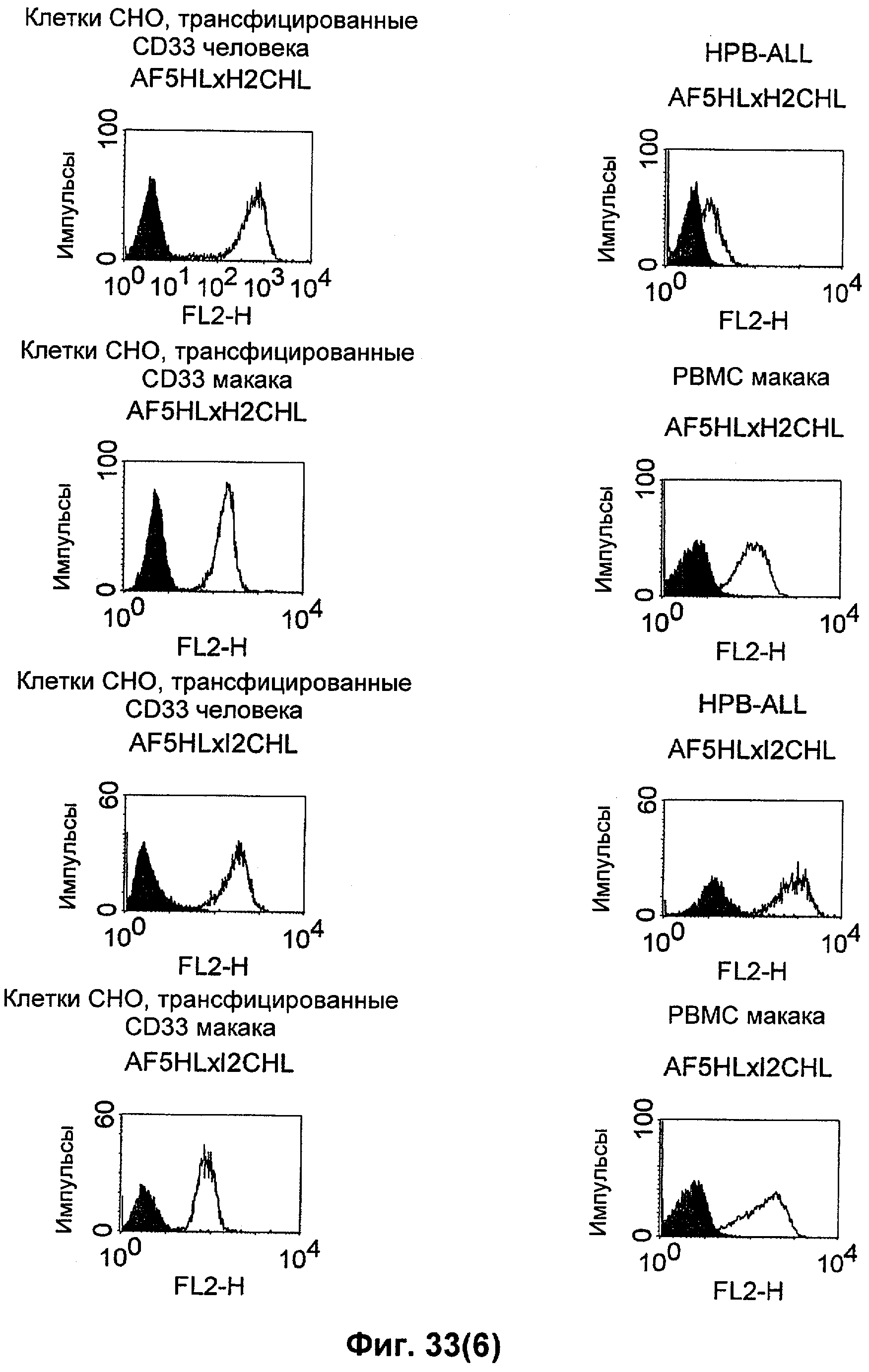
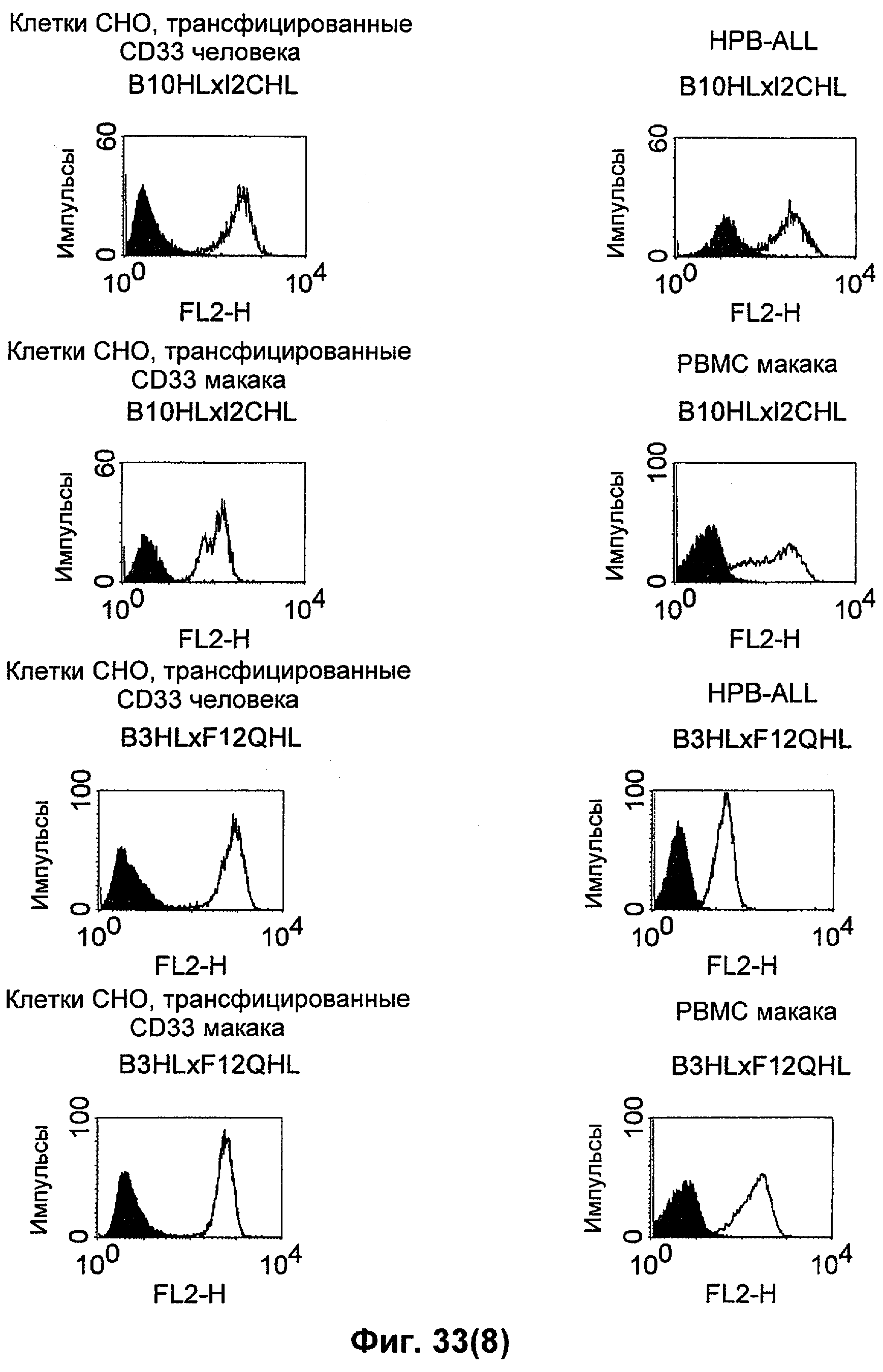
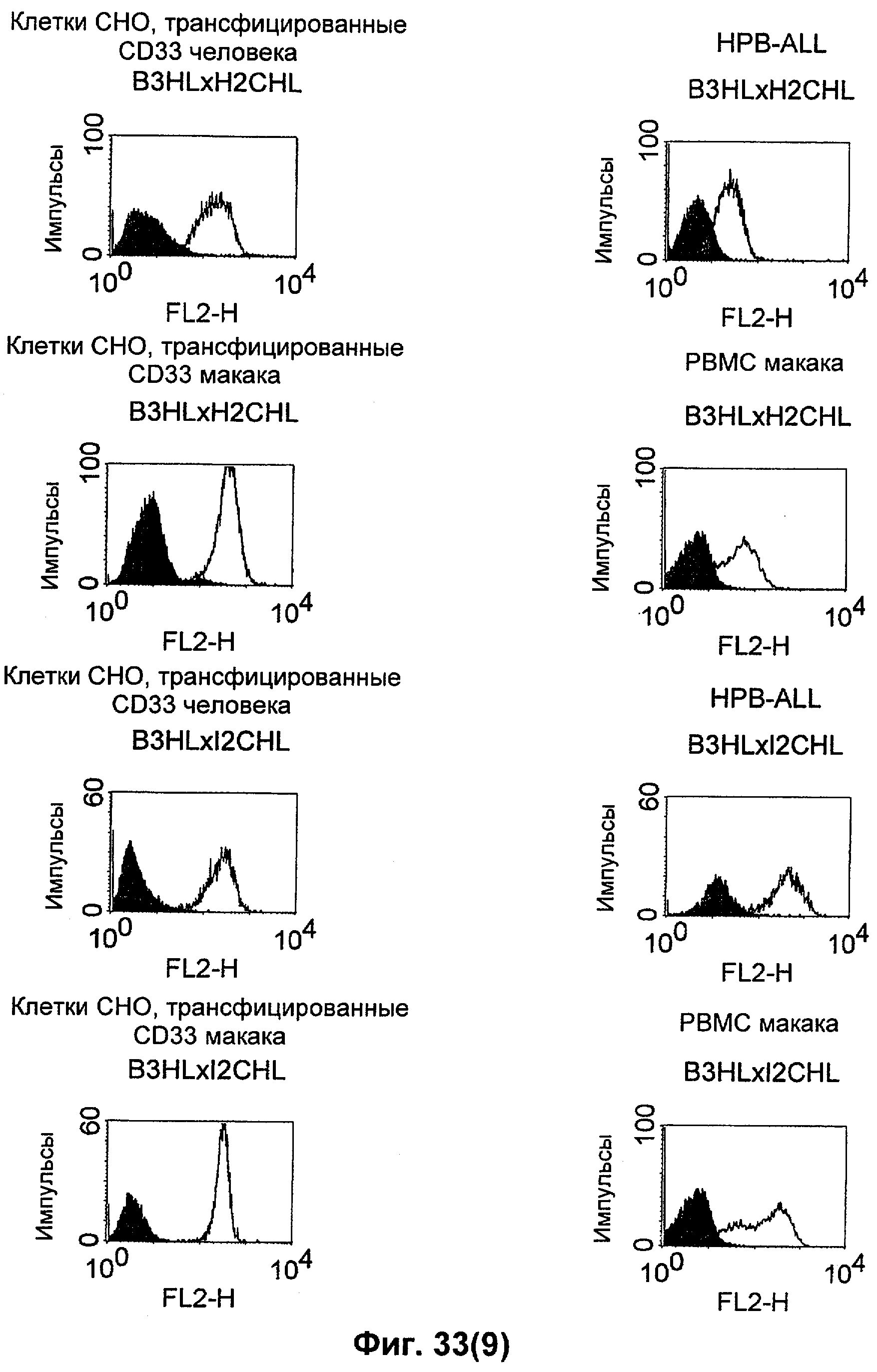
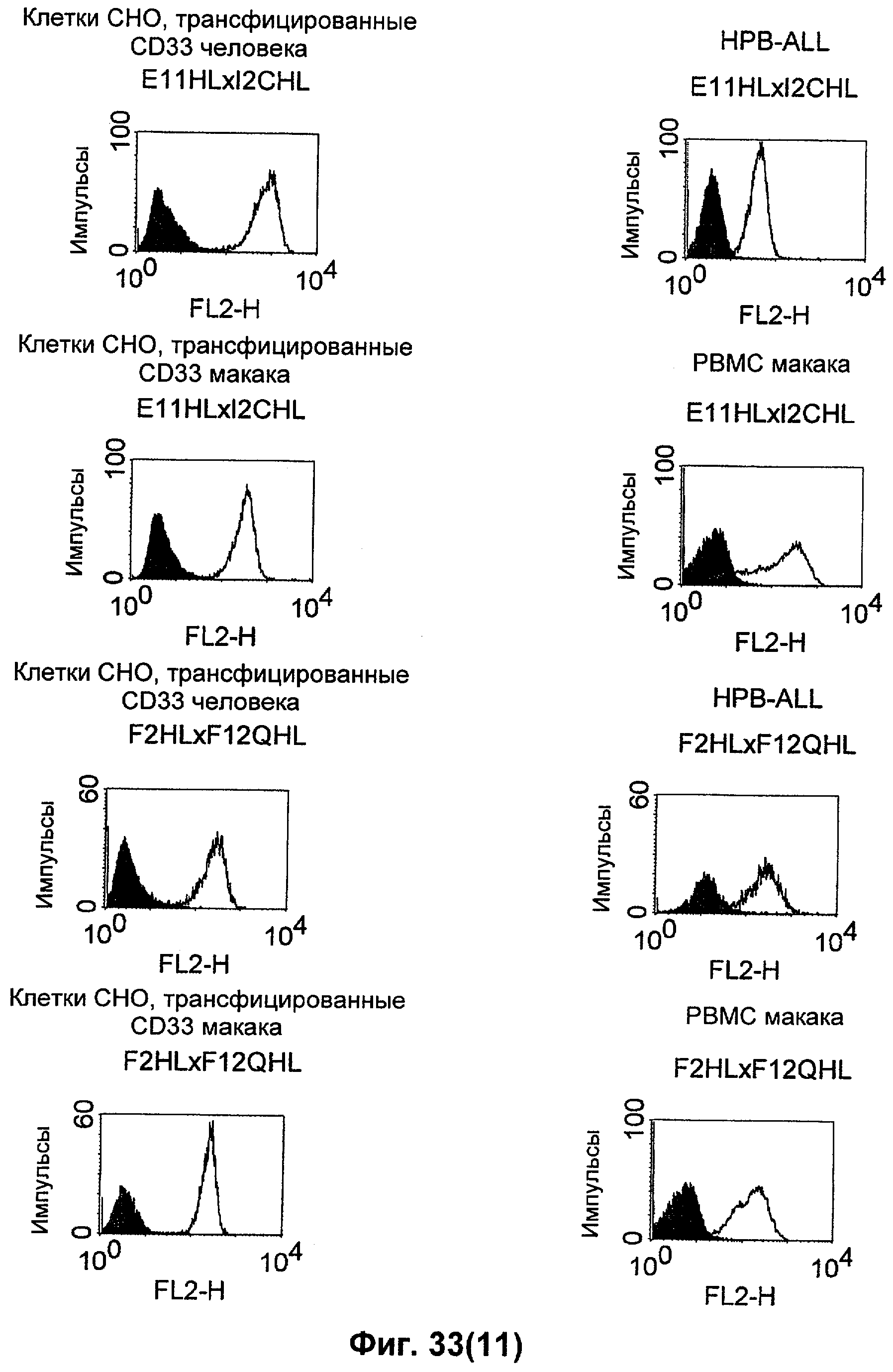
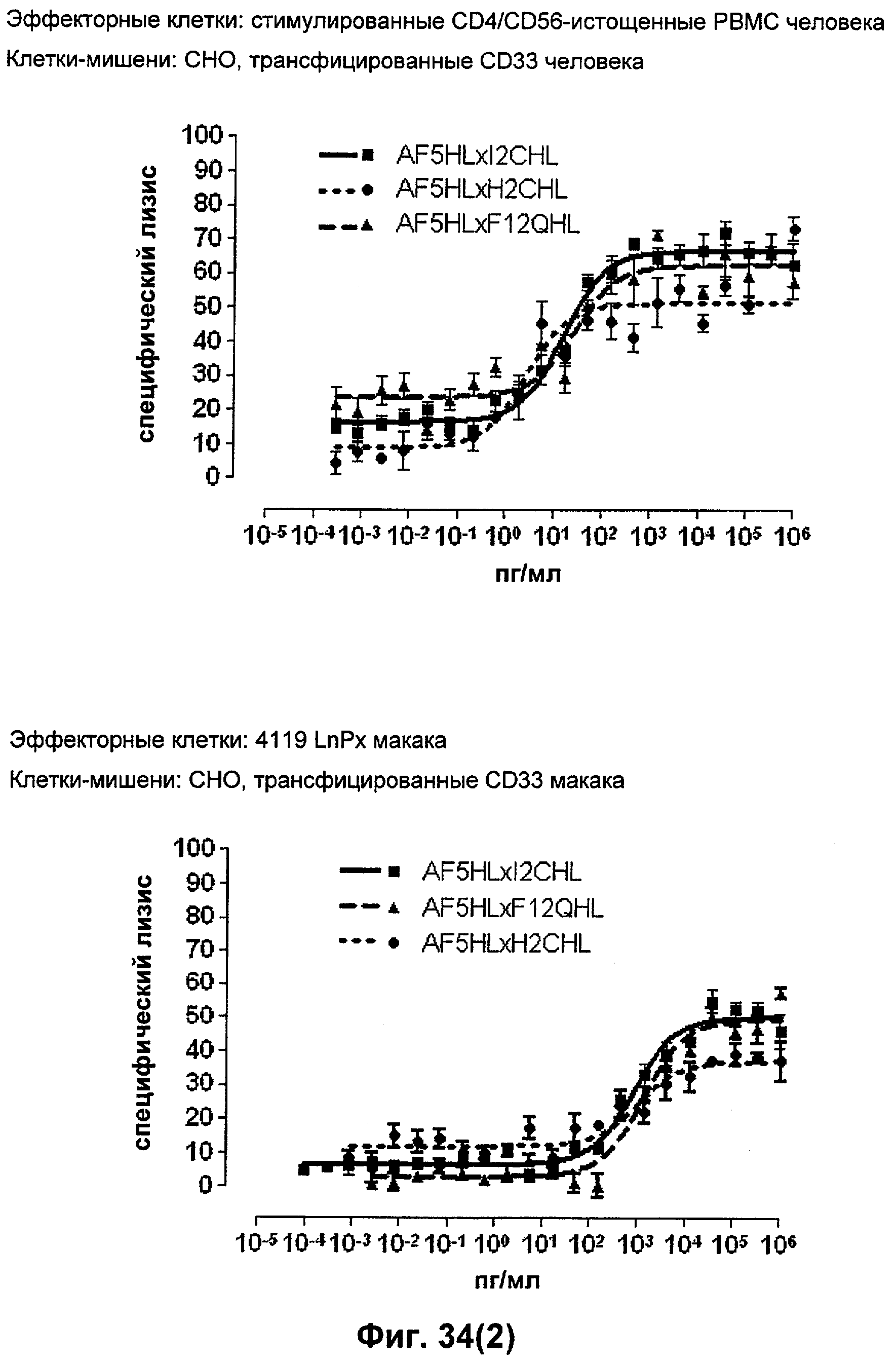
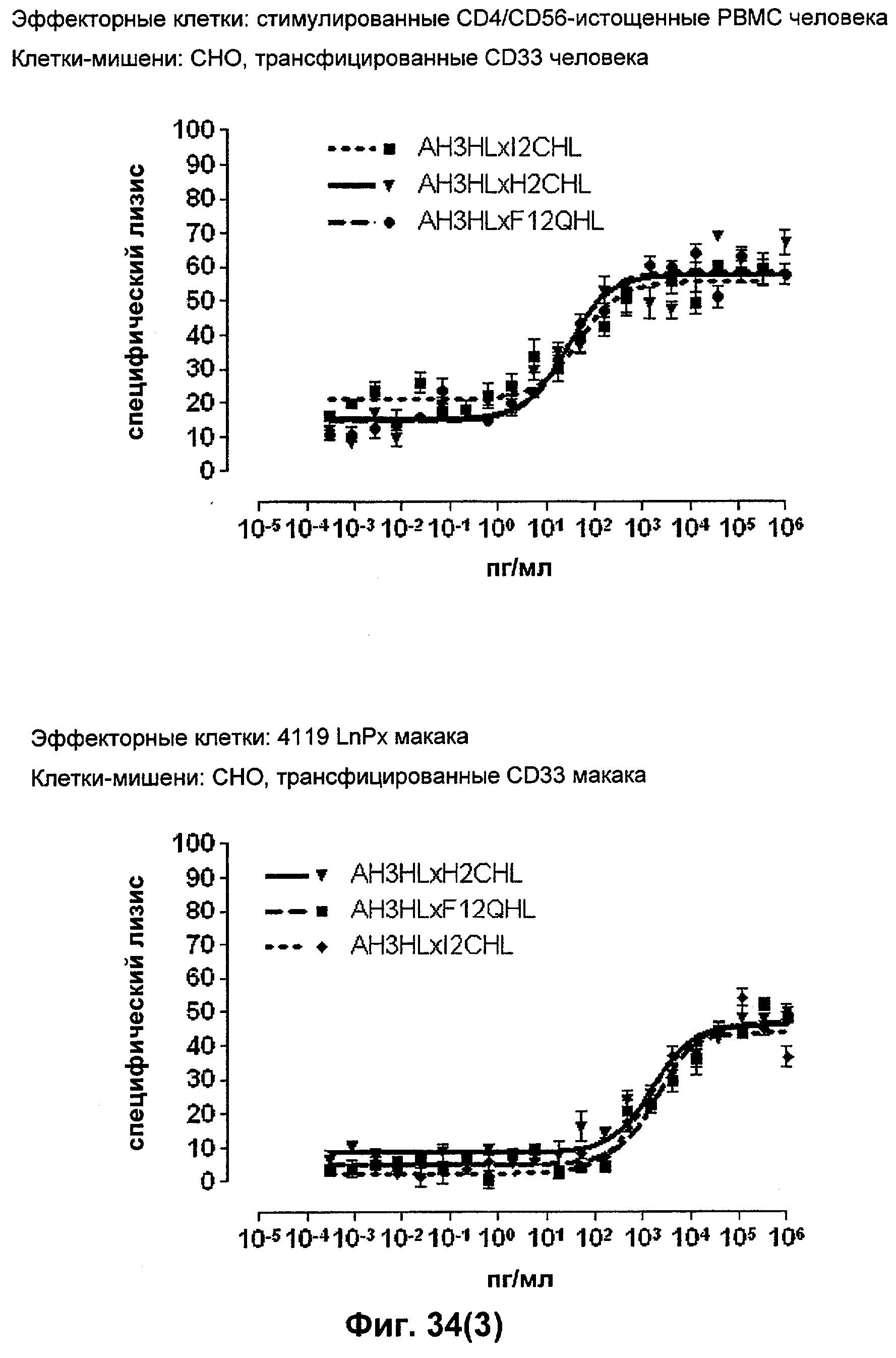
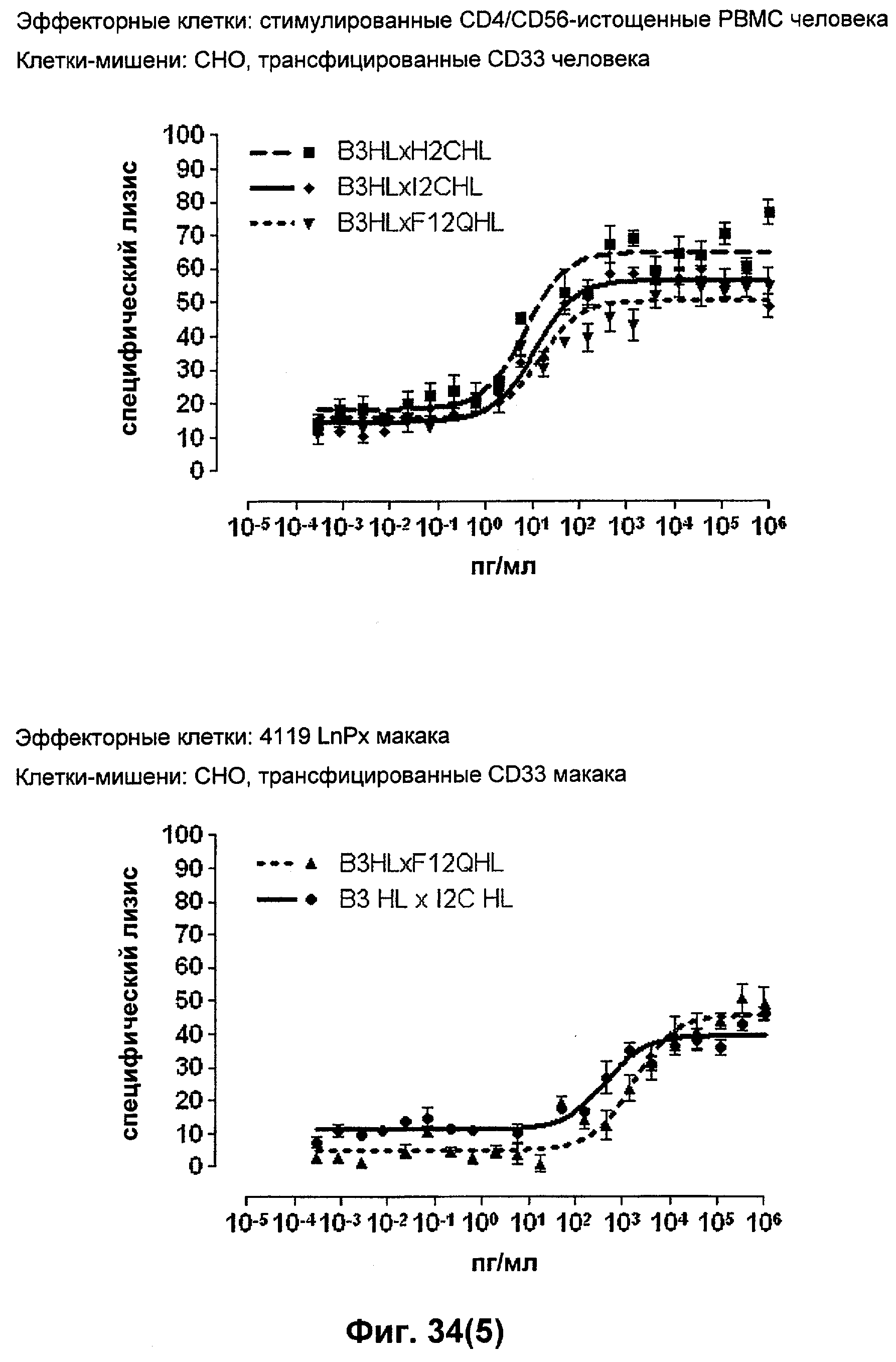
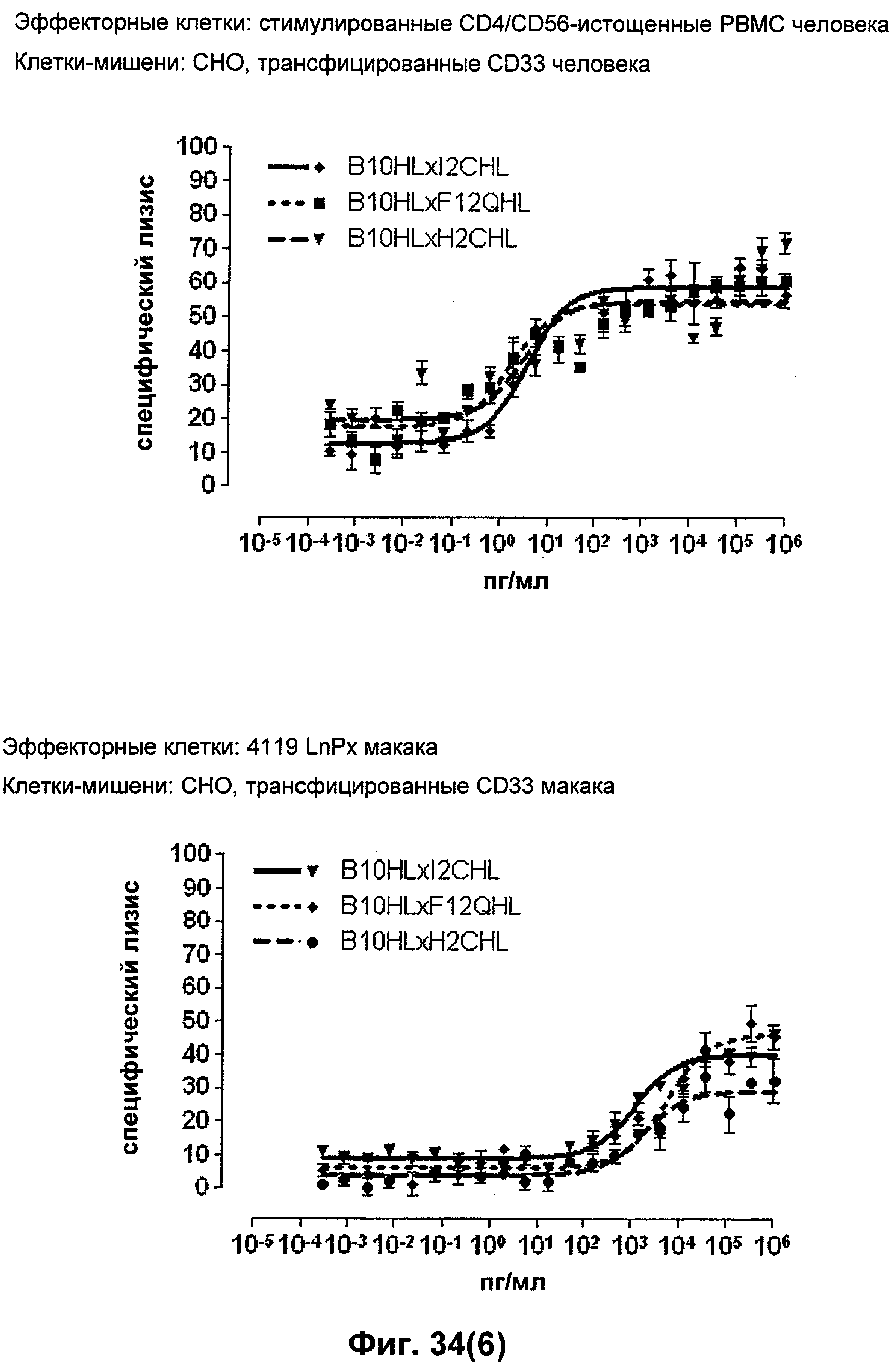
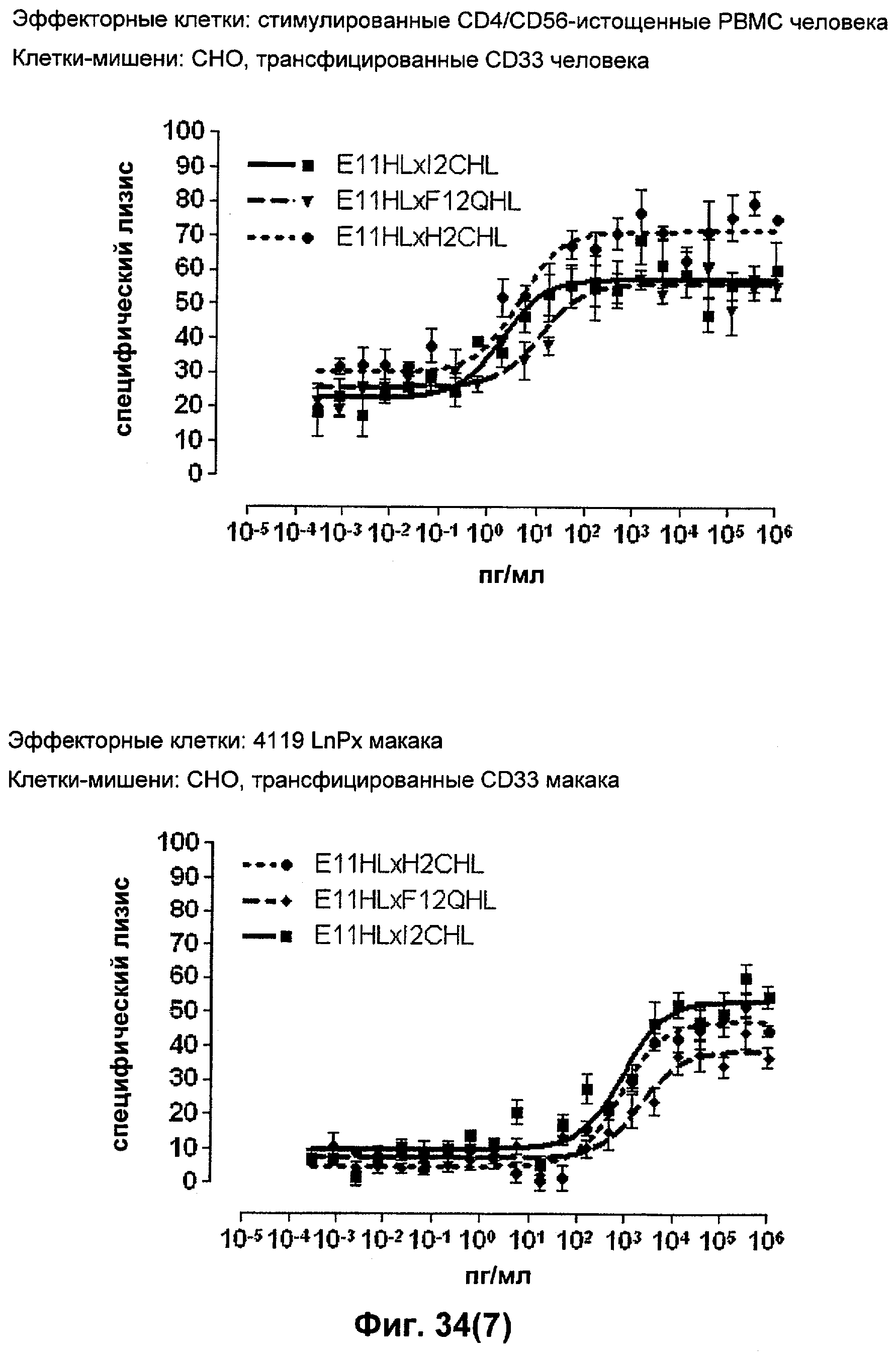
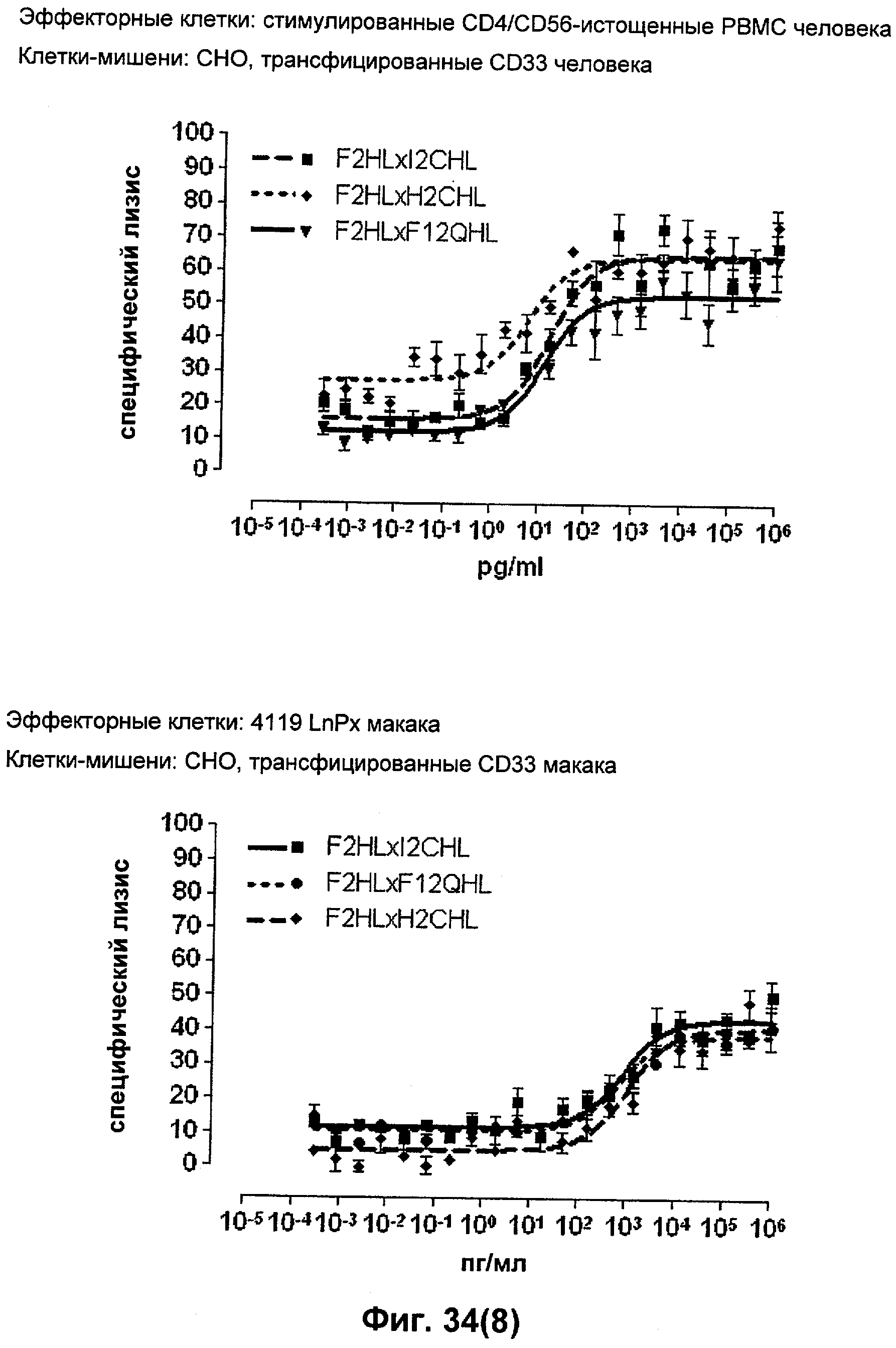
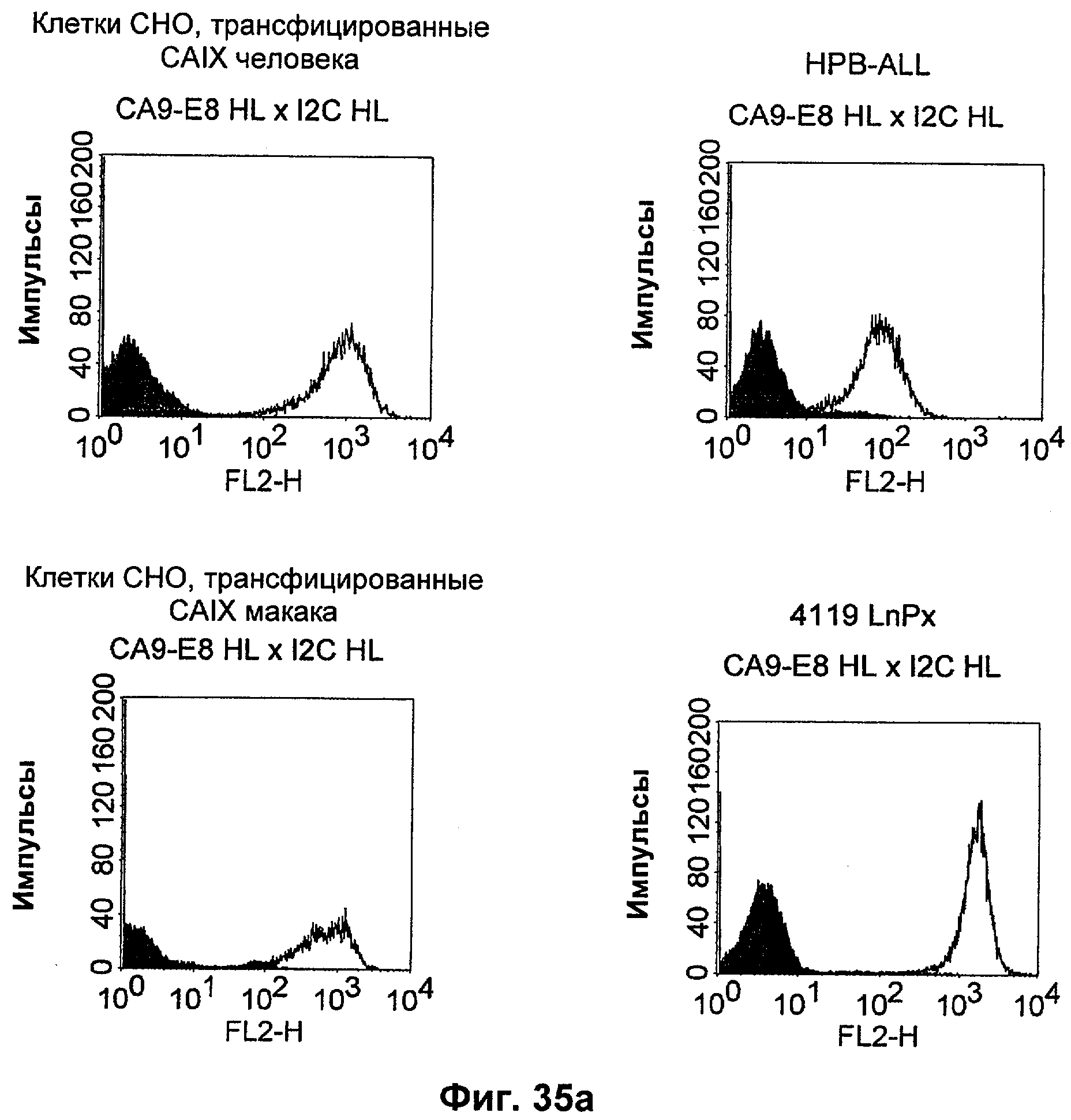
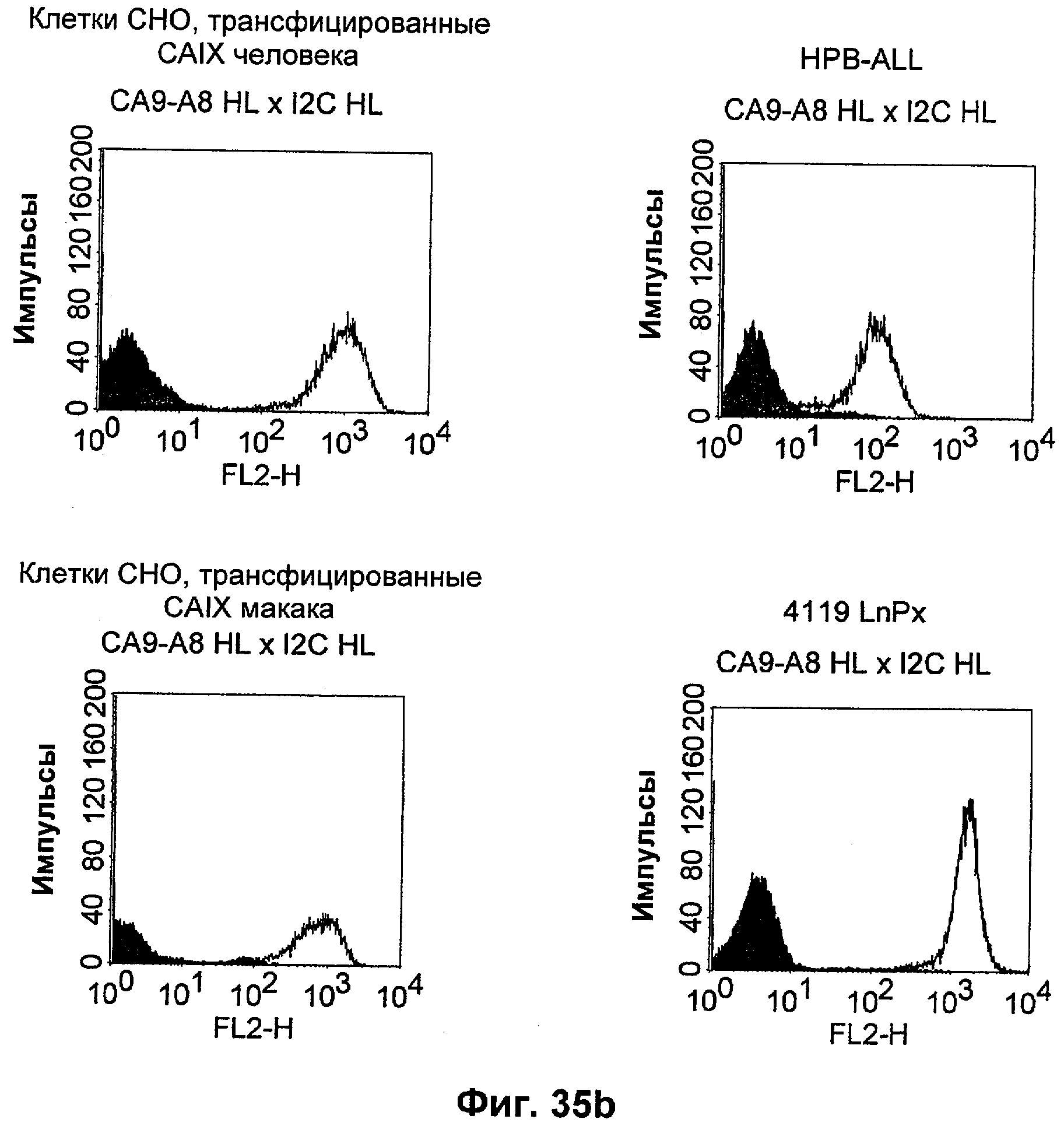
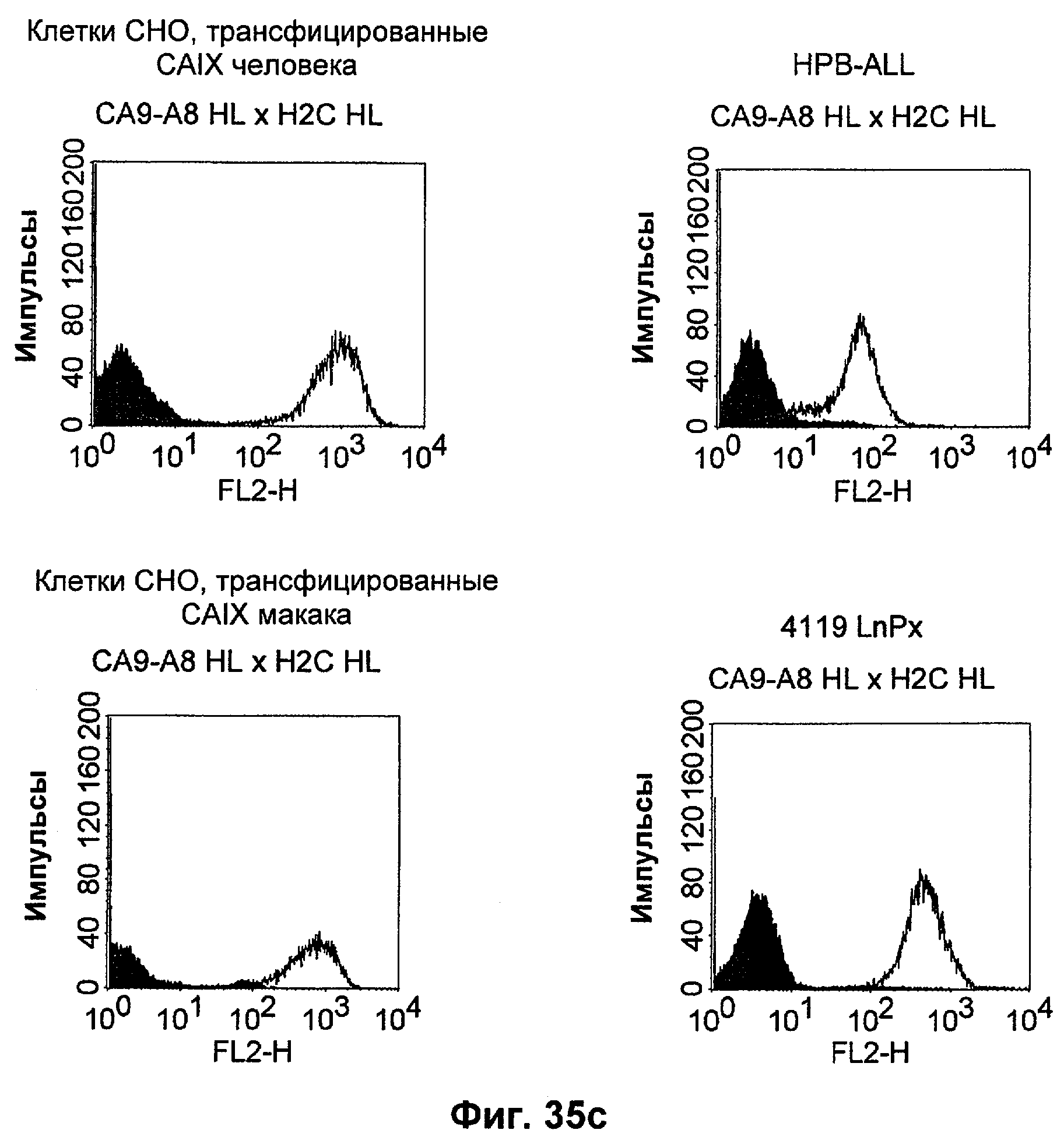
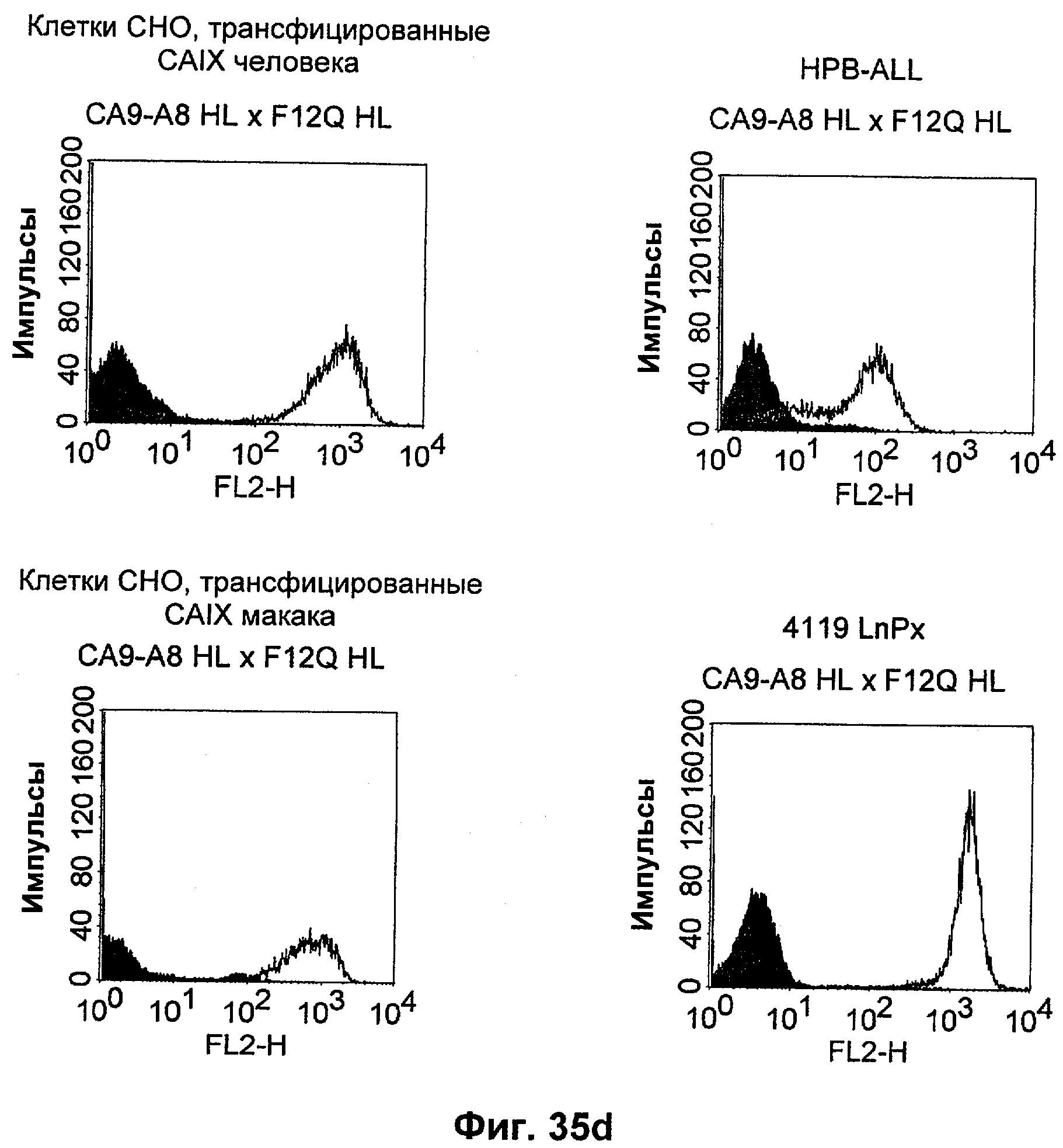
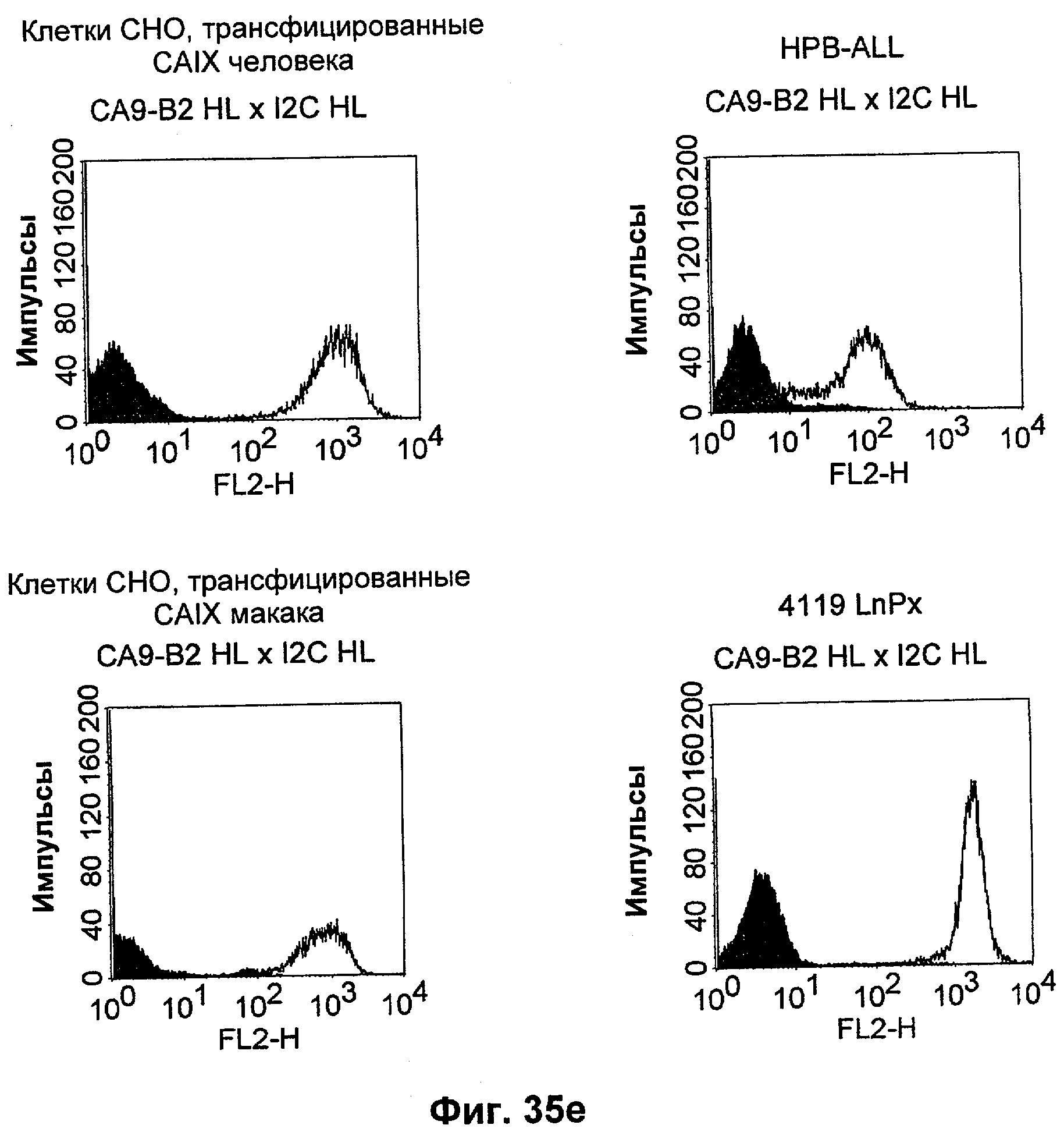
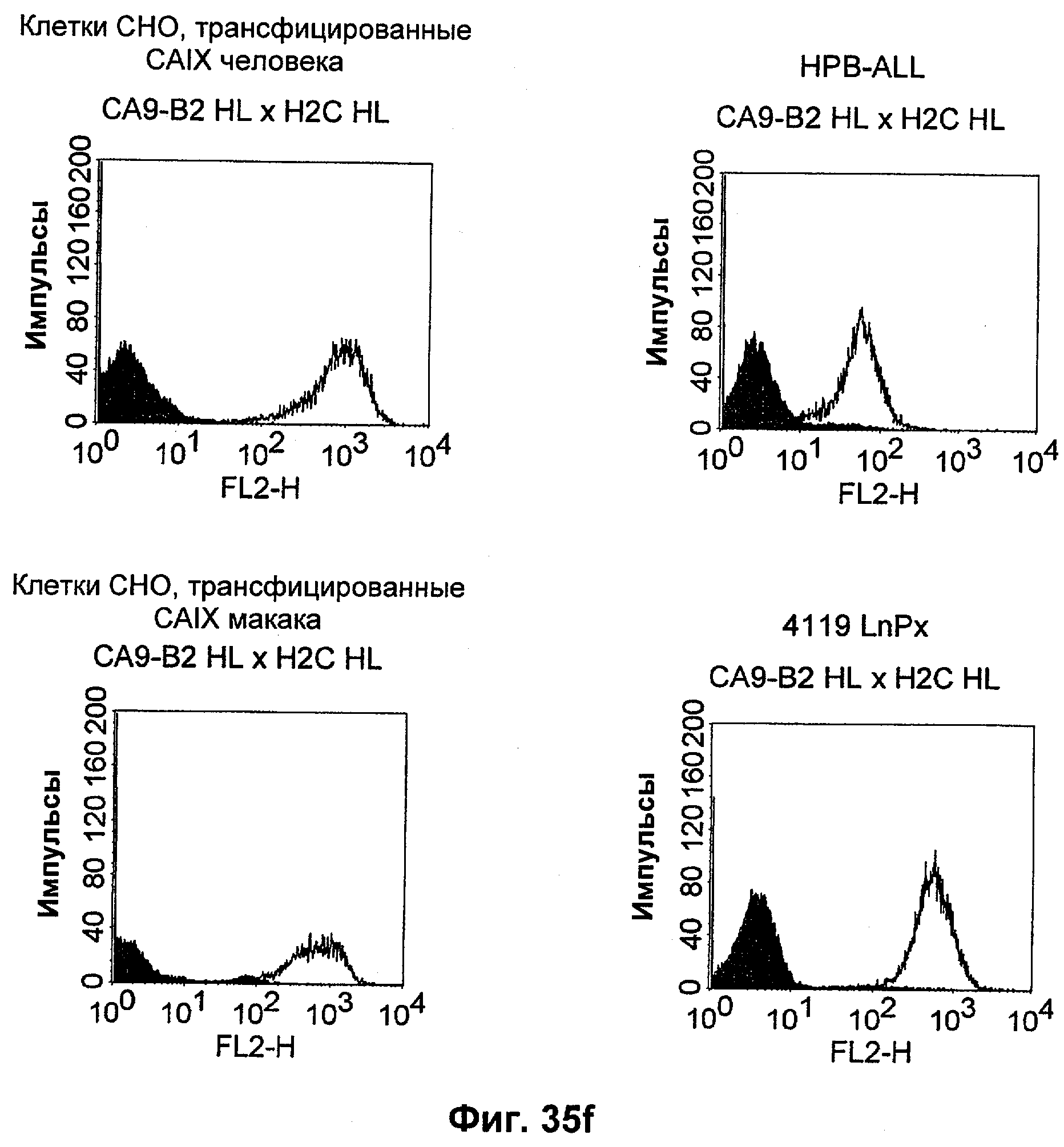
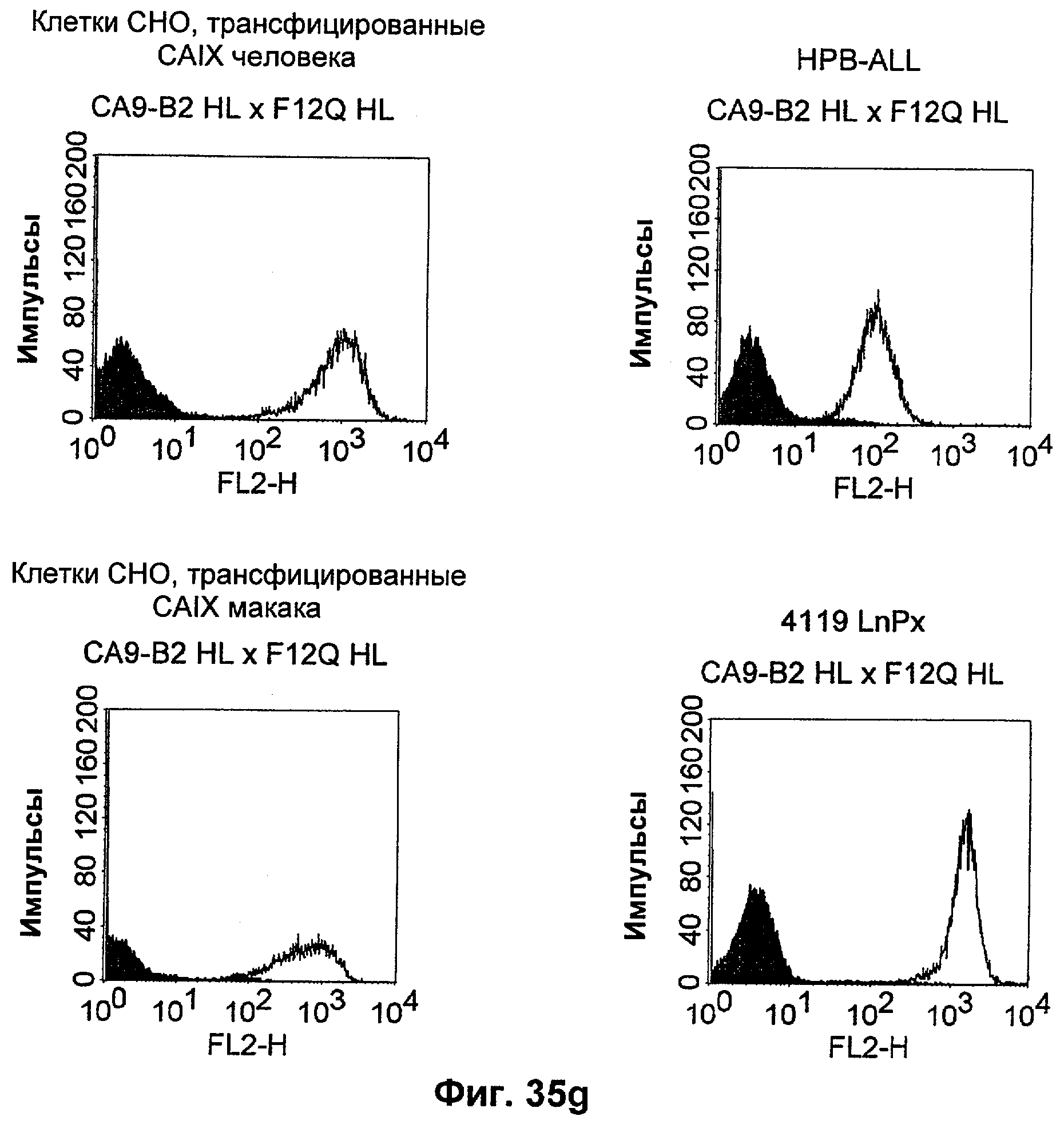
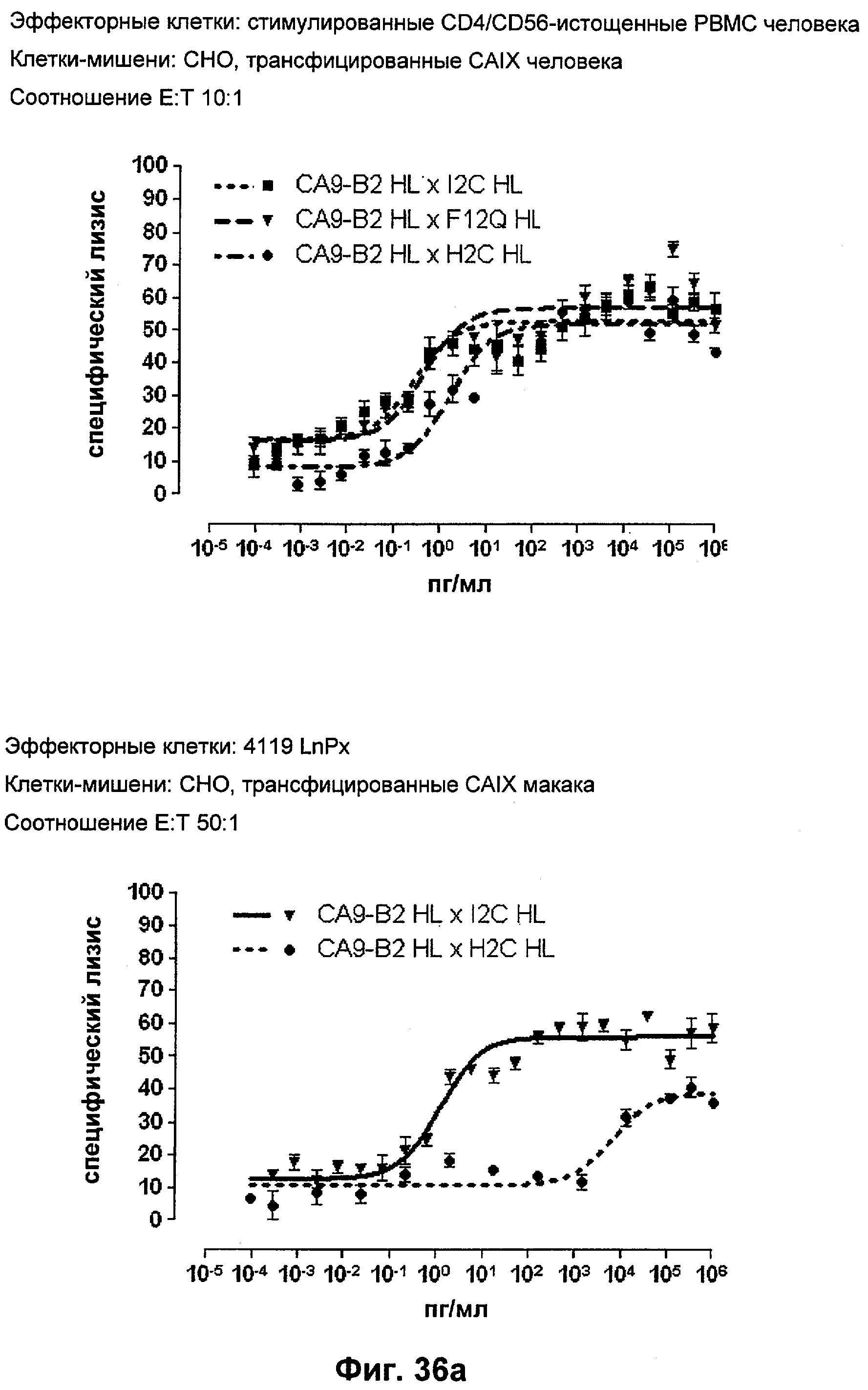
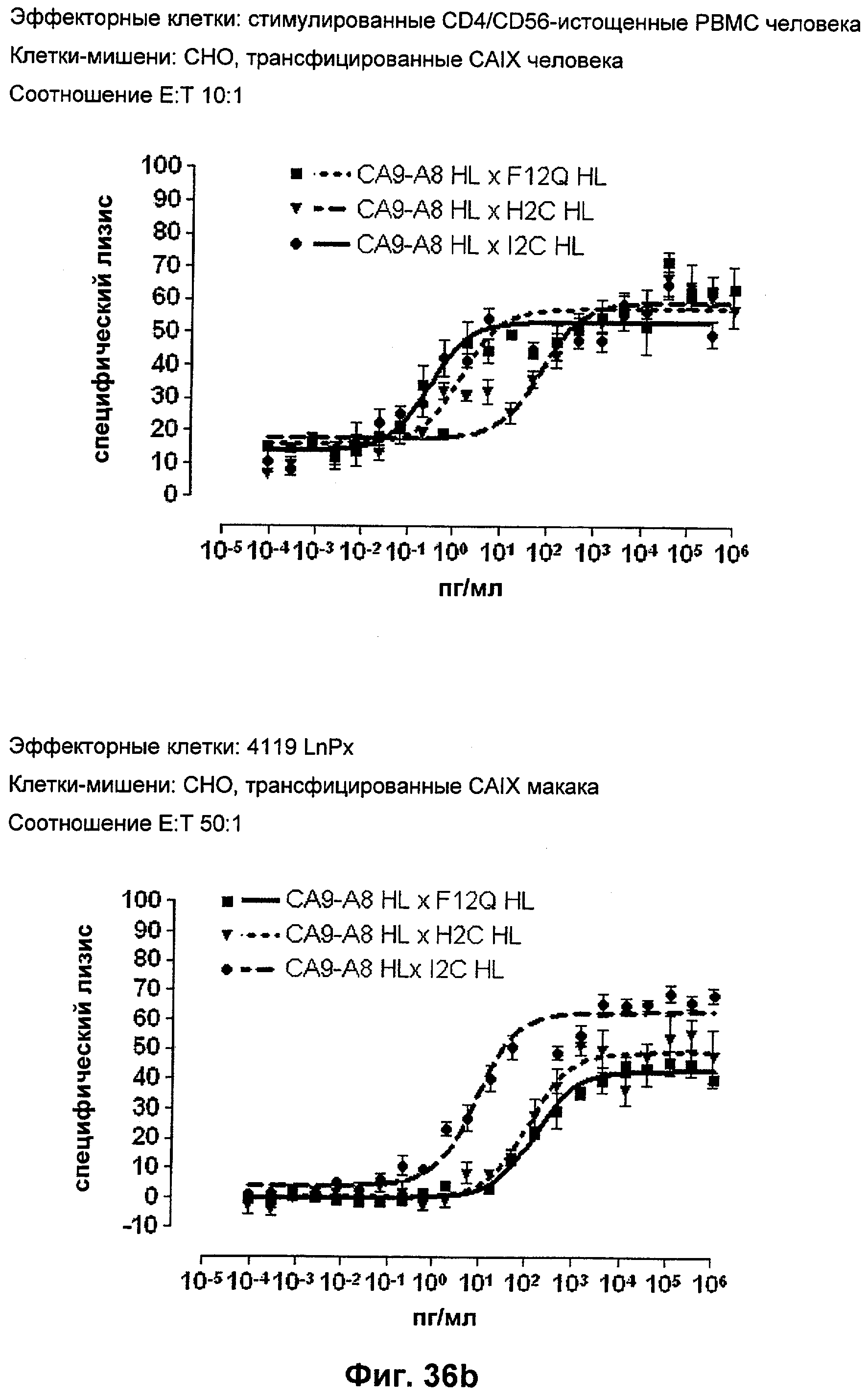
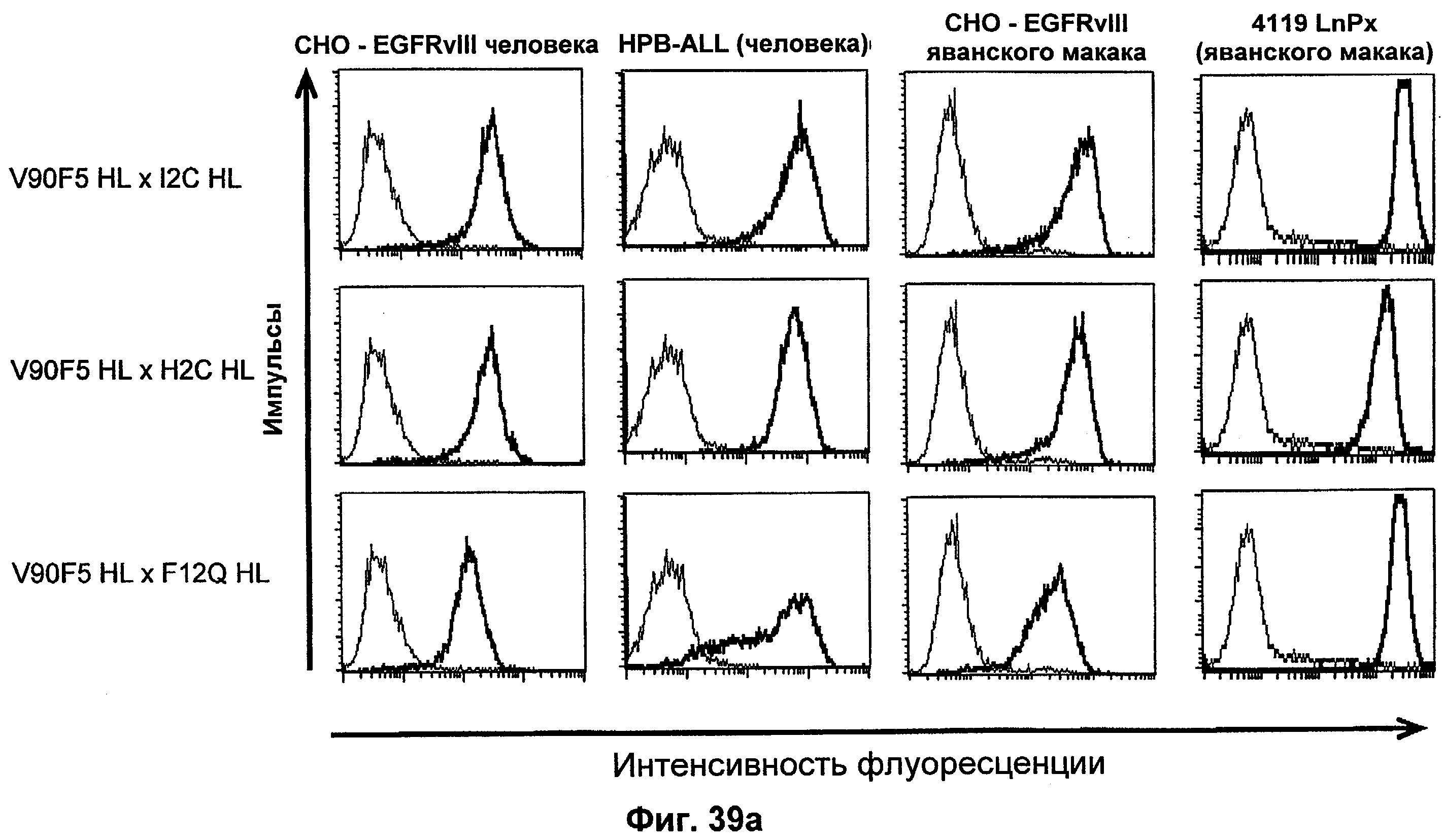
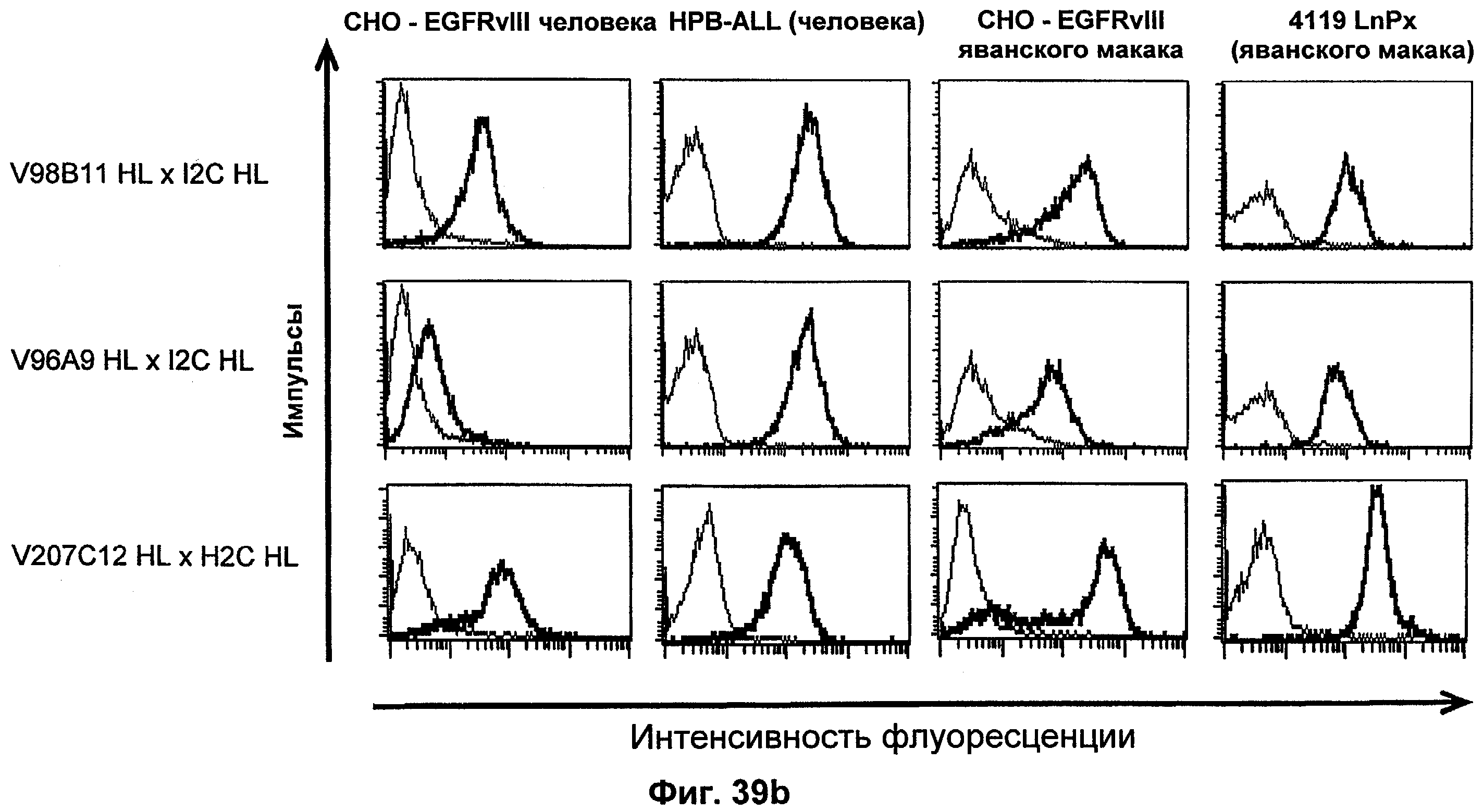
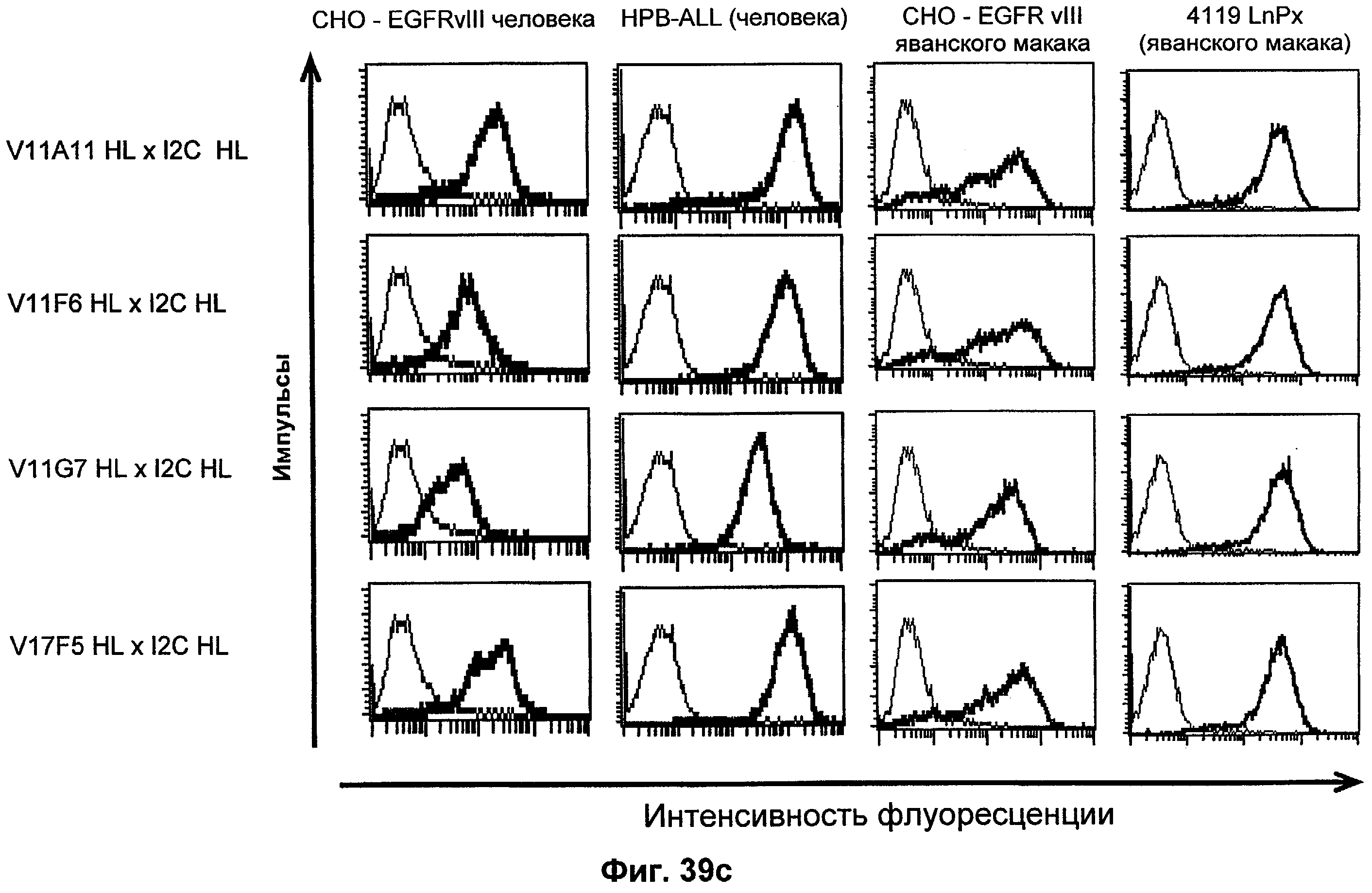
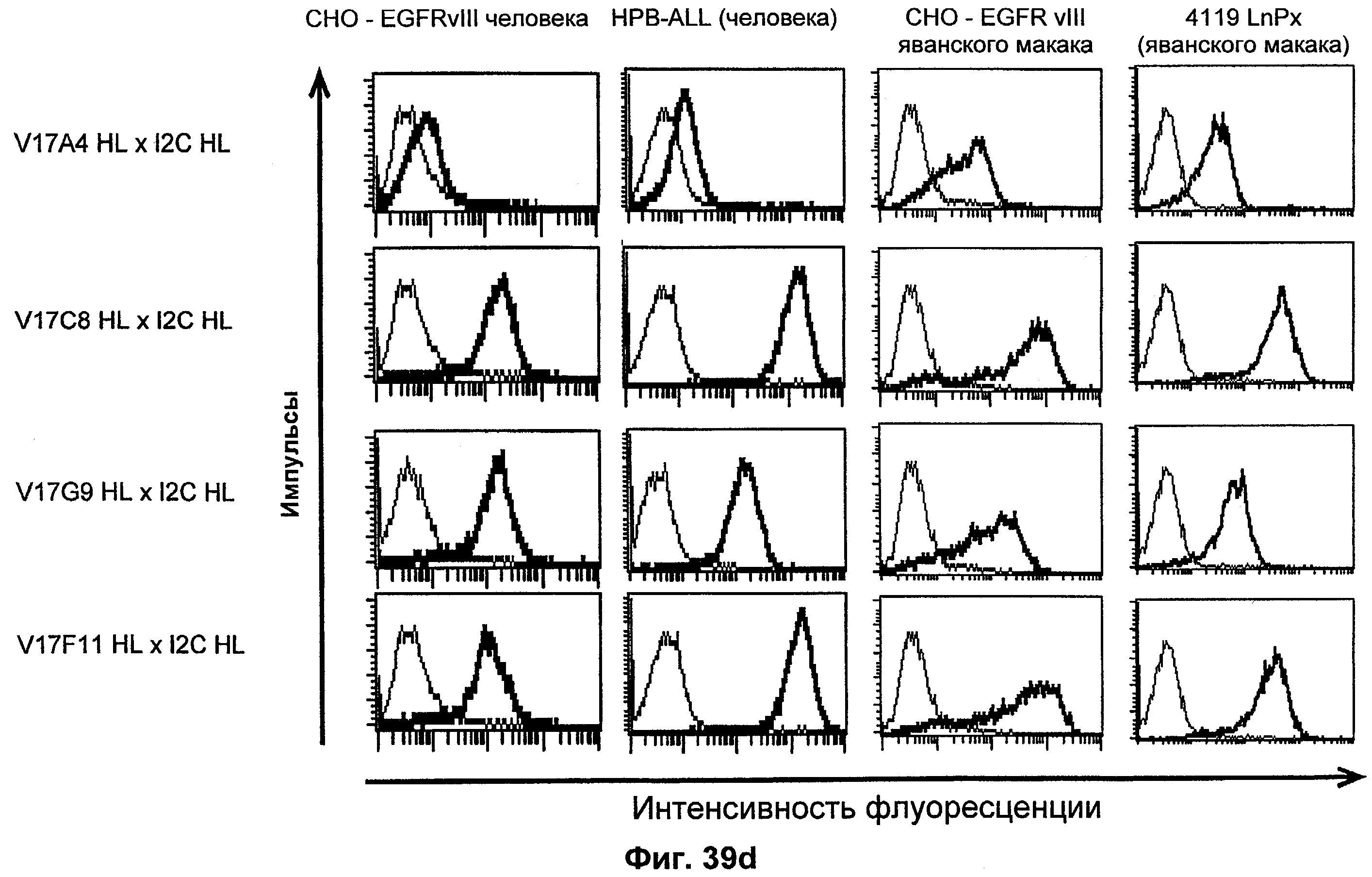
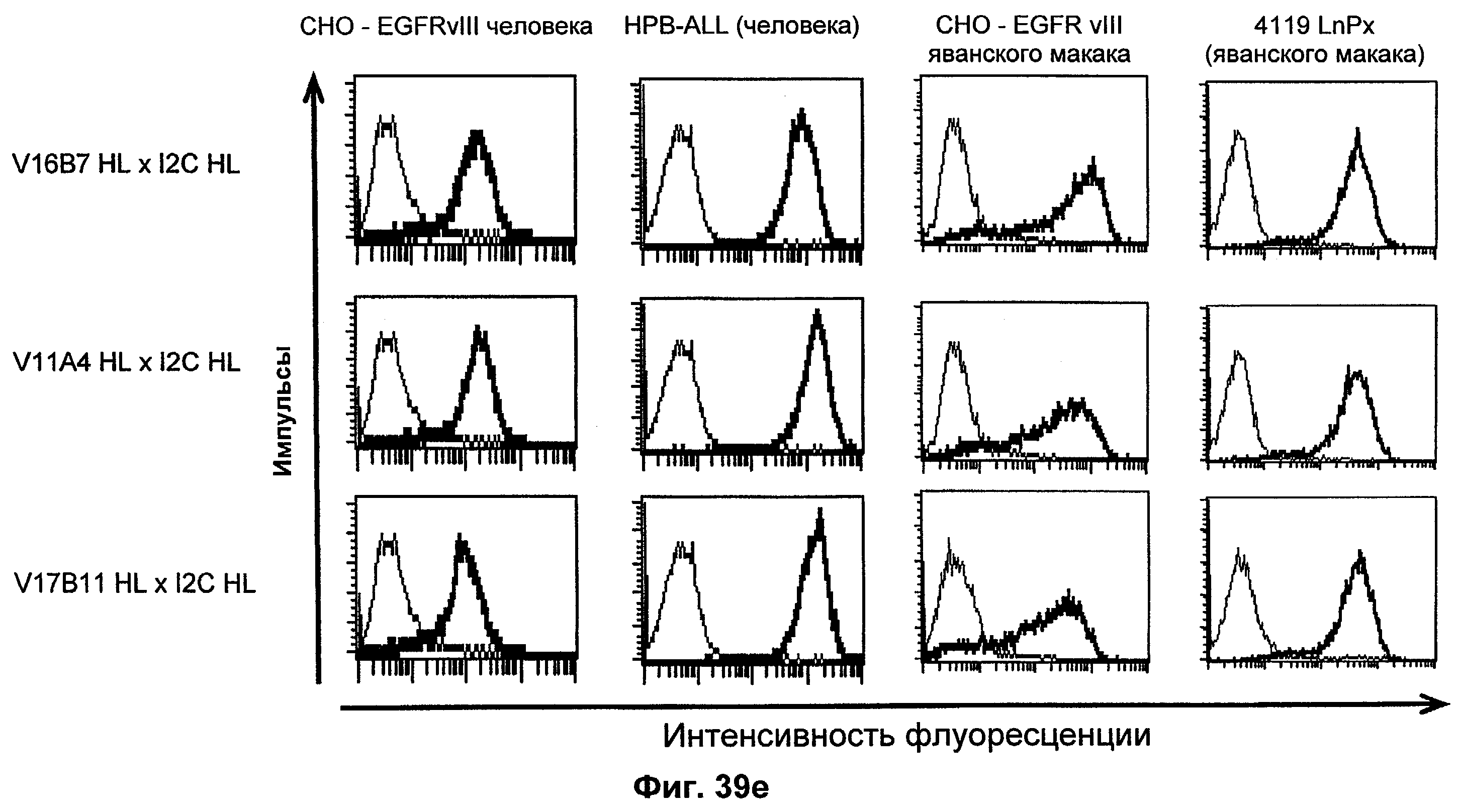
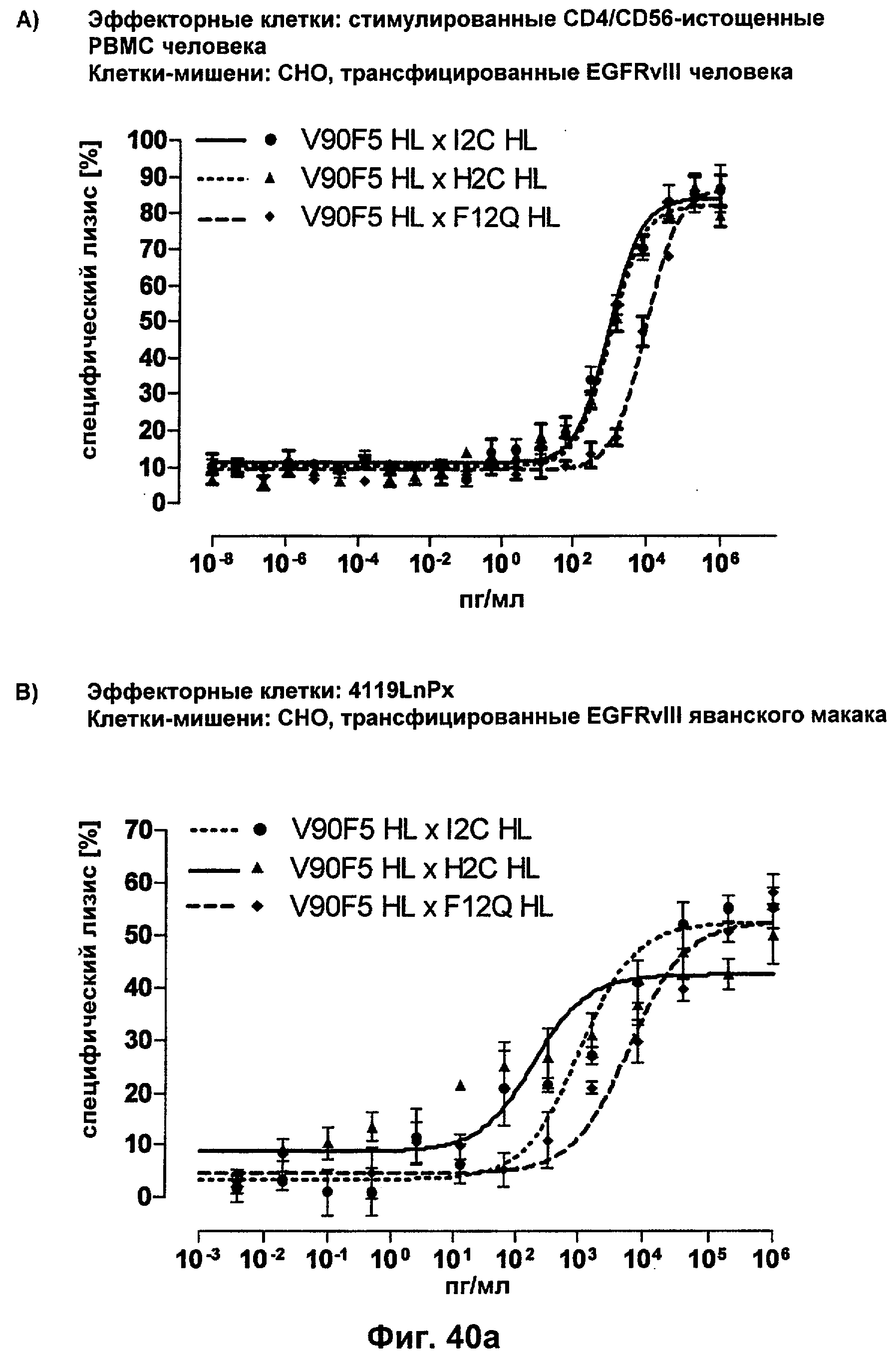
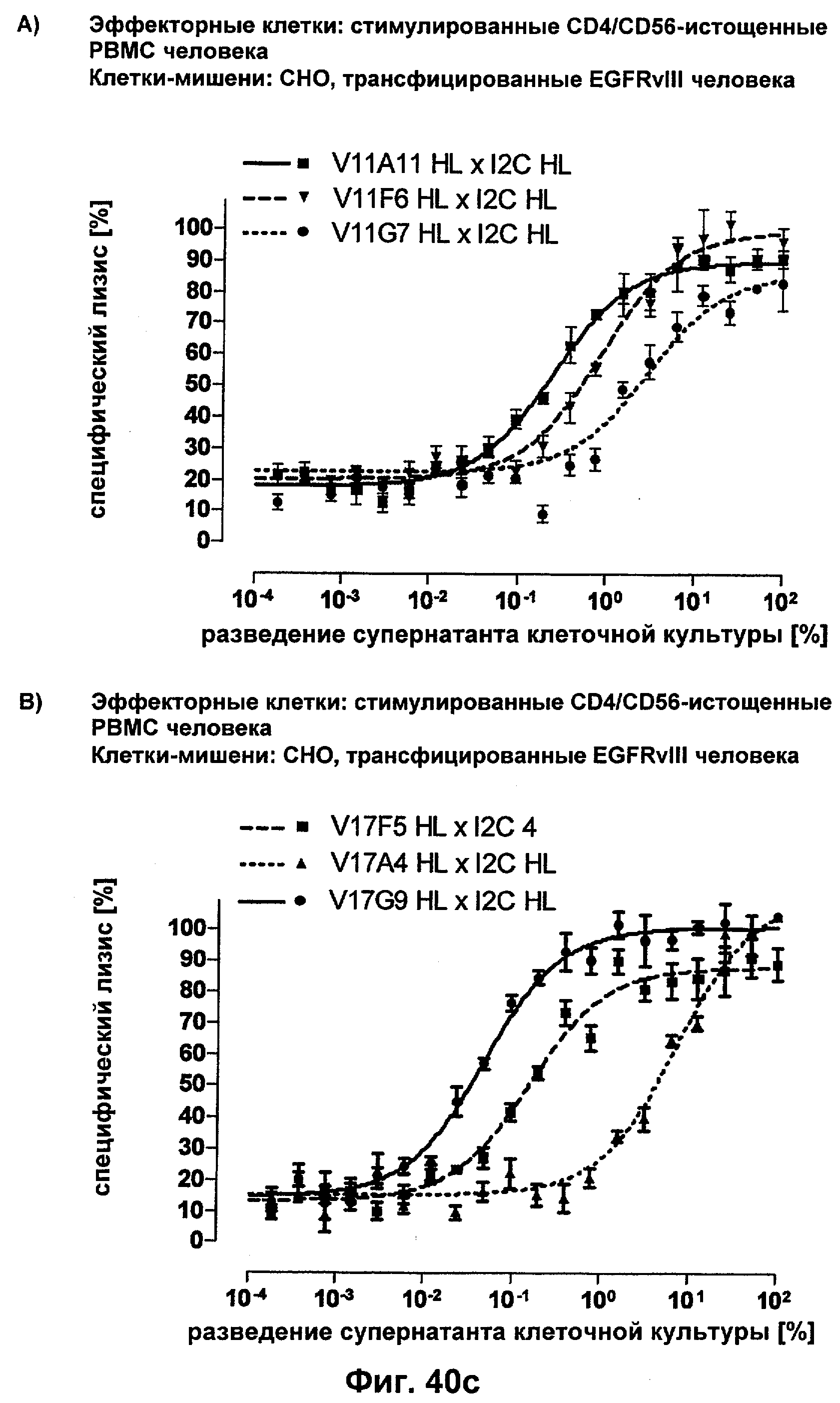
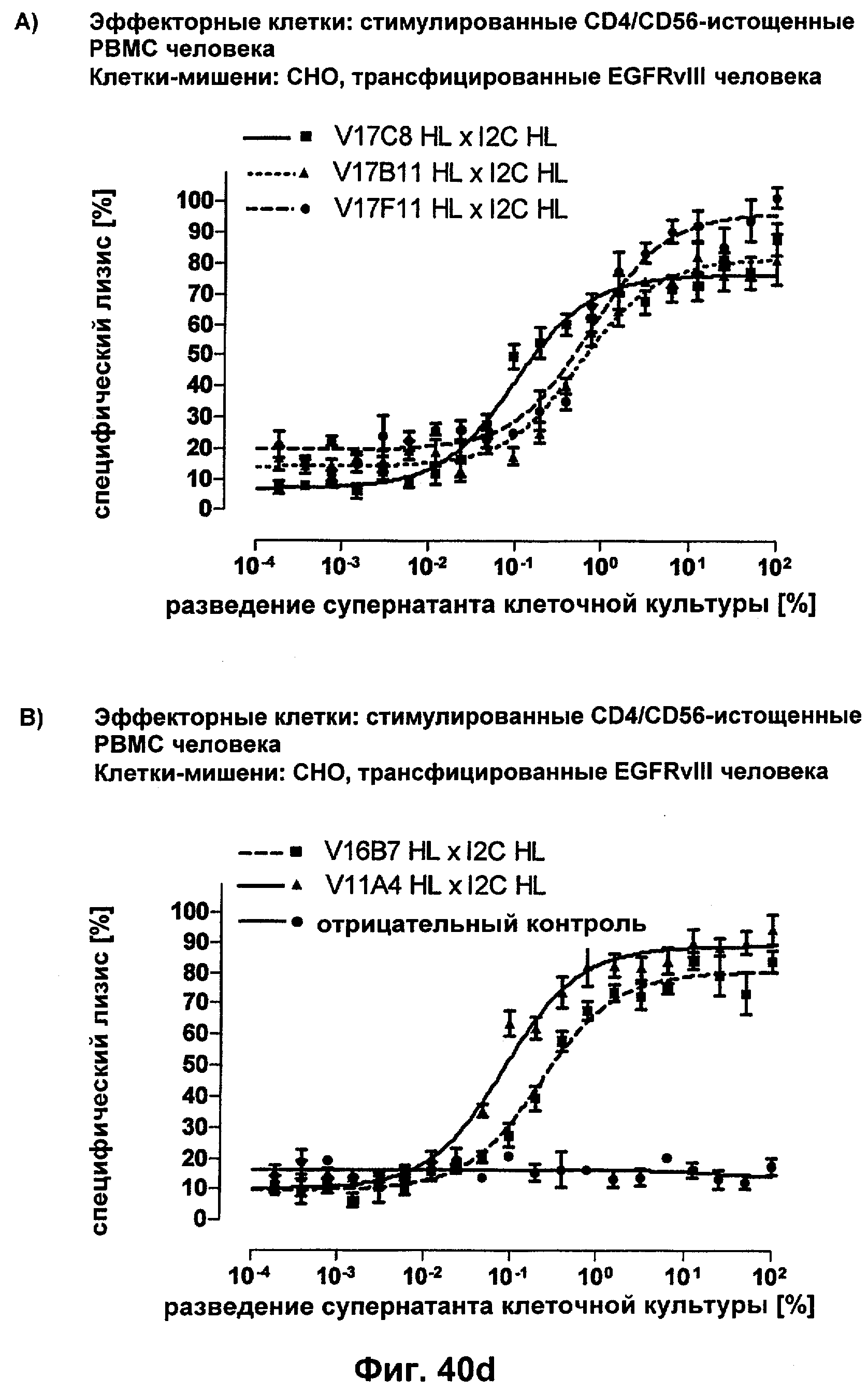
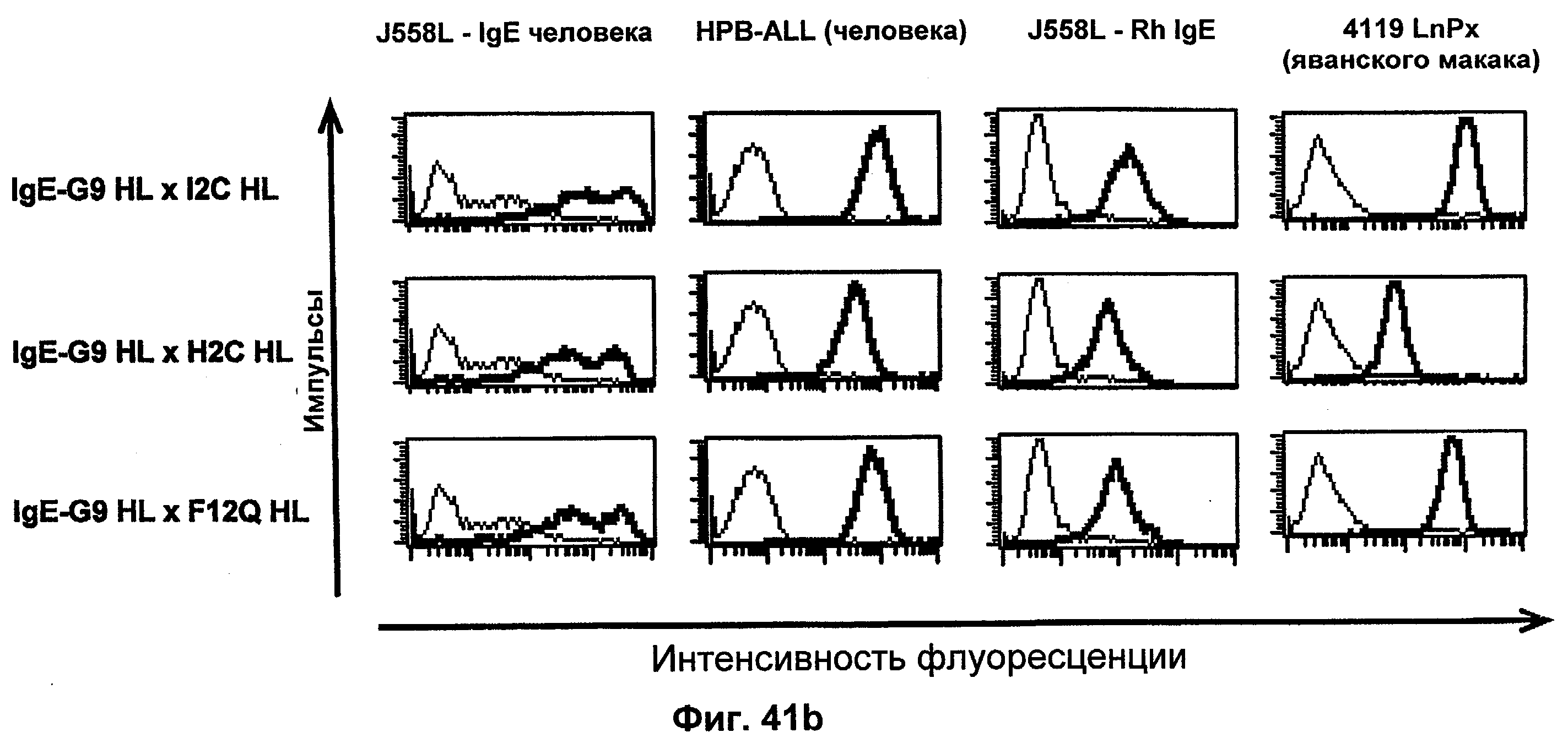
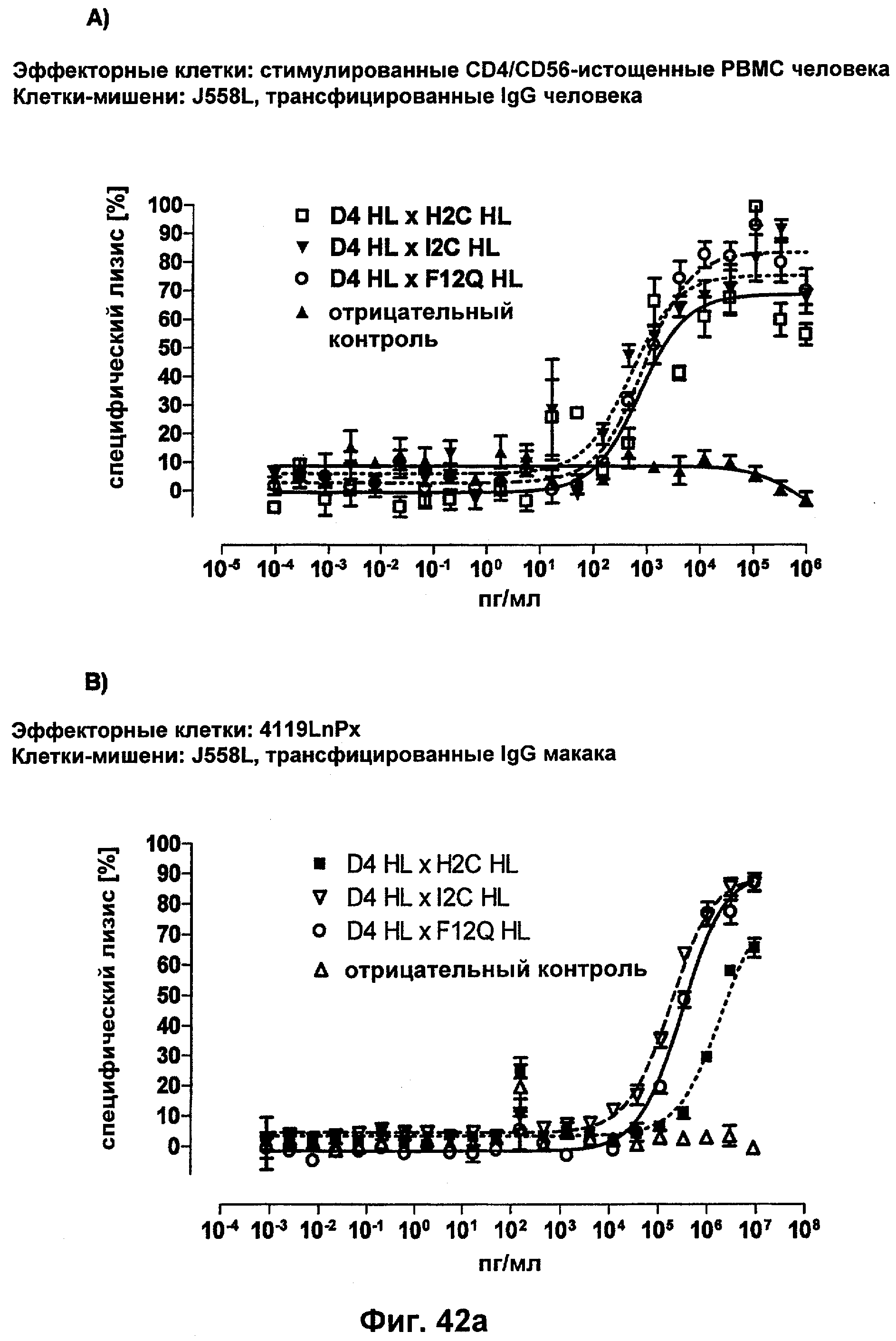
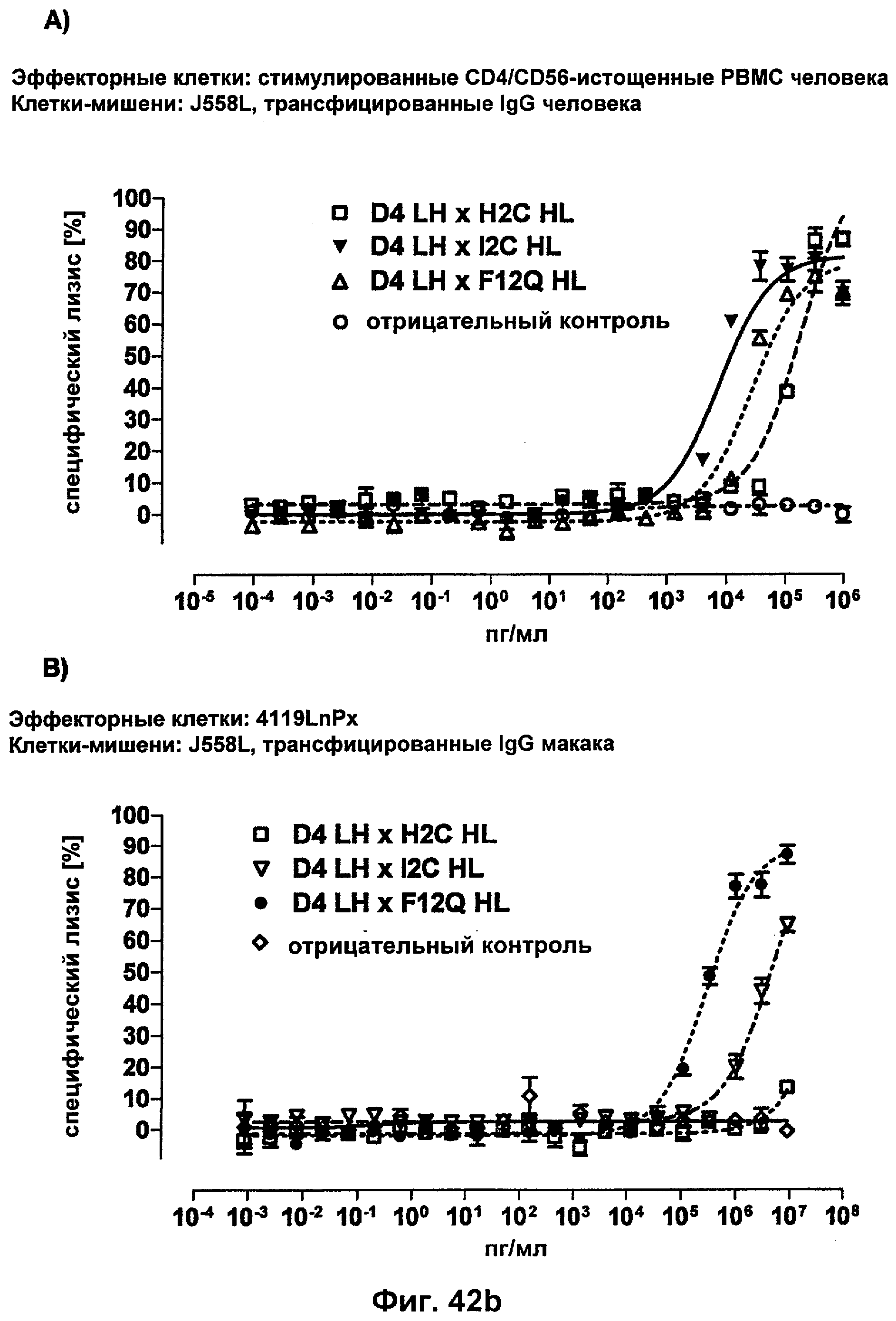
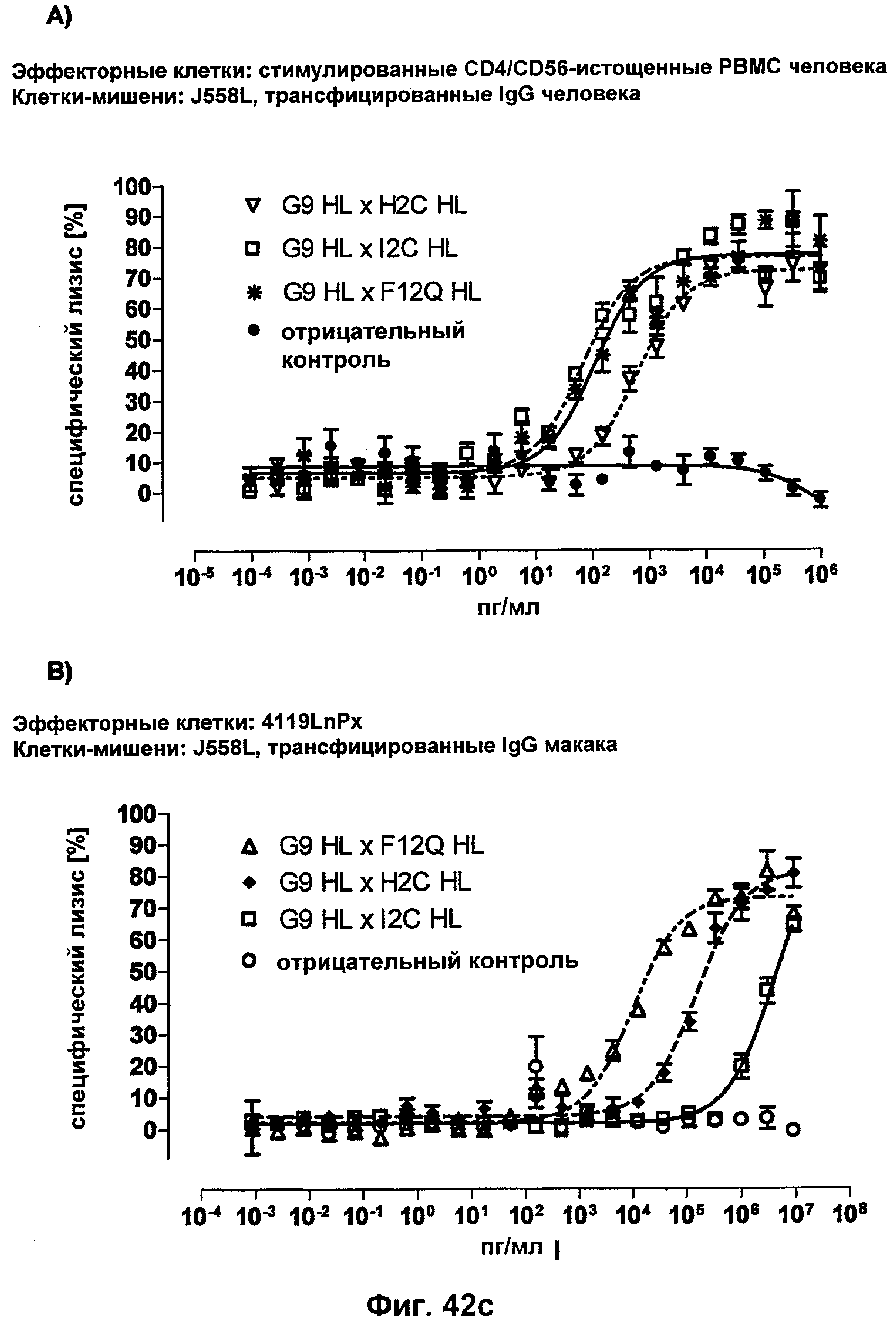
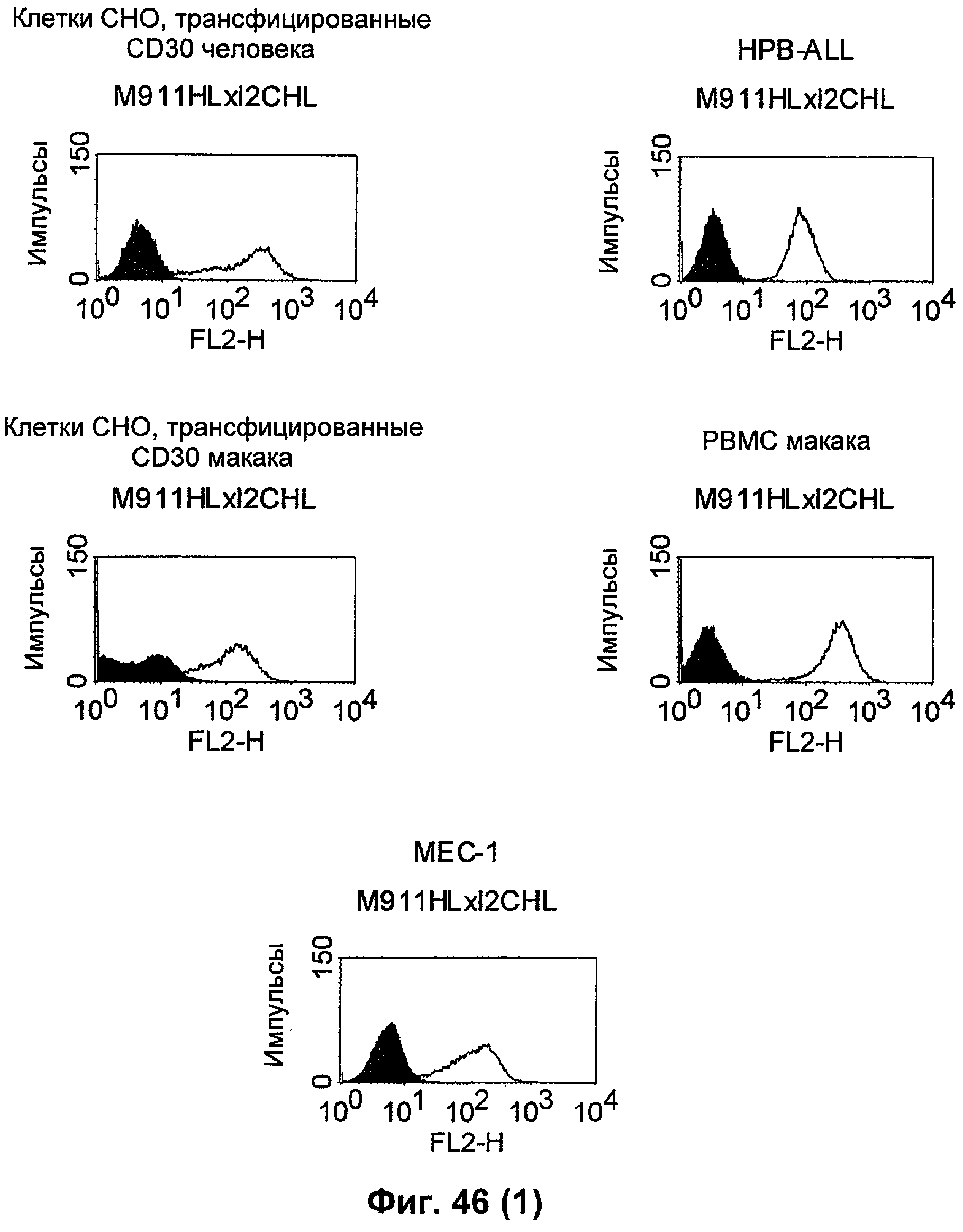
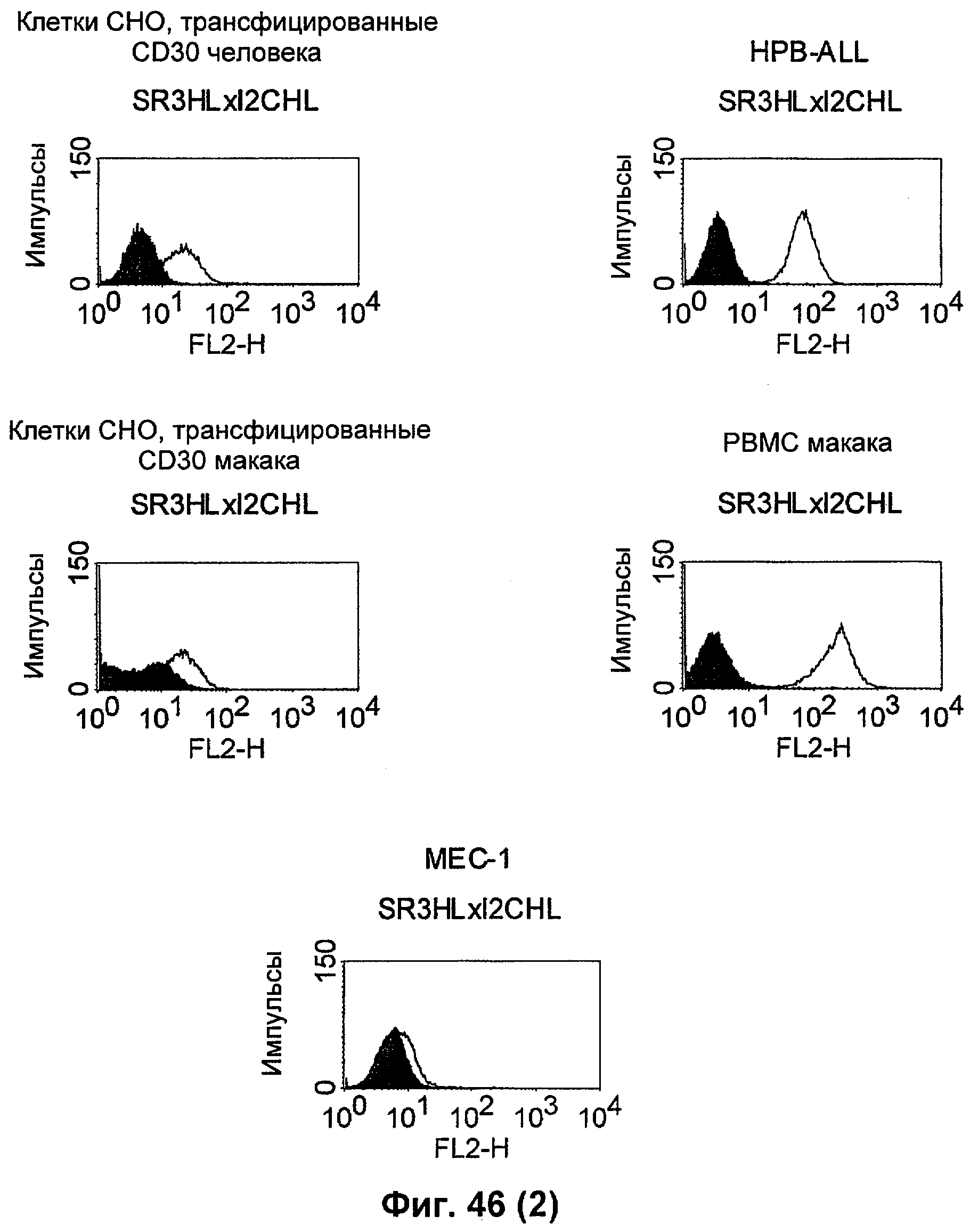
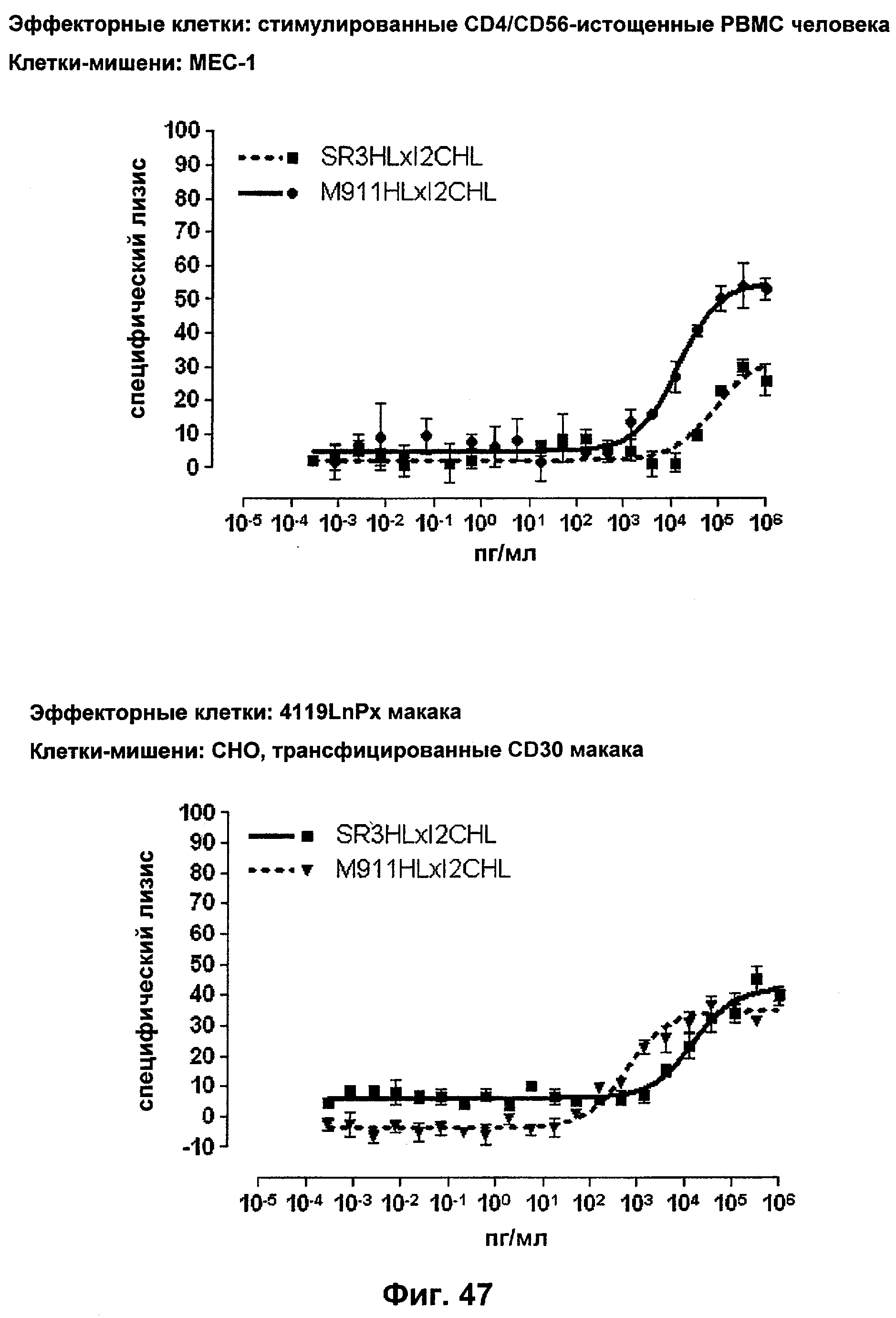
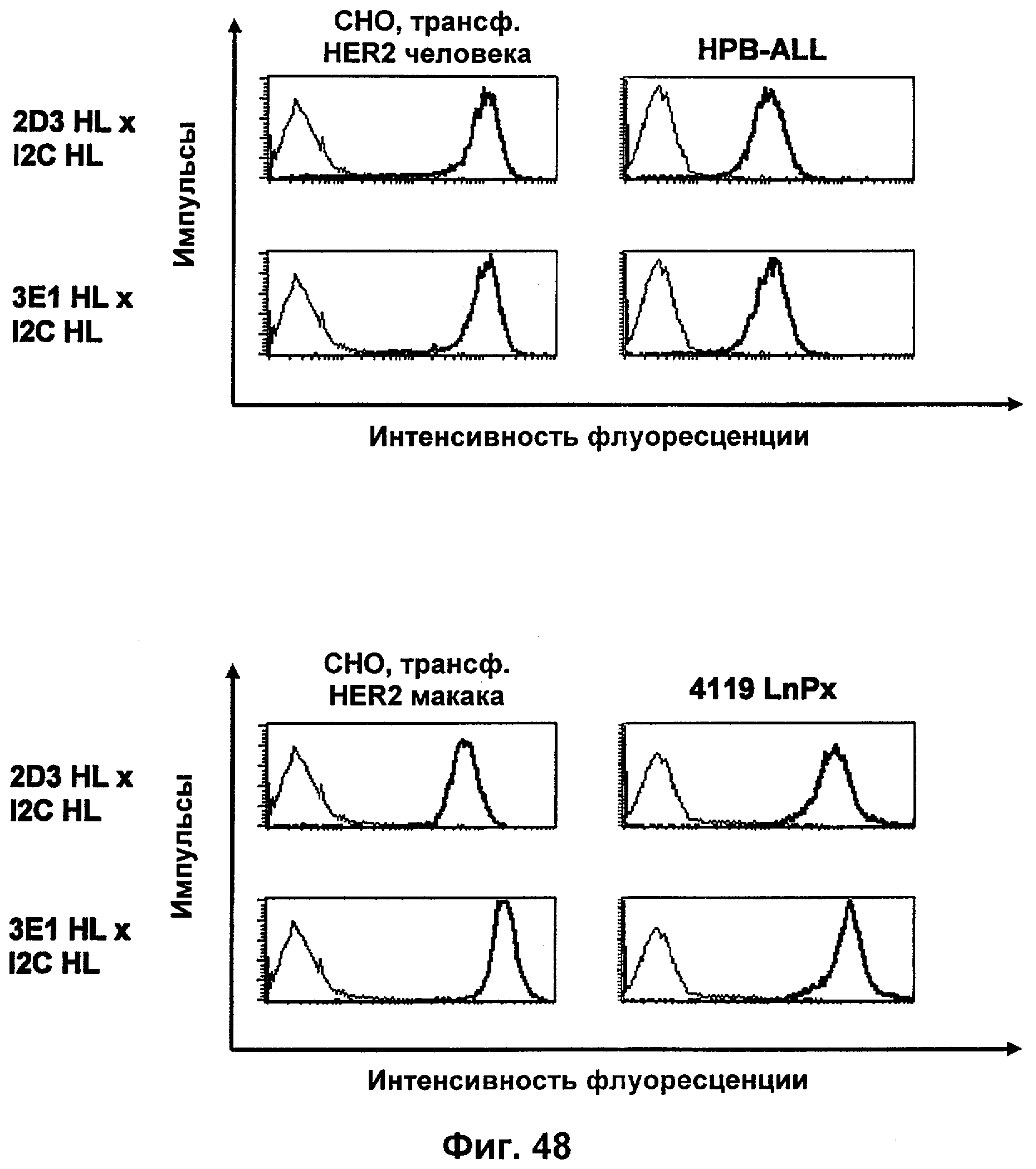
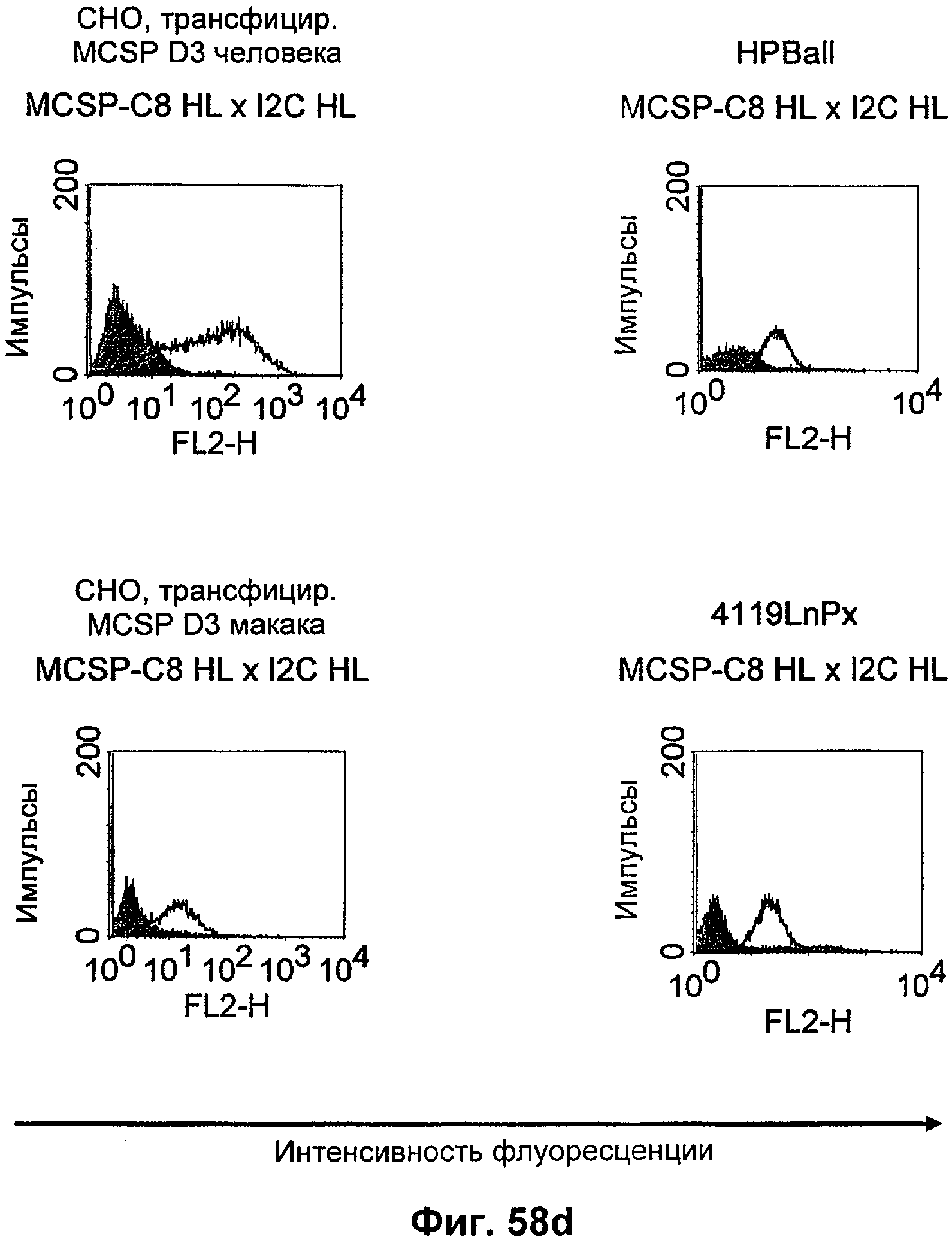
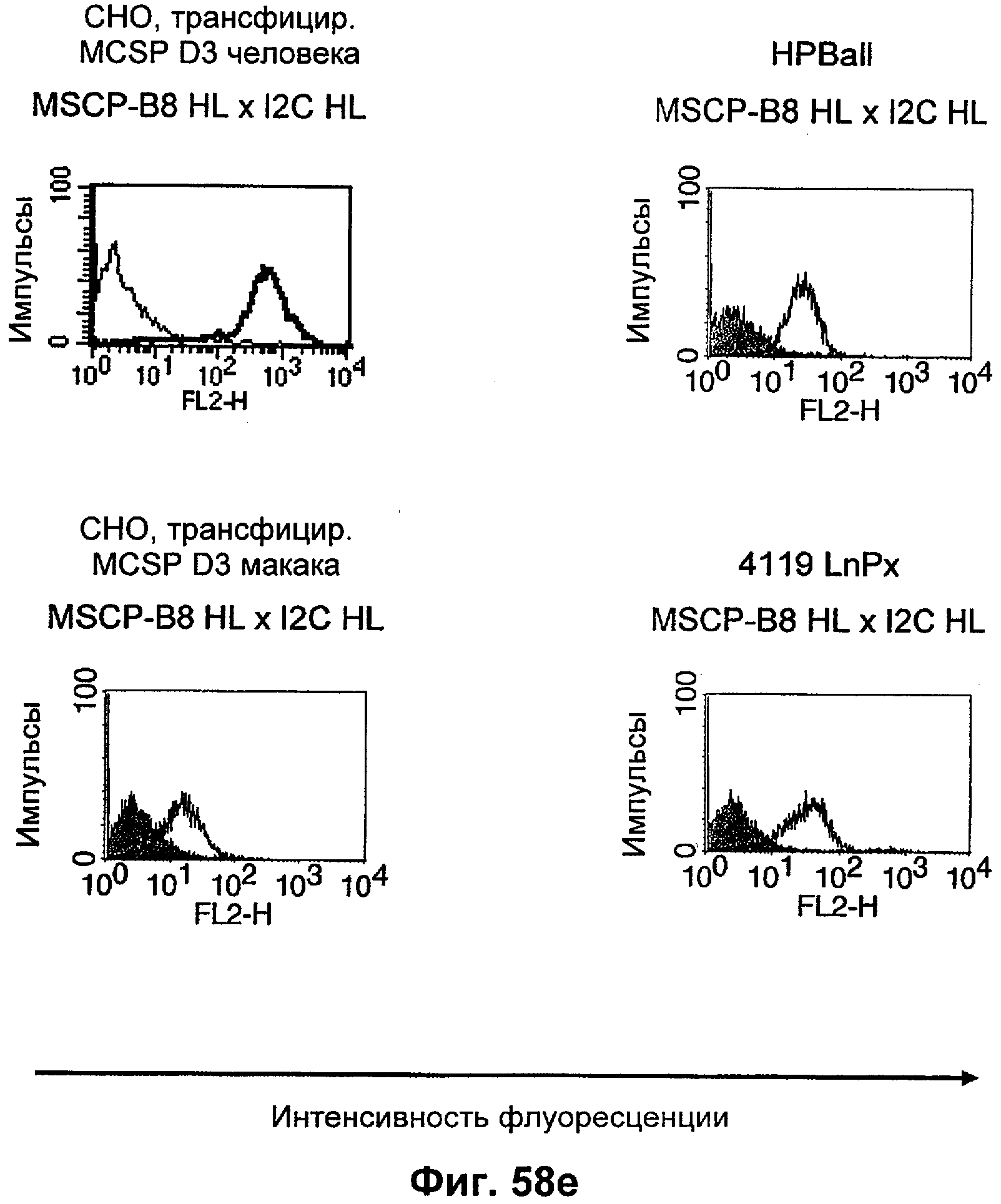
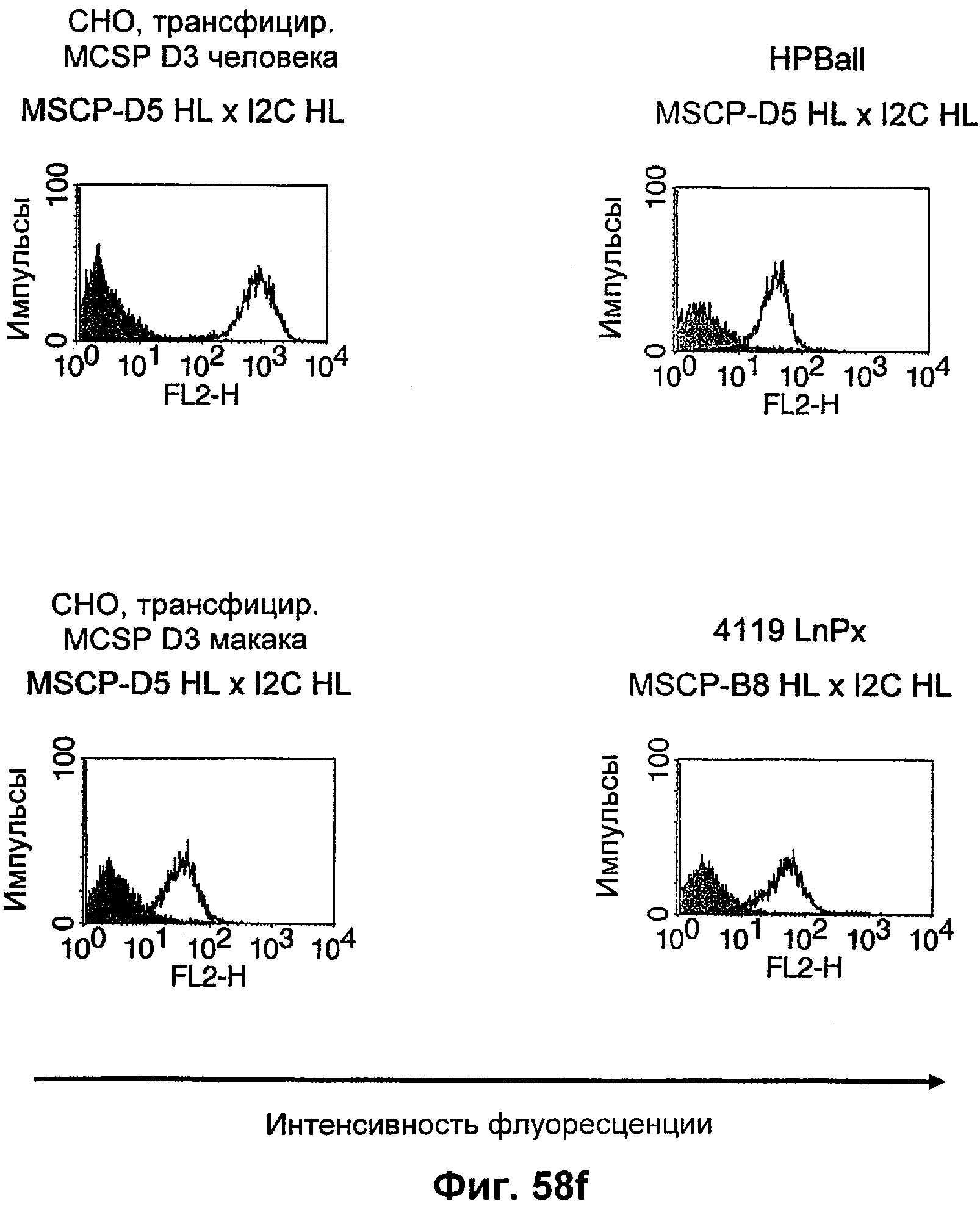
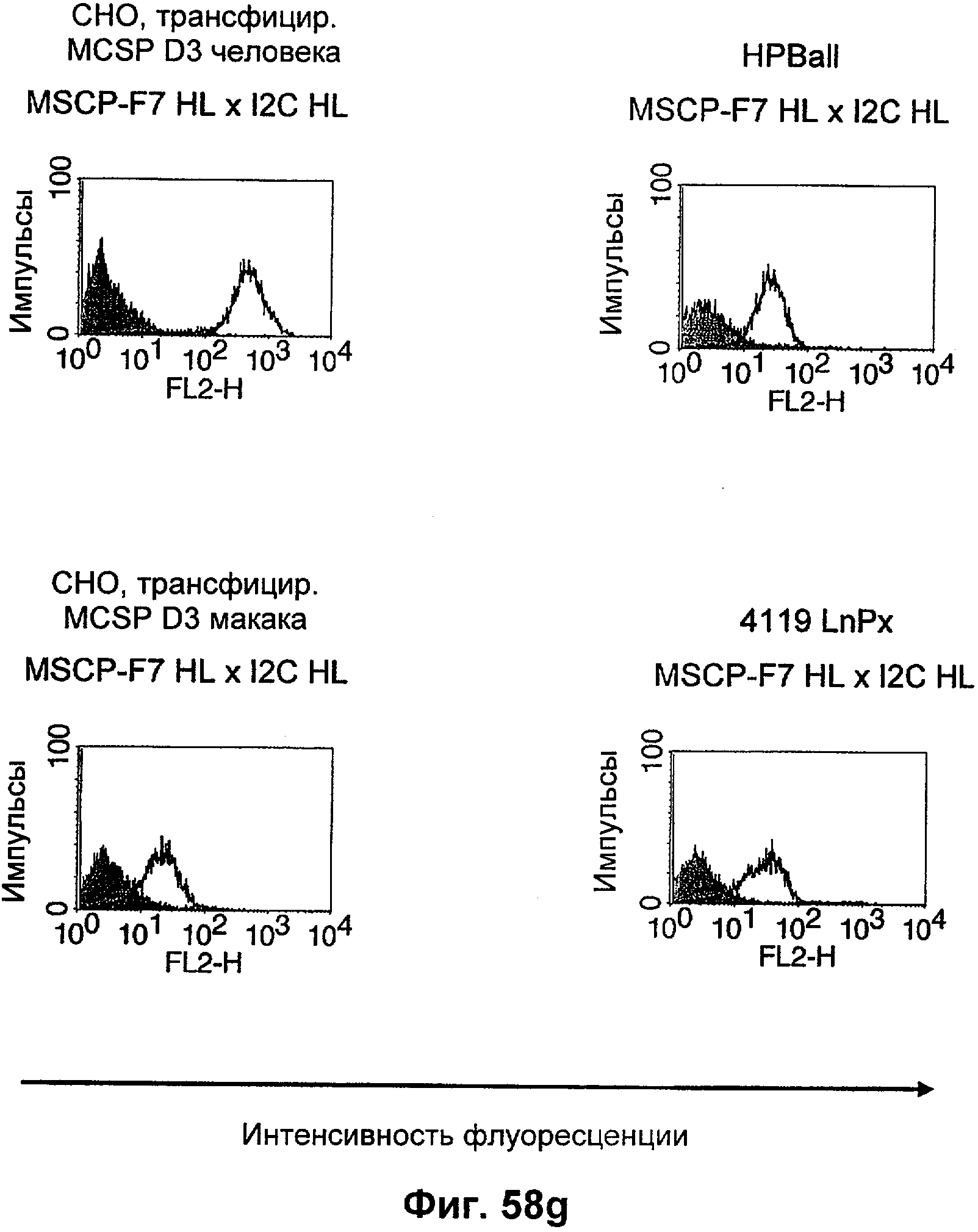
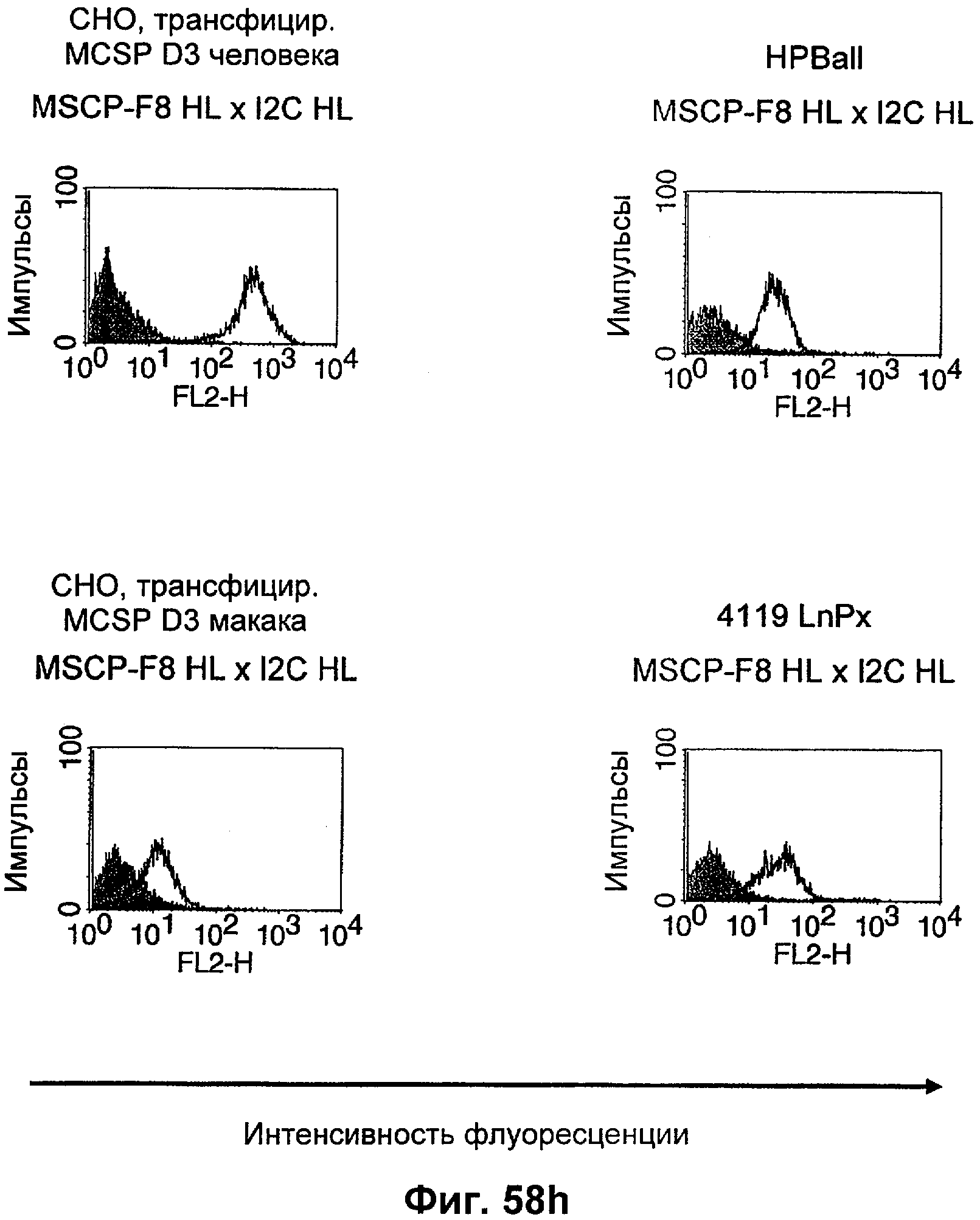
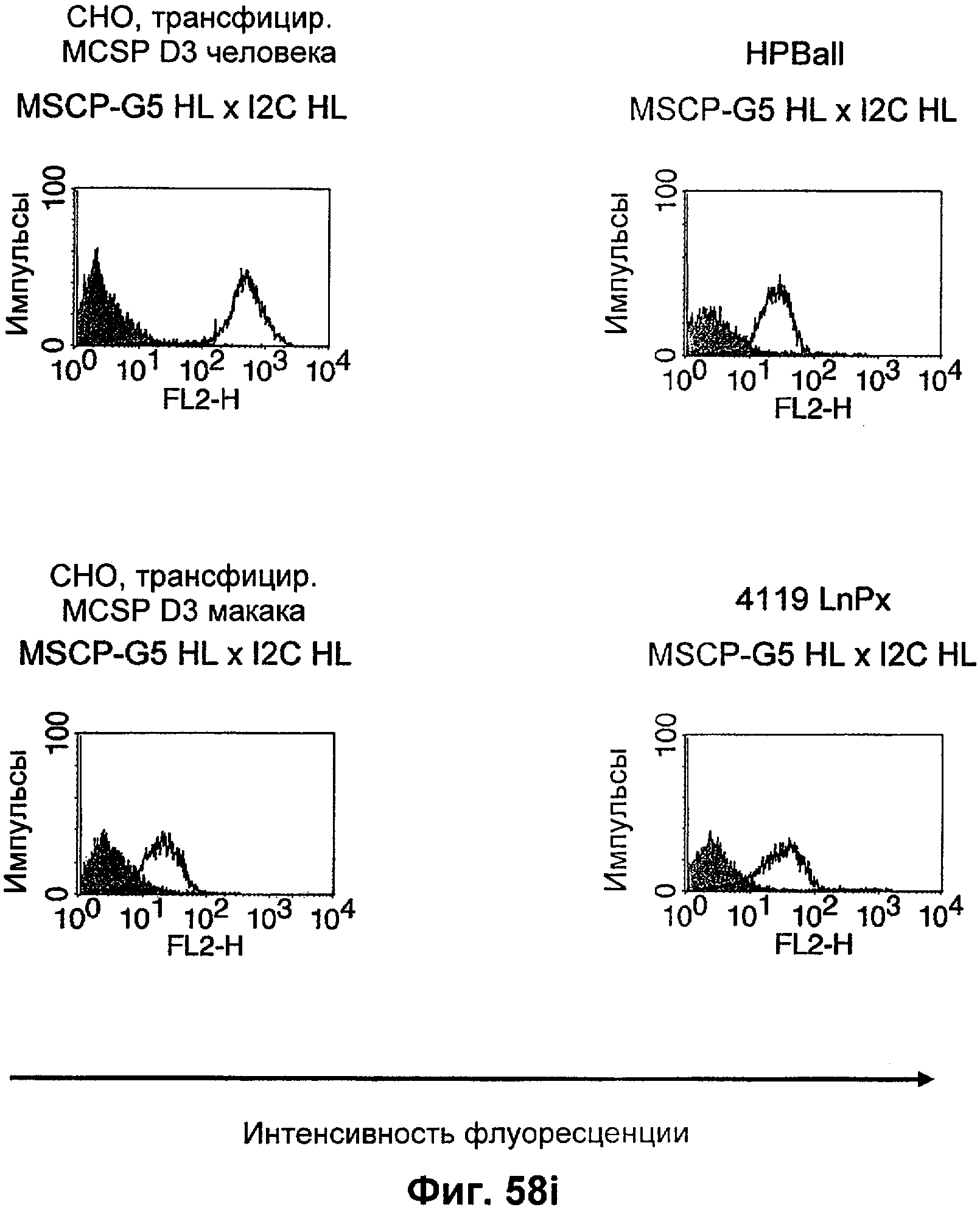
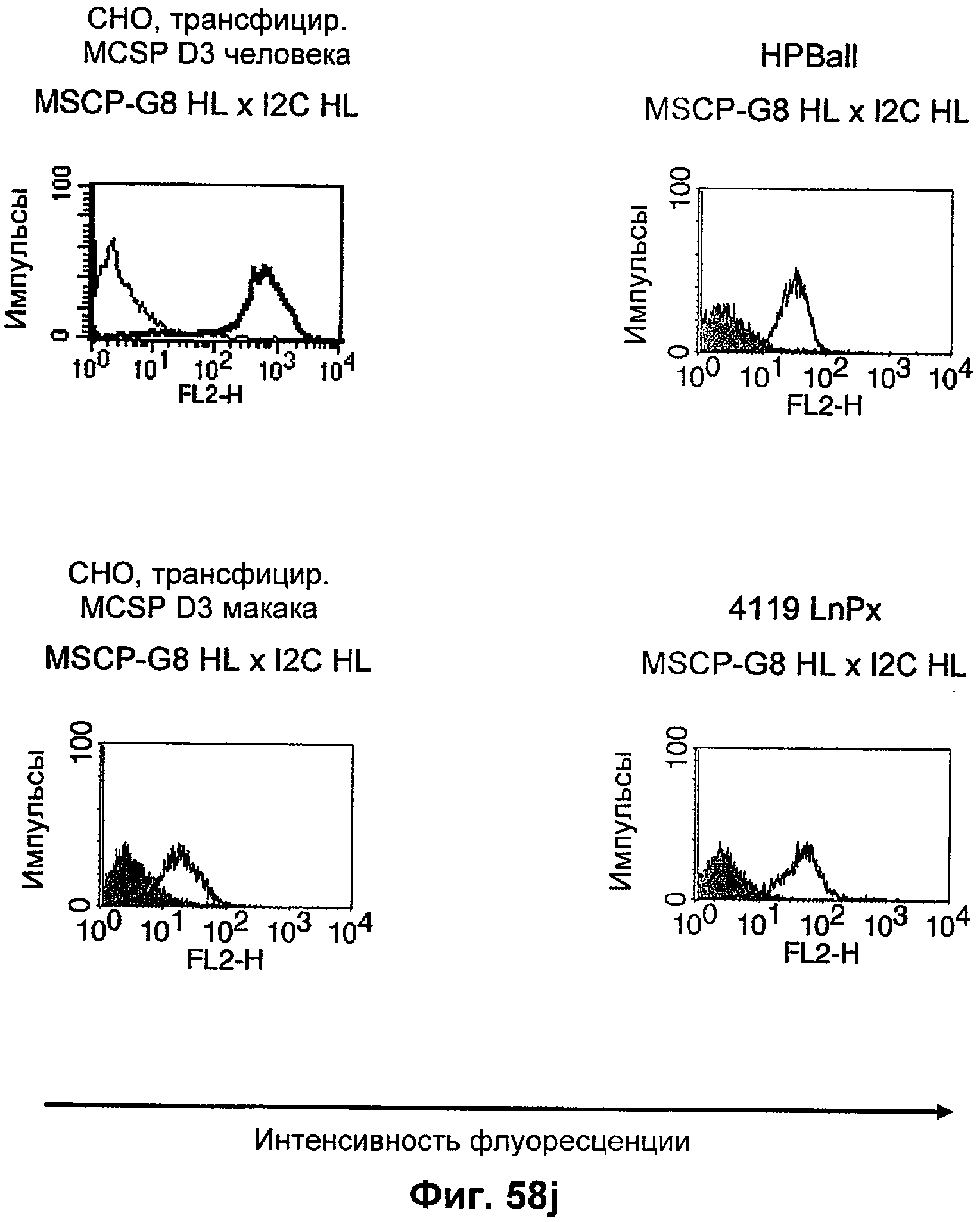
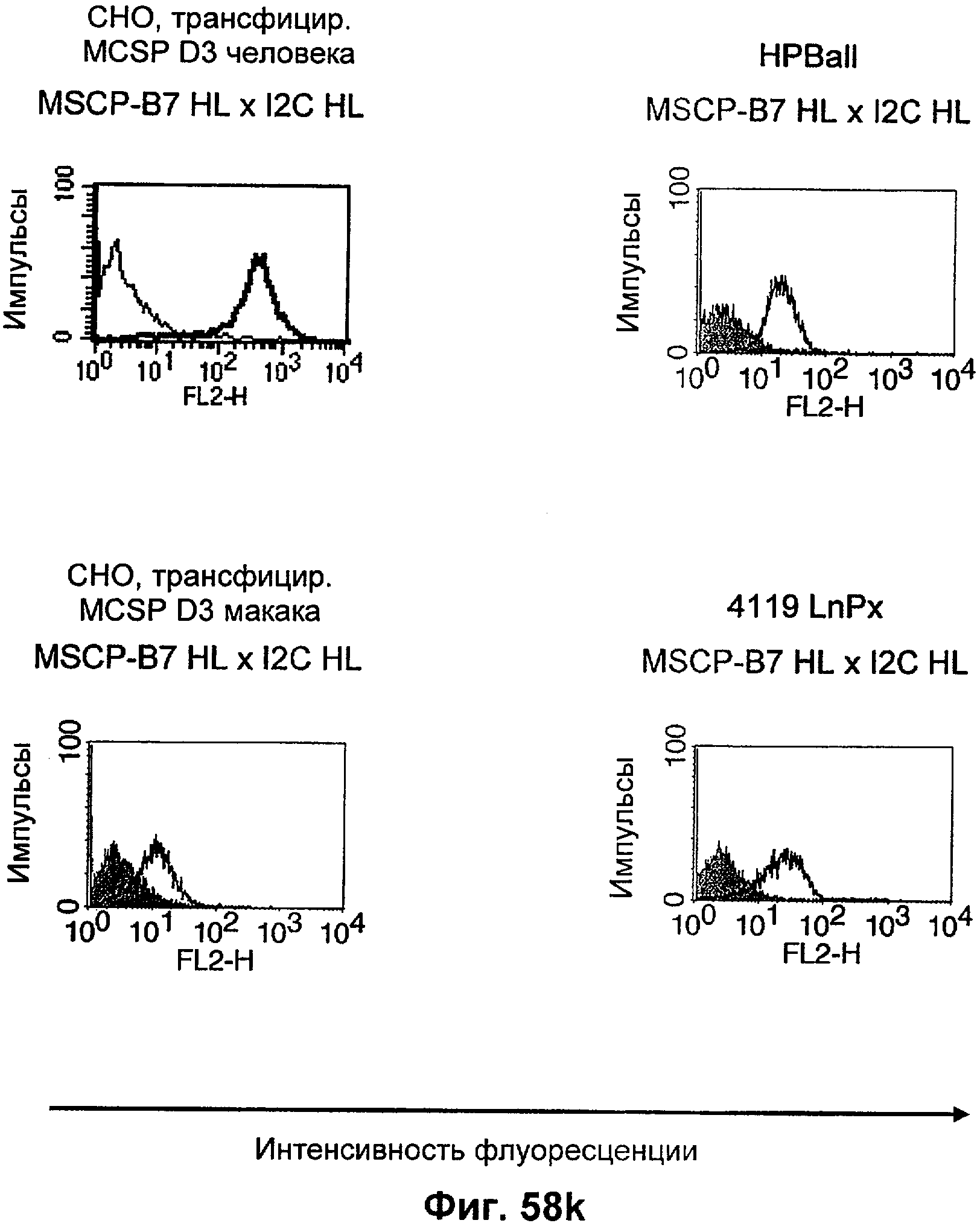
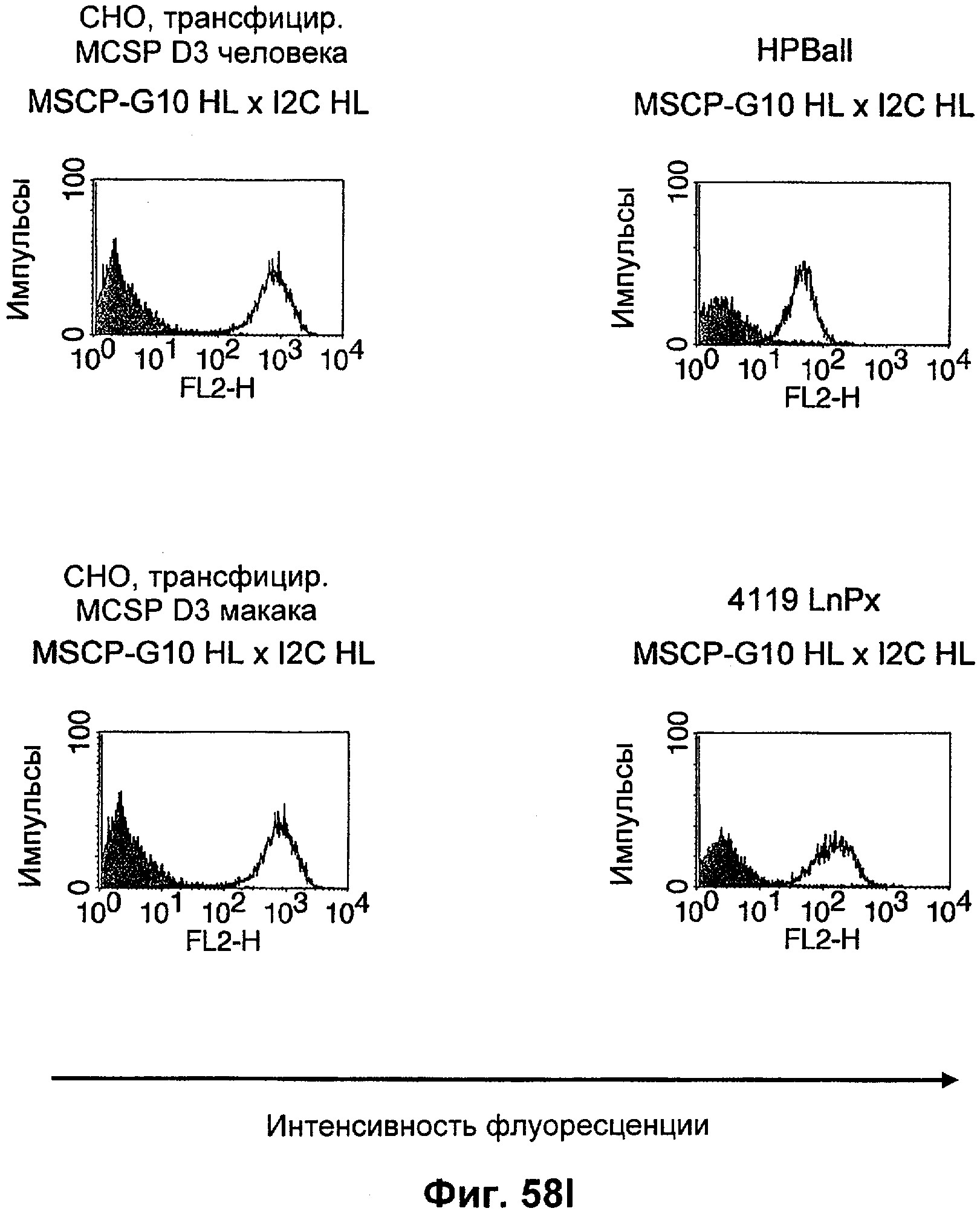
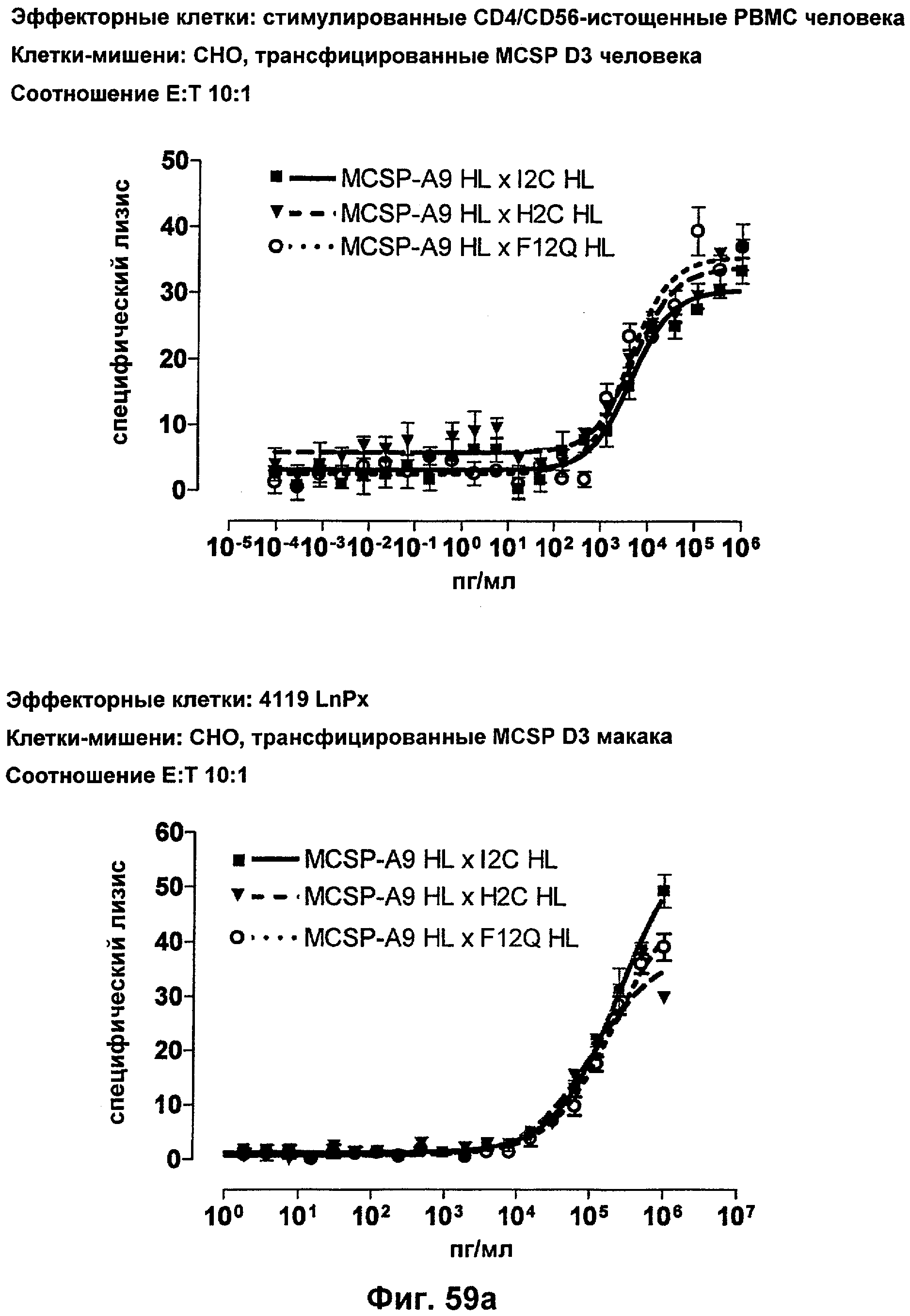
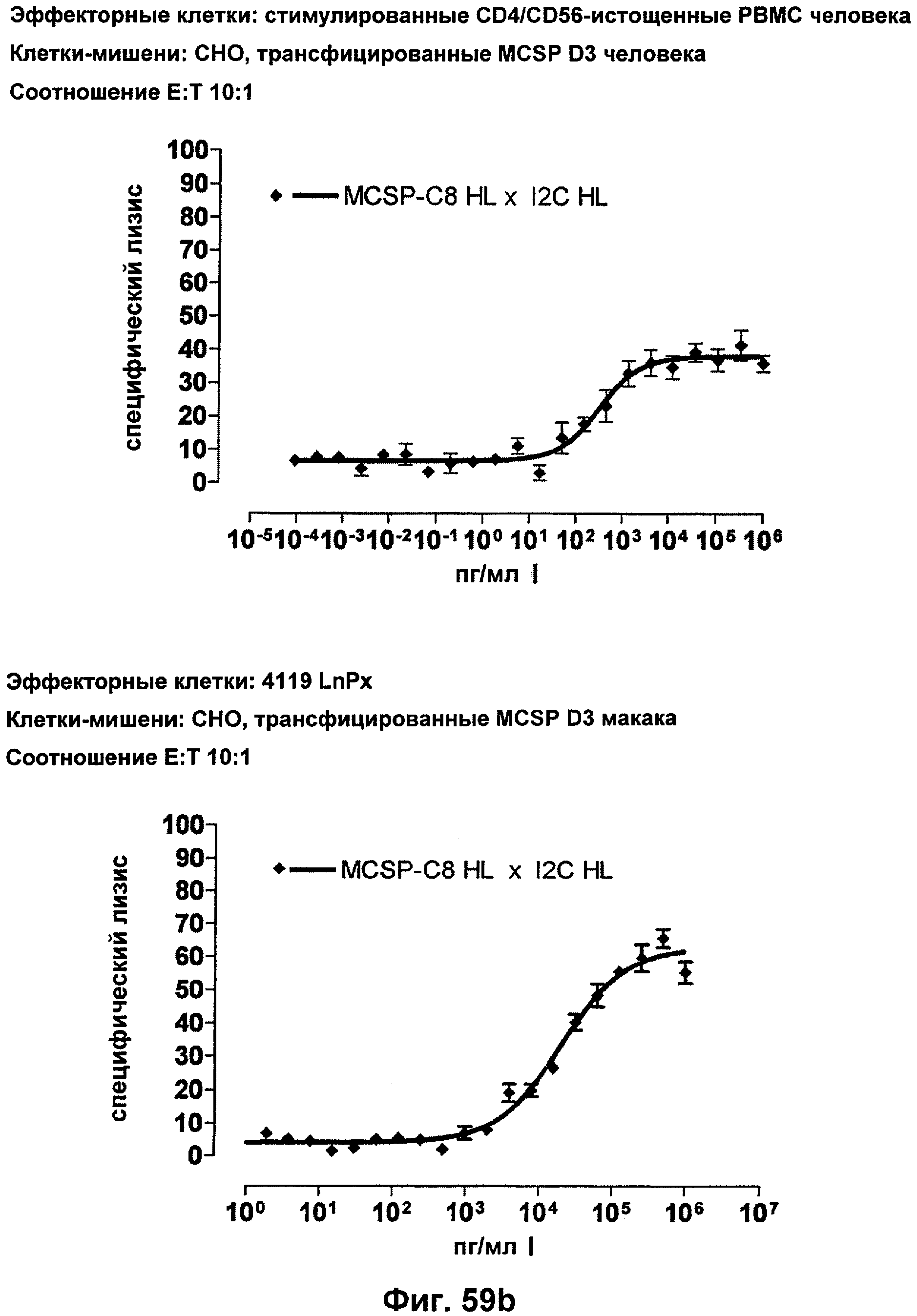
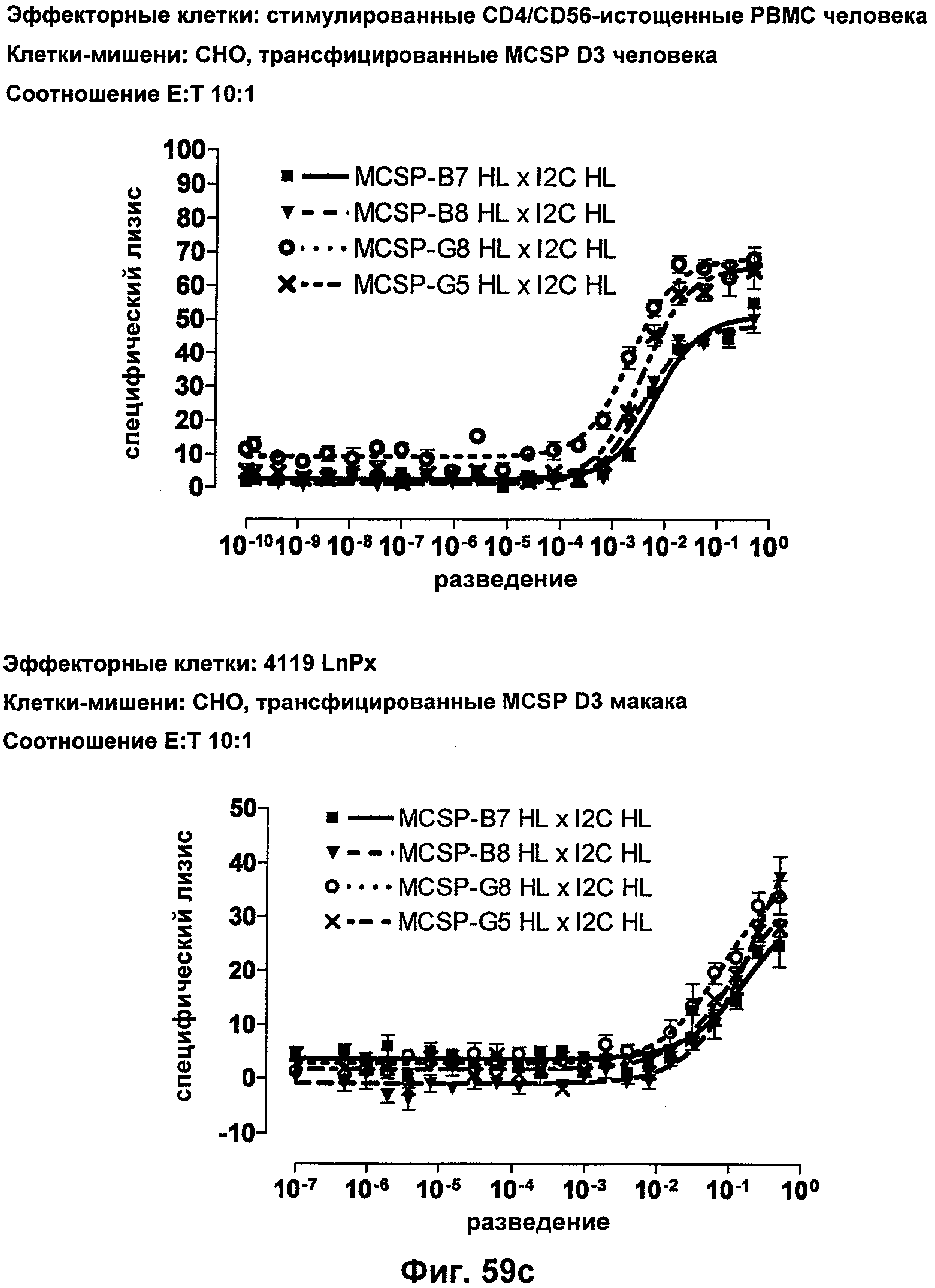
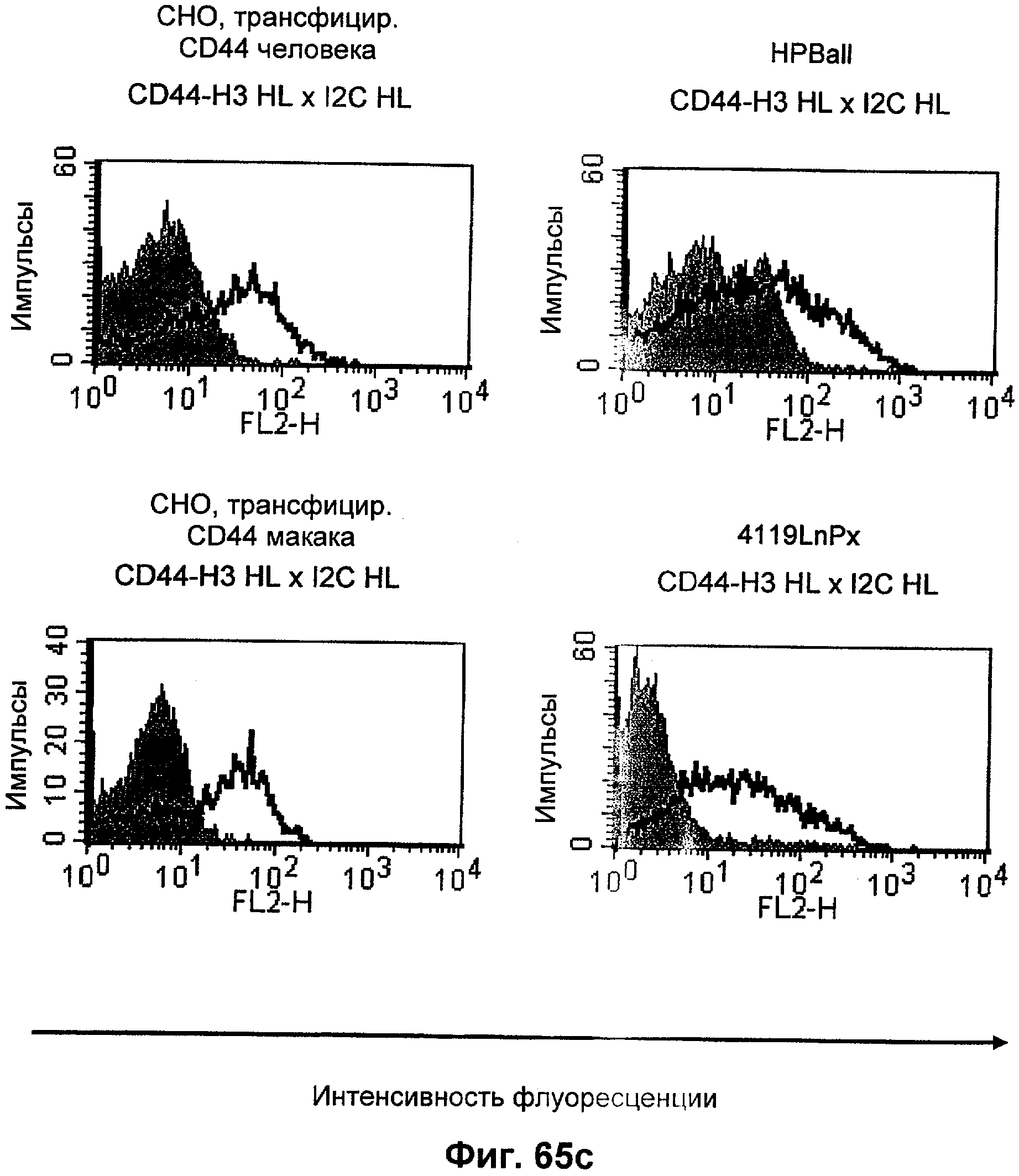
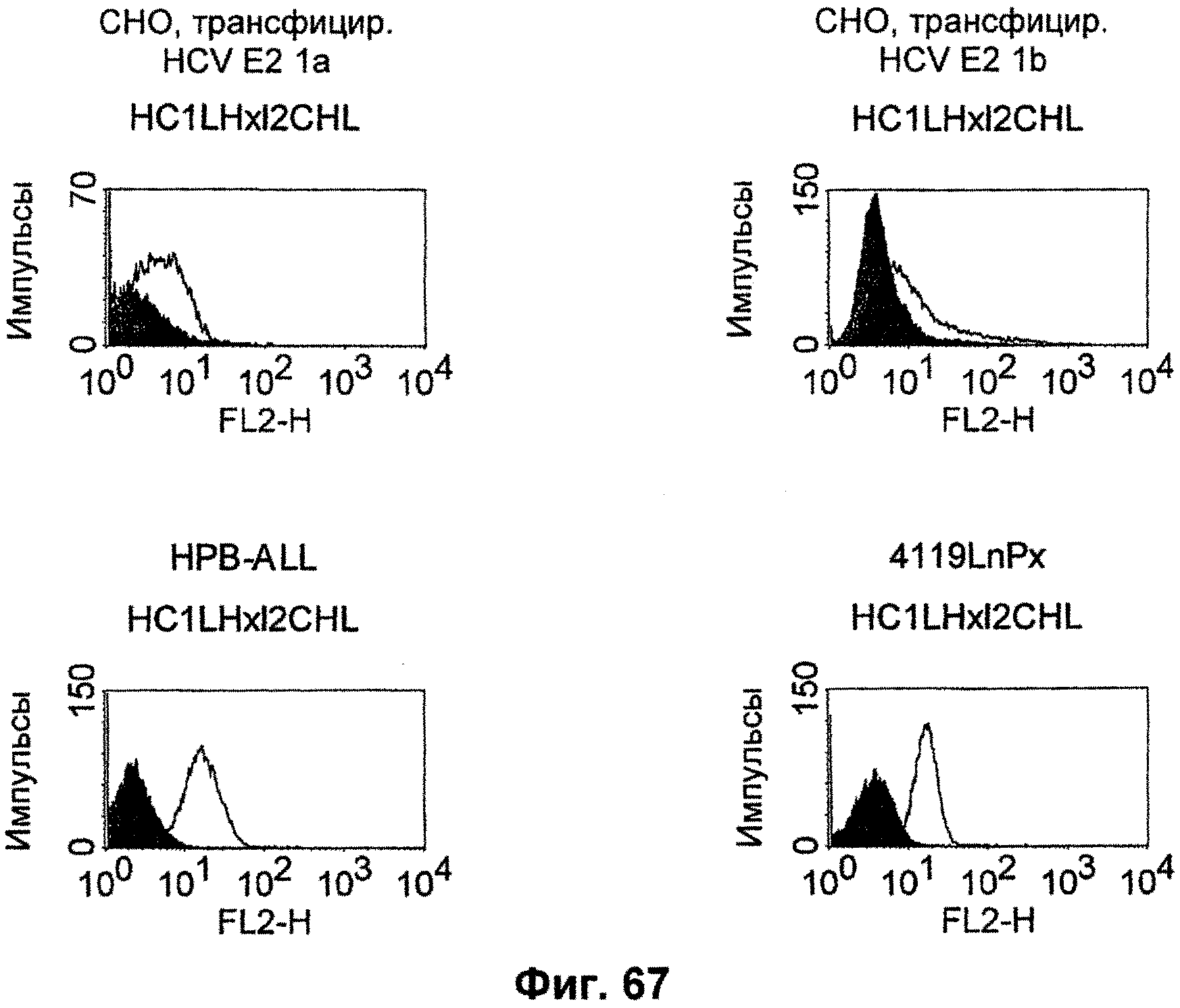
Термин "перекрестно-видовая специфичность" или "межвидовая специфичность", как он использован в данной заявке, означает связывание связывающего домена, описанного в данном изобретении, с одной и той же молекулой-мишенью у людей и приматов, не являющихся шимпанзе. Таким образом, "перекрестно-видовую специфичность" или "межвидовую специфичность" следует понимать как межвидовую реактивность к одинаковой молекуле X, экспрессирующейся в разных видах, а не к молекуле, отличающейся от X. Межвидовая специфичность моноклонального антитела, распознающего, например, CD3-эпсилон человека, в отношении CD3-эпсилон примата, не являющегося шимпанзе, например CD3-эпсилон макака, может быть определена, например, с помощью FACS-анализа (клеточный сортер с активацией флуоресценции (fluorescence-activated cell sorter)). FACS-анализ проводят таким образом, что соответствующее моноклональное антитело тестируют на связывание с клетками человека и примата, не являющегося шимпанзе, например клетками макака, экспрессирующими указанные антигены CD3-эпсилон человека и примата, не являющегося шимпанзе, соответственно. Соответствующий анализ показан в следующих ниже примерах.
Как использовано в данной заявке, термин "CD3-эпсилон" означает молекулу, экспрессирующуюся как часть Т-клеточного рецептора, и имеет значение, обычно приписываемое ему в предшествующем уровне техники. Что касается человека, то он охватывает индивидуальную или независимо комбинированную форму всех известных субъединиц CD3, например CD3-эпсилон, CD3-дельта, CD3-гамма, CD3-зета, CD3-альфа и CD3-бета. CD3-антигенами приматов, не являющихся шимпанзе, которые упомянуты в данной заявке, являются, например, CD3 Масаса fascicutaris и CD3 Масаса mulatta. Что касается Масаса fascicularis, то он охватывает CD3-эпсилон FN-18-отрицательные и CD3-эпсилон FN-18-положительные, CD3-гамма и CD3-дельта. Что касается Масаса mulatta, то он охватывает CD3-эпсилон, CD3-гамма и CD3-дельта. Предпочтительно, указанным CD3, как использовано в данной заявке, является CD3-эпсилон.
CD3-эпсилон человека указана в GenBank под № доступа NM_000733 и содержит SEQ ID NO: 1. CD3-гамма человека указана в GenBank под № доступа NM_000073. CD3-дельта человека указана в GenBank под № доступа NM_000732.
Цепь CD3-эпсилон "FN-18-отрицательная" Масаса fascicularis (т.е. CD3-эпсилон, не распознаваемая моноклональным антителом FN-18 вследствие полиморфизма, как изложено выше) указана в GenBank под № доступа АВ073994.
Цепь CD3-эпсилон "FN-18-положительная" Масаса fascicularis (т.е. CD3-эпсилон, распознаваемая моноклональным антителом FN-18) указана в GenBank под № доступа АВ073993. CD3-гамма Масаса fascicularis указана в GenBank под № доступа АВ073992. CD3-дельта Масаса fascicularis указана в GenBank под № доступа АВ073991.
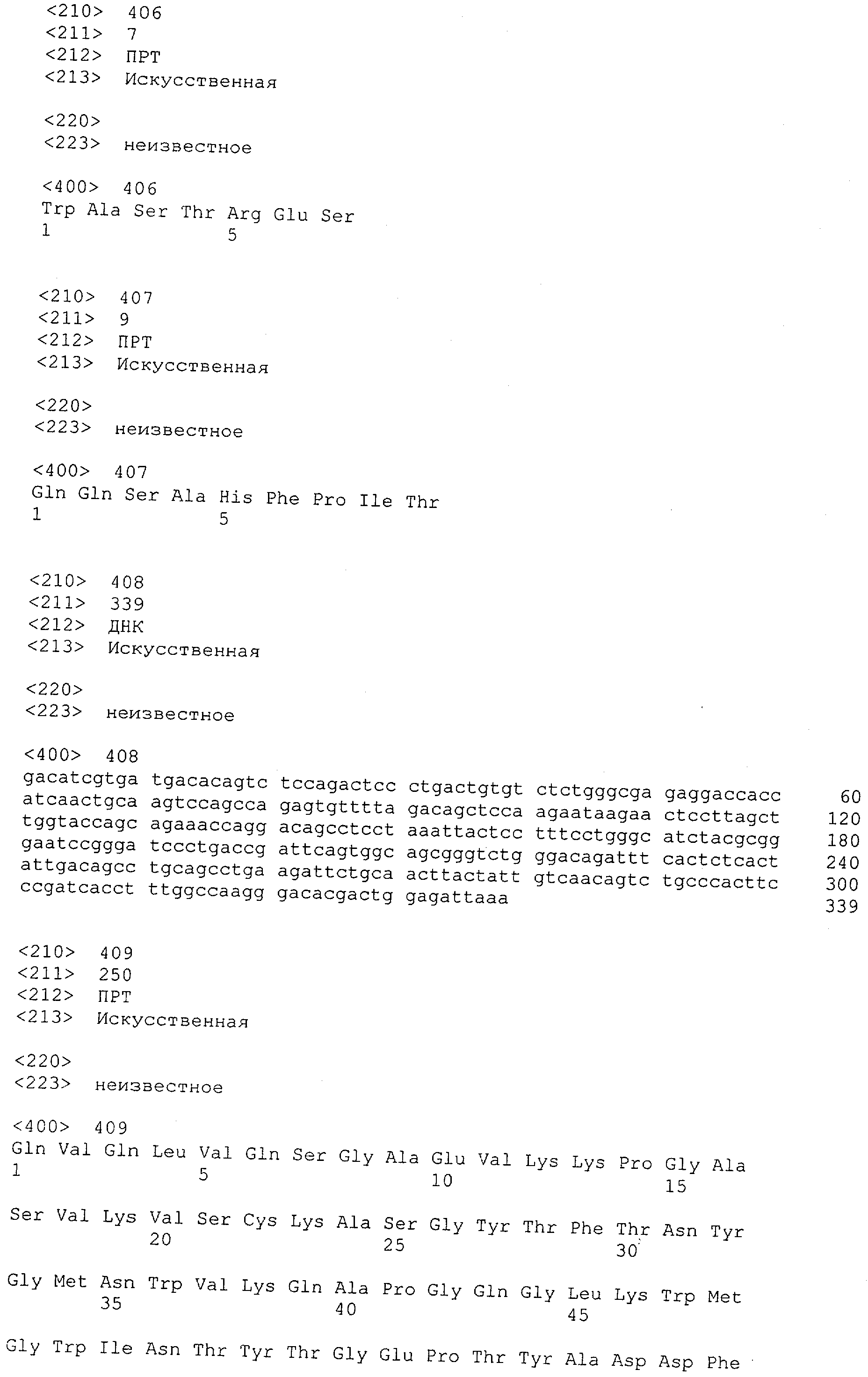
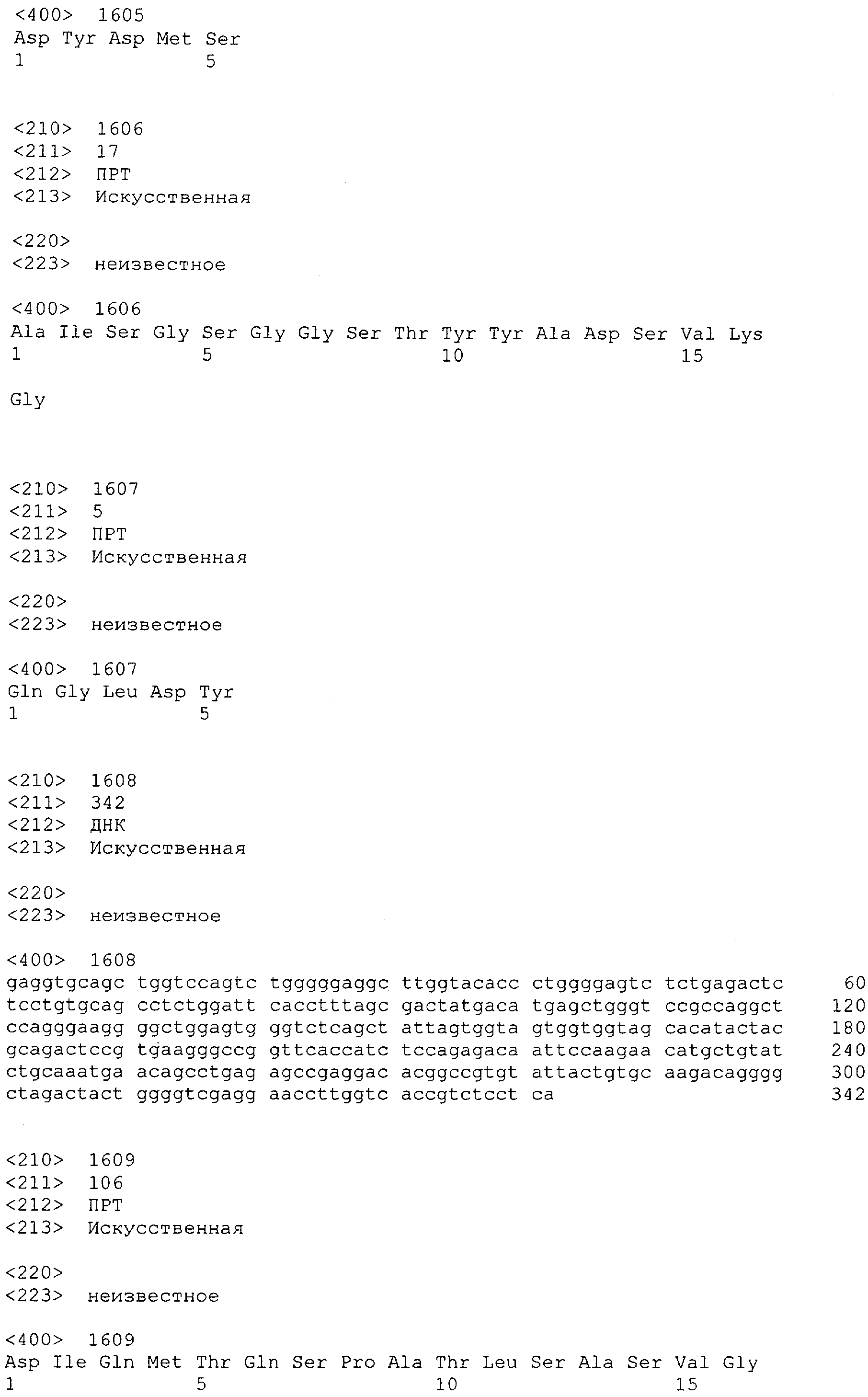
Последовательности нуклеиновой кислоты и аминокислотные последовательности соответствующих CD3-эпсилон, гамма и дельта гомологов Масаса mulatta могут быть идентифицированы и выделены с использованием рекомбинантных методик, описанных в данной области техники (Sambrook et al. Molecular Cloning: A Laboratory Manual; Cold Spring Harbor Laboratory Press, 3rd edition, 2001). Это применимо, с учетом необходимых изменений, к CD3-эпсилон, гамма и дельта гомологам других приматов, не являющихся шимпанзе, которые определены в данной заявке. Идентификация аминокислотной последовательности обыкновенной игрунки (Callithrix jacchus), обыкновенной беличьей обезьяны (Saimiri sciureus) и игрунки эдиповой (Saguinus oedipus) описана в прилагаемых примерах. Аминокислотная последовательность внеклеточного домена CD3-эпсилон Callithrix jacchus представлена в SEQ ID NO: 3, та же последовательность Saguinus oedipus представлена в SEQ ID NO: 5, и та же последовательность Saimiri sciureus представлена в SEQ ID NO: 7.
В соответствии с упомянутым выше, термин "эпитоп" определяет антигенную детерминанту, которая специфически связывается с/идентифицируется связывающей молекулой, которая определена выше. Связывающие домены или молекулы могут специфически связываться/взаимодействовать с конформационными или непрерывными эпитопами, уникальными для целевой структуры, например с CD3-эпсилон цепью человека и приматов, не являющихся шимпанзе. Отличительным признаком конформационных или непрерывных эпитопов является, для полипептидных антигенов, наличие двух или более отдельных аминокислотных остатков, которые разнесены в первичной последовательности, но сближаются на поверхности молекулы, когда полипептид сворачивается в нативный белок/антиген (Sela, (1969) Science, 166, 1365 и Laver, (1990) Cell, 61, 553-6). Два или более отдельных аминокислотных остатков, вносящих вклад в этот эпитоп, присутствуют в отдельно расположенных участках одной или более чем одной полипептидной цепи. Эти остатки сближаются на поверхности молекулы, когда полипептидная(ые) цепь(и) сворачивается(ются) в трехмерную структуру с образованием эпитопа. И наоборот, непрерывный или линейный эпитоп состоит из двух или более отдельных аминокислотных остатков, которые присутствуют в единственном линейном сегменте полипептидной цепи. В настоящем изобретении "зависимый от окружения" эпитоп CD3 относится к конформации указанного эпитопа. Такой зависимый от окружения эпитоп, расположенный на эпсилон-цепи CD3, может складываться в правильную конформацию, только если он погружен в остаток эпсилон-цепи и удерживается в правильном положении посредством гетеродимеризации эпсилон-цепи либо с гамма-, либо с дельта-цепью CD3. И наоборот, независимый от окружения эпитоп CD3, как он предложен в данной заявке, относится к N-концевому, содержащему аминокислотные остатки 1-27, полипептиду, или его функциональному фрагменту, CD3-эпсилон. Этот N-концевой, содержащий аминокислотные остатки 1-27, полипептид или его функциональный фрагмент сохраняет свою трехмерную структурную целостность и правильную конформацию, когда его удаляют из нативного окружения в CD3-комплексе. Независимость от окружения N-концевого, содержащего аминокислотные остатки 1-27, полипептида или его функционального фрагмента, являющегося частью внеклеточного домена CD3-эпсилон, представляет собой, таким образом, эпитоп, который полностью отличается от эпитопов CD3-эпсилон, описанных в WO 2004/106380 в связи со способом получения человеческих связывающих молекул. В указанном способе использовали отдельно экспрессированный рекомбинантный CD3-эпсилон. Конформация этого отдельно экспрессированного рекомбинантного CD3-эпсилон отличалась от конформации, адаптированной к его природной форме, т.е. форме, в которой субъединица CD3-эпсилон ТСР/CD3-комплекса существует как часть нековалентного комплекса либо с субъединицей CD3-дельта, либо с субъединицей CD3-гамма ТСР/CD3-комплекса. Если в качестве антигена для селекции антител из библиотеки антител используют такой отдельно экспрессированный рекомбинантный белок CD3-эпсилон, то из данной библиотеки идентифицируют антитела, специфичные к этому антигену, несмотря на то, что такая библиотека не содержит антитела со специфичностью к собственным антигенам/аутоантигенам. Это вызвано тем, что отдельно экспрессированный рекомбинантный белок CD3-эпсилон не существует in vivo; он не является аутоантигеном. Следовательно, субпопуляции В-клеток, экспрессирующих антитела, специфичные к этому белку, не были истощены in vivo; библиотека антител, сконструированная из таких В-клеток, будет содержать генетический материал для антител, специфичных к этому отдельно экспрессированному рекомбинантному белку CD3-эпсилон.
Однако, поскольку независимый от окружения N-концевой, содержащий аминокислотные остатки 1-27, полипептид или его функциональный фрагмент представляет собой эпитоп, который сворачивается в его нативную форму, связывающие домены по настоящему изобретению не могут быть идентифицированы способами, основанными на подходе, описанном в WO 04/106380. Поэтому можно подтвердить в тестах, что связывающие молекулы, описанные в WO 04/106380, не способны связываться с N-концевыми аминокислотными остатками 1-27 эпсилон-цепи CD3. Следовательно, традиционные анти-CD3-связывающие молекулы или молекулы антител против CD3 (например, описанные в WO 99/54440) связываются с эпсилон-цепью CD3 в положении, которое находится ближе к С-концу, чем независимый от окружения N-концевой, содержащий аминокислотные остатки 1-27, полипептид или функциональный фрагмент, предложенный в данной заявке. Молекулы антител ОКТ3 и UCHT-1 из предшествующего уровня техники обладают специфичностью в отношении эпсилон-субъединицы ТСР/CD3-комплекса между аминокислотными остатками 35 и 85 и, соответственно, эпитоп этих антител также располагается ближе к С-концу. В дополнение к этому, UCHT-1 связывается с эпсилон-цепью CD3 в области между аминокислотными остатками 43 и 77 (Tunnacliffe, Int. Immunol., 1 (1989), 546-50; Kjer-Nielsen, PNAS, 101 (2004), 7675-7680; Salmeron, J. Immunol., 147 (1991), 3047-52). Следовательно, анти-CD3-молекулы из предшествующего уровня техники не связываются с определенным в данной заявке независимым от окружения N-концевым, содержащим аминокислотные остатки 1-27, эпитопом (или его функциональным фрагментом) и не направлены против него.
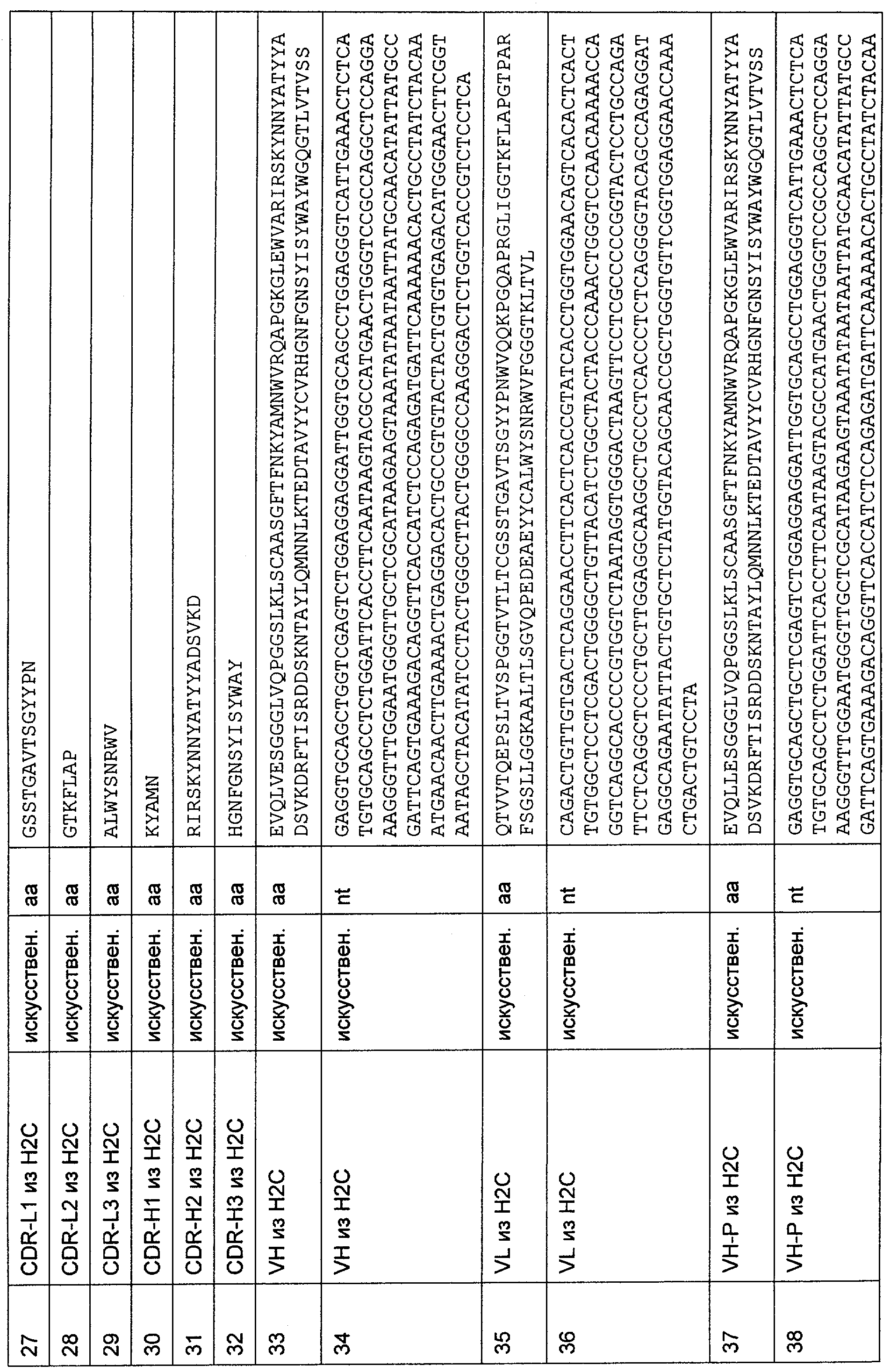
Для создания связывающего домена, предпочтительно человека, содержащегося в полипептиде по изобретению, например в биспецифическом одноцепочечном антителе, как оно определено в данной заявке, могут быть использованы, например, моноклональные антитела, связывающиеся с CD3-эпсилон как человека, так и примата, не являющегося шимпанзе (например, с CD3-эпсилон макака).
В предпочтительном воплощении полипептида по изобретению приматом, не являющимся шимпанзе, является обезьяна Старого Света. В более предпочтительном воплощении данного полипептида обезьяной Старого Света является обезьяна рода Papio (павианы) или рода макаков. Наиболее предпочтительно, обезьяной рода макаков является ассамский макак (Масаса assamensis), варварийская обезьяна (Масаса sylvanus), индийский макак, или боннет (Масаса radiata), макак обутый (Масаса ochreata), макак целебесский хохлатый (Масаса nigra), макак формозский горный (Масаса cyclopis), снежная обезьяна или японский макак (Масаса fuscata), яванский макак, или макак-крабоед, или длиннохвостый макак, или яванский макак (Масаса fascicularis), львинохвостый макак (Масаса silenus), макак южный свинохвостый (Масаса nemestrina), макак резус (Масаса mulatta), макак тибетский короткохвостый (Масаса thibetana), макак тонкинский (Масаса tonkeana), макак цейлонский (Масаса sinica), макак короткохвостый, или макак краснолицый, или макак медвежий (Масаса arctoides) или макак Моора (Масаса maurus). Наиболее предпочтительно, обезьяной рода павианов является Hamadryas Baboon, Papio hamadryas; Guinea Baboon, Papio papio; Olive Baboon, Papio anubis; Yellow Baboon, Papio cynocephalus; Chacma Baboon, Papio ursinus.
В альтернативном предпочтительном воплощении полипептида по изобретению примат, не являющийся шимпанзе, представляет собой обезьяну Нового Света. В более предпочтительном воплощении данного полипептида обезьяной Нового Света является обезьяна рода Callithrix (игрунковые), рода Saguinus (тамарины или сагуины) или рода Saimiri (беличьи обезьяны). Наиболее предпочтительно, обезьяной рода Callithrix является Callithrix jacchus (игрунка обыкновенная), обезьяной рода Saguinus является Saguinus oedipus (эдипов тамарин), а обезьяной рода Saimiri является Saimiri sciureus (обезьяна обыкновенная беличья).
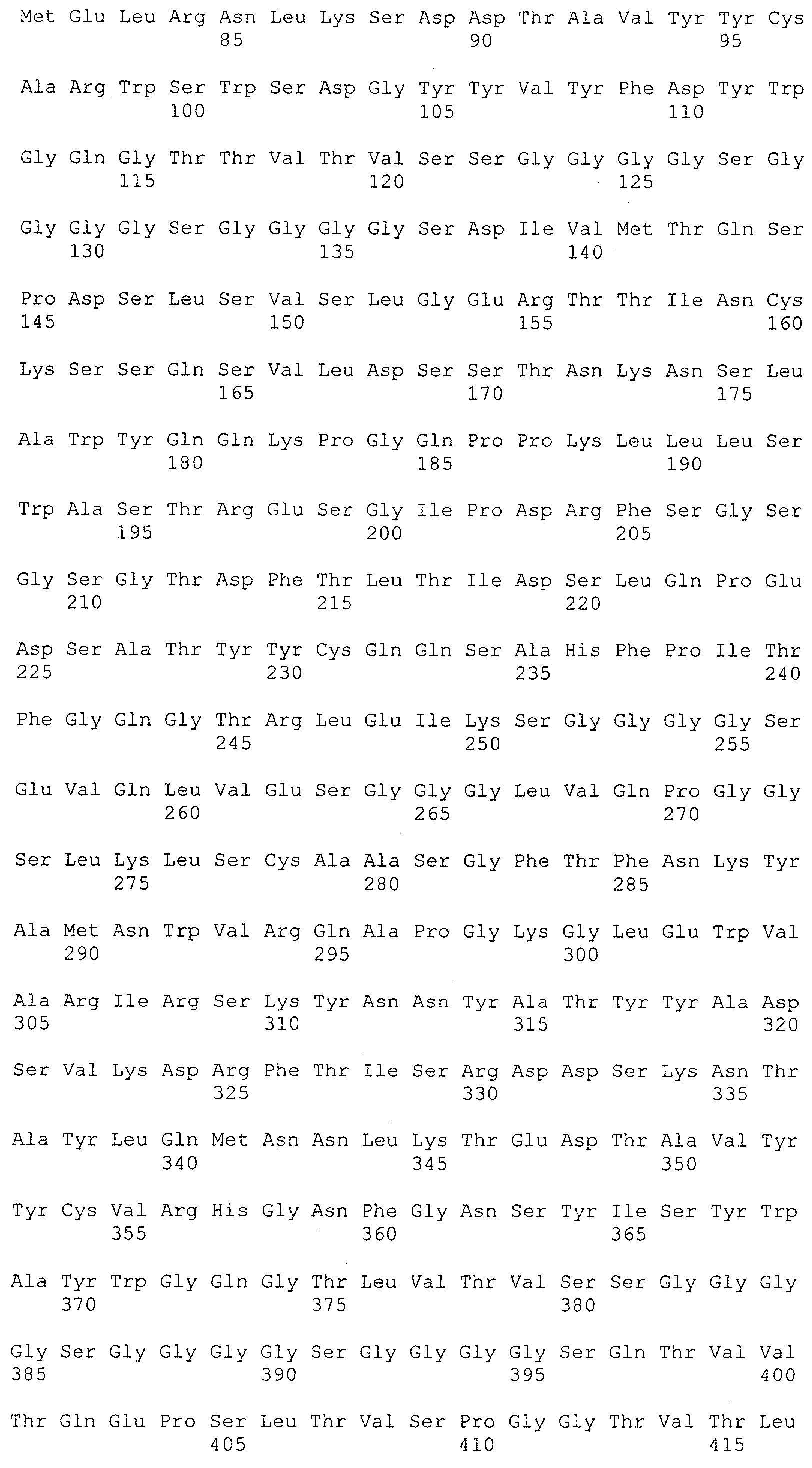
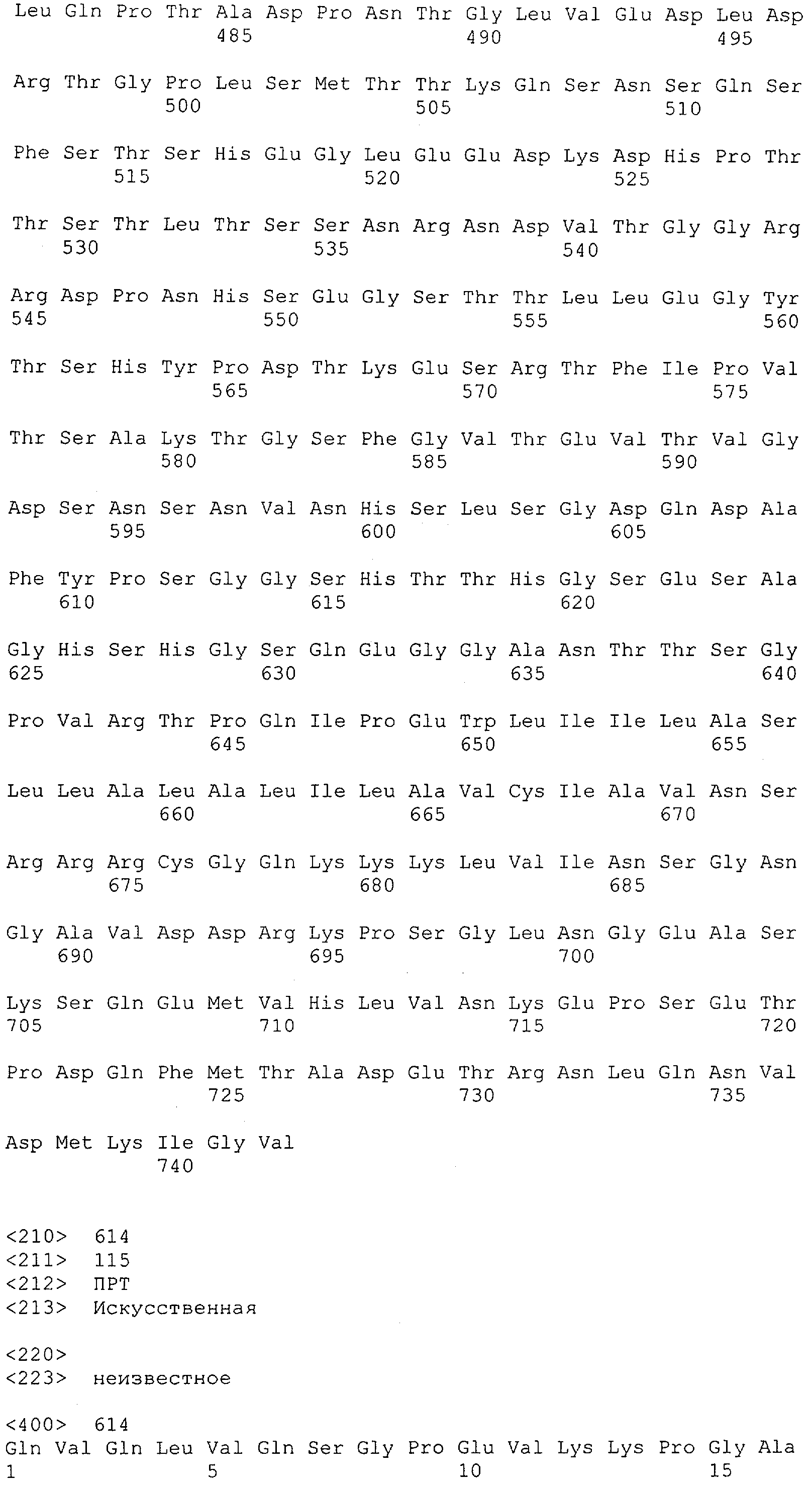
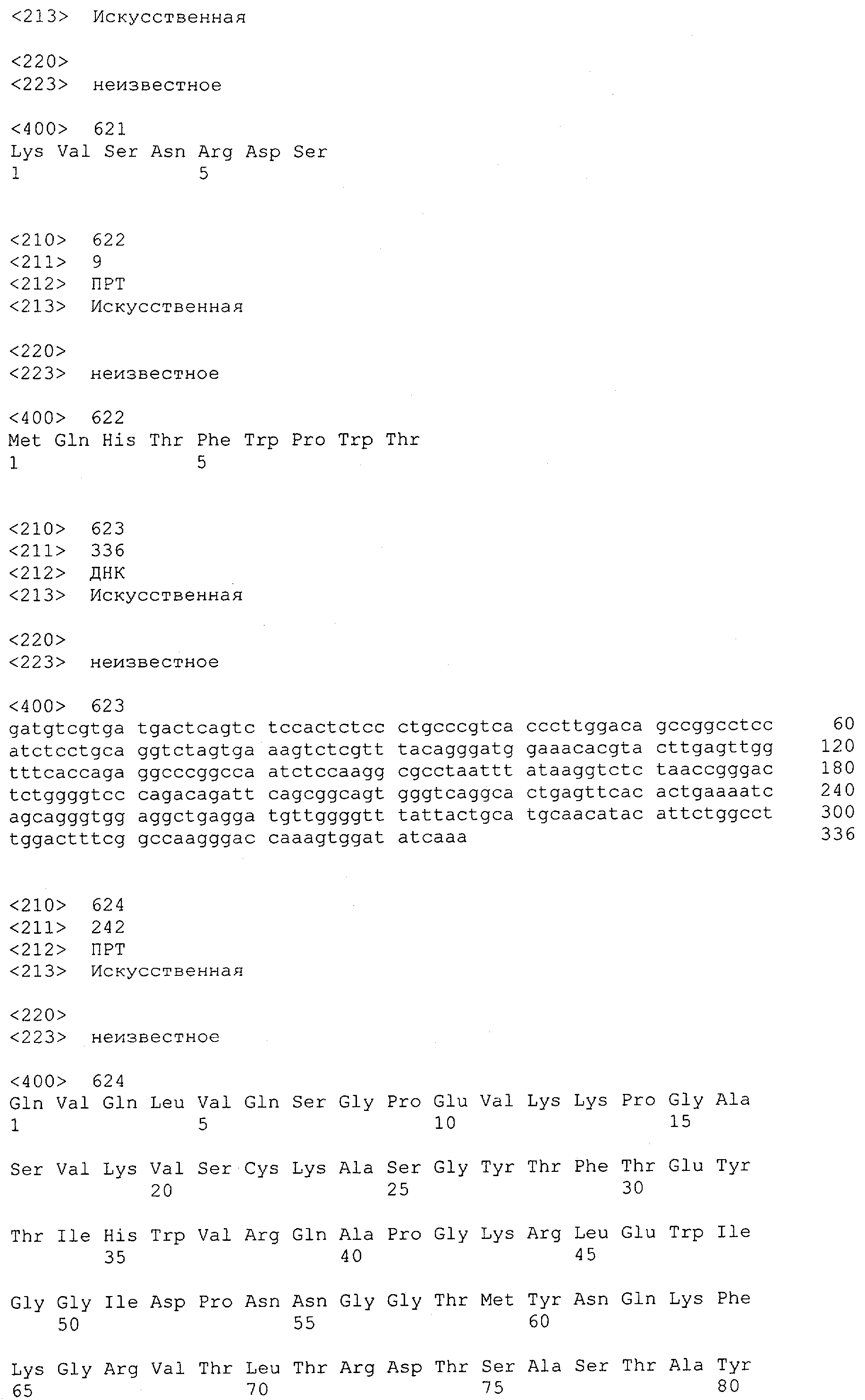
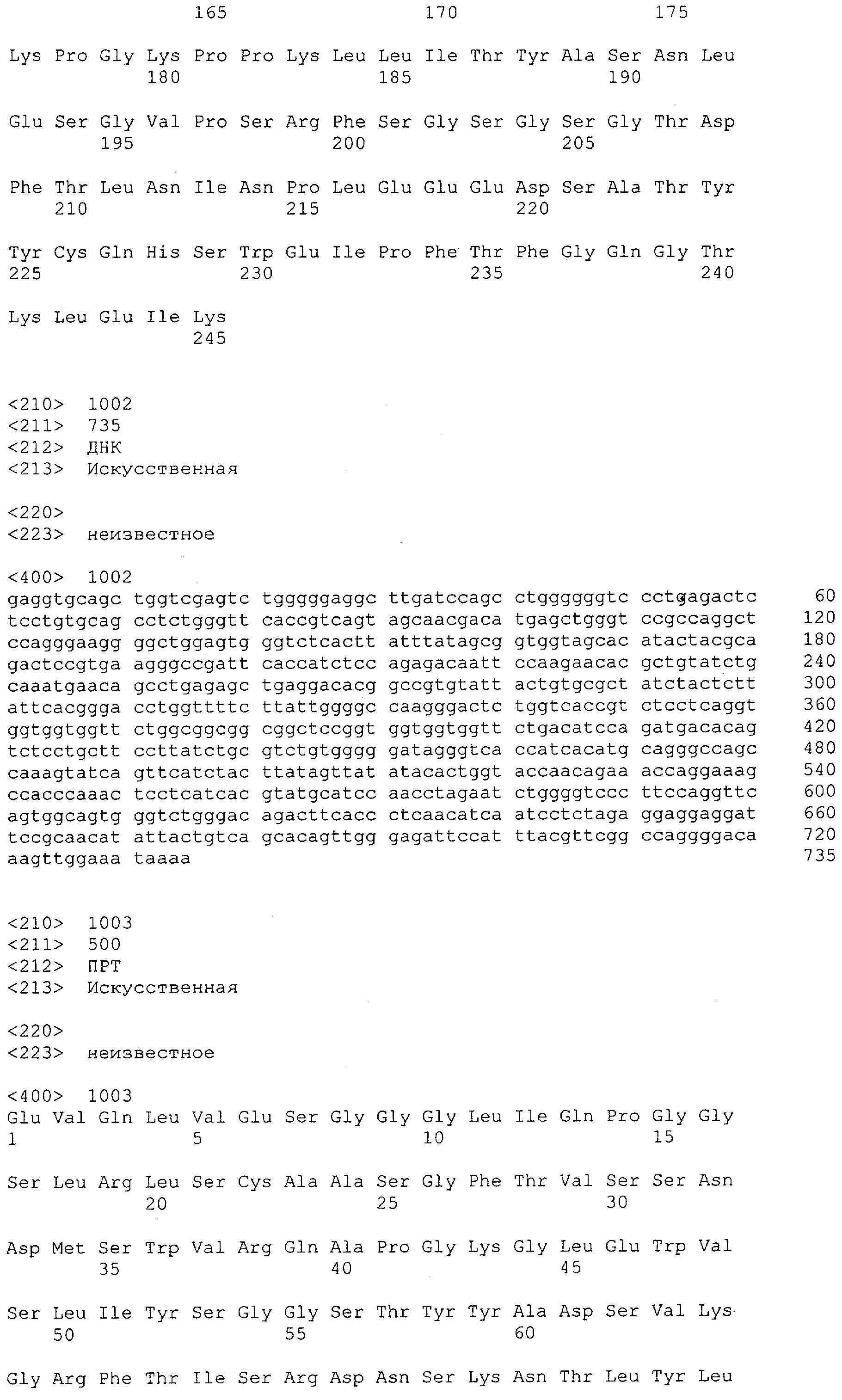
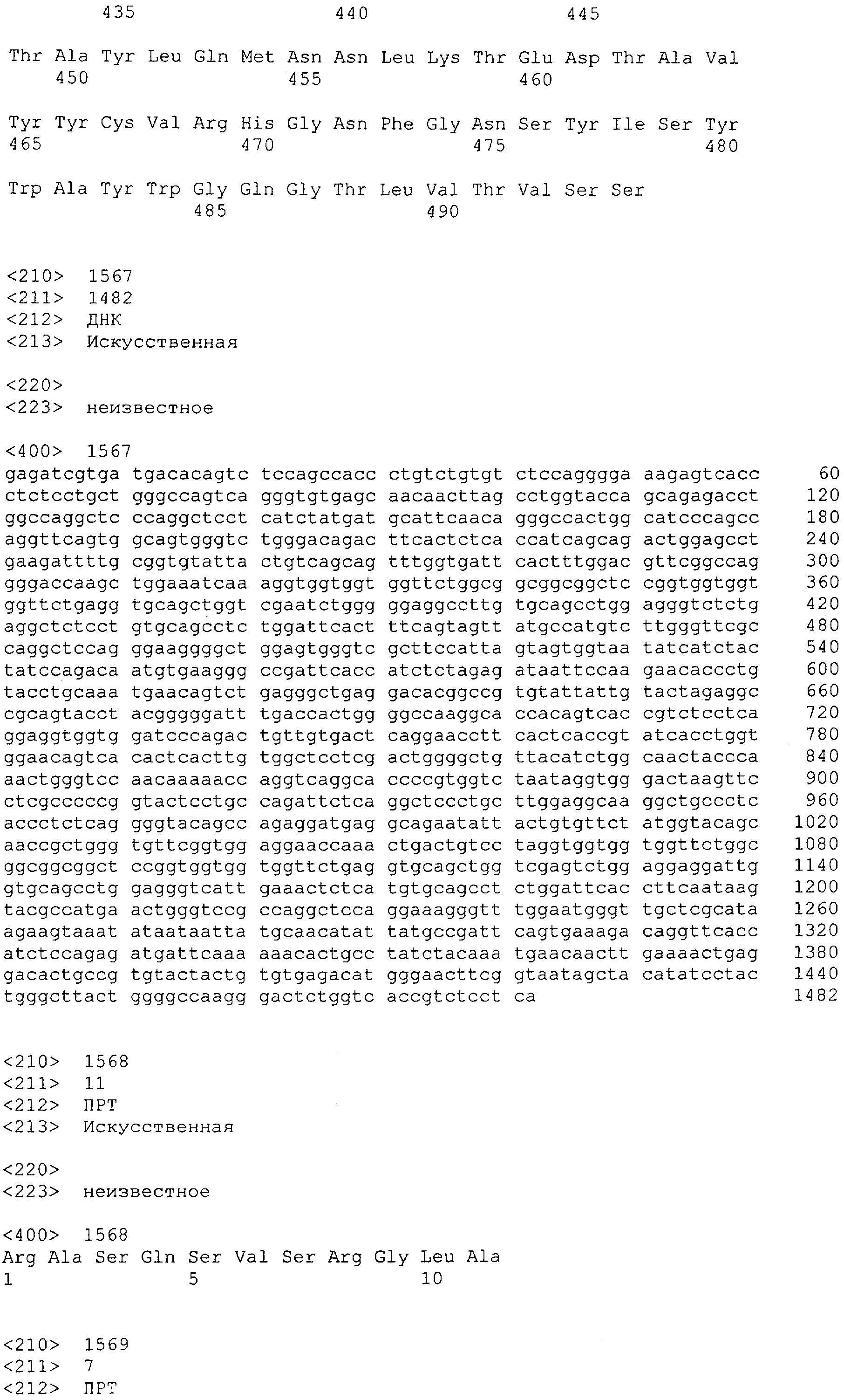
Как описано в данном изобретении выше, полипептид по изобретению связывается посредством первого связывающего домена с эпитопом CD3ε(эпсилон)-цепи человека и примата, не являющегося шимпанзе, причем данный эпитоп представляет собой часть аминокислотной последовательности, входящей в группу, состоящую из 27 аминокислотных остатков, как представлено в SEQ ID NO: 2, 4, 6 или 8, или ее функциональный фрагмент.
В соответствии с настоящим изобретением для полипептида по изобретению предпочтительно, чтобы указанный эпитоп представлял собой часть аминокислотной последовательности, содержащей 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6 или 5 аминокислот.
Более предпочтительно, когда указанный эпитоп содержит по меньшей мере аминокислотную последовательность Gln-Asp-Gly-Asn-Glu (Q-D-G-N-E-D).
В пределах настоящего изобретения "функциональный фрагмент N-концевых 1-27 аминокислотных остатков" означает, что указанный функциональный фрагмент по-прежнему представляет собой независимый от окружения эпитоп, сохраняющий свою трехмерную структурную целостность, когда его удаляют из его нативного окружения в CD3-комплексе (и сливают с гетерологической аминокислотной последовательностью, такой как ЕрСАМ или Fc-область иммуноглобулина, например, как показано в Примере 3.1). Сохранение трехмерной структуры в пределах 27 аминокислотного N-концевого полипептида, или его функционального фрагмента, CD3-эпсилон может быть использовано для создания связывающих доменов, которые связываются с N-концевым полипептидным фрагментом CD3-эпсилон in vitro и с нативным CD3-комплексом (CD3-эпсилон-субъединицей CD3-комплекса) на Т-клетках in vivo с той же аффинностью связывания. В настоящем изобретении "функциональный фрагмент N-концевых 1-27 аминокислотных остатков" означает, что CD3-связывающие молекулы, предложенные в данной заявке, по-прежнему могут связываться с такими функциональными фрагментами, и это не зависит от окружения. Специалист в данной области техники осведомлен о методах картирования эпитопов с целью определения того, какие аминокислотные остатки эпитопа распознаются такими анти-CD3-связывающими молекулами (например аланиновое сканирование или pep-spot-анализ).
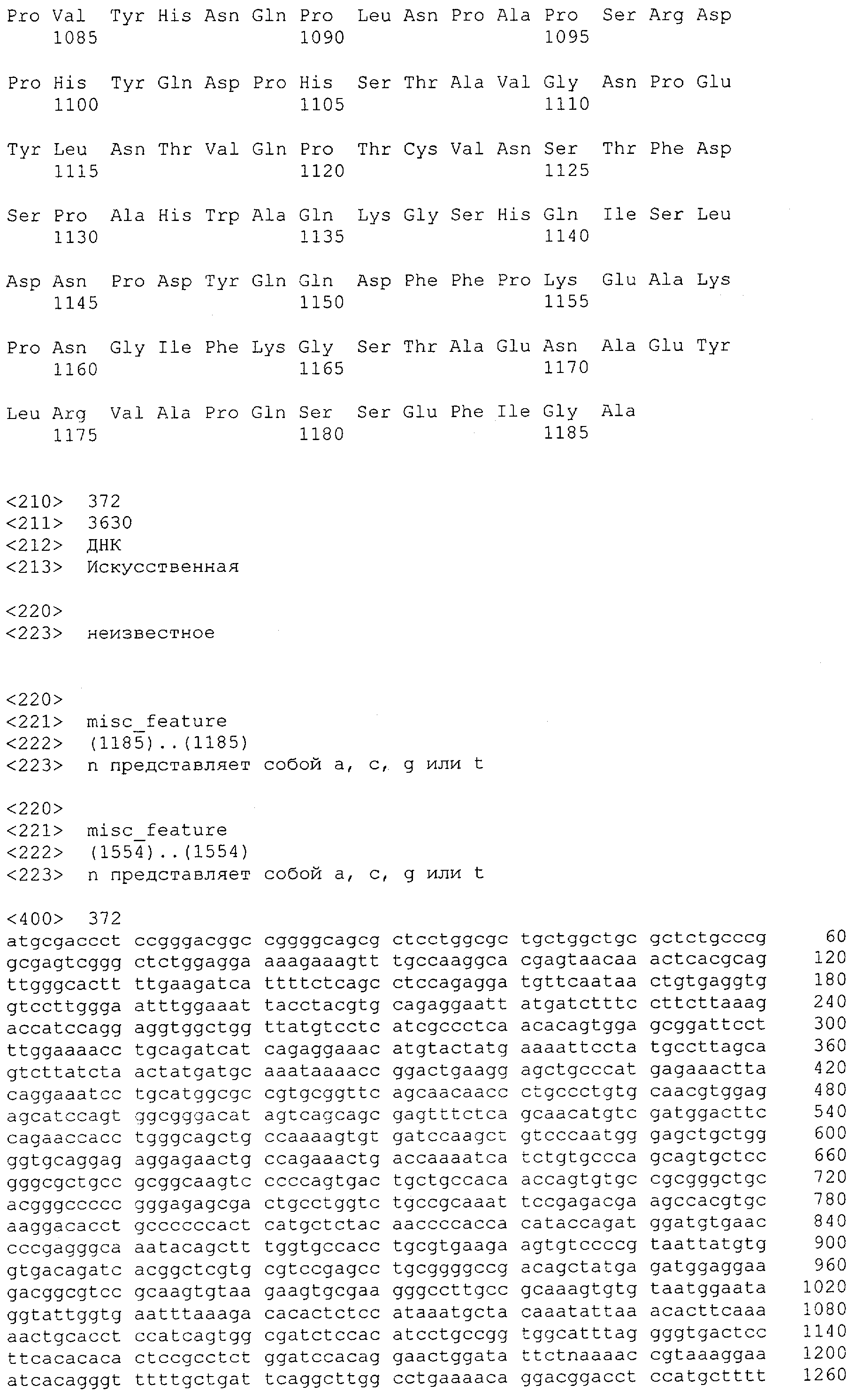
В предпочтительном воплощении изобретения полипептид по изобретению содержит (первый) связывающий домен, способный связываться с эпитопом CD3ε-цепи человека и примата, не являющегося шимпанзе, и второй связывающий домен, способный связываться с клеточным поверхностным антигеном.
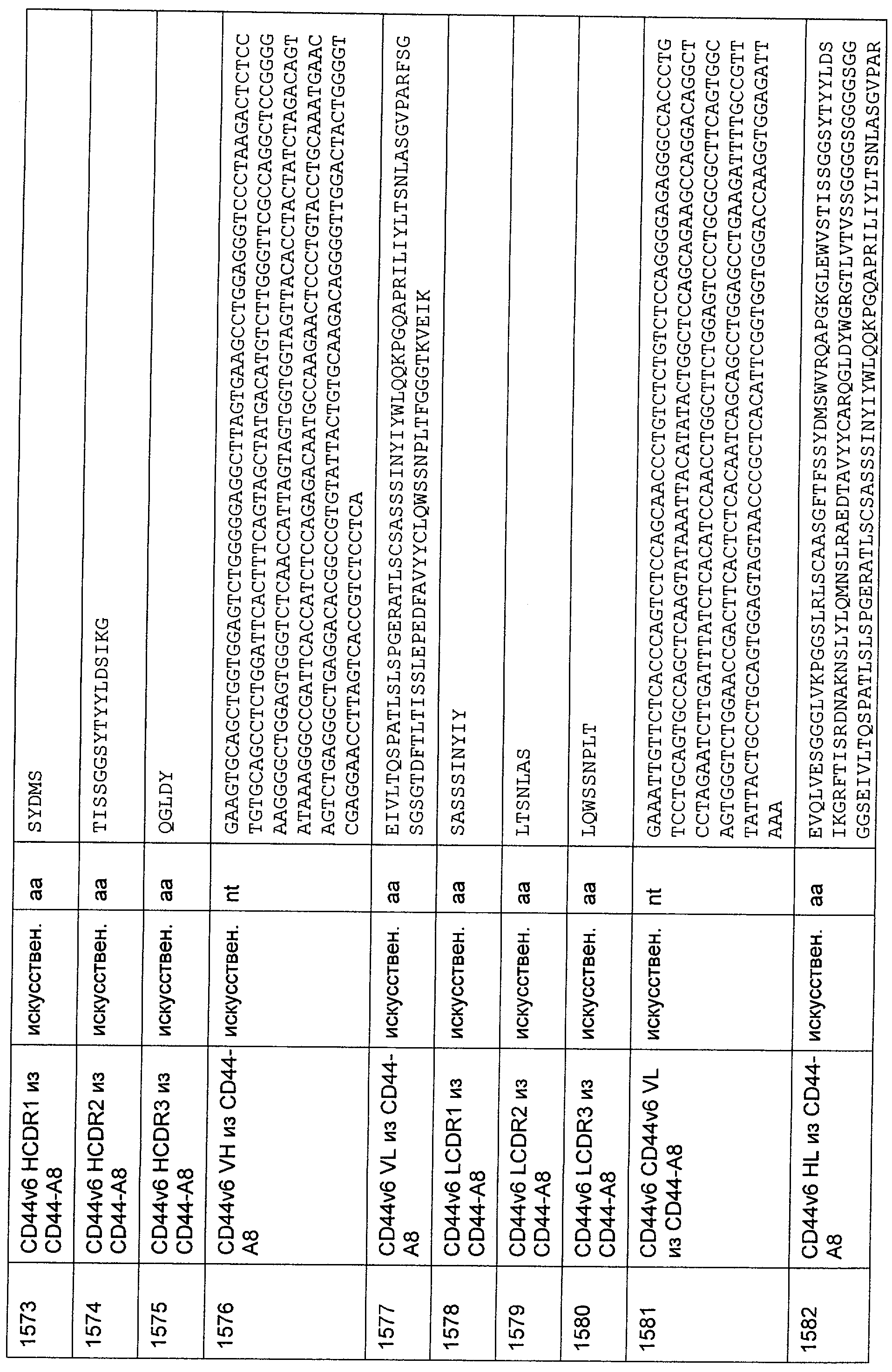
Термин "клеточный поверхностный антиген", как он использован в данной заявке, означает молекулу, которая обнаруживается на поверхности клетки. В большинстве случаев эта молекула будет располагаться в или на плазматической мембране клетки, так что по меньшей мере часть этой молекулы остается доступной в ее третичной форме снаружи клетки. Неограничивающим примером молекулы клеточной поверхности, которая локализована в плазматической мембране, является трансмембранный белок, содержащий, в его третичной конформации, области гидрофильности и гидрофобности. При этом по меньшей мере одна гидрофобная область делает возможным внедрение или вставку молекулы клеточной поверхности в гидрофобную плазматическую мембрану клетки, тогда как гидрофильные области располагаются по обеим сторонам плазматической мембраны в цитоплазму и внеклеточное пространство, соответственно. Неограничивающими примерами молекул клеточной поверхности, расположенных на плазматической мембране, являются белки, которые модифицированы по остатку цистеина для того, чтобы нести пальмитоильную группу, белки, модифицированные по С-концевому остатку цистеина для того, чтобы нести фарнезильную группу, или белки, которые модифицированы по С-концу для того, чтобы нести гликозил-фосфатидилинозитольный ("GPI") якорь. Эти группы позволяют осуществлять ковалентное присоединение белков к наружной поверхности плазматической мембраны, где они остаются доступными для распознавания внеклеточными молекулами, такими как антитела. Примеры клеточных поверхностных антигенов включают EGFR, EGFRvIII (вариант EGFR, тип III), MCSP, карбоангидразу IX (CAIX), CD30, CD33, Her2/neu, IgE, CD44v6 (вариант CD44 тип 6) и Muc-1. В дополнение к этому, примеры для соответствующих антител клеточной поверхности содержат антигены, характерные для конкретного заболевания или недомогания, т.е. рака, аутоиммунных заболеваний или инфекционных заболеваний, включая вирусные инфекции. Соответственно, термин "клеточные поверхностные антигены" очевидно включает вирусные белки, такие как нативные, не подвергавшиеся процессингу вирусные белки, экспонированные на поверхности инфицированных клеток (описанные среди прочих для оболочечных белков вируса гепатита В, С и ВИЧ-1 (вирус иммунодефицита человека)).
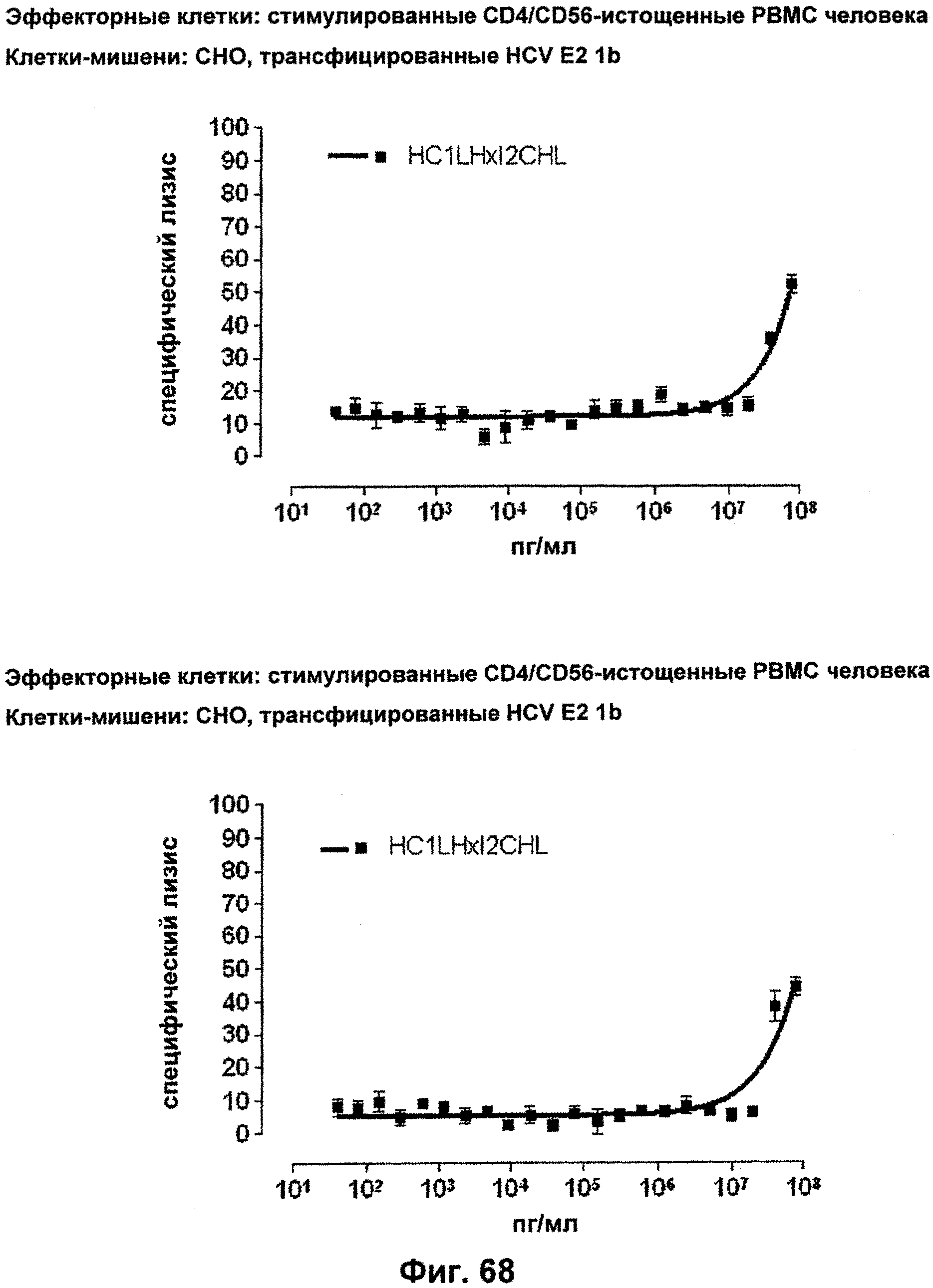
Одной из защитных функций цитотоксических Т-клеток является уничтожение инфицированных вирусами клеток, поэтому уникальное свойство биспецифических связывающих молекул по изобретению активировать и перенаправлять цитотоксические Т-клетки независимо от их аутохтонной специфичности оказывает сильное влияние на широкий спектр хронических вирусных инфекций. Для большинства этих инфекций удаление персистентно инфицированных клеток является единственным шансом на выздоровление. В настоящее время разрабатываются адоптивные терапии на основе Т-клеток против хронических инфекций CMV (цитомегаловирус) и EBV (Rooney, C.M., et al., Use of gene-modified virus-specific T lymphocytes to control Epstein-Barr-virus-related lymphoproliferation. Lancet, 1995. 345 (8941): p.9-13; Walter, E.A., et al., Reconstitution of cellular immunity against cytomegalovirus in recipients of allogeneic bone marrow by transfer of T cells clones from the donor. N. Engl. J. Med., 1995. 333 (16): p.1038-44).
Хроническая инфекция гепатита В (HBV) несомненно является одним из наиболее интересных и заслуживающих внимания показаний. Во всем мире от 350 до 400 миллионов людей инфицированы HBV. Современное лечение хронического HBV гепатита основано на применении γ-интерферона и нуклеозидных или нуклеотидных аналогов, длительной терапии со значительными побочными эффектами, такими как индукция внезапного обострения гепатита, лихорадки, миалгий, тромбоцитопении и депрессии. Несмотря на то, что в настоящее время существует более 4 утвержденных схем терапевтического лечения, редко достигают удаления вируса. Персистирующее воспаление при хроническом гепатите В приводит к циррозу печени и гепатоцеллюлярной карциноме более чем у 25% пациентов. Кроме того, вплоть до 40% пациентов с хроническим гепатитом В умирают из-за серьезных осложнений, что является причиной 0,6-1,0 миллиона смертельных случаев в год во всем мире.
HBV, прототип гепаднавирусов, представляет собой оболочечный вирус, геном которого в релаксированной кольцевой (рк) форме обратно транскрибируется в РНК-прегеном. После инфекции ркДНК импортируется в ядро гепатоцитов, где она преобразуется в ковалентно замкнутую кольцевую ДНК (кзкДНК), содержащую четыре перекрывающиеся рамки считывания. Он служит в качестве транскрипционной матрицы для прегеномной РНК и трех субгеномных РНК. РНК-прегеном функционирует в качестве мРНК для трансляции вирусного коревого белка и вирусной полимеразы. Инфицированные клетки непрерывно продуцируют поверхностный белок HBV (HBsAg) с кзкДНК, даже когда репликация HBV прекращается. HBsAg состоит из небольших поверхностных (S) белков с очень незначительной долей средних и больших (L) поверхностных белков. Как HBV S, так и L нацелены на мембрану эндоплазматического ретикулума (ER), откуда они транспортируются в мембранных везикулах через транс-Гольджи органеллы в плазматическую мембрану (Gorelick, F.S. and С.Shugrue, Exiting the endoplasmic reticulum. Mol. Cell Endocrinol., 2001. 177 (1-2): p.13-8). S и L белки постоянно экспрессируются на поверхности HBV-реплицирующих гепатоцитов, как показано недавно (Chu, С.М. and Y.F. Liaw, Membrane staining for hepatitis В surface antigen on hepatocytes: a sensitive and specific marker of active viral replication in hepatitis B. J. Clin. Pathol., 1995, 48(5): p.470-3).
Прототипами вирусов, которые экспонируют оболочечные белки на клеточной поверхности, являются вирус гепатита В (HBV), вирус гепатита С (HCV) и ВИЧ-1, которые представляют собой тяжелое бремя заболеваний в целом. Для вируса ВИЧ-1 недавно показано, что Т-клетки, модифицированные химерной конструкцией TCR с Fv-антителом, направленной на оболочечный белок др120, могут уничтожать ВИЧ-1-инфицированные клетки-мишени (Masiero, S., et al., T-cell engineering by a chimeric T-cell receptor with fntibody-type specificity for the HIV-1 др120. Gene Ther, 2005, 12 (4): p.299-310). Принадлежащий гепаднавирусам вирус гепатита В (HBV) экспрессирует комплекс оболочечного белка HBsAg, который непрерывно продуцируется из эписомальной кзкДНК, даже когда HBV репликация уменьшается.
Экспрессия в виде интактных S и L белков HBV на поверхности клетки делает их доступными для антител, которые представляют собой отличительный признак сероконверсии, когда пациенты восстанавливаются от острой фазы инфекций и происходит замена циркулирующего в крови HBsAg на анти-HBs. Если сероконверсия не происходит, то вплоть до 30% гепатоцитов продолжают экспрессировать S белок HBV также после высокоактивной противовирусной терапии большой продолжительности. Таким образом, помимо Т-лимфоцитов, специфически распознающих процессированные внутриклеточно пептиды HBV и презентированные молекулами МНС на клеточной поверхности, другие формы Т-клеточного взаимодействия возможно нацелены на интактный поверхностный белок, такой как S и L антигены, доступные в наружной клеточной мембране. С использованием одноцепочечных фрагментов антител, распознающих небольшие (S) и большие (L) оболочечные белки вируса гепатита В, созданы искусственные Т-клеточные рецепторы, позволяющие направлять трансплантированные Т-клетки к инфицированным гепатоцитам и после антиген-контактной активации этих Т-клеток секретировать цитокины и уничтожать инфицированные гепатоциты.
Ограничением для этого подхода является то, что (1) существует необходимость манипуляции с Т-клетками in vitro, (2) используемые для переноса Т-клеточных рецепторов ретровирусы могут приводить к инсерционному мутагенезу в Т-клетках, и что (3) после такого переноса Т-клеток цитотоксический ответ невозможно ограничить.
Для преодоления этих ограничений могут быть созданы биспецифические одноцепочечные молекулы антител, содержащие первый домен со специфичностью связывания с антигеном CD3-эпсилон человека и примата, не являющегося шимпанзе (как предложено в данной заявке в контексте данного изобретения), а также второй домен со специфичностью связывания с оболочечными белками HBV или HCV инфицированных гепатоцитов, и они включены в объем этого изобретения.
Согласно настоящему изобретению также предпочтительно, чтобы второй связывающий домен связывался с клеточным поверхностным антигеном человека и/или примата, не являющегося шимпанзе.
Для образования второго связывающего домена полипептида по изобретению, например биспецифических одноцепочечных антител, как они определены в данной заявке, могут быть использованы моноклональные антитела, связывающиеся с соответствующими клеточными поверхностными антигенами как человека, так и/или примата, не являющегося шимпанзе. Соответствующие связывающие домены для биспецифического полипептида, как он определен в данной заявке, могут быть получены, например, из моноклональных антител с межвидовой специфичностью в соответствии с рекомбинантными методами, описанными в данной области техники. Моноклональное антитело, связывающееся с клеточным поверхностным антигеном человека и с гомологом указанного клеточного поверхностного антигена примата, не являющегося шимпанзе, могут быть протестированы в FACS-анализах, которые изложены выше. Специалистам в данной области техники очевидно, что антитела с межвидовой специфичностью также могут быть созданы гибридомными методами, описанными в литературе (Milstein and Kohler, Nature, 256 (1975), 495-7). Например, мышей можно попеременно иммунизировать CD33 человека и примата, не являющегося шимпанзе. Из этих мышей посредством гибридомной технологии выделяют гибридомные клетки, продуцирующие антитела с межвидовой специфичностью, и анализируют с помощью FACS, как изложено выше. Создание и анализ биспецифических полипептидов, таких как биспецифические одноцепочечные антитела, демонстрирующие межвидовую специфичность, как описано в данном изобретении, показаны в следующих ниже примерах. Преимущества биспецифических одноцепочечных антител, демонстрирующих межвидовую специфичность, включают перечисленные ниже пункты.
Что касается полипептида по изобретению, то особенно предпочтительно, чтобы первый связывающий домен, способный связываться с эпитопом CD3ε-цепи человека и примата, не являющегося шимпанзе, содержал VL-область, содержащую CDR-L1, CDR-L2 и CDR-L3, выбранные из:
(а) CDR-L1, как представлено в SEQ ID NO: 27, CDR-L2, как представлено в SEQ ID NO: 28, и CDR-L3, как представлено в SEQ ID NO: 29;
(б) CDR-L1, как представлено в SEQ ID NO: 117, CDR-L2, как представлено в SEQ ID NO: 118, и CDR-L3, как представлено в SEQ ID NO: 119;
и
(в) CDR-L1, как представлено в SEQ ID NO: 153, CDR-L2, как представлено в SEQ ID NO: 154, и CDR-L3, как представлено в SEQ ID NO: 155.
Вариабельные области, т.е. вариабельная легкая цепь ("L" или "VL") и вариабельная тяжелая цепь ("Н" или "VH") понимаются в данной области техники как обеспечивающие связывающий домен антитела. Эти вариабельные области содержат гипервариабельные участки.
Термин "гипервариабельный участок" (CDR) хорошо известен в данной области техники для определения антигенной специфичности антитела. Термин "CDR-L" или "L CDR" относится к CDR в VL, в то время как термин "CDR-H" или "Н CDR" относится к CDR в VH.
В альтернативном предпочтительном воплощении данного полипептида по изобретению первый связывающий домен, способный связываться с эпитопом CD3ε-цепи человека и примата, не являющегося шимпанзе, содержит VH-область, содержащую CDR-H1, CDR-H2 и CDR-H3, выбранные из:
(а) CDR-H1, как представлено в SEQ ID NO: 12, CDR-H2, как представлено в SEQ ID NO: 13, и CDR-H3, как представлено в SEQ ID NO: 14;
(б) CDR-H1, как представлено в SEQ ID NO: 30, CDR-H2, как представлено в SEQ ID NO; 31, и CDR-H3, как представлено в SEQ ID NO: 32;
(в) CDR-H1, как представлено в SEQ ID NO: 48, CDR-H2, как представлено в SEQ ID NO: 49, и CDR-H3, как представлено в SEQ ID NO: 50;
(г) CDR-H1, как представлено в SEQ ID NO: 66, CDR-H2, как представлено в SEQ ID NO: 67, и CDR-H3, как представлено в SEQ ID NO: 68;
(д) CDR-H1, как представлено в SEQ ID NO: 84, CDR-H2, как представлено в SEQ ID NO: 85, и CDR-H3, как представлено в SEQ ID NO: 86;
(е) CDR-H1, как представлено в SEQ ID NO: 102, CDR-H2, как представлено в SEQ ID NO: 103, и CDR-H3, как представлено в SEQ ID NO: 104;
(ж) CDR-H1, как представлено в SEQ ID NO: 120, CDR-H2, как представлено в SEQ ID NO: 121, и CDR-H3, как представлено в SEQ ID NO: 122;
(з) CDR-H1, как представлено в SEQ ID NO: 138, CDR-H2, как представлено в SEQ ID NO: 139, и CDR-H3, как представлено в SEQ ID NO: 140;
(и) CDR-H1, как представлено в SEQ ID NO: 156, CDR-H2, как представлено в SEQ ID NO: 157, и CDR-H3, как представлено в SEQ ID NO: 158; и
(к) CDR-H1, как представлено в SEQ ID NO: 174, CDR-H2, как представлено в SEQ ID NO; 175, и CDR-H3, как представлено в SEQ ID NO: 176.
Также предпочтительно, чтобы первый связывающий домен, способный связываться с эпитопом CD3ε-цепи человека и примата, не являющегося шимпанзе, содержал VL-область, выбранную из группы, состоящей из VL-области, как представлено в SEQ ID NO: 35, 39, 125, 129, 161 или 165.
Альтернативно предпочтительно, чтобы первый связывающий домен, способный связываться с эпитопом CD3ε-цепи человека и примата, не являющегося шимпанзе, содержал VH-область, выбранную из группы, состоящей из VH-области, как представлено в SEQ ID NO: 15, 19, 33, 37, 51, 55, 69, 73, 87, 91, 105, 109, 123, 127, 141, 145, 159, 163, 177 или 181.
Более предпочтительно, полипептид по изобретению характеризуется первым связывающим доменом, способным связываться с эпитопом CD3ε-цепи человека и примата, не являющегося шимпанзе, который содержит VL-область и VH-область, выбранные из группы, состоящей из:
(а) VL-области, как представлено в SEQ ID NO: 17 или 21, и VH-области, как представлено в SEQ ID NO: 15 или 19;
(б) VL-области, как представлено в SEQ ID NO: 35 или 39, и VH-области, как представлено в SEQ ID NO: 33 или 37;
(в) VL-области, как представлено в SEQ ID NO: 53 или 57, и VH-области, как представлено в SEQ ID NO: 51 или 55;
(г) VL-области, как представлено в SEQ ID NO: 71 или 75, и VH-области, как представлено в SEQ ID NO: 69 или 73;
(д) VL-области, как представлено в SEQ ID NO: 89 или 93, и VH-области, как представлено в SEQ ID NO: 87 или 91;
(е) VL-области, как представлено в SEQ ID NO: 107 или 111, и VH-области, как представлено в SEQ ID NO: 105 или 109;
(ж) VL-области, как представлено в SEQ ID NO: 125 или 129, и VH-области, как представлено в SEQ ID NO: 123 или 127;
(з) VL-области, как представлено в SEQ ID NO: 143 или 147, и VH-области, как представлено в SEQ ID NO: 141 или 145;
(и) VL-области, как представлено в SEQ ID NO: 161 или 165, и VH-области, как представлено в SEQ ID NO: 159 или 163; и
(к) VL-области, как представлено в SEQ ID NO: 179 или 183, и VH-области, как представлено в SEQ ID NO: 177 или 181.
Согласно предпочтительному воплощению полипептида по изобретению пары VH-областей и VL-областей находятся в формате одноцепочечного антитела (scFv). VH- и VL-области организованы в следующем порядке: VH-VL или VL-VH. Предпочтительно, чтобы VH-область располагалась на N-конце линкерной последовательности. VL-область располагается на С-конце линкерной последовательности.
Предпочтительное воплощение описанного выше полипептида по изобретению характеризуется первым связывающим доменом, способным связываться с эпитопом CD3ε-цепи человека и примата, не являющегося шимпанзе, содержащим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 23, 25, 41, 43, 59, 61, 77, 79, 95, 97, 113, 115, 131, 133, 149, 151, 167, 169, 185 или 187.
Изобретение также относится к описанному выше полипептиду, где второй связывающий домен связывается с клеточным поверхностным антигеном, предпочтительно представляющим собой опухолевый антиген.
Термин "опухолевый антиген", как он использован в данной заявке, можно понимать как такие антигены, которые представлены на опухолевой клетке. Эти антигены могут быть представлены на клеточной поверхности посредством внеклеточного участка, который часто объединен с трансмембранной и цитоплазматической частью молекулы. Эти антигены иногда могут быть презентированы только опухолевыми клетками и никогда нормальными клетками. Опухолевые антигены могут экспрессироваться исключительно на опухолевых клетках или могут представлять собой опухолеспецифическую мутацию в сравнении с нормальными клетками. В этом случае они называются опухолеспецифическими антигенами. Более общими являются антигены, которые презентированы опухолевыми клетками и нормальными клетками, и они называются опухолеассоциированными антигенами. Эти опухолеассоциированные антигены могут сверхэкспрессироваться по сравнению с нормальными клетками или являются доступными для связывания антител в опухолевых клетках вследствие менее компактной структуры опухолевой ткани по сравнению с нормальной тканью. Неограничивающими примерами опухолевых антигенов, как они использованы в данной заявке, являются EGFR (Liu, Br. J. Cancer, 82/12 (2000), 1991-1999; Bonner, Semin. Radial Oncol., 12 (2002), 11-20; Kiyota, Oncology, 63/1 (2002), 92-98; Kuan, Brain Tumor Pathol., 17/2 (2000), 71-78), EGFRvIII (Kuan, Brain Tumor Pathol. 17/2 (2000), 71-78), карбоангидраза IX (MN/CA IX) (Uemura, Br. J. Cancer 81/4 (1999), 741-746; Longcaster, Cancer Res. 61/17 (2001), 6394-6399; Chia, J. Clin. Oncol. 19/16 (2001), 3660-3668; Beasley, Cancer Res. 61/13 (2001), 5262-5267), CD33 (Abutalib, Curr. Pharm. Biotechnol. 7 (2006), 343-69), MCSP (Campoli, Crit. Rev. Immunol. 24 (2004), 267-96) или IgE (Infuhr, Allergy 60 (2005), 977-85).
Предпочтительно, чтобы опухолевый антиген был выбран из EGFR, EGFRvIII, MCSP, ЕрСАМ, карбоангидразы IX (CAIX), CD30, CD33, Her2/neu, CD44v6 и Muc-1.
EGFR (также известный как с-erb1 или HER1) принадлежит erbB-семейству рецепторных тирозинкиназ. При активации путем связывания лиганда из EGF-семейства ростовых факторов, EGFR образует гомодимеры или гетеродимеры со вторым EGFR или другим членом семейства erbB-рецепторов, соответственно, запуская сигнальный каскад посредством митоген-активируемых протеинкиназ и других транскрипционных факторов, приводящих к пролиферации, дифференцировке и репарации (Olayioye, EMBO J., 19 (2000), 3159-67). EGFR сверхэкспрессируется при многих видах рака эпителия, включая колоректальный рак, рак молочной железы, легкого и головы и шеи (Mendelsohn, J. Clin. Oncol., 21 (2003), 2787-99; Mendelsohn, J. Clin. Oncol., 20 (18, Suppl.) (2002), 1S-13S; Prewett, Clin. Cancer Res., 8 (2002), 994-1003). Сверхэкспрессия и/или мутация EGFR в злокачественных клетках вызывает конститутивную активацию киназной активности, что приводит к пролиферации, ангиогенезу, инвазии, метастазированию и ингибированию апоптоза (Mendelsohn (2003, выше; Ciardiello, Clin. Cancer Res., 7 (2001), 2958-70; Perez-Soler, Oncologist, 9 (2004), 58-67). Показано, что моноклональные антитела, направленные на внеклеточный лиганд-связывающий домен или внутриклеточный тирозинкиназный сигнальный каскад EGFR, эффективны в качестве противоопухолевой мишени (Laskin, Cancer Treat. Review, 30 (2004), 1-17). Например, гуманизированное моноклональное антитело к EGFR цетуксимаб (эрбитукс), которое конкурентно ингибирует внеклеточный домен EGFR с целью ингибирования лигандной активации рецептора, было одобрено Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA) в 2004 г. для лечения метастатического рака толстой кишки в комбинации с ингибитором топоизомеразы иринотеканом.
Меланома-ассоциированный протеогликан хондроитинсульфат (MCSP) клеточной поверхности, также известный как высокомолекулярный меланома-ассоциированный антиген (HMW-MAA) или меланома-ассоциированный протеогликан, представляет собой большой протеогликан клеточной поверхности более чем 450 кДа, содержащий гликопротеиновое ядро 250 кДа и гликозаминогликановые цепи, присоединенные к нему (Pluschke, PNAS, 93 (1996), 9710; Nishiyama, J. Cell Biol., 114 (1991) 359). Точная функция MCSP еще не выяснена. Он может действовать в качестве рецептора адгезии, который опосредует взаимодействия клеток с внеклеточным матриксом (ЕСМ) и вероятно вовлечен в ангиогенез, тканевую инвазию и распластывание клеток (cell spreading) (Burg, Cancer Res. 59 (1999), 2869; lida, J. Biol. Chem. 276 (2001), 18786; Eisenmann, Nat. Cell Biol. 1 (1999), 507; lida, Cancer Res. 55 (1995), 2177; Campoli (2004), выше). MCSP может усиливать связывание лигандов под действием интегрина а4Ы, а активация MCSP может усиливать интегрин-опосредованное распластывание клеток посредством cdc42- и p130cas-зависимых механизмов. MCSP связывается через хондроитинсульфат с МТ3-ММР(матриксная металлопротеаза), что может разрушать различные белки ЕСМ. Он может специфически ограничивать положение МТ3-ММР до клеточных сайтов адгезии с ЕСМ. Таким образом, по-видимому, для инвазии коллагена I типа и разрушения желатина I типа требуются обе молекулы (lida (2001), выше). MSCP является главным маркером меланомы, когда он высоко экспрессируется на поверхности опухолевых клеток. Он экспрессируется по меньшей мере в 90% меланомных образований (Natali, J. Natl. Cancer Inst. 72 (1984), 13). Среди всех меланома-ассоциированных антигенов MCSP демонстрирует самую низкую степень гетерогенности (Natali, Cancer Res. 45 (1985), 2883). В противоположность первичным опухолям поверхностной распространенной меланомы (частота встречаемости: 60%), узелковой меланомы (частота встречаемости: 20%) и ограниченного предракового меланоза (частота встречаемости: 10%), которые обычно являются MCSP-положительными формами (Reza Ziai, 1987, Cancer Res. 47: 2474), первичные опухоли лентигиноза конечностей (частота встречаемости: 5%) часто являются MCSP-отрицательными (Kageshita, Cancer Res. 51 (1991), 1726). Сейчас в США ежегодно (2002) диагностируются 53600 новых случаев меланомы. В целом частота заболевания меланомой увеличивается.
В предпочтительном воплощении изобретения полипептид представляет собой молекулу биспецифического одноцепочечного антитела.
Описанные выше в данном изобретении проблемы, касающиеся разработки молекул-имитаторов для доклинических исследований, также усугубляются, если лекарственное средство-кандидат представляет собой биспецифическое антитело, например биспецифическое одноцепочечное антитело. Так, биспецифическое антитело требует, чтобы оба распознаваемых антигена обладали межвидовой специфичностью к данному виду животного, чтобы сделать возможным тестирование безопасности на таком животном.
Как уже отмечалось в данной заявке выше, согласно настоящему изобретению предложены полипептиды, содержащие первый связывающий домен, способный связываться с эпитопом CD3ε-цепи человека и примата, не являющегося шимпанзе, и второй связывающий домен, способный связываться с клеточным поверхностным антигеном, причем второй связывающий домен предпочтительно связывается также с клеточным поверхностным антигеном человека и/или примата, не являющегося шимпанзе. Преимущество биспецифических одноцепочечных молекул антител в качестве лекарственных средств-кандидатов, удовлетворяющих требованиям для предпочтительного полипептида по изобретению, заключается в применении таких молекул в доклиническом тестировании на животных, а также в клинических исследованиях и даже для терапии у людей. В предпочтительном воплощении биспецифических одноцепочечных антител с межвидовой специфичностью по изобретению второй связывающий домен, способный связываться с клеточным поверхностным антигеном, имеет человеческое происхождение. В биспецифической молекуле с межвидовой специфичностью по изобретению связывающий домен, способный связываться с эпитопом эпсилон-цепи CD3 человека и примата, не являющегося шимпанзе, расположен в порядке VH-VL или VL-VH на N-конце или С-конце биспецифической молекулы. Примеры биспецифических молекул с межвидовой специфичностью по изобретению с различной расположением VH- и VL-цепи в первом и втором связывающем домене описаны в прилагаемых примерах.
Как использовано в данной заявке, "биспецифическое одноцепочечное антитело" означает единичную полипептидную цепь, содержащую два связывающих домена. Каждый связывающий домен содержит одну вариабельную область из тяжелой цепи антитела ("VH-область"), причем VH-область первого связывающего домена специфически связывается с молекулой CD3ε, a VH-область второго связывающего домена специфически связывается с клеточным поверхностным антигеном, как определено более подробно ниже. Два связывающих домена возможно связаны друг с другом посредством короткого полипептидного спейсера. Неограничивающим примером полипептидного спейсера является Gly-Gly-Gly-Gly-Ser (G-G-G-S) и его повторы. Каждый связывающий домен дополнительно может содержать одну вариабельную область из легкой цепи антитела ("VL-область"), при этом VH-область и VL-область в пределах каждого первого и второго связывающих доменов связаны друг с другом через полипептидный линкер, например типа, описанного и заявленного в ЕР 623679 В1, но в любом случае имеющим длину, достаточную для того, чтобы позволить VH-области и VL-области первого связывающего домена и VH-области и VL-области второго связывающего домена образовывать пары друг с другом таким образом, чтобы, будучи вместе, они были способны специфически связываться с соответствующими первой и второй молекулами.
Согласно предпочтительному воплощению данного изобретения охарактеризованная выше молекула биспецифического одноцепочечного антитела содержит группу из следующих последовательностей, таких как CDR Н1, CDR H2, CDR Н3, CDR L1, CDR L2 и CDR L3 во втором связывающем домене, выбранных из группы, состоящей из:
SEQ ID NO: 189-194, SEQ ID NO: 201-206, SEQ ID NO: 219-224, SEQ ID NO: 237-242, SEQ ID NO: 255-260, SEQ ID NO: 273-279, SEQ ID NO: 382-384 и 387-389, SEQ ID NO: 400-402 и 405-407, SEQ ID NO: 418-420 и 423-425, SEQ ID NO: 436-438 и 441-443, SEQ ID NO: 454-456 и 459-461, SEQ ID NO: 472-474 и 477-479, SEQ ID NO: 490-492 и 495-497, SEQ ID NO: и 508-510 и 513-515,
SEQ ID NO: 530-532 и 1568-1570, SEQ ID NO: 545-547 и 550-552, SEQ ID NO: 559-561 и 564-566,
SEQ ID NO: 577-579 и 582-584,
SEQ ID NO: 615-617 и 620-622, SEQ ID NO: 633-635, 638, 639 и 1571, SEQ ID NO: 650-652 и 655-657, SEQ ID NO: 668-670 и 673-675, SEQ ID NO: 682-684 и 687-689, SEQ ID NO: 696-698 и 701-703, SEQ ID NO: 710-712 и 715-717, SEQ ID NO: 724-726 и 729-731, SEQ ID NO: 738-740 и 743-745, SEQ ID NO: 752-754 и 757-759, SEQ ID NO: 766-768 и 771-773, SEQ ID NO: 780-782 и 785-787, SEQ ID NO: 794-796 и 799-801, SEQ ID NO: 808-810 и 813-815, SEQ ID NO: 822-824 и 827-829, SEQ ID NO: 836-838 и 841-843, SEQ ID NO: 850-852 и 855-857,
SEQ ID NO: 866-868 и 871-873, SEQ ID NO: 884-886 и 889-891, SEQ ID NO: 902-904 и 907-909, SEQ ID NO: 920-922 и 925-927, SEQ ID NO: 938-940 и 943-945, SEQ ID NO: 956-958 и 961-963, SEQ ID NO: 974-976 и 979-981, SEQ ID NO: 992-994 и 997-999, SEQ ID NO: 1006-1008 и 1011-1013, SEQ ID NO: 1020-1022 и 1025-1027, SEQ ID NO: 1034-1036 и 1039-1041, SEQ ID NO: 1048-1050 и 1053-1055, SEQ ID NO: 1062-1064 и 1067-1069, SEQ ID NO: 1076-1078 и 1081-1083, SEQ ID NO: 1090-1092 и 1095-1097,
SEQ ID NO: 1114-1116 и 1119-1121, SEQ ID NO: 1128-1130 и 1133-1135,
SEQ ID NO: 1141-1143 и 1146-1148, SEQ ID NO: 1155-1157 и 1160-1162, SEQ ID NO: 1169-1171 и 1174-1176, SEQ ID NO: 1183-1185 и 1188-1190, SEQ ID NO: 1197-1199 и 1202-1204, SEQ ID NO: 1211-1213 и 1216-1218, SEQ ID NO: 1125-1227 и 1230-1232, SEQ ID NO: 1239-1241 и 1244-1246, SEQ ID NO: 1253-1255 и 1258-1260, SEQ ID NO: 1267-1269 и 1272-1274, SEQ ID NO: 1281-1283 и 1286-1288, SEQ ID NO: 1295-1297 и 1300-1302, SEQ ID NO: 1309-1311 и 1314-1316, SEQ ID NO: 1323-1325 и 1328-1330,
SEQ ID NO: 1343-1345 и 1348-1350, SEQ ID NO: 1361-1363 и 1366-1368, SEQ ID NO: 1375-1377 и 1380-1382, SEQ ID NO: 1389-1391 и 1394-1396, SEQ ID NO: 1403-1405 и 1408-1410, SEQ ID NO: 1417-1419 и 1422-1424, SEQ ID NO: 1431-1433 и 1436-1438, SEQ ID NO: 1445-1447 и 1450-1452, SEQ ID NO: 1459-1461 и 1464-1466, SEQ ID NO: 1473-1475 и 1478-1480,
SEQ ID NO: 1486-1491, SEQ ID NO: 1492-1497,
SEQ ID NO: 1505-1507 и 1510-1512, SEQ ID NO: 1531-1533 и 1536-1538,
SEQ ID NO: 1573-1575 и 1578-1580, SEQ ID NO: 1591-1593 и 1596-1598, SEQ ID NO: 1605-1607 и 1610-1612, и SEQ ID NO: 1619-1621, 1624-1626, SEQ ID NO: 1634-1636 и 1639-1641 и SEQ ID NO: 1652-1654, SEQ ID NO: 1657-1659 и SEQ ID NO: 1669-1674.
Особенно предпочтительное воплощение изобретения относится к охарактеризованному выше полипептиду, где молекула биспецифического одноцепочечного антитела содержит последовательность, выбранную из:
(а) аминокислотной последовательности, как представлено в любой из SEQ ID NO: 291, 293, 295, 297, 299, 301, 303, 305, 307, 309, 311, 313, 315, 317, 319, 321, 323, 325, 327, 329, 331, 333, 335, 337, 339, 341, 343, 345, 347, 393, 395, 397, 411, 413, 415, 429, 431, 433, 447, 449, 451, 465, 467, 469, 483, 485, 487, 501, 503, 505, 519, 521, 523, 1336, 1338, 1340, 538, 540, 542, 556, 570, 572, 574, 588, 590, 592, 626, 628, 630, 643, 645, 647, 661, 663, 665, 679, 693, 707, 721, 735, 749, 763, 777, 791, 805, 819, 833, 847, 861, 863, 877, 879, 881, 895, 897, 899, 913, 915, 917, 931, 933, 935, 949, 951, 953, 967, 969,971, 985, 987, 989,1003,1017, 1031, 1045, 1059, 1073, 1087, 1101, 1125, 1138, 1152, 1166, 1180, 1194, 1208, 1222, 1236, 1250, 1264, 1278, 1292, 1306, 1320, 1334, 1354, 1356, 1358, 1372, 1386, 1400, 1414, 1428, 1442, 1456, 1470, 1484, 1500, 1502, 1518, 1520, 1522, 1524, 1526, 1528, 1544, 1546, 1548, 1550, 1552, 1554, 1556, 1558, 1560, 1562, 1564, 1566, 1586, 1588, 1602, 1616, 1630, 1647, 1649 или 1663; и
(б) аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, как представлено в любой из SEQ ID NO: 292, 294, 296, 298, 300, 302, 304, 306, 308, 310, 312, 314, 316, 318, 320, 322, 324, 326, 328, 330, 332, 334, 336, 338, 340, 342, 344, 346, 348, 394, 396, 398, 412, 414, 416, 430, 432, 434, 448, 450, 452, 466, 468, 470, 484, 486, 488, 502, 504, 506, 520, 522, 524, 1337, 1339, 1341, 539, 541, 543, 557, 571, 573, 575, 589, 591, 593, 627, 629, 631, 644, 646, 648, 662, 664, 666, 680, 694, 708, 722, 736, 750, 764, 778, 792, 806, 820, 834, 848, 862, 864, 878, 880, 882, 896, 898, 900, 914, 916, 918, 932, 934, 936, 950, 952, 954, 968, 970, 972, 986, 988, 990, 1004, 1018, 1032, 1046, 1060, 1074, 1088, 1102, 1126, 1139, 1153, 1167, 1181, 1195, 1209, 1223, 1237, 1251, 1265, 1279, 1293, 1307, 1321, 1335, 1355, 1357, 1359, 1373, 1387, 1401, 1415, 1429, 1443, 1457, 1471, 1485, 1501, 1503, 1519, 1521, 1523, 1525, 1527, 1529, 1545, 1547, 1549, 1551, 1553, 1555, 1557, 1559, 1561, 1563, 1565, 1567, 1587, 1589, 1603, 1617, 1631, 1648, 1650 или 1664.
В предпочтительном воплощении изобретения биспецифические одноцепочечные антитела обладают межвидовой специфичностью к CD3-эпсилон и к клеточному поверхностному антигену, распознаваемому их вторым связывающим доменом. В более предпочтительном воплощении эти биспецифические одноцепочечные антитела обладают межвидовой специфичностью к CD3-эпсилон человека и примата, не являющегося шимпанзе, и MCSP, EGFR, EGFRvIII, карбоангидразе IX, CD30, CD33, IgE, H CD44v6, Muc-1, HBV и HCV. В альтернативном воплощении согласно настоящему изобретению предложена последовательность нуклеиновой кислоты, кодирующая описанный выше полипептид по изобретению.
Настоящее изобретение также относится к вектору, содержащему молекулу нуклеиновой кислоты по настоящему изобретению.
Многие подходящие векторы известны специалистам в молекулярной биологии, выбор которых будет зависеть от желаемой функции, и включают плазмиды, космиды, вирусы, бактериофаги и другие векторы, традиционно используемые в генетической инженерии. Для конструирования различных плазмид и векторов могут быть использованы методы, хорошо известные специалистам в данной области техники; см., например методики, описанные в Sambrook et al. (выше) и Ausubel, Current Protocols in Molecular Biology, Green Publishing Associates and Wiley Interscience, N.Y. (1989), (1994). Альтернативно, полинуклеотиды и векторы по изобретению могут быть включены в липосомы для доставки в клетки-мишени. Как указано более подробно ниже, для выделения индивидуальных последовательностей ДНК использовали клонирующий вектор. Если необходима экспрессия конкретного полипептида, то релевантные последовательности могут быть перенесены в экспрессирующие векторы. Типичные клонирующие векторы включают pBluescript SK, pGEM, pUC9, pBR322 и pGBT9. Типичные экспрессирующие векторы включают pTRE, pCAL-n-EK, pESP-1, pOP13CAT.
Предпочтительно, указанный вектор содержит последовательность нуклеиновой кислоты, которая представляет собой регуляторную последовательность, функциональным образом связанную с указанной последовательностью нуклеиновой кислоты, определенной в данной заявке.
Термин "регуляторная последовательность" относится к последовательностям ДНК, которые необходимы для воздействия на экспрессию кодирующих последовательностей, с которыми они лигированы. Природа таких регуляторных последовательностей различается в зависимости от организма-хозяина. У прокариот регуляторные последовательности в общем случае включают промотор, сайт связывания рибосом и терминаторы. У эукариот в общем случае регуляторные последовательности включают промоторы, терминаторы и, в некоторых случаях, энхансеры, трансактиваторы или транскрипционные факторы. Термин "регуляторная последовательность" предназначен для включения, как минимум, всех компонентов, присутствие которых необходимо для экспрессии, и также может включать в себя дополнительные предпочтительные компоненты.
Термин "функциональным образом связанный" относится к смежному положению, где описанные таким образом компоненты находятся во взаимозависимости, позволяющей им функционировать надлежащим образом. Регуляторная последовательность, "функциональным образом связанная" с кодирующей последовательностью, лигирована таким образом, что экспрессии кодирующей последовательности достигают в условиях, совместимых с регуляторными последовательностями. В том случае, когда регуляторной последовательностью является промотор, специалисту очевидно, что предпочтительно использовать двухцепочечную нуклеиновую кислоту.
Таким образом, упомянутым вектором предпочтительно является экспрессирующий вектор. "Экспрессирующий вектор" представляет собой конструкцию, которая может быть использована для трансформации выбранного хозяина и обеспечивает экспрессию кодирующей последовательности в выбранном хозяине. Экспрессирующие векторы могут представлять собой, например, клонирующие векторы, бинарные векторы или интегрирующие векторы. Экспрессия включает транскрипцию молекулы нуклеиновой кислоты предпочтительно в транслируемую (область) мРНК. Регуляторные элементы, обеспечивающие экспрессию в прокариотах и/или эукариотических клетках, хорошо известны специалистам в данной области техники. В случае эукариотических клеток они содержат в норме промоторы, обеспечивающие инициацию транскрипции, и возможно поли-А-сигналы, обеспечивающие терминацию транскрипции и стабилизацию этого транскрипта. Возможные регуляторные элементы, позволяющие осуществлять экспрессию в прокариотических клетках-хозяевах, включают, например, промотор PL, lac, trp или tac в Е. coli, а примерами регуляторных элементов, позволяющих осуществлять экспрессию в эукариотических клетках-хозяевах, являются промотор АОХ1 или GAL1 в дрожжах или промоторы на основе CMV, SV40 (обезьяний вирус 40), RSV (вирус саркомы Рауса), CMV-энхансер, SV40-энхансер или глобиновый интрон в клетках млекопитающих и других животных.
Кроме элементов, которые отвечают за инициацию транскрипции, подобные регуляторные элементы также могут содержать сигналы терминации транскрипции, такие как сайт SV40-поли-А или сайт tk-поли-А, расположенный ниже данного полинуклеотида. Кроме того, в зависимости от используемой экспрессирующей системы, к кодирующей последовательности описанной последовательности нуклеиновой кислоты могут быть добавлены лидерные последовательности, способные направлять данный полипептид в клеточный компартмент или секретировать его в среду, и они хорошо известны в данной области техники; см. также прилагаемые Примеры. Лидерная(ые) последовательность(и) собирае(ю)тся в соответствующей фазе с последовательностями инициации и терминации трансляции, и предпочтительно, чтобы лидерная последовательность была способна направлять секрецию транслированного белка или его участка в периплазматическое пространство или внеклеточную среду. Возможно, что гетерологичная последовательность может кодировать слитый белок, включающий N-концевой идентифицирующий пептид, обеспечивающий желаемые характеристики, например, стабилизацию или упрощенную очистку экспрессированного рекомбинантного продукта; см. выше. В этом контексте в данной области техники известны подходящие экспрессирующие векторы, такие как Okayama-Berg кДНК-экспрессирующий вектор pcDV1 (Pharmacia), pCDM8, pRc/CMV, pcDNAI, pcDNA3 (In-vitrogene), pEF-DHFR, pEF-ADA или pEF-neo (Mack et al. PNAS (1995) 92, 7021-7025 и Raum et al. Cancer Immunol. Immunother. (2001) 50(3), 141-150) или pSPORTI (GIBCO BRL).
Предпочтительно, когда экспрессирующие регуляторные последовательности будут представлять собой эукариотические промоторные системы в векторах, способных трансформировать трансфицируемые эукариотические клетки-хозяева, но также можно использовать регуляторные последовательности прокариотических хозяев. После того, как вектор будет включен в соответствующего хозяина, этот хозяин поддерживается в условиях, подходящих для обеспечения высокого уровня экспрессии нуклеотидных последовательностей, и при желании, дальше могут следовать сбор и очистка полипептида по изобретению; см., например прилагаемые Примеры.
Альтернативной экспрессирующей системой, которая может быть использована для экспрессии белка, активного в отношении клеточного цикла, является система насекомых. В одной из таких систем в качестве вектора для экспрессии чужеродных генов в клетках Spodoptera frugiperda или в личинках Trichoplusia используется вирус ядерного полиэдроза Autographa califomica (AcNPV). Кодирующая последовательность описываемой молекулы нуклеиновой кислоты может быть клонирована в несущественную область вируса, такую как полиэдриновый ген, и помещена под контроль полиэдринового промотора. Успешная вставка указанной кодирующей последовательности будет инактивировать полиэдриновый ген и приводить к получению рекомбинантного вируса, в котором отсутствует белок оболочки. Эти рекомбинантные вирусы затем используют для инфицирования клеток S. frugiperda или личинок Trichoplusia, в которых экспрессируется белок по изобретению (Smith, J. Virol. 46 (1983), 584; Engelhard, Proc. Nat. Acad. Sci. USA, 91 (1994), 3224-3227).
Дополнительные регуляторные элементы могут включать транскрипционные, а также трансляционные энхансеры. Предпочтительно, описанные выше векторы по изобретению содержат селектируемый и/или сравнительный маркер (scorable marker).
Селектируемые маркерные гены, полезные для селекции трансформированных клеток и, например, растительной ткани и растений, хорошо известны специалистам в данной области техники и придают, например, устойчивость к антиметаболитам в качестве основы селекции для dhfr, который обеспечивает устойчивость к метотрексату (Reiss, Plant Physiol. (Life Sci. Adv.) 13 (1994), 143-149); npt, который обеспечивает устойчивость к аминогликозидам неомицину, канамицину и паромицину (Herrera-Estrella, EMBO J., 2 (1983), 987-995); и hygro, который обеспечивает устойчивость к гигромицину (Marsh, Gene, 32 (1984), 481-485). Описаны дополнительные селектируемые гены, а именно trpB, который позволяет клеткам утилизировать индол вместо триптофана; hisD, который позволяет клеткам утилизировать гистинол вместо гистидина (Hartman, Proc. Natl. Acad. Sci. USA, 85 (1988), 8047); манноза-6-фосфатизомераза, которая позволяет клеткам утилизировать маннозу (WO 94/20627); и ODC (орнитиндекарбоксилаза), которая обеспечивает устойчивость к ингибитору орнитиндекарбоксилазы 2-(дифторметил)-DL-орнитину (DFMO) (McConlogue, 1987, в: Current Communications in Molecular Biology, Cold Spring Harbor Laboratory ed.); или дезаминаза из Aspergillus terreus, которая обеспечивает устойчивость к бластицидину S (Tamura, Biosci. Biotechnol. Biochem., 59 (1995), 2336-2338).
Полезные сравнительные маркеры также известны специалистам в данной области техники и имеются в продаже. Предпочтительно, когда указанным маркером является ген, кодирующий люциферазу (Giacomin, PI. Sci., 116 (1996), 59-72; Scikantha, J. Bad, 178 (1996), 121), зеленый флуоресцентный белок (Gerdes, FEBS Lett., 389 (1996), 44-47) или β-глюкуронидазу (Jefferson, EMBO J., 6 (1987), 3901-3907). Это воплощение, в частности, полезно для простого и быстрого скрининга клеток, тканей и организмов, содержащих упомянутый вектор.
Как описано выше, упомянутая молекула нуклеиновой кислоты может быть использована сама по себе или как часть вектора для экспрессии полипептида по изобретению в клетках, например, для его очистки, а также для генотерапевтических задач. Молекулы нуклеиновых кислот или векторы, содержащие последовательность(и) ДНК, кодирующую(ие) любой описанный выше полипептид по изобретению, вводят в клетки, которые в свою очередь продуцируют интересующий полипептид. Генная терапия, основанная на введении терапевтических генов в клетки с использованием методик ex vivo или in vivo, представляет собой одно из наиболее важных применений генного переноса. Подходящие векторы, способы или системы доставки генов для генной терапии in vitro или in vivo описаны в литературе и известны специалисту в данной области техники; см., например Giordano, Nature Medicine, 2 (1996), 534-539; Schaper, Circ. Res., 79 (1996), 911-919; Anderson, Science, 256 (1992), 808-813; Verma, Nature, 389 (1994), 239; Isner, Lancet, 348 (1996), 370-374; Muhlhauser, Circ. Res., 77 (1995), 1077-1086; Onodera, Blood, 91 (1998), 30-36; Verma, Gene Ther., 5 (1998), 692-699; Nabel, Ann. N.Y. Acad. Sci., 811 (1997), 289-292; Verzeletti, Hum. Gene Ther., 9 (1998), 2243-51; Wang, Nature Medicine, 2 (1996), 714-716; WO 94/29469; WO 97/00957, US 5580859; US 5589466; или Schaper, Current Opinion in Biotechnology, 7 (1996), 635-640. Упомянутые молекулы нуклеиновых кислот и векторы могут быть сконструированы для непосредственного введения или для введения посредством липосом или вирусных векторов (например, аденовирусного, ретровирусного) в клетку. Предпочтительно, чтобы указанная клетка представляла собой клетку зародышевой линии, эмбриональную клетку или яйцеклетку или происходила из них, наиболее предпочтительно указанная клетка представляет собой стволовую клетку. Примером эмбриональной стволовой клетки может быть, среди прочего, стволовая клетка, которая описана в Nagy, Proc. Natl. Acad. Sci. USA, 90 (1993), 8424-8428.
Кроме того, согласно изобретению предложен хозяин, подвергнутый трансформации или трансфекции вектором по изобретению. Указанный хозяин может быть получен путем введения описанного выше вектора по изобретению или описанной выше молекулы нуклеиновой кислоты по изобретению в хозяина. Присутствие по меньшей мере одного вектора или по меньшей мере одной молекулы нуклеиновой кислоты в хозяине может опосредовать экспрессию гена, кодирующего описанные выше конструкции одноцепочечных антител.
Описываемые молекула нуклеиновой кислоты или вектор по изобретению, которые вводят хозяину, либо могут быть встроены в геном хозяина, либо могут поддерживаться внехромосомно.
Хозяином может быть любая прокариотическая или эукариотическая клетка.
Термин "прокариот" предназначен для включения всех бактерий, которые могут быть трансформированы или трансфицированы молекулами ДНК или РНК с целью экспрессии белка по изобретению. Прокариотические хозяева могут включать грамотрицательные, а также грамположительные бактерии, такие как, например, E. coli, S. typhimurium, Serratia marcescens и Bacillus subtilis. Термин "эукариотический" предназначен для включения клеток дрожжей, высших растений, насекомых и предпочтительно млекопитающих. В зависимости от хозяина, используемого в процедуре рекомбинантного получения, белок, кодируемый полинуклеотидом по настоящему изобретению, может быть гликозилированным или может быть негликозилированным. Особенно предпочтительно использование плазмиды или вируса, содержащих кодирующую последовательность полипептида по изобретению, генетически слитую с N-концевой FLAG-меткой и/или С-концевой His-меткой. Предпочтительно, длина указанной FLAG-метки составляет примерно 4-8 аминокислот, наиболее предпочтительно 8 аминокислот. Описанный выше полинуклеотид можно использовать для трансформации или трансфекции хозяина, применяя любую из методик, общепризнанных среди специалистов обычной квалификации в данной области техники. Кроме того, методы получения слитых, функциональным образом связанных генов и их экспрессии, например в клетках млекопитающих и бактериях, хорошо известны в данной области техники (Sambrook, выше).
Предпочтительно, указанным хозяином является бактерия или клетка насекомых, грибов, растений или животных.
В частности предусматривается, что указанный хозяин может представлять собой клетку млекопитающих. В частности, предпочтительные клетки-хозяева включают клетки СНО (яичника китайского хомячка), клетки COS (фибробласты африканской зеленой мартышки), линии миеломных клеток типа SP2/0 или NS/0. Как проиллюстрировано в прилагаемых примерах, в качестве хозяев особенно предпочтительны клетки СНО.
Более предпочтительно, указанная клетка-хозяин представляет собой человеческую клетку или человеческую клеточную линию, например per.с6 (Kroos, Biotechnol. Prog., 2003, 19: 163-168).
Таким образом, в следующем воплощении настоящее изобретение относится к способу получения полипептида по изобретению, включающему культивирование хозяина по изобретению в условиях, способствующих экспрессии данного полипептида по изобретению, и извлечение полученного полипептида из культуры.
Трансформированные хозяева могут быть выращены в ферментерах и культивированы в соответствии с методиками, известными в данной области техники, для достижения оптимального клеточного роста. Затем полипептид по изобретению может быть выделен из ростовой среды, клеточных лизатов или клеточных мембранных фракций. Выделение и очистка, например, экспрессируемых микробами полипептидов по изобретению могут быть осуществлены любыми традиционными методами, такими как, например, препаративные хроматографические разделения и иммунологические разделения, как, например, разделения, вовлекающие использование моноклональных или поликлональных антител, направленных, например, против метки (tag) полипептида по изобретению или как описано в прилагаемых примерах.
Условия культивирования хозяина, позволяющие осуществить экспрессию, известны в данной области техники как зависимые от системы хозяина и экспрессирующей системы/экспрессирующего вектора, используемых в таком способе. Параметры, которые должны быть изменены для достижения условий, способствующих экспрессии рекомбинантного полипептида, известны в данной области техники. Таким образом, подходящие условия могут быть определены специалистом в данной области техники в отсутствие дополнительного изобретательского вклада.
После проведения экспрессии полипептид по изобретению может быть очищен в соответствии со стандартными в данной области техники процедурами, включая осаждение сульфатом аммония, аффинные колонки, колоночную хроматографию, электрофорез в геле и тому подобное; см. Scopes, "Protein Purification", Springer-Verlag, N.Y. (1982). Для фармацевтических применений предпочтительны по существу чистые полипептиды с гомогенностью по меньшей мере примерно 90-95% и наиболее предпочтительны с гомогенностью 98-99% или более. Будучи очищенным, частично или до гомогенности, при желании, полипептид по изобретению затем можно использовать в терапевтических целях (в том числе экстракорпорально) или для разработки и проведения аналитических процедур. Кроме того, в прилагаемых примерах подробно описаны примеры методов извлечения полипептида по изобретению из культуры.
Кроме того, согласно данному изобретению предложена композиция, содержащая полипептид по изобретению или полипептид, полученный описанным выше способом. Предпочтительно, указанная композиция представляет собой фармацевтическую композицию.
В соответствии с изобретением термин "фармацевтическая композиция" относится к композиции для введения пациенту, предпочтительно пациенту человеку. Конкретная предпочтительная фармацевтическая композиция по данному изобретению содержит связывающие молекулы, направленные против и созданные против независимых от окружения эпитопов CD3. Предпочтительно, фармацевтическая композиция содержит подходящие композиции носителей, стабилизаторов и/или эксципиентов. В предпочтительном воплощении фармацевтическая композиция содержит композицию для парентерального, трансдермального, внутрипросветного, внутриартериального, интратекального и/или интраназального введения или введения посредством прямой инъекции в ткань. В частности предусматривается, что указанную композицию вводят пациенту посредством инфузии или инъекции. Введение подходящих композиций может быть осуществлено разными способами, например, путем внутривенного, внутрибрюшинного, подкожного, внутримышечного, местного или интрадермального введения. В частности, согласно настоящему изобретению предложено непрерывное введение подходящей композиции. В качестве неограничивающего примера, непрерывное, т.е. постоянное введение, может быть реализовано посредством небольшой насосной системы, приводимой в действие пациентом для дозирования поступления терапевтического агента в организм пациента. Фармацевтическая композиция, содержащая связывающие молекулы, направленные против и созданные против независимых от окружения эпитопов CD3 по изобретению, может быть введена с использованием указанных насосных систем. Такие насосные системы в общем случае известны в данной области техники, и обычно рассчитаны на периодическую замену картриджей, содержащих вводимый инфузией терапевтический агент. При замене картриджа в такой насосной системе может произойти временное прекращение в иных случаях непрерываемого потока терапевтического агента в организм пациента. В таком случае фаза введения перед заменой картриджа и фаза введения после замены картриджа все же будут рассматриваться совместно составляющими "непрерывное введение" такого терапевтического агента в соответствии со смыслом фармацевтических средств и способов по изобретению.
Постоянное или непрерывное введение этих связывающих молекул, направленных против и созданных против независимых от окружения эпитопов CD3 по данному изобретению, может быть внутривенным или подкожным с использованием устройства для доставки жидкости или небольшой насосной системы, включая механизм подачи жидкости для подачи жидкости из резервуара и запускающий механизм для приведения в действие приводного механизма. Насосные системы для подкожного введения могут включать иглу или канюлю для протыкания кожи пациента и доставки подходящей композиции в организм пациента. Указанные насосные системы могут быть непосредственно зафиксированы на коже или прикреплены к коже пациента изолированно от вены, артерии или кровеносного сосуда, тем самым обеспечивая прямой контакт между насосной системой и кожей пациента. Насосная система может быть прикреплена к коже пациента от 24 часов до нескольких суток включительно. Насосная система может быть небольшого размера с резервуаром для небольших объемов. В качестве неограничивающего примера, объем резервуара для подходящей фармацевтической композиции, которая должна быть введена, может составлять от 0,1 до 50 мл.
Непрерывное введение может быть трансдермальным с использованием пластыря, накладываемого на кожу и заменяемого через определенные промежутки времени. Специалист в данной области техники осведомлен о системах использования пластыря для доставки лекарственного средства, подходящих для этой задачи. Следует отметить, что трансдермальное введение особенно подходит в качестве непрерываемого введения, поскольку замена первого использованного пластыря предпочтительно может быть осуществлена одновременно с заменой на новый, второй пластырь, например на поверхности кожи, расположенной в непосредственной близости от первого использованного пластыря и непосредственно перед удалением первого использованного пластыря. Проблем с прерыванием потока или сильным повреждением клеток не возникает.
Композиция по настоящему изобретению, содержащая, в частности, связывающие молекулы, направленные против и созданные против независимых от окружения эпитопов CD3, могут дополнительно содержать фармацевтически приемлемый носитель. Примеры подходящих фармацевтических носителей хорошо известны в данной области техники и включают растворы, например забуференные фосфатом физиологические растворы, воду, эмульсии, такие как эмульсии масло/вода, различные типы увлажняющих агентов, стерильные растворы, липосомы и т.д. Композиции, содержащие такие носители, могут быть изготовлены хорошо известными традиционными способами. Композиции могут содержать углеводы, буферные растворы, аминокислоты и/или поверхностно-активные вещества. Углеводы могут представлять собой нередуцирующие сахара, предпочтительно трегалозу, сахарозу, октасульфат, сорбит или ксилит. Такие композиции могут быть использованы для непрерывных введений, которые могут быть внутривенными или подкожными с использованием и/или без использования насосных систем. Аминокислоты могут представлять собой заряженные аминокислоты, предпочтительно лизин, ацетат лизина, аргинин, глутамат и/или гистидин. Поверхностно-активные вещества могут представлять собой детергенты, предпочтительно с молекулярной массой более 1,2 кДа, и/или простой полиэфир, предпочтительно с молекулярной массой более 3 кДа. Неограничивающими примерами предпочтительных детергентов являются Tween 20, Tween 40, Tween 60, Tween 80 или Tween 85. Неограничивающими примерами предпочтительного простого полиэфира являются PEG (полиэтиленгликоль) 3000, PEG 3350, PEG 4000 или PEG 5000. Предпочтительное значение рН буферных систем, используемых в настоящем изобретении, может составлять 5-9, и они могут содержать цитрат, сукцинат, фосфат, гистидин и ацетат. Композиции по настоящему изобретению можно вводить субъекту в подходящей дозе, которая может быть определена, например в результате исследований с применением возрастающих доз посредством введения увеличивающихся доз полипептида по изобретению, демонстрирующего межвидовую специфичность, описанную в данном изобретении в отношении приматов, не являющихся шимпанзе, например макаков. Как указано выше, полипептид по изобретению, демонстрирующий межвидовую специфичность, описанную в данном изобретении, может быть предпочтительно использован в той же самой форме в доклиническом тестировании на приматах, не являющихся шимпанзе, и в виде лекарственного средства у людей. Эти композиции также можно вводить в комбинации с другими белковыми и небелковыми лекарственными средствами. Эти лекарственные средства можно вводить одновременно с композицией, содержащей полипептид по изобретению, который определен в данной заявке, или отдельно до или после введения указанного полипептида в соответствии с определенными временными интервалами и дозами. Режим дозирования будет определяться лечащим врачом и клиническими показателями. Как хорошо известно в областях медицины, дозировки для любого пациента зависят от многих факторов, включая размер пациента, площадь поверхности тела, возраст, конкретное вводимое соединение, пол, время и путь введения, общее состояние здоровья и другие лекарственные средства, предполагаемые для совместного введения. Композиции для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, включая физиологический раствор и забуференные среды. Парентеральные разбавители включают раствор хлорида натрия, декстрозу в растворе Рингера, декстрозу и хлорид натрия, раствор Рингера с лактозой или нелетучие масла. Внутривенные разбавители включают жидкие и питательные наполнители, электролиты-наполнители (например на основе декстрозы в растворе Рингера) и тому подобное. Также могут присутствовать консерванты и другие добавки, такие как, например, антимикробные средства, антиоксиданты, хелатирующие агенты, инертные газы и тому подобное. К тому же, композиция по настоящему изобретению может содержать белковые носители, такие как, например, сывороточный альбумин или иммуноглобулин, предпочтительно человеческого происхождения. Предусматривается, что композиция по изобретению может содержать, в дополнение к полипептиду по изобретению, определенному в данной заявке, дополнительные биологически активные агенты в зависимости от предполагаемого применения композиции. Такими агентами могут быть лекарственные средства, действующие на желудочно-кишечную систему, лекарственные средства, действующие в качестве цитостатических средств, лекарственные средства, предупреждающие гиперурикемию, лекарственные средства, подавляющие иммунные реакции (например, кортикостероиды), лекарственные средства, модулирующие воспалительный ответ, лекарственные средства, действующие на систему кровообращения, и/или такие агенты, как цитокины, известные в данной области техники.
Биологическая активность фармацевтической композиции, определенной в данной заявке, может быть определена, например, на основании анализов цитотоксичности, как описано в следующих ниже примерах, в WO 99/54440, или Schlereth и др. (Cancer Immunol. Immunother., 20 (2005), 1-12). "Эффективность" или "эффективность in vivo", как использовано в данной заявке, относится к реакции на терапию фармацевтической композицией по изобретению, полученной с применением, например стандартизированных критериев оценки ответа NCI (Национальный институт рака США). Успех или эффективность терапии in vivo с использованием фармацевтической композиции по изобретению относится к эффективности композиции в отношении ее предполагаемой цели, т.е. к способности композиции вызывать ее желаемый эффект, т.е. истощение патологических клеток, например опухолевых клеток. Эффективность in vivo может быть проконтролирована в соответствии с утвержденными стандартными методами определения соответствующих нозологических форм, включая, но не ограничиваясь этим, определение количества лейкоцитов, дифференциальный анализ крови, метод сортировки флуоресцентно-активированных клеток, аспирацию костного мозга. В дополнение к этому могут быть использованы методы определения клинико-химических параметров, специфичных для различных заболеваний, и другие утвержденные стандартные методы. Кроме того, могут быть использованы компьютерная томография, рентгеновская, ядерно-магнитно-резонансная томография (например для оценки ответа на основе критериев Национального института рака США [Cheson BD, Horning SJ, Coiffier В, Shipp MA, Fisher Rl, Connors JM, Lister ТА, Vose J, Grillo-Lopez A, Hagenbeek A, Cabanillas F, Klippensten D, Hiddemann W, Castellino R, Harris NL, Armitage JO, Carter W, Hoppe R, Canellos GP. Report of an international workshop to standardize response criteria for non-Hodgkin's lymphomas. NCI Sponsored International Working Group.J. Clin. Oncol., 1999 Apr; 17(4); 1244]), позитронно-эмиссионное томографическое сканирование, определение количества лейкоцитов, дифференциальный анализ крови, сортировка флуоресцентно-активированных клеток, аспирация костного мозга, биопсии/гистологии лимфатических узлов и определение различных лимфома-специфических клинико-химических параметров (например лактатдегидрогеназы) и другие утвержденные стандартные методы.
Другой главной проблемой в разработке таких лекарственных средств, как фармацевтическая композиция по изобретению, является прогнозируемая модуляция фармакокинетических свойств. С этой целью определяют фармакокинетический профиль лекарственного средства-кандидата, т.е. профиль фармакокинетических параметров, которые влияют на способность конкретного лекарственного средства лечить заданное состояние. Фармакокинетические параметры лекарственного средства, оказывающего влияние на способность лекарственного средства лечить конкретное болезненное состояние, включают, но не ограничиваются этим: период полувыведения, объем распределения, метаболизм "первого прохождения" через печень и степень связывания с сывороткой крови. На эффективность заданного лекарственного агента может оказывать влияние каждый из упомянутых выше параметров.
"Период полувыведения" означает время, за которое 50% введенного лекарственного средства выводится посредством биологических процессов, например метаболизма, экскреции и т.д.
Под "метаболизмом первого прохождения через печень" понимают способность лекарственного средства метаболизироваться после первого контакта с печенью, т.е. в процессе его первого прохождения через печень.
"Объем распределения" означает степень удерживания лекарственного средства во всех различных компартментах организма, таких как, например, внутриклеточные и внеклеточные пространства, ткани и органы и т.д., и распределение лекарственного средства в этих компартментах.
"Степень связывания с сывороткой крови" означает способность лекарственного средства взаимодействовать или связываться с белками сыворотки крови, такими как альбумин, что приводит к снижению или потере биологической активности лекарственного средства.
Фармакокинетические параметры также включают биодоступность, латентный период (Tlag), Tmax, скорости всасывания, время начала и/или Cmax для заданного количества вводимого лекарственного средства.
"Биодоступность" означает количество лекарственного средства в компартменте крови.
"Латентный период" означает отставание по времени между введением лекарственного средства и его детекцией и возможностью измерения в крови или плазме.
"Tmax" представляет собой время, после которого достигается максимальная концентрация лекарственного средства в крови, а "Cmax" представляет собой максимальную концентрацию в крови, получаемую при использовании данного лекарственного средства. На промежуток времени для достижения концентрации лекарственного средства в крови или тканях, который необходим для его биологического эффекта, оказывают влияние все параметры. Фармакокинетические параметры биспецифических одноцепочечных антител, предпочтительного воплощения полипептида по изобретению, демонстрирующих межвидовую специфичность, которые могут быть определены в доклиническом тестировании на животных - приматах, не являющихся шимпанзе, перечисленных выше, также приведены, например в публикации Schlereth и др. (Cancer Immunol. Immunother., 20 (2005), 1-12).
Термин "токсичность", как он использован в данной заявке, относится к токсическим эффектам лекарственного средства, выражающимся в неблагоприятных событиях или тяжелых неблагоприятных событиях. Эти побочные явления можно было бы отнести к отсутствию переносимости лекарственного средства в целом и/или отсутствию локальной переносимости после введения. Токсичность также могла бы включать тератогенный или карциногенный эффекты, вызываемые этим лекарственным средством.
Термин "безопасность", "безопасность in vivo" или "переносимость", как он использован в данной заявке, определяет введение лекарственного средства без индуцирования тяжелых неблагоприятных событий сразу после введения (локальная переносимость) и в течение более продолжительного применения лекарственного средства. "Безопасность", "безопасность in vivo" или "переносимость" могут быть оценены, например, через регулярные интервалы во время лечения и последующего наблюдения. Измерения включают клиническую оценку, например органных манифестаций, и скрининг лабораторных аномалий. В соответствии со стандартами NCI-CTC и/или MedDRA может быть проведена клиническая оценка и зарегистрировано/закодировано отклонение относительно нормальных данных. Органные манифестации могут включать такие критерии, как аллергия/иммунология, кровь/костный мозг, сердечная аритмия, свертывание и тому подобное, которые приведены, например, в Общих терминологических критериях для неблагоприятных событий (Common Terminology Criteria for adverse events) v3.0 (CTCAE). Лабораторные параметры, которые могут быть протестированы, включают, например, гематологический, клинико-химический, коагуляционный профиль и анализ мочи и исследование других жидкостей организма, таких как сыворотка, плазма, лимфоидная или цереброспинальная жидкость, ликвор и тому подобное. Таким образом, безопасность может быть оценена, например путем медицинского осмотра, использования методов визуализации (т.е. ультразвук, рентгеновские лучи, СТ-сканирования, магнитно-резонансная визуализация (MRI)), других измерений с применением технических устройств (т.е. электрокардиограмма), основных показателей состояния организма, путем измерения лабораторных параметров и регистрации неблагоприятных событий. Например, неблагоприятные события у приматов, не являющихся шимпанзе, в применениях и способах по изобретению могут быть исследованы гистопатологическими и/или гистохимическими методами.
Термин "эффективная и нетоксичная доза", как он использован в данной заявке, относится к переносимой дозе биспецифического одноцепочечного антитела, как оно определено в данной заявке, которая достаточно высока для того, чтобы вызвать истощение патологических клеток, устранение опухоли, сокращение опухоли или стабилизацию заболевания без или по существу без основных токсических эффектов. Такие эффективные и нетоксичные дозы могут быть определены, например, в исследованиях действия возрастающих доз, описанных в данной области техники, и она должна быть ниже дозы, индуцирующей тяжелые неблагоприятные побочные явления (дозолимитирующая токсичность (dose limiting toxicity, DLT)).
На вышеупомянутые термины также имеются ссылки, например, в Preclinical safety evaluation of biotechnology-derived pharmaceuticals (Доклиническая оценка безопасности биотехнологически произведенных фармацевтических средств) 86; ICH Harmonised Tripartite Guideline; ICH Steering Committee meeting on July 16, 1997.
Кроме того, изобретение относится к фармацевтической композиции, содержащей полипептид по данному изобретению (т.е. полипептид, содержащий по меньшей мере один связывающий домен, способный связываться с эпитопом эпсилон-цепи CD3 человека и примата, не являющегося шимпанзе, причем этот эпитоп представляет собой часть аминокислотной последовательности, входящей в группу, состоящую из SEQ ID NO: 2, 4, 6 или 8 по данному изобретению, или получаемой в соответствии со способом по изобретению) для предупреждения, лечения или ослабления заболевания, выбранного из пролиферативного заболевания, опухолевого заболевания или иммунологического расстройства. Предпочтительно, указанная фармацевтическая композиция дополнительно содержит подходящие композиции носителей, стабилизаторов и/или эксципиентов.
Следующий аспект изобретения относится к применению полипептида, который определен в данной заявке выше или получен согласно способу, определенному в данной заявке выше, для изготовления фармацевтической композиции для предупреждения, лечения или ослабления заболевания. Предпочтительно, указанное заболевание представляет собой пролиферативное заболевание, опухолевое заболевание или иммунологическое расстройство. Также предпочтительно, когда указанное опухолевое заболевание представляет собой злокачественное заболевание, предпочтительно рак.
В другом предпочтительном воплощении применения данного полипептида по изобретению указанная фармацевтическая композиция подходит для введения в комбинации с дополнительным лекарственным средством, т.е. как часть комбинированной терапии. В указанной комбинированной терапии активный агент возможно может быть включен в ту же фармацевтическую композицию, что и полипептид по изобретению, или может быть включен в отдельную фармацевтическую композицию. В этом последнем случае указанная отдельная фармацевтическая композиция подходит для применения до введения, одновременно с введением или после введения указанной фармацевтической композиции, содержащей полипептид по изобретению. Дополнительное лекарственное средство или фармацевтическая композиция могут представлять собой небелковое соединение или белковое соединение. В том случае, если дополнительным лекарственным средством является белковое соединение, предпочтительно, чтобы это белковое соединение могло обеспечивать сигнал активации для иммунных эффекторных клеток.
Предпочтительно, указанное белковое соединение или небелковое соединение можно вводить одновременно или неодновременно с полипептидом по изобретению, молекулой нуклеиновой кислоты, как они определены в данной заявке выше, вектором, как он определен в данной заявке выше, или хозяином, как он определен в данной заявке выше.
Другой аспект изобретения относится к способу предупреждения, лечения или ослабления заболевания у субъекта, нуждающегося в этом, включающему стадию введения эффективного количества фармацевтической композиции по изобретению. Предпочтительно, указанное заболевание представляет собой пролиферативное заболевание, опухолевое заболевание, или иммунологическое расстройство. Еще более предпочтительно, указанное опухолевое заболевание представляет собой злокачественное заболевание, предпочтительно рак.
В другом предпочтительном воплощении способа по изобретению указанная фармацевтическая композиция подходит для введения в комбинации с дополнительным лекарственным средством, т.е. как часть комбинированной терапии. В указанной комбинированной терапии активный агент возможно может быть включен в ту же фармацевтическую композицию, что и полипептид по изобретению, или может быть включен в отдельную фармацевтическую композицию. В этом последнем случае указанная отдельная фармацевтическая композиция подходит для применения до введения, одновременно с введением или после введения указанной фармацевтической композиции, содержащей полипептид по изобретению. Дополнительное лекарственное средство или фармацевтическая композиция могут представлять собой небелковое соединение или белковое соединение. В том случае, если дополнительным лекарственным средством является белковое соединение, предпочтительно, чтобы это белковое соединение могло обеспечивать сигнал активации для эффекторных клеток иммунной системы.
Предпочтительно, указанное белковое соединение или небелковое соединение можно вводить одновременно или неодновременно с полипептидом по изобретению, молекулой нуклеиновой кислоты, как они определены в данной заявке выше, вектором, как он определен в данной заявке выше, или хозяином, как он определен в данной заявке выше.
Предпочтительно, для описанного выше способа по изобретению, указанным субъектом является человек.
В следующем аспекте изобретение относится к набору, содержащему полипептид по изобретению, молекулу нуклеиновой кислоты по изобретению, вектор по изобретению или хозяина по изобретению.
Настоящее изобретение дополнительно характеризуется следующим ниже перечнем пунктов.
Пункт 1. Способ идентификации (а) полипептида(ов), содержащего(их) связывающий домен с межвидовой специфичностью, способный связываться с эпитопом CD3-эпсилон (CD3ε) человека и примата, не являющегося шимпанзе, включающий стадии:
(а) приведение в контакт полипептида(ов) с N-концевым фрагментом внеклеточного домена CD3ε, состоящим максимально из 27 аминокислот, содержащих аминокислотную последовательность Gln-Asp-Gly-Asn-Glu-Glu-Met-Gly (SEQ ID NO: 381) или Gln-Asp-Gly-Asn-Glu-Glu-Ile-Gly (SEQ ID NO: 382), фиксированным посредством его С-конца на твердой фазе;
(б) элюирование связанного(ых) полипептида(ов) с указанного фрагмента; и
(в) выделение полипептида(ов) из элюата (б).
Предпочтительно, чтобы полипептид(ы), идентифицируемый(е) вышеупомянутым способом по изобретению, имел(и) человеческое происхождение.
Настоящий "способ идентификации (а) полипептида(ов)" понимают как способ выделения одного или более разных полипептидов с одной и той же специфичностью к фрагменту внеклеточного домена CD3ε, содержащего на своем N-конце аминокислотную последовательность Gln-Asp-Gly-Asn-Glu-Glu-Met-Gly (SEQ ID NO: 381) или Gln-Asp-Gly-Asn-Glu-Glu-Ile-Gly (SEQ ID NO: 382), из множества полипептидов-кандидатов, а также способ очистки полипептида из раствора. Неограничивающие воплощения способа выделения одного или более разных полипептидов с одной и той же специфичностью к фрагменту внеклеточного домена CD3s включают способы селекции антиген-специфических связывающих структур, например, пэннинг-методами, обычно используемыми для гибридомного скрининга, скрининга временно/стабильно трансфицированных клонов эукариотических клеток-хозяев или в методах фагового дисплея. Неограничивающим примером последнего способа очистки полипептида из раствора является, например, очистка рекомбинантно экспрессирующегося полипептида из культурального супернатанта или препарата такой культуры.
Как указано выше, фрагмент, используемый в способе по изобретению, представляет собой N-концевой фрагмент внеклеточного домена молекулы CD3ε приматов. Аминокислотная последовательность внеклеточного домена молекулы CD3ε различных приматов представлена в SEQ ID NO: 1, 3, 5 и 7. Две формы N-концевого октамера представлены в SEQ ID NO: 381 и 382. Предпочтительно, чтобы этот N-конец был доступным без ограничений для связывания полипептидов, которые должны быть идентифицированы согласно способу по изобретению. Термин "доступный без ограничений" в контексте изобретения понимают как не имеющий дополнительных мотивов, таких как His-метка. Интерференция такой His-метки со связывающей молекулой, идентифицируемой способом по изобретению, описано в прилагаемых Примерах 6 и 34.
Согласно способу по изобретению указанный фрагмент фиксируют через его С-конец на твердой фазе. Специалист в данной области техники легко и без каких-либо изобретательских трудностей выберет подходящую твердофазную подложку в зависимости от используемого воплощения способа по изобретению. Примеры твердой подложки включают, но не ограничиваются этим, матрицы типа гранул (например, агарозные гранулы, сефарозные гранулы, полистирольные гранулы, декстрановые гранулы), планшеты (культуральные планшеты или многолуночные планшеты), а также чипы, известные, например от Biacore®. Выбор средств и способов фиксации/иммобилизации фрагмента на указанной твердой подложке зависит от выбора твердой подложки. Обычно используемым способом фиксации/иммобилизации является связывание через N-гидроксисукцинимидный (NHS) сложный эфир. Лежащая в основе этого связывания химия, а также альтернативные способы фиксации/иммобилизации известны специалисту в данной области техники, например из Hermanson "Bioconjugate Techniques", Academic Press, Inc. (1996). Для фиксации/иммобилизации на хроматографических подложках обычно используют следующие средства: NHS-активированную сефарозу (например HiTrap-NHS от GE Life Science - Amersham), CnBr-активированную сефарозу (например, GE Life Science - Amersham), NHS-активированные декстрановые гранулы (Sigma) или активированный полиметакрилат. Эти реагенты также могут быть использованы в периодическом подходе. Кроме того, в периодическом подходе могут быть использованы декстрановые гранулы, содержащие оксид железа (например, доступные от Miltenyi). Эти гранулы могут быть использованы в комбинации с магнитом для отделения гранул от раствора. Полипептиды могут быть иммобилизованы на чипе Biacore (например, чипах СМ5) путем применения NHS-активированного карбоксиметилдекстрана. Следующими примерами соответствующей твердой подложки являются многолуночные планшеты с реакционно-способными аминогруппами (например, планшеты Nunc Immobilizer™).
Согласно способу по изобретению указанный фрагмент внеклеточного домена CD3-эпсилон может быть связан с твердой подложкой напрямую или посредством участка аминокислот, который может представлять собой линкерную или другую белковую/полипептидную группировку. Альтернативно, внеклеточный домен CD3-эпсилон может быть связан непосредственно через одну или более чем одну адапторную молекулу.
Средства и способы оценки пептида, связанного с иммобилизованным эпитопом, хорошо известны в данной области техники. То же самое справедливо для способов выделения идентифицируемого(ых) полипептида(ов) из элюата.
В соответствии с изобретением способ выделения из множества полипептидов-кандидатов одного или более разных полипептидов с той же специфичностью к фрагменту внеклеточного домена CD3ε, содержащего на своем N-конце аминокислотную последовательность Gln-Asp-Gly-Asn-Glu-Glu-X-Gly, может включать одну или более стадий следующих способов селекции антиген-специфических структур.
CD3ε-специфические связывающие молекулы могут быть выбраны из репертуаров антител. Библиотека фагового дисплея может быть сконструирована на основе стандартных процедур, которые описаны, например, в "Phage Display: A Laboratory Manual"; Ed. Barbas, Burton, Scott & Silverman; Cold Spring Harbor Laboratory Press, 2001. Форматом фрагментов антител в библиотеке антител может быть scFv, но в общем случае также может быть Fab-фрагмент или даже фрагмент однодоменного антитела. Для выделения фрагментов антител могут быть использованы наивные библиотеки фрагментов антител. Для отбора связывающих структур с возможно низкой иммуногенностью при их последующем терапевтическом применении предпочтительными могут быть библиотеки фрагментов человеческих антител с целью прямой селекции фрагментов человеческих антител. В некоторых случаях они могут составлять основу для синтетических библиотек антител (Knappik et al. J. Mol. Biol., 2000, 296: 57 ff). Соответствующим форматом может быть Fab, scFv (как описано ниже) или доменные антитела (dAb, обзор которых приведен в Holt et al., Trends Biotechnol., 2003, 21: 484 ff).
В данной области техники также известно, что во многих случаях не существует источника человеческих иммунных антител, полезного против целевого антигена. Поэтому данным целевым антигеном иммунизируют животных, и из ткани животных, например селезенки или РВМС (мононуклеарные клетки периферической крови), выделяют соответствующие библиотеки антител. N-концевой фрагмент может быть биотинилирован или ковалентно связан с белками типа KLH (гемоцианин лимфы улитки) или бычьего сывороточного альбумина (BSA). Согласно общим подходам для иммунизации используют грызунов. Некоторые репертуары иммунных антител не человеческого происхождения могут быть особенно благоприятны по другим причинам, например, из-за присутствия однодоменных антител (VHH), происходящих из видов одногорбых верблюдов (camelid species) (как описано в Muyldermans, J. Biotechnol., 74: 277; De Genst et al., Dev. Como. Immunol., 2006, 30: 187 ff). Таким образом, соответствующим форматом библиотеки антител могут быть Fab, scFv (как описано ниже) или однодоменные антитела (VHH).
В одном из возможных подходов мыши F1 в возрасте 10 недель от скрещиваний balb/c×C57black могут быть иммунизированы целыми клетками, например экспрессирующими трансмембранную ЕрСАМ, демонстрирующую на N-конце в качестве трансляционного слияния N-концевые аминокислоты 1-27 зрелой CD3ε-цепи. Альтернативно, мыши могут быть иммунизированы слитым белком 1-27 CD3-эпсилон-Fc (соответствующий подход описан в прилагаемом Примере 2). После бустерной(ых) иммунизации(ий) могут быть отобраны образцы крови и сывороточный титр антител против CD3-положительных Т-клеток может быть протестирован, например в FACS-анализе. Обычно, сывороточные титры значительно выше у иммунизированных, чем у неиммунизированных животных.
Иммунизированные животные могут стать основой для создания иммунных библиотек антител. Примеры таких библиотек включают библиотеки фагового дисплея. Такие библиотеки в общем случае могут быть созданы на основе стандартных методик, которые описаны, например в "Phage Display: A Laboratory Manual"; Ed. Barbas, Burton, Scott & Silverman; Cold Spring Harbor Laboratory Press, 2001.
Кроме этого, нечеловеческие антитела могут быть гуманизированы посредством фагового дисплея в результате создания библиотек более вариабельных антител, которые впоследствии могут быть обогащены в отношении связывающих агентов (binders) в процессе селекции.
В подходе с применением фагового дисплея любой из пулов фагов, который экспонирует библиотеки антител, образует основу для селекции связывающих структур с использованием соответствующего антигена в качестве целевой молекулы. Центральный этап, на котором выделяют антиген-специфические, антиген-связанные фаги, обозначается как пэннинг. Благодаря экспонированию фрагментов антител на поверхности фагов, этот общий способ называется фаговым дисплеем. Один из предпочтительных способов селекции заключается в применении небольших белков, таких как домен N2 нитевидного фага, трансляционно слитый с N-концом scFv, экспонируемых данным фагом. Другим дисплейным методом, известным в данной области техники, который может быть использован для выделения связывающих структур, является метод рибосомного дисплея (обзор которого приведен в Groves & Osbourn, Expert. Opin. Biol. Ther., 2005, 5: 125 ff; Lipovsek & Pluckthun, J. Immunol. Methods, 2004, 290: 52 ff).
Чтобы продемонстрировать связывание scFv-содержащих фаговых частиц со слитым белком 1-27 CD3ε-Fc, фаговая библиотека, несущая клонированный scFv-репертуар, может быть получена из соответствующего культурального супернатанта с использованием PEG (полиэтиленгликоль). scFv-содержащие фаговые частицы могут быть проинкубированы с иммобилизованным слитым белком CD3ε-Fc. Иммобилизованный слитый белок CD3ε-Fc может быть нанесен в виде покрытия на твердую фазу. Связывающие структуры могут быть элюированы, и этот элюат можно использовать для инфицирования свежей порции неинфицированных бактериальных хозяев. Бактериальные хозяева, подвергнутые успешной трансдукции фагмидной копией, кодирующей человеческий scFv-фрагмент, вновь могут быть подвергнуты селекции на устойчивость к карбенициллину и после этого инфицированы, например хелперным фагом VCMS 13 для начала второго раунда экспонирования антител (antibody display) и селекции in vitro. В норме осуществляют суммарно от 4 до 5 циклов селекции.
Связывание выделенных связывающих структур можно протестировать на CD3-эпсилон-положительных клетках Jurkat, клетках HPBall, PBMC или трансфицированных эукариотических клетках, которые несут N-концевую CD3ε-последовательность, слитую с экспонируемой на поверхности ЕрСАМ, используя проточно-цитометрический анализ (см. прилагаемый Пример 4).
Пункт 2. Способ по пункту 1, где полипептид(ы) содержит(ат) идентифицированный связывающий домен в качестве первого связывающего домена и второй связывающий домен, способный связываться с клеточным поверхностным антигеном.
Для создания второго связывающего домена полипептида, идентифицируемого способом по изобретению, например биспецифических одноцепочечных антител, как они определены в данной заявке, могут быть использованы моноклональные антитела, связывающиеся с соответствующими клеточными поверхностными антигенами как человека, так и примата, не являющегося шимпанзе. Соответствующие связывающие домены для биспецифического полипептида, как он определен в данной заявке, могут быть получены, например, из моноклональных антител с межвидовой специфичностью с использованием рекомбинантных методов, описанных в данной области техники. Моноклональное антитело, связывающееся с клеточным поверхностным антигеном человека и с гомологом указанного клеточного поверхностного антигена примата, не являющегося шимпанзе, может быть протестировано в FACS-анализах, которые приведены выше. Кроме того, для создания антител с межвидовой специфичностью могут быть использованы гибридомные методики, описанные в литературе (Milstein and Kohler, Nature, 256 (1975), 495-7). Например, мышей можно попеременно иммунизировать CD33 человека и примата, не являющегося шимпанзе. Из этих мышей посредством гибридомной технологии выделяют гибридомные клетки, продуцирующие антитела с межвидовой специфичностью, и анализируют с помощью FACS, как приведено выше. Создание и анализ биспецифических полипептидов, таких как биспецифические одноцепочечные антитела, демонстрирующие межвидовую специфичность, которые описаны в данном изобретении, показаны в следующих ниже Примерах. Преимущества биспецифических одноцепочечных антител, демонстрирующих межвидовую специфичность, включают перечисленные ниже пункты.
Пункт 3. Способ по пункту 2, где второй связывающий домен связывается с клеточным поверхностным антигеном человека и/или примата, не являющегося шимпанзе.
Пункт 4. Способ по любому из пунктов 1-3, где первый связывающий домен представляет собой антитело.
Пункт 5. Способ по пункту 4, где антитело представляет собой одноцепочечное антитело.
Пункт 6. Способ по любому из пунктов 2-5, где второй связывающий домен представляет собой антитело.
Пункт 7. Способ по любому из пунктов 1-6, где фрагмент внеклеточного домена CD3ε состоит из одного или более фрагментов полипептида, имеющего аминокислотную последовательность, выбранную из любой последовательности, представленной в SEQ ID NO: 2, 4, 6 или 8.
Пункт 8. Способ по пункту 7, где длина указанного фрагмента составляет 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 аминокислотных остатков.
Пункт 9. Способ по любому из пунктов 1-8, где способ идентификации представляет собой способ скрининга множества полипептидов, содержащих связывающий домен с межвидовой специфичностью, связывающийся с эпитопом CD3ε человека и примата, не являющегося шимпанзе.
Пункт 10. Способ по любому из пунктов 1-8, где способ идентификации представляет собой способ очистки/выделения полипептида, содержащего связывающий домен с межвидовой специфичностью, связывающийся с эпитопом CD3ε человека и примата, не являющегося шимпанзе.
Пункт 11. Применение N-концевого фрагмента внеклеточного домена CD3ε, состоящего максимально из 27 аминокислот, содержащих аминокислотную последовательность Gln-Asp-Gly-Asn-Glu-Glu-Met-Gly (SEQ ID NO: 381) или Gln-Asp-Gly-Asn-Glu-Glu-Ile-Gly (SEQ ID NO: 382) для создания связывающего домена с межвидовой специфичностью.
В соответствии с указанным применением по изобретению предпочтительно, чтобы созданный связывающий домен с межвидовой специфичностью имел человеческое происхождение.
Пункт 12. Применение по пункту 11, где связывающий домен с межвидовой специфичностью представляет собой антитело.
Пункт 13. Применение по пункту 12, где антитело представляет собой одноцепочечное антитело.
Пункт 14. Применение по пунктам 12-13, где антитело представляет собой биспецифическое антитело.
Эти и другие воплощения описаны и включены в описание и Примеры настоящего изобретения. Рекомбинантные методики и иммунологические методы описаны, например в Sambrook et al. Molecular Cloning: A Laboratory Manual; Cold Spring Harbor Laboratory Press, 3rd edition 2001; Lefkovits; Immunology Methods Manual; The Comprehensive Sourcebook of Techniques; Academic Press, 1997; Golemis; Protein-Protein Interactions: A Molecular Cloning Manual; Cold Spring Laboratory Press, 2002. Дополнительная литература, касающаяся любого из антител, способов, применений и соединений, используемых в соответствии с настоящим изобретением, можно извлечь из общедоступных библиотек и баз данных, используя, например электронные устройства. Например, можно использовать общую базу данных "Medline", доступную через Интернет, например по адресу http://www.ncbi.nlm.nih.gov/PubMed/medline.html. Дополнительные базы данных и адреса, такие как http://www.ncbi.nlm.nih.gov/ или перечисленные на домашней странице сервиса EMBL (European Molecular Biology Laboratory) под адресом http://www.embl.de/services/index.html, известны специалисту в данной области техники и также могут быть получены с использованием, например, http://www.google.com.
В графических материалах показано следующее.
Фиг.1
Слитая конструкция N-концевых аминокислот 1-27 CD3-эпсилон приматов с гетерологичным растворимым белком.
Фиг.2
На Фиг. показаны средние величины абсорбции повторенных в четырех экземплярах образцов, измеренных в анализе ELISA (твердофазный иммуноферментный анализ), определяющем присутствие конструкции, состоящей из N-концевых аминокислот 1-27 зрелой эпсилон-цепи CD3 человека, слитой с шарнирным и Fc-гамма-участком человеческого IgG1 и С-концевой 6-гистидиновой меткой, в супернатанте (SN) временно трансфицированных клеток 293. В первом столбце, отмеченном как "27 аа huCD3E", показана средняя величина абсорбции для конструкции, во втором столбце, отмеченном как "нерелев. SN", показана средняя величина для супернатанта клеток 293, трансфицированных нерелевантной конструкцией в качестве отрицательного контроля. Сравнение величин, полученных для данной конструкции, с величинами, полученными для отрицательного контроля, четко демонстрирует присутствие рекомбинантной конструкции.
Фиг.3
На Фиг. показаны средние величины абсорбции повторенных в четырех экземплярах образцов, измеренные в ELISA-анализе, определяющем связывание анти-CD3-связывающих молекул с межвидовой специфичностью в форме неочищенных препаратов одноцепочечных антител, экспрессируемых в периплазматическое пространство, с конструкцией, содержащей N-концевые аминокислоты 1-27 зрелой эпсилон-цепи CD3 человека, слитой с шарнирным и Fc-гамма-участком человеческого IgG1 и С-концевой His6-меткой. В столбцах показаны, слева направо, средние величины абсорбции для специфичностей, обозначенных как A2J HLP, I2C HLP, E2M HLP, F70 HLP, G4H HLP, H2C HLP, E1L HLP, F12Q HLP, F6A HLP и Н1Е HLP. В самом правом столбце, помеченном как "отр. контр." показана средняя величина абсорбции для препарата одноцепочечного мышиного антитела против CD3 человека в качестве отрицательного контроля. Сравнение величин, полученных для анти-CD3-специфичностей, с величинами, полученными для отрицательного контроля (отр. контр.), четко демонстрирует сильное связывание анти-CD3-специфичностей с N-концевыми аминокислотами 1-27 зрелой эпсилон-цепи CD3 человека.
Фиг.4
Слитая конструкция N-концевых аминокислот 1-27 CD3-эпсилон приматов с гетерологичным мембраносвязанным белком.
Фиг.5
Перекрывания гистограмм разных трансфектантов, протестированных в FACS-анализе, определяющем присутствие рекомбинантных трансмембранных слитых белков, состоящих из ЕрСАМ яванского макака и N-концевых аминокислот 1-27 эпсилон-цепи CD3 человека, игрунки, тамарина, беличьей обезьяны и домашней свиньи, соответственно. Перекрывания гистограмм, слева направо и сверху вниз, показывают результаты для трансфектантов, экспрессирующих конструкции, содержащие 27-мер человека, 27-мер игрунки, 27-мер тамарина, 27-мер беличьей обезьяны и 27-мер свиньи, соответственно. Для отдельных перекрываний тонкая линия представляет образец, инкубированный с PBS (забуференный фосфатом физиологический раствор), содержащим 2% FCS (фетальная сыворотка теленка) вместо анти-Flag М2-антитела, в качестве отрицательного контроля, а жирная линия показывает образец, инкубированный с анти-Flag М2-антителом. Для каждой конструкции перекрывание гистограмм показывает связывание анти-Flag М2-антитела с трансфектантами, что четко демонстрирует экспрессию рекомбинантных конструкций в трансфектантах.
Фиг.6
Перекрывания гистограмм разных трансфектантов, протестированных в FACS-анализе, определяющем связывание анти-CD3-связывающих молекул с межвидовой специфичностью в форме неочищенных препаратов одноцепочечных антител, экспрессируемых в периплазматическое пространство, с N-концевыми аминокислотами 1-27 эпсилон-цепи CD3 человека, игрунки, тамарина и беличьей обезьяны, соответственно, слитой с ЕрСАМ яванского макака.
Фиг.6А:
Перекрывания гистограмм, слева направо и сверху вниз, показывают результаты для трансфектантов, экспрессирующих 1-27 CD3-EpCAM, содержащий 27-мер человека, протестированных с использованием CD3-специфических связывающих молекул, обозначенных как Н2С HLP, F12Q HLP, Е2М HLP и G4H HLP, соответственно.
Фиг.6В:
Перекрывания гистограмм, слева направо и сверху вниз, показывают результаты для трансфектантов, экспрессирующих 1-27 CD3-EpCAM, содержащий 27-мер игрунки, протестированных с использованием CD3-специфических связывающих молекул, обозначенных как Н2С HLP, F12Q HLP, Е2М HLP и G4H HLP, соответственно.
Фиг.6С:
Перекрывания гистограмм, слева направо и сверху вниз, показывают результаты для трансфектантов, экспрессирующих 1-27 CD3-EpCAM, содержащий 27-мер тамарина, протестированных с использованием CD3-специфических связывающих молекул, обозначенных как Н2С HLP, F12Q HLP, Е2М HLP и G4H HLP, соответственно.
Фиг.6D:
Перекрывания гистограмм, слева направо и сверху вниз, показывают результаты для трансфектантов, экспрессирующих 1-27 CD3-EpCAM, содержащий 27-мер беличьей обезьяны, протестированных с использованием CD3-специфических связывающих молекул, обозначенных как Н2С HLP, F12Q HLP, E2M HLP и G4H HLP, соответственно.
Фиг.6Е:
На гистограммах, слева направо и сверху вниз, показаны результаты для трансфектантов, экспрессирующих 1-27 CD3-EpCAM, содержащий 27-мер свиньи, протестированных с использованием CD3-специфических связывающих молекул, обозначенных как Н2С HLP, F12Q HLP, E2M HLP и G4H HLP, соответственно.
Для отдельных перекрываний тонкая линия представляет образец, инкубированный с препаратом одноцепочечного мышиного антитела против CD3 человека в качестве отрицательного контроля, а жирная линия показывает образец, инкубированный с соответствующими указанными анти-CD3-связывающими молекулами. Принимая во внимание отсутствие связывания с трансфектантами 27-мера свиньи и уровни экспрессии конструкций, показанных на Фиг.5, перекрывания гистограмм демонстрируют специфическое и сильное связывание тестируемых анти-CD3-специфичностей человеческих биспецифических одноцепочечных антител с полной межвидовой специфичностью с клетками, экспрессирующими рекомбинантные трансмембранные слитые белки, содержащие N-концевые аминокислоты 1-27 эпсилон-цепи CD3 человека, игрунки, тамарина и беличьей обезьяны, соответственно, слитые с ЕрСАМ яванского макака, и таким образом демонстрируют межвидовую специфичность анти-CD3-связывающих молекул в отношении многих приматов.
Фиг.7
FACS-анализ для определения CD3-эпсилон человека на трансфицированных мышиных EL4 Т-клетках. Графический анализ демонстрирует перекрывание гистограмм. Жирная линия показывает трансфицированные клетки, инкубированные с антителом UCHT-1 против CD3 человека. Тонкая линия представляет клетки, инкубированные с мышиным контролем IgG1 изотипа. Связывание антитела UCHT1 против CD3 четко демонстрирует экспрессию эпсилон-цепи CD3 человека на клеточной поверхности трансфицированных мышиных EL4 Т-клеток.
Фиг.8
Связывание анти-CD3 антител с межвидовой специфичностью с аланиновыми мутантами в эксперименте по аланиновому сканированию. Столбцы на отдельных графических материалах, слева направо и сверху вниз, показывают величины связывания, рассчитанные в условных единицах по логарифмической шкале для трансфектанта дикого типа (WT) и для всех аланиновых мутантов для положения 1-27. Величины связывания рассчитывают, используя следующую формулу:
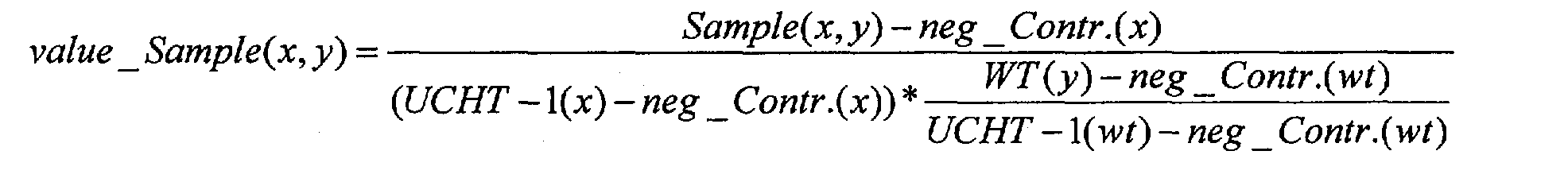
В этом уравнении value_Sample означает величину связывания в условных единицах, представляющую степень связывания специфического анти-CD3-антитела со специфическим аланиновым мутантом, как показано на этом графическом материале, Sample означает среднюю геометрическую величину флуоресценции, полученную для специфического анти-CD3-антитела, проанализированного на специфическом аланин-сканирующем трансфектанте, neg_Contr. означает среднюю геометрическую величину флуоресценции, полученную для отрицательного контроля, проанализированного на специфическом аланиновом мутанте, UCHT-1 означает среднюю геометрическую величину флуоресценции, полученную для антитела UCHT-1, проанализированного на специфическом аланиновом мутанте, WT означает среднюю геометрическую величину флуоресценции, полученную для специфического анти-CD3-антитела, проанализированного на трансфектанте дикого типа,×указывает на соответствующий трансфектант, у указывает на соответствующее анти-CD3-антитело, a wt указывает на то, что соответствующий трансфектант относится к дикому типу. Индивидуальные положения аланиновых мутантов помечены с помощью однобуквенного кода аминокислоты дикого типа и номера положения.
Фиг.8А:
На Фиг. показаны результаты для анти-CD3-антитела A2J HLP с межвидовой специфичностью, экспрессируемого в виде химерной молекулы IgG. Сниженная активность связывания наблюдается для мутаций с заменой на аланин в положении 4 (аспарагин), в положении 23 (треонин) и в положении 25 (изолейцин). Полная потеря связывания наблюдается для мутаций с заменой на аланин в положении 1 (глутамин), в положении 2 (аспартат), в положении 3 (глицин) и в положении 5 (глутамат).
Фиг.8В:
На Фиг. показаны результаты для анти-CD3-антитела Е2М HLP с межвидовой специфичностью, экспрессируемого в виде химерной молекулы IgG. Сниженная активность связывания наблюдается для мутаций с заменой на аланин в положении 4 (аспарагин), в положении 23 (треонин) и в положении 25 (изолейцин). Полная потеря связывания наблюдается для мутаций с заменой на аланин в положении 1 (глутамин), в положении 2 (аспартат), в положении 3 (глицин) и в положении 5 (глутамат).
Фиг.8С:
На Фиг. показаны результаты для анти-CD3-антитела Н2С HLP с межвидовой специфичностью, экспрессируемого в виде химерной молекулы IgG. Сниженная активность связывания наблюдается для мутаций с заменой на аланин в положении 4 (аспарагин). Полная потеря связывания наблюдается для мутаций на аланин глутамин в положении 1 (глутамин), в положении 2 (аспартат), в положении 3 (глицин) и в положении 5 (глутамат).
Фиг.8D:
показывает результаты для анти-CD3-антитела F12Q HLP с межвидовой специфичностью, протестированного в виде периплазматически экспрессируемого одноцепочечного антитела. Полная потеря связывания наблюдается для мутаций с заменой на аланин в положении 1 (глутамин), в положении 2 (аспартат), в положении 3 (глицин) и в положении 5 (глутамат).
Фиг.9
FACS-анализ, определяющий связывание анти-CD3-связывающей молекулы Н2С HLP с межвидовой специфичностью с CD3 человека, содержащим и не содержащим N-концевую His6-метку.
Перекрывания гистограмм осуществляют на клеточной линии EL4, трансфицированной CD3 эпсилон-цепью дикого типа человека (левая гистограмма) или CD3 эпсилон-цепью человека, содержащей N-концевую His6-метку (правая гистограмма), протестированной в FACS-анализе, определяющем связывание связывающей молекулы Н2С HLP с межвидовой специфичностью. Образцы инкубируют с контролем соответствующего изотипа в качестве отрицательного контроля (тонкая линия), антителом UCHT-1 против CD3 человека в качестве положительного контроля (пунктирная линия) и анти-CD3-антителом Н2С HLP с межвидовой специфичностью в форме химерной молекулы IgG (жирная линия).
Перекрывания гистограмм демонстрируют сравнимое связывание антитела UCHT-1 с обоими трансфектантами по сравнению с изотипическим контролем, демонстрирующим экспрессию обеих рекомбинантных конструкций. Перекрывания гистограмм также демонстрируют связывание анти-CD3-связывающей молекулы Н2С HLP только с CD3 эпсилон-цепью дикого типа человека, но не с His6-CD3-эпсилон-цепью человека. Эти результаты демонстрируют, что наличие свободного N-конца существенно для связывания анти-CD3-связывающей молекулы Н2С HLP с межвидовой специфичностью.
Фиг.10
Насыщающее связывание EGFR-21-63 LH×Н2С на CD3-положительных РВМС человека с целью определения величины KD CD3-связывания на клетках с помощью FACS-анализа. Анализ осуществляют, как описано в Примере 7.
Фиг.11
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными EGFR человека, с CD3+ Т-клеточной линией человека HPB-ALL, с клетками СНО, трансфицированными EGFR яванского макака, и Т-клеточной линией макака 4119 LnPx. FACS-окрашивание осуществляют, как описано в Примере 12. Жирная линия представляет клетки, инкубированные с очищенным белком в концентрации 2 мкг/мл, которые после этого инкубируют с анти-his-антителом и РЕ-меченым детектирующим антителом. Тонкая линия на гистограммах отражает отрицательный контроль: клетки, инкубированные только с анти-his-антителом и детектирующим антителом.
Фиг.12
Цитотоксическая активность, индуцированная указанными одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. А): стимулированные CD4-/CD56- РВМС человека используют в качестве эффекторных клеток, клетки СНО, трансфицированные EGFR человека, в качестве клеток-мишеней. В): Т-клеточную линию макака 4119 LnPx используют в качестве эффекторных клеток, клетки СНО, трансфицированные EGFR яванского макака, в качестве клеток-мишеней. Анализ осуществляют, как описано в Примере 13.
Фиг.13
Цитотоксическая активность, индуцированная указанными одноцепочечными конструкциями с межвидовой специфичностью. перенаправленными на указанные целевые клеточные линии. А):
стимулированные CD4-/CD56- РВМС человека используют в качестве эффекторных клеток, клетки СНО, трансфицированные EGFR человека, в качестве клеток-мишеней. В): Т-клеточную линию макака 4119 LnPx используют в качестве эффекторных клеток, клетки СНО, трансфицированные EGFR яванского макака, в качестве клеток-мишеней. Анализ осуществляют, как описано в Примере 13.
Фиг.14
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными MCSP D3 человека, с CD3+ Т-клеточной линией человека HPB-ALL, с клетками СНО, трансфицированными MCSP D3 яванского макака, и с Т-клеточной линией макака 4119 LnPx. FACS-окрашивание осуществляли, как описано в Примере 17. Жирная линия представляет клетки, инкубированные с очищенным белком в концентрации 2 мкг/мл, которые после этого инкубируют с анти-his-антителом и РЕ-меченым детектирующим антителом. Тонкая линия на гистограммах отражает отрицательный контроль: клетки, инкубированные только с анти-his-антителом и детектирующим антителом.
Фиг.15
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными MCSP D3 человека, с CD3+ Т-клеточной линией человека HPB-ALL, с клетками СНО, трансфицированными MCSP D3 яванского макака, и с Т-клеточной линией макака 4119 LnPx. FACS-окрашивание осуществляли, как описано в Примере 17. Жирная линия представляет клетки, инкубированные с очищенным белком в концентрации 2 мкг/мл, которые после этого инкубируют с анти-his-антителом и РЕ-меченым детектирующим антителом. Тонкая линия на гистограммах отражает отрицательный контроль; клетки, инкубированные только с анти-his-антителом и детектирующим антителом.
Фиг.16
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными MCSP D3 человека, с CD3+ Т-клеточной линией человека HPB-ALL, с клетками СНО, трансфицированными MCSP D3 яванского макака, и с Т-клеточной линией макака 4119 LnPx. FACS-окрашивание осуществляли, как описано в Примере 17. Жирная линия представляет клетки, инкубированные с очищенным белком в концентрации 2 мкг/мл, которые после этого инкубируют с анти-his-антителом и РЕ-меченым детектирующим антителом. Тонкая линия на гистограммах отражает отрицательный контроль: клетки, инкубированные только с анти-his-антителом и детектирующим антителом.
Фиг.17
Цитотоксическая активность, индуцированная указанными MCSP-специфическими одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. А): стимулированные CD4-/CD56- РВМС человека используют в качестве эффекторных клеток, клетки СНО, трансфицированные MCSP D3 человека, в качестве клеток-мишеней. В): Т-клеточную линию макака 4119 LnPx используют в качестве эффекторных клеток, клетки СНО, трансфицированные MCSP D3 яванского макака, в качестве клеток-мишеней. Анализ осуществляют, как описано в Примере 18.
Фиг.18
Цитотоксическая активность, индуцированная указанными MCSP-специфическими одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. А) и В): Т-клеточную линию макака 4119 LnPx используют в качестве эффекторных клеток, клетки СНО, трансфицированные MCSP D3 яванского макака, в качестве клеток-мишеней. Анализ осуществляют, как описано в Примере 18.
Фиг.19
Цитотоксическая активность, индуцированная указанными MCSP-специфическими одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. А) и В): стимулированные CD4-/CD56- РВМС человека используют в качестве эффекторных клеток, клетки СНО, трансфицированные MCSP D3 человека, в качестве клеток-мишеней. Анализ осуществляют, как описано в Примере 18.
Фиг.20
Цитотоксическая активность, индуцированная указанными MCSP-специфическими одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. А): стимулированные CD4-/CD56- РВМС человека используют в качестве эффекторных клеток, клетки СНО, трансфицированные MCSP D3 человека, в качестве клеток-мишеней. В): Т-клеточную линию макака 4119 LnPx используют в качестве эффекторных клеток, клетки СНО, трансфицированные MCSP D3 яванского макака, в качестве клеток-мишеней. Анализ осуществляют, как описано в Примере 18.
Фиг.21
Цитотоксическая активность, индуцированная указанными MCSP-специфическими одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. А): стимулированные CD4-/CD56- РВМС человека используют в качестве эффекторных клеток, клетки СНО, трансфицированные MCSP D3 человека, в качестве клеток-мишеней. В): Т-клеточную линию макака 4119 LnPx используют в качестве эффекторных клеток, клетки СНО, трансфицированные MCSP D3 яванского макака, в качестве клеток-мишеней. Анализ осуществляют, как описано в Примере 18.
Фиг.22
Стабильность в плазме MCSP- и CD3-биспецифических одноцепочечных антител с межвидовой специфичностью, протестированных путем измерения цитотоксической активности, индуцированной образцами указанных одноцепочечных конструкций, инкубируемых в присутствии 50% человеческой плазмы при 37°С и 4°С в течение 24 часов, соответственно, или с добавлением 50% человеческой плазмы непосредственно перед тестированием цитотоксичности или без добавления плазмы. Клетки СНО, трансфицированные MCSP человека, используют в качестве целевых клеточных линий, а стимулированные CD4-/CD56- РВМС человека используют в качестве эффекторных клеток. Анализ осуществляют, как описано в Примере 19.
Фиг.23
Начальное уменьшение и восстановление (т.е. перераспределение) абсолютного количества Т-клеток (незакрашенные квадраты) в периферической крови B-NHL-пациентов (номера пациентов 1, 7, 23, 30, 31 и 33 в Таблице 4), по существу не имевших циркулирующих СD19-положительных целевых В-клеток (закрашенные треугольники) во время начальной фазы внутривенной инфузии CD3-связывающей молекулы CD19×CD3, распознающей традиционный зависимый от окружения эпитоп CD3. Абсолютные количества клеток приведены в 1000 клеток на микролитр крови. Первая точка на графике показывает исходные количества непосредственно перед началом инфузии. Доза CD19×CD3 приведена в круглых скобках рядом с номером пациента.
Фиг.24
(A) Повторное перераспределение Т-клеток (незакрашенные квадраты) у B-NHL-пациента №19 (Таблица 4), не имевшего циркулирующих CD 19-положительных целевых В-клеток (закрашенные треугольники) и продемонстрировавшего ЦНС-симптомы при непрерывной внутривенной инфузии CD19×CD3 с начальной дозой 5 мкг/м2/24 ч в течение одних суток с последующим резким увеличением дозы до 15 мкг/м2/24 ч. Абсолютные количества клеток приведены в 1000 клеток на микролитр крови. Первая точка на графике показывает исходные количества непосредственно перед началом инфузии. После восстановления циркулирующих Т-клеток из первого эпизода перераспределения, инициированного лечением, начинающимся с 5 мкг/м2/24 ч, пошаговое увеличение дозы от 5 до 15 мкг/м2/24 ч инициировало второй эпизод перераспределения Т-клеток, ассоциированный с развитием ЦНС-симптомов, преимущественно таких как спутанность сознания и дезориентация.
(B) Повторное перераспределение Т-клеток у B-NHL пациента, у которого развились ЦНС-симптомы после повторной внутривенной болюсной инфузии с использованием CD19×CD3 при 1,5 мкг/м2. Абсолютные количества клеток приведены в 1000 клеток на микролитр крови. Продолжительность инфузии для каждого болюсного введения составляла от 2 до 4 часов. Вертикальные стрелки указывают на начало болюсных инфузий. Точки на графике в начальный момент каждого болюсного введения показывают количество Т-клеток непосредственно перед началом болюсной инфузий. Каждая болюсная инфузия инициировала эпизод перераспределения Т-клеток, за которым следовало восстановление количества Т-клеток перед следующей болюсной инфузией. Окончательно, третий эпизод перераспределения Т-клеток был ассоциирован с развитием ЦНС-симптомов у этого пациента.
Фиг.25
Комплексная картина перераспределения Т-клеток (незакрашенные квадраты) у B-NHL-пациента №20 (Таблица 4) без циркулирующих CD19-положительных целевых В-клеток (закрашенные треугольники) во время линейного увеличения (ramp) инфузий CD19×CD3, т.е. плавного постепенного увеличения скорости потока от полного нуля до 15 мкг/м2/24 ч в течение первых 24 часов лечения. Абсолютные количества клеток приведены в 1000 клеток на микролитр крови. Первая точка на графике показывает исходные количества непосредственно перед началом инфузий. Доза CD19×CD3 приведена в скобках рядом с номером пациента. Т-клетки, вновь появляющиеся в циркулирующей крови после начального перераспределения, инициированного первой экспозицией с CD19×CD3, снова исчезают из циркулирующей крови, что частично индуцируется все еще возрастающими уровнями CD19×CD3 во время фазы линейного увеличения.
Фиг.26
Количества Т- и В-клеток во время лечения с применением CD19×CD3 B-NHL-пациента №13 (Таблица 4), у которого имелось значительное количество циркулирующих CD19-положительных клеток-мишеней В-(лимфомы) (закрашенные треугольники). Абсолютные количества клеток приведены в 1000 клеток на микролитр крови. Первая точка на графике показывает исходные количества непосредственно перед началом инфузий. Доза CD19×CD3 приведена в скобках рядом с номером пациента. Т-клетки (незакрашенные квадраты) полностью исчезают из кровотока после начала инфузий CD19×CD3 и не появляются вновь до тех пор, пока циркулирующие CD19-положительные клетки В-(лимфомы) (закрашенные треугольники) не будут истощены в периферической крови.
Фиг.27
Повторное перераспределение Т-клеток (незакрашенные квадраты) у B-NHL-пациента №24 (Таблица 4), у которого по существу не было циркулирующих целевых СD19-положительных В-клеток (закрашенные треугольники) и развились ЦНС-симптомы в результате инициации инфузии CD19×CD3 без добавления HSA (сывороточный альбумин человека), необходимого для стабилизации лекарственного средства (верхняя панель). После первого восстановления циркулирующих Т-клеток в конце начального перераспределения, неравномерный поток лекарственного средства, обусловленный отсутствием стабилизирующего HSA, инициировал второй эпизод перераспределения Т-клеток, ассоциированный с развитием ЦНС-симптомов, преимущественно таких как спутанность сознания и дезориентация. Когда этому же пациенту снова начинали вводить раствор CD19×CD3, содержащий добавку HSA для стабилизации лекарственного средства, то не наблюдали никакого повторного перераспределения Т-клеток (нижняя панель) и также развития каких-либо ЦНС-симптомов у пациента. Абсолютные количества клеток приведены в 1000 клеток на микролитр крови. Первая точка на графике показывает исходные количества непосредственно перед началом инфузии. Доза CD19×CD3 приведена в скобках рядом с номером пациента.
Фиг.28
Модель адгезии Т-клеток к эндотелиальным клеткам, индуцированной моновалентным связыванием с зависимыми от окружения эпитопами CD3. Моновалентное взаимодействие традиционной CD3-связывающей молекулы с ее зависимым от окружения эпитопом на CD3-эпсмпон может приводить к аллостерическому изменению конформации CD3 с последующим рекрутингом Nck2 к цитоплазматическому домену CD3-эпсилон (Gil et al. (2002) Cell 109: 901). Поскольку Nck2 непосредственно связан с интегринами через PINCH и ILK (Legate et al. (2006) Nat. Rev. Mol. Cell Biol. 7: 20), рекрутинг Nck2 к цитоплазматическому домену CD3-эпсилон после аллостерического изменения конформации CD3 в результате связывания традиционной CD3-связывающей молекулы (такой как CD19×CD3 из Примера 20) с ее зависимым от окружения эпитопом на CD3 эпсилон, может увеличивать адгезивность Т-клеток к эндотелиальным клеткам посредством временного перехода интегринов на поверхности Т-клеток в их более адгезивную изоформу в результате передачи сигнала изнутри наружу.
Фиг.29
Цитотоксическая активность тестируемого вещества, CD33-AF5 VH-VL×I2C VH-VL, использованного в исследовании in vivo на яванских макаках, описанном в Примере 21. Специфический лизис CD33-положительных клеток-мишеней определяли в стандартном анализе высвобождения51хрома при возрастающих концентрациях CD33-AF5 VH-VL×I2C VH-VL. Время анализа составляло 18 часов. Т-клеточную линию макака 4119 LnPx использовали в качестве источника эффекторных клеток. Клетки СНО, трансфицированные CD33 яванского макака, служили в качестве клеток-мишеней. Соотношение эффекторных клеток к клеткам-мишеням (Е:Т-соотношение) составляло 10:1. Концентрацию CD33-AF5 VH-VL×I2C VH-VL, необходимую для полумаксимального лизиса клеток-мишеней (EC50), вычисляли из кривой доза-эффект, и она составляла 2,7 нг/мл.
Фиг.30
(A) Дозо- и времязависимое истощение CD33-положительных моноцитов из периферической крови яванских макаков в результате непрерывной внутривенной инфузии CD33-AF5 VH-VL×I2C VH-VL, как описано в Примере 21. Процентное содержание относительно исходного (т.е. 100%) абсолютного количества циркулирующих CD33-положительных моноцитов после продолжительности лечения, указанной над столбцами, показано для каждого из двух яванских макаков для заданного уровня дозы. Уровень доз (т.е. скорость потока при инфузии) указан под столбцами. Никакого истощения циркулирующих CD33-положительных моноцитов не наблюдали у животных 1 и 2, которых лечили в течение 7 суток дозой 30 мкг/м2/24 ч. У животных 3 и 4, которых лечили в течение 7 суток дозой 60 мкг/м2/24 ч, количество циркулирующих CD33-положительных моноцитов уменьшилось до 68% и 40% от исходного, соответственно. При 240 мкг/м2/24 ч циркулирующие CD33-положительные моноциты были почти полностью истощены в периферической крови через 3 суток лечения (животные 5 и 6). При 1000 мкг/м2/24 ч истощение циркулирующих CD33-положительных моноцитов в периферической крови завершалось уже через 1 сутки лечения (животные 7 и 8).
(B) Ход изменения количества Т-клеток и CD33-MOHOHHTOB в периферической крови двух яванских макаков в процессе непрерывной инфузии CD33-AF5 VH-VL×I2C VH-VL в течение 14 суток при 120 мкг/м2/24 ч. Абсолютные количества клеток приведены в 1000 клеток на микролитр крови. Первая точка на графике показывает исходные количества непосредственно перед началом инфузии. После начальной мобилизации CD33-моноцитов в течение первых I2 часов после начала инфузии, CD33-моноциты в периферической крови (закрашенные треугольники) истощаются на две трети (животное 10) и 50% (животное 9) относительно соответствующих исходных количеств в процессе дальнейшей инфузии. Количество циркулирующих Т-клеток (незакрашенные квадраты) демонстрирует ограниченное начальное уменьшение, за которым следует восстановление уже в присутствии циркулирующих CD33-положительных целевых моноцитарных клеток.
Фиг.31
Цитотоксическая активность тестируемого вещества, MCSP-G4 VH-VL×I2C VH-VL, использованного в исследовании in vivo на яванских макаках, описанном в Примере 22. Специфический лизис MCSP-положительных клеток-мишеней определяли в стандартном анализе высвобождения 51 хрома при возрастающих концентрациях MCSP-G4 VH-VL×I2C VH-VL. Время анализа составляло 18 часов. Т-клеточную линию макака 4119 LnPx использовали в качестве источника эффекторных клеток. Клетки СНО, трансфицированные MCSP яванского макака, служили в качестве клеток-мишеней. Соотношение эффекторных клеток к клеткам-мишеням (Е:Т-соотношение) составляло 10:1. Концентрацию MCSP-G4 VH-VL×I2C VH-VL, необходимую для полумаксимального лизиса клеток-мишеней (ЕС50), вычисляли из кривой доза-эффект, и она составляла 1,9 нг/мл.
Фиг.32
Отсутствие начальных эпизодов уменьшения и последующего восстановления абсолютного количества Т-клеток (т.е. перераспределения) в периферической крови яванских макаков во время начальной фазы внутривенной инфузии CD3-связывающей молекулы MCSP-G4 VH-VL×I2C VH-VL, распознающей по существу независимый от окружения эпитоп CD3. Абсолютные количества клеток приведены в 1000 клеток на микролитр крови. Первая точка на графике показывает исходные количества непосредственно перед началом инфузии. Доза MCSP-G4 VH-VL×I2C VH-VL приведена в круглых скобках рядом с номером животного. При известном отсутствии MCSP-положительных клеток-мишеней в циркулирующей крови яванских макаков не наблюдается индукции перераспределения Т-клеток (т.е. начального эпизода уменьшения и последующего восстановления абсолютного количества Т-клеток) вследствие опосредованного клетками-мишенями перекрестного связывания CD3. Кроме того, индукции перераспределения Т-клеток (т.е. начального эпизода уменьшения и последующего восстановления абсолютного количества Т-клеток), вызванной сигналом, который Т-клетки могут получать посредством исключительного взаимодействия только с CD3-связывающим сайтом, можно избежать, используя такие CD3-связывающие молекулы, как MCSP-G4 VH-VL×12C VH-VL, распознающие по существу независимый от окружения эпитоп CD3.
Фиг.33
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными CD33 человека, с CD3+ Т-клеточной линией человека HPB-ALL, с клетками СНО, трансфицированными CD33 макака, и РВМС макака, соответственно. FACS-окрашивание осуществляют, как описано в Примере 23.4. Жирные линии представляют клетки, инкубированные с очищенной биспецифической одноцепочечной конструкцией в концентрации 5 мкг/мл или супернатантом клеточной культуры трансфицированных клеток, экспрессирующих конструкции биспецифического антитела с межвидовой специфичностью. Закрашенные гистограммы отражают отрицательные контроли. В качестве отрицательного контроля использовали супернатант нетрансфицированных клеток СНО. Для каждой биспецифической одноцепочечной конструкции с межвидовой специфичностью перекрывание гистограмм демонстрирует специфическое связывание данной конструкции с CD33 человека и макака и CD3 человека и макака.
Фиг.34
На диаграммах показаны результаты анализов высвобождения хрома, в которых измеряют цитотоксическую активность, индуцированную указанными CD33-специфическими одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. Также указаны используемые эффекторные клетки. Анализы осуществляют, как описано в Примере 23.5. Диаграммы четко демонстрируют для каждой показанной конструкции сильное возрастание цитотоксической активности эффекторных клеток человека и макака против клеток СНО, трансфицированных CD33 человека и макака, соответственно.
Фиг.35
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными CAIX человека, с CD3+ Т-клеточной линией человека HPB-ALL, с клетками СНО, трансфицированными CAIX макака, и Т-клеточной линией макака 4119 LnPx, соответственно. FACS-окрашивание осуществляли, как описано в Примере 24.5. Жирные линии представляют клетки, инкубированные с очищенной биспецифической одноцепочечной конструкцией в концентрации 2 мкг/мл. Закрашенные гистограммы отражают отрицательные контроли. В качестве отрицательного контроля для связывания с Т-клеточными линиями использовали супернатант нетрансфицированных клеток СНО. В качестве отрицательного контроля для связывания с клетками СНО, трансфицированными CAIX, использовали одноцепочечную конструкцию с нерелевантной целевой специфичностью. Для каждой биспецифической одноцепочечной конструкции с межвидовой специфичностью перекрывание гистограмм демонстрирует специфическое связывание данной конструкции с CAIX человека и макака и CD3 человека и макака.
Фиг.36
На диаграммах показаны результаты анализов высвобождения хрома, в которых измеряют цитотоксическую активность, индуцированную указанными CAIX-специфическими одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. Также указаны используемые эффекторные клетки. Анализы осуществляют, как описано в Примере 24.6. Диаграммы четко демонстрируют для каждой показанной конструкции сильное возрастание цитотоксической активности эффекторных клеток человека и макака против клеток СНО, трансфицированных CAIX человека и макака, соответственно.
Фиг.37
Цитотоксическая активность, индуцированная указанными EpCAN-специфическими одноцепочечными конструкциями против клеток СНО, трансфицированных ЕрСАМ человека, с использованием Т-клеток человека в качестве эффекторных клеток. Анализ осуществляли, как описано в разделе "Примеры". Диаграммы четко демонстрируют сильное возрастание цитотоксической активности под действием каждой конструкции.
Эффекторные клетки: стимулированные CD4/CD56-истощенные РВМС человека.
Клетки-мишени: СНО, трансфицированные ЕрСАМ человека.
Фиг.38
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с клетками СНО, трансфицированными ЕрСАМ человека (2а), с нетрансфицированными клетками СНО в виде EpCAN- и CD3-отрицательной клеточной линии (2b), с РВМС человека (2 с) и с Т-клеточной линией макака 4119 LnPx (2d), соответственно. Клетки инкубировали с супернатантом, содержащим соответствующую биспецифическую одноцепочечную конструкцию. FACS-окрашивание осуществляют, как описано в разделе "Примеры". Для каждой биспецифической одноцепочечной конструкции с межвидовой специфичностью перекрывание гистограмм демонстрирует специфическое связывание данной конструкции с ЕрСАМ человека и CD3 человека и макака.
а: СНО-ЕрСАМ (человек),
b: СНО (нетрансфицированные),
с: РВМС человека,
d: 4119LnPx макака (CD3+).
Фиг.39
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными EGFRvIII человека, с CD3+ Т-клеточной линией человека HPB-ALL, с клетками СНО, трансфицированными EGFRvIII яванского макака, и с Т-клеточной линией макака 4119 LnPx. FACS-окрашивание осуществляют, как описано в Примере 26.3. Жирная линия представляет клетки, инкубированные с очищенным мономерным белком в концентрации 2 мкг/мл, которые после этого инкубируют с анти-his-антителом и РЕ-меченым детектирующим антителом. Тонкая линия на гистограммах отражает отрицательный контроль: клетки, инкубированные только с анти-his-антителом и детектирующим антителом.
Фиг.40
Цитотоксическая активность, индуцированная указанными одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. А): стимулированные CD4-/CD56- РВМС человека используют в качестве эффекторных клеток, клетки СНО, трансфицированные EGFRvIII человека, в качестве клеток-мишеней. В): Т-клеточную линию макака 4119 LnPx используют в качестве эффекторных клеток, клетки СНО, трансфицированные EGFRvIII яванского макака, в качестве клеток-мишеней. Анализ осуществляют, как описано в Примере 26.3.
Фиг.41
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками J558L, трансфицированными IgE человека, с CD3+ Т-клеточной линией человека НРВ-ALL, с клетками J558L, трансфицированными IgE макака, и с Т-клеточной линией макака 4119 LnPx. FACS-окрашивание осуществляют, как описано в Примере 27.2. Жирная линия представляет клетки, инкубированные с супернатантом клеточной культуры клеток СНО, трансфицированных указанной биспецифической одноцепочечной конструкцией с межвидовой специфичностью, которые после этого инкубируют с анти-his-антителом и РЕ-меченым детектирующим антителом. Тонкая линия на гистограммах отражает отрицательный контроль: клетки, инкубированные только с анти-his-антителом и детектирующим антителом.
Фиг.42
Цитотоксическая активность, индуцированная указанными одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. А): стимулированные CD4-/CD56- РВМС человека используют в качестве эффекторных клеток, клетки J558L, трансфицированные IgE человека, в качестве клеток-мишеней. В): Т-клеточную линию макака 4119 LnPx используют в качестве эффекторных клеток, клетки J558L, трансфицированные IgE макака, в качестве клеток-мишеней. Анализ осуществляют, как описано в Примере 27.2.
Фиг.43
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными CD44 человека, с CD3+ Т-клеточной линией человека HPB-ALL, с клетками СНО, трансфицированными CD44 макака, и с РВМС макака, соответственно. FACS-окрашивание осуществляли, как описано в Примере 28.6. Жирные линии представляют клетки, инкубированные с очищенной биспецифической одноцепочечной конструкцией в концентрации 5 мкг/мл. Закрашенные гистограммы отражают отрицательные контроли, PBS с 2% FCS использовали в качестве отрицательного контроля. Для каждой биспецифической одноцепочечной конструкции с межвидовой специфичностью перекрывание гистограмм демонстрирует специфическое связывание данной конструкции с CD44 человека и макака и CD3 человека и макака.
Фиг.44
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными человеческим CD44 без экзона v6. FACS-окрашивание осуществляют, как описано в Примере 28.6. В качестве контроля экспрессии CD44, клетки СНО, трансфицированные человеческим CD44 без экзона v6, и клетки СНО, трансфицированные полноразмерным CD44 человека, инкубировали с анти-CD44 антителом. Жирные линии представляют клетки, инкубированные с очищенной биспецифической одноцепочечной конструкцией в концентрации 5 мкг/мл или анти-CD44 антителом (5 мкг/мл), как указано. Закрашенные гистограммы отражают отрицательные контроли. PBS с 2% FCS использовали в качестве отрицательного контроля. Для каждой биспецифической одноцепочечной конструкции с межвидовой специфичностью перекрывание гистограмм демонстрирует отсутствие связывания данной конструкции с человеческим CD44 без экзона v6. Присутствие CD44 на клетках СНО, трансфицированных человеческим CD44 без экзона v6, было продемонстрировало посредством сравнимого связывания анти-CD44 антитела с этими клетками и с клетками, трансфицированными полноразмерным CD44 человека. FACS-анализ связывания продемонстрировал специфичность биспецифических одноцепочечных конструкций с межвидовой специфичностью к экзону v6 CD44.
Фиг.45
На диаграмме показаны результаты анализов высвобождения хрома, в которых измеряют цитотоксическую активность, индуцированную указанными CD44-специфическими одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на клетки СНО, трансфицированные CD44 человека, как описано в Примере 28.1. В качестве эффекторных клеток использовали стимулированные РВМС человека, истощенные по CD4 и CD56, с соотношением Е:Т, равным 10:1. Анализ осуществляют, как описано в Примере 28.7. Диаграмма продемонстрировала для каждой конструкции сильное возрастание цитотоксической активности эффекторных клеток человека против клеток СНО, трансфицированных CD44 человека.
Фиг.46
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными CD30 человека, с CD30+ В-клеточной линией человека МЕС-1, с CD3+ Т-клеточной линией человека HPB-ALL, с клетками СНО, трансфицированными CD30 макака, и РВМС макака, соответственно. FACS-окрашивание осуществляли, как описано в Примере 29.5. Жирные линии представляют клетки, инкубированные с очищенной биспецифической одноцепочечной конструкцией в концентрации 5 мкг/мл. Закрашенные гистограммы отражают отрицательные контроли. PBS с 2% FCS использовали в качестве отрицательного контроля. Для каждой биспецифической одноцепочечной конструкции с межвидовой специфичностью перекрывание гистограмм демонстрирует специфическое связывание данной конструкции с CD30 человека и макака и CD3 человека и макака.
Фиг.47
На диаграммах показаны результаты анализов высвобождения хрома, в которых измеряют цитотоксическую активность, индуцированную указанными CD30-специфическими одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. Также указаны используемые эффекторные клетки. Анализы осуществляли, как описано в Примере 29.6. Диаграммы четко демонстрируют для каждой конструкции сильное возрастание цитотоксической активности эффекторных клеток человека и макака против клеток, положительных в отношении CD30 человека и макака, соответственно.
Фиг.48
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными HER2 человека, с CD3+ Т-клеточной линией человека HPB-ALL, с клетками СНО, трансфицированными HER2 макака, и с Т-клеточной линией макака 4119LnPx, соответственно. FACS-окрашивание осуществляли, как описано в Примере 30.5. Жирные линии представляют клетки, инкубированные с очищенной биспецифической одноцепочечной конструкцией в концентрации 2 мкг/мл. Тонкие линии отражают отрицательные контроли. В качестве отрицательного контроля использовали PBS с 2% FCS. Для каждой биспецифической одноцепочечной конструкции с межвидовой специфичностью перекрывание гистограмм демонстрирует специфическое связывание данной конструкции с HER2 человека и макака и CD3 человека и макака.
Фиг.49
На диаграммах показаны результаты анализов высвобождения хрома, в которых измеряют цитотоксическую активность, индуцированную указанными НЕР2-специфическими одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. Также указаны используемые эффекторные клетки. Анализы осуществляли, как описано в Примере 30.6. Диаграммы четко демонстрируют для каждой показанной конструкции сильное возрастание цитотоксической активности эффекторных клеток человека и макака против клеток СНО, трансфицированных HER2 человека и макака, соответственно.
Фиг.50
Мониторинг очистки биспецифической одноцепочечной молекулы с межвидовой специфичностью, обозначенной как E292F3 HL×I2C HL, с использованием SDS-PAGE и вестерн-блоттинга. Образцы из элюата, супернатанта клеточной культуры (SN) и проскока (flow through) с колонки (FT) анализировали, как указано. Белковый маркер (М) наносили в качестве эталона масс. Интенсивная белковая зона с молекулярной массой от 50 до 60 кДа в SDS-PAGE демонстрирует эффективную очистку биспецифической одноцепочечной молекулы с межвидовой специфичностью до очень высокой степени чистоты с использованием одностадийного метода очистки, описанного в Примере 31.2. Вестерн-блоттинг с определением гистидин6-метки подтверждает идентичность белковой зоны в элюате как биспецифической одноцепочечной молекулы с межвидовой специфичностью. Слабый сигнал для проскока образца в этом чувствительном методе определения дополнительно указывает на практически полный захват биспецифических одноцепочечных молекул в данном методе очистки.
Фиг.51
Мониторинг очистки биспецифической одноцепочечной молекулы с межвидовой специфичностью, обозначенной как V207C12 ML×H2C HL, с использованием SDS-PAGE и вестерн-блоттинга. Образцы из элюата, супернатанта клеточной культуры (SN) и проскока (flow through) с колонки (FT) анализировали, как указано. Белковый маркер (М) наносили в качестве эталона масс. Интенсивная белковая зона с молекулярной массой от 50 до 60 кДа в SDS-PAGE демонстрирует эффективную очистку биспецифической одноцепочечной молекулы с межвидовой специфичностью до очень высокой степени чистоты с использованием одностадийного метода очистки, описанного в Примере 31.2. Вестерн-блоттинг с определением гистидин6-метки подтверждает идентичность белковой зоны в элюате как биспецифической одноцепочечной молекулы с межвидовой специфичностью. Слабый сигнал для проскока образца в этом чувствительном методе определения дополнительно указывает на практически полный захват биспецифических одноцепочечных молекул в данном методе очистки.
Фиг.52
Мониторинг очистки биспецифической одноцепочечной молекулы с межвидовой специфичностью, обозначенной как AF5HL×F12QHL, с использованием SDS-PAGE и вестерн-блоттинга. Образцы из элюата, супернатанта клеточной культуры (SN) и проскока (flow through) с колонки анализировали, как указано. Белковый маркер (М) наносили в качестве эталона масс. Интенсивная белковая зона с молекулярной массой от 50 до 60 кДа в SDS-PAGE демонстрирует эффективную очистку биспецифической одноцепочечной молекулы с межвидовой специфичностью до очень высокой степени чистоты с использованием одностадийного метода очистки, описанного в Примере 31.2. Вестерн-блоттинг с определением гистидин6-метки подтверждает идентичность белковой зоны в элюате биспецифической одноцепочечной молекулы с межвидовой специфичностью. Сигнал для проскока образца в этом чувствительном методе определения объясняется насыщением аффинной колонки благодаря высокой концентрации биспецифических одноцепочечных молекул в супернатанте.
Фиг.53
Стандартная кривая для AF5HL×Il2CHL в 50%-ной сыворотке макака. На верхней диаграмме показана стандартная кривая, полученная для этого анализа, как описано в Примере 32.2.
На нижней диаграмме показаны результаты для качественного контроля образцов AF5HL×I2CHL в 50%-ной сыворотке макака. Степени извлечения выше 90% для QC-образца с высокой и средней концентрацией и выше 80% для QC-образца с низкой концентрацией.
Таким образом, анализ позволяет определять AF5HL×I2CHL в образцах с сывороткой в диапазоне от 10 нг/мл до 200 нг/мл (перед разведением).
Фиг.54
Стандартная кривая для MCSP-G4 HL×I2C HL в 50%-ной сыворотке макака. На верхней диаграмме показана стандартная кривая, полученная для этого анализа, как описано в Примере 32.2.
На нижней диаграмме показаны результаты для качественного контроля образцов MCSP-G4 HL×I2C HL в 50%-ной сыворотке макака. Степени извлечения выше 98% для QC-образца с высокой и средней концентрацией и выше 85% для QC-образца с низкой концентрацией.
Таким образом, анализ позволяет осуществлять определение MCSP-G4 HL×I2C HL в образцах с сывороткой в диапазоне от 10 нг/мл до 200 нг/мл (перед разведением).
Фиг.55
FACS-анализ связывания анти-Flag-антитела с клетками СНО, трансфицированными N-концевыми аминокислотами 1-27 CD3-эпсилон указанных видов, слитыми с ЕрСАМ яванского макака. FACS-окрашивание осуществляли, как описано в Примере 33.1. Жирные линии представляют клетки, инкубированные с анти-Flag-антителом. Закрашенные гистограммы отражают отрицательные контроли. В качестве отрицательного контроля использовали PBS с 2% FCS. Гистограммы демонстрируют сильное и сравнимое связывание анти-Flag-антитела со всеми трансфектантами, что указывает на сильную и одинаковую экспрессию трансфицированных конструкций.
Фиг.56
FACS-анализ связывания конструкции 12С IgG1 с клетками СНО, экспрессирующими N-концевые аминокислоты 1-27 CD3-эпсилон указанных видов, слитые с ЕрСАМ яванского макака. FACS-окрашивание осуществляют, как описано в Примере 33.3. Жирные линии представляют клетки, инкубированные с 50 мкл супернатанта клеточной культуры клеток, экспрессирующих конструкцию I2C IgG1. Закрашенные гистограммы отражают отрицательный контроль. Клетки, экспрессирующие N-концевые аминокислоты 1-27 CD3-эпсилон свиньи, слитые с ЕрСАМ яванского макака, использовали в качестве отрицательного контроля. В сравнении с отрицательным контролем гистограммы четко демонстрируют связывание конструкции I2C IgG1 с N-концевыми аминокислотами 1-27 CD3-эпсилон человека, игрунки, тамарина и беличьей обезьяны.
Фиг.57
FACS-анализ связывания конструкции I2C IgG1, как описано в Примере 33.2, с человеческим CD3 с и без N-концевой His6-метки, как описано в Примерах 6.1 и 5.1, соответственно. Жирные линии представляют клетки, инкубированные с антителом UCHT-1 против CD3 человека, Penta-His-антителом (Qiagen) и супернатантом клеточной культуры клеток, экспрессирующих конструкцию I2C IgG1, соответственно, как указано. Закрашенные гистограммы отражают клетки, инкубированные с нерелевантным мышиным антителом IgG1 в качестве отрицательного контроля.
Перекрывания на верхних двух гистограммах показывают сравнимое связывание антитела UCHT-1 с обоими трансфектантами по сравнению с изотипическим контролем, демонстрирующим экспрессию обеих рекомбинантных конструкций. Перекрывания на центральных гистограммах демонстрируют связывание Penta-His-антитела с клетками, экспрессирующими His6-CD3-эпсилон-цепь человека (His6-CD3), но не с клетками, экспрессирующими CD3-эпсилон-цепь дикого типа (WT-CD3). Перекрывания на нижних гистограммах демонстрируют связывание конструкции I2C IgG1 с человеческой CD3-эпсилон-цепью дикого типа, но не с His6-CD3-эпсилон-цепью человека. Эти результаты демонстрируют, что присутствие свободного N-конца существенно для связывания анти-CD3-связывающей молекулы I2C с межвидовой специфичностью с CD3-эпсилон-цепью.
Фиг.58
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными MCSP D3 человека, с CD3+ Т-клеточной линией человека HPB-ALL, с клетками СНО, трансфицированными MCSP D3 макака, и с Т-клеточной линией макака 4119 LnPx, соответственно. FACS-окрашивание осуществляли, как описано в Примере 17. Жирные линии представляют клетки, инкубированные с очищенной биспецифической одноцепочечной конструкцией в концентрации 2 мкг/мл или клеточным супернатантом, содержащим данную биспецифическую одноцепочечную конструкцию, соответственно. Закрашенные гистограммы отражают отрицательные контроли. Супернатант нетрансфицированных клеток СНО использовали в качестве отрицательного контроля связывания с Т-клеточными линиями. Одноцепочечную конструкцию с нерелевантной целевой специфичностью использовали в качестве отрицательного контроля связывания с клетками СНО, трансфицированными MCSP D3. Для каждой биспецифической одноцепочечной конструкции с межвидовой специфичностью перекрывание гистограмм демонстрирует специфическое связывание данной конструкции с MCSP D3 человека и макака и CD3 человека и макака.
Фиг.59
Цитотоксическая активность, индуцированная указанными MCSP D3-специфическими одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. Также использовали эффекторные клетки и отношение эффекторных клеток к клеткам-мишеням, как указано. Анализ осуществляют, как описано в Примере 18. Диаграммы четко демонстрируют сильный рекрутинг цитотоксической активности с межвидовой специфичностью под действием каждой конструкции.
Фиг.60
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными CD33 человека, с CD3+ Т-клеточной линией человека HPB-ALL, с клетками СНО, трансфицированными CD33 макака, и РВМС макака, соответственно. FACS-окрашивание осуществляли, как описано в Примере 36.2. Жирные линии представляют клетки, инкубированные с супернатантом клеточной культуры трансфицированных клеток, экспрессирующих конструкции биспецифических антител с межвидовой специфичностью. Закрашенные гистограммы отражают отрицательные контроли. В качестве отрицательного контроля использовали супернатант нетрансфицированных клеток СНО. Для каждой биспецифической одноцепочечной конструкции с межвидовой специфичностью перекрывание гистограмм демонстрирует специфическое связывание данной конструкции с CD33 человека и макака и CD3 человека и макака.
Фиг.61
На диаграммах показаны результаты анализов высвобождения хрома, в которых измеряют цитотоксическую активность, индуцированную указанными CD33-специфическими одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. Также указаны используемые эффекторные клетки. Анализы осуществляют, как описано в Примере 36.3. Диаграммы четко демонстрируют для каждой конструкции сильный рекрутинг цитотоксической активности эффекторных клеток человека и макака против клеток СНО, трансфицированных CD33 человека и макака, соответственно.
Фиг.62
Перераспределение Т-клеток у шимпанзе при еженедельной внутривенной болюсной инфузии PBS/5% HSA и PBS/5% HSA плюс конструкция одноцепочечного ЕрСАМ/CD3-биспецифического антитела в дозах 1,6; 2,0; 3,0 и 4,5 мкг/кг. Продолжительность инфузии для каждого болюсного введения составляла 2 часа. Вертикальные стрелки указывают на начало болюсных инфузии. Точки на графике в начале каждого болюсного введения показывают количества Т-клеток непосредственно перед началом болюсной инфузии. Каждая болюсная инфузия конструкции одноцепочечного EpCAM/CD3-биспецифического антитела, которая распознает традиционный зависимый от окружения CD3-эпитоп, инициирует эпизод перераспределения Т-клеток с последующим восстановлением Т-клеток до исходных величин перед следующей болюсной инфузией.
Фиг.63
CD3-специфический ELISA-анализ периплазматических препаратов, содержащих Flag-меченые белковые scFv-фрагменты из отобранных клонов.
Периплазматические препараты растворимых белковых scFv-фрагментов добавляли в лунки планшета для ELISA, которые были покрыты растворимым слитым белком [CD3-эпсилон (аа 1-27) человека]-Fc (аа означает аминокислоту) и были дополнительно блокированы PBS с 3% BSA. Определение осуществляли, используя моноклональное анти-Flag-биотин-меченое антитело, затем конъюгированный с пероксидазой стрептавидин. ELISA проявляли раствором субстрата ABTS (2,2'-азинобис(3-этилбензотиозолин-6-сульфонат). Величины OD (оптической плотности) (ось у) измеряли при 405 нм, используя ELISA-ридер. Названия клонов представлены на оси х.
Фиг.64
ELISA-анализ периплазматических препаратов, содержащих Flag-меченые белковые scFv-фрагменты из отобранных клонов. Те же периплазматические препараты растворимых белковых scFv-фрагментов, что и на Фиг.63, добавляли в лунки планшета для ELISA, которые не были покрыты растворимым белком слияния [CD3-эпсилон (аа 1-27) человека]-Fc, но были покрыты IgG1 человека (Sigma) и блокированы 3%-ным BSA в PBS.
Определение осуществляли, используя моноклональное анти-Flag-биотин-меченое антитело, затем конъюгированный с пероксидазой стрептавидин. ELISA проявляли раствором субстрата ABTS. Величины OD (ось у) измеряли при 405 нм, используя ELISA-ридер. Названия клонов представлены на оси х.
Фиг.65
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью с клетками СНО, трансфицированными CD44 человека, с CD3+ Т-клеточной линией человека HPB-ALL, с клетками СНО, трансфицированными CD44 макака, и с Т-клеточной линией макака 4119 LnPx, соответственно. Клетки СНО, трансфицированные CD44delv6 человека, использовали в качестве контроля для того, чтобы подчеркнуть специфичность указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью к CD44. FACS-окрашивание осуществляют, как описано в Примере 39.3. Жирные линии представляют клетки, инкубированные с клеточным супернатантом, содержащим биспецифическую одноцепочечную конструкцию. Закрашенные гистограммы отражают отрицательные контроли. В качестве отрицательного контроля связывания с Т-клеточными линиями использовали супернатант нетрансфицированных клеток СНО. Одноцепочечную конструкцию с нерелевантной целевой специфичностью использовали в качестве отрицательного контроля связывания с CD44- и CD44delv6-трансфицированными клетками СНО. Для каждой биспецифической одноцепочечной конструкции с межвидовой специфичностью перекрывание гистограмм демонстрирует специфическое связывание данной конструкции с CD44 человека и макака и CD3 человека и макака. Перекрывание гистограмм для каждой конструкции демонстрирует отсутствие какого-либо специфического связывания с клетками СНО, трансфицированными CD44delv6 человека.
Фиг.66
Цитотоксическая активность, индуцированная указанными CD44-специфическими одноцепочечными конструкциями с межвидовой специфичностью, перенаправленными на указанные целевые клеточные линии. Также указаны используемые эффекторные клетки и отношение эффекторных клеток к клеткам-мишеням. Анализ осуществляют, как описано в Примере 39.4. Диаграммы четко демонстрируют возможность опосредования цитотоксичности под действием каждой из этих биспецифических конструкций.
Фиг.67
FACS-анализ связывания указанных биспецифических одноцепочечных конструкций с межвидовой специфичностью, как описано в Примере 41.
Фиг.68
Цитотоксическая активность, индуцированная указанными связывающими молекулами с межвидовой специфичностью, как описано в Примере 41.
Настоящее изобретение дополнительно описано посредством следующих ниже неограничивающих иллюстративных примеров, которые обеспечивают лучшее понимание настоящего изобретения и многих его преимуществ.
ПРИМЕРЫ
1. Идентификация последовательностей CD3-эпсилон из образцов крови приматов, не являющихся человеком
Для идентификации CD3-эпсилон использовали образцы крови следующих приматов, не являющихся человеком: Callithrix jacchus, Saguinus oedipus и Saimiris ciureus. Для выделения общей клеточной РНК готовили образцы свежей, обработанной гепарином цельной крови в соответствии с протоколом производителя (QIAamp RNA Blood Mini Kit, Qiagen). Осуществляли транскрипцию экстрагированной мРНК в кДНК в соответствии с опубликованными протоколами. Кратко, 10 мкл осажденной РНК инкубировали с 1,2 мкл 10-кратной гексануклеотидной смеси (Roche) при 70°С в течение 10 минут и хранили на льду. Добавляли реакционную смесь, содержащую 4 мкл 5-кратного буфера superscript II, 0,2 мкл 0,1 М дитиотреитола, 0,8 мкл superscript II (Invitrogen), 1,2 мкл дезоксирибонуклеозидтрифосфатов (25 мкМ), 0,8 мкл ингибитора РНКазы (Roche) и 1,8 мкл воды, не содержащей ДНКаз и РНКаз (Roth). Реакционную смесь инкубировали при комнатной температуре в течение 10 минут с последующей инкубацией при 42°С в течение 50 минут и при 90°С в течение 5 минут. Реакционную смесь оставляли охлаждаться на льду, затем добавляли 0,8 мкл РНКазы Н (1 ед./мкл, Roche) и инкубировали в течение 20 минут при 37°С.
кДНК первой цепи из каждого образца подвергали 35 отдельным циклам полимеразной цепной реакции, используя ДНК-полимеразу Tag (Sigma) и следующую комбинацию праймеров, сконструированную на основании изучения базы данных: прямой праймер 5'-AGAGTTCTGGGCCTCTGC-3' (SEQ ID NO: 377); обратный праймер 5'-CGGATGGGCTCATAGTCTG-3' (SEQ ID NO: 378). Амплифицированные зоны 550 п.о. выделяли из геля (Gel Extraction Kit, Qiagen) и секвенировали (Sequiserve, Vaterstetten/Germany, см. перечень последовательностей).
CD3-эпсилон Callithrix iacchus
Нуклеотиды
CAGGACGGTAATGAAGAAATGGGTGATACTACACAGAACCCATATAAAGT
TTCCATCTCAGGAACCACAGTAACACTGACATGCCCTCGGTATGATGGACATGA
AATAAAATGGCTCGTAAATAGTCAAAACAAAGAAGGTCATGAGGACCACCTGTTA
CTGGAGGACTTTTCGGAAATGGAGCAAAGTGGTTATTATGCCTGCCTCTCCAAA
GAGACTCCCGCAGAAGAGGCGAGCCATTATCTCTACCTGAAGGCAAGAGTGTG
TGAGAACTGCGTGGAGGTGGAT
Аминокислоты
QDGNEEMGDTTQNPYKVSISGTTVTLTCPRYDGHEIKWLVNSQNKEGHEDH
LLLEDFSEMEQSGYYACLSKETPAEEASHYLYLKARVCENCVEVD
CD3-эпсилон Sacfuinus oedipus
Нуклеотиды
CAGGACGGTAATGAAGAAATGGGTGATACTACACAGAACCCATATAAAGT
TTCCATCTCAGGAACCACAGTAACACTGACATGCCCTCGGTATGATGGACATGA
AATAAAATGGCTTGTAAATAGTCAAAACAAAGAAGGTCATGAGGACCACCTGTTA
CTGGAGGAIIIIICGGAAATGGAGCAAAGTGGTTATTATGCCTGCCTCTCCAAA
GAGACTCCCGCAGAAGAGGCGAGCCATTATCTCTACCTGAAGGCAAGAGTGTG
TGAGAACTGCGTGGAGGTGGAT
Аминокислоты
QDGNEEMGDTTQNPYKVSISGTTVTLTCPRYDGHEIKWLVNSQNKEGHEDH
LLLEDFSEMEQSGYYACLSKETPAEEASHYLYLKARVCENCVEVD
CD3-эпсилон Saimiri sciureus
Нуклеотиды
CAGGACGGTAATGAAGAGATTGGTGATACTACCCAGAACCCATATAAAGT
TTCCATCTCAGGAACCACAGTAACACTGACATGCCCTCGGTATGATGGACAGGA
AATAAAATGGCTCGTAAATGATCAAAACAAAGAAGGTCATGAGGACCACCTGTTA
CTGGAAGATTTTTCAGAAATGGAACAAAGTGGTTATTATGCCTGCCTCTCCAAAG
AGACCCCCACAGAAGAGGCGAGCCATTATCTCTACCTGAAGGCAAGAGTGTGT
GAGAACTGCGTGGAGGTGGAT
Аминокислоты
QDGNEEIGDTTQNPYKVSISGTTVTLTCPRYDGQEIKWLVNDQNKEGHEDHL
LLEDFSEMEQSGYYACLSKETPTEEASHYLYLKARVCENCVEVD
2. Создание одноцепочечных фрагментов антител (scFv) с межвидовой специфичностью, связывающихся с N-концевыми аминокислотами 1-27 CD3-эпсилон человека и различных приматов, не являющихся шимпанзе
2.1. Иммунизация мышей с использованием N-конца CD3-эпсилон, выделенного из его нативного CD3-окружения посредством слияния с гетерологичным растворимым белком
Мышей F1 от скрещиваний balb/c×C57black в возрасте десяти недель иммунизировали слитым белком CD3-эпсилон-Fc, несущим большую часть N-концевых аминокислот (1-27) зрелой эпсилон-цепи CD3 (1-27 CD3-Fc) человека и/или обыкновенной беличьей обезьяны. Для этого 40 мкг слитого белка 1-27 CD3-Fc вместе с 10 нмоль тиоат-модифицированного CpG-олигонуклеотида (5'-tccatgacgttcctgatgct-3') в 300 мкл PBS на одну мышь вводили посредством внутрибрюшинной инъекции. Мыши получали бустерные иммунизации через 21, 42 и возможно 63 суток тем же способом. Через десять суток после первой бустерной иммунизации брали образцы крови, и титр антител в сыворотке против слитого белка 1-27 CD3-Fc тестировали с использованием ELISA. Дополнительно тестировали титр против CD3-положительной Т-клеточной линии человека HPBall методом проточной цитометрии согласно стандартным протоколам. Сывороточные титры были значительно выше у иммунизированных, чем у неиммунизированных животных.
2.2. Создание иммунной библиотеки scFv мышиных антител: конструирование комбинаторной библиотеки антител и фаговый дисплей
Через трое суток после последней инъекции клетки селезенки мышей собирали для получения общей РНК согласно стандартным протоколам.
С использованием ОТ-ПЦР (полимеразная цепная реакция с обратной транскрипцией) на РНК селезенки мышей с применением VK- и VH-специфических праймеров конструировали библиотеку ДНК-фрагментов вариабельной области легкой цепи (каппа) (VK) и вариабельной области тяжелой цепи (VH) иммуноглобулинов (Ig) мыши. кДНК синтезировали согласно стандартным протоколам.
Праймеры конструировали таким образом, чтобы создать сайт распознавания для 5'-XhoI и 3'-BstEII для амплифицированных V-фрагментов тяжелой цепи и сайт распознавания для 5'-Sacl и 3'-Spel для амплифицированных VK-фрагментов ДНК. Для ПЦР-амплификации ДНК-фрагментов VH каждый из восьми различных праймеров, специфичных к 5'-VH-семейству (MVH1 (GC)AG GTG CAG CTC GAG GAG TCA GGA CCT; MVH2 GAG GTC CAG CTC GAG CAG TCT GGA CCT; MVH3 CAG GTC CAA CTC GAG CAG CCT GGG GCT; MVH4 GAG GTT CAG CTC GAG CAG TCT GGG GCA; MVH5 GA(AG) GTG AAG CTC GAG GAG TCT GGA GGA; MVH6 GAG GTG AAG CTT CTC GAG TCT GGA GGT; MVH7 GAA GTG AAG CTC GAG GAG TCT GGG GGA; MVH8 GAG GTT CAG CTC GAG CAG TCT GGA GCT) объединяли с одним 3'-VH-праймером (3'MuVHBstEII tga gga gac ggt gac cgt ggt ccc ttg gcc cca g); для ПЦР-амплификации фрагментов VK-цепи каждый из семи различных праймеров, специфичных к 5'-VK-семейству (MUVK1 ССА GTT CCG AGC TCG TTG TGA СТС AGG ААТ СТ; MUVK2 ССА GTT CCG AGC TCG TGT TGA CGC AGC CGC СС; MUVK3 ССА GTT CCG AGC TCG TGC ТСА ССС AGT СТС СА; MUVK4 ССА GTT CCG AGC ТСС AGA TGA ССС AGT СТС СА; MUVK5 ССА GAT GTG AGC TCG TGA TGA ССС AGA СТС СА; MUVK6 ССА GAT GTG AGC TCG ТСА TGA ССС AGT СТС СА; MUVK7 ССА GTT CCG AGC TCG TGA TGA CAC AGT СТС СА) объединяли с одним 3'-УК-праймером (3'MuVkHindIII/BsiWI tgg tgc act agt cgt acg ttt gat etc aag ctt ggt ccc).
Для амплификации использовали следующую ПЦР-программу: денатурация при 94°С в течение 20 с; отжиг праймеров при 52°С в течение 50 с и удлинение праймеров при 72°С в течение 60 с; и 40 циклов, затем окончательное удлинение в течение 10 мин при 72°С.
450 нг фрагментов легкой цепи каппа (расщепленных Sacl-Spel) лигировали с 1400 нг фагмиды pComb3H5Bhis (расщепленной Sacl-Spel; большой фрагмент). Полученную комбинаторную библиотеку антител затем подвергали трансформации в 300 мкл электрокомпетентных клеток Escherichia coli XL1 Blue с помощью электропорации (2,5 кВ; кювета с щелью 0,2 см; 25 мкФ; 200 Ом, Biorad gene-pulser), получая в результате библиотеку размером более 107 независимых клонов. Через один час фенотипической экспрессии отбирали положительные трансформанты по устойчивости к карбенициллину, кодируемой вектором pComb3H5BHis, в 100 мл жидкой SB(super broth)-культуры в течение ночи. Затем клетки собирали центрифугированием и плазмиду получали, используя имеющийся в продаже набор для получения плазмид (Qiagen).
2800 нг этой плазмидной ДНК, содержащей VK-библиотеку (расщепленной XhoI-BstEII; большой фрагмент), лигировали с 900 нг V-фрагментов тяжелой цепи (расщепленных XhoI-BstEII), и снова подвергали трансформации в две аликвоты по 300 мкл электрокомпетентных клеток Е. coli XL1 Blue с помощью электропорации (2,5 кВ; кювета с щелью 0,2 см; 25 мкФ, 200 Ом), получая в результате библиотеку VH-VK scFv (одноцепочечный вариабельный фрагмент) общим размером более 107 независимых клонов.
После фенотипической экспрессии и медленной адаптации к карбенициллину клетки Е. coli, содержащие библиотеку антител, переносили в SB-карбенициллин(50 мкг/мл)-селективную среду. Клетки Е. coli, содержащие библиотеку антител, затем инфицировали инфекционной дозой, равной 1012 частиц хелперного фага VCSM13, приводящей к продуцированию и секреции нитевидного фага М13, где фаговая частица содержит одноцепочечную pComb3H5BHis-ДНК, кодирующую мышиный scFv-фрагмент, и экспонировала соответствующий scFv-белок в виде трансляционного слияния с оболочечным белком III фага. Этот пул фагов, экспонирующих библиотеку антител, затем использовали для селекции антигенсвязывающих структур.
2.3. Селекция CD3-специфических связывающих агентов на основе фагового дисплея
Фаговую библиотеку, несущую клонированный scFv-репертуар, получали из соответствующего культурального супернатанта посредством осаждения с помощью PEG8000/NaCl и центрифугирования. Приблизительно от 1011 до 1012 scFv-фаговых частиц ресуспендировали в 0,4 мл PBS/0,1% BSA и инкубировали с 105-107 клеток Jurkat (CD3-положительная линия Т-клеток человека) в течение 1 часа на льду при слабом перемешивании. Эти клетки Jurkat выращивали заранее в среде RPMI, обогащенной фетальной сывороткой теленка (10%), глутамином и пенициллином/стрептомицином, собирали центрифугированием, промывали в PBS и ресуспендировали в PBS/1% FCS (содержащем азид натрия). scFv-несущие фаги, которые не связывались специфически с клетками Jurkat, удаляли с помощью пяти стадий промывки с использованием PBS/1% FCS (содержащего азид натрия). После промывки связавшиеся структуры элюировали с клеток посредством ресуспендирования клеток в HCI-глициновом буфере рН 2,2 (10 мин инкубации с последующим интенсивным перемешиванием) и после нейтрализации с помощью 2М Трис рН 12 элюат использовали для инфицирования свежей неинфицированной культуры Е. coli XL1 Blue (OD600 больше 0,5). Культуру Е. coli, содержащую клетки Е. coli, подвергнутые успешной трансдукции фагмидной копией, кодирующей человеческий scFv-фрагмент, вновь подвергали селекции на устойчивость к карбенициллину и затем инфицировали хелперным фагом VCMS 13 для того, чтобы начать второй раунд экспонирования антител и селекции in vitro. Обычно осуществляли суммарно от 4 до 5 циклов селекции.
2.4. Скрининг CD3-специфических связывающих агентов Плазмидную ДНК, соответствующую 4-5 раундам пэннинга, выделяли из культур Е. coli после селекции. Для получения растворимого scFv-белка, фрагменты VH-VL-ДНК вырезали из плазмид (Xhol-Spel). Эти фрагменты клонировали через те же сайты рестрикции в плазмиду pComb3H5BFlag/His, отличающуюся от исходной pComb3H5BHis тем, что экспрессируемая конструкция (например scFv) включает в себя Flag-метку (TGD YKDDDDK) между scFv и His6-меткой и дополнительные фаговые белки делегированы. После лигирования каждый пул (различные раунды пэннинга) плазмидной ДНК подвергали трансформации в 100 мкл компетентных к тепловому шоку (heat shock competent) E.coli TG1 или XLI blue и высевали на карбенициллин-LB-агар. Одиночные колонии переносили перекалыванием в 100 мкл LB-карб (50 мкг/мл).
E.coli, трансформированные pComb3H5BHis, содержащей VL- и VH-сегмент, продуцируют растворимый scFv в значительных количествах после вырезания фрагмента гена III и индукции с помощью 1 мМ IPTG (изопропилтиогалактопиранозид). Благодаря подходящей сигнальной последовательности scFv-цепь экспортируется в периплазму, где она сворачивается в функциональную конформацию.
Одиночные бактериальные колонии E.coli TG1 с чашек для трансформации отбирали для получения небольших количеств периплазмы и выращивали на SB-среде (например 10 мл), дополненной 20 мМ MgCl2 и карбенициллином (50 мкг/мл), и ресуспендировали в PBS (например 1 мл) после сбора. В результате четырех циклов замораживания при -70°С и оттаивания при 37°С наружная мембрана бактерий разрушалась под действием температурного шока и растворимые периплазматические белки, включая scFv, высвобождались в супернатант. После удаления центрифугированием интактных клеток и клеточного дебриса собирали супернатант, содержащий scFv человека против CD3 человека, и использовали для дальнейшего исследования.
2.5. Идентификация CD3-специфических связывающих агентов
Связывание выделенных scFv тестировали методом проточной цитометрии на эукариотических клетках, экспрессирующих на своей поверхности гетерологичный белок, представляющий на своем N-конце первые 27 N-концевых аминокислот CD3-эпсилон.
Как описано в Примере 4, первые аминокислоты 1-27 N-концевой последовательности зрелой эпсилон-цепи CD3 Т-клеточного рецепторного комплекса человека (аминокислотная последовательность: QDGNEEMGGITQTPYKVSISGTTVILT) были слиты с N-концом трансмембранного белка ЕрСАМ таким образом, чтобы N-конец был расположен на наружной поверхности клетки. Кроме этого, FLAG-эпитоп был встроен между N-концевой 1-27 CD3-эпсилон последовательностью и последовательностью ЕрСАМ. Этот продукт слияния экспрессировали в клетках почки человеческого эмбриона (НЕК) и клетках яичника китайского хомячка (СНО).
Эукариотические клетки, экспонирующие большую часть 27 N-концевых аминокислот зрелой CD3-эпсилон других видов приматов, получали таким же образом для Saimiri sciureus (обыкновенная беличья обезьяна) (CD3-эпсилон N-концевая аминокислотная последовательность: QDGNEEIGDTTQNPYKVSISGTTVTLT), для Callithrix jacchus (CD3-эпсилон N-концевая аминокислотная последовательность: QDGNEEMGDTTQNPYKVSISGTTVTLT) и для Saguinus oedipus (CD3-эпсилон N-концевая аминокислотная последовательность: QDGNEEMGDTTQNPYKVSISGTTVTLT).
Для анализа методом проточной цитометрии 2,5×105 клеток инкубируют с 50 мкл супернатанта или с 5 мкг/мл очищенных конструкций в 50 мкл PBS с 2% FCS. Связывание конструкций определяли с использованием анти-His-антитела (Penta-His-антитело, не содержащее BSA, Qiagen GmbH, Hilden, FRG) в концентрации 2 мкг/мл в 50 мкл PBS с 2% FCS. В качестве реагента для второй стадии использовали конъюгированный с R-фикоэритрином, аффинно очищенный F(ab')2-фрагмент антитела козы против IgG мыши (специфичный к Fc-гамма-фрагменту), разбавленный 1:100 в 50 мкл PBS с 2% FCS (Dianova, Hamburg, FRG). Образцы измеряли на FACSscan (BD biosciences, Heidelberg, FRG).
Связывание всегда подтверждали методом проточной цитометрии, как описано в предшествующем абзаце, на первичных Т-клетках человека и различных приматов (например обыкновенной беличьей обезьяны (Saimili sciureus), обыкновенной игрунки (Callithrix jacchus); эдипова тамарина (Saguinus oedipus)).
2.6. Создание человеческих/гуманизированных эквивалентов scFv, специфичных к CD3-эпсилон вида, не являющегося человеком Осуществляли выравнивание VH-области мышиных анти-CD3 scFv относительно аминокислотных последовательностей антитела зародышевой линии человека. Выбирали VH-последовательность антитела зародышевой линии человека, которая имела наибольшую гомологию с VH вида, не являющегося человеком, и осуществляли прямое выравнивание данных двух аминокислотных последовательностей. Имелся ряд каркасных остатков для VH вида, не являющегося человеком, которые отличались от каркасных областей VH человека ("различные положения в каркасе"). Некоторые из этих остатков могут участвовать в связывании антитела с его мишенью и активности антитела в отношении его мишени.
Для конструирования библиотеки, которая содержит мышиные CDR и которые в каждом положении каркаса отличаются от обоих вариантов выбранной человеческой VH-последовательности (человеческий и материнский мышиный аминокислотный остаток), синтезировали вырожденные олигонуклеотиды. В состав этих олигонуклеотидов входит в разных положениях "человеческий" остаток с вероятностью 75% и мышиный с вероятностью 25%. Для одной человеческой VH, например, необходимо было синтезировать шесть таких олигонуклеотидов, которые перекрывают концевой участок из приблизительно 20 нуклеотидов. Для этого каждый второй праймер представлял собой антисмысловой праймер. Сайты рестрикции, необходимые для последующего клонирования в олигонуклеотиды, удаляли.
Эти праймеры могут иметь длину от 60 до 90 нуклеотидов в зависимости от числа праймеров, которые необходимы для перекрывания по всей V-последовательности.
Эти праймеры, например шесть праймеров, смешивали в равных количествах (например, 1 мкл каждого праймера (концентрированный раствор праймера: 20-100 мкМ) с 20 мкл ПЦР-реакции) и добавляли к ПЦР-смеси, состоящей из ПЦР-буфера, нуклеотидов и Taq-полимеразы. Эту смесь инкубировали при 94°С в течение 3 минут, при 65°С в течение 1 минуты, при 62°С в течение 1 минуты, при 59°С в течение 1 минуты, при 56°С в течение 1 минуты, при 52°С в течение 1 минуты, при 50°С в течение 1 минуты и при 72°С в течение 10 минут в ПЦР-циклере. После этого продукт подвергали электрофорезу в агарозном геле и продукт размером от 200 до 400 выделяли из геля согласно стандартным методам.
Этот ПЦР-продукт затем использовали в качестве матрицы для стандартной ПЦР-реакции с применением праймеров, которые вводят подходящие для клонирования N-концевые и С-концевые сайты рестрикции. Фрагмент ДНК правильного размера (для VH приблизительно 350 нуклеотидов) выделяли с помощью электрофореза в агарозном геле согласно стандартным методам. Таким способом был амплифицирован достаточный VH-фрагмент ДНК. Этот VH-фрагмент теперь представлял собой пул VH-фрагментов, каждый из которых имел различное количество "человеческих" и "мышиных" остатков в соответствующих различающихся положениях в каркасе (пул гуманизированных VH). Аналогичную процедуру осуществляли для VL-области мышиного анти-CD3 scFv (пул гуманизированных VL).
Пул гуманизированных VH затем объединяли с пулом гуманизированных VL в векторе для фагового дисплея pComb3H5Bhis для формирования библиотеки функциональных scFv, из которой после дисплея с использованием нитевидного фага отбирали анти-CD3-связывающие агенты, производили скрининг, идентифицировали и подтверждали, как описано выше для родительских не-человеческих (мышиных) анти-CD3 scFv. Одиночные клоны затем анализировали на наличие подходящих свойств и аминокислотной последовательности. Те scFv, аминокислотная последовательность которых имеет наибольшую гомологию с V-сегментами зародышевой линии человека, являются предпочтительными, в частности те, у которых по меньшей мере один CDR среди CDR 1 и II VH и CDR 1 и II VL-каппа или CDR 1 и II VL-лямбда демонстрируют более чем 80% идентичности аминокислотной последовательности с наиболее близким соответствующим CDR из всех V-сегментов зародышевой линии человека. Анти-CD3 scFv превращали в рекомбинантные биспецифические одноцепочечные антитела, как описано в следующих ниже Примерах 10 и 16, и дополнительно характеризовали.
3. Создание рекомбинантного слитого белка, состоящего из N-концевых аминокислот 1-27 эпсилон-цепи CD3 человека, слитых с Fc-областью IgG1 (1-27 CD3-Fc)
3.1. Клонирование и экспрессия 1-27 CD3-Fc
Кодирующую последовательность N-концевых аминокислот 1-27 эпсилон-цепи CD3 человека, слитую с шарнирной областью и Fc-гамма-участком человеческого иммуноглобулина IgG1, а также с состоящей из 6 гистидиновых остатков меткой, получали генным синтезом (gene synthesis) согласно стандартным протоколам (последовательность кДНК и аминокислотная последовательность рекомбинантного слитого белка представлены в SEQ ID NO: 350 и 349). Фрагмент генного синтеза конструировали таким образом, чтобы он содержал сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность первых 27 аминокислот внеклеточного участка зрелой эпсилон-цепи CD3 человека, затем, в рамке считывания, кодирующую последовательность шарнирной области и Fc-гамма-участка человеческого IgG1, затем, в рамке считывания, кодирующую последовательность состоящей из 6 гистидиновых остатков метки и стоп-кодон (Фиг.1). Фрагмент генного синтеза конструировали также таким образом, чтобы ввести сайты рестрикции в начало и в конец кДНК, кодирующей данный слитый белок. Введенные сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, используют в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через EcoRI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Mack et al. Proc. Natl. Acad. Sci. USA 92 (1995) 7021-7025), следуя стандартным протоколам. Плазмиду с подтвержденной последовательностью использовали для трансфекции в экспрессирующей системе FreeStyle 293 (Invitrogen GmbH, Karlsruhe, Germany) в соответствии с протоколом производителя. Через 3 суток собирали супернатанты клеточных культур трансфектантов и тестировали с применением ELISA на присутствие рекомбинантной конструкции. Специфичное к Fc-гамма-фрагменту IgG человека антитело козы (полученное от Jackson ImmunoResearch Europe Ltd., Newmarket, Suffolk, UK) разбавляли в PBS до концентрации 5 мкг/мл и им покрывали (100 мкл/лунку) лунки 96-луночного планшета MaxiSorp для ELISA (Nunc GmbH & Со. KG, Wiesbaden, Germany) в течение ночи при 4°С. Лунки промывали PBS с 0,05% Tween 20 (PBS/Tween) и блокировали 3%-ным BSA в PBS (бычий альбумин, фракция V, Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany) в течение 60 минут при комнатной температуре (KT). После этого лунки еще раз промывали PBS/Tween и затем инкубировали с супернатантами клеточной культуры в течение 60 минут при KT. После промывки лунок осуществляли инкубацию с анти-His6-антителом, конъюгированным с пероксидазой (Roche Diagnostics GmbH, Roche Applied Science, Mannheim, Germany), разбавленным 1:500 в PBS с 1% BSA, в течение 60 минут при KT. Затем лунки промывали 200 мкл PBS/Tween и добавляли 100 мкл раствора субстрата SIGMAFAST OPD (SIGMAFAST OPD [дигидрохлорид о-фенилендиамина]) (Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany) в соответствии с протоколом производителя. Реакцию останавливали, добавляя 100 мкл 1 М H2SO4. Интенсивность получаемой в результате окраски измеряли на спектрофотометре для микропланшетов PowerWaveX (BioTek Instruments, Inc., Winooski, Vermont, USA) при 490 нм с вычитанием фоновой абсорбции при 620 нм. Как показано на Фиг.2, присутствие конструкции по сравнению с нерелевантным супернатантом мнимо трансфицированных (mock-transfected) клеток НЕК 293, используемых в качестве отрицательного контроля, четко определялось.
3.2. Анализ связывания одноцепочечных антител с межвидовой специфичностью с 1-27 CD3-Fc
Связывание неочищенных препаратов экспрессирующихся в периплазму одноцепочечных антител с межвидовой специфичностью, специфичных к CD3-эпсилон, с 1-27 CD3-Fc тестировали в ELISA-анализе. Козье антитело против IgG человека, специфичное к Fc-гамма-фрагменту (Jackson ImmunoResearch Europe Ltd., Newmarket, Suffolk, UK), разбавляли в PBS до концентрации 5 мкг/мл и наносили в виде покрытия по 100 мкл/лунку на 96-луночный планшет для ELISA MaxiSorp (Nunc GmbH & Со. KG, Wiesbaden, Germany) в течение ночи при 4°С.Лунки промывали PBS с 0,05% Tween 20 (PBS/Tween) и блокировали PBS с 3% BSA (бычий альбумин, фракция V, Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany) в течение 60 минут при KT. После этого лунки промывали PBS/Tween и инкубировали с супернатантами клеток, экспрессирующих конструкцию 1-27 CD3-Fc, в течение 60 минут при KT. Лунки промывали PBS/Tween и инкубировали с неочищенными препаратами экспрессирующихся в периплазму одноцепочечных антител с межвидовой специфичностью, как описано выше, в течение 60 минут при комнатной температуре. После промывки PBS/Tween лунки инкубировали с пероксидазой, конъюгированной с анти-Flag М2-антителом (Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany), разбавленным 1:10000 в PBS с 1% BSA в течение 60 минут при KT. Лунки промывали PBS/Tween и инкубировали с 100 мкл раствора субстрата SIGMAFAST OPD (OPD [дигидрохлорид о-фенилендиамина]) (Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany) в соответствии с протоколом производителя. Развитие окраски останавливали с помощью 100 мкл 1 М H2SO4 и производили измерения на спектрофотометре для микропланшетов PowerWaveX (BioTek Instruments, Inc., Winooski, Vermont, USA) при 490 нм с вычитанием фоновой абсорбции при 620 нм. Наблюдали сильное связывание человеческих одноцепочечных антител с межвидовой специфичностью, специфичных к CD3-эпсилон, с конструкцией 1-27CD3-FC по сравнению с мышиным анти-CD3 одноцепочечным антителом (Фиг.3).
4. Создание рекомбинантных трансмембранных слитых белков из N-концевых аминокислот 1-27 CD3-эпсилон различных приматов, не являющихся шимпанзе, слитых с ЕрСАМ яванского макака (1-27CD3-ЕрСАМ)
4.1. «локирование и экспрессия 1-27 CD3-EpCAM
CD3-эпсилон выделяли из различных приматов, не являющихся шимпанзе (игрунки, тамарина, беличьей обезьяны), и свиньи. Кодирующие последовательности 1-27 N-концевых аминокислот зрелой эпсилон-цепи CD3 человека, обыкновенной игрунки (Callithiixjacchus), эдипова тамарина (Saguinus oedipus), обыкновенной беличьей обезьяны (Saimiri sciureus) и домашней свиньи (Sus scrota; используемой в качестве отрицательного контроля), слитые с N-концом Flag-меченой ЕрСАМ яванского макака, получали генным синтезом согласно стандартным протоколам (последовательность кДНК и аминокислотная последовательность рекомбинантных слитых белков представлены в SEQ ID NO: 351-360). Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала BsrGI-сайт, позволяющий осуществлять слияние в правильной рамке считывания с кодирующей последовательностью иммуноглобулинового лидерного пептида из 19 аминокислот, уже имеющегося в целевом экспрессирующем векторе, затем, в рамке считывания, кодирующую последовательность N-концевых аминокислот 1-27 внеклеточного участка зрелых эпсилон-цепей CD3, затем, в рамке считывания, кодирующую последовательность Flag-метки и затем, в рамке считывания, кодирующую последовательность зрелого трансмембранного белка ЕрСАМ яванского макака (Фиг.4). Фрагменты генного синтеза конструировали также таким образом, чтобы ввести сайт рестрикции в конец кДНК, кодирующей данный слитый белок. Введенные сайты рестрикции, BsrGI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагменты генного синтеза затем клонировали через BsrGI и SalI, следуя стандартным протоколам, в производное плазмиды, обозначенной pEF DHFR (pEF-DHFR описана в Mack et al. Proc. Natl. Acad. Sci. USA 92 (1995) 7021-7025), которая уже содержала кодирующую последовательность иммуноглобулинового лидерного пептида из 19 аминокислот. Плазмиды с подтвержденной последовательностью использовали для временной трансфекции клеток НЕК 293 с использованием реагента MATra-A (IBA GmbH, Gottingen, Germany) и 12 мкг плазмидной ДНК для прикрепленных клеток НЕК 293 в 175 мл флаконах для клеточных культур в соответствии с протоколом производителя. Через 3 суток культивирования клеток трансфектанты тестировали в отношении экспрессии на клеточной поверхности рекомбинантного трансмембранного белка с помощью FACS-анализа согласно стандартным протоколам. С этой целью 2,5×105 клеток инкубировали с анти-Flag М2-антителом (Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany) в концентрации 5 мкг/мл в PBS с 2% FCS. Связавшееся антитело определяли с использованием конъюгированного с R-фикоэритрином, аффинно очищенного F(ab')2-фрагмента антитела козы против IgG мыши (специфичного к Fc-гамма-фрагменту), разбавленного 1:100 в PBS с 2% FCS (Jackson ImmunoResearch Europe Ltd., Newmarket, Suffolk, UK). Образцы измеряли на FACScalibur (BD biosciences, Heidelberg, Germany). Экспрессия Flag-меченых рекомбинантных трансмембранных слитых белков, состоящих из ЕрСАМ яванского макака и N-концевых аминокислот 1-27 эпсилон-цепи CD3 человека, игрунки, тамарина, беличьей обезьяны и свиньи, соответственно, четко определялась на трансфицированных клетках (Фиг.5).
4.2. Связывание одноцепочечных анти-CD3-антител с межвидовой специфичностью с 1-27 CD3-EpCAM
Связывание неочищенных препаратов экспрессирующихся в периплазму одноцепочечных анти-CD3-антител с межвидовой специфичностью с N-концевыми аминокислотами 1-27 эпсилон-цепей CD3 человека, игрунки, тамарина и беличьей обезьяны, соответственно, слитыми с Ер-САМ яванского макака, тестировали с помощью FACS-анализа согласно стандартным протоколам. С этой целью 2,5×105 клеток инкубировали с неочищенными препаратами экспрессирующихся в периплазму одноцепочечных анти-CD3-антител с межвидовой специфичностью (получение осуществляли, как описано выше, и согласно стандартным протоколам) и одноцепочечным мышиным антителом против CD3 человека в качестве отрицательного контроля. В качестве вторичного антитела использовали Penta-His-антитело (Qiagen GmbH, Hildesheim, Germany) в концентрации 5 мкг/мл в 50 мкл PBS с 2% FCS. Связывание антитела определяли с использованием конъюгированного с R-фикоэритрином, аффинно очищенного F(ab')2-фрагмента антитела козы против IgG мыши (специфичного к Fc-гамма-фрагменту), разбавленного 1:100 в PBS с 2% FCS (Jackson ImmunoResearch Europe Ltd., Newmarket, Suffolk, UK). Образцы измеряли на FACScalibur (BD biosciences, Heidelberg, Germany). Как показано на Фиг.6 (А-Е), наблюдали связывание одноцепочечных антител с трансфектантами, экспрессирующими рекомбинантные трансмембранные слитые белки, состоящие из 1-27 N-концевых аминокислот CD3-эпсилон человека, игрунки, тамарина или беличьей обезьяны, слитые с ЕрСАМ яванского макака. Никакого связывания одноцепочечных антител с межвидовой специфичностью со слитым белком, состоящим из 1-27 N-концевых аминокислот CD3-эпсилон свиньи, слитых с ЕрСАМ яванского макака, который использовали в качестве отрицательного контроля, не наблюдали. Была показана межвидовая специфичность одноцепочечных анти-CD3-антител в отношении многих приматов. Сигналы, полученные с использованием анти-Flag М2-антитела и одноцепочечных антител с межвидовой специфичностью, были соизмеримыми, что указывает на сильную активность связывания одноцепочечных антител с межвидовой специфичностью с N-концевыми аминокислотами 1-27 CD3-эпсилон.
5. Анализ связывания одноцепочечных анти-CD3-антител с межвидовой специфичностью посредством аланинового сканирования мышиных клеток, трансфицированных эпсилон-цепью CD3 человека и ее аланиновыми мутантами
5.1. Клонирование и экспрессия CD3-эпсилон человека, дикий тип Кодирующую последовательность эпсилон-цепи CD3 человека получали генным синтезом согласно стандартным протоколам (последовательность кДНК и аминокислотная последовательность эпсилон-цепи CD3 человека представлены в SEQ ID NO: 362 и 361). Фрагмент генного синтеза конструировали таким образом, чтобы он содержал сайт Козака для эукариотической экспрессии данной конструкции и сайты рестрикции в начале и в конце кДНК, кодирующей CD3-эпсилон человека. Введенные сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза затем клонировали через EcoRI и SalI в плазмиду, обозначенную pEF NEO, следуя стандартным протоколам. pEF NEO получена из pEF DHFR (Mack et al. Proc. Natl. Acad. Sci. USA 92 (1995) 7021-7025) в результате замены кДНК DHFR на кДНК (гена) устойчивости к неомицину с применением традиционного молекулярного клонирования. Плазмиду с подтвержденной последовательностью использовали для трансфекции мышиной Т-клеточной линии EL4 (АТСС № TIB-39), культивируемой в RPMI со стабилизирующей добавкой L-глутамина, дополненной 10% FCS, 1% пенициллина/стрептомицина, 1% HEPES (N-2-гидроксиэтил-пиперазин-N-2-этансульфоновая кислота), 1% пирувата, 1% заменимых аминокислот (все Biochrom AG Berlin, Germany) при 37°С, 95% влажности и 7% CO2. Трансфекцию осуществляли с помощью реагента для трансфекции SuperFect (Qiagen GmbH, Hilden, Germany) и 2 мкг плазмидной ДНК в соответствии с протоколом производителя. Через 24 часа клетки промывали PBS и снова культивировали в вышеупомянутой среде для культивирования клеток с 600 мкг/мл G418 для селекции (РАА Laboratories GmbH, Pasching, Austria). Через 16-20 суток после трансфекции наблюдали рост устойчивых клеток. Еще через 7-14 суток клетки тестировали в отношении экспрессии CD3-эпсилон человека с помощью FACS-анализа согласно стандартным протоколам. 2,5×105 клеток инкубировали с антителом UCHT-1 против CD3 человека (BD biosciences, Heidelberg, Germany) в концентрации 5 мкг/мл в PBS с 2% FCS. Связывание антител определяли с использованием конъюгированного с R-фикоэритрином, аффинно очищенного F(ab')2-фрагмента антитела козы против IgG мыши (специфичного к Fc-гамма-фрагменту), разбавленного 1:100 в PBS с 2% FCS (Jackson ImmunoResearch Europe Ltd., Newmarket, Suffolk, UK). Образцы измеряли на FACSCalibur (BD biosciences, Heidelberg, Germany). Экспрессия человеческой CD3-эпсипон-цепм дикого типа в трансфицированных EL4-клетках показана на Фиг.7.
5.2. Клонирование и экспрессия одноцепочечных анти-CD3-антител с межвидовой специфичностью в виде IgG1-антител
Для обеспечения улучшенных средств определения связывания одноцепочечных анти-CD3-антител с межвидовой специфичностью Н2С HLP, A2J HLP и Е2М HLP превращали в IgG1-антитела, содержащие мышиные IgG1 и константные области лямбда человека. Последовательности кДНК, кодирующие тяжелые и легкие цепи соответствующих IgG-антител, получали генным синтезом согласно стандартным протоколам. Фрагменты генного синтеза для каждой специфичности конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот (SEQ ID NO: 364 и 363), затем, в рамке считывания, кодирующую последовательность соответствующей вариабельной области тяжелой цепи или соответствующей вариабельной области легкой цепи, затем, в рамке считывания, кодирующую последовательность константной области тяжелой цепи мышиного IgG1 (SEQ ID NO: 366 и 365) или кодирующую последовательность константной области легкой цепи лямбда человека (SEQ ID NO: 368 и 367), соответственно. Сайты рестрикции вводили в начало и в конец кДНК, кодирующей данный слитый белок. Сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали для последующих процедур клонирования. Фрагменты генного синтеза клонировали через EcoRI и SalI в плазмиду, обозначенную pEF DHFR (Mack et al. Proc. Natl. Acad. Sci. USA 92 (1995) 7021-7025) для конструкций тяжелой цепи, и pEF ADA (pEF ADA описана в Raum et al., Cancer Immunol. Immunother., 50(3), (2001), 141-50) для конструкций легкой цепи, согласно стандартным протоколам. Плазмиды с подтвержденными последовательностями использовали для котрансфекции соответствующих конструкций легкой и тяжелой цепей в экспрессирующей системе FreeStyle 293 (Invitrogen GmbH, Karlsruhe, Germany) в соответствии с протоколом производителя. Через 3 суток супернатанты клеточных культур трансфектантов собирали и использовали для эксперимента по аланиновому сканированию.
5.3. Клонирование и экспрессия аланиновых мутантов CD3-эпсилон человека для аланинового сканирования
27 фрагментов кДНК, кодирующих человеческую CD3-эпсилон-цепь с заменой одного кодона в последовательности дикого типа CD3-эпсипон человека на кодон, кодирующий аланин (GCC), для каждой аминокислоты среди аминокислот 1-27 внеклеточного домена зрелой эпсилон-цепи CD3 человека, соответственно, получали генным синтезом. За исключением замененного кодона кДНК-фрагменты были идентичны вышеупомянутому фрагменту кДНК CD3 дикого типа человека. Только один кодон был заменен в каждой конструкции по сравнению с описанным выше фрагментом кДНК CD3 дикого типа человека. Сайты рестрикции EcoRI и SalI вводили в кДНК-фрагменты в положения, идентичные конструкции дикого типа. Все сканируемые по аланину конструкции клонировали в pEF NEO, и плазмиды с подтвержденной последовательностью трансфицировали в EL-4-клетки. Трансфекцию и селекцию трансфектантов осуществляли, как описано выше. В результате этого получали панель экспрессируемых конструкций, в которых первая аминокислота эпсилон-цепи CD3 человека, глутамин (Q, Gln) в положении 1, была заменена на аланин. Последней аминокислотой, замененной на аланин, был треонин (Т, Thr) в положении 27 зрелой CD3-эпсилон дикого типа человека. Для каждой аминокислоты между глутамином 1 и треонином 27, соответственно, были получены трансфектанты с заменой аминокислоты дикого типа на аланин.
5.4. Эксперимент по аланиновому сканированию
Химерные IgG-антитела, как описано в 2), и одноцепочечные антитела с межвидовой специфичностью, специфичные к CD3-эпсилон, тестировали в эксперименте по аланиновому сканированию. Связывание антител с клеточными линиями EL4, трансфицированными мутантными по аланину конструкциями CD3-эпсилон человека, как описано в 3), тестировали с помощью FACS-анализа согласно стандартным протоколам. 2,5×105 клеток соответствующих трансфектантов инкубировали с 50 мкл супернатанта клеточной культуры, содержащего химерные IgG-антитела, или с 50 мкл неочищенных препаратов экспрессирующихся в периплазму одноцепочечных антител. Для образцов, инкубированных с неочищенными препаратами экспрессирующихся в периплазму одноцепочечных антител, анти-Flag М2-антитело (Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany) использовали в качестве вторичного антитела в концентрации 5 мкг/мл в 50 мкл PBS с 2% FCS. Для образцов, инкубированных с химерными IgG-антителами, необходимости во вторичном антителе не было. Для всех образцов связывание молекул антител определяли с использованием конъюгированного с R-фикоэритрином, аффинно очищенного F(ab')2-фрагмента антитела козы против IgG мыши (специфичного к Fc-гамма-фрагменту), разбавленного 1:100 в PBS с 2% FCS (Jackson ImmunoResearch Europe Ltd., Newmarket, Suffolk, UK). Образцы измеряли на FACSCalibur (BD biosciences, Heidelberg, Germany). Определяли дифференциальное связывание химерных IgG-молекул или одноцепочечных антител с межвидовой специфичностью с клеточными линиями EL4, трансфицированными аланиновыми мутантами CD3-эпсилон человека. В качестве отрицательного контроля использовали либо изотипический контроль, либо неочищенный препарат экспрессирующегося в периплазму одноцепочечного антитела нерелевантной специфичности, соответственно. Антитело UCHT-1 использовали в качестве положительного контроля уровня экспрессии аланиновых мутантов CD3-эпсилон человека. Клеточные линии EL4, трансфицированные аланиновыми мутантами аминокислот тирозина в положении 15, валина в положении 17, изолейцина в положении 19, валина в положении 24 или лейцина в положении 26 зрелой эпсилон-цепи CD3, не оценивали из-за очень низких уровней экспрессии (данные не показаны). Связывание одноцепочечных антител с межвидовой специфичностью и одноцепочечных антител в формате химерных IgG с клеточными линиями EL4, трансфицированными аланиновыми мутантами CD3-эпсилон человека, показано на Фиг.8 (A-D) в виде относительного связывания в условных единицах со средними геометрическими величинами флуоресценции соответствующих отрицательных контролей, вычтенными из всех соответствующих средних геометрических величин флуоресценции для образцов. Для компенсации различных уровней экспрессии все величины для образцов для конкретного трансфектанта затем делили на среднюю геометрическую величину флуоресценции антитела UCHT-1 для соответствующего трансфектанта. С целью сравнения с величиной специфичности для образца дикого типа все величины соответствующих специфичностей для образцов окончательно делили на величину для образца дикого типа, при этом величина для образца дикого типа была принята за 1 условную единицу связывания.
Используемые расчеты подробно представлены следующей формулой:
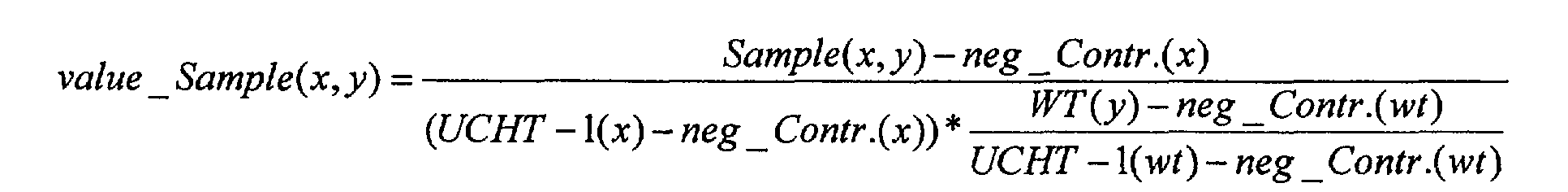
В этом уравнении value_Sample означает величину связывания в условных единицах, представляющую степень связывания специфического анти-CD3-антитела со специфическим аланиновым мутантом, как показано на Фиг.8 (A-D); Sample означает среднюю геометрическую величину флуоресценции, полученную для специфического анти-CD3-антитела, проанализированного на специфическом аланин-сканирующем трансфектанте; neg_Contr. означает среднюю геометрическую величину флуоресценции, полученную для отрицательного контроля, проанализированного на специфическом аланиновом мутанте; UCHT-1 означает среднюю геометрическую величину флуоресценции, полученную для антитела UCHT-1, проанализированного на специфическом аланиновом мутанте; WT означает среднюю геометрическую величину флуоресценции, полученную для специфического анти-CD3-антитела, проанализированного на трансфектанте дикого типа; × указывает на соответствующий трансфектант; у указывает на соответствующее анти-CD3-антитело, a wt указывает на то, что соответствующий трансфектант относится к дикому типу.
Как можно видеть из Фиг.8 (A-D), IgG-антитело A2J HLP продемонстрировало ярко выраженную потерю связывания для аминокислот: аспарагина в положении 4, треонина в положении 23 и изолейцина в положении 25 зрелой эпсилон-цепи CD3. Полную потерю связывания IgG-антитела A2J HLP наблюдали для аминокислот: глутамина в положении 1, аспартата в положении 2, глицина в положении 3 и глутамата в положении 5 зрелой эпсилон-цепи CD3. IgG-антитело Е2М HLP продемонстрировало ярко выраженную потерю связывания для аминокислот: аспарагина в положении 4, треонина в положении 23 и изолейцина в положении 25 зрелой эпсилон-цепи CD3. IgG-антитело Е2М HLP продемонстрировало полную потерю связывания аминокислот: глутамина в положении 1, аспартата в положении 2, глицина в положении 3 и глутамата в положении 5 зрелой эпсилон-цепи CD3. IgG-антитело Н2С HLP продемонстрировало промежуточную потерю связывания для аминокислоты аспарагина в положении 4 зрелой эпсилон-цепи CD3, и оно продемонстрировало полную потерю связывания для аминокислот: глутамина в положении 1, аспартата в положении 2, глицина в положении 3 и глутамата в положении 5 зрелой эпсилон-цепи CD3. Одноцепочечное антитело F12Q HLP продемонстрировало по существу полную потерю связывания для аминокислот: глутамина в положении 1, аспартата в положении 2, глицина в положении 3 зрелой эпсилон-цепи CD3 и глутамата в положении 5 зрелой эпсилон-цепи CD3.
6. Анализ связывания анти-CD3-связывающей молекулы Н2С HLP с межвидовой специфичностью с человеческой CD3-эпсилон-цепью с N-концевой His6-меткой и без нее, которую трансфицировали в мышиную Т-клеточную линию EL4
6.1. Клонирование и экспрессия человеческой CD3-эпсилон-цепи с N-концевой гексагистидиновой меткой (His6-меткой)
Фрагмент кДНК, кодирующий человеческую CD3-эпсилон-цепь с N-концевой His6-меткой, получали генным синтезом. Фрагмент генного синтеза конструировали таким образом, чтобы он содержал сначала сайт Козака для эукариотической экспрессии данной конструкции, затем, в рамке считывания, иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность His6-метки, затем, в рамке считывания, кодирующую последовательность зрелой эпсилон-цепи CD3 человека (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO: 380 и 379). Фрагмент генного синтеза конструировали также таким образом, чтобы он содержал сайты рестрикции в начале и в конце кДНК. Введенные сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза затем клонировали через EcoRI и SalI в плазмиду, обозначенную pEF-NEO (как описано выше), следуя стандартным протоколам. Плазмиду с подтвержденной последовательностью использовали для трансфекции мышиной Т-клеточной линии EL4. Трансфекцию и селекцию трансфектантов осуществляли, как описано выше. Через 34 суток клеточного культивирования трансфектанты использовали в описанном ниже анализе.
6.2. Связывание анти-CD3-связывающей молекулы Н2С HLP с межвидовой специфичностью с человеческой CD3-эпсилон-цепью с N-концевой Hise-меткой и без нее
Химерное IgG-антитело Н2С HLP со специфичностью связывания, специфичное к CD3-эпсилон, тестировали в отношении связывания с CD3-эпсилон человека с N-концевой His6-меткой и без нее. Связывание этого антитела с клеточными линиями EL4, трансфицированными His6-CD3-эпсилон человека и человеческим CD3-эпсилон дикого типа соответственно, тестировали с помощью FACS-анализа согласно стандартным протоколам. 2,5×105 клеток трансфектантов инкубировали с 50 мкл супернатанта клеточной культуры, содержащего химерное IgG-антитело или 50 мкл соответствующих контрольных антител в концентрации 5 мкг/мл в PBS с 2% FCS. В качестве отрицательного контроля использовали соответствующий изотипический контроль, а в качестве положительного контроля экспрессии конструкций использовали CD3-специфическое антитело UCHT-1, соответственно. Связывание антител определяли с использованием конъюгированного с R-фикоэритрином, аффинно очищенного F(ab')2-фрагмента антитела козы против IgG мыши (специфичного к Fc-гамма-фрагменту), разбавленного 1:100 в PBS с 2% FCS (Jackson ImmunoResearch Europe Ltd., Newmarket, Suffolk, UK). Образцы измеряли на FACSCalibur (BD biosciences, Heidelberg, Germany). По сравнению с EL-4-клеточной линией, трансфицированной человеческим CD3-эпсилон дикого типа, определяли очевидную потерю связывания химерного IgG со специфичностью связывания - Н2С HLP - с CD3-эпсилон человека с N-концевой Н1з6-меткой. Эти результаты показали, что свободный N-конец CD3-эпсилон является существенным для связывания специфической анти-CD3-связывающей молекулы Н2С HLP с межвидовой специфичностью с эпсилон-цепью CD3 человека (Фиг.9).
7. Определение константы связывания KD биспецифического одноцепочечного антитела, обладающего межвидовой специфичностью к EGFR приматов и CD3 приматов (EGFR LH×Н2С HLP), со слитым белком 1-27 CD3-Fc, измеренной методом поверхностного плазмонного резонанса, в сравнении со связыванием с CD3-экспрессирующими РВМС, измеренным с использованием клеточного сортера с активацией флуоресценции (FACS)
7.1. Измерение методом поверхностного плазмонного резонанса
Для определения аффинности связывания биспецифического одноцепочечного антитела EGFR-21-63 LH×Н2С HLP с полной межвидовой специфичностью с аминокислотами 1-27 N-конца эпсилон-цепи CD3 человека осуществляли измерение методом поверхностного плазменного резонанса с рекомбинантным слитым белком, состоящим из N-концевых аминокислот 1-27 зрелой эпсилон-цепи CD3 человека, слитых с Fc-областью человеческого IgG1 (1-27 CD3-Fc). Для этого в систему Biacore 2000® (Biacore, Uppsala, Sweden) помещали карбоксиметил-декстрановый чип Biacore CM5 (Biacore, Uppsala, Sweden). Одну проточную ячейку (flow cell) активировали раствором гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида/N-гидроксисукцинимида в соответствии со стандартными процедурами. Затем добавляли раствор слитого белка 1-27 CD3-Fc, что приводило к образованию стабильной ковалентной связи между белком и декстрановым слоем чипа Biacore. Несвязавшийся белок удаляли посредством энергичной промывки с последующим блокированием непрореагировавших оставшихся NHS-активированных карбоксигрупп путем добавления раствора этаноламина. Успешное присоединение белка подтверждалось более высоким значением сигнала, измеренного в виде единиц ответа (Response Units) по сравнению с сигналом до присоединения. Ячейку сравнения подготавливали так же, как описано, но без добавления раствора белка.
Очищенное биспецифическое антитело EGFR-21-63 LH×H2C HLP энергично диализовали против HBS-EP буфера (Biacore, Uppsala, Sweden) в ячейке для минидиализа Slide-A-Lyzer® (Pierce, Rockford-II, USA). Концентрацию белка после диализа определяли по поглощению при 280 нм, получая концентрацию 43 мкг/мл.
Раствор белка переносили в 96-луночный планшет и последовательно разбавляли буфером HBS-EP в соотношении 1:1 для 10 последующих лунок.
Измерения методом поверхностного плазменного резонанса осуществляли путем раздельного внесения образцов во все 11 лунок. Между измерениями проточную ячейку регенерировали ацетатным буфером для высвобождения связанного белка.
Сигналы связывания молекул биспецифических антител получали, вычитая сигнал ячейки сравнения из сигнала измеряемой ячейки, конъюгированной с белком 1-27 CD3-Fc. Кривые ассоциации и диссоциации измеряли в виде единиц ответа и регистрировали. Константы связывания вычисляли, используя программное обеспечение Biacore® для подгонки кривых на основе модели Ленгмюра.
Рассчитанное значение константы связывания KD для первых пяти концентраций составило 1,52×10-7 М.
7.2. Определение константы связывания CD3 в измерении с помощью FACS
Для тестирования аффинности молекул биспецифического антитела с межвидовой специфичностью в отношении прочности связывания с нативным CD3 человека осуществляли дополнительный анализ насыщающего связывания с помощью FACS. Выбранную молекулу биспецифического антитела EGFR-21-63 LH×H2C HLP использовали для установления ряда разведении с коэффициентом 1:1,5 и начальной концентрацией 63,3 мкг/мл. Каждую из молекул биспецифического антитела инкубировали в этих различных концентрациях с 1,25×105 РВМС человека в течение 1 часа при 4°С с последующими двумя стадиями промывки PBS при 4°С. Определение связавшихся молекул биспецифического антитела осуществляли с использованием Penta-His-антитела (Qiagen GmbH, Hildesheim, Germany) в концентрации 5 мкг/мл в 50 мкл PBS с 2% FCS. После инкубирования в течение 45 минут при 4°С и двух стадий промывки связывание Penta-His-антитела определяли с использованием конъюгированного с R-фикоэритрином, аффинно очищенного F(ab')2-фрагмента антитела козы против IgG мыши (специфичного к Fc-гамма-фрагменту), разбавленного 1:100 в PBS с 2% FCS (Jackson ImmunoResearch Europe Ltd., Newmarket, Suffolk, UK). Проточную цитометрию осуществляли на аппарате FACS-Canto II, для получения и анализа данных использовали программное обеспечение FACS Diva (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002). Строили график зависимости полученных средних значений интенсивности флуоресценции от концентрации молекул используемого биспецифического антитела и анализировали с применением биоматематического программного обеспечения Prism в анализе одностороннего связывания (one side binding analysis) (гипербола). С применением программного обеспечения вычисляли соответствующую величину KD, описывающую связывание лиганда (молекулы биспецифического антитела) с рецептором (CD3-положительная субфракция РВМС) в соответствии с законом действия масс. Лежащая в основе формула имеет следующий вид: Y=Bmax×X/(Kd+X), где Вmax представляет собой максимальное связывание. KD представляет собой концентрацию лиганда, необходимую для достижения полумаксимального связывания. FACS-окрашивание осуществляли в двух повторностях, величины R2 были больше 0,95.
Из определений полумаксимальное связывание для молекулы биспецифического антитела EGFR-21-63 LH×H2C HLP достигалось при концентрации 8472 нг/мл, что соответствует 154 нМ (1,54×10-7 М) при установленном значении молекулярной массы 55000 дальтон (Фиг.10).
Таким образом доказано, что аффинность EGFR-21-63 LH×H2C HLP к N-концевым аминокислотам 1-27 эпсилон-цепи CD3 человека, выделенной из ее нативного CD3-окружения, равна аффинности EGFR-21-63 LH×H2C HLP к нативному CD3 на интактных Т-клетках.
8. Получение клеток СНО, трансфицированных EGFR человека Клеточную линию, положительную в отношение EGFR человека, А431 (линия клеток эпидермоидной карциномы, CRL-1555, Американская коллекция типовых культур, Rockville, MD), использовали для получения общей РНК, которую выделяли в соответствии с инструкциями к набору (Qiagen, RNeasy Mini Kit, Hilden, Germany). Полученную РНК использовали для синтеза кДНК полимеразной цепной реакцией с обратной транскрипцией со случайными праймерами. Для клонирования полноразмерной последовательности EGFR-антигена человека использовали следующие олигонуклеотиды:
5' EGFR AG XbaI 5'-GGTCTAGAGCATGCGACCCTCCGGGACGGCCGGG-3';
3' EGFR AG SalI 5'-TTTTAAGTCGACTCATGCTCCAATAAATTCACTGCT-3'. Кодирующую последовательность амплифицировали с помощью ПЦР (денатурация при 94°С в течение 5 мин, отжиг при 58°С в течение 1 мин, удлинение при 72°С в течение 2 мин в течение первого цикла; денатурация при 94°С в течение 1 мин, отжиг при 58°С в течение 1 мин, удлинение при 72°С в течение 2 мин в течение 30 циклов; окончательное удлинение при 72°С в течение 5 мин). ПЦР-продукт затем расщепляли XbaI и SalI, лигировали в соответствующим образом расщепленный экспрессирующий вектор pEF-DHFR (Raum et al., Cancer Immunol. Immunother. 2001; 50: 141-150) и подвергали трансформации в Е. coli. Вышеупомянутые процедуры осуществляли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью (SEQ ID 370, аминокислотная последовательность SEQ ID 369) трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентраций метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
9. Получение клеток СНО, экспрессирующих внеклеточный домен EGFR яванского макака
Последовательность кДНК внеклеточного домена EGFR яванского макака получали в результате серии из двух ПЦР на кДНК из толстой кишки яванского макака (№ по каталогу С1534090-Cy-ВС; полученной от BioCat GmbH, Heidelberg, Germany), с применением следующих условий реакции: 1 цикл при 94°С в течение 3 минут, затем 35 циклов при 94°С в течение 1 минуты, при 53°С в течение 1 минуты и при 72°С в течение 2 минут, затем заключительный цикл при 72°С в течение 3 минут. Использовали следующие праймеры:
1) прямой праймер: 5'-CGCTCTGCCCGGCGAGTCGGGC-3',
обратный праймер: 5'-CCGTCTTCCTCCATCTCATAGC-3';
2) прямой праймер: 5'-ACATCCGGAGGTGACAGATCACGGCTCGTGC-3,
обратный праймер: 5'-CAGGATATCCGAACGATGTGGCGCCTTCGC-3'.
В результате проведения этих ПЦР получали два перекрывающихся фрагмента (А: 1-869, В: 848-1923), которые выделяли и секвенировали согласно стандартным протоколам, используя ПЦР-праймеры, и таким образом получали участок последовательности кДНК EGFR яванского макака размером 1923 п.о. от третьего нуклеотида в кодоне +1 зрелого белка до 21-го кодона трансмембранного домена. С целью создания конструкции для экспрессии EGFR яванского макака, фрагмент кДНК получали генным синтезом согласно стандартным протоколам (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO: 372 и 371). В этой конструкции кодирующую последовательность EGFR яванского макака от аминокислоты +2 до +641 зрелого белка EGFR включали в кодирующую последовательность EGFR человека, заменяя кодирующую последовательность из аминокислот от +2 до +641. Фрагмент генного синтеза конструировали также таким образом, чтобы он содержал сайт Козака для эукариотической экспрессии данной конструкции и сайты рестрикции в начале и в конце кДНК, кодирующей по существу внеклеточный домен EGFR яванского макака, слитый с трансмембранным и внутриклеточным доменами EGFR человека. Кроме этого, вводили консервативную мутацию в положение, соответствующее аминокислоте 627 (4-я аминокислота трансмембранного домена), заменяя валин на лейцин, для создания сайта рестрикции (SphI) с целью клонирования. Введенные сайты рестрикции, XbaI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза затем клонировали через XbaI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Mack et al. Proc. Natl. Acad. Sci. USA, 92 (1995) 7021-7025). Клон с подтвержденной последовательностью этой плазмиды использовали для трансфекции клеток CHO/dhfr-, как описано выше.
10. Создание EGFR- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
10.1. Клонирование связывающих молекул с межвидовой специфичностью
Как правило, молекулы биспецифических одноцепочечных антител, каждое из которых содержит домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD3-эпсилон человека и примата, не являющегося шимпанзе, а также домен со специфичностью связывания, демонстрирующий межвидовую специфичность к EGFR человека и примата, не являющегося шимпанзе, конструировали, как представлено в следующей ниже Таблице 1.
Вышеупомянутые конструкции, содержащие вариабельные домены легкой цепи (L) и вариабельные домены тяжелой цепи (Н) с межвидовой специфичностью к EGFR человека и яванского макака, получали генным синтезом. Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность соответствующей молекулы биспецифического одноцепочечного антитела, затем, в рамке считывания, кодирующую последовательность состоящей из 6 гистидиновых остатков метки и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие сайты рестрикции в начало и в конец данного фрагмента. Введенные сайты рестрикции использовали в последующих процедурах кпонирования. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие N- и С-концевые сайты рестрикции. Фрагмент генного синтеза клонировали через эти сайты рестрикции в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по дигидрофолатредуктазе (DHFR) клетки яичника китайского хомячка (СНО) для эукариотической экспрессии данной конструкции.
Данные конструкции трансфицировали стабильно или временно в дефектные по DHFR клетки СНО (АТСС № CRL 9096) посредством электропорации или, альтернативно, временно трансфицировали в НЕК 293 (клетки эмбриональной почки человека, АТСС номер: CRL-1573) согласно стандартным протоколам.
10.2. Экспрессия и очистка молекул биспецифических одноцепочечных антител
Молекулы биспецифических одноцепочечных антител экспрессировали в клетках яичника китайского хомячка (СНО). Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкций индуцировали, увеличивая конечные концентрации МТХ до 20 нМ включительно. После двух пассажей стационарной культуры клетки выращивали в роллерных флаконах в жидкой соевой среде HyQ PF СНО, не содержащей нуклеозидов (с 4,0 мМ L-глутамина, содержащей 0,1% Pluronic F-68; HyClone), в течение 7 суток перед сбором. Клетки выделяли центрифугированием и супернатант, содержащий экспрессированный белок, хранили при -20°С. Альтернативно, конструкции временно экспрессировали в клетках НЕК 293. Трансфекцию осуществляли с помощью реагента 293fectin (Invitrogen, №12347-019) в соответствии с протоколом производителя.
Для хроматографии использовали систему Akta® Explorer (GE Health Systems) и программное обеспечение Unicorn®. Аффинную хроматографию с иммобилизованным металлом ("IMAC") осуществляли с использованием Fractogel EMD chelate® (Merck), который нагружали ZnCb в соответствии с протоколом, предложенным производителем. Колонку уравновешивали буфером А (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl), и супернатант клеточной культуры (500 мл) наносили на колонку (10 мл) при скорости потока 3 мл/мин. Колонку промывали буфером А для удаления несвязавшегося образца. Связавшийся белок элюировали с использованием двухстадийного градиента буфера В (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl; 0,5 М имидазол) в соответствии со следующим протоколом:
стадия 1: 20% буфера В в 6 объемах колонки;
стадия 2: 100% буфера В в 6 объемах колонки.
Элюированные белковые фракции со стадии 2 объединяли для дальнейшей очистки. Все химические реактивы имели степень чистоты, подходящую для исследований, и были приобретены у Sigma (Deisenhofen) или Merck (Darmstadt).
Гель-фильтрацию осуществляли на препаративной колонке HiLoad 16/60 Superdex 200 (GE/Amersham), уравновешенной Equi-буфером (25 мМ цитрат; 200 мМ лизин; 5% глицерин; рН 7,2). Элюированные белковые образцы (скорость потока 1 мл/мин) подвергали стандартным SDS-PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия) и вестерн-блоттингу для детекции. Перед очисткой колонку калибровали для определения молекулярной массы (набор маркеров молекулярной массы, Sigma MW GF-200). Концентрацию белка определяли, используя OD при 280 нм.
Очищенный белок, биспецифическое одноцепочечное антитело, анализировали в SDS-PAGE в восстанавливающих условиях и предварительно залитых 4-12%-ных бис-Трис-гелях (Invitrogen). Приготовление и нанесение образцов осуществляли согласно протоколу, предложенному производителем. Молекулярную массу определяли, используя белковый стандарт MultiMark (Invitrogen). Гель окрашивали коллоидным Coomassie (протокол Invitrogen). Чистота выделенного белка составляла более 95%, как определено SDS-PAGE.
Биспецифическое одноцепочечное антитело имеет молекулярную массу примерно 52 кДа в нативных условиях, как определено гель-фильтрацией в PBS. Все конструкции очищали согласно данному методу.
Вестерн-блоттинг осуществляли, используя мембрану Optitran® BA-S83 в аппарате для блоттинга Invitrogen в соответствии с протоколом, предложенным производителем. Используемые антитела были направлены против Mis-метки (Penta-His, Qiagen) и антитела козы против Ig мыши, меченого щелочной фосфатазой (АР) (Sigma), a BCIP/NBT (5-бром-4-хлор-3-индолилфосфат)/нитротетразолиевый голубой) (Sigma) использовали в качестве субстрата. Определили единственную полосу при 52 кДа, что соответствовало очищенному биспецифическому одноцепочечному антителу.
11. Определение константы связывания KD биспецифических одноцепочечных антител, обладающих полной межвидовой специфичностью, со слитым белком 1-27 CD3-Fc, измеренной методом поверхностного плазменного резонанса
Для определения аффинностей связывания молекул биспецифического одноцепочечного антитела с межвидовой специфичностью к EGFR приматов и CD3 приматов с аминокислотами 1-27 N-конца зрелой эпсилон-цепи CD3 человека осуществляли измерения методом поверхностного плазменного резонанса с рекомбинантным слитым белком, состоящим из N-концевых аминокислот 1-27 эпсилон-цепи CD3 человека, слитых с Fc-областью человеческого IgG1 (1-27 CD3-Fc). Для этого в систему Biacore 2000® (Biacore, Uppsala, Sweden) устанавливали карбоксиметил-декстрановый СМ5 чип Biacore (Biacore, Uppsala, Sweden). Проточную ячейку активировали раствором гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида/N-гидроксисукцинимида в соответствии со стандартными процедурами. Затем добавляли раствор слитого белка 1-27 CD3-Fc, что приводило к образованию стабильной ковалентной связи между белком и декстрановым слоем чипа Biacore. Несвязавшийся белок удаляли посредством энергичной промывки с последующим блокированием оставшихся непрореагировавших NHS-активированных карбоксигрупп путем добавления раствора этаноламина. Успешное присоединение белка подтверждали более высоким значением сигнала, измеренного в виде единиц ответа по сравнению с сигналом до присоединения. Ячейку сравнения подготавливали так же, как описано, но без добавления раствора белка.
Концентрацию очищенных биспецифических одноцепочечных антител, приведенных ниже, корректировали до 5 мкг/мл буфером HBS-EP (Biacore, Uppsala, Sweden) и переносили в 96-луночный планшет, каждое в объеме 150 мкл.
Измерения методом поверхностного плазменного резонанса осуществляли для всех образцов и проточные ячейки регенерировали между измерениями ацетатным буфером для высвобождения связанного белка (все согласно стандартным протоколам).
Сигналы связывания биспецифических одноцепочечных антител получали, вычитая сигнал ячейки сравнения из сигнала измеряемой ячейки, конъюгированной с белком 1-27 CD3-Fc.
Кривые ассоциации и диссоциации измеряли в виде единиц ответа и регистрировали. Константы связывания вычисляли, используя программное обеспечение Biacore® для подгонки кривых на основе модели Ленгмюра. Рассчитанные значения аффинностей для тестируемых биспецифических одноцепочечных молекул с полной межвидовой специфичностью к N-концевым аминокислотам 1-27 CD3-эпсилон человека приведены в виде величин KD ниже и лежат в диапазоне от 2,54×10-6 М до 2,49×10-7 М. "LH" относится к организации вариабельных доменов в порядке VL-VH. "HL" относится к организации вариабельных доменов в порядке VH-VL. G4H, F70, A2J, E1L, Е2М, Н1Е и F6A относятся к различным CD3-связывающим молекулам с межвидовой специфичностью.
Молекула биспецифического антитела KD (W)
12. Проточно-цитометрический анализ связывания EGFR- и CD3-биспецифических антител с межвидовой специфичностью
С целью тестирования функциональности конструкций биспецифических антител с межвидовой специфичностью в отношении способности связываться с EGFR и CD3 человека и яванского макака, соответственно, осуществляли FACS-анализ. Для этого клетки СНО, трансфицированные EGFR человека, как описано в Примере 8, и CD3-положительную линию клеток HPB-ALL Т-клеточного лейкоза человека (DSMZ, Braunschweig, ACC483) использовали для тестирования связывания с антигенами человека. Способность связываться с антигенами яванского макака тестировали с использованием созданного трансфектанта с EGFR яванского макака, описанного в Примере 9, и Т-клеточной линии макака 4119 LnPx (любезно предоставленной проф. Fickenscher, Hygiene Institute, Virology, Erlangen-Nuernberg; опубликованной в Knappe A, et al., и Fickenscher H., Blood 2000, 95, 3256-61). 200000 клеток соответствующей клеточной популяции инкубировали в течение 30 мин на льду с 50 мкл очищенного белка конструкций биспецифических антител с межвидовой специфичностью (2 мкг/мл). Альтернативно, использовали супернатант клеточной культуры с временно продуцированными белками. Клетки дважды промывали в PBS и связывание конструкции определяли с использованием мышиного Penta-His-антитела (Qiagen; разбавленного 1:20 в 50 мкл PBS с 2% FCS). После промывки связавшиеся анти-His-антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. В качестве отрицательного контроля использовали свежую культуральную среду.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002).
Связывающая способность некоторых биспецифических одноцепочечных молекул, специфичных к EGFR и обладающих межвидовой специфичностью к CD3 человека и примата, не являющегося шимпанзе, была ясно определена, как показано на Фиг.11. В FACS-анализе все конструкции демонстрировали связывание с CD3 и EGFR по сравнению с культуральной средой и первым и вторым детектирующим антителом в качестве отрицательного контроля. Была продемонстрирована межвидовая специфичность биспецифического антитела к антигенам CD3 и EGFR человека и яванского макака.
13. Биологическая активность EGFR- и CD3-биспецифических одноцепочечных антител с межвидовой специфичностью
Биологическую активность созданных биспецифических одноцепочечных антител анализировали по высвобождению хрома 51 (51Cr) в анализах цитотоксичности in vitro, используя EGFR-положительные клеточные линии, описанные в Примерах 8 и 9. В качестве эффекторных клеток использовали стимулированные CD8-положительные Т-клетки человека или Т-клеточную линию макака 4119 LnPx, соответственно.
Получение стимулированных CD8+ Т-клеток осуществляли следующим образом.
На чашку Петри (диаметр 145 мм; Greiner) предварительно наносили имеющееся в продаже анти-CD3-специфическое антитело в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязавшийся белок удаляли за одну стадию промывки, используя PBS. Свежие РВМС выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. 3-5×107 РВМС добавляли в предварительно покрытую чашку Петри в 120 мл RPMI 1640/10% FCS/IL-2 (интерлейкин-2) 20 ед./мл (пролейкин, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали, промывали один раз RPMI 1640. Добавляли IL-2 до конечной концентрации 20 ед./мл и снова культивировали в течение одних суток. CD8+ цитотоксические Т-лимфоциты (CTL) выделяли посредством истощения CD4+ Т-клеток и CD56+ МК-клеток.
Клетки-мишени дважды промывали PBS и метили 11,1 МБк51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 45 минут при 37°С. После этого меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали в анализе цитотоксичности. Анализ осуществляли в 96-луночном планшете в общем объеме 250 мкл дополненной среды RPMI (как и выше) с соотношением Е:Т 10:1. Наносили 1 мкг/мл молекул биспецифического одноцепочечного антитела с межвидовой специфичностью и 20 их трехкратных разведении. Альтернативно, супернатант клеточной культуры временно продуцируемых белков последовательно разбавляли 1:2 поэтапно. Время анализа составляет 18 часов, и цитотоксичность измеряли в относительных величинах высвобожденного хрома в супернатанте, соответствующих разнице максимального лизиса (добавление Тритона-Х) и спонтанного лизиса (без эффекторных клеток). Все измерения осуществляли в четырех повторностях. Измерение активности хрома в супернатантах осуществляли с использованием гамма-счетчика Wizard 3" (Perkin Elmer Life Sciences GmbH, Koln, Germany). Анализ экспериментальных данных осуществляли с применением Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA). Сигмоидальные кривые доза-эффект обычно имели величины R2 более 0,90, как определено с использованием программного обеспечения. Величины ЕС50, рассчитанные данной программой анализа, использовали для сравнения биологической активности.
Как показано на Фиг.12 и 13, все созданные конструкции биспецифических одноцепочечных антител с межвидовой специфичностью демонстрировали цитотоксическую активность против клеток-мишеней, положительных в отношении EGFR человека, индуцированных CD8+ клетками человека, и клеток-мишеней, положительных в отношении EGFR яванского макака, индуцированных Т-клеточной линией макака 4119LnPx. Биспецифическое одноцепочечное антитело с другой целевой специфичностью использовали в качестве отрицательного контроля.
14. Клонирование и экспрессия С-концевых, трансмембранных и укороченных внеклеточных доменов MCSP человека
Кодирующую последовательность С-концевого, трансмембранного и укороченного внеклеточного домена MCSP человека (аминокислоты 1538-2322) получали генным синтезом согласно стандартным протоколам (последовательность кДНК и аминокислотная последовательность рекомбинантной конструкции для экспрессии С-концевого, трансмембранного и укороченного внеклеточного домена MCSP человека (обозначенного как D3 человека) представлены в SEQ ID NO: 374 и 373). Фрагмент генного синтеза конструировали таким образом, чтобы он содержал сначала сайт Козака для эукариотической экспрессии данной конструкции, затем кодирующую последовательность иммуноглобулинового лидерного пептида из 19 аминокислот, затем, в рамке считывания, FLAG-метку, затем, в рамке считывания, последовательность, содержащую несколько сайтов рестрикции для целей клонирования и кодирующую искусственный линкер из 9 аминокислот (SRTRSGSQL), затем, в рамке считывания, кодирующую последовательность С-концевого, трансмембранного и укороченного внеклеточного домена MCSP человека и стоп-кодон. Сайты рестрикции вводили в начало и в конец данного фрагмента ДНК. Сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент расщепляли EcoRI и SalI и клонировали в pEF-DHFR (pEF-DHFR описана в Mack et al. Proc. Natl. Acad. Sci. USA 92 (1995) 7021-7025), следуя стандартным протоколам. Плазмиду с подтвержденной последовательностью использовали для трансфекции клеток CHO/dhfr- (ATCC № CRL 9096). Клетки культивировали в среде RPMI 1640 со стабилизирующей добавкой глутамина, дополненной 10% FCS, 1% пенициллина/стрептомицина (все приобретено у Biochrom AG Berlin, Germany) и нуклеозидами из концентрированного раствора реагентов со степенью чистоты "для клеточных культур" (Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany) до конечной концентрации аденозина 10 мкг/мл, дезоксиаденозина 10 мкг/мл и тимидина 10 мкг/мл, в инкубаторе при 37°С, 95% влажности и 7% CO2. Трансфекцию осуществляли с помощью реагента для трансфекции PolyFect (Qiagen GmbH, Hilden, Germany) и 5 мкг плазмидной ДНК в соответствии с протоколом производителя. После культивирования в течение 24 часов клетки промывали один раз PBS и снова культивировали в RPMI 1640 со стабилизирующей добавкой глутамина и 1% пенициллина/стрептомицина. Таким образом, клеточная культуральная среда не содержала нуклеозидов, и поэтому селекцию осуществляли на трансфицированных клетках. Приблизительно через 14 суток после осуществления трансфекции наблюдали рост устойчивых клеток. Еще через 7-14 суток трансфектанты тестировали в отношении экспрессии конструкции с помощью FACS-анализа. 2,5×105 клеток инкубировали с 50 мкл анти-Flag-М2-антитела (Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany), разбавленного до концентрации 5 мкг/мл в PBS с 2% FCS. Связывание антитела определяли с использованием конъюгированного с R-фикоэритрином, аффинно очищенного F(ab')2-фрагмента антитела козы против IgG мыши (специфичного к Fc-гамма-фрагменту), разбавленного 1:100 в PBS с 2% FCS (ImmunoResearch Europe Ltd., Newmarket, Suffolk, UK). Образцы измеряли на FACScalibur (BD biosciences, Heidelberg, Germany).
15. Клонирование и экспрессия С-концевых, трансмембранных и укороченных внеклеточных доменов MCSP макака
Последовательность кДНК С-концевых, трансмембранных и укороченных внеклеточных доменов MCSP макака (обозначенных как D3 макака) получали в результате серии из трех ПЦР на кДНК из кожи макака (№ по каталогу С1534218-Cy-ВС; BioCat GmbH, Heidelberg, Germany) с применением следующих условий реакции: 1 цикл при 94°С в течение 3 мин, 40 циклов при 94°С в течение 0,5 мин, при 52°С в течение 0,5 мин и при 72°С в течение 1,75 мин, затем заключительный цикл при 72°С в течение 3 мин. Использовали следующие праймеры:
прямой праймер: 5'-GATCTGGTCTACACCATCGAGC-3';
обратный праймер: 5'-GGAGCTGCTGCTGGCTCAGTGAGG-3';
прямой праймер: 5'-TTCCAGCTGAGCATGTCTGATGG-3';
обратный праймер: 5'-CGATCAGCATCTGGGCCCAGG-3';
прямой праймер: 5'-GTGGAGCAGTTCACTCAGCAGGACC-3';
обратный праймер: 5'-GCCTTCACACCCAGTACTGGCC-3'.
В результате проведения этих ПЦР получали три перекрывающихся фрагмента (А: 1-1329, В: 1229-2428, С: 1782-2547), которые выделяли и секвенировали согласно стандартным протоколам, используя эти ПЦР-праймеры, и таким образом получали участок последовательности кДНК MCSP макака размером 2547 п.о. (последовательность кДНК и аминокислотная последовательность этого участка MCSP макака представлены в SEQ ID NO: 376 и 375) от 74 п.о., расположенной выше последовательности, кодирующей С-концевой домен, до 121 п.о., расположенной ниже стоп-кодона. Другую ПЦР с применением следующих условий реакции: 1 цикл при 94°С в течение 3 мин, 10 циклов при 94°С в течение 1 мин, при 52°С в течение 1 мин и при 72°С в течение 2,5 мин, заключительный цикл при 72°С в течение 3 мин, использовали для слияния ПЦР-продуктов А и В вышеупомянутых реакций. Использовали следующие праймеры:
прямой праймер: 5'-tcccgtacgagatctggatcccaattggatggcggactcgtgctgttctcacacagagg-3';
обратный праймер: 5'-agtgggtcgactcacacccagtactggccattcttaagggcaggg-3'.
Праймеры для этой ПЦР конструировали таким образом, чтобы ввести сайты рестрикции в начало и в конец фрагмента кДНК, кодирующего С-концевые, трансмембранные и укороченные внеклеточные домены MCSP макака. Введенные сайты рестрикции, Mfel на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. ПЦР-фрагмент затем клонировали через Mfel и SalI в плазмиду Bluescript, содержащую фрагмент EcoRI/Mfel вышеупомянутой плазмиды pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), путем замены С-концевых, трансмембранных и укороченных внеклеточных доменов MCSP человека. Фрагмент генного синтеза содержал кодирующие последовательности иммуноглобулинового лидерного пептида и Flag-метку, а также искусственного линкера (SRTRSGSQL), в рамке считывания, с 5'-концом фрагмента кДНК, кодирующего С-концевые, трансмембранные и укороченные внеклеточные домены MCSP макака. Этот вектор использовали для трансфекции клеток CHO/dhfr- (ATCC № CRL 9096). Клетки культивировали в RPMI 1640 со стабилизирующей добавкой глутамина, дополненной 10% FCS, 1% пенициллина/стрептомицина (все от Biochrom AG Berlin, Germany) и нуклеозидами из концентрированного раствора реагентов со степенью чистоты "для клеточных культур" (Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany) до конечной концентрации аденозина 10 мкг/мл, дезоксиаденозина 10 мкг/мл и тимидина 10 мкг/мл, в инкубаторе при 37°С, 95% влажности и 7% CO2. Трансфекцию осуществляли с помощью реагента для трансфекции PolyFect (Qiagen GmbH, Hilden, Germany) и 5 мкг плазмидной ДНК в соответствии с протоколом производителя. После культивирования в течение 24 часов клетки промывали один раз PBS и снова культивировали в RPMI 1640 со стабилизирующей добавкой глутамина и 1% пенициллина/стрептомицина. Таким образом, клеточная культуральная среда не содержала нуклеозидов, и поэтому селекцию осуществляли на трансфицированных клетках. Приблизительно через 14 суток после осуществления трансфекции наблюдали рост устойчивых клеток. Еще через 7-14 суток трансфектанты тестировали в отношении экспрессии рекомбинантной конструкции с помощью FACS-анализа. 2,5×105 клеток инкубировали с 50 мкл анти-Flag-М2-антитела (Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany), разбавленного до концентрации 5 мкг/мл в PBS с 2% FCS. Связывание антитела определяли с использованием конъюгированного с R-фикоэритрином, аффинно очищенного F(ab')2-фрагмента антитела козы против IgG мыши (специфичного к Fc-гамма-фрагменту), разбавленного 1:100 в PBS с 2% FCS (ImmunoResearch Europe Ltd., Newmarket, Suffolk, UK). Образцы измеряли на FACScalibur (BD biosciences, Heidelberg, Germany).
16. Создание и характеристика MCSP- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
Молекулы биспецифических одноцепочечных антител, каждое из которых содержит связывающий домен с межвидовой специфичностью к CD3-эпсилон человека и примата, не являющегося шимпанзе, а также связывающий домен с межвидовой специфичностью к MCSP человека и примата, не являющегося шимпанзе, конструировали, как представлено в следующей ниже Таблице 2.
Вышеупомянутые конструкции, содержащие вариабельные домены тяжелой цепи (VH) и вариабельные домены легкой цепи (VL) с межвидовой специфичностью к MCSP D3 человека и макака, и VH- и VL-домены с межвидовой специфичностью к CD3 человека и макака, получали генным синтезом. Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность соответствующей молекулы биспецифического одноцепочечного антитела, затем, в рамке считывания, кодирующую последовательность гистидин6-метки и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие N- и С-концевые сайты рестрикции. Фрагмент генного синтеза клонировали через эти сайты рестрикции в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Данные конструкции трансфицировали стабильно или временно в дефектные по DHFR клетки СНО (АТСС № CRL 9096) посредством электропорации или, альтернативно, временно трансфицировали в НЕК 293 (клетки эмбриональной почки человека, АТСС номер: CRL-1573) согласно стандартным протоколам.
Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкций индуцировали путем добавления увеличивающихся концентраций метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно. После двух пассажей стационарной культуры клетки выращивали в роллерных флаконах в жидкой соевой среде HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone) в течение 7 суток перед сбором. Клетки выделяли центрифугированием и супернатант, содержащий экспрессированный белок, хранили при -20°С.
Для хроматографии использовали систему Akta® Explorer (GE Health Systems) и программное обеспечение Unicorn®. Аффинную хроматографию с иммобилизованным металлом ("IMAC") осуществляли с использованием Fractogel EMD chelate® (Merck), который нагружали ZnCl2 в соответствии с протоколом, предложенным производителем. Колонку уравновешивали буфером А (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl), и супернатант клеточной культуры (500 мл) наносили на колонку (10 мл) при скорости потока 3 мл/мин. Колонку промывали буфером А для удаления несвязавшегося образца. Связавшийся белок элюировали с использованием двухстадийного градиента буфера В (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl; 0,5 М имидазол) в соответствии со следующим протоколом:
стадия 1: 20% буфера В в 6 объемах колонки;
стадия 2: 100% буфера В в 6 объемах колонки.
Элюированные белковые фракции со стадии 2 объединяли для дальнейшей очистки. Все химические реактивы имели степень чистоты, подходящую для исследований, и были приобретены у Sigma (Deisenhofen) или Merck (Darmstadt).
Гель-фильтрацию осуществляли на препаративной колонке HiLoad 16/60 Superdex 200 (GE/Amersham), уравновешенной Equi-буфером (25 мМ цитрат; 200 мМ лизин; 5% глицерин; рН 7,2). Элюированные белковые образцы (скорость потока 1 мл/мин) подвергали стандартным SDS-PAGE и вестерн-блоттингу для детекции. Перед очисткой колонку калибровали для определения молекулярной массы (набор маркеров молекулярной массы, Sigma MW GF-200). Концентрацию белка определяли, используя OD при 280 нм.
Очищенный белок, биспецифическое одноцепочечное антитело, анализировали с использованием SDS-PAGE в восстанавливающих условиях и предварительно залитых 4-12%-ных гелей в бис-Трис-буфере (Invitrogen). Приготовление и нанесение образцов осуществляли согласно протоколу, предложенному производителем. Молекулярную массу определяли, используя белковый стандарт MultiMark (Invitrogen). Гель окрашивали коллоидным Coomassie (протокол Invitrogen). Чистота выделенного белка составляла более 95%, как определено SDS-PAGE.
Биспецифическое одноцепочечное антитело имеет молекулярную массу примерно 52 кДа в нативных условиях, как определено гель-фильтрацией в забуференном фосфатом физиологическом растворе (PBS). Все конструкции очищали согласно данному методу.
Вестерн-блоттинг осуществляли, используя мембрану Optitran® BA-S83 в аппарате для блоттинга Invitrogen в соответствии с протоколом, предложенным производителем. Для детекции белка биспецифического одноцепочечного антитела использовали антитело против His-метки (Penta-His, Qiagen). Антитело козы против Ig мыши, меченое щелочной фосфатазой (АР) (Sigma), использовали в качестве вторичного антитела, a BCIP/NBT (Sigma) в качестве субстрата. Определили единственную полосу при 52 кДа, что соответствовало очищенному биспецифическому одноцепочечному антителу.
Альтернативно, конструкции временно экспрессировали в дефектных по DHFR клетках СНО. Кратко, 4×105 клеток на одну конструкцию культивировали в 3 мл полной среды RPMI 1640 со стабилизирующей добавкой глутамина, дополненной 10% фетальной сыворотки теленка, 1% пенициллина/стрептомицина и нуклеозидами из концентрированного раствора реагентов со степенью чистоты "для клеточных культур" (Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany) до конечной концентрации аденозина 10 мкг/мл, дезоксиаденозина 10 мкг/мл и тимидина 10 мкг/мл, в инкубаторе при 37°С, 95% влажности и 7% СО3 за одни сутки до проведения трансфекции. Трансфекцию осуществляли с помощью реагента для трансфекции Fugene 6 (Roche, №11815091001) в соответствии с протоколом производителя. 94 мкл среды OptiMEM (Invitrogen) и 6 мкл Fugene 6 смешивают и инкубируют в течение 5 минут при комнатной температуре. После этого добавляли 1,5 мкг ДНК на одну конструкцию, перемешивали и инкубировали в течение 15 минут при комнатной температуре. При этом дефектные по DHFR клетки СНО промывали 1×PBS и ресуспендировали в 1,5 мл полной среды RPMI 1640. Смесь для трансфекции разбавляли 600 мкл полной среды RPMI 1640, добавляли к клеткам и инкубировали в течение ночи при 37°С, 95% влажности и 7% СО2. Через сутки после проведения трансфекции инкубируемый объем для каждого подхода увеличивали до 5 мл путем добавления полной среды RPMI 1640. Супернатант собирали через 3 суток инкубации.
17. Проточно-цитометрический анализ связывания MCSP- и CD3-биспецифических антител с межвидовой специфичностью
С целью тестирования функциональности конструкций биспецифических антител с межвидовой специфичностью в отношении способности связываться с MCSP D3 и CD3 человека и макака, соответственно, осуществляли FACS-анализ. Для этого клетки СНО, трансфицированные MCSP D3 человека (как описано в Примере 14) и CD3-положительную линию клеток HPB-ALL Т-клеточного лейкоза человека (DSMZ, Braunschweig, ACC483) использовали для тестирования связывания с антигенами человека. Способность связываться с антигенами макака тестировали с использованием созданного трансфектанта с MCSP D3 макака (описанного в Примере 15) и Т-клеточной линии макака 4119 LnPx (любезно предоставленной проф. Fickenscher, Hygiene Institute, Virology, Erlangen-Nuernberg; опубликованной в Knappe A, et al., и Fickenscher H., Blood 2000, 95, 3256-61). 200000 клеток соответствующей клеточной популяции инкубировали в течение 30 мин на льду с 50 мкл очищенного белка конструкций биспецифических антител с межвидовой специфичностью (2 мкг/мл) или с супернатантом клеточной культуры трансфицированных клеток, экспрессирующих эти конструкции биспецифических антител с межвидовой специфичностью. Клетки дважды промывали в PBS с 2% FCS, и связывание данной конструкции определяли с использованием мышиного анти-His-антитела (Penta-His-антитело; Qiagen; разбавленное 1:20 в 50 мкл PBS с 2% FCS). После промывки связавшиеся анти-his-антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. В качестве отрицательного контроля для связывания с Т-клеточными линиями использовали супернатант нетрансфицированных клеток СНО. Одноцепочечную конструкцию с нерелевантной целевой специфичностью использовали в качестве отрицательного контроля связывания с MCSP-D3-трансфицированными клетками СНО.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002).
Биспецифическое связывание одноцепочечных молекул, приведенных выше, которые демонстрируют межвидовую специфичность к MCSP D3 и межвидовую специфичность к CD3 человека и макака, четко определялось, как показано на Фиг.14, 15, 16 и 58. В FACS-анализе все конструкции демонстрировали связывание с CD3 и MCSP D3 при сравнении с соответствующими отрицательными контролями. Была продемонстрирована межвидовая специфичность биспецифических антител к антигенам CD3 и MCSP D3 человека и макака.
18. Биологическая активность MCSP- и CD3-биспецифических одноцепочечных антител с межвидовой специфичностью
Биологическую активность созданных биспецифических одноцепочечных антител анализировали по высвобождению хрома 51 (51Cr) в анализах цитотоксичности in vitro, используя MCSP D3-положительные клеточные линии, описанные в Примерах 14 и 15. В качестве эффекторных клеток использовали стимулированные CD4/CD56-истощенные РВМС человека, стимулированные РВМС человека или Т-клеточную линию макака 4119 LnPx, как показано в соответствующих графических материалах.
Получение стимулированных CD4/CD56-истощенных РВМС осуществляли следующим образом.
На чашку Петри (диаметр 145 мм; Greiner bio-one GmbH, Kremsmünster) наносили имеющееся в продаже анти-CD3-специфическое антитело (например, ОКТ3, Othoclone) в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязавшийся белок удаляли за одну стадию промывки, используя PBS. Свежие РВМС выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. 3-5×107 РВМС добавляли в предварительно покрытую чашку Петри в 120 мл RPMI 1640 со стабилизирующей добавкой глутамин/10% FCS/IL-2 20 ед./мл (пролейкин, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали и промывали один раз RPMI 1640. Добавляли IL-2 до конечной концентрации 20 ед./мл, и клетки снова культивировали в течение одних суток в той же среде для культивирования клеток, как упомянуто выше. Посредством истощения CD4+ Т-клеток и CD56+ МК-клеток согласно стандартным протоколам осуществляли обогащение CD8+ цитотоксических Т-лимфоцитов (CTL).
Клетки-мишени дважды промывали PBS и метили 11,1 МБк51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 45 минут при 37°С. После этого меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали в анализе цитотоксичности. Анализ осуществляли в 96-луночном планшете в общем объеме 250 мкл дополненной среды RPMI (как и выше) с соотношением Е:Т 10:1. Наносили 1 мкг/мл молекул биспецифического одноцепочечного антитела с межвидовой специфичностью и 20 их трехкратных разведении. Если использовали супернатант, содержащий молекулы биспецифических одноцепочечных антител с межвидовой специфичностью, то наносили 21 его двукратное разведение и 20 его трехкратных разведении в анализе цитотоксичности соответственно для макака и человека. Время анализа составляло 18 часов, и цитотоксичность измеряли в относительных величинах высвобожденного хрома в супернатанте, соответствующих разнице между максимальным лизисом (добавление Тритона-Х) и спонтанным лизисом (без эффекторных клеток). Все измерения осуществляли в четырех повторностях. Измерение радиоактивности хрома в супернатантах осуществляли с использованием гамма-счетчика Wizard 3" (Perkin Elmer Life Sciences GmbH, Koln, Germany). Анализ экспериментальных данных осуществляли с применением Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA). Сигмоидальные кривые доза-эффект обычно имеют величины R2 выше 0,90, как определено с использованием этого программного обеспечения. Величины EC50, рассчитанные с помощью данной программы анализа, использовали для сравнения биологической активности.
Как показано на Фиг.17-21 и 59, все созданные конструкции биспецифических одноцепочечных антител с межвидовой специфичностью демонстрируют цитотоксическую активность против клеток-мишеней, положительных в отношении MCSP D3 человека, индуцированных стимулированными CD4/CD56-истощенными РВМС человека или стимулированными РВМС человека, и против клеток-мишеней, положительных в отношении MCSP D3 макака, индуцированных Т-клеточной линией макака 4119 LnPx.
19. Стабильность в плазме MCSP- и CD3-биспецифических одноцепочечных антител с межвидовой специфичностью
Стабильность созданных биспецифических одноцепочечных антител в плазме человека анализировали путем инкубации биспецифических одноцепочечных антител в 50%-ной плазме человека при 37°С и 4°С в течение 24 часов и последующего тестирования биологической активности. Биологическую активность исследовали в анализе цитотоксичности in vitro по высвобождению хрома 51 (51Cr), используя MCSP-положительную линию клеток СНО (экспрессирующих MCSP, клонированный в соответствии с Примером 14 или 15) в качестве целевых, а стимулированные CD8-положительные Т-клетки человека в качестве эффекторных клеток.
Величины ЕС50, рассчитанные с помощью программы анализа, которая описана выше, используют для сравнения биологической активности биспецифических одноцепочечных антител, инкубируемых с 50%-ной плазмой человека в течение 24 часов при 37°С и 4°С, соответственно, с биспецифическими одноцепочечными антителами без добавления плазмы или смешанными с таким же количеством плазмы непосредственно перед анализом.
Как показано на Фиг.22 и в Таблице 3, биологическая активность биспецифических антител G4 H-L×I2C H-L, G4 H-L×H2C H-L и G4 H-L×F12Q H-L была незначительно снижена по сравнению с контролями без добавления плазмы или с добавлением плазмы непосредственно перед тестированием биологической активности.
20. Перераспределение циркулирующих Т-клеток в отсутствие циркулирующих клеток-мишеней, инициированное первой экспозицией с CD3-связывающими молекулами, направленными на традиционные, то есть зависимые от окружения эпитопы CD3, представляет собой главный фактор риска неблагоприятных событий, связанных с началом лечения
Перераспределение Т-клеток у пациентов с В-клеточной неходжкинской лимфомой (B-NHL) после начала лечения традиционными CD3-связывающими молекулами
Традиционные СD19×CD3-связывающие молекулы представляют собой CD3-связывающую молекулу формата биспецифических тандемных scFv (Loffler (2000, Blood, Volume 95, Number 6) или WO 99/54440). Она состоит из двух разных связывающих участков, направленных на (1) CD19 на поверхности нормальных и злокачественных В-клеток человека, и (2) CD3 на Т-клетках человека. В результате перекрестного связывания CD3 на Т-клетках с CD19 на В-клетках эта конструкция инициирует перенаправленный лизис нормальных и злокачественных В-клеток посредством цитотоксической активности Т-клеток. CD3-эпитоп, распознаваемый такой традиционной CD3-связывающей молекулой, локализован на эпсилон-цепи CD3, где он принимает надлежащую конформацию только при погружении в остальную часть эпсилон-цепи и удерживании в правильном положении посредством гетеродимеризации эпсилон-цепи либо с гамма-, либо с дельта-цепью CD3. Взаимодействие этого сильно зависимого от окружения эпитопа с традиционной CD3-связывающей молекулой (см., например Loffler (2000, Blood, Volume 95, Number 6) или WO 99/54440), даже когда оно осуществляется просто моновалентным образом и без какого-либо перекрестного связывания, может индуцировать аллостерическое изменение конформации CD3, приводящее к экспонированию скрытого в других случаях, обогащенного пролином участка в цитоплазматическом домене CD3-эпсилон. Будучи экспонированным, обогащенный пролином участок может стимулировать молекулу сигнальной трансдукции Nck2, которая способна запускать дальнейшие внутримолекулярные сигналы. Несмотря на то, что этого недостаточно для полной Т-клеточной активации, которая непременно требует перекрестного связывания нескольких молекул CD3 на поверхности Т-клетки, например, посредством перекрестного связывания нескольких анти-CD3 молекул, связанных с несколькими молекулами CD3 на Т-клетке с несколькими молекулами CD19 на поверхности В-клетки, простое моновалентное взаимодействие традиционных CD3-связывающих молекул с зависимым от окружения эпитопом на CD3-эпсилон все же не остается инертным в отношении Т-клеток в контексте передачи сигнала. Без связи с теорией полагают, что традиционные моновалентные CD3-связывающие молекулы (известные в данной области) могут индуцировать некоторые Т-клеточные реакции при инфузии их людям даже в тех случаях, когда циркулирующих клеток-мишеней для перекрестного связывания с CD3 нет. Важной Т-клеточной реакцией на внутривенную инфузию традиционной моновалентной CD19×CD3-связывающей молекулы B-NHL-пациентам, по существу не имеющим циркулирующих CD19-положительных В-клеток, является перераспределение Т-клеток после начала лечения. Обнаружено, что в фазе I клинического испытания эта Т-клеточная реакция имеет место во время начальной фазы внутривенной инфузии CD19×CD3-связывающих молекул у всех индивидуумов без циркулирующих CD19-положительных целевых В-клеток, по существу независимо от дозы CD19×CD3-связывающих молекул (Фиг.23). Однако обнаружено, что резкие увеличения экспозиции с CD19×CD3-связывающими молекулами инициировали фактически такую же реакцию перераспределения Т-клеток у этих пациентов, что и первоначальная экспозиция Т-клеток с CD19×CD3-связывающими молекулами в начале лечения (Фиг.24А), и даже постепенное увеличение экспозиции CD19×CD3-связывающих молекул по-прежнему может оказывать эффекты на перераспределение циркулирующих Т-клеток (Фиг.25). Кроме того, обнаружено, что эта по существу не зависящая от дозы Т-клеточная реакция перераспределения в отсутствие циркулирующих клеток-мишеней, инициированная традиционными CD3-связывающими молекулами, подобными CD19×CD3-связывающей молекуле (например, описанной в WO 99/54440), у 100% подвергнутых лечению индивидуумов, является основным фактором риска неблагоприятных событий, связанных с началом лечения.
В соответствии с протоколом исследования для фазы I открытого многоцентрового испытания на пациентах (interpatient) с возрастанием дозы были набраны пациенты с рецидивирующей гистологически подтвержденной медленно растущей В-клеточной неходжкинской лимфомой (B-NHL), включая лимфому из клеток мантийной зоны. Протокол исследований был утвержден независимыми комиссиями по этике всех участвующих центров и послан для уведомления компетентным контролирующим органам.
Для включения в данное исследование необходимо было иметь поддающееся измерению заболевание (по меньшей мере с одним очагом не менее 1,5 см), которое документально подтверждено с помощью СТ-сканирования (компьютерная томография). Пациенты получали традиционную CD19×CD3-связывающую молекулу посредством непрерывной внутривенной инфузии с использованием портативной насосной минисистемы в течение четырех недель при постоянной скорости потока (т.е. уровне дозы). Пациентов госпитализировали в течение первых двух недель лечения, после чего их выписывали из больницы, и они продолжали лечение дома. Пациентам без видимого прогрессирования заболевания после четырех недель предлагали продолжить лечение в течение следующих четырех недель. До этого момента тестировали шесть разных уровней доз без достижения максимально переносимой дозы (MTD): 0,5; 1,5; 5; 15; 30 и 60 мкг/м2/24 ч. Каждая группа состояла из трех пациентов, если не наблюдали никаких неблагоприятных событий, определяемых согласно протоколу исследований как DLT (дозолимитирующая токсичность). Если отмечали один случай DLT среди первых трех пациентов, то группу расширяли до шести пациентов, которым - при отсутствии второго случая DLT - разрешали дальше увеличивать дозу. Соответственно, уровни доз без DLT в группах из 3 пациентов или с одним случаем DLT в группах из 6 пациентов рассматривались как безопасные. Используемое в исследовании лечение прекращали у всех пациентов, у которых развилась DLT. Для доз 15 и 30 мкг/м2/24 ч в течение первых 24 ч исследовали различные режимы начала лечения в нескольких дополнительных группах: (1) пошаговое увеличение после 5 мкг/м2/24 ч в течение первых 24 ч до поддерживающей дозы 15 мкг/м2/24 ч (группа пациентов 15-step), (2) плавное непрерывное линейное увеличение (ramp) скорости потока фактически от нуля до 15 или 30 мкг/м2/24 ч (группы пациентов 15-ramp и 30-ramp) и (3) начало (лечения) посредством использования поддерживающей дозы с самого начала (группы пациентов 15-flat, 30-flat и 60-flat). Все группы пациентов с уровнем доз 0,5; 1,5 и 5 мкг/м2/24 ч начинали (лечение) с поддерживающей дозы с самого начала (т.е. flat-инициация (инициация постоянной дозой)).
Изменение во времени абсолютного количества В- и Т-клеток в периферической крови определяли с использованием четырехцветного FACS-анализа следующим образом.
Сбор образцов крови и рутинный анализ
У пациентов групп 15-ramp, 15-flat, 30-ramp, 30-flat и 60-flat брали образцы крови (6 мл) до и через 0,75, 2, 6, 12, 24, 30, 48 часов после начала инфузии CD19×CD3-связывающих молекул (как описано в WO 99/54440), а также на 8-е, 15-е, 17-е, 22-е, 24-е, 29-е, 36-е, 43-и, 50-е, 57-е сутки лечения и через 4 недели после окончания инфузии традиционных CD19×CD3-связывающих молекул, используя EDTA(этилендиаминтетрауксусная кислота)-содержащие пробирки Vacutainer™ (Becton Dickinson), которые перевозили для анализа при 4°С. У пациентов группы 15-step брали образцы крови (6 мл) до и через 6, 24, 30, 48 часов после начала инфузии CD19×CD3-связывающих молекул, а также на 8-е, 15-е, 22-е, 29-е, 36-е, 43-и, 50-е, 57-е сутки лечения и через 4 недели после окончания инфузии традиционных CD19×CD3-связывающих молекул. Для уровней доз 0,5; 1,5 и 5 мкг/м2/24 ч брали образцы крови (6 мл) до и через 6, 24, 48 часов после начала инфузии CD19×CD3-связывающих молекул, а также на 8-е, 15-е, 22-е, 29-е, 36-е, 43-и, 50-е, 57-е сутки лечения и через 4 недели после окончания инфузии традиционных CD19×CD3-связывающих молекул. В некоторых случаях по рабочим причинам имели место небольшие вариации этих временных точек. FACS-анализ субпопуляций лимфоцитов осуществляли в интервале 24-48 ч после отбора образцов крови. Абсолютное количество субпопуляций лейкоцитов в образцах крови определяли с помощью дифференциального анализа крови на CoulterCounter™ (Coulter).
Выделение РВМС из образцов крови
Выделение РВМС (мононуклеарных клеток периферической крови) осуществляли в соответствии с адаптированным протоколом выделения в градиенте Ficoll™. Кровь переносили при комнатной температуре в 10 мл пробирки Leucosep™ (Greiner), предварительно заполненные 3 мл раствора Biocoll™ (Biochrom). Центрифугирование осуществляли в откидном роторе в течение 15 мин при 1700×g и 22°С без торможения. РВМС сверху слоя Biocoll™ отбирали, промывали один раз буфером для FACS (PBS/2% FBS [фетальная сыворотка теленка; Biochrom]), центрифугировали и ресуспендировали в буфере для FACS. Центрифугирование во время всех стадий промывки осуществляли в откидном роторе в течение 4 мин при 800×g и 4°С. При необходимости, лизис эритроцитов осуществляли посредством инкубирования выделенных РВМС в 3 мл буфера для лизиса эритроцитов (8,29 г NH4Cl; 1,00 г КНСО3; 0,037 г EDTA; до 1,0 л H2Obidesi (дважды дистиллированная), рН 7,5) в течение 5 мин при комнатной температуре с последующей стадией промывки в буфере для FACS.
Окрашивание РВМС мечеными флуоресцентной меткой антителами против молекул клеточной поверхности
Моноклональные антитела получали от Invitrogen1№ по каталогу MHCD1301,2№ по каталогу MHCD1401), Dako (5№ по каталогу С7224) или Becton Dickinson (3№ по каталогу 555516,4№ по каталогу 345766) и использовали в соответствии с рекомендациями производителей. 5×105-1×106 клеток окрашивали, используя следующую комбинацию антител: анти-CD131 / анти-CD142 (FITC (флуоресцеинизотиоцианат))×анти-CD563 (РЕ (фикоэритрин))×анти-CD34 (PerCP (перидининхлорофилл))×анти-CD195 (АРС (аллофикоцианин)). Клетки осаждали в 96-луночных мультититрационных планшетах (multititer plates) с V-образными лунками (Greiner) и супернатант удаляли. Клеточные осадки ресуспендировали в общем объеме 100 мкл, содержащем специфические антитела, разбавленные в буфере для FACS. Инкубацию осуществляли в темноте в течение 30 мин при 4°С. После этого образцы дважды промывали буфером для FACS и клеточные осадки ресуспендировали в буфере для FACS для анализа методом проточной цитометрии.
Проточно-цитометрическое определение окрашенных лимфоцитов с помощью FACS
Сбор данных осуществляли с помощью 4-цветного FACSCalibur™ BD (Becton Dickinson). Для каждого измерения брали 1×104 клеток определенных субпопуляций лимфоцитов. Чтобы получить процентное содержание субпопуляций лимфоцитов и провести классификацию интенсивностей экспрессии молекул клеточной поверхности, осуществляли статистический анализ с использованием программы CellQuest Pro™ (Becton Dickinson). Затем процентные содержания отдельных субпопуляций лимфоцитов относительно общих лимфоцитов (т.е. В- плюс Т- плюс NK-клетки, за исключением миелоидных клеток с CD13/14-окрашиванием) по данным FACS коррелировали с количеством лимфоцитов, полученным из дифференциального анализа крови, для подсчета абсолютных количеств Т-клеток (CD3+, CD56-, CD13/14-) и В-клеток (CD19+, CD13/14-).
Перераспределение Т-клеток во время начальной фазы лечения традиционной CD19×CD3-связывающей молекулой (например, как описано в WO 99/54440) у всех пациентов, которые по существу не имели никаких циркулирующих CD19-положительных В-клеток в начале лечения, показано на Фиг.23. Для сравнения на Фиг.26 показан репрезентативный пример перераспределения Т-клеток во время начальной фазы лечения CD19×CD3-связывающей молекулой у пациента со значительным количеством циркулирующих CD19-положительных В-клеток.
В обоих случаях (т.е. когда по существу нет или когда много циркулирующих В-клеток) количества циркулирующих Т-клеток быстро уменьшаются после начала лечения. Однако в отсутствие циркулирующих В-клеток Т-клетки имеют тенденцию очень рано возвращаться в циркулирующую кровь, в то время как возвращение Т-клеток в циркулирующую кровь тех пациентов, у которых содержалось значительное количество циркулирующих В-клеток в начале лечения, обычно задерживается до тех пор, пока эти циркулирующие В-клетки не будут истощены. Таким образом, картины перераспределения Т-клеток главным образом различаются по кинетике возвращения Т-клеток в циркулирующую кровь.
Оценку эффективности, основанную на СТ-сканировании, осуществляли с использованием сравнительной радиологии центральной нервной системы (central reference radiology) через 4 недели лечения, а для пациентов, дополнительно получающих лечение в течение 4 недель, также через 8 недель лечения, кроме того, во всех случаях, через четыре недели после окончания лечения. Исчезновение и/или нормализацию размера всех известных поражений (включая увеличенную селезенку), а также очищение костного мозга от лимфомных клеток в случаях инфильтрации костного мозга принимали за полный ответ (CR). Уменьшение по меньшей мере на 50% от исходного уровня суммы продуктов двух наибольших диаметров (SPD) каждого заранее определенного целевого поражения принимали за частичный ответ (PR); уменьшение по меньшей мере на 25% рассматривали как минимальный ответ (MR). Прогрессирующее заболевание (PD) определяли как не менее чем 50%-ное увеличение SPD от исходного уровня. Отклонения SPD от исходного уровня в диапазоне от +50% до -25% рассматривали как стабильное заболевание (SD).
Демографические данные пациентов, полученные дозы и клинический исход для 34 пациентов суммированы в Таблице 4. Клиническая противоопухолевая активность CD19×CD3-связывающей молекулы явно демонстрировала дозозависимый характер: стойкое истощение циркулирующих CD19-положительных В(лимфомных)-клеток в периферической крови наблюдали, начиная с 5 мкг/м2/24 ч. При 15 мкг/м2/24 ч и 30 мкг/м2/24 ч были зарегистрированы первые объективные клинические ответы (PR и CR), а также случаи частичной и полной элиминации клеток В-лимфомы из инфильтрованного костного мозга. И наконец, при 60 мкг/м2/24 ч уровень ответа повышался до 100% (PR и CR) и очистка костного мозга от клеток В-лимфомы была полной во всех поддающихся оценке случаях.
CD19×CD3-связывающая молекула хорошо переносилась большинством пациентов. Наиболее часто встречающиеся неблагоприятные события со степенями тяжести 1-4 у 34 пациентов, независимо от причины, суммированы в Таблице 5. Неблагоприятные события, связанные с CD19×CD3-связывающей молекулой, обычно были временными и полностью обратимыми. В частности, были 2 пациента (пациенты №19 и №24 в Таблице 4) по существу без циркулирующих CD19-положительных В-клеток, лечение которых было прекращено раньше из-за неблагоприятных в отношении ЦНС событий (основные симптомы: спутанность сознания и дезориентация), связанных с повторным перераспределением Т-клеток во время начальной фазы инфузии CD19×CD3-связывающей молекулы.
Один из этих пациентов (№19) находился в группе 15-step.Он получал CD19×CD3-связывающую молекулу в дозе 5 мкг/м2/24 ч в течение первых 24 ч с последующим резким увеличением до поддерживающей дозы 15 мкг/м2/24 ч. Соответствующая картина перераспределения Т-клеток показывает, что количество циркулирующих Т-клеток быстро уменьшалось на момент начала инфузии при 5 мкг/м2/24 ч с последующим ранним повторным появлением Т-клеток в циркулирующей крови по существу без циркулирующих CD19-положительных В-клеток. Как следствие, количество периферических Т-клеток полностью восстанавливалось, когда дозу CD19×CD3-связывающей молекулы увеличивали через 24 ч с 5 до 15 мкг/м2/24 ч. Следовательно дозовый шаг (dose step) мог инициировать второй эпизод перераспределения Т-клеток, как показано на Фиг.24А. Это повторное перераспределение Т-клеток было связано с побочными эффектами в отношении ЦНС (основные симптомы: спутанность сознания и дезориентация) у этого пациента, что явилось причиной прекращения инфузии. Взаимосвязь между повторным перераспределением Т-клеток и такими неблагоприятными в отношении ЦНС событиями также наблюдали на предварительной фазе I клинических испытаний у B-NHL-пациентов, получавших CD19×CD3-связывающую молекулу (например, как описано в WO 99/54440) в виде повторной болюсной инфузии в течение 2-4 часов каждая, после чего обычно следовал 2-х суточный интервал без лечения (Фиг.24В). Каждая единичная болюсная инфузия инициировала один эпизод перераспределения Т-клеток, заключающийся в быстром уменьшении количества циркулирующих Т-клеток и в восстановлении количества Т-клеток перед следующей болюсной инфузией. В целом, неблагоприятные в отношении ЦНС события, связанные с повторным перераспределением Т-клеток, наблюдали у 5 из 21 пациента. На Фиг.24В показан репрезентативный пример одного пациента, участвовавшего в клинических испытаниях с применением болюсной инфузии, у которого развились ЦНС-симптомы после третьего эпизода перераспределения Т-клеток. Обычно у пациентов с неблагоприятными в отношении ЦНС событиями в клинических испытаниях с применением болюсной инфузии также наблюдается низкие количества циркулирующих В-клеток.
Второй пациент (№24) из клинического испытания с применением непрерывной инфузии, лечение которого было прекращено раньше из-за неблагоприятных в отношении ЦНС событий (основные симптомы: спутанность сознания и дезориентация), имеющих отношение к повторному перераспределению Т-клеток во время начальной фазы инфузии CD19×CD3-связывающей молекулы, находился в группе 15-flat. По ошибке этот пациент получал инфузию CD19×CD3-связывающей молекулы без добавления HSA, который необходим для стабилизации лекарственного средства. Результирующий неравномерный поток лекарственного средства инициировал повторяющиеся эпизоды перераспределения Т-клеток вместо только одного (Фиг.27А) с последующим заключением о необходимости прекращения инфузии из-за развития ЦНС-симптомов. Однако когда этому же пациенту снова начинали правильно вводить раствор CD19×CD3-связывающей молекулы, содержащий дополнительно HSA для стабилизации лекарственного средства (например, как описано в WO 99/54440), то не наблюдали никакого повторного перераспределения Т-клеток и также развития каких-либо ЦНС-симптомов у пациента (Фиг.27В). Поскольку этот пациент также не имел по существу никаких циркулирующих В-клеток, то циркулирующие Т-клетки могли реагировать с быстрой кинетикой перераспределения даже при едва различимых изменениях в воздействии лекарственного средства, как наблюдали. Неблагоприятные в отношении ЦНС события, связанные с перераспределением Т-клеток у пациентов, не имеющих по существу никаких циркулирующих клеток-мишеней, могут быть объяснены временным увеличением адгезивности Т-клеток к эндотелиальным клеткам с последующей сильной одновременной адгезией циркулирующих Т-клеток к стенкам кровеносного сосуда с последующим уменьшением количества Т-клеток в циркулирующей крови, как наблюдали. Массовое одновременное прикрепление Т-клеток к стенкам кровеносных сосудов может вызывать увеличение проницаемости эндотелия и активацию эндотелиальных клеток. Следствием увеличенной проницаемости эндотелия является перенос жидкости из внутрисосудистого компартмента в интерстициальные тканевые компартменты, включая интерстиций ЦНС. Активация эндотелиальных клеток путем прикрепления Т-клеток может оказывать прокоагуляционные эффекты (Monaco et al. J. Leukoc. Biol. 71 (2002) 659-668) с возможными нарушениями в кровотоке (включая церебральный кровоток) в особенности в отношении капиллярной микроциркуляции. Таким образом, неблагоприятные в отношении ЦНС события, связанные с перераспределением Т-клеток у пациентов, по существу не имеющих циркулирующих клеток-мишеней, могут быть следствием капиллярной утечки и/или нарушений в капиллярной микроциркуляции вследствие адгезии Т-клеток к эндотелиальным клеткам. Эндотелиальный стресс, вызванный одним эпизодом перераспределения Т-клеток, переносится большинством пациентов, тогда как усиленный эндотелиальный стресс, вызванный повторяющимся перераспределением Т-клеток, часто является причиной неблагоприятных в отношении ЦНС событий. Более чем один эпизод перераспределения Т-клеток может иметь меньший риск только у пациентов с низкими исходными количествами циркулирующих Т-клеток. Однако ограниченный эндотелиальный стресс, вызванный одним эпизодом перераспределения Т-клеток, также может вызывать неблагоприятные в отношении ЦНС события в редких случаях повышенной чувствительности к таким событиям, какие наблюдали у 1 из 21 пациента в клинических испытаниях с болюсной инфузией CD19×CD3-связывающей молекулы.
Без связи с теорией полагают, что временное повышение Т-клеточной адгезивности в отношении эндотелиальных клеток у пациентов, по существу не имеющих циркулирующих клеток-мишеней, можно объяснить как Т-клеточную реакцию на моновалентное взаимодействие традиционной CD3-связывающей молекулы, такой как CD19×CD3-связывающая молекула (например, WO 99/54440), с ее зависимым от окружения эпитопом на CD3-эпсилон, приводящее к аллостерическому изменению конформации CD3 с последующим рекрутингом Nck2 к цитоплазматическому домену CD3-эпсилон, как описано выше.
Поскольку Nck2 непосредственно связан с интегринами через PINCH и ILK (Фиг.28), рекрутинг Nck2 к цитоплазматическому домену CD3-эпсилон после аллостерического изменения конформации CD3 в результате связывания традиционной CD3-связывающей молекулы, такой как CD19×CD3-связывающая молекула, с ее зависимым от окружения эпитопом на CD3 эпсилон, может увеличивать адгезивность Т-клеток к эндотелиальным клеткам посредством временного перехода интегринов на поверхности Т-клеток в их более адгезивную изоформу в результате сигналинга изнутри наружу.
Используемые сокращения: АЕ, неблагоприятное событие; АР, щелочная фосфатаза; LDH, лактатдегидрогеназа; CRP, С-реактивный белок; ALT, аланинтрансаминаза; AST, аспартаттрансаминаза; GGT, гамма-глутамилтрансфераза; данные по АЕ с дополнительным циклом лечения пациента 34 пока еще на включены.
Как объяснено выше, традиционные CD3-связывающие молекулы (например, описанные в WO 99/54440), способные связываться с зависимым от окружения эпитопом, даже функциональные, приводят к нежелательному эффекту перераспределения Т-клеток у пациентов, вызывающему неблагоприятные в отношении ЦНС события. В противоположность этому, связывающие молекулы по настоящему изобретению, связываясь с независимыми от окружения N-концевыми аминокислотами 1-27 CD3-эпсилон-цепи, не вызывают таких эффектов перераспределения Т-клеток. Как следствие этого, CD3-связывающие молекулы по изобретению ассоциированы с лучшим профилем безопасности по сравнению с традиционными CD3-связывающими молекулами.
21. Биспецифические CD3-связывающие молекулы по изобретению, индуцирующие опосредованный Т-клетками лизис клеток-мишеней путем распознавания целевого поверхностного антигена, истощают целевые антиген-положительные клетки in vivo
Биспецифическая CD3-связывающая молекула по изобретению, распознающая CD33 в качестве целевого антигена, истощает CD33-положительные циркулирующие моноциты в периферической крови яванских макака
Конструкцию CD33-AF5 VH-VL×I2C VH-VL (аминокислотная последовательность: SEQ ID NO: 415) продуцировали путем экспрессии в клетках СНО, используя кодирующую нуклеотидную последовательность SEQ ID NO: 416. Обе кодирующие последовательности: (1) N-концевого лидерного пептида тяжелой цепи иммуноглобулина, содержащего стартовый кодон, встроенный в консенсусную последовательность Козака, и (2) С-концевой His6-метки, за которой следует стоп-кодон, присоединяли, в рамке считывания, к нуклеотидной последовательности SEQ ID NO: 416 перед вставкой результирующего фрагмента ДНК, полученного генным синтезом, в сайт множественного клонирования экспрессирующего вектора pEF-DHFR (Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150). Стабильную трансфекцию дефектных по DHFR клеток СНО, селекцию DHFR-положительных трансфектантов, секретирующих CD3-связывающую молекулу CD33-AF5 VH-VL×I2C VH-VL в культуральный супернатант, и амплификацию генов с использованием метотрексата для повышения уровней экспрессии осуществляли, как описано (Mack et al. Proc. Natl. Acad. Sci. USA 92 (1995) 7021-7025). Тестируемое вещество для лечения яванских макаков продуцировали в 20-литровом ферментере. Для очистки белка из сбора 3 ферментации использовали аффинную хроматографию IMAC, нацеленную на С-концевую His6-метку на CD33-AF5 VH-VL×I2C VH-VL, с последующей препаративной гель-фильтрацией (SEC). Общий выход конечного, не содержащего эндотоксин, тестируемого вещества составил 60 мг. Аналитический SEC-профиль CD33-AF5 VH-VL×I2C VH-VL для применения на яванских макаках показал, что тестируемое вещество почти полностью состояло из мономера. Эффективность тестируемого вещества измеряли в анализе цитотоксичности, как описано в Примере 23.5, используя клетки СНО, трансфицированные CD33 яванского макака, в качестве клеток-мишеней и Т-клеточную линию макака 4119LnPx в качестве источника эффекторных клеток (Фиг.29). Концентрация CD33-AF5 VH-VL×I2C VH-VL, необходимая для полумаксимального лизиса клеток-мишеней (EC50) эффекторными Т-клетками, составляла 2,7 нг/мл.
Молодых (в возрасте приблизительно 3 года) взрослых яванских макаков (Масаса fascicularis) обрабатывали посредством непрерывной внутривенной инфузии CD3-связывающей молекулы CD33-AF5 VH-VL×I2C VH-VL при различных скоростях потока (т.е. уровнях доз) для исследования истощения циркулирующих CD33-положительных моноцитов в периферической крови. Эта ситуация эквивалентна лечению традиционной CD3-связывающей молекулой CD19×CD3 (специфичной к CD19 на В-клетках и CD3 на Т-клетках) тех B-NHL-пациентов, у которых имеются циркулирующие CD19-положительные целевые В-клетки (см., например WO99/54440). Выяснили, что истощение циркулирующих CD19-положительных целевых В-клеток в периферической крови являлось достоверной заменой общей клинической эффективности традиционной CD3-связывающей молекулы (CD19×CD3, предложенной в WO99/54440) у пациентов с CD19-положительными В-клеточными малигномами, подобными B-NHL. Аналогично, истощение циркулирующих CD33-положительных моноцитов в периферической крови рассматривается как достоверный заменитель общей клинической эффективности CD33-направленных биспецифических CD33-связывающих молекул по изобретению, подобных CD33-AF5 VH-VL×12C VH-VL, у пациентов с CD33-положительными миелоидными малигномами, такими как AML (острый миелоидный лейкоз).
Непрерывную инфузию осуществляли согласно способу с использованием поворотного (swivel) механизма следующим образом. Обезьянам через бедренную вену в полую хвостовую вену вводят венозный катетер. Катетер продвигают подкожно до задней плечевой области и выводят на поверхность тела около задней лопатки. Затем трубку пропускают через корсет и защитную пружину. Корсет закрепляют вокруг животного, а катетер посредством трубки присоединяют к инфузионному насосу.
Раствор для введения (1,25 М лизин; 0,1% Tween 80; рН 7) без тестируемого вещества инфузировали непрерывно при скорости 48 мл/24 ч в течение 7 суток до начала лечения для привыкания животных к условиям инфузии. Лечение начинали путем добавления тестируемого вещества CD33-AF5 VH-VL×I2C VH-VL к раствору для введения в количестве, необходимом для каждого индивидуального тестируемого уровня дозы (т.е. скорости потока CD33-AF5 VH-VL×I2C VH-VL). Резервуар для инфузии меняли каждые сутки в течение всей фазы привыкания и лечения. Планируемая продолжительность лечения составляла 7 суток, за исключением уровня дозы 120 мкг/м2/24 ч, при котором животные получали лечение в течение 14 суток.
Ход изменения во времени абсолютных количеств циркулирующих Т-клеток и CD33-положительных моноцитов определяли с помощью 4- или 3-цветного FACS-анализа, соответственно.
Сбор образцов крови и рутинный анализ
Образцы крови (1 мл) получали до и через 0,75, 2, 6, 12, 24, 30, 48, 72 часа после начала непрерывной инфузии MCSP-G4 VH-VL×I2C VH-VL, а также через 7 и 14 суток (и через 9 суток при уровне дозы 120 мкг/м2/24 ч) лечения, используя EDTA-содержащие пробирки Vacutainer™ (Becton Dickinson), которые перевозили для анализа при 4°С. В некоторых случаях по рабочим причинам имели место небольшие вариации этих временных точек. FACS-анализ субпопуляций лимфоцитов осуществляли в интервале 24-48 ч после отбора образцов крови. Абсолютное количество субпопуляций лейкоцитов в образцах крови определяли с помощью дифференциального анализа крови в обычной ветеринарной лаборатории.
Выделение РВМС из образцов крови
Выделение РВМС (мононуклеарных клеток периферической крови) осуществляли в соответствии с адаптированным протоколом выделения в градиенте Ficoll™. Кровь переносили при комнатной температуре в 5 мл пробирки Falcon™, предварительно заполненные 1 мл раствора Biocoll™ (Biochrom). Центрифугирование осуществляли в откидном роторе в течение 15 мин при 1700×g и 22°С без торможения. РВМС сверху слоя Biocoll™ отбирали, промывали один раз буфером для FACS (PBS/2% FBS [фетальная сыворотка теленка; Biochrom]), центрифугировали и ресуспендировали в буфере для FACS. Центрифугирование во время всех стадий промывки осуществляли в откидном роторе в течение 4 мин при 800×g и 4°С. При необходимости, лизис эритроцитов осуществляли посредством инкубирования выделенных РВМС в 3 мл буфера для лизиса эритроцитов (8,29 г NH4Cl; 1,00 г КНСО3; 0,037 г EDTA; до 1,0 л H2Obidest (вода стерильная, подходящая для HPLC), рН 7.5) в течение 5 мин при комнатной температуре с последующей стадией промывки в буфере для FACS.
Окрашивание РВМС мечеными флуоресцентной меткой антителами против молекул клеточной поверхности
Моноклональные антитела, реактивные в отношении антигенов яванского макака, получали от Becton Dickinson (1№ по каталогу 345784,2№ по каталогу 556647,3№ по каталогу 552851,6№ по каталогу 557710), Beckman Coulter (4№ по каталогу IM2470) и Miltenyi (5№ по каталогу 130-091-732) и использовали в соответствии с рекомендациями производителей. 5×105 - 1×106 клеток окрашивали, используя следующую комбинацию антител: анти-CD141 (FITC)×анти-CD562 (РЕ)×анти-CD33 (PerCP)×анти-CD194 (АРС) и анти-CD141 (FITC)×анти-CD335 (РЕ)×анти-СD166 (Alexa Fluor 647™). Клетки осаждали в 96-луночных мультититрационных планшетах с V-образными лунками (Greiner) и супернатант удаляли. Клеточные осадки ресуспендировали в общем объеме 100 мкл, содержащем специфические антитела, разбавленные в буфере для FACS. Инкубацию осуществляли в темноте в течение 30 мин при 4°С.После этого образцы дважды промывали буфером для FACS и клеточные осадки ресуспендировали в буфере для FACS для анализа методом проточной цитометрии.
Проточно-цитометрическое определение окрашенных лимфоцитов с помощью FACS
Сбор данных осуществляли с помощью 4-цветного BD FACSCalibur™ (Becton Dickinson). Для каждого измерения брали 1×104 клеток определенных субпопуляций лимфоцитов. Чтобы получить процентное содержание субпопуляций лимфоцитов и провести классификацию интенсивностей экспрессии молекул клеточной поверхности, осуществляли статистический анализ с использованием программы CellQuest Pro™ (Becton Dickinson). процентные содержания отдельных субпопуляций лимфоцитов относительно общих лимфоцитов (т.е. В- плюс Т- плюс NK-клетки, за исключением миелоидных клеток с CD13/14-окрашиванием) по данным FACS коррелировали с количеством лимфоцитов, полученным из дифференциального анализа крови, для подсчета абсолютных количеств Т-клеток (CD3+, CD56-, CD13/14-). Абсолютные количества CD33-положительных моноцитов вычисляли, умножая количества моноцитов, полученные из дифференциального анализа крови, на соответствующие отношения CD33-положительных моноцитов (CD33+, CD14+) ко всем моноцитам (CD14+) по данным FACS.
Процентное содержание по сравнению с исходным уровнем (т.е. 100%) абсолютных количеств циркулирующих CD33-положительных моноцитов в конце лечения с применением CD33-AF5 VH-VL×I2C VH-VL в 4 группах из 2 яванских макаков с увеличением дозы внутри группы от 30 до 60 и от 240 до 1000 мкг/м2/24 ч показаны на Фиг.30А.
Как показано на Фиг.30А, непрерывная внутривенная инфузия CD33-AF5 VH-VL×I2C VH-VL индуцирует истощение циркулирующих CD33-положительных моноцитов дозозависимым образом. Несмотря на то, что при 30 мкг/м2/24 ч все еще не наблюдалось никакого заметного истощения циркулирующих CD33-положительных моноцитов, первое изменение в сторону уменьшения числа CD33-положительных моноцитов стало заметным при 60 мкг/м2/24 ч через 7 суток лечения. При 240 мкг/м2/24 ч циркулирующие CD33-положительные моноциты были почти полностью истощены в периферической крови через 3 суток лечения. Это достигалось еще быстрее при 1000 мкг/м2/24 ч, когда истощение циркулирующих CD33-положительных моноцитов в периферической крови завершалось уже через 1 сутки лечения.
Эти полученные данные были подтверждены результатами, представленными на Фиг.30В, демонстрирующими истощение циркулирующих CD33-положительных моноцитов на две трети и на 50% по сравнению с соответствующим исходным уровнем у двух яванских макаков, которых лечили путем непрерывной инфузии CD33-AF5 VH-VL×I2C VH-VL при дозе 120 мкг/м2/24 ч в течение 14 суток.
Этот исход очевидно указывает на клиническую эффективность CD3-связывающих молекул по изобретению в целом и биспецифических CD33-направленных CD3-связывающих молекул по изобретению для лечения CD33-положительных малигном, подобных AML, в частности. Кроме того, перераспределение Т-клеток во время начальной фазы лечения с применением CD33-AF5 VH-VL×I2C VH-VL в присутствии циркулирующих клеток-мишеней (т.е. CD33-положительных моноцитов) кажется менее ярко выраженным, чем перераспределение Т-клеток во время начальной фазы лечения с применением традиционных CD19×CD3-конструкций, как описано в WO99/54440 для B-NHL-пациентов со значительным количеством циркулирующих клеток-мишеней (т.е. СD19-положительных В-клеток), как показано на Фиг.26. Несмотря на то, что Т-клетки полностью исчезают из кровотока после начала инфузии CD19×CD3 и не появляются вновь до тех пор, пока циркулирующие СD19-положительные целевые В-клетки не будут истощены в периферической крови (Фиг.26), начальное исчезновение циркулирующих Т-клеток не будет полным после начала инфузии CD33-AF5 VH-VL×I2C VH-VL, и количество Т-клеток все еще будет восстанавливаться, пока присутствуют циркулирующие CD33-положительные клетки-мишени (Фиг.30В). Это является подтверждением того, что CD3-связывающие молекулы по изобретению (направленные против и созданные против эпитопа СD3ε(эпсилон)-цепи человека и приматов, не являющихся шимпанзе, и представляющие собой часть или фрагмент или полноразмерную аминокислотную последовательность, представленную в SEQ ID NO: 2, 4, 6 или 8) путем распознавания независимого от окружения эпитопа CD3 демонстрируют более благоприятный профиль перераспределения Т-клеток, чем традиционные CD3-связывающие молекулы, распознающие зависимый от окружения эпитоп CD3, подобные связывающим молекулам, предложенным в WO99/54440.
22. CD3-связывающие молекулы по изобретению, направленные на по существу независимые от окружения эпитопы CD3, благодаря индукции меньшего перераспределения циркулирующих Т-клеток в отсутствие циркулирующих клеток-мишеней снижают риск неблагоприятных событий, связанных с началом лечения
Уменьшенное перераспределение Т-клеток у яванских макаков после начала лечения с применением репрезентативной CD3-связывающей молекулы с межвидовой специфичностью по изобретению
Конструкцию MCSP-G4 VH-VL×12C VH-VL (аминокислотная последовательность: SEQ ID NO: 313) продуцировали путем экспрессии в клетках СНО, используя кодирующую нуклеотидную последовательность SEQ ID NO: 314. Обе кодирующие последовательности: (1) N-концевого лидерного пептида тяжелой цепи иммуноглобулина, содержащего стартовый кодон, встроенный в консенсусную последовательность Козака, и (2) С-концевой His6-метки, за которой следует стоп-кодон, присоединяли, в рамке считывания, к нуклеотидной последовательности SEQ ID NO: 314 перед вставкой результирующего фрагмента ДНК, полученного генным синтезом, в сайт множественного клонирования экспрессирующего вектора pEF-DHFR (Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150). Стабильную трансфекцию дефектных по DHFR клеток СНО, селекцию DHFR-положительных трансфектантов, секретирующих CD3-связывающую молекулу MCSP-G4 VH-VL×I2C VH-VL в культуральный супернатант, и амплификацию генов с использованием метотрексата для повышения уровней экспрессии осуществляли, как описано (Mack et al. Proc. Natl. Acad. Sci. USA 92 (1995) 7021-7025). Тестируемое вещество для лечения яванских макаков продуцировали в 200-литровом ферментере. Для очистки белка из сбора использовали аффинную хроматографию 1МАС, нацеленную на С-концевую His6-метку на MCSP-G4 VH-VL×12C VH-VL, с последующей препаративной гель-фильтрацией (SEC). Общий выход конечного, не содержащего эндотоксин, тестируемого вещества составил 40 мг. Тестируемое вещество состояло на 70% из мономеров, на 30% из димеров и содержало небольшое количество примесных мультимеров более высокого порядка. Эффективность тестируемого вещества измеряли в анализе цитотоксичности, как описано в Примере 18, используя клетки СНО, трансфицированные MCSP яванского макака, в качестве клеток-мишеней и Т-клеточную линию макака 4119LnPx в качестве источника эффекторных клеток (Фиг.31). Концентрация MCSP-G4 VH-VL×I2C VH-VL, необходимая для полумаксимального лизиса клеток-мишеней (ЕС50) эффекторными Т-клетками, составляла 1,9 нг/мл.
Молодых (в возрасте приблизительно 3 года) взрослых яванских макаков (Масаса fascicularis) обрабатывали посредством непрерывной внутривенной инфузии CD3-связывающей молекулы MCSP-G4 VH-VL×I2C VH-VL при различных скоростях потока (т.е. уровнях доз) для исследования перераспределения циркулирующих Т-клеток после начала лечения в отсутствие циркулирующих клеток-мишеней. Несмотря на то, что CD3-связывающая молекула MCSP-G4 VH-VL×I2C VH-VL может распознавать как MCSP яванского макака, так и CD3 яванского макака, не наблюдалось никаких циркулирующих в крови клеток, экспрессирующих MCSP. Поэтому единственным видом взаимодействия, которое возможно в циркулирующей крови, является связывание CD3-специфического "плеча" на MCSP-G4 VH-VL×I2C VH-VL с CD3 на Т-клетках. Эта ситуация эквивалентна лечению традиционной CD3-связывающей молекулой (CD19×CD3-связывающей молекулой, специфичной к CD19 на В-клетках и CD3 на Т-клетках) тех B-NHL пациентов, у которых нет циркулирующих CD19-положительных целевых В-клеток, как описано в Примере 20.
Непрерывную инфузию осуществляли согласно способу с использованием поворотного (swivel) механизма следующим образом. Обезьянам через бедренную вену в полую хвостовую вену вводят венозный катетер. Катетер продвигают подкожно до задней плечевой области и выводят на поверхность тела около задней лопатки. Затем трубку пропускают внутрь корсета и защитной пружины. Корсет закрепляют вокруг животного, а катетер присоединяют к инфузионному насосу посредством трубки.
Раствор для введения (1,25 М лизин; 0,1% Tween 80; рН 7) без тестируемого вещества инфузировали непрерывно при скорости 48 мл/24 ч в течение 7 суток до начала лечения для привыкания животных к условиям инфузии. Лечение начинали путем добавления тестируемого вещества MCSP-G4 VH-VL×I2C VH-VL к раствору для введения в количестве, необходимом для каждого индивидуального тестируемого уровня дозы (т.е. скорости потока MCSP-G4 VH-VL×I2C VH-VL). Резервуар для инфузии меняли каждые сутки в течение всей фазы привыкания и лечения. Продолжительность лечения составляла 7 суток.
Ход изменения во времени абсолютных количеств Т-клеток в периферической крови определяли с помощью 4-цветного FACS-анализа следующим образом.
Сбор образцов крови и рутинный анализ
Образцы крови (1 мл) получали до и через 0,75, 2, 6, 12, 24, 30, 48, 72 часа после начала непрерывной инфузии MCSP-G4 VH-VL×I2C VH-VL, а также через 7 суток лечения, используя EDTA-содержащие пробирки Vacutainer™ (Becton Dickinson), которые перевозили для анализа при 4°С. В некоторых случаях по рабочим причинам имели место небольшие вариации этих временных точек. FACS-анализ субпопуляций лимфоцитов осуществляли в интервале 24-48 ч после отбора образцов крови. Абсолютное количество субпопуляций лейкоцитов в образцах крови определяли с помощью дифференциального анализа крови в обычной ветеринарной лаборатории.
Выделение РВМС из образцов крови
Выделение РВМС (мононуклеарных клеток периферической крови) осуществляли в соответствии с адаптированным протоколом выделения в градиенте Ficoll™. Кровь переносили при комнатной температуре в 5 мл пробирки Falcon™, предварительно заполненные 1 мл раствора Biocoll™ (Biochrom). Центрифугирование осуществляли в откидном роторе в течение 15 мин при 1700×g и 22°С без торможения. РВМС сверху слоя Biocoll™ отбирали, промывали один раз буфером для FACS (PBS/2% FBS [фетальная сыворотка теленка; Biochrom]), центрифугировали и ресуспендировали в буфере для FACS. Центрифугирование во время всех стадий промывки осуществляли в откидном роторе в течение 4 мин при 800×g и 4°С.При необходимости, лизис эритроцитов осуществляли посредством инкубирования выделенных РВМС в 3 мл буфера для лизиса эритроцитов (8,29 г NH4Cl; 1,00 г КНСО3; 0,037 г EDTA; до 1,0 л H2Obidest, pH 7.5) в течение 5 мин при комнатной температуре с последующей стадией промывки в буфере для FACS.
Окрашивание РВМС мечеными флуоресцентной меткой антителами против молекул клеточной поверхности
Моноклональные антитела, реактивные в отношении антигенов яванского макака, получали от Becton Dickinson (1№ по каталогу 345784,2№ в по каталогу 556647,3№ по каталогу 552851) и Beckman Coulter (4№ по каталогу IM2470) и использовали в соответствии с рекомендациями производителей. 5×105-1×106 клеток окрашивали, используя следующую комбинацию антител: анти-CD141 (FITC)×анти-CD562 (РЕ)×анти-CD33 (PerCP)×анти-СD194 (АРС). Клетки осаждали в 96-луночных мультититрационных планшетах с V-образными лунками (Greiner) и супернатант удаляли. Клеточные осадки ресуспендировали в общем объеме 100 мкл, содержащем специфические антитела, разбавленные в буфере для FACS. Инкубацию осуществляли в темноте в течение 30 мин при 4°С. После этого образцы дважды промывали буфером для FACS и клеточные осадки ресуспендировали в буфере для FACS для анализа методом проточной цитометрии.
Проточно-цитометрическое определение окрашенных лимфоцитов с помощью FACS
Сбор данных осуществляли с помощью 4-цветного BD FACSCalibur™ (Becton Dickinson). Для каждого измерения брали 1×104 клеток определенных субпопуляций лимфоцитов. Чтобы получить процентное содержание субпопуляций лимфоцитов и провести классификацию интенсивностей экспрессии молекул клеточной поверхности, осуществляли статистический анализ с использованием программы CellQuest Pro™ (Becton Dickinson). Затем процентные содержания отдельных субпопуляций лимфоцитов относительно общих лимфоцитов (т.е. В- плюс Т- плюс NK-клетки, за исключением миелоидных клеток с CD13/14-) по данным FACS коррелировали с количеством лимфоцитов, полученным из дифференциального анализа крови, для подсчета абсолютных количеств Т-клеток (CD3+, CD56-, CD13/14-).
Перераспределение Т-клеток во время начальной фазы лечения с применением MCSP-G4 VH-VL×12C VH-VL на яванских макаках при уровнях доз 60, 240 и 1000 мкг/м2/24 ч показано на Фиг.32. Эти животные вообще не демонстрировали никаких признаков перераспределения Т-клеток во время начальной фазы лечения, т.е. количества Т-клеток скорее увеличивались, чем уменьшались после начала лечения. Принимая во внимание, что перераспределение Т-клеток постоянно наблюдается у всех 100% пациентов без циркулирующих клеток-мишеней после начала лечения традиционной CD3-связывающей молекулой (например, конструкцией CD19×CD3, как описано в WO 99/54440) против зависимого от окружения эпитопа CD3, было продемонстрировано, что существенно меньшее перераспределение Т-клеток в отсутствие циркулирующих клеток-мишеней после начала лечения можно наблюдать при применении CD3-связывающей молекулы по изобретению, направленной и разработанной против эпитопа эпсилон-цепи CD3 человека и примата, не являющегося шимпанзе, как определено любой аминокислотной последовательностью из SEQ ID NO: 2, 4, 6 или 8, или ее фрагмента. Это явно отличается от случая CD3-связывающих молекул, направленных против зависимого от окружения эпитопа CD3, подобного конструкциям, описанным в WO 99/54440. Связывающие молекулы против независимых от окружения эпитопов, как они предложены (среди прочего) в любой из SEQ ID NO: 2, 4, 6 или 8 (или фрагментами этих последовательностей), обеспечивают существенно меньшее (вредное и нежелательное) перераспределение Т-клеток. Поскольку перераспределение Т-клеток во время начальной фазы лечения CD3-связывающими молекулами является основным фактором риска для неблагоприятных в отношении ЦНС событий, CD3-связывающие молекулы, предложенные в данном описании и способные распознавать независимый от окружения эпитоп CD3, обладают существенным преимуществом по сравнению с CD3-связывающими молекулами, известными в данной области техники и направленными против зависимых от окружения эпитопов CD3. Действительно, ни одна из яванских макаков, которую лечили с применением MCSP-G4 VH-VL×I2C VH-VL, не продемонстрировала никаких признаков ЦНС-симптомов.
Согласно данному изобретению предложен независимый от окружения эпитоп CD3, и он соответствует первым 27 N-концевым аминокислотам CD3-эпсилон или фрагментам этого участка из 27 аминокислот. Этот независимый от окружения эпитоп удаляют из его нативного окружения в CD3-комплексе и подвергают слиянию с гетерологичными аминокислотными последовательностями без потери его структурной целостности. Анти-CD3-связывающие молекулы, предложенные в данном описании и созданные (и направленные) против независимого от окружения эпитопа CD3-эпсилон, обеспечивают неожиданное клиническое улучшение в отношении перераспределения Т-клеток и, таким образом, более благоприятный профиль безопасности. Без связи с теорией полагают, что поскольку эпитоп CD3 не зависит от окружения, образуя автономный самодостаточный субдомен без большого влияния на остальную часть CD3-комплекса, CD3-связывающие молекулы, предложенные в данном описании, в меньшей степени индуцируют аллостерические изменения конформации CD3, чем традиционные CD3-связывающие молекулы (аналогичные молекулам, предложенным в WO 99/54440), которые распознают зависимые от окружения эпитопы CD3, подобные молекулам, предложенным в WO 99/54440. Как следствие (опять без связи с теорией), индукция внутриклеточного рекрутинга NсК2 под действием CD3-связывающлх молекул, предложенных в данном описании, также снижена, что приводит к менее выраженному переходу Т-клеточных интегринов в их изоформу и меньшей адгезии Т-клеток к эндотелиальным клеткам. Предпочтительно, чтобы препараты CD3-связывающих молекул по изобретению (направленных против и созданных против независимого от окружения эпитопа, как он определен в данном описании) по существу состояли из мономерных молекул. Эти мономерные молекулы являются даже более эффективными (чем димерные или мультимерные молекулы) в избегании перераспределения Т-клеток и, таким образом, риска неблагоприятных в отношении ЦНС событий во время начальной фазы лечения.
23. Создание и характеристика CD33- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
23.1. Получение клеток СНО, экспрессирующих CD33 человека Кодирующую последовательность CD33 человека, которая опубликована в GenBank (номер доступа NM_001772), получали генным синтезом согласно стандартным протоколам. Фрагмент генного синтеза конструировали таким образом, чтобы он содержал сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность зрелого белка CD33 человека, затем, в рамке считывания, кодирующую последовательность дипептида серин-глицин, гистидин6-метку и стоп-кодон (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO; 525 и 526). Фрагмент генного синтеза конструировали также таким образом, чтобы ввести сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через EcoRI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Вышеупомянутые процедуры осуществляли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
23.2. Получение клеток СНО, экспрессирующих внеклеточный домен CD33 макака
Последовательность кДНК CD33 макака получали в результате серии из 3 ПЦР на кДНК из костного мозга макака согласно стандартным протоколам. Использовали следующие условия реакции: 1 цикл при 94°С в течение 3 минут, затем 35 циклов при 94°С в течение 1 минуты, при 53°С в течение 1 минуты и при 72°С в течение 2 минут, затем заключительный цикл при 72°С в течение 3 минут, и следующие праймеры:
3) прямой праймер:
5'-gaggaattcaccatgccgctgctgctactgctgcccctgctgtgggcaggggccctggctatgg-3',
обратный праймер: 5'-gatttgtaactgtatttggtacttcc-3';
4) прямой праймер: 5'-attccgcctccttggggatcc-3',
обратный праймер: 5'-gcataggagacattgagctggatgg-3';
5) прямой праймер: 5'-gcaccaacctgacctgtcagg-3',
обратный праймер: 5'-agtgggtcgactcactgggtcctgacctctgagtattcg-3'.
В результате проведения этих ПЦР получали три перекрывающихся фрагмента, которые выделяли и секвенировали согласно стандартным протоколам, используя эти ПЦР-праймеры, и таким образом получали участок последовательности кДНК CD33 макака от второго нуклеотида в кодоне+2 до третьего нуклеотида в кодоне +340 зрелого белка. Для создания конструкции для экспрессии CD33 макака, фрагмент кДНК получали генным синтезом согласно стандартным протоколам (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO: 527 и 528). В этой конструкции кодирующую последовательность CD33 макака от аминокислоты +3 до +340 зрелого белка CD33 подвергали слиянию с кодирующей последовательностью CD33 человека, заменяя кодирующую последовательность человека, состоящую из аминокислот от+3 до+340. Фрагмент генного синтеза также конструировали таким образом, чтобы он содержал сайт Козака для эукариотической экспрессии данной конструкции и сайты рестрикции в начале и в конце фрагмента, содержащего кДНК, кодирующую по существу целый внеклеточный домен CD33 макака, трансмембранный домен CD33 макака и химерный внутриклеточный домен CD33 макака и человека. Введенные сайты рестрикции, XbaI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза затем клонировали через XbaI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150). Клоны с подтвержденной последовательностью этой плазмиды использовали для трансфекции клеток CHO/dhfr-, как описано выше.
23.3. Создание молекул CD33- и CD3-биспецифических антител с межвидовой специфичностью «локирование связывающих молекул с межвидовой специфичностью
В общем случае, молекулы биспецифических антител, каждое из которых содержит домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD3-эпсилон человека и примата, не являющегося шимпанзе, а также домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD33 человека и примата, не являющегося шимпанзе, конструировали, как представлено в следующей ниже Таблице 6.
Вышеупомянутые конструкции, содержащие вариабельные домены легкой цепи (L) и вариабельные домены тяжелой цепи (Н) с межвидовой специфичностью к CD33 человека и макака и CD3-специфические VH- и VL-комбинации, демонстрирующие межвидовую специфичность к CD3 человека и макака, получали генным синтезом. Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность соответствующей молекулы биспецифического антитела, затем, в рамке считывания, кодирующую последовательность гистидин6-метки и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие сайты рестрикции в начало и в конец данного фрагмента. Введенные сайты рестрикции использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через эти сайты рестрикции в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Упомянутые выше методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
Экспрессия и очистка молекул биспецифических антител Молекулы биспецифических антител экспрессировали в клетках яичника китайского хомячка (СНО). Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкций индуцировали путем добавления увеличивающихся концентраций МТХ до конечных концентраций 20 нМ МТХ включительно. После двух пассажей стационарной культуры клетки выращивали в роллерных флаконах в жидкой соевой среде HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone) в течение 7 суток перед сбором. Клетки выделяли центрифугированием и супернатант, содержащий экспрессированный белок, хранили при -20°С.Альтернативно, осуществляли временную экспрессию конструкций в клетках НЕК 293. Трансфекцию осуществляли с помощью реагента 293fectin (Invitrogen, №12347-019) в соответствии с протоколом производителя.
Для хроматографии использовали систему Akta® Explorer (GE Health Systems) и программное обеспечение Unicorn®. Аффинную хроматографию с иммобилизованным металлом ("IMAC") осуществляли с использованием Fractogel EMD chelate® (Merck), который нагружали ZnCb в соответствии с протоколом, предложенным производителем. Колонку уравновешивали буфером А (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl), и супернатант клеточной культуры (500 мл) наносили на колонку (10 мл) при скорости потока 3 мл/мин. Колонку промывали буфером А для удаления несвязавшегося образца. Связавшийся белок элюировали с использованием двухстадийного градиента буфера В (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl; 0,5 М имидазол) в соответствии со следующим протоколом:
стадия 1: 20% буфера В в 6 объемах колонки;
стадия 2: 100% буфера В в 6 объемах колонки.
Элюированные белковые фракции со стадии 2 объединяли для дальнейшей очистки. Все химические реактивы имели степень чистоты, подходящую для исследований, и были приобретены у Sigma (Deisenhofen) или Merck (Darmstadt).
Гель-фильтрацию осуществляли на препаративной колонке HiLoad 16/60 Superdex 200 (GE/Amersham), уравновешенной Equi-буфером (25 мМ цитрат; 200 мМ лизин; 5% глицерин; рН 7,2). Элюированные белковые образцы (скорость потока 1 мл/мин) подвергали стандартному определению с использованием SDS-PAGE и вестерн-блоттинга. Перед очисткой колонку калибровали для определения молекулярной массы (набор маркеров молекулярной массы, Sigma MW GF-200). Концентрацию белка определяли, используя OD при 280 нм.
Очищенный белок, биспецифическое антитело, анализировали с использованием SDS-PAGE в восстанавливающих условиях и предварительно залитых 4-12%-ных гелей в бис-Трис-буфере (Invitrogen). Приготовление и нанесение образцов осуществляли согласно протоколу, предложенному производителем. Молекулярную массу определяли, используя белковый стандарт MultiMark (Invitrogen). Гель окрашивали коллоидным Coomassie (протокол Invitrogen). Чистота выделенного белка составляла более 95%, как определено SDS-PAGE.
Биспецифическое антитело имеет молекулярную массу примерно 52 кДа в нативных условиях, как определено гель-фильтрацией в PBS. Все конструкции очищали согласно данному методу. Вестерн-блоттинг осуществляли, используя мембрану Optitran® BA-S83 в аппарате для блоттинга Invitrogen в соответствии с протоколом, предложенным производителем. Для детекции белка биспецифического антитела использовали антитело против His-метки (Penta-His, Qiagen). Антитело козы против Ig мыши, меченое щелочной фосфатазой (АР) (Sigma), использовали в качестве вторичного антитела, a BCIP/NBT (Sigma) в качестве субстрата. Определили единственную полосу при 52 кДа, соответствующую очищенному биспецифическому антителу.
23.4. Проточно-цитометрический анализ связывания CD33- и CD3-биспецифических антител с межвидовой специфичностью
С целью тестирования функциональности конструкций биспецифических антител с межвидовой специфичностью в отношении способности связываться с CD33 и CD3 человека и макака, соответственно, осуществляли FACS-анализ. Для этого клетки СНО, трансфицированные CD33 человека, как описано в Примере 23.1, и CD3-положительную линию клеток HPB-ALL Т-клеточного лейкоза человека (DSMZ, Braunschweig, ACC483) использовали для тестирования связывания с антигенами человека. Способность связываться с антигенами макака тестировали с использованием созданного CD33-трансфектанта макака, описанного в Примере 23.2, и РВМС макака (получение РВМС макака осуществляли центрифугированием в градиенте фикола периферической крови обезьян макаков согласно стандартным протоколам). 200000 клеток соответствующих клеточных линий РВМС инкубировали в течение 30 мин на льду с 50 мкл очищенного белка конструкций биспецифических антител с межвидовой специфичностью (5 мкг/мл) или с супернатантом клеточной культуры трансфицированных клеток, экспрессирующих конструкции биспецифических антител с межвидовой специфичностью. Клетки дважды промывали в PBS с 2% PCS, и связывание данной конструкции определяли с использованием мышиного анти-His-антитела (Penta-His-антитело; Qiagen; разбавленное 1:20 в 50 мкл PBS с 2% PCS). После промывки связавшиеся анти-his-антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. В качестве отрицательного контроля использовали супернатант нетрансфицированных клеток СНО. Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002).
Специфическое связывание CD3 человека и примата, не являющегося шимпанзе, с CD3-связывающими молекулами по изобретению четко определялось, как показано на Фиг.33. В FACS-анализе все конструкции демонстрировали связывание с CD3 и CD33 при сравнении с соответствующими отрицательными контролями. Продемонстрирована межвидовая специфичность биспецифических антител к антигенам CD3 и CD33 человека и макака.
23.5. Биологическая активность CD33- и CD3-биспецифических антител с межвидовой специфичностью
Биологическую активность созданных биспецифических антител анализировали по высвобождению хрома 51 (51Cr) в анализах цитотоксичности in vitro, используя CD33-положительные клеточные линии, описанные в Примерах 23.1 и 23.2. В качестве эффекторных клеток использовали стимулированные CD4/CD56-истощенные РВМС человека или Т-клеточную линию макака 4119 LnPx, как показано в соответствующих графических материалах.
Получение стимулированных РВМС человека осуществляли следующим образом.
На чашку Петри (диаметр 85 мм; Nunc) наносили имеющееся в продаже aнти-CD3-cпeцифичecкoe антитело (например, ОКТ3, Othoclone) в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязавшийся белок удаляли за одну стадию промывки, используя PBS. Свежие РВМС выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. 3-5×107 РВМС добавляли в предварительно покрытую чашку Петри в 50 мл RPMI 1640 со стабилизирующей добавкой глутамин/10% FCS/IL-2 20 ед./мл (пролейкин, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали и промывали один раз RPMI 1640. Добавляли IL-2 до конечной концентрации 20 ед./мл и клетки снова культивировали в течение одних суток в той же среде для культивирования клеток, как упомянуто выше.
Клетки-мишени дважды промывали PBS и метили 11,1 МБк51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 45 минут при 37°С.После этого меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали в анализе цитотоксичности. Анализ осуществляли в 96-луночном планшете в конечном объеме 250 мкл дополненной среды RPMI (как и выше) с соотношением Е:Т 10:1. Наносили 1 мкг/мл молекул биспецифического одноцепочечного антитела с межвидовой специфичностью и 20 их трехкратных разведении. Время анализа составляло 18 часов, и цитотоксичность измеряли в относительных величинах высвобожденного хрома в супернатанте, соответствующих разнице между максимальным лизисом (добавление Тритона-X) и спонтанным лизисом (без эффекторных клеток). Все измерения осуществляли в четырех повторностях. Измерение радиоактивности хрома в супернатантах осуществляли с использованием гамма-счетчика Wizard 3" (Perkin Elmer Life Sciences GmbH, Koln, Germany). Анализ экспериментальных данных осуществляли с применением Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA). Сигмоидальные кривые доза-эффект обычно имеют величины R2 выше 0,90, как определено с использованием этого программного обеспечения. Величины EC50, рассчитанные с помощью данной программы анализа, использовали для сравнения биологической активности.
Как показано на Фиг.34, все созданные биспецифические конструкции с межвидовой специфичностью демонстрируют цитотоксическую активность против клеток-мишеней, положительных в отношении CD33 человека, индуцированных стимулированными СD4/СD56-истощенными РВМС человека, и против клеток-мишеней, положительных в отношении CD33 макака, индуцированных Т-клеточной линией макака 4119 LnPx.
24. Создание и характеристика CAIX- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
24.1. Получение клеток СНО, экспрессирующих CAIX человека
Кодирующую последовательность CAIX человека, которая опубликована в GenBank (номер доступа NM_001216), получали генным синтезом согласно стандартным протоколам. Фрагмент генного синтеза конструировали таким образом, чтобы он содержал кодирующую последовательность белка CAIX человека, включающую ее лидерный пептид (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO: 604 и 605). Фрагмент генного синтеза конструировали также таким образом, чтобы ввести сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции, XbaI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через XbaI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Вышеупомянутые процедуры осуществляли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентраций метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
24.2. Получение клеток СНО, экспрессирующих CAIX макака Кодирующую последовательность CAIX макака, которая опубликована в GenBank (номер доступа ХМ_001088481), получали генным синтезом согласно стандартным протоколам. Фрагмент генного синтеза конструировали таким образом, чтобы он содержал кодирующую последовательность белка CAIX макака, включающую ее лидерный пептид (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO: 606 и 607). Фрагмент генного синтеза конструировали также таким образом, чтобы ввести сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции, XbaI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через XbaI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Вышеупомянутые процедуры осуществляли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентраций метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
24.3. Создание CAIX- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
Клонирование связывающих молекул с межвидовой специфичностью
В общем случае, молекулы биспецифических одноцепочечных антител, каждое из которых содержит домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD3-эпсилон человека и примата, не являющегося шимпанзе, а также домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CAIX человека и примата, не являющегося шимпанзе, конструировали, как представлено в следующей ниже Таблице 7.
Вышеупомянутые конструкции, содержащие вариабельные домены легкой цепи (L) и вариабельные домены тяжелой цепи (Н) с межвидовой специфичностью к CAIX человека и макака и CD3-специфические VH- и VL-комбинации, демонстрирующие межвидовую специфичность к CD3 человека и макака, получали генным синтезом. Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность соответствующей молекулы биспецифического одноцепочечного антитела, затем, в рамке считывания, кодирующую последовательность состоящей из 6 гистидиновых остатков метки и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие сайты рестрикции в начало и в конец данного фрагмента. Введенные сайты рестрикции использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через эти сайты рестрикции в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Упомянутые выше методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентраций метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
24.4. Экспрессия и очистка молекул биспецифических одноцепочечных антител
Молекулы биспецифических одноцепочечных антител экспрессировали в клетках яичника китайского хомячка (СНО). Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкций индуцировали путем добавления увеличивающихся концентраций МТХ до конечных концентраций 20 нМ МТХ включительно. После двух пассажей стационарной культуры клетки выращивали в роллерных флаконах в жидкой соевой среде HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone) в течение 7 суток перед сбором. Клетки выделяли центрифугированием и супернатант, содержащий экспрессированный белок, хранили при -20°С.Альтернативно, осуществляли временную экспрессию конструкций в клетках НЕК 293. Трансфекцию осуществляли с помощью реагента 293fectin (Invitrogen, №12347-019) в соответствии с протоколом производителя.
Для хроматографии использовали систему Akta® Explorer (GE Health Systems) и программное обеспечение Unicorn®. Аффинную хроматографию с иммобилизованным металлом ("IMAC") осуществляли с использованием Fractogel EMD chelate® (Merck), который нагружали ZnCl2 в соответствии с протоколом, предложенным производителем. Колонку уравновешивали буфером А (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl), и супернатант клеточной культуры (500 мл) наносили на колонку (10 мл) при скорости потока 3 мл/мин. Колонку промывали буфером А для удаления несвязавшегося образца. Связавшийся белок элюировали с использованием двухстадийного градиента буфера В (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl; 0,5 М имидазол) в соответствии со следующим протоколом:
стадия 1: 20% буфера В в 6 объемах колонки,
стадия 2: 100% буфера В в 6 объемах колонки.
Элюированные белковые фракции со стадии 2 объединяли для дальнейшей очистки. Все химические реактивы имели степень чистоты, подходящую для исследований, и были приобретены у Sigma (Deisenhofen) или Merck (Darmstadt).
Гель-фильтрацию осуществляли на препаративной колонке HiLoad 16/60 Superdex 200 (GE/Amersham), уравновешенной Equi-буфером (25 мМ цитрат; 200 мМ лизин; 5% глицерин; рН 7,2). Элюированные белковые образцы (скорость потока 1 мл/мин) подвергали стандартным SDS-PAGE и вестерн-блоттингу для детекции. Перед очисткой колонку калибровали для определения молекулярной массы (набор маркеров молекулярной массы, Sigma MW GF-200). Концентрацию белка определяли, используя OD при 280 нм.
Очищенный белок, биспецифическое одноцепочечное антитело, анализировали с использованием SDS-PAGE в восстанавливающих условиях и предварительно залитых 4-12%-ных гелей в бис-Трис-буфере (Invitrogen). Приготовление и нанесение образцов осуществляли согласно протоколу, предложенному производителем. Молекулярную массу определяли, используя белковый стандарт MultiMark (Invitrogen). Гель окрашивали коллоидным Coomassie (протокол Invitrogen). Чистота выделенного белка составляет более 95%, как определено SDS-PAGE.
Биспецифическое одноцепочечное антитело имеет молекулярную массу примерно 52 кДа в нативных условиях, как определено гель-фильтрацией в PBS. Все конструкции очищали согласно данному методу.
Вестерн-блоттинг осуществляли, используя мембрану Optitran® BA-S83 в аппарате для блоттинга Invitrogen в соответствии с протоколом, предложенным производителем. Для детекции белка биспецифического одноцепочечного антитела использовали антитело против His-метки (Penta-His, Qiagen). Антитело козы против Ig мыши, меченое щелочной фосфатазой (АР) (Sigma), использовали в качестве вторичного антитела, a BCIP/NBT (Sigma) в качестве субстрата. Определили единственную полосу при 52 кДа, соответствующую очищенному биспецифическому антителу.
24.5. Проточно-цитометрический анализ связывания CAIX- и CD3-биспецифических антител с межвидовой специфичностью
С целью тестирования функциональности конструкций биспецифических антител с межвидовой специфичностью в отношении способности связываться с CAIX и CD3 человека и макака, соответственно, осуществляли FACS-анализ. Для этого клетки СНО, трансфицированные CAIX человека, как описано в Примере 24.1, и CD3-положительную линию клеток HPB-ALL Т-клеточного лейкоза человека (DSMZ, Braunschweig, ACC483) использовали для тестирования связывания с антигенами человека. Способность связываться с антигенами макака тестировали с использованием созданного CAIX-трансфектанта макака, описанного в Примере 24.2, и Т-клеточной линии макака 4119LnPx (любезно предоставленной проф. Fickenscher, Hygiene Institute, Virology, Erlangen-Nuernberg; опубликованной в Knappe A, et al., и Fickenscher H., Blood 2000, 95, 3256-61). 200000 клеток соответствующих клеточных линий инкубировали в течение 30 мин на льду с 50 мкл очищенного белка конструкций биспецифических антител с межвидовой специфичностью (2 мкг/мл) или с супернатантом клеточной культуры трансфицированных клеток, экспрессирующих конструкции биспецифических антител с межвидовой специфичностью. Клетки дважды промывали в PBS с 2% FCS, и связывание данной конструкции определяли с использованием мышиного анти-His-антитела (Penta-His-антитело; Qiagen; разбавленное 1:20 в 50 мкл PBS с 2% FCS), После промывки связавшиеся анти-his-антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. В качестве отрицательного контроля связывания с Т-клеточными линиями использовали супернатант нетрансфицированных клеток СНО. Одноцепочечную конструкцию с нерелевантной целевой специфичностью использовали в качестве отрицательного контроля связывания с CAIX-трансфицированными клетками СНО.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002).
Биспецифическое связывание приведенных выше одноцепочечных молекул, которые демонстрируют межвидовую специфичность к CAIX и межвидовую специфичностью к CD3 человека и примата, не являющегося шимпанзе, четко определялось, как показано на Фиг.35. В FACS-анализе все конструкции демонстрировали связывание с CD3 и CAIX при сравнении с соответствующими отрицательными контролями. Была продемонстрирована межвидовая специфичность биспецифических антител к антигенам CD3 и CAIX человека и примата, не являющегося шимпанзе.
24.6. Биологическая активность CAIX- и CD3-биспецифических одноцепочечных антител с межвидовой специфичностью
Биологическую активность созданных биспецифических одноцепочечных антител анализировали по высвобождению хрома 51 (51Cr) в анализах цитотоксичности in vitro, используя CAIX-положительные клеточные линии, описанные в Примерах 24.1 и 24.2. В качестве эффекторных клеток использовали стимулированные СD4/СD56-истощенные РВМС человека, стимулированные РВМС человека или Т-клеточную линию макака 4119LnPx, как показано в соответствующих графических материалах. Получение стимулированных РВМС человека осуществляли следующим образом.
На чашку Петри (диаметр 145 мм; Greiner) наносили имеющееся в продаже анти-CD3-специфическое антитело (например, ОКТ3, Othoclone) в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязавшийся белок удаляли за одну стадию промывки, используя PBS. Свежие РВМС выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. 3-5×107 РВМС добавляли в предварительно покрытую чашку Петри в 120 мл RPMI 1640 со стабилизирующей добавкой глутамин/10% FCS/IL-2 20 ед./мл (пролейкин, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали и промывали один раз RPMI 1640. Добавляли IL-2 до конечной концентрации 20 ед./мл и клетки снова культивировали в течение одних суток в той же среде для культивирования клеток, как упомянуто выше.
Получение стимулированных СD4/СD56-истощенных РВМС человека осуществляли следующим образом.
На чашку Петри (диаметр 145 мм; Greiner) наносили имеющееся в продаже анти-CD3-специфическое антитело (например, ОКТ3, Othoclone) в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязавшийся белок удаляли за одну стадию промывки, используя PBS. Свежие РВМС выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. 3-5×107 РВМС добавляли в предварительно покрытую чашку Петри в 120 мл RPMI 1640 со стабилизирующей добавкой глутамин/10% FCS/IL-2 20 ед./мл (пролейкин, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали и промывали один раз RPMI 1640. Добавляли IL-2 до конечной концентрации 20 ед./мл и клетки снова культивировали в течение одних суток в той же среде для культивирования клеток, как упомянуто выше. CD8+ цитотоксические Т-лимфоциты (CTL) обогащали посредством истощения CD4+ Т-клеток и CD56+ NK клеток согласно стандартным протоколам.
Клетки-мишени дважды промывали PBS и метили 11,1 МБк51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 45 минут при 37°С.После этого меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали в анализе цитотоксичности. Анализ осуществляли в 96-луночном планшете в конечном объеме 250 мкл дополненной среды RPMI (как и выше) с отличающимися соотношениями Е:Т от 5:1 до 50:1, которые указаны в соответствующих графических материалах. Наносили 1 мкг/мл молекул биспецифического одноцепочечного антитела с межвидовой специфичностью и 20 их трехкратных разведении. Время анализа составляло 16 часов, и цитотоксичность измеряли в относительных величинах высвобожденного хрома в супернатанте, соответствующих разнице между максимальным лизисом (добавление Тритона-Х) и спонтанным лизисом (без эффекторных клеток). Все измерения осуществляли в четырех повторностях. Измерение радиоактивности хрома в супернатантах осуществляли с использованием гамма-счетчика Wizard 3" (Perkin Elmer Life Sciences GmbH, Koln, Germany). Анализ экспериментальных данных осуществляли с применением Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA). Сигмоидальные кривые доза-эффект обычно имеют величины R2 выше 0,90, как определено с использованием этого программного обеспечения. Величины ЕС50, рассчитанные с помощью данной программы анализа, использовали для сравнения биологической активности.
Как показано на Фиг.36, все созданные конструкции биспецифических одноцепочечных антител с межвидовой специфичностью демонстрировали цитотоксическую активность против клеток-мишеней, положительных в отношении CAIX человека, индуцированных стимулированными CD4/CD56-истощенными РВМС человека или стимулированными РВМС человека, и против клеток-мишеней, положительных в отношении CAIX макака, индуцированных Т-клеточной линией макака 4119LnPx.
25. Создание и характеристика EpCAN- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
Конструирование EpCAN-специфических биспецифических антител
Основой для конструирования EpCAN-специфических биспецифических антител служило полностью человеческое, EpCAN-специфическое антитело HD69 (Raum et al. Cancer Immunol. Immunother. (2001) 50: 141 ff). VH и VL амплифицировали с помощью ПЦР с ДНК HD69 согласно стандартным методам. Затем VH и VL клонировали в плазмиду, создавая таким образом функциональный scFv (ориентация VН-линкер-VL) согласно стандартным протоколам. Эту scFv-содержащую конструкцию затем амплифицировали с помощью ПЦР, используя праймеры, вводящие N-концевой сайт рестрикции для BsrGI и С-концевой сайт рестрикции для BspE1, полезные для функционального клонирования в формат биспецифического антитела (5'-HD69-BsrG1: 5'-gacaggtgtacactccgaggtgcagctgctcgagtctgg-3'; 3'-HD69-BspE1: 5'-tgatagtccggatttgatctccagcttggtcc-3'). ПЦР-продукт затем клонировали в три подходящих экспрессирующих вектора, каждый из которых содержал одну CD3-специфическую комбинацию VH и VL, обладающую межвидовой специфичностью к CD3 человека и макака (Н2С HL, F12Q HL и I2C, соответственно), кодируя тем самым три функциональные биспецифические конструкции HD69 HL×Н2С HL, HD69 HL×F12Q HL и HD69 HL×I2C HL. Затем эти конструкции посредством электропорации трансфицировали в дефектные по DHFR клетки СНО для стабильной трансфекции в соответствии со стандартными методиками, получая в результате три пула трансфицированных клеток, каждый из которых экспрессировал один из трех биспецифических продуктов.
Биологическую активность созданных биспецифических одноцепочечных антител (в супернатантах культур клеток СНО, экспрессирующих соответствующие биспецифические конструкции) анализировали по высвобождению хрома 51 (51Cr) в анализах цитотоксичности in vitro, используя EpCAN-положительную клеточную линию СНО-ЕрСАМ (экспрессирующую связанную с поверхностью ЕрСАМ человека, опубликованную в Raum et al. Cancer Immunol. Immunother. (2001) 50: 141 ff) в качестве клеток-мишеней. В качестве эффекторных клеток использовали стимулированные CD8-положительные Т-клетки человека. Как показано на Фиг.37, все созданные конструкции биспецифических одноцепочечных антител демонстрировали цитотоксическую активность против клеток-мишеней, положительных в отношении ЕрСАМ человека, индуцированных CD8+-клетками человека. В качестве отрицательного контроля использовали супернатант культуры нетрансфицированных клеток СНО, которые не демонстрировали никакой детектируемой цитотоксичности.
Чтобы продемонстрировать межвидовую активность созданных биспецифических конструкций на СD3-"плече", осуществляли проточно-цитометрический анализ, в котором подтверждали связывание данных конструкций с клетками, экспрессирующими CD3 человека, и клетками, экспрессирующими CD3 макака. Кроме того, исследовали специфичность к EpCAN-положительным клеткам.
Кратко, клетки СНО, трансфицированные ЕрСАМ человека, и CD3-положительные Т-клетки человека в выделенных РВМС человека использовали для тестирования связывания с антигенами человека. Активность связывания с CD3-антигеном макака тестировали с использованием Т-клеточной линии макака 4119LnPx (любезно предоставленной проф. Fickenscher, Hygiene Institute, Virology, Erlangen-Nuernberg; опубликованной в Knappe A, et al., и Fickenscher H., Blood 2000, 95, 3256-61). 200000 клеток соответствующих клеточных линий инкубировали в течение 30 мин на льду с супернатантом клеточной культуры трансфицированных клеток, экспрессирующих конструкции биспецифических антител с межвидовой специфичностью к CD3. Клетки дважды промывали в PBS с 2% FCS, и связывание конструкции определяли с использованием мышиного анти-His-антитела (Penta-His-антитело; Qiagen; разбавленное 1:20 в 50 мкл PBS с 2% FCS). После промывки связавшиеся анти-His-антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. Супернатант нетрансфицированных клеток СНО использовали в качестве отрицательного контроля связывания с Т-клеточными линиями.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002).
Биспецифическое связывание одноцепочечных молекул, которые демонстрируют специфичность к ЕрСАМ человека и межвидовую специфичность к CD3 человека и макака, четко определялось, как показано на Фиг.38. В проточно-цитометрическом анализе все конструкции демонстрировали связывание с CD3 и ЕрСАМ при сравнении с соответствующими отрицательными контролями и с EpCAM/CD3-отрицательной линией клеток СНО.
26. Создание и характеристика EGFRvIII- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
26.1. Получение и экспрессия клеток СНО, трансфицированных EGFRvIII человека
Кодирующую последовательность С-концевого, трансмембранного и цитоплазматического домена мутантного рецептора эпидермального фактора роста (DeltaEGFR, de2-7 EGFR или EGFRvIII используются как синонимы), содержащую делецию 267 аминокислот внеклеточного домена (Kuan СТ, Wikstrand CJ, Bigner DD: EGF mutant receptor vIII as a molecular target in cancer therapy; Endocr. Relat. Cancer. 2001 Jun; 8(2): 83-96) получали генным синтезом согласно стандартным протоколам. Фрагмент генного синтеза конструировали таким образом, чтобы он содержал сначала сайт Козака для эукариотической экспрессии данной конструкции, затем кодирующую последовательность лидерного пептида из 24 аминокислот, затем, в рамке считывания, кодирующую последовательность С-концевого внеклеточного домена, трансмембранного и цитоплазматического домена человека и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести сайты рестрикции в начало и в конец данного фрагмента ДНК. Сайты распознавания ферментами рестрикции XbaI и SalI на 5'- и 3'-конце, соответственно, вводили с целью клонирования. Синтезированную ДНК затем расщепляли XbaI и SalI, лигировали в соответствующим образом расщепленный вектор pEF-DHFR и подвергали трансформации в Е. coli. Клон с подтвержденной нуклеотидной последовательностью (последовательность кДНК и аминокислотная последовательность рекомбинантной конструкции представлены в SEQ ID NO:
599 и 598) трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано выше.
26.2. Создание и экспрессия EGFRvIII яванского макака По аналогии с примером 26.1 создавали вариант vIII EGFR яванского макака путем делеции 267 аминокислот из внеклеточного домена и вставки новой аминокислоты глицина в сайт слияния (аминокислота №6).
Фрагмент генного синтеза конструировали таким образом, чтобы он содержал сначала сайт Козака для эукариотической экспрессии данной конструкции, затем кодирующую последовательность лидерного пептида из 24 аминокислот, затем, в рамке считывания, кодирующую последовательность С-концевого внеклеточного домена яванского макака, трансмембранного и цитоплазматического домена (в обоих случаях человека) и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести сайты рестрикции в начало и в конец данного фрагмента ДНК. Введенные сайты рестрикции, XbaI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Данный фрагмент расщепляли XbaI/SalI и клонировали в pEF-DHFR, следуя стандартным протоколам. Плазмиду с подтвержденной нуклеотидной последовательностью использовали для трансфекции клеток CHO/dhfr- (ATCC № CRL 9096, культивируемых в среде RPMI 1640 со стабилизирующей добавкой глутамина, полученной от Biochrom AG Berlin, Germany, дополненной 10% FCS, 1% пенициллина/стрептомицина (все от Biochrom AG Berlin, Germany) и нуклеозидами из концентрированного раствора реагентов со степенью чистоты "для клеточных культур" (Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany) до конечной концентрации 10 мкг/мл аденозина, 10 мкг/мл дезоксиаденозина и 10 мкг/мл тимидина, в инкубаторе при 37°С, 95% влажности и 7% СС>2.) Трансфекцию осуществляли с помощью реагента для трансфекции PolyFect (Qiagen GmbH, Hilden, Germany) и 5 мкг плазмидной ДНК в соответствии с протоколом производителя. После культивирования в течение 24 часов клетки промывали один раз PBS и снова культивировали в упомянутой выше клеточной культуральной среде, за исключением того, что она не была дополнена нуклеозидами, и использовали диализованную FCS, полученную от Biochrom AG Berlin, Germany. Таким образом, клеточная культуральная среда не содержала нуклеозидов, и поэтому селекцию осуществляли на трансфицированных клетках. Приблизительно через 14 суток после осуществления трансфекции наблюдали рост устойчивых клеток. Еще через 7-14 суток трансфектанты определили как положительные в отношении экспрессии конструкции с помощью FACS-анализа.
26.3. Создание EGFRvIII- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
В общем случае, молекулы биспецифических одноцепочечных антител, каждое из которых содержит домен со специфичностью связывания с антигеном CD3 человека и примата, не являющегося шимпанзе, а также домен со специфичностью связывания с антигеном EGFRvIII человека и примата, не являющегося шимпанзе, конструировали, как представлено в следующей ниже Таблице 9.
Вышеупомянутые конструкции, содержащие вариабельные домены легкой цепи (L) и вариабельные домены тяжелой цепи (Н) с межвидовой специфичностью к EGFRvIII человека и яванского макака и CD3-специфические VH- и VL-комбинации, демонстрирующие межвидовую специфичность к CD3 человека и макака, получали генным синтезом. Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность соответствующей молекулы биспецифического одноцепочечного антитела, затем, в рамке считывания, кодирующую последовательность состоящей из 6 гистидиновых остатков метки и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через эти сайты рестрикции в плазмиду, обозначенную pEF-DHFR, следуя стандартным протоколам. Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно. Альтернативно, конструкции использовали для временной трансфекции дефектных по DHFR клеток СНО согласно стандартным протоколам.
Для оценки способности связываться с антигеном EGFRvIII человека осуществляли эксперименты по связыванию с использованием FACS на клеточной линии СНО, трансфицированной EGFRvIII человека. Межвидовую специфичность к ткани яванского макака тестировали, используя клетки СНО, трансфицированные EGFRvIII яванского макака. Такие же изменения в клеточных линиях используют в анализах цитотоксичности, проводимых с EGFRvIII- и CD3-биспецифическими одноцепочечными антителами с межвидовой специфичностью. За исключением этого анализы осуществляли, как описано в Примерах 4 и 5. Как показано на Фиг.39, созданные EGFRvIII- и CD3-биспецифические одноцепочечные антитела с межвидовой специфичностью демонстрировали связывание с антигенами как человека, так и яванского макака, подтверждая свою полную межвидовую специфичность.
Как показано на Фиг.40, все созданные конструкции биспецифических одноцепочечных антител с межвидовой специфичностью демонстрировали цитотоксическую активность против клеток-мишеней, положительных в отношении EGFRvIII человека, индуцированных CD8+ клетками человека, и клеток-мишеней, положительных в отношении EGFRvIII яванского макака, индуцированных Т-клеточной линией макака 4119LnPx. В качестве отрицательного контроля использовали нерелевантное биспецифическое одноцепочечное антитело.
27. Создание и характеристика IgE- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
27.1. Клонирование и экспрессия мембраносвязанной формы IgE человека и макака
Мышиную клеточную линию J558L (полученную из Interlab Project, Istituto Nazionale per la Ricerca sul Cancro, Geneva, Италия, ЕСАСС 88032902), вариант миеломной клеточной линии со спонтанной потерей тяжелой цепи, которая синтезирует и секретирует легкую цепь лямбда, использовали для комплементации вариантом мембраносвязанной тяжелой цепи IgE человека и макака, соответственно. Для создания таких конструкций синтетические молекулы получали генным синтезом согласно стандартным протоколам (нуклеотидные последовательности конструкций представлены в SEQ ID NO:
595 и 594). В этих конструкциях кодирующую последовательность эпсилон-цепи CD3 человека и макака подвергали слиянию с трансмембранной областью IgE человека, соответственно. Встроенная специфичность VH-цепи направлена против гаптена ((4-гидрокси-3-нитро-фенил)ацетил) (NP). Фрагмент генного синтеза конструировали также таким образом, чтобы он содержал сайт Козака для эукариотической экспрессии данной конструкции, иммуноглобулиновый лидерный пептид и сайты рестрикции в начале и в конце ДНК. Введенные сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали во время стадии клонирования в экспрессирующую плазмиду, обозначенную pEF-DHFR. После подтверждения последовательности (макак: ХМ_001116734: эпсилон-С-область Ig макака резуса (Масаса mulatta), мРНК; человек: МС_000014: хромосома 14 Homo sapiens, полная последовательность, Национальный центр биотехнологической информации, http://www.ncbi.nlm.nih.gov/entrez) данные плазмиды использовали для трансфекции клеток CHO/dhfr-, как описано выше. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляют, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцируют путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
27.2. Создание IgE- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
В общем случае, молекулы биспецифических одноцепочечных антител, каждое из которых содержит домен со специфичностью связывания с CD3-антигеном человека и примата, не являющегося шимпанзе, а также домен со специфичностью связывания с IgE-антигеном человека и примата, не являющегося шимпанзе, конструировали, как представлено в следующей ниже Таблице 10.
Вышеупомянутые конструкции, содержащие вариабельные домены легкой цепи (L) и вариабельные домены тяжелой цепи (Н) с межвидовой специфичностью к IgE человека и макака, и CD3-специфические VH- и VL-комбинации, демонстрирующие межвидовую специфичность к CD3 человека и макака, получали генным синтезом. Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность соответствующей молекулы биспецифического одноцепочечного антитела, затем, в рамке считывания, кодирующую последовательность состоящей из 6 гистидиновых остатков метки и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через эти сайты рестрикции в плазмиду, обозначенную pEF-DHFR, следуя стандартным протоколам. Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно. Альтернативно, конструкции использовали для временной трансфекции дефектных по DHFR клеток СНО согласно стандартным протоколам.
Для оценки способности связываться с IgЕ человека осуществляли эксперименты по связыванию с использованием FACS на клеточной линии J558L, трансфицированной IgЕ человека. Межвидовую специфичность к клеткам, положительным в отношении IgЕ макака, тестировали, используя клетки J558L, трансфицированные IgЕ макака. Эксперименты по связыванию, а также анализы цитотоксичности осуществляли, как описано выше.
Как показано на Фиг.41, созданные IgЕ- и CD3-биспецифические одноцепочечные антитела с межвидовой специфичностью демонстрировали связывание с антигенами как человека, так и яванского макака, подтверждая свою полную межвидовую специфичность.
Как показано на Фиг.42, все созданные конструкции биспецифических одноцепочечных антител с межвидовой специфичностью демонстрировали цитотоксическую активность против клеток-мишеней, положительных в отношении IgЕ человека, индуцированных CD8+ клетками человека, и клеток-мишеней, положительных в отношении IgЕ макака, индуцированных Т-клеточной линией макака 4119LnPx. В качестве отрицательного контроля использовали нерелевантное биспецифическое одноцепочечное антитело.
28. Создание и характеристика CD44- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
28.1. Получение клеток СНО, экспрессирующих CD44 человека
Кодирующую последовательность CD44 человека, опубликованную в GenBank (номер доступа AJ251595) и также содержащую экзон CD44v6, получали генным синтезом согласно стандартным протоколам. Фрагмент генного синтеза конструировали таким образом, чтобы он содержал сначала сайт Козака для эукариотической экспрессии данной конструкции, затем кодирующую последовательность белка CD44 человека и стоп-кодон (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO: 608 и 609). Фрагмент генного синтеза конструировали также таким образом, чтобы ввести сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через EcoRI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Упомянутые выше методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
28.2. Получение клеток СНО, экспрессирующих CD44 человека без экзона v6
Кодирующую последовательность CD44 человека, опубликованную в GenBank (номер доступа AJ251595), с делетированной последовательностью, кодирующей экзон v6, получали генным синтезом согласно стандартным протоколам. Фрагмент генного синтеза конструировали таким образом, чтобы он содержал сначала сайт Козака для эукариотической экспрессии данной конструкции, затем кодирующую последовательность белка CD44 человека без экзона v6 и стоп-кодон (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO: 610 и 611). Фрагмент генного синтеза конструировали также таким образом, чтобы ввести сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через EcoRI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Упомянутые выше методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
28.3. Получение клеток СНО, экспрессирующих CD44 макака Кодирующую последовательность CD44 макака, опубликованную в GenBank (номер доступа ХМ_001115359) и также содержащую экзон CD44v6, получали генным синтезом согласно стандартным протоколам (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO: 612 и 613). В используемой конструкции кодирующая последовательность соответствует CD44 макака за исключением точечной мутации в положении 1 кодона пятой аминокислоты сигнального пептида белка CD44, которая приводит к замене аргинина на триптофан в соответствии с последовательностью человека. Кроме того, фрагмент генного синтеза конструировали таким образом, чтобы он содержал сайт Козака для эукариотической экспрессии данной конструкции и сайты рестрикции в начале и в конце фрагмента. Введенные сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза затем клонировали через EcoRI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Клон с подтвержденной нуклеотидной последовательностью этой плазмиды использовали для трансфекции клеток CHO/dhfr-, как описано выше.
28.4. Создание CD44v6- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
В общем случае, молекулы биспецифических одноцепочечных антител, каждое из которых содержит домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD3-эпсилон человека и примата, не являющегося шимпанзе, а также домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD44v6 человека и примата, не являющегося шимпанзе, конструируют, как представлено в следующей ниже Таблице 11.
Вышеупомянутые конструкции, содержащие вариабельные домены легкой цепи (L) и вариабельные домены тяжелой цепи (И) с межвидовой специфичностью к CD44 человека и макака, и CD3-специфические VH- и VL-комбинации, демонстрирующие межвидовую специфичность к CD3 человека и макака, получают генным синтезом. Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность соответствующей молекулы биспецифического одноцепочечного антитела, затем, в рамке считывания, кодирующую последовательность гистидин6-метки и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через эти сайты рестрикции в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Упомянутые выше методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
28.5. Экспрессия и очистка молекул биспецифических одноцепочечных антител
Молекулы биспецифических одноцепочечных антител экспрессировали в клетках яичника китайского хомячка (СНО). Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкций индуцировали путем добавления увеличивающихся концентраций МТХ до конечных концентраций 20 нМ МТХ включительно. После двух пассажей стационарной культуры клетки выращивали в роллерных флаконах в жидкой соевой среде HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone) в течение 7 суток перед сбором. Клетки выделяли центрифугированием и супернатант, содержащий экспрессированный белок, хранили при -20°С.Альтернативно, осуществляли временную экспрессию конструкций в клетках НЕК 293. Трансфекцию осуществляли с помощью реагента 293fectin (Invitrogen, №12347-019) в соответствии с протоколом производителя.
Для хроматографии использовали систему Akta® Explorer (GE Health Systems) и программное обеспечение Unicorn®. Аффинную хроматографию с иммобилизованным металлом ("IMAC") осуществляли с использованием Fractogel EMD chelate® (Merck), который нагружали ZnCb в соответствии с протоколом, предложенным производителем. Колонку уравновешивали буфером А (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl), и супернатант клеточной культуры (500 мл) наносили на колонку (10 мл) при скорости потока 3 мл/мин. Колонку промывали буфером А для удаления несвязавшегося образца. Связавшийся белок элюировали с использованием двухстадийного градиента буфера В (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl; 0,5 М имидазол) в соответствии со следующим протоколом:
стадия 1: 20% буфера В в 6 объемах колонки,
стадия 2: 100% буфера В в 6 объемах колонки.
Элюированные белковые фракции со стадии 2 объединяли для дальнейшей очистки. Все химические реактивы имели степень чистоты, подходящую для исследований, и были приобретены у Sigma (Deisenhofen) или Merck (Darmstadt).
Гель-фильтрацию осуществляли на препаративной колонке HiLoad 16/60 Superdex 200 (GE/Amersham), уравновешенной Equi-буфером (25 мМ цитрат; 200 мМ лизин; 5% глицерин; рН 7,2). Элюированные белковые образцы (скорость потока 1 мл/мин) подвергали стандартным SDS-PAGE и вестерн-блоттингу для детекции. Перед очисткой колонку калибровали для определения молекулярной массы (набор маркеров молекулярной массы, Sigma MW GF-200). Концентрацию белка определяли, используя OD при 280 нм.
Очищенный белок, биспецифическое одноцепочечное антитело, анализировали с использованием SDS-PAGE в восстанавливающих условиях и предварительно залитых 4-12%-ных гелей в бис-Трис-буфере (Invitrogen). Приготовление и нанесение образцов осуществляли согласно протоколу, предложенному производителем. Молекулярную массу определяли, используя белковый стандарт MultiMark (Invitrogen). Гель окрашивали коллоидным Coomassie (протокол Invitrogen). Чистота выделенного белка составляет более 95%, как определено SDS-PAGE.
Биспецифическое одноцепочечное антитело имеет молекулярную массу примерно 52 кДа в нативных условиях, как определено гель-фильтрацией в PBS. Все конструкции очищали согласно данному методу.
Вестерн-блоттинг осуществляли, используя мембрану Optitran® BA-S83 в аппарате для блоттинга Invitrogen в соответствии с протоколом, предложенным производителем. Для детекции белка биспецифического одноцепочечного антитела использовали антитело против His-метки (Penta-His, Qiagen). Антитело козы против Ig мыши, меченое щелочной фосфатазой (АР) (Sigma), использовали в качестве вторичного антитела, a BCIP/NBT (Sigma) в качестве субстрата. Определили единственную полосу при 52 кДа, соответствующую очищенному биспецифическому одноцепочечному антителу.
28.6. Проточно-цитометрический анализ связывания CD44- и CD3-биспецифических антител с межвидовой специфичностью
С целью тестирования функциональности конструкций биспецифических антител с межвидовой специфичностью в отношении способности связываться с CD44 и CD3 человека и макака, соответственно, осуществляли FACS-анализ. Для этого клетки СНО, трансфицированные CD44 человека, как описано в Примере 28.1, и CD3-положительную линию клеток HPB-ALL Т-клеточного лейкоза человека (DSMZ, Braunschweig, ACC483) использовали для тестирования связывания с антигенами человека. Способность связываться с антигенами макака тестировали с использованием созданного CD44-трансфектанта макака, описанного в Примере 28.3, и РВМС макака (получение РВМС макака осуществляли с применением центрифугирования в градиенте фиколла периферической крови обезьян макаков согласно стандартным протоколам). Специфичность к экзону v6 CD44 тестировали с использованием трансфицированных клеток СНО, экспрессирующих CD44 человека без экзона v6, полученных, как описано в Примере 28.2. 200000 клеток соответствующих клеточных линий или РМВС макака инкубировали в течение 30 мин на льду с 50 мкл очищенного белка конструкций биспецифических антител с межвидовой специфичностью (5 мкг/мл) или с 50 мкл имеющегося в продаже анти-CD44-антитела (Becton Dickinson biosciences, Heidelberg; также 5 мкг/мл). Клетки дважды промывали в PBS с 2% FCS, и связывание конструкции определяли с использованием мышиного анти-his-антитела (Penta-His-антитело; Qiagen; разбавленное 1:20 в 50 мкл PBS с 2% FCS). Анти-his-антитело не использовали для образцов, инкубируемых с имеющимся в продаже анти-CD44-антителом. После промывки связавшееся анти-his-антитело или анти-CD44-антитело определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. В качестве отрицательного контроля использовали PBS с 2% FCS.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002).
Биспецифическое связывание приведенных выше одноцепочечных молекул, которые демонстрируют межвидовую специфичность к CD44 и межвидовую специфичность к CD3 человека и примата, не являющегося шимпанзе, четко определялось, как показано на Фиг.43. В FACS-анализе все конструкции демонстрировали связывание с CD3 и CD44 при сравнении с соответствующими отрицательными контролями. Была продемонстрирована межвидовая специфичность биспецифических антител к антигенам CD3 и CD44 человека и макака.
Специфичность к экзону v6 CD44 продемонстрирована на Фиг.44 посредством отсутствия связывания данных конструкций с клетками СНО, трансфицированными CD44 человека без экзона v6. Экспрессия CD44 этими клетками продемонстрирована посредством сравнительного связывания имеющегося в продаже анти-CD44-антитела с этими клетками и с клетками СНО, трансфицированными полноразмерным CD44 человека.
28.7. Биологическая активность CD44- и CD3-биспецифических одноцепочечных антител с межвидовой специфичностью
Биологическую активность созданных биспецифических одноцепочечных антител анализировали по высвобождению хрома 51 (51Cr) в анализах цитотоксичности in vitro, используя СD44-положительную клеточную линию, описанную в Примере 28.1. В качестве эффекторных клеток использовали стимулированные СD4/СD56-истощенные РВМС человека.
Получение стимулированных РВМС осуществляли следующим образом.
На чашку Петри (диаметр 145 мм; Greiner) наносили имеющееся в продаже анти-CD3-специфическое антитело (например, ОКТ3, Othoclone) в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязавшийся белок удаляли за одну стадию промывки, используя PBS. Свежие РВМС выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. 3-5×107 РВМС добавляли в предварительно покрытую чашку Петри в 120 мл RPMI 1640 со стабилизирующей добавкой глутамин/10% FCS/IL-2 20 ед./мл (пролейкин, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали и промывали один раз RPMI 1640. Добавляли IL-2 до конечной концентрации 20 ед./мл и клетки снова культивировали в течение одних суток в той же среде для культивирования клеток, как упомянуто выше.
CD8+ цитотоксические Т-лимфоциты (CTL) обогащали посредством истощения CD4+Т-клеток и CD56+МК-клеток согласно стандартным протоколам.
Клетки-мишени дважды промывали PBS и метили 11,1 МБк51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 45 минут при 37°С.После этого меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали в анализе цитотоксичности. Анализ осуществляли в 96-луночном планшете в конечном объеме 250 мкл дополненной среды RPMI (как и выше) с соотношением Е:Т 10:1. Наносили 1 мкг/мл молекул биспецифического одноцепочечного антитела с межвидовой специфичностью и 20 их трехкратных разведении. Время анализа составляло 18 часов, и цитотоксичность измеряли в относительных величинах высвобожденного хрома в супернатанте, соответствующих разнице между максимальным лизисом (добавление Тритона-X) и спонтанным лизисом (без эффекторных клеток). Все измерения осуществляли в четырех повторностях. Измерение радиоактивности хрома в супернатантах осуществляли с использованием гамма-счетчика Wizard 3" (Perkin Elmer Life Sciences GmbH, Koln, Germany). Анализ экспериментальных данных осуществляли с применением Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA). Сигмоидальные кривые доза-эффект обычно имеют величины R2 выше 0,90, как определено с использованием этого программного обеспечения. Величины EC50, рассчитанные с помощью данной программы анализа, использовали для сравнения биологической активности.
Как показано на Фиг.45, созданные конструкции биспецифических одноцепочечных антител с межвидовой специфичностью демонстрировали цитотоксическую активность против клеток-мишеней, положительных в отношении CD44 человека, индуцированных стимулированными CD4/CD56-истощенными РВМС человека.
29. Создание и характеристика CD30- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
29.1. Получение клеток СНО, экспрессирующих CD30 человека
Кодирующую последовательность CD30 человека, опубликованную в GenBank (номер доступа М83554), получали генным синтезом согласно стандартным протоколам. Фрагмент генного синтеза конструировали таким образом, чтобы он содержал сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность зрелого белка CD30 человека и стоп-кодон (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO: 1103 и 1104). Фрагмент генного синтеза конструировали также таким образом, чтобы ввести сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Внутренние сайты рестрикции удаляли посредством молчащей мутации кодирующей последовательности во фрагменте генного синтеза (BsrGI: нуклеотид 243 с Т на С; SalI: нуклеотид 327 с А на G; SalI: нуклеотид 852 с А на G; EcoRI: нуклеотид 1248 с Т на С). Фрагмент генного синтеза клонировали через EcoRI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Упомянутые выше методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
29.2. Получение клеток СНО, экспрессирующих CD30 макака Последовательность кДНК CD30 макака получали в результате серии из 4 ПЦР на кДНК из костного мозга макака согласно стандартным протоколам. Использовали следующие условия реакции: 1 цикл при 94°С в течение 2 минут, затем 35 циклов при 94°С в течение 1 минуты, при 55°С в течение 1 минуты и при 72°С в течение 1 минуты, затем заключительный цикл при 72°С в течение 3 минут, и следующие праймеры:
6) прямой праймер: 5'-cctcgccgcgctgggactgc-3',
обратный праймер: 5'-ggtgccactggagggttccttgc-3';
7) прямой праймер: 5'-gcttcttccattctgtctgcccagcagg-3',
обратный праймер: 5'-ggtaggggacacagcgggcacaggagttgg-3';
8) прямой праймер: 5'-cctggcatgatctgtgccacatcagcc-3',
обратный праймер: 5'-gcgttgagctcctcctgggtctgg-3';
9) прямой праймер: 5'-cctcccrgcccaagctagagcttgtgg-3',
обратный праймер: 5'-
cgactctagagcggccgctcactttccagaggcagctgtgggcaaggggtcttctttcccttcc-3'.
ПЦР-реакции осуществляли с добавлением бетаина со степенью чистоты "для ПЦР" до конечной концентрации 1 М. В результате проведения этих ПЦР получали четыре перекрывающихся фрагмента, которые выделяли и секвенировали согласно стандартным протоколам, используя эти ПЦР-праймеры, и таким образом получали участок последовательности кДНК, кодирующую CD30 макака от кодона 12 лидерного пептида до кодона 562 зрелого белка. С целью создания конструкции для экспрессии CD30 макака получали фрагмент кДНК генным синтезом согласно стандартным протоколам (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO: 1105 и 1106). В этой конструкции кодирующую последовательность CD30 макака от аминокислоты 12 лидерного пептида до аминокислоты 562 зрелого белка CD30 подвергали слиянию с кодирующей последовательностью CD30 человека, заменяя соответствующую часть в кодирующей последовательности человека. Кроме того, фрагмент генного синтеза конструировали таким образом, чтобы он содержал сайт Козака для эукариотической экспрессии данной конструкции и сайты рестрикции в начале и в конце фрагмента, содержащего кДНК, кодирующую целый внеклеточный домен CD30 макака, трансмембранный домен CD30 макака и химерный (макак-человек) внутриклеточный CD30 домен. Введенные сайты рестрикции, XbaI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза затем клонировали через XbaI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150). Клон с подтвержденной последовательностью этой плазмиды использовали для трансфекции клеток CHO/dhfr-, как описано выше.
29.3. Создание CD30- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
Клонирование связывающих молекул с межвидовой специфичностью
В общем случае, молекулы биспецифических одноцепочечных антител, каждое из которых содержит домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD3-эпсилон человека и примата, не являющегося шимпанзе, а также домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD30 человека и примата, не являющегося шимпанзе, конструируют, как представлено в следующей ниже Таблице 12.
Вышеупомянутые конструкции, содержащие вариабельные домены легкой цепи (L) и вариабельные домены тяжелой цепи (Н) с межвидовой специфичностью к CD30 человека и макака, и CD3-специфические VH- и VL-комбинации, демонстрирующие межвидовую специфичность к CD3 человека и макака, получали генным синтезом. Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность данного фрагмента биспецифического тандемного одноцепочечного антитела, затем, в рамке считывания, кодирующую последовательность состоящей из 6 гистидиновых остатков метки и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через эти сайты рестрикции в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Упомянутые выше методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данного фрагмента биспецифического тандемного одноцепочечного антитела. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно. 29.4. Экспрессия и очистка фрагмента биспецифического тандемного одноцепочечного антитела
Данный фрагмент биспецифического тандемного одноцепочечного антитела экспрессировали в клетках яичника китайского хомячка (СНО). Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкций индуцировали путем добавления увеличивающихся концентраций МТХ до конечных концентраций 20 нМ МТХ включительно. После двух пассажей стационарной культуры клетки выращивали в роллерных флаконах в жидкой соевой среде HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone) в течение 7 суток перед сбором. Клетки выделяли центрифугированием и супернатант, содержащий экспрессированный белок, хранили при -20°С. Альтернативно, осуществляли временную экспрессию конструкций в клетках НЕК 293. Трансфекцию осуществляли с помощью реагента 293fectin (Invitrogen, №12347-019) в соответствии с протоколом производителя.
Для хроматографии использовали систему Akta® Explorer (GE Health Systems) и программное обеспечение Unicorn®. Аффинную хроматографию с иммобилизованным металлом ("IMAC") осуществляли с использованием Fractogel EMD chelate® (Merck), который нагружали ZnCb в соответствии с протоколом, предложенным производителем. Колонку уравновешивали буфером А (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl), и супернатант клеточной культуры (500 мл) наносили на колонку (10 мл) при скорости потока 3 мл/мин. Колонку промывали буфером А для удаления несвязавшегося образца. Связавшийся белок элюировали с использованием двухстадийного градиента буфера В (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl; 0,5 М имидазол) в соответствии со следующим протоколом:
стадия 1: 20% буфера В в 6 объемах колонки,
стадия 2: 100% буфера В в 6 объемах колонки.
Элюированные белковые фракции со стадии 2 объединяли для дальнейшей очистки. Все химические реактивы имели степень чистоты, подходящую для исследований, и были приобретены у Sigma (Deisenhofen) или Merck (Darmstadt).
Гель-фильтрацию осуществляли на препаративной колонке HiLoad 16/60 Superdex 200 (GE/Amersham), уравновешенной Equi-буфером (25 мМ цитрат;
200 мМ лизин; 5% глицерин; рН 7,2). Элюированные белковые образцы (скорость потока 1 мл/мин) подвергали стандартным SDS-PAGE и вестерн-блоттингу для детекции. Перед очисткой колонку калибровали для определения молекулярной массы (набор маркеров молекулярной массы, Sigma MW GF-200). Концентрацию белка определяли, используя OD при 280 нм.
Очищенный белок, биспецифическое одноцепочечное антитело, анализировали с использованием SDS-PAGE в восстанавливающих условиях и предварительно залитых 4-12%-ных гелей в бис-Трис-буфере (Invitrogen). Приготовление и нанесение образцов осуществляли согласно протоколу, предложенному производителем. Молекулярную массу определяли, используя белковый стандарт MultiMark (Invitrogen). Гель окрашивали коллоидным Coomassie (протокол Invitrogen). Чистота выделенного белка составляет более 95%, как определено SDS-PAGE.
Биспецифическое одноцепочечное антитело имеет молекулярную массу примерно 52 кДа в нативных условиях, как определено гель-фильтрацией в PBS. Все конструкции очищали согласно данному методу.
Вестерн-блоттинг осуществляли, используя мембрану Optitran® BA-S83 в аппарате для блоттинга Invitrogen в соответствии с протоколом, предложенным производителем. Используемыми антителами были антитела, направленные против His-метки (Penta-His, Qiagen), антитело козы против Ig мыши, меченое щелочной фосфатазой (АР) (Sigma), а в качестве субстрата использовали BCIP/NBT (Sigma). Определили единственную полосу при 52 кДа, соответствующую очищенному биспецифическому одноцепочечному антителу.
29.5. Проточно-цитометрический анализ связывания CD30- и CD3-биспецифических антител с межвидовой специфичностью
С целью тестирования функциональности конструкций биспецифических антител с межвидовой специфичностью в отношении способности связываться с CD30 и CD3 человека и макака, соответственно, осуществляли FACS-анализ. Для этого клетки СНО, трансфицированные CD30 человека, как описано в Примере 29.1, CD30-положительную В-клеточную линию МЕС-1 человека (DSMZ, Braunschweig, ACC 497) и CD3-положительную линию клеток HPB-ALL Т-клеточного лейкоза человека (DSMZ, Braunschweig, ACC483) использовали для тестирования связывания с антигенами человека. Способность связываться с антигенами макака тестировали с использованием созданного CD3О-трансфектанта макака, описанного в Примере 29.2, и Т-клеточной линии макака 4119LnPx (любезно предоставленной проф. Fickenscher, Hygiene Institute, Virology, Erlangen-Nuernberg; опубликована в Knappe A, et al., и Fickenscher H., Blood 2000, 95, 3256-61). 200000 клеток соответствующих клеточных линий инкубировали в течение 30 мин на льду с 50 мкл очищенного белка конструкций биспецифических антител с межвидовой специфичностью (5 мкг/мл). Клетки дважды промывали в PBS с 2% FCS, и связывание конструкции определяли с использованием мышиного Penta-His-антитела (Qiagen;
разбавленного 1:20 в 50 мкл PBS с 2% FCS). После промывки связавшиеся анти-His-антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. В качестве отрицательного контроля использовали PBS с 2% FCS.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002).
Биспецифическое связывание приведенных выше одноцепочечных молекул, которые демонстрируют межвидовую специфичность к CD30 и межвидовую специфичностью к CD3 человека и примата, не являющегося шимпанзе, четко определялось, как показано на Фиг.46. В FACS-анализе все конструкции демонстрировали связывание с CD3 и CD30 по сравнению с отрицательным контролем. Была продемонстрирована межвидовая специфичность биспецифических антител к антигенам CD3 и CD30 человека и макака.
29.6. Биологическая активность CD30- и CD3-биспецифических одноцепочечных антител с межвидовой специфичностью
Биологическую активность созданных биспецифических одноцепочечных антител анализировали по высвобождению хрома 51 (51Cr) в анализах цитотоксичности in vitro, используя CD30-положительную В-клеточную линию МЕС-1 (DSMZ, Braunschweig, АСС 497) и клетки СНО, трансфицированные CD30 макака, описанные в Примере 29.2. В качестве эффекторных клеток использовали стимулированные СD4/СD56-истощенные РВМС человека или Т-клеточную линию макака 4119LnPx, соответственно.
Получение стимулированных РВМС человека осуществляли следующим образом.
На чашку Петри (диаметр 145 мм; Greiner) наносили имеющееся в продаже анти-CD3-специфическое антитело (например, ОКТ3, Othoclone) в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязавшийся белок удаляли за одну стадию промывки, используя PBS. Свежие РВМС выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. 3-5×107 РВМС добавляли в предварительно покрытую чашку Петри в 120 мл RPMI 1640 со стабилизирующей добавкой глутамин/10% FCS/IL-2 20 ед./мл (пролейкин, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали и промывали один раз RPMI 1640. Добавляли IL-2 до конечной концентрации 20 ед./мл и клетки снова культивировали в течение одних суток в той же среде для культивирования клеток, как упомянуто выше.
CD8+ цитотоксические Т-лимфоциты (CTL) обогащали посредством истощения CD4+Т-клеток и CD56+МК-клеток согласно стандартным протоколам.
Клетки-мишени дважды промывали PBS и метили 11,1 МБк51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 60 минут при 37°С.После этого меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали в анализе цитотоксичности. Анализ осуществляли в 96-луночном планшете в конечном объеме 250 мкл дополненной среды RPMI (как и выше) с соотношением Е:Т 10:1. Наносили 1 мкг/мл молекул биспецифического одноцепочечного антитела с межвидовой специфичностью и 20 их трехкратных разведении. Время анализа составляло 4 часа для анализа с использованием МЕС-1 и СD4/СD56-истощенных РВМС человека, и 18 часов для анализа с использованием клеток СНО, трансфицированных CD30 макака, и Т-клеточной линии макака 4119LnPx. Цитотоксичность измеряли в относительных величинах высвобожденного хрома в супернатанте, соответствующих разнице между максимальным лизисом (добавление Тритона-Х) и спонтанным лизисом (без эффекторных клеток). Все измерения осуществляли в четырех повторностях. Измерение радиоактивности хрома в супернатантах осуществляли с использованием гамма-счетчика Wizard 3" (Perkin Elmer Life Sciences GmbH, Koln, Germany). Анализ экспериментальных данных осуществляли с применением Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA). Сигмоидальные кривые доза-эффект обычно имеют величины R2 выше 0,90, как определено с использованием этого программного обеспечения. Величины ЕС50, рассчитанные с помощью данной программы анализа, использовали для сравнения биологической активности.
Как показано на Фиг.47, все созданные конструкции биспецифического одноцепочечного антитела с межвидовой специфичностью демонстрировали цитотоксическую активность против клеток-мишеней, положительных в отношении CD30 человека, индуцированных стимулированными CD4/CD56-истощенными РВМС человека, и клеток-мишеней, положительных в отношении CD30 макака, индуцированных Т-клеточной линией макака 4119LnPx.
30. Создание и характеристика HER2- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
30.1. Получение клеток СНО, экспрессирующих HER2 человека
Кодирующую последовательность HER2 человека, опубликованную в GenBank (номер доступа Х03363), получали генным синтезом согласно стандартным протоколам. Фрагмент генного синтеза конструировали таким образом, чтобы он содержал кодирующую последовательность белка HER2 человека, включая его лидерный пептид (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO: 1107 и 1108). Фрагмент генного синтеза конструировали также таким образом, чтобы ввести сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции, XbaI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через XbaI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Упомянутые выше методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
30.2. Получение клеток СНО, экспрессирующих внеклеточный домен HER2 макака
Описанную выше кодирующую последовательность HER2 человека модифицировали так, чтобы она кодировала аминокислоты от 123 до 1038 белка HER2 макака, опубликованную в GenBank (номер доступа ХР_001090430). Кодирующую последовательность этого химерного белка получали генным синтезом согласно стандартным протоколам (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO: 1109 и 1110). Кроме того, фрагмент генного синтеза конструировали таким образом, чтобы он содержал сайт Козака для эукариотической экспрессии данной конструкции и сайты рестрикции в начале и в конце фрагмента. Введенные сайты рестрикции, XbaI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза затем клонировали через XbaI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150). Клон с подтвержденной последовательностью этой плазмиды использовали для трансфекции клеток CHO/dhfr-, как описано выше.
30.3. Создание HER2- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
«локирование связывающих молекул с межвидовой специфичностью
В общем случае, молекулы биспецифических одноцепочечных антител, каждое из которых содержит домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD3-эпсилон человека и примата, не являющегося шимпанзе, а также домен со специфичностью связывания, демонстрирующий межвидовую специфичность к HER2 человека и макака, конструируют, как представлено в следующей ниже Таблице 13.
Вышеупомянутые конструкции, содержащие вариабельные домены легкой цепи (L) и вариабельные домены тяжелой цепи (Н) с межвидовой специфичностью к HER2 человека и макака, и CD3-специфические VH- и VL-комбинации, демонстрирующие межвидовую специфичность к CD3 человека и макака, получали генным синтезом. Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность соответствующей молекулы биспецифического одноцепочечного антитела, затем, в рамке считывания, кодирующую последовательность состоящей из 6 гистидиновых остатков метки и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через эти сайты рестрикции в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Упомянутые выше методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
30.4. Экспрессия и очистка молекул биспецифических одноцепочечных антител
Молекулы биспецифических одноцепочечных антител экспрессировали в клетках яичника китайского хомячка (СНО). Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкций индуцировали путем добавления увеличивающихся концентраций МТХ до конечных концентраций 20 нМ МТХ включительно. После двух пассажей стационарной культуры клетки выращивают в роллерных флаконах в жидкой соевой среде HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone) в течение 7 суток перед сбором. Клетки выделяли центрифугированием и супернатант, содержащий экспрессированный белок, хранили при -80°С. Трансфекцию осуществляли с помощью реагента 293fectin (Invitrogen, №12347-019) в соответствии с протоколом производителя.
Для хроматографии использовали систему Akta® Explorer (GE Health Systems) и программное обеспечение Unicorn®. Аффинную хроматографию с иммобилизованным металлом ("IMAC") осуществляли с использованием Fractogel EMD chelate® (Merck), который нагружали ZnCl2 в соответствии с протоколом, предложенным производителем. Колонку уравновешивали буфером А (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl), и супернатант клеточной культуры (500 мл) наносили на колонку (10 мл) при скорости потока 3 мл/мин. Колонку промывали буфером А для удаления несвязавшегося образца. Связавшийся белок элюировали с использованием двухстадийного градиента буфера В (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl; 0,5 М имидазол) в соответствии со следующим протоколом:
стадия 1: 20% буфера В в 6 объемах колонки,
стадия 2: 100% буфера В в 6 объемах колонки.
Элюированные белковые фракции со стадии 2 объединяли для дальнейшей очистки. Все химические реактивы имели степень чистоты, подходящую для исследований, и были приобретены у Sigma (Deisenhofen) или Merck (Darmstadt).
Гель-фильтрацию осуществляли на препаративной колонке HiLoad 16/60 Superdex 200 (GE/Amersham), уравновешенной Equi-буфером (25 мМ цитрат; 200 мМ лизин; 5% глицерин; рН 7,2). Элюированные белковые образцы (скорость потока 1 мл/мин) подвергали стандартным SDS-PAGE и вестерн-блоттингу для детекции. Перед очисткой колонку калибровали для определения молекулярной массы (набор маркеров молекулярной массы, Sigma MW GF-200). Концентрацию белка определяли, используя OD при 280 нм.
Очищенный белок, биспецифическое одноцепочечное антитело, анализировали с использованием SDS-PAGE в восстанавливающих условиях и предварительно залитых 4-12%-ных гелей в бис-Трис-буфере (Invitrogen). Приготовление и нанесение образцов осуществляли согласно протоколу, предложенному производителем. Молекулярную массу определяли, используя белковый стандарт MultiMark (Invitrogen). Гель окрашивали коллоидным Coomassie (протокол Invitrogen). Чистота выделенного белка составляет более 95%, как определено SDS-PAGE.
Биспецифическое одноцепочечное антитело имеет молекулярную массу примерно 52 кДа в нативных условиях, как определено гель-фильтрацией в PBS. Все конструкции очищали согласно данному методу.
Вестерн-блоттинг осуществляли, используя мембрану Optitran® BA-S83 в аппарате для блоттинга Invitrogen в соответствии с протоколом, предложенным производителем. Для детекции белка биспецифического одноцепочечного антитела использовали антитело против His-метки (Penta-His, Qiagen). Антитело козы против Ig мыши, меченое щелочной фосфатазой (АР) (Sigma), использовали в качестве вторичного антитела, a BCIP/NBT (Sigma) в качестве субстрата. Определили единственную полосу при 52 кДа, соответствующую очищенному биспецифическому одноцепочечному антителу.
30.5. Проточно-цитометрический анализ связывания HER2- и CD3-биспецифических одноцепочечных антител с межвидовой специфичностью
С целью тестирования функциональности конструкций биспецифических антител с межвидовой специфичностью в отношении способности связываться с HER2 и CD3 человека и макака, соответственно, осуществляли FACS-анализ. Для этого клетки СНО, трансфицированные HER2 человека, как описано в Примере 30.1, и CD3-положительную линию клеток HPB-ALL Т-клеточного лейкоза человека (DSMZ, Braunschweig, ACC483) используют для тестирования связывания с антигенами человека. Способность связываться с антигенами макака тестировали с использованием созданного трансфектанта с HER2 макака, описанного в Примере 30.2, и Т-клеточной линии макака 4119LnPx (любезно предоставленной проф. Fickenscher, Hygiene Institute, Virology, Erlangen-Nuernberg; опубликована в Knappe A, et al., и Fickenscher H., Blood 2000, 95, 3256-61). 200000 клеток соответствующих клеточных линий инкубировали в течение 30 мин на льду с 50 мкл очищенного белка конструкций биспецифических антител с межвидовой специфичностью (2 мкг/мл). Клетки дважды промывали в PBS с 2% FCS, и связывание конструкции определяли с использованием мышиного анти-His-антитела (Penta-His-антитело; Qiagen; разбавленного 1:20 в 50 мкл PBS с 2% FCS). После промывки связавшиеся анти-His-антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. PBS с 2% FCS использовали в качестве отрицательного контроля связывания с Т-клеточными линиями, а также с НЕР2-трансфицированными клетками СНО.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002).
Биспецифическое связывание приведенных выше одноцепочечных молекул, которые демонстрируют межвидовую специфичность к HER2 и межвидовую специфичность к CD3 человека и примата, не являющегося шимпанзе, четко определялось, как показано на Фиг.48. В FACS-анализе все конструкции демонстрировали связывание с CD3 и HER2 при сравнении с соответствующими отрицательными контролями. Была продемонстрирована межвидовая специфичность биспецифических антител к антигенам CD3 и HER2 человека и макака.
30.6. Биологическая активность HER2- и CD3-биспецифических одноцепочечных антител с межвидовой специфичностью
Биологическую активность созданных биспецифических одноцепочечных антител анализировали по высвобождению хрома 51 (51Cr) в анализах цитотоксичности in vitro, используя НЕР2-положительные клеточные линии, описанные в Примерах 30.1 и 30.2. В качестве эффекторных клеток использовали нестимулированные СD56-истощенные РВМС человека или Т-клеточную линию макака 4119LnPx, как указано на соответствующих графических материалах.
Получение нестимулированных СD56-истощенных РВМС человека осуществляли следующим образом.
Свежие РВМС выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. Истощение CD56+МК-клеток осуществляли в соответствии со стандартными протоколами.
Клетки-мишени дважды промывали PBS и метили 11,1 МБк51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 45 минут при 37°С. После этого меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали в анализе цитотоксичности. Анализ осуществляли в 96-луночном планшете в конечном объеме 250 мкл дополненной среды RPMI (как и выше) с соотношением Е:Т 10:1. Наносили 1 мкг/мл молекул биспецифического одноцепочечного антитела с межвидовой специфичностью и 15-21 их пятикратных разведении. Время анализа составляло 18 часов, и цитотоксичность измеряли в относительных величинах высвобожденного хрома в супернатанте, соответствующих разнице между максимальным лизисом (добавление Тритона-Х) и спонтанным лизисом (без эффекторных клеток). Все измерения осуществляли в четырех повторностях. Измерение радиоактивности хрома в супернатантах осуществляли с использованием гамма-счетчика Wizard 3" (Perkin Elmer Life Sciences GmbH, Koln, Germany). Анализ экспериментальных данных осуществляли с применением Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA). Сигмоидальные кривые доза-эффект обычно имеют величины R2 выше 0,90, как определено с использованием этого программного обеспечения. Величины ЕС50, рассчитанные с помощью данной программы анализа, использовали для сравнения биологической активности.
Как показано на Фиг.49, все созданные конструкции биспецифического одноцепочечного антитела с межвидовой специфичностью демонстрировали цитотоксическую активность против клеток-мишеней, положительных в отношении HER2 человека, индуцированных нестимулированными CD56- истощенными РВМС, и против клеток-мишеней, положительных в отношении HER2 макака, индуцированных Т-клеточной линией макака 4119LnPx.
31. Очистка биспецифических одноцепочечных молекул с межвидовой специфичностью аффинной хроматографией, основанной на применении независимого от окружения эпитопа CD3-эпсилон, соответствующего N-концевым аминокислотам 1-27
31.1. Создание аффинной колонки, идентифицирующей выделенный независимый от окружения эпитоп CD3-эпсилон человека, соответствующий N-концевым аминокислотам 1-27
Плазмиду для экспрессии конструкции 1-27 CD3-Fc, состоящей из 1-27 N-концевых аминокислот эпсилон-цепи CD3 человека, слитых с шарнирной и Fc-гамма-участком иммуноглобулина IgG1 человека, как описано выше (Пример 3; последовательность кДНК и аминокислотная последовательность рекомбинантного слитого белка представлены в SEQ ID NO: 350 и 349), трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкций индуцировали путем добавления увеличивающихся концентраций МТХ до конечных концентраций 20 нМ МТХ включительно. После двух пассажей стационарной культуры клетки выращивали в роллерных флаконах в жидкой соевой среде HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone) в течение 7 суток перед сбором. Клетки выделяли центрифугированием и супернатант, содержащий экспрессированный белок, хранили при -20°С.Для выделения слитого белка согласно стандартным протоколам готовили аффинную колонку на основе антител козы против Fc человека, используя имеющееся в продаже аффинно очищенное антитело козы, специфичное к Fc-фрагменту IgG человека, обладающее минимальной перекрестной реактивностью к сывороточным белкам быка, лошади и мыши (Jackson ImmunoResearch Europe Ltd.). С применением этой аффинной колонки слитый белок выделяли из супернатанта клеточной культуры на системе Akta Explorer (GE Amersham) и элюировали лимонной кислотой. Элюат нейтрализовали и концентрировали. После диализа против буфера для сочетания (coupling buffer), не содержащего амины, очищенный слитый белок подвергали сочетанию с N-гидрокси-сукцинимид(МН8)-активированным носителем для колонки HiTrap объемом 1 мл (GE Amersham).
После сочетания оставшиеся NHS-группы блокировали, колонку промывали и хранили при 5°С в буфере для хранения, содержащем 0,1% азида натрия.
31.2. Очистка биспецифических одноцепочечных молекул с межвидовой специфичностью с использованием аффинной колонки с пептидом CD3 человека
200 мл супернатанта культуры клеток, экспрессирующих биспецифические одноцепочечные молекулы с межвидовой специфичностью, стерильно фильтровали (0,2 мкм) и наносили на аффинную колонку с пептидом CD3, используя систему Akta Explorer (GE Amersham).
Затем колонку промывали забуференным фосфатом физиологическим раствором (PBS) рН 7,4 для удаления несвязавшегося образца. Элюирование осуществляли кислотным буфером рН 3,0, содержащим 20 мМ лимонную кислоту и 1 М хлорид натрия. Элюированный белок немедленно нейтрализовали 1 М трисгидроксиметиламином (Трис) рН 8,3, содержащимся в пробирках для сбора фракций коллектора фракций.
Анализ белка осуществляли с использованием SDS-PAGE и вестерн-блоттинга.
Для SDS-PAGE используют бис-Трис гели 4-12% (Invitrogen). В качестве подвижного буфера использовали 1×MES(N-мopфoлинэтaнcульфoнaт)-SDS-буфер (Invitrogen). В качестве белкового стандарта наносили 15 мкл предварительно окрашенных белков из набора Sharp Protein Standard (Invitrogen). Электрофорез проводили в течение 60 минут при максимальных значениях напряжения и тока 200 вольт и 120 мА. Гели промывали в деминерализованной воде и окрашивали Coomassie в течение одного часа. Гели отмывают от краски в деминерализованной воде в течение 3 часов. Изображения получают при помощи системы документации Syngene Gel.
Для проведения вестерн-блоттинга приготавливали два геля SDS-PAGE и белки переносили электроблоттингом на нитроцеллюлозную мембрану. Мембрану блокировали 2%-ным бычьим сывороточным альбумином в PBS и инкубировали с биотинилированным мышиным Penta-His-антителом (Qiagen). В качестве вторичного реагента использовали конъюгат стрептавидина с щелочной фосфатазой (DAKO). Блоты окрашивали, используя раствор субстрата BCIP/NBT (Pierce).
Как показано на Фиг.50, 51 и 52, применение аффинной колонки с пептидом CD3, как описано выше, позволяет осуществлять высокоэффективную очистку биспецифических одноцепочечных молекул из супернатанта клеточной культуры. Таким образом, одноцепочечные анти-CD3-антитела с межвидовой специфичностью, входящие в состав биспецифических одноцепочечных молекул, благодаря своим специфическим связывающим свойствам, делают возможным общий эффективный одностадийный способ очистки биспецифических одноцепочечных молекул с межвидовой специфичностью без необходимости использования каких-либо меток, присоединенных исключительно в целях очистки.
32. Общий фармакокинетический анализ биспецифических одноцепочечных молекул с межвидовой специфичностью
32.1. Получение (1-27CD3)-Fc для применения в фармакокинетическом анализе
Кодирующую последовательность N-концевых аминокислот 1-27 эпсилон-цепи CD3 человека, слитую с шарнирной областью и Fc-гамма-участком иммуноглобулина IgG1 человека, получали генным синтезом согласно стандартным протоколам (последовательность кДНК и аминокислотная последовательность рекомбинантного слитого белка представлены в SEQ ID NO: 1111 и 1112). Фрагмент генного синтеза конструировали таким образом, чтобы он содержал сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность первых 27 аминокислот внеклеточного участка зрелой эпсилон-цепи CD3 человека, затем, в рамке считывания, кодирующую последовательность шарнирной области и Fc-гамма-участка IgG1 человека и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие сайты рестрикции в начало и в конец кДНК, кодирующей данный слитый белок. Введенные сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через EcoRI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Упомянутые выше методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентраций метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно. После двух пассажей стационарной культуры клетки выращивали в роллерных флаконах в жидкой соевой среде HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone) в течение 7 суток перед сбором. Клетки выделяли центрифугированием и супернатант, содержащий экспрессированный белок, хранили при -20°С.Для выделения слитого белка согласно стандартным протоколам готовили аффинную колонку на основе антител козы против Fc человека, используя имеющееся в продаже аффинно очищенное антитело козы, специфичное к Fc-фрагменту IgG человека, обладающее минимальной перекрестной реактивностью к сывороточным белкам быка, лошади и мыши (Jackson ImmunoResearch Europe Ltd.). С применением этой аффинной колонки слитый белок выделяли из супернатанта клеточной культуры на системе Akta Explorer (GE Amersham) и элюировали лимонной кислотой. Элюат нейтрализовали и концентрировали.
32.2. Фармакокинетический анализ биспецифических одноцепочечных молекул с межвидовой специфичностью
В основе анализа лежит технология ECL-ELISA (иммуноферментный анализ с усиленной хемилюминесценцией) с использованием мечения рутением для детекции на углеродных планшетах (carbon plates), измеряемых на приборе Sektor Imager (MSD). На первом этапе углеродные планшеты (96-луночный планшет с высокими связывающими свойствами (High Bind Plate) от MSD, кат.: L15xB-3) покрывали 5 мкл/лунку очищенного 1-27CD3-FC в концентрации 50 нг/мл, описанного в Примере 32.1. Затем планшеты сушили в течение ночи при 25°С. После этого планшеты блокировали 5%-ным BSA (Paesel&Lorei, №100568) в PBS в концентрации 150 мкл/лунку в течение 1 ч при 25°С в инкубаторе при встряхивании (700 об/мин). На следующем этапе планшеты промывали три раза 0,05% Tween в PBS. Стандартную кривую в 50%-ной сыворотке макака в PBS получали с помощью последовательных разведении 1:4 соответствующей биспецифической одноцепочечной молекулы с межвидовой специфичностью, подлежащей детекции в анализе, начиная с 100 нг/мл. Образцы для контроля качества (QC) готовили в 50%-ной сыворотке макака в PBS в диапазоне от 1 нг/мл до 50 нг/мл соответствующей биспецифической одноцепочечной молекулы с межвидовой специфичностью в зависимости от ожидаемых концентраций образца в сыворотке. Стандартные, QC или неизвестные образцы переносили в углеродные планшеты в концентрации 10 мкл/лунку и инкубировали в течение 90 мин при 25°С в инкубаторе при встряхивании (700 об/мин). Затем планшеты три раза промывали 0,05% Tween в PBS. Для детекции добавляли по 25 мкл/лунку Penta-His-биотинилированного антитела (Qiagen, 200 мкг/мл в 0,05% Tween в PBS) и инкубировали в течение 1 ч при 25°С в инкубаторе при встряхивании (700 об/мин). На втором этапе детекции добавляли по 25 мкл/лунку раствора метки стрептавидин-сульфо (Streptavidin-SulfoTag) (MSD; кат.: R32AD-1; серия:
WO010903) и инкубировали в течение 1 ч при 25°С в инкубаторе при встряхивании (700 об/мин). После этого планшеты три раза промывали 0,05% Tween в PBS. Окончательно добавляли по 150 мкл/лунку буфера для считывания от MSD (MSD, кат.: R9ZC-1) и планшеты считывали на приборе Sektor Imager.
На Фиг.53 и 54 продемонстрирована возможность определения биспецифических одноцепочечных молекул с межвидовой специфичностью в образцах сыворотки обезьян-макаков. Таким образом, одноцепочечные анти-CD3-антитела с межвидовой специфичностью, входящие в состав биспецифических одноцепочечных молекул, благодаря своим специфическим связывающим свойствам, делают возможным высокочувствительный общий анализ определения биспецифических одноцепочечных молекул с межвидовой специфичностью. Изложенный выше анализ может быть использован в случае формальных токсикологических исследований, необходимых для разработки лекарственных средств, и может быть легко адаптирован для измерения взятых у пациентов образцов в связи с клиническим применением биспецифических одноцепочечных молекул с межвидовой специфичностью.
33. Создание рекомбинантных трансмембранных слитых белков, состоящих из N-концевых аминокислот 1-27 CD3-эпсилон различных приматов, не являющихся шимпанзе, слитых с ЕрСАМ из яванского макака (1-27 CD3-EpCAM)
33.1. Клонирование и экспрессия (1-27 CD3)-EpCAM CD3-эпсилон выделяли из различных приматов, не являющихся шимпанзе (игрунки, тамарина, беличьей обезьяны), и свиньи. Кодирующие последовательности 1-27 N-концевых аминокислот зрелой эпсилон-цепи CD3 человека, обыкновенной игрунки (Callithrix jacchus), эдипова тамарина (Saguinus oedipus), обыкновенной беличьей обезьяны (Saimiri sciureus) и домашней свиньи (Sus scrofa; используемой в качестве отрицательного контроля), слитые с N-концом Flag-меченой ЕрСАМ яванского макака, получали генным синтезом согласно стандартным протоколам (последовательность кДНК и аминокислотная последовательность рекомбинантных слитых белков представлены в SEQ ID NO: 351-360). Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала BsrGI-сайт, позволяющий осуществлять слияние в правильной рамке считывания с кодирующей последовательностью иммуноглобулинового лидерного пептида из 19 аминокислот, уже имеющегося в целевом экспрессирующем векторе, затем, в рамке считывания, кодирующую последовательность N-концевых 1-27 аминокислот внеклеточного участка зрелых эпсилон-цепей CD3, затем, в рамке считывания, кодирующую последовательность Flag-метки и затем, в рамке считывания, кодирующую последовательность зрелого трансмембранного белка ЕрСАМ яванского макака. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести сайт рестрикции в конце кДНК, кодирующей данный слитый белок. Введенные сайты рестрикции, BsrGI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагменты генного синтеза затем клонировали через BsrGI и SalI, следуя стандартным протоколам, в производное плазмиды, обозначенной pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), которая уже содержит кодирующую последовательность иммуноглобулинового лидерного пептида из 19 аминокислот. Плазмиды с подтвержденной последовательностью использовали для трансфекции дефектных по DHFR клеток СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентраций метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
Трансфектанты тестировали в отношении экспрессии на клеточной поверхности рекомбинантного трансмембранного белка с помощью FACS-анализа согласно стандартным протоколам. С этой целью 2,5×105 клеток инкубировали с 50 мкл анти-Flag М2-антитела (Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany) в концентрации 5 мкг/мл в PBS с 2% FCS. Связавшееся антитело определяли с использованием конъюгированного с R-фикоэритрином, аффинно очищенного F(ab')2-фрагмента антитела козы Против IgG мыши (специфичного к Fc-гамма-фрагменту), разбавленного 1:100 в PBS с 2% FCS (Jackson ImmunoResearch Europe Ltd., Newmarket, Suffolk, UK). Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-lnterscience, 2002).
Экспрессия Flag-меченых рекомбинантных трансмембранных слитых белков, состоящих из ЕрСАМ яванского макака и 1-27 N-концевых аминокислот эпсилон-цепи CD3 человека, игрунки, тамарина, беличьей обезьяны и свиньи, соответственно, четко определялась на трансфицированных клетках (Фиг.55).
33.2. Клонирование и экспрессия одноцепочечного анти-CD3-антитела I2C HL с межвидовой специфичностью в форме IgG1-антитела
С целью обеспечения улучшенных средств определения связывания одноцепочечного анти-CD3-антитела с межвидовой специфичностью, I2C VHVL-специфичность превращали в IgGI-антитело с мышиными IgG1 и мышиными каппа-константными областями. Последовательности кДНК, кодирующие тяжелую цепь IgG-антитела, получали генным синтезом согласно стандартным протоколам. Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность вариабельной области тяжелой цепи или вариабельной области легкой цепи, затем, в рамке считывания, кодирующую последовательность константной области тяжелой цепи мышиного IgG1, опубликованную в GenBank (номер доступа АВ097849), или кодирующую последовательность константной области легкой цепи каппа мыши, опубликованную в GenBank (номер доступа D14630).
Сайты рестрикции вводили в начало и в конец кДНК, кодирующей данный слитый белок. Сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали для последующих процедур клонирования. Фрагменты генного синтеза клонировали через EcoRI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150) для конструкции тяжелой цепи и pEFADA (pEFADA описана в Raum et al., Cancer Immunol. Immunother., 50(3), (2001), 141-150) для конструкции легкой цепи согласно стандартным протоколам. Плазмиды с подтвержденными последовательностями использовали для котрансфекции соответствующими конструкциями легкой и тяжелой цепей в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкций индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно и дезоксикоформицина (dCF) до конечной концентрации 300 нМ dCF включительно. После двух пассажей стационарной культуры супернатант клеточной культуры собирали и использовали в последующем эксперименте.
33,3. Связывание одноцепочечного анти-CD3-антитела I2C HL с межвидовой специфичностью в форме IgG1-антитела с 1-27 CD3-EpCAM
Связывание созданной конструкции I2C IgG1 с 1-27 N-концевыми аминокислотами эпсилон-цепей CD3 человека, игрунки, тамарина и беличьей обезьяны, соответственно, слитыми с Ер-САМ яванского макака, как описано в Примере 33.1, тестировали с помощью FACS-анализа согласно стандартным протоколам. С этой целью 2,5×105 клеток инкубировали с 50 мкл супернатанта клеточной культуры, содержащего конструкцию I2C IgG1, которая описана в Примере 33.2. Связывание этого антитела определяли с использованием конъюгированного с R-фикоэритрином, аффинно очищенного F(ab')2-фрагмента антитела козы против IgG мыши (специфичного к Fc-гамма-фрагменту), разбавленного 1:100 в PBS с 2% FCS (Jackson ImmunoResearch Europe Ltd., Newmarket, Suffolk, UK). Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002).
Как показано на Фиг.56, наблюдали связывание конструкции I2C IgG1 с трансфектантами, экспрессирующими рекомбинантные трансмембранные слитые белки, состоящие из 1-27 N-концевых аминокислот CD3-эпсилон человека, игрунки, тамарина или беличьей обезьяны, слитые с ЕрСАМ яванского макака, по сравнению с отрицательным контролем, состоящим из 1-27 N-концевых аминокислот CD3-эпсилон свиньи, слитых с ЕрСАМ яванского макака. Таким образом, была продемонстрирована межвидовая специфичность I2C в отношении многих приматов. Сигналы, полученные с использованием анти-Р!ад-М2-антитела и конструкции I2C IgG1, были соизмеримыми, что указывает на сильную связывающую активность специфичности I2C, обладающей межвидовой специфичностью, с N-концевыми аминокислотами 1-27 CD3-эпсилон.
34. Связывание анти-CD3-связывающей молекулы I2C, обладающей межвидовой специфичностью, с человеческой CD3-эпсилон-цепью с N-концевой His6-меткой и без нее
Химерное IgG1-антитело со специфичностью связывания I2C, как описано в Примере 33.2, специфичное к CD3-эпсилон, тестировали в отношении связывания с человеческой CD3-эпсилон-цепью с N-концевой His6-меткой и без нее. Связывание этого антитела с клеточными линиями EL4, трансфицированными His6-CD3-эпсилон человека, как описано в Примере 6.1, и человеческой CD3-эпсилон-цепью дикого типа, как описано в Примере 5.1, соответственно, тестировали с помощью FACS-анализа согласно стандартным протоколам. 2,5×105 клеток трансфектантов инкубировали с 50 мкл супернатанта клеточной культуры, содержащего конструкцию I2C IgG1 или 50 мкл соответствующих контрольных антител в концентрации 5 мкг/мл в PBS с 2% FCS. В качестве отрицательного контроля использовали соответствующий изотипический контроль, а в качестве положительного контроля экспрессии конструкций использовали CD3-специфическое антитело UCHT-1, соответственно. Определение His6-метки осуществляли с использованием Penta-His-антитела (Qiagen). Связывание антител определяли с использованием конъюгированного с R-фикоэритрином, аффинно очищенного F(ab')2-фрагмента антитела козы против IgG мыши, специфичного к Fc-гамма-фрагменту, разбавленного 1:100 в PBS с 2% FCS (Jackson ImmunoResearch Europe Ltd., Newmarket, Suffolk, UK). Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-lnterscience, 2002).
Сравнимое связывание антитела UCHT-1 против CD3 человека с обоими трансфектантами демонстрирует приблизительно одинаковые уровни экспрессии данных конструкций. Связывание Penta-His-антитела подтвердило присутствие His6-метки на конструкции His6-CD3 человека, но не на конструкции дикого типа.
По сравнению с клеточной линией EL4, трансфицированной человеческой CD3-эпсилон-цепью дикого типа, определяли очевидную потерю связывания конструкции I2C IgG1 с CD3-эпсилон-цепью человека, содержащей N-концевую His6-метку. Эти результаты показывают, что свободный N-конец CD3-эпсилон является существенным для связывания анти-CD3-связывающей специфичности I2C с межвидовой специфичностью с эпсилон-цепью CD3 человека (Фиг.57).
35. Конструкции биспецифических одноцепочечных антител, направленные на CD3 человека и примата, не являющегося шимпанзе, и опухолеспецифические эпитопы Мuс-1
VH-последовательность антитела зародышевой линии человека VH3 (3-72) (http://vbase.mrc-cpe.cam.ac.uk/) выбрали в качестве каркасного окружения (framework context) для CDRH1 (SEQ ID 1486), CDRH2 (SEQ ID 1487) и CDRH3 (SEQ ID 1488). Подобно этому, VH-последовательность антитела зародышевой линии человека VH3 3-73 (http://vbase.mrc-cpe.cam.ac.uk/) выбрали в качестве каркасного окружения для CDRH1 (SEQ ID 1492), CDRH2 (SEQ ID 1493) и CDRH3 (SEQ ID 1494). Для каждой VH человека необходимо было синтезировать несколько вырожденных олигонуклеотидов, которые перекрывают концевой участок из приблизительно 15-20 нуклеотидов. Для этого каждый второй праймер представлял собой антисмысловой праймер. Для VH3 3-72 использовали следующие олигонуклеотиды:
5' VH72-A-Xhol
GAAGTGAAGCTTCTCGAGTCTGGAGGAGGCTTGGTGCAACCTGGAGGATCCMT
GARACTCTCTTGTGCTGCT;
3'VH72-B
CTGGCGGACCCAGTCCATCCAGGCATCACTAAAAGTGAATCCAGAAGCAGCAC
AAGAGAG;
5' VH72-C
GACTGGGTCCGCCAGKCTCCAGRGAAGGGGCTTGAGTGGGTTGSTGAAATTAG
AAACAAAGCCAAT;
3' VH72-D
TTTGGAATCATCTCTTGAGATGGTGAACCTCCCTTTCACAGACTCATCATAATAT
GTTGCATGATTATTGGCTTTGTTTCT;
5' VH72-E
AGAGATGATTCCAAAARTAGMSTGTACCTGCAAATGAWMAGCTTAARARCTGAA
GACACTGSCSTTTATTACTGTACTGGG;
3' VH72-F-BstEII
GACCGTGGTGACCAGAGTCCCCTGGCCCCAGTTAGCAAACTCCCCAGTACAGT
AATA.
Для VH3 3-73 использовали следующие олигонуклеотиды:
5' VH73-A-Xhol
CAAGTTCAGCTGCTCGAGTCTGGAGGAGGCTTGGTGCAACCTGGAGGATCC;
3' VH73-B
CCAGTTCATCCAGTAGTTACTGAAAGTGAATCCAGAGGCARCACAGGAGAGTTT
CAKGGATCCTCCAGGTTG;
5' VH73-C
TACTGGATGAACTGGGTCCGCCAGKCTYCAGRGAAGGGGCTTGAGTGGGTTGS
TGAAATTAGATTGAAATCTAAT;
3' VH73-D
TTTGGAATCATCTCTTGAGATGGTGAACCTCCCTTTCACAGACTCCGCATAATGT
GTTGCATAATTATTAGATTTCAATCT;
5' VH73-E
AGAGATGATTCCAAAARTASTGYCTACCTGCAAATGAACARCTTAARARCTGAAG
ACACTGSCRTTTATTACTGTACGGGA;
3' VH73-F-BstEII
GACCGTGGTGACCGTGGTCCCTTGGCCCCAGTAAGCAAATTGTCCCACTCCCG
TACAGTAATA.
Каждый из этих наборов праймеров перекрывает всю соответствующую VH-последовательность.
В пределах каждого набора праймеры смешивали в равных количествах (например, 1 мкл каждого праймера (концентрированные растворы праймеров:
20-100 мкМ) в 20 мкл ПЦР-реакции) и добавляли к ПЦР-смеси, состоящей из ПЦР-буфера, нуклеотидов и Taq-полимеразы. Эту смесь инкубировали при 94°С в течение 3 минут, при 65°С в течение 1 минуты, при 62°С в течение 1 минуты, при 59°С в течение 1 минуты, при 56°С в течение 1 минуты, при 52°С в течение 1 минуты, при 50°С в течение 1 минуты и при 72°С в течение 10 минут в ПЦР-циклере. После этого продукт подвергали электрофорезу в агарозном геле и продукт размером от 200 до 400 выделяли из геля согласно стандартным методам.
Каждый из VH ПЦР-продуктов затем использовали в качестве матрицы для стандартной ПЦР-реакции с применением праймеров, которые вводят подходящие для клонирования N-концевые и С-концевые сайты рестрикции. Фрагмент ДНК надлежащего размера (для VH приблизительно 350 нуклеотидов) выделяли с помощью электрофореза в агарозном геле согласно стандартным методам. Таким способом амплифицировали достаточный ДНК-фрагмент VH.
VL-последовательность антитела зародышевой линии человека VkllA18 (http://vbase.mrc-cpe.cam.ac.uk/) выбрали в качестве каркасного окружения для CDRL1 (SEQ ID 1489), CDRL2 (SEQ ID 1490) и CDRL3 (SEQ ID 1491). Подобно этому, VL-последовательность антитела зародышевой линии человека VL7 7а (http://vbase.mrc-cpe.cam.ac.uk/) выбрали в качестве каркасного окружения для CDRL1 (SEQ ID 1495), CDRL2 (SEQ ID 1496) и CDRL3 (SEQ ID 1497). Для каждой VL человека необходимо было синтезировать несколько вырожденных олигонуклеотидов, которые перекрывают концевой участок из приблизительно 15-20 нуклеотидов. Для этого каждый второй праймер представлял собой антисмысловой праймер. Сайты рестрикции, необходимые для последующего клонирования в пределах олигонуклеотидов, делетировали. Для VkllA18 использовали следующие олигонуклеотиды:
5'Vk2A18-A-Sacl
CCTGATGAGCTCGTGATGACCCAAACTCCACTCTCCCTGYCTGTCASTCYTGGA
SAKCMAGCTTCCATCTCTTGC;
3'Vk2A18-B
CCAATATAAATAGGTGTTTCCATTGTTGTGTACCAGGTTCTGACTAGATCTGCAA
GAGATGGAAGC;
5'Vk2A18-C
ACCTATTTATATTGGTWCCTGCAGAAGYCAGGCCAGTCTCCAMAGCTCCTGATT
TATAGGGCTTCCATC;
3'Vk2A18-D
CTTGAGTGTGAAATCTGTCYCTGATCCACTGCCACTGAACCTGTCTGGGACCCC
AGAAAATCGGATGGAAGCCCTATA;
5'Vk2A18-E
ACAGATTTCACACTCAAGATCAGCAGAGTGGAGGCTGAGGATSTGGGAGTTTAT
TWCTGCTTTCAAGGTACACAT;
3'Vk2A18-F-BsiWI/Spel
CCCGATACTAGTCGTACGTTTGATTTCCAGCTTGGTGCCTTGACCGAACGTCCA
CGGAACATGTGTACCTTGAAAGCA.
Для VL7 7a использовали следующие олигонуклеотиды:
5' Vlam7a-A-Sacl
CCTGCAGAGCTCGTTGTGACTCAGGAAYCTKCACTCACCRYATCACCTGGTGRA
ACAGTCACACTCACTTGT;
3' Vlam7a-B
CCAGTTGGCATAGTTACTTGTTGTAACAGCCCCAGTACTTGAGCGACAAGTGAG
TGTGACTGT;
5' Vlam7a-C
AACTATGCCAACTGGKTCCAASAAAAACCAGRTCAKKYAYYCMSTGSTCTAATAK
RTGGTACCAACAACCGA;
3' Vlam7a-D
GGTGAGGGCAGCCTTGYCTCCAAKCAGGGAGCCTGAGAATCTGGCAGGARYM
CMTGGTGCTCGGTTGTTGGTACC;
5' Vlam7a-E
AAGGCTGCCCTCACCMTCWCAGGGGYACAGMCTGAGGATGAGGCARWATATT
WCTGTGCTCTATGGTACAGC;
3' Vlam7a-F-BsiWI/Spel
CCAGTAACTAGTCGTACGTAGGACAGTCAGTTTGGTTCCTCCACCGAACACCCA
ATGGTTGCTGTACCATAGAGCACA.
Каждый из этих наборов праймеров перекрывал всю соответствующую VL-последовательность.
В пределах каждого набора праймеры смешивали в равных количествах (например, 1 мкл каждого праймера (концентрированные растворы праймеров:
20-100 мкМ) в 20 мкл ПЦР-реакции) и добавляли к ПЦР-смеси, состоящей из ПЦР-буфера, нуклеотидов и Taq-полимеразы. Эту смесь инкубировали при 94°С в течение 3 минут, при 65°С в течение 1 минуты, при 62°С в течение 1 минуты, при 59°С в течение 1 минуты, при 56°С в течение 1 минуты, при 52°С в течение 1 минуты, при 50°С в течение 1 минуты и при 72°С в течение 10 минут в ПЦР-циклере. После этого продукт подвергали электрофорезу в агарозном геле и продукт размером от 200 до 400 выделяли из геля согласно стандартным методам.
Каждый из VL ПЦР-продуктов затем использовали в качестве матрицы для стандартной ПЦР-реакции с применением праймеров, которые вводят подходящие для клонирования N-концевые и С-концевые сайты рестрикции. Фрагмент ДНК надлежащего размера (для VL приблизительно 330 нуклеотидов) выделяли с помощью электрофореза в агарозном геле согласно стандартным методам. Таким способом амплифицировали достаточный ДНК-фрагмент VL.
Конечный VH ПЦР-продукт на основе VH3 3-72 (т.е. репертуар человеческих/гуманизированных VH) затем объединяли с конечным VL ПЦР-продуктом на основе VRIIA18 (т.е. репертуаром человеческих/гуманизированных VL), а конечный VH ПЦР-продукт на основе VH3 3-73 (т.е. репертуар человеческих/гуманизированных VH) с конечным VL ПЦР-продуктом на основе VL7 7а (т.е. репертуаром человеческих/гуманизированных VL) в векторе для фагового дисплея pComb3H5Bhis с образованием двух различных библиотек функциональных scFv, из которых - после экспонирования на нитевидном фаге - отбирали, подвергали скринингу, идентифицировали и подтверждали анти-Мис-1-связывающие структуры, как описано ниже.
450 нг фрагментов легкой цепи (расщепленных Sacl-Spel) лигировали с 1400 нг фагмиды pComb3H5Bhis (расщепленной Sacl-Spel; большой фрагмент). Полученную комбинаторную библиотеку антител затем подвергали трансформации в 300 мкл электрокомпетентных клеток Escherichia coli XL1 Blue с помощью электропорации (2,5 кВ; кювета с щелью 0,2 см; 25 мкФ; 200 Ом, Biorad gene-pulser), получая в результате библиотеку размером более 107 независимых клонов. Через один час фенотипической экспрессии отбирали положительные трансформанты по устойчивости к карбенициллину, кодируемой вектором pComb3H5BHis, в 100 мл жидкой super broth (SB)-культуры в течение ночи. Затем клетки собирали центрифугированием и плазмиду получали, используя имеющийся в продаже набор для получения плазмид (Qiagen).
2800 нг этой плазмидной ДНК, содержащей VL-библиотеку (расщепленной Xhol-BstEII; большой фрагмент), лигировали с 900 нг V-фрагментов тяжелой цепи (расщепленной Xhol-BstEII), и снова подвергали трансформации в две аликвоты по 300 мкл электрокомпетентных клеток Е. coli XL1 Blue с помощью электропорации (2,5 кВ; кювета с щелью 0,2 см; 25 мкФ, 200 Ом), получая в результате VH-VL scFv вариабельный фрагмент-библиотеку общим размером более 107 независимых клонов.
После фенотипической экспрессии и медленной адаптации к карбенициллину клетки Е. coli, содержащие библиотеку антител, переносили в 8 В-карбенициллин(50 мкг/мл)-селективную среду. Клетки Е. coli, содержащие библиотеку антител, затем инфицировали инфекционной дозой, равной 1012 частиц хелперного фага VCSM13, приводящей к продуцированию и секреции нитевидного фага М13, где фаговая частица содержит одноцепочечную pComb3H5BHis-ni-IK, кодирующую scFv-фрагмент, и экспонировала соответствующий scFv-белок в виде трансляционного слияния с оболочечным белком III фага. Этот пул фагов, экспонирующих библиотеку антител, использовали для селекции антигенсвязывающих структур.
Получение клеток СНО, экспрессирующих MUC-1 человека
Кодирующую последовательность MUC-1 человека, которая опубликована в GenBank (номер доступа J05581), получали генным синтезом согласно стандартным протоколам. Фрагмент генного синтеза конструировали таким образом, чтобы он содержал сначала сайт Козака для эукариотической экспрессии данной конструкции, затем кодирующую последовательность белка MUC-1 человека и стоп-кодон (последовательность кДНК и аминокислотная последовательность данной конструкции представлены в SEQ ID NO: 1498 и 1499). Внутренняя повторяющаяся последовательность (нуклеотиды 382-441) MUC-1, которая содержится только один раз в депонированной в GenBank версии, в данном фрагменте генного синтеза содержится шестнадцать раз, что является отражением множества повторов в физиологически экспрессированном MUC-1. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Внутренние сайты рестрикции Xmal удаляли посредством молчащей мутации кодирующей последовательности во фрагменте генного синтеза (нуклеотид 441: с С на Т; это последний нуклеотид в первом повторе, и поэтому он мутировал одинаково в 15 последующих повторяющихся последовательностях; и нуклеотид 2160: с G на С). Фрагмент генного синтеза клонировали через EcoRI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Вышеупомянутые процедуры осуществляли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
Для селекции антиген-связывающих структур фаговую библиотеку, несущую клонированный scFv-репертуар, получали из соответствующего культурального супернатанта посредством осаждения с помощью PEG8000/NaCl и центрифугирования. Приблизительно от 1011 до 1012 scFv-фаговых частиц ресуспендировали в 0,4 мл PBS/0,1% BSA и инкубировали с 105-107 клеток СНО, трансфицированных Мuс-1 (см. в качестве примера Мuс-1 RoK), в течение 1 часа на льду при слабом перемешивании. Эти Muc-1 -трансфицированные клетки СНО заранее собирали центрифугированием, промывали в PBS и ресуспендировали в PBS/1% FCS (содержащем азид натрия). scFv-фаги, которые не связываются специфически с Muc-1 -трансфицированными клетками СНО, удаляли посредством промывки до пяти стадий включительно, используя PBS/1% FCS (содержащий азид натрия). После промывки связавшиеся структуры элюировали из клеток посредством ресуспендирования клеток в HCI-глициновом буфере, рН 2,2 (10 мин инкубации с последующим интенсивным перемешиванием) и после нейтрализации 2 М Трис, рН 12, элюат использовали для инфицирования свежей неинфицированной культуры Е. coli XL1 Blue (OD600 больше 0,5). Культуру Е. coli, содержащую клетки Е. coli, подвергнутые успешной трансдукции фагмидной копией, кодирующей человеческий/гуманизированный scFv-фрагмент, вновь подвергали селекции на устойчивость к карбенициллину и затем инфицировали хелперным фагом VCMS 13 для того, чтобы начать второй раунд экспонирования антител и селекции in vitro. Обычно осуществляли суммарно от 4 до 5 циклов селекции.
С целью скрининга Мuс-1-специфических связывающих структур плазмидную ДНК, соответствующую 4-5 раундам пэннинга, выделяли из культур Е. coli после селекции. Для получения растворимого scFv-белка, VH-VL-ДНК-фрагменты вырезали из плазмид (Xhol-Spel). Эти фрагменты клонировали через те же сайты рестрикции в плазмиду pComb3H5BFlag/His, отличающуюся от исходной pComb3H5BHis тем, что экспрессируемая конструкция (например, scFv) включает в себя Flag-метку (DYKDDDDK) между scFv и His6-меткой, и дополнительные фаговые белки делегированы. После лигирования каждый пул (различные раунды пэннинга) плазмидной ДНК подвергали трансформации в 100 мкл компетентных к тепловому шоку Е. coli TG1 или XLI blue и высевали на карбенициллин-LB-агар. Одиночные колонии переносили перекалыванием в 100 мкл LB-карб (50 м кг/мл).
Е. coli, трансформированные pComb3H5BHis, содержащей VL- и VH-сегмент, продуцируют растворимый scFv в значительных количествах после вырезания фрагмента гена III и индукции с помощью 1 мМ IPTG. Благодаря подходящей сигнальной последовательности scFv-цепь экспортировалась в периплазму, где она сворачивается в функциональную конформацию.
Одиночные бактериальные колонии Е. coli TG1 с чашек для трансформации переносили перекалыванием для получения небольших количеств периплазмы и выращивали на SB-среде (например 10 мл), дополненной 20 мМ MgCl2 и карбенициллином (50 мкг/мл), и перерастворяли в PBS (например 1 мл) после сбора. В результате четырех циклов замораживания при -70°С и оттаивания при 37°С наружная мембрана бактерий разрушалась под действием теплового шока, и растворимые периплазматические белки, включая scFv, высвобождались в супернатант. После удаления центрифугированием интактных клеток и клеточного дебриса собирали супернатант, содержащий scFv против Мuс-1, и использовали для идентификации Мuс-1-специфических связывающих структур следующим образом.
Связывание scFv с Мuс-1 тестировали методом проточной цитометрии на Мuс-1-трансфицированных клетках СНО; нетрансфицированные клетки СНО использовали в качестве отрицательного контроля.
Для проточной цитометрии 2,5×105 клеток инкубировали с 50 мкл периплазматического препарата scFv или с 5 мкг/мл очищенных scFv в 50 мкл PBS с 2% FCS. Связывание scFv определяли с использованием анти-His-антитела (Penta-His-антитело, не содержащее BSA, Qiagen GmbH, Hilden, FRG) в концентрации 2 мкг/мл в 50 мкл PBS с 2% FCS. В качестве реагента для второй стадии использовали конъюгированный с R-фикоэритрином, аффинно очищенный F(ab')2-фрагмент антитела козы против IgG мыши (специфичный к Fc-гамма-фрагменту), разбавленный 1:100 в 50 мкл PBS с 2% FCS (Dianova, Hamburg, FRG). Образцы измеряли на FACSscan (BD biosciences, Heidelberg, FRG).
Отдельные клоны затем анализировали в отношении подходящих свойств и аминокислотной последовательности. Мuс-1-специфические scFv превращали в рекомбинантные биспецифические одноцепочечные антитела посредством присоединения их через Gly4Ser1-линкер к CD3-специфическому scFv I2C (SEQ ID 185) или любому другому CD3-специфическому scFv по изобретению, получая в результате конструкции с доменной организацией VHMuc1 - (Gly4Ser1)3 - VLMuc1 - Gly4Ser1 - VHCD3 - (Gly4Ser1)3 - VLCD3 или с альтернативными доменными организациями. Для экспрессии в клетках СНО кодирующие последовательности: (1) N-концевого лидерного пептида тяжелой цепи иммуноглобулина, содержащего стартовый кодон, встроенный в консенсусную последовательность Козака, и (2) С-концевой His6-метки, за которой следует стоп-кодон, присоединяли, в рамке считывания, к нуклеотидной последовательности, кодирующей биспецифические одноцепочечные антитела, перед вставкой результирующего фрагмента ДНК, полученного генным синтезом, в сайт множественного клонирования экспрессирующего вектора pEF-DHFR (Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150). Стабильную трансфекцию дефектных по DHFR клеток СНО, селекцию DHFR-положительных трансфектантов, секретирующих биспецифические одноцепочечные антитела в культуральный супернатант, и амплификацию генов с использованием метотрексата для повышения уровней экспрессии осуществляли, как описано (Mack et al. Proc. Natl. Acad. Sci. USA 92 (1995) 7021-7025). Все другие известные в данной области техники методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)).
Идентификацию функциональных конструкций биспецифических одноцепочечных антител осуществляли с использованием проточно-цитометрического анализа культурального супернатанта трансфицированных клеток СНО. С этой целью связывание с CD3 тестировали на CD3-положительной линии клеток HPB-ALL Т-клеточного лейкоза человека (DSMZ, Braunschweig, ACC483) и на Т-клеточной линии макака 4119LnPx. Связывание с опухолеспецифическими эпитопами Мuс-1 тестировали на Мuс-1-трансфицированных клетках СНО. 200000 клеток соответствующей клеточной линии инкубировали в течение 30 мин на льду с 50 мкл супернатанта клеточной культуры. Клетки дважды промывали в PBS с 2% FCS и связанную конструкцию биспецифического одноцепочечного антитела определяли с использованием мышиного анти-His-антитела (Penta-His-антитело; Qiagen; разбавленное 1:20 в 50 мкл PBS с 2% FCS). После промывки связавшиеся анти-His-антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. Супернатант нетрансфицированных клеток СНО использовали в качестве отрицательного контроля.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002). Только те конструкции, которые демонстрируют биспецифическое связывание с CD3 человека и макака, а также с опухолеспецифическими эпитопами Мuс-1, были отобраны для дальнейшего использования.
Для получения белка, клетки СНО, экспрессирующие полностью функциональное биспецифическое одноцепочечное антитело и адаптированные к жидкой соевой среде HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone), выращивали в роллерных флаконах с жидкой соевой средой HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone) в течение 7 суток. Культуральный супернатант осветляли от клеток центрифугированием и хранили при -20°С до очистки. В качестве хроматографического оборудования для очистки биспецифического одноцепочечного антитела из культурального супернатанта использовали систему Akta® Explorer (GE Health Systems) и программное обеспечение Unicorn®. Аффинную хроматографию с иммобилизованным металлом ("IMAC") осуществляли с использованием Fractogel EMD chelate® (Merck), который нагружали ZnCl2 в соответствии с протоколом, предложенным производителем. Колонку уравновешивали буфером А (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl), и супернатант клеточной культуры (500 мл) наносили на колонку (10 мл) при скорости потока 3 мл/мин. Колонку промывали буфером А для удаления несвязавшегося образца. Связавшийся белок элюировали с использованием двухстадийного градиента буфера В (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl; 0,5 М имидазол) в соответствии со следующим протоколом:
стадия 1: 20% буфера В в 6 объемах колонки;
стадия 2: 100% буфера В в 6 объемах колонки.
Элюированные белковые фракции со стадии 2 объединяли для дальнейшей очистки. Все химические реактивы имели степень чистоты, подходящую для исследований, и были приобретены у Sigma (Deisenhofen) или Merck (Darmstadt).
Гель-фильтрацию осуществляли на препаративной колонке HiLoad 16/60 Superdex 200 (GE/Amersham), уравновешенной Equi-буфером (25 мМ цитрат;
200 мМ лизин; 5% глицерин; рН 7,2). Элюированные белковые образцы (скорость потока 1 мл/мин) подвергали стандартным SDS-PAGE и вестерн-блоттингу для детекции. Перед очисткой колонку калибровали для определения молекулярной массы (набор маркеров молекулярной массы, Sigma MW GF-200). Концентрацию белка определяли, используя OD при 280 нм.
Очищенный белок, биспецифическое одноцепочечное антитело, анализировали с использованием SDS-PAGE в восстанавливающих условиях и предварительно залитых 4-12%-ных гелей в бис-Трис-буфере (Invitrogen). Приготовление и нанесение образцов осуществляли согласно протоколу, предложенному производителем. Молекулярную массу определяли, используя белковый стандарт MultiMark (Invitrogen). Гель окрашивали коллоидным Coomassie (протокол Invitrogen). Чистота выделенного белка составляет более 95%, как определено SDS-PAGE.
Биспецифическое одноцепочечное антитело имеет молекулярную массу примерно 52 кДа в нативных условиях, как определено гель-фильтрацией в PBS. Все конструкции очищали согласно данному методу.
Вестерн-блоттинг осуществляли, используя мембрану Optitran® BA-S83 в аппарате для блоттинга Invitrogen в соответствии с протоколом, предложенным производителем. Для определения биспецифических одноцепочечных белковых антител использовали антитело против His-метки (Penta-His, Qiagen). Антитело козы против Ig мыши, меченое щелочной фосфатазой (АР) (Sigma), использовали в качестве вторичного антитела, a BCIP/NBT (Sigma) в качестве субстрата. Определили единственную полосу при 52 кДа, соответствующую очищенному биспецифическому одноцепочечному антителу.
Эффективность биспецифических одноцепочечных антител, взаимодействующих с CD3 человека и макака и с опухолеспецифическими эпитопами Мuс-1, в системе человека и примата, не являющегося шимпанзе, определяли с помощью анализа цитотоксичности на основе высвобождения хрома, используя Мuс-1-трансфицированные клетки СНО в качестве клеток-мишеней и стимулированные СD4/СD56-истощенные РВМС человека или Т-клеточную линию макака 4119LnPx в качестве эффекторных клеток.
Получение стимулированных РВМС человека осуществляли следующим образом. На чашку Петри (диаметр 145 мм; Greiner) наносили имеющееся в продаже анти-CD3-специфическое антитело (например, ОКТ3, Othoclone) в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязавшийся белок удаляли за одну стадию промывки, используя PBS. Свежие РВМС выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. 3 - 5×107 РВМС добавляли в предварительно покрытую чашку Петри в 120 мл RPMI 1640 со стабилизирующей добавкой глутамин/10% FCS/IL-2 20 ед./мл (пролейкин, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали и промывали один раз RPMI 1640. Добавляли IL-2 до конечной концентрации 20 ед./мл и клетки снова культивировали в течение одних суток в той же среде для культивирования клеток, как упомянуто выше.
Клетки-мишени дважды промывали PBS и метили 11,1 МБк51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 45 минут при 37°С.После этого меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали в анализе цитотоксичности. Анализ осуществляли в 96-луночном планшете в конечном объеме 250 мкл дополненной среды RPMI (как и выше) с соотношением Е:Т 10:1. Наносили 1 мкг/мл молекул биспецифического одноцепочечного антитела с межвидовой специфичностью и 20 их трехкратных разведении. Время анализа составляло 18 часов, и цитотоксичность измеряли в относительных величинах высвобожденного хрома в супернатанте, соответствующих разнице между максимальным лизисом (добавление Тритона-X) и спонтанным лизисом (без эффекторных клеток). Все измерения осуществляли в четырех повторностях. Измерение радиоактивности хрома в супернатантах осуществляли с использованием гамма-счетчика Wizard 3" (Perkin Elmer Life Sciences GmbH, Koln, Germany). Анализ экспериментальных данных осуществляли с применением Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA). Сигмоидальные кривые доза-эффект обычно имеют величины R2 выше 0,90, как определено с использованием этого программного обеспечения. Величины EC50, как меру эффективности, вычисляли с помощью данной программы анализа.
36. Создание CD33- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
36.1. Создание CD33- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
В общем случае, молекулы биспецифических одноцепочечных антител, каждое из которых содержит домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD3-эпсилон человека и макака, а также домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD33 человека и макака, конструировали, как представлено в следующей ниже Таблице 14.
Вышеупомянутые конструкции, содержащие вариабельные домены легкой цепи (L) и вариабельные домены тяжелой цепи (Н) с межвидовой специфичностью к CD33 человека и макака, и CD3-специфические VH- и VL-комбинации, демонстрирующие межвидовую специфичность к CD3 человека и макака, получали генным синтезом. Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность соответствующей молекулы биспецифического одноцепочечного антитела, затем, в рамке считывания, кодирующую последовательность гистидин6-метки и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через эти сайты рестрикции в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Упомянутые выше методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно. После двух пассажей супернатант стационарной клеточной культуры собирали и использовали в последующих экспериментах.
36.2. Проточно-цитометрический анализ связывания CD33- и CD3-биспецифических антител с межвидовой специфичностью
С целью тестирования функциональности конструкций биспецифических антител с межвидовой специфичностью в отношении способности связываться с CD33 и CD3 человека и макака, соответственно, осуществляли FACS-анализ. Для этого клетки СНО, трансфицированные CD33 человека, как описано в Примере 23.1, и CD3-положительную линию клеток HPB-ALL Т-клеточного лейкоза человека (DSMZ, Braunschweig, ACC483) использовали для тестирования связывания с антигенами человека. Способность связываться с антигенами макака тестировали с использованием созданного CD33-трансфектанта макака, описанного в Примере 23.2, и РВМС макака (получение РВМС макака осуществляли посредством центрифугирования в градиенте фиколла периферической крови обезьян макаков согласно стандартным протоколам). 200000 клеток соответствующих клеточных линий или РВМС инкубировали в течение 30 мин на льду с 50 мкл супернатанта клеточной культуры трансфицированных клеток, экспрессирующих конструкции биспецифических антител с межвидовой специфичностью. Клетки дважды промывали в PBS с 2% FCS, и связывание конструкции определяли с использованием мышиного анти-His-антитела (Penta-His-антитело; Qiagen; разбавленное 1:20 в 50 мкл PBS с 2% FCS). После промывки связавшиеся анти-His-антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. Супернатант нетрансфицированных клеток СНО использовали в качестве отрицательного контроля.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002).
Биспецифическое связывание приведенных выше одноцепочечных молекул, которые демонстрировали межвидовую специфичность к CD33 и межвидовую специфичность к CD3 человека и примата, не являющегося шимпанзе, четко определялось, как показано на Фиг.60. В FACS-анализе все конструкции демонстрировали связывание с CD3 и CD33 при сравнении с соответствующими отрицательными контролями. Была продемонстрирована межвидовая специфичность биспецифических антител к антигенам CD3 и CD33 человека и макака.
36.3. Биологическая активность CD33- и CD3-биспецифических одноцепочечных антител с межвидовой специфичностью
Биологическую активность созданных биспецифических одноцепочечных антител анализировали по высвобождению хрома 51 (51Cr) в анализах цитотоксичности in vitro, используя CD33-положительные клеточные линии, описанные в Примерах 23.1 и 23.2. В качестве эффекторных клеток использовали стимулированные CD4/CD56-HCTOiiteHHbie РВМС человека или Т-клеточную линию макака 4119LnPx, как указано на соответствующих графических материалах.
На чашку Петри (диаметр 145 мм; Greiner bio-one GmbH, Kremsmunster) наносили имеющееся в продаже aнти-CD3-cпeцифичecкoe антитело (например, ОКТ3, Othoclone) в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязавшийся белок удаляли за одну стадию промывки, используя PBS. Свежие РВМС выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. 3 - 5×107 РВМС добавляли в предварительно покрытую чашку Петри в 120 мл RPMI 1640 со стабилизирующей добавкой глутамин/10% FCS/IL-2 20 ед./мл (пролейкин, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали и промывали один раз RPMI 1640. Добавляли IL-2 до конечной концентрации 20 ед./мл и клетки снова культивировали в течение одних суток в той же среде для культивирования клеток, как упомянуто выше.
CD8+ цитотоксические Т-лимфоциты (CTL) обогащали посредством истощения CD4+Т-клеток и CD56+МК-клеток согласно стандартным протоколам.
Клетки-мишени дважды промывали PBS и метили 11,1 МБк51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 45 минут при 37°С.После этого меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали в анализе цитотоксичности. Анализ осуществляли в 96-луночном планшете в конечном объеме 250 мкл дополненной среды RPMI (как и выше) с соотношением Е:Т 10:1. Применяли супернатант клеток, экспрессирующих молекулы биспецифических одноцепочечных антител с межвидовой специфичностью в конечной концентрации 50% и 20 его трехкратных разведении. Время анализа составляло 18 часов, и цитотоксичность измеряли в относительных величинах высвобожденного хрома в супернатанте, соответствующих разнице между максимальным лизисом (добавление Тритона-X) и спонтанным лизисом (без эффекторных клеток). Все измерения осуществляли в четырех повторностях. Измерение радиоактивности хрома в супернатантах осуществляли с использованием гамма-счетчика Wizard 3" (Perkin Elmer Life Sciences GmbH, Koln, Germany). Анализ экспериментальных данных осуществляли с применением Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA). Сигмоидальные кривые доза-эффект обычно имеют величины R2 выше 0,90, как определено с использованием этого программного обеспечения. Величины EC50, рассчитанные с помощью данной программы анализа, использовали для сравнения биологической активности.
Как показано на Фиг.61, все созданные конструкции биспецифического одноцепочечного антитела с межвидовой специфичностью демонстрируют цитотоксическую активность против клеток-мишеней, положительных в отношении CD33 человека, индуцированных стимулированными CD4/CD56-истощенными РВМС, и против клеток-мишеней, положительных в отношении CD33 макака, индуцированных Т-клеточной линией макака 4119LnPx.
37. Перераспределение циркулирующих Т-клеток шимпанзе при экспозиции с традиционной биспецифической CD3-связывающей молекулой, направленной на целевую молекулу, которая отсутствует в клетках циркулирующей крови
Единственного самца шимпанзе подвергали действию возрастающих внутривенных доз конструкции одноцепочечного EpCAM/CD3-биспецифического антитела (Schlereth (2005) Cancer Res. 65: 2882). Подобно традиционной конструкции одноцепочечного СD19/CD3-биспецифического антитела (Loffler (2000, Blood, Volume 95, №6) или WO 99/54440) СD3-"плечо" указанной ЕрСАМ/CD3-конструкции также направлено против традиционного зависимого от окружения CD3-эпитопа человека и шимпанзе. В 0-е сутки животное получало 50 мл PBS/5% HSA без тестируемого вещества, затем 50 мл PBS/5% HSA плюс конструкцию одноцепочечного EpCAM/CD3-биспецифического антитела в дозе 1,6; 2,0; 3,0 и 4,5 мкг/кг на 7-е, 14-е, 21-е и 28-е сутки, соответственно. Продолжительность инфузии составляла 2 часа на одно введение. Для каждой еженедельной инфузии шимпанзе вводили внутримышечно седативное средство телазол 2-3 мг/кг, интубировали и помещали в условия анестезии изофлураном/О2 с поддержанием стабильного среднего кровяного давления. Второй внутривенный катетер размещали на противоположной конечности для отбора (гепаринизированных) образцов цельной крови в моменты времени, указанные на Фиг.62, для FACS-анализа циркулирующих клеток крови. После стандартного лизиса эритроцитов Т-клетки окрашивали FITC-меченым антителом, взаимодействующим с CD2 шимпанзе (Becton Dickinson), и процентное содержание Т-клеток относительно общего содержания лимфоцитов определяли методом проточной цитометрии. Как показано на Фиг.62, каждое введение конструкции одноцепочечного ЕрСАМ/CD3-биспецифического антитела индуцировало быстрое уменьшение количества циркулирующих Т-клеток, как наблюдали для конструкции одноцепочечного СD19/CD3-биспецифического антитела у B-NHL-пациентов, у которых по существу не было циркулирующих целевых В(лимфомных)-клеток. Поскольку в циркулирующей крови людей и шимпанзе нет EpCAN-положительных клеток-мишеней, уменьшение количества циркулирующих Т-клеток при экспозиции с конструкцией одноцепочечного EpCAM/CD3-биспецифического антитела может быть объяснено исключительно сигналом, который Т-клетки получают вследствие прямого взаимодействия СD3-"плеча" конструкции с традиционным, зависимым от окружения CD3-эпитопом в отсутствие какого-либо перекрестного связывания, опосредованного клетками-мишенями. Подобно перераспределению Т-клеток, индуцированному при их экспозиции с конструкцией одноцепочечного СD19/CD3-биспецифического антитела у B-NHL-пациентов, у которых по существу не было циркулирующих целевых В(лимфомных)-клеток, перераспределение Т-клеток у шимпанзе при экспозиции с конструкцией одноцепочечного ЕрСАМ/CD3-биспецифического антитела может быть объяснено конформационным изменением CD3 после связывания с зависимым от окружения CD3-эпитопом, приводящего в дальнейшем к временному увеличению Т-клеточной адгезивности к эндотелию кровеносных сосудов (см. Пример 20). Это наблюдение подтверждает, что традиционные CD3-связывающие молекулы, направленные на зависимые от окружения CD3-эпитопы - исключительно посредством этого взаимодействия -могут вызывать картину перераспределения Т-клеток периферической крови, которое связано с риском неблагоприятных в отношении ЦНС событий у людей, как описано в Примере 20.
38. Специфическое связывание scFv-клонов с N-концом CD3-эпсилон человека
38.1. Бактериальная экспрессия scFv-конструкций в Е. coli XL1 Blue
Как упомянуто выше, клетки E. coli XL1 Blue, трансформированные pComb3H5Bhis/Flag, содержащей VL- и VH-сегмент, продуцируют растворимый scFv в достаточных количествах после вырезания фрагмента гена III и индукции с помощью 1 мМ IPTG. scFv-цепь экспортируется в периплазму, где она сворачивается в функциональную конформацию.
Для этого эксперимента были выбраны следующие scFv-клоны:
1) scFv 4-10, 3-106, 3-114, 3-148, 4-48, 3-190 и 3-271, которые описаны в WO 2004/106380,
2) scFv из клонов Н2С, F12Q и I2C, связывающих анти-CD3-эпсилон человека, как описано в данном изобретении.
Для получения периплазматических препаратов бактериальные клетки, трансформированные соответствующими scFv-содержащими плазмидами, допускающими периплазматическую экспрессию, выращивали в SB-среде, дополненной 20 мМ NgCl2 и карбенициллином (50 мкг/мл), и ресуспендировали в PBS после сбора. В результате четырех циклов замораживания при -70°С и оттаивания при 37°С наружная мембрана бактерий разрушалась под действием осмотического шока и растворимые периплазматические белки, включая scFv, высвобождались в супернатант. После удаления центрифугированием интактных клеток и клеточного дебриса собирали супернатант, содержащий scFv человека против CD3 человека, и использовали для дальнейшего исследования. Эти неочищенные супернатанты, содержащие scFv, далее будут называться периплазматическими препаратами (РРР).
38.2. Связывание scFv со слитым белком [CD3-эпсилон (аа 1-27) человека]-Fc
Эксперименты с использованием ELISA осуществляли путем покрытия лунок 96-луночных пластиковых планшетов (Nunc, maxisorb) слитым белком [CD3-эпсилон (аа 1-27) человека]-Fc обычно при 40C в течение ночи. Раствор антигена для покрытия затем удаляли, лунки промывали один раз PBS/0,05% Tween 20 и затем блокировали PBS/3% BSA в течение по меньшей мере одного часа. После удаления блокирующего раствора в лунки добавляли РРР и контрольные растворы и инкубировали обычно в течение одного часа при комнатной температуре. Затем лунки трижды промывали PBS/0,05% Tween 20. Определение scFv, связавшихся с иммобилизованным антигеном, осуществляли, используя меченое биотином антитело против FLAG-метки (М2 anti Flag-Bio, Sigma, обычно в конечной концентрации 1 мкг/мл PBS), и определяли с использованием меченого пероксидазой стрептавидина (Dianova, 1 мкг/мл PBS). Сигнал развивался при добавлении раствора субстрата ABTS и измерялся при длине волны 405 нм. Неспецифическое связывание тестируемых образцов с блокирующим агентом и/или участком IgG1 человека из слитого белка [CD3-эпсилон (аа 1-27) человека]-Fc исследовали путем проведения идентичного анализа с идентичными реагентами и идентичным хронометрированием на планшетах для ELISA, которые были покрыты IgG1 человека (Sigma). В качестве отрицательного контроля использовали PBS.
Как показано на Фиг.63, scFv Н2С, F12Q и I2C демонстрируют сильные сигналы связывания на слитом белке [CD3-эпсилон (аа 1-27) человека]-Fc. scFv человека 3-106, 3-114, 3-148, 3-190, 3-271, 4-10 и 4-48 (которые описаны в WO 2004/106380) не демонстрируют какого-либо значительного связывания, превышающего уровень отрицательного контроля.
Для исключения возможности того, что положительное связывание scFv Н2С, F12Q и I2C с лунками, покрытыми слитым белком [CD3-эпсилон (аа 1-27) человека]-Fc, может быть обусловлено связыванием с BSA (используемым в качестве блокирующего агента) и/или Fc-гамма-участком IgG1 человека из слитого белка [CD3-эпсилон (аа 1-27) человека]-Fc, параллельно осуществляли второй ELISA эксперимент. В этом втором ELISA эксперименте все параметры были идентичны параметрам в первом ELISA эксперименте, за исключением того, что во втором ELISA эксперименте вместо слитого белка [CD3-эпсилон (аа 1-27) человека]-Fc наносили IgG1 человека (Sigma). Как показано на Фиг.64, ни один из протестированных scFv не показал какого-либо значительного связывания с BSA и/или IgG1 человека, превышающего уровень фона.
Взятые вместе, эти результаты позволяют сделать заключение о том, что традиционные CD3-связывающие молекулы, распознающие зависимый от окружения CD3-эпитоп (например, которые описаны в WO 2004/106380), не связываются специфически с (аа 1-27)-областью CD3-эпсилон человека, в то время как scFv H2C, F12Q и I2C, связывающиеся с независимым от окружения эпитопом CD3-эпсилон, четко демонстрируют специфическое связывание с N-концевыми 27 аминокислотами CD3-эпсилон человека.
39. Создание CD44- и CD3-биспецифических одноцепочечных молекул с межвидовой специфичностью
39.1. Клонирование связывающих молекул с межвидовой специфичностью
В общем случае, молекулы биспецифических одноцепочечных антител, каждое из которых содержит домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD3-эпсилон человека и макака, а также домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD44 человека и макака, конструировали, как представлено в следующей ниже Таблице 15.
Вышеупомянутые конструкции, содержащие вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) с межвидовой специфичностью к CD44 человека и макака, и VH- и VL-домены с межвидовой специфичностью к CD3 человека и макака, получали генным синтезом. Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность соответствующей молекулы биспецифического одноцепочечного антитела, затем, в рамке считывания, кодирующую последовательность состоящей из 6 гистидиновых остатков метки и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие N- и С-концевые сайты рестрикции. Фрагмент генного синтеза клонировали через эти сайты рестрикции в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по дигидрофолатредуктазе (DHFR) клетки яичника китайского хомячка (СНО) для эукариотической экспрессии данной конструкции.
39.2. Экспрессия молекул биспецифических одноцепочечных антител
Эти биспецифические конструкции временно экспрессировали в дефектных по DHFR клетках СНО. Кратко, 4×105 клеток на одну конструкцию культивировали в 3 мл полной среды RPMI 1640 со стабилизирующей добавкой глутамина, дополненной 10% фетальной сыворотки теленка, 1% пенициллина/стрептомицина и нуклеозидами из концентрированного раствора реагентов со степенью чистоты "для клеточных культур" (Sigma-Aldrich Chemie GmbH, Taufkirchen, Germany) до конечной концентрации аденозина 10 мкг/мл, дезоксиаденозина 10 мкг/мл и тимидина 10 мкг/мл, в инкубаторе при 37°С, 95% влажности и 7% СО3 за одни сутки до проведения трансфекции. Трансфекцию осуществляли с помощью реагента для трансфекции Fugene HD (Roche, №04709691001) в соответствии с протоколом производителя. 94 мкл среды OptiMEM (Invitrogen) и 6 мкл Fugene HD смешивали и инкубировали в течение 5 минут при комнатной температуре. Затем добавляли 1,5 мкг ДНК на конструкцию, перемешивали и инкубировали в течение 15 минут при комнатной температуре. При этом дефектные по DHFR клетки СНО промывали 1×PBS и ресуспендировали в 1,5 мл полной среды RPMI 1640. Смесь для трансфекции разбавляли 600 мкл полной среды RPMI 1640, добавляли к клеткам и инкубировали в течение ночи при 37°С, 95% влажности и 7% СО3 Через сутки после проведения трансфекции инкубируемый объем для каждого подхода увеличивали до 5 мл путем добавления полной среды RPMI 1640. Супернатант собирали через 3 суток инкубации.
39.3. Проточно-цитометрический анализ связывания CD44- и CD3-биспецифических антител с межвидовой специфичностью
С целью тестирования функциональности конструкций биспецифических антител с межвидовой специфичностью в отношении способности связываться с CD44 и CD3 человека и макака, соответственно, осуществляли FACS-анализ. Для этого клетки СНО, трансфицированные CD44 человека (как описано в Примере 28.1) и CD3-положительную линию клеток HPB-ALL Т-клеточного лейкоза человека (DSMZ, Braunschweig, ACC483) использовали для тестирования связывания с антигенами человека. Способность связываться с антигенами макака тестировали с использованием созданного CD44-трансфектанта макака (описанного в Примере 28.3) и Т-клеточной линии макака 4119LnPx (любезно предоставленной проф. Fickenscher, Hygiene Institute, Virology, Erlangen-Nuernberg; опубликована в Knappe A, et al., и Fickenscher H., Blood 2000, 95, 3256-61). Чтобы продемонстрировать специфичность конструкций биспецифических антител с межвидовой специфичностью к CD44, тестировали связывание CD44delv6 (CD44 с делегированным экзоном v6) человека, используя клетки СНО, трансфицированные CD44delv6 человека (получение описано в Примере 28.2).
200000 клеток соответствующих клеточных линий инкубировали в течение 30 мин на льду с 50 мкл супернатантов клеточной культуры трансфицированных клеток, экспрессирующих конструкции биспецифических антител с межвидовой специфичностью. Клетки дважды промывали в PBS с 2% FCS, и связывание конструкции определяли с использованием мышиного анти-His-антитела (Penta-His-антитело; Qiagen; разбавленное 1:20 в 50 мкл PBS с 2% FCS). После промывки связавшиеся анти-His-антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. Супернатант нетрансфицированных клеток СНО использовали в качестве отрицательного контроля связывания с Т-клеточными линиями. Одноцепочечную конструкцию с нерелевантной целевой специфичностью использовали в качестве отрицательного контроля связывания с CD44- и CD44delv6-трансфицированными клетками СНО.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002).
Биспецифическое связывание приведенных выше одноцепочечных молекул, которые демонстрируют межвидовую специфичность к CD44 и межвидовую специфичность к CD3 человека и макака, четко определялось, как показано на Фиг.65 (a-d). Никакого связывания молекул с CD44delv6 из Фиг.65е не наблюдалось. Поэтому была четко продемонстрирована межвидовая специфичность биспецифических антител к антигенам CD3 и CD44 человека и макака.
39.4. Биологическая активность CD44- и CD3-биспецифических одноцепочечных антител с межвидовой специфичностью
Биологическую активность созданных биспецифических одноцепочечных антител анализировали по высвобождению хрома 51 (51Cr) в анализах цитотоксичности in vitro, используя CD44-положительную клеточную линию человека, описанную в 28.1. В качестве эффекторных клеток использовали стимулированные CD4/CD56-истощенные PBMC человека, стимулированные РВМС человека, как указано на соответствующем графическом материале.
Получение стимулированных CD4/CD56-истощенных PBMC осуществляли следующим образом.
На чашку Петри (диаметр 145 мм; Greiner bio-one GmbH, Kremsmunster) наносили имеющееся в продаже aнти-CD3-cпeцифичecкoe антитело (например, ОКТ3, Othoclone) в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязавшийся белок удаляли за одну стадию промывки, используя PBS. Свежие PBMC выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. 3 - 5×107 РВМС добавляли в предварительно покрытую чашку Петри в 120 мл RPMI 1640 со стабилизирующей добавкой глутамин/10% FCS/IL-2 20 ед./мл (пролейкин, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали и промывали один раз RPMI 1640. Добавляли IL-2 до конечной концентрации 20 ед./мл и клетки снова культивировали в течение одних суток в той же среде для культивирования клеток, как упомянуто выше.
CD8+ цитотоксические Т-лимфоциты (CTL) обогащали посредством истощения CD4+Т-клеток и CD56+МК-клеток согласно стандартным протоколам.
Клетки-мишени дважды промывали PBS и метили 11,1 МБк51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 45 минут при 37°С.После этого меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали в анализе цитотоксичности. Анализ осуществляли в 96-луночном планшете в конечном объеме 250 мкл дополненной среды RPMI (как и выше) с соотношением Е:Т 10:1. В анализе цитотоксичности в отношении человека применяли клеточный супернатант, содержащий молекулы биспецифических одноцепочечных антител с межвидовой специфичностью и 20 его двукратных разведении. Время анализа составляло 18 часов, и цитотоксичность измеряли в относительных величинах высвобожденного хрома в супернатанте, соответствующих разнице между максимальным лизисом (добавление Тритона-X) и спонтанным лизисом (без эффекторных клеток). Все измерения осуществляли в четырех повторностях. Измерение радиоактивности хрома в супернатантах осуществляли с использованием гамма-счетчика Wizard 3" (Perkin Elmer Life Sciences GmbH, Koln, Germany). Анализ экспериментальных данных осуществляли с применением Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA). Сигмоидальные кривые доза-эффект обычно имеют величины R2 выше 0,90, как определено с использованием этого программного обеспечения. Величины ЕС5о, рассчитанные с помощью данной программы анализа, использовали для сравнения биологической активности.
Как показано на Фиг.66, все созданные конструкции биспецифического одноцепочечного антитела с межвидовой специфичностью демонстрировали цитотоксическую активность против клеток-мишеней, положительных в отношении CD44 человека, индуцированных стимулированными CD4/CD56-истощенными РВМС.
40. Создание фрагмента биспецифического тандемного одноцепочечного антитела с межвидовой специфичностью в отношении HCV-антигена и CD3
40.1. Получение клеток ОНО, экспрессирующих гликопротеин Е2 оболочки HCV (генотипы 1а и 1b HCV)
Кодирующие последовательности гликопротеина Е2 оболочки вируса гепатита С (HCV) (генотипы 1а и 1b HCV; изоляты HCV соответствующих подтипов; последовательности определены согласно стандартным протоколам), каждую в виде белков трансляционного слияния с трансмембранным и внутриклеточным доменом CD4 человека, получали генным синтезом согласно стандартным протоколам. Фрагменты генного синтеза конструировали таким образом, чтобы они содержали сначала сайт Козака для эукариотической экспрессии данной конструкции, затем кодирующую последовательность сигнального пептида из 14 аминокислот, затем кодирующую последовательность первых 278 (генотип 1а) или 279 (генотип 1b) аминокислот гликопротеина Е2 оболочки HCV, двойную последовательность myc-эпитопа и кодирующую последовательность трансмембранного и внутриклеточного домена CD4 человека, соответствующую аминокислотам 372-433 зрелого белка (которая опубликована в GenBank, номер доступа М 12807) и стоп-кодон (кДНК и аминокислотные последовательности данных конструкций представлены в SEQ ID NO: от HCV-1 до HCV-4, генотипы 1а и 1b, соответственно). Фрагменты генного синтеза конструировали также таким образом, чтобы ввести сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции, EcoRI на 5'-конце и SalI на 3'-конце, использовали в последующих процедурах клонирования. Фрагменты генного синтеза клонировали через EcoRI и SalI в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Упомянутые выше методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии данной конструкции. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно. Окончательно были получены две клеточные линии:
клеточная линия СНО с доменом Е2 генотипа 1а HCV, экспрессируемым на поверхности, и другая клеточная линия СНО с доменом Е2 генотипа 1b HCV, экспрессируемым на поверхности.
40.2. Клонирование фрагмента биспецифического тандемного одноцепочечного антитела с межвидовой специфичностью
В общем случае, фрагмент биспецифического тандемного одноцепочечного антитела, содержащего домен со специфичностью связывания, демонстрирующий межвидовую специфичность к CD3-эпсилон человека и макака, а также со специфичностью связывания с HCV, конструировали, как представлено в следующей ниже Таблице 16.
Вышеупомянутую конструкцию, содержащую вариабельные домены легкой цепи (L) и вариабельные домены тяжелой цепи (Н), специфичные к антигенам HCV, и VH- и VL-комбинации, демонстрирующие межвидовую специфичность к CD3 человека и макака, получали генным синтезом. Фрагмент генного синтеза конструировали таким образом, чтобы он содержал сначала сайт Козака для эукариотической экспрессии данной конструкции, затем иммуноглобулиновый лидерный пептид из 19 аминокислот, затем, в рамке считывания, кодирующую последовательность фрагмента биспецифического тандемного одноцепочечного антитела, затем, в рамке считывания, кодирующую последовательность гистидин6-метки и стоп-кодон. Фрагмент генного синтеза конструировали также таким образом, чтобы ввести подходящие сайты рестрикции в начало и в конец фрагмента. Введенные сайты рестрикции использовали в последующих процедурах клонирования. Фрагмент генного синтеза клонировали через эти сайты рестрикции в плазмиду, обозначенную pEF-DHFR (pEF-DHFR описана в Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150), следуя стандартным протоколам. Упомянутые выше методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)). Клон с подтвержденной нуклеотидной последовательностью трансфицировали в дефектные по DHFR клетки СНО для эукариотической экспрессии фрагмента биспецифического тандемного одноцепочечного антитела. Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкции индуцировали путем увеличения концентрации метотрексата (МТХ) до конечной концентрации 20 нМ МТХ включительно.
40.3. Экспрессия и очистка фрагмента биспецифического тандемного одноцепочечного антитела
Фрагмент биспецифического тандемного одноцепочечного антитела экспрессировали в клетках яичника китайского хомячка (СНО). Экспрессию эукариотического белка в дефектных по DHFR клетках СНО осуществляли, как описано в Kaufmann R.J. (1990) Methods Enzymol. 185, 537-566. Генную амплификацию конструкций индуцировали путем добавления увеличивающихся концентраций МТХ до конечных концентраций 20 нМ МТХ включительно. После двух пассажей стационарной культуры, клетки выращивали в роллерных флаконах в жидкой соевой среде HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone) в течение 7 суток перед сбором. Клетки выделяли центрифугированием и супернатант, содержащий экспрессированный белок, хранили при -20°С.Альтернативно, осуществляли временную экспрессию конструкций в клетках НЕК 293. Трансфекцию осуществляют с помощью реагента 293fectin (Invitrogen, №12347-019) в соответствии с протоколом производителя.
Для хроматографии использовали систему Akta® Explorer (GE Health Systems) и программное обеспечение Unicorn®. Аффинную хроматографию с иммобилизованным металлом ("IMAC") осуществляли с использованием Fractogel EMD chelate® (Merck), который нагружали ZnCl2 в соответствии с протоколом, предложенным производителем. Колонку уравновешивали буфером А (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl), и супернатант клеточной культуры (500 мл) наносили на колонку (10 мл) при скорости потока 3 мл/мин. Колонку промывали буфером А для удаления несвязавшегося образца. Связавшийся белок элюировали с использованием двухстадийного градиента буфера В (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl; 0,5 М имидазол) в соответствии со следующим протоколом:
стадия 1: 20% буфера В в 6 объемах колонки,
стадия 2:100% буфера В в 6 объемах колонки.
Элюированные белковые фракции со стадии 2 объединяли для дальнейшей очистки. Все химические реактивы имели степень чистоты, подходящую для исследований, и были приобретены у Sigma (Deisenhofen) или Merck (Darmstadt).
Гель-фильтрацию осуществляли на препаративной колонке HiLoad 16/60 Superdex 200 (GE/Amersham), уравновешенной Equi-буфером (25 мМ цитрат;
200 мМ лизин; 5% глицерин; рН 7,2). Элюированные белковые образцы (скорость потока 1 мл/мин) подвергали стандартным SDS-PAGE и вестерн-блоттингу для детекции. Перед очисткой колонку калибровали для определения молекулярной массы (набор маркеров молекулярной массы, Sigma MW GF-200). Концентрацию белка определяли, используя OD при 280 нм.
Очищенный фрагмент биспецифического тандемного одноцепочечного антитела анализировали с использованием SDS-PAGE в восстанавливающих условиях и предварительно залитых 4-12%-ных гелей в бис-Трис-буфере (Invitrogen). Приготовление и нанесение образцов осуществляли согласно протоколу, предложенному производителем. Молекулярную массу определяли, используя белковый стандарт MultiMark (Invitrogen). Гель окрашивали коллоидным Coomassie (протокол Invitrogen). Чистота выделенного белка составляла более 95%, как определено SDS-PAGE.
Фрагмент биспецифического тандемного одноцепочечного антитела имеет молекулярную массу примерно 52 кДа в нативных условиях, как определено гель-фильтрацией в PBS.
Вестерн-блоттинг осуществляли, используя мембрану Optitran® BA-S83 и аппарат для блоттинга Invitrogen в соответствии с протоколом, предложенным производителем. Использовали антитела, направленные против His-метки (Penta-His, Qiagen), и антитело козы против Ig мыши, меченое щелочной фосфатазой (АР) (Sigma), a BCIP/NBT (Sigma) в качестве субстрата. Определили единственную полосу при 52 кДа, соответствующую очищенному фрагменту биспецифического тандемного одноцепочечного антитела.
40.4. Проточно-цитометрический анализ связывания фрагмента биспецифического тандемного одноцепочечного антитела с межвидовой специфичностью в отношении антигена HCV и CD3
С целью тестирования функциональности фрагмента биспецифического тандемного одноцепочечного антитела с межвидовой специфичностью в отношении способности связываться с антигеном HCV и CD3 человека и макака, соответственно, осуществляли FACS-анализ. Для этого клетки СНО, трансфицированные антигеном Е2 HCV из двух разных генотипов HCV (1а и 1b), которые описаны в Примере 40.1, CD3-положительную линию клеток НРВ-ALL Т-клеточного лейкоза человека (DSMZ, Braunschweig, ACC483) и Т-клеточную линию макака 4119LnPx использовали для тестирования связывания с соответствующими антигенами. 200000 клеток соответствующих клеточных линий инкубировали в течение 30 мин на льду с 50 мкл супернатанта клеточной культуры трансфицированных клеток, экспрессирующих данную конструкцию биспецифического антитела с межвидовой специфичностью. Клетки дважды промывали в PBS с 2% FCS, и связывание фрагмента биспецифического тандемного одноцепочечного антитела определяли с использованием мышиного анти-His-антитела (Penta-His-антитело; Qiagen; разбавленное 1:20 в 50 мкл PBS с 2% FCS). После промывки связавшиеся анти-his-антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. PBS с 2% FCS.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002). Биспецифическое связывание фрагмента биспецифического тандемного одноцепочечного антитела с антигеном HCV и CD3 человека и примата, не являющегося шимпанзе, четко определялось, как показано на Фиг.67. В FACS-анализе данный фрагмент биспецифического тандемного одноцепочечного антитела демонстрировал связывание с CD3 и антигенами HCV при сравнении с соответствующими отрицательными контролями. Была продемонстрирована межвидовая специфичность фрагмента биспецифического тандемного одноцепочечного антитела к CD3 человека и макака, с одной стороны, и HCV-специфичность, с другой стороны.
40.5. Биологическая активность фрагмента биспецифического тандемного одноцепочечного антитела с межвидовой специфичностью в отношении антигена HCV и CD3
Биологическую активность фрагмента биспецифического тандемного одноцепочечного антитела анализировали по высвобождению хрома 51 (51Cr) в анализах цитотоксичности in vitro, используя положительную в отношении антигенов HCV клеточную линию, описанную в Примере 40.1. В качестве эффекторных клеток использовали стимулированные CD4/CD56-HCTouneHHbie РВМС человека от двух разных доноров.
На чашку Петри (диаметр 145 мм; Greiner bio-one GmbH, Kremsmunster) наносили имеющееся в продаже aнти-CD3-cпeцифичecкoe антитело (например, ОКТ3, Othoclone) в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязавшийся белок удаляли за одну стадию промывки, используя PBS. Свежие РВМС выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. 3 - 5×107 РВМС добавляли в предварительно покрытую чашку Петри в 120 мл RPMI 1640 со стабилизирующей добавкой глутамин/10% FCS/IL-2 20 ед./мл (пролейкин, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали и промывали один раз RPMI 1640. Добавляли IL-2 до конечной концентрации 20 ед./мл и клетки снова культивировали в течение одних суток в той же среде для культивирования клеток, как упомянуто выше.
CD8+ цитотоксические Т-лимфоциты (CTL) обогащали посредством истощения CD4+Т-клеток и CD56+МК-клеток согласно стандартным протоколам. Клетки-мишени дважды промывали PBS и метили 11,1 МБк51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 45 минут при 37°С.После этого меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали в анализе цитотоксичности. Анализ осуществляли в 96-луночном планшете в общем объеме 250 мкл дополненной среды RPMI (как и выше) с соотношением Е:Т 10:1. Использовали 76,4 мкг/мл фрагмента биспецифического тандемного одноцепочечного антитела с межвидовой специфичностью и 20 его двукратных разведении. Время анализа составляло 18 часов, и цитотоксичность измеряли в относительных величинах высвобожденного хрома в супернатанте, соответствующих разнице между максимальным лизисом (добавление Тритона-Х) и спонтанным лизисом (без эффекторных клеток). Все измерения осуществляли в четырех повторностях. Измерение радиоактивности хрома в супернатантах осуществляли с использованием гамма-счетчика Wizard 3" (Perkin Elmer Life Sciences GmbH, Koln, Germany). Анализ экспериментальных данных осуществляли с применением Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA).
Как показано на Фиг.68, фрагмент биспецифического тандемного одноцепочечного антитела с межвидовой специфичностью демонстрировал цитотоксическую активность против положительных в отношении антигенов HCV клеток-мишеней человека.
41. Фрагменты биспецифических тандемных одноцепочечных антител, направленные на CD3 человека и примата, не являющегося шимпанзе, и на антигены вируса гепатита, экспонируемые на поверхности инфицированных клеток
41.1. Вирус гепатита В (HBV)
Приведенные ниже вырожденные олигонуклеотиды, которые совместно перекрывают концевой участок из приблизительно 15-20 нуклеотидов и где каждый второй праймер представляет собой антисмысловой праймер, использовали для получения окружения последовательности VH человека для CDRH1 (SEQ ID 1634), CDRH2 (SEQ ID 1635) и CDRH3 (SEQ ID 1636):
5'C8-VH-A-XhoI
CCACTTCTCGAGTCTGGCGSCGRASTGMWGMAGCCTGGCGSCTCCSTGMRGS
TGTCCTGCRMGGCCTCCGGC;
3'C8-VH-B
CCCTGGAGCCTGCCGCACCCAGGACATGGCGTAGCCGGWGAAGGTGWAGCC
GGAGGCCKYGCAGGA;
5'C8-VH-C
CGGCAGGCTCCAGGGMAGGGACTGGAATGGRTGRGCTCCATCTCCGGCTCCG
GCGGCTCCACCTACTACGCCGACTCCGTGAAGGGCCGG;
3'C8-VH-D
CTTGGCGCAGTAGTACASGGCGGTGTCCTCGGMCCGCAGGGAGYTCAKCTSCA
KGTACASGGTGYTCKTGGAGKTGTCCCGGSTSATTGTGAMCCGGCCCTTCACGGA;
3'C8-VH-E-BstEII
GACCGTGGTGACCAGGGTGCCCTGGCCCCAGTTGCCCAGAGGGAAGTAGTAG
ATGGAGGAGCCGTAGTATTCCTGCCGGCCAGGAGGCTTGGCGCAGTAGTA;
Этот набор праймеров перекрывает всю VH-последовательность. В пределах каждого набора праймеры смешивали в равных количествах (например, 1 мкл каждого праймера (концентрированные растворы праймеров:
20-100 мкМ) в 20 мкл ПЦР-реакции) и добавляли к ПЦР-смеси, состоящей из ПЦР-буфера, нуклеотидов и Taq-полимеразы. Эту смесь инкубировали при 94°С в течение 3 минут, при 65°С в течение 1 минуты, при 62°С в течение 1 минуты, при 59°С в течение 1 минуты, при 56°С в течение 1 минуты, при 52°С в течение 1 минуты, при 50°С в течение 1 минуты и при 72°С в течение 10 минут в ПЦР-циклере. После этого продукт подвергали электрофорезу в агарозном геле и продукт размером от 200 до 400 выделяли из геля согласно стандартным методам.
Полученный VH ПЦР-продукт затем использовали в качестве матрицы для стандартной ПЦР-реакции с применением праймеров, которые вводят подходящие для клонирования N-концевые и С-концевые сайты рестрикции (праймер 5'C8-VH-A-Xhol и праймер 3'C8-VH-E-BstEII). Фрагмент ДНК надлежащего размера (для VH приблизительно 350 нуклеотидов) выделяли с помощью электрофореза в агарозном геле согласно стандартным методам. Таким способом амплифицировали достаточный ДНК-фрагмент VH.
Приведенные ниже вырожденные олигонуклеотиды, которые совместно перекрывают концевой участок из приблизительно 15-20 нуклеотидов и где каждый второй праймер представляет собой антисмысловой праймер, использовали для получения окружения последовательности VL человека для CDRL1 (SEQ ID 1639), CDRL2 (SEQ ID 1640) и CDRL3 (SEQ ID 1641), которые являлись дополнительными по отношению к CDRH1 (SEQ ID 1634), CDRH2 (SEQ ID 1635) и CDRH3 (SEQ ID 1636):
5'CS-VI-A-Sacl
CCTCAAGAGCTCGCCCTGAYGCAGCCTSCCTCCGTGTCCGTGKCCCYTGGCMA
GACCGCCMGCATCACCTGCGGCGGCAAC;
3'C8-VI-B
CAGCACAGGGGMCTGTCCTGGCTTCTGCTGATACCAGTGCACGGACTTGGAGC
CGATGTTGTTGCCGCCGCAGGTGAT;
5'C8-VI-C
CAGAAGCCAGGACAGKCCCCTGTGCTGGTCRTATACGACGACTCCGACCGCCC
TTCCGGCATCCCTGAGCGGTTCTCCGGCTCC;
3'CS-VI-D
GACCTGGCAGTAGTAGTCGGCCTCGTCCMYGGCCTSCRCCCSGGAGATGGTCA
GGGTGRCGGTGKTGCCGGAGYTGGAGCCGGAGAACCG;
3'C8-VI-E-BsiWI/Spel
CCCGATACTAGTCGTACGCAGCACGGTCAGCTTTGTTCCGCCGCCAAACACCA
CCAGGTCGGAGGAGGAGTCCCAGACCTGGCAGTAGTAGTCGGC.
Этот набор праймеров перекрывает всю соответствующую VL-последовательность. В пределах каждого набора праймеры смешивали в равных количествах (например, 1 мкл каждого праймера (концентрированные растворы праймеров: 20-100 мкМ) в 20 мкл ПЦР-реакции) и добавляли к ПЦР-смеси, состоящей из ПЦР-буфера, нуклеотидов и Taq-полимеразы. Эту смесь инкубировали при 94°С в течение 3 минут, при 65°С в течение 1 минуты, при 62°С в течение 1 минуты, при 59°С в течение 1 минуты, при 56°С в течение 1 минуты, при 52°С в течение 1 минуты, при 50°С в течение 1 минуты и при 72°С в течение 10 минут в ПЦР-циклере. После этого продукт подвергали электрофорезу в агарозном геле и продукт размером от 200 до 400 выделяли из геля согласно стандартным методам.
Полученный VL ПЦР-продукт затем использовали в качестве матрицы для стандартной ПЦР-реакции с применением праймеров, которые вводят подходящие для клонирования N-концевые и С-концевые сайты рестрикции (праймер 5'C8-VI-A-Sacl и праймер 3'C8-VI-E-BsiWI/Spel). Фрагмент ДНК надлежащего размера (для VL приблизительно 330 нуклеотидов) выделяли с помощью электрофореза в агарозном геле согласно стандартным методам. Таким способом амплифицировали достаточный ДНК-фрагмент VL.
Конечный VH ПЦР-продукт (т.е. репертуар человеческих/гуманизированных VH) затем комбинировали с его соответствующим конечным VL ПЦР-продуктом (т.е. репертуаром человеческих/гуманизированных VL) в векторе для фагового дисплея pComb3H5Bhis с целью создания библиотеки функциональных scFv-фрагментов антител, из которых - после экспонирования на нитевидном фаге -отбирали, подвергали скринингу, идентифицировали и подтверждали анти-HBS-связывающие структуры (HBS означает поверхностный антиген вируса гепатита В), как описано ниже.
450 нг фрагментов легкой цепи (расщепленных Sacl-Spel) лигировали с 1400 нг фагмиды pComb3H5Bhis (расщепленной Sacl-Spel; большой фрагмент). Полученную комбинаторную библиотеку антител затем подвергали трансформации в 300 мкл электрокомпетентных клеток Escherichia coli XL1 Blue с помощью электропорации (2,5 кВ; кювета с щелью 0,2 см; 25 мкФ; 200 Ом, Biorad gene-pulser), в результате получая библиотеку размером более 107 независимых клонов. Через один час фенотипической экспрессии отбирали положительные трансформанты по устойчивости к карбенициллину, кодируемой вектором pComb3H5BHis, в 100 мл жидкой super broth (SB)-культуры в течение ночи. Затем клетки собирали центрифугированием и плазмиду получали, используя имеющийся в продаже набор для получения плазмид (Qiagen).
2800 нг этой плазмидной ДНК, содержащей VL-библиотеку (расщепленной Xhol-BstEII; большой фрагмент), лигировали с 900 нг V-фрагментов тяжелой цепи (расщепленной Xhol-BstEII) и снова подвергали трансформации в две аликвоты по 300 мкл электрокомпетентных клеток Е. coli XL1 Blue с помощью электропорации (2,5 кВ; кювета с щелью 0,2 см; 25 мкФ, 200 Ом), получая в результате библиотеку VH-VL scFv-фрагментов антител общим размером более 107 независимых клонов.
После фенотипической экспрессии и медленной адаптации к карбенициллину клетки Е. coli, содержащие библиотеку антител, переносили в 8 В-карбенициллин(50 мкг/мл)-селективную среду. Клетки Е. coli, содержащие библиотеку антител, затем инфицировали инфекционной дозой, равной 1012 частиц хелперного фага VCSM13, приводящей к продуцированию и секреции нитевидного фага М13, где фаговая частица содержит одноцепочечную рСотЬЗН5 ВН1з-ДНК, кодирующую scFv-фрагмент антитела, и экспонировала соответствующий scFv-фрагмент антитела в виде трансляционного слияния с оболочечным белком III фага. Этот пул фагов, экспонирующих библиотеку антител, использовали для селекции антигенсвязывающих структур.
Подобным же образом вышеупомянутую процедуру применяли для другой целевой связывающей структуры. Для этой цели приведенные ниже вырожденные олигонуклеотиды, которые совместно перекрывают концевой участок приблизительно из 15-20 нуклеотидов и где каждый второй праймер представляет собой антисмысловой праймер, использовали для получения окружения последовательности VH человека для CDRH1 (SEQ ID 1669), CDRH2 (SEQ ID 1670) и CDRH3 (SEQ ID 1671):
5'C9-VH-A-Xhol
CCACTTCTCGAGTCTGGGGSAGRGGTGRWGMAGCCTGGGRSGTCCSTGARAS
TCTCCTGTGCAGCCTCTGGA;
3'C9-VH-B
CCACTCCAGCCCCTKGCCTGGAGCCTGGCGGACCCAGTGTATGCCATAATTAC TGAAGGTGWATCCAGAGGCTGCACAGGA;
5'C9-VH-C
GCTCCAGGCMAGGGGCTGGAGTGGRTGGSACTTATATCATATGATGGAAATAA
GAAATTCTATGCAGACTCCGTGAAGGGCCGA;
3'C9-VH-D
GTAATATACAGCCGTGTCCTCAGRTCTCAGGCTGCTCAKTTSCAKATMCACCGT
GYTCKTAGAAGTGTCTCTGGTSATGGYGAMTCGGCCCTTCACGGAGTC;
3'C9-VH-E-BstEII
GACCGTGGTGACCAGGGTTCCCTGGCCCCAGTAGTCAAATTCCCCCCAGTACA
AGGCAATACCCCCAGATTTCGCACAGTAATATACAGCCGTGTC.
В качестве праймеров для конечной стандартной ПЦР-реакции для введения подходящих для клонирования N-концевых и С-концевых сайтов рестрикции в VH использовали олигонуклеотиды 5'C9-VH-A-Xhol и 3'C9-VH-E-BstEII.
Аналогично VH, приведенные ниже вырожденные олигонуклеотиды, которые совместно перекрывают концевой участок приблизительно из 15-20 нуклеотидов и где каждый второй праймер представляет собой антисмысловой праймер, использовали для получения окружения последовательности VL человека для CDRL1 (SEQ ID 1672), CDRL2 (SEQ ID 1673) и CDRL3 (SEQ ID 1674), которые являлись дополнительными по отношению к CDRH1 (SEQ ID 1669), CDRH2 (SEQ ID 1670) и CDRH3 (SEQ ID 1671):
5'C9-VI-A-Sacl
CCTCAAGAGCTCGWACTGACTCAGCCACCCTCGGTGTCAGYGGCCCCAGGACA
GAMGGYCAYGATTTCCTGTGGGGGAAAC;
3'C9-VI-B
GCCTGGCWKCTGCTGATACCAGTGCACGGTTGTACTTCCAATGTTGTTTCCCCC
ACAGGAAAT;
5'CQ-VI-C
TGGTATCAGCAGMWGCCAGGCMMGGCCCCTRWGCTGSTCRTCTATGATGATA
ACGAGCGACCCTCAGGGATCCCTGASCGATTCTCTGGCTCC;
3'C9-VI-D
CACTTGACAATAATAGTCGGCCTCATCCCCGGYTTSGASCCYGKTGATGSYCAG
GGTGGCCGAGGTCCCAGASTTGGAGCCAGAGAATCG;
3'C9-VI-E-BsiWI/Spel
CCCGATACTAGTCGTACGTAGGACGGTCAGCTTCGTCCCTCCGCCGAATACCA
CATGATCACTACCACTATCCCACACTTGACAATAATAGTC.
В качестве праймеров для конечной стандартной ПЦР-реакции для введения подходящих для клонирования N-концевых и С-концевых сайтов рестрикции в VL использовали олигонуклеотиды 5'C9-VI-A-Sacl и 3'C9-VI-E-BsiWI/Spel.
Для селекции антиген-связывающих структур фаговую библиотеку, несущую клонированный scFv-репертуар, получали из соответствующего культурального супернатанта посредством осаждения смесью PEG (полиэтиленгликоль) 8000/NaCl и центрифугирования. Приблизительно от 1011 до 1012 scFv-фаговых частиц ресуспендируют в 0,4 мл PBS/0,1% BSA и инкубируют с иммобилизованным HBS-антигеном (например EngerixR -В, GlaxoSmithKline, Germany; HBvaxProTM, Aventis Pasteur MSD SNC, France) в течение 2 часов при 37°С при слабом перемешивании. Иммобилизованный HBS-антиген (например, 5 мкг/мл PBS) наносили в виде покрытия на лунки, и лунки затем блокировали согласно стандартным протоколам.
Фаговые частицы, экспонирующие scFv-фрагменты антител, которые не связываются специфически с целевым антигеном, удаляли с помощью стадий промывки PBS/0,1% BSA (для увеличения жесткости промывки в раствор для промывки можно добавлять Tween 20). После промывки связавшиеся структуры элюировали с помощью HCI-глицинового буфера рН 2,2, а после нейтрализации с помощью 2 М Трис, рН 12, элюат использовали для инфицирования свежей неинфицированной культуры Е. coli XL1 Blue. Для элюирования остальных сильно связавшихся структур в элюируемых лунках, в них добавляли по 200 мкл свежей культуры Е. coli XL1 blue (OD600 больше 0,5) и инкубировали в течение следующих 10 минут при слабом перемешивании. Обе культуры Е. coli затем смешивали и клетки успешно трансдуцировали фагмидной копией, кодирующей scFv-фрагмент антитела человека, вновь подвергали селекции на устойчивость к карбенициллину и после этого инфицировали хелперным фагом VCMS 13 для того, чтобы начать второй раунд экспонирования антител и селекции in vitro. Обычно осуществляли суммарно от 4 до 5 циклов селекции.
С целью скрининга HBS-специфических связывающих структур плазмидную ДНК, соответствующую 4-5 раундам пэннинга, выделяли из культур Е. coli после селекции. Для получения растворимого scFv-фрагмента антитела, VH-VL-ДНК-фрагменты вырезали из плазмид (Xhol-Spel). Эти фрагменты клонировали через те же сайты рестрикции в плазмиду pComb3H5BFlag/His, отличающуюся от исходной pComb3H5BHis тем, что экспрессируемая конструкция (например scFv-фрагмент антитела) включает в себя Flag-метку (DYKDDDDK) между scFv-фрагментом антитела и His6-меткой, и дополнительные фаговые белки делегированы. После лигирования каждый пул (различные раунды пэннинга) плазмидной ДНК подвергали трансформации в 100 мкл компетентных к тепловому шоку Е. coli TG1 или XLI blue и высевали на карбенициллин-LB-агар. Одиночные колонии переносили перекалыванием в 100 мкл LB-карб (50 мкг/мл).
Е. coli, трансформированные pComb3H5BHis, содержащей VL- и VH-сегмент, продуцируют растворимый scFv-фрагмент антитела в достаточных количествах после вырезания фрагмента гена III и индукции с помощью 1 мМ IPTG. Благодаря подходящей сигнальной последовательности scFv-фрагмент антитела экспортировался в периплазму, где он сворачивается в функциональную конформацию.
Одиночные бактериальные колонии Е. coli TG1 с чашек для трансформации переносили перекалыванием для получения небольших количеств периплазмы и выращивали в SB-среде (например 10 мл), дополненной 20 мМ MgCl2 и карбенициллином 50 мкг/мл (и ресуспендировали в PBS (например 1 мл) после сбора). В результате четырех циклов замораживания при -70°С и оттаивания при 37°С наружная мембрана бактерий разрушалась под действием теплового шока, и растворимые периплазматические белки, включая scFv-фрагменты антител, высвобождались в супернатант. После удаления центрифугированием интактных клеток и клеточного дебриса собирали супернатант, содержащий scFv-фрагменты антител против HBS, и использовали для идентификации HBS-специфических связывающих структур следующим образом.
HBS-антиген наносили в виде покрытия на лунки 96-луночных пластиковых планшетов (Nunc, maxisorb) обычно при 40C в течение ночи. Лунки промывали один раз PBS/0,05% Tween 20 и затем блокировали PBS/3% BSA в течение по меньшей мере одного часа. После удаления блокирующего раствора в лунки добавляли периплазматические препараты и контрольные растворы и инкубировали обычно в течение одного часа при комнатной температуре. Затем лунки трижды промывали PBS/0,05% Tween 20. Определение scFv-фрагментов антител и контрольных антител, связавшихся с иммобилизованным антигеном, осуществляли, используя моноклональное мышиное анти-His6-антитело или антитело против FLAG-метки (Qiagen anti-PentaHis и М2 anti Flag Sigma, каждое обычно в конечной концентрации 1 мкг/мл PBS), и определяли с использованием меченого пероксидазой поликлонального антитела козы против Fab-фрагмента мыши (Dianova,1 мкг/мл PBS). Сигнал развивался при добавлении раствора субстрата ABTS и измерялся при длине волны 405 нм. Неспецифическое связывание тестируемых образцов с блокирующим агентом проверяли, проводя идентичные анализы с идентичными реагентами и идентичным хронометрированием на ELISA-планшетах, которые не были покрыты антигеном, а были только блокированы BSA.
Для исключения возможности того, что такое положительное связывание может быть обусловлено связыванием с BSA (используемым в качестве блокирующего агента в первом ELISA эксперименте), параллельно осуществляли второй ELISA эксперимент. В этом втором ELISA эксперименте все параметры были идентичны параметрам в первом ELISA эксперименте, за исключением того, что во втором ELISA эксперименте не использовали покрытие антигеном, а имело место только блокирование с использованием BSA.
С целью идентификации тех HBS-специфических scFv-фрагментов антител, идентифицированных посредством ELISA, которые также связываются с HBS-антигеном, экспонируемым на поверхности HBV-инфицированных клеток, непрямую иммунофлуоресценцию с использованием FLAG-меченого scFv-фрагмента антител, затем конъюгированного с FITC анти-Р1-АО-антитела на клетках HepG2.2.15 (Bohne F, Chmielewski M, Ebert G, et al. T-cells redirected against hepatitis В virus surface proteins eliminate infected hepatocytes. Gastroenterology 2008; 134: 239-47) осуществляли согласно стандартным протоколам (например Current Protocols in Immunology, Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002, unit 21.3). Неинфицированные клетки HepG2 служили в качестве отрицательного контроля. Условия культивирования клеток HepG2.2.15 для оптимального экспонирования HBS-антигена на клеточной поверхности описаны Bohne и др. (Bohne F, Chmielewski M, Ebert G, et al. T-cells redirected against hepatitis B virus surface proteins eliminate infected hepatocytes. Gastroenterology 2008; 134: 239-47).
Клоны с подтвержденной специфичностью связывания с HBS-антигеном на поверхности HBV-инфицированных клеток затем анализировали в отношении подходящих белковых свойств и аминокислотной последовательности. HBS-специфические scFv-фрагменты антител превращали в рекомбинантные фрагменты биспецифических тандемных одноцепочечных антител посредством их присоединения через С6бегч-линкер к CD3-специфическому scFv-фрагменту антитела I2C (SEQ ID 185) или любому другому CD3-специфическому scFv-фрагменту антитела по изобретению, получая в результате конструкции с доменной организацией VHMuc1 - (Gly4Ser1)3 - VLMuc1 - Gly4Ser1 - VHCD3 - (Gly4Ser1)3 - VLCD3 или с альтернативными доменными организациями. Для экспрессии в клетках СНО обе кодирующие последовательности: (1) N-концевого лидерного пептида тяжелой цепи иммуноглобулина, содержащего стартовый кодон, встроенный в консенсусную последовательность Козака, и (2) С-концевой His6-метки, за которой следует стоп-кодон, присоединяли, в рамке считывания, к нуклеотидной последовательности, кодирующей фрагменты биспецифического тандемного одноцепочечного антитела, перед вставкой результирующего фрагмента ДНК, полученного генным синтезом, в сайт множественного клонирования экспрессирующего вектора pEF-DHFR (Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150). Стабильную трансфекцию дефектных по DHFR клеток СНО, селекцию DHFR-положительных трансфектантов, секретирующих биспецифические одноцепочечные антитела в культуральный супернатант, и амплификацию генов с использованием метотрексата для повышения уровней экспрессии осуществляли, как описано (Mack et al. Proc. Natl. Acad. Sci. USA 92 (1995) 7021-7025). Все другие известные в данной области техники методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)).
Функциональные фрагменты биспецифических тандемных одноцепочечных антител идентифицировали посредством ELISA и проточной цитометрии, используя культуральный супернатант трансфицированных клеток СНО. С этой целью связывание с CD3 тестировали на CD3-положительной линии клеток HPB-ALL Т-клеточного лейкоза человека (DSMZ, Braunschweig, АСС483) и на Т-клеточной линии макака 4119LnPx. 200000 клеток соответствующей клеточной линии инкубировали в течение 30 мин на льду с 50 мкл супернатанта клеточной культуры. Клетки дважды промывали в PBS с 2% FCS, и связанный фрагмент биспецифического тандемного одноцепочечного антитела определяли с использованием мышиного анти-His-антитела (Penta-His-антитело; Qiagen; разбавленное 1:20 в 50 мкл PBS с 2% FCS). После промывки связавшиеся анти-His-антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. Супернатант нетрансфицированных клеток СНО использовали в качестве отрицательного контроля.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002). Связывание с HBS-антигеном тестировали с применением ELISA, как описано выше. Определение связавшегося фрагмента биспецифического тандемного одноцепочечного антитела осуществляли с использованием моноклонального мышиного анти-His6-антитела (Qiagen anti-PentaHis, обычно в конечной концентрации 1 мкг/мл PBS) с последующим использованием меченого пероксидазой поликлонального антитела козы против Fab-фрагмента антитела мыши (Dianova, 1 мкг/мл PBS).
Только те конструкции, которые демонстрируют биспецифическое связывание с CD3 человека и макака, а также с HBS-антигеном, были отобраны для дальнейшего использования.
Для получения белка, клетки СНО, экспрессирующие полностью функциональные фрагменты биспецифических тандемных одноцепочечных антител и адаптированные к жидкой соевой среде HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone), выращивали в роллерных флаконах с жидкой соевой средой HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone) в течение 7 суток. Культуральный супернатант осветляли от клеток центрифугированием и хранили при -20°С до очистки. В качестве хроматографического оборудования для очистки фрагмента биспецифического тандемного одноцепочечного антитела из культурального супернатанта использовали систему Akta® Explorer (GE Health Systems) и программное обеспечение Unicorn®. Аффинную хроматографию с иммобилизованным металлом ("IMAC") осуществляли с использованием Fractogel EMD chelate® (Merck), который нагружали ZnCb в соответствии с протоколом, предложенным производителем. Колонку уравновешивали буфером А (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl), и супернатант клеточной культуры (500 мл) наносили на колонку (10 мл) при скорости потока 3 мл/мин. Колонку промывали буфером А для удаления несвязавшегося образца. Связавшийся белок элюировали с использованием двухстадийного градиента буфера В (20 мМ натрий-фосфатный буфер рН 7,2;
0,1 М NaCl; 0,5 М имидазол) в соответствии со следующим протоколом:
стадия 1: 20% буфера В в 6 объемах колонки;
стадия 2: 100% буфера В в 6 объемах колонки.
Элюированные белковые фракции со стадии 2 объединяли для дальнейшей очистки. Все химические реактивы имели степень чистоты, подходящую для исследований, и были приобретены у Sigma (Deisenhofen) или Merck (Darmstadt).
Гель-фильтрацию осуществляли на препаративной колонке HiLoad 16/60 Superdex 200 (GE/Amersham), уравновешенной Equi-буфером (25 мМ цитрат;
200 мМ лизин; 5% глицерин; рН 7,2). Элюированные белковые образцы (скорость потока 1 мл/мин) подвергали стандартным SDS-PAGE и вестерн-блоттингу для детекции. Перед очисткой колонку калибровали для определения молекулярной массы (набор маркеров молекулярной массы, Sigma MW GF-200). Концентрацию белка определяли, используя OD при 280 нм.
Очищенный фрагмент биспецифического тандемного одноцепочечного антитела анализировали с использованием SDS-PAGE в восстанавливающих условиях и предварительно залитых 4-12%-ных гелей в бис-Трис-буфере (Invitrogen). Приготовление и нанесение образцов осуществляли согласно протоколу, предложенному производителем. Молекулярную массу определяли, используя белковый стандарт MultiMark (Invitrogen). Гель окрашивали коллоидным Coomassie (протокол Invitrogen). Чистота выделенного белка составляет более 95%, как определено SDS-PAGE.
Фрагмент биспецифического тандемного одноцепочечного антитела имеет молекулярную массу примерно 52 кДа в нативных условиях, как определено гель-фильтрацией в PBS. Все конструкции очищали согласно данному методу.
Вестерн-блоттинг осуществляли, используя мембрану Optitran® BA-S83 в аппарате для блоттинга Invitrogen в соответствии с протоколом, предложенным производителем. Для определения фрагментов биспецифических тандемных одноцепочечных антител использовали антитело против Mis-метки (Penta-His, Qiagen). Антитело козы против Ig мыши, меченое щелочной фосфатазой (АР) (Sigma), использовали в качестве вторичного антитела, a BCIP/NBT (Sigma) в качестве субстрата. Определили единственную полосу при 52 кДа, соответствующую очищенному фрагменту биспецифического тандемного одноцепочечного антитела.
Эффективность фрагментов биспецифических тандемных одноцепочечных антител, взаимодействующих с CD3 человека и макака и с HBS-антигеном, в системе человека и примата, не являющегося шимпанзе, определяли с помощью нерадиоактивного анализа цитотоксичности, используя клетки HepG2.2.15 в качестве клеток-мишеней, как описано Bohne и др. (Bohne F, Chmielewski M, Ebert G, et al. T cells redirected against hepatitis В virus surface proteins eliminated infected hepatocytes. Gastroenterology 2008; 134: 239-47), и стимулированные CD4/CD56-HCTOiyeHHbie PBMC человекам или Т-клеточную линию макака 4119LnPx вместо Т-клеток, подвергнутых трансдукции химерным Т-клеточным рецептором, в качестве эффекторных клеток. С целью получения кривых доза-эффект концентрацию каждого фрагмента биспецифического тандемного одноцепочечного антитела титровали в анализе цитотоксичности при фиксированном соотношении Е:Т (например 10:1 или 5:1) (вместо соотношения Е:Т, которое описано Bohne и др.).
Получение стимулированных РВМС человека осуществляли следующим образом. На чашку Петри (диаметр 85 мм; Nunc) наносили имеющееся в продаже анти-CD3-специфическое антитело (например, ОКТ3, Othoclone) в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязавшийся белок удаляли за одну стадию промывки, используя PBS. Свежие РВМС выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. 3 - 5×107 РВМС добавляли в предварительно покрытую чашку Петри в 50 мл RPMI 1640 со стабилизирующей добавкой глутамин/10% FCS/IL-2 20 ед./мл (пролейкин, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали и промывали один раз RPMI 1640. Добавляли IL-2 до конечной концентрации 20 ед./мл и клетки снова культивировали в течение одних суток в той же среде для культивирования клеток, как упомянуто выше.
Анализ экспериментальных данных, полученных в анализе цитотоксичности, осуществляли с применением Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA). Сигмоидальные кривые доза-эффект обычно имеют величины R2 выше 0,90, как определено с использованием этого программного обеспечения. Величины ЕС50, как показатель эффективности, вычисляли с помощью данной программы анализа.
41.2. Вирус гепатита С (HCV)
Приведенные ниже вырожденные олигонуклеотиды, которые совместно перекрывают концевой участок приблизительно из 15-20 нуклеотидов и где каждый второй праймер представляет собой антисмысловой праймер, использовали для получения окружения последовательности VH человека для CDRH1 (SEQ ID 1652), CDRH2 (SEQ ID 1653) и CDRH3 (SEQ ID 1654):
5'Hd-VH-A-Xhol
CAGCTACTCGAGTSGGGCGSAGGACTGKTGMAGCCTKSGGRGTCCCTGAGWC
TCTCCTGCGCTG;
3'HCI-VH-B
CCACTCCAGCCCCTTCCCAGGGGMCTGGCGGAYCCAGGTCCAGAAGTAACCAC
TWAAGGTAMMACCAKAGRCAGCGCAGGAGAGWCTCAGGGAC;
5'HC1-VH-C
CTGGGAAGGGGCTGGAGTGGRTTRGTGAAAGCAATTATAGTGGAAGTACCAGG
TACAACCCGTCCCTCAAGAGTCGAKTCACCATATCA;
3'Hd-VH-D
ATACAGCCGTGTCCKCGGCTSTCASAGAAYTCAKCTKCAGGKAGARCKKGTTCT
KGGAGKTGTCTMYTGATATGGTGAMTCGACTCTTG;
5'HC1-VH-E
AGCCGMGGACACGGCTGTATATTACTGTGCGAGAGGTTGGGCGGTGGACGGT
ATGGACGTCTGGGGCCGAGGGACCTTGGTCACCGTC;
3'HCI-VH-F-BstEII GAGACGGTGACCAAGGTCCCTCGGCCCCAGACGTCCATACC.
Этот набор праймеров перекрывает всю VH-последовательность. В пределах каждого набора праймеры смешивали в равных количествах (например, 1 мкл каждого праймера (концентрированные растворы праймеров:
20-100 мкМ) в 20 мкл ПЦР-реакции) и добавляли к ПЦР-смеси, состоящей из ПЦР-буфера, нуклеотидов и Taq-полимеразы. Эту смесь инкубировали при 94°С в течение 3 минут, при 65°С в течение 1 минуты, при 62°С в течение 1 минуты, при 59°С в течение 1 минуты, при 56°С в течение 1 минуты, при 52°С в течение 1 минуты, при 50°С в течение 1 минуты и при 72°С в течение 10 минут в ПЦР-циклере. После этого продукт подвергали электрофорезу в агарозном геле и продукт размером от 200 до 400 выделяли из геля согласно стандартным методам.
Полученный VH ПЦР-продукт затем использовали в качестве матрицы для стандартной ПЦР-реакции с применением праймеров, которые вводят подходящие для клонирования N-концевые и С-концевые сайты рестрикции (праймер 5'Hd-VH-A-Xhol и праймер 3'HCI-VH-F-BstEII). Фрагмент ДНК надлежащего размера (для VH приблизительно 350 нуклеотидов) выделяли с помощью электрофореза в агарозном геле согласно стандартным методам. Таким способом амплифицировали достаточный ДНК-фрагмент VH.
Приведенные ниже вырожденные олигонуклеотиды, которые совместно перекрывают концевой участок приблизительно из 15-20 нуклеотидов и где каждый второй праймер представляет собой антисмысловой праймер, использовали для получения окружения последовательности VL человека для CDRL1 (SEQ ID 1657), CDRL2 (SEQ ID 1658) и CDRL3 (SEQ ID 1659), которые являлись дополнительными по отношению к CDRH1 (SEQ ID 1652), CDRH2 (SEQ ID 1653) и CDRH3 (SEQ ID 1654):
5'Hd-Vl-A-Sacl ACTAGCGAGCTCGWGCTGACACAGCCACCCTCG;
5'HC1-VI-B
GCTGACACAGCCACCCTCGGYGTCAGKGACCCCAGGACAGASGGYCASGATCT
CCTGCTCTGGAGATGCATTGCCAAAGCAATATGC;
3'HC1-VI-C
CCCTGAGGGCCTCTCATTATCTTTATATATCASCAACWYAGGGGCCKKGCCTGG
CWKCTGCTGATACCAGTAAGCATATTGCTTTGGCAATGC;
5'HC1-VI-D
GATAATGAGAGGCCCTCAGGGRTCCCTGASCGATTCTCTGGCTCCARGTCAGG GACATCAGYCTCGTTGRCCATCAGTGGASTCMRGKCAGAAGACGAGGCTGACT A;
3'Hd-VI-E-BsiWI/Spel
GCTACTACTAGTCGTACGTAGGACGGTCAGCTGGGTCCCTCCGCCGAACACCC
AGGAAGAACCACTGCTGTCTGCTGATTGACAGTAATAGTCAGCCTCGTCTTCTG.
Этот набор праймеров перекрывает всю соответствующую VL-последовательность. В пределах каждого набора праймеры смешивали в равных количествах (например, 1 мкл каждого праймера (концентрированные растворы праймеров: 20-100 мкМ) в 20 мкл ПЦР-реакции) и добавляли к ПЦР-смеси, состоящей из ПЦР-буфера, нуклеотидов и Taq-полимеразы. Эту смесь инкубировали при 94°С в течение 3 минут, при 65°С в течение 1 минуты, при 62°С в течение 1 минуты, при 59°С в течение 1 минуты, при 56°С в течение 1 минуты, при 52°С в течение 1 минуты, при 50°С в течение 1 минуты и при 72°С в течение 10 минут в ПЦР-циклере. После этого продукт подвергали электрофорезу в агарозном геле и продукт размером от 200 до 400 выделяли из геля согласно стандартным методам.
Полученный VL ПЦР-продукт затем использовали в качестве матрицы для стандартной ПЦР-реакции с применением праймеров, которые вводят подходящие для клонирования N-концевые и С-концевые сайты рестрикции (праймер 5'HCI-VI-A-Sacl и праймер 3'Hd-VI-E-BsiWI/Spel). Фрагмент ДНК надлежащего размера (для VL приблизительно 330 нуклеотидов) выделяли с помощью электрофореза в агарозном геле согласно стандартным методам. Таким способом амплифицировали достаточный ДНК-фрагмент VL.
Конечный VH ПЦР-продукт (т.е. репертуар человеческих/гуманизированных VH) затем комбинировали с соответствующим ему конечным ПЦР-продуктом VL (т.е. репертуаром человеческих/гуманизированных VL) в векторе для фагового дисплея pComb3H5Bhis с целью создания библиотеки функциональных scFv-фрагментов антител, из которых - после экспонирования на нитевидном фаге -отбирали, подвергали скринингу, идентифицировали и подтверждали анти-HBS-связывающие структуры, как описано ниже.
450 нг фрагментов легкой цепи (расщепленных Sacl-Spel) лигировали с 1400 нг фагмиды pComb3H5Bhis (расщепленной Sacl-Spel; большой фрагмент). Полученную комбинаторную библиотеку антител затем подвергали трансформации в 300 мкл электрокомпетентных клеток Escherichia coli XL1 Blue с помощью электропорации (2,5 кВ; кювета с щелью 0,2 см; 25 мкФ; 200 Ом, Biorad gene-pulser), в результате получая библиотеку размером более 107 независимых клонов. Через один час фенотипической экспрессии отбирали положительные трансформанты по устойчивости к карбенициллину, кодируемой вектором pComb3H5BHis, в 100 мл жидкой super broth (SB)-культуры в течение ночи. Затем клетки собирали центрифугированием и плазмиду получали, используя имеющийся в продаже набор для получения плазмид (Qiagen).
2800 нг этой плазмидной ДНК, содержащей VL-библиотеку (расщепленной Xhol-BstEII; большой фрагмент), лигировали с 900 нг V-фрагментов тяжелой цепи (расщепленной Xhol-BstEII), и этим еще раз подвергали трансформации в две аликвоты по 300 мкл электрокомпетентных клеток Е. coli XL1 Blue с помощью электропорации (2,5 кВ; кювета с щелью 0,2 см; 25 мкФ, 200 Ом), получая в результате библиотеку VH-VL scFv-фрагментов антител общим размером более 107 независимых клонов.
После фенотипической экспрессии и медленной адаптации к карбенициллину клетки Е. coli, содержащие библиотеку антител, переносили в 5 В-карбенициллин(50 мкг/мл)-селективную среду. Клетки Е. coli, содержащие библиотеку антител, затем инфицировали инфекционной дозой, равной 1012 частиц хелперного фага VCSM13, приводящей к продуцированию и секреции нитевидного фага М13, где фаговая частица содержит одноцепочечную рСотЬЗН5 ВН1з-ДНК, кодирующую scFv-фрагмент антитела, и экспонировала соответствующий scFv-фрагмент антитела в виде трансляционного слияния с оболочечным белком III фага. Этот пул фагов, экспонирующих библиотеку антител, использовали для селекции антигенсвязывающих структур.
Для этой цели фаговую библиотеку, несущую клонированный репертуар scFv-фрагментов антител, получали из соответствующего культурального супернатанта посредством осаждения смесью PEGSOOO/NaCl и центрифугирования. Приблизительно от 1011 до 1012 фаговых частиц, экспонирующих scFv-фрагмент антител, ресуспендируют в 0,4 мл PBS/0,1% BSA и инкубируют с 105 - 107 клеток СНО, трансфицированных антигеном Е2 HCV из генотипов 1а и/или 1b HCV, которые описаны в Примере 40.1, в течение 1 часа на льду при медленном перемешивании. Эти HCV-антиген-трансфицированные клетки СНО собирали заранее центрифугированием, промывали в PBS и ресуспендировали в PBS/1% FCS (содержащем азид натрия). Фаговые частицы, экспонирующие scFv-фрагменты антител, которые не связываются специфически с HCV-антиген-трансфицированными клетками СНО, удаляли посредством промывки до пяти стадий включительно, используя PBS/1% FCS (содержащий азид натрия). После промывки связавшиеся структуры элюировали с клеток посредством ресуспендирования клеток в HCI- глициновом буфере рН 2,2 (10 мин инкубации с последующим интенсивным перемешиванием) и после нейтрализации 2 М Трис, рН 12, элюат использовали для инфицирования свежей неинфицированной культуры Е. coli XL1 Blue (OD600 больше 0,5). Культуру Е. coli, содержащую клетки Е. coli, подвергнутые успешной трансдукции фагмидной копией, кодирующей человеческий/гуманизированный scFv-фрагмент антитела, вновь подвергали селекции на устойчивость к карбенициллину и затем инфицировали хелперным фагом VCMS 13 для того, чтобы начать второй раунд экспонирования антител и селекции in vitro. Обычно осуществляли суммарно от 4 до 5 циклов селекции.
С целью скрининга HCV-антиген-специфических связывающих структур плазмидную ДНК, соответствующую 4-5 раундам пэннинга, выделяли из культур Е. coli после селекции. Для получения растворимого scFv-фрагмента антитела, VH-VL-ДНК-фрагменты вырезали из плазмид (Xhol-Spel). Эти фрагменты клонировали через те же сайты рестрикции в плазмиду pComb3H5BFlag/His, отличающуюся от исходной pComb3H5BHis тем, что экспрессируемая конструкция (например, scFv-фрагмент антител) включает в себя Flag-метку (DYKDDDDK) между scFv-фрагментом антитела и His6-меткой, и дополнительные фаговые белки делегированы. После лигирования каждый пул (различные раунды пэннинга) плазмидной ДНК подвергали трансформации в 100 мкл компетентных к тепловому шоку Е. coli TG1 или XLI blue и высевали на карбенициллин-LB-агар. Одиночные колонии переносили перекалыванием в 100 мкл LB-карб (50 мкг/мл).
Е. coli, трансформированные pComb3H5BHis, содержащей VL- и VH-сегмент, продуцируют растворимый scFv-фрагмент антитела в достаточных количествах после вырезания фрагмента гена III и индукции с помощью 1 мМ 1PTG. Благодаря подходящей сигнальной последовательности scFv-фрагмент антитела экспортировался в периплазму, где он сворачивается в функциональную конформацию.
Одиночные бактериальные колонии Е. coli TG1 с чашек для трансформации переносили перекалыванием для получения небольших количеств периплазмы и выращивали в SB-среде (например 10 мл), дополненной 20 мМ MgCl2 и карбенициллином 50 мкг/мл (и ресуспендировали в PBS (например 1 мл) после сбора). В результате четырех циклов замораживания при -70°С и оттаивания при 37°С наружная мембрана бактерий разрушалась под действием теплового шока, и растворимые периплазматические белки, включая scFv-фрагменты антител, высвобождались в супернатант. После удаления центрифугированием интактных клеток и клеточного дебриса собирали супернатант, содержащий scFv-фрагменты антител против HCV, и использовали для идентификации HCV-антиген-специфических связывающих структур следующим образом.
Связывание scFv-фрагментов антител с HCV тестируют посредством проточной цитометрии HCV-антиген-трансфицированных клетках СНО (см. Пример 40.1); нетрансфицированные клетки СНО использовали в качестве отрицательного контроля.
Для проточной цитометрии 2,5×105 клеток инкубировали с 50 мкл периплазматического препарата scFv-фрагмента антитела или с 5 мкг/мл очищенных scFv-фрагментов антител в 50 мкл PBS с 2% FCS. Связывание scFv-фрагмента антитела определяли с использованием анти-His-антитела (Penta-His-антитело, не содержащее BSA, Qiagen GmbH, Hilden, FRG) в концентрации 2 мкг/мл в 50 мкл PBS с 2% FCS. В качестве реагента для второй стадии использовали конъюгированный с R-фикоэритрином, аффинно очищенный F(ab')2-фрагмент антитела козы против IgG мыши (специфичный к Fc-гамма-фрагменту), разбавленный 1:100 в 50 мкл PBS с 2% FCS (Dianova, Hamburg, FRG). Образцы измеряли на FACSscan (BD biosciences, Heidelberg, FRG).
Отдельные клоны затем анализировали в отношении подходящих свойств и аминокислотной последовательности. HCV-специфические scFv-фрагменты антител превращали в рекомбинантные биспецифические тандемные одноцепочечные фрагменты антител посредством присоединения их через Gly4Ser1-линкер к CD3-специфическому scFv-фрагменту антитела I2C (SEQ ID 185) или любому другому CD3-специфическому scFv-фрагменту антитела по изобретению, получая в результате конструкции с доменной организацией VHMuc1 - (Gly4Ser1)3 - VLMuc1 - Gly4Ser1 - VHCD3 - (Gly4Ser1)3 - VLCD3 или с альтернативными доменными организациями. Для экспрессии в клетках СНО обе кодирующие последовательности: (1) N-концевого лидерного пептида тяжелой цепи иммуноглобулина, содержащего стартовый кодон, встроенный в консенсусную последовательность Козака, и (2) С-концевой His6-метки, за которой следует стоп-кодон, присоединяли, в рамке считывания, к нуклеотидной последовательности, кодирующей фрагменты биспецифического тандемного одноцепочечного антитела, перед вставкой результирующего фрагмента ДНК, полученного генным синтезом, в сайт множественного клонирования экспрессирующего вектора pEF-DHFR (Raum et al. Cancer Immunol. Immunother. 50 (2001) 141-150). Стабильную трансфекцию дефектных по DHFR клеток СНО, селекцию DHFR-положительных трансфектантов, секретирующих фрагменты биспецифических одноцепочечных антител в культуральный супернатант, и амплификацию генов с использованием метотрексата для повышения уровней экспрессии осуществляли, как описано (Mack et al. Proc. Natl. Acad. Sci. USA 92 (1995) 7021-7025). Все другие известные в данной области техники методики выполняли согласно стандартным протоколам (Sambrook, Molecular Cloning; A Laboratory Manual, 3rd edition, Cold Spring Harbour Laboratory Press, Cold Spring Harbour, New York (2001)).
Идентификацию функциональных фрагментов биспецифических тандемных одноцепочечных антител осуществляли посредством проточно-цитометрического анализа культурального супернатанта из трансфицированных клеток СНО. С этой целью связывание с CD3 тестировали на CD3-положительной линии клеток HPB-ALL Т-клеточного лейкоза человека (DSMZ, Braunschweig, ACC483) и на Т-клеточной линии макака 4119LnPx. Связывание с HCV тестировали на HCV-антиген-трансфицированных клетках СНО (см. Пример 40.1). 200000 клеток соответствующей клеточной линии инкубировали в течение 30 мин на льду с 50 мкл супернатанта клеточной культуры. Клетки дважды промывали в PBS с 2% FCS, и связанный фрагмент биспецифического тандемного одноцепочечного антитела определяли с использованием мышиного анти-His-антитела (Penta-His-антитело; Qiagen;
разбавленное 1:20 в 50 мкл PBS с 2% FCS). После промывки связавшиеся анти-His-антитела определяли с помощью Fc-гамма-специфического антитела (Dianova), конъюгированного с фикоэритрином, разбавленного 1:100 в PBS с 2% FCS. Супернатант нетрансфицированных клеток СНО использовали в качестве отрицательного контроля.
Проточную цитометрию осуществляли на аппарате FACS-Calibur; для получения и анализа данных использовали программное обеспечение CellQuest (Becton Dickinson biosciences, Heidelberg). FACS-окрашивание и измерение интенсивности флуоресценции осуществляли, как описано в Current Protocols in Immunology (Coligan, Kruisbeek, Margulies, Shevach and Strober, Wiley-Interscience, 2002).
Только те конструкции, которые демонстрируют биспецифическое связывание с CD3 человека и макака, а также с антигеном HCV, были отобраны для дальнейшего использования.
Для получения белка, клетки СНО, экспрессирующие полностью функциональный фрагмент биспецифического тандемного одноцепочечного антитела и адаптированные к жидкой соевой среде HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone), выращивали в роллерных флаконах с жидкой соевой средой HyQ PF СНО без нуклеозидов (с 4,0 мМ L-глутамина, с 0,1% Pluronic F-68; HyClone) в течение 7 суток. Культуральный супернатант осветляли от клеток центрифугированием и хранили при -20°С до очистки. В качестве хроматографического оборудования для очистки фрагмента биспецифического тандемного одноцепочечного антитела из культурального супернатанта использовали систему Akta® Explorer (GE Health Systems) и программное обеспечение Unicorn®. Аффинную хроматографию с иммобилизованным металлом ("IMAC") осуществляли с использованием Fractogel EMD chelate® (Merck), который нагружали ZnCl2 в соответствии с протоколом, предложенным производителем. Колонку уравновешивали буфером А (20 мМ натрий-фосфатный буфер рН 7,2; 0,1 М NaCl), и супернатант клеточной культуры (500 мл) наносили на колонку (10 мл) при скорости потока 3 мл/мин. Колонку промывали буфером А для удаления несвязавшегося образца. Связавшийся белок элюировали с использованием двухстадийного градиента буфера В (20 мМ натрий-фосфатный буфер рН 7,2;
0,1 М NaCl; 0,5 М имидазол) в соответствии со следующим протоколом:
стадия 1: 20% буфера В в 6 объемах колонки;
стадия 2: 100% буфера В в 6 объемах колонки.
Элюированные белковые фракции со стадии 2 объединяли для дальнейшей очистки. Все химические реактивы имели степень чистоты, подходящую для исследований, и были приобретены у Sigma (Deisenhofen) или Merck (Darmstadt).
Гель-фильтрацию осуществляли на препаративной колонке HiLoad 16/60 Superdex 200 (GE/Amersham), уравновешенной Equi-буфером (25 мМ цитрат; 200 мМ лизин; 5% глицерин; рН 7,2). Элюированные белковые образцы (скорость потока 1 мл/мин) подвергали стандартным SDS-PAGE и вестерн-блоттингу для детекции. Перед очисткой колонку калибровали для определения молекулярной массы (набор маркеров молекулярной массы, Sigma MW GF-200). Концентрацию белка определяли, используя OD при 280 нм.
Очищенный фрагмент биспецифического тандемного одноцепочечного антитела анализировали с использованием SDS-PAGE в восстанавливающих условиях и предварительно залитых 4-12%-ных гелей в бис-Трис-буфере (Invitrogen). Приготовление и нанесение образцов осуществляли согласно протоколу, предложенному производителем. Молекулярную массу определяли, используя белковый стандарт MultiMark (Invitrogen). Гель окрашивали коллоидным Coomassie (протокол Invitrogen). Чистота выделенного белка составляет более 95%, как определено SDS-PAGE.
Фрагмент биспецифического тандемного одноцепочечного антитела имеет молекулярную массу примерно 52 кДа в нативных условиях, как определено гель-фильтрацией в PBS. Все конструкции очищали согласно данному методу.
Вестерн-блоттинг осуществляли, используя мембрану Optitran® BA-S83 в аппарате для блоттинга Invitrogen в соответствии с протоколом, предложенным производителем. Для определения фрагментов биспецифических тандемных одноцепочечных антител использовали антитело против Mis-метки (Penta-His, Qiagen). Антитело козы против Ig мыши, меченое щелочной фосфатазой (АР) (Sigma), использовали в качестве вторичного антитела, a BCIP/NBT (Sigma) в качестве субстрата. Определили единственную полосу при 52 кДа, соответствующую очищенному фрагменту биспецифического тандемного одноцепочечного антитела.
Эффективность фрагментов биспецифических тандемных одноцепочечных антител, взаимодействующих с CD3 человека и макака и с антигеном HCV, в системе человека и примата, не являющегося шимпанзе, определяли по анализу цитотоксичности, основанному на высвобождении хрома 51 (51Cr), используя HCV-антиген-трансфицированные клетки СНО в качестве клеток-мишеней (см. Пример 40.1), а стимулированные CD4/CD56- РВМС человека или Т-клеточную линию макака 4119LnPx в качестве эффекторных клеток. Получение стимулированных РВМС человека осуществляли следующим образом. На чашку Петри (диаметр 85 мм; Nunc) наносили имеющееся в продаже анти-CD3-специфическое антитело (например, ОКТ3, Othoclone) в конечной концентрации 1 мкг/мл в течение 1 часа при 37°С. Несвязавшийся белок удаляли за одну стадию промывки, используя PBS. Свежие РВМС выделяли из периферической крови (30-50 мл крови человека) центрифугированием в градиенте фиколла согласно стандартным протоколам. 3 - 5×107 РВМС добавляли в предварительно покрытую чашку Петри в 50 мл RPMI 1640 со стабилизирующей добавкой глутамин/10% FCS/IL-2 20 ед./мл (пролейкин, Chiron) и стимулировали в течение 2 суток. На третьи сутки клетки собирали и промывали один раз RPMI 1640. Добавляли IL-2 до конечной концентрации 20 ед./мл и клетки снова культивировали в течение одних суток в той же среде для культивирования клеток, как упомянуто выше.
Клетки-мишени дважды промывали PBS и метили 11,1 МБк51Cr в конечном объеме 100 мкл RPMI с 50% FCS в течение 45 минут при 37°С.После этого меченые клетки-мишени промывали 3 раза 5 мл RPMI и затем использовали в анализе цитотоксичности. Анализ осуществляли в 96-луночном планшете в общем объеме 250 мкл дополненной среды RPMI (как и выше) с соотношением Е:Т 10:1. Наносили 1 мкг/мл молекул биспецифического одноцепочечного антитела с межвидовой специфичностью и 20 их трехкратных разведении. Время анализа составляло 18 часов, и цитотоксичность измеряли в относительных величинах высвобожденного хрома в супернатанте, соответствующих разнице между максимальным лизисом (добавление Тритона-X) и спонтанным лизисом (без эффекторных клеток). Все измерения осуществляли в четырех повторностях. Измерение радиоактивности хрома в супернатантах осуществляли с использованием гамма-счетчика Wizard 3" (Perkin Elmer Life Sciences GmbH, Koln, Germany). Анализ экспериментальных данных осуществляли с применением Prism 4 для Windows (версия 4.02, GraphPad Software Inc., San Diego, California, USA). Сигмоидальные кривые доза-эффект обычно имеют величины R2 выше 0,90, как определено с использованием этого программного обеспечения. Величины ЕС50, как меру эффективности, вычисляли с помощью данной программы анализа.
Реферат
Настоящее изобретение относится к биотехнологии и иммунологии, а именно к модулированию Т-клеточного иммунитета в отношении клеток, экспрессирующих специфический мембранный антиген предстательной железы (PSMA). Предложен полипептид, который представляет собой биспецифическое одноцепочечное антитело, способное связываться с эпитопом CD3ε(эпсилон)-цепи человека, а также приматов,и, содержащим последовательность Gln-Asp-Gly-Asn-Glu (QDGNE), а также полипептид, содержащий связывающий домен, представляющий собой антитело, способное связываться с эпитопом CD3ε(эпсилон)-цепи человека, а также приматов,и, и второй связывающий домен, представляющий собой антитело, способное связываться с клеточным поверхностным антигеном. Также рассмотрены последовательности нуклеиновых кислот, кодирующие полипептиды по изобретению, векторы, клетка-хозяин, основанный на ее использовании способ получения полипептидов по изобретению, фармацевтическая композиция и применение полипептидов по изобретению для предупреждения, лечения или ослабления заболевания, выбранного из пролиферативного заболевания, опухолевого заболевания или иммунологического расстройства, а также применение N-концевого фрагмента внеклеточного домена CD3ε для создания полипептида по изобретению. 10 н. и 12 з.п. ф-лы, 68 ил., 16 табл., 41 пр.
Формула
CDR (гипервариабельный участок)-L1, выбранный из группы, состоящей из SEQ ID NO: 27, 117 и 153;
CDR-L2, выбранный из группы, состоящей из SEQ ID NO: 28, 118 и 154;
CDR-L3, выбранный из группы, состоящей из SEQ ID NO: 29, 119 и 155;
CDR-H1, выбранный из группы, состоящей из SEQ ID NO: 12, 30, 48, 66, 84, 102, 120, 138, 156 и 174;
CDR-H2, выбранный из группы, состоящей из SEQ ID NO: 13, 31, 49, 67, 85, 103, 121, 139, 157 и 175; и
CDR-H3, выбранный из группы, состоящей из SEQ ID NO: 14, 32, 50, 68, 86, 104, 122, 140, 158 и 176.
CDR (гипервариабельный участок)-L1, выбранный из группы, состоящей из SEQ ID NO: 27, 117 и 153;
CDR-L2, выбранный из группы, состоящей из SEQ ID NO: 28, 118 и 154;
CDR-L3, выбранный из группы, состоящей из SEQ ID NO: 29, 119 и 155;
CDR-H1, выбранный из группы, состоящей из SEQ ID NO: 12, 30, 48, 66, 84, 102, 120, 138, 156 и 174;
CDR-H2, выбранный из группы, состоящей из SEQ ID NO: 13, 31, 49, 67, 85, 103, 121, 139, 157 и 175; и
CDR-H3, выбранный из группы, состоящей из SEQ ID NO: 14, 32, 50, 68, 86, 104, 122, 140, 158 и 176, и
второй связывающий домен, который представляет собой антитело, способное связываться с клеточным поверхностным антигеном.
(а) CDR-L1, как представлено в SEQ ID NO: 27, CDR-L2, как представлено в SEQ ID NO: 28, и CDR-L3, как представлено в SEQ ID NO: 29;
(б) CDR-L1, как представлено в SEQ ID NO: 117, CDR-L2, как представлено в SEQ ID NO: 118, и CDR-L3, как представлено в SEQ ID NO: 119; и
(в) CDR-L1, как представлено в SEQ ID NO: 153, CDR-L2, как представлено в SEQ ID NO: 154, и CDR-L3, как представлено в SEQ ID NO: 155.
(а) CDR-H1, как представлено в SEQ ID NO: 12, CDR-H2, как представлено в SEQ ID NO: 13, и CDR-H3, как представлено в SEQ ID NO: 14;
(б) CDR-H1, как представлено в SEQ ID NO: 30, CDR-H2, как представлено в SEQ ID NO: 31, и CDR-H3, как представлено в SEQ ID NO: 32;
(в) CDR-H1, как представлено в SEQ ID NO: 48, CDR-H2, как представлено в SEQ ID NO: 49, и CDR-H3, как представлено в SEQ ID NO: 50;
(г) CDR-H1, как представлено в SEQ ID NO: 66, CDR-H2, как представлено в SEQ ID NO: 67, и CDR-H3, как представлено в SEQ ID NO: 68;
(д) CDR-H1, как представлено в SEQ ID NO: 84, CDR-H2, как представлено в SEQ ID NO: 85, и CDR-H3, как представлено в SEQ ID NO: 86;
(е) CDR-H1, как представлено в SEQ ID NO: 102, CDR-H2, как представлено в SEQ ID NO: 103, и CDR-H3, как представлено в SEQ ID NO: 104;
(ж) CDR-H1, как представлено в SEQ ID NO: 120, CDR-H2, как представлено в SEQ ID NO: 121, и CDR-H3, как представлено в SEQ ID NO: 122;
(з) CDR-H1, как представлено в SEQ ID NO: 138, CDR-H2, как представлено в SEQ ID NO: 139, и CDR-H3, как представлено в SEQ ID NO: 140;
(и) CDR-H1, как представлено в SEQ ID NO: 156, CDR-H2, как представлено в SEQ ID NO: 157, и CDR-H3, как представлено в SEQ ID NO: 158; и
(к) CDR-H1, как представлено в SEQ ID NO: 174, CDR-H2, как представлено в SEQ ID NO: 175, и CDR-H3, как представлено в SEQ ID NO: 176.
(а) VL-области, как представлено в SEQ ID NO: 17 или 21, и VH-области, как представлено в SEQ ID NO: 15 или 19;
(б) VL-области, как представлено в SEQ ID NO: 35 или 39, и VH-области, как представлено в SEQ ID NO: 33 или 37;
(в) VL-области, как представлено в SEQ ID NO: 53 или 57, и VH-области, как представлено в SEQ ID NO: 51 или 55;
(г) VL-области, как представлено в SEQ ID NO: 71 или 75, и VH-области, как представлено в SEQ ID NO: 69 или 73;
(д) VL-области, как представлено в SEQ ID NO: 89 или 93, и VH-области, как представлено в SEQ ID NO: 87 или 91;
(е) VL-области, как представлено в SEQ ID NO: 107 или 111, и VH-области, как представлено в SEQ ID NO: 105 или 109;
(ж) VL-области, как представлено в SEQ ID NO: 125 или 129, и VH-области, как представлено в SEQ ID NO: 123 или 127;
(з) VL-области, как представлено в SEQ ID NO: 143 или 147, и VH-области, как представлено в SEQ ID NO: 141 или 145;
(и) VL-области, как представлено в SEQ ID NO: 161 или 165, и VH-области, как представлено в SEQ ID NO: 159 или 163; и
(к) VL-области, как представлено в SEQ ID NO: 179 или 183, и VH-области, как представлено в SEQ ID NO: 177 или 181.
SEQ ID NO: 189-194, SEQ ID NO: 201-206, SEQ ID NO: 219-224, SEQ ID NO: 237-242, SEQ ID NO: 255-260, SEQ ID NO: 273-279, SEQ ID NO: 382-384 и 387-389, SEQ ID NO: 400-402 и 405-407, SEQ ID NO: 418-420 и 423-425, SEQ ID NO: 436-438 и 441-443, SEQ ID NO: 454-456 и 459-461, SEQ ID NO: 472-474 и 477-479, SEQ ID NO: 490-492 и 495-497, SEQ ID NO: 508-510 и 513-515,
SEQ ID NO: 530-532 и 1568-1570, SEQ ID NO: 545-547 и 550-552, SEQ ID NO: 559-561 и 564-566,
SEQ ID NO: 577-579 и 582-584,
SEQ ID NO: 615-617 и 620-622, SEQ ID NO: 633-635, 638, 639 и 1571, SEQ ID NO: 650-652 и 655-657, SEQ ID NO: 668-670 и 673-675, SEQ ID NO: 682-684 и 687-689, SEQ ID NO: 696-698 и 701-703, SEQ ID NO: 710-712 и 715-717, SEQ ID NO: 724-726 и 729-731, SEQ ID NO: 738-740 и 743-745, SEQ ID NO: 752-754 и 757-759, SEQ ID NO: 766-768 и 771-773, SEQ ID NO: 780-782 и 785-787, SEQ ID NO: 794-796 и 799-801, SEQ ID NO: 808-810 и 813-815, SEQ ID NO: 822-824 и 827-829, SEQ ID NO: 836-838 и 841-843, SEQ ID NO: 850-852 и 855-857,
SEQ ID NO: 866-868 и 871-873, SEQ ID NO: 884-886 и 889-891, SEQ ID NO: 902-904 и 907-909, SEQ ID NO: 920-922 и 925-927, SEQ ID NO: 938-940 и 943-945, SEQ ID NO: 956-958 и 961-963, SEQ ID NO: 974-976 и 979-981, SEQ ID NO: 992-994 и 997-999, SEQ ID NO: 1006-1008 и 1011-1013, SEQ ID NO: 1020-1022 и 1025-1027, SEQ ID NO: 1034-1036 и 1039-1041, SEQ ID NO: 1048-1050 и 1053-1055, SEQ ID NO: 1062-1064 и 1067-1069, SEQ ID NO: 1076-1078 и 1081-1083, SEQ ID NO: 1090-1092 и 1095-1097,
SEQ ID NO: 1114-1116 и 1119-1121, SEQ ID NO: 1128-1130 и 1133-1135,
SEQ ID NO: 1141-1143 и 1146-1148, SEQ ID NO: 1155-1157 и 1160-1162, SEQ ID NO: 1169-1171 и 1174-1176, SEQ ID NO: 1183-1185 и 1188-1190, SEQ ID NO: 1197-1199 и 1202-1204, SEQ ID NO: 1211-1213 и 1216-1218, SEQ ID NO: 1125-1227 и 1230-1232, SEQ ID NO: 1239-1241 и 1244-1246, SEQ ID NO: 1253-1255 и 1258-1260, SEQ ID NO: 1267-1269 и 1272-1274, SEQ ID NO: 1281-1283 и 1286-1288, SEQ ID NO: 1295-1297 и 1300-1302, SEQ ID NO: 1309-1311 и 1314-1316, SEQ ID NO: 1323-1325 и 1328-1330,
SEQ ID NO: 1343-1345 и 1348-1350, SEQ ID NO: 1361-1363 и 1366-1368, SEQ ID NO: 1375-1377 и 1380-1382, SEQ ID NO: 1389-1391 и 1394-1396, SEQ ID NO: 1403-1405 и 1408-1410, SEQ ID NO: 1417-1419 и 1422-1424, SEQ ID NO: 1431-1433 и 1436-1438, SEQ ID NO: 1445-1447 и 1450-1452, SEQ ID NO: 1459-1461 и 1464-1466, SEQ ID NO: 1473-1475 и 1478-1480,
SEQ ID NO: 1486-1491, SEQ ID NO: 1492-1497,
SEQ ID NO: 1505-1507 и 1510-1512, SEQ ID NO: 1531-1533 и 1536-1538,
SEQ ID NO: 1573-1575 и 1578-1580, SEQ ID NO: 1591-1593 и 1596-1598, SEQ ID NO: 1605-1607 и 1610-1612, SEQ ID NO: 1619-1621 и 1624-1626, SEQ ID NO: 1634-1636 и 1639-1641, SEQ ID NO: 1652-1654, SEQ ID NO: 1657-1659 и SEQ ID NO: 1669-1674.
(а) аминокислотной последовательности, как представлено в любой из SEQ ID NO: 291, 293, 295, 297, 299, 301, 303, 305, 307, 309, 311, 313, 315, 317, 319, 321, 323, 325, 327, 329, 331, 333, 335, 337, 339, 341, 343, 345, 347, 393, 395, 397, 411, 413, 415, 429, 431, 433, 447, 449, 451, 465, 467, 469, 483, 485, 487, 501, 503, 505, 519, 521, 523, 1336, 1338, 1340, 538, 540, 542, 556, 570, 572, 574, 588, 590, 592, 626, 628, 630, 643, 645, 647, 661, 663, 665, 679, 693, 707, 721, 735, 749, 763, 777, 791, 805, 819, 833, 847, 861, 863, 877, 879, 881, 895, 897, 899, 913, 915, 917, 931, 933, 935, 949, 951, 953, 967, 969, 971, 985, 987, 989, 1003, 1017, 1031, 1045, 1059, 1073, 1087, 1101, 1125, 1138, 1152, 1166, 1180, 1194, 1208, 1222, 1236, 1250, 1264, 1278, 1292, 1306, 1320, 1334, 1354, 1356, 1358, 1372, 1386, 1400, 1414, 1428, 1442, 1456, 1470, 1484, 1500, 1502, 1518, 1520, 1522, 1524, 1526, 1528, 1544, 1546, 1548, 1550, 1552, 1554, 1556, 1558, 1560, 1562, 1564, 1566, 1586, 1588, 1602, 1616, 1630, 1647, 1649 или 1663; и
(б) аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, как представлено в любой из SEQ ID NO: 292, 294, 296, 298, 300, 302, 304, 306, 308, 310, 312, 314, 316, 318, 320, 322, 324, 326, 328, 330, 332, 334, 336, 338, 340, 342, 344, 346, 348, 394, 396, 398, 412, 414, 416, 430, 432, 434, 448, 450, 452, 466, 468, 470, 484, 486, 488, 502, 504, 506, 520, 522, 524, 1337, 1339, 1341, 539, 541, 543, 557, 571, 573, 575, 589, 591, 593, 627, 629, 631, 644, 646, 648, 662, 664, 666, 680, 694, 708, 722, 736, 750, 764, 778, 792, 806, 820, 834, 848, 862, 864, 878, 880, 882, 896, 898, 900, 914, 916, 918, 932, 934, 936, 950, 952, 954, 968, 970, 972, 986, 988, 990, 1004, 1018, 1032, 1046, 1060, 1074, 1088, 1102, 1126, 1139, 1153, 1167, 1181, 1195, 1209, 1223, 1237, 1251, 1265, 1279, 1293, 1307, 1321, 1335, 1355, 1357, 1359, 1373, 1387, 1401, 1415, 1429, 1443, 1457, 1471, 1485, 1501, 1503, 1519, 1521, 1523, 1525, 1527, 1529, 1545, 1547, 1549, 1551, 1553, 1555, 1557, 1559, 1561, 1563, 1565, 1567, 1587, 1589, 1603, 1617, 1631, 1648, 1650 или 1664.

Комментарии