Способ получения и отбора молекул, включающих по меньшей мере две различные группировки, и их применение - RU2646159C2
Код документа: RU2646159C2
Чертежи












































Описание
В данном документе раскрыт способ получения и отбора молекул, образованных сочетанием двух различных группировок, таких как связывающие группировки, эффекторные группировки или полезные нагрузки, с помощью транспептид азы, такой как сортаза А, где по меньшей мере две различные группировки соединены in vivo. Это достигается путем добавления к сортазе и к одной из ее группировок сигнала удерживания в эндоплазматическом ретикулуме.
Уровень техники
За последние годы разработано и подвергнуто клиническим испытаниям широкое разнообразие специфических терапевтических белков, включая антитела, фрагменты антител и лиганды рецепторов клеточной поверхности. Примерами белков являются антитела, конъюгаты Fc-области или носители для целевой доставки. Некоторые из этих терапевтических белков были конъюгированы с несколькими классами терапевтических токсинов, такими как низкомолекулярные лекарственные вещества, ферменты, радиоизотопы, белковые токсины и другие токсины для специфической доставки пациентам.
Эффективная доставка к месту заболевания является необходимым условием для высокой эффективности и низкой токсичности любой терапевтической молекулы. Например, в данном контексте могут использоваться антитела. Если антитело само по себе не является терапевтическим элементом, то конъюгация эффекторной молекулы с антителом позволяет достичь точной локализации лекарственного средства в нужном месте в организме человека. Это увеличивает эффективную концентрацию лекарственного средства в его целевой области, тем самым оптимизируя терапевтический эффект агента. Кроме того, с целевой доставкой врач может иметь возможность понизить дозу терапевтического агента и, таким образом, минимизировать системное воздействие - что особенно актуально, если полезная нагрузка лекарственного препарата имеет ассоциированные токсичности, или если он будет использоваться для лечения хронических заболеваний (см., например, McCarron, Р.А., et al., Mol. Interventions 5 (2005) 368-380).
В WO 2010087994 приведены способы их связывания и применения. Рекомбинантные подходы к lgG-подобным биспецифическим антителам описаны в Marvin, J.S., et al. (Acta Pharmacol. Sinica 26 (2005) 649-658). В Levary, D.A., et al. (PLoS one, 6 (2011) e18342.1-e18342.6) сообщается о белок-белковом слиянии, катализируемом сортазой А. В WO 2013/003555 сообщается о применении сортаз для проведения химической реакции белкового связывания.
Strijbis, К. et al (Traffic 13 (2012) 780-789) сообщают о белковом связывании в живых клетках с использованием сортазы. Ими было заявлено, что Са2+-зависимая сортаза А от S. aureus не является функциональной внутри клетки, но что Са2+-независимая сортаза А от S. pyogenes является функциональной в цитозоле и в просвете эндоплазматического ретикулума (ER) как Saccharomyces cerevisiae, так и клеток млекопитающих НЕК293Т.
Краткое описание изобретения
В данном документе раскрыт способ получения in vivo внутриклеточно фермент-катализируемого (т.е. ферментативного) конъюгата первого полипептидного домена со вторым полипептидным доменом с помощью Са2+-зависимого фермента сортазы А от золотистого стафилококка (S. aureus), где один из полипептидных доменов и растворимый фермент сортаза А содержат сигнальную последовательность удерживания в эндоплазматическом ретикулуме.
Эта технология особенно подходит для быстрого создания, например, библиотеки комбинаций первой группы полипептидных доменов (например, первой группы связывающих доменов, таких как родственные пары вариабельных доменов антител) и второй группы полипептидных доменов (например, второй группы связывающих доменов, таких как родственные пары вариабельных доменов антител, но направленные против других эпитопов/антигенов, чем у первой группы, или группы молекул полезной нагрузки). Эта библиотека может быть легко получена, например, путем временной трансфекции клеток НЕК, и затем полученные комбинации могут быть подвергнуты скринингу, например, на наличие предполагаемого биологического эффекта или предназначенных свойств.
Одним из аспектов, описанных в данном документе, является способ получения полипептида, содержащего по меньшей мере два полипептидных домена, который включает этап
- культивирования клетки, содержащей
а) нуклеиновую кислоту, кодирующую растворимую сортазу А с С-концевым сигналом удерживания в эндоплазматическом ретикулуме,
b) нуклеиновую кислоту, кодирующую первый полипептидный домен, содержащий на его С-конце или в С-концевой области сортазный мотив, за которым следует сигнал удерживания в эндоплазматическом ретикулуме, и
c) нуклеиновую кислоту, кодирующую второй полипептидный домен, содержащий на его N-конце олигоглициновый мотив по меньшей мере из двух остатков глицина,
где клетка секретирует опосредованный/катализируемый сортазой А конъюгат первого полипептидного домена и второго полипептидного домена,
и, таким образом, получения полипептида, содержащего по меньшей мере два полипептидных домена.
Одним из аспектов, описанных в данном документе, является способ получения мультиспецифической связывающей молекулы, содержащей по меньшей мере две связывающих группировки, включающий этап
- культивирования клетки, содержащей
a) нуклеиновую кислоту, кодирующую растворимую сортазу А с С-концевым сигналом удерживания в эндоплазматическом ретикулуме,
b) нуклеиновую кислоту, кодирующую первую связывающую группировку, содержащую на ее С-конце или в С-концевой области сортазный мотив, за которым следует сигнал удерживания в эндоплазматическом ретикулуме, и
c) нуклеиновую кислоту, кодирующую вторую связывающую группировку, содержащую на ее N-конце по меньшей мере диглицин,
где клетка секретирует опосредованный/катализируемый сортазой А конъюгат первой связывающей группировки и второй связывающей группировки,
где первая связывающая группировка специфически связывается с первым антигеном или мишенью, а вторая связывающая группировка специфически связывается со вторым антигеном или мишенью,
и таким образом, получения мультиспецифической связывающей молекулы, содержащей по меньшей мере две связывающих группировки.
В одном воплощении всех аспектов сортаза А является сортазой А от золотистого стафилококка (S. aureus). В одном воплощении нуклеиновая кислота, кодирующая (растворимую) сортазу А с С-концевым сигналом удерживания в эндоплазматическом ретикулуме, кодирует аминокислотную последовательность SEQ ID №51 или SEQ ID №52.
В данном документе сообщается о способе получения высокоспецифических терапевтических молекул с заданными свойствами для лечения заболевания, такого как рак или вирусная инфекция, у пациента, нуждающегося в лечении, где терапевтическая молекула адаптирована к характеристикам заболевания пациента и/или к генотипу/фенотипу пациента.
Такая адаптация достигается путем изготовления молекулы с заданными свойствами с учетом генотипа/фенотипа вызывающих заболевание/пораженных клеток пациента.
На первом этапе определяется генотип/фенотип клеток (например, наличие и число/количество специфических для заболевания молекул клеточной поверхности), которые станут мишенями терапевтической молекулы. Это может быть достигнуто, например, с помощью методик клеточной визуализации, таких как иммуногистохимическое окрашивание (IHC, иммуногистохимия) клеток пациента, полученных, например, из крови и/или биопсийного материала, с использованием флуоресцентно меченных моноспецифических (терапевтических или диагностических) антител. Альтернативно генотип/фенотип клеток может быть проанализирован после окрашивания мечеными терапевтическими или диагностическими антителами с использованием способов на основе FACS. Методики визуализации in vivo, включая оптическую визуализацию, молекулярную визуализацию, флуоресцентную визуализацию, биолюминесцентную визуализацию, ЯМР, ПЭТ, ОФЭКТ, КТ и прижизненную микроскопию, также могут быть использованы для определения генотипа/фенотипа связанных с заболеванием клеток пациента. В зависимости от определенного генотипа/фенотипа клеток пациента, связанных с заболеванием, может быть выбрана/выбирается комбинация нацеливающих/связывающих группировок с заданными свойствами, и они объединяются в терапевтическую молекулу. Такая терапевтическая молекула может быть, например, биспецифическим антителом.
Такие терапевтические молекулы с заданными свойствами i) будут высокоспецифичными, ii) будут иметь хорошую терапевтическую эффективность и iii) будут вызывать, меньше и/или менее тяжелые побочные эффекты по сравнению с обычными выбираемыми терапевтическими средствами. Это может быть достигнуто путем придания терапевтической молекуле улучшенных нацеливающих свойств и/или улучшенных свойств доставки с заданными свойствами, например, для доставки терапевтической полезной нагрузки в место ее предполагаемого действия.
Улучшенная доставка терапевтической молекулы к месту ее действия, такому как, например, раковая клетка, может быть достигнута за счет более высокой/повышенной селективности и/или специфичности к целевой терапевтической молекуле по сравнению с обычными выбираемыми терапевтическими молекулами. Эта терапевтическая молекула содержит по меньшей мере две группировки, которые специфически связываются или могут быть связаны с различными белками (например, с двумя различными маркерами клеточной поверхности).
Повышенная селективность и/или специфичность терапевтической молекулы с заданными свойствами может быть достигнута или за счет одновременного связывания обеих нацеливающих группировок с их соответствующими мишенями/эпитопами, или за счет одновременного связывания обоих полипептидных доменов с их партнерами связывания, или за счет их сочетания.
Особенно подходящим является сочетание двух связывающих группировок, имеющих аффинность от низкой до средней к их соответствующим мишеням/эпитопам. Кроме того, нецелевое связывание значительно уменьшается или даже может быть полностью устранено.
Было обнаружено, что с помощью способа, описанного в данном документе, можно индивидуально сделать, например, биспецифические связывающие молекулы, такие как, например, биспецифические антитела, специфически направленные на два поверхностных маркера, находящихся на поверхности клетки, такой как раковая клетка. Так как специфичности связывания являются индивидуальными и обеспечиваются исходными компонентами, то можно индивидуально сделать мультиспецифическую нацеливающую и связывающую молекулу просто путем определения поверхностных маркеров, присутствующих на клетке, например, на раковой клетке, и конъюгации соответствующих фрагментов антител, которые специфически связываются с этими поверхностными маркерами или их соответствующими лигандами, путем ферментативной процедуры. Так как ферментативная конъюгация выполняется с помощью фермента сортазы А, в одном воплощении с помощью сортазы А от S. aureus, то полученная биспецифическая связывающая молекула (биспецифическое антитело) характеризуется наличием аминокислотной последовательности LPXTG (SEQ ID №01, где X может быть любым аминокислотным остатком).
Одним из аспектов, описанных в данном документе, является способ выбора мультиспецифической связывающей молекулы, которая специфически связывается с двумя различными эпитопами или антигенами, включающий этап
- выбора из множества мультиспецифических связывающих молекул, содержащих различные комбинации первой связывающей группировки и второй связывающей группировки, мультиспецифической связывающей молекулы, которая специфически связывается с двумя различными эпитопами или антигенами.
Одним из аспектов, описанных в данном документе, является способ выбора биспецифического антитела, включающий следующие этапы:
(i) определение маркеров клеточной поверхности, присутствующих в образце, содержащем клетку, и выбор по меньшей мере первого поверхностного маркера и второго поверхностного маркера,
(ii) трансфекция клетки (а) нуклеиновой кислотой, кодирующей Fab антитела, или scFab-фрагмент, или scFv антитела, содержащий среди 20 (двадцати) С-концевых аминокислотных остатков аминокислотную последовательность LPXTG (SEQ ID №01, где X может быть любым аминокислотным остатком), а затем сигнал удерживания в эндоплазматическом ретикулуме KDEL (SEQ ID №02), где Fab, или scFab-фрагмент, или scFv антитела специфически связываются с первым поверхностным маркером или его лигандом, (b) нуклеиновой кислотой, кодирующей фрагмент антитела с одной ветвью, содержащий тяжелую цепь полноразмерного антитела, легкую цепь полноразмерного антитела и полипептид Fc-области тяжелой цепи антитела, где тяжелая цепь полноразмерного антитела и легкая цепь полноразмерного антитела являются родственными цепями антитела, комплементарными друг другу, и пара их вариабельных доменов (VH и VL) образуют антигенсвязывающий сайт, который специфически связывается со вторым поверхностным маркером или его лигандом, где тяжелая цепь полноразмерного антитела и полипептид Fc-области тяжелой цепи антитела ковалентно связаны друг с другом через один или более чем один дисульфидный мостик, формируя шарнирную область антитела, и где полипептид Fc-области тяжелой цепи антитела имеет олигоглициновую Gm (m=2, или 3, или 4, или 5) аминокислотную последовательность на его N-конце, и (с) нуклеиновой кислотой, кодирующей растворимую сортазу А с С-концевым сигналом удерживания в эндоплазматическом ретикулуме,
и, таким образом, получения биспецифического антитела.
Одним из аспектов, описанных в данном документе, является способ определения комбинации антигенсвязывающих сайтов, включающий следующие этапы:
(i) определение специфичности связывания и/или селективности и/или аффинности и/или эффекторной функции и/или периода полужизни in vivo множества биспецифических антител, полученных путем объединения (а) каждого участника из первого множества Fab антитела, или scFab-фрагментов, или scFv-фрагментов антитела, где каждый участник содержит содержащей среди 20 С-концевых аминокислотных остатков аминокислотную последовательность LPXTG (SEQ ID №01, где X может быть любым аминокислотным остатком), а затем сигнал удерживания в эндоплазматическом ретикулуме KDEL (SEQ ID №02), где Fab, или scFab-фрагмент, или scFv антитела специфически связывается с первым эпитопом или антигеном, с (b) каждым участником из множества фрагментов антитела с одной ветвью, содержащих тяжелую цепь полноразмерного антитела, легкую цепь полноразмерного антитела и полипептид Fc-области тяжелой цепи антитела, где тяжелая цепь полноразмерного антитела и легкая цепь полноразмерного антитела являются родственными цепями антитела, комплементарными друг другу, и пара их вариабельных доменов (VH и VL) образуют антигенсвязывающий сайт, который специфически связывается со вторым эпитопом или антигеном, где тяжелая цепь полноразмерного антитела и полипептид Fc-области тяжелой цепи антитела ковалентно связаны друг с другом через один или более чем один дисульфидный мостик, формируя шарнирную область антитела, и где полипептид Fc-области тяжелой цепи антитела имеет олигоглициновую Gm (m=2, или 3, или 4, или 5) аминокислотную последовательность на его N-конце, ковалентно за счет катализируемой сортазой А ферментативной реакции,
и
(ii) выбор биспецифического антитела с подходящей специфичностью связывания и/или селективностью и/или аффинностью и/или эффекторной функцией и/или периодом полужизни in vivo и, таким образом, определение комбинации антигенсвязывающих сайтов.
В одном воплощении всех аспектов сортаза А является сортазой А золотистого стафилококка (S. aureus). В одном воплощении нуклеиновая кислота, кодирующая (растворимую) сортазу А с С-концевым сигналом удерживания в эндоплазматическом ретикулуме, кодирует аминокислотную последовательностей SEQ ID №51 или SEQ ID №52.
Одним из аспектов, описанных в данном документе, является биспецифическое антитело, полученное способом, описанным в данном документе.
Одним из аспектов, описанных в данном документе, является биспецифическое антитело, содержащее аминокислотную последовательность LPXTG (SEQ ID №01, где X может быть любым аминокислотным остатком) в одной из своих тяжелых цепей.
Далее приведены воплощения всех аспектов, описанных в данном документе.
В одном воплощении каждый из участников множества мультиспецифических связывающих молекул получен способом, описанным в данном документе.
В одном воплощении мультиспецифическая связывающая молекула выбрана на основании ее специфичности связывания и/или селективности, и/или аффинности, и/или эффекторной функции, и/или времени полужизни In vivo.
В одном воплощении связывающая группировка является родственной парой вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела.
В одном воплощении мультиспецифическая связывающая молекула представляет собой биспецифическое антитело, содержащее две или четыре связывающих группировки.
В одном воплощении первый полипептидный домен и второй полипептидный домен выбраны независимо друг от друга среди полноразмерного антитела, scFv, scFab, тяжелой цепи антитела, легкой цепи антитела, фрагмента Fc-области тяжелой цепи антитела, пары вариабельного домена легкой цепи антитела и вариабельного домена тяжелой цепи антитела, антигенсвязывающих фрагментов антитела, VH, VL, СН1, СН2, СН3, СН4, CL, шарнирной области антитела, цитокинов, рецепторов, рецепторных лигандов, обнаруживаемых меток, маркеров и партнеров связывающей пары.
В одном воплощении сигнал удерживания в эндоплазматическом ретикулуме выбран среди SEQ ID №02 (KDEL), SEQ ID №03 (HDEL) или SEQ ID №04 (SFIXXXXMP).
В одном воплощении сортазный мотив представляет собой LPXTG (SEQ ID №01, где X может быть любым аминокислотным остатком).
В одном воплощении первый связывающий домен или первая связывающая группировка имеют среди 20 С-концевых аминокислотных остатков аминокислотную последовательность LPXTG (SEQ ID №01, где X может быть любым аминокислотным остатком).
В одном воплощении клетка представляет собой клетку млекопитающего или дрожжевую клетку. В одном воплощении клетка млекопитающего выбрана среди клетки НЕК, клетки яичника китайского хомяка (СНО) или клетки ВНК.
В одном воплощении Fc-область содержит мутацию природного аминокислотного остатка в позиции 329 и по меньшей мере еще одну мутацию по меньшей мере одного аминокислотного остатка, выбранного из группы, включающей аминокислотные остатки в позиции 228, 233, 234, 235, 236, 237, 297, 318, 320, 322 и 331, с заменой другим остатком, где остатки в Fc-области пронумерованы в соответствии с индексом ЕС по Кабату. Изменение этих конкретных аминокислотных остатков приводит к изменению эффекторной функции Fc-области по сравнению с немодифицированной Fc-областью (дикого типа).
В одном воплощении связывающая группировка выбрана из (или первая связывающая группировка и вторая связывающая группировка независимо друг от друга выбраны из) группы связывающей группировки на основании дарпинового домена, связывающей группировки на основании антикалинового домена, связывающей группировки на основании фрагмента Т-клеточного рецептора, такого как домен scTCR, связывающей группировки на основании верблюжьего VH-домена, связывающей группировки на основании десятого домена фибронектина III типа, связывающей группировки на основании тенасцинового домена, связывающей группировки на основании кадгеринового домена, связывающей группировки на основании ICAM-домена, связывающей группировки на основании домена титина, связывающей группировки на основании GCSF-R-домена, связывающей группировки на основании домена цитокинового рецептора, связывающей группировки на основании домена ингибитора гликозидазы, связывающей группировки на основании домена супероксиддисмутазы или фрагментов антител, таких как Fab- или scFab- или scFv-фрагмент.
В одном воплощении первый полипептидный домен содержит i) аминокислотную последовательность LPXTG (SEQ ID №01, где X может быть любым аминокислотным остатком) в аминокислотной последовательности его С-концевой области (т.е. среди двадцати С-концевых аминокислотных остатков) и и) сигнал удерживания в эндоплазматическом ретикулуме KDEL (SEQ ID №02) на его С-конце, а второй полипоптидный домен содержит олигоглицин Gm (m=2, или 3, или 4, или 5) на его N-конце.
В одном воплощении второй полипептидный домен или вторая связывающая группировка содержит олигоглициновую Gm (m=2, или 3, или 4, или 5) аминокислотную последовательность на своем N-конце.
Одним из аспектов, описанных в данном документе, является фармацевтический состав, содержащий мультиспецифическую связывающую молекулу, описанную в данном документе.
Одним из аспектов, описанных в данном документе, является применение мультиспецифической связывающей молекулы, описанной в данном документе, в производстве лекарственного средства.
В одном воплощении лекарственное средство предназначено для лечения рака.
Одним из аспектов, описанных в данном документе, является способ лечения индивидуума, страдающего от рака, который включает введение индивидууму эффективного количества мультиспецифической связывающей молекулы, описанной в данном документе.
Одним из аспектов, описанных в данном документе, является способ разрушения раковых клеток у индивидуума, включающий введение индивидууму эффективного количества мультиспецифической связывающей молекулы, описанной в данном документе.
Одним из аспектов, описанных в данном документе, является фармацевтический состав, содержащий биспецифическое антитело, описанное в данном документе.
Одним из аспектов, описанных в данном документе, является применение биспецифического антитела, описанного в данном документе, в производстве лекарственного средства.
В одном воплощении лекарственное средство предназначено для лечения рака.
Одним из аспектов, описанных в данном документе, является способ лечения индивидуума, страдающего от рака, который включает введение индивидууму эффективного количества биспецифического антитела, описанного в данном документе.
Одним из аспектов, описанных в данном документе, является способ разрушения раковых клеток у индивидуума, включающий введение индивидууму эффективного количества биспецифического антитела, описанного в данном документе. В одном воплощении всех аспектов, описанных в данном документе, Fc-область является человеческой Fc-областью или ее вариантом.
В одном воплощении Fc-область человеческого антитела относится или к человеческому lgG1-подклассу, или к человеческому lgG2-подклассу, или к человеческому lgG3-подклассу, или к человеческому lgG4-подклассу.
В одном воплощении Fc-область антитела представляет собой Fc-область человеческого антитела подкласса lgG1 или человеческого антитела подкласса lgG4.
В одном воплощении Fc-область человеческого антитела содержит мутацию природного аминокислотного остатка по меньшей мере в одной из следующих аминокислотных позиций: 228, 233, 234, 235, 236, 237, 297, 318, 320, 322, 329 и/или 331, с заменой другим остатком, где остатки в Fc-области антитела пронумерованы в соответствии с ЕС-индексом по Кабату.
В одном воплощении Fc-область человеческого антитела содержит мутацию природного аминокислотного остатка в позиции 329 и по меньшей мере еще одну мутацию по меньшей мере одного аминокислотного остатка, выбранного из группы, включающей аминокислотные остатки в позициях 228, 233, 234, 235, 236, 237, 297, 318, 320, 322 и 331, с заменой другим остатком, где остатки в Fc-области пронумерованы в соответствии с ЕС-индексом по Кабату. Замена этих конкретных аминокислотных остатков приводит к изменению эффекторной функции Fc-области по сравнению с немодифицированной Fc-областью (дикого типа).
В одном воплощении Fc-область человеческого антитела имеет сниженную аффинность к FcγRIIIA и/или FcγRIIA и/или FcγRI по сравнению с конъюгатом, содержащим соответствующую Fc-область IgG дикого типа.
В одном воплощении аминокислотный остаток в позиции 329 Fc-области человеческого антитела замещен на глицин, или аргинина, или аминокислотный остаток, достаточно большой, чтобы разрушить «пролиновый сэндвич» в Fc-области.
В одном воплощении мутация природного аминокислотного остатка в Fc-области человеческого антитела является по меньшей мере одной из S228P, Е233Р, L234A, L235A, L235E, N297A, N297D, P329G и/или P331S.
В одном воплощении мутация представляет собой L234A и L235A, если Fc-область антитела относится к человеческому lgG1-подклассу, или S228P и L235E, если Fc-область антитела относится к человеческому lgG4-подклассу.
В одном воплощении Fc-область антитела содержит мутацию P329G.
В одном воплощении Fc-область антитела содержит мутацию T366W в полипептиде Fc-области первой тяжелой цепи и мутации T366S, L368A и Y407V в полипептиде Fc-области второй тяжелой цепи, где нумерация осуществляется в соответствии с индексом ЕС по Кабату.
В одном воплощении Fc-область антитела содержит мутацию S354C в полипептиде Fc-области первой тяжелой цепи и мутацию Y349C в полипептиде Fc-области второй тяжелой цепи.
Описание графических материалов
Фиг. 1 Плазмидная карта экспрессионной плазмиды с растворимой сортазой А, содержащей эндоплазматический сигнал удерживания на своем С-конце.
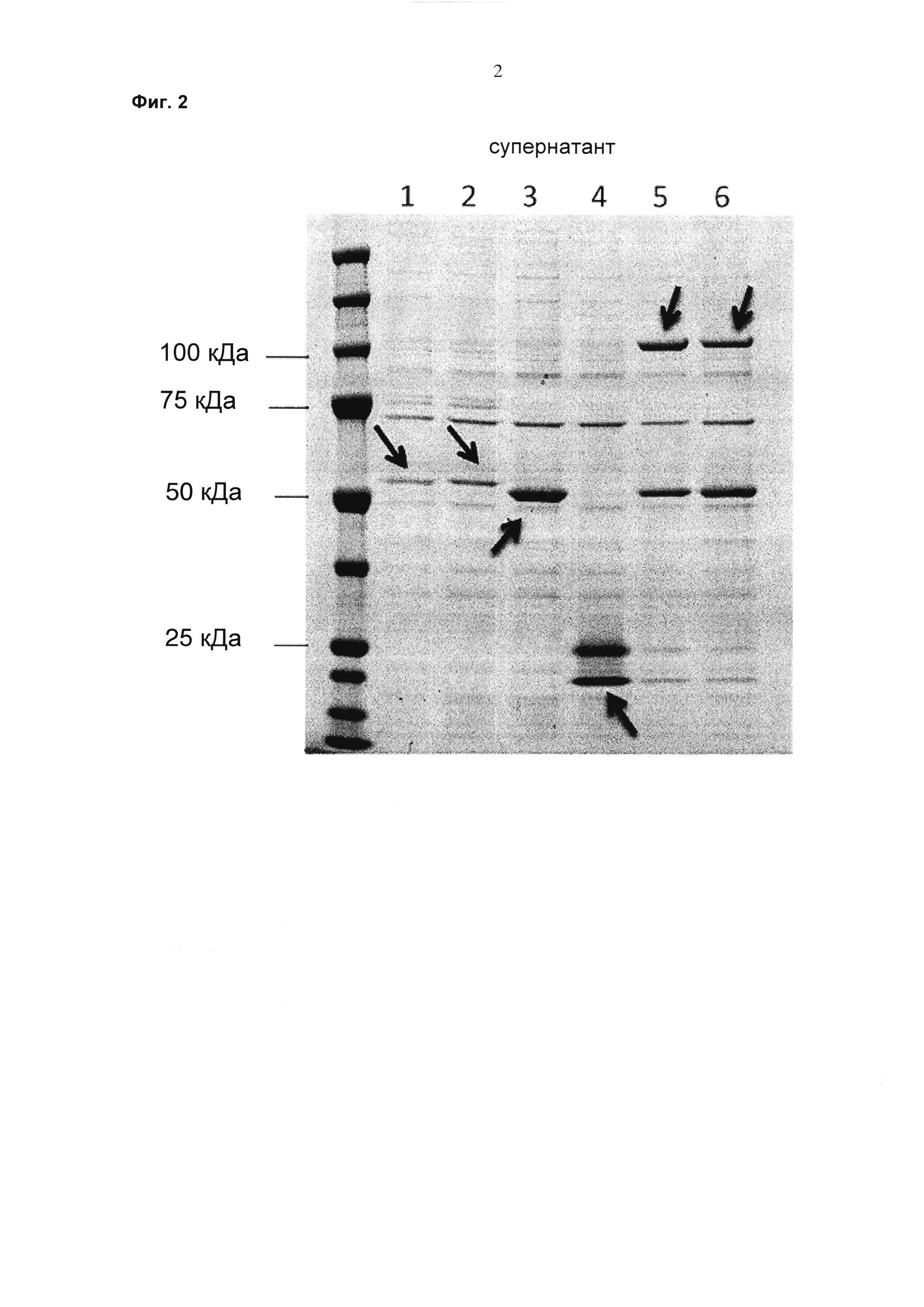
Фиг. 2 Окрашенный по Кумасси SDS-гель, восстанавливающие условия; культуральные супернатанты от клеток НЕК293, трансфицированных scFab-GS-His6-GS-LPETGGS-KDEL (дорожка 1), scFab-GS-His6-GAPPPS-LPETGGS-KDEL (дорожка 2), (GGGGS)2-scFab (дорожка 3), растворимой сортазой A-KDEL (дорожка 4), комбинацией 1+3+4 (соотношение плазмид 2,5: 5: 1) (дорожка 5), комбинацией 2+3+4 (соотношение плазмид 2: 8: 1) (дорожка 6); scFab-GS-His6-GS-LPETGGS-KDEL и scFab-GS-His6-GAPPPS-LPETGGS-KDEL остаются, в основном, внутриклеточно (GGGGS)2-scFab экспрессируется и секретируется в среду (примерно 50 кДа), для комбинации можно увидеть полосу ферментативного конъюгата примерно 100 кДа.
Фиг. 3 Окрашенный по Кумасси SDS-гель, восстанавливающие условия; клеточные лизаты (слева) клеток НЕК293, трансфицированных scFab-GS-His6-GS-LPETGGS-KDEL (дорожка 1), scFab-GS-His6-GAPPPS-LPETGGS-KDEL (дорожка 2), (GGGGS)2-scFab (дорожка 3), растворимой сортазой A-KDEL (дорожка 4), комбинацией 1+3+4 (соотношение плазмид 2,5: 5: 1) (дорожка 5), комбинацией 2+3+4 (соотношение плазмид 2: 8: 1) (дорожка 6); scFab-GS-His6-GS-LPETGGS-KDEL и scFab-GS-His6-GAPPPS-LPETGGS-KDEL остаются, в основном, внутриклеточно.
Фиг. 4 Анализ вестерн-блот SDS-геля с использованием идентичных образцов и выполненный в таких же условиях, как и гели из фиг. 2 и 3; молекулы scFab-LPXTG и продукт конъюгации обнаруживали с помощью антител против His-метки (PentaHis-AK (Qiagen)); для комбинации можно увидеть полосу ферментативного конъюгата примерно 100 кДа.
Подробное описание изобретения
I. ОПРЕДЕЛЕНИЯ
В данном описании и формуле изобретения нумерация остатков в Fc-области тяжелой цепи иммуноглобулина осуществляется в соответствии с индексом ЕС по Кабату (Kabat, Е.А., et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991), NIH Publication 91-3242, включен в данный документ посредством ссылки).
Термин "изменение" обозначает мутацию, добавление или удаление одного или более чем одного аминокислотного остатка в родительской аминокислотной последовательности.
Термин "метка" обозначает последовательность аминокислотных остатков, соединенных друг с другом посредством пептидных связей, которая имеет специфические связывающие свойства. В одном воплощении метка представляет собой метку для аффинности или очистки. В одном воплощении метка выбрана среди Arg-метки, His-метки, Flag-метки, SxFlag-метки, Strep-метки, Nano-метки, SBP-метки, с-тус-метки, S-метки, калмодулин-связывающего пептида, целлюлозо-связывающего домена, хитин-связывающего домена, GST-метки или МВР-метки. В одном воплощении метка выбрана среди SEQ ID №05 (RRRRR), или SEQ ID №06 (RRRRRR), или SEQ ID №07 (НННННН), или SEQ ID №08 (KDHLIHNVHKEFHAHAHNK), или SEQ ID №09 (DYKDDDDK), или SEQ ID №10 (DYKDHDGDYKDHDIDYKDDDDK), или SEQ ID №11 (AWRHPQFGG), или SEQ ID №12 (WSHPQFEK), или SEQ ID №13 (MDVEAWLGAR), или SEQ ID №14 (М DVEAW LG ARVPLVET), или SEQ ID №15 (MDEKTTGWRGGHWEGLAGELEQLRARLEHHPQGQREP), или SEQ ID №16 (EQKLISEEDL), или SEQ ID №17 (KETAAAKFERQHMDS), или SEQ ID №18 (KRRWKKNFIAVSAANRFKKISSSGAL), или SEQ ID №19 (целлюлозо-связывающий домен), или SEQ ID №20 (целлюлозо-связывающий домен), или SEQ ID №21 (TNPGVSAWQVNTAYMETKHQLVTYNGKTYKCLQPHTSLAGWEP SNVPALWQLQ), или SEQ ID №22 (GST-метка), или SEQ ID №23 (МВР-метка).
Термин "антигенсвязывающий фрагмент антитела" означает молекулу, отличную от полноразмерного антитела, которая содержит часть полноразмерного антитела, связывающуюся с антигеном, с которым связывается интактное антитело. Примеры фрагментов антитела включают, но не ограничиваясь ими, Fv, scFv, Fab, scFab, Fab', Fab'-SH, F(ab')2, димерные антитела, линейные антитела, одноцепочечные молекулы антител (например, scFv) и мультиспецифические антитела, образованные из фрагментов антител.
Фрагменты антител включают, но не ограничиваясь ими, фрагменты Fab, Fab', Fab'-SH, F(ab')e, Fv и scFv, а также другие фрагменты, описанные ниже. Обзор некоторых фрагментов антител см. в Hudson, P.J., et al., Nat. Med. 9 (2003) 129-134. Обзор scFv-фрагментов см., например, в Plueckthun, A., In: The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore (eds.), Springer-Verlag, New York (1994), pp.269-315; см. также WO 93/16185; US 5571894 и US 5587458. обсуждение фрагментов Fab and F(ab')2, содержащих остатки эпитопа связывания рецептора реутилизации и имеющих повышенное время полужизни in vivo, см. в US 5,869,046.
Фрагменты антител могут быть получены различными методиками, в том числе, но не ограничиваясь ими, протеолитическим расщеплением или расщеплением интактного антитела, а также производством рекомбинантными клетками-хозяевами (например, E.coli, или фагом, или эукариотическими клетками), как описано в данном документе.
Термин "биспецифическое антитело" обозначает антигенсвязывающую молекулу, которая может специфически связываться с первым антигеном или эпитопом и со вторым антигеном или эпитопом, где первый антиген или эпитоп отличается от второго антигена или эпитопа.
Форматы биспецифических антител описаны, например, в WO 2009/080251, WO 2009/080252, WO 2009/080253, WO 2009/080254, WO 2010/112193, WO 2010/115589, WO 2010/136172, WO 2010/145792 и WO 2010/145793.
Термин "класс" антитела относится к типу константного домена или константной области, которой обладает его тяжелая цепь. Есть пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть разделены на подклассы (изотипы), например, IgG1, lgG2, lgG3, lgG4, lgA1 и lgA2. Сегменты генов, кодирующие константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ, соответственно. Кроме того, существует два класса легких цепей антител, присутствующих в антителах человеческого происхождения: каппа и лямбда, которые могут образовывать интактные антитела в комбинации с их родственными партнерами - тяжелыми цепями. Гены, кодирующие легкие цепи каппа или лямбда, называются κ и μ, соответственно.
Термин "эффекторная функция" обозначает те биологические активности, относящиеся к Fc-области антитела, которые изменяются в зависимости от класса и/или подкласса антитела. Примеры эффекторных функций антитела включают: C1q-связывание и комплементзависимую цитотоксичность (CDC); Fc-рецепторное связывание; антителозависимую клеточно-опосредованную цитотоксичность (ADCC); антителозависимый клеточной фагоцитоз (ADCP); понижающую регуляцию рецепторов клеточной поверхности (например, В-клеточного рецептора); и активацию В-клеток. Такая функция может быть осуществлена, например, путем связывания Fc-области с Fc-рецептором на иммунной клетке с фагоцитарной или литической активностью, или связывание Fc-области с компонентами системы комплемента.
"Эффективное количество" агента, например, фармацевтического состава, относится к количеству, эффективному в дозах и в течение периодов времени, необходимых для достижения желаемого терапевтического или профилактического результата.
Термин "Fc-область" обозначает С-концевую область иммуноглобулина. Fc-область представляет собой димерную молекулу, содержащую два связанных дисульфидными мостиками фрагмента тяжелых цепей антитела (полипептидные цепи Fc-областей тяжелых цепей). Fc-область может быть получена путем расщепления папаином или IdeS или трипсином интактного (полноразмерного) антитела, или могут быть получены рекомбинантным путем.
Fc-область, получаемая из полноразмерного антитела или иммуноглобулина, содержит по меньшей мере остаток 226 (Cys) на С-конце полноразмерной тяжелой цепи и, таким образом, включает часть шарнирной области и два или три константных домена, т.е. домен СН2, домен СН3 и дополнительный/экстрадомен СН4 в случае антител класса IgE и IgM. Как известно из US 5648260 и US 5624821, модификация определенных аминокислотных остатков в Fc-области приводит к фенотипическим эффектам.
Формирование димерной Fc-области, содержащей два одинаковых или неодинаковых фрагмента тяжелых цепей антитела, опосредуется нековалентной димеризацией содержащихся доменов СНЗ (вовлеченные аминокислотные остатки см., например, в Dall'Acqua, Biochem. 37 (1998) 9266-9273). Fc-область ковалентно стабилизирована за счет образования дисульфидных связей в шарнирной области (см., например, Huber, et al., Nature 264 (1976) 415-420; Thies, et al., J. Mol. Biol. 293 (1999) 67-79). Введение изменений аминокислотных остатков в домен СН3 для того, чтобы нарушить димеризацию доменов СН3-СН3, не оказывает отрицательного воздействия на связывание неонатального Fc-рецептора (FcRn) благодаря тому, что остатки, участвующие в димеризации СН3-СН3-доменов, расположены на внутренней границе СН3-доменов, тогда как остатки, участвующие во взаимодействии Fc-o6nacTb-FcRn, расположены на внешней стороне доменов СН2-СН3.
Остатки, связанные с эффекторными функциями Fc-области, расположены в шарнирной области, СН2- и/или СН3-доменах, определенных для молекулы полноразмерного антитела. Функции, связанные/опосредованные с Fc-областью, представляют собой:
(i) антителозависимую клеточную цитотоксичность (ADCC),
(ii) связывание и активацию комплемента (C1q), комплементзависимую цитотоксичность (CDC),
(iii) антителозависимый клеточной фагоцитоз (ADCP),
(iv) фагоцитоз/клиренс комплексов антиген-антитело (иммунных комплексов),
(v) высвобождение цитокинов в некоторых случаях и
(vi) период полужизни/скорость клиренса антитела и комплекосв антиген-антитело.
Эффекторные функции, связанные с Fc-областью, вызываются/инициируются при взаимодействии Fc-области со специфическими молекулами или рецепторами с эффекторной функцией. Преимущественно антитела подкласса lgG1 могут осуществить активацию рецептора, в то время как антитела подклассов lgG2 и lgG4 не имеют эффекторной функции или имеют ограниченную эффекторную функцию.
Рецепторы, вызывающие эффекторную функцию, относятся к Fc-рецепторам типов (и подтипов) FcγRI, FcγRII и FcγRIII. Эффекторные функции, связанные с подклассом lgG1, могут быть уменьшены посредством введения конкретных аминокислотных замен в нижнюю шарнирную область, таких как L234A и/или L235A, которые участвуют в FcγR- и C1q-связывании. Кроме того, некоторые аминокислотные остатки, особенно расположенные в доменах СН2 и/или СН3, связаны с контролем периода полужизни молекулы антитела или Fc-гибридного полипептида в кровотоке. Период полужизни в кровотоке определяется связыванием Fc-области с неонатальным Fc-рецептором (FcRn).
Термин "человеческая Fc-область" обозначает С-концевую область тяжелой цепи иммуноглобулина человеческого происхождения, который содержит по меньшей мере часть шарнирной области, домен СН2 и домен СН3. В одном воплощении Fc-область тяжелой цепи человеческого антитела IgG простирается примерно от Glu216, или примерно от Cys226, или примерно от Pro230, до карбоксильного конца тяжелой цепи. Тем не менее, С-концевой лизин (Lys447) Fc-области антитела может присутствовать или не присутствовать.
Полипептидная цепь Fc-области дикого типа человеческого lgG1 имеет следующую аминокислотную последовательность:

Полипептидная цепь Fc-области дикого типа человеческого lgG4 имеет следующую аминокислотную последовательность:


Термин "полноразмерное антитело" обозначает антитело, имеющее структуру и аминокислотную последовательность, по существу идентичную нативной структуре антитела, а также полипептиды, которые включают Fc-область, описанную в данном документе.
Термин "тяжелая цепь полноразмерного антитела" обозначает полипептид, содержащий в направлении от N- к С-концу вариабельный домен антитела, первый константный домен, шарнирную область тяжелой цепи антитела, второй константный домен и третий константный домен, и в некоторых случаях четвертый константный домен.
Термин "Fc-область тяжелой цепи антитела" обозначает полипептид, содержащий шарнирную область тяжелой цепи антитела, первый константный домен (обычно домен СН2) и второй константный домен (обычно домен СН3).
Термин "домен СН2" обозначает часть полипептида тяжелой цепи антитела, которая простирается приблизительно от позиции ЕС 231 до позиции ЕС 340 (система нумерации ЕС по Кабату). В одном воплощении домен СН2 имеет аминокислотную последовательность SEQ ID №26

Домен СН2 является уникальным в том, что он не тесно спарен с другим доменом. Скорее, две N-связанные разветвленные углеводные цепи размещены между двумя СН2-доменами интактной нативной Fc-области. Было предположение, что углевод может обеспечивать замену спариванию «домен-домен» и помогать стабилизации домена СН2. Burton, Mol. Immunol. 22 (1985) 161-206.
Термин "домен СН3" обозначает часть полипептида тяжелой цепи антитела, которая простирается приблизительно от позиции ЕС 341 до позиции ЕС 446. В. одном воплощении домен СН3 имеет аминокислотную последовательность SEQ ID №27

Термин "легкая цепь полноразмерного антитела" обозначает полипептид, включающий в направлении от N- к С-концу вариабельный домен антитела и константный домен.
Термин "шарнирная область" обозначает часть полипептида тяжелой цепи антитела, которая соединяет в тяжелой цепи антитела дикого типа СН1-домен и СН2-домен, например, примерно от позиции 216 до позиции 230 в соответствии с системой ЕС по Кабату, или примерно от позиции 226 до позиции 230 в соответствии с системой ЕС по Кабату. Шарнирные области других подклассов IgG могут быть определены путем выравнивания цистеиновых остатков последовательности шарнирной области подкласса lgG1.
Шарнирная область, как правило, представляет собой димер, состоящий из двух полипептидов с одинаковой аминокислотной последовательностью. Шарнирная область обычно содержит примерно 25 аминокислотных остатков и является гибкой, что позволяет антигенсвязывающим областям двигаться независимо друг от друга. Шарнирную область можно разделить на три субдомена: верхнюю, среднюю и нижнюю шарнирные области (см., Roux, et al., J. Immunol. 161 (1998)4083).
Термин "нижняя шарнирная область" Fc-области обозначает участок аминокислотных остатков, находящихся с С-конца от средней (центральной) шарнирной области, т.е. остатки с 233 по 239 Fc-области в соответствии с нумерацией ЕС по Кабату.
Термин "Fc-область дикого типа" обозначает аминокислотную последовательность, идентичную аминокислотной последовательности природной Fc-области. Fc-области дикого типа включают нативную человеческую Fc-область lgG1 (аллотипы не-А и А), нативную человеческую Fc-область lgG2, нативную человеческую Fc-область lgG3 и нативную человеческую Fc-область lgG4, а также их природные варианты.
Термин "индивидуум" или "субъект" обозначает млекопитающее. Млекопитающие включают, но не ограничиваясь ими, домашних животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и приматов, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В некоторых воплощениях индивидуум или субъект является человеком.
«Процент (%) идентичности аминокислотной последовательности» по отношению к референсной полипептидной последовательности определяется как процент аминокислотных остатков в кандидатной последовательности, которые идентичны аминокислотным остаткам в референсной полипептидной последовательности после выравнивания последовательностей и введения при необходимости пробелов для достижения максимального процента идентичности последовательностей, и без учета любых консервативных замен как части идентичности последовательности. Выравнивание последовательностей с целью определения процента идентичности аминокислотных последовательностей может быть достигнуто различными способами, которые доступны специалистам в данной области, например, с использованием общедоступного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для выравнивания последовательностей, в том числе любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Тем не менее, для целей данного изобретения значения % идентичности аминокислотных последовательностей получают с использованием компьютерной программы для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 была разработана Genentech, Inc., и исходный код был подан с пользовательской документацией в бюро авторских прав США, Вашингтон, округ Колумбия, 20559, где он был зарегистрирован под номером TXU510087. Программа ALIGN-2 находится в открытом доступе от Genentech, Inc., Саут-Сан-Франциско, Калифорния, или может быть скомпилирована из исходного кода. Программа ALIGN-2 должна быть скомпилирована для применения на операционной системе UNIX, включая цифровую UNIX V4.0D. Все параметры сравнения последовательностей установлены программой ALIGN-2 и не меняются.
В ситуациях, когда ALIGN-2 используется для сравнения аминокислотных последовательностей, % идентичности аминокислотной последовательности данной аминокислотной последовательности А с данной аминокислотной последовательностью В (альтернативно можно сказать, что данная аминокислотная последовательность А имеет или содержит определенный % идентичности аминокислотной последовательности с данной аминокислотной последовательностью В) вычисляется следующим образом:
100 × доля X/Y,
где X обозначает число аминокислотных остатков, оцененных как идентичные совпадения с помощью программы для выравнивания - последовательностей ALIGN-2 при выравнивании в этой программе А и В, и где Y обозначает общее число аминокислотных остатков в В. Следует иметь в виду, что если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, то % идентичности аминокислотной последовательности А с В не будет равен % идентичности аминокислотной последовательности В с А. Если специально не указано иное, то все значения % идентичности аминокислотной последовательности, используемые в данном описании, получены так, как описано в предыдущем абзаце, с использованием компьютерной программы ALIGN-2.
Термин "фармацевтический состав" относится к препарату, который находится в такой форме, чтобы обеспечить биологическую активность активного ингредиента, содержащегося в нем, и который не содержит дополнительных компонентов, которые являются неприемлемо токсичными для субъекта, которому будет осуществляться введение состава.
Понятие "фармацевтически приемлемого носителя" относится к ингредиенту в фармацевтическом составе, помимо активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемые носители включают, но не ограничиваясь ими, буфер, эксципиент, стабилизатор или консервант.
Термин "фенотип пациента" обозначает состав рецепторов клеточной поверхности типа клеток от пациента. Состав может быть как качественным, так и количественным. Клетка, для которой определяется/дан генотип, может быть отдельной клеткой или образцом, содержащим клетки.
Термин "позиция" обозначает расположение аминокислотного остатка в аминокислотной последовательности полипептида. Позиции могут быть пронумерованы последовательно или в соответствии с утвержденным форматом, например, индексом ЕС по Кабату для нумерации антител.
Термин "рецептор" означает полипептид, способный связывать по меньшей мере один лиганд. В одном воплощении рецептор представляет собой рецептор клеточной поверхности, имеющий внеклеточный лигандсвязывающий домен и, возможно, другие домены (например, трансмембранный домен, внутриклеточный домен и/или мембранный якорь). Рецептор, который должен быть оценен в анализе, описанном в данном документе, может быть интактным рецептором или его фрагмент или его производным (например, гибридным белком, содержащим связывающий домен рецептора, слитый с одним или более чем одним гетерологичным полипептидом). Кроме того, рецептор, который должен быть оценен на предмет его связывающих свойств, может присутствовать в клетке, или его можно выделить и, возможно, покрыть им аналитический планшет или какую-либо другую твердую фазу.
Используемый в данном документе термин «лечение» (и его грамматические варианты, такие как «лечить») относится к клиническому вмешательству в попытке изменить естественное развитие заболевания у индивидуума, которого лечат, и которое может быть выполнено либо для профилактики, либо в ходе клинической патологии. Желательные эффекты лечения включают, но не ограничиваясь ими, предотвращение возникновения или рецидива заболевания, ослабление симптомов, уменьшение любого прямого или косвенного патологического последствия заболевания, предотвращение метастазирования, уменьшение скорости прогрессирования заболевания, улучшение или временное облегчение болезненного состояния, достижение ремиссии или улучшение прогноза. В некоторых воплощениях антитела данного изобретения используются для задержки развития заболевания или замедления прогрессии заболевания.
II. Молекулы с заданными свойствами, содержащие первый и второй полипептидный домен
Было обнаружено, что при использовании модульного подхода, описанного в данном документе, могут быть получены терапевтические полипептиды с заданными свойствами. Эти полипептиды имеют заданные свойства в связи с полипептидными доменами, из которых они сформированы.
При создании терапевтических молекул с заданными свойствами путем объединения двух полипептидных доменов могут быть объединены различные способы действия, например, двойное нацеливание (объединение двух связывающих группировок, биспецифических или мультиспецифических связывающих молекул), нацеливание и доставка полезной нагрузки (объединение связывающей группировки (нацеливание) и эффекторной группировки (полезная нагрузка), например антитело-конъюгат), или комбинированное ингибирование рецептора (объединение двух рецепторов и/или лигандов). Полученные терапевтические агенты являются отдельными терапевтическими молекулами, одновременно выполняющими способы действия отдельных полипептидных доменов. При этом, например, ожидается совокупный/синергический эффект по сравнению с однодоменными терапевтическими молекулами.
При использовании уже имеющихся терапевтических группировок, таких как производные терапевтических антител, можно быстро и легко получить продукцию мультиспецифической терапевтической молекулы.
Например, связывающие молекулы/антитела с разработанной авидностью могут связываться с двумя или более маркерами клеточной поверхности, присутствующими на одной клетке. Это связывание является авидным, только если все/обе связывающие группировки одновременно связываются с клеткой. Для этой цели особенно подходят антитела с аффинностью от низкой до средней, от низкой до высокой или от средней до высокой. С другой стороны, это также позволяет в процессе скрининга исключить менее специфические комбинации специфичностей связывания.
При таком подходе возможно создание специально разработанных и, таким образом, весьма эффективных терапевтических молекул. Эти молекулы будут вызывать меньше или менее тяжелые/ослабленные побочные эффекты благодаря их улучшенным свойствам, таким как целевая доставка (например, полезной нагрузки к опухолевым клеткам) и улучшенное нацеливание на клетки-мишени, основанное на более высокой селективности и специфичности нацеливающего компонента (содержащего по меньшей мере две связывающие молекулы).
Более высокая селективность и специфичность мультиспецифической связывающей молекулы осуществляется за счет одновременного связывания (авидности) комбинации двух связывающих молекул с "низкой аффинностью", что снижает или полностью предотвращает потенциальное связывание "вне мишени".
Способы, описанные в данном документе
Одним из аспектов, описанных в данном документе, является способ получения полипептида, содержащего по меньшей мере два полипептидных домена, включающий этап
- культивирования клетки, содержащей
a) нуклеиновую кислоту, кодирующую растворимую сортазу А с С-концевым сигналом удерживания в эндоплазматическом ретикулуме,
b) нуклеиновую кислоту, кодирующую первый полипептидный домен, содержащий на его С-конце или в С-концевой области сортазный мотив, за которым следует сигнал удерживания в эндоплазматическом ретикулуме, и
c) нуклеиновую кислоту, кодирующую второй полипептидный домен, содержащий на его N-конце по меньшей мере диглициновый мотив,
где клетка секретирует лигируемый сортазой А конъюгат первого полипептидного доменами второго полипептидного домена,
и, таким образом, получения полипептида, содержащего по меньшей мере два полипептидных домена.
Одним из аспектов, описанных в данном документе, является способ получения мультиспецифической связывающей молекулы, содержащей по меньшей мере две связывающих группировки, включающий этап
- культивирования клетки, содержащей
а) нуклеиновую кислоту, кодирующую растворимую сортазу А с С-концевым сигналом удерживания в эндоплазматическом ретикулуме,
b) нуклеиновую кислоту, кодирующую первую связывающую группировку, содержащую на ее С-конце или в С-концевой области сортазный мотив, за которым следует сигнал удерживания в эндоплазматическом ретикулуме, и
c) нуклеиновую кислоту, кодирующую вторую связывающую группировку, содержащую на ее N-конце по меньшей мере диглициновый мотив,
где клетка секретирует лигируемый сортазой А конъюгат первой связывающей группировки и второй связывающей группировки,
где первая связывающая группировка специфически связывается с первым антигеном или мишенью, а вторая связывающая группировка специфически связывается со вторым антигеном или мишенью,
и, таким образом, получения мультиспецифического полипептида, содержащего по меньшей мере две связывающих группировки.
Одним из аспектов, описанных в данном документе, является способ выбора мультиспецифической связывающей молекулы, который специфически связывается с двумя различными эпитопами или антигенами, включающий этап
- выбора из множества мультиспецифических связывающих молекул, содержащих различные комбинации первой связывающей группировки и второй связывающей группировки, мультиспецифической связывающей группировки, которая специфически связывается с двумя различными эпитопами или антигенами.
Одним из аспектов, описанных в данном документе, является способ выбора биспецифического антитела, включающий следующие этапы:
(i) определение маркеров клеточной поверхности, присутствующих в образце, содержащем клетку, и выбор по меньшей мере первого поверхностного маркера и второго поверхностного маркера,
(ii) трансфекция клетки (а) нуклеиновой кислотой, кодирующей Fab-фрагмент, или scFab антитела, или scFv антитела, содержащий среди 20 С-концевых аминокислотных остатков аминокислотную последовательность LPXTG (SEQ ID №01, где X может быть любым аминокислотным остатком), а затем сигнал удерживания в эндоплазматическом ретикулуме KDEL (SEQ ID №02), где Fab-фрагмент, или scFab-фрагмент, или scFv антитела специфически связываются с первым поверхностным маркером или его лигандом, (b) нуклеиновой кислотой, кодирующей фрагмент антитела с одной ветвью, содержащий тяжелую цепь полноразмерного антитела, легкую цепь полноразмерного антитела и полипептид Fc-области тяжелой цепи антитела, где тяжелая цепь полноразмерного антитела и легкая цепь полноразмерного антитела являются родственными цепями антитела, комплементарными друг другу, и пара их вариабельных доменов (VH и VL) образует антигенсвязывающий сайт, который специфически связывается со вторым поверхностным маркером или его лигандом, где тяжелая цепь полноразмерного антитела и полипептид Fc-области тяжелой цепи антитела ковалентно связаны друг с другом через один или более чем один дисульфидный мостик, формируя шарнирную область антитела, и где полипептид Fc-области тяжелой цепи антитела имеет олигоглициновую Gm (m=2, или 3, или 4, или 5) аминокислотную последовательность на его N-конце, и (с) нуклеиновой кислотой, кодирующей растворимую сортазу А с С-концевым сигналом удерживания в эндоплазматическом ретикулуме,
и, таким образом, получения биспецифического антитела.
Одним из аспектов, описанных в данном документе, является способ определения комбинации антигенсвязывающих сайтов, включающий следующие этапы:
(i) определение специфичности связывания и/или селективности, и/или аффинности, и/или эффекторной функции, и/или периода полужизни in vivo множества биспецифических антител, полученных путем объединения (а) каждого участника из первого множества Fab-фрагментов антитела, или scFab-фрагментов антитела, или scFv-фрагментов антитела, где каждый участник содержит среди 20 С-концевых аминокислотных остатков аминокислотную последовательность LPXTG (SEQ ID №01, где X может быть любым аминокислотным остатком), а затем сигнал удерживания в эндоплазматическом ретикулуме KDEL (SEQ ID №02), где Fab-фрагмент, или scFab-фрагмент, или scFv антитела специфически связывается с первым эпитопом или антигеном, с (b) каждым участником из множества фрагментов антитела с одной ветвью, содержащих тяжелую цепь полноразмерного антитела, легкую цепь полноразмерного антитела и полипептид Fc-области тяжелой цепи антитела, где тяжелая цепь полноразмерного антитела и легкая цепь полноразмерного антитела являются родственными цепями антитела, комплементарными друг другу, и пара их вариабельных доменов (VH и VL) образуют антигенсвязывающий сайт, который специфически связывается со вторым эпитопом или антигеном, где тяжелая цепь полноразмерного антитела и полипептид Fc-области тяжелой цепи антитела ковалентно связаны друг с другом через один или более чем один дисульфидный мостик, формируя шарнирную область антитела, и где полипептид Fc-области тяжелой цепи антитела имеет олигоглициновую Gm (m=2, или 3, или 4, или 5) аминокислотную последовательность на его N-конце, за счет реакции ферментативного сочетания, опосредованной сортазой А,
и
(ii) выбор биспецифического антитела с подходящей специфичностью связывания, и/или селективностью, и/или аффинностью, и/или эффекторной функцией, и/или периодом полужизни in vivo и, таким образом, определение комбинации антигенсвязывающих сайтов.
Далее приведены воплощения всех способов, описанных в данном документе.
В одном воплощении всех аспектов сортаза А является сортазой А от золотистого стафилококка (S. aureus). В одном воплощении нуклеиновая кислота, кодирующая (растворимую) сортазу А с С-концевым сигналом удерживания в эндоплазматическом ретикулуме, кодирует аминокислотную последовательность SEQ ID №51 или SEQ ID №52.
В одном воплощении каждый из участников множества мультиспецифических связывающих молекул получен способом, описанным в данном документе.
В одном воплощении мультиспецифическая связывающая молекула выбрана на основании ее специфичности связывания, и/или селективности, и/или аффинности, и/или эффекторной функции, и/или времени полужизни in vivo.
В одном воплощении связывающая группировка является родственной парой вариабельного домена тяжелой цепи антитела и вариабельного домена легкой цепи антитела.
В одном воплощении мультиспецифическая связывающая молекула представляет собой биспецифическое антитело, содержащее две или четыре связывающих группировки.
В одном воплощении первый полипептидный домен и второй полипептидный домен выбраны независимо друг от друга среди полноразмерного антитела, scFv, scFab, тяжелой цепи антитела, легкой цепи антитела, фрагмента Fc-области тяжелой цепи антитела, пары вариабельного домена легкой цепи антитела и вариабельного домена тяжелой цепи антитела, антигенсвязывающих фрагментов антитела, VH, VL, СН1, СН2, СН3, СН4, CL, шарнирной области антитела, цитокинов, рецепторов, рецепторных лигандов, обнаруживаемых меток, маркеров и партнеров связывающей пары.
В одном воплощении сигнал удерживания в эндоплазматическом ретикулуме выбран среди SEQ ID №02 (KDEL), SEQ ID №03 (HDEL) или SEQ ID №04 (SFIXXXXMP).
В одном воплощении сортазный мотив представляет собой LPXTG (SEQ ID №01, где X может быть любым аминокислотным остатком).
В одном воплощении первый связывающий домен или первая связывающая группировка содержат или имеют среди 20 С-концевых аминокислотных остатков аминокислотную последовательность LPXTG (SEQ ID №01, где X может быть любым аминокислотным остатком).
В одном воплощении клетка представляет собой клетку млекопитающего или дрожжевую клетку. В одном воплощении клетка млекопитающего выбрана среди клетки НЕК, клетки СНО или клетки ВНК.
В одном воплощении Fc-область содержит мутацию природного аминокислотного остатка в позиции 329 и по меньшей мере еще одну мутацию по меньшей мере одного аминокислотного остатка, выбранного из группы, включающей аминокислотные остатки в позициях 228, 233, 234, 235, 236, 237, 297, 318, 320, 322 и 331, с заменой другим остатком, где остатки в Fc-области пронумерованы в соответствии с индексом ЕС по Кабату. Изменение этих конкретных аминокислотных остатков приводит к изменению эффекторной функции Fc-области по сравнению с немодифицированной Fc-областью (дикого типа).
В одном воплощении связывающая группировка выбрана из (или первая связывающая группировка и вторая связывающая группировка независимо друг от друга выбраны из) группы связывающей группировки на основании дарпинового домена, связывающей группировки на основании антикалинового домена, связывающей группировки на основании фрагмента Т-клеточного рецептора, такого как домен scTCR, связывающей группировки на основании верблюжьего VH-домена, связывающей группировки на основании десятого домена фибронектина III типа, связывающей группировки на основании тенасцинового домена, связывающей группировки на основании кадгеринового домена, связывающей группировки на основании ICAM-домена, связывающей группировки на основании домена титина, связывающей группировки на основании GCSF-R-домена, связывающей группировки на основании домена цитокинового рецептора, связывающей группировки на основании домена ингибитора гликозидазы, связывающей группировки на основании домена супероксидсупероксиддисмутазы или фрагментов антител, таких как Fab- или scFab- или scFv-фрагменты.
В одном воплощении первый полипептидный домен содержит i) аминокислотную последовательность LPXTG (SEQ ID №01, где X может быть любым аминокислотным остатком) в аминокислотной последовательности его С-концевой области (т.е. среди двадцати С-концевых аминокислотных остатков) и ii) сигнал удерживания в эндоплазматическом ретикулуме KDEL (SEQ ID №02) на его С-конце, а второй полипептидный домен содержит олигоглицин Gm (m=2, или 3, или 4, или 5) на его N-конце.
В одном воплощении второй полипептидный домен или вторая связывающая группировка содержат олигоглициновую Gm (m=2, или 3, или 4, или 5) аминокислотную последовательность на своем N-конце.
В одном воплощении Fc-область человеческого антитела относится или к человеческому lgG1-подклассу, или к человеческому lgG2-подклассу, или к человеческому lgG3-подклассу, или к человеческому lgG4-подклассу.
В одном воплощении Fc-область антитела представляет собой Fc-область человеческого антитела подкласса lgG1 или человеческого антитела подкласса lgG4.
В одном воплощении Fc-область человеческого антитела содержит мутацию природного аминокислотного остатка по меньшей мере в одной из следующих аминокислотных позиций: 228, 233, 234, 235, 236, 237, 297, 318, 320, 322, 329 и/или 331, с заменой другим остатком, где остатки в Fc-области антитела пронумерованы в соответствии с ЕС-индексом по Кабату.
В одном воплощении Fc-область человеческого антитела содержит мутацию природного аминокислотного остатка в позиции 329 и по меньшей мере еще одну мутацию по меньшей мере одного аминокислотного остатка, выбранного из группы, включающей аминокислотные остатки в позициях 228, 233, 234, 235, 236, 237, 297, 318, 320, 322 и 331, с заменой другим остатком, где остатки в Fc-области пронумерованы в соответствии с индексом ЕС по Кабату. Замена этих конкретных аминокислотных остатков приводит к изменению эффекторной функции Fc-области по сравнению с немодифицированной Fc-областью (дикого типа).
В одном воплощении Fc-область человеческого антитела имеет сниженную аффинность к FcγRIIIA и/или FcγRIIA и/или FcγRI по сравнению с конъюгатом, содержащим соответствующую Fc-область IgG дикого типа.
В одном воплощении аминокислотный остаток в позиции 329 Fc-области человеческого антитела замещен или на глицин, или на аргинин, или на аминокислотный остаток, достаточно большой, чтобы разрушить «пролиновый сэндвич» в Fc-области.
В одном воплощении мутация природного аминокислотного остатка в Fc-области человеческого антитела является по меньшей мере одной из S228P, Е233Р, L234A, L235A, L235E, N297A, N297D, P329G и/или P331S.
В одном воплощении мутация представляет собой L234A и L235A, если Fc-область антитела относится к человеческому lgG1-подклассу, или S228P и L235E, если Fc-область антитела относится к человеческому lgG4-подклассу.
В одном воплощении Fc-область антитела содержит мутацию P329G.
В одном воплощении Fc-область антитела содержит мутацию T366W в полипептиде Fc-области первой тяжелой цепи и мутации T366S, L368A и Y407V в полипептиде Fc-области второй тяжелой цепи, где нумерация осуществляется в соответствии с индексом ЕС по Кабату.
В одном воплощении Fc-область антитела содержит мутацию S354C в полипептиде Fc-области первой тяжелой цепи и мутацию Y349C в полипептиде Fc-области второй тяжелой цепи.
В одном воплощении Fc-область антитела содержит, помимо мутации аминокислотного остатка пролина в позиции 329, по меньшей мере еще одно добавление, мутацию или делецию аминокислотного остатка в Fc-области, что коррелирует с повышенной стабильностью конъюгата Fc-области антитела.
В одном воплощении другое добавление, мутация или делеция аминокислотного остатка в Fc-области находится в позиции 228 и/или 235 в Fc-области, если Fc-область относится к подклассу lgG4. В одном воплощении аминокислотный остаток серин в позиции 228 и/или аминокислотный остаток лейцин в позиции 235 замещен другой аминокислотой. В одном воплощении конъюгат Fc-области антитела содержит остаток пролин в позиции 228 (мутация остатка серина в остаток пролин). В одном воплощении конъюгат Fc-области антитела содержит остаток глутаминовую кислоту в позиции 235 (мутация остатка лейцина а остаток глутаминовую кислоту).
В одном воплощении Fc-область содержит три аминокислотных мутации. В одном воплощении три аминокислотные мутации представляют собой мутации P329G, S228P и L235E (P329G SPLE).
В одном воплощении другое добавление, мутация или делеция аминокислотного остатка в Fc-области находится в позиции 234 и/или 235 в Fc-области, если Fc-область относится к подклассу lgG1. В одном воплощении аминокислотный остаток лейцин в позиции 234 и/или аминокислотный остаток лейцин в позиции 235 мутированы в другую аминокислоту.
В одном воплощении Fc-область содержит аминокислотную мутацию в позиции 234, где аминокислотный остаток лейцин мутирован в аминокислотный остаток аланин.
В одном воплощении Fc-область содержит аминокислотную мутацию в позиции 235, где аминокислотный остаток лейцин мутирован в аминокислотный остаток аланин.
В одном воплощении Fc-область содержит аминокислотную мутацию в позиции 329, где аминокислотный остаток пролин мутирован в аминокислотный остаток глицин, аминокислотную мутацию в позиции 234, где аминокислотный остаток лейцин мутирован в аминокислотный остаток аланин, и аминокислотную мутацию в позиции 235, где аминокислотный остаток лейцин мутирован в аминокислотный остаток аланин.
Варианты Fc-области с повышенной аффинностью к FcRn имеют более длинные периоды полужизни в сыворотке, и такие молекулы полезно применять в способах лечения млекопитающих, у которых желательно введение антитела или конъюгата Fc-области с долгим системным периодом полужизни, например, для лечения хронического заболевания или нарушения.
Конъюгаты Fc-области антитела со сниженной аффинностью связывания FcRn имеют короткий период полужизни в сыворотке, и такие молекулы полезно применять в способах лечения млекопитающих, у которых желательно меньшее системное время полужизни введенного конъюгата Fc-области антитела, например, чтобы избежать токсичных побочных эффектов, или для применения в диагностической визуализации in vivo. Гибридные полипептиды или конъюгаты Fc-области с пониженной аффинностью связывания FcRn с меньшей вероятностью проникают через плаценту и, таким образом, могут быть использованы в лечении заболеваний или расстройств у беременных женщин.
Fc-область с измененной аффинностью связывания FcRn в одном воплощении представляет собой Fc-область с изменением аминокислоты в одной или более чем одной из аминокислотных позиций 238, 252, 253, 254, 255, 256, 265, 272, 286, 288, 303, 305, 307, 309, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 386, 388, 400, 413, 415, 424, 433, 434, 435, 436, 439 и/или 447.
Fc-область в одном воплощении представляет собой Fc-область с изменением одной или более чем одной аминокислоты в аминокислотных позициях 252, 253, 254, 255, 288, 309, 386, 388, 400, 415, 433, 435, 436, 439 и/или 447.
Fc-область, которая демонстрирует повышенное связывание с FcRn, содержит в одном воплощении изменение одной или более чем одной аминокислоты в аминокислотных позициях 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 и/или 434.
В одном воплощении Fc-область представляет собой Fc-область подкласса lgG1 и включает аминокислотные мутации P329G и/или L234A и L235A.
В одном воплощении Fc-область представляет собой Fc-область подкласса lgG4 и включает аминокислотные мутации P329G и/или S228P и L235E.
В одном воплощении Fc-область антитела содержит мутацию T366W в полипептиде Fc-области первой тяжелой цепи и мутации T366S, L368A и Y407V в полипептиде Fc-области второй тяжелой цепи, где нумерация осуществляется в соответствии с индексом ЕС по Кабату.
В одном воплощении Fc-область антитела содержит мутацию S354C в полипептиде Fc-области первой тяжелой цепи и мутацию Y349C в полипептиде цепи Fc-области второй тяжелой цепи.
Ферментативная конъюгация с помощью сортазы А
Мультидоменный полипептид может быть получен in vivo с помощью фермента сортазы А.
Многие грамположительные бактерии используют сортазу для ковалентного заякоривания различных поверхностных белков, включая факторы вирулентности, в их клеточной стенке (пептидогликане). Сортазы являются ферментами, связанными с мембраной. Сортаза А золотистого стафилококка дикого типа (SrtA) представляет собой полипептид из 206 аминокислот с N-концевой трансмембранной областью. На первом этапе сортаза А распознает субстратные белки, которые содержат аминокислотную последовательность мотива LPXTG (SEQ ID №01), и расщепляет амидную связь между Thr и Gly с помощью Cys активного сайта. Эта реакция расщепления пептида приводит к образованию тиоэфирного промежуточного продукта на субстрате сортазы А. На втором этапе тиоэфирный ацил-ферментативный промежуточный продукт путем нуклеофильной атаки аминогруппы во втором полипептиде-субстрате, содержащем олигоглицин (соответствующий пентаглициновой единице пептидогликана в S. aureus), приводит к ковалентному связыванию белка клеточной стенки и к восстановлению сортазы А. В отсутствие олигоглициновых нуклеофилов ацил-ферментативный промежуточный продукт может быть гидролизован молекулой воды.
Опосредованное сортазой лигирование/конъюгация начали применяться для различных целей белковой инженерии и биоконъюгации. Эта новая методика дает возможность введения природных и синтетических функциональных групп в LPXTG-меченные рекомбинантные или химически синтезированные полипептиды. Примеры включают ковалентное присоединение олигоглицин-дериватизированных полимеров (например, ПЭГ), флуорофоров, витаминов (например, биотина и фолата), липидов, углеводов, нуклеиновых кислот, синтетических пептидов и белков (например, GFP), (Tsukiji, S. and Nagamune, Т., ChemBioChem 10 (2009) 787-798; Рорр, M.W.-L. and Ploegh, H.L., Angew. Chem. Int. Ed. 50 (2011) 5024-5032).
Было показано, что триглициновый и даже диглициновый мотив аминокислотного компонента является достаточным для SrtA-опосредованного этапа лигирования (Clancy, K.W., et al., Peptide Science 94 (2010) 385-396).
Для ферментативной конъюгации может быть использована растворимая усеченная сортаза А без трансмембранной области (SrtA; аминокислотные остатки 60-206 золотистого стафилококка SrtA) (Ton-That, Н., et al., Proc. Natl. Acad. Sci. USA 96 (1999) 12424-12429; llangovan, H., et al., Proc. Natl. Acad. Sci. USA 98 (2001)6056-6061).
Любой полипептидный домен, содержащий олигоглициновый мотив по меньшей мере на одном из его N-концов (Gm, m=2, или 3, или 4, или 5), может быть экспрессирован и очищен из супернатанта эукариотических клеток (например, клеток НЕК293, клеток СНО).
Связывающая группировка (например, одноцепочечный антигенсвязывающий полипептид, такой как scFv, scFab, или дарпин, или мультицепочечный антигенсвязывающий полипептид, такой как dsFv или Fab), содержащая мотив распознавания SrtA на С-конце одной полипептидной цепи, может быть экспрессирована и очищена из супернатанта эукариотических клеток (например, клеток НЕК293, клеток СНО).
Подход "Combimatrix"
Желательно совместить первую связывающую группировку, такую как Fab-фрагмент антитела, с другой специфически связывающейся группировкой, такой как второй Fab-фрагмент антитела или фрагмент антитела с одной ветвью, содержащий полноразмерную тяжелую цепь и родственную ей полноразмерную легкую цепь и связанный дисульфидным мостиком полипептид Fc-области тяжелой цепи. Кроме того, можно провести скрининг того, показывает ли первая связывающая группировка лучшие свойства при соединении ее с множеством различных других связывающих группировок. С помощью так называемого подхода Combimatrix простым способом можно нацелить множество комбинаций связывающих группировок. Следует отметить, что вторые связывающие группировки либо могут связываться с различными мишенями/эпитопами/антигенами, либо могут связываться с тем же антигеном, но с другими эпитопами, либо могут связываться с тем же эпитопом, но быть другими вариантами одной связывающей группировки (например, гуманизированными кандидатами).
В этом случае автоматизированная платформа может выполнять процесс. Подходящей является любая платформа, которая использует, например, 96-луночные планшеты или другие форматы с высокой пропускной способностью, например, пипетирующий робот Eppendorf epMotion 5075vac.
Вначале выполняют клонирование конструкций, кодирующих связывающие группировки. Плазмиды с нуклеиновыми кислотами, кодирующими связывающие группировки, обычно получают путем синтеза гена или ПЦР-аплификации, где С-концевая область закодированной связывающей группировки содержит сортазный мотив и сигнал удерживания в эндоплазматическом ретикулуме, а N-концевая область, соответственно, другой связывающей группировки содержит N-концевой олигоглициновый мотив, содержащий по меньшей мере два последовательных остатка глицина (диглицин). Плазмиды по отдельности переносят в отдельные лунки многолуночного планшета (может быть загружен целый планшет). После этого плазмиды расщепляют смесью рестрикционных ферментов, чтобы вырезать область, кодирующую связывающую группировку. Желательно разработать весь генный синтез и/или праймеры для ПЦР таким образом, чтобы для всех плазмид была необходима одинаковая смесь рестрикционных ферментов. Впоследствии, этап очистки дает очищенные фрагменты ДНК. Эти фрагменты лигируют в плазмидный остов, который был вырезан из акцепторного вектора той же смесью рестрикционных ферментов, что упомянута выше. Альтернативно, процедура клонирования может быть выполнена с помощью этапа SLIC-опосредованного клонирования. После лигирования автоматизированная платформа переносит все лигазные смеси в другой многолуночный планшет с компетентными клетками Е. coli (например, ТорЮ Multi Shot, Invitrogen) и выполняет реакцию трансформации. Клетки культивируют до нужной плотности. Из аликвоты культивационной смеси могут быть сделаны глицериновые стоки. Из культуры выделяют плазмиду (например, с помощью мини-набора для выделения плазмид (например, NucleoSpin 96 Plasmid, Macherey& Nagel)). Идентичность плазмиды проверяют путем расщепления аликвоты подходящей рестрикционной смесью и с помощью электрофореза в SDS-геле (например, E-Gel 48, Invitrogen). После этого в новый планшет может быть загружена аликвота плазмиды для проведения контрольной реакции секвенирования.
На следующем этапе экспрессируют связывающие группировки. Для этого клетки НЕК высевают в многолуночный планшет (например, 48-луночный планшет) и трансфицируют соответствующими комбинациями выделенных плазмид (содержащих области, кодирующие связывающие группировки, в соответствующих базовых векторах) вместе с плазмидой, кодирующей растворимую сортазу, несущую С-концевой сигнал эндоплазматического удерживания. Таким образом, НЕК-клетки совместно трансфицируют тремя экспрессионными плазмидами: i) плазмидой, кодирующей связывающую группировку, которая имеет С-концевую His-метку, сортазный мотив и сигнал эндоплазматического удерживания (в направлении с N-конца к С-концу), ii) плазмидой, кодирующей связывающую группировку, которая имеет N-концевой олигоглициновый мотив, содержащий по меньшей мере два остатка глицина, и iii) плазмидой, кодирующей растворимую сортазу, которая имеет С-концевой сигнал эндоплазматического удерживания. Трансфицированные клетки НЕК культивируют в течение нескольких дней и затем собирают культуральный супернатант (например, фильтрацией через фильтровальный планшет 1,2 мкм и 0,22 мкм с помощью вакуумной станции). Титры можно контролировать путем выполнения, например, ELISA.
Связывающие группировки ковалентно связывают друг с другом с помощью опосредованной сортазой реакции транспептидации в ходе экспрессии in vivo. Это достигается, поскольку связывающий домен, содержащий С-концевой мотив распознавания сортазы, содержит сигнал удерживания в эндоплазматическом ретикулуме. Используемая растворимая сортаза содержит такой же сигнал удерживания в эндоплазматическом ретикулуме на своем С-конце. Таким образом, обе молекулы практически полностью сохраняются в эндоплазматическом ретикулуме. После ввода второго полипептидного домена в эндоплазматический ретикулум происходит реакция ферментативной конъюгации, и ферментативный конъюгат, который лишен сигнала удерживания в эндоплазматическом ретикулуме, который удаляется при реакции ферментативной транспептидации, секретируется в культуральную среду. Конъюгаты могут быть собраны из культуральной среды с помощью процедуры отрицательной His-tag-селекции (культуральный супернатант вносят в планшеты His MultiTrap HP (GE Healthcare) и фильтруют, в результате чего все молекулы, которые содержат His-метку, связываются с матрицей (т.е. конъюгатами) и могут быть элюированы после промывания с помощью соответствующего элюирующего буфера, в то время как все другие молекулы не связываются с хроматографическим материалом.
Мультиспецифические связывающие молекулы сделаны с использованием подхода Combimatrix, см. таблицу ниже.

Лунки в первом столбце многолуночного планшета обозначают различные плазмиды, кодирующие первые связывающие группировки, содержащие С-концевой сортазный мотив (обозначены арабскими цифрами, например, от 1 до 11, в 96-луночном планшете). Лунки в первом ряду того же планшета обозначают плазмиды, кодирующие вторые связывающие группировки, содержащие олигоглицин на N-конце/в N-концевой области (за исключением первого ряда, обозначены буквами, например, от А до G). После этого все плазмиды из первого ряда, кодирующие первую связывающую группировку, объединяют со всеми плазмидами из первого столбца, кодирующими вторую связывающую группировку (например, получая 77 комбинаций в 96-луночном планшете), обозначая их комбинацией цифры и буквы (например, 1A-11G). Кроме того, во все лунки добавляют плазмиду, кодирующую сортазу. Все комбинации совместно трансфицируют в НЕК-клетки и затем экспрессируют и конъюгируют in vivo с помощью сортазы А, содержащей сигнал удерживания в эндоплазматическом ретикулуме. После выполнения ферментативной конъюгации in vivo может быть проведен дополнительный этап очистки. После этого мультиспецифические связывающие молекулы готовы к оценке в биохимических или клеточных анализах.
III. Рекомбинантные способы
Подходящие клетки-хозяева для клонирования и/или экспрессии/секреции векторов, кодирующих полипептиды, включают прокариотические или эукариотические клетки, описанные в данном документе: Например, полипептиды могут быть получены в бактериях, в частности, когда не нужны гликозилирование и Fc-эффекторные функции (см., например, US 5648237, US 5789199 и US 5840523, Charlton, Methods in Molecular Biology 248 (2003) 245-254 (B.K.C. Lo, (ed.), Humana Press, Totowa, NJ), где описывается экспрессия фрагментов антител в Е. coli). После экспрессии полипептид может быть выделен из массы бактериальных клеток в растворимой фракции или может быть выделен из нерастворимой фракции, так называемых телец включения, которые могут быть солюбилизированы, и полипептид может быть подвергнут рефолдингу для образования биоактивных форм. Также полипептид может быть далее очищен.
Помимо прокариотов, для векторов, кодирующих полипептиды, подходящими клонирующими или экспрессирующими хозяевами являются эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, включая штаммы грибов и дрожжей, у которых пути гликозилирования являются «гуманизированными», что приводит к продукции полипептида с частично или полностью человеческим характером гликозилирования (см. Gerngross, T.U., Nat. Biotech. 22 (2004) 1409-1414; и Li, Н. et al., Nat. Biotech. 24 (2006) 210-215).
Подходящие клетки-хозяева для экспрессии гликозилированных полипептидов также получают из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы, которые могут быть использованы в сочетании с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
Культуры растительных клеток также могут быть использованы в качестве хозяев (см., например, патенты США №№5959177, 6040498, 6420548, 7125978 и 6417429 (описывающие технологию PLANTIBODIES™ для получения антител в трансгенных растениях)).
Также в качестве хозяев могут быть использованы клетки позвоночных. Например, могут быть использованы клеточные линии млекопитающих, приспособленные к росту в суспензии. Другими примерами используемых клеточных линий-хозяев от млекопитающих являются клеточная линия COS-7 (клетки почки обезьяны CV1, трансформированные SV40); клеточная линия НЕК293 (человеческая эмбриональная почка); клеточная линия ВНК (почка детеныша хомяка); клеточная линия мышиных клеток Сертоли ТМ4 (ТМ4-клетки, описанные, например, в Mather, J.P., Biol. Reprod. 23 (1980) 243-251); клеточная линия CV1 (клетки почки обезьяны); клеточная линия VERO-76 (клетки почки африканской зеленой обезьяны); клеточная линия HELA (клетки человеческой карциномы шейки матки); клеточная линия MDCK (клетки почки собаки); клеточная линия BRL-3A (клетки печени крысы buffalo); клеточная линия W138 (клетки легких человека); клеточная линия Hep G2 (клетки печени человека); клеточная линия ММТ 060562 (клетки опухоли молочной железы мыши); клеточная линия TRI, описанная, например, в Mather, J.P. et al., Annals N.Y. Acad. Sci. 383 (1982) 44-68; клеточная линия MRC 5; и клеточная линия FS4. Другие используемые линии клеток-хозяев от млекопитающих включают клеточную линию СНО (клетки яичника китайского хомячка), в том числе клеточную линию DHFR-отрицательных СНО-клеток (Urlaub, G. et al., Proc. Natl. Acad. Sci. USA 77 (1980) 4216); и клеточные линии миеломы, такие как клеточные линии Y0, NS0 и Sp2/0. Обзор некоторых линий клеток-хозяев от млекопитающих, подходящих для продукции полипептидов, см., например, в Yazaki, and Wu, Methods in Molecular Biology, Antibody Engineering 248 (2004) 255-268 (B.K.C. Lo, (ed.), Humana Press, Totowa, NJ).
IV. Способы и композиции для диагностики и обнаружения
В некоторых воплощениях любые биспецифические антитела, представленные в данном документе, используются для обнаружения присутствия одного или обоих антигенов в биологическом образце. Термин «обнаружение», используемый в данном документе, включает количественное или качественное обнаружение. В некоторых воплощениях биологический образец содержит клетку или ткань, такую как биопсия раковых клеток.
В одном воплощении предложено биспецифическое антитело для применения в способе диагностики или обнаружения. В другом аспекте предложен способ обнаружения присутствия раковых клеток в биологическом образце. В некоторых воплощениях способ включает контактирование биологического образца с биспецифическим антителом, описанным в данном документе, в условиях, разрешающих связывание биспецифического антитела с его антигеном или антигенами, и обнаружение того, образуется ли комплекс между биспецифическим антителом и его антигеном или антигенами. Такой способ может быть способом in vitro или in vivo.
Примеры нарушений, которые могут быть диагностированы с использованием антитела изобретения, включают рак.
В некоторых воплощениях предложены меченые биспецифические антитела. Метки включают, но не ограничиваясь ими, метки или группировки, которые обнаруживаются непосредственно (такие как флуоресцентные, хромофорные, электронно-плотные, хемилюминесцентные и радиоактивные метки), а также группировки, такие как ферменты или лиганды, которые обнаруживаются косвенно, например, через ферментативную реакцию или молекулярное взаимодействие. Примеры меток включают, но не ограничиваясь ими, радиоизотопы32Р,14С,125I,3Н и131I, флуорофоры, такие как хелаты редкоземельных элементов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например люциферазу светлячка и бактериальную люциферазу (US 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, оксидазы сахаридов, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу, гетероциклические оксидазы, например уриказу и ксантиноксидазу, в сочетании с ферментом, который использует пероксид водорода для окисления предшественника метки, таким как HRP, лактопероксидазу или микропероксидазу, биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и т.п.
V. Фармацевтические составы
Фармацевтические составы биспецифического антитела, описанного в данном документе, получают путем смешивания такого антитела, имеющего требуемую степень чистоты, с одним или более чем одним возможным фармацевтически приемлемым носителем (Remington's Pharmaceutical Sciences, 16th edition, Osol, A. (ed.) (1980)), в виде лиофилизированных составов или водных растворов. Фармацевтически приемлемые носители, как правило, нетоксичны для реципиентов в используемых дозах и концентрациях и включают, но не ограничиваясь ими: буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецил диметилбензил аммония хлорид; гексаметония хлорид; бензалкония хлорид; бензетониума хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол, 3-пентанол и т-крезол); низкомолекулярные (менее чем примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). Типичные фармацевтически приемлемые носители в данном документе также включают дисперсные агенты промежуточных лекарственных средств, такие как растворимые нейтрально-активные гликопротеины гиалуронидазы (sHASEGP), например, человеческие растворимые РН-20 гликопротеины гиалуронидазы, такие как rhuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые типичные sHASEGP и способы применения, в том числе rhuPH20, описаны в US 2005/0260186 и US 2006/0104968. В одном аспекте sHASEGP комбинирован с одной или более чем одной дополнительной гликозамингликаназой, такой как хондроитиназа.
Типичные лиофилизированные составы антител описаны в US 6267958. Водные составы антител включают те, которые описаны в US 6171586 и WO 2006/044908, последние составы включают гистидин-ацетатный буфер.
Состав в данном документе может также содержать более одного активного ингредиента, если нужно для конкретных показаний при лечении, предпочтительно с дополняющими активностями, которые не влияют друг на друга. Такие активные ингредиенты предпочтительно присутствуют в комбинации в количествах, которые эффективны для данной цели.
Активные ингредиенты могут быть заключены в микрокапсулы, полученные, например, с помощью методик коацервации или путем межфазной полимеризации, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и полиметилметакрилатные микрокапсулы, соответственно, в коллоидных системах доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики раскрыты в Remington's Pharmaceutical Sciences, 16th edition, Osol, A. (ed.) (1980).
Могут быть изготовлены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, при этом матрицы находятся в виде формованных изделий, например пленок или микрокапсул.
Составы, используемые для введения in vivo, обычно являются стерильными. Стерильность может быть легко достигнута, например, путем фильтрации через стерилизующие фильтрационные мембраны.
VI. Терапевтические способы и композиции
Любое из биспецифических антител, представленных в данном документе, может быть использовано в терапевтических способах.
В одном аспекте предложено биспецифическое антитело для применения в качестве лекарственного средства. В других аспектах предложено биспецифическое антитело для применения в лечении рака. В некоторых воплощениях предложено биспецифическое антитело для применения в способе лечения. В некоторых воплощениях данное изобретение предлагает биспецифическое антитело для применения в способе лечения индивидуума, страдающего от рака, который включает введение индивидууму эффективного количества биспецифического антитела. В одном таком воплощении способ также включает введение индивидууму эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, описанного ниже. В других воплощениях изобретение предлагает биспецифическое антитело для применения в удалении/уничтожении/лизисе раковых клеток. В некоторых воплощениях данное изобретение предлагает биспецифическое антитело для применения в способе удаления/уничтожения/лизиса раковых клеток у индивидуума, включающем введение индивидууму эффективного количества биспецифического антитела для удаления/уничтожения/лизиса раковых клеток. «Индивидуум» в соответствии с любым из указанных выше воплощений может быть человеком.
В другом аспекте изобретение предлагает применение биспецифического антитела в производстве или изготовлении лекарственного средства. В одном воплощении лекарственное средство предназначено для лечения рака. В другом воплощении лекарственное средство предназначено для применения в способе лечения рака, включающем введение индивидууму, страдающему от рака, эффективного количества лекарственного средства. В одном таком воплощении способ также включает введение индивидууму эффективного количества по меньшей мере одного дополнительного терапевтического агента, например, описанного ниже. В другом воплощении лекарственное средство предназначено для удаления/уничтожения/лизиса раковых клеток. В другом воплощении лекарственное средство предназначено для применения в способе удаления/уничтожения/лизиса раковых клеток у индивидуума, включающем введение индивидууму эффективного количества лекарственного средства для удаления/уничтожения/лизиса раковых клеток. «Индивидуум» в соответствии с любым из указанных выше воплощений может быть человеком.
В другом аспекте данное изобретение предлагает способ лечения рака. В одном воплощении способ включает введение индивидууму, страдающему от рака эффективного количества биспецифического антитела. В одном таком воплощении способ также включает введение индивидууму эффективного количества по меньшей мере одного дополнительного терапевтического агента, описанного ниже. «Индивидуум» в соответствии с любым из указанных выше воплощений может быть человеком.
В другом аспекте изобретение предлагает способ удаления/уничтожения/лизиса раковых клеток у индивидуума. В одном воплощении способ включает введение индивидууму эффективного количества биспецифического антитела для удаления/уничтожения/лизиса раковых клеток. В одном воплощении "индивидуум" является человеком.
В другом аспекте изобретение предусматривает фармацевтические составы, содержащие любое из биспецифических антител, представленных в данном документе, например, для применения в любом из указанных выше терапевтических способов. В одном воплощении фармацевтический состав содержит любое из биспецифических антител, представленных в данном документе, и фармацевтически приемлемый носитель. В другом воплощении фармацевтический состав содержит любое из биспецифических антител, представленных в данном документе, и по меньшей мере один дополнительный терапевтический агент, например, описанный ниже.
Антитела изобретения могут быть использованы в терапии по отдельности или в комбинации с другими агентами. Например, антитело по изобретению может быть введено совместно по меньшей мере с одним дополнительным терапевтическим агентом. В некоторых воплощениях дополнительный терапевтический агент является цитотоксическим агентом или химиотерапевтическим агентом.
Такие комбинированные терапии, отмеченные выше, охватывают комбинированное введение (где два или более двух терапевтических агентов включены в одни и те же или отдельные составы), а также раздельное введение, и в этом случае введение антитела изобретения может происходить до, одновременно и/или после введения дополнительного терапевтического агента и/или адъюванта. Антитела изобретения также могут быть использованы в сочетании с лучевой терапией.
Антитело по изобретению (и любой дополнительный терапевтический агент) может быть введено с помощью любых подходящих средств, в том числе путем парентерального, внутрилегочного и интраназального, и, если желательно местное лечение, внутриочагового введения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное, внутрикожное или подкожное введение. Дозирование может быть осуществлено любым подходящим способом, например с помощью инъекций, таких как внутривенные или подкожные инъекции, частично в зависимости от того, является ли введение кратковременным или хроническим. В данном описании рассматриваются различные схемы дозировки, включая, но не ограничиваясь ими, одно или множество введений в различные временные точки, болюсное введение и импульсную инфузию.
Антитела по изобретению будут собраны в состав, дозированы и введены в соответствии с надлежащей медицинской практикой. Факторы, подлежащие рассмотрению в этом контексте, включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние отдельного пациента, причину нарушения, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам. Антитело не обязательно, но может быть собрано в состав с одним или более чем одним агентом, используемым в настоящее время для профилактики или лечения рассматриваемого нарушения. Эффективное количество таких других агентов зависит от количества антитела, присутствующего в составе, от типа заболевания или лечения и от других факторов, описанных выше. Как правило, они используются в тех же дозах и с теми же путями введения, которые описаны в данном документе, или в дозировках от 1 до 99% от описанных в данном документе, или в любой дозировке и любым путем, который является эмпирически/клинически подходящим.
Для профилактики или лечения заболевания подходящая доза антитела изобретения (при использовании его отдельно или в сочетании с одним или более чем одним другим дополнительным терапевтическим агентом) будет зависеть от типа заболевания, подлежащего лечению, от типа антитела, тяжести и течения заболевания, от того, вводят ли антитело с профилактической или терапевтической целью, от предыдущей терапии, истории болезни пациента и ответа на антитело, а также по усмотрению лечащего врача. Антитело вводят пациенту подходящим образом одномоментно или серийно. В зависимости от типа и тяжести заболевания изначальной кандидатной дозировкой антитела для введения пациенту может быть дозировка от примерно 1 мкг/кг до 15 мг/кг (например, от 0,5 мг/кг до 10 мг/кг) в зависимости, например, от того, вводится ли оно в ходе одного или нескольких отдельных введений или путем непрерывной инфузии. Одна из типичных суточных доз может варьировать от примерно 1 мкг/кг до 100 мг/кг или более в зависимости от указанных выше факторов. В случае повторных введений в течение нескольких дней или дольше в зависимости от состояния, как правило, лечение может быть продолжено до необходимого подавления симптомов заболевания. Один из примеров дозировки антитела будет находиться в диапазоне от примерно 0,05 мг/кг до примерно 10 мг/кг. Таким образом, пациенту может быть введена одна или более чем одна доза примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любая их комбинация). Такие дозы можно вводить периодически, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал от примерно двух до примерно двадцати или, например, примерно шесть доз антитела). Может быть введена первоначальная более высокая нагрузочная доза с последующими одной или более чем одной сниженной дозой. Тем не менее, могут использоваться и другие режимы дозирования. Ход этого лечения легко контролировать с помощью обычных методик и анализов.
Понятно, что любой из вышеуказанных составов или терапевтических способов может быть осуществлен с использованием иммуноконъюгата изобретения вместо или в дополнение к биспецифическому антителу.
VII. Продукт производства
В другом аспекте данного изобретения предусматривается продукт производства, содержащий материалы, используемые для лечения, профилактики и/или диагностики нарушений, описанных выше. Продукт производства содержит контейнер и этикетку или листок-вкладыш, вложенный или прикрепленный к контейнеру. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы, пакеты для внутривенно вводимых растворов и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, которая сама по себе или в сочетании с другой композицией эффективна для лечения, профилактики и/или диагностики состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет для внутривенно вводимого раствора или флакон с пробкой, прокалываемой иглой для подкожной инъекции). По меньшей мере один активный агент в композиции представляет собой антитело изобретения. На этикетке или вкладыше в упаковку указывается, что композиция используется для лечения выбранного состояния. Кроме того, изделие может включать: (а) первый контейнер с композицией, содержащейся в нем, где композиция содержит антитело изобретения; и (b) второй контейнер с композицией, содержащейся в нем, где композиция содержит дополнительный цитотоксический или другой терапевтический агент. Продукт производства в этом воплощении изобретения также может содержать вкладыш в упаковку, указывающий, что композиции могут быть использованы для лечения конкретного состояния. Альтернативно или дополнительно изделие может также включать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, например, бактериостатическую воду для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Он может также включать другие материалы, желательные с коммерческой и потребительской точки зрения, в том числе другие буферы, разбавители, фильтры, иглы и шприцы.
Понятно, что любой из указанных выше продуктов производства может включать иммуноконъюгат изобретения вместо или в дополнение к биспецифическому антителу.
Примеры
Ниже приведены примеры способов и композиций изобретения. Понятно, что на практике могут применяться различные другие воплощения, учитывая общее описание, данное выше.
Хотя предшествующее изобретение было описано в некоторых деталях с целью иллюстрации и примера в целях ясности понимания, описания и примеры не должны быть истолкованы как ограничивающие объем изобретения.
Материалы и методы
Методики рекомбинантной ДНК
Для манипуляций с ДНК были использованы стандартные способы, описанные в Sambrook, J., et al., Molecular cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Молекулярно-биологические реагенты использовали в соответствии с инструкциями изготовителя.
Генный и олигонуклеотидный синтез
Нужные генные сегменты получали путем химического синтеза на Geneart GmbH (Регенсбург, Германия). Синтезированные фрагменты генов клонировали в плазмиду для размножения/амплификации в Е. coli. Последовательности ДНК субклонированных фрагментов гена подтверждали секвенированием ДНК. Альтернативно, короткие синтетические фрагменты ДНК собирали путем отжига химически синтезированных олигонуклеотидов или с помощью ПЦР. Соответствующие олигонуклеотиды получали с помощью Metabion GmbH (Planegg-Martinsried, Германия)
Определение белка
Белковую концентрацию очищенных полипептидов оценивали путем определения оптической плотности (OD) при 280 нм с использованием молярного коэффициента экстинкции, рассчитанного на основании аминокислотной последовательности полипептида.
Пример 1
Создание плазмид для экспрессии антител и фрагментов антител, включающих одноцепочечные Fab-фрагменты антител
Нужные белки экспрессировали путем временной трансфекции эмбриональных клеток почек человека (НЕК 293). Для экспрессии нужного гена/белка (например, полноразмерной тяжелой цепи антитела, полноразмерной легкой цепи антитела, scFab-фрагментов или Fc-цепи, содержащей олигоглицин на ее N-конце) был использован транскрипционный блок, включающий следующие функциональные элементы:
- немедленно-ранний энхансер и промотор цитомегаловируса человека (P-CMV), включая интрон А,
- 5'-нетранслируемую область тяжелой цепи человеческого иммуноглобулина (5'-UTR),
- сигнальную последовательность тяжелой цепи мышиного иммуноглобулина (SS),
- ген/белок, который нужно экспрессировать, и
- последовательность полиаденилирования бычьего гормона роста (BGH рА).
Помимо экспрессионного блока/кассеты, содержащей нужный ген, который должен быть экспрессирован, основная/стандартная плазмида для экспрессии в клетках млекопитающих включает:
- сайт начала репликации из вектора pUC18, который разрешает репликацию этой плазмиды в Е. coli, и
- ген β-лактамазы, который придает устойчивость к ампициллину в Е. coli.
а) Создание плазмиды для экспрессии одноцепочечного Fab-фрагмента (scFab) с С-концевой His-меткой. сортазным мотивом и сигналом удерживания в ER
Гибридный ген, кодирующий scFab, содержащий С-концевую His-метку, за которой следует мотив распознавания сортазы и сигнала эндоплазматического удерживания (ER), был собран путем слияния фрагмента ДНК, кодирующего соответствующие элементы последовательности (His6-Tag (НННННН, SEQ ID №07), сортазный мотив (LPETGGS, SEQ ID №28) и сигнал удерживания ER (KDEL, SEQ ID №02), отделенные друг от коротким элементом с последовательностью GS (GSHHHHHHGSLPETGGSKDEL (SEQ ID №29)), с химерной крысиной/человеческой одноцепочечной Fab-молекулой (Vкаппа-huСкаппа-линкер-Vтяж-huCH1).
Экспрессионная плазмида для временной экспрессии в клетках НЕК293 гибридного белка, включающего scFab-фрагмент с С-концевой His-меткой, сортазным мотивом и сигналом удерживания в ER, содержала, помимо scFab-фрагмента с С-концевой His-меткой, сортазным мотивом и сигналом удерживания в ER, экспрессионную кассету, сайт начала репликации из вектора pUC18, который разрешает репликацию этой плазмиды в Е. coli, и ген бета-лактамазы, который придает устойчивость к ампициллину в Е. coli. Транскрипционный блок гибридного гена, включающего scFab-фрагмент с С-концевой His-меткой, сортазным мотивом и сигналом удерживания в ER, содержит следующие функциональные элементы:
- немедленно-ранний энхансер и промотор цитомегаловируса человека (P-CMV), включая интрон А,
- 5'-нетранслируемую область тяжелой цепи человеческого иммуноглобулина (5'-UTR),
- сигнальную последовательность тяжелой цепи мышиного иммуноглобулина,
- нуклеиновую кислоту, кодирующую scFab (Vкаппа-huСкаппа-линкер-Vтяж-huCH1),
- нуклеиновую кислоту, кодирующую His-метку,
- нуклеиновую кислоту, кодирующую мотив распознавания сортазы,
- нуклеиновую кислоту, кодирующую сигнал удерживания в ER, и
- последовательность полиаденилирования бычьего гормона роста (BGH рА).
Аминокислотная последовательность зрелого scFab-фрагмента антитела против рецептора трансферрина 3D8 с С-концевой His-меткой, сортазным мотивом и сигналом удерживания в ER представляет собой


b) Создание плазмиды для экспрессии одноцепочечного Fab-фрагмента (scFab) с N-концевым мотивом глицин-серин
Гибридный ген scFab, содержащий N-концевой мотив глицин-серин, был собран путем слияния фрагмента ДНК, кодирующего соответствующий элемент последовательности ((G4S)2, SEQ ID №31), с химерной крысиной/человеческой одноцепочечной Fab-молекулой (Vкаппа-huСкаппа-линкер-Vтяж-huCH1).
Экспрессионная плазмида для временной экспрессии в клетках НЕК293 scFab-фрагмента с N-концевым мотивом глицин-серин содержала, помимо scFab-фрагмента с N-концевым мотивом глицин-серин, экспрессионную кассету, сайт начала репликации из вектора pUC18, который разрешает репликацию этой плазмиды в Е. coli, и ген бета-лактамазы, который придает устойчивость к ампициллину в Е. coli. Транскрипционный блок гибридного гена, включающего scFab-фрагмент с N-концевым мотивом глицин-серин, содержит следующие функциональные элементы:
- немедленно-ранний энхансер и промотор цитомегаловируса человека (P-CMV), включая интрон А,
- 5'-нетранслируемую область тяжелой цепи человеческого иммуноглобулина (5'-UTR),
- сигнальную последовательность тяжелой цепи мышиного иммуноглобулина,
- нуклеиновую кислоту, кодирующую мотив (G4S)2,
- нуклеиновую кислоту, кодирующую scFab (Vкаппа-huСкаппа-линкер-Vтяж-huCH1),и
- последовательность полиаденилирования бычьего гормона роста (BGH рА).
Аминокислотная последовательность зрелого scFab-фрагмента антитела против рецептора трансферрина 3D8 с N-концевым мотивом глицин-серин представляет собой


с) Создание плазмиды для экспрессии фрагмента Fc-области антитела (FC) с N-концевым триглициновым мотивом
Гибридный ген FC, содержащий N-концевой триглициновый мотив, был собран путем слияния фрагмента ДНК, кодирующего соответствующий элемент последовательности (GGG, SEQ ID №33), с молекулой Fc-области тяжелой цепи человеческого антитела.
Экспрессионная плазмида для временной экспрессии в клетках НЕК293 фрагмента Fc-области антитела с N-концевым триглициновым мотивом содержала, помимо Fc-области тяжелой цепи антитела с N-концевым триглициновым мотивом, экспрессионную кассету, сайт начала репликации из вектора pUC18, который разрешает репликацию этой плазмиды в Е. coli, и ген бета-лактамазы, который придает устойчивость к ампициллину в Е. coli. Транскрипционный блок гибридного гена, включающего фрагмент Fc-области антитела (FC) с N-концевым триглициновым мотивом, включает следующие функциональные элементы:
- немедленно-ранний энхансер и промотор цитомегаловируса человека (P-CMV), включая интрон А,
- 5'-нетранслируемую область тяжелой цепи человеческого иммуноглобулина (5'-UTR),
- сигнальную последовательность тяжелой цепи мышиного иммуноглобулина,
- нуклеиновую кислоту, кодирующую GGG,
- нуклеиновую кислоту, кодирующую Fc-область, и
- последовательность полиаденилирования бычьего гормона роста (BGH рА).
Аминокислотная последовательность зрелого фрагмента Fc-области антитела с N-концевым триглициновым мотивом представляет собой

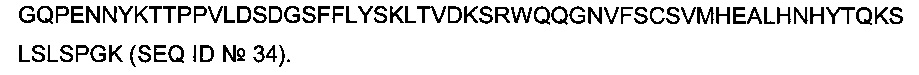
d) Плазмида для экспрессии тяжелых и легких цепей антитела
Экспрессионные плазмиды, кодирующие следующие полипептиды/белки, были построены в соответствии со способами, описанными ранее:
- вариабельный домен тяжелой цепи пертузумаба объединяли с константной областью тяжелой цепи человеческого подкласса lgG1, содержащего мутацию T366W:

- вариабельный домен легкой цепи пертузумаба объединяли с константной областью человеческой легкой каппа-цепи:
DIQMTQSPSSLSASVGDRVTITCKASQDVSIGVAWYQQKPGKAPKLLIYSASY RYTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYIYPYTFGQGTKVEIKRTVA APSVFIFPPSDEQLKSGTASWCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDS KDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID №36).
- вариабельный домен тяжелой цепи трастузумаба объединяли с константной областью тяжелой цепи человеческого подкласса lgG1, содержащего мутации T366S, L368A и Y407V:

- вариабельный домен легкой цепи трастузумаба объединяли с константной областью человеческой легкой каппа-цепи:

- VH-CH1-фрагмент антитела, содержащий вариабельный домен тяжелой цепи пертузумаба и человеческую константную область тяжелой цепи 1 (СН1) подкласса lgG1, содержащую С-концевую аминокислотную последовательность GGGSHHHHHHGSLPETGGSKDEL:

- VH-CH1-фрагмент антитела, содержащий вариабельный домен тяжелой цепи пертузумаба и человеческую константную область тяжелой цепи 1 (СН1) подкласса lgG1, содержащую С-концевую последовательность

- VH-CH1-фрагмент антитела, содержащий вариабельный домен тяжелой цепи пертузумаба и человеческую константную область тяжелой цепи 1 (СН1) подкласса lgG1, содержащую С-концевую последовательность

- VH-CH1-фрагмент антитела, содержащий вариабельный домен тяжелой цепи трастузумаба и человеческую константную область тяжелой цепи 1 (СН1) подкласса lgG1, содержащую С-концевую последовательность


- VH-CH1-фрагмент антитела, содержащий вариабельный домен тяжелой цепи трастузумаба и человеческую константную область тяжелой цепи 1 (СН1) подкласса lgG1, содержащую С-концевую последовательность

- VH-CH1-фрагмент антитела, содержащий вариабельный домен тяжелой цепи трастузумаба и человеческую константную область тяжелой цепи 1 (СН1) подкласса lgG1, содержащую С-концевую последовательность

- полипептид Fc-области тяжелой цепи (человеческий lgG1 (СН2-СН3)) с мутациями T366S, L368A и Y407V, содержащий N-концевую последовательность GGGDKTHTCPPC:

- полипептид, Fc-области тяжелой цепи (человеческий lgG1 (СН2-СН3)) с мутациями T366S, L368A и Y407V, содержащий N-концевую последовательность GGHTCPPC:


- полипептид Fc-области тяжелой цепи (человеческий lgG1 (СН2-СН3)) с мутациями T366S, L368A и Y407V, содержащий N-концевую последовательность GGCPPC:

- полипептид Fc-области тяжелой цепи (человеческий lgG1 (СН2-СНЗ)) с мутацией T366S, содержащий N-концевую последовательность

- полипептид Fc-области тяжелой цепи (человеческий lgG1 (СН2-СНЗ)) с мутацией T366S, содержащий N-концевую последовательность

- полипептид Fc-области тяжелой цепи (человеческий lgG1 (СН2-СН3)) с мутацией T366S, содержащий N-концевую последовательность GGCPPC:

Пример 2
Создание плазмиды для экспрессии растворимой сортазы А от S. aureus с С-концевым сигналом удерживания в ER
Гибридный ген сортазы, содержащий С-концевой сигнал удерживания в ER, был собран путем слияния фрагмента ДНК, кодирующего сигнал удерживания в ER (KDEL), с усеченной с N-конца молекулой сортазы А золотистого стафилококка (60-206) (SrtA-KDEL).
Экспрессионная плазмида для временной экспрессии в клетках НЕК293 растворимой сортазы с сигналом удерживания в ER содержала, помимо растворимой сортазы с сигналом удерживания в ER, экспрессионную кассету, сайт начала репликации из вектора pUC18, который разрешает репликацию этой плазмиды в Е. coli, и ген бета-лактамазы, который придает устойчивость к ампициллину в Е. coli. Транскрипционный блок растворимой сортазы с сигналом удерживания в ER включает следующие функциональные элементы:
- немедленно-ранний энхансер и промотор цитомегаловируса человека (P-CMV), включая интрон А,
- 5'-нетранслируемую область тяжелой цепи человеческого иммуноглобулина (5'-UTR),
- сигнальную последовательность тяжелой цепи мышиного иммуноглобулина,
- нуклеиновую кислоту, кодирующую усеченную с N-конца сортазу А от S. aureus,
- нуклеиновую кислоту, кодирующую сигнал удерживания в ER, и
- последовательность полиаденилирования бычьего гормона роста (BGH рА).
Так как С-концевой аминокислотный остаток усеченной с N-конца сортазы А от S. aureus уже является лизином (К), то для образования функционального сигнала удерживания в ER (KDEL) с С-концом фермента должна быть слита только аминокислотная последовательность DEL.
Аминокислотная последовательность зрелой растворимой сортазы с сигналом удерживания в ER (KDEL) представляет собой
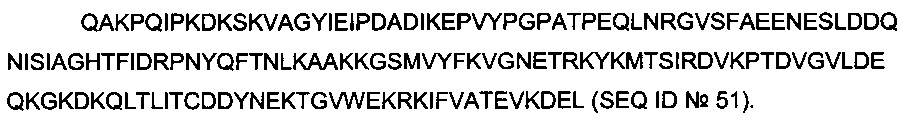
Аминокислотная последовательность зрелой растворимой сортазы с сигналом удерживания в эндоплазматическом ретикулуме GSKDEL представляет собой

Пример 3
Временная экспрессия, очистка и аналитическая характеризация конъюгатов, полученных in vivo путем опосредованной сортазой транспептидации
Конъюгаты получали in vivo во временно трансфицированных клетках НЕК293 (полученные из человеческой линии эмбриональных клеток почки 293), культивируемых в среде F17 (Invitrogen Corp.). Для трансфекции использовали трансфекционный реагент "293-Free" (Novagen). Молекулы scFab, удлиненные с N- и С-конца, как описано выше, а также растворимую сортазу экспрессировали в отдельных экспрессионных плазмидах. Трансфекцию выполняли, как указано в инструкциях изготовителя. Клеточные культуральные супернатанты, содержащие гибридный белок, собирали с третьего по седьмой (3-7) дни после трансфекции. Супернатанты хранили при пониженной температуре (например, -80°С) до очистки.
Общая информация касательно рекомбинантной экспрессии человеческих иммуноглобулинов, например, в клетках НЕК293, приведена в: Meissner, P. et al., Biotechnol. Bioeng. 75 (2001) 197-203.
Культуральные супернатанты фильтровали и затем очищали путем аффинной хроматографии с Ni2+-ионами. Секретированные белки, содержащие His-метку, захватывали путем аффинной хроматографии с помощью Ni Sepharose™ High Performance His-Trap HP (GE Healthcare). Несвязанные белки удаляли путем промывания 10 мМ Tris-буфером, рН 7,5, содержащим 500 мМ NaCl и 30 мМ имидазола. Связанные белки, содержащие His-метку, элюировали 10 мМ Tris-буфером, рН 7,5, содержащим 500 мМ NaCl и 500 мМ имидазола. Эксклюзионную хроматографию на Superdex 200™ (GE Healthcare) использовали в качестве второго этапа очистки. Эксклюзионную хроматографию проводили в 20 мМ гистидиновом буфере, 0,14 М NaCl, рН 6,0. Восстановленные белки диализовали в 10 мМ гистидиновом буфере, рН 6,0, содержащем 140 мМ NaCl, и хранили при -80°С.
Концентрацию белков определяли путем измерения оптической плотности (OD) при 280 нм с использованием молярного коэффициента экстинкции, рассчитанного на основании аминокислотной последовательности. Чистоту анализировали с помощью SDS-PAGE в присутствии и в отсутствие восстанавливающего агента (5 мМ 1,4-дитиотретитола) и окрашивания Кумасси. Общее содержание Fc-гибридных белковых препаратов определяли путем высокоэффективной SEC с использованием аналитической эксклюзионной колонки SK3000SWx1 (Tosohaas, Штутгарт, Германия). Целостность аминокислотного остова восстановленных Fc-гибридных белков проверяли с помощью масс-спектрометрии Nano Electrospray QTOF после удаления N-гликанов путем ферментативной обработки пептид-N-гликозидазой F (Roche Applied Science).
Реферат
Изобретение относится к биохимии. Предложен способ получения мультиспецифической связывающей молекулы, содержащей по меньшей мере две связывающих группировки, такой как антитело, где способ включает культивирование клетки, содержащей нуклеиновую кислоту, кодирующую растворимую сортазу А из S. aureus с С-концевым сигналом удерживания в эндоплазматическом ретикулуме, нуклеиновую кислоту, кодирующую первую связывающую группировку, содержащую на ее С-конце сортазный мотив, за которым следует сигнал удерживания в эндоплазматическом ретикулуме, и нуклеиновую кислоту, кодирующую вторую связывающую группировку, содержащую на ее N-конце по меньшей мере диглицин. Указанная клетка секретирует опосредованный сортазой А конъюгат первой связывающей группировки и второй связывающей группировки. Данное изобретение обеспечивает фермент-катализируемое получение мультиспецифической связывающей молекулы и может найти дальнейшее применение, в частности, для быстрого создания библиотек таких связывающих молекул. 6 з.п. ф-лы, 4 ил., 1 табл., 3 пр.

Комментарии