Способ усовершенствования процесса удаления вирусов при очистке белков - RU2573894C2
Код документа: RU2573894C2
Чертежи
Описание
Уровень техники
Область изобретения
Настоящее изобретение относится к области очистки белков. В частности, настоящее изобретение относится к способам повышения производительности вирусных фильтров путем комплексного применения удаления эндотоксинов и катионообменных сред в процессе подготовки к фильтрации.
Описание уровня техники в данной области
Линии клеток млекопитающих заняли основное место среди используемых продуцентов терапевтических средств на основе рекомбинантных белков вследствие их способности правильно осуществлять укладку белка и посттрансляционную модификацию, например, гликозилирование (Chu and Robinson Current Opinion in Biotechnology 12: 180-187, 2001). В то же время известно, что эти клетки содержат ретровирус-подобные частицы (Lieber et al. Science 182: 56-59, 1973; Lubiniecki et al. Dev Biol Stand 70: 187-191, 1989), и их использование сопряжено с риском возможного загрязнения посторонними вирусами (Gamick, Dev Biol Stand. Basel: Karger 93: 21-29, 1998). Хотя биофармацевтическая промышленность, производящая лекарственные средства на основе рекомбинантных белков, характеризуется хорошими показателями безопасности, в. прошлом были случаи вирусного заражения крови и продуктов на основе плазмы крови (Brown, Dev. Biol. Stand. 81, 1993; Thomas, Lancet 343: 1583-1584, 1994). Для уменьшения риска вирусного загрязнения во время производства рекомбинантных белков, в последующие процессы очистки включают стадии процессов, удаляющих эндогенные и посторонние вирусы. Очистка от вирусов в соответствии с требованиями достигается за счет комбинирования нескольких этапов процесса, обеспечивающих либо инактивацию вируса, либо удаление вируса из потока поступающего материала. В то время как инактивация вирусов достигается с помощью таких способов, как инкубирование при низких значениях pH, температурная обработка и обработка детергентами, удаление вирусов обычно осуществляют с помощью хроматографии и фильтрации (Curtis et al., Biotechnology and Bioengineering 84(2): 179-186, 2003).
В отличие от хроматографических сред, которые удаляют вирусы на основе таких физико-химических свойств, как суммарный заряд, фильтрация вирусов удаляет вирусы за счет исключения по размеру и поэтому считается более надежной методикой. На сегодняшний день фильтрация вирусов в процессе дальнейшей очистки биотерапевтических средств, получаемых из культур клеток млекопитающих, ограничена удалением ретровирусов (диаметром 80-100 нм) вследствие отсутствия мембран с высокой пропускной способностью и номинальным размером пор менее 60 нм.
Последние достижения в технологии мембран сделали возможным производство мембран с высокой пропускной способностью и номинальным размером пор около 20 нм. Эти вирусные фильтры удерживают парвовирусы (диаметром 18-26 нм) и пропускают белки размером до 160 кДа (~8 нм), например, моноклональные антитела (mAb).
Высокой селективности и высокой пропускной способности фильтров парвовирусов достигают путем наложения тонкого удерживающего мембранного слоя на микропористую подложку. Этот тонкий удерживающий слой позволяет осуществлять очень точное разделение белков и вирусов, и в то же время чувствителен к засорению примесями, присутствующими в потоке поступающего материала, приводящему к снижению производительности фильтра и потока. Засорение вирусных фильтров связано с такими загрязнителями, как белковые агрегаты и денатурированный белок. Bohonak и Zydney (Bohonak and Zydney, Journal of Membrane Science 254(1-2): 71-79, 2005) показали, что потеря производительности фильтра может быть обусловлена образованием осадка на фильтре или закупоркой пор. Другие современные публикации (Bolton et al., Biotechnol. Appl. Biochem. 43: 55-63, 2006; Levy et al., Filtration in the Biopharamaceutical Industry. (Meltzer, Т.Н. and Jomitz, M.W., eds.) pp.619-646, Marcel Dekker, New York, 1998) посвящены возможной причине засорения фильтров - адсорбции примесей на стенках пор. В нескольких публикациях (Bolton et al., Biotechnology and Applied Biochemistry 42: 133-142, 2005; Hirasaki et al., Polymer Journal 26(11): 1244-1256, 1994; Omar and Kempt, Transfusion 42(8): 1005-1010, 2002) также продемонстрировано, что понижение производительности фильтра или закупорка пор может снижать удерживание вирусов на несколько порядков величины, влияя на надежность типового технологического процесса.
Таким образом, значительное количество современных исследований сфокусировано на подыскании предварительных фильтров для удаления засоряющих примесей из потока поступающего материала для минимизации засорения вирусного фильтра и обеспечения высокой производительности, пропускной способности и надежного удерживания вирусов. Bolton et al. (Bolton et al. 2006) выполнили тщательное исследование, включавшее тестирование нескольких мембран в качестве предварительных фильтров и продемонстрировало, что за счет использования глубинного фильтра Viresolve™ в качестве предварительного фильтра можно увеличить производительность мембран по отношению к парвовирусам при нормальном потоке (NFP) почти на порядок. Brown et al. (Brown et al. 2008, Use of Charged Membranes to Identify Soluble Protein Foulants in order to Facilitate Parvovirus Filtration. IBC's 20th Antibody Development and Production, San Diego, CA) выполнили оценку сильного катионообменного мембранного адсорбера в качестве предварительного фильтра перед фильтром, удерживающим парвовирусы, и показали, что производительность вирусного фильтра можно повысить в несколько раз для 11 различных потоков mAb. Авторы предложили гипотезу, что катионообменный мембранный адсорбер удалял высокомолекулярные (~600-1500 кДа) белковые агрегаты из поступающего потока за счет конкурентной адсорбции, предотвращая засорение вирусного фильтра. В патенте США №7,118,675 (Siwak et al.) описан процесс, использующий заряженные мембраны для удаления белковых агрегатов из раствора белка с целью предотвращения засорения вирусного фильтра.
Краткое описание изобретения
Настоящее изобретение, по меньшей мере, частично основано на экспериментально полученных данных о том, что засорение парвовирусных фильтров может вызываться примесями, не упоминавшимися в литературе, и для улучшения производительности фильтрации вирусов требуются более совершенные решения в области предварительной фильтрации. Соответственно, настоящее изобретение представляет новое решение в области предварительной фильтрации, значительно превосходящее по функциональности лучшие подходы в области предварительной фильтрации, описанные в литературе (катионообменные мембранные адсорберы).
В одном из аспектов, настоящее изобретение относится к способу улучшения производительности вирусного фильтра во время очистки белков, включающему обработку композиции, содержащей белок, подлежащий очистке, на стадии катионного обмена и на стадии удаления эндотоксинов (в любом порядке), перед пропусканием через указанный вирусный фильтр.
В одном из вариантов реализации, диаметр пор вирусного фильтра составляет от приблизительно 15 до приблизительно 100 нм.
В еще одном из вариантов реализации, диаметр пор вирусного фильтра составляет от приблизительно 15 до приблизительно 30 нм.
В еще одном из вариантов реализации, размер пор вирусного фильтра составляет приблизительно 20 нм.
В одном из дальнейших вариантов реализации, вирус, подлежащий удалению, является парвовирусом.
В еще одном из дальнейших вариантов реализации, диаметр парвовируса составляет от приблизительно 18 до приблизительно 26 нм.
В другом варианте реализации, белок представляет собой антитело или фрагмент антитела, например, антитело, полученное с использованием технологий рекомбинантных ДНК, или его фрагмент.
В еще одном варианте реализации, антитело является терапевтическим антителом.
В еще одном варианте реализации, рекомбинантное антитело или фрагмент антитела продуцируют в клетке-хозяине млекопитающего, например, клетке яичника китайского хомячка (СНО).
В одном из дальнейших вариантов реализации, композицию, содержащую белок, подлежащий очистке, перед фильтрацией вирусов вначале подвергают обработке на стадии катионного обмена, а затем - на стадии удаления эндотоксинов.
В еще одном из дальнейших вариантов реализации, композицию, содержащую белок, подлежащий очистке, перед фильтрацией вирусов вначале подвергают обработке на стадии удаления эндотоксинов, а затем - на стадии катионного обмена.
В еще одном из вариантов реализации, композицию, содержащую белок, подлежащий очистке, перед фильтрацией вирусов одновременно подвергают обработке на стадии катионного обмена и удаления эндотоксинов путем совместного содержания этих двух материалов в одном модуле.
В еще одном варианте реализации, фильтрацию вирусов осуществляют сразу после стадии удаления эндотоксинов.
В одном из дальнейших вариантов реализации, фильтрацию вирусов осуществляют сразу после стадии катионного обмена.
В другом варианте реализации, фильтрацию вирусов осуществляют при значениях pH между приблизительно 4 и приблизительно 10.
В еще одном варианте реализации, концентрация белка, подлежащего очистке, в композиции составляет приблизительно 1-40 г/л.
В еще одном варианте реализации, антитело, подлежащее очистке, представляет собой антитело к одному или нескольким антигенам, выбираемым из группы, состоящей из HER1 (EGFR), HER2, HER3, HER4, VEGF, CD20, CD22, CD11a, CD11b, CD11c, CD18, ICAM, VLA-4, VCAM, IL-17A и/или F, IgE, DR5, CD40, Apo2L/TRAIL, EGFL7, NRP1, митоген-активируемой протеинкиназы (МАРК) и Фактора D.
В одном из дальнейших вариантов реализации, антитело выбирают из группы, включающей антиэстрогенное рецепторное антитело, рецепторное антитело к прогестерону, антитело к р53, антитело к катепсину D, антитело к Bc1-2, антитело к Е-кадгерину, антитело к СА125, антитело к СА15-3, антитело к СА19-9, антитело к с-еrbВ-2, антитело к Р-гликопротеину, антитело к СЕА, антитело к белку ретинобластомы, антитело к онкобелку ras, антитело к Lewis X, антитело к Ki-67, антитело к PCNA, антитело к CD3, антитело к CD4, антитело к CD5, антитело к CD7, антитело к CD8, антитело к CD9/p24, антитело к CD 10, антитело к CD11c, антитело к CD13, антитело к CD14, антитело к CD15, антитело к CD19, антитело к CD23, антитело к CD30, антитело к CD31, антитело к CD33, антитело к CD34, антитело к CD35, антитело к CD38, антитело к CD41, антитело к LCA/CD45, антитело к CD45RO, антитело к CD45RA, антитело к CD39, антитело к CD100, антитело к CD95/Fas, антитело к CD99, антитело к CD 106, антитело к убиквитину, антитело к CD71, антитело к с-mус, антитело к цитокератинам, антитело к виментинам, антитело к белкам HPV, антитело к легким цепям каппа, антитело к легким цепям лямбда, антитело к меланосомам, антитело к простатоспецифическому антигену, антитело к S-100, антитело к тау-антигену, антитело к фибрину, антитело к кератину и антитело к Tn-антигену.
Краткое описание чертежей
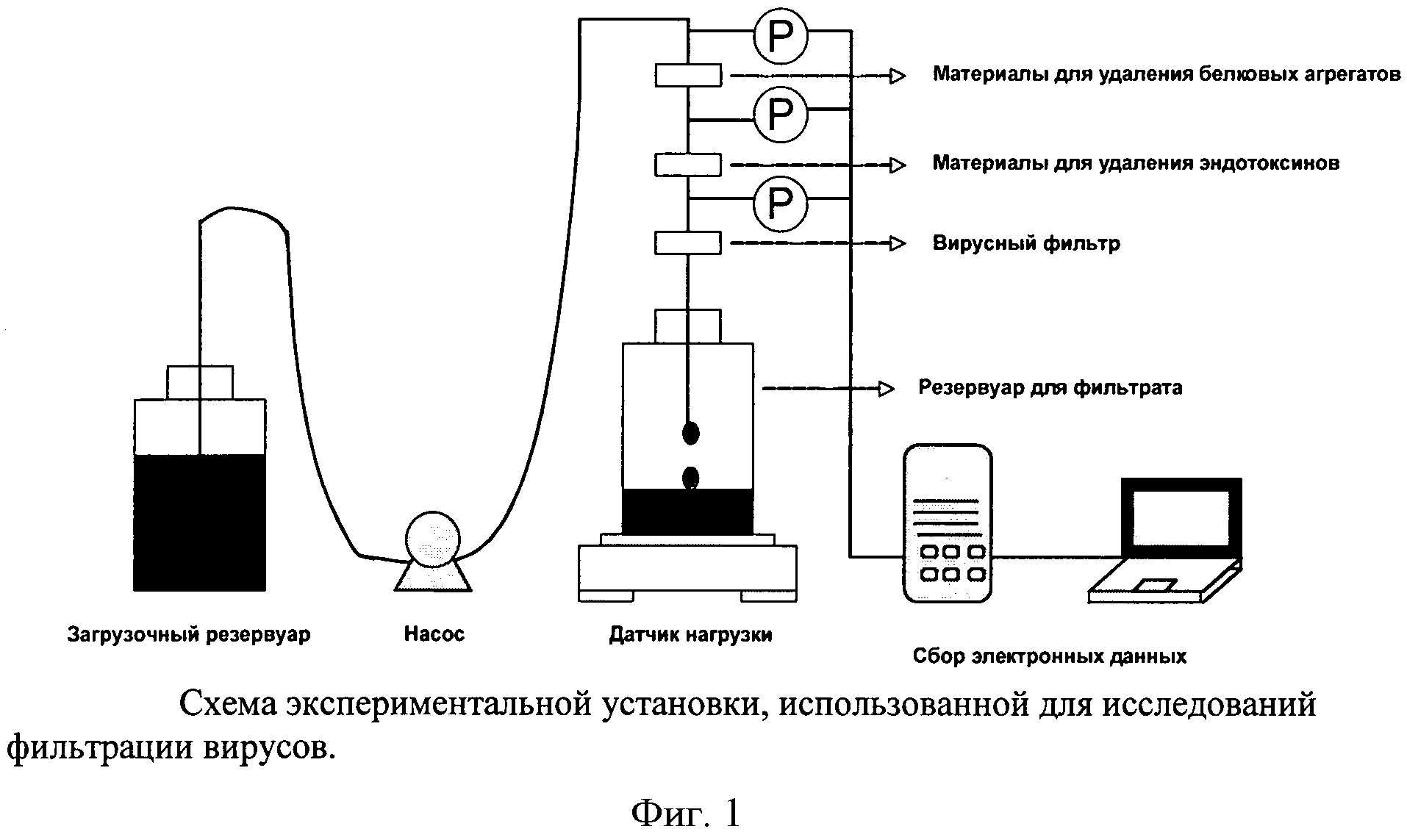
Фигура 1: Схема экспериментальной установки, использованной для исследований фильтрации вирусов.
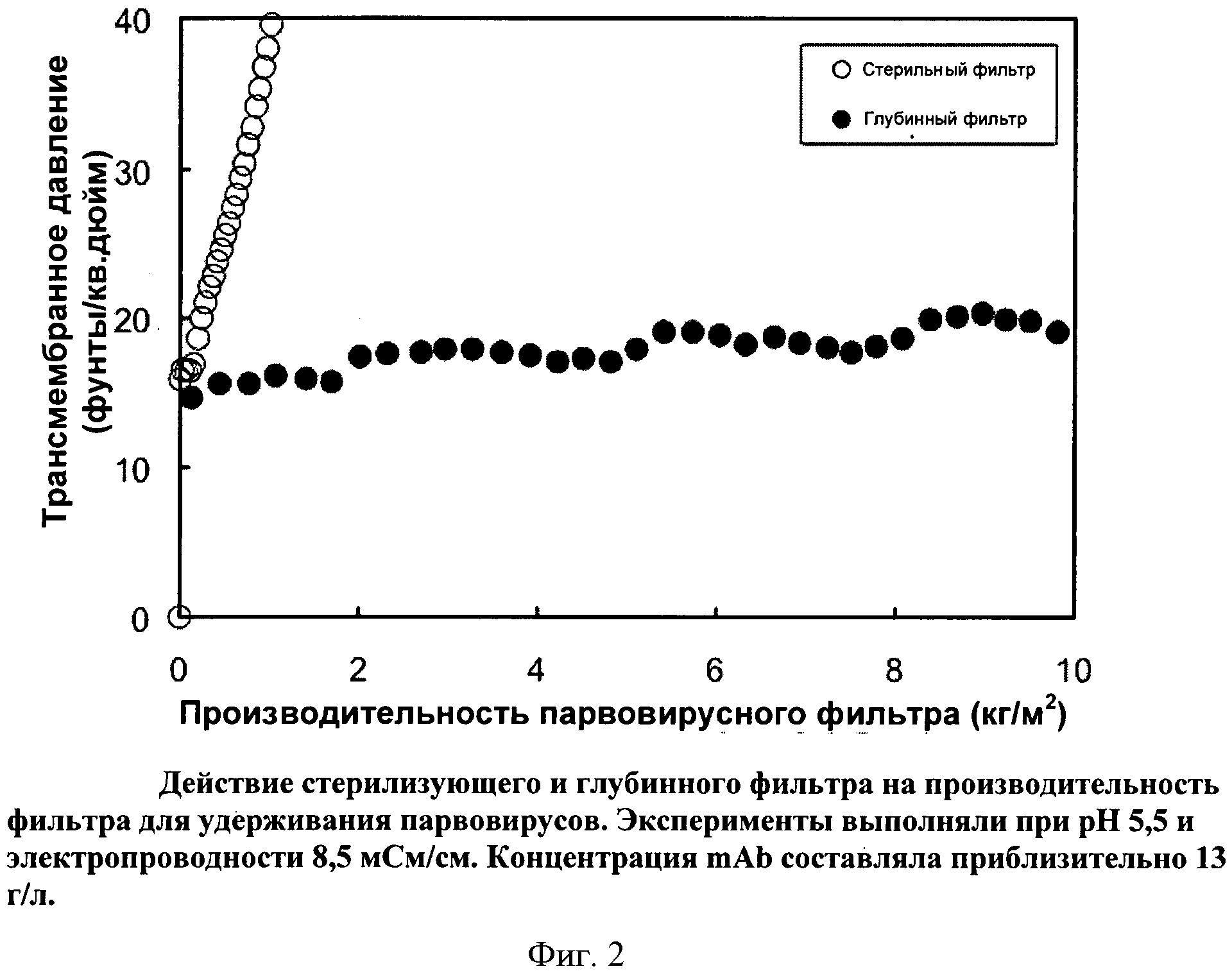
Фигура 2: Действие стерилизующего и глубинного фильтра на производительность фильтра Viresolve Pro, удерживающего парвовирусы. Эксперименты выполняли при pH 5,5 и электропроводности 8,5 мСм/см. Концентрация mAb составляла приблизительно 13 г/л.
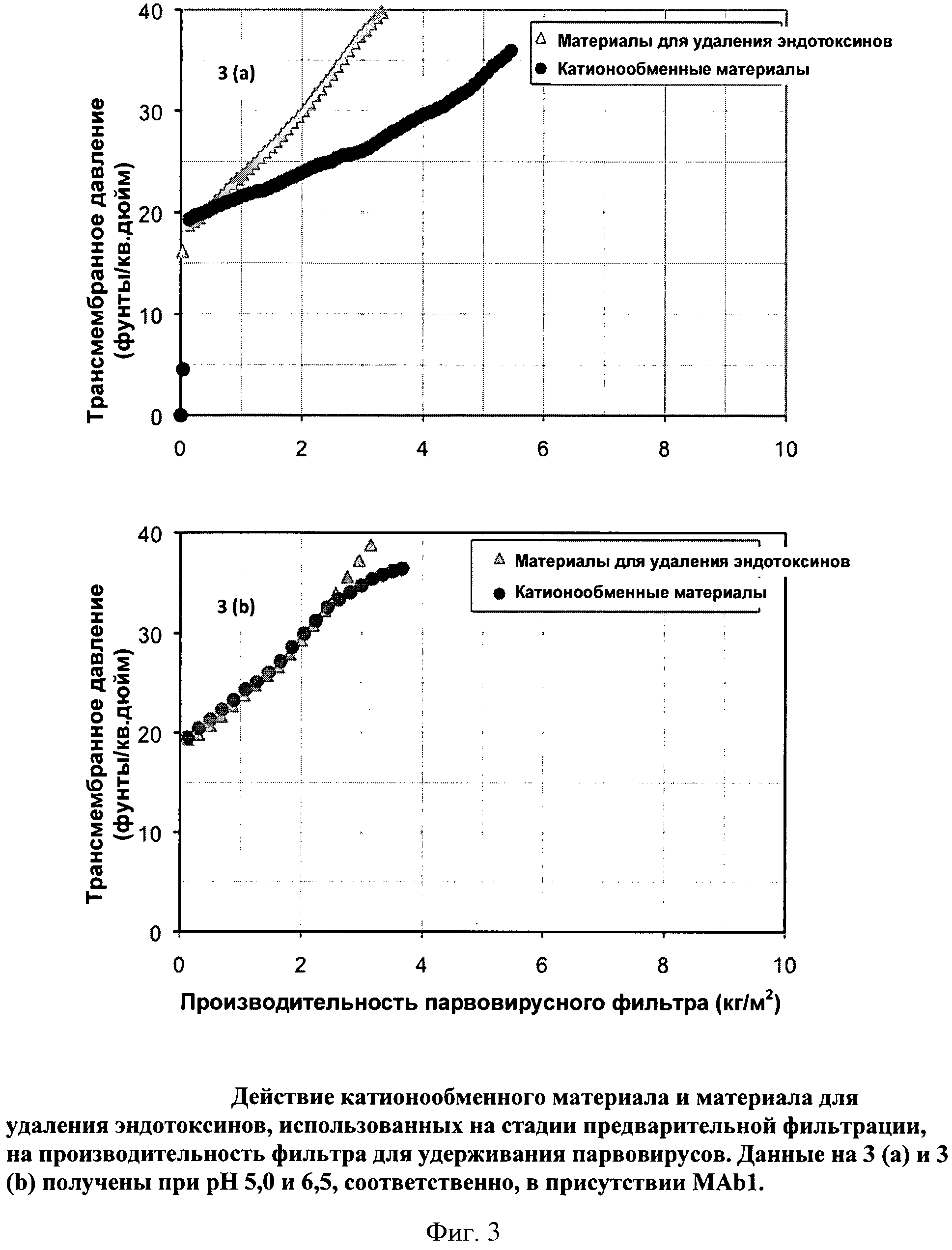
Фигура 3 (а) и (b): Действие катионообменного мембранного адсорбера и мембранного адсорбера для удаления эндотоксинов, использованных в качестве предварительных фильтров, на производительность фильтра Viresolve Pro, удерживающего парвовирусы. Данные на 3 (а) и 3 (b) получены при pH 5,0 и 6,5, соответственно, в присутствии МАb1.
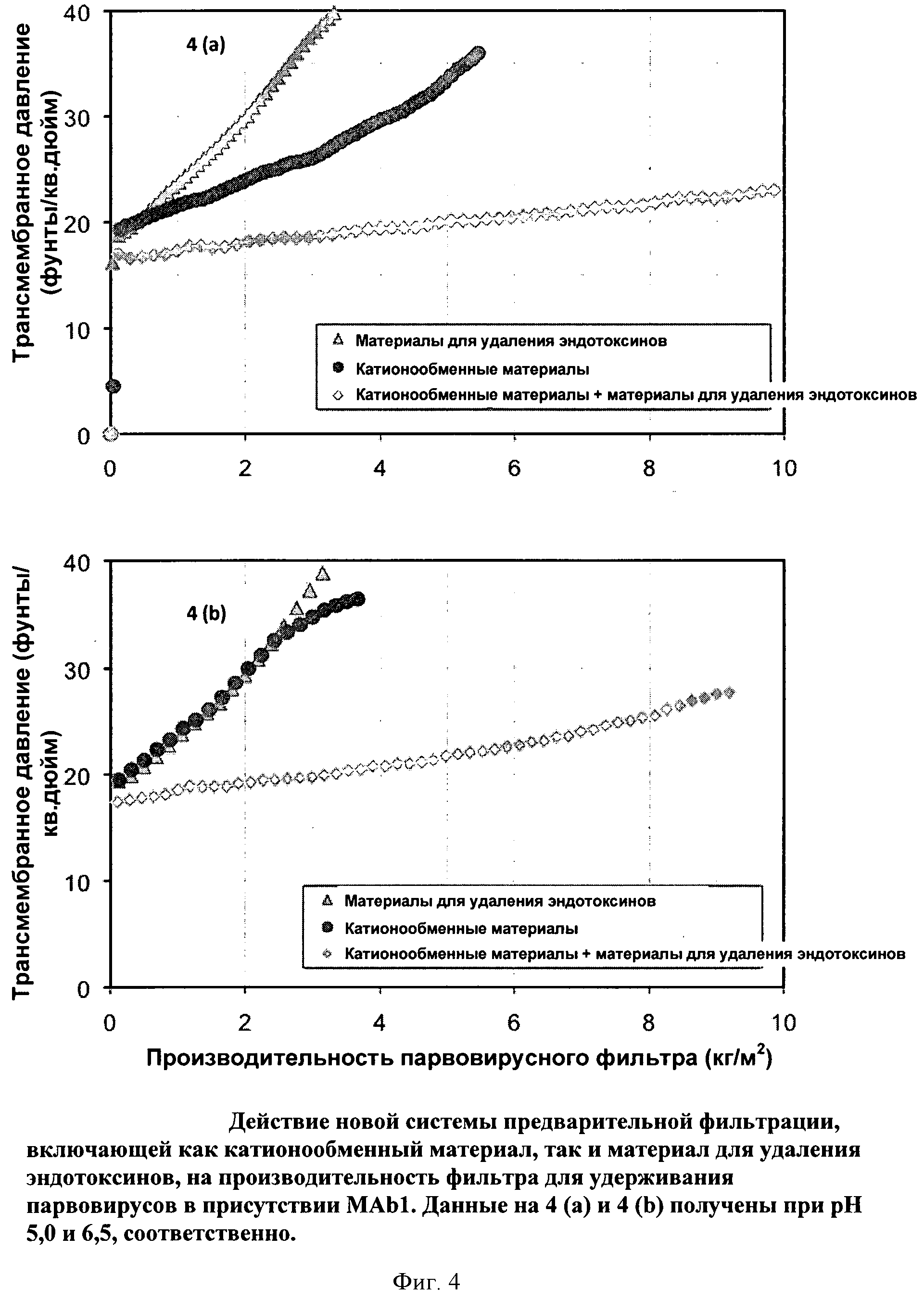
Фигура 4 (а) и (b): Действие новой системы предварительной фильтрации, включающей как катионообменный мембранный адсорбер, так и мембранный адсорбер для удаления эндотоксинов, на производительность фильтра Viresolve Pro, удерживающего парвовирусы, в присутствии МАb1. Данные на 4 (а) и 4 (b) получены при pH 5,0 и 6,5, соответственно.
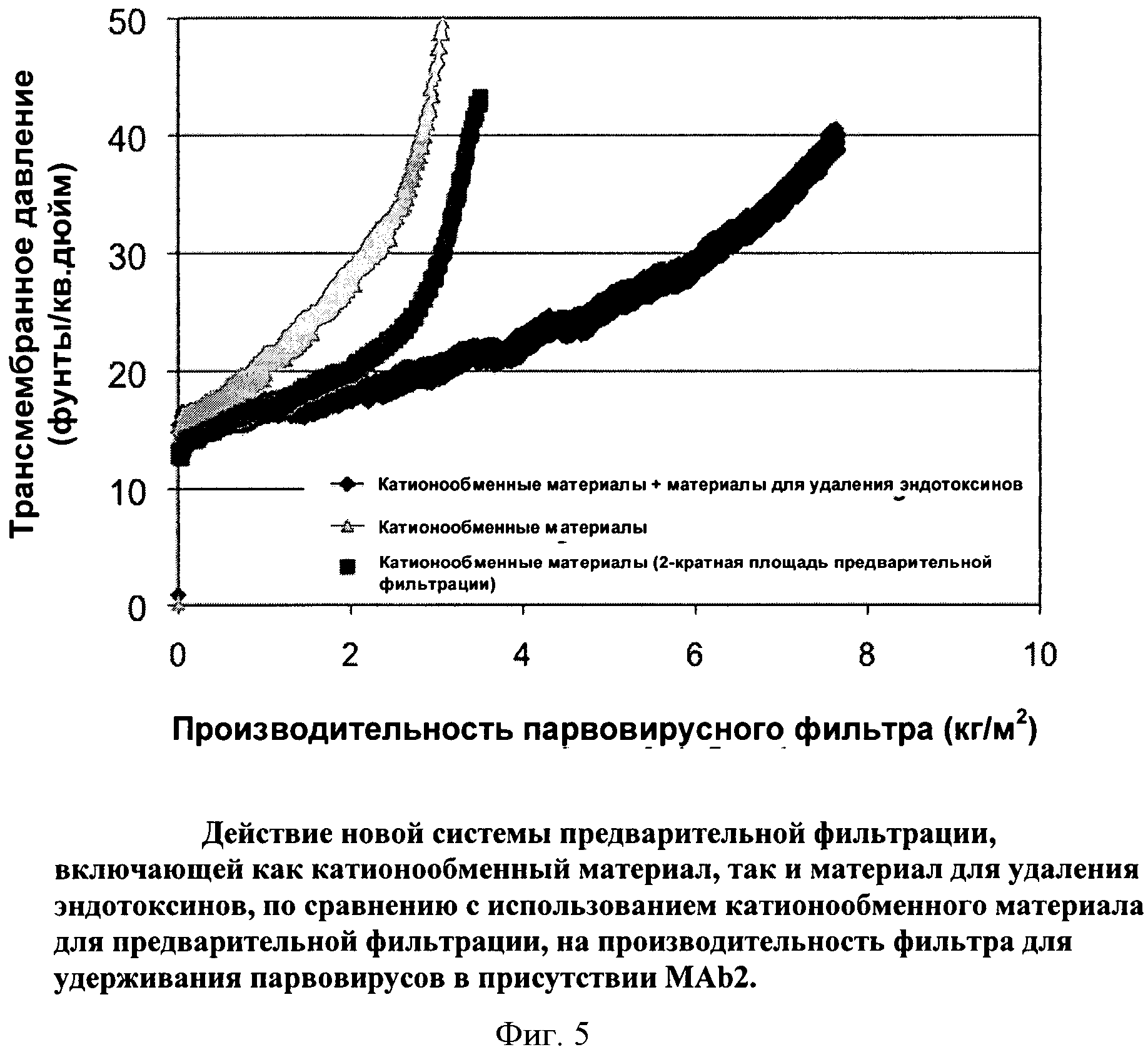
Фигура 5: Действие новой системы предварительной фильтрации, включающей как катионообменный мембранный адсорбер, так и мембранный адсорбер для удаления эндотоксинов, по сравнению с использованием катионообменного материала для предварительной фильтрации, на производительность фильтра Viresolve Pro, удерживающего парвовирусы, в присутствии MAb2.
Подробное описание предпочтительных вариантов реализации
I. Определения
Под "белком" понимают последовательность аминокислот, длина цепи которой достаточна для образования более высоких уровней третичной и/или четвертичной структуры. Таким образом, белки отличают от "пептидов", которые также являются молекулами на основе аминокислот, не обладающими такой структурой. Для целей настоящего изобретения, белок обычно обладает молекулярной массой, равной, по меньшей мере, 15-20 кДа, предпочтительно, по меньшей мере, приблизительно 20 кДа.
Примеры белков, входящих в рамки определения, приведенного в настоящем документе, включают белки млекопитающих, например, CD4, интегрины и их субъединицы, например, бета-7, гормон роста, включая гормон роста человека и бычий гормон роста; рилизинг-фактор гормона роста; паратиреоидный гормон; тиреотропный гормон; липопротеины; α-1-антитрипсин; А-цепь инсулина; В-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, например, фактор VIIIC, фактор IX, тканевый фактор и фактор фон Виллебранда; антикоагулянты, например, протеин С; предсердный натрийуретический фактор; сурфактант легких; активатор плазминогена, например, урокиназа или тканевой активатор плазминогена (t-PA, например, Activase®, TNKase®, Retevase®); бомбазин; тромбин; факторы некроза опухолей α и β; энкефалиназа; хемокин, экспрессируемый и выделяемый Т-клетками при активации; макрофагальный белок воспаления человека (MIP-1-α); сывороточный альбумин, например, человеческий сывороточный альбумин; мюллерова ингибирующая субстанция; пептид, связанный с гонадотропином мыши; ДНКаза; ингибин; активин; фактор роста эндотелия сосудов (ФРЭС); IgE, рецепторы гормонов или факторов роста; интегрин; белок А или D; ревматоидные факторы; нейротрофические факторы, например, нейротрофический фактор костей (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6) или фактор роста нервов, например, NGF-β; тромбоцитарный фактор роста (PDGF); фактор роста фибробластов, например, aFGF и bFGF; эпидермальный фактор роста (ЭФР); трансформирующий ростовой фактор (ТРФ), например, ТРФ-α и ТРФ-β, включая ТРФ-β1, ТРФ-β2, ТРФ-β3, ТРФ-Р4 или ТРФ-Р5; инсулиноподобный фактор роста-1 и -II (ИФР-1 и ИФР-П); дез(1-3)-ИФР-1 (ИФР-1 головного мозга); белки, связывающие инсулиноподобный фактор роста; другие CD-белки, например, CD3, CD8, CD19 и CD20; эритропоэтин (ЕРО); тромбопоэтин (ТРО); остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (КМБ); интерферон, например, интерферон-α, -β и -γ; колониестимулирующие факторы (КСФ), например, М-КСФ, ГМ-КСФ и Г-КСФ; интерлейкины (ИЛ), например, от ИЛ-1 до ИЛ-10; супероксиддисмутаза; рецепторы Т-клеток; поверхностные белки мембран; стимулятор гемолиза (DAF-фактор); вирусный антиген, например, фрагмент оболочки ВИЧ; транспортные белки; "хоминг"-рецептор; адрессины; регуляторные белки; интегрины, например, CD11a, CD11b, CD11c, CD18, фактор межклеточной адгезии (ICAM), VLA-4 и фактор адгезии сосудистого эндотелия (VCAM); опухолеассоциированный антиген, например, рецептор HER1 (EGFR), HER2, HER3 или HER4; Apo2L/TRAIL и фрагменты любого из вышеперечисленных полипептидов; а также иммуноадгезины и связывающиеся с ними антитела; и биологически активные фрагменты или варианты любого из вышеперечисленных белков.
В частности, в рамки термина "белок", в соответствии с определением, приведенным в настоящем документе, включают терапевтические антитела и иммуноадгезины, включая, в том числе, антитела к одному или нескольким из следующих антигенов: HER1 (EGFR), HER2, HER3, HER4, VEGF, CD20, CD22, CD11a, CD11b, CD11c, CD18, фактор межклеточной адгезии (ICAM), VLA-4, фактор адгезии сосудистого эндотелия (VCAM), IL-17A и/или F, IgE, DR5, CD40, Apo2L/TRAIL, EGFL7, NRP1, митоген-активируемая протеинкиназа (МАРК) и фактор D, а также их фрагменты.
Другие типичные антитела включают антитела, выбираемые из группы, включающей антиэстрогенное рецепторное антитело, рецепторное антитело к прогестерону, антитело к р53, антитело к катепсину D, антитело к Bc1-2, антитело к Е-кадгерину, антитело к СА125, антитело к СА15-3, антитело к СА19-9, антитело к с-егЬВ-2, антитело к Р-гликопротеину, антитело к СЕА, антитело к белку ретинобластомы, антитело к онкобелку ras, антитело к Lewis X, антитело к Ki-67, антитело к PCNA, антитело к CD3, антитело к CD4, антитело к CD5, антитело к CD7, антитело к CD8, антитело к CD9/p24, антитело к CD10, антитело к CD11c, антитело к CD13, антитело к CD14, антитело к CD15, антитело к CD19, антитело к CD23, антитело к CD30, антитело к CD31, антитело к CD33, антитело к CD34, антитело к CD35, антитело к CD38, антитело к CD41, антитело к LCA/CD45, антитело к CD45RO, антитело к CD45RA, антитело к CD39, антитело к CD 100, антитело к CD95/Fas, антитело к CD99, антитело к CD106, антитело к убиквитину, антитело к CD71, антитело к с-mус, антитело к цитокератинам, антитело к виментинам, антитело к белкам HPV, антитело к легким цепям каппа, антитело к легким цепям лямбда, антитело к меланосомам, антитело к простатоспецифическому антигену, антитело к S-100, антитело к тауантигену, антитело к фибрину, антитело к кератину и антитело к Tn-антигену, но не ограничиваются ими.
"Выделенный" белок, например антитело, представляет собой белок, определенный и извлеченный и/или отделенный от других компонентов своего природного окружения. Загрязняющие компоненты природного окружения представляют собой материалы, которые мешают диагностическому или терапевтическому использованию белка, например, антитела, и могут включать ферменты, гормоны и другие белковоподобные или небелковоподобные растворенные вещества. В предпочтительных вариантах реализации, белок, например, антитело, очищают (1) до более чем 95 масс.% в соответствии с определением по Лоури, и более предпочтительно - до более чем 99 масс.%, (2) до степени, достаточной для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности с помощью секвенатора с вращающимся стаканом, или (3) до гомогенности, определяемой при электрофорезе в ДСН-ПААГ при восстанавливающих или невосстанавливающих условиях с помощью окрашивания кумасси голубым или, предпочтительно, серебром.
Белок, предпочтительно, является практически чистым, и желательно - практически гомогенным (т.е. свободным от загрязняющих белков). Термин "практически чистый" белок означает композицию, содержащую, по меньшей мере, приблизительно 90 масс.%, предпочтительно - по меньшей мере, приблизительно 95 масс.% данного белка от общей массы композиции.
Термин "практически гомогенный" белок означает композицию, содержащую, по меньшей мере, приблизительно 99 масс.% белка от общей массы композиции.
Термин "антитело" используют в его наиболее широком смысле; в частности, он охватывает моноклональные антитела (включая полноразмерные антитела, содержащие Fc-фрагмент иммуноглобулина), композиции антител с полиэпитопной специфичностью, биспецифические антитела, диатела и одноцепочечные молекулы, а также фрагменты антител (например, Fab, F(ab')2 и Fv).
Стандартное 4-цепочечное антитело представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Антитело IgM состоит из 5 стандартных гетеротетрамерных единиц вместе с дополнительным полипептидом, называемым J-цепью, и содержит 10 сайтов связывания с антигеном, в то время как антитела IgA включают 2-5 стандартных 4-цепочечных единиц, которые могут полимеризоваться, образуя поливалентные комплексы в комбинации с J-цепью. В случае IgG, 4-цепочечная единица обычно имеет молекулярную массу около 150000 дальтон. Каждая L-цепь соединяется с Н-цепью посредством одной ковалентной дисульфидной связи, в то время как две Н-цепи соединяются друг с другом посредством одной или нескольких дисульфидных связей, в зависимости от изотипа Н-цепи. Каждая Н- и L-цепь также содержит регулярно расположенные дисульфидные мостики внутри цепи. Каждая Н-цепь содержит на N-конце вариабельный домен (VH), за которым в α и γ-цепях следуют три константных домена (СН), а в µ и ε-изотипах - четыре СН-домена. Каждая L-цепь на М-конце несет вариабельный домен (VL), за которым следует константный домен на другом конце. VL присоединен к VH, a Cl - к первому константному домену тяжелой цепи (СН1). Считается, что определенные аминокислотные остатки образуют связующее звено между вариабельными доменами легкой и тяжелой цепей. Соединение VH и VL в единое целое образует единичный сайт связывания с антигеном. Информацию о структуре и свойствах различных классов антител см., например, в Basic and Clinical Immunology, 8th Edition, Daniel P. Sties, Abba I. Terr and Tristram G. Parsolw (eds), Appleton & Lange, Norwalk, CT, 1994, ст.71 и Глава 6.
L-цепь любого вида позвоночных на основе аминокислотной последовательности ее константного домена можно отнести к одному из двух обособленных типов, называемых каппа и лямбда. В зависимости от аминокислотной последовательности константного домена тяжелых цепей (СН), иммуноглобулины можно отнести к различным классам или изотипам. Существует пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, несущие тяжелые цепи, обозначаемые как α, δ, ε, γ и µ, соответственно. Кроме того, классы γ и µ подразделяют на подклассы на основе сравнительно небольших различий в последовательности и функциях СН; например, у человека экспрессируются следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2.
Термин "вариабельный" относится к тому факту, что последовательности определенных сегментов вариабельного домена различаются от антитела к антителу в широких пределах. V-домен опосредует связывание с антигеном и определяет специфичность конкретного антитела к конкретному антигену. В то же время, вариабельность неравномерно распределена на всем протяжении вариабельного домена. Напротив, V-области состоят из относительно невариабельных фрагментов из 15-30 аминокислотных остатков, называемых каркасными участками (FR) и разделенных более короткими крайне вариабельными областями, называемыми "гипервариабельными участками" или, иногда, "участками, определяющими комплементарность" (CDR), длина каждого из которых составляет приблизительно 9-12 аминокислотных остатков. Вариабельные домены природных легких и тяжелых цепей содержат четыре FR, преимущественно принимающих конфигурацию β-листа и соединенных тремя гипервариабельными участками, образующими петли, соединяющие структуры β-типа, а в некоторых случаях - являющиеся их частью. Гипервариабельные участки каждой цепи объединены друг с другом в непосредственной близости от FR и, вместе с гипервариабельными участками другой цепи, участвуют в образовании антиген-связывающего сайта антитела (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). Константные домены не вовлечены напрямую в связывание антитела с антигеном, однако проявляют различные эффекторные функции, например, участвуют в антителозависимой клеточно-обусловленной цитотоксичности (ADCC).
Термин "гипервариабельный участок" (а также "участки, определяющие комплементарность" или CDR) в настоящем документе относится к аминокислотным остаткам в составе антитела, которые (обычно три или четыре коротких участка с крайней вариабельностью последовательности) располагаются в пределах V-региона домена иммуноглобулина, образуют сайт связывания с антигеном и являются основными детерминантами специфичности к антигену. Существует, по меньшей мере, два способа идентификации остатков CDR: (1) Подход на основе межвидовой изменчивости последовательностей (т.е., Kabat et al., Sequences of Proteins of Immunological Interest (National Institute of Health, Bethesda, MS 1991); и (2) подход на основе кристаллографических исследований комплексов антиген-антитело (Chothia, С. et al., J. Mol. Biol. 196: 901-917 (1987)). Однако, в тех случаях, когда эти две методики идентификации остатков определяют перекрывающиеся, но не идентичные области, их можно комбинировать для определения гибридного CDR.
Термин "моноклональное антитело" в настоящем описании относится к антителу, полученному из популяции в значительной степени однородных антител, т.е. отдельные антитела в составе популяции являются идентичными, за исключением возможных мутаций, происходящих по естественным причинам, которые могут присутствовать в небольших количествах. Моноклональные антитела являются высокоспецифичными, поскольку они направлены против одиночной антигенной детерминанты. Кроме того, по сравнению с традиционными (поликлональными) препаратами антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одиночной детерминанты антигена. Кроме специфичности, моноклональные антитела обладают преимуществом, заключающимся в том, что они синтезируются культурой гибридомы, не загрязненной другими иммуноглобулинами. Определение "моноклональное" указывает на особенность антител, заключающуюся в том, что они получены из практически однородной популяции антител, и не должно расцениваться как необходимость получения антител с помощью какого-либо конкретного способа. Например, моноклональные антитела для использования в соответствии с настоящим изобретением можно получить с помощью гибридомной технологии, впервые описанной в работе Kohler et al., Nature, 256: 495 (1975), либо с помощью технологии рекомбинантных ДНК (см., например, патент США №4,816,567). "Моноклональные антитела" также можно выделить из фаговой библиотеки антител с помощью методик, описанных, например, в публикациях Clackson et al, Nature, 352: 624-628 (1991) и Marks et al., J. Mol. Biol., 222: 581-597 (1991).
Моноклональные антитела в настоящем описании, в частности, включают "химерные" антитела (иммуноглобулины), в которых фрагмент тяжелой и/или легкой цепи идентичен или гомологичен соответствующим последовательностям антител, полученных из организмов конкретной видовой принадлежности, или принадлежащих к конкретному классу или подклассу антител, в то время как остальная часть цепи(ей) идентична(ы) или гомологична(ы) соответствующим последовательностям антител, полученных из организмов другой видовой принадлежности, или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они обладают желательной биологической активностью (патент США №4,816,567; Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)).
"Интактным" антителом является антитело, включающее сайт связывания с антигеном, а также CL и, по меньшей мере, домены тяжелой цепи СН1, СН2 и СН3.
"Фрагмент антитела" содержит фрагмент интактного антитела, предпочтительно сайт связывания с антигеном и/или вариабельный участок интактного антитела. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; диатела; линейные антитела (см. патент США 5,641,870, Пример 2; Zapata et al., Protein Eng. 8(10): 1057-1062 [1995]); молекулы одноцепочечных антител и полиспецифические антитела, сформированные из фрагментов антител.
Папаиновый гидролиз антител позволял получить два идентичных антигенсвязывающих фрагмента, названных "Fab”-фрагментами, и остаточный "Fc"-фрагмент, указывающий на хорошую способность к кристаллизации. Fab-фрагмент состоит из полноразмерной L-цепи вместе с вариабельным доменом Н-цепи (VH) и первым константным доменом одной из тяжелых цепей (СН1). Каждый Fab-фрагмент является моновалентным по отношению к связыванию с антигеном, т.е. содержит единственный сайт связывания с антигеном. Обработка антител пепсином позволяет выделить одиночный крупный F(ab')2-фрагмент, который приблизительно соответствует двум Fab-фрагментам с различной антигенсвязывающей активностью, соединенным дисульфидной связью, и сохраняет способность к перекрестному связыванию антигена. Fab'-фрагменты отличаются от Fab-фрагментов тем, что несут несколько дополнительных остатков на С-конце СН1-домена, включая один или несколько остатков цистеина из шарнирной области антитела. Fab'-SH в настоящем документе представляет собой обозначение Fab', в котором остаток(ки) цистеина в константных доменах несет(ут) свободную тиоловую группу. Фрагменты антител F(ab')2 исходно получали в виде пар Fab'-фрагментов, между которыми расположены шарнирные остатки цистеина. Кроме того, известны другие варианты химического соединения фрагментов антител.
Fc-фрагмент включает С-концевые фрагменты обеих Н-цепей, соединенные друг с другом дисульфидными связями. Эффекторные функции антител определяются последовательностями Fc-области, которую также распознают Fc-рецепторы (FcR), встречающиеся на некоторых типах клеток.
"Fv" представляет собой минимальный фрагмент антитела, содержащий полный сайт распознавания и связывания антигена. Этот фрагмент состоит из димера вариабельных доменов одной тяжелой и одной легкой цепей, жестко связанных посредством нековалентных связей. При укладке этих двух доменов наружу выступают шесть гипервариабельных петель (по три петли из Н- и L-цепи), аминокислотные участки которых участвуют в связывании с антигеном и придают антителу специфичность по отношению к связыванию антигена. В то же время, даже одиночный вариабельный домен (или половина Fv-фрагмента, включающая только три CDR, специфичных к антигену) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью по сравнению с полноразмерным сайтом связывания.
"Одноцепочечные Fv", также сокращенно обозначаемые как "sFv" или "scFv" представляют собой фрагменты антител, включающие домены VH и VL, соединенные в составе одиночной полипептидной цепи. Предпочтительно, полипептид sFv также содержит полипептидный линкер между доменами VH и VL, позволяющий sFv формировать структуру, желательную для связывания с антигеном. Обзор sFv описан Pluckthun в The Pharmacology of Monoclonal Antibodies, vol.113, Rosenburg and Moore eds., Springer-Verlag, New York, pp.269-315 (1994).
Термин "диатела" относится к небольшим фрагментам антител, полученным путем конструирования sFv-фрагментов (см. предыдущий абзац) с короткими линкерами (около 5-10) остатков) между доменами VH и VL, благодаря чему достигается межцепочечное, а не внутрицепочечное сопряжение V-доменов, приводящее к образованию бивалентного фрагмента, т.е. фрагмента, несущего два сайта связывания с антигеном. Биспецифические антитела представляют собой гетеродимеры двух "скрещенных" sFv-фрагментов, в которых VH- и VL-домены двух антител присутствуют на различных полипептидных цепях. Более подробное описание диател приведено, например, в источниках ЕР 404,097; WO 93/11161; Hollinger et al., Proc. Nail. Acad. Sci. USA 90: 6444-6448 (1993).
Антитело, которое "связывается" с молекулой-мишенью или целевым антигеном, представляет собой антитело, способное связывать указанный антиген с достаточной аффинностью, что делает возможным использование этого антитела для адресного воздействия на клетку, экспрессирующую данный антиген.
Антитело, которое "специфически связывается с" или является "специфичным к" определенному полипептиду или эпитопу в составе определенного полипептида, представляет собой антитело, которое связывается с указанным определенным полипептидом или эпитопом в составе определенного полипептида и практически не связывается с любым другим полипептидом или эпитопом полипептида. В таких вариантах реализации, степень связывания антител с этими другими полипептидами или эпитопами полипептидов составляет менее 10% согласно показаниям флуоресцентной сортировки активированных клеток (FACS) или радиоиммунопреципитационного анализа (RIA) по сравнению со связыванием с целевым полипептидом или эпитопом-мишенью.
"Гуманизированные" формы антител нечеловеческого происхождения (например, мыши) представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (например, Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), состоящие главным образом из последовательностей, характерных для человека, и содержащие минимальное количество последовательностей, происходящих из иммуноглобулинов нечеловеческого происхождения. В большинстве случаев, гуманизированные антитела представляют собой иммуноглобулины человека (антитела реципиента), в которых остатки из гипервариабельного участка (CDR) реципиента замещены остатками из гипервариабельного участка антитела нечеловеческого происхождения (антитела донора), например, антитела мыши, крысы или кролика, обладающими желательной специфичностью, аффинностью и емкостью. В некоторых случаях, остатки каркасного участка Fv (FR) иммуноглобулина человека замещают соответствующими остатками нечеловеческого происхождения. Кроме того, "гуманизированные антитела" в настоящем описании также могут содержать остатки, не присутствующие ни в антителах реципиента, ни в антителах донора. Эти модификации вносят для дальнейшей очистки и оптимизации функционирования антител. Гуманизированные антитела в оптимальном варианте также содержат, по меньшей мере, фрагмент константного участка иммуноглобулина (Fc), обычно происходящий из иммуноглобулина человека. Более подробное описание см. в публикациях Jones et al., Nature, 321: 522-525 (1986); Reichmann et al, Nature, 332: 323-329 (1988); и Presta, Curr. Op. Struct. Biol., 2: 593-596 (1992).
"Эффекторные функции" антитела относятся к его биологической активности, относимой на счет Fc-участка (последовательности природного Fc-участка или аминокислотной последовательности мутантного Fc-участка) антитела, и меняются в зависимости от изотипа антитела. Примеры эффекторных функций антител включают: связывание с C1q и комплементзависимую цитотоксичность; связывание с рецептором Fc; антителозависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; подавление рецепторов поверхности клетки (например, рецепторов В-клеток); и активацию В-клеток.
"Антителозависимая клеточно-опосредованная цитотоксичность" или ADCC относится к форме цитотоксичности, при которой секретируемые Ig связываются с Fc-рецепторами (FcR), присутствующими на некоторых цитотоксических клетках (например, естественных киллерах (NK-клетках), нейтрофилах и макрофагах), позволяя этим цитотоксическим эффекторным клеткам специфически связываться с клетками-мишенями, несущими антигены, и, как следствие, уничтожать эти клетки-мишени с помощью цитотоксинов. Антитела "вооружают" (сенсибилизируют) цитотоксические клетки и необходимы для уничтожения клеток-мишеней в соответствии с этим механизмом. Основные опосредующие ADCC клетки - NK-клетки - экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия Fc на поверхности гематопоэтических клеток кратко изложена в Таблице 3 на странице 464 работы Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991). Для оценки ADCC-активности молекулы, представляющей интерес, можно выполнить анализ ADCC in vitro, например, согласно описанию в патентах США №5,500,362 или 5,821,337. Эффекторные клетки, пригодные для такого анализа, включают мононуклеары периферической крови (РВМС) и естественные киллеры (NK). В качестве альтернативы или дополнения, ADCC-активность молекулы, представляющей интерес, можно оценить т vivo, например, на животной модели, например, согласно описанию в публикации Clynes et al., PNAS USA 95: 652-656 (1998).
Термин "Fc-рецептор" или "FcR" описывает рецептор, связывающийся с Fc-участком антитела. Предпочтительный FcR представляет собой нативную последовательность FcR человека. При этом предпочтительный FcR представляет собой рецептор, связывающийся с антителом IgG (гамма-рецептор), и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и формы этих рецепторов, подвергшиеся альтернативным вариантам сплайсинга, рецепторы FcγRII включают FcγRIIA ("активирующий рецептор") и FcγRIIB ("ингибирующий рецептор"), которые обладают сходными аминокислотными последовательностями, отличающимися главным образом в области их цитоплазматических доменов. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене иммунорецепторный тирозиновый активирующий мотив (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене иммунорецепторный тирозиновый ингибирующий мотив (ITIM) (см. М. Daeron, Annu. Rev. Immunol. 15: 203-234 (1997). Обзор FcR приведен в работах Ravetch and Kinet, Annu. Rev, Immunol. 9: 457-92 (1991); Capel et al., Immunomethods 4: 25-34 (1994); и de Haas et al., J. Lab. din. Med. 126: 330-41 (1995). Другие FcR, включая рецепторы, которые будут идентифицированы в будущем, входят в рамки термина "FcR" в настоящем документе. Этот термин также включает неонатальный рецептор, FcRn, который отвечает за передачу материнских IgG плоду. Guyer et al., J. Immunol. 117: 587 (1976) и Kirn et al., J. Immunol. 24: 249 (1994).
"Эффекторные клетки человека" представляют собой лейкоциты, экспрессирующие один или несколько FcR и выполняющие Эффекторные функции. Предпочтительно, эти клетки экспрессируют, по меньшей мере, FcγRIII и выполняют эффекторную функцию ADCC. Примеры лейкоцитов человека, опосредующих ADCC, включают мононуклеары периферической крови (РВМС), естественные киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы, причем предпочтительными являются РВМС и MNK-клетки. Эффекторные клетки можно выделить из естественного источника, например, крови.
"Комплементзависимая цитотоксичность" или "CDC" относится к лизису клетки-мишени в присутствии комплемента. Классический путь активации комплемента инициируется связыванием первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), связанными с распознаваемым ими антигеном. Для оценки активации комплемента можно выполнить CDC-тест, например, согласно описанию в публикации Gazzano-Santoro et al.,J. Immunol. Methods 202: 163 (1996).
Термины "конъюгат", "конъюгированный" и "конъюгация" относятся к любым формам ковалентного и нековалентного соединения молекул и включают, в числе прочего, прямое генетическое или химическое слияние, сопряжение через линкер или перекрестно сшивающий агент, или нековалентное связывание, например, с помощью лейциновой "молнии". Конъюгаты антител несут дополнительный компонент, например, цитотоксическое соединение, лекарство, композицию, соединение, радиоактивный элемент или определяемую метку, присоединенную к антителу или фрагменту антитела.
Термин "лечение" относится как к терапевтическому лечению, так и к профилактическим и предохранительным мероприятиям. "Те, кто нуждается в лечении", включают тех, кто уже страдает расстройством, а также тех, у кого расстройство следует предотвратить.
Термин "млекопитающее" для лечебных целей относится к любому животному, относящемуся к млекопитающим, включая людей, нечеловекообразных высших приматов, домашних и сельскохозяйственных животных, а также животных, используемых в спортивных целях, содержащихся в зоопарках и домашних условиях, например, собакам, лошадям, кроликам, крупному рогатому скоту, свиньям, хомячкам, мышам, кошкам и т.д. Предпочтительно, млекопитающее является человеком.
"Расстройство" представляет собой любое состояние, улучшающееся в результате лечения белком. Этот термин включает хронические и острые расстройства или заболевания, включая патологические состояния млекопитающих, являющиеся предрасполагающими факторами для рассматриваемого расстройства.
"Терапевтически эффективное количество" представляет собой, по меньшей мере, минимальную концентрацию, необходимую для достижения измеряемого улучшения или предотвращения определенного расстройства. Терапевтически эффективные количества известных белков широко известны в данной области, в то время как эффективные количества белков, рассматриваемых ниже в настоящем документе, можно определить с помощью стандартных методик, которыми владеют специалисты, например, врачи.
II. Способы выполнения изобретения
А. Получение белка
В соответствии с настоящим изобретением, белок получали с помощью технологии рекомбинантных ДНК, т.е. путем культивирования клеток, трансформированных или трансфицированных вектором, содержащим нуклеиновую кислоту, кодирующую белок, в соответствии с общеизвестными в данной области подходами.
Получение белка с помощью рекомбинантных методик можно осуществить трансфицируя или трансформируя подходящие клетки-носители экспрессионными или клонирующими векторами и культивируя их в стандартных питательных средах, модифицированных соответствующим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желательные последовательности. Специалист может выбрать условия культивирования, например, среды, температуру, pH и т.п., не выполняя лишних экспериментов. В большинстве случаев, принципы, протоколы и практические методики для максимизации продуктивности культур клеток можно найти в источниках Mammalian Cell Biotechnology: A Practical Approach, M.Butler, Ed. (IRL Press, 1991) и Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press. Способы трансфекции известны специалистам и включают, например, CaPO4 и CaCl2-трансфекцию, электропорацию, микроинъекцию и т.д. Подходящие методики также описаны в Sambrook et al., supra. Дополнительные методики трансфекции описаны в публикациях Shaw et al., Gene 23: 315 (1983); WO 89/05859; Graham et al., Virology 52: 456-457 (1978) и патенте США 4,399,216.
Нуклеиновую кислоту, кодирующую желательный белок, можно вставить в реплицируемый вектор для клонирования или экспрессии. Подходящие векторы являются общедоступными и могут быть в форме плазмиды, космиды, вирусной частицы или фага. Подходящие нуклеотидные последовательности можно вставить в вектор с помощью различных процедур. В большинстве случаев, ДНК вставляют в подходящий(е) сайт(ы) эндонуклеаз рестрикции с помощью методик, известных в данной области. Компоненты вектора обычно включают одну или несколько сигнальных последовательностей, сайт инициации репликации, один или несколько маркерных генов, энхансерный элемент, промотор и терминатор транскрипции, но не ограничиваются ими. Для конструирования подходящих векторов, содержащих один или несколько из этих компонентов, используют стандартные методики лигирования, известные специалистам.
Белок в различной форме можно выделить из культуральной среды или лизата клеток-носителей. Если белок является мембраносвязанным, его можно отделить от мембраны с помощью подходящего детергента или путем ферментативного расщепления. Клетки, использованные для экспрессии, также можно разрушить с помощью различных физических или химических средств, например, циклического замораживания-размораживания, ультразвукового, механического разрушения или с использованием агентов, лизирующих клетки.
Очистку белка можно осуществить с помощью любой известной методики, например, фракционирования на ионообменной колонке, преципитации с этанолом, обращенно-фазной ВЭЖХ, хроматографии на диоксиде кремния или катионообменной смоле (например, ДЭАЭ), хроматофокусирования, электрофореза в ДСН-ПААГ, преципитации с сульфатом аммония, гель-фильтрации с использованием колонок с носителем белок А-сефароза (например, Sephadex® G-75) с целью удаления таких примесей, как IgG, и металлохелатирующих колонок для связывания форм, меченных эпитопами.
В. Получение антител
В некоторых вариантах реализации настоящего изобретения, выбранный белок представляет собой антитело. Методики получения антител, включая поликлональные, моноклональные, гуманизированные, биспецифические и гетероконъюгатные антитела, приведены ниже.
(i) Поликлональные антитела.
Образование поликлональных антител у животных обычно индуцируют путем множественных подкожных (п/к) или внутрибрюшинных (в/б) инъекций соответствующего антигена и адъюванта. Полезным приемом может оказаться конъюгирование соответствующего антигена с белком, который является иммуногенным для вида, к которому принадлежит иммунизируемый организм, например, гемоцианином фиссуреллы, сывороточным альбумином, бычьим тиреоглобулином или ингибитором трипсина сои. Примеры адъювантов для возможного использования включают полный адъювант Фрейнда и адъювант MPL-TDM (монофосфорил-липид А, синтетический дикориномиколат трегалозы). Специалист может выбрать протокол иммунизации, не выполняя лишних экспериментов.
Спустя месяц животных стимулировали путем множественных подкожных инъекций пептида или конъюгата в полном адъюванте Фрейнда в количестве от 1/5 до 1/10 от исходного в различные участки тела. Спустя интервал времени от семи до 14 суток у животных проводили пробоотбор крови и анализировали титр антител в сыворотке. Животных стимулировали до достижения постоянного уровня титра. Предпочтительно, животных стимулировали конъюгатами одного и того же антигена, конъюгированного с различными белками и/или с помощью различных перекрестно сшивающих реагентов. Конъюгаты также можно получить в культуре рекомбинантных клеток в виде гибридных белков. Кроме того, для усиления иммунного ответа можно использовать агенты, вызывающие агрегацию, например, алюминиевые квасцы. (и) Моноклональные антитела.
Моноклональные антитела получают из популяции в значительной степени однородных антител, т.е. отдельные антитела в составе популяции являются идентичными, за исключением мутаций, происходящих по естественным причинам, которые могут присутствовать в небольших количествах. Таким образом, определение "моноклональные" указывает на особенность антител, заключающуюся в том, что они не являются смесью различных антител.
Например, моноклональные антитела можно получить с помощью гибридомной технологии, впервые описанной в работе Kohler et al., Nature, 256: 495 (1975), либо с помощью технологии рекомбинантных ДНК (патент США №4,816,567).
В соответствии с технологией гибридом, мышь или другое подходящее животное-носитель, например, хомячка, иммунизируют в соответствии с описанием в настоящем документе с целью выделения лимфоцитов, продуцирующих или способных продуцировать антитела, специфически связывающиеся с белком, используемым для иммунизации. В качестве альтернативы, лимфоциты можно иммунизировать in vitro. Затем лимфоциты сливают с миеломными клетками с помощью подходящего агента, вызывающего слияние клеток, например, полиэтиленгликоля, получая клетку гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Иммунизирующий агент обычно включает белок, входящий в разрабатываемый состав. В случае, если предпочтительными являются клетки человеческого происхождения, обычно используют лимфоциты периферической крови ("PBL"), либо, если желательны клетки млекопитающих нечеловеческого происхождения, используют клетки селезенки или лимфоузлов. Затем лимфоциты сливают с клетками иммортализованной линии с помощью подходящего агента, вызывающего слияние клеток, например, полиэтиленгликоля, получая клетку гибридомы. Goding, Monoclonal antibodies: Principles and Practice, Academic Press (1986), pp.59-103. Клетки иммортализованных линий обычно представляют собой трансформированные клетки млекопитающих, в частности, миеломные клетки грызунов, крупного рогатого скота или человека. Обычно используют клетки миеломных линий крысы или мыши. Полученные таким образом клетки гибридомы высевают и выращивают в подходящей культуральной среде, предпочтительно содержащей одно или несколько веществ, подавляющих рост или выживание негибридных исходных миеломных клеток. Например, если исходные миеломные клетки дефектны по ферменту гипоксантин-гуанинфосфорибозилтрансферазе (HGPRT или ГГФТ), культуральная среда для гибридом обычно включает гипоксантин, аминоптерин и тимидин (среда HAT), которые предотвращают рост HGPRT-дефектных клеток.
Предпочтительными являются миеломные клетки, которые способны к эффективному слиянию, поддерживают стабильно высокий уровень продукции антител выбранными клетками-продуцентами антител и чувствительны к таким средам, как среда HAT. В числе прочего, предпочтительными миеломными клеточными линиями являются миеломные линии мышей, например, линии, происходящие от опухолей мышей МОРС-21 и МРС-11 и доступные для приобретения в Центре распространения клеток института Солка, Сан-Диего, Калифорния, США, и клетки SP-2, доступные для приобретения в Американской коллекции типовых культур, Роквилл, Мэриленд, США. Кроме того, описано использование линий клеток миеломы человека и гетеромиеломы мыши-человека для получения моноклональных антител человека (Kozbor, J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой растут клетки гибридомы, анализируют на продукцию моноклональных антител против заданного антигена. Предпочтительно, специфичность связывания моноклональных антител, продуцированных клетками гибридомы, определяют с помощью иммунопреципитации или анализа связывания in vitro, например, радиоиммуноанализа (RIA) или твердофазного иммуноферментного анализа (ELISA).
Сродство связывания моноклональных антител можно определить, например, с помощью анализа Скэтчарда, описанного в работе Munson et al., Anal. Biochem., 107: 220 (1980).
После того, как установлено, что клетки гибридомы продуцируют антитела, обладающие желательной специфичностью, аффинностью и/или активностью, клоны можно субклонировать, используя способ серийных разведений, и вырастить с помощью стандартных способов (Coding, supra). Подходящие для этих целей культуральные среды включают, например, среду D-MEM или RPMI-1640. Кроме того, клетки гибридомы можно вырастить in vivo в организме животного в виде асцитной опухоли.
Иммунизирующий агент обычно включает белок, несущий эпитоп, с которым связывается антитело. В случае, если предпочтительными являются клетки человеческого происхождения, обычно используют лимфоциты периферической крови ("PBL"), либо, если желательны клетки млекопитающих нечеловеческого происхождения, используют клетки селезенки или лимфоузлов. Затем лимфоциты сливают с клетками иммортализованной линии с помощью подходящего агента, вызывающего слияние клеток, например, полиэтиленгликоля, получая клетку гибридомы. Goding, Monoclonal Antibodies: Principals and Practice, Academic Press (1986), pp.59-103.
Клетки иммортализованных линий обычно представляют собой трансформированные клетки млекопитающих, в частности, миеломные клетки грызунов, крупного рогатого скота или человека. Обычно используют клетки миеломных линий крысы или мыши. Клетки гибридомы можно культивировать в подходящей культуральной среде, предпочтительно содержащей одно или несколько веществ, подавляющих рост или выживание негибридных иммортализованных клеток. Например, если исходные клетки дефектны по ферменту гипоксантин-гуанинфосфорибозилтрансферазе (HGPRT или ГГФТ), культуральная среда для гибридом обычно включает гипоксантин, аминоптерин и тимидин ("среда HAT"), которые предотвращают рост ГГФТ-дефектных клеток.
Предпочтительными являются иммортализованные линии клеток, которые способны к эффективному слиянию, поддерживают стабильно высокий уровень экспрессии антител выбранными клетками-продуцентами антител и чувствительны к таким средам, как среда HAT. Более предпочтительными иммортализованными клеточными линиями являются миеломные линии мышей, которые можно приобрести, например, в Центре распространения клеток института Солка, Сан-Диего, Калифорния, США, и в Американской коллекции типовых культур, Роквилл, Мэриленд, США. Кроме того, описано использование линий клеток миеломы человека и гетеромиеломы мыши-человека для получения моноклональных антител человека. Kozbor, J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc., New York, (1987) pp.51-63.
Культуральную среду, в которой культивируют клетки гибридомы, затем можно анализировать на присутствие моноклональных антител против белка, включаемого в разрабатываемый состав. Предпочтительно, специфичность связывания моноклональных антител, продуцированных клетками гибридомы, определяют с помощью иммунопреципитации или анализа связывания in vitro, например, радиоиммуноанализа (RIA) или твердофазного иммуноферментного анализа (ELISA). Такие методики и способы анализа известны в данной области. Сродство связывания моноклональных антител можно определить, например, с помощью анализа Скэтчарда, описанного в работе Munson and Pollard, Anal. Biochem., 107: 220 (1980).
После идентификации желательных клеток гибридомы клоны можно субклонировать, используя способ серийных разведении, и вырастить с помощью стандартных способов. Goding, supra. Подходящие для этих целей культуральные среды включают, например, среду Игла, модифицированную по Дульбекко, и среду RPMI-1640. В качестве альтернативы, клетки гибридомы можно вырастить in vivo в организме млекопитающего в виде асцитной опухоли.
Моноклональные антитела, секретируемые субклонами, отделяют от культуральной среды, асцитной жидкости или сыворотки с помощью стандартных процедур очистки иммуноглобулинов, например, гель-фильтрации на белок А-сефарозе, хроматографии на гидроксиапатите, гель-электрофореза, диализа или аффинной хроматографии.
ДНК, кодирующую моноклональные антитела, легко выделить и секвенировать с помощью стандартных процедур (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи антител мыши). Предпочтительным источником такой ДНК служат клетки гибридомы. После выделения эту ДНК можно поместить в экспрессионные векторы, которыми затем можно трансфицировать клетки-носители, например, клетки Е. coli, клетки обезьян линии COS, клетки яичника китайского хомячка (СНО) или миеломные клетки, которые при других условиях не продуцируют белки иммуноглобулинов, с целью синтеза моноклональных антител в рекомбинантных клетках-носителях. Обзорные статьи, посвященные рекомбинантной экспрессии ДНК, кодирующей антитела, в бактериях, включают публикации Skerra et al., Curr. Opinion in Immunol., 5: 256-262 (1993) и Plückthun, Immunol. Revs. 130: 151-188 (1992).
В дальнейших вариантах реализации, антитела можно выделить из фаговых библиотек антител, полученных с использованием методик, описанных в статье McCafferty et al., Nature, 348: 552-554 (1990). Clackson et al., Nature, 352: 624-628 (1991) и Marks et al., J. Mol. Biol., 222: 581-597 (1991) описали выделение антител мыши и человека, соответственно, с использованием фаговых библиотек. Следующие публикации описывают получение высокоаффинных (в диапазоне нМ) антител человека путем комбинирования цепей (Marks et al., Bio/Technology, 10: 779-783 (1992)), а также комбинаторную инфекцию и рекомбинацию in vivo в качестве стратегий конструирования очень крупных фаговых библиотек (Waterhouse et al., Nuc. Acids. Res., 21: 2265-2266 (1993)). Таким образом, эти методики являются жизнеспособной альтернативой традиционным гибридомным методикам выделения моноклональных антител.
Кроме того, ДНК можно модифицировать, например, путем подстановки кодирующей последовательности константных доменов тяжелой и легкой цепей человека вместо гомологичных последовательностей мыши (патент США №4,816,567; Morrison, et al., Proc. Natl. Acad. Sci. USA, 81: 6851 (1984)), или ковалентного объединения кодирующей последовательности полипептида, не являющегося иммуноглобулином, или ее фрагмента, с кодирующей последовательностью иммуноглобулина.
Обычно такие полипептиды, не являющиеся иммуноглобулинами, подставляют вместо константных доменов антитела, или вариабельных доменов одного из сайтов связывания с антигеном в составе антитела с целью создания химерного бивалентного антитела, включающего сайт связывания, обладающий специфичностью к антигену, и еще один сайт связывания, обладающий специфичностью к другому антигену.
Химерные или гибридные антитела также можно получить in vitro с помощью известных способов химического синтеза белков, включая способы, использующие перекрестно сшивающие агенты. Например, иммунотоксины можно сконструировать с помощью реакции тиольно-дисульфидного обмена или путем образования тиоэфирной связи. Примеры подходящих для этой цели реагентов включают иминотиолат и метил-4-меркаптобутиримидат.
(iii) Гуманизированные антитела и антитела человека.
Антитела в соответствии с разрабатываемым способом также могут включать гуманизированные антитела или антитела человека. Гуманизированные формы антител нечеловеческого происхождения (например, мыши) представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (например, Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), содержащие минимальное количество последовательностей, происходящих из иммуноглобулинов нечеловеческого происхождения. Гуманизированные антитела включают иммуноглобулины человека (антитела реципиента), в которых остатки из гипервариабельного участка (CDR) реципиента замещены остатками из CDR антитела нечеловеческого происхождения (антитела донора), например, антитела мыши, крысы или кролика, обладающими желательной специфичностью, аффинностью и емкостью. В некоторых случаях, остатки каркасного участка Fv иммуноглобулина человека замещают соответствующими остатками нечеловеческого происхождения. Гуманизированные антитела также могут содержать остатки, не встречающиеся ни в антителах реципиента, ни в импортированных последовательностях CDR или каркасного участка. В общем случае, Гуманизированные антитела содержат практически все из по меньшей мере одного, а обычно - двух вариабельных доменов, в которых все или практически все CDR-участки соответствуют аналогичным участкам из иммуноглобулина нечеловеческого происхождения, и все или практически все FR-области, соответствующие консенсусной последовательности иммуноглобулина человека. Гуманизированные антитела в оптимальном варианте также содержат, по меньшей мере, фрагмент константного участка иммуноглобулина (Fc), обычно происходящий из иммуноглобулина человека. Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988) and Presta, Curr. Opin. Struct. Biol. 2: 593-596 (1992).
Широко известны способы гуманизирования антител нечеловеческого происхождения. В общем случае, гуманизированное антитело несет один или несколько аминокислотных остатков, внедренных в него из источника нечеловеческого происхождения. Эти аминокислотные остатки нечеловеческого происхождения часто называют "импортными" остатками, которые обычно взяты из "импортного" вариабельного домена. Гуманизацию в принципе можно выполнить в соответствии со способом, описанным Winter и соавторами, Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-327 (1988); Verhoeyen et al., Science 239: 1534-1536 (1988), или с использованием подстановки CDR или последовательностей CDR грызунов вместо соответствующих последовательностей антитела человека. Соответственно, такие "Гуманизированные" антитела представляют собой химерные антитела (патент США №4,816,567), в которых фрагмент, существенно меньший по сравнению с интактным вариабельным доменом человека, замещен соответствующей последовательностью нечеловеческого происхождения. Фактически, Гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки в CDR-участках и, возможно, некоторые остатки в FR-участках заменены остатками из аналогичных сайтов антител грызунов.
Выбор вариабельных доменов как легких, так и тяжелых цепей человека для использования при изготовлении гуманизированных антител очень важен для снижения антигенности. Согласно так называемому способу "наилучшего соответствия", последовательность вариабельного домена антитела грызуна сравнивают с полной библиотекой известных последовательностей вариабельных доменов человека. Затем последовательность человека, наиболее близкую к последовательности грызуна, принимают в качестве человеческого каркасного участка (FR) гуманизированного антитела. Sims et al; J. Immunol., 151: 2296 (1993); Chothia et al., J. Mol. Biol., 196: 901 (1987). В еще одном способе используют определенный каркасный участок на основе консенсусной последовательности всех антител человека, относящихся к определенной подгруппе легких или тяжелых цепей. Один и тот же каркасный участок можно использовать в составе нескольких различных гуманизированных антител. Carter et al., Proc. Natl. Acad. Sci. USA, 89: 4285 (1992); Presta et al., J. Immnol., 151: 2623 (1993).
Кроме того, важно, чтобы при гуманизации сохранялась высокая аффинность антител к антигену и другие выгодные биологические свойства. Для достижения этой цели, в соответствии с предпочтительным способом, гуманизированные антитела получают с помощью анализа исходных последовательностей и различных воображаемых гуманизированных продуктов, используя трехмерные модели исходной и гуманизированной последовательностей. Трехмерные модели иммуноглобулинов общедоступны и известны специалистам. Доступны компьютерные программы, иллюстрирующие и отображающие вероятные трехмерные конформационные структуры выбранных последовательностей иммуноглобулинов-кандидатов. Исследование этих изображений позволяет проанализировать вероятную роль остатков при функционировании последовательности иммуноглобулина-кандидата, т.е. установить остатки, влияющие на способность иммуноглобулина-кандидата связываться с антигеном. Таким образом, можно выбрать и комбинировать остатки в FR-участках импортируемой последовательности и в последовательности-реципиенте, обеспечивая желательные характеристики антитела, например, повышенную аффинность к антигену(ам)-мишени(ям). В общем случае, остатки CDR-участков напрямую и в наиболее значительной степени влияют на связывание с антигеном.
В качестве альтернативы, в настоящее время возможно получить трансгенных животных (например, мышей), которые после иммунизации способны продуцировать полный репертуар антител человека при отсутствии продукции эндогенных иммуноглобулинов. Например, описано, что гомозиготная делеция гена J-сегмента тяжелых цепей антитела (JH) у химерных и мутантных зародышевых линий мышей приводит к полному ингибированию. продукции эндогенных антител. Перенос набора генов иммуноглобулинов из зародышевой линии человека в мышей таких мутантных зародышевых линий приведет к продукции антител человека после антигенной стимуляции. См., например, Jakobovits et al., Proc, Natl. Acad. Sci. USA, 90: 2551 (1993); Jakobovits et al., Nature, 362: 255-258 (1993); Bruggermann et al., Year in Immuno., 7: 33 (1993). Антитела человека также можно получить на основе библиотек фагового дисплея (Hoogenboom et al., J. Mol. Biol., 227: 381 (1991); Marks et al., J. Mol. Biol., 222: 581-597 (1991)).
Кроме того, антитела человека можно получить с помощью различных методик, известных в данной области, включая использование библиотек фагового дисплея. Hoogenboom and Winter, J. Mol. Biol. 227: 381 (1991); Marks et al., J. Mol. Biol. 222: 581 (1991). Для получения моноклональных антител человека также можно использовать методики Cole et al. и Boerner et al. (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R.Liss, p.77 (1985) и Boerner et al., J. Immunol. 147(1): 86-95 (1991). Аналогично, антитела человека можно получить путем внедрения локусов иммуноглобулина человека в трансгенных животных, например, мышей, у которых частично или полностью инактивированы гены эндогенных иммуноглобулинов. После стимуляции наблюдают продукцию антител человека, весьма сходную с таковой в организме человека во всех отношениях, включая реаранжировку генов, сборку и репертуар антител. Этот подход описан, например, в патентах США №№5,545,807; 5,545,806, 5,569,825, 5,625,126, 5,633,425, 5,661,016 и в следующих научных публикациях: Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-13 (1994), Fishwild et al., Nature Biotechnology 14: 845-51 (1996), Neuberger, Nature Biotechnology 14: 826 (1996) и Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93(1995).
(iv) Антителозависимая терапия с использованием пролекарств, опосредованная ферментом (ADEPT)
Антитела в соответствии с настоящим изобретением также можно использовать в ADEPT путем конъюгирования антитела с ферментом, активирующим пролекарство, который превращает пролекарство (например, пептидный химиотерапевтический агент, см. WO 81/01145) в активное противоопухолевое лекарство. См., например, WO 88/07378 и патент США №4,975,278.
Ферментативный компонент иммуноконъюгата, пригодный для использования в ADEPT, включает любой фермент, способный воздействовать на пролекарство, переводя его в более активную цитотоксическую форму.
Ферменты, пригодные для реализации способа в соответствии с настоящим изобретением, включают гликозидазу, глюкозооксидазу, лизоцим человека, глюкуронидазу человека, щелочную фосфатазу, пригодную для превращения фосфатсодержащих пролекарств в свободные молекулы лекарств; арилсульфатазу, пригодную для превращения сульфатсодержащих пролекарств в свободные молекулы лекарств; цитозиндезаминазу, пригодную для превращения нетоксичного 5-фторцитозина в противоопухолевое лекарство 5-фторурацил; протеазы, например, протеазу Serratia, термолизин, субтилизин, карбоксипептидазы (например, карбоксипептидазу G2 и карбоксипептидазу А) и катепсины (например, катепсины В и L), пригодные для превращения пептидсодержащих пролекарств в свободные молекулы лекарств; D-аланилкарбоксипептидазы, пригодные для превращения пролекарств, содержащих D-аминокислотные замены; углеводрасщепляющие ферменты, например, β-галактозидазу и нейраминидазу, пригодные для превращения гликозилированных пролекарств в свободные молекулы лекарств; β-лактамазу, пригодную для превращения пролекарств, модифицированных β-лактамными группами, в свободные молекулы лекарств; и пенициллинамидазы, например, амидазу пенициллина V или амидазу пенициллина G, пригодные для превращения пролекарств, модифицированных по атомам аминного азота феноксиацетильной или фенилацетильной группами, соответственно, в свободные молекулы лекарств, но не ограничиваются ими. В качестве альтернативы, для превращения пролекарств в соответствии с изобретением в свободные молекулы активных лекарств можно использовать антитела, обладающие ферментативной активностью, также известные как "абзимы" (см., например, Massey, Nature 328: 457-458 (1987)). В соответствии с описанием в настоящем документе можно получить конъюгаты антитело-абзим для доставки абзима к популяции опухолевых клеток.
Ферменты в соответствии с настоящим изобретением можно ковалентно связать с антителами к IL-17 или LIF с помощью широко известных методик, например, использования гетеробифункциональных перекрестно сшивающих агентов, обсуждавшихся выше. В качестве альтернативы, с помощью технологий рекомбинантных ДНК, широко известных в данной области, можно сконструировать гибридные белки, включающие, по меньшей мере, антигенсвязывающий участок антитела в соответствии с изобретением, присоединенный к, по меньшей мере, функционально активному фрагменту фермента в соответствии с изобретением (см., например, Neuberger et al., Nature 312: 604-608 (1984)).
(iv) Биспецифические и полиспецифические антитела
Биспецифические антитела (BsAb) представляют собой антитела, специфически связывающиеся с, по меньшей мере, двумя различными эпитопами. Такие антитела могут являться производными полноразмерных антител или фрагментов антител (например, биспецифические антитела F(ab')2).
Известны способы изготовления биспецифических антител. Традиционная продукция полноразмерных биспецифических антител основана на совместной экспрессии двух пар, состоящих из тяжелой и легкой цепи иммуноглобулина, причем эти две цепи обладают различной специфичностью. Millstein et al., Nature, 305: 537-539 (1983). Вследствие случайного выбора тяжелой и легкой цепей иммуноглобулина эти гибридомы (квадромы) потенциально продуцируют смесь 10 различных молекул антител, из которых только одна обладает правильной биспецифической структурой. Очистка соответствующего антитела, обычно выполняемая с помощью аффинной хроматографии, весьма трудоемка, а выход продукта низок. Аналогичные процедуры описаны в WO 93/08829 и статье Traunecker et al., EMBO J., 10: 3655-3659 (1991).
Вариабельные домены антител с желательной специфичностью связывания (сайты связывания антитело-антиген) можно объединить с последовательностями константных доменов иммуноглобулинов в составе гибридного белка. Этот гибрид предпочтительно содержит константный домен тяжелой цепи иммуноглобулина, включая, по меньшей мере, шарнирный фрагмент, участки СН2 и СН3. Предпочтительным является наличие, по меньшей мере, в одном из гибридов первого константного участка тяжелой цепи (СН1), содержащего сайт, необходимый для связывания с легкой цепью. ДНК, кодирующие гибриды тяжелых цепей иммуноглобулинов, и, при желании, легкой цепи иммуноглобулина, внедряют в отдельные экспрессионные векторы и совместно трансфицируют в подходящий организм-носитель. Дальнейшие подробности получения биспецифических антител см., например, в публикации Suresh et al; Methods in Enzymology 121: 210 (1986).
В соответствии с другим подходом, вариабельные домены антител с желательной специфичностью связывания (сайты связывания антитело-антиген) объединяют с последовательностями константных доменов иммуноглобулинов в составе гибридного белка. Этот гибрид предпочтительно содержит константный домен тяжелой цепи иммуногпобулина, включая, по меньшей мере, шарнирный фрагмент, участки СН2 и СН3. Предпочтительным является наличие, по меньшей мере, в одном из гибридов первого константного участка тяжелой цепи (СН1), содержащего сайт, необходимый для связывания с легкой цепью. ДНК, кодирующие гибриды тяжелых цепей иммуноглобулинов, и, при желании, легкой цепи иммуноглобулина, внедряют в отдельные экспрессионные векторы и совместно трансфицируют в подходящий организм-носитель. Этот подход обеспечивает значительную гибкость подгонки взаимного соотношения этих трех полипептидных фрагментов в вариантах реализации, если неравные соотношения этих трех полипептидных цепей, используемых при конструировании, обеспечивают оптимальный выход продукта. В то же время, возможно внедрить кодирующие последовательности двух или всех трех полипептидных цепей в один экспрессионный вектор, если экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит к высокому выходу продукта или если эти соотношения не имеют особого значения.
В соответствии с еще одним подходом, описанным в WO 96/27011, можно сконструировать область контакта между двумя молекулами антител, обеспечивая максимальное увеличение процентного соотношения гетеродимеров, выделяемых из культуры рекомбинантных клеток. Предпочтительно, область контакта содержит, по меньшей мере, фрагмент участка СН3 константного домена антитела. Согласно этому способу, одну или несколько аминокислот с небольшими боковыми цепями на поверхности контакта первой молекулы антитела заменяют аминокислотами с более крупными боковыми цепями (например, тирозином или триптофаном). На поверхности контакта другой молекулы антитела создают компенсаторные "полости" такого же или сходного размера путем замены аминокислот с крупными боковыми цепями аминокислотами с меньшими боковыми цепями (например, аланином или треонином). Этот подход обеспечивает механизм повышения выхода гетеродимера по сравнению с нежелательными конечными продуктами, например, гомодимерами.
В предпочтительном варианте реализации этого подхода, биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина на одном плече, несущей одну область специфического связывания, и гибридной пары тяжелой и легкой цепей иммуноглобулина (обеспечивающей вторую область специфического связывания) на другом плече. Обнаружено, что такая асимметричная структура облегчает отделение желательного биспецифического соединения от нежелательных комбинаций цепей иммуноглобулинов, поскольку наличие легкой цепи иммуноглобулина только на одной половине этой биспецифической молекулы обеспечивает легкий способ разделения. Этот подход описан в WO 94/04690, опубликованном 3 марта 1994 г. Дальнейшие подробности получения биспецифических антител см., например, в публикации Suresh et al., Methods in Enzymology 121: 210 (1986).
Биспецифические антитела включают перекрестно сшитые или "гетероконъюгатные" антитела. Например, одно из антител в составе гетероконъюгата может быть сопряжено с авидином, а другое - с биотином. Такие антитела были предложены, например, для адресного воздействия клеток иммунной системы на нежелательные клетки (патент США №4,676,980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373). Гетероконъюгатные антитела можно получить с помощью любого удобного способа перекрестного сшивания. Подходящие перекрестно сшивающие агенты широко известны в данной области и описаны в патенте США №4,676,980 вместе с рядом методик поперечного сшивания.
Кроме того, в литературе описаны методики получения биспецифических антител из фрагментов антител. Следующие методики также можно использовать для получения бивалентных фрагментов антител, не обязательно являющихся биспецифическими. Например, in vitro можно химически связать Fab'-фрагменты, полученные из культуры Е. coli, получая бивалентные антитела. См. Shalaby et al., J. Exp. Med., 175: 217-225 (1992).
Биспецифические антитела можно получить в виде полноразмерных антител или фрагментов антител (например, биспецифические антитела F(ab')2). В литературе описаны методики получения биспецифических антител из фрагментов антител. Например, биспецифические антитела можно получить с помощью химического связывания. Brennan et al., Science 229: 81 (1985) описывает процедуру, согласно которой интактные антитела протеолитически расщепляют, получая F(ab')2-фрагменты. Эти фрагменты восстанавливают в присутствии агента, образующего комплексы с дитиоловыми группами - арсенита натрия - с целью стабилизации соседних дитиоловых групп и предотвращения образования межмолекулярных дисульфидных связей. Полученные Fab'-фрагменты затем превращают в производные тионитробензоата (TNB). Одно из производных Fab'-TNB затем вновь превращают в производное Fab'-TNB, формируя биспецифическое антитело. Полученные биспецифические антитела можно использовать в качестве агентов для селективной иммобилизации ферментов.
Fab'-фрагменты можно напрямую выделить из культуры Е. coli и подвергнуть химическому соединению, формируя биспецифические антитела. Shalaby et al., J. Exp. Med. 175: 217-225 (1992) описывает получение молекул полностью гуманизированных биспецифических антител F(ab')2. Каждый Fab'-фрагмент отдельно выделяли из культуры Е. coli и подвергали направленному химическому соединению in vitro, формируя биспецифическое антитело. Биспецифическое антитело, полученное таким образом, было способно связываться с клетками, сверхэкспрессирующими рецептор ErbB2, и нормальными Т-клеткам и человека, а также переключать литическую активность цитотоксических лимфоцитов человека по отношению к опухолям молочной железы человека.
Кроме того, описаны различные методики изготовления и выделения бивалентных фрагментов антител напрямую из культуры рекомбинантных клеток. Например, бивалентные гетеродимеры можно получить, используя лейциновые "молнии". K-ostelny et al., J. Immunol., 148(5): 1547-1553 (1992). Пептиды-лейциновые "молнии" из белков Fos и Jun соединили с Fab'-фрагментами двух различных антител путем слияния генов. Гомодимеры антител восстанавливали по шарнирному участку, получая мономеры, и затем вновь окисляли, получая гетеродимеры антител. Технология "диател", описанная в публикации Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993), представляет альтернативный механизм изготовления биспецифических/бивалентных фрагментов антител. Фрагменты, содержащие вариабельный домен тяжелой цепи (VH), соединяют с вариабельным доменом легкой цепи (VL) с помощью короткого линкера, который не допускает сопряжения между двумя доменами на одной и той же цепи. Соответственно, стимулируют сопряжение VH и VL-доменов одного фрагмента с комплементарными VL и VH-доменами другого фрагмента, тем самым формируя два сайта связывания с антигеном. Кроме того, описана еще одна стратегия изготовления биспецифических/бивалентных фрагментов антител путем использования одноцепочечных Fv (sFv)-димеров. См. Gruber et al., J. Immunol., 152: 5368 (1994).
Рассматриваются антитела с более чем двумя валентностями. Например, можно получить триспецифические антитела. Tutt et al., J. Immunol. 147: 60 (1991).
Типичные биспецифические антитела могут связываться с двумя различными эпитопами данной молекулы. В качестве альтернативы, возможна комбинация антибелкового плеча с плечом, связывающим молекулу-активатор сигнального каскада на лейкоците, например, молекулу Т-клеточного рецептора (например, CD2, CD3, CD28 или В7), или Fc-рецептор IgG (FcγR), например, FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD 16), позволяющая сфокусировать защитные клеточные механизмы на клетках, экспрессирующих определенный белок. Биспецифические антитела также можно использовать для локализации цитотоксических агентов в области клеток, экспрессирующих определенный белок. Такие антитела содержат плечо, связывающее белок, и плечо, связывающее цитотоксический агент или радионуклидный хелатор, например, EOTUBE, DPTA, DOTA или ТЕТА. Еще одно биспецифическое антитело, представляющее интерес, связывает целевой белок, и, кроме того, связывает тканевый фактор свертывания крови (TF).
(v) Гетероконъюгатные антитела
Гетероконъюгатные антитела также рассматриваются в рамках настоящего изобретения. Гетероконъюгатные антитела состоят из двух ковалентно соединенных антител. Такие антитела были предложены, например, для адресного воздействия клеток иммунной системы на нежелательные клетки (патент США №4,676,980) и для лечения ВИЧ-инфекции. WO 91/00360, WO 92/200373 и ЕР 03089. Предполагают, что антитела можно получить in vitro с помощью известных способов химического синтеза белков, включая способы, использующие перекрестно сшивающие агенты. Например, иммунотоксины можно сконструировать с помощью реакции тиольно-дисульфидного обмена или путем образования тиоэфирной связи. Примеры подходящих для этой цели реагентов включают иминотиолат и метил-4-меркаптобутиримидат, а также реагенты, описанные, например, в патенте США №4,676,980.
С. Очистка белков, включая антитела
Если полипептид-мишень экспрессируют в рекомбинантных клетках нечеловеческого происхождения, полипептид-мишень является полностью свободным от белков или полипептидов человеческого происхождения. В то же время, для получения практически гомогенных препаратов полипептида-мишени необходимо очищать полипептид-мишень от белков или полипептидов рекомбинантной клетки. На первой стадии, культуральную среду или лизат обычно центрифугируют для удаления дисперсных остатков клеток. Затем отделяют фракции мембран и растворимых белков. Затем можно очистить полипептид-мишень из фракции растворимых белков и из мембранной фракции лизата культуры, в зависимости от того, является ли полипептид-мишень мембраносвязанным. Типичными примерами процедур очистки являются следующие процедуры: фракционирование на иммуноаффинных или ионообменных колонках; преципитация с этанолом; обращенно-фазная ВЭЖХ; хроматография на диоксиде кремния или катионообменной смоле, например, ДЭАЭ; хроматофокусирование; электрофорез в ДСН-ПААГ; преципитация с сульфатом аммония; гель-фильтрации с использованием колонок с, например, Sephadex® G-75; и колонок с белок А-сефарозой для удаления таких примесей, как IgG.
В настоящее время большинство компаний, производящих моноклональные антитела (МАЬ), используют трехколоночную схему, включающую аффинную хроматографию с белком А для захвата продукта, с последующей анионообменной хроматографией в проточном режиме для удаления отрицательно заряженных примесей, например, белка клеток-носителей (НСР), эндотоксинов, ДНК носителя и смытого с колонки белка А, а затем - катионообменную хроматографию или хроматографию с гидрофобным взаимодействием (HIC) в режиме удерживания для удаления положительно заряженных примесей, включая остаточный НСР и агрегированный продукт.
Вирусы, которые могут присутствовать в растворах белков, крупнее, чем сами белки. Таким образом, полагают, что вирусы можно удалить из раствора белка на основе их размера, путем фильтрации.
Фильтрация вирусов может удалить более крупные вирусы, например, ретровирусы (диаметром 80-100 нм), с помощью мембран с высокой пропускной способностью и номинальным размером пор около 60 нм. Поскольку также доступны для приобретения мембраны с высокой пропускной способностью и номинальным размером пор 20 нм, с помощью фильтрации можно удалить и более мелкие вирусы, например, парвовирусы (диаметром 18-26 нм), в то же время пропуская белки размером до 160 кДа (~8 нм), например, моноклональные антитела. Настоящее изобретение в первую очередь направлено на решение проблем, как правило, связанных с фильтрацией таких более мелких вирусов с помощью фильтров для удаления вирусов с порами меньшего размера.
Обычно стадию фильтрации вирусов можно осуществлять в любой из нескольких точек последующего технологического процесса. Например, при типичном процессе очистки моноклональных антител, фильтрация вирусов может иметь место после стадии инактивации вирусов низкими значениями pH, либо после промежуточной стадии колоночной хроматографии, либо после конечной стадии колоночной хроматографии.
В соответствии с настоящим изобретением, эксплуатацию блока фильтрации вирусов можно осуществлять на любой стадии последующего технологического процесса. Фильтрацию вирусов во время последующей обработки моноклональных антител обычно выполняют после стадии аффинной хроматографии (стадии захвата) и стадии ионообменной очистки (стадии доочистки). Экспериментальная установка, использованная в экспериментах, описанных в настоящем документе, показана на Фигуре 1. В то же время следует подчеркнуть, что настоящее изобретение не является столь ограниченным. Для реализации способов согласно настоящему изобретению можно использовать другие устройства, известные в данной области техники.
При фильтрации вирусов в тангенциальном потоке раствор белка обычно прокачивают по кругу при постоянной скорости потока на удерживающей стороне. Разница давлений, получаемая по обе стороны фильтра для удаления вирусов, позволяет раствору белка проникать через фильтр, в то время как вирусы остаются на удерживающей стороне.
В случае так называемой фильтрации вирусов "в нормальном потоке" или с "тупиковым фильтром" можно использовать тот же вирусный фильтр, что и при фильтрации в тангенциальном потоке, хотя периферическое оборудование и технологический процесс в этом случае значительно проще и дешевле, чем при фильтрации вирусов в тангенциальном потоке. Так, теоретически, при фильтрации в "нормальном потоке" раствор, содержащий макромолекулы, до фильтрации помещают в емкость высокого давления и продавливают через фильтр для удаления вирусов с помощью источника давления, обычно азота (газообразного) или воздуха. В качестве альтернативы, насос можно использовать со стороны концентрата, обеспечивая фильтрацию жидкости через фильтр для удаления вирусов при заранее заданной скорости потока.
В общем случае, степень тонкости фильтрации обычно выражают через размер пор или приблизительную молекулярную массу (относительную молекулярную массу), при которой молекулы удерживаются фильтром, так называемый уровень отсечки.
Вирусные фильтры известны в данной области техники и поставляются, в числе прочих, компаниями Millipore из штата Массачусетс, США, и Asahi Chemical Industry Co., Ltd. из Японии. Фильтры, пригодные для удерживания парвовирусов, включают Viresolve® Pro (Millipore Corp., Биллерика, штат Массачусетс, США). Мембрана Viresolve® Pro обладает асимметричной двуслойной структурой и изготовлена из полиэфирсульфона (PES). Структура мембраны рассчитана на удерживание вирусов размером более 20 нм, но в то же время позволяет белкам с молекулярной массой менее 180 кДа проходить сквозь мембрану. Другие фильтры, пригодные для удаления мелких вирусов, включая парвовирусы, из растворов белков, включают капсулы фильтров для удаления вирусов Novasip™ DV20 и DV50 Virus Removal Filter Capsules (Pall Corp., Ист-Хиллз, штат Нью-Йорк, США), Virosart® CPV, Planova 20 N (Asahi Kasei) и BioEX (Asahi Kasei). Капсулы фильтров Novasip DV20 grade используют мембранные картриджи с гофрированными фильтрами Ultipor VF-grade DV20 grade для удаления парвовирусов и других вирусов размером до 20 нм из растворов белков объемом до 5-10 литров. Капсулы фильтров Novasip DV50 grade включают мембранный картридж Ultipor VF DV50 grade Ultipleat® для удаления вирусов размером 40-50 нм и крупнее. Капсулы фильтров Novasip Ultipor VF поставляются в нестерильном виде, а также могут быть стерилизованы гамма-излучением. Virosart® CPV использует двуслойную полиэфирсульфоновую асимметричную мембрану и удерживает парвовирусы на 99,99%, а ретровирусы - на 99,9999%.
Предварительная фильтрация поступающего раствора может оказывать сильное влияние на производительность фильтра. Предварительная фильтрация обычно направлена на удаление загрязнений и примесей, которые могут привести к засорению вирусного фильтра, например, белковых агрегатов, ДНК и других следовых материалов.
Согласно настоящему изобретению, резкого улучшения эффективности вирусных фильтров можно достичь за счет стадии предварительной фильтрации, включающей использование как катионообменных материалов, так и материалов для удаления эндотоксинов. В этом контексте, термин "материал" или "материалы" используют для обозначения любых средств для осуществления стадий катионного обмена и удаления эндотоксинов, соответственно. Так, термин "катионообменный материал", в частности, включает, в числе прочего, катионообменные смолы, матриксы, абсорбирующие вещества и т.п. Термин "материал для удаления эндотоксинов" включает, в числе прочего, поверхность любой положительно заряженной мембраны, включая, например, хроматографические материалы для удаления эндотоксинов, аффинные материалы для удаления эндотоксинов и т.п.
Катионообменные материалы, пригодные для использования на стадии предварительной фильтрации в соответствии с настоящим изобретением включают, в числе прочего, доступные для приобретения материалы Mustang® S, Sartobind® S, Viresolve® Shield, SPFF, SPXL, Capto® S, Poros® 50 HS, Fractogel® S, Hypercel® D и т.д.
Материалы для удаления эндотоксинов, пригодные для использования на стадии предварительной фильтрации в соответствии с настоящим изобретением включают, в числе прочего, доступные для приобретения материалы Mustang® E, Mustang® Q, Sartobind® Q, Chromasorb®, Possidyne®, Capto® Q, QSFF, Poros® Q, Fractogel® Q и т.д.
Стадию предварительной фильтрации можно осуществить, например, путем сбора общего стока хроматографических колонок в ходе процесса и его обработки в системе фильтрации, включающей материал для удаления эндотоксинов, катионообменный материал и парвовирусный фильтр. Материал для удаления эндотоксинов и катионообменный материал действуют в качестве стадии предварительной фильтрации; производительность парвовирусного фильтра не зависит от последовательности двух стадий в системе фильтрации. Система фильтрации может работать непрерывно в виде единого блока или в виде различных блоков. Например, в одном из вариантов реализации, общий сток хроматографических колонок вначале обрабатывают на материалах для удаления эндотоксинов, собранный сток затем обрабатывают на катионообменных материалах, а следующий сток фильтруют через парвовирусный фильтр. Как упомянуто выше, порядок использования катионообменных материалов и материалов для удаления эндотоксинов в технологической последовательности не влияет на производительность парвовирусного фильтра. Процесс можно осуществлять в широком диапазоне pH, например, в диапазоне pH 4-10, причем оптимальная производительность фильтра зависит от профиля распределения примесей и характеристик продукта. Аналогично, концентрация белка может меняться в широком диапазоне, например, в пределах 1-40 г/л, и не ограничивает количество материала, пропускаемого через парвовирусный фильтр.
Более полное понимание настоящего изобретения будет достигнуто из следующих примеров. В то же время их не следует рассматривать в качестве информации, ограничивающей рамки настоящего изобретения. Все цитаты в тексте описания недвусмысленным образом включены в настоящий документ посредством ссылки.
Пример
Материалы и методы
1. Раствор белка
Поскольку фильтрацию вирусов во время последующей обработки моноклональных антител обычно выполняют после стадии аффинной хроматографии (стадии захвата) и стадии ионообменной очистки (стадии доочистки), все эксперименты по фильтрации выполняли с коммерчески значимыми стоками, полученными в ходе ионообменной (катионо- или анионообменной) хроматографии. Концентрация mAb и электропроводность стока катионообменной и анионообменной колонок составляли, соответственно, 10 мг/мл и 10 мСм/см, и 8 мг/мл и 4 мСм/см. Эксперименты по фильтрации выполняли либо с использованием свежего исходного материала (используемого в течение 24 часов после получения), либо с использованием исходного материала, замороженного после получения при -70°С и размороженного перед использованием при 4-8°С. В результатах, полученных для свежего или замороженного/размороженного исходного материала, не было выявлено значимых различий. Концентрацию белка определяли с помощью спектрофотометра в УФ и видимой части спектра (NanoDrop ND - 1000, NanoDrop Technologies, Уилмингтон, штат Делавэр, США) путем измерения поглощения при длине волны 280 нм.
2. Мембраны
Эксперименты по фильтрации выполняли с использованием фильтров для удерживания парвовирусов Viresolve® Pro (Millipore Corp., Биллерика, штат Массачусетс, США). Мембрана Viresolve® Pro обладала асимметричной двухслойной структурой и была изготовлена из полиэфирсульфона (PES). Структура мембраны была рассчитана на удерживание вирусов размером более 20 нм, но в то же время позволяла белкам с молекулярной массой менее 180 кДа проходить сквозь мембрану. Предварительные фильтры для Viresolve® Pro, испытанные в данном исследовании, включали глубинный фильтр Viresolve® Optiscale 40 (Millipore Corp., Биллерика, штат Массачусетс, США), 0,2-мкм стерильный фильтр Fluorodyne EX Mini (Pall Corp., Ист-Хиллз, штат Нью-Йорк, США) и мембранные адсорберы семейства Mustang® (Pall Corp., Ист-Хиллз, штат Нью-Йорк, США). Мембранные адсорберы были получены от поставщика в полностью закупоренных блоках Acrodisc®. В Таблице 1 кратко изложены ключевые свойства (функциональная группа, объем слоя, размер пор и т.д.) всех предварительных фильтров, использованных в данном исследовании.
3. Экспериментальная установка
Эксперименты по фильтрации выполняли с использованием изготовленного по специальному заказу аппарата, показанного на Фигуре 1. Загружаемый материал, т.е. полученный в ходе процесса сток, содержащий mAb, помещали в загрузочный резервуар и фильтровали через систему фильтрации, состоящую из различных комбинаций предварительных фильтров и доступных для приобретения парвовирусных фильтров. Во всех экспериментах по фильтрации использовали способ с постоянной скоростью фильтруемого потока (Pmax). Датчики давления разместили перед каждым фильтром и соединили в систему Millidaq или Netdaq для записи данных о разности давлений в зависимости от времени или массы материала, пропускаемого через систему. Фильтраты парвовирусного фильтра собирали в резервуар, который находился на датчике нагрузки для записи массы материала, пропускаемого через систему, в зависимости от времени.
Результаты и обсуждение
В процессе очистки mAb, экспрессированных в культуре клеток млекопитающих, в качестве первого этапа для удаления клеток и остатков клеток обычно используют центрифугирование и фильтрацию через глубинный фильтр, затем - аффинную хроматографию для захвата mAb и удаления белков клетки-носителя (НСР), затем - катионообменную хроматографию, фильтрацию вирусов и анионообменную хроматографию для дальнейшего удаления таких примесей, как агрегаты, вирусы, смытый с колонки белок А и НСР. Большую часть экспериментов в ходе этого исследования выполняли с использованием стока катионообменной хроматографии, которая являлась второй стадией хроматографии.
На Фигуре 2 показаны экспериментальные данные, полученные при различном давлении по разные стороны Viresolve Pro при постоянной скорости потока, равной 200 л/м2/ч в поступающем потоке раствора терапевтических mAb с использованием различных предварительных фильтров. Ось Х представляет собой массу mAb, поданную на квадратный метр вирусного фильтра. Ось Y представляет собой разность давлений по обе стороны вирусного фильтра в зависимости от массы материала, пропускаемого через фильтр. Данные однозначно показывают, что глубинный фильтр обеспечивал увеличение производительности фильтрации вирусов на несколько порядков величины по сравнению со стерильным фильтром. Аналогичные наблюдения были сделаны Bolton et al. (Bolton et al. Appl. Biochem. 43: 55-63, 2006) при оценке действия глубинного фильтра Viresolve Prefilter™ в качестве предварительного фильтра перед фильтром для удерживания парвовирусов NFP (Millipore Corp.) в растворе поликлональных IgG. Авторы связывали повышение производительности с селективной адсорбцией засоряющего агента - денатурированного белка - вследствие гидрофобных взаимодействий.
Хотя глубинные фильтры традиционно и успешно используют для осветления культуральной жидкости, существуют несколько ограничений, заслуживающих особого рассмотрения при их использовании после стадии захвата, т.е., в качестве предварительного фильтра перед фильтром для удерживания парвовирусов.
(a) Основа глубинных фильтров являются нестабильной, что делает невозможной очистку системы после установки и приводит к нестерильности процесса и возможности роста микрофлоры.
(b) Композиция глубинных фильтров включает в качестве основного компонента диатомит, который обычно является пищевым материалом и создает потенциальные проблемы с качеством продукции.
(c) Диатомит обычно получают из природных источников, его получение не связано со стандартизованным химическим процессом, и, таким образом, существует большое количество его разновидностей.
(d) Глубинные фильтры также проявляют тенденцию к вымыванию из них металлов, бета-гликанов и других примесей, удаление которых необходимо демонстрировать и подтверждать во время последующих операций.
Эти ограничения создают дополнительные трудности при разработке процесса, поскольку блоки, расположенные после глубинного фильтра, приходится конструировать с учетом необходимости адекватного удаления вымываемых веществ. В то же время, даже при условии соблюдения требований к удалению вымываемых веществ существуют поводы для беспокойства, связанные с тем, что количество веществ, вымываемых из значительной части глубинных фильтров, может существенно превышать их количество, которое можно удалить в ходе процесса; это связано с тем, что основные компоненты фильтра получены из природных источников, т.е. для них отсутствует стандартизованный процесс химического синтеза.
Таким образом, существует значительный интерес к разработке предварительных фильтров, которые не обладают этими ограничениями. Как упоминалось выше, Brown et al. (Brown et al. IBC's 20th Antibody Development and Production, San Diego, CA, 2008) недавно показали, что сильный отрицательно заряженный ионообменник Mustang S при использовании в качестве предварительного фильтра повышает производительность фильтра для удерживания парвовирусов в несколько раз. Таким образом, были выполнены эксперименты для оценки действия различных материалов предварительных фильтров на Viresolve® Pro. Экспериментальные данные, полученные при pH 5,0 и 6,5, показаны на Фигурах 3 (а) и (b). Эти данные показывают, что хотя катионообменные материалы имели небольшое преимущество перед адсорберами для удаления эндотоксинов при pH 5,0, это преимущество исчезало при pH 6,5. Хотя общая производительность обоих материалов была выше, чем у стерильного фильтра (Фигура 2), их производительность, тем не менее, была в существенной степени недостаточной для успешной эксплуатации блока в промышленном масштабе.
Основываясь на гипотезе, что как катионообменный материал, так и материал для удаления эндотоксинов могут удалять два различных засоряющих агента, каждый из которых может приводить к засорению фильтра, авторы изобретения поставили эксперимент с использованием новой системы предварительной фильтрации, включавшей как катионообменный материал, так и материал для удаления эндотоксинов. Результаты эксперимента при pH 5,0 и pH 6,5 показаны на Фигуре 4 (а) и (b), соответственно. Эти данные недвусмысленно показывают, что комбинация двух материалов давала значительно лучший эффект, чем каждый из материалов по отдельности. Например, при pH 5,0 и разности давлений, равной 20 фунтам на квадратный дюйм, комбинация катионообменного материала и материала для удаления эндотоксина обеспечивала улучшение производительности более чем на порядок величины. Хотя аналогичная тенденция также проявлялась при pH 6,5, общая производительность при этом значении pH была ниже, чем при pH 5,0. Это могло быть обусловлено более надежным удалением примесей при более низких pH.
Экспериментальные результаты при использовании MAb2 показаны на Фигуре 5. В соответствии с данными на Фигуре 4, новая система предварительной фильтрации, содержавшая как материал для удаления эндотоксинов, так и катионообменный материал, в значительной степени увеличивала производительность, показывая, что материал для удаления эндотоксинов и катионообменный материал взаимно усиливают действие друг друга и удаляют засоряющие агенты, относящиеся к двум различным классам.
Выводы
Большинство предыдущих работ фокусировались на использовании глубинных фильтров или катионообменных мембранных адсорберов в качестве предварительных фильтров для увеличения производительности фильтров для удерживания парвовирусов. Хотя глубинные фильтры обеспечивают надежный механизм повышения производительности фильтрации вирусов, ограничения, связанные с ними, например, вымывание веществ из материала фильтра, ограничивают их применение на определенных стадиях технологической последовательности очистки. Хотя катионообменные мембранные адсорберы могут увеличить производительность фильтров для удерживания парвовирусов в некоторых потоках растворов моноклональных антител (mAb), они не могут быть универсальным средством, как видно из данных настоящего исследования, что указывает на возможность присутствия множественных засоряющих агентов, на которую следует обратить внимание при дальнейшем усовершенствовании фильтров для удаления парвовирусов.
Настоящее изобретение, как демонстрируют вышеприведенные результаты экспериментов, освещает два аспекта - (1) материал для удаления эндотоксинов сам по себе может эффективно увеличивать производительность парвовирусных фильтров при его использовании для предварительной фильтрации и (2) сопряжение материала для удаления эндотоксинов и катионообменного материала в системе предварительной фильтрации может обеспечить увеличение производительности фильтрации парвовирусов в несколько раз, снижая стоимость сырья и облегчая операции фильтрации вирусов в промышленном масштабе.
Реферат
Настоящее изобретение относится к области биотехнологии. Способ улучшения производительности вирусного фильтра во время очистки белков предусматривает обработку композиции, содержащей белок, подлежащий очистке, на стадии катионного обмена и на стадии удаления эндотоксинов, одновременно или в любом порядке, перед пропусканием через указанный вирусный фильтр. При этом вирус, подлежащий удалению фильтрацией, является парвовирусом. Использование способа позволяет повысить эффективность работы вирусных фильтров. 18 з.п. ф-лы, 5 ил., 1 табл., 1 пр.

Комментарии