Гуманизированные антагонисты, направленные против c-met - RU2398777C2
Код документа: RU2398777C2
Чертежи













































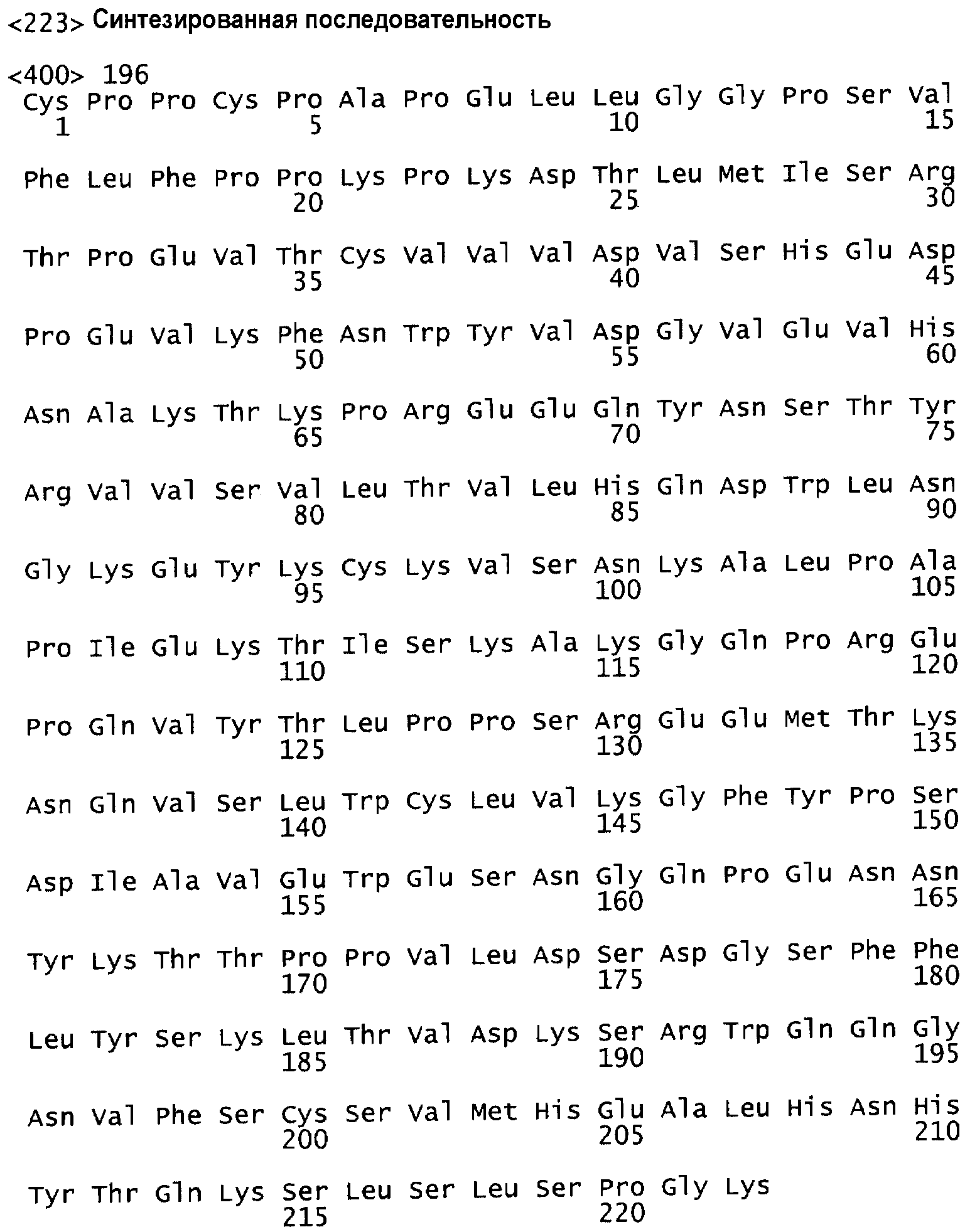




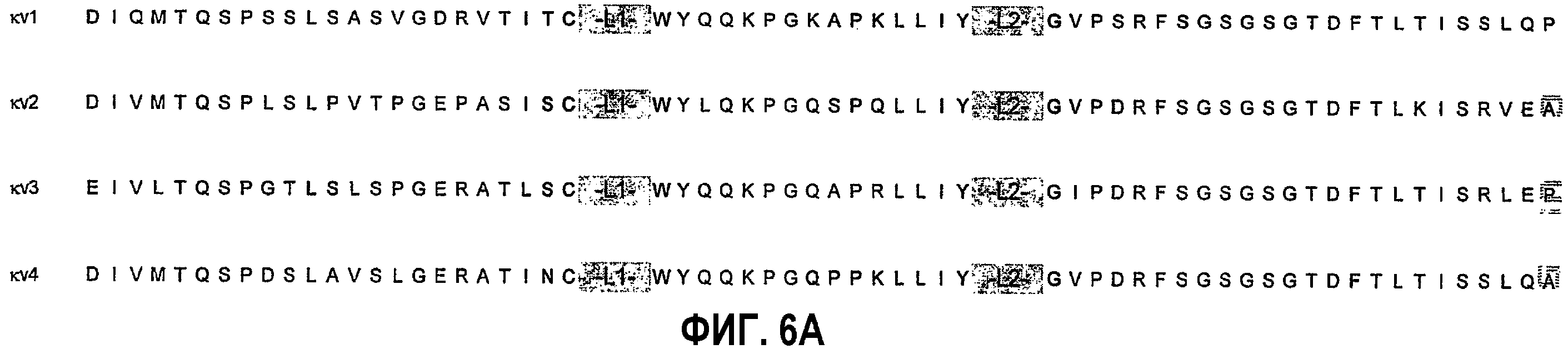







Описание
Родственные заявки
Настоящая заявка представляет собой действительную заявку, поданную в соответствии со ст. 37 СFR (Свода Федеральных правил) 1.53(b)(1), которая согласно ст. 35 USC (Кодекса законов США) 119(е) испрашивает приоритет предварительной заявки № 60/598991, поданной 5 августа 2004, содержание которой во всей своей полноте вводятся в настоящее описание посредством ссылки.
Область, к которой относится изобретение
В общих чертах настоящее изобретение относится к области молекулярной биологии и регуляции факторов роста. Более конкретно настоящее изобретение относится к модуляторам пути передачи сигнала HGF/c-met и к применению указанных модуляторов.
Предшествующий уровень техники
HGF представляет собой мезенхимальный плейотропный фактор, обладающий митогенной, мотогенной и морфогенной активностью в ряде клеток различных типов. Действие HGF опосредуется специфической тирозинкиназой, c-met и аберрантным HGF, причем экспрессия c-met часто наблюдается в различных опухолях (см., например, Maulik et al., Cytokine & Growth Factor Reviews (2002), 13:41-59; Danilkovich-Miagkova & Zbar, J. Clin. Invest. (2002) 109(7):863-867). Регуляция пути передачи сигнала HGF/c-Мet вовлечена в прогрессирование роста опухолей и развитие метастазов (см, например, Trusolino & Comoglio, Nature Rev. (2002), 2:289-300).
HGF связывается с внеклеточным доменом тирозинкиназного рецептора Met (RTK) и регулирует различные биологические процессы, такие как рассеяние, пролиферация и выживание клеток. Передача сигнала HGF-Met, в основном, происходит при нормальном развитии эмбриона, а в частности при миграции мышечных клеток-предшественников и развитии печени и нервной системы (Bladt et al., 1995; Hamanoue et al., 1996; Maina et al., 1996; Schmidt et al., 1995; Uehara et al., 1995)). Эволюционные фенотипы Met- и HGF-дефицитных мышей имеют очень большое сходство, что позволяет предположить, что HGF является узнаваемым лигандом для рецептора Met (Schmidt et al., 1995; Uehara et al., 1995). HGF-Met также играет определенную роль в регенерации печени, в ангиогенезе и в заживлении ран (Bussolino et al., 1992; Matsumoto & Nakamura, 1993; Nusrat et al., 1994). Предшественник рецептора Met подвергается протеолитическому расщеплению с образованием внеклеточной субъединицы α и мембранной остовной субъединицы β, связанных дисульфидными связями (Tempest et al., 1988). Субъединица β содержит цитоплазматический киназный домен и у своего С-конца имеет связывающий сайт для множества субстратов, где белки-адаптеры связываются и инициируют передачу сигнала (Bardelli et al., 1997; Nguyen et al., 1997; Pelicci et al., 1995; Ponzetto et al., 1994; Weidner et al., 1996). После связывания с HGF активация Met приводит к фосфорилированию тирозина и к последующей передаче сигнала посредством Gаb1- и Grb2/Sos-опосредуемой активации киназы Р13 и Rаs/MAPK, соответственно, что, в свою очередь, приводит к подвижности и пролиферации клеток (Furge et al., 2000; Hartmann et al., 1994; Ponzetto et al., 1996; Royal & Park, 1995).
Было показано, что Met трансформируется в обработанную канцерогеном клеточную линию остеосаркомы (Cooper et al., 1984; Park et al., 1986). Сверхэкспрессия или амплификация гена Met наблюдается при различных раковых заболеваниях человека. Так, например, при раке ободочной кишки наблюдается, по меньшей мере, 5-кратная сверхэкспрессия белка Met, причем, сообщалось, что при метастазах в печени происходит амплификация его гена (Di Renzo et al., 1995; Liu et al., 1992). Также сообщалось, что белок Met сверхэкспрессируется при плоскоклеточной карциноме ротовой полости, гепатоцеллюлярной карциноме, почечно-клеточной карциноме, карциноме молочной железы и карциноме легких (Jin et al., 1997; Morello et al., 2001; Natali et al., 1996; Olivero et al., 1996; Suzuki et al., 1994). Кроме того, сверхэкспрессия мРНК наблюдается в гепатоцеллюлярной карциноме, карциноме желудка и карциноме ободочной кишки (Boix et al., 1994; Kuniyasu et al., 1993; Liu et al., 1992).
При почечной папиллярной карциноме в киназном домене Met был обнаружен ряд мутаций, которые вызывают активацию конститутивного рецептора (Olivero et al. 1999; Schmidt et al., 1997; Schmidt et al., 1999). Эти активирующие мутации приводят к конститутивному фосфорилированию тирозина Met, активации МАРК, образованию патологических очагов и к онкогенезу (Jeffers et al., 1997). Кроме того, эти мутации усиливают подвижность и инвазию клеток (Giordano et al., 2000, Lorenzato et al., 2002). HGF-зависимая активация Met в трансформированных клетках опосредует увеличение подвижности, рассеяния и миграции клеток, что, в конечном счете, приводит к инвазивному росту опухоли и к развитию метастазов (Jeffers et al., 1996; Meiners et al., 1998).
Было показано, что Met взаимодействует с другими белками, которые стимулируют активацию, трансформацию и инвазию рецептора. Сообщалось, что в неопластических клетках, Met взаимодействует с интегрином α6β4, рецептором для компонентов внеклеточного матрикса (ЕСМ), таких как ламинины, и стимулирует HGF-зависимый инвазивный рост опухоли (Trusolino et al., 2001). Кроме того, было показано, что внеклеточный домен Met взаимодействует с членом семейства семафоринов, плексином В1 и усиливает инвазивный рост опухоли (Giordano et al., 2002). Кроме того, также сообщалось, что CD44v6, который участвует в онкогенезе и развитии метастазов, образует комплекс с Met и HGF, что приводит к активации рецептора Met (Orian-Rousseau et al., 2002).
Met является членом подсемейства RТК, которое включает Ron и Sea (Maulik et al., 2002). Предсказание структуры внеклеточного домена Met позволяет предположить о наличии общей гомологии Met с семафоринами и плексинами. N-конец Met содержит домен Sema, состоящий приблизительно из 500 аминокислот, которые являются консервативными для всех семафоринов и плексинов. Семафорины и плексины принадлежат к большому семейству секретируемых и мембраносвязанных белков, впервые описанных с точки зрения их роли в развитии нервных тканей (Van Vactor & Lorenz, 1999). Однако совсем недавно было обнаружено, что сверхэкспрессия семафорина коррелирует с инвазией опухоли и с метастазами. Богатый цистеином домен PSI (также называемый доменом Met-родственной последовательности), обнаруженный в плексинах, семафоринах и интегринах, расположен рядом с доменом Sеma, за которым следуют четыре повтора IРТ, которые представляют собой иммуноглобулин-подобные области, присутствующие в плексинах и в факторах транскрипции. Последние исследования позволяют предположить, что домен Sеma Met является достаточным для связывания HGF с гепарином (Gherardi et al., 2003). Кроме того, в публикации Kong-Beltran et al. (Cancer Cell (2004), 6:61-73) сообщалось, что домен Sеma Met является необходимым для димеризации и активации рецептора.
Были описаны многочисленные молекулы, нацеленные на HGF/c-met-путь передачи сигнала. Такими молекулами являются антитела, такие как антитела, описанные в патенте США № 5686292. Было показано, что часть внеклеточного домена c-met обладает антагонистическим действием, направленным против пути HGF/c-met. Однако, если принять во внимание ту важную роль, которую играет этот путь в этиологии различных патологических состояний, то совершенно очевидно, что необходимо разработать средство, которое обладало бы клиническими свойствами, являющимися оптимальными для его применения в качестве терапевтического средства. Настоящее изобретение удовлетворяет указанным требованиям, а также имеет другие преимущества.
Все цитируемые здесь работы, включая патентные заявки и публикации, во всей своей полноте вводятся в настоящее описание посредством ссылки.
Описание изобретения
Настоящее изобретение частично основано на идентификации ряда антагонистов биологического пути HGF/c-met, который представляет собой биологический/клеточный процесс, являющийся важной и преимущественной терапевтической задачей. Настоящее изобретение относится к композициям и к способам, основанным на подавлении активации HGF/c-met, включая, но не ограничиваясь ими, подавление связывания HGF с внеклеточной частью c-met и мультимеризацию рецептора. Описанные здесь антагонисты представляют собой важные терапевтические и диагностические средства, которые могут быть использованы для лечения патологических состояний, ассоциированных с аномальной или нежелательной передачей сигнала по пути HGF/c-met. В соответствии с этим настоящее изобретение относится к способам, к композициям, к наборам и к промышленным изделиям, предназначенным для модуляции пути HGF/c-met, включая модуляцию связывания с лигандом c-met, димеризацию c-met, активацию и другие биологические/физиологические активности, ассоциированные с передачей сигнала HGF/c-met.
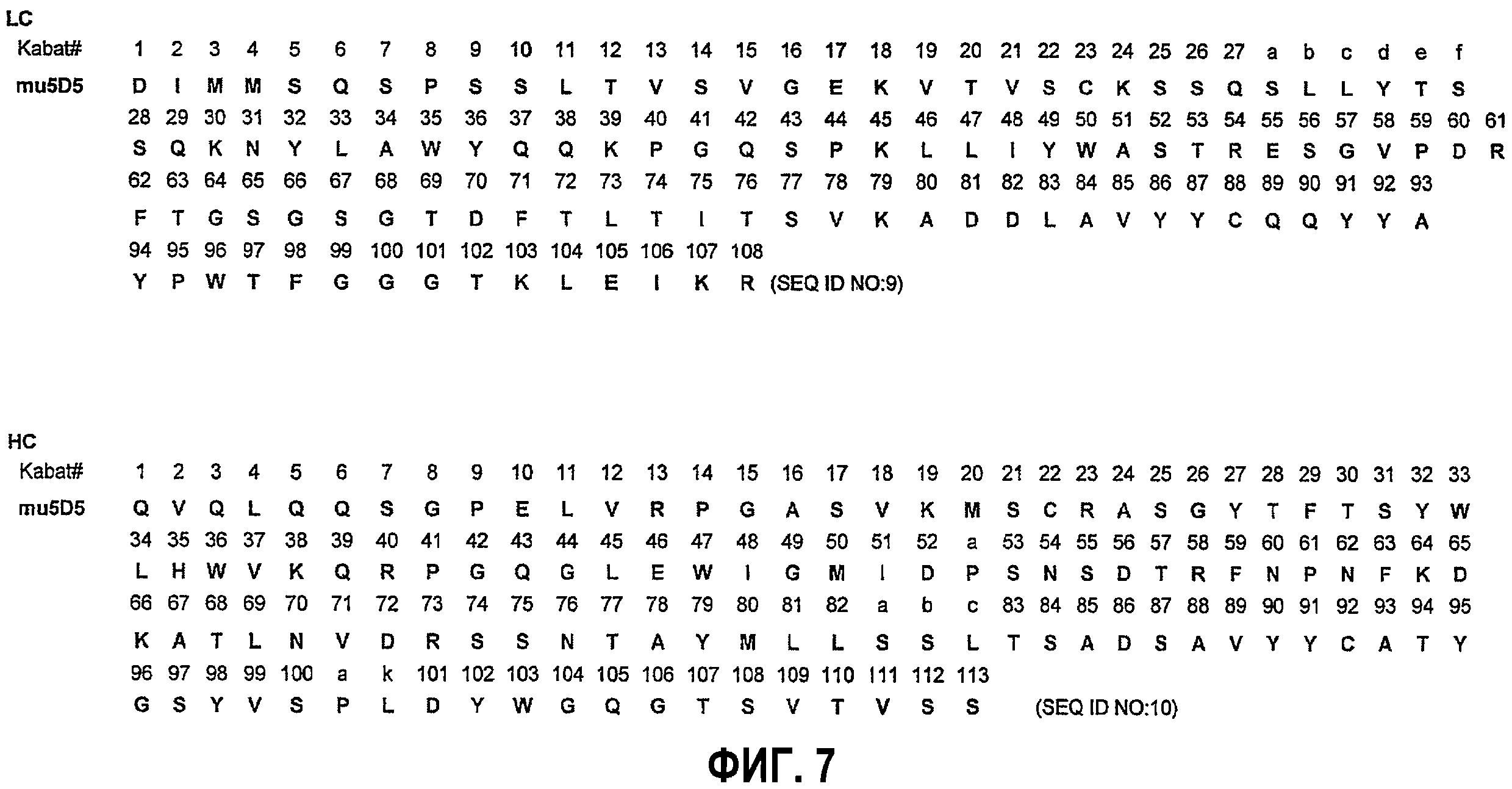
В одном из своих аспектов настоящее изобретение относится к терапевтическим средствам против HGF/c-met, подходящим для терапевтического применения и способным в различной степени нарушать пути передачи сигнала HGF/c-met. Так, например, в одном из своих вариантов настоящее изобретение относится к гуманизированному антителу против c-met, где аффинность указанного моновалентного антитела против человеческого c-met (например, аффинность Fab-фрагмента этого антитела против человеческого c-met), по существу, аналогична аффинности моновалентного мышиного антитела (например, аффинности Fab-фрагмента мышиного антитела против человеческого c-met), включающего последовательность вариабельного домена легкой цепи и тяжелой цепи, представленной на фиг.7 (SEQ ID NO:9 и 10), или состоящего, или по существу состоящего, из указанной последовательности. В другом своем варианте настоящее изобретение относится к гуманизированному антителу против c-met, где аффинность моновалентного антитела против человеческого c-met (например, аффинность Fab-фрагмента антитела против человеческого c-met) ниже, например, по меньшей мере, в 3, 5, 7 или 10 раз, чем аффинность моновалентного мышиного антитела (например, аффинность Fab-фрагмента мышиного антитела против человеческого c-met), включающего последовательность вариабельного домена легкой цепи и тяжелой цепи, представленной на фиг.7 (SEQ ID NO:9 и 10), или состоящего, или по существу, состоящего из указанной последовательности. В другом своем варианте настоящее изобретение относится к гуманизированному антителу против c-met, где аффинность моновалентного антитела против человеческого c-met (например, аффинность Fab-фрагмента антитела против человеческого c-met) является более высокой, например, по меньшей мере, в 3, 5, 7, 10 или 13 раз, чем аффинность моновалентного мышиного антитела (например, аффинность Fab-фрагмента мышиного антитела против человеческого c-met), включающего последовательность вариабельного домена легкой цепи и тяжелой цепи, представленной на фиг.7 (SEQ ID NO:9 и 10), или состоящего, или по существу, состоящего из указанной последовательности. В одном из вариантов изобретения аффинность моновалентного мышиного антитела против человеческого c-met, по существу, аналогична аффинности связывания Fab-фрагмента, содержащего последовательности вариабельного домена антитела, продуцируемого гибридомной клеточной линией, депонированной в Американской коллекции типовых культур рег.№ АТСС НВ-11894 (гибридома 1А3.3.13) или НВ-11894 (гибридома 5D5.11.6). Как хорошо установлено специалистами, аффинность связывания лиганда с его рецептором может быть определена с помощью любого из различных анализов и выражается различными количественными величинами. В соответствии с этим в одном из вариантов изобретения аффинность связывания выражается в виде величин Кd и представляет собой истинную аффинность связывания (например, с минимизированными эффектами авидности). Обычно и предпочтительно аффинность связывания измеряют in vitro, независимо от того, измеряют ли эту аффинность в бесклеточной или в клеточной системе. Как будет более подробно описано ниже, кратное различие в аффинностях связывания может быть определено количественно как отношение величины аффинности связывания моновалентного гуманизированного антитела (например, в Fab-форме) к величине аффинности связывания моновалентного эталонного антитела сравнения (например, в Fab-форме)(например, мышиного антитела, имеющего донорные последовательности гипервариабельной области), где указанные величины аффинности связывания определяют в тех же самых условиях анализа. Таким образом, в одном из вариантов изобретения кратное различие в аффинностях связывания определяют как отношение величин Кd гуманизированного антитела в Fab-форме к величине Кd аффинности связывания эталонного Fab-антитела сравнения. Так, например, в одном из вариантов изобретения, если антитело согласно изобретению (А) имеет “в 3 раза более низкую” аффинность по сравнению с аффинностью эталонного антитела (М), то величина Кd для А составляет 3х, величина Кd для М составляет 1х, а отношение Кd для А к Кd для М составляет 3:1. И наоборот, в одном из вариантов изобретения, если антитело согласно изобретению (С) имеет “в 3 раза более высокую” аффинность по сравнению с аффинностью эталонного антитела (R), то величина Кd для С составляет 1х, величина Кd для R составляет 3х, а отношение Кd для С к Кd для R составляет 1:3. Для измерения аффинности связывания может быть применен любой из различных анализов, известных специалистам, включая описанные здесь анализы, например Biacore, радиоиммуноанализ (РИА) и ELISA.
В одном из аспектов настоящего изобретения антагонист HGF/c-met согласно изобретению включает антитело против c-met, содержащее:
(а) по меньшей мере, одну, две, три, четыре или пять последовательностей гипервариабельной области (HVR), выбранных из группы, состоящей из:
(i) HVR-L1, включающей последовательность А1-А17, где А1-А17 представляет собой KSSQSLLYTSSQKNYLA (SEQ ID NO:1)
(ii) HVR-L2, включающей последовательность В1-В7, где В1-В7 представляет собой WASTRES (SEQ ID NO:2)
(iii) HVR-L3, включающей последовательность С1-С9, где С1-С9 представляет собой QQYYAYPWT (SEQ ID NO:3)
(iv) HVR-Н1, включающей последовательность D1-D10, где D1-D10 представляет собой GYTFTSYWLH (SEQ ID NO:4)
(v) HVR-H2, включающей последовательность E1-E18, где E1-E18 представляет собой GMIDPSNSDTRFNPNFKD (SEQ ID NO:5) и
(vi) HVR-H3, включающей последовательность F1-F11, где F1-F11 представляет собой XYGSYVSPLDY (SEQ ID NO:6), а Х не является R; и
(b) по меньшей мере, один вариант HVR, где указанный вариант последовательности HVR имеет модификацию, по меньшей мере, в одном остатке последовательности, представленной в SEQ ID NO:1, 2, 3, 4, 5 или 6. В одном из вариантов изобретения HVR-L1 антитела согласно изобретению содержит последовательность SEQ ID NO:1. В одном из вариантов изобретения HVR-L2 антитела согласно изобретению содержит последовательность SEQ ID NO:2. В одном из вариантов изобретения HVR-L3 антитела согласно изобретению содержит последовательность SEQ ID NO:3. В одном из вариантов изобретения HVR-Н1 антитела согласно изобретению содержит последовательность SEQ ID NO:4. В одном из вариантов изобретения HVR-Н2 антитела согласно изобретению содержит последовательность SEQ ID NO:5. В одном из вариантов изобретения HVR-Н3 антитела согласно изобретению содержит последовательность SEQ ID NO:6. В одном из вариантов изобретения HVR-Н3 содержит последовательность TYGSYVSPLDY (SEQ ID NO:7). В одном из вариантов изобретения HVR-Н3 содержит последовательность SYGSYVSPLDY (SEQ ID NO:8). В одном из вариантов изобретения антитело согласно изобретению, содержащее эти последовательности (в описанной здесь комбинации), является гуманизированным или человеческим.
В одном из своих аспектов настоящее изобретение относится к антителу, содержащему одну, две, три, четыре, пять или шесть областей HVR, где каждая область HVR содержит последовательность, или состоит, или, по существу, состоит из последовательности, которая выбрана из группы, состоящей из SEQ ID NO:1, 2, 3, 4, 5, 6, 7 и 8, и где SEQ ID NO:1 соответствует HVR-L1, SEQ ID NO:2 соответствует HVR-L2, SEQ ID NO:3 соответствует HVR-L3, SEQ ID NO:4 соответствует HVR-Н1, SEQ ID NO:5 соответствует HVR-Н2, а SEQ ID NO:6, 7 или 8 соответствуют HVR-Н3. В одном из вариантов изобретения антитело согласно изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-Н1, HVR-Н2 и HVR-Н3, где каждая из этих областей содержит SEQ ID NO:1, 2, 3, 4, 5 и 7, в соответствующем порядке. В одном из вариантов изобретения антитело согласно изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-Н1, HVR-Н2 и HVR-Н3, где каждая из этих областей содержит SEQ ID NO:1, 2, 3, 4, 5 и 8 в соответствующем порядке.
Варианты HVR в антителе согласно изобретению могут иметь модификации в одном или нескольких остатках HVR. В одном из вариантов изобретения вариант HVR-L2 содержит 1-5 (1, 2, 3, 4 или 5) замен в любой комбинации в следующих положениях: В1 (М или L), В2 (P, T, G или S), B3 (N, G, R или Т), В4 (I, N или F), В5 (P, I, L или G), В6 (A, D, T или V) и В7 (R, I, M или G). В одном из вариантов изобретения вариант HVR-Н1 содержит 1-5 (1, 2, 3, 4 или 5) замен в любой комбинации в следующих положениях: D3 (N, P, L, S, A, I), D5 (I, S или Y), D6 (G, D, T, K, R), D7 (F, H, R, S, T или V) и D9 (М или V). В одном из вариантов изобретения вариант HVR-Н2 содержит 1-4 (1, 2, 3 или 4) замены в любой комбинации в следующих положениях: Е7 (Y), Е9 (I), Е10 (I), Е14 (T или Q), E15 (D, K, S, T или V), E16 (L), E17 (E, H, N или D) и Е18 (Y, E или Н). В одном из вариантов изобретения вариант HVR-Н3 содержит 1-5 (1, 2, 3, 4 или 5) замен в любой комбинации в следующих положениях: F1 (T, S), F3 (R, S, H, T, A, K), F4 (G), F6 (R, F, M, T, E, K, A, L, W), F7 (L, I, T, R, K, V), F8 (S, A), F10 (Y, N) и F11 (Q, S, H, F). Буква(ы) в скобках после каждого положения означает(ют) репрезентативную замену (т.е. модификацию) аминокислоты, причем для специалиста в данной области очевидно, что эффективность замен одних аминокислот другими аминокислотами, в соответствии с настоящим изобретением, может быть оценена рутинными методами, известными специалистам и/или описанными в настоящей заявке. В одном из вариантов изобретения HVR-L1 имеет последовательность SEQ ID NO:1. В одном из вариантов изобретения в положении F1 в варианте HVR-Н3 присутствует Т. В одном из вариантов изобретения в положении F1 в варианте HVR-Н3 присутствует S. В одном из вариантов изобретения в положении F3 в варианте HVR-Н3 присутствует R. В одном из вариантов изобретения в положении F3 в варианте HVR-Н3 присутствует S. В одном из вариантов изобретения в положении F7 в варианте HVR-Н3 присутствует Т. В одном из вариантов изобретения антитело согласно изобретению содержит вариант HVR-Н3, где в положении F1 присутствует T или S, в положении F3 присутствует R или S, а в положении F7 присутствует Т.
В одном из вариантов изобретения антитело согласно изобретению содержит вариант HVR-Н3, где в положении F1 присутствует Т, в положении F3 присутствует R, а в положении F7 присутствует Т. В одном из вариантов изобретения антитело согласно изобретению содержит вариант HVR-Н3, где в положении F1 присутствует S. В одном из вариантов изобретения антитело согласно изобретению содержит вариант HVR-Н3, где в положении F1 присутствует Т, а в положении F3 присутствует R. В одном из вариантов изобретения антитело согласно изобретению содержит вариант HVR-Н3, где в положении F1 присутствует S, в положении F3 присутствует R, а в положении F7 присутствует Т. В одном из вариантов изобретения антитело согласно изобретению содержит вариант HVR-Н3, где в положении F1 присутствует Т, в положении F3 присутствует S, в положении F7 присутствует Т, а в положении F8 присутствует S. В одном из вариантов изобретения антитело согласно изобретению содержит вариант HVR-Н3, где в положении F1 присутствует Т, в положении F3 присутствует S, в положении F7 присутствует Т, а в положении F8 присутствует А. В некоторых вариантах изобретения указанный вариант антитела HVR-Н3 дополнительно содержит HVR-L1, HVR-L2, HVR-L3, HVR-Н1 и HVR-Н2, где каждая из этих областей содержит, в соответствующем порядке, последовательность, представленную в SEQ ID NO:1, 2, 3, 4 и 5. В некоторых вариантах изобретения такие антитела дополнительно включают консенсусную последовательность человеческой каркасной области тяжелой цепи подгруппы III. В одном из вариантов этих антител указанная консенсусная последовательность каркасной области имеет замены в положениях 71, 73 и/или 78. В некоторых вариантах этих антител в положении 71 присутствует А, в положении 73 присутствует Т и/или в положении 78 присутствует А. В одном из вариантов указанных антител эти антитела дополнительно включают консенсусную последовательность человеческой каркасной области легкой цепи кI.
В одном из вариантов изобретения антитело согласно изобретению содержит вариант HVR-H2, где в положении В6 присутствует V. В некоторых вариантах изобретения указанный вариант HVR-L2-антитела дополнительно включает HVR-L1, HVR-L3, HVR-Н1, HVR-Н2 и HVR-Н3, где каждая из этих областей содержит, в соответствующем порядке, последовательность, представленную в SEQ ID NO:1, 3, 4, 5 и 6. В некоторых вариантах изобретения указанный вариант HVR-L2-антитела дополнительно включает HVR-L1, HVR-L3, HVR-Н1, HVR-Н2 и HVR-Н3, где каждая из этих областей содержит, в соответствующем порядке, последовательность, представленную в SEQ ID NO:1, 3, 4, 5 и 7. В некоторых вариантах изобретения указанный вариант HVR-L2-антитела дополнительно включает HVR-L1, HVR-L3, HVR-Н1, HVR-Н2 и HVR-Н3, где каждая из этих областей содержит, в соответствующем порядке, последовательность, представленную в SEQ ID NO:1, 3, 4, 5 и 8. В некоторых вариантах изобретения такие антитела дополнительно включают консенсусную последовательность человеческой каркасной области тяжелой цепи подгруппы III. В одном из вариантов этих антител указанная консенсусная последовательность каркасной области имеет замены в положениях 71, 73 и/или 78. В некоторых вариантах этих антител в положении 71 присутствует А, в положении 73 присутствует Т и/или в положении 78 присутствует А. В одном из вариантов этих антител указанные антитела дополнительно включают консенсусную последовательность человеческой каркасной области легкой цепи κI.
В одном из вариантов изобретения антитело согласно изобретению содержит вариант HVR-L2, где в положении Е14 присутствует Т, в положении Е15 присутствует К, а в положении Е17 присутствует Е. В одном из вариантов изобретения антитело согласно изобретению содержит вариант HVR-Н2, где в положении Е17 присутствует Е. В некоторых вариантах изобретения указанный HVR-Н3-вариант антитела дополнительно включает HVR-L1, HVR-L2, HVR-L3, HVR-Н1 и HVR-Н3, где каждая из этих областей содержит, в соответствующем порядке, последовательность, представленную в SEQ ID NO:1, 2, 3, 4 и 6. В некоторых вариантах изобретения указанный вариант антитела HVR-Н2 дополнительно включает HVR-L1, HVR-L2, HVR-L3, HVR-Н1 и HVR-Н3, где каждая из этих областей содержит, в соответствующем порядке, последовательность, представленную в SEQ ID NO:1, 2, 3, 4 и 7. В некоторых вариантах изобретения указанный HVR-Н2-вариант антитела дополнительно включает HVR-L1, HVR-L2, HVR-L3, HVR-Н1 и HVR-Н3, где каждая из этих областей содержит, в соответствующем порядке, последовательность, представленную в SEQ ID NO:1, 2, 3, 4 и 8. В некоторых вариантах изобретения такие антитела дополнительно включают консенсусную последовательность человеческой каркасной области тяжелой цепи подгруппы III. В одном из вариантов этих антител указанная консенсусная последовательность каркасной области имеет замены в положениях 71, 73 и/или 78. В некоторых вариантах этих антител в положении 71 присутствует А, в положении 73 присутствует Т и/или в положении 78 присутствует А. В одном из вариантов этих антител указанные антитела дополнительно включают консенсусную последовательность человеческой каркасной области легкой цепи κI.
В одном из своих аспектов настоящее изобретение относится к антителу, содержащему одну, две, три, четыре, пять или все последовательности HVR, представленные на фиг. 2, 3 и/или 4 (SEQ ID NO:56-163).
Терапевтическое средство, используемое для введения индивидууму-хозяину, предпочтительно, вырабатывает незначительный иммунный ответ или вообще не вырабатывает иммунного ответа против указанного агента у данного индивидуума. В одном из своих вариантов настоящее изобретение относится к указанному агенту. Так, например, в одном из своих вариантов настоящее изобретение относится к гуманизированному антителу, которое вырабатывает и/или, предположительно, вырабатывает у индивидуума-хозяина иммунный ответ в виде продуцирования человеческого антимышиного антитела (НАМА), на уровне, который, по существу, значительно ниже уровня продуцирования антитела, содержащего последовательности SEQ ID NO:9 и 10. В другом примере настоящее изобретение относится к гуманизированному антителу, которое вырабатывает и/или, предположительно, вырабатывает минимальный иммунный ответ в виде продуцирования человеческого антимышиного антитела (НАМА), или вообще не вырабатывает такого ответа. В одном из примеров антитело согласно изобретению вырабатывает иммунный ответ в виде продуцирования антимышиного антитела на клинически приемлемом уровне или на более низком уровне.
Гуманизированное антитело согласно изобретению может содержать одну или несколько последовательностей человеческой и/или человеческой консенсусной последовательности негипервариабельной области (например, каркасной области) в вариабельном домене тяжелой цепи и/или легкой цепи. В некоторых вариантах изобретения в последовательностях человеческой и/или человеческой консенсусной последовательности негипервариабельной области присутствует одна или несколько дополнительных модификаций. В одном из вариантов изобретения вариабельный домен тяжелой цепи антитела согласно изобретению содержит человеческую консенсусную каркасную последовательность, которая, в одном из вариантов изобретения, представляет собой консенсусную каркасную последовательность подгруппы III. В одном из вариантов изобретения антитело согласно изобретению содержит консенсусную каркасную последовательность подгруппы III, модифицированную, по меньшей мере, в одном положении аминокислоты. Так, например, в одном из вариантов изобретения модифицированная консенсусная каркасная последовательность подгруппы III может содержать замену в одном или нескольких из положений 71, 73 и/или 78. В одном из вариантов изобретения указанными заменами являются R71А, N73Т и/или N78А в любой их комбинации.
Как известно специалистам, и как более подробно описано ниже, положение/окружение аминокислот, определяющих гипервариабельную область данного антитела, может варьироваться в зависимости от ситуации и различных определений, известных специалистам (как описано ниже). Некоторые положения в вариабельном домене могут рассматриваться как пограничные положения гипервариабельной области, которые, в соответствии с одним из ряда критериев, могут, предположительно, находиться в гипервариабельной области, а в соответствии с другим из ряда критериев они могут, предположительно, находиться за пределами гипервариабельной области. Одно или несколько из этих положений могут также присутствовать в удлиненных гипервариабельных областях (подробно определенных ниже). Настоящее изобретение относится к антителам, содержащим модификации в этих гибридных гипервариабельных положениях. В одном из вариантов изобретения эти гибридные гипервариабельные положения включают одно или несколько из положений 26-30, 33-35В, 47-49, 57-65, 93, 94 и 102 в вариабельном домене тяжелой цепи. В одном из вариантов изобретения эти гибридные гипервариабельные положения включают одно или несколько из положений 24-29, 35-36, 46-49, 56 и 97 в вариабельном домене легкой цепи. В одном из вариантов изобретения антитело согласно изобретению содержит вариант консенсусной каркасной последовательности человеческой цепи подгруппы III, модифицированный в одном или нескольких гибридных гипервариабельных положениях. В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, включающий вариант консенсусной каркасной последовательности человеческой цепи подгруппы III, модифицированный в одном или нескольких из положений 27-28, 30, 33-35, 49, 57-65, 94 и 102. В одном из вариантов изобретения указанное антитело имеет замену F27Y. В одном из вариантов изобретения указанное антитело имеет замену Т28N, P, L, S, A или I. В одном из вариантов изобретения указанное антитело имеет замену S30I, T или Y. В одном из вариантов изобретения указанное антитело имеет замену А33W. В одном из вариантов изобретения указанное антитело имеет замену М34L или M34V. В одном из вариантов изобретения указанное антитело имеет замену S35Н. В одном из вариантов изобретения указанное антитело имеет замену T57I. В одном из вариантов изобретения указанное антитело имеет замену Y58R. В одном из вариантов изобретения указанное антитело имеет замену Y59F. В одном из вариантов изобретения указанное антитело имеет замену A60N. В одном из вариантов изобретения указанное антитело имеет замену D61P, T или Q. В одном из вариантов изобретения указанное антитело имеет замену S62N, D, K, T или V. В одном из вариантов изобретения указанное антитело имеет замену V63F или V63L. В одном из вариантов изобретения указанное антитело имеет замену К64Е, H, N, D или Q. В одном из вариантов изобретения указанное антитело имеет замену G65D, Y, E или Н. В одном из вариантов изобретения указанное антитело имеет замену R94T или R94S. В одном из вариантов изобретения указанное антитело имеет замену Y102Q, S, H или F. В одном из вариантов изобретения указанное антитело согласно изобретению имеет указанную модификацию R94T или R94S, а также имеет одну или несколько модификаций в положении 96 и/или 100. В одном из вариантов изобретения указанными модификациями являются замены G96R и/или S100T (т.е. в HVR-Н3). В одном из вариантов изобретения указанное антитело согласно изобретению содержит вариабельный домен легкой цепи, включающий вариант консенсусной каркасной последовательности человеческой цепи каппа подгруппы I, модифицированный в одном или нескольких из положений 24, 25, 29 и 56. В одном из вариантов изобретения указанное антитело имеет замену R24K. В одном из вариантов изобретения указанное антитело имеет замену А25S. В одном из вариантов изобретения указанное антитело имеет замену I29Q. В одном из вариантов изобретения указанное антитело имеет замены S56R, I, M или G.
В одном из вариантов изобретения указанное антитело согласно изобретению содержит вариабельный домен тяжелой цепи, включающий вариант человеческой консенсусной каркасной последовательности цепи подгруппы III, модифицированный в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 или во всех положениях 27-28, 30, 33-35, 49, 57-65, 94 и 102. В одном из вариантов изобретения указанную модификацию выбирают из группы, состоящей из F27Y, T28 (N, P, L, S, A или I), S30 (I, T или Y), A33W, M34 (L,V), S35H, T57I, Y58R, Y59F, A60N, D61 (P,T,Q), S62 (N, D, K, T, V), V63 (F,L), K64(E, H, N, D, Q), G65(D, Y, E, H), R94(T,S) и Y102(Q, S, H, F). В одном из вариантов изобретения антитело согласно изобретению, содержащее указанные модификации R94T или R94S, дополнительно содержит одну или несколько модификаций в положении 96 и/или 100. В одном из вариантов изобретения указанными модификациями являются замены G96R и/или S100T (т.е. в HVR-Н3).
В одном из вариантов изобретения указанное антитело согласно изобретению содержит вариабельный домен легкой цепи, включающий вариант консенсусной каркасной последовательности человеческой цепи каппа подгруппы I, модифицированной в 1, 2, 3 или во всех положениях 24, 25, 29 и 56. В одном из вариантов изобретения модификация выбрана из группы, состоящей из R24K, A25S, I29Q и S56(R, I, M, G).
Антитело согласно изобретению может содержать любые подходящие человеческие или консенсусные каркасные человеческие последовательности легкой цепи при условии, что такое антитело обладает нужными биологическими свойствами (например, нужной аффинностью связывания). В одном из вариантов изобретения антитело согласно изобретению содержит, по меньшей мере, часть каркасной последовательности (или всю каркасную последовательность) человеческой легкой цепи κ. В одном из вариантов изобретения антитело согласно изобретению содержит, по меньшей мере, часть каркасной консенсусной последовательности (или всю эту последовательность) человеческой цепи κ подгруппы I.
В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой и/или легкой цепи, включающий каркасную последовательность, представленную в SEQ ID NO:13 и/или 16 (фиг.1), при условии, что в положении 94 тяжелой цепи отсутствует R (а предпочтительно, но необязательно, присутствует S или Т).
В одном из аспектов изобретения антитело согласно изобретению представляет собой гуманизированное антитело против c-met, которое ингибирует связывание человеческого фактора роста гепатоцитов с его рецептором более эффективно, чем эталонное антитело, включая химерное антитело против c-met, содержащее вариабельную последовательность легкой цепи и тяжелой цепи, представленную на фиг.7 (SEQ ID NO:9 и 10). Так, например, в одном из вариантов изобретения антитело согласно изобретению ингибирует связывание HGF при концентрации IC50, которая составляет менее примерно половины значения IC50 химерного антитела. В одном из вариантов изобретения величина IC50 антитела согласно изобретению составляет примерно 0,1; 0,2; 0,3 или 0,4 от величины IC50 химерного антитела. Сравнение эффективностей ингибирования связывания HGF с его рецептором может быть осуществлено различными методами, известными специалистам, включая методы, описанные ниже в примерах. В одном из вариантов изобретения величины IC50 определяют в диапазоне концентраций примерно от 0,01 нМ до 1000 нМ.
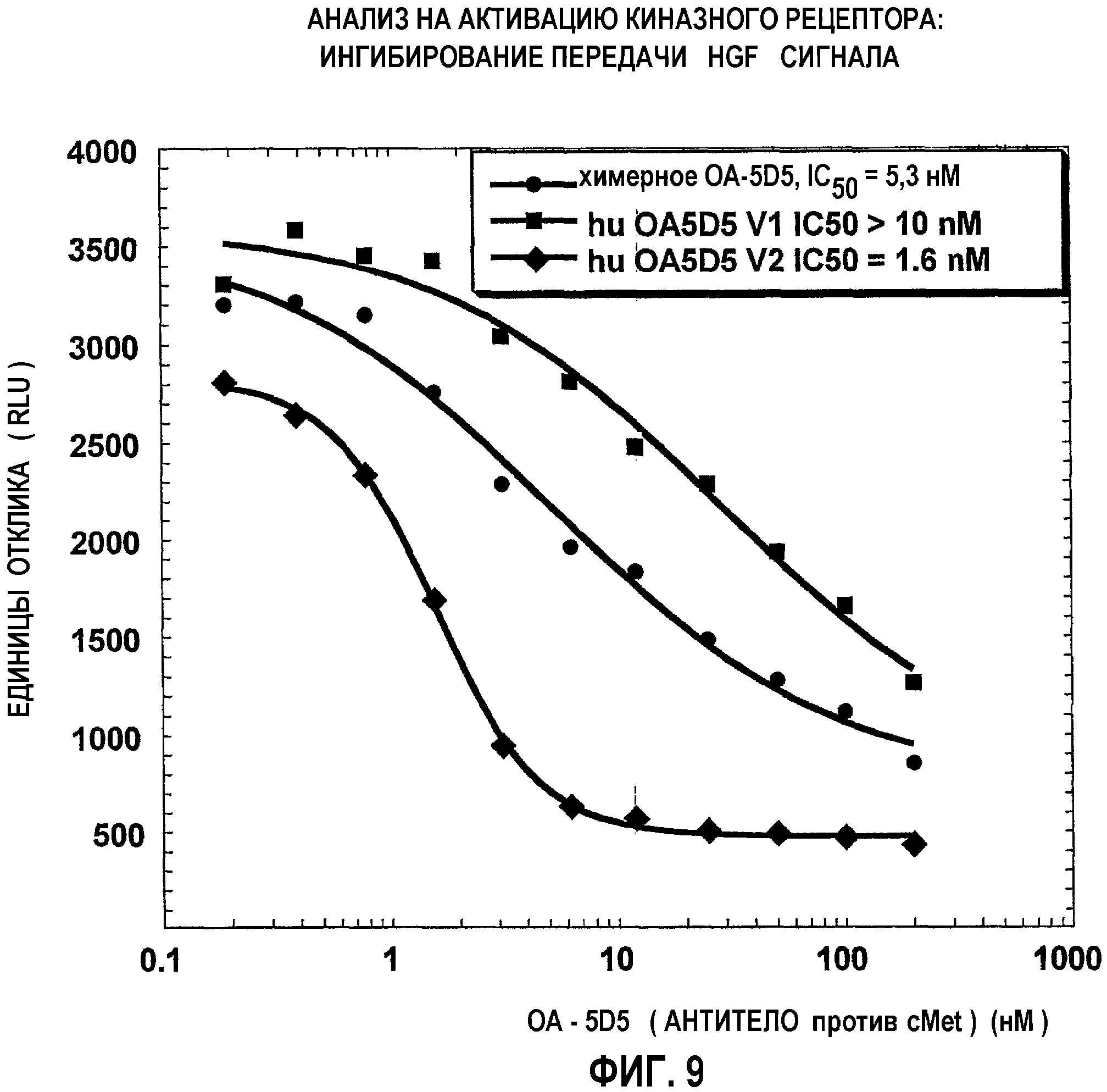
В одном из аспектов изобретения антитело согласно изобретению представляет собой гуманизированное антитело против c-met, которое ингибирует активацию рецептора человеческого фактора роста гепатоцитов (HGF) более эффективно, чем эталонное антитело, включая химерное антитело против c-met, содержащее вариабельную последовательность легкой цепи и тяжелой цепи, представленную на фиг.7 (SEQ ID NO:9 и 10). Так, например, в одном из вариантов изобретения антитело согласно изобретению ингибирует активацию рецептора при концентрации IC50, которая составляет менее примерно половины значения IC50 химерного антитела. В одном из вариантов изобретения величина IC50 антитела согласно изобретению составляет примерно 0,1; 0,2; 0,3 или 0,4 от величины IC50 химерного антитела. Сравнение эффективностей ингибирования активации рецептора HGF может быть осуществлено различными методами, известными специалистам, включая методы, описанные ниже в примерах. В одном из вариантов изобретения величины IC50 определяют в диапазоне концентраций примерно от 0,1 до 100 нМ.
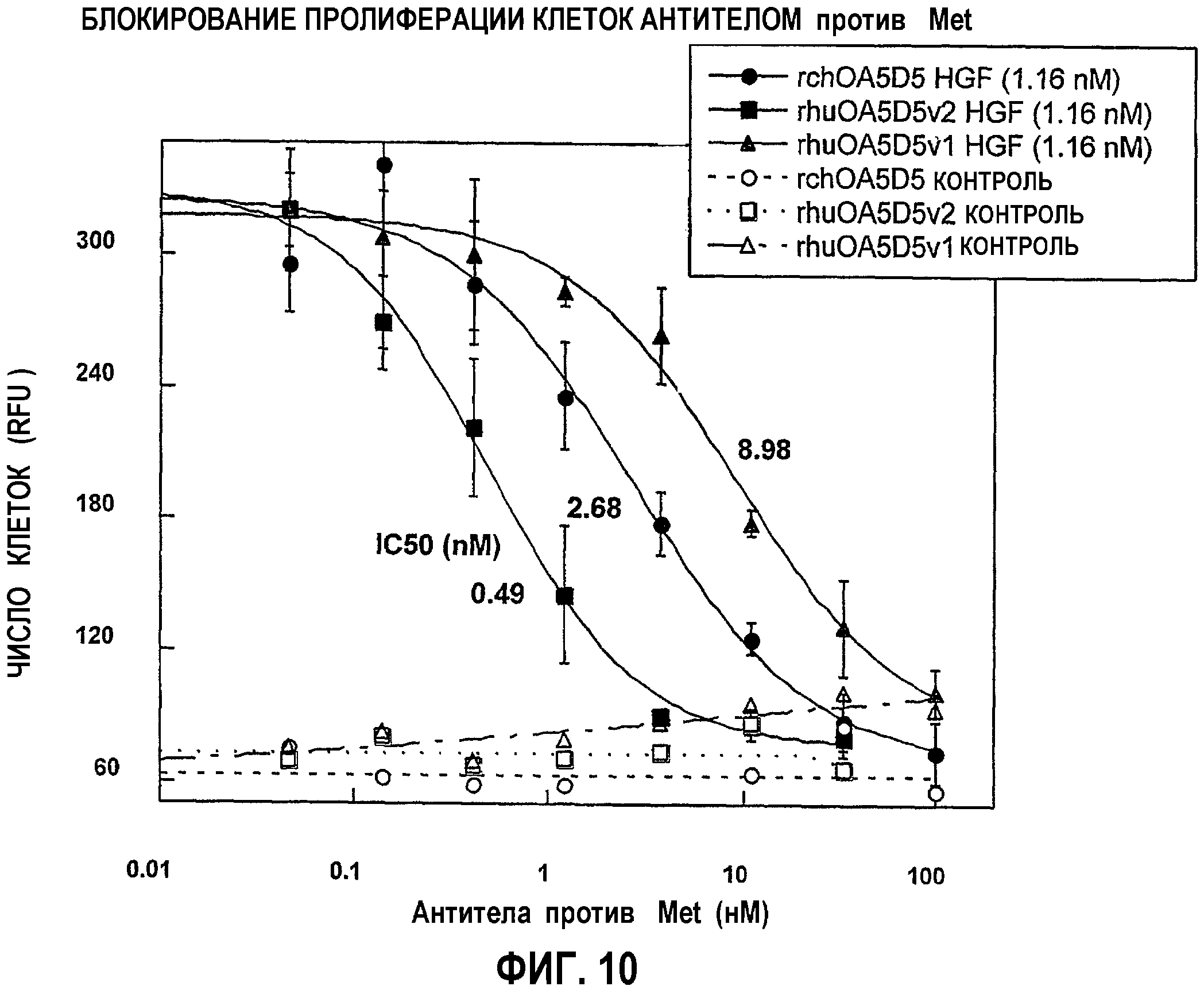
В одном из аспектов изобретения антитело согласно изобретению представляет собой гуманизированное антитело против c-met, которое ингибирует c-met-зависимую пролиферацию клеток более эффективно, чем эталонное антитело, включая химерное антитело против c-met, содержащее вариабельную последовательность легкой цепи и тяжелой цепи, представленную на фиг.7 (SEQ ID NO:9 и 10). Так, например, в одном из вариантов изобретения антитело согласно изобретению ингибирует пролиферацию клеток при концентрации IC50, которая составляет менее примерно половины значения IC50 химерного антитела. В одном из вариантов изобретения величина IC50 антитела согласно изобретению составляет примерно 0,1; 0,2; 0,3 или 0,4 от величины IC50 химерного антитела. Сравнение эффективностей ингибирования пролиферации клеток может быть осуществлено различными методами, известными специалистам, включая методы, описанные ниже в примерах. В одном из вариантов изобретения величины IC50 определяют в диапазоне концентраций примерно от 0,1 до 100 нМ.
В одном из вариантов изобретения гуманизированное антитело и химерное антитело являются моновалентными. В одном из вариантов изобретения гуманизированное антитело и химерное антитело содержат одну Fab-область, присоединенную к Fc-области. В одном из вариантов изобретения эталонное химерное антитело содержит последовательности вариабельных доменов, представленные на фиг.7 (SEQ ID NO:9 и 10), которые присоединены к человеческой Fc-области. В одном из вариантов изобретения человеческой Fc-областью является область IgG (например, IgG1, 2, 3 или 4).
В одном из своих аспектов настоящее изобретение относится к антителу, содержащему вариабельный домен тяжелой цепи, включающий последовательности HVR1-НС, HVR2-НС и/или HVR3-НС, представленные на фиг.13. В одном из вариантов изобретения вариабельный домен включает последовательности FR1-НС, FR2-НС, FR3-НС и/или FR4-НС, представленные на фиг.13. В одном из вариантов изобретения указанное антитело содержит последовательности СН1 и/или Fc, представленные на фиг.13. В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, включающий последовательности HVR1-НС, HVR2-НС и/или HVR3-НС и последовательности FR1-НС, FR2-НС, FR3-НС и/или FR4-НС, представленные на фиг.13. В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, включающий последовательности HVR1-НС, HVR2-НС и/или HVR3-НС и последовательности СН1 и/или Fc, представленные на фиг.13. В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, включающий последовательности HVR1-HC, HVR2-HC и/или HVR3-HC; последовательности FR1-HC, FR2-HC, FR3-HC и/или FR4-HC, представленные на фиг.13; и последовательности СН1 и/или Fc, представленные на фиг.13. В одном из вариантов изобретения Fc-область антитела согласно изобретению содержит комплекс, состоящий из полипептида, содержащего последовательность Fc, представленную на фиг.13, и полипептида, содержащего последовательность Fc, представленную на фиг.14.
В одном из своих аспектов настоящее изобретение относится к антителу, содержащему вариабельный домен легкой цепи, включающий последовательности HVR1-LС, HVR2-LС и/или HVR3-LС, представленные на фиг.13. В одном из вариантов изобретения указанный вариабельный домен включает последовательности FR1-LС, FR2-LС, FR3-LС и/или FR4-LС, представленные на фиг.13. В одном из вариантов изобретения указанное антитело содержит последовательность CL1, представленную на фиг.13.
В одном из вариантов изобретения антитело согласно изобретению содержит вариабельные домены легкой и тяжелой цепей, описанные в предыдущих двух параграфах. В одном из вариантов изобретения указанное антитело является моновалентным и содержит Fc-область. В одном из вариантов изобретения Fc-область содержит, по меньшей мере, один “выступ” (“вздутие”), и, по меньшей мере, одну “полость” (“углубление”), где присутствие такого выступа и такой полости способствует образованию комплекса между полипептидом Fc, содержащим указанный выступ, и полипептидом Fc, содержащим указанную полость, например, как описано в WO 2005/063816. В одном из вариантов изобретения Fc-область антитела согласно изобретению содержит первый и второй полипептиды Fc, где каждый из указанных первого и второго полипептидов имеет одну или несколько мутаций по сравнению с человеческой Fc-областью дикого типа. В одном из вариантов изобретения мутация в полости представляет собой T366S, L368A и/или Y407A. В одном из вариантов изобретения мутация в выступе представляет собой T366W. В одном из вариантов изобретения указанный первый полипептид содержит последовательность Fc, представленную на фиг.13, а указанный второй полипептид содержит последовательность Fc, представленную на фиг.14.
Антагонисты согласно одному или нескольким аспектам изобретения могут быть использованы для модуляции HGF/c-met-ассоциированных эффектов, включая, но не ограничиваясь ими, активацию с-met, последующую передачу молекулярного сигнала (например, активированное митогеном фосфорилирование протеинкиназы (МАРК)), пролиферацию клеток, миграцию клеток, выживание клеток, морфогенез клеток и ангиогенез. Эти эффекты могут модулироваться по любому биологически релевантному механизму, включая дизрупцию лиганда (например, HGF), связывающегося с c-met, фосфорилирование c-met и/или мультимеризацию c-met. В соответствии с этим в одном из своих вариантов настоящее изобретение относится к антителу-антагонисту против с-met, которое ингибирует связывание HGF с c-met. В одном из вариантов изобретения антитело-антагонист с-met согласно изобретению ингибирует мультимеризацию с-met (например, димеризацию c-met). В одном из вариантов изобретения антитело-антагонист c-met согласно изобретению ингибирует димеризацию домена Sema c-met. В одном из примеров антитело-антагонист c-met негативно влияет на способность домена Sema c-met осуществлять димеризацию c-met. Такое негативное влияние может быть прямым или опосредованным. Так, например, антитело-антагонист c-met может связываться с последовательностью в домене Sеma c-met и, тем самым, ингибировать взаимодействие указанного связанного домена с его партнером по связыванию (таким как другая молекула c-met). В другом примере антитело-антагонист c-met может связываться с последовательностью, которая не присутствует в домене Sеma c-met, но при этом такое связывание приводит к нарушению способности домена Sеma c-met взаимодействовать с его партнером по связыванию (таким как другая молекула c-met). В одном из вариантов изобретения антитело-антагонист согласно изобретению связывается с c-met (например, с внеклеточным доменом), в результате чего нарушается димеризация c-met. В одном из вариантов изобретения антитело-антагонист согласно изобретению связывается с c-met, в результате чего нарушается способность домена Sеma c-met осуществлять димеризацию c-met. Так, например, в одном из вариантов изобретения настоящее изобретение относится к антителу-антагонисту, которое, после его связывания с молекулой c-met, ингибирует димеризацию указанной молекулы. В одном из вариантов изобретения антитело-антагонист c-met согласно изобретению специфически связывается с последовательностью в домене Sеma c-met.
В одном из вариантов изобретения антитело-антагонист согласно изобретению ингибирует димеризацию c-met, включая его гомодимеризацию. В одном из вариантов изобретения антитело-антагонист согласно изобретению ингибирует димеризацию c-met, включая его гетеродимеризацию (то есть димеризацию c-met с молекулой, не являющейся c-met).
В некоторых случаях может оказаться предпочтительным получение антитела-антагониста c-met, которое не препятствует связыванию лиганда (такого как HGF) с c-met. В соответствии с этим в одном из своих вариантов настоящее изобретение относится к антителу, которое не связывается с HGF-связывающим сайтом на c-met. В другом варианте изобретения антитело согласно изобретению, по существу, не ингибирует связывание HGF с c-met. В одном из вариантов изобретения антитело согласно изобретению, по существу, не конкурирует с HGF за связывание с c-met. В одном из примеров антитело-антагонист согласно изобретению может быть использовано в комбинации с одним или несколькими другими антагонистами, где указанные антагонисты направлены на подавление различных процессов и/или функций в пути передачи сигнала HGF/c-met. Так, например, в одном из вариантов изобретения антитело-антагонист c-met согласно изобретению связывается с эпитопом на c-met, отличающимся от эпитопа, связывающегося с другим антагонистом c-met (таким как Fab-фрагмент моноклонального антитела, продуцируемого гибридомной клеточной линией, депонированной в Американской коллекции типовых культур рег. № АТСС НВ-11894 (гибридома 1А3.3.13). В другом варианте изобретения антитело-антагонист c-met согласно изобретению отличается от Fab-фрагмента (то есть, не является таким фрагментом) моноклонального антитела, продуцируемого гибридомной клеточной линией, депонированной в Американской коллекции типовых культур рег. № АТСС НВ-11894 (гибридома 1А3.3.13).
В одном из своих вариантов настоящее изобретение относится к антителу-антагонисту c-met, которое ингибирует мультимеризацию c-met и связывание с лигандом. Так, например, антитело-антагонист согласно изобретению, которое ингибирует мультимеризацию c-met (например, димеризацию), может, кроме того, обладать способностью конкурировать с HGF за связывание с c-met.
В одном из вариантов антитела-антагониста c-met согласно изобретению связывание указанного антагониста с c-met приводит к ингибированию активации c-met под действием HGF. В другом варианте антитела-антагониста c-met согласно изобретению связывание указанного антагониста с c-met в клетке приводит к ингибированию пролиферации, выживания, рассеяния, морфогенеза и/или подвижности этой клетки.
В одном из вариантов изобретения антитело-антагонист c-met согласно изобретению специфически связывается, по меньшей мере, с частью домена Sеma c-met или его варианта. В одном из примеров антитело-антагонист согласно изобретению специфически связывается, по меньшей мере, с одной из последовательностей, выбранной из группы, состоящей из LDAQT (SEQ ID NO:15)(например, остатков 269-273 с-met), LTEKRKKRS (SEQ ID NO:16)(например, остатков 300-308 c-met), KPDSAEPM (SEQ ID NO:17)(например, остатков 350-357 c-met) и NVRCLQHF (SEQ ID NO:18)(например, остатков 381-388 с-met). В одном из вариантов изобретения антитело-антагонист согласно изобретению специфически связывается с конформационным эпитопом, образованным частью или всей, по меньшей мере, из одной последовательностью, выбранной из группы, состоящей из LDAQT (например, остатков 269-273 с-met), LTEKRKKRS (например, остатков 300-308 c-met), KPDSAEPM (например, остатков 350-357 c-met) и NVRCLQHF (например, остатков 381-388 с-met). В одном из вариантов изобретения антитело-антагонист согласно изобретению специфически связывается с аминокислотной последовательностью, которая, по меньшей мере, на 50, 60, 70, 80, 90, 95 или 98% идентична или аналогична последовательностям LDAQT, LTEKRKKRS, KPDSAEPM и/или NVRCLQHF.
В одном из вариантов изобретения антитело согласно изобретению специфически связывается с рецептором HGF животного первого вида и не связывается специфически с рецептором HGF животного второго вида. В одном из вариантов изобретения указанным животным первого вида является человек и/или примат (например, собакоподобная обезьяна), а указанным животным второго вида является животное семейства мышиных (например, мышь), и/или животное семейства собачьих. В одном из вариантов изобретения указанным животным первого вида является человек. В одном из вариантов изобретения указанным животным первого вида является примат, например, собакоподобная обезьяна. В одном из вариантов изобретения указанным животным второго вида является животное семейства мышиных, например, мышь. В одном из вариантов изобретения указанным животным второго вида является животное семейства собачьих.
В одном из своих аспектов настоящее изобретение относится к композициям, содержащим одно или несколько антител-антагонистов согласно изобретению и носитель. В одном из вариантов изобретения указанный носитель является фармацевтически приемлемым.
В одном из своих аспектов настоящее изобретение относится к нуклеиновым кислотам, кодирующим антитело-антагонист против c-met согласно изобретению.
В одном из своих аспектов настоящее изобретение относится к векторам, содержащим нуклеиновую кислоту согласно изобретению. В одном из вариантов изобретения настоящее изобретение относится к клеткам-хозяевам, содержащим нуклеиновую кислоту или вектор согласно изобретению. Указанным вектором может быть вектор любого типа, например рекомбинантный вектор, такой как экспрессионный вектор. При этом могут быть использованы любые из различных клеток-хозяев. В одном из вариантов изобретения клеткой-хозяином является прокариотическая клетка, например, E.coli. В одном из вариантов изобретения клеткой-хозяином является эукариотическая клетка, например клетка млекопитающего, такая как клетка яичника китайского хомячка (СНО).
В одном из своих аспектов настоящее изобретение относится к способам получения антагониста согласно изобретению. Так, например, настоящее изобретение относится к способу получения антитела-антагониста против c-met (которое, как определено в настоящем изобретении, содержит полноразмерные последовательности и их фрагменты), где указанный способ включает экспрессию в подходящей клетке-хозяине рекомбинантного вектора согласно изобретению, кодирующего указанное антитело (или его фрагмент), и выделение указанного антитела.
В одном из своих аспектов настоящее изобретение относится к промышленному изделию, включающему контейнер и композицию, содержащуюся в этом контейнере, где указанная композиция включает одно или несколько антител-антагонистов против с-met согласно изобретению. В одном из вариантов изобретения указанная композиция содержит нуклеиновую кислоту согласно изобретению. В одном из вариантов изобретения указанная композиция содержит антитело-антагонист, а также носитель, который, в некоторых вариантах изобретения, является фармацевтически приемлемым. В одном из вариантов изобретения промышленное изделие согласно изобретению также включает инструкции по введению указанной композиции (например, антитела-антагониста) индивидууму.
В одном из своих аспектов настоящее изобретение относится к набору, содержащему первый контейнер, включающий композицию, содержащую одно или несколько антител-антагонистов против c-met согласно изобретению, и второй контейнер, включающий буфер. В одном из вариантов изобретения указанный буфер является фармацевтически приемлемым. В одном из вариантов изобретения композиция, содержащая антитело-антагонист, также содержит носитель, который, в некоторых вариантах изобретения, является фармацевтически приемлемым. В одном из вариантов изобретения указанный набор также включает инструкции по введению указанной композиции (например, антитела-антагониста) индивидууму.
В одном из своих аспектов настоящее изобретение относится к применению антитела-антагониста против c-met согласно изобретению при получении лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль, клеточно-пролиферативное расстройство, иммунное расстройство (такое как аутоиммунное расстройство) и/или расстройство, ассоциированное с нарушением ангиогенеза.
В одном из своих аспектов настоящее изобретение относится к применению нуклеиновой кислоты согласно изобретению при получении лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль, клеточно-пролиферативное расстройство, иммунное расстройство (такое как аутоиммунное расстройство) и/или расстройство, ассоциированное с нарушением ангиогенеза.
В одном из своих аспектов настоящее изобретение относится к применению экспрессионного вектора согласно изобретению при получении лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль, клеточно-пролиферативное расстройство, иммунное расстройство (такое как аутоиммунное расстройство) и/или расстройство, ассоциированное с нарушением ангиогенеза.
В одном из своих аспектов настоящее изобретение относится к применению клетки-хозяина согласно изобретению при получении лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль, клеточно-пролиферативное расстройство, иммунное расстройство (такое как аутоиммунное расстройство) и/или расстройство, ассоциированное с нарушением ангиогенеза.
В одном из своих аспектов настоящее изобретение относится к применению промышленного изделия согласно изобретению при получении лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль, клеточно-пролиферативное расстройство, иммунное расстройство (такое как аутоиммунное расстройство) и/или расстройство, ассоциированное с нарушением ангиогенеза.
В одном из своих аспектов настоящее изобретение относится к применению набора согласно изобретению при получении лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль, клеточно-пролиферативное расстройство, иммунное расстройство (такое как аутоиммунное расстройство) и/или расстройство, ассоциированное с нарушением ангиогенеза.
Настоящее изобретение относится к способам и композициям, которые пригодны для модулирования болезненных состояний, ассоциированных с нарушением регуляции HGF/c-met-путей передачи сигнала. HGF/c-met-путь передачи сигнала участвует во множестве биологических и физиологических функций, включая, например, пролиферацию клеток и ангиогенез. Таким образом, в одном из своих аспектов настоящее изобретение относится к способу, включающему введение индивидууму антитела согласно изобретению.
В одном из своих аспектов настоящее изобретение относится к способу ингибирования c-met-активированной пролиферации клеток, где указанный способ включает контактирование клеток или тканей с эффективным количеством антитела согласно изобретению и, тем самым, ингибирование пролиферации клеток, ассоциированной с активацией c-met.
В одном из своих аспектов настоящее изобретение относится к способу лечения патологического состояния, ассоциированного с нарушением регулирования активации c-met у индивидуума, где указанный способ включает введение указанному индивидууму эффективного количества антитела согласно изобретению и, тем самым, лечение указанного состояния.
В одном из своих аспектов настоящее изобретение относится к способу ингибирования роста клеток, экспрессирующих c-met или фактор роста гепатоцитов или то и другое, где указанный способ включает контактирование указанных клеток с антителом согласно изобретению и, тем самым, ингибирование роста указанных клеток. В одном из вариантов изобретения указанные клетки контактируют с HGF, экспрессируемым другой клеткой (например, посредством паракринного эффекта).
В одном из своих аспектов настоящее изобретение относится к способу терапевтического лечения млекопитающего, имеющего раковую опухоль, содержащую клетки, экспрессирующие c-met или фактор роста гепатоцитов или то и другое, где указанный способ включает введение указанному млекопитающему эффективного количества антитела согласно изобретению и, тем самым, эффективное лечение указанного млекопитающего. В одном из вариантов изобретения указанные клетки контактируют с HGF, экспрессируемым другой клеткой (например, посредством паракринного эффекта).
В одном из своих аспектов настоящее изобретение относится к способу лечения или предупреждения клеточно-пролиферативного расстройства, ассоциированного с повышенной экспрессией или активностью c-met или фактора роста гепатоцитов, или того и другого, где указанный способ включает введение индивидууму, нуждающемуся в таком лечении, эффективного количества антитела согласно изобретению и, тем самым, эффективное лечение или предупреждение указанного клеточно-пролиферативного расстройства. В одном из вариантов изобретения указанным пролиферативным расстройством является рак.
В одном из своих аспектов настоящее изобретение относится к способу ингибирования роста клеток, где рост указанных клеток, по меньшей мере частично, зависит от рост-потенцирующего действия c-met или фактора роста гепатоцитов, или того и другого, и где указанный способ включает контактирование указанных клеток с эффективным количеством антитела согласно изобретению и, тем самым, ингибирование роста указанных клеток. В одном из вариантов изобретения указанные клетки контактируют с HGF, экспрессируемым другой клеткой (например, посредством паракринного эффекта).
Настоящее изобретение относится к способу терапевтического лечения опухоли у млекопитающего, где рост указанной опухоли, по меньшей мере частично, зависит от рост-потенцирующего действия c-met или фактора роста гепатоцитов, или от того и другого, и где указанный способ включает контактирование указанных клеток с эффективным количеством антитела согласно изобретению и, тем самым, эффективное лечение указанной опухоли. В одном из вариантов изобретения указанные клетки контактируют с HGF, экспрессируемым другой клеткой (например, посредством паракринного эффекта).
Способы согласно изобретению могут быть применены для воздействия на любое релевантное патологическое состояние, например на клетки и/или ткани, ассоциированные с нарушением HGF/c-met-пути передачи сигнала. В одном из вариантов изобретения клетка, которая является мишенью в способе согласно изобретению, представляет собой раковую клетку. Так, например, раковой клеткой может быть клетка, выбранная из группы, состоящей из клеток рака молочной железы, клеток рака ободочной кишки, клеток рака легких, клеток папиллярной карциномы (например, щитовидной железы), клеток рака толстой кишки, клеток рака поджелудочной железы, клеток рака яичника, клеток рака шейки матки, клеток рака центральной нервной системы, клеток остеосаркомы, клеток карциномы почек, клеток гепатоцеллюлярной карциномы, клеток рака мочевого пузыря, клеток карциномы желудка, клеток плоскоклеточной карциномы головы и шеи, клеток меланомы и лейкозных клеток. В одном из вариантов изобретения клетка, которая является мишенью в способе согласно изобретению, представляет собой гиперпролиферирующую и/или гиперпластическую клетку. В одном из вариантов изобретения клетка, которая является мишенью в способе согласно изобретению, представляет собой диспластическую клетку. В другом варианте изобретения клетка, которая является мишенью в способе согласно изобретению, представляет собой метастатическую клетку.
Способы согласно изобретению могут также включать дополнительные стадии лечения. Так, например, в одном из вариантов изобретения указанный способ дополнительно включает стадию, в которой клетку- и/или ткань-мишень (например, раковую клетку) подвергают лучевой терапии или химиотерапии.
Как описано в настоящей заявке, активация c-met представляет собой важный биологический процесс, нарушение регуляции которого приводит к различным патологическим состояниям. В соответствии с этим в одном из вариантов способов согласно изобретению клеткой-мишенью (например, раковой клеткой) является клетка, в которой, по сравнению с нормальной клеткой той же самой ткани, наблюдается повышенный уровень активации c-met. В одном из вариантов изобретения способ согласно изобретению вызывает гибель клетки-мишени. Так, например, контактирование этой клетки с антагонистом согласно изобретению может приводить к нарушению способности данной клетки передавать сигнал по c-met-пути, и, тем самым, к ее гибели.
Нарушение регуляции активации c-met (и тем самым, передачи сигнала) может быть обусловлено различными изменениями в клетках, включая, например, сверхэкспрессию HGF (узнаваемого лиганда c-met) и/или самого c-met. В соответствии с этим в некоторых вариантах изобретения способ согласно изобретению направлен на уничтожение клетки (например, раковой клетки), в которой c-met или фактор роста гепатоцитов, либо то и другое, экспрессируются на более высоком уровне, чем в нормальной клетке той же самой ткани. Клетка, экспрессирующая c-met, может регулироваться посредством HGF, происходящего от различных источников, то есть по аутокринному или паракринному механизму. Так, например, в одном из способов согласно изобретению клетка мишень контактирует/связывается с фактором роста гепатоцитов, экспрессируемым в другой клетке (например, по паракринному механизму). Указанная другая клетка может происходить от той же самой или от другой ткани. В одном из вариантов изобретения клетка-мишень контактирует/связывается с HGF, экспрессируемым самой клеткой-мишенью (например, по аутокринному механизму/петле). Активация и/или передача сигнала c-met может также происходить независимо от лиганда. Следовательно, в одном из вариантов способов согласно изобретению активация c-met в клетке-мишени происходит независимо от лиганда.
Краткое описание графического материала
На фиг.1 проиллюстрировано выравнивание последовательностей вариабельных областей легкой и тяжелой цепей: консенсусной последовательности легкой цепи человеческого антитела подгруппы I, консенсусной последовательности тяжелой цепи человеческого антитела подгруппы III, мышиного антитела против c-met 5D5 и “гуманизированного” 5D5-гибридного антитела.
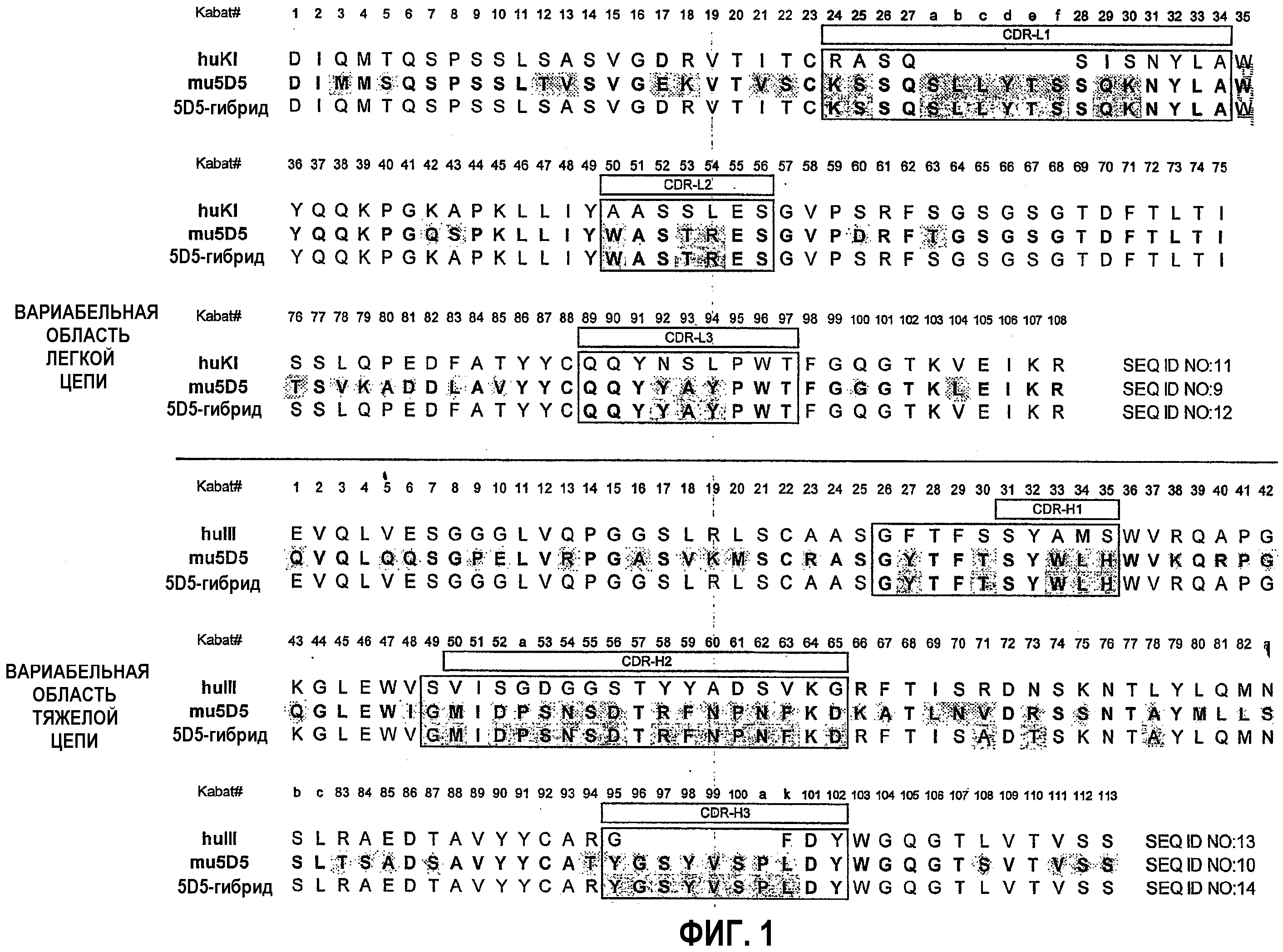
На фиг.2 представлены различные последовательности HVR аффинно зрелых антител, выбранных из библиотек с отдельно рандомизированной HVR.
На фиг.3 представлены последовательности HVR-Н3 аффинно зрелых антител, выбранных из пула библиотек, состоящих из комбинации из шести библиотек, включающих все шесть HVR, где каждая библиотека рандомизирована по одной HVR.
На фиг.4 представлены результаты анализа Biacore выбранных антител против c-met.
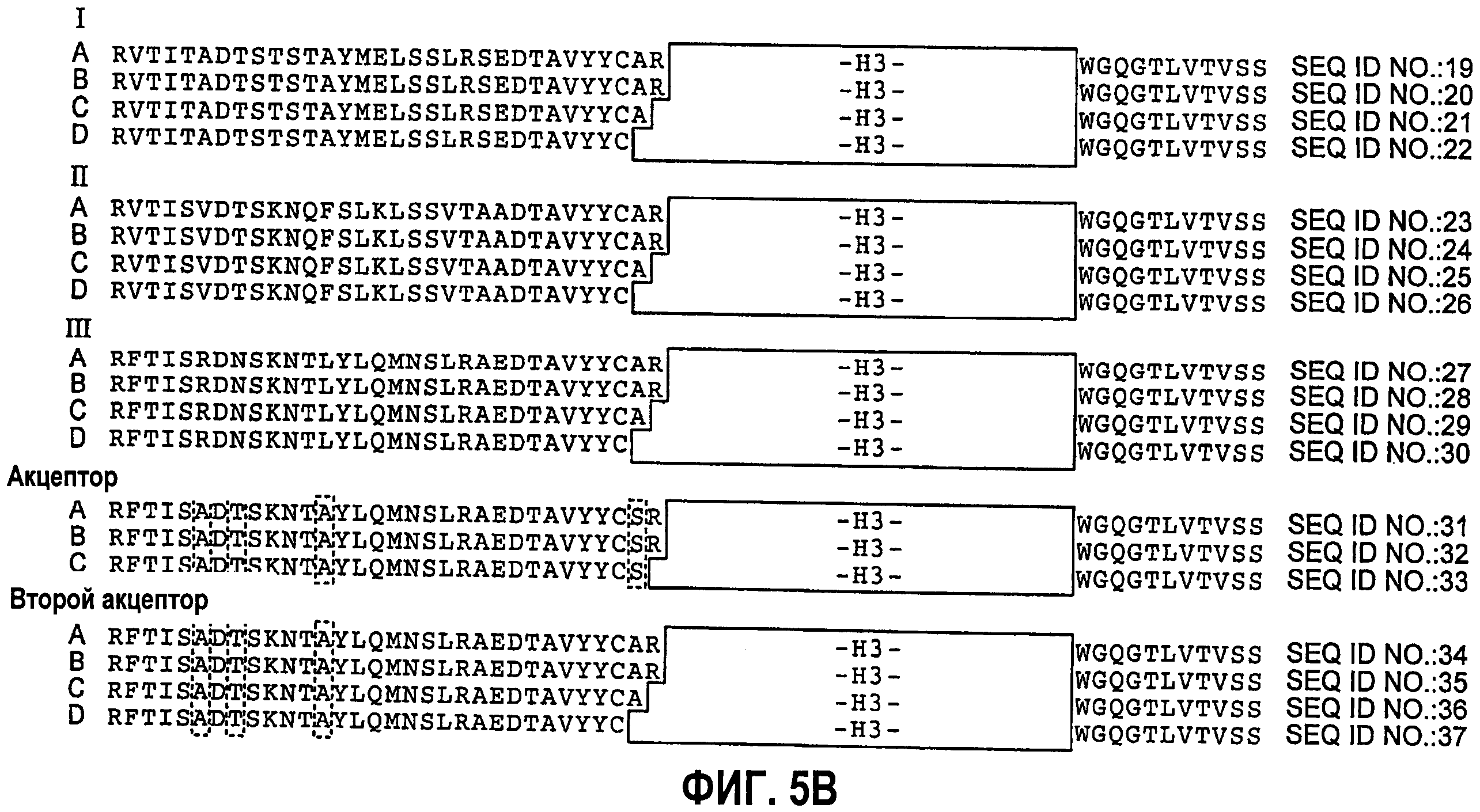
На фиг.5А,В и 6А,В представлены репрезентативные акцепторные консенсусные каркасные последовательности человеческого антитела, которые могут быть использованы в настоящем изобретении вместе со следующими идентификаторами последовательностей:
Консенсусные каркасные последовательности вариабельной области тяжелой цепи (VН)(фиг.5А,В)
консенсусная каркасная последовательность человеческой VH подгруппы I без CDR Кэбата (SEQ ID NO:19);
консенсусная каркасная последовательность человеческой VH подгруппы I без удлиненных гипервариабельных областей (SEQ ID NO:20-22);
консенсусная каркасная последовательность человеческой VH подгруппы II без CDR Кэбата (SEQ ID NO:23);
консенсусная каркасная последовательность человеческой VH подгруппы II без удлиненных гипервариабельных областей (SEQ ID NO:24-26);
консенсусная каркасная последовательность человеческой VH подгруппы III без CDR Кэбата (SEQ ID NO:27);
консенсусная каркасная последовательность человеческой VH подгруппы III без удлиненных гипервариабельных областей (SEQ ID NO:28-30);
акцепторная каркасная последовательность человеческой VH без CDR Кэбата (SEQ ID NO:31);
акцепторная каркасная последовательность человеческой VH без удлиненных гипервариабельных областей (SEQ ID NO:32-33);
акцепторная каркасная последовательность 2 человеческой VH без CDR Кэбата (SEQ ID NO:34);
акцепторная каркасная последовательность 2 человеческой VH без удлиненных гипервариабельных областей (SEQ ID NO:35-37);
Консенсусные каркасные последовательности вариабельной области легкой цепи (VL)(фиг.6А,В)
консенсусная каркасная последовательность человеческой VL каппа подгруппы I (SEQ ID NO:38);
консенсусная каркасная последовательность человеческой VL каппа подгруппы II (SEQ ID NO:39);
консенсусная каркасная последовательность человеческой VL каппа подгруппы III (SEQ ID NO:40);
консенсусная каркасная последовательность человеческой VL каппа подгруппы IV (SEQ ID NO:41).
На фиг.7 представлены последовательности вариабельного домена легкой цепи (LС) и тяжелой цепи (НС) донорного антитела (мышиного антитела 5D5).
На фиг.8 представлены графические данные для блокирования связывания HGF с его рецептором антителом согласно изобретению.
На фиг.9 представлены графические данные для ингибирования активации рецептора HGF антителом согласно изобретению.
На фиг.10 представлены графические данные для ингибирования пролиферации клеток антителом согласно изобретению: “rchOA5D5 HGF” означает химерное моноцепочечное антитело 5D5 + HGF”; “rhuOA5D5v2 HGF” означает OA5D5.v2 + HGF; “rhuOA5D5v1 HGF” означает OA5D5.v1 + HGF”. Термин “rchOA5D5-контроль” означает химерное моноцепочечное антитело 5D5 без HGF”; “rhuOA5D5v2-контроль” означает OA5D5.v2 без HGF; “rhuOA5D5v1-контроль” означает OA5D5.v1 без HGF”.
На фиг.11А,В представлены данные ингибирования фосфорилирования рецептора в присутствии антитела согласно изобретению. На фиг.11А проиллюстрировано фосфорилирование рецептора клеток Н358. На фиг.11В проиллюстрировано фосфорилирование рецептора клеток Н358, трансфицированных фактором HGF.
На фиг.12 представлены графические данные, иллюстрирующие эффективность in vivo антитела согласно изобретению. “TI” означает частоту возникновения опухолей. TI=8/10 означает, что из группы, состоящей из 10 мышей, 8 мышей имеют опухоли. TI=2/8 означает, что из группы, состоящей из 8 мышей, 2 мыши имеют опухоли.
На фиг.13 представлены аминокислотные последовательности каркасной области (FR), гипервариабельной области (HVR), первого константного домена (CL или СН1) и Fc-области (Fc) одного из вариантов антитела согласно изобретению (5D5.v2). Представленная последовательность Fc имеет мутации Т366S, L368A и Y407V во “впадинах” (полостях), как описано в WO 2005/063816.
На фиг.14 представлена последовательность полипептида Fc, содержащая мутацию T366W в “выступе” (“вздутии”), описанную в WO 2005/063816. В одном из вариантов изобретения полипептид Fc, составляющий эту последовательность, образует комплекс с полипептидом Fc, составляющим последовательность Fc, представленную на фиг.13, в результате чего образуется Fc-область антитела согласно изобретению.
Способы осуществления настоящего изобретения
Настоящее изобретение относится к способам, композициям, наборам и к промышленным изделиям для идентификации и/или использования ингибиторов пути передачи сигнала HGF/c-met.
Подробное описание этих способов, композиций, наборов и промышленных изделий приводится ниже.
Общие методы
Настоящее изобретение может быть осуществлено, если это не оговорено особо, с применением стандартных методов, известных специалистам в области молекулярной биологии (включая методы рекомбинантных ДНК), микробиологии, биологии клетки, биохимии и иммунологии. Такие методы подробно описаны в литературе, например, в руководствах: “Molecular Cloning: A Laboratory Manual”, второе издание (Sambrook et al., 1989); “Oligonucleotide Synthesis” (M.J. Gait, ed., 1984); “Animal Cell Culture” (R.I. Freshney ed., 1987); “Methods in Enzymology” (Academic Press, Inc.); “Current Protocols in Molecular Biology” (F.M. Ausubel et al., eds., 1987 и самое последнее периодическое издание); “PCR: The Polymerase Chain Reaction” (Mullis et al., ed., 1994); “A Practical Guide to Molecular Cloning” (Perbal Bernard V., 1988); “Phage Display: A Laboratory Manual” (Barbas et al., 2001).
Определения
Используемый здесь термин “модификация” аминокислотного остатка/положения означает замену в первичной аминокислотной последовательности по сравнению с исходной аминокислотной последовательностью, где указанная замена внесена в результате изменений в последовательности, сделанных в указанных аминокислотных остатках/положениях. Так, например, типичными модификациями являются замена остатка (или замена в указанном положении) другой аминокислотой (например, консервативная или неконсервативная замена), инсерция одной или нескольких (обычно менее чем 5 или 3) аминокислот, смежных с указанным остатком/положением, и делеция указанного остатка/положения. Используемый здесь термин “аминокислотная замена” или модификация означает замену аминокислотного остатка, присутствующего в уже определенной (исходной) аминокислотной последовательности, другим аминокислотным остатком. Вообще говоря, и предпочтительно, чтобы такая модификация приводила к изменению, по меньшей мере, одной физико-биохимической активности такого варианта полипептида, по сравнению с активностью полипептида, содержащего исходную аминокислотную последовательность (или последовательность “дикого типа”). Так, например, в случае антитела, указанной измененной физико-биохимической активностью может быть аффинность связывания, способность к связыванию и/или влияние такого связывания с молекулой-мишенью.
“Выделенное” антитело представляет собой антитело, которое было идентифицировано и отделено от компонентов его природного окружения и/или выделено из таких компонентов. Примесными компонентами его природного окружения являются вещества, которые могут негативно влиять на диагностическое или терапевтическое применение указанного антитела, и такими веществами могут быть ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах изобретения указанное антитело может быть очищено (1) более чем на 95% по массе антитела, как может быть определено методом Лаури, а наиболее предпочтительно, более чем на 99% по массе антитела, (2) до уровня, достаточного для продуцирования N-концевой или внутренней аминокислотной последовательности, состоящей, по меньшей мере, из 15 остатков с использованием секвенатора с центрифужными чашками, или (3) до гомогенности, оцениваемой с помощью электрофореза в ПААГ-ДСН в восстанавливающих или в не восстанавливающих условиях с использованием кумасси синего, или, предпочтительно, серебряного красителя. Выделенным антителом является антитело in situ в рекомбинантных клетках, поскольку в них отсутствует, по меньшей мере, один компонент природного окружения этого антитела. Однако, обычно, выделенное антитело может быть получено, по меньшей мере, в одну стадию очистки.
Используемый здесь термин “остаток вариабельного домена, пронумерованный по Кэбату” или “аминокислотное положение, пронумерованное по Кэбату” и их варианты означает систему, используемую для нумерации вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи антител, описанной в монографии Кэбата (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). В соответствии с этой системой нумерации фактическая первичная аминокислотная последовательность может содержать меньшее число или дополнительное число аминокислот, соответствующее укороченной или удлиненной FR- или CDR-области вариабельного домена. Так, например, вариабельный домен тяжелой цепи может включать инсерцию одной аминокислоты (остатка 52а в соответствии с нумерацией Кэбата) после остатка 52 Н2 и остатки (например, остатки 82а, 82b и 82с и т.п., в соответствии с нумерацией Кэбата), встроенные после остатка 82 FR тяжелой цепи. Нумерация остатков данного антитела по Кэбату может быть осуществлена после выравнивания его последовательности в областях гомологии со “стандартной” последовательностью, пронумерованной по Кэбату.
Используемые здесь термины “по существу, аналогичный” или “по существу, тот же самый” означают достаточно высокую степень сходства между двумя численными величинами (обычно между одной величиной, соответствующей антителу согласно изобретению, и другой величиной, соответствующей эталонному антителу сравнения), а именно такую степень сходства, которая позволяла бы специалисту в данной области считать различие между этими двумя величинами несущественными или биологически и/или статистически незначимыми в отношении их биологических свойств, определяемых указанными величинами (например, величинами Kd). Различия между указанными двумя величинами составляет, предпочтительно, менее чем примерно 50%, более предпочтительно, менее чем примерно 40%, еще более предпочтительно, менее чем примерно 30%, еще более предпочтительно, менее чем примерно 20%, а наиболее предпочтительно, менее, чем примерно на 10% по сравнению с величинами эталонного/ антитела сравнения.
Термин “аффинность связывания”, по существу, означает силу суммарных нековалентных взаимодействий одного сайта связывания молекулы (например, антитела) с его партнером по связыванию (например, с антигеном). Если это не оговорено особо, то используемый здесь термин “аффинность связывания” означает природную аффинность связывания, при которой происходит взаимодействие 1:1 между членами пар связывания (например, антитела с антигеном). Аффинность связывания молекулы Х с его партнером Y, в общих чертах, может называться константой диссоциации (Kd). Аффинность может быть определена стандартными методами, известными специалистам, включая описанные здесь методы. Низкоаффинные антитела обычно связываются с антигеном с меньшей скоростью и имеют тенденцию легко диссоциироваться, тогда как высокоаффинные антитела обычно связываются с антигеном с большей скоростью и имеют тенденцию оставаться связанными в течение более длительного периода времени. Специалистам в данной области известны различные методы измерения аффинности связывания, и для осуществления настоящего изобретения может быть применен любой из этих методов. Конкретные репрезентативные варианты осуществления изобретения описаны ниже.
В одном из вариантов изобретения “Kd” или “величину Kd” согласно изобретению определяют с помощью анализа на связывание с радиоактивно меченным антигеном (РИА), осуществляемого с использованием Fab-варианта представляющего интерес антитела и его антигена, описанного ниже, где указанный анализ позволяет измерять аффинность связывания Fab с антигеном в растворе путем уравновешивания Fab минимальной концентрацией125I-меченного антигена в присутствии титрационного набора не меченных антигенов, с последующей иммобилизацией связанного антигена на планшете, сенсибилизированном антителом против Fab-фрагмента (Chen et al. (1999) J. Mol. Biol. 293:865-881). В целях создания соответствующих условий для анализа микротитрационные планшеты (Dynex) сенсибилизируют в течение ночи 5 мкг/мл связывающего антитела против-Fab (Cappel Labs) в 50 мМ карбонате натрия (рН 9,6), а затем блокируют 2%-ным (масс./об.) альбумином бычьей сыворотки в PBS в течение 2-5 часов при комнатной температуре (приблизительно при 23°С). В не-адсорбирующем планшете (Nunc # 269620), 100 пМ или 26 пМ125I-антигена смешивают с серийными разведениями представляющего интерес Fab (например, в соответствии с оценкой антитела против VEGF, Fab-12, Presta et al. (1997) Cancer Res. 57:4593-4599). Затем представляющий интерес Fab инкубируют в течение ночи, однако, для гарантии достижения равновесия инкубирование может быть проведено в течение более длительного периода времени (например, 65 часов). После этого смеси переносят в планшет для иммобилизации и инкубируют при комнатной температуре (например, в течение одного часа). Затем раствор удаляют и планшет восемь раз промывают 0,1% Твином-20 в PBS. После сушки планшетов добавляют 150 мкл/лунку сцинтилляционной жидкости (MicroScint-20; Packard), и планшеты подсчитывают на гамма-счетчике Topcount (Packard) в течение 10 минут. Концентрации каждого Fab, которые составляют 20% или менее от максимального связывания, отбирают для их использования в анализах на конкурентное связывание. В соответствии с другим вариантом изобретения Kd или величину Kd измеряют в анализе методом поверхностного плазменного резонанса с использованием BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С с использованием чипов СМ5 с иммобилизованным на них антигеном при величине единиц отклика (RU), составляющей ~10. Вкратце биосенсорные чипы с карбоксиметилированным декстраном (CM5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщиков. Антиген разводят 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ), а затем инъецируют при скорости потока 5 мкл/минуту до достижения величины единиц отклика (RU) связанного белка, составляющей ~10. После инъекции антигена для блокирования непрореагировавших групп вводят 1М этаноламин. Для измерения кинетики реакции вводят инъекции двухкратных серийных разведений Fab (0,78 нМ-500 нМ) в PBS, содержащем 0,05% Твина-20 (PBSТ) при 25°С и при скорости потока приблизительно 25 мкл/мин. Скорость ассоциации (kon) и скорость диссоциации (koff) вычисляют с использованием простой лангмуровской модели связывания 1:1 (BIAcore Evaluation Software version 3.2) при одновременном построении сенсорограмм ассоциации и диссоциации. Константу равновесной диссоциации (Кd) вычисляют как отношение koff/kon (см., например, Chen, Y., et al. (1999) J. Mol. Biol. 293:865-881). Если скорость ассоциации превышает 106 М-1 · S-1, как было определено выше методом поверхностного плазмонного резонанса, то такая скорость ассоциации может быть определена методом гашения флуоресценции, который позволяет измерять увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм) при 25°С для 20 нМ антитела против антигена (в Fab-форме) в PBS, рН 7,2, в присутствии возрастающих концентраций антигена, как было измерено на спектрофотометре, таком как спектрометр, снабженный ограничителем потока (Aviv Instrumtnts), или на спектрофотометре SLM-Aminco серии 8000 (ThermoSpectronic), снабженном кюветой для перемешивания, содержащей красный краситель.
“Скорость ассоциации” или “kon” согласно изобретению может быть также определена описанным выше методом поверхностного плазмонного резонанса с использованием BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С и с использованием чипов СМ5 с иммобилизованным на них антигеном при величине единиц отклика (RU), составляющей ~10. Вкратце, биосенсорные чипы с карбоксиметилированным декстраном (CM5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщиков. Антиген разводят 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ), а затем инъецируют при скорости потока 5 мкл/минуту до достижения величины единиц отклика (RU) связанного белка, составляющей ~10. После инъекции антигена для блокирования не прореагировавших групп вводят 1М этаноламин. Для измерения кинетики реакции инъецируют двухкратные серийные разведения Fab (0,78 нМ-500 нМ) в PBS, содержащем 0,05% твина 20 (PBSТ) при 25°С и при скорости потока приблизительно 25 мкл/мин. Скорость ассоциации (kon) и скорости диссоциации (koff) вычисляют с использованием простой лангмуровской модели связывания 1:1 (BIAcore Evaluation Software version 3.2) при одновременном построении сенсорограмм ассоциации и диссоциации. Константу равновесной диссоциации (Кd) вычисляют как отношение koff/kon (см., например, Chen, Y., et al. (1999) J. Mol. Biol. 293:865-881). Однако, если скорость ассоциации превышает 106 М-1 · S-1, как было определено выше с помощью анализа методом поверхностного плазмонного резонанса, то такая скорость ассоциации может быть определена методом гашения флуоресценции, который позволяет измерять увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм) при 25°С для 20 нМ антитела против антигена (в Fab-форме) в PBS, рН 7,2, в присутствии возрастающих концентраций антигена, измеренных на спектрофотометре, таком как спектрометр, снабженный ограничителем потока (Aviv Instrumеtnts), или на спектрофотометре SLM-Aminco серии 8000 (ThermoSpectronic), снабженном кюветой для перемешивания. “Kd” или “величина Kd” согласно изобретению представляет собой величину, измеряемую с помощью анализа на связывание с радиоактивно меченным антигеном (РИА), осуществляемого с использованием Fab-варианта представляющего интерес антитела и указанного антигена, как описано ниже, где указанный анализ позволяет измерять аффинность связывания Fab с антигеном в растворе путем уравновешивания Fab-варианта минимальной концентрацией125I-меченного антигена в присутствии титрационного набора не меченных антигенов, с последующей иммобилизацией связанного антигена на планшете, сенсибилизированном антителом против Fab-фрагмента (Chen et al. (1999) J. Mol. Biol. 293:865-881). В целях создания соответствующих условий для анализа микротитрационные планшеты (Dynex) сенсибилизируют в течение ночи 5 мкг/мл связывающего антитела против Fab (Cappel Labs) в 50 мМ карбонате натрия (рН 9,6), а затем блокируют 2%-ным (масс./об.) альбумином бычьей сыворотки в PBS в течение 2-5 часов при комнатной температуре (приблизительно при 23°С). В не-адсорбирующем планшете (Nunc # 269620), 100 пМ или 26 пМ125I-антигена смешивают с серийными разведениями представляющего интерес Fab (например, в соответствии с анализом антитела против VEGF, Fab-12, Presta et al. (1997) Cancer Res. 57:4593-4599). Затем представляющий интерес Fab инкубируют в течение ночи, однако, для гарантии достижения равновесия, инкубирование может быть проведено в течение более длительного периода времени (например, 65 часов). После этого смеси переносят в планшет для иммобилизации и инкубируют при комнатной температуре в течение одного часа. Затем раствор удаляют и планшет восемь раз промывают 0,1% Твином-20 в PBS. После сушки планшетов добавляют 150 мкл/лунку сцинтилляционной жидкости (MicroScint-20; Packard), и планшеты подсчитывают на гамма-счетчике Topcount (Packard) в течение 10 минут. Концентрации каждого Fab, которые составляют 20% или менее от максимального связывания, отбирают для их использования в анализах на конкурентное связывание. В соответствии с другим вариантом изобретения Kd или величину Kd измеряют методом поверхностного плазмонного резонанса с использованием BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С и с использованием чипов СМ5 с иммобилизованным на них антигеном при величине единиц отклика (RU), составляющей ~10. Вкратце биосенсорные чипы с карбоксиметилированным декстраном (CM5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщиков. Антиген разводят 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ), а затем инъецируют при скорости потока 5 мкл/минуту до достижения величины единиц отклика (RU) связанного белка, составляющей ~10. После инъекции антигена для блокирования не прореагировавших групп вводят 1М этаноламин. Для измерения кинетики реакции инъецируют двухкратные серийные разведения Fab (0,78 нМ-500 нМ) в PBS, содержащем 0,05% Твина-20 (PBSТ) при 25°С и при скорости потока приблизительно 25 мкл/мин. Скорость ассоциации (kon) и скорость диссоциации (koff) вычисляют с использованием простой лангмуровской модели связывания 1:1 (BIAcore Evaluation Software version 3.2) при одновременном построении сенсорограмм ассоциации и диссоциации. Константу равновесной диссоциации (Кd) вычисляют как отношение koff/kon (см., например, Chen, Y., et al. (1999) J. Mol. Biol. 293:865-881). Если скорость ассоциации превышает 106 М-1 · S-1, как было определено выше методом поверхностного плазмонного резонанса, то такая скорость ассоциации может быть определена методом гашения флуоресценции, который позволяет измерять увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм) при 25°С для 20 нМ антитела против антигена (в Fab-форме) в PBS, рН 7,2, в присутствии возрастающих концентраций антигена, измеренных на спектрофотометре, таком как спектрометр, снабженный ограничителем потока (Aviv Instrumtnts), или спектрофотометре SLM-Aminco серии 8000 (ThermoSpectronic), снабженном кюветой для перемешивания, содержащей красный краситель.
В одном из вариантов изобретения “скорость ассоциации” или “kon” согласно изобретению может быть также определена описанным выше методом поверхностного плазмонного резонанса с использованием BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С и с использованием чипов СМ5 с иммобилизованным на них антигеном при величине единиц отклика (RU), составляющей ~10. Вкратце биосенсорные чипы с карбоксиметилированным декстраном (CM5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщиков. Антиген разводят 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ), а затем инъецируют при скорости потока 5 мкл/минуту до достижения величины единиц отклика (RU) связанного белка, составляющей ~10. Затем вводят 1М этаноламин для блокирования не прореагировавших групп. Для измерения кинетики реакции инъецируют двухкратные серийные разведения Fab (0,78 нМ-500 нМ) в PBS, содержащем 0,05% Твина-20 (PBSТ) при 25°С и при скорости потока приблизительно 25 мкл/мин. Скорость ассоциации (kon) и скорости диссоциации (koff) вычисляют с использованием простой лангмуровской модели связывания 1:1 (BIAcore Evaluation Software version 3.2) при одновременном построении сенсорограмм ассоциации и диссоциации. Константу равновесной диссоциации (Кd) вычисляют как отношение koff/kon (см., например, Chen, Y., et al. (1999) J. Mol. Biol. 293:865-881). Однако, если скорость ассоциации превышает 106 М-1 · S-1, как было определено выше методом поверхностного плазмонного резонанса, то такая скорость ассоциации может быть определена методом гашения флуоресценции, который позволяет измерять увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм) при 25°С для 20 нМ антитела против антигена (в Fab-форме) в PBS, рН 7,2, в присутствии возрастающих концентраций антигена, измеренных на спектрофотометре, таком как спектрометр, снабженный ограничителем потока (Aviv Instrumtnts), или на спектрофотометре SLM-Aminco серии 8000 (ThermoSpectronic), снабженном кюветой для перемешивания.
Используемые здесь термины “по существу сниженный” или “по существу, отличающийся” означают достаточно высокую степень различия между двумя численными величинами (обычно, между одной величиной, соответствующей антителу согласно изобретению, и другой величиной, соответствующей эталонному/антителу сравнения), а именно такую степень различия, которая позволяла бы специалисту в данной области считать различие между двумя измеренными величинами, характеризующими их биологические свойства (например, величинами Kd, НАМА-ответ), статистически значимыми. Различия между указанными двумя величинами составляет, предпочтительно, более чем примерно 10%, более предпочтительно, более чем примерно 20%, еще более предпочтительно, более чем примерно 30%, еще более предпочтительно, более чем примерно 40%, а наиболее предпочтительно, более чем примерно на 50% по сравнению с величинами для эталонного/антитела сравнения.
“Процент (%) идентичности аминокислотных последовательностей” пептидов или полипептидов определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в конкретной пептидной или полипептидной последовательности, после выравнивания этих последовательностей и введения в них “пробелов”, если это необходимо, для достижения максимального процента идентичности последовательностей, причем какие-либо консервативные замены не рассматриваются как часть идентичных последовательностей. Выравнивание, осуществляемое в целях определения процента идентичности аминокислотных последовательностей, может быть проведено различными методами, известными специалистам, например, с использованием общедоступных компьютерных программ, таких как программы BLAST, BLAST-2, ALIGN или Mеgalign (DNASTAR). Специалист в данной области может самостоятельно определить соответствующие параметры выравнивания, включая использование любых алгоритмов, необходимых для достижения оптимального выравнивания по всей длине сравниваемых последовательностей. Однако в целях настоящего изобретения % идентичности аминокислотных последовательностей вычисляют с применением компьютерных программ ALIGN-2, используемых для сравнения последовательностей, и полный исходный код для программы ALIGN-2 представлен ниже в таблице А. Компьютерная программа ALIGN-2, предназначенная для сравнения последовательностей, была разработана фирмой Genentech, Inc. и указанный исходный код, представленный ниже в таблице А, был зарегистрирован в документации для пользователей в Ведомстве по копирайту США Вашингтон, D.C., 20559, под регистрационным номером U.S. Copyright Registration No TXU510087. Программа ALIGN-2 является общедоступной программой от Genentech, Inc. South San Francisco, California либо она может быть составлена по исходному коду, приведенному ниже на фиг.8. Программа ALIGN-2 должна быть составлена для применения в операционной системе UNIX, а предпочтительно в цифровой системе UNIX V4.0D. Все параметры сравнения последовательностей были установлены в программе ALIGN-2 и не изменялись.
В случае, если для сравнения аминокислотных последовательностей используется программа ALIGN-2, то % идентичности данной аминокислотной последовательности А с данной аминокислотной последовательностью В (или, другими словами, данная аминокислотная последовательность А имеет или составляет определенный % идентичности с данной аминокислотной последовательностью В) вычисляют следующим образом:
100 · Х/Y,
где Х представляет собой число аминокислотных остатков, которые были оценены как полностью соответствующие при выравнивании последовательностей с использованием программы ALIGN-2, с помощью которой проводили сравнение последовательностей А и В, и где Y представляет собой полное число аминокислотных последовательностей в последовательности В. При этом следует отметить, что если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, то % идентичности аминокислотной последовательности А аминокислотной последовательности В не равен % идентичности аминокислотной последовательности В аминокислотной последовательности А.
Если это не оговорено особо, то общий % идентичности используемых здесь аминокислотных последовательностей вычисляли, как описано в предыдущем параграфе с использованием компьютерной программы ALIGN-2.
Таблица А
















Используемый здесь термин “вектор” означает молекулу нуклеиновой кислоты, способную переносить другую нуклеиновую кислоту, к которой она присоединена. Одним типом векторов является “плазмида”, представляющая собой кольцевую двухцепочечную ДНК-петлю, с которой могут быть лигированы дополнительные ДНК-сегменты. Другим типом вектора является фаговый вектор. Еще одним типом вектора является вирусный вектор, в котором дополнительные ДНК-сегменты могут быть лигированы с вирусным геномом. Некоторые векторы способны автономно реплицироваться в клетке-хозяине, в которую они были введены (например, бактериальные векторы, имеющие бактериальный ориджин репликации, и эписомные векторы млекопитающих). Другие векторы (например, не-эписомные векторы млекопитающих) могут интегрироваться в геном клетки-хозяина после их введения в указанную клетку-хозяина, в результате чего они могут реплицироваться вместе с геномом хозяина. Кроме того, некоторые векторы способны регулировать экспрессию генов, к которым они были функционально присоединены. Такие векторы называются здесь “рекомбинантными экспрессионными векторами” (или просто “рекомбинантными векторами”). В общих чертах, экспрессионные векторы, обычно применяемые в методах рекомбинантных ДНК, часто имеют форму плазмид. В настоящем описании термины “плазмида” и “вектор” могут быть взаимозаменяемыми, поскольку плазмида является наиболее распространенной формой вектора.
Используемые здесь термины “полинуклеотид” или “нуклеиновая кислота” являются взаимозаменяемыми и означают полимеры любой длины, состоящие из нуклеотидов, и такими полимерами являются ДНК и РНК. Нуклеотидами могут быть дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любой субстрат, который может быть включен в полимер посредством ДНК- или РНК-полимеразы либо посредством реакции синтеза. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Если это необходимо, то модификация нуклеотидной структуры может быть осуществлена до или после сборки полимера. Нуклеотидные последовательности могут прерываться не-нуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после синтеза, например, путем его конъюгирования с меткой. Модификациями других типов являются, например, “кэпы”; замена одного или нескольких природных нуклеотидов их аналогами; межнуклеотидные модификации, такие как, например, модификации путем введения незаряженных связей (например, метилфосфонатов, фосфотриэфиров, фосфоамидатов, карбаматов и т.п.) и заряженных связей (например, фосфортиоатов, фосфордитиоатов и т.п.); модификации, содержащие боковые группы, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин, и т.п.); модификации, содержащие интеркалирующие агенты (например, акридин, псорален и т.п.); модификации, содержащие хелатообразующие агенты (например, металлы, радиоактивные металлы, бор, металлы-окислители и т.п.); модификации, содержащие алкилирующие агенты; модификации, содержащие модифицированные связи (например, альфа-аномерные нуклеиновые кислоты и т.п.), а также не модифицированные формы полинуклеотида(ов). Кроме того, любые гидроксильные группы, обычно присутствующие в сахарах, могут быть заменены, например, фосфонатными группами и фосфатными группами; защищены стандартными защитными группами; или активированы с образованием дополнительных связей с дополнительными нуклеотидами; либо они могут быть конъюгированы с твердыми или полутвердыми носителями. 5'- и 3'-концевые ОН могут быть фосфорилированы или замещены аминами или органическими “кэпирующими” группами, состоящими из 1-20 атомов углерода. Другие гидроксилы могут быть также дериватизированы стандартными защитными группами. Полинуклеотиды могут также содержать аналогичные формы сахаров, таких как рибоза или дезоксирибоза, известных специалистам, включая, например, 2'-О-метил-2'-О-аллилрибозу; 2'-фтор- или 2'-азидорибозу; карбоциклические аналоги сахаров; альфа-аномерные сахара; эпимерные сахара, такие как арабиноза, ксилоза или ликсоза; сахар пиранозу, сахар фуранозу; седогептулозу; ациклические аналоги и основные нуклеозидные аналоги, такие как метилрибозид. Одна или несколько фосфодиэфирных связей могут быть заменены альтернативными линкерными группами. Такими альтернативными линкерными группами являются, но не ограничиваются ими, варианты, в которых фосфат заменен Р(О)S (“тиоат”), Р(S)S (“дитиоат”), (О)NR2 (“амидат”), Р(О)R, Р(О)ОR', СО или СН2 (“формацеталь”), где каждый из R или R' независимо представляет собой Н или замещенный, или незамещенный алкил (С1-20), необязательно содержащий эфирную связь (-О-), арил, алкенил, циклоалкил, циклоалкенил или аралдил. Не все связи в полинуклеотиде должны быть идентичными. Вышеприведенное описание относится ко всем используемым здесь полинуклеотидам, включая РНК и ДНК.
Используемый здесь термин “олигонуклеотид”, в общих чертах, означает короткие, в основном одноцепочечные, обычно синтетические полинуклеотиды, длина которых составляет, главным образом, но необязательно, менее чем, примерно, 200 нуклеотидов. Термины “олигонуклеотид” и “полинуклеотид” не являются взаимоисключающими. Вышепривиденное описание полинуклеотида может в равной степени и полностью относиться к олигонуклеотидам.
Используемый здесь термин “фактор роста гепатоцитов” или “HGF”, если он не определен конкретно или если в данном контекста описания он не имеет иной смысл, означает любой нативный или модифицированный (нативный или синтетический) полипептид HGF, способный активировать путь передачи сигнала HGF/c-met в условиях, благоприятствующих такому процессу передачи сигнала. Термин “HGF дикого типа” обычно означает полипептид, содержащий аминокислотную последовательность природного белка HGF. Термин “последовательность HGF дикого типа” обычно означает аминокислотную последовательность, присутствующую в природном HGF.
Термины “антитело” и “иммуноглобулин”, используемые здесь в самом широком смысле, являются взаимозаменяемыми и включают моноклональные антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела, мультиспецифические антитела (например, биспецифические антитела, при условии, что они обладают нужной биологической активностью), а также могут включать некоторые фрагменты антител (более подробно описанные ниже). Антитело может быть человеческим, гуманизированным и/или аффинно зрелым.
“Фрагменты антител” содержат только часть интактного антитела, где указанная часть, предпочтительно, сохраняет, по меньшей мере, одну функцию, а предпочтительно, большинство функций или все функции, обычно присущие такой части природного интактного антитела. В одном из вариантов изобретения фрагмент антитела содержит антигенсвязывающий сайт интактного антитела, а поэтому он сохраняет свою способность связываться с антигеном. В другом варианте изобретения фрагмент антитела, например фрагмент, содержащий Fc-область, сохраняет, по меньшей мере, одну из биологических функций, обычно присущих Fc-области интактного антитела, таких как связывание с FcRn, способность модулировать время полужизни антитела, ADCC-ассоциированные функции и связывание с комплементом. В одном из вариантов изобретения фрагментом антитела является одновалентное антитело, которое имеет время полужизни in vivo, в основном, аналогичное времени полужизни интактного антитела. Так, например, такой фрагмент антитела может содержать антигенсвязывающую область, присоединенную к последовательности Fc и способную сообщать указанному фрагменту стабильность in vivo. В одном из вариантов изобретения антитело согласно изобретению представляет собой однофрагментное антитело, описанное в WO 2005/063816. В одном из вариантов изобретения указанное однофрагментное антитело содержит мутации в Fc, а именно “выступы” и “впадины”, описанные в WO 2005/063816. Так, например, мутациями во “впадине” могут быть Т366А, L368А и/или Y407V в полипептиде Fc, а мутацией в полости может быть Т366W.
Используемый здесь термин “моноклональное антитело” означает антитело, полученное из популяции, по существу, гомогенных антител, то есть отдельных антител, входящих в состав такой популяции, являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в небольших количествах. Моноклональные антитела являются высокоспецифическими, то есть направлены против одного антигена. Кроме того, в противоположность препаратам поликлональных антител, которые обычно включают различные антитела против различных антигенных детерминант (эпитопов), каждое моноклональное антитело направлено против одной антигенной детерминанты на данном антигене.
Описанные здесь моноклональные антитела, в частности, включают “химерные” антитела, в которых часть тяжелой цепи и/или легкой цепи идентична или гомологична соответствующим последовательностям, присутствующим в антителах, происходящих от конкретного вида, или принадлежащих к конкретному классу или подклассу антител, а остальная часть этой(их) цепи(ей) идентична или гомологична соответствующим последовательностям, присутствующим в антителах, происходящих от другого вида, или принадлежащих к другому классу или подклассу антител; а также фрагменты этих антител, при условии, что они обладают нужной биологической активностью (см. патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci., USA, 81:6851-6855 (1984)).
“Гуманизированные” формы не-человеческих (например, мышиных) антител представляют собой химерные антитела, которые содержат минимальную последовательность, происходящую от не-человеческого иммуноглобулина. В своей большей части гуманизированные антитела представляют собой человеческие иммуноглобулины (антитела-реципиенты), в которых остатки в реципиентной гипервариабельной области заменены остатками от гипервариабельной области не-человеческого антитела (донорного антитела), такого как мышиное антитело, крысиное антитело, кроличье антитело или антитело примата, не являющегося человеком, которое имеет нужную специфичность, аффинность или функцию. В некоторых случаях остатки каркасной области (FR) человеческого иммуноглобулина могут быть заменены соответствующими не-человеческими остатками. Кроме того, гуманизированные антитела могут содержать остатки, которые отсутствуют в антителе-реципиенте или в донорном антителе. Такие модификации могут быть внесены для дополнительного улучшения функции антитела. В общих чертах гуманизированное антитело может включать, по существу, весь, по меньшей мере, один, а обычно все два вариабельных домена, в которых все или, по существу, все гипервариабельные петли, соответствующие петлям не-человеческих иммуноглобулинов, и все или, по существу, все FR являются последовательностями человеческого иммуноглобулина. Гуманизированное антитело может также, но необязательно, содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно человеческого иммуноглобулина. Более подробное описание можно найти в публикации Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). См. также нижеследующие обзорные статьи и приведенные там ссылки: Vaswani & Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle & Gross, Curr. Op. Biotech. 5:428-433 (1994).
“Антиген” представляет собой предварительно определенный антиген, с которым может селективно связываться антитело. Антигенами-мишенями могут быть полипептид, углевод, нуклеиновая кислота, липид, гаптен или другие природные или синтетические соединения. Предпочтительным антигеном-мишенью является полипептид. Используемый здесь термин “акцепторная человеческая каркасная область” означает каркасную область, содержащую аминокислотную последовательность каркасной области VL или VH, происходящую от каркасной области человеческого иммуноглобулина или от консенсусной каркасной области человеческого иммуноглобулина. Акцепторная человеческая каркасная область, “происходящая от” каркасной области человеческого иммуноглобулина или консенсусной каркасной области человеческого иммуноглобулина, может содержать ту же самую аминокислотную последовательность либо она может содержать уже существующие модификации аминокислотной последовательности. Если такие модификации присутствуют, то предпочтительно, чтобы их число составляло не более чем 5, а более предпочтительно, 4 или менее либо 3 или менее. Если указанные уже существующие модификации аминокислотной последовательности присутствуют в VH, то предпочтительно, чтобы такие модификации присутствовали только в трех, двух или в одном из положений 71Н, 73Н и 78Н; так, например, аминокислотными остатками в этих положениях могут быть 71А, 73Т и/или 78А. В одном из вариантов изобретения человеческая аминокислотная последовательность акцепторной каркасной области VL идентична человеческой аминокислотной последовательности каркасной области VL или человеческой консенсусной каркасной области иммуноглобулина.
“Человеческая консенсусная каркасная область” представляет собой каркасную область, которая включает аминокислотные остатки, наиболее часто встречающиеся в выбранных последовательностях каркасных областей VL или VH человеческого иммуноглобулина. В общих чертах VL- или VH-последовательности человеческого иммуноглобулина выбирают из подгруппы последовательностей вариабельных доменов. Обычно такая подгруппа последовательностей представляет собой подгруппу, определенную Кэбатом и др. В одном из вариантов изобретения подгруппой для VL является подгруппа каппа I по Кэбату и др. В одном из вариантов изобретения подгруппой для VН является подгруппа III по Кэбату и др.
“Консенсусная каркасная область VH подгруппы III” включает консенсусную последовательность, полученную из аминокислотных последовательностей вариабельной области тяжелой цепи подгруппы III по Кэбату и др. В одном из вариантов изобретения аминокислотная последовательность консенсусной каркасной области VH подгруппы III включает, по меньшей мере, часть или все из нижеследующих последовательностей: EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO:42)-H1-WVRQAPGKGLEWV (SEQ ID NO:43)-H2-RFTISRDNSKNTLYLQMNSLRAEDTAVYYC (SEQ ID NO:44)-H3-WGQGTLVTVSS (SEQ ID NO:45).
“Консенсусная каркасная область VL подгруппы I” включает консенсусную последовательность, полученную из аминокислотных последовательностей вариабельной области легкой цепи каппа подгруппы I по Кэбату и др. В одном из вариантов изобретения аминокислотная последовательность консенсусной каркасной области VL подгруппы I включает, по меньшей мере, часть или все из нижеследующих последовательностей: DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO:46)-L1-WYQQKPGKAPKLLIY (SEQ ID NO:47)-L2-GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO:48)-L3-FGQGTKVEIK (SEQ ID NO:49).
“Немодифицированная человеческая каркасная область” представляет собой человеческую каркасную область, имеющую такую же аминокислотную последовательность, как и последовательность акцепторной человеческой каркасной области; так, например, в акцепторной человеческой каркасной области отсутствует(ют) замена(ы) человеческих аминокислотных остатков не-человеческими аминокислотными остатками.
Используемый здесь термин “модифицированная гипервариабельная область” означает гипервариабельную область, содержащую одну или несколько (например, от 1 и примерно до 16) аминокислотных замен.
Используемый здесь термин “немодифицированная гипервариабельная область” означает гипервариабельную область, содержащую такую же аминокислотную последовательность, как и последовательность не-человеческого антитела, от которого она происходит, то есть последовательность, в которой отсутствуют одна или несколько аминокислотных замен.
Используемые здесь термины “гипервариабельная область”, “HVR” или “HV” означают области вариабельного домена антитела, которые являются в данной последовательности гипервариабельными и/или образуют петли определенной структуры. В общих чертах указанные антитела содержат шесть гипервариабельных областей; три области в VH (Н1, Н2, Н3) и три области в VL (L1, L2, L3). В настоящей заявке используется ряд гипервариабельных областей, который входит в объем настоящего изобретения. Гипервариабельные области (комплементарность-определяющие области (CDR)) по Кэбату обладают высокой степенью вариабельности последовательности и имеют наиболее частое применение (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Вместо определения гипервариабельных областей по Кэбату Чотия предложил определять гипервариабельные области по локализации структурных петель (Chothia & Lesk, J. Mol.Biol. 196:901-917 (1987)). Определение гипервариабельных областей AbМ представляет собой компромисс между “CDR” по Кэбату и “структурным петлям” по Чотия, и такие определения используются в компьютерной программе по моделированию антител Oxford Molecular's AbМ. “Контактные” гипервариабельные области определяют исходя из анализа имеющихся сложных кристаллических структур. Остатки каждой из этих гипервариабельных областей приводятся ниже.
Термин “гипервариабельные области” может включать “удлиненные гипервариабельные области”, а именно 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 (L3) в VL; и 26-35 (Н1), 50-65 или 49-65 (Н2) и 93-102, 94-102 или 95-102 (Н3) в VH. Остатки вариабельных доменов для каждого из указанных определений пронумерованы по Кэбату и др., см. выше.
“Каркасными” или “FR” остатками являются остатки вариабельных доменов, за исключением гипервариабельных областей, определенных выше.
“Человеческое антитело” представляет собой антитело, имеющее аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, продуцируемого у человека и/или полученного любыми описанными здесь методами конструирования человеческих антител. Такое определение человеческого антитела, в частности, исключает гуманизированное антитело, содержащее не-человеческие антигенсвязывающие остатки.
“Аффинно зрелое” антитело представляет собой антитело, имеющее одну или несколько модификаций в одной или нескольких CDR, что позволяет повышать аффинность данного антитела по отношению к антигену, по сравнению с родительским антителом, не имеющим такой(их) модификации(й). Предпочтительные аффинно зрелые антитела имеют наномолярные или даже пикомолярные аффинности по отношению к антигену-мишени. Аффинно зрелые антитела получают известными методами. В публикации Marks и др. (Bio/Technology 10:779-783 (1992) описано созревание аффинности в результате перестановки доменов VH и VL. Неспецифический мутагенез CDR и/или каркасных остатков описан в публикациях Barbas et al., Proc. Natl. Acad. Sci., USA, 91:3809-3813 (1994); Schier et al., Gene 169:147-155 (1995); Yelton et al., J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995) и Hawkins et al., J. Mol. Biol. 226:889-896 (1992).
“Блокирующее” антитело или “антитело-антагонист” представляет собой антитело, ингибирующее или снижающее биологическую активность антигена, с которым оно связывается. Предпочтительные блокирующие антитела или антитела-антагонисты, по существу, или полностью ингибируют биологическую активность антигена.
Используемый здесь термин “антитело-агонист” означает антитело, которое имитирует, по меньшей мере, одну из функциональных активностей представляющего интерес полипептида.
Термин “расстройство” означает любое состояние, которое восприимчиво к лечению веществом/молекулой или способом согласно изобретению. Такими расстройствами являются хронические и острые расстройства или заболевания, включая патологические состояния, которые создают у данного млекопитающего предрасположенность к рассматриваемому состоянию. Не ограничивающими примерами описанных здесь расстройств, подвергаемых лечению, являются злокачественные и доброкачественные опухоли; злокачественные заболевания, не относящиеся к лейкозу и лимфолейкозу; патологии нервных клеток, глиальных клеток, астроцитов, клеток гипоталамуса и другие гландулярные, макрофагальные, эпителиальные, стромальные и бластоцелиальные расстройства; а также воспалительные, иммунологические и другие расстройства, ассоциированные с ангиогенезом.
Термины “клеточно-пролиферативное расстройство” и “пролиферативное расстройство” означают расстройства, ассоциированные с определенной степенью аномальной пролиферации клеток. В одном из вариантов изобретения указанным клеточно-пролиферативным расстройством является рак.
Используемый здесь термин “опухоль” означает все неопластические клетки, подвергающиеся росту и пролиферации, независимо от того, являются ли они доброкачественными или злокачественными, и все предраковые и раковые клетки и ткани. Используемые здесь термины “рак”, “раковый”, “клеточно-пролиферативное расстройство”, “пролиферативное расстройство” и “опухоль” не являются взаимоисключающими.
Используемые здесь термины “рак” и “раковый” относятся к физиологическому состоянию млекопитающих, которое обычно характеризуется нерегулируемым ростом/пролиферацией клеток. Примерами раковых заболеваний являются, но не ограничиваются ими, карцинома, лимфома, бластома, саркома и лейкоз. Более конкретными примерами таких раковых заболеваний являются плоскоклеточный рак, мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарцинома легких, плоскоклеточная карцинома легких, рак брюшной полости, гепатоцеллюлярный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластома, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатома, рак молочной железы, рак толстой кишки, рак ободочной кишки, карцинома эндометрия или матки, карцинома слюнных желез, рак почек, рак предстательной железы, рак вульвы, рак щитовидной железы, карцинома печени и различные типы рака головы и шеи.
Нарушения ангиогенеза могут приводить к развитию многих расстройств, которые могут быть подвергнуты лечению композициями и способами согласно изобретению. Такими расстройствами являются ненеопластические и неопластические состояния. Неопластическими состояниями являются, но не ограничиваются ими, состояния, описанные выше. Ненеопластическими состояниями являются, но не ограничиваются ими, нежелательная или аберрантная гипертрофия, артрит, ревматоидный артрит (РА), псориаз, псориазные бляшки, саркоидоз, атеросклероз, атеросклеротические бляшки, диабетическая и другие пролиферативные ретинопатии, включая ретинопатию недоношенных или ретролентальную фиброплазию, неоваскулярная глаукома, старческая дегенерация желтого пятна, диабетический отек желтого пятна, неоваскуляризация роговицы глаза, неоваскуляризация трансплантата роговицы глаза, отторжение трансплантата роговицы глаза, неоваскуляризация сетчатки/сосудистой оболочки глаза, неоваскуляризация угла глазного яблока (покраснение глаза), неоваскулярное заболевание глаз, рестеноз сосудов, артериовенозная мальформация (АВМ), менингиома, гемангиома, ангиофиброма, гиперплазия щитовидной железы (включая болезнь Грейвса), трансплантация роговицы глаза и других тканей, хроническое воспаление, воспаление легких, острое поражение легких/респираторный дистресс-синдром взрослых (РДСВ), сепсис, первичная легочная гипертензия, злокачественные экссудаты в области легких, отек головного мозга (например, ассоциированный с ударом/закрытым повреждением/травмой головы), синовит, образование паннуса при РА, оссифицирующий миозит, гипертрофия костей, остеоартрит (ОА), не поддающийся лечению асцит, поликистоз яичника, эндометриоз, заболевания, ассоциированные с секвестрацией жидкости в третьем пространстве (полости полых органов) (панкреатит, туннельный синдром, ожоги, заболевание кишечника), фиброма матки, преждевременные роды, хроническое воспаление, такое как ВЗК (болезнь Крона и язвенный колит), отторжение почечного аллотрансплантата, воспалительное заболевание кишечника, нефротический синдром, нежелательный или аберрантный рост тканевой массы (не-раковых тканей), гемофилическая артропатия, гипертрофированные рубцы, подавление роста волос, синдром Ослера-Вебера, пиогенная гранулема, ретролентальная фиброплазия, склеродермия, трахома, васулярная адгезия (сращение сосудов), синовит, дерматит, преэклампсия, асциты, выпоты в область перикарда (например, ассоциированные с перикардитом) и плевральные выпоты.
Используемый здесь термин “лечение” означает клиническое вмешательство в целях изменения природных процессов, происходящих в организме индивидуума и в клетках, подвергаемых лечению, и такое лечение может быть профилактическим либо оно может быть осуществлено в процессе развития клинической патологии. Желательными эффектами лечения являются предотвращение рецидива или снижение частоты рецидивов, ослабление симптомов, уменьшение любых прямых или опосредованных патологических последствий заболевания, предупреждение метастазов, снижение степени прогрессирования заболевания, ослабление или снижение степени патологического состояния, а также ремиссия или улучшение прогноза. В некоторых вариантах изобретения антитела согласно изобретению используются для замедления развития заболевания или расстройства.
Термин “эффективное количество” означает количество, которое является эффективным в определенных дозах и в течение определенного периода времени, необходимых для достижения нужного терапевтического или профилактического результата.
“Терапевтически эффективное количество” вещества/молекулы согласно изобретению, агониста или антагониста может варьироваться в зависимости от таких факторов, как патологическое состояние, возраст, пол и масса индивидуума, а также способность данного вещества/молекулы, агониста или антагониста вырабатывать нужный ответ у индивидуума. Терапевтически эффективным количеством также является количество, при введении которого терапевтически благоприятные эффекты указанного вещества/молекулы, агониста или антагониста преобладают над любыми их токсическими или побочными эффектами. Термин “профилактически эффективное количество” означает количество, которое является эффективным в определенных дозах и в течение определенного периода времени, необходимых для достижения нужного профилактического результата. Поскольку профилактическую дозу вводят индивидуумам перед началом развития заболевания или на ранней стадии развития заболевания, то обычно, но необязательно, такое профилактически эффективное количество должно быть меньше терапевтически эффективного количества.
Используемый здесь термин “цитотоксическое средство” означает вещество, ингибирующее или предотвращающее функцию клеток и/или вызывающее деструкцию клеток. Этот термин включает радиоактивные изотопы (например,211At131I,125I,90Y,186Re,188Re,153Sm,212Bi,32Р и радиоактивные изотопы Lu), химиотерапевтические средства, например, метотрексат, адриамицин, винкаалкалоиды (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины, такие как токсины в виде небольших молекул, или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты, и различные противоопухолевые или противораковые средства, описанные ниже. Ниже описаны и другие цитотоксические средства. Противоопухолевое средство вызывает деструкцию опухолевых клеток.
“Химиотерапевтическое средство” представляет собой химическое соединение, используемое для лечения рака. Примерами химиотерапевтических средств являются алкилирующие агенты, такие как тиотепа и циклофосфамид цитоксан®; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (в частности, буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, маринол®); бета-лапахон; лапахол; колхицины; бетулиновая кислота; камптотецин (включая синтетический аналог топотекан (гикамтин®), СРТ-11 (иринотекан, камптозар®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги, такие как адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновая кислота; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, КW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотные аналоги горчичного газа, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловый аналог горчичного газа; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, а в частности, калихеамицин гамма II и калихеамицин омега II (см., например, Agnew, Chem. Intl. Ed. Engl., 33:183-186 (1994)); динемицин, включая динемицин А; эсперамицин, а также неокарзиностатиновый хромофор и родственные хромофоры, такие как хромопротеиновые энедииновые антибиотики), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксирубицин адриамицин® (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексан, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; антиадренергические средства, такие как аминоглютетимид, митотан, трилостан; заменитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамидный гликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; ацетат эллиптиния; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; майтанзиноиды, такие как майтазин и анзамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантон; 2-этилгидразид; прокарбицин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2”-трихлортриэтиламин; трихотецены (в частности, токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин (элдизин®, филдезин®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (“Ara-C”); тиотепа; таксоиды, например, паклитаксел Таксол® (Bristol-Myers Squibb Oncology, Princeton, N.J.); не содержащий кремофора АбраксанТМ, сконструированная на основе альбумина композиция из наночастиц паклитаксела (American Pharmaceuticals Partners, Schaumberg, Illinois) и доцетаксел Таксотер® (Rhône-Poulenc Rorer, Antony, France); хлоранбуцил; гемцитабин (Гемзар®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (Велбан®); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (Онковин®); оксалиплатин; лейкововин; винорелбин (Навелбин®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДМФО); ретиноиды, такие как ретиноевая кислота; капецитабин (Кселода®); фармацевтически приемлемые соли, оксиды или производные всех вышеуказанных соединений, а также комбинации из двух или более вышеуказанных соединений, такие как СНОР, где указанная аббревиатура используется в комбинированной терапии и означает циклофосфамид, доксорубицин, винкристин и преднизолон, и FOLFOX, где указанная аббревиатура используется в комбинированной терапии и означает оксалиплатин (Элоксатинтм), 5-FU и лейковорин.
В это определение также входят противогормональные средства, регулирующие, снижающие, блокирующие или ингибирующие действие гормонов, которые могут стимулировать рост раковой опухоли, и эти средства часто применяются для системного или общего лечения. Такими средствами могут быть сами гормоны. Примерами таких средств являются антиэстрогены и селективные модуляторы рецептора эстрогена (SERM), включая, например, тамоксифен (включая тамоксифен Нолвадекс®), ралоксифен Эвиста®, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен Фарестон®; антипрогестероны; ингибиторы рецептора эстрогена (ERD); средства, подавляющие или блокирующие функции яичников, например, агонисты рилизинг-фактора лютеинизирующего гормона (LHRH), такие как Лупрон® и ацетат лейпролида Элигард®, ацетат гозерелина, ацетат бузерелина и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, ингибирующие фермент ароматазу и регулирующие продуцирование эстрогенов в коре надпочечника, такие как, например, 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола Мегаза®, экземестан Аромазин®, форместан, фадрозол, ворозол Ривизор®, летрозол Фемара® и анастрозол Аримидекс®. Кроме того, в такое определение химиотерапевтических средств входят бифосфонаты, такие как клодронат (например, Бонефос® или Остак®), этидронат Дидрокал®, NE-58095, золедроновая кислота/золедронат Зомета®, алендронат Фозамакс®, памидронат Аредия®, тилудронат Скелид® или ризедронат Актонел®, а также троксацитабин (нуклеозидный аналог 1,3-диоксоланцитозина); антисмысловые олигонуклеотиды, в частности, олигонуклеотиды, ингибирующие экспрессию генов пути передачи сигнала, участвующих в нежелательной пролиферации клеток, такие как, например, РКС-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина Тератопа® и вакцины, применяемые в генотерапии, например вакцина Алловектин®, вакцина Лейвектин® и вакцина Ваксид®; ингибитор топоизомеразы 1 Луртотекан®; rmRH Абареликс®; дитозилат лапатиниба (ингибитор тирозинкиназы, состоящий из двух небольших молекул Erb-2 и EGFR, также известный как GW572016) и фармацевтически приемлемые соли, оксиды или производные всех вышеуказанных соединений.
Используемый здесь термин “рост-ингибирующее средство” означает соединение или композицию, ингибирующие рост клеток, зависящий от активации HGF/c-met либо in vitro, либо in vivo. Таким образом, средством, ингибирующим рост клеток, может быть средство, значительно снижающее процент HGF/c-met-зависимых клеток в фазе S. Примерами средств, ингибирующих рост клеток, являются средства, блокирующие прохождение клеточного цикла (в другой фазе, кроме фазы S), такие как средства, индуцирующие блокирование фазы G1 и фазы М. Классическими средствами, блокирующими фазу М, являются винкаалкалоиды (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Такими средствами, блокирующими фазу G1, а также блокирующими переход в фазу S, являются, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, мехлоретамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в публикации The Molecular Basis of Cancer, Mendelsohn & Israel, eds., Chapter 1, entitled “Cell cycle regulation, oncogenes and antineoplastic drugs”, Murakami et al. (WB Saunders: Philadelphia, 1995), в частности, на стр.13. Таксаны (паклитаксел и доцетаксел) представляют собой противораковые лекарственные средства, получаемые из такого дерева, как тис. Доцетаксел (Таксотер®, Rhone-Poulenc Rorer), получаемый из Европейского тиса, представляет собой полусинтетический аналог паклитаксела (Таксола®, Bristol-Myers Squibb). Паклитаксел и доцетаксел индуцируют сборку микротрубочек из тубулиновых димеров и стабилизируют микротрубочки путем предупреждения деполимеризации, что приводит к ингибированию митоза клеток.
“Доксорубицин” представляет собой антрациклиновый антибиотик. Доксорубицин имеет полное химическое название (8S-цис)-10-[(3-амино-2,3,6-тридезокси-α-L-ликсо-гексапиранозил)окси]-7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метокси-5,12-нафтацендион.
Получение вариантов антител, продуцирующих пониженный НАМА-ответ или вообще не продуцирующих такого ответа
Одним из важных аспектов клинической разработки подходящих терапевтических средств является снижение или элиминация НАМА-ответа (см. например, Khaxzaeli et al., J. Natl. Cancer. Inst. (1988), 80:937; Jaffers et al., Transplantation (1986) 41:572; Shawler et al., J. Immunol. (1985) 135:1530; Sears et al., J. Biol. Response Mod. (1984) 3:138; Miller et al., Blood (1983) 62:988; Hakimi et al., J. Immunol. (1991), 147:1352; Reichmann et al., Nature (1988) 332:323; Junghans et al., Cancer Res. (1990) 50:1495). Как описано в настоящей заявке, настоящее изобретение относится к антителам, которые были гуманизированы, так, что такая гуманизация приводила к снижению или элиминации НАМА-ответа. Варианты таких антител могут быть также получены известными рутинными методами, некоторые из которых описаны ниже.
Так, например, аминокислотная последовательность описанного здесь антитела может служить в качестве исходной (родительской) последовательности, которая может быть использована для придания вариабельности каркасной(ым) и/или гипервариабельной(ым) последовательности(ям). Выбранная каркасная последовательность, к которой присоединена исходная гипервариабельная последовательность, называется здесь акцепторной человеческой каркасной последовательностью. Хотя акцепторные человеческие каркасные последовательности могут происходить или могут быть получены из человеческого иммуноглобулина (его VL- и/или VH-областей), однако, предпочтительно, чтобы акцепторные человеческие каркасные последовательности происходили или были получены из человеческой консенсусной каркасной последовательности, поскольку такие каркасные последовательности обладают, как было продемонстрировано, минимальной иммуногенностью для человека или вообще не обладают такой иммуногенностью.
Если акцептор происходит от человеческого иммуноглобулина, то человеческая каркасная последовательность может быть, но необязательно, выбрана исходя из ее гомологии донорной каркасной последовательности путем выравнивания донорной каркасной последовательности с различными человеческими каркасными последовательностями в наборе человеческих каркасных последовательностей, а наиболее гомологичная каркасная последовательность может быть, но необязательно, выбрана в качестве акцептора.
В одном из вариантов изобретения описанные здесь человеческие консенсусные каркасные последовательности происходят или их получают из консенсусных каркасных последовательностей VH подгруппы III и/или VL цепи каппа подгруппы I.
Таким образом, акцепторная человеческая каркасная последовательность VH может содержать одну, две, три или все из нижеследующих каркасных последовательностей:
FR1, включающей EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO:42);
FR2, включающей WVRQAPGKGLEWV (SEQ ID NO:43);
FR3, включающей RFTISХ1DХ2SKNTХ3YLQMNSLRAEDTAVYYC (SEQ ID NO:50), где Х1 представляет собой А или R, Х2 представляет собой Т или N, а Х3 представляет собой А или L,
FR4, включающей WGQGTLVTVSS (SEQ ID NO:45).
Примерами консенсусных каркасных последовательностей VH-области являются:
консенсусная каркасная последовательность человеческой VH подгруппы I без CDR Кэбата (SEQ ID NO:19);
консенсусная каркасная последовательность человеческой VH подгруппы I без удлиненных гипервариабельных областей (SEQ ID NO:20-22);
консенсусная каркасная последовательность человеческой VH подгруппы II без CDR Кэбата (SEQ ID NO:23);
консенсусная каркасная последовательность человеческой VH подгруппы II без удлиненных гипервариабельных областей (SEQ ID NO:24-26);
консенсусная каркасная последовательность человеческой VH подгруппы III без CDR Кэбата (SEQ ID NO:27);
консенсусная каркасная последовательность человеческой VH подгруппы III без удлиненных гипервариабельных областей (SEQ ID NO:28-30);
акцепторная каркасная последовательность человеческой VH без CDR Кэбата (SEQ ID NO:31);
акцепторная каркасная последовательность человеческой VH без удлиненных гипервариабельных областей (SEQ ID NO:32-33);
акцепторная каркасная последовательность 2 человеческой VH без CDR Кэбата (SEQ ID NO:34); или
акцепторная каркасная последовательность 2 человеческой VH без удлиненных гипервариабельных областей (SEQ ID NO:35-37).
В одном из вариантов изобретения акцепторная каркасная человеческая последовательность VH содержит одну, две, три или все из нижеследующих каркасных последовательностей:
FR1, включающей EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO:42);
FR2, включающей WVRQAPGKGLEWV (SEQ ID NO:43);
FR3, включающей RFTISADTSKNTAYLQMNSLRAEDTAVYYC (SEQ ID NO:51);
FR3, включающей RFTISADTSKNTAYLQMNSLRAEDTAVYYCA (SEQ ID NO:52); RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR (SEQ ID NO:53); RFTISADTSKNTAYLQMNSLRAEDTAVYYCS (SEQ ID NO:54); RFTISADTSKNTAYLQMNSLRAEDTAVYYCSR (SEQ ID NO:55); и
FR4, включающей WGQGTLVTVSS (SEQ ID NO:45).
Акцепторная каркасная человеческая последовательность VL может содержать одну, две, три или все из нижеследующих каркасных последовательностей:
FR1, включающей DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO:46);
FR2, включающей WYQQKPGKAPKLLIY (SEQ ID NO:47);
FR3, включающей GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO:48);
FR4, включающей FGQGTKVEIK (SEQ ID NO:49).
Примерами консенсусных каркасных последовательностей VL являются:
консенсусная каркасная последовательность человеческой VL цепи каппа подгруппы I (SEQ ID NO:38);
консенсусная каркасная последовательность человеческой VL цепи каппа подгруппы II (SEQ ID NO:39);
консенсусная каркасная последовательность человеческой VL цепи каппа подгруппы III (SEQ ID NO:40); или
консенсусная каркасная последовательность человеческой VL цепи каппа подгруппы IV (SEQ ID NO:41).
Хотя акцепторная последовательность может быть идентична выбранной человеческой каркасной последовательности, независимо от того, происходит ли она от человеческого иммуноглобулина или от человеческой консенсусной каркасной последовательности, однако, в настоящем изобретении также рассматривается акцепторная последовательность, которая, по сравнению с последовательностью человеческого иммуноглобулина или человеческой консенсусной каркасной последовательностью, может содержать уже существующие аминокислотные замены. Эти уже существующие замены являются, предпочтительно, минимальными, а обычно они представляют собой только четыре, три, две модификации или одну аминокислотную модификацию аминокислот по сравнению с последовательностью человеческого иммуноглобулина или консенсусной каркасной последовательностью.
В акцепторные человеческие каркасные последовательности VL и/или VH вводят остатки гипервариабельной области не-человеческого антитела. Так, например, могут быть включены остатки, соответствующие остаткам CDR по Кэбату, остаткам гипервариабельной петли по Чотия, остаткам AbМ и/или контактным остаткам. При этом могут быть, но необязательно, включены остатки удлиненной гипервариабельной области, а именно 24-34 (L1), 50-56 (L2) и 89-97 (L3), 26-35 (Н1), 50-65 или 49-65 (Н2) и 93-102, 94-102 или 95-102 (Н3).
Что касается обсуждаемого в настоящей заявке “введения” остатков гипервариабельной области, то в этой связи следует отметить, что такое введение может быть достигнуто различными методами, например нуклеиновая кислота, кодирующая нужную аминокислотную последовательность, может быть генерирована путем введения мутаций в нуклеиновую кислоту, кодирующую последовательность мышиного вариабельного домена, а именно замены ее каркасных остатков акцепторными каркасными человеческими остатками, или путем введения мутаций в нуклеиновую кислоту, кодирующую последовательность человеческого вариабельного домена, а именно замены остатков ее гипервариабельного домена не-человеческими остатками, или путем синтеза нуклеиновой кислоты, кодирующей нужную последовательность и т.п.
В описанных здесь примерах варианты гибридной гипервариабельной области получают путем мутагенеза нуклеиновой кислоты, кодирующей человеческие акцепторные последовательности, методом Кункеля с использованием отдельного олигонуклеотида для каждой гипервариабельной области. Kunkel et al., Methods Enzymol. 154:367-382 (1987). Соответствующие замены могут быть внесены в каркасную и/или в гипервариабельную область рутинными методами для коррекции и повторного подтверждения соответствующих взаимодействий “гипервариабельная область - антиген”.
Фаговое (фагмидное) представление (также называемое в некоторых случаях методом фагового представления) может применяться как удобный и быстрый метод продуцирования и скрининга множества различных потенциальных вариантов антител в библиотеке, генерированной путем рандомизации последовательностей. Однако специалистам известны и другие методы получения и скрининга модифицированных антител.
Метод фагового (фагмидного) представления является эффективным средством генерирования и отбора новых белков, связывающихся с лигандом, таким как антиген. Методы фагового (фагмидного) представления позволяют генерировать крупные библиотеки вариантов белков, из которых могут быть быстро отобраны белки, имеющие последовательности, связывающиеся с молекулой-мишенью с высокой аффинностью. Нуклеиновые кислоты, кодирующие варианты полипептидов, обычно присоединяют к последовательности нуклеиновой кислоты, кодирующая белок вирусной оболочки, такой как ген белка III или ген белка VIII. Были разработаны моновалентные системы фагмидного представления, в которых последовательность нуклеиновой кислоты, кодирующая белок или полипептид, присоединена к последовательности нуклеиновой кислоты, кодирующей часть гена белка III (Bass S., Proteins 8:309 (1990); Lowman & Wells, Methods: A Companion to Methods in Enzymology, 3:205 (1991)). В моновалентной системе фагмидного представления гибридный ген экспрессируется на низком уровне, а также экспрессируется ген белков III дикого типа, в результате чего сохраняется инфекционность частиц. Методы генерирования пептидных библиотек и скрининга этих библиотек описаны во многих патентах (например, в патенте США № 5723286, в патенте США № 5432018, в патенте США № 5580717, в патенте США № 5427908 и в патенте США № 5498530).
Библиотеки антител или антигенсвязывающих полипептидов были получены различными методами, включая модификацию одного гена путем встраивания рандомизированных последовательностей ДНК или клонирования семейства родственных генов. Методы представления антител или антигенсвязывающих фрагментов с применением фагового (фагмидного) представления описаны в патентах США №№ 5750373, 5733743, 5837242, 5969108, 6172197, 5580717 и 5658727. Затем библиотеку скринируют на экспрессию антител или антигенсвязывающих белков с нужными свойствами.
Методы замены выбранных аминокислот, кодируемых матричной нуклеиновой кислотой, хорошо известны специалистам, и некоторые из них описаны в настоящей заявке. Так, например, остатки гипервариабельной области могут быть заменены в соответствии с методом Кункеля (см., например, Kunkel et al., Methods Enzymol. 154:367-382 (1987)).
Последовательность олигонуклеотидов включает один или несколько сконструированных наборов кодонов для модифицируемых остатков гипервариабельной области. Набор кодонов представляет собой различные последовательности нуклеотидных триплетов, используемых для кодирования нужных вариантов аминокислот. Наборы кодонов могут быть представлены символами, обозначающими конкретные нуклеотиды или эквимолярные смеси нуклеотидов, указанные ниже в соответствии с кодом, утвержденным Международным биохимическим союзом (IUB).
Коды IUB
Так, например, в наборе кодонов DVK D может представлять собой нуклеотиды А или G или Т; V может представлять собой А или G или С; и К может представлять собой G или Т. Этот набор кодонов может включать 18 различных кодонов и может кодировать аминокислоты Ala, Trp, Tyr, Lys, Thr, Asn, Lys, Ser, Arg, Asp, Glu, Gly и Сys.
Наборы олигонуклеотидов или праймеров могут быть синтезированы стандартными методами. Набор олигонуклеотидов может быть синтезирован, например, методом твердофазного синтеза и может содержать последовательности, представляющие все возможные комбинации нуклеотидных триплетов, составляющих указанный набор кодонов и кодирующих нужную группу аминокислот. Методы синтезы олигонуклеотидов с “вырожденностью” выбранных нуклеотидов в некоторых положениях хорошо известны специалистам. Такие последовательности нуклеотидов, имеющие наборы определенных кодонов, могут быть синтезированы с использованием коммерчески доступных синтезаторов нуклеиновых кислот (поставляемых, например, Apрlied Biosystems, Foster City, CA) либо они могут быть закуплены у фирм-поставщиков (например, у Life Technologies, Rockville, MD). Поэтому последовательность синтезированных олигонуклеотидов, имеющая конкретный набор кодонов, обычно включает множество олигонуклеотидов с различными последовательностями, где различия между этими последовательностями определяются набором кодонов, имеющихся в полной последовательности. Олигонуклеотиды, используемые в настоящем изобретении, имеют последовательности, способные гибридизоваться с матричной нуклеиновой кислотой, кодирующей вариабельный домен, а также могут включать сайты рестриктирующих ферментов, используемые для клонирования.
В одном из методов последовательности нуклеиновой кислоты, кодирующие варианты аминокислот, могут быть получены путем олигонуклеотид-опосредуемого мутагенеза. Этот метод хорошо известен специалистам и описан Zoller et al., Nucleic. Acids. Res., 10:6487-6504 (1987). Вкратце, последовательности нуклеиновой кислоты, кодирующие варианты аминокислот, получают путем гибридизации последовательностей олигонуклеотидов, имеющих нужные наборы кодонов, с матричной ДНК, где указанная матрица представляет собой одноцепочечную форму плазмиды, содержащую последовательность матричной нуклеиновой кислоты, кодирующей вариабельную область. После гибридизации ДНК-полимеразу используют для синтеза полноразмерной второй комплементарной цепи матрицы, которая, таким образом, будет включать олигонуклеотидный праймер и будет содержать наборы кодонов, имеющиеся в данной олигонуклеотидной последовательности.
В общих чертах олигонуклеотиды имеют длину, по меньшей мере, в 25 нуклеотидов. Оптимальный олигонуклеотид имеет 12-15 нуклеотидов, которые полностью комплементарны матрице с обеих сторон от нуклеотида(ов), кодирующего(их) мутацию(и). Это дает гарантию того, что данный олигонуклеотид будет соответствующим образом гибридизоваться с одноцепочечной молекулой матричной ДНК. Олигонуклеотиды могут быть легко синтезированы методами, известными специалистам, например, методами, описанными Crea et al., Proc. Natl. Acad. Sci., USA, 75:5765 (1978).
Матричную ДНК генерируют с помощью векторов, которые происходят от бактериофаговых векторов М13 (подходящими векторами являются коммерчески доступные векторы М13mp18 и М13mp19), или с помощью векторов, содержащих одноцепочечный фаговый ориджин репликации, описанный Viera et al., Meth. Enzymol., 153:3 (1987). Таким образом, ДНК, которая должна быть мутирована, может быть встроена в один из этих векторов с получением одноцепочечной матрицы. Получение одноцепочечной матрицы описано в разделах 4.21-4.41 руководства Sambrook et al., см. выше.
Для модификации нативной последовательности ДНК олигонуклеотид гибридизуют с одноцепочечной матрицей в подходящих условиях гибридизации. Затем добавляют ДНК-полимеризующий фермент, обычно ДНК-полимеразу Т7 или фрагмент ДНК-полимеразы I Кленова, для синтеза комплементарной цепи матрицы с использованием олигонуклеотида в качестве праймера. Таким образом, получают гетеродуплексную молекулу, в которой одна цепь ДНК кодирует мутированную форму гена 1, а другая цепь (исходная матрица) кодирует нативную не модифицированную последовательность гена 1. Затем эту гетеродуплексную молекулу переносят в подходящую клетку-хозяина, обычно прокариота, такого как JМ101 E.coli. После культивирования клетки высевают на планшеты с агарозой и скринируют с использованием олигонуклеотидного праймера, радиоактивно меченного 32-фосфатом, для идентификации бактериальных колоний, содержащих мутированную ДНК.
Вышеописанный метод может быть модифицирован в целях получения гомодуплексной молекулы, в которой обе цепи плазмиды имеют мутацию(и). Для этого осуществляют нижеследующие модификации. Одноцепочечный олигонуклеотид отжигают с одноцепочечной матрицей, описанной выше. Смесь трех дезоксирибонуклеотидов, таких как дезоксирибоаденозин (dАТР), дезоксирибогуанозин (dGTP) и дезоксириботимидин (dTT), объединяют с модифицированным тиодезоксирибоцитозином, обозначенным dСТР-(aS)(который может быть получен у Amersham). Затем эту смесь добавляют в комплекс “матрица-олигонуклеотид”. После добавления ДНК-полимеразы в эту смесь получают цепь ДНК, идентичную матрице, за исключением мутированных оснований. Кроме того, эта новая цепь ДНК вместо dСTP будет содержать dСТР-(aS), что обеспечивает защиту этой цепи от расщепления рестриктирующей эндонуклеазой. После ник-расщепления матричной цепи двухцепочечного гетеродуплекса соответствующим рестриктирующим ферментом, матричная цепь может быть расщеплена нуклеазой ЕхоIII или другой соответствующей нуклеазой на участке, расположенном после области, содержащей мутагенизируемый(е) сайт(ы). Затем реакцию прекращают и получают молекулу, которая только частично является одноцепочечной. После этого получают полноразмерный двухцепочечный ДНК-гомодуплекс с использованием ДНК-полимеразы в присутствии всех четырех дезоксирибонуклеотид-трифосфатов, АТФ, и ДНК-лигазы. Эта гомодуплексная молекула может быть затем перенесена в подходящую клетку-хозяина.
Как было показано ранее, последовательность набора олигонуклеотидов имеет длину, достаточную для гибридизации с матричной нуклеиновой кислотой, и может также, но необязательно, содержать рестрикционные сайты. Матричная ДНК может быть получена с помощью векторов, происходящих от бактериофаговых векторов М13, или с помощью векторов, содержащих одноцепочечный фаговый ориджин репликации, описанный Viera et al., Meth. Enzymol., 153:3 (1987). Таким образом, ДНК, предназначенная для мутирования, должна быть встроена в один из этих векторов с получением одноцепочечной матрицы. Получение одноцепочечной матрицы описано в разделах 4.21-4.41 руководства Sambrook et al., см. выше.
В соответствии с другим методом библиотека может быть сконструирована путем создания выше- и нижерасположенных наборов олигонуклеотидов, каждый из которых имеет множество олигонуклеотидов с различными последовательностями, где указанные различные последовательности определяются наборами кодонов, присутствующих в последовательности указанных олигонуклеотидов. Эти наборы из выше- и нижерасположенных олигонуклеотидов вместе с последовательностью матричной нуклеиновой кислоты, кодирующей вариабельный домен, могут быть использованы в полимеразной цепной реакции для получения “библиотеки” ПЦР-продуктов. Такие ПЦР-продукты могут именоваться “кластерами нуклеиновых кислот”, поскольку они могут быть присоединены к другим родственным или не-родственным последовательностям нуклеиновой кислоты, например к белкам вирусной оболочки и к доменам димеризации с применением известных методов молекулярной биологии.
Последовательности ПЦР-праймеров включают один или несколько наборов кодонов, сконструированных в целях сообщения белкам доступности для растворителя и высокой степени разнообразия положений в гипервариабельной области. Как описано выше, набором кодонов является набор из различных нуклеотидных триплетных последовательностей, кодирующих нужные варианты аминокислот.
Антитела, отобранные в соответствующих стадиях скрининга/отбора и удовлетворяющие нужным критериям, могут быть выделены и клонированы стандартными рекомбинантными методами.
Векторы, клетки-хозяева и рекомбинантные методы
Для продуцирования антитела согласно изобретению методами рекомбинантных ДНК нуклеиновую кислоту, кодирующую такое антитело, выделяют и встраивают в реплицируемый вектор для последующего клонирования (амплификации ДНК) или экспрессии. ДНК, кодирующая антитело, может быть легко выделена и секвенирована в соответствии со стандартными процедурами (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелую и легкую цепи антитела). Для этой цели подходящими являются многие векторы. Выбор вектора отчасти зависит от используемой клетки-хозяина. Обычно предпочтительными клетками-хозяевами являются либо прокариотические клетки, либо эукариотические клетки (обычно, клетки млекопитающих).
Генерирование антител с использованием прокариотических клеток-хозяев
Конструирование вектора
Полинуклеотидные последовательности, кодирующие полипептидные компоненты антитела согласно изобретению, могут быть получены стандартными рекомбинантными методами. Нужные полинуклеотидные последовательности могут быть выделены и секвенированы из антитело-продуцирующих клеток, таких как гибридомные клетки. Альтернативно полинуклеотиды могут быть синтезированы с помощью синтезатора нуклеотидов или ПЦР-методами. После получения последовательностей, кодирующих полипептиды, эти последовательности встраивают в рекомбинантный вектор, способный реплицироваться и экспрессировать гетерологичные полинуклеотиды в прокариотических хозяевах. В целях настоящего изобретения могут быть использованы многие доступные и известные векторы. Выбор соответствующего вектора зависит, главным образом, от размера нуклеиновых кислот, встраиваемых в указанный вектор, и от конкретной клетки-хозяина, трансформируемой этим вектором. Каждый вектор содержит различные компоненты, в зависимости от его функции (амплификации или экспрессии гетерологичного полинуклеотида или того и другого) и от его совместимости с конкретной клеткой-хозяином, в которой он находится. Компонентами векторов обычно являются, но не ограничиваются ими, ориджин репликации, селективный маркерный ген, промотор, сайт связывания с рибосомой (RBS), сигнальная последовательность, вставка гетерологичной нуклеиновой кислоты и последовательность терминации транскрипции.
В основном плазмидные векторы, содержащие репликон и регуляторные последовательности, происходящие от видов, совместимых с клеткой-хозяином, используются с этими же хозяевами. Такой вектор обычно содержит сайт репликации, а также последовательности-маркеры, способствующие проведению фенотипического отбора в трансформированных клетках. Так, например, E.coli обычно трансформируют плазмидой рВR322, происходящей от E.coli определенного вида. рВR322 содержит гены, кодирующие резистентность к ампициллину (Аmp) и к тетрациклину (Теt), и позволяет легко идентифицировать трансформированные клетки. рВR322 и ее производные или другие микробные плазмиды или бактериофаг могут также содержать промоторы, которые могут быть использованы в этом микробном микроорганизме для экспрессии эндогенных белков, либо они могут быть модифицированы так, чтобы они содержали такие промоторы. Примеры производных рВR322, используемых для экспрессии конкретных антител, подробно описаны в патенте США № 5648237, Carter et al.
Кроме того, фаговые векторы, содержащие репликон и регуляторные последовательности, совместимые с микроорганизмом-хозяином, могут быть использованы в качестве векторов, трансформирующих эти клетки-хозяева. Так, например, бактериофаг, такой как λGEM.TM-11, может быть использован для получения рекомбинантного вектора, который может быть применен для трансформации восприимчивых клеток-хозяев, таких как E.coli LЕ392.
Экспрессионный вектор согласно изобретению может содержать две или более пар промотор-цистрон, каждая из которых кодирует полипептидные компоненты. Промотором является не транслируемая регуляторная последовательность, локализованная выше (со стороны 5'-конца) от цистрона, модулирующего ее экспрессию. Прокариотические промоторы обычно подразделяются на два класса, индуцибельные и конститутивные. Индуцибельным промотором является промотор, который инициирует повышение уровней транскрипции цистрона, находящегося под его контролем, в ответ на изменения условий культивирования, например, в присутствии или в отсутствии питательных элементов или при изменении температуры.
Большинство промоторов, распознаваемых различными потенциальными клетками-хозяевами, хорошо известны специалистам. Выбранный промотор может быть функционально присоединен к цистронной ДНК, кодирующей легкую или тяжелую цепь, путем выделения промотора из ДНК-источника посредством ее гидролиза рестриктирующими ферментами и встраивания выделенной промоторной последовательности в вектор согласно изобретению. Нативная промоторная последовательность и многие гетерологичные промоторы могут быть использованы для прямой амплификации и/или экспрессии генов-мишеней. В некоторых вариантах изобретения используются гетерологичные промоторы, поскольку они, по сравнению с нативным промотором для нужных полипептидов, позволяют значительно повышать уровень транскрипции и увеличивать выходы экспрессируемого гена-мишени.
Промоторами, подходящими для использования в прокариотических хозяевах, являются промотор РhoA, промоторные системы β-галактамазы и лактозы, промоторная система триптофана (trp) и гибридные промоторы, такие как промотор tac или trc. Однако могут быть также использованы и другие промоторы, которые являются функциональными в бактериях (например, другие известные бактериальные или фаговые промоторы). Нуклеотидные последовательности этих промоторов были опубликованы, что облегчает специалистам в данной области проводить их лигирование с цистронами, кодирующими нужные легкие и тяжелые цепи (Siebenlist et al. (1980) Cell 20:269), с использованием линкеров или адаптеров для доставки всех требуемых рестрикционных сайтов.
В одном из аспектов изобретения каждый цистрон в рекомбинантном векторе содержит такой компонент, как секреторную сигнальную последовательность, регулирующую транслокацию экспрессируемых полипептидов через мембрану. В общих чертах, указанной сигнальной последовательностью может быть компонент вектора либо такой последовательностью может быть часть нужного ДНК-полипептида, встраиваемого в этот вектор. Сигнальной последовательностью, выбранной в целях осуществления изобретения, должна быть последовательность, распознаваемая и процессируемая (то есть отщепляемая сигнальной пептидазой) клеткой-хозяином. В случае использования прокариотических клеток-хозяев, не распознающих и не процессирующих сигнальные последовательности, которые являются нативными для гетерологичных полипептидов, эту сигнальную последовательность заменяют прокариотической сигнальной последовательностью, выбранной, например, из группы, состоящей из лидерной последовательности щелочной фосфатазы, пенициллиназы, lpp или термостабильного энтеротоксина II (SТII), LamB, PhoE, PelB, OmpA и МВР. В одном из вариантов изобретения сигнальными последовательностями, используемыми в обоих цистронах экспрессионной системы, являются сигнальные последовательности SТII или их варианты.
В другом аспекте изобретения продуцирование иммуноглобулинов согласно изобретению может происходить в цитоплазме клетки-хозяина, а поэтому в данном случае не требуется присутствия секретирующих сигнальных последовательностей в каждом цистроне. В соответствии с этим легкие и тяжелые цепи иммуноглобулина экспрессируются и подвергаются укладке и сборке с образованием функциональных иммуноглобулинов в цитоплазме. Некоторые штаммы хозяев (например, trxB--штаммы E.coli) имеют соответствующие условия в цитоплазме, которые благоприятствуют образованию дисульфидных связей, и тем самым, способствуют правильной укладке и сборке субъединиц экспрессируемого белка. Proba & Pluckthun Gene, 159:203 (1995).
Настоящее изобретение относится к экспрессионной системе, в которой количественное отношение экспрессированных полипептидных компонентов может быть модулировано для максимизации выхода секретированных и “правильно” собранных антител согласно изобретению. Такую модуляцию осуществляют, по меньшей мере частично, путем одновременной модуляции эффективности трансляции полипептидных компонентов.
Один из методов модуляции эффективности трансляции описан в патенте США № 5840523, Simmons et al. В этом методе используются варианты области инициации трансляции (TIR) в цистроне. Для данной TIR может быть создан набор вариантов аминокислотных последовательностей или последовательностей нуклеиновой кислоты с определенным диапазоном эффективностей трансляции, и такой набор является удобным инструментом, который дает возможность легко корректировать указанный фактор для обеспечения нужного уровня экспрессии конкретной цепи. Варианты TIR могут быть получены стандартными методами мутагенеза, который приводит к изменению кодонов, что может, в свою очередь, приводить к изменению аминокислотной последовательности, хотя предпочтительными являются молчащие мутации в нуклеотидной последовательности. Альтерациями в TIR может быть, например, изменение числа или расположения последовательностей Шайна-Дальгарно, наряду с изменениями в сигнальной последовательности. Одним из методов генерирования сигнальных последовательностей-мутантов является создание “банка кодонов” в начале кодирующей последовательности, который не изменяет аминокислотную последовательность сигнальной последовательности (то есть мутации являются молчащими). Это может быть достигнуто путем введения замены в третье нуклеотидное положение каждого кодона; и при этом, некоторые аминокислоты, такие как лейцин, серин и аргинин, присутствуют в нескольких первых и вторых положениях, что может вносить дополнительные трудности при создании такого банка. Этот метод мутагенеза подробно описан в публикации Yansura et al. (1992) METHODS: A Companion to Methods in Enzymol. 4:151-158.
Набор генерируемых векторов, предпочтительно, имеет различные эффективности TIR для каждого присутствующего в нем цистрона. Такой ограниченный набор позволяет проводить сравнение уровня экспрессии каждой цепи, а также выхода нужных продуктов антитела с использованием различных комбинаций эффективностей TIR. Эффективности TIR могут быть определены путем количественной оценки уровня экспрессии репортерного гена, как подробно описано в патенте США № 5840523, Simmons et al. Исходя из сравнения эффективностей трансляции, нужные отдельные TIR отбирают для их объединения в конструкциях экспрессионных векторов согласно изобретению.
Прокариотическими клетками-хозяевами, подходящими для экспрессии антител согласно изобретению, являются архебактерии (Archaebacteria) и эубактерии (Eubacteria), такие как грам-отрицательные или грам-положительные микроорганизмы. Примерами подходящих бактерий являются Esсherichia (например, E.coli), Bacilli (например, B.subtilis), энтеробактерии, бактерии вида Pseudomonas (например, P.aeruginosa), Salmonella typhimurium, Serratia marcescаns, Klebsiella, Proteus, Shigella,Rhizobia, Vitreoscilla или Paracoccus. В одном из вариантов изобретения используются грам-отрицательные клетки. В одном из вариантов изобретения в качестве хозяев согласно изобретению используются клетки E.coli. Примерами штаммов E.coli являются штамм W3110 (Bachmann, Cellular & Molecular Biology, vol. 2 (Washington, D.C.: American Society for Microbiology, 1987), pp.1190-1219; АТСС, номер депозита № 27325) и их производные, включая штамм 33D3, имеющий генотип W3110 ΔfhuA (ΔtonA) ptr3 lac Iq lacL8 ΔompTΔ(nmpc-fepE)degP41 kanR (патент США № 5639635). Подходящими также являются и другие штаммы и их производные, такие как E.coli 294 (АТСС 31446), E.coli В, E.coli 1776 (АТСС 31537) и E.coli RV308 (ATCC 31608). Эти примеры являются иллюстративными, но не органичивающими. Методы конструирования производных любой из вышеупомянутых бактерий, имеющих определенные генотипы, известны специалистам и описаны, например, в публикации Bass et al., Proteins 8:309-314 (1990). Обычно соответствующие бактерии необходимо отбирать с учетом реплицируемости репликона в клетках бактерии. Так, например, бактерии E.coli, Serratia или Salmonella могут быть подходящими для их использования в качестве хозяина, если для доставки репликона используются хорошо известные плазмиды, такие как pBR322, pBR325, pACYC177 или pKN410. Обычно клетки-хозяева должны секретировать минимальные количества протеолитических ферментов, а поэтому в клеточную культуру желательно включать дополнительные ингибиторы протеазы.
Продуцирование антител
Клетки-хозяева трансформируют вышеуказанными экспрессионными векторами и культивируют в стандартной питательной среде, модифицированной так, чтобы она была подходящей для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности.
Термин “трансформация” означает введение ДНК в прокариотического хозяина так, чтобы эта ДНК либо реплицировалась в виде внехромосомного элемента, либо интегрировалась в хромосому. В зависимости от используемой клетки-хозяина трансформацию осуществляют стандартными методами, подходящими для таких клеток. Бактериальные клетки, содержащие прочные барьеры, такие клеточные стенки обычно обрабатывают кальцием, а именно хлоридом кальция. В другом методе трансформации используют полиэтиленгликоль/ДМСО. Еще одним методом трансформации является электропорация.
Прокариотические клетки, используемые для продуцирования полипептидов согласно изобретению, культивируют в среде, известной специалистам и подходящей для культивирования выбранных клеток-хозяев. Примерами подходящей среды являются бульон Луриа (LВ) с необходимыми питательными добавками. В некоторых вариантах изобретения такая среда также содержит средство для отбора, выбранное исходя из конструирования экспрессионного вектора, которое способствуют селективному росту прокариотических клеток, содержащих экспрессионный вектор. Так, например, в среду для культивирования клеток, экспрессирующих ген резистентности к ампициллину, добавляют ампициллин.
Помимо источников углерода, азота и неорганического фосфата в среду могут быть также включены любые необходимые добавки в соответствующих концентрациях, вводимые как отдельно, так и в смеси с другими добавками или средой, такими как комплексный источник азота. Культуральная среда может, но необязательно, содержать один или несколько восстановителей агентов, выбранных из группы, состоящей из глутатиона, цистеина, цистамина, тиогликолята, дитиоэритритола и дитиотреитола.
Прокариотические клетки-хозяева культивируют при соответствующих температурах. Для культивирования E.coli, предпочтительной температурой является, например, температура примерно от 20 до 39°С, более предпочтительно, примерно от 25 до 37°С, а еще более предпочтительно, примерно при 30°С. рН среды может варьироваться в пределах примерно от 5 до 9, в зависимости, главным образом, от организма хозяина. Для E.coli, рН составляет, предпочтительно, примерно от 6,8 до 7,4, а более предпочтительно, примерно 7,0.
Если в экспрессионном векторе согласно изобретению используется индуцибельный промотор, то экспрессия белка индуцируется в условиях, подходящих для активации данного промотора. В одном из аспектов изобретения для регуляции транскрипции полипептидов используются промоторы РhoA. В соответствии с этим трансформированные клетки-хозяева культивируют в среде для индуцирования с ограниченным содержанием фосфата. Предпочтительной средой с ограниченным содержанием фосфата является среда С.R.А.Р. (см., например, Simmons et al., J. Immunol. Methods (2002) 263:133-147). В комбинации с используемой векторной конструкцией могут быть использованы и различные другие индукторы, известные специалистам.
В одном из вариантов изобретения экспрессируемые полипептиды согласно изобретению секретируются в периплазму клеток-хозяев и могут быть выделены из этой периплазмы. Выделение белка, главным образом, осуществляют путем дизрупции микроорганизма такими методами, как осмотический шок, обработка ультразвуком или лизис. После дизрупции клеток клеточный дебрис или целые клетки могут быть удалены путем центрифугирования или фильтрации. Эти белки могут быть дополнительно очищены, например, с помощью хроматографии на аффинной смоле. Альтернативно белки могут транспортироваться в клеточную среду и отделяться от нее. Клетки могут быть удалены из культуры, а супернатант культуры может быть подвергнут фильтрации и концентированию для дополнительной очистки полученных белков. Экспрессированные полипептиды могут быть затем выделены и идентифицированы хорошо известными методами, такими как электрофорез в полиакриламидном геле (ПААГ) и Вестерн-блот-анализ.
В одном из аспектов изобретения антитела продуцируют в большом количестве посредством ферментации. Для получения рекомбинантных белков могут быть проведены различные крупномасштабные процедуры ферментации в культуре с подпиткой. Крупномасштабную ферментацию проводят в ферментере емкостью, по меньшей мере, 1000 литров, а предпочтительно, примерно от 1000 до 100000 литров. Такие ферментеры снабжены лопастной мешалкой для равномерного распределения кислорода и микроэлементов, а в частности глюкозы (предпочтительного источника углерода/энергии). Термин “лабораторная ферментация”, в общих чертах, означает ферментацию в ферментере объемом не более чем примерно 100 литров, и такой объем может варьироваться примерно от 1 до 100 литров.
В процессе ферментации индуцирование экспрессии белков обычно инициируют после того как клетки, культивируемые в подходящих условиях, достигнут нужной плотности, например, OD550, составляющей примерно 180-220, то есть ранней стационарной фазы. В комбинации с используемой векторной конструкцией могут быть использованы и различные другие индукторы, известные специалистам и описанные выше. Перед индуцированием клетки могут быть культивированы в течение меньшего периода времени. Клетки обычно индуцируют в течение примерно 12-50 часов, хотя время индуцирования может быть увеличено или уменьшено.
Для увеличения выхода продукта и для улучшения качества полипептидов согласно изобретению могут быть изменены различные условия ферментации. Так, например, для обеспечения “правильной” сборки и укладки секретированных полипептидов антител могут быть использованы дополнительные векторы, в которых происходит сверхэкспрессия белков-шаперонов, таких как белки Dsb (DsbA, DsbB, DsbC, DsbD и/или DsbG) или FkpA (пептидилпролил, цис,транс-изомераза с шаперонной активностью), и которые предназначены для ко-трансформации прокариотических клеток-хозяев. Было продемонстрировано, что белки-шапероны облегчают правильную укладку и растворимость гетерологичных белков, продуцируемых в бактериальных клетках-хозяевах. Chen et al. (1999) J. Bio. Chem. 274:19601-19605; Georgiou et al., патент США № 6083715; Georgiou et al., патент США № 6027888; Bothmann & Pluckthun (2000) J. Biol. Chem. 275:17100-17105; Ramm & Pluckthun (2000) J. Biol. Chem. 275:17106-17113; Arie et al. (2001) Mol. Microbiol. 39:199-210.
Для минимизации протеолиза экспрессируемых гетерологичных белков (а в частности, белков, которые являются протеолитически чувствительными), в настоящем изобретении могут быть использованы некоторые штаммы-хозяева, дефицитные по протеолитическим ферментам. Так, например, штаммы клеток-хозяев могут быть модифицированы для введения генетической(их) мутации(й) в гены, кодирующие известные бактериальные протеазы, такие как протеаза III, OmpT, DegP, Tsp, протеаза I, протеаза Mi, протеаза V, протеаза VI и их комбинации. Некоторые дефицитные по протеазе штаммы E.coli являются доступными и описаны, например, в публикации Joly et al. (1998), см. выше; Georgiou et al., патент США № 5264365; Georgiou et al., патент США № 5508192; Hara et al., Microbial Drug Resistance, 2:63-72 (1996).
В одном из вариантов изобретения штаммы E.coli, дефицитные по протеолитическим ферментам и трансформированные плазмидами, сверхэкспрессирующими один или несколько белков-шаперонов, используются в качестве клеток-хозяев в экспрессионной системе согласно изобретению.
Очистка антител
В одном из вариантов изобретения продуцируемый здесь белок антитела дополнительно очищают для получения препаратов, которые являются, по существу, гомогенными и которые могут быть использованы для проведения дополнительных анализов и для других целей. Для таких случаев могут быть применены стандартные методы очистки белков, известные специалистам. Примерами подходящих методов очистки являются следующие процедуры очистки: фракционирование на иммуноаффинных или ионообменных колонках, осаждение этанолом, обращенно-фазовая ВЭЖХ, хроматография на двуокиси кремния или на катионообменной смоле, такой как DЕАЕ, хроматофокусирование, электрофорез ДСН-ПААГ, осаждение сульфатом аммония и гель-фильтрация с использованием, например, сефадекса G-75.
В одном из аспектов изобретения для иммуноаффинной очистки полноразмерных продуктов антител согласно изобретению используют белок А, иммобилизованный на твердой фазе. Белок А представляет собой 41 кД-белок клеточной стенки, происходящий от Staphylococcus aureus, который с высокой аффинностью связывается с Fc-областью антител (Lindmark et al. (1983), J. Immunol. Meth. 62:1-13). Твердой фазой, на которой иммобилизован белок А, является предпочтительно колонка, имеющая стеклянную поверхность или кремнийсодержащую поверхность, а более предпочтительно стеклянная колонка с регулируемым размером пор или колонка с нанесенной на нее кремниевой кислотой. В некоторых вариантах указанная колонка покрыта реагентом, таким как глицерин, для предотвращения неспецифического присоединения примесей.
В первой стадии очистки препарат, полученный из клеточной культуры, описанной выше, наносят на твердую фазу с иммобилизованным на ней белком А для специфического связывания представляющего интерес антитела с белком А. Затем твердую фазу промывают для удаления примесей, неспецифически связанных с твердой фазой. И наконец, представляющее интерес антитело отделяют от твердой фазы путем элюирования.
Продуцирование антител с использованием эукариотических клеток-хозяев
Компонентами векторов обычно являются, но не ограничиваются ими, один или несколько из следующих компонентов: сигнальная последовательность, ориджин репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
(i) Компонент сигнальная последовательность
Вектор, используемый в эукариотических клетках-хозяевах, может также содержать сигнальную последовательность или другой полипептид, имеющий специфический сайт расщепления у N-конца зрелого белка, или представляющий интерес полипептид. Выбранной гетерологичной сигнальной последовательностью, предпочтительно, является последовательность, которая распознается и процессируется (то есть отщепляется сигнальной пептидазой) клеткой-хозяином. Для экспрессии в клетках млекопитающих используются сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например сигнальная последовательность gD вируса простого герпеса.
ДНК для такой области предшественника лигируют с антителокодирующей ДНК с сохранением рамки считывания.
(ii) Ориджин репликации
Обычно такой компонент как ориджин репликации не является необходимым для экспрессионных векторов млекопитающих. Так, например, ориджин репликации SV40 обычно используется только потому, что он содержит ранний промотор.
(iii) Компонент селективный ген
Экспрессионный и клонирующий векторы могут содержать селективный ген, также называемый селективным маркером. Обычно селективные гены кодируют белки, которые: (а) сообщают резистентность к антибиотиками или к другим токсинам, например к ампициллину, неомицину, метотрексату или тетрациклину, (b) комплементируют дефицит, обусловленный ауксотрофией, если это необходимо, или (с) обеспечивают доставку важных питательных веществ, которые не поступают из комплексных сред.
Одним из примеров схемы отбора является использование лекарственного средства, прекращающего рост клетки-хозяина. Клетки, которые были успешно трансформированы гетерологичным геном, продуцируют белок, сообщающий резистентность к лекарственному средству, и, тем самым, способствующий выживанию этих клеток в селективной среде. Для такого доминантного отбора могут быть использованы лекарственные средства, такие как неомицин, микофеноловая кислота и гигромицин.
Другими примерами подходящих селективных маркеров для клеток млекопитающих являются маркеры, которые позволяют идентифицировать клетки, способные встраивать в свой геном антителокодирующую нуклеиновую кислоту, например, такие маркеры, как ген DHFR, тимидинкиназы, металлотионеина-I и II, а предпочтительно гены, кодирующие металлотионеин приматов, ген аденозин-дезаминазы, орнитин-декарбоксилазы и т.п.
Так, например, клетки, трансформированные селективным геном DHFR, сначала идентифицируют путем культивирования всех трансформантов в культуральной среде, содержащей метотрексат (Mtx), конкурентный антагонист DHFR. Если используется DHFR дикого типа, то подходящей клеткой-хозяином является клеточная линия яичника китайского хомячка (СНО), дефицитная по DHFR-активности (например, АТСС СRL-9069).
Альтернативно клетки-хозяева (в частности, хозяева дикого типа, содержащие эндогенный DHFR), трансформированные или ко-трансформированные ДНК-последовательностями, кодирующими антитело, белок DHFR дикого типа и другой селективный маркер, такой как аминогликозид-3'-фосфотрансфераза (АРН), могут быть отобраны путем культивирования клеток в среде, содержащей агент для отбора по селективному маркеру, такой как аминогликозидный антибиотик, например канамицин, неомицин или G418 (см. патент США № 4965199).
(iv) Компонент промотор
Экспрессионные и клонирующие векторы обычно содержат промотор, распознаваемый организмом-хозяином и функционально присоединенный к нуклеиновой кислоте, кодирующей полипептид антитела. Промоторные последовательности, подходящие для эукариотов, известны специалистам. Фактически все гены эукариотов имеют АТ-богатую область, локализованную приблизительно в области, расположенной на 25-30 нуклеотидов выше от сайта инициации транскрипции. Другой такой последовательностью, локализованной приблизительно в области, расположенной на 70-80 нуклеотидов выше от сайта инициации транскрипции многих генов, является область CNCAAT, где N может означать любой нуклеотид. У 3'-конца большинства эукариотических генов расположена последовательность ААТААА, которая может служить сигналом для присоединения poly A-хвоста к 3'-концу кодирующей последовательности. Все указанные последовательности могут быть соответствующим образом встроены в эукариотические экспрессионные векторы.
Транскрипция полипептидов антител из векторов, присутствующих в клетках-хозяевах млекопитающих, регулируется, например, промоторами, полученными из геномов таких вирусов, как полиомавирус, вирус оспы домашней птицы, аденовирус (такой как аденовирус 2), вирус коровьей папиломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита В и обезьяний вирус 40 (SV40); гетерологичными промоторами млекопитающих, например, промотором актина или промотором иммуноглобулина; и промоторами белков теплового шока, при условии, что такие промоторы являются совместимыми с системами клеток-хозяев.
Ранние и поздние промоторы вируса SV40 обычно получают в виде рестрикционного фрагмента SV40, который также содержит ориджин репликации вируса SV40. Предранний промотор человеческого цитомегаловируса обычно получают в виде рестрикционного HindIII-фрагмента Е. Система экспрессии ДНК в клетках-хозяевах млекопитающих, полученная на основе коровьего папиломавируса, используемого в качестве вектора, описана в патенте США № 4419446. Модификация этой системы описана в патенте США № 4601978. Описание экспрессии кДНК человеческого β-интерферона в мышиных клетках под контролем промотора тимидинкиназы вируса простого герпеса можно также найти в публикации Reyers et al., Nature 297:598-601 (1982). Альтернативно в качестве промотора может быть использован вирус саркомы Рауса, имеющий длинный концевой повтор.
(v) Компонент энхансерный элемент
Транскрипция ДНК, кодирующей полипептид антитела согласно изобретению в высших эукариотах, часто усиливается при встраивании в вектор энхансерной последовательности. В настоящее время известно много энхансерных последовательностей, происходящих от генов млекопитающих (генов глобина, эластазы, альбумина, α-фетопротеина и инсулина). Однако обычно используется энхансер от вируса эукариотической клетки. Примерами является энхансер вируса SV40, локализованный в поздней области ориджин репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер полиомавируса, локализованный в поздней области ориджин репликации, и энхансеры адновируса (см. также публикацию Yaniv, Nature 297:17-18 (1982), в которой описаны энхансерные элементы для активации эукариотических промоторов). Энхансер может быть встроен в вектор в 5'- или 3'-положеннии по отношению к последовательности, кодирующей полипептид антитела, но, предпочтительно, чтобы он был локализован в 5'-положении от промотора.
(vi) Компонент сайт терминации транскрипции
Экспрессионные векторы, используемые в эукариотических клетках-хозяевах, обычно также содержат последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно расположены со стороны 5'-конца, а иногда, со стороны 3'-конца от нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибированные в виде полиаденилированных фрагментов в нетранслированной части мРНК, кодирующей антитело. В качестве такого компонента, как сайт терминации транскрипции, может быть использована область полиаденилирования коровьего гормона роста (см. заявку WO 94/11026 и имеющееся там описание экспрессионных векторов).
(vii) Отбор и трансформация клеток-хозяев
Клетками-хозяевами, подходящими для клонирования или экспрессии ДНК в вышеописанных векторах, являются описанные здесь клетки высших эукариотов, включая клетки-хозяева позвоночных. Размножение клеток позвоночных в культуре (в тканевой культуре) уже стало рутинной процедурой. Примерами подходящих линий клеток-хозяев млекопитающих являются клеточная линия CV1 почек обезьяны, трансформированная SV40 (COS-7, ATCC CRL 1651); клеточная линия почек человеческого эмбриона (клетки 293 или клетки 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen. Virol. 36:59 (1977)); клетки почек детеныша хомячка (ВНК, АТСС CCL 10); клетки яичника китайского хомячка/DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); мышиные клетки Сертоли (ТM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почек обезьяны (CV1 ATCC CCL 70); клетки почек африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почек собак (MDCK, ATCC CCL 34); клетки печени лабораторной крысы Buffalo (BRL 3A, ATCC CRL 1442); клетки легких человека (W138, ATCC CCL 75); клетки печени человека (HepG2, HB 8065); опухолевые клетки мышиной молочной железы (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annal N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC5; клетки FS4 и клеточная линия человеческой гепатомы (HepG2).
Клетки-хозяева трансформируют вышеописанными экспрессионными или клонирующими векторами для продуцирования антитела и культивируют в подходящих питательных средах, модифицированных, если это необходимо, для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности.
(viii) Культивирование клеток-хозяев
Клетки-хозяева, используемые для продуцирования антитела согласно изобретению, могут быть культивированы в различных средах. Средами, подходящими для культивирования клеток-хозяев, являются коммерчески доступные среды, такие как среда Хэмса F10 (Sigma), минимальная поддерживающая среда ((МЕМ)(Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла (DMEM), Sigma). Кроме того, в качестве культуральной среды для культивирования клеток-хозяев может быть использована любая среда, описанная в публикации Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), в патентах США №№ 4767704, 4657866, 4927762, 4560655 или 5122469; в WO 90/03430; в WO 87/00195 или в патенте США Re.№ 30985. В любую из этих сред могут быть добавлены, если это необходимо, гормоны и/или другие факторы роста (такие как инсулин, трансферрин или эпидермальный фактор роста), соли (такие как хлорид натрия, фосфат кальция и магния), буферы (такие как HEPES), нуклеотиды (такие как аднозин и тимидин), антибиотики (такие как лекарственное средство гентамицинТМ), микроэлементы (определенные как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярных дозах) и глюкоза или эквивалентный источник энергии. Могут быть также включены любые другие необходимые добавки в соответствующих концентрациях, известных специалистам в данной области. Условия культивирования, такие как температура, рН и т.п., аналогичны условиям, ранее используемым для экспрессии выбранных клеток-хозяев, и известны среднему специалисту в данной области.
(ix) Очистка антитела
C применением техники рекомбинантных ДНК антитело может быть продуцировано внутри клеток либо оно может быть непосредственно секретировано в среду. Если в первой стадии антитело продуцируется внутри клеток, то затем клеточный дебрис, или клетки-хозяева, или их лизированные фрагменты удаляют, например, путем центрифугирования или ультрафильтрации. Если антитело секретируется в среду, то обычно сначала концентрируют супернатанты, полученные из таких экспрессионных систем, с использованием коммерчески доступного фильтра для концентрирования белков, например устройства для ультрафильтрации Amicon или Millipore Pellicon. Для ингибирования протеолиза в любой из предшествующих стадий может быть использован ингибитор протеазы, такой как PMSF, а для предупреждения размножения случайно вносимых примесных микроорганизмов могут быть использованы антибиотики.
Композиция антитела, полученная из клеток, может быть очищена, например, с помощью хроматографии на гидроксиапатитах, гель-электрофореза, диализа и аффинной хроматографии, при этом предпочтительным методом очистки является аффинная хроматография. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, присутствующего в данном антителе. Белок А может быть использован для очистки антител, содержащих тяжелые цепи γ1, γ2 или γ4 человеческого иммуноглобулина (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Для всех мышиных изотипов и для человеческой цепи γ3 рекомендуется G-белок (Guss et al., EMBO J. 5:15671575 (1986)). В качестве матрицы, с которой связывается аффинный лиганд, наиболее часто используется агароза, но могут быть использованы и другие матрицы. Механически стабильные матрицы, такие как стекло с регулируемым размером пор или поли(стиролдивинил)бензол, обеспечивают более высокую скорость потока и позволяют сократить время обработки, чем это может быть достигнуто с использованием агарозы. Если антитело содержит домен СН3, то для его очистки может быть использована смола Bakerbond ABXTM (J.T. Baker, Phillipsburg, N.J.). В зависимости от выделяемого антитела могут быть также применены и другие методы очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, обращенно-фазовая ВЭЖХ, хроматография на двуокиси кремния, хроматография на гепарин-сефарозеТМ, хроматография на анионо- или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматофокусирование, электрофорез в ДСН-ПААГ и осаждение сульфатом аммония.
После проведения любой(ых) предварительной(ых) стадии(й) очистки смесь, содержащая представляющее интерес антитело и примеси, может быть подвергнута гидрофобной хроматографии при низком рН с использованием элюирующего буфера при рН примерно 2,5-4,5, предпочтительно, при низкой концентрации соли (например, примерно 0-0,25М).
Анализы на активность
Антитела согласно изобретению могут быть охарактеризованы по их физическим/химическим свойствам и биологическим функциям с помощью различных анализов, известных специалистам.
Очищенные иммуноглобулины могут быть дополнительно охарактеризованы с помощью ряда анализов, включая, но не ограничиваясь ими, N-концевое секвенирование, аминокислотный анализ, эксклюзионная жидкостная хроматография высокого давления в неденатурирующих условиях (ЖХВД), масс-спектрометрия, ионообменная хроматография и гидролиз папаином.
В некоторых вариантах изобретения полученные здесь иммуноглобулины анализируют на их биологическую активность. В некоторых вариантах изобретения иммуноглобулины согласно изобретению тестируют на их активность связывания с антигеном. Анализами на связывание с антигеном, которые известны специалистам и могут быть использованы в настоящем изобретении, являются, но не ограничиваются ими, любые анализы на прямое или конкурентное связывание с применением методов, таких как Вестерн-блот-анализ, радиоиммуноанализы, ELISA (твердофазный иммуноферментный анализ), “сэндвич”-иммуноанализы, иммунопреципитационные анализы, флуоресцентные иммуноанализы и иммуноанализы с использованием белка А. Репрезентативный анализ на связывание с антигеном описан ниже в разделе “Примеры”.
В одном из своих вариантов настоящее изобретение относится к модифицированному антителу, обладающему несколькими, но не всеми эффекторными функциями, что делает его предпочтительным кандидатом для многих применений, в которых время полужизни антител in vivo является важным фактором, особенно в тех случаях, когда некоторые эффекторные функции (такие как, комплемент-зависимая и антитело-зависимая клеточная цитотоксичность (ADCC)) не имеют важного значения или даже являются нежелательными. В некоторых вариантах изобретения для гарантии того, что будут сохраняться только предпочтительные свойства иммуноглобулина, оценивают Fc-активность продуцируемого иммуноглобулина. Анализы на in vitro и/или in vivo цитотоксичность могут быть проведены для подтверждения уменьшения/элиминации CDС- и/или ADCC-активности. Так, например, для гарантии того, что антитело не будет связываться с FcγR (а поэтому, вероятно, не будет обладать ADCC-активностью), но будет сохранять способность связываться с FcRn, могут быть проведены анализы на связывание с рецептором Fc (FcR). Первичные клетки, опосредующие ADCC, то есть NK-клетки, экспрессируют только FcRγIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках систематизирована в таблице 3 на стр. 464 публикации Ravetch & Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Пример in vitro анализа для оценки ADCC-активности представляющей интерес молекулы описан в патентах США №№ 5500362 или 5821337. Подходящими эффекторными клетками для таких анализов являются мононуклеарные клетки периферической крови (МКПК) и природные клетки-киллеры (NK). Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы может быть оценена in vivo у животного-модели, например, как описано в публикации Clynes et al., PNAS (USA) 95:652-656 (1998). Анализы на связывание с С1q могут быть также проведены для подтверждения отсутствия способности данного антитела связываться с С1q, а следовательно, для подтверждения отсутствия CDС-активности. Для оценки активации комплемента может быть проведен анализ на CDC, например, анализ, описанный в публикации Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996). Оценка связывания с FcRn и in vivo клиренса/времени полужизни может быть также осуществлена методами, известными специалистам, например, методами, описанными в разделе “Примеры”.
Гуманизированные антитела
Настоящее изобретение относится к гуманизированным антителам. Различные методы гуманизации не-человеческих антител известны специалистам. Так, например, гуманизированное антитело может иметь один или несколько введенных в него аминокислотных остатков, происходящих от источника, не являющегося человеком. Эти не-человеческие аминокислотные остатки часто называют “импортными” остатками, которые обычно берут из “импортного” вариабельного домена. Гуманизация может быть осуществлена, в основном, методом, описанным Винтером (Winter) и сотрудниками (Jones et al. (1986), Nature 321:522-525; Riechmann et al. (1988), Nature, 332:323-327; Verhoеyen et al. (1988), Science 239:1534-1536), путем замены последовательностей гипервариабельной области соответствующими последовательностями человеческого антитела. В соответствии с этим такие “гуманизированные” антитела представляют собой химерные антитела (патент США № 4816567), в которых, в основном, меньшая часть вариабельного домена интактного человеческого антитела заменена соответствующей последовательностью, происходящей от не-человеческого антитела. Фактически гуманизированные антитела обычно представляют собой человеческие антитела, в которых некоторые остатки гипервариабельной области и, возможно, некоторые остатки каркасной области (FR) заменены остатками, происходящими от аналогичных участков антител грызунов.
Выбор вариабельных доменов как легкой, так и тяжелой цепи человеческого антитела, используемых при создании гуманизированных антител, является очень важным фактором для снижения антигенности. В соответствии с так называемым методом “подгонки” последовательность вариабельного домена антитела грызуна скринируют по всей библиотеке известных последовательностей вариабельных доменов человеческого антитела. Затем человеческую последовательность, которая имеет наибольшее сходство с последовательностью грызунов, берут в качестве человеческой каркасной области (FR) для создания гуманизированного антитела (Sims et al. (1993), J. Immunol. 151:2296; Chothia et al. (1987), J. Mol. Biol. 196:901). В другом методе используют конкретную каркасную область, происходящую от консенсусной последовательности всех человеческих антител конкретной подгруппы легких или тяжелых цепей. Та же самая каркасная область может быть использована для создания нескольких различных гуманизированных антител (Carter et al. (1992), Proc. Natl. Acad. Sci., USA, 89:4285; Presta et al. (1993), J. Immunol, 151:2623).
Важно также, чтобы антитела были гуманизированы с сохранением высокой аффинности к данному антигену, а также других желательных биологических свойств. Для достижения этой цели в соответствии с одним из методов гуманизированные антитела получают путем анализа исходных последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются общедоступными и хорошо известны специалистам. Существуют компьютерные программы, которые иллюстрируют и представляют вероятные трехмерные конформационные структуры отобранных последовательностей-кандидатов иммуноглобулинов. Исследование этих представлений позволяет проанализировать вероятную роль данных остатков в функционировании последовательностей иммуноглобулина-кандидата, то есть остатков, которые влияют на способность иммуноглобулина-кандидата связываться с его антигеном. Таким образом, остатки FR могут быть выбраны из реципиентных и “импортных” последовательностей и объединены, в результате чего может быть получено желаемое антитело с нужными свойствами, такими как повышенная аффинность по отношению к антигену(ам)-мишени(ям). В общих чертах остатки гипервариабельной области непосредственно и в значительной степени влияют на связывание с антигеном.
Варианты антител
В одном из своих аспектов настоящее изобретение относится к фрагменту антитела, содержащему модификации в пограничной области полипептидов Fc, составляющих Fc-область, где указанные модификации облегчают и/или стимулируют гетеродимеризацию. Такие модификации включают введение “выступа” в первый полипептид Fc и “полости” во второй полипептид Fc, где указанный “выступ” может быть расположен в “полости” так, что он будет стимулировать образование комплекса между первым и вторым полипептидами Fc. Методы генерирования антител с такими модификациями известны специалистам, например описаны в патенте США № 5731168.
В некоторых вариантах изобретения рассматриваются описанные здесь модификации аминокислотной последовательности указанных антител. Так, например, может оказаться желательным повысить аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела получают путем введения соответствующих нуклеотидных замен в нуклеиновую кислоту, кодирующую антитело, или путем пептидного синтеза. Такими модификациями, являются, например, делеции, и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. При этом в конечную конструкцию могут быть введены любые комбинации делеций, инсерций и замен, при условии, что такая конечная конструкция будет обладать нужными свойствами. Аминокислотные модификации могут быть введены в рассматриваемую аминокислотную последовательность антитела в процессе получения такой последовательности.
Метод, применяемый для идентификации некоторых остатков или областей антитела, которые имеют предпочтительную локализацию для мутагенеза, называется “аланин-сканирующим мутагенезом” и описан Cunningham & Wells (1989), Science 244:1081-1085. В этом методе остаток или группу нужных остатков (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) идентифицируют и заменяют нейтральной или отрицательно заряженной аминокислотой (наиболее предпочтительно, аланином или полиаланином) для влияния на взаимодействие этих аминокислот с антигеном. Затем локализацию аминокислот, проявляющих функциональную чувствительность к таким заменам, уточняют путем введения дополнительных или других модификаций в положениях замены. Так, например, положение для введения замены в аминокислотную последовательность может быть определено заранее, тогда как природа мутации per se необязательно должна быть определена заранее. Так, например, для анализа эффективности мутации в данном сайте Ala-сканирующий или неспецифический мутагенез осуществляют в нужном кодоне или в нужной области, и экспрессированные иммуноглобулины скринируют на нужную активность.
Вставками в аминокислотные последовательности являются вставки у амино- и/или карбокси-концов, образующие гибриды, имеющие длину от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки внутри последовательности, состоящие из одного или множества аминокислотных остатков. Примерами концевых инсерций является антитело с N-концевым метионильным остатком или антитело, присоединенное к цитотоксическому полипептиду. Другими инсерционными вариантами молекулы антитела являются гибриды, например, N- или С-концов антитела с ферментом (например, для ADEPT) или полипептидом, который увеличивает время полужизни антитела в сыворотке.
Вариантом другого типа является вариант с заменой аминокислоты. Эти варианты имеют, по меньшей мере, один аминокислотный остаток в молекуле антитела, замененный другим остатком. При этом считается, что сайтами, представляющими наибольший интерес для мутагенеза с заменами, являются гипервариабельные области, однако, рассматриваются также и модификации в FR. Консервативные замены представлены в таблице 2 под заголовком “Предпочтительные замены”. Если такие замены приводят к изменению биологической активности, то могут быть введены более существенные замены, названные в таблице 2 “репрезентативными заменами”, или замены, дополнительно описанные ниже с указанием классов аминокислот, и полученные продукты могут быть скринированы.
Значительные изменения биологических свойств антитела могут быть достигнуты путем выбора замен, которые значительно отличаются по своему влиянию (а) на структуру полипептидного остова в области замены, например, складчатую или спиральную конформацию, (b) на заряд или гидрофобность молекулы в нужном сайте, или (с) на объем боковой цепи. По общим свойствам своих боковых цепей аминокислоты подразделяются на нижеследующие группы (как описано в публикации A.L. Lehninger, Biochemistry, second ed., pp.73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala (А), Val (V), Leu (L), Ile (I), Pro (Р), Phe (F), Trp (W), Met (М);
(2) незаряженные полярные: Gly (G), Ser (S), Thr (Т), Сys (С), Tyr (Y), Asn (N), Gln (Q);
(3) кислотные: Asp (D), Glu (Е);
(4) основные: Lys (К), Arg (R), His (Н).
Альтернативно по общим свойствам боковых цепей природные остатки могут быть подразделены на следующие группы:
(1) гидрофобные остатки: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные остатки: Cys, Ser, Thr, Asn, Gln;
(3) кислотные остатки: Asp, Glu;
(4) основные остатки: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические остатки: Trp, Tyr, Phe.
Не-консервативные замены предусматривают замены аминокислоты одного класса аминокислотой другого класса. Такие замены остатков могут быть также введены в консервативные сайты, или, более предпочтительно, в другие остальные (не-консервативные) сайты.
Одним из типов вариантов замен являются замены одного или нескольких остатков гипервариабельной области родительского антитела (например, гуманизированного или человеческого антитела). В общих чертах полученный(е) вариант(ы), выбранный(е) для дальнейшего исследования, должен(ны) иметь улучшенные биологические свойства по сравнению со свойствами родительского антитела, от которого он(они) происходит(ят). Стандартным методом генерирования таких вариантов замен является аффинное созревание с применением фагового представления. Вкратце, в несколько сайтов гипервариабельных областей (например, 6-7 сайтов) вносят мутации с получением всех возможных аминокислотных замен в каждом сайте. Полученные таким образом антитела представляют на частицах нитчатых фагов в виде гибридов с продуктом гена III М13, упакованным в каждую частицу. Затем представленные на фаге варианты скринируют на их биологическую активность (например, аффинность связывания), как описано в настоящей заявке. Для идентификации сайтов гипервариабельных областей, которые являются кандидатами на модификацию, может быть проведен аланин-сканирующий мутагенез, позволяющий идентифицировать остатки гипервариабельной области, которые играют значительную роль в связывании с антигеном. Альтернативно или дополнительно может оказаться полезным проанализировать кристаллическую структуру комплекса “антиген - антитело” в целях идентификации участков контактирования антитела с антигеном. Такие контактные остатки и соседние остатки являются кандидатами на замену, проводимую описанными здесь методами. После получения таких вариантов панель из таких вариантов подвергают описанному здесь скринингу, и антитела, обладающие наилучшими свойствами, как может быть определено в одном или нескольких релевантных анализах, могут быть отобраны для дальнейшего исследования.
Молекулы нуклеиновой кислоты, кодирующие варианты аминокислотной последовательности антитела, получают различными методами, известными специалистам. Такими методами являются, но не ограничиваются ими, выделение из природного источника (в случае природных вариантов аминокислотной последовательности) или олигонуклеотид-опосредуемый (или сайт-направленный) мутагенез, ПЦР-мутагенез и кластерный мутагенез ранее полученного варианта или немодифицированного варианта указанного антитела.
Может оказаться желательным введение одной или нескольких аминокислотных модификаций в Fc-область полипептидов иммуноглобулина согласно изобретению, и тем самым, создание варианта Fc-области. Такой вариант Fc-области может содержать человеческую последовательность Fc-области (например, Fc-области человеческого IgG1, IgG2, IgG3 или IgG4), имеющий аминокислотную модификацию (например, замену) в одном или в нескольких положениях аминокислот, включая положения цистеина шарнирной области.
В соответствии с настоящим описанием и известным уровнем техники в некоторых вариантах изобретения предусматривается, что антитело, используемое в способах согласно изобретению, может содержать одну или несколько модификаций по сравнению с аналогом этого антитела дикого типа, например, в Fc-области. Эти антитела, тем не менее, сохраняют почти все свойства, необходимые для достижения терапевтической эффективности по сравнению со свойствами аналога дикого типа. Так, например, считается, что в Fc-области могут быть сделаны некоторые модификации, которые будут изменять (то есть, либо увеличивать, либо уменьшать) уровень связывания с С1q и/или комплемент-зависимую цитотоксичность (CDС), например, как описано в WO 99/51642 (см. также публикацию Duncan & Winter, Nature 322:738-40 (1988); патент США № 5648260; патент США № 5624821; и WO 94/29351), в которой описаны другие примеры вариантов Fc-области.
Иммуноконъюгаты
Настоящее изобретение также относится к иммуноконъюгатам или конъюгатам “антитело-лекарственное средство” (АDC), содержащим антитело, конъюгированное с цитотоксическим агентом, таким как химиотерапевтическое средство, лекарственное средство, средство, ингибирующее рост опухоли, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения, или его фрагменты), или радиоактивный изотоп (то есть, радиоактивный конъюгат).
Использование конъюгатов “антитело - лекарственное средство” для местной доставки цитотоксических или цитостатических агентов, то есть лекарственных средств для уничтожения или ингибирования роста опухолевых клеток в целях лечения рака (Syrigos & Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz & Springer (1997) Adv. Drg. Del. Rev. 26:151-172; патент США № 4975278), теоретически позволяет обеспечивать доставку лекарственного средства в опухоли и их аккумуляцию внутри клеток, где системное введение этих неконъюгированных лекарственных средств может приводить не только к элиминации опухолевых клеток, но также и к продуцированию уровней токсичности, которые являются неприемлемыми для нормальных клеток (Baldwin et al. (1986) Lancet pp. (Mar. 15, 1986):603-05; Thorpe (1985) “Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review “Monoclonal Antibodies 84:Biological and Clinical Applications, A. Pinchera et al. (ed.s), pp.475-506). Поэтому желательно обеспечить максимальную эффективность при минимальной токсичности. Сообщалось, что в этих стратегиях могут быть использованы как поликлональные антитела, так и моноклональные антитела (Rowland et al. (1986) Cancer Immunol. Immunother. 21:183-87). Лекарственными средствами, используемыми в этих методах, являются дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al. (1986) см. выше). Токсинами, используемыми в конъюгатах “антитело - токсин”, являются бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гелданамицин (Mandler et al. (2000) Jour. of the Nat. Cancer Inst. 92(19):1573-1581; Mandler et al. (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al. (2002) Bioconjugate Chem. 13:786-791), майтанзиноиды (ЕР 1391213; Liu et al. (1996) Proc. Natl. Acad. Sci., USA, 93:8618-8623) и калихеамицин (Lode et al. (1998) Cancer Res. 58:2928; Hinman et al. (1993) Cancer Res. 53:3336-3342). Эти токсины могут осуществлять свое цитотоксическое и цитостатическое действие в соответствии с определенными механизмами, включая связывание с тубулином, связывание с ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства при их конъюгировании с крупными антителами или с лигандами рецепторов белка имеют тенденцию к потере или к снижению активности.
Зевалин® (ибритумомаб тиуксетан, Biogen/Idec) представляет собой конъюгат “антитело - радиоизотоп”, состоящий из цепи каппа мышиного моноклонального антитела IgG1, направленного против антигена CD20, присутствующего на поверхности нормальных и злокачественных В-лимфоцитов, и радиоизотопа111In или90Y, связанного с агентом, образующим хелатный комплекс с тиомочевинным линкером (Wiseman et al. (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al. (2002) Blood 99(12):4336-42; Witzig et al. (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al. (2002) J. Clin. Oncol. 20(15):3262-69). Хотя зевалин обладает активностью против В-клеточной не-ходжкинской лимфомы (НХЛ), однако, его введение приводит к развитию тяжелой и продолжительной цитопении у большинства пациентов. Милотаргтм (гемтузумаб озогамицин, Wyeth Pharmaceuticals), представляющий собой конъюгат “антитело - лекарственное средство”, состоящий из антитела против человеческого CD33, связанного с калихеамицином, в 2000 г. был разрешен к применению путем инъекции для лечения острого миелоидного лейкоза (Drugs of the Future (2000) 25(7):686; патенты США №№ 4970198; 5079233; 5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Кантузумаб мертанзин (Immunogen, Inc.), представляющий собой конъюгат “антитело - лекарственное средство”, состоящий из антитела против человеческого C242, связанного посредством дисульфидного линкера SРР с майтанзиноидным лекарственным средством, DМ1, находится в стадии испытаний фазы II, проводимых в целях исследования возможности его применения для лечения раковых опухолей, экспрессирующих СаnAg, таких как рак толстой кишки, поджелудочной железы, желудка и т.п. MLN-2704 (Millenium Pharm., BZL Biologics, Immunogen Inc.), представляющий собой конъюгат “антитело - лекарственное средство”, состоящий из моноклонального антитела против простатического мембранного антигена (PSMA), связанного с майтанзиноидным лекарственным средством, DМ1, находится в стадии исследования на возможность его применения для лечения опухолей предстательной железы. Ауристатиновые пептиды, ауристатин Е (АЕ) и монометилауристатин (ММАЕ), синтетические аналоги доластатина были конъюгированы с химерными моноклональными антителами сВR96 (специфичными к антигену Lewis Y, присутствующему на карциномах) и сАС10 (специфичными к CD30, присутствующему на гематологических злокачественных опухолях) (Doronina et al. (2003) Nature Biotechnology 21(7):778-784) и находятся на стадии разработки терапевтических свойств на их основе.
Химиотерапевтические средства, используемые для получения таких иммуноконъюгатов, описаны выше. Ферментативно активными токсинами и их фрагментами, которые могут быть использованы для этих целей, являются А-цепь дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (от Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, белка диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. Для продуцирования радиоактивно конъюгированных антител могут быть использованы различные радионуклиды. Примерами таких радионуклидов являются212Bi,131I,131In,90Y и186Re. Конъюгаты антитела и цитотоксического лекарственного средства получают с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилтиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Так, например, иммунотоксин рицин может быть получен как описано в публикации Vitetta et al. Science, 238:1098 (1987).14С-меченная 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (МХ-DTPA) является репрезентативным хелатообразующим агентом для конъюгирования радионуклида с антителом (см. WO 94/11026).
В настоящем изобретении также рассматриваются конъюгаты антитела и одного или нескольких низкомолекулярных токсинов, таких как калихеамицин, майтанзиноиды, трихотецен и СС1065, и производные этих токсинов, обладающие токсической активностью.
Майтанзин и майтанзиноиды
В одном из вариантов изобретения антитело (полноразмерное антитело или его фрагменты) согласно изобретению конъюгировано с одной или несколькими молекулами майтанзиноида.
Майтанзиноиды представляют собой митотические ингибиторы, которые действуют посредством ингибирования полимеризации тубулина. Майтанзин был впервые выделен у восточно-африканской землеройки Maytenus serrata (патент США № 3896111). Затем было обнаружено, что некоторые микробы также продуцируют майтанзиноиды, такие как майтанзинол и сложные эфиры С-3-майтанзинола (патент США № 4151042). Синтетический майтанзинол, его производные и аналоги описаны, например, в патентах США №№ 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533, описание которых точно и во всей своей полноте вводится в настоящую заявку посредством ссылки.
Конъюгаты “майтанзиноид-антитело”
В целях увеличения терапевтического индекса майтанзина и майтанзиноидов эти соединения были конъюгированы с антителами, специфически связывающимися с антигенами опухолевых клеток. Иммуноконъюгаты, содержащие майтанзиноиды, и их терапевтическое применение описаны, например, в патентах США №№ 5208020, 5416064 и в Европейском патенте ЕР 0425235В1, которые точно и во всей своей полноте вводятся в настоящую заявку посредством ссылки. В публикации Liu et al. Proc. Natl. Acad. Sci., USA, 93:8618-8623 (1996) описаны иммуноконъюгаты, содержащие майтанзиноид, обозначенный DМ1, который был связан с моноклональным антителом С242, направленным против рака ободочной кишки человека. Было обнаружено, что указанный конъюгат является в высокой степени цитотоксичным для культивированных раковых клеток толстой кишки и обладает противоопухолевой активностью в анализе на рост опухоли in vivo. В публикации Chari et al., Cancer Research 52:127-131 (1992) описаны иммуноконъюгаты, в которых майтанзиноид был конъюгирован посредством дисульфидного линкера с мышиным антителом А7, связывающимся с антигеном, присутствующим на клеточных линиях рака толстой кишки человека, или с другим мышиным моноклональным антителом ТА.1, которое связывается с онкогеном HER-2/neu. Цитотоксичность конъюгата “ТА.1- майтанзиноид” была протестирована in vitro на клеточной линии рака молочной железы человека SК-ВR-3, которая экспрессирует 3 × 105 поверхностных антигенов HER-2 на клетку. Этот конъюгат лекарственного средства достигал степени цитотоксичности, аналогичной цитотоксичности свободного майтанзиноидного лекарственного средства, и такая цитотоксичность может быть повышена путем увеличения числа молекул майтанзиноида на молекулу антитела. Конъюгат “А7 - майтанзиноид” обнаруживал низкую системную цитотоксичность у мышей.
Конъюгаты “антитело-майтанзиноид” (иммуноконъюгаты)
Конъюгаты “антитело-майтанзиноид” получают путем химического связывания антитела с молекулой майтанзиноида, где указанное связывание не приводит к значительному снижению биологической активности антитела или молекулы майтанзиноида. Молекулы майтанзиноида, присутствующие в данном конъюгате в количестве примерно 3-4 молекулы на одну молекулу антитела, обнаруживают эффективность в повышении цитотоксичности по отношению к клеткам-мишеням, но, при этом, не оказывают негативного влияния на функцию или растворимость антитела, хотя предполагается, что даже одна молекула токсина на антитело, по сравнению с неконъюгированным антителом, будет повышать цитотоксичность конъюгата. Майтанзиноиды хорошо известны специалистам и могут быть синтезированы известными методами либо они могут быть выделены из природных источников. Подходящие майтанзиноиды описаны, например, в патенте США № 5208020 и в других патентах и в непатентных публикациях, описанных выше. Предпочтительными майтанзиноидами являются майтанзинол и аналоги майтанзинола, имеющие модификации в ароматическом кольце или в других положениях молекулы майтанзинола, такие как различные сложные эфиры майтанзинола.
Для создания конъюгатов “антитело - майтанзиноид” может быть использовано множество линкерных групп, известных специалистам, включая, например, группы, описанные в патенте США № 5208020 или в Европейском патенте ЕР 0425235В1, и в публикации Chari et al., Cancer Research 52:127-131 (1992). Линкерными группами являются дисульфидные группы, тиоэфирные группы, группы, чувствительные к воздействию кислоты, фотохимически неустойчивые группы, группы, чувствительные к действию пептидазы, или группы, чувствительные к действию эстеразы, описанные в вышеупомянутых патентах, при этом предпочтительными являются дисульфидные и тиоэфирные группы.
Конъюгаты “антитело - майтанзиноид” могут быть получены с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Особенно предпочтительными связывающими агентами для создания дисульфидной связи являются N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 [1978]) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPР).
Линкер может быть присоединен к молекуле майтанзиноида в различных положениях в зависимости от типа связи. Так, например, сложноэфирная связь может быть образована посредством реакции с гидроксильной группой стандартными методами связывания. Такая реакция может осуществляться в положении С-3, имеющем гидроксильную группу, в положении С-14, модифицированном гидроксиметилом, в положении С-15, модифицированном гидроксильной группой, и в положении С-20, имеющем гидроксильную группу. В предпочтительном варианте изобретения указанная связь образуется в положении С-3 майтанзинола или его аналога.
Калихеамицин
Другой представляющий интерес иммуноконъюгат содержит антитело, конъюгированное с одной или несколькими молекулами калихеамицина. Антибиотики семейства калихеамицинов способны продуцировать двухцепочечные ДНК-разрывы в субпикомолярных концентрациях. Описание получения конъюгатов семейства калихеамицинов можно найти в патентах США №№ 5712354, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все патенты принадлежат компании American Cyanamid Company). Структурными аналогами калихеамицина, которые могут быть использованы в этих целях, являются, но не ограничиваются ими, γ1I, α2I, α3I, N-ацетил-γ1I, PSAG и θ1I (см. Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) и вышеупомянутые патенты США, принадлежащие компании American Cyanamid). Другим противоопухолевым лекарственным средством, с которым может быть конъюгировано антитело, является средство QFA, которое представляет собой антифолат. Калихеамицин и QFA имеют внутриклеточные активные сайты и с трудом проходят через плазматическую мембрану. Поэтому поглощение этих агентов клетками путем интернализации, опосредуемой антителом, приводит к значительному усилению их цитотоксических эффектов.
Другие цитотоксические средства
Другими противоопухолевыми средствами, которые могут быть конъюгированы с антителами согласно изобретению, являются ВСNU, стрептозоцин, винкристин и 5-фторурацил, семейство агентов, известных под общим названием комплекс LL-Е33288, описанный в патентах США №№ 5053394, 5770710, а также эсперамицины (патент США № 5877296).
Ферментативно активными токсинами и их фрагментами, которые могут быть использованы в этих целях, являются А-цепь дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (от Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены (см., например, заявку WO 93/21232, опубл.28 октября 1993).
В настоящем изобретении также рассматривается иммуноконъюгат, образующийся между антителом и соединением, имеющим нуклеолитическую активность (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКазой).
Для селективной деструкции опухоли может быть использовано антитело, которое может содержать высокорадиоактивный атом. Для продуцирования радиоактивно конъюгированных антител могут быть использованы различные радиоактивные изотопы. Примерами таких радионуклидов являются211At,131I,125I,90Y,186Re,188Re,153Sm,212Bi,32Р,212Рb и радиоактивные изотопы Lu. Если указанный конъюгат используется для детекции, то он может содержать радиоактивный атом для сцинтиграфических исследований, например99mТс или123I, или спин-метку для визуализации методом ядерного магнитного резонанса (ЯМР) (известной также как МР-визуализация, МРВ), такую как иод-123, иод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки могут быть включены в конъюгат известными методами. Так, например, пептид может быть синтезирован биологическими методами либо он может быть синтезирован методом химического синтеза аминокислот с использованием подходящих аминокислотных предшественников, включающих, например, фтор-19 вместо водорода. Такие метки, как99mТс или123I,186Re,188Re и111In могут быть присоединены посредством цистеинового остатка пептида. Иттрий-90 может быть присоединен посредством лизинового остатка. Для введения иода-123 может быть применен метод IODOGEN (Fraker et al. (1978) Biochem. Biophys. Res. Commun. 80:49-57). Другие методы подробно описаны в публикации “Monoclonal Antibodies in Immunoscintigraphy” (Chatal, CRC Press 1989).
Конъюгаты антитела и цитотоксического лекарственного средства могут быть получены с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат, иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Так, например, иммунотоксин рицин может быть получен, как описано в публикации Vitetta et al. Science, 238:1098 (1987).14С-меченная 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (МХ-DTPA) является репрезентативным хелатообразующим агентом для конъюгирования радионуклида с антителом (см. WO 94/11026). Линкером может быть “отщепляемый линкер”, облегчающий высвобождение цитотоксического лекарственного средства в клетке. Так, например, могут быть использованы линкеры, чувствительные к воздействию кислоты; линкеры, чувствительные к действию пептидазы, фотохимически неустойчивые линкеры, диметиловые линкеры или дисульфид-содержащие линкеры (Chari et al., Cancer Research 52:127-131 (1992), патент США № 5208020).
Соединениями, специально рассматриваемыми в настоящем изобретении, являются, но не ограничиваются ими, ADC, полученные с использованием перекрестно-связывающих реагентов, таких как BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, поставляются фирмой Pierce Biotechnology, Inc., Rockford, IL., USA). См. руководство по применению и каталог (Application Handbook and Catalog), 2003-2004, стр. 467-498.
Получение конъюгатов “антитело - лекарственное средство”
В конъюгатах “антитело - лекарственное средство” (ADC) согласно изобретению антитело (Ab) конъюгировано с одной или с несколькими молекулами лекарственного средства (D) посредством линкера (L), где, например, на одну молекулу антитела приходится примерно от 1 до 20 молекул лекарственного средства. Конъюгаты ADC формулы (I) могут быть получены несколькими способами, предусматривающими проведение реакций органического химического синтеза с использованием условий и реагентов, известных специалистам, где указанные способы включают: (1) реакцию взаимодействия нуклеофильной группы антитела с двухвалентным линкерным реагентом с образованием Ab-L посредством ковалентной связи, а затем реакцию взаимодействия с молекулой лекарственного средства D; и (2) реакцию взаимодействия нуклеофильной группы молекулы лекарственного средства с двухвалентным линкерным реагентом с образованием D-L посредством ковалентной связи, а затем реакцию взаимодействия с нуклеофильной группой антитела
Ab - (L - D)р. (I)
Нуклеофильными группами, присутствующими на антителах, являются, но не ограничиваются ими: (i) N-концевые аминогруппы, (ii) аминогруппы боковой цепи, например лизина, (iii) тиоловые группы боковой цепи, например цистеина, и (iv) гидроксильные или аминогруппы сахаров, где указанное антитело является гликозилированным. Аминогруппы, тиольные группы и гидроксильные группы являются нуклеофильными и могут подвергаться реакции взаимодействия с образованием ковалентных связей с нуклеофильными группами на линкерных молекулах или линкерных реагентах, включая: (i) активные сложные эфиры, такие как NНS-эфиры, HOBt-эфиры, галогенформиаты и галегенангидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы. Некоторые антитела имеют восстанавливаемые межцепьевые дисульфиды, то есть цистеиновые мостики. Для конъюгирования с линкерными реагентами антитела могут быть сделаны реакционноспособными путем их обработки восстановителем, таким как DТТ (дитиотреитол). Каждый цистеиновый мостик, теоретически, может образовывать два реакционноспособных тиоловых нуклеофила. В антитела могут быть введены дополнительные нуклеофильные группы посредством реакции взаимодействия лизинов с 2-иминотиоланом (реагентом Траута), что будет приводить к превращению амина в тиол.
Конъюгаты “антитело - лекарственное средство” согласно изобретению могут быть также получены путем модификации антитела с введением в него электрофильных групп, которые могут реагировать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. Сахара гликозилированных антител могут быть окислены, например, периодатными окислителями с образованием альдегидных или кетоновых групп, которые могут реагировать с аминогруппой линкерных реагентов или молекул лекарственного средства. Полученные иминовые группы шиффова основания могут образовывать стабильную связь либо они могут быть восстановлены, например, борогидридными реагентами с образованием стабильных аминовых связей. В одном из вариантов изобретения реакция взаимодействия углеводной части гликозилированного антитела с галактозооксидазой или с метапериодатом натрия может приводить к образованию карбонильных (альдегидных и кетоновых) групп в белке, которые могут реагировать с соответствующими группами на лекарственном средстве (Hermanson, Bioconjugate Techniques). В другом варианте изобретения белки, содержащие N-концевые сериновые или треониновые остатки, могут реагировать с метапериодатом натрия с образованием альдегида вместо первой аминокислоты (Geoghegan & Stroh (1992), Bioconjugate Chem. 3:138-146; патент США № 5362852). Такой альдегид может взаимодействовать с молекулой лекарственного средства или с линкерным нуклеофилом.
Аналогичным образом нуклеофильными группами на молекуле лекарственного средства являются, но не ограничиваются ими, аминогруппы, тиольные, гидроксильные, гидразидные, оксимовые, гидразиновые, тиосемикарбазоновые, гидразинкарбоксилатные и арилгидразидные группы, способные реагировать с образованием ковалентных связей с электрофильными группами на линкерных молекулах и линкерных реагентах, включая: (i) активные сложные эфиры, такие как NНS-эфиры, HOBt-эфиры, галогенформиаты и галегенангидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы.
Альтернативно гибридный белок, содержащий антитело и цитотоксическое средство, может быть получен, например, рекомбинантными методами или методом пептидного синтеза. Длина ДНК может составлять соответствующие области, кодирующие две части конъюгата, либо смежные друг с другом, либо разделенные областью, кодирующей линкерный пептид, который не оказывает негативного влияния на желаемые свойства данного конъюгата.
В еще одном варианте изобретения указанное антитело может быть конъюгировано с “рецептором” (таким как стрептавидин) для его предварительного нацеливания на опухоль, где указанный конъюгат “антитело-рецептор” вводят пациенту с последующим удалением несвязанного конъюгата из кровотока с использованием агента для клиренса, а затем вводят “лиганд” (например, авидин), конъюгированный с цитотоксическим средством (например, радионуклеотидом).
Производные антител
Антитела согласно изобретению могут быть дополнительно модифицированы так, чтобы они содержали другие не-белковые молекулы, которые известны специалистам и являются легко доступными. Предпочтительными молекулами, подходящими для дериватизации антител, являются водорастворимые полимеры. Неограничивающими примерами водорастворимых полимеров являются полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (гомополимеры или статистические сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. При промышленном изготовлении следует отдать предпочтение пропиональдегиду полиэтиленгликоля благодаря его стабильности в воде. Этот полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединяемых к антителу, может варьироваться, и если присоединяют более чем один полимер, то эти полимеры могут иметь одинаковые или различные молекулы. В общих чертах число и/или тип полимеров, используемых для дериватизации, могут быть выбраны исходя из нескольких факторов, включая, но не ограничиваясь ими, конкретные свойства или функции дериватизируемого антитела, независимо от конкретных условий терапии, при которых будет использоваться указанное производное антитела и т.п.
Фармацевтические композиции
Терапевтические композиции, содержащие антитело согласно изобретению, получают в виде препаратов, удобных для хранения, путем смешивания антитела, имеющего нужную степень чистоты, с необязательными физиологически приемлемыми носителями, эксципиентами или стабилизаторами (Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1980)), в форме водных растворов, лиофилизованных препаратов или других сухих препаратов. Приемлемые носители, эксципиенты или стабилизаторы в используемых дозах и концентрациях должны быть нетоксичными для реципиентов, и ими являются буферы, такие как фосфат, цитрат, гистидин и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензэтония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные полипептиды (имеющие примерно менее чем 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; металлокомплексы (например, комплексы Zn - белок); и/или неионогенные поверхностно-активные вещества, такие как твинТМ, плюроникТМ или полиэтиленгликоль (ПЭГ).
Описанная здесь композиция может также содержать несколько активных соединений, необходимых для конкретного показания, а предпочтительно, имеющих дополнительные активности, не оказывающие негативного влияния друг на друга. Такие молекулы могут присутствовать в комбинации в количествах, эффективных для применения в нужных целях.
Активные ингредиенты могут быть также заключены в микрокапсулу, полученную, например, методами коацервации или путем межфазной полимеризации, например, в гидроксиметилцеллюлозную или желатиновую микрокапсулу и полиметилметакрилатную микрокапсулу, соответственно, в системы для доставки коллоидальных лекарственных средств (например, в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такая методика описана в руководстве Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1980).
Композиции, используемые для введения in vivo, должны быть стерильными. Это может быть легко достигнуто путем фильтрации через стерильные фильтрующие мембраны.
Могут быть получены препараты замедленного высвобождения. Подходящими примерами препаратов замедленного высвобождения являются полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих иммуноглобулин согласно изобретению, где указанные матрицы имеют форму готовых изделий, например пленок или микрокапсул. Примерами матриц замедленного высвобождения являются полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, неразлагаемый сополимер этилена-винилацетата, разлагаемые сополимеры молочной кислоты - гликолевой кислоты, такие как LUPRON DEPOTТМ (микросферы для инъекций, состоящие из сополимера молочной кислоты - гликолевой кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляная кислота. Полимеры, такие как сополимер этилена - винилацетата и сополимер молочной кислоты - гликолевой кислоты способны высвобождать молекулы в течение более 100 дней, а некоторые гидрогели высвобождают белки за более короткие периоды времени. Если инкапсулированные иммуноглобулины сохраняются в организме в течение длительного периода времени, то они могут денатурироваться или агрегироваться под воздействием влаги при 37оС, что приводит к потере биологической активности и к возможным изменениям иммуногенности. Для стабилизации в зависимости от конкретного механизма могут быть разработаны рациональные стратегии. Так, например, если было обнаружено, что механизмом агрегации является образование межмолекулярной S-S-связи посредством тио-дисульфидного обмена, то стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации из кислотных растворов, регуляции содержания влаги с использованием соответствующих добавок, и получения конкретных композиций на основе полимерной матрицы.
Применения
Антитело согласно изобретению может быть использовано, например, в терапевтических методах in vitro, ex vivo и in vivo. Антитела согласно изобретению могут быть использованы в качестве антагониста для частичного или полного блокирования специфической антигенной активности in vitro, ex vivo и/или in vivo. Кроме того, по меньшей мере, некоторые антитела согласно изобретению могут нейтрализовать активность антигена, происходящего от других видов. В соответствии с этим антитела согласно изобретению могут быть использованы для ингибирования специфической антигенной активности, например, в клеточной культуре, содержащей указанный антиген, в организме человека или других млекопитающих, имеющих антиген, с которым перекрестно реагирует антитело согласно изобретению (например, шимпанзе, павианов, игрунок, собакоподобных обезьян и макак-резусов, а также свиней или мышей). В одном из вариантов изобретения антитело согласно изобретению может быть использовано для ингибирования антигенной активности путем контактирования указанного антитела с антигеном так, чтобы осуществлялось ингибирование активности антигена. Предпочтительным антигеном является человеческая белковая молекула.
В одном из вариантов изобретения антитело согласно изобретению может быть использовано в способе ингибирования антигена у индивидуума, страдающего расстройством, при котором антигенная активность оказывает негативное воздействие, где указанный способ включает введение данному индивидууму антитела согласно изобретению для ингибирования указанной антигенной активности у данного индивидуума. Предпочтительным антигеном является человеческая белковая молекула, а предпочтительным индивидуумом является человек. Альтернативно указанным индивидуумом может быть млекопитающее, экспрессирующее антиген, с которым связывается антитело согласно изобретению. Кроме того, указанным индивидуумом может быть млекопитающее, которому был введен указанный антиген (например, путем прямого введения антигена или экспрессии антигенного трансгена). Антитело согласно изобретению может быть введено человеку в терапевтических целях. Кроме того, антитело согласно изобретению может быть введено млекопитающему, не являющемуся человеком (например, примату, свинье или мыши) и экспрессирующему антиген, с которым перекрестно реагирует иммуноглобулин, в целях лечения этого млекопитающего либо оно может быть введено животному с моделью человеческого заболевания. Что касается животного-модели, то такие животные могут быть использованы для оценки терапевтической эффективности антител согласно изобретению (например, для определения доз и времени введения). Блокирующими терапевтически эффективными антителами согласно изобретению являются, например, но не ограничиваются ими, анти-HER2 антитело, анти-VEGF антитело, анти-IgЕ антитело, анти-CD11 антитело, антитело против интерферона и антитело против тканевого фактора. Антитела согласно изобретению могут быть использованы для лечения, ингибирования, замедления прогрессирования, предупреждения/замедления возникновения рецидивов, улучшения динамики или предупреждения заболеваний, расстройств или состояний, ассоциированных с аномальной экспрессией и/или активностью одной или нескольких молекул антигена, включая, но не ограничиваясь ими, злокачественные и доброкачественные опухоли; злокачественные заболевания, не относящиеся к лейкозу и лимфолейкозу; патологии нервных клеток, глиальных клеток, астроцитов, клеток гипоталамуса и другие гландулярные, макрофагальные, эпителиальные, стромальные и бластоцелиальные расстройства; а также воспалительные, ангиогенные и иммунологические расстройства.
В одном из аспектов изобретения блокирующее антитело согласно изобретению является специфичным к антигену-лиганду и ингибирует антигенную активность путем блокирования или предотвращения взаимодействия лиганда-рецептора с антигеном-лигандом, и тем самым, ингибирует соответствующий путь передачи сигнала и других молекулярных или клеточных процессов. Настоящее изобретение также относится к рецептор-специфическим антителам, которые должны, но необязательно, предотвращать связывание с лигандом и подавлять активацию рецептора, что приводит к ингибированию любых ответов, которые в нормальных условиях должны инициироваться посредством связывания с лигандом. Настоящее изобретение также относится к антителам, которые, предпочтительно, или исключительно, связываются с комплексами “лиганд-рецептор”. Антитело согласно изобретению может также действовать как агонист конкретного рецептора антигена и тем самым потенцировать, усиливать или активировать все или несколько активностей, участвующих в лиганд-опосредуемой активации рецептора.
В некоторых вариантах изобретения иммуноконъюгат, содержащий антитело, конъюгированное с цитотоксическим агентом, вводят указанному пациенту. В некоторых вариантах изобретения иммуноконъюгат и/или антиген, с которым он связывается, интернализуется в клетке, что приводит к повышению терапевтической эффективности иммуноконъюгата, направленной на уничтожение клетки-мишени, с которой он связывается. В одном из вариантов изобретения цитотоксический агент подавляет нуклеиновую кислоту или взаимодействует с нуклеиновой кислотой в клетке-мишени. Примерами таких цитотоксических агентов являются любые описанные здесь химиотерапевтические средства (такие как майтанзиноид или калихеамицин), радиоактивный изотоп или рибонуклеаза, или ДНК-эндонуклеаза.
Антитела согласно изобретению, взятые отдельно или в комбинации с другими композициями, могут быть использованы в терапевтических целях. Так, например, антитело согласно изобретению может быть введено вместе с другим антителом, химиотерапевтическим(и) средством(ами) (включая смеси химиотерапевтических средств), с другим(и) цитотоксическим(и) средством(ами), антиангиогенным(и) средством(ами), цитокинами и/или с рост-ингибирующим(и) средством(ами). Если антитело согласно изобретению ингибирует рост опухоли, то может оказаться особенно желательным его объединение с одним или несколькими другими терапевтическими средствами, также ингибирующими рост опухоли. Так, например, антитело согласно изобретению может быть объединено с анти-VEGF антителом (например, авастином) и/или с анти-ЕrbB антителами (например, с анти-HER2 антителом, герцептином®) для его применения в схеме лечения, например, любых описанных здесь заболеваний, включая рак ободочной кишки, рак молочной железы с метастазами и рак почек. Альтернативно или дополнительно пациент может быть подвергнут комбинированной лучевой терапии (например, облучением внешним пучком или терапии с использованием радиоактивно меченного агента, такого как антитело). Такой указанной выше комбинированной терапией является комбинированное введение (где два или более агентов включены в одну или ту же или в отдельные композиции) и отдельное введение, при котором антитело согласно изобретению может быть введено до и/или после проведения вспомогательной терапии.
Антитело согласно изобретению (и вспомогательное терапевтическое средство) вводят различными способами, включая парентеральное, подкожное, внутрибрюшинное, внутрилегочное и интраназальное введение, а если необходимо местное лечение, то антитело вводят в пораженный участок. Парентеральной инфузией является внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Кроме того, подходящим способом введения является периодическое вливание, а в частности вливание антитела в уменьшающихся дозах. Такие дозы могут быть введены любым подходящим способом, например, путем инъекций, таких как внутривенные или подкожные инъекции, и эти дозы отчасти зависят от того, является ли такое введение периодическим или постоянным.
Антитело-содержащую композицию согласно изобретению приготавливают, разделяют на дозы и вводят в соответствии с хорошо известной медицинской практикой. Факторами, учитываемыми для приготовления таких композиций, являются конкретное расстройство, подвергаемое лечению, конкретное млекопитающее, подвергаемое лечению, клиническое состояние отдельного пациента, этиологический фактор, вызывающий данное расстройство, участок, на который направлено данное средство, способ введения, схема введения и другие факторы, известные практическим врачам. Указанное антитело должно быть, но необязательно, приготовлено в виде композиции с одним или несколькими средствами, используемыми для предупреждения или лечения рассматриваемого расстройства. Эффективное количество таких других средств зависит от количества антител согласно изобретению, присутствующих в данной композиции, типа расстройства или способа лечения и от других факторов, обсуждаемых выше. Указанные другие средства обычно вводятся в тех же самых дозах и теми же способами, которые обычно использовались ранее, либо эти дозы составляют примерно 1-99% от используемых ранее доз.
Для предупреждения или лечения заболеваний подходящие дозы антитела согласно изобретению (используемого отдельно или в комбинации с другими средствами, такими как химиотерапевтические средства) зависят от типа заболевания, подвергаемого лечению, типа антитела, тяжести и курса лечения заболевания, независимо от того вводят ли указанное антитело в профилактических или терапевтических целях, от проводимого ранее лечения, от истории болезни пациента и его восприимчивости к антителу и от назначения лечащего врача. Такое антитело может быть введено пациенту один раз или более во время проведения курса лечения. В зависимости от типа и тяжести заболевания начальная предварительно установленная доза антитела, вводимого пациенту, составляет примерно от 1 мкг/кг до 15 мг/кг (например, 0,1 мг/кг - 10 мг/кг), независимо от того, осуществляют ли одноразовое или многократное введение или непрерывную инфузию данного антитела. Типичная суточная доза может составлять примерно от 1 мкг/кг до 100 мг/кг или более в зависимости от вышеупомянутых факторов. Для повторного введения в течение нескольких дней или более, в зависимости от состояния, лечение может проводиться до тех пор, пока не будет достигнуто желаемое подавление симптомов заболевания. Репрезентативная доза антитела может составлять примерно от 0,05 до 10 мг/кг. Так, например, пациенту могут быть введены одна или несколько доз, составляющих примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любая их комбинация). Такие дозы могут быть введены периодически, например, еженедельно или раз в три недели (например, пациенту может быть введено от двух до двадцати, например, примерно шесть доз антитела). При этом сначала могут быть введены более высокие дозы, а затем может быть введена одна или несколько более низких доз. Репрезентативная схема введения доз включает введение начальной дозы, составляющей примерно 4 мг/кг, с последующим еженедельным введением поддерживающей дозы, составляющей примерно 2 мг/кг антитела. Однако могут быть применены и другие схемы введения. Мониторинг эффекта такой терапии может быть легко проведен стандартными методами и с применением стандартных анализов.
Промышленные изделия
В другом своем аспекте настоящее изобретение относится к промышленному изделию, содержащему материалы, используемые для лечения, предупреждения и/или диагностики описанных выше расстройств. Промышленное изделие содержит контейнер и этикетку или вкладыш, вложенный в упаковку или наклеенный на контейнер. Подходящими контейнерами являются, например, бутыли, флаконы, шприцы и т.п. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Этот контейнер содержит композицию, которая сама по себе или в комбинации с другой композицией является эффективной для лечения, предупреждения и/или диагностики данного состояния и может иметь стерильное входное отверстие (например, таким контейнером может быть пакет для внутривенного введения раствора или сосуд, имеющий пробку, протыкаемую иглой для подкожных инъекций). В данной композиции, по меньшей мере, одним активным агентом является антитело согласно изобретению. На этикетке или во вкладыше, вложенном в упаковку, указано, что такая композиция используется для лечения данного конкретного заболевания, такого как рак. Кроме того, указанное промышленное изделие может включать (а) первый контейнер с содержащейся в нем композицией, включающей антитело согласно изобретению, и (b) второй контейнер с содержащейся в нем композицией, включающей дополнительное цитотоксическое средство. В этом варианте изобретения промышленное изделие согласно изобретению может дополнительно содержать вложенный в упаковку вкладыш, в котором указано, что композиции, содержащие первое и второе антитело, могут быть использованы для лечения конкретного состояния, например рака. Альтернативно или дополнительно указанное промышленное изделие может дополнительно содержать второй (или третий) контейнер, включающий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать и другие материалы, необходимые для коммерческого производства и для потребителя, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Ниже приводятся примеры способов и композиций согласно изобретению. При этом следует отметить, что исходя из приведенного выше общего описания изобретения могут быть осуществлены и другие различные варианты изобретения.
ПРИМЕРЫ
Материалы и методы
Нумерацию остатков проводили по Кэбату (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). При этом были использованы однобуквенные обозначения аминокислот. Вырожденность ДНК представлена кодом IUB (N = A/C/G/T, D = A/G/T, V = A/C/G, B = C/G/T, H = A/C/T, K = G/T, M = A/C, R = A/G, S = G/C, W = A/T, Y = C/T).
Прямое присоединение гипервариабельной области к акцепторной человеческой консенсусной каркасной области. Фагмидой, используемой в данной работе, является вектор для представления моновалентного Fab-g3 (pV0350-2В), имеющий две открытые рамки считывания под контролем промотора phoA, и описанный, по существу, в работе Lee et al., J. Mol. Biol. (2004) 340(5):1073-93. Первая открытая рамка считывания состоит из сигнальной последовательности stII, присоединенной к доменам VL и СН1 акцепторной легкой цепи, а вторая открытая рамка считывания состоит из сигнальной последовательности stII, присоединенной к доменам VН и СН1 акцепторной тяжелой цепи, за которой следует усеченная последовательность оболочечного белка малого фага Р3. Lee et al., см. выше.
VL- и VH-домены мышиного антитела 5D5 (гибридома 5D5.11.6, АТСС, рег. № НВ-11895, депонированная 23 мая 1995) сравнивали путем выравнивания с доменами консенсусной человеческой последовательности каппа I (huKI) и с доменами консенсусной человеческой последовательности VH подгруппы III (huIII). Для получения HVR-гибрида использовали акцепторную каркасную область VH, которая отличается от человеческой консенсусной последовательности домена VH подгруппы III в 3-х положениях: R71А, N73Т и L78А (Carter et al., Proc. Natl. Acad. Sci., USA, 89:4285 (1992)). Гипервариабельные области мышиного антитела 5D5 (mu5D5) встраивали в акцепторную консенсусную каркасную человеческую последовательность с получением антитела 5D5 с непосредственно присоединенным к нему HVR (5D5-гибрида). В домене VL к человеческой акцепторной консенсусной последовательности присоединяли области в следующих положениях: 24-34 (L1), 50-56 (L2) и 89-97 (L3). В домене VН присоединяли области в следующих положениях: 26-35 (Н1), 49-65 (Н2) и 95-102 (Н3) (фиг.1).
Варианты, полученные путем прямого присоединения, были генерированы с помощью мутагенеза по Кункелю с использованием отдельных олигонуклеотидов для каждой гипервариабельной области. Нужные клоны оценивали путем секвенирования ДНК.
“Мягкая” рандомизация гипервариабельных областей. В каждой гипервариабельной области создавали вариабельность последовательностей с применением стратегии “мягкой” (частичной) рандомизации, которая позволяет сохранять смещение в сторону последовательности мышиной гипервариабельной области. Это было осуществлено с использованием стратегии синтеза смешанных олигонуклеотидов, описанной в работе Gallop et al., J.Med.Chem. 37:1233-1251 (1994). В данном положении гипервариабельной области, подвергаемой мутации, кодон, кодирующий аминокислоту дикого типа, синтезировали как 70-10-10-10-смесь нуклеотидов, в результате получали, в среднем, 50% частоту мутаций в каждом положении.
Частично рандомизированные олигонуклеотиды были расположены после последовательностей мышиной гипервариабельной области и охватывали те же самые области, которые были идентифицированы в результате прямого присоединения гипервариабельной области. Набор аминокислот, присутствующих в начале Н2 (в положении 49) в VH-домене, был ограничен аминокислотами А, G, S или Т, что достигалось с использованием кодона RGC.
Создание фаговых библиотек. Пулы рандомизированных олигонуклеотидов, сконструированных для каждой гипервариабельной области, были отдельно фосфорилированы в шести реакционных смесях по 20 мкл, содержащих 660 нг олигонуклеотида, 50 мМ триса, рН 7,5, 10 мМ MgCl2, 1 мМ АТФ, 20 мМ ДТТ и 5 ед. полинуклеотид-киназы в течение 1 часа при 37оС. Затем эти шесть фосфорилированных олигонуклеотидных пула объединяли с 20 мкг матрицы Кункеля в 50 мМ триса, рН 7,5, 10 мМ MgCl2, в конечном объеме 500 мкл с получением отношения “олигонуклеотид:матрица”, равного 3. Смесь отжигали при 90°С в течение 4 минут и при 50°С в течение 5 минут, а затем охлаждали на льду. Избыток негибридизованного олигонуклеотида удаляли с помощью набора для ПЦР-очистки QIAQUICK (набор Qiagen 28106) в соответствии с измененным протоколом для предупреждения избыточной денатурации гибридизованной ДНК. К 500 мкл гибридизованной смеси добавляли 150 мкл РВ, и смесь распределяли по двум колонкам с двуокисью кремния. После промывки каждой колонки 750 мкл РЕ и дополнительного центрифугирования для сушки колонок каждую колонку элюировали 110 мкл 10 мМ триса, 1 мМ EDTA, рН 8. Затем гибридизованную и очищенную матрицу (220 мкл) достраивали путем добавления 1 мкл 100 мМ АТФ, 10 мкл 25 мМ dNTP (25 мМ каждого из dATP, dCTP, dGTP и dTTP), 15 мкл 100 мМ ДTT, 25 мкл 10х буфера ТM (0,5 М триса, рН 7,5, 0,1 М MgCl2), 2400 единиц лигазы Т4 и 30 единиц полимеразы Т7 в течение 3 часов при комнатной температуре.
Достроенный продукт анализировали на смеси трис-ацетат-EDTA/агарозных гелях (Sidhu et al., Methods in Enzymology 328:333-363 (2000)). В основном наблюдались три полосы: нижняя полоса соответствовала “правильно” достроенному и лигированному продукту, средняя полоса соответствовала достроенному, но не лигированному, продукту, а верхняя полоса соответствовала продукту со сдвигом цепи. Верхняя полоса была продуцирована вследствие побочной активности, присущей полимеразе Т7, а поэтому образования такой полосы трудно избежать (Lechner et al., J. Biol. Chem. 258:11174-11184 (1983)), однако, эта полоса трансформируется в 30 раз менее эффективно, чем нижняя полоса, и обычно играет незначительную роль в образовании библиотеки. Образование средней полосы обусловлено отсутствием 5'-фосфата для конечной реакции лигирования, причем эта полоса трансформируется достаточно эффективно и образует главным образом последовательность дикого типа.
Затем достроенный продукт очищали и подвергали электропорации в клетках SS320, после чего их размножали в присутствии хелперного фага М13/КО7, как описано в публикации Sidhu et al., Methods in Enzymology 328:333-363 (2000). Размеры библиотек составляли 1-2 х 109 независимых клонов. Произвольно выбранные клоны, полученные из исходных библиотек, секвенировали для оценки качества библиотеки.
Фаговый отбор. Был получен человеческий рецептор HGF, который использовали в форме Fc-гибрида (HGFR-Fc) (Mark et al., J. Biol. Chem. (1992) 267:26166-26171). HGFR-Fc наносили на микротитрационные планшеты MaxiSorp (Nunc) при 5 мкг/мл в PBS. Для первого раунда отбора использовали восемь лунок с мишенями, а одну лунку с мишенью использовали для последующих раундов отбора. Лунки блокировали в течение 1 часа с использованием казеинового ингибитора (Pierce). Фаг выделяли из супернатанта культуры и суспендировали в PBS, содержащем 1% ВSA и 0,05% Твина-20 (PBSВТ). После связывания с лунками в течение 2 часов несвязанный фаг удаляли путем интенсивного промывания буфером PBS, содержащим 0,05% Твина-20 (PBSТ). Связанный фаг элюировали путем инкубирования лунок с 50 мМ HCl, 0,5 М КСl в течение 30 минут. Фаг амплифицировали с использованием клеток Тор10 и хелперного фага М13/КО7, а затем культивировали в течение ночи при 37оС в среде 2YT, содержащей 50 мкг/мл карбанециллина. Для оценки степени обогащения титры фага, элюированного из лунок, покрытых мишенями, сравнивали с титрами фага, выделенного из лунки, не покрытой мишенями.
Для созревания аффинности фаговые библиотеки сортировали методом сортировки в растворе. HGFR-Fc биотинилировали путем смешивания 500 мкл 3,6 мг/мл HGFR-Fc в PBS и 10 мкл 1 М фосфата калия, рН 8, с 20 мкл 4 мМ сульфо-NHS-LС-биотина (Pierce). Биотинилированный HGFR-Fc (b-HGFR-Fc) очищали на колонке с NАР5 (Amersham Biosciences) в PBS. Лунки микротитрационного планшета сенсибилизировали 10 мкг/мл нейтравидина в PBS в течение ночи при 4°С, а затем блокировали в течение 1 часа казеиновым ингибитором (Pierce). В первом раунде пэннинга 200 мкл фага, суспендированного в PBS, содержащем 0,05% Твина-20 (PBSТ) и 1% ВSA, смешивали с 10 нМ b-HGFR-Fc в течение 1 часа. Фаг, связанный с b-HGFR-Fc, иммобилизовали на лунках, покрытых нейтравидином, в течение 10 минут, а несвязанный фаг удаляли путем промывки буфером PBSТ. Фаг элюировали с использованием 20 мМ HCl, 500 мМ КСl в течение 45 минут, затем нейтрализовали и размножали в клетках ХL1blue (Stratagene) в присутствии хелперного фага КО7 (New England Biolabs). Последующие раунды сортировки проводили аналогичным образом, за некоторыми исключениями, а именно: в раунде 2 конечная концентрация b-HGFR-Fc составляла 5,6 нМ; в раунде 3 конечная концентрация b-HGFR-Fc составляла 0,1 нМ; в раунде 4 конечная концентрация b-HGFR-Fc составляла 0,5 нМ; а для иммобилизации на нейтравидине к смеси в течение 1 часа добавляли 780 нМ небиотинилированного HGFR-Fc.
ELISA фага. Микротитрационные планшеты MaxiSorp сенсибилизировали человеческим HGFR-Fc при 5 мкг/мл в PBS в течение ночи, а затем блокировали казеиновым ингибитором. Фаг, полученный из супернатантов культуры, инкубировали с серийно разведенным HGFR-Fc в PBSТ, содержащем 1% ВSA, в микротитрационном планшете для культивирования тканей в течение 1 часа, а затем 80 мкл смеси переносили в лунки, покрытые мишенью, и оставляли на 15 минут для иммобилизации несвязанного фага. Планшет промывали PBSТ и добавляли ПХ-конъюгированное антитело против М13 (Amersham Pharmacia Biotech)(1:5000 в PBSТ, содержащем 1% ВSA) в течение 40 минут. Планшет промывали PBSТ и проявляли добавлением тетраметилбензидинового субстрата (Kirkegaard & Perry Laboratories, Gaithersburg, MD). Для определения IC50 строили кривую зависимости оптической плотности при 405 нм от концентрации мишени в растворе. Полученную величину использовали для оценки аффинности Fab-клона, представленного на поверхности фага.
Продуцирование Fab и определение аффинности. Для экспрессии Fab-белка в целях определения аффинности между тяжелой цепью и g3 в векторе фагового представления встраивали стоп-кодон. Клоны трансформировали в клетки 34В8 E.coli и культивировали в среде АР5 при 30°С (Presta et al. Cancer Res. 57:4593-4599 (1997)). Клетки собирали центрифугированием, суспендировали в 10 мМ триса, 1 мМ EDTA, рН 8 и разрушали с помощью микрофлюидизатора. Fab очищали с помощью аффинной хроматографии на G-белке.
Определение аффинности осуществляли с помощью поверхностного плазмонного резонанса с использованием BIAcoreTM-2000. HGFR-Fc иммобилизовали (~1000 единиц отклика (RU)) на чипе СМ5 и вводили различные концентрации Fab (4-500 нМ) в PBSТ. После каждой инжекции чип регенерировали с использованием 100 мМ HCl. Реакцию на связывание корректировали путем вычитания RU из данных, полученных для контрольной проточной кюветы. Для анализа кинетики реакции использовали лангмуровскую модель связывания 1:1 при одновременном подборе kon и koff.
Электрохемилюминесцентный анализ на блокирование связывания HGF/c-met антителом ОА5D5
Очищенный белок сМеt-Ig, полученный от Genentech (South San Francisco, CA), биотинилировали путем инкубирования с 20-кратным молярным избытком NHS-Х-биотина в 0,1 М NaНСО3, рН 8,5, с использованием биотин-Х-NHS (Research Organics, Cleveland, OH). Очищенный человеческий 2-цепочечный HGF, полученный от Genentech, метили BV-TAG (cat # 110034) химическим методом с использованием NHS-эфира в соответствии с инструкциями производителей (BioVeris International, Gaithersburg, MD). сМеt-Ig-биотин (500 нг/мл), HGF-рутениевую метку (250 нг/мл) и титры антитела ОА5D5 в концентрации от 3333 до 0,21 нМ инкубировали в аналитическом разбавителе в объеме 100 мкл: PBS + 0,5% ВSA/0,5% Твина-20/0,033% проклина (Supelco Inc. Bellefonte PA). Смеси инкубировали в герметично закрытых полипропиленовых круглодонных 96-луночных планшетах (Corning) в течение 2-4 часов при комнатной температуре и при встряхивании. Затем добавляли магнитные сферы, покрытые стрептавидином (Dynabeads, BioVeris). После окончательного 45-минутного инкубирования при интенсивном перемешивании планшеты считывали на устройстве BioVeris серии М (BioVeris International, Gaithersburg, MD).
KIRA (HGF-зависимое фосфорилирование Met)
Клетки А549 (АТСС, Manassas, VA) поддерживали в культуральной среде (среде F12 Хэмса/DMEM 50:50 [Gibco, Grand Island, NY], содержащей 10% фетальную телячью сыворотку (FBS, Sigma, St. Louis, MO). Для получения клеток в целях проведения анализа клетки выделяли из конфлюэнтных культур с использованием аккутазы (ICN, Aurora, OH) и высевали в 96-луночные планшеты при плотности 50000 клеток на лунку. После инкубирования в течение ночи при 37оС культуральную среду удаляли и клетки помещали на 30-60 минут в бессывороточную среду, содержащую 0,1% FBS. Для определения способности ОА-5D5 ингибировать фосфорилирование с-Met эту молекулу серийно разводили в концентрации от 200 до 0,19 нМ в среде с 0,1% FBS и добавляли в аналитические планшеты. После 15-минутного инкубирования при 37оС добавляли HGF (50 нг/мл). Затем планшеты инкубировали еще 10 минут при 37оС, среду удаляли и добавляли буфер для лизиса клеток (Cell Signaling Technologies, Cat.# 9803, Beverly, MA, в который была добавлена смесь ингибиторов протеазы, закупленная у фирмы Calbiochem, cat # 539131, San Diego, CA). Лизаты анализировали на фосфорилирование с-Met с помощью электрохемилюминесцентного анализа на аппарате BioVeris серии М (BioVeris International, Gaithersburg, MD). mAb против фосфотирозина (клон 4G10, Upstate, Lake Placid, MY) метили BV-TAG химическим методом с использованием NHS-эфира в соответствии с инструкциями производителей (BioVeris). Антитела против внеклеточного домена с-Met подвергали биотинилированию с использованием биотина-Х-NHS (Research Organics, Cleveland, OH). BV-TAG-меченное 4G10 и биотинилированое mAb против с-Met разводили в аналитическом буфере (PBS/0,5% Твина-20/0,5% ВSA) и добавляли в виде смеси в клеточные лизаты. После инкубирования в течение 1,5-2 часов при комнатной температуре и при интенсивном встряхивании добавляли магнитные сферы, покрытые стрептавидином (Dynabeads, BioVeris). После окончательного 45-минутного инкубирования планшеты считывали на аппарате BioVeris.
Культивирование клеток и анализ на пролиферацию
ВаF3 представляет собой мышиные IL-3-зависимые лимфоидные клетки, которые обычно не экспрессируют с-Met и не отвечают на HGF. Однако HGF стимулирует пролиферацию и выживание клеток ВаF3-hMet в отсутствии IL-3, полученных путем их трансфекции нормальной полноразмерной кДНК человеческого с-Met (Schwall et al., J. Cell. Biol. (1996) 133:709-718). Клетки ВаF3-hMet и ВаF3-neo пересевали рутинным методом в среду RPMI 1640, содержащую 5% фетальную телячью сыворотку, 4 мкл/л β-меркаптоэтанола, 100 ед./мл пенициллина, 100 мкг/мл сульфата стрептомицина, 2 мМ L-глутамина и 5% WEHI-кондиционированной среды в качестве источника IL-3. Для измерения HGF-зависимой пролиферации число клеток после 3-дневной обработки количественно оценивали путем добавления 25 мкл Alarma голубого (Trek Diagnostic Systems; Cleveland, OH), а через 6 часов определяли интенсивность флуоресценции. В качестве контроля проводили эксперименты по пролиферации этих клеток в отсутствии HGF. Клетки Н358-PSF2 и HGF-PSF8 пересевали в среду RPMI 1640, содержащую 10% фетальную телячью сыворотку, 100 ед./мл пенициллина, 100 мкг/мл сульфата стрептомицина и 2 мМ L-глутамина. Аналитическая среда представляла собой среду RPMI 1640 + 0,1%, 0,5% ВSA или 10% FBS, соответственно. Анализ проводили как описано выше.
Иммунопреципитация и Вестерн-блот-анализ
Клетки Н358 представляют собой клеточную линию, происходящую от не-мелкоклеточной карциномы легких человека (NSCLC). Клетки Н358-PSF2 и H358-PSF8 представляют собой клетки Н358, стабильно трансфицированные человеческим HGF (Tsao et al., Neoplasia, Vol.2, № 3, 2000), и эти клетки были культивированы в среде RPMI 1640, содержащей 10% фетальную телячью сыворотку, 100 ед./мл пенициллина, 100 мкг/мл сульфата стрептомицина и 2 мМ L-глутамина. Детекцию фосфорилирования тирозина с-Met осуществляли в основном как описано в литературе (Zioncheck, J. Bio. Chem., 270(28):16871-8, 1995). Вкратце, клетки высевали на 60 мм-планшеты в течение ночи, среду заменяли средой RPMI 1640, содержащей 0,5% ВSA, а затем добавляли комбинации, содержащие или не содержащие 1 нМ HGF или антитела-конкурента ОА5D5.v2. После выдерживания в течение 10 минут при 37оС среду удаляли и клетки подвергали лизису в буфере для лизиса (150 Мм NаСl, 1,5 мМ MgCl2, 1% тритона Х-100, 1х смесь ингибитора протеазы, 1х смесь ингибитора фосфатазы (Sigma, St. Louis, MO)). После центрифугирования супернатант лизата инкубировали с поликлональным антителом (IgG) против сMet (с-28; Santa Cruz Biotechnology, Santa Cruz, CA), связанным с G-белок - сефарозой, в течение 1 часа при 4°С. Иммунные комплексы промывали и кипятили в 1х буфере для образца, а затем разделяли с помощью электрофореза в ДСН-ПААГ и подвергали электроблоттингу на нитроцеллюлозе. Белки, содержащие фосфотирозин, визуализировали путем детекции хемилюминесценции с использованием антитела против фосфотирозина (4G10; Upstate Biotechnology, Walthаm, MA), а затем ПХ-конъюгированного козьего антимышиного Fab (1:10000; Jackson Labs, West Grove, PA), а в случае полноразмерного сMet, с использованием антитела с-28 (1:400; Santa Cruz Biotechnology, Santa Cruz, CA), а затем ПХ-конъюгированного козьего антикроличьего Fc (1:10000; Jackson Labs, West Grove, PA).
Исследование опухолевого ксенотрансплантата
Бестимусных самок мышей подкожно инокулировали 5 миллионами клеток карциномы поджелудочной железы КР4. Когда размер опухоли достигал 150-200 мм3, мышей разделяли на 2 группы по 10 мышей в каждой. Мышам группы 1 два раза в неделю, i.p., инъецировали носитель. Мышам группы 2 два раза в неделю, i.p., инъецировали 30 мг/кг ОА5D5.v2. Размер опухоли измеряли два раза в неделю. Когда объем опухоли в два раза превышал объем исходной опухоли или когда опухоль изъязвлялась, мышей умерщвляли.
Результаты и обсуждение
Гуманизация 5D5. Человеческая акцепторная каркасная область, используемая для гуманизации 5D5, содержит домен консенсусной последовательности VL человеческой цепи каппа I и вариант домена консенсусной последовательности VH человеческой цепи подгруппы III. Вариант домена VH в человеческой консенсусной последовательности имеет 3 замены: R71А, N73Т и L78А. Домены VL и VH мышиного 5D5 выравнивали с доменами человеческой цепи каппа I и цепи подгруппы III, после чего каждую HVR идентифицировали и присоединяли к человеческой акцепторной каркасной последовательности с получением 5D5-гибрида, который может быть представлен на фаге в виде Fab. При фаговом представлении тестирование 5D5-гибрида на связывание с иммобилизованным HGFR-Fc не обнаруживало какого-либо связывания.
Было получена библиотека, в которой каждую из областей HVR 5D5-гибрида подвергали “мягкой” рандомизации. Эту библиотеку подвергали пэннинг-анализу на иммобилизованный HGFR-Fc в 4 раунда отбора. Клоны собирали для анализа последовательности ДНК и отбирали один обнаруженный клон. Этот клон имел одну замену в VH-домене в положении 94 (R94S) непосредственно за пределами нужной области HVR-Н3, подвергаемой мутагенезу. Анализ этого клона посредством ELISA фага показал, что он имеет аффинность, аналогичную аффинности моновалентного мышиного 5D5. При экспрессии в виде Fab и тестировании с помощью Biacore был определен Кd, который составлял 9,8 нМ, тогда как Кd аффинности моновалентного мышиного 5D5 составлял 8,3 нМ. Таким образом, было неожиданно обнаружено, что указанная замена приводила к полному восстановлению аффинности связывания с 5D5-гибридом, а 5D5-гибрид + R94S (hu5D5.v1) представлял собой полностью гуманизированное антитело. Интересно отметить, что в этом положении мышиного антитела находится гомологичная аминокислота треонин. MacCallum и др. (MacCallum et al., J. Mol. Biol. 262; 732-745 (1996)) проанализировали кристаллические структуры комплекса “антитело - антиген”, и было обнаружено, что положения 93 и 94 тяжелой цепи являются частью контактной области, а поэтому, очевидно, что при гуманизации антител эти положения входят в определение гипервариабельной области Н3 (HVR-Н3).
Созревание аффинности hu5D5.v1. Для повышения аффинности hu5D5.v1 в остове hu5D5.v1 генерировали шесть библиотек фагового представления, каждая из которых была мишенью для одной HVR, в целях проведения “мягкой” рандомизации. Во избежание повторного отбора hu5D5.v1 из потенциально высокого фона матрицы дикого типа в подвергаемую мутации HVR встраивали стоп-кодоны, а затем генерировали каждую библиотеку. Для повышения эффективности фагового отбора, проводимого на основе аффинности, применяли метод сортировки в растворе. При изменении концентрации биотинилированной мишени, уменьшении времени иммобилизации на фаге для снижения фона и при добавлении небиотинилированной мишени для элиминации клонов с более высокой скоростью диссоциации были успешно отобраны клоны с высокой аффинностью. Lee et al., см. выше. В первом раунде отбора наблюдалось обогащение (мишень-зависимая иммобилизация на фаге), что позволяет предположить, что в каждой библиотеке присутствует большое число клонов с явно высокой аффинностью по отношению к HGFR-Fc. В последующих раундах строгость отбора (см. вышеописанные методы) повышали, а в 3 раунде все шесть библиотек объединяли и получали седьмой пул библиотеки. После 4 раундов отбора клоны каждого из 7 пулов библиотек анализировали. Все клоны в этих библиотеках, нацеленные на HVR-L1 и HVR-L3, были идентичны клонам hu5D5.v1; однако, в библиотеках, нацеленных на HVR-L2, HVR-Н1, HVR-Н2 и HVR-Н3, наблюдались новые последовательности (фиг.2). В пуле библиотек, состоящем из комбинации из всех 6 библиотек, преобладали последовательности HVR-Н3-библиотеки, что позволяет предположить, что эти последовательности вносят самый большой вклад в аффинность к HGFR-Fc (фиг.3). Отобранные клоны скринировали с помощью ELISA фага и экспрессировали в виде Fab-белка, а затем их аффинность определяли с использованием Biacore. Несколько клонов из комбинированной библиотеки, имеющих замены в HVR-Н3, обладали повышенной аффинностью по сравнению с аффинностью антитела hu5D5.v1 или мышиного моновалентного антитела 5D5 (фиг.4). Эти клоны имели S/Т в положении 94, R/S в положении 96, Т/S в положении 100 и Р/S/А в положении 100а. Самый лучший клон, клон 78 (hu5D5.v2), по сравнению с клоном hu5D5.v1, имел 3 замены (94Т, 96R и 100Т) и обладал в 13 раз более высокой аффинностью.
Таким образом, в результате присоединения 6 HVR мышиного 5D5 к человеческой акцепторной каркасной последовательности HVR-Н3 удлинялась на один остаток в положении 94 (треонин), а внесение двух замен в HVR-Н3 приводило к получению полноразмерного человеческого антитела 5D5, обладающего в 13 раз более высокой аффинностью связывания с HGFR. Кроме того, в анализах на фосфорилирование рецептора и т.п. (данные не приводятся) было определено, что отобранные гуманизированные антитела, описанные в настоящей заявке, обладают биологической активностью, по меньшей мере, сравнимой с активностью родительского антитела 5D5.
Характеризация антитела согласно изобретению. Были охарактеризованы антитела против Met в форме одного фрагмента (также называемые “однофрагментными” антителами или “ОА”). Были протестированы два антитела согласно изобретению. В частности, антитело “ОА-5D5.v2” включает один Fab-фрагмент, содержащий последовательности вариабельного домена, представленные на фиг.13, где указанный Fab-фрагмент был присоединен к Fc-области, и где указанная Fc-область представляет собой комплекс, состоящий из одного полипептида Fc, содержащего последовательность Fc, представленную на фиг.13, и одного полипептида Fc, содержащего последовательность Fc, представленную на фиг.14. Указанные антитела были охарактеризованы следующим образом:
(1) В анализе на способность ОА-5D5.v2 блокировать связывание НGF с его рецептором было обнаружено, что ОА-5D5.v2 способно блокировать связывание HGF с его рецептором, по меньшей мере, с такой же эффективностью, как и два конкурентных антитела, а именно химерное однофрагментное антитело (содержащее Fab-фрагмент, происходящий от мышиного родительского антитела 5D5 (вариабельные домены представлены на фиг.7), присоединенного к человеческой Fc-области) и другое антитело согласно изобретению (OA-5D5.v1). При тестировании с использованием всех концентраций антитела в диапазоне примерно от 3333 до 0,21 нМ в условиях, описанных выше в разделе "Материалы и методы", было обнаружено, что это антитело OA-5D5.v2 имеет величину IC50, которая составляет менее примерно половины величины IC50 эталонного антитела, такого как химерное однофрагментное антитело и OA-5D5.v1. Следует отметить, что OA-5D5.v1 также обладает блокирующей активностью при лучшей концентрации IC50, чем IС50 эталонного химерного антитела. См. фиг.8.
(2) В анализе на способность OA-5D5.v2 ингибировать активацию рецептора HGF было обнаружено, что оно способно ингибировать активацию киназного рецептора, по меньшей мере, с такой же эффективностью, как и два конкурентных антитела, описанных в приведенном выше п.(1). При тестировании с использованием всех концентраций антитела в диапазоне примерно от 200 до 0,19 нМ в условиях, описанных выше в разделе "Материалы и методы", было обнаружено, что это антитело OA-5D5.v2 имеет величину IC50, которая составляет менее примерно половины величины IC50 эталонного антитела, такого как химерное однофрагментное антитело и OA-5D5.v1. См. фиг.9.
(3) OA-5D5.v2 также тестировали на перекрестное связывание с рецепторами разных видов, а именно человека, примата (собакоподобной обезьяны), животных семейства собачьих и мышиных (мыши). Было обнаружено, что OA-5D5.v2 специфически связывается с рецептором HGF человека и примата (собакоподобной обезьяны), но не связывается с рецептором HGF животных семейства собачьих и мышиных (мыши) (данные не приводятся).
(4) OA-5D5.v2 тестировали на его способность ингибировать пролиферацию клеток в присутствии HGF. Как показано на фиг.10, OA-5D5.v2 ингибировало пролиферацию клеток, по меньшей мере, с такой же эффективностью, как и его аналоги, то есть химерное антитело и OA-5D5.v1 (как описано выше в п.(1)). При тестировании с использованием всех концентраций антитела в диапазоне примерно от 0,01 до 100 нМ в условиях, описанных выше в разделе "Материалы и методы", было обнаружено, что это антитело OA-5D5.v2 имеет величину IC50, которая составляет менее примерно половины величины IС50 эталонного антитела, такого как химерное однофрагментное антитело и OA-5D5.v1. См. фиг.10. Специфическое связывание OA-5D5.v2 с Met-трансфицированными клетками подтверждали с помощью FACS-анализа (данные не приводятся).
(5) OA-5D5.v2 тестировали на его способность ингибировать фосфорилирование тирозина рецептора в присутствии HGF. Как показано на фиг.11А и В, OA-5D5.v2 ингибировало фосфорилирование тирозина рецептора при концентрациях антитела примерно от 10 до 1000 нМ. См. фиг.11А и В.
(6) OA-5D5.v2 тестировали на in vivo эффективность при его использовании в модели опухолевого ксенотрансплантата, полученной на основе клеточной линии опухоли поджелудочной железы (КР4). Результаты исследования такой эффективности показали, что антитело OA-5D5.v2 способно ингибировать рост опухоли и способствовать регрессии опухоли in vivo. Как показано на фиг.12, у большинства животных, обработанных указанным антителом, наблюдалось полное исчезновение опухоли.
Неполный список публикаций







Реферат
Настоящее изобретение относится к области биотехнологии и представляет собой гуманизированную форму мышиного антитела против c-met. Кроме того, изобретение относится к композиции, содержащей антитела по изобретению, а также к способам применения таких антител. Антитела по изобретению позволяют в различной степени нарушать пути передачи сигнала HGF/c-met. 8 н. и 21 з.п. ф-лы, 18 ил., 2 табл.
Формула
(a) (i) HVR-L1, имеющую последовательность А1-А17, где А1-А17 представляет собой KSSQSLLYTSSQKNYLA (SEQ ID NO:1);
(ii) HVR-L2, имеющую последовательность В1-В7, где В1-В7 представляет собой WASTRES (SEQ ID NO:2);
(iii) HVR-L3, имеющую последовательность С1-С9, где С1-С9 представляет собой QQYYAYPWT (SEQ ID NO:3);
(iv) HVR-H1, имеющую последовательность D1-D10, где D1-D10 представляет собой GYTFTSYWLH (SEQ ID NO:4);
(v) HVR-H2, имеющую последовательность E1-E18, где E1-E18 представляет собой GMIDPSNSDTRFNPNFKD (SEQ ID NO:5); и
(b) один из вариантов HVR-H3, имеющий последовательность, выбранную из группы последовательностей SEQ ID NO:159, SEQ ID NO:145, SEQ ID NO:162 и SEQ ID NO:163, где моновалентная аффинность указанного антитела по отношению к человеческому c-met превышает моновалентную аффинность мышиного антитела, содержащего последовательность вариабельной области легкой цепи SEQ ID NO:9 и последовательность вариабельной области тяжелой цепи SEQ ID NO:10, и где указанное антитело ингибирует c-met-зависимую пролиферацию клеток более эффективно, чем эталонное антитело, включающее химерное антитело против с-met, содержащее последовательность вариабельной области легкой цепи SEQ ID NO:9 и последовательность вариабельной области тяжелой цепи SEQ ID NO:10.
последовательности HVR1-HC, HVR2-HC и HVR3-HC, представленные в SEQ ID NO:191-193, соответственно,
последовательности FR1-HC, FR2-HC, FR3-HC и FR4-HC, представленные в SEQ ID NO:187-190, соответственно, и
последовательности СН1 и Fc, представленные в SEQ ID NO:194 и 195, соответственно,
и вариабельный домен легкой цепи, включающий
последовательности HVR1-LC, HVR2-LC и HVR3-LC, представленные в SEQ ID NO:183-185, соответственно,
последовательности FR1-LC, FR2-LC, FR3-LC и/или FR4-LC, представленные в SEQ ID NO:179-182, соответственно, и
последовательность CL1, представленную в SEQ ID NO:186.

Комментарии