Способ разделения стереоизомерных смесей - SU468408A3
Код документа: SU468408A3
Описание
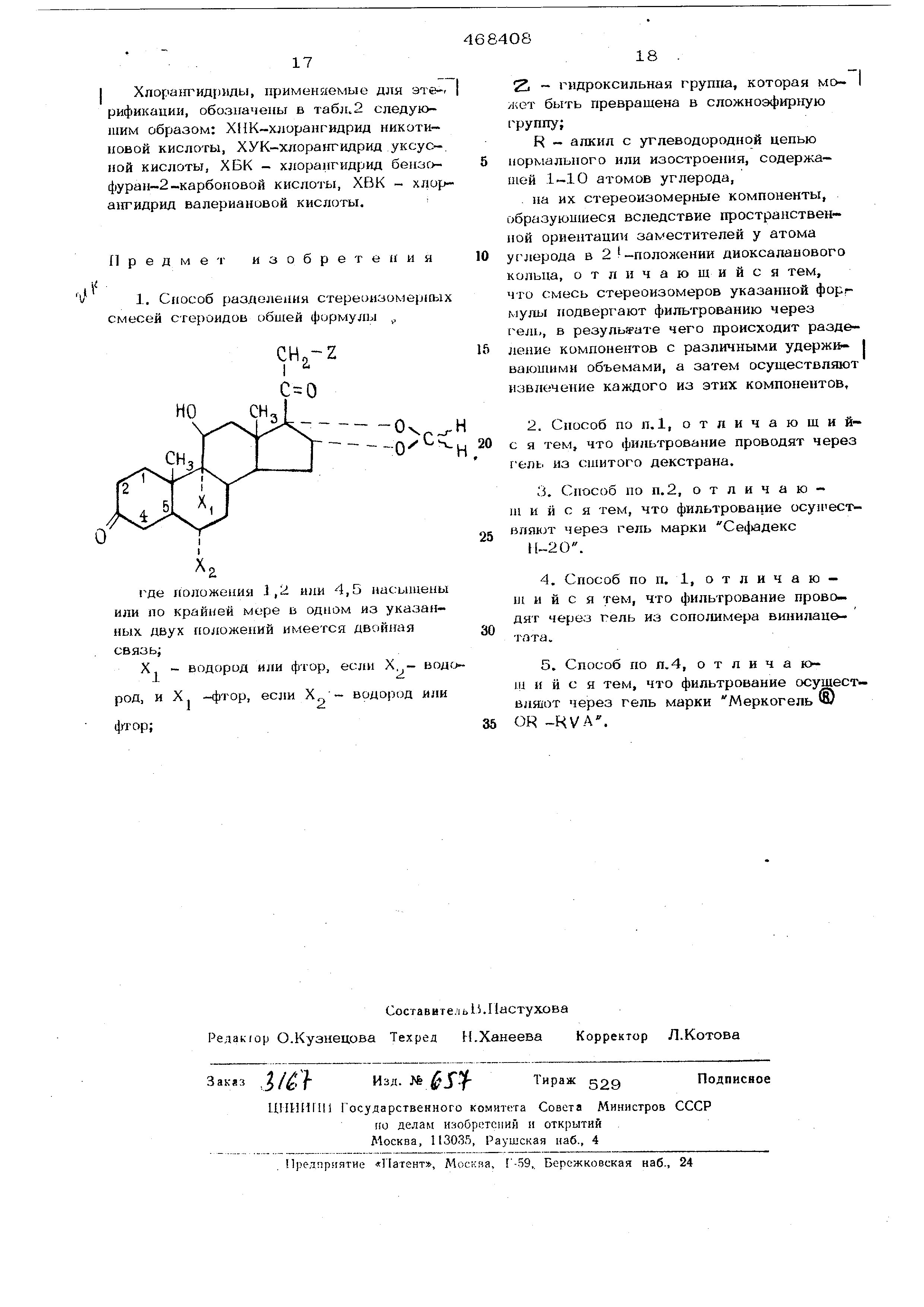
где положения 1,2 и 4,5 насыщены или по крайней мере в одном из указаииых положений имеется двойная связь ,
R алкил нормального или изостроения , содержащий 1-10, предпочтительно 1-6, атомов углерода;
Х - водород или фтор, если Х водород , и Х - фтор, если радикал Х„водород или фтор;
2L - гвдроксильная группа, которая может быть превращена в сложноэфирную
группу,
на их стереоизомерные компоненты, образующиеся вследствие пространственной ориенташш заместителей у атома углерода в 2 - положении диоксаланового кольца, заключающийся в том, что смесь стереоизомеров указанной формулы подвергают фильтрованию через гель, в результате чего происходит разделение компонентов с различными удерживающим объемами, а затем осуществляют извлечение каждого из этих компонентов.
Фильтрование можно осуществлять чэрез гели различного типа. Одним типом таких материалов явля5отся оксипропилиро ванные сщитые декстрановые гели типа f Сефадекс LH, на пример Сефадекс
LH - 2О с мол.в. 1ОО-4ООО, дающие хорощее фракционирование. Другой тип полезных гелей представляет собой сополимеры винилацетата с мол.в. до -vlOOO, а именно Меркогель® типа . Гели используют в виде равновесной системы с подходящим растворителем. В качес - ве элюирующего средства можно применят галогенированные углеводороды, простые : или сложные эфиры или их смеси, причем наилучшие результаты получают при применении хлороформа, дихлорметана, дихлорэтана , тетрагидрофурана, диоксана и этил1 ацетата. В результате достигают вполне удовлетворительног о отделения ст ёотЁзомера А от стереоизомера В, причем смесь изомеров А и В можно также с успехом отделять от побочных продуктов, образующихся при синтезе стероидов.
В приведенной формуле гвдроксильная группа в положении 21 может быть этерифицирована жирной кислотой. Такая жирная кислота может в своей структуре иметь углеводородную цепь нормального или изостроения и предпочтительно содержит 1-12 атомов углерода. В качестве примера подходящей кислоты можно назвать уксусную, пропноновую и так далее илн гетероциклическую карбоновую кислоту
Стероиды указанной формулы в виде циклических ацеталей можно синтезировать известным способом: взаимодействием 16, 17-диоксистероидов с альдегидом в присутствии кислого катализатора, например хлорной кислоты, rt-толуолсульфокислоты, хлористоводородной кислоты и тому подобное , в среде диоксана или другого подхо- . дящего растворителя. В результате реакции получают смесь стереоизомеров А и В с од инаковыми молекулярными весами и практически одинаковой растворимостью, причем эти стереоизомеры, как было найдено , с больщим трудом поддаются раздеI лению обычными способами разделения стереоизомеров, например перекристалли- зацией.
Для гель-фильтрации применяют колонку длиной 85 см с внутренним диаметром 2,5 см при скорости потока 1 мл/ мин. Удерживающие объемы, приведенные в примерах, получены при применении хлороформа в качестве элюируюя1его средства .
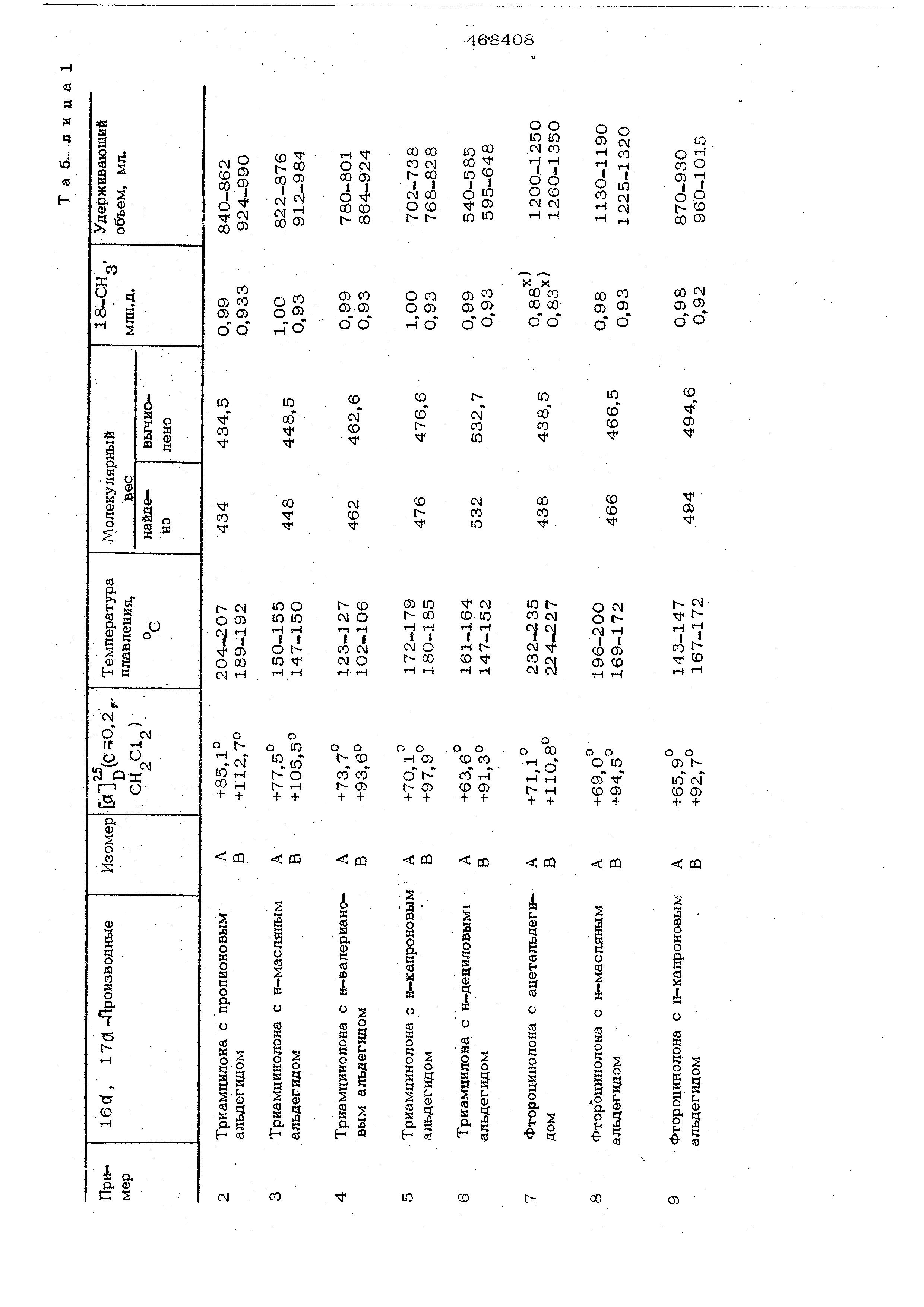
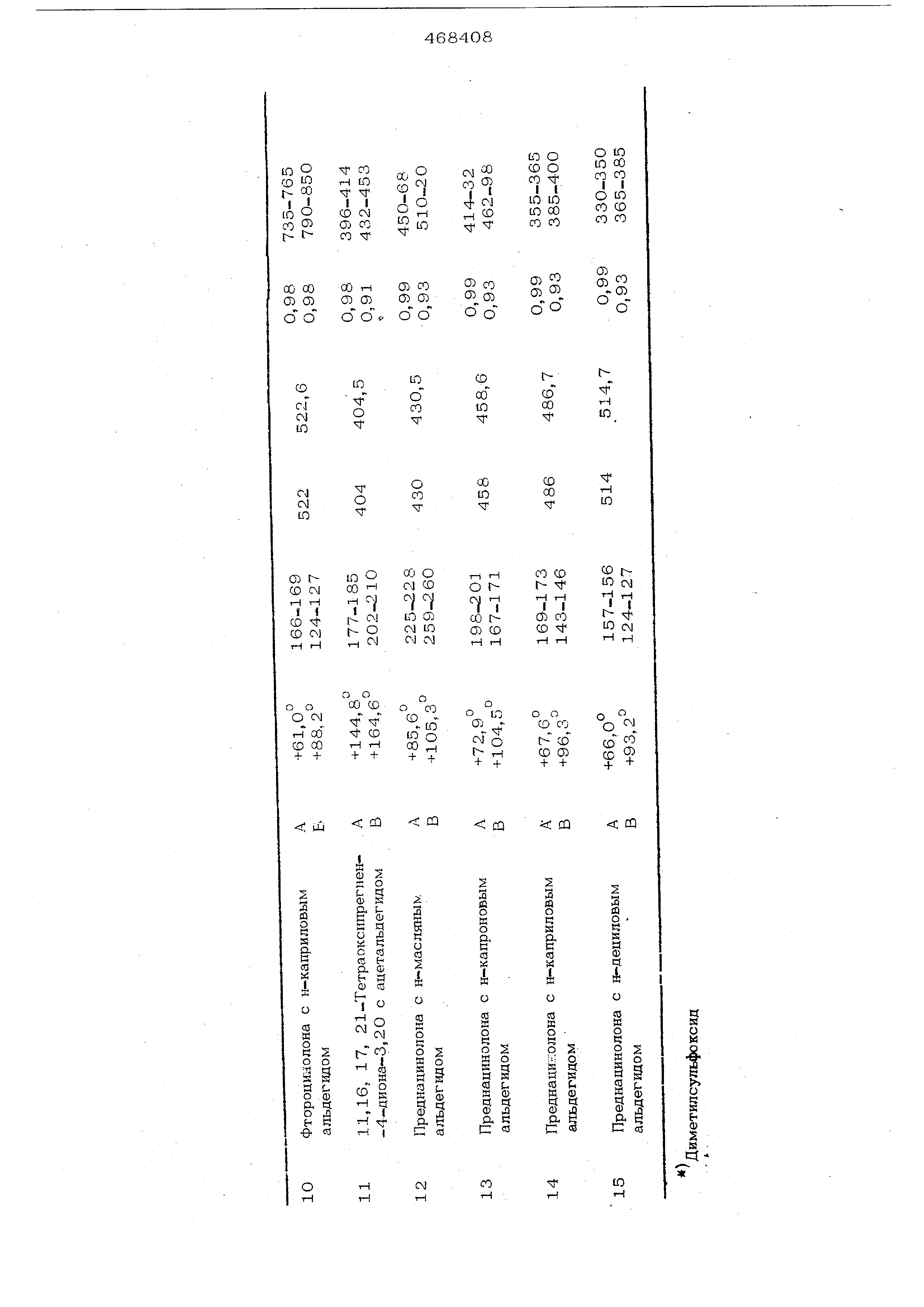
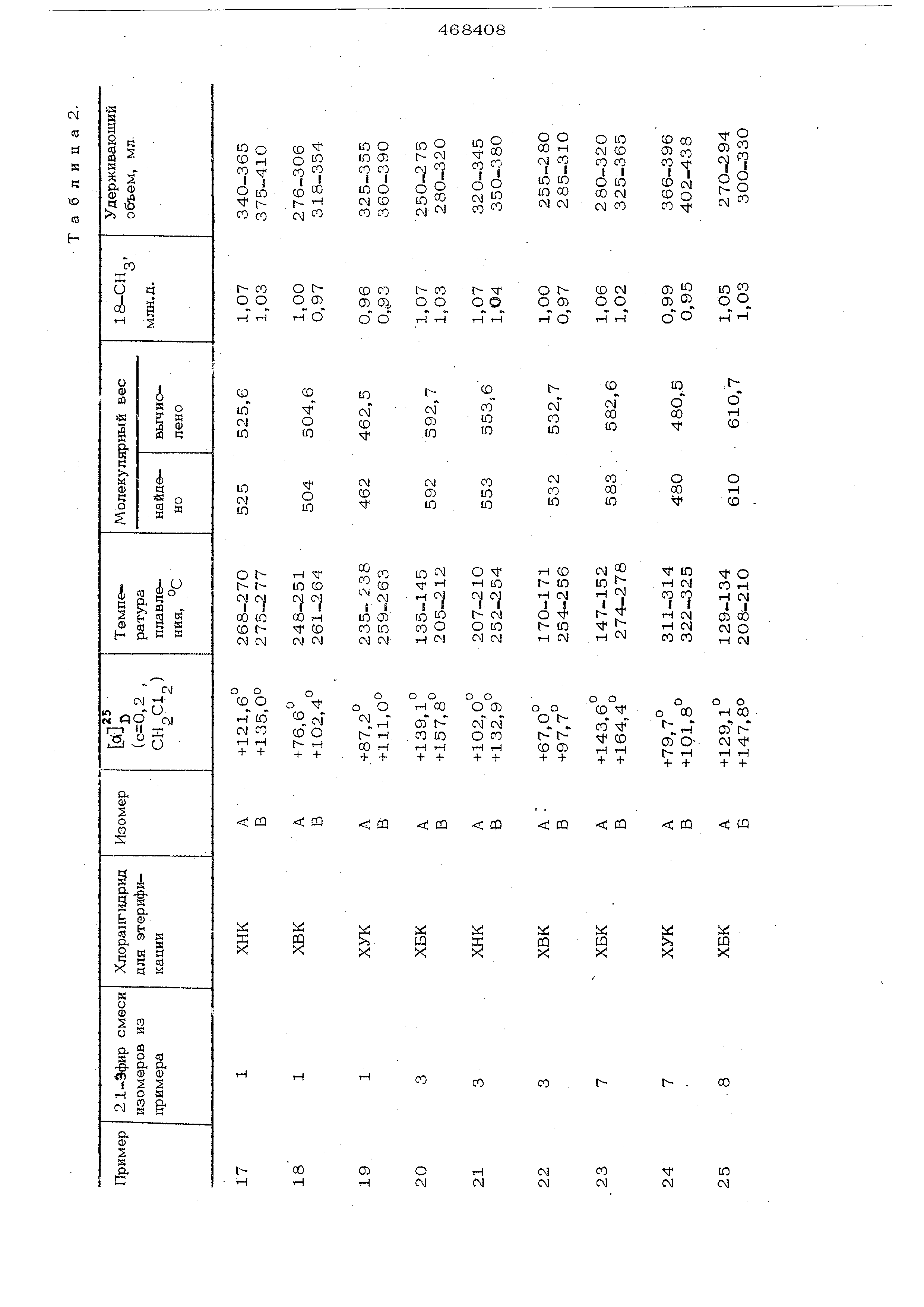
При фильтрации через геЛь на колонке неочищенного продукта более легко отделяются побочные продукты от смеси изомеров , чем изомеры друг от друга, так как в первом случае имеет место боль- щая разница в удерживающих объемах. Найдено также, что растворимость неочищенного продукта, а также растворимость очищенной изомерной смеси понижается , в то время, как повыщается степень разделения по мере уменьшения полярности растворителей. Это особенно проявляется у производных, замещенных короткой боковой непью у атома углеро да в положении 2 диоксоланрвого коль ца. Поэтому при хроматографическом разделении, описанном в примерах, рекоме1Щуется сначала отделять смесь изомеров от побочных продуктов, содержащихся в неочищенном продукте, с по мощью немного более nofinpHoro растворителя , а затем - изомеры друг от друга с помощью растворителя, обладающего меньщей полярностью. Можно использовать всю мощность колонки и в каждом процессе отделять побочные продукты от значительных количеств неочищенного продукта или возможное частичное использование мощности колонки вследствие ограниченной растворимости смеси изомеров в растворителях с меньщей полярностью может быть компенсировано пов торной хроматографией .на колонке, проводимой через относительно короткий промежуток времени без удаления ранее загруженной смеси из колонки. I С помошью растворителей, которые являются высокоактивными при предварительном разделении, таких как дихлор метан, дихлорэтан, тетрагидрофуран и этилацетат, вполне удовлетворительно разделяют изомеры в то время, как хлороформ и диоксан дают лучшие результаты для изомеров, с трудом поддающихся разделению. Во всех примерах молокулярш.ю веса определяют посредством масс -спектросл-.ко ПИИ, а во всех исследованиях ядерно-магнитного резонанса в качестве внутреннего эталона применяют тетраметилсилан. Температуру плавления определяют с помощью микроскопа Рейхерта для определения тем ператур плавления. Пример. 160( , 17d - {2йодород-2-метил )метиле1ЩИОкси-9-фторпрегнадиен-1 ,4-диол-11 Э , 21 дион-3,2О К раствору 112,0 мг свежеотогнанног паральдегида и О,2 мл хлорной кислоты в 75 мл хорошо очи1не1П10го и высушешгого диоксана добавляют по частям 500,0 Ml триамцилона в течение 40 мин . Р еакцио}Н(ую смесь перемешива ют еще 5,5 час при комнатной темпера- , туре, после чего ее разбавляют 20О мл дихлорметана. Раствор промывают дважды раствором бикарбоната натрия и трижды водой, а затем высушивают. Растворители упаривают под вакуумом, остаток обрабатывают эфигроы и осаждают петролейньгм эфиром. Высушенный неочищенный продукт (533,0 мг) хроматографируют на колонке, заполненной оксипропилированным сшитым декстрановым гелем Сефадекс® L.H-20 (мол.в. 1004000 ), с применением дихлорметана в качестве элюирующего растворителя. Полу чают 431,7 мг (81%) чистой смеси изомеров , т.пл. примерно 207-222°С; и 5 +107,20° (с 0,3, ); .| МОЛ.В. 420 (теоретический 42О,5).1 Смесь изомеров (338,2 мг) хромато-л графируют на колонке, заполненной гелем Сефадекс® LH-2O, с применением хлоро-, форма в качестве, элюирующего средства. / Получают два разных изомера (Л и В) 1ба , 17а - (2-водс од -2-мeтил)мeтилeндиoкc -9-фторпрегнадиен-1 , 4-диол-11 , 21-диона -3,2О. Выход изомера А 123,4 мг (37%); Т.ПЛ.217-2190С; &7,4°(,3, СН С1 ); МОЛ.В. 420 (теоретический 420,5); удерживающий объем 920-990 мл.. Выход .изомера В 194,7 мг (58%|j т.пл. 224-2280С; ,8О (,3, ).; МОЛ.В. 42О (теоретический 420,5); удерживающий объем 1О2О-110Омл Чистоту изомеров А и В (98%) устанавливают по ЯМР - спектроскопии, изучая сиг-нал для 18.-СН , расположенный при (S 1,00 млн.д,(СДС1 ) для А и при 6 0,92 млн.д.(СДСЦ) для В. Аналогичные результаты по разделению изомеров получают с применением геля иа сополимера винилацетата (Меркогель® OH-HVA 2000, мол.в, до 1ООО), а также с использованием (кроме хлороформа и дихлорметана, дихлорэтана, этилацетата, тётч рагидрофурана и диоксана в качестве элк ирующих средств на обоих типах гелей. Примеры 2-15. Аналогично методике , описанной в примере 1, синтезируют смеси различных изомеров, и по методике разделения, описанной там же, получают изомеры, приведенные в табл. 1. Иссле дования ЯМР проводят в среде СДС1 , если не указана другая среда.
in о r
CO о ООН
о о
г- CD
со 05





Реферат

Формула


Комментарии