Способ производства сульфата калия из хлорида калия и серной кислоты - RU2708204C1
Код документа: RU2708204C1
Чертежи



Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к системам и способам производства сульфата калия из хлорида калия и серной кислоты.
УРОВЕНЬ ТЕХНИКИ
Производство сульфата калия из хлорида калия и серной кислоты уже тщательно проанализировано из-за его малой распространенности и коммерческой ценности. Обычно используют печь Мангейма (Mannheim), в которой создают высокую температуру в диапазоне 450-600°С для стимулирования сухой конверсии KCl в K2SO4. Среди недостатков этого способа особенно выделяется один. Способ требует большого количества энергии, настолько большого, что технологичность способа иногда сомнительна.
В патенте США 3998935 описан способ, в соответствии с которым проводят реакцию KCl с горячим раствором KHSO4 с целью получения K2SO4 после кристаллизации путем охлаждения. Однако, поскольку непосредственный контакт происходит в отдельном реакторе, после чего следует стадия кристаллизации путем охлаждения, для осуществления этого способа требуется трехстадийная реакция. Кроме того, в данном способе при некоторых исходных концентрациях образуется избыток KHSO4.
В способе, описанном в патенте США 4045543, сделана попытка уменьшить сложность способа, описанного в патенте США 3998935, путем исключения кристаллизации промежуточной соли. Это осуществляют в ходе четырехстадийного способа: реакция, выпаривание, кристаллизация и фильтрация. Однако, основным недостатком, при этом, является то, что способ малорентабелен из-за необходимости проведения стадии выпаривания HCl, на которой образуется раствор с относительно небольшой концентрацией.
В патенте США 4436710 предлагается способ, в соответствии с которым для получения смешанной соли K2SO4 и KHSO4 используют умеренно высокую температуру (290-350°С). Это сопровождается стадией растворения в водной фазе и кристаллизации путем охлаждения с получением K2SO4 и представляет собой, в сущности, технологическую стадию способа Мангейма, сопровождаемую двумя стадиями кристаллизации. По существу, способ не позволяет значительно уменьшить энергопотребление.
В способе, описанном в патенте США 4588573, используют подход, изложенный в патентах США 3998935 и 4045543, проводя реакцию KCl и H2SO4 с выделением дистиллята HCl/H2O. Раствор охлаждают с целью кристаллизации сильнокислых смешанных солей, которые поэтапно превращают из KH3(SO4)2 в KHSO4 и в K2SO4. Однако, это многостадийный способ, в котором используют установку, подобную описанной в патенте США 3998935.
Наконец, в WO 03/074424 представлен подход, в соответствии с которым двойную соль, K3HSO4, отделяют и превращают в K2SO4 путем растворения в воде.
Все упомянутые выше способы являются многостадийными и очень сложными процессами, часто предусматривающими получение промежуточных солей, или энергоемкими и, следовательно, нерентабельными. Кроме того, использование кристаллизации путем охлаждения часто приводит к существенной кристаллизации KCl, представляющего собой нежелательную примесь в солях K2SO4. Следовательно, имеется потребность в относительно простом способе производства K2SO4, который, по сравнению со многими традиционными способами, требует меньшего количества энергии и не включает сложных многостадийных процессов и процессов, предусматривающих кристаллизацию путем охлаждения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящим изобретением обеспечивается способ, в соответствии с которым реагенты, KCl и H2SO4, не приводят в непосредственный контакт в первой технологической установке. Вместо этого, суспензию или раствор KCl приводят в контакт с рециркулируемым потоком, обогащенным H2SO4, в испарительном кристаллизаторе с получением кристаллизованного К2SO4 и парообразной смеси НCl и Н2О. На данном этапе, если нужно, парообразная смесь НCl и Н2О может быть подвергнута обработке в отдельном процессе с целью получения более концентрированной НCl. Кроме того, на данном этапе кристаллизованный К2SO4 может быть подвергнут дополнительной обработке с целью очистки и/или повышения качества. H2SO4 технического качества подают в резервуар, в котором собирается маточный раствор или фильтрат, поступающий из установки разделения/обезвоживания. Присутствующий в фильтрате остаточный хлорид из жидкости переходит в паровую фазу. Образовавшийся раствор представляет собой рециркулируемый поток, обогащенный H2SO4.
В одном из вариантов осуществления настоящим изобретением обеспечивается способ производства сульфата калия и соляной кислоты. Способ включает смешивание воды с хлоридом калия с получением суспензии или раствора хлорида калия. Суспензию или раствор хлорида калия смешивают с рециркулированной серной кислотой с получением кислой смеси K+, Cl-, SO42-. Затем, кислую смесь K+, Cl-, SO42- подают в испарительный кристаллизатор, где проводят процесс кристаллизации с получением концентрата, содержащего кристаллы сульфата калия, и паровую фазу соляная кислота/вода. Концентрат, содержащий кристаллы сульфата калия, подают в сепаратор твердой и жидкой фаз, отделяют кристаллы сульфата калия от концентрата и получают фильтрат. Затем, кристаллы сульфата калия промывают. Кроме того, как вариант, способ включает отделение соляной кислоты от паровой фазы соляная кислота/вода с получением раствора соляной кислоты. Как вариант, полученный концентрат содержит кристаллы, включающие калий и сульфат. Кристаллы калия и сульфата могут иметь форму сульфата калия (K2SO4), бисульфата калия (KHSO4) или смесь и того, и другого.
Другие цели и преимущества настоящего изобретения станут ясны и очевидны по рассмотрении нижеследующего описания и прилагаемых чертежей, которые лишь поясняют изобретение.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой схематичное пояснение основного способа производства сульфата калия и соляной кислоты.
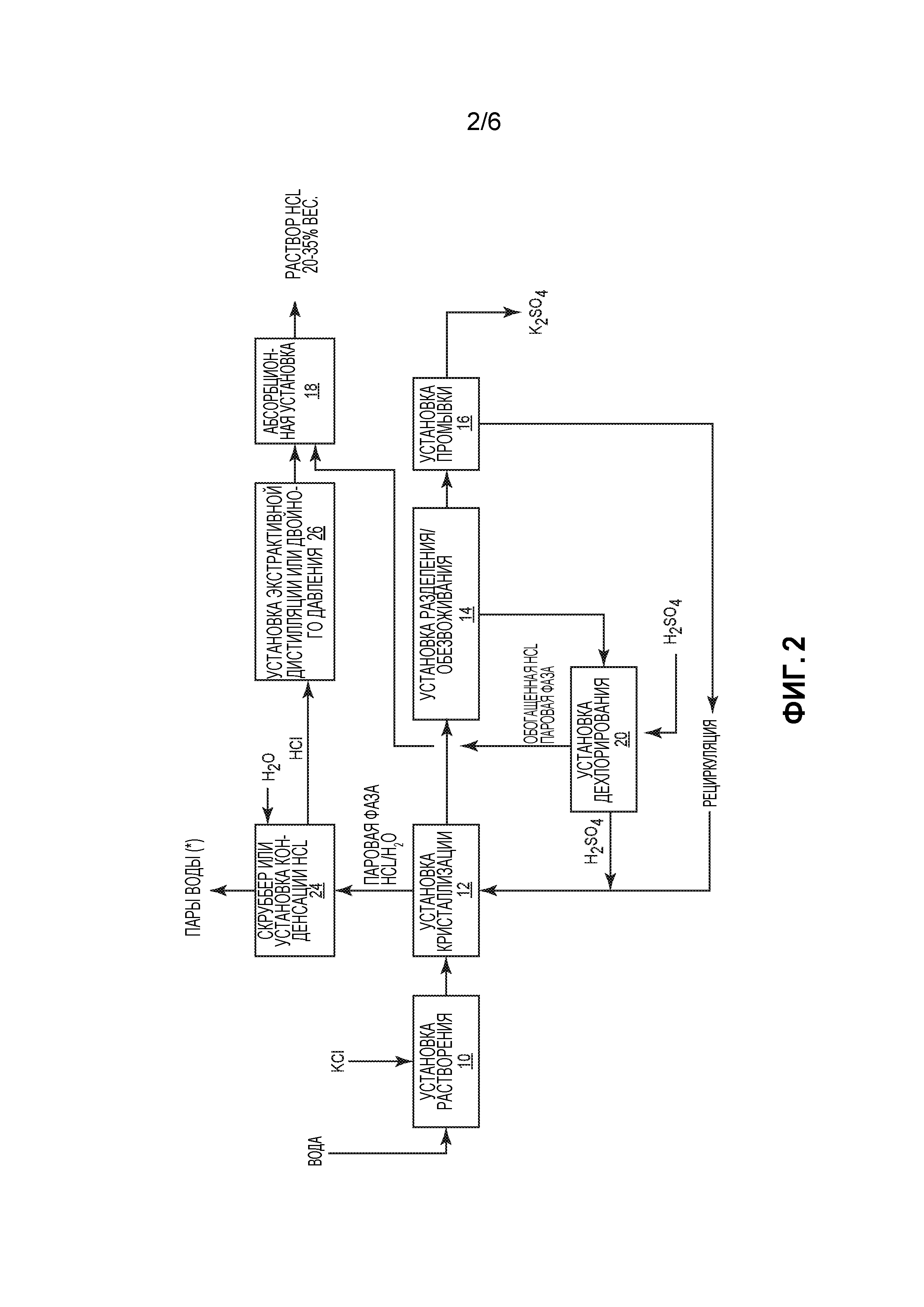
Фиг. 2 представляет собой схематичное пояснение способа производства сульфата калия, во многих отношениях подобного показанному на фиг. 1, но включающего дополнительные процессы обработки паровой фазы HCl/H2O, образовавшейся в кристаллизаторе, с получением более концентрированного раствора HCl.
Фиг. 3 представляет собой схематичное пояснение способа производства сульфата калия, подобного показанному на фиг. 2, но включающего альтернативный процесс обработки паровой фазы HCl/H2O, образовавшейся в кристаллизаторе, с получением более концентрированного раствора HCl.
На фиг. 4 показан еще один альтернативный вариант способа производства сульфата калия, в котором кристаллизованный сульфат калия подвергают дополнительным операциям промывки с целью повышения качества производимого сульфата калия.
Фиг. 5 представляет собой схематичное пояснение способа производства сульфата калия и соляной кислоты, включающего возможность осаждения солей магния и кальция, которые могут быть добавлены к сульфату калия или к потоку отходов.
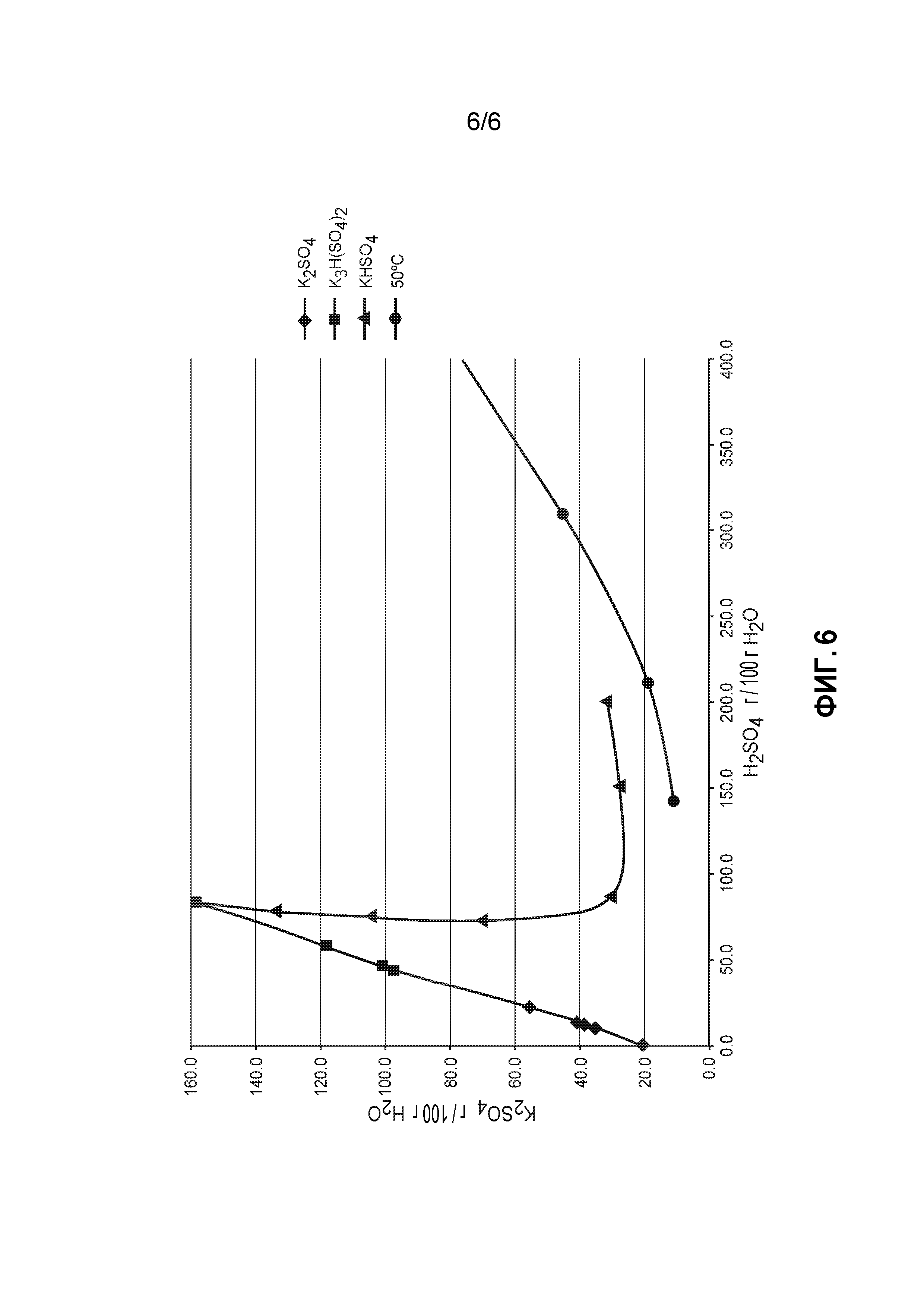
На фиг. 6 представлены диаграммы растворимости K2SO4, H2SO4 и Н2О.
ОПИСАНИЕ ПРИМЕРНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение может быть реализовано в форме ряда примерных вариантов его осуществления. В своей основе, настоящее изобретение относится к способу, в соответствии с которым суспензию или раствор хлорида калия (KCl) приводят в контакт с рециркулируемым потоком, обогащенным H2SO4, в испарительном кристаллизаторе. В процессе кристаллизации образуется заданный продукт, кристаллизованный K2SO4, и паровая фаза HCl/Н2О. Каждый из этих продуктов затем может быть подвергнут дополнительной обработке; например, паровая фаза HCl/Н2О может быть подвергнута обработке с получением концентрированного раствора HCl, тогда как кристаллизованный K2SO4 может быть подвергнут процессу очистки.
На фиг. 1 показан примерный вариант осуществления изобретения. Сначала воду и хлорид калия подают в установку 10 растворения, получая суспензию или раствор KCl, который направляют в установку 12 кристаллизации. Рециркулируемый поток, обогащенный H2SO4, также подают в установку 12 кристаллизации, где он вступает в реакцию с суспензией KCl с образованием K2SO4, HCl и Н2О. В качестве альтернативы, рециркулированный поток, обогащенный H2SO4, смешивают с суспензией KCl по потоку выше установки 12 кристаллизации. Установка 12 кристаллизации должна быть разработана и должна эксплуатироваться в таком режиме, чтобы вместе с К2SO4 кристаллизовалось очень мало или вообще не кристаллизовалось хлоридов. По завершении испарительной кристаллизации в установке 12 образуется концентрат, содержащий кристаллизованный K2SO4 и паровую фазу HCl/Н2О. В некоторых случаях, как вариант, полученный в установке 12 кристаллизации концентрат содержит кристаллы, включающие сульфат калия или бисульфат калия или смесь и того, и другого. Концентрат, содержащий кристаллизованный K2SO4, направляют в установку 14 разделения и обезвоживания, где твердые кристаллы соли отделяют от концентрата, получая фильтрат. Твердую фазу, содержащую кристаллы K2SO4, направляют в установку 16 промывки, чтобы гарантировать, что в ней не осталось захваченного раствора, который может отрицательно влиять на качество соли после сушки. После промывки отводят конечный заданный продукт - K2SO4.
Фильтрат, полученный в установке 14 разделения твердой и жидкой фаз и обезвоживания, направляют в установку 20 дехлорирования. В этой установке происходит удаление из фильтрата почти всего хлорида с получением обогащенной HCl паровой фазы, которую затем соединяют с паровой фазой HCl/Н2О, полученной в установке 12 кристаллизации. К оставшемуся фильтрату в установке 20 дехлорирования добавляют H2SO4, получая обогащенный H2SO4 раствор. Следствием этого является увеличение кислотности обогащенного H2SO4 раствора в достаточной степени для того, чтобы остаточный хлорид в фильтрате образовывал концентрированную HCl, тогда как бисульфат калия оставался растворимым. На данном этапе примеси неочищенного KCl, такие как магний и кальций, могут быть удалены в форме осажденных твердых сульфатов с целью повышения качества конечных кристаллов калия и сульфата. Жидкий раствор, образовавшийся при смешивании фильтрата установки 14 разделения/обезвоживания с H2SO4, соединяют со сбросным потоком, образующимся в установке 16 промывки, получая рециркулируемый поток, обогащенный H2SO4, который снова подают в установку 12 кристаллизации для проведения реакции. Обогащенную HCl паровую фазу из установки 20 дехлорирования и паровую фазу HCl/Н2О из установки 12 кристаллизации подают в абсорбционную установке 18, получая высококонцентрированный раствор HCl. Этот высококонцентрированный раствор HCl в одном из вариантов осуществления изобретения содержит 20-35% вес. HCl.
Поскольку точный состав паровой фазы HCl/Н2О из установки 12 кристаллизации и, следовательно, конечная концентрация раствора HCl зависит от уровня кислотности маточного раствора в установке 12 кристаллизации и содержания остаточного калия после кристаллизации, могут возникать ситуации, когда конечный раствор HCl не имеет заданную или пороговую концентрацию. Следовательно, в тех случаях, когда концентрация HCl в паровой фазе, получаемой в установке 12 кристаллизации, относительно низкая, может оказаться желательным провести процесс концентрирования с целью увеличения концентрации HCl.
Фиг. 2 поясняет альтернативный способ, подобный показанному на фиг. 1, но включающий скруббер или установку 24 конденсации HCl. Паровую фазу HCl/H2O из установки 12 кристаллизации подают в скруббер или установку 24 конденсации, где образуется водяной пар и концентрированный раствор HCl (например, в диапазоне 16-20% вес.). Этот концентрированный раствор затем подают в необязательную установку 26 экстракционной дистилляции или двойного давления, в которой образуется высококонцентрированная паровая фаза HCl, которая может быть направлена в абсорбционную установку 18 для получения раствора HCl со степенью чистоты, приблизительно, 20-35% вес.
Для случая, когда раствор HCl имеет концентрацию, меньшую, чем нужно, но близкую к концентрации, требующейся для повторного использования, на фиг. 3 предлагается способ, альтернативный показанному на фиг. 2. Этот способ подобен показанному на фиг. 2, но скруббер или установка 24 конденсации HCl в нем заменена на установку 28 экстракционной дистилляции/дегидратации паровой фазы HCl, в которую подают H2SO4. Из входящего потока низкоконцентрированной паровой фазы HCl/H2O в установке 28 образуется концентрированная паровая фаза HCl/H2O и разбавленный раствор H2SO4, который может быть рециркулирован в установку 12 кристаллизации.
Наконец, в зависимости от содержания других компонентов, таких как хлорид и бисульфат калия, в кристаллизованном К2SO4, полученная соль К2SO4 может нуждаться в дополнительной очистке с целью повышения ее качества. На фиг. 4 поясняется примерный вариант осуществления настоящего изобретения, в котором, после проведения технологических стадий, показанных на фиг. 1, кристаллизованный К2SO4 направляют в колонну 30 промывки и приводят в контакт с противоточным потоком раствора сульфата калия. Наличие колонны промывки позволяет повысить качество К2SO4 и может сочетаться с добавлением нейтрализующего основания, такого как КОН, во второй установке 32 промывки и обезвоживания с целью дополнительного понижения кислотности хлорида и соли. Дополнительным эффектом этого является превращение возможно оставшегося бисульфата калия в сульфат калия. КОН может распыляться на кристаллы в форме раствора и/или вводиться в резервуар 34 растворения К2SO4.
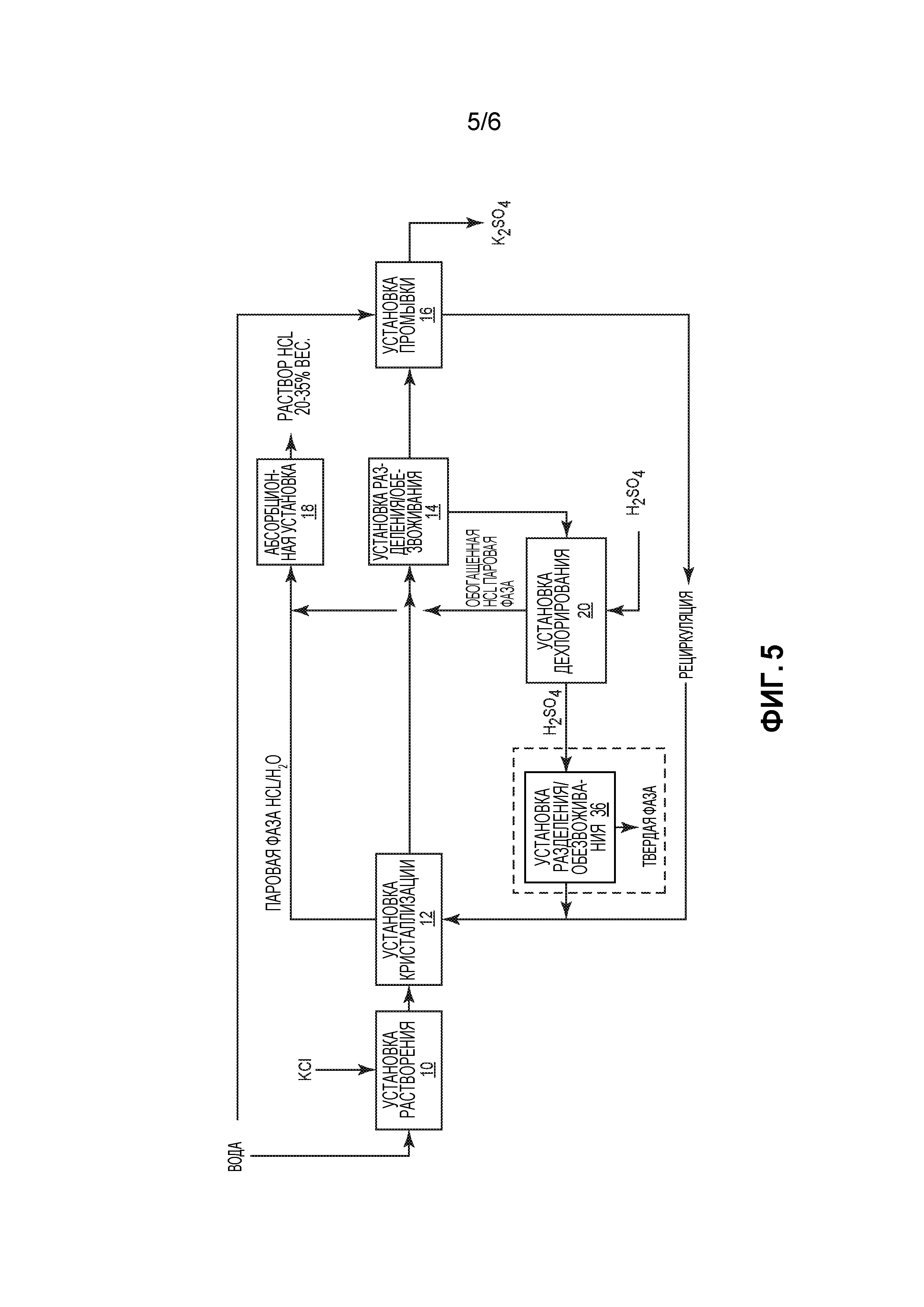
На фиг. 5 представлен другой вариант осуществления способа настоящего изобретения. Он во многих отношениях подобен способу, показанному на фиг. 1 и описанному выше. Однако, как вариант, обогащенный Н2SO4 раствор, полученный в установке 20 дехлорирования, подают в установку 36 разделения/обезвоживания. В ней осаждают и отфильтровывают соли магния и кальция, которые могут быть добавлены к конечному продукту К2SO4 или к потоку отходов в случае, когда требуется высокая степень чистоты К2SO4.
На чертежах показано производство К2SO4. Специалистам в данной области ясно, что этим способом также могут быть произведены KCl и KHSO4. Действительно, в некоторых случаях количество KCl и/или КНSO4 может превосходить количество производимого К2SO4. Следовательно, при смешивании суспензии или раствора хлорида кальция с серной кислотой образуется кислая смесь K+, Cl-, SO42-, из которой посредством кристаллизации получают концентрат, содержащий сульфат и соли калия.
Описанному выше способу свойственны многочисленные преимущества. Настоящим изобретением обеспечивается способ, в котором потоки реагентов перегруппированы с получением одностадийного процесса кристаллизации с повышенной эффективностью извлечения соляной кислоты в оптимальных условиях с одновременной кристаллизацией сульфата калия при среднем уровне кислотности. В частности, реагенты - хлорид кальция и серную кислоту - не вводят на одной и той же технологической стадии, чтобы сместить профиль кислотности по сравнению с некоторыми известными способами. Выпаривание соляной кислоты/воды и кристаллизацию К2SO4, теоретически, проводят в одной и той же технологической установке. Ожидается, что реагенты и продукты имеют лучшее, по меньшей мере, то же качество, что и в обычных способах производства сульфата калия, при существенно сниженных капитальных затратах, а также сниженных эксплуатационных затратах и затратах на техническое обслуживание и ремонт. Кроме этого, рабочую температуру поддерживают достаточно высокой для того, чтобы ограничить совместное осаждение какого-либо количества хлорида калия вместе с кристаллами сульфата калия. В способе также имеется первая стадия промывки и обезвоживания кристаллов сульфата калия, на которой предусматривается изменение кислотности раствора для конкретной стадии дехлорирования. В способе также имеется необязательная вторая стадия промывки/обезвоживания, на которой предусматривается регулирование свойств кристаллов сульфата калия в соответствии с наивысшими требованиями, предъявляемыми к качеству.
Конечно, настоящее изобретение может быть реализовано иначе, нежели описано в настоящем документе, не выходя за рамки объема и существенных отличительных особенностей изобретения. Таким образом, данные варианты осуществления изобретения следует рассматривать во всех аспектах как пояснительные и не имеющие ограничительного характера; подразумевается, что изобретение охватывает все изменения в пределах смысла и эквивалентности прилагаемой формулы изобретения.
Реферат
Изобретение относится к неорганической химии. Для получения сульфата калия и соляной кислоты смешивают хлорид калия с водой с получением суспензии, которую смешивают с рециркулируемой серной кислотой с получением кислой смеси K, Cl, SO. Смесь подвергают обработке в процессе кристаллизации с получением кристаллов сульфата калия и паровой фазы соляная кислота/вода. Соляную кислоту отделяют от паровой фазы соляная кислота/вода с получением раствора соляной кислоты. Обеспечивается упрощение способа производства, повышение эффективности извлечения соляной кислоты с одновременной кристаллизацией сульфата калия. 9 з.п. ф-лы, 6 ил.

Комментарии