Дисульфидный поликатионный амфифил, композиция на его основе с нейтральным фосфолипидом и способ ее получения - RU2610271C1
Код документа: RU2610271C1
Описание
Изобретение относится к области химии, биотехнологии, медицины и химико-фармацевтической промышленности, и раскрывает дисульфидный поликатионный амфифил, композицию на его основе для транспорта нуклеиновых кислот в клетки в присутствии сыворотки крови в ростовой среде и способ получения такой композиции. Композиция включает дисульфидный поликатионный амфифил и нейтральный фосфолипид и образует комплекс с нуклеиновой кислотой. При этом катионный липид присутствует в количестве 50% (мол.) на общее количество липидов в композиции.
Для лечения наследственных и приобретенных заболеваний в последние десятилетия разрабатывается подход, получивший название генная терапия, основанный на введении терапевтических нуклеиновых кислот в дефектные клетки-мишени [Ginn S.L. et al. Gene therapy clinical trials worldwide to 2012 - an update //J. Gene Med., 2013, Vol.15, №2, pages 65-77; Flotte T.R. Gene therapy: The first two decades and the current state-of-the-art //J. Cell. Physiol., 2007, Vol.213, №2, pages 301-305]. Успешная доставка нуклеиновых кислот к месту терапевтического действия является лимитирующим фактором данного подхода. Катионные амфифилы и липосомы на их основе представляют одно из основных средств доставки генетического материала в эукариотические клетки [Ibraheem D. et al. Gene therapy and DNA delivery systems //Int. J. Pharm., 2014, Vol. 459, №1-2, pages 70-83; Vitor M.T. et al. Cationic liposomes as non-viral vector for RNA delivery in cancer immunotherapy //Recent Pat. Drug Deliv. Formul, 2013, Vol.7, №2, pages 99-110; Deshpande P.P. et al. Current trends in the use of liposomes for tumor targeting // Nanomedicine (Lond), 2013, Vol.8, №9, pages 1509-1528]. В структуру катионного амфифила должна входить положительно заряженная группа/группы, необходимые для связывания и компактизации молекулы нуклеиновой кислоты, и гидрофобный домен, обеспечивающий защиту нуклеиновой кислоты путем инкапсулирования и прохождение через отрицательно заряженную клеточную мембрану эукариотических клеток по механизму эндоцитоза [Barrait G. Delivery to intracellular targets by nanosized particles in intracellular delivery (fundamental biomedical technologies, 5ed. (Ed. Prokop A.) //Springer Netherlands, 2011, pages 73-95; Lee Y. et al. Delivery of nucleic acid drugs in nucleic acid drugs (Ed. Murakami A.) // Springer Berlin Heidelberg, 2012, Vol. 249, pages 95-134]. Данные структурные элементы, как правило, связаны между собой спейсерами различной длины и природы [Mintzer M.A. et al. Nonviral vectors for gene delivery // Chem. Rev., 2009, Vol.109, pages 259-302].
Среди липофильных полиаминов производные тетраамина - спермина - наиболее эффективно связывают и упаковывают нуклеиновые кислоты [Geall A.J. et al. Synthesis of cholesteryl polyamine carbamates: pKa studies and condensation of calf thymus DNA // Bioconjugate Chem., 2000, Vol.11, pages 314-326; Maslov M.A. et al. Novel cholesterol spermine conjugates provide efficient cellular delivery ofplasmid DNA and small interfering RNA //J. Control. Release, 2012, Vol.160, pages 182-193] и поэтому лучше переносят их в клетки. Однако эффективность таких соединений все еще остается недостаточно высокой для их клинического применения. Это связано с большим количеством биологических барьеров, препятствующих попаданию нуклеиновых кислот в эукариотические клетки [Wiethoff С.М. et al. Barriers to nonviral gene delivery // J. Pharm. Set, 2003, Vol.92, pages 203-217]. Один из подходов, позволяющих улучшить эффективность доставки за счет контролируемого высвобождения нуклеиновых кислот в цитоплазму, заключается во введении в структуру катионного амфифила дисульфидной группы, способной разрушаться под действием внутриклеточных восстановителей, прежде всего глутатиона [Østergaard H. et al. Monitoring disulfide bond formation in the eukaryotic cytosol //J. Cell Biol, 2004, Vol. 166, pages 337-345].
В экспериментах по доставке катионные амфифилы часто смешивают с так называемыми липидами-помощниками, подобными 1,2-ди-О-олеоилфосфатидилэтаноламину (DOPE) или холестерину, так как такие липиды способны переходить из ламелярной фазы в инвертированную гексагональную, которая способствует улучшению доставки нуклеиновой кислоты [Zhdanov R.I. et al. Cationic lipid-DNA complexes-lipoplexes for gene transfer and therapy//Bioelectrochemistry, 2002, Vol.58, №1, pages 53-64].
На эффективность доставки нуклеиновых кислот оказывает огромное воздействие сыворотка крови, которая вызывает агрегацию и деградацию комплексов катионных липосом с нуклеиновыми кислотами под действием макромолекул, находящихся в крови, что является основным препятствием для успешного их применения в условиях in vivo. Поэтому необходимым условием оценки эффективности систем доставки нуклеиновых кислот в условиях in vitro является биологический скрининг в присутствии сыворотки крови в ростовой среде.
Техническим результатом заявленного изобретения является расширение арсенала средств, способных эффективно доставлять нуклеиновые кислоты в клетки в присутствии сыворотки в ростовой среде.
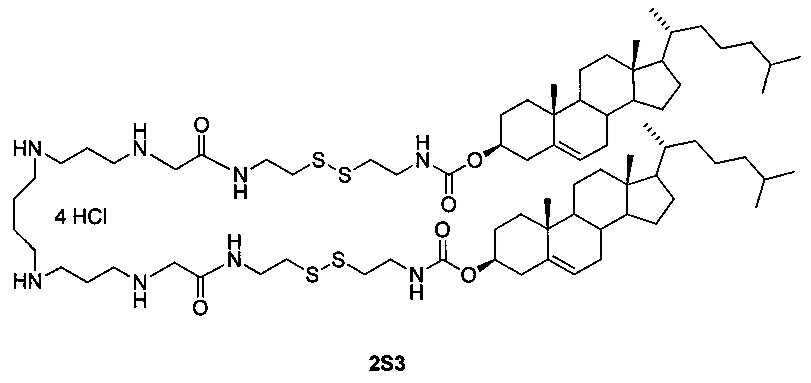
Технический результат достигается дисульфидным поликатионным амфифилом 1,32-бис(холест-5-ен-3β-илоксикарбониламино)-8,25-диоксо-3,4,21,22-тетратиа-7,10,14,19,23,26-гексаазадотриаконтан тетрагидрохлоридом (2S3), представляющим собой аналог поликатионного амфифила с высоким трансфицирующим потенциалом [Maslov М.А. et al. Novel cholesterol spermine conjugates provide efficient cellular delivery of plasmid DNA and small interfering RNA // J. Control. Release, 2012, Vol. 160, pages 182-193, патент РФ №2423147, опубл. 10.07.2011], следующего строения:

В структуру дисульфидного поликатионного амфифила 2S3 входит остаток спермина для связывания и компактизации молекулы нуклеиновой кислоты, остаток холестерина для формирования гидрофобного окружения. Для связывания гидрофобной и сперминовой частей используют биодеградируемые линкеры дисульфидного или карбамоильного типа. Наличие дисульфидного линкера улучшает эффективность доставки за счет контролируемого высвобождения нуклеиновых кислот в цитоплазму под действием внутриклеточных восстановителей.
Технический результат также достигается предлагаемой композицией, которая содержит: 1) дисульфидный поликатионный амфифил 2S3 в качестве компонента, связывающего и упаковывающего нуклеиновую кислоту и 2) нейтральный фосфолипид в качестве структурообразующего и промотирующего компонента.
Технический результат также достигается способом получения композиции для доставки коротких и протяженных нуклеиновых кислот, характеризующийся тем, что липидную пленку, состоящую из дисульфидного поликатионного амфифила и нейтрального фосфолипида DOPE, гидратируют в воде и полученную эмульсионно-дисперсионную систему подвергают ультразвуковой обработке или экструзии.
Исходным соединением в синтезе предлагаемого дисульфидного поликатионного амфифила 2S3 являлся спермин (1), из которого было получено региоселективно защищенное производное спермина (2) согласно описанному ранее методу [Petukhov I.A. et al. Synthesis of polycationic lipids based on cholesterol and spermine // Russ. Chem. Bull., 2010, Vol. 59, pages 260-268]. Алкилирование соединения (2) действием этилового эфира бромуксусной кислоты в присутствии карбоната цезия в условиях реакции Фукуямы [Bajaj A. et al. Effect of the nature of the spacer on gene transfer efficacies of novel thiocholesterol derived gemini lipids in different cell lines: a structure-activity investigation //J. Med. Chem., 2008, Vol. 51, pages 2533-2540; Fraix A. et al. Cationic lipophosphoramidates with two disulfide motifs: synthesis, behaviour in reductive media and gene transfection activity // Org. Biomol. Chem., 2013, Vol 11, pages 1650-1659] приводило к соединению (3). Удаление 2-нитробензолсульфонильных групп действием тиофенола в присутствии карбоната калия давало соединение (4). Затем осуществляли блокирование вторичных аминогрупп ди-трет-бутилпирокарбонатом в присутствии триэтиламина при 0°С, получая полностью защищенное производное спермина, гидролиз которого действием водно-метанольного раствора гидроксида натрия давал соединение (5). Для введения дисульфидной группы цистамин (2,2'-диаминодиэтил дисульфида) вводили во взаимодействие с хлорформиатом холестерина (6), получая соединение (7). Ключевой стадией синтеза являлась реакция конденсации сперминового производного (5) с холестериновой компонентой (7) в присутствии 2-этокси-1-этоксикарбонил-1,2-дигидрохинолина. На заключительной стадии для соединения (8) проводили удаление Вос-защитных групп действием 3М раствора хлороводорода в диоксане, получая целевое соединение (9).
N,N-диизопропилэтиламин, N,N-диметилформамид, 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин, триэтиламин, хлорформиат холестерина, цистамина дигидрохлорид, этилбромацетат были получены от Aldrich; ди-трет-бутилдикарбонат, холестерин, цезия карбонат получены от Fluka; спермин был получен от Sigma; тиофенол был получен от Merck. Остальные растворители и реагенты были отечественного производства.
Хлористый метилен, триэтиламин и N,N-диизопропилэтиламин кипятили над гидридом кальция и перегоняли перед реакцией. Метанол и N,N-диметилформамид выдерживали над прокаленными молекулярными ситами 3 и 4 Å соответственно.
Тонкослойную хроматографию проводили на пластинках Kieselgel 60 F254 (Merck). Обнаружение пятен на хроматограммах проводили раствором фосформолибденовая кислота - церий (IV) сульфат с последующим прогреванием и с помощью УФ-лампы (254 нм). Колоночную хроматографию осуществляли на силикагеле Kieselgel 60 (0.040-0.063 мм и 0.063-0.200 мм, Merck). Спектры ЯМР1Н и13С регистрировали на приборах Bruker DPX 300 и Bruker DRX 500 с использованием CDCl3 в качестве растворителя, если не указано иное. Химические сдвиги ЯМР1H приведены относительно остаточного сигнала CHCl3 (δΗ 7.26 м.д.). Химические сдвиги ЯМР13С приведены относительно центрального сигнала растворителя (δC 77.0 м.д. для растворов в CDCl3). Масс-спектры получали на время-пролетном масс-спектрометре «Bruker Ultraflex» (Германия) методом матриксной лазерно-десорбционной ионизации на матрице с использованием в качестве матрицы 2,5 дигидроксибензойной кислоты, если не указано иное. Оптическое вращение измеряли на цифровом поляриметре ПУ-07 (Россия).
На основе дисульфидного поликатионного амфифила 2S3 и нейтрального фосфолипида DOPE была приготовлена композиция (2S3:DOPE, 1:1, мольное соотношение). Структурообразующий нейтральный липид 1,2-ди-О-олеоилфосфатидилэтаноламин (DOPE), чаще всего используется в качестве второго компонента систем доставки нуклеиновых кислот. DOPE не может самостоятельно переносить нуклеиновые кислоты, так как не имеет в своей структуре катионной группировки, необходимой для связывания и компактизации нуклеиновых кислот. Для формирования композиций использовали гидратирование липидной пленки, состоящей из поликатионного амфифила и DOPE, взятых в соотношении 1:1 (мол.), с последующей ультразвуковой обработкой или экструзией.
Для изучения способности предлагаемой композиции доставлять нуклеиновые кислоты в клетки млекопитающих использовали протяженную плазмидную ДНК (pEGFP-C2, «Clontech» (Германия)) и короткую 21-звенную двуцепочечную РНК (siPHK, ИХБФМ СО РАН) (последовательность смысловой цепи 5'-GCGCCGAGGUGAAGUUCGATT-3', антисмысловой цепи - 5'-UCGAACUUCACCUCGGCGCGG-3').
Для формирования комплексов нуклеиновых кислот с предлагаемой композицией инкубировали аликвоты растворов нуклеиновых кислот и композиции, рассчитанные в соответствии с соотношением положительных зарядов аминогрупп к отрицательным зарядам фосфатных групп (соотношение N/P=6/1).
Эффективность проникновения нуклеиновых кислот с использованием композиции 2S3:DOPE в клетки млекопитающих in vitro была исследована в экспериментах по трансфекции клеток плазмидной ДНК, кодирующей зеленый флуоресцирующий белок (EGFP) и короткой интерферирующей РНК, направленной против матричной РНК гена, кодирующего EGFP.
Сопоставительный анализ заявляемой композиции 2S3:DOPE с известными и широко используемыми трансфектантами, такими как Lipofectamine®2000 и композицией 2X3:DOPE [Maslov M. A. et al. Novel cholesterol spermine conjugates provide efficient cellular delivery of plasmid DNA and small interfering RNA // J. Control. Release, 2012, Vol.160, pages 182-193] показал, что предлагаемые соединения обладают следующими преимуществами:
1) заявляемая композиция с высокой эффективностью доставляет в клетки млекопитающих протяженные и короткие нуклеиновые кислоты в присутствии сыворотки крови в ростовой среде, что позволяет рассматривать ее в качестве перспективного средства доставки терапевтических нуклеиновых кислот в эукариотические клетки.
2) заявляемая композиция не требует сложной процедуры приготовления, для получения рабочего раствора достаточно подвергнуть ультразвуковой обработке или экструзии гидратированную липидную пленку, состоящую из дисульфидного поликатионного амфифила и DOPE, взятых в соотношении 1:1.
3) Заявляемая композиция стабильна при хранении как в сухом виде, так и в виде водных формуляций.
4) Заявляемая композиция превосходит известные аналоги по эффективности трансфекции в эукариотические клетки.
Поиск по источникам научно-технической и патентной литературы показал, что заявляемое соединение, композиция на его основе и способ ее получения в известных источниках не описаны.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез дисульфидного поликатионного амфифила 2S3 (1,32-бис(холест-5-ен-3β-илоксикарбониламино)-8,25-диоксо-3,4,21,22-тетратиа-7,10,14,19,23,26-гексаазадотриаконтан тетрагидрохлорида)
Этап 1. Получение диэтил N7,N12-ди-трет-бутоксикарбонил-N3,N16-бис(2-нитробензолсульфонил)-3,7,11,16-тетраазаоктадекан-1,18-диоата (2) К раствору соединения 1 (0.1530 г, 0.1980 ммоль) в безводном Ν,Ν-диметилформамиде (3 мл) добавили карбонат цезия (0.1290 г, 0.3960 ммоль) и этилбромацетат (0.11 мл, 0.9900 ммоль). Реакционную смесь перемешивали 30 ч при 65°С, фильтровали через Celite®545, промывая дихлорметаном. Растворители удалили в вакууме. Остаток хроматографировали на колонке с силикагелем, элюируя смесью хлороформ - метанол - 1% водн. уксусная кислота (120:1:0.2). Получили 0.1406 г (90%) соединения 2 в виде бледно-желтого масла. Масс-спектр ESI, m/z: 967 [M+Na]+. Вычислено для C40H60N6O16S2: 967.3405 [M+Na]+. Спектр ЯМР1Н (δ, м.д., J, Гц): 1.18 (т, 6 Η, 2 СН2СН3, J=7.1), 1.42 (уш.с, 22 Η, 2 СМе3), NCH2(CH2)2CH2N), 1.76-1.81 (м, 4 H, 2 NCH2CH2CH2N), 3.12-3.18 (м, 8 H, 2 NCH2CH2CH2N, NCH2(CH2)2CH2N), 3.37-3.42 (m, 4 H, 2 NCH2CH2CH2N), 4.09 (кв, 4 H, 2 CH2CH3, J=7.1), 4.18 (с, 4 H, 2 СН2СОО), 7.58-7.63 (м, 2 H), 7.67-7.72 (м, 4 H) и 8.04-8.07 (м, 2 Н, 2 С6Н4). Спектр ЯМР13С (δ, м.д.): 14.14, 25.96, 26.97, 28.55, 44.60, 46.44, 47.06, 47.95, 61.58, 79.68, 124.24, 130.96, 131.82, 133.30, 133.72, 148.10, 155.33, 168.75.
Этап 2. Получение диэтил N7,N12-ди-трет-бутоксикарбонил-3,7,12,16-тетраазаоктадекан-1,18-диоата (3)
К раствору соединения 2 (0.7001 г, 0.7411 ммоль) в безводном Ν,Ν-диметилформамиде (6 мл) добавили карбонат калия (0.2553 г, 1.852 ммоль), через 15 минут тиофенол (0.76 мл, 7.411 ммоль). Реакционную смесь перемешивали 1 ч при 24°С, затем фильтровали через Celite®545, промывая хлороформом. Растворители удалили в вакууме. Остаток хроматографировали на колонке с силикагелем, элюируя сначала хлороформом, затем смесью хлороформ - метанол - 25% водн. аммиак (100:1:0.1) с повышением полярности до 100:6:0.1. Получили 0.2689 г (63%) соединения 3 в виде желтого масла. Спектр ЯМР1H (δ, м.д., J, Гц): 1.20 (т, 6 Η, 2 СН2СН3, J=7.1), 1.37 (уш.с, 22 Η, 2 СМе3, NCH2(CH2)2CH2N), 1.63-1.67 (м, 4 H, 2 NCH2CH2CH2NH), 2.53-2.57 (m, 4 H, 2 NCH2CH2CH2NH), 3.10-3.17 (m, 8 H, 2 NCH2CH2CH2NH, NCH2(CH2)2CH2N), 3.33 (с, 4 H, 2 CH2COO), 4.11 (кв, 4 H, СН2СН3, J=7.1). Спектр ЯМР13C (δ, м.д.): 14.36, 25.76, 26.16, 28.60, 41.94, 46.81, 46.99, 50.89, 60.98, 79.49, 155.37, 171.92.
Этап 3. Получение диэтил N3,N7,N12,N16-тетра-трет-бутоксикарбонил-3,7,12,16-тетраазаоктадекан-1,18-диоата (4)
К охлажденному до 0°С раствору соединения 3 (0.1400 г, 0. 2436 ммоль) и безводного триэтиламина (0.17 мл, 1.218 ммоль) в безводном хлористом метилене (5 мл) прикапали раствор ди-трет-бутилдикарбоната (0.1310 г, 0.6087 ммоль) в безводном хлористом метилене (3 мл). Реакционную смесь перемешивали 48 ч при 24°С. Затем разбавили 20 мл хлористого метилена, промыли 3% водн. хлористоводородной кислоты (до рН 4), водой до рН 7. Органический слой сушили сульфатом натрия, фильтровали, растворители удалили в вакууме. Остаток хроматографировали на колонке с силикагелем, элюируя смесью толуол - ацетон (10:1). Получили 0.130 г (69%) соединения 4 в виде бесцветного кристаллизующегося масла. Спектр ЯМР1Н (δ, м.д., J, Гц): 1.26 (т, 6 Н, 2 СН2СН3, J=7.1), 1.40-1.46 (м, 40 Н, 4 СМе3, NCH2(CH2)2CH2N), 1.72-1.76 (м, 4 Н, 2 NCH2CH2CH2N), 3.13-3.19 (м, 8 Н, 2 NCH2CH2CH2N, NCH2(CH2)2CH2N), 3.20-3.29 (м, 4 Η, 2 NCH2CH2CH2N), 3.84 (уш.с, 2 H, СН2СОО), 3.93 (уш.с, 2 H, СН2СОО), 4.17 (кв, 4 Н, 2 СН2СН3, J=7.1). Спектр ЯМР13С (δ, м.д.): 14.38, 25.78, 28.34, 28.50, 28.58, 44.82, 46.58, 49.39, 52.05, 61.08, 79.38, 80.36, 155.60, 155.79, 170.68.
Этап 4. Получение N3,N7,N12,N16-тетра-трет-бутоксикарбонил-3,7,12,16-тетраазаоктадекан-1,18-диовой кислоты (5)
К раствору соединения 4 (0.130 г, 0.1677 ммоль) в метаноле (3 мл) добавили раствор гидроксида натрия (0.0335 г, 0.8387 ммоль) в метанол - вода (0.6 мл, 50:1 объемн.). Реакционную смесь перемешивали 96 ч при 24°С, затем прикапали 2% водн. хлористоводородная кислота до рН 4, растворители удалили в вакууме. Остаток хроматографировали на колонке с силикагелем, элюируя смесью хлороформ - метанол - 1% водн. уксусная кислота (10:1:0.1) с повышением полярности до 2:1:0.1. Получили 0.1038 г (87%) соединения 5 в виде бежевых кристаллов. Тпл 62-64°С. Масс-спектр ESI, m/z: 741 [М+Na]+. Вычислено для C34H62N4O12: 741.4262 [М+Na]+. Спектр ЯМР1H (CDCl3:CD3OD=1:1, δ, м.д., J, Гц): 1.41 (уш.с, 40 Η, 4 СМе3, NCH2(CH2)2CH2N), 1.69-1.73 (м, 4 Η, 2 NCH2CH2CH2N), 3.11-3.19 (м, 8 Η, 2 NCH2CH2CH2N, NCH2(CH2)2CH2N), 3.20-3.29 (м, 4 Η, 2 NCH2CH2CH2N), 3.75 (уш.с, 4 Η, 2 СН2СОО). Спектр ЯМР13С (δ, м.д.): 25.35, 27.36, 27.54, 28.74, 44.69, 45.39, 46.55, 49.36, 79.34, 79.76, 155.50, 155.62, 167.77.
Этап 5. Получение (холестен-5-ен-3β-ил)-N-(2-[(2-аминоэтил)дитио]этил}карбамат гидрохлорида (7)
К раствору цистамин дигидрохлорида (0.300 г, 1.332 ммоль) в 0.7 M водн. гидроксиде натрия (4 мл) прилили метанол (30 мл), растворитель удалили в вакууме. Сухой остаток растворили в безводном хлористом метилене (15 мл), раствор декантировали, добавили к нему безводный триэтиламин (38 мкл, 0.2664 ммоль), охладили до 0°С и по каплям добавили раствор хлорформиата холестерина (0.1190 г, 0.2664 ммоль) в безводном хлористом метилене (1 мл). Реакционную смесь перемешивали 2 ч при 22°С, разбавили хлористым метиленом (20 мл) и промыли 1% водн. хлористоводородной кислотой (1×15 мл). Водную фазу экстрагировали хлористым метиленом (5×10 мл). Объединенный органический экстракт промыли насыщ. водн. хлоридом натрия (2×15 мл), объединенный водный экстракт промыли этилацетатом (2×20 мл). Объединенный органический экстракт сушили над сульфатом натрия, фильтровали, растворитель удалили в вакууме. Остаток хроматографировали на силикагеле в системе хлороформ - метанол (15:1) с повышением полярности до 12:1. Получили 0.103 г (66%) соединения 7 в виде бледно-желтых кристаллов. Тпл=130-132°С. [α]D23 -27.13 (с 1, хлористый метилен). Масс-спектр, m/z (Ioтн(%))· 564.456 [M-Cl]+. Вычислено для C32H56N2O2S2: 564.378 [М-Cl]+. Спектр ЯМР1H (500 МГц, CDCl3:CD3OD=10:1, δ, м.д., J, Гц): 0.61 (с, 3 Н, С(13)Ме), 0.79 (д, 3 H, J=6.6, С(25)Ме), 0.80 (д, 3Н, J=6.6, С(25)Ме), 0.85 (д, 3 H, J=6.2, С(20)Ме), 0.94 (с, 3 Н, С(10)Ме), 0.87-1.62 (м, 21 Н, Chol), 1.65-2.07 (м, 5 Н, Chol), 2.17-2.35 (м, 2 Н, Н2С(4) Chol), 2.68-2.77 (м, 4 Н, 2 CH2S), 2.90-2.96 (м, 2 H, CH2NH3), 3.35-3.44 (м, 2 H, CH2NHC(O)O), 4.34-4.47 (м, 1 Н, Н(3) Chol), 5.25-5.34 (м, 1 Н, Н(6) Chol), 5.39-5.46 (м, 1 H, NHCO). Спектр ЯМР13С (δ, м.д.): 11.83, 18.69, 19.28, 21.05, 22.51, 22.76, 23.83, 24.27, 27.99, 28.16, 28.21, 31.90, 35.79, 36.20, 36.57, 36.98, 38.17, 38.53, 39.52, 39.76, 39.92, 41.32, 42.33, 50.06, 56.18, 56.72, 74.70, 122.58, 139.77, 156.43.
Этап 6. Получение N10,N14,N19,N23-тетра-трет-бутоксикарбонил-1,32-бис(холест-5-ен-3β-илоксикарбониламино)-8,25-диоксо-3,4,21,22-тетратиа-7,10,14,19,23,26-гексаазадотриаконтана (8)
К раствору соединения 7 (0.0850 г, 0.1413 ммоль) в безводном хлористом метилене (5 мл) при перемешивании добавили N,N-диизопропилэтиламин (49 мкл, 0.2826 ммоль), затем через 10 мин последовательно добавили раствор соединения 5 (0.0400 г, 0.0565 ммоль) в безводном хлористом метилене (3 мл) и 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин (0.0350 г, 0.1413 ммоль) в безводном хлористом метилене (3 мл) и перемешивали 48 ч при 50°С. Реакционную смесь разбавили хлористым метиленом (30 мл), промыли насыщ. водн. карбонатом натрия (1×10 мл), водой (1×10 мл), 1% водн. хлористоводородной кислотой (1×10 мл), водой (2×10 мл). Органический экстракт сушили сульфатом натрия, фильтровали, растворитель удалили в вакууме. Остаток хроматографировали на колонке с силикагелем, элюируя смесью хлороформ - метанол (100:1) с повышением полярности до 50:1. Получили 0.070 г (69%) соединения 8 в виде бледно-желтого кристаллизующегося масла. Масс-спектр ESI, m/z: 1835 [M+Na]+. Вычислено для C98H170N8O14S4: 1834.1617 [M+Na]+. Спектр1H ЯМР (500 МГц, δ, м.д., J, Гц): 0.66 (с, 6 Η, 2 С(13)Ме), 0.83 (д, 6H, J=6.6, 2 С(25)Ме), 0.85 (д, 6 H, J=6.6, 2 С(25)Ме), 0.90 (д, 6 H, J=6.2, 2 С(20)Ме), 0.99 (с, 6 Н, 2 С(10)Ме), 1.01-1.58 (м, 42 Н, Chol), 1.43 (уш.с, 18 Н, 2 СМе3), 1.45 (уш.с, 18 Н, 2 СМе3), 1.71-1.76 (м, 4 H, NCH2(CH2)2CH2N), 1.79-2.02 (м, 10 Н, Chol), 2.21-2.37 (м, 4 Н, 2 Н2С(4) Chol), 2.74-2.84 (м, 8 Н, 4 CH2S), 3.10-3.21 (м, 8 Н, 2 NCH2CH2CH2N, NCH2(CH2)2CH2N), 3.22-3.29 (м, 4 Н, 2 NCH2CH2CH2N), 3.42-3.50 (м, 4 Н, 2 NHCH2CH2S), 3.53-3.61 (м, 4 Н, 2 NHCH2CH2S), 3.81 (с, 4 Н, 2 СН2СОО), 4.42-4.52 (м, 2 Н, 2 Н(3) Chol), 5.18-5.31 (м, 2Н, 2 NHCO), 5.32-5.38 (м, 2Н, 2 Н(6) Chol). Спектр13С ЯМР (δ, м.д.): 11.11, 13.34, 17.98, 18.58, 20.31, 21.80, 22.05, 23.09, 23.54, 24.95, 26.55, 27.25, 27.42, 27.47, 27.65, 27.77, 28.76, 30.68, 31.15, 35.04, 35.45, 35.69, 35.83, 36.26, 36.94, 37.44, 37.82, 38.78, 39.01, 41.58, 43.98, 45.99, 49.30, 50.94, 55.43, 55.96, 73.80, 78.69, 80.09, 117.52, 120.25, 121.78, 139.05, 154.69, 155.38, 161.77, 169.13.
Этап 7. Получение 1,32-бис(холест-5-ен-3β-илоксикарбониламино)-8,25-диоксо-3,4,21,22-тетратиа-7,10,14,19,23,26-гексаазадотриаконтан тетрагидрохлорид (9)
К охлажденному до 0°С раствору соединения 8 (0.0900 г, 0. 0496 ммоль) в безводном CH2Cl2(10 мл) добавили 3N раствор хлористоводородной кислоты в диоксане (6 мл), перемешивали 24 ч при 22°С. Растворитель удалили в вакууме, остаток перекристаллизовывали последовательно из этанола (5 мл) и диэтилового эфира (5 мл). Получили 0.070 г (91%) соединения 9 в виде бежевых кристаллов, разлагается при нагревании выше 180°С. Масс-спектр, m/z (/отн(%)): 1412.276 [М+2Н]+, 1414.282 [М+4Н]+. Вычислено для C78H138N8O6S4: 1410.962 [М]+. Спектр1H ЯМР (CDCl3:CD3OD=1:1, δ, м.д, J, Гц): 0.61 (с, 6 Н, 2 С(13)Ме), 0.78 (д, 6 H, J=6.6, 2 С(25)Ме), 0.79 (д, 6 H, J=6.6, 2 С(25)Ме), 0.84 (д, 6 H, J=6.2, 2 С(20)Ме), 0.94 (с, 6 Н, 2 С(10)Ме), 0.99-1.57 (м, 42Н, Chol), 1.71-1.88 (м, 10Н, Chol), 1.89-1.99 (м, 4 Н, NCH2(CH2)2CH2N), 2.18-2.33 (м, 4 Н, 2 Н2С(4) Chol), 2.69-2.79 (м, 8 Н, 4 CH2S), 2.91-3.09 (м, 4 Н, 2 NCH2CH2CH2N), 3.30-3.40 (м, 8 Н, 2 NCH2CH2CH2N, NCH2(CH2)2CH2N), 3.44-3.52 (м, 4 Н, 2 NHCH2CH2S), 3.85-3.95 (м, 4 Н, 2 NHCH2CH2S), 4.18 (с, 4 Н, 2 СН2СОО), 4.32-4.44 (м, 2 Н, 2 Н(3) Chol), 5.25-5.33 (м, 2 Н, 2 Н(6) Chol).
Пример 2. Получение композиции 2S3:DOPE
Раствор дисульфидного поликатионного амфифила 2S3 и нейтрального фосфолипида DOPE в соотношении (1:1) в подходящем органическом растворителе упаривали в вакууме до образования липидной пленки. Полученную липидную пленку гидратировали в необходимом количестве автоклавированной деионизированной воды в течение 5 часов, а затем озвучивали на ультразвуковой бане до получения однородной композиции. Озвучивание можно заменить экструзией через поликарбонатную мембрану с размером пор от 50 до 200 нм.
Пример 3. Трансфекция клеток НЕК 293 плазмидной ДНК с использованием липосом 2S3:DOPE
Исследование доставки плазмидной ДНК в клетки НЕК 293 проводили с помощью проточной флуоциториметрии. Эффективность трансфекции оценивали по количеству клеток, содержащих зеленый флуоресцентный белок (EGFP) от общего количества клеток в образце. Клетки НЕК 293 высаживали в 24-луночные планшеты (1×105 клеток на лунку в 500 мкл среды DMEM с 10% эмбриональной телячьей сывороткой) и культивировали в течение суток при 37°С в атмосфере, содержащей 5% CO2. Перед проведением трансфекции для экспериментов в присутствии сыворотки среду в лунках заменяли на 200 мкл среды DMEM с 10% эмбриональной телячьей сывороткой. Липосомы 2S3:DOPE в 25 мкл среды OptiMEM смешивали с раствором pEGFP-C2 (0.5 мкг в лунке) в 25 мкл этой же среды в оптимальном соотношении N/P=6/1 и инкубировали 20 мин при 25°С. Полученную смесь добавляли к клеткам и выдерживали в течение 4 ч при 37°С в атмосфере, содержащей 5% CO2, затем заменяли среду на 500 мкл DMEM с 10% эмбриональной телячьей сывороткой. Через 48 ч клетки промывали фосфатно-солевым буфером (300 мкл), добавляли 50 мкл раствора трипсина и инкубировали 2 мин (37°С, 5% CO2). По окончании инкубации в лунки добавляли 400 мкл DMEM с 10% эмбриональной телячьей сывороткой, клетки суспендировали и переносили в пробирки. Полученную клеточную суспензию центрифугировали при 1200 об/мин, отбирали среду и промывали 500 мкл фосфатно-солевого буфера. Затем клетки фиксировали 600 мкл 2% раствора формальдегида в фосфатно-солевом буфере. Анализ уровня трансфекции клеток проводили на флуоцитометре АСЕА NovoCyte™ 3000 (Bioscience Inc., USA). В этих экспериментах определяли количество клеток, экспрессирующих белок EGFP, и средний уровень флуоресценции клеток при длине волны возбуждения 488 нм. В качестве объекта сравнения был выбран коммерчески доступный препарат - Lipofectamine 2000 и липосомы 2X3:DOPE.
Результаты трансфекции клеток плазмидной ДНК pEGFP-C2 в присутствии эмбриональной телячьей сыворотки в ростовой среде представлены в таблице 1.

Пример 4. Трансфекция клеток ВНК IR-780 короткой интерферирующей РНК с использованием композиций 2S3:DOPE
Исследование проникновения siPHK, направленной на подавление синтеза зеленого флуоресцирующего белка EGFP, проводили на клетках линии ВНК IR-780, стабильно экспрессирующих данный белок. В качестве мишени была выбрана мРНК, кодирующая белок EGFP, таким образом по уменьшению флуоресценции клеток, определяемой этим белком, можно судить об эффективности доставки siPHK в цитоплазму клетки.
Клетки ВНК IR-780 высаживали в 24-луночные планшеты (0.13×105 клеток на лунку в 500 мкл среды DMEM с 10% эмбриональной телячьей сывороткой) и культивировали в течение суток при 37°С в атмосфере, содержащей 5% СО2. Перед проведением трансфекции для экспериментов в присутствии сыворотки среду в лунках заменяли на 200 мкл среды DMEM с 10% эмбриональной телячьей сывороткой. Композиции при оптимальном соотношении N/P=6/1 в 25 мкл среды OptiMEM смешивали с раствором siPHK (с конечной концентрацией siPHK 50 нМ) в 25 мкл этой же среды и выдерживали 20 мин при 25°С. Полученную смесь добавляли к клеткам и выдерживали в течение 4 ч при 37°С в атмосфере, содержащей 5% СО2, затем заменяли среду на 500 мкл DMEM с 10% эмбриональной телячьей сывороткой. Через 72 ч клетки обрабатывали, как описано в примере 3. В качестве объекта сравнения был выбран коммерчески доступный препарат - Lipofectamine 2000 и липосомы 2X3:DOPE. Результаты по трансфекции клеток короткой интерферирующей РЕК с композициями в присутствии сыворотки в ростовой среде, определенные по уровню снижения экспрессии белка EGFP, представлены в таблице 2.

Таким образом, приведенные примеры однозначно указывают на способность предлагаемой композиции 2S3:DOPE, состоящей из дисульфидного поликатионного амфифила и нейтрального фосфолипида, эффективно способствовать проникновению коротких и протяженных нуклеиновых кислот в клетки млекопитающих в присутствии сыворотки крови, что позволяет использовать их в качестве агентов для доставки нуклеиновых кислот в клетки млекопитающих в условиях как in vitro, так и in vivo.
Реферат
Изобретение относится к дисульфидному поликатионному амфифилу 1,32-бис(холест-5-ен-3β-илоксикарбониламино)-8,25-диоксо-3,4,21,22-тетратиа-7,10,14,19,23,26-гексаазадотриаконтан тетрагидрохлорида:.Изобретение также относится к композиции для доставки протяженных и коротких нуклеиновых кислот в клетки млекопитающих и к способу получения композиции для доставки протяженных и коротких нуклеиновых кислот. Технический результат: получен дисульфидный поликатионный амфифил, способный эффективно доставлять нуклеиновые кислоты в клетки в присутствии сыворотки в ростовой среде. 3 н. и 1 з.п. ф-лы, 2 табл., 4 пр.
Формула

Комментарии