Способ получения кеталя стероидного производного,способы получения соединений - RU2165430C2
Код документа: RU2165430C2
Описание
Изобретение относится к способу получения циклических кеталей стероидного производного.
Известен способ получения кеталей стероидного производного (патент DD-296931 Германии). В соответствии с данным способом производное гонадиена обрабатывают спиртом при добавлении силил-галогенида в качестве катализатора. Данный способ используют для получения метил-, этил-, пропилкеталей производных 3-кето-5(10), 9 (11) - гонадиена. Однако циклические кетали стероидных производных данным способом не получены. Указанный выше способ является усовершенствованием ранее известного способа, так как получение диалкилкеталей по использовавшемуся способу, как, например, реакция производного 3-кетогонадиена со спиртом в присутствии кислоты приводит к продукту, который в использовавшихся условиях является нестабильным и который частично разрушается при выделении или высушивании. Чтобы получить кето в стабильной форме, его нужно, во-первых, нейтрализовать щелочью, что имеет недостаток в том, что следующий стадией надо вновь удалять щелочь.
Существует потребность в хорошем способе получения кеталей и, в частности, циклических кеталей определенных стероидных производных в качестве промежуточных продуктов в синтезе стероидов, обладающих прогестагенной активностью, в частности, для применения их в контрацепции и для гормональной поддерживающей терапии у женщин в пери- и постклимактерическом периоде. Однако выяснилось, что такой способ, как описанный в 00-296931, не подходит для экономически приемлемого получения кеталей.
Выходы, получаемые с помощью данного способа получения циклического 3-этиленкетеля эстра-4,6-диен-3,17-диона, находились обычно между 50 и 65%, в исключительных случаях до около 75%. Более того, в данном случае образовывались значительные количества (до 50%) нежелательного 3,17-дикеталя.
Существует потребность в способе получения кеталей, в частности, циклических кеталей производных 3-кето-5(10), 9(11)-стероиддиена, который может быть охарактеризован и который дает высокий выход стабильных кеталей и не приводит к образованию дикеталей в случае 3,17-дикетостероидных производных.
Способ по настоящему
изобретению получения кеталя стероидного производного, соответствующего общей формуле I:

где R1 является CH3 или C2H5;
R2 является ОН;
R3 является H, CH3 или CH2CN; или как
R2 и R3 вместе являются О;
R4 является (2-5C) алкиленом;
заключающийся в том, что соединение формулы II:

где R1, R2 и R3 имеют ранее приведенные значения, обрабатывают в присутствии ортоэфира формулы III:

где R4 является (2-5C) алкиленом, или ортоэфира формулы IV:

где R4 имеет ранее указанное значение,
или их смеси
спиртом, соответствующим общей формуле HOR4OH, где R4 имеет ранее приведенное значение, этот способ отвечает вышеуказанным требованиям.
Предпочтительно R4 является 1.2-этандиилом, 1,3-пропандиилом или 2,2-диметил-1,3-пропандиилом.
Спирт, соответствующий общей формуле HOR4OH, также может быть получен in situ, исходя из начального вещества, которое дает свободный спирт в условиях реакции. Ацетализацию в общем случае проводят в обычных кислых условиях.
Способ может специфически использоваться для получения кеталя формулы I, где R1 является CH3, R2 и R3, оба являются O и R4 является -CH2 -CH2-.
Данный продукт чрезвычайно пригоден в качестве промежуточного продукта в получении прогестагенного диеногеста.
Термин (2-5C) алкилен означает алкиленовую группу, содержащую от 2 до 5 атомов углерода, как, например, этилен, пропилен, 2,2-диметилпропилен и тому подобное.
Термин Hal означает галоген, как, например, хлор, бром, или иод. Хлор является предпочтительным.
Ортоэфиры добавляют в качестве поглотителей воды. Подходящими ортоэфирами являются 2,21-[1,2-этандиил-бис(окси)] бис-1,3-диоксолан, 2,21-[1,3-пропандиил(окси)] бис-1,3-диоксан и 2,21-[2,2-диметил-1,3- пропандиил)бис(окси)] бис-5,5-диметил)-1,3-диоксан или их смесь. Данные ортоэфиры легко получить способами, известными в данной области, например, путем нагревания триалкилортоформиата, такого как триметил- или триэтилортоформиат, с двухатомным спиртом, таким как этиленгликоль. Использование вышеуказанных ортоэфиров ведет к тому, что реакция протекает с постоянной скоростью, приводя к меньшему количеству загрязняющих продуктов.
Далее, изобретение относится к способу получения
соединения формулы I, где R1, R2,
R3 и R4 имеют ранее приведенные значения, отличающиеся тем, что:
а) соединение общей формулы V:

где R1, R2 и R3 имеют ранее приведенные значения, конденсируют с соединением формулы CH-C(OR4O)-(CH2)3-XHal, где R4 и Hal имеют ранее приведенные значения, и X является атомом металла, в частности, магния;
б) гидроксигруппу полученного продукта окисляют обычным способом;
в) циклизуют в щелочных условиях;
г) кеталь отщепляют в кислых условиях;
д) после чего в щелочных условиях циклизуют с получением соединения формулы II, где R1, R2 и R3 имеют ранее приведенные значения,
е) после чего полученный продукт обрабатывают в соответствии с вышеописанным способом ацетапизации.
Преимуществом данного способа является то, что используются недорогие исходные сырьевые продукты и что степень окисления образовавшихся A- и B-колец стероида равняется точно одному. Данный процесс особенно предпочтителен в случае получения подходящих промежуточных продуктов для получения диеногеста. В данном случае исходят из соединений общей формулы IV, где R1 является CH3 , а как R2, так и R3 является O.
Обычными способами окисления гидроксигруппы являются способы, описанные в справочниках, и которые ясны специалисту. Примерами подходящих способов окисления является обработка оксидом хрома/пиридином, хлором/пиридином, дихроматом кальция, пиридинхроматами и N-бромсукцинимидом и окисление по Оппенауэру.
Замыкание цикла из стадии д) реакции протекает в щелочных условиях, причем условия могут быть достигнуты с помощью любого реактива. В частности, подходящей является обработка трет-бутилатом калия.
Далее, изобретение относится к способу получения соединения формулы II, где R1 является CH3, R2 является OH и R3 является CH2CN, заключающемуся в том, что 17-кетогруппа кеталевых стероидных производных формулы I превращается в 17- спирооксирановую группу, после чего оксирановая группа раскрывается путем обработки цианидом, после чего кеталевая группа полученного продукта реакции отщепляется в кислых условиях.
Превращение в 17-спирооксиран может быть осуществлено обычным способом с получением 17-спирооксирановых стероидных производных, например, по методу Ponsold et al., Pharmazie 33 (1978), 792 с иодидом триметилсульфония и трет-бутилатом калия. В качестве основания могут быть также использованы гидрид натрия, амид лития или метоксид натрия в таких растворителях, как диметилформамид, тетрагидрофуран и диметилсульфоксид.
Раскрытие оксиранового кольца осуществляют с помощью цианида. Предпочтительно в качестве цианида используют цианид калия или натрия.
Отщепление кеталя может быть осуществлено обычным способом с помощью кислот в подходящих растворителях. Примерами являются соляная кислота, серная кислота и тому подобное в спиртах, кетонах (например, в ацетоне), этилацетате и тому подобном, возможно, смешанным с водой.
В заключение, изобретение относится к синтезу соединений формулы II, где R1 является CH3, R2 является OH и R3 является CH2CN, характеризующемуся тем, что, исходя из соединения формулы V, путем использования вышеописанного способа, через ацетализацию соединения формулы II в соединении формулы I, которое превращается в соответствии с вышеописанным методом в соединение формулы II, где R1 является CH3, R2 является OH и R3 является CH2CN.
Изобретение проиллюстрировано далее следующими примерами.
Пример 1
(+)-5 α -Гидрокси-7а β -метил-4
α -[7,7- (диметилпропилендиокси)-3-оксооктил]-2,3, 3а α 4,5,
6,7,7а-октагидро-1Н-инден-1-он
1,2-Дибромметан (3,2 г) добавляют к смеси 19,6 г магниевых стружек и 105 мл сухого
этилового эфира при 22oC. После начала реакции температура
поднимается приблизительно до 32oC и происходит выделение газа. Смесь перемешивают в течение еще 30 мин. Смесь 17,5 г
5-хлор-2-пентанонеопентилацеталя и 3,2 г 1,2- дибромметана добавляют в
реакционную смесь в течение приблизительно 30 мин при медленном перемешивании. Температуру доводят до кипения (приблизительно
36oC). Смесь перемешивают в течение еще 15 мин. Смесь 132,7 г
5-хлор-2-пентаноне- опентилацеталя и 105 мл тетрагидрофурана добавляют в реакционную смесь в течение приблизительно 2 ч, так
чтобы реакционная смесь продолжает кипеть. Реакционную смесь перемешивают
без нагревания до тех пор, пока температура не понижается вновь. 400 мл тетрагидрофурана добавляют в реакционную смесь в
течение приблизительно 1 ч. Смесь Гриньяра нагревают в течение еще 3 ч до
кипения и охлаждают до 20oC. Избыток магния удаляют и определяют молярность раствора Гриньяра.
750 мл 0,8 М раствора хлорида 2-пентаноннеопентилацеталь-5-магния в тетрагидрофуране добавляют к суспензии 126,7 г лактона (+)-5 α -гидрокси-7a β -метил-2,3,3а α ,4,5,6,7, 7а-октагидро-1Н-инден- 1-он-4 α -(3-пропионовой кислоты) (USP 4784953, включен в качестве ссылки) при -30oC в течение приблизительно 2 ч. Перемешивают в течение еще 90 мин при -30oC. Реакционную смесь добавляют к раствору 525 г хлорида аммония в 525 мл воды при 0oC в течение 1 ч. К данной смеси добавляют 550 мл воды. Тетрагидрофуран отгоняют под вакуумом при добавлении воды, посредством чего pH возрастает до 7,7. При 50o C добавляют 840 мл толуола и после 30 мин перемешивания слои разделяют. Слой толуола промывают при 50o C водой и 0,1% пиридина и в слой толуола, перемешиваемый в течение 30 мин при 20oC, добавляют 20 г сульфата натрия. Суспензию отфильтровывают и к фильтрату добавляют 0,1% (по объему) пиридина. После высушивания остатка определяют массу нетто раствора в толуоле.
Пример 2
(+)-3,3-(Диметилпропилендиокси)-4,5-секоэстр-9-ен-5.17-дион
72 г газообразного
хлора вводят в раствор 236 г (+)-5 α -гидрокси-7a β -метил-4 α
-[7,7-(диметилпропилендиокси)-3- оксо-октил]-2,3,3a α 4,5,6,7,7а-октагидро-1Н-инден-1-она в 1500 мл толуола
и 285 мл пиридина при 0oC в течение от 7 до 8 ч. Реакционную смесь
перемешивают в течение еще одного часа при 0oC. Реакционную смесь вливают в раствор 274 г сульфита натрия и
228 г карбоната натрия в 2500 мл воды. Слои разделяют и слой толуола промывают
водой. Раствор 246 г гидроксида калия в 345 мл воды и 810 мл метанола добавляют к раствору в толуоле. Реакционную смесь
перемешивают в течение еще 2 ч при 65oC. После охлаждения до 50oC слои разделяют, и слой толуола промывают при 50oC, используя 50%-ный раствор метанола, а после этого
- воду. К раствору в толуоле добавляют 375 мл пиридина и раствор выпаривают
досуха. К высушиваемому остатку добавляют 1100 мл этанола и 4 мл пиридина и данную смесь кипятят в течение 50 мин. После
охлаждения до 40oC раствор обрабатывают активированным углем
(Norit). После фильтрации раствор в этаноле используют как таковой.
Пример 3
Эстра-4,9-диен-3,
17-диен-дион
Раствор 100 г (+)-3,3-диметилпропилендиокси-4,
5-секоэстр-9-ен-5,17-дион и 18,7 мл 2H соляной кислоты в 500 мл ацетона перемешивают в атмосфере азота в течение 2,5 ч при 23oC. Раствор 4,5 г ацетата натрия в 1120 мл воды добавляют к
реакционной смеси. Ацетон отгоняют, посредством чего объем поддерживают тем же при добавлении воды. 5%-ный хлорид натрия (по объему)
и 200 мл толуола добавляют при 50oC. Слои разделяют и
водный слой экстрагируют добавлением толуола. Отобранные экстракты толуола промывают 5%-ным раствором хлорида натрия и выпаривают до
объема 500 мл. Данный раствор используют в следующей стадии.
Раствор (+)-4,5-секоэстр-9-ен-3,5,17-триона в толуоле добавляют к суспензии 8 г трет-бутилата калия в 240 мл толуола и 77 мл трет-бутанола в атмосфере азота при 18oC. К реакционной смеси добавляют 8 мл уксусной кислоты с последующим добавлением 768 мл воды. Слои разделяют, и слой толуола промывают 5%-ным раствором хлорида натрия. Раствор в толуоле выпаривают до объема 175 мл и добавляют 440 мл гексана. Суспензию кипятят в течение 30 мин. После охлаждения ее перемешивают в течение 2 ч при 0o C. После фильтрования и высушивания получают 66 г неочищенного эстра-4,9-диен-3,17-диона, после очистки посредством колонки с силикагелем и кристаллизации из смеси этилацетата и гексана получают 40 г чистого эстра-4,9-диен-3,17-диона.
Пример 4
3,3-Этиленкеталь эстра-5(10), 9(11)-диен-3,17- диона
Смесь 500 мл циклогексана,183 мл триэтилорформиата, 92 мл
этиленгликоля и 0,9 г п-толуолсульфокислоты перемешивают в
течение 30 мин при комнатной температуре и после этого нагревают до кипения. Образовавшийся этанол отгоняют совместно с циклогексаном, тогда
как объем поддерживают путем постоянного добавления
циклогексана. После 4,5 ч остаток циклогексана отгоняют и 1 экв. остатка добавляют как таковой в качестве поглотителя воды в атмосфере азота к 1 г
эстра-4,9-диен-3,17-диона, 0,1 экв. хлористого
водорода в диоксане и 1,5 экв. этиленгликоля в 15 мл диметоксиэтана при -10oC. Через 75 мин реакционную смесь вливают в насыщенный водный
раствор гидрокарбоната натрия. Кристаллическую
массу отфильтровывают после 15 мин высушивания, промывают водой и высушивают под вакуумом, после чего получают 1,1 г 3,3-этиленкеталя эстра-5 (10), 9
(II)-диен-3,17-диона. После кристаллизации из
этанола получают 1 г продукта, обладающего чистотой выше, чем 97%.
Пример 5
3-Этиленкеталь 17 β-спиро-1',
2'-оксиранэстра-5 (10), 9(11) - диен-3-она
т-Бутилат
(32,7 г) добавляют к раствору 30,0 г 3-этиленкеталя эстра-5(10), 9(11)-диен-3,17-диона и 42,2 г иодида триметилсульфония в 300 мл
диметилформамида при температуре ≤ 35oС. Смесь
перемешивают при приблизительно 30oC в течение 75 мин, после чего реакционную смесь медленно вливают в 2,7 л воды. Водный
слой трижды экстрагируют добавлением 300 мл этилацетата.
Органический слой промывают водой, выпаривают досуха и высушивают под вакуумом при 50oC, что дает 29,8 г 3-этиленкеталя 17 β
спиро-1',2'-оксиранэстра-5(10),9(11)-диен-3-она.
Пример 6
3-Этиленкеталь 17 α -циaнoмeтил-17 β гидpoкcиэcтpa-5(10), 9(11)-диен-3-она
Раствор 64,5 г
цианида калия в 120 мл воды добавляют к раствору 25,8 г
3-этиленкеталя 17 β -спиро-1,2 оксиранэстра-5(10), 9(11)-диен-3-она в 645 мл этанола. Смесь перемешивают в течение 5 ч при 25o
C, после чего медленно добавляют 650 мл воды. Смесь
оставляют стоять в течение 15 ч, после чего прозрачный раствор декантируют от маслянистого остатка. Маслянистый остаток растворяют в 150 мл
этилацетата, после чего органический раствор промывают водой
и выпаривают досуха, что дает 20,2 г 3-этиленкеталя 17 α цианометил-17 β -гидроксиэстра-5(10),9(11)-диен-3-она.
Пример 7
17 α -Цианометил-17 β
-гидроксиэстра-4,9-диен-3-он (диеногест)
Соляную кислоту (11,0 мл) добавляют к раствору 17,0 г 3-этиленкеталя 17 α
цианометил-17 β -гидроксиэстра-5 (10),9(11)-диен-3-она в 362
мл ацетона. Смесь перемешивают в течение 2 ч при 25oC, после чего смесь нейтрализуют с помощью 20,8 мл триэтиламина и
добавляют 110 мл воды. Ацетон (320 мл) отгоняют и после охлаждения до
20oC кристаллы отфильтровывают и высушивают под вакуумом при 50oC, что дает 13,0 г неочищенного l7 α
-цианометил-17 β -гидроксиэстра-4,9-диен-3-она. Неочищенный
продукт выкристаллизовывают дважды из ацетона, что дает 7,4 г 17 α -цианометил- анометил-17 β гидроксиэстра-4,
9-диен-3-она, обладающего чистотой ≥ 98%.
Реферат
Изобретение относится
к способу получения промежуточных продуктов в синтезе стероидов с прогестагенной активностью, а именно: кеталя стероидного
производного общей формулы I
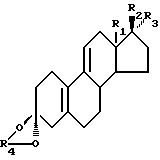
где R1 является СН3 или C2C5; R2 является ОН; R3 является Н, CH3 или CH2CN, или R2 и R3 вместе являются O; R4 является (2-5С) алкиленом, заключающийся в том, что соединение формулы II
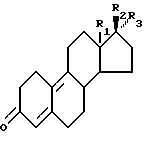
где R1, и R2, и R3 имеют ранее приведенные значения, обрабатывают в присутствии ортоэфира формулы III
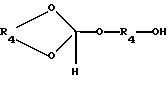
где R4 является (2-5С) алкиленом, или ортоэфира формулы IV

где R4 имеет ранее указанное значение, или их смеси спиртом, соответствующим общей формуле HOR4OH, где R4 имеет ранее приведенное значение. Способ позволяет получать продукты с минимальным количеством примесей. 3 с. и 3 з.п. ф-лы.
Формула
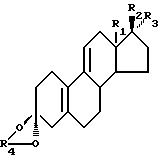
где R1 является CH3 или C2H5;
R2 является OH;
R3 является H, CH3 или CH2CN или R2 и R3 вместе являются O;
R4 является (2 - 5 C) алкиленом,
отличающийся тем, что соединение формулы II

где R1, R2 и R3 имеют ранее приведенные значения,
обрабатывают в присутствии ортоэфира формулы III

где R4 является (2 - 5 C) алкиленом,
или ортоэфира формулы IV

где R4 имеет ранее указанное значение,
или их смеси спиртом, соответствующим общей формуле
HOR4OH,
где R4 имеет ранее приведенное значение.

где R1, R2 и R3 имеют ранее приведенные значения,
конденсируют с соединением формулы
CH3-C(OR4O)-(CH2)3-XHal,
где R4 имеет ранее приведенные значения;
Hal - атом хлора, брома или йода;
X является атомом металла, в частности магния;
б) гидроксигруппу полученного продукта окисляют обычным способом; в) циклизуют в щелочных условиях; г) кеталь отщепляют в кислых условиях; д) после чего в щелочных условиях циклизуют с получением соединения формулы II, где R1, R2 и R3 имеют ранее приведенные значения; е) после чего полученный продукт обрабатывают в соответствии со способом, описанным в пп.1 - 3.

Комментарии