Способ получения 16β-метильного стероида, промежуточные продукты. - RU2151774C1
Код документа: RU2151774C1
Описание
Настоящее изобретение относится к методу получения 16β- метиловых стероидов и промежуточным продуктам.
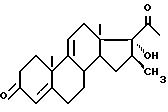
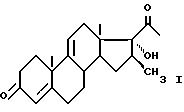
Таким образом, предметом настоящего изобретения является метод получения соединения
формулы (I):
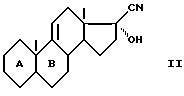
отличающейся тем, что осуществляется обработка соединения формулы (II):
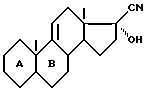
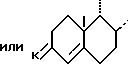
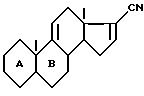
(II) в которой циклы A и B представляют собой остаток:
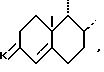
или
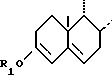
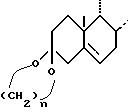
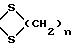
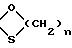
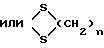
в котором K представляет собой оксо-радикал или защитную группу оксо-радикала формулы:
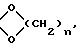
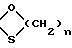
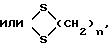
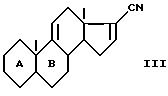
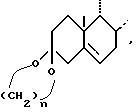
n имеет значение 2 или 3, a R1 представляет собой эфирный или сложно-эфирный остаток, обезвоживающим веществом, для получения соединения формулы (III):
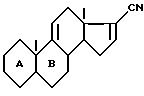
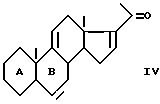
в которой A и B имеют вышеуказанное значение, которое, когда К представляет собой оксо-радикал, подвергают воздействию соответствующего блокирующего реактива указанного оксо-радикала, для получения соответствующего соединения формулы (III), в которой К имеет значения, отличные от значений оксо-радикала и определенные выше, соединение формулы (III) подвергают воздействию органометаллического метилирующего реактива для получения, после гидролиза промежуточного имина, метилкетона формулы (IV):
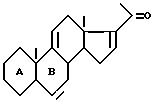
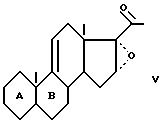
который подвергают обработке в щелочной среде с помощью эпоксидирующего вещества для получения соединения формулы (V):
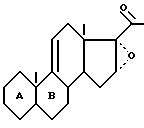
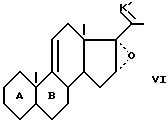
в которой защищают 20-кето-функциональную группу для получения соединения формулы (VI):
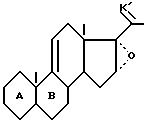
в которой К' представляет собой защитную группу кетоновой функциональной группы, идентичной или отличающейся от К, формулы:
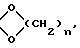
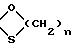
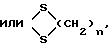
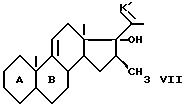
при этом n имеет вышеуказанное значение, которое подвергают обработке органометаллическим метилирующим реактивом, для получения 16β- метилового производного формулы (VII):
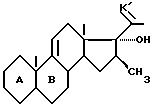
в которой производят разблокировку кетоновой функциональной группы в положении 3 и 20 для получения целевого продукта формулы (I).
Когда R1 представляет собой эфирный остаток, речь может идти об остатке, известном специалистам, для блокировки положения 3 в этой форме, и, в частности, речь может идти об алкильном радикале, включающем от 1 до 6 атомов углерода, об алкоксиалкоксиалкильном радикале, включающем от 3 до 8 атомов углерода, об арильном радикале, включающем от 6 до 10 атомов углерода, или об аралкильном радикале, включающем от 7 до 12 атомов углерода.
Когда R1 представляет собой алкильный радикал, речь идет, например, о таком радикале, как метильный, этильный, пропильный, изопропильный, n-бутильный, втор-бутильный, трет-бутильный, пентильный или гексильный.
Когда R1 представляет собой алкоксиалкоксиалкильный радикал, речь идет, например, о метоксиэтоксиметильном радикале.
Когда R1 представляет собой аралкильный радикал, речь идет, например, о бензильном или фенетильном радикале.
Когда R1 представляет собой арильный радикал, речь идет, например, о фенильном радикале или о фенильном радикале, замещенном, в частности, одним или несколькими алкильными радикалами.
Когда R1 представляет собой эфирный остаток, речь может также идти о силилированной группе, например, о триалкилсилильной группе, такой как триметилсилильная, трет-бутилдиметилсилильная или же, например, о три-арилсилильной группе, такой как трифенилсилильная, или о диарилалкил-силильной группе, такой как дифенил трет-бутилсилильная.
Когда R1 представляет собой сложноэфирный остаток, речь может идти о любом остатке, известном специалистам, для блокировки положения 3 в этой форме, и, в частности, речь может идти об остатке -COR1, в котором R1 является алкильным, арильным или аралкильным радикалом, как определено выше.
Защита кетоновой функциональной группы в 3 производится методами, хорошо известными специалистам. Так можно использовать, в частности, диол, дитиол или смешанный тиол формулы HO-(CH2)n-OH, HS-(CH2)n -SH или HO-(CH2)n-SH, в кислой среде, например, в присутствии концентрированной хлористоводородной кислоты или концентрированного бромистого водорода, в каталитическом количестве, P-толуолсульфокислоты, или же в присутствии кислоты Левиса, такой как хлористый цинк, тетрахлорид титана или трифторид бора, предпочтительно в форме эфирной вытяжки.
Можно также использовать метилэтилдиоксолан в присутствии кислоты, например, одной из перечисленных выше кислот. Можно также использовать галогенид алкила, алкоксиалкоксиалкила, аралкила или арила в присутствии основания, образующего на промежуточном этапе енолат, например, щелочной гидрид, алкоголят или гидроокисел.
Использовать можно также и галогенид триалкила, триарила или диарилалкилсилила в щелочной среде, как указано выше.
Можно также использовать хлорид соответствующей кислоты, действуя в присутствии основания, которым может быть азотосодержащее основание, такое как, например, триэтиламин, пиридин, диметиламинопиридин, или минеральное основание, в частности, щелочной гидрид, алкоголят или гидроокисел.
В качестве обезвоживающего вещества применяется, в частности, оксихлорид фосфора, который предпочтительно используют в присутствии третичного амина, такого как пиридин. Использовать можно также и кислоту Левиса, такую как хлористое железо, трифторид бора и его комплексные соединения, например, эфирную вытяжку, тетрахлорид титана, хлористый алюминий или же хлорид олова, неорганическую кислоту, такую как серная кислота, сульфокислоту, такую как паратолуолсульфокислота или хлор-сульфокислота, или же производное, такое как хлорид метансульфонила.
Органометаллическим метилирующим реактивом, ведущим к получению метилкетона, является, например, магнийорганическое, литийорганическое, кадмийорганическое соединение, или же производное меди, такое как CH3Cu, (CH3)2CuMg, (CH3)2CuLi. Предпочтение в этом случае отдается магнийорганическим соединениям, таким как метилмагнийгалогенид или метиллитийгалогенид.
Действовать следует в среде растворителя, в первую очередь - эфира, такого как простой этиловый эфир, тетрагидрофуран или диоксан, однако использовать можно и ароматический растворитель, такой как толуол или ксилол. Действовать можно и в среде смеси эфира и ароматического растворителя.
Гидролиз имина, полученного на промежуточном этапе, выполняется с помощью водной кислоты, например, уксусной или муравьиной, или неорганической кислоты, такой как хлористоводородная кислота.
В качестве эпоксидирующего вещества может использоваться надкислота, такая как метахлорнадбензойная, надбензолдикарбоновая, надвольфрамовая, или же перекись водорода, используемая самостоятельно или в присутствии гексахлорацетона или гексафторацетона.
В качестве эпоксидирующего вещества может также использоваться гидроперекись, такая как гидроперекись трет- бутила, которая применяется в присутствии ацетилацетоната ванадия или других металлов, таких как молибден, в каталитическом количестве. Предпочтение в этом случае отдается перекиси водорода.
Операция производится в слабощелочной среде, либо в присутствии основания, например, едкого натра, либо в забуференной среде, например, с помощью ацетата натрия, вторичного фосфата натрия или бикарбоната натрия, или же с помощью смеси третичного фосфата натрия и фосфорной кислоты.
Операция выполняется в среде органического растворителя, такого как метиленхлорид, тетрахлорметана, трихлорметана, метанола, тетрагидрофурана, диоксана, толуола, этилацетата или смеси перечисленных растворителей, возможно, в присутствии воды.
Защита 20-кетоновой функциональной группы производится в форме кеталя, смешанного кеталя или дитиокеталя, обычными методами, хорошо известными специалистам. Таким образом используются диол, дитиол или смешанный тиол формулы HO-(CH2)n-OH, HS-(CH2)n-SH или HO-(CH2)n- SH в кислой среде, например, в присутствии концентрированной хлористоводородной или бромистоводородной кислоты, в каталитическом количестве, пара-толуолсульфокислоты, или же в присутствии кислоты Левиса, такой как хлористый цинк, тетрахлорид титана или трифторид бора, предпочтительно в форме эфирной вытяжки.
В качестве органометаллического метилирующего реактива, который вводят в реакцию с эпоксидом формулы (VI), используется один из вышеупомянутых реактивов, причем предпочтение отдается тем из них, которые указаны выше в качестве таковых.
Освобождение кетоновой функциональной группы в положении 3 и 20 производится методами, соответствующими типу защитной группы. Используется кислый агент в присутствии воды или, в случае кеталя, смеси воды и предельного спирта жирного ряда. Речь идет, например, о неорганической или органической кислоте, такой как хлористоводородная, бромистоводородная, серная, хлорная, азотная, уксусная, муравьиная, щавелевая кислота, паратолуолсульфокислота, или смесь кислот, или же о кислой смоле, например, о сульфоновой смоле. В случае тиокеталя или смешанного кеталя, снятие защиты осуществляется путем воздействия йодом в присутствии основания, например, бикарбоната щелочи, или путем воздействия йодом в каталитическом количестве, в присутствии окислителя, в частности, перекиси водорода, путем воздействия йодистым метилом, глиоксиловой кислотой или же солями металлов, таких как ртуть, кадмий, медь или серебро. Вообще операция может выполняться в растворителе, таком как низший предельный спирт жирного ряда, например, метанол или этанол, в смеси с галогенсодержащим растворителем, например, метиленхлоридом, в присутствии воды. В случае смешанного кеталя, снятие защиты может также осуществляться, например, с помощью соли, содержащей двухвалентную ртуть, такой как хлористая ртуть, в присутствии буферной смеси уксусной кислоты и ацетата калия при температуре около +100o C, с помощью никеля Ренея, в тех же условиях, что и описанные выше, или же с помощью смеси хлористоводородной и уксусной кислот - при повышенной температуре.
В случае, когда R1 представляет собой эфирный или сложноэфирный остаток, применяется также кислотная обработка, в частности, в тех же условиях, что и описанные выше для кеталя.
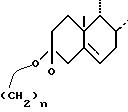
Предметом
настоящего изобретения является, в частности, вышеописанный метод, отличающийся тем, что на
начальном этапе используется соединение формулы (II), в которой циклы A и B представляют собой остаток:
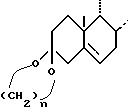
причем n имеет то же значение, что и указанное выше, в частности он равняется 2.
Предметом настоящего изобретения также, в частности, является вышеописанный метод, отличающийся тем, что 20-кето- функциональную группу защищают тем же кеталем, что и в положении 3, в частности, этилендиоксильной группой.
Кроме того, предметом настоящего изобретения в качестве новых промышленных продуктов и, в частности, в качестве промежуточных продуктов, которые могут быть полезными при внедрении метода данного изобретения, является продукт формулы (III), в которой К имеет вышеуказанные значения, за исключением одного оксо-радикала, а также продукты формул (IV), (V), (VI) и (VII), как указано выше.
Продукты формулы (II), используемые на начальном этапе способа, общеизвестны или могут быть приготовлены из продукта 3-кето, описание которого приводится в патенте ЕЭС N 263569, с использованием обычных методов, хорошо известных специалистам. Среди разработок, которые можно использовать, назовем французский патент 1079781, патент ГДР 281394 или патентную заявку WO 88/03534.
Продукт формулы (I) представляет собой важный промежуточный продукт для синтеза бетаметазона, как это описано, например, в патенте ЕЭС 54810.
Приводимые далее примеры иллюстрируют применение изобретения, вместе с тем не ограничивая его.
Пример 1: 16β-метил-17α- гидрокси-прегна 4,9 (11)-диен 3,
20-дион
Этап А: циклический 3-(1,2-этандиил)-ацеталь 17-циано-андрост-5,9 (11), 16
(17)-триен-3-она
В среде инертного газа смешивают 30 г циклического 3-(1,2-этандиил)-ацеталя
17α-гидрокси-17β- цианоандрост-5,9 (11) диен-3-она и 240 см3 безводного
пиридина, после чего добавляют 30 см3 оксихлорида фосфора. Затем выдерживают в течение 2 ч
при взбалтывании в масляной ванне при температуре +40oC, а затем в течение 18 ч при
температуре +45oC. После этого смесь вливают в смесь 450 г льда, 240 см3
хлористо-водородной кислоты при 22oБ и 100 см3 воды. После этого производят
взбалтывание при комнатной температуре, центрифугируют, промывают полученные кристаллы водой и
высушивают их. Сырой продукт суспензируют в смеси простого изопропилового эфира и изопропанола (2: 1), а
затем центрифугируют и высушивают кристаллы. В результате получают 24,27 г искомого продукта
(tпл 205-208oC).
Инфракрасный спектр: (CHCl3)
Поглощение при 2217 см-1 (CN), 1660, 1630 и 1593 см-1 (C = C).
Спектр ЯРМ: (CDCl3 + C5D5N - 300 МГц - млн-1)
0,91 (s): 18-CH3; 1,23 (s): 19-CH3; 3, 96: кеталь; 5,44 (m) - 5,45
(m): H6 и H11; 6,65: H16.
Этап Б: циклический 3-(1,
2-этандиил) ацеталь прегна-5,9 (11), 16 (17)-триен-3,20-диона
В среде инертного газа
смешивают 9 г продукта, полученного на Этапе A, и 27 см3 толуола, после чего вводят 27 см3 3 М раствора метилмагнийхлорида в тетрагидрофуране. Затем за 3 ч 30 мин нагревают до
температуры +60/65oC, охлаждают в ванне лед - метанол и добавляют 36 см3
тетрагидрофурана, после чего вливают под азотным давлением, при температуре не выше +10oC, в
смесь 81 см3 льда, 27 см3 воды и 135 см3 уксусной кислоты,
охлажденной с помощью ванны лед - метанол. Температуре дают подняться примерно до +20oC, смесь
концентрируют при пониженном давлении, слегка нагревая в водяной бане при температуре +45oC, а затем вливают в 20 объемов смеси воды и льда. Температуре дают вновь подняться при
взбалтывании, а затем центрифугируют кристаллы, промывают их водой и высушивают. Таким образом получают
9,03 г сырого продукта, который сгущают в смеси 45 см3 метанола, 5 см3
воды и 0,5 см3 триэтиламина. Затем нагревают при температуре кипения в течение 1 ч 30 мин и
охлаждают при комнатной температуре, центрифугируют кристаллы, промывают их раствором метанола,
содержащим 10% воды и высушивают. В результате получают 7,12 г искомого продукта (tпл
217-219oC).
Инфракрасный спектр: (CHCl3)
Поглощение при
1664, 1590, 1361 см-1: ненасыщенный метилкетон α,β.
Спектр
ЯРМ: (CDCl3 + C5D5N - 300 МГц - млн-1)
0,87 (s):
18-CH3; 1,22 (s): 19-CH3; 2,26 (s): метилкетон; 3,94 (m): кеталь; 5,44 - 5,
45 (m): -CH= в положении 11 и 5; 6,71 (t): -CH= в положении 16.
Этап В: циклический
3-(1,2-этандиил)-ацеталь 16α,17α- эпокси-прегна-5,9 (11)-диен- 3,20-диона
В
среде инертного газа смешивают 7 г продукта, полученного на Этапе Б, 70 см3
тетрагидрофурана и 35 см3 метанола. Затем вводят 7 см3 концентрированного едкого натра и 7
см3 перекиси водорода при 200 объемах. После этого нагревают в течение 17 ч
при температуре +40/45oC, охлаждают при комнатной температуре и вливают в смесь 70 см3
воды и 70 г льда. Затем выдерживают при взбалтывании, давая температуре подняться, после
чего центрифугируют, промывают водой до исчезновения окисляющей способности и высушивают. Таким образом
получают 7,08 г искомого продукта, который используется без дополнительной обработки на
следующем этапе.
Инфракрасный спектр: (CHCl3)
Поглощение при 1704 (C = O),
901-855 см-1 (эпоксид).
Спектр ЯРМ: (CDCl3 + C5D5N - 300 МГц - млн-1)
1,00 (s): 18-CH3; 1,20 (s): 19-CH3; 2,04 (s): метилкетон; 3,74 (s): -CH= в положении 16; 3,94 (m): кеталь; 5,40 (m) 5,
51 (t): -CH= в положении 11 и 5.
Этап Г: циклический 3,20 бис-(1,2-этандиил)-ацеталь
16α,17α - эпокси-прегна-5,9 (11)-диен-3,20-диона
В среде инертного газа
смешивают 4 г продукта, полученного на Этапе В, 40 см3 метиленхлорида, 40 см3
этиленгликоля, 20 см3 этилортоформиата и 0,3 г обезвоженной паратолуолсульфокислоты. По
истечении 7 ч концентрируют при пониженном давлении в 1 мбар при комнатной температуре, а затем
выдерживают при взбалтывании в течение 30 мин. После этого вливают под 300 см3 10-процентного
водного раствора бикарбоната натрия и дегазируют в течение 30 мин. Затем центрифугируют,
промывают водой и высушивают образовавшиеся кристаллы. Продукт очищают методом хроматографии на двуокиси
кремния (элюант : толуол - этилацетат (8: 2)) с 0,05% триэтиламина. Затем полученный продукт
поглощают циклогексаном, центрифугируют и высушивают при пониженном давлении. Таким образом получают 3,28 г
искомого продукта (tпл 176-177oC).
Инфракрасный спектр: (CHCl3). Отсутствие C = O. Наличие кеталя.
Спектр ЯРМ: (CDCl3 +
C5D5N - 300 МГц - млн-1)
0,94 (s): 18-CH3; 1,20 (s): 19-CH3; 1,42 (s): CH3-; 3,41 (s): H в положении 16; 3,85 по 4,05: кеталь;
5,41 и 5,48: Н в положении 6 и H в положении 11.
Этап Д: циклический
3,20 бис-(1,2-этандиил)-ацеталь 16β-метил,17α- гидрокси-прегна-5,9 (11)-диен-3,20-диона
В
среде инертного газа замораживают 24 см3 3 М раствора метилмагнийбромида в
эфире. Растворитель выпаривают при пониженном давлении, одновременно подогревая в ванне при температуре +60/65oC. Затем вводят 21 см3 тетрагидрофурана и 3 г продукта,
полученного на Этапе Г, после чего взбалтывают в течение 16 ч, доводя температуру ванны до +70oC. Затем добавляют 4
см3 эфирного раствора вышеуказанного магнийорганического
соединения и 10 см3 тетрагидрофурана и взбалтывают в течение 7 ч. После этого вновь добавляют 10 см3
тетрагидрофурана, выдерживают при температуре кипения в течение 16 ч,
охлаждают примерно до +40oC и вливают в смесь 16 г обезвоженного вторичного фосфата натрия и 900 см3 воды,
выдерживаемую при температуре 0oC. Температуре дают
подняться, после чего продукт центрифугируют, промывают водой и высушивают. Затем продукт очищают сгущением в 15 объемах смеси
метиленхлорида и этилацетата (9:1) с 0,05% триэтиламина, а затем
- хроматографией на двуокиси кремния, элюируя той же смесью. В результате получают 2,42 г искомого продукта (tпл 180-181oC).
Инфракрасный спектр: (CHCl3)
Поглощение при 3580 см-1: OH; 1670-1644 см-1: C = C.
Спектр ЯРМ: (CDCl3 +
C5D5N - 300 МГц - млн-1
)
0,87 (s): 18-CH3; 1,19 (d): CH3-CH-; 1,20 (s): 19-CH3; 1,39 (s): CH3-C-; 3,85 по 4,05:
кетали; 5,45 и 5,48: H в положении 6 и H в положении
11.
Этап Е: 16β-метил,17α- гидрокси-прегна 4,9 (11)-диен-3,20-дион
В среде инертного газа смешивают 2 г
продукта, полученного на Этапе Д, 15 см3
ацетона и 5 см3 воды. Затем вводят 4 капли концентрированной серной кислоты, нагревают в течение 4 ч 30 мин в ванне при температуре
+60oC. Затем добавляют 20 см3 воды,
дают остыть, центрифугируют кристаллы, промывают их водой и высушивают. Таким образом получают 1,55 г целевого продукта (tпл
173oC).
Инфракрасный спектр:
(CHCl3)
Поглощение при 3610 см-1: -OH; 1709-1353 см-1: CO = CH3; 1663-1616 см-1:
кето3Δ4.
Спектр ЯРМ: (CDCl3
- 300 МГц - млн-1)
0,87 (s): 18-CH3; 1,19 (d,J = 7): CH3-CH-; 1,34 (s): 19-CH3; 2,27 (s):
CO-CH3; 3,01 (s): 1H мобильн.; 5,52 (m): H в
положении 11; 5,75 (m): H в положении 4.
Реферат
Описывается способ получения 16β-метильного стероида формулы I, отличающийся тем, что проводят обработку соединения общей формулы II, в которой циклы А и В представляют собой остаток, в котором К представляет собой оксо-радикал или защитную группу оксо-радикала формулы, n = 2 или 3, обезвоживающим веществом для получения соединения общей формулы III, в котором А и В имеют вышеуказанные значения, причем в случае, когда К представляет оксо-радикал подвергают воздействию соответствующего блокирующего реагента для оксо-радикала для получения соединения формулы III, где К имеет значения, отличные от оксо и определенные выше, соединение формулы III подвергают воздействию органометаллического метилирующего реагента для получения после гидролиза промежуточного имина метилкетона общей формулы (IV), где А и В имеют вышеуказанные значения, который подвергают обработке в щелочной среде эпоксидирующим веществом для получения соединения общей формулы V, где А и В имеют вышеуказанные значения, в которой защищают 20-кетогруппу для получения соединения общей формулы VI, в которой K' представляет защитную группу 20-кетогруппы формулы; А, В и n имеют вышеуказанные значения, которое подвергают обработке органометаллическим метилирующим реагентом для получения 16β-метильного производного общей формулы (VII), где K', А и В имеют вышеуказанные значения, после чего производят разблокировку кетогрупп в положениях 3 и 20 для получения целевого продукта формулы I. Описываются также новые промежуточные продукты. Технический результат - упрощение процесса. 2 с. и 6 з.п. ф-лы.
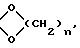
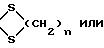
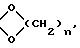
Формула
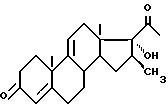
отличающийся тем, что проводят обработку соединения общей формулы II
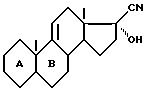
в которой циклы А и В представляют собой остаток
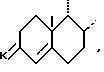
в котором К представляет собой оксо-радикал или защитную группу оксо-радикала формулы:
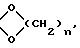
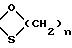
или
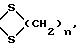
n = 2 или 3,
обезвоживающим веществом для получения соединения общей формулы III
в котором А и В имеет вышеуказанные значения, причем в случае, когда К представляет оксо-радикал, подвергают воздействию соответствующего блокирующего реагента для оксо-радикала для получения соединения формулы III, где К имеет значение, отличные от оксо и определенные выше, соединение формулы III подвергают воздействию органометаллического метилирующего реагента для получения после гидролиза промежуточного имина метилкетона общей формулы IV
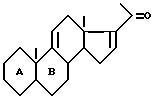
где А и В имеют вышеуказанные значения,
который подвергают обработке в щелочной среде эпоксидирующим веществом для получения соединения общей формулы V
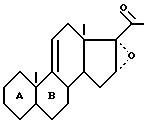
где А и В имеют вышеуказанные значения,
в которой защищают 20-кетогруппы для получения соединения общей формулы VI
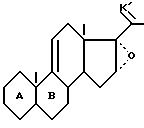
в которой K' представляет защитную группу 20-кетогруппы формулы
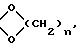
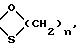
или
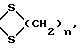
A, B и n имеют вышеуказанные значения,
которое подвергают обработке органометаллическим метилирующим реагентом для получения 16β- метильного производного общей формулы VII
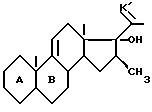
где K', A и B имеют вышеуказанные значения,
после чего производят разблокировку кетогрупп в положениях 3 и 20 для получения целевого продукта формулы I.
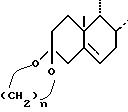
причем n имеет то же значение, что и указанное выше, в частности n = 2.

Комментарии