Стероиды, способ получения стероидов, способ получения 16-метиленстероидов, соединения - RU2099346C1
Код документа: RU2099346C1
Описание
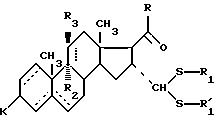
Изобретение относится к области синтеза стероидных соединений. Более конкретно, изобретение относится к новым стероидам общей формулы I:
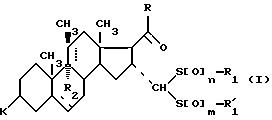
где
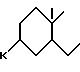
Среди соединений формулы (I) можно
назвать:
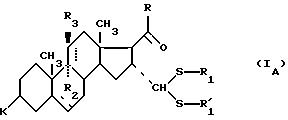
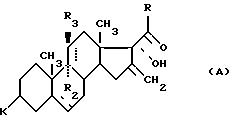
соединение формулы (I), отвечающее общей формуле (IА):
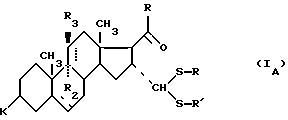
где K, R, R1, R3 и пунктирные линии имеют значение, определенное выше, и R1 и
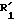
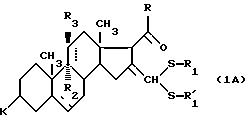
соединения формулы (I), отвечающие общей формуле (IВ):
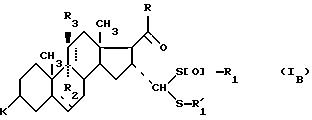
где K, R, R1,
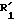
соединения формулы (I), отвечающие общей формуле (IC):
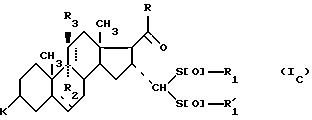
где K, R, R1,
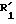
Среди соединений формулы (I), особенно можно назвать:
21-ацетокси-16альфа-[бис-(фенилтио)метил] прегна-1,4,
9/11/-триен-3,20-дион;
21-ацетокси-16альфа-[/фенилтио//фенилсульфенил/метил]прегна- 1,4,9/11/-триен-3,20-дион;
21-ацетокси-16альфа-[бис-(фенилсульфинил)метил] прегна- 1,4,
9/11/-триен-3,20-дион.
Изобретение относится также к способу получения соединений формулы (I), заключающемуся в том, что соединение формулы (II):
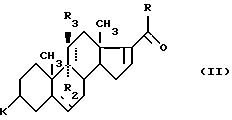
где K, R, R2, R3 и пунктирные линии имеют значения, указанные выше, подвергают в щелочной среде действию реактива формулы (Р):
R1S-CH2-NO2 (P)
где R1 имеет значение, указанное выше, для получения соединения формулы (III)
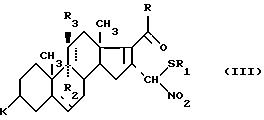
где K, R, R1, R2, R3 и пунктирные линии имеют значения, указанные выше, в присутствии карбоновой кислоты подвергают действию тиола или тиофенола формулы:
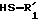
где
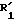
где K, R, R1,
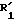
где K, R, R1,
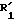
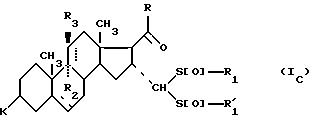
где K, R, R1,
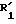
В частности,
способ согласно изобретению заключается в том, что соединение
формулы (II):
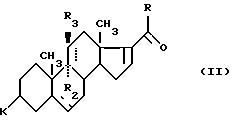
где K, R, R2, R3 и пунктирные линии имеют определенное выше значение, подвергают в щелочной среде действию реактива формулы (Р):
R1S-CH2-NO2 (P)
где R1 имеет определенное выше значение, для получения соединения формулы (III):
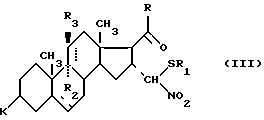
где K, R, R1, R2, R3 и пунктирные линии имеют определенное выше значение, которое в присутствии кислоты подвергают действию тиола или тиофенола формулы
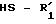
где
где K, R, R1,
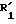
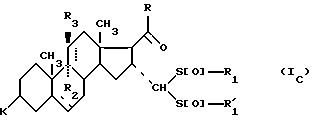
где K, R, R1,
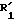
Действие реактива формулы P на соединение формулы (II) ведется в присутствии основания, которым может быть, в частности, аминированное основание, например, вторичный или третичный амин, такой как диэтиламин или триэтиламин, диазабициклоундецен (ДБУ), диазабициклононен (ДБН), ацетат, карбонат, гидрид, гидроокись или алкоксид щелочного металла, причем сильные основания предпочтительно употребляются в каталитических количествах.
Работают в среде органического растворителя, которым может быть, например, эфир, такой как тетрагидрофуран или диоксан, спирт, такой как метанол или этанол, растворитель ароматического ряда, такой как бензол или толуол, или диметилформамид, диметилсульфоксид или хлористый метилен.
Действие тиола или тиофенола катализируется кислотой, предпочтительно слабой, которой может быть, в частности, муравьиная, уксусная или пропионовая кислота, кислота Льюиса, такая как хлористый цинк или хлористый алюминий, или фосфорная кислота. Данная кислота, может также играть роль растворителя. Растворителем может быть также растворитель ароматического ряда, такой как бензол или толуол. Условия реакции выбираются таким образом, чтобы они были совместимы с защитной группой гидроксила, которая может находиться на соединении (II), и со структурой молекулы в целом, которую хотят сохранить.
Окислителем, используемым для превращения соединения формулы (IA) в моносульфоксид или дисульфоксид, может быть перкислота такая, как м-хлорнадбензойная кислота, надбензойная кислота, надфталевая кислота, соль магния мононадфталевой кислоты или перекись водорода в присутствии карбоновой кислоты, такой как уксусная кислота или периодат, перборат или персульфат, в частности, натрия или калия.
Соединения формулы (III), использующиеся для получения стероидов формулы (I), являются новыми соединениями.
Стероиды формулы (I) могут быть использованы в
синтезе 16-метилен-стероидов, общей формулы (А):
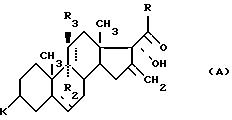
где K, R, R2, R3 и пунктирные линии имеют указанное выше значение.
Соединения формулы (А) употребляются в качестве промежуточных продуктов в синтезе терапевтически активных соединений.
Способ получения 16-метилен-стероидов общей формулы А:
где R алкил C1-C4 , CH2OR', где R'- H или защитная группа для гидроксигруппы,
- - - R2, R3 и K имеют вышеуказанные значения,
заключается в том, что соединение общей формулы IA:
где -, R, R1,
где K, R,
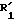
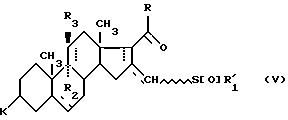
где K, R,
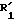
Согласно этому
способу можно:
выделять или не выделять дисульфоксид формулы (Ic):
сначала удалить только нагреванием первую группу -S(O)RI из дисульфоксида формулы (Ic) для получения моносульфоксидного соединения (V), а затем удалить вторую
группу -S(O)RI через промежуточную форму сульфената, описанного ниже, в горячем виде с помощью тиофильного
агента;
выделять или не выделять полученный моносульфоксид формулы (V);
удалить только нагреванием группу -S(O)RI из соединения формулы (IB);
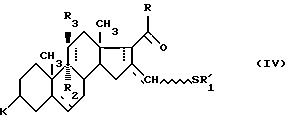
выделять
или не выделять моносульфид формулы (V), полученный окислением соединения
формулы (IV).
Окислителем, используемым для превращения соединения формулы (IA) в соединение формулы (Ic) или для превращения соединения формулы (IV) в соединение формулы (V) является один из тех, которые приведены выше.
Тиофильным агентом может быть, например, трифенилфосфин, триметил- или триэтилфосфин, трифенил, триметил- или триэтилфосфит, диметил- или диэтилфосфит, вторичный амин, например диэтиламин, фосфористая кислота, тиол, такой как тиофенол или метилмеркаптан, или тиосульфат или бисульфит, например, натрия. Особенно предпочитают трифенилфосфин.
Работают в среде органического растворителя или смеси органических растворителей предпочтительно с обратным холодильником. Можно применять растворители ароматического ряда, такие как бензол, толуол, ксилол, или циклогексан, тетрагидрофуран, диоксан, диметоксиэтан, моноглим или диглим, при желании, в смеси с протонным растворителем, в частности со спиртом, таким как метанол, этанол или изопропанол.
При необходимости действуют в присутствии щелочного карбоната, такого как карбонат натрия или карбонат калия.
Для сведения можно
отметить, что во время реакции аллиловая форма сульфоксида формулы (V) находится в равновесии с
сульфенатной формой (Va):
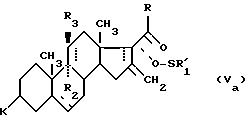
которая восстанавливается до получения целевого соединения (А).
Снятие защиты с полученных продуктов, имеющих один или два защищенных гидроксида, осуществляют известными специалисту способами.
Изобретение относится
также к новым промежуточным продуктам формулы (IV), определенной выше, а также к соединению формулы (Vб
):
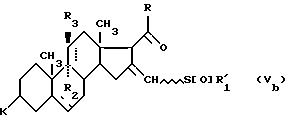
соответствующему соединениям формулы (V), в которой пунктирная в положении 16/17/ и 16/16'/ означает вторую связь только в положении 16/16'/, и к соединению формулы (Vc):
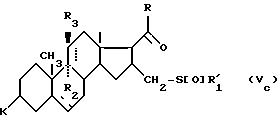
соответствующему соединениям формулы (V), в которой пунктирная линия в положении 16/17/ и 16/16'/ означает вторую связь только в положении 16/17/, за исключением тех, где R радикал метил, R2 и R3 атом водорода и двойная связь находится в 9/11/.
Соединения формулы (А), где R радикал метил, описаны, в частности, в американских патентах 3354184, 3178462, 3312692, 3359287, 3064015, 3519619 или могут быть получены исходя из соединений, описанных в этих патентах, способами, известными специалистам. Соединения формулы (А), где R радикал -CH2OH, свободный или защищенный, описаны, например, в немецких патентах 1263765, 1263766, и в американских патентах 3350394, 4567001, 3354184, во французском патенте 1285336 или в европейских патентах 104054 или 174496, или могут быть получены способами, известными специалистам, исходя из соединений, описанных в этих патентах или в американских патентах 3309272 или 3178462.
Соединения формулы (II), в которой R означает метил, описаны в английских патентах 881501, 2199325 или могут быть получены исходя из соединений, описанных в этих патентах, а также в немецких патентах 2207420 или американских патентах 4113722 и 3976638, способами, известными специалистам. Соединения формулы (II), где R радикал -CH2OH, свободный или защищенный, описаны, например, в американских патентах 2802839, 2745852, 2773058, 2864834, бельгийских патентах 540478 или 789, немецком патенте 2207420, голландском патенте 6902507 или в советском патенте 819119, или могут быть получены, исходя из соединений, описанных в этих патентах, а также в американских патентах 3976638 или 2966504, европейском патенте 123736 или канадском патенте 760431, способами известными специалистам.
Реактивы формулы (Р), где RI радикал метил или фенил, описаны в J. Chem. Soc. Chem. Comm. 1983, 835, 1878, 362 или еще J. Org. Chem. 1978, 43, 3101. Другие реактивы формулы (Р) могут быть приготовлены способами, которые описаны в данных выше ссылках.
Следующие примеры иллюстрируют изобретение, но не ограничивают ее.
Пример 1. 21-Ацетокси-16альфа-[бис-(фенилтио)метил] прегна-1,4,9/11/-триен -3, 20-дион.
Стадия А: 21-ацетокси-16альфа-[(фенилтио)нитрометил] - 1,4,9/11/-прегнатриен-3,20-дион.
2, 01 г 21-ацетокси-1,4,9/11/, 16-прегнатриен-3,20-диона и 1,1 г (фенилтио)нитрометана растворяют в инертной атмосфере и без доступа света, в смеси сухого ТГФ (20 мл) и трет-бутанола (20 мл). Прибавляют 0,8 мл ДБУ /1,8-диазабицикло[5,4,0] ундек-7-ен/ и реакционную смесь перемешивают при комнатной температуре 8 часов. Прибавляют 2 г лимонной кислоты в 50 мл воды. После экстракции дихлорметаном, фильтрования на двуокиси кремния, сушки на сульфате натрия, фильтрования и выпаривания растворителя под уменьшенным давлением получают 3,73 г сырого продукта. Избыток (фенилтио)нитрометана удаляют поглощением сырого продукта реакции смесью пентан (75 мл) эфир (30 мл). Получают 2,79 21-ацетокси-16альфа[(фенилтио)нитрометил]-1,4,9/11/-прегнатриен- 3,20-диона. Т.пл. 92 100oC.
ИК-спектр (см-1): 1740 (s); 1720 (s); 1655 (w);
1615 (w); 1540 (s), (NO2); 885 (w) (C-sph)
ЯМР-спектр1Н:
2 изомера: 0,72 и 0,73 (3Н, s,
Me-18); 1,41 (3H, s, Me-19); 2,17 и 2,20 (3H, s, COCH3); 2,
67 и 2,97 (1H, d, J 9,2 Гц, С17-Н); 3,60 (1H, m, W1/2 35 Гц, C16-H); 4,43 и 4,75 (2H, система AB,
J 16,9 Гц и 4,58 и 4,88 (2H, система AB, J 17,0 Гц); 5,38 (1H, d, J
8,14 Гц, C16'-H) и 5,43 (1H, d, J 5,9 Гц, C16'-H); 5,55 (1H, массив, W1/2 10 Гц, C11-H);
6,08 (1H, массив, W1/2 10 Гц, C4-H); 6,30
(1H, d-d, J 10,2 Гц, J 1,7 Гц, C2-H); 7,17 (1H, d, J 10,2 Гц, C1-H), 7,34 7,38 (5H, массив).
ЯМР-спектр13С:
30 углеродов 2 изомера:
четные: 29,87 и 30,65 (s); 32,00 (s); 34,60 (s); 44,38 и 44,60 (g); 45,91 (g); 69,01 (g); 130,58 (g); 130,98 (g); 143,21 и 143,34
(g); 166,03 (g); 170,40 (g); 186,24 (g); 201,40 и 201,65 (g).
нечетные: 13,64 (p, 18-Me); 20,52 (p, COCH3); 26,61 (p, 119-Me); 36,29 (t); 40,05 и 40,17 (t); 40,97 (t); 52,21 и 52,62 (t); 61,95 (t); 98,03 и 98,54 (t); 119,65 (t); 124,18 (t); 127,62 (t); 129,71 (t); 129,87 (t); 132,94 (t); 133,23 (t); 154,17 (t).
Масс-спектр: m/z 512 (M+); 483; 391; 314; 213.
Стадия Б: 21-ацетокси-16альфа-[(фенилтио)метил]-1,4,9/11/-прегнатриен- 3,20-дион.
2 мл тиофенола и 5 мл уксусной кислоты смешивают и нагревают до кипения в атмосфере азота. Прибавляют 2,51 г 21-ацетокси-16альфа-[(фенилтио)нитрометил] -1,4,9/11/-прегна-триен- 3,20-диона и смесь нагревают с рефлюксом 4 часа 30 минут. Когда смесь остывает, то прибавляют 25 мл эфира. После нейтрализации уксусной кислоты раствором (насыщенным) бикарбоната натрия прибавляют 25 мл эфира. Органический слой собирается, промывается водой, а затем сушится и концентрируется. Получают 4 г коричневого масла. Удаление избытка тиофенола ведется поглощением сырого продукта смесью эфира (25 мл) и пентана (100 мл). Получают 1,70 г целевого производного дисульфида. Т. пл. 98 100oC после очищения хроматографией на двуокиси кремния (элюент: эфир дихлорметан 9-1).
(альфа)D -13,4o (К 12,7 мг/мл; хлороформ).
ИК-спектр (см-1): 1750 (s); 1720 (s); 1665 (s); 1630 (m); 1610 (w); 1585 (w); 1550 (w); 1480 (w); 1440 (w); 1410 (w); 1370 (w); 1270 (m); 1120(w); 1155 (w); 1070 (m); 1050 (m); 1025 (m); 890 (m).
ЯМР-спектр1H: 0,61 (3H, s, Me-18); 1,37 (3H, s, Me-19); 2,10 (3H, s, COCH3); 2,87 (1H, d, J 9,2 Гц, C17-H); 3,31 (1H, m, W1/2 19Гц, C16-H); 4,25 и 4,68 (2H, система AB, J 16,9 Гц); 4,33 (1H, d, J 4,8 Гц, C16'-H; 5,47 (1H, массив, W1/2 9 Гц, C11-H); 6,03 (1H, массив, W1/2 5 Гц, C4-H); 6,23 (1H, d-d, J 10,1 Гц, J 1,7 Гц, C2-H); 7,10 (1H, d, J 10,2 Гц, C1-H), 7,18 7,41 (1OH, массив).
ЯМР-спектр13С:
четные:
30,38 (s); 32,14 (s); 34,64
(s); 40,23 (s); 44,54 (g); 134,40 (g); 143,38 (g); 154,45 (g); 166,50 (g); 170,32 (g); 186,31 (g); 202,50 (g),
нечетные: 13,18 (p); 20,53 (p), 26,61 (p); 36,50 (t);
43,52 (t); 45,98 (t); 52,
75 (t); 62,47 (t); 64,64 (t); 69,09 (t); 119,89 (t); 124,03 (t); 127,49 (t); 127,88 (t); 127,97 (t); 129,16 (t); 132,27 (t); 132,57 (t).
Масс-спектр: m/z 489 (M+ Sph).
Пример 2. 21-Ацетокси-16альфа-[(фенилтио) (фенилсульфинил)метил] -1,4,9(11)-прегнатриен-3,20-дион.
60 мг дисульфида, полученного в примере 1, растворяют в 1мл дихлорметана и охлаждают до -60oC. Прибавляют 26 мг метахлорпербензойной кислоты. По истечении 1 часа снова прибавляют 5 мл метахлорпербензойной кислоты. Реакционную смесь оставляют при -60oC на 1 час. Прибавляют 2 мл насыщенного раствора бикарбоната натрия; доводят смесь до комнатной температуры и экстрагируют дихлорметаном (2 • 1,5 мл). Затем органический слой промывается водой (3 • 2 мл), потом сушат и выпаривают растворитель под уменьшенным давлением. Получают 56 мг целевого сырого моносульфоксида.
Это производное неустойчиво и сохраняется в холодильнике.
Пример 3. 21-Ацетокси-16альфа-[бис-(фенилсульфинил)метил] -1,4,9(11)- прегнатриен-3,20-дион.
1,09 полученного в примере 1 продукта растворяют в 10 мл дихлорметана и охлаждают до -78oC. Прибавляют 796 мг 80%-ной метахлорпербензойной кислоты и выдерживают реакционную смесь при -78oC 3 часа. Прибавляют 15 мл насыщенного раствора бикарбоната натрия; смесь сразу доводится до комнатной температуры и экстрагируется дихлорметаном. Органический слой промывается водой, сушится и растворитель выпаривается под уменьшенным давлением. Полученный дисульфоксид очищают хроматографией на двуокиси кремния (элюант циклогексан этиловый эфир уксусной кислоты 1-1); получают 649 мг целевого продукта.
ИК-спектр (см-1): 3050, 2960, 2920, 1745(s), 1720 (s), 1660 (s), 1625, 1615 (m), 1580, 1450 (m), 1375, 1320, 1270, 1240 (s), 1150 (m), 1090 (m), 1050 (m), 890.
ЯМР-спектр1H:
1-й изомер:
0,62 (3H, s, Me-18); 1,40 (3H, s, Me-19); 2,18 (3H, s, COCH3); 3,43 3,54 (3H, 16-H, 16'-H и 17-H); 4,29 и 4,59 (2H, система AB, J 16,6 Гц); 5,51 (1H,
массив, W1/2 10 Гц, C11-H); 6,08 (1H, массив, W1/2 5 Гц, C4-H); 6,28 (1H, d-d, J 10,2 Гц, J 1,7 Гц, C2-H); 7,15 (1H, d, J 10,1 Гц, C1
-H); 7,31 7,66 (1OH, массив).
2-й изомер: 0,68 (3H, s, Me-18); 1,40 (3H, s, Me-19); 2,13 (3H, s, COCH3); 3,54 3,62 (3H, 16H, 16'-H b 17-H); 4,44 и 4,79 (2H, система AB, J 16, 5 Гц); 5,58 (1H, массив, W1/2 10 Гц, C11-H); 6,08 (1H, массив, W1/2 5 Гц, C4-H); 6,28 (1H, dd, J 10,2 Гц, J 1,7 Гц, C2-H); 7,18 (1H, d, J 10,1 Гц, C1-H); 7,31-7,66 (1OH, массив).
Пример 3'. 21-Ацетокси-16альфа-[(фенилтио) (фенилсульфинил)] и 16альфа-[бис-(фенилсульфинил)метил]-1,4,9(11)-прегнатриен-3,20-дионы.
0,206 полученного в примере 1 дисульфида разбавляют в 2 мл уксусной кислоты в атмосфере аргона. Охлаждают до 0oC на ледяной ванне. К смеси прибавляют 5 капель 30%-ной перекиси водорода. Прибавляют несколько капель дихлорметана и дают температуре подняться. После выдерживания в течение 21 часа при комнатной температуре получают в большом количестве моносульфоксид, сравнительно идентичный продукту примера 2. Реакцию продолжают еще 50 часов (приблизительно) в инертной атмосфере и при комнатной температуре, а затем останавливают реакцию прибавлением воды.
После обработки как указано в примере 3 получают целевой дисульфоксид, идентичный продукту, который получен в примере 3.
Пример 4. 21-Ацетокси-16-метилен-17альфа-гидроксипрегна-1,4,9(11)-триен- 3,20-дион.
Стадия А. 21-Ацетокси-16альфа-[(фенилтио)метил] -1,4,9(11) 16-прегнатриен-3,20-дион и соответствующее 16альфа-[(фенилтио)метилен]овое производное.
Моносульфоксид, полученный как в примере 2 исходя из 204 мг дисульфида, поглощают 3 мл сухого толуола. Прибавляют 101 мг трифенилфосфина и раствор нагревают с рефлюксом в атмосфере аргона 15 часов. По истечении 6 часов нагревания прибавляют 55 мг трифенилфосфина. Затем толуол выпаривают и продукт очищают хроматографией на двуокиси кремния [элюант: циклогексан/этиловый эфир уксусной кислоты 9/1, а затем 3/1] Получают смесь двух изомеров с двойной связью в положении 16 (дельта 16-16' или дельта 16-17).
Спектр ИК (см-1): 3020, 2910, 2820, 1750 (s), 1720 (m), 1660 (s), 1620 (m), 1580, 1550, 1430, 1370, 1260, 1040, 880.
ЯМР-спектр1H: 0,80 (3H, s, Me-18); 1,41 и 1,42 (3H, s, Me-19); 2,18 и 2,19 (3H, s, COCH3); 3,38 (1H, m, W1/2 10 Гц, C17-H); 3,72 и 4,09 (2H, система AB, J 13,6 Гц, C16-H); 4,44 и 4,67 (2H, система AB, J 16,6 Гц) и 4,71 и 4,90 (2H, система AB, J 17 Гц); 5,50 и 5,59 (1H, массив, W1/2 12,5 Гц, C11-H); 6,09 (1H, массив, W1/2 5 Гц, C4-H); 6,30 (1H, d-d, J 10,2 Гц, J 1,7 Гц, C2-H); 6,31 и 6,27 (1H, d, J 1,9 Гц, C16'-H), 7,16 7,52 (6H, массив).
ЯМР спектр13С:
четные: 32,03; 34,27; 34,66; 36,66; 37,12; 37,77; 40,
41; 44,05; 45,97; 47,09; 68,08; 69,01; 134,58; 136,18; 143,06; 143,79;
144,11; 145,90; 151,58; 166,37; 170,29; 186,34; 193,57; 200,77,
нечетные: 14,16; 16,02; 20,53; 26,54; 28,72; 35,73; 51,
19; 63,20; 117,37; 119,84; 120,23; 123,97; 126,43; 127,43; 128,54; 129,
09; 131,72; 154,47.
Масс-спектр: m/z 490, 489, 488 (М+), 448, 447, 446 (М+ -COCH3), 430, 415, 387, 319, 207.
Стадия Б: 21-Ацетокси-16альфа-[(фенилсульфинил)метил] -1,4,9(11) 16-прегнатетраен-3,20-дион и соответствующее 16альфа-[(фенилсульфинил)метилен] овое производное 6,42 г смеси изомеров, полученной на предыдущей стадии, растворяют в 100 см3 дихлорметана и охлаждают до -78oC в атмосфере азота. Прибавляют 2,92 г 80-ной метахлорпербензойной кислоты и перемешивают около 2 часов.
При низкой температуре обрабатывают насыщенным раствором бикарбоната натрия, а затем водой, сушат и упаривают досуха. После хроматографии на двуокиси кремния (элюант этиловый эфир уксусной кислоты, а затем этиловый эфир уксусной кислоты / метанол 9-1) получают 3,44 г смеси целевых сульфоксидов.
Стадия В: 21-Ацетокси-16-метилен-17альфа-гидроксипрегна-1,4,9(11)-триен-3, 20-дион.
Продукт, полученный на предыдущей стадии, растворяют в смеси 50 см3 толуола и 50 см3 метанола и прибавляют 2,68 г трифенилфосфина. Нагревают 20 часов при 85 90oC, а затем охлаждают и отгоняют растворитель.
После хроматографии на двуокиси кремния (элюант эфир - дихлорметан-петролейный эфир 4-1-5), получают 1,97 г целевого продукта. Т. пл. 213 215oC (разл.) после кристаллизации в метаноле. /альфа/D -32,8o /К 10,5 мг/мл; хлороформ/.
ИК-спектр (см-1): 3200; 2900; 2850; 2250; 1750 (s); 1730 (s); 1675 (s); 1625; 1605; 1440; 1410; 1370; 1235 (s); 1075; 915 (s).
ЯМР-спектр1H: 0,70 (3H, s, Me-18); 1,41 (3H, s, Me-19); 2,17 (3H, s, COCH3); 4,93 и 5,07 (2H, система AB, J 17,6 Гц); 5,02 (1H, s, C=CH2); 5,15 (1H, s, C=CH2); 5,60 (1H, массив, W1/2=12 Гц, C11-H); 6,07 (1H, массив, W1/2 5 Гц, C4-H); 6,29 (1H, d-d, J 10,2 Гц, J 1,4 Гц, C2-H); 7,20 (1H, d, J 10,2 Гц, C1 -H).
ЯМР-спектр13С:
четные: 31,96 (s); 32,25 (s); 33,36 (s); 35,05 (s); 46,04 (g); 45,45 (g); 68,65 (g); 89,65 (g); 114,45 (s); 142,28 (g); 152,64 (g); 166,49 (g);
170,64 (g); 186,37 (g); 204,00 (g),
нечетные:
14,18 (р); 20,60 (р); 26,81 (р); 36,38 (t); 64,31 (t); 120,83 (t); 124,05 (t); 127,50 (t); 154,51 (t).
Пример 5. 21-Ацетокси-16-метилен-17альфа-гидроксипрегна-1,4,9(11)-триен- 3, 20-дион.
205 мг смеси, полученной как это описано на стадии А примера 4, растворяют в 3 мл дихлорметана и охлаждают до -78oC в азоте. Прибавляют 91 мг 80 -ной метахлорпербензойной кислоты. После 2 часов реакции исходный продукт совершенно исчез. Прибавляют 221 мг трифенилфосфина при низкой температуре, а затем выпаривают дихлорметан под уменьшенным давлением и заменяют его сухим толуолом. После 2 часов 30 минут нагрева с рефлюксом упаривают досуха и после очищения хроматографией на двуокиси кремния (элюант: циклогексан эфир, 4-1 до 0-1) получают 113 мг целевого спирта, идентичного спирту, полученному в примере 4. Т. пл. 213 215oC.
Пример 6. 21-Ацетокси-16-метилен-17альфа-гидроксипрегна-1,4,9(11)-триен -3, 20-дион.
648 мг дисульфоксида, полученного в примере 3, в атмосфере аргона растворяют в 10 см3 толуола и раствор охлаждается до -60oC. Прибавляют 500 мг карбоната кальция и реакционную смесь нагревают 2 часа при 80oC. Затем прибавляют 540 мг трифенилфосфина, а также 10 см3 метанола. Полученный раствор нагревается с обратным холодильником при 80oC в течение 11 часов, а затем охлаждают и доводят до сухого состояния. После хроматографии на двуокиси кремния (элюант: циклогекcан этиловый эфир уксусной кислоты: 7-3, а затем 1-1) получают 217 мг целевого спирта, идентичного тому, который получен в примере 4. Т. пл. 213 215oC.
Пример 6'. 21-Ацетокси-16-метилен-17альфа-гидроксипрегна-1,4, 9(11)-триен- 3,20-дион.
287 мг дисульфоксида, полученного в примере 3 или 3', растворяют в 5 мл сухого толуола и прибавляют 250 мг карбоната кальция. Раствор нагревают с обратным холодильником 75 минут. Прибавляют 5 капель (1 эквивалент) триметилфосфита и 5 мл метанола, а затем 8 капель триметилфосфина после 8 часов и после 24 часов. После 34 часов нагревания с обратным холодильником наблюдают путем хроматографии в тонком слое, что реакция закончена полностью. После охлаждения раствора прибавляют 15 мл дихлорметана и 15 мл воды. Полученную смесь отфильтровывают и органический и водяной слой разделяют. Органический слой промывают насыщенным раствором бикарбоната и насыщенным раствором хлористого натрия. После сушки и удаления растворителя получают 256 мг сырого целевого продукта, который хроматографируют на двуокиси кремния (элюант: петролейный эфир этиловый эфир уксусной кислоты 7-3, а затем 1-1). Получают 64 мг, т.е. 36% целевого продукта, идентичного тому, который получен в примере 4. Т. пл. 213 215oC.
Пример 7. 21-Ацетокси-16-метилен-17альфа-гидроксипрегна-1, 4,9(11)-триен- 3,20-дион.
702 мг полученного в примере 1 продукта растворяют в 10,5 см3 дихлорметана в атмосфере азота и раствор охлаждают до -60oC. Прибавляют 319 мг 80-ной метахлорпербензойной кислоты. После 30 минут прибавляют 243,6 мг метахлорпербензойной кислоты и реакция протекает 5 часов между -60oC и -40oC. Тогда прибавляют 942 мг трифенилфосфина, выпаривают дихлорметан под уменьшенным давлением и заменяют его 11 см3 сухого толуола. Полученный раствор нагревают с обратным холодильником 7 часов. Охлаждают, выпаривают растворитель и хроматографируют остаток на колонке двуокиси кремния (элюант: циклогексан этиловый эфир уксусной кислоты: 1-0 до 1-1), получают 115 мг целевого спирта, который идентичен спирту, который получен в примере 4. Т. пл. 213 215oC.
Пример 8. 16-Метилен-17альфа-гидрокси-4-прегнен-3,20-дион.
Стадия А: 16альфа-[(фенилтио)-нитрометил]-4-прегнен-3,20-дион.
138 мг 4, 16-прегнадиен-3,20-диона и 110 мг (фенилтио)нитрометана растворяют в атмосфере (инертной) и в отсутствии света, в 2 мл смеси (1-1) тетрагидрофурана и трет-бутанола, а затем прибавляют 0,1 мл ДБУ (1, 8-диазабицикло-5,4,0-ундец-7-ен) и реакционную смесь перемешивают при комнатной температуре 48 часов. Затем прибавляют раствор 0,5 г лимонной кислоты в 5 мл воды. После экстракции дихлорметаном, сушки на сульфате натрия фильтрации и выпаривания растворителя под уменьшенным давлением, остаток хроматографируют на двуокиси кремния, элюируя эфиром и получают 48,3 мг целевого продукта в виде смеси 2-1 эпимеров. Т. пл. 166 172oC.
ИК-спектр (СНВr3): 1702, 1660, 1551 см-1
ЯМР-спектр (200 МГц):
1H: 7,4 (5H, m); 5,7
(1H, s); 5,4 (1H, 2d); 3,55 (1H, m); 2,87 (1/3H, d, J 8,8 Гц); 2,64 (2/3H, d, J 8,8 Гц); 2,23 (2/3 3H, s); 2,16 (1/3 3H,
s); 1,18 (3H, s); 0,71 (3H, s),
13C (чнм): 14,38; 17,47; 21,
04; 28,72; 29,23; 31,58; 31,58; 31,76; 32,64; 34,00; 35,39; 35,83; 38,66; 38,76; 40,67; 45,23; 53,50; 54,75; 55,24; 66,86;
98,66; 98,99; 124,26; 129,53; 129,80; 131,45; 132,94; 170,18; 199,19; 206,
37.
Стадия Б: 16-Метилен-17альфа-гидрокси-4-прегнен-3,20-дион.
Действуя как это указано в примере 3, но исходя из продукта полученного в стадии А, получают соответствующий дисольфоксид, который превращают, как это указано в примере 6, для получения 16-метилен-17альфа-гидрокси-4-прегнен-3, 20-диона (целевого), полученного как это указано в патенте США 3354184.
Пример 9. 3бета-ацетокси-16-метилен-17альфа-гидрокси-5-прегнен-3,20-дион.
Стадия А: 3бета-ацетокси-16альфа-[(фенилтио)нитрометил]-5-прегнен-20-он.
124,3 г 3бета-ацетокси 5,16-прегнадиен-20-она и 89,7 мг (фенилтио)-нитрометана растворяют в инертной атмосфере и в отсутствии света в 2 мл смеси (1-1) тетрагидрофурана и трет-бутанола, а затем прибавляют 0,05 мл ДБУ (1,8-диазабицикло[5,4,0] ундец-7-ен) и реакционную смесь перемешивают при комнатной температуре 48 часов. Тогда прибавляют раствор 0,5 г лимонной кислоты в 5 мл воды. После экстракции с дихлорметаном, сушки на сульфате натрия, фильтрации и отгонки растворителя под уменьшенным давлением, остаток хроматографируют на двуокиси кремния, элюируя смесью эфир петролейный эфир (1-3) и получают 66 мг целевого продукта в виде смеси 2-1 эпимеров. Т.пл. 135 159oC.
ИК-спектр
(СНВr3): 1720, 1702, 1551 см-1
ЯМР-спектр
(200 МГц):
1H: (дельта) 7,4 (5H, m); 5,35 (1H, 2d); 4,6 (1H, m); 3,55 (1H, m); 2,85 (1/3H, d, J 8,8 Гц); 2,
64 (2/3H, d, J 8,8 Гц); 2,23 (2/3 3H, s); 2,16 (1/3 3H, s); 2,04 (3H, s);
1,02 (3H, s); 0,66 (3H, s).
13С (чнм): 14,19; 19,32; 20,88; 21,46; 27,72; 29,36; 31,53; 36,58; 36,96; 38,04; 38,72; 40,46; 45,19; 49,64; 55,35; 55,83; 66,90; 73,74; 98,73; 99,06; 121,96; 129,43; 129,71; 132,88; 139,72; 170,56; 206,64.
Стадия Б: 3бета-ацетокси-16-метилен-17альфа-гидрокси-5-прегнен-3,20-дион.
Действуя как это указано в примере 3, но исходя из продукта, полученного выше на стадии А, получают соответствующий дисульфоксид, который превращают как это указано в примере 6, чтобы получить 3бета-ацетокси-16-метилен-17альфа-гидрокси-5-прегнен-3,20 дион (описанный в патенте США 3 519 619).
Пример 10. 16-Метилен-17альфа-гидрокси-4-прегна-4,9(11)диен-3,20-дион.
Стадия А: 16альфа-[(фенилтио)нитрометил]4,9(11)-прегнадиен-3,2-дион.
100 мг прегна-4,9(11),16-триен-3, 20-диона и 100 мг (фенилтио)нитрометана растворяют в инертной атмосфере и в отсутствии света, в 1 мл смеси (1-1) тетрагидрофурана и трет-бутанола, а затем прибавляют 30 мг ДБУ (1,8-диазабицикло[5,4,0] -ундец-7-ен) и реакционную смесь перемешивают 16 часов при комнатной температуре. Тогда прибавляют раствор 0,5 г лимонной кислоты в 5 мл воды. После экстракции дихлорметаном, сушки на сульфате натрия и выпаривания растворителя под уменьшенным давлением, остаток хроматографируют на двуокиси кремния, элюируя смесью петролейный эфир этиловый эфир уксусной кислоты (2-1) и получают 129 мг целевого продукта в виде смеси 2-1 эпимеров. Т.пл. 198 200oC (разл.) после перекристаллизации в смеси хлороформ-метанол.
ИК-спектр (CHBr3): 1707, 1665, 1614, 1552 см-1
ЯМР-спектр (200 МГц)
1H:
(дельта) 7,4 (5H, m); 5,75 (1H, s); 5,55 (1H, m); 5,4 (1H, 2d); 3,6 (1H, m); 2,95 (1/3H, d, J 9 Гц); 2,75 (2/3H, d, J 9 Гц); 2,24 (2/3 3H,
s); 2,17 (1/3 3H, s); 1,34 (3H, s); 0,65 (3H, s).
13C (чнм): 13,96; 26,16; 29,50; 30,08; 31,28; 31,98; 32,60; 33,90; 34,25; 36,94; 40,70; 41,07; 43,47; 51,58; 52,09; 66,50; 66,68; 98,46; 98,81; 117,84; 124,26; 129,41; 129,70; 132, 81; 145,10; 198,70; 206,03.
Стадия Б: 16-метилен-17альфа-гидроксипрегна-4,9(11)диен-3,20-дион.
Действуя как это указано в примере 3, исходя из продукта, полученного на предыдущей стадии А, получают соответствующий дисульфоксид, который превращают, как это указано в примере 6, для получения 16-метилен-17альфа-гидроксипрегна 4,9(11)-диен-3,20-диона (описанного в патенте США 3 359 287).
Пример 11. 21-Ацетокси-9альфа-фтор-11-бета-ацетокси-16альфа-бис- (2-пиридилтио)метилпрегна-1,4-диен-3,20-дион.
Стадия А: 21-Ацетокси-9альфа-фтор-11-бета-ацетокси-16альфа-[(2-пиридилтио) нитрометил]прегна-1,4-диен-3,20-дион.
Суспендируют в атмосфере инертного газа 0,1 г 21-ацетокси-9альфа-фтор-11- бета-ацетоксипрегна-1,4,16-триен-3,20-диона в смеси 4 см3 тетрагидрофурана и 1 см3 трет-бутанола. Прибавляют в отсутствии света 0,046 г (2-тиопиридил)-нитрометана и 0,035 см3 1,8-диазобицикло[5,4,0]-ундец-7-ена. Нагревают при перемешивании при 60oC в течение 2,5 часов, потом прибавляют раствор 0,1 г лимонной кислоты в 2 см3 воды. Экстрагируют метиленхлоридом, сушат органическую фазу и выпаривают растворитель. Хроматографируют на оксиде кремния, элюируя смесью этилацетат-гептан (7-3). Получают 0,128 г целевого соединения. Т.пл. 161 - 162oC.
ИК-спектр (нуйол)
Поглощение при 1735, 1657 и 1556 см-1.
Анализ: C13H35FN2O8S
Вычислено, С 60,57; H 5,74; N 4,56.
Найдено, C 60,02; H 5,61; N 4,51.
1H-ЯМР-спектр (250 МГц)дельта чнм 0,94 (2с, 3Н, Me); 1,4 (с, 3Н, Me); 2,15 (с, 6Н, COMe); 6,11 (с, 1Н); 6,32 (д, 1Н, J 9 Гц); 6,78 (д, 1Н, J 10,5 Гц); 7,6 (т, 1Н, J 7,5 Гц); 8,3 (д, 0,4H, J 3 Гц); 8,46 (д, 0,6H, J 3Гц).
Стадия В: 21-ацетокси-9альфа-фтор-11-бета-ацетокси-16альфа- [бис-(2-пиридилтио)метил]прегна-1,4-диен-3, 20-дион.
Работают по методике стадии Б примера 1, исходя из 0,128 г продукта, полученного на предыдущей стадии А, и заменив тиофенол на пиридин-2-тиол. Получают целевой продукт.
Реферат
Использование: в качестве промежуточных продуктов в синтезе стероидных препаратов. Сущность: продукт - стероиды общей формулы I, приведенной в описании. Продукт получают многостадийным способом, включающим стадии тиоалкилирования и окисления тиоалкильной группы. 4с. и 11 з.п. ф-лы.
Формула
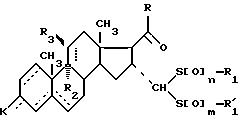
где
в котором R4 атом водорода или группа, защищающая гидроксильный радикал;
R метил, -CH2OH или CH2OR1, в котором R1 - группировка, защищающая гидроксильный радикал;
R1 и R1', одинаковые или различные, фенильный, пиридильный, тиазолильный или бензотиазолильный радикал;
n и m, одинаковые или различные, 0 или 1;
R2 и R3 атом водорода или R2 атом фтора и R3 формилокси или ацетилоксирадикал,
и пунктирные линии в положении 9/11/ символизируют возможное наличие двойной связи.
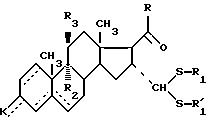
где - - -, R1, R2, R3 и К имеют вышеуказанные значения и
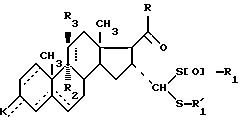
где - - -, R, R1,
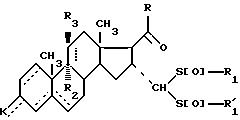
где - -, R, R1,
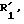
углерод-углеродная связь.
где - -, R, R2, R3 и К имеют вышеуказанные значения,
подвергают действию в щелочной среде реагента общей формулы P
R1S CH2 NO2,
где R1 имеет вышеуказанные значения,
в присутствии аминированного основания для получения соединения общей формулы III
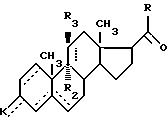
где - - -, R, R1, R2, R3 и К имеют вышеуказанные значения,
которое в присутствии карбоновой кислоты подвергают действию тиола или тиофенола общей формулы
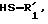
где
где - -, R, R1,
которое далее подвергают действию одного эквивалента окислителя, такого, как надкислота или перекись водорода, в присутствии карбоновой кислоты для получения соединения общей формулы IВ
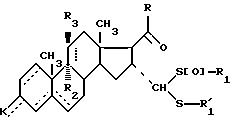
где - -, R, R1,
или действие по меньшей мере двух эквивалентов окислителя, такого, как надкислота или перекись водорода, в присутствии карбоновой кислоты для получения соединений общей формулы IС
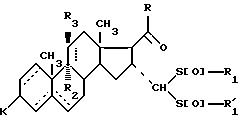
где - - -, R, R1,
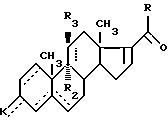
где - - -, R, R2, R3 и К имеют вышеуказанные значения,
подвергают действию в щелочной среде реагента формулы P
R1S CH2 NO2,
где R1 имеет вышеуказанные значения,
для получения соединения общей формулы III
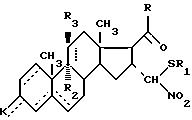
где - - -, R, R1, R2, R3 и К имеют вышеуказанные значения,
которое в присутствии карбоновой кислоты подвергают действию тиола или тиофенола общей формулы
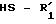
где
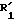
для получения соединения общей формулы IА
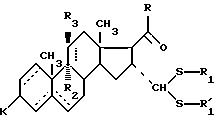
где - - -, R, R1,
и соединение формулы IА подвергают воздействию по меньшей мере двух эквивалентов окислителя, такого, как надкислота или перекись водорода, в присутствии карбоновой кислоты для получения соединения общей формулы IС
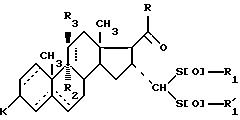
где - - -, R, R1,
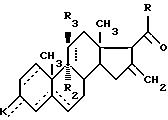
где R алкил C1 C4, CH2 OR', где R' H или защитная группа для гидроксигруппы,
- - -, R2, R3 и К имеют вышеуказанные значения,
отличающийся тем, что соединение общей формулы IА
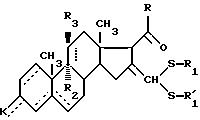
где - - -, R, R1,
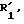
обрабатывают по меньшей мере двумя эквивалентами окислителя, такого, как надкислота или перекись водорода, в присутствии карбоновой кислоты для получения соединения общей формулы IC по п.10, которое подвергают в горячем виде действию тиофильного средства для получения соединения формулы А, или соединение общей формулы IВ по п.9, нагревают в присутствии тиофильного агента для получения соединения общей формулы IV
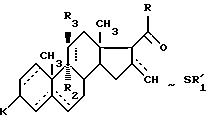
где - - - R,
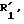
символ означает присутствие смеси изомеров формулы IV, после чего его подвергают действию по меньшей мере одного эквивалента окислителя, такого, как надкислота или перекись водорода, в присутствии карбоновой кислоты для получения соединения общей формулы V
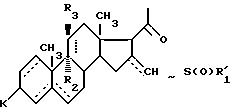
где - - -, R,
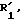
которые в горячем виде подвергают действию тиофильного средства для получения целевого соединения формулы А.
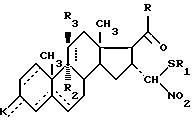
где - - -, R, R1, R2, R3 и К имеют вышеуказанные значения,
в качестве промежуточных продуктов.
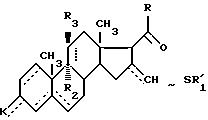
где - - -, R, R1, R2, R3 и К имеют вышеуказанные значения,
в качестве промежуточных продуктов.
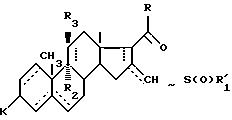
где - - -, R,
в качестве промежуточных продуктов.

Комментарии