Замещенные кортикоид-17-алкилкарбонаты, способ получения замещенных кортикоид-17-алкилкарбонатов - RU2060997C1
Код документа: RU2060997C1
Чертежи



















Описание
Изобретение касается замещенных кортикоид-17-алкилкарбонатов
формулы

Наиболее предпочтительны соединения формулы (I) с Y, равным водороду, и Z, равным водороду или метилу, а также R2, равным -СН(СН3)2, -СН2-СН(СН3)2, -СН2С(СН3)3, -(СН2)2-О-СН3; связь между С1 и С2 является простой или двойной связью, как указано в формуле (I) с помощь пунктирной линии.
Изобретение касается также способа
получения соединений I, который отличается тем, что соединения формулы (V)


R4 (CH2)n COOH (VI) или с галогенформиатом формулы (VII)
R4 (CH2)n OCO-Hal (VII) или с галогенидом сульфокислоты формулы (VIII)
R5 SO2 Hal (VIII) и при необходимости переводят 21-сульфокислый эфир, полученный таким образом, с помощь солей галогенидов в 21-галогениды формулы (I) с R1, равным хлору, брому, йоду, фтору.
Кроме
тогош, предметом изобретения является способ получения соединения формулы (V), в котором проводят реакцию между
основными кортикостероидами формулы (VI)

C


(VII) в инертных растворителях при температурах более 20оС до 120оС, предпочтительно до температуры кипения реакционной смеси, в частности приблизительно 50-60оС.
В формулах (VI) A, Y, Z и R3 имеют вышеуказанные значения, R6 H, CH3 и R7 СН3, СН(СН3)2, С(СН3)3 или СН2ОСН3.
Исключено получение соединений, в которых одновременно R6 Н,
а R7не содержит никакой разветвленной углеродной цепочки. Стероид 17, 21-диалкилортокарбонаты
формулы V, использованные в качестве исходных веществ, получают аналогично способу патента ФРГ
N 1668079. Для по- лучения 17,21-диалкилортокарбонатов формулы (V), замещенных алкоксигруппами и
разветвленных в алкиловом радикале, необходимы существенно более высокие реакционные температуры, чаще
всего выше чем 50оС, и более длительное время реакции (двухкратное или четырехкратное
время реакции), чем при получении линейных аналогов в соответствии с патентом ФРГ 1668079 (НОЕ 68/F
012). 21-гидроксигруппа является реакционноспособной, при этом получат 21-алкилкарбонатное,
21-карбонокислое производное или 21-алкил- или -арилсульфолкислый эфир на основе
кортикоид-17-алкилкарбонатов, с обычными для этого ацилирущими средствами:
а) Для получения 21-алкилкарбонатов
использут преимущественно алкиловый эфир хлормуравьиной кислоты формулы,
Cl-

b) Для получения 21-карбонокислых эфиров используют преимущественно
карбонокислые галогениды формулы,
Hal-

с) Для получения 21-сульфокислых эфиров используют сульфокислые галогениды формулы Сl-SO2-R (5), в которой R(5) имеет значение, указанное для формулы I. Преимущественно используют хлорид метансульфокислоты или р-хлорфенилсульфокислоты или хлорид р-толуолсульфокислоты.
d) Полученные кортикоид-17-алкилкарбонат-21-сульфокислые эфиры могут при необходимости взаимодействовать с солями галогенидов в инертных растворителях до соответствующих кортикоид-17-алкилкарбонат-21-галогенидов согласно европейскому патенту N 00 04 975.
На второй стадии способа растворяют стероидоные компоненты в инертном растворителе, например в эфире, как диоксан, тетрагидрофуран, диглим, или при необходимости галоидированных углеводородах, как бензол, толуол, циклогексан, хлористый метилен, хлороформ, или в смеси из этих растворителей. Для удаления галогеноводородной кислоты, образущейся во время реакции, добавляют 1 1000 молярных эквивалентов третичного основания, как пиридин, хинолин, триэтиламин или диметиланилин. Можно использовать однако также для удаления кислоты неорганическое основание, как гидрокарбонат натрия или карбонат кальция. Затем добавляют 1-200 молярных эквивалента, преимущественно 1-3 молярных эквивалента, одного из приведенных выше ацилирующих средств, при необходимости растворенных в растворителе, указанном выше, при температуре 40оС до температуры кипения использованного растворителя, предпочтительно от 0 до 25оС. Затем дают постоять реакционной смеси 1-120 ч при температуре от -40оС до температуры кипения растворителя, предпочтительно от 0 до 25оС.
При использовании ангидридов карбоновой кислоты в качестве ацилирующего средства можно обойтись без добавки растворителей. Как правило, достаточно добавить только органическое основание, предпочтительно пиридин, к использованному в избытке ангидриду кислоты.
В начале работы выливают реакционную смесь в воду, которая при необходимости может быть смешана с бикарбонатом натрия, причем реакционные продукты выпадают в виде кристаллов зачастую только после длительного остаивания. Образовавшиеся в виде масла продукты реакции концентрируют путем встряхивания с подходящим экстрагирующим агентом и путем выпаривания. Реакционные продукты могут быть, если необходимо, разделены перекристаллизацией с помощью хроматографии или очищены. Часто используют также интенсивное дигерирование (выстаивание при повышенной температуре) для последующей очистки реакционных продуктов в органическом растворителе, который реакционный продукт по возможности растворяет мало или совсем не растворяет, а именно такой, как диэтиловый эфир или циклогексан, или смесь из этих компонентов.
Гидроксигнруппа в II-положении может, при необходимости оксидироваться до кетогруппы обычными способами. Предпочтительно проводится это окисление трехокисью хрома в кислой среде в инертном органическом растворителе.
Соединения, полученные указанными способом, обладают ценными фармакологическими свойствами. Они, в частности, оказывают очень сильное антивоспалительное действие при местном и топическом применении и отчасти показывают неожиданно хорошее соотношение при стандартных фармакологических экспериментах между местными и систематическими противовоспалительными эффектами.
Кроме того, предложено средство для лечения воспалительных дерматозов, состоящее или включающее соединение формулы (I).
Соединения, полученные способом по данному изобретению, могут найти применение в ветеренарии и в медицине при лечении воспалительных дерматозов различного генеза в форме суспензий, мазей, кремов, пульверизаторов и т.д.
При этом следует выделить как особенное преимущество для местной и топической формы терапии то, что продукты, полученные способом изобретения, по причине своего очень благоприятного соотношения между местными и систематическими противовопалительными эффектами даже при высокодозовой и длительной терапии могут вызывать лишь незначительные систематические побочные действия. При наружном лечении применяют мази, кремы, суспензии и т.д. с концентрацией 0,01-2 мас. Продукты, полученные способом по изобретению, в частности, показывают в фармакологических экспериментах лучшее соотношение (между местным систематическим противовопаслительным действием, чем соответствующие препараты с линейной 17-алкилкарбонатгруппой, к которым относятся также предникарбат, описанный в европейском патентном описании N 742. Также новые соединения по данному способу имеют более сильную местную противовоспалительную эффективность, чем их известные кортикоид-аналоги с алкильной частью, в линейном алкильном радикале 17-алкилкарбонатгруппы.
Кортикоид-17-алкилкарбонат-21-производные с 17-алкилкарбонатгруппой, разветвленной в алкильной части, по сравнению с аналогичными кортикоид-17-алкилкарбонат-21-производными с боковой линейно расположенной цепочкой 17-алкилкарбоната оказывают еще более незначительную атрофию, что является преимуществом при кожно-терапевтическом лечении.
Фармакологическая экспериментальная часть.
Преднизолон-17-изо-пропилкарбонат-21-ацетат (соединение I) (пример 4, четвертое соединение) (температура плавления 126 128оС; ДС: R

1. Местное противовоспалительное действие на ушное воспаление кротоновым маслом крыс после кожного применения.
Используют способ тестирования на ушах крыс Тонелли и др. мужские особи вистар-крыс собственного разведения массой около 50 г получили в правое ухо возбудитель инфекции или тестируемое вещество накожным применением (20 мкл внутрь или снаружи). Левое ухо оставалось необработанным. В качестве раствора, вызывающего воспаление, послужило снова кротоновое масло (С), которое присутствовали в следующей смеси растворителей: С: пиридин: этанол: эфир в соотношении 4 20 10 66. Исследуемые кортикоиды растворяли в ней в указанных конечных концентрациях. Подвергли анализу лишь смесь растворителей С. Через 4 ч после кожной обработки животных наркотизировали эфиром. Из правого (обработанного) и из левого (необработанного) уха выштанцовывали круглые пластинки размером 8 мм в диаметре и тот час же взвешивали. Эту разницу в качестве параметра степени воспаления во время контроля (МГ,

Таким образом, для соединения I 50% ингибирующая доза соответствует 0,1 мг/мл, а для соединения II 0,3 мг/мл.
2. Исследование систематического противовоспалительного действия в эксперименте "Противовоспалительное действие после подкожного применения: отек конечности Каррагиннена у крыс". В качестве теста на острое систематическое противовоспалительное действие выбирали отек коонечностей Каррагиннена у крыс методом, описанным Винтером и др. (1962). Мужские особи Спрейг-Долей крыс массой около 120 г получали исследуемые вещества (0,2 мл/100 г), растворенные в кунжутном масле. Через 30 мин вводили в левую заднюю конечность 0,1 0,5% раствора Каррагиннена. Через 6 ч измеряли увеличение отека объемноаналитически. Контрольные особи получали только кунжутное масло. Объемы конечностей указаны в мл, х ± S. Противовоспалительное действие характеризуют здесь также при указании почти 50%-ной ингибирующий дозы в мг/мл (см. табл.2).
Таким образом 50% ингибирующая доза для соединения I> 0,3 мг/мл, для соединения II ≈0,5 мг/мл.
В экспериментах 1 и 2 на крысах для препаратов I и II получают данные, показывающие значительно более сильное (≈в 3 раза) местное противовоспалительное действие соединения I по сравнению с соединением II и, кроме того, уменьшение системного действия соединения I по сравнению с соединением II на фактор > 6. Таким образом документально показано лучшее (на порядок) соотношение преднизолон-17-изопропилкарбонат-21-ацетат (соединения I) по сравнению с преднизолон-17-п-пропилкарбонат-21-ацетатом (соединение II).
Кроме того, соединения, полученные данным способом в соответствии с изобретением, могут сочетаться в галеновых комбинациях с различными антибиотиками, действующими местно и хорошо переносимыми кожей, например, типа гентамицина, нефмицина, эритромицина, тетрациклина или фузидиновой кислоты и других. Такого рода комбинации из соединений, по- лученных способом по изобретению, и местно действующих антибиотиков могут применяться для лечения первичных бактериальных или бактериально сверхинфицированных воспалительных дерматозов.
Примеры исполнения.
К примерам, приведенным далее, необходимо сделать следующие общие замечания: температуры плавления определяют в аппарате согласно Тоттоли (Фирма Бюхи) и они не исправлены.
IR-спектры (в KBr) снимают с помощью решетчатого спектрофотометра Перкина-Элера 521. Соотетственно приводятся только характерные полосы. Съемка спектров проходила с помощью спектрального фотометра Бекманна ДК 1 А. Масс-спектроскопические исследования (МS) проводятся, главным образом, с помощью прибора МS9 (Фирма АЕI). Указанные МS-спектров (высший молярный вес) в основном в: МS м/z /M+H+/ (измерение с чистыми изотопами). Как правило, измеряли FAB-МS-спектры.
Для тонкослойной хроматографии (DC) служили готовые пластины из силикагеля F254 (Фирма Мерк). Если не указано другого, то в качестве растворителя использовали хлорид метилена: метанол 19 (длина пробега 7 см). Соответственно проявляли два раза. Пятна выявляли или с помощью UV-лампы при 254 пм или опрыскиванием 10% метанольным раствором серной кислоты, а также после нагревания до 100оС они становились видимыми. Rf-значения следует понимать как относительные. Для хроматографии на колонке использовали 15 силикагель 60, размер зерен 0,063-0,2 мм (Фирма Мерк).
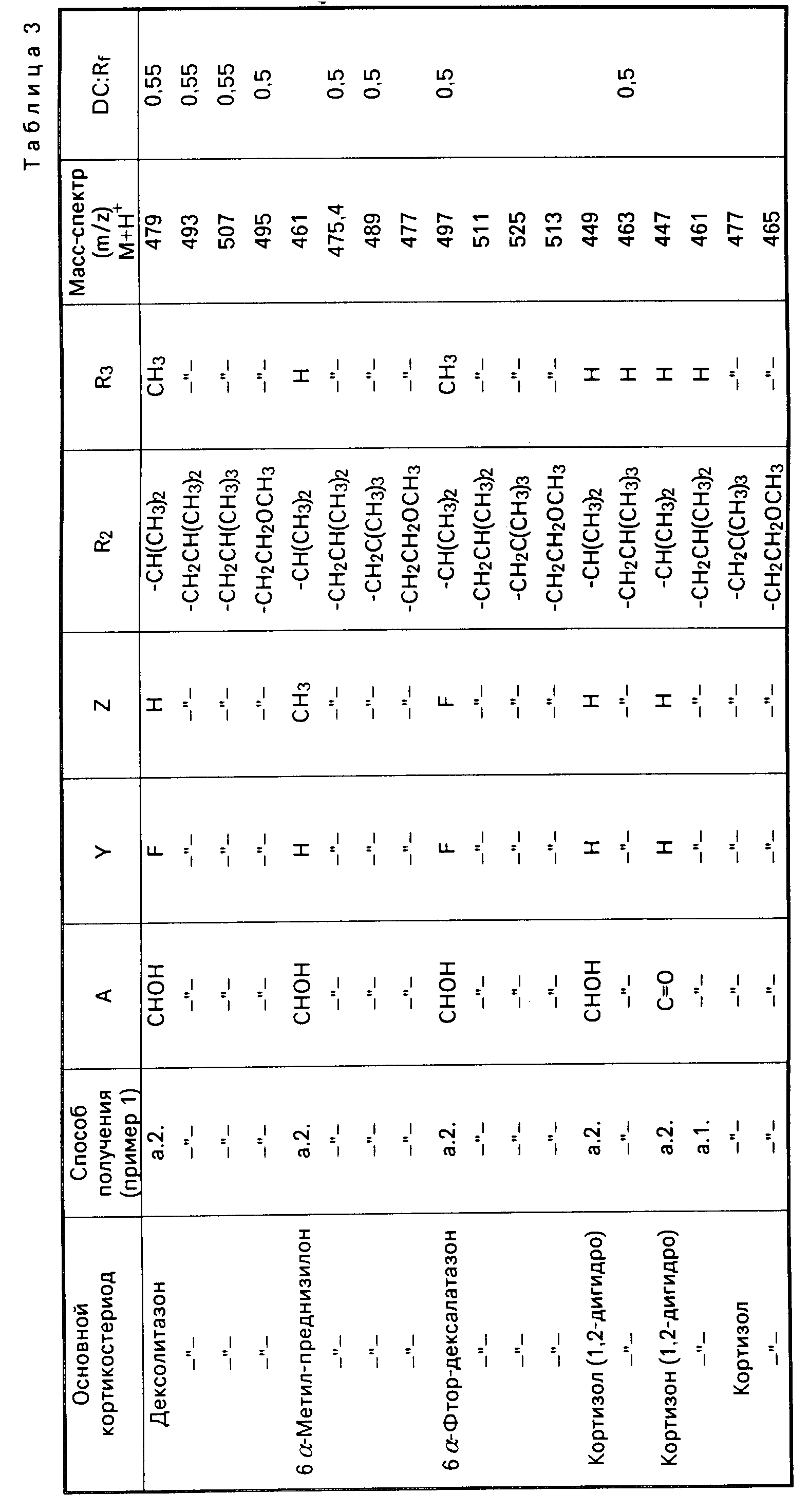
П р и м е р 1. а.1.) Раствор 1,2 г преднизолон-17,21-диизопропилортокарбоната (ДС: Rf приблизительно 0,65) в 18 мл ледяной уксусной кислоты и 0,18 мл воды отстаивается 5 ч при 22оС. DC-проверка показала, что после этого времени имелось оптимальное количество необходимого преднизолон-17-изопропилкарбоната. Реакционную смесь выливают в 0,5 л воды, которая доводится с помощью раствора аммиака до рН 5, при этом выпадал кристаллический осадок. После фильтрования, промывания водой и высушивания получают после дигерирования 0,7 г преднизолон-17-изопропилкарбоната с температурой плавления 128оС (Тоттоли). Оставшийся водный фильтрат экстрагируют хлоридом метилена. После отгонки растворителя остается пенистый остаток, который кристаллизуется из диизопропилового эфира, при этом получают 0,3 г преднизолон-изопропилкарбоната с температурой плавления 126оС. Оба осадка объединяются и перекристаллизовываются из этанола. Температура плавления 131оС (Тоттоли). Масс-спектр МS м/z 447 (М+H+).
DC:R

(СН2Сl2 CH3OH 19:1) Характерные IR-полосы: 3450, 2940, 2870, 1740, 1720, 1270 см-1.
а.2) Тот же продукт получают следующим образом. Раствор или суспензию из 24 г преднизолон-17, 21-диизопропилортокарбоната в 120 мл ледяной уксусной кислоты и 50 г ацетата аммония перемешивается 2 ч при 22оС и после DC-проверки (смотри а. I.) смешивается с 3 л воды, насыщенной NaCl. Выпавшее масло концентрируется после декантирования водной фазы через складчатый фильтр и экстрагируется хлоридом метилена, не содержащего кислоты. Органическая фаза промывается водой и сушится сульфатом натрия. После отгонки растворителя получают 18,5 г преднизолон-17-изопропилкарбоната в виде масла или пены, который согласно DC/Rf около 0,45) однороден и который после сушки в высоком вакууме без последующей обработки может использоваться. Для получения его в виде кристаллов, 5 г продукта перекристаллизовывают из смеси этанола/диэтилового эфира. Получают целевой продукт, аналогичный а.I. с температурой плавления 131оС и ДС/Rf 0,45).
b) Аналогично, как описано в примере 1 (а.2.), проводится взаимодействие 35 г преднизолон-17, 21-диизобутилортокарбоната в 175 мл ледяной уксусной кислоты и 73 г ацетата аммония. Получают 28,4 г преднизолон-17-изобутилкарбоната в виде пены. DC-Rf около 0,5.
MS m/Z
461 (M+H+)
с) Так
же, как описано в примере 1 (а.2), взаимодействуют 43 г преднизолон-17,21-дитрет-бутилметилортокарбоната в 201 мл ледяной уксусной кислоты и 89 г ацетата аммония.
Маслянистый реакционный продукт (34
г) очищают на силикагеле 35 70 (размеры колонны 5,5 х 41 см) хроматографически. После расхода 3 л смеси хлорида метилена/метанола 89 2 (побочный продукт согласно
DC) используют 1,5 л элюацинного
средства хлорид метилена/метанол 96 4. После отгонки растворителей получают необходимый преднизолон-17-трет-бутилметилкарбонат в виде светлого масла.
DC около 0,5.
MS
m/z 475 (М+H+)
d) Таким же образом, как описано в примере 1 (а.2.), смешивают 21 г преднизолон-17, 21-диметоксиэтилортокарбоната в 105 мл ледяной
уксусной кислоты и 44 г ацетата
аммония 4 ч при 35-40оС. Полученный маслянистый реакционный продукт (13,5 г) кристаллизуют из диэтилового эфира и получают 8,2 г
преднизолон-17-метоксиэтилкарбоната с температурой
плавления 131оС.
MS m/z 463 (М+H+)
П р и м е р 2.
а) К раствору, состоящему из 6 г преднизолон-17-изобутилкарбоната в 155 мл пиридина, добавляют 35 ангидрида уксусной кислоты. Через 4 ч помешивания при 20оС к смеси добавляют 1,8 л полунасыщенного водного раствора поваренной соли, причем выпадает в осадок масло. Водную фазу декантируют, масло впитывается хлоридом метилена, органическая фаза промывается водой и сушится с сульфатом натрия. После отгонки растворителя остается масло, которое кристаллизуется из диэтилового эфира. Получают 3,5 г кристаллического преднизолон-17-изобутилкарбонат-21-ацетата с температурой плавления 185оС.
MS m/z 503 (M+H+)
b) К
раствору 6,85 преднизолон-17-изобутилкарбоната в 68 мл абсол. пиридина добавляют при помешивании при 0оС в течение 60 мин. 2 г чистого
хлорида пропионовой кислоты в 2 мл диоксана. Через 30
мин помешивания при 0оС и через 3 ч помешивания при 20оС реакционная смесь выливается в 1,8 л воды, содержащей 100 г NaCl.
Маслянистый осадок отфильтровывают, хорошо промывают
водой и сушат в высоком вакууме. Получают 6,3 г пены, которая имеет в DC наряду с главным пятном при Rf 0,7 еще более слабые побочные
пятна при Rf около 0,5-0,55. Для получения
в чистом виде хроматографируют на 150 г силикагеля (размер зерен 0,063 0,200 мм/Мерк АГ/; колонна 28 х 5 см) с 1,7 л хлорида метилена и 800 мл
хлорида метилена/метанола 995:5. После отгонки элюента
получают из диэтилового эфира 3,8 г кристаллического преднизолон-17-изобутилкарбонат-21-п-пропи- оната с температурой плавления 136о
С.
MS m/z 571 (M+H+)
DC Rf

П р и м е р 3. Аналогично примеру 1 а.1 или а.2 получают из кортикостероид-17, 21-ортоалкилкарбонатов формулы (V) приведенные в таблице 3 кортикостероид-17-алкилкарбонаты со свободной 21-гидроксильной группой (R1-OH) формулы I.
П р и м е р 4. Таким же
образом исходя из преднизолон-17-изопропилкарбоната, преднизолон-17-трет-бутилметилкарбона- та, преднизолон-17-метоксиэтилкарбоната, аналогично
примеру 1, 2b получают
преднизолон-17-изопропилкарбонат-21-пропио- нат,
MS m/z 503 (M+H+) преднизолон-17-трет-бутилмлетилкарбо- нат-2-пропионат
MS m/z 531 (M+H+
)
преднизолон-17-метоксиэтилкарбонат-21-пропионат,
MS m/z 519 (M+H+) аналогично примеру 2. (2.а): преднизолон-17-изо-пропилкарбонат-21-ацетат,
MS m/z 489 (M+H+)
преднизолон-17-трет-бутилметилкарбонат-21-ацетат,
MS m/z 505 (M+H+) преднизолон-17-метиоксиэтилкарбонат-21-ацетат.
MS m/z 505 (M+H+)
П р и м е
р
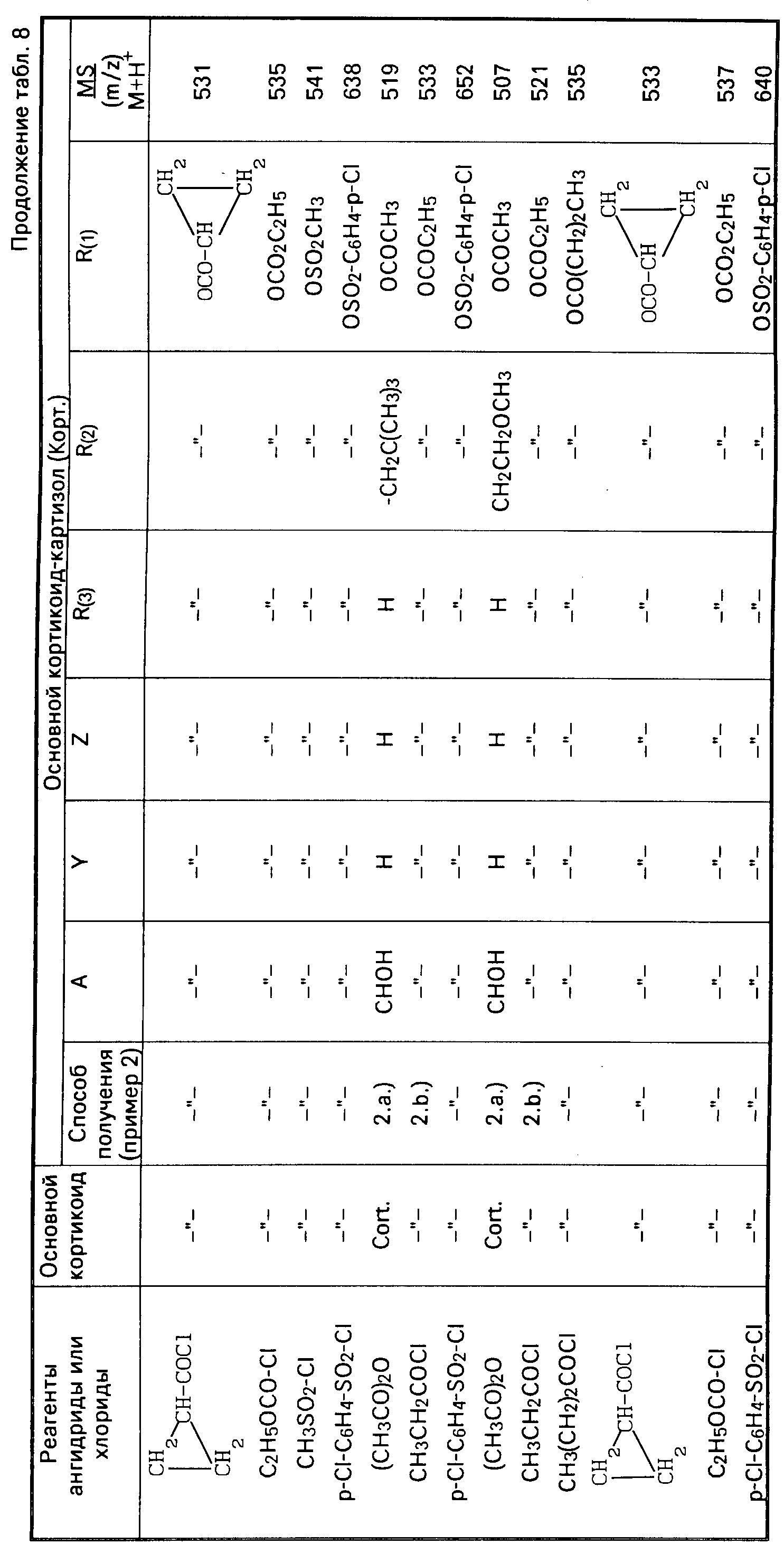
5. Аналогично примерам 2.а. и 2.b, получают следующие кортикостероид-17-алкилкарбонат-21-карбонокислый эфир (R1) OCO(CH2)n R4), -21-угольнокислые эфиры
(R1 OCO2(CH2)2 R4 или 21-алкил- или арилсульфокислые эфиры (R1 OSO2R5) формулы (I) в соответствии с табл.4-9,
если в примере 2.а используют вместо ангидрида уксусной кислоты аналогичные ангидриды карбоновой кислоты (СО[СО(СН2)nR4]2) или вместо хлорида пропионовой
кислоты в примере 2.b. соответствующие хлориды карбоновой кислоты (Сl-CO-(CH2)nR4) или хлориды угольной кислоты или эфиры хлормуравьиной кислоты (Сl-СО-О-(СН2)nR4) или алкил- или арилсульфокислые хлориды (Сl-SO2-R5).
Значения А, Y, Z, R3, R2, R1, R4, R5 указаны вначале к формуле (I).
Примечание.
В соответствующих реакциях с алкил- или арилсульфокислыми хлоридами добавляют преимущественным образом абсолютный ацетон к реакционной смеси, причем соотношение ацетон и пиридина приблизительно 10:4.
В реакциях с хлоридами карбоновой кислоты преимуществнным образом добавляют часто абсолютный диоксан к реакционной смеси, например, в случае хлорида циклопропилкарбоновой кислоты, причем соотношение диоксана и пиридина около 1: 1, а для ускорения реакции реакционную смесь часто, в частности, в случае с хлоридом циклопропилкарбоновой кислоты, нагревают приблизительно до 60оС (DC-проверка течения реакций).
Характеристика продуктов реакции проводится тонкослойной хроматографией (DC); при этом продукты реакции имеют Rf значения около 0,65 0,75. Как правило, характеризуют продукты реакции с помощью масс-спектров с МS м/z /M+H+ /. (Как правило, FАВ-спектры).
М+H+ значения соответственно округляют. Также IR-,1H-NMR- и UV-спектры могут привлекаться для характеристики.
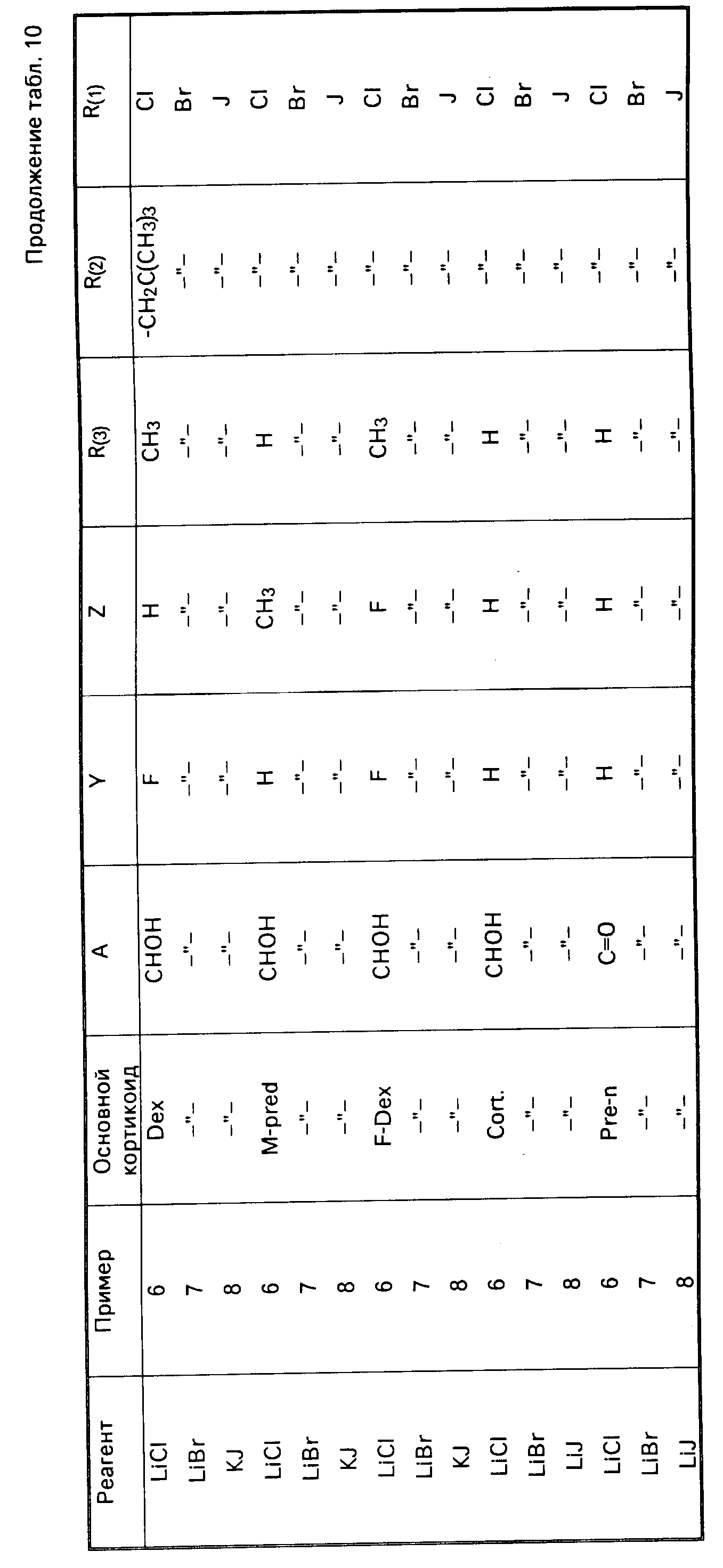
П р и м е р 6. Раствор из 540 мг преднизолон-17-изобутилкарбонат-21-р-хлорбен- золсульфоната в 5,6 мл абсолютного диметилформамида смешивают с 1,04 г сухого хлорида лития и помешивают в N2 - атмосфере 4 ч при 100оС, затем выливат в 200 мл водного раствора поваренной соли. Фильтруют образовавшийся осадок, сушат его и перекристаллизовывают его из ацетона (метиленхлорида) диэтилового эфира. Получают 420 мг преднизолон-17-изобутилкарбонат-21-хлорида. Температура плавления 132оС.
MS m/z 480 (m+H+)
DC 0,7
Аналогично
получают из преднизолон -17-изопропилкарбонат-21-р-хлорбензол- сульфоната преднизолон-17-изопропилкарбонат-21-хлорид, из
преднизолон-17-трет-бутилметилкарбонат-21-р-хлорбензолсуль- фоната
преднизолон-17-трет-бутилметилкарбонат-21-хлорид, из преднизолон-17-метоксиэтилкарбонат-р-хлорбензолсульфо- ната
преднизилон-17-метоксиэтилкарбонат-21-хлорид.
П р и м е р 7. Раствор 300 мг преднизолон-17-изобутилкарбонат-21-р-хлорбензол- сульфоната в 3 мл абсолютного диметилформамида смешивают с 630 мг сухого бромида лития и перемешивают в N2-атмосфере 4 ч при 110оС. Реакционную смесь выливают в 20 мл водного раствора поваренной соли, фильтруют образовавшийся осадок, сушат его и хроматографируют его на силикагеле (размеры колонны 17 х 3 см) с хлоридом метилена (метанолом) 99 1 в качестве элюационного средства. После отгонки растворителей получают кристаллизацией из диэтилового эфира 310 мг преднизолон-17-изобутилкарбонат-21-бро- мида.
MS m/z 524 (M+H+)
Тот же самый продукт, если вместо LiВr используют 0,5 г бромида калия, и
реакционную смесь подвергают дальнейшей обработке, и очистке (хроматография).
Аналогично получают из преднизолон-17- изопропилкарбонат-21-р-хлорбензолсуль- фоната
преднизолон-17-изопропилкарбонат-21-бромид; из преднизолон-17-трет-бутилметилкарбонат-21-хлорбензолсульфона- та
преднизолон-17-бутилметилкарбонат-21-бромид; из
преднизолон-17-метоксиэтилкарбонат-р-хлорбензолсульфоната преднизолон-17-метоксиэтилкарбонат-21-бромид.
П р и м е р 8. Раствор 540 мг преднизолон-17-изобутилкарбонат-21-р-хлорбензол- сульфоната в 10 мл абсол. диметилформамида смешивают с 1,00 г сухого йодида калия и перемешивают в N2-атмосфере 2 ч при 100оС. Выливают в 200 мл водного раствора поваренной соли, фильтруют образовавшийся осадок, сушат его и кристаллизуют его из ацетона (хлорида метилена) диэтилового эфира или хроматографируют его, как указано в примере 7 для соответствующего 21-бромида. Получают 300 мг преднизолон-17-изобутилкарбонат-21-йодида. Температура плавления 110оС.
MS m/z 571 (M+H+)
DC
0,7
Таким же способом получают из преднизолон-17-изопропилкарбонат-21-р-хлор- бензолсульфоната преднизолон-17-изопропилкарбонат-21-йодид; из
преднизолон-17-трет-бутилметилкарбонат-21-р-хлорбензол- сульфоната преднизолон-17-трет-бутилметилкарбонат-21-йодид; из преднизолон-17-метоксиэтилкарбонат-р-хлорбензолсульфо- ната
преднизолон-17-метоксиэтилкарбонат-21-йодид. Такие же продукты реакции получают, если кипятят 300 мг приведенного выше 21-хлорсульфоната с 60 мг йодида лития в 6 мл абсолютного ацетона или
бутанола-(2) 3 ч в атмосфере N2 при кипячении, выливают в 20 мл Н2О, экстрагируют хлоридом метилена, после обычной переработки кристаллизуют из диизопропилового эфира (200-300
мг
выхода).
П р и м е р 9. В соответствии с табл.10 получают с помощью алкилгалогенидов из основных кортикоид-17-алкил- или 17-метоксиэтилкарбонат-21-р-хлорбензолсуль- фонатов соответствующие 21-галогенидпроизводные формулы (I), если проводят реакцию таким образом, как описано для примера 6, 7 и 8. Характеристика продуктов реакции может осуществляться с помощью тонкослойной хроматограии (DC); при этом продукты реакции имеют Rf значения около 0,65-0,75. Как правило, продукты реакции характеризуются с помощью масс-спектров с MS m/z (M+H+ ) (как правило, FAB-спектры).
М+H+ значения соответственно округляли. Также IR-,1H- NMR и UV-спектры могут использоваться при характеристике.
П р и м е р 10. К раствору 1,5 г преднизолон в 45 мл абсолютного диоксана добавляют 7 мл тетра-изопропилового эфира ортоугольной кислоты, а также 0,2 г р-толуолсульфокислоты. После 3-5 ч нагревания при 60оС и перемешивания DC-диаграмма показывает интенсивное пятно с Rf значением около 0,8 для необходимого продукта реакции и лишь едва различимое внешне "пятно" исходного продукта с Rf значением около 0,3. Реакционную смесь выливают в 500 мл водного раствора поваренной соли, фильтруют осадок, промывают его водой и сушат. После перекристаллизации из хлорида метилена (этанола)диэтилового эира по- лучают 1,3 г преднизолон-17, 21-диизопропил-орто-карбоната с температурой плавления 185оС.
MS m/z 489 (M+H+)
IR
3420, 1730,
1660, 1620, 1600, 1100 см-1
UV:λмакс= 242,5 мм, ∈ 15600
При использовании вновь исходной смеси, которая теперь вместо нагревания до
60о
С перемешивается 3 ч при 20оС (комнатная температура), получают согласно аналогичным переработкам реакционный продукт (1,1 г), который во всех спектральных характеристиках
(например,
МSM+H+ 360) значительно идентичен исходному веществу преднизолону. DС Rf= 0,3 очень сильное пятно (преднизолон), Rf около 0,8 видно лишь очень слабое
пятно
(необходимый продукт реакции).
П р и м е р 11. К раствору 25 г преднизолон в 750 мл абсолютного диоксана добавляют 70 мл тетраизобутилового эфира ортоугольной кислоты, а также 2 г р-толуолсульокислоты. После 5 ч нагревания при 60оС и перемешивания DC-диаграмма показывает интенсивное пятно с Rf значением около 0,8 необходимого продукта реакции еще едва различимое снаружи "пятно" исходного продукта с Rf значением около 0,3. Реакционную смесь выливают в 8 л водного раствора поваренной соли, фильтруют осадок, промывают его водой и сушат. После перекристаллизации из хлорида метилена (этанола) диэтилового эира получают 38,8 г преднизолон-17,21-диизобутил-орто-карбо- ната с температурой плавления 113оС.
MS m/z
517 (M+H+)
IR 3380, 1750, 1735, 1660, 1615, 1600, 1120, 1090 см-1
П р и м е р 12. К раствору 25 г преднизолона в 550 мл абсолютного диоксана добавляют 60 мл
тетра-трет-бутилметилового эфира ортоугольной кислоты, а также 2 г р-толуолсульфокислоты. Через 6 ч нагревания при 60оС и помешивания DC-диаграмма показывает интенсивное пятно с Rf значением около 0,8 необходимого реакционного продукта и еще едва различимое извне (пятно) исходного продукта с Rf значением около 0,3. Реакционную смесь выливают в 8 л водного
раствора поваренной соли, фильтруют маслянистый осадок, он поглощается хлоридом метилена, промывают органическую фазу водой, сушат ее, отгоняют растворитель. Масло (35 г) хроматографируют на оксиде
алюминия, Akt StII (колонна 25 х х8 см) с хлоридом метилена в качестве элюационного средства (100 мл фракции). Фракции, которые показывают в DCRf значением около 0,8 см, объединяют,
отгоняют элюационного средства и получают после очистки 14 г желтого маслянистого преднизолон-17,21-ди-трет -бутилметилортокарбоната.
MS m/z 545 (M+H+)
П р и м е р
13. К раствору 25 г преднизолона в 500 мл абсолютного диоксана добавляют 7 мл тетраметоксиэтиловго эфира ортоугольной кислоты, а также 2 г р-толуолсульфокислоты. После 5 ч нагревания и при 60оС и перемешивания DC-диаграмма показывает интенсивное пятно с Rf значением около 0,8 необходимого реакционного продукта и еще едва различимое извне "пятно" исходного продукта с
Rf значением около 0,3. Реакцинную смесь выливают в 8 л водного раствора поваренной соли и отфильтровывают от маслянистого осадка. Дальнейшая обработка и хроматография (очистка) так, как в
примере 12. Получают 27,5 г преднизолон-17,21-диметоксиэтилортокарбоната с температурой плавления 125оС (разложение) при растирании с диэтиловым эфиром.
MS m/z 521 (M+H+)
IR 3400, 1725, 1660, 1620, 1600, 1125, 1060 см-1.
П р и м е р 14. Аналогично примеру 10, получают, если используют вместо преднизолона: из дексаметазона дексаметазон-17,21-диизопропилортоакрбонат.
MS m/z 521 (m+H+) из 6α -метилпреднизолона-6α -метилпреднизолон-17,21-диизопропилортокарбонат.
MS
m/z 503 (M+H+) из 6α -фтордеса-метазола 6α -фтордексаметанон-17, 21-диизопропилортокаробнат,
MS m/z 539 (M+H+) из кортизола кортизол-17,
21-диизопропилортокарбонат,
MS m/z 491 (M+H+) из преднизолона преднизон-17,21-диизопропилортокарбонат,
MS m/z 487 (M+H+) из кортизона кортизон-17,
21-диизопропилортокарбонат,
MS m/z 489 (M+H+) из вещества Райхштайна S-(вещество Райхштайна S)-17,21-диизопропилортокарбонат,
MS m/z 475 (M+H+) из 6 α
-16 α -диметилпреднизолона 6 α -16 α диметилпреднизолон-17,21-диизопропи- лортокарбонат,
MS m/z 517 (M+H+) из 6α -фторпреднизолона 6α
-фторпреднизолон-17,21-изопропилортокарбонат,
MS m/z 507 (M+H+)
П р и м е р 15. Аналогично примеру 11 получают, если используют вместо преднизолона: из дексаметазона
дексаметазон-17,21-диизобутилортокарбонат,
MS + m/z 549 (M+H+) из 6α -метилпреднизолона 6α -метилпреднизолон-17,21-ди-изобутилортокарбонат
MS + m/z 531
(M+H+) из 6 α -фтордексаметазона-6α -фтордексаметазон-17,21-диизобутилортокарбонат,
MS m/z 567 (M+H+) из кортизола кортизол 17,
21-ди-изобтил-ортокарбонат
MS m/z 519 (M+H+) из преднизона преднизон-17,21-диизо-бутил-ортокарбонат,
MS m/z 515 (M+H+) из кортизона кортизон-17,
21-диизобутилортокарбонат,
MS m/z 517 (M+H+) из вещества Райхштайна S (вещество Райхштайна S)-17,21-диизобутилортокарбонат,
MS m/z 503 (M+H+) из 6α
-16α -диметилпреднизолона 6α -16α -диметилпреднизолон-17,21-диизобутилизобу- тилортокарбонат,
MS m/z 545 (M+H+) из 6α -фторпреднизолона 6α
-фторпреднизолон-17,21-диизобутилортокарбонат,
MS m/z 535 (M+H+) из 6α -метил-дексаметазона- 6α -метил-дексаметазон-ди-изобутил-ортокарбонат.
П р и м
е р 16. Таким же образом, как описано в примере 12, получают, если используют вместо преднизолона: из дексаметазона-дексаметазон-17,21-ди-трет-бутил- метил-ортокарбонат,
MS m/z 577 (M+H+) из 6 α -метилпреднизолона- 6 α -метилпреднизолон-17,21-ди-трет -бутилметил-ортокарбонат,
MS m/z 559 (M+H+) из 6α -фтордексаметазона 6α
фтордексаметазон-17,21-ди-трет- бутилметил-ортокарбонат,
MS m/z 595 (M+H+) из кортикозола-кортизол-17,21-ди-трет-бутилметил-ортокарбонат,
MS m/z 547 (m+H+) из
преднизона-преднизон-17,21-ди-трет -бутилметил-ортокарбонат.
MS m/z 543 (М+H+)
П р и м е р 17. Таким же образом, как описано в примере 13, получюат, если
используют
вместо преднизолона: из дексаметазона-дексаметазон-17,21 ди-метокси- этил-ортокарбонат,
MS m/z 553 (M+H+) из 6 α-метилпреднизолона-6α -метилпреднизолон-17,
21-ди-изометоксиэтил-ортокар- бонат,
MS m/z 535 (M+H+) из 6 α -фтордексаметазона-6α -фтордексаметазон-17,21 -ди-метоксиэтилортокарбонат,
MS m/z (M+H+) из кортизола-кортизол-17,21-ди-метоксиэтилортокарбонат,
MS m/z 523 (M+H+) из преднизона-преднизон-17,21-ди-метоксиэтил-ортокарбонат.
MS m/z 519 (M+H+)
Реферат
Использование:
в
качестве противовоспалительного препарата. Сущность: кортикоид-17-алкилкарбонаты ф-лы I с определенными значениями радикалов. Продукт получают кислым гидролизом с помощью слабой кислоты
соответствующего 17, 21-ортоэфира, с последующей этерификацией полученного 21 - гидроксипроизводного ф-лы I. Структура соединения ф-лы I
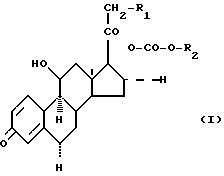
где R1 - O - ацил ф-лы -O - CO - (CH2)n - R3; n=0, 1, 2, R3 - C1 - C3 алкил; R2 - разветвленный алкил C3 - C6. 1 з. п. ф-лы, 9 табл.
Формула

где R1 0-ацил формулы -O-CO-(CH2)n-R3;
n 0, 1, 2;
R3 C1 -C3-алкил;
R2 разветвленный C3-C6-алкил.
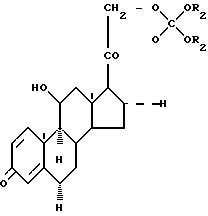
где R2 имеет указанные значения
с последующей этерификацией полученного 21-гидроксипроизводного формулы I, где R1 OH, ангидридом карбоновой кислоты общей формулы III
R3 (CH2)n COOH,
где R3 и n имеют указанные значения.

Комментарии