Способ получения гидрокортизона, соединения в качестве промежуточных продуктов в синтезе гидрокортизона - RU2060257C1
Код документа: RU2060257C1
Описание
Изобретение
относится к способу получения гидрокортизона и к новым промежуточным соединениям синтеза, а именно к способу получения
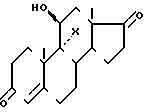
гидрокортизона формулы I


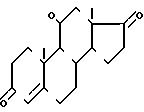
HO-(CH2)n-SH или HS-(CH2)n-SH, где n равно 2 или 3, для получения соединения формулы IV




HaI3C CO2R где Hal атом хлора или брома и R С1-С6 алкил или радикал аралкил с 7 15 атомами углерода, в присутствии цинка или кислоты Льюиса, для получения соединения формулы VI

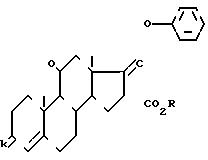


Таким образом,
изобретение касается способа получения гидрокортизона, заключающегося в том, что галогенгидрин формулы II

HO-(CH2)n-SH или HS-(CH2)n-SH где n имеет определенное выше значение, для получения соединения формулы IV:
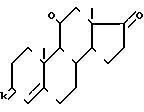

Hal3C CO2R, а затем продолжают синтез как это описано выше.
В частности предметом изобретения является способ получения, описанный выше, заключающийся в том, что в соединении формулы (II) Х атом брома.
Реакция перегруппировки галогенгидрина предпочтительно ведется в присутствии такого высшего спирта или многоатомного спирта, как, например, глицерин или диол, такой как пропиленгликоль или, предпочтительно этиленгликоль, употребляемого в избытке, нагревая до температуры ниже 100оС. Можно работать в присутствии растворителя, предпочтительно с точкой кипения ниже 100оС, причем нагревание осуществляют с рефлюксом. Сорастворителем является инертный растворитель в условиях реакции, например этиловый эфир уксусной кислоты.
Обработка кислотой ведется водной кислотой, например соляной кислотой, серной кислотой или бромистым водородом.
Защита функции 3-оксо ведется действием дитиола в кислой среде, в частности этандитиолом в присутствии концентрированной соляной кислоты или бромистого водорода в каталитическом количестве, или в присутствии кислоты Льюиса, такой как хлористый цинк, тетрахлорид титана или трифторид бора, предпочтительно в виде эфирной вытяжки.
Блокировку функции 3-оксо, а затем перегруппировку галогенгидрина можно проводить по способу без выделения промежуточного продукта формулы (V).
Перегруппировка галогенгидрина облегчается промежуточной блокировкой функцией оксо в положении 3 или 3 и 17, что позволяет использовать очень мягкие условия реакций.
В этой связи можно указать, что вследствие блокировки появляется неустойчивость связи углерод галоген в положении 9, что облегчает перегруппировку.
Кислотой Люьиса при обработке соединения формулы (IV) тригалоацетатом является, например, хлористый цинк, хлористый алюминий, хлористый диэтилалюминий или, предпочтительно, тетрахлорид титана.
Тригалоацетатом алкила является в частности трихлорацетат метила или этила.
Действуют, предпочтительно, в среде циклического эфира, такого как тетрагидрофуран или диоксан.
Действие фенола на соединение формулы (VI) осуществляется в присутствии гидроокиси или щелочного или щелочноземельного карбоната, в частности натрия, калия, бария или кальция, гидрида, алкоголята, или амида щелочного металла, в частности натрия, калия или лития, или еще алкила лития, в частности бутил лития.
Действуют в среде органического растворителя, например кетона, такого как ацетон или метилэтилкетон, а при случае, в смеси с галогенированным растворителем, таким как хлористый метилен или с эфиром, таким как диоксан или тетрагидрофуран.
Восстановителем может быть, в частности, гидрид, предпочтительно, алюминия, например алюмогидрид лития, или щелочной борогидрид, например борогидрид натрия, при случае, катализированный солью лития или борогидрид лития.
Снятие защиты функции 3-оксо ведется действием иода в присутствии основания, например щелочного бикарбоната, или действием иода в каталитическом количестве в присутствии окислителя, в частности перекиси водорода. Обычно работают в растворителе, таком как низший алканол, например метанол или этанол, в смеси с галогенированным растворителем, например хлористый метилен в присутствии воды.
Средством эпоксидации может быть перкислота, такая как метахлорпербензойная кислота, надфталевая кислота, первольфрамовая кислота или перекись водорода, одна или в присутствии гексахлор- или гексафторацетона.
Можно действовать в среде органического растворителя, такого как хлористый метилен, тетрахлорметан, хлороформ, метанол, тетрагидрофуран, диоксан, толуол или этиловый эфир уксусной кислоты, при случае в присутствии воды. Можно также действовать в буферной среде, например, вторичного фосфата натрия или смеси третичного фосфата натрия фосфорной кислоты.
Гидролиз эпоксида производится действием водной кислоты, причем кислотой является минеральная кислота, такая как соляная кислота, сеpная кислота или азотная кислота.
Предметом изобретения являются
новые промышленные соединения в качестве
промежуточных соединений, необходимых для выполнения описанного способа. Этими соединениями являются:
соединения формулы F



где n равна 2 или 3, в частности 2, и либо L радикал оксо, причем линия пунктиром в положении II одна связь и Х атом водорода, либо L радикал гидрокси в положении β причем линия пунктиром в положении II не представляет связь и Х атом хлора, брома или иода, в частности атом брома,
соединения формулы G
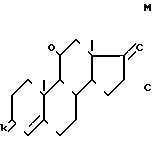
где K группировка/ защищающая радикал 3-оксо/ формулы


где n равно 2 или 3, в частности равно 2, М либо атом хлора или брома, в частности атом хлора, либо группировка
O

соединения формулы J

Соединения формулы (II) известны.
Пример иллюстрирует изобретение, но не ограничивает его.
П р и м е р. Гидрокортизон.
Стадия А. Циклический 3[(1, 2-этандиил)меркаптол]андрост-4-ен-3,11,17-триона.
а) Андрост-4-ен-3,11,17-трион.
В атмосфере инертного газа и при комнатной температуре смешивают 1,05 г 9- α -бром-11- β -гидроксиандрост-4-ен-3,17-диона, 7,5 см3этилового эфира уксусной кислоты и 2,5 см3 этиленгликоля. Нагревают с рефлюксом при перемешивании 10 ч, охлаждают, а затем прибавляют 10 см3 2 н.соляной кислоты и 10 см3 воды, перемешивают 20 ч, а затем удаляют этиловый эфир уксусной кислоты под уменьшенным давлением. После высаливания хлористым натрием охлаждают до около 0оС, отсасывают кристаллы, промывают их водой и сушат. Поглощают их хлористым метиленом, прибавляют этиловый эфир уксусной кислоты, отгоняют хлористый метилен, ледянят раствор и отсасывают кристаллы, а затем сушат их. Получают 0,52 г целевого продукта. Т.пл. 221оС. Экстракцией водного слоя хлористым метиленом и хроматографией на двуокиси кремния сырого продукта, элюируя смесью хлористый метилен этиловый эфир уксусной кислоты (95-5), после кристаллизации в этиловом эфире уксусной кислоты получают 0,097 г целевого продукта. Т.пл. 220оС.
б). Циклический 3[(1,2-этандиил)меркаптол]андрост-4-ен-3,11,17-триона.
В инертном газе при комнатной температуре перемешивают 100 см3 метанола, 5 г продукта, полученного как это указано выше, 1,8 см3этандитиола и 2,5 см3 эфирной вытяжки трифторида бора. Перемешивают 1 ч 30 мин и отгоняют метанол, поглощают хлористым метиленом, промывают насыщенным водным раствором бикарбоната натрия, водой и сушат, а затем доводят досуха. Полученный продукт кристаллизуют в гексане и получают 5,99 г целевого продукта. Т.пл. 160оС.
ЯМР-спектр (CDCl3 90 МГц чнм).
18-СН3 0,85; 19-CH3 1,27; тиокеталь: 3,7-3,47; Н4 5,6.
ИК-спектр (СHCl3).
Отсутствие δ -4-3-она; поглощение при 1645 см-1 (С=С), 1709 см-1(С=0 в 11), 1740 см-1 (С=0 в 17).
Стадия А'.
Циклический 3[(1,2-этандиил)меркаптол]андрост-4-ен-3,11,17-триона.
В инертном газе смешивают 4 г 9 α -бром-11- β -гидроксиандрост-4-ен-3, 20-диона и 40 см3 этилового эфира уксусной кислоты, а затем при комнатной температуре прибавляют 0,9 см3 этандитиола. Потом медленно прибавляют 0,09 см3 соляной кислоты в 22оБе, затем выдерживают при перемешивании 6 ч. Прибавляют 9,3 см3этиленгликоля, нагревают с рефлюксом 20 ч, а затем охлаждают до 20оС и реакционную смесь выливают в смесь 40 см3 2 н. соляной кислоты и 30 см3 воды, перемешивают 16 ч, а затем удаляют этиловый эфир уксусной кислоты под уменьшенным давлением (20 мм/Hg) при максимум 35о С. Затем охлаждают суспензию до 0 5оС, перемешивают 1 ч и отсасывают кристаллы. Промывают их водой, а затем сушат и хроматографируют на двуокиси кремния, элюируя смесью гексан-диоксан (9-1). Получают 3,2 г целевого продукта.
ЯМР-спектр (CDCl3 300 МГц чнм).
18-СН3 0,84 (S); 19-CH3 1,26 (S); тиокеталь: 3,15 3,4 H4 5,57; скелетная формула 1,1 2,61 (м).
ИК-спектр (CHCl3).
Поглощения при 1741 1709 см-1 (кетоны); 1641 см-1 (С=С).
Стадия Б.
Метиловый эфир 20-хлор-3,3-[1,2-этандиил-бис(тио)] -11-оксо-прегна-4, 17(20)-ди-ен-21-оновой кислоты.
В инертной атмосфере смешивают 100 см3 тетрагидрофурана и 12,55 г порошка цинка. Медленно прибавляют при от -10 до -15оС, 7,9 см3тетрахлорида титана, а затем смесь 100 см3 тетрагидрофурана, 8,6 см3метиловый эфир трихлоруксусной кислоты и 18 г продукта, полученного как описано на стадии А или А'. Дают температуре подняться, а затем перемешивают при комнатной температуре 1 ч 30 мин. Прибавляют при 10 15оС, 100 см3 смеси вода пиридин (4-1), перемешивают смесь 1 л, давая температуре подняться, а затем прибавляют 100 см3 смеси вода концентрированная соляная кислота (6-4). Перемешивают 15 мин, экстрагируют хлористым метиленом, промывают водой органический слой, сушат его и отгоняют растворитель. Кристаллы растворяют в хлористом метилене, прибавляют изопропиловый эфир, отгоняют хлористый метилен, охлаждают и отсасывают кристаллы. Маточные растворы хроматографируют на двуокиси кpемния, элюируя смесь циклогексан-этиловый эфир уксусной кислоты (8-2). Получают 21,8 г целевого продукта. Т.пл. ≈ 175оС.
ИК-спектр (CHCl3).
Поглощения при 1715 см-1 и 1730 см-1 (С=0) макс. 1705 см-1, 1643 см-1 (C=C δ 4) и 1610 см-1 (С=С).
ЯМР-спектр (CDCl3 0, МГц чнм)
Смесь изомеров 20
Сl.
18-СН3: 1,02 -0,98; 19-CH3 1,25; тиокеталь 3,33; CH3 -сложный эфир 3,83 3,82; Н4 5,58.
Стадия В.
Метиловый эфир 20-фенокси-3,3[1,2-этандиил-бис-(тио)]11-оксо-прегна-4,17(20)-диен-21-оновой кислоты.
В инертной атмосфере нагревают с рефлюксом смесь 18 г фенола, 150 см3 бутанона, 30 г продукта, полученного по способу, описанному на стадии Б, и 17,7 г карбоната калия. Спустя 16 ч смесь выливают в смесь 100 см3 воды, 90 г льда и 10 см3 10%-ного раствора едкого натра, Экстрагируют хлористым метиленом, промывают водой органический слой и концентрируют его. Поглощают метанолом, оставляют медленно остужаться и отсасывают кристаллы, а затем сушат их. В два приема получают 27,4 г целевого продукта. Т.пл. ≈ 208-210оС.
ИК-спектр (CHCl3).
Поглощение при 1592 1491 см-1 (ароматическое соединение типа С6Н5-О-); 1714 1705 см-1 (С=С); 1646 см-1 (С=С).
ЯМР-спектр (CDCl3 90 МГц чнм).
18-СН3 0,9; 19-CH3 1,21; тиокеталь: 3,33; CH3 сложный эфир: 3,63; Н4 5,58; C6H5 6,81 7,39. Смесь изомеров 20-О-С6Н5.
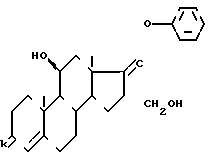
Стадия Г.
Циклический (11 β ) 3,3-[(1,
2-этандиил)меркаптол]-20-фенокси-11,21-дигидрок-сипрегна-4,17(20)-ди ен-3
В инертном газе смешивают 20 г
полученного на стадии В продукта и 200 см3 толуола, охлаждают до -25оС и медленно вводят 110 см3 20%-ного раствора алюмогидрида диизобутила в толуоле. Дают температуре
подняться до 10оС, перемешивают 1 ч, а затем заново охлаждают до
-15оС. Медленно прибавляют 10 см3 метанола, дают температуре подняться до 0оС и медленно
прибавляют 200 см3 2 н. раствора соляной кислоты. Декантируют,
промывают водой органический слой, сушат и отгоняют растворитель. Остаток хроматографируют на двуокиси кремния, элюируя смесью
толуол-этиловый эфир уксусной кислоты (9-1). Получают 17,4 г целевого
продукта.
ИК-спектр (CHCl3).
Поглощение при 1490 1596 см-1 (С6
Н5-О-С); 1644 см-1 (С=С δ 4) и 1682 см-1 (С=С); 3612 см-1 (ОН свободный)
ЯМР-спектр (CDCl3 C5D5N) (90 МГц
чнм)
18-СН3 1,17; 19-CH3 1,29; тиокеталь
3,33 CH2OH 4,15; H11 4,32; H4 5,45.
Стадия Д.
(11 β) 11, 21-дигидрокси-20-феноксипрегна-4,17(20)-диен-3-он.
5 г Полученного продукта растворяют в 10 см3 хлористого метилена и 30 см3 метанола, прибавляют 2,5 см3 опресненной воды, а затем 0,3 г иода. Получают рН 1,5 и в течение 15 мин вводят 1,4 см3 50%-ной перекиси водорода. Силу окисления нейтрализуют прибавкой 2 г тиосульфата натрия. Затем прибавляют 5 г кларцеля, фильтруют и концентрируют досуха под уменьшенным давлением. Сухой экстракт растворяют в хлористом метилене, промывают его раствором 1 г тиосульфата натрия в 25 см3 воды, декантируют, сушат и концентрруют досуха под уменьшенным давлением и получают 4,8 г сырого целевого продукта.
1,8 г этого продукта очищают хроматографически на двуокиси кремния (элюант хлористый метилен изопропанол 97,5 2,5) и получают 1,7 г целевого продукта. Т.пл.188оС.
ИК-спектр (СНСl3).
Поглощения при 3613
см-1 (ОН); 1662, 1617 и 868 см-1
(дельта 4-3 оксо); 1597-1491 см-1 (-O-C6H5)
ЯМР-спектр (CDCl3 C5D5N 90
МГц чнм.).
18-СН3 1,17; 19-CH3 1,42; H11 4,27; H4 5,67; CH2OH 4,11; C6H5 6,87 до 7,37.
Стадия Е.
(11 β ) 11, 21-дигидрокси-17,20-эпокси-20-феноксипрегна-4-ен-3-он.
В инертном газе смешивают 1,0 г полученного на стадии Д продукта, 10 см3 этилового эфира уксусной кислоты и 5 см3 воды. Прибавляют 0,5 г вторичного фосфата натрия, 0,65 г надфталевой кислоты и 0,75 см3 50%-ной перекиси водорода, перемешивают 3 ч 15 мин, прибавляют 0,15 г вторичного фосфата натрия и 0,20 г надфталевой кислоты и перемешивают 1 ч 15 мин. Затем прибавляют 20 см3 этилового эфира уксусной кислоты и 9 см3 1 н. раствора едкого натра, перемешивают 5 мин, декантируют, промывают органический слой водой и водой, содержащей бисульфит натрия и 1 н. раствор серной кислоты, сушат и упаривают досуха. Получают 1,05 г сырого целевого продукта (который неустойчив), употребляемые в данном виде на следующей стадии.
Rf: 0,28 (двуокись кремния -СН2Сl2) диоксан -90(10)
ИК-спектр (CHCl3
).
Поглощение при 3613 см-1 (ОН): 1662 и 1616 см-1 ( δ 4-3-он); 1600, 1590 и 1494 см-1 (ароматическое соединение).
ЯМР-спектр (CDCl3 300 МГц чнм).
18-СН3 1,29 (S); 19-CH3 1,43 (S); -C-CH2-O-; 3,49 (dd) и 4,20 (dd); H11 экв. 4,32; H4 5,68; H от О-С6Н5 пара 7,06 (т), орто 7,13 (d) и мета 7,29 (т).
Стадия Ж. Гидрокортизон.
В инертном газе смешивают 5 см3 метанола, 3 см3 воды и 0,08 см3 1 н. раствора серной кислоты (рН 2). При комнатной температуре прибавляют 0,525 г полученного на стадии Е продукта и перемешивают 16 ч. Нейтрализуют прибавлением бикарбоната натрия и экстрагируют хлористым метиленом. Органический слой сушат и упаривают досуха. Остаток поглощают хлористым метиленом, содержащим 5 метанола, в горячем виде, а затем концентрируют до начала кристаллизации. Дают остыть, отсасывают кристаллы и сушат их. Концентрируют маточные растворы и остаток хроматографируют на двуокиси кремния, элюируя смесью хлористый метилен метанол (95 5). Получают в общем 0,318 г целевого гидрокортизона. Т.пл. 224оС. α+164о ± 2,5о (К 1 этанол).
ИК-спектр (вазелиновое масло).
Поглощение при 3430 см-1 (ОН), 1710 см-1 (С=О), 1642, 1630 и 1610 см-1 ( δ 4-3-он).
Реферат
Использование: в синтезе известного стероидного препарата гидрокортизона. Сущность: новый способ получения гидрокортизонов, состоящий из восьми стадий, и новые промежуточные соединения в синтезе гидрокортизонов ф-л, указанных в тексте описания. 4 с. и 13 з. п. ф-лы.
Формула

отличающийся тем, что либо галогенгидрин общей формулы II

где X хлор, бром или иод,
подвергают реакции перегруппировки в присутствии высшего спирта или многоатомного спирта для получения после обработки кислотой продукта формулы III

функцию 3-оксо которого селективно защищают действием тиола или дитиола формулы
HO -(CH2)n SH или HS (CH2)n -SH,
где n 2 или 3,
для получения соединения общей формулы IV

где K защитная группа для 3-оксо функции формулы


n имеет значение,
или указанное соединение формулы II обрабатывают средством для защиты функции 3-оксо, соответствующим для значений K, для получения соединения общей формулы V

где X и K имеют указанное значение,
которое далее подвергают реакции перегруппировки в присутствии спирта для получения после обработки кислотой соединения формулы IV, а затем обрабатывают данное соединение формулы IV тригалоидацетатом формулы
Hal3C CO2 R
где Hal хлор или бром;
R C1-C6-алкил или C7-C15-аралкилгруппа,
в присутствии цинка и кислоты Льюиса для получения соединения общей формулы VI
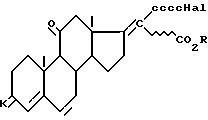
где K, Hal и R имеют указанные значения,
которое в щелочной среде обрабатывают фенолом для получения соединения общей формулы VII

где K и R имеют указанные значения,
которое затем подвергают воздействию восстановителя для получения соединения формулы VIII

где K имеет указанное значение,
функцию 3-оксо которого освобождают от блокировки для получения соединения формулы IX

которое обрабатывают средством эпоксидирования для получения соединения формулы X

которое гидролизуют в кислой среде.
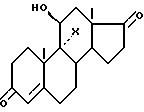
где X имеет указанное значение,
подвергают реакции перегруппировки в присутствии высшего или многоатомного спирта для получения после обработки кислотой соединения формулы III

функцию 3-оксо которого селективно защищают действием тиола или дитиола формулы
HO-(CH)2SH или HS (CH2)n SH,
где n имеет указанное значение,
для получения соединения формулы IV

где K имеет указанное значение,
которое обрабатывают реактивом формулы Hal3C-CO2R, а затем продолжают синтез, как это описано в п. 1.
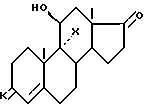
где X и K имеют указанное значение,
которое подвергают реакции перегруппировки в присутствии высшего или многоатомного спирта для получения после обработки кислотой соединения формулы IV, а затем обрабатывают соединение формулы IV реактивом формулы
Hal3C CO2R,
а затем продолжают синтез, как это описано в п. 1.

где K группировка, защищающая радикал 3-оксо формул

или

где n 2 или 3, предпочтительно 2,
L либо радикал оксо, причем линия пунктиром в положении 11 означает связь и X водород, либо L радикал гидрокси в положении β, причем линия пунктиров в 11 не представляет связь и X хлор, бром или иод и, в частности, бром,
в качестве промежуточных продуктов в синтезе гидрокортизона по пп. 1 - 14.
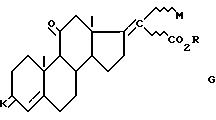
где K группировка, защищающая радикал 3-оксо формул
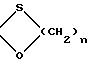
или

где n 2 или 3, в частности равно 2;
M хлор или бром, в частности хлор,
либо группировка

в качестве промежуточных соединений в синтезе по пп. 1 17.

где K1 кислород, или радикал K, который имеет указанные значения, причем линия пунктиром в положении 17 означает связь, либо K1 - кислород, линия пунктиром в положении 17 функция эпокси,
в качестве промежуточных соединений синтеза по пп. 1 14.

Комментарии