Способ получения 11-кетостероидного производного - RU2108340C1
Код документа: RU2108340C1
Описание
Изобретение касается способа получения 11-кетостероидного производного.
В частности, изобретение касается способа получения
соединения формулы (I)
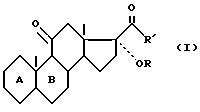
где
R - атом водорода или остаток сложного или простого эфира, R' - радикал метил или радикал -CH2OR'', причем R'' - остаток сложного или простого эфира, одинаковый или отличный от R, а циклы A и B означают группу
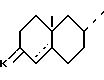
где
K - атом кислорода или группа, защищающая радикал 3-оксо, формулы
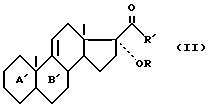
где
R и R' - определены выше и циклы A' и B' - либо циклы A и B, такие как они определены выше, либо один из следующих остатков:
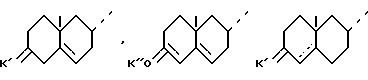
где
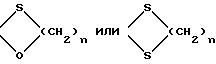
K' - защищающая группа формулы:
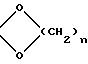
где
n определено выше, а K'' - радикал алкил с 1 - 8 атомами углерода и радикал алкил с 6 - 12 атомами углерода, в галогеногидрин формулы (III)
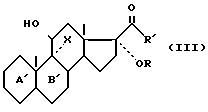
где
X - атом галогена и R, R', A' и B' определены выше, и отличается тем, что данный галогенгидрин подвергают реакции перегруппировки в присутствии спирта, чтобы получить, после обработки кислотой, целевое соединение формулы (I).
Под атомом галогена предпочтительно подразумевают атом хлора, брома или иода, причем бром является предпочтительным.
Когда R и R'' - остаток сложного эфира, то предпочтительно это радикал ацил с 1 - 8 атомами углерода и особенно радикал формил, ацетил, пропионил, бутирил, валерил или бензоил.
Когда R и R'' - остаток эфира, то предпочтительно радикал алкил с 1 - 6 атомами углерода, например метил, этил или пропил, радикал тетрагидропиранил или остаток силилированного эфира, например триалкилсилил, такой как триметил- или диметрил-трет-бутилсилил, триарилсилил, например трифенилсилил, или диарилалкилсилил, например дифенилтретбутилсилил.
Когда K'' - радикал алкил, то предпочтительно это радикал метил или этил.
Когда K'' - радикал арил, то предпочтительно это радикал фенил.
В частности, согласно изобретению реакцию перегруппировки ведут в присутствии высшего спирта или многоатомного спирта.
Высший спирт или многоатомный спирт предпочтительно выбирают в группе, образованной глицерином, этиленгликолем и пропиленгликолем, причем этиленгликоль особенно предпочтителен.
Предпочтительно действуют в присутствии спирта или многоатомного спирта, взятого в избытке, нагревая при температуре ниже 100oC. Под избытком подразумевают предпочтительно от 10 до 20 эквивалентов.
Кроме того, целесообразно работать в присутствии сорастворителя, инертного в условиях реакции, с точкой кипения ниже 100oC и с обратным холодильником.
Сорастворителем может быть, например, сложный эфир, такой как этиловый эфир уксусной кислоты, бензол или циклогексан. Особенно предпочитают этиловый эфир уксусной кислоты.
Последующая обработка кислотой предпочтительно ведется водной минеральной или органической кислотой, например соляной кислотой, бромистым водородом, серной, хлорной, азотной кислотами, паратолуолсульфокислотой, уксусной, муравьиной, щавелевой кислотой или же кислой смолой.
Обработка кислотой, в частности, приводит к освобождению кеталя, промежуточно образованного в положении 20 и, возможно, в положении 3, под действием спирта. Также, следствием этой обработки в случае, если употребляют в качестве исходного соединение формулы (II), где циклы A' и B' отличаются от циклов A и B и только в этом случае происходит освобождение системы 3-кето Δ4 или функции 3-кето.
В частности, согласно изобретению используют галогенгидрин формулы (III), где X - атом брома.
Изобретение также относится к способу, согласно которому используют галогенгидрин формулы (III), где циклы A' и B' - группа
формулы
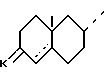
где
K и линия пунктиром в 4/5/ определены выше.
Согласно изобретению используют также галогеногидрин формулы (III), где R выбирается в группе, образованной атомом водорода, радикалом ацил с 1 - 8 атомами углерода, радикалом алкил с 1 - 6 атомами углерода, радикалом тетрагидропиранил и остатком силилированного простого эфира и R' - радикал метил или радикал -CH2-OR'', где R'' - одинаковый или отличный от R, имеет значения R, указанные выше.
Способ преобразования стероида 9α -гало- 11β -окси в производстве 11-кето описан в технической литературе (европейский патент 30368). Согласно этому способу нагревают галогеногидрин при повышенной температуре (180 - 350oC, практически 250 - 300oC) в присутствии апротонного растворителя с высокой точкой кипения, в течение короткого времени (несколько минут).
Растворителем является, в частности, дифенил, дибензофуран, окись дифенилена или метиловые эфиры многоатомных спиртов.
Способ согласно изобретению требует более мягких условий, что возможно только при получении промежуточных соединений, блокированных "по месту" на уровне кетоновых функций. Для сведения можно сказать, что вследствие блокировки связь углеводородгалоген в положении 9 становится неустойчивой, что облегчает перегруппировку и таким образом создает очень мягкие условия реакции. На практике реакцию ведут при температур ниже 100oC в присутствии соответствующего сорастворителя.
В способе по европейскому патенту N 30368 не предусмотрено образование промежуточных соединений, получаемых в способе изобретения, и из-за этого в известном способе требуются другие условия реакции, без которых он не приводит к искомому результату. Кроме того, совершенно очевидно, что такой способ, в котором необходимо кратковременно нагревать до высоких температур галогеногидрин, вряд ли может быть осуществлен на промышленном уровне, где используются реагенты в очень больших количествах. Напротив, способ данного изобретения легко позволяет осуществлять синтез в промышленном масштабе. Кроме того, применяя более мягкие условия, чем те которые описаны в европейском патенте N 30368, создается преимущество на уровне выхода целевого продукта, так как образование побочных продуктов или разложение очень ограничено, что таким образом представляет преимущество, поскольку этот синтез становится более экономичным на промышленном уровне.
Галогенгидрины формулы (III) обычно известны или могут быть легко получены способами, известными специалистам. В качестве примера можно привести: J. A. C. S. 79 1135 (1957), USP 2 763 671, 2 852 511 или 2 963 498, BF 1 188 434, USP 3 100 210, 3 084 174 или 3 499 081, ЕП. 97 328 или 3341 или еще DD 268 955. Соединения формулы (II) также известны или могут быть получены по известным способам.
Соединения формулы (I) являются либо известными терапевтическими активными соединениями, либо известными промежуточными продуктами, для приготовления активных терапевтических соединений.
Следующие примеры, иллюстрируют изобретение, но не ограничивают его.
Пример 1. 17α -оксипрегн-4-ен-3,11,20-трион.
Стадия А. 9α -бром- 11β-17α- -диоксипрегн-4-ен-3,20-дион.
В инертном газе смешивают 2 г 17α -оксипрегна 4, 9/11/-диен-3,20-диона и 10 см3 тетрагидрофурана, а затем прибавляют при 0oC 1,3 г N-бромсукцинимида. Охлаждают до около -3oC, а затем медленно прибавляю смесь 1,3 см3 65 %-ной хлорной кислоты и 2,5 см3 воды. Выдерживают при перемешивании 3 часа 30 минут, а затем выливают в 100 см3 смеси вода - лед. Отфильтровывают кристаллы, промывают их водой и сушат. Получают 2,5 г целевого продукта, употребляемого в данном виде.
Стадия Б. 17α -оксипрегн-4-ен-3,11,20-трион.
В инертном газе смешивают 2,05 г 9α -бром- 11β-17α -диоксипрегн-4-ен-3,20-диода, 14 см3 этилового эфира уксусной кислоты и 4,6 см3 этиленгликоля. Нагревают с рефлюксом 16 часов, а затем охлаждают до 20oC. Прибавляют 3, 2 см3 концентрированной соляной кислоты и 35 см3 воды, а затем перемешивают 20 часов. Затем перегоняют этиловый эфир уксусной кислоты под уменьшенным давлением и прибавляют 7 г хлористого натрия. Перемешивают 30 минут при 20oC, а затем отсасывают кристаллы и промывают их соляной водой. Эти кристаллы забирают в хлористый метилен, сушат раствор и концентрируют досуха. Остаток хроматографируют на двуокиси кремния, элюируя смесью хлористый метилен - этиловый эфир уксусной кислоты (8-2) и получают 1, 26 г целевого продукта.
ИК-спектр /CHCl3/: Поглощения при 3610 см-1 /OH/; 1706-1667 см-1 (сопряженный кетон) 1617 см-1 /C=C/.
Пример 2. 17α -ацетоксипрегн-4-ен-3,11,20-трион.
Стадия А. 9α -бром- 11β -окси 17β -ацетоксипрегн-4-ен-3,20-дион.
В инертной атмосфере смешивают 3,7 г 17α -ацетоксипрегна 4,9 (11)-диен-3, 20-диона и 18,5 см3 тетрагидрофурана, а затем охлаждают до 0o/ - 5oC и прибавляют 2,18 г N -бромсукцинимида. Затем медленно прибавляют смесь 1,7 см3 70 %-ной хлорной кислоты и 3,4 см3 воды, а потом перемешивают 1 час. Затем выливают в 100 объемов смеси вода-лед, отфильтровывают кристаллы, промывают их водой и сушат. Получают 4,82 г целевого продукта.
Спектр ИК /CHCl3/: Поглощения при 3612 см-1 /OH/; 1731 см-1 /OAc/; 1716 и 1354 см-1 /-CO-CH3/; 1662 и 1621 см-1 / Δ 4,3-он/.
Стадия Б. 17α -ацетоксипрегн-4-ен-3,11,20-трион.
В инертном газе нагревают с рефлюксом 1 г полученного в стадии А продукта, 7 см3 этилового эфира уксусной кислоты и 2,3 см3 этиленгликоля. Выдерживают рефлюкс 24 часа, а затем охлаждают до 20oC и прибавляют 1,6 см3 концентрированной соляной кислоты и 17,5 см3 воды. Перемешивают 16 часов, а затем перегоняют под уменьшенным давлением этиловый эфир уксусной кислоты. Насыщают хлористым натрием и экстрагируют хлористым метиленом. Органический слой промывают насыщенным водным раствором бикарбоната натрия, а затем водой, насыщенной хлористым натрием, и сушат. Концентрируют досуха и остаток хроматографируют на двуокиси кремния, элюируя смесью хлористый метилен - этиловый эфир уксусной кислоты /9-1/. Получают 0,51 г целевого продукта, который перекристаллизируют в этаноле.
ИК спектр /CHCl3 /: Поглощения при 1735 см-1 /OAc/; 1708 см-1 /11 и 20 кето/; 1668 и 1618 см-1 / Δ 4,3-он/.
ЯМР спектр /CDCl3, 259 МГц, чнм/: 0,63 /S/ : 18-CH3; 1,42 /S/ : 19-CH3; 2,03 /S/ и 2,15 /S/ : CO-CH3; 5,74 /S/ : H4.
Пример 3. 17α -окси 21-ацетоксипрегн-4-ен-3,11, 20-трион.
Стадия А. 9α -бром- 11β,17α -диокси 21-ацетоксипрегн-4-ен-3,20-дион.
В инертном газе перемешивают 4,71 г 17α -окси-21-ацетоксипрегна 4,9/11/-диен-3,20-диона и 65 см3 тетрагидрофурана, а затем прибавляют при 0o/ -5oC 3,26 г N -бромсукцинимида, а потом медленно смесь 2,6 см3 70 %-ной хлорной кислоты и 5,2 см3 воды. По истечении 1 часа 15 минут при перемешивании при 0o/ -5oC выливают раствор на 50 объемов смеси вода-лед, отфильтровывают, промывают кристаллы водой, а затем сушат их. Получают 5,89 г целевого продукта.
ИК-спектр /CHCl3/ : Поглощения при 1743 - 1722 см-1 /-CO-CH2OAc/; 1628 см-1/ 4,3-кето/; Комплексное поглощение область /OH/ NH/.
Стадия Б. 17α -окси 21-ацетоксипрегн-4-ен-3,11,20-трион.
В инертном газе смешивают 0,7 г полученного в стадии А продукта, 4,9 см3 этилового эфира уксусной кислоты и 1,6 см3 этиленгликоля. Нагревают с рефлексом 5 часов 15 минут, а затем охлаждают до 20oC и прибавляют 1,1 см3 концентрированной соляной кислоты и 12,2 см3 воды. Выдерживают при перемешивании 16 часов, а затем отгоняют этиловый эфир уксусной кислоты под уменьшенным давлением. Водный слой насыщают хлористым натрием, а затем отсасывают кристаллы, промывают их водой, насыщенной хлористым натрием, а потом сушат. Продукт поглощают смесью хлороформ-изопропанол /97-3/, фильтруют и хроматографируют фильтрат на двуокиси кремния, элюируя смесью хлороформ-изопропанол /97-3/. Получают 0,23 г целевого продукта.
ИК-спектр /CHCl3/: Поглощения при 3610 см-1 /OH/; 1748, 1730, 1707 и 1667 см-1 /C=C/.
Пример 4. 17α , 21-оксипрегн-4-ен-3,11,20-трион /кортизон/.
Стадия А: 9α-бром-11β,17α, 21-триоксипрегн-4-ен-3,20-дион.
В инертном газе смешивают при 0o/-5oC 4,2 г 17α , 21-диоксипрегна-4,9/11/-диен-3,20-диона и 46 см3 тетрагидрофурана. Прибавляют 3,26 г N-бромсукцинимида, а затем медленно смесь 2,6 см3 70 %-ной хлорной кислоты и 5,2 см3 воды. Спустя 1 час 15 минут при 0o/-5oC выливают раствор на 50 объемов смеси вода-лед. Фильтруют, промывают кристаллы водой и сушат. Получают 4,86 г целевого продукта.
ИК-спектр /Вазелиновое масло/ : Поглощения при 1710 см-1 /несопряженный кетон/, 1663 и 1618 см3 /сопряженный кетон/, поглощение область OH/ NH/.
Стадия Б: 17α ,21-оксипрегн-4-ен-3,11,20-трион.
В инертном газе перемешивают 0,7 г полученного в стадии А продукта, 4,9 см3 этилового эфира уксусной кислоты и 1,6 см3 этиленгликоля. Нагревают с рефлюксом 5 ч 15 мин, а затем охлаждают до 20oC и прибавляют 1,1 см3 концентрированной соляной кислоты и 12,2 см3 воды. Перемешивают 16 ч, а затем отгоняют этиловый эфир уксусной кислоты под уменьшенным давлением. Насыщают хлористым натрием и экстрагируют хлористым метиленом, промывают насыщенным водным раствором бикарбоната натрия органический слой, а затем насыщенным водным раствором хлористого натрия, сушат и концентрируют досуха. Остаток хроматографируют на двуокиси кремния, элюируя смесью хлороформ-изопропанол (92,5 - 7,5). Получают 0,11 г целевого продукта, который можно очистить, растворяя в смеси хлористый метилен - изопропиловый эфир и отгоняя хлористый метилен. Целевой продукт кристаллизуется.
ИК-спектр (Вазелиновое масло): Поглощения при 3480 см-1(OH); 1700 см-1 (11 и 20 кето); 1650 см-1 (сопряженный кетон); 1613 см-1 (C=C).
Пример 5. Получение циклического 3-[(1,2-этандиил)меркаптол]- - 17α -окси-21-ацетоксипрегн-4-ен-3,11,20-триона.
Стадия А. Циклический 3-[(1, 2-этандиил)меркаптол]- 9α -бром- - 11β-17α -диокси-21-ацетоксипрегн-4-ен-3,20-диона.
Работают по методике стадии А примера 3 заявки, исходя из 4,4 г циклического 3-[(1,2-этандиил)-меркаптол]- 17α -окси-21- -ацетоксипрегна-4,9/11/-диен-3,30-диона, получают 5,3 г целевого продукта.
ИК-спектр /CHCl3/: Поглощения при 1743-1722 см-1 (-CO-CH2OAc). Область поглощения OH/NH.
Исходный продукт получают следующим образом.
Смешивают в атмосфере инертного газа при 20oC 100 см3 метанола 6,4 г 17α -окси-1-ацетоксипрегна-4,9/11/-диен-3,20-диона, 1,8 см3 этандитиола и 2,5 см3 эфирата трехфтористого бора. Перемешивают 2 часа и выпаривают растворитель. Обрабатывают метиленхлоридом, промывают насыщенным водным раствором бикарбоната натрия, водой и сушат. Выпаривают досуха и получают 7,9 г целевого продукта, используемого как таковой в приведенном выше примере.
ИК-спектр /CHCl3/: Отсутствие 3-кето- Δ -4; поглощение при 1745-1730 см-1 /-CO-CH2OAc/; область поглощения OH/NH; поглощение при 1610 см-1 / Δ 9,11/.
Стадия В: Получение циклического β -[(1,2-этандиил)меркаптол] 17α -окси-21-ацетоксипрегн-4-ен-3,11, 20-триона.
Работают по методике, аналогичной методике стадии В примера 3, используя в качестве исходного продукта 0,48 г продукта, полученного на стадии А выше. После очистки хроматографией на оксиде кремния, элюируя смесью толуол-изопропанол 95/5, получают 0,3 г целевого продукта.
ИК-спектр (CHCl3): Поглощение при 1646 см-1 (C=C), 1749, 1729 и 1706 см-1 (C=O /OAc, 20-кето, 11-кето), 3608 см-1 (OH + ассоциированный).
ЯМР-спектр: (CDCl3, 300 МГц, ппм)
0,63 /c/, 18-CH3; 1,23 /c/: 13-CH3; 2,17 /c/: OAc; 2,54 /c/: OH; 3,15 - 3,40: тиокеталь;
4,64 /д. J = 17,5/; 5,13 /д. J = 17,5/; CO-CH2O; 5,55 /д/ : H4.
Пример 6. Получение 17α -оксипрегн-4-ен-3,11,20-триона перегруппировкой в н-бутаноле.
Смешивают 1,5 г 9α -бром-11 11β,17α -диоксипрегн-4-ен-3,20-диона и 15 см3 н-бутанола в атмосфере инертного газа и кипятят с обратным холодильником в течение 3,5 ч. Раствору дают остыть. Целевой продукт медленно осаждается. Отфильтровывают и промывают изопропанолом и смесью изопропилового эфира с изопропанолом, потом сушат. Получают 0,67 г целевого продукта. Продукт очищают кипячением с обратным холодильником в этиловом эфире и после фильтрования и сушки получают 0,585 г целевого продукта, титр которого определяют ВЭЖХ. Он составляет 91,5 %, что соответствует 0,53 г чистого продукта.
Пример 7. Получение 17α -оксипрегн-4-ен-3,11,20-триона перегруппировкой в н-пропаноле.
Работают по методике и в условиях, полностью идентичных использованным в примере с н-бутанолом, исходя из 1,5 г стероида и 15 см3 н-пропанола. Таким образом получают 0,55 г сырого целевого продукта, который очищают в этиловом эфире, как в предыдущем примере. Получают 0,353 г чистого продукта. Как и ранее, объединяют маточные воды и доводят до сухого остатка, полученный продукт очищают, это дает 0,297 г чистого продукта. Следовательно, в сумме получают 0,650 г целевого продукта или выход равен 53,7 %.
Различные маточные воды, полученные выше, снова объединяют и концентрируют досуха. Растворяют 0,78 г сырого полученного продукта в ТГФ и определяют титр целевого продукта с помощью ВЭЖХ. Таким образом получают 0,177 г чистого продукта, идентичного продукта примера 1 заявки.
Суммарный баланс реакции следовательно составляет 0,712 г, что соответствует выходу 58,6 %.
Пример 8. 17α -Оксипрегн-4-ен-3,11,20-трион.
Стадия А. 9α -Хлор- 11β,17α -диоксипрегн-4-ен-3,20-дион.
Смешивают в атмосфере инертного газа 2 г 17α -оксипрегна-4,9/11/-диен-3,20-диона и 10 см3 тетрагидрофурана, потом прибавляют при 0oC 1 г N -хлорсукцинимида. Охлаждают до -3oC, потом медленно прибавляют смесь 1,3 см3 65 %-ной хлорной кислоты и 2,5 см3 воды. Перемешивают 3,5 часа, потом выливают в 100 см3 смеси лед-вода. Отфильтровывают кристаллы, промывают их водой и сушат. Получают 2,3 г целевого продукта, используемого как таковой для следующей стадии.
Стадии В. 17α -Оксипрегн-4-ен-3,11,20-трион.
Работают, как описано для стадии В примера 1, используя 2,06 г 9α -хлор- 11β,17α -диоксипрегн-4-ен-3,20-диона и получают 1,2 г целевого продукта после хроматографии сырого продукта на оксиде кремния, элюируя смесью метиленхлорид-этилацетат (8-2).
Пример 9. Приготовление 17α -гидрокси-21-ацетоксипрегна-3,11,20- -триона.
Стадия А. 9α -Бром- 11β,17α -дигидрокси-21-ацетоксипрегна-3, 20- -дион.
Смешивают в атмосфере инертного газа 4,7 г 17α -гидрокси-21- -ацетоксипрегн-9(11)-ен-3,20-диона и 65 см3 тетрагидрофурана, затем при температуре 0o/-5oC вводят 3,26 г N - бромсукцинимида. Медленно добавляют смесь 2,6 см3 70%-ной хлорной кислоты и 5,2 см3 воды. После перемешивания в течение 1 часа при температуре 0oC/5oC, выливают раствор в 50 объемов смеси льда с водой, фильтруют кристаллы, промывают и сушат. Получают 5,9 г целевого продукта, используемого на следующей стадии.
Стадия В. 17α -Гидрокси-21-ацетоксипрегна-3,11,20-трион.
Доводят до кипения с обратным холодильником в атмосфере инертного газа смесь из 0,7 г соединения, полученного на стадии А, 5 см3 этилацетата и 1,6 см3 этиленгликоля. Выдерживают при рефлюксе 5 часов, затем охлаждают до 20oC и добавляют 1,1 см3 концентрированной соляной кислоты и 13 см3 воды. Перемешивают 16 часов и отгоняют этилацетат под уменьшенным давлением. Насыщают хлоридом натрия, затем центрифугируют полученные кристаллы, промывают их водой, насыщенной хлоридом натрия, сушат и перекристаллизовывают из ацетона. Получают 0,25 г целевого продукта. Т.пл. = 230o C.
Реферат
Изобретение относится к новому способу получения 11-кетостероидных производных общей формулы I, где R - H, ацил C1 - C8, R1 - CH3, CH2OR11, R11 - H, ацил C1 - C8, 3-оксогруппа защищена в виде этилендитиокеталя, заключающемуся в том, что соединение формулы II преобразуют в галогеногидрин формулы III, в присутствии спирта, и полученный продукт обрабатывают кислотой. 6 з.п. ф-лы.
Формула
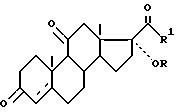
где R - водород или ацил С1 - С8;
R1 - метил, радикал CH2OR11, где R11 - водород или ацил С1 - С8, 3-оксогруппа может быть защищена в виде
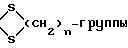
где n = 2;
путем превращения соединения общей формулы II
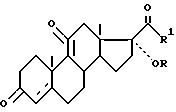
где R, R1,
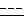
в галогенгидрин общей формулы III
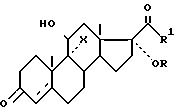
где Х - бром или хлор;
R, R1,
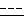
отличающийся тем, что галогенгидрин общей формулы III подвергают реакции перегруппировки в присутствии спирта для получения после обработки кислотой целевого соединения общей формулы I.

Комментарии