Способ получения стероидных соединений или их четвертичных аммонийных солей - SU1318169A3
Код документа: SU1318169A3
Описание
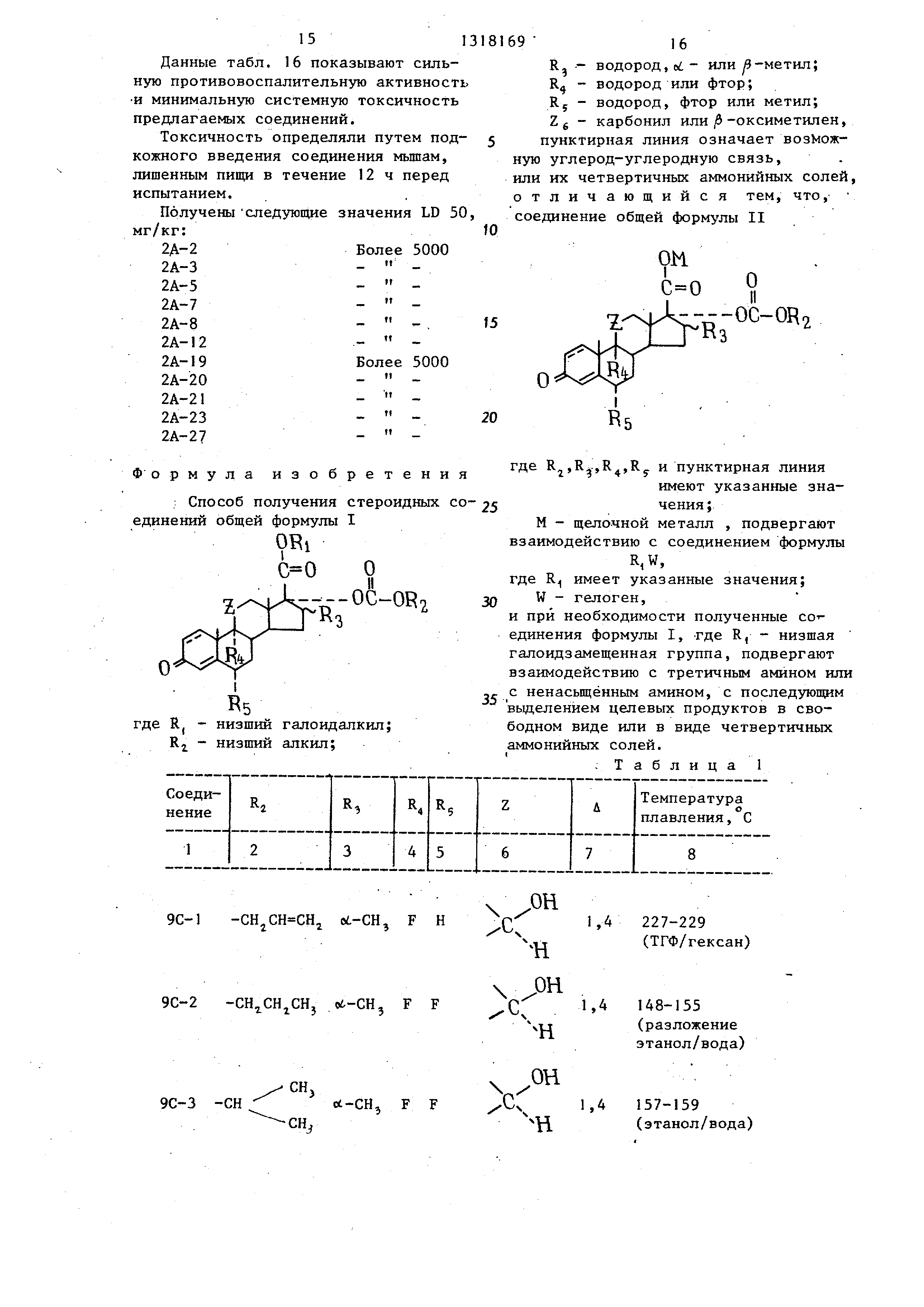
Изобретение OTFIOCHTCH к спо.собу получения стероидных соединений общей формулы
ORi
о II
,
где R, - низший галоидалкил;
R - низший алкил;
R - водород, «; или/3-метил;
R - водород или фтор;
R - водород, фтор или метил;
Z - карбонил или -оксиметилен пунктирная линия означает возможную углерод-углеродную связь, или их четвертичных аммонийных соле обладающих рядом ценных фармакологических свойств.
Цель изобретения - получение новых стероидных соединений, обладающих высокой противовоспалительной активностью при минимальной системной активности.
Пример. 1. 1 1|6-окси-1 7сх.-ме- Еоксикарбонилоксиандрост- -ен-З-он- 1 7/}-карбоновую кислоту объединяют с эквивалентным количеством IN гидроокиси натрия в метаноле и этот раствор разбавляют в 100 раз от первоначального объема этиловым эфиром. Полученную суспензию замораживают в течение 1 ч. Затем образующиеся кристаллы удаляют при помощи фильтрации сушат в эксикаторе, который откачивают , и растворяют в гексаметилфос- форамиде (10 вес,%/объем), Часть полученного раствора, содержащего 1 моль соли кислоты, т..е. 1 I/J-окси- 1 7о(,-метоксикарбонилоксиандрост-4-ен- З-он-17р-карбоксилат натрия, объединяют с 4 моль хлорметилйодида. Реакционную смесь поддерживают при комнатной температуре в течение 3 ч, затем разбавляют до 10 раз от первоначального объема этилацетатом. Разбавленную реакционную смесь промываю последовательно 5%-ным тиосульфатом натрия, 3%-ным бикарбонатом натрия и водой. Органический слой отделяют, сушат сульфатом магния и фильтруют. Фильтрат концентрируют под вакуумом до образования пены. Пену очищают
81692
путем кристаллизации из подходящего растворителя (этиловьш эфир или тет- рагидрофуран/гексан). Таким образом получают хлорметил-1 1/3-окси-1 7ог.-мет- 5 оксикарбонил-оксиандрост-4-ен-З-он- 17 -карбоксилат с т.пл. 171-173 С после кристаллизации.
ИК (КВг) 3000-2800 (С-Н), 1760, 1748 (CsD), 1650 () . , o ЯМР (CdCl,)S 5,67 (с, 1, ), 5,82, 5,62, (ABq, J 5,5 Hz2, ), 4,47 (в, 1, СНОН).
Вычислено, % :
С 60,72; Н 6,87; С1 7,79.
15
5
5
С,,Н,,С10.
Найдено, %: С 60,50; Н 7,06; С1 7,06; С1 7,50.
Замена стероидной кислоты на эквивалентное количество 17 -этоксикарбо0 нилокси-1 1/3-от :сиандрост-4-ен-3-он-1 7/3- карбоновой кислоты и повторе ние указанной методики дает получение промежуточной соли 1 7об-этоксикарбонил-ок- си-1 1р-оксиандрост-4-ен-3-он-1 7/ -карб- оксилата натрия, а в качестве конечного продукта получают хлорметил-1 7oi- этоксикарбо.нилокси- 11| -оксиандрост-4- ен-З-он-17р-карбоксилат, т.пл. 197- 200. С после кристаллизации.
0 ИК (КВг) 3600-3200 (0-Н), 3000- 2800 (С-Н), 1763., 1740 (), 1650 () см - . ЯМР (CDC1,,)
5,7 (с, 1, ), . 5,81, 5,62 (ABq, J 5HZ, 2, -ОСН,,С1, Вычислено, %: С 61,46; Н 7,09. Н., СЮ,
С 61,58; Н 7,08.
..1.и7
Найдено,
Таким же образом при замене стеро- идной кислоты эквивалентным количеством 1 7о6-бутоксикарбонилокси-1 1й-окси- андрост-4-ен-3-он-17 -карбоновой кислотой и при повторении описанной методики получают промежуточную соль 1 7«4-бутоксикарбонилокси-1 1в-оксианд- рост-4-ен-3-он-1 7/3-карбоксилат натрия , а в качестве конечного продукта получают хлорметил-1 7о|1-бутоксикарбо- нилокси-11 -оксиандрост-4-ен-3-он- 17р-карбоксилат с т.пл. 98-100 С после кристаллизации.
ИК (КВг) 3600-3300 (0-Н), 3000- 2800 (С-Н), 1765 (), 1735 (), 1650 () см.
ЯМР (CDC1,) S 5,80,8 5,60 (2, Bq, J 4,5HZ-QCHjCl), 5,67 (с, I, ), 4,45 (в, 1, СНОН), 4,08 (т, 2, J бНК, O COCHi-Clp.
Вычислено, %: С 62,77; Н 7,44; С1 7,14. С,,Н„С10,.
Найдено, %: С 62,88; Н 7,23; С1 7,30.
При замене стероидной кислоты на эквивалентное количество 11р-окси- 17р-изопропоксикарбонш1оксиандрост-4- ен-З-он-17р-карбоновой кислоты и при повторении описанной процедуры полу- чают, промежуточную соль 1 lp-oкcи-17oi- изoпpoпoкcикapбoнилoкcиaндpocт-4-eн- 3-oн-l 7й-карбоксилат натрия, в качестве конечного продукта получают хлор- метил- 1 1р-окси-17с6-изопропоксикарбо- нилоксиандрост-4-ен-З-он-17 -карбо- ксилат с т.пл. 183,5-184, после перекристаллизации из тетрагидрофура- на - гексана.
Стероидную кислоту заменяют также на эквивалентное количество 17а;-эток- сикарбоннлокси-1 1|3-оксиандрост-4-ен- З-он-17й-карбоновой кислоты, хлор- метилйодид заменяют на эквивалентное количество бутилхлорида и процедуру повторяют за исключением стадии промывки 5%-ным тиосульфатом натрия.
Таким же образом получают промежуточную соль 1 7.л:;-этоксикарбонилокси- 1 Ш-оксиандрост-4-ен-3-он-1 7/ -карбок- силат натрия и конечный продукт бутил- 7об-этоксикарбонилокси- 11 -окси- андрост-4-ен-3-он-1 7/ -карбоксилат с т.пл. 148-149°С после кристаллизации из ацетона.
После хроматографии и кристаллизации ИК (КВг) 3600-3200 (р-Н), 3000- 2800 (С-Н), 1750 (), Гб70 () .
ЯМР (CDC1,)S 5,64 (с, 1, ) 4,46 (в, 1, СНОН), 4,32-4,95 (м, 4, сосен jCH, , COOCHjCHj-).
Вычислено, %: С 67,99; Н 8,39.
С OY
Найдено, %: С 67,76; Н 7,74.
.Пример 2. Следуя методике :примера 1 и заменяя соответствующие реагенты, получают следующие соединения :
2А-1: хлорметил-1 7сг,-этоксикарбо- нилокси-9об-фтор-1 1 А-оксиандрост-4- ен-З-он-17|3-карбоксилат, т.пл. 228- 229 С (ТГФ/гексан);
2А-2: хлорметил- 7е -этоксикарбо- нилокси-9о(.-фтор- 1 -окси-16 -метил- андрост-, 4-диен-З-он-1 7/}-карбокси- лат, т.пл. 220-22 °С (ТГФ/гексан);
5
- О - т S -
20 - -30 35
-
,40
50
,4
2А-3: хлорметил- 7об-этоксикарбо- нилокси-9|)б-фтор- 1Й-ОКСИ-1 6л-метил- андрост-1 ,4-диен-З-он-1 7/ -карбокси- лат, т.пл. 230-235°С (ТГФ/гексан); 52А-4: хлорметил-1 7()-этоксикарбонилокси-1 1| -оксиандрост-1,4-диен-З- он- 7/ -карбоксилат, т.пл, 220,5- 223,5°С (ТГФ/гексан);
2А-5: хлорметил-1 1 -окси-1 7а;-изо- пропоксикарбонилоксиандрост-1,4-диен- З-он-17 3-карбоксилат, т.пл. 197- 98 С (ТГФ/гексан);
2А-6: хлорметил 17о(,-этоксикарбо- нилокси-9с6-фтор- 1р-оксиандрост-1 ,4- диен-З-он-17 -карбоксилат, т.пл.245- 248 С (ТГФ/гексан);
2А-7: хлорметил-9о -фто р-1 1/ -окси- 1 7с6-изопропоксикарбонилокси-1 6об-ме- тиландрост-,4-диен-З-он-17ft-карбок- силат, т.пл. 84,5-186°С (ТГФ/гексан ) ;
2А-8: хлорметил-9«:,-фтор- /3-окси- 1 7| -изопропоксикарбонилокси- 6р-ме- тиландрост-,4-диен-З-он-1 7 -карбок- силат, т.пл. 174-175,5°С (ТГФ);
2А-9: хлорметил-1 1Й-ОКСИ- 7|; -изо- бутоксикарбонилоксиандрост-4-ен-З-он- 17 -карбоксилат, т.пл. 140-141°С (ТГФ/изопропиловьй эфир);
2А- 10: хлорметил- 17оС-циклогексил- оксикарбонилокси-1 1 -оксиандрост-4- ен-З-он-17 -карбоксилат, т.пл. 148- 50°С (изопропиловый эфир/гексан);
хлорметил-1 1 -окси-1 7ot- пропоксикарбонилоксиандрост-4-ен-З- он-17(3-карбоксилат, т.пл. 181-182 С (ТГФ/гексан) ;
2А-1 2: хлорметил-9 -фтор- If) -окси- 1 6(-метил-1 7о;,-пропоксикарбонилокси- андрост-1 ,4-диен-З-он- 1 7/3-карбокси- лат, т.пл. 176-176,5°С (ТГФ/гексан);
2А-13: метил-1 1 -окси-1 7(-изопроп- оксикарбонилоксиандрост-4-ен-З-он- 7р-карбоксилат, т.пл. 21 1,5-213,5 с (ТГФ/гексан);
2А-14: этоксиметил-1 1/3-ОКСИ-1 7вб- изопропоксикарбонилоксиандрост-4-ен- 3-ОН- 7р-карбок силат, т.пл. 137- 38 С (ТГФ/гексан);
2А-15: хлорметил-1 7о6-бензилокси- карбонилокси-11 -оксиандрост-4-ен-З- он-17 -карбоксилат, т.пл. 82-183-С (этанол);
1-хлорэтил-1 l|3-oкcи-17a6- изoпpoпoкcикapбoнилoкcиaндpocт-4-eн- 3-oн-l 7 -карбоксилат, т.пл. 181- 182, ТГФ/гексан , т.пл. 199-200 с (ТГФ/гексан);
45
51з
2А-17: этоксикарбонилметил-I 1/3 окси-1 7й,-изопропоксикарбонилоксианд- рост 4-ен-3-он-17р-карбоксилат, т.пл; 73-7/4 С (изопропиловый эфир);
2А-18: 1-хлорэтил-9в -фтор-П/5-ок- си-1 7(х;-изопропоксикарбор{илокси-1 6/3- метиландрост-Г, 4-диен-З-он- 1 7| -карб- оксилат, т.пл, 67,5-169°С (ТГФ/гек- сан), т.пл. 163-164 С (ТГФ/гексан);
2А-1 9: хлорметил-9|х;-фтор-1 7с -изо- пропаксик рбонилокси- 6 метиланд- рост-1,4-диен-3,11-дион-17-карбокси- лат, т.пл. 200-20 с (ТГФ/изопропи- ловый эфир);
2А-20: хлорметил-9с С-фтор-1 7об-изо- пропоксикарбонилокси-1 бо -метиланд- рост-1 ,4-диен-З, 1 i -дион- 7-карбокси- лат, т.пл. 138-140°С (ТГФ/изопропи- ловый эфир);
2А-2 1 : хлорметил-9о6-фтор-1 1|3 -окси- 1 7oi-мeтcкcикapбoнилoкcи-1 боб-метил- андрост-1,4-диен-З-он-17/э -карбокси- лат, т.пл. 260-263°С (ТГФ/гексан);
2А-22: фторметил-1 1 -окси-1 7if,-ii30- пропоксикарбонилоксиандрост-4-ен-З он-17/3-карбоксилат, т.пл. 207,5- 210°С (ТГФ/гексан);
2А-23: хлорметил-9ог,-фтор-1 1/5-окси- 16(у;-метил-1 7о,-пёнтилоксикарбонилокси- андрост-1,4-диен-З-он-17р-карбокси- лат, т.пл. 176-177°С (ТГФ/гексан);
2А-24: хлорметил-1 6ci., 1 (эток- сикарбонилокси) -6(li-фтop- 1/3-оксианд- рост-154 диен-3-он-17р-карбоксилат, т.пл. 153-154°С (ТГФ/гексан);
2А-25: фтормерил-1 7|)-этоксикарбо- нилокси-9сЛ-фтор-1 1 -окси-16о6-метил- андрост-1 ,4-диен-З-он-1 7/ -карбокси лат, т.пл. 239-240, (ТГО/гексан);
2А-26 ацетоксиметил-1 7(-этокси- карбонилокси-1 1В-оксиандрост-4--ен-3- он-17/З-карбоксилат ЯМР (CDCl) 5,76 (с., 2, ОСН,,0), 2,01 (с., 3, СОШ,)
2А-27: хлорметил-1 7об-этоксикарбо- нилокси-6о, 9с1С-дифтор-1 1 -окси-1 6(i.-Me- тиландрост-1,4-диен-З-он- 7 -карбок- силат, т.пл. 195-197 с (ТГФ/гексан);
2А-28; 2-ХЛОРЭТИЛ-1 7сб-этоксикарбо- нилокси-9о6-фтор-1 1/5-окси- 6л-метш1- андрост-1 ,4-диен-З-он- 7/3 -карбокси- дат, т.пл. 243-245°С (ТГФ/гексан);
2А-29: метил-17об-этоксикарбонил- окси-9л-фтор-1 5 -о кси- 6« -метиланд рост-1,4-диен-З-он-1 7/3-карбоксилат, т.пл. 258,5-262,5 С (ТГФ/гексан);
2А-30: 2-хлорметш1-1 7об-изопропок- сикарбонилокси-11 -оксиандрост-4-ен9 6
З-он-17 -карбоксилат, т.пл. 188,8- 189, (ТГФ/гексан).
Соединения 2А-16 и 2А-18 - диас- тереомеры.
Пример 3. Исходный материал 1 1р-окси-1 7{1,;-метоксикарбонилоксианд- рост-4-ен-З-он- 1 7/3-карбоновую кислоту , используемую в примере 1, заменяют на эквивгшентное количество 11/,
1 71х;-диоксиандрост-4-ен-3-он-1 7/i -кар- боновой кислоты и повторяют методику примера I. Таким образом, получают в качестве промежуточной соли I 1/5-1 7e.- диоксиандрост-4-ен-З-он-1 7/3-карбоксилат натрия, а в качестве конечного продукта - хлорметил-1 1/J, 1 7 б-диокси- андрост-4-ен-3-он-1 7/5-карбоксилат с т.пл. 184-186 С (перекристаллизация из системы тетрагидрофуран/эфир-гексан ) .
Пример 4, Хлорметил- 7(б-эт- оксикарбонил.окси-9сб-фтор- 1/3-окси- 16об-метиландрост-1 ,4-диен-З-он- 7/3- карбоксилат (2 г) растворяют в безводном дихлорметане (200 мл) и добавляют при комнатной температуре пири- днний хлорформат (3,5 г) при перемешивании . Полученную смесь перемешива- ют .в течение 24 ч, затем растворитель
концентрируют при пониженном давлении при 10-20°С, Остаток подвергают
хроматографии на колонке с силикаге- лем (Кизель гель 60), используя хлороформ в качестве злюирующего растворителя , с последующей перекристаллизацией из смеси тетрагидрофурана и изопропилового эфира с получением хлорметил-1 7()б-этоксикарбонилокси-9о|1- фтор-1 боб-метил андрост-1 ,4-диен-З, 1 1дион-1 7р-карбоксилата с выходом 1,7 г, т.пл.38-140°С.
Пример 5, По примеру 4 получают хлорметил 9о -фтор-1 7с6-изопроп- оксикарбонилокси- 1 6/3-метиландрост1 ,4-диен-3, 1 1 -дион-1 Jj -карбоксилат,
т.пл. 200-201 С.
Пример 6. Используя общую методику примера I, но заменяя соответствующие реагенты, получают ме- тил-1 7oi- (2-хпорэтокси)карбонилокси- -9| ;-фтор-1 l/i-окси-1 боб-метил андрост- 1,4-диен-З-он-1 7/1-карбоксилат. Про- дукт после перекристаллизации из изо- пропанола имеет т„ пл. 223-227 С.
Пример 7„ По примеру I получают 2-хлорэтил- 7о -этоксикарбонилок- си-9о -фтор- 1/5-окси-1 боС-метиландрост- 1,4-диен-З-он-1 7/ -карбоксилат. Продукт
после перекристаллизации из тетрагид рофурана - гексана имеет т. пл. 243- .
Пример 8, Кпорметил-17а;.- этоксикарбонилокси-11 -оксиандрост- 4-ен-3-он-17р-карбоксилат (0,01 моль и I,2-диметилпирролидин (0,01 моль растворяют в ацетонитриле.(80 мл и нагревают до температуры кипения с обратным холодильни- ком., Реакционную смесь выдерживают при этой температуре при перемешивании в течение 4 ч. Примерно 65 мл ацетонитрила выделяют,, затем смесь охлаждают до комнатной температуры и избыток этилового эфира добавляют для осаждения. Осадок отделяют фильтрацией , промывают и сушат в вакууме, таким образом, получая соответствующую четвертичную аммониевую соль.
Пример 9. Следуя общей методике , описанной в примере 1, и используя соответствующие реагенты, получают следующие новые промежуточ- ные продукты:
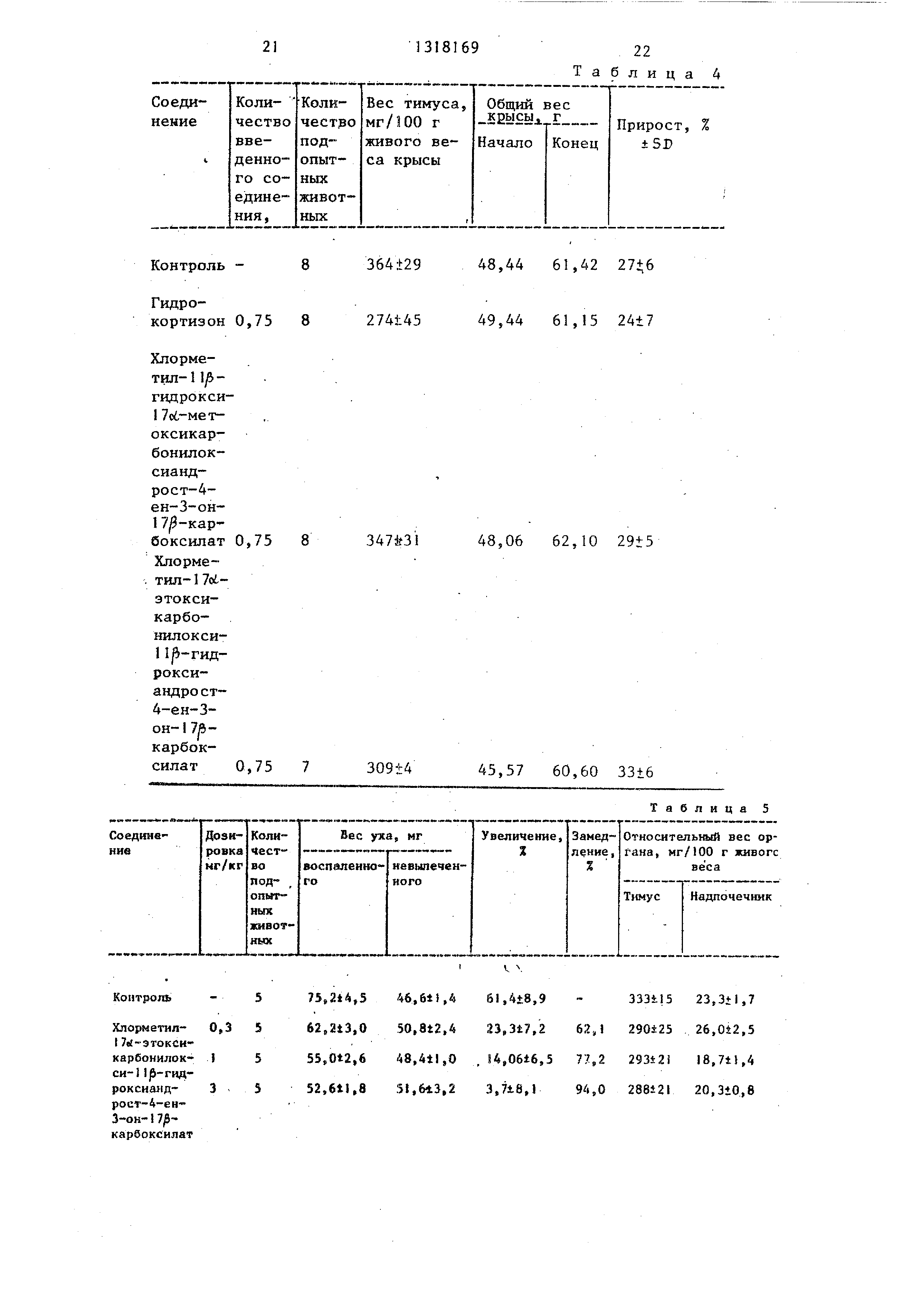
9С-1 : 1 7об-аллилоксикарбонилокси- 9с6-фтор-1 1 -окси-1б9,-метиландрост- 1,4-диен-3-он-17 -карбоновая кислота
9С-2: 11 -н-пропоксикарбонилокси- боб, 9к,-дифтор-1 1р-окси-1 боб-метил анд- рост-1,4-диен-З-он-17р-карбоновая кислота;
9С-3: 1 7о -изопропоксикарбонилок- си-6о, 9(у1-дифтор-1 1р-окси-1 6 -метил- андрост-1,4-диен-З-он-17й-карбоновая кислота;
9С-4: 1 7о -этоксикарбонилокси-6об- фтор-1 1 -окси-1 6о6-метиландрост-1 ,4- диен-3-он-1 7 -карбоновая кислота;
9С-5: 1 7о.-н-пропоксйкарбонилокси - 6()(,-фтор-1 lp-окси-16о6-метиландрост- 1,4-диен-З-он-17 -карбоновая кислота
9С-6: 1 7об-изопропоксикарбонилокси бс -фтор-1 1р-окси-1 6л-метиландрост- 1,4-диен-З-он-1 7|5-карбоновая кислота
9С-7: 1 7об-метоксикарбонилокси-1 1/3 оксиандрост- 1 ,4-диен-З-он-1 7/}-карбо- новая кислота;
9С-8: 1 7об-метоксикарбонилокси-6(1бфтор-1 1|5-окси-16об-метиландрост-1,4- диен-З-он-1 7/5-карбоновая кислота;
9С-9: I 7об-этоксикарбонилокси-1 1/3- оксиандрост-,4-диен-З-он-17 -карбо- новая кислота;
9С-10: 17(s -мeтoкcикapбoнилoкcи-9 фтop-l 1 -окси-16 -метиландрост-1,4- диен-З-он-1 7/5-карбоновая кислота;
98
9С-11: 1 7о -н-пропоксикарбонилокси- 9о:-фтор-1 jb-OKCH-16 -метиландрост- 1 ,4-диен-3-он-1 7/3-карбоновая кислота.
Промежуточные продукты представлены в табл. 1 ,
Пример 10. Следуя методике описанной в примере 1 , и используя соответствующие реагенты, получают следующие соединения:
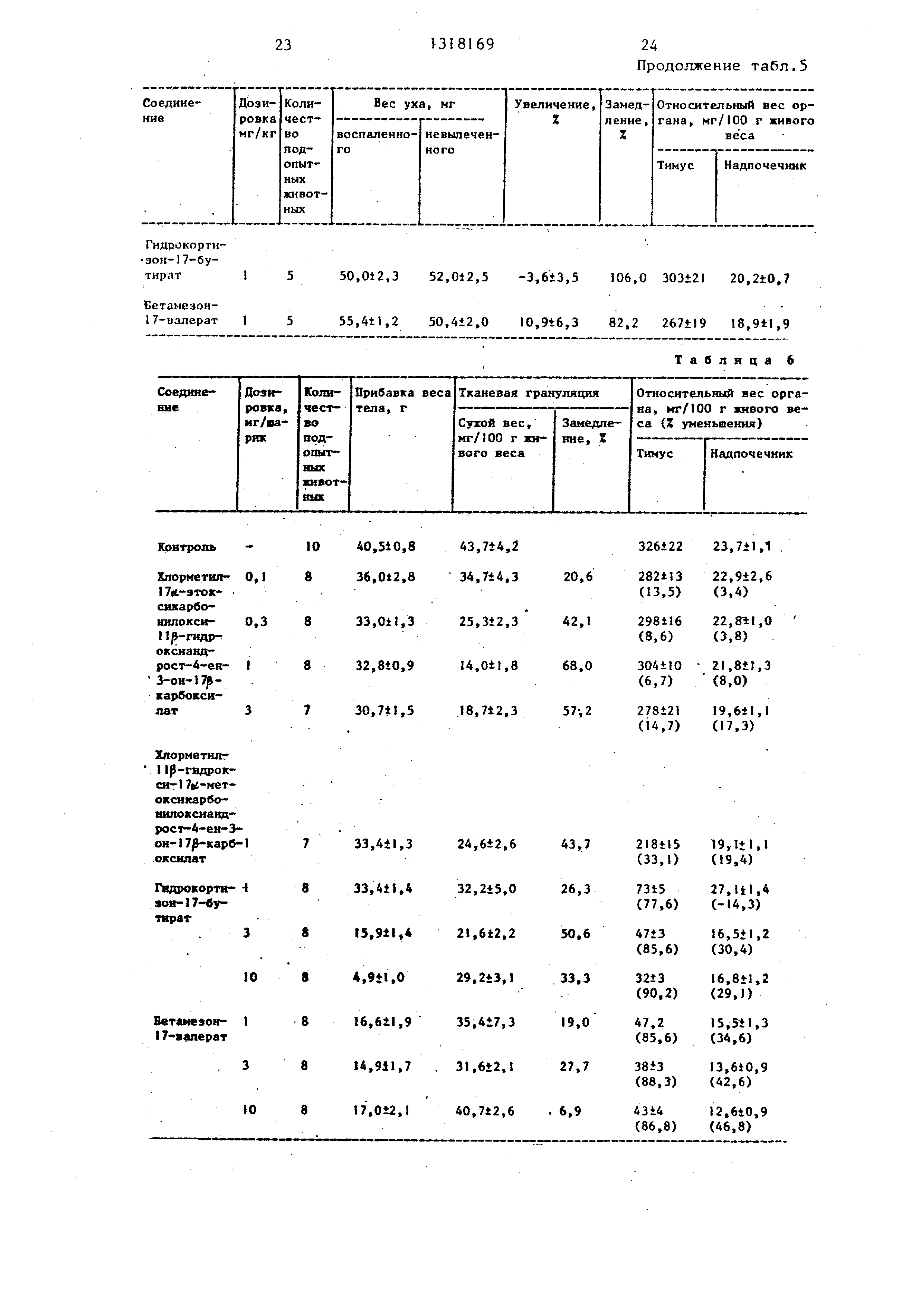
10С-1 : хлорметил-1 7о:-изопропокси- карбонилокси-бос, 9а;-дифтор-1 1 -окси- 1 боб-метил андрост-1 ,4-диен-З-он-1 карбоксилат;
10С-2: хлорметил-1 7о --н-пропокси- карбонилокси-бс, 9с,-дифтор- 1 1 -окси- 16о(.-метиландрост-1 ,4-диен-З-он-1 карбоксилат;
1ОС-3: фторметил-1 7с -н-пропокси- карбонилокси-91ч1-фтор- 1 1 -окси-1 бл,- метиландрост-1,4-диен-З-он-1 7/3-карб- оксилат;
1 ОС-4 : 2-хлорэтил- 1 7ei -изопропокси карбопилокси-1 1 -оксиандрост-1 ,4-диен-З-он-1 7й-карбоксилат;
10С-5: метил-1 7(б-(2-хлорэтокси) карбонилокси-9|Х--фтор-1 1/3-окси-16ot- метиландрост-1,4-диен-З-он-17 -карб- оксилат;
10С-6: хлорметил-1 7сс-этоксикарбо- нилокси-6с гфтор-1 p-oKCH- бс(.-метил- андрост-1 ,4-диен-З-он-1 7/3-карбокси- лат;
1 ОС-7: хлорметил-1 7ог,-н-пропокси- карбонилокси-бсс-фтор- 1 -окси-16(- метиландрост-1 ,4-диен-З-он-1 7 3-карб- оксилат;
10С-8: XJтopмeтил-l 7й;,-изопропокси- карбонилокси-бл-фтор-1 1|3-окси-1 6ct- метиландрост-1 , 4-диен-З-он-1 7/3-карб- оксилат;
10С-9: хлорметил-1 7о6-н-пропокси- карбонилокси-11р-оксиандрост-1,4-диен-З-он- 1 7|3-карбоксилат;
1ОС-1 0: хлорметил-1 7об-метоксикар- бонилокси-1 -оксиандрост-1,4-диен- З-он-17р-карбоксилат;
1 ОС-1 1 : хлорметил- 1 7сс-метоксикар- бонилокси-б(Л-фтор-1 1 -окси-1 бо -метил андрост-1,4-диен-З-он-17 -карбокси- лат;
ЮС-12: хлорметил-1 7йб-метоксикар- бонилокси-9о.-фтор-1 1 -окси-16р-метил андрост-1 ,4-диен-З-он-1 7/ -карбокси- лат;
ЮС-13: хлорметил-I 7с1 -н-пропокси- карбонил-окси-9об-фтор-1 1р-окси-1бу - метиландрост-1 ,4-диен-З-он-1 7/3-карб- оксилат.
913
Полученные соединения представлены в табл. 2.
Пример 1 1 , К раствору 3 г хлорметил-1 Ip-OKCH-l 7об-изопропокси- карбонилоксиаидрост-4-ен-3-он-1 7/3- карбоксилата в ЮОМл ацетонитрила добавляют 7,9 г (10 моль) AgF и ука- занную смесь перемешивают при комнатной температуре в течение 12 дн., закрывая реакционною систему от света . Затем реакционную смесь фильтруют и твердь й осадок на фильтре полностью промывают этилацетатом. Фильтрат и раствор этилацетата соединяют и смесь промывают водой и насыщенным водным раствором хлористого натрия и высушивают над безводным сульфатом натрия. Растворители отгоняют, получая 2 г неочищенного кристаллическог продукта. Продукт подвергают препаративной тонкослойной хроматографии (силикагель 60F 254, Merck) используя в качестве растворителя для элю- ирования смесь хлороформа и метанола (15:1). Затем продукт перекристал- лизовывают из смеси тетрагидрофурана и н-гексана с получением 180 мг фторметил- 1 р-окси-1 7об-изопропокси- карбонилоксиандрост-4-ен-3-он-1 7/5- карбоксилата в- виде бесцветных игл, плавящихся при 207,5-210 С.
Пример 12. По примеру 11, заменяя реагенты, получают следующие со един е ния:
12-1 : фторметил-1 7об-этоксикарбо- нилокси-9(1-фтор- 1р-окси- бе -метил- андрост-1,4-диен-З-он- i 7/3-карбокси лат;
12-2: фторметил-1 7 л-н-пропоксИ карбонилокси-9о1-фтор-11 р -окси-16с 5- метиландрост-1 ,, 4-диен-З-он-1 7й-карб- оксилат.
Пример 13. По методике, описанной в примерах 1 или 12, с заменой Соответствуюнщх реагентов получены соединения, представленные, в табл. 3.
Мягкие стероиды формулы I и четвертичные аммониевые соли являются сильными местными противовоспалительными агентами. Однако в силу того , что их легкое разрушение in vivo ведет только к неактивному стероидному метаболиту, соединения обладают гораздо меньшей системной активное- тью, чем известные глюкокортикосте- роиды, из чьих неактивных метаболи910
тон они происходят. Многие из соединений совершенно лишены системной активности .
Результаты исследований активности предлагаемых соединений указывают на сильную противовоспалительную активность и минимальную системную активность (токсичность) мягких стероидов формулы I. Благодаря зтому соецинекия могут быть использованы при лечении топических или других локализованных воспалительных процессов, не вызывая серьезных системных побочных действий, обычно проявляемых известными природными и синтетическими глюкокортикостероидами, такими как кортизон, гидрокортизон, гидрокортизон- 1 7а1-бутират, бетаметазон-17-ва- лерат, триамцинолон, бетаметазон дипропионат и др.
Испытание по инволюции тимуса. Испытуемыми животными были самки крыс Spague-Dawley весом приблизительно по 40-45 г. Одну сторону каждого уха каждой крысы обрабатывали 25 мкл раствора (этанол/изопропил- миристат или ацетон/изопропилмиристат 90:10), содержащего испытываемое со- единение. Контрольных животных обрабатывали аналогичным образом, но без испытываемого соединения. Через 24 ч всех крыс умерщвляли и взвешивали , их тимусы (вилочковой желез г) удаляли и взвешивали.
В табл. 4 показано влияние топического назначения стероидов на вес тимуса, где SD - стандартное (среднеквадратичное ) отклонение.
Изменение веса тимусов является
мерой системной активности, а следовательно , токсичности. Чем ниже вес тимусов, тем выше системная активность .
Как видно из приведенных данных,
даже гидрокортизон, природный глю- кокортикоид, вызывает значительное снижение веса тимуса пго сравнению с контролем. Снижение веса тимуса, вызванное равными дозами предлагаемых
соединений, гораздо менее значительно , следовательно,, эти соединения имеют гораздо меньшую системную активность , чем гидрокортизон.
55
Изучение побледнения.
Исследования побледнения людей типа Mekenzie предпринимали для изучения эффектов побледнения, вызываемых испытываемыми соединений, в част1113
ности хлорметил-1 7с,-этоксикарбонил- окси-1 1й-оксиандрост-4-ен-3-он-1 7|J- карбоксилатом. Способность соединений вызывать побледнение у людей, как было обнаружено, связано с их проти- вовоспалительной активностью.
Испытываемое соединение растворяли в смеси этанол/изопропилпиристат (90:10 или 70:30) в концентрациях 0,03; 0,01; 0,003; 0,001 и 0,0003 М. Кусочки марлевого бинта пропитывали раствором по 50 мкл и повязку накладывали на предплечье. После 6-часовой выдержки повязку удаляли. Через 1-5 ч после удаления повязки наблюдали по- бледнение даже при самых низких концентрациях испытываемого соединения.
При испытании гидрокортизона побледнение не наблюдалось при концентрациях гидрокортизона ниже 0,03 М. Кроме того, замечено, что гидрокортизон в концентрации 0,03 М вызывал приблизительно ту же степень побледнения , что и хлорметил- 7od-3TOKCHKap- бонилокси-1 1|5-оксиандрост-4-ен-1 карбоксилата в концентрации 0,001 М.
Испытание с отеком уха.
Опытными животными были крысы Sprague-Dawley весом приблизительно по 150 г. Испытываемое соединение растворяли в ацетоне, содержащем 5% кротонового масла, и 50 мкл раствора наносили на внутреннюю поверхность правого уха крысы. Контрольную группу обрабатывали идентично только но- сителем, т.е. 5%-ным раствором кротонового масла в ацетоне. Через 6 ч
после нанесения кротонового масла одну и ту же область каждого уха удаляли путем рассечения под анестези- ей. Через 48 ч после обработки стероидом животных умерщвляли и тимусы и надпочечники удаляли и взвешивали. Результаты испытаний-, показывающие ингибирующее действие топически при- меняемых стероидов .на опухоль уха, вызванную кротоновым маслом, сведе-ны в табл. 5.
Как видно из табл. 5, хлорметил- 1 7об этоксикарбонилокси-11 -оксианд- рост-4-ен-З-он-17й-карбоксилат существенно ингибирует образование опухоли (а следовательно и увеличение веса) уха, вызываемое кротоновым маслом, т.е. соединение проявляет значительную противовоспалительную активность. С другой стороны, в противоположность действию, вызываемому.
6912
бетаметазон-17-валератом, предлагаемое соединение не вызвало значительного уменьшения веса тимуса по сравнению с контролем, т.е. оно не обнаружило значительной степени (системной активности.
Испытание с образованием гранулемы .
Испытываемое соединение растворяли в ацетоне и определенные дозы с различными концентрациями инъецировали в хлопковые пилюли-шарики. Пилюли высушивали, а затем по одной пилюле имплантировали под кожу каждой подопытной крысе-самцу Sprague-Dawley весом 152-189 г. Через шесть дне животных умершвляли и грануляционную ткйнь (гранулему), которая образовывалась внутри шарика и вокруг имплантированного шарика, удаляли, высушивали и взвешивали. Кроме того, удаляли и взвешивали тимусы и надпочечники . Способность соединения ингиби- ровать образование гранулемы в данно опыте указывает на локальную противовоспалительную активность: чем ниже вес грануляционной ткани, тем выше противовоспалительная активность. С другой стороны, значительное снижение веса тимуса является свидетельством высокой системной активности; и наоборот, незначительное снижение веса тимуса испытываемым соединением по сравнению с контролем свидетельствует об отсутствии (или наличии ми- нимальны.х) системных побочных эффектов .
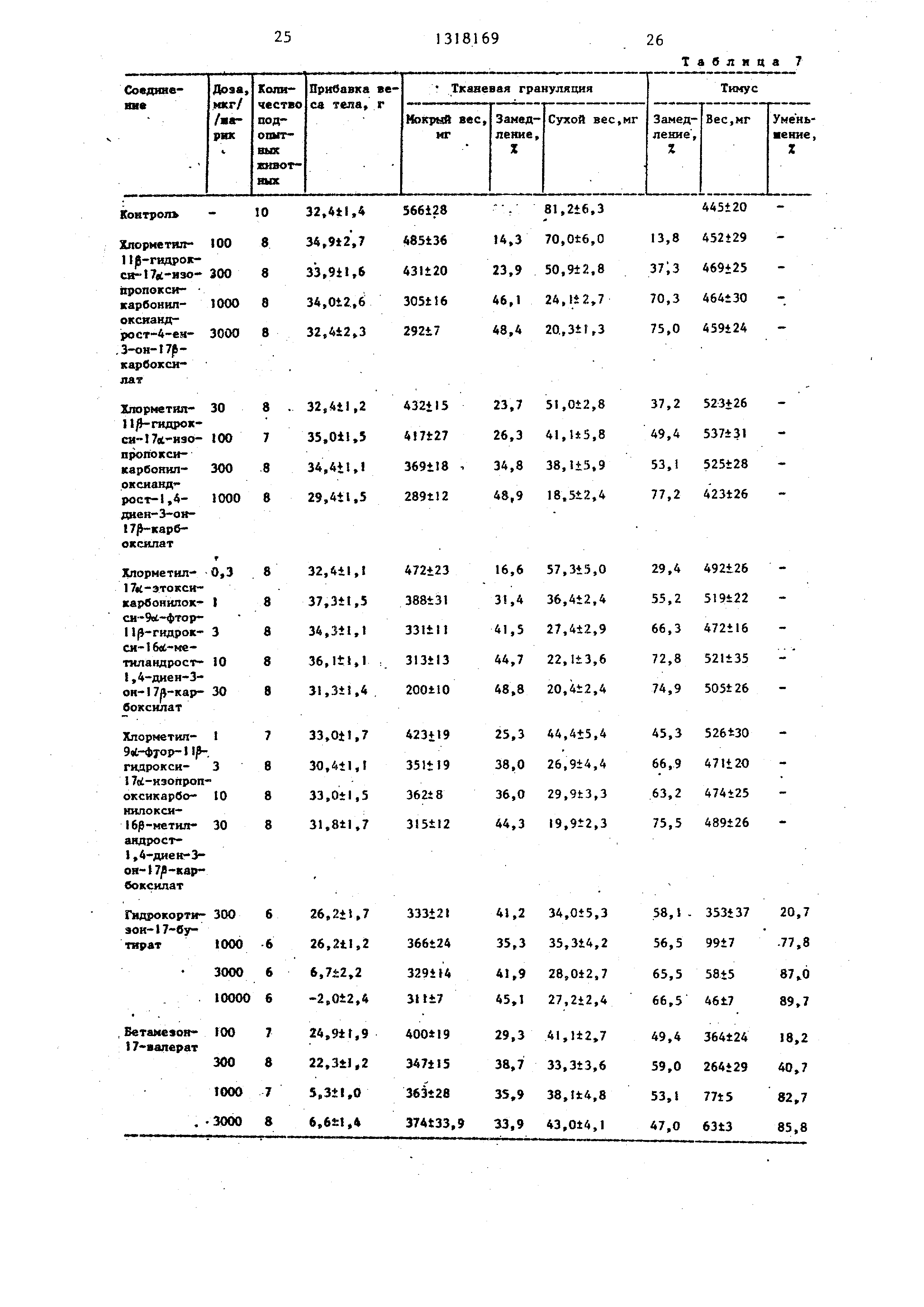
Влияние стероидов при местном назначении на вес тела, вес тимуса и образование тканевой грануляции, вызванной имплантацией крысам хлопковых шариков показано з табл.6-9.
Приведенные в табл. 6-9 данные свидетельствуют о том, что предлагаемые соединения проявляют значительную противовоспалительную активность при более низких дозах, чем известные стероиды (гидрокортизон-17-бути- рат и бета-метазон-17-валерат). С другой стороны, все известные стероиды резко снижают вес тимусов и, таким образом, показывают очень высоку системную активность, в то время как предлагаемые соединения почти не снижают вес тимусов. Таким образом, предлагаемые соединения имеют гораздо больший терапевтический коэффициент , т.е. разграничение локальной
1313
противовоспалительной и системной активности, чем известные стероидные противовоспалительные агенты.
Ео результатам испытаний, вычисляли . величины , ЕДу и ЕД и относительную силу действия (относительную активность) предлагаемых соединений , которые показаны в табл.10 Сила «действия хлормвтил-1 1р-окси-1 7oi- изопропоксикарбонилоксиандрост-4-ен- З-он-17р-карбоксилата принята за 1 при каждом уровне ЕД, а силы действия других соединений выражены относительно данной величины. Величины ЕД,,, и ЕД представляют собой дозы, требуемые для достижения соответственно 40, 50 и 60% снижения веса грануляционной ткани.
Испытание по ингибированию тимуса
Определяли дейстйие отдельных соединений на вес тимусов у крыс при систематическом назначении лекарства (подкожно). В каждом из исследований использовали самцов крыс Sprague-Daw- ley. Испытываемые соединения суспендировали в 0,5%-ной карбоксиметилцел- лкшозе и инъецировали подкожно один. раз в день ё течение трех дней. На пятый день (чербз 48 ч после последней обработки) животных умерщвляли и регистрировали вес тимусов, Увеличение (прирост) веса тела измеряли через 24 ч после последней обработки.
Результаты опытов представлены в табл. 11-13.
Величины ТЕД45 , ТЕД (тимолити- ческие эффективные дозы, требуемые для достижения 40 и 50% ингибирова- ния веса тимусов соответственно) и относительная сила действия предлагаемых соединений и известных стероидов , назначаемых подкожно, показаны в табл. 14, причем относительная сила известного стероида бетаметазон-17- ваперата принята за 1, а сила других соединений выражена относительно данной величины. Очевидно, что чем вьше ингибирование активности тимуса в заданной дозе, тем более токсичным является соединение.
Определяли тимолитическую активность предлагаемых соединений по сравнению с бетаметазон-17-валератом Лекарство вводили крысам внутривенно при этом использовали слепой анализ на гранулему в хлопчатобумажном шарике . Использовали самцов крыс Spra914
gue-Dawley весом по 1 85 г (166-196 г). Два хлопчатобумажных шарика по 30 мг, не содержащих испытываемых соедине- НИИ, стерилизовали и имплантировали
подкожно в спину каждого опытного животного. Данный день считался днем нулевой имплантации. Испытываемые соединения , суспендированные в 0,8%-ном полисорбате-80, вводили внутривенно один раз в день последовательно в течение трех дней, начиная с первого дня. На 5-й день животных умерщвляли и два шарика с соответствующими гранулемами удаляли, высушивали в печи в течение ночи при 58 С и взвешивали (сухой вес гранулемы). Вес тимусов и конечный вес тела также регистрировали. Результаты даны в табл. 15.
В предыдущих опытах определяли дезактивацию мягких стероидов, вводимых внутривенно крысай. Соотношение между силой действия испытываемых
стероидов и бетаметазон-17-ваперата против локального воспаления было 283:0,7 (табл. 11). Это означает, что испытываемые соединения проявля- ют -локальную противоспалительную активность , которая приблизительно в 400 раз выше активности бетаметазон- 17-валерата. Испытываемые соединения вводили крысам внутривенно для проверки на системную противовоспалительную активность по сравнению с бетаметазон-1 7-валератом. Испытываемые соединения обладают более низкой активностью по торможению образования грануляционной ткани, а также в отношении активности обратного развития тимуса, чем бетаметазон-17-ва- лерат. Из результатов опытов можно сделать предположение, что соединения , которые нелегко подвергаются метаболизму (дезактивации), обладают системной противовоспалительной ак- итвностью, как зто- имеет место в случае с бетаметазон-i7-валератом.
Величины ЕД , вычисленные по данным анализа на локальную гранулему в хлопчатобумажном шарике, и величины , вычисленные на основе опытов по ингибированию тимуса, использовали для определения относительной силы действия и терапевтического коэффициента (индекса) предлагаемых соединений по сравнению с известными стероидами (табл. 16).
15
Данные табл. 16 показывают сильную противовоспалительную активност и минимальную системную токсичность предлагаемых соединений.
Токсичность определяли путем под кожного введения соединения мьшам, лишенным пищи в течение 12 ч перед испытанием.
Получены следующие значения LD 5 мг/кг:
2Д-2Более 5000
2А-3
2А-5
2 А-7
2А-8- -,
2А-12- 2А-19Более 5000
2А-20- 2А-21- 2А-23
2 А-2 7
II 11 It
Т|
It
9
16
R, .- водород, об - или -метил;
R, - водород или фтор;
Rj - водород, фтор или метил;
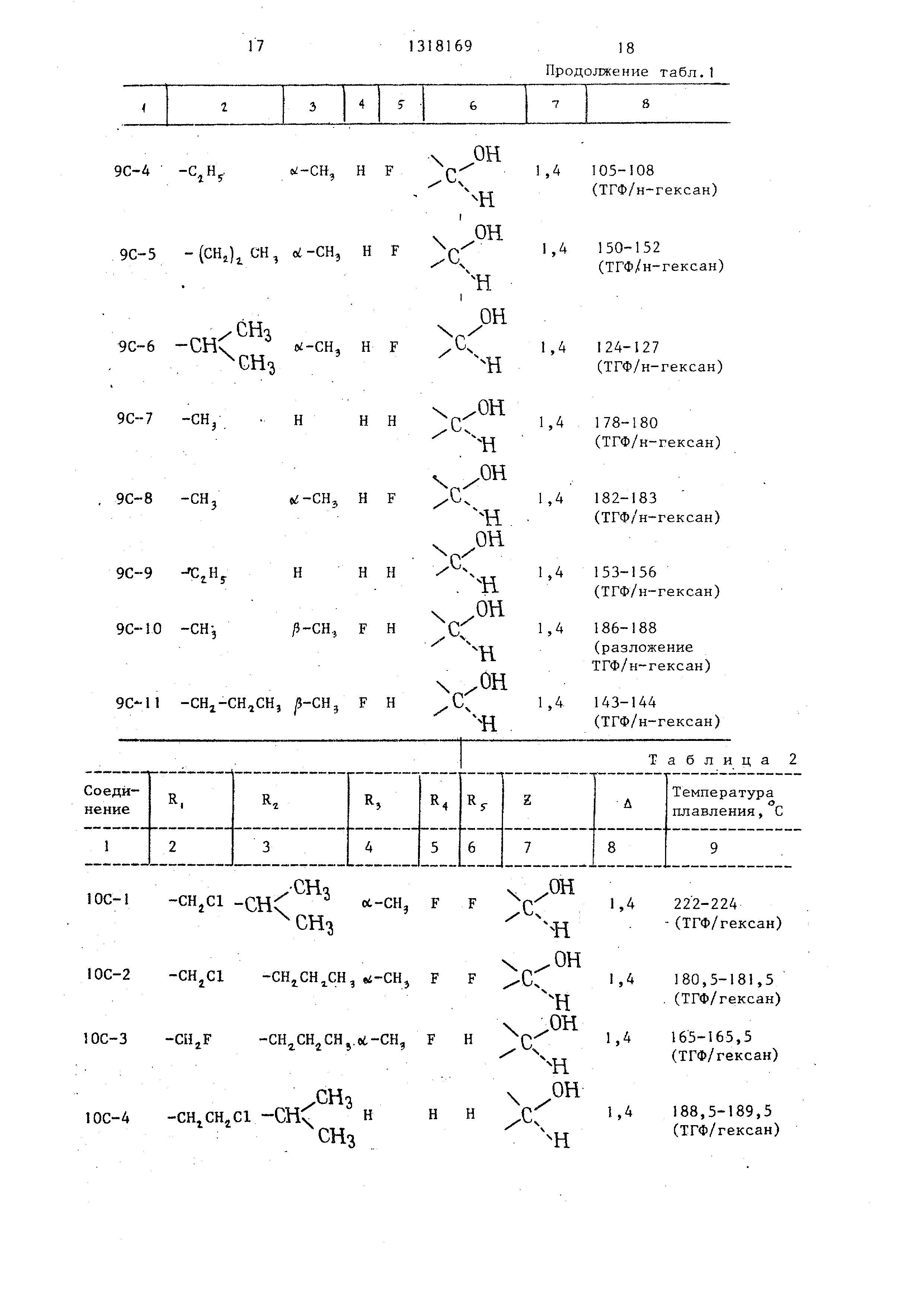
Zg - карбонил или ,й-оксиметилен, пунктирная линия означает возМож- ную углерод-углеродную связь, или их четвертичных аммонийных солей отличающийся тем, что, соединение общей формулы И
ОН
о
.-- VTR-20
Формула изобретения
; Способ получения стероидных соединений общей формулы I
о
, 3
где RI - низший галоидалкил; R - низший алкил;
5
0
5
где Rj,R,R,Ry и пунктирная линия
имеют указанные значения;
М - щелочной металл , подвергают взаимодействию с соединением формулы
R,W, где R имеет указанные значения;
W - гелоген,
и при необходимости полученные со единения формулы I, -где R( низшая галоидзамещенная группа, подвергают взаимодействию с третичным амином или с ненасьпцённым амином, с последующим выделением целевых продуктов в свободном виде или в виде четвертичных
аммо нийных солей. I
; Т а б л и ц а 1















Реферат
Изобретение касается замещенных стероидных соединений, в частности, общей формулы CH - сн,СН ,- СИ - ОК(...X)-CR СИ. ,нения формулы II R,W, где R,-W указано вьше, а W - галоген. При необходимости получения соединения I, где R, - низший галоидалкил, обрабатывают указанную соль щелочного металла ненасыщенным амином. Выделение соединения I ведут либо в свободном виде , либо в виде четвертичных гшмоний- ньгх солей.Испытания соединения I показывают , что они обладают сильным местным противовоспалительным действием без побочных эффектов, которые наблюдаются в известных случаях кор- тизон, гидрокортизон и др. . 16 табл. i СО X) от:) со см

Формула


Комментарии