Олигосахаридсодержащие 14-аминостероиды, способ их получения, фармацевтическая композиция, способ лечения, способ введения аминогруппы - RU2153503C2
Код документа: RU2153503C2
Чертежи










Описание
Область, к которой относится изобретение
Изобретение относится к новым
олигосахарид-содержащим 14-аминостероидным соединениям. Это изобретение также относится к фармацевтическим композициям, содержащим эти новые соединения, а также к способу лечения застойной сердечной
недостаточности (ЗСН) с применением соединений настоящего изобретения. Далее это изобретение относится к новому процессу введения аминогруппы в положение 14 стероидного скелета.
ЗСН - это прогрессирующее заболевание, при котором сердце в значительной степени не способно поддерживать адекватный минутный сердечный выброс (СВ), который представляет собой объем крови, постоянно перекачиваемый сердцем, чтобы доставить обогащенную кислородом кровь к периферическим тканям. В начальный период заболевания сердца остальной организм компенсирует недостаток СВ и такие компенсирующие механизмы приводят в конечном счете к синдрому, известному как ЗСН. По мере того, как ЗСН прогрессирует, происходят структурные и гемодинамические нарушения. Такие структурные нарушения проявляются на макроскопическом уровне в виде вентрикулярной гипертрофии в миокарде, а на микроскопическом - в виде фиброза межуточной (интерстициальной), периваскулярной и заместительной ткани в стенке желудочка, уменьшенной плотности капилляров миокарда и смерти клеток миокарда. Когда происходит фиброз тканей миокарда, он ставит под угрозу деятельность сердца, т.к. на остающиеся, жизнеспособные клетки приходится большая нагрузка.
Гемодинамически в недостаточном сердце способность развить усилие вдоль систолы (фаза в сердечном цикле, в течение которой происходит выброс крови из желудочка) уменьшается. Так, для выполнения одной и той же внешней работы требуется больший конечный диастолический объем (во время диастолической фазы сердечного цикла происходит наполнение желудочка). При сердечной недостаточности уменьшенный выброс, вызванный несоответствием работоспособности и нагрузки, приводит к увеличению конечного диастолического давления и давления в легочных капиллярах. Частыми последствиями являются легочная эмболия и периферический отек. По мере того, как ЗСН прогрессирует, пациент испытывает ухудшающиеся симптомы утомляемости и затрудненного дыхания.
Эффективное лечение ЗСН требует определения ее этиологии, если возможно, так как некоторые этиологии ЗСН требуют своей особой (уникальной) формы лечения. ЗСН имеет множество причин, включая болезни миокарда, такие как опущение митрального клапана или стеноз аорты; болезни перикарда; врожденный порок сердца; легочное заболевание, сердечная аритмия, гипертония и диабет. Например, если причиной ЗСН является миокардит или аритмия, то лечение пациента антибактериальным или антиаритмическим агентом, соответственно, может восстановить у пациента нормальную сердечную деятельность.
Однако, если этиологии не реагируют на проводимое лечение, назначают один или более из трех вариантов лечения: 1) улучшение сердечной деятельности назначением агента, изменяющего сократимость мышечной ткани, такого как дигиталис; 2) уменьшение нагрузки на сердце за счет отдыха и/или назначения сосудорасширяющих лекарств, таких как каптоприл; и 3) регулирование содержания натрия и задерживания воды с помощью бессолевой диеты или назначением диуретиков, таких как тиазид. Лечение ЗСН индивидуализируется в соответствии с симптомами у пациентов и переносимостью ими лекарств. Например, некоторые пациенты имеют сильную тенденцию к отравлению дигиталисом, тогда как у других пациентов с более легкой формой заболевания может наступить улучшение от диуретиков, имеющих большую терапевтическую широту. Более того, обычный здравый смысл подсказывает, что диуретики пригодны как первое средство при терапии ЗСН, и что за лечением диуретиками должны последовать сосудорасширяющие средства и дигиталис. Было также замечено, что дигиталис наиболее эффективен при назначении пациентам, страдающим ЗСН в тяжелой форме. См. общие положения, Braunwald, Heart Disease: A Textbook of Cardiovascular Medicine. Vol. (3rd ed. 1988), Chung, E.K., Quick Reference to Cardiovascular Disease. Chapter 27 (2d ed. 1983) и Fowler, N.O., Caidiac Diagnosis and Treatment. Chapter 12 (2d ed. 1976).
Хотя дигиталис пригоден для улучшения симптомов, связанных с гемодинамическими нарушениями, характерными для тяжелой формы ЗСН, в действительности его малая терапевтическая широта ограничивает его терапевтическое применение. См. общие положения, Braunwald, Heart Disease: A Textbook of Cardiovascular Medicine, Vol. (3rd ed. 1988), Chung, E.K., Quick Reference to Cardiovascular Disease. Chapter 27 (2d ed. 1983) и Fowler, N.O., Cardiac Diagnosis and Treatment. Chapter 12 (2d ed. 1976) и Goodman and Gilman, The Pharmacological Basis of Therapeutics, Chapter 34 (8th ed. 1990).
Проблемы токсичности, связанные с дигиталисом, побудили исследователей попытаться получить более безопасные активные сердечные средства. Кардиоактивные соединения, содержащие стероидный скелет, описаны в следующих патентах: заявка WO 87/04167 (Chiodini et al.), опубликованная 16 июля 1987 года, описывает аминогликозидные производные стероидов, у которых в положении 3 находится остаток аминосахара, а в положении 14 - ацеталь. В реферате утверждается, что соединения пригодны для лечения гипертонии. Патент Франции 2,642,973 (Guina), опубликован 17 августа 1990 года, описывает дигиталисоподобное соединение, 2,3-диоксиметил-6-метил-3-бета-D-глюкозастрофантидин, которое содержит стероидный скелет, замещенный в положении 3 на остаток глюкозы, в положении 17 - на остаток лактона, а в положении 14 - гидроксильной группой. Реферат утверждает, что соединение пригодно для предотвращения патологических состояний, возникающих в результате сердечной недостаточности, для которых прописывается дигиталис, и для предотвращения патологических состояний, возникающих при гипертонии вследствие объизвествления артерии. Соединение Guina, как утверждают, является положительным инотропом (изменяет сократимость мышечной ткани), периферическим сосудорасширяющим средством и противоаритмическим агентом. Заявка WO 87/04167 (Chiodini et al.), 16 июля 1987 года, описывает аминогликозидный стероид, имеющий в 3 положении остатки алкилзамещенных аминосахаров, такие как 2-амино или 2-алкиламино-2-дезокси-гексопиранозил, 3-амино или 3-алкиламино-3-дезокси-гексопиранозил, 3-амино или 3-алкиламино-3,6-дидезокси-гексопиранозил, 3-амино или 3-алкиламино-2,3,6-тридезокси-гексопиранозил, 4-амино или 4-алкиламино-2,4, 6-тридезокси-гексопиранозил и циклический амид (лактам) в положении 17. В положении 14 заместитель представляет собой Н. Сказано, что соединение может применяться как противогипертоническое средство. Заявка WO 91/17176 (Kenny, et al. ), опубликована 14 ноября 1991 года, описывает стероидный гликозид, применимый в качестве сосудосуживающегося средства, имеющий в положении 3 фрагмент сахара, такого как пентоза, гексоза или их комбинация, и лактонный цикл в положении 17, в положении 14 заместитель ОН, H или F, Cl, Br или NH2; DD 296,502 A5, выдан 5 декабря 1991 года, предлагает для лечения сердечной недостаточности стероидный амин, у которого в положении 3 находится сульфониламиногруппа, а в положении 17 заместитель 5- или 6-членный лактонный цикл, в положении 14 заместителем является OH. Патент США 5,144,017 (LaBella) 1 сентября 1992 года заявляет стероидные соединения, которые, как указано, применимы в качестве сердечных стимуляторов, и в которых в положении 3 заместителем является гликозидный радикал, такой как β D-глюкозид, α L-рамнозид, тридигитоксозид и в положении 17 заместителями являются ацетокси или аминогруппа, а в положении 14 заместителем является OH-группа; патент США 5,175,281 (McCall), 29 декабря 1992 года, заявляет пиримидинилпиперазинильные стероидные соединения, применимые для лечения спинальных травм, черепных травм и соответствующих церебральных сосудистых спазм, предотвращения повреждений, возникающих при восстановлении деятельности сердца и легких при инфаркте, соединения, в которых в положении 3 находятся заместители ОН, CH3O, COOH или бензокси, в положении 14 находится H, а в положении 17 заместителем является гетероциклический амин. DD 256,134 A1 (Wunderwald, et al. ), выдано 27 апреля 1988 года, заявляет способ получения кардиоактивных стероидов, в которых в 3-положении стероидной молекулы находится заместитель - морфолиноформилокси-остаток, положение 17 стероидного скелета замещено лактонным циклом; а в положении 14 находятся заместители ОН, H или олефин. Заявленные соединения, как утверждается, применимы для увеличения сократительной способности сердечной мышцы. Патент Японии 4-290899 (Ichikawa, et al.), выданный 15 октября 1992 года, заявляет кардиотоническое стероидное соединение, в котором в 3-положении стероидного скелета находится олигосахарид; указанный олигосахарид состоит из трех глюкопиранозильных фрагментов, в положении 14 находится OH-группа, а положение 17 замещено лактонным циклом. Templeton, et al., 36 J. Med. Chem. 42-45 (1993) описывает синтез производных 14-гидрокси-21-нор-5 β, 14 β- прегнана и 5 β, 14 β- прегнан С-3 α- L-рамнозидов и трис β- D-дигитоксозидов. Сообщается, что указанные соединения являются эффективными кардиотоническими средствами. Эти производные, имеющие С-17 β COCH2ОН, CH2OH, COOH, COOMe, CH2NH2 или CH2 NO2 группу, влияют на ту сторону сердечной мышцы, которая реагирует на рецептор дигиталиса. Templeton, et al., 1 J. Chem. Sci. Trans., 2503-2517 (1992) описывает синтез 20 α- и 20 β- ацетамидо-, амино-, нитро- и гидрокси-3 β- гликозида (α- L-рамнопиранозида и трис-β-D-дигитоксозида) и генин-производных 14-гидрокси-5 β, 14 β- прегнана вместе с С-20 оксимом, гидразоном и амидиногидразоном. Утверждается, что эти соединения являются эффективными кардиотоническими средствами.
Кроме того, ингибиторы ангиотензин-превращающего фермента (АПФ), как было показано, уменьшают смертность среди больных ЗСН. Cм. Nicklas, J.M. and Pitt, В., et al. (The SOLVD Jnvestigators), "Effect of Enalapril on Survival in Patients with Reduced Left Ventricular Ejection Fractions and Congestive Heart Failure", N. Engl. J. Med. 325(5):293 (1991).
Тем не менее четыре миллиона человек еще страдают от ЗСН. Смертность через пять лет после установления диагноза ЗСН наблюдается для 60% мужчин и 45% женщин. Это ясно указывает, что нужны лучшие лечебные средства для лечения ЗСН. См. Parmley, W.W., "Pathophysiology and Current Therapy of Congestive Heart Failure", J. Am. Col. Cardiol. 13:771-785 (1989); Francis, G. S. et al., "Congestive Heart Failure: Pathophysiology and Therapy", Cardiovascular Pharmacology, 3rd Edition (1990).
14-Аминостероидные соединения, как было показано, активны при лечении ЗСН, так как усиливают сократительную способность сердечной мышцы. Эти соединения дают терапевтический эффект за счет усиления сократительной способности сердечной мышцы без побочного действия дигиталиса. Эти 14-аминостероиды и способы их получения описаны в следующих трех патентах вместе с приведенными в них ссылками: патент США 4,325,879 (Jarreau, et al.), выдан 20 апреля 1982 года (U.S. '879) (эквивалентен французской заявке 2,464,270); патент США 4, 552,868 (Jarreau, et al.), выдан 12 ноября 1985 года (U.S. '868); патент США 4,584,289 (Jarreau, et al.), выдан 22 апреля 1986 года (U. S. '289) и патент США 4,885,280 (Jarreau, et al.), выдан 5 декабря 1989 года (U. S. '280). Эти четыре патента описывают 14-аминостероидные соединения, обладающие кардиотонической активностью, и способы их получения. U.S. '879; '868; '289 и '280 - все заявляют применение азотистоводородной кислоты для получения азидных производных в положении 14, которые затем восстанавливаются до аминов. Adeoti, S. B., et al., "Introduction Of A 14 β -Nitrated Function, Into The Steroid Ring To Prepare The Cardioactive Molecule, 14 β -Amino-5 β Pregnane-3 β , 20 β -Diol, from Progesterone and Deoxycholic Acid, " 45(12) Tetrahedron Letters, 3717-3730 (1989) описывает два способа введения 14 β -амино функции в стероидную молекулу, включая 1) реакцию циклизации в присутствии N3H, BF3• Et2O или аммиака или 2) обработку стероидного скелета N3H, BF3•Et2O. Указанные методы позволяют получать кардиоактивный 14 β амино-5 β прегнан-3 β , 20 β- диол. Naidoo. В.К. et al., "Cardiotonic Steroids I: Importance of 14b-hydroxy Group in Digitoxigenin," 63 (9) Jnl Pharm Sci., 1391-1394 (1974) описывает экспериментальные попытки получить 14 β- аминостероидные соединения, используя иодизоцианат. Однако исследователям не удалось ввести аминогруппу в положение 14 стероидного скелета, используя химию иодизоцианата. Применимость химии иодизоцианата к синтезу стероидных соединений в общем виде описана в: Ponsold, К., et al., "Gekoppelt Additionsreactionen an 14, 15-ungesattigten Androstanen Einfluss des positiven Halogens auf die Regioselektivitat," Journal f. pract. Chemie, Band 325, Heft 1, 1983, S. 123132; Ponsold, K., et al., "Synthese und Reaktivitat von Estra-1,3,5(10)-trienen mit heterocyclischen Vierringen in 14,15-Stellung", "Journal f. pract. Chemie, Band 328, Heft 5/6, 1986, S. 673-681; и Bohl, M., et al. , "Quantitative structure-activity relationships of estrogenic steroids substituted at C14, C15", Steroid Biochem. Vol. 5, pp. 589-597, 1987.
Было найдено, что 14-аминостероидные соединения настоящего изобретения, у которых в положении 3 заместителем является фрагмент олигосахарида, представляют собой более эффективные инотропные агенты. Указанные олигосахаридсодержащие 14-аминостероиды более устойчивы к метаболизму и, следовательно, обеспечивают большую продолжительность инотропной активности, чем ранее применявшиеся на практике 14-аминостероиды. Было также найдено, что аминогруппа может быть введена в положение 14 стероидного скелета по способу с применением иодизоцианата, который более безопасен и эффективен, чем предыдущие методы.
Сущность изобретения
Олигосахарид-содержащие 14-аминостероидные
соединения и фармацевтически-пригодные соли или эфиры кислот из них общей формулы

в которой a) R1 означает
(i) COOR5, где
R5 означает водород; алкил с 1-6 атомами углерода; низшие алкилы с 1-6 атомами углерода, замещенные аминогруппой; арилалкил или гетероарилалкил или карбоциклическое кольцо; или
(ii) CHR6OH, где
R6 означает атом водорода или низший алкил с 1-6 атомами углерода; или
(iii) COR''', где
R''' означает водород; низший алкил с 1-6 атомами углерода; аминозамещенные низшие алкилы с 1-6 атомами углерода; амино или диалкиламино; и
b) R2 означает -NR7R8, где
R7 и R8, которые могут быть одинаковыми или различными, означают атомы водорода или низшие алкилы с 1-6 атомами углерода; и
с) R3 означает
(i) олигосахаридный остаток сахара, имеющий следующую структуру:

где R9 означает водород; метил; гидрокси; карбокси; ацетокси; арилалкокси; гетероарилалкокси; или бензокси; R10 означает водород; метил; карбокси; ацетокси; арилалкокси; гетероарилалкокси; бензокси или гидрокси; R11 означает кислород; в котором далее, если R11 является заместителем у концевого моносахаридного остатка, R11 означает OH; метил; ацетокси; гетероарилалкокси; арилалкокси; и R12 означает водород; метил; метилгидроксиметил; или ацетоксиметил; или
(ii) олигосахаридный остаток сахара, имеющий следующую структуру:

где R14 и R15, которые могут быть одинаковыми или различными, означают водород; низшие алкилы с 1-6 атомами углерода; арилалкил; гетероарилалкил; гетероарил или арил; R17 может быть водород; гидрокси; ацетокси или бензокси; R18 или R19 означает гидрокси; ацетокси или бензокси; или
(iii) олигосахаридный остаток, имеющий следующую структуру:

где R14 и R15, которые могут быть одинаковыми или различными, означают водород; низшие алкилы с 1-6 атомами углерода; гетероарилалкил; арилалкил или арил; R14a означает кислород; где далее, если R14a означает заместитель у концевого моносахаридного остатка, R14a должен быть гидрокси; метил; ацетокси; арилалкокси или гетероарилалкокси; и
d) R4 означает
(i) ОН, или
(ii) H, или
(iii) OR13, где R13 означает моносахаридный остаток; ацетокси; бензокси; арилалкил или гетероарилалкил; и
е) Z означает
(i) -CH-, где а и b означают одинарные связи, или
(ii) =С, где либо а, либо b означают двойную связь.
Настоящее изобретение также относится к способу введения аминогруппы в положение 14 стероидного скелета, в котором указанная аминогруппа диастереоселективно вводится в положение 14
стероидного ядра через присоединение иодизоцианата и который включает стадии:
а) присоединение иодизоцианата к двойной связи в положении 14-15 стероидного ядра; и
b) дегалоидирование;
и
с) превращение изоцианата в амин в положении 14 стероидного ядра.
Определение используемых терминов
Далее приводится список определений терминов, используемых в
дальнейшем.
"Аминостероид" означает стероидное циклическое соединение, имеющее аминогруппу в стероидном ядре.
"Алкил" означает незамещенный или замещенный, неразветвленный, циклический или разветвленный, насыщенный углеводородный остаток, имеющий от 1 до 8 атомов углерода и, предпочтительно, если не указано иначе, от 1 до 4 атомов углерода. Предпочтительные алкильные группы включают, но не ограничиваются только этим, метил, этил, пропил, изопропил и бутил; одновалентный радикал, произведенный из алифатического углеводорода за вычетом 1H; как, например, метил. Низшие алкильные группы содержат 1-6 атомов углерода.
"Гетероалкил" употребляется ниже для незамещенной или замещенной насыщенной 3-8 членной цепи и включающей атомы углерода и один или два гетероатома.
"Алкенил" означает незамещенную или замещенную, неразветвленную или разветвленную углеводородную цепь, имеющую от 2 до 8 атомов углерода, предпочтительно от 2 до 4 атомов углерода, и имеющую по крайней мере одну олефиновую двойную связь.
"Алкинил" означает незамещенную или замещенную, прямую или разветвленную углеводородную цепь, имеющую от 2 до 8 атомов углерода, предпочтительно от 2 до 4 атомов, и имеющую по крайней мере одну тройную связь.
"Ацетат": соль уксусной кислоты, содержащая CH3COO-радикал.
"Ацетокси": Ацетилокси. Радикал CH3COO-.
"Ацетил": Ацильный радикал CH3СО-.
"Агликон": тот компонент гликозида, например, растительный пигмент, который не является сахаром.
"Карбоциклическое кольцо" или "Карбоцикл", как употребляется в дальнейшем, означает незамещенный или замещенный, насыщенный, ненасыщенный или ароматический углеводородный цикл, обычно содержащий от 3 до 8 атомов, предпочтительно от 5 до 7 атомов.
"Гетероциклическое кольцо" или "Гетероцикл", как употребляется в дальнейшем, означает незамещенный или замещенный, насыщенный или ненасыщенный или ароматический цикл, состоящий из атомов углерода и одного или двух гетероатомов в кольце. Гетероциклические кольца обычно содержат от 3 до 8, предпочтительно от 5 до 7 атомов. Если не указано иначе, гетероатом может независимо выбираться из азота, серы и кислорода.
"Арил" означает ароматическое карбоциклическое кольцо. Арильные группы включают, но не ограничиваются этим, фенил, толил, ксилил, куменил и нафтил; органические радикалы получены из ароматического углеводорода вычитанием одного атома водорода: например, фенил из бензола.
"Гетероарил" означает ароматическое гетероциклическое кольцо. Предпочтительные гетероарильные группы включают, но не ограничиваются этим, теснил, фурил, пирролил, пиридинил, пиразинил, оксазолил, тиазолил, хинолинил, пиримидинил и тетразолил.
"Алкокси" означает атом кислорода, имеющий заместителем углеводородную цепь, где углеводородная цепь означает алкил или алкенил (например, -O-алкил или -O-алкенил); "Алкокси" - алкильный радикал, присоединенный к остальной части молекулы через кислород; как метокси. Предпочтительные алкоксигруппы включают, но не ограничиваются этим, метокси, этокси, пропокси и алкилокси.
"Гидроксиалкил" означает замещенную углеводородную цепь, которая имеет заместитель гидрокси (например, -ОН), и может иметь другие заместители. Предпочтительные гидроксиалкильные группы включают, но не ограничиваются этим, гидроксиэтил, гидроксипропил, фенилгидроксиалкил.
"Карбоксиалкил" означает замещенную углеводородную цепь, которая имеет заместитель карбокси (например, -COOH), и может иметь другие заместители. Предпочтительные карбоксиалкильные группы включают карбоксиметил, карбоксиэтил и их кислоты и эфиры.
"Аминоалкил" означает углеводородную цепь (например, алкил), замещенную на фрагмент амина (например, NH-алкил), такую как диметиламиноалкил.
"Алкиламино" означает фрагмент амина, имеющий один или два алкильных заместителя (например, -N-алкил).
"Алкениламино" означает фрагмент амина, имеющий один или два алкенильных заместителя (например, -N-алкенил).
"Алкиниламино" означает фрагмент амина, имеющий один или два алкинильных заместителя (например, -N-алкинил).
"Алкилимино" означает фрагмент имина, имеющий один или два алкильных заместителя (например, N=алкил).
"Арилалкокси" означает атом кислорода, имеющий
заместитель арилалкил, например, фенилметокси; фенилметиленокси

"Гетероарилалкокси" означает атом кислорода, имеющий заместитель гетероарилалкил, например

"Арилалкил" означает алкильный фрагмент с арилом в качестве заместителя. Предпочтительные арилалкильные группы включают бензил и фенилэтил.
"Гетероарилалкил" означает алкильный фрагмент с гетероарильной группировкой в качестве заместителя.
"Ариламино" означает остаток амина, замещенный арильной группой (например, -NH-арил).
"Арилокси" означает атом кислорода, имеющий арильный заместитель (например, -O-арил).
"Ацил" или "карбонил" означает фрагмент, образованный удалением гидрокси из карбоновой кислоты (например, R-C(=O)-). Предпочтительные алкилацильные группы включают, но не ограничиваются этим, ацетил, пропионил и бутаноил.
"Ацилокси" означает атом кислорода, имеющий ацильный заместитель (например, -O-ацил); например, -O-С(=O)-алкил.
"Ациламино" означает остаток амина, имеющий ацильный заместитель (например, -N-ацил); например, -NH-(C=O)-алкил.
"Бензокси": Бензоилоксирадикал.
"Бензоил": Арильный радикал, С6H5СО-, произведен от бензойной кислоты.
"Бензоилокси": Бензокси. Радикал C6H5COO-, произведен от бензойной кислоты.
"Карбамат": Соль карбаминовой кислоты; она содержит -NCO2-радикал, также известна на практике как уретан или эфир карбаминовой кислоты.
"Карбокси": Префикс, указывает на кислотную карбоксильную группу.
"Эфир" (сложный): Органическая соль, образованная из спирта (основание) и органической кислоты с выделением воды;
функциональные производные карбоновых кислот - означают те соединения, которые превращаются в карбоновые кислоты простым гидролизом. Наиболее обычны из таких производных - это эфиры, в которых
гидроксигруппа замещена на алкокси группу, например
"Гликозид": Природное соединение сахара с другими веществами, которые гидролизуются с образованием сахара плюс основное соединение (например, кониферин дает глюкозу плюс конифериловый спирт как основу); глюкозиды дают глюкозу, фруктозиды дают фруктозу, галактозиды дают галактозу и т.д.; циклический ацеталь углевода.
"Гало", "галоген" или "галоид" означает радикалы атомов хлора, брома; фтора или иода. Предпочтительными галоидами являются хлор, бром и фтор.
"Лактон": Любой из класса внутренних эфиров гидроксикарбоновых кислот, образованный потерей молекулы воды из гидрокси и карбоксильной групп кислот, характеризующийся наличием карбонил-окси группы -OCO- в кольце и классифицирующийся по положению гидроксигруппы в исходной кислоте; циклический эфир.
"Фармацевтически-приемлемые" соли означает катионную соль, образованную любой кислотной (например, карбоксильной) группой, или анионную соль, образованную любой основной (например, амино) группой. Многие такие соли известны в практике, как описано в заявке WO 87/05297 (Johnston et al.), опубликована 11 сентября 1987 года, и приведенных там ссылках. Предпочтительные катионные соли включают соли щелочных металлов (таких как натрий и калий), щелочноземельных металлов (таких как магний и кальций). Предпочтительные анионные соли включают соли галоидводородных кислот (такие как солянокислые).
"Соли": Вещества, полученные в результате реакции между кислотами и основаниями: соединение радикалов металла (положительный) и неметалла (отрицательный): М•ОН(основание) + HX(кислота) = MX(соль) + H2 O(вода).
"Стероидный скелет": Общее название для группы липидов, объединяющих стеролы, желчные кислоты, сердечные гликозиды, сапонины и половые феромоны.

"Заместитель": Любой атом или группа, замещающие водород исходного соединения.
"Заместить": поставить в соединении на место одного элемента или радикала заместитель.
"Замещенный": Относится к соединению, которое подверглось замещению.
"Замещение": Реакция, при которой атом или группа атомов в молекуле (обычно органической) замещается на другой (другую).
В заместителях самих может происходить замещение. Такие замещения могут осуществляться одним или более заместителей. Такие заместители включают, но не ограничиваются этим, те, которые приведены в C.Hansh и A.Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology (1979) и в данных там ссылках. Предпочтительные заместители включают, но не ограничиваются этим, алкил, алкенил, алкокси, гидрокси, оксо, амино, аминоалкил (например, аминометил и т.д.), циано, гало, карбокси, алкоксиацетил (например, карбэтокси и т. д. ), тиол, арил, циклоалкил, гетероарил, гетероциклоалкил (например, пиперидинил, морфолинил, пиперазинил, пирролидинил и т.д.), имино, тиоксо, гидроксиалкил, арилокси, арилалкил и их комбинации.
"Моносахарид" означает единичный фрагмент сахара: например, гексоза, 2-дезоксиглюкоза, 6-дезоксигексоза, 2, 6-дидезоксигексоза и т.д., рамноза, глюкоза, арабиноза, дигитоксоза, фруктоза, галактоза, рамнопираноза, гексопираноза, 6-дезоксиглюкоза, 4,6-дидезоксиглюкопираноза, манноза, цимароза, ксилоза, ликсоза, рибоза, дигиталоза, 4-амино-2,4,6-тридезоксиликсогексопираноза, 4-амино-4,6-дидезоксиглюкопираноза, 2,3-дидезоксирамнопираноза, 4-метокси-4,6-дидезоксирамнопираноза.
"Олигосахарид" означает сахар, содержащий 2-8 моносахаридных остатков, преимущественно 2-3. Последний моносахаридный остаток олигосахарида известен как "концевой" ("терминальный") моносахаридный остаток. Моносахаридные остатки, составляющие олигосахарид, могут быть одинаковыми и различными. Указанные моносахаридные остатки могут соединяться гликозидной связью от OH-группы одного моносахаридного остатка к аномерному углероду другого моносахаридного остатка.
"Моносахаридный" или "олигосахаридный" остаток может быть графически изображен в виде цикла или в виде
конфигурации кресла. Например, глюкоза (моносахарид) может быть представлена соответственно


Подробное описание изобретения
Настоящее изобретение охватывает некоторые олигосахаридсодержащие 14-аминостероидные соединения, способы их получения, фармацевтические композиции из них и метод лечения, использующий указанные новые соединения и композиции из них для лечения застойной сердечной недостаточности у людей и других млекопитающих. Конкретные соединения и композиции, которые применяются в изобретении, должны быть, соответственно, фармацевтически приемлемыми. Употребляемое ниже выражение "фармацевтически приемлемый" компонент означает, что он пригоден для применения человеком и/или другими млекопитающими без чрезмерных неблагоприятных побочных эффектов (таких как токсичность, возбудимость, аллергическая реакция) и при этом имеет значительное соотношение польза/риск.
Активные вещества
Олигосахарид-содержащие
14-аминостероидные соединения и фармацевтически приемлемые соли кислот или эфиры общей формулы

в которой
a) R1 означает
(i) COOR5, где
R5 означает водород; низший алкил с 1-6 атомами углерода; низший алкил с 1-6 атомами углерода, замещенный аминогруппой; арилалкил или гетероарилалкил или карбоциклическое кольцо, или
(ii) CHR6OH, где
R6 означает водород или низший алкил с 1-6 атомами углерода, или
(iii) COR''', где
R''' означает водород; низший алкил с 1-6 атомами углерода; низший алкил с 1-6 атомами углерода, замещенный аминогруппой; амино или диалкиламино: и
b) R2 означает -NR7R8, где
R7 и R8, которые могут быть одинаковыми или различными, означают атомы водорода или низший алкил с 1-6 атомами углерода; и
с) R3 означает
(i) остаток олигосахарида, имеющий следующую структуру:

где R9 означает водород; метил; гидрокси; карбокси; ацетокси; арилалкокси; гетероарилалкокси или бензокси; R10 означает водород; метил; карбокси; ацетокси; арилалкокси; гeтероарилалкокси; бензокси или гидрокси; R11 означает кислород; если же далее R11 является заместителем у терминального моносахаридного остатка, то R11 означает ОН; метил; ацетокси; гетероарилалкокси; арилалкокси; и R12 означает водород; метил; метилгидроксиметил; или ацетоксиметил; или
(ii) олигосахаридный остаток, имеющий следующее строение:

где R14 и R15, которые могут быть одинаковыми или различными, означают водород; низший алкил с 1-6 атомами углерода; арилалкил; гетероарилалкил; гетероарил или арил; R17 может быть водород; гидрокси; ацетокси или бензокси; R18 и R19 означают гидрокси; ацетокси и бензокси; или
(iii) олигосахаридный остаток, имеющий следующее строение:

где R14 и R15, которые могут быть одинаковыми или различными, означают водород; низший алкил с 1-6 атомами углерода; гетероарилалкил; арилалкил; арил или гетероарил; R14a означает кислород; но если R14a является заместителем в концевом моносахаридном остатке, то R14a должен быть гидрокси; метил; ацетокси; арилалкокси или гетероарилалкокси; и
d) R4 означает
(i) ОН, или
(ii) H, или
(iii) OR13, где R13 означает моносахаридный остаток; ацетокси; бензокси; арилалкил или гетероариалкил; и
е) Z означает
(i) -CH, где а и b означают одинарную связь, или
(ii) =С, где а или b означают двойную связь.
Символ "_ ", употребляемый в дальнейшем, указывает, что стереохимия не определена и что заместители в стероидном скелете могут иметь α- или β-конфигурацию. Предпочтительно заместители в стероидном скелете имеют β-конфигурацию. Далее моносахаридные единицы, составляющие остаток олигосахарида, могут иметь как α-, так и

Настоящее изобретение также включает способ введения аминогруппы в положение 14 стероидного скелета, отличающийся тем, что
аминогруппа вводится диастереоселективно в положение 14 стероидного скелета путем присоединения иодизоцианата и включает следующие стадии:
а) присоединение иодизоцианата к двойной связи в
положении 14-15 стероидного скелета;
b) дегалоидирование; и
с) превращение изоциано- в аминогруппу в положении 14 стероидного скелета.
Олигосахарид-содержащие
14-аминостероидные соединения настоящего изобретения
Стероидный скелет
Новые олигосахарид-содержащие 14-аминостероидные соединения настоящего изобретения состоят из стероидного
скелета, в котором указанный стероидный скелет имеет различные заместители.
Заместители в стероидном скелете
Заместители R1
Заместители R1
находятся в положении 17 стероидного скелета. Имеются три (3) возможных заместителя R1. R1 может быть эфиром карбоновой кислоты, COOR5, где R5 означает
водород, низший алкил с 1-6 атомами углерода, низший алкил с 1-6 атомами углерода, замещенный аминогруппой, арилалкил, гетероарилалкил или карбоциклическое кольцо. Предпочтительными заместителями
R5 являются низший алкил с 1-6 атомами углерода, арилалкил или карбоцикл, более предпочтительным R5 является низший алкил с 1-6 атомами углерода, а самым предпочтительным R5 является метил; в этом случае R1 означает COOCH3 (карбоксиметиловый эфир).
R1 может также быть CHR6OH, где R6 означает атом водорода или низшую алкильную группу, содержащую 1-6 атомов углерода; предпочтительно R6 является H или CH3; тогда R1 означает CH2ОН или CH(CH3)ОН.
Наконец, R1 может быть COR''', где R''' означает водород, низший алкил с 1-6 атомами углерода, металамино, амино или диалкиламино. Предпочтительно R''' означает амино или метиламино. Наиболее предпочтительным R''' является амино; в таком случае R1 означает CONH2.
Наиболее предпочтительным заместителем R1 в стероидном скелете является эфир карбоновой кислоты, COOR5, где R5 означает метил (COOCH3).
Заместитель R2
Заместитель R2
находится в положении 14 стероидного скелета. Имеется один (1) заместитель R2. R2 означает -NR7R8, где R7 и R8, которые могут быть
одинаковыми или различными, означают атомы водорода или низшие алкилы с 1-6 атомами С. Предпочтительно R7 и R8 означают H; и тогда R2 означает NH2.
Заместители R3
Заместители R3 находятся в 3-положении стероидного скелета. Имеются три (3) возможных заместителя R3. R3 может быть
олигосахарид-содержащим остатком, имеющим следующую структуру:

где R9 означает водород; метил; гидрокси; карбокси; ацетокси; арилалкокси или бензокси; R10 означает водород; метил; карбокси; ацетокси; арилалкокси; гетероарилалкокси; бензокси или гидрокси; R11 означает кислород, если R11 является заместителем у концевого моносахаридного остатка, R11 означает ОН, метил; ацетокси; арилалкокси; гетероарилалкокси; a R12 означает водород, метил, метилгидроксиметил или ацетоксиметил. В соединениях настоящего изобретения, когда R11 означает кислород, этот кислород служит для связи моносахаридных остатков через гликозидную связь.
Олигосахаридный остаток может состоять из двух или трех моносахаридных остатков, предпочтительно трех моносахаридных остатков. Эти моносахаридные остатки могут быть одинаковыми или различными. Предпочтительными моносахаридными остатками являются дидезоксирибогексопираноза и рамнопираноза.
Предпочтительными заместителями R9 являются водород, метил и гидрокси. Самый предпочтительный R9 означает водород. Предпочтительными заместителями R10 являются водород, метил и гидрокси. Наиболее предпочтительным заместителем R10 является гидрокси. R11 означает кислород, за исключением тех случаев, когда R11 является заместителем терминального моносахаридного остатка олигосахаридного остатка. Предпочтительным заместителем R11 у терминального моносахаридного остатка является гидрокси.
Предпочтительными заместителями R12 являются водород и метил.
R3 означает также олигосахарид-содержащий остаток, имеющий следующую структуру:
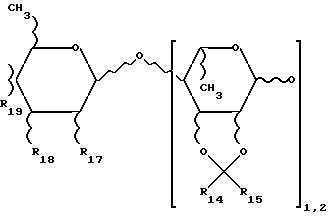
где R14 и R15, которые могут быть одинаковыми или различными, означают водород; низший алкил с 1-6 атомами углерода; арилалкил; гетероарилалкил; гетероарил или арил; R17 может быть водород, гидрокси, ацетокси или бензокси; R18 и R19 означают гидрокси, ацетокси и бензокси.
Остаток олигосахарида может состоять из двух или трех моносахаридных остатков, предпочтительно трех моносахаридных остатков. Эти моносахаридные остатки могут быть одинаковыми или различными. Предпочтительными моносахаридными остатками являются дидезоксирибогексопираноза и рамнопираноза.
Предпочтительными заместителями R14 являются водород и низший алкил с 1-6 атомами углерода. Более предпочтительным заместителем R14 является низший алкил с 1-6 атомами углерода. Самым предпочтительным заместителем R14 является метил. Предпочтительными заместителями R15 являются водород и низший алкил с 1-6 атомами углерода. Более предпочтительным заместителем R15 является низший алкил с 1-6 атомами углерода. Самым предпочтительным заместителем R15 является метил. Предпочтительными заместителями R17 являются водород, ацетокси и гидрокси. Самым предпочтительным заместителем R17 является водород. Предпочтительными заместителями R18 являются гидрокси и ацетокси. Самым предпочтительным заместителем R18 является гидрокси. Предпочтительными заместителями R19 являются гидрокси и ацетокси. Самым предпочтительным заместителем R19 является гидрокси.
Наконец, R3 означает олигосахаридный остаток, имеющий
следующую структуру:

где R14 и R15, которые могут быть одинаковыми или различными, означают водород; низший алкил с 1-6 атомами углерода, арилалкил; гетероарилалкил, гетероарил или арил; R14a означает кислород; если же R14a является заместителем у концевого моносахаридного остатка, то R14a должен быть гидрокси, метил, ацетокси, арилалкокси или гетероарилалкокси. В соединениях настоящего изобретения, когда R14a означает кислород, этот кислород служит для связи моносахаридного остатка через гликозидную связь.
Олигосахаридный остаток может состоять из двух или трех моносахаридных остатков, предпочтительно трех моносахаридных остатков. Эти моносахаридные остатки могут быть одинаковыми или различными. Предпочтительными моносахаридными остатками являются дидезоксирибогексопираноза и рамнопираноза.
Предпочтительными R14 и R15 являются низшие алкилы с 1-6 атомами углерода, а самыми предпочтительными R14 и R15 является метил. Когда R14a является заместителем у концевого моносахаридного остатка, то предпочтительным R14a является гидрокси.
Заместители R4
Заместители R4 находятся в 12 положении стероидного скелета. R4 может быть ОН, H или OR13, где R13 означает моносахаридный остаток; ацетокси; бензокси;
арилалкил; или гетероарилалкил. Предпочтительными заместителями R4 являются H или OR13, где R13 означает моносахаридный остаток. Этот моносахаридный остаток выбирается
из гексозы, 2-дезоксиглюкозы, 6-дезоксигексозы, 2,6-дидезоксигексозы, рамнозы, глюкозы и арабинозы, дигитоксозы, фруктозы, галактозы, рамнопиранозы, гексопиранозы, 6-дезоксиглюкозы, 4,
6-дидезоксигликопиранозы, маннозы, цимарозы, ксилозы, ликсозы, рибозы, дигиталозы, глюкозамина, 4-амино-2,4,6-тридезоксиликсогексопиранозы, 4-амино- 4,6-дидезоксигликопиранозы, 2,
3-дидезоксирамнопиранозы, 4-метокси-4,6-дидезоксирамнопиранозы, предпочтительно их β-D или α-L аномеры.
Самым предпочтительным заместителем R4 является Н.
Z
Z означает -CH-, где а и b означают одинарную связь, или =С, где а или b означает двойную связь. Предпочтительным Z является -CH-, где а и b означают одинарную связь.
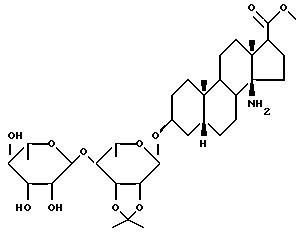
Предпочтительным олигосахарид-содержащим 14-аминостероидом настоящего изобретения является
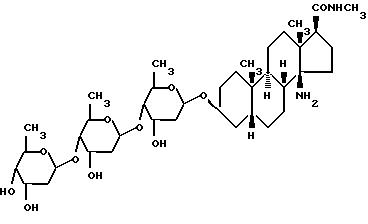
(3β,5β,14β,17β)-14-Амино-3[(O-2,6-дидезокси-β-D-рибо-гексопиранизил-(1--->4)-O-2,6-дидезокси-

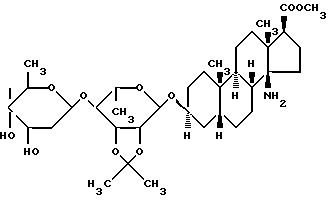
Метиловый эфир (3β,5β,14β,17β) -14-амино-3[(O-2,6-ди-дезокси- β - D- рибо-гексопиранизил-(1--->4)-6-дезокси-2,3-O-(1-метил- этилиден)- α -L-маннопиранозил]-окси]-андростан-17-карбоновой кислоты

(3β,5β,14β,17β) -14-Амино-3[(O-2,6-дидезокси- β -D-рибо- гексопиранизил-(1--->4)-O-2, 6-дидезокси- β -D- рибо-гексопиранозил-(1--->4)-2,6-дидезокси- β-D-рибо-гексопиранозил)окси]андростан-17-карбоксамид

Метиловый эфир (3β,5β,14β,17β)-14-амино-3[(O-2,6-дидезокси- β -D- рибо-гексопиранизил-(1--->4)-2, 6-ди-дезокси-


Метиловый эфир (3β,5β,14β,17β)-14-aминo-3[(O-2,6-дидезокси- β -D- рибо-гексопиранизил-(1--->4)-O-2,6-ди-дезокси- β -D-рибо-гексопиранизил(1--->4)-2,6-дидезокси- β -D-рибо-гексопиранизил)окси] андростан-17-карбоновой кислоты

Метиловый эфир 14 β-амино-3 β-[α -(L)-рамнопиранозил-окси- (1---> 4)- α -(L)-рамнопиранозилокси]-5 β -андростан-17 β- карбоновой кислоты

Метиловый эфир 14 β-амино-3β-[α- -(L)-рамнопиранозил-окси- (1--->4)-2', 3'-O-изопропилиден- α -(L)-рамно-пиранозил-окси]-5β -андростан-17 β-карбоновой кислоты

Метиловый эфир 14 β-амино-3 β -[2'',3''-O-изопропилиден- α -(L)-рамнопиранозил-окси] -(1--->4)-2',3'-O-изопропилиден- α -(L)-рамнопиранозил-окси] -5 β -андростан-17β-карбоновой кислоты

Метиловый эфир 14 β-амино-3 β -[2'',3'',4''-три-O-ацетил- α -(L)-рамнопиранозил-окси-(1--->4)-2', 3'-O-изопропилиден- α -(L)- рамнопиранозил-окси]-5 β -андростан-17 β- карбоновой кислоты

Метиловый эфир 14 β -амино-3 β -[4''-O-ацетил-2'',3''-O- изопропилиден- β -(L)-рамнопиранозил-окси-(1--->4)-2',3'-O- изопропилиден- α -(L)-рамнопиранозил-окси]-5 β -андростан-17

Метиловый эфир (3β,5β,14β,17β) -14-амино-3[(2,6-дидезокси- β -D-рибо-гексопиранизил-(1---> 4)-6-дезокси- α -L-рибо-маннопиранозил)-окси]-андростан-17-карбоновой кислоты.
Синтез олигосахарид-содержащих 14-аминостероидных соединений настоящего изобретения
Настоящее изобретение также включает в себя метод введения аминогруппы в положение 14 стероидного скелета. Ранее в химической практике согласно патентам США 4,325,879; 4,552,868; 4,552,868; 4,552,289;
4,885,250 и ссылкам, приведенным в них, использовали азотистоводородную кислоту для введения азидного фрагмента в положение 14 стероидного скелета. Азидный фрагмент затем восстанавливали до
аминогруппы в положении 14 стероидного скелета. Настоящий способ, который включает применение иодизоцианата, является усовершенствованием современного эксперимента, так как последний использует
взрывчатую иодистоводородную кислоту; он более удобен для применения в больших промышленных масштабах; он дает лучшие выходы 14-аминостероидного соединения; и он дает возможность вводить аминогруппу в
положение 14 в присутствии других чувствительных к кислоте функциональных групп стероидного ядра. Олигосахаридный остаток в положении 3 стероидного скелета чувствителен к кислоте и чрезвычайно легко
отщепляется азотистоводородной кислотой. Таким образом, использование иодизоцианата устраняет проблему отщепления олигосахаридного остатка от стероидного скелета.
Способ настоящего изобретения позволяет диастереоселективно вводить аминогруппу в положение 14 стероидного скелета путем присоединения иодизоцианата по двойной связи в положении 14-15 стероидного скелета с последующим дегалоидированием и превращением изоцианата в аминогруппу в положении 14.
Конкретно, способ настоящего изобретения включает:
а) генерирование in situ иодизоцианата, используя
предпочтительно, но не ограничиваясь этим, цианат серебра и иод в подходящих растворителях, которые включают, но не ограничиваются этим, эфиры кислот, такие как этилацетат, изопропилацетат или
пропилацетат, нитрилы, такие как ацетонитрил или пропионитрил, галоидуглеводороды, такие как хлористый метилен, хлороформ или дихлорэтан, эфиры, такие как тетрагидрофуран или трет.-бутилметиловый эфир,
или их смеси. Предпочтительные растворители включают смесь нитрилов, более предпочтительно ацетонитрила, с простыми или сложными эфирами, более предпочтительно, с этилацетатом или
трет.-бутилметиловым эфиром. Температура реакции присоединения может быть в интервале от -30 до 100oC, предпочтительно от -10 до 5oC. Время реакции присоединения изоцианата может
быть в интервале от 1 до 6 часов, предпочтительно от 1 до 3 часов. Реагенты могут прибавляться друг к другу в любом порядке и с любой скоростью, наиболее предпочтителен такой порядок, когда иод
прибавляется в растворителе к смеси стероида и цианата серебра за 30-60 минут;
b) дегалоидирование предпочтительно проводить обработкой органооловогидридами, включая, но не ограничиваясь этим,
алкилоловогидриды, такие как три-н-бутилоловогидрид или арилоловогидриды, такие как дифенилоловогидрид или трифенилоловогидрид, и радикальным инициатором, включая, но не ограничиваясь этим, 2,
2'-азобисизобутиронитрил (АИБН) или перекиси, такие как перекись бензоила или перекись третичного лаурила, в подходящем растворителе, включая, но не ограничиваясь этим, сложные эфиры, такие как
этилацетат, изопропилацетат или пропилацетат, нитрилы, такие как ацетонитрил или пропионитрил, галоидуглеводороды, такие как хлористый метилен, хлороформ или дихлорэтан, простые эфиры, такие как
диэтиловый эфир, тетрагидрофуран или трет. -бутилметиловый эфир, углеводороды, такие как гексаны или гептаны, ароматические, такие как бензол или толуол, или их смеси. Предпочтительные растворители
включают ароматические, более предпочтительными являются толуол и галоидированные углеводороды, самым предпочтительным является хлористый метилен. Температура реакции галоидирования может находиться в
интервале от 0 до 100oC, наиболее предпочтительно от 15 до 30oC. Время реакции может быть от 1 до 6 часов, наиболее предпочтительно от 2 до 4 часов; и
c) водный гидролиз
изоцианатной группы до амина с применением сильных кислот, включая, но не ограничиваясь этим, соляную кислоту, серную кислоту, бромистоводородную кислоту или трифторуксусную кислоту, или оснований,
включая, но не ограничиваясь этим, гидроокись лития, гидроокись натрия, гидроокись калия, карбонат лития, карбонат натрия, карбонат калия или другие основания, способные генерировать гидроксид-ион в
водной среде, такие как триэтиламин или пиридин. Подходящие сорастворители для реакции гидролиза включают, но не ограничиваются этим, смешивающиеся с водой нитрилы, такие как ацетонитрил или
пропионитрил, смешивающиеся с водой эфиры, такие как тетрагидрофуран, диметоксиэтан или диоксан, или другие смешивающиеся с водой растворители, такие как N,N'-диметилформамид или диметилсульфоксид,
или их смеси. Предпочтительные растворители включают смешивающиеся с водой нитрилы, предпочтительно ацетонитрил, и смешивающиеся с водой эфиры, наиболее предпочтительно тетрагидрофуран, диметоксиэтан
и диоксан. Температура реакции гидролиза может быть в интервале от 0 до 60oC, для катализируемого кислотой гидролиза наиболее предпочтительно от 15 до 30oC; и в интервале от
комнатной температуры до 100oC для катализируемого основанием гидролиза, наиболее предпочтительно от 80 до 100oC. Время реакции катализируемого кислотного гидролиза может быть в
интервале от 4 до 72 часов, наиболее предпочтительно от 12 до 36 часов; и может составлять от 2 до 48 часов для катализируемого основаниями гидролиза, наиболее предпочтительно от 2 до 12 часов.
Следующие, но не ограничивающиеся только ими, примеры являются иллюстрацией иодизоцианатного способа введения аминогруппы в положение 14 стероидного скелета.
Пример 1
Метиловый эфир (3β,5β,14β,17β) -14-амино-3[(O-2,6-дидезокси- β -D-рибо-гексопиранизил-(1--->4)-O-2,6-ди-дезокси- β -D-рибо- гексопиранозил-(1--->
4)-2,6-дидезокси- β -D-рибо-гексопиранозил)окси]андростан-17-карбоновой кислоты.
Схема к примеру 1 (см. в конце описания).
A. (3β,5β) -3[(O-3,
4-Ди-O-ацетил-2,6-дидезокси- β -D-рибо-гексопиранозил-(1--->4)-O-3-O-ацетил-2,6-дидезокси- β -D-рибо-гексопиранозил-(1--->4)-3-O-ацетил-2,6-дидезокси- β
-D-рибо-гексопиранозил)окси]-14-гидрокси-кард-20(22)-енолид
Дигитоксин (2,0 г, 0,0026 моля) растворяют в безводном пиридине (50 мл). Добавляют безводный уксусный ангидрид (25 мл) и раствор
нагревают до 80oC 3 часа. По охлаждении до комнатной температуры реакционную смесь выливают в воду со льдом (500 мл), при этом образуется твердое соединение янтарного цвета. Смесь
экстрагируют хлористым метиленом (2 x 100 мл). Органические вытяжки объединяют, промывают насыщенным водным раствором бикарбоната натрия (2 x 100 мл), насыщенным водным раствором хлористого натрия (1
x 100 мл), сушат (сульфат магния), обрабатывают darco и фильтруют. Фильтрат упаривают в вакууме досуха. Следы пиридина удаляют азеотропной перегонкой с толуолом (2 x 20 мл), а затем с метанолом (2 x
20 мл). В результате получают 1,8 г (74%) соединение 1 в виде белого твердого вещества.
B. (3β,5β,14β,17β) -3-[(O-3,4-Ди-O-ацетил-2,6-дидезокси- β
-D-рибо- гексопиранизил-(1--->4)-O-3-O-ацетил-2,6-дидезокси- β -D-рибо- гексопиранозил(1--->4)-3-O-ацетил-2,6-дидезокси- β -D-рибо- гексопиранозил)окси] -14,
21-дигидрокси-прегнан-20-он
Соединение 1 (0,93 г, 0,001 моля) растворяют в хлористом метилене (100 мл) и охлаждают до -78oC. Охлажденный раствор обрабатывают озоном 8 минут, пока
не получат устойчивый синий цвет. В этот момент озонирование прекращают и реакционную смесь перемешивают еще 0,5 часа. Реакционную смесь продувают кислородом с умеренной скоростью в течение 15 минут,
а затем азотом до исчезновения синего цвета. Реакционную смесь доводят до комнатной температуры, добавляют насыщенный водный раствор карбоната калия (50 мл) и образовавшуюся смесь перемешивают 20
часов. Разделяют два слоя и органический слой промывают водой (1 x 50 мл) насыщенным водным раствором хлористого натрия (1 x 50 мл), сушат (сульфат магния) и фильтруют. Фильтрат упаривают в вакууме,
получают белую пену, которую хроматографируют на силикагеле (230-400 меш), используя в качестве элюента смесь хлористый метилен:метанол (97:3). Фракции, содержащие чистый продукт, объединяют,
упаривают и сушат в вакууме 24 часа, получают 0,6 г (62%) соединения 2 в виде белого твердого вещества. ЯМР и масс-спектры соответствуют строению. Это соединение используют на следующей стадии.
C. (3β,5β,14β,17β) -3[(O-3,4-Ди-O-ацетил-2,6-дидезокси- β -D- рибо-гексопиранизил-(1--->4)-O-3-O-ацетил-2,6-дидезокси- β
-D- рибо-гексопиранозил(1--->4)-3-O-ацетил-2,6-дидезокси- β- D-рибо-гексопиранозил)окси]-14-гидроксиандростан-17-карбоновая кислота
К раствору соединения 2 (17 г, 0,187 моля) в
ацетоне (200 мл) добавляют раствор карбоната калия (3,88 г, 0,028 моля) в воде (25 мл), а затем раствор периодата натрия (12 г, 0,056 моля) в воде (50 мл). Образовавшуюся смесь перемешивают при
комнатной температуре 24 часа. Реакционную смесь разбавляют водой (250 мл), затем подкисляют до pH 1 1N соляной кислотой. После подкисления раствор быстро экстрагируют хлористым метиленом (2 x 300
мл). Объединенные органические вытяжки промывают 5% соляной кислотой (1 x 200 мл), водой (1 x 200 мл), сушат (сульфат магния) и фильтруют. Фильтрат упаривают в вакууме до белого твердого вещества.
Твердое вещество хроматографируют на силикагеле, используя в качестве элюента смесь хлористый метилен : метанол (97,5:2,5). Фракции, содержащие чистый продукт, объединяют и концентрируют в вакууме;
получают 16,2 г (97%) соединения 3 в виде белого твердого вещества. Это соединение используют в следующей стадии.
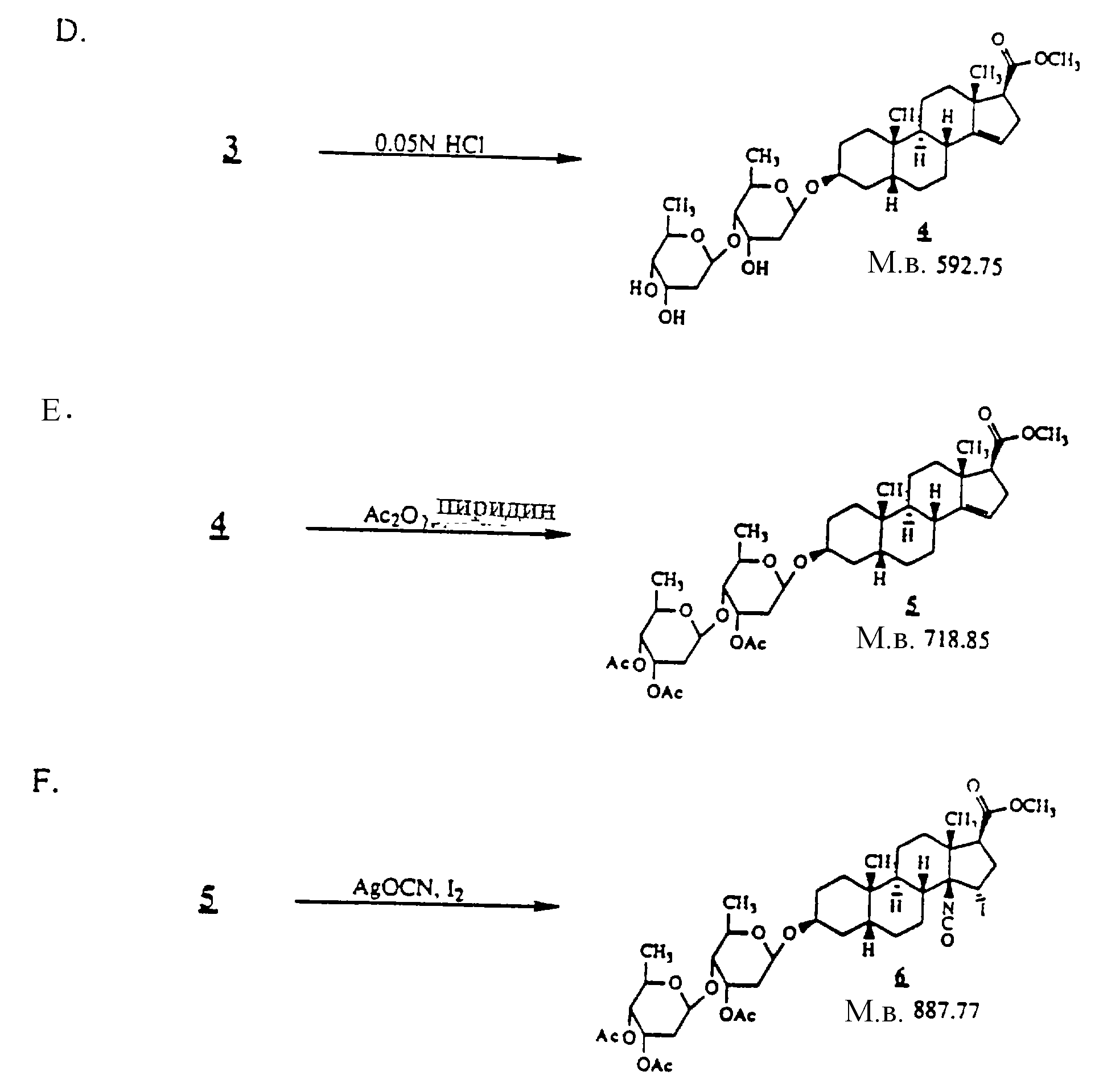
D. Метиловый эфир (3β,5β,14β,17β)-3-[(O-3,
4-ди-O-ацетил-2,6- дидезокси- β-D-рибо-гексопиранизил-(1--->4)-O-3-O- ацетил-2,6-дидезокси-β D-рибо-гексопиранозил(1--->4)-3-O-ацетил-2,6- дидезокси- β
-D-рибо-гексопиранозил)окси] -14-гидроксиандростан- 17-карбоновой кислоты
К раствору соединения 3 (15 г, 0,017 моля) в безводном ацетонитриле добавляют 1,8-диазобицикло[5.4.0]ундец-7-ен (DBU,
2,4 мл, 2,89 г, 0,019 моля), а затем йодистый метил (1,18 мл, 2,7 г, 0,019 моля). Образовавшийся раствор перемешивают при комнатной температуре 20 часов. Реакционную смесь разбавляют водой (1 л) и
экстрагируют хлористым метиленом (5 x 200 мл). Объединенные вытяжки промывают насыщенным водным раствором хлористого натрия (2 x 200 мл), сушат (сульфат магния) и фильтруют. Фильтрат упаривают в
вакууме досуха. Твердое вещество хроматографируют на силикагеле (230-400 меш), используя в качестве элюента смесь хлористый метилен : метанол (99:1). Фракции, содержащие чистый продукт, упаривают в
вакууме досуха и сушат в вакууме; получают 13,68 г (90%) соединения 4 в виде белого твердого вещества, это соединение используют в следующей стадии.
Е. Метиловый эфир (3β,
5β,14β,17β) -3-[(O-3,4-ди-O-ацетил-2,6- дидезокси- β -D-рибо-гексопиранизил-(1--->4)-O-3-O-ацетил-2,6- дидезокси- β -D-рибо-гексопиранозил(1--->
4)-3-O-ацетил-2,6-дидезокси- β -D-рибо-гексопиранозил)окси]андрост-14-ен-17-карбоновой кислоты
Соединение 4 (4,02 г, 0,0044 моля) растворяют в безводном пиридине (20 мл) и раствор
охлаждают до -5oC в бане лед/метанол. Добавляют по каплям раствор хлористого тионила (5 мл) в пиридине (5 мл) в течение 25 минут, затем реакционную смесь выливают в лед с водой (400 мл) и
перемешивают пока лед не растает (10 мин). Образовавшуюся смесь экстрагируют этилацетатом (3 x 150 мл). Объединенные вытяжки промывают 1N соляной кислотой (1 x 100 мл), водой (2 x 100 мл), насыщенным
раствором бикарбоната натрия (2 x 100 мл), насыщенным водным раствором хлористого натрия (1 x 100 мл), сушат (сульфат магния) и фильтруют. Фильтрат упаривают в вакууме до пенообразного состояния. Эту
пену хроматографируют на силикагеле (230-400 меш), используя в качестве элюента смесь этилацетат : смесь гексанов (30:70). Фракции, содержащие чистый продукт, объединяют и упаривают в вакууме,
получают 3,26 г (83%) соединения 5 в виде белого твердого вещества. Это соединение используют на
следующей стадии.
F. Метиловый эфир (3β,5β,14β,17β)
-3-[(О-3,4-ди-O-ацетил-2,6- дидезокси- β -D-рибо-гексопиранизил] -1-(1--->4)-O-3-O-ацетил-2,6- дидезокси- β -D-рибо-гексопиранозил(1--->4)-3-O-ацетил-2,
6- дидезокси- β -D-рибо-гексопиранозил)окси]-15-иодо-14-изоцианатоандростан- 17-карбоновой кислоты
Соединение 5 (0,27 г, 0,3 ммоля) растворяют в этилацетате (1,35 мл) и ацетонитриле (2,
7 мл) и раствор охлаждают до 1oC (баня лед/этанол). Добавляют цианат серебра (0,054 г, 0,36 ммоля), а затем - по каплям иод (0,081 г, 0,32 ммоля) в этилацетате (4 мл). По окончании
присоединения иода (20 мин) реакционную смесь перемешивают при охлаждении еще 1,5 часа. Реакционную смесь затем разбавляют этилацетатом (20 мл) и фильтруют через целит. Фильтрат промывают 1% водным
раствором сульфита натрия (1 x 100 мл) и органический слой упаривают в вакууме. Получают 0,32 г (99%) соединения 6 в виде пены. Это соединение используют на следующей стадии.
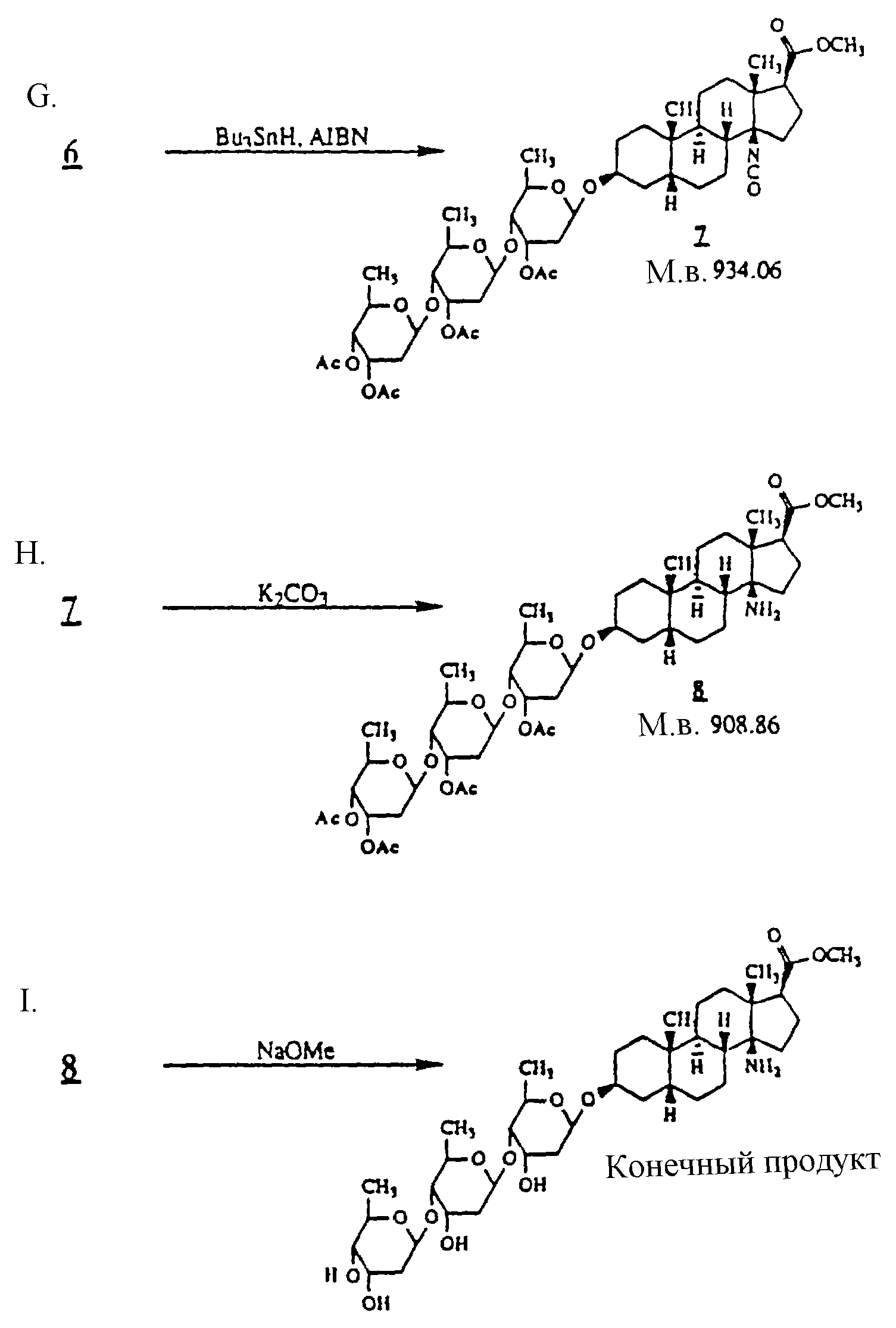
G.
Метиловый эфир (3β,5β,14β,17β) -3-[(O-3,4-ди-O-aцeтил-2,6- дидезокси- β -D-рибо-гексопиранизил-(1--->4)-O-3-O-ацетил-2,6- дидезокси- β
-D-рибо-гексопиранозил(1--->4)-3-O-ацетил-2,6- дидезокси- β -D-рибо-гексопиранозил)окси]-14-изоцианатоандростан- 17-карбоновой кислоты
В высушенном на пламене приборе в
атмосфере азота растворяют 6 (0,32 г, 0,3 ммоля) в безводном хлористом метилене (10 мл). К этому раствору добавляют каталитическое количество 2,2'-азобисизобутиронитрила (AIBN, 0,003 г), а затем
гидрид трибутилолова (0,085 мл, 0.091 г, 0,31 ммоля). Образовавшийся раствор перемешивают при комнатной температуре в течение 1 часа, а затем упаривают в вакууме. Полученное масло затирают с гексаном
до твердого вещества, которое собирают фильтрованием и сушат на воздухе. Получают 0,25 г (89%) соединения 7. Это соединение используют на следующей стадии.
Н. Метиловый эфир (3β,
5β,14β,17β) -3-[(O-3,4-ди-O-aцeтил-2,6- дидезокси- β -D-рибо-гексопиранизил-(1--->4)-O- 3-O-ацетил-2,6-дидезокси- β -D-рибо-гексопиранозил(1--->
4)-3-O-ацетил-2,6- дидезокси- β -D-рибо-гесопиранозил)окси]-14-амино-андростан-17-карбоновой кислоты
К раствору соединения 7 (0,3 г, 0,32 ммоля) в ацетонитриле (15 мл) добавляют
раствор карбоната калия (0,66 г, 4,8 ммоля, 15 экв) в воде (10 мл). Реакционную смесь кипятят при перемешивании 4 часа. По охлаждении до комнатной температуры реакционную смесь упаривают в вакууме,
удаляя ацетонитрил. К оставшемуся водному остатку добавляют воду (20 мл) и смесь подкисляют 1N соляной кислотой до pH 1, а затем быстро подщелачивают (pH 9) концентрированным раствором аммиака. Водную
смесь экстрагируют хлористым метиленом (2 x 30 мл), объединенные вытяжки сушат (сульфат магния) и фильтруют. Фильтрат упаривают в вакууме, полученное твердое соединение сушат в вакууме, получают 0,23
г (79%) сырого 8. Это соединение используют непосредственно на следующей стадии.
I. Метиловый эфир (3β,5β,14β,17β) -14-амино-3-[(O-2,6-ди- дезокси- β
-D-рибо-гексопиранизил-(1--->4)-O-2,6-дидезокси- β -D-рибо-гексопиранозил(1--->4)-2,6-дидезокси- β -D-рибо- гексопиранозил)окси] андростан-17-карбоновой кислоты
В
высушенном пламенем приборе в атмосфере азота растворяют соединение 8 (0,23 г, 0,3 ммоля) в безводном метаноле (9 мл). Добавляют раствор алкоголята натрия (0,063 г, 1,2 ммоля, 4 экв) в безводном
метаноле (2 мл) и смесь перемешивают при комнатной температуре 3 часа. Реакционную смесь упаривают в вакууме и получают в остатке белое вещество. Остаток растворяют в воде (30 мл) и охлаждают
(лед/вода). Раствор подкисляют 1N соляной кислотой до pH 1 и затем быстро подщелачивают (pH 9) концентрированным водным раствором аммиака. Водную смесь экстрагируют хлористым метиленом (2 x 30 мл).
Объединенные вытяжки высушивают (сульфат магния) и фильтруют. Фильтрат упаривают в вакууме досуха. Твердое вещество хроматографируют на силикагеле (230-400 меш), используя в качестве элюента смесь
хлористый метилен : метанол (9:1), содержащую 0.5% концентрированного водного раствора аммиака. Фракции, содержащие чистый продукт, объединяют и упаривают в вакууме досуха, затем высушивают в вакууме;
получают метиловый эфир
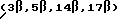
Пример 2
Метиловый
эфир (3β,5β,14β,17β) -14-амино-3-[(O-2,6-ди-дезокси- β -D-рибо- гексопиранизил-(1--->4)-O-2,6-дидезокси- β
-D-рибо-гексопиранозил)окси]андростан-17-карбоновой кислоты
Схема к примеру 2 (см. в конце описания).
A. Метиловый эфир (3β,5β,17β) -3-[(O-2,
6-дидезокси- β -D-рибо- гексопиранизил-(1--->4)-O-2,6-дидезокси- β -D-рибо- гексопиранозил(1--->4)-2,6-дидезокси- β
-D-рибо-гексопиранозил)окси]андрост-14-ен-17-карбоновой кислоты
Получение метилового эфира (3β,5β,17β) -3-[(O-3,4-ди-O-ацетил-2,6-дидезокси- β
-D-рибо-гексопиранизил-(1--->4)-O-3-O-ацетил-2,6-дидезокси- β -D-рибо-гексопиранозил(1--->4)-3-O-ацетил-2,6-дидезокси- β
-D-рибо-гексопиранозил)окси]андрост-14-ен-17-карбоновой кислоты описано ранее в примере 1.
В высушенном на пламене приборе в атмосфере азота растворяют метиловый эфир (3β, 5β,17β) -3-[(O-3,4-ди-O-ацетил-2,6-дидезокси- β -D- рибо-гексопиранизил-(1--->4)-O-3-O-ацетил-2,6-дидезокси- β -D-рибо- гексопиранозил(1--->4)-3-O-ацетил-2, 6-дидезокси- β -D-рибо- гексопиранозил)окси]андрост-14-ен-17-карбоновой кислоты (2,29 г, 0,0025 моля) в безводном метаноле (50 мл). Добавляют раствор метилата натрия (0,72 г, 0,014 моля) в безводном метаноле (10 мл) и перемешивают при комнатной температуре 3 часа. Реакционную смесь упаривают в вакууме досуха, остаток растворяют в воде (50 мл). Смесь подкисляют до pH 1 1N соляной кислотой, затем быстро подщелачивают (pH 9) концентрированным водным раствором аммиака. Образовавшуюся смесь экстрагируют хлористым метиленом (2 x 50 мл). Объединенные вытяжки сушат (сульфат магния) и фильтруют. Фильтрат упаривают в вакууме досуха и сушат в вакууме; получают 1,9 г (100%) 1. ЯМР и масс-спектры соответствуют структуре. Это соединение используют на следующей стадии.
B. Метиловый эфир (3β,5β,17β) -3-[(O-2,6-дидезокси-4-O-[1-(1- метил-2-оксоэтокси)-3-оксопропил]- β -D-рибо-гексопиранизил- (1--->4)-2,6-дидезокси- β
-D-рибо-гексопиранозил)окси]андрост-14-ен- 17-карбоновой кислоты
К раствору соединения 1 (1,9 г, 0,0012 моля) в смеси этанол : вода (95: 5) (100 мл) добавляют раствор периодата натрия (1,9 г,
0,009 моля) в воде (20 мл). Реакционную смесь перемешивают 20 часов при комнатной температуре. Отфильтровывают и фильтрат упаривают в вакууме досуха. Остаток растворяют в воде (100 мл) и экстрагируют
хлористым метиленом (3 x 50 мл). Объединенные вытяжки промывают 1% водным раствором бисульфата натрия (1 x 50 мл), водой (2 x 50 мл), сушат (сульфат магния) и фильтруют. Фильтрат упаривают в вакууме,
получают 2 в виде белой пены 1,81 г (96%). Это соединение используется на следующей стадии.
С. Метиловый эфир (3β,5β,17β) -3-[(O-2,
6-дидезокси-4-O-[3- гидроксипропил-1-(2-гидрокси-1-метилэтокси)] - β -D-рибо- гексопиранизил-(1--->4)-2,6-дидезокси- β -D-рибо- гексопиранозил)окси]андрост-14-ен-17-карбоновой
кислоты
К раствору 2 (1,81 г, 0,0025 моля) в 100 мл смеси метанол : вода (95:5) добавляют натрийборгидрид (0,94 г, 0,025 моля) и раствор перемешивают 1 час при комнатной температуре.
Добавляют по каплям к реакционной смеси уксусную кислоту до pH 7. Реакционную смесь упаривают в вакууме досуха. Остаток растворяют в воде (30 мл) и экстрагируют хлористым метиленом (3 x 25 мл), сушат
(сульфат магния) и фильтруют. Фильтрат упаривают в вакууме досуха, сушат в вакууме и получают 1,31 г (72%) 3. Это соединение используют на следующей стадии.
D. Метиловый эфир
(3β,5β,17β) -3-[(O-2,6-дидезокси- β -D-рибо- гексопиранизил-(1--->4)- 2,6-дидезокси- β -D-рибо- гексопиранозил)окси]андрост-14-ен-17-карбоновой кислоты
К раствору соединения 3 (1,3 г, 0,0018 моля) в метаноле (100 мл) добавляют 0,05N соляную кислоту (22.1 мл). Реакционную смесь перемешивают при комнатной температуре 3 часа, нейтрализуют
насыщенным водным раствором бикарбоната натрия и упаривают в вакууме досуха. Остаток растворяют в воде (50 мл) и экстрагируют хлористым метиленом (3 x 25 мл). Объединенные вытяжки сушат (сульфат
магния) и фильтруют. Фильтрат упаривают в вакууме, получают пенообразное вещество. После сушки его в вакууме получают 1,0 г (94%) 4. Это соединение используют на следующей стадии.
E.
Метиловый эфир (3β,5β,17β) -3-[(O-3,4-ди-O-ацетил- 2,6-ди-дезокси- β -D-рибо-гексопиранизил-(1--->4)-О- -O-3-ацетил-2,6-дидезокси- β
-D-рибо-гексопиранизил)-окси]андрост- 14-ен-17-карбоновой кислоты
Соединение 4 (1,0 г, 0,0017 моля) растворяют в безводном пиридине (15 мл). Добавляют безводный уксусный ангидрид (15 мл) и
перемешивают 3 часа при 80oC. Реакционную смесь постепенно охлаждают до комнатной температуры и перемешивают 18 часов. Выливают в воду (200 мл) и перемешивают 10 мин. Водную смесь
экстрагируют хлористым метиленом (2 x 75 мл). Объединенные вытяжки промывают насыщенным водным раствором бикарбоната натрия (3 x 100 мл), водой (1 x 100 мл), сушат (сульфат магния) и фильтруют.
Фильтрат упаривают в вакууме, полученную пену сушат в вакууме, получают 0,78 г (64%) соединения 5. Это соединение используют на следующей стадии.
F. Метиловый эфир (3β,5β
,14β,15α,17β) -3-[(O-3,4-ди-O-ацетил-2,6-дидезокси- β -D-рибо-гексопиранизил- (1--->4)-O-3-O-ацетил-2,6- дидезокси- β -D-рибо-гексопиранозил)окси]
-15-иодо-14- изоцианатоандростан-17-карбоновой кислоты
Соединение 5 (0,76 г, 0,001 моля) растворяют в этилацетате (4,5 мл) и ацетонитриле (9 мл) и раствор охлаждают до 1oC
(лед/метанол). Добавляют по каплям цианат серебра (0,19 г, 0,0013 моля), а затем по каплям иод (0,30 г, 0,0012 моля) в этилацетате (13,5 мл). По окончании присоединения иода (20 мин) реакционную смесь
перемешивают на холоду 1 час. Реакционную смесь разбавляют этилацетатом (50 мл) и фильтруют через целит. Фильтрат промывают 1% водным раствором бисульфита натрия (1 x 50 мл) и органический слой
упаривают в вакууме. Получают 0,9 г (96%) 6 в виде пенообразного твердого вещества. Это соединение используют на следующей стадии.
G. Метиловый эфир (3β,5β,14β,
17β) -3-[(O-3,4-ди-O-ацетил-2,6- дидезокси- β -D-рибо-гексопиранизил-(1--->4)-O-3-O-ацетил-2,6- ди-дeзoкcи-β
-D-рибo-гeкcoпиpaнозил)oкcи]-14-изoциaнaтo-aндpoстан-17- карбоновой кислоты
В высушенном на пламене приборе в атмосфере азота растворяют 6 (0,9 г, 0,001 моля) в безводном хлористом метилене
(18 мл). К этому раствору добавляют каталитическое количество 2,2'-азобисизобутиронитрила (AIBN, 0,001 г), а затем гидрид трибутилолова (0,3 мл, 0,32 г, 0,001 моля). Образовавшийся раствор
перемешивают при комнатной температуре 3 часа, затем упаривают в вакууме. Полученное масло затирают с гексаном, получают белое твердое вещество, которое собирают фильтрованием и сушат на воздухе.
Получают 0,65 г (84%) соединения 7. Это соединение используют на следующей стадии.
Н. Метиловый эфир (3β,5β,14β,17β) -3-[(O-3,4-ди-O-ацетил-2,
6- дидезокси- β -D-рибо-гексопиранизил-(1--->4)-O-3-O-ацетил-2,6- дидезокси- β -D-рибо-гексопиранозил)окси]-14-амино-андростан-17- карбоновой кислоты
К суспензии
соединения 7 (0,65 г, 0,00085 моля) в ацетонитриле (25 мл) добавляют раствор карбоната калия (1,8 г, 0,013 моля, 15 экв) в воде (10 мл). Реакционную смесь перемешивают при кипении 3 часа. По
охлаждении до комнатной температуры из реакционной смеси отгоняют в вакууме ацетонитрил. К водному остатку добавляют воду (10 мл) и смесь подкисляют 1N соляной кислотой до pH 1, затем быстро
подщелачивают (pH 9) концентрированным водным раствором аммиака. Водную смесь экстрагируют хлористым метиленом (2 x 50 мл) и объединенные вытяжки сушат (сульфат магния) и фильтруют. Фильтрат упаривают
в вакууме досуха, сушат в вакууме, получают 0,6 г (96%) сырого 8. Это соединение используют непосредственно на следующей стадии.
I. Метиловый эфир (3β,5β,14β,
17β) -14-амино-3-[(O-2,6-ди-дезокси- β -D- рибо-гексопиранизил-(1--->4)-O-2,6-дидезокси- β -D-рибо- гексопиранозил)окси]андростан-17-карбоновой кислоты
В
высушенном пламенем приборе в атмосфере азота растворяют соединение 8 (0,60 г, 0,0082 моля) в безводном метаноле (25 мл). Добавляют раствор метилата натрия (0,35 г, 0,007 моля) в безводном метаноле
(10 мл) и реакционную смесь перемешивают 1 час при комнатной температуре, затем упаривают в вакууме, получают белый остаток, который растворяют в воде (50 мл) и охлаждают (лед/вода). Раствор
подкисляют 1N соляной кислотой до pH 1, затем быстро подщелачивают (pH 9) концентрированным водным раствором аммиака. Водную смесь экстрагируют хлористым метиленом (3 x 25 мл). Объединенные вытяжки
сушат (сульфат магния) и фильтруют. Фильтрат упаривают в вакууме досуха и хроматографируют на силикагеле (230-400 меш), используя в качестве элюента смесь хлористый метилен : метанол (9:1), содержащую
0.5% концентрированного водного раствора аммиака. Фракции, содержащие чистый продукт, объединяют и упаривают в вакууме; остаток сушат в вакууме; получают метиловый эфир (3β,5β,14β,
17β) -14-амино-3-[(O-2,6-ди-дезокси- β -D-рибо-гексопиранизил-(1--->4)-O-2,6-дидезокси- β -D-рибо-гексопиранозил)окси] андростан-17-карбоновой кислоты - конечный
продукт.
Пример 3
Метиловый эфир (3β,5β,14β,17β) -14-амино-3-гидрокси-андростан-17-карбоновой кислоты
Схема к примеру 3 (см. в конце
описания).
A. Метиловый эфир (3β,5β,14β,17β) -3-ацетилокси-15-иодо-14-изоцианато-андростан-17-карбоновой кислоты
Получение метилового эфира
(3β,5β,17β) -3-ацетилокси-андрост-14- ен-17-карбоновой кислоты описано в патентах США 4,855,280; 4,584,289; 4,325,879, а также в данных там ссылках.
Метиловый эфир (3β,5β,17β) -3-ацетилокси-андрост-14-ен-17- карбоновой кислоты (50 г, 0,134 моля) растворяют в этилацетате (160 мл) и ацетонитриле (320 мл) и раствор охлаждают до 1oC (лед/метанол). Добавляют цианат серебра (23,7 г, 0,158 моля), а затем по каплям иод (37,2 г, 0,147 моля) в этилацетате (480 мл). По окончании присоединения иода (20 мин) реакционную смесь перемешивают на холоде еще 1 час, затем фильтруют и фильтрат промывают 1% водным раствором бисульфита натрия (1 x 500 мл). Органический слой затем упаривают в вакууме, получают 70 г (96%) 1 в виде масла. Это соединение используют на следующей стадии.
B. Метиловый эфир (3β,5β,14β,17β) -3-ацетилокси-14-изоцианато- андростан-17-карбоновой кислоты
Соединение 2 (65 г, 0,121 моля) растворяют в хлористом метилене (325 мл). К этому раствору добавляют 2,2'-aзoбиcизoбутиpoнитpил (AIBN, 0,005 г), а затем гидрид трибутилолова (33,3 мл, 36 г, 0,
126 моля). Образовавшийся раствор перемешивают при 29oC в течение 2,5 часов, затем упаривают в вакууме. Образовавшееся масло затирают со смесью гексанов (350 мл), при этом получающееся
твердое вещество собирают фильтрованием и сушат на воздухе. Получают 38,3 г (77%) 2. Это соединение используют на следующей стадии.
C. Метиловый эфир (3β,5β,14β,
17β) -14-амино-3-гидрокси-андростан-17-карбоновой кислоты
Соединение 2 смешивают с ацетонитрилом (247 мл) и концентрированной соляной кислотой (133 мл) и перемешивают. Через 3 часа
добавляют воду (133 мл) и реакционную смесь перемешивают 48 часов при комнатной температуре. Охлаждают в бане лед/вода и, поддерживая температуру ниже 25oC, прибавляют по каплям
концентрированный водный раствор аммиака и доводят pH до 9. Образовавшуюся смесь экстрагируют хлористым метиленом (4 x 200 мл), объединенные вытяжки промывают водой (1 x 250 мл), сушат (сульфат
магния) и упаривают в вакууме, Получают метиловый эфир (3β,5β,14β,17β) -14-амино-3-гидрокси-андростан-17-карбоновой кислоты, конечный продукт.
Далее сложные эфиры 17-карбоновых кислот, полученные с использованием иодизоцианата, проиллюстрированные примерами 1, 2 и 3, приведенными выше, могут быть превращены в амиды 17-карбоновых кислот, как проиллюстрировано примерами 5, 6 и 7.
Пример 4
(3β,5β,14β,17β) -14-Амино-3-[(O-2,6-дидезокси- β -D-рибо-гексопиранизил-(1--->4)-O-2,
6-дидезокси- β -D-рибо-гексопиранозил)окси]-N-метил-андростан-17-карбоксамид
Схема к примеру 4 (см. в конце описания).
В автоклав из нержавеющей стали помещают A, метиловый эфир (3β,5β,14β,17β) -14-амино-3-[(O-2,6-дидезокси- β -D-рибо-гексопиранизил-(1--->4)-O-2,6-дидезокси-

Пример 5
(3β,5β
,14β,17β) -14-Амино-3-((O-2,6-дидезокси- β -D-рибо- гексопиранизил-(1--->4)-O-2,6-дидезокси- β -D-рибо- гексопиранозил)окси]андростан-17-карбоксамид
Схема к
примеру 5 (см. в конце описания).
В автоклав из нержавеющей стали помещают A, метиловый эфир (3β,5β,14β,17β) -14-амино-3-[(O-2,6-дидезокси- β -D-рибо-гексопиранизил(1--->4)-O-2,6-дидезокси- β -D-рибо-гексопиранозил)окси] андростан-17-карбоновой кислоты (0,61 г, 0,001 моля) в метаноле (15 мл) и раствор охлаждают в бане лед/вода. Протекают газообразный аммиак до насыщения (15 мин), реакционный сосуд закрывают и выдерживают 10 дней при 90oC. По охлаждении до комнатной температуры реактор открывают и содержимое упаривают в вакууме досуха. Твердое вещество очищают хроматографией на силикагеле, используя в качестве элюента смесь хлористый метилен : метанол (75:25), содержащую 1% концентрированного раствора аммиака в воде. Фракции, содержащие чистый продукт, объединяют, упаривают и сушат в вакууме, получая чистый конечный продукт.
Пример 6
(3β,5β,14β
,17β) -14-Амино-3-[(О-2,6-дидезокси- β -D-рибо-гексопиранизил-(1--->4)-O-2,6-дидезокси- β -D-рибо- гексопиранозил(1--->4)-2,6-дидeзoкcи- β
-D-pибo- гекcoпиранозил)oкcи]aндpocтaн-17-карбоксамид
Схема к примеру 6 (см. в конце описания).
В автоклав из нержавеющей стали помещают 289 мг (0,0004 моля) 1 метилового эфира (3β,5β,14β,17β) -14-амино-3-[(O-2,6-дидезокси- β -D- рибо-гексопиранизил-(1--->4)-O-2,6-дидезокси- β -D-рибо- гексопиранозил- (1--->4)-2, 6-дидезокси- β -D-рибо-гексопиранозил)окси] андростан-17-карбоновой кислоты и 10 мл MeOH, затем пропускают NH3 газ, охлаждая баней лед/вода, до насыщения (15 мин). Прозрачный раствор закрывают в автоклаве и нагревают 10 дней при 90oC. По окончании реакции (следят по ТСХ) светло-желтую реакционную смесь упаривают на роторном испарителе, получают твердое вещество беловатого цвета, которое чистят флеш-хроматографией, используя в качестве подвижной фазы 25% MeOH/CH2Cl2+NH4OH. Фракции собирают и проводят мониторинг ТСХ. По ее результатам объединенные фракции (43-81), имеющие на хроматограмме одно пятно с Rf 0,23, упаривают на роторном испарителе, получают беловатое твердое вещество, которое сушат в вакууме при 55oC в течение ночи; получают чистый конечный продукт.
Пример 7
(3β,5β,14β,17β) -14-Амино-3-[(O-2,6-дидезокси- β
-D-рибо-гексопиранизил-(1--->4)-O-2,6-дидезокси- β -D-рибо-гексопиранозил(1--->4)-2,6-дидезокси- β -D-рибо-гексопиранозил)окси]-N-метил-андростан-17-карбоксамид
Схема к примеру 7 (см. в конце описания).
В автоклав из нержавеющей стали помещают 289 мг (0,0004 моля) 1 метилового эфира (3β,5β,14β,17β) -14-амино-3-[(O-2,6-дидезокси- β -D-рибо-гексо-пиранизил-(1--->4)-O-2,6-дидезокси- β -D- рибо-гексопиранозил(1--->4)-2,6-дидезокси- β -D-рибо- гексопиранозил)окси]андростан-17-карбоновой кислоты и 10 мл MeOH, пропускают при охлаждении (лед/вода) метиламин до насыщения. Прозрачный раствор нагревают в закрытом автоклаве при 90oC в течение 10 дней.
Автоклав вынимают из печи, охлаждают, открывают и хроматографируют (ТСХ). Если хроматограмма показывает отсутствие исходного вещества, светло-желтую реакционную смесь упаривают на роторном испарителе и получают полужидкий остаток, который очищают флеш-хроматографией, используя в качестве подвижной фазы 20% MeOH/CH2Cl2+NH4OH. (Начальное соотношение: 20/80/0,9; конечное соотношение 20/80/1,8. ) На основании результатов ТСХ объединенные фракции 22-98, имеющие одно пятно с Rf 0,43 (20% MeOH/CH2Cl2+NH4OH) упаривают на роторном испарителе. Получают беловатое твердое вещество. Его затирают с холодным эфиром и собирают фильтрованием конечный продукт беловатого цвета, который сушат в вакууме при 55oC 48 часов и получают чистый конечный продукт.
Новые соединения настоящего изобретения получены также методами экспериментальной химии, описанными ранее в патентах США 4,325,879; 4,552,868; 4,552,868; 4,584,289 и 4,885,280 и в приведенных в них ссылках. Следующие, но не ограничивающиеся только ими, примеры иллюстрируют, как соединения настоящего изобретения можно получить известными ранее методами.
Пример 8
Метиловый эфир (3β,5β,14β,17β) -14-амино-3[(O-2,6-дидезокси- β
-D- рибо-гексопиранизил-(1--->4)-6-дезокси-2,3-O-(1-метилэтилиден)- α- L-маннопиранозил]-окси]-андростан-17-карбоновой кислоты
Схема к примеру 8 (см. в конце описания).
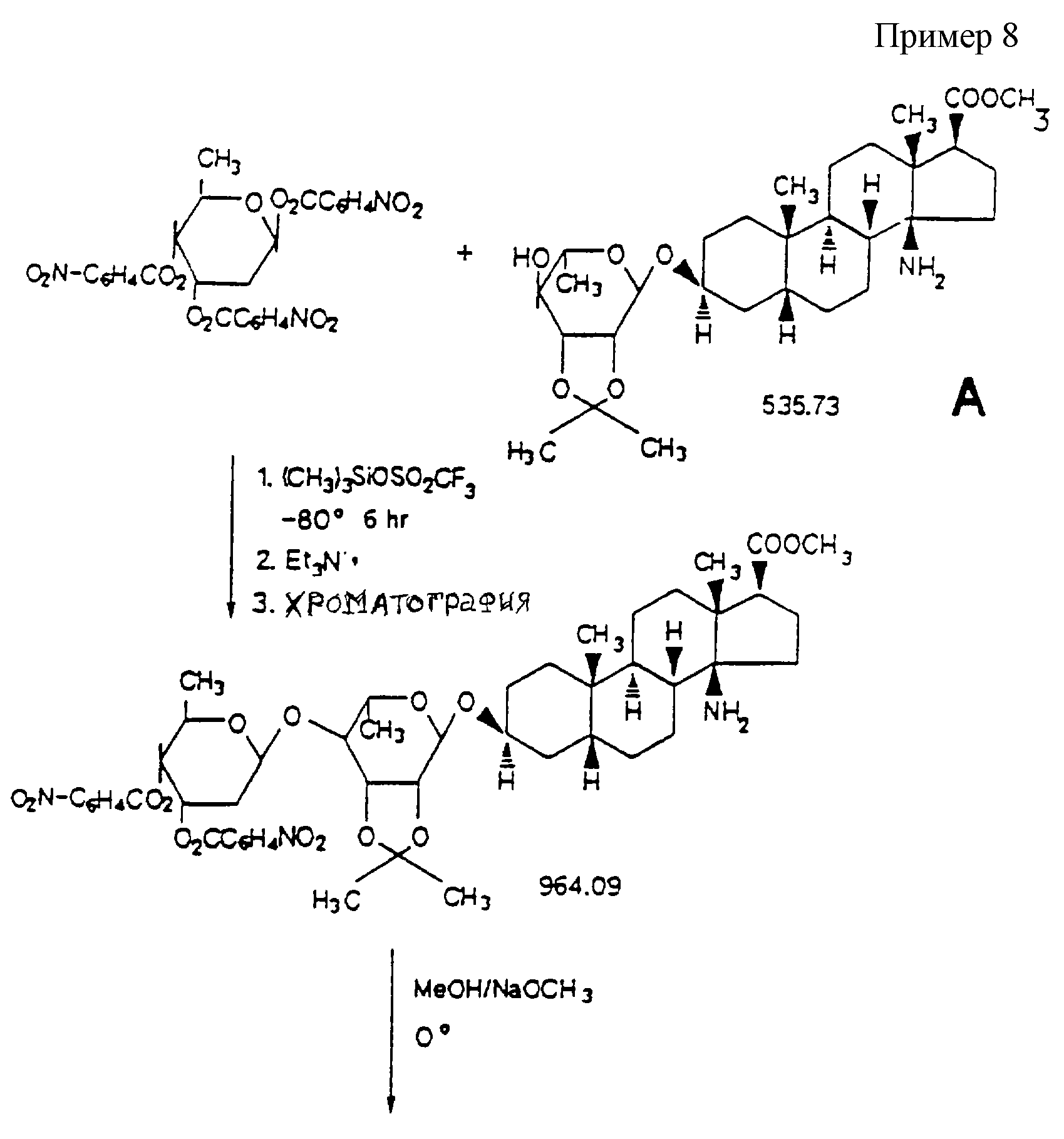
К смеси 1,125 г (2,1 ммоля) A, метилового эфира (3β,5β,14β,17β) -амино-3-[[6-дезокси-2,3-O-(1-метилэтилиден)- α - L-манно-пиранозил]-окси]-андростан-17-карбоновой кислоты, полученного по методике, описанной в Патенте США 4,885,280 и в ссылках в нем, и 1,250 г (2,1 ммоля) 2,6-дидезокси-1,3, 4-D-(4- нитробензоил)-D-рибогексано-пиранозида в 60 мл CH2Cl2 добавляют 3,0 г молекулярных сит 4

Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле. Примеси удаляют CH2Cl2, затем нужную фракцию вымывают EtOAc/CH2Cl2 (1:4) в количестве 1,98 г.
К раствору 400 мг (0,415 ммоля) вышеописанного p-нитробензоилпроизводного дисахарида в 1,0 мл сухого метанола (Aldrich, безводный) добавляют шприцем 7,2 мл 0,1217 мМ NaOCH3 в сухом метаноле (Aldrich). Смесь перемешивают при 0oC 6 часов и из реакционной смеси выпадает конечный продукт - метиловый эфир (3β,5β,14β,17β) -14-амино-3-[(O-2,6-дидезокси- β -D-рибо-гексопиранизил-(1--->4)-6-дезокси-2,3-O-(1-метилэтилиден)- α -D-манно-пиранозил]-окси]андростан-17-карбоновой кислоты.
Пример 9
Метиловый эфир 14 β -амино- 3β-[α -(L)-рамнопиранозилокси-(1--->4)-2',
3'-O-изопропилиден- α -(L)-рамнопиранозилокси]-5 β -андростан-17 β -карбоновой кислоты
260 мг метилового эфира 14 β -азидо-3 β -[2',3'-O-изопропилиден- α -(L)-рамнопиранозилокси]-5 β -андростан-17 β -карбоновой кислоты, полученного по методикам, описанным в Патентах США 4,895,280 и 4,325,879 и в данных в них ссылках, растворяют в 12 мл ацетонитрила и раствор перемешивают 15 минут в присутствии молекулярных сит (130 мг, 3
После добавления насыщенного раствора бикарбоната натрия, фильтрования, экстракции толуолом и очистки хроматографией под давлением (500 mb) на колонке с силикагелем (элюент этилацетат/гексан 1:2), получили 252 мг метилового эфира 14 β -азидо-3 β -[три- 2'',3'', 4''-О-ацетат- α -(L)- рамнопиранозилокси-(1--->4)- 2', 3'-O-изопропилиден- α -(L)-рамнопиранозилокси]-5 β -андростан-17 β -карбоновой кислоты.
Это ди-рамнозил-14-азидопроизводное может быть перекристаллизовано из смеси этиловый эфир/петролейный эфир.
Смесь 8,5 мл абсолютного этилового спирта, обескислороженного продуванием аргона, 99,5 мг порошкообразного теллура и 74 мг натрийборгидрида, содержащего 250 мг вышеописанного ди-рамнозил-14- азидопроизводного, перемешивают 24 часа при комнатной температуре.
После фильтрования через целит, упаривания, экстракции этилацетатом и промывания водой остаток очищают хроматографией под давлением на колонке с силикагелем, элюируя смесью хлороформ/этиловый спирт/водный аммиак (89:10: 1), и получают метиловый эфир 14 β -амино- 3β-[α- -(L)-paмнoпиpaнoзил-oкcи- (1--->4)-2', 3'-О-изопропилиден- α -(L)-рамнопиранозилокси] - 5 β -андростан-17

Пример 10
Метиловый эфир 14 β -амино-3 β -[три-2'',3'',4''-O-ацетил- α
-(L)-рамнопиранозил-окси-(1--->4)-2', 3'-O-изопропилиден- α -(L)-рамнопиранозилокси] -5 β -андростан-17 β -карбоновой кислоты

5,0 г три-гидрокси-производного, полученного, как указано в Примере 8, растворяют в 3,7 мл хлористого метилена и раствор охлаждают на ледяной бане. Прибавляют уксусный ангидрид (2,4 мл) и диметиламинопиридин (313 мг) и реакционную смесь перемешивают в течение ночи при комнатной температуре.
В реакционную смесь вливают водный раствор натриевой щелочи, а затем экстрагируют хлористым метиленом.
Органический слой промывают H2O+NH4OH, сушат Na2SO4 и упаривают досуха. Сырой триацетат, полученный таким образом, очищают флеш-хроматографией на силикагеле, элюируя смесью хлористый метилен/метанол/водный раствор аммиака (97: 2,7: 0,27), при этом получают метиловый эфир 14 β -амино-3 β -[три-2'', 3'', 4''-O-ацетил- α- -(L)- рамнопиранозил-окси-(1--->4)-2',3'-O-изопропилиден- α -(L) рамнопиранозилокси]-5 β-андростан-17 β- карбоновой кислоты.
Пример 11
Метиловый эфир 14 β -амино-3 β -[2'',3''-O-изoпpoпилидeн- α
-(L)-рамнопиранозил-окси-(1--->4)-2', 3'-O-изопропилиден- α -(L)- рамнопиранозилокси]-5 β андростан-17 β карбоновой кислоты

К раствору 11,2 г три-гидрокси-производного, полученного, как указано в Примере 8, в 77 мл ацетона добавляют 97 мл диметоксипропана и 3,5 г p-толуолсульфокислоты•H2O. Реакционную смесь перемешивают при комнатной температуре 1 час и прибавляют водный раствор натриевой щелочи при перемешивании в течение нескольких минут, а затем экстрагируют смесью хлористый метилен/метанол.
Органические вытяжки промывают H2O+NH4OH, сушат Na2SO4 и упаривают досуха. Полученный таким образом сырой продукт очищают перекристаллизацией из изопропилового эфира и получают метиловый эфир 14 β-амино-3 β-[2'',3''-O- изопропилиден- α -(L)-рамнопиранозил-окси-(1--->4)-2', 3'- O-изопропилиден- α-(L)-рамнопиранозилокси]-5 β- андростан- 17 β- -карбоновой кислоты.
Пример 12
Метиловый эфир 14

Три-гидрокси-производное (103 мг), полученное, как указано в Примере 8, растворяют в 2 мл хлороформа в присутствии 0,2 мл трифторуксусной кислоты и воды (1%). Реакцию проводят при комнатной температуре в течение 1 часа.
После экстракции смесью хлористый метилен/метанол (85:15), промывания насыщенным раствором бикарбоната, водой, упаривания досуха остаток очищают хроматографией на колонке с силикагелем под давлением; элюент - смесь хлористый метилен/метанол/водный аммиак (84:15:1). Получают метиловый эфир 14 β -амино- 3β-[α -(L)-рамнопиранозилокси-(1--->4)- α -(L)- рамнопиранозилокси)-5 β-андростан-17 β-карбоновой кислоты.
Испытание фармакологической активности
Считается, что положительный инотропный эффект кардиотонического стероидного соединения вызван его действием на Na+ и K+ насос в сарколемме клеток сердечной мышцы. В особенности
кардиотонические стероиды ингибируют Na+, К+-активированную аденозинтрифосфатазу, что, в свою очередь, приводит к увеличению внутриклеточного кальция. Таким образом, требуется
больше кальция для того, чтобы запустить механизм сокращения. См. в общем виде, Goodman and Gilman. The pharmacological Basis of Therapeutics. Chapter 34 (8th ed., 1990).
Положительная инотропная активность новых химических объектов контролировалась как в изолированных сердечных тканях, так и на подопытных животных. Изолированные ткани позволяют проводить непосредственное измерение инотропного потенциала соединения, так как система фактически свободна от метаболических, нейрогормональных и абсорбционных вмешательств, которые могут влиять на реакцию ткани. Опыты in vivo позволяют произвести оценку, которая принимает во внимание физиологические параметры, отсутствующие в опыте с изолированной тканью.
В опытах по инотропной активности использовались полоски папиллярных мышц морских свинок. Хотя на папиллярную мышцу оказывает влияние деятельность клапана, основное сокращение, проявляемое этой мышцей, подобно сокращению вентрикулярной мышцы. Для опыта сегмент папиллярной мышцы, вырезанный из сердца морской свинки, помещается в тканевую жидкость, что дает возможность контролировать температуру ткани, при этом для функционирования клетки необходима жидкостная среда, содержащая субстрат. Присоединив датчик к свободному концу полоски мышцы так, чтобы мышца находилась между закрепленным основанием и датчиком, и, подавая электрические импульсы, можно измерять сокращение, или укорочение в ответ на изменение концентрации испытуемого соединения. В типичных условиях положительную инотропию определяют как увеличение силы сокращения, вызванное неизвестным агентом, и данные обычно публикуются как концентрация медикамента, необходимая, чтобы вызвать увеличение силы сокращения на 50% по сравнению с эталонной (EC50).
Определение положительной инотропии in vivo проводится двумя методами. Первый метод очень похож на метод, описанный для определения силы сокращения с помощью хирургического присоединения тензиометра к поверхности сердца. По второму методу силовой датчик помещают внутри левого желудочка для определения изменения давления. Сократительная сила миокарда коррелируется со скоростью увеличения давления в левом желудочке и выражается как +dP/dt. В любом случае данные сообщаются в виде количества медикамента, необходимого для достижения уровня активности, равного увеличению сократительной способности на 30% или +dP/dt (то есть ED30) и выражаются в виде мг медикамента/кг веса животного.
Фармацевтические
композиции
Новые олигосахарид-содержащие 14-аминостероидные соединения настоящего изобретения могут вводиться в организм человека и других млекопитающих различными путями, включая, но не
ограничиваясь этим, дозировки для орального приема и инъекции (внутривенные, внутримышечные, внутрибрюшинные - интраперитональные, подкожные). Многочисленные другие формы, содержащие
олигосахарид-содержащие 14-аминостероидные соединения настоящего изобретения, могут легко быть созданы опытными специалистами с применением фармацевтических носителей, как определяется ниже. С точки
зрения удобства пациента обычно предпочтительны оральные формы.
Термин "фармацевтическая композиция", применяемый в дальнейшем, означает комбинацию, составленную из безопасного и эффективного количества олигосахарид-содержащего 14-аминостероидного соединения в качестве активного ингредиента, шаг их смесей, и фармацевтически-приемлемых носителей.
Фраза "безопасное и эффективное количество", употребляемое в дальнейшем, означает количество соединения или композиции, достаточно большое, чтобы значительно изменить симптомы и/или условия лечения, но достаточно малое, чтобы избежать серьезных побочных эффектов (с разумным соотношением польза/риск) со здравой медицинской точки зрения. Безопасное и эффективное количество активного ингредиента для использования в фармацевтических композициях, которое используется при лечении по способу изобретения в дальнейшем, может меняться в зависимости от конкретных условий лечения, возраста и физического состояния, длительности лечения, характера проводимого одновременно (совместно) лечения, особенностей используемого активного ингредиента, особенностей применяемого фармацевтически-приемлемого носителя, а также знаний и опыта лечащего врача.
Термин "фармацевтически-приемлемые носители", применяемый в дальнейшем, включает любое физиологически неактивное вещество, известное на практике, совместимое с физическими и химическими характеристиками конкретного олигосахарид-содержащего 14-аминостероидного соединения, выбранного для применения в качестве активного ингредиента. Фармацевтически-приемлемые носители включают, но не ограничиваются этим, полимеры, смолы, пластификаторы, наполнители, связующие вещества, смазки, агенты, способствующие проглатыванию, разрыхлители, растворители, со-растворители, буферные системы, поверхностно-активные вещества, консерванты, подслащивающие вещества, фармацевтические красители или пигменты и агенты вязкости.
Термин "форма для орального применения", употребляемая ниже, означает любую фармацевтическую композицию, которую назначают для систематического индивидуального применения человеком путем введения указанной композиции в желудочно-кишечный тракт через рот данного человека. Для целей настоящего изобретения вводимая форма может быть в виде таблетки, покрытой или не покрытой оболочкой; раствора; суспензии; или капсулы, покрытой или не покрытой оболочкой.
Термин "инъекция", применяемый в дальнейшем, означает любую фармацевтическую композицию, которую назначают для систематического приема человеку или другому млекопитающему путем введения раствора или эмульсии, содержащих активный ингредиент, через прокол в коже данного индивидуума внутривенно, внутримышечно, внутрибрюшинно или подкожно.
Скорость введения в систему опытный специалист может удовлетворительно контролировать, меняя один или несколько нижеприведенных факторов:
(а)
подходящий активный ингредиент;
(b) фармацевтически-приемлемые носители; условием является то, чтобы различные варианты их не влияли на активность данного выбранного активного ингредиента;
(с) тип носителя, сопутствующая желаемая консистенция и проницаемость (способность к набуханию) указанных носителей;
(d) устойчивость во времени самого носителя и/или его вместе с
другими носителями;
(е) размер частиц гранулированного активного ингредиента; и
(f) зависимость состояния носителя от pH.
Как заявлялось выше, фармацевтически-приемлемые носители включают, но не ограничиваются этим, смолы, наполнители, связующие вещества, смазки, вещества, способствующие проглатыванию, растворители, разрыхлители, со-растворители, поверхностно-активные вещества, консерванты, вещества, придающие сладкий вкус и аромат, буферные системы, фармацевтические красители и пигменты.
Предпочтительным растворителем является вода.
Ароматизирующие вещества, применяемые в дальнейшем, выбираются из тех, которые описаны в Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Company, 1990, pp. 1288-1300, а также в ссылках, помещенных там. Фармацевтические композиции, пригодные для исследования в дальнейшем, обычно содержат 0-2% ароматизирующего вещества.
Красители и пигменты, применяемые ниже, включают те, которые описаны в Handbook of Pharmaceutical Excipients. pp.81-90, 1986, by the American Pharmaceutical Association & the Pharmaceutical Society of Great Britain, а также в данных там ссылках. Фармацевтические композиции, приведенные ниже, содержат 0-2% красителей или пигментов.
Предпочтительные со-растворители включают, но не ограничиваются этим, этанол, глицерин, пропиленгликоль, полиэтиленгликоль. Фармацевтические композиции настоящего изобретения содержат 0-50% со-растворителей.
Предпочтительные буферные системы включают, но не ограничиваются этим, уксусную, борную, угольную, фосфорную, янтарную, малоновую, винную, лимонную, уксусную, бензойную, молочную, глюконовую, глутаровую и глутаминовую кислоты и их натриевые, калиевые и аммониевые соли. Фармацевтические композиции настоящего изобретения обычно содержат 0-5% буферных систем.
Предпочтительные поверхностно-активные вещества включают, но не ограничиваются этим, эфиры полиоксиэтиленсорбитана и жирной кислоты, полиоксиэтилен-моноалкиловые эфиры, моноэфиры сахарозы, простые и сложные эфиры ланолина, алкилсульфаты, натриевые, калиевые и аммониевые соли жирных кислот. Фармацевтические композиции настоящего изобретения содержат 0-2% поверхностно-активных веществ.
Предпочтительные консерванты включают, но не ограничиваются этим, фенол, алкиловые эфиры п-гидроксибензойной кислоты, о-фенилфенолбензойной кислоты и их соли, борную кислоту и ее соли, сорбиновую кислоту и ее соли, хлорбутанол, бензиловый спирт, тимеросал, ацетат и нитрат фенилртути, нитромерсол, бензалконий-хлорид, цетилпиридиний-хлорид, метилпарабен и пропилпарабен. Наиболее предпочтительными являются соли бензойной кислоты, цетилпиридиний-хлорид, метилпарабен и пропилпарабен. Композиции настоящего изобретения обычно содержат 0-2% консервантов.
Предпочтительные подслащивающие вещества включают, но не ограничиваются этим, сахарозу, глюкозу, сахарин, сорбит, маннит и аспартам. Наиболее предпочтительными являются сахароза и сахарин. Фармацевтические композиции настоящего изобретения содержат 0-5% подслащивающих веществ.
Предпочтительные агенты вязкости включают, но не ограничиваются этим, метилцеллюлозу, натрий-карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, натрий-альгинат, карбомер, повидон, гуммиарабик, смола гуара, смола ксантана и трагаканта. Наиболее предпочтительны метилцеллюлоза, карбомер, смола гуара, смола ксантана, повидон, натрий-карбоксиметилцеллюлоза и алюмосиликат магния. Композиции настоящего изобретения содержат 0-5% вяжущих агентов.
Предпочтительные наполнители включают, но не ограничиваются этим, лактозу, маннит, сорбит, трехосновный кальций фосфат, двухосновный кальций-фосфат, прессующийся сахар, крахмал, сульфат кальция, декстро- и микрокристаллическую целлюлозу. Композиции настоящего изобретения содержат 0-75% наполнителей.
Предпочтительные смазки включают, но не ограничиваются этим, стеарат магния, стеариновую кислоту и тальк. Фармацевтические композиции настоящего изобретения содержат 0,5-2% смазок.
Предпочтительные агенты, способствующие проглатыванию, включают, но не ограничиваются этим, тальк и коллоидную двуокись кремния. Композиции настоящего изобретения содержат 0-5% таких веществ.
Предпочтительные разрыхлители включают, но не ограничиваются этим, крахмал, натрий-гликолат крахмала, кросповидон, кроскармелознатрий и микрокристаллическую целлюлозу. Композиции настоящего изобретения включают 4-15% разрыхлителей.
Предпочтительные связующие включают, но не ограничиваются этим, гуммиарабик, трагакант, гидроксипропилцеллюлозу, пре-желатинизированный крахмал, желатин, повидон, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу, растворы сахаров, таких как сахароза и сорбит, и этилцеллюлозу. Композиции настоящего изобретения включают 1-10% связующих.
Соединения настоящего изобретения могут составлять от 0,1 до примерно 99,9% по весу от фармацевтических композиций настоящего изобретения. Предпочтительно соединения настоящего изобретения составляют от 20 до 80% по весу от фармацевтических композиций настоящего изобретения.
Соответственно, фармацевтические композиции настоящего изобретения включают от 15-95% олигосахарид-содержащего 14-аминостероидного соединения в качестве активного ингредиента или их смесей; 0-2% ароматизирующих веществ; 0-50% со-растворителей; 0-5% буферной системы; 0-2% поверхностно-активных веществ; 0-2% консервантов; 0-5% подслащивающих веществ; 0-5% агентов вязкости; 0-75% наполнителей; 0,5-2% смазок; 1-5% агентов, способствующих проглатыванию; 4-15% разрыхлителей и 1-10% связующих веществ.
Применяемые фармацевтические композиции описаны здесь. Опытный специалист может неограниченно варьировать описанные ниже примеры и получать широкий ряд фармацевтических композиций.
Выбор фармацевтически-приемлемого носителя зависит в основном от того, каким путем вводятся олигосахарид-содержащие 14-аминостероидные соединения. Если соединение вводится в виде инъекции, то предпочтительным фармацевтическим носителем является физиологический раствор, pH которого доводится до 7,4. Удобные фармацевтически-приемлемые носители для наружного применения включают такие, которые пригодны для использования в кремах, гелях, пластырях и т.п.
Предпочтительным способом введения олигосахарид-содержащих 14-aминостероидных соединений настоящего изобретения является прием через рот. Следовательно, предпочтительной формой однократного приема являются таблетки, капсулы и т. п., содержащие безопасное и эффективное количество олигосахарид-содержащих 14-аминостероидных соединений настоящего изобретения. Фармацевтически-приемлемые носители, пригодные для приготовления однократной дозы для орального приема, хорошо известны в практике. Их выбор будет зависеть от дополнительных факторов, таких как вкус, стоимость, устойчивость при хранении, которые находятся вне целей настоящего изобретения, и этот выбор может быть легко сделан опытным специалистом.
Для орального приема могут быть использованы различные разовые формы, включая такие твердые формы как таблетки, капсулы, гранулы и порошки. Эти разовые формы для орального приема содержат безопасное и эффективное количество, преимущественно от 0,25 до 5,0 мг олигосахарид-содержащего 14-аминостероида. Более предпочтительно, чтобы эти дозы для орального приема содержали 0,5 - 1,0 мг олигосахарид-содержащего 14-аминостероида. Таблетки могут быть спрессованы, растерты в порошок, покрыты энтеросолюбильной оболочкой, оболочкой сахара, пленкой или многократно прессованные, содержащие приемлемые связующие, смазки, разбавители, разрыхлители, красители, корригенты, вещества, способствующие текучести, вещества, способствующие плавлению. Жидкие формы для орального приема включают водные растворы, эмульсии, суспензии, растворы и/или суспензии, полученные из нешипучих гранул и шипучие препараты, полученные из шипучих гранул, содержащие подходящие растворители, консерванты, эмульгаторы, суспензирующие вещества, разбавители, подсластители, агенты, способствующие плавлению и придающие запах. Предпочтительные носители для орального приема содержат желатин, пропиленгликоль, хлопковое масло и кунжутное масло.
Композиции этого изобретения могут назначаться для местного приема субъектом, то есть непосредственное накладывание или нанесение композиции на ткани эпидермы или эпителия субъекта. Такие композиции включают, например, лосьоны, кремы, растворы, гели и твердые вещества. Эти композиции для локального приема содержат безопасное и эффективное количество, предпочтительно от примерно 0,5 до 2,0 мг олигосахарид-содержащих 14-аминостероидов. Более предпочтительные местные композиции содержат 1,0 мг олигосахарид-содержащих 14-аминостероидов. Подходящие носители для местного применения предпочтительно остаются на коже в виде долго сохраняющейся пленки и удаляются с потом или водой. Как правило, носитель является органическим по природе и способен сохранять в себе диспергированный или растворенный олигосахарид-содержащий 14-аминостероид. Носитель может содержать фармацевтически-приемлемые смягчающие агенты, эмульгаторы, загустители и растворители.
Композиции настоящего изобретения могут также назначаться в виде ингаляций. Такие композиции готовятся с применением основы, состоящей из растворителя, такого как вода или гликоль, консервантов, таких как метил или пропил парабен и газов-вытеснителей, таких как азот или двуокись углерода.
Кроме того, композиции этого изобретения могут назначаться в виде подвижного имплантанта, образованного из силиконового каучука, сополимеров этилен-винилацетата или молочно-гликолевых сополимеров.
Чтобы проиллюстрировать, как приготовить фармацевтические композиции, содержащие новые соединения настоящего изобретения, приведены следующие, но не ограничивающиеся только ими, примеры фармацевтических композиций.
Примеры фармацевтических композиций
Пример 1
Форма для экстренного орального применения (таблетка), содержащая (3β,5β,
14β,17β)- 14-амино-3[(O-2,6-дидезокси- β -D-рибо- гексопиранизил-(1--->4)-O-2,6-дидезокси- β -D-рибо- гексопиранозил(1--->-2,6-дидезокси- β
-D-рибо-гексопиранозил)окси] -N-метиландростан-17-карбоксиамид, имеет следующий состав:
Активный ингредиент - Количество
(3β,5β,14β,17β) -14-Амино-3-[(O-2,
6-дидезокси- β -D-рибо- гексопиранизил-(1--->4)-O-2,6-дидезокси- β -D-рибо- гексопиранозил(1--->4)-2,6-дидезокси- β
-D-рибо-гексопиранозил)окси]-N-метиландростан-17-карбоксиамид - 1,0 мг
Носители
Микрокристаллическая целлюлоза - 28,5 мг
Лактоза, водная - 67,2 мг
Кросповидон - 3,0
мг
Стеарат магния - 0,3 мг
Руководство по приготовлению (на 10 000 таблеток)
1) 10,0 г медикамента, 285,0 микрокристаллической целлюлозы, 672,0 г лактозы и 30,0 г
кросповидона смешивают в смесителе Патерсона-Келли (ПК) или любом другом пригодном смесителе,
2) вышеописанную смесь смешивают с 3,0 г стеарата магния в ПК или другом удобном смесителе,
3) вышеописанную конечную смесь прессуют в таблетки на любой подходящей машине для таблетирования.
Пример 2
Форма для парентерального введения, содержащая метиловый
эфир (3β,5β,14β,17β) -14-амино-3-[(O-2,6-дидезокси- β -D-рибо-гексопиранизил-(1--->4)-6-дезокси-2,3-O-(1-метилэтилиден)- α
-L-маннопиранозил]-окси]-андростан-17-карбоновой кислоты; для внутривенных инъекций (ВИ) применима следующая композиция:
Активный ингредиент - Количество
Метиловый эфир (3β,
5β,14β,17β) -14-амино-3-[[(O-2,6-дидезокси- β -D-рибо-гексопиранизил-(1---4>)-6-дезокси-2,3-O-(1-метилэтилиден)- α
-L-маннопиранозил]-окси]-андростан-17-карбоновой кислоты - 1,0 мг
Носители
Маннит - 200,0 мг
Лимонная кислота/цитрат натрия - Количество, достаточное, чтобы довести pH до 5,
5-6,5
Руководство по приготовлению (на 1000 ампул)
1) 1,0 г лекарства, 200,0 г маннита и достаточное количество цитрата натрия и лимонной кислоты растворяют в 2200,0 мл стерильной
деонизированной воды для инъекций,
2) вышеописанный раствор фильтруют через стерильный мембранный фильтр 0,22 микрона,
3) 2,2 мл вышеописанного стерильного раствора помещают в
стеклянную ампулу Тип 1 и лиофилизуют в подходящем лиофилизаторе,
4) ампулы, после лиофилизации и обработки стоппером (бромистым бутилом или подобным) запаивают. Лиофилизованный продукт
смешивают с 2,0 мл стерилизованной воды для инъекции непосредственно перед применением.
Пример 3
Форма выпуска для длительного орального приема (таблетки), содержащая
(3β,5β,14β,17β) -14-амино-3-[(O-2,6-дидезокси- β -D-рибо- гексопиранизил-(1--->4)-O-2,6-дидезокси- β -D-рибо-гексопиранозил (1--->4)-2,
6-дидезокси- β -D-рибо-гексопиранозил)окси] андростан-17- карбоксамид, имеет следующий состав:
Активный ингредиент - Количество
(3β,5β,14β,17β)
-14-Амино-3-[(O-2,6-дидезокси- β -D-рибо- гексопиранизил-(1--->4)-O-2,6-дидезокси- β -D-рибо-гексопиранозил- (1--->4)-2,6-дидезокси- β
-D-рибо-гексопиранозил)окси]андростан-17- карбоксамид - 5,0 мг
Носители
Гидроксипропилметилцеллюлоза - 120,0 мг
Лактоза, водная - 120,0 мг
Стеарат магния - 12,0
мг
Коллоидная двуокись кремния - 4,0 мг
Руководство по приготовлению (на 10000 таблеток)
1) 50,0 г лекарства, 1,2 кг гидроксипропилметилцеллюлозы и 1,2 кг лактозы смешивают
тщательно в смесителе Патерсона-Келли с двумя кожухами или другом пригодном смесителе,
2) к этой смеси добавляют 120 г стеарата магния и 40 г коллоидной двуокиси кремния и слегка смешивают в
подходящем смесителе,
3) полученную смесь прессуют в таблетки весом 261,0 мг на подходящем прессе для таблеток.
Дополнительные примеры
Помимо вышеприведенных трех
примеров активный ингредиент лекарства применяется в ряде различных форм:
1) фармацевтическая аэрозоль, содержащая растворитель (например, воду, гликоли), консерванты (метил или
пропилпарабены) и газообразные вытеснители (азот, двуокись углерода) или другие подходящие носители,
2) свечи для введения в прямую кишку, содержащие масло какао или полиэтиленгликоль,
3) подкожный имплантант, содержащий силиконовые каучуки, этилен-винилацетатный сополимер, лакто-гликолевые сополимеры и гидрогели других подходящих полимеров,
4) промышленно-доступные
аппараты для имплантации,
5) трансдермальная система, содержащая силиконовую жидкость в мембране из сополимера этилен-винилацетат или другие подходящие ингредиенты для подачи с или без помощи
ионофореза,
6) прикрепляющийся к слизистой оболочке рта пластырь, содержащий гидроколлоидные полимеры (гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, повидон) и другие подходящие
полимеры.
Методы лечения
Термин застойная сердечная недостаточность (ЗСН), как здесь употребляется, означает прогрессирующее заболевание, при котором гемодинамическая
способность, в связи с нарушением работы сердечной мышцы, значительно и необратимо изменяется. Характер ЗСН, в зависимости от симптомов у пациента, может быть поделен на 4 класса в соответствии с
классификацией Нью-Йоркской Ассоциации Кардиологов (NYHA).
Нью-Йоркская Ассоциация Кардиологов
Функциональная классификация
Класс
I. Пациенты с сердечным
заболеванием, но без ограничения физической активности. Обычная физическая нагрузка не вызывает чрезмерной утомляемости, сердцебиения, одышки, ангинозных болей.
II. Пациенты с сердечным заболеванием, приводящим к небольшому ограничению физической активности. Им приносит облегчение отдых. Обычная физическая активность вызывает утомляемость, сердцебиение, одышку и ангинозные боли.
III. Пациенты с сердечным заболеванием, которое приводит к значительному ограничению физической активности. Они чувствуют облегчение во время отдыха. Активность, меньшая, чем обычная, вызывает утомляемость, сердцебиение, одышку, ангинозные боли.
IV. Пациенты с сердечным заболеванием, которое приводит к тому, что любая физическая активность вызывает дискомфорт. Симптомы сердечной недостаточности или синдромы грудной жабы могут наблюдаться даже во время отдыха. Любая физическая активность увеличивает дискомфорт.
Классы III и IV по Нью-Йоркской классификации, а также относящиеся к открытой застойной сердечной недостаточности, часто лечат, назначая соединения, которые увеличивают сократимость сердца, вызывая положительный инотропный эффект. Эталонным соединением для увеличения сократимости сердца является дигоксин (оральный прием). Лечение симптомов открытой ЗСН назначением инотропов с целью увеличения CO, чтобы покрыть метаболические потребности организма, может облегчить жизнь пациента, больного ЗСН, так как сердце лучше обеспечивает обмен веществ в организме. Обычный здравый смысл, однако, указывает, что инотроп, такой как дигиталис, может ускорить смерть, так как инотропное действие увеличивает нагрузку на сердце. Более того, дигиталис имеет узкое отношение лечебная доза : токсичная доза, и назначение дигиталиса на стадиях, более ранних, чем класс III по Нью-Йоркской классификации, не является, по-видимому, благоразумным.
Кроме того, бипиридиновый инотроп, Милринон, как было показано, ухудшает вентрикулярную аритмию и, возможно, увеличивает смертность. См. DiBianco, R. , et al. "A Comparison of Oral Milrinone, Digoxin, and Their Combination in the Treatment of Patients with Chronic Heart Failure", N. Engl. J. Med. 320: 677 (1989).
Термин "гемодинамическая", используемый здесь, относится к механической способности сердца. Начальные гемодинамические последствия сердечной недостаточности - это уменьшение ударного объема крови, который является мерой количества крови, подаваемой сердцем за один удар. Поэтому сердце компенсирует его, увеличивая CO, чтобы поддержать ток к жизненным органам. По мере усугубления признаков сердечной недостаточности внутрисердечное давление поднимается, так же как легочное и венозное давление. Сердце в значительной степени неспособно обеспечить требуемое содержание CO.
Термин "структурное повреждение", используемый здесь, относится к микроскопическим и макроскопическим изменениям в сердце человека, страдающего ЗСН. Структурно, на микроскопическом уровне происходят следующие изменения. Ранняя стадия гипертрофии сердца характеризуется морфологически увеличением размера мышечных волокон и митохондрий, а также укрупнением митохондрий и ядер. Клетки мышц больше, чем нормальные, но организация клеток в основном сохраняется. На дальнейшей стадии гипертрофии, преимущественное увеличение размера числа специфических органелл, таких как митохондрия, так же как иррегулярное присоединение новых сократительных элементов на локальной поверхности клетки приводит к неуловимым нарушениям организации клеток и клеточного контура. Соседние клетки могут отличаться по степени увеличения.
Клетки, подвергшиеся длительной гипертрофии, обнаруживают более очевидные нарушения в организации клеток, такие как заметно увеличенные ядра с дольчатыми мембранами, которые вытесняют соседние мышечные волокна и вызывают нарушение нормальной регистрации Z полосок. Более раннее преимущественное увеличение митохондрий заменяется преобладанием по объему мышечных волокон. Последняя стадия гипертрофии характеризуется гибелью клеток и утратой сократительных элементов с заметным разрывом Z полосок, резким нарушением нормального параллельного расположения саркомеров, расширением и значительной кривизной T-канальцев и заменой сократительных элементов фиброзной тканью. См. Braunwald, Heart Disease: A Textbook of Cardiovascular Medicine. Vol. 1 (3rd ed. 1988). Эти микроскопические изменения проявляются на макроскопическом уровне сердечной гипертрофией или расширением сердца. Гипертрофированное сердце становится менее эффективным вследствие микроскопических изменений, вызывающих потерю сократительных элементов и фиброзные отложения, и клинические симптомы у пациента становятся более серьезными по мере того, как он прогрессирует по Нью-Йоркской классификации.
Соединения настоящего изобретения увеличивают сердечную сократимость. Доза может быть от 0,001 мг до 5 мг/кг в день, что определяется лечащим врачом в соответствии со способом лечения, тяжестью ЗСН и длительностью лечения.
Чтобы проиллюстрировать конкретное применение таких новых олигосахарид-содержащих 14-аминостероидных соединений для лечения ЗСН, представлены следующие, но не ограничивающиеся ими, примеры клинических испытаний.
Клинические испытания
Пример 1
Женщина 65 лет, белая, страдающая ожирением, 20 лет больна инсулинонезависимым диабетом mellitus и гипертонией, 2-мя годами ранее перенесла инфаркт
миокарда. Госпитализирована в кардиологическое отделение через 12 часов после возникновения инфаркта миокарда. Течение заболевания в больнице осложняется отеком легких, который проявляется в сильной
одышке в состоянии покоя, ортопное, набухании шейных вен, двусторонних хрипах в межлопаточной области, увеличении размеров сердца и выявленных при рентгенографии грудной клетки инфильтратах. Давление
в легочных клиновидных капиллярах составляет 35 мм Hg. Назначено лечение: морфин, кислород, внутривенно нитроглицерин, петлевой диуретик и 0,25 мг (3β,5β,14β,17β
)-14-амино-3[(O-2,6-дидезокси- β-D-рибо-гексопиранизил-(1--->4)-O-2,6-дидезокси- β-D-рибо- гексопиранозил-(1--->4)-2,6-дидезокси- β-D-рибо-гексопиранозил)окси]
-N-метил-андростан-17-карбоксиамида внутривенно каждые 4 часа в течение трех дней, а затем 0,25 мг (3β,5β,14β,17β) -14-амино-3-[(O-2,6-дидезокси- β
-D-рибо-гексопиранизил-(1--->4)-O-2,6-дидезокси- β-D- рибо-гексопиранозил(1--->4)-2,6-дидезокси- β-D-рибо- гексопиранозил)окси]-N-метил-андростан-17-карбоксиамида
перорально один раз в день. При таком режиме наступает улучшение и ее выписывают через 10 дней с меньшей одышкой (застойная сердечная недостаточность, класс II по Нью-Йоркской классификации) и
продолжают лечение амбулаторно, назначая диуретик, ингибитор АПФ, нитроглицерин и перорально 0,25 мг (3β,5β,14β,17β) -14-амино-3[(O-2,6-дидезокси- β
-D-рибо-гексопиранизил-(1--->4)-O-2,6-дидезокси- β-D-рибо-гексопиранозил(1--->4)-2,6-дидезокси- β-D-рибо- гексопиранозил)окси]-N-метил-андростан-17-карбоксиамида
ежедневно.
Пример 2
Мужчина, черный, 44 лет, страдает многолетней неконтролируемой гипертонией и застойной сердечной недостаточностью средней тяжести (класс II по
Нью-Йоркской классификации) в течение одного года, за последние 2 недели наблюдалось несколько обмороков. Он также жалуется на утомляемость и одышку во время одевания. Лечение включает дигоксин (0,25
мг/день), лазикс и ингибитор АПФ. Фиксируется S3 ритм галопа, отеки голеней, гипертрофия левого желудочка и желудочковая экстрасистолия на ЭКГ. Дополнительные обследования показывают: полиморфную
желудочковую экстрасистолию, эпизоды желудочковой тахикардии (при Холтеровском мониторировании), фракция выброса 30% при радионуклидной вентрикулографии и уровень дигоксина в сыворотке 2,2 нг/мл.
Предполагается, что аритмия и обмороки являются результатом отравления дигиталисом, и препарат прекратили давать. Метиловый эфир (3β,5β,14β,17β) -14-aминo-3[(O-2,
6-дидeзoкcи- β -D- рибо-гексопиранизил-(1--->4)-6-дезокси-2,3-O-(1-метилэтилиден)- α -L-маннопиранозил] -окси] -андростан-17-карбоновой кислоты назначают для перорального приема
по 0,25 мг в день. Так как утомляемость и одышка не исчезают, дозу увеличивают через 6 недель до 1 мг ежедневно, новых случаев обмороков не наблюдается, при повторном Холтеровском мониторировании
наблюдаются уменьшение желудочковой экстрасистолии, отсутствие вентрикулярной тахикардии и увеличение фракции выброса до 38%. Одышка в покое исчезла, и он может работать в саду со слабыми и редкими
приступами одышки (класс II по Нью-Йоркской классификации). За год наблюдения его состояние не изменилось.
Пример 3
Женщина, китаянка, 24 лет, ранее здоровая, жалобы на
одышку при чрезмерных усилиях в течение двух месяцев. В семье не было больных сердечными заболеваниями; она не курит и не принимает алкоголь. Физические показатели в норме, за исключением тахикардии и
смещения вбок точки максимального импульса. Пульс 105 и на ЭКГ видно неспецифическое уплощение зубца Т, а рентгенограмма показывает увеличение размера сердца. Эхокардиограмма показывает увеличение
обоих желудочков с глобальной гипокинезией, фракция выброса 40%. Клапан кажется нормальным. Тест с нагрузкой на тредмиле не показывает наличия ишемии. Диагноз: идиопатическая расширительная
кардиомиопатия (класс I по Нью-Йоркской классификации). Первоначально назначенное лечение ингибитором АПФ вызывает непереносимый кашель, и поэтому прекращено. Назначают (3β,5β,14β,
17β) -14-амино-3[(O-2,6-дидезокси- β -D-рибо-гексопиранизил- (1--->4)-O-2,6-дидезокси- β -D-рибо-гексопиранозил-(1--->4)-2,6-дидезокси- β
-D-рибо-гексопиранозил)окси] андростан-17-карбоксамид перорально по 1 мг дважды в день, и в течение следующего месяца ее толерантность к нагрузкам увеличивается. Увеличивается фракция выброса (по
эхокардиограмме) до 55%, и время испытания на тредмиле дошло до 200 секунд.
Пример 4
Мужчина, белый, 55 лет, 2 инфаркта миокарда; отец умер неожиданно в возрасте 50 лет,
стенокардия поддерживается в стабильном состоянии в течение двух лет изосорбид динитратом и бета блокаторами. За предыдущий месяц, однако, у него появилась одышка при ходьбе и подъеме по лестнице,
отеки голени и периодические приступы одышки ночью.
Пульс в состоянии покоя 90, 1+ отеки голеней, S3 ритм галопа, увеличенное сердце и Kerly B линии на рентгенограмме. Диагноз: застойная сердечная недостаточность в легкой степени (класс II по NYHA) вследствие ишемической болезни сердца. Бета блокаторы отменили и добавили ингибитор АПФ и диуретик, но это новое назначение усугубляет течение застойной сердечной недостаточности. Назначают перорально метиловый эфир (3β,5β,14β,17β) -14-амино-3[(O-2,6-дидезокси- β -D- рибо-гексопиранизил- (1--->4)-2,6-дидезокси- β -D-рибо-гексопиранозил)окси] -андростан-17-карбоновой кислоты 4 мг один раз в день. Одышка и отечность проходят (класс I по NYHA), пульс падает до 75, S3 ритм галопа исчезает, размеры сердца уменьшаются. Признаки застоя в легких на рентгенограмме исчезают. При испытании с нагрузкой на тредмиле время испытания через 1 месяц увеличивается до 170 секунд. В следующие два года ухудшения не наблюдаются.
Пример 5
Женщина, черная, 60 лет, перенесла три инфаркта миокарда и в результате тяжелой (класс IV
по NYHA) застойной сердечной недостаточности госпитализирована. Несмотря на лечение максимальными переносимыми дозами лазикса, изосорбид динитрата, дигоксина и ингибитора АПФ в предыдущие шесть недель
наблюдалась четыре раза острая декомпенсация. Ее симптомы: отечность, одышка в состоянии покоя, ортопное, спит на 3-х подушках, заметная утомляемость и спутанное сознание. Принято решение прекратить
давать дигоксин и назначить лечение метиловым эфиром (3β,5β,14β,17β) -14-амино-3[(O-2,6-дидезокси- β -D-рибо-гексопиранизил-(1--->4)- O-2,6-дидезокси- β
-D-рибо-гексопиранозил(1--->4)-2,6-дидезокси- β -D-рибо-гексопиранозил)окси] -андростан-17-карбоновой кислоты. Начальная доза метилового эфира (3β,5β,14β,17β
)-14-амино-3[(O-2,6-дидезокси- β- D-рибо-гексопиранизил-(1--->4)-O-2,6-дидезокси- β- D-рибо-гексопиранозил(1--->4)-2,6-дидезокси- β- D-рибо-гексопиранозил)окси]
-андростан-17-карбоновой кислоты составляет 0,5 мг перорально один раз в день, но по показаниям титрования, проводимого для адекватного контроля за симптомами, через 2
месяца доводится до 2 мг трижды
в день. В конце двухмесячного курса лечения ее ортопное, спутанное сознание и отечность исчезли; у нее увеличивается способность к ежедневной деятельности; она может одеваться без одышки (класс III по
NYHA, застойная сердечная недостаточность средней степени). Фракция выброса увеличивается с 20 до 35%. Ее состояние остается стабильным в течение следующих трех месяцев.
Пример 6
Недавно (2 месяца) мужчина, 60 лет, белый, умеренный алкоголик, курит сигареты 30 лет, госпитализирован после трех месяцев прогрессирующего ухудшения одышки при нагрузке, утомляемости, ортопное,
отечности и приступов одышки по ночам. У него бывает одышка при малых напряжениях (во время чистки зубов). Физические данные: вес значительно снижен, частота дыхания 30 в минуту, пульс 90/50, S3 ритм
галопа, 2+ отечность выше голени, набухание шейных вен, печень увеличена, асцит, хрипы в нижних отделах легких, увеличенное сердце. Внимательный осмотр позволяет поставить диагноз: хронический
алкогольный гепатит, хроническая пневмония и средней степени (класс III по NYHA) застойная сердечная недостаточность вследствие токсической (алкогольной) кардиомиопатии. Лечение начато
гидрохлор-тиазидом, ингибитором АПФ и метиловым эфиром 14 β-амино- 3β-[α-(L)- рамно-пиранозилокси-(1--->4)-

Пример 7
Женщина, 70 лет, белая, сидячий образ
жизни, рентгенограмма, сделанная для хирурга по поводу катаракты, показала увеличенные размеры сердца. Отрицает, что были когда-либо боли в грудной клетке, одышка, гипертония, диабет или сердечное
заболевание. На ЭКГ - неспецифические изменения сегмента ST и зубца Т; стандартные клинические лабораторные анализы нормальные. Тест с нагрузкой на тредмиле прерван из-за общей усталости. На
эхокардиограмме - увеличение правого и левого желудочков, клапанный аппарат интактен и фракция выброса 30%. Ей назначен профилактический курс метилового эфира 14 β -амино- 3β-[α
(L)-paмнoпиpaнoзилoкси-(1--->)-2', 3'-O-изoпpoпилидeн- α -(L)- paмнoпиранозилокси] -5 β- андростан-17 β-карбоновой кислоты перорально по 0,25 мг в день. Фракция выброса
увеличивается до 40% и к моменту госпитализации хирургом по поводу катаракты через 5 лет все симптомы отсутствуют.
Реферат
Описываются новые олигосахаридсодержащие 14-аминостероиды общей формулы I, где R1 - COOR5, где R5 - низший алкил с 1-6 атомами углерода, COR, где R - аминогруппа, возможно замещенная низшим алкилом с 1-6 атомами углерода; R2 - NH2-группа; R3 - остаток олигосахарида общей формулы II, где Rg - водород, гидрокси, ацетокси, бензоилкси; R10 - атом кислорода, а если далее R11 является заместителем терминального моносахаридного остатка, R11 - ОН, метил, ацетокси и R - водород, метил, метилгидроксиметил, или олигосахаридный остаток общей формулы III, где R14 и R15, одинаковые или различные, означают низший алкил с 1-6 атомами углерода; R17 может быть водород; гидрокси, ацетокси или бензокси; R18 и R19 означают гидрокси, ацетокси или бензокси, или олигосахаридный остаток общей формулы VI, где R14 и R15, одинаковые или различные, означают низший алкил с 1-6 атомами углерода; R14a - гидрокси, ацетокси; R4 - Н. Соединения формулы I активны при лечении застойной сердечной недостаточности, т.к. усиливают сократительную способность сердечной мышцы. Описываются также способ их получения, фармацевтическая композиция на основе соединений формулы I, способ лечения и способ введения аминогруппы. 5 с. и 7 з.п. ф-лы.



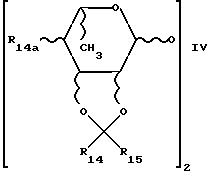
Формула

где R1 - COOR5, где R5 - низший алкил с 1 - 6 атомами углерода, COR111, где R111 - аминозамещеный низший алкил с 1 - 6 атомами углерода, амино- или диалкиламиногруппа; R2 - NH2-группа;
R3 - остаток олигосахарида общей формулы

где R9 означает водород, гидрокси, ацетокси, бензоилокси;
R10 - ацетокси, гидрокси, 4-нитробензоилокси;
R11 - атом кислорода, а если далее R11 является заместителем у терминального моносахаридного остатка, то R11 означает OH, метил, ацетокси;
R12 означает водород, метил, метилгидроксиметил или олигосахаридный остаток общей формулы

где R14 и R15, одинаковые или различные, означают низший алкил с 1 - 6 атомами углерода;
R17 может быть водород, гидрокси, ацетокси или бензокси;
R18 и R19 - гидрокси, ацетокси или бензокси или олигосахаридный остаток общей формулы

где R14 и R15, одинаковые или различные, означают низший алкил с 1 - 6 атомами углерода;
R14а означает гидрокси, ацетокси;
R4 - H.

в котором R9 означает водород, гидрокси, ацетокси, или бензокси;
R10 - ацетокси, гидрокси, 4-нитробензокси;
R11 - атом кислорода, и если R11 является заместителем у терминального моносахаридного остатка, то R12 означает водород, метил, метилгидроксиметил.
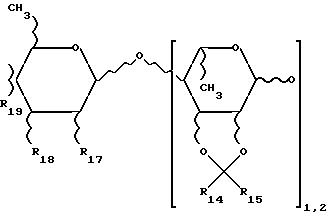
где R14 и R15, одинаковые или различные, означают низший алкил с 1 - 6 атомами углерода;
R17 может быть водород, гидрокси, ацетокси или бензокси;
R18 и R19 - гидрокси, ацетокси или бензокси.

где R14 и R15, одинаковые или различные, означают низший алкил с 1 - 6 атомами углерода, а R14а - гидрокси, ацетокси.

Комментарии