Способ получения производных @ @ 19-норстероидов - SU1340593A3
Код документа: SU1340593A3
Описание
Изобретение относится к способу получения новых производных стероидов , именно производных Л -19-нор- стероидов общей формулы
(I)
20
25
де R, - галогензамещенный тиенил,
или фенил, замещенный галогеном , низшей алкильной группой , низшей алкилтиогруп- 15 пой, которая может быть окислена в виде сульфона, фенильной группой, низшей алкокси- или феноксигруппой; Rj - метильная группа; RJ - гидроксильная группа R4 - низший алкинил, RJ - водород или 0 -метильная
группаJ
X - кето- или гидроксиимино- , группа J
А В - двойная связь или эпокси- группа между углеродами 9 и 10,
обладающих ценными фармакологическими свойствами.
Цель изобретения - получение новых производных стероидов, обладающих преимуществами в, фармакологическом отношении перед известными стероидами -ц подобного действия.
Пример 1. 3,3-Этилен бис(ок- си) 17(-(проп-1-инил) (2 -тиенил) эстр 9-ен Зо, 17/ 1-диол.
g
30
При -25 Сив атмосфере азота вво- дят 0,82 г хлористой меди в 162 см бромистого тиенил магния в тетрагид- рофуране (1,05 М/1), Перемешивают в течение 15 мин и капля по капле вводят так, чтобы температура не поднималась выше , раствор 15 г 3,3- -этилен бис(окси)5о/, 10о -эпокси Мd- -(проп-1-инил)эстр 9(11)-ен 17/5-ола в 80 см тетрагидрофурана. Оставляют в атмосфере азота, перемешив ают в течение 1 ч при -25 С, а затем 2 ч при , Затем выливают в ледяной водный раствор хлористого аммония. Перемешивают, экстрагируют эфиром, промывают водой органический слой, сушат ико нцентрируют под уменьшенным давлением, получают 18,8 г сырого продукта. Очищают, хроматографируя на двуокиси кремния (элюант: хлоро
0
5
5
ц
форм - этиловый эфир уксусной кислоты 9-1), и выделяют 9,85 г продукта, т.пл. 250 С.
Приготовление исходного продукта 3,3-этилен бис(окси) Зс/, 10о(-эпокси 17о( -(проп-1-инил)эстр 9(11)-ен 17/3- -ола получают следующим способом.
а) 3,3-бис-Метокси 17 о/-(проп-1- -инил)эстр 5(10) 9( 11)диен-17/з-ол. в/) Пропинмагнийбромид: В атмосфере азота вводят 350 см раствора этилмагнийбромида в тетра- гидрофуране (1,1 М/1). Охлаждают до и пропускают пропин в течение 2 ч, выдерживая температуру при 10°С на ледяной бане. Дают температуре подняться до 20 С, продолжая пропускание пропина. ) Конденсация:
В предыдущий раствор вводят при г20 С в течение 50 мин раствор 50 г 3,3-бис-метоксизстра 5 (10) 9 (11)- -диен 17-она в 240 см тетрагидрофурана и 2 капли триэтиламина, перемешивают 75 мин, а затем выливают в ледяной водный раствор хлористого аммония .
Перемешивают 15 мин, а затем экстрагируют эфиром и промывают насьш1;ен- ным раствором б1жарбоната натрия в воде, содержащей 2 капли пиридина. Сушат, концентрируют под уменьшенным давлением и полз/ чают 62,4 г сырого продукта, 974 мг этого продукта хрома- тографируют на двуокиси кремния элюант: этиловый эфир - петролейный эфир (т.кип. 60-80°С) 3-1, получают 744мг очищенного продукта, который пере- кристаллизовьюают в горячем виде в смеси, содержащей 5,5 см изопропило- -вого эфира, 0,4 см хлористого метилена и следы пиридина. Отфильтровывают , концентрируют,,затравляют крис- g таллизацию, отсасывают, промывают
изопропиловым эфиром, сушат и получа- : ют 444 мг продукта (чистого), т.пл. 138 С.
б) 3,3-Этилеи -бис(окси) 17с5(-(проп- -1-инил)эстр 5 (10) 9 (11)-диен 17/j- -ол.
В атмосфере азота вводят 88,5 г полученного продукта fe пункте а в 442,5 см гликоля. При перемешивании и в атмосфере азота нагревают при 60 С
0
0
0
iS
и вводят 4,425 г хлоргидрата пиридина. Перемешивают еще 15 мин при , а затем охлаждают до 20°С, при охлаждении (при 40°С) прибавляют 17,7 см
триэтиламина. При суспензию выливают в 3 л ледяной воды. Оставляют 1 ч при О с, а затем отсасывают, промывают водой, сушат и получают 75,4 г продукта, т.пл. ISS-lAO C.
в) 3,3-Этилен бис(окси)5о(, Юс/-эпокси 17о(-(проп-1-инил)эстр 9 (11)- -ен 17э-ол:
30 г полученного в пункте 6 продукта охлаждают до в 150 см хлористого метилена, содержащего 2 капли пиридина, прибавляют 1,8 см полутор3 ,3-бис-Метокси 5 с, 10о(-эпокси
ной гидроокиси гексафторацетона, капля по капле прибавляют 4,35 CM IS17о(-(проп-1-инил)эстр 9 (11)-ен Mjb
85%-ной перекиси водорода, перемеши--ол получают следующим способом, вают при 0°С в течение 72 ч, затем 62,4 г полученного в примере 1
выливают в смесь 250 г льда в 500 ,3-бис-меток и (проп-1-инил)
0,2 н. тиосульфоната натрия. Переме-эстр 5 (10) 9 (11)--диен 17/з-ола вво20
шивают и экстрагируют хлористым метиленом . Промывают органический слой, сушат его, концентрируют под уменьшенным давлением и получают 31,6 г целевого продукта.
дят в атмосфере азота в 280 см хлористого метилена. Охлаждают до О С при перемешивании и прибавляют за один раз 8,5 см полуторной гидроокиси гексафторацетона, а затем капля
Пример 2. 3,3-Этилен бис(ок- 25 по капле 10,1 см 85%-ной перекиси
.си) 1 1 р-(п-фторфенил) (проп-1- -инил)эстр 9-ен 5с , 17/3-диол:
Действуют в условиях примера 1 п-фторфенилмагнийбромидом на 3,3- -этилен бис(окси)5о, 10 -эпоксй Md- -(проп-1-инил)эстр 9 (11)-ен 1 7/3-ол в присутствии хлористой меди в тетра гидрофуране.
После хроматографии получают це - левой продукт o Jjj -57,5 ± 1,5°
(С 1% CHClg).
Пример 3. 3,3-Этилен бис(ок си) 11/ь-(п-трифторметилфенил) -(проп-1-инил)эстр 9-ен 5с/, 17/з-ДИол
Действуют как в примерах 1 и 2, употребляя п-трифторметилфенилмагний бромид на том же продукте,
Получают целевой продукт a Jp -56t2,5° (С 0,4%, CHClj),
Пример 4. 3,3-бис-Метокси 11р -метил 1 (проп-1-инил)эстр 9-ен 5 о , 17/Ь-диол.
В атмосфере азота охлаждают до смесь 11,4 г йодистой меди в 120 см эфира и в течение 30 мин прибавляют 69 см метил лития 1,74 М в эфире. Перемешивают еще 10 мин при 0°С, а затем капля по капле в течение 30 мин вводят 5,5 г 3,3-бис-мет- окси 5of, 10о( -эпокси 17о(-(проп-1-инил эстр 9 (11)-ен 17|й-ол в 50 см тетра гидрофурана. Оставляют 2 ч при пере- .мешивании и при 0°С, а затем выливают в водный ледяной раствоц аммония.
0593
Перемешивают один час при комнатной температуре. Экстрагируют эфиром, промывают, сушат, концентрируют досуха под уменьшенным давлением и получают 5,7 г сырого продукта.
Хроматографируют 6,8 г полученного продукта на двуокиси кремния (элю- ант:хлористый метилен - ацетон 9-1 10 при 1% трихлорэтиламина). Получают 4,05 г целевого продукта,-т.пл. I55 c,oi 80 ± 2МС 1%, CHClj).
Приготовление исходного продукта.
3,3-бис-Метокси 5 с, 10о(-эпокси
дят в атмосфере азота в 280 см хлористого метилена. Охлаждают до О С при перемешивании и прибавляют за один раз 8,5 см полуторной гидроокиси гексафторацетона, а затем капля
водорода. Оставляют 41 ч при и при перемешивании выливают в смесь 1,4 см раствора 0,5 М/л бисульфита натрия, 200 г льда и 5 капель пириди- 0 на. Перемешивают 15 мин, а затем зк- страгирзтот хлористым метиленом, содержащим 2 капли пиридина. Органический слой промывают водой, содержащей следы пиридина, сушат его, концентри- g руют досуха под уменьшенным давлением и получают 63,8 г целевого про- : дукта.
Пример 5. 3,3-бис-Метокси 1 1/i-(npona-1 ,2-диенил) 17of-(npon-1- 0 -инил)эстр 9-ен 5 о/, 17/5-диол.
с() Алленил лития () : Охлаждают до 0°С 300 см сухого тетрагидрофурана и пропускают газ ал- лен до растворения. около 18-20 г. Затем охлаждают до -70°С и прибавляют капля по капле в 30 мин 180 см н-бутил лития в н-гексане 1,35 г. Перемешивают 1 ч при -70°С.
/з) Меднолитийдиалленнл (СН С CH)j CuLiJ :
К предьщущей суспензии прибавляют маленькими фракциями около 15 мин 24,66 г комплекса диметилсульфидбро- мида меди. Перемешивают еще 1 ч 30 мин при -70°С.
у) Конденсация на эпоксидё: При -70°С и в течение 10 мин вводят капля по капле раствор 11 г 3,3- -бис-метокси 5oi, 10о(-эпокси 17о/-(проп5
0
5
513405936
-1-инил)эстр 9 (11)-ен в под уменьшенным давлением. Получают 60 см сухого тетрагидрофурана и дают 5,45 г сырого продукта, отбирают медленно дойти до -2G°C (около t5 С), 370 мг, которые очищают хроматографи- . Перемешивают при этой температуре и чески на двуокиси кремния (элюант: в атмосфере азота 18 ч. Затем вылива :бензол - этиловый эфир уксусной кис- ют при перемешивании в ледяной вод- лоты 8-2) и выделяют 450 мг чистого ный раствор хлористого аммония. По продукта, т.пл. . истечении 1 ч перемешивания при ком- Вычислено, %: С 69,38-, Н 8,73j ватной температур® экстрагируют эфи- ig N 2,89,
Найдено, %: С 69,4; Н 9,0-,N 2,9. Пример 29а. 3,3-Этилен бис(окси) 17о -этинил 11/г-2 -метилром , промывают, сушат и концентрируют досуха под уменьшенным давлением.
Получают 11,2 г сырого целевого продукта.
Хроматографируют на двуокиси крем- 15 -(проп-1-енш1)эстр 9-ен 5о/, 17/з-диол. ния (элюант:хлористый метилен - аце- -5,45 г полученного в примере 29
тон 9-1 с 1% триэтиламина). Получают 6,6 г целевого продукта. «1 -25 + t 1 ° (С 1%, СНС1з).
Пример 6. 3,3-бис-Метокси 1 (проп-1-инил) 11 -третбутилэстр 9-ен 5, 17/з-диол.
Действуют как это указано в примесырого продукта растворяют в 50 см этилендиамина. Перемешивают в атмосфера азота при 50°С и прибавляют ма- 2Q ленькими фракциями 6 г комплекса аце,- тиленид лития этилендиамина. После 3ч при той же температуре выливают реакционную смесь в смесь вода - лед и
ре 1, но исходя из 13,8 см третбу- эстрагируют эфиром, а затем хлорофор- тилмагнийхлорида в 0,65 М тетрагидро- 25 мом. Органические слои сушатся, а
30
фуране и 1,1 г 3,3-бис-метокси 5о(, 10о -эпокси (проп-1-инш1) эстр 8 (11)-ен П/з-ола. После перемешивания при -20°С в течение 3 ч получают целевой продукт, т.пл. 148-150°С.
Пример 7. 3,3-бис-Метокси 11/г-(2-фурил) 1 7с/-(проп-1-инил)эстр 9-ен 5а , 17/9-диол.
Действуют как в примере 5, медно- литийдифурил конденсируют на 3,3-бис- -метокси 5о/, 10(У-эпокси 17о(-(проп-1- -инил)эстр 9 (11)-ен 17/4-ол.
Получают целевой продукт d j -62 t ,.5° (С 1%, СНС1з).
Примеры 8-28. Действуя как в примере 1, получают продукты 8-28, которые показаны в табл. 1. . Пример 29. 3,3-Этилен бис (окси) 17с/-триметил силилокси 11/э40
затем растворитель вьшаривается под уменьшенным давлением. Сырой продукт Хроматографируют на двуокиси кремния (элюант:бензол - этиловый эфир уксусной кислоты 7-3 с 0,1% триэтиламина) и получают 2,763 г целевого продукта, RP 0,3, который перекристаллизовы- вают из изопропилового эфира, т.пл. 208°С (в качестве побочного продукта получают 0,26 г продукта 17-кето)-. Вычислено, %: С 75,69; Н 8,80;
4 Найдено, %: С 75,9, Н 8,8.
Пример 30. 3,3-Этилен бис (окси) 17о -трйметилсилокси 11/J-(3- -метоксифенил) 5 з -гидрокси эстр 9-ен 17 -карбонитрил,
Действуют так же, как-в примере 1, исходя из продукту примера 29 иЗ-меток- (2 -метил проп-1 -енил) 5о -гидрокси 45сифенилмагнийбромида. Таким образом,
эстр 9-ен 17 -карбонитрил.получают 9,406 г целевого продукта.
Капля к капле прибавляют при -40°Ст.пл. 166°С. 32 см 0,95 М раствора 2-метил проп-1-Вычислено, %: С 69,23; Н 8,06;
-енил лития в эфире, содержащем 3,1 г комплекса диметилсульфидбромида ме- gQ ди в суспензии к 30 см - тетрагидрофурана . Прибавляют 4,16 г 3-(1,2-этан- диил) ацеталь 5 о/, 10о(-эпокси 17с|(-три- метилсилйл окси 17/5-цианоэстр 9 (11)- -ен 3-она.55
По истечении 30 мин при выливают в раствор хлористого аммония и экстрагируют эфиром. Сушат органи- ,ческий слой и отгоняют растворитель
N 2,60.
C.
Найдено, %: С 69,4; Н 8,1-, N 2,6.
Пример ЗОа. 3,3-Этилен бис (окси) 5о, 17 /-дигидр6кси 11|в-(3-ме- токсифенил) 19-нор прегн 9-ен 20-он.
Концентрируют 20 см 1,3 М раствора метилмагнийбромида в тетрагидро- фуране, чтобы получить раствор 7 см 2 М тетрагидрофурана. Прибавляют 2,79 г продукта по примеру 30 и насырого продукта растворяют в 50 см этилендиамина. Перемешивают в атмосфера азота при 50°С и прибавляют ма- ленькими фракциями 6 г комплекса аце,- тиленид лития этилендиамина. После 3ч при той же температуре выливают реакционную смесь в смесь вода - лед и
0
0
затем растворитель вьшаривается под уменьшенным давлением. Сырой продукт Хроматографируют на двуокиси кремния (элюант:бензол - этиловый эфир уксусной кислоты 7-3 с 0,1% триэтиламина) и получают 2,763 г целевого продукта, RP 0,3, который перекристаллизовы- вают из изопропилового эфира, т.пл. 208°С (в качестве побочного продукта получают 0,26 г продукта 17-кето)-. Вычислено, %: С 75,69; Н 8,80;
4 Найдено, %: С 75,9, Н 8,8.
Пример 30. 3,3-Этилен бис (окси) 17о -трйметилсилокси 11/J-(3- -метоксифенил) 5 з -гидрокси эстр 9-ен 17 -карбонитрил,
Действуют так же, как-в примере 1, исходя из продукту примера 29 иЗ-меток5сифенилмагнийбромида . Таким образом,
N 2,60.
C.
Найдено, %: С 69,4; Н 8,1-, N 2,6.
Пример ЗОа. 3,3-Этилен бис (окси) 5о, 17 /-дигидр6кси 11|в-(3-ме- токсифенил) 19-нор прегн 9-ен 20-он.
Концентрируют 20 см 1,3 М раствора метилмагнийбромида в тетрагидро- фуране, чтобы получить раствор 7 см 2 М тетрагидрофурана. Прибавляют 2,79 г продукта по примеру 30 и нагревают с рефлюксом в течение одной ночи. Прибавляют 10 см 1,3 М раствора магнийорганического соединения и перегоняют 5 см тетрагидрофурана
100 мг полученного в пункте а продукта растворяют в 2 см хлористого метилена. Прибавляют А50 мг бикарбоната натрия и перемешивают при . Прибавляют 0,1 см хлораля, а затем
и нагревают при 100 С в течение 7 ч, Гидролизуют при помощи ледяного водного раствора хлористого аммония, эЬстрагируют эфиром и сушат и отгоняют растворитель под уменьшенным давле- д 0,1 см перекиси водорода (110 объе- нием.мов). Реакция оканчивается по истеХроматографируют на двуокиси крем- чении 4 ч. Реакционную смесь выли- ния (элюант бенз ол - этиловый эфир вают в раствор тиосульфата натрия, уксусной кислоты 6-4 с 0,1% триэтил- экстрагируют хлористым метиленом и амина) и получают 1,722 г чистого це- выпаривают растворитель под уменьшен- левого продукта, который перекристал- ным давлением, лизовывают в смеси изопропиловый
Вьщеляют 98 мг целевого эпоксида.
эфир - хлористый метилен, т.пл. 190°С Вычислено, %: С 72,17 Н 7,94;
q,s
,0.
Найдено, %: С 72,5, Н 8,0.
Пример 31. 3,20-бис-Этилен кеталь (-метил ll/S-пропил 5о{-гидро кси 19-нор прегн 9-ен 3,20-диона. I Исходя из 3,20-бис-этилен кеталь .17с/-метил 5о1, 10с/-эпокси 19-нор прег 9 (11)-ен 3,20-диона и пропилмагний- бромида, действуют так же, как и в примере 1 (2 ч при -30°С).
Приготовление исходного продукта.
3,20-бис-Этиленкеталь 17о(-метил 5, 10о -эпокси 19-нор прегн 9(11)-ен 3,20-диона получают следующим образом
а) 3,20-бис-Этиленкеталь 17с -метил 19-нор прегн 5(10) 9(11)-ен 3,20-диона .
Прибавляют 1,5 г моногидрата пара- толуолсульфокислоты к раствору 21 г ;17в -метш1 19-нор прегн 4,9-диен 3,20- диона в смеси 200 см хлористого метилена , 200 см этиленгликоля и 100 см ЭТШ1ОВОГО эфира ортомуравьиной кислоты . Реакционную смесь нагревают с обратным холодильником в течение 7 ч и прибавляют 2 см триэтиламина. Част растворителя удаляют перегонкой,прибавляют воду и собирают осадок фильтрованием , затем промывают его водой, растворяют его в хлористом метилене и сушат. После прибавки изопропилово- го эфира и концентрации целевой продукт кристаллизуют (22,65 г). Аналитическую пробу получают хроматогра- фически, а затем перекристаллизовыва- ют в изопропиловом эфире, т.п. 175 С.
Вычислено, %: С 74,96i Н 9,06.
ЯЛ«.4 Найдено, %: C75,0;H9;i.
б) 3,20-бис-Этилен кеталь 17« -метил 5о, 10о(-эпокси 19-нор прегн 9(11)- -ен 3,20-диона.
100 мг полученного в пункте а продукта растворяют в 2 см хлористого метилена. Прибавляют А50 мг бикарбоната натрия и перемешивают при . Прибавляют 0,1 см хлораля, а затем
0,1 см перекиси водорода (110 объе- мов). Реакция оканчивается по истечении 4 ч. Реакционную смесь выли- вают в раствор тиосульфата натрия, экстрагируют хлористым метиленом и выпаривают растворитель под уменьшен- ным давлением,
0
5
0
5
Вьщеляют 98 мг целевого эпоксида.
Пример 31а. 3,20-бис-Этш1ен кеталь 17о -метил 11 9-винил 19-нор прегн 9-ен 5в;-ола.
Исходя из исходного продукта примера 31 и винилмагнийбромида, действуют так же, как и в примере 1 (2ч при -30°С).
Получают целевой продукт, т.пл. 192°С.
Вычислено, %: С 72,94 Н 9,07.
Найдено, %: С 72,7, Н 9,2. Приготовление исходного продукта.
а)Охлаждают до -50 С смесь 120см тетрагидрофурана и 6,6 см N-цикло- гексил изопр опиламина и прибавляют
в течение 12 мин 19,6 см н-бутилли- тия в гексане. Перемешивают, затем прибавляют 8,9 г 3,3-этилен бис(ок- си) 17о( -метил 19-нор прегн 5(10) 9(11)-диен 20-она.
Перемешивают 1 ч при (-35) (-40) С, а затем прибавляют 17,4 г окислителя (оксодипероксо пиридино гексаметилфосфорамидо) молибден VI и перемешивают при (-30) - (-35)°С в течение 1 ч 30 мин. Тогда выливают (- в ледяную воду, экстрагируют этиловым эфиром уксусной кислоты, промывают, затем сушат и концентрируют досуха.
Остаток хроматографируют на двуокиси кремния (элюент:бензол) и получают 4,03 г продукта, который употребляют в данном виде в следующей стадии.
б)Охлаждают до (0-5) С раствор 1,826 г полученного 3,3-этилендиокси
е 17 -метил 21-гидрокси 19-нор прегн 5(10) 9(.11)-Диен 20-она в 18,3 см хлористого метилена и прибавляют 7,8 см молярного раствора гидроперекиси гексафторацетона в хлористом ме0
10
1340593 О
тилене. Оставляют 75 мин при (01 5)°С, сифенил-магнийбромида (0,9 М) в тет- а затем выливают в 0,5 М раствор тио- рагидроЛуране и 7,5 г 20К-ацетокси сульфата натрия. Экстрагируют хлороформом , промывают, сушат и получают 2,02 г продукта.
Полученные проду :ть: 32-38 приведены в табл. 1.
Пример 39. трет-Бутиловый эфир (3,3-этилен бис(окси) 1 1 /3-(3- -метоксифенил) 17о -(проп-1-инил) 17,i- -эстр 9-ен 5с/-гидрокси 17-ил уксусной кислоты.
Раствор 960 мг 3,3-этипен 6ис(ок- . си) 1 (3-метоксифенил) 17(У-(проп-1- 15 лоту, а затем 40 см хлористого ме- -инил)эстр 9-ен 5о/, 17/3-диола, полу- тилена к суспензии 45 г 20К-ацетокси
17о/-метил прегн 4,9-диен 3-она в 180 см- гликоля и 180 см- этилового эфира ортомуравьиной кислоты.
Перемешивают 45 мин при комнатной температуре в атмосфере азота, а затем прибавляют 10 см триэтиламина.
Отгоняют растворитель под уменьшенным давлением, В течение 1 ч прибав- СпуСтя 1 ч 30 мин выливают в вод- 25 ляют 500 см ледяной воды, выливают ный раствор хлористого аммония, экст- при перемешивании в 2 л ледяной воды, рагируют эфиром, промывают, сушат, содержащей пиридин, упаривают досуха, и получают целевой После перемешивания при 0°С отса5 / , 10с/ эпокси 3,3-этилен бис(окси) 17/J-метил 19-нор прегн 9(11)-ена. По истечении 18 ч перемешивают при -20 С, после хроматографии под давлением получают 5,4 г целевого продукта, который можно кристаллизовать в эфире , т.пл. 160 С,о(п +19,5 t 1 (С 1%, CHClj).
Приготовление исходного продукта.
а) При перемешивании и при 25 С прибавляют 2,7 г паратолуолсульфокисченный в примере 13, в 30 см- тетра- гидрофурана охлаждают до -40°С, и прибавляют капля по капле 3,2 см бу- тиллития в н-гексане (1,25 М/л). Дают 20 температуре подняться до комнатной, а затем прибавляют капля по капле 1,3 см трет-бутилового эфира бром- уксусной кислоты.
продукт,
Пример 40. 3,3-Этилен бис(ок-зо 50,5 г продукта, который перекристалси ) 11 в-тиен-2-ил 17о( -метил 5о, 21-ди-лизовывают растворением с рефлюксом
гидрокси 19-нор прегн 9-ен 20-он.в 10 см изопропилового эфира, содер300 мг хлористой меди прибавляютжащего 1% триэтиламина и перекристалк 40 см 0,5 М хиенилмагнийбромида влизовЫвают в холодном виде. Получают
тетрагидрофуране. Охлаждают до (-20)- 450 мг целевого продукта, т.пл. 148°С.
+121 t 2,5° (С 0,5%, CHClj).
(-25)С и оставляют в контакте 30 мин Затем прибавляют капля по капле 2,02 г 3-этилен бис(окси) 17с -метил 5с, 10о(- -эпокси 21--гидрокси 19-нор прегн-9 (11)-ен 20-она в растворе в 20 см сухого тетрагидрофурана.
Оставляют в контакте два часа при (-20) - (-25) С, а затем гидролизуют водным раствором хлористого аммония.
б) Охлаждают до смесь 40 г полученного 20К-ацетокси 3,3-этилен бис(окси) 17о(-мегил 19-нор прегн 40 5,9-диена и 200 см хлористого метилена , содержащего 0,1 см пиридина, и прибавляют 2,5 см полуторного гидрата гексафторацетона и 1 см 85%-ной перекиси водорода,,а затем 0,1 см
Экстрагируют этиловым эфиром и полу- 45 пиридина. Перемешивают в течение 6 - чают 2,218 г смолы, которую хромато- 7 ч при 0°С, выливают смесь в 1,5 л
раствора 0,2 М тиосульфата натрия, 500 г льда и 1 см пиридина.
Перемешивают 10 мин при комнатной вого продукта, Rj 0,29, т.пл. 240 С. 50 температуре, а затем декантируют,
экстрагируют хлористым метиленом, про- мьюают 0,2 М раствором тиосульфата натрия, сушат, концентрируют досуха под уменьшенным давлением и получают
графируют на двуокиси кремния (элю- ент:бензол - этиловый эфир уксусной кислоты 1-1) и получают 701 мг целеПолученные продукты 41 и 42 при- . ведены в табл. 1.
Пример 43. 20К-Ацетокси 3,3-этилен бис(окси) (3-метилоксифе- gg 44 г сырого продукта. Забирают при
нил) 17о1-метил 19-нор прегн 9-ен 5 о1-ол.
Действуют как это указано в примере 40, но исходя из 80 см 3-метилок60 С Б 40 см изопропилового эфира, содержащего 1% пиридина, а затем дают дойти до комнатной температуры. Получают 27,6 г целевого продукта,т.пл.
0
сифенил-магнийбромида (0,9 М) в тет- рагидроЛуране и 7,5 г 20К-ацетокси
15 лоту, а затем 40 см хлористого ме- тилена к суспензии 45 г 20К-ацетокси
5/, 10с/ эпокси 3,3-этилен бис(окси) 17/J-метил 19-нор прегн 9(11)-ена. По истечении 18 ч перемешивают при -20 С, после хроматографии под давлением получают 5,4 г целевого продукта, который можно кристаллизовать в эфире , т.пл. 160 С,о(п +19,5 t 1 (С 1%, CHClj).
Приготовление исходного продукта.
а) При перемешивании и при 25 С прибавляют 2,7 г паратолуолсульфокиссывают , промывают, сушат и получают
+121 t 2,5° (С 0,5%, CHClj).
б) Охлаждают до смесь 40 г полученного 20К-ацетокси 3,3-этилен бис(окси) 17о(-мегил 19-нор прегн 5,9-диена и 200 см хлористого метилена , содержащего 0,1 см пиридина, и прибавляют 2,5 см полуторного гидрата гексафторацетона и 1 см 85%-ной перекиси водорода,,а затем 0,1 см
44 г сырого продукта. Забирают при
60 С Б 40 см изопропилового эфира, содержащего 1% пиридина, а затем дают дойти до комнатной температуры. Получают 27,6 г целевого продукта,т.пл.
20
25
l60t C,(j,-4,5f 1 (С 1%, СНС1з).
Пример 44,Циклический 1,2- -этандиил ацеталь 1 (димeтилaми- нo)-пpoп-1-инил 5с/, 1 7/J-дигидрокси 1 1 1-(3-метоксифенил)эстр 9-ен 3-она.
а)3,3-Этилен бис (окси) 1 1/ь-(3-ме- токси)фенил 5о/-гидроксиэстр 9-ен
17-он.
При комнатной температуре перемешивают до растворения смесь 5 г 3,3- -этилен бис(окси)5о/, 10о( -эпокси эстр 9(11)-ен 17-она в 50 см тетрагидро - фурана, содержащего 310 мг хлористой меди и 195 мг хлорида лития. Охлаждают до -20°С и прибавляют капля по капле 31 см 0,75 М раствора 3-меток- сифенилмагнийбромида в тетрагидрофу- ране.
Оставляют 1 ч при -20°С, нагревают до -15 С, а затем прибавляют то же количество магнийорганического соединения .
Выливают в ледяной водный раствор хлористого аммония, перемешивают, экстрагируют эфиром, а затем хлористым метиленом, промывают органический слой насыщенным водным раствором хлористого натрия, сушат и выпаривают растворитель.
После хроматографии получают целевой продукт.
б) Циклический 1,2-этандиш1 аце- таль 1 (диметиламино)-проп-1- -инил 5о, 17/5-дигидрокси 11/з-(3-ме- токсифенил)эстр 9-ен З-она.
Доводят до 30 мл диизопро- иламид лития (0,67 М/л) в эфире и едленно прибавляют 3,9 см К,М-ди- етиламинопропина. Дают температуре подняться до 0°С, а затем охлаждают о -40°С и тогда вводят капля по капе 4 г полученного 3,3-этилен ЬисСок- ,g си) 11 -(3-метокси)фенил 5о( -гидрокси стр 9-ен 17-она в растворе в 11 см етрагидрофурана.
Дают температуре подняться до 0°С течение 1 ч, выливают в 300 см на- 50 ыщенного раствора хлористого аммоig
g
30
35
40
ния, экстрагируют этиловым эфиром уксусной кислоты, промывают, насыщенным водным раствором хлористого натрия , сушат, выпаривают растворитель и получают 4,9 г целевого продукта. 600 мг этого продукта хроматографи- руют на двуокиси кремния (.элюант: хлористый метилен - метанол, 92-8),
20
25
.
, g
50
34059312
получают 200 мг чистого продукта. Лг -62 t 2,5 (С 0,3.-, СНС1з). Вычислено, %: С 73,6; Н 8,3. Найдено, %: С 73,3, Н 8,3. Пример 45.ГЗ,3-Этилеи бис
(окси) 1 1/}-(4-гидроксифенил) 17о(-(проп- -1-инил)эстр 9-ен 5 о, 17/ -диол.7.
а). Приготовление 4-триметилсилил- ig окси фенилмагнийбромида.
7,8 г растворенного в 15 см- тетрагидрофурана , п-бромфенола, а затем 5,75 см хлористого т.риметилсилила, прибавляют к 50 см 0,9 М раствора g изопропилмагнийхлорида в тетрагидро- фуранё. Выливают раствор на 1,2 г магниевых стружек. Прибавляют немного 1,2-дибромэтана, а затем 2 см гекса- метилфосфатриамида и потом нагревают 2 ч 30 мин с рефлюксом.
б) 3,3-Этилен бис(окси) 1 1/ь-(4-гид- роксифенил) 1 7о(-(проп-1-ИНШ1) экстр 9-ен 5о, 17/5-диол.
350 мг хлористой меди, а затем 1,45 г 3,3-этилен бис(окси) 5У, lOof-эпокси 17о(-(проп-1 -инил) эстр 9(11)-ен 17/}-ола, растворенного в 15 см тетрагидрофурана, прибавляют к 75 см описанного раствора магний- 30 органического соединения.
Выливают в водный раствор хлористого аммония, экстрагируют эфиром, промывают органический слой 1%-ным раствором едкого натра. Сушат, а затем отгоняют растворитель под уменьшенным давлением.
После хроматографии на двуокиси кремния (элюант:бензол - этиловый эфир уксусной кислоты 7-3), выделяют 207 мг целевого продукта.
-Вычислено, %: С 74,97, Н 7,81.
CjgHj Oj
Найдено, %: С 75,0; Н 7,9. i, -58,5 t 2,5° (С 0,5%, СНС1з) .
35
40
Пример 46. 17/3-Гидрокси 17о(-(проп-1-инил) 11/5-(2-тиенил)эстр 4,9-диен 3-он.
9,85 г полученного в примере 1 продукта вводят в 330 см этанола при 95°С. Нагревают с рефлюксом и прибавляют за один раз 9,85 г смолы Редекс CF. Оставляют с рефлюксом при перемешивании ив атмосфере азота 4 ч. Отфильтровывают , прополаскивают этанолом и концентрируют под уменьшенным давлением. Получают 9 г сырого продукта , который хроматографируют на двуокиси Кремния (элюат:хлороформ - этиловый эфир уксусной кислоты 9-1). Выделяют 6,5 г целевого продукта, который перекристаллиэуют в изопропиловом эфире. Отсасывают, прополаскивают изопропиловым эфиром, сушат и получают 5,315 г чистого-продукта, т.пл. .
Вычислено, %: С 76,5j Н 7,18; S 8,16.
U A.Oj S
7,5i
ггчв 4 Найдено, %: С 76,4; Н
S 8,0.
Га(р t83 t 2° (1%, CHCIj). Полученные продукты 47-80 приведе- ны в табл. 1.
Пример 81. трет-Бутиловый ;эфир (3-метоксифенил)3-оксо 17в(- -(проп-1-инил) 17/5 эстра-4,9-диен- 17 ил(окси) уксусной кислоты.
Забирают в 40 см метанола и 4 см 2 Н. соляной кислоты, полученный в приготовлении 36 трет-бутиловый эфир 1(3-этилен бис(окси) 11/5-(3-метокси- фенил) 17 -проп-1-инил) 17 /э эстр 9-ен 5о -гидрокси 17-ил(окси) уксусной кислоты . После одного часа перемешивания при комнатной температуре выливают в половинный водный раствор бикарбоната
натрия, перемешивают 5 мин, экстраги- зо рия. Сушат, а затем выпаривают раст- руют эфирон, промывают насьш1енным воритель. Остаток хроматографируют раствором хлористого натрия, сушат и на двуокиси кремния (элюант:хлорис- упаривают досуха под уменьшенным давлением .
тый метилен - а детон 95-5) и получают 1,075 г целевого продукта, который Остаток хроматографируют на двуоки- перекристаллизуют в смеси метаноЛа, си кремния Сэлюант:петролейный эфир изопропилового эфира, т.пл. 185 - (кип. 60-80°С) - этиловый эфир уксусной кислоты 7-3. Получают 720 мг целевого продукта.
189°С.
Пример 92. 9(з(, 10о(-ЭпЬкси 17/5-гидрокси 11/з-(4-метилсульфонил)
фенил 17о -(проп-1-инил)эстр 4-ен 3-он.
В течение 5 мин прибавляют маленькими порциями 960 мг 85%-ной метахлор- надбензойной кислоты к раствору
Пример 82. Cd 1 ;1-(3-Метокси- Q фенил)3-оксо 17о(-(проп-1-инил) 17 эстр 4,9-диен 17-ил(окси) уксусная кислота.
С рефлюксом нагревают в течение 5 ч смесь 5 г, полученного как в при- g 570 мг такого,как получен в примере 36 продукта, 500 мг паратолуол- мере 68, 11 р-(4-метилтио)фенил сульфокислоты и 100 см бензола. Полученную смолу выпаривают досуха, хроматографируют ее на двуокиси кремния
50
(элюант:хлористый метилен - метанол 92,5-7,5).
Собирают 886 мг целевого продукта. ir +50, (С 0,3%, в CHClj).
Пример 83. Соль натрия р-гидрокси 17«1-(проп-1-инил)эстр 4,9- -диен 3-она в 13 см охлажденного до хлористого метилена.
Перемешивают 1 ч 30 мин при 0°С и в атмосфере азота, а затем при перемешивании выливают в 100 см 0,5 М водного раствора тиосульфата натрия и перемешивают некоторое время при
-(З-метоксифенил)З-оксо 17о1-(проп-1- gg комнатной температуре.
-инил) эстр 4,9-диен 17-ил (ок- Экстрагируют хлористым метиленом,
си) уксусной кислоты.
Перемешивают до растворения смесь 305 мг полученной в примере 82 кислопромывают водным раствором бикарбоната натрия, сушат и концентрируют досуха .
0
g
ты и 3 см этанолового едкого натра (0,2 М/л), отфильтровывают легкое нерастворимое вещество. Упаривают досуха под уменьшенным давлением, остаток растирают в изопропиловом эфире до сгущения. Перемешивают, отсасывают и прополаскивают изопропиловым эфиром . Сушат и получают 280 мг целевого продукта, т.пл. 270°С.
Вычислено, %: Na 4,63.
Найдено, %: Na 4,45.
Полученные продукты 84-90 приведены в табл. 1.
Пример 91.- 9ci, 10й -Эпокси 17 -гидрокси 11 р-(4-метоксифенил) 17с/- -(проп-1-инил)эстр 4-ен 3-он.
При перемешивании прибавляют порциями 700 мг 85%-ной метахлорнадбен- Q войной кислоты к раствору при 1,3 г, приготовленного как в примере 59, 11 ;ь-(4-меток си) фенил. 17 з-гидрокси 17о/-(проп-1-инш1)эстр 4,9-диен-З-она в 25 см хлористого метилена.
После одного часа при дают температуре подняться до комнатной, промывают 0,5 н„ водным раствором тиосульфата натрия, а затем насьш1ен- ным водным раствором бикарбоната нат5
тый метилен - а детон 95-5) и получают 1,075 г целевого продукта, который перекристаллизуют в смеси метаноЛа, изопропилового эфира, т.пл. 185 -
189°С.
Пример 92. 9(з(, 10о(-ЭпЬкси 17/5-гидрокси 11/з-(4-метилсульфонил)
фенил 17о -(проп-1-инил)эстр 4-ен 3-он.
В течение 5 мин прибавляют маленькими порциями 960 мг 85%-ной метахлор- надбензойной кислоты к раствору
570 мг такого,как получен в примере 68, 11 р-(4-метилтио)фенил
570 мг такого,как получен в примере 68, 11 р-(4-метилтио)фенил
-гидрокси 17«1-(проп-1-инил)эстр 4,9- -диен 3-она в 13 см охлажденного до хлористого метилена.
Перемешивают 1 ч 30 мин при 0°С и в атмосфере азота, а затем при перемешивании выливают в 100 см 0,5 М водного раствора тиосульфата натрия и перемешивают некоторое время при
промывают водным раствором бикарбоната натрия, сушат и концентрируют досуха .
15
Полученный продукт хроматографи- руют на двуокиси кремния (элюант:безол - этиловый эфир уксусной кислот 1-1). Получают 750 мг целевого продукта , который перекристаллизуют в смеси изопропиловый эфир и хлористы метилен.
(, CHCl),
93. 3-Метоксиимино
т.пл. 205-208 С. +67,5 t 1,5°
П РИМ е р
- 1 1/5-(4-бромфенил) 17о(-(проп-1-инш1) эстр 4,9-диен 17л-ол изомеры син (Z) и анти (Е) ;
Прибавляют 170 мг хлоргидрата ме тилгидроксиламина к раствору около 700 мг продукта, полученного как в примере 67, 11/ь- Г(4-бромо)фенил 1 -гидрокси (проп-1-инил)эстр 4,9- -диен 3-она в 10 см этанола и перемшивают 2 ч при комнатной температуре Выливают в воду, экстрагируют эфиром а затем хлористым метиленом. Сушат органический слой, отгоняют раство- .ритель и хроматографируют остаток на двуокиси кремния (элюант:бензол - этиловый эфир уксусной кислоты 9-1)
Таким образом, получают 408 мг продукта изомера анти (Е), т.пл, 185 С, а затем 200 мг продукта изомера син (Z) , т,пл, 217 С,
Анализ продукта анти:
Вычислено, %: С 68,1; Н 6,52; 2,83i Вг 16,16.
Найдено, %: С 68,3; Н 6,6; 2,9; Вг 16,0.
Пример 94, 11/а-(3-Фторфенил 3-гидроксиимино (проп-1-инил) эстр 4,9-диен 17/5-ол изомеры син (Z и анти (Е).
За один раз прибавляют 1,27 г Хлоргидрата гидроксиламина к раствору 3,7 г такого, как получен в примере 71, 11/5- (3-Фтор)фенил -гидрокси 17о(-(проп-1-инил)эстр 4,9- -диен 3-она, в 44,4 см абсолютного этанола и 7,6 см пиридина.
Нагревают 1 ч с рефлюксом, охлаждают до О С, а затем выливают при перемешивании в 450 см смеси вода - лед. Экстрагируют хлористым метиленом , промывают водой органический слой, сушат его, затем концентрируют под уменьшенным давлением.
N
N
Сырой продукт хроматографируют под давлением (элюант:циклогексан - этиловый эфир уксусной кислоты 7-3), Получают 2,7 г анти изомера (е) и 857 мг син изомера (Z).
0
5
0
5
0
16
Продукт антиперекристаллизуется в смеси 20 .см изопропилового эфира и 10 см хлористого метилена. Получают 2,145 г чистого продукта, т.пл. . +35 2,5 (,5%., CHClj).
%: С 77,3, Н 7,21;
0
5
Вычислено, N 3,34.
Найдено, %: С 77,3; Н 7,5, N 3,3. Пример 95. 1 1;5-трет-Бутил 9о/, 10о -эпокси 17р-гидроокси 17с/- (проп-1-инил)эстр 4-ён 3-он.
Действуя как в примере 91, но исходя из 2,11 г такого как полученного в примере 51, 1 1 9-трет-бутш1 гидроокси 17(/-(проп-1-инил)эстр 4,9- -диен 3-она и 2,92 г метахлорнадбен- зойной кислоты, после хроматографии получают 0,55 г целевого продукта, т.пл. 186-187 С.
Вычислено, %: С 78,49; Н 8,96, Найдено, %: С 78,4; Н 9,0. d +38 ± 1 (С 1%, СНС1з).
Пример 96, 11/3-Пиклопентил 9of, 10о/-эпокси 17/5-гидрокси 170/- -(проп-1-инил)эстр 4-ен 3-он,
Действуют как в примере 91, но исходя из 1,5 г такого как, полученного в примере 48, 11 -циклопентил 17/5- -гидрокси 17о. -(проп-1-инил)эстр 4,9- -диен 3-она и 0,8 г мета хлорнадбен- зойной кислоты. После хроматографии получают 0,7 г целевого продукта, т.пл. .
Вычислено, %: С 79,15; Н 8,68. Найдено, %: С 79,6; Н 8,7. c/Jj +6,5 1 1 ° (, CHClj). Пример 97. 1 1/3-(3-Meтoкcифe- нил) 9(3/, 10о/-эпокси 17;в-гидрокси -(проп-1-инил)зстр 4-ен 3-он,
Действуют как в примере 91, но исходя из 1,05 г продукта такого как в
45 примере 58, 11/}-(3-метоксифенип) 17/}- -гидрокси 17о/-(проп-1-инил)эстр 4,9- -диен 3-она и 0,608 г метахлорнадбен- зойной кислоты. После хроматографии получают 0,65 г целевого продукта,
50 иЗв +43 t 2,5 (,6%, СНС1з).
Пример 98. 11/}-Фенил 9(з/, 10|)/-эпокси 17 -гидрокси 17о(-(проп-1- -инил)эстр 4-ен 3-он.
Действуют как в примере 91, но
55 исходя из 1,15 г такого продукта, как полученного в примере 65, 11/3-фенил 17 -гидрокси 17о;-(проп-1-инил)эстр 4,9-диен 3-она и 0,608 г метахлорнад- бензойной кислоты.
17
После хроматографии получают О, 85 г кристаллов, т.пл. ISG-ISy C.
Вычислено, %: С 80,56; Н 7,51.
Найдено, %:С80,6;Н7,3.
+47,5 ± 1,5 (, CHClj).
Пример 99. 11/з- 4(3-Метил) бутил сульфонил фенил 9о1, 10(/-эпокси 17/3 -гидрокси 17о/- (проп-1 -инил) э стр 4-ен 3-он.о
Действуют как л примере 92, но исходя из 1 1/)-Г4-(3-метил)бутилтио фенил 17/3-гидрокси 1 7с/-(проп-1- -инил)эстр 4,9-диен 3-она, такого,как
30
35
ОН получен в примере 92. Получают де- g в пример 45) в 2 см метанола и 0,3см левой продукт, т.пл. .
+62 t 2,5 (,6%, СНС1з).
Пример 100. 23-К,К-Диметил- амино 1 7/э-гидрокси 11р-(3-метоксифе- нил) 19-21,24-тринор Md-шопа 4,8-ди-2о ен-20-ин 3-он,
Перемешивают один час при комнатной температуре 4,3 г продукта, полученный ,как в примере 100 циклический этандиилацеталь (диметиламино 25
1-ПрОПИНИл) 5с/, 1 7;9-ДИГИДрОКСИ 1 1;9 (-З-метоксифенил)эстр 9-ен 3-она в 100 см метанола и 3 см 2 н. соляной кислоты.
Выливают в смесь 300 см этилового эфира уксусной кислоты и 200 см водного раствора (0,25 М) бикарбоната натрия. Декантируют, заново экстрагируют этиловым эфиром уксусной кислоты , соединяют органические слои. Промывают насыщенным водным раствором хлористого натрия, сушат, выпаривают растворитель, и хроматографиру- ют остаток на двуокиси кремнияГэлю- ант : (хлористый метилен - метанол 95-5) (ацетон - этиловый эфир уксусной кислоты 3-1 )J . Выделяют 1,7 г целевого продукта, употребляемого в данном виде в следующей стадии, d +40 i 1° (С 1%, CHClj).
Пример 101. Хлоргидрат 23- -N,N-димeтилaминo 17 -гидрокси 11р-(3- -метоксифенил) 19,21,24-тринор-1 70/- -ола-4,9-диен 20-ин 3-она.
1,5 г полученного в примере 100 продукта растворяют в 50 см эфира, перемешивают 10 мин при комнатной температуре и удаляют легкое нерастворимое вещество. Затем капля по капле вводят 16,5 см эфирного раствора насыщенной хлористоводородной кислоты. Суспензию перемешивают 10 мин, потом отсасывают, прополаскивают эфиром и получают 1,4 г целевого продукта.
40
45
50
55
2 н. соляной кислоты. Выливают в ледяной раствор бикарбоната натрия, экстрагируют эфиром, а затем хлористым метиленом.
Промывают органический слой насыщенным водным раствором хлористого натрия, сушат, концентрируют досуха под уменьшенным давлением и хромато- графируют остаток на двуокиси кремния (элюант:хлористый метилен - ацетон 92,5-7,5). Получают 71 мг целевого продукта, o/Jp +67° (С 0,25%, CHCl,).
Пример 103. 1 1/з-(3-Гидрокси- фенил) 1 7/Ь-гидрокси 1 7aif-( проп-1-инил) эстра 4,8-диен-он.
Стадия А. 3,3-Этилен диокси 1 - 3-(2-тетрагидропиранилокси)фенил (проп-1-инил)эстр 9-ен 5.о/, 17/3- -диол.
а). Приготовление магнийорганичес- кого соединения.
В атмосфере азота мешают 20,6 г тетрагидропиранилового эфира мета- бромфенола и 160 см тетрагидрофура- на. Выливают 10 см раствора на 2,2 г стружек магния, а затем после начала реакции медленно выливают остаток раствора выдерживая температуру при 52± 2°С. Затем нагревают с рефлюксом в течение 30 мин и охлаждают до 20°С.
б). Прибавление магнийорганического соединения.
В инертном газе растворяют 5,55 г 3,3-этилен диокси 5с/, 10о/-эпокси -(проп-1-инил)эстр 9(11)-ен 17/5-ола в 55 см тетрагидрофурана и прибавляют 0,36 г безводной хлористой меди и 0,18 г хлористого лития. В течение 30 мин при , к раствору прибавляют 102 см вьшгеполученного раствора магнийорганического соединения. Выдерживают 1 ч при перемешивании и при О С, а затем вводят 50 см водно0593
18 49 1
2(,05%, , С 72,63; Н 1,12;
10
т.пл. 190 С, вода).
Вычислено, %: N 2,82.
Найдено, %: С 72,5, Н 7,7; N 2,7.
Пример 102. 1 7/а-Гидрокси 1 7о(- (проп-1 -инип) 11/з-(4-гидроксифе- нил)эстр 4,9-диен 3-он.
При комнатной температуре перемешивают в течение 2 ч раствор 90 мг 3,3-этилен бис(окси) 11J|-(4-гидpoкcи- фeнил) 17 ( проп-1-инил) э стр 9-ен 5о/, 17/з-диола (такого, как он получен
в пример 45) в 2 см метанола и 0,3см
2 н. соляной кислоты. Выливают в ледяной раствор бикарбоната натрия, экстрагируют эфиром, а затем хлористым метиленом.
Промывают органический слой насыщенным водным раствором хлористого натрия, сушат, концентрируют досуха под уменьшенным давлением и хромато- графируют остаток на двуокиси кремния (элюант:хлористый метилен - ацетон 92,5-7,5). Получают 71 мг целевого продукта, o/Jp +67° (С 0,25%, CHCl,).
Пример 103. 1 1/з-(3-Гидрокси- фенил) 1 7/Ь-гидрокси 1 7aif-( проп-1-инил) эстра 4,8-диен-он.
Стадия А. 3,3-Этилен диокси 1 - 3-(2-тетрагидропиранилокси)фенил (проп-1-инил)эстр 9-ен 5.о/, 17/3- -диол.
а). Приготовление магнийорганичес- кого соединения.
В атмосфере азота мешают 20,6 г тетрагидропиранилового эфира мета- бромфенола и 160 см тетрагидрофура- на. Выливают 10 см раствора на 2,2 г стружек магния, а затем после начала реакции медленно выливают остаток раствора выдерживая температуру при 52± 2°С. Затем нагревают с рефлюксом в течение 30 мин и охлаждают до 20°С.
б). Прибавление магнийорганического соединения.
В инертном газе растворяют 5,55 г 3,3-этилен диокси 5с/, 10о/-эпокси -(проп-1-инил)эстр 9(11)-ен 17/5-ола в 55 см тетрагидрофурана и прибавляют 0,36 г безводной хлористой меди и 0,18 г хлористого лития. В течение 30 мин при , к раствору прибавляют 102 см вьшгеполученного раствора магнийорганического соединения. Выдерживают 1 ч при перемешивании и при О С, а затем вводят 50 см водного раствора хлористого аммония, Де- кантиру от, экстрагируют этиловым эфиром уксусной кислоты, промывают водой органический слой, сушат его и выпаривают растворитель. Остаток хрома- тографируют на лвуок иси кремния, элю- ируя смесью хлористый метилен - ацетон (95-5), содержащей 1% триэтиламина . Получают 6,3 г целевого продукта, Q цией (Т), моченого тритием продукта
в этиловом эфи- R или 17,2 1-диметил-19-нор - -прекоторыи кристаллизуют ре, т.пл. .
Стадия Б. 1 Т/з-СЗ-Гидроксифенил) 1 7/5-гидрокси 1 7(У(проп-1-инил)эстр , А,9-диен 3-он.
Вводят в суспензию при и в атмосфере инертного газа, 5,42 г полученного в стадии А продукта, в 100 см этанола при 95°С, прибавляют 5,5 г смолы Дереке CF, а затем нагревают с рефлюксом в течение 1 ч 30 мин. Отфильтровывают, выпаривают растворитель и хроматографируют остаток на двуокиси кремния, элюир я смесью цик- логексан - этиловый эфир уксусной кислоты (1-1). Получают 3,8 г целевого продукта, который кристаллизуют в этиловом эфире уксусной кислоты, а затем в ацетоне, т.пл, 215 С.
o(j) +34,5 ± °(С 1%, CHClj).
Вычислено, %: С 80,56-, Н 7,51.
(П2,51)
Найдено, %: С 80,5; Н 7,5.
Испытания проведены для сравнения активностей следуюпщх продуктов:
Продукт X: 1 1 (9-(п-метоксифенил) 17о/-метил 4 ° эстр диен-17/З-ол 3-он (пример 30), продукт У: (п-фтор- фенил) 17 -этинил J эстр диен- -17о/-ол 3-он (пример 33), и продукт Z: .11/3-(2-тиенил) 1 7оС-этинил эстр диен 17/з-ол 3-он (пример 15), активностью продуктов примеров 47, 55-57, 64, 68, 71, 73, 81, 77, 79, 80, 83, 84, 91, 92 и 94.
Испытания проводят, чтобы определить относительное сродство соединений для прогестогенного и глюкокорти- коидного рецепторов и антиглюкокорти- коидального действия упомянутых соединений .
А. Прогрстогенныр рецептор матки кроликов.
Незрелым кроликам, весящим около
15
20
25
30
35
40
45
50
генадиен-3,20-диона в присутствии возрастающих концентрац ш (0-2500 х X 10 м) холодного R, холодного прогестерона , либо холодного испытуемого соединения. Затем измеряли концентрацию связанного меченног о тритием R (В), для каждой инкубированной пробы по методу адсорбции на углерод-декстране.
В. Глюкокортикоидный рецептор .ви- лочковой железы крыс.
Самцам Sprague-Dawley EOPS крыс, весом 160-200 г удалили надпочечники и через 4-8 дней животных убили. Ви- лочковые железы удалили и гомогенизировали при в содержащем буффер ТС растворе 10 мМ Трис, 0,25 М сахарозы , 2 мМ дитиотриинтола, НС1 для рН 7,4, используя политетрафторэтиле- новый стакан Поттера при норме 1 г ткани на 10 мл ТС. Гомогенат ультра-- центрифугировали при 105,000 г в течение 90 мин при и аликвоты, полученной надосадочной жидкости инкубировали при в течение времени (t) с постоянной концентрацией (Т) меченного тритием дексаметазона в присутствии возрастающей концентрации (О - ) либо холодного дексаметазона , либо холодного испытуемого продукта . Концентрацию связанного, меченного тритием дексаметазона (В) измеряли для каждой инкубированной пробы по адсорбционной методике на углерод-декстране .
Расчет относительного сродства концентрации (ARL) был идентичным для двух, упомянутых рецепторных испытаний . Один давал две следующие кривые: процент связанного, меченного тритием гормона В/Т как функция от логарифма концентрации холодного гормона и В/Т, как функция от логарифма концентрации холодного испытуемого продукта . Один определял линию уравнения .
1 кг, ввели через кожу 25 мкг эстра- диола и через 5 дней животных убили. удалили, взвесили и гомогенизировали при 0°С с помощью политет- рафторэтичрлс вого стакана П&ттера в
содержащем буффер ТС pacTiiopo ( Грис 10 мМ, 0,25 М сахарозы, HCi pll 7,4) с 1 г ткани на 50 мл ТС. Гомо- генат ультрацентрифугирорали при 105,000 г в течение 90 мин при и аликвоты полученной насадочной жидкости инкубировали при 0 С в течение времени (t) с постоянной концентра5
0
5
0
5
0
5
0
5
генадиен-3,20-диона в присутствии возрастающих концентрац ш (0-2500 х X 10 м) холодного R, холодного прогестерона , либо холодного испытуемого соединения. Затем измеряли концентрацию связанного меченног о тритием R (В), для каждой инкубированной пробы по методу адсорбции на углерод-декстране.
В. Глюкокортикоидный рецептор .ви- лочковой железы крыс.
Самцам Sprague-Dawley EOPS крыс, весом 160-200 г удалили надпочечники и через 4-8 дней животных убили. Ви- лочковые железы удалили и гомогенизировали при в содержащем буффер ТС растворе 10 мМ Трис, 0,25 М сахарозы , 2 мМ дитиотриинтола, НС1 для рН 7,4, используя политетрафторэтиле- новый стакан Поттера при норме 1 г ткани на 10 мл ТС. Гомогенат ультра-- центрифугировали при 105,000 г в течение 90 мин при и аликвоты, полученной надосадочной жидкости инкубировали при в течение времени (t) с постоянной концентрацией (Т) меченного тритием дексаметазона в присутствии возрастающей концентрации (О - ) либо холодного дексаметазона , либо холодного испытуемого продукта . Концентрацию связанного, меченного тритием дексаметазона (В) измеряли для каждой инкубированной пробы по адсорбционной методике на углерод-декстране .
Расчет относительного сродства концентрации (ARL) был идентичным для двух, упомянутых рецепторных испытаний . Один давал две следующие кривые: процент связанного, меченного тритием гормона В/Т как функция от логарифма концентрации холодного гормона и В/Т, как функция от логарифма концентрации холодного испытуемого продукта . Один определял линию уравнения .
IjQ В/Т(макс) + В/т(мин:) 2 . где В/Т,(макс) - процент спяяанного,
21
В/Т (мин) меченного тритием гормона для инкубации гормона при концентрации Ti процент связанного, меченного тритием гормона для инкубации , меченного тритием гормона при концентрации (Т) в присутствии большого избытка холодного гормона (2500- 10 М) Точка пересечения линии 1 и кривых позволяет определить концентрации холодного гормона ссылки (СН) и холодного испытуемого соединения (СХ), которые ингибируют на 50% связь, меченного тритием гормона с рецептором,Относительное сродство связывания (ARL) испытуемого продукта определяли по уравнению
ARL 100 .(СН/СХ). . С, Антиглюкокортикоидальное действие .
Используемое испытание представляло собой испытание Даусса и др. под названием Отношение между глюкокор- тикоидной структурой и действиями на тимоциты для тимоцитов мышей. Тимо- циты крыс с удаленными надпочечниками инкубировали при 37°С в течение 3 ч в питательной среде, содержащей 5 10 моль дексаметазона в присутствии или в отсутствии испытуемого вещества при различных концентрациях. Добавили меченный тритием уридин и инкубацию продолжали в течение 1 ч. Инкубированные пробы охлаждали и обработали 5%-ным раствором трифторуксусной кислоты и смесь отфильтровали через Whatman SE/A бумагу. Фильтр промыли три раза 5%-ным раствором трифторуксусной кислоты и определяли остаточную радиоактивность на фильтре. Глю- кокортикоиды и особенно дексамета- зон вызывали уменьшение внедрения меченного тритием уридина и испытуемые соединения примеров 47, 55, 56, 57, 59, 64, 68, 73, 71 и 84 препятствовали этому эффекту. Резульаты сведены в табл. 2.
I. Исследование действия продуктов изобретения на гормонные рецепторы.
Минералокортикоидовый рецептор почки крысы.
Весящие от 140 до 160 г крысы самцы породы Sprague-Dawley EOPS с уда
59322
ленными надпочечниками 4-8 дней раньше , умерщвляются и юс почки подвергают перфузии на месте с 50 мл буферного раствора Трис 10 мМ, сахароза 0,25 М, НС 1 рН 7,4. Затем почки выде
0
0
рутотся при о с при помощи Поттера тефпон-стекло (1 г ткани для 3 мл буферного раствора. Продукт гомогенизации центрифугируется в течение 10мин при 0°С и в 800 г.
Чтобы удалить фиксацию насьпценного тритием альдостерона на глюкокортикос идном рецепторе, 11/;,, 17 -дигидрокси 21-метил прегн 1,4,6-триен 20-ин 3-он стероид, который фиксируется только на глюкокортикоидном рецепторе, прибавляется к находящемуся на поверхности продукту при конечной концентрации в . Этот находящийся на поверхности продукт разделяется на ультрацентрифуге при 105000 г в течение 60 мин при . Таким образом, полу5 ченные аликвотные части поверхностного продукта инкубируются при с постоянной концентрацией (Т) насыщенного тритием альдостерона в присутствии увеличивающейся концентрации (0- 2500 ), холодного альдостерона или холодного изучаемого продукта. После времени (Т) инкубации, концентрация связанного, насыщенного тритием альдостерона (В) измеряется техникой поглощения на уголь-декстран.
Андрогенный рецептор простаты крысы.
Самцы крысы породы Sprague Dawley EOPS, весящие 160-200 г, кастрируются . 24 ч спустя кастрации животные умерщвляются, простаты извлекаются, взвешиваются и подвергаются гомогенизации при 0°С при помощи Поттера тефлон - стекло в буферном растворе TS (Трис 10 мМ, сахароза 0,25 М, НС1 рН 7,4) (1 г ткани на 5 мл TS). Продукт гомогенизирования затем подвергается ультрацентрифугированию (105,000 г в течение 60 мин) при . Таким образом полученные аликвотные части поверхностного продукта подвергаются инкубации при 0°С в течение времени Е инкубации с постоянной концентрацией (Т) насьпценного тритием тестостерона в присутствии повьш1аю- щейся концентрации (0-1000 М), либо холодного тестостерона, либо изучаемого продукта. Затем концентрация связанного насыщенного тритием
5
0
5
0
5
тестосте-ренона (В) измеряется в каждом продукте инкубации техникой поглощения угля-декстрана.
Прогестогенный рецептор матки самки кролика.
Весящие около 1 кг, не достигшие половой зрелости крольчихи, получают надкожное применение 25 мкг эстрадио- ла. 5 дней после этой обработки животные умерщвляются, матки извлекаются , взвешиваются и гомогенизируются при 0°С, при помощи Поттера тефлон- стекло в буферном растворе TS (Трис.- 10 мМ, Сахароза 0,25 М, НС1 рН 7,4) (1 г ткани на 50 мл TS). Продукт гомогенизации затем подвергается ульт- рацентрифугации при (105,000 г в течение 90 мин). Таким образом.
25
вающихся концентраций (0-1000-10 М) либо холодного эстрадиола, либо холодного изучаемого продукта. Затем концентрация связанного насьпценного тритием (в) эстрадиола измеряется в каждом продукте инкубации техникой поглощения уголь-декстран.
Вычисление относительного аффинитета связи.
Вычисление относительного аффинитета связи (ОАС) одинаково для всех рецепторов.
Чертят две кривые: процент связанного насыщенного тритием гормона
В
35 ;;; в зависимости от логарифма концентрации холодного контрольного гормона В
30
полученные аликвотные части поверхно- on эстрадиола, в присутствии увеличи . .-. /-п тпг, .1 f
стного Продукта подвергаются инкубации при (f С в течение времени (t) с постоянной концентрацией (Т) насыщенного тритием продукта.R (17,21- -диметил 19-нор-4,9-прегнадиен 3,20 1-дион) в присутствии увеличивающихся концентраций (0-2500-Ю М) либо R холодного, либо холодного прогестерона , либо холодного изучаемого продукта . Концентрация связанного насыщенного тритием R (в) затем измеряется в каждом продукте инкубации техникой поглощения на уголь-декстран.
Глюкокортикоидовьй рецептор зобной железы крысы.
Весящим 160-200 г самцам крысам породы Sprague Dawley EOPS удаляют надпочечники. 4-8 дней после этого удаления животные умерщвляются и зобные железы вынимаются и гомогенизируются при 0°С в буферном растворе Трис 10 мМ, сахароза 0,25 М, дитио- трейтол 2 мМ, НС1 рН 7,4, при помощи Поттера политетрафторэтилен-стекло (1 г ткани на 10 мл TS). Продукт гомогенизирования затем подвергается ультрацентрифугированию (105,000 г в течение 90 мин) при 0°С. Таким образом , полученные аликвотные части поверхностного продукта подвергаются инкубации при в течение времени (t) с постоянной концентрацией (Т) насыщенного тритием дексаметазона в присутствии увеличивающейся концентрации (0-2500 -10 М) либо холодного дексаметазона, либо изучаемого холодного продукта. Затем концентрация связанного насыщенного тритием дексаметазона (в) измеряется в каждъм продук40
И В зависимости от логарифма концентрации изучаемого холодного продукта .
45
50
55
Определяют прямую уравнения Т-С(,
г В В -,/„ В L ;j макс. + - , где - макс. Процент связанного насьпценного тритием гормона для инкубации этого насыщенного тритием гормона при концентв рации (Т), - мин - процент связанного
насьщенного тритием гормона для инкубации этого насыщенного тритием гормона при концентрации (Т) в присутствии большого избытка холодного гормона (2500-10-9 М).
Пересечения прямой I с кривыми позволяют определить концентрации холодного, контрольного гормона (СН) и изучаемого холодного продукта (СХ),
те инкубации техникой поглоп1ения уголь-декстран.
Зкстрогенный рецептор матки мьпии.
Не достигшие полового возраста в возрасте 18-21 дней мьши самки-умерщвляются , матки собираются, а затем гомогенизируются при ОТ. при помощи Поттера тефлон-стекло в буферном растворе TS (Трис 10 мМ, сахароза 0,25 М, НС1 рН 7,4) 1 г ткани на 25мл TS). Продукт гомогенизирования затем подвергается ультрацентрифугированию . (105,000 г в течение 90 мин) при . Таким .образом полученные аликвотные части поверхностного продукта подвергаются инкубации при или в течение времени (t) с постоянной концентрацией (Т) насьпценного трити
вающихся концентраций (0-1000-10 М) либо холодного эстрадиола, либо холодного изучаемого продукта. Затем концентрация связанного насьпценного тритием (в) эстрадиола измеряется в каждом продукте инкубации техникой поглощения уголь-декстран.
Вычисление относительного аффинитета связи.
Вычисление относительного аффинитета связи (ОАС) одинаково для всех рецепторов.
Чертят две кривые: процент связанного насыщенного тритием гормона
В
;;; в зависимости от логарифма концентрации холодного контрольного гормона В
эстрадиола, в присутствии увеличи .-. /-п тпг, .1 f
И В зависимости от логарифма концентрации изучаемого холодного продукта .
5
0
5
Определяют прямую уравнения Т-С(,
г В В -,/„ В L ;j макс. + - , где - макс. Процент связанного насьпценного тритием гормона для инкубации этого насыщенного тритием гормона при концентв рации (Т), - мин - процент связанного
насьщенного тритием гормона для инкубации этого насыщенного тритием гормона при концентрации (Т) в присутствии большого избытка холодного гормона (2500-10-9 М).
Пересечения прямой I с кривыми позволяют определить концентрации холодного, контрольного гормона (СН) и изучаемого холодного продукта (СХ),
Исследованные соединения, особен но продукт примера 84, обладают бол шим антиглюкокортикоидным действием чем известные соединения X, Y и Z.
25134059326
которые ингибируют на 50% связь насыщенного тритием гормона на рецепторе.
Относительный аффинитет связи (ОАС). изучаемого продукта определяется уравнением:
( с и 1
Формула изобретени Способ получения производных з -19-норстероидов общей формулы
10 „ R г
-R
ОАС 100 {Щ
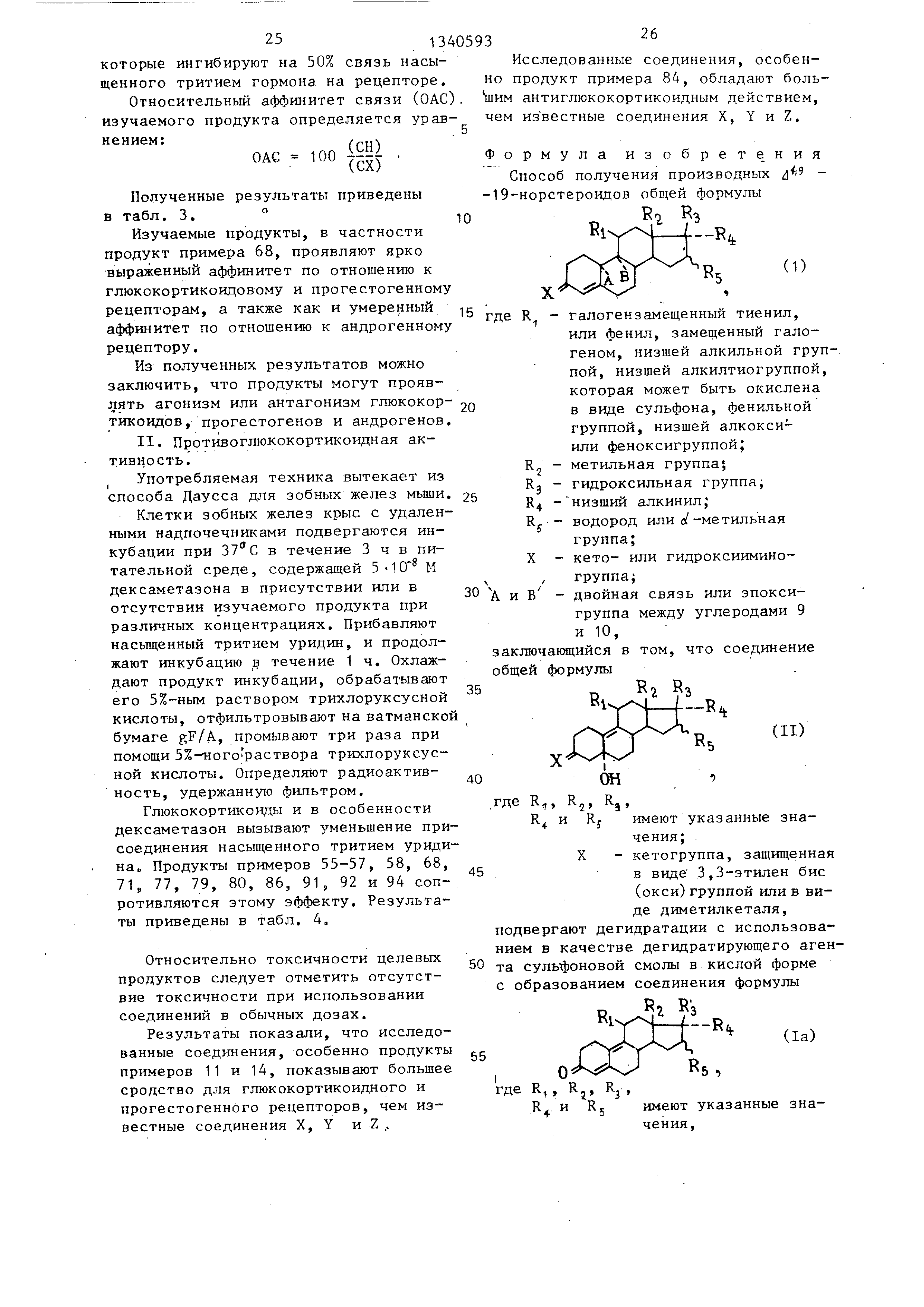
Полученные результаты приведены в табл. 3.
Изучаемые продукты, в частности продукт примера 68, проявляют ярко выраженный аффинитет по отношению к глюкокортикоидовому и прогестогенному рецепторам, а также как и умеренный аффинитет по отношению к андрогенному рецептору.
Из полученных результатов можно заключить, что продукты могут проявлять агонизм или антагонизм глюкокор- тикоидов, прогестогенов и андрогенов.
II. Противоглюкокортикоидная активность .
Употребляемая техника вытекает из способа Даусса для зобных желез мьши.
Клетки зобных желез крыс с удаленными надпочечниками подвергаются инкубации при 37 С в течение 3 ч в питательной среде, содержащей М дексаметазона в присутствии или в отсутствии изучаемого продукта при различных концентрациях. Прибавляют насьш ;енный тритием уридин, и продолжают инкубацию в течение 1 ч. Охлаждают продукт инкубации, обрабатывают его 5%-ным раствором трихлоруксусной кислоты, отфильтровывают на ватманской бумаге gF/A, промывают три раза при помощи 5%-ного раствора трихлоруксусной кислоты. Определяют радиоактивность , удержанную фильтром.
Глюкокортикоиды и в особенности дексаметазон вызывают уменьшение присоединения насыщенного тритием уриди- НЕо Продукты примеров 55-57, 58, 68, 71, 77, 79, 80, 86, 91, 92 и 94 сопротивляются этому эффекту. Результаты приведены в табл. 4.
Относительно токсичности целевых продуктов следует отметить отсутствие токсичности при использовании соединений в обычных дозах.
Результаты показали, что исследованные соединения, особенно продукты примеров 11 и 14, показывают большее сродство для глюкокортикоидного и прогестогенного рецепторов, чем известные соединения X, Y и Z ..
Rt
(1)
15
где R - галогензамещенный тиенил,
или фенил, замещенный гало геном, низшей алкильной гр
пой, низшей алкилтиогруппо которая может быть окислен 20 в виде сульфона, фенильной группой, низшей алкокси- или феноксигруппой; Rj - метильная группа; Rj - гидроксильная группаj R4 - низший алкинил;
RJ, - водород или fl/-метильная
группа;
X - кето- или гидроксиимино- ч , группа;
30 А и в - двойная связь или эпокси- группа между углеродами 9 и 10,
заключающийся в том, что соединение общей формулы
35
40
п 1 г «1уН--4-R.
ОН
R.
(II)
.где RR , и
2 5 Rr
X
45
50
имеют указанные значения;
хетогруппа, защищенн в виде 3,3-этилен би ( окси) группой или в в де диметилкеталя,
подвергают дегидратации с использов нием в качестве дегидратирующего аг та сульфоновой смолы в кислой форме с образованием соединения формулы
55
где R,
.-, До К з
Tr-f--
R5,
(la)
R, и
Rj
RS
имеют указанные зна чения.
Исследованные соединения, особенно продукт примера 84, обладают боль- шим антиглюкокортикоидным действием, чем известные соединения X, Y и Z.
Rt
(1)
15
где R - галогензамещенный тиенил,
или фенил, замещенный галогеном , низшей алкильной груп-.
пой, низшей алкилтиогруппой, которая может быть окислена в виде сульфона, фенильной группой, низшей алкокси- или феноксигруппой; Rj - метильная группа; Rj - гидроксильная группаj R4 - низший алкинил;
RJ, - водород или fl/-метильная
группа;
X - кето- или гидроксиимино- , группа;
А и в - двойная связь или эпокси- группа между углеродами 9 и 10,
заключающийся в том, что соединение общей формулы
п 1 г «1уН--4-R.
ОН
R.
(II)
.где RR , и
2 5 Rr
X
5
0
имеют указанные значения;
хетогруппа, защищенная в виде 3,3-этилен бис (окси) группой или в виде диметилкеталя,
подвергают дегидратации с использованием в качестве дегидратирующего агента сульфоновой смолы в кислой форме с образованием соединения формулы
5
где R,
.-, До К з
Tr-f--
R5,
(la)
R, и
Rj
RS
имеют указанные значения .
с последующим, в случае необходимости , окислением органической надкис- лотой с получением соответствующих 9,10-эпоксипроизводных и в случае, когда R - фенил, замещенный низшей
3-Метилфенил- То же магнийбромид
10
4-Хлорфенил- магнийбромид
11
2-Хлортиен-5-ил-магнийбромид
12
3-Хлорфенил- магнийбромид
3-Метоксифенилмагнийбромид
3,3-Этилен бис (окси) 5о(, 10о/ эпокси 7о1-(проп- -1-инил)эстр 9 (11)-ен
.14
4-Метоксифе- То же
нилмагнийбромид
алкилтиогруппой, и получают соответствующие п-фенилзамещенные низшей ал- килсульфонилгруппой, или полученное соединение формулы (la) подвергают взаимодействию с гидроксиламином. IТ а б л и ц а 1
(С 0,9%, СНС1з)
3,3-Этилен бис(окси) 11/5- (3-метил) фен ил (пропинил) эстр-95о (, 17 -диол, т.пл. 206°С, с1 -72,5
±1,5° (, СНС1) 3,3-Этилен бис(окси) (4-хлор)фенил 17о/-(проп-1-инил)зстр 9-ен 5о, 17|&-диол, т.пл. 180 С, Мр -62t 2 (, СНС1
3,3-Этнлен бис(окси)
(5-хлорти нил)
17о( - (проп-1 -инил) э стр
9-ен 5с/, 17 5-диол,
т.пл. 204°CWi5
-23 ±1 (, CHCIj
3,3-Этилен бис(окси) (3-хлорфенш1) 17(/-(проп-1-инш1)зстр 9-ен 5с1, , т.пл. 191° С, Мд -67,7t 2° (, CHClj)
3,3-Этш1ен бис(окси) 11/}-(3-метоксифенил) 17о(-(проп-1 -инил) эстр-9-ен 50, ол,- т.пл. (jfJi, -74 ±2° (,5%, CHCl,)
3,3-Этилен бис(окси) 11э-(4-метоксифенил) 17о(-(проп-1-инил)эстр 9-ен 5о(, 17/1-диол,
15
16
3,4-бис-Ме- токсифенил .магнийбромид
3-Трифторметилфенилмагнийбромид
т.пл. 226 C,o/JD -68 t 2,5 (, CHClj)
3,3-Этилен бис(окси)2 ч при
11|а-(3,4-бис-метокси) -15° С фенил J 17о/ - (проп-1 -инил) эстр 9-ен 5с1, 17/ -диол, т.пл. 230°С, Ы, 671 12° (,85%, CHClp 1
3,3-Этилен бис(окси) 3,3-Зтилен бис(окси) 30 мин
5а(, 10о(-эпокси 11/5-(3-трифторметил) при
-(проп-1-инил)э стр 9(11)-ен 17/а-ол
фенил (проп-1- -20°С
-инил)эстр 9-ен 5о/,
3-Трифторметил4-хлорфенилмагнийбромид
То же
18
2-Нафтилмагний- бромид
19
4-Феноксифенил- магнийбромид
3,3-Этилен бис(окси) 3,3-Этилен бис(окси) 45 мин 5d, Юо -эпокси11/1-(4-феноксифенил) при
17о(-(проп-1-инил)17о( -(проп-1-инил)эстр -10°С
эстр 9(11)-ен 9-ен 5ei, 17,6-диол,
т.пл. , Мр -681 1,(.%,
20
Фенилмагний- бромид
То же
21
(З-Бром)фенилмагний- бромид
11/5-(3-трифторметил) при
фенил (проп-1- -20°С
-инил)эстр 9-ен 5о/,
17/3-диол, т.пл.
179°С, с1 58 t 2
(,8%, CHClj)
3,3-Этилен бис(окси) 30 мин
11/}-(3-трифторметил, при
4-хлор) фенил 17о/- -10° С
-(проп-1-инил)э стр
9-ен 5с, 17/з-диол,
MD -47,5 t 1,5°
(,9%, CHClj)
3,3-Этилен бис(окси (2-нафтил) 17о/- (проп-1-инил)эстр 9-ен 50/, 17/3-диол, т.пл. 276,5 C,, -14± 2°(,5%, CHClj)
СНС1з)
3,3-Этилен бис(окси)
11/}-фенил 17с/ -(проп-
-1-инил)эстр 9-ен
5с/, 17 -диол, т. пл
234°С, MI, -74,5 12,5 (,5%, СНС1з)
3,3-Этилен бис(окси)
11/5 - Г( 3-бром) фенил
17й/-(проп-1-™ил) эстр 9-ен 5в/, 17|i-ДИОЛ; ) -61
t1,5° (, CHClj)
22Г(4-Бром)фе-3,3-Этилен бис(окси) 3,3-Этилен бис(окси) 30 мин
нилмагний-5 о/, 10 -эпокси11 -(4-бром)фенил при
бромидТУо -Спроп-Т-инил)(проп-1-инил)эстр -15 С
эстр 9(11)-ен 9-ен 5о/, 1 7/9-диол-,
-55 t ,8%, CHClj)
4-Метилтйофенилмагнийбромид
То же
24
3-Тиенилмаг- нийбромид
Пропилмагний- бромид
3,3-Этипен бис(окси) 5, Юа -эпокси -(проп-1-инил)э стр 9(11)-ен 17/з-ол
26
3-Фторфенил- магнкйбромид
То же
27
3-Фенилркси- фенилмагний- бромид
28
4гФеннпфенил- магнийбромид
3,3-Этилеп бис( окси) 11/5-(4-метш1тио)фе- -Д1ил (проп-1-инил) эстр 9-ен 5df, 17/j- -диол, т.пл. 90°С, затем , MB -5 t1,5° (, CHClj)
3,3-Этилен бис(окси)
11р-(3-тиеншт)
-(проп-1-инил)эстр
9-ген 5с1, 17,4 -диол,
т.пл. 240 С, TafJi)
-38 t2,5° (,
CHClj)
3,3-Этилен бис(окси) 11 -пропил 17а -(проп- -1-инил)эстр 9-ен 5, 17/3-диол, т.пл. ) -108,5 t 3 (С 1%, CHClj)
3,3-Этилен бис(окси)
(З-фтор) фенил
17с - {проп-1-инил)
эстр 9-ен 5о, 17|J-диол , т.пл 228°С,
Мд -58,5 t2,5
(С 1Z, CHClj)
3,3-Этилен бис(окси) 11j5 - (З-фенилокси)фе- нил 17о/-(проп-1-
-инил)эстр 9-ен 5с(, 17Л-ДИОЛ, т.пл. 190°С -59,5 t 1,50 (С 1%, СНС1з)
3,3-Этилен бис(окси) (4-фенил)фенил (проп-1 -инил) эстр 9-ен 5о, 17р-диол, т.пл. 165° С, , -52 t 2°. (, CHClj)
2
3
4
4-Метилтиофенилмагнийбромид
Диметилмед- нолитиевое органическое соединение
4-Метилтиофенилмагнийбромид
3,20-6ис-Этилен ке- таль I7oif-метил 50/, 10о/-эпокси 19-нор прегна 9(11)-ен 3,20-диона (полученный по приме- РУ 31)
3,20-бис-Этилен кеталь 1бо/-метил 5с/, 10о(-эпокси 19-нор прегна- -9(11)-ен 3,20-диона
То же
Циклопропил- меди олитиевое органическое
соединение
3,3-Этилен бис(окон) 5с/, ЮсУ-эпокси 17о/- (проп-1-инил)эстр 9 (11)-ен
4-Изопропнл- фенилмагний- бромид ,.
То же
37
3-Метилтиофенилмагнийбромид
3-(2-Пропе- нилокси)фе- нилмагний- бромид
Циклопентил- магнийбромид
3,3-3т11лен бисСокси) 3, IOof-эпокси 17t5f-(npon-1 -ниил) эстр 9(П)-ен 17/г-ол
3,3,20,20-бис-Этилен бис(окси) 17rt -метил (4-метилтиофенил) 19-нор прегна-9-ен 5о(- ол
3,3,20,20-бис-Этилен бис(окси) 11 , -дкметил 19-нор прег на-9-ен 50/-ол, т.пл, 140° С
3,3,20,20-бис-Этилен бис(окси) 1 6с/-метил 11р-(4-метилтиофенил 19-нор прегна-9-ен 5о;-ол, т.пл. 189 С
11)5-Циклопропил 3., 3-этилен бис(окси) 1 7(У(проп-1-инил) эстр 9-ен 5с, 17/3-диол
3,3-Этилен бис(окси)
11/5-(4-иэопропилфе-
нид) 1 (проп-1-инил
эстр 9-ен 50, 17/а-ди-
ол, т.пл. 194 С,
d(Jj, -66,5t 2,5°
(С 0,5%, CHClj)
3,3-Этилен бис(окси)
11/Ь(3-метилтиофенил)
17о(-(проп-1-инил)эстр
9-ен 5с/, 17р-диол,
т.пл. ,.
-65,61 2 ,7%, СНС1з)
3,3-Этилен бис(окси)
11 f СЗ (2-пропенил-
-окси) фенил 17 о(- (проп-1-инил)эстр
9-ен 5d, 17/5-диол,
т.пл. 165°С,
-71 t 2,5°(,8%,
СНС1з)
3,3-Зтилен бис(окси)
11р-циклопентил17о ( -(проп-1-инил)
эстр 9-ен Зс,
42
4(3-Метилбутил тио)фенилмаг- нийбромид
7
8
9
0
1
52
3,3-Этилен бис (окси) -(4-фторфенил) (проп-1- -инил)эстр 9-ен 5 о/, 17/9-диол (пример 2)
3,3-Этилен бис (окси) 11Д-(4- -трифторметип- фенил) 17(/-(проп- -1-инил)эстр 9-ен 5 а/, 17 -диол (пример 3)
3,3-бис-Меток- си 11 -метил 17(1/-(проп-1- -инил)эстр 9-ен 5о, 17/1- -диол (пример 4)
3,3-бис-МеТОК- СИ (пропа- -1,2-диенш1) 1 7a -(пpoп-1- -инил)эcтp 9-е 5о1, 17 -дйол: (пример 5)
3,3-бис-Меток- си 11 -трет- бутил 17 ai- -(проп-1-иннл) эстр 9-ен 5 с/, 17/1-диол (пример 6)
3,3-Метокси 11/}-(2-фурил) 1 7о(-(проп-1 ti
о же
17Л-ДИОЛ, tcl -98 t (, CHCl,)
3,3-Этилен бис(окси) 1 ч при 11|в-(3-метил) бутил -20 С тиофенил (проп- -1-инил)эстр 9-ен 5а/, 17 -диол, ) -52 + 1,5° (С 0,5%, CHClj)
(4-Фторфеннп) 17/3- 2ч -гидрокси 17(/-(проп-1- -инш1)эстр 4,9-диен 3-он, т.пл. 135-140 С, затем 162/164 С, Jj, 19 t 1,5 (,8%, CHCl)
11/%-Г(-Трифторметип)фе- нил 17/ -гидрокси -(проп-1-инил)эстр 4,9- -диен 3-он, т.пл. 180 С, затем 218 С, +29t Л (, CHClj)
1 -Метил 17;5-гидрокси 17а(-(проп-1-инил)эстр 4,9-диен 3-01Ц т.пл. 213°С, , -153 ± 2,5 С 1,5%, CHClj)
11/5-(Проп-1,2-диенил) 17 -гидрокси 17о/-(проп- -1-инил)эстр 4,9-диен 3-он, т.пл. 133 С, (j, +122 t 2 ° (,9%, CHClj)
11/Ь-трет-Бутип 17 -гнцрок-
си 17в(-(проп-1-инил)
эстр 4,9-диен 3-он,
т.пл. 168 С, r.yjjj
- 152t 2,5 (,
CHClj)
(2-Фурш1) 17/5-гнцрок- 1 ч си 17о(-(проп-1 инил)эстр 4,9-диен 3-он, т.пл.
-инил)эстр 9-ен 5о/, -диол (при-- мер 7)
3 3,3-Этилен бис (окси) (4-метил)фе- нил j17o/-(пpoп- -1-инил)эcтp 9-ен 5di, -диол (пример 8)
А3,3-Этилен 6jjc
(окси) 11/4- (3-метил) фенил 17о(-(проп- -1-инил)эстр 9-ен 50/, -диол (пример 9)
53,3-Этилен бис
(окси) (4-хлор) фенил 17о/-(проп- -1-инил)эстр 9-ен 5о(, -диол (пример 10)
563,3-Этилен бис
(окси) (5- --хлортиенил) 1 7o/-(пpoп-1- -инил)эcтp 9-ен 5 о/, 1-7/1-. -диол (пример 11)
573,3-Этилен бис (окси) 11 /J- -(3-хлорфенил) 17о/-(проп-1- -инил)эстр 9-ен 5о/,17/1- -диол (пример 12)
583,3-Этилен бис (окси) 11р- -(3-метоксифе- нил) 17oi-(npon- -1-инил)эстр
208°C,To Ji, +2,,5(,
CHClj)
11р- (4-Метил)фенил 17 - -гидрокси 17с/-(прсп-1- -инил)эстр 4,9-диен 3-он, т.пл. , Ив +70 f 1,5 (С 1%, СНС1з)
1 1/3 (3-Метил)фенил 17/1-гидрокси 17«/-(проп- -1-инил)эстр 4,9-диен 3-он, т.пл. 182°С,
35 ± 1 (1%, СНС1,)
(4-Хлор)фенил
17/3-гидрокси 17о/-(проп- -1-инил)эстр 4,9-диен 3-он, т.пл. , 87.12,5 (С 0,5%, CHClj)
11|3-(5-Хлортиенил)
17/з-гидрокси 17о(-(проп- -1-инш1)эстр 4,9-диен 3-он, с 115,5 t 2« (С 1%, СНС1,,)
(3-Хлорфенил) 17/4- -гидрокси (проп- -1-инил)эстр 4,9- -диен 3-он, Вычислено, С 77,03i Н 6,94i С1 8,42. Найдено, %: С 76,8j Н 7,0; С1 8,4
11/1-(3-Метоксифенил) 17/5-гидрок.си 17в(-(проп -1-инил)эстр 4,9-диен 3-он, т.пл. 120 С, Мг, +451 1
9-ен , 17,9- -диол (пример 13)
59З З-Этилен бис (окси) 11/}-(4- -иетоксифенил) 17с(-(проп-1- -инил)эстр 9-ен 5 of, 17р-диол (пример 14)
603,3-Этш1ен бис (окси) 11 -(3, 4-бис метокси)фенил J 17.cf-(npon-1- -инил)эстр 9-ен 5о(, 1 -диол (пример 15)
61 3,3-Этнлен бис (окси) (3- -трифторметил)фенил 17о/-(проп- -1-инил)эстр 9-ен 5(/, 17 -диол (пример 16)
623,3-Этилен бис
(окси) 11/J-(3- -трифторметил, 4- -хлор) фенил -(проп-1-инш1) эстр 9-ен 5(3/, 17 -диол (пример 17)
63 3,3-Этилен бис (окси) 11д-(2- -нафтил) Md- -(проп-1-инил) эстр 9-ен 5of, 1 7 -диол (пример 18)
64 3,3-Этилен бис (окси) 11/j-(4- -феноксифеншт) 1 70/-(проп-1-инил) эстр 9-ен 5о, 17/5-диол (при- мер 19)
53,3-Этилен бис
(окси) нил 17о(-(проп-1- -инил)эстр
(, CHCIj)
11у9-(4-Метоксифенил), 17/з-гидрокси (проп- -1-инил)эстр 4,9-диен. 3-он, т.пл. 120 С, , +73 ± 2° (, CHClj)
11/5- (3, 4-бис-Метокси) фенил 1 7у9-гидрокси (проп-1-инил)эстр 4,9-диен 3-он, т.пл. 2094, Wj, +53,5t1,5 (,2%, СНС1,)
11 (З-Трифторметил)фе- нил 17/3-гидрокси -(проп-1-инил)эстр 4,9- -диен 3-он, т.пл. 202°С, Wj +21,5t 1 (,9%, СНС1з)
11/J-Г(3-Трифторметш1-4- -хлор)фенил 17Д-ГИДРОК- си 17о(-(прон-1-инил)эстр 4,9-диен 3-он, т.пл. 188°С, cijjf +69 1 2,5 (С 0,7%, СНС,)
(2-Нафтил)
- гццрокси 17ef-(npdn-1- -инш1)эстр 4,9-диен 3-он, т.пл. 170°С, tci +252± 4 (, CHClj)
(4-Фенокси)фенил
17/ь-гидрокси 17о/-(проп-1- -иннл)эстр 4,9-диен 3-он, +73,5 i 1,5 (,8%, CHClj)
11/ -Фенил 17/5-гидрокси 17 о/- 1ч -(проп-1-инил)эстр 4,9-диен 3-он, т.пл, 190°С +35,5 ± 2° (,5%,
9-ен 5о/, 17/з-ди- ол (пример 20)
3,3-Этилен бис (окси) 11,г-(3- -бром) фенил 17о(- -(проп-1-инил)эстр 19-ен 5о(, 17/з-ди- ол (пример 2 Т)
7
8
9
0
71
72
3,3-Этипен бис (окси) 11/s-C(4- -бром)фенил 17о( - (проп-1-инил) эстр 9-ен 5of, 17/)-диол (пример 22)
3,3-Этилен бис (окси) 11/3- (4- -метилтио)фенил 17с/- (проп-1 -инил) эстр 9-ен So/, 17 -диол (пример 23)
3,3-Этилен бис (окси) 11/i-(3- -тиенил) 17 о/ - -(проп-1-инил) эстр 9-ен 5о/, 17/5-диол (пример 24)
3,3-Этилен бис (окси) H/j- -пропил 17о1- -(проп-1-инил) эстр 9-ен 5о(, 17 -диол
3,3-Этилен бис (окси) 11/5-t(3- -фтор)фенш1 17о(- -(проп-1-инил) эстр 9-ен Зо/, 17 1-диол
3,3-Этипен бис (окси) 11/i-(3-фенштокси ) фенил 17о(-(проп-1-инил)
11
CHClj)
11/1-(3-Бром)фенил 17/ |-гид- рокси 17af-( проп-1-инил) эстр 4,9-диен 3-он, Wn +45,54 1,5 (, CKClj)
Вычислено, %: С 69,67; Н 6,28; Вг 17,17. Найдено, %: С 69,7, Н 6,3; Вг 17,2
1 (4-Бром) фенил 17/ь- -гидрокси 17о/-(проп-1- -инил)эстр А,9-диен 3-он, т.пл. 214°С, +88,5 t 2°(,
CHClj)
lip- (4-Метилтио)фенил 17 -гидрокси (пропи- -1-инил)эстр 4,9-диен 3-он, т.пл. 148-150°С , +1351 2,5°(, CHCl,)
11/5-(3-Тиенил) 17/5-гид- рокси 17о(-(проп- 1-инил) эстр 4,9-диен 3-он, т.-пл. 202°С, Го(в +91,51 + 2° (, СНС1з)
11/5-Пропил 17/5-гидро- кси 17о(-(проп-1-инил) эстр 4,9-диен 3-он, т.пл. 141°С, о(3п -146,5 1 2,5(С 0,75%, СНС1з)
(3-Фтор)фенил 17 -
-гидрокси 17d(-(npon-1-
-инил)эстр 4,9-диен
3-он, т.пл. 172 С,
+251 2° (0,5%,
CHClj)
11р- (3-Фенилокси)фенил 17р-гидрокси 17а(-(проп- -1-инил)эстр 4,9-диен, 3-он
эстр 9-ен 5(/, диол (пример 27)
3
4
3,3-Этипен бис (окси) (4- -фенил)фенилЗ 17о/- -(проп-1-инил)эстр 9-ен 5о/, 17 -диол (пример 28)
3,3-Этилен бис (окси) (2- -метил проп-1- -енил) 17(/-эти- нил эстр 9-ен 5с/, 17/ь-диол (пример 29А)
5
6
3,3-Этилен бис (окси )5of, 17о/- -дигидрокси 11/)- -3(метоксифенил) 19-нор прегн 9-ен 20-он (пример ЗОА)
3,20-бис-Этилен кеталь 17о/-метил 5 -гидрокси -пропил 19-нор прегн 9-ен 3,20-диона (пример 31)
3,3-20,20-бис-Эти- лен бис (окси) 17о/- -метил 11/з-(4-метнл тиофенип) 19-нор прегн 9-ен (пример 32)
3,3-20,20-бис- -Этипен бис (окон) 11/i, 1бо/-диметил 19-нор прегн 9-ен (пример 33)
Вычислено, %: С 82,81; Н 7 Найдено, %: С 82,6; Н 7,3 UJl, +51 t 1,5 (С 0,95%, CHClj)
11/6-(4-Фенил)фенил 17/}- 1 -гидрокси 1 7о( -(проп-1- -инил)эстр 4,9-диен 3-он, т.пл. 240°С, Мв +181,5± 3° (, СЦС1з)
11/3-(2-Метш1 проп-1-енил) 17/3-гидрокси 17й -этинил эстр 4,9-диен 3-он, т.пл. 150°С
Вычислено, %: С 82,24; Н 8,63.
Найдено, %: С 82,1j Н 8,5. d -212,5 t ЗЧС 1%, СНС1з)
(3-Метоксифенил) 17о/- гидрокси 19-нор прегн 4,9-диен 3,20-диок, т.пл. 173°С, U30 +108,51 ±2,5° (,5%, CHClj)
11 -Пропшт 17о( -метил 19прегн 4,9-диен 3,20-дион
т.пл. 122°С
Вычислено, %: С 81,31;
Н 9,67
Найдено, Z: С 81,3; Н 9,
-105 ± 2°(,
CHClj)
(4-Метил)тиофенш1 171 -метш1 19-нор прегн
4,9-диен 3-20-дион Вычислено, %: С 77,37; Н 7,88; S 7,38 Найдено, %: С 77,6;
Н 8,0; S 7,4
o(jo ± 4,5
(,6%, CHClj)
11)5. 16 -Диметил
19-нор прегн 4,9-диен 3,20-дион, т.пл. 155°С, R 0,26
3,3-20,20-бистЭтилен бис(окси) 1бх/- -метил (4-ме- тилтиофенил) 19-нор прегн 9-ен 5(/-ол (пример 34)
11/г-Циклопропил
3,3-этилен бис (окси) 17о( (проп- -1-инип)эстр 9-ен 5о(, 17 -диол (пример 35)
3,3-Этш1ен бис (окси) 11/з-(4- -изопропилфенил)
17 (/-(проп-1-инил) эстр 9-ен 5of, 17/5-диол (пример 37)
3,3-Этилен бис (окси) ..
11й-(3-метш1тио- фенил) 17of-(npon- -1-инил)эстр 9-ен 5о, 17 -диол (пример 38)
3,3-Этилен бис
(окси) (2- -пропенилокси)фенил 1 7 (У- ( проп- 1 - -инил)эстр 9-ен 5 о/, 17р-диол (пример 39)
3,3-Этилен бис
(окси) ен 2-ил, 17с/-ме- тнл 5,21-ди- гидрокси 19-иор
16(;/-Метил 1 1/}-(4-метил- 1 ч тиофенил) 19-нор прегн 4,9-диен 3,,20-дион Вычислено, %: С 77,37; Н 7,88i S 7,.38 Найдено,%: С 7,6; Н 8,0 S 7,4. о(3р +290 ± 5° (С 0,6%, CHClj)
1 1 -Цшслопропил 11jb- 2 ч
-гидрокси 17(У-(проп-1- 30 мин
-инил)эстр 4,9-диен
3-он
Вычислено, %: С 82,24;
Н 8,63
Найдено, %: С 82,2; Н 8,7
Rf 0,28
1 1 А-(4-Изопропил)фенйл 45 мин 17 -гидрокси, (проп- -1-инш1(эстр 4,9-диен 3-он, т.пл. , ) +73± 2 (С 0,7%, СНС1з)
(3-Метилтио) фенил 1 ч
1 7/1-гидрокси 17о(-(проп1-инил )эстр 4,9-днен
3-он
Вычислено, %: С 77,73;
Н 7,45
Найдено, %: С 77,7;
Н 7,6
+521 1,5° ,
(, СНС1з)
(2-Пропенилокси) 40 мин
фенил 17 3-гидрокси
17 в(-(проп-1 -инил) эстр
4,9-диен 3-он
Вычислено, %: С 81,41;
Н 7,74Найдено , %: С 81,7;
Н 7,9.
Ы3д +52,51 2,,5°
(,7%, CHClj)
1/&-Тиенш1 7ii- teтшl 30 мин 1-гидрокси 19-норпри
регн 4,9 (10) диен ,20-дион (ычислено, %:: С 73,3;
47
прегн 9-ен 20-он (пример 4О)
3,3-Этилен бис (окси) 11/з-цикло- пентил 17а -(проп- 1-инил)эстр 9-ен 5с{, 17/5-диол (пример 41)
20К-Ацетокси, 3,3- этилен бис(окси) (3-метоксифе- нил) 17 /-метил 19-нор прегн 9-ен 5(-ол (пример 43)
3,3-Этилен бис (окси)
1 1/3- 4(3-метил)бу- тилтиофенил 17с/- -(проп-1-инил)э стр 9-ен 5, 170-диол (пример 42)
1340593
48
Продолжение табл. 1
Н 7,5; S 7,6 Найдено, %: С 73,13, Н 7,36, S 7,81 Hs +138,,5 (,57%, )
11/5-Циклопентил 17/г- гидрокси 17о/-(проп-1- -инил)эстр 4,9-диен 3-он
-/.
Вычислено, %: С 82,49
Н 9,05.
Найдено, %: С 82,2
Н 9,3.
/ Л +122± 2,5° .
(,9%, CHClj)
20К-Ацетокси 11/9-(3-ме
токсифенил) 17о -метил
19-нор прегн 4,9-диен
3-он, т.пл.
Вычислено, %: С 77,88;
Н 8,28.
Найдено, %: С 77,6;
Н 8,2.
to Jj +168i- 2,5
(, CHClj)
11/5- 4(3-Метил)бутилтио фенил 17 9-гидрокси 17o -(проп-1-инил)эстр 4,9- -диен 3-он
Вычислено, %: С 78,62; Н 8,25- S 6,56 Найдено, %: С 78,4; Н 8,35, S 6,4. o(l, +133,5 ± 2,5° (, CHClj)
Таблица 2
0,9 0,01 1 0,1 3.4 0,4 0,4 0,04 3,1 0,2 ,01- 1,9 0,7 0,5 0,1 0,02 0,02 0,3 0,1 1,4 0,1 0,5 0,07 0,35 0,04
1,3 3274536
11,5 116080
9.60,363126 6,3 .12,4236910
7.72,033129 0,1 0,6108513
1,1 3,066230
1,6 38176
0,4119
6,48,23,6
5,64167
0,4
0,6
18
13
8,3 2,4 24 62
0,13 0,05 19 16
Таблица 3

























Реферат
Изобретение относится к производным стероидов, в частности к - -19-норстероидам (НС) общей формулы. Pl-CH-CH2-CRi-СКзС- К С 7 СН-СН-СНг СН- R 5 снгСНг-с...А снг х-с-сн- с-сНг , где к -галоидэамещенный тиенил, или фенил, не-или замещенный галоидом, низшим алкилом, алкилтиогруппой, которая может быть окислена в сульфоне, низшей алкокси- или феноксигруппой; R - СН,; Rj - ОН; R - низший ал- кинил; Rj - И или d -CH, X С О или -NHOH; А и В вместе - двойная связь или эпоксидгруппа между углеро- дами 9 и 10, обладающим антиглюкокор- тикоидньм действием. Цель - создание более активных веществ указанного класса. Получение НС ведут дегидратацией соответствующего 9, Ю-дегидро- производного соединения (с X- , которая защищена 3,3-зтилен-бис(окси) группой или диметилкеталем) с помощью сульфоновой смолы в кислой форме с образованием , 4,9 диен-3-она. При необходимости ведут окисление органической надкислотой для получения 9, Ю-эпоксипроизводньпс, когда R - фенил, замещенный низшей алкилтиогруппой , то получают 11-фенилзамещенные низшей апкилсульфонилгруппой.Для введения X - NH-OH 4-, 6 диен-3-оны обрабатывают гидроксиламином. Новые НС обладают большим антиглюкокорти- коидным действием, чем известные -эстрадиены, 4 табл. СУ) со о ел со 00 ы

Формула


Комментарии