Способ получения 7α-метилстероидов, соединение - RU2305105C2
Код документа: RU2305105C2
Описание
Изобретение относится к новому способу получения 7α-метилстероидов.
7α-Метилстероиды представляют собой важный класс фармакологически активных соединений. Одним примером стероида с метильной группой в 7-положении является (7α,17α)-17-гидрокси-7-метил-19-норпрегн-5(10)-ен-20-ин-3-он (тиболон), который является активным компонентом Livial®, используемым для гормональной заместительной терапии при лечении менопаузных нарушений. Тиболон является соединением, обнаруживающим тканеспецифическую гормональную активность. В лабораторных и клинических исследованиях тиболон обнаруживает эстрогенные действия на терморегуляторную систему, вагинальную ткань и кости, но не демонстрирует эстрогенную активность в отношении молочной железы или эндометрия. Перспективные действия тиболона на кости также исследуют в настоящее время для профилактики остеопороза у женщин, у которых имеется вероятность развития такого состояния. (1) Pavlov, P.W., et al. Gynecol. Endocrinol. 1999; 13: 230-237, 2) Tibolone (Livial). A new steroid for the menopause. Drug Ther. Bull. 1991; 29: 77-8, 3) Moore R.A. Systematic and economical review for Livial. In: Rymer J (Ed.), Livial: A review of clinical studies. Br. J. Gynaecol. 1999; 106 (3 Suppl. 19) 1).
Другим фармакологическим важным классом 7α-метилстероидов является 7α -метил-19-нортестостерон (MENTTM) и относящиеся к нему сложные эфиры в 17-положении (WO99/67271), которые являются синтетическими андрогенами, разработанными для гормональной заместительной терапии и для регулирования оплодотворяющей способности спермы. Исследования показали, что (MENTTM) является более сильнодействующим, чем мужской гормон тестостерон, в сохранении мышечной массы, потенции и либидо и в его способности подавлять продуцирование спермы. Кроме того, MENTTM не увеличивает простату на столько же, насколько это делает тестостерон, что может привести к безопасному лекарственному использованию. (1) Ogawa, S., et al. 1996; 30: 74-84. Hormones and Behavior, 2) Robbins, A., et al. Society for Neuroscience Abstracts 1994; 20 (part 1): 376, 3) Sundaram, K., et al. Annals of Medicine 1993; 25: 199-205, 4) Morali, G. et al. Biology of Reproduction 1993; 49: 577-581). Третьим примером потенциального интересного стероида с метильной группой в 7-положении является цитрат 3-гидрокси-7α-метил-21-[2'-метокси-4'-(диэтиламинометил)фенокси]-19-норпрегна-1,3,5(10)-триена (SR 16234), который является селективным модулятором рецептора эстрогена (SERM), который, как обнаружено, обладает сильнодействующей противоопухолевой активностью с тканеселективными свойствами и проявляет антагонист-антиэстрогенную активность в опухолевых клетках молочной железы человека. (1) WO 01/58919 А2, 2) WO 99/33859 А2, 3) US 6281205 B1, 4) US 20020032180 A1).
С точки зрения химического синтеза, стереоселективное введение заместителей у С-7 является ключевым превращением для представителей этого важного класса стероидов в совокупности. В соответствии с литературой введение алкильной группы в 7-положение скелета стероида обычно выполняют а) катализируемым хлоридом меди(I) или ацетатом меди(II) 1,6-сопряженным присоединением алкилмагнийгалогенов к 4,6-ненасыщенным 3-кетостероидам или b) сопряженным присоединением медьлитийалкильных реагентов к 4,6-ненасыщенным 3-кетостероидам. Однако обычно указанные способы дают смеси 7α- и 7β-алкилстероидов (1) Modi, S.P. et al, J. Org. Chem. 1989; 54: 2317-2321, 2) Grunwell, J. F. Steroids, 1976; 27: 6, 759, 3) Campbell, J.A. et al., J. Am. Chem. Soc. 1959; 81: 4069, 4) Grunwell, J. F., et al., Steroids, 1976; 27: 750, 5) патент США 3798213, 6) van Vliet N.P., et al. Recl. Trav. Chim. Pays-Bas 1986; 105: 111) с отношением α:β, составляющим от 1,5:1 до 9:1. Отделение фармакологических интересных 7α-изомеров от сопутствующих нежелательных 7β -изомеров, которые являются менее эффективными ингибиторами ферментов (O'Reilly, J.M. et al. J. Med. Chem. 1995; 38: 2842), может быть достигнуто только хроматографическим разделением или в трудоемких процедурах обработки многократной перекристаллизацией. Обе операции значительно снижают выход нужного 7α-изомера.
В WO 01/58919 4,6-ненасыщенный 3-кетостероид алкилируют в 7-положении метиллитием в присутствии бромида лития. В данном случае указывают, что стереоселективность данного 7-алкилирования повышается после защиты имеющейся гидроксильной группы образованием тетрагидропиридилового эфира, предположительно посредством образования комплекса с литием в пользу присоединения с α-стороны стероида. К сожалению, несмотря на повышение селективности, в этом последнем способе высокая способность ацетатной защитной группы взаимодействовать с метиллитием отражается в только умеренном, 67% выходе 7α-метилстероида.
Были разработаны альтернативные способы введения 7-алкильных групп, но они в целом не являются пригодными. Может быть введен только ограниченный набор алкильных групп, способ ограничивается синтезом стероидов с ароматическим А-кольцом, или требуются дополнительные стадии реакции, что делает эти способы обычно неэффективными. Например, 7α-замещенные эстрадиолы были получены превращением 6-кетоэстрадиолов в 6-(фенилсульфонил)-6-дегидроэстрадиол, который испытывает сопряженное присоединение литийорганических реагентов к С-7-положению с последующими дополнительными стадиями для удаления сульфоновой группы. (Kunzer, H. et al. Tetrahedron Lett. 1994; 35:11, 1691). В более позднем подходе 7α-замещенные эстрадиолы были получены алкилированием 6-кетоэстрадиолов с последующим деоксигенированием и снятием защиты эфиратом трифторида бора и триэтилсиланом. (Tedesco, R. et al. Tetrahedron Lett. 1997; 38: 46, 7997). В WO 01/58919 6-кетоэстрадиол алкилируют в 7-положении взаимодействием с метилиодидом в присутствии литийдиизопропиламина с последующим каталитическим удалением 6-кетона с использованием водорода и платины и палладия; сообщается, что стереоселективность данного 7-алкилирования повышается после защиты присутствующей гидроксильной группы превращением в ТНР-эфир (тетрагидропиридиловый эфир), предположительно за счет стерического затруднения с β -стороны стероида. В DE 4018828 А описано, что 7α-метилэстрадиолы были получены последовательностью реакций из 8,9-ненасыщенных эстрадиолов: взаимодействием с формальдегидом в присутствии кислот Льюиса с последующим каталитическим гидрированием, тозилированием и восстановлением. В ЕР 0262201 B1 описывается получение 7α-пропилстероидов из 4,6-ненасыщенных 3-кетостероидов реакцией Sakurai с аллилтриалкилсиланами или с соединениями типа аллилтриалкилолова в присутствии кислот Льюиса с последующим селективным гидрированием с использованием трис(трифенилфосфин)родий(I)хлорида (катализатор Вилкинсона) (см. также Nickisch, K; Laurent, H. Tetrahedron Lett. 1988; 29: 13, 1533).
Следовательно, основным требованием в синтезе 7-алкилстероидов является регулирование диастереоселективности опосредованного медью 1,6-сопряженного присоединения, которое является наиболее прямым способом введения 7-алкильных групп.
В соответствии с настоящим изобретением, теперь обнаружен способ получения 7α-метилстероидов формулы I

где R1 представляет собой водород, метил или С≡СН,
R2 представляет собой (СН2)nOH, где n равно 0, 1 или 2;
опосредованным медью 1,6-сопряженным присоединением реактива Гриньяра СН3MgX, причем Х является галогеном (Cl, Br или I) к 4,6-ненасыщенному 3-кетостероиду формулы II
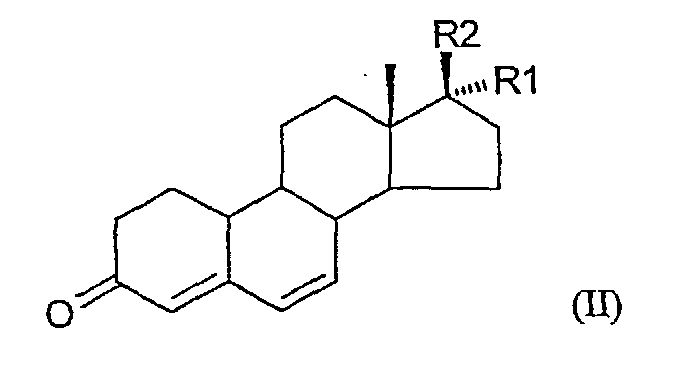
где R1 и R2 имеют значения, указанные выше, включающий защиту гидроксигруппы стероида формулы II триалкилсилильной группой с последующей обработкой гидроксизащищенного стероида реактивом Гриньяра.
Способ изобретения приводит к существенному повышению растворимости стероидного субстрата, делает возможным повышение концентрации стероидных субстратов в указанном способе (возможен диапазон концентраций, но концентрация стероида, предпочтительно, составляет от 0,1 до 0,3 молярной) и неожиданно проявляет заметно повышенную стереоселективность в пользу нужного 7α-изомера. Уровни нежелательного 7β-изомера снижаются до уровня ниже 2,5%, что представляет собой более чем шестикратное улучшение в селективности (приблизительно от 6:1 до 39:1).
Хотя триалкилсилильная защита гидроксигруппы в способе, где вводили 7α-этильную группу, была ранее описана (WO 01/05806), указанная селективность была только 85:15 (α:β).
R1, предпочтительно, представляет собой водород, метил или С≡СН и R2 представляет собой ОН или R1 представляет собой водород и R2 представляет собой (СН2)2ОН. Более предпочтительно, когда R2 представляет собой ОН, R1 представляет собой водород или С≡СН.
Предпочтительным реактивом Гриньяра, который используют в способе изобретения, является СН3MgCl. Реакцию Гриньяра в способе по изобретению можно проводить в нескольких растворителях или смесях растворителей, которые хорошо известны специалисту в данной области, таких как тетрагидрофуран, диметоксиэтан, диэтиловый эфир, моно- и диглим (1,2-диметоксиэтан и диметиловый эфир диэтиленгликоля, соответственно), толуол и тому подобное. Предпочтительным растворителем является тетрагидрофуран или диэтиловый эфир либо смесь этих растворителей. Тетрагидрофуран является наиболее предпочтительным растворителем.
Реактив Гриньяра используют в эквимолярном или в избыточном количестве относительно стероида. Молярное отношение стероида к реактиву Гриньяра составляет 1:1-1:7.
Стадия, в которой триалкилсилильную защитную группу вводят в соответствии со способом по изобретению, может быть объединена с реакцией 1,6-сопряженного присоединения, что позволяет сохранять повышенную стереоселективность в пользу нужного 7α-изомера и без снижения выхода. Используемый здесь термин «алкил» означает (1-4С)алкильную группу, являющуюся неразветвленной или разветвленной алкильной группой, имеющей 1-4 атома углерода, в частности, метилом или этилом. Предпочтительными защитными группами являются триметилсилил или триэтилсилил, наиболее предпочтительно, триметилсилил.
В способе данного изобретения для катализирования реакции Гриньяра используют медный катализатор, такой как ацетат меди(II), хлорид меди(II), бромид меди(II), иодид меди(II) и тому подобное. Предпочтительные катализаторы выбирают из ацетата меди(II) или хлорида меди(II). Наиболее предпочтительным катализатором является ацетат меди(II). Температура реакции Гриньяра в способе по изобретению не является очень критической, но должна поддерживаться на низком уровне, предпочтительно, между -78°С и 0°С. Предпочтительный температурный диапазон составляет от -35°С до -25°С.
Данный новый способ впервые делает доступным прямой подход для повышения стереоселективности катализируемого медью 1,6-сопряженного присоединения метилмагнийгалогенов к гидроксилированным 4,6-ненасыщенным 3-кетостероидам. Следовательно, трудоемкие процедуры обработки посредством затруднительных хроматографических разделений или многократной перекристаллизации являются ненужными.
В подходящем способе изобретения 4,6-ненасыщенный гидрокси-3-кетостероид обрабатывают триалкилсилильным реагентом для защиты функциональной гидроксигруппы, после чего раствор силилзащищенного стероида добавляют к смеси медного катализатора и реактива Гриньяра в подходящем растворителе, после чего смесь перемешивают в течение некоторого периода времени с последующим удалением защитной группы. Удаление триалкилсилильной группы протекает в обычных условиях, необходимых для сопряжения в 4-ненасыщенные 3-кетостероиды, что приводит к осуществлению эффективной одностадийной процедуры. В подходящем случае способ заканчивают обработкой кислотой как для удаления триалкилсилильной группы, так и приведения 3,5-ненасыщенного магнийенолята в равновесие с требуемыми 7α-метилстероидами формулы I.
Способ изобретения, в частности, пригоден для получения 7α-метилстероида (7α,17α )-17-гидрокси-7-метил-19-норпрегн-4-ен-20-ин-3-она, подходящего для получения (7α,17α)-17-гидрокси-7-метил-19-норпрегн-5(10)-ен-20-ин-3-она (тиболона), для получения 7α -метил-19-нортестостерона (MENT) и для получения (7α)-21-гидрокси-7-метил-19-норпрегн-4-ен-3-она, подходящего для получения цитрата 3-гидрокси-7α -метил-21-[2'-метокси-4'-(диэтиламинометил)фенокси]-19-норпрегна-1,3,5(10)-триена (SR 16234). Для сравнения, без введения триалкилсилильной защитной группы MENT получали катализируемым медью 1, 6-конъюгатным присоединением из 17β-17-гидроксиэстра-4,6-диен-3-она с выходом приблизительно 55%, с 7α,β-отношением 85:15 (в соответствии с процедурами, описанными в US 5342834; FR 4521 М). Выделение 7α-изомера можно было достичь только многократной перекристаллизацией соответственно из гептана и водного ацетона, что понижает общий выход до невысоких 44%. В подходящем способе в соответствии с данным изобретением введение триметилсилильной защитной группы перед реакцией 1,6-сопряженного присоединения повышает общий выход MENT до 79%, что является улучшением общего выхода на 80%.
Следующей целью настоящего изобретения является соединение 21-гидрокси-19-норпрегн-4,6-диен-3-он, который является подходящим промежуточным продуктом для использования в способе настоящего изобретения для получения (7α)-21-гидрокси-7-метил-19-норпрегн-4-ен-3-она, который, в свою очередь, является подходящим для получения цитрата 3-гидрокси-7α -метил-21-[2'-метокси-4'-(диэтиламинометил)фенокси]-19-норпрегна-1,3,5(10)-триена (SR 16234).
Изобретение дополнительно иллюстрируется следующими примерами, которые не предназначаются для какого-либо ограничения изобретения.
ПРИМЕРЫ
ПРИМЕР 1
7α-Метил-19-нортестостерон (MENT)
Хлортриметилсилан (34,4 мл, 370 ммоль) добавляют по каплям в атмосфере азота при 20°С к раствору (17β)-17-гидроксиэстра-4,6-диен-3-она (25 г, 92 ммоль) (Wettstein, A. Helv. Chim. Acta, 1940; 23: 388) и триэтиламина (50 мл, 350 ммоль) в безводном тетрагидрофуране (250 мл). Образовавшуюся смесь перемешивают при кипячении с обратным холодильником в течение 2 час. Реакционную смесь охлаждают до комнатной температуры, добавляют воду (125 мл) и смесь экстрагируют толуолом (250 мл). Объединенный органический слой промывают 10% водным раствором хлорида натрия (125 мл) и упаривают при пониженном давлении, получая при этом 17-триметилсилилоксизамещенный промежуточный продукт в виде остаточного твердого вещества, которое без выделения растворяют в безводном тетрагидрофуране (250 мл). Данный раствор добавляют при -30°С в течение 2 час к смеси ацетата меди(II) (2,58 г, 12,5 ммоль) и 3 М раствора метилмагнийхлорида (61,6 г, 185 ммоль) в тетрагидрофуране (120 мл) и оранжево-красный раствор перемешивают при -30°С в течение 1 часа. Затем реакционную смесь выливают в раствор серной кислоты (36,5 мл, 681 ммоль) и воды (500 мл) и перемешивают при 40°С в течение 2,5 часа. Ацетат натрия добавляют до рН 3,5 и смесь экстрагируют этилацетатом (260 мл) и промывают водным хлоридом аммония (83 мл, 10%). После удаления растворителей упариванием при пониженном давлении добавляют водный ацетон (150 мл, 50%) и при -10°С кристаллизуют 7α-метил-19-нортестостерон (MENT) (19,6 г, 79%) (в соответствии с US 5342834; FR 4521 М) с 7α,β -отношением 99:1.1Н-ЯМР (400 МГц, CDCl3): δ 5,68 (шир. т, 1Н, С(4)Н), 3,54 (т, 1Н, С(17)Н), 2,37-0,88 (м, 19Н), 0,66 (с, 3Н, С(18)Н3), 0,61 (д, 3Н, С(7)СН3).
ПРИМЕР 2
(7α,17α)-17-Гидрокси-7-метил-19-норпрегн-4-ен-20-ин-3-он
Хлортриметилсилан (6,28 мл, 67,5 ммоль) добавляют по каплям в атмосфере азота при 20°С к раствору (17α)-17-гидрокси-19-норпрегна-4,6-диен-20-ин-3-она (5,0 г, 17 ммоль) (GB 935116) и пиридина (11,4 мл, 142 ммоль) в безводном тетрагидрофуране (50 мл). Образовавшуюся смесь перемешивают при кипячения с обратным холодильником в течение 2,5 часов. Реакционную смесь охлаждают до комнатной температуры, добавляют воду (25 мл) и смесь экстрагируют толуолом (50 мл). Объединенный органический слой промывают водным метанолом (25 мл, 70%) и упаривают при пониженном давлении, получая при этом 17-триметилсилилоксизамещенный промежуточный продукт в виде остаточного твердого вещества, которое без выделения растворяют в безводном тетрагидрофуране (110 мл). Данный раствор добавляют при -30°С в течение 2 часов к смеси ацетата меди(II) (0,58 г, 2,9 ммоль) и 3 М раствора метилмагнийхлорида (40 г, 118 ммоль) в тетрагидрофуране (50 мл) и перемешивают при -30°С в течение 1 часа. Затем реакционную смесь выливают в раствор серной кислоты (6,8 мл, 126 ммоль) и водного тетрагидрофурана (160 мл, 15%) и перемешивают при 20°С в течение 8 час. Добавляют ацетат натрия до рН 3,5 и после удаления растворителей упариванием при пониженном давлении кристаллизуют (7α,17α)-17-гидрокси-7-метил-19-норпрегн-4-ен-20-ин-3-он (5,2 г, 99%) (в соответствии с литературой: Van Vliet, N.P., et al. Recl. Trav. Chim. Pays-Bas, 1986; 105: 111) c 7α,β-отношением 95:5.1Н-ЯМР (400 МГц, CDCl3): δ 5,86 (шир. т, 1Н, С(4)Н), 2,59 (с, 1Н, С(21)Н), 2,52-0,86 (м, 19Н), 0,94 (с, 3Н, С(18)Н3), 0,79 (д, 3Н, С(7)СН3).
ПРИМЕР 3
21-Гидрокси-19-норпрегн-4,6-диен-3-он
4-Толуолсульфоновую кислоту (100 мг, 0,56 ммоль) добавляют в атмосфере азота при -5°С к суспензии 21-гидрокси-19-норпрегна-4-ен-3-она (30,0 г, 99,2 ммоль) (WO 01/58919) и триэтилортоформиата (22,1 мл, 133 ммоль) в этаноле (60 мл). После перемешивания в течение 2 час при 0°С реакционную смесь гасят триэтиламином (0,22 мл, 1,6 ммоль) и нагревают при кипячении с обратным холодильником в течение 15 мин. Реакционную смесь разбавляют этанолом (50 мл), этилацетатом (1,0 л), водой (500 мл) и дихлорметаном (500 мл). Органический слой отделяют, водный слой экстрагируют (дихлорметан, 2 х 250 мл) и объединенные органические слои концентрируют в вакууме. Раствор остатка (50 г) в ТГФ (140 мл) добавляют к суспензии хлоранила (26 г, 106 ммоль) в метаноле (140 мл), воде (19 мл), уксусной кислоте (5,1 мл) и пиридине (1,9 мл) при 20°С. После перемешивания при такой температуре в течение 2 час реакционную смесь гасят раствором гидроксида натрия (42 г, 1,05 моль) и гидросульфита натрия (4,9 г, 28 ммоль) в воде (490 мл). Водный слой экстрагируют (дихлорметан, 3 х 500 мл), объединенные органические слои промывают до нейтрального значения рН (вода, 4 х 100 мл) и концентрируют в вакууме, получая при этом 21-гидрокси-19-норпрегн-4, 6-диен-3-он (25,0 г, 84%). Продукт очищают колоночной хроматографией и кристаллизуют из этилацетата (10,9 г, 37%).1Н ЯМР (400 МГц, CDCl3): δ 6,25-6,17 (АВХ dq, 2Н, С(6)Н и С(7)Н), 5,76 (шир. д, 1Н, С(4)Н), 3,73-3,58 (м, 2Н, С(21)Н2ОН), 2,50-1,08 (м, 19Н), 0,69 (с, 3Н, С(18)Н3).
(7α )-21-Гидрокси-7-метил-19-норпрегн-4-ен-3-он
Хлортриметилсилан (2,0 мл, 33,3 ммоль) добавляют по каплям в атмосфере азота при 20°С к суспензии 21-гидрокси-19-норпрегна-4, 6-диен-3-она (5,0 г, 17 ммоль) и триэтиламина (12 мл, 80 ммоль) в безводном тетрагидрофуране (100 мл). Образовавшуюся смесь перемешивают при кипячения с обратным холодильником в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры, добавляют воду (50 мл), органический слой отделяют и водный слой экстрагируют толуолом (25 мл). Объединенные органические слои концентрируют в вакууме, получая при этом сырой промежуточный продукт - силиловый простой эфир (11 г). Раствор силилового простого эфира в тетрагидрофуране (121 мл) добавляют в течение 45 мин к раствору ацетата меди (285 мг, 2,86 ммоль) и метилмагнийхлорида (3,0 М раствор в ТГФ, 38,8 мл, 116 ммоль) в ТГФ (45 мл) при -20°С. После перемешивания в течение 1 часа при такой температуре реакционную смесь гасят раствором серной кислоты (6,7 г, 68 ммоль) в воде (125 мл) и ТГФ (25 мл). После перемешивания в течение 17 час при 20°С реакционную смесь перегоняют для удаления ТГФ и продукт экстрагируют дихлорметаном (3 х 50 мл). После концентрирования в вакууме (7α)-21-гидрокси-7-метил-19-норпрегн-4-ен-3-он получают в виде аморфного твердого вещества (5,2 г, 99%) (в соответствии с литературой WO 01/58919) с 7α,β-отношением 95:5.1Н-ЯМР (400 МГц, CDCl3): δ 5,85 (шир. т, 1Н, С(4)Н), 3,75-3,57 (м, 2Н, С(21)Н2ОН), 2,50-0,97 (м, 22Н), 0,77 (д, 3Н, С(7)СН3), 0,67 (с, 3Н, С(18)Н3).
Реферат
Изобретение относится к улучшенному способу получения 7α-метилстероидов общей формулы I, где R1 - Н, -СН3 или -С≡СН, R2 - (СН2)nОН, n=0, 1 или 2; опосредованным медью (предпочтительно ацетатом или хлоридом Cu(II)) 1,6-сопряженным присоединением реактива Гриньяра CH3MgX, где Х - галоген к 4,6-ненасыщенному 3-кетостероиду формулы II, где R1 и R2 имеют вышеуказанные значения, причем гидроксигруппа стероида формулы II защищена триалкилсилильной группой с последующей его обработкой реактивом Гриньяра и удалением защитной группы. Способ повышает стереоселективность по выходу 7α-изомера. 2 н. и 16 з.п.ф-лы.
Формула


Комментарии