Нейроактивные стероиды, композиции и их применения - RU2699359C2
Код документа: RU2699359C2
Чертежи















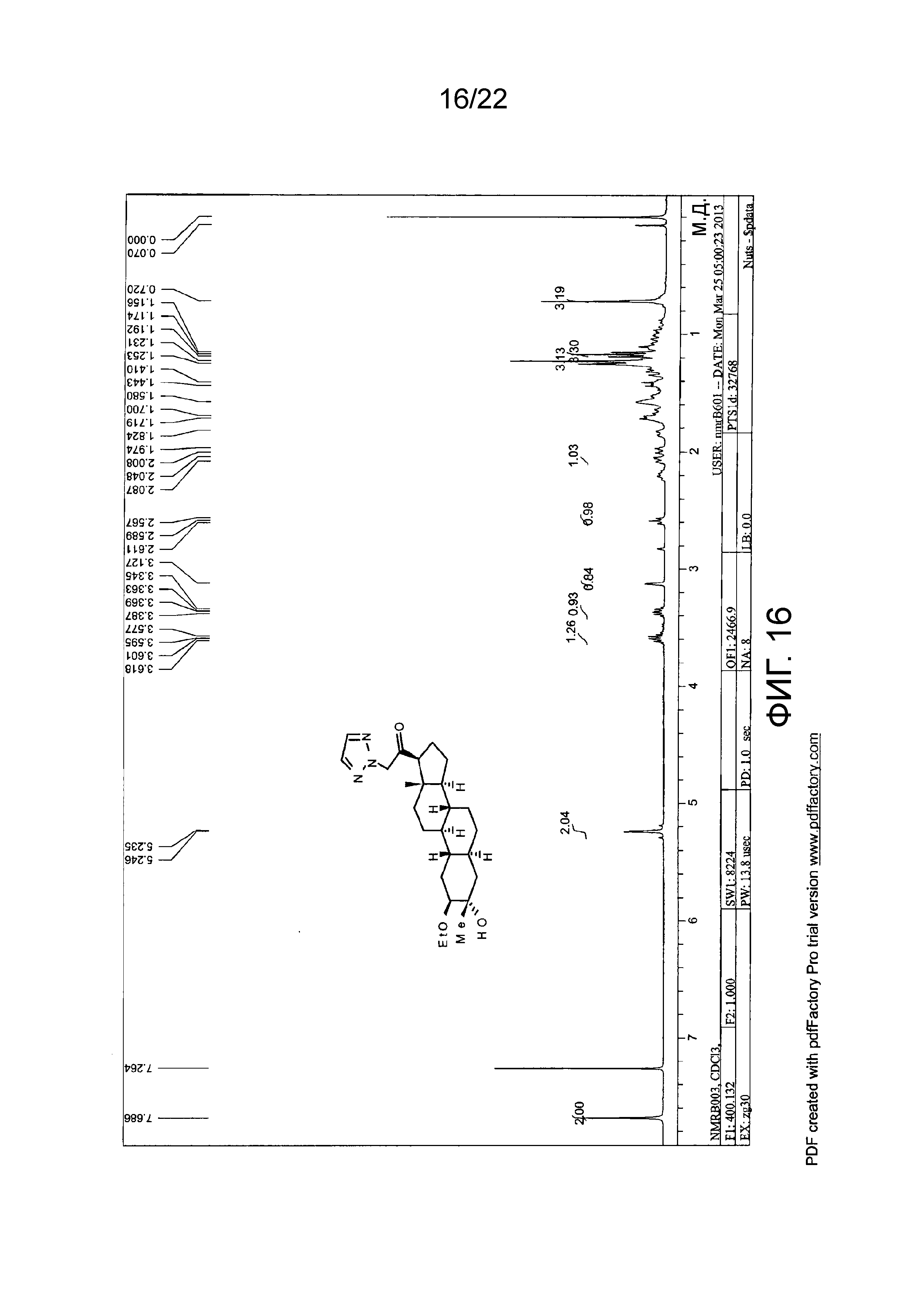






Описание
Родственные заявки
Настоящая заявка заявляет приоритет международной заявки № РСТ/CN2014/078820, поданной 29 мая 2014, полностью включенной в настоящее описание в качестве ссылки.
Предпосылки создания изобретения
Возбудимость головного мозга определяют как уровень возбуждения животного, континуум которого колеблется от комы до конвульсий и регулируется различными нейротрансмиттерами. Как правило, нейротрансмиттеры ответственны за регуляцию проводимости ионов через нейронные мембраны. В покое нейронная мембрана обладает потенциалом (или мембранной разностью потенциалов) приблизительно -70 мВ, где внутренняя часть клетки является отрицательной по отношению к наружной части. Потенциал (разность потенциалов) является результатом инонного баланса (K+, Na+, Cl-, органические ионы) через нейронную полупроницаемую мембрану. Нейротрансмиттеры хранятся в пресинаптических везикулах и высвобождаются под влиянием потенциалов действия нейронов. При высвобождении в синаптическую щель химический трансмиттер возбуждения, такой как ацетилхолин, будет вызывать деполяризацию мембраны (изменение потенциала от -70 мВ до -50 мВ). Такой эффект опосредуется постсинаптическими никотиновыми рецепторами, которые стимулируются ацетилхолином с повышением проницаемости мембраны для ионов Na+. Пониженный мембранный потенциал стимулирует возбудимость нейронов в форме постсинаптического потенциала действия.
В случае комплекса рецепторов GABA (GRC) действие на возбудимость головного мозга опосредуется GABA как нейротрансмиттером. GABA имеет глубокое влияние на общую возбудимость головного мозга, поскольку до 40% нейронов в головном мозгу используют GABA как нейротрансмиттер. GABA регулирует возбудимость отдельных нейронов путем регуляции проводимости хлорид-ионов через нейронную мембрану. GABA взаимодействует со своим сайтом узнавания на GRC для облегчения тока хлорид-ионов вниз по электрохимическому градиенту GRC в клетку. Внутриклеточное повышение уровней этого аниона вызывает гиперполяризацию трансмембранного потенциала, делая нейрон менее чувствительным к факторам возбудимости (т.е. пониженную возбудимость нейронов). Иными словами, чем выше концентрация хлорид-иона в нейроне, тем ниже возбудимость головного мозга (уровень возбуждения).
Документально хорошо подтверждено, что GRC ответственен за посредничество в тревоге, эпилептическую активность и седативный эффект. Таким образом, GABA и лекарственные средства, которые действуют как GABA или способствуют действиям GABA (например, терапевтически применимые барбитураты и бензодиазепины (BZ), такие как валиум®), оказывают свое терапевтически полезное действие путем взаимодействия со специфическими регуляторными сайтами GRC. Накопленные данные теперь показывают, что кроме сайта связывания бензодиазепинов и барбитуратов GRC содержит отдельный сайт для нейроактивных стероидов (Lan N. C. et al., Neurochem. Res., 16: 347-356 (1991)).
Нейроактивные стероиды могут иметь место эндогенно. Наиболее сильными эндогенными нейроактивными стероидами являются 3α-гидрокси-5-восстановленный прегнан-20-он и 3α-21-дигидрокси-5-восстановленный прегнан-20-он - метаболиты гормональных стероидов прогестерона и дезоксикортикостерона соответственно. Способность этих стероидных метаболитов изменять возбудимость головного мозга выяснена в 1986 (Majewska M. D. et al., Science, 232: 1004-1007 (1986); Harrison N. L. et al., J. Pharmacol. Exp. Ther., 241: 346-353 (1987)).
Показано, что гормон яичников прогестерон и его метаболиты оказывают глубокое действие на возбудимость головного мозга (Backstrom T. et al., Acta Obstet. Gynecol. Scand. Suppl., 130: 19-24 (1985); Pfaff D.W and McEwen B. S., Science, 219: 808-814 (1983); Gyermek et al., J. Med. Chem., 11: 117 (1968); Lambert J. et al., Trends Pharmacol. Sci., 8: 224-227 (1987)). Уровни прогестерона и его метаболитов изменяются с фазами менструального цикла. Документально хорошо подтверждено, что уровни прогестерона и его метаболитов снижаются перед началом менструального цикла. Также хорошо подтвержден документально ежемесячный рецидив некоторых физических симптомов перед началом менструального цикла. Такие симптомы, которые связали с предменструальным синдромом (PMS), включают стресс, тревогу и мигреневые головные боли (Dalton K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)). Пациентки с PMS имеют ежемесячный рецидив симптомов, которые имеют место перед менструацией и отсутствуют после менструации.
Подобным образом, снижение уровня прогестерона также по времени коррелирует с возрастанием частоты припадков у женщин, больных эпилепсией, т.е. катамениальной эпилепсией (Laidlaw J., Lancet, 1235-1237 (1956)). Более четкую корреляцию наблюдают с уменьшением уровней метаболитов прогестерона (Rosciszewska et al., J. Neurol. Neurosurg. Psych., 49: 47-51 (1986)). Кроме того, у больных с первичной генерализованной малой эпилепсией временное число случаев припадков коррелирует с числом случаев симптомов предменструального синдрома (Backstrom T. et al., J. Psychosom. Obstet. Gynaecol., 2: 8-20 (1983)). Обнаружено, что стероид дезоксикортикостерон эффективен при лечении больных с эпилептическими приступами, коррелирующими с их менструальными циклами (Aird R.B. and Gordan G., J. Amer. Med. Soc., 145: 715-719 (1951)).
Синдромом, также связанным с низкими уровнями прогестерона, является постнатальная депрессия (PND). Сразу после родов уровни прогестерона падают существенно, что ведет к началу PND. Симптомы PND колеблются от умеренной депрессии до психоза, требующего госпитализации. PND также ассоциируется с сильной тревогой и раздражимостью. PND-ассоциированная депрессия не поддается лечению классическими антидепрессантами, и у женщин, испытывающих PND, отмечается повышенная заболеваемость PMS (Dalton K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)).
В целом такие наблюдения предполагают ключевую роль прогестерона и дезоксикортикостерона и особенно их метаболитов в гомеостатической регуляции возбудимости головного мозга, что проявляется как повышение эпилептической активности или симптомов, связанных с катамениальной эпилепсией, PMS и PND. Корреляция между пониженными уровнями прогестерона и симптомами, связанными с PMS, PND и катамениальной эпилепсией (Backstrom T. et al., J. Psychosom. Obstet. Gynaecol., 2: 8-20 (1983)); Dalton K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)), подсказала применение прогестерона при их лечении (Mattson et al., ʺMedroxyprogesterone therapy of catamenial epilepsy,ʺ в Advances in Epileptology: XVth Epilepsy International Symposium, Raven Press, New York (1984), pp. 279-282, и Dalton K., Premenstrual Syndrome and Progesterone Therapy, 2nd edition, Chicago Yearbook, Chicago (1984)). Однако прогестерон не является сообразно эффективным при лечении вышеуказанных синдромов. Например, для прогестерона не существует соотношения доза-реакция при лечении PMS (Maddocks et al., Obstet. Gynecol., 154: 573-581 (1986); Dennerstein et al., Brit. Med. J., 290:16-17 (1986)).
Требуются новые и улучшенные нейроактивные стероиды, которые действуют как модуляторы для возбудимости головного мозга, а также как средства для предотвращения и лечения связанных с ЦНС заболеваний. Соединения, композиции и способы, описанные в настоящем описании, предназначены для такой цели.
Сущность изобретения
Настоящее изобретение основано на получении новых 19-нор- (т.е. С19-десметил-) соединений, например, родственных прогестерону, дезоксикортикостерону и их метаболитам, с хорошей действенностью, фармакокинетическими свойствами (РК), пероральной биодоступностью, возможностью получения лекарственных средств, устойчивостью, безопасностью и/или метаболизмом. Одной из ключевых особенностей соединений, описанных в настоящем описании, является дизамещение в положении С3 (где, например, один заместитель представляет собой 3α-гидроксигруппу). Предвиденное авторами изобретения дизамещение в С-3 будет устранять возможность окисления гидроксигруппы до кетона, предотвращать дальнейший метаболизм и уменьшать возможность вторичного исключения путей метаболизма, таких как глюкуронирование. Авторы изобретения также предполагают, что общее действие дизамещения в С3 должно улучшить все РК параметры и уменьшить возможную токсичность и побочное действие, что может допустить, в некоторых воплощениях, пероральное введение и/или постоянное введение. Другой ключевой особенностью соединений, описанных в настоящем описании, является присутствие водорода в положении С19 («19-нор»), а не в метильной группе. Авторы изобретения предполагают, что 19-нор-соединения, по сравнению с их С19-метил-аналогами, будут иметь улучшенные физические свойства, такие как улучшенная растворимость. Авторы изобретения также предполагают улучшение растворимости, например, когда циклическая система АВ находится в цис-конфигурации.
Таким образом, в одном аспекте изобретение относится к 19-нор-С3,3-дизамещенным С21-триазол- и теразолстероидам формулы (I)

и их фармацевтически приемлемым солям; где в указанной формуле А выбирают из группы

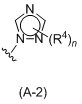
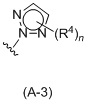

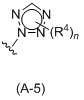
Стероиды формулы (I), их виды и их фармацевтически приемлемые соли все вместе называются в настоящем описании «соединениями по настоящему изобретению».
В другом аспекте изобретение относится к фармацевтической композиции, включающей соединение по настоящему изобретению и фармацевтически приемлемый эксципиент. В некоторых воплощениях соединение по настоящему изобретению вводят в фармацевтическую композицию в эффективном количестве. В некоторых воплощениях соединение по настоящему изобретению вводят в терапевтически эффективном количестве. В некоторых воплощениях соединение по настоящему изобретению вводят в профилактически эффективном количестве.
Соединения по настоящему изобретению, описанные в настоящем описании, в некоторых воплощениях действуют как модуляторы GABA, например, воздействуя на рецептор GABAА или положительным или отрицательным образом. Полагают, что как модуляторы возбудимости центральной нервной системы (ЦНС), что опосредуется их способностью модулировать рецептор GABAА, такие соединения обладают активностью в отношении ЦНС.
Таким образом, в другом аспекте изобретение относится к способам лечения связанного с ЦНС расстройства у пациента, нуждающегося в этом, включающим введение пациенту эффективного количества соединения по настоящему изобретению. В некоторых воплощениях связанное с ЦНС расстройство выбирают из группы, включающей расстройство сна, расстройство настроения, расстройство шизофренического спектра, конвульсивное расстройство, расстройство памяти и/или познания, нарушение движений, изменение личности, расстройство аутистического спектра, боль, травматическое повреждение головного мозга, сосудистое заболевание, расстройство злоупотребления веществами и/или синдром отмены и шум в ушах. В некоторых воплощениях соединение вводят перорально, подкожно, внутривенно или внутримышечно. В некоторых воплощениях соединение вводят длительно.
Другие цели и преимущества станут очевидны для специалистов в данной области техники при рассмотрении следующих далее подробного описания, примеров и формулы изобретения.
Определения
Химические определения
Определения конкретных функциональных групп и химических терминов подробнее описаны ниже. Химические элементы идентифицированы согласно Периодической таблице элементов, версия CAS, Handbook of Chemistry and Physics, 75th Ed., на внутренней стороне обложки, и конкретные функциональные группы определяются, как правило, как описано в настоящем разделе. Кроме того, основные принципы органической химии, а также определенные функциональные группы и реакционная способность описаны в Thomas Sorrell, Organic Chemistry, University Science Books, Sausalito, 1999; Smith and March, Marchʹs Advanced Organic Chemistry, 5th Edition, John Wiley & Sons, Inc., New York, 2001; Larock, Comprehensive Organic Transformations, VCH Publishers, Inc., New York, 1989; и в Carruthers, Some Modern Methods of Organic Synthesis, 3rd Edition, Cambridge University Press, Cambridge, 1987.
Соединения, описанные в настоящем описании, могут включать один или несколько асимметричных центров и, таким образом, могут существовать в различных изомерных формах, например, энантиомеров и/или диастереомеров. Например, соединения, описанные в настоящем описании, могут находиться в форме отдельного энантиомера, диастереомера или геометрического изомера, или могут находиться в форме смеси стереоизомеров, включая рацемические смеси и смеси, обогащенные одним или несколькими стереоизомерами. Изомеры можно выделить из смесей способами, известными специалистам в данной области техники, включая хиральную высокоэффективную жидкостную хроматографию (ВЭЖХ) и образование и кристаллизацию хиральных солей; или предпочтительные изомеры можно получить асимметричным синтезом. См., например, Jacques et al., Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen et al., Tetrahedron, 33: 2725 (1977); Eliel, Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962); и Wilen, Tables of Resolving Agents and Optical Resolutions, p. 268 (E.L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN 1972). Изобретение дополнительно охватывает соединения, описанные в настоящем описании, в виде отдельных изомеров, по существу свободных от других изомеров, и с другой стороны, смеси различных изомеров.
Когда приводится интервал величин, предполагается, что охватывается каждая величина и поддиапазон в пределах интервала. Например, предполагается, что «С1-6-алкил» охватывает C1, C2, C3, C4, C5, C6, C1-6, C1-5, C1-4, C1-3, C1-2, C2-6, C2-5, C2-4, C2-3, C3-6, C3-5, C3-4, C4-6, C4-5 и С5-6-алкил.
Предполагается, что следующие далее термины имеют значения, представленные сразу же ниже, и применимы для понимания описания и предполагаемого объема настоящего изобретения. При описании изобретения, которое может включать соединения, фармацевтические композиции, содержащие такие соединения, и способы применения таких соединений и композиций, приведенные далее термины, если они присутствуют, имеют следующие далее значения, если не указано иное. Также следует понимать, что при описании в настоящем описании любая из групп, определенных далее, может быть замещена различными заместителями, и предполагается, что соответствующие определения включают такие замещенные группы в своем объеме, определенном ниже. Если не установлено иное, термин «замещенный» следует определять так, как указано ниже. Также следует понимать, что термины «группы» и «радикалы» могут считаться взаимозаменяемыми, когда используются в настоящем описании. Неопределенные артикли могут использоваться в настоящем описании для обозначения одного или больше одного (т.е. по меньшей мере одного) грамматических объектов статьи. Например, «аналог» с неопределенным артиклем обозначает один аналог или больше одного аналога.
«Алкил» относится к радикалу линейной или разветвленной насыщенной углеводородной группы, имеющей от 1 до 20 атомов углерода («С1-20-алкил»). В некоторых воплощениях алкильная группа имеет 1-12 атомов углерода («С1-12-алкил»). В некоторых воплощениях алкильная группа имеет 1-10 атомов углерода («С1-10-алкил»). В некоторых воплощениях алкильная группа имеет 1-9 атомов углерода («С1-9-алкил»). В некоторых воплощениях алкильная группа имеет 1-8 атомов углерода («С1-8-алкил»). В некоторых воплощениях алкильная группа имеет 1-7 атомов углерода («С1-7-алкил»). В некоторых воплощениях алкильная группа имеет 1-6 атомов углерода («С1-6-алкил»). В некоторых воплощениях алкильная группа имеет 1-5 атомов углерода («С1-5-алкил»). В некоторых воплощениях алкильная группа имеет 1-4 атома углерода («С1-4-алкил»). В некоторых воплощениях алкильная группа имеет 1-3 атома углерода («С1-3-алкил»). В некоторых воплощениях алкильная группа имеет 1-2 атома углерода («С1-2-алкил»). В некоторых воплощениях алкильная группа имеет 1 атом углерода («С1-алкил»). В некоторых воплощениях алкильная группа имеет 2-6 атомов углерода («С2-6-алкил»). Примеры С1-6-алкильных групп включают метил (С1), этил (С2), н-пропил (С3), изопропил (С3), н-бутил (С4), трет-бутил (С4), втор-бутил (С4), изобутил (С4), н-пентил (С5), 3-пентанил (С5), амил (С5), неопентил (С5), 3-метил-2-бутанил (С5), третичный амил (С5) и н-гексил (С6). Другие примеры алкильных групп включают н-гептил (С7), н-октил (С8) и т.п. Если не конкретизировано иное, в каждом случае алкильная группа является независимо необязательно замещенной, т.е. незамещенной («незамещенный алкил») или замещенной («замещенный алкил») одним или несколькими заместителями, например, от 1 до 5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых воплощениях алкильная группа представляет собой незамещенный С1-10-алкил (например, -СН3). В некоторых воплощениях алкильная группа представляет собой замещенный С1-10-алкил. Обычные аббревиатуры алкилов включают Me (-CH3), Et (-CH2CH3), изо-Pr (-CH(CH3)2), н-Pr (-CH2CH2CH3), н-Bu (-CH2CH2CH2CH3) или изо-Bu (-CH2CH(CH3)2).
При использовании в настоящем описании «алкилен», «алкенилен» и «алкинилен» относятся к двухвалентному радикалу алкильной, алкенильной и алкинильной группы, соответственно. Когда приводится интервал или число атомов углерода для определенной алкиленовой, алкениленовой и алкиниленовой группы, имеется в виду, что интервал или число относятся к интервалу или числу атомов углерода в линейной углеродной двухвалентной цепи. «Алкиленовые», «алкениленовые» и «алкиниленовые» группы могут быть незамещенными или замещенными одним или несколькими заместителями, описанными в настоящем описании.
«Алкилен» относится к алкильной группе, в которой два атома водорода удалены с образованием двухвалентного радикала, и которая может быть замещенной или незамещенной. Незамещенная алкиленовая группа включает, но не ограничивается перечисленным, метилен (-CH2-), этилен (-CH2CH2-), пропилен (-CH2CH2CH2-), бутилен (-CH2CH2CH2CH2-), пентилен (-CH2CH2CH2CH2CH2-), гексилен (-CH2CH2CH2CH2CH2CH2-) и т.п.. Примеры замещенных алкиленовых групп, например, замещенных одной или несколькими алкильными (метильными) группами, включают, но не ограничивается перечисленным, замещенный метилен (-CH(CH3)-, (-C(CH3)2-), замещенный этилен (-CH(CH3)CH2-,-CH2CH(CH3)-, -C(CH3)2CH2-,-CH2C(CH3)2-), замещенный пропилен (-CH(CH3)CH2CH2-, -CH2CH(CH3)CH2-, -CH2CH2CH(CH3)-, -C(CH3)2CH2CH2-, -CH2C(CH3)2CH2-, -CH2CH2C(CH3)2-) и т.п.
«Алкенил» относится к радикалу линейной или разветвленной углеводородной группы, имеющей от 2 до 20 атомов углерода, одну или несколько углерод-углеродных двойных связей (например, 1, 2, 3 или 4 углерод-углеродные двойные связи) и, необязательно, одну или несколько углерод-углеродных тройных связей (например, 1, 2, 3 или 4 углерод-углеродные тройные связи) («С2-20-алкенил»). В некоторых воплощениях алкенил не содержит тройные связи. В некоторых воплощениях алкенильная группа имеет 2-10 атомов углерода («С2-10-алкенил»). В некоторых воплощениях алкенильная группа имеет 2-9 атомов углерода («С2-9-алкенил»). В некоторых воплощениях алкенильная группа имеет 2-8 атомов углерода («С2-8-алкенил»). В некоторых воплощениях алкенильная группа имеет 2-7 атомов углерода («С2-7-алкенил»). В некоторых воплощениях алкенильная группа имеет 2-6 атомов углерода («С2-6-алкенил»). В некоторых воплощениях алкенильная группа имеет 2-5 атомов углерода («С2-5-алкенил»). В некоторых воплощениях алкенильная группа имеет 2-4 атома углерода («С2-4-алкенил»). В некоторых воплощениях алкенильная группа имеет 2-3 атома углерода («С2-3-алкенил»). В некоторых воплощениях алкенильная группа имеет 2 атома углерода («С2-алкенил»). Одна или несколько углерод-углеродных двойных связей могут быть внутренними (как в 2-бутениле) или концевыми (как в 1-бутениле). Примеры С2-4-алкенильных групп включают этенил (С2), 1-пропенил (С3), 2-пропенил (С3), 1-бутенил (С4), 2-бутенил (С4), бутадиенил (С4) и т.п. Примеры С2-6-алкенильных групп включают вышеуказанные С2-4-алкенильные группы, а также пентенил (С5), пентадиенил (С5), гексенил (С6) и т.п. Другие примеры алкенила включают гептенил (С7), октенил (С8), октадиенил (С8) и т.п. Если не указано иное, в каждом случае алкенильная группа является независимо необязательно замещенной, т.е. незамещенной («незамещенный алкенил») или замещенной («замещенный алкенил») одним или несколькими заместителями, например, от 1 до 5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых воплощениях алкенильная группа представляет собой незамещенный С2-10-алкенил. В некоторых воплощениях алкенильная группа представляет собой замещенный С2-10-алкенил.
«Алкенилен» относится к алкенильной группе, в которой два атома водорода удалены с образованием двухвалентного радикала, и которая может быть замещенной или незамещенной. Примеры незамещенных двухвалентных алкениленовых групп включают, но не ограничиваются перечисленным, этенилен (-CH=CH-) и пропенилен (например, -CH=CHCH2-, -CH2-CH=CH-). Примеры замещенных двухвалентных алкениленовых групп, например, замещенных одной или несколькими алкильными (метильными) группами, включают, но не ограничиваются перечисленным, замещенный этенилен (-C(CH3)=CH-, -CH=C(CH3)-), замещенный пропенилен (например, -C(CH3)=CHCH2-, -CH=C(CH3)CH2-, -CH=CHCH(CH3)-, -CH=CHC(CH3)2-, -CH(CH3)-CH=CH-,-C(CH3)2-CH=CH-, -CH2-C(CH3)=CH-, -CH2-CH=C(CH3)-) и т.п.
«Алкинил» относится к радикалу линейной или разветвленной углеводородной группы, имеющей от 2 до 20 атомов углерода, одну или несколько углерод-углеродных тройных связей (например, 1, 2, 3 или 4 углерод-углеродные тройные связи) и, необязательно, одну или несколько углерод-углеродных двойных связей (например, 1, 2, 3 или 4 углерод-углеродные двойные связи) («С2-20-алкинил»). В некоторых воплощениях алкинил не содержит двойные связи. В некоторых воплощениях алкинильная группа имеет 2-10 атомов углерода («С2-10-алкинил»). В некоторых воплощениях алкинильная группа имеет 2-9 атомов углерода («С2-9-алкинил»). В некоторых воплощениях алкинильная группа имеет 2-8 атомов углерода («С2-8-алкинил»). В некоторых воплощениях алкинильная группа имеет 2-7 атомов углерода («С2-7-алкинил»). В некоторых воплощениях алкинильная группа имеет 2-6 атомов углерода («С2-6-алкинил»). В некоторых воплощениях алкинильная группа имеет 2-5 атомов углерода («С2-5-алкинил»). В некоторых воплощениях алкинильная группа имеет 2-4 атома углерода («С2-4-алкинил»). В некоторых воплощениях алкинильная группа имеет 2-3 атома углерода («С2-3-алкинил»). В некоторых воплощениях алкинильная группа имеет 2 атома углерода («С2-алкинил»). Одна или несколько углерод-углеродных тройных связей могут быть внутренними (как в 2-бутиниле) или концевыми (как в 1-бутиниле). Примеры С2-4-алкинильных групп включают, без ограничения, этинил (С2), 1-пропинил (С3), 2-пропинил (С3), 1-бутинил (С4), 2-бутинил (С4) и т.п. Примеры С2-6-алкинильных групп включают вышеуказанные С2-4-алкинильные группы, а также пентинил (С5), гексинил (С6) и т.п. Другие примеры алкинила включают гептинил (С7), октинил (С8) и т.п. Если не указано иное, в каждом случае алкинильная группа является независимо необязательно замещенной, т.е. незамещенной («незамещенный алкинил») или замещенной («замещенный алкинил») одним или несколькими заместителями, например, от 1 до 5 заместителями, 1-3 заместителями или 1 заместителем. В некоторых воплощениях алкинильная группа представляет собой незамещенный С2-10-алкинил. В некоторых воплощениях алкинильная группа представляет собой замещенный С2-10-алкинил.
«Алкинилен» относится к алкинильной группе, в которой два атома водорода удалены с образованием двухвалентного радикала, и которая может быть замещенной или незамещенной. Примеры двухвалентных алкиниленовых групп включают, но не ограничиваются перечисленным, замещенный или незамещенный этинилен, замещенный или незамещенный пропинилен и т.п.
Термин «гетероалкил», используемый в настоящем описании, относится к алкильной группе, имеющей значения, указанные в настоящем описании, которая дополнительно включает 1 или несколько (например, 1, 2, 3 или 4) гетероатомов (например, атомов кислорода, серы, азота, бора, кремния, фосфора) в основной цепи, где один или несколько гетероатомов встроены между соседними атомами углерода в исходной углеродной цепи, и/или один или несколько гетероатомов встроены между атомом углерода и исходной молекулой, т.е. точкой присоединения. В некоторых воплощениях гетероалкильная группа относится к насыщенной группе, имеющей от 1 до 10 атомов углерода и 1, 2, 3 или 4 гетероатома («гетеро-С1-10-алкил»). В некоторых воплощениях гетероалкильная группа представляет собой насыщенную группу, имеющую 1-9 атомов углерода и 1, 2, 3 или 4 гетероатома («гетеро-С1-9-алкил»). В некоторых воплощениях гетероалкильная группа представляет собой насыщенную группу, имеющую 1-8 атомов углерода и 1, 2, 3 или 4 гетероатома («гетеро-С1-8-алкил»). В некоторых воплощениях гетероалкильная группа представляет собой насыщенную группу, имеющую 1-7 атомов углерода и 1, 2, 3 или 4 гетероатома («гетеро-С1-7-алкил»). В некоторых воплощениях гетероалкильная группа представляет собой насыщенную группу, имеющую 1-6 атомов углерода и 1, 2 или 3 гетероатома («гетеро-С1-6-алкил»). В некоторых воплощениях гетероалкильная группа представляет собой насыщенную группу, имеющую 1-5 атомов углерода и 1 или 2 гетероатома («гетеро-С1-5-алкил»). В некоторых воплощениях гетероалкильная группа представляет собой насыщенную группу, имеющую 1-4 атома углерода и 1 или 2 гетероатома («гетеро-С1-4-алкил»). В некоторых воплощениях гетероалкильная группа представляет собой насыщенную группу, имеющую 1-3 атома углерода и 1 гетероатом («гетеро-С1-3-алкил»). В некоторых воплощениях гетероалкильная группа представляет собой насыщенную группу, имеющую 1-2 атома углерода и 1 гетероатом («гетеро-С1-2-алкил»). В некоторых воплощениях гетероалкильная группа представляет собой насыщенную группу, имеющую 1 атом углерода и 1 гетероатом («гетеро-С1-алкил»). В некоторых воплощениях гетероалкильная группа представляет собой насыщенную группу, имеющую 2-6 атомов углерода и 1 или 2 гетероатома («гетеро-С2-6-алкил»). Если не указано иное, в каждом случае гетероалкильная группа независимо является незамещенной («незамещенный гетероалкил») или замещенной («замещенный гетероалкил») одним или несколькими заместителями. В некоторых воплощениях гетероалкильная группа представляет собой незамещенный гетеро-С1-10-алкил. В некоторых воплощениях гетероалкильная группа представляет собой замещенный гетеро-С1-10-алкил.
Термин «гетероалкенил», используемый в настоящем описании, относится к алкенильной группе, определенной в настоящем описании, которая дополнительно включает один или несколько (например, 1, 2, 3 или 4) гетероатомов (например, атомов кислорода, серы, азота, бора, кремния, фосфора) в основной цепи, где один или несколько гетероатомов встроены между соседними атомами углерода в исходной углеродной цепи, и/или один или несколько гетероатомов встроены между атомом углерода и исходной молекулой, т.е. точкой присоединения. В некоторых воплощениях гетероалкенильная группа относится к группе, имеющей от 2 до 10 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома («гетеро-С2-10-алкенил»). В некоторых воплощениях гетероалкенильная группа имеет 2-9 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома («гетеро-С2-9-алкенил»). В некоторых воплощениях гетероалкенильная группа имеет 2-8 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома («гетеро-С2-8-алкенил»). В некоторых воплощениях гетероалкенильная группа имеет 2-7 атомов углерода, по меньшей мере одну двойную связь и 1, 2, 3 или 4 гетероатома («гетеро-С2-7-алкенил»). В некоторых воплощениях гетероалкенильная группа имеет 2-6 атомов углерода, по меньшей мере одну двойную связь и 1, 2 или 3 гетероатома («гетеро-С2-6-алкенил»). В некоторых воплощениях гетероалкенильная группа имеет 2-5 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома («гетеро-С2-5-алкенил»). В некоторых воплощениях гетероалкенильная группа имеет 2-4 атома углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома («гетеро-С2-4-алкенил»). В некоторых воплощениях гетероалкенильная группа имеет 2-3 атома углерода, по меньшей мере одну двойную связь и 1 гетероатом («гетеро-С2-3-алкенил»). В некоторых воплощениях гетероалкенильная группа имеет 2-6 атомов углерода, по меньшей мере одну двойную связь и 1 или 2 гетероатома («гетеро-С2-6-алкенил»). Если не указано иное, в каждом случае гетероалкенильная группа независимо является незамещенной («незамещенный гетероалкенил») или замещенной («замещенный гетероалкенил») одним или несколькими заместителями. В некоторых воплощениях гетероалкенильная группа представляет собой незамещенный гетеро-С2-10-алкенил. В некоторых воплощениях гетероалкенильная группа представляет собой замещенный гетеро-С2-10-алкенил.
Термин «гетероалкинил», используемый в настоящем описании, относится к алкинильной группе, имеющей значения, указанные в настоящем описании, которая дополнительно включает один или несколько (например, 1, 2, 3 или 4) гетероатомов (например, атомов кислорода, серы, азота, бора, кремния, фосфора), где один или несколько гетероатомов встроены между соседними атомами углерода в исходной углеродной цепи, и/или один или несколько гетероатомов встроены между атомом углерода и исходной молекулой, т.е. точкой присоединения. В некоторых воплощениях гетероалкинильная группа относится к группе, имеющей от 2 до 10 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома («гетеро-С2-10-алкинил»). В некоторых воплощениях гетероалкинильная группа имеет 2-9 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома («гетеро-С2-9-алкинил»). В некоторых воплощениях гетероалкинильная группа имеет 2-8 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома («гетеро-С2-8-алкинил»). В некоторых воплощениях гетероалкинильная группа имеет 2-7 атомов углерода, по меньшей мере одну тройную связь и 1, 2, 3 или 4 гетероатома («гетеро-С2-7-алкинил»). В некоторых воплощениях гетероалкинильная группа имеет 2-6 атомов углерода, по меньшей мере одну тройную связь и 1, 2 или 3 гетероатома («гетеро-С2-6-алкинил»). В некоторых воплощениях гетероалкинильная группа имеет 2-5 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома («гетеро-С2-5-алкинил»). В некоторых воплощениях гетероалкинильная группа имеет 2-4 атома углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома («гетеро-С2-4-алкинил»). В некоторых воплощениях гетероалкинильная группа имеет 2-3 атома углерода, по меньшей мере одну тройную связь и 1 гетероатом («гетеро-С2-3-алкинил»). В некоторых воплощениях гетероалкинильная группа имеет 2-6 атомов углерода, по меньшей мере одну тройную связь и 1 или 2 гетероатома («гетеро-С2-6-алкинил»). Если не указано иное, в каждом случае гетероалкинильная группа независимо является незамещенной («незамещенный гетероалкинил») или замещенной («замещенный гетероалкинил») одним или несколькими заместителями. В некоторых воплощениях гетероалкинильная группа представляет собой незамещенный гетеро-С2-10-алкинил. В некоторых воплощениях гетероалкинильная группа представляет собой замещенный гетеро-С2-10-алкинил.
Используемые в настоящем описании термины «алкилен», «алкенилен», «алкинилен», «гетероалкилен», «гетероалкенилен» и «гетероалкинилен» относятся к двухвалентным радикалам алкильной, алкенильной, алкинильной группы, гетероалкильной, гетероалкенильной и гетероалкинильной группы соответственно. Когда приводятся интервал или число атомов углерода для определенной «алкиленовой», «алкениленовой», «алкиниленовой», «гетероалкиленовой», «гетероалкениленовой» или «гетероалкиниленовой» группы, следует иметь в виду, что интервал или число атомов углерода относятся к интервалу или числу атомов углерода в линейной углеродной двухвалентной цепи. «Алкиленовые», «алкениленовые», «алкиниленовые», «гетероалкиленовые», «гетероалкениленовые» и «гетероалкиниленовые» группы могут быть незамещенными или замещенными одним или несколькими заместителями, описанными в настоящем описании.
«Арил» относится к радикалу моноциклической или полициклической (например, бициклической или трициклической) 4n+2 ароматической циклической системы (например, имеющей 6, 10 или 14 π-электронов, распределенных в циклической структуре), имеющей 4-14 циклических атомов углерода и ноль гетероатомов, предусмотренных в ароматической циклической системе («С6-14-арил»). В некоторых воплощениях арильная группа имеет шесть циклических атомов углерода («С6-арил»; например, фенил). В некоторых воплощениях арильная группа имеет десять циклических атомов углерода («С10-арил»; например, нафтил, такой как 1-нафтил и 2-нафтил). В некоторых воплощениях арильная группа имеет четырнадцать циклических атомов углерода («С14-арил»; например, антрацил). «Арил» также включает циклические системы, в которых арильный цикл, определенный выше, конденсирован с одной или несколькими карбоциклическими или гетероциклическими группами, где радикал или точка присоединения находится в арильном цикле, и в таких случаях число атомов углерода остается обозначаюшим число атомов углерода в арильной циклической системе. Типичные арильные группы включают, но не ограничиваются перечисленным, группы, происходящие от ацеантрилена, аценафтилена, ацефенатрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, гексацена, гексафена, гексалена, as-ундацена, s-ундецена, индана, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плейадена, пирена, рубицена, трифенилена и тринафталина. В особенности, арильные группы включают фенил, нафтил, инденил и тетрагидронафтил. Если не указано иное, в каждом случае арильная группа является независимо необязательно замещенной, т.е. незамещенной («незамещенный арил») или замещенной («замещенный арил») одним или несколькими заместителями. В некоторых воплощениях арильная группа представляет собой незамещенный С6-14-арил. В некоторых воплощениях арильная группа представляет собой замещенный С6-14-арил.
В некоторых воплощениях арильная группа замещена одной или несколькими группами, выбранными из галогена, (С1-С8)алкила, (С1-С8)галогеналкила, циано, гидрокси, (С1-С8)алкокси и амино.
Примеры характерных замещенных арилов включают следующие группы:

в которых один из R56 и R57 может представлять собой водород, и по меньшей мере один из R56 и R57, каждый независимо, выбран из (С1-С8)алкила, (С1-С8)галогеналкила, 4-10-членного гетероциклила, алканоила, (С1-С8)алкокси, гетероарилокси, алкиламино, ариламино, гетероариламино, NR58COR59, NR58SOR59, NR58SO2R59, COO-алкила, COO-арила, CONR58R59, CONR58OR59, NR58R59, SO2NR58R59, S-алкила, SO-алкила, SO2-алкила, S-арила, SO-арила, SO2-арила; или R56 и R57 могут соединяться с образованием цикла (насыщенного или ненасыщенного) из 5-8 атомов, необязательно содержащего один или несколько гетероатомов, выбранных из N, O или S. R60 и R61 представляют собой независимо водород, (С1-С8)алкил, (С1-С4)галогеналкил, (C3-C10)циклоалкил, 4-10-членный гетероциклил, (C6-C10)арил, замещенный (C6-C10)арил, 5-10-членный гетероарил или замещенный 5-10-членный гетероарил.
Другие характерные арильные группы, имеющие конденсированную гетероциклическую группу, включают следующие группы:

в которых каждый W выбирают из C(R66)2, NR66, O и S; и каждый Y выбирают из карбонила, NR66, O и S; и R66 представляет собой независимо водород, (С1-С8)алкил, (C3-C10)циклоалкил, 4-10-членный гетероциклил, (C6-C10)арил и 5-10-членный гетероарил.
«Конденсированный арил» относится к арилу, имеющему два своих циклических атома углерода, общих со вторым арильным или гетероарильным циклом или с карбоциклической или гетероциклической группой.
«Аралкил» является комбинацией алкила и арила, имеющих значения, указанные в настоящем описании, и относится к необязательно замещенной алкильной группе, замещенной необязательно замещенной арильной группой.
«Гетероарил» относится к радикалу 5-10-членного моноциклического или бициклического 4n+2 ароматической циклической системы (например, имеющей 6 или 10 π-электронов, распределенных в циклической структуре), имеющей циклические атомы углерода и 1-4 гетероатома, предусмотренных в ароматической циклической системе, где каждый гетероатом выбран независимо из атомов азота, кислорода и серы («5-10-членный гетероарил»). В гетероарильных группах, которые содержат один или больше атомов азота, точка присоединения может представлять собой атом углерода или азота, как позволяет валентность. Гетероарильные бициклические системы могут включать один или несколько гетероатомов в одном или обоих циклах. «Гетероарил» включает циклические системы, в которых гетероарильный цикл, определенный выше, конденсирован с одной или несколькими карбоциклическими или гетероциклическими группами, где точка присоединения находится в гетероарильном цикле, и в таких случаях число атомов углерода остается обозначающим число атомов углерода в гетероарильной циклической системе. «Гетероарил» также включает циклические системы, в которых гетероарильный цикл, определенный выше, конденсирован с одной или несколькими арильными группами, где точка присоединения находится или в арильном или в гетероарильном цикле, и в таких случаях число атомов углерода обозначает число циклических атомов в конденсированной (арил/гетероарил) циклической системе. В бициклических гетероарильных группах, в которых один цикл не содержит гетероатом (например, индолил, хинолинил, карбазолил и т.п.), точка присоединения может находиться в любом цикле, т.е. или в цикле, содержащем гетероатом (например, в 2-индолиле), или в цикле, который не содержит гетероатом (например, в 5-индолиле).
В некоторых воплощениях гетероарильная группа представляет собой 5-10-членную ароматическую циклическую систему, имеющую циклические атомы углерода и 1-4 циклических гетероатома, предусмотренных в ароматической циклической системе, где каждый гетероатом выбирают независимо из атомов азота, кислорода и серы («5-10-членный гетероарил»). В некоторых воплощениях гетероарильная группа представляет собой 5-8-членную ароматическую циклическую систему, имеющую циклические атомы углерода и 1-4 циклических гетероатома, предусмотренных в ароматической циклической системе, где каждый гетероатом выбирают независимо из атомов азота, кислорода и серы («5-8-членный гетероарил»). В некоторых воплощениях гетероарильная группа представляет собой 5-6-членную ароматическую циклическую систему, имеющую циклические атомы углерода и 1-4 циклических гетероатома, предусмотренных в ароматической циклической системе, где каждый гетероатом выбирают независимо из атомов азота, кислорода и серы («5-6-членный гетероарил»). В некоторых воплощениях 5-6-членный гетероарил имеет 1-3 циклических гетероатома, выбранных из атомов азота, кислорода и серы. В некоторых воплощениях 5-6-членный гетероарил имеет 1-2 циклических гетероатома, выбранных из атомов азота, кислорода и серы. В некоторых воплощениях 5-6-членный гетероарил имеет 1 циклический гетероатом, выбранный из атомов азота, кислорода и серы. Если не указано иное, в каждом случае гетероарильная группа является независимо необязательно замещенной, т.е. незамещенной («незамещенный гетероарил») или замещенной («замещенный гетероарил») одним или несколькими заместителями. В некоторых воплощениях гетероарильная группа представляет собой незамещенный 5-14-членный гетероарил. В некоторых воплощениях гетероарильная группа представляет собой замещенный 5-14-членный гетероарил.
Примеры 5-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения, пирролил, фуранил и тиофенил. Примеры 5-членных гетероарильных групп, содержащих два гетероатома, включают, без ограничения, имидазолил, пиразолил, оксазолил, изоксазолил, тиазолил и изотиазолил. Примеры 5-членных гетероарильных групп, содержащих три гетероатома, включают, без ограничения, триазолил, оксадиазолил и тиадиазолил. Примеры 5-членных гетероарильных групп, содержащих четыре гетероатома, включают, без ограничения, тетразолил. Примеры 6-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения, пиридинил. Примеры 6-членных гетероарильных групп, содержащих два гетероатома, включают, без ограничения, пиридазинил, пиримидинил и пиразинил. Примеры 6-членных гетероарильных групп, содержащих три или четыре гетероатома, включают, без ограничения, триазинил и тетразинил, соответственно. Примеры 7-членных гетероарильных групп, содержащих один гетероатом, включают, без ограничения, азепинил, оксепинил и тиепинил. Примеры 5,6-членных бициклических гетероарильных групп включают, без ограничения, индолил, изоиндолил, индазолил, бензотриазолил, бензотиофенил, изобензотиофенил, бензофуранил, бензоизофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензоксадиазолил, бензтиазолил, бензизотиазолил, бензтиадиазолил, индолизинил и пуринил. Примеры 6,6-членных бициклических гетероарильных групп включают, без ограничения, нафтиридинил, птеридинил, хинолинил, изохинолинил, циннолинил, хиноксалинил, фталазинил и хиназолинил.
Примеры характерных гетероарилов включают следующие группы:

в которых каждый Y выбирают из карбонила, N, NR65, O и S; и R65 представляет собой независимо водород, (C1-C8)алкил, (C3-C10)циклоалкил, 4-10-членный гетероциклил, (C6-C10)арил и 5-10-членный гетероарил.
«Гетероаралкил» представляет собой комбинацию алкила и гетероарила, определенных в настоящем описании, и относится к необязательно замещенной алкильной группе, замещенной необязательно замещенной гетероарильной группой.
«Карбоциклил» или «карбоциклический» относится к радикалу неароматической циклической углеводородной группы, имеющей от 3 до 10 циклических атомов углерода («С3-10-карбоциклил») и ноль гетероатомов в неароматической циклической системе. В некоторых воплощениях карбоциклильная группа имеет 3-8 циклических атомов углерода («С3-8-карбоциклил»). В некоторых воплощениях карбоциклильная группа имеет 3-6 циклических атомов углерода («С3-6-карбоциклил»). В некоторых воплощениях карбоциклильная группа имеет 5-10 циклических атомов углерода («С5-10-карбоциклил»). Примеры С3-6-карбоциклильных групп включают, без ограничения, циклопропил (С3), циклопропенил (С3), циклобутил (С4), циклобутенил (С4), циклопентил (С5), циклопентенил (С5), циклогексил (С6), циклогексенил (С6), циклогексадиенил (С6) и т.п. Примеры С3-8-карбоциклильных групп включают, без ограничения, вышеуказанные С3-6-карбоциклильные группы, а также циклогептил (С7), циклогептенил (С7), циклогептадиенил (С7), циклогептатриенил (С7), циклооктил (С8), циклооктенил (С8), бицикло[2.2.1]гептанил (С7), бицикло[2.2.1]октанил (С8) и т.п. Примеры С3-10-карбоциклильных групп включают, без ограничения, вышеуказанные С3-8-карбоциклильные группы, а также циклононил (С9), циклононенил (С9), циклодецил (С10), циклодеценил (С10), октагидро-1Н-инденил (С9), декагидронафталинил (С10), спиро[4.5]деканил (С10) и т.п. Как поясняют приведенные выше примеры, в некоторых воплощениях карбоциклильная группа является или моноциклической («моноциклический карбоциклил») или содержит конденсированную, мостиковую или спироциклическую систему, такую как бициклическая система («бициклический карбоциклил»), и может быть насыщенной или может быть частично ненасыщенной. «Карбоциклил» также включает циклические системы, в которых карбоциклильный цикл, определенный выще, конденсирован с одной или несколькими арильными или гетероарильными группами, где точка присоединения находится в карбоциклильном цикле, и в таких случаях число атомов углерода остается обозначающим число атомов углерода в карбоциклической системе. Если не указано иное, в каждом случае карбоциклильная группа является независимо необязательно замещенной, т.е. незамещенной («незамещенный карбоциклил») или замещенной («замещенный карбоциклил») одним или несколькими заместителями. В некоторых воплощениях карбоциклильная группа представляет собой незамещенный С3-10-карбоциклил. В некоторых воплощениях карбоциклильная группа представляет собой замещенный С3-10-карбоциклил.
В некоторых воплощениях «карбоциклил» представляет собой моноциклическую насыщенную карбоциклильную группу, имеющую от 3 до 10 циклических атомов углерода («С3-10-циклоалкил»). В некоторых воплощениях циклоалкильная группа имеет 3-8 циклических атомов углерода («С3-8-циклоалкил»). В некоторых воплощениях циклоалкильная группа имеет 3-6 циклических атомов углерода («С3-6-циклоалкил»). В некоторых воплощениях циклоалкильная группа имеет 5-6 циклических атомов углерода («С5-6-циклоалкил»). В некоторых воплощениях циклоалкильная группа имеет 5-10 циклических атомов углерода («С5-10-циклоалкил»). Примеры С5-6-циклоалкильных групп включают циклопентил (С5) и циклогексил (С6). Примеры С3-6-циклоалкильных групп включают вышеуказанные С5-6-циклоалкильные группы, а также циклопропил (С3) и циклобутил (С4). Примеры С3-8-циклоалкильных групп включают вышеуказанные С3-6-циклоалкильные группы, а также циклогептил (С7) и циклооктил (С8). Если не указано иное, в каждом случае циклоалкильная группа является независимо необязательно замещенной, т.е. незамещенной («незамещенный циклоалкил») или замещенной («замещенный циклоалкил») одним или несколькими заместителями. В некоторых воплощениях циклоалкильная группа представляет собой незамещенный С3-10-циклоалкил. В некоторых воплощениях циклоалкильная группа представляет собой замещенный С3-10-циклоалкил.
«Гетероциклил» или «гетероциклический» относится к радикалу 3-10-членной неароматической циклической системы, имеющей циклические атомы углерода и 1-4 циклических гетероатома, где каждый гетероатом выбирают независимо из атомов азота, кислорода, серы, бора, фосфора и кремния («3-10 членный гетероциклил»). В гетероциклильной группе, которая содержит один или больше атомов азота, точка присоединения может находиться у атома углерода или атома азота, как допускает валентность. Гетероциклильная группа может быть или моноциклической («моноциклический гетероциклил») или конденсированной, мостиковой или спироциклической системой, такой как бициклическая система («бициклический гетероциклил»), и может быть насыщенной или может быть частично ненасыщенной. Гетероциклильные бициклические системы могут включать один или несколько гетероатомов в одном или обоих циклах. «Гетероциклил» также включает циклические системы, в которых гетероциклильный цикл, определенный выше, конденсирован с одной или несколькими карбоциклильными группами, в которых точка присоединения находится или в карбоциклильном или гетероциклильном цикле, или циклические системы, в которых гетероциклильный цикл, определенный выше, конденсирован с одной или несколькими арильными или гетероарильными группами, в которых точка присоединения находится в гетероциклильном цикле, и в таких случаях число атомов углерода остаются определяющим число членов в гетероциклильной циклической системе. Если не указано иное, в каждом случае гетероциклильная группа является независимо необязательно замещенной, т.е. незамещенной («незамещенный гетероциклил») или замещенной («замещенный гетероциклил») одним или несколькими заместителями. В некоторых воплощениях гетероциклильная группа представляет собой незамещенный 3-10-членный гетероциклил. В некоторых воплощениях гетероциклильная группа представляет собой замещенный 3-10-членный гетероциклил.
В некоторых воплощениях гетероциклильная группа представляет собой 5-10-членную неароматическую циклическую систему, имеющую циклические атомы углерода и 1-4 циклических гетероатома, где каждый гетероатом выбирают независимо из атомов азота, кислорода, серы, бора, фосфора и кремния («5-10 членный гетероциклил»). В некоторых воплощениях гетероциклильная группа представляет собой 5-8-членную неароматическую циклическую систему, имеющую циклические атомы углерода и 1-4 циклических гетероатома, где каждый гетероатом выбирают независимо из атомов азота, кислорода и серы («5-8 членный гетероциклил»). В некоторых воплощениях гетероциклильная группа представляет собой 5-6-членную неароматическую циклическую систему, имеющую циклические атомы углерода и 1-4 циклических гетероатома, где каждый гетероатом выбирают независимо из атомов азота, кислорода и серы («5-6 членный гетероциклил»). В некоторых воплощениях 5-6-членный гетероциклил имеет 1-3 циклических гетероатома, выбранных из атомов азота, кислорода и серы. В некоторых воплощениях 5-6-членный гетероциклил имеет 1-2 циклических гетероатома, выбранных из атомов азота, кислорода и серы. В некоторых воплощениях 5-6-членный гетероциклил имеет один циклический гетероатом, выбранный из атомов азота, кислорода и серы.
Примеры 3-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения, азирдинил, оксиранил, тиоренил. Примеры 4-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения, азетидинил, оксетанил и тиетанил. Примеры 5-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения, тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил, пирролидинил, дигидропирролил и пирролил-2,5-дион. Примеры 5-членных гетероциклильных групп, содержащих два гетероатома, включают, без ограничения, диоксоланил, оксасульфуранил, дисульфуранил и оксазолидин-2-он. Примеры 5-членных гетероциклильных групп, содержащих три гетероатома, включают, без ограничения, триазолинил, оксадиазолинил и тиадиазолинил. Примеры 6-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения, пиперидинил, тетрагидропиранил, дигидропиридинил и тианил. Примеры 6-членных гетероциклильных групп, содержащих два гетероатома, включают, без ограничения, пиперазинил, морфолинил, дитианил, диоксанил. Примеры 6-членных гетероциклильных групп, содержащих два гетероатома, включают, без ограничения, триазинанил. Примеры 7-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения, азепанил, оксепанил и тиепанил. Примеры 8-членных гетероциклильных групп, содержащих один гетероатом, включают, без ограничения, азоканил, оксеканил и тиоканил. Примеры 5-членных гетероциклильных групп, конденсированных с С6-арильным циклом (также называемых в настоящем описании 5,6-бициклическим гетероциклическим циклом), включают, без ограничения, индолинил, изоиндолинил, дигидробензофуранил, дигидробензотиенил, бензоксазолинонил и т.п.. Примеры 6-членных гетероциклильных групп, конденсированных с арильным циклом (также называемых в настоящем описании 6,6-бициклическим гетероциклическим циклом), включают, без ограничения, тетрагидрохинолинил, тетрагидроизохинолинил и т.п.
Отдельные примеры гетероциклильных групп показаны в следующих далее пояснительных примерах

в которых W выбирают из CR67, C(R67)2, NR67, O и S; и каждый Y выбирают из NR67, O и S; и R67 представляет собой независимо водород, (С1-С8)алкил, (С3-С10)циклоалкил, 4-10-членный гетероциклил, (С6-С10)арил, 5-10-членный гетероарил. Такие гетероциклилы могут быть необязательно замещены одной или несколькими группами, выбранными из группы, включающей ацил, ациламино, ацилокси, алкокси, алкоксикарбонил, алкоксикарбониламино, амино, замещенный амино, аминокарбонил (карбамоил или амидо), аминокарбониламино, аминосульфонил, сульфониламино, арил, арилокси, азидо, карбоксил, циано, циклоалкил, галоген, гидрокси, кето, нитро, тиол, -S-алкил, -S-арил, -S(О)-алкил, -S-(О)-арил, -S(О)2-алкил и -S-(О)2-арил. Замещающие группы включают карбонил или тиокарбонил, которые дают, например, производные лактама и мочевины.
«Гетеро» при использовании для описания соединения или группы, присутствующей в соединении, означает, что один или больше атомов углерода в соединении или группе заменены атомом азота, кислорода или серы. Гетеро можно применить к любой из углеводородных групп, описанных выше, таких как алкил, например, гетероалкил, циклоалкил, например, гетероциклил, арил, например, гетероарил, циклоалкенил, например, циклогетероалкенил, и т.п., имеющих от 1 до 5, и в частности, от 1 до 3 гетероатомов.
«Ацил» относится к радикалу -С(О)R20, где R20 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, определенные в настоящем описании. «Алканоил» представляет собой ацильную группу, в которой R20 представляет собой группу иную, чем водород. Характерные ацильные группы включают, но не ограничиваются перечисленным, формил (-CHO), ацетил (-C(=O)CH3), циклогексилкарбонил, циклогексилметилкарбонил, бензоил (-C(=O)Ph), бензилкарбонил (-C(=O)CH2Ph), -C(O)-(C1-C8)алкил, -C(O)-(CH2)t((C6-C10)арил), -C(O)-(CH2)t(5-10-членный гетероарил), -C(O)-(CH2)t((C3-C10)циклоалкил) и -C(O)-(CH2)t(4-10-членный гетероциклил), в которых t равен целому числу от 0 до 4. В некоторых воплощениях R21 представляет собой (C1-C8)алкил, замещенный галогеном или гидрокси; или (C3-C10)циклоалкил, 4-10-членный гетероциклил, (C6-C10)арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным (C1-C4)алкилом, галогеном, незамещенным (C1-C4)алкокси, незамещенным (C1-C4)галогеналкилом, незамещенным (C1-C4)гидроксиалкилом или незамещенным (C1-C4)галогеналкокси или гидрокси.
«Ациламино» относится к радикалу -NR22C(O)R23, где в каждом случае R22 и R23 представляет собой независимо водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, определенные в настоящем описании, или R22 представляет собой аминозащитную группу. Примеры групп «ациламино» включают, но не ограничиваются перечисленным, формиламино, ацетиламино, циклогексилкарбониламино, циклогексилметилкарбониламино, бензоиламино и бензилкарбониламино. Конкретными примерами групп «ациламино» являются -NR24C(O)-(C1-C8)алкил, -NR24C(O)-(CH2)t((C6-C10)арил), -NR24C(O)-(CH2)t(5-10-членный гетероарил), -NR24C(O)-(CH2)t((C3-C10)циклоалкил) и -NR24C(O)-(CH2)t(4-10-членный гетероциклил), в которых t равен целому числу от 0 до 4, и каждый R24 представляет собой независимо Н или (C1-C8)алкил. В некоторых воплощениях R25 представляет собой Н, (C1-C8)алкил, замещенный галогеном или гидрокси; (C3-C10)циклоалкил, 4-10-членный гетероциклил, (C6-C10)арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным (C1-C4)алкилом, галогеном, незамещенным (C1-C4)алкокси, незамещенным (C1-C4)галогеналкилом, незамещенным (C1-C4)гидроксиалкилом или незамещенным (C1-C4)галогеналкокси или гидрокси, и R26 представляет собой Н, (C1-C8)алкил, замещенный галогеном или гидрокси; (C3-C10)циклоалкил, 4-10-членный гетероциклил, (C6-C10)арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным (C1-C4)алкилом, галогеном, незамещенным (C1-C4)алкокси, незамещенным (C1-C4)галогеналкилом, незамещенным (C1-C4)гидроксиалкилом или незамещенным (C1-C4)галогеналкокси или гидроксилом; при условии, что по меньшей мере один из R25 и R26 является иным, чем Н.
«Ацилокси» относится к радикалу -ОС(О)R27, где R27 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил, определенные в настоящем описании. Характерные примеры включают, но не ограничиваются перечисленным, формил, ацетил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил и бензилкарбонил. В некоторых воплощениях R28 представляет собой (C1-C8)алкил, замещенный галогеном или гидрокси; (C3-C10)циклоалкил, 4-10-членный гетероциклил, (C6-C10)арил, арилалкил, 5-10-членный гетероарил или гетероарилалкил, каждый из которых замещен незамещенным (C1-C4)алкилом, галогеном, незамещенным (C1-C4)алкокси, незамещенным (C1-C4)галогеналкилом, незамещенным (C1-C4)гидроксиалкилом или незамещенным (C1-C4)галогеналкокси или гидрокси.
«Алкокси» относится к группе -OR29, где R29 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил или замещенный или незамещенный гетероарил. Определенные алкоксигруппы включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, трет-бутокси, втор-бутокси, н-пентокси, н-гексокси и 1,2-диметилбутокси. Определенные алкоксигруппы представляют собой низшие алкокси, т.е. с числом атомов углерода от 1 до 6. Другие определенные алкоксигруппы имеют от 1 до 4 атомов углерода.
В некоторых воплощениях R29 представляет собой группу, которая имеет 1 или больше заместителей, например, от 1 до 5 заместителей, и в частности, от 1 до 3 заместителей, в частности, 1 заместитель, выбранные из группы, включающей амино, замещенный амино, (С6-С10)арил, арилокси, карбоксил, циано, (С3-С10)циклоалкил, 4-10-членный гетероциклил, галоген, 5-10-членный гетероарил, гидроксил, нитро, тиоалкокси, тиоарилокси, тиол, алкил-S(O)-, арил-S(O)-, алкил-S(O)2-, арил-S(O)2-. Примеры групп «замещенный алкокси» включают, но не ограничиваются перечисленным, -O-(CH2)t(C6-C10)арил), -O-(CH2)t(5-10-членный гетероарил), -O-(CH2)t(C3-C10)циклоалкил) и -O-(CH2)t(4-10-членный гетероциклил), в которых t равен целому числу от 0 до 4, и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы сами могут быть замещены незамещенным (С1-С4)алкилом, галогеном, незамещенным (С1-С4)алкокси, незамещенным (С1-С4)галогеналкилом, незамещенным (С1-С4)гидроксиалкилом или незамещенным (С1-С4)галогеналкокси или гидрокси. Отдельными примерами групп «замещенный алкокси» являются -OCF3, -OCH2CF3, -OCH2Ph, -OCH2-циклопропил, -OCH2CH2OH и -OCH2CH2NMe2.
«Амино» относится к радикалу -NH2.
«Замещенный амино» относится к аминогруппе формулы -N(R38)2, где R38 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или аминозащитную группу, где по меньшей мере один R38 не является водородом. В некоторых воплощениях каждый R38 выбирают независимо из водорода, (С1-С8)алкила, (С3-С8)алкенила, (С3-С8)алкинила, (С6-С10)арила, 5-10-членного гетероарила, 4-10-членного гетероциклила или (С3-С10)циклоалкила; или (С1-С8)алкила, замещенного галогеном или гидрокси; (С3-С8)алкинила, замещенного галогеном или гидрокси, или -(CH2)t((C6-C10)арила), -(CH2)t(5-10-членного гетероарила), -(CH2)t((C3-C10)циклоалкила) или -(CH2)t(4-10-членного гетероциклила), в которых t равен целому числу от 0 до 8, каждый из которых замещен незамещенным (C1-C4)алкилом, галогеном, незамещенным (C1-C4)алкокси, незамещенным (C1-C4)галогеналкилом, незамещенным (C1-C4)гидроксиалкилом или незамещенным (C1-C4)галогеналкокси или гидрокси; или обе группы R38 соединяются с образованием алкиленовой группы.
Примеры групп «замещенный амино» включают, но не ограничиваются перечисленным, -NR39-(C1-C8)алкил, -NR39-(CH2)t((C6-C10)арил),- NR39-(CH2)t(5-10-членный гетероарил), -NR39-(CH2)t((C3-C10)циклоалкил) и -NR39-(CH2)t(4-10-членный гетероциклил), в которых t равен целому числу от 0 до 4, например, 1 или 2, каждый R39 представляет собой независимо Н или (C1-C8)алкил; и любые присутствующие алкильные группы сами могут быть замещены галогеном, замещенным или незамещенным амино или гидрокси; и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы сами могут быть замещены незамещенным (C1-C4)алкилом, галогеном, незамещенным (C1-C4)алкокси, незамещенным (C1-C4)галогеналкилом, незамещенным (C1-C4)гидроксиалкилом или незамещенным (C1-C4)галогеналкокси или гидрокси. Для того, чтобы избежать сомнений, термин «замещенный амино» включает группы алкиламино, замещенный алкиламино, алкилариламино, замещенный алкилариламино, ариламино, замещенный ариламино, диалкиламино и замещенный диалкиламино, определенные ниже. Замещенный амино охватывает как группы монозамещенный амино, так и группы дизамещенный амино.
«Азидо» относится к радикалу -N3.
«Карбамоил» или «амидо» относится к радикалу -C(O)NH2.
«Замещенный карбамоил» или «замещенный амидо» относится к радикалу -C(O)N(R62)2, где каждый R62 представляет собой независимо водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный карбоциклил, замещенный или незамещенный гетероциклил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил или аминозащитную группу, где по меньшей мере один R62 не является водородом. В некоторых воплощениях каждый R62 выбирают из Н, (С1-С8)алкила, (С3-С10)циклоалкила, 4-10-членного гетероциклила, (С6-С10)арила, аралкила, 5-10-членного гетероарила и гетероаралкила; или (С1-С8)алкила, замещенного галогеном или гидрокси; или (С3-С10)циклоалкила, 4-10-членного гетероциклила, (С6-С10)арила, аралкила, 5-10-членного гетероарила и гетероарилалкила, каждый из которых замещен незамещенным (C1-C4)алкилом, галогеном, незамещенным (C1-C4)алкокси, незамещенным (C1-C4)галогеналкилом, незамещенным (C1-C4)гидроксиалкилом или незамещенным (C1-C4)галогеналкокси или гидрокси; при условии, что по меньшей мере один R62 является иным, чем Н.
Примеры «замещенных карбамоильных» групп включают, но не ограничиваются перечисленным, -C(O)NR64-(C1-C8)алкил, -C(O)NR64-(CH2)t((C6-C10)арил), -C(O)N64-(CH2)t(5-10-членный гетероарил), -C(O)NR64-(CH2)t((C3-C10)циклоалкил) и -C(O)NR64-(CH2)t(4-10-членный гетероциклил), в которых t равен целому числу от 0 до 4, каждый R64 представляет собой независимо H или (C1-C8)алкил, и любые присутствующие арильные, гетероарильные, циклоалкильные или гетероциклильные группы сами могут быть замещены незамещенным (C1-C4)алкилом, галогеном, незамещенным (C1-C4)алкокси, незамещенным (C1-C4)галогеналкилом, незамещенным (C1-C4)гидроксиалкилом или незамещенным (C1-C4)галогеналкокси или гидрокси.
«Карбокси» относится к радикалу -ОС(О)ОН.
«Циано» относится к радикалу -CN.
«Гало» или «галоген» относится к фтору (F), хлору (Cl), брому (Br) или иоду (I). В некоторых воплощениях галогеногруппа представляет собой или фтор или хлор.
«Гидрокси» относится к радикалу -ОН.
«Нитро» относится к радикалу -NO2.
«Циклоалкилалкил» относится к алкильному радикалу, в котором алкильная группа замещена циклоалкильной группой. Типичные циклоалкилалкильные группы включают, но не ограничиваются перечисленным, циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, циклогептилметил, циклооктилметил, циклопропилэтил, циклобутилэтил, циклопентилэтил, циклогексилэтил, циклогептилэтил и циклооктилэтил и т.п.
«Гетероциклилалкил» относится к алкильному радикалу, в котором алкильная группа замещена гетероциклильной группой. Типичные гетероциклилалкильные группы включают, но не ограничиваются перечисленным, пирролидиниметил, пиперидинилметил, пиперазинилметил, морфолинилметил, пирролидиниэтил, пиперидинилэтил, пиперазинилэтил, морфолинилэтил и т.п.
«Циклоалкенил» относится к замещенной или незамещенной карбоциклильной группе, имеющей от 3 до 10 атомов углерода, имеющей один цикл или несколько конденсированных циклов, включая конденсированные и мостиковые циклические системы, и имеющей по меньшей мере один и, в частности, от 1 до 2 сайтов олефиновой ненасыщенности. Такие циклоалкенильные группы включают, например, моноциклические структуры, такие как циклогексенил, циклопентенил, циклопропенил и т.п.
«Конденсированный циклоалкенил» относится к циклоалкенилу, имеющему два своих циклических атома углерода, общих со вторым алифатическим или ароматическим циклом, и имеющему свою олефиновую ненасыщенность, расположенную как разделяющую ароматичность с циклоалкенильным циклом.
«Этилен» относится к замещенному или незамещенному -(С-С)-.
«Этенил» относится к замещенному или незамещенному -(С=С)-.
«Этинил» относится к -(С≡С)-.
«Азотсодержащая гетероциклильная» группа обозначает 4-7-членную неароматическую циклическую группу, содержащую по меньшей мере один атом азота, например, но без ограничения, морфолин, пиперидин (например, 2-пиперидинил, 3-пиперидинил и 4-пиперидинил), пирролидин (например, 2-пирролидинил и 3-пирролидинил), азетидин, пирролидон, имидазолин, имидазолидинон, 2-пиразолин, пиразолидин, пиперазин и N-алкилпиперазин, такой как N-метилпиперазин. Отдельные примеры включают азетидин, пиперидон и пиперазон.
«Тиокето» относится к группе =S.
Алкильные, алкенильные, алкинильные, карбоциклильные, гетероциклильные, арильные и гетероарильные группы, определенные в настоящем описании, являются необязательно замещенными (как, например, «замещенная» или «незамещенная» алкильная, «замещенная» или «незамещенная» алкенильная, «замещенная» или «незамещенная» алкинильная, «замещенная» или «незамещенная» карбоциклильная, «замещенная» или «незамещенная» гетероциклильная, «замещенная» или «незамещенная» арильная или «замещенная» или «незамещенная» гетероарильная группа). Вообще термин «замещенный», предваряется ли он термином «необязательно» или нет, означает, что по меньшей мере один атом водорода, присутствующий в группе (например, у атома углерода или азота) заменен допустимым заместителем, например, заместителем, который после замещения приводит к устойчивому соединению, например, соединению, которое не претерпевает спонтанно трансформацию, такую как перегруппировка, циклизация, элиминирование, или другую реакцию. Если не указано иное, «замещенная» группа имеет заместитель в одном или нескольких возможных для замещения положениях в группе, и когда в любой данной структуре замещено более одного положения, заместитель в каждом положении является или одним и тем же или другим заместителем. Предполагается, что термин «замещенный» включает замещение всеми допустимыми заместителями органических соединений, любым из заместителей, описанных в настоящем описании, который приводит к образованию устойчивого соединения. Для целей настоящего изобретения гетероатомы, такие как атом азота, могут иметь водородные заместители и/или любой подходящий заместитель, описанный в настоящем описании, который удовлетворяет валентностям гетероатомов и приводит к образованию устойчивого соединения.
Примеры заместителей у атома углерода включают, но не ограничиваются перечисленным, галоген, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORaa, -ON(Rbb)2, -N(Rbb)2, -N(Rbb)3+X-, -N(ORcc)Rbb, -SH, -SRaa, -SSRcc, -C(=O)Raa, -CO2H, -CHO, -C(ORcc)2, -CO2Raa, -OC(=O)Raa, -OCO2Raa, -C(=O)N(Rbb)2, -OC(=O)N(Rbb)2, -NRbbC(=O)Raa, -NRbbCO2Raa, -NRbbC(=O)N(Rbb)2, -C(=NRbb)Raa, -C(=NRbb)ORaa, -OC(=NRbb)Raa, -OC(=NRbb)ORaa, -C(=NRbb)N(Rbb)2, -OC(=NRbb)N(Rbb)2, -NRbbC(=NRbb)N(Rbb)2, -C(=O)NRbbSO2Raa, -NRbbSO2Raa, -SO2N(Rbb)2, -SO2Raa, -SO2ORaa, -OSO2Raa, -S(O)Raa, например, -S(=O)Raa, -OS(=O)Raa, -Si(Raa)3, -OSi(Raa)3, -C(=S)N(Rbb)2, -C(=O)SRaa, -C(=S)SRaa, -SC(=S)SRaa, -SC(=O)SRaa, -OC(=O)SRaa, -SC(=O)ORaa, -SC(=O)Raa, -P(=O)2Raa, -OP(=O)2Raa, -P(=O)(Raa)2, -OP(=O)(Raa)2, -OP(=O)(ORcc)2, -P(=O)2N(Rbb)2, -OP(=O)2N(Rbb)2, -P(=O)(NRbb)2, -OP(=O)(NRbb)2, -NRbbP(=O)(ORcc)2, -NRbbP(=O)(NRbb)2, -P(Rcc)2, -P(Rcc)3, -OP(Rcc)2, -OP(Rcc)3, -B(Raa)2, -B(ORcc)2, -BRaa(ORcc), C1-10-алкил, C1-10-пергалогеналкил, C2-10-алкенил, C2-10-алкинил, C3-10-карбоциклил, 3-14-членный гетероциклил, C6-14-арил и 5-14-членный гетероарил, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил замещен независимо 0, 1, 2, 3, 4 или 5 группами Rdd;
или два соседних атома водорода у атома углерода заменяются группой =O, =S, =NN(Rbb)2, =NNRbbC(=O)Raa, =NNRbbC(=O)ORaa, =NNRbbS(=O)2Raa, =NRbb или =NORcc;
в каждом случае Raa выбирают независимо из C1-10-алкила, C1-10-пергалогеналкила, C2-10-алкенила, C2-10-алкинила, C3-10-карбоциклила, 3-14-членного гетероциклила, C6-14-арила и 5-14-членного гетероарила, или две группы Raa соединяются с образованием 3-14-членного гетероциклила или 5-14-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил замещен независимо 0, 1, 2, 3, 4 или 5 группами Rdd;
в каждом случае Rbb выбирают независимо из -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10-алкила, C1-10-пергалогеналкила, C2-10-алкенила, C2-10-алкинила, C3-10-карбоциклила, 3-14-членного гетероциклила, C6-14-арила и 5-14-членного гетероарила, или две группы Rbb соединяются с образованием 3-14-членного гетероциклила или 5-14-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил замещен независимо 0, 1, 2, 3, 4 или 5 группами Rdd;
в каждом случае Rсс выбирают независимо из водорода, C1-10-алкила, C1-10-пергалогеналкила, C2-10-алкенила, C2-10-алкинила, C3-10-карбоциклила, 3-14-членного гетероциклила, C6-14-арила и 5-14-членного гетероарила, или две группы Rсс соединяются с образованием 3-14-членного гетероциклила или 5-14-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил замещен независимо 0, 1, 2, 3, 4 или 5 группами Rdd;
в каждом случае Rdd выбирают независимо из галогена, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -ORee, -ON(Rff)2, -N(Rff)2, -N(Rff)3+X-, -N(ORee)Rff, -SH, -SRee, -SSRee, -C(=O)Ree, -CO2H, -CO2Ree, -OC(=O)Ree, -OCO2Ree, -C(=O)N(Rff)2, -OC(=O)N(Rff)2, -NRffC(=O)Ree, -NRffCO2Ree, -NRffC(=O)N(Rff)2, -C(=NRff)ORee, -OC(=NRff)Ree, -OC(=NRff)ORee, -C(=NRff)N(Rff)2, -OC(=NRff)N(Rff)2, -NRffC(=NRff)N(Rff)2,- NRffSO2Ree, -SO2N(Rff)2, -SO2Ree, -SO2ORee, -OSO2Ree, -S(O)Ree, например, -S(=O)Ree, -Si(Ree)3, -OSi(Ree)3, -C(=S)N(Rff)2, -C(=O)SRee, -C(=S)SRee, -SC(=S)SRee, -P(=O)2Ree, -P(=O)(Ree)2, -OP(=O)(Ree)2, -OP(=O)(ORee)2, C1-6-алкила, C1-6-пергалогеналкила, C2-6-алкенила, C2-6-алкинила, C3-10-карбоциклила, 3-10-членного гетероциклила, C6-10-арила и 5-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил замещен независимо 0, 1, 2, 3, 4 или 5 группами Rgg, или два соседних заместителя Rdd могут соединяться с образованием =O или =S;
в каждом случае Rее выбирают независимо из C1-6-алкила, C1-6-пергалогеналкила, C2-6-алкенила, C2-6-алкинила, C3-10-карбоциклила, C6-10-арила, 3-10-членного гетероциклила и 3-10-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил замещен независимо 0, 1, 2, 3, 4 или 5 группами Rgg;
в каждом случае Rff выбирают независимо из водорода, C1-6-алкила, C1-6-пергалогеналкила, C2-6-алкенила, C2-6-алкинила, C3-10-карбоциклила, 3-10-членного гетероциклила, C6-10-арила и 5-10-членного гетероарила, или две группы Rff соединяются с образованием 3-14-членного гетероциклила или 5-14-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил замещен независимо 0, 1, 2, 3, 4 или 5 группами Rgg; и
в каждом случае Rgg выбирают независимо из галогена, -CN, -NO2, -N3, -SO2H, -SO3H, -OH, -OC1-6-алкила, -ON(C1-6-алкил)2, -N(C1-6-алкил)2, -N(C1-6-алкил)3+X-, -NH(C1-6-алкил)2+X-, -NH2(C1-6-алкил)+X-, -NH3+X-, -N(OC1-6-алкил)(C1-6-алкил), -N(OH)(C1-6-алкил), -NH(OH), -SH, -SC1-6-алкила, -SS(C1-6-алкила), -C(=O)(C1-6-алкила), -CO2H, -CO2(C1-6-алкила), -OC(=O)(C1-6-алкила), -OCO2(C1-6-алкила), -C(=O)NH2, -C(=O)N(C1-6-алкил)2, -OC(=O)NH(C1-6-алкила), -NHC(=O)(C1-6-алкила), -N(C1-6-алкил)C(=O)(C1-6-алкила), -NHCO2(C1-6-алкила), -NHC(=O)N(C1-6-алкил)2, -NHC(=O)NH(C1-6-алкила), -NHC(=O)NH2, -C(=NH)O(C1-6-алкила), -OC(=NH)(C1-6-алкила), -OC(=NH)OC1-6-алкила, -C(=NH)N(C1-6-алкил)2, -C(=NH)NH(C1-6-алкила), -C(=NH)NH2, -OC(=NH)N(C1-6-алкил)2, -OC(NH)NH(C1-6-алкила), -OC(NH)NH2, -NHC(NH)N(C1-6-алкил)2, -NHC(=NH)NH2, -NHSO2(C1-6-алкила), -SO2N(C1-6-алкил)2, -SO2NH(C1-6-алкила), -SO2NH2,- SO2C1-6-алкила, -SO2OC1-6-алкила, -OSO2C1-6-алкила, -SOC1-6-алкила, -Si(C1-6-алкил)3, -OSi(C1-6-алкил)3, -C(=S)N(C1-6-алкил)2, C(=S)NH(C1-6-алкила), C(=S)NH2, -C(=O)S(C1-6-алкила), -C(=S)SC1-6-алкила, -SC(=S)SC1-6-алкила, -P(=O)2(C1-6-алкила), -P(=O)(C1-6-алкил)2, -OP(=O)(C1-6-алкил)2, -OP(=O)(OC1-6-алкил)2, C1-6-алкила, C1-6-пергалогеналкила, C2-6-алкенила, C2-6-алкинила, C3-10-карбоциклила, C6-10-арила, 3-10-членного гетероциклила, 5-10-членного гетероарила; или два соседних заместителя Rgg могут соединяться с образованием =O или =S; где Х- представляет собой противоион.
«Противоион» или «противоион-анион» представляет собой отрицательно заряженную группу, связанную с катионной четвертичной аминогруппой для того, чтобы сохранить электронейтральность. Примеры противоионов включают ионы-галогениды (например, F-, Cl-, Br-, I-), NO3-, ClO4-, OH-, H2PO4-, HSO4-, SO4-2, сульфонат-ионы (например, метансульфонат, трифторметансульфонат, п-толуолсульфонат, бензолсульфонат, 10-камфорсульфонат, нафталин-2-сульфонат, нафталин-1-сульфоновая кислота-5-сульфонат, этан-1-сульфоновая кислота-2-сульфонат и т.п.) и карбоксилат-ионы (например, ацетат, этаноат, пропаноат, бензоат, глицерат, лактат, тартрат, гликолят и т.п.).
Атомы азота могут быть замещенными или незамещенными, как позволяет валентность, и включают первичные, вторичные, третичные и четвертичные атомы азота. Примеры заместителей у атома азота включают, но не ограничиваются перечисленным, водород, -OH, -ORaa, -N(Rcc)2, -CN, -C(=O)Raa, -C(=O)N(Rcc)2, -CO2Raa, -SO2Raa, -C(=NRbb)Raa, -C(=NRcc)ORaa, -C(=NRcc)N(Rcc)2, -SO2N(Rcc)2, -SO2Rcc, -SO2ORcc, -SORaa, -C(=S)N(Rcc)2, -C(=O)SRcc, -C(=S)SRcc, -P(=O)2Raa, -P(=O)(Raa)2, -P(=O)2N(Rcc)2, -P(=O)(NRcc)2, C1-10-алкил, C1-10-пергалогеналкил, C2-10-алкенил, C2-10-алкини, C3-10-карбоциклил, 3-14-членный гетероциклил, C6-14-арил и 5-14-членный гетероарил, или две группы Rcc, присоединенные к атому азота, соединяются с образованием 3-14-членного гетероциклила или 5-14-членного гетероарила, где каждый алкил, алкенил, алкинил, карбоциклил, гетероциклил, арил и гетероарил замещен независимо 0, 1, 2, 3, 4 или 5 группами Rdd, и где Raa, Rbb, Rcc и Rdd имеют значения, указанные выше.
Эти и другие примеры заместителей подробнее описаны в разделах «Подробное описание», «Примеры» и в формуле изобретения. Не предполагается, что изобретение ограничено каким-либо образом перечисленными выше примерами заместителей.
Другие определения
Термин «фармацевтически приемлемая соль» относится к таким солям, которые в рамках здравого медицинского суждения подходят для применения в контакте с тканями людей и низших животных без чрезмерной токсичности, раздражения, аллергической реакции и т.п., и соответствуют разумному отношению польза/риск. Фармацевтически приемлемые соли хорошо известны в технике. Например, Berge et al. подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences (1977), 66: 1-19. Фармацевтически приемлемые соли соединений по настоящему изобретению включают соли, полученные из подходящих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых солей - нетоксичных солей присоединения являются соли, образованные аминогруппой с неорганическими кислотами, такими как хлороводородная кислота, бромоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или путем использования других способов, используемых в технике, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипаты, альлгинаты, аскорбаты, аспартаты, бензолсульфонаты, бензоаты, бисульфаты, бораты, бутираты, камфораты, камфорсульфонаты, цитраты, циклопентанпропионаты, диглюконаты, додецилсульфаты, этансульфонаты, формиаты, фумараты, глюкогептонаты, глицерофосфаты, глюконаты, гемисульфаты, гептаноаты, гексаноаты, гидроиодиды, 2-гидроксиэтансульфонаты, лактобионаты, лактаты, лаураты, лаурилсульфаты, малаты, малеаты, малонаты, метансульфонаты, 2-нафталинсульфонаты, никотинаты, нитраты, олеаты, оксалаты, пальмитаты, памоаты, пектинаты, персульфаты, 3-фенилпропионаты, фосфаты, пикраты, пивалаты, пропионаты, стеараты, сукцинаты, сульфаты, тартраты, тиоцианаты, п-толуолсульфонаты, ундеканоаты, валераты и т.п. Фармацевтически приемлемые соли, образованные из соответствующих оснований, включают соли щелочных металлов, щелочноземельных металлов, аммониевые соли и соли N+(C1-4-алкил)4. Характерные соли щелочных или щелочноземельных металлов включают натриевые, литиевые, калиевые, кальциевые, магниевые соли и т.п. Также фармацевтически приемлемые соли включают, в соответствующем случае, нетоксичные соли катионов аммония, четвертичного аммония и амино, образованные с использованием таких противоионов, как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат.
«Субъект», которому предполагается введение, включает, но не ограничивается перечисленным, людей (т.е. мужчину или женщину любой возрастной группы, например, педиатрического пациента (например младенца, ребенка, подростка) или взрослого пациента (например молодого взрослого, взрослого средних лет или престарелого взрослого)) и/или животных, не относящихся к людям, например, млекопитающего, такого как приматы (например макака, макака-резус), крупный рогатый скот, свиньи, лошади, овцы, козы, грызуны, кошки и/или собаки. В некоторых воплощениях субъектом является человек. В некоторых воплощениях субъектом является животное, не относящееся к человеку. Термины «человек», «пациент» и «субъект» в настоящем описании используются взаимозаменяемо.
Заболевание, расстройство и состояние в настоящем описании используются взаимозаменяемо.
Используемые в настоящем описании, и если не указано иное, термины «лечить», «лечащий» и «лечение» предполагают действие, которое происходит в то время, когда субъект страдает от специфического заболевания, расстройства или состояния, которое уменьшает тяжесть заболевания, расстройства или состояния или задерживает или замедляет развитие заболевания, расстройства или состояния («терапевтическое лечение»), и также предполагают действие, которое происходит до того, как субъект начинает страдать от специфического заболевания, расстройства или состояния («профилактическое лечение»).
Вообще «эффективное количество» соединения относится к количеству, достаточному для выявления желательной биологической реакции. Как будет понятно специалистам в данной области техники, эффективное количество соединения по изобретению может изменяться в зависимости от таких факторов, как желательная биологическая конечная цель, фармакокинетика соединения, заболевание, от которого лечат, способ введения и возраст, здоровье и состояние субъекта. Эффективное количество охватывает терапевтическое и профилактическое лечение.
Как используется в настоящем описании, и если конкретно не указано иное, «терапевтически эффективное количество» соединения представляет собой количество, достаточное для получения терапевтического благоприятствования при лечении заболевания, расстройства или состояния или задержки или минимизации одного или нескольких симптомов, связанных с заболеванием, расстройством или состоянием. Терапевтически эффективное количество соединения обозначает количество терапевтического средства, одного или в комбинации с другими терапиями, которое обеспечивает терапевтическое благоприятствование при лечении заболевания, расстройства или состояния. Термин «терапевтически эффективное количество» может охватывать количество, которое улучшает общую терапию, ослабляет или позволяет избежать симптомов или причин заболевания или состояния или усиливает терапевтическую эффективность другого терапевтического средства.
Как используется в настоящем описании, и если конкретно не указано иное, «профилактически эффективное количество» соединения представляет собой количество, достаточное для предупреждения заболевания, расстройства или состояния или одного или нескольких симптомов, связанных с заболеванием, расстройством или состоянием, или предотвращения его рецидива. Профилактически эффективное количество соединения обозначает количество терапевтического средства, одного или в комбинации с другими средствами, которое обеспечивает профилактическое благоприятствование при предупреждении заболевания, расстройства или состояния. Термин «профилактически эффективное количество» может охватывать количество, которое улучшает общую профилактику или усиливает профилактическую эффективность другого профилактического средства.
Краткое описание чертежей
Фиг. 1-22 отображают характерные спектры1Н ЯМР примеров соединений, описанных в настоящем описании.
Подробное описание некоторых воплощений изобретения
Как описано в настоящем описании, настоящее изобретение относится к нейроактивным 19-нор-С3,3-дизамещенным С21-триазол- и тетразолстероидам формулы (I)

или их фармацевтически приемлемым солям; где в указанной формуле А выбирают из группы




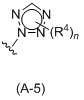
R1 представляет собой (C1-C6)галогеналкил (CHF2, CH2F) или (C1-C6)алкил (например, CH3, CH2CH3, CH2OCH3, CH2OCH2CH3); R2 и R3 выбирают независимо из H, галогена (например, F), (C1-C6)алкила (например, CH3) или алкокси (например, OCH3, OCH2CH3); R4 представляет собой галоген (например, Cl, F), циано, нитро, -S(O)xRa, -NRbRc, (C1-C6)алкил (например,CH3, CF3), (C1-C6)алкокси, -C(O)Ra, -C(O)ORa или -C(O)NRbRc; Ra представляет собой H или (C1-C6)алкил; каждый Rb и Rc представляет собой независимо H, -S(O)xRa, -C(O)Ra, (C1-C6)алкил или (C1-C6)алкокси, или Rb и Rc, взятые вместе с атомом, к которому они присоединены, образуют цикл (например, Rb и Rc, взятые вместе с атомом, к которому они присоединены, образуют 4-8-членный цикл, например, гетероциклический цикл, например, морфолиновый цикл, пирролидиновый цикл, пиперидиновый цикл; n равен целому числу от 0 до 2; и x равен целому числу от 0 до 2.
В некоторых воплощениях, когда A представляет собой (A-1) или (A-2), тогда R1 выбирают из -CHF2, -CH2F, -CCl3, -CHCl2, -CH2Cl, -CBr3, -CHBr2, -CH2Br или (C1-C6)алкила; или когда A представляет собой (A-3) или (A-5), R1 представляет собой -CH3, -CH2F, -CH2OCH3 или -CHF2, и n равен 0, тогда по меньшей мере один из R2 и R3 не является H.
В некоторых воплощениях, когда A представляет собой (A-1), (A-3) или (A-5), и n равен 0, тогда по меньшей мере один из R2 и R3 не является H.
В некоторых воплощениях, когда A представляет собой (A-1), (A-3) или (A-5), тогда по меньшей мере один из R2 и R3 не является H.
В некоторых воплощениях, когда A представляет собой (A-1) или (A-2), и n равен 0, тогда R1 выбирают из -CHF2, -CH2F, -CCl3, -CHCl2, -CH2Cl, -CBr3, -CHBr2, -CH2Br или (C1-C6)алкила.
В некоторых воплощениях n равен 0 или 1. В некоторых воплощениях n равен 0. В некоторых воплощениях n равен 1.
В некоторых воплощениях соединение формулы (I) выбирают из соединения формулы (Iа)

В некоторых воплощениях соединение формулы (I) выбирают из соединения формулы (Ib)

В некоторых воплощениях соединение формулы (I) выбирают из соединения формулы (II)

В некоторых воплощениях n равен 1, и R4 представляет собой галоген, циано, -S(O)хRa или (C1-C6)алкил. В некоторых воплощениях R4 представляет собой -CH3. В некоторых воплощениях R4 представляет собой циано. В некоторых воплощениях R4 представляет собой -S(O)2CH3. В некоторых воплощениях А выбирают из группы
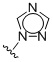

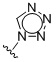


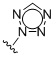





В некоторых воплощениях R1 представляет собой (C1-C6)алкил. В некоторых воплощениях R1 представляет собой -CH3.
В некоторых воплощениях R2 и R3 представляют собой Н.
В некоторых воплощениях n равен 1, и R4 представляет собой галоген, циано, -S(O)хRa или (C1-C6)алкил.
В некоторых воплощениях R4 представляет собой -CH3.
В некоторых воплощениях R4 представляет собой -C(О)ORa. В некоторых воплощениях Rа представляет собой Н. В некоторых воплощениях Rа представляет собой (C1-C6)алкил. В некоторых воплощениях Rа представляет собой -СН2СН3.
В некоторых воплощениях R4 представляет собой -C(O)NRbRc. В некоторых воплощениях Rb и Rc представляют собой H.
В некоторых воплощениях R4 представляет собой циано. В некоторых воплощениях R4 представляет собой -S(O)2СН3.
В некоторых воплощениях А выбирают из группы











В некоторых воплощениях соединение выбирают из группы

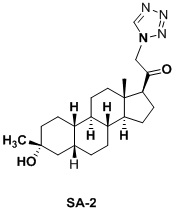



















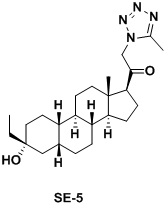
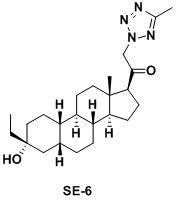
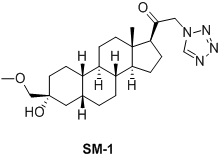










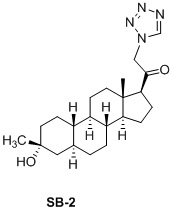



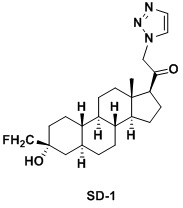


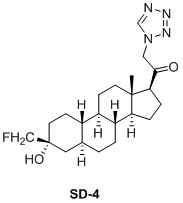
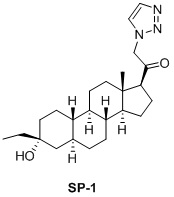




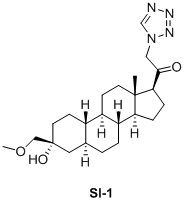




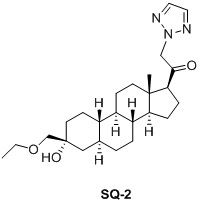

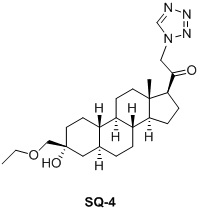





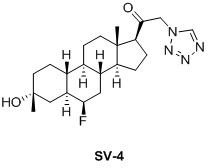
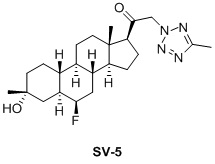
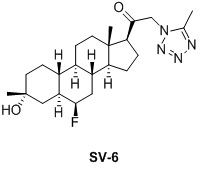




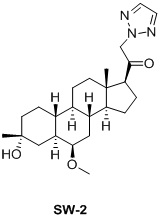
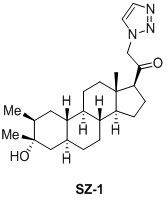






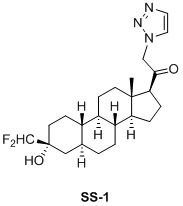
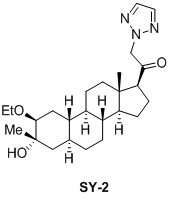
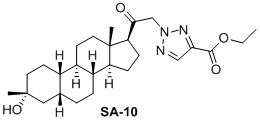







В одном аспекте настоящее изобретение относится к фармацевтической композиции, включающей соединение, описанное в настоящем описании (например, соединение формулы (I)), или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент.
В одном аспекте настоящее изобретение относится к способу лечения связанного с ЦНС расстройства у субъекта, нуждающегося в этом, включающему введение субъекту эффективного количества соединения, описанного в настоящем описании (например, соединения формулы (I)), или его фармацевтически приемлемой соли. В некоторых воплощениях связанное с ЦНС расстройство представляет собой расстройство сна, пищевое расстройство, расстройство настроения, расстройство шизофренического спектра, конвульсивное расстройство, расстройство памяти и/или познания, расстройство движений, расстройство личности, расстройство аутистического спектра, боль, травматическое повреждение головного мозга, сосудистое заболевание, расстройство злоупотребления веществами и/или синдром отмены или шум в ушах. В некоторых воплощениях связанное с ЦНС расстройство представляет собой депрессию (например, послеродовую депрессию). В некоторых воплощениях связанное с ЦНС расстройство представляет собой тремор (например, эссенциальное дрожание). В некоторых воплощениях связанное с ЦНС расстройство представляет собой пищевое расстройство (например, нервную анорексию, нервную булимию, компульсивное переедание, кахексию).
В некоторых воплощениях соединение вводят перорально, подкожно, внутривенно или внутримышечно. В некоторых воплощениях соединение вводят длительно.
В одном аспекте настоящее изобретение относится к способу вызывания седативного эффекта и/или анестезии у субъекта, включающему введение субъекту эффективного количества соединения формулы (I).
В одном аспекте настоящее изобретение относится к способу лечения припадков у субъекта, включающему введение субъекту эффективного количества соединения формулы (I).
В одном аспекте настоящее изобретение относится к способу лечения эпилепсии у субъекта, где способ включает введение субъекту эффективного количества соединения формулы (I).
В одном аспекте настоящее изобретение относится к способу лечения эпилептического статуса (SE) у субъекта, где способ включает введение субъекту эффективного количества соединения формулы (I). В некоторых воплощениях эпилептический статус представляет собой судорожный эпилептический статус (например, ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, суперрефрактерный эпилептический статус) или бессудорожный эпилептический статус (например, генерализованный эпилептический статус, сложный парциальный эпилептический статус).
В одном аспекте настоящее изобретение относится к способу лечения расстройства (например, такого расстройства, как описанное в настоящем описании, например, расстройства, связанного с функцией GABA) у субъекта, нуждающегося в этом, где способ включает введение субъекту терапевтически эффективного количества соединения, его фармацевтически приемлемой соли или фармацевтической композиции одного из соединений формулы (I).
Фармацевтические композиции
В другом аспекте изобретение относится к фармацевтической композиции, включающей соединение по настоящему изобретению (также называемое «активным ингредиентом») и фармацевтически приемлемый эксципиент. В некоторых воплощениях фармацевтическая композиция включает эффективное количество активного ингредиента. В некоторых воплощениях фармацевтическая композиция включает терапевтически эффективное количество активного ингредиента. В некоторых воплощениях фармацевтическая композиция включает профилактически эффективное количество активного ингредиента.
Фармацевтические композиции по настоящему изобретению можно вводить различными путями, включая, но не ограничиваясь перечисленным, пероральное (энтеральное) введение, парентеральное (путем инъекции) введение, ректальное введение, трансдермальное введение, интрадермальное введение, интратекальное введение, подкожное (SC) введение, внутривенное (IV) введение, внутримышечное (IM) введение и интраназальное введение.
Как правило, соединения по настоящему изобретению вводят в эффективном количестве. Количество соединения, вводимое фактически, будет типично определяться врачом с учетом релевантных обстоятельств, включая состояние, от которого лечат, выбранный путь введения, фактическое вводимое соединение, возраст, массу и реакцию отдельного пациента, тяжесть симптомов у пациента и т.п.
При использовании для предупреждения начала расстройства ЦНС соединения по настоящему изобретению будут вводиться субъекту, имеющему опасность развития состояния, типично по совету и под наблюдением врача при уровнях доз, описанных выше. Субъекты в опасности развития определенного состояния, как правило, включают тех, кто имеет семейный анамнез состояния, или тех, у кого генетическим исследованием или скринингом идентифицирована особая подверженность к развитию состояния.
Фармацевтические композиции по настоящему изобретению также можно вводить длительно («длительное введение»). Длительное введение относится к введению соединения или его фармацевтической композиции в течение продолжительного периода времени, например, в течение 3 месяцев, 6 месяцев, 1 года, 2 лет, 3 лет, 5 лет и т.д., или может продолжаться неограниченно долго, например, всю остальную жизнь субъекта. В некоторых воплощениях предполагается, что длительное введение обеспечивает постоянный уровень соединения в крови, например, в терапевтическом окне, в течение длительного периода времени.
Фармацевтические композиции по настоящему изобретению также можно доставлять с использованием различных методов дозирования. Например, в некоторых воплощениях фармацевтические композиции могут даваться в виде болюса, например, для того, чтобы поднять концентрацию соединения в крови до эффективного уровня. Постановка болюсной дозы зависит от системных уровней активного ингредиента, желательных для организма, например, внутримышечная или подкожная болюсная доза допускает медленное высвобождение активного ингредиента, в то время как болюсная доставка непосредственно в вену (например, IV-вливанием) делает возможной значительно более быструю доставку, которая быстро повышает концентрацию активного ингредиента в крови до эффективного уровния. В других воплощениях фармацевтическую композицию можно вводить в виде обычной инфузии, например, IV-вливанием, для обеспечения поддержания установившейся концентрации активного ингредиента в организме субъекта. Кроме того, в еще других воплощениях фармацевтическую композицию можно вводить сначала в виде болюсной дозы, а затем непрерывной инфузией.
Композиции для перорального введения можно получить в форме объемных жидких растворов или суспензий или массы порошка. Однако чаще композиции предоставляют в стандартных лекарственных формах для облегчения точного дозирования. Термин «стандартная лекарственная форма» относится к физически дискретным единицам, подходящим в качестве однократных дозировок для больных людей и других млекопитающих, где каждая единица содержит предварительно установленное количество активного материала, рассчитанное на получение желательного терапевтического действия, в сочетании с подходящим фармацевтическим эксципиентом. Типичные стандартные лекарственные формы включают предварительно наполненные жидкими композициями предварительно установленного объема ампулы или шприцы или пилюли, таблетки, капсулы или подобные формы в случае твердых композиций. В таких композициях соединение обычно составляет минорный компонент (от примерно 0,1 до примерно 50 мас.% или предпочтительно от примерно 1 до примерно 40 мас.%), где остальное составляют различные среды или эксципиенты и способствующие переработке вспомогательные вещества для формирования нужной лекарственной формы.
При пероральном приеме лекарственного средства характерными схемами являются одна-пять, в особенности, две-четыре и типично три пероральные дозы в сутки. При использовании таких схем приема каждая доза предоставляет от примерно 0,01 до примерно 20 мг/кг соединения по настоящему изобретению, где предпочтительные дозы предоставляют, каждая, от примерно 0,1 до примерно 10 мг/кг, и в особенности, от примерно 1 до примерно 5 мг/кг.
Трансдермальные дозы, как правило, выбирают для предоставления схожих или меньших уровней в крови, чем уровни, достигаемые с использованием инъекций, как правило, в количестве, колеблющемся от примерно 0,01 до примерно 20 мас.%, предпочтительно от примерно 0,1 до примерно 20 мас.%, предпочтительно от примерно 0,1 до примерно 10 мас.%, и предпочтительнее от примерно 0,5 до примерно 15 мас.%.
Уровни доз, вводимых инъекцией, колеблются от примерно 0,1 мг/кг/час до по меньшей мере 10 мг/кг/час, все в течение от примерно 1 часа до примерно 120 час и в особенности 24-96 часов. Также для достижения адекватных установившихся уровней можно вводить предварительно нагружающий болюс от примерно 0,1 мг/кг до примерно 10 мг/кг или больше. Предполагается, что максимальная общая доза не превышает примерно 2 г/сутки для больного человека в 40-80 кг.
Жидкие формы, подходящие для перорального введения, могут включать подходящую водную или неводную среду с буферами, суспендирующими и диспергирующими веществами, красителями, корригентами и т.п. Твердые формы могут включать, например, любой из следующих ингредиентов или соединений, схожих по природе: связующее, такое как микрокристаллическая целлюлоза, трагакнтная камедь или желатин; эксципиент, такой как кархмал или лактоза, дезинтегратор, такой как альгиновая кислота, примогель или кукурузный крахмал; лубрикант, такой как стеарат магния; глидант, такой как коллоидный диоксид кремния; подслащивающий агент, такой как сахароза или сахарин; или корригент, такой как перечная мята, метилсалицилат или апельсиновая отдушка.
Инъецируемые композиции типично имеют основой стерильный физиологический раствор или забуференный фосфатом физиологический раствор или другие инъецируемые эксципиенты, известные в технике. Как и прежде, активное соединение в таких композициях типично является минорным компонентом, как правило, составляющим примерно от 0,05 до 10 мас.%, где остальное составляет инъецируемый эксципиент и т.п.
Трансдермальные композиции типично составляют в виде топической мази или крема, содержащих активный(е) ингредиент(ы). При получении в виде мази активные ингредиенты типично будут соединены или с парафиновой или со смешивающейся с водой основой мази. С другой стороны, активные ингредиенты можно ввести в крем, например, крем с основой масло-в-воде. Такие трансдермальные препараты хорошо известны в технике и, как правило, включают дополнительные ингредиенты для усиления проникания в кожу или устойчивости активных ингредиентов или препарата. Все такие известные трансдермальные препараты и ингредиенты включены в объем настоящего изобретения.
Соединения по настоящему изобретению также можно вводить с помощью трансдермального устройства. Соответственно, трансдермальное введение можно выполнять с использованием пэтча или резервуара или пористой мембраны или различных твердых матриц.
Вышеописанные компоненты для композиций, вводимых перорально, инъекцией или топически, являются только характерными. Другие материалы, а также методы переработки и подобное приводятся в части 8 Remingtonʹs Pharmaceutical Sciences, 17th edition, 1985, Mack Publishing Company, Easton, Pennsylvania, включенной в настоящее описание в качестве ссылки.
Соединения по настоящему изобретению также можно вводить в формах с отсроченным высвобождением или из систем доставки с пролонгированным высвобождением лекарственного средства. Описание характерных материалов для пролонгированного высвобождения можно найти в Remingtonʹs Pharmaceutical Sciences.
Настоящее изобретение также относится к фармацевтически приемлемым препаратам соединения по настоящему изобретению. В одном воплощении препарат включает воду. В другом воплощении препарат включает производное циклодекстрина. Наиболее распространенными декстринами являются α-, β- и γ-циклодекстрины, состоящие из 6, 7 и 8 α-1,4-соединенных звеньев, соответственно, необязательно включающие один или несколько заместителей на соединенных группах сахаров, которые включают, но не ограничиваются перечисленным, метилированное, гидроксиалкилированное, ацилированное и простое сульфоалкилэфирное замещение. В некоторых воплощениях циклодекстрин представляет собой (простой сульфоалкиловый эфир)-β-циклодекстрин, например, сульфобутиловый эфир-β-циклодекстрин, также известный как каптизол. См., например, US 5376645. В некоторых воплощениях препарат включает гексапропил-β-циклодекстрин (например, 10-50% в воде).
Настоящее изобретение также относится к фармацевтически приемлемой соли присоединения кислоты соединения по настоящему изобретению. Кислота, которую можно использовать для получения фармацевтически приемлемой соли, является кислотой, которая образует нетоксичную соль присоединения кислоты, т.е. соль, содержащую фармакологически приемлемые анионы, такие как гидрохлорид, гидроиодид, гидробромид, нитрат, сульфат, бисульфат, фосфат, ацетат, лактат, цитрат, тартрат, сукцинат, малеат, фумарат, бензоат, пара-толуолсульфонат и т.п.
Следующие далее примеры препаратов иллюстрируют характерные фармацевтические композиции, которые можно получить согласно настоящему изобретению. Однако настоящее изобретение не ограничивается приведенными далее фармацевтическими композициями.
Пример препарата 1 - таблетки. Соединение по настоящему изобретению можно смешать в виде сухого порошка с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Добавляют в качестве лубриканта небольшое количество стеарата магния. Смесь формуют в таблетки по 240-270 мг (80-90 мг активного соединения на таблетку) в прессе для таблетирования.
Пример препарата 2 - капсулы. Соединение по настоящему изобретению можно смешать в виде сухого порошка с разбавителем крахмалом в массовом соотношении приблизительно 1:1. Смесью заполняют 250-мг капсулы (125 мг активного соединения на капсулу).
Пример препарата 3 - жидкость. Соединение по настоящему изобретению (125 мг) можно смешать с сахарозой (1,75 г) в ксантановой смолой (4 мг), и полученную смесь можно перемешать, пропустить через сито №10 меш U.S. и затем смешать с предварительно приготовленным раствором микрокристаллической целлюлозы и натрий карбоксиметилцеллюлозы (11:89, 50 мг) в воде. Бензоат натрия (10 мг), отдушку и краситель разбавляют водой и добавляют при перемешивании. Затем можно добавить достаточно воды для того, чтобы получить общий объем 5 мл.
Пример препарата 4 - таблетки. Соединение по настоящему изобретению можно смешать в виде сухого порошка с сухим желатиновым связующим приблизительно в массовом соотношении приблизительно 1:2. Добавляют в качестве лубриканта небольшое количество стеарата магния. Смесь формуют в таблетки по 450-900 мг (150-300 мг активного соединения на таблетку) в прессе для таблетирования.
Пример препарата 5 - инъекция. Соединение по настоящему изобретению можно растворить или суспендировать в инъецируемой водной среде в забуференном стерильном физиологическом растворе до концентрации приблизительно 5 мг/мл.
Пример препарата 6 - таблетки. Соединение по настоящему изобретению можно смешать в виде сухого порошка с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Добавляют в качестве лубриканта небольшое количество стеарата магния. Смесь формуют в таблетки по 90-150 мг (30-50 мг активного соединения на таблетку) в прессе для таблетирования.
Пример препарата 7 - таблетки. Соединение по настоящему изобретению можно смешать в виде сухого порошка с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Добавляют в качестве лубриканта небольшое количество стеарата магния. Смесь формуют в таблетки по 30-90 мг (10-30 мг активного соединения на таблетку) в прессе для таблетирования.
Пример препарата 8 - таблетки. Соединение по настоящему изобретению можно смешать в виде сухого порошка с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Добавляют в качестве лубриканта небольшое количество стеарата магния. Смесь формуют в таблетки по 0,3-30 мг (0,1-10 мг активного соединения на таблетку) в прессе для таблетирования.
Пример препарата 9 - таблетки. Соединение по настоящему изобретению можно смешать в виде сухого порошка с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Добавляют в качестве лубриканта небольшое количество стеарата магния. Смесь формуют в таблетки по 150-240 мг (50-80 мг активного соединения на таблетку) в прессе для таблетирования.
Пример препарата 10 - таблетки. Соединение по настоящему изобретению можно смешать в виде сухого порошка с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Добавляют в качестве лубриканта небольшое количество стеарата магния. Смесь формуют в таблетки по 270-450 мг (90-150 мг активного соединения на таблетку) в прессе для таблетирования.
Способы применения и лечения
Как в общих чертах описано в настоящем описании, настоящее изобретение относится к нейроактивным стероидам, которые могут действовать, например, как модуляторы GABA. В некоторых воплощениях такие соединения представляются как применимые в качестве терапевтических средств для лечения расстройства, описанного в настоящем описании, например, тремора (например, эссенцильного дрожания); депрессии (например, послеродовой депрессии), включающего введение субъекту эффективного количества соединения по настоящему изобретению или его композиции. В некоторых воплощениях соединение вводят внутривенно.
Более ранние исследования (см., например, Gee et al., European Journal of Pharmacology, 136: 419-423 (1987)) показали, что некоторые 3α-гидроксилированные стероиды являются на порядки величины более сильными как модуляторы комплекса рецептора GABA, чем другие уже известные (см., например, Majewska et al., Science, 232: 1004-1007 (1986); Harrison et al., J. Pharmacol. Exp. Ther., 241: 346-353 (1987)). Majewska et al. и Harrison et al. сообщают, что 3α-гидроксилированные-5-восстановленные стероиды имеют только значительно меньшие уровни эффективности. Теперь результаты экспериментов in vitro и in vivo показывают, что высокая эффективность таких стероидов позволяет им быть терапевтически применимыми при модуляции возбудимости головного мозга через GRC (см., например, Gee et al., European Journal of Pharmacology, 136: 419-423 (1987); Wieland et al., Psychopharmacology, 118(l): 65-71 (1995)).
Также были получены различные синтетические стероиды в качестве нейроактивных стероидов. См., например, патент США 5232917, в котором раскрываются нейроактивные стероиды, применимые при лечении стресса, тревоги, инсомнии, припадков и расстройств настроения, которые терапевтически благоприятно соответствуют GRC-активным средствам, например, при депрессии. Кроме того, ранее показано, что такие стероиды взаимодействуют в уникальном сайте в GRC, который отличается от других известных сайтов взаимодействия (например, барбитуратов, бензодиазепинов и GABA), в которых ранее выявлены терапевтически благоприятные действия при стрессе, тревоге, расстройствах сна, настроения и при эпилептических припадках (см., например, Gee K.W. and Yamamura H.I., ʺBenzodiazepines and Barbiturates: Drugs for the Treatment of Anxiety, Insomnia and Seizure Disorders,ʺ в Central Nervous System Disorders, Horvell, ed., Marcel-Dekker, New York (1985), pp. 123-147; Lloyd K.G. and Morselli, P.L., ʺPsychopharmacology of GABAergic Drugs,ʺ в Psychopharmacology: The Third Generation of Progress, H.Y. Meltzer, ed., Raven Press, N.Y. (1987), pp. 183-195; и Gee et al., European Journal of Pharmacology, 136: 419-423 (1987)). Такие соединения являются подходящими из-за длительности, эффективности и пероральной действенности (наряду с другими формами введения).
Соединения по настоящему изобретению, описанные в настоящем описании, могут модулировать функцию GABA и поэтому могут действовать как нейроактивные стероиды для лечения и предупреждения связанных с ЦНС состояний у субъекта. Модуляция при использовании в настоящем описании относится к ингибированию или потенцированию функции рецептора GABA. Соответственно, соединения и фармацевтические композиции по настоящему изобретению находят применение в качестве терапевтических средств для предупреждения и/или лечения состояний ЦНС у млекопитающих, включая людей и млекопитающих, не относящихся к людям. Таким образом, и как указано ранее, настоящее изобретение включает в свой объем и распространяется на перечисленные способы лечения, а также на соединения для таких способов и на применение таких соединений для получения лекарственных средств, применимых в таких способах.
Примеры состояний ЦНС, связанных с GABA модуляцией, включают, но не ограничиваются перечисленным, расстройства сна [например, инсомнию], расстройства настроения [например, депрессию, дистимическое расстройство (например, легкую степень депрессии), биполярное расстройство (например, I и/или II), тревожные расстройства (например, генерализованное тревожное расстройство (GAD), социальное тревожное расстройство), стресс, посттравматическое стрессовое расстройство (PTSD), компульсивные расстройства (например, обсессивно-компульсивное расстройство (OCD))], расстройства шизофренического спектра [например, шизофрению, шизоаффективное расстройство], судорожные синдромы [например, эпилепсию (например, эпилептический статус (SE)), припадки], расстройства памяти и/или познания [например, расстройства внимания (например, гиперактивное расстройство с дефицитом внимания (ADHD)), деменцию (например, деменцию по типу Альцгеймера, деменцию с тельцами Леви, деменцию сосудистого типа], расстройства движения [например, болезнь Гентингтона, болезнь Паркинсона], расстройства личности [например, антисоциальное расстройство личности, обсессивно-компульсивное расстройство личности], расстройства аутистического спектра (ASD) [например, аутизм, моногенные причины аутизма, такие как синаптопатические, например, синдром Ретта, синдром ломкой Х хромосомы, синдром Ангельмана], боль [например, невропатическую боль, болевые синдромы, связанные с травмой, острую боль, хроническую боль], травматическое повреждение головного мозга (TBI), сосудистые расстройства [например, удар, ишемию, пороки сосудов], злоупотребления веществами и/или синдромы отмены [например, привычку к опиатам, кокаину или алкоголю] и шум в ушах.
В еще одном аспекте настоящее изобретение относится к комбинации соединения по настоящему изобретению и другого фармакологически активного средства. Соединения по настоящему изобретению можно вводить как единственное активное средство, или их можно вводить в комбинации с другими средствами. Введение в комбинации можно осуществлять любым методом, очевидным для специалистов в данной области техники, включая, например, раздельное, последовательное, одновременное и поочередное введение.
В другом аспекте настоящее изобретение относится к способу лечения или предупреждения возбудимости головного мозга у субъекта, чувствительного к или пораженного состоянием, связанным с возбудимостью головного мозга, включающему введение субъекту эффективного количества соединения по настоящему изобретению.
В еще одном аспекте настоящее изобретение относится к способу лечения или предупреждения тремора у субъекта, включающему введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению. В некоторых воплощениях тремор представляет собой эссенциальное дрожание.
В еще одном аспекте настоящее изобретение относится к способу лечения или предупреждения расстройств настроения у субъекта, включающему введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению. В некоторых воплощениях расстройство настроения представляет собой депрессию. В некоторых воплощениях расстройство настроения представляет собой послеродовую депрессию.
В еще одном аспекте настоящее изобретение относится к способу облегчения или предупреждения PMS или PND у субъекта, включающему введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению.
В еще одном аспекте настоящее изобретение относится к способу лечения или предупреждения стресса или тревоги у субъекта, включающему введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению или композиции с ним.
В еще одном аспекте настоящее изобретение относится к способу облегчения или предупреждения инсомнии у субъекта, включающему введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению или композиции с ним.
В еще одном аспекте настоящее изобретение относится к способу вызывания сна и поддержания по существу уровня REM-сна, который обнаруживается при нормальном сне, где существенного возобновления инсомнии не вызывается, включающему введение эффективного количества соединения по настоящему изобретению
В еще одном аспекте настоящее изобретение относится к способу улучшения познания или лечения расстройства памяти путем введения субъекту терапевтически эффективного количества соединения по настоящему изобретению. В некоторых воплощениях расстройство представляет собой болезнь Альцгеймера. В некоторых воплощениях расстройство представляет собой синдром Ретта.
В еще одном аспекте настоящее изобретение относится к способу лечения расстройств внимания путем введения субъекту терапевтически эффективного количества соединения по настоящему изобретению. В некоторых воплощениях расстройство внимания представляет собой ADHD.
В некоторых воплощениях соединение вводят субъекту длительно. В некоторых воплощениях соединение вводят субъекту перорально, подкожно, внутримышечно или внутривенно.
Тревожные расстройства
Тревожное расстройство является общим термином, перекрывающим некоторые различные формы анормального и патологического страха и тревоги. Сегодняшние психиатрические диагностические критерии распознают широкое разнообразие тревожных расстройств.
Генерализованное тревожное расстройство представляет собой распространенное хроническое расстройство, характеризующееся продолжительной тревогой, которая не сфокусирована на каком-либо одном объекте или ситуации. Лица, страдающие от генерализованной тревоги, испытывают неспецифический упорный страх и беспокойство и становятся чрезмерно обеспокоенными повседневными вещами. Генерализованное тревожное расстройство является наиболее распространенным тревожным расстройством, поражающим пожилых людей.
При паническом расстройстве личность страдает от кратковременных приступов интенсивного ужаса и чувства страха, часто отмечаемых дрожью, лихорадкой, спутанностью сознания, головокружением, тошнотой, затрудненным дыханием. Такие панические атаки определяются АРА как страх или дискомфорт, который внезапно появляется и достигает апогея менее чем за десять минут, может продолжаться в течение нескольких часов и может запускаться стрессом, страхом или спокойным упражнением, хотя конкретная причина не всегда видна. Кроме повторяющихся неожиданных панических атак диагноз панического расстройства также требует, чтобы указанные атаки имели хронические последствия: беспокойство в связи с возможными атаками, упорный страх будущих атак или существенные изменения в поведении, связанных с атаками. Соответственно, личности, страдающие от панического расстройства, испытывают симптомы даже вне специфических панических эпизодов. Часто страдающие от паники замечают обычные изменения сердечных сокращений, что приводит их к мысли, что с их сердцем что-то не так, или они продвигаются к другой панической атаке. В некоторых случаях во время панических атак имеет место повышенная бдительность (гипервигильность) к функционированию организма, где любое ощущаемое физиологическое изменение интерпретируется как возможная угрожающая жизни болезнь (т.е. крайняя ипохондрия).
Обсессивно-компульсивное расстройство представляет собой тип тревожного расстройства, характеризующийся главным образом повторяющимися обсессиями (дистрессивные, упорные и навязчивые мысли и образы) и компульсивными побуждениями (побуждения к выполнению специфических действий или ритуалов). Картина мышления при OCD может иметь сходство с суевериями, постольку поскольку она вовлекает веру в каузальном соотношении, где в действительности она не существует. Часто процесс полностью нелогичен; например, компульсивное побуждение к ходьбе в определенной картине может быть использовано для облегчения обсессии приближающейся беды. И во многих случаях компульсивное побуждение совершенно необъяснимо, просто побудительный мотив к завершению ритуала, спровоцированный нервозностью. В меньшинстве случаев страдающие от OCD могут испытывать только обсессии без явных компульсивных побуждений; значительно меньшее число больных испытывает только компульсивные побуждения.
Отдельной самой большой категорией тревожных расстройств является фобия, которая включает все случаи, в которых страх и тревога провоцируются определенным стимулом или ситуацией. Страдающие от этого типично предчувствуют ужасные последствия от столкновения с объектом их страха, который может представлять собой что угодно от животного до расположения к жидкости организма.
Посттравматическое стрессовое расстройство или PTSD представляет собой тревожное расстройство, которое является результатом перенесенной травмы. Посттравматический стресс может являться результатом экстремальной ситуации, такой как бой (конфликт), изнасилование, положения заложника или даже тяжелые аварии. Он также может являться результатом длительного (хронического) воздействия тяжелого стрессора, например, как у солдат, которые пережили отдельные сражения, но не могут справиться с непрерывной битвой. Обычные симптомы включают «стоп-кадры», поступки избегания или депрессию.
Пищевые расстройства
Пищевые расстройства отличаются нарушениями пищевого поведения и регуляции массы и ассоциируются с широким рядом вредных физиологических, физических и социальных последствий. Индивидуум с пищевым расстройством может просто начать съедать меньшие или большие количества пищи, но в какой-то момент его побуждение съедать меньше или больше выходит из-под контроля. Пищевые расстройства могут характеризоваться тяжелым дистрессом или беспокойством о массе или форме тела или экстремальными усилиями по управлению массой или поглощением пищи. Пищевые расстройства включают нервно-психическую анорексию, нервно-психическую булимию, расстройство переедания, кахексию и их варианты.
Индивидуумы с нервно-психической анорексией обычно видят себя как имеющих избыточную массу даже когда они имеют недостаточную массу. У индивидуумов с нервно-психической анорексией может стать навязчивым контроль за едой, продуктами и массой. Индивидуумы с нервно-психической анорексией обычно часто взвешиваются, тщательно делят на части пищу и едят очень маленькие количества только определенных продуктов. Индивидуумы с нервно-психической анорексией могут склоняться к перееданию с последующим крайним соблюдением диеты, чрезмерными упражнениями, вызыванием у себя рвоты или злоупотреблением слабительными средствами, диуретиками или клизмами. Симптомы включают крайне низкую массу тела, серьезные ограничения по продуктам, упорное стремление похудеть и нежелание поддерживать нормальную или здоровую массу, сильная боязнь набрать вес, искаженное представление о фигуре или отрицание серьезности низкой массы тела, нарушение менструации у девушек и женщин. Другие симптомы включают утоньшение костей, ломкие волосы и ногти, сухую и желтоватую кожу, рост тонких волос на всем теле, умеренную анемию, истощение мышц и слабость, тяжелую констипацию, низкое кровяное давление или замедленное сердцебиение и пульс, нарушение структуры и функции сердца, поражение головного мозга, недостаточность многих органов, падение внутренней температуры тела, летаргию, вялость и бесплодие. Индивидуумы с нервно-психической булимией имеют повторяющиеся и частые эпизоды поедания необычно больших количеств пищи и ощущение утраты контроля за такими эпизодами. За таким перееданием следует поведение, которое компенсирует переедание, такое как усиленная рвота, чрезмерное употребление слабительных средств или диуретиков, голодание, избытчные упражнения или комбинация таких поступков.
В отличие от людей с нервно-психической анорексией люди с нервно-психической булимией обычно поддерживают то, что касается здоровья или нормального веса, хотя некоторые имеют несколько избыточную массу. Но подобно людям с нервно-психической анорексией, они обычно боятся увеличения веса, отчаянно хотят сбавить вес и чувствуют себя несчастными из-за размера и формы тела. Обычно булимическое поведение скрывают, поскольку оно часто сопровождается ощущениями раздражения или притворства. Цикл переедания и очищения может случаться любой - от нескольких раз в неделю до нескольких раз в сутки. Другие симптомы включают хронически воспаленное и раздраженное горло, набухание слюнных желез в области шеи и челюсти, стертую зубную эмаль и все более чувствительные и гниющие зубы в результате воздействия желудочной кислоты и расстройства кислотного рефлюкса и других желудочно-кишечных проблем, кишечный дистресс и раздражение от злоупотребления слабительными средствами, тяжелое обезвоживание из-за удаления жидкостей, электролитный дисбаланс (что может привести к сердечному приступу или удару).
Индивидуумы с расстройством переедания теряют контроль над своей едой. В отличие от нервно-психической анорексии, за периодами переедания не следуют компенсаторное поведение, подобное очистке, избыточным упражнениям или голоданию. Индивидуумы с расстройством переедания часто имеют избыточную массу или ожирение. Индивидуумы с ожирением с расстройством переедания находятся в зоне высокого риска развития сердечно-сосудистого заболевания и высокого кровяного давления. Они также испытывают чувство вины, стыда и дистресс от своего переедания, что может привести к еще большему перееданию.
Кахексия также известна как «расстройство истощения» и представляет собой связанную с питанием проблему, испытываемую многими раковыми больными. Индивидуумы с кахексией могут продолжать нормально есть, но их организм может отказаться использовать витамины и питательные вещества, которые он принимает с пищей, или они будут терять аппетит и прекращать есть. Когда индивидуум испытывает потерю аппетита и прекращает есть, можно считать, что он имеет развитую нервно-психическую анорексию.
Нейродегенеративные заболевания и расстройства
Термин «нейродегенеративное заболевание» включает болезни и расстройства, которые ассоциируются с прогрессирующей утратой структуры или функции нейронов или гибелью нейронов. Нейродегенеративные заболевания и расстройства включают, но не ограничиваются перечисленным, болезнь Альцгеймера (включая ассоциированные симптомы слабого, умеренного или тяжелого когнитивного ухудшения); боковой амиотрофический склероз (ALS); гипоксические и ишемические повреждения; атаксию и судорогу (включая лечение и предупреждение припадков, которые вызваны шизоаффективным расстройством или лекарственными средствами, применяемыми для лечения шизофрении); забывчивость в легкой форме; отек головного мозга; мозжечковую атаксию, включая нейроакантоцитозный синдром Маклеода (MLS); закрытую травму головы; кому; контузионные повреждения (например, повреждение спинного мозга и повреждение головы); деменции, включая мультиинфарктную деменцию и сенильную деменцию; нарушения сознания; синдром Дауна; вызванный лекарственными средствами паркинсонизм (такой как вызванная нейролептиками острая акатизия, острая дистония, паркинсонизм или поздняя дискенезия, неролептический злокачественный синдром, или вызванный лекарственными средствами постуральный тремор); эпилепсию; синдром ломкой Х хромосомы; синдром Жилль де ла Туретта; травму головы; ухудшение и потерю слуха; болезнь Гентингтона; синдром Леннокса; вызванную леводопой дискинезию; олигофрению; расстройства движения, включая акинезии и акинетические (ригидные) синдромы (включая кальцификацию базальных ганглиев, кортикобазалльную дегенерацию, мультисистемную атрофию, комплекс паркинсонизм-ALS деменция, болезнь Паркинсона, постэнцефалитный паркинсонизм и прогрессирующий надъядерный паралич); миотонические спазмы и расстройства, связанные с мышечной спастичностью, или слабость, включая хорею (такую как доброкачественная наследственная хорея, хорея, вызванная лекарственными средствами, гемибаллизм, болезнь Гентингтона, нейроакантоцитоз, хорею Сиденгама и симптоматическую хорею), дискенезию (включая тики, такие как сложные тики, простые тики и симптоматические тики), миоклонус (включая генерализованный миоклонус и очаговый cyloclonus), тремор (такой как тремор в покое, ортостатический тремор и интенционный тремор) и дистонию (включая аксиальную дистонию, дистонический крампи клерков, гемиплегическую дистонию, пароксизмальную дистонию и фокальную дистонию, такую как блефароспазм, оромандибулярная дистония и спастическая дистония и кривошея); повреждение нейронов, включая повреждение глаза, ретинопатию или дегенерацию желтого пятна; нейротоксическое повреждение, которое следует за мозговым ударом, тромбоэмболическим ударом, геморрагическим ударом, церебральной ишемией, церебральным спазмом сосудов, гипогликемией, амнезией, гипоксией, аноксией, перинатальной асфексией и остановкой сердца; болезнь Паркинсона; припадок; эпилептический статус; удар; шум в ушах; тубулярный склероз и вызванную вирусной инфекцией нейродегенерацию (например, вызванную синдромом приобретенного иммунодефицита (СПИДом) и энцефалопатиями). Нейродегенеративные заболевания также включают, но не ограничиваются перечисленным, нейротоксическое повреждение, которое следует за мозговым ударом, тромбоэмболическим ударом, геморрагическим ударом, церебральной ишемией, церебральным спазмом сосудов, гипогликемией, амнезией, гипоксией, аноксией, перинатальной асфексией и остановкой сердца. Способы лечения или предупреждения нейродегенеративного заболевания также включают лечение или предупреждение утраты функции нейронов, характеризующей нейродегенеративное расстройство.
Эпилепсия
Эпилепсия является расстройством головного мозга, характеризующимся повторяющимися припадками в неустановленное время. Типы эпилепсии могут включать, но не ограничиваться перечисленным, генерализованную эпилепсию, например, абсансную эпилепсию у детей, юношескую миоклоническую эпилепсию, эпилепсию с большими приступами при пробуждении, синдром Веста, синдром Леннокса-Гасто, парциальную эпилепсию, например, височную эпилепсию, лобную эпилепсию, доброкачественную фокальную эпилепсию детского возраста.
Эпилептический статус (SE)
Эпилептический статус (SE) может включать, например, судорожный эпилептический статус, например, ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус; бессудорожный эпилептический статус, например, генерализованный эпилептический статус, сложный частичный эпилептический статус; генерализованные периодические эпилептиформные разряды и периодические латерализованные эпилептиформные разряды. Судорожный эпилептический статус характеризуется наличием судорожных эпилептических припадков и может включать ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус. Ранний эпилептический статус лечат терапией первой линии. Установившийся эпилептический статус характеризуется эпилептическими припадками, которые остаются несмотря на лечение терапией первой линии, и назначают терапию второй линии. Рефрактерный эпилептический статус характеризуется эпилептическими припадками, которые остаются несмотря на лечение терапией первой линии и второй линии, и обычно назначают общие анестетики. Супер-рефрактерный эпилептический статус характеризуется эпилептическими припадками, которые остаются несмотря на лечение терапией первой линии, терапией второй линии и общими анестетиками в течение 24 часов или долее.
Бессудорожный эпилептический статус может включать, например, фокальный бессудорожный эпилептический статус, например, сложный частичный эпилептический статус; простой частичный бессудорожный эпилептический статус, едва различимый бессудорожный эпилептический статус; генерализованный бессудорожный эпилептический статус, например, поздний абсансный бессудорожный эпилептический статус, атипичный абсансный бессудорожный эпилептический статус или типичный абсансный бессудорожный эпилептический статус.
Композиции, описанные в настоящем описании, также можно вводить как профилактическое средство субъекту, имеющему расстройство ЦНС, например, травматическое повреждение головного мозга, эпилептический статус, например, судорожный эпилептический статус, например, ранний эпилептический статус, установившийся эпилептический статус, рефрактерный эпилептический статус, супер-рефрактерный эпилептический статус; бессудорожный эпилептический статус, например, генерализованный бессудорожный эпилептический статус, например, сложный частичный эпилептический статус; генерализованные периодические эпилептиформные разряды и периодические летерализованные эпилептиформные разряды, до начала приступа.
Припадок
Припадок представляет собой физические проявления или изменения в поведении, которые происходят после эпизода анормальной электрической активности в головном мозгу. Термин «припадок» часто используют взаимозаменяемо с термином «судорога». Судороги это когда тело человека сотрясается быстро и неконтролируемо. Во время судорог мышцы человека повторно сокращаются и расслабляются.
На основании типа поведения и активности головного мозга припадки делятся на две большие категории: генерализованные и частичные (также называемые локальными или фокальными). Классификация типа припадка помогает врачам диагностировать, имеет ли пациент эпилепсию или не имеет.
Генерализованные припадки продуцируются электрическими импульсами из всей площади всего головного мозга, в то время как частичные припадки продуцируются (по меньшей мере изначально) электрическими импульсами в относительно небольшой части головного мозга. Часть головного мозга, генерирующую припадки, иногда называют фокусом.
Существует шесть типов генерализованных припадков. Наиболее частым и драматическим, и, следовательно, наиболее известным, является генерализованная судорога, также называемая большим судорожным припадком. При таком типе припадка пациент теряет сознание и обычно падает. За потерей сознания следует генерализованное окоченение тела (называемое «тонической» фазой припадка) в течение 30-60 секунд, затем резкое вздрагивание («клоническая» фаза) в течение 30-60 секунд, после чего пациент впадает в глубокий сон («постиктальная» или послеприпадочная фаза). Во время больших припадков могут иметь место повреждения и травмы, такие как прикусывание языка и недержание мочи.
Абсансные припадки вызывают кратковременную потерю сознания (всего несколько секунд) с немногими симптомами или без них. Пациент, чаще всего ребенок, прерывает деятельность и становится безучастным. Такие припадки начинаются и заканчиваются внезапно и могут происходить несколько раз в сутки. Пациенты обычно не сознают, что у них происходит припадок, за исключением того, что они могут осознавать «потерю времени».
Миоклонические припадки заключаются в спорадических подергиваниях, обычно по обеим сторонам тела. Пациенты иногда описывают подергивания как электрические удары. Такие припадки, когда сильные, могут привести к падению или непреднамеренному бросанию предметов.
Клонические припадки являются повторяющимися ритмическими вздрагиваниями, которые затрагивают обе стороны тела в одно и то же время.
Тонические припадки характеризуются ригидностью мышц.
Атонические припадки заключаются во внезапной и общей потере тонуса мышц, особенно рук и ног, которая часто приводит к падению.
Припадки, описанные в настоящем описании, могут включать эпилептические припадки; острые повторяющиеся припадки; кластерные припадки; непрерывные припадки; упорные припадки; пролонгированные припадки; рецидивирующие припадки; припадки эпилептического статуса, например, рефрактерного судорожного эпилептического статуса, припадки бессудорожного эпилептического статуса; рефрактерные припадки; миоклонические припадки; тонические припадки; тонико-клонические припадки; сложные частичные припадки; вторичные генерализованные припадки; атипичные абсансные припадки; абсансные припадки; атонические припадки; доброкачественные роландические припадки; фебрильные припадки; эмоциональные припадки; фокальные припадки; геластические припадки; генерализованные начальные припадки; инфантильные спазмы; джексоновские припадки; выраженные двусторонние миоклонические припадки; мультифокальные припадки; неонатальные начальные припадки; ночные припадки; затылочные припадки; посттравматические припадки; едва различимые припадки; припадки Сильвана; визуальные рефлекторные припадки или припадки отдергивания.
Тремор
Тремор представляет собой непроизвольное ритмичное по времени сокращение и расслабление мышц, которое может вовлекать колебания или подергивания одной или нескольких частей тела (например, кистей рук, плеч, глаз, лица, головы, голосовых складок, туловища, ног).
Мозжечковый тремор или интенционный тремор представляет собой медленный обширный тремор конечностей, который происходит после целенаправленного движения. Мозжечковый тремор вызывается повреждениями в или повреждением мозжечка в результате, например, опухоли, удара, заболевания (например, рассеянного склероза, наследственного дегенеративного расстройства).
Дистонический тремор происходит у индивидуумов, пораженных дистонией, расстройством движения, при котором длительные непроизвольные сокращения мышц вызывают скручивающие и повторяющиеся телодвижения и/или болезненные и анормальные положения тела или позиции. Дистонический тремор может поражать любую мышцу тела. Дистонические треморы происходят нерегулярно и часто могут быть ослаблены полноценным отдыхом.
Эссенциальный тремор или доброкачественный эссенциальный тремор является наиболее обычным типом тремора. Эссенциальный тремор может быть у кого-то умеренным и непрогрессирующим и может медленно прогрессировать, начинаясь на одной стороне тела, но в пределах 3 лет поражает обе стороны. Кисти рук поражаются наиболее часто, но также могут затрагиваться голова, голос, язык, ноги и туловище. Частотность тремора может снижаться с возрастом, но тяжесть может возрастать. Повышенное волнение, стресс, страх, физическое истощение или низкий уровень сахара в крови могут спровоцировать треморы и/или повысить их тяжесть.
Ортостатический тремор характеризуется быстрыми (например, более 12 Гц) ритмическими сокращениями мышц, что происходит в ногах и туловище сразу после вставания. Кремпи ощущаются в бедрах и голенях, и пациент может неконтролируемо дрожать, когда его просят стоять на одном месте. Ортостатический тремор может иметь место у пациентов с эссенциальным тремором.
Паркинсоновский тремор вызывается повреждением структур в головном мозгу, которые контролируют движение. Паркинсоновский тремор часто является предшественником болезни Паркинсона и типично виден как «круговое» движение кистей рук, которое также может поражать подбородок, губы, ноги и туловище. Типично паркинсоновский тремор появляется в возрасте после 60. Движение начинается в одной конечности или на одной стороне тела и может прогрессировать, включая другую сторону.
Физиологический тремор может происходить у здоровых индивидуумов и не имеет клинического значения. Его можно видеть во всех произвольных группах мышц. Физиологический тремор может быть вызван некоторыми лекарственными средствами, похмельным синдромом или медицинским состоянием, включающим гиперфункцию щитовидной железы и липогликемию. Тремор классически имеет частоту приблизительно 10 Гц.
Психогенный тремор или истерический тремор может иметь место в состоянии покоя или во время постурального или кинетического движения. Пациент с психогенным тремором может иметь конверсионное расстройство или другое психическое заболевание.
Рубральный тремор характеризуется крупноразмашистым слабым дрожанием, которое может присутствовать в покое, при принятии позы и действии. Тремор ассоциируется с состояниями, поражающими красные ядра в среднем мозгу, классическими необычными ударами.
Расстройства настроения
Клиническая депрессия также известна как большая депрессия, большое депрессивное расстройство (MDD), тяжелая депрессия, униполярная деперессия, униполярное расстройство и рецидивирующая депрессия, и относится к психическому расстройству, характеризующемуся глубоким и устойчивым плохим настроением, которое сопровождается низкой самооценкой и утратой интереса или удовольствия от нормальной доставляющей удовольствие деятельности. Некоторые люди с клинической депрессией имеют тревожный сон, потерю массы и обычно чувствуют возбуждение и раздражение. Клиническая депрессия влияет как на чувства и мысли индивидуума, так и на поведение, и может привести к ряду эмоциональных и физических проблем. Индивидуумы с клинической депрессией могут иметь тревогу от повседневной деятельности и приобрести ощущение, что жизнь не стоит того, чтобы жить.
Постуральная депрессия (PND) также относится к послеродовой депрессии (PPD) и относится к типу клинической депрессии, которая поражает женщин после родов. Симптомы могут включать уныние, усталость, изменения в сне и пищевых привычках, сниженном сексуальном желании, эпизоды плача, тревогу и раздражительность. В некоторых воплощениях PND представляет собой рефрактерную депрессию (например, рефрактерную депрессию, описанную в настоящем описании).
Атипичная депрессия (AD) характеризуется реактивностью настроения (например, парадоксальной ангедонией) и позитивностью, существенным приростом массы или повышенным аппетитом. Пациенты, страдающие от AD, также могут иметь избыточный сон или сонливость (гиперсомнию), ощущение тяжести в конечностях и существенное социальное ухудшение как следствие гиперчувствительности к ощущаемому отторжению при межличностных отношениях.
Меланхоличная депрессия характеризуется утратой удовольствия (анденомией) при большинстве или всех действиях, недостаточностью реакции на приятные стимулы, депрессивным настроением, более выраженным, чем при горе или потере, чрезмерной потерей массы или чрезмерным сознанием вины.
Психотическая большая депрессия (PMD) или психотическая депрессия относится к большому депрессивному эпизоду, в частности, меланхолической природы, где индивидуум испытывает психотические симптомы, такие как бред и галлюцинации.
Кататоническая депрессия относится к большой депрессии, включающей нарушения двигательного поведения и другие симптомы. Индивидуум может стать немым и ступорозным и или неподвижным или совершает бессмысленные и странные движения.
Сезонное аффективное расстройство (SAD) относится к типу сезонной депрессии, при которой индивидуум имеет сезонные картины депрессивных эпизодов, приходящихся на осень или зиму.
Дистимия относится к состоянию, родственному униполярной депрессии, где очевидны одни и те же физические и познавательные проблемы. Они не являются тяжелыми и имеют склонность длиться продолжительно (например, по меньшей мере 2 года).
Двойная депрессия относится к недостаточному депрессивному настроению (дистимии), которое длится по меньшей мере 2 года и перемежается периодами большой депрессии.
Депрессивное расстройство личности (DPD) относится к расстройству личности с депрессивными признаками.
Рецидивирующая кратковременная депрессия (RBD) относится к состоянию, при котором индивидуумы имеют депрессивные эпизоды примерно один раз в месяц, где каждый эпизод длится 2 недели или меньше и типично менее 2-3 дней.
Малое депрессивное расстройство или малая депрессия относится к депрессии, при которой по меньшей мере 2 симптома имеются в течение 2 недель.
Биполярное расстройство или маниакально-депрессивное расстройство вызывает исключительные колебания настроения, которые включают эмоциональные взлеты (мания или гипомания) и падения (депрессия). Во время периодов мании индивидуум может ощущать или действовать анормально счастливо, энергично или раздраженно. Они часто принимают плохие решения, мало заботясь о последствиях. Обычно снижается потребность в сне. Во время периодов депрессии они могут быть крикливыми, плохо контактировать визуально с другими и отрицательно смотреть на жизнь. Среди людей с таким расстройством высока опасность суицида - свыше 60% у людей старше 20 лет, в то время как причинение себе вреда происходит у 30-40%. Другие проблемы с психическим здоровьем, такие как тревожное расстройство и неправильное применение веществ, обычно ассоциируются с биполярным расстройством.
Депрессия, вызванная хроническим медицинским состоянием, относится к депрессии, вызванной таким медицинским состоянием, как рак или хроническая боль, химиотерапия, хронический стресс.
Депрессия, резистентная к лечению, относится к состоянию, когда индивидуумов лечат от депрессии, но симптомы не улучшаются. Например, антидепрессанты или советы психолога (психотерапия) не облегчают симптомы у индивидуумов с депрессией, резистентной к лечению. В некоторых случаях у индивидуумов с депрессией, резистентной к лечению, симптомы улучшаются, но возвращаются. Рефрактерная депрессия имеет место у пациентов, страдающих от депрессии, которые резистентны к стандартному фармакологическому лечению, включающему трициклические антидепрессанты, MAOI, SSRI и двойной и тройной прием ингибиторов и/или анксиолетические лекарственные средства, а также нефармакологическому лечению (например, психотерапии, электросудорожной терапии, стимуляции блуждающего нерва и/или транскраниальной магнитной стимуляции).
Суицидальность, суицидальное мышление, суицидальное поведение относятся к склонности индивидуума совершить самоубийство. Суицидальное мышление касается мыслей около или необычной озабоченности о суициде. Размах суицидального мышления широко меняется от, например, быстропроходящих мыслей до пространных мыслей, подробного планирования, обыгрывания, незавершенных попыток. Симптомы включают разговоры о суициде, приобретение средств для совершения суицида, отказ от социального контакта, поглощение мыслями о смерти, ощущение захвата или безнадежности ситуации, возрастание употребления алкоголя или лекарственных средств, совершение опасных или самоубийственных поступков, прощальные разговоры с людьми, как если бы они не увидятся снова.
Симптомы депрессии включают постоянные ощущения страха или печали, чувство беспомощности, безнадежности, пессимизма, никчемности, слабой энергии, беспокойства, раздраженности, усталости, потерю интереса к приятной деятельности или увлечениям, отсутствие позитивных мыслей или планов, избыточную сонливость, переедание, потерю аппетита, инсонмию, причинение вреда себе, мысли о суициде и попытку суицида. Наличие, тяжесть, частота и длительность симптомов могут изменяться от случая к случаю. Симптомы депрессии и их характер может выяснить врач или психолог (например, проверкой психического состояния).
Анестезия/Седация
Анестезия представляет собой вызванное фармакологически и обратимое состояние амнезии, аналгезии, потери чувствительности, потери рефлексов скелетных мышц, ослабленной стрессовой реакции или всего этого одновременно. Такие действия можно получить от одного лекарственного средства, которое одно обеспечивает правильную комбинацию действий, или иногда с помощью комбинации лекарственных средств (например, снотворных средств, седативных средств, парализующих средств, анальгетиков) для достижения весьма специфической комбинации результатов. Анальгетики позволяют пациентам переносить операцию и другие процедуры без дистресса и боли, которые они инача могли бы испытывать.
Седация представляет собой уменьшение разражительности или возбуждения путем введения фармакологического средства, как правило, для облегчения медицинской процедуры или диагностической процедуры.
Седация и обезболивание включают непрерывный спектр состояний сознания, колеблющихся от минимальной седации (анксиолизис) до общей анестезии.
Минимальная седация также известна как анксиолизис. Минимальная седация представляет собой вызванное лекарственным средством состояние, во время которого пациент нормально реагирует на словесные команды. Могут ухудшиться когнитивная функция и координация. Дыхательная функция и функция сердечно-сосудистой системы обычно не поражаются.
Умеренная седация/анальгезия (седация под контролем сознания) представляет собой вызванную лекарственным средством депрессию сознания, во время которой пациент реагирует целенаправленно на словесную команду или одну или сопровождающуюся свето-тактильной стимуляцией. Обычно нет необходимости в поддержании дыхательных путей пациента. Типично самопроизвольное дыхание является адекватным. Обычно функция сердечно-сосудистой системы сохраняется.
Глубокая седация/анальгезия представляет собой вызванную лекарственным средством депрессию сознания, во время которой пациент не может легко встать, но целенаправленно реагирует (без потери рефлекса на болевой раздражитель) после повторной или болевой стимуляции. Может ухудшиться независимая дыхательная функция, и пациенту может потребоваться помощь для поддержания собственных дыхательных путей. Самопроизвольное дыхание может быть неадекватным. Обычно функция сердечно-сосудистой системы сохраняется.
Общая анестезия представляет собой вызванную лекарственным средством потерю сознания, во время которой пациент не может реагировать даже на болевой раздражитель. Способность поддерживать независимую дыхательную функцию часто ухудшается, и обычно требуется помощь для поддержания дыхательных путей пациента. Может потребоваться дыхание под положительным давлением из-за угнетенного самопроизвольного дыхания или вызванного лекарственным средством угнетения нейромышечной функции. Может ухудшиться функция сердечно-сосудистой системы.
Седация в отделении интенсивной терапии (ICU) позволяет подавить осведомленность пациента об окружающей среде и ослабить его реакцию на внешнюю стимуляцию. Это может сыграть роль при лечении тяжелобольного пациента и охватывает широкий спектр контроля за симптомами, который будет изменяться от пациента к пациенту и у отдельных пациентов в течение всего времени течения их болезни. Глубокую седацию при интенсивной терапии применяют для облегчения переносимости эндотрахеальной трубки и синхронизации дыхания, часто с нейромышечными блокаторами.
В некоторых воплощениях в ICU седацию (например, длительную седацию, непрерывную седацию) вызывают и поддерживают в течение продолжительного периода времени (например, 1 сутки, 2 суток, 3 суток, 5 суток, 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца). Средства для длительной седации могут иметь длительное действие. Седативные средства в ICU могут иметь короткий период полувыведения.
Процедурная седация и анальгезия, также отнесенная к седации в сознании, представляет собой метод введения седативных средств или диссоциативных средств с или без анальгетиков для вызывания состояния, которое позволяет субъекту переносить неприятные процедуры с сохранением сердечно-легочной функции.
Примеры
Для того, чтобы изобретение, описанное в настоящем описании, можно было полнее понять, приводятся следующие далее примеры. Синтетические и биологические примеры, описанные в настоящей заявке, представлены как пояснения соединений, фармацевтических композиций и способов по настоящему изобретению и никоим образом не должны рассматриваться как ограничивающие его объем.
Материалы и методы
Соединения по настоящему изобретению можно получить из легкодоступных исходных материалов с использованием описанных далее общих способов и процедур. Следует иметь в виду, что когда приводятся типичные или предпочтительные условия процессов (т.е. температуры реакций, время, молярные отношения реагентов, растворители, давление и т.д.), также можно использовать другие условия процессов, если не установлено иное. Оптимальные условия реакций могут изменяться в связи с определенными используемыми реагентами или растворителями, но такие условия может определить специалист в данной области техники обычным экспериментом.
Кроме того, что будет очевидно для специалистов в данной области техники, обычные защитные группы могут быть необходимы для предохранения некоторых функциональных групп от участия в нежелательных реакциях. Выбор подходящей защитной группы для определенной функциональной группы, а также подходящие условия для ее введения и удаления хорошо известны в технике. Например, многие защитные группы и их введение и удаление описаны в T. W. Greene and P. G. M. Wuts, Protecting Groups in Organic Synthesis, Second Edition, Wiley, New York, 1991, и ссылках, цитированных в указанной работе.
Соединения по настоящему изобретению можно выделить и очистить известными стандартными процедурами. Такие процедуры включают (но не ограничиваются перечисленным) перекристаллизацию, колоночную хроматографию, ВЭЖХ или сверхкритическую флюидную хроматографию (SFC). Следующие далее схемы представлены с деталями получения характерных триазолов и тетразолов, которые перечислены в настоящем описании. Соединения по настоящему изобретению специалист в области органического синтеза может получить из известных или коммерчески доступных исходных материалов и реагентов. Примеры хиральных колонок, доступных для использования при разделении/очистке энантиомеров/диастереомеров по настоящему изобретению, включают, но не ограничиваются перечисленным, ChiralPak® AD-10, CHIRALCEL® OB, CHIRALCEL® OB-H, CHIRALCEL® OD, CHIRALCEL® OD-H, CHIRALCEL® OF, CHIRALCEL® OG, CHIRALCEL® OJ и CHIRALCEL® OK.
Приведенные в настоящем описании данные1Н-ЯМР (например, для промежуточных соединений), могут представлять часть полного спектра ЯМР соединения, например, соединения, описанного в настоящем описании. Например, приведенные данные1Н-ЯМР могут не включать область между δ (м.д.) примерно 1 - примерно 2,5 м.д. Копии полного спектра1Н-ЯМР для характерных примеров приводятся на фигурах.
Пример общего метода препаративной ВЭЖХ. Колонка Waters RBridge преп., 10 мкм, C18, 19×250 мм. Подвижная фаза ацетонитрил, вода (NH4HCO3) (30 л воды, 24 г NH4HCO3, 30 мл NH3.H2O). Скорость потока 25 мл/мин.
Пример общего метода аналитической ВЭЖХ. Подвижная фаза А: вода (10 мМ NH4HCO3), В: ацетонитрил. Градиент 5-95% В за 1,6 или 2 мин. Скорость потока 1,8 или 2 мл/мин. Колонка XBridge C18, 4,6×50 мм, 3,5 мкм, при 45°C.
Синтетические процедуры
Соединения по изобретению можно получить согласно способам, описанным в технике (Upasani et al., J. Med. Chem., 1997, 40: 73-84; и Hogenkamp et al., J. Med. Chem., 1997, 40: 61-72), и с использованием соответствующих реагентов, исходных материалов и способов очистки, известных специалистам в данной области техники. В некоторых воплощениях соединения, описанные в настоящем описании, можно получить с использованием способов, показанных на общих схемах 1-3, включающих нуклеофильное замещение бромида 19-норпрегнана нуклеофилом. В некоторых воплощениях нуклеофил взаимодействует с бромидом 19-норпрегнана в присутствии К2СО3 в ТГФ.
Схема 1

Схема 2

Схема 3
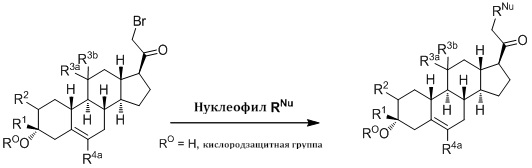
Пример 1. Синтез SA и промежуточных соединений для SA
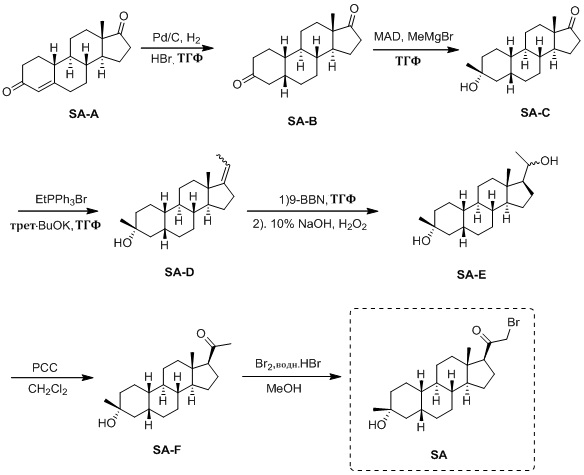
Синтез соединения SA-B. Соединение SA-A (50 г, 184 ммоль) и палладиевую чернь (2,5 г) в тетрагидрофуране (300 мл) и концентрированную бромоводородную кислоту (1,0 мл) гидрируют водородом при ~1 МПа (10 атм). После перемешивания при комнатной температуре в течение 24 час смесь фильтруют через слой целита, фильтрат концентрируют в вакууме, и получают сырое соединение. Перекристаллизация из ацетона дает соединение SA-B (42,0 г, выход 83,4%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 2,45-2,41 (м, 1H), 2,11-3,44 (м, 2H), 3,24 (с, 3H), 2,18-2,15 (м, 1H), 2,01-1,95 (м, 1H), 1,81-1,57 (м, 7H), 1,53-1,37 (м, 7H), 1,29-1,13 (м, 3H), 1,13-0,90 (м, 2H), 0,89 (с, 3H).
Синтез соединения SA-С. Раствор SA-B (42,0 г, 153,06 ммоль) в 600 мл безводного толуола в атмосфере N2 при -78°С добавляют по каплям к раствору бис(2,6-ди-трет-бутил)-4-метилфеноксида алюминия (MAD) (459,19 ммоль, 3,0 экв., свежеприготовленный). По завершении добавления реакционную смесь перемешивают в течение 1 часа при -78°С. Затем к полученной выше смеси в атмосфере N2 при -78°С постепенно, по каплям, добавляют 3,0 М MeMgBr (153,0 мл, 459,19 ммоль). Затем реакционную смесь перемешивают в течение 3 час при такой температуре. ТСХ (петролейный эфир/этилацетат=3:1) показывает завершение реакции. Затем к полученной выше смеси при -78°С постепенно, по каплям, добавляют насыщенный водный раствор NH4Cl. По завершении добавления смесь фильтруют, остаток на фильтре промывают EtOAc, органический слой промывают водой и рассолом, сушат над безводным Na2SO4, фильтруют и концентрируют, остаток очищают флэш-хроматографией на силикагеле (петролейный эфир/этилацетат, 20:1-3:1), и получают соединение SA-C (40,2 г, выход 90,4%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 2,47-2,41 (м, 1H), 2,13-2,03 (м, 1H), 1,96-1,74 (м, 6H), 1,70-1,62 (м, 1H), 1,54-1,47 (м, 3H), 1,45-1,37 (м, 4H), 1,35-1,23 (м, 8H), 1,22-1,10 (м, 2H), 1,10-1,01 (м, 1H), 0,87 (с, 3H).
Синтез соединения SA-D. К раствору PPh3EtBr (204,52 г, 550,89 ммоль) в ТГФ (500 мл) при 0°С добавляют раствор трет-BuOK (61,82 г, 550,89 ммоль) в ТГФ (300 мл). По завершении добавления реакционную смесь перемешивают в течение 1 часа при 60°С, и затем при 60°С добавляют по каплям раствор SA-C (40,0 г, 137,72 ммоль) в ТГФ (300 мл). Реакционную смесь греют при 60°С в течение 18 час. Реакционную смесь охлаждают до комнатной температуры, гасят насыщ. раствором NH4Cl и экстрагируют EtOAc (3×500 мл). Объединенные органические слои промывают рассолом, сушат и концентрируют, и получают сырой продукт, который очищают флэш-хроматографией (петролейный эфир/этилацетат, 50:1-10:1), и получают соединение SA-D (38,4 г, выход 92%) в виде белого порошка.1H ЯМР: (400 МГц, CDCl3) δ 5,17-5,06 (м, 1H), 2,42-2,30 (м, 1H), 2,27-2,13 (м, 2H), 1,89-1,80 (м, 3H), 1,76-1,61 (м, 6H), 1,55-1,43 (м, 4H), 1,42-1,34 (м, 3H), 1,33-1,26 (м, 6H), 1,22-1,05 (м, 5H), 0,87 (с, 3H).
Синтез соединения SA-Е. К раствору SA-D (38,0 г, 125,62 ммоль) в сухом ТГФ (800 мл) на ледяной бане добавляют по каплям раствор BH3.Me2S (126 мл, 1,26 моль). По завершении добавления реакционную смесь перемешивают в течение 3 час при комнатной температуре (14-20°С). ТСХ (петролейный эфир/этилацетат, 3:1) показывает завершение реакции. Смесь охлаждают до 0°С, и добавляют 3,0 М водный раствор NaOH (400 мл), а затем 30% водный раствор Н2О2 (300 мл). Смесь перемешивают в течение 2 час при комнатной температуре и затем фильтруют и экстрагируют EtOAc (3×500 мл). Объединенные органические слои промывают насыщенным водным раствором Na2S2O3 и рассолом, сушат над Na2SO4 и концентрируют в вакууме, и получают сырой продукт реакции (43 г, сырой) в виде бесцветного масла. Сырой продукт используют на следующей стадии без дополнительной очистки.
Синтез соединения SA-F. К раствору SA-Е (43,0 г, 134,16 ммоль) в дихлорметане (800 мл) при 0°С добавляют по частям РСС (53,8 г, 268,32 ммоль). Затем реакционную смесь перемешивают при комнатной температуре (16-22°С) в течение 3 час. ТСХ (петролейный эфир/этилацетат, 3:1) показывает завершение реакции, и затем реакционную смесь фильтруют и промывают DCM. Органическую фазу промывают насыщенным водным раствором Na2S2O3 и рассолом, сушат над Na2SO4 и концентрируют в вакууме, и получают сырой продукт реакции. Сырой продукт очищают колоночной хроматографией (петролейный эфир/этилацетат, 50:1-8:1), и получают соединение SA-F (25,0 г, выход 62,5% за две стадии) в виде белого порошка.1H ЯМР (SA-F): (400 МГц, CDCl3) δ 2,57-2,50 (м, 1H), 2,19-2,11 (м, 4H), 2,03-1,97 (м, 1H), 1,89-1,80 (м, 3H), 1,76-1,58 (м, 5H), 1,47-1,42 (м, 3H), 1,35-1,19 (м, 10H), 1,13-1,04 (м, 3H), 0,88-0,84 (м, 1H), 0,61 (с, 3H).
Синтез соединения SA. К раствору SA-F (10 г, 31,46 ммоль) и водн. HBr (5 капель, 48% в воде) в 200 мл МеОН добавляют по каплям бром (5,52 г, 34,54 ммоль). Реакционную смесь перемешивают при 17°С в течение 1,5 час. Полученный раствор гасят насыщенным водным раствором NaHCO3 при 0°С и экстрагируют EtOAc (150 мл × 2). Объединенные органические слои сушат и концентрируют. Остаток очищают колоночной хроматографией на силикагеле, элюируют (РЕ:ЕА=15:1-6:1), и получают соединение SA (9,5 г, выход 76,14%) в виде не совсем белого твердого вещества. ЖХ/МС: rt 5,4 мин; m/z 379,0, 381,1, 196,1.
Пример 2. Синтез соединенияSA-1

К суспензии К2СО3 (25 мг, 0,18 ммоль) в ТГФ (5 мл) добавляют 3Н-1,2,4-триазол (32 мг, 0,46 ммоль) и SA (36 мг, 0,09 ммоль). Смесь перемешивают при rt в течение 24 час. Реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают названное в заголовке соединение в виде не совсем белого твердого вещества (11 мг, 31,3%).1H ЯМР: (400 МГц, CDCl3), δ (м.д.), 7,67 (c, 1H), 7,64 (c, 1H), 5,27 (AB, 1H), 4,18 (AB, 1H), 2,65 (1H, т), 1,27 (c, CH3), 0,67 (c, 3H).
Пример 3. Синтез соединенияSA-2

К суспензии К2СО3 (25 мг, 0,18 ммоль) в ТГФ (5 мл) добавляют 1Н-тетразол (16 мг, 0,23 ммоль) и SA (70 мг, 0,09 ммоль). Смесь перемешивают при rt в течение 15 час. Реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают названное в заголовке соединение в виде не совсем белого твердого вещества SA-2 (8 мг, 11,7%) и побочный продукт (10 мг, 14,0%).
SA-2:1H ЯМР (500 МГц, CDCl3) δ (м.д.) 8,74 (с, 1Н), 5,31 (АВ, 1Н), 5,17 (АВ, 1Н), 2,65 (1Н, т), 1,28 (с, СН3), 0,67 (с, 3Н).
Пример 4. Синтез соединенияSA-3

К суспензии SA (1 г, 2,52 ммоль) в ДМФА (20 мл) добавляют К2СО3 (1,04 г, 7,55 ммоль) и 4-метил-2Н-1,2,3-триазол (313,64 мг, 3,77 ммоль). Смесь перемешивают при комнатной температуре в течение 3 час. Затем реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (30 мл). Объединенные органические слои промывают рассолом (10 мл × 3), сушат над сульфатом натрия, фильтруют и концентрируют. Остаток очищают преп. ВЭЖХ, и получают названное в заголовке соединение SA-3 (269,2 мг, выход=26,59%) в виде не совсем белого твердого вещества.1H ЯМР (SA-3) (400 МГц, CDCl3) δ 7,42 (c, 1H), 5,14-5,13 (м, 2H), 2,57-2,56 (м, 1H), 2,33 (c, 3H), 2,01-2,00 (м, 2H), 1,81-1,70 (м, 6H), 1,45-1,39 (м, 7H), 1,27-1,24 (м, 9H), 1,01-1,00 (м, 3H), 0,70 (c, 3H).
Пример 5. Синтез соединенийSA-4 и SA-5

К раствору 4-метил-2Н-1,2,3-триазола (836,4 мг, 10,07 ммоль) и К2СО3 (1,39 г, 10,07 ммоль) в ДМФА (20 мл) при комнатной температуре (13-17°С) в атмосфере N2 добавляют соединение SA (2,0 г, 5,03 ммоль). Реакционную смесь перемешивают при комнатной температуре (13-17°С) в течение 4 час. ТСХ показывает завершение реакции. Затем реакционную смесь выливают в воду и экстрагируют EtOAc (50 мл × 3). Объединенные органические слои промывают рассолом, сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают на силикагеле, и получают 730 мг смеси SA4/SA-5 и побочный продукт (500 мг, выход 25%). Смесь разделяют очистой SFC, и получают SA-4 (249,8 мг, выход 12,5%) и SA-5 (426,2 мг, выход 21,3%) в виде не совсем белого твердого вещества.1H ЯМР (SA-4): (400 МГц, CDCl3) δ 7,49 (c, 1H), 5,14-5,02 (м, 2H), 2,67-2,63 (м, 1H), 2,21-2,16 (м, 4H), 2,11-2,08 (м, 1H), 1,88-1,75 (м, 6H), 1,65-1,55 (м, 1H), 1,51-1,37 (м, 7H), 1,33-1,22 (м, 8H), 1,14-1,08 (м, 3H), 0,69 (c, 3H).1H ЯМР (SA-5): (400 МГц, CDCl3) δ 7,35 (c, 1H), 5,20-5,04 (м, 2H), 2,65-2,61 (м, 1H), 2,38 (c, 3H), 2,25-2,17 (м, 1H), 2,09-2,05 (м, 1H), 1,88-1,63 (м, 7H), 1,50-1,28 (м, 15H), 1,15-1,06 (м, 3H), 0,67 (c, 3H).
Пример 6. Синтез соединенийSA-6 и SA-7

К раствору соединения SA (120 мг, 0,29 ммоль) в ТГФ (3 мл) добавляют К2СО3 (210 мг, 1,5 ммоль) и 5-метил-2Н-тетразол (126 мг, 1,5 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи, когда анализ ЖХМС показывает завершение реакции. Затем реакционную смесь разбавляют EtOAc (20 мл), и полученный раствор промывают рассолом (10 мл), сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ, и получают SA-6 (10 мг, 0,025 ммоль, выход=8%) и SA-7 (8 мг, 0,020 ммоль, выход=7%) в виде не совсем белого твердого вещества.SA-6:1H ЯМР (400 МГц, CDCl3) δ 5,16-5,03 (м, 2H), 2,66 (т, 1H), 2,46 (с, 3 H), 2,25-2,10 (м, 1H), 2,08-2,02 (м, 1H), 1,90-1,70 (м, 7H), 1,68-1,02 (м, 18H), 0,67 (с, 3H). ЖХ-МС: rt=2,20 мин; m/z=401,3 (М+H)+. SA-7:1H ЯМР (400 МГц, CDCl3) δ 5,40-5,30 (м, 2H), 2,62 (т, 1H), 2,55 (с, 3 H), 2,30-2,00 (м, 2H), 1,90-1,56 (м, 7H), 1,50-1,02 (м, 18H), 0,70 (с, 3H). ЖХ-МС: rt=2,30 мин; m/z=401,2 (М+H)+.
Пример 7. Синтез соединенияSA-8

К раствору соединения SA (150 мг, 0,377 ммоль) и К2СО3 (104,3 мг, 0,755 ммоль) в сухом ДМФА (10 мл) при комнатной температуре (14-20°С) в атмосфере N2 добавляют 5-(трифторметил)-1Н-тетразол (104 мг, 0,755 ммоль). Реакционную смесь перемешивают в течение 18 час при той же температуре. Реакционную смесь выливают в воду и экстрагируют EtOAc (50 мл × 3). Органические слои промывают рассолом, сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают на колонке с силикагелем (РЕ:EtOAc=10:1-1:1), и получают SA-8 (89,1 мг, выход 51,9%) в виде белого порошка. 1H ЯМР (SA-8): (400 МГц, CDCl3) δ 5,51 (с, 2H), 2,69-2,65 (м, 1H), 2,26-2,18 (м, 1H), 2,09-2,05 (м, 1H), 1,87-1,77 (м, 6H), 1,69-1,62 (м, 1H), 1,55-1,43 (м, 7H), 1,37-1,26 (м, 8H), 1,19-1,09 (м, 3H), 0,72 (с, 3H).
Пример 8. Синтез соединенияSA-9

К суспензии К2СО3 (25 мг, 0,18 ммоль) в ТГФ (5 мл) добавляют 3Н-1,2,4-триазол (16 мг, 0,23 ммоль) и SA (70 мг, 0,09 ммоль). Смесь перемешивают при rt в течение 15 час. Реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают названное в заголовке соединение в виде не совсем белого твердого вещества SA-9 (15 мг, 22%). SA-9:1H ЯМР (400 МГц, CDCl3), δ (м.д.), 7,76 (с, 1H), 7,64 (с, 1H), 5,27 (AB, 1H), 5,14 (AB, 1H), 2,65 (1H, т), 1,27(с, 3H), 0,67 (с, 3H).
Пример 9. Синтез SС-SS и промежуточных соединений дляSС-SS

Синтез соединений SC-KK и SC-LL. К раствору иодида триметилсульфоксония (43 г, 210 ммоль) в 200 мл ДМСО при перемешивании добавляют NaH (60%, 8,4 г, 210 ммоль). После перемешивания при комнатной температуре в течение 1 часа добавляют по каплям суспензию соединения SC (30 г, 105 ммоль) в 20 мл ДМСО. Через 2,5 часа реакционную смесь выливают в воду, охлажденную льдом, и экстрагируют этилацетатом (100 мл × 3). Затем объединенные этилацетатные слои промывают рассолом (100 мл × 3), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (петролейный эфир/этилацетат=20:1-15:1), и получают соединение SC-LL (14,7 г, 49 ммоль, 47%).
Синтез соединений SC-ММ и SC-NN. К смеси реагентов SC-KK и SC-LL (3,0 г, 10,0 ммоль, 1:1) добавляют сухой (Bu)4NF, и затем смесь греют при 100°С в течение ночи. Оставшуюся смесь выливают в 50 мл Н2О и экстрагируют этилацетатом (2×50 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Остаток очищают флэш-хроматографией (петролейный эфир/этилацетат=20:1), и получают продукт смесь SC-ММ и SC-NN (2,1 г, 6,5 ммоль, 65%) в виде не совсем белого твердого вещества.
Синтез соединений SC-ОО и SC-РР. К раствору смеси реагентов SC-ММ и SC-NN (2,1 г, 6,5 ммоль) в безводном ТГФ (30 мл) добавляют ВН3.ТГФ (1,0 М, 13,0 мл, 13,0 ммоль), и раствор перемешивают при 25°С в течение ночи. Затем реакцию гасят, добавляя воду (5 мл). Добавляют 2 М раствор NaOH (20 мл), а затем 30% Н2О2 (20 мл). Смесь перемешивают при комнатной температуре в течение 1 часа. Смесь разбавляют этилацетатом (200 мл), и полученный раствор промывают рассолом (2×100 мл), сушат над сульфатом магния и концентрируют в вакууме. Полученную сырую смесь используют непосредственно на следующей стадии без дополнительной очистки.
Синтез соединений SC-QQ и SC-RR. К раствору неочищенной смеси реагентов SC-ОО и SC-РР (2,2 г, 6,5 ммоль, теоретическое количество) в дихлорметане (40 мл) добавляют по частям хлорхромат пиридиния (Рсс) (2,8 г, 13,0 ммоль). Раствор перемешивают при 25°С в течение ночи. Затем смесь фильтруют через тонкий слой силикагеля, и силикагель промывают дихлорметаном (3×50 мл). Все фильтраты объединяют и концентрируют в вакууме. Остаток очищают флэш-хроматографией (петролейный эфир/этилацетат=15:1), и получают продукт SC-QQ (910 мг, 2,7 ммоль, выход=41% (2 стадии)) в виде не совсем белого твердого вещества, и продукт SC-RR (850 мг, 2,5 ммоль, выход=39% (2 стадии)) в виде не совсем белого твердого вещества. СоединениеSC-QQ:1Н-ЯМР (500 МГц, CDCl3) δ (м.д.): 4,17 (д, 2H), 2,53 (т, 1H), 2,17-2,13 (м, 2H), 2,11 (с, 3H), 2,03-2,00 (м, 1H), 0,62 (с, 3H). СоединениеSC-RR:1Н-ЯМР (500 МГц, CDCl3) δ (м.д.): 4,45 (AB×д, 1H), 4,39 (AB×д, 1H), 2,54 (т, 1H), 0,62 (с, 3H).
Синтез соединения SF. К раствору реагента SC-RR (100 мг, 0,301 ммоль) в метаноле (10 мл) добавляют 48% бромоводородную кислоту (152 мг, 0,903 ммоль), а затем бром (241 мг, 0,077 мл, 1,505 ммоль). Раствор греют при 25°С в течение 1,5 часов. Затем смесь выливают в холодную воду (50 мл). Полученное твердое вещество экстрагируют этилацетатом (2×50 мл). Объединенные органические экстракты промывают рассолом (50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SF используют непосредственно на следующей стадии без дополнительной очистки.
Пример 10. Синтез соединения SF-1.
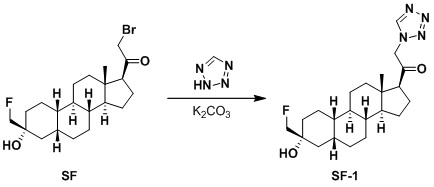
К суспензии К2СО3 (55 мг, 0,4 ммоль) в ТГФ (5 мл) добавляют 2Н-тетразол (28 мг, 0,4 ммоль) и соединение SF (83 мг, 0,2 ммоль). Смесь перемешивают при RT в течение 15 час, и затем реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Оставшуюся смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SF-1 в виде не совсем белого твердого вещества (6 мг, 8%). SF-1:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 8,75 (с, 1H), 5,32 (AB, 1H), 5,19 (AB, 1H), 4,48 (AB×д, 1H), 4,38 (AB×д, 1H), 2,68 (т, 1H), 0,68 (с, 3H). ЖХ-МС: rt=2,10 мин, m/z=405,4 [М+H]+.
Пример 11. Синтез соединений SF-2 и SF-3.

К суспензии К2СО3 (55 мг, 0,4 ммоль) в ТГФ (5 мл) добавляют 5-метил-2Н-тетразол (33,6 мг, 0,4 ммоль) и SF (85 мг, 0,2 ммоль), и смесь перемешивают при RT в течение 15 час. Полученную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Оставшуюся смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SF-2 в виде не совсем белого твердого вещества (22 мг, 26%) и SF-3 в виде не совсем белого твердого вещества (38 мг, 45%). SF-2:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 5,15 (AB, 1H), 5,06 (AB, 1H), 4,48 (AB×д, 1H), 4,39 (AB×д, 1H), 2,68 (т, 1H), 2,47 (с, 3H), 0,69 (с, 3H). ЖХ-МС: rt=2,09 мин, m/z=419,3 [М+H]+. SF-3:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 5,35 (т, 2H), 4,48 (AB×д, 1H), 4,38 (AB×д, 1H), 2,63 (т, 1H), 2,56 (с, 3H), 2,25-2,18 (м, 2H), 2,10-2,04 (м, 1H), 0,72 (с, 3H). ЖХ-МС: rt=2,20 мин, m/z=419,1 [М+H]+.
Пример 12. Синтез соединения SF-4.

К суспензии К2СО3 (55 мг, 0,4 ммоль) в ТГФ (5 мл) добавляют 2Н-1,2,3-триазол (28 мг, 0,4 ммоль) и соединение SF (85 мг, 0,2 ммоль). Смесь перемешивают при RT в течение 15 час, затем полученную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Оставшуюся смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SF-4 в виде не совсем белого твердого вещества (12 мг, 15%). SF-4:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 7,76 (д, 1H), 7,64 (д, 1H), 5,28 (AB, 1H), 5,14 (AB, 1H), 4,48 (AB×д, 1H), 4,38 (AB×д, 1H), 2,66 (т, 1H), 2,25 (с, 1H), 2,23-2,20 (м, 1H), 2,11-2,08 (м, 1H), 0,68 (с, 3H). ЖХ-МС: rt=2,05 мин, m/z=404,3 [М+H]+.
Пример 13. Синтез SG и промежуточных соединений для SG.

Синтез соединений SG-B1 и SG-B2. К раствору соединения SC (800 мг, 2,79 ммоль) и PhSO2CF2H (540 мг, 2,79 ммоль) в ТГФ (25 мл) и НМРА (0,5 мл) при -78°С в атмосфере N2 добавляют по каплям 1 М раствор LHMDS в ТГФ (4 мл). После перемешивания при -78°С в течение 2 час реакцию гасят насыщенным водным раствором NH4Cl (10 мл), и смесь оставляют нагреваться до комнатной температуры и затем экстрагируют EtOAc (20 мл × 3). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (петролейный эфир/этилацетат=10/1), и получают смесь соединений SG-B1 и SG-B2 (700 мг). Смесь дополнительно очищают хиральной ВЭЖХ, и получают соединение SG-B1 (200 мг, t=4,31 мин);1H ЯМР (400 МГц, CDCl3), δ (м.д.), 7,99-7,97 (д, 2H), 7,77-7,75 (м, 1H), 7,64-7,60 (м, 2H), 5,14-5,08 (м, 1H), 0,88 (с, 3H); и соединение SG-B2 (260 мг, t=5,66 мин);1H ЯМР (400 MHz, CDCl3), δ (м.д.), 8,00-7,98 (д, 2H), 7,77-7,75 (м, 1H), 7,64-7,60 (м, 2H), 5,14-5,09 (м, 1H), 0,88 (с, 3H).
Синтез соединения SG-С. К раствору соединения SG-B2 (100 мг, 0,209 ммоль) и безводного Na2HPO4 (100 мг) в безводном метаноле (5 мл) при -20°С в атмосфере N2 добавляют амальгаму Na/Hg (500 мг). После перемешивания при -20°С - 0°С в течение 1 часа метанольный раствор декантируют, и твердый остаток промывают Et2O (5×3 мл). Объединенные органические слои промывают рассолом (20 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (петролейный эфир/этилацетат=10/1), и получают соединение SG-С (36 мг, 0,106 ммоль, 51%).
1H ЯМР (400 МГц, CDCl3), δ (м.д.), 6,02-5,88 (т, 1H), 5,17-5,15 (м, 1H), 0,88 (с, 3H).
Синтез соединения SG-D. К раствору соединения SG-С (150 мг, 0,443 ммоль) в сухом ТГФ (5 мл) добавляют комплекс боран-тетрагидрофуран (1,34 мл 1 М раствора в ТГФ). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь охлаждают на ледяной бане, затем медленно гасят 10% водным раствором NaOH (1 мл) и затем 30% водным раствором Н2О2 (1,2 мл). Смесь перемешивают при комнатной температуре в течение 1 часа и затем экстрагируют EtOAc (3×10 мл). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (10 мл) и рассолом (10 мл), сушат над MgSO4, фильтруют и концентрируют, и получают сырое соединение SG-D (210 мг). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SG-Е. К раствору неочищенного соединения SG-D (210 мг), растворенного в 10 мл насыщенного Н2О дихлорметана (дихлорметан встряхивают с несколькими миллилитрами Н2О и затем отделяют от водного слоя) добавляют периодинат Десс-Мартина (380 мг, 0,896 ммоль). После перемешивания при комнатной температуре в течение 24 час реакционную смесь экстрагируют дихлорметаном (3×10 мл). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (10 мл) и рассолом (10 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетета=5:1), и получают соединение SG-Е (90 мг, 0,254 ммоль, 57%) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, CDCl3), δ (м.д.), 6,01-5,73 (т, 1H), 2,55-2,54 (м), 2,12 (с), 0,62 (с, 3H).
Синтез соединения SG. К раствору соединения SG-Е (80 мг, 0,226 ммоль) в МеОН (5 мл) добавляют 2 капли HBr (48%), а затем бром (100 мг, 0,63 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь выливают в смесь воды со льдом и затем экстрагируют этилацетатом (15 мл × 3). Объединенные органические слои промывают рассолом (20 мл), сушат над MgSO4, фильтруют и концентрируют, и получают сырое соединение SG (95 мг). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Пример 14. Синтез соединений SG-1 и SG-2.
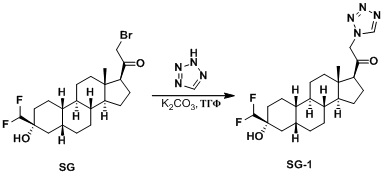
К суспензии К2СО3 (55 мг, 0,4 ммоль) в ТГФ (5 мл) добавляют 2Н-тетразол (28 мг, 0,4 ммоль) и 10 (86 мг, 0,2 ммоль). Смесь перемешивают при RT в течение 15 час. Полученную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Оставшуюся смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SG-1 в виде не совсем белого твердого вещества (12 мг, 14,2%) и не совсем белый твердый побочный продукт (15 мг, 17,7%).
SG-1:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 8,74 (с, 1H), 5,87 (т, 1H), 5,32 (AB, 1H, J=18,0 Гц), 5,19 (AB, 1H), 2,68 (т, 1H, J=8,5 Гц), 2,26-2,20 (м), 2,09-2,05 (м), 0,68 (с, 3H). ЖХ-МС: rt=2,11 мин, m/z=423,3 [М+H]+.
Пример 15. Синтез соединений SG-3 и SG-4.

К суспензии К2СО3 (55 мг, 0,4 ммоль) в ТГФ (5 мл) добавляют 5-метил-2Н-тетразол (28 мг, 0,4 ммоль) и SG (86 мг, 0,2 ммоль). Смесь перемешивают при RT в течение 15 час. Полученную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Оставшуюся смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SG-3 в виде не совсем белого твердого вещества (15 мг, 17%) и SG-4 в виде не совсем белого твердого вещества (30 мг, 34%). SG-3:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 5,87 (т, 1H), 5,15 (AB, 1H), 5,05 (AB, 1H), 2,67 (т, 1H), 2,47 (с, 3H), 2,22-2,20 (м, 1H) 2,09-2,07 (м, 1H), 0,69 (с, 3H). ЖХ-МС: rt=2,14 мин, m/z=437,1 [М+H]+. SG-4:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 5,87 (т, 1H), 5,35 (с, 2H), 2,63 (т, 1H), 2,56 (с, 3H), 0,72 (с, 3H). ЖХ-МС: rt=2,24 мин, m/z=437,0 [М+H]+.
Пример 16. Синтез соединения SG-5.
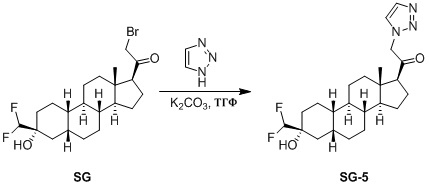
К суспензии К2СО3 (25 мг, 0,18 ммоль) в ТГФ (5 мл) добавляют 1Н-1,2,3-триазол (50 мг, 0,72 ммоль) и реагент (100 мг, 0,23 ммоль). Смесь перемешивают при комнатной температуре в течение 15 час, и затем реакционную смесь выливают в 10 мл Н2О и экстрагируют EtOAc (2×20 мл). Объединенные органические слои промывают рассолом (10 мл), сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Оставшуюся смесь очищают преп. ВЭЖХ с обращенной фазой, и получают названное в заголовке соединение SG-5 (15,4 мг, 0,0365 ммоль, 22%). SG-5:1H ЯМР (400 МГц, CDCl3) δ (м.д.): 7,75 (с, 1H), 7,64 (с, 1H), 5,87 (т, 1H), 5,27 (AB, 1H), 5,14 (AB, 1H), 2,66 (т, 1H), 0,69 (с, 3H).
Пример 17. Синтез SE и промежуточных соединений для SE.


Синтез соединения SE-А. К раствору EtMgBr (5 ммоль, 1М в ТГФ) в ТГФ (20 мл) при 0°С добавляют раствор соединения SC (858 мг, 3 ммоль) в сухом ТГФ (5 мл) в течение 30 мин через шприц-насос. После перемешивания при 0°С в течение 5 час реакционную смесь нагревают до комнатной температуры и перемешивают в течение ночи. Реакцию гасят охлажденной льдом водой, и смесь экстрагируют EtOAc (15 мл × 3). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Белый остаток очищают колоночной флэш-хроматографией (петролейный эфир/этилацетат=20:1-10:1), и получают SE-А (900 мг).
Синтез соединения SE-В. К раствору SE-А (200 мг, 0,66 ммоль) в сухом ТГФ (5 мл) добавляют комплекс боран-тетрагидрофуран (2 мл 1,0 М раствора в ТГФ). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь охлаждают на ледяной бане, и затем реакцию медленно гасят 10% водным раствором NaOH (1 мл), а затем 30% водным раствором Н2О2 (1,2 мл). Смесь перемешивают при комнатной температуре в течение 1 часа и затем экстрагируют EtOAc (3×10 мл). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (10 мл) и рассолом (10 мл), сушат над MgSO4, фильтруют и концентрируют, и получают соединение SE-В (260 мг, неочищенное). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SE-С. К растворусоединения SE-В (260 мг, неочищенное), растворенного в 10 мл дихлорметана, добавляют РСС (449 мг). После перемешивания при комнатной температуре в течение 24 час реакционную смесь экстрагируют дихлорметаном (3×10 мл). Объединенные органические слои промывают 10% водным раствором NaCl (10 мл) и рассолом (10 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=4:1-2:1), и получают названный в заголовке SE-С (15 мг) в виде не совсем белого твердого вещества.1H ЯМР (500 МГц, CDCl3), δ (м.д.), 2,49 (1H, т), 0,84 (т, 3H), 0,59 (с, 3H).
Синтез соединения SE. К растворусоединения SE-С (30 мг, 0,09 ммоль) в МеОН (5 мл) добавляют 2 капли HBr (48%), а затем бром (100 мг, 0,62 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь выливают в смесь воды со льдом и затем экстрагируют этилацетатом (10 мл × 3). Объединенные органические слои промывают рассолом (20 мл), сушат над MgSO4, фильтруют и концентрируют, и получают соединение SE (36 мг, неочищанное). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Пример 18. Синтез соединений SE-1 и SE-2.

К суспензии К2СО3 (50 мг, 0,36 ммоль) в ТГФ (5 мл) добавляют 1Н-тетразол (40 мг, 0,46 ммоль) и SM (100 мг, 0,243 ммоль). Смесь перемешивают при rt в течение 15 час. Реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают названное в заголовке соединение в виде не совсем белого твердого вещества SЕ-1 (9 мг, 9,2%) и SЕ-2 (15 мг, 15,6%). SЕ-1:1H ЯМР (400 МГц, CDCl3) δ (м.д.): 8,75 (с, 1H), 5,32 (AB, 1H), 5,20 (AB, 1H), 2,67 (т, 1H), 1,59 (к, 2H), 0,88 (т, 3H), 0,68 (с, 3H). ЖХ-МС: rt=2,27 мин, m/z=383,4 (М+-H2O+1). SЕ-2:1H ЯМР (400 МГц, CDCl3), δ (м.д.): 8,57 (с, 1H), 5,46 (с, 2H), 2,67 (т, 1H), 1,59 (к, 2H), 0,88 (т, 3H), 0,71(с, 3H). ЖХ-МС: rt=2,36 мин, m/z=383,4 (М+-H2O+1).
Пример 19. Синтез соединений SE-3 и SE-4.
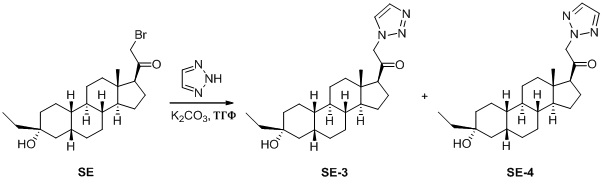
К суспензии K2СО3 (50 мг, 0,36 ммоль) в ТГФ (5 мл) добавляют 2Н-1,2,3-триазол (36 мг, 0,52 ммоль) и SE (100 мг, 0,25 ммоль). Смесь перемешивают при rt в течение 24 час. Затем реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают названное в заголовке соединение в виде не совсем белого твердого вещества SЕ-3 (9 мг, 9,3%) и SЕ-4 (10 мг, 10,3%).
SЕ-3:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 7,75 (д, 1H), 7,64 (д, 1H), 5,27 (AB, 1H), 5,13 (AB, 1H), 2,67 (1H, т), 1,59 (2H, к), 0,90 (3H, т), 1,28 (с, 3H), 0,67 (с, 3H). ЖХ-МС: rt=2,31 мин, m/z=400,4 (М++1). SЕ-4:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 7,68 (с, 2H), 5,25 (AB, 1H), 5,21 (AB, 1H), 2,58 (т, 1H), 1,59 (2H, к), 0,90 (3H, т), 0,71 (с, 3H). ЖХ-МС: rt=2,42 мин, m/z=400,4 (М++1).
Пример 20. Синтез соединений SE-5 и SE-6.

К суспензии К2СО3 (55 мг, 0,4 ммоль) в ТГФ (5 мл) добавляют 5-метил-2Н-тетразол (33,6 мг, 0,4 ммоль) и соединение SE (82 мг, 0,2 ммоль). Смесь перемешивают при RT в течение 15 час, и затем полученную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Оставшуюся смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SЕ-5 в виде не совсем белого твердого вещества (11,1 мг, 13,5%) и SЕ-6 в виде не совсем белого твердого вещества (30,6 мг, 37,26%). SЕ-5:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 5,13 (AB, 1H), 5,07 (AB, 1H), 2,66 (т, 1H), 2,47 (с, 3H), 2,24-2,17 (м, 1H), 2,11-2,05 (м, 1H), 1,47 (к, 2H), 0,93 (т, 3H), 0,69 (с, 3H). ЖХ-МС: rt=2,13 мин, m/z=415,1 [М+H]+. SЕ-6:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 5,37 (AB, 1H), 5,33 (AB, 1H), 2,62 (т, 1H), 2,56 (с, 3H), 2,25-2,18 (м, 1H), 2,09-2,06 (м, 1H), 1,47 (к, 2H), 0,93 (т, 3H), 0,72 (с, 3H). ЖХ-МС: rt=2,26 мин, m/z=415,3 [М+H]+.
Пример 21. Синтез SМ и промежуточных соединений для SМ.
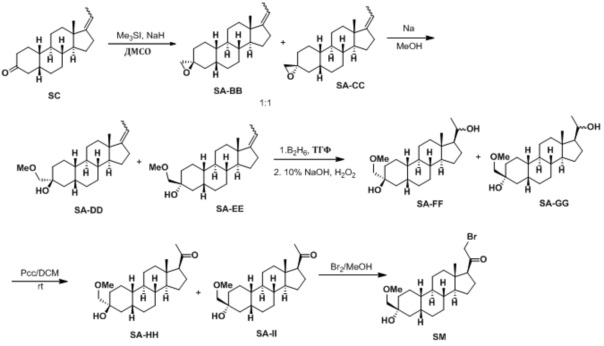
Синтез соединений SA-DD и SA-EE. Смесь соединений SA-ВВ и SA-СС (5,0 г, 16,7 ммоль) растворяют в сухом метаноле (250 мл), добавляют металлический Na (1,2 г, 50,0 ммоль), и раствор кипятят с обратным холодильником в течение 16 час. Затем метанол выпаривают, остаток растворяют в дихлорметане, раствор промывают Н2О (350 мл) и рассолом (100 мл), сушат над MgSO4, фильтруют и концентрируют. Сырое целевое соединение очищают хроматографией на силикагеле (петролейный эфир/этилацетат=10:1-5:1), раствор концентрируют, и получают смесь продуктов SA-DD и SA-EE (4,6 г, 83%) в виде не совсем белого твердого вещества.
Синтез соединений SA-FF и SA-GG. К раствору смеси реагентов SA-DD и SA-EE (4,6 г, 13,9 ммоль) в безводном ТГФ (30 мл) добавляют ВН3.ТГФ (1,0 М, 27,7 мл, 27,7 ммоль), раствор перемешивают при 25°С в течение ночи, и затем реакцию гасят, добавляя воду (5 мл). Добавляют 2 М раствор NaOH (30 мл), а затем 30% Н2О2 (30 мл). Смесь перемешивают при комнатной температуре в течение 1 часа. Смесь разбавляют этилацетатом (200 мл), и полученный раствор промывают рассолом (2×200 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырую смесь продуктов используют непосредственно на следующей стадии без дополнительной очистки.
Синтез соединений SA-НН и SA-II. К раствору неочищенной смеси реагентов SA-FF и SA-GG (4,9 г, 13,9 ммоль, теоретическое количество) в дихлорметане (40 мл) добавляют по частям хлорхромат пиридиния (РСС) (6,0 г, 27,8 ммоль). Раствор перемешивают при 25°С в течение ночи, затем смесь фильтруют через тонкий слой силикагеля, и силикагель промывают дихлорметаном (3×50 мл). Все фильтраты объединяют и концентрируют в вакууме. Остаток очищают флэш-хроматографией (петролейный эфир/этилацетат=15:1), и получают продукт SA-НН (2,1 г, 6,03 ммоль, выход=43% (2 стадии)) в виде не совсем белого твердого вещества и продукт SA-II (2,2 г, 6,32 ммоль, выход=45% (2 стадии)) в виде не совсем белого твердого вещества. СоединениеSA-НН:1Н-ЯМР (500 МГц, CDCl3) δ (м.д.): 3,40 (c, 3H), 3,20 (c, 2H), 2,62-2,51 (м, 2H), 2,11 (c, 3H), 2,02-1,99 (м, 2H), 0,62 (c, 3H). СоединениеSA-II:1Н-ЯМР (500 МГц, CDCl3) δ (м.д.): 3,42 (AB, 1H), 3,38 (AB, 1H), 3,40 (c, 3H), 2,65 (c, 1H), 2,54 (т, 1H), 2,16-2,14 (м, 1H), 2,11 (c, 3H), 2,02-1,98 (м, 1H), 0,61 (c, 3H).
Синтез соединения SМ. К раствору реагента SA-II (100 мг, 0,30 ммоль) в метаноле (10 мл) добавляют 48% бромоводородную кислоту (152 мг, 0,903 ммоль), а затем бром (241 мг, 0,077 мл, 1,51 ммоль). Раствор греют при 25°С в течение 1,5 часов, затем смесь выливают в холодную воду (50 мл), и полученное твердое вещество экстрагируют этилацетатом (2×50 мл). Объединенные органические экстракты промывают рассолом (50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SМ используют непосредственно на следующей стадии без дополнительной очистки.
Пример 22. Синтез соединения SМ-1.

К раствору соединения SМ (120 мг, 0,28 ммоль) в ТГФ (3 мл) добавляют К2СО3 (190 мг, 1,4 ммоль) и 1Н-тетразол (100 мг, 1,4 ммоль). Полученный раствор перемешивают при комнатной температуре в течение ночи, и затем реакционную смесь разбавляют EtOAc (20 мл). Полученный раствор промывают рассолом (10 мл), сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ, и получают SМ-1 (12 мг, 10%) и не совсем белый твердый побочный продукт (14 мг, 12%). SМ-1:1H ЯМР (500 МГц, CDCl3), δ (м.д.), 8,74 (c, 1H), 5,32 (AB, 1H), 5,19 (AB, 1H), 3,42 (AB, 1H), 3,40 (с, 3H), 3,39 (AB, 1H), 2,68 (т, 1H), 2,66 (c, 1H), 0,67 (c, 3H). ЖХ-МС: rt=2,19 мин; m/z=399,2 (М-18)+.
Пример 23. Синтез соединений SМ-3 и SМ-4.

К суспензии К2СО3 (55 мг, 0,4 ммоль) в ТГФ (5 мл) добавляют 5-метил-2Н-тетразол (33,6 мг, 0,4 ммоль) и 10 (85 мг, 0,2 ммоль). Смесь перемешивают при RT в течение 15 час, затем выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Оставшуюся смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SМ-3 в виде не совсем белого твердого вещества (8,6 мг, 10%) и не совсем белое твердое вещество SМ-4 (12 мг, 13,9%). SМ-3: 1Н ЯМР (500 МГц, CDCl3) δ (м.д.): 5,15 (AB, 1H), 5,05 (AB, 1H), 3,42 (AB, 1H), 3,39 (AB, 1H), 3,40 (c, 3H), 2,67 (т, 1H), 2,64 (c, 1H), 2,47 (c, 3H), 2,21-2,17 (м, 1H), 2,08-2,05 (м, 1H), 0,68 (c, 3H). ЖХ-МС: rt=2,14 мин, m/z=431,2 [М+H]+. SМ-4:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 5,37 (AB, 1H), 5,33 (AB, 1H), 3,42 (AB, 1H), 3,38 (AB, 1H), 3,40 (c, 3H), 2,63 (т, 1H), 2,56 (c, 3H), 0,71 (c, 3H). ЖХ-МС: rt=2,25 мин, m/z=431,2 [М+H]+.
Пример 24. Синтез соединений SМ-5.

К суспензии К2СО3 (55 мг, 0,4 ммоль) в ТГФ (5 мл) добавляют 2Н-1,2,3-триазол (28 мг, 0,4 ммоль) и соединение SM (85 мг, 0,2 ммоль). Смесь перемешивают при RT в течение 15 час, и затем полученную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Оставшуюся смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SМ-5 в виде не совсем белого твердого вещества (25 мг, 30%). Соединение SМ-5:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 7,76 (c, 1H), 7,65 (c, 1H), 5,28 (AB, 1H), 5,14 (AB, 1H), 3,42 (AB, 1H), 3,39 (AB, 1H), 3,40 (c, 3H), 2,66 (т, 1H), 2,23-2,20 (м, 1H), 2,10-2,08 (м, 1H), 0,67 (c, 3H). ЖХ-МС: rt=2,14 мин, m/z=415,8 [М+H]+.
Пример 25. Синтез SО и промежуточных соединений для SО.

Синтез соединений SO-C и SO-D. Смесь соединений SO-А и SO-В (5,0 г, 16,7 ммоль) растворяют в сухом этаноле (250 мл), и добавляют Na (1,2 г, 50,0 ммоль). Раствор кипятят с обратным холодильником в течение 16 час. Этанол выпаривают, остаток растворяют в дихлорметане, раствор промывают Н2О (3×50 мл) и рассолом (100 мл), сушат над MgSO4, фильтруют и концентрируют. Сырое целевое соединение очищают хроматографией на силикагеле (петролейный эфир/этилацетат=10:1-5:1), раствор концентрируют, и получают смесь продуктов SО-С и SО-D (4,5 г, 78%) в виде не совсем белого твердого вещества.
Синтез соединений SО-Е и SО-F. К раствору смеси реагентов SО-С и SО-D (4,5 г, 13,0 ммоль) в безводном ТГФ (30 мл) добавляют ВН3.ТГФ (1,0 М, 27,7 мл, 27,7 ммоль), и раствор перемешивают при 25°С в течение ночи. Затем реакцию гасят, добавляя воду (5 мл). Добавляют 2 М раствор NaOH (30 мл), а затем 30% Н2О2 (30 мл). Смесь перемешивают при комнатной температуре в течение 1 часа. Смесь разбавляют этилацетатом (200 мл), и полученный раствор промывают рассолом (2×100 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырую смесь продуктов используют непосредственно на следующей стадии без дополнительной очистки.
Синтез соединений SО-G и SО-H. К раствору неочищенной смеси реагентов SО-Е и SО-F (4,5 г, 13,0 ммоль, теоретическое количество) в дихлорметане (40 мл) добавляют по частям хлорхромат пиридиния (РСС) (5,7 г, 26,0 ммоль). Раствор перемешивают при 25°С в течение ночи. Затем смесь фильтруют через тонкий слой силикагеля, и силикагель промывают дихлорметаном (3×50 мл). Все фильтраты объединяют и концентрируют в вакууме. Остаток очищают флэш-хроматографией (петролейный эфир/этилацетат=15:1), и получают продукт SО-G (2,0 г, 5,5 ммоль, выход=42% (2 стадии)) в виде не совсем белого твердого вещества и продукт SО-Н (1,8 г, 4,97 ммоль, выход=38% (2 стадии)) в виде не совсем белого твердого вещества. SО-Н:1Н-ЯМР (500 МГц, CDCl3) δ (м.д.): 3,53 (к, 2H), 3,45 (AB, 1H), 3,41 (AB, 1H), 2,54 (т, 1H), 2,16-2,12 (м), 2,11 (c), 2,02-1,98 (м), 1,2 (т, 3H), 0,61 (c, 3H).
Синтез соединения SО. К раствору реагента SО-Н (100 мг, 0,301 ммоль) в метаноле (10 мл) добавляют 48% бромоводородную кислоту (152 мг, 0,903 ммоль), а затем бром (241 мг, 0,077 мл, 1,505 ммоль). Раствор греют при 25°С в течение 1,5 часов. Затем смесь выливают в холодную воду (50 мл). Полученное твердое вещество экстрагируют этилацетатом (2×50 мл). Объединенные органические экстракты промывают рассолом (50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SО используют непосредственно на следующей стадии без дополнительной очистки.
Пример 26. Синтез соединений SО-1 и SО-2.

К суспензии К2СО3 (55 мг, 0,4 ммоль) в ТГФ (3 мл) добавляют 5-метил-2Н-тетразол (33,6 мг, 0,4 ммоль) и 10 (85 мг, 0,2 ммоль). Смесь перемешивают при RT в течение 15 час. Полученную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Оставшуюся смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SО-1 в виде не совсем белого твердого вещества (9,6 мг, 10,8%) и SО-2 в виде не совсем белого твердого вещества (17,5 мг, 19,7%). SО-1:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 5,15 (AB, 1H), 5,05 (AB, 1H), 3,54 (к, 2H), 3,45 (AB, 1H), 3,41 (AB, 1H), 2,75 (c, 1H), 2,66 (т, 1H), 2,47 (c, 3H), 2,24-2,17 (м, 1H), 2,08-2,05 (м, 1H), 1,21 (т, 3H), 0,68 (c, 3H). ЖХ-МС: rt=2,24 мин, m/z=445,3 [М+H]+. SО-2:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 5,36 (AB, 1H), 5,35 (AB, 1H), 3,54 (к, 2H), 3,45 (AB, 1H), 3,41 (AB, 1H), 2,75 (c, 1H), 2,63 (т, 1H), 2,56 (c, 3H), 2,24-2,17 (м, 1H), 2,09-2,05 (м, 1H), 1,21 (т, 3H), 0,71 (c, 3H). ЖХ-МС: rt=2,35 мин, m/z= 427,3 [М-H2O+H]+.
Пример 27. Синтез SL и промежуточных соединений для SL.

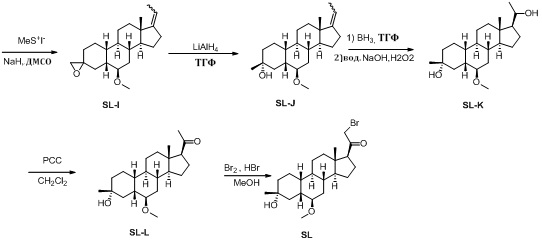
Синтез соединения SL-В. SA-A (10 г, 36,7 ммоль) добавляют к 50 мл ацетилхлорида и 50 мл уксусного ангидрида. Реакционную смесь греют при 120°С в течение 5 час, упаривают в вакууме, и получают SL-В в виде не совсем белого твердого вещества (10 г, выход 87%).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 5,78 (с, 1H), 5,55 (с, 1H), 2,4 (2H, дд), 2,13 (с, 3H), 0,90 (с, 3H).
Синтез соединения SL-С. К раствору SL-В (10 г, 31,8 ммоль) в 200 мл ТГФ и 20 мл Н2О при 0°С добавляют м-СРВА (11 г, 63,6 ммоль), перемешивают при rt в течение 15 час, реакционную смесь экстрагируют 500 мл EtOAc, экстракт промывают 100 мл насыщенного раствора Na2SO3, 100 мл насыщенного раствора NaHCO3 и 100 мл рассола и упаривают в вакууме, затем остаток очищают хроматографией (РЕ:EtOAc=5:1), и получают SL-С в виде не совсем белого твердого вещества (2,2 г, выход 24%).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 5,92 (с, 1H), 4,44 (с, 1H), 0,95 (с, 3H).
Синтез соединения SL-D. К раствору SL-С (2 г, 6,94 ммоль) в 50 мл EtOAc добавляют 200 мг Pd/C. Реакционную смесь гидрируют Н2, ~100 кПа (1 атм), в течение 15 час. Реакционную смесь упаривают в вакууме, затем остаток очищают хроматографией (РЕ:EtOAc=1:2), и получают SL-D в виде не совсем белого твердого вещества (1 г, выход 50%).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 3,83 (с, 1H), 0,93 (с, 3H).
Синтез соединения SL-Е. К раствору SL-D (1 г, 3,4 ммоль) в 100 мл МеОН добавляют 50 мг TsOH, и смесь греют при 60°С в течение 2 час. Реакционную смесь экстрагируют 500 мл EtOAc, экстракт промывают 100 мл насыщенного раствора NaHCO3 и 100 мл рассола, упаривают в вакууме, и получают SL-Е в виде не совсем белого твердого вещества (1 г, выход 91%).1Н ЯМР (400 МГц, MeOD), δ (м.д.), 3,80 (с, 1H), 3,20 (с, 3H), 3,15 (с, 3H), 0,89 (с, 3H).
Синтез соединения SL-F. К раствору бромида этилтрифенилфосфония (10,67 г, 28,84 ммоль) в 30 мл ТГФ добавляют KO-трет-Bu (3,23 г, 28,80 ммоль). Реакционную смесь греют при 60°С в течение 1 часа, затем к смеси добавляют SL-Е (3,23 г, 9,6 ммоль) и перемешивают при 60°С в течение 15 час. Реакционную смесь экстрагируют 500 мл EtOAc, экстракт промывают рассолом и упаривают в вакууме, затем остаток очищают хроматографией (РЕ:EtOAc=3:1), и получают SL-F в виде не совсем белого твердого вещества (2,18 г, выход 65%).1Н ЯМР (400 МГц, d6-ацетон), δ (м.д.), 5,09-5,07 (м, 1H), 3,65 (с, 1H), 3,11 (с, 3H), 3,08 (с, 3H), 0,88 (с, 3H).
Синтез соединения SL-G. К раствору SL-F (1 г, 2,9 ммоль) в 50 мл ТГФ добавляют NaH (2 г, 5,8 ммоль), и смесь перемешивают при rt в течение 1 часа. Затем к смеси добавляют 1 мл MeI, и смесь перемешивают при rt в течение ночи. Реакцию гасят 5 мл Н2О, смесь экстрагируют 100 мл EtOAc, экстракт промывают рассолом и упаривают в вакууме, затем остаток очищают хроматографией (РЕ:EtOAc=10:1), и получают SL-G в виде не совсем белого твердого вещества (577 мг, выход 55%).1Н ЯМР (400 МГц, d6-ацетон), δ (м.д.), 4,96-4,93 (м, 1H), 3,12 (с, 3H), 3,00 (с, 1H), 2,98 (с, 3H), 2,96 (с, 3H), 0,75 (с, 3H).
Синтез соединения SL-Н. К раствору SL-G (1 г, 2,8 ммоль) в 20 мл ТГФ добавляют 2 мл 2 М соляной кислоты, и смесь перемешивают при rt в течение 1 часа. Реакцию гасят 5 мл Н2О, смесь экстрагируют 100 мл EtOAc, экстракт промывают рассолом и упаривают в вакууме, затем остаток очищают хроматографией (РЕ:EtOAc=10:1), и получают SL-Н в виде не совсем белого твердого вещества (750 мг, выход 83%).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 5,15-5,11 (м, 1H), 3,32 (с, 3H), 3,14 (с, 1H), 0,92 (с, 3H).
Синтез соединения SL-I. К раствору иодида триметилсульфония (6,4 г, 31,5 ммоль) в 10 мл ДМСО добавляют NaH (60%, 800 мг, 31,5 ммоль). После перемешивания при комнатной температуре в течение 1 часа добавляют по каплям суспензию SL-Н (1 г, 3,2 ммоль) в 5 мл ДМСО. Через 15 час реакционную смесь выливают в охлажденную льдом воду и экстрагируют 300 мл EtOAc, экстракт промывают 100 мл рассола, сушат и упаривают в вакууме, затем остаток очищают хроматографией (РЕ:EtOAc=10:1), и получают SL-I и его изомер в виде не совсем белого твердого вещества (793 мг, выход 76%).
Синтез соединения SL-J. К раствору SL-I и его изомера (150 мг, 0,45 ммоль) в 10 мл ТГФ добавляют LiAlH4 (50 мг, 1,35 ммоль), и смесь перемешивают при rt в течение 1 часа. Реакцию гасят 5 мл Н2О, смесь экстрагируют 100 мл EtOAc, экстракт промывают рассолом и упаривают в вакууме, затем остаток очищают хроматографией (РЕ:EA=3:1), и получают SL-J в виде не совсем белого твердого вещества (72 мг, выход 48%).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 5,11-5,10 (м, 1H), 3,33 (с, 3H), 3,12 (с, 1H), 1,22 (с, 3H), 0,89 (с, 3H).
Синтез соединения SL-K. К раствору SL-J (100 мг, 0,3 ммоль) в сухом ТГФ (5 мл) добавляют комплекс боран-тетрагидрофуран (1 мл; 1,0 М раствор в ТГФ). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь охлаждают на ледяной бане, затем постепенно гасят 10% водным раствором NaOH (1 мл) и затем 30% водным раствором Н2О2 (1 мл). После перемешивания при комнатной температуре в течение одного часа смесь экстрагируют EtOAc (3×100 мл). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (100 мл) и рассолом (100 мл), сушат над MgSO4, фильтруют и концентрируют, и получают SL-K в виде не совсем белого твердого вещества (100 мг, 91%). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SL-L. К раствору SL-K (100 мг, 0,29 ммоль) в 20 мл DCM добавляют РСС (190 мг, 0,87 ммоль), и смесь перемешивают при rt в течение 2 час. Реакцию гасят 5 мл Н2О, смесь экстрагируют 100 мл EtOAc, экстракт промывают рассолом и упаривают в вакууме, затем остаток очищают хроматографией (РЕ:EtOAc=3:1), и получают SL-L в виде не совсем белого твердого вещества (55 мг, выход 55%).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 3,30 (с, 3H), 3,10 (с, 1H), 2,5 (1H, т, J=10 Гц), 2,1 (с, 3H), 1,16 (с, 3H), 0,56 (с, 3H).
Синтез соединения SL. К раствору SL-L (40 мг, 0,11 ммоль) в МеОН (5 мл) добавляют 2 капли HBr (48%), а затем бром (150 мг, 0,33 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь выливают в смесь воды со льдом, затем экстрагируют EtOAc (10 мл × 3). Объединенные органические слои промывают рассолом (20 мл), сушат над MgSO4, фильтруют и концентрируют, и получают неочищенное соединение SL в виде не совсем белого твердого вещества (40 мг, выход 80%). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Пример 28. Синтез соединений SL-1 и SL-2.

К суспензии SL (40 мг, 0,09 ммоль) в ТГФ (5 мл) добавляют 1Н-1,2,3-триазол (30 мг, 0,45 ммоль) и К2СО3 (60 мг, 0,45 ммоль). Смесь перемешивают при 25°С в течение 15 час. Реакционную смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SL-1 в виде не совсем белого твердого вещества (5 мг, выход 13%) и SL-2 в виде не совсем белого твердого вещества (5 мг, выход 13%). SL-1:1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 7,75 (с, 1H), 7,64 (с, 1H), 5,25-5,13 (м, 2H), 3,31 (с, 3H), 3,11 (с, 1H), 1,24 (с, 3H), 0,71 (с, 3H). SL-2:1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 7,68 (с, 2H), 5,27-5,19 (м, 2H), 3,31 (с, 3H), 3,11 (с, 1H), 1,21 (с, 3H), 0,75 (с, 3H).
Пример 29. Синтез SH и промежуточных соединений для SH.

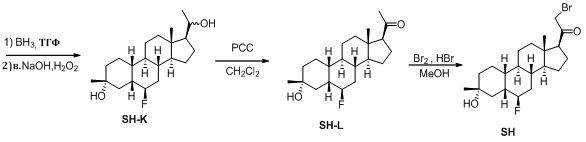
Синтез соединения SH-С. К раствору соединения SL-В (10 г, 31,8 ммоль) в 200 мл ТГФ и 20 мл Н2О при 0°С добавляют м-СРВА (11 г, 63,6 ммоль). После перемешивания при rt в течение 15 час реакционную смесь разбавляют 500 мл EtOAc. Полученный раствор промывают 300 мл насыщ. раствора Na2S2O3, 300 мл насыщ. раствора NaHCO3 и 300 мл рассола и упаривают в вакууме. Остаток очищают хроматографией (РЕ:ЕА=5:1), и получают SH-С в виде не совсем белого твердого вещества (1,1 г, 3,8 ммоль, выход 12%).1Н ЯМР (500 МГц, CDCl3), δ (м.д.), 6,25 (с, 1H), 4,27 (дд, 1H), 0,93 (с, 3H).
Синтез соединения SH-D. К раствору соединения SН-С (2 г, 6,94 ммоль) в 50 мл EtOAc добавляют 200 мг Pd/C. Реакционную смесь гидрируют Н2, ~100 кПа (1 атм), в течение 15 час. Реакционную смесь упаривают в вакууме, затем остаток очищают хроматографией (РЕ:EtOAc=1:2), и получают SН-D в виде не совсем белого твердого вещества (1,5 г, выход 75%).1Н ЯМР (500 МГц, CDCl3), δ (м.д.), 3,97 (тд, 1H), 0,88 (с, 3H).
Синтез соединения SН-Е. К раствору соединения SН-D (1 г, 3,4 ммоль) в 100 мл МеОН добавляют 50 мг TsOH. Раствор греют при 60°С в течение 2 час. Затем реакционную смесь разбавляют 500 мл EtOAc, промывают 100 мл насыщ. раствора NaHCO3 и 100 мл рассола, упаривают в вакууме, и получают SН-Е в виде не совсем белого твердого вещества (1 г, выход 91%).
Синтез соединения SН-F. К раствору бромида этилтрифенилфосфония (10,67 г, 28,84 ммоль) в 30 мл ТГФ добавляют KO-трет-Bu (3,23 г, 28,80 ммоль). Реакционную смесь греют при 60°С в течение 1 часа, и затем к смеси добавляют соединение SН-Е (3,23 г, 9,6 ммоль). Раствор греют при 60°С в течение 15 час. Затем реакционную смесь разбавляют 500 мл EtOAc. Полученный раствор промывают 100 мл рассола, упаривают в вакууме, затем остаток очищают хроматографией (РЕ:EA=3:1), и получают SН-F в виде не совсем белого твердого вещества (2 г, 5,74 ммоль, выход 62%).1Н ЯМР (500 МГц, MeOD), δ (м.д.), 5,15-5,12 (м, 1H), 3,80-3,78 (м, 1H), 3,21 (с, 3H), 3,15 (с, 3H), 1,67 (д, 3H), 0,95 (с, 3H).
Синтез соединения SН-G. К растворусоединения SН-F (0,5 г, 1,43 ммоль) в 10 мл DCM при -78°С добавляют DAST (0,5 мл, 10 ммоль). Реакционную смесь перемешивают при -78°С в течение 30 мин, затем реакцию гасят 5 мл насыщ. раствора NaHCO3, смесь экстрагируют 50 мл DCM, экстракт промывают 100 мл рассола, сушат над Na2SO4, концентрируют в вакууме, остаток очищают хроматографией (РЕ:EA=30:1), и получают SН-G в виде не совсем белого твердого вещества (175 мг, 0,05 ммоль, выход 35%).
Синтез соединения SН-Н. К раствору SН-G (350 мг, 1 ммоль) в 20 мл ТГФ добавляют 2 М HCl (2 мл). Раствор перемешивают при rt в течение 1 часа, затем реакционную смесь экстрагируют 100 мл EtOAc, экстракт промывают 100 мл рассола и упаривают в вакууме. Затем полученный остаток очищают хроматографией (РЕ:EA=10:1), и получают SН-Н в виде не совсем белого твердого вещества (210 мг, 0,7 ммоль, выход 60%).1Н ЯМР (500 МГц, CDCl3), δ (м.д.), 5,17-5,14 (м, 1H), 4,80-4,66 (м, 1H), 2,61-2,57 (м, 1H), 1,79 (д, 3H), 0,93 (с, 3H).
Синтез соединения SН-I. К суспензии иодида триметилсульфония (3,2 г, 16 ммоль) в 10 мл ДМСО при перемешивании добавляют NaH (60%, 400 мг, 16 ммоль). После перемешивания при комнатной температуре в течение 1 часа добавляют по каплям суспензию соединения SН-Н (486 мг, 1,6 ммоль) в 5 мл ДМСО. Через 15 час реакционную смесь выливают в охлажденную льдом воду и экстрагируют 300 мл EtOAc. Полученный раствор промывают 100 мл рассола, сушат (Na2SO4) и упаривают в вакууме. Затем полученный остаток очищают хроматографией (РЕ:EA=10:1), и получают смесь SН-I и его изомера С-3 в виде не совсем белого твердого вещества (290 мг, 0,91 ммоль, выход 58%).
Синтез соединения SН-J. К раствору SН-I и его изомера С-3 (300 мг, 0,94 ммоль) в 10 мл ТГФ добавляют LiAlH4 (100 мг, 2,7 ммоль). Суспензию перемешивают при rt в течение 1 часа. Затем реакцию гасят 5 мл Н2О, и смесь экстрагируют 100 мл EtOAc. Полученный раствор промывают рассолом и упаривают в вакууме. Затем полученный остаток очищают хроматографией (РЕ:EA=3:1), и получают SН-J в виде не совсем белого твердого вещества (140 мг, выход 48%).1Н ЯМР (500 МГц, CDCl3), δ (м.д.), 5,15-5,12 (м, 1H), 4,72-4,60 (м, 1H), 1,70 (д, 3H), 1,27 (с, 3H), 0,92 (с, 3H).
Синтез соединения SН-K. К раствору соединения SН-J (100 мг, 0,3 ммоль) в сухом ТГФ (5 мл) добавляют комплекс боран-тетрагидрофуран (1 мл; 1,0 М раствор в ТГФ). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь охлаждают на ледяной бане, затем постепенно гасят 10% водным раствором NaOH (1 мл) и затем 30% водным раствором Н2О2 (1 мл). После перемешивания при комнатной температуре в течение одного часа смесь экстрагируют EtOAc (3×100 мл). Затем объединенные органические экстракты промывают 10% водным раствором Na2S2O3 (100 мл) и рассолом (100 мл), сушат над MgSO4, фильтруют и концентрируют, и получают сырой SН-K в виде не совсем белого твердого вещества (100 мг, 91%). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SН-L. К раствору соединения SН-K (100 мг, 0,29 ммоль) в 20 мл DCM добавляют РСС (190 мг, 0,87 ммоль), и полученный раствор перемешивают при rt в течение 2 час. Затем реакционную смесь фильтруют через слой целита, и фильтрат упаривают в вакууме. Затем остаток очищают хроматографией (РЕ:EA=3:1), и получают SН-L в виде не совсем белого твердого вещества (53 мг, выход 53%).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 4,71-4,57 (м, 1H), 2,54 (1H, т), 2,15 (с, 3H), 1,28 (с, 3H), 0,58 (с, 3H).
Синтез соединения SН. К раствору соединения SН-L (40 мг, 0,11 ммоль) в МеОН (5 мл) добавляют 2 капли HBr (48%), а затем бром (150 мг, 0,33 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь выливают в смесь воды со льдом и затем экстрагируют EtOAc (10 мл × 3). Объединенные органические слои промывают рассолом (20 мл), сушат над MgSO4, фильтруют и концентрируют, и получают неочищенное соединение SН в виде желтого твердого вещества (40 мг, выход 80%). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Пример 30. Синтез соединений SН-1 и SН-2.

К суспензии SН (50 мг, 0,12 ммоль) в ТГФ (5 мл) добавляют 2Н-1,2,3-триазол (120 мг, 1,8 ммоль) и К2СО3 (200 мг, 1,2 ммоль). Смесь перемешивают при 25°С в течение 15 час. Реакционную смесь экстрагируют этилацетатом (20 мл × 3). Объединенные органические слои промывают рассолом (20 мл), сушат над MgSO4, фильтруют и концентрируют, и получают сырой продукт реакции. Сырой продукт очищают преп. ВЭЖХ с обращенной фазой, и получают SН-1 в виде не совсем белого твердого вещества (12 мг, 0,03 ммоль, выход 25%) и SН-2 в виде не совсем белого твердого вещества (5,7 мг, 0,014 ммоль, выход 8,33%). SН-1:1Н ЯМР (500 МГц, CDCl3), δ (м.д.), 7,76 (с, 1H), 7,65 (с, 1H), 5,29 (1H, AB), 5,14 (1H, AB), 4,73-4,59 (м, 1H), 2,68 (1H, т), 1,30 (с, 3H), 0,67 (с, 3H). SН-2:1Н ЯМР (500 МГц, CDCl3), δ (м.д.), 7,69 (с, 2H), 5,27 (1H, AB), 5,23 (1H, AB), 4,73-4,59 (м, 1H), 4,64-4,59 (м, 1H), 2,60 (1H, т), 1,29 (с, 3H), 0,70 (с, 3H).
Пример 31. Синтез SВ и промежуточных соединений для SВ.




Синтез соединений SB-B и SВ-С. В 2,7 л сжиженного аммиака в трехгорлой колбе при -70°С добавляют небольшие кусочки лития (7,63 г, 1,1 моль). Как только весь литий растворится, синий раствор нагревают до -50°С. Добавляют по каплям раствор 19-норандрост-4-ен-3,17-диона SВ-А (1,30 г, 110 ммоль) и трет-BuOH (8,14 г, 110 ммоль) в 800 мл безводного тетрагидрофурана и перемешивают в течение 90 мин, пока реакционная смесь не станет светло-желтой. Добавляют хлорид аммония (70 г), и смесь оставляют для испарения избытка аммиака. Остаток экстрагируют 0,5 N HCl (500 мл) и дихлорметаном (500 мл × 2). Объединенные органические слои промывают насыщенным раствором NaHCO3, сушат над Na2SO4, фильтруют и концентрируют, и получают смесь SB-B и SВ-С (21 г, 70%), которую используют непосредственно на следующей стадии без дополнительной очистки. Раствор SB-B и SВ-С (21 г, 76 ммоль) в 50 мл безводного дихлорметана добавляют к суспензии хлорхромата пиридиния (РСС) (32,8 г, 152 ммоль) в 450 мл дихлорметана. После перемешивания при комнатной температуре в течение 2 час к темнокоричневой реакционной смеси добавляют 2 N раствор NaOH (500 мл), и смесь перемешивают еще в течение 10 мин. Полученный раствор экстрагируют дихлорметаном, объединенные органические слои промывают 2 N HCl и рассолом, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=20:1-10:1), и получают названное в заголовке соединение SВ-С (16,8 г, 80%) в виде не совсем белого твердого вещества.1Н ЯМРSВ-В (400 МГц, CDCl3), δ (м.д.), 3,65 (т, 1Н), 0,77 (с, 3Н). 1Н ЯМРSВ-С (400 МГц, CDCl3), δ (м.д.), 0,88 (с, 3Н).
Синтез соединения SB-D. К раствору соединения SВ-С (16,8 г, 61,3 ммоль) в метаноле (250 мл) добавляют иод (1,54 г, 6,1 ммоль). После перемешивания при 60°С в течение 12 час растворитель удаляют в вакууме. Сырой продукт растворяют в дихлорметане (200 мл), и раствор промывают насыщенным раствором NaHCO3 (150 мл) и рассолом, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают хроматографией на оксиде алюминия (петролейный эфир/этилацетат=100:1), и получают соединение SB-D (14 г, 43,8 ммоль, 71%).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 3,18 (с, 3H), 3,12 (с, 3H), 0,85 (с, 3H).
Синтез соединения SB-Е. К суспензии трет-BuOK (7,36 г, 65,7 ммоль) в ТГФ (100 мл) при 0°С постепенно добавляют бромид этилтрифенилфосфония (26 г, 70 мл). После перемешивания при 60°С в течение 3 час добавляют соединение SB-D (7 г, 21,9 ммоль), и смесь перемешивают при 60°С еще в течение 2 час. После охлаждения до комнатной температуры реакционную смесь выливают в насыщенный раствор хлорида аммония и экстрагируют EtOAc (2×500 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют, и получают сырое соединение SB-Е (7,36 г, 100%). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SB-F. Раствор неочищенного соединения SB-Е (7,36 г, 21,9 ммоль) в ТГФ (50 мл) подкисляют 1 N соляной кислотой до рН=3. После перемешивания при комнатной температуре в течение 12 час реакционную смесь экстрагируют этилацетатом (250 мл × 2). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Остаток очищают колоночной хроматографией (петролейный эфир/этилацетат=30:1-20:1), и получают соединение SВ-F (4,8 г, 16,7 ммоль, 76% за две стадии).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 5,12-5,10 (м, 1H), 0,77 (с, 3H).
Синтез соединения SB-G. К раствору МеMgBr (28 ммоль, 1М в ТГФ) в ТГФ (50 мл) при 0°С добавляют раствор соединения SВ-F (4,8 г, 16,8 ммоль) в сухом ТГФ (10 мл) в течение 30 мин через шприц-насос. После перемешивания при 0°С в течение 5 час реакционную смесь нагревают до комнатной температуры и перемешивают в течение ночи. Реакцию гасят охлажденной льдом водой, и смесь экстрагируют EtOAc (150 мл × 3). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Белый остаток очищают колоночной флэш-хроматографией (петролейный эфир/этилацетат=20:1-10:1), и получают соединение SB-G (2,5 г, 8,28 ммоль, 49%; Rf=0,35, петролейный эфир/этилацетат=10:1).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 5,05-5,03 (м, 1H), 1,21 (с, 3H), 0,90 (с, 3H).
Синтез соединения SВ-Н. К растворусоединения SB-G (2 г, 6,62 ммоль) в сухом ТГФ (50 мл) добавляют комплекс боран-тетрагидрофуран (20 мл 1,0 М раствора в ТГФ). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь охлаждают на ледяной бане и затем постепенно гасят 10% водным раствором NaOH (10 мл), а затем 30% водным раствором Н2О2 (12 мл). После перемешивания при комнатной температуре в течение одного часа смесь экстрагируют EtOAc (3×100 мл). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (100 мл) и рассолом (100 мл), сушат над MgSO4, фильтруют и концентрируют, и получают сырое соединение SE-В (2 г, 100%). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SВ-I. К растворунеочищенногосоединения SВ-Н (2 г, 6,62 ммоль) в 60 мл влажного дихлорметана (дихлорметан встряхивают с несколькими миллилитрами Н2О и затем отделяют от водного слоя) добавляют периодинат Десс-Мартина (5,5 г, 13 ммоль). После перемешивания при комнатной температуре в течение 24 час реакционную смесь экстрагируют дихлорметаном (3×100 мл). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (100 мл) и рассолом (100 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетат=10:1-5:1), и получают соединение SВ-I (1 г, 3,14 ммоль, 47% за две стадии) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3), δ (м.д.), 2,56 (т, 1H), 2,11 (с и м, 4H), 2,0 (дт, 1H), 1,8 (дм, 2H), 1,54 (м, 6H), 1,43 (м, 1H), 1,34 (м, 2H), 1,20 (м, 12H), 0,7 (м, 2H), 0,62 (с, 3H).
Синтез соединения SВ. К растворусоединения SВ-I (600 мг, 1,89 ммоль) в МеОН (20 мл) добавляют 5 капель HBr (48%), а затем бром (302 мг, 1,89 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь выливают в смесь воды со льдом и затем экстрагируют этилацетатом (100 мл × 3). Объединенные органические слои промывают рассолом (200 мл), сушат над MgSO4, фильтруют и концентрируют, и получают сырое соединение SВ (600 мг).
Пример 32. Синтез соединения SВ-1

К суспензии К2СО3 (25 мг, 0,18 ммоль) в ТГФ (5 мл) добавляют 1,2,4-триазол (13 мг, 0,18 ммоль) и соединение SB (36 мг, 0,09 ммоль). После перемешивания при комнатной температуре в течение 15 час реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Реакционную смесь очищают преп. ВЭЖХ с обращенной фазой, и получают названное в заголовке соединение в виде не совсем белого твердого вещества (15 мг, 42%). SВ-1: 1H ЯМР (500 МГц, CDCl3), δ (м.д.), 8,14 (с, 1H), 7,96 (с, 1H), 5,02 (AB, 1H), 4,93 (AB, J=18,0 Гц, 1H), 2,63 (т, 1H), 1,21 (с, CH3), 0,69 (с, 3H).
Пример 33. Синтез соединения SВ-2.

К суспензии К2СО3 (25 мг, 0,18 ммоль) в ТГФ (5 мл) добавляют тетразол (13 мг, 0,18 ммоль) и соединение SB (36 мг, 0,09 ммоль). После перемешивания при комнатной температуре в течение 15 час реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Реакционную смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SВ-2 в виде не совсем белого твердого вещества (7 мг, 19%) и не совсем белый твердый побочный продукт (4 мг, 11%). SВ-2: 1H ЯМР (500 МГц, CDCl3), δ (м.д.), 8,58 (с, 1H), 5,49 (AB, 1H), 5,44 (AB, 1H), 2,63 (т, 1H), 1,21 (с, CH3), 0,72 (с, 3H).
Пример 34. Синтез соединений SВ-4 и SВ-5.

К суспензии К2СО3 (67 мг, 0,50 ммоль) в ТГФ (5 мл) добавляют 5-метил-1Н-тетразол (42,0 мг, 0,50 ммоль) и соединение SB (100 мг, 0,25 ммоль). После перемешивания при комнатной температуре в течение 15 час реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом (2×10 мл), сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают SВ-4 в виде не совсем белого твердого вещества (10,1 мг, 0,025 ммоль, 10,1%) и SВ-5 в виде не совсем белого твердого вещества (21,3 мг, 0,053 ммоль, 21,2%). SВ-4: 1H ЯМР (500 МГц, CDCl3) δ (м.д.): 5,12 (AB, 1H), 5,06 (AB, 1H), 2,66 (т, 1H), 2,47 (с, 3H), 1,21 (с, CH3), 0,69 (с, 3H). ЖХМС: Rt=2,19 мин. m/z=401,3 [M+H]+. SВ-5: 1H ЯМР (500 МГц, CDCl3) δ (м.д.): 5,35 (AB, 1H), 5,34 (AB, 1H), 2,63 (т, 1H), 2,56 (с, 3H), 1,21 (с, CH3), 0,72 (с, 3H). ЖХМС: Rt=2,30 мин. m/z=401,3 [M+H]+.
Пример 35. Синтез соединения SВ-6.

К суспензии К2СО3 (25 мг, 0,18 ммоль) в ТГФ (5 мл) добавляют 1,2,3-триазол (13 мг, 0,18 ммоль) и соединение SB (36 мг, 0,09 ммоль). После перемешивания при комнатной температуре в течение 15 час реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Реакционную смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SВ-6 в виде не совсем белого твердого вещества (12 мг, 33%). SВ-6: 1H ЯМР (500 МГц, CDCl3), δ (м.д.), 7,76 (с, 1H), 7,64 (д, 1H), 5,26 (AB, 1H), 5,14 (AB, 1H), 2,59 (т, 1H), 1,21 (с, 3H), 0,68 (с, 3H).
Пример 36. Синтез SD и промежуточных соединений для SD.

Синтез соединения SD-В1 и SD-В2. К раствору соединения SC (1,3 г, 4,5 ммоль) и PhSO2CH2F (790 мг, 4,5 ммоль) в ТГФ (25 мл) и НМРА (0,5 мл) при -78°С в атмосфере N2 добавляют по каплям 1 М раствор LHMDS в ТГФ (5,5 мл). После перемешивания при -78°С в течение 2 час реакцию гасят насыщенным водным раствором NH4Cl (10 мл), смесь оставляют нагреваться до комнатной температуры и затем экстрагируют EtOAc (20 мл × 3). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (петролейный эфир/этилацетат=10/1), и получают смесь соединений SD-В1 и SD-В2 (1,53 г). Смесь дополнительно очищают хиральной ВЭЖХ, и получают соединение SD-В1-А (220 мг, t=3,41 мин).1Н ЯМР (500 МГц, CDCl3), δ (м.д.), 7,99-7,97 (м, 2H), 7,75-7,74 (м, 1H), 7,62-7,55 (м, 2H), 5,13-5,09 (м, 1H), 4,86-4,78 (д, 1H), 0,88 (с, 3H); SD-B1-B (200 мг, t=3,66 мин);1Н ЯМР (500 МГц, CDCl3), δ (м.д.), 7,96-7,95 (м, 1H), 7,71-7,69 (м, 1H), 7,62-7,58 (м, 2H), 5,13-5,09 (м, 1H), 4,87-4,77 (д, 1H), 0,88 (с, 3H); SD-B2-A (235 мг, t=4,9мин).1Н ЯМР (500 МГц, CDCl3), δ (м.д.), 7,99-7,97 (м, 1H), 7,72-7,70 (м, 1H), 7,62-7,59 (м, 2H), 5,29-5,20 (д, 1H), 4,88-4,78 (м,1H), 0,88 (с, 3H); SD-B2-B (220 мг, t=5,2 мин).1Н ЯМР (500 МГц, CDCl3), δ (м.д.), 7,99-7,97 (м, 2H), 7,72 (м, 1H), 7,62-7,59 (м, 2H), 5,30-5,20 (д, 1H), 5,09-5,08 (м, 1H), 0,88 (с, 3H).
Синтез соединения SD-С. К раствору соединения SD-В1-А (200 мг, 0,434 ммоль) и безводного Na2HPO4 (100 мл) в безводном метаноле (15 мл) при -20°С в атмосфере N2 добавляют амальгаму Na/Hg (400 мг). После перемешивания при -20°С - 0°С в течение 1 часа метанольный раствор декантируют, и твердый остаток промывают Et2O (5×3 мл). Растворитель из объединенной органической фазы удаляют в вакууме, добавляют 20 мл рассола, и затем смесь экстрагируют Et2O. Объединенную эфирную фазу сушат над MgSO4, эфир удаляют, и получают сырой продукт реакции, который дополнительно очищают хроматографией на силикагеле (РЕ/ЕА=10/1), и получают 99 мг продукта, 69%.1H ЯМР (500 МГц, CDCl3), δ (м.д.), 5,12-5,10 (м, 1H), 4,21-24,11 (д, 2H), 0,88 (с, 3H).
Синтез соединения SD-D. К раствору соединения SD-С (95 мг, 0,296 ммоль) в сухом ТГФ (5 мл) добавляют комплекс боран-тетрагидрофуран (1 мл 1 М раствора в ТГФ). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь охлаждают на ледяной бане и затем постепенно гасят 10% водным раствором NaOH (1 мл) и затем 30% водным раствором Н2О2 (1,2 мл). Смесь перемешивают при комнатной температуре в течение 1 часа и затем экстрагируют EtOAc (3×10 мл). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (10 мл) и рассолом (10 мл), сушат над MgSO4, фильтруют и концентрируют, и получают соединение SD-D (120 мг, неочищенное). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SD-Е. К раствору соединения SD-D (120 мг, неочищенное), растворенного в 10 мл влажного дихлорметана (дихлорметан встряхивают с несколькими миллилитрами Н2О и затем отделяют от водного слоя), добавляют периодинат Десс-Мартина (300 мг, 0,707 ммоль). После перемешивания при комнатной температуре в течение 24 час реакционную смесь экстрагируют дихлорметаном (3×10 мл). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (10 мл) и рассолом (10 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетет=1:5), и получают соединение SD-Е (70 мг, 70% за две стадии) в виде не совсем белого твердого вещества. 1H ЯМР (500 МГц, CDCl3), δ (м.д.), 4,21-4,11 (д, 2H), 2,19 (с), 0,62 (с, 3H).
Синтез соединения SD. К раствору реагента (200 мг, 0,594 ммоль) в метаноле (5 мл) добавляют 48% бромоводородную кислоту (300 мг, 1,782 ммоль), а затем бром (475 мг, 0,152 мл, 2,97 ммоль). Раствор греют при 25°С в течение 2 часов. Затем смесь выливают в холодную воду (50 мл). Полученное твердое вещество экстрагируют этилацетатом (2×100 мл). Объединенные органические экстракты промывают рассолом (100 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Пример 37. Синтез соединения SD-1.

К суспензии К2СО3 (63 мг, 0,47 ммоль) в ТГФ (10 мл) добавляют 1,2,3-1Н-триазол (11,4 мг, 0,47 ммоль) и соединение SD (100 мг, 0,23 ммоль). После перемешивания при комнатной температуре в течение 15 час реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом (2×10 мл), сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают SD-1 в виде не совсем белого твердого вещества (28,7 мг, 29,5%) и SGE-00921-01-А в виде не совсем белого твердого вещества (22,8 мг, 23,4%). SD-1: 1H ЯМР (500 МГц, CDCl3), δ (м.д.), 7,76 (д, 1H), 7,65 (д, 1H), 5,28 (AB, 1H), 5,14 (AB, 1H), 4,17 (д, 2H), 2,66 (т, 1H), 0,68 (с, 3H). ЖХМС: Rt=2,18 мин. m/z=404,2 [М+H]+.
Пример 38. Синтез соединений SD-2 и SD-3.

К суспензии К2СО3 (63 мг, 0,47 ммоль) в ТГФ (10 мл) добавляют 5-метил-1Н-тетразол (39,5 мг, 0,47 ммоль) и соединение SD (100 мг, 0,23 ммоль). После перемешивания при комнатной температуре в течение 15 час реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом (2×10 мл), сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают SD-2 в виде не совсем белого твердого вещества (6,5 мг, 0,016 ммоль, 6,7%) и SD-3 в виде не совсем белого твердого вещества (25,8 мг, 0,062 ммоль, 25,8%). SD-2: 1H ЯМР (500 МГц, CDCl3), δ (м.д.): 5,12 (AB, 1H), 5,06 (AB, 1H), 4,17 (д, J=47,8 Гц, 2H), 2,67 (т, 1H), 2,47 (с, 3H), 0,69 (с, 3H). ЖХМС: Rt=2,11 мин. m/z=419,3 [М+H]+. SD-3:1H ЯМР (500 МГц, CDCl3) δ (м.д.): 5,35 (AB, 1H), 5,34 (AB, 1H), 4,17 (д, 2H), 2,63 (т, 1H), 2,56 (с, 3H), 0,72 (с, 3H). ЖХМС: Rt=2,21 мин. m/z=419,3 [М+H]+.
Пример 39. Синтез соединений SD-4 и SD-5.

К раствору неочищенного реагента 11 (100 мг, 0,241 ммоль) в безводном ТГФ (5 мл) добавляют 1Н-тетразол (140 мг, 1,2 ммоль), а затем карбонат калия (85 мг, 1,2 ммоль). Раствор греют при 60°С в течение 2 час, затем раствор охлаждают до комнатной температуры и разбавляют этилацетатом (100 мл). Полученный раствор промывают рассолом (2×50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции очищают преп. ВЭЖХ с обращенной фазой, и получают продукт SD-4 (15 мг, 0,04 ммоль, выход=17%) и не совсем белый твердый побочный продукт (26 мг, 0,06 ммоль, выход=25%). SD-4: 1H ЯМР (500 МГц, CDCl3), δ (м.д.): 8,75 (1H, с), 5,32 (1H, AB, J=18,5 Гц), 5,18 (1H, AB), 4,17 (2H, д), 2,68 (1H, т), 0,68 (3H, с). ЖХМС: rt=2,14 мин, m/z=405 [М+H]+.
Пример 40. Синтез SP и промежуточных соединений для SP.

Синтез соединения SP-В. К раствору реагента SC (4,4 г, 15,18 ммоль) в сухом ТГФ (50 мл) при 0°С добавляют по каплям 3 М раствор этилмагнийбромида в ТГФ (51,28 мл). Затем раствор постепенно нагревают до температуры окружающей среды и перемешивают в течение 15 час. Добавляют насыщ. раствор NH4Cl (20 мл) для гашения реакции, и полученный раствор экстрагируют этилацетатом (3×100 мл). Экстракты промывают рассолом, сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь петролейный эфир:этилацетат=10:1), и получают продукт SР-В (3,15 г, 10,00 ммоль, 64,8%) в виде не совсем белого твердого вещества.
Синтез соединения SP-С. К раствору реагента SР-В (500 мг, 1,58 ммоль) в безводном ТГФ (10 мл) при комнатной температуре добавляют ВН3.ТГФ (1,0 М, 7,23 мл, 7,23 ммоль), и раствор перемешивают при 25°С в течение ночи. Затем реакцию гасят, добавляя воду (5 мл). Добавляют 2 М раствор NaOH (10 мл), а затем 30% Н2О2 (10 мл). Полученную смесь перемешивают при комнатной температуре в течение 1 часа. Затем смесь разбавляют этилацетатом (200 мл), и полученный раствор промывают рассолом (2×100 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт SP-С используют непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения SР-D. К раствору реагента SР-С (6,53 г, 19,67 ммоль) в безводном DCM (100 мл), охлажденному на бане со смесью льда с водой, добавляют по частям хлорхромат пиридиния (8,48 г, 39,34 ммоль). Смесь перемешивают при температуре окружающей среды в течение ночи. Затем раствор разбавляют DCM (50 мл) и фильтруют. Объединенные органические растворы промывают рассолом (100 мл), сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь петролейный эфир:этилацетат=10:1), и получают продукт SР-D (2,5 г, 7,53 ммоль, выход 39%) в виде не совсем белого твердого вещества. SР-D:1Н-ЯМР (500 МГц, CDCl3) δ (м.д.): 2,54 (1H, т), 2,11 (3H, с), 1,42-1,45 (2H, к), 0,91 (3H, т), 0,62 (3H, с).
Синтез соединения SР. К раствору реагента SР-D (80 мг, 0,24 ммоль) в метаноле (5 мл) добавляют 48% бромоводородную кислоту (148 мг, 0,884 ммоль), а затем бром (241 мг, 0,077 мл, 1,505 ммоль). Раствор греют при 25°С в течение 1,5 часов, и затем смесь выливают в холодную воду (50 мл). Полученное твердое вещество экстрагируют этилацетатом (2×50 мл). Объединенные органические экстракты промывают рассолом (20 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SР используют непосредственно на следующей стадии без дополнительной очистки.
Пример 41. Синтез соединений SР-1 и SР-2.

К раствору неочищенного реагента SP (500 мг, 1,2 ммоль) в безводном ТГФ (10 мл) добавляют 1,2,4-1Н-триазол (500 мг, 6,0 ммоль), а затем карбонат калия (1,02 г, 6 ммоль). Раствор греют при 60°С в течение 2 час, затем раствор охлаждают до комнатной температуры и разбавляют этилацетатом (100 мл). Полученный раствор промывают рассолом (2×50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции очищают преп. ВЭЖХ с обращенной фазой, и получают продукт SР-1 (105 мг, 0,26 ммоль, выход=22%) и SР-2 (62 мг, 0,15 ммоль, выход=13%) в виде не совсем белого твердого вещества. SР-1: 1H ЯМР (500 МГц, CDCl3), δ (м.д.): 7,75 (1H, с), 7,64 (1H, с), 5,26 (1H, AB), 5,14 (1H, AB), 2,66 (1H, т), 0,91 (3H, т), 0,68 (3H, с). ЖХМС: rt=2,35 мин, m/z=400 [М+H]+. SР-2: 1H ЯМР (500 МГц, CDCl3), δ (м.д.): 7,68 (2H, с), 5,25 (1H, AB), 5,23 (1H, AB, 2,59 (1H, т), 0,91 (3H, т), 0,70 (3H, с). ЖХМС: rt=2,49 мин, m/z=400 [М+H]+.
Пример 42. Синтез соединения SР-3.

К раствору неочищенного реагента SP (247,5 мг, 0,603 ммоль, теоретическое количество) в ТГФ (5 мл) добавляют тетразол (84 мг, 1,202 ммоль), а затем карбонат калия (166 мг, 1,202 ммоль), и смесь греют при 50°С в течение 2 час. Затем реакционную смесь разбавляют этилацетатом (100 мл). Полученный раствор промывают рассолом (2×50 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают нужный продукт SР-3 (14,4 мг, 0,0359 ммоль, выход=6,0%) в виде не совсем белого твердого вещества. Другой нужный продукт при преп. ВЭЖХ не получают из-за его его очень слабой абсорбции (214 нм, 254 нм). SР-3:1H ЯМР (400 МГц, CDCl3), δ (м.д.): 8,57 (1H, с), 5,46 (1H, AB), 5,45 (1H, AB), 2,65 (1H, т), 1,45 (2H, к), 0,91 (3H, т), 0,73 (3H, с). ЖХМС: rt=2,48 мин, m/z=401,1 [М+H]+.
Пример 43. Синтез соединений SР-4 и SP-5.

К суспензии К2СО3 (67 мг, 0,50 ммоль) в ТГФ (5 мл) добавляют 5-метил-1Н-тетразол (42,0 мг, 0,50 ммоль) и соединение SР (100 мг, 0,24 ммоль). После перемешивания при комнатной температуре в течение 15 час реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом (2×10 мл), сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают SР-4 в виде не совсем белого твердого вещества (15,2 мг, 0,037 ммоль, 15,2%) и SР-5 в виде не совсем белого твердого вещества (13,3 мг, 0,032 ммоль, 13,3%). SD-4: 1H ЯМР (500 МГц, CDCl3), δ (м.д.): 5,13 (AB, 1H), 5,05 (AB, 1H), 2,66 (т, 1H), 2,48 (с, 3H), 0,91 (т, 1H), 0,69 (с, 3H). ЖХМС: Rt=2,30 мин. m/z=415,3 [М+H]+. SD-5: 1H ЯМР (500 МГц, CDCl3), δ (м.д.): 5,36 (AB, 1H), 5,35 (AB, 1H), 2,63 (т, 1H), 2,58 (с, 3H), 0,91 (т, 1H), 0,72 (с, 3H). ЖХМС: Rt=2,38 мин. m/z=415,3 [М+H]+.
Пример 44. Синтез SI и промежуточных соединений для SI.

Синтез соединения SI-B. К раствору соединения SI-A (5 г, 15 ммоль) в сухом ТГФ (20 мл) добавляют комплекс боран-тетрагидрофуран (30 мл 1 М раствора в ТГФ), реакционную смесь перемешивают при температуре окружающей среды в течение 1 часа, затем реакционную смесь охлаждают на ледяной бане, и затем постепенно добавляют 10% водный раствор NaOH (56 мл). Смесь охлаждают на льду, и постепенно добавляют 30% водный раствор Н2О2 (67 мл). Смесь перемешивают при температуре окружающей среды в течение 1 часа и затем экстрагируют EtOAc (3×100 мл). Объединенные EtOAc экстракты промывают 10% водным раствором Na2S2O3 (100 мл) и рассолом (100 мл) и сушат над MgSO4. Фильтрация и удаление растворителя дают сырой продукт, 3,2 г, для реакции на следующей стадии.
Синтез соединения SI-C. К раствору соединения SI-B (3,2 г, 9 ммоль) в ТГФ (40 мл) добавляют 2M HCl (3 мл). Реакционный раствор перемешивают при RT в течение 12 час, и затем удаляют растворитель при пониженном давлении. Сырое целевое соединение очищают хроматографией на силикагеле (елюент смесь петролейный эфир/этилацетат=10:1-5:1), и получают 2,2 г продукта в виде не совсем белого твердого вещества, выход 81,40%.
Синтез соединения SI-D. К раствору иодида триметилсульфония (6,43 г, 31,5 ммоль) в 100 мл ДМСО при перемешивании добавляют 60 мас.% NaH (1,26 г, 31,5 ммоль). После перемешивания при комнатной температуре (15°С) в течение 1 часа добавляют по каплям раствор соединения SI-С (2,2 г, 7,2 ммоль) в 20 мл ДМСО. Через 2,5 часа реакционную смесь выливают в смесь воды со льдом и экстрагируют эфиром (100 мл × 3). Затем объединенные эфирные слои промывают рассолом (100 мл × 3), сушат (MgSO4), фильтруют и концентрируют, и получают сырой продукт, 1,6 г, для реакции на следующей стадии.
Синтез соединения SI-Е. Соединение SI-D (1,6 г, 5 ммоль) растворяют в 60 мл насыщенного Н2О CH2Cl2 (используя делительную воронку, CH2Cl2 встряхивают с несколькими миллилитрами Н2О и затем отделяют от водного слоя). Добавляют DMP (4,2 г, 10 ммоль), и полученную реакционную смесь энергично перемешивают в течение 24 час. Реакционный раствор разбавляют DCM (100 мл), промывают 10% водным раствором Na2S2O3 (100 мл) и рассолом (100 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (элюент смесь петролейный эфир/этилацетат=20:1-10:1), и получают названное в заголовке соединение (1,2 г, 3,79 ммоль, 75%) в виде не совсем белого твердого вещества.1H ЯМР (400 МГц, CDCl3), δ (м.д.): 2,63 (с, 1H), 2,59 (с, 1H), 2,12 (с, 3H), 0,63 (с, 3H).
Синтез соединений SI-F1 и SI-F2.

SI-Е (1,2 г, 3,8 ммоль) растворяют в сухом метаноле (250 мл), и добавляют Na (262 мг, 11,4 ммоль). Раствор кипятят с обратным холодильником в течение 16 час. Метанол выпаривают, остаток растворяют в дихлорметане, и раствор промывают Н2О (3×50 мл) и рассолом (100 мл), сушат над MgSO4, фильтруют и концентрируют. Сырое целевое соединение очищают хроматографией на силикагеле (элюент смесь петролейный эфир/этилацетат=10:1-5:1), и получают SI-F1 (300 мг, 25%) и SI-F2 (300 мг, 25%) в виде не совсем белого твердого вещества. SI-F1:1H ЯМР (400 МГц, CDCl3), δ (м.д.): 3,39 (с, 3H), 3,19 (с, 2H), 2,54 (т, 1H), 2,11 (с, 3H), 0,61 (с, 3H). SI-F2:1H ЯМР (400 МГц, CDCl3), δ (м.д.): 3,39 (с, 5H), 3,37 (с, 2H), 2,52 (т, 1H), 2,11 (с, 3H), 0,62 (с, 3H).
Синтез соединения SI. Раствор SI-F1 (50 мг, 0,14 ммоль) в МеОН и … обрабатывают 2 каплями HBr (48%) и затем бромом (6 капель). Смесь перемешивают при rt в течение 1 часа и выливают в смесь воды со льдом. Смесь экстрагируют ЕА (50 мл), и экстракт сушат над сульфатом натрия.
Пример 45. Синтез соединения SI-1.

К раствору неочищенного реагента (245,3 мг, 0,574 ммоль, теоретическое количество) в ТГФ (5 мл) добавляют тетразол (201 мг, 2,87 ммоль), а затем карбонат калия (397 мг, 2,87 ммоль). Смесь греют при 60°С в течение ночи. Затем раствор разбавляют этилацетатом (100 мл). Полученный раствор промывают рассолом (2×50 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают фракцию 1 и фракцию 2. Фракция 2 представляет собой чистый продукт SI-1 (27,5 мг, 0,066 ммоль, общий выход за две стадии=11,5%) в виде не совсем белого твердого вещества. Фракцию 1 дополнительно очищают хроматографией на силикагеле (элюент смесь петролейный эфир/этилацетат=1:4), и получают не совсем белый твердый побочный продукт(8,2 мг, 0,0197 ммоль, общий выход за две стадии=3,49%). SI-1:1H ЯМР (500 МГц, CDCl3), δ (м.д.): 8,75 (1H, с), 5,32 (1H, AB), 5,21 (1H, AB), 3,39 (3H, с), 3,19 (2H, с), 2,67 (1H, т), 0,68 (3H, с). ЖХ-МС: rt=2,19 мин, m/z=417,3 [М+H]+.
Пример 46. Синтез соединения SI-2.

К суспензии К2СО3 (248 мг, 1,8 ммоль) в ТГФ (50 мл) добавляют 1,2,3-1Н-триазол (130 мг, 1,8 ммоль) и соединение SI (400 мг, 0,94 ммоль). После перемешивания при комнатной температуре в течение 15 час реакционную смесь выливают в 50 мл Н2О и экстрагируют EtOAc (2×100 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Реакционную смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SI-2 в виде не совсем белого твердого вещества (80 мг, 20%). SI-2: 1H ЯМР (500 МГц, CDCl3), δ (м.д.), 7,76 (д, 1H), 7,64 (д, 1H), 5,27 (AB, 1H), 5,13 (AB, 1H), 3,39 (с, 3H), 3,19 (с, 2H), 2,66 (т, 1H), 0,68 (с, 3H).
Пример 47. Синтез соединений SI-3 и SI-4.

К суспензии К2СО3 (67 мг, 0,50 ммоль) в ТГФ (5 мл) добавляют 5-метил-1Н-тетразол (42,0 мг, 0,50 ммоль) и соединение SI (100 мг, 0,23 ммоль). После перемешивания при комнатной температуре в течение 15 час реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом (2×10 мл), сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают SI-3 в виде не совсем белого твердого вещества (12,6 мг, 0,029 ммоль, 12,7%) и SI-4 в виде не совсем белого твердого вещества (22,3 мг, 0,052 ммоль, 22,5%). SI-3: 1H ЯМР (500 МГц, CDCl3), δ (м.д.): 5,13 (AB, 1H), 5,05 (AB, 1H), 3,39 (с, 3H), 3,19 (с, 2H), 2,66 (т, 1H), 2,47 (с, 3H), 0,69 (с, 3H). ЖХ-МС: R=2,14 мин. m/z=431,3 [М+H]+. SI-4: 1H ЯМР (500 МГц, CDCl3), δ (м.д.): 5,35 (AB, 1H), 5,34 (AB, 1H), 3,39 (с, 3H), 3,19 (с, 2H), 2,63 (т, 1H), 2,56 (с, 3H), 0,72 (с, 3H). ЖХ-МС: Rt=2,25 мин. m/z=401,3 [М+H]+.
Пример 48. Синтез SQ и промежуточных соединений для SQ.

Синтез соединения SQ-В. К раствору иодида триметилсульфония (8,1 г, 36,9 ммоль) в 100 мл ДМСО при перемешивании добавляют NaH (60%, 1,26 г, 31,5 ммоль). После перемешивания при комнатной температуре в течение 1 часа добавляют по каплям суспензию соединения SС (2,2 г, 7,2 ммоль) в ДМСО (20 мл). Смесь перемешивают еще 2,5 часа, затем выливают в смесь воды со льдом и экстрагируют эфиром (100 мл × 3). Затем объединенные эфирные слои промывают рассолом (100 мл), сушат над MgSO4, фильтруют и концентрируют, и получают сырой продукт SQ-В (2,2 г). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SQ-С. Соединение SQ-В (2,2 г, 7,3 ммоль) растворяют в сухом метаноле (250 мл), и добавляют Na (672 мг, 29,2 ммоль). Раствор кипятят с обратным холодильником в течение 6 час. Метанол выпаривают, остаток растворяют в дихлорметане, и раствор промывают Н2О (3×50 мл) и рассолом (100 мл), сушат над MgSO4, фильтруют и концентрируют. Сырое целевое соединение очищают хроматографией на силикагеле (петролейный эфир/этилацетат=10:1-5:1), концентрируют, и получают SQ-С (1,8 г, 87%) в виде не совсем белого твердого вещества.
1H ЯМР (500 МГц, CDCl3), δ (м.д.), 5,03-5,01 (м, 1H), 3,43 (к, 2H), 3,13 (с, 2H), 0,80 (с, 3H).
Синтез соединения SQ-D. К раствору соединения SQ-С (1,8 г, 5,2 ммоль) в сухом ТГФ (50 мл) добавляют комплекс боран-тетрагидрофуран (20 мл 1,0 М раствора в ТГФ). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь охлаждают на ледяной бане и затем постепенно гасят 10% водным раствором NaOH (10 мл) и затем 30% водным раствором Н2О2 (12 мл). Смесь перемешивают при комнатной температуре в течение 1 часа и затем экстрагируют EtOAc (3×100 мл). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (100 мл) и рассолом (100 мл), сушат над MgSO4, фильтруют и концентрируют, и получают сырое соединение SQ-D (1,8 г, 100%). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SQ-Е. К раствору неочищенного соединения SQ-D (1,8 г, 5,2 ммоль), растворенного в 60 мл насыщенного Н2О дихлорметана (дихлорметан встряхивают с несколькими миллилитрами Н2О и затем отделяют от водного слоя) добавляют периодинат Десс-Мартина (4,4 г, 10,4 ммоль). После перемешивания при комнатной температуре в течение 24 час реакционную смесь экстрагируют дихлорметаном (3×100 мл). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (100 мл) и рассолом (100 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетет=10:1-5:1), и получают соединение SQ-Е (1 г, 2,8 ммоль, 56% за две стадии) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, CDCl3), δ (м.д.), 3,52 (к, 2H), 3,21 (с, 2H), 2,54 (т, 2H), 2,11 (с, 3H), 1,20 (т, 3H), 0,61 (с, 3H). ЖХМС: Rt=7,25 мин. m/z=345,1 [М-17]+.
Синтез соединения SQ. К раствору соединения SQ-Е (600 мг, 1,65 ммоль) в МеОН (20 мл) добавляют 5 капель HBr (48%) и затем бром (264 мг, 1,65 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь выливают в смесь воды со льдом и затем экстрагируют этилацетатом (100 мл × 3). Объединенные органические слои промываютрассолом (200 мл), сушат над MgSO4, фильтруют и концентрируют, и получают сырое соединение SQ (600 мг, 100%). Сырой продукт реакции используют на следующей стадии без дополнительной очистки. ЖХМС: Rt=7,25 мин. m/z=463,1 [М+Na]+.
Пример 49. Синтез соединений SQ-1 и SQ-2.

К суспензии К2СО3 (188 мг, 1,36 ммоль) в ТГФ (10 мл) добавляют 1,2,3-1Н-триазол (94 мг, 0,68 ммоль) и соединение SQ (300 мг, 0,68 ммоль). После перемешивания при комнатной температуре в течение 15 час реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом (2×10 мл), сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают SQ-1 в виде не совсем белого твердого вещества (81 мг, 0,19 ммоль, 27,9%) и SQ-2 в виде не совсем белого твердого вещества (41 мг, 0,10 ммоль, 14,7%). SQ-1: 1H ЯМР (400 МГц, CDCl3), δ (м.д.): 7,76 (с, 1H), 7,64 (с, 1H), 5,28 (AB, 1H), 5,14 (AB, 1H), 3,53 (к, 2H), 3,22 (с, 2H), 2,66 (т, 1H), 1,20 (т, 3H), 0.68 (с, 3H). ЖХМС: Rt=2,21 мин. m/z=430,3 [М+H]+. SQ-2: 1H ЯМР (400 МГц, CDCl3), δ (м.д.): 7,69 (с, 2H), 5,27 (AB, 1H), 5,22 (AB, 1H), 3,53 (к, 2H), 3,22 (с, 2H), 2,60 (т, 1H), 1,20 (т, 3H), 0,71 (с, 3H). ЖХМС: Rt=2,34 мин. m/z=430,3 [М+H]+.
Пример 50. Синтез соединений SQ-3 и SQ-4.

К суспензии К2СО3 (94 мг, 0,68 ммоль) в ТГФ (10 мл) добавляют 1,2,3-1Н-триазол (48 мг, 0,68 ммоль) и соединение SQ (150 мг, 0,34 ммоль). После перемешивания при комнатной температуре в течение 15 час реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом (2×10 мл), сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают SQ-3 в виде не совсем белого твердого вещества (20,9 мг, 0,049 ммоль, 14,4%) и SQ-4 в виде не совсем белого твердого вещества (15,2 мг, 0,035 ммоль, 10,3%). SQ-3: 1H ЯМР (400 МГц, CDCl3), δ (м.д.): 8,57 (с, 1H), 5,46 (AB, 1H), 5,45 (AB, 1H), 3,53 (к, 2H), 3,22 (с, 2H), 2,66 (т, 1H), 1,21 (т, 3H), 0,72 (с, 3H). ЖХМС: Rt=2,35 мин. m/z=431,4 [М+H]+. SQ-4: 1H ЯМР (400 МГц, CDCl3), δ (м.д.): 8,74 (с, 1H), 5,32 (AB, J=18,0 Гц, 1H), 5,18 (AB, J=18,1 Гц, 1H), 3,52 (к, 2H), 3,22 (с, 2H), 2,68 (т, 1H), 1,20 (т, 3H), 0,68 (с, 3H). ЖХМС: Rt=2,22 мин. m/z=431,4 [М+H]+.
Пример 51. Синтез соединений SQ-5 и SQ-6.

К суспензии К2СО3 (67 мг, 0,50 ммоль) в ТГФ (5 мл) добавляют 5-метил-1Н-тетразол (42,0 мг, 0,50 ммоль) и соединение SQ (100 мг, 0,25 ммоль). После перемешивания при комнатной температуре в течение 15 час реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом (2×10 мл), сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают SQ-5 в виде не совсем белого твердого вещества (8,5 мг, 0,019 ммоль, 8,1%) и SQ-6 в виде не совсем белого твердого вещества (14,8 мг, 0,034 ммоль, 13,2%). SQ-5: 1H ЯМР (500 МГц, CDCl3), δ (м.д.): 5,13 (AB, 1H), 5,06 (AB, 1H), 3,53 (к, 2H), 3,22 (с, 2H), 2,67 (т, 1H), 1,21 (т, 3H), 0,69 (с, 3H). ЖХМС: Rt=2,26 мин. m/z=445,4 [М+H]+. SQ-6: 1H ЯМР (500 МГц, CDCl3), δ (м.д.): 5,36 (AB, 1H), 5,35 (AB, 1H), 3,53 (к, 2H), 3,22 (с, 2H), 2,64 (т, 1H), 2,56 (с, 2H), 1,20 (т, 3H), 0,72 (с, 3H). ЖХМС: Rt=2,35 мин. m/z=445,3 [М+H]+.
Пример 52. Синтез SV и промежуточных соединений для SV.

Синтез соединения SV-В. К раствору SL-B (68 г, 216,27 ммоль) в 600 мл CH3CN при -4°С добавляют по частям selectflour (90,22 г, 324,4 ммоль). Полученную реакционную смесь перемешивают при -4°С в течение 3 час. После этого ТСХ показывает завершение реакции, и тогда смесь фильтруют и концентрируют. Продукт реакции очищают колоночной хроматографией на силикагеле, элюируют смесями (петролейный эфир/этилацетат, 20:1-15:1-10:1-8:1-6:1-5:1), и получают SV-В (26,3 г, выход 41,8%) в виде не совсем белого твердого вещества.1H ЯМР (SV-В) (400 МГц, CDCl3), δ (м.д.), 6,02-5,94 (м, 1H,), 5,20-5,01 (м, 1H), 2,55-2,26 (м, 6H), 2,16-2,05 (м, 1H), 2,01-1,83 (м, 4H), 1,48-1,22 (м, 5H), 0,98-0,78 (м, 6H).
Синтез соединения SВ-Х. К раствору SV-B (27 г, 92,98 ммоль) в EtOAc (350 мл) при 20°С добавляют Pd/C (2,7 г, 5%). Раствор перемешивают при 20°С в течение 10 час в атмосфере водорода при давлении ~100 кПа (1 атм). После этого ЖХМС показывает завершение реакции, и тогда смесь фильтруют и концентрируют. Продукт реакции очищают колоночной хроматографией на силикагеле, элюируют смесями (петролейный эфир/этилацетат, 40:1-35:1-30:1-25:1-20:1-15:1-10:1-6:1), и получают SВ-Х (15,6 г, 56,38%) в виде не совсем белого твердого вещества.1H ЯМР (SВ-Х) (400 МГц, CDCl3), δ (м.д.)=4,68-4,56 (м, 1H), 2,64-2,51 (м, 1H), 2,53-2,03 (м, 8H), 1,97-1,80 (м, 4H), 1,49-1,20 (м, 6H), 0,96-0,92 (м, 2H), 0,88-0,78 (м, 1H).
Синтез соединения SВ-Y. К раствору SB-Х (47 г, 160,75 ммоль) в МеОН (600 мл) при 23°С добавляют 2,35 г TsOH. Раствор перемешивают при 60°С в течение 1,5 час. После этого ТСХ показывает завершение реакции, и тогда смесь фильтруют и концентрируют, и получают SВ-Y (35 г, 64,33%) в виде не совсем белого твердого вещества.1H ЯМР (SВ-Y) (400 МГц, CDCl3), δ (м.д.)=4,74-4,57 (м, 1H), 3,16 (с, 3H), 3,10 (с, 3H), 2,47-2,35 (м, 1H), 2,15-2,09 (м, 1H), 2,06-1,82 (м, 6H), 1,77-1,15 (м, 11H), 1,05-0,96 (м, 1H), 0,89 (с, 3H), 0,83-0,77 (м, 1H).
Синтез соединения SВ-Z. К раствору бромида этилтрифенилфосфония (115,17 г, 310,23 ммоль) в 150 мл ТГФ добавляют КО-трет-Bu (34,81 г, 310,23 ммоль). Реакционную смесь греют при 60°С в течение 1 час, и добавляют SВ-Y (35 г, 103,41 ммоль) к смеси, которую перемешивают при 60°С еще в течение 15 час. Реакционную смесь охлаждают и экстрагируют 1500 мл EtOAc, экстракт промывают рассолом и концентрируют, и получают SВ-Z в виде не совсем белого твердого вещества (120 г, неочищенный).1H ЯМР (SВ-Z) (400 МГц, CDCl3), δ (м.д.)=5,13-5,07 (м, 1H), 4,67-4,54 (м, 1H), 3,14 (с, 3H), 3,09 (с, 3H), 2,42-2,15 (м, 3H), 1,92-1,79 (м, 3H), 1,67-1,61 (м, 4H), 1,57-1,50 (м, 2H), 1,45-1,15 (м, 10H), 1,01-0,94 (м, 1H), 0,92 (с, 3H), 0,90-0,84 (м, 1H).
Синтез соединения SВ-АА. К раствору SВ-Z (120 г, неочищенный) в 600 мл ТГФ добавляют 2 М соляную кислоту, 90 мл. Реакционную смесь перемешивают при 22°С в течение 1 часа. После этого ТСХ показывает завершение реакции, и тогда реакцию гасят водн. раствором NaHCO3. Реакционную смесь экстрагируют 500 мл EtOAc, экстракт промывают рассолом и упаривают в вакууме. Полученный остаток очищают хроматографией (петролейный эфир/этилацетат=150:1-125:1-100:1-80:1-60:1-50:1), и получают SВ-АА в виде не совсем белого твердого вещества (24 г, выход 76,23%).1H ЯМР (SВ-АА) (400 МГц, CDCl3), δ (м.д.)=5,13 (м, 1H), 4,65-4,48 (м, 1H), 2,62-2,42 (м, 1H), 2,44-2,07 (м, 8H), 1,92-1,80 (м, 1H), 1,72-1,55 (м, 8H), 1,36-1,08 (м, 6H), 0,92 (с, 3H), 0,83-0,73 (м, 1H).
Синтез соединения SВ-ВВ. К раствору Me3SOI (78,07 г, 354,75 ммоль) в 50 мл ТГФ добавляют раствор трет-BuOK (39,81 г, 354,75 ммоль) в 50 мл ТГФ. Реакционную смесь перемешивают при 60°С в течение 1,5 час. Затем в реакционную смесь добавляют раствор SВ-АА (24 г, 78,83 ммоль) в ТГФ (300 мл). Реакционную смесь перемешивают в течение 2,5 час при 23°С. После этого ТСХ показывает завершение реакции, и тогда реакцию гасят водой. Реакционную смесь экстрагируют 500 мл EtOAc, экстракт промывают рассолом и упаривают в вакууме, и получают SВ-ВВ как сырой продукт (50 г).1H ЯМР (SВ-ВВ) (400 МГц, CDCl3), δ (м.д.)=5,20-5,11 (м, 1H), 4,65-4,52 (м, 1H), 2,74-2,68 (м, 2H), 2,48-1,81 (м, 9H), 1,72-1,64 (м, 4H), 1,55-1,06 (м, 10H), 0,97-0,89 (м, 3H), 0,85-0,77 (м, 1H).
Синтез соединения SВ-СС. К раствору SВ-ВВ (50 г, неочищенный) в 300 мл ТГФ при 0°С добавляют LiALH4 (8,99 г, 236,49 ммоль), и реакционную смесь перемешивают при 23°С в течение 1,5 час. После этого ТСХ показывает завершение реакции, и тогда реакцию гасят водой. Реакционную смесь экстрагируют 1000 мл EtOAc, экстракт промывают рассолом и упаривают в вакууме. Полученный остаток очищают хроматографией (петролейный эфир/этилацетат=100:1-80:1-60:1-50:1-40:1-30:1), и получают SВ-СС в виде не совсем белого твердого вещества (19 г, выход 75,19%).1H ЯМР (SВ-СС) (400 МГц, CDCl3), δ (м.д.)=5,17-5,07 (м, 1H), 4,66-4,48 (м, 1H), 2,41-2,32 (м, 1H), 2,28-2,15 (м, 2H), 2,09-2,05 (м, 1H), 1,88-1,75 (м, 2H), 1,68-1,64 (м, 3H), 1,40-1,31 (м, 1H), 1,25-1,13 (м, 9H), 0,89 (с, 3H), 0,81-0,72 (м, 1H).
Синтез соединения SВ-DD. К раствору SВ-СС (19 г, 59,29 ммоль) в сухом ТГФ (500 мл) при 0°С добавляют C2H9BS (59,29 мл; 10 М раствор в ТГФ). После перемешивания при комнатной температуре в течение 2 час реакционную смесь охлаждают на ледяной бане и затем постепенно гасят 3 М водным раствором NaOH (160 мл), а затем 30% водным раствором Н2О2 (100 мл). После перемешивания при 20°С в течение 1,5 час смесь фильтруют и экстрагируют EtOAc (300 мл). Объединенные органические слои обрабатывают водн. раствором Na2S2O3, экстрагируют, экстракт сушат и концентрируют, и получают SВ-DD как сырой продукт (21 г, неочищенный). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SВ-ЕЕ. К раствору SВ-DD (21 г, 59,29 ммоль) в 200 мл CH2Cl2 при 0°С добавляют РСС (25,56 г, 118,58 ммоль) и перемешивают при 22°С в течение 2 час. Реакционную смесь фильтруют и экстрагируют 20 мл CH2Cl2, экстракт промывают водн. раствором NaHCO3, водн. раствором Na2S2O3 и рассолом и упаривают в вакууме. Остаток очищают хроматографией (петролейный эфир/этилацетат=15:1-10:1-6:1), и получают SВ-ЕЕ в виде не совсем белого твердого вещества (12 г, выход 60,15%).1H ЯМР (SВ-ЕЕ) (400 МГц, CDCl3), δ (м.д.)=4,65-4,46 (м, 1H), 2,55-2,51 (м, 1H), 2,22-2,09 (м, 4H), 2,06-1,97 (м, 32H), 1,88-1,77 (м, 2H), 1,69-1,54 (м, 5H), 1,48-1,30 (м, 3H), 1,28-1,05 (м, 11H), 0,83-0,72 (м, 1H), 0,63 (с, 3H).
Синтез соединения SV. К раствору SВ-ЕЕ (12 г, 35,66 ммоль) в 1500 мл МеОН при 0°С добавляют HBr (5 капель) и Br2 (2,01 мл, 39,23 ммоль). Реакционную смесь перемешивают при 16°С в течение 2 час. Реакционную смесь гасят водн. раствором NaHCO3 и концентрируют. Затем смесь экстрагируют 1000 мл EtOAc, экстракт промывают рассолом и упаривают в вакууме. Продукт очищают колоночной хроматографией на силикагеле с элюированием смесями (петролейный эфир/этилацетат=12:1-10:1-8:1-6:1-3:1), и получают SV в виде не совсем белого твердого вещества (12,3 г, выход 83,03%).1H ЯМР (SV) (400 МГц, CDCl3), δ (м.д.)=4,64-4,47 (м, 1H), 3,95-3,86 (м, 2H), 2,89-2,80 (м, 1H), 2,23-2,16 (м, 1H), 2,07-1,64 (м, 8H), 1,46-1,06 (м, 14H), 0,83-0,74 (м, 1H), 0,67 (с, 3H).
Пример 53. Синтез соединений SV-1 и SV-2.

К суспензии SV (40 мг, 0,09 ммоль) в ТГФ (5 мл) добавляют 1Н-1,2,3-триазол (30 мг, 0,45 ммоль) и K2СО3 (60 мг, 0,45 ммоль). Смесь перемешивают при 25°С в течение 15 час. Затем раствор разбавляют этилацетатом (100 мл), и полученный раствор промывают рассолом (100 мл), сушат над сульфатом натрия и концентрируют в вакууме. Реакционную смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SV-1 в виде не совсем белого твердого вещества (10 мг, выход 26%) и SV-2 в виде не совсем белого твердого вещества (10 мг, выход 26%).
SV-1:1H ЯМР (400 МГц, CDCl3), δ (м.д.), 7,75 (с, 1H), 7,65 (с, 1H), 5,29-5,25 (1H, AB), 5,25-5,17 (1H, AB), 4,61-4,52 (д, 1H), 2,6 (1H, т), 1,18 (с, 3H), 0,63 (с, 3H). SV-2:1H ЯМР (400 МГц, CDCl3), δ (м.д.), 7,68 (с, 2H), 5,24-5,23 (м, 2H), 4,60-4,50 (д, 1H), 2,6 (1H, т), 1,25 (с, 3H), 0,74 (с, 3H).
Пример 54. Синтез соединений SV-3 и SV-4.

К суспензии SV (100 мг, 0,24 ммоль) в 3 мл ДМФА добавляют 2Н-тетразол (33,73 мг, 0,48 ммоль) и K2СО3 (99,82 мг, 0,72 ммоль). Реакционную смесь перемешивают при 28°С в течение 2 час. Полученный раствор гасят водой и экстрагируют EtOAc (50 мл). Органический слой промывают рассолом (20 мл), сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесями (РЕ/ЕА=12/1-2/1), и получают SV-3 (16,1 мг, выход 16,67%) и SV-4 (28,3 г, выход 29,17%) в виде не совсем белого твердого вещества.1H ЯМР (SV-3): (400 МГц, CDCl3), δ 8,60 (с, 1 H), 5,57-5,42 (м, 2H), 4,73-4,48 (м, 1H), 2,74-2,60 (м, 1H), 2,31-2,21 (м, 1H), 2,16-2,108 (м, 1H), 1,97-1,89 (м, 1H), 1,86-1,60 (м, 7H), 1,55-1,11 (м, 14H), 0,88-0,80 (м, 1H), 0,77(с, 3H).1H ЯМР (SV-4): (400 МГц, CDCl3), δ 8,75 (с, 1H), 5,36-5,16 (м, 2H), 4,66-4,47 (м, 1H), 2,73-2,62 (м, 1H), 2,30-2,18 (м, 1H), 2,09-1,74 (м, 6H), 1,67-1,60 (м, 3H), 1,38-1,16 (м, 11H), 0,88-0,75 (м, 1H), 0,70 (с, 3H).
Пример 55. Синтез соединений SV-5 и SV-6.

К раствору SV (100 мг, 0,24 ммоль) в 3 мл ДМФА добавляют 5-метил-2Н-тетразол (40,48 мг, 0,48 ммоль) и К2СО3 (99,82 мг, 0,72 ммоль). Реакционную смесь перемешивают в течение 1 часа при 21°С. Полученный раствор гасят водой и экстрагируют EtOAc (50 мл). Органический слой концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагеле (РЕ/ЕtOАc=8/1-1/1), и получают SV-5 (21,3 мг, выход 21,4%) и SV-6 (27,1 г, выход 26,89%) в виде не совсем белого твердого вещества.1H ЯМР (SV-5): (400 МГц, CDCl3), δ 5,43-5,31 (м, 2H), 4,68-4,49 (м, 1H), 2,69-2,62 (м, 1H), 2,59 (с, 3H), 2,31-2,20 (м, 1H), 2,14-2,09 (м, 1H), 1,95-1,88 (м, 1H), 1,85-1,60 (м, 8H), 1,46-1,20 (м, 12H), 1,02-0,93 (м, 1H), 0,89-0,80 (м, 1H), 0,77 (с, 3H).1H ЯМР (SV-6): (400 МГц, CDCl3), δ 5,21-5,05 (м, 2H), 4,69-4,50 (м, 1H), 2,73-2,63 (м, 1H), 2,50 (с, 3H), 2,30-2,19 (м, 1H), 2,13-2,01 (м, 2H), 1,98-1,57 (м, 9H), 1,45-1,14 (м, 12H), 0,90-0,80 (м, 1H), 0,73 (с, 3H).
Пример 56. Синтез соединения SV-7.

К раствору SV (100 мг, 0,24 ммоль) в 15 мл ДМФА добавляют 4-метил-2Н-1,2,3-триазол (40,01 мг, 0,48 ммоль) и K2СО3 (99,82 мг, 0,72 ммоль). Реакционную смесь перемешивают при 28°С в течение 2 час. Полученный раствор гасят водой и экстрагируют EtOAc (50 мл). Органический слой промывают рассолом (20 мл), сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ, и получают SV-7 (20,6 г, выход 20,83%) в виде не совсем белого твердого вещества.1H ЯМР (SV-7): (400 МГц, CDCl3), δ 7,45 (с, 1H), 5,23-5,10 (м, 2H), 4,68-4,49 (м, 1H), 2,64-2,57 (м, 1H), 2,35 (с, 3H), 2,30-2,18 (м, 1H), 2,14-2,00 (м, 2H), 1,93-1,58 (м, 8H), 1,46-1,09 (м, 13H), 0,86-0,76 (м, 1H), 0,75 (с, 3H).
Пример 57. Синтез соединений SV-8 и SV-9.

К раствору SV (200 мг, 0,48 ммоль) в 10 мл ДМФА (5 мл) добавляют 4-метил-2Н-1,2,3-триазол (80,02 мг, 0,96 ммоль) и K2СО3 (199,63 мг, 1,44 ммоль). Реакционную смесь перемешивают при 17°С в течение 2 час. Полученный раствор гасят водой и экстрагируют EtOAc (50 мл). Органический слой сушат и концентрируют. Остаток очищают на силикагеле, и получают смесь SV-8/SV-9 и побочного продукта (60 мг). Смесь расщепляют очисткой SFC, и получают SV-8 (38,8 мг, выход 29,84%) и SV-9 (31,5 г, выход 23,3%) в виде не совсем белого твердого вещества.1H ЯМР (SV-8): (400 МГц, CDCl3), δ 7,347 (с, 1H), 5,191-5,041 (к, J1=17,6 Гц, J2=42,4 Гц), 4,62-4,50 (м, 1H), 2,66-2,61 (м, 1H), 2,37 (с, 3H), 2,10-2,06 (м, 1H), 1,87-1,74 (м, 2H), 1,70-1,50 (м, 7H), 1,30-1,04 (м, 14H), 0,86-0,76 (м, 1H), 0,70 (с, 3H).1H ЯМР (SV-9): (400 МГц, CDCl3), δ 7,488 (с, 1 H), 5,08-5,07 (м, 2H), 4,63-4,50 (м, 1H), 2,68-2,63 (м, 1H), 2,22 (с, 3H), 2,04-1,89 (м, 2H), 1,80-1,73 (м, 7H), 1,64-1,60 (м, 1H), 1,56-1,20 (м, 14H), 0,80-0,70 (м, 1H), 0,64 (с, 3H).
Пример 58. Синтез соединения SW и промежуточных соединений для SW.

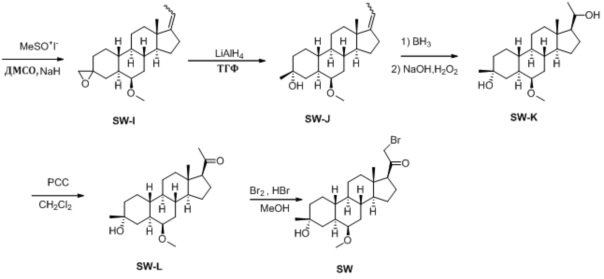
Синтез соединения SW-В. SW-А (10 г, 36,7 ммоль) добавляют к 50 мл ацетилхлорида и 50 мл уксусного ангидрида. Реакционную смесь греют при 120°С в течение 5 час, упаривают в вакууме, и получают SW-В в виде не совсем белого твердого вещества (10 г, выход 87%).1H ЯМР (400 МГц, CDCl3), δ (м.д.), 5,78 (с, 1H), 5,55 (с, 1H), 2,4 (дд, 2H), 2,13 (с, 3H), 0,90 (с, 3H).
Синтез соединения SW-С. К раствору SW-В (10 г, 31,8 ммоль) в 200 мл ТГФ и 20 мл Н2О при 0°С добавляют м-СРВА (11 г, 63,6 ммоль), перемешивают при rt в течение 15 час, и реакционную смесь экстрагируют 500 мл EtOAc, экстракт промывают 100 мл насыщ. раствора Na2S2O3, 100 мл насыщ. раствора NaHCO3 и 100 мл рассола и упаривают в вакууме, затем остаток очищают хроматографией (РЕ:ЕtOАc=5:1), и получают SW-С в виде не совсем белого твердого вещества (2,2 г, выход 24%).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 5,62 (с, 1H), 4,44 (с, 1H), 0,95 (с, 3H).
Синтез соединения SW-D. К раствору SW-С (2 г, 6,94 ммоль) в 50 мл EtOAc добавляют 200 мг Pd/C. Реакционную смесь гидрируют Н2, ~100 кПа (1 атм), в течение 15 час. Затем реакционную смесь упаривают в вакууме, остаток очищают хроматографией (РЕ:EtOAc=1:2), и получают SW-D в виде не совсем белого твердого вещества (0,5 г, выход 25%).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 3,84 (с, 1H), 2,62 (1Н, т), 0,95 (с, 3H).
Синтез соединения SW-Е. К раствору SW-D (1 г, 3,4 ммоль) в 100 мл МеОН добавляют 50 мг TsOH и греют при 60°С в течение 2 час. Реакционную смесь экстрагируют 500 мл EtOAc, экстракт промывают 100 мл насыщенного раствора NaHCO3 и 100 мл рассола, упаривают в вакууме, и получают SW-Е в виде не совсем белого твердого вещества (1 г, выход 91%).
Синтез соединения SW-F. К раствору бромида этилтрифенилфосфония (10,67 г, 28,84 ммоль) в 30 мл ТГФ добавляют KO-трет-Bu (3,23 г, 28,80 ммоль). Реакционную смесь греют при 60°С в течение 1 часа. Добавляют SW-Е (3,23 г, 9,6 ммоль), и полученную смесь перемешивают при 60°С в течение 15 час. Затем реакционную смесь экстрагируют 500 мл EtOAc, экстракт промывают рассолом и упаривают в вакууме. Полученный сырой остаток очищают хроматографией (РЕ:EtOAc=3:1), и получают SW-F в виде не совсем белого твердого вещества (2,17 г, выход 64%).
Синтез соединения SW-G. К раствору SW-F (1 г, 2,9 ммоль) в 50 мл ТГФ добавляют NaH (2 г, 5,8 ммоль), и полученную смесь перемешивают при rt в течение 1 часа. Затем к смеси добавляют 1 мл MeI, и затем смесь перемешивают при rt в течение ночи. Реакцию гасят 5 мл Н2О, смесь экстрагируют 100 мл EtOAc, экстракт промывают рассолом и упаривают в вакууме. Полученный остаток очищают хроматографией (РЕ:EtOAc=10:1), и получают SW-G в виде не совсем белого твердого вещества (587 мг, выход 59%).
Синтез соединения SW-Н. К раствору SW-G (1 г, 2,8 ммоль) в 20 мл ТГФ добавляют 2 М соляную кислоту (2 мл), и полученную реакционную смесь перемешивают при rt в течение 1 часа. Затем реакцию гасят 5 мл Н2О, смесь экстрагируют 100 мл EtOAc, и экстракт промывают рассолом и упаривают в вакууме. Остаток очищают хроматографией (РЕ:EtOAc=10:1), и получают SW-Н в виде не совсем белого твердого вещества (745 мг, выход 81%).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 5,05-5,03 (м, 1H), 3,24 (с, 3H), 3,11 (с, 1H), 2,6 (1H, т), 0,87 (с, 3H).
Синтез соединения SW-I. К раствору иодида триметилсульфоксония (3,6 г, 16,5 ммоль) в 5 мл ТГФ при перемешивании добавляют трет-бутанолат калия (1,90 г, 16,5 ммоль). После перемешивания при 60°С в течение 1,5 час добавляют по каплям суспензию SW-Н (1 г, 3,3 ммоль) в 10 мл ТГФ. Еще через 3 часа реакционную смесь выливают в охлажденную льдом воду и экстрагируют EtOAc (100 мл × 3), экстракт промывают рассолом (100 мл × 3), сушат (MgSO4), фильтруют и упаривают в вакууме, и получают SW-I и в виде не совсем белого твердого вещества (800 мг, выход 73%). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SW-J. К раствору SW-I (150 мг, 0,45 ммоль) в 10 мл ТГФ добавляют LiAlH4 (50 мг, 1,35 ммоль), и полученную реакционную смесь перемешивают при rt в течение 1 часа. Затем реакцию гасят 5 мл Н2О, и смесь экстрагируют 100 мл EtOAc, экстракт промывают рассолом и упаривают в вакууме. Остаток очищают хроматографией (РЕ:EA=3:1), и получают SW-J в виде не совсем белого твердого вещества (108 мг, выход 72%).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 5,12-5,10 (м, 1H), 3,29 (с, 1H), 3,18 (с, 1H), 1,23 (с, 3H), 0,88 (с, 3H).
Синтез соединения SW-K. К раствору SW-J (100 мг, 0,3 ммоль) в сухом ТГФ (5 мл) добавляют комплекс боран-тетрагидрофуран (1 мл; 1,0 М раствор в ТГФ). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь охлаждают на ледяной бане и затем постепенно гасят 10% водным раствором NaOH (1 мл) и затем 30% водным раствором Н2О2 (1 мл). После перемешивания при комнатной температуре в течение одного часа смесь экстрагируют EtOAc (3×100 мл). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (100 мл) и рассолом (100 мл), сушат над MgSO4, фильтруют и концентрируют, и получают SW-K в виде не совсем белого твердого вещества (90 мг, 81%). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SW-L. К раствору соединения SW-K (100 мг, 0,29 ммоль) в 20 мл DCM добавляют РСС (190 мг, 0,87 ммоль), и полученный раствор перемешивают при rt в течение 2 час. Реакцию гасят 5 мл Н2О, смесь экстрагируют 100 мл EtOAc, экстракт промывают рассолом и упаривают в вакууме, затем остаток очищают хроматографией (РЕ:EA=3:1), и получают SW-L в виде не совсем белого твердого вещества (52 мг, выход 51%).1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 3,26 (с, 3Н), 3,16 (с, 1H), 2,11 (с, 3H), 1,20 (с, 3H), 0,61 (с, 3H).
Синтез соединения SW. К раствору SW-L (40 мг, 0,11 ммоль) в МеОН (5 мл) добавляют 2 капли HBr (48%), а затем бром (150 мг, 0,33 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь выливают в смесь воды со льдом и затем экстрагируют EtOAc (10 мл × 3). Объединенные органические слои промывают рассолом (20 мл), сушат над MgSO4, фильтруют и концентрируют, и получают неочищенное соединение SW в виде не совсем белого твердого вещества (40 мг, выход 80%). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Пример 59. Синтез соединений SW-1 и SW-2.
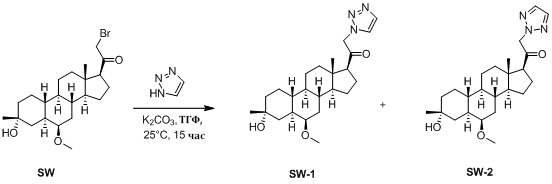
К суспензии SW (40 мг, 0,09 ммоль) в ТГФ (5 мл) добавляют 1Н-1,2,3-триазол (30 мг, 0,45 ммоль) и K2СО3 (60 мг, 0,45 ммоль). Смесь перемешивают при 25°С в течение 15 час. Затем раствор разбавляют этилацетатом (100 мл), и полученный раствор промывают рассолом (100 мл), сушат над сульфатом натрия и концентрируют в вакууме. Реакционную смесь очищают преп. ВЭЖХ с обращенной фазой, и получают SW-1 в виде не совсем белого твердого вещества (10 мг, выход 26%) и SW-2 в виде не совсем белого твердого вещества (8 мг, выход 20%). SW-1:1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 7,75 (с, 1H), 7,64 (с, 1H), 5,27-5,24 (1H, AB), 5,17-5,13 (1H, AB), 3,28 (с, 3H), 3,17 (с, 1H), 2,7 (1Н, т), 1,23 (с, 3Н), 0,65 (с, 3H). SW-2:1Н ЯМР (400 МГц, CDCl3), δ (м.д.), 7,68 (с, 2H), 5,28-5,25 (1H, AB), 5,23-5,20 (1H, AB), 3,28 (с, 3H), 3,17 (с, 1H), 2,6 (1H, т), 1,24 (с, 3H), 0,75 (с, 3H).
Пример 60. Синтез SZ и промежуточных соединений для SZ.


Синтез соединения SZ-B. К раствору соединения SZ-А (500 мг, 1,82 ммоль) в ТГФ (18 мл) при -78°С добавляют LiHMDS (1,0 М раствор в ТГФ, 4,00 мл, 4,00 ммоль). Раствор перемешивают при -78°С в течение 30 минут. Затем добавляют НМРА (0,69 мл, 4,00 ммоль). Раствор перемешивают при -78°С еще в течение 30 минут. Затем добавляют иодметан (0,34 мл, 5,46 ммоль). Раствор дополнительно перемешивают при -78°С в течение 2 час, нагревают до комнатной температуры и перемешивают в течение 1 часа. Реакцию гасят, добавляя воду (2 мл). Большую часть ТГФ удаляют в вакууме. Затем остаток разбавляют этилацетатом (100 мл), и полученный раствор промывают рассолом (2×100 мл) и сушат над сульфатом магния. Удаление растворителя в вакууме дает сырой продукт реакции SZ-B (350 мг, 67%) в виде густого масла. Сырой продукт используют на следующей стадии без дополнительной очистки. SZ-B:1Н ЯМР (400 МГц, CDCl3), δ (м.д.): 5,74 (1Н, с), 3,67 (1Н, т), 1,11 (3Н, д), 0,81 (3Н, с).
Синтез соединения SZ-С. К жидкому аммиаку (100 мл) при -78°С добавляют литий (687 мг, 99,0 ммоль). Жидкость становится темно-синей. Затем к Li-аммиачному раствору добавляют раствор реагента SZ-B (950 мг, 3,30 ммоль) в трет-BuOH (244 мг, 3,30 ммоль) и ТГФ (20 мл). Смесь перемешивают при -78°С в течение 4 час. Затем добавляют твердый NH4Cl (7 г) для гашения реакции. Смесь из темно-синей становится белой. Смесь оставляют нагреваться до комнатной температуры, и аммиак выпаривают в вытяжном шкафу в течение ночи. К остатку добавляют воду (100 мл). Смесь подкисляют конц. HCl до рН 6-7. Затем добавляют этилацетат (100 мл). Отделенный водный слой дополнительно экстрагируют этилацетатом (2×100 мл). Объединенные органические экстракты промывают рассолом (200 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SZ-С используют непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения SZ-D. К раствору неочищенного соединения SZ-С (980 мг, 3,40 ммоль) в дихлорметане (60 мл) добавляют дихромат пиридиния (PDC) (2,56 г, 6,80 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Раствор фильтруют через тонкий слой целита. Целит промывают CH2Cl2 (3×50 мл). Объединенный CH2Cl2 раствор концентрируют в вакууме. Остаток очищают флэш-хроматогрфией (элюент смесь петролейный эфир/EtOAc=5:1), и получают продукт SZ-D (680 мг, 69%) в виде не совсем белого твердого вещества. SZ-D:1Н ЯМР (500 МГц, CDCl3), δ (м.д.): 1,02 (3Н, д), 0,91 (3Н, с).
Синтез соединения SZ-Е. К раствору соединения SZ-D (3,24 г, 11,24 ммоль) в безводном метаноле (100 мл) добавляют моногидрат п-толуолсульфоновой кислоты (193 мг, 1,12 ммоль). Раствор греют при 70°С в течение 3 часов. Реакцию гасят, добавляя насыщ. раствор Na2CO3 (10 мл). Большую часть метанола удаляют в вакууме. Затем остаток разбавляют этилацетатом (200 мл). Полученный раствор промывают насыщенным раствором Na2CO3 (2×100 мл). Объединенные водные слои экстрагируют этилацетатом (50 мл). Объединенные органические экстракты промывают рассолом (100 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь петролейный эфир/EtOAc=15:1 с добавлением 0,1% NEt3), и получают продукт SZ-Е (1,76 г, 47%) в виде не совсем белого твердого вещества. Дополнительно также извлекают исходное соединение SZ-Е (1,34 г). Выход относительно извлеченного исходного материал составляет 93%. SZ-Е:1Н ЯМР (500 МГц, d6-ацетон), δ (м.д.): 3,080 (3H, с), 3,076 (3H, с), 2,37 (1H, дд), 1,98 (1H, дд), 0,91 (3H, д), 0,85 (3H, с).
Синтез соединения SZ-F. К суспензии бромида этилтрифенилфосфония (6,67 г, 17,96 ммоль) в безводном ТГФ (25 мл) добавляют трет-BuОК (2,01 г, 17,96 ммоль). Раствор становится красным, и затем его греют при 70°С в течение 2 часов. Затем добавляют соединение SZ-Е (2,00 г, 5,99 ммоль) в один прием. Раствор греют при 70°С в течение ночи. Затем реакцию гасят, добавляя воду (10 мл). Смесь разбавляют этилацетатом (200 мл), полученный раствор промывают рассолом (2×100 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SZ-F используют непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения SZ-G. К неочищенному продукту SZ-F (2,25 г, 6,50 ммоль, теоретическое количество) в ТГФ (50 мл) добавляют 4 М HCl (2 мл). Раствор перемешивают при температуре окружающей среды в течение 1 часа. Смесь разбавляют этилацетатом (300 мл), и полученный раствор промывают насыщенным раствором Na2CO3 (2×100 мл). Объединенные водные слои экстрагируют EtOAc (100 мл). Объединенные органические экстракты промывают рассолом (100 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь петролейный эфир/EtOAc=20:1), и получают нужный продукт SZ-G, 1,78 г (5,94 ммоль, выход 91%). SZ-G:1Н ЯМР (500 МГц, CDCl3), δ (м.д.): 5,13 (1H, кт), 1,66 (3H, дт), 1,02 (3H, д), 0,91 (3H, с).
Синтез соединения SZ-Н. К раствору иодида триметилсульфоксония (6,53 г, 29,70 ммоль) в безводном ДМСО (30 мл) добавляют гидрид натрия (60 мас.%, 1,19 г, 29,70 ммоль). Смесь перемешивают при 25°С в течение 1 часа. Затем добавляют раствор неочищенного соединения SZ-G (2,05 г, загрязнен некоторым количеством PPh3, теоретическое количество 1,78 г, 5,94 ммоль) в безводном ТГФ (10 мл). Смесь перемешивают при 25°С в течение ночи. Реакцию гасят, добавляя воду (5 мл). Смесь разбавляют этилацетатом (300 мл), и полученный раствор промывают водой (2×100 мл), затем рассолом (100 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SZ-Н используют непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения SZ-I. К раствору неочищенного реагента SZ-Н (теоретическое количество 1,21 г, 3,85 ммоль) в безводном ТГФ (30 мл) добавляют по частям алюмогидрид лития (731 мг, 19,25 ммоль). Суспензию перемешивают при 25°С в течение 1 часа. Затем реакцию гасят, добавляя EtOAc (5 мл) и затем воду (5 мл). Не совсем белое твердое вещество отфильтровывают и тщательно промывают EtOAc (5×100 мл). Объединенный фильтрат промывают рассолом (200 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь петролейный эфир/EtOAc=15:1), и получают продукт SZ-I (560 мг, 1,78 ммоль, общий выход за 2 стадии 30%) в виде не совсем белого твердого вещества. SZ-I: 1Н ЯМР (500 МГц, CDCl3), δ (м.д.): 5,11 (1H, кт), 2,05 (1H, с), 1,56 (3H, с), 1,17 (3H, с), 0,91 (3H, д), 0,88 (3H, с).
Синтез соединения SZ-J. К раствору реагента SZ-I (320 мг, 1,013 ммоль) в безводном ТГФ (20 мл) добавляют BH3.ТГФ (1,0 М, 5,07 мл, 5,065 ммоль). Полученный раствор перемешивают при 25°С в течение ночи, и затем реакцию гасят, добавляя воду (4 мл). Добавляют 2 М водный раствор NaOH (8 мл), а затем 30% Н2О2 (8 мл). Смесь перемешивают при комнатной температуре в течение 1 часа. Смесь разбавляют EtOAc (200 мл), и полученный раствор промывают рассолом (2×100 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SZ-J используют непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения SZ-К. К раствору неочищенного соединения SZ-J (320 мг, 1,013 ммоль) в дихлорметане (30 мл) добавляют по частям дихромат пиридиния (PDC) (1,14 мг, 3,039 ммоль). Раствор перемешивают при 25°С в течение ночи. Затем смесь фильтруют через тонкий слой силикагеля, и силикагель промывают дихлорметаном (3×50 мл). Все фильтраты объединяют и концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь петролейный эфир/EtOAc=6:1), и получают продукт SZ-К (140 мг, 0,422 ммоль, выход 42%, 2 стадии) в виде не совсем белого твердого вещества. SZ-К: 1Н ЯМР (500 МГц, CDCl3), δ (м.д.): 2,54 (1H, т), 2,12 (3H, с), 1,99 (1H, тд), 1,82-1,86 (1H, м), 1,18 (3H, с), 0,92 (3H, д), 0,61 (3H, с). SZ-К: 13С ЯМР (100 МГц, CDCl3), δ (м.д.): 209,79, 71,09, 63,94, 55,87, 47,94, 47,78, 46,97, 44,35, 41,16, 40,20, 39,04, 37,93, 34,48, 33,13, 31,55, 30,91, 28,45, 25,80, 24,20, 22,73, 15,15, 13,43.
Синтез соединения SZ. К раствору соединения SZ-К (100 мг, 0,301 ммоль) в метаноле (10 мл) добавляют 48% бромоводородную кислоту (152 мг, 0,903 ммоль), а затем бром (241 мг, 0,077 мл, 1,505 ммоль). Раствор греют при 25°С в течение 2 часов. Затем смесь выливают в холодную воду (50 мл). Полученное твердое вещество экстрагируют этилацетатом (2×50 мл). Объединенные органические экстракты промывают рассолом (50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SZ используют непосредственно на следующей стадии без дополнительной очистки.
Пример 61. Синтез соединений SZ-1 и SZ-2.

К раствору неочищенного соединения SZ (80 мг, 0,195 ммоль) в безводном ТГФ (6 мл) добавляют 1,2,3-триазол (40,4 мг, 0,585 ммоль), а затем карбонат калия (80,9 мг, 0,585 ммоль). Раствор греют при 50°С в течение ночи. Затем раствор разбавляют EtOAc (100 мл). Полученный раствор промывают рассолом (2×50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции очищают преп. ВЭЖХ с обращенной фазой, и получают продукт SZ-1 (15 мг, 19%) и продукт SZ-2 (6 мг, 7,7%) в виде не совсем белого твердого вещества. SZ-1:1H ЯМР (500 МГц, CDCl3), δ (м.д.): 7,77 (1H, с), 7,65 (1H, с), 5,28 (1H, AB), 5,14 (1H, AB), 2,66 (1H, т), 1,18 (3H, с), 0,92 (3H, д), 0,68 (3H, с). SZ-2:1H ЯМР (500 МГц, CDCl3), δ (м.д.): 7,69 (2H, с), 5,25 (1H, AB), 5,23 (1H, AB), 2,60 (1H, т), 1,18 (3H, с), 0,92 (3H, д), 0,71 (3H, с).
Пример 62. Синтез SS и промежуточных соединений для SS.
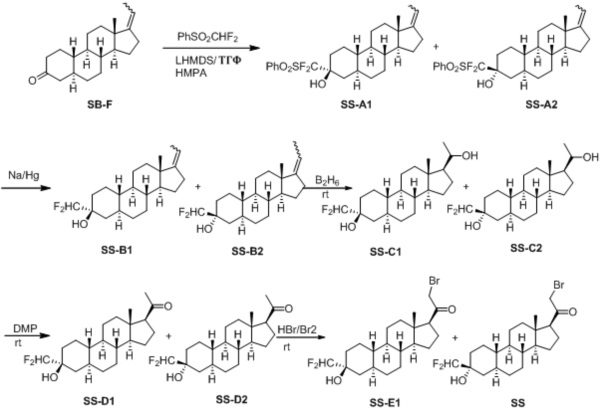
Синтез соединений SS-A1 и SS-A2. К раствору соединения SB-F (800 мг, 2,79 ммоль) и PhSO2CH2F (540 мг, 2,795 ммоль) в ТГФ (25 мл) и НМРА (0,5 мл) при -78°С в атмосфере N2 добавляют по каплям 1 М раствор LHMDS в ТГФ (4 мл). После перемешивания при -78°С в течение 2 час реакцию гасят насыщенным водным раствором NH4Cl (10 мл), смесь оставляют нагреваться до комнатной температуры и затем экстрагируют EtOAc (20 мл × 3). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (петролейный эфир/этилацетат=10/1), и получают смесь соединения SS-A1 и SS-A2 (650 мг). Смесь дополнительно очищают хиральной ВЭЖХ, и получают соединение SS-А1 (250 мг, t=3,29 мин) и SS-A2 (235 мг, t=3,89 мин).
Синтез соединения SS-В2. К раствору соединения SS-А2 (230 мг, 0,489 ммоль) и безводного Na2HPO4 (150 мг) в безводном метаноле (5 мл) при -20°С в атмосфере N2 добавляют амальгаму Na/Hg (700 мг). После перемешивания при -20°С - 0°С в течение 1 часа метанольный раствор декантируют, и твердый остаток промывают Et2O (5×3 мл). Растворитель из объединенной органической фазы удаляют в вакууме, добавляют 20 мл рассола, и затем смесь экстрагируют Et2O. Объединенную эфирную фазу сушат над MgSO4, фильтруют и концентрируют. Сырой продукт реакции очищают хроматографией на силикагеле (РЕ/ЕА=10/1), и получают соединение SS-В2 (120 мг, 73%).1H ЯМР (400 МГц, CD3COCD2), δ (м.д.), 6,02-5,88 (т, 1H), 5,13-5,08 (м, 1H), 0,92 (с, 3H).
Синтез соединения SS-C2. К раствору соединения SS-B2 (120 мг, 0,355 ммоль) в сухом ТГФ (5 мл) добавляют комплекс боран-тетрагидрофуран (1,20 мл; 1,0 М раствор в ТГФ). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь охлаждают на ледяной бане и затем постепенно гасят 10% водным раствором NaOH (1 мл) и затем 30% водным раствором Н2О2 (1,2 мл). Смесь перемешивают при комнатной температуре в течение 1 часа и затем экстрагируют EtOAc (3×10 мл). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (10 мл) и рассолом (10 мл), сушат над MgSO4, фильтруют и концентрируют, и получают соединение SS-С2 (180 мг, неочищенное). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SS-D2. К раствору соединения SS-С2 (180 мг, неочищенное) в 10 мл влажного дихлорметана (дихлорметан встряхивают с несколькими миллилитрами Н2О и затем отделяют от водного слоя) добавляют периодинат Десс-Мартина (380 мг, 0,896 ммоль). После перемешивания при комнатной температуре в течение 24 час реакционную смесь экстрагируют дихлорметаном (3×10 мл). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (10 мл) и рассолом (10 мл), сушат над MgSO4, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (петролейный эфир/этилацетет=1:5), и получают соединение SS-D2 (70 мг, 55,7% за две стадии) в виде не совсем белого твердого вещества. 1H ЯМР (400 МГц, CDCl3), δ (м.д.), 5,90-5,61 (т, 1H), 2,48-2,43 (м, 1Н), 2,10 (с, 3Н), 0,55 (с, 3H).
Синтез соединения SS. К раствору соединения SS-D2 (50 мг, 0,14 ммоль) в МеОН (5 мл) добавляют 2 капли HBr (48%), а затем бром (100 мг, 0,62 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь выливают в смесь воды со льдом и затем экстрагируют этилацетатом (15 мл × 3). Объединенные органические слои промывают рассолом (20 мл), сушат над MgSO4, фильтруют и концентрируют, и получают соединение SS (72 мг, неочищенное). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Пример 63. Синтез соединения SS-1.

К суспензии К2СО3 (126 мг, 0,92 ммоль) в ТГФ (10 мл) добавляют 1,2,3-1Н-триазол (22,4 мг, 0,92 ммоль) и соединение SS (200 мг, 0,46 ммоль). После перемешивания при комнатной температуре в течение 15 час реакционную смесь выливают в 5 мл Н2О и экстрагируют EtOAc (2×10 мл). Объединенные органические слои промывают рассолом (2×10 мл), сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток очищают преп. ВЭЖХ с обращенной фазой, и получают SS-1 в виде не совсем белого твердого вещества (53,8 мг, 0,13 ммоль, 27,7%). SS-1: 1H ЯМР (400 МГц, CDCl3), δ (м.д.): 7,76 (д, 1H), 7,64 (д, 1H), 5,82 (т, 1Н), 5,25 (AB, 1H), 5,13 (AB, 1H), 2,65 (т, 1H), 0,69 (с, 3H). ЖХМС: Rt=2,18 мин. m/z=404,2 [М+H]+.
Пример 64. Синтез SN и промежуточных соединений для SN.


Синтез соединения SN-B. К раствору реагента SN-А (10,0 г, 36,44 ммоль) в пиридине (30 мл) добавляют уксусный ангидрид (5,0 мл, 52,89 ммоль). Смесь перемешивают при 60°С в течение ночи. Затем раствор выливают в смесь воды со льдом (200 мл). Белое выпавшее в осадок вещество отфильтровывают и растворяют в этилацетате (300 мл). Полученный раствор промывают насыщ. раствором CuSO4.5H2O (2×200 мл) для того, чтобы удалить оставшийся пиридин. Органический слой дополнительно промывают рассолом (200 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь петролейный эфир/этилацетат=4:1), и получают продукт SN-В (11,125 г, 35,16 ммоль, выход=96%) в виде не совсем белого твердого вещества. SN-B: 1H ЯМР (500 МГц, CDCl3), δ (м.д.):5,83 (1H, с), 4,62 (1H, ll), 2,05 (3H, с), 0,86 (3H, с).
Синтез соединения SN-С. К раствору реагента SN-В (4,68 г, 14,79 ммоль) в ТГФ (150 мл) при -78°С добавляют LiHMDS (1,0 М раствор в ТГФ, 17,74 мл, 17,74 ммоль). Раствор перемешивают при -78°С в течение 30 минут. Затем добавляют НМРА (3,09 мл, 17,74 ммоль). Раствор перемешивают при -78°С еще в течение 30 минут. Затем добавляют иодметан (2,76 мл, 44,37 ммоль). Раствор дополнительно перемешивают при -78°С в течение 2 час, нагревают до комнатной температуры и перемешивают в течение 1 часа. Реакцию гасят, добавляя воду (2 мл). Большую часть ТГФ удаляют в вакууме. Затем остаток разбавляют этилацетатом (300 мл), и полученный раствор промывают рассолом (2×100 мл) и сушат над сульфатом магния. Удаление растворителя в вакууме дает сырой продукт SN-C (4,50 г, 13,62 ммоль, выход=92%) в виде густого масла. Сырой продукт реакции используют на следующей стадии без дополнительной очистки. SN-C: 1H ЯМР (500 МГц, CDCl3), δ (м.д.): 5,75 (1H, с), 4,62 (1H, т), 2,05 (3H, с), 1,10 (3H, д), 0,86 (3H, с).
Синтез соединений SN-D1 и SN-D2. К раствору неочищенного реагента SN-C (11,62 г, 35,16 ммоль, теоретическое количество) в метаноле (100 мл) и воде (20 мл) добавляют гидроксид натрия (2,81 г, 70,32 ммоль). Раствор греют при 60°С в течение 1 часа. Затем большую часть растворителя метанола удаляют в вакууме. Оставшийся раствор подкисляют 2 М HCl до рН 5-6. Водный слой экстрагируют этилацетатом (3×100 мл). Объединенные органические экстракты промывают рассолом (200 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь петролейный эфир/этилацетат=5:1), и получают чистый продукт SN-D1 (2,354 г, 8,162 ммоль, выход=23%) и чистый продукт SN-D2 (5,306 г, 18,40 ммоль, выход=50%) в виде не совсем белого твердого вещества. SN-D1: 1H ЯМР (500 МГц, CDCl3), δ (м.д.): 5,81 (1H, с), 3,67 (1H, т), 1,11 (3H, д), 0,81 (3H, с). SN-D2: 1H ЯМР (500 МГц, CDCl3), δ (м.д.): 5,74 (1H, с), 3,67 (1H, т), 1,11 (3H, д), 0,81 (3H, с).
Синтез соединения SN-E. К жидкому аммиаку (200 мл) при -78°С добавляют литий (1,80 г, 260 ммоль). После этого жидкость становится темно-синей. Затем к Li-аммиачному раствору добавляют раствор реагента SN-D1 (3,0 г, 10,40 ммоль) в трет-BuOH (1,0 мл, 10,40 ммоль) и ТГФ (100 мл). Смесь перемешивают при -78°С в течение 4 час. Затем добавляют твердый NH4Cl (20 г) для гашения реакции. Смесь из темно-синей становится белой. Смесь оставляют нагреваться до комнатной температуры, и аммиак выпаривают в вытяжном шкафу в течение ночи. К остатку добавляют воду (300 мл). Смесь подкисляют конц. HCl до рН 6-7. Затем добавляют этилацетат (300 мл). Отделенный водный слой дополнительно экстрагируют этилацетатом (2×100 мл). Объединенные органические экстракты промывают рассолом (300 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SN-E используют непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения SN-F. К раствору неочищенного реагента SN-E (1,749 г, 6,022 ммоль) в дихлорметане (60 мл) добавляют дихромат пиридиния (PDC) (3,398 г, 9,033 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Раствор фильтруют через тонкий слой целита. Целит промывают CH2Cl2 (3×50 мл). Объединенный CH2Cl2 раствор концентрируют в вакууме. Остаток очищают флэш-хроматогрфией (элюент смесь петролейный эфир/этилацетат=5:1), и получают продукт SN-F (1,298 г, 4,50 ммоль, выход=75%) в виде не совсем белого твердого вещества. SN-F:1Н ЯМР (400 МГц, CDCl3), δ (м.д.): 1,02 (3Н, д), 0,91 (3Н, с).
Синтез соединения SN-G. К раствору реагента SN-F (1,948 г, 6,754 ммоль) в безводном метаноле (50 мл) добавляют моногидрат п-толуолсульфоновой кислоты (128 мг, 0,6754 ммоль). Раствор греют при 70°С в течение 3 часов. Реакцию гасят, добавляя насыщ. раствор Na2CO3 (10 мл). Большую часть метанола удаляют в вакууме. Затем остаток разбавляют этилацетатом (200 мл). Полученный раствор промывают насыщ. раствором Na2CO3 (2×100 мл). Объединенные водные слои экстрагируют этилацетатом (50 мл). Объединенные органические экстракты промывают рассолом (100 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают флэш-хроматогрфией (элюент смесь петролейный эфир/EtOAc=10:1 с добавлением 0,1% NEt3), и получают продукт SN-G (652 мг, 1,949 ммоль, выход=29%) в виде не совсем белого твердого вещества. Дополнительно также извлекают исходный материал (1,338 г). Таким образом, выход относительно извлеченного исходного материала составляет 92%. SN-G:1Н ЯМР (500 МГц, d6-ацетон), δ (м.д.): 3,079 (3H, с), 3,075 (3H, с), 2,38 (1H, дд), 1,98 (1H, дд), 0,91 (3H, д, J=7,2 Гц), 0,85 (3H, с).
Синтез соединения SN-H. К раствору бромида этилтрифенилфосфония (8,795 г, 23,69 ммоль) в безводном ТГФ (20 мл) добавляют трет-BuОК (2,658 г, 23,69 ммоль). После этого раствор становится красноватым, и затем его греют при 70°С в течение 2 часов. Затем добавляют реагент SN-G (1,642 г, 4,909 ммоль) в один прием. Раствор греют при 70°С в течение ночи. Реакцию гасят, добавляя воду (10 мл). Смесь разбавляют этилацетатом (200 мл), и полученный раствор промывают рассолом (2×100 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт SN-H используют непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения SN-I. К неочищенному продукту SN-H (1,702 г, 4,909 ммоль, теоретическое количество) в ТГФ (30 мл) добавляют 2 М HCl (3 мл). Раствор перемешивают при температуре окружающей среды в течение 1 часа. Смесь разбавляют этилацетатом (300 мл), и полученный раствор промывают насыщ. раствором Na2CO3 (2×100 мл). Объединенные водные слои экстрагируют этилацетатом (100 мл). Объединенные органические экстракты промывают рассолом (100 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают флэш-хроматогрфией (элюент смесь петролейный эфир/EtOAc=100:3), и получают сырой продукт SN-I (1,746 г) в виде не совсем белого твердого вещества, которое загрязнено некоторым количеством неотделившегося PPh3. Судя по единому спектру1Н ЯМР, отношение нужного продукта к PPh3 составляет 3:1, таким образом количество нужного продукта SN-I составляет 1,354 г (4,506 ммоль), выход составляет 92%. SN-I:1Н ЯМР (500 МГц, CDCl3), δ (м.д.): 5,13 (1H, кт), 1,66 (3H, дт), 1,02 (3H, д), 0,91 (3H, с).
Синтез соединения SN-J. К раствору иодида триметилсульфоксония (5,213 г, 23,69 ммоль) в безводном ДМСО (30 мл) добавляют гидрид натрия (60 мас.%, 948 мг, 23,69 ммоль). Смесь перемешивают при 25°С в течение 1 часа. Затем добавляют раствор неочищенного реагента (1,746 г, загрязнен некоторым количеством оставшегося PPh3, теоретическое количество 1,354 г, 4,506 ммоль) в безводном ТГФ (10 мл). Смесь перемешивают при 25°С в течение ночи. Реакцию гасят, добавляя воду (5 мл). Смесь разбавляют этилацетатом (300 мл), и полученный раствор промывают водой (2×100 мл), затем рассолом (100 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SN-J используют непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения SN-К. К раствору неочищенного реагента SN-J (теоретическое количество 1,417 г, 4,506 ммоль) в безводном ТГФ (30 мл) добавляют по частям алюмогидрид лития (342 мг, 9,012 ммоль). Суспензию перемешивают при 25°С в течение 1 часа. Затем реакцию гасят, добавляя этилацетат (5 мл) и затем воду (5 мл). Не совсем белое твердое вещество отфильтровывают и тщательно промывают этилацетатом (5×100 мл). Объединенный фильтрат промывают рассолом (200 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь петролейный эфир/EtOAc=20:1), и получают продукт SN-К (458 мг, 1,447 ммоль, общий выход за 2 стадии=32%) в виде не совсем белого твердого вещества.
Синтез соединения SN-L. К раствору реагента SN-K (438 мг, 1,447 ммоль) в безводном ТГФ (15 мл) добавляют BH3. ТГФ (1,0 М, 7,23 мл, 7,23 ммоль). Раствор перемешивают при 25°С в течение ночи. Затем реакцию гасят, добавляя воду (5 мл). Добавляют 2 М раствор NaOH (10 мл), а затем 30% Н2О2 (10 мл). Смесь перемешивают при комнатной температуре в течение 1 часа. Смесь разбавляют этилацетатом (200 мл), и полученный раствор промывают рассолом (2×100 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции используют непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения SN-М. К раствору неочищенного реагента SN-L (484 мг, 1,447 ммоль, теоретическое количество) в дихлорметане (40 мл) добавляют по частям дихромат пиридиния (PDC) (1633 мг, 4,341 ммоль). Раствор перемешивают при 25°С в течение ночи. Затем смесь фильтруют через тонкий слой силикагеля, и силикагель промывают дихлорметаном (3×50 мл). Все фильтраты объединяют и концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь петролейный эфир/этилацетат=8:1), и получают продукт SN-М (305 мг, 0,917 ммоль, выход=63% (2 стадии)) в виде не совсем белого твердого вещества. SN-М: 1Н ЯМР (500 МГц, CDCl3), δ (м.д.): 2,54 (1H, т), 0, 2,12-2,19 (1H, м), 2,12 (3H, с), 1,99 (1H, тд), 1,80-1,86 (1H, м), 1,17 (3H, с), 0,92 (3H, д), 0,61 (3H, с). SN-М: 13С ЯМР (100 МГц, CDCl3), δ (м.д.): 209,75, 71,09, 63,96, 55,89, 47,96, 47,80, 47,00, 44,35, 41,19, 40,22, 39,05, 37,95, 34,49, 33,14, 31,54, 30,92, 28,46, 25,82, 24,22, 22,76, 15,14, 13,45.
Синтез соединения SN. К раствору соединения SN-М (100 мг, 0,301 ммоль) в метаноле (10 мл) добавляют 48% бромоводородную кислоту (152 мг, 0,903 ммоль), а затем бром (241 мг, 0,077 мл, 1,505 ммоль). Раствор греют при 25°С в течение 1,5 часов. Затем смесь выливают в холодную воду (50 мл). Полученное твердое вещество экстрагируют этилацетатом (2×50 мл). Объединенные органические экстракты промывают рассолом (50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SN используют непосредственно на следующей стадии без дополнительной очистки.
Пример 65. Синтез соединений SN-1 и SN-2.

К раствору неочищенного соединения SN (124 мг, 0,301 ммоль) в безводном ТГФ (6 мл) добавляют 1,2,3-триазол (31 мг, 0,45 ммоль), а затем карбонат калия (62 мг, 0,45 ммоль). Раствор греют при 50°С в течение ночи. Затем раствор разбавляют этилацетатом (100 мл). Полученный раствор промывают рассолом (2×50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции очищают преп. ВЭЖХ с обращенной фазой, и получают продукт SN-1 (21 мг, 0,526 ммоль, выход=17%) и продукт SN-2 (16 мг, 0,0400 ммоль, выход=13%) в виде не совсем белого твердого вещества. SN-1:1H ЯМР (400 МГц, CDCl3), δ (м.д.): 7,76 (1H, с), 7,65 (1H, с), 5,20 (1H, AB), 5,14 (1H, AB), 2,66 (1H, т), 2,21 (1H, дд), 1,18 (3H, с), 0,92 (3H, д), 0,68 (3H, с). SN-2:1H ЯМР (400 МГц, CDCl3), δ (м.д.): 7,69 (2H, с), 5,27 (1H, AB), 5,23 (1H, AB), 2,60 (1H, т), 2,20 (1H, дд), 1,17 (3H, с), 0,92 (3H, д), 0,71 (3H, с).
Пример 66. Синтез SU и промежуточных соединений для SU.

Синтез соединения SU-В. К NН3 (жидкий, 2,0 л) при -78°С добавляют литий (7,0 г, 1 моль). После того, как жидкость станет темно-синей, добавляют по каплям раствор соединения SU-А (27,0 г, 100 ммоль) в трет-BuOH (7,4 г, 100 ммоль) и ТГФ (20 мл). Смесь перемешивают при -78°С в течение 4 часов. Затем добавляют твердый NH4Cl (50 г) для гашения реакции. Смесь из темно-синей становится белой. Смесь оставляют нагреваться до комнатной температуры, и аммиак выпаривают в течение ночи. Остаток растворяют в 0,5 N соляной кислоте (50 мл), и раствор экстрагируют дихлорметаном (200 мл × 3). Объединенные органические слои промывают насыщенным раствором NaHCO3 (200 мл) и рассолом (200 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции очищают флэш-хроматографией (РЕ/EtOAc=4:1), и получают продукт SU-В (18,98 г, 68,7%) в виде не совсем белого твердого вещества. SU-В:1H ЯМР (500 МГц, CDCl3), δ (м.д.): 3,66 (1H, т, J=8,0 Гц), 2,29-2,27 (2H, м), 2,12-2,07 (2H, м), 1,83-1,81 (2H, м), 1,50 (1H, с), 0,77 (3H, с).
Синтез соединения SU-С. Образец соединения SU-В в 19,0 г (68,84 ммоль) при 0°С растворяют в 50 мл ТГФ. Затем добавляют по каплям за 30 мин 70 мл раствора MeMgBr в ТГФ (3 М). Реакционную смесь поддерживают при 0°С в течение 8 час. Реакцию гасят охлажденной льдом водой, и смесь экстрагируют EtOAc (200 мл × 3). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Белый остаток очищают колоночной флэш-хроматографией (РЕ/EtOAc=5:1), и получают продукт SU-С (19,0 г, 94%) в виде не совсем белого твердого вещества. SU-С:1H ЯМР (500 МГц, CDCl3), δ (м.д.): 5,78 (1H, уш), 5,36 (1H, т), 3,67 (1H, т), 1,73 (3H, с), 0,77 (3H, с).
Синтез соединения SU-D. К раствору соединения SU-С (19,0 г, 65,07 ммоль) в дихлорметане (100 мл) добавляют дихромат пиридиния (PDC) (48,9 г, 130,14 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Раствор фильтруют через тонкий слой целита. Целит промывают CH2Cl2 (3×100 мл). Объединенный CH2Cl2 раствор концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь РЕ/EtOAc=5:1), и получают продукт SU-D (10,0 г, 53%) в виде не совсем белого твердого вещества. SU-D:1Н ЯМР (500 МГц, CDCl3), δ (м.д.): 2,44 (1H, дд), 2,07 (1H, м), 1,21 (3H, с), 0,87 (3H, с).
Синтез соединения SU-Е. К раствору соединения SU-D (5,0 г, 17,2 ммоль) в безводном толуоле (100 мл) добавляют п-толуолсульфоновую кислоту на силикагеле (80 г), и смесь перемешивают при 45°С в течение 1 часа. Нерастворимые побочные продукты удаляют из силикагеля элюированием смесью РЕ/EtOAc (10/1). Сырой продукт реакции SU-Е (3,20 г, 11,75 ммоль) используют на следующей стадии без дополнительной очистки.
Синтез соединения SU-F. К раствору соединения SU-Е (3,20 г, 11,75 ммоль) в 10 мл безводного дихлорметана добавляют м-СРВА (4,04 г, 23,50 ммоль), и реакционную смесь перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь экстрагируют CH2Cl2, объединенные органические слои дважды промывают раствором NaHCO3 (100 мл) и рассолом, сушат над Na2SO4 и концентрируют. Сырой продукт реакции SU-F используют на следующей стадии без дополнительной очистки.
Синтез соединения SU-G. К раствору соединения SU-F (11,75 ммоль) в метаноле добавляют H2SO4 (0,5 мл), и реакционную смесь перемешивают в течение 2 час при комнатной температуре. Затем реакционный раствор экстрагируют CH2Cl2 (200 мл × 3), объединенные органические слои промывают раствором NaHCO3 (100 мл) и рассолом, сушат над Na2SO4 и концентрируют. Остаток очищают хроматографией (РЕ/EtOAc=10:1), и получают соединение SU-G (3,30 г, 10,30 ммоль, выход=87% за две стадии) в виде не совсем белого твердого вещества.
Синтез соединения SU-Н. К раствору бромида этилтрифенилфосфония (11,52 г, 31,0 ммоль) в безводном ТГФ (20 мл) добавляют трет-BuОК (3,48 г, 31,0 ммоль). Раствор становится красноватым, и его греют при 70°С в течение 3 часов. Затем добавляют соединение SU-G (3,30 г, 10,30 ммоль) в один прием. Реакционный раствор греют при 70°С в течение ночи, и затем реакцию гасят, добавляя воду (10 мл). Смесь разбавляют EtOAc (200 мл), и полученный раствор промывают рассолом (2×100 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SU-H (1,90 г) используют непосредственно на следующей стадии без дополнительной очистки.
Синтез соединения SU-I. К раствору соединения SU-H (1,90 г, 5,72 ммоль) в сухом ТГФ (20 мл) добавляют BH3.ТГФ (18 мл 1,0 М раствора в ТГФ). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь охлаждают на ледяной бане и затем постепенно гасят 10% водным раствором NaOH (12 мл) и затем 30% Н2О2 (20 мл). Смесь перемешивают при комнатной температуре в течение 1 часа и затем экстрагируют EA (100 мл × 3). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (50 мл) и рассолом, сушат над Na2SO4, фильтруют и концентрируют, и получают сырое соединение SU-I (1,86 г, 5,31 ммоль). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SU-J. К раствору неочищенного соединения SU-I (1,86 г, 5,31 ммоль) в дихлорметане (50 мл) добавляют по частям дихромат пиридиния (PDC) (3,98 г, 10,62 ммоль). Раствор перемешивают при 25°С в течение ночи. Затем смесь фильтруют через тонкий слой силикагеля, и силикагель промывают дихлорметаном (3×50 мл). Все фильтраты объединяют и концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь РЕ/EtOAc=10:1), и получают продукт SU-J (1,20 г, 3,45 ммоль, 65%) в виде не совсем белого твердого вещества.
SU-J:1Н ЯМР (500 МГц, CDCl3), δ (м.д.): 3,33 (3H, с), 3,04 (1H, с), 2,53 (1H, т), 2,12 (3H, с), 1,26 (3H, с), 0,62 (3H, с).
Синтез соединения SU. К раствору реагента SU-J (100 мг, 0,287 ммоль) в метаноле (10 мл) добавляют 48% HBr (152 мг, 0,903 ммоль), а затем бром (0,08 мл, 1,505 ммоль). Раствор греют при 25°С в течение 1,5 часов. Затем смесь выливают в холодную воду (50 мл). Полученное твердое вещество экстрагируют этилацетатом (2×50 мл). Объединенные органические экстракты промывают рассолом (50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SU используют непосредственно на следующей стадии без дополнительной очистки.
Пример 67. Синтез соединений SU-1 и SU-2.
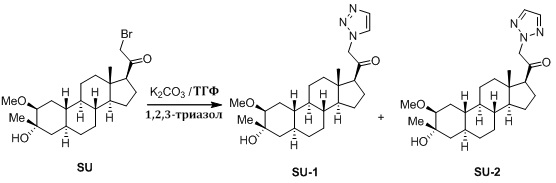
К раствору неочищенного соединения SU (100 мг, 0,243 ммоль) в безводном ТГФ (6 мл) добавляют 1,2,3-триазол (34 мг, 0,50 ммоль), а затем карбонат калия (70 мг, 0,50 ммоль). Раствор греют при 50°С в течение ночи. Затем раствор разбавляют EtOAc (100 мл). Полученный раствор промывают рассолом (2×50 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции очищают преп. ВЭЖХ с обращенной фазой, и получают продукт SU-1 (35 мг, 0,084 ммоль, выход=34%) и продукт SU-2 (20 мг, 0,048 ммоль, 20%) в виде не совсем белого твердого вещества. SU-1:1H ЯМР (500 МГц, CDCl3), δ (м.д.): 7,76 (1H, с), 7,65 (1H, с), 5,27 (1H, AB), 5,14 (1H, AB), 3,34 (3H, с), 3,04 (1H, с), 2,65 (1H, т), 1,24 (3H, с), 0,68 (3H, с). SU-2:1H ЯМР (500 МГц, CDCl3), δ (м.д.): 7,68 (2H, с), 5,26 (1H, AB), 5,22 (1H, AB), 3,33 (3H, с), 3,04 (1H, с), 2,59 (1H, т), 1,24 (3H, с), 0,72 (3H, с).
Пример 68. Синтез SY и промежуточных соединений для SY.

Синтез соединения SY-В. К NН3 (жидкий, 2,0 л) при -78°С добавляют литий (7,0 г, 1 моль). После того, как жидкость станет темно-синей, добавляют по каплям раствор реагента SY-А (27,0 г, 100 ммоль) в трет-BuOH (7,4 г, 100 ммоль) и ТГФ (20 мл). Смесь перемешивают при -78°С в течение 4 час, и затем добавляют твердый NH4Cl (50 г) для гашения реакции. После этого смесь из темно-синей становится белой. Смесь оставляют нагреваться до комнатной температуры, и аммиак выпаривают в вытяжном шкафу в течение ночи. Остаток растворяют в 0,5 N HCl (50 мл), и раствор экстрагируют дихлорметаном (200 мл × 3). Объединенные органические слои промывают насыщенным раствором NaHCO3 (200 мл) и рассолом (200 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции очищают флэш-хроматографией (РЕ/EA=4:1), и получают продукт SY-В (18,98 г, 68,76%) в виде не совсем белого твердого вещества. SY-В:1H ЯМР (500 МГц, CDCl3), δ (м.д.): 3,66 (1H, т), 2,29-2,27 (2H, м), 2,12-2,07 (2H, м), 1,83-1,81 (2H, м), 1,50 (1H, с), 0,77 (3H, с).
Синтез соединения SY-С. Образец соединения SY-В в 19,0 г (68,84 ммоль) при 0°С растворяют в 50 мл ТГФ. Затем добавляют по каплям за 30 мин 70 мл раствора MeMgBr в ТГФ (3 М), и затем реакционную смесь поддерживают при 0°С в течение 8 час. Реакцию гасят охлажденной льдом водой, и смесь экстрагируют EA (200 мл × 3). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют. Белый остаток очищают колоночной флэш-хроматографией (РЕ/EA=5:1), и получают продукт SY-С (19,0 г, 65,07 ммоль, выход=94%) в виде не совсем белого твердого вещества. SY-С:1H ЯМР (500 МГц, CDCl3), δ (м.д.): 5,78 (1H, уш), 5,36 (1H, т), 3,67 (1H, т), 1,73 (3H, с), 0,77 (3H, с).
Синтез соединения SY-D. К раствору реагента SY-С (19,0 г, 65,07 ммоль) в дихлорметане (100 мл) при комнатной температуре добавляют дихромат пиридиния (PDC) (48,9 г, 130,14 ммоль), и смесь перемешивают при комнатной температуре в течение ночи. Раствор фильтруют через тонкий слой целита. Целит промывают CH2Cl2 (3×100 мл). Объединенный CH2Cl2 раствор концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь РЕ/EA=5:1), и получают продукт SY-D (10,0 г, 34,48 ммоль, выход=53%) в виде не совсем белого твердого вещества. SY-D:1Н ЯМР (500 МГц, CDCl3), δ (м.д.): 2,44 (1H, дд), 2,07 (1H, м), 1,21 (3H, с), 0,87 (3H, с).
Синтез соединения SY-Е. К раствору реагента SY-D (5,0 г, 17,2 ммоль) в безводном толуоле (100 мл) быстро добавляют п-толуолсульфоновую кислоту на силикагеле (80 г), и смесь перемешивают при 45°С в течение 1 часа. Продукт извлекают из силикагеля элюированием (смесь РЕ/EA=30:1). Сырой продукт реакции SY-Е (3,20 г, 11,75 ммоль) используют на следующей стадии без дополнительной очистки.
Синтез соединения SY-F. К раствору SY-Е (3,20 г, 11,75 ммоль) в 10 мл безводного дихлорметана добавляют м-СРВА (4,04 г, 23,50 ммоль), и реакционную смесь перемешивают в течение ночи при комнатной температуре. Затем раствор экстрагируют CH2Cl2 (2×100 мл), объединенные органические слои дважды промывают раствором NaHCO3 (100 мл) и рассолом, сушат над Na2SO4 и концентрируют. Сырой продукт реакции SY-F используют на следующей стадии без дополнительной очистки.
Синтез соединения SY-G. К раствору SY-F (900 мг, 3,12 ммоль) в этаноле(50 мл) добавляют концентрированную H2SO4 (0,5 мл), и реакционную смесь перемешивают в течение 2 час при комнатной температуре. Как только ТСХ покажет завершение конверсии, раствор экстрагируют CH2Cl2 (200 мл × 3), объединенные органические слои промывают раствором NaHCO3 (100 мл) и рассолом, сушат над Na2SO4 и концентрируют. Остаток очищают хроматографией (РЕ/EA=10:1), и получают соединение SY-G (600 мг, 1,80 ммоль, выход=57,6% за две стадии) в виде не совсем белого твердого вещества.
Синтез соединения SY-Н. К раствору бромида этилтрифенилфосфония (1,99 г, 5,96 ммоль) в безводном ТГФ (10 мл) добавляют трет-BuОК (500 мг, 4,48 ммоль). Раствор становится красноватым, и его греют при 70°С в течение 3 часов. Затем добавляют реагент SY-G (600 мг, 1,79 ммоль) в один прием. Раствор греют при 70°С в течение ночи. Реакцию гасят, добавляя воду (5 мл). Смесь разбавляют этилацетатом (100 мл), и полученный раствор промывают рассолом (2×50 мл), сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают флэш-хроматографией (элюент смесь петролейный эфир/этилацетат=20:1), и получают продукт SY-H (1,55 г, 4,48 ммоль, 75,2%) в виде не совсем белого твердого вещества.
Синтез соединения SY-I. К раствору соединения SY-H (1,20 г, 3,47 ммоль) в сухом ТГФ (20 мл) добавляют BH3.ТГФ (18 мл 1,0 М раствора в ТГФ). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь охлаждают на ледяной бане и затем постепенно гасят 10% водным раствором NaOH (10 мл) и затем 30% Н2О2 (15 мл). Смесь перемешивают при комнатной температуре в течение 1 часа и затем экстрагируют EA (100 мл × 3). Объединенные органические слои промывают 10% водным раствором Na2S2O3 (50 мл) и рассолом, сушат над Na2SO4, фильтруют и концентрируют, и получают сырое соединение SY-I (1,12 г). Сырой продукт реакции используют на следующей стадии без дополнительной очистки.
Синтез соединения SY-J. К раствору неочищенного реагента SY-I (1,12 г, 3,08 ммоль) в дихлорметане (50 мл) при комнатной температуре добавляют по частям дихромат пиридиния (PDC) (3,32 г, 6,36 ммоль). Раствор перемешивают при 25°С в течение ночи, затем смесь фильтруют через тонкий слой силикагеля, и силикагель промывают дихлорметаном (3×50 мл). Все фильтраты объединяют и концентрируют в вакууме. Остаток очищают флэш-хроматогрфией (элюент смесь РЕ/EA=10:1), и получают продукт SY-J (0,95 г, 2,62 ммоль, выход=85,1%) в виде не совсем белого твердого вещества. SY-J:1Н ЯМР (500 МГц, CDCl3), δ (м.д.): 3,59 (1H, м), 3,36 (1H, м), 3,12 (1H, с), 2,53 (1H, т), 2,14 (3H, с), 1,23 (3H, с), 1,17 (3H, т), 0,62 (3H, с).
Синтез соединения SY. К раствору реагента SY-J (80 мг, 0,221 ммоль) в метаноле (5 мл) добавляют 48% бромоводородную кислоту (148 мг, 0,884 ммоль), а затем бром (241 мг, 0,077 мл, 1,505 ммоль). Раствор греют при 25°С в течение 1,5 часов, и затем смесь выливают в холодную воду (50 мл). Полученное твердое вещество экстрагируют этилацетатом (2×50 мл). Объединенные органические экстракты промывают рассолом (20 мл), сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт реакции SY используют непосредственно на следующей стадии без дополнительной очистки.
Пример 69. Синтез соединений SY-1 и SY-2.
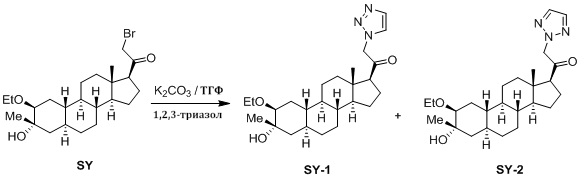
К раствору соединения SY (110 мг, неочищенное) в сухом ТГФ (5 мл) добавляют карбонат калия (100 мг) и 0,3 мл 1Н-1,2,3-триазола. Реакционную смесь греют при 50°С в течение двух суток и затем экстрагируют EtOAc (3×10 мл). Объединенные EtOAc экстракты промывают рассолом (10 мл), сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают препаративной ВЭЖХ, и получают названное в заголовке соединение SY-1 (23 мг, выход=21%) и SY-2 (9 мг, выход=8%) в виде не совсем белого твердого вещества. SY-1:1H ЯМР (500 МГц, CDCl3), δ (м.д.): 7,77 (1H, с), 7,66 (1H, с), 5,27 (1H, AB), 5,13 (1H, AB), 3,61-3,57 (1H, м), 3,38-3,34 (1H, м), 3,12 (1H, с), 2,64 (1H), 1,23 (3H, с), 1,16 (3H, т), 0,68 (3H, с). SY-2:1H ЯМР (500 МГц, CDCl3), δ (м.д.): 7,68 (2H, с), 5,26 (1H, AB), 5,21 (1H, AB), 3,61-3,57 (1H, м), 3,38-3,34 (1H, м), 3,12 (1H, с), 2,59 (1H, т), 2,08-1,97 (1H, м), 1,23 (3H, с), 1,16 (3H, т), 0,72 (3H, с).
Пример 70. Синтез соединений SA-10, SA-11, SA-12, SA-13 и SA-14.

Стадия 1. К раствору SA (4,3 г, 10,8 ммоль) в ацетоне (50 мл) при 25°С добавляют К2СО3 (2,98 г, 21,6 ммоль) и 2Н-1,2,3-триазол-4-карбоксилат (2,28 г, 16,2 ммоль). Смесь перемешивают при 25°С в течение 12 часов. ТСХ показывает, что исходный материал исчез. Реакцию гасят водой (30 мл), и затем смесь экстрагируют ЕА (30 мл × 2). Объединенную органическую фазу промывают крепким рассолом (50 мл), сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (силикагель 100-200 меш, петролейный эфир/этилацетат=3/1), и получают SA-10 (2,6 г, чистота 95%, выход 50%, на выходе 54 мг) в виде белого твердого вещества и SA-11 (1,5 г, чистота 95%, выход 28,7%, на выходе 21 мг) в виде светло-желтого твердого вещества. SA-10:1H ЯМР CDCl3, Bruker_P_400 МГц, δ 8,11 (с, 1H), 5,35-5,22 (м, 2H), 4,43 (к, J=7,3 Гц, 2H), 2,64-2,55 (м, 1H), 2,24-2,03 (м, 2H), 1,91-1,60 (м, 7H), 1,50-1,23 (м, 18H), 1,18-1,04 (м, 3H), 0,71 (с, 3H). ЖХМС Rt=1,081 мин в 2-мин хроматографии, 30-90 AB, чистота 98,95%, MС ESI, вычисл. для C26H39N3O4 [М-H2O+H]+ 440, найдено 440. SA-11:1H ЯМР CDCl3, Bruker_P_400 МГц, δ 8,17 (с, 1H), 5,33-5,12 (м, 2H), 4,43 (к, J=7,1 Гц, 2H), 2,71-2,61 (м, 1H), 2,28-2,15 (м, 1H), 2,06 (д, J=12,0 Гц, 1H), 1,90-1,70 (м, 6H), 1,69-1,60 (м, 1H), 1,55-1,38 (м, 10H), 1,37-1,21 (м, 8H), 1,18- 1,02 (м, 3H), 0,67 (с, 3H). ЖХМС Rt=1,000 мин в 2-мин хроматографии, 30-90 AB, чистота 96,6%, MС ESI, вычисл. для C26H39N3O4 [М-H2O+H]+ 440, найдено 440.
Стадия 2. К раствору SA-10 (300 мг, 655 мкмоль) в EtOH (8 мл) при 25°С добавляют LiOH.H2O (137 мг, 3,27 ммоль). Смесь перемешивают при 25°С в течение 16 час. ЖХМС показывает, что реакция завершена. Реакционную смесь выливают в воду (20 мл), подкисляют HCl (2 М) до рН 3-4 и экстрагируют ЕА (50 мл × 2). Объединенные органические слои концентрируют в вакууме. Остаток очищают преп. ВЭЖХ (0,05% HCl-ACN), и получают SA-12 (90 мг, чистота 100%, выход 32%, на выходе 28 мг) и побочный продукт (13 мг, чистота 100%, выход 4,62%) в виде белого твердого вещества. SA-12:1H ЯМР, ДМСО Bruker_P_400 МГц, δ 8,24 (с, 1H), 5,76-5,39 (м, 2H), 4,27 (с, 1H), 2,78 (с, 1H), 2,05 (д, J=11,5 Гц, 2H), 1,76-1,59 (м, 8H), 1,49-1,23 (м, 10H), 1,16-1,04 (м, 8H), 0,61 (с, 3H). ЖХМС Rt=0,913 мин в 2-мин хроматографии, 30-90 AB, чистота 96,6%, MС ESI, вычисл. для C24H35N3O4 [М+Na]+ 452, найдено 452.
Стадия 3. К раствору SA-12 (300 мг, 698 мкмоль) в DCM (15 мл) при 25°С добавляют HATU (395 мг, 1,04 ммоль) и DIEA (224 мг, 1,74 ммоль). Смесь перемешивают при 25°С в течение 15 мин. К раствору добавляют гидрат аммиака (0,3 мл, 26% в воде). Смесь перемешивают при 25°С в течение 30 мин. ЖХМС показывает, что реакция завершена. Смесь концентрируют. Остаток очищают преп. ВЭЖХ (0,05% HCl-ACN), и получают SA-13 (120 мг, чистота 100%, выход 40,1%) в виде белого твердого вещества. SA-13:1H ЯМР, ДМСО Bruker_А_400 МГц, δ 8,13 (с, 1H), 7,81 (с, 1H), 7,54 (с, 1H), 5,63-5,33 (м, 2H), 4,24 (с, 1H), 2,79-2,71 (м, 1H), 2,08-1,97 (м, 2H), 1,78-0,94 (м, 25H), 0,60 (с, 3H). ЖХМС Rt=0,878 мин в 2-мин хроматографии, 30-90 AB, чистота 100%, MС ESI, вычисл. для C24H36N4O3 [М-H2O+H]+ 411, найдено 411.
Стадия 4. К раствору SA-13 (82 мг, 764 мкмоль) в DCM (4 мл) при 25°С добавляют TFAA (120 мг, 573 мкмоль) и пиридин (60,3 мг, 764 мкмоль). Смесь перемешивают при 25°С в течение 16 час. ЖХМС показывает, что реакция завершена. Смесь концентрируют, остаток очищают преп. ВЭЖХ (0,1% ТФК-ACN), и получают SA-14 (35 мг, чистота 98,8%, выход 44%) в виде белого твердого вещества. SA-14:1H ЯМР, CDCl3 Bruker_Р_400 МГц, δ 8,04-8,00 (м, 1H), 5,35-5,24 (м, 2H), 2,67-2,60 (м, 1H), 2,26-2,04 (м, 3H), 1,96-1,86 (м, 3H), 1,83-1,72 (м, 6H), 1,69-1,62 (м, 4H), 1,58-1,06 (м, 11H), 0,71 (с, 3H). ЖХМС Rt=1,313 мин в 2-мин хроматографии, 30-90 AB, чистота 98.8%, MС ESI, вычисл. для C24H34N4O2 [М-H2O+H] 393, найдено 393.
Пример 71. Синтез соединений SA-17, SA-18 и SA-20.
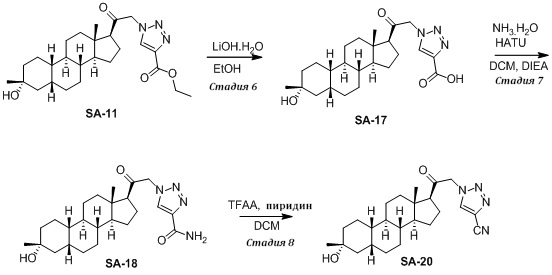
Стадия 6. К раствору SA-11 (200 мг, 437 мкмоль) в EtOH (5 мл) при 25°С добавляют LiOH.H2O (91,4 мг, 2,18 ммоль). Смесь перемешивают при 25°С в течение 16 час. ЖХМС показывает, что реакция завершена. Реакционную смесь выливают в воду (20 мл), подкисляют HCl (2 М) до рН 3-4 и экстрагируют ЕА (50 мл × 2). Объединенные органические слои концентрируют в вакууме. Остаток очищают преп. ВЭЖХ (0,05% HCl-ACN), и получают SA-17 (86 мг, чистота 100%, выход 45,9%, на выходе 26 мг) и побочный продукт (12 мг, чистота 100%, выход 6,41%) в виде белого твердого вещества. SA-17:1H ЯМР, ДМСО Bruker_N_400 МГц, δ 8,58 (с, 1H), 5,62-5,33 (м, 2H), 4,28 (с, 1H), 2,81 (т, J=8,7 Гц, 1H), 2,14-2,00 (м, 2H), 1,81-1,61 (м, 7H), 1,54-1,20 (м, 10H), 1,19-0,97 (м, 8H), 0,61 (с, 3H). ЖХМС Rt=0,867 мин в 2-мин хроматографии, 30-90 AB, чистота 100%, MС ESI, вычисл. для C24H35N3O4 [М-H2O+H] 412, найдено 412.
Стадия 7. К раствору SA-17 (200 мг, 465 мкмоль) в DCM (10 мл) при 25°С добавляют HATU (264 мг, 697 мкмоль) и DIEA (149 мг, 1,16 ммоль). Смесь перемешивают при 25°С в течение 15 мин. К раствору добавляют гидрат метанамина (0,2 мл, 26% в воде). Смесь перемешивают при 25°С в течение 30 мин. ЖХМС показывает, что реакция завершена. Смесь концентрируют. Остаток очищают преп. ВЭЖХ (0,05% HCl-ACN), и получают SA-18 (55 мг, чистота 99,5%, выход 27,4%, на выходе 10 мг) в виде белого твердого вещества. SA-18:1H ЯМР, ДМСО Bruker_А_400 МГц, δ 8,40 (с, 1H), 7,86 (с, 1H), 7,47 (с, 1H), 5,59-5,31 (м, 2H), 4,24 (с, 1H), 2,83-2,74 (м, 1H), 2,12-2,00 (м, 2H), 1,78-0,96 (м, 23H), 0,59 (с, 3H). ЖХМС Rt=0,877 мин в 2-мин хроматографии, 30-90 AB, чистота 100%, MС ESI, вычисл. для C24H36N4O3 [М-H2O+H]+ 411, найдено 411.
Стадия 8. К раствору SA-18 (45 мг, 105 мкмоль) в DCM (4 мл) при 25°С добавляют TFAA (66,1 мг, 315 мкмоль) и пиридин (33,1 мг, 420 ммоль). Смесь перемешивают при 25°С в течение 16 час. ЖХМС показывает, что реакция завершена. Смесь концентрируют, остаток очищают преп. ВЭЖХ, и получают SA-20 (6,5 мг, чистота 98,8%, выход 14,8%) в виде белого твердого вещества. SA-20:1H ЯМР, CDCl3 Bruker_Р_400 МГц, δ 8,13 (с, 1H), 5,37-5,13 (м, 2H), 2,72-2,65 (м, 1H), 2,28-2,03 (м, 3H), 1,97-1,85 (м, 3H), 1,84-1,73 (м, 5H), 1,70-1,64 (м, 4H), 1,60-1,23 (м, 9H), 1,20-1,07 (м, 3H), 0,67 (с, 3H). ЖХМС Rt=1,263 мин в 2-мин хроматографии, 30-90 AB, чистота 98,89%, MС ESI, вычисл. для C24H34N4O2 [М-H2O+H]+ 393, найдено 393.
Методы анализа
Соединения по настоящему изобретению можно оценить с использованием различных анализов, примеры которых описаны ниже.
Ингибирование связывания TBPS стероидами
Описаны анализы связывания [35S]-трет-бутилбициклофосфоротионата (TBPS) с использованием кортикальных мембран головного мозга крысы в присутствии 5 мкМ GABA (Gee et al., J. Pharmacol. Exp. Ther., 1987, 241, 346-353; Hawkinson et al., Mol. Pharmacol., 1994, 46, 977-985; Lewin A.H et al., Mol. Pharmacol., 1989, 35, 189-194).
Коротко, после декапитации под наркозом диоксидом углерода у крыс Sprague-Dawley (200-250 г) быстро извлекают кору головного мозга. Кору головного мозга гомогенизируют в 10 объемах охлажденного на льду 0,32 М раствора сахарозы с использованием стеклянного/тефлонового гомогенизатора и центрифугируют при 1500×g в течение 10 мин при 4°С. Полученные супернатанты центрифугируют при 10000×g в течение 20 мин при 4°С, и получают осадки Р2. Осадки Р2 ресуспендируют в смеси 200 мМ NaCl/50 мМ Na-K-фосфатный буфер, рН 7,4, и центрифугируют при 10000×g в течение 10 мин при 4°С. Такую промывочную процедуру повторяют дважды, и осадки ресуспендируют в 10 объемах буфера. Аликвоты (100 мкл) мембранных суспензий инкубируют с 3 нМ [35S]-TBPS и 5-мкл аликвотами испытываемого лекарственного средства, растворенного в диметилсульфоксиде (ДМСО) (конечная концентрация 0,5%), в присутствии 5 мкМ GABA. Смесь для инкубации доводят до конечного объема 1,0 мл буфером. Неспецифическое связывание определяют в присутствии 2 мкМ немеченого TBPS и в интервале от 15 до 25%. После 90-мин инкубации при комнатной температуре анализы обрывают фильтрацией через стеклянные фильтры (Schleicher and Schuell, № 32) с использованием харвестера (Brandel) и промывают три раза буфером, охлажденным льдом. Радиоактивность, связанную с фильтром, измеряют жидкостной сцинтилляционной спектрометрией. С использованием Prism (GraphPad) осуществляют подбор кривой по всем данным для каждого лекарственного средства, усредненных для каждой концентрации. Данные подбирают для частичной модели ингибирования вместо полной, если сумма квадратов существенно меньше по F-критерию. Подобным образом, данные подбирают для двухкомпонентной модели ингибирования вместо однокомпонентной, если сумма квадратов существенно меньше по F-критерию. Концентрации испытываемого соединения, вызывающие 50% ингибирование (IC50) специфического связывания и максимальную степень ингибирования (Imax), определяют для отдельных экспериментов с той же моделью, которую используют для всех данных, и затем вычисляют среднее±SEM в отдельных экспериментах. В качестве положительного контроля для таких исследований служит пикротоксин, так как показано, что он устойчиво ингибирует связывание TBPS.
Различные соединения скринируют или можно скринировать in vitro для определения их потенциала как модуляторов связывания [35S]-TBPS. Такие анализы можно выполнять в соответствии с описанной выше процедурой.
Электрофизиология пэтч-кламп рекомбинантных рецепторов α1β2γ2 и α4β3δ GABAA
Используют электрофизиологию клеток для измерения фармакологических свойств модуляторов рецепторов GABAA по изобретению в гетерологичных клеточных системах. Каждое соединение испытывают на его способность воздействовать на опосредуемые GABA токи при субмаксимальной дозе агониста (EC20 GABA=2 мкм). Клетки LTK устойчиво трансфицируют субединицами α1β2γ2 рецептора GABA, а клетки СНО временно трансфицируют субъединицами α4β3δ методом с липофектамином. Клетки пассируют при слиянии примерно 50-80% и высевают в 35-мм стерильные чашки для культивирования, содержащие 2 мл полной культуральной среды без антибиотиков или фунгицидов. Конфлюентные кластеры клеток связаны электрически (Pritchett et al., Science, 1988, 242, 1306-1308). Поскольку реакции в отдаленных клетках не являются адекватно фиксированным потенциалом, и из-за неопределенностей в степени фиксации (Verdoorn et al., Neuron, 1990, 4, 919-928), клетки культивируются при плотности, которая позволяет регистрировать отдельные клетки (без видимых связей с другими клетками).
Токи целых клеток измеряют с помощью амплификатора HEKA EPC-10 с использованием программы PatchMaster или используя высокопроизводительную платформу QPatch (Sophion). Раствор электролита для всех экспериментов содержит (в мМ) 137 мМ NaCl, 4 мМ KCl, 1,8 мМ CaCl2, 1 мМ MgCl2, 10 мМ HEPES, 10 мМ D-глюкозы, pH (NaOH) 7,4. В некоторых случаях также добавляют 0,005% кремофора. Внутриклеточный (пипетка) раствор содержит 130 мМ KCl, 1 мМ MgCl2, 5 мМ Mg-ATФ, 10 мМ HEPES, 5 мМ EGTA, pH 7,2. Во время экспериментов клетки и растворы поддерживают при комнатной температуре (19°С-30°С). В случае ручной регистрации потенциала фиксации чашки с клеточными культурами помещают на чашкодержатель микроскопа и непрерывно заливают (1 мл/мин) раствором электролита. После образования гигаомной изоляции между пэтч-электродами и клеткой (интервал сопротивления в пипетке 2,5 MОм - 6,0 MОм; интервал сопротивления изоляции >1 ГОм) клеточную мембрану на кончике пипетки разрывают для обеспечения электрического доступа внутрь клетки (пэтч-конфигурация «целая клетка»). В случае экспериментов с использованием системы QPatch клетки переносят в виде суспензии в систему QPatch в растворе электролита и выполняют автоматическую регистрацию целых клеток.
В клетках фиксируют напряжение при исходном потенциале -80 мВ. Для анализа испытываемых изделий рецепторы GABA стимулируют 2 мкМ GABA после последовательной преинкубации возрастающих концентраций испытываемого изделия. Длительность преинкубации составляет 30 с, и длительность стимула GABA составляет 2 с. Испытываемые изделия разбавляют до 0,01, 0,1, 1 и 10 мкМ в растворе электролита. Все концентрации испытываемых изделий испытывают на каждой клетке. Относительную потенциацию в процентах определяют как максимальную амплитуду в ответ на GABA ЕС20 в присутствии испытываемого изделия, деленную на максимальную амплитуду в ответ на одну GABA ЕС20, умноженную на 100.
Утрата рефлекса выпрямления у крыс
Фармакокинетику в плазме и качественную оценку седативного действия получают на самцах крыс Sprague-Dawley согласно следующей процедуре. Крысам через дорсальную вену стопы дают внутривенно болюсную дозу (60 секунд) в дозах, колеблющихся от 5 до 15 мг/кг, в соответствующей среде. Для того, чтобы оценить седативное действие, крыс осторожно придерживают руками в положении лежа на боку для введения дозы. Если во время введения дозы наблюдают пониженный мышечный тонус, сдерживание постепенно ослабляют. Если животное неспособно вернуться в выпрямленное положение, регистрируют время до начала утраты рефлекса выпрямления (LRR). В случае, когда LRR не происходит во время дозирования, животных оценивают через 5-минутные интервалы после помещения в дорсальное лежачее положение. Вялое или неполное выпрямление два раза подряд в пределах 30-секундного интервала оценивают как утрату рефлекса выпрямления. После появления LRR животных оценивают каждые 5 минут таким же способом. Восстановление рефлекса выпрямления определяют как способность крысы выпрямляться самой полностью в пределах 20 секунд, будучи помещенной в дорсальное лежачее положение. Длительность LRR определяют как промежуток времени между LRR и возвращением рефлекса выпрямления.
Метод с острым PTZ
Противосудорожное действие испытываемых соединений оценивают на мышах в анализе припадка, вызванного пентилентетразолом, схоже со способами, описанными в Giardina & Gasior (2009), Curr. Protoc. Pharmacol., глава 5. Самцов мышей CD-1 размещают в группах по пять особей в регулируемых условиях (температура 22±2°С, цикл чередования света и темноты 12:12, свет включают в 8:00 утра) и доступе к воде и корму ad libitum. Мышей размещают за 1 неделю до поведенческого тестирования, и в это время они весят 25-35 г. Пентилентетразол (PTZ, Sigma) растворяют в стерильном 0,9% физиологическом растворе в концентрации 12 мг/мл для подкожного введения. Испытываемые соединения подготавливают и вводят через орально-гастральный зонд или интраперитонеальной инъекцией в предварительно установленное время (типично, за 30 или 60 минут) до инъекции PTZ. Все растворы готовят свежими и дают в объеме 10 мл/кг массы тела.
Мышей выдерживают в испытательной камере в течение по меньшей мере 30 мин до введения соединения. Мышей произвольно распределяют по меньшей мере в четыре испытательные группы (среда и по меньшей мере три дозы испытываемого соединения) по 10 мышей на группу. После введения соединения мышей наблюдают на предмет качественной оценки седативного действия в предварительно установленное время (30 или 60 минут). В предварительно установленное время после лекарственного средства мышам инъецируют s.с. PTZ (120 мг/кг). Сразу же после инъекции PTZ мышей размещают по одной в камеру для наблюдения и включают трехканальный таймер. За каждой мышью наблюдают в течение 30 мин, и наблюдатели, связанные с обработками, регистрируют следующие параметры поведения: 1) латентность клонических судорог, которые сохраняются в течение 3 с, с последующим отсутствием рефлекса выпрямления; 2) латентность тонических судорог, характеризующихся жестким выпрямлением всех четырех конечностей, которые превышают угол в 90 градусов с корпусом; 3) латентность до гибели; 4)число клонических и тонических судорог. Данные представляют как среднее±S.E.М., и используют однофакторный дисперсионный анализ с апостериорным критерием Даннета или Бонферрони для детекции значимых различий в латентности и числе между группой среды и группой дозы. Величины р<0,05 рассматривают как статистически значимые.
Таблица 1. Связывание TBPS соединениями-примерами.
В таблице 1 «А» показывает IC50 1 нМ - 50 нМ, «В» показывает IC50 >50 нм - 100 нМ, «С» показывает IC50 >100 нМ - 100 нМ, и «D» показывает IC50>500 нМ.
Таблица 2. Электрофизиологическая оценка соединений-примеров в GABAA-R.
В таблице 2% эффективности рецепторов GABAA α1β2γ2 и α4β3δ: «А» - 10-100, «В» >100-500, «С» >500; D показывает, что результат недоступен или не определен, * в кремофоре.
Таблица 3. Утрата рефлекса выпрямления (крыса, IV, 5 мг/кг)
A≤20 мин; B>20 мин
LRR: утрата рефлекса выпрямления
Таблица 4. Минимальные эффективные противосудорожные дозы определены как наименьшие дозы, которые значимо снижают латентность тонических приступов у мышей, обработанных PTZ
A≤1 мг/кг; B>1-3 мг/кг; C>3 мг/кг; PO - пероральное введение; IP - интраперитонеальная инъекция.
Другие воплощения
В формуле изобретения артикли единственного и множественного числа могут обозначать один или более одного, если не указано противоположное или иное, очевидное из контекста. Пункты формулы изобретения или описания, которые включают «или» между одним или несколькими членами группы, считаются удовлетворительными, если одни, более одного или все члены группы присутствуют в, используются в или иначе соотносятся с данным продуктом или способом, если не указано противоположное или иное, очевидное из контекста. Изобретение включает воплощения, в которых именно один член группы присутствует в, используется в или иначе соотносится с данным продуктом или способом. Изобретение включает воплощения, в которых более одного или все члены группы присутствуют в, используются в или иначе соотносятся с данным продуктом или способом.
Кроме того, изобретение охватывает все варианты, комбинации и преобразования, в которых одно или больше ограничений, элементов, условий и описательных терминов из одного или нескольких перечисленных пунктов включены в другой пункт. Например, любой пункт, который зависит от другого пункта, может быть модифицирован для включения одного или нескольких ограничений, заложенных в любом другом пункте, который зависит от того же самого основного пункта. Когда элементы присутствуют в виде перечней, например, в формате группы Маркуша, каждая подгруппа элементов также раскрывается, и любой(ые) элемент(ы) может(могут) быть удален(ы) из группы. Это следует понимать, как правило, так, что когда изобретение или аспекты изобретения упоминаются как включающие определенные элементы и/или особенности, некоторые воплощения изобретения или аспектов изобретения состоят или состоят по существу из таких элементов и/или особенностей. В целях упрощения такие воплощения в настоящем описании не изложены конкретно in haec verba. Также отмечается, что термины «включающий» и «содержащий» предполагаются открытыми и допускают включение дополнительных элементов или стадий. Когда приводятся интервалы, конечные точки включаются. Кроме того, если не указано иное или иное не очевидно из контекста и суждения специалиста в данной области техники, величины, которые выражены как интервалы, могут допускать любую конкретную величину или подинтервал величин в пределах установленных интервалов в различных воплощениях изобретения, до одной десятой единицы нижнего предела интервала, если контекст четко не указывает иное.
В заявке имеются ссылки на различные выданные патенты, опубликованные заявки на патент, журнальные статьи и другие публикации, которые все включены в настоящее описание в качестве ссылок. Если имеется противоречие между любой из включенных ссылок и настоящим описанием, контролем будет описание. Кроме того, любое определенное воплощение настоящего изобретения, которое попадает в рамки известного уровня техники, может быть недвусмысленно исключено из любого одного или нескольких пунктов формулы изобретения. Поскольку такие воплощения считаются известными специалисту в данной области техники, они могут быть исключены даже если исключение не установлено недвусмысленно в настоящем описании. Любое определенное воплощение изобретения может быть исключено из любого пункта по любой причине, связана она или нет с наличием известного уровня техники.
Специалисты в данной области техники выяснят или способны выяснить с использованием самых обычных экспериментов многие эквиваленты для конкретных воплощений, описанных в настоящем описании. Не предполагается, что объем воплощений настоящего изобретения ограничивается описанным выше описанием, но установлен в прилагаемой формуле изобретения. Специалистам в данной области техники будет понятно, что можно осуществить различные изменения и модификации для настоящего описания без отхода от сущности или объема настоящего изобретения, определенного в следующей далее формуле изобретения.
Реферат
Изобретение относится к соединению формулы (I), в котором А выбирают из группы,,,и; Rпредставляет собой -CH, -CHF, -CHF, -CHCH, -CHOCHили -CHOCHCH; Rи Rвыбирают независимо из -H, галогена, -CH, -OCHили -OCHCH; Rпредставляет собой -CF, циано, -CH, -C(O)ORили -C(O)NRR; Rпредставляет собой -H, или (C-C)алкил; каждый Rи Rпредставляет собой независимо H; и n равен целому числу от 0 до 1; или когда A представляет собой (A-3) или (A-5), Rпредставляет собой -CН, -CHF, -CHОCНили -CHF, и n равен 0, тогда по меньшей мере один из Rи Rне является H. Изобретение также относится к индивидуальным соединениям, к фармацевтической композиции, к способу лечения расстройства, связанного с ЦНС, связанного с функцией GABA, к способу лечения припадка, к способу лечения эпилепсии, к способу лечения эпилептического статуса. Технический результат: получены новые соединения формулы (I), обладающие свойствами модулятора GABA, которые могут быть полезны при лечении расстройства, связанного с ЦНС. 9 н. и 23 з п. ф-лы, 71 пр., 4 табл., 22 ил.H(I)
Формула


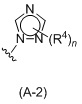




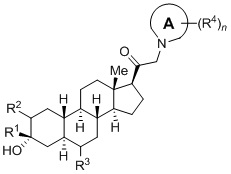



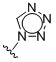
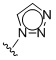
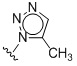





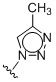




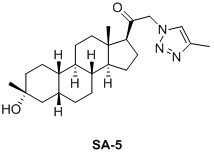

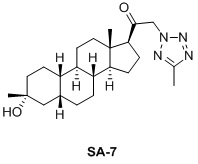






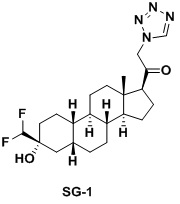


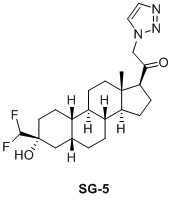

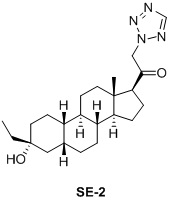


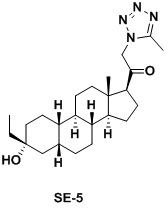

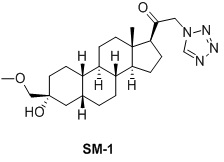






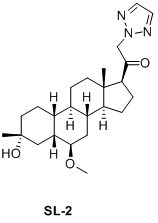





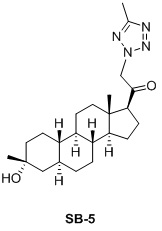



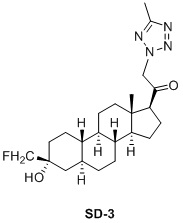


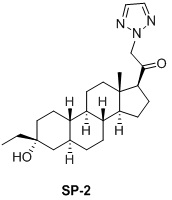

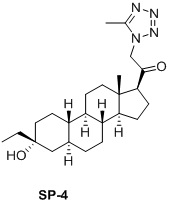


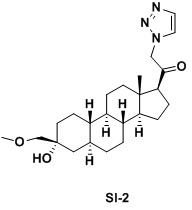

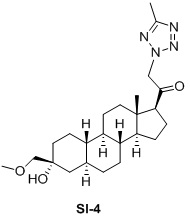
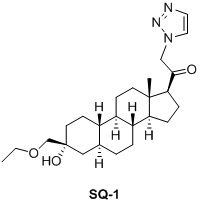


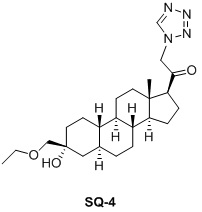

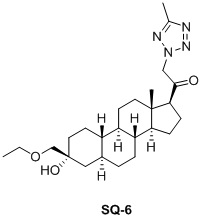


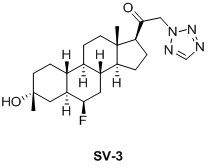







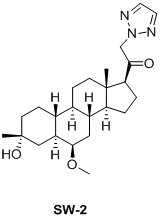






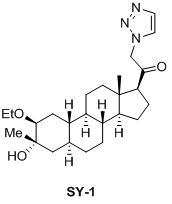













Документы, цитированные в отчёте о поиске
3альфа-гидрокси-3бета-метоксиметил-21-гетероцикл-замещенные стероиды, фармацевтическая композиция, способ облегчения или профилактики бессонницы или погружения в наркоз

Комментарии