Антиандрогенные соединения, предшественник антиандрогенного соединения, фармацевтические композиции - RU2141966C1
Код документа: RU2141966C1
Чертежи












Описание
Изобретение относится к новым ингибиторам активности половых стероидных гормонов, таких как антиандрогенные соединения, которые оказывают эффективное антагонистическое воздействие и при этом практически лишены агонистических свойств. В частности, некоторые предпочтительные способы осуществления изобретения относятся к определенным аналогам тестостерона, которые обладают высоким сродством к рецепторам андрогена, но не активизируют указанные рецепторы. Некоторые антиандрогены могут также ингибировать воспроизводство половых стероидных гормонов или их предшественников.
В процессе лечения некоторых андрогензависимых болезней важным является уменьшить или по возможности устранить вызываемые андрогеном эффекты. Для этого желательно не только блокировать доступ к рецепторам андрогена с помощью "антиандрогенов", препятствуя андрогенам связываться с указанными рецепторами и активировать их, но и снизить концентрацию андрогенов, способных активировать рецепторы. Свободные рецепторы андрогена, даже в отсутствие андрогена, могут быть биологически активными. По этой причине антиандрогены, которые связываются и блокируют рецепторы, могут дать лучшие терапевтические результаты, чем лечение, которое лишь приводит к подавлению воспроизводства андрогенов.
Антиандрогены могут оказать значительное терапевтическое воздействие, замедляя или останавливая течение андрогензависимых заболеваний, в частности заболеваний, возникновению или развитию которых способствует активация рецепторов андрогена.
Желательно, чтобы антиандроген, используемый в лечении для снижения активности рецепторов андрогена, не только обладал бы хорошим сродством к рецептору андрогена, но и не проявлял бы заметную потенциальную андрогенную активность. Первое относится к способности антиандрогена связываться с рецептором андрогена, блокируя тем самым доступ андрогенов к рецептору. Последнее относится к тому воздействию, которое антиандроген оказывает на рецептор, как только он с ним связывается. Некоторые антиандрогены могут обладать потенциальной андрогенной активностью ("агонистическая активность"), которая приводит к нежелательной активации тех самых рецепторов андрогена, активность которых они должны подавлять. Другими словами, антиандрогены с потенциальной андрогенной активностью могут успешно присоединяться к рецепторам андрогена, блокируя доступ к указанным рецепторам природных андрогенов, что является полезным, однако сами же могут активировать рецептор, что нежелательно.
У известных нестероидных антиандрогенов, таких как флутамид и анандрон, нежелательная андрогенная активность отсутствует, однако их сродство к рецептору может оказаться хуже, чем у стероидных антиандрогенов (т.е. производных андронов, имеющих стероидное ядро, которое модифицируют таким образом, чтобы придать соединению антиандрогенные свойства). Однако, как полагают, стероидные антиандрогены с большей вероятностью могут обладать нежелательными агонистическими свойствами.
В заявке, опубликованной 24 января 1991 под номером Международной патентной публикации WO 91/00732, заявители описывают новые стероидные антиандрогены, в том числе соединения со стероидным ядром, содержащим новые заместители в положении 17α. Опубликованная заявка включает 17α- галоалкинильные заместители. Примеры многочисленных 17α- иодоалкинильных заместителей, изменяющихся от иодопентинила до иодододецинила, представлены в примерах. Как рассматривается подробно далее, было показано, что общую эффективность антиандрогенных соединений можно значительно увеличить, если тщательно контролировать размер, конфигурацию и идентичность 17α- заместителя и, в частности, путем ограничения его размера, как это описано и заявлено в указанной заявке. Определенные нортестостероновые соединения с определенными 17α -галоалкильными боковыми цепями, использовали в различных и нефармацевтических целях Салмоном и др. ((1) J. Steroid Biochem., Vol. 33, N 1, pp. 25-31 (1989) и (2) J. Steroid Biochem., Vol. 26, N 3, pp. 383-91 (1987)).
В Международной патентной публикации WO 92/057963 приводятся некоторые 16,16-дизамещенные андростеновые производные для лечения андрогензависимых заболеваний кожи.
В Европейской патентной публикации 0435321 описываются некоторые 17-замещенные производные A-норстероид-3-карбоновой кислоты для использования при ингибировании активности 5α-редуктазы млекопитающих.
Целью настоящего изобретения являются улучшенные антиандрогены, обладающие хорошим сродством к рецептору андрогенов и при этом практически лишенные андрогенной активности. Указанные антиандрогены могут быть полезны при лечении андрогензависимых заболеваний, что подробно рассматривается далее.
Первым аспектом настоящего изобретения
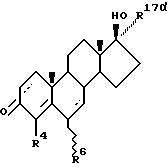
является антиандрогенное соединение, имеющее структурную формулу (I):

где пунктирные линии обозначают необязательно пи-связи;
R4 обозначают атом водорода или метил;
R6 обозначает атом водорода, метил, этил или атом галогена;
а R17α выбирают из группы, включающей:
A) ненасыщенный углеводородный фрагмент, содержащий по крайней мере один атом углерода, отделенный от D-кольца молекулярной формулы (I) по крайней мере тремя промежуточными атомами углерода, отделенного от указанного D-кольца молекулярной формулы (I), более, чем четырьмя промежуточными атомами.
B) галогензамещенный ненасыщенный
углеводородный фрагмент, содержащий по крайней мере один атом галогена, отделенный от указанного D-кольца по крайней мере тремя промежуточными атомами, и не одержащий атома углерода, отделенного от
указанного D-кольца молекулярной формулы (I), более, чем четырьмя промежуточными атомами и
C) галогеналкильный фрагмент, содержащий по крайней мере один атом галогена, отделенный от
указанного D-кольца по крайней мере тремя промежуточными атомами, и не содержащий атома углерода, отделенного от указанного D-кольца молекулярной формулы (I), более, чем четырьмя, промежуточными
атомами.
Другим аспектом настоящего изобретения является предшественник лекарственного средства, который в условиях in vivo превращается в вышеуказанное соединение.
Еще
одним аспектом настоящего изобретения является антиандрогенное соединение, имеющее структурную формулу (I):

где пунктирные линии обозначают необязательно пи-связи;
R4 обозначают атом водорода или метил;
R6 обозначает атом водорода, метил, этил или атом галогена;
а R17α выбирают из группы, включающей:
A) ненасыщенный углеводородный фрагмент, содержащий по крайней мере один атом углерода, отделенный от D-кольца молекулярной формулы (I) по крайней мере тремя промежуточными атомами углерода, и не содержащий атома углерода, отделенного от указанного D-кольца молекулярной формулы (I), более чем четырьмя промежуточными атомами.
B) галогензамещенный ненасыщенный углеводородный фрагмент, содержащий по крайней мере один атом галогена, отделенный от указанного D-кольца по крайней мере
тремя промежуточными атомами, и не содержащий атома углерода, отделенного от указанного D-кольца молекулярной формулы (I), более чем четырьмя, промежуточными атомами и
C) галогеналкильный
фрагмент, содержащий по крайней мере один атом галогена, отделенный от указанного D-кольца по крайней мере тремя промежуточными атомами, и не содержащий атома углерода, отделенного от указанного
D-кольца молекулярной формулы (I), более чем четырьмя, промежуточными атомами, при условии, что R17α не является группой

если R4 и R6 оба обозначают атом водорода. По другому аспекту R17α не является группой

не зависимо от идентичности R4 и R6.
Следующим аспектом изобретения являются фармацевтические композиции для местного и общего назначения, содержащие антиандрогены по настоящему изобретению вместе с фармацевтически приемлемыми разбавителями или носителями.
По следующему аспекту изобретения новые антиандрогены или содержащие их фармацевтические композиции используют при лечении или предотвращении андрогензависимых заболеваний кожи, таких как угри, избыточное оволосение у женщин, себорея, андрогенное облысение, преждевременное облысение у мужчин и т.п.
По следующему аспекту изобретения они используются при лечении или предотвращении андрогензависимых системных заболеваний, таких как рак предстательной железы или доброкачественная гиперплазия предстательной железы.
Если специально не оговаривается, заместители в стероидных ядрах антиандрогенов по настоящему изобретению могут иметь альфа- или бета-стереохимию. Необязательные пи-связи, обозначенные пунктирными линиями в структурной формуле, не зависят от любых связей, которые могут возникать в структуре, при этом наличие одной из них не зависит от присутствия или отсутствия другой, если их взаимозависимость не определяется требованиями валентности. Рассматриваемые соединения могут использоваться в виде предшественника лекарственного средства, которое может в условиях in vivo превращаться в требуемое активное соединение. Атомы стероидных ядер, для которых не указано никаких заместителей, могут быть далее необязательно замещены (если позволяют требования валентности), при условии, что подобные заместители не оказывают значительного и негативного воздействия на средство соединений к рецептору андрогенов и не делают соединения значительно более андрогенными.
Термин "низший" при описании химических фрагментов означает в данном случае фрагмент, содержащий не более 8 атомов. Например, "низший алкил" означает (C1-C8)алкил. Любой фрагмент, содержащий более двух атомов, может иметь, если специально не оговаривается, прямую или разветвленную цепь.
Антиандрогены и содержащие их фармацевтические композиции могут использоваться в соответствии с настоящим изобретением при лечении антиандрогензависимых заболеваний, развитию которых способствует активирование рецепторов андрогенов, в частности, рака предстательной железы и доброкачественной гиперплазии предстательной железы, угрей, избыточного оволосения у женщин, себореи, андрогенного облысения, преждевременного облысения у мужчин и т.п.
17α- Заместитель у антиандрогенов по настоящему изобретению может быть как разветвленным, так и с прямой цепью. Наиболее длинная цепочка преимущественно содержит 4-5 атомов углерода, при этом предпочтительными являются фрагменты с прямой цепью. Предпочтительными являются также ненасыщенные фрагменты, такие как галогензамещенные фрагменты. Ненасыщенные фрагменты преимущественно являются ненасыщенными в положениях α,β у D - кольца стероида. Предпочтительными являются иодзамещенные 17α фрагменты (в частности, EM 250, см. далее).
Галогензамещенные фрагменты могут содержать атом галогена более чем в
одном положении. Аналогично ненасыщенные фрагменты могут быть ненасыщенными в нескольких местах, например, -C ≡ C-CH=CH2. Необязательная двойная связь преимущественно располагается в
4-положении A-кольца стероида. Предпочтительные заместители R17α являются, но не ограничиваются, бутинилом, бутенилом, пентинилом, пентенилом, галобутинилом, галобутенилом,
галопентинилом, галопентенилом, галобутилом и галопентилом. Другими предпочтительными фрагментами являются, но не ограничиваются, CH2CH2CH=CHX и

где R100 выбирают из группы, включающей атомы водорода, фтора, хлора, брома и иода, n обозначает 2 или 3, а пунктирная линия обозначает необязательную пи-связь. Наиболее предпочтительными являются галобутинил и галобутенил.
Наиболее предпочтительным антиандрогеном для местного назначения является EM-250, т. к. полагают, что он не оказывает системного антиандрогенного воздействия несмотря на то, что обладает значительным антиандрогенным воздействием при местном использовании. Таким образом, ожидается, что случайное проникновение через кожу, которое возможно при местном назначении EM-250, не вызовет нежелательное системное воздействие.
Еще одним аспектом
настоящего изобретения является предшественник лекарственного средства, который в условиях in vivo превращается в соединение:
где пунктирные линии обозначают необязательно пи-связи;
R4 обозначают атом водорода или метил;
R6 обозначает атом водорода, метил, этил или атом галогена;
а R17α выбирают из группы, включающей:
A) ненасыщенный углеводородный фрагмент, содержащий по крайней мере один атом углерода, отделенный от D-кольца молекулярной формулы (I) по крайней мере тремя промежуточными атомами углерода, и не содержащий атома углерода, отделенного от указанного D-кольца молекулярной формулы (I), более чем четырьмя промежуточными атомами.
B) галогензамещенный ненасыщенный углеводородный фрагмент, содержащий по крайней мере один атом галогена, отделенный от указанного
D-кольца по крайней мере тремя промежуточными атомами, и не содержащий атома углерода, отделенного от указанного D-кольца молекулярной формулы (I), более чем четырьмя промежуточными атомами и
C) галогеналкильный фрагмент, содержащий по крайней мере один атом галогена, отделенный от указанного D-кольца по крайней мере тремя промежуточными атомами, и не содержащий атома углерода, отделенного
от указанного D-кольца молекулярной формулы (I), более чем четырьмя промежуточными атомами.
Известно много модификаций химических фрагментов в активных соединениях, такие как
гидроксильная или кетонная группа, которые приводят к получению форм предшественников, при этом указанные формы предшественника лекарственного средства способны в условиях in vivo превращаться в
активное соединение, например, за счет гидролиза, ферментативного катализа и т.п. Предпочтительные формы предшественника лекарственного средства в соответствии с настоящим изобретением имеют
заместитель в 3-положении стероидного ядра, который in vivo превращается в 3-кето-группу. Среди преимущественных 3-заместителей предпочтительных форм предшественников лекарственного средства выбирают
заместитель из группы замещенных или незамещенных фрагментов, включающий:

Как подробнее рассматривается далее, помещая конкретные указанные заместители в 3-положение, можно вызвать смещение двойных стероидных связей, получая предпочтительный предшественник лекарственного средства формулы:

В процессе использования 3-положение вновь превращается в =O, а двойная связь смещается обратно, что приводит к образованию предпочтительного активного андрогена.
Ниже вместе с предпочтительными методами синтеза приводятся некоторые не ограничивающие изобретение примеры предпочтительных активных соединений и их предпочтительных модификаций в виде предшественников лекарственного средства.
Пример 1
Синтез 17α_
(4'-хлорбутинил)-17β_гидрокси-4-андростен-3-она (EM 248)
Этот синтез представлен схемой 1
Тиокеталь 2
К раствору тестостерона 1 (288,43 г, 1,0 моль) (получают
от компании "Schering A. G.", Германия) в ледяной уксусной кислоте (2,5 л) при 10oC добавляют этандитиол (85 мл, 1,06 моль) и эфират трехфтористого бора (800 мл). Смесь перемешивают при
указанной температуре в течение 1 часа и выливают в лед (2 кг). Из водной фазы выделяют белый порошок, который извлекают фильтрованием, промывают водой (2 х 2 л) и сушат на воздухе.
Перекристаллизацией из метанола получают чистый тиокеталь 2. Выход: 328,28 г (90%). Синтез1H ЯМР δ (хлороформ-d, 300 МГц, TMC): 0,74 (синглет, 3H, 18-CH3), 1,03 (синглет,
3H, 19-CH3), 3,14 - 3,42 (мультиплет, 4H, SCH2), 3,60 (триплет, J = 8,4 Гц, 17α H), 5,47 (синглет, 1H, C-4H).
Кетон 3
Способ А: Раствор тиокеталя
2 (182,3 г, 0,5 моль) в сухом дихлорметане (1,5 л) при комнатной температуре и при механическом перемешивании по каплям добавляют к раствору хлорхромата пиридиния (150 г, 0,7 моль), молекулярным ситам
3A (200 г) и ацетату натрия (25 г). По окончании добавления смесь перемешивают в течение 16 часов, а затем разбавляют диэтиловым эфиром (2 л) и отфильтровывают через слой силикагеля на воронке с
фильтрующим дном. Фильтрат упаривают в вакууме и полученное твердое вещество перекристаллизовывают из метанола и получают чистый кетон 3. Выход: 158,7 г (87%). Спектр1H ЯМР δ
(хлороформ-d, 300 МГц, TMC): 0,86 (синглет, 3H, 18-CH3), 1,02 (синглет, 3H, 19-CH3), 3,12 - 3,42 (мультиплет, 4H, SCH2), 5,49 (синглет, 1H, C-4H).
Способ Б: Тиокеталь 2 (182,3 г, 0,5 моль) растворяют в растворе N-окиси 4-метилморфолина (87,9 г, 0,75 моль) в сухом дихлорметане (1,5 л). Добавляют 200 г порошкообразных молекулярных сит 4A. Порциями по 1 г через каждые 5 минут добавляют катализатор - перрутенат тетрапропиламмония (6 г, 3,5% мольн). Исходные материалы вступают во взаимодействие в течение часа. Твердое вещество отделяют фильтрованием через небольшой слой силикагеля и 4-метилморфолин удаляют из фильтрата промыванием разбавленной соляной кислотой (1N). После сушки над сульфатом магния растворитель удаляют в вакууме. Полученный твердый остаток растворяют в минимальном (500 мл) количестве смеси этилацетат/четыреххлористый углерод (4/6). Раствор отфильтровывают через слой силикагеля, элюируя смесью того же состава. Упаривая растворитель и высушивая, получают кетон 3 (137 г, вход 75%).
Эфир тетрагидропиранила 4
К раствору метиллития (500 мл 1,4 молярного раствора в эфире, 0,7 моль) в 1 л
безводного тетрагидрофурана в 5-литровой круглодонной колбе при температуре минус 30oC в атмосфере аргона добавляют по каплям 2-(3-бутинилокси)тетрагидро-2H-пирана (112,5 г, 0,729 моль). По
окончании прибавления охлаждающую баню убирают и оставляют раствор при комнатной температуре на 4 часа. Вновь охлаждают раствор до минус 30oC и по каплям добавляют раствор кетона 3 (75 г, 0,
2 моль) в 2,5 л безводного тетрагидрофурана. По окончании прибавления охлаждающую баню убирают и оставляют раствор при комнатной температуре на 16 час. К полученной смеси добавляют 100 мл насыщенного
раствора соли и разбавляют этилацетатом, органическую фазу промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель упаривают и через некоторое время продукт
кристаллизуется. Для полноты осаждения добавляют гексан. Твердое вещество отфильтровывают и промывают гексаном. Соединение 4 используют без дальнейшей очистки на следующей стадии. Выход: 95,8 г (90%).
Спектр1H ЯМР δ (хлороформ-d, 300 МГц, TMC): 0,82 (синглет, 3H, 18-CH3), 1,01 (синглет, 3H, 19-CH3), 2,52 (триплет, 2H, J = 6,8 Гц, CCCH2), 3,15 - 3,
44 (мультиплет, 4H, SCH2), 3,50 - 3,56 (мультиплет, 2H, CH2OTHP), 3,75 - 3,90 (мультиплет, 2H, пирановый OCH2), 4,66 (синглет, 1H, OCHO), 5,47 (синглет, 1H, C-4H).
Спирт 5
Смесь соединения 4 (100 г, 0,19 моль) и иодистого метила (250 мл, 3,8 моль) в 96%-ном этаноле (2,5 л) кипятят с обратным холодильником в течение 16 часов. Растворитель
удаляют в вакууме и сырую смесь разбавляют этилацетатом (2,5 л). Органическую фазу промывают 3%-ным раствором едкого натра (3 х 50 мл) и сушат над сульфатом магния. Растворитель упаривают, твердое
вещество промывают диэтиловым эфиром, отфильтровывают через воронку с фильтрующим дном и вновь промывают диэтиловым эфиром. Соединение 5 можно использовать без дальнейшей очистки на следующей стадии:
получено 45,5 г (выход 66%); небольшой образец перекристаллизовывают из смеси этилацетата и гексана и получают: т.пл. 179-181oC; спектр1H ЯМР δ (хлороформ-d, 300 МГц,
TMC): 0,85 (синглет, 3H, 18-CH3), 1,17 (синглет, 3H, 19-CH3), 2,45 (триплет, 2H, J = 6,0 Гц, CCCH2), 3,70 (триплет, 2H, J = 6,1 Гц, CH2OH), 5,41 (синглет,
1H, C-4H).
17α_(4'-хлорбутинил)-17β_гидрокси-4-андростен-3-он (EM 248)
Смесь спирта 5 (15 г, 0,04 моль), трифенилфосфина (21 г, 0,08 моль) и
четыреххлористого углерода (9,3 г, 0,06 моль) кипятят в течение 10 часов с обратным холодильником в 1 л безводного дихлорметана. Растворитель упаривают, сырую смесь переносят на силикагель и
полученный гель хроматографируют методом испарительной тонкослойной хроматографии, элюируя смесью эфир-гексан (70: 30). Соединение затем перекристаллизовывают из диэтилового эфира. Выход 85%; т. пл.
120-121oC; спектр1H ЯМР


Пример 2
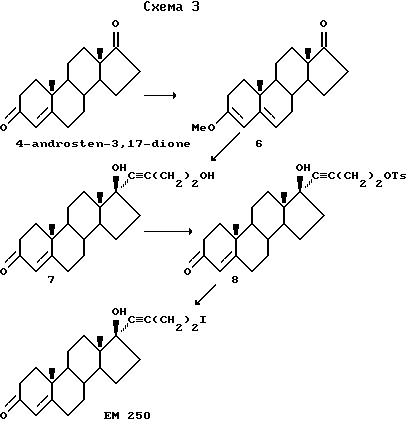
Синтез 17α-(4'-иодбутинил)-17β-гидрокси-4-андростен-3-она (EM 250)
Синтез A
К смеси трифенилфосфина (7,87 г, 30 ммоль) и иода (7,61 г, 30 ммоль) в сухом дихлорметане (500 мл) при комнатной температуре добавляют имидазол (2,04 г, 30 ммоль). Через небольшой промежуток времени выделяется твердое вещество. После этого при комнатной температуре добавляют спирт 5 (7,13 г, 20 ммоль). Перемешивают смесь в течение 30 минут, раствор разбавляют эфиром (100 мл) и образовавшееся твердое вещество отфильтровывают на воронке со стеклянным фильтрующим дном. Фильтрат упаривают и остаток очищают методом испарительной хроматографии на силикагеле, элюируя смесью диэтилового эфира и гексана (70/30). Соединение (EM 250) затем очищают перекристаллизацией из диэтилового эфира. Выход 6,34 г (68%); т.пл. 124,5-125,5oC; ИК спектр ν см-1 (KBr): 1611, 1653, 2873, 2948, 3380 и 3510; спектр1H ЯМР δ (хлороформ-d, 300 МГц, TMC): 0,86 (синглет, 3H, 18-CH3), 1,17 (синглет, 3H, 19-CH3), 2,80 (триплет, 2H, J = 7,1 Гц, CCCH), 3,21 (триплет, 2H, J = 7,1 Гц, CH2), 5,71 (синглет, 1H, C-4H); спектр13C ЯМР δ (хлороформ-d, 75, МГц, TMC): 2,5, 12,7, 20,8, 23,2, 23,9, 31,5, 32,7, 33,9, 35,7, 36,3, 38,6, 38,96, 46,8, 49,8, 53,5, 65,8, 79,8, 84,8, 85,7, 123,9, 171,2, 199,5: масс-спектр m/e: 467 (M+), 426, 369, 339, 321, 245, 149, 123, 105, 79 (100); масс-спектр высокого разрешения: вычислено для C23H31O2I: 466,1369; найдено: 466,1382; элементный анализ: вычислено: C 59,23; H 6,70; I 27,21; найдено: C 59,22; H 6,55; I 27,05 (схема 2).

Синтез Б
3-Метоксиандроста-3,5-диен-17-он (6)
К 4-андростен-3,17-диону (15 г, 52 ммоль) (получен от компании "Aldrich Chemical Company", Милуоки, штат Висконсин, США) в тетрагидрофуране (100 мл) добавляют триметоксиэтан (17 г, 156 ммоль) и моногидрат п-толуолсульфокислоты (450 мг, 2,37 ммоль). Смесь перемешивают в течение 2,5 часов и добавляют триэтиламин (2,1 мл, 2,37 ммол), а затем воду (4 мл). После удаления растворителя получают влажную массу желтого цвета, которую перемешивают в воде (100 мл) в течение 10 минут и отфильтровывают. Твердое вещество промывают водой (4 раза) и сушат при 80oC в высоком вакууме в течение 12 часов, получая целевой продукт (15,6 г, 100%). Спектр1H ЯМР δ (хлороформ-d, 300 МГц, TMC): 0,93 (синглет, 3H, 18-CH3), 0,99 (синглет, 3H, 19-CH3), 3, 57 (синглет, 3H, OCH3), 5,13 (синглет, 1H, C-4H), 5,25 (уширенный синглет, 1H, C-6H): спектр13C ЯМР δ (хлороформ-d, 75 МГц, TMC): 220,83, 155,36, 140,92, 117,31; 98,35, 54,20, 51,89, 48,38, 47,58, 35,78, 35,23, 33,68, 31,46, 31,41, 30,66, 25,18, 21,76, 20,44, 18,89, 13,61.
17β- Гидрокси-17α- (4'-гидроксибутинил)-4-андростен-3- он(7) н-Бутиллитий (7,9 мл, 19,78 ммоль) добавляют по каплям к смеси ди-изо-пропиламина (0,14 мл, 5% 19,98 ммоль) и 3-бутин-1-ол (1,5 мл, 19,98 ммоль) в ТГФ (30 мл) при температуре минус 40oC. Смесь перемешивают в течение 1 часа, а затем добавляют хлортриметилсилан (2,5 мл, 19,98 ммоль) и смесь перемешивают еще в течение часа (окончание реакции определяют методом ЯМР). По каплям добавляют н-бутиллитий (7,9 мл, 19,78 ммоль). Через 1 час добавляют стероид 6 (2 г, 6,6 ммоль) в ТГФ (35 мл) и смесь перемешивают в течение 90 минут (анализ по ТСХ показывает отсутствие исходного соединения) при температуре минус 40oC. Добавляют воду (30 мл) и концентрированную смоляную кислоту (3 мл) и кипятят с обратным холодильником в течение 1 часа (за протеканием реакции гидролиза наблюдают по ТСХ). Тетрагидрофуран удаляют и водный раствор экстрагируют хлористым метиленом (5 х 40 мл). Органические вытяжки объединяют, последовательно промывают насыщенными растворами бикарбоната натрия и соли. После сушки и удаления растворителя (сначала в вакууме водоструйного насоса, а затем в глубоком вакууме) получают сырой продукт (2,4 г), который перекристаллизовывают из смеси н-гексана и этилацетата (содержимое перед фильтрованием выдерживают в холодном помещении в течение 24 часов) и получают чистый продукт (2,01 г, 85%); спектр ПМР δ (хлороформ-d, 300 МГц, TMC): 0,84 (синглет, 3H, 18-CH3), 1,16 (синглет, 3H, 19-CH3), 3,14 (уширенный синглет, 1H, OH), 3,30 (синглет, 1H, OH), 3,68 (триплет, 2H, J = 5,87 Гц, CH2OH), 5,71 (синглет, 1H, С-4H); спектр13C ЯМР δ (хлороформ-d, 75 МГц, TMC): 199,58, 171,42, 123,48, 85,71, 82,69, 79,27, 60,75, 53,17, 49,59, 46,35, 38,64, 38,38, 35,96, 35,36, 33,62, 32,54, 32,39, 31,22, 22,87, 22,78, 20,47, 17,13, 12,58.
17β-Гидрокси-17α-(4'-тозилоксибутинил)-4-андростен-3- он (8)
В трехгорлую колбу, снабженную мешалкой и термометром, помещают
17α-гидрокси-17β-(4'-гидроксибутинил)-4-андростен-3-он (4,0 г, 11,22 ммоль) и пиридин (10,65 г, 134,64 ммоль). Охлаждают колбу до 0oC. При указанной температуре добавляют
п-толуолсульфохлорид (2,25 г, 12,34 ммоль) порциями в течение от 20 до 30 минут или с такой скоростью, чтобы температура ни в коем случае не поднималась выше 20oC. Затем перемешивают смесь
при комнатной температуре в течение 12 часов и разбавляют раствором 30 мл соляной кислоты в 70 мл воды. Водный раствор экстрагируют хлористым метиленом (3 х 100 мл). Органические вытяжки объединяют,
промывают насыщенным раствором соли и сушат. Растворитель удаляют при вакууме, создаваемом водоструйным насосом при 40oC, и получают твердое вещество, которое затем высушивают в глубоком
вакууме в течение 3 часов и получают 4,84 г (93%) продукта. Анализ с помощью1H ЯМР указывает на смесь тозилата (75%) и хлорида (25%). Спектр1H ЯМР

17α-(4'-иодбутинил)-17β-гидрокси-4-андростен-3-он (EM
250)
Полученную ранее смесь (2,2 г, 4,45 ммоль) и иодид натрия (1,33 г, 4,45 ммоль) в 2-бутаноле (12 мл) кипятят с обратным холодильником (при 100oC) в течение 12 часов (по
прошествии 1 часа ТСХ показывает полное
превращение тозилата в иодид, однако для конверсии хлорида в иодид необходимо 12 часов (ЯМР). После удаления растворителя получают остаток, который растворяют
в воде (50 мл) и экстрагируют хлористым метиленом (3 х 80 мл). Органические вытяжки объединяют, промывают 15%-ным водным раствором бисульфита натрия (80 мл), а затем насыщенным раствором соли и сушат.
Растворитель удалят при пониженном давлении при температуре 40oC и получают сырой продукт, который очищают на хроматографической колонне, элюируя смесью гексан/ацетон (4/1) и получают
чистый целевой продукт (1,95 г, 95%). Перекристаллизовывают из смеси гексана и ацетона и получают продукт, который идентичен соединению по п. А; т.пл. 124,5-125,5oC (схема 3).
Пример 3
Аналогично методикам, приведенным в Примерах 1 и 2, используя различные тетрагидропиранилоксиалкины и различные тетрагалоидные производные углерода в качестве алкилирующих агентов, получают следующие соединения, указанные в таблице 1.
Пример 4
Синтез 17β-гидрокси-17

При комнатной температуре в атмосфере аргона кетоенол 6 (300 мг, 1 ммоль) и хлорметилфенилсульфон (191 мг, 1 ммоль) в сухом тетрагидрофуране обрабатывают 1М раствором трет-бутоксида калия (1,3 мл). После того как все исходные вещества прореагируют, о чем судят по данным ТСХ, добавляют воду и экстрагируют эфиром, получая эпоксисульфон 9.
Неочищенный эпоксисульфон 9 (360 мг, 0,08 ммоль) в сухом тетрагидрофуране в течение 2 часов в атмосфере аргона при комнатной температуре обрабатывают трет-бутоксидом калия (890 мг, 8 ммоль) и водой (43 мг, 2,4 ммоль). После экстракции эфиром получают сырой гидроксимальдегид 10, который растворяют в смеси триэтиламина (10 мл), уксусного ангидрида (150 мкл) и 4-(диметиламино)пиридина (10 мг). Выдерживают под аргоном в течение нескольких дней и добавляют метанол, смесь перемешивают в течение 30 минут и упаривают в вакууме. Ацетоксиальдегид 11 экстрагируют эфиром и очищают методом испарительной хроматографии на силикагеле, элюируя смесью этилацетата и гексана.
Ацетоксиальдегид 11 (188 мг, 0,8 ммоль) в тетрагидрофуране добавляют под азотом в LiBr комплекс илида, полученного in situ из 3-бром-(тетрагидро-2'H-пиран-2'-ил)оксипропана, трифенилфосфина, бромида лития и н-бутиллития в том же растворителе при низкой температуре. Через несколько часов добавляют фениллитий (0,5 мл), затем трет-бутиловый спирт и раствор нагревают до тех пор, пока реакция не закончится. Приливают воду и аддукт 12 экстрагируют эфиром и очищают методом испарительной хроматографии на силикагеле, элюируя смесью этилацетата и гексана.
В атмосфере аргона при 0oC к раствору аддукта 12 (350 мг, 0,7 ммоль) в сухом тетрагидрофуране (5 мл) добавляют раствор трет-бутоксида калия (110 мг, 1 ммоль) в трет-бутиловом спирте. Перемешивают в течение 40 минут, выливают раствор в ледяную воду и экстрагируют этилацетатом. Остаток растворяют в метаноле (10 мл) и добавляют несколько капель концентрированной соляной кислоты. Кипятят смесь с обратным холодильником в течение 2 часов, упаривают в вакууме и экстрагируют этилацетатом. Кетодиол 13 очищают методом испарительной хроматографии на силикагеле, элюируя смесью этилацетата и гексана.
К смеси трифенилфосфина (196 г, 0,75 ммоль) и иода (190 мг, 0,75 ммоль) в сухом дихлорметане (10 мл) при комнатной температуре добавляют имидазол (51 г, 0,75 ммоль). Через небольшой промежуток времени выпадает осадок. Затем при комнатной температуре добавляют кетодиол 13 (234 мг, 0,5 ммоль), перемешивают смесь в течение 30 минут и разбавляют эфиром. Образовавшееся твердое вещество отфильтровывают. Фильтрат упаривают и хроматографируют на силикагеле, элюируя смесью эфира и гексана, и получают иодид EM 816 (схема 4).

Пример 5
Аналогично методикам, приведенным в Примере 4, используя различные бром (тетрагидро-2'H-пиран-2'-ил)оксиалканы или различные тетрагалоидные производные углерода вместо иода, получат следующие соединения, указанные в Таблице 2.
Пример 6
Синтез
17α-(4'-бромбут-1'(Z)-енил)-17β-гидрокси-4- андростен-3-она
Этот синтез поясняется Схемой 5.
Гидроксикеталь 14
Тестостерон (50 г, 0,17 моль) (получают
от фирмы "Schering A.G.", Германия) обрабатывают диэтиленгликолем (100 мл) в толуоле (1 л) в аппарате с насадкой Дина-Старка в присутствии каталитического количества п-толуолсульфокислоты (1 г) при
кипячении с обратным холодильником в течение 16 часов. После охлаждения добавляют эфир, органическую фазу отделяют, промывают насыщенным водным раствором бикарбоната натрия и водой, сушат и упаривают,
получая гидроксикеталь 14.
Кетокеталь 15
К гидроксикеталю 14 (40 г, 0,12 моль) в сухом хлористом метилене (1 л) добавляют дихромат пиридиния (90 г, 0,24 моль) и оставляют
смесь на ночь перемешиваться при комнатной температуре, а затем отфильтровывают через предварительно обработанный 1%-ным триэтиламином силикагель, элюируя смесью этилацетата и гексана.
Бутинил-аддукт 16
В осушенную пламенем горелки колбу в атмосфере аргона помещают (тетрагидро-2'-H-пиран-2'-ил)оксибутин (77 г, 0,5 моль) и безводный тетрагидрофуран (1 л). Раствор охлаждают
до минус 78oC, добавляют 2,5 раствор н-бутиллития (200 мл) и перемешивают раствор при указанной температуре в течение 2 часов. Затем добавляют кетокеталь 15 (33 г, 0,1 моль) в
тетрагидрофуране (1 л). Через два часа приливают воду и дают смеси нагреться до комнатной температуры. Раствор упаривают в вакууме и остаток экстрагируют эфиром. Органическую фазу промывают водой,
сушат и упаривают. Остаток очищают на силикагеле, используя в качестве элюента смесь этилацетата и гексана.
Z-Бутенил-аддукт 17
К бутинил-аддукту 16 (43,7 г, 0,09 моль),
растворенному в 500 мл сухого ацетона и 120 мл сухого пиридина, добавляют отравленный свинцом 5%-ный палладий на карбонате кальция (4 г) катализатор Линдлара, получают от фирмы "Aldrich Chemical
Company", Милуоки, штат Висконсин, США). После трех продувок водородом смесь перемешивают в атмосфере водорода в течение по крайней мере 15 минут и отфильтровывают на целите. Твердое вещество
промывают смесью метанола и хлористого метилена и растворитель упаривают. Остаток очищают методом тонкослойной испарительной хроматографии на силикагеле, элюируя смесью этилацетата и гексана.
17α-(4'-Бромбут-1'(z)-енил)-17β-гидрокси-4-андростен-3-он (18)
По методике, описанной А.Вагнером и др. (Tetrahedron Letters 30, 557-558, 1989)
тетрагидропиранилокси-группу превращают в бромид. Так, четырехбромистый углерод (31,5 г, 0,095 моль) добавляют при комнатной температуре в атмосфере аргона к раствору z-бутенил-аддукта 17 (25,2 г, 0,
06 моль) в безводном хлористом метилене (300 мл). Перемешивают в течение 10 минут, охлаждают раствор до 0oC и добавляют трифенилфосфин (44,5 г, 0,17 моль). Полученную смесь оставляют на
ночь перемешиваться при комнатной температуре и отфильтровывают через силикагель. Растворитель упаривают, остаток растворяют в смеси (500 мл) метанола и воды (9:1) и добавляют несколько капель соляной
кислоты. Смесь нагревают в течение нескольких минут, охлаждают, упаривают и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором бикарбоната натрия и водой, сушат и упаривают
досуха. Остаток очищают методом тонкослойной испарительной хроматографии на силикагеле, элюируя смесью этилацетата и гексана (схема 5).

Пример 7
Синтез 17α-(4'-иодбут-1'(z)-енил)-17β-гидрокси-4-андростен-3-он (19)
Полученное ранее соединение 18 (2,1 г, 5 ммоль) и иодид натрия (1,5 г, 5 ммоль) в 2-бутаноле (12 мл) кипятят с обратным холодильником в течение 12 часов. После удаления растворителя полученный остаток растворяют в воде (50 мл) и экстрагируют хлористым метиленом (3 х 80 мл). Органические вытяжки объединяют и промывают 1%-ным водным раствором бисульфита натрия (80 мл), а затем насыщенным раствором соли и сушат. После удаления растворителя при температуре 49oC и пониженном давлении получают сырой продукт, который очищают колоночной хроматографией, элюируя смесью гексана и ацетона, и получают чистый продукт (4,75 ммоль, 95%).
Пример 8
Аналогично методикам, приведенным в Примерах 6 и 7, используя в качестве реагентов различные (тетрагидро-2'H-пиран-2'-ил)оксиалкины и различные
тетрагалоидные производные углерода, получают следующие соединения, указанные в таблице 3.
Пример 9
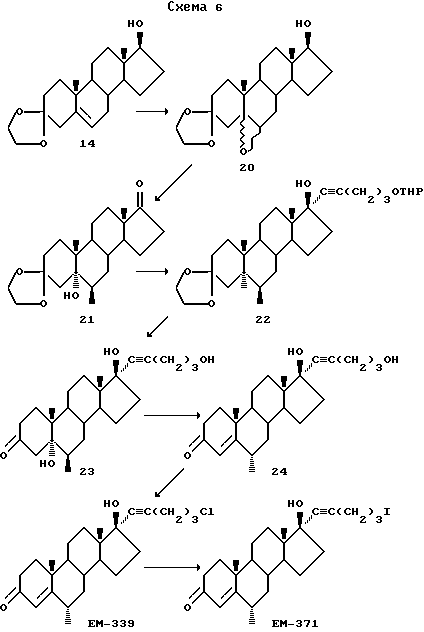
Синтез 17α-(5'-хлорпентинил)-17β
-гидрокси-6-метил-4-андростен-3-она (EM 339)
Этот синтез поясняется Схемой 6.
Эпоксид 20
К кеталю 14 (40 г, 0,21 моль) в изо-пропаноле (500 мл) добавляют магниевую
соль мононадфталевую кислоту (89,6 г, 0,18 моль) в воде (250 мл). Смесь нагревают в течение 3 часов при температуре 50oC, затем упаривают и отфильтровывают. Фильтрат экстрагируют
этилацетатом и промывают органическую фазу водой, сушат и упаривают. Остаток очищают методом тонкослойной испарительной хроматографии на силикагеле, элюируя смесью этилацетата и гексана (4:6) и
получают β-изомер (20 г) и α-изомер (17 г).
Кетоспирт 2
К метилмагнийхлориду (20 мл, 6М раствор в ТГФ) в атмосфере аргона добавляют по каплям α-изомер
эпоксида 20 (7,0 г, 0,02 моль) в безводном эфире (250 мл). Кипятят смесь с обратным холодильником в течение часа, а затем дополнительно перемешивают при комнатной температуре в течение 3 часов и
добавляют хлорид аммония. Экстрагируют смесь диэтиловым эфиром. Органическую фазу промывают водой, сушат и упаривают досуха.
Остаток растворяют в хлористом метилене (400 мл), добавляют целит (18 г) и дихромат пиридиния (18 г) и перемешивают смесь при комнатной температуре в течение 24 часов. Выливают реакционную смесь в диэтиловый эфир и отфильтровывают через флорисил, покрытый слоем целита. Упаривая растворитель, получают сырой кетоспирт 21, который очищают методом тонкослойной испарительной хроматографии на силикагеле, элюируя смесью этилацетата и гексана (4:6).
Аддукт 22
В атмосфере аргона при температуре минус 60oC добавляют 2-(4-пентилокси)тетрагидро-2H-пиран (13,8 г, 0,083 моль) по каплям к раствору метиллития (59 мл 1,4 М
раствора в эфире, 0,08 моль) в 200 мл безводного ТГФ, помещенного в круглодонную колбу емкостью 1 л. По окончании добавления охлаждающую баню убирают и раствор оставляют на 5 часов. Снова охлаждают
раствор до минус 60oC и по каплям добавляют раствор кетоспирта 21 (6 г, 0,017 моль) в 150 мл безводного ТГФ. По окончании добавления охлаждающую баню убирают и раствор оставляют на 16 часов
при комнатной температуре. К полученной смеси приливают 20 мл насыщенного раствора соли, раствор разбавляют этилацетатом, промывают органическую фазу насыщенным раствором соли и сушат над безводным
сульфатом магния. Затем растворитель упаривают и остаток очищают методом тонкослойной испарительной хроматографии на силикагеле, элюируя смесью этилацетата и гексана (от 0:10 до 4:6), и получают
аддукт 22 (7,5 г, 0,014 моль).
Кетотриол 23
Аддукт 22 (6,2 г, 12 ммоль) растворяют в смеси уксусной кислоты, ацетона, тетрагидрофурана и воды (4:2:2:1) и кипятят с обратным
холодильником в течение 24 часов. Смесь упаривают до половины ее объема, охлаждают и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором соли, сушат и упаривают. Остаток
перекристаллизовывают из смеси бензола и гексана и получают чистый кетотриол 23 (3,1 г, 7,7 ммоль).
Енондиол 24
К кетотриолу 23 (1,0 г, 2,8 ммоль), растворенному в метаноле
(150 мл), добавляют 0,1 М раствор едкого натра (10 мл) и раствор в течение 24 часов нагревают до температуры 50oC. После нейтрализации разбавленной соляной кислотой добавляют воду и
экстрагируют смесь этилацетатом. Органическую фазу промывают водой, сушат и упаривают досуха. Остаток очищают методом тонкослойной испарительной хроматографии на силикагеле, элюируя смесью ацетона и
гексана (от 0:10 до 2:8), и получают енондиол 24 (784 мг, 2,0 ммоль) с т.пл. 153-154oC.
17α-(5'-хлорпентинил)-17β-гидрокси-6α-метил-4-андростен-3-она
(EM 339)
Смесь енондиола 24 (102 мг, 0,27 ммоль), трифенилфосфина (131 мг, 0,5 ммоль) и четыреххлористого углерода (40 мг, 0,26 ммоль) кипятят в течение 10 часов с обратным холодильником в 20
мл безводного дихлорметана. После упаривания растворителя сырую смесь очищают методом тонкослойной испарительной хроматографии на силикагеле, элюируя смесью этилацетата и гексана (от 0:10 до 3:7), и
получают соединение EM 339 (66 мг, 0,16 ммоль): т.пл. 56-58oC; ИК спектр ν см-1 (KBr): 1606,4, 1663,1, 2871,9, 2947,6 и 3414,4; спектр1Н ЯМР δ
(хлороформ-d, 300 МГц, TMC): 0,88 (синглет, 3H, 18-CH3), 1,07 (дублет, 3H, J = 6,43 Гц, 6-CH3), 1,19 (синглет, 3H, 19-CH3), 2,42 (триплет, 2H, J = 6,85 Гц, CCCH2), 3,63 (триплет, 2H, J = 6,37 Гц, CH2Cl), 5,79 (синглет, 1H, C-4H); спектр13C ЯМР

Пример 10
Синтез 17α- (5'-иодпентинил)-17β- гидрокси-6-метил-4-андростен-3-она (EM 371)
17α- (5'-Бромпентинил)-17β- гидрокси-6-метил-4-андростен-3-он (EM 304)
Указанное соединение получают аналогично примеру 9, взяв четырехбромистый углерод вместо четыреххлористого углерода. ИК спектр ν см-1 (KBr): 1600, 1650, 2890, 2950 и 3400; спектр ПМР δ (хлороформ-d, 300 МГц, TMC): 0,88 (синглет, 3H, 18-CH3), 1,07 (дублет, 3H, J = 6,44 Гц, 6-CH3), 1,20 (синглет, 3H, 19-CH3), 2,42 (триплет, 2H, J = 5,28 Гц, CCCH2), 3,50 (триплет, 2H, J = 4,98 Гц, CH2Br), 5,79 (синглет, 1H, C-4H); спектр13C ЯМР δ (хлороформ-d, 75 МГц, TMC); 12,8, 17,5, 18,3, 20,9, 23,0, 31,4, 32,3, 32,6, 33, 8, 35,9, 36,0, 38,9, 39,1, 40,5, 43,6, 46,7, 49,8, 53,7, 79,7, 84,2, 121,2, 174,4 и 199,8; масс-спектр m/e: 448, 446 (M+), 433, 431, 340, 259, 137 (100), 91, 55.
17α
-(5'-Иодпентинил)-17β-гидрокси-6-метил-4-андростен-3-он (EM 371)
К EM-304 (140 мг, 0,32 ммоль) в ацетоне (20 мл) добавляют иодид натрия (75 мг, 0,5 ммоль) и полученную смесь оставляют
на ночь кипеть с обратным холодильником. После охлаждения и удаления растворителя добавляют воду и экстрагируют смесь этилацетатом. Органическую фазу промывают 1%-ным раствором бисульфита натрия,
водой, сушат и упаривают. Остаток очищают методом тонкослойной испарительной хроматографии на силикагеле, элюируя смесью ацетона и гексана (от 0:10 до 1:9), и получают EM-371 (79 мг, 0,16 ммоль):
т.пл. 68-70oC; ИК спектр ν см-1 (KBr): 1605,9, 1683,1, 2941,3 и 3423,3): спектр1H ЯМРδ (хлороформ-d, 300 МГц, TMC): 0,87 (синглет, 3H, 18-CH3
), 1,06 (дублет, 3H, J = 6,32 Гц, 6-CH3), 1,18 (синглет, 3H, 19-CH3), 1,96 (квартет, 2H, J = 6,7 Гц, CH2CH2I), 3,27 (триплет, 2H, J = 6,80 Гц, CH I), 5,78
(синглет, 1H, C-4H); спектр13C ЯМР δ (хлороформ-d, 75 МГц, TMC); 5,2, 12,8, 18,3, 20,9, 22,9, 29,6, 31,3, 31,8, 32,6, 33,6, 33,7, 35,9, 36,0, 38,9, 39,1, 40,5, 43,8, 49,2, 53,7, 79,
7, 84,8, 121,2, 174,3 и 199,8; масс-спектр m/e: 494 (M+), 479, 367, 300, 259, 137, 91, 79, 67 (100), 55 (табл. 4).
Пример 11
Синтез 17α-(5'-хлорпентинил)-17β
-гидрокси-6-метил-4-андростен-3-она (EM 683)
К EM-339 (100 мг, 0,25 ммоль) в бензоле (20 мл) добавляют п-толуолсульфокислоту (4,72 мл, 0,025 ммоль) и хлоранил (74 мл, 0,29 ммоль). Смесь
кипятят с насадкой Дина-Старка в течение 2 часов. После охлаждения добавляют эфир и органическую фазу промывают раствором бисульфата натрия, водой, сушат над сульфатом магния и упаривают досуха.
Остаток очищают методом тонкослойной испарительной хроматографии на силикагеле, элюируя смесью этилацетата и гексана, и получают целевое соединение (48 мг, выход 48%). ИК спектр ν см-1 (KBr): 1070, 1577, 1624, 2870, 2943 и 3421; спектр1H ЯМР δ (хлороформ-d, 300 МГц, TMC): 0,92 (синглет, 3H, 18-CH3), 1,09 (синглет, 3H, 19-CH3), 1,83
(синглет, 3H, 6-CH3), 1,95 (квартет, 2H, J = 6,53 Гц, CH2CH2Cl), 3,41 (триплет, 2H, J = 6,87 Гц, CCCH2), 3,62 (триплет, 2H, J = 6,32 Гц, CH2Cl),
5,86 (синглет, 1H, C-4H), 5,94 (синглет, 1H, C-7H); спектр13C ЯМР

Пример 12
Аналогично методике,
приведенной в Примере 11, получают следующие соединения, приведенные в Таблице 5, взяв в качестве исходных различные соединения, получаемые в соответствии с Примерами 9 и 10.
Пример
13
Синтез 17α-(бут-3-ен-1-инил)-17 β- гидрокси-4-андростен- 3-она (EM 656)
К EM-250 (466 мг, 1 ммоль) в бензоле (25 мл) добавляют фторид цезия (759 мг, 5 ммоль). Смесь
перемешивают при комнатной температуре в течение 24 часов, промывают водой, сушат и упаривают досуха. Остаток очищают методом тонкослойной испарительной хроматографии на силикагеле, элюируя смесью
диэтилового эфира и гексана (6:4), и получают целевое соединение (186 мг, 0,55 ммоль): спектр1H ЯМР δ (хлороформ-d, 300 МГц, TMC): 0,90 (синглет, 3H, 18-CH3), 1,20
(синглет, 3H, 19-CH3), 5,46 (дублет дублетов, 1H, J = 10,97 Гц, J = 1,82 Гц, =CH2), 5,61 (дублет дублетов, 1H, J = 17,4 Гц, J = 1,82 Гц, =CH2), 5,73 (синглет, 1H,
C-4H), 5,83 (дублет дублетов, 1H, J = 17,4 Гц, J = 10,97 Гц, CH=CH2).
Пример 14
Синтез 17α-(пент-4-ен-1-инил)-17β-гидрокси-4-андростен- 3-она
Получают из EM-159 аналогично методике, приведенной в Примере 13.
Пример 15
Синтез 17α-(4'-иодбутил)-17β-гидрокси-4-андростен-3-она (29)
Синтез
указанного соединения поясняется Схемой 7.
Гидроксикеталь 55
Андростанолон (50 г, 0,17 моль) (получают от фирмы "Aldrich Chemical Company", Милуоки, штат Висконсин, США)
обрабатывают диэтиленгликолем (100 мл) в толуоле (1 л) в аппарате с насадкой Дина-Старка в присутствии каталитического количества п-толуолсульфокислоты (1 г) при кипячении с обратным холодильником в
течение 16 часов. После охлаждения добавляют эфир, органическую фазу отделяют, промывают насыщенным водным раствором бикарбоната натрия и водой, сушат и упаривают, получая гидроксикеталь 25.
Кетокеталь 26
К гидроксикеталю 25 (40 г, 0,12 моль) в сухом хлористом метилене (1 л) добавляют дихромат пиридиния (90 г, 0,24 моль) и оставляют смесь на ночь перемешиваться при
комнатной температуре, а затем отфильтровывают через предварительно обработанный 1%-ным триэтиламином силикагель, элюируя смесью этилацетата и гексана.
Бутинил-аддукт 27
В
осушенную пламенем горелки колбу в атмосфере аргона помещают (тетрагидро-2'H-пиран-2'-ил)оксибутин (77 г, 0,5 моль) и безводный тетрагидрофуран (1 л). Раствор охлаждают до минус 78oC,
добавляют 2,5 раствор н-бутиллития (200 мл) и перемешивают раствор при указанной температуре в течение 2 часов. Затем добавляют кетокеталь 26 (33 г, 0,1 моль) в тетрагидрофуране (1 л). Через два часа
приливают воду и дают смеси нагреться до комнатной температуры. Раствор упаривают в вакууме и остаток экстрагируют эфиром. Органическую фазу промывают водой, сушат и упаривают. Остаток очищают на
силикагеле, используя в качестве элюента смесь этилацетата и гексана.
Кетоспирт 28
К бутинил-аддукту 27 (43,7 г, 0,09 моль), растворенного в 500 мл этанола, добавляют 5%-ный
палладий на угле. После трех продувок водородом смесь перемешивают под умеренным давлением водорода в течение по крайней мере 60 минут и отфильтровывают на целите. Твердое вещество промывают смесью
метанола и хлористого метилена и растворитель упаривают. Остаток растворяют в метаноле, добавляют несколько капель концентрированной соляной кислоты и кипятят с обратным холодильником в течение 1
часа. После охлаждения и упаривания части растворителя кетоспирт 28 экстрагируют этилацетатом, промывают водой, сушат и очищают методом тонкослойной испарительной хроматографии на силикагеле, элюируя
смесью этилацетата и гексана.
17α-(4'-Иодбутил)-17β-гидрокси-4-антростен-3-он (29)
К перемешиваемому раствору кетоспирта 28 (1,8 г, 5 ммоль) в диметилформамиде
(50 мл), содержащем каталитическое количество моногидрата п-толуолсульфокислоты (100 мг, 0,5 ммоль), при комнатной температуре в течение 8 часов добавляют бромид (880 г, 5,5 ммоль) в том же
растворителе (10 мл). Смесь выливают в воду и экстрагируют этилацетатом. Органическую фазу промывают 1%-ным раствором бисульфата натрия и водой, сушат и упаривают. Остаток растворяют в
диметилформамиде (50 мл) и добавляют карбонат лития (1,0 г) и бромид лития (1,0 г) и кипятят смесь с обратным холодильником в течение нескольких часов. После охлаждения смесь выливают в воду и
экстрагируют этилацетатом. Органическую фазу промывают 1%-ным раствором бисульфита натрия и водой, сушат и упаривают. Остаток очищают методом тонкослойной испарительной хроматографии на силикагеле,
элюируя смесью этилацетата и гексана. Полученный указанным способом очищенный енонспирт добавляют при комнатной температуре к смеси трифенилфосфина (1,3 г, 5 ммоль), иода (1,26 г, 5 ммоль) и имидазола
(0,34 г, 5 ммоль). Смесь перемешивают в течение 30 минут и разбавляют эфиром. Образовавшиеся твердые вещества отфильтровывают на воронке с фильтрующим дном. Фильтрат упаривают и остаток очищают
методом тонкослойной испарительной хроматографии на силикагеле, элюируя смесью этилацетата и гексана. (схема 7)

Пример 16
Синтез 17 α- (5'-хлорпентинил)-17β-гидрокси-6-фтор-4- андростен-3-она (EM 649)
Этот синтез поясняется Схемой 8
Фторкеталь 30
К альфа-изомеру эпоксида 20 (1 г, 2,9 ммоль) в безводной смеси эфира и бензола (1: 1) при температуре от 5 до 10oC добавляют эфират трехфтористого бора (1 мл) и перемешивают при комнатной температуре в течение 3 часов. Органическую фазу промывают насыщенным раствором бикарбоната натрия и водой, сушат и упаривают, получая твердое вещество белого цвета (380 мг, выход 36%).
Фторспирт 31
Раствор фторкеталя 30 (320 мг, 0,87 ммоль) в сухом дихлорметане (15 мл) при комнатной температуре и при перемешивании добавляют по каплям к раствору
хлорхромата пиридиния (0,6 г, 0,7 моль), молекулярных сит 3A (0,5 г) и ацетата натрия (100 мг). По окончании добавления смесь перемешивают еще в течение 16 часов, разбавляют диэтиловым эфиром (100 мл)
и отфильтровывают через слой силикагеля на воронке с фильтрующим дном. Фильтрат упаривают и остаток очищают методом тонкослойной испарительной хроматографии на силикагеле, элюируя смесью этилацетата и
гексана, и получают фторспирт 31 (270 мг, выход 84%).
Фтордиол 32
В круглодонную колбу емкостью 0,5 л в атмосфере аргона при температуре минус 78oC к раствору
метиллития (19,6 мл 1,4 М раствора MeLi в эфире, 0,028 моль) в 100 мл безводного ТГФ добавляют 2-(4-пентилокси)тетрагидро-2H-пиран (4,61 г, 0,027 моль). По окончании добавления охлаждающую баню
убирают и оставляют раствор на 2 часа. Вновь охлаждают до минус 78oC и по каплям добавляют раствор фторспирта 31 (2 г, 5,48 ммоль) в 100 мл безводного тетрагидрофурана. По окончании
добавления охлаждающую баню убирают и оставляют раствор при комнатной температуре на 16 часов. К полученной смеси приливают насыщенный раствор соли и разбавляют этилацетатом, промывают насыщенным
раствором соли и сушат над безводным сульфатом магния. Растворитель упаривают и остаток очищают методом испарительной тонкослойной хроматографии на силикагеле, используя в качестве элюента смесь
этилацетата и гексана (от 0:10 до 4:6), получая фтордиол 32.
Фтортриол 33
Смесь фтордиола 32 (410 мг, 0,776 ммол), уксусной кислоты (40 мл), ТГФ (20 мл), ацетона (20 мл) и
воды (10 мл) кипятят с обратным холодильником в течение 8 часов. Охлаждают, выливают смесь в воду и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором бикарбоната натрия и
водой, сушат и упаривают. Остаток очищают методом испарительной тонкослойной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана, и получают фтортриол 33 (181 мг,
выход 57%).
17α- (5'-Хлорпентинил)-17β- гидрокси-6-фтор-4-андростен-3- он (EM 649)
Смесь фтортриола 33 (100 мг, 0,246 ммоль), трифенилфосфина (129 мг, 0,492
ммоль) и четыреххлористого углерода (5 мл) кипятят с обратным холодильником в 20 мл безводного дихлорметана в течение 3 часов. После упаривания растворителя сырую смесь переносят на силикагель и
хроматографируют, элюируя смесью ацетон/гексан (от 0:10 до 3:7); ИК спектр ν см-1 (KBr): 1670, 2943 и 3433; спектр1H ЯМР


Пример 17
Синтез 17α-(4'-хлорбутинил)-17β -гидроксиандроста-1,4- диена
Смесь EM-248 (187 мг, 0,5 ммоль), дихлордицианобензохинона (170 мг, 0,75 ммоль), п-нитрофенола (5 мг) и толуола (3 мл) нагревают в течение 12 часов. После охлаждения добавляют эфир (150 мл) и промывают раствор бисульфитом натрия, 1 N раствором едкого натра и водой, сушат и упаривают. Остаток очищают методом испарительной тонкослойной хроматографии на силикагеле, используя в качестве элюента смесь эфира и гексана (7:3). После перекриcталлизации получают целевое соединение (56 мг, выход 30%).
Пример 18
Синтез 17α
-(4'-иодбутинил)-17β-гидрокси-4-метил-4- андростен-3-она
Указанное соединение получают по способу, аналогичному приведенному для получения 17α-(4'-иодбутинил)-17β
-гидрокси-4-андростен-3-она (EM 250), синтез Б, Пример 2, используя в качестве исходного 4-метил-4-андростен-3,17-дион вместо 4-андростен-3,17-диона.
Получение 4-метил-4-андростен-3, 17-диона можно осуществлять следующим способом.
Смесь ацетата тестостерона (получают от "Steraloids Inc", Уилтон, штат Нью-Гемпшир, США) (3,3 г, 10 ммоль), водного раствора формальдегида (1 мл) и тиофенола (0,9 г, 8 ммоль) перемешивают в триэтаноламине (30 мл) в течение 10 часов под аргоном при температуре 110oC. Через 4 часа после начала нагрева добавляют дополнительное количество формальдегида (0,7 мл) и тиофенола (0,5 мг). Охлаждают, выливают в насыщенный раствор соли и экстрагируют хлористым метиленом. Органическую фазу промывают разбавленным раствором едкого натра и водой, сушат и упаривают. Остаток очищают методом испарительной тонкослойной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана. Остаток, очищенный перекристаллизацией из ацетона (15 мл), добавляют к никелю Ренея (35 г) в ацетоне (60 мл), кипящему с обратным холодильником в течение 1 часа. Кипячение продолжают еще в течение 15 минут и горячую органическую фазу декантируют, а металлический осадок промывают горячим ацетоном. Фильтраты объединяют, упаривают и очищают методом испарительной тонкослойной хроматографии на силикагеле, используя в качестве элюента смесь этилацетата и гексана. Очищенный остаток растворяют в растворе едкого натра в метаноле (50 мл, 3%) и оставляют при комнатной температуре под аргоном в течение 4 часов. После упаривания смесь выливают в воду, экстрагируют хлористым метиленом. Органический слой промывают насыщенным раствором соли, сушат и упаривают досуха. Остаток, очищенный методом испарительной тонкослойной хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и гексана, растворяют в ацетоне (30 мл) и при 0oC обрабатывают небольшим избытком реактива Джонса (8 N раствор хромового ангидрида) (до появления красного окрашивания). Через 15 минут добавляют изо-пропанол (1 мл) и смесь выливают в насыщенный раствор соли, экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат и упаривают досуха. Очисткой остатка методом испарительной тонкослойной хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и гексана получают чистый 4-метил-4-андростен-3,17-диодн.
Предшественники лекарственных средств
Формы предшественников лекарственных средств
в соответствии с настоящим изобретением могут быть приготовлены по известным методикам путем модифицирования заместителей в соединениях во фрагменты, которые в условиях in vivo снова превращаются в
немодифицированный заместитель (см., например, H.Bundgaard, "Desing and application of prodrugs" в монографии "A Textbook of Drug Design and Development, Ed. P.Krogsgaard-Larsen and H.Bundgaard,
Harwood Academic Publishers GmbH, Chur, Switzerland, 1991, pp. 113-191). В некоторых предпочтительных вариантах осуществления изобретения предшественники лекарственных средств получают, например,
путем трансформирования 3-кето-группы антиандрогенов по настоящему изобретению в оксазолидины, тиазолидины, диоксаны, диоксоланы, дитиоланы или дитианы. Все они являются неустойчивыми внутри организма
и регенерируют исходное 3-кетопроизводное. Далее приводятся не ограничивающие настоящее изобретение примеры некоторых предпочтительных модификаций предшественников лекарственных средств, которые могут
быть использованы в качестве антиандрогенов по настоящему изобретению.
Пример 19
17α-(4'-хлорбутинил)-17β-гидрокси-5-андростен-3-спиро-2'-(1',
3'-тиазолидин-4'-этилкарбоксилат) (34)
Синтез поясняется схемой 9.
17α-(4'-хлорбутинил)-17β-гидрокси-4-андростен-3-он (EM-248) (0,37 г, 1 ммоль) растворяют в атмосфере аргона в пиридине (5 мл), к которому добавлен гидрохлорид этилового эфира L-цистеина. Реакционную смесь нагревают по крайней мере 12 часов. Избыток пиридина упаривают и остаток растворяют в хлористом метилене. Органический слой промывают водой, сушат над сульфатом магнияиупаривают,получая17α-(4'-хлорбутинил)-17β-гидрокси-5-андростен-3-спиро-2'- (1', 3'-тиаолидин-4'-этилкарбоксилат).

Пример 20
17α -(4'-хлорбутинил)-17β-гидрокси-5-андростен-3-спиро-2'-(1', 3'-оксазолидин-4'-этилкарбоксилат) (35)
Синтез поясняется Схемой 10
EM-248 (3,7 г, 10 ммоль) растворяют в абсолютном этаноле, добавляют ацетат натрия и гидрохлорид этилового эфира L-цистеина (17 г, 100 ммоль). Реакционную смесь оставляют нагреваться на ночь в атмосфере аргона, затем упаривают и добавляют хлористый метилен с целью осадить избыток гидрохлорид этилового эфира L-серина. Раствор отфильтровывают и фильтрат дважды промывают водой, сушат над сульфатом магния, отфильтровывают и упаривают в вакууме. Остаток растирают с этанолом и получают кристаллы.

Пример 21
17α -(4'-иодбутинил)-17β-гидрокси-3,3-метилэтилендиокси- 5-андростен (38)
Синтез поясняется Схемой 11
К спирту 5 (3,75 г, 10 ммоль) в бензоле (100 мл) и пропиленгликоле (20 мл) (используют рацемическую смесь или преимущественно чистый энантиомер) добавляют п-толуиловую кислоту (189 мг, 2 ммоль) и кипятят смесь с насадкой Дина-Старка в течение 24 часов. Охлаждают, разбавляют смесь насыщенным раствором бикарбоната натрия и водой, сушат и упаривают досуха в вакууме, получая сырой кетадиол 36.
Кетальтозилат 37
В трехгорлой колбе емкостью 100 мл,
снабженной мешалкой и термометром, помещают кетадиол 36 (3,46 г, 8 ммоль) и пиридин (7,9 г, 100 мл). Охлаждают колбу до 0oC и добавляют при этой температуре порциями хлорангидрид
п-толуолсульфокислоты в течение от 20 до 30 минут или с такой скоростью, чтобы температура не поднималась выше 20oC. Смесь перемешивают при комнатной температуре в течение 12 часов, и затем
смесь разбавляют раствором 20 мл соляной кислоты в 70 мл ледяной воды. Водный раствор экстрагируют хлористым метиленом. Органическую фазу промывают насыщенным раствором соли и упаривают. Удаляя
растворитель при 40oC, получают кетальтозилат 37.
17α-(4'-иодбутинил)-17β-гидрокси-3,3-метилэтилендиокси-5- андростен (38)
Кетальтозилат 37 (2,62 г, 4,
45 ммоль) и NaI (1,33 г, 4,45 ммоль) в 2-бутаноле (12 мл) кипятят с обратным холодильником в течение 12 часов. Удаляя растворитель, получают остаток, который растворяют в воде (50 мл) и экстрагируют
хлористым метиленом. Органическую фазу промывают 1%-ным раствором бисульфита натрия (80 мл), а затем насыщенным раствором соли и сушат. Удаляя растворитель при температуре 40oC и пониженном
давлении, получают сырой продукт, который очищают методом испарительной тонкослойной хроматографии на силикагеле, предварительно обработанном 0,1%-ным триметиламином, элюируя смесью этилацетата и
гексана.

Пример 22
Синтез 17

17α-(4'-хлорбутинил)-17β-гидрокси-3-этоксиандроста-3,5- диен (39) EM-248 (1,9 г, 5 ммоль) в ТГФ (20 мл) обрабатывают триэтоксиметаном (1,7 г, 16 ммоль) и моногидратом п-толуолсульфокислоты (45 м, 0,24 ммоль). Смесь перемешивают в течение 2,5 часа, добавляют триэтиламин (0,2 мл, 1,6 ммоль) и воду (0,5 мл). Удаляя растворитель, получают остаток, который перемешивают с водой (20 мл) в течение 10 минут и отфильтровывают. Твердое вещество промывают водой и сушат в глубоком вакууме при температуре 80oC, получая сырое соединение 39. Чистый продукт получают очисткой методом испарительной тонкослойной хроматографии на силикагеле, предварительно обработанном 0,1%-ным триметиламином, элюируя смесью этилацетата и гексана. 17α-(4'-иодбутинил)-17β-гидрокси-3-этоксиандроста-3,5- диен (40)
Соединение 39 (800 мг, 2 ммоль) и al (580 мг, 2 ммоль) в 2-бутаноле (12 мл) кипятят с обратным холодильником в течение 12 часов. Удаляя растворитель, получают остаток, который растворяют в воде (50 мл) и экстрагируют хлористым метиленом. Органическую фазу промывают 1%-ным раствором бисульфита натрия (80 мл), а затем насыщенным раствором соли и сушат. Удаляя растворитель при температуре 40oC и пониженном давлении, получают сырой продукт, который очищают методом испарительной тонкослойной хроматографии на силикагеле, предварительно обработанном 0,1%-ным триметиламином, элюируя смесью этилацетата и гексана.

Антиандрогены по настоящему изобретению, которые включают предшественники лекарственных средств, преимущественно смешивают с фармацевтически приемлемым разбавителем или носителем, получая фармацевтические композиции, содержащие стандартные количества антиандрогенов, которые используются в данной области техники. Лечащий врач может принять решение изменить концентрацию и/или дозу, с целью подобрать дозу для каждого пациента. Лечащий врач, предпочтительно в начале курса лечения, следит за общей ответной реакцией организма пациента и уровнем антиандрогена в сыворотке крови (по сравнению с предпочтительными концентрациями в сыворотке, которые указаны ранее), а также следит за общей реакцией организма пациента в ответ на лечение, изменяя при необходимости дозу в том случае, если обмен веществ пациента или его реакция на лечение являются нетипичными. Могут также применяться капсулы, содержащие приведенные выше антиандрогены. Как подробнее рассматривается далее, носители и разбавители включают твердые вещества и жидкости. Если композиция готовится впрок, то обычно в нее добавляются используемые в данной области техники консерванты (в частности, бензиловый спирт). Новые фармацевтические композиции по изобретению могут использоваться при лечении андрогензависимых заболеваний. При систематическом введении (в частности, при лечении рака предстательной железы, доброкачественной гиперплазии предстательной железы или других заболеваний, которые главным образом не оказывают воздействия на кожу) используются обычные разбавители и носители, которые, как известно из области техники, являются фармацевтически приемлемыми для системного применения, в частности, солевой раствор, вода, водный спирт, масло и т.п. Часто носитель является смесью ингредиентов.
При составлении композиции, предназначенной для системного использования, антиандрогены могут готовиться для введения обычными способами перорально или в виде инъекций. Антиандрогены можно вводить, например, перорально. Соединение по настоящему изобретению можно смешивать с обычными фармацевтическими наполнителями (в частности, с высушенной распылением лактозой и стеаратом магния) и готовить таблетки или капсулы для перорального введения. В формы для перорального введения могут добавляться вкусовые добавки. Если необходимы капсулы для перорального введения, то активными ингредиентами данного изобретения можно наполнять фармацевтические капсулы, известные из области техники, содержащие или не содержащие дополнительные разбавители и другие добавки, которые рассматриваются здесь.
Активные соединения можно готовить в виде таблеток или драже, покрытых оболочкой путем смешивания с тонкодисперсным порошком носителя, например цитрата натрия, карбоната кальция и дикальцийфосфата, и связующими, такими как поливинилпирролидон, желатин или производные целлюлозы; можно использовать также смазывающие средства, такие как стеарат магния, лаурилсульфат натрия, "карбовакс" или полиэтиленгликоль.
Можно использовать также закрытые капсулы, например из твердого желатина, а также закрытые мягкие желатиновые капсулы, содержащие умягчитель или пластификатор, в частности глицерин. Закрытые капсулы содержат активное соединение преимущественно в виде гранул, в частности, в смеси с наполнителями, такими как лактоза, сахароза, маннит, крахмал, такой как картофельный крахмал или амилопектин, производные целлюлозы или кремневые кислоты с высокой степенью дисперсности. В мягких желатиновых капсулах активные ингредиенты преимущественно содержатся в виде растворов или суспензий в подходящих растворителях, таких как растительные масла или жидкие полиэтиленгликоли.
Можно использовать твердые системы доставки лекарства, описанные в Патентах США с номерами 3742951, 3797494 или 4568343.
Иным способом активные ингредиенты могут находиться в наносимых на кожу бляшках, структура которых известна из области техники, например из структур, приведенных в Европейском патенте 0279982.
Для облегчения проникновения лекарства через кожу, если необходимо достижение системного воздействия, можно использовать растворители, как это описано в Патентах США с номерами 5064654, 5071644 или 5071657. При лечении системных заболеваний место нанесения на кожу следует менять для предотвращения избыточной местной концентрации стероидов.
В предпочтительных вариантах осуществления изобретения ингибиторы по настоящему изобретению используют для лечения андрогензависимых болезней кожи, таких как угри, себорея, избыточное оволосение у женщин, андрогенное облысение, преждевременное облысение у мужчин и т.п. При использовании для указанных целей антиандрогены преимущественно вводят местно вместе с обычными носителями или разбавителями, пригодными для нанесения на кожу. При местном назначении разбавитель или носитель предпочтительно не должен способствовать трансдермальному проникновению активных ингредиентов в кровяной поток или другие ткани, в которых они могут вызвать нежелательные системные эффекты.
Если соединение используют вместе с носителем или разбавителем для кожного или местного применения, то носитель или разбавитель может быть выбран из многих известных в косметике или из области медицины, в частности, используют любой гель, крем, лосьон, мазь, жидкий или нежидкий носитель, эмульгатор, растворитель, жидкий разбавитель или иное подобное связующее, которое не оказывает вредного воздействия на кожу или другие живые ткани животного. Носитель или разбавитель обычно представляет собой смесь нескольких ингредиентов, включая жидкие спирты, жидкие гликоли, жидкие полиалкиленгликоли, воду, жидкие амиды, жидкие эфиры, жидкий ланолин и производные ланолина и похожие соединения. Спирты включают моно- и полиатомные спирты, в том числе этанол, глицерин, сорбит, изо-пропанол, диэтиленгликоль, пропиленгликоль, гексиленгликоль, маннит и метоксиэтанол. Типичными носителями могут также быть простые эфиры, в том числе диэтиловый и дипропиловый эфир, метоксиполиоксиэтилены, карбоваксы, полиэтиленглицерины, полиоксиэтилены и сорбиты. Обычно носитель для местного назначения, с целью достижения максимальной гидрофильной или липофильной растворимости, включает как воду, так и спирт, в частности, смеси этанола или изо-пропанола с водой.
Носитель для местного назначения может также включать различные другие ингредиенты, обычно используемые в составах мазей и лосьонов и хорошо известные в косметике и области медицины. Например, могут присутствовать ароматизирующие вещества, консерванты, отдушка, гелеобразующие средства, загустители, такие как карбоксиметилцеллюлоза, поверхностно-активные вещества, стабилизаторы, мягчительные средства, красители и другие подобные средства.
Концентрация активного ингредиента в мази, креме, геле или лосьона обычно составляет от 3 до 20 процентов, предпочтительно - от 5 до 10 процентов, наиболее предпочтительно - от 5 до 10 процентов (по весу относительно общего количества лосьона, крема, геля или мази). В пределах предпочтительного интервала значений большая концентрация позволяет использовать лосьон, гель или крем в меньшем количестве или не так часто.
Далее приводятся следующие не ограничивающие настоящее изобретение примеры приготовления типичного крема, лосьона и мази. Помимо указанных носителей опытные специалисты могут использовать другие носители с целью подобрать растворитель для конкретного дерматологического назначения.
Примеры 23, 24 и 25 приведены в конце описания.
Если антиандрогены вводятся систематически, то они преимущественно назначаются перорально или парентерально. Если объектом воздействия является кожа, то предпочтительным является конечно же местное введение.
Концентрация активного ингредиента изменяется известным образом в зависимости от способа введения фармацевтической композиции. Композиции, пригодные для перорального введения, могут предпочтительно включать по крайней мере один ингибитор антиандрогенов, если общее содержание указанных антиандрогенов в указанных фармацевтических композициях составляет приблизительно от 1% до 95% от веса композиции, предпочтительно приблизительно от 5% до приблизительно 20%. Если используется комбинация антиандрогенов, то общая суммарная доза всех антиандрогенов должна укладываться в указанные выше интервалы значений. Уровень антиандрогенов в крови является предпочтительным критерием адекватности дозы, который учитывает индивидуальные различия в усвоении и обмене веществ. Фармацевтически приемлемым разбавителем преимущественно является крахмал или лактоза (вместе или без тартразина).
Если композиция подготовлена для парентеральной инъекции, то антиандроген преимущественно добавляют в количестве приблизительно от 1,0 мг/мл до приблизительно 100 мг/мл (предпочтительно приблизительно от 2,0 мг/мл до приблизительно от 2,0 мг/мл до приблизительно 10 мг/мл).
Если требуется оказать системное воздействие, то необходимо лишь, чтобы антиандроген назначался нужным образом и с дозировкой, достаточной для того, чтобы обеспечить необходимый его уровень в сыворотке крови. Содержание антиандрогена в сыворотке обычно должно поддерживаться в интервале от 10 до 2000 микрограмм на литр, предпочтительно - в интервале от 100 до 1000 мкг/л и наиболее предпочтительно - в интервале от 200 до 500 мкг/л. Адекватный уровень содержания лекарственного средства в сыворотке устанавливается также в соответствии с ответной реакцией пациента на терапевтическое воздействие.
Для типичного пациента подходящая доза антиандрогена, необходимая для достижения требуемой концентрации, составляет при пероральном назначении от 10 до 2000 мг активного компонента в день на 50 кг веса тела. Если введение проводится в виде инъекции, то рекомендуется приблизительно от 1 до 2000 мг в день на 50 кг веса тела, предпочтительно - от 10 до 100.
При местном назначении лосьон, гель или крем необходимо тщательно втереть в кожу, так чтобы не было видно остатка, после чего кожу по возможности не следует мочить в течение по крайней мере 30 минут. Количество лекарственного средства должно составлять по крайней мере 0,02 мг антиандрогена на квадратный сантиметр (преимущественно от 0,1 до 1 мг/кв. см) при каждом его использовании. Желательно наносить композицию для местного применения на пораженный участок от 1 до 6 раз в день, в частности 3 раза в день, через подходящие регулярные интервалы времени. В некоторых предпочтительных вариантах осуществления изобретения антиандрогены по настоящему изобретению используют в сочетании с другим активным ингредиентом как составляющую комбинированного лечения. Например, новый антиандроген можно применять совместно с отдельным ингибитором 5 α- редуктазы, который можно включать в ту же самую фармацевтическую композицию, что и антиандроген, или же вводить отдельно. Активное соединение может обладать как антиандрогенной активностью, так и ингибирующей активностью по отношению к 5 α- редуктазе, и может дополняться другим соединением, с целью усиления любой или обеих указанных активностей (в частности, антиандрогена или другого ингибитора 5 α- редуктазы). Комбинированная терапия может также включать лечение одним или большим количеством соединений, которые ингибируют воспроизводство тестостерона или его предшественников. В некоторых предпочтительных вариантах осуществления изобретения фармацевтическая композиция для местного назначения включает далее ингибитор активности стероидной 5 α- редуктазы. Один из таких ингибиторов ("Proscar") поставляется фирмами "Merck Sharp" и "Dohme". Другими примерами подобных ингибиторов являются EM-735 и EM-638, синтез которых приводится далее.

Получение 17β-гидрокси-17α-бутил-4-аза-5-андрост-1- ен-3-она (EM 735):
17β-Гидрокси-5-оксо-A-нор-3,5-андростан-3-оновая кислота (a)
К перемешиваемому раствору ацетата тестостерона (получают от фирмы "Steraloids Inc. , Уилтон, штат Нью-Гемшир, США) (200 г, 0,605 моль) в трет-бутиловом спирте (2 л) добавляют раствор карбоната натрия (96,3 г, 0,908 моль) в 460 мл воды. Нагревают смесь до кипячения и постепенно (в течение 1 часа) добавляют раствор периодата натрия (893,8 г, 4,17 моль) и перманганата калия (70,8 г, 0,45 моль) в теплой воде (75oC), при этом продолжают кипячение с обратным холодильником. Охлаждают реакционную смесь до 30oC и через 15 минут твердые вещества удаляют фильтрованием. Промывают осадок 800 мл воды, фильтрат и промывные воды объединяют и упаривают при пониженном давлении для удаления большей части трет-бутилового спирта (конечный объем 1,0 л). Водный остаток охлаждают и подкисляют соляной кислотой до значения pH 3,0. Экстрагируют водную фазу хлористым метиленом (4 х 800 мл), органические вытяжки объединяют, промывают водой, сушат и упаривают досуха. Полученное твердое вещество подвергают гидролизу ацетатной группы кипячением с раствором NaOH (34,3 г, 0,857 моль) в метаноле (2,0 л) в течение 12 часов. Упаривают реакционную смесь до объема 400 мл, разбавляют водой (600 мл) и подкисляют до значения pH 3. Твердое вещество отфильтровывают, промывают водой и сушат. Фильтрат экстрагируют хлористым метиленом (3 х 1,0 л), органические вытяжки объединяют и концентрируют до состояния сиропа. Осадок и сироп обрабатывают кипящим этилацетатом, охлаждают до 0oC и оставляют стоять при указанной температуре на ночь, получая 125 г (67%) бесцветных кристаллов: т.пл. 205-207oC.
17β-Гидрокси-4-метил-4-аза-андрост-5-ен-3-он (b)
В трубке Шленка барботируют при комнатной температуре метиламин до
насыщения в смесь секокислоты (a) (8,0 г, 25,98 моль) в этиленгликоле (80 мл). Прозрачный желтоватый раствор нагревают градиентно (3oC/мин) до температуры 180oC и выдерживают при
указанной температуре в течение 1 часа. Охлаждают реакционную смесь до 10oC и при перемешивании добавляют воду (80 мл). Твердое вещество отфильтровывают, промывают водой (20 мл) и сушат,
получая 6,1 г соединения (b) (81%): т.пл. 181-183oC.
17β-Гидрокси-4-метил-4-аза-5α-андростан-3-он (c)
Раствор соединения (b) (6 г, 20,7 ммоль) в
уксусной кислоте (99,9%, 130 мл) гидрируют в присутствии оксида платины (600 мг) под давлением 45 фунтов на дюйм, начиная от комнатной температуры, и нагревают до температуры 60oC в течение
12 часов. Реакционную смесь охлаждают и отфильтровывают. Катализатор промывают уксусной кислотой (30 мл). Фильтраты объединяют и упаривают досуха (5,5 г, 91%); т.пл. 178-180oC.
4-Метил-4-аза-5α-андростан-3,17-дион (d)
К перемешиваемому раствору соединения (c) (7,3 г, 25 ммоль) в хлористом метилене (260 мл) добавляют хлорхромат пиридиния (8,1 г, 37
ммоль) и перемешивают смесь при комнатной температуре в течение 3 часов. Реакционную смесь для удаления твердых осадков отфильтровывают через слой флорисила (30-60 меш), а фильтрат промывают водой (2
х 200 мл) и сушат. Полученный остаток очищают методом испарительной колоночной хроматографии на силикагеле и получают дион (d) (4,4 г, 61%); т.пл. 126-128oC.
17β
-Гидрокси-17 α-(1'-бутинил)-4-метил-4-аза-андростан-3- он (EM-728)
К раствору ди-изо-пропиламина (8,35 г, 82,51 ммоль) в сухом н-гексане (150 мл) при температуре -20oC
добавляют н-бутиллитий (33 мл 2,5М раствора в гексане, 82,5 ммоль), а затем добавляют 100 мл сухого диэтилового эфира. Смесь перемешивают в атмосфере аргона при температуре минус 20oC в
течение 1 часа. В диэтиловый эфир (10 мл) при температуре минус 50oC барботируют 1-бутен (со скоростью приблизительно 1,0 г/мин). Охлажденный раствор 1-бутена в диэтиловом эфире (5,5
эквив.) добавляют при температуре минус 50oC к раствору литийди-изо-пропиламина. Через 10 минут к раствору 4-метил-4-аза-5-андростан-3,17-диона (d) (5,0 г, 16,50 ммоль) в диэтиловом эфире
(250 мл) при температуре минус 50oC добавляют раствор 1-бутиниллития. Через 1 час реакционной смеси дают нагреться до 0oC и перемешивают при комнатной температуре в течение 12
часов. Прерывают реакцию добавлением водного раствора хлорида аммония (5 мл) и разбавляют водой (100 мл). Органическую фазу отделяют и водную фазу экстрагируют этилацетатом (3 х 80 мл). Органические
вытяжки объединяют, сушат над сульфатом магния, отфильтровывают и упаривают, получая сырой продукт, который очищают испарительной колоночной хроматографией на силикагеле (гексан: ацетон-этилацетат, от
75:10:15 до 55:30:15) и получают 4,20 г EM-728 с выходом 71%: т.пл. 155-157oC; ИК спектр ν см-1 (KBr) 3335, 2947, 2870, 1624, 1609, 1444, 1399, 1316, 1240, 1052, 1024;
спектр1H ЯМР δ (хлороформ-d, 300 МГц, TMC): 0,84 (синглет, 3H, 18-CH3), 0,90 (синглет, 3H, 19-CH3), 0,78 - 1,01 (мультиплет, 1H), 1,15 (триплет, 3H, J = 7,6, 7,
6 Гц, 4'-CH3), 1,25 - 1,49 (9H, мультиплет), 1,50 - 1,69 (4H, мультиплет), 1,78 - 1,92 (2H, мультиплет), 1,96 (1H, дублет дублетов, J = 2,0, 2,1 Гц), 2,00 (2H, два дублета дублетов, J = 3,0,
7,4, 12,0 Гц), 2,21 (1H, два дублета дублетов, J = 3,0, 5,1, 10,3 Гц), 2,24 (2H, квартет, J = 7,6 Гц, 3'-CH2), 2,44 (2H, дублет дублетов, J = 4,7, 9,5 Гц), (3H, синглет, 4-NCH3),
3,14 (1H, синглет, OH), 3,03 (дублет дублетов, 1H, J = 3,6, 12,6 Гц, 5 α- H); спектр13C ЯМР δ (хлороформ-d, 300 МГц, TMC): 170,8, 87,8 (2'-С), 82,9 (17-C), 79,8 (1'-C), 65,8,
51,7, 49,9, 47,0, 39,1, 36,5, 35,0, 33,0, 32,7, 31,6, 29,8, 29,1, 25,3, 23,0, 22,6, 20,9, 14,1, 12,9, 12,5. Масс-спектр с электронной ионизацией (относительные интенсивности) 327 (M+, 94), 342 (100),
328 (48), 262 (94), 248 (27), 206 (22), 138 (25), 124 (63), 112 (61), 96 (33), 79 (24), 70 (85). Масс-спектр высокого разрешения: вычислено для C23H35O2N: 357,2668;
найдено: 357,2662.
17β-Гидрокси-17α-бутил-4-аза-андростан-3-он (EM-700)
К перемешиваемому раствору EM-728 (1,0 г, 2,80 ммоль) в этилацетате (60 мл) добавляют 0,
10 г палладия на активированном угле (содержание палладия 10%). Колбу откачивают до вакуума 22 мм рт.ст. и трижды продувают водородом. В течение 3 часов перемешивают смесь при комнатной температуре в
атмосфере водорода, подаваемого из баллона. Реакционную смесь отфильтровывают через Celite 521 и промывают его этилацетатом. После удаления растворителя получают сырой продукт, который пропускают
через короткую колонку с силикагелем, элюируя смесью гексан: ацетон (7:3), и получают 0,96 г соединения EM-700 с выходом 95%: т. пл. 155-157oC. ИК спектр

17β
-Гидрокси-17α-бутил-4-аза-5α-андрост-1-ен-3-он (EM-735)
В трехгорлую колбу емкостью 50 мл, снабженную трубкой для ввода газа, обратным холодильником, капельной воронкой,
механической мешалкой и погружным термометром, помещают 25 мл диоксана, а затем порциями при перемешивании 0,96 г (2,66 моль) EM-700. К полученной суспензии порциями добавляют 0,73 г (3,19 ммоль) 2,
3-дихлор-5,6-дициано-1,4-бензохинона. Колбу откачивают (до остаточного давления 22 дюйма рт.ст.), и трижды продувают аргоном. К перемешиваемой суспензии через делительную воронку со скоростью 5 мл/мин
добавляют бис(триметилсилил)трифторацетамид (1,98 г, 7,72 ммоль). Температура в течение тридцати минут медленно поднимается с 22oC до 25oC, а большая часть твердых веществ при
этом растворяется и образуется прозрачный раствор. Раствор перемешивают при температуре 22oC в течение 18 часов (после чего методом ТСХ наблюдают образование двух диастереомерных аддуктов).
Затем раствор нагревают на масляной бане, так чтобы он слегка кипел (температура бани 120oC, температура раствора 108oC). Через 16 часов реакционную смесь охлаждают до 22oC и выливают в смесь 50 мл хлористого метилена и 9,2 мл 1%-ного водного раствора бисульфита натрия. Гетерогенную смесь перемешивают в течение 15 минут и отфильтровывают для удаления осадка
гидрохинона. Отделяют темно-красный органический слой и промывают его 20 мл 6N раствора соляной кислоты, затем насыщенным раствором соли, сушат и упаривают. Сырую смесь растворяют в смеси
тетрагидрофурана (25 мл), воды (12,5 мл) и ледяной уксусной кислоты (25 мл) и перемешивают при температуре 55oC в течение 3 часов. Растворитель удаляют, остаток разбавляют 40 мл воды и
экстрагируют дихлорметаном (3 х 50 мл). Органические вытяжки объединяют, промывают 50 мл насыщенного раствора хлорида натрия, сушат и упаривают. Полученный остаток очищают далее хроматографически на
силикагеле (гексан: этилацетат, от 95:5 до 70: 30), выделяя 0,412 г (выход 43%) целевого продукта EM-735: т.пл. 194-196oC; ИК спектр ν см-1 (KBr): 3397, 2946, 2866, 1658,
1602, 1434, 1400, 1099, 1013, 820; спектр1H ЯМР δ (хлороформ-d, 300 МГц, TMC): 0,89 (синглет, 3H, 18-CH3), 0,93 (синглет, 3H, 19-CH3), 0,94 (триплет, 3H, J = 7,
6, 7,9 Гц, 4'-CH3), 0,90 - 1,01 (мультиплет, 1H), 1,25 (1H, дублет дублетов, J = 2,8, 2,4 Гц), 1,39 (1H, дублет дублетов, J = 6,7, 11,7 Гц), 1,35 - 1,53 (мультиплет, 9H), 1,55 - 1,60
(мультиплет, 4H), 1,61 - 1,66 (мультиплет, 2H), 1,78 (1H, дублет дублетов, J = 3,3, 11,7 Гц), 1,85 (1H, дублет дублетов, J = 3,4, 13,2 Гц), 1,97 (триплет, 1H, J = 3,0, 3,3 Гц), 1,97 (1H, дублет
дублетов, J = 4,2, 8,5 Гц), 2,95 (3H, синглет, 4-NCH3), 3,32 (дублет дублетов, 1H, J = 3,7, 13,1 Гц, 5 α- H), 5,84 (1H, дублет, J = 9,6 Гц), 6,69 (1H, дублет, J = 9,9 Гц); спектр13C ЯМР δ (хлороформ-d, 300 МГц, TMC): 165,6, 148,7, 123,2, 83,2, 63,9, 50,0, 47,9, 46,7, 39,6, 36,5, 35,6, 34,4, 31,5, 29,8, 27,6, 25,8, 24,4, 23,6, (2C), 21,0, 14,6, 14,2, 12,2;
масс-спектр с электронной ионизацией (относительные интенсивности) 359 (M+, 86), 344 (12), 302 (32), 284 (15), 260 (81), 246 (27), 232 (26), 137 (44), 124 (100), 113 (46), 70 (53). Масс-спектр
высокого разрешения: вычислено для C23H37O2N: 359,2824; найдено: 359,2805.
Получение 17(2', 3', α)- 2',5'-дигидрофуран-4-метил-4-аза-5α
- андростан-3-он (EM-638)
17β-Гидрокси-17α-(3-гидрокси-1'-пропенил)-4-метил-4-аза-5α-андростан-3-он
К алкину (100 мг, 0,288 ммоль) в 10 мл сухого пиридина
добавляют 30 мг палладия на карбонате кальция. Раствор трижды продувают водородом и откачивают, а затем гидрируют при комнатной температуре в течение 3 часов при атмосферном давлении. Как только все
исходное соединение прореагирует, смесь отфильтровывают через целит и получают сырой продукт, который хроматографируют на силикагеле, элюируя смесью хлористого метилена и метанола (9:1), и получают 73
мг продукта (73%).
17(2', 3', α)- 2',5'-Дигидрофуран-4-метил-4-аза-5α-андростан-3-он (EM-638)
К раствору 17β-гидрокси-17α
-(3'-гидрокси-1'-пропенил)-4- метил-4-аза-5α-андростан-3-она (730 мг, 2,0 ммоль) в 30 мл сухого пиридина добавляют п-тозилхлорид (800 мг, 4,0 ммоль) и перемешивают в течение 6 часов при
комнатной температуре. Пиридин упаривают и реакционную смесь экстрагируют хлористым метиленом. Сырой продукт очищают испарительной хроматографией, элюируя смесью хлористого метилена и метанола (9:1),
и получают 420 мг EM-638 с выходом 88%. ИК спектр ν см-1 (KBr): 3045 (двойная связь), 1646 (амид); спектр1H ЯМР δ (хлороформ-d, 300 МГц, TMC): 0,87 (синглет, 3H,
18-CH3), 0,88 (синглет, 3H, 19-CH3), 2,41 (2H, дублет дублетов, J = 4,5, 9,3 Гц), 2,90 (синглет, 3H, 4-NCH3), 3,0 (1H, дублет дублетов, J = 3,5, 12,5 Гц, 5 α
- H), 4,52 (2H, мультиплет, O-CH2), 5,78 (мультиплет, 2H, CH=CH). Спектр13C ЯМР δ (хлороформ-d): 170,8, 132,1, 124,4, 100,6, 74,4, 65,8, 52,0, 50,8, 45,7, 39,4, 35,5, 34,
8, 32,9 (2C), 29,8, 29,1, 29,0, 25,3, 23,1, 20,6, 14,2, 12,3. Масс-спектр высокого разрешения: вычислено для C22H33O2N: 343,2502; найдено: 343,2524.
Ингибитор 5 α- редуктазы смешивают в композициях в обычном количестве и назначают с обычными дозами, т.е. в том же количестве и с теми же дозами, что и указанный ранее антиандроген.
Комбинированное лечение с использованием ингибитора 5 α- редуктазы и антиандрогена оказывается благотворное воздействие за счет ингибирования рецепторов андрогена по двум различным механизмам, незначительно снижая уровень тестостерона, уменьшение которого может привести к нежелательным побочным эффектам у некоторых пациентов. В соответствующих случаях, когда рак предстательной железы или другое андрогензависимое заболевание не поддается лечению, можно использовать сопутствующую терапию, направленную на уменьшение уровня тестостерона (в частности, хирургическую или химическую кастрацию, например, путем назначения антагонистов LHRH или антагонистов, известных из области техники) (табл. 6).
Несмотря на то, что настоящее изобретение поясняется в связи с конкретными способами его осуществления, многие другие варианты и модификации, а также использование изобретения по другому назначению вполне очевидно для специалистов. Настоящее изобретение определяется формулой изобретения и не ограничивается приведенным описанием.
Реферат
Описываются новые антиандрогенные соединения общей формулы I, где значения R4, R6, R17α указаны в п.1 формулы. Соединения оказывают эффективное антагонистическое воздействие и при этом практически лишены агонистических свойств. Описывается также предшественник антиандрогенного соединения и фармацевтические композиции на основе соединений общей формулы I, которые используются для лечения андрогензависимых заболеваний. 5 с. и 3 з.п. ф-лы, 6 табл.

Формула

где пунктирная линия обозначает необязательную пи-связь;
R4 обозначает атом водорода или -CH3;
R6 обозначает атом водорода, метил, -CH2CH3 или галоген, однако R6 является водородом, когда необязательно пи-связь в положении 6, 7 отсутствует;
R17α представляет собой A) галогензамещенный ненасыщенный углеводородный фрагмент, содержащий по крайней мере один атом галогена, отделенный от указанного D- кольца по крайней мере 4 промежуточными атомами углерода, и не содержащий атома углерода, отделенного от указанного D- кольца более чем четырьмя промежуточными атомами; B) галогеналкильный фрагмент, содержащий по крайней мере один атом галогена, отделенный от указанного D- кольца по крайней мере тремя промежуточными атомами и не содержащий атома углерода, отделенного от указанного D- кольца более чем четырьмя промежуточными атомами,
при условии, что R17α не является -C≡C-(CH2)3X, когда R4 или R6 оба представляют водород, X представляет галоген.

3. Антиандрогенное соединение по п.1, выбранное из группы, включающей 17α - (5' -хлорпентинил)-17β-гидрокси-6α-метил-4-андростен-3-он

17α - (5' -иодпентинил)-17β-гидрокси-6α-метил-4-андростен-3-он

17α-(4'-хлорбутинил)-17β-гидрокси-4-андростен-3-он

17α-(5' -хлорпентинил)-17β-гидрокси-6-метил-4-андростен-4,6-диен-3-он

4. Предшественник антиандрогенного соединения общей формулы

где пунктирная линия обозначает необязательную пи-связь;
R4 обозначает атом водорода или -CH3;
R6 обозначает атом водорода, метил, -CH2CH3 или галоген, однако R6 является водородом, когда необязательно пи-связь в положении 6, 7 отсутствует;
R17α представляет собой A) галогензамещенный ненасыщенный углеводородный фрагмент, содержащий по крайней мере один атом галогена, отделенный от указанного D- кольца по крайней мере 4 промежуточными атомами углерода, и не содержащий атома углерода, отделенного от указанного D- кольца более чем четырьмя промежуточными атомами; B) галогеналкильный фрагмент, содержащий по крайней мере один атом галогена, отделенный от указанного D- кольца по крайней мере тремя промежуточными атомами и не содержащий атома углерода, отделенного от указанного D- кольца более чем четырьмя промежуточными атомами,
при условии, что R17α не является -C≡C-(CH2)3X,, когда R4 или R6 оба представляют водород, X представляет галоген, где R3 является группой, которая in vivo превращается в кетогруппу.

где n равно 2 или 3;
X обозначает атом хлора, брома или иода;
R4 представляет водород;
R6 представляет метил.

Комментарии