Способ получения 3β-гидрокси-17-(1н-бензимидазол-1-ил)андроста-5,16-диена - RU2749134C1
Код документа: RU2749134C1
Чертежи


Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к области способов синтеза активных ингредиентов для фармацевтического применения, и в частности, к способу получения в промышленном масштабе 3β-гидрокси-17-(1Н-бензимидазол-1-ил)андроста-5,16-диена, также известного как галетерон – соединения, применимого для лечения рака предстательной железы, имеющего следующую формулу:

Уровень техники
Галетерон, 3β-гидрокси-17-(1Н-бензимидазол-1-ил)андроста-5,16-диен, впервые описан в статье «Three dimensional pharmacophore modeling of human CYP17 inhibitors. Potential agents for prostate cancer therapy», O. Omoshile et al., J. Med. Chem., 2003, 46 (12), pages 2345-2351, фигура 1 на странице 2347, с аббревиатурой VN/124-1*. В статье не сообщается экспериментальное описание получения, как цели работы, молекул, среди которых галетерон, но дается ссылка на некоторые другие публикации по их синтезу.
Среди публикаций, цитированных в статье O. Omoshile et al., важной является статья «Novel 17-azolyl steroids, potent inhibitors of human cytochrome 17α-Hydroxylase-C17,20-lyase (P45017α): potential agents for the treatment of prostate cancer», V. C. O. Njar et al., J. Med. Chem., 1998, 41 (6), pages 902-912, в которой описывается последовательность реакций, которая, вспоминаемая и описанная определенно в J. Med. Chem. 2005, 48, 2972-2984, ведет к получению галетерона.
Первая стадия синтеза описана в «Novel C-17-Heteroaryl steroidal CYP17 inhibitors/antiandrogens: synthesis, in vitro biological activity, pharmacokinetics, and antitumor activity in the LAPC4 human prostate cancer xenograft model», V. D. Handratta et al., J. Med. Chem., 2005, 48 (8), pages 2972-2984. Эта стадия синтеза состоит из реакции Вильсмейера-Хаака, в которой используют 3β-ацетоксиандроста-5-ен-17-он (1) в качестве исходного материала для получения 3β-ацетокси-17-хлорандроста-5,16-диена (2) и 3β-ацетокси-17-хлор-16-формиландроста-5,16-диена (3), как показано на приведенной далее схеме.

Только промежуточное соединение (3) с выходом в реакции 77% применимо для последующих взаимодействий, в то время как соединение (2) с выходом в реакции 11,4% следует отбросить.
В указанной выше статье Njar et al. разделение двух продуктов реакции осуществляют флэш-хроматографией (FCC) на силикагеле.
Синтез, описанный в статье Handratta et al., начинается с соединения (3), полученного так, как описано выше; соединение (3) вводят во взаимодействие с бензимидазолом, получая таким образом промежуточное соединение 3β-ацетокси-17-(1H-бензимидазол-1-ил)-16-формиландроста-5,16-диен (4):
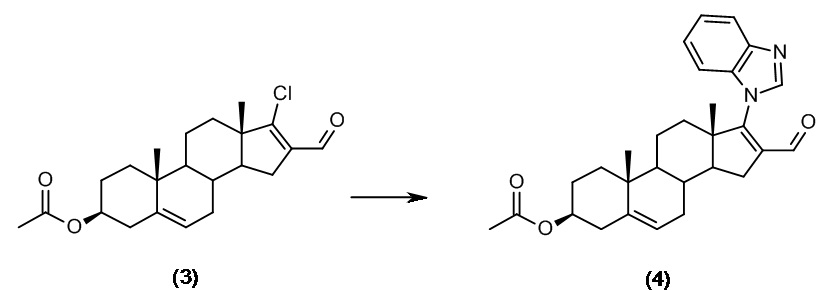
Очистку промежуточного соединения (4) осуществляют флэш-хроматографией (FCC) на силикагеле.
Затем промежуточное соединение (4) термически деформилируют, используя в качестве катализатора 10% палладий на угле (Pd/C), в количестве, равном 50 мас.% промежуточного соединения (4):

Очистку промежуточного соединения (5) осуществляют флеш-хроматографией (FCC) на силикагеле.
Наконец, промежуточное соединение (5) деацетилируют в щелочных средах, и сырой галетерон (6) кристаллизуют из смеси этилацетат/метанол.

В связи с описанными выше реакциями в описаниях эксперимента данные по качеству (титр и чистота по ВЭЖХ) не приводятся.
Сущность изобретения
Целью настоящего изобретения является путь синтеза для получения галетерона, который проще, чем способы уровня техники, и легко применим в промышленности.
Эта цель достигается настоящим изобретением, которое в своем первом аспекте относится к способу получения галетерона (6), включающему взаимодействие между 17-иодандостра-5,16-диен-3β-олом (I) и бензимидазолом с образованием 3β-гидрокси-17-(1H-бензимидазол-1-ил)андостра-5,16-диена (6) (галетерона):

В своем втором аспекте изобретение относится к отделению фильтрацией от реакционной смеси соединения, которое можно получить путем взаимодействия галетерона с физиологически приемлемой органической или неорганической кислотой, причем это соединение применимо для очистки нужного продукта.
Предпочтительно фильтрацией выделяют диоксалат галетерона.
В третьем аспекте изобретение относится к солям, полученным взаимодействием с галетероном, которые используют для его очистки.
Краткое описание фигур
Фигуры 1, 2 и 3 показывают результаты анализа ВЭЖХ продуктов, полученных согласно способу по изобретению.
Подробное описание изобретения
В своем первом аспекте изобретение относится к способу синтеза галетерона (6), который применим в промышленном масштабе, включающему стадии, описанные подробно в настоящем описании далее.
В настоящем описании и в формуле изобретения в случае расхождения между химическим названием соединения и формулой, приведенной для него, последнюю следует рассматривать как правильную.
Цель стадий изобретения заключается во взаимодействии между 17-иодандроста-5,16-диен-3β-олом (I) и бензимидазолом в присутствии основания, 8-гидроксихинолина и иодида меди как катализаторов для образования 3β-гидрокси-17-(1H-бензимидазол-1-ил)андроста-5,16-диена (6), также известного как галетерон.

Соединение (I) 17-иодандроста-5,16-диен-3β-ол является соединением, уже известным из литературы как промежуточное соединение, применимое для синтеза абиратерона ацетата (II).
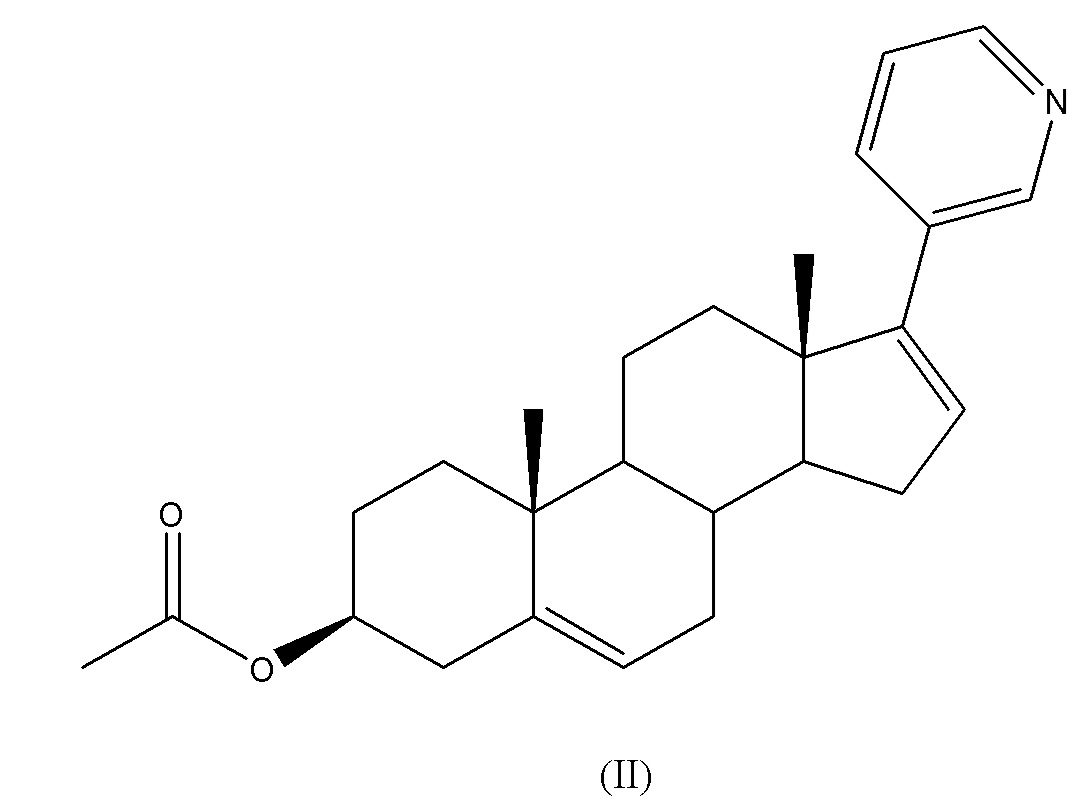
Получение соединения (I) 17-иодандроста-5,16-диен-3β-ола описано в Organic Preparations and Procedures Int., 29(1), 123-134 (1997), в описании синтеза абиратерона ацетата.
Реакцию в настоящем изобретении осуществляют в одном органическом растворителе в присутствии бензимидазола, основания, иодида меди (CuI) и 8-гидроксихинолина (органический лиганд). В иодиде меди медь присутствует в степени окисления +1, и соединение обычно указывается в литературе с пометкой иодид меди (I), причем (I) показывает указанную степень окисления; в настоящем описании и в формуле изобретения будет приводиться только название «иодид меди» или формула CuI для того, чтобы избежать путаницы с соединением (I) – реагентом в реакции по изобретению.
Органический растворитель выбирают из диметилформамида (ДМФА), диметилацетамида (DMA), диметилсульфоксида (ДМСО) и 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинона (DMPU) и используют в количестве от 5 до 20 объемов, измеренных в мл, относительно массы в г соединения (I), загружаемого в реакцию (концентрация (об./мас.)).
Предпочтительным растворителем является диметилформамид, и его предпочтительно используют в объеме от 5 до 10 крат от массы (об./мас.) соединения (I).
Температура реакции составляет от 130°С до 200°С.
Пробная реакция, выполненная в микроволновом реакторе при поддержании температуры реакции 200°С в течение 1 часа, не показывает разложения исходного соединения (I) или полученного галетерона (6).
Предпочтительно температура реакции составляет от 140°С до температуры кипения реакционной смеси, полученной после добавления всех компонентов.
Время реакции составляет от 12 до 48 часов, предпочтительно от 14 до 24 часов.
В качестве органического лиганда проверяют 8-гидроксихинолин, 2-гидроксихинолин, 3-гидроксихинолин, 4-гидроксихинолин и 6-гидроксихинолин. Образование галетерона наблюдают только при использовании 8-гидроксихинолина.
8-Гидроксихинолин используют в количестве по меньшей мере 1,8% относительно массы соединения (I), используемого в реакции. Предпочтительно 8-гидроксихинолин используют в количестве, равном 3,6% от массы соединения (I), загружаемого в реакцию.
Используемое основание можно выбрать из карбоната натрия, карбоната калия, карбоната цезия, трет-бутилата натрия, трет-бутилата калия, гидроксида натрия и гидроксида калия.
Предпочтительно используют карбонат калия (К2СО3).
Основание используют в количестве по меньшей мере 40% и предпочтительно 80% относительно массы соединения (I).
Бензимидазол используют в количестве по меньшей мере 30%, предпочтительно по меньшей мере 36% относительно массы соединения (I).
Катализатор CuI используют в количестве от 1,2% до 5% от массы соединения (I). Предпочтительно CuI используют в количестве, равном 2,4% относительно массы соединения (I).
Сырой галетерон, полученный в реакции, выполненной при следовании указаниям, приведенным выше, можно очистить, подвергая его хроматографии на силикагеле и кристаллизуя его из органического растворителя согласно обычным методам, известным в области органического синтеза.
Однако авторы изобретения неожиданно удостоверились, что получение производного галетерона с кислотой и выделение его из реакционной смеси простой фильтрацией предоставляет особенно эффективный способ обогащения без обращения к очисткам путем хроматографии, с уровнями чистоты, которые требуются для активного ингредиента для применения в фармацевтических композициях. В качестве кислот можно использовать физиологически приемлемые неорганические или органические кислоты, такие как хлороводородная кислота, бромоводородная кислота, серная кислота, фосфорная кислота, уксусная кислота, пропионовая кислота, малеиновая кислота, лимонная кислота, молочная кислота, щавелевая кислота, бензойная кислота, фумаровая кислота, янтарная кислота, винная кислота и ксинафоевая (xinafoic) кислота; эти кислоты можно использовать в безводной или гидратированной форме.
Предпочтительно в качестве кислоты используют гидрат щавелевой кислоты в количествах по меньшей мере два моля кислоты на моль галетерона, который очищают, получая диоксалат галетерона формулы

После удаления большей части катализатора фильтрацией раствор, в котором образовался галетерон, можно обработать скавенджером металла для устранения любых остаточных количеств металла, который возможно присутствует; подходящими для такой цели являются продукты группы QuadraSil®, продаваемые Sigma-Aldrich, в частности, продукт QuadraSil® MP, состоящий из сферических частиц макропористого диоксида кремния, функционализированного для удаления остаточных металлов из содержащих их продуктов (QuadraSil® является зарегистрированным товарным знаком компании Johnson Matthey).
Образование диоксалата галетерона происходит путем взаимодействия галетерона с щавелевой кислотой в органическом растворителе, из которого диоксалат выделяется как твердое вещество, которое можно отфильтровать.
После фильтрации диоксалат промывают подходящим растворителем, например, толуолом, метиленхлоридом или ацетонитрилом, сушат (обычно при пониженном давлении), затем ресуспендируют в подходящем органическом растворителе и обрабатывают основанием, добавленным в чистом виде или растворенным в растворителе, и извлекают чистый галетерон.
Органический растворитель, в котором суспендируют диоксалат, выбирают из ксилола, толуола, циклогексана, гептана, гексана, метиленхлорида и ацетонитрила или чистых или смешанных друг с другом; предпочтительным растворителем для этой операции является чистый метиленхлорид.
Основание выбирают из гидрокарбоната натрия, гидрокарбоната калия, гидроксида натрия, гидроксида лития, гидроксида калия, карбоната натрия, карбоната цезия и карбоната калия, растворенных в воде или в спирте, таком как метанол, этанол, изопропанол; предпочтительно используют гидроксид натрия, растворенный в метаноле.
Изобретение будет дополнительно поясняться следующими далее примерами.
ПРИБОРЫ, МЕТОДЫ И УСЛОВИЯ ИСПЫТАНИЙ
ЯМР
Спектрометр ЯМР JEOL 400 YH (400 МГц); пробирки ЯМР Aldrich® ColorSpec®;
программа JEOL Delta, v5.1.1;
спектры регистрируют в дейтерированном хлороформе Sigma-Aldrich: хлороформ-d, атома D 99,8%, содержит 0,1% (об./об.) тетраметилсилана (TMS) в качестве внутреннего стандарта; и хлороформ-d, “100%”, атома D 99,96%, содержит 0,03% (об./об.) TMS.
МС
Система ВЭЖХ-масс АВ Sciex API 2000 ЖХ/МС/МС;
Образцы впрыскивают непосредственно и ионизируют химически (CI).
ДСК
Прибор Perkin Elmer, мод. Diamond;
капсулы Perkin Elmer стандартные алюминиевые и крышки, код 02190041;
скорость сканирования 10°C/мин;
температурный интервал 20°C – 200°C.
ИК
Спектрометр Thermo Scientific Nicolet 6700;
регистрируют спектры FT-IR в KBr (твердый) и коэффициент диффузного отражения smart-iTR (ATR);
бромид калия Sigma-Aldrich, код 221864 (для ИК-анализа).
ВЭЖХ
Хроматографическая система Agilent, модель 1200 и 1260;
УФ-детектор, модель 1260 DAD VL, и лазерный детектор 1290 Infinity ELSD.
Система ЖХ/МС/МС
Хроматографическая система Agilent, модель 1100 с УФ-детектором DAD, соединенная с масс-спектрометром API 2000, Applied Biosystems.
Система Easy max 102 Mettler Toledo
Рабочее место для выполнения реакций синтеза.
Микроволновый реактор Milestone FlexiWAVE
Микроволновый реактор с двумя магнетронами по 950 ватт с общей мощностью 1900 ватт;
Milestone FlexiWAVE состоит из одной микроволновой платформы, которая, в комбинации с определенными дополнениями, позволяет выполнять классический синтез в стекле и при высоком давлении.
Пластины для ТСХ
MERCK. Силикагель для ТСХ 60 F254 на алюминиевых подложках 20 × 20 см, код 1.0554.0001.
Пластины для HPTLC
MERCK. Силикагель для HPTLC 60 F254 с зоной концентрации 10 × 2,5 см, код 1.13727.0001.
Детектор ТСХ/HPTLC
Кислый раствор фосфомолибдата церия.
Получение: 25 г гидрата фосфомолибденовой кислоты (Aldrich P7390), 10 г гидрата сульфата церия (IV) (Aldrich 31606) и 600 мл воды перемешивают до растворения с 60 мл 95-98% серной кислоты (Aldrich 258105); полученную смесь доводят водой до конечного объема 1000 мл; слой пропитывают раствором, затем греют до синего окрашивания.
УФ-свет при 254 и 366 нм.
Общие условия выполнения ТСХ (если не указано иное)
Элюент. Смесь метиленхлорид/метанол 9/1, об./об..
Детектор. УФ-церийфосфомолибденовый детектор.
Реакционный образец. 1 мл реакционной смеси в 2 мл воды экстрагируют 2 мл изопропилацетата. Наносят 1 мкл.
Пластина. Силикагель для ТСХ 60 F254 на алюминиевых подложках 20 × 20 см.
Rf: исходный 0,60 – продукта 0,52.
Эталонный образец: аутентичные образцы, идентифицированные анализами ЯМР и массы.
Нанесение. Каждый контрольный тест выполняют, помещая на пластину реакционный образец, эталонный образец исходного продукта и конечного продукта и искусственную смесь реакционного образца с эталонными образцами.
Растворители и реагенты
Растворители и реагенты, используемы в примерах ниже, если не указано иное, должны представлять качественные коммерчески доступные продукты или продукты, которые можно получить процедурами, описанными в доступных публикациях.
Аббревиатуры
Аббревиатуры Rf и RRT, используемые в примерах, показывают фактор задержки в тонкослойной хроматографии (ТСХ) и относительное время удерживания соединения в высокоэффективной жидкостной хроматографии (ВЭЖХ), соответственно.
ПРИМЕР 1

Загружают 300 г 17-иодандрости-5,16-диен-3β-ола (I), 260,45 г K2CO3, 106,86 г бензимидазола, 7,18 г CuI, 10,94 г 8-гидроксихинолина и 1,5 л ДМФА в колбу в атмосфере азота и кипятят с обратным холодильником в течение 16 часов.
По окончании этого периода контроль ТСХ показывает, что реакция завершена.
Смесь охлаждают до 25°С, выливают в 6 л воды и перемешивают в течение 15 минут. Смесь фильтруют, и полученное твердое вещество промывают водой.
Твердое вещество растворяют в 3 л метиленхлорида (CH2Cl2), и получают двухфазную систему; добавляют 1 л воды, 6 г угля, 15 г дикалита, и все перемешивают в течение 10 минут. Смесь фильтруют, промывая остаток на фильтре 300 мл CH2Cl2.
Фазы разделяют, и органическую фазу промывают 300 мл насыщенного водного раствора NaCl.
Загружают 15 г QuadraSil® MP, перемешивают в течение 16 часов при 20 < T < 25°C, фильтруют через мембрану Millipore (JGWP), промывая 50 мл CH2Cl2.
Органическую фазу концентрируют при 45°С при пониженном давлении, отгоняя примерно 600 мл растворителя.
В оставшийся органический раствор добавляют дигидрат щавелевой кислоты (190,06 г) и перемешивают в течение 1 часа.
Полученное твердое вещество отфильтровывают, промывают 300 мл CH2Cl2 и сушат при 45°С и пониженном давлении в течение 16 часов.
Твердое вещество ресуспендируют в 1,35 л ацетонитрила (CH3CN), смесь кипятят с обратным холодильником в течение 15 минут и затем охлаждают до 25°C.
Смесь фильтруют, промывают 450 мл CH3CN, твердое вещество сушат при 45°С и пониженном давлении, и получают 358,9 г кристаллического порошка (промежуточное соединение 6-OX), элементный анализ которого показывает содержание углерода 63,18%, водорода 6,44%, азота 5,43%, кислорода 24,73%.
Суспендируют 332,0 г промежуточного диоксалата (6-ОХ) в 2324 мл CH2Cl2; к суспензии добавляют по каплям насыщенный водный раствор NaHCO3, и получают полное растворение твердого вещества (pH водной фазы равен 4,7).
Двухфазный раствор фильтруют, фазы разделяют, и органическую фазу промывают насыщенным водным раствором NaCl (300 мл).
Органическую фазу концентрируют, отгоняя до 2/3 объема, и загружают 700 мл трет-бутилового спирта (трет-BuOH); осуществляют перегонку до полного удаления CH2Cl2 и 120 мл трет-BuOH. Наблюдают выпадение продукта в осадок.
Загружают 581 мл воды, и смесь кипятят с обратным холодильником. Смесь охлаждают до 20 < T < 25°C, твердое вещество отфильтровывают и промывают 230 мл смеси трет-BuOH/вода, 1/1, и получают 293,2 г влажного продукта.
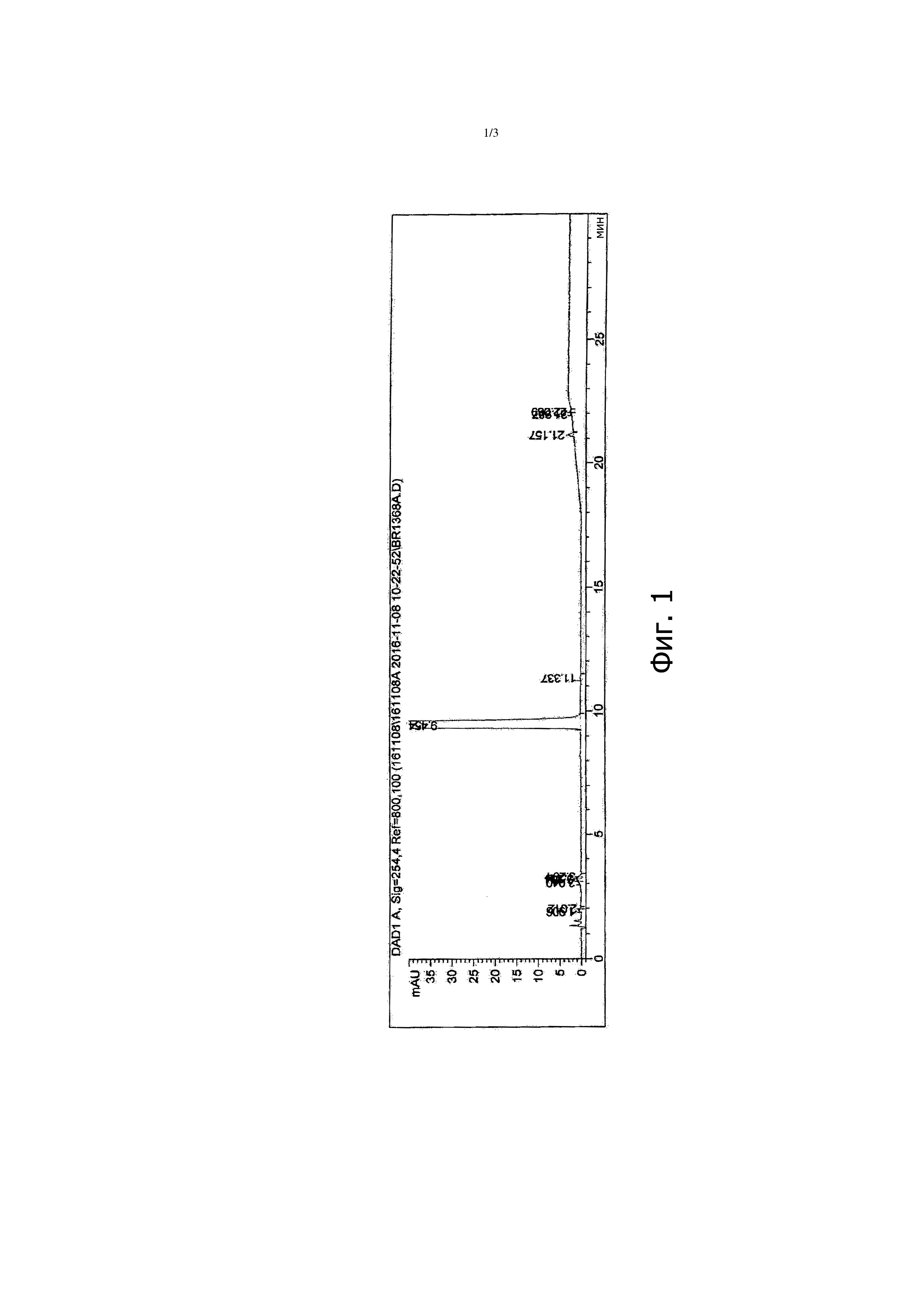
Образец, высушенный для аналитических целей и анализированный ВЭЖХ, показывает хроматографическую чистоту 99,55%; кривая ВЭЖХ приводится на фигуре 1.
Смешивают 290 г влажного продукта с 506,5 мл трет-BuOH и 506,5 мл воды, смесь кипятят с обратным холодильником в течение нескольких минут, охлаждают ее до 20 < T < 25°C, твердое вещество отфильтровывают и промывают 200 мл смеси трет-BuOH/вода, 1/1.
Твердое вещество сушат в сушильном шкафу при 50°C при пониженном давлении до постоянной массы (192,1 г).
Продукт, анализированный ВЭЖХ, показывает хроматографическую чистоту 99,73%; кривая ВЭЖХ приводится на фигуре 2.
Растворяют 190 г продукта при кипячении с обратным холодильником в 1235 мл (6,5 объемов) метилового спирта МеОН.
Отгоняют 95 мл растворителя, затем смесь охлаждают до 0°C в течение 1 часа. Смесь фильтруют, и остаток на фильтре промывают 100 мл холодного МеОН. Остаток сушат при 50°C при пониженном давлении в течение 16 часов.
Получают 163,4 г галетерона с чистотой по ВЭЖХ 99,83%; кривая ВЭЖХ приводится на фигуре 3.
ПРИМЕР 2
В атмосфере азота 500 мг 17-иодандроста-5,16-диен-3β-ола (I), 12 мг CuI, 430 мг K2CO3, 180 мг бензимидазола, 5 мл ДМФА и 18 мг 8-гидроксихинолина загружают в стеклянный реактор системы Easy max от Mettler Toledo и кипятят с обратным холодильником в течение 16 часов.
По окончании этого периода контроль ТСХ показывает, что реакция завершена.
Сырой образец подвергают хроматографии на силикагеле, элюируя смесью метиленхлорид/метанол, 9/1. Фракции, содержащие продукт, концентрируют досуха и кипятят с обратным холодильником в чистом метаноле до растворения. После охлаждения отфильтровывают кристаллическое твердое вещество, которое, высушенное до постоянной массы, представляет собой чистый галетерон (227 мг).
ПРИМЕР 3
Повторяют процедуру примера 2 только с тем отличием, что в качестве растворителя вместо ДМФА используют ДМСО (5 мл).
По окончании реакции контроль ТСХ показывает, что последняя завершена.
ПРИМЕР 4
Повторяют процедуру примера 2 только с тем отличием, что в качестве растворителя вместо ДМФА используют DMPU (5 мл).
По окончании реакции контроль ТСХ показывает, что последняя завершена.
ПРИМЕР 5
Повторяют процедуру примера 2 только с тем отличием, что используют 344 мг K2CO3 (68,8 мас.% относительно соединения (I)).
По окончании реакции контроль ТСХ показывает, что последняя завершена.
ПРИМЕР 6
Повторяют процедуру примера 2 только с тем отличием, что используют 258 мг K2CO3 (51,6 мас.% относительно соединения (I)).
По окончании реакции контроль ТСХ показывает, что последняя завершена.
ПРИМЕР 7
Повторяют процедуру примера 2 только с тем отличием, что в качестве растворителя вместо ДМФА используют DMА (5 мл).
По окончании реакции контроль ТСХ показывает, что последняя почти завершена с примерно 15% непрореагировавшего соединения (I).
ПРИМЕР 8
Повторяют процедуру примера 2, но используя 2,5 мл растворителя ДМФА.
По окончании реакции контроль ТСХ показывает, что последняя завершена.
ПРИМЕР 9
Повторяют процедуру примера 2, но используя 6 мг CuI.
По окончании реакции контроль ТСХ показывает, что последняя завершена частично.
ПРИМЕР 10
Повторяют процедуру примера 2, но используя 9 мг 8-гидроксихинолина.
По окончании реакции контроль ТСХ показывает, что последняя завершена частично.
Реферат
Изобретение относится к области органической химии, а именно к способу получения 3β-гидрокси-17-(1H-бензимидазол-1-ил)андроста-5,16-диена (6) (галетерона), включающего взаимодействие между 17-иодандроста-5,16-диен-3β-олом (I) и бензимидазолом в присутствии органического растворителя, основания, иодида меди и 8-гидроксихинолина, где 8-гидроксихинолин используют в количестве по меньшей мере 1,8 мас.% относительно соединения (I), и иодид меди (CuI) используют в количестве от 1,2 мас.% до 5 мас.% относительно соединения (I), используемого в реакции, и где температура реакции составляет от 130°С до 200°С. Также изобретение относится к промежуточному соединению диоксалату 3β-гидрокси-17-(1H-бензимидазол-1-ил)андроста-5,16-диена (галетерона). Технический результат: разработан новый способ получения галетерона, отличающийся простотой и легкостью реализации в промышленности. 2 н. и 13 з.п. ф-лы, 3 ил., 10 пр.
Формула



Комментарии