Применение 5а-андростан-3в,5,6в-триола для изготовления нейропротекторных лекарственных средств - RU2541093C2
Код документа: RU2541093C2
Чертежи


Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому медицинскому применению соединения 5α-андростан-3β,5,6β-триол (далее обозначаемого как YC-6).
УРОВЕНЬ ТЕХНИКИ
Лечение при остром ишемическом инсульте (ОИС) традиционно заключается в тромболизисе или нейропротекции. Нейропротекция обозначает лекарственные средства или меры во время лечения ОИС, которые способны подавлять патологические и биохимические реакции в тканях головного мозга, вызванные ишемией, нарушать различные пути ишемического каскада и продлевать выживаемость нейронов.
В настоящее время нейропротекция стала одной из важных тем исследований в области лечения ОИС. На стадии клинической разработки находятся различные нейропротекторы, механизмы действия которых заключаются в предотвращении или ограничении повреждений головного мозга после ишемии путем блокирования различных вредных патологических процессов, вызванных ишемией для уменьшения отмирания ткани мозга и способствования восстановлению функции. Нейропротекторы могут уменьшать размер церебрального инфаркта, не приводят к осложнениям в виде кровоизлияния, которые могут возникнуть во время лечения с помощью тромболитиков или антикоагулянтов, и могут быть использованы без подтверждения этиологии, что делает возможным своевременное лечение. Поэтому терапевтическое действие нейропротекторов является перспективным.
В настоящее время не существует нейропротекторов, для которых была бы доказана безопасность и эффективность. Лекарственные средства, которые находятся на стадии клинических испытаний и имеют потенциальную ценность для клинического применения, включают блокаторы кальциевых каналов (БКК), модуляторы кальциевых каналов, ингибиторы высвобождения глутамата, γ-аминомасляную кислоту (ГАМК), агонисты рецепторов, акцепторы свободных радикалов, антитела к молекулам межклеточной адгезии и т.д.
По сравнению с различными соединениями нейроактивные стероиды вызывают интерес из-за их многопланового действия при нейропротекции. Уровни нейроактивных стероидов коррелируют с развитием и прогрессией некоторых заболеваний центральной нервной системы (ЦНС) и играют значительную роль в модуляции повреждения, смерти нейронов и этих заболеваний ЦНС. Указанные стероидные гормоны как природные, так и синтетические, обладающие с активностью в нервных тканях, в 1980-х получили название «нейроактивные стероиды (НАС)». Эти стероидные гормоны использовались в клинике в качестве заместительной терапии. Известно, что эстроген является одним из НАС, который имеет сильнейший нейропротекторный эффект. Яичники женщин в постменопаузе не вырабатывают эстроген, что, вероятно, приводит к отложению белка бета-амилоида (Аβ) и затем болезни Альцгеймера (БА). Введение эстрогена может значительно снизить уровни Аβ в мозге. В клинике были получены хорошие результаты при лечении БА с помощью эстрогена. Было показано, что in vitro аллопрегнанолон защищает нейроны гиппокампа в культуре при необратимом нейротоксическом инсульте, вызванном гипоксией или глутаматом. 5α-андростан-3β,5,6β-триол (YC-6) представляет собой соединение, которое, как было выяснено в процессе исследований авторов настоящего изобретения в области нейростероидов, оказывает нейропротекторное действие и имеет следующую формулу. Обзор литературы до настоящего времени не выявил сообщений о фармакологическом действии YC-6 или его нейроактивности/нейропротекторном действии.

КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является обеспечение применения 5α-андростан-3β,5,6β-триола в изготовлении нейропротекторных лекарственных средств для того, чтобы создать новое лекарственное средство для лечения заболеваний, опосредованных нейронами.
Наши исследования показали, что 5α-андростан-3β,5,6β-триол (YC-6) достоверно подавляет связанные с экзайотоксичностью повреждения гранулярных нейронов мозжечка, кортикальных нейронов и моторных нейронов спинного мозга, вызванные глутаматом, увеличивает выживаемость нейронов и снижает высвобождение лактат дегидрогеназы дозозависимым образом с наименьшей эффективной концентрацией 1 мкМ. Также YC-6 значительно подавляет повреждение кортикальных нейронов головного мозга, вызванное ишемией, дозозависимым образом с наименьшей эффективной концентрацией 2,5 мкМ.
Для подтверждения нейропротекторного действия YC-6 in vivo использовали модель фокальной ишемии головного мозга и модель повреждения спинного мозга, вызванного блокадой брюшной аорты, для исследования защитного действия YC-6 при повреждении нейронов, вызванном ишемией головного мозга у крыс, и ишемией спинного мозга у кроликов.
1 мг/кг YC-6 вводили с помощью инъекций в хвостовую вену крыс в группе YC-6 за 30 мин до ишемии мозга. У животных в группе YC-6 была намного выше балльная оценка неврологической функции и намного меньше площадь инфаркта мозга, чем в нелеченной контрольной группе, что указывает на то, что YC-6 оказывает значительное защитное действие при повреждении нейронов мозга.
У кроликов, получавших 2 мг/кг YC-6 за 30 мин до ишемии спинного мозга, была значительно выше балльная оценка неврологической функции, чем в контрольной группе, не получавшей лечение. Паралич отсутствовал в группе YC-6, тогда как в контрольной группе у всех животных был паралич. Методами гистопатологии было показано, что по сравнению с контрольной группой у животных в группе YC-6 сохранялось большее количество нормальных моторных нейронов в передних рогах спинного мозга, что также указывало на то, что YC-6 оказывает значительное защитное действие против повреждения нейронов спинного мозга.
Учитывая все указанное выше, YC-6 обладает защитным действием против повреждения нейронов, вызванного гипоксией, ишемией головного мозга или ишемией спинного мозга. На сегодняшний момент отсутствуют исследования, свидетельствующие об активности в отношении нейронов/нейропротекторном действии YC-6.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1. Защитное действие YC-6 против вызванной глутаматом экзайотоксичности для гранулярных нейронов мозжечка, моторных нейронов спинного мозга и кортикальных нейронов головного мозга. Морфология (А) гранулярных нейронов, (В) моторных нейронов спинного мозга и (С) кортикальных нейронов головного мозга; (D) скорость высвобождения LDH и (Е) выживаемость нейронов.* и**: статистически значимые различия про сравнению с группой глутамата (Glu) гранулярных нейронов мозжечка,*P<0.05 и**P<0.01;# и##: статистически значимые различия по сравнению с группой (Glu) моторных нейронов спинного мозга,#P<0.05 и##P<0.01;$и$$ статистически значимые различия по сравнению с группой глутамата (Glu) кортикальных нейронов головного мозга,$P<0.05 и$$P<0.01.
Фигура 2. Защитное действие YC-6 YC-6 против поражения кортикальных нейронов, вызванного гипоксией. (А) результаты исследования с помощью фазово-контрастной микроскопии; (В) степень выживаемости нейронов; (С) скорость высвобождения LDH.##: статистически значимые различия по сравнению с контрольной группой, P<0.01;* и**: статистически значимые различия по сравнению с группой гипоксии,*P<0.05,**P<0.01.
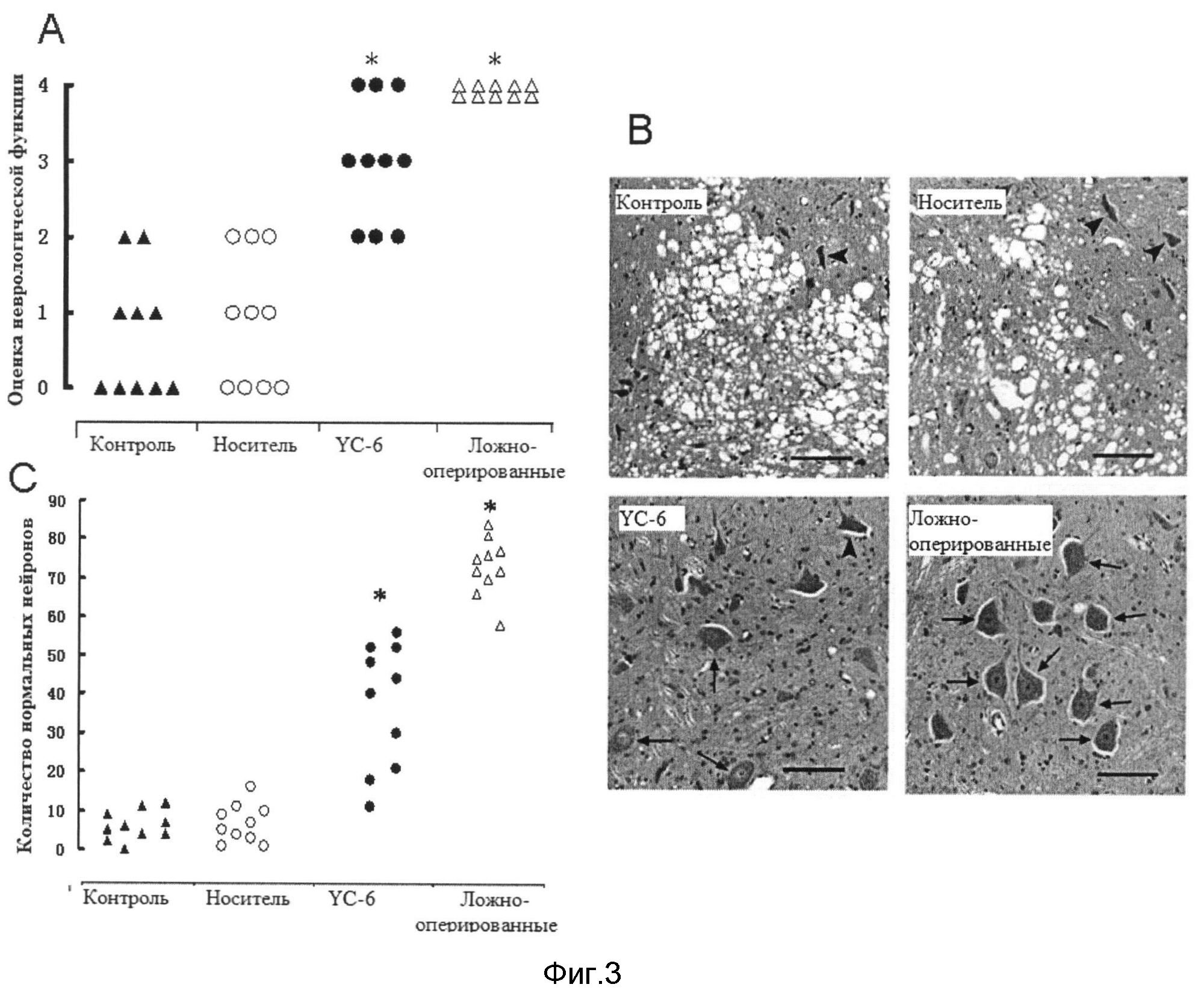
Фигура 3. Нейропротекторное действие YC-6 при ишемии спинного мозга кроликов, вызванной блокадой брюшной аорты. (А) балльная оценка неврологической функции; (В) гистопатология срезов (окраска ГЭ); (С) число нормальных моторных нейронов спинного мозга.
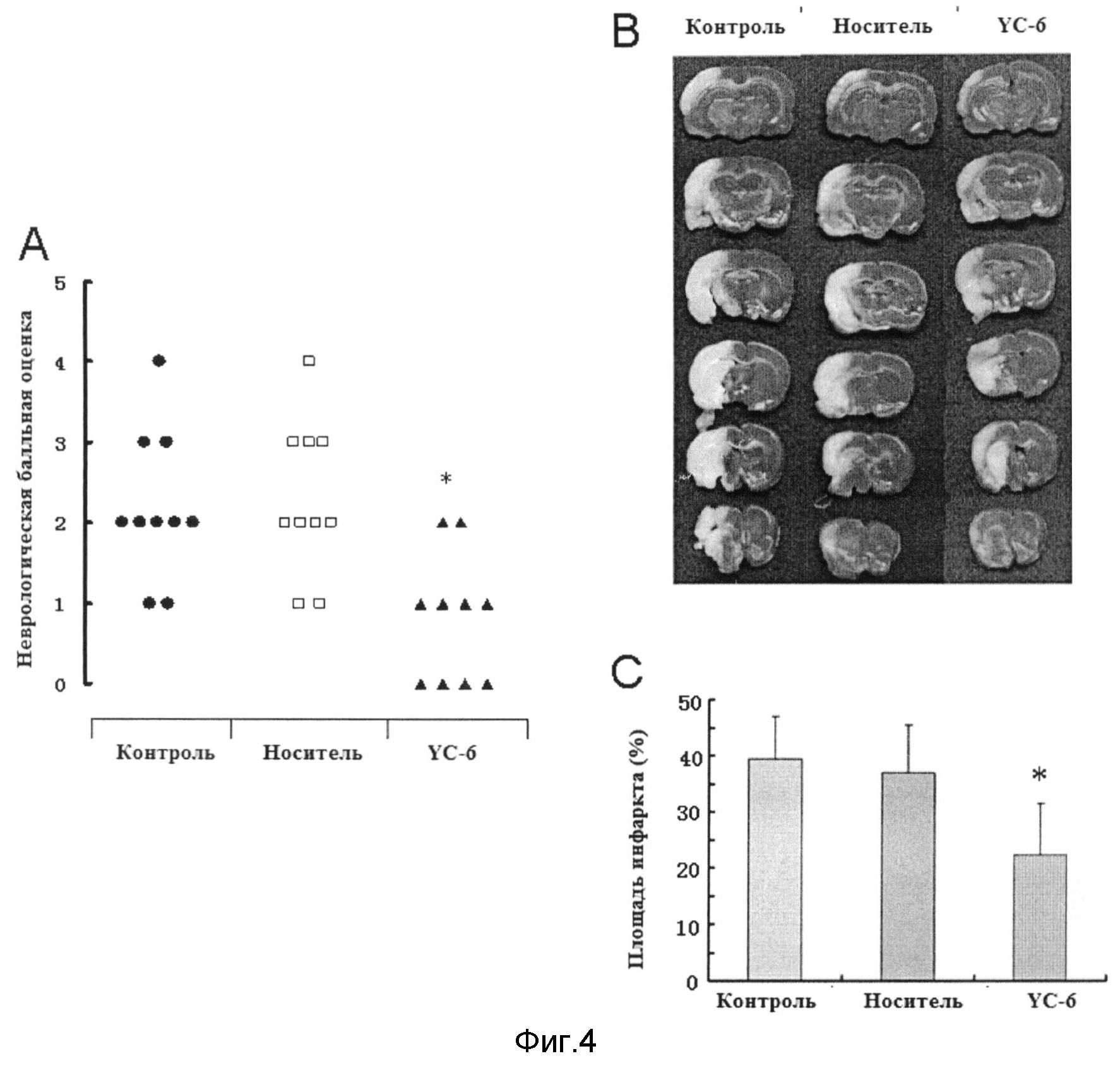
Фигура 4. Нейропротекторное действие YC-6 при фокальной ишемии мозга крыс.(А) балльная оценка неврологической функции; (В) срезы мозга (окрашивание ТТС); (С) сравнение размера инфаркта мозга.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет более подробно описано ниже с помощью примеров. Однако настоящее изобретение не ограничивается следующими примерами.
ПРИМЕР 1. Первичная культура нейронов
1. Первичные культуры гранулярных нейронов мозжечка крысы
Мозжечок после удаления мозговых оболочек и кровеносных сосудов получали у 7-8 дневных крыс, весивших 15-20 г. ДНазу I 0,05 г/л использовали для разделения ткани на отдельные клетки пипетированием после ферментативной обработки 0,25 г/л трипсином. Затем суспензию центрифугировали для получения осадка и ресуспендировали его в среде ВМЕ, содержащей 10% (v/v) FBS и 25 мМ КС1. После этого клетки сеяли на чашки Петри, покрытые полилизином. Через 24 часа после посева добавляли 10 мкМ Ara-С для подавления роста и пролиферации не-нейрональных клеток, чтобы чистота гранулярных нейронов мозжечка была не меньше 95%. Добавляли глюкозу в процессе культивирования для обеспечения дополнительной энергии для клеточного метаболизма. Эксперименты проводили в течение 8 дней in vitro.
2. Моторные нейроны спинного мозга крысы
Спинной мозг получали у самок крыс SD на 15-неделе беременности. Удаляли мозговые оболочки и пленку крови. Ткань костного мозга плодов крыс обрабатывали 0,125% трипсином и затем центрифугировали для получения промежуточного слоя, обогащенного моторными нейронами. Разрушенные клетки удаляли с помощью центрифугирования и клетки разделяли по различной скорости прикрепления в течение 1 часа. Находящиеся в суспензии моторные нейроны спинного мозга с замедленной скоростью прикрепления собирали и сеяли. Через 24 часа после посева добавляли Ara-С. Питательную среду меняли на 3 DIV с бессывороточной средой L-15 с последующей сменой половины среды через каждые 2-3 дня. Эксперименты проводили в течение 3-5 дней in vitro.
3. Кортикальные нейроны крысы
Кору мозга с удаленными мозговыми оболочками и кровеносными сосудами получали у новорожденных крыс (возраст 1 день). ДНазу I 0,05 г/л использовали для разделения ткани на отдельные клетки пипетированием после ферментативной обработки 0,25 г/л трипсином. Затем суспензию центрифугировали для получения осадка и разбавляли его в среде DMEM-F12, содержавшей 5% (v/v) FBS и 2% В27. Клетки сеяли на чашки Петри, покрытые полилизином. Через 24 часа после посева добавляли 10 мкМ Ara-С для подавления роста и пролиферации не-нейрональных клеток, чтобы чистота гранулярных нейронов мозжечка была не меньше 95%. Проводили замену половины среды на свежую 2-3 раза в неделю. Эксперименты проводили в течение 10 дней in vitro.
ПРИМЕР 2. Защитное действие YC-6 на первичных культурах нейронов
1. Защитное действие YC-6 при вызванной глутаматом экзайтотоксичности в отношении гранулярных нейронов мозжечка
Гранулярные нейроны мозжечка, культивированные в течение 8 дней, делили на 4 группы: контрольная группа, группа глутамата, группа МК801+глутамат и группа YC-6+глутамат. Контрольную группу не обрабатывали ничем. Группу глутамата обрабатывали 200 мкМ глутамата. Группу МК801 и группу YC-6 предварительно обрабатывали различными концентрациями МК801 (10 мкМ) и YC-6, соответственно, с последующей инкубацией при 37°C в течение 30 минут, а затем добавляли глутамат. Через 24 часа с помощью фазово-контрастной микроскопии оценивали морфологию нейронов. Клетки окрашивали FDA и считали клетки под инвертированным флуоресцентным микроскопом для определения степени выживаемости нейронов. Также в каждой группе определяли активность лактатдегидрогеназы (LDH).
Выживаемость = Количество живых клеток в каждой группе/Количество живых клеток в контрольной группе * 100%
Результаты показали, что большинство гранулярных нейронов мозжечка в группе YC-6+глутамат и группе МК801+глутамат сохраняли целостность тела и процессов и имели повышенную выживаемость и сниженное высвобождение LDH. Статистически значимые различия наблюдались между группами YC-6 и МК801 и группой глутамата. Как показано на Фигурах 1-А, D и Е, действие YC-6 зависело от концентрации. YC-6 не влияло на выживаемость нормальных нейронов в пределах указанных доз.
2. Защитное действие YC-6 при экзайтотоксичности глутамата в отношении моторных нейронов спинного мозга
Первичную культуру моторных нейронов спинного мозга на 5 день культивирования in vitro делили на четыре группы: контрольная группа, группа глутамата, группа МК801+глутамат и группа YC-6+глутамат. Контрольную группу не обрабатывали ничем. Группу глутамата обрабатывали 200 мкМ глутамата. Группу МК801 и группу YC-6 предварительно обрабатывали МК801 (10 мкМ) и YC-6 в различных концентрациях, соответственно, с последующей инкубацией при 37°C в течение 30 минут, после чего добавляли глутамат. Через 24 часа с помощью фазово-контрастного микроскопа оценивали морфологию нейронов. Клетки окрашивали FDA и под инвертированным флуоресцентным микроскопом проводили подсчет клеток для определения выживаемости нейронов. В каждой группе также определяли активность лактатдегидрогеназы (LDH).
Выживаемость = Количество живых клеток в каждой группе/Количество живых клеток в контрольной группе * 100%
Исследования с помощью фазово-контрастного микроскопа показали, что в контрольной группе большое количество живых моторных нейронов спинного мозга выживали с интактным треугольным или полигональным телом. Клетки были стереоскопическими и имели гало и заметные нейриты. Небольшое количество моторных нейронов спинного мозга выживало в группе глутамата, несмотря на образованные нейриты. Клетки в данной группе были серьезно повреждены. Число моторных нейронов спинного мозга в группах МК801 + глутамат и YC-6 + глутамат значительно увеличивалось, и наблюдали много нейритов несмотря на небольшое количество мертвых клеток. По сравнению с контрольной группой выживаемость в остальных группах была снижена в различной степени. По сравнению с группой глутамата выживаемость в группе YC-6+глутамат была значительно повышена и зависела от концентрации YC-6, как показано на Фигурах 1-В, D и Е. YC-6 не оказывало действия на выживаемость нормальных нейронов в пределах указанных доз.
3. Защитное действие YC-6 при вызванной глутаматом экзайтотоксичности в отношении кортикальных нейронов
Первичную культуру кортикальных нейронов на 10 день культивирования in vitro делили на четыре группы: контрольная группа, группа глутамата, группа МК801 + глутамат и группа YC-6+глутамат. Контрольную группу не обрабатывали ничем. Группу глутамата обрабатывали 200 мкМ глутамата. Группу МК801 и группу YC-6 предварительно обрабатывали МК801(10 мкМ) и YC-6 в различных концентрациях, соответственно, с последующей инкубацией при 37°C в течение 30 минут, после чего добавляли глутамат. Через 24 часа с помощью фазово-контрастного микроскопа оценивали морфологию нейронов. Клетки окрашивали FDA и под инвертированным флуоресцентным микроскопом проводили подсчет клеток для определения выживаемости нейронов. В каждой группе также определяли активность лактатдегидрогеназы (LDH).
Выживаемость = Количество живых клеток в каждой группе/Количество живых клеток в контрольной группе * 100%
Результаты показали, что большое количество кортикальных нейронов в группах YC-6+глутамат и МК801+глутамат сохраняли интактное тело и нейриты, и имели повышенную выживаемость и пониженное высвобождение LDH. Статистически значимые различия наблюдали между группами YC-6 и МК801 и группой глутамата. Как показано на Фигурах 1-С, D и Е, действие YC-6 зависело от концентрации. YC-6 не оказывало действия на выживаемость нормальных нейронов в пределах указанных доз.
4. Защитное действие YC-6 при поражении кортикальных нейронов, вызванном гипоксией
Первичную культуру кортикальных нейронов на 10 день культивирования in vitro делили на четыре группы: контрольная группа, группа с гипоксией, группа МК801+гипоксия и группа YC-6+гипоксия. На каждую группу отводили по три лунки в двух параллельностях. Контрольную группу инкубировали в CO2-инкубаторе при нормоксии. Группу с гипоксией помещали в рабочую станцию с гипоксией (1% концентрация кислорода). Группу МК801 + гипоксия и группу YC-6 + гипоксия предварительно обрабатывали МК80Ц10 мкМ) и YC-6 в различных концентрациях за 30 мин до помещения в рабочую станцию с гипоксией (1% концентрация кислорода). Через 12 часов с помощью фазово-контрастного микроскопа исследовали и делали фотографии клеток.
Обработку проводили в 96-луночных планшетах. В каждую лунку добавляли 200 мкл стокового раствора МТТ и инкубировали в течение 4 часов. В живых клетках образовывались кристаллы синего цвета. Из каждой лунки удаляли жидкость и заменяли ее на 150 мкл DMSO для растворения кристаллов. Кристаллы растворялись через полчаса, и определяли значения OD при длине волны 570 нм с использованием считывающего устройства для микропланшетов. Из каждой группы получали по 50 мкл питательной среды в различные моменты времени и определяли высвобождение LDH в каждой лунке согласно инструкции производителя. Данные представляли в виде среднее ± SD, проводили однопараметрический анализ ANOVA и использовали парный t-тест и анализ вариантов среднего множества образцов. Смотрите ссылки [1] и [2]. [1] Brewer G.J. Isolation and culture of aldut rat hippocampal neurons. J. Neurosci. Meth. 1997, 71:143-155. [2] Lee M.M., Hseih M.T. Magnolol protects cortical neuronal cells from chemical hypoxia in rats. Neuroreport 1998, 9:3451-3456.
Результаты показали, что клетки в первичной культуре кортикальных нейронов крысы на 10 день культивирования in vitro имели конусообразную форму или много конечную форму со светлым телом, четкими границами и ядром. Клетки имели очень высокую преломляющую способность, и нейриты соединялись с образованием сети.
Показано, что у кортикальных нейронов под действием гипоксии нарушается целостность, и снижается преломляющая способность. Нейриты разрушались или исчезали. Цитоплазма претерпевала гранулярную дегенерацию. Некоторые тела разбухали или исчезали.
По сравнению с контрольной группой в группе МК801+гипоксия и группе YC-6+гипоксия отсутствовали отличия в морфологии кортикальных нейронов. Защитное действие в отношении нейронов YC-6 зависело от концентрации (Фигура 2А). Метод МТТ показал, что действие гипоксии значительно снижало выживаемость нейронов (P<0.05), тогда как YC-6 повышало выживаемость нейронов в зависимости от концентрации (Фигура 2В). Данные высвобождения LDH соответствовали результатам МТТ. В группе, предварительно обработанной YC-6, уменьшалось поражение нейронов, вызванное гипоксией, в зависимости от концентрации (Фигура 2-С, P<0.05).
ПРИМЕР 3. Нейропротекторное действие YC-6 при ишемии спинного мозга у кролика, вызванной блокадой брюшной аорты
40 самцов новозеландских белых кроликов делили на 4 группы (n=10): Контрольная группа для моделирования ишемии спинного мозга кролика; группа YC-6, которой внутривенно вводили 2 мг/кг стероидного YC-6 через краевую вену уха кролика за 30 мин до ишемии спинного мозга; группа носителя, в которой таким же образом за 30 мин до ишемии спинного мозга вводили эквивалентное количество гидроксипропил циклодекстринов (1 мл/кг); группа ложно-оперированных животных, в которой осуществляли только воздействие на брюшную аорту, но не блокаду.
Процесс установления модели ишемии спинного мозга у кроликов осуществляли согласно ссылкам [3] и [4] и предыдущему сообщению авторов [5]. [3] Celik М. et al. Erythropoietin prevents motor neuron apopotosis and neurologic disability in experimental spinal cord ischemic injury. Proc Natl Acad Sci USA, 2002, 99: 2258-2263. [4] Johnson SH, Kraimer J.M., Graeber G.M. Effects of flunarizine on neurological recovery and spinal cord blood flow in experimental spinal cord ischemia in rabbits. Stroke, 1993, 24: 1547-1553. [5] Sang H., Cao L., Qiu P., Xiong L., Wang R., Yan G. Isoflurane produces delayed preconditioning against spinal cord ischemic injury via release of free radicals in rabbits. Anesthesiology, 2006, 105: 953-960.
Физиологические параметры получали для каждой группы непосредственно перед ишемией, через 10 мин после ишемии и через 20 мин после реперфузии. Использовали балльную оценку согласно Talov [5] для получения функциональной оценки каждой группы: 0 баллов, полный паралич задних конечностей; 1 балл, визуальная подвижность суставов задних конечностей; 2 балла, свободная подвижность суставов задней конечности, но неспособность подниматься; 3 балла, способность подниматься, но неспособность ходить; 4 балла, полное восстановление функции движения задних конечностей и способность ходить, как здоровое животное.
После оценки неврологической деятельности у кроликов под анестезией получали ткань спинного мозга поясничных сегментов (L5-L7). Ткань заключали в парафин, делали срезы и затем проводили окрашивание гематоксилин-эозином. Анализ патологических изменений с помощью оптического микроскопа проводил исследователь, который не знал, как животных распределяли по группам, и он определял количество нормальных моторных нейронов передних рогов спинного мозга. Количество нормальных моторных нейронов передних рогов спинного мозга у каждого животного представляли в виде среднего значения по трем срезам.
Результаты показали, что отсутствовали статистически значимые различия (Р>0.05) физиологических параметров непосредственно перед ишемией, через 10 мин после ишемии и через 20 мин после реперфузии. Проводили балльную оценку неврологической функции, она представлена на Фигуре 3-А. Неврологическая функция задних конечностей кроликов в группе ложно-оперированных животных была полностью нормальной на всем протяжении наблюдения (4 балла); ни одно животное в контрольной группе и группе носителя не было способно вставать; 7 кроликов в группе YC-6 могли вставать (3 балла или больше). Балльная оценка неврологической функции в группе YC-6 и группе ложно-оперированных животных была значительно выше, чем в контрольной группе и группе носителя (P<0.05).
В контрольной группе и группе носителя ткани спинного мозга поясничных сегментов были серьезно повреждены, о чем свидетельствовало достоверное исчезновение нормальных моторных нейронов и обширная вакуолярная дегенерация. В группе YC-6, тем не менее, повреждение спинного мозга было заметно меньше, и наблюдали нормальные моторные нейроны (Фигура 3-В). Количество нормальных моторных нейронов передних рогов спинного мозга в группах YC-6 и ложно-оперированных животных было заметно повышено (Фигура 3-С).
В заключение, YC-6 представляет собой нейропротектор при ишемии спинного мозга.
ПРИМЕР 4. Нейропротекторное действие YC-6 при фокальной ишемии мозга крыс (МСАО)
30 самцов крыс SD случайным образом распределяли по трем группам (n=10): Контрольная группа для моделирования фокальной ишемии мозга крыс; группа YC-6, которой за 30 мин до ишемии мозга внутривенно через хвостовую вену вводили 1 мг/кг YC-6; группа носителя, которой тем же образом вводили эквивалентное количество гидроксипропил циклодекстринов (2 мл/кг) за 30 мин до ишемии мозга.
Крыс подвергали послеоперативному голоданию на протяжении 12 часов, в течение которого обеспечивали свободный доступ к питью. Модель окклюзии средней мозговой артерии (МСАО) осуществляли методом введения нити в просвет сосуда [6]. [6] Wang Q., Peng Y., Chen S., Gou X., Ни В., Du J., Lu Y, Xiong L. Pretreatment with electroacupuncture induces rapid tolerance to focal cerebral ischemia through regulation of endocannabinoid system. Stroke, 2009, 40(6): 2157-2164. После окклюзии в течение 120 мин нить вынимали и проводили реперфузию. За местным мозговым кровотоком наблюдали с помощью лазерного Допплеровского флуометра. Животных возвращали в клетки, им давали ходить и обеспечивали свободный доступ к воде и еде. Через 72 часа реперфузии после ишемии мозга использовали метод Лонга [7] для определения и балльной оценки неврологической функции наблюдателем, который не знал, каким образом крыс распределяли по группам: оценка 0 - без нарушения функции; оценка 1 - не способно вытягивать левую переднюю конечность; оценка 2 - переворот налево; оценка 3 - падение влево; оценка 4 - без автономной деятельности, сопровождающейся сознательным подавлением; оценка 5 - смерть. [7] Longa E.Z., Weinstein P.R., Carlson S., Cummins R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke, 1989, 20(1): 84-91.
После оценки неврологической функции крыс забивали и быстро изымали мозг. После приготовления срезов срезы сразу же окрашивали раствором ТТС в течение 30 мин с последующей фиксацией в параформальдегиде. Через 24 часа получали фотографии срезов с использованием цифровой камеры и снимки переносили в компьютер. Использовали программное обеспечение для обработки снимков (ADOBE, PHOTOSHOP 8.0) для количественной оценки площади инфаркта (нормальная ткань мозга показана розовым, и зона инфаркта показана белым). Для определения отклонений площади инфаркта, вызванных отеком мозга, площадь инфаркта выражали в виде доли от нормальной ткани с противоположной стороны.
Размер инфаркта = (Размер нормальной ткани с противоположной стороны - Размер нормальной ткани с соответствующей стороны)/Размер нормальной ткани с противоположной стороны * 100%.
Балльную оценку неврологического поведения (NBS) проводили с использованием теста Крускалла-Уоллиса. Если между группами были различия, для парного сравнения использовали U-критерий Манна - Уитни и поправку Бонферрони. Размер инфаркта и физиологические параметры представляли в виде среднее ± ошибка SD и анализировали с использованием однопараметрического ANOVA и последующего критерия Стьюдент-Ньюман-Кейля (СНК) для парного сравнения среди нескольких групп.*P<0.05 указывает на статистически значимые различия.
Баллы за функциональную оценку животных в каждой группе показаны на Фигуре 5. По сравнению с контрольной группой и группой носителя, в группе YC-6 наблюдались значительные улучшения неврологической функции и уменьшенный размер инфаркта (*P<0.05).
Учитывая все указанное выше, YC-6, т.е. 5α-андростан-3β,5,6β-триол, обладает защитным действием при повреждениях мозга, вызванных гипоксией, ишемией головного мозга или ишемией спинного мозга.
Реферат
Предложено применение 5α-андростан-3β,5,6β-триола для изготовления нейропротекторных лекарственных средств. Технический результат состоит в том, что соединение обладает значительным защитным действием против повреждений нейронов, вызванных ишемией головного мозга, ишемией спинного мозга или гипоксией, и не имеет заметных токсических реакций в пределах своей эффективной дозы. 3 з.п. ф-лы, 4 ил.

Комментарии