Доставка нуклеиновых кислот - RU2160278C2
Код документа: RU2160278C2
Чертежи


















Описание
Настоящее изобретение относится к способу индуцирования соединений, в частности нуклеиновых кислот, в клетку. Кроме того, настоящее изобретение относится к препаратам для использования по этому способу.
Существует ряд ситуаций, когда необходимо доставить конкретные соединения в клетки. Одной из таких операций является трансфекция эукариотических клеток ДНК. Для этого в настоящее время используют различные коммерческие средства, такие как "Transfectam" (Promega), "DOTAR" (Boehringer Mannheim), "Lipofectin" или "Lipofectamine" (BRL) или применяют трансфекцию, опосредованную кальцийфосфатом.
Способность доставлять в клетки нуклеиновую кислоту с помощью других соединений используют в лекарственной и генной терапии. Доставка соединений в клетки будет изменяться в зависимости от формулы соединения, представленной ниже. Такие изменения можно обнаружить в виде модификаций, касающихся длительности их действия (например, медленное высвобождение или поддерживающее действие), количества требуемого лекарства или способа доставки. Доставка в клетки применяемых соединений, отличающихся в рамках параметров, описанных ниже, может также обеспечивать целевую специфичность лекарственных средств в отношении клеток или тканей.
Авторы настоящего изобретения установили, что ассоциация молекул с соединениями, модифицированными ацильными производными жирной кислоты с общей формулой, приведенной ниже, облегчают доставку такого рода соединений в клетки.
В соответствии с первой целью настоящее
изобретение состоит из способа интродуцирования нуклеиновой кислоты в клетку, включающего в себя выдерживание клетки с соединением, имеющим формулу
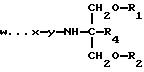
в которой: w представляет собой нуклеиновую кислоту;
x представляет собой пептид или аминокислоту;
y представляет собой линкер, имеющий цепь длиной, эквивалентной 1-20 атомам углерода, или не имеющий ее;
R4 представляет собой H или CH2O - R3; а R1, R2 и R3 являются одинаковыми или различными и представляют собой либо водород, метильную, этильную, гидроксильную или ацильную группу, полученную из жирной кислоты, имеющей углеродную цепь, из 3-24 насыщенных или ненасыщенных углеродных атомов, с условием, что по крайней мере один из R1, R2 и R3 представляет собой ацильную группу, полученную из жирной кислоты.
В соответствии со второй целью настоящее изобретение состоит из способа по интродуцированию нуклеиновой кислоты в клетку, включающего в себя выдерживание клетки с соединением,
имеющим формулу
w...x-y-NH-CH2-CH2O-R5
в которой: w представляет собой нуклеиновую кислоту;
x представляет собой пептид или аминокислоту;
y представляет собой линкер, имеющий цепь длиной, эквивалентной 1-20 атомам углерода, или не имеющий ее;
R5 представляет собой ацильную группу, полученную из жирной кислоты,
имеющей углеродную цепь из 3-24 насыщенных или ненасыщенных углеродных атомов.
В соответствии с третьей целью настоящее изобретение включает в себя соединение, используемое для
интродуцирования нуклеиновой кислоты в клетку, данное соединение, имеющее формулу

в которой: w представляет собой нуклеиновую кислоту;
x представляет собой пептид или аминокислоту;
y представляет собой цепь длиной, эквивалентной 1-20 углеродным атомам, или не имеющий ее;
R4 представляет собой H или CH2O-R3; а R1, R2 и R3 являются одинаковыми или различными и представляют собой либо водород, метильную, этильную, гидроксильную или ацильную группу, полученную из жирной кислоты, имеющей углеродную цепь из 3-24 насыщенных или ненасыщенных углеродных атомов, с условием, что по крайней мере один из R1, R2 и R3 представляет собой ацильную группу, полученную из жирной кислоты.
В соответствии с четвертой целью настоящее изобретение включает в
себя соединение, используемое для интродуцирования нуклеиновой кислоты в клетку, данное соединение, имеющее формулу
w...x-y-NH-CH2-CH2O-R5
в которой:
w представляет собой нуклеиновую кислоту;
x представляет собой пептид или аминокислоту;
y представляет собой линкер, имеющий цепь длиной, эквивалентной 1-20 атомам углерода, или не
имеющий ее;
R5 представляет собой ацильную группу, полученную из жирной кислоты, имеющей углеродную цепь из 3-24 насыщенных или ненасыщенных углеродных атомов.
В предпочтительном варианте каждой цели настоящего изобретения "y" присутствует.
В предпочтительном варианте осуществления настоящего изобретения нуклеиновая кислота представляет собой ДНК, РНК или олигонуклеотиды ДНК или РНК, модифицированные олигонуклеотиды или их комбинации. Нуклеиновая кислота может также нести химические добавки, такие как флуоресцеин (ФИТЦ), холестерин, биотин или радиоактивную метку.
Данный способ настоящего изобретения можно использовать для доставки нуклеиновых кислот, включающих в себя ДНК или РНК, модифицированные олигонуклеотиды или их сочетания, в эукариотические клетки, включающие в себя устоявшиеся клеточные линии животного или растительного происхождения, первичные клеточные линии животного или растительного происхождения, целые организмы животных и растений, примененных системно, местно или в виде аэрозоля. По этому вопросу сошлемся на EPO 426688, включенный в настоящее описание в виде ссылки. Нуклеиновая кислота может также нести химические добавки, такие как флуоресцеин (ФИТЦ), холестерин, биотин или радиоактивную метку. Данный способ настоящего изобретения рассмотрели главным образом для того, чтобы осуществить применение соединения преимущественно в виде водной смеси на поверхности соответствующих клеток. Однако в случае целых организмов соединение можно применять по необходимости преимущественно в неводной форме, путем локальной или общей инъекции, местно или путем ингаляции.
Описание этого изобретения включает в себя также присоединение меченых соединений, таких как флуоресцеин (ФИТЦ) или биотин к пептиду для визуализации и отслеживания в клетках и целых организмах. Меченые соединения вводят в клетки любыми вышеописанными путями или способами.
Пептид может быть любой длины и может включать в себя функциональные домены, такие как сигналы, локализованные ядром и/или связывающие нуклеиновую кислоту. Такие функциональные домены могут объединяться в тандем или в вильчатую структуру, такую, которую можно построить с использованием лизина. Обычно пептид будет обладать суммарным положительным зарядом для приготовления и удержания нуклеиновой кислоты путем присоединения, например, пептида, имеющего один или больше остатков лизина. Можно, однако, создать пептид, несущий суммарный отрицательный заряд, если это является преимуществом для других форм доставки, например для системной доставки ин виво.
Линкер может быть любым из множества молекул, хорошо известных в технике. Однако в настоящее время предпочтительно, чтобы линкер представлял собой аминокислоту или пептид, например аланин, лейцин, глицин, фенилаланин, лизин или его гомологи или гетерополимер. Линкер может также включать в себя атипичные аминокислоты, позволяющие таким образом увеличивать длину линкера больше, чем при использовании обычной аминокислоты. В этом отношении особенно предпочтительно, чтобы линкер представлял собой аминомасляную, аминокапроновую или аминокаприловуюа кислоту.
В наиболее предпочтительном варианте осуществления настоящего изобретения R1, R2 и R3 являются одинаковыми, но предпочтительно представляют собой ацильные производные жирных кислот, включающие в себя группу, состоящую из пальмитата, миристата, лаурата, олеата и холестерина, и особенно - лаурата или миристата.
В представленной авторами заявке на Австралийский патент N 649242 раскрыт способ присоединения аминокислот или пептидов к 1-3 ацильным производным жирных кислот путем трометаминового или этаноламинового производного. Используя этот способ, можно получить обширный ряд пептид/ацильных производных жирнокислотных конъюгатов, имеющих 1-3 ацильных производных остатков жирной кислоты. В результате использования способа, раскрытого в этой заявке, можно получить вводящее трилизиналанин-трис-трипальмитатное соединение (КЗАТРЗ). Раскрытие этой заявки включено в настоящее изобретение путем ссылки.
Нуклеиновую кислоту ("w" в соединении) можно связать с остатком данного соединения, используя положительно заряженные аминокислоты, например лизин, аргинин, орнитин и т.д. в положении "x" данного соединения. Особенно предпочтительными группами являются монолизиновая, дилизиновая, трилизиновая, тетрализиновая или пентализиновая группы. Альтернативно нуклеиновую кислоту можно присоединить ковалентно к пептиду или аминокислоте "x". Кроме того, линкерную группу аланин можно заместить, например, на лейциновую, глициновую, фенилаланиновую или α-BOC (без ε-BOC) лизиновую группы и ряд ацильных производных жирных кислот может варьировать от 1 до 3. Нужно отметить, что когда необходимо использовать одно ацильное производное жирных кислот, трис можно заменить на этаноламин.
Очевидно, что технология приготовления лекарственного средства путем введения в липосомы с помощью стандартных способов с использованием такого липида, как диолеоилфосфатидилэтаноламин (DOPE), DOPC (DOP-холин) или холестерин, может увеличить эффективность изобретения, способствуя доставке соединений в клетки. Это весьма вероятно, когда имеется 2 алифатических ацильных производных. Способы изготовления липосом описаны, например, у Felgner, P.L. et al 1987 PNAS 84 pp 7413-7417 и Yago, K et al 1993 Biochem and Biophys. Res. Comm. 196(3) pp 1042-1048. Показано также, что простое добавление DOPE к растворам соединения может существенно усилить их активность (нижеприведенный эксперимент 4, VerafectinG2 ± DOPE). Подобно другим модификациям условий трансфекции наличие таких добавок, как соли может усиливать трансфекцию. Описанные изменения ионной силы и присутствие щелочно-земельных катионов меняют эффективность трансфекции (Loeffler and Behr, Methods in Enzimology 1993, H, 599-654).
Главным применением настоящего изобретения должна стать доставка генотерапевтического лекарственного средства. Относительно эффективный перенос генов в клетки, наблюдавшийся до сих пор, в сочетании с низкой токсичностью (особенно если сравнивать с коммерческими лекарственными средствами) делает настоящее изобретение идеальным для терапевтического использования многих соединений. Дополнительную информацию, относящуюся к генной терапии, можно найти у Nabel et al, 1993 PNAS 90 pp 11307-11311, описание которой включено в описание путем ссылки.
Чтобы суть настоящего изобретения была более понятной, предпочтительные его варианты поясняются при рассмотрении
нижеследующих примеров и фигур, в которых:
Фигура 1a показывает токсичность Verafectin и DMSO, а 1b показывает выживание в % в присутствии Verafectin по сравнению с DMSO.
Цитотоксичность определяли, используя стандартный тест с MTT (3-[4,5-Диметилтиазолил-2-ил]-2,5-дифенилтетразолийбромид; Тиазолий голубой).
Verafectin представляет собой K3ATP3, и его концентрация указана в мкМ, DMSO использовали в эквивалентной концентрации, до которой разбавляли Verafectin.
a. Результаты гибели клеток с уменьшением ОП.
b. Выживаемость клеток в присутствии одного лишь разбавленного DMSO, взятая за 100%, и выживаемость в присутствии соответствующей концентрации Verafectin.
Фигура 2a показывает цитотоксичность Verafectin и этанола, а 2b - показывает выживаемость в % в присутствии Verafectin по сравнению с этанолом.
Цитотоксичность определяли, используя стандартный тест с MTT (3-[4,5,Диметилтиазолил-2-ил]2,5-дифенилтетразолийбромид; Тиазолий голубой).
Verafectin (K3ATP3) растворяли в 100% нагретом этаноле при концентрации 10 мг/мл и затем разбавляли водой до концентраций, выраженных в мкМ.
a. Параллельно разбавляли этанол и испытывали на цитотоксичность при тех же концентрациях, что и разбавленный Verafectin.
b. Выживаемость клеток в присутствии одного лишь разбавленного этанола, взятая за 100%, и выживаемость в присутствии соответствующей концентрации Verafectin.
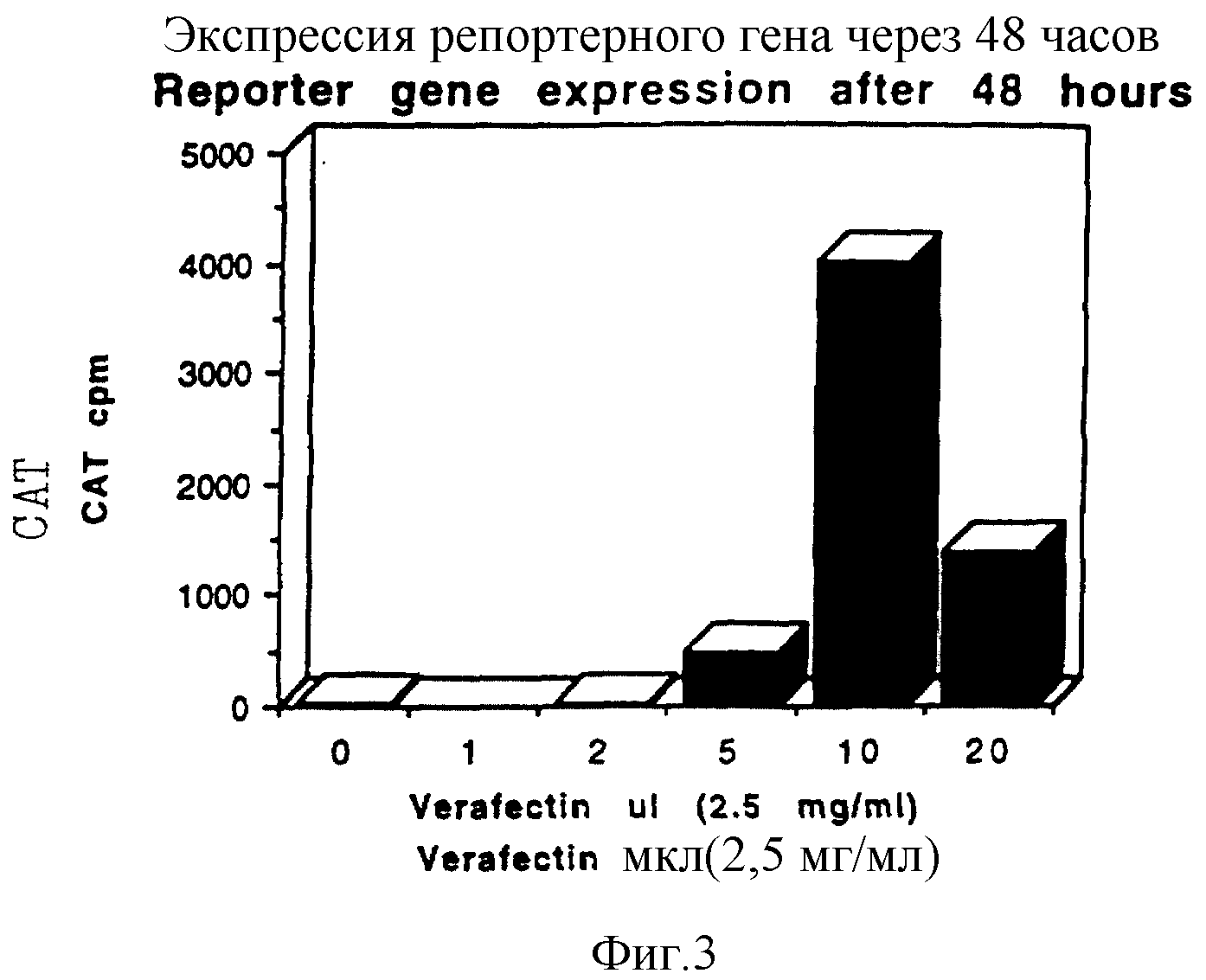
Фигура 3 показывает экспрессию CAT через 48 часов после трансфекции pSVLCAT, опосредованной с помощью Verafectin.
Количество Verafectin, выраженное в мкМ, смешивали в 1 мкг pSVLCAT, перед наслаиванием на клетки для трансфекции. Представленные результаты отражают уровни экспрессии CAT, измеренные для 50 мкл клеточной культуральной среды через 48 часов после трансфекции.
Фигура 4 показывает экспрессию CAT, проанализированную спустя 48 часов после трансфекции клеток CHO, опосредованную с помощью тестируемых факторов.
Представленные результаты отражают концентрацию трансфецирующего фактора, дающей наивысший уровень трансфекции в эксперименте. Она составила 5 мкл в каждом случае. Анализы CAT проводили по методу Neuman J.R., Morency, C.A. and Russian, K.O. (1987) Biotecniques 5, p 444-447.
Ничего: фактора трансфекции нет, TF: Transfectam (Promega), Lfe: Lipofectamine (BRL), VF A3: K3ATP3, VF G2:K3GTP2.
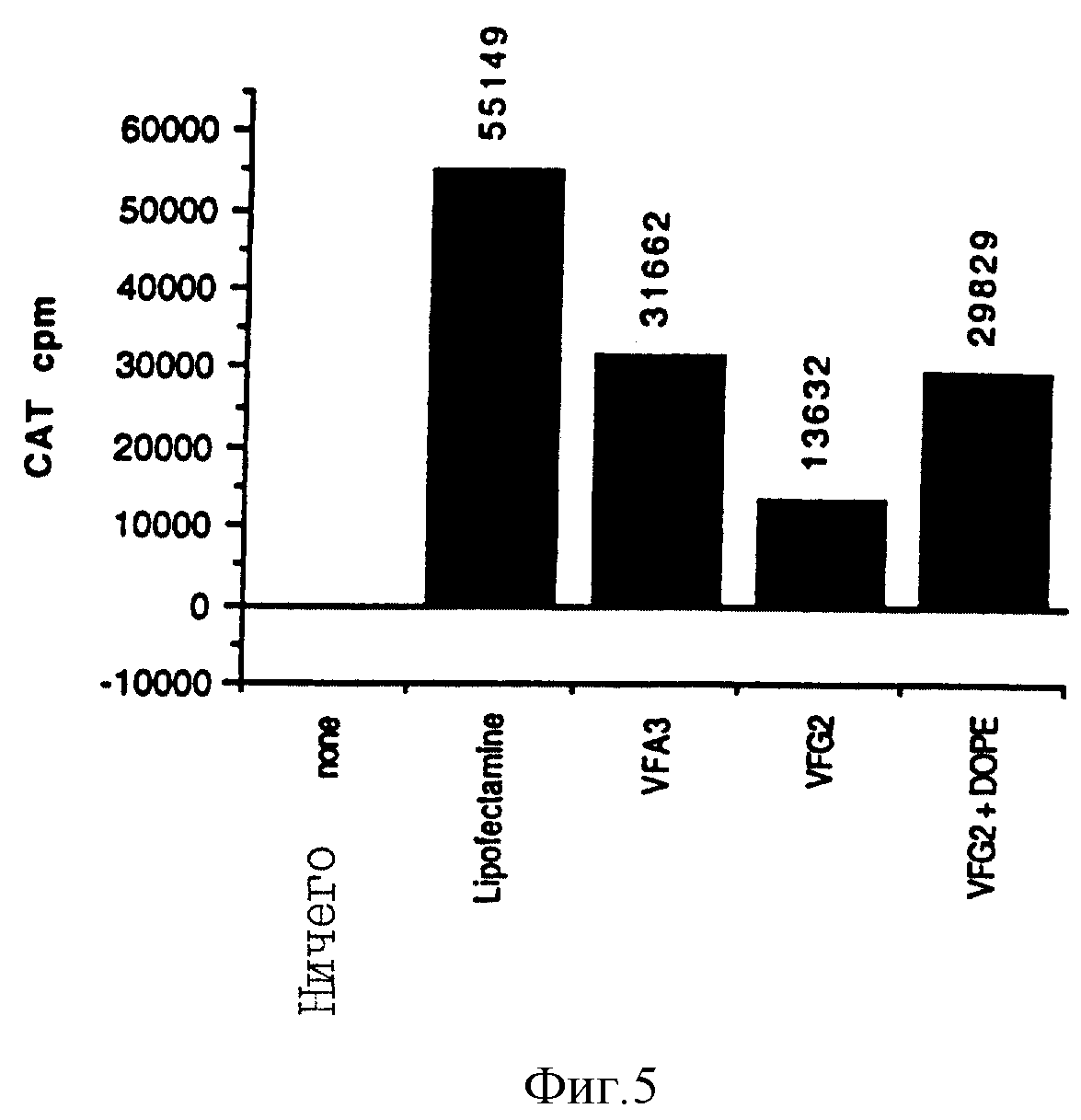
Фигура 5 показывает экспрессию CAT, проанализированную через 48 часов после трансфекции клеток Cos 1, опосредованную с помощью тестируемых факторов.
Представленные результаты отражают концентрацию фактора трансфекции, дающей наивысший уровень трансфекции. Ничего: нет фактора, VF A3: K3ATP3, VF G2: K3GTP2, VF G2+DOPE: K3GTP2+DOPE.
Фигура 6 показывает относительную цитотоксичность факторов трансфекции.
Пояснительная подпись
a. (Клетки CHO)
Жизнеспособность клеток после трансфекции разными факторами на время сбора клеток в
CAT-анализе.
Ничего: трансфецирующего реагента нет, TF: Transfectam, Lfe: Lipofectamine, VF G2: Verafectin G2 - все по 5 мкл. Высота ОП отражает степень выживания клеток.
b. (Клетки Cos 1)
Жизнеспособность клеток как и на фиг. a. VF A3: Verafectin A3 - 9 мкл, Lfe - 5 мкл. Анализы в этом эксперименте проводили в 35 мм чашках.
Фигуры 7a и 7b показывают результаты по пептиду "x" в эксперименте "a".
Фигура 8 показывает результаты по пептиду "x" в эксперименте "b".
Фигура 9 показывает результаты по пептиду "x" в эксперименте "c".
(Пояснительная подпись - фигуры 7, 8 и 9; ничего: нет фактора, используемого с плазмидной ДНК, rb/реагент: пустой реагент, номер следующего описания соединения указывает no. мкл из 2 мМ маточного раствора (разбавленный водой). 7b: 100% выживаемость клеток в чашках, где осуществляли "псевдотрансфекцию" без ДНК или трансфецирующего фактора. 0% выживаемости в отсутствие клеток. Выживаемость оценивали, используя краситель alamar blue).
Фигуры 10a и 10b показывают результаты по линкеру "y" в эксперименте "a".
Фигура 11 показывает результаты по линкеру "y" в эксперименте "b".
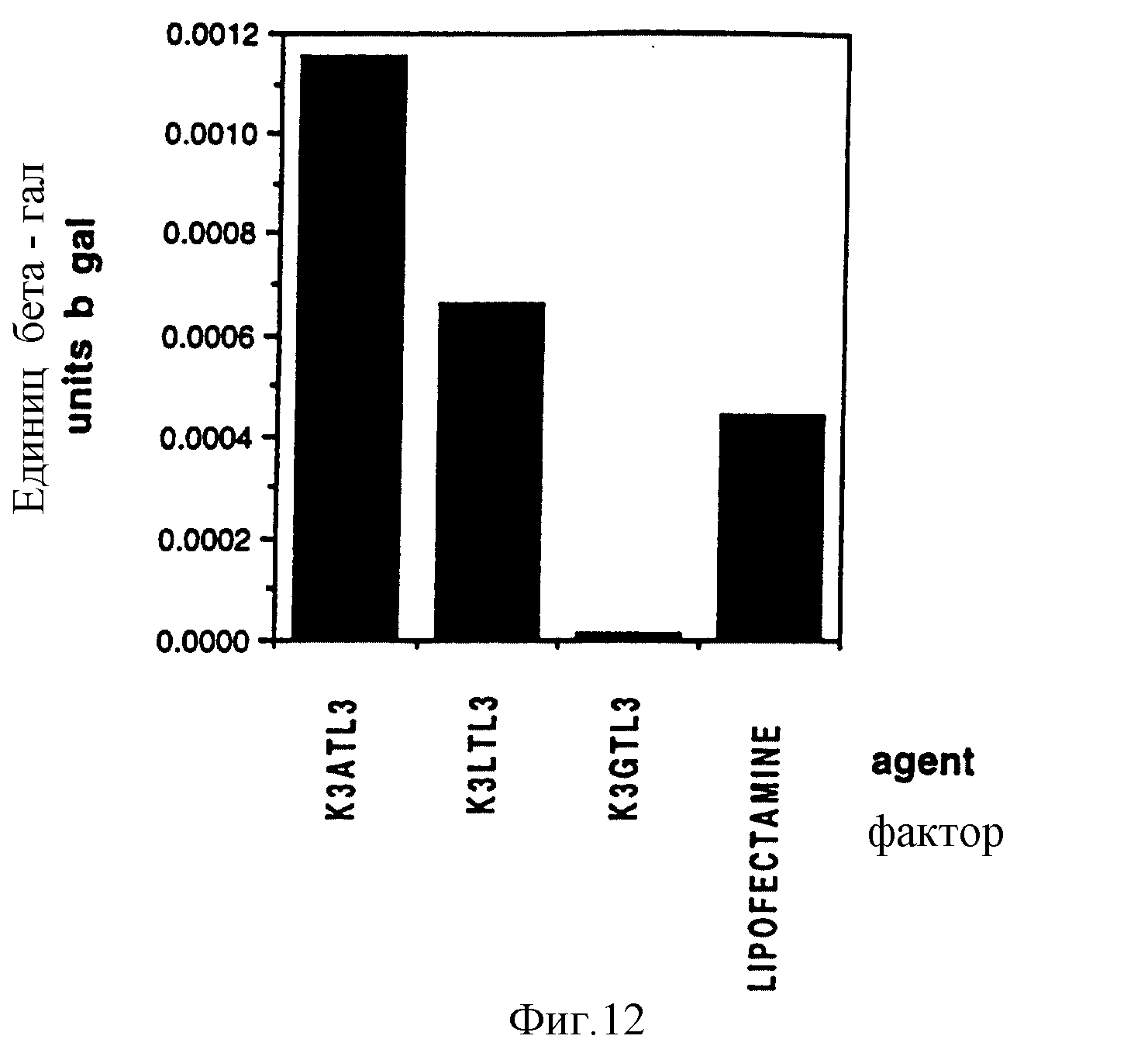
Фигура 12 показывает результаты по линкеру "y" в эксперименте "c".
(Пояснительная подпись - фигуры 10a, 10b, 11, 12; фактор: испытуемое соединение брали из 2 мМ маточного раствора, за исключением особо оговоренных случаев. (. 4): маточный раствор фактора 0,4 мМ. 0: нет фактора. Только ДНК при стандартных условиях трансфекции. Пустая среда: только среда при анализе CAT. Относительная выживаемость (alamar blue): измерение ОП570-595 культуральной среды с добавленным alamar blue во время инкубации при 37oC).
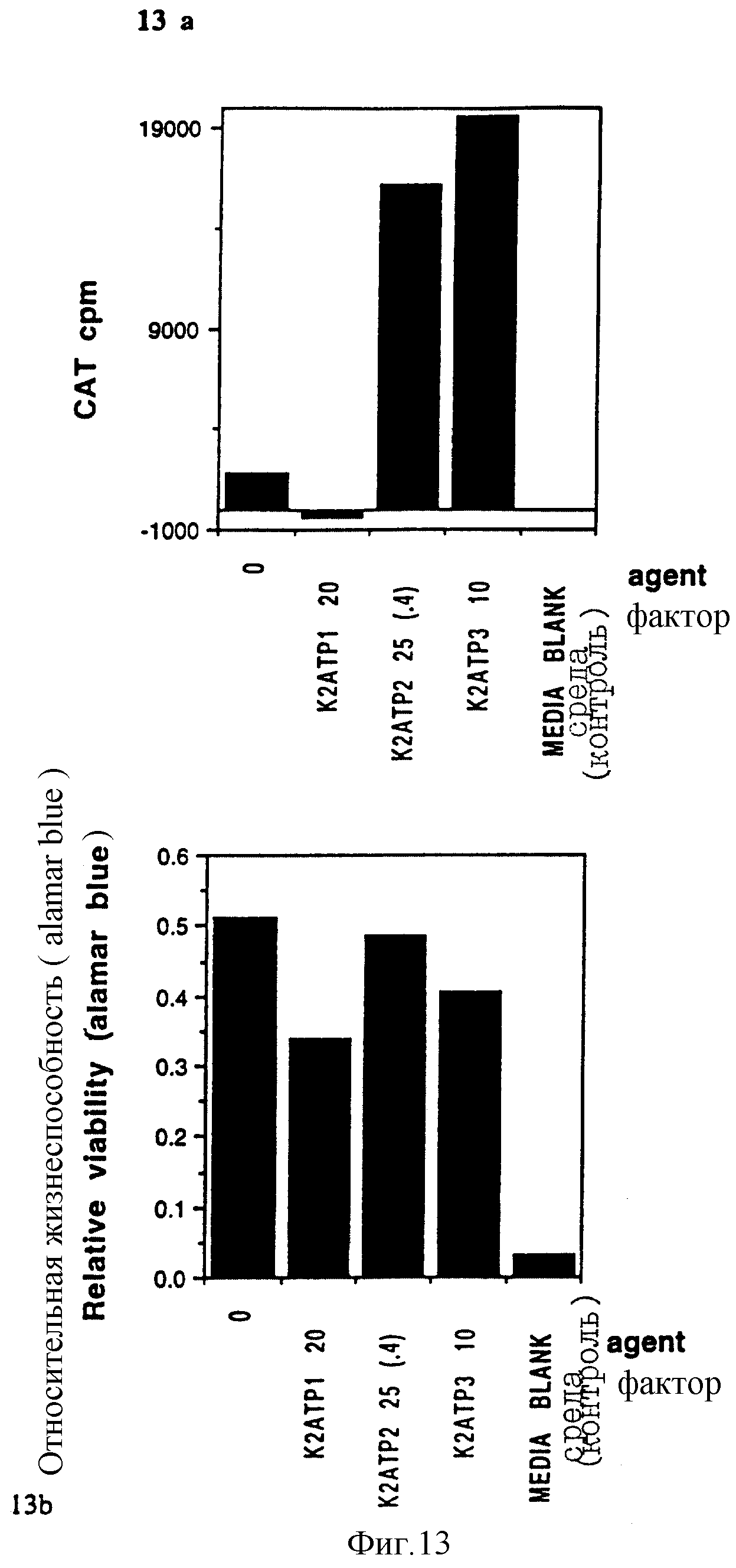
Фигуры 13a и 13b показывают результаты по R1-R4-производным в эксперименте "a".
(Пояснительная подпись: такая же, как и Пояснительная подпись к фигурам 10a, 10b, 11, 12).
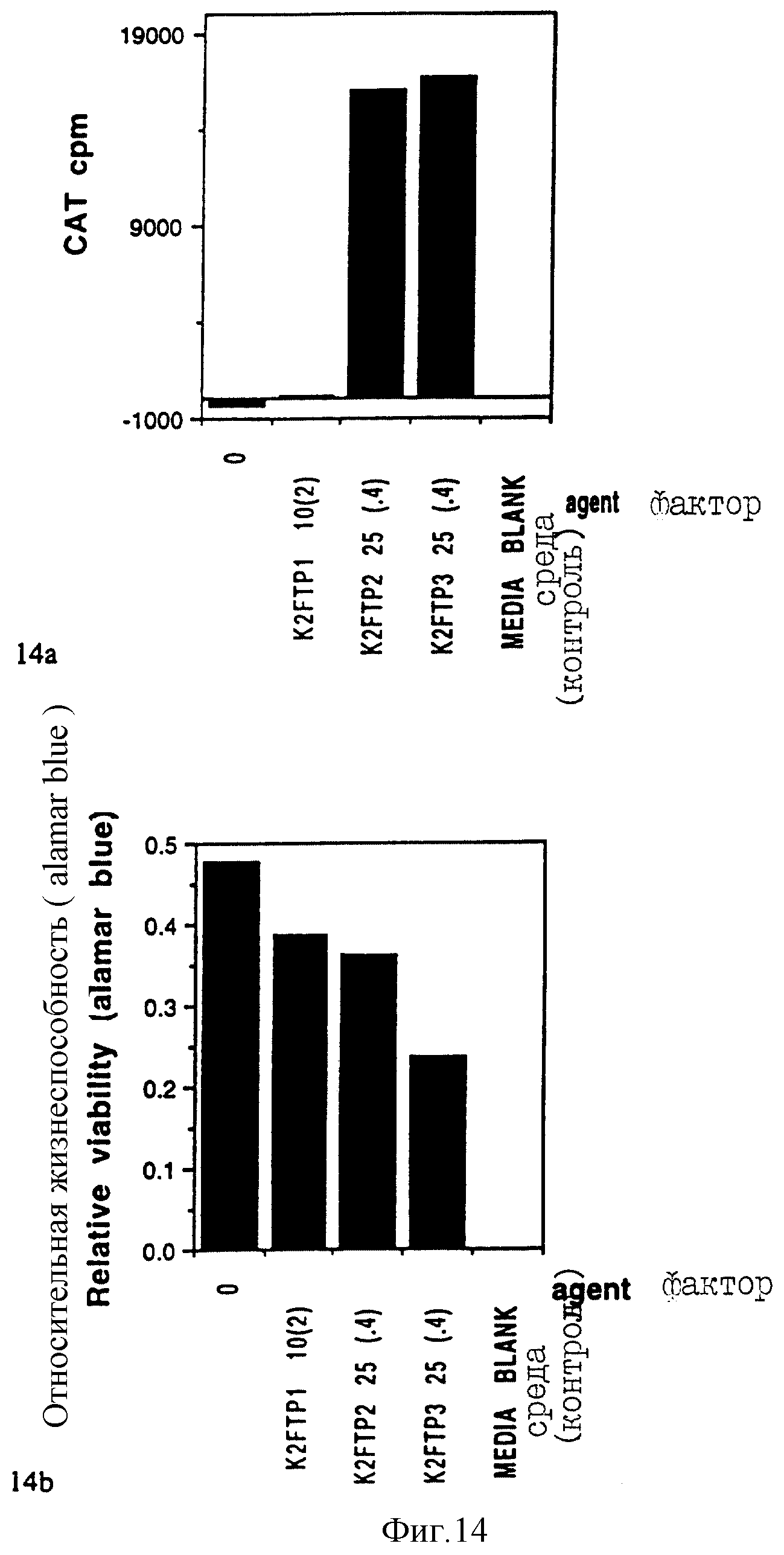
Фигуры 14a и 14b показывают результаты по R1-R4-производным в эксперименте "b".
(Пояснительная подпись: такая же, как и Пояснительная подпись для фигур 10a, 10b, 11, 12).
Фигуры 15a и 15b показывают результаты по R1-R4 в эксперименте "c".
(Пояснительная подпись: такая же, как и Пояснительная подпись для фигур 10a, 10b, 11, 12. Показано стандартное отклонение).
Фигуры 16a и 16b показывают результаты по R1-R4-производным в эксперименте "d".
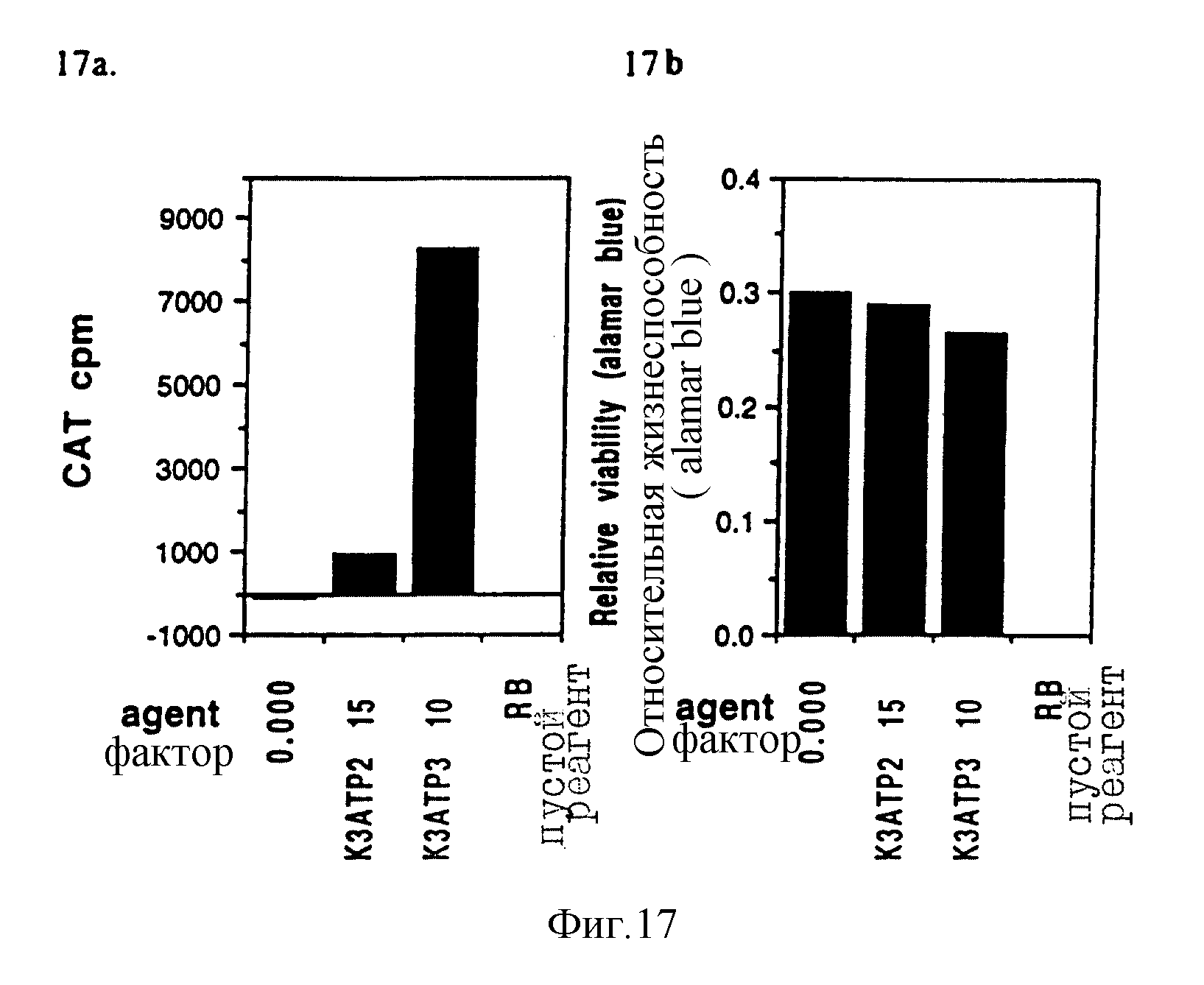
Фигуры 17a и 17b показывают результаты по R1-R4-производным в эксперименте "e".
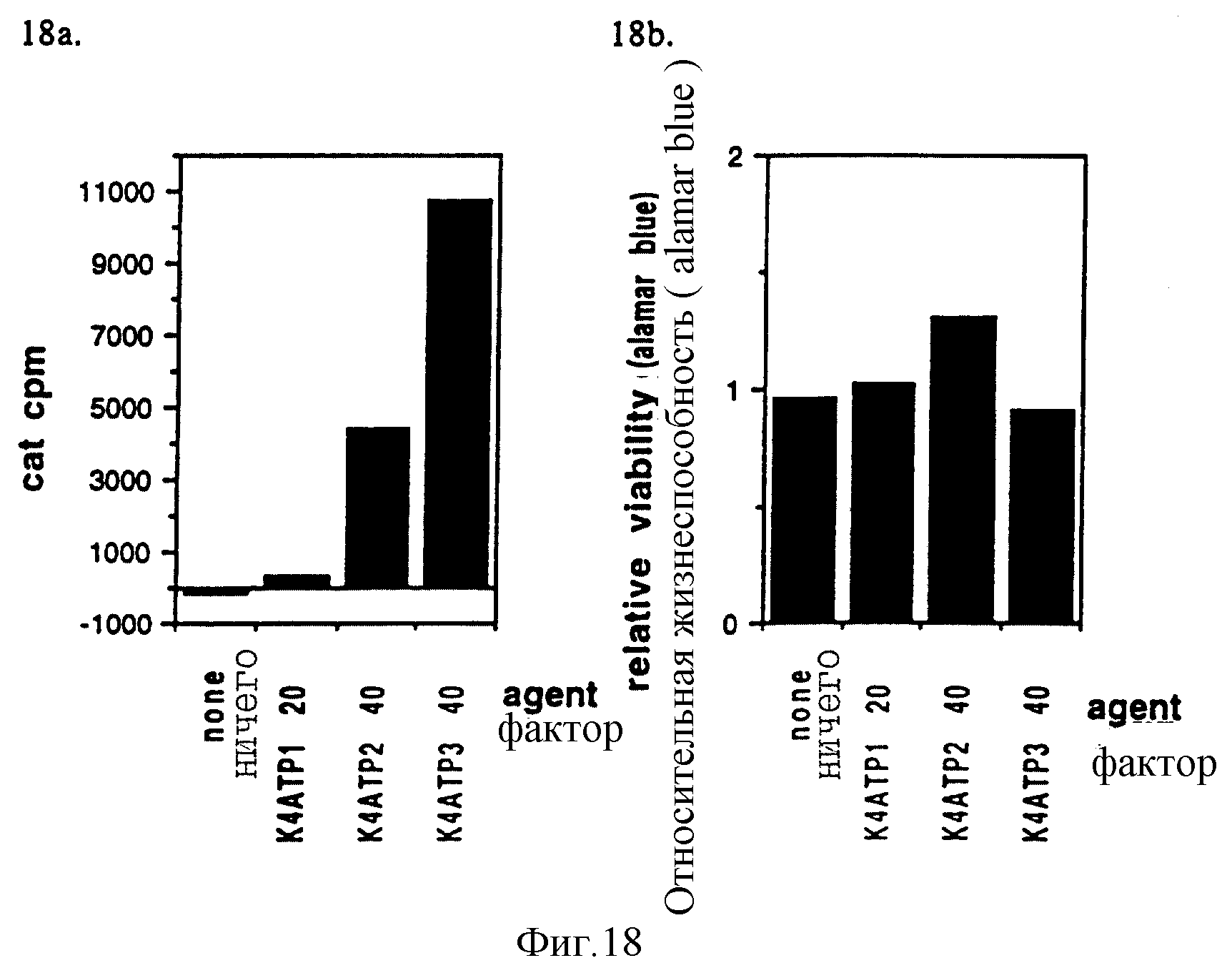
Фигуры 18a и 18b показывают результаты по R1-R4-производным в эксперименте "g". Клетки Cos 1 трансфецировали согласно стандартному анализу в 60 мм чашках. 50 мкл 48 ч культурального супернатанта инкубировали в течение 5 часов при 37oC для анализа CAT.
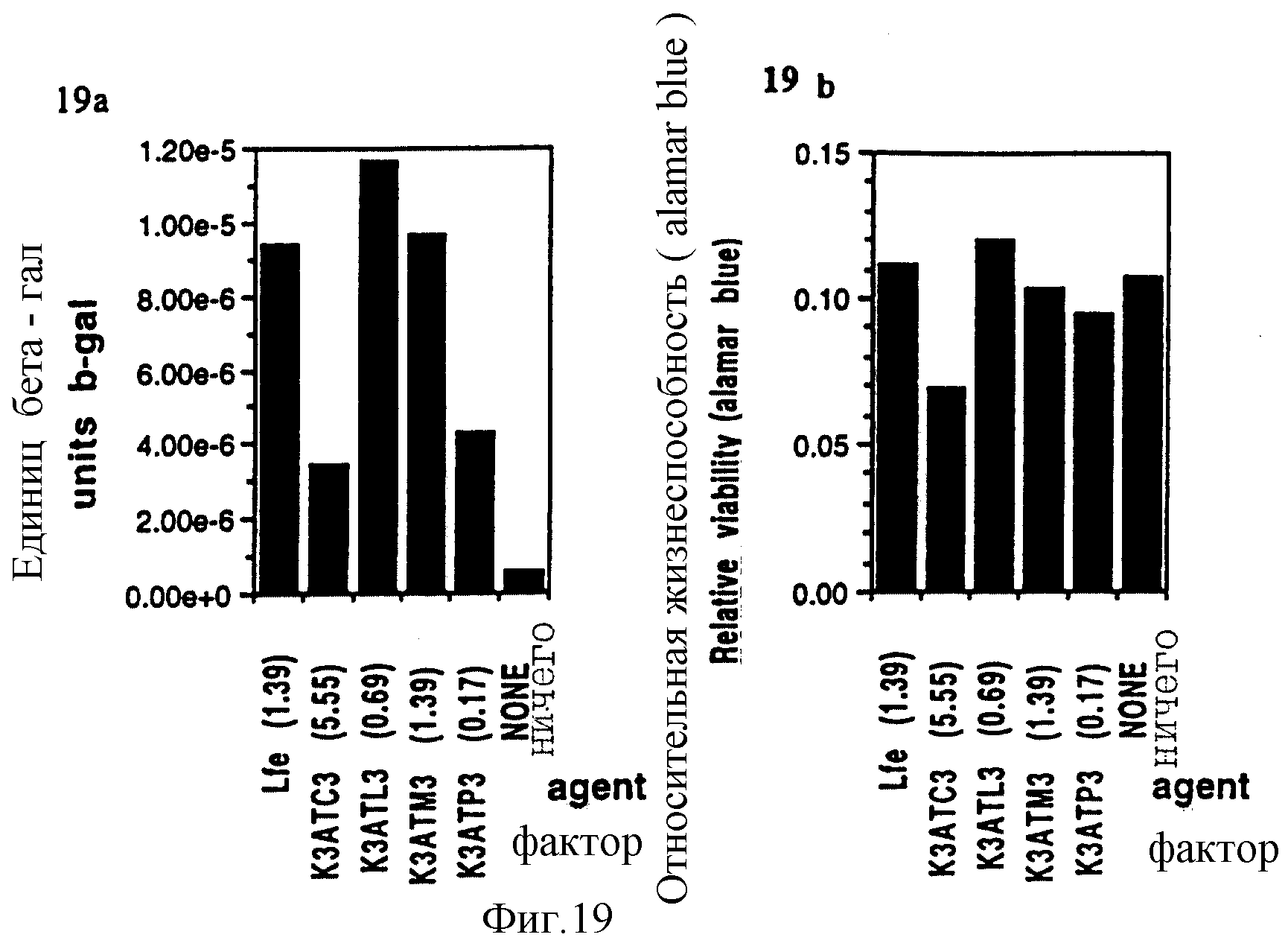
Фигуры 19a и 19b показывают результаты по R1-R4, C10-C16 в эксперименте "b". Клетки HeLa.
(Пояснительная подпись: фигуры 19a и 19b: Lfe: Lipofectamine, (1,39) соотношение [липид] /[ДНК], при котором происходит оптимальная трансфекция. Ничего: фактора нет, но ДНК включена в трансфекцию. Цитотоксичность определяли с Alamar blue).
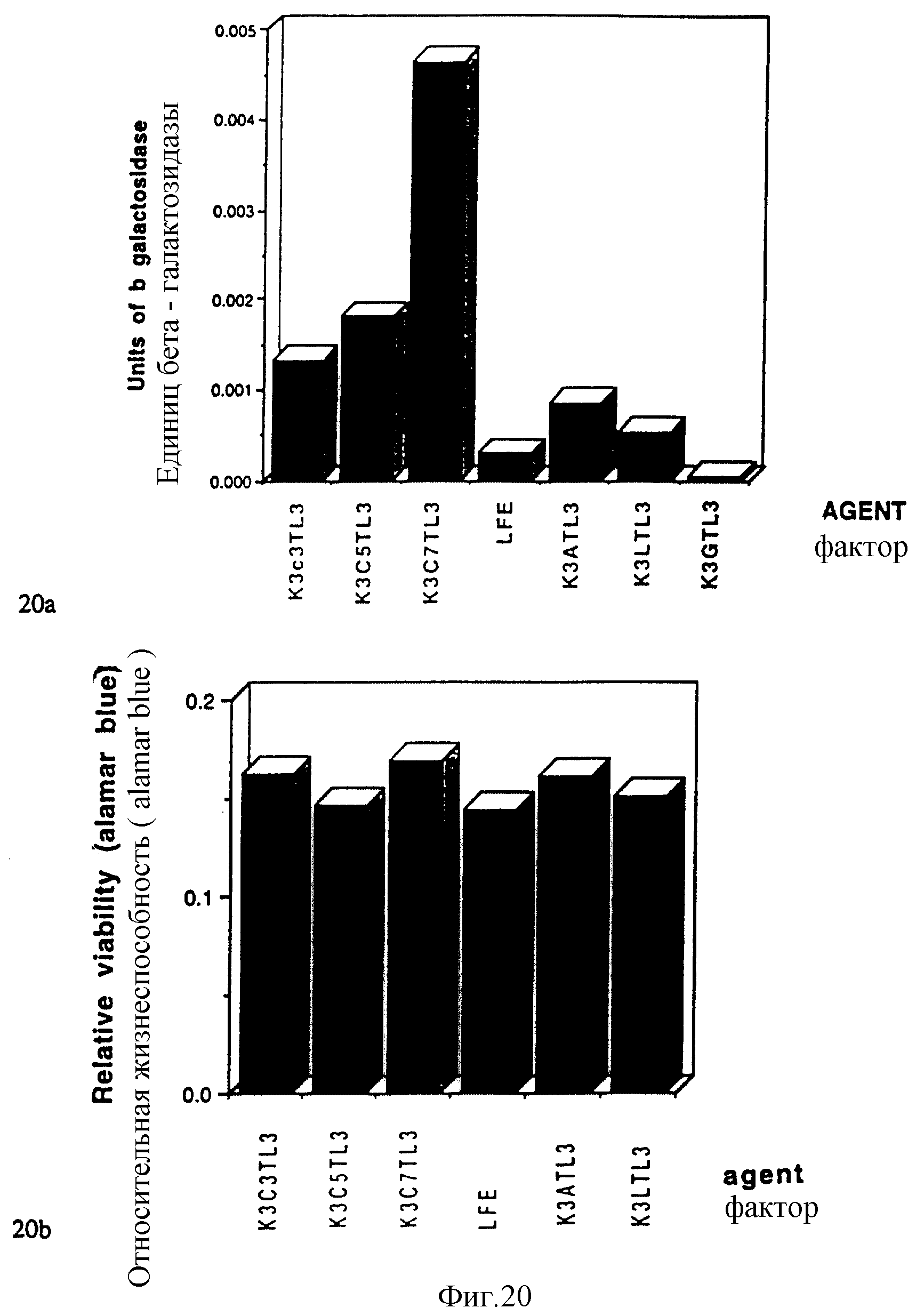
Фигуры 20a и 20b показывают результаты по линкеру "y", представленному необычными аминокислотами, в эксперименте "1".
(Пояснительная подпись: LFE: Lipofectamine. Уровни экспрессии гена показаны в "a" в единицах β -галактозидазы. Относительную жизнеспособность анализировали в "b", используя краситель "alamar blue", и представили в виде оптической плотности, измеренной после периода инкубации в присутствии красителя. Высокая ОП указывает на высокую выживаемость клеток).
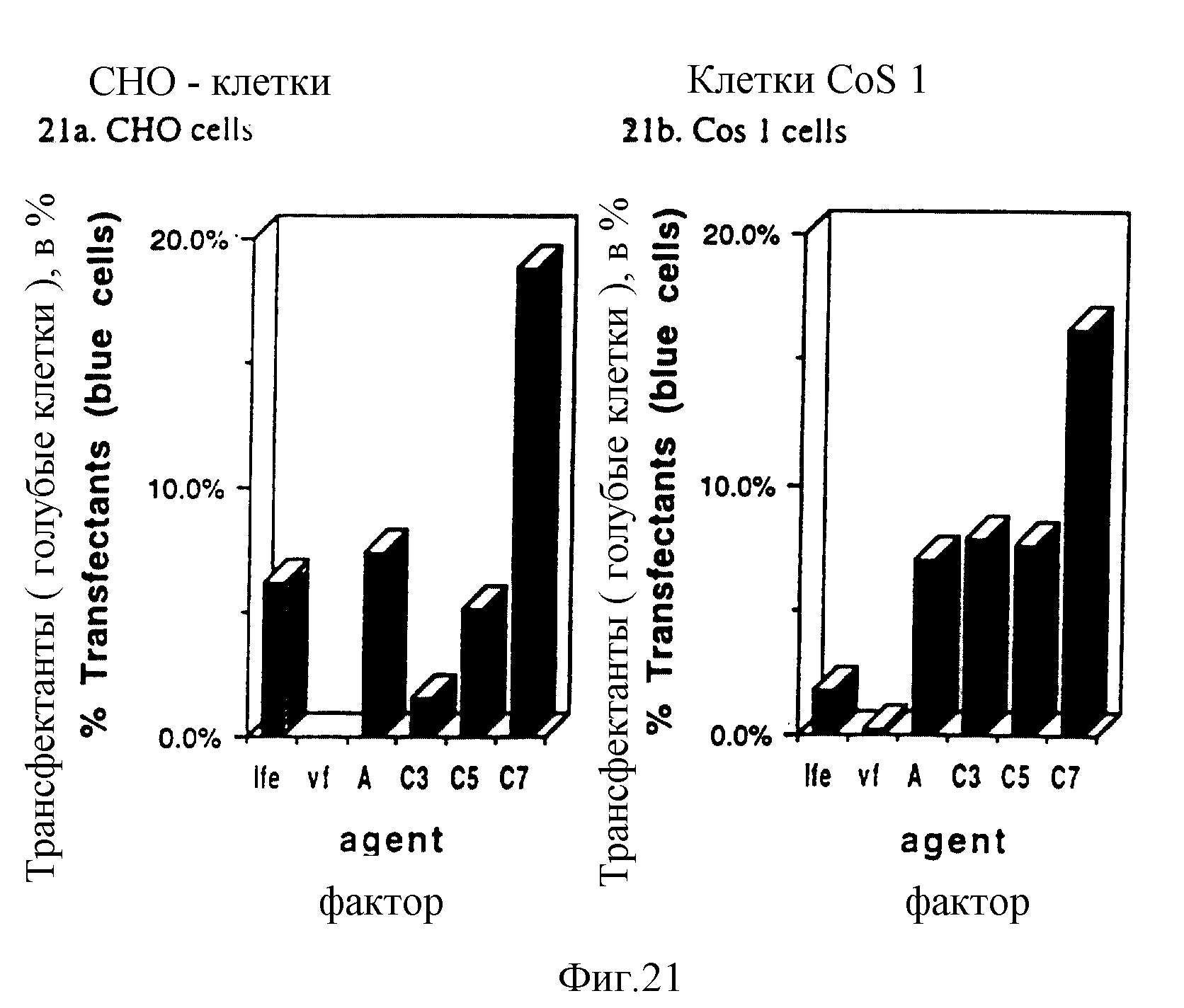
Фигуры 21a и 21b показывают результаты по линкеру "y", представленному необычными аминокислотами, в эксперименте "2".
(Пояснительная подпись: lfe: Lipofectamine, vf: Verafectin A3, C3; K3C3TL3, C5; K3C5TL3, C7; K3C7TL3, %% трансфектантов вычисляли по числу окрашенных в голубой цвет клеток среди неокрашенных клеток. a: клетки CHO, b: клетки Cos 1).
Фигуры 22a и 22b показывают результаты по линкеру "y", представленному необычными аминокислотами, в клеточных линиях PC3 и Jurkat.
Фигура 23a показывает результаты "технологии приготовления лекарственного средства" в эксперименте "A".
Экспрессия CAT в трансфецированных клетках CHO при использовании различных технологий приготовления липосом, ингредиентов и Lipofectamine (Lfe). Показаны результаты представительного эксперимента.
Фигура 23b показывает результаты "технологии приготовления лекарственного средства" в эксперименте "b".
Процент трансфецированных клеток при использовании липосомных композиций, отдельных ингредиентов и коммерческих препаратов. VF A2: K3ATP2. Липосомы компоновали, используя VF A2 и DOPE при определенном соотношении VF A2: DOPE. Представлены результаты одиночного эксперимента.
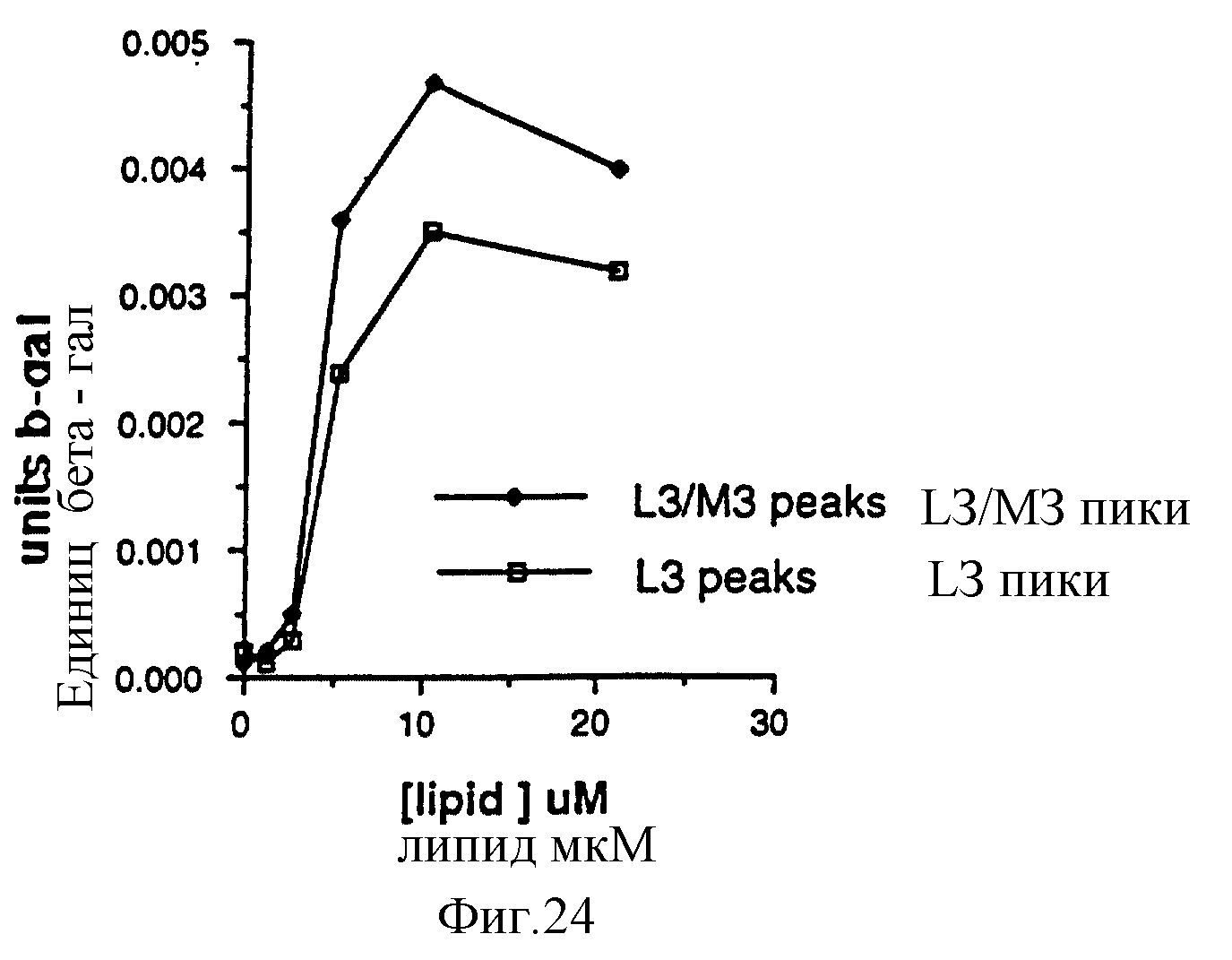
Фигура 24 показывает результаты "нетехнологичных смесей" в эксперименте "2".
(Пояснительная подпись: эффективность трансфекции оценивали по уровню экспрессивных β-галактозидазных единиц спустя 48 часов. L3: K3ATL3, M3: K3ATM3. Пик отражает комбинацию липопептида и ДНК, дающих наивысшее показание. [липид] отражает использованную концентрацию тотального липопептида).
Примеры
Химия
Использованные сокращения:
α-BOC(ε-Z-Lys) = α-Бутилоксикарбонил-ε-карбобензокси-Лизин
AEP = Аланин-этаноламин-пальмитат
ATP1
= Аланин-трис-монопальмитат
ATP2 = Аланин-трис-дипальмитат
ATP3 = Аланин-трис-трипальмитат
CDCl3 = Хлороформ-d
DCCD = Дициклогексилкарбодиимид
DCM = Дихлорметан
DIEA = Диизопропилэтиламин
DMAP = Диметиламинопиридин
DMF = Диметилформамид
DMCO-D6 - Диметилсульфоксид-d6
DSC =
Дисукцинимидилкарбонат
FATP1 = Флуоресцеин аланин-трис-монопальмитат
FATP2 = Флуоресцеин аланин-трис-дипальмитат
FATP3 = Флуоресцеин аланин-трис-трипальмитат
FITC =
Флуоресцеинизотиоцианат (изомер I)
HOSU = Гидроксисукцинимид
TEA = Триэтиламин
TFA = Трифторуксусная кислота
THF = Тетрагидрофуран
Tris =
2-амино-2-гидрокси-метил-1,3-пропандиол
Z = N-карбобензокси
Материалы и методы
α-BOC(ε-Z-Lys) получили из Института пептидов, Inc. (Осака, Япония), а DSC
получили из Tokyo Kasei Kogyo Co. (Токио, Япония). Все аминокислоты были L-формы и закуплены у компании Sigma Chemical (St. Louis, MO), за исключением особо оговоренных случаев. Все растворители имели
квалификацию ч.д.а. и не подвергались дополнительной очистке.
Тонкослойная хроматография
Осуществляли на пластинках с Alufolein силикагелем 60 F254 (Merck) в
следующей системе растворителей: Rf1, хлороформ/метанол/уксусная кислота - 95/5/3; Rf2, хлороформ/метанол/триэтиламин - 95/7/3.
Жидкостная хроматография высокого разрешения (ЖХВР)
Аналитическую ЖХВР осуществляли на оборудовании для ЖХВР Миллипор Уотерс (Waters Chromatography Division of Millipore, Milford,
MA), включающему в себя систему подачи растворителя серии 6000A с автоматическим регулированием градиента и запоминающее устройство, модель 746. Хроматографию осуществляли на колонке (100х8) в
обращенной фазе с C18-матрицей NOVOPAKTM. Пептиды и конъюгаты трис-пептид анализировали в линейном градиенте элюирования 24-80% ацетонитрила с 0,1% TFA в течение 5 мин при скорости потока 2
мл/мин (Система A). Детекцию осуществляли при 260 нм, используя Waters Lambda Max 480; (RfA). Конъюгаты липопептида анализировали на колонке C18 с помощью
линейного градиента от 50% воды, 50% ацетонитрила с 0,1% TFA до 50% ацетонитрила, 50% THF с 0,1% TFA в течение 5 мин при скорости потока 2 мл/мин (Система B); (RfB).
Разделение соединений, меченых флуоресцеином осуществляли на полупрепаративной обратнофазовой колонке (25х10) с C4-матрицей PrepPakR при скорости потока 6 мл/мин.
Препаративная ЖХВР
Разделение осуществляли на Millipore Waters DeltaPrep 4000 HPLC, используя обратнофазовую колонку (100х40 мм) с C4-матрицей PrePak и элюировали с помощью
линейного градиента теми же элюирующими буферными системами, приведенными выше для аналитической ЖХВР, при скорости потока 20 мл/мин.
Ядерный магнитный резонанс (ЯМР)
Спектры
ЯМР регистрировали на 200 МГц Brucker-спектрофотометре.
Химический синтез
Получение ATP1, ATP2 и ATP3.
Эти соединения получали путем гидрогенизации Z-Ала-Трис-моно, ди- и трипальмитатов при давлении 2,812 кг/см2 (40 фунтов на квадратный дюйм) в гидрогенизаторе Parr в присутствии палладия на углероде (10%) в этаноле. Удаление бензилокарбонильной группы отслеживали с помощью ЖХВР (Система B). После удаления катализатора фильтрацией и выпаривания растворителей, ATP1, ATP2 и ATP3 получали в достаточном количестве. Синтез и очистка ZATP1, ZATP2 и ZATP3 и соответствующие глицильные соединения описаны у Whittaker, R.G., Hayes, P. J. and Bender, V.J., 1993), Peptide Research, 6, 125-128, и Whittaker R. W. Патент N 649242, Аминокислоты, пептиды или их производные, присоединенные к жирам.
Получение FATP1, FATP2 и FATP3.
К раствору ATP1 (10 мг, 25 мкм) в DCM (500 мкл) приливали при перемешивании раствор ФИТЦ (10 мг, 25 мкм) в DMF (500 мкл). Точное значение pH в реакции поддерживали добавлением TEA, а ход реакции отслеживали с помощью ЖХВР (Система B). Образование флуоресцеин-Ала-трис-пальмитата полностью заканчивалось через 10 мин и продукт выделяли очисткой с помощью препаративной ЖХВР до получения FATR1-продукта до хроматографически чистого состояния, Rf: 7,08. Растворители удаляли при пониженном давлении, а FATR1-продукт лиофилизировали из третичного бутанола.
FATR2 и FATR3 синтезировали таким же образом в результате реакции ATP2 (16,3 мг, 25 мкм) и ATP3 (22 мг, 25 мкм) в DCM (500 мкл) с ФИТЦ (10 мг, 26 мкм) до получения хроматографически чистых продуктов, соответственно, Rf: 8,61 и 9,92.
Получение аланин-этаноламин-пальмитата, меченого флуоресцеином.
Аланин-этаноламин-пальмитат (AEP) получали гидрогенизацией Z-Ала-этаноламин-пальмитата в гидрогенизаторе Parr'а в присутствии палладия на угле (10%) в этаноле. Удаление бензилоксикарбонильной группы отслеживали с помощью ЖХВР (Система B). После удаления катализатора фильтрацией и выпаривания растворителя названное соединение получали в достаточном количестве.
Получение (Лиз)n-соединений.
Синтез и выделение очисткой Z-Ала-этаноламина и соответствующего пальмитата описаны у Whittaker, R.G., Hayes, P.J. and Bender, V.J., 1993), Peptide Research, 6, 125-128, и Whittaker R.G. Патент N 649242, Аминокислоты, пептиды или их производные, присоединенные к жирам.
К раствору AEP (20 мг, 54 мкм) в DMF (500 мкл) добавляли при перемешивании ФИТЦ (22 мг, 56 мкм) и точно поддерживали pH 9,0 добавлением TEA. Реакция протекала полностью менее чем за 20 мин и продукт выделили очисткой с помощью препаративной ЖХВР до получения названного соединения в хроматографически чистом состоянии, Rf: 7,01.
Синтез олиго-Лиз-соединений [(BOC(ε-Z-Лиз)n] осуществляли по классическому способу в растворе (1). Липопептиды BOC(ε-Z-Лиз)n-X-трис-пальмитата синтезировали, присоединяя олиго-Лиз и пальмитиновую кислоту с помощью линкерного аминокислотного (X)-трис-соединения. Осуществление синтеза заключается в присоединении BOC(ε-Z-Лиз)n-OH к трис-аминокислоте с помощью активированного эфира и последующим присоединением пальмитиновой кислоты к этому конъюгату с помощью симметричного ангидрида. Чистоту интермедиата и конечного продукта контролировали с помощью ТСХ, ЖХВР и ЯМР.
1) Bodansky, M. and Bodansky, A. 1984. Основы синтеза пептидов, Springer-Verlag, Берлин.
2) Whittaker, R.G., Hayes, P.J. and Bender, V.J., 1993, Надежный способ присоединения триса к аминокислотам и пептидам, Peptide Research, 6, 3 (p. 125-128).
Типичные примеры синтеза приведены ниже.
Стадия (I) α
-BOC(ε-Z-Лиз)2OH
α-BOC(ε-Z-Лиз)OH, (9,9 г, 30 ммолей) растворяли в 100 мл DCM. HOSU (5,2 г, 45 ммолей) и DIEA (9,0 г, 15 мМ) добавляли к раствору и охлаждали
до 0oC. DCCD (6,2 г, 30 ммолей растворяли в 50 мл DCM, добавляя по каплям в реакционную смесь. Полученный раствор перемешивали при 0oC в течение 1 ч с последующим выдерживанием
при
комнатной температуре в течение ночи для получения активированного эфира (α≠BOC(ε-Z-Лиз)OSU в количестве 86% по ЖХВР. Преципитат DCU (Дициклогексилмочевина) отфильтровывали и
α-амино (( ε-Z-Лиз)OH (7,56 г, 27 мМ) добавляли к реакционной смеси и перемешивали при комнатной температуре в течение ночи. Соединение I получали в количестве 93%, как определили с
помощью ЖХВР. Растворитель удаляли при пониженном давлении, а маслянистый остаток растворяли в этилацетате и промывали кислотой, основанием и водой. Этилацетатную фазу высушивали над сульфатом натрия
и упаривали досуха. Осадок растирали в порошок с диэтиловым эфиром до получения 16,6 г соединения I в количестве 93%, Rf1: 0,52, RtA: 7,33
мин;1HЯМР: δ (DMSO-d6, ppm), 1,39 (9H, s, BOC(CH3)3), 1,4-1,8 (12H, brs, β,γ,δ CH2), 2,99 (4H, brs, ε CH2), 3,95 (1H, m, αCH), 4,14 (1H, m, αCH ), 5,03 (4H, s, Ar-CH2), 6,89 (1H, d, α-уретан NH, J = 7,5 Гц), 7,25 (2H, t, ε-уретан NH), 7,41 (10H, m, Ar(H)), 7,
95 (1H, d, амид NH, J = 8,5 Гц).
Стадия (II) H(ε-Z-Лиз)2OH
Соединение I (15,6 г, 27 ммолей) растворяли в 50 мл DCM и охлаждали до 0oC. TFA (50 мл)
приливали к реакционной смеси и перемешивали ее при 0oC в течение 10 мин и в последующие 50 мин - при комнатной температуре. Растворитель и избыток TFA выпаривали досуха, а маслянистый
остаток растирали в порошок с диэтиловым эфиром. Получили 15,3 г соединения II; Rf2: 0,19, RtA: 6,07 мин.
Стадия (III)
α-BOC(ε-Z-Лиз)3OH
α-BOC(ε-Z-Лиз)OH (8,96 г, 27 ммолей) активировали с помощью HOSU и DCCD, как в примере I. DCU отфильтровывали и фильтрат добавляли к
15,1 г соединения II. DIEA (6 г, 46 ммолей) добавляли к реакционной смеси и перемешивали в течение ночи при комнатной температуре. Растворитель выпаривали, а остаток растворяли в этилацетате и
промывали кислотой, основанием и водой. Этилацетат сушили над сульфатом натрия и выпаривали досуха. Остаток растирали в порошок с диэтиловым эфиром до получения 20 г белого осадка соединения III в
количестве 87%; Rf1: 0,36; RtA: 7,92 мин.1HЯМР: δ (DMSO-d6, ppm), 1,39 (9H, s, BOC(CH3)3
), 1,4-1,8 (18H, brs, β,γ,δ CH2), 2,99 (6H, brs, εCH2 ), 3,95 (1H, m, αCH ), 4,14 (1H, m, αCH ), 4,34 (1H, m, αCH ), 5,03 (6H, s,
Ar-CH2), 6,8 (1H, d, ε-уретан NH, J = 7,5 Гц), 7,25 (3H, t, ε-уретан NH), 7,41 (15H, m, Ar(H)), 7,80 (1H, d, амид NH, J = 8 Гц), 8,15 (1H, d, амид NH, J = 8 Гц).
Стадия (IV) α-BOC(ε-Z-Лиз)3-Ала-трис
α-BOC(ε-Z-Лиз)3OH (1 г, 1,2 ммоля) растворяли в 40 мл DMF и добавляли DSC (0,92 г, 3,6 ммоля).
После добавления DIEA (0,2 мл, 1,2 ммоля) и перемешивания при комнатной температуре в течение 1 ч активированный эфир три-Лиз образовывался в количестве 78%, как определили с помощью ЖХВР. В
реакционную смесь добавляли трис-Ала (0,46 г, 2,4 ммоля) и pH доводили до 8 добавлением 0,6 мл DIEA. Получение названного соединения продолжили с помощью ЖХВР. Спустя 2 ч активированный эфир почти
полностью утилизировали либо путем присоединения к Ала-трис, с образованием соединения IV, или в результате гидролиза до три-Лиз-соединения. Общее количество соединения IV составило 52% по ЖХВР.
Препаративной ЖХВР произвели 270 мг очищенного соединения с RtA: 7,4 мин.1HЯМР: δ (DMSO-d6, ppm), 1,39 (9H, s, BOC(CH3)3), 1,4-1,9 (18H, brs, β,γ,δ CH2), 2,97 (6H, brs, ε CH2), 3,53 (6H, d, трис (CH)2, J = 3 Гц), 3,75-4,43 (4H, brs, αCH ), 3,89
(3H, t, OH), 5,08 (6H, s, Ar-CH2), 6,8 (1H, d, α-уретан NH, J = 7,4 Гц), 7,19 (3H, t, ε-уретан NH), 7,41 (15H, m, Ar(H)), 7,80 (1H, d, амид NH, J = 8 Гц), 8,15 (1H, d, амид NH,
J = 8 Гц), 8,35 (1H, d, амид NH, J = 8 Гц).
Стадия (V) α-BOC(ε-Z-Лиз)3-Ала-трис(пальмитат)n, n = 1, 2, 3
α-BOC(ε-Z-Лиз)3-Ала-трис (173 мг, 0,173 ммоля) растворяли в 3 мл DCM и 1 мл DMF. Пальмитиновую кислоту и каталитическое количество DMAP добавляли к реакционной смеси. Ее охлаждали до 0oC и DCCD (71
мг, 0,346 ммоля) растворяли в 2 мл DCM, капельно добавляя в реакционную смесь. Ее перемешивали при 0oC в течение 30 мин и затем выдерживали при комнатной температуре в течение ночи.
Соотношение названного соединения к моно-, ди- и трипальмитат составило 17%, 40% и 43% по ЖХВР (система B).
Растворитель упаривали досуха, а остаток повторно растворяли в DCM. Отфильтровывали DCU и фильтрат промывали бикарбонатом натрия (5%) и водой. Препаративной ЖХВР этой смеси получили высокоочищенные соединения монопальмитата (17 мг, RtB: 7, 63 мин), дипальмитата (76 мг, RtB: 8,65 мин) и трипальмитата (63 мг, RtB: 9,29 мин).1HЯМР соединения трипальмитата: δ (CDCl3, ppm): 0,8-0,95 (9H, t, CH3), 1,3-1,47 (84H, m, BOC (CH3)3), пальмитат (CH2), Ала (CH3)), 1,47-1,9 (18H, brs, β,γ, δCH2), 1,83 (6H, t, CH2), 2,28 (6H, t, CH2), 3,09 (6H, brs, ε CH2), 3,97 (2H, m, α CH), 4,29 (1H, m, α CH), 4,35 (6H, s, трис(CH2), 4,47 (1H, t, αCH), 5,04 (6H, s, Ar-CH2), 5,56 (1H, d, амид NH, J = 7 Гц), 5,7 (1H, d, амид NH, J = 7,5 Гц), 5,78 (1H, d, амид NH, J = 7,5 Гц), 6,92 (1H, d, α-уретан NH, J = 7,4 Гц), 7,19 (3H, t, ε-уретан NH), 7,35 (15H, m, Ar(H)).
Стадия (VI) (Лиз)3-Ала-трис(пальмитат)3
Соединение V (45 мг)
растворяли в DCM (2 мл) и охлаждали до 0oC. Добавляли TFA (2 мл) для удаления Boc-группы при 0oC в течение 10 мин и при комнатной температуре в течение 30 мин. Растворитель и
избыток TFA тщательно удаляли повторным упариванием с диэтиловым эфиром1HЯМР этого соединения показал исчезновение BOC (CH3)-группы. Затем остаток растворили в растворе
DCM/метанол (50/50, 4 мл) и гидрогенизировали в течение 2 ч при давлении 40 фунтов на квадратный дюйм в гидрогенизаторе Parr'а, используя 10% палладий/углерод для удаления Z-групп. Удаление Z-групп
подтверждали1HЯМР-спектроскопией (по исчезновению химического сдвига при 5,04 и 7,35 ppm).
Биология
Использованные сокращения:
A = Аланин
DDME =
(Неполная) Модифицированная Дюльбекко среда Игла, удвоенной концентрации, замороженная, оттаянная при 37oC, отфильтрованная и разбавленная до 1х перед использованием (Loeffler, J-P and Behr,
J-P, Методы в энзимологии (1993) H, p. 599-654.
DME = Модифицированная Дюльбекко среда Игла
DOPE = Диолеоил фосфатидил-этаноламин
EM = Электронный микроскоп(ия)
F = Фенилаланин
FCS = Околоплодная сыворотка теленка
FLAEP = флуоресцеин-аланин-этаноламин-пальмитат
FLATP3 = флуоресцеин-аланин-трис-пальмитат
G = Глицин
K = Лизин
K3ATP1-3 = трилизиналанин-трис-моно-трипальмитат
L = Лейцин
Lfe = Lipofectamine (Gibco BRL)
MTS = 3-(4,
5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4- сульфофенил)-2H-тетразолий, внутренняя соль; (реактив Owen'a)
MTT = 3-[4,5, Диметилтиазол-2-ил]2,5-дифенилтетразолий бромид; тиазолий
голубой
PBS = фосфатно-солевой буферный раствор
TEM = Трансмиссионный электронный микроскоп
VF = Verafectin = K3ATR3
VFA3 = K3ATR3
VFG2 = K3GTP2
A. Клеточное поглощение и распределение.
С целью оценить способность доставлять соединения в клетки, провели предварительные эксперименты с флуоресцеин-аланин-этаноламин-пальмитатом (FLAEP) и с флуоресцеин-аланин-трис-пальмитатом (FLATP3).
FLAEP- и FLATP3-конъюгаты разбавляли раствором DMSO в водной среде (PBS) до 10 мкМ и наслаивали на отмытый монослой почти сливающихся клеток Cos 1, растущих на поверхности прокипяченных покровных стекол. После инкубационного периода, как указано в эксперименте, при выдерживании до 24 часов, клетки отмывали и фиксировали в формальдегиде в течение 20 минут. Затем клетки наблюдали при лазерном возбуждении в конфокальном микроскопе MRC 500 фирмы Bio Rad.
Клетки, фиксированные в течение только пятнадцати минут, после обработки FLAEP либо FLATP3, проявляли интенсивное цитоплазматическое окрашивание. Клетки, выдержанные эквивалентно лишь с одним флуоресцеином, проявляли очень слабую общую флуоресценцию целой клетки. Следует особенно подчеркнуть, что FLATP3, как оказалось, предпочтительно связывается с клеточными и ядерными мембранами и сохраняется в клетках, не препятствуя их росту в течение 24 часов, несмотря на то, что раствор для конъюгирования смывали с монослоя спустя 2 часа и заменяли на сыворотку, содержащую среду. Такую длительность окрашивания не наблюдали при использовании FLAEP-конъюгата в тех же условиях.
Фиксация в 4% параформальдегиде сохраняла клеточную морфологию лучше, чем фиксация в формальдегиде. Поэтому в клетке получали более высокое разрешение флуоресцентного изображения. Это свидетельствует о том, что оба конъюгата локализуются в очень дискретных участках цитоплазмы, а не распределены равномерно. Наблюдения в световом микроскопе свидетельствуют, что участками локализации могут быть эндоплазматический ретикулум, аппарат Гольджи и, возможно, митохондриальные мембраны.
Наблюдения, проведенные при низком разрешении (объектив 40х) на живых, нефиксированных клетках, выдержанных в том же промежутке времени, что и фиксированные клетки, позволяет видеть, что отличающийся образец окраски FLAEP-конъюгат легко проникает в клетку, но концентрируется преимущественно в ядрах. Вероятно это свидетельствует о том, что это генерализованное цитоплазматическое и ядерное распределение зависит от молекул, которые остаются неприсоединенными к компонентам этих компартментов. При фиксации такие молекулы будут вымываться из клеток, задерживающих только конъюгат, который связывается с клеточными компонентами. FLATP3-конъюгат показывает сходный результат для живых и фиксированных клеток.
В клетках, обработанных любым соединением при концентрации 10 мкМ в течение до 2 часов, явной токсичности не наблюдали. После 72 часов выдерживания клеток Cos 1 в присутствии до 50 мкМ FLAEP или больше наблюдали значительную цитотоксичность в стандартном цитотоксическом анализе с MTT (смотри ниже). После такого же длительного 72-часового периода выдерживания FLATP3 вызывал почти 80% цитотоксичности при концентрации 12,5 мкМ (при одной и той же концентрации разбавленного DMSO) и 70% цитотоксичности - при концентрации 6,25 мкМ.
Эти результаты ясно указывают на то, что вводящие соединения, несущие липидные ацильные производные, могут облегчать их собственное проникновение в клетки. Наблюдаемая цитотоксичность незначительна в период, необходимый для проникновения соединения в клетку, но существенно увеличивается при продолжительном выдерживании. В соответствии с этим осуществили эксперименты, в которых выясняли действительно ли подобные соединения можно использовать для введения в клетки других соединений, таких как ДНК, путем их связывания.
B. Эксперименты по трансфекции.
a) Цитотоксичность.
Цитотоксичность определяли, используя стандартный анализ с помощью MTT (3-[4,5, Диметилтиазол-2-ил] 2,5-дифенилтетразолийбромид; тиазолий голубой). Клетки Cos 1 высеяли в лунки с 100 мкл культуральной среды 96-луночного планшета для микротитрования в концентрации 2•104 клеток/лунку для их прикрепления. Затем добавляли испытуемое соединение в концентрации 2х на 100 мкл культуральной среды при удвоенном разведении. Клетки инкубировали в нормальных условиях культивирования при 37oC и 5% CO2 в течение 72 часов 20 мкл MTT (5 мг/мл PBS) добавляли на 2,5 часа при 37oC и затем всю жидкость удаляли. Добавляли 100 мкл подкисленного пропанола и планшет встряхивали в течение 10 минут перед определением ОП при 570 нм с референсной ОП 630 нм.
Сконструировали вводящее соединение, K3ATP3 (трилизиналанин-трис-трипальмитат), названное VerafectinA3, которое, как ожидали, присоединится к ДНК благодаря своему суммарному положительному заряду. Оно не растворяется в водном растворе, частично растворяется в нагретом этаноле и растворяется в DMSO. Цитотоксичность испытывали путем непрерывного выдерживания клеток Cos 1 в течение 72 часов с K3ATP3, в виде разбавленного маточного раствора (2,5 мг/мл) в 25% DMSO. Наблюдали 70% выживших клеток по сравнению с такой же концентрацией DMSO, разбавленного соединением при концентрации 12,5-50 мкМ (фиг. 1a и b). Когда соединение растворяли в этаноле аналогичной концентрации, выживших клеток было несколько больше (фиг. 2a и b).
b) Доставка ДНК
Эксперимент 1: Чтобы проверить трансфекционные свойства вводящего соединения K3ATP3 (VerafectinA3), целую
неразрезанную плазмиду, несущую ген, кодирующий CAT (хлорамфеникол-ацетилтрансферазу) под контролем позднего промотора SV40, pSVLCAT (Cameron, F. H. and Jennings, P.A. (1989) PNAS 86, 9139-9143),
смешивали с испытуемым фактором и помещали на клетки Cos 1 при различных условия. Через 48 часов культивирования оценивали уровень секретированного CAT в культуральной среде.
Способ:
Раствор I: 1 мкг плазмидной ДНК в 500 мкл модифицированной Дюльбекко среды Игла (DME)
Раствор II: 0-20 мкл VerafectinA3 (2,5 мг/мл 25% DMSO) в 500 мкл, DME, встряхнуть.
Объединить растворы I и II, коротко встряхнуть и инкубировать при комнатной температуре в течение 10 мин.
Добавить смесь к отмытым клеткам в 60 мм чашках для тканевой культуры (посеянных из расчета 0,5•105 клеток/чашку в предыдущий день) на 6 часов при 37oC, 5% CO2.
Добавить 2 мл DME + 10% FCS и оставить на 48 часов.
Определить уровни CAT в тканевой культуральной среде (Sleigh, M.J. (1986) Anal. Biochem. 156.251-256).
Результаты:
Значительные уровни CAT
обнаружили в образцах, трансфецированных 5 мкл (12,5 мкг) VerafectinA3 (2,5 мг/мл = 1,8 мМ) и выше. Пиковый уровень CAT наблюдали при 10 мкл (25 мкг) VerafectinA3 (фиг. 3).
Эксперимент 2:
Чтобы сравнить уровни трансфекции в клетках Cos 1, использовали маточный раствор VerafectinA3 (10 мг/мл), растворенный либо в 100% DMSO, или в этаноле и в течение оптимального
времени выдерживали клетки с комплексом VerafectinA3/ДНК.
Способ:
a - Сравнить VerafectinA3, растворенный в DMSO и этаноле.
b - Сравнить действие VerafectinA3 на клетки в течение 6 часов и в течение ночи. VerafectinA3 в концентрации 10 мг/мл в 100% растворителе разбавить водой до 2,5 мг/мл.
Трансфекцию выполняли также, как и в эксперименте 1. VerafectinA3 оставляли в контакте с клетками в течение разного времени.
Результаты:
i) Значительные уровни CAT обнаружили во всех образцах, обработанных 10
мкл (25 мг) VerafectinA3 и выше.
ii) Этанольные образцы проявили сниженную эффективность трансфекции.
iii) Инкубация с VerafectinA3 в течение ночи снижала уровни CAT почти на 50%, по сравнению с 6-часовой инкубацией.
Эксперимент 3:
Чтобы сравнить уровни трансфекции, достигнутые для клеток CHO, использовали VerafectinA3 и G2, и
коммерческие реагенты Transfectam (Promega) и Lipofectamine (BRL).
Способ:
Условия применения были одни и те же для Verafectin'а и для Transfectam'а (смотри выше), за тем
исключением, что использовали 0,5 мкг ДНК pSVLCAT/60 мм чашку.
Lipofectamine применяли согласно инструкции для пользователей.
0,5 мкг pSVLCAT/60 мм чашку.
Клетки CHO высевали в концентрации 1•105/60 мм чашку и оставляли на ночь для прикрепления, в среде DME/Hans с 10% FCS.
Transfectam 5 или 10 мкл маточного раствора 1 мг/400 мкл.
Lipofectamine 5 или 10 мкл (смеси, составленной 3:1 с DOPE) 2 мг/мл.
VerafectinA3 (K3ATP3) и VerafectinG2 (K3G[Глицин]TP2) по 5, 10 и 15 мкл каждого из 2 мМ маточного раствора (2,8 и 2,3 мг/мл соответственно).
Инкубационный период без сыворотки в присутствии испытуемых факторов и ДНК длился 6 часов, затем добавляли 1 мл DME/Hams + 10% FCS. Через 24 часа среду заменили 2 мл свежей DME/Hams + 10% FCS до сбора клеток спустя 48 часов.
Результаты:
Клетки CHO лизировали через 48 часов после начала
операции трансфекции и проверили на CAT-активность. Во всех случаях пик трансфекции наблюдали при 5 мкл трансфекционного фактора. Уровни CAT, полученные при использовании VerafectinA3, равнялись
приблизительно 54% от уровней, полученных для Transfectam и 18% - от уровней, полученных для Lipofectamine.
Уровни cat, полученные при использовании VerafectinG2, равнялись приблизительно 64% от уровней, полученных для Transfectam и 22% - от уровней, полученных для Lipofectamine.
Смотри фигуру 4.
Эксперимент 4:
Чтобы сравнить
уровни трансфекции, достигнутые для клеток Cos 1 при использовании VerafectinA3 (K3ATP3) и VerafectinG2 (K3GTP2), использовали коммерческий реагент Lipofectamine (BRL).
Условия применения описаны выше и были теми же, что для Verafectin'а. Условия применения Lipofectamine находились в соответствии с инструкцией для пользователей.
Клетки Cos 1 высевали в концентрации 5•105/60 мм чашку и оставляли для прикрепления на ночь, в среде DME с 10% FCS.
Раствор A: 0,5 мкг pSVLCAT/60 мм чашку.
Раствор B: Lipofectamine 10 и 15 мкл (смеси, составленной 3:1 с DOPE) 2 мг/мл.
или; VerafectinA3 и VerafectinG2 20 мкл 2 мМ (соответственно 2,8 и 2,3 мг/мл) маточного раствора.
или VerafectinG2 также протестировали с эквимолярным количеством DOPE. VerafectinG2 и DOPE смешивали в DDME и встряхивали в течение 30 секунд перед использованием.
Растворы A и B объединяли перед наслаиванием на отмытые клетки.
Инкубационный период без сыворотки в присутствии испытываемых факторов и ДНК длился 6 часов, затем добавляли 1 мл DME + 10% FCS. Через 24 часа среду заменили на 2 мл свежей DME + 10% FCS до сбора клеток через 48 часов.
Результаты:
Образцы тканевой культуральной среды (супернатанты) клеток Cos 1 проверяли на
CAT-активность через 48 часов после начала операции трансфекции. Клетки Cos 1 трансфецировали VerafectinA3 и VerafectinG2 до уровней приблизительно 60% и 30% соответственно, который достигают,
используя Lipofectamine. Добавление эквимолярного количества отдельно взятого DOPE (2 мМ в DMSO/H2O) к образцу VerafectinG2 примерно удваивает эффективность трансфекции по сравнению с одним
лишь VerafectinG2, доводя ее до 60% от уровня, который достигали при использовании Lipofectamine и равную действию VerafectinA3. Полученные уровни CAT представлены на фигуре 5.
C.
Относительная цитотоксичность
Сравнивали относительные уровни цитотоксичности, обусловленные разными факторами, используя в эксперименте краситель "Alamar blue" (Alamar, Sacramento CA). Виды
соединений настоящего изобретения обычно проявляют значительно более низкую цитотоксичность, чем другие факторы.
Для примера фигуры 6a и b.
Относительные уровни цитотоксичности определяли в последующих экспериментах, используя краситель MTS, маркированный как Клеточный титр 96, водный (Promega).
D. Относительная эффективность вариантов соединений, приводящих к "трансфекции".
Линии клеток Cos 1 или CHO трансфецировали 0,5 мкг pSVLCAT или 2 мкг плазмиды pPGKLacZ, используя ряд концентраций по каждому трансфекционному соединению. Оптимальная концентрация соединения, которая представляет собой концентрацию, дающую наивысший уровень CAT через 48 часов или наибольшую процентную долю lac z (β-галактозидаза) окрашенных клеток через 24 часа, использовали для сопоставления данных в таблице 1. Так как все соединения не тестировали в одном эксперименте, абсолютные значения, характеризующие трансфекцию, не использовали. Скорее, используемые значения характеризуют относительную эффективность трансфекции со стороны Lipofectamine (BRL), который включили во все эксперименты в качестве контроля. Поэтому таблица 1 отражает относительные эффективности ряда соединений в опосредовании трансфекциии, по крайней мере, клеток одного типа.
Эксперименты осуществили, как описано выше в эксперименте 1, раздел B; с вариациями - в эксперименте 3. Представленные результаты получены при оптимальных уровнях трансфецирующего фактора. Все представленные результаты получены данными авторами; в их число не включены коммерческие агенты, ответственные за литературное оформление.
Другие варианты синтезированных и испытанных соединений описаны ниже.
Заключение
Результаты, представленные в таблице 1, свидетельствуют, что все тестированные соединения, которые имели K1-4-, A- или G-линкер и пальмитат 1-3, смогли обеспечить определенный
уровень трансфекции в испытываемых видах клеток. Соединения, которые не содержали лизина или пальмитата, были неспособны обеспечить трансфекцию, что свидетельствует о потребности и ДНК, притягивающей
составляющую (K) и предполагаемую проникающую в клетку составляющую (пальмитат). Разные линкеры оказывали влияние на уровень трансфекции и оба были способны содействовать трансфекции.
Изменчивость вводящего соединения, изменяющего эффективность трансфекции
Соединения с общей формулой рассматривались как состоящие из описанных основных строительных блоков "x, y, R1-R4". Эти
компоненты последовательно меняли, чтобы выяснить оптимальные строительные блоки для трансфекции стандартных клеточных линий в стандартной системе анализа. Результаты будут представлены путем
использования образцовых экспериментов и показаны в виде уровней экспрессии репортерного гена, полученных в стандартных условиях, либо как общие уровни экспрессии (экспрессия CAT или β
-галактозидазы) или в виде процентной доли трансфецированных клеток (β-галактозидаза - голубые клетки). Репрезентативные уровни цитотоксичности также будут описаны.
Пептид "x".
Вводящее соединение VerafectinA3, описанное выше, несет 3 остатка лизина (K3), придающие молекулам заряд 4+. Протестировали варианты, которые несли от K0 до K5 остатков лизина и, соответственно, заряд от 0+ до 6+.
Цель: Оценить оптимальное количество K-остатков, необходимое для эффективной трансфекции.
Способ: В отдельных экспериментах провели
сравнения между:
a: K0ATP3, K3ATP3, K5ATP3 и K2ATP2, K5ATP2 (клетки CHO)
b: K1ATP2, K2ATP2 (клетки Cos 1).
c. K3ATP3, K4ATP3, K5ATP3 (клетки CHO).
Все тестируемые липопептидные реагенты вначале растворили при концентрации 10 мМ в 75% DMSO, а затем разбавили водой, чтобы приготовить 2 мМ маточный раствор, который хранили при 4oC.
Из 2 мМ маточного раствора отобрали ряд объемов липопептида от 2 мкл до 15 мкл и разбавили в 500 мкл DDME. 1 мкг плазмиды pSVLCAT отдельно разбавили в 500 мкл DDME. Растворы объединили, выдержали 10-20 мин при комнатной температуре перед добавлением к 500 мкл DDME в 60 мм чашках субсливных клеток CHO (2•105 день-1) или клетки Cos 1 (5•105 день-1), отмыли DDME, свободной от сыворотки.
Клетки инкубировали в течение 6 часов в стандартных условиях при 37oC и в течение 6 часов при 5% CO2. В течение ночной инкубации к клеткам добавляли 1,5 мл DME/Hams + 10% FCS (CHO) или 10% FCS (Cos 1). На последующие 24 часа перед сбором клеток среду заменили свежей - DME/Hams + 10% FCS или 10% FCS. Получали клеточный лизат и определяли CAT-активность, как описано выше. В случае клеток Cos 1 CAT-активность определяли в культуральных супернатантах.
Результаты:
a: Для трипальмитатных
соединений K3ATP3 получили хорошую трансфекцию (средняя - 6237 cpm для 25 мкл лизата после 20 мин экспериментального времени при 37oC, 1 мкл C14-ацетил KoA (общее количество
импульсов-40-50000 cpm)). K5-соединение дало значительно сниженное количество импульсов при его оптимальном уровне (средняя 1785 cpm). K0-соединение показало умеренную трансфекцию в данной
экспериментальной системе, однако при использовании β--гал экспериментальной системы (описанной ниже) для CHO-клеток, наблюдали низкие уровни трансфекции.
У дипальмитатных соединений присутствие K2 существенно улучшало трансфекцию, давая среднюю 5418 cpm, по сравнению со средней 132 cpm для K5-соединения. Жизнеспособность трансфецированных чашечных клеток указана на графике 7b. Наивысшая токсичность (при самой низкой ОП) отмечена в чашках, проявляющих самые высокие уровни трансфекции.
Смотри фигуры 7a и 7b.
b. Включение одиночного K существенно не влияет на протекание трансфекции, средняя 12670 cpm (25 мкл лизата, 135 мин инкубации при 37oC, 2 мкл C14-ацетил-KoA (общее количество импульсов)-90-100000 cpm)). Присутствие второго лизинового остатка примерно в 5 раз увеличивает уровни трансфекции (средняя 62215 cpm), относительно оптимальных результатов, наблюдаемых при том же уровне соединения.
Фигура 8.
c. И соединение K4ATP3, и соединение K5ATP3 показали значительное снижение трансфекции в отношении к K3-эквиваленту, давая средний уровень измененной CAT-активности со значениями соответственно 1071, 6363 и 13467 после 2 часов инкубации в 20 мкл лизата.
Фигура 9.
Заключение
На основании
представленных данных нарастание оптимальной активности при включении 0-5 лизиновых остатков в Kn=1-5 FNH2/3 можно изобразить следующим рядом:
K3≥K2>K5>
K4>>K1.
Репрезентативный график клеточной жизнеспособности показан для эксперимента b (смотри фиг. 7b). Это свидетельствует об обратной зависимости между жизнеспособностью клеток и трансфекцией. Это является обычной картиной.
Линкер "y".
Вводящее соединение, описанное выше, несет 3 лизиновых остатка и аланиновый (A) линкер в положении "y". Испытывали варианты, которые несли аланин (A), лейцин (L), фенилаланин (F), лизин (K) или глицин (G).
Цель: Определить оптимальный линкерный остаток для эффективной трансфекции.
Способ: В отдельных экспериментах провели сравнение между:
a. K2 K/F/L TP2 (Cos 1)
b. K2 A/L TP2 (Cos 1)
c. K3 A/L/G TL3 (Cos 1)
Для трансфекции pSVLCAT и последующего анализа фермента CAT эксперименты "a" и "b" осуществляли, как описано выше.
В эксперименте "c" трансфецировали плазмиду pPGKlaczNLS, кодирующую β--галактозидазу под контролем мышиного PGK-промотора (любезно представленную G. Hannan) или pSVGAL, которая использует ранний промотор SV40 (Sleih, M.J. and Lockett, T.J. (1985). EMBO J. 4: 3831-3837). Этот эксперимент и анализ модифицировали по Felgner et al J. Biol. Chem. 269(4) 2550-2561, 1994. Эти условия позволили одновременно проанализировать 72 различные комбинации и концентрации ДНК и испытуемого фактора на микротитровальной плашке. В качестве оптимального результата для каждого реагента выбирали хорошо выраженный уровень генного продукта.
Цитотоксичность определяли, используя краситель alamar blue, а образец графика показан для эксперимента "a".
Результаты.
a: При сравнении линкеров K, F и L в дилизиновом, дипальмитатном соединении L показал намного лучшие результаты по сравнению с F и был в сущности более эффективен, чем K-соединение. Смотри фиг. 10a. Токсичность L- и F-соединений была несколько выше, чем K-соединения, указывая тем самым, что высокие уровни CAT не были видны просто потому, что были высоки уровни выживаемости клеток.
Фигура 10b.
b: При сравнении между A-линкером, использованным в экспериментах по сравнению пептида, и L-линкером, показавшим высшие уровни экспрессии гена в эксперименте "a", данные два соединения показали очень близкие активности.
Фигура 11.
c: Два лидирующих линкера A и L анализировали на фоне трилизина, трилаурата (L3) против G-линкера. В этом случае линкерное соединение A было наилучшим для получения трансфекции по сравнению с другими соединениями, показавшими относительные уровни трансфекции: L 57%, G 12% и Lipofectamine 39%.
Фигура 12.
Заключение
При сравнении представленных данных эффективности разных линкеров можно выстроить в ряд
A≥L>F>K>>G.
Липидные ацильные производные "R1-R4".
I. Ряд ацильных производных на трис-линкере, 1-3.
Наличие трис-линкера облегчает присоединение одного, двух или трех липидных ацильных производных к пептиду и линкеру. Вообще, все эти производные должны быть идентичны друг другу. Соединения, несущие все идентичные строительные блоки, и несущие один, два или три липидных ацильных производных, сравнили, используя стандартную трансфекцию и аналитические методики, описанные выше.
Цель. Сравнить способность липидных ацильных производных пептидных соединений, несущих один, два или три липидных ацильных производных трансфецировать клетки млекопитающих.
Способ.
Соединения тестировали на их способность трансфецировать либо CAT- или β--гал-ген, привнесенные плазмидами, и анализировали, как описано выше.
Эксперименты:
a. K2 A T P1/P2/P3 (Пальмитата 1, 2 или 3) (Cos 1)
b. K2 F T
P1/P2/P3 (Cos 1)
c. K2 L T P1/P2/P3 (Cos 1)
d. K2 K T P2/P3 (Cos 1)
e. K3 A T P2/P3 (CHO)
f. K2 A T P1/P3 (Cos 1)
K3 A T M1/M2/M3 (Миристат 1, 2 или 3)
(Cos 1)
K3 A T L1/L2/L3 (Лаурат 1, 2 или 3) (Cos 1)
g. K4 A T P1/P2/P3 (Cos 1)
Результаты.
a: Сравнение соединений, протестированных в эксперименте "a", показало, что молекулы ди- и трипальмитата оба дают высокие уровни трансфекции, тогда как молекула монопальмитата очень неэффективна.
Фигура 13a.
В других экспериментах K3-монопальмитатное соединение показало 30% активности от молекул K3-трипальмитата (не показано).
Относительная цитотоксичность соединений показана на прилагаемом графике.
Фигура 13b.
b: Относительные трансфекционные способности моно-, ди- и трипальмитатного соединений с фенилаланиновым линкером были сходны с соединениями с аланиновым линкером (a).
Фигуры 14a и b.
c: Относительные трансфекционные способности моно-, ди- и трипальмитатного соединений с лейциновым линкером были сходны с соединениями с аланиновым линкером (a).
Фигуры 15a и b.
d: В случае лизинового линкера дипальмитат оказался значительно менее активным, чем молекула трипальмитата. Увеличение трансфекционной активности трипальмитата сопровождается увеличением цитотоксичности, как это видно в предыдущих случаях.
Фигуры 16a и b.
e: В этом сравнении молекула трипальмитата гораздо более эффективна (средняя 8325 cpm), чем дипальмитат (средняя 984 cpm). Уровни цитотоксичности несколько выше с увеличением трансфекции.
Фигуры 17a и b.
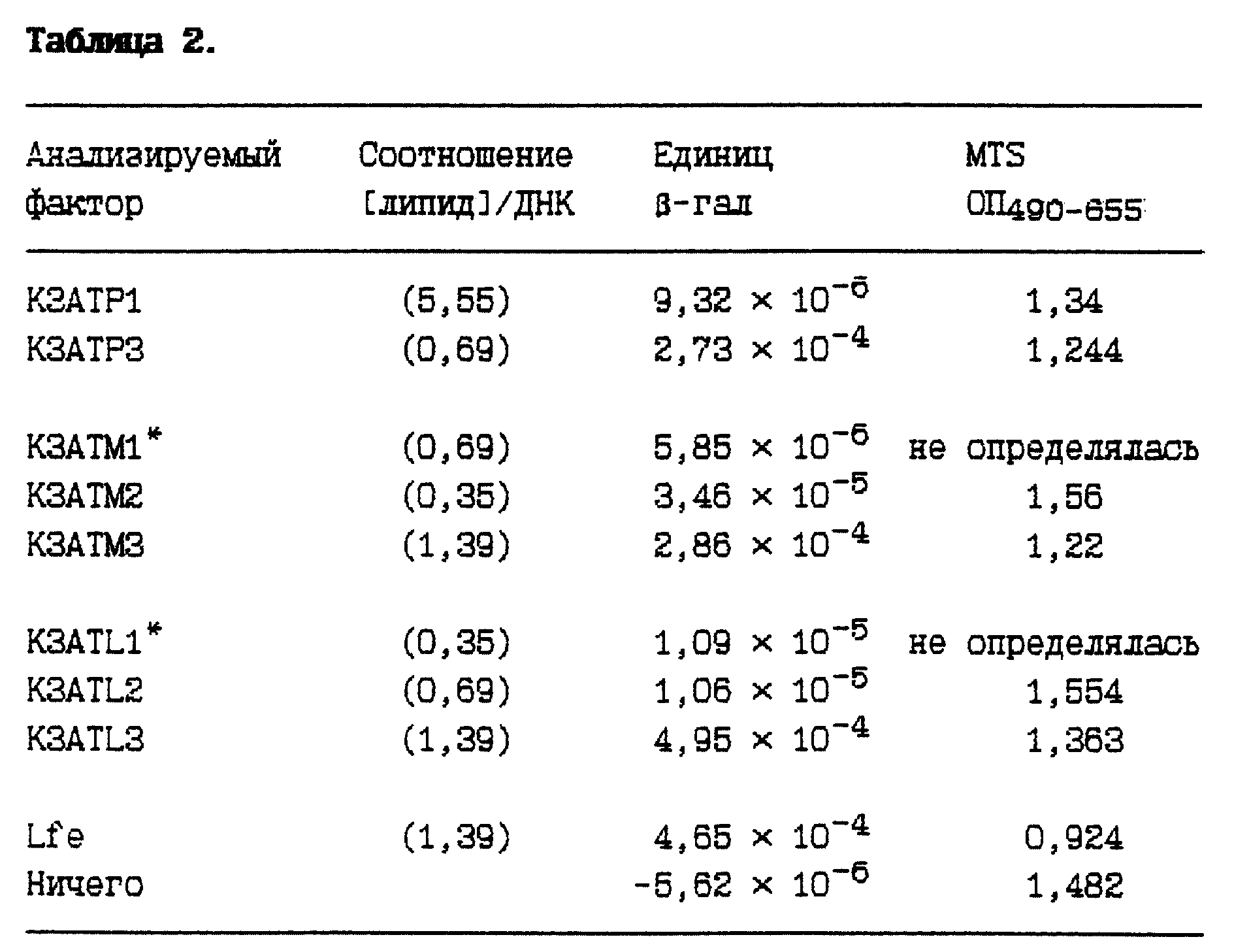
f: В этом сравнении, где соединения с разными липидными ацильными группами (n = 1-3) сравнивали на трансфекционную эффективность на фоне 3 отличающихся длиной липидных ацильных производных (пальмитат, миристат и лаурат), соединения с 3 липидными ацильными группами были стабильно более эффективными в трансфекции, чем соединение с 2 группами или с 1 группой. При наличии 3 липидных ацильных групп токсичность была в целом несколько выше, но всегда меньше, чем с lipofectamin'ом. Смотри таблицу 2.
Каждый представленный результат является наивысшим показателем, найденным среди отличающимися условиями 72 лунок микротитровальной плашки. Показано соотношение [липид]/[ДНК], при котором этот максимум был получен. Показанные эксперименты осуществили на клетках Cos 1, как описано выше. ОП MTS представляет собой измерение относительной жизнеспособности.*Эти точки взяты из отдельного эксперимента, а небольшая изменчивость между абсолютными значениями экспериментов является ожидаемой. Жизнеспособность в этом эксперименте измеряли с помощью красителя alamar blue и поэтому не поддается прямому сравнению.
g. K4-соединения.
Провели сравнение между тремя пальмитатами на фоне тетрализиналанина (K4ATP1/2/3). Как следует из предыдущих экспериментов, трипальмитат был более эффективен, чем ди- или монопальмитат. При использовании какого-либо одного из этих соединений активность была умеренной. Цитотоксичность была ниже, даже несмотря на высокие уровни этих реагентов, необходимых для оптимальной трансфекции.
Фигуры 18a и b.
Заключение.
Результаты экспериментов по соединениям "K3" сходны с соединениями "K4". То есть три липидные ацильные группы - это лучше, чем две или одна группа, что касается их способности трансфецировать клетки.
Заключение по R1-R4.
Как показано в вышеприведенных примерах, соединения с тремя липидными ацильными производными в целом показывают более высокую способность трансфецировать клетки, чем соединения с одним или двумя липидными ацильными производными. В оптимальных точках трансфекции данные соединения являются в целом значительно менее токсичными для клеток, чем коммерческое средство "Lipofectamine". Хотя большая часть представленных данных в этом разделе взята из экспериментов, осуществленных на клетках Cos 1, эти результаты были отражены в результатах, полученных для CHO-клеток. Оптимальные концентрации для различных соединений отличались у клеточных линий, также как и абсолютные уровни генного продукта, однако оптимальное соотношение между [липид] /[ДНК] в целом не зависело от типа клеток, и относительная трансфектабельность соединений оставалась сходной.
Сравнение представленных данных позволяет оценить эффективность численно отличающихся липидных ацильных групп (n = 1-3) несоставных несмешанных соединений в виде
ряда
3>2>1.
Липидные ацилпроизводные "R1-R4"
II. Длина углеродной цепи.
Цель: Определить, действительно ли липидные ацилпроизводные разной длины (относительно C16) (пальмитат) обладают большей способностью трансфецировать клетки млекопитающих.
Способ: Создали варианты соединения трис-трилизиналанин (K3AT), несущих
от одного до трех липидных ацилпроизводных, отличающихся следующими данными:
C16 Пальмитат (P)
C14 Миристат (M)
C12 Лаурат (L)
C10 Капроат (C)
Каждое из
этих соединений проверяли на трансфекционную способность и цитотоксичность на стандартных клеточных линиях, используя стандартные условия, как писано выше.
Результаты.
a: Сравнение P-, M-, L- и C-производных в клетках Cos 1 и CHO.
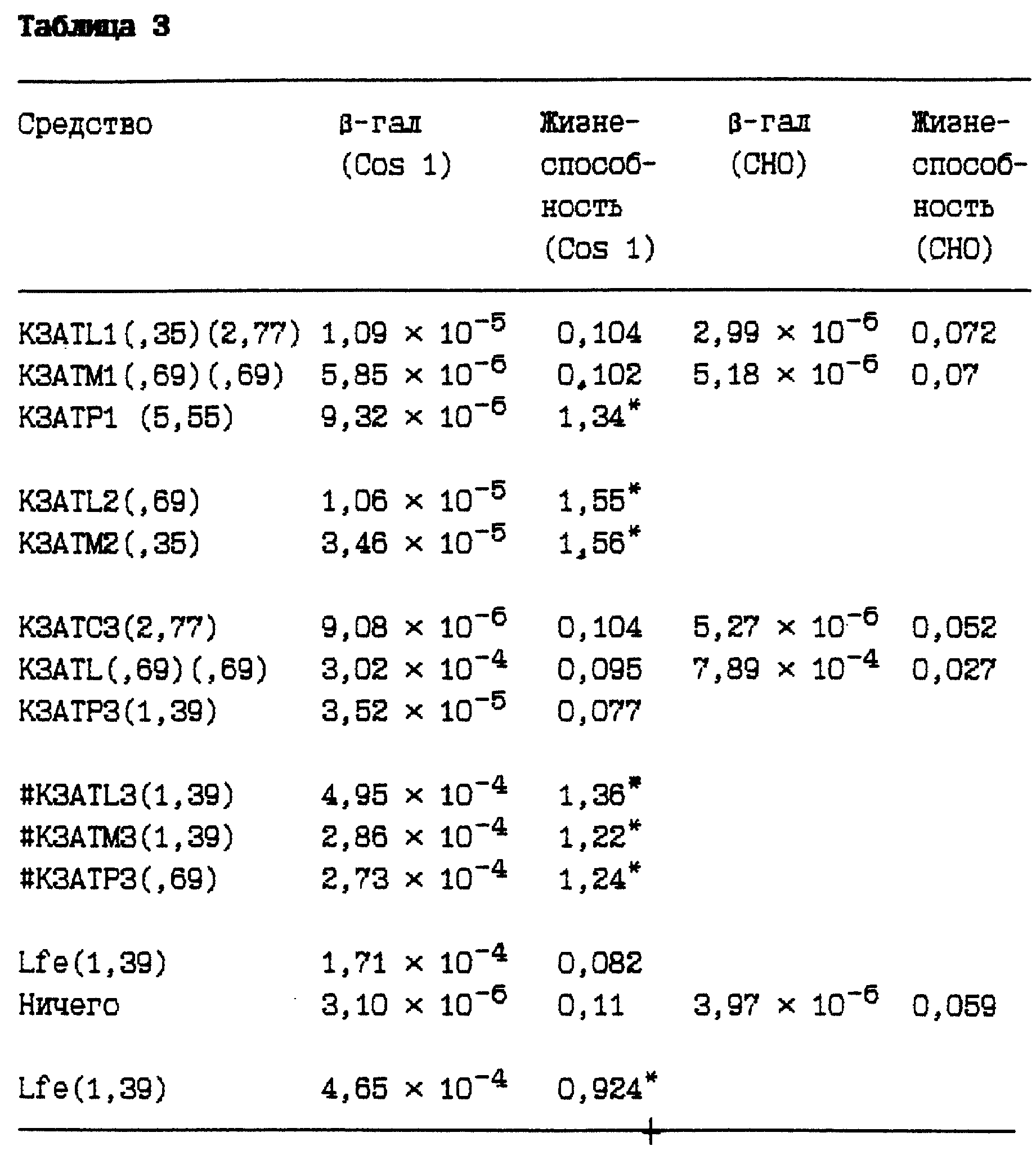
Таблица 3 свидетельствует, что соединения с лауратом и миристатом в целом способны трансфецировать клетки более эффективно, чем первоначально использованные производные пальмитата. Капроат был минимально активным производным среди этих соединений.
Пояснительная подпись к таблице 3.
Каждый представленный результат является наивысшим показателем для 72, отличающимися условиями, лунок микротитровальной плашки. Соединение [липид] /[ДНК] , при котором получено это максимальное показание, представлено в скобках для двух отличающихся типов клеток в следующем порядке; (Cos 1) (CHO). Представленные эксперименты осуществили на клетках Cos 1, как описано выше. Жизнеспособность измеряли с помощью красителя alamar blue. Знаком # обозначили соединения, проанализированные в отдельном эксперименте. Знак* означает, что жизнеспособность определили с помощью красителя MTS. ОП является измерением относительной жизнеспособности клеток, выдержанных с разными факторами, а также с красителем alamar blue, наивысшее значение свидетельствует о наибольшей клеточной жизнеспособности.
b. R1-R4 как C10-C16, проанализированные на клетках HeLa.
Цель: Определить, действительно ли самая эффективная липидная ацильная группа, выявленная на клетках Cos 1 и CHO, также является самой эффективной и на клетках HeLa.
Способ: Вместо клеток Cos 1 и CHO в DME + 10% FCS посеяли HeLa-клетки при плотности 2• 104/лунку и трансфецировали их pPGKlaczNLS, как описано выше.
Спустя 48 часов с помощью красителя alamar blue определили цитотоксичность и подвергали β -гал-анализу.
Результаты:
Результаты β-гал-анализа свидетельствуют, что как и в отношении клеток Cos 1 и CHO, с уменьшением длины углеродной цепи от C16 до C12,
трансфекционная способность увеличивается. При использовании молекулы C10 трансфекционная способность была сильно урезанной и равнялась в этой серии пику трансфекционной эффективности для C12.
Неожиданно оказалось, что пиковый уровень клеточной жизнеспособности был также присущ C12-соединению (K3ATL3).
Фигуры 19a и b.
Заключение.
Изменение длины липидных ацильных производных сильно влияет на способность данных соединений трансфецировать некоторые типы клеток. В каждом из всех проанализированных типов клеток трансфекция поддерживается примерно на одном уровне. И миристат, и лаурат в этом отношении дают большие уровни трансфекции, чем модельный пальмитат, по сравнению с лауратом, который является наилучшим среди них.
Линкер "y" - это необычные аминокислоты
Ряд аминокислот использовали в качестве линкерных групп. Он включает в себя, как указано выше, лейцин, глицин, аланин, фенилаланин, α-BOC (без
ε-)-лизин. Кроме того, проанализировали также необычные аминокислоты, такие как аминомасляная, аминокапроновая и аминокаприловая кислоты (которые создают удлиненный линкер соответственно из 3,
5 и 7 углерод-углерод одиночных связей).
Эксперимент 1.
Цель: Определить трансфекционные свойства соединений с большей длиной интервала между трисом и заряженным пептидом "x" с помощью необычных аминокислотных линкеров, меняющих длины в положении "y".
Способ: Синтезировали пептид/липидацильные конъюгаты, используя необычные аминокислоты - аминомасляную (C3), аминокапроновую (C5) и аминокаприловую (C7) кислоты в качестве линкерных групп, трилизиновый домен, связывающий нуклеиновую кислоту, и лаурат для трех липидных ацильных групп. В этих новых конъюгатах связующая ДНК и трис/липидацильные составляющие были разделены с помощью дополнительных, соответственно, 3, 5 и 7 связанных углеродов, по сравнению с модельной молекулой. Эти соединения затем проанализировали по стандартному способу, описанному выше, чтобы определить их относительную способность трансфецировать клетки.
Результаты:
K3-"y"-TL3-соединения, где y=C3, C5, C7, A, L, G, сравнили на трансфекционную эффективность относительно друг друга и с коммерческим средством - Lipofectamine'ом, используя описанную выше стандартную
систему репортерного гена β-гал. Все соединения, за исключением K3GTL3, оказались более эффективными для трансфекции, чем Lipofectamine. C3-, C5- и, особенно, C7-соединения проявили гораздо
большую эффективность, чем соединения, использующие стандартный одиночный аминокислотный линкер.
Фигура 20a.
Цитотоксичность факторов показана на прилагаемом графике.
Фигура 20b.
Отметим, что увеличенные уровни трансфекции не сопровождаются увеличением цитотоксичности.
Эксперимент 2.
Доля трансфецированных клеток.
Цель: Определить, действительно ли увеличение трансфекции, проявленное соединениями C3-C7, обусловлено увеличением доли трансфецированных клеток.
Способ: Эти конъюгаты применили в трансфекции клеток CHO и Cos 1 с помощью pPGKlaczNLS, чтобы оценить доли трансфецированных клеток. Условия трансфекции были такими же, как описано выше в CAT-экспериментах с клетками, выращенными в 35 мм чашках для трансфекции. Клетки высевали за день до трансфекции при плотности 3,4•105/чашку (Cos 1) или 6,8•104 /чашку (CHO). После анализа на жизнеспособность через 24 часа трансфекции клетки отмывали 2х в PBS, затем фиксировали в течение 5 мин при 4oC в 0,2% глутаральдегиде в 0,1 М фосфатном буфере, pH 7,3. Клетки отмывали 2х холодным PBS. Свежеприготовленный раствор для окрашивания (10 мл 0,1 М фосфатный буфер, pH 7,3; 1,0 мл смеси из 105 мг железистосинеродистого калия в 2,5 мл H2O и 82 г железосинеродистого калия в 2,5 мл H2O (1:1); 0,2 мл 2% X-гал в диметилформамиде, 11,2 мкл 1 М MgSO4) (2 мл) добавляли в каждую чашку и чашки инкубировали при 37oC до развития окраски. Клетки, выбранные из случайных зон, помещали под световой микроскоп и определяли долю голубых клеток (экспрессирующие β-гал).
Результаты:
Увеличенная трансфекция, наблюдаемая при использовании испытываемых факторов отражена в увеличенной доле трансфецированных клеток, что показано по численности окрашенных в голубой цвет клеток. Фигура
21a показывает результаты, полученные на клетках CHO, а фигура 21b показывает результаты для клеток Cos 1. На оси X этих панелей Lfe - означает Lipofectamine; vf - означает модельный
пептид/липидацильный конъюгат K3ATP3; A - означает K3ATL3, а C3, C5 и C7 - представляют аминомасляную, аминокапроновую и аминокаприловую кислоту, соединившие конъюгаты.
Фигуры 21a и b.
Заключение.
Увеличение длины линкерной части пептид/липидацильных конъюгатов намного улучшают их трансфекционные свойства по суммарным уровням экспрессии репотерного гена, а также по доле трансфецированных клеток. Следует особенно подчеркнуть, что пиковые уровни трансфекции при использовании этих реагентов достигнуты при относительно низком уровне токсичности. Действие этих факторов не подтверждает более ранние наблюдения о том, что увеличенные уровни трансфекции прямо связаны с увеличенными уровнями цитотоксичности.
Улучшенная способность конъюгатов с удлиненными линкерами стимулировать трансфекцию не зависит от типа клеток. Данные, представленные на фигурах 22a и b, свидетельствуют, что K3C7TL3, конъюгат, сшитый аминокаприловой кислотой, также представляет собой реагент более эффективно, чем lipofectamine, трансфецирующий линию PC3 эпителиальных клеток рака предстательной железы человека и T-клеточную линию Jurkat (фигура 22b).
Фигуры 22a и b.
Исследованные типы клеток.
Как описано выше, конъюгаты с представленной общей формулой использовали для успешной трансфекции нескольких типов клеток. Более полный список трансфецированных клеток приведен в конце описания в таблице 5.
Олигонуклеотидная трансфекция.
Цель: Определить, действительно ли соединения, которые проявили способность переносить репортерные гены в целых плазмидах в клетки, также эффективны при трансфекции олигонуклеотидами.
Способ: 18-мерный 5'-флуоресцентный тиофосфорный олигонуклеотид трансфецировали в CHO-клетки. Провели сравнение способности K3C7ATL3, K3ATL3 без фактора трансфецировать олигонуклеотид в клетки. Олигонуклеотид последовательно разбавляли из 121,2 мкМ раствора нуклеотида до 60,6 и 30,3 мкМ нуклеотидного раствора. Тестируемые липопептиды последовательно разбавляли из 84 мкМ до 42 и 21 мкМ. Эти разведения комбинировали в матрицу 3 х 3, дающую, как видно, половинные концентрации. Другими словами, самым разбавленным олигонуклеотидом становится 60,6 мкМ раствор нуклеотида (3,37 мкМ 18-мерный олигонуклеотид) и 42 мкМ липопептид. Смесь инкубировали в течение 10 мин при комнатной температуре и затем наслаивали на CHO-клетки (сеяли при плотности 1•104/лунку предыдущим днем), отмывали свободной от сыворотки средой DDME в общем объеме 100 мкл. Лунки, содержащие смесь с нетестированным фактором, имели три различные концентрации олигонуклеотида, наслоенные при тех же условиях.
После 3 часов инкубации в стандартных условиях при 37oC и 5% CO2 смесь удаляли и заменяли на 50 мкл DDME. Под конфокальным микроскопом клетки выглядели живыми. Уровень флуоресценции был настолько высок, что точечную диафрагму для лазера, на конфокальном микроскопе MRC 500 фирмы Bio Rad, закрывали до минимума. Все изображения собирали на одних и тех же уставках для количественного сравнения.
После конфокального анализа в лунки вновь добавляли 100 мкл EMEM + 10% FCS и клетки инкубировали в стандартных условиях в течение ночи. Клетки повторно проверили на флуоресценцию.
Результаты.
Результаты трансфекции через 3 часа после трансфекции представлены в таблице 4.
Заключение.
Использование любого трансфекционного фактора дает 100% выживаемость клеток, поглотивших высокие уровни олигонуклеотида. В 3-часовой временной точке, описанной в эксперименте, клеточные ядра интенсивно окрасились флуоресцентным олигонуклеотидом.
Результаты, отмеченные звездочкой "*", иллюстрируют наименее сильную флуоресценцию, чем результаты, не отмеченные ею, исключая эксперимент без анализируемого фактора. Без фактора уровни флуоресценции ограничены одиночным пятном с меняющейся интенсивностью в каждой флуоресцирующей клетке при уровне детекции, примененной в эксперименте.
Очевидно, что большая доля клеток по сравнению с перечисленными в таблице 4 поглотила олигонуклеотид в отсутствие трансфекционного фактора, однако поглощенное количество было недостаточным для регистрации используемого уровня обнаружения.
После ночной инкубации в полной среде (EMEM + 10% FCS) уровни флуоресценции были снижены во всех образцах, но особенно заметным изменением явилась утрата флуоресценции большинством ядер при характерной пятнистой цитоплазматической окраске. Уровни флуоресценции в образцах, в которых использовали трансфецирующий фактор, были намного выше, чем в тех образцах, в которых не использовали трансфецирующий фактор.
Технология изготовления лекарственного средства.
Большинство предоставляемых коммерческих трансфекционных соединений изготовлены в виде липосом с нейтральным липидом, диолеоилфосфатидилэтаноламином (DOPE). Кроме того, из литературных источников следует, что соединения с двумя липидными ацильными производными, вероятно более всего пригодны для образования устойчивых липосомных структур, чем соединения с одним или тремя липидными ацильными производными, и действительно коммерческие факторы безвариантно имеют два ацильных производных. В свете вышеприведенных результатов, которые свидетельствуют, что более короткая цепь ацильных производных, особенно лаурата, проявляет повышенную функциональную активность при трансфекции клеток, возможно, что использование соединений с более короткой цепью фосфатидилэтаноламина также может свидетельствовать о более эффективной трансфекции. Поэтому использование DOPE необходимо рассматривать в данном способе в качестве иллюстрации его способности образовывать эффективные липосомные структуры для трансфекции и не ограничивается им.
Цель: Проанализировать эффективность липосомных композиций с липидом DOPE.
Способ: Verafectin A2 (K3ATP3) компоновали в липосомы, используя стандартные способы (K. Yagi et al. Biochem. Biophys. Res. Comm. 196 3., 1993 pp 1042-1048) и помещали в воду при 2 мМ. Композиции готовили при молярных соотношениях 1:2, 1:1 и 2:1 с DOPE.
Липосомные композиции сравнили с коммерческими соединениями, как описано в отдельных экспериментах ниже:
a. Используя стандартную методику трансфекции,
описанную выше, и 1 мкг плазмиды pSVLCAT, эти композиции анализировали на клетках CHO при единственной концентрации, эквивалентной 10 мкл Verafectin'а A2 (2 мМ) на образец и сравнивали с несоставным
соединением и Lipofectamin'ом на том же виде клеток. Образование CAT анализировали через 48 часов после трансфекции.
b. Липосомные композиции анализировали при тех же концентрациях используемой плазмиды pPGKlacz, кодирующей экспрессию β-гал, и сравнивали с Lipofectamine'ом и DOTAP (Boehringer Mannheim). Спустя 24 часа после трансфекции клетки фиксировали и окрашивали для выявления экспрессии β-гал.
Результаты:
a. Использование липосомных композиций приводило к расширению CAT-экспрессии из клеток CHO от 62%а до 156% от оптимума
Lipofectamine'а, который индуцировал экспрессию при использовании трех различных соотношений в двух отдельных экспериментах. Использование VFA2-соединения в нелипосомной композиции давало уровни около
5% от Lipofectamine'а. DOPE, взятый отдельно, в любом виде - некомпозитном или "композитном", благодаря липосомной методике, не давала трансфекции. NB. DOPE, взятый отдельно, не образует истинной
липосомы, смотри ниже EM-раздел.
Фигура 23a.
b. Предварительный подсчет окрашенных клеток среди неокрашенных свидетельствует, что лучшая липосомная композиция (K3ATP2:DOPE 1:2) давала двойное, а DOTAP давал примерно половинное число трансфецированных клеток по отношению к клеткам, полученным с Lipofectamine. Долю трансфецированных CHO-клеток при использовании Lipofectamine при этих условиях определили в 17,5%.
Фигура 23b.
Концентрация фактора не была оптимальной для этих VerafectinA2/DOPE-композиций. А данные по lipofectamine и DOTAP получены при оптимальных концентрациях.
Предварительные данные свидетельствуют, что цитотоксичность этих композиций примерно эквивалентна Lipofectamine и DOTAP (не показано).
Электронная микроскопия.
Растворы составных и несоставных соединений анализировали на наличие мембраноподобной структуры. В отдельных
экспериментах проанализировали следующие образцы:
a. Негативно окрашенные образцы составных соединений K3ATP:DOPE и несоставных соединений K3C7ATL3 и Lipofectamine.
b. Ротационные натененные образцы K3C7ATL3 и Lipofectamine смешивали с двукратным количеством нуклеотида (плазмидой).
Способ.
Негативное окрашивание.
Исходные растворы липосом с концентрацией 2 мМ разбавляли 1:10 профильтрованной дистиллированной водой и смешивали 1:1 с отфильтрованным негативным красителем (аммоний молибденовокислый 2%, pH 6,5), наслаивали на углеродную пленку-подложку, покрытую 200 меш медно/родиевой сеточкой для электронной микроскопии, и исследовали в электронном микроскопе Jeol JEM 100XC при 60 кВ при увеличении между 33k и 100k.
Ротационное металлонатенение.
Липосомное соотношение 0,69 и 0,25: 1 моль ДНК-нуклеотидов разбавляли водой и смешивали в течение 10 мин при комнатной температуре, наслаивали на углеродную пленку-подложку, покрытую сеточками, и вращением натеняли платина-палладиевый металл (60: 40), выпаривали под углом 7o и исследовали в электронном микроскопе при 60 кВ с увеличением между 26k и 66k.
Результаты.
a. Чтобы определить успешное образование липосом, негативно окрашенные образцы составленного K3ATP2:DOPE анализировали в TEM. Установлено, что эти образцы образовали мультиламеллярные липосомные структуры, тогда как DOPE, взятый отдельно, в таких же условиях их не образовывал.
Как композитная, проявляющая способность к активной трансфекции липосома представляла интерес, чтобы выяснить действительно ли чистые несоставные соединения, которые давали эффективную трансфекцию, имели какую-либо мембраноподобную структуру. Некоторые из этих соединений потому негативно окрасили и вновь проанализировали в TEM. Интересно отметить, что эти соединения, которые давали эффективную трансфекцию и имели 3 липидных ацильных производных, обнаруживали спонтанно образованные "плоты" или "стога" мембраносвязанных везикул с размером от 10 нм до 0,2 мкм.
b. Соединения смешивали с плазмидной ДНК в субоптимальном (0,25) и оптимальном (0,69) соотношениях липопептид:нуклеотид и натеняли ротацией. Анализ этих образцов четко показал, что при оптимальном соотношении для осуществления трансфеции большая часть ДНК включалась в коллекции липосом. При соотношениях, когда соединение было представлено недостаточно (0,25:1), большое количество ДНК оставалось свободной в растворе. Это было справедливо для обоих анализируемых соединений - и для K3C7TL3 и для Lipofectamine, которые проявляли большое сходство под EM при смешивании с ДНК, тогда как без соединения с ДНК их проявление было различным.
Некомпозитные смеси трансфекционных соединений и других липидов.
Отмечали расхождение между частью клеток, трансфецированных олигонуклеотидами (100% флуоресцирующих клеток) и клетками, которые экспрессировали генный продукт (<100% голубых клеток). Поскольку для получения генного продукта необходимо, чтобы ДНК, находящаяся в ядрах, транскрибировалась и транслировалась, и принимая во внимание, что только олигонуклеотид обладает преимуществом для проникновения через плазменную мембрану, чтобы осуществить "трансфекцию", полученный результат не был неожиданным. Тем не менее это свидетельствует о том, что успешная трансфекция и образование генного продукта представляет собой многоступенчатый процесс, который мог бы выиграть от сочетания соединений, которые возможно обладают разными способностями, чтобы пересекать различные мембраны, например плазменную и ядерную мембраны.
С учетом этого, объединили ряд других идентичных соединений, несущих различные липидные ацильные группы, отличающиеся и по числу и по длине, и проанализировали на β--гал в чашечном анализе, как описано ниже.
Улучшение трансфекции с помощью некоторых соединений можно было видеть при простом добавлении нейтрального липида DOPE, как показано в вышеприведенном эксперименте 4 с использованием VerafectinG2 (K3GTP2).
Цель: Выяснить, действительно ли смеси липопептидных соединений с общей формулой, описанной в данной заявке, обладают преимуществом для улучшения трансфекции генами, как установили по обнаруженному генному продукту, по сравнению с использованием чистого соединения.
Смеси соединений; Эксперимент 1.
Способ: Предварительно установили, что для достижения оптимального уровня трансфекции при использовании соединения K3ATL3 требуется 5 мкМ K3ATL3. K3ATL3 смешивали отдельно с K3ATL1, K3ATL2, K3ATM3, K3ATP3 и K3ATC3, чтобы получить общую концентрацию липида 5 мкМ в 100 мкл при соотношении 0: 5, 1: 4, 2:3, 3:2, 3:1 и 5:0. Аналогичным образом K3ATM3 смешали с K3ATM1, K3ATM2 и K3ATP3. Каждую липидную смесь объединяли с константным количеством ДНК pSVGAL (0,5 мкг/лунку) и давали возможность для нормального протекания трансфекции.
Результаты:
Экспрессия во всех лунках была ниже
при удвоенном оптимальном количестве использованной ДНК, однако отметили высокий уровень экспрессии в лунках, содержащих комбинацию K3ATL3 и K3ATM3, взятых в соотношении 4:1, показавших более высокий
уровень экспрессии β-гал, чем взятые по отдельности K3ATL3 или K3ATM3 (данные не показаны).
Эксперимент 2:
Он был посвящен дальнейшему анализу созданной смеси двух
липопептидов K3ATL3 и K3ATM3 (4:1 по молярности) и тестированию их в стандартном чашечном опыте, в котором использовали вдвое разбавленные концентрации и липопептида, и ДНК. Это сравнили с экспрессией,
полученной при использовании чистого соединения при тех же условиях.
Результаты:
Небольшое, но определенное увеличение экспрессии получили, используя смесь липопептидов. По
каждой проанализированной концентрации липопептида оптимальный уровень трансфекционного фактора приводил к более высокому уровню трансфекции для использованной смеси L3/M3 (4:1) по сравнению с одним
лишь L3, взятым в той же концентрации.
Фигура 24.
Заключение.
Комбинации липопептидных трансфекционных факторов могут давать лучшие уровни трансфекции в сравнении с любым отдельным фактором. Ожидается, что дальнейшее тестирование в этом направлении было полезным для других комбинаций, дающих лучшие уровни трансфекции по каждому отдельному компоненту. Данные результаты свидетельствуют, что смеси этих молекул могут оказывать существенное действие на их индивидуальные трансфекционные характеристики.
Трансфекция ин виво.
Цель: Определить, действительно ли соединения с представленной общей формулой можно использовать для эффективной доставки ДНК в целый организм, проявляемой в экспрессии доставленного гена.
Способ: Плазмиду pGFP-N1 (Clontech), кодирующую Зеленый Флуоресцентный Белок, 10 мкг в 10 мкл разбавляли в 20 мкл 5% раствором декстрозы в воде и затем объединяли с 2,1 мкл 10 мМ K3ATL3 (10% DMSO) в 27,9 мкл 5% раствора декстрозы в воде. Через 10 мин после инкубации при комнатной температуре смесь инъецировали в ножную мышцу голой мыши. Мышь обескровливали через 24 часа и мышцу быстро замораживали на сухом льду. Делали тканевые срезы и анализировали под конфокальным микроскопом на флуоресценцию.
Результаты:
В цитоплазме
мышечных клеток наблюдали точечную флуоресценцию и очень сильную флуоресценцию в концевых пластинках двигательного нерва. На тканевом срезе неинъецированной ноги флуоресценцию не наблюдали.
Заключение.
Предварительные эксперименты показывают, что, используя эти соединения, можно достигнуть эффективного переноса гена в целый организм.
Настоящее изобретение обеспечивает эффективный способ доставки соединения, в частности ДНК, в эукариотические клетки. Данный способ представляет собой более эффективный, чем стандартные традиционные на основе CaPO4 способы трансфекции, будучи при некоторых вариантах осуществления настоящего изобретения значительно лучше для использования коммерческих трансфекционных факторов. Очевидно, что данный способ, представленный в настоящем изобретении, будет в равной степени пригоден и для доставки других соединений, таких как фармацевтические препараты нуклеиновой кислоты, такие как рибозимы, антисмысловые последовательности и т.п.
Специалистам в данной области следует иметь в виду, что в настоящее изобретение могут быть внесены ряд изменений и/или модификаций, как показано в конкретных вариантах его осуществления, не выходя за рамки существа или объема широко представленного настоящего изобретения. Поэтому изложенные варианты, рассмотренные всесторонне, в том числе иллюстративно, не ограничены ими.
Реферат
Изобретение относится к биотехнологии и может быть использовано для интродуцирования нуклеиновых кислот в клетки. Для доставки нуклеиновых кислот клетку выдерживают с соединением, имеющим формулу w...x-y-NH-CR4(CH2OR1)(CH2OR2), в которой w представляет собой нуклеиновую кислоту, х представляет собой пептид или аминокислоту, у представляет собой линкер, имеющий цепь длиной, эквивалентной 1-20 углеродным атомам, или отсутствует, R4 представляет собой Н или СН2О - R3; R1, R2 и R3 являются одинаковыми или различными и представляют собой либо водород, метильную, этильную, гидроксильную или ацильную группу, полученную из жирной кислоты, имеющей углеродную цепь из 3-24 насыщенных или ненасыщенных углеродных атомов, с условием, что по крайней мере один из радикалов R1, R2 и R3 представляет собой ацильную группу, полученную из жирной кислоты или с соединением, имеющим формулу w. . ..xyNHCH2CH2OR5, в которой w представляет собой нуклеиновую кислоту, х представляет собой пептид или аминокислоту, у представляет собой линкер, имеющий цепь длиной, эквивалентной 1-20 углеродным атомам, или отсутствует, R5 представляет собой ацильную группу, полученную из жирной кислоты, имеющей углеродную цепь из 3-24 насыщенных или ненасыщенных углеродных атомов. Изобретение позволяет осуществлять доставку генотерапевтического лекарственного средства в клетки. 4 c. и 39 з.п. ф-лы, 24 ил., 5 табл.
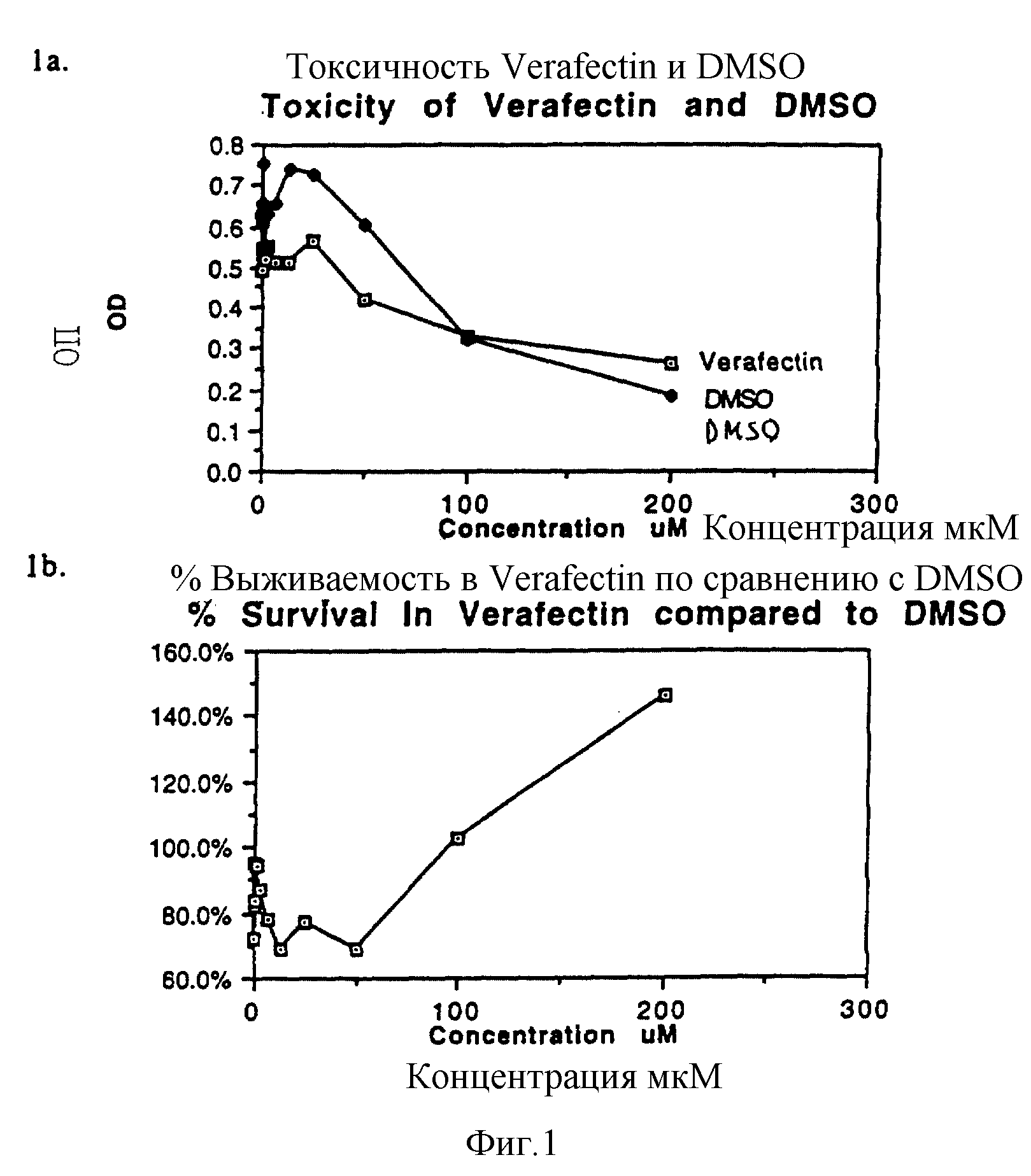
Формула

в которой
w представляет собой нуклеиновую кислоту;
x представляет собой пептид или аминокислоту;
y представляет собой линкер, имеющий длину цепи, эквивалентную 1 - 20 атомам углерода, или отсутствует;
R4 представляет собой H или CH2O - R3;
R1, R2 и R3 являются одинаковыми или различными и представляют собой либо водород, метильную, этильную, гидроксильную, либо ацильную группу, полученную из жирной кислоты, имеющей углеродную цепь из 3 - 24 насыщенных или ненасыщенных атомов углерода, при условии, что, по меньшей мере, один из R1, R2 и R3 представляет собой ацильную группу, полученную из жирной кислоты.
w ... x - y - NH - CH2 - CH2O - R5,
в которой w представляет собой нуклеиновую кислоту;
x представляет собой пептид или аминокислоту;
y представляет собой линкер, имеющий длину цепи, эквивалентную 1 - 20 атомам углерода, или отсутствует;
R5 представляет собой ацильную группу, полученную из жирной кислоты, имеющей углеродную цепь из 3 - 24 насыщенных или ненасыщенных атомов углерода.

в которой w представляет собой нуклеиновую кислоту;
x представляет собой пептид или аминокислоту
y представляет собой линкер, имеющий длину цепи, эквивалентную 1 - 20 атомам углерода, или отсутствует;
R4 представляет собой H или CH2O - R3;
R1, R2 и R3 являются одинаковыми или различными и представляют собой либо водород, метильную, этильную, гидроксильную, либо ацильную группу, полученную из жирной кислоты, имеющей углеродную цепь из 3 - 24 насыщенных или ненасыщенных атомов углерода, при условии, что, по меньшей мере, один из R1, R2 и R3 представляет собой ацильную группу, полученную из жирной кислоты.
w ... x - y - NH - CH2 - CH2O - R5
в которой w представляет собой нуклеиновую кислоту;
x представляет собой пептид или аминокислоту;
y представляет собой линкер, имеющий длину цепи, эквивалентную 1 - 20 атомам углерода, или отсутствует;
R5 представляет собой ацильную группу, полученную из жирной кислоты, имеющей углеродную цепь из 3 - 24 насыщенных или ненасыщенных атомов углерода.

Комментарии