Способ получения антибиотика прадимицина, штамм actinomadura species - продуцент прадимицина - RU2057181C1
Код документа: RU2057181C1
Чертежи







Описание
Изобретение относится к способу ферментации, предназначенному для получения прадимициновых антибиотиков, а также к продуцированию микроорганизма указанных антибиотиков.
Среди различных описанных соединений семейства прадимицина, продуцируемого разновидностью Actinomadura, прадимицины FA-I (Ia) и FA-2 (Ib) [1] содержат фрагмент D-серина. Бенаномицин А (II) соединение, являющееся ближайшим аналогом прадимицинов, было описано в I.Autibiot, 1988, 41:807-811; это соединение отличается от прадимицинов тем, что в нем отсутствует аминогруппа сахаров, свойственная прадимицинам. В заявке на Европейский патент 432827, опубликованной 19 июня 1991 г раскрывается соединение 4'-деамино-4'-аксиальный-гидроксипрадимицин Fa-2 (III, далее в тексте ВМУ-28960), который получают из прадимицина FA-2 химическими средствами. В ЕР 432527 также раскрыт ВМУ-28960 и это соединение может быть получено из диэксилозил прадимицина FA-2.

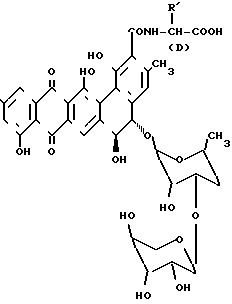
Ia R' CH2OH; R2 NHCH3
Ib R' CH2OH; R2 NH2
II R' CH3; R2 OH
III R' CH2OH; R2 OH
Химические способы получения ВМУ-28960 и его дезксилозильного производного трудны и трудоемки, причем в результате целевые продукты получают с низким выходом. Таким образом, чрезвычайно желательна разработка альтернативного способа, пригодного для массового производства таких антибиотиков. В результате интенсивного поиска микроорганизмов, способных продуцировать ВМУ-28960 и деэксилозил ВМУ-28960, было установлено, что таким продуцентом антибиотика является новый штамм микроорганизма, принадлежащий к виду Actinomadura.
Настоящим изобретением обеспечивается способ получения антибиотика
общей формулы:

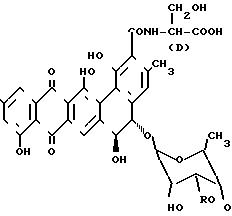
Согласно другому аспекту настоящее изобретение предусматривает биологически чистую культуру микроорганизма Actinomadura sp. АВ 1236 с идентификационными характеристиками согласно АТСС 55208 и способную продуцировать ВМУ-28960 и деэксилозил ВМУ-28960 в ходе культивации в водной среде, содержащей ассимилируемый источник углерода, азота и D-серина.
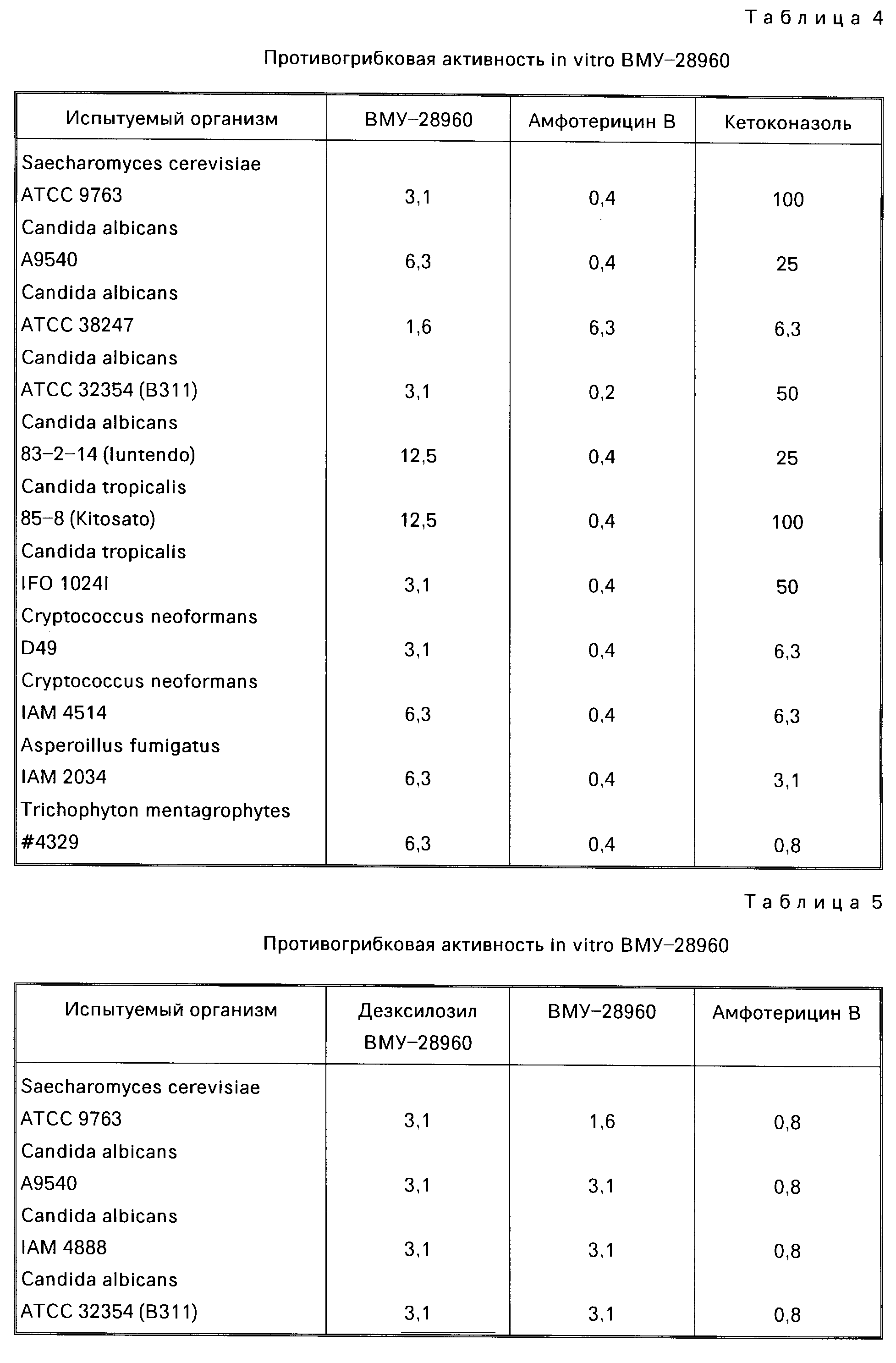
На фиг. 1 представлен ИК-спектр (KBr) ВМУ-28960; на фиг.21Н ЯМР спектр (ДМСО-Д6, 400 МГц) ВМУ-28960; на фиг.313С-ЯМР спектр (ДМСО-Д6, 100 МГц) ВМУ-28960; на фиг.4 ИК-спектр (КBr) десксилозил ВМУ-28960; на фиг.51H-ЯМР спектр (ДМСО-д6, 400 МГц) десксилозил ВМУ-28960.
Настоящее изобретение обеспечивает способ ферментации, пригодный для массового производства ВМУ-28960, и дескилозил ВМУ-28960. В таком способе используется новый микроорганизм, принадлежащий к роду Actinomadura.
I. Скрининг микроорганизмов, продуцирующих ВМУ-28960
Полную петлю
каждого актиномицета, выделенного из образцов почвы, инокулировали в виде пятна на три агаровые
пластины, глюкозадрожжевой сойтоновый агар (глюкоза 1% дрожжевой экстракт 0,05% сойтон (Дифко
Лабораторис) 0,05% CaCl2 x x 2H2O 0,01% и агар 1,5%), глицерин-дрожжевой сойтоновый
агар (глицерин 1% дрожжевой экстракт 0,05% сойтон, 0,05% CaCl2·2H2
O, 0,01% и агар 1,5% ) и крахмал-дрожжевой сойтоновой агар (растворимый крахмал 1% дрожжевой экстракт 0,
05% сойтон 0,05% CaCl2·2H2O 0,01% и агар 1,5%) и затем инкубировали
в течение 1-2 недель при 37оС. Штаммы, продуцирующие способные к диффузии пигменты с цветом
от темно-фиолетового до темно-красного, на каждой агаровой пластине инокулировали в 500-мл
Эрленмейровские колбы, содержащие 100 мл продукционной среды, составленной из 2% глицерина. Эсусан мито
(Аджиномото Ко. Клт. ) 1,5% CoCl2 ·6H2O 0,000 1% KH2
PO4 0,1125% К2НРО4 0,0025% и D-серина 0,2% и инкубировали на роторном
встряхивателе (200 об/мин) при 32оС. Через 10 дней инкубации за продуцированием
ВМУ-28960 в бульоне следили с помощью анализа надосадочной жидкости в агаровых отверстиях с использованием в
качестве испытательного организма Candida albicans А9540.
Бульоны с анти-Candida активностью центрифугировали, разбавляли в 10 раз с помощью ДМСО и фильтровали (Гелман Сайнсез Джэпэн, Лтд. Экикродиск 1302, размер пор: 0,45 мкм). Фильтраты анализировали методом HPIC на Эксцел пак SIL-C185R (Екогава Электроник Ко. Лтд.) с использованием системы ацетонитрил: 0,02 М фосфатный буффер, рН 7,0 (15:85) при объемной скорости 1 мл/мин с детекцией при длине волны 254 нм и с помощью ТСХ на силикагелевых тонко-слойных пластинах (Кэйзель гель 60 F254 0,25 мм: mfd Мерк). В качестве проявляющих растворительных систем использовали смесь н-бутанол: уксусная кислота:вода (2:1:1, BW 14) и метилацетат: н-пропанол: 28% воды, аммиак (45: 10: 5: 60), S-114, ВМУ-28960 имел время удерживания в методе НPIC 11,5 мин в присутствии указанной выше системы растворителей и значения 0,50 и 0,24 при исполь- зовании BW-14 и S-114 соответственно.
Различные актиномицеты подвергали скринингу и было установлено, что штамм АВ 1236, принадлежащий к виду Actinomadura, продуцирует желаемое соединение с уровнем содержания, подходящим для массового получения. Таксономные характеристики штамма АВ 1236 будут описаны ниже.
II. Организм продуцирующий ВМУ-28960.
Actinomadura sp. АВ1236 представляет собой новый штамм, выделенный из образца
почвы, собранного в Шиндужку, Токио, Япония 24 октября 1990 г. Культура штамма АВ 1236 была депонирована в
Американской коллекции типовых культур в соответствии с Будапештским договором по
международному признанию депонирования микроорганизмов в целях патентования, и все ограничения, касающиеся доступности
депонированных микроорганизмов, будут окончательно сняты после выдачи патента по
настоящей заявке. Депонированной культуре был присвоен каталожный номер АТСС 55208
А. Морфология и
культуральные характеристики штамма АВ 1236
Среда и методы, используемые для
таксономического исследования штамма, описаны Ширлингом и Готтлибом в статье "Методы и характеристики
разновидностей Steptomyces", Int. J. Syst. Bact. 1966, 16: 313-340; Ваксманом в книге
Актиномицеты, т.11, Классификация, идентификация и описание вида и разновидностей, с. 328-334. / Под ред. Вильямса
и Вилкинса Ко. Балтимора, 1961; Аран в статье "Культурная среда для антиномицет,
опубликованной Японским обществом актиномицет, 1975, Штамм инкубировали в течение 2-4 недель при 37оС.
Определение цветовых характеристики проводили путем сравнения цвета культуры с цветом
чипсов (chips) в соответствии с Manual of color names (Джэпэн Колор Энтерпрайс Ко. Лтд. 1987).
Штамм АВ 1236 лучше рос на органической среде, чем на неорганической среде при температурах 20-41оС и образовывал разветвленный вегетативный мицелий. Зрелый воздушный мицелий имел цвет в интервале от белого до серовато-белого как на дрожжевом крахмальном агаре, так и на дрожжевом-крахмально-солодовом агаре (YSM, растворимый крахмал 1% дрожжевой экстракт 0,1% солодовый экстракт 0,1% CaCl2·2H2O 0,05% и агар 1,5%).
Методом сканирующей электронной микроскопии было установлено, что верхняя часть коротких спорофор имела по 2-8 спор на одну цепь. Форма таких спор была субсферической (0,8-1,0х1,0-1,2 мкм по размеру) и их поверхность была гладкой. Такие споры не обладают подвижностью. Цвет вегетативного мицелия и способных к диффузии пигментов на органической агаровой среде изменялся от бледно-фиолетового до темно-красного. В результате добавления 0,1 N HCl цвет изменялся от бледно-оранжевого до яркого желтовато-оранжевого. В табл.1 суммированы культуральные характеристики штамма АВ 1236 на различных агаровых средах.
В. Физиологические характеристики штамма АВ 1236.
В табл. 2 и 3 представлены физиологические характеристики и примеры утилизации источников углерода штамма АВ 1236.
Антибиотическую восприимчивость штамма АВ 1236 испытывали с использованием антибиотических дисков (Тридиск, Эйке, Кэмикл Ко. Лтд.). Такие диски помещали на поверхность дрожжевого глюкозно-солодового агара (дрожжевой экстрат 0,1% глюкоза 1% солодовый экстракт 0,1% CaCl2·2H2O ),05% и агар 1,5% ), которые засевали штаммом АВ 1236 (4% прививочного материала), после чего пластины инкубировали в течение 4 дней при 37оС. Штамм АВ 1236 оказался устойчивым в отношении 50 мкг фосфомицина и 300 ед. поли- миксина В и восприимчивым к 20У ампицилина, 1 мкг клавулановой кислоты, 2 мкг тикарциллина, 10 мкг цефалексина, 30 мкг тетрациклина, 10 мкг хлорамникола, 0,5 мкг эритромицина, 2 мкг езомицина, 2 мкг линомицина, 5 мкг канамицина, 5 мкг гентамицина, 5 мкг тобрамицина, 2 мкг налидиксовой кислоты, 2 мкг норфлоксацина и 50 У колистина.
С. Химический анализ клеток АВ 1236.
Композиции целевых клеток анализировали в соответствии со способом, описанным Бекером и Лешевалье в статье "Быстрая дифференциация между Nocardia и Spreptomyces методом бумажной хроматографии гидролизата целых клеток" (Appl. Microb. 1964, 12, р.421-423) и в статье "Химические составы препаратов клеточных стенок из штаммов различных видоферм аэробных актиномицетов" (Appl. Microb, 1965, 13, р.236-243). Штамм АВ 1236 содержал мезо-диаминопимеровую кислоту, мадурозу, рибозу, маннозу, глюкозу и галактозу. Таким образом, штамм АВ 1236 имел клеточную стенку, принадлежащую к типу III В. Муколовые кислоты не детектировались по методу Миникина с сотр. описанному в статьи "Дифференциация Mycobacterium, Nocardia и родственной таксы с помощью анализа методом тонкослойной хроматографии метанолизатов целого организма" (J.Cen. Microb. 1975, 88, р.200-204). Фосфолипидный анализ с использованием метода Лешавалье с сотр. описанный в статьях "Идентификция аэробных актиномицет клинического значения" (J.Lab, Chin. Med. 1968, 71, р.984-944) и "Гемотаксономия аэробных актиномицет: фосфолипидная композиция" (Biochem. Syst. Ecol. 1977, 5, р.249-260), позволил установить, что клеточная стенка штамма АВ 1236 относится к типу РI, содержащему дифосфатидилинозитол моноид, фосфатидилнозитол и дифосфатилглицерин. Анализ менахинонового состава с использованием метода Коллинза с сотр. описанного в статье "Замечания относительно разделения природных смесей бактериальных менахинонов с использованием обратимофазной тонкослойной хроматографии" (J. Appl. Bacteriol, 1980, 48, р.277-282), позволил установить наличие 47 МК-9 (Н8), 35% МК-9 (Н6) 10% МК-9 (Н4) и 8% МК-9 (Н-10). Анализ на жирные кислоты целых клеток, проведенный согласно методу Сузуки с сотр. описанному в статье "Таксономическое значение состава клеточных жирных кислот в некоторых бактериях вида Корниформ" (Jut. J. Syst. Bacteriol. 1983, 33, р.188-200), позволил выявить наличие 49% 14-метаилпентадекановой кислоты (изо 16:0), 13% 14-метилгексадекановой кислоты (антиизо 17: 0) и 8% 10-метилгептадекановой кислот (10 Ме 17:0), при этом в системе присутствовали в небольших количествах другие жирные кислоты.
Штамм АВ 1236 имеет морфологические, культуральные и хемотоксономические свойства, согласующиеся со свойствами микроорганизма вида Actinomadura, описанного Лешевелье, и с характеристиками такого вида, предложенными Кроппенштедтом с сотр. в статье "Таксономическое исследование актиномицет вида Actinomadura и Microtetraspora" (System. Appl. Microbiol. 1990, 13, р.148-160). Таким образом, штамм АВ 1236 был идентифицирован как разновидность Actinomadura.
III. Продуцирование антибиотика.
ВМУ-28960 и ВМУ-28960 и дезксилозильный ВМУ-28960 может быть продуцирован штаммом АВ 1236 в условиях, которые традиционно применяются для получения общепринятых продуктов ферментации. Продуцирующий организм выращивают в питательной среде, содержащей ассимилируемый источник D-серина помимо известных питательных источников для актиномицет, т.е. ассимилируемых источников углерода и азота плюс необязательные неорганические соли и другие известные факторы роста. Аэробные условия при погружении предпочтительно используются для получения больших количеств антибиотика, хотя для получения ограниченных количеств можно также использовать поверхностные культуры и бутыли.
Могут применяться ассимилируемые источники D-серина либо D-серина или DI-серина. Примерами ассимилируемых источников углерода могут служить глицерин; такие сахара, как рибоза, глюкоза, сахароза, целлобиоза; крахмал; а также такие другие карбогидраты, как декстрин. Примерами ассилимируемых источников азота могут служить хлористый аммоний, сульфат аммония, мочевина, нитрат аммония, нитрат натрия, а также такие органические источники азота, как пептон, мясной экстракт, дрожжевой экстракт, солодовая жидкость, соевой порошок, мука хлопкового семени и т.п. Могут также при необходимости добавляться такие неорганические соли как хлористый кобальт и фосфат калия. Кроме этого, получение антибиотика облегчается в результате добавления в продукционную среду треонина; в качестве треонина могут использоваться D-треонин, 1-треонин или их смесь. Получению антибиотика также благоприятствует добавление D-циклосерина. Предпочтительной жидкой средой является среда, описанная в примере 2 или примере 3. Другая более употребительная жидкая среда состоит из глюкозы и/или глицерина (1-4%), формамедина (1-3%), КН2РО4 (0,1-0,2%) и D-серина (0,1-0,2%). В качестве противовспенивающих агентов можно также использовать деканол, кремний и т.д.
Получение антибиотика можно осуществлять при любой температуре, подходящей для удовлетворительного роста продуцирующего организма. Обычно оптимальное производство антибиотика осуществляют во встряхиваемых колбах после периода инкубации в 5-14 дней, хотя в некоторых случаях период инкубации может быть более длительным. Аэрация в колбах со встряхиванием достигается перемешиванием, например, встряхиванием в роторной трясучке. Если ферментацию проводят в ферменторах, желательно получить вегетативный прививочный материал в питательном бульоне путем инокулирования культурного бульона из скошенных культур или лиофилизированной культуры организма. После получения таким методом активного прививочного материала его асептически переносят в среду ферментора. Перемешивание в ферменторе осуществляют механическими средствами, а аэрация может обеспечиваться инжектированием в перемешиваемую среду воздуха или кислорода. За ходом получения антибиотика можно следить с использованием хроматографических или спектроскопических методик или с помощью общепринятого биологического анализа. Предпочтительные условия ферментации включают аэробное культивирование при рН 5-8 при 20-37оС в течение 5-14 дней, предпочтительно при рН 6-7 и температуре 28-35оС в течение 5-12 дней.
Хотя в настоящем изобретении описывается получение антибиотика с помощью специфического штамма микроорганизма, хорошо известно, что таксономические свойства актиномицет могут регулироваться естественным путем или искусственно. Таким образом, следует иметь в виду, что способ настоящего изобретения не ограничивается конкретным микроорганизмом, а включает варианты и мутанты, полученные из конкретного штамма такими различными искусственными методами, как облучение ультрафиолетовым светом или рентгеновскими лучами или обработка такими химическими мутагенными агентами, как N-метил-N'-нитро-N-нитрозогуанидин. Полученные таким образом мутанты и варианты могут быть подвергнуты скринингу на получение антибиотика по методике, описанной ранее.
IV. Выделение и очистка антибиотика
ВМУ-28960 и дезксилозил ВМУ-28960 могут быть выделены из культурных
бульонов методами, традиционными для выделения гидрофильных кислотных соединений. Примерами таких методов могут служить экстракция органическим растворителем, использование ионо-обменных смол,
распределительной хроматографии и кислотное осаждение, такие методы могут использоваться как таковые или в комбинациях друг с другом. Ниже следует пример метода выделения и очистки. После завершения
ферментации рН бульона устанавливали на значении, равном 2, и подвергали центрифугированию или фильтровали. Полученный в результате надосадочный слой или фильтрат адсорбировали на такой
высокопористой
смоле, как Дианон НР-20 (Митшубиши Казеи Ко.) и элюировали таким несмешивающимся с водой органическим растворителем, как метанол или ацетон. Полученный таким образом элюат
концентрировали, как метанол
или ацетон. Полученный таким образом элюат концентрировали и лиофилизировали с получением сырого антибиотического комплекса. В целях дополнительной очистки сырой материал
может быть загружен в
обратимо-фазную силикагелевую колонку, например, УМС-ОДSA60 (Ямамура Кэмикл Лаб.) и элюирован смесью ацетонитрил: 0,02 М фосфатный буфер при рН 7,0. Фракции, содержащие
ВМУ-28960, объединяли и
обессоливали с получением чистого ВМУ-28960. Дезксилозил ВМУ-28960 может быть получен путем аналогичного выделения и очистки (предпочтительно не подкислять ферментационный
бульон).
V.
Физико-химические свойства антибиотика
ВМУ-28960, полученный по предлагаемому способу обладает следующими физико-химическими свойствами, которые идентичны
свойствам ВМУ-28960, полученного
путем полусинтеза в соответствии с ЕР 432 527.
Внешний вид: аморфный темно-красновато-оранжевый порошок.
Температура плавления: > 220оС (постепенное разложение).
FAB-MS (положительный): m/z 844 (М+Н)+
Молекулярная формула: C39H41NO20.
Спектр УФ-абсорбции, λмакс нм (ε):
0,02 N NaOH:MeOH (1:1) 211 (34,700), 320 (15, 100), 498 (14, 100).
ИК-спектр: показан на фиг.1.
Растворимость в растворителе
Растворим: диметил сульфоксид, N,N-диметилформамид и водный раствор щелочи.
Плохо растворим: этанол, метанол и ацетон.
Нерастворим: этил ацетат, бензол, хлороформ, подкисленная вода и т.п.
Тонкослойная хроматография (силикагелевая пластина):
Rf 0,24 (метил ацетат: н-пропанол: 28% водный
аммиак 45:105:60).
Анализ HPIC:
Колонка: космесил 5С18-АR 5 мкм; 4,6 мм вн. диаметр х 150 мм.
Элюент СН3ССl: 0,02 М фосфатный буфер, рН 7, 0 (15:85).
Объемная скорость: 1,0 мл/мин.
УФ-детектор: 254 нм.
Время удерживания: 11,5 мин.
Внутренний стандарт: прадимицин А (Rt 9,7 мин).
1Н ЯМР спектр: показан на фиг.2.
13С ЯМР-спектр: показан на фиг.3.
Дезксилозил ВМУ-28960 обладает следующими
физико-химическими свойствами:
Внешний вид:
темно-красновато-оранжевый порошок
Температура плавления: 180оС.
НР-FAB-MS (положительный): m/z 712.1871
(М+Н)+
Молекулярная формула: С34Н33NO16
УФ-абсорбционный спектр, λмакс нм ( ε):
в Н2О-МеОН-ДМСО (4,5:4,
5:1); 470 (10, 100),
в 0,02 N HCl-MeOH-ДMCO (4,
5:4,5:1): 461(10,600)
в 0,02 N NAOH-MeOH (1:1): 213 (31,500), 242 (30,100) 320 (13,600), 498 (12,600).
ИК-спектр (КBr) λмакс. см-1 показан на фиг.4.
Растворимость в растворителях
Растворим: диметилсульфоксид, диметилформамид и водные растворы щелочей.
Плохо растворим: этанол, метанол, ацетон и ацетонитрил.
Нерастворим: подкисленная вода, н-бутанол, этилацетат, хлороформ и другие общепринятые органические растворители.
1Н ЯМР спектр: показан на фиг.5.
VI. Биологические активности антибиотика
Противогрибковые активности in vitro ВМУ-28960 и дезксилозил ВМУ-28960,
полученные в настоящем процессе ферментации, определяли
общепринятым методом агарового разбавления на агаре дрожжевой морфологии, содержащем 1/15М фосфатного буфера (рН 7,0). Полученные результаты
представлены в табл.4 и 5.
Среда: агар
дрожжевой морфологии + 1/15 М фосфатный буфер (рН 7,0)
Количество прививочного материала: 106 кл/кл (107 кл/мл для Т).
Условия инкубации: 28оС, 40 с (60
ч для Т.mentagrophytes)
Среда: агар дрожжевой морфологии + 1/15М фосфатного буфера (рН 7,0).
Количество прививочного материала: 106 кл/мл (Тм: 107 кл/мл.
Условия инкубирования: 28оС, 40 ч (60 ч для T/mentagrophytes).
In vivo эффективность ВМУ-28960 оценивали по системному заражению Candida albicans А9540 самцов мышей разновидности ICR (масса тела 20-24 г). Для каждого уровня дозировки использовали группы из пяти мышей. Мышей подвергали внутривенному заражению 10-кратной средней летальной дозой патогена суспензированного в физиологическом растворе и сразу после заражения внутривенно применяли ВМУ-28960. Средние значения защитной дозы (РД50) рассчитывали на основании оценок выживания, зарегистрированный на 21 день. Полученные результаты представлены в табл.6.
ВМУ-28960 хорошо переносится мышами разновидности 10Р; после внутривенного применения ВМУ-28960 вплоть до дозировок 600 мг/кг не отмечалось летальности или каких-либо побочных эффектов.
Следующие ниже примеры приведены с целью более полной иллюстрации настоящего изобретения и они некоим образом не ограничивают сферу изобретения.
П р и м е р 1. Посевная культура
Чистую культуру
продуцирующего организма Actinomadura разн. АВ 1236, АТССС 55208 наносили
полосами на скос агара YSM и инкубировали в течение 2 недель при 37оС. Одну петлю штамма инокулировали в 500-мл
Эрленмейеровскую колбу, содержащую 100 мл среды, состоящей из глюкозы 0,5%
растворимого крахмала 2% дрожжевого экстракта 0,2% NZ-казы 0,3% экстракта рыбьего мяса ДЗОХ (Банму Ю К.К.) 0,5% и СаСО3 0,3% (рН среды устанавливали перед помещением в автоклав равным 7,0).
Культуру инкубировали на роторном встряхивателе в течение 5 дней при 32оС и использовали в качестве посевной
культуры.
П р и м е р 2.
Ферментация в колбе
5 мл порции посевной культуры, указанной в примере 1, переносили в 500-мл Эрленмейеровскую колбу, содержащую 100
мл продукционной среды, состоящей из 2% глицерина, 1,5% Эсусан ми-то (соевая
мука: Аджиномото Ко. Инк. ), 0,025% К2НРО4, 0,1125% КН2О4 0,0005% СоCl2·6H2O и 0,125% D-серина в присутствии 10 мкг/мл
D-циклосерина (Вако Пьюз Кэмикл Индастриез Лтд.). Культуру инкубировали на роторном встряхивателе при скорости 200 об/ин и при
28оС в течение 12 дней, при этом продуцирование ВМУ-28960
достигало 530 мкг/мл.
П р и м е р 3.
Ферментация в колбе (влияние добавления треонина)
5
мл порции посевной культуры, полученной в примере 1, переносили в
500-мл Эрленмейеровские колбы, содержащие 100 мл продуционной среды, состоящей из 2% глицерина, 1,5% фармамедиа (Трэйдерс Протеин), 0,
1% КН2РО4, 0,2% 1-или D-треонина, 0,0005%
СoСl2·6H2O, 0,2% D-серина и 10 мкг/мл D-циклосерина. Культуру инкубировали на роторном испарителе,
работающем со скоростью 200 об/мин в течение 11 дней при 28о
С. С целью демонстрации влияния треонина на продуцирование ВМУ-28960 ферментацию также осуществляли в отсутствии теронина.
Полученные результаты представлены в табл.7.
П р и м е р 4.
Выделение и очистка ВМУ-28960
Ферментационный бульон (2,0 л) из примера 2 подкисляли до рН2 с
использованием 6 N HCl и центрифугировали. Надосадочный слой (1,7 л) загружали
на колонку Дианон НР-20 (300 мл) и такую колонку вначале промывали водой (1,5 л) и затем элюировали 1,6 л метанола.
Элюат концентрировали и затем лиофилизировали с получением 2,1 г сырого продукта.
Это твердое вещество растворяли в 1 л воды и рН раствора устанавливали равным 6,3 с помощью 1N NaOH. Полученный
раствор применяли на колонке с Дианоном НР-20 и колонку вначале промывали смесью 0,002 N
HCl: ацетон (1:1) и затем элюировали 1 л смеси 0,002 N NaOH: ацетон (1: 1). В результате концентрирования
элюата получали твердое вещество (690 мг). Часть (400 мг) такого твердого вещества растворяли
в смеси ацетонитрил: 0,02 М фосфатный буфер, рН 7,0 (12,5 87,5, 30 мл) и подвергали хроматографическому
разделению на колонке с УМС гелем, ODS А60 (500 мл, Ямамара Кэкикл Лаб.), которую уравновешивали
с помощью той же системы растворителей. Элюирование осуществляли с помощью того же растворителя.
Фракции, содержащие ВМУ-28960, концентрировали, обессоливали с помощью Дианон НР-20 и лиофилизировали с
получением ВМУ-28960 (82 мг).
П р и м е р 5. Выделение и очистка дезксилозил ВМУ-28960.
Культурный бульон (25 л), полученный ферментацией штамма ДВУ236 в присутствии Десерина, подвергали центрифугированию. Надосадочный слой (27 л) пропускали через 3,8 л Дианона НР-20. Смолу последовательно промывали 80% воды ацетона (8 л) и смесью ацетона 0,01 N HCl (60:40) (12 л) и затем элюировали смесью ацетон 0,01 N NaOH (60:40) (12 л) с получением 16,04 г сырого продукта. Комплекс (2 г) растворяли в 200 мл смеси СH3CN 0,02 М фосфатный буфер, рН 7,0 (13:87) и загружали на колонку с УМС гелем, ОДS A 60 (10 л, Ямамура Кэмикл Лаб.), которую уравновешивали той же системой растворителей. Элюирование осуществляли с помощью системы растворителей, которую использовали для растворения образца, и за составом элюатов следили методом НPIC. Колонка: Космосил 5С18 АР, 5 мкм, 4,6 мм вн.диаметр х 150 мм, Накалаи Теску Инк. подвижная фаза: CH3CN 1/15 М фосфатный буфер, рН 3,5 (27:73), объемная скорость: 1,0 мл/мин. Детекция: УФ-поглощение при 254 нм, время удерживания: дезксилозил ВМУ-28960 8,3 мин, ВМУ-28960, 7,6 мин). Быстро элюируемую красную фракцию (3,7 н), содержащую дезксидозил ВМУ-28960, концентрировали и подвергали хроматографической очистке на колонке с Дианоном НР-20 (30 мл) с использованием в качестве элюента смеси ацетон 0,1 N NaOH (60:40) (50 мл). Красные элюаты концентрировали и лиофилизировали с получением 29 мг твердого вещества. рН водного раствора образца устанавливали равным 2,5 с помощью 0,1 N HCl с целью осаждения чистого дезксилозил ВМУ-28960 (19 мг). Медленно элюирующую фракцию (24 л) со стадии хроматографирования на УМС геле обрабатывали аналогичным образом с получением 700 мг чистого ВМУ-28960.
Реферат
Использование: микробиологическая и медицинская промышленность, производство антибиотиков. Сущность изобретения: способ получения антибиотика прадимицина культивированием штамма микроорганизма вида Actinomadura species АВ 1236, АТСС 55208 в аэробных условиях в питательной среде, содержащей источники углерода, азота, минеральных солей, Д-серии, Д-циклосерин и треонин, погруженным методом, выделением целевого продукта из культуральной жидкости и его очисткой. 2 с. п. ф-лы, 5 ил., 6 табл.

Комментарии