Способ получения нетилмицина - SU1630614A3
Код документа: SU1630614A3
Описание
Целью изобретения является повышение выхода целевого продукта - антибиотика нетилмицина, которое достигается тем, что осуществляют взаимодействие сиз.омицина с защищенными- амино-группами с ацетальдегидом в среде апротонного органического растворителя , разрушение содержащегося в реакционной смеси непрореагировавшего ацетальдегида, восстановление получаемого при этом продукта и после- дующее снятие защитных групп и выделение целевого продукта в свободном виде или в виде кислотно-аддитивной соли, причем перед взаимодействием с ацетальдегидом сизоми-, цин с защищенными амино-группами подвергают силилированию в безводной среде при температуре кипения реакционной смеси, а взаимодействие силилированного сизомицина с ацет- альдегидом проводят в безводной среде.
Пример 1.А.В круглодонную трехгорлую колбу емкостью 500 мл,
снабженную мешалкой, обратным холо- дильником, снабженным сушильной трубкой , и термометром, подают 15,0 г (26,2 ммоль) 3,2 ,6 -три-М-ацетил- сизомицина, 0,750 г (1,12 ммоль) 3,2 , 6 -тру- 1-ацетилсизомицина в виде сульфатной соли, 150 мл 1,2-ди- метоксиэтана и 25 мл (118,5 ммоль) гексаметилдисилазана. Реакционную смесь нагревают до кипения на масляной бане |Ъ температурой 105°CJ в те чение 5 ч. За ходом реакции силилиро вания следят при помощи Н-ЯМР. После удаления растворителя получают
18 г 3,2,б -три-М-ацетил-5,2, триметилсилилсизомицина.
Б. К продукту стадии А добавляют 150 мл 1,2-диметоксиэтана и 1 50 мл хлористого метилена при комнатной температуре. После охлаждения реакционной смеси до 15ЙС добавляют 3,0 мл (53,6 ммоль) холодного ацетальдегида . Продолжают размешивать в течение 30 мин, после чего добавляют 1,9 г (50,2 ммоль) порошкового бора- на натрия. Реакционную смесь нагрева ют до комнатной температуры и размешивают в течение 15 мин с тем, чтобы полностью разрушить избыток ацетальдегида . Затем к реакционной смеси каплями быстро добавляют 30 мл 0,5 М водного боратного буфера (рН 9,75), после чего размешивают при комнатной температуре в течение 2 ч с тем, чтобы восстановить имино-группьг до со
с 5 о
5 0 с
0
5 Q
5
ответствующей этиламино-группы. К реакционной смеси добавляют 30 мл 10%- ной водной гидроокиси натрия, служащей для дезактивации борана натрия. Растворители, 1,2,-диметоксиэтан и хлористый метилен, удаляют под пониженным давлением. Затем добавляют 200 мл 10%-ного водного раствора гидроокиси . натрия и реакционную смесь нагревают с обратным холодильником на масляной бане (103°С) в атмосфере азота в течение 20 ч. За ходом реакции следят при помощи тонкослойной хроматографии с использованием в качестве растворителя смеси хлороформа, метанола и концентрированной гидроокиси аммония в соотношении 1:1:1. Продукт гидролиза охлаждают при помощи ледяной
бани, подкисляют до рН 6 добавлением , 25%-ной водной серной кислоты и осадок фильтруют. После очистки путем хроматографии на силикагеле с ис- , пользованием в качестве элюента смеси хлороформа, метанола и гидроокиси аммония получают 9,66 г (88% теории ) нетилмицина. СсП + 164° (0,3%, Н40).
ЯКР (DU0) (Г, (ч./млн) 1,05 (ЗН, т, Гц, ); 1,19 (ЗН, с, -С-СКз); 2,5 (ЗН, с, N-CKj); 4,85 (1Н, м, СН-); 4,95 (Ш, д, Гц, НГ1); 5,33 ОН, Д, ,5 Гц, H f).
Н-ЯКР-спектры промежуточных продуктов по примеру 1.
Трисилилированный три-К-ацетил- РИЗОМИЦИН.
Н-ЯМР (CDgCla) (Р, ч/млн: 0,118 Гс, 9Н, 81-( 0,124 с, 9Н,
si-( tc 9Н )з1;
1,38 tc, ЗК, «Ц при 1,93 с, ЗН, CHy-C-Nl; 1,96 с, ЗН, CH,-{j-Nj;
О°
1J98 (с, ЗН, CH3-C-N); 2,45 (с, ЗН,
О
при С-3-); 4,69 (дд, 1Н, J 3,29 и 4,02 Гц, СК при С-4 ); 5,01 (д,.1Н, ,19 Гц, СН при С-1); 5,08 (д, 1Н, ,82 Гц, СН при С-1); 6,03 (д, 1Н, ,99 Гц, NH-C-); 6,47.
О (дд, 1Н, ,ll и 6,96 Гц, CH2-NH-(-);
( 7,1 (д, 1Н, ,13 Гц, Щ-С-).
О
СН
о
NH,
О
Ш.
(I)


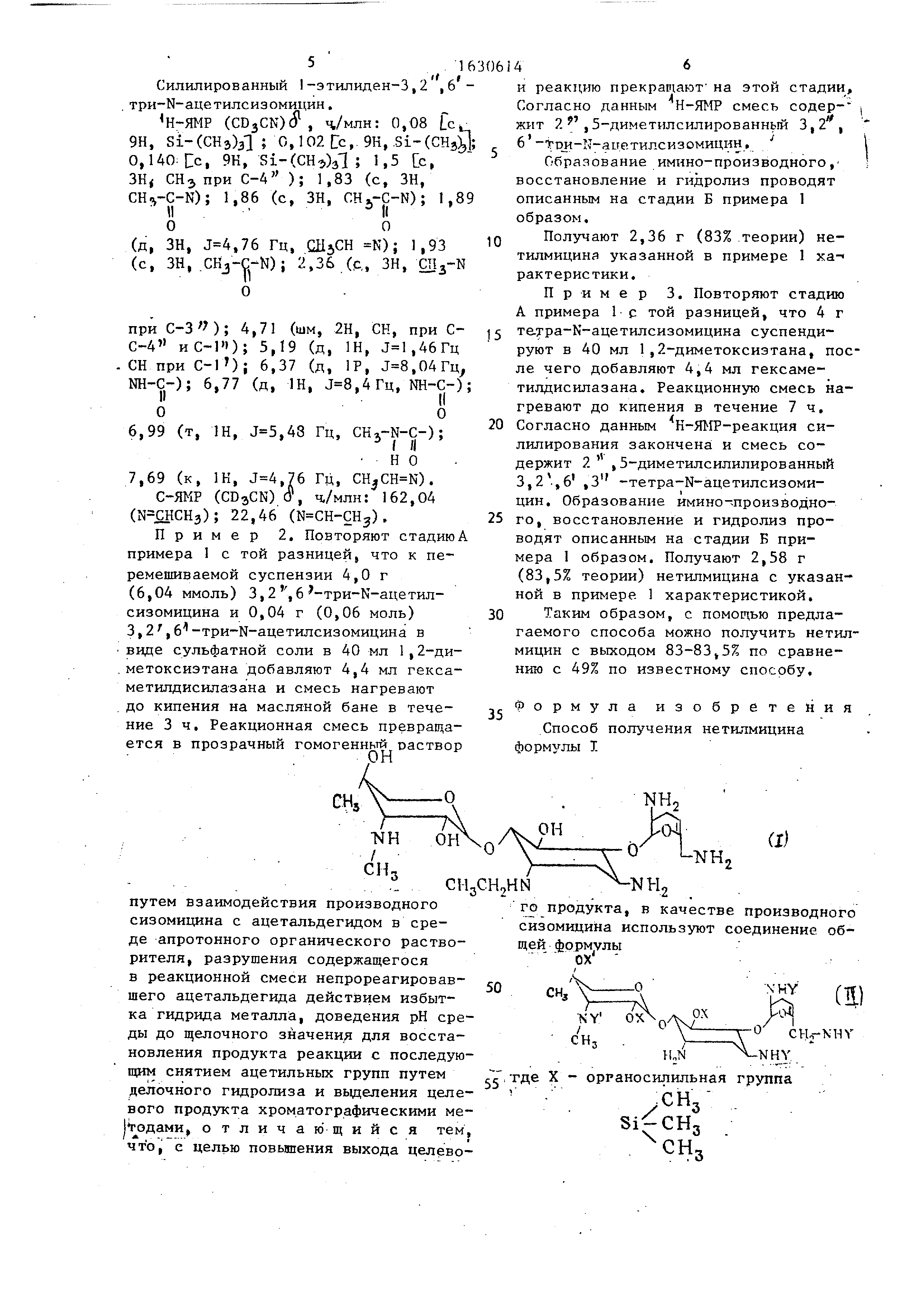
Реферат
Изобретение касается антибиотиков , в частности получения натилми- цина. Цель изобретения - повышение выхода целевого продукта. Для этого ведут синтез из сизомицина ф-лы I ОХ1 NHY СНо-Ч НУ где X - триметилсилильная группа, Х - Н или Si(CH3)3; Y и У ацетильная группа, которое образуется при реакции соединения (Ь-лы IT с гексаме- тилазаном в безводном органическом растворителе при кипении реакционной смеси в присутствии катализатора - сульфатной соли соединения ф-лы II. ЪНУ CH2-M- Y Hj-N -Nin Полученный таким образом сизомицин обрабатывают ацеiальдегидом в среде апротонного органического растворителя с последующим разрулением непрореагировавшего ацетапьдегида дей- с-гвием избытка гидрида металла, доведением рК среды до 9,75 (для обеспечения восстановления продукта реакции ) , делочным гидролизом (для снятия ацетильных групп) и выделением целевого продукта хроматографическим методом. При этом разрушение непрореагировавшего ацетальдегида ведут в 4безводной среде с помощью боргидрида натрия. Выход в этом случае повышается с 49 до 83-83,5%. с (Л оэ со о О5 4

Формула



Комментарии